Propiedades del agua de mar
Anuncio

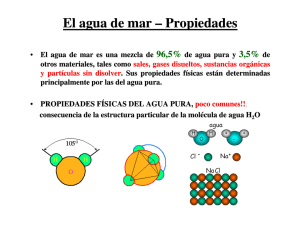
Oceanografía Propiedades del Agua de Mar El agua de mar es una mezcla de 96,5% de agua pura y 3,5% de otros materiales, tales como sales, gases disueltos, sustancias orgánicas y partículas sin disolver. Sus propiedades físicas están determinadas principalmente por las del agua pura 96,5%. Por lo tanto, las propiedades físicas del agua pura se discutirán primero. El agua pura, en comparación con los fluidos de composición similar, presenta muchas propiedades poco comunes. Esto es a consecuencia de la estructura particular de la molécula de agua H2O: Los átomos del hidrógeno llevan una carga positiva, los de oxígeno llevan dos cargas negativas, pero el arreglo del átomo en la molécula de agua es tal que las cargas no están neutralizadas; las cargas estarían neutralizadas si el ángulo fuese de 180° en lugar de 105°). Las principales consecuencias de la estructura molecular del agua pura son: 1. La molécula de agua es un dipolo eléctrico, formando agregados de moléculas (polímeros), de 6 moléculas en promedio a unos 20°C. Por lo tanto, el agua reacciona más lenta a los cambios que las moléculas individuales; por ejemplo el punto de ebullición se desplaza de -80°C a 100°C, mientras que el de congelación lo hace de -110°C a 0°C. 2. El agua tiene un fuerte e inusual poder de disociación, es decir separa el material disuelto en iones eléctricamente cargados. En consecuencia, el material disuelto aumenta mucho la conductividad eléctrica del agua. La conductividad del agua pura es relativamente baja, pero la de la agua de mar está a mitad de camino entre el agua pura y el cobre. A 20°C, la resistencia de la agua de mar de contenido salino del 3,5% por encima de los 1,3 km aproximadamente, iguala a la del agua pura por sobre 1 mm. 3. El ángulo de 105° es cercano al ángulo de un tetraedro, es decir una estructura con cuatro brazos que emanan de un centro a ángulos iguales (109° 28'). Consecuentemente, los átomos de oxígeno en el agua tratan de tener cuatro átomos del hidrógeno asociados a ellos en un arreglo tetraédrico. Esto se llama un "enlace de hidrógeno", en contraste al enlace molecular (iónico) y al enlace covalente. Los enlaces del hidrógeno necesitan una energía de enlace de 10 a 100 veces más pequeña que la de los moleculares, así que el agua es muy flexible en su reacciones para cambiar las condiciones químicas. 4. Los tetraedros tienen por naturaleza mallas más abiertas que los arreglos más cercanos (o más cerrados) de empaquetamiento molecular. Ellos forman agregados de moléculas individuales, de a dos, de a cuatro y ocho. A altas temperaturas los agregados individuales y los de dos moléculas dominan; a medida que baja la temperatura los racimos más grandes comienzan a dominar. Los racimos más grandes ocupan menos espacio que los del mismo número de moléculas en racimos más pequeños. Como resultado, la densidad del agua presenta un máximo a los 4°C. Las propiedades físicas de la mayoría de las substancias muestran una variación uniforme con la temperatura. En oposición, la mayoría de las propiedades físicas del agua pura presentan un mínimo a una cierta temperatura intermedia. La velocidad del sonido muestra un máximo a los 74°C (Tabla 3.1). Una lista de algunos mínimos de temperatura Primero se dan las propiedades físicas seguidas por la temperatura en °C donde ocurre el mínimo. solubilidad del oxígeno volumen específico 80 4 calor específico 34 solubilidad del hidrógeno 37 compresibilidad 44 rapidez de la luz -1 rapidez del sonido (máximo) 74 Al congelarse, todas las moléculas de agua forman tetraedros. Esto conduce a una extensión repentina en el volumen, es decir una disminución de la densidad. La fase sólida del agua es por lo tanto más ligera que la fase líquida, lo que representa una rara propiedad. Algunas consecuencias importantes son: 1. El hielo flota. Esto es importante para la vida en los lagos de agua dulce, puesto que el hielo actúa como un aislante contra la pérdida de calor adicional, previniendo el congelamiento del agua desde la superficie hasta el fondo. 2. La densidad muestra una rápida disminución a medida que se acerca al punto de congelación. La expansión que resulta durante el congelamiento es una causa importante del desgaste de las rocas debido a la acción atmosférica. 3. El punto de congelación disminuye con la presión. Por consiguiente, el derretimiento tiene lugar en la base de los glaciares, lo cual que facilita el flujo del glaciar. 4. Los enlaces del hidrógeno ceden bajo la presión, es decir el hielo bajo presión llega a ser plástico. Como resultado, el hielo que se forma sobre tierra en las regiones Antárticas y Árticas, fluye hacia el mar y forma icebergs en los bordes más externos. Sin este proceso toda el agua del mundo terminaría eventualmente en forma de hielo en las regiones polares. El concepto de salinidad Según lo mencionado antes, el agua de mar contiene 3,5% de sales, gases disueltos, sustancias orgánicas y materia particulada sin disolver. La presencia de estas adiciones influencia la mayoría de las propiedades físicas del agua de mar (densidad, compresibilidad, punto de congelación, temperatura del máximo de densidad) hasta cierto punto, pero no las determina. Algunas propiedades (viscosidad, absorción lumínica) no son afectadas perceptiblemente por la salinidad. Dos propiedades que son determinadas por la cantidad de sal en el mar son la conductividad y la presión osmótica. Idealmente, la salinidad debe ser la suma de todas las sales disueltas en gramos por el kilogramo de agua de mar. En la práctica, esto es difícil de medir. La observación que - no importa cuanta sal esté en el mar - los distintos componentes contribuyen en una razón fija, ayuda a superar la dificultad. Esto permite la determinación del contenido salino a través de la medición de una cantidad substituta y del cálculo del total de todo el material que hace la salinidad de esa medida. Así, la determinación de la salinidad se podría hacer a través de su componente más importante, el cloruro. El contenido del cloruro fue definido en 1902 como la cantidad total en gramos de iones cloruros contenidos en un kilogramo de agua de mar, si todos los halógenos son substituidos por los cloruros. La definición refleja el proceso químico de titulación para la determinación del contenido de cloruro y sigue siendo de importancia al cuando se trata de datos históricos. La salinidad fue definida en 1902 como la cantidad total en gramos de sustancias disueltas contenidas en un kilogramo de agua de mar, si todos los carbonatos se convierten en óxidos, todos los bromuros y los yoduros en los cloruros, y todas las sustancias orgánicas se han oxidados. La relación entre la salinidad y el cloruro se determinó a través de una serie de medidas fundamentales de laboratorio, basadas en muestras del agua de mar de todas las regiones de los océanos del mundo y dada por S (o/oo) = 0,03 +1,805 Cl (o/oo) (1902) El símbolo o/oo se lee "partes por mil". Un contenido salino del 3,5% es equivalente a 35 o/oo, o 35 gramos de sal por kilogramo de agua de mar. El hecho de que la ecuación de 1902 da una salinidad de 0,03 o/oo para una clorinidad cero es una tema de inquietud. Indica un problema con las muestras del agua de mar utilizadas en las medidas del laboratorio. Científicos de las Naciones Unidas, organización educacional, científico y cultural (la UNESCO) decidieron a repetir la determinación base de la relación entre la clorinidad y la salinidad e introdujeron una nueva definición, conocida como salinidad absoluta, S (o/oo) = 1,80655 Cl (o/oo) (1969) Las definiciones de 1902 y 1969 dan resultados idénticos a la salinidad de 35 o/oo y no difieren perceptiblemente entre sí para la mayoría de las aplicaciones. La definición de la salinidad se revisó de nuevo cuando las técnicas para determinar la salinidad a partir de medidas de conductividad, temperatura y presión se desarrollaron. Desde 1978, la " Escala Práctica de Salinidad " define la salinidad en términos de una razón o cociente de conductividades: " La salinidad practica, denotada por S, de una muestra de agua de mar, se define en términos de la razón, K de la conductividad eléctrica de una muestra de agua de mar a 15°C y a la presión de una atmósfera estándar, a la de una solución del cloruro del potasio (KCl), en la cual la fracción de masa total de KCl es de 0,0324356, a la misma temperatura y presión. El valor de K igual a uno corresponde exactamente, por definición, a una salinidad práctica igual a 35. " La fórmula correspondiente es: S = 0,0080 - 0,1692 K1/2 + 25,3853 K + 14,0941 K3/2 - 7,0261 K2 + 2,7081 K5/2 Observe que en esta definición, la salinidad es un cociente y el símbolo (o/oo) es innecesario, pero el antiguo valor de 35o/oo corresponde al valor de 35 en la salinidad práctica. Algunos oceanógrafos aún no se acostumbran a usar números sin unidades para la salinidad de manera que escriben "35 psu", donde psu es por "practical salinity unit", por sus siglas en inglés - "unidad práctica de salinidad-". Como la salinidad práctica es una razón y por lo tanto no tiene unidades, la unidad "psu" es algo sin sentido y fuertemente desalentadora. Una vez más las diferencias minuciosas ocurren entre las antiguas definiciones y la nueva Escala Práctica de Salinidad, pero son generalmente insignificantes. Conductividad Eléctrica La conductividad del agua de mar depende del número de iones disueltos por unidad de volumen (es decir la salinidad) y de la movilidad de los iones (es decir de la temperatura y presión). Sus unidades son mS/cm (mili-Siemens por centímetro). La conductividad aumenta en la misma cantidad con un aumento de la salinidad de 0,01, un aumento de la temperatura de 0,01°C, y un aumento de la profundidad (es decir, presión) de 20 m. En la mayoría de las aplicaciones oceanográficas prácticas el cambio de la conductividad esta dominado por la temperatura. Densidad La densidad es uno de los parámetros más importantes en el estudio de la dinámica oceánica. Las pequeñas diferencias horizontales de la densidad (causadas, por ejemplo, por diferencias en el calentamiento superficial) pueden producir corrientes muy fuertes. Por lo tanto, la determinación de la densidad ha sido una de las tareas más importantes en oceanografía. El símbolo para la densidad es la letra griega (rho). La densidad del agua de mar depende de la temperatura T, salinidad S y presión p. Esta dependencia se conoce como la Ecuación de Estado del Agua de Mar. La ecuación de estado para un gas ideal está dada por by p= RT donde R es la constante de los gases. El agua de mar no es un gas ideal, pero sobre pequeños rangos de temperatura se comporta como si lo fuera. La ecuación exacta para todo el rango de temperaturas, de salinidades y de presiones encontradas en el océano = (T,S,p) (donde S es la salinidad) es el resultado de muchas determinaciones cuidadosas de laboratorio. Las primeras determinaciones fundamentales para establecer la ecuación fueron hechas en 1902 por Knundsen y Ekman. Su ecuación expresó las nuevas determinaciones fundamentales de en g cm-3. Nuevas determinaciones fundamentales, basadas en datos sobre un gran rango de presión y salinidad, dio lugar a una nueva ecuación de la densidad, conocida como la "Ecuación Internacional de Estado" (1980). Esta ecuación utiliza la temperatura en °C, la salinidad de la Escala Práctica de Salinidad y la presión en decibares, dbar (1 dbar = 10.000 pascal = 10.000 N m-2). Así, una densidad de 1,025 g cm-3 en la antigua fórmula, corresponde a una densidad de 1025 kg m-3 en la Ecuación Internacional de Estado del Agua de Mar. La densidad aumenta con un aumento en la salinidad y una disminución de la temperatura, excepto a temperaturas por debajo del máximo de densidad. La densidad oceánica es generalmente cercana al valor 1025 kg m-3 (En el agua dulce la densidad esta cerca de 1000 kg m-3). Los oceanógrafos usan el símbolo t (La letra griega sigma con el subíndice t) para representar la densidad, la cual ellos - 1000 y usualmente pronuncian "sigma-t". Esta cantidad se define como t = no lleva unidades (esta debería llevar las mismas unidades de ). Una densidad de agua de mar típica es t = 25. Algo fácil de recordar es que t cambia la misma cantidad si la T cambia en 1°C, S en 0,1, y p en el equivalente a un cambio de 50 m de profundidad. Observe que el máximo de densidad está arriba del punto de congelación para salinidades menores que 24,7, pero por debajo del punto de congelación para las salinidades mayores que 24,7. Esto afecta el procesos de convección térmica: • • S < 24,7: El agua se enfría hasta que alcanza la densidad máxima; entonces, cuando el agua superficial se hace más ligera (es decir, después de haber pasado el máximo de densidad) el enfriamiento está restringido a la capa mezclada por el viento, la cual eventualmente se congela por encima. Las cuencas profundas están llenas de aguas de máxima densidad. S > 24,7:La convección alcanza todo el cuerpo de agua. El enfriamiento se retrasa porque una gran cantidad de calor se almacena en el cuerpo de agua. Esto es debido a que el agua alcanza el punto de congelación antes de que se logre el de máxima densidad. Si su navegador Internet utiliza JavaScript usted puede verificar el rango de densidad del agua de mar y su dependencia de temperatura y salinidad a presión superficial, con este calculador de densidad de agua de mar: Introduzca un valor para la temperatura, un valor para la salinidad y presione el botón calcular. Verifique su resultado contra el diagrama TS apropiado. http://www.loseskakeados.com