ENZIMAS
Anuncio

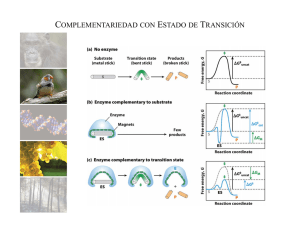
Fases del Metabolismo ENZIMAS • Definición: son macromoléculas, en su mayoría de origen proteico, que catalizan las reacciones bioquímicas que se producen en la células de los seres vivos. Propiedades: • Eficiencia: actúan en bajas concentraciones (micromoleculares) suficiente para acelerar, millones de veces, la velocidad de una reacción. • Especificidad: son capaces de distinguir entre sustancias estrechamentes relacionadas como los esteroisomeros. • Regulación: muchas enzimas pueden aumentar o disminuir su actividad catalítica, según necesidades fisiológicas. 1 Sito activo: región de la superficie de la enzima que fija al sustrato Especificidad del sitio activo 2 COFACTORES : moléculas de naturaleza no proteica que cooperan con algunas enzimas para darle óptima actividad. Inorgánico Zn+2, Mg+2, Fe+2, Cu+2, K+, Na+ COFACTOR Forman parte de la E No forman parte de la E Orgánico (Coenzima) Agente que transfiere grupos el enlace puede ser: covalente o no covalente Interviene en la reacción como otro sustrato Proteína (apoenzima; inactiva o menos activa) Proteína ~ Cofactor holoenzima (catalizador activo en forma óptima) la facilidad de disociación es variable Cofactor (ión inorgánico o sustancia orgánica; inactivo como catalizador) 3 Coenzima: Nicotinamida Adenina Dinucleótido y la transferencia de un ión hidruro 4 Coenzima: Flavina Adenina Dinucleótido y la transferencia de hidrógenos FAD FADH2 (Oxidado) (Reducido) Coenzima: Coenzima A y la transferencia de grupos acilos Acetil Co A 5 NOMENCLATURA: • Sistema común: se añade el sufijo asa al nombre del sustrato o al nombre de la reacción que cataliza. • Sistema Internacional: divide a las enzimas en 6 clases de acuerdo al tipo de reacción que catalizan. Se utiliza un código de 4 dígitos para cada enzima. CLASIFICACIÓN DE ENZIMAS CODIGO CLASIFICACIÓN TIPO DE REACCIÓN QUE CATALIZA 1 OXIDOREDUCTASAS OXIDACIÓN Y REDUCCIÓN 2 TRANSFERASAS 3 HIDROLASAS 4 LIASAS 5 ISOMERASAS 6 LIGASAS O SINTETASAS TRANSFERENCIA DE UN GRUPO DE ÁTOMOS DE UNA MOLECULA A OTRA HIDRÓLISIS DE VARIOS GRUPOS FUNCIONALES RUPTURA DE UNA MOLECULA POR UN PROCESO DISTINTO AL DE HIDRÓLISIS TRASFORMA UN SUSTRATO EN SU ISÓMERO CATALIZAN LA FORMACION DE ENLACES 6 Grupo 1: OXIDOREDUCTASAS – Son enzimas que catalizan reacciones de oxidoreducción (transferencia de electrones de una molécula a otra).Ej.: Deshidrogenasas COOH HO-C-H CH 3 L- lactato lactato deshidrogenasa NAD + NAD H + H + ox red COOH C=O CH 3 piruvato Grupo 2: TRANSFERASAS • Catalizan la transferencia de un grupo de átomos desde un sustrato al otro. Ej.: Hexoquinasa H-C=O H-C-OH HO-C-H H-C=O Hexoquinasa E.C: 2.7.1.1 H-C-OH H-C-OH CH2OH D- Glucosa H-C-OH HO-C-H H-C-OH ATP ADP Nombre Sistemático: ATP glucosa fosfotransferasa E.C: (2) Clase Transferasa (7) subclase fosfotransferasa (1) grupo OH como aceptor (1) D-Glucosa como aceptor de fosfatos H-C-OH CH2O-P D- Glucosa 6 P 7 Grupo 3: HIDROLASAS • Catalizan reacciones donde el agua provoca la ruptura de un enlace. Ej.: Lipasas O H 2 C-O-C-R H 2 C-OH O H-C-O- C-R O + 3 H 2O Lipasas H-C-OH + 3 HO-C-R O H 2 C-O- C-R H 2 C-OH Grupo 4: LIASAS • Catalizan la ruptura de la molécula del sustrato por un proceso distinto al de hidrólisis, formando dobles enlaces por eliminación de grupos o rompiendo dobles enlaces por adición de grupos. Ej.: Aldolasa CH 2 -O-P C=O HO-C-H H-C-OH H-C-OH CH 2 O-P Aldolasa CH 2-O-P C=O H-C=O + H-C-OH CH 2OH Fosfato de dihidroxiacetona CH 2O-P Gliceraldehido 3-P Fructosa 1,6-di P 8 Grupo 5: ISOMERASAS • Son enzimas que transforman a un sustrato en su isómero. Ej.: Fosfogluco-isomerasa H-C=O CH 2 -OH H-C-OH HO-C-H C=O Fosfogluco isomerasa HO-C-H H-C-OH H-C-OH H-C-OH H-C-OH CH 2 O-P CH 2 O-P Fructosa 6- P D- Glucosa 6 P Grupo 6: LIGASAS O SINTETASAS • Catalizan la formación de enlaces. La energía necesaria para la síntesis es provista por el ATP. Ej.: Glutamina sintetasa COOH COOH H-C-NH 2 (CH 2)2 COOH Glutamato + NH 3 + ATP Glutamina sintetasa H-C-NH 2 (CH 2)2 + ADP + Pi O=C-NH2 Glutamina 9 Modo de Acción de las Enzimas: E+S ES E+P FENÓMENOS DEL SITIO ACTIVO 10 Glucosa + ATP Hexoquinasa Glucosa-6-fosfato + ADP Hexoquinasa Energía Libre (G) Diagrama de la coordenada de reacció reacción catalizada por enzima y sin catalizar. Energía de Fijación (-) (∆ ∆G‡) (∆ ∆G‡) (+) (+) Energía Libre Estandar (∆G0) (-) Avance de la reacción 11 Cinética Enzimática Determinación de la velocidad de la reacción y los parámetros que la modifican. S Ecuaciones: P V= ∆ [P] ∆t V= - ∆ [S] ∆t ESTADO ESTACIONARIO EN LA CINÉTICA ENZIMÁTICA 12 Velocidad inicial (V0 ) de una reacción catalizada por enzimas Velocidad de reacción Velocidad Inicial V0 Efecto de [Sustrato] sobre la velocidad inicial de una reacción catalizada por enzimas Ecuación de Michaelis Menten Concentración de Sustrato [S] 13 REPRESENTACIÓN DE DOBLE INVERSA (Lineweaver- Burk) pendiente Y= b + mx Ecuación de una recta con ordenada al origen Efecto de la Temperatura V0 Temperatura óptima Temp. 14 Efecto del pH INHIBICIÓN ENZIMÁTICA Inhibición Irreversible Competitiva Inhibición Reversible No Competitiva 15 Inhibición Competitiva 1/V0 +I -I 1/Vmax. -1/Km 0 1/[S] Inhibición No Competitiva 1/V0 +I 1/Vmax. -I -1/Km 0 1/[S] 16 Inhibición No Competitiva REGULACIÓN ENZIMÁTICA Enzimas reguladoras: muestran una actividad catalítica mayor o menor en respuesta a ciertas señales. Regulación Alostérica Regulación por modulación covalente 17 Regulación alostérica Regulación por modulación covalente Ej: Glucosan + Pi Glucosa n-1 + Glucosa 1- P Glucógeno fosforilasa Cadena lateral de Ser Cadena lateral de Ser Fosforilasa b menos activa Fosforilasa fosfatasa Fosforilasa quinasa Fosforilasa a más activa 18