Universidad Nacional de Ingeniería UNI-Norte Curso Química General Básica
Anuncio

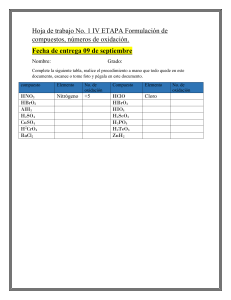
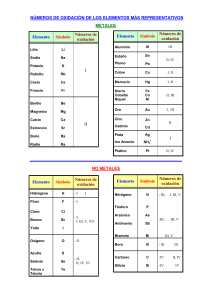
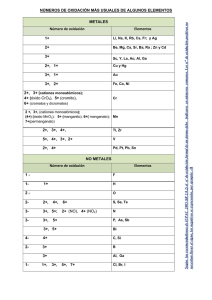
Universidad Nacional de Ingeniería UNI-Norte Curso Química General Básica EJERCICIOS PARA RESOLVER Clase Práctica No 3 Objetivos: 1. Determino el número de oxidación de diferentes elementos y compuestos de la tabla periódica. 2. Identificar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 3. Fomentado el respeto, espirito crítico a través de la participación individual. Contenidos: - Número de Oxidación - Enlaces Químicos - Nomenclatura Orientaciones Generales: 1. Organícese en parejas 2. Analicen los planteamientos que a continuación se les brinda y resuelvan lo indicando. 3. Presenten en plenario sus resultados ante los compañeros de grupo. a). Determina el número de oxidación de los diferentes compuestos: Na Cl , NaF , CaSe, LiH, ], PO4-3 , AlCl3, PH3, HNO3, H2O, H2SO4, BaF2, NO2, BaO , Zn , Cu, N2, Al , Ar, NaOH, KCl, CO3-2 , NO3b). Determina el número de oxidación del manganeso en los compuestos: MnO2 Mn2O3 c). Determina el número de oxidación del Cl en los compuestos: Cl2O7 Cl2O Cl2O5 d). Determina el número de oxidación del Ni en los compuestos: Ni2O3 NiO e) ¿Cuál es el número de oxidación del átomo de P en el H3PO4? f) ¿Cuál es el número de oxidación del Cr en el ión dicromato, Cr2O7 -2? g) Elabore un mapa conceptual en el que queden reflejados el concepto, tipos, características y aplicaciones del enlace químico. h) El enlace iónico, ¿qué propiedades da a un compuesto? Diseña un experimento que te permita identificar esas propiedades. i) Explica la polaridad de los enlaces en la molécula de agua, H2O y en la de HCl j) Discute en tu grupo qué diferencia hay entre enlace iónico y enlace covalente. ¿Qué diferencias presentan estos tipos de enlace respecto a la electronegatividad y la polaridad? k) Justifica, razonadamente, ¿por qué se ha prohibido el uso de pinturas, crayones y otros materiales que contengan plomo en sus estructuras? l) Presenta un cuadro comparativo con el resultado de la investigación de las propiedades características que tienen algunos compuestos según el tipo de enlace que presentan en su estructuración. Bibliografía: - Chang, R. (2006). Principios Esenciales de Química General. Madrid, España: McGraw - Hill. - Malone, L. J. (2000). Introducción a la Química. México: LIMUSA, S.A DOCENTE: Ing. Alba Díaz Corrales 2