relación del hombre con su entorno
Anuncio
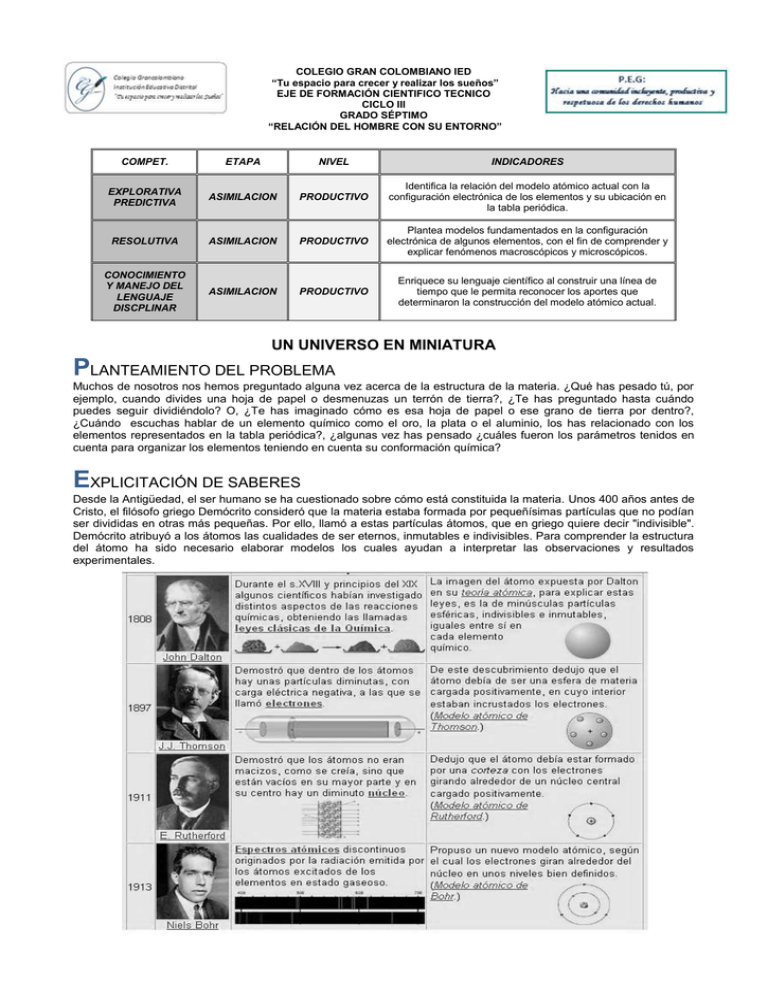
COLEGIO GRAN COLOMBIANO IED “Tu espacio para crecer y realizar los sueños” EJE DE FORMACIÓN CIENTIFICO TECNICO CICLO III GRADO SÉPTIMO “RELACIÓN DEL HOMBRE CON SU ENTORNO” COMPET. ETAPA NIVEL INDICADORES EXPLORATIVA PREDICTIVA ASIMILACION PRODUCTIVO Identifica la relación del modelo atómico actual con la configuración electrónica de los elementos y su ubicación en la tabla periódica. RESOLUTIVA ASIMILACION PRODUCTIVO Plantea modelos fundamentados en la configuración electrónica de algunos elementos, con el fin de comprender y explicar fenómenos macroscópicos y microscópicos. CONOCIMIENTO Y MANEJO DEL LENGUAJE DISCPLINAR ASIMILACION PRODUCTIVO Enriquece su lenguaje científico al construir una línea de tiempo que le permita reconocer los aportes que determinaron la construcción del modelo atómico actual. UN UNIVERSO EN MINIATURA PLANTEAMIENTO DEL PROBLEMA Muchos de nosotros nos hemos preguntado alguna vez acerca de la estructura de la materia. ¿Qué has pesado tú, por ejemplo, cuando divides una hoja de papel o desmenuzas un terrón de tierra?, ¿Te has preguntado hasta cuándo puedes seguir dividiéndolo? O, ¿Te has imaginado cómo es esa hoja de papel o ese grano de tierra por dentro?, ¿Cuándo escuchas hablar de un elemento químico como el oro, la plata o el aluminio, los has relacionado con los elementos representados en la tabla periódica?, ¿algunas vez has pensado ¿cuáles fueron los parámetros tenidos en cuenta para organizar los elementos teniendo en cuenta su conformación química? EXPLICITACIÓN DE SABERES Desde la Antigüedad, el ser humano se ha cuestionado sobre cómo está constituida la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba formada por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Para comprender la estructura del átomo ha sido necesario elaborar modelos los cuales ayudan a interpretar las observaciones y resultados experimentales. 1. Completa las siguientes afirmaciones. Thomson descubrió que los átomos estaban formados por dos tipos de cargas ___________ y_____________. El modelo atómico propuesto por Rutherford indicaba que el átomo estaba formado por una región central llamada____________ donde se concentraban las cargas________________, y una _____________, donde giran los____________________. Según Bohr los electrones giran en________________ mientras se encuentren en ellos no liberan ni absorben _____________________. Los electrones que se encuentran en niveles más cercanos al núcleo poseen ______________________ energía de los que se encuentran __________________ de él. Demócrito postuló que la materia era _______________________, y estaba formada por una partícula a la cual llamó átomo que significa ________________________. En un principio se pensaba que la materia era________________. Las partículas que encontramos en el núcleo son ______________ ______que posee carga___________________ y los _________________ que no poseen carga. El número másico indica el número de ____________________ más ___________________. La envoltura nuclear está formada por los ________________ que poseen carga____________________. El número atómico A representa la cantidad de ____________________ que están en el núcleo. La cantidad de electrones y protones es ______________________. 2. Relaciona las siguientes conclusiones experimentales con el modelo atómico a que dieron lugar: 3. Observa el esquema y de acuerdo con el indica el nombre y la carga eléctrica de cada una de las partículas señaladas. ¿Qué nombre reciben las partículas indicadas como (+) (-) (0)? ¿En que región del átomo se encuentran las partículas (+)? ¿En que región del átomo se encuentran las partículas (-)? ¿En que región del átomo se encuentran las partículas (0)? A. B. C. D. 4. Observa con atención los siguientes gráficos de modelos atómicos. Responde: a) ¿Cuál de los 4 modelos es el más antiguo? ¿Quién lo propuso? ¿Qué planteaba este modelo? b) ¿Cuál es el modelo más reciente? ¿Quién lo propuso? ¿Por qué se descartaron los otros modelos? 5. Explica las siguientes afirmaciones: a) La materia es discontinua b) El átomo es eléctricamente neutro c) Los electrones que se ubican en un mismo nivel no tienen exactamente la misma energía. d) La formación de un ión no implica cambios en el número atómico del átomo. 6. El número atómico del hierro es Z = 26. Indica cuales de las siguientes afirmaciones son correctas. a) Puede existir un isótopo del hierro cuyo número atómico sea 27. b) El hierro tiene 26 protones en el núcleo. c) Los átomos de hierro tienen 26 neutrones en su núcleo 7. Escribe la letra clave en el lugar correspondiente 8. Complete la siguiente tabla Isótopos 63 Cu 65 Cu Número de protones Número de neutrones Número de electrones Número másico (A) Mg 25 Mg 26 Mg 24 Sr 86 Sr 87 Sr 88 Sr 84 9. Completa el siguiente cuadro Población electrónica máxima Un orbital Un subnivel p Un subnivel d Primer nivel energético Nivel energético más externo 10. Identifique el bloque, periodo y grupo de los elementos que presentan las siguientes configuraciones. 1s22s22p63s23p64s23d104p5 1s22s22p63s2 1s22s22p63s23p64s23d104p65s24d105p3 1s22s22p63s23p64s23d104p65s24d105p66s1 1s22s22p63s23p64s23d9 1s22s22p63s23p64s23d104p65s24d8 1s22s22p63s23p64s23d104p65s24d105p66s24f2 11. Construye la configuración electrónica y el diagrama de orbitales para los siguientes elementos. Carbono Cromo Germanio Magnesio 12. En los elementos anteriores identifica: Un metal alcalino ____________________________. Un Halógeno____________________________. Un metal precioso____________________________. Un elemento de la familia del nitrógeno____________________________. Un lantánido____________________________. Un elemento de transición____________________________. Un metal alcalinotérreo____________________________. Hierro Praseodimio NEGOCIACIÓN COLABORATIVA 13. Completa el siguiente mapa conceptual. 14. Escribe dentro del paréntesis una F o una V según las siguientes afirmaciones sean falsas o verdaderas. Convierte luego las afirmaciones falsas en verdaderas. a. b. c. d. e. f. ( ( ( ( ( ( ) El subnivel 1s tiene un valor energético menor que el subnivel 2s. ) El subnivel 3p tiene un valor energético mayor que el subnivel 4s. ) El subnivel 4s un valor energético menor que el subnivel 3d. ) El subnivel 5p tiene un valor energético mayor que el subnivel 4f. ) El subnivel 4d tiene un valor energético menor que el subnivel 5s. ) la cantidad de electrones en un nivel energético n, en un átomo no puede ser superior a 2n2. 15. El escritor Isaac Asimov aseguraba que si se pudiera comprimir la Tierra, de manera que su materia ocupara todo el espacio vacio que hay en los átomos, se reduciría a una esfera de 13.7 Km de diámetro. De acuerdo con la experiencia que hizo Rutherford, ¿cómo podrías justificar esta afirmación? 16. ¿Consideras que la formulación de un nuevo modelo indicaría un fracaso de la ciencia, o sería un signo de progreso de la ciencia? ¿Por qué? 17. Teniendo en cuenta el modelo mecánico cuántico del átomo, responde: a) ¿Qué postula este modelo en cuanto a la trayectoria de los electrones? b) ¿Que nombre recibe la zona en donde hay mayor probabilidad de encontrar un electrón? Un conjunto de átomos del mismo tipo forman un elemento químico determinado. Para poder representar y distinguir un elemento químico se utiliza un símbolo químico y dos números, conocidos como: número atómico y número másico. 18. a) b) c) d) e) Determinar el número de protones, electrones y neutrones de los siguientes isótopos: C: A = 14 Z=6 Ca: A = 41 Z = 20 Cl: Z = 17 N = 18 Ba: e = 54 A = 137 S: N = 16 Z = 16 El número atómico (Z) indica el número de protones que contiene el núcleo atómico. Para un átomo neutro, el número de protones es idéntico al número de electrones. El número másico (A) indica el número de protones más el de neutrones que tiene el átomo en su núcleo. 19. Utilizando la información anterior completa la siguiente tabla. Nombre Fósforo Símbolo P Nº atómico 15 Nº másico 31 Nº protones 15 20. Resuelve el siguiente crucigrama Horizontales 1: Partícula cargada negativamente que gira en torno al núcleo atómico Verticales 2: Exterior del átomo Horizontales 3: Partícula sin carga residente en el núcleo atómico Verticales 3: Parte central del átomo Horizontales 4: Número.... Representa el número de protones en el núcleo Verticales 5: Número.... Representa el número de partículas en el núcleo Horizontales 6: Variedades de un elemento que se diferencian en el número de neutrones del núcleo Horizontales 7: Partícula con carga positiva residente en el núcleo atómico 21. Relaciona los números atómicos de la columna de la izquierda con la ubicación en la tabla periódica señaladas en la columna de la derecha 22. Observa la tabla periódica y escribe el nombre de los elementos llamados metales de acuñar. ¿Por qué reciben este nombre? 23. En el siguiente grupo de letras desordenadas se encuentra el nombre de un elemento químico. Encuéntralo y consulta sus propiedades físicas, químicas y sus usos principales. Nº electrones 15 Nº neutrones 16 SOLUCIÓN Y SOCIALIZACIÓN 24. Consulta: ¿Cual es la importancia de la química atómica? y sus usos en la industria, la medicina y en la vida cotidiana. La biografía de los científicos más representativos en el estudio de la constitución de la materia. Con esta información elabora un poster, para socializar a tus compañeros en una muestra e carácter artístico. AUTOEVALUACION RESOLUCIÒN DE NUEVOS SABERES 25. A partir de la lectura”La tabla periódica y los nuevos elementos” responde las siguientes preguntas: ¿Qué propiedades podrías predecir para los elementos que se descubran en el futuro? ¿Cómo se obtuvieron los elementos 101 al 106? ¿Qué aplicación presentan los elementos radiactivos en la vida diaria?. Plantea tres ejemplos. ¿Qué consecuencias traería el uso inadecuado de los elementos radiactivos? BIBLIOGRAFÍA Bechara, B., Clavijo, M., & Samacà, N. (1999). Ciencias Naturales 7. Santafè de Bogota : Santillana S.A. Ramírez, Pedro, Samacá, Elsy. (1995). Procesos Naturales 6. Santafè de Bogota : Santillana S.A. Parga, Diana, Mora, William. (2000). Olimpiadas 10. Santafè de Bogota : Voluntad



