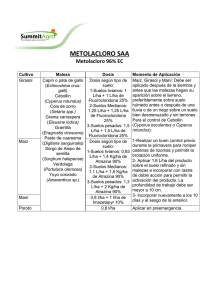
Ver tesis - Universidad de Colima
Anuncio

INDICE Pag INDICE DE CUADROS RESUMEN ABSTRACT I. INTRODUCCION 1 II. REVISION DE LITERATURA 6 2.1 Antecedentes históricos del uso de los herbicidas 6 2.2 Los usos de la atrazina 7 2.3 Retención de atrazina en el suelo 8 2.3.1 Efecto de las propiedades y la composición del suelo en la retención de atrazina 2.3.2 Adsorción y desorción de los metabolitos de atrazina 9 11 2.4 Persistencia de la atrazina en el suelo 12 2.5 Transformación de la atrazina en el suelo 13 2.5.1 Factores abióticos responsables de la degradación de atrazina 2.5.2 Factores atrazina bióticos responsables de la degradación 16 de la 21 2.5.2.1 Principales microorganismos capaces de degradar la atrazina 24 2.5.3 Los sistemas de labranza, como práctica importante en el proceso degradativo de atrazina 27 2.5.4 Incorporación de abono al suelo y su efecto en el proceso degradativo de atrazina 29 2.5.4.1 Estudios relacionados con la movilidad de atrazina en el suelo 33 2.5.4.2 Condiciones del suelo 34 2.6 Conclusiones de la revisión de literatura 35 III. MATERIALES Y MÉTODOS 37 3.1 Ubicación geográfica del sitio experimental 37 3.2 Suelo 37 3.3 Descripción de las Columnas 38 3.4 Establecimiento del experimento 39 3.5 Diseño experimental 41 3.6 Variables evaluadas 42 3.6.1 Propiedades del suelo original 3.6.2 42 3.6.1.1 Densidad aparente 42 3.6.1.2 Densidad real 43 3.6.1.3 Textura 43 Características experimental. químicas del suelo durante la fase 44 3.6.2.1 pH del suelo 44 3.6.2.2 Carbono orgánico 44 3.6.2.3 Nitrógeno 45 3.6.2.4 Relación carbono nitrógeno 45 3.6.3 Población microbiana 46 3.6.4 Producción CO2 46 3.6.5 Análisis de residuos de atrazina 48 3.6.5.1 Curva de calibración 48 3.6.5.2 Residuos de atrazina en el suelo 49 3.6.5.3 Residuos de atrazina en agua lixiviada 50 3.6.5.4 Cálculo de la degradación de la atrazina 51 3.7 Análisis estadístico 51 IV. RESULTADOS 52 4.1 Propiedades fisicoquímicas del suelo 54 4.2 Características químicas del suelo experimental 54 4.3 Densidad población microbiana heterotrófica enriquecido con abono verde y atrazina total del suelo 55 4.4 Producción de CO2 después de la aplicación de abono verde y atrazina 58 4.5 Análisis de residuos de atrazina y algunos de sus metabolitos en el suelo 60 4.5.1 Residuos obtenidos a la profundidad de 0-15 cm 60 4.5.2 Residuos obtenidos a la profundidad de 15-30 cm 64 4.6. Análisis de residuos de atrazina en agua lixiviada de las columnas 68 4.7 Porcentaje de mineralización de la atrazina aplicada al suelo 72 V. DISCUSIÓN 75 VI. CONCLUSIONES 78 VII. REFERENCIAS 79 INDICE DE CUADROS Y FIGURAS Pag Cuadro 2.1. Persistencia de la atrazina en suelos con manejo de residuos vegetales 28 Cuadro 2.2. Pérdida de atrazina por arrastre en distintos sistemas de labranza 29 Cuadro 4.1. Análisis de varianza del efecto de la incorporación de niveles de abono verde sobre cuatro propiedades químicas del suelo agrícola esterilizado y no esterilizado contaminado con atrazina. 53 Cuadro 4.2. Efecto de cuatro niveles de abono verde incorporado a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre la concentración de carbono orgánico durante dos periodos de incubación. 53 Cuadro 4.3 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre la concentración de nitrógeno en dos periodos de incubación. 54 Cuadro 4.4 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre la relación C/N durante dos periodos de incubación. Cuadro 4.5 Análisis de varianza del efecto de la adición de niveles de abono verde sobre la densidad de la población heterotrofica bacteriana total de un suelo agrícola esterilizado y no esterilizado contaminando con atrazina. Cuadro 4.6 Efecto de la adición de cuatro niveles de abono verde a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre la densidad de la población herterotrófica bacteriana total en un suelo durante cinco periodos de incubación. Cuadro 4.7 Análisis de varianza del efecto de niveles de abono verde sobre el número de UFC de actinomicetos y propágulos de hongos/g suelo esterilizado y no esterilizado contaminado con atrazina. Cuadro 4.8 Efecto de la incorporación de cuatro niveles de abono verde a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre el número de UFC de actinomicetos/g viables, durante cinco períodos de incubación. Cuadro 4.9 Efecto de la incorporación de cuatro niveles de abono verde a un suelo agrícola esterilizado y no esterilizado contaminado con atrazina sobre el número de propágulos viables de hongos /g durante cinco períodos de incubación. 54 55 56 57 57 58 Cuadro 4.10 análisis de varianza del efecto de la incorporación de niveles de abono verde sobre la producción de CO 2. en un suelo agrícola esterilizado y no esterilizado contaminado con atrazina, durante nueve períodos de incubación. Cuadro 4.11 Efecto de la incorporación de cuatro niveles de abono verde en un suelo agrícola esterilizado y no esterilizado contaminado con atrazina en la producción de CO2 en mg durante nueve períodos de incubación. Cuadro 4.12 Análisis incorporados contaminado comprendido incubación. de varianza de los efectos de niveles de abono verde a un suelo agrícola esterilizado y no esterilizado con atrazina sobre su degradación en el espacio de 0 a 15 cm de profundidad, durante ocho períodos de Cuadro 4.13. Efecto de la incorporación de cuatro niveles de abono verde en un suelo agrícola esterilizado y no esterilizado sobre la degradación de atrazina expresada en ppm a la profundidad de 0 a 15 cm, durante ocho periodos de incubación. 59 60 61 62 Cuadro 4.14 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina vía atrazina desetil-2-hidroxy encontrados de 0 a 15 cm de profundidad durante ocho periodos de incubación. 63 Cuadro 4.15 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina vía atrazina desetil en encontrados de 0 a 15 cm de profundidad, durante ocho periodos de incubación. 64 Cuadro 4.16 Análisis de varianza del efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina, a la profundidad de 15 a 30 cm, durante ocho periodos de incubación. 65 Cuadro 4.17 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina a la profundidad de 15 a 30 cm, durante ocho periodos de incubación. . 66 Cuadro 4.18 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina vía atrazina desetil-2-hidroxi a la profundidad de 15 a 30 cm, durante ocho periodos de incubación. Cuadro 4.19 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la degradación de la atrazina vía atrazina desetil a la profundidad de 15 a 30 cm, durante ocho periodos de incubación Cuadro 4.20 Análisis de varianza del efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la lixiviación de atrazina y sus metabolitos producto de su degradación durante ocho períodos de incubación. Cuadro 4.21 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la lixiviación de la atrazina, durante ocho periodos de incubación. 67 68 69 70 Cuadro 4.22 Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la lixiviación de la atrazina desetil-2-Hidroxi, durante ocho periodos de incubación. 71 Cuadro 4.23. Efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la lixiviación de la atrazina desetil durante ocho periodos de incubación. 72 Cuadro 4.24 Efecto de un suelo agrícola esterilizado y no esterilizado sobre la lixiviación de la atrazina desisopropil, durante ocho periodos de incubación. 72 Cuadro 4.25 Análisis de varianza del efecto de cuatro niveles de abono verde incorporados a un suelo agrícola esterilizado y no esterilizado sobre la mineralización de la atrazina durante 4 períodos de incubación. 73 Cuadro 4.26 Efecto de cuatro niveles de abono verde incorporado a un suelo agrícola esterilizado y no esterilizado sobre la mineralización de atrazina durante cuatro periodos de incubación. 74 Figuras Figura 1. Estructura de la atrazina 14 Figura 2. Estructuras de algunos metabolitos de la atrazina Figura 3. Ruta de degradación Figura 4 Mapa de la ruta metabólica de atrazina Figura 5. Columna de PVC para estudiar el movimiento y degradación de la atrazina Figura 6. Respirómetro tipo Bartha modificado para medir la producción de dióxido de carbono. 15 20 26 39 47 II ANTECEDENTES 2.1 Antecedentes históricos del uso de los herbicidas Desde la introducción de los herbicidas a finales de 1940, se redujeron en forma considerable las prácticas agrícolas, por lo tanto los residuos vegetales permanecieran sobre la superficie del suelo favoreciendo la retención de agua y reducción de la pérdida del suelo. Esta tecnología fue ampliamente aceptada, y por lo mismo el consumo de herbicidas aumentó, al mismo tiempo se incrementó la resistencia de algunas especies de malezas y los residuos en el ambiente (Max, 1988; Lyon et al., 1996). La aceptación de los herbicidas fue por fases y se sabe que tuvieron que pasar por cuatro etapas, caracterizadas por los métodos de aplicación. La fase I inició con el uso de 2,4-D (2, 4- ácido diclorofenoxiacético) a mediados de 1950, y se utilizó para controlar selectivamente malezas dicotiledoneas postemergentes y ocasionalmente como pre-emergentes. En la fase II los herbicidas se aplicaron principalmente al suelo. La simazina cubrió el 1% de la superficie de maíz sembrado en 1959, seguido por el CDAA (2-cloro-N,N-di-2propenilacetamida) con el 8% de la superficie sembrada de soya en 1965 y el 17% de la superficie de maíz en 1966. La fase III, corresponde a una etapa de transición en el control de malezas, destacando la introducción de trifluralina (2,6-dinitro-N,N-dipropil-4- trifluorometil) y benzenamina para controlar zacates en soya en el período de 1964 a 1969 (Pike y Glover, 1991). La fase IV inició en 1979, el uso óptimo de la tecnología y la eficiencia económica de la aplicación de los herbicidas fue su principal característica, los productos más utilizados fueron alaclor, tiocarbamatos, EPTC y butilato. Posteriormente el metolaclor en combinación con atrazina adquirió mucha popularidad durante el período de 1982 a 1990 y más recientemente su uso se ha diversificado (Pike y Glover, 1991). En los últimos 30 años, los herbicidas pasaron a ser un pilar importante de la producción agrícola y sin duda alguna el grupo de las triazinas es el más ampliamente utilizado en todo el mundo para controlar malezas (Buser, 1990), se calcula que solamente en Estados Unidos de Norteamérica se consumieron alrededor de 80 millones de libras (Newman, 1994), con lo cual se incrementaron las concentraciones de residuos en algunas zonas maiceras, sobrepasando las 3 ppb en el suelo y el agua potable (Pionke y Glotfelty, 1990). En Alemania el uso de atrazina está restringido (Friesel, 1986), principalmente porque este plaguicida está clasificado como un posible producto cancerígeno en humanos (Newman, 1994). Además, se ha señalado que una dosis de 0.03 g/l causa un dramático incremento en el grado de saturación 1996). de los ácidos grasos en las membranas celulares (Laura et al., Asimismo, la atrazina está considerada como un plaguicida que presenta una moderada movilidad encontrándose frecuentemente en el subsuelo, manto friático (Foster y Chilton, 1991) aguas profundas y agua potable (Williams et al., 1988). 2.2. Los usos de la atrazina [6-cloro-N’-(-metil)-1,3,5-triazina –2,4 diamina] La atrazina desde su introducción en 1950, ha sido el herbicida más popular en los cultivos de maíz y sorgo por tener un precio relativamente bajo y un eficiente control de malezas. Se aplica en pre-emergencia y post-emergencia mezcla con metolaclor alaclor [ y a menudo se [2-cloro-N-(2,6-dietilfenil-N-(metoximetil 2-cloro-N-(2,2 acetamida)], etil-6-metilfenil)-N-(2-metoxi-1-metil- etil)acetamida), butilato (S-etil bis(2-metilpropil) carbomotioato] o con otros herbicidas que controlan dicotiledoneas como dicamba (3,6 dicloro-2-ácido metoxibenzoico), nicosulfuron 2-[ [ [ [ 4,6-dimetoxi-2-pirimidil) aminol carbonil aminol sulfonil -N,N-dimetil-3- piridinecarboxamida o bromoxinil (3,5- dibromo-4-hidroxibenzonitrilo), y para el control total de malezas la atrazina se utiliza en forma de mezcla con cianamina 2-[[4-cloro-6-(etilamino)-1,3,5- triazin-2-yl] amino]-2- metilpropanenitrilo (Koskinen y Clay, 1997). El mayor consumo de la atrazina está registrado de 1987 a 1989, con un promedio por año de 29 millones de kg de ingrediente activo, del cual fue aplicado en los Estados Unidos de Norteamérica cerca del 84% en maíz (Gianessi y Puffer, 1991). En 1995 el consumo se incrementó de 31-33 millones de kg de ingrediente activo (Aspelin, 1996). Sin embargo las cantidades de residuos de atrazina en el agua fueron similares a las encontradas en 1989 y 1995. No obstante otros investigadores determinaron concentraciones superiores en 1989 y 1990 que en 1994, 1995 y 1998 (Scribner et al., 2000). Mismas que son transportadas a través de las zona de las raíces de las plantas, canales naturales o artificiales que llegan hasta las aguas subterráneas o bien puede ser transformada o retenida (Koskinen y Clay, 1997). 2.3 Retención de atrazina en el suelo La retención de la atrazina vegetales y es más eficiente en presencia de residuos carbono orgánico (Buman y Ros, 1983), lo cual favorece la volatilización, fotodegradación y son expuestos a otros procesos co-oxidativos que reducen a partes más simples el herbicida (Mills et al., 1989; Jones et al., 1990). La adsorción del herbicida esta relacionada con la cantidad de carbono orgánico (Ying y Williams, 2000). Sin embargo la abundancia de este elemento en el suelo, puede disminuir la biodegradación de atrazina, para lo cual es necesario adicionar fosfato inorgánico y de esta forma estimular la degradación (Strong et al., 2000), está reportado que la retención de atrazina está en función del tipo de suelo. Así, un suelo pobre con solamente 0.4% de carbono orgánico, y otro rehabilitado con 1.55% con dicho elemento, mostró diferencias significativas en el contenido de ácido húmico, ácido fúlvico, humín, materia orgánica soluble, contenido de materia orgánica total, relación hidrogeno oxigeno, relación oxigeno carbono pero no se encontró diferencia en la adsorción de la atrazina (Sluszny et al., 1999). 2.3.1 Efecto de las propiedades y la composición del suelo en la retención de atrazina La cantidad de herbicida retenido por el suelo fluctúa de 0 a 100% del total aplicado, pero típicamente la adsorción en suelos aluviales o francos y franco arcillosos está entre 50-80%. La retención varios factores importantes tales como: sedimentos depende de contenido de materia orgánica, contenido y tipo de arcilla, pH, cantidad de producto aplicado y cantidad de carbono orgánico en la solución del suelo (Koskinen y Clay, 1997). En algunas regiones de los Estados Unidos de Norteamérica se estima que la atrazina y el alaclor se acumulan en más de 240 g/m-2 por año, aunque en Nueva Inglaterra se ha llegado a acumular solamente 10 g/m-2 por año, en los Grandes Lagos de 12 a 63 g/m-2 por año y en agua de lluvia se reporta 0.6% de atrazina y 0.4% de alaclor (Goolsby et al., 1997). La adsorción de atrazina y de su metabolito hidroxiatrazina no es afectada en suelos con pH de 6.1 y 4.5, así como de 6.1 y 4.0, en cambio s-glutation atrazina no es adsorbida al suelo respectivamente (Clay y Koskinen, 1990). con pH de 4.0 y 4.5 Si el suelo contiene 3.3 g/kg de carbono orgánico puede incrementarse la adsorción de atrazina y se reduce la producción de desetilatrazina (Ray y Krapac, 1994). La adsorción de atrazina y el alaclor no presentan una correlación significativa con la profundidad del suelo, contenido de arcilla y contenido de carbono orgánico. Y su coeficiente de distribución en suelos con textura fina es de 1.5 a 5.5, en cambio en suelos con textura gruesa su coeficiente de distribución es de 0.40 a 0.87 respectivamente (Sonon y Schwab, 1995). También se ha encontrado que la movilidad de los residuos de atrazina no está relacionada con la distribución del carbono orgánico. En suelos arcillosos la atrazina es adsorbida a los 36 cm de profundidad y sus metabolitos diamino atrazina, desetilatrazina y desisoprilatrazina han sido encontrados a la profundidad de 54 cm 10 meses después de la aplicación de atrazina (Dousset et al., 1995). La adsorción de atrazina en suelo seco y húmedo es de 13 a 22% respectivamente y en presencia de residuos vegetales la adsorción y la degradación se incrementan. Si el suelo carece de materia orgánica, no existe biodegradación, en cambio se incrementa la volatilización (Shelton et al., 1995). A medida que se incrementa la profundidad del suelo el herbicida se degrada más lentamente y se adsorbe menos, además de que la actividad microbiana es mínima (Jury et al., 1987; Kookama y Aylmore, 1994; Di y Aylmore, 1997; Miller et al., 1997). No obstante otros estudios han demostrado que la tasa de degradación entre la capa superior y el subsuelo es similar (Sparling et al., 1998; Di et al., 1998; 2001). Está comprobado que la atrazina es más persistente en el subsuelo que sobre la superficie, así el porcentaje de 14 C derivado de la transformación del herbicida fue de 73 a 80% en la superficie y en el subsuelo de 22 a 36%, en cambio dietil atrazina fue más persistente en el subsuelo con 69 a 83% y en la superficie se encontró solamente de 5.4 a 23% después de 60 días de la aplicación del herbicida. (Kruger et al., 1997). La adsorción de la atrazina no tienen relación con el contenido de arcilla y carbono orgánico, pero sí con el grado de humificación de la materia orgánica (Dousset et al., 1994). Aunque (Stehouwer et al., 1993) sostienen que el carbono orgánico que se encuentra en los macroporos hechos por las lombrices de tierra, favorece la formación de compuestos complejos con los grupos funcionales de amidas y ácidos carboxílicos de la materia orgánica a través de las uniones del hidrógeno de la molécula de la atrazina (Welhouse y Blean, 1993) y posiblemente con los grupos funcionales de fenoles y quinonas. Además si el contenido de materia orgánica es cercano al 5%, su superficie mineral arcillosa adsorbe moléculas de atrazina, favoreciendo su mineralización total (Walker y Crawford, 1968). En suelos con textura migajón arcillosa los metabolitos de la atrazina permanecen en su forma simple de los 70 a 80 cm un mes después de su aplicación o a los 90 cm de profundidad 16 meses después, esto se atribuye a los movimientos directos que tienen a través de los macroporos verticales del suelo, los cuales se han encontrando distribuidos de la siguiente manera hidroxiatrazina (HA) arriba de los 10 cm de profundidad con un 9%, con incremento hasta del 24% 6 meses después de la aplicación, el 26% de desetilatrazina (DEA) de los 10 a 20 cm 16 meses después del tratamiento y desetildesisopropilatrazina (DEDIA) a los 80 cm (Sorenson et al., 1994) o bien en el interior de los tejidos de los cultivos (Khan y Saidak, 1981; Levy y Chesters, 1995). 2.3.2 Adsorción y desorción de los metabolitos de atrazina Adicionando amoniaco al suelo se regula el pH, con lo cual se logra disminuir la adsorcion de atrazina, en cambio se agiliza su degradación. (Clay et al., 1996). Sin embargo los metabolitos de la atrazina presentan propiedades únicas que influyen en su retención y adherencia al suelo. Por ejemplo dietil atrazina, deisopropil atrazina se adsorben poco al suelo y atrazina desetil (DEA) es el que menos se retiene (Brouwer et al., 1990), además DEA tiene baja afinidad a suelos arenosos con bajos niveles de carbono orgánico y la adsorción no presenta correlación con el contenido de arcilla y el pH del suelo (Ray y Krapac, 1994). En cambio la hidroxiatrazina se adsorbe más fácilmente en suelos tratados con amoniaco que en aquellos no tratados y puede mantenerse retenido en el suelo durante los primeros seis días después de la aplicación, con tan solo una baja desorción (Clay y Koskinen, 1990; Clay et al., 1996). 2.4 Persistencia de la atrazina en el suelo La atrazina se ha encontrado en suelos agrícolas nueve años después de su aplicación (Foster y Chilton, 1991). Otros reportes indican períodos de persistencia más cortos que fluctúa de 14 a 109 días dependiendo de la textura y profundidad del suelo, por ejemplo en un suelo arcilloso de Iowa a la profundidad de 100 cm permaneció 55 días (Weed et al., 1995). Mientras que en Nebraska con similar tipo de suelo tuvo una persistencia de 42 a 50 días (Ghadiri et al., 1984). En Maryland en un suelo franco arcilloso a la profundidad de 10 a 30 cm el herbicida permaneció de 26 a 35 y 60 días, respectivamente (Helling et al., 1988; Isensee y Sadeghi, 1994). En Ohio los residuos de atrazina permanecen durante dos ciclos de cultivo a la profundidad de 0 a 15 cm, pero se calcula que en ambos periodos la mayor parte del herbicida se disipa durante los primeros 35 días (Workman et al., 1995), la degradación de atrazina en suelos arcillosos de Nebraska bajo los sistemas de labranza de conservación y convencional han alcanzado niveles de hasta del 75% a los 61 días después de su aplicación (Ghadiri et al., 1984). Otros investigadores consideran que los sistemas de labranza presentan muchas bondades, sin embargo resulta difícil generalizar la influencia que tiene sobre la persistencia de la atrazina, ya que el efecto de la labranza actúa sobre las características físicas y químicas del suelo, por lo que la labranza como tal, no tiene efecto, pero la permanencia de las partes vegetales y su consecuente descomposición conjuntamente con las condiciones climáticas, tiene efectos que favorecen la disipación de la atrazina y de sus residuos (Gaynor et al., 1987). 2.5 Transformación de la atrazina en el suelo La molécula de atrazina es muy estable, por ello existe una relativa resistencia al ataque microbiano. No obstante existen otros elementos del suelo que pueden inducir hidrólisis química de la atrazina vía hidroxiatrazina la cual corresponde a la forma no fitotóxica (Armstrong et al., 1967; Harris, 1967b; Skipper et al., 1967; Armstrong y Chester, 1968). Las pérdidas por volatilización, arrastre superficial y degradación de la atrazina, han sido ampliamente investigados (Curran et al., 1992; Fleming et al., 1992; Yen et al., 1994; Machado-Neto y Victoria-Fiho, 1995; Sadeghi y Isensee, 1997;), los sistemas de labranza se han utilizado para evaluar varios de estos fenómenos, tomando en cuenta la capacidad de detención que la materia orgánica tiene hacia la molécula de atrazina (Fig. 1), y la interacción con la degradación independiente del suelo (Sadeghi et al., 1998). Figura 1. 6-cloro-N-etil-N´-(1metiletil)-1,3,5-triazina-2,4-diamina (atrazina) La atrazina puede ser transformada a través del mecanismo hidrolítico que incluye: declorinación hidrolítica, N-desalquilación, desaminación y la desunión de los anillos. Encontrándose que los metabolitos más comunes de atrazina son: hidroxiatrazina (HA) (6-hidroxi-Netil-N’-(1-metil etil)-1,3,5 triazina-2,4- diamina), desetilatrazina (DEA) (6-cloro-N-(1-metil etil)-1,3,5-triazina –2,4 diamina), desisopropilatrazina dietildesisopropilatrazina (DEDIA) (DIA) (6-cloro-N-etil-1,3.5-triazina) (6-cloro-1,3,5-triazina –2,4 y diamina), también incluyen algunos otros productos hidroxilados análogos de (DEA, DIA y DEDIA) estas reacciones de transformación o de degradación puede deberse a factores bióticos o abióticos (Barrett, 1996). (Fig. 2). 2.5.1 Factores abióticos responsables de la degradación de atrazina En la naturaleza se encuentran algunos factores que pueden afectar la degradación de la atrazina por ejemplo. Si las temperaturas son bajas o bien si los suelos presentan deficiencia de nutrientes y una pobre comunidad microbiana la degradación puede ser nula (Scribner et al.,1992). La cantidad de carbono y nitrógeno presente en el suelo también influyen en la mineralización de la atrazina (Assaf y Turco, 1994), y su persistencia en el ambiente, está en función de la flora microbiana nativa y cuando no existe degradación en un sitio, lo más probable es que los microorganismos no presentan las enzimas específicas que provoca la degradación biológica o bien están ausentes (Cook, 1987). Las propiedades del suelo son muy importantes, un alto contenido de arena, favorece la lixiviación del herbicida debido a que estos suelos carecen de materia orgánica y arcilla, lo cual limita la habilidad para atenuar el movimiento de los agroquímicos, por lo tanto son fácilmente desplazados a zonas donde los microorganismos degradadores están ausentes (Schmidt y Kessler, 1989; Burkart y Kolpin,1993). Suelos sin cubierta vegetal presentan poca capacidad de retención de la atrazina y según estudios pueden llegar alcanzan hasta 28 µg/g de suelo (Shelton et al., 1995), en este tipo de suelos las turbulencias del aire modifican la concentración, peso y tamaño de las moléculas del herbicida, dispersándolo en forma de vapores tóxicos a la atmósfera (Glotfelty et al., 1983). La estabilidad de los residuos de la atrazina está asociada al contenido de humedad que proporciona la materia orgánica del suelo, pero especialmente las partícula de tamaño de 0.2 a 2.0 µm (Barriuso y Koskinen, 1996; Barriuso et al., 1997). En la disipación de atrazina y sus metabolitos, además de los factores ya mencionados participan la temperatura, volatilización, adsorción, absorción por las plantas, transporte o arrastre a través del suelo, manejo del suelo y cultivo Koskinen y Clay, (1997). La degradación fotoquímica se lleva a cabo a través de la luz solar y solo ocurre sobre la superficie del suelo. Mediante la degradación de un plaguicida se derivan una serie de procesos, mismos que pueden formar subproductos. Si el plaguicida se mineraliza totalmente es convertido en CO2, y una parte del carbono es transformada en humus por los microorganismos del suelo. También se pueden formar otros productos degradados muy estables y subproductos que pueden adherirse a la fracción del suelo (Fomsgaard, 1995). Este mismo autor señala que la degradación química no tiene mucha importancia en la transformación total del plaguicida en el subsuelo. Además la transformación de la atrazina puede estar dada por pH, concentración de carbono orgánico Sobresaliendo el agua en el suelo y contenido de humedad. y el pH como los elementos más importantes precursores de la hidrólisis (Widmer et al., 1993). Altas concentraciones de carbono orgánico en el agua y suelo favorece la hidrólisis de la atrazina o puede descomponerse químicamente en una solución de radicales libres (Koskinen et al., 1994). O el herbicida es ampliamente adsorbido (Y ing y Williams, 2000). Se ha encontrado que un pH alto disminuye la degradación de atrazina (Obien y Green, 1969; Holford et al., 1989). Aunque otros estudios con suelos ácidos y alcalinos, han revelado degradación importante a través de una transformación química directa, cuyo metabolito principal es hidroxiatrazina (Qiao et al., 1996). No obstante se ha determinado que en suelos alcalinos la atrazina es fácilmente lixiviada, el inconveniente es que rápidamente se transporta a las capas inferiores del suelo donde se dificulta su degradación por la ausencia de factores que actúan sobre el herbicida (Holfor et al., 1989). La adsorción de la atrazina puede disminuir si antes se regula la acidez del suelo mediante la aplicación de amoniaco (Clay et al., 1996), y la adición de hidrógeno y luz ultravioleta acelera la degradación con la cual se obtiene amelina vía hidroxilación directa y desalquilación (Sanlaville et al., 1996). Solo que una parte del herbicida es removido del suelo por volatilización, pudiendo alcanzar hasta el 1% (Langenbach et al., 2000), mismo que se acumula en la atmósfera, los que a través de las precipitaciones pluviales es devuelto a los sistemas acuáticos (Miller et al ., 2000). En climas con precipitación pluvial promedio de 386 mm y pH de 8.5 la atrazina tiene escaso movimiento y se dispersa no más allá de los 40 cm de profundidad del suelo alcanzando degradarse a los 62 días después de la aplicación. Aunque después de este período de tiempo se ha encontrado hasta 0.02 g de atrazina por gramo de suelo, cantidades que han resultado ser tolerables por los cultivos de trigo, cebada y alfalfa (Stork, 1997). Asimismo (McGlamery y Slife, 1966; Clay et al., 1988; Goetz et al, 1988; Clay y Koskinen, 1990; Liu et al., 1995) sostienen que la atrazina es una molécula básica débil y que con un pH bajo rapidamente es protonizada, y los suelos con pH en el rango de 4 a 6 adsorben con mayor facilidad a la atrazina, que suelos con pH mayores y esto se acompaña de 1.0 a 1.9% de carbono orgánico la degradación del herbicida es mínima (Chapman y Cole, 1982). Bajo condiciones de laboratorio la atrazina con un régimen de humedad de 0.1 bar resultó ampliamente degradada por una acción no biológica llamada desalquilación (Dao et al., 1979). En el suelo estéril la atrazina puede ser transformada preferentemente a hidroxiatrazina, mediante hidrólisis no biológica (Li y Felbech, 1972). En tanto que los suelos no estériles con materia orgánica la degradación descomposición de los de la atrazina componentes dependerá orgánicos y del la estado de presencia de microorganismos (Benoit y Preston, 2000). Se ha determinado también, hidrólisis química de varios compuestos derivados de cloro-1,3,5-triazinas, en soluciones alcalinas, notándose el desplazamiento nucleofílico del Cl por OH, mientras que en medios ácidos ha resultado una protonación del átomo de nitrógeno de la cadena, seguida por el rompimiento de unión C-Cl. La protonación del átomo de nitrógeno crea una deficiencia electrónica de unión del carbono con el cloro, el cual incrementa la tendencia al desplazamiento nucleofílico del Cl por el agua (Horrobin, 1963). A continuación se presenta el proceso de descomposición abiótica de atrazina vía hidrólisis química (Skipper et al., 1967; Armstrong y Chester, 1968) (Fig. 3). La atrazina también, puede ser degradada a través del proceso de ozonación y adición de radicales OH. Con este proceso se ha demostrado que el grupo etil es más reactivo que el grupo isopropil, lo que significa que a mayor proporción del grupo etil puede causar una oxidación directa a acetamida o derivados de imina vía proceso desalquilación. En contraste, el grupo isopropil provoca una desalquilación directa del grupo amino libre (Acero et al., 2000). 2.5.2 Factores bióticos responsables de la degradación de la atrazina La cantidad de microorganismos que se encuentran en el subsuelo a menudo es 100 veces más pequeña que los encontrados en la capa superior del suelo, esto se demostró en suelos Daneses donde se encontró 109 bacterias /g de suelo extraído a la profundidad de 1 m y 10 bacterias /g de suelo extraído a la profundidad de 5 a 6 m, la presencia de esta gama de microorganismos debe garantizar la degradación o eliminación de compuestos tóxicos presentes en el suelo mediante la acción de enzimas de origen vegetal y microbiano que son liberadas e inmovilizadas sobre los coloides del suelo (Tortensson, 1980). Algunas enzimas hidrolíticas con potencial importante para metabolizar herbicidas son: amidasas, esterasas, fosfatasas, arilsulfatasas y ureasas. De las cuales las esterasas llevan a cabo la hidrólisis de diclofop-metil ester convirtiéndolo en ácidos libres. Las esterasas y las hidrogenasas son indicadoras de actividad microbiana; mientras que las fosfatasas y sulfatasas están relacionadas con el ciclo de nutrientes (Gaynor et al., 1992). Otros microbios presentan enzimas que son sintetizadas en presencia de ciertos substratos (Spain et al.,1980; Spain y Veld, 1983), generalmente estas moléculas son altamente tóxicas y persistentes, pero que mediante la acción de dichas enzimas específicas son fácilmente degradadas (Alexander, 1999). Diversas poblaciones de microorganismos degradan orgánicos y plaguicidas dirigidos al control de los materiales plagas, malezas y enfermedades. El inconveniente es, que estos compuestos sean metabolizados antes de que ejerzan acción sobre el organismo objeto a control, lo cual significaría pérdida para el agricultor, de lo cual no hay reportes (Racke, 1990). Los microorganismos representan el elemento más importante del ambiente ya que estos realizan una mineralización completa de la atrazina en el suelo. Definiéndose a la mineralización como la degradación completa del substrato a CO 2 y H2O y a la degradación como la alteración del substrato original, pero no necesariamente a CO2, por lo que la degradación microbial en el suelo está en función de la habilidad, cantidad de microorganismos y la disponibilidad del herbicida (Entry y Emmingham, 1995). Muchos compuestos tóxicos son degradados co-metabolicamente. Es decir, a través de un proceso en que los microorganismos mientras crecen a expensas de un substrato, son capaces de transformar un compuesto sin que se derive algún nutriente o energía para su crecimiento (Bollag y Liu, 1990). Además, existe otro mecanismo llamado co-oxidación, en este caso del substrato se forman análogos los cuales son degradados por enzimas no específicas. Se considera que esta es la forma como se degradan los herbicidas muy persistentes (Schmidt et al., 1985). Entre los microorganismos que metabolizan plaguicidas se encuentran diversos grupos de bacterias que incluyen miembros de los géneros Klebsiella (Jutzi et al., 1982;), Alcaligenes, Flavobacterium, Pseudomonas, Nocardia y Rhodococcus sp. (Behki et al., 1993). Estos microbios requieren de condiciones ambientales que favorezcan su actividad (Aislabie y Jones, 1995). Dentro de los hongos Phanerochaete chrysosporium (Hickey et al., 1994; Mougin et al.,), Pleurotus pulmonarius (Masaphy et al., 1996a) entre otros. Muchas bacterias y otros microorganismos utilizan a la atrazina como fuente de carbono, nitrógeno y energía (Racke y Coats, 1990; Radosevich et al., 1995). Las cepas nativas de Nocardia y Pseudomonas, presentan capacidad para gran degradar las cadenas de la atrazina (Cook et al., 1978; Mandelbaum et al., 1995), otra bacteria competente para mineralizar a la atrazina es Agrobacterium radiobacter JI4a (Struthers et al., 1998). Las Pseudomonas de la cepa ADP utiliza a la atrazina como única fuente de nitrógeno, el metabolismo de esta triazina da como resultado a la hidroxiatrazina, metabolitos polares y dióxido de carbono. Este último es liberado en un 80% lo cual indica una completa mineralización de los anillos. Por lo cual esta bacteria esta considerada como la más sobresaliente dentro del proceso de biorremediación (Mandelbaum et al.,1993a; 1995). Las bacterias Pseudomonas con RNA del grupo I conocida también como DSM 93-9 es una cepa no específica para degradar a la atrazina, sin embargo cuando se le adiciona atrazina en el medio en el que se encuentra cultivada, lo utiliza eficientemente como fuente de carbono y ha llegado a crecer hasta 80 g de peso seco por mol de atrazina (Yanze-Kontchou y Gschwind, 1994). En suelos agrícolas con historial de aplicaciones de atrazina arriba de los 10 años está demostrada la hidroxilación de la atrazina por bacterias adaptadas a través de oxígeno 18 (Mandelbaum et al., 1993b). El hongo transformación Phanerochaete chrysosporium es responsable de la de los herbicidas s-triazinas. Este oxida los metabolitos clorinados formados durante la N-desalquilación de atrazina y la hidroxiatrazina resultante del proceso es convertida en un producto desconocido, a través del fenómeno de transformación por el sistema citocromo p-450 (Mougin et al., 1997). En condiciones de laboratorio ha sido evaluado el potencial del hongo P. chrysosporium para biorremediar suelos solamente se encontró una biorremediación contaminados con atrazina y escasa y lenta, se cree que la transformación se debe a la catálisis por enzimas asociadas con otras peroxidasas capaces de biodegradar (Hickey et al., 1994). Pleurotus pulmonarius estimuló la N-desalquilación En cambio y propilhidroxilación, (Masaphy et al., 1996b). Otros microorganismos importantes en la degradación de atrazina, simazina, propazina y cianazina son Rhodococcus sp cepa TE1 (Behki et al., 1993), y Streptomyces cepas PS/5 después de la aplicación con el 78% de degradación 28 días y lo utiliza como fuente de carbono y nitrógeno (Fadullon et al.,1998; Shelton et al., 1998). 2.5.2.1 Principales microorganismos capaces de degradar la atrazina Con respecto a los microorganismos que presentan potencial degradativo de la atrazina se reporta a Rhodococcus (Behki et al., 1993, Behki y Khan, 1994). Pseudomonas (Behki y Khan, 1986; Yanze-Kontchou y Gschwind, 1994; Mandelbaum et al., 1995; De Souza et al., 1998), Acinetobacter calcoaceticus (Mirgain et al., 1993), Clavibacter michiganese (De Souza et al., 1998) Agrobacterium radiobacter (Radosevich et al., 1997; Struthers et al., 1998), Klebsiella pneumonidae (Karns y Eaton, 1997); los actinomicetos Nocardia (Giardi et al., 1985) y Streptomyces (Fadullon et al., 1998); y los hongos Phanerochaete chrysosporium (Hickey et al., 1994), Pleurotus pulmonarius (Masaphy et al.,1993), En la Fig.3 se puede observar la ruta degradativa de atrazina cuando es atacada por algunos de estos microorganismos. Los metabolitos desalquilados pueden ser desalogenados por Rhodococcus (Shao et al.,1995) y por Pseudomonas sp y otros géneros de bacterias (Behki y Khan, 1986). Rhodococcus sp cepa NI86/21 degrada también a la atrazina vía N-desalquilación a hidroxipropil (Nagy et al., 1995a). Asimismo se ha identificada una cepa mutante de Rhodococcus sp NI86/21 y la FAJ2027 y Rhodococcus erythropolis SQ1 con potencial degradativo de la atrazina (Nagy et al., 1995b; 1995c). La mezcla de Rhodococcus corallinuos y Pseudomonas sp de la cepa NRRL B-12228 proporcionan un metabolismo completo de dietilsimazina (2-cloro-4amino-6-etilamino-1, 3,5-triazina) (Cook y Hutter, 1984) y la mezcla de Pseudomonas sp cepa NRRL B-12228 y cepa NRRL B-12227, llevan a cabo la declorinación y alquilación parcial de los anillos de la s- triazina (Cook y Hutter, 1981). Atrazina Pseudomonas sp cepa ADP atrazina clorohidrolasa Atrazina Rhodococcus spp cepa NI86/21, TE1 Pseudomonas spp cepa 192 y 194 Streptomyces sp cepa PS/5 atrazina monooxigenasa Hidroxiatrazina Atrazina Rhodococcus spp cepa NI86/21, TE1 Pseudomonas spp cepa 192 y 194 Streptomyces sp. cepa PS/5 atrazina monooxigenasa Desisopropilatrazina Rhodococcus corallinus cepa NRRLB-15444R hidroxiatrazina etilamino hidrolasa Desetilatrazina Pseudomonas s pp. cepa 192 y 194 Nocardia sp desisopropil atrazinamonooxigenasa s-triazina hidrolasa dietilatrazina mono N-Isopropilamelide desisopropildesisopropildesetil hidroxiatrazina atrazina Pseudomonas spp.cepa 192 y194 desisopropildesetilatrazina hidrolasa desisopropilhidroxiatrazina aminohidrolasa N-Isopropil- Pseudomonas sp. cepa NRRLB-12227 s-triazina amelide hidrolasa Isopropilamino hidrolasa hidroxi 2,4-Dihidroxi-6-(N'-ethil)- 2-hidroxi-4,6-diamino- 2,cloro-4- amino-1,3,5-triazina 1,3,5-triazina (amelina) 6-amino Pseudomonas sp. cepa Pseudomonas spp.cepas 1,3,5triazina NRRLB-12228 NRRLB-12227 y 12228 2,4-dihidroxi6-(N´-ethil)-amino -1,3,5-triazina aminohidrolasa amelina aminohidrolasa 2-cloro-4hidroxi-6-amino 1,3,5-triazina nohidrolasa 2,4,-Dihidroxi-6-amino 1,3,5-triazine (Ammelide) amelide aminohidrolasa 2-cloro-4,6dihidroxi-1,3,5triazina 2-cloro-4,6dihidroxi-1, 3,5-triazina hidrolasa ácido cianurico Ácidocianurico amidohidrolasa Biuret Biuret amidohidrolasa Urea Ureasa Dióxido de carbono Figura. 4. Mapa de la ruta metabólica de atrazina (Wackett, 1998). 2.5.3 Los sistemas de labranza, como práctica importante en el proceso degradativo de atrazina En los sistemas agrícolas, el manejo de los residuos de vegetales, como una perspectiva hacia la agricultura sustentable, proporcionan muchos beneficios al suelo incluyendo la protección de la erosión, conservación de humedad, evitan la evaporación y disminuyen la emergencia de malezas (Locke y Bryson, 1997). La permanencia de los residuos del cultivo sobre el suelo mantiene un alto contenido de humedad y carbono orgánico, lo cual forma un ambiente favorable para la actividad microbiana del suelo, que influyen en gran medida en el tamaño y composición de la población (Wagner y Chahal, 1966; Doran, 1980a; Linn y Dorán,1984; Franzluebbers et al.,1994). La cubierta del suelo a través de los residuos del cultivo, restablece las poblaciones microbianas y se reduce el laboreo con lo cual favorece a las poblaciones de bacterias, actinomicetos y hongos (Doran, 1980b), inhiben los efectos de la atrazina sobre las poblaciones de microorganismos nitrificantes (Hendrix et al., 1988; Rothrock y Hargrove, 1988). Además la materia orgánica favorece la volatilización y fotodegradación de la atrazina, esta intercepta al herbicidas y permite que les llegue ya que la luz directa del sol y lo predispone a elevadas temperaturas, movimiento del aire y su consecuente evaporación, por lo tanto son importantes en la ruta de degradación (Banks y Robinson, 1982; Mills et al., 1989). En el Cuadro 1, se presentan algunos estudios donde se ha demostrado que el manejo de residuos vegetales tienen un efecto significativo sobre la disipación y fijación de residuos fitotóxicos. Cuadro 1. Persistencia de la atrazina en suelos con manejo de residuos vegetales. Práctica de manejo Localización Prof. del suelo (cm) Residualidad promedio (días) Fuente Convencional /Conservación Convencional (trigo) Convencional (sorgo Conservación (sorgo) Conservación (maíz) Conservación (maíz) Convencional/Conservación (maíz) Conservación con cal (maíz) Conservación sin cal (maíz) Iowa Washington Nebraska Nebraska Maryland Maryland Maryland Kentucky Kentucky 0 - 25 55,31 Barcker y Johnson, 1979 0 - 76 0-10 102,112 42 50 71 60 26-35 Brown et al., 1985 Ghadiri et al., 1984 0-20 0-120 0-50 0-15 Gish et al., 1986 Helling et al., 1988 Isensee y Sadeghi, 1994 32 22 Kells et al., 1980 Está probado que el sistema de labranza cero influye en la transformación, retención y transporte de la atrazina. La humedad, temperatura, pH y materia orgánica propias de este sistema induce la actividad microbiana de oxidación de la molécula de la atrazina. No obstante, las interacciones de las prácticas de manejo del cultivo aun se les desconoce su efecto neto sobre la persistencia y movimiento de este herbicida en el suelo (Koskinen y Clay, 1997). La actividad del hongo de la pudrición de la raíz Pleurotus pulmonarius, asociado con paja de algodón y arroz se ve favorecida e incrementa de manera significativa la clorinación y declorinación de atrazina (Masaphy et al., 1996b). La dispersión de la atrazina a través de la lluvia en suelos con vegetales durante 1987 a 1991 fue registrada de los 10 residuos a 50 cm de profundidad durante los dos primeros meses fue de 22 a 59% y 47 a 73% en cero labranza y labranza convencional, respectivamente (Isensee y Sadeghi, 1994). EL incremento de las lluvias aumenta significativamente el arrastre de la atrazina y desetilatrazina en labranza convencional, a diferencia de labranza cero donde los residuos de atrazina permanecen en mayor cantidad y en tiempos más prolongados (Masse et al., 1996). Mediante la incorporación de bacterias degradadoras de atrazina al suelo se ha registrado degradación de los anillos y su mineralización completa dos días después de su aplicación en el sistema de labranza cero y siete días después en labranza convencional (Radosevich et al., 1997). El resultado inmediato de la labranza de conservación se debe a las cantidades importantes de carbono orgánico que conserva el suelo (Novak et al., 1996), y que coadyuva, para mantener activa la comunidad microbiana que mineralizadora atrazina (Ostrofsky et al., 1997). Asimismo (Novak et al., 1996) encontró que la labranza de conservación adsorbe de manera significativa a la atrazina que se encuentra a la profundidad de 3 cm y deja que se lixivie una mínima cantidad (Cuadro 2). Cuadro 2. Pérdida de atrazina por arrastre en distintos sistemas de labranza Práctica de manejo Convencional Convencional (maíz) Conservación (maíz) Convencional (maíz) Conservación (maíz G) Conservación (maíz E) Subsueleo (punzón) Conservación Conservación (maíz) Subsueleo (arado) Conservación l (maíz) Pérdida de atrazina (%) 1.2-7.7 0.65 1.15 0.9-2 3.7-8.86 1.6-7.2 1.89 1.09 1.83 1.32 0.75 Duración del estudio 3 años Tipo de lluvia Natural Fuente 2 años Isenseey Sadeghi,1993 2 años Natural Natural simulada 4 años Simulada Pantone et al., 1996 1 año Simulada Seta et al., 1993 Gaynor et al.,1992 Myers et al., 1995 2.5.4 Incorporación de abono al suelo y su efecto en el proceso degradativo de atrazina El suelo es considerado como un medio ambiente complejo donde los compuestos orgánicos pueden ser adsorbidos, precipitados, lixiviados, volatilizados y degradados. En este sentido la materia orgánica es un factor clave, ya que al humificarse se convierte en un importante amortiguador, favorece el intercambio ionico, puede servir como un surfactante, como quelante y en general un absorbente (Kozak, 1996). Muchos estudios han confimado que la fracción orgánica del suelo esta altamente relacionada con la actividad del herbicida (Upchurch et al., 1962; Harris 1966; Upchurch et al.,1966), además está involucrada en la adsorción (Harris y Warren, 1964; Harris y Sheets, 1965; Nearpass, 1965; Talbert y Fletchall, 1965; Grover, 1966; Harris, 1966; McGlamery y Slife, 1966; Harris, 1967a; Day et al.,1968; Lavy, 1968) y la hidrólisis de los herbicidas s-triazinas (Armstrong et al., 1967; Harris, 1967b; Armstrong y Chesters, 1968). La acumulación de residuos vegetales en el suelo, incrementa el contenido de carbono orgánico, estimula la actividad microbiana y enzimática, facilita la degradación, así como la transformación bioquímica de los herbicidas (Locke y Bryson,1997), cuyas propiedades del suelo y del metabolito son muy importantes para el proceso degradativo ya que algunos compuestos son rápidamente metabolizados y otros son más persistentes (Locke et al., 1996). La adición de remediadores orgánicos al suelo tiene influencia directa sobre el pasaje, ruta degradativa de los plaguicidas y la velocidad con que estos fenómenos se lleven acabo dependen de la naturaleza y de su grado de descomposición de estos materiales (Alvey y Crowley, 1995), lo cierto es que los remediadores orgánicos proporcionan al suelo carbono y nitrógeno, elementos que favorecen una mayor actividad microbiana los cuales actúan sobre la biotransformación de los plaguicidas (Hance, 1973), y reducen la lixiviación, promueven la adsorción y degradación (Cox et al., 1999; Sluszny et al., 1999). La materia orgánica en el suelo proporciona humedad, además estimula la actividad biológica y favorece la degradación de desetilatrazina, atrazina, desisopropilatrazina y otros productos polares (Kruger et al., 1997) durante la descomposición de la materia orgánica se producen materiales húmicos, los cuales tienen efectos considerables sobre la catálisis e hidrólisis de los grupos funcionales de atrazina. Sin embargo, no se ha encontrado catálisis de los iones carboxilados durante la síntesis del ácido fúlvico, el cual se ha cuantificado y caracterizado mediante los valores de distribución de los iones de hidrógeno disociados de los grupos carboxílicos (Gamble y Khan, 1985). Esta demostrado que la adición de materia orgánica de fácil descomposición y residuos de cultivos estimula la actividad microbiana en el suelo (Entry y Emmingham, 1995). En cambio las altas concentraciones de nitrógeno y la adición de fertilizantes orgánicos inhiben la actividad microbiana (Donnelly et al., 1993) o se produce muy poca mineralización de la atrazina en el campo (Rouchaud et al., 1996). Además se ha confirmado que la mineralización de la atrazina puede ser substancialmente estimulada cuando se adiciona al suelo substratos que contengan carbono tales como celulosa, abono verde y paja (Yassir et al., 1998). La composta con desechos municipales induce un menor porcentaje de degradación de atrazina, en cambio la de paja se ha encontrado una alta actividad enzimática, lo cual permite una mayor degradación, destacando la producción del metabolito hidroxiatrazina (Houot et al., 1998). Esto demuestra que la mineralización del herbicida depende del grado de transformación de la materia orgánica (Benoit y Preston, 2000) y la cantidad de su metabolito hidroxiatrazina en el suelo es controlado por la cantidad de atrazina adsorbida, lo que a su vez, está en función el contenido de materia orgánica, arcilla y pH. Mismos que pueden propiciar una muy buena adsorción de atrazina y una posterior hidrólisis (Lerch et al., 1999). La desorción de atrazina está negativamente correlacionada con el contenido de materia orgánica y positivamente correlacionada con el pH del suelo (Jenks et al., 1998). Existen reportes que indican que la materia orgánica dispersada sobre las aguas negras de riego puede disminuir los riesgos de contaminación de las aguas subterráneas, ya que esta, adsorbe los contaminantes y los predisponen al ataque de los microorganismos degradadores (Celis et al.,1998). La celulosa induce cambios en la comunidad bacteriana, proporcionando condiciones favorables para que estas se multipliquen, mismas que por la cantidad de su biomasa degradaran más rápidamente a la atrazina. En cambio los hongos son relativamente afectados por los diferentes tipos de substratos como fuente de carbón y la glucosa ayuda a la activación de la mineralización de atrazina co-metabolicamente, la cual es controlada por la tasa de liberación de substratos polimerizados fácilmente disponibles y listos para ser metabolizados a co-substratos de bajo peso molecular (Yassir et al., 1998). No todos los abonos incorporados al suelo tienen el mismo efecto sobre el pasaje y la ruta degradativa de los pesticidas. La velocidad de estos procesos dependen de la naturaleza de los abonos orgánicos, es decir del contenido de proteínas, fibras, almidones, cenizas entre otros (Alvey y Crowley, 1995). Por tanto los procesos degradativos y de mineralización del herbicida en la capa superior del suelo siempre será mayor ya que en ella, se encuentra la zona de germinación de las malezas elevada cantidad de materia orgánica y mayor actividad microbiana (Isensee y Sadeghi 1994; Sadeghi y Isensee 1997). Es evidente que la materia orgánica del suelo juega un papel importante y está directamente involucrada en la formación de los residuos de los plaguicidas en general, aunque la función de los diferentes compuestos orgánicos aun no se conocen, pero se sabe que la mayor estabilidad de unión de los residuos de plaguicidas esta asociada con la capacidad que tiene la materia orgánica para mantener humedad (Barriuso y Houot, 1996). 2.5.4.1 Estudios relacionados con la movilidad de atrazina en el suelo La atrazina y sus metabolitos desalquilados son muy persistentes y su movilidad está en razón de su baja afinidad con los constituyentes del suelo, ya que su coeficiente de adsorción (L kg -1) va de 0.47 (Seybold et al., 1994) a 8.7 (Clay y Koskinen, 1990), además depende de la textura y contenido de materia orgánica. Numerosos remediadores orgánicos han sido utilizados con el objeto de disminuir la lixiviación y el arrastre superficial. Al respecto el estiércol de cerdos y de ganado bovino retienen hasta un 50% de los residuos del herbicida (Rouchaud et al., 1994). Y la adición de subproductos lácteos incrementa la tasa de mineralización de atrazina (Gan et al., 1996). Los residuos vegetales sobre el suelo interceptan de manera significativa una porción del herbicida aplicado y lo predisponen al ataque de los microorganismos (Reddy et al., 1997). Así (Topp et al., 1996) con muestras de suelo que durante los últimos 4 años había recibido un tratamiento de 100 ton/ha de abono, les asperjó de 2.5 a 25 µg de atrazina por gramo, los resultados revelaron una degradación completa 18 días después del tratamiento. En otra investigación se encontró que la parte vegetativa sin triturar de chícharo Pisum sativum L incorporada al suelo como abono verde incrementó la degradación de hidroxiatrazina a los 10 días de incubación (Horswell et al., 1997). Mientras tanto, los estudios dirigidos para medir la dispersión de varios contaminantes a través del flujo del agua en el suelo y otros elementos en solución, se han empleado en muchos investigaciones columnas de pvc con suelo empaquetado (Fermanich et al., 1991; Loffredo et al., 1991). Esta técnica es ampliamente utilizada y permite estudiar el transporte de elementos de interés a través de columnas de suelo. En estas se pueden incluir el estudio de suelos perturbados o no (Vepraskas et al., 1990) empaquetados uniformemente en cilindros, donde el suelo puede tener diferente textura o densidad (Yaron et al., 1965). La movilidad de atrazina ha sido estudiada en suelos empaquetados en columnas (Bowman 1989; Alhajjar et al., 1990). No obstante en estos estudios no se ha tomado en consideración el efecto de los macroporos y el flujo preferencial del herbicida. Sin embargo las columnas son una herramienta muy importante utilizada para examinar el potencial de lixiviación de atrazina, sus principales productos degradados y dispersión de radioactividad (Schiavon, 1988 a,b). Asimismo (Fleming et al., 1992) utilizó columnas para conocer el movimiento de atrazina encapsulada y no encapsulada, en un suelo con un tamaño de poro de 0.44 volúmenes, en el cual se aplicó 7. 6 cm de espesor de agua sobre la superficie durante 2 h con lo cual se obtuvo una movilidad del 9-21% comparada con la atrazina no encapsulada. De igual manera las columnas han sido utilizadas para probar el efecto que tiene la cal agrícola (CaCO3) y Nitrógeno – nitrato (NO 3-N) sobre la movilidad de la atrazina en el suelo (Chinkuyu y Kanwar, 1999). 2.5.4.2 Condiciones del suelo La presencia o ausencia de microorganismos determina el destino de los compuestos presentes en el suelo. En este sentido está demostrado por estudios de laboratorio y campo que la tasa degradativa de ciertos pesticidas es limitada en ausencia de microorganismos. La eliminación de microorganismos a través de la esterilización del suelo es un tratamiento drástico considerado como un biocida de amplio espectro, el cual puede llevarse a cabo mediante medios químicos, utilizando fumigantes tales como: Bromuro de metilo, vapam o por medios físicos calentando suelo mediante solarización (Avidov et al., 1985) o a través de autoclave (Alvey y Crowley, 1996). En un suelo estéril tratado con atrazina se plantó maíz, el análisis respectivo de los residuos indicó que la hidroxiatrazina encontrada se formó a través del metabolismo de la planta, en tanto que, en el suelo no estéril se registró mineralización microbiana (Alvey y Crowley, 1996). Por su parte (Kruger et al., 1993 y 1997) en el suelo no estéril encontró que la atrazina se triplica su transformación a atrazina desetil y atrazina desisopropil de los 60 a 120 días de incubación, asimismo los productos polares se incrementan comparados con el suelo estéril. Otra investigación realizada por (Miller et al.,1997) reveló que en los suelos estériles se incrementa la residualidad de primisulfuron en un promedio mayor a 7 semanas. 2.6 Conclusiones de la revisión de literatura La atrazina es el herbicida más ampliamente utilizado en zonas donde se siembra maíz y sorgo, es fácil de manejarlo, es relativamente barato y además presenta un eficiente control de las malas hierbas. Su uso continuo e indiscriminado ha provocado acumulación de sus residuos en el suelo, pero principalmente en el agua que se encuentra en ríos, pozos, lagos, mares y agua subterránea, lo cual es un riesgo para la salud del ambiente y humana. En países como Estados Unidos de Norteamérica, Canadá, Francia y Alemania muchos trabajos han sido abordados desde la degradación por plantas nativas y el mismo cultivo, incorporación de materia orgánica al suelo en forma de desechos de animales, de residuos vegetales y adición de reguladores de pH´s del suelo entre otros. Sin embargo dichos estudios aún son insuficientes y principalmente en condiciones de campo que es donde los pocos intentos hechos hacia la aplicación de los resultados obtenidos en condiciones controladas han sido poco certeros. Con relación a los trabajos hechos en México la realidad es que falta mucho por hacer y pudiera plantearse una línea que este relacionada con la biorremediación donde se incluya en primer lugar: La caracterización de los microorganismos nativos con potencial degradativo sobre atrazina, Estudios relacionados con la interacción que los microorganismos tienen en el proceso degradativo de la atrazina en medios enriquecidos y no enriquecidos con diferentes componentes orgánicos, Buscar que fuente de carbono y energía favorece la actividad microbiana. Misma que conduzca a una mayor degradación de la atrazina y de sus diferentes metabolitos. Otro estudio sería la búsqueda de la estructura genética de los microorganismos biodegradadores recolectados en sitios donde se ha utilizado de manera intensiva la atrazina para controlar malezas y por último estudios de adaptación de aquellos microorganismos modificados genéticamente. III MATERIALES Y MÉTODOS 3.1 Ubicación geográfica del sitio experimental La presente investigación se llevó a cabo en las instalaciones del área de Posgrado de la Facultad de Ciencias Biológicas y Agropecuarias de la Universidad de Colima, ubicada en Tecomán, Colima a 33 msnm, con 18° 54' de latitud Norte y 103° 52' de longitud Oeste. El clima es considerado como cálido seco (BS) con una precipitación media de 710 mm anuales, la temperatura de 26°C y una humedad relativa de 71.33 % (SPP, 1985). 3.2 Suelo. El suelo seleccionado para llevar a cabo la investigación, se ubica en un predio agrícola del ejido Pueblo Juárez, Municipio de Coquimatlán, Colima, México. Mismo que se encontraba preparado para el establecimiento del cultivo de la sandia (Citrullus lanatus L). Pero de acuerdo a antecedentes, este terreno había sido cultivado por varios años con el monocultivo de maíz y recibido aplicaciones de atrazina. Previo al experimento se obtuvieron muestras de suelo por el método zigzag recomendado por Jackson (1958) y se determinaron las características físicas, químicas, biológicas y la presencia de residuos de atrazina a través de cromatografía de gases. Una vez caracterizado el suelo del predio agrícola antes mencionado, se recolectaron al azar 24 submuestras de suelo a la profundidad de 0 a 30 cm (Kruger et al., 1993; Sorenson et al., 1993). Este suelo se mezcló homogéneamente y se tamizó con una malla de 60.35 mm. De esta mezcla se hicieron 24 porciones de 14.5 kg c/u de las cuales 12 no se esterilizaron y 12 se esterilizaron a través de autoclave a 121°C durante 30 min, a intervalos de un día entre esterilización, esta operación se llevó a cabo 3 veces (Kruger et al., 1997). Posteriormente, tanto al suelo esterilizado como el no esterilizado ya empaquetado en columnas de cloruro de polivinilo (PVC) se les adicionó su respectivo nivel de abono verde, donde fue completamente mezclada. 3.3 Descripción de las columnas utilizadas Cada unidad experimental estuvo compuesta por una columna de cloruro de polivinilo (PVC) de 50 cm de altura y un diámetro de 20 cm, estas fueron parafinadas antes de empacar el suelo con el fin de evitar el flujo de pared durante el proceso de lavado. El proceso de parafinado se llevó a cabo mediante la inmersión de los tubos de PVC en parafina líquida previamente fundida a una temperatura mayor de 50º C. En el fondo de cada columna se les sujetó una malla plástica de 1.0 mm, sobre la cual se suspendió un papel filtro Whatman # 42 con el propósito de evitar la salida del suelo al momento del empacado y para dar mayor consistencia por la parte exterior se cubrió con plástico (Kruger et al., 1993), que en el centro tenían un orificio de aproximadamente 1.5 cm de diámetro, para que pasaran los productos lixiviados, los que se colectaron con un embudo de plástico de 20 cm de diámetro conectados a un matraz erlenmeyer de 500 ml (Fig. 5). Estas columnas se sujetaron dentro de un aro metálico que ayudó a fijar y mantener en forma vertical dichas columnas durante la fase experimental. Figura 5. Columna de PVC con suelo para estudiar el movimiento y degradación de atrazina. 3.4 Establecimiento del experimento La fuente de abono verde incorporada al suelo fue la leguminosa Canavalia ensiformis L. A los 2.5 meses de establecida en campo la parte aérea de la planta fue cosechada y triturada en un par de ocasiones con un molino de martillo que contenía una malla con orificios de 0.47 cm de diámetro previamente desinfectada con alcohol etílico al 70%. Posteriormente se mezcló con el suelo esterilizado y no esterilizado a razón de 0, 20, 30 y 40 toneladas por hectárea (Demetrio et al.,1998) y fueron empaquetadas en las columnas previamente descritas. Una vez que el suelo había sido empaquetado junto con el abono verde se inundaron con agua destilada esterilizada durante tres días, a partir del cuarto día, se adicionó a cada columna 200 ml de agua diariamente hasta completar 10 días. Lo anterior se realizó con el propósito de que las partículas del suelo ocuparan los espacios vacíos en forma natural y tomaran la humedad necesaria (Kruger et al., 1993). Después se suspendieron los riegos hasta alcanzar el 40% de humedad, en este momento se hizo la aplicación de la atrazina a través del producto comercial Gesaprim Combi 500 FW. Formulado por Ciba Agro S.A de C.V compuesto químicamente de Atrazina (2-cloro-4Etilamino-6-Isopropilamino-S-triazina) y Terbutrina (2-terbutilamino-4- Etilamino-6-Metiltio-1,3-5-triazina) equivalente a 250 g i.a/L c/u. El herbicida se aplicó a cada una de las columnas, la dosis que se utilizó fue de 4 mg/kg de suelo (=4 ppm) correspondiente a 1.5 kg de ingrediente activo por hectárea, el cual fue disuelto en 9 ml de agua desionizada y 1 ml de metanol ( 9:1 v/v) (Dousset et al., 1997; Kruger et al., 1997; Wenk et al., 1997), y se aplicó sobre un kg de suelo, este suelo tratado se acomodó sobre la parte superior de cada columna que ya contenían 13.5 kg de suelo y su respectiva cantidad de abono verde, con lo cual se completo la cantidad total de 14.5 kg por columna. El sistema de columnas, fue colocado en condiciones semicontroladas de invernadero con temperatura máxima y mínima promedio de 32.7 y 20.7°C respectivamente y humedad relativa de 65.66% en promedio. La humedad del suelo fue mantenida entre 50 y 70% de capacidad de campo, adicionando 200 ml de agua esterilizada cada tercer día. Dicha cantidad de agua fue determinada en base a un ensayo en blanco sobre la evaporación ocurrida diariamente durante un período de 15 días. Unicamente cada 15 días se inundó el suelo con 1000 ml de agua para provocar la lixiviación a través de las columnas para hacer las determinaciones de atrazina lixiviada. Adicionalmente a las columnas en el invernadero se establecieron 27 respirómetros tipo Bartha modificado, producción de CO 2, regidos bajo los cuales sirvieron para medir la los mismos tratamientos probados sistema de columnas, estos contenían 100 g de suelo cada uno. en el 3.5 Diseño experimental El experimento en columnas, se estableció bajo el diseño completamente al azar con arreglo trifactorial, (Ostle,1994) y tres repeticiones, donde el factor A fue la condición del suelo (suelo esterilizado y no esterilizado), el factor B fue el nivel de abono verde adicionado al suelo (0, 20, 30 y 40 ton/ha) y el Factor C fue el periodo de incubación, (60 y 120 días para la medición de las variables químicas; 5, 15, 45, 75, 105 días para la medición de la variable población microbiana y 15, 30, 45, 60, 75, 90, 105 y 120 días, para la medición de la variable degradación de atrazina), lo que dio un total de 16, 40 y 64 tratamientos respectivamente. El experimento en matraces Bartha, también se estableció bajo el diseño completamente al azar con arreglo trifactorial y tres repeticiones, cuyos factores de estudio fueron los mismos que los del experimento en columna, solo que en este caso el tiempo de incubación fue de 4, 6, 8, 10, 12, 14, 16, 18, 20 días, lo que dio un total de 72 tratamientos, además de un blanco con solo agua destilada estéril. El modelo de predicción de las variables dependientes fue: Yijkl= µ +α i+ β j+ γk +( α β ) ij+( α γ ) ik+( β γ )jk+( α β γ ) ijk +ε ijkl Donde: µ = media de tratamientos α i = Efecto verdadero de la iésima condición del suelo (esterilizado y no esterilizado) β j = Efecto verdadero del jésimo nivel de abono orgánico adicionado al suelo γk = Efecto verdadero del késimo período de incubación (αβ)ij = Efecto verdadero de la interacción de la iésima condición del suelo (esterilizado y no esterilizado) con el jésimo nivel de abono verde adicionado al suelo. ( α γ ) ik= Efecto verdadero de la interacción de la iésima condición del suelo (esterilizado y no esterilizado) con el késimo período de incubación. ( βγ ) jk= Efecto verdadero de la interacción de la jésima nivel de abono verde adicionado al suelo con el késimo período de incubación ( α β γ ) ijk= Efecto verdadero de la interacción de la iésima condición del suelo (esterilizado y no esterilizado) con el jésima nivel de abono verde adicionado al suelo y el késimo período de incubación. ε ijk= Este término representa la variación de Y ijkl cuya causa es inexplicable y que es de naturaleza aleatoria; es decir ε ijk representa al término de error experimental. 3.6 Variables evaluadas 3.6.1 Propiedades del suelo original 3.6.1.1 Densidad aparente La determinación de la densidad aparente se hizo a través del método del petróleo que consistió en seleccionar dos terrones de la muestra de suelo, cada terrón se dividió en dos partes iguales, una de las partes se pesó y se puso a secar en una estufa a 110°C, hasta obtener su peso constante. La otra parte del terrón se pesó y se introdujo a un recipiente con petróleo durante 30 min. Una vez saturado el terrón se introdujo en una probeta graduada parcialmente llena de petróleo y se midió el volumen desplazado por la muestra. Con los datos del terrón ya seco por medio de una estufa se calculó el contenido de humedad, le fue restada para obtener el peso del terrón seco ( Richards, 1954). 3.6.1.2 Densidad real Esta se llevó a cabo a través del método del picnómetro, para lo cual se pesó el picnómetro incluyendo su tapón y otros accesorios, se le agregó 10 g de suelo secado al aire; luego se determinó el contenido de agua de la muestra del suelo secado a 105°C con un duplicado de la misma. Se llenó el picnómetro hasta la mitad con agua destilada, para trasladar al fondo del mismo las partículas de suelo adheridas en el interior. Se puso a hervir suavemente el contenido del matraz por varios minutos, con agitación frecuente para prevenir pérdida del suelo por la formación de espuma. En seguida se enfrió el picnómetro y su contenido a temperatura ambiente y nuevamente el picnómetro se pesó con sus accesorios respectivos y se anotó la temperatura (Richards, 1954). 3.6.1.3 Textura La textura fue determinada a través del método de Bouyoucos. Se pesaron 50 g de suelo en un vaso de precipitado de 250 ml y se le agregó una lámina de 2 mm de agua destilada, calculando que con esta cantidad cubriera la superficie de dicho recipiente. Luego se adicionó 5 ml de oxalato de sodio saturado y 5 ml de metasilicato de sodio se agitó y se dejó reposar 15 min. Al término de este tiempo se sometió a agitación con un aparato agitador mecánico durante 15 minutos. El contenido se vació en una probeta con capacidad de 1 litro y lentamente se le adicionó agua destilada a dicho recipiente en donde se encontraba el hidrómetro de Bouyoucos, hasta completar un litro. Se retiró el hidrómetro y con un agitador de mano se suspendieron las partículas de suelo durante un minuto, a los 40 seg se tomó la lectura con el hidrómetro y dos horas después, se tomaron las temperaturas (Richards, 1954). 3.6.2 Características químicas del suelo durante la fase experimental Las propiedades químicas del suelo experimental se determinaron dos veces: 60 y 120 días después de la incorporación de atrazina y Canavalia ensiformis L. A la profundidad de 0-30 cm estas fueron: pH, carbono orgánico, relación carbono/nitrógeno (C:N) y nitrógeno (N). Estas propiedades también fueron determinadas al suelo original antes de la fase experimental. 3.6.2.1 pH del suelo El pH se obtuvo a través de una suspensión de suelo con agua destilada se agitó periódicamente obtuvieron las durante una hora. A partir de ese momento se lecturas sumergiendo los electrodos del potenciómetro Beckman a la solución (Richards,1954). 3.6.2.2 Carbono orgánico La determinación del carbono total se hizo mediante el método de Walkley y Black (1934) que consiste en pesar submuestras de 0.5 g de suelo y se vierten en un matraz erlenmeyer de 500 ml, fue necesario procesar un testigo sin suelo. Se añadió 10 ml de dicromato de potasio a 1N y 20 ml de ácido sulfúrico concentrado, se mezcló el suelo con el ácido y el dicromato en cada matraz. Se dejaron reposar los matraces durante 30 min. Posteriormente se añadió 200 ml de agua destilada, 10 ml de ácido fosfórico al 86% y 1 ml de indicador difenilamina sulfonato de bario (solución acuosa al 0.16%) esto último con pipeta volumétrica. La valoración se realizó con la solución de sulfato ferroso 1 N (disolviéndose 280 g de FeSO 4.7H2O de grado reactivo y 80 ml de H2SO 4 concentrado, se enfrió y diluyó en un litro agua). Este reactivo se tuvo que normalizar cada día por titulación en función de 10 ml de dicromato de potasio 1 N., ya el porcentaje de carbono orgánico en el suelo se estimó utilizando el factor de recuperación del 77% de Walkley (Allison, 1965). 3.6.2.3 Nitrógeno El contenido de nitrógeno se determinó a través del procedimiento propuesto por Bremner y Mulvaney (1982) que consistió en 1 g de suelo previamente seco, mismo que fue puesto en un matraz Khjeldal, posteriormente se le agregó una cucharada de selenio, 8 perlas de vidrio y 20 ml de H2 SO 4 concentrado, una vez hecha esta preparación; los matraces Khjeldal se dejaron en el digestor durante 90 min, para la destilación de la mezcla y una vez que ésta se había enfriado, se le adicionó 200 ml de agua destilada, 4 granallas de zinc, 125 ml de NaOH al 40%. El producto destilado se captó en matraces Erlenmeyer que contenían 20 ml de H3 BO 3, más 3 gotas de rojo de metilo y 3 gotas de verde de bromo cresol, en seguida el destilado recolectado se tituló con la solución 0.1 N de HCl hasta que el color verde que tenía el destilado cambió a rosa. 3.6.2.4 Relación Carbono –Nitrógeno Esta relación se calculó una vez que ya se conocía el contenido de carbono y nitrógeno, a través de la siguiente razón (C/N) Walkley y Black (1934). 3.6.3 Población microbiana Para estimar la población microbiana se tomaron 10 g de suelo a la profundidad de 0 - 30 cm de cada columna. La primera muestra se tomó un día antes de la aplicación de atrazina y las demás a los 5, 15, 45, 75 y 105 días después de su incorporación. El suelo antes de ser procesado fue secado en forma aislada bajo sombra al aire libre sobre bolsas de papel dextrasa. Posteriormente un gramo de suelo seco bajo sombra, fue mezclado con 9 ml de agua destilada desionizada esterilizado en un tubo de ensaye obteniendo de esta manera la solución madre, a partir de la cual se hicieron las diluciones de 10-2 hasta 10-9. De cada dilución se sembró 0.1 ml por triplicado en cajas de petri que contenían medio de cultivo selectivo y se incubaron a 26°C durante un periodo de 24 a 48 horas para las bacterias, de 48 a 96 h para los hongos y 9 a 14 h para los actinomicetos (Loss et al., 1979). Los conteos de las unidades formadoras de colonias (UFC) de bacterias y actinomicetos y el número de propágulos de hongos (Mislivec y Starck, 1984) se llevó a cabo en placas de agar nutritivo, papa dextrosa agar y agar nitrato caseina almidón, respectivamente. Para inhibir el crecimiento de hongos, en el conteo de bacterias se utilizó el antibiótico nistatina a una dosis de 7500 unidades por cada 100 ml de medio de cultivo y cloranfenicol a razón de 500 mg por litro de medio más el colorante rosa de Bengala a razón de 1 ppm en 30,000 de medio, para inhibir el crecimiento de bacterias cuando se estimó la población de hongos (Cho et al., 1994; Grossbard y Marsh, 1974; Martín, 1950). 3.6.4 Producción de CO2 Para medir la evolución de dióxido de carbono derivado del metabolismo aeróbico de los microorganismos se utilizaron respirómetros tipo Bartha modificado por Luna y Sanchez-Yañez, (1991) (Fig 6), los cuales estuvieron estructurados de un matraz erlenmeyer de 500 ml, donde se encuentran unidos dos tubos de ensaye de 18 mm de diámetro por 5 cm de longitud, estos fueron fabricados en el Centro Regional de Operaciones y Desarrollo de Equipo, dependiente de la Secretaría de Educación Pública en Celaya, Gto. México. El matraz estuvo provisto de un tapón de goma No. 7, al que se le adaptó un tubo de cristal empacado con algodón, fibra de vidrio, sílica gel y lentejas de NaOH para captar el CO2 atmosférico. Los tubos adyacentes también fueron sellados con un tapón de goma No. 2, se les insertó una aguja de 16 x 1.1/4 pulgadas de acero inoxidable, y se les adaptó una fracción de sonda para alimentación infantil de hule, para prolongar su extensión. 2 Figura 6. Respirómetro tipo Bartha modificado. Para medir la producción de CO 2 como producto de la actividad microbiana sobre atrazina. 1. Algodón, 2. Fibra de vidrio, 3. Sílica gel, 4. Hidróxido de sodio, 5. Aguja, 6. Matraz erlenmeyer, 7. Tapón de goma, 8. Jeringa, 9. Tubos de ensaye de 18 x 150, con NaOH a 0.5 N para capturar CO2. La extracción y reemplazamiento de la solución de NaOH al 0.5 N del respirómetro se llevó a cabo cada 48 h, en cada uno de los tratamientos y se vaciaron en matraces de 250 ml, agregándoles la misma cantidad en ml de BaCl2 al 1%. Posteriormente se aforó a 100 ml con agua destilada y se le agregó de 3-4 gotas de fenolftaleina que sirvió de indicador, luego se hizo la valoración con HCl al 0.5 N (Luna y Sánchez-Yáñez,1991; Mandelbaum et al., 1995; Shapir y Mandelbaum, 1997; Stotzky, 1965). El CO2 producido en mg se calculó con la siguiente fórmula: mg de CO2 producido =[(ml NaOH) (N NaOH)-(ml HCl) (N HCl)] x 22. 3.6.5 Análisis de residuos de atrazina 3.6.5.1 Curva de calibración Para llevar a cabo la curva de calibración se utilizaron los siguientes estándares: atrazina al 99.6% de pureza y sus metabolitos atrazina desetil-2-hidroxi 98% (DEHA), atrazina desisopropil 97% (DIA) y atrazina desetil 95% (DEA), (Supelco - Sigma -Aldrich Química S.A de CV.) Las soluciones de los estándares de atrazina y la de sus metabolitos fueron preparados el mismo día que se llevó a cabo la curva de calibración. La atrazina, atrazina desisopropil (DIA) y atrazina desetil (DEA) fueron preparados disolviendo 100 mg en 100 ml de acetato de etilo. Mientras que para diluir atrazina desetil-2-hidroxi se utilizó 50 mg en 100 ml de acetonitrilo acidificado con HCl a razón 5 mmol/L (Di Corcia et al., 1997). Los datos obtenidos por medio del cromatógrafo fueron en cuenta de áreas, mismos que para hacer los cálculos a partes por millón (ppm), se sometieron a través de la ecuación de regresión obtenida de cada estándar antes señalado. Las concentraciones para construir la curva de calibración de atrazina fueron los siguientes valores 0.05, 0.1, 0.5, 1.5, 2.5, 4 y 6 ppm encontrándose la ecuación (Y= 14851x- 798.01) y un coeficiente de correlación de 0.999, con un porciento de respuesta asignado al modelo entre la variable dependiente e independiente de 99.8% (R2). Los valores de la curva de atrazina desisopropil (DIA) fueron: 0.01, 0.05, 0.1, 0.5, 2.5, 4 y 6 la ecuación fue (Y=10971x – 667) y un coeficiente de correlación de 0.988 y una (R2) de 97.62%. Asimismo los valores de atrazina desetil (DEA) fueron 0.01, 0.5, 1.5, 2.5, 4, 6, y la ecuación (Y= 6343.1x – 809.36) con un coeficiente de correlación 0.9996 y una (R2) de 99.92%. Por su parte los valores de la curva de atrazina desetil2-hidroxi (DEHA) fueron 0.01, 0.05, 0.1, 0.5 y 1.5, obteniéndose la ecuación (Y= 7730.3x – 336.29) y el coeficiente de correlación 0.9882 y una (R2) de 97.65%. 3.6.5.2 Residuos de atrazina en el suelo La atrazina se cuantificó a 2 profundidades del suelo 0-15 y 15-30 cm (Sorenson et al., 1994) durante los 0, 15, 30, 45, 60, 75, 90, 105 y 120 días después de la aplicación del herbicida. Para cada periodo en ambas profundidades se tomaron 5 g de suelo y se mezclaron con 4 ml de agua destilada y 2 ml de acetato de etilo/hexano (1:1 v/v), en un tubo de ensaye. Inmediatamente después los tubos fueron incubados a 26°C con movimiento orbital a 200 rpm en un incubador Shaker de la Compañía Lab-Line Instruments Inc. La separación de fases se llevó a cabo mediante una centrifuga Eppendorf 5403 de la compañía Geratebau eppendorf GMBH a 1200 g durante 10 min (Shapir y Mandelbaum, 1997). La fase orgánica fue colectada y analizada con un cromatógrafo de gases Varian Chrompack 3800 CP (Varian, Harbor City, C.A), inyector con temperatura programable (Varian 1079), Detector Termoiónico Específico (TSD) y una columna DB-1 megabore de 30 m x 0.53 mm de diámetro interno y una película de 1.5 µm (J & W Scientific, Folsom, C.A). Las condiciones de operación del cromatógrafo de acuerdo a lo sugerido por (Shapir y Mandelbaum, 1997; Shapir et al., 1998) fue de la siguiente manera: temperatura del inyector 250°C, temperatura del detector 300°C, temperatura de la columna 165°C durante 5 min. Posteriormente fue subiendo 20°C por min hasta alcanzar 290°C, el gas de arrastre utilizado fue helio (He) con un flujo de 5 ml/ min, el volumen de inyección 1µl y tiempo de corrida fue de 12.25 min. 3.6.5.3 Residuos de atrazina en agua lixiviada El proceso de extracción de la atrazina de las muestras de agua lixiviadas de las columnas fue el sugerido por Aguirre y Segura-Miranda (1996) que consistió en recolectar 100 ml del agua lixiviada de cada una de las columnas, mismos que fueron depositados en embudos de separación de 500 ml, a estos se les adicionó 100 ml de diclorometano (cloruro de metileno) y 100 ml de NaCl al 10%. La mezcla se agitó durante 2 min y se dejó reposar hasta que las fases se separaron completamente. La capa de cloruro de metileno fue recuperada y la otra capa que quedó en el embudo de separación fue lavada nuevamente con el mismo proceso. El extracto de cloruro de metileno recuperado en el primer lavado como en el segundo, fueron filtrados a través de una capa de sulfato de sodio contenida sobre un papel filtro No. 2 colocado sobre un embudo de plástico con un diámetro interno de 55 mm y tallo de 7 x 40 mm. El filtrado resultante se llevó al rotavapor al vacío a 45°C para evaporar el solvente, una vez evaporado este, se le adicionó 2 ml de acetato de etilo para recuperar y concentrar la solución. De esta porción recuperada se tomó un microlitro y se inyectó al cromatógrafo de gases Varian Chrompack 3800 CP (Varian, Harbor City, C.A), inyector con temperatura programable (Varian 1079), detector termoiónico específico (TSD) y una columna DB-1 megabore de 30 m x 0.53 mm diámetro interno y una película de 1.5 µm (J & W Scientific, Folsom, C.A). Las condiciones de operación del cromatógrafo fueron las mismas que para los residuos obtenidos del suelo. 3.6.5.4 Cálculo de la mineralización de la atrazina La tasa de mineralización se calculó por diferencia de la cantidad que se aplicó en el tiempo cero, es decir el 100% y la cantidad encontrada al finalizar cada período de incubación. 3.7 Análisis estadístico El análisis de varianza (ANOVA) se llevó a cabo de acuerdo al modelo estadístico del diseño completamente al azar y la diferenciación de los promedios o prueba de medias se llevó a cabo con la prueba de Tukey al 0.05 de probabilidad. Los datos originales de las variables atrazina –desetil-2Hidroxi, atrazina desetil, atrazina desisopropil tanto de la profundidad 0-15 y 15-30 se les hizo transformación por raíz cuadrada y para lixiviados solamente la atrazina desisopropil de acuerdo con Snedecor y Cochran (1980). RESUMEN La estabilidad química de la atrazina y el desbalance mineral del suelo, favorecen su acumulación en este sitio y con ello la contaminación ambiental se incrementa. Una alternativa de solución a este problema es establecer el equilibrio fisicoquímico en el suelo mediante la incorporación de abono verde (AV) para favorecer la degradación y/o mineralización de la atrazina. El objetivo de esta investigación fue evaluar el efecto de la incorporación de AV sobre las propiedades químicas del suelo, la microflora nativa y la degradación y mineralización de la atrazina. utilizado El diseño experimental fue completamente al azar con arreglo trifactorial y tres repeticiones, que consistió en suelo no esterilizado (SNE) y esterilizado (SE) contaminado con atrazina, mezclado con diferentes niveles de abono verde (AV): 0, 20, 30 y 40 ton/ha, e incubado en columnas de PVC dependiendo de la variable estudiada. Los resultados indican que a los 15 días de incubación, la atrazina en el SNE y SE se mineralizó entre 3-9%, excepto en el SE sin AV con solamente 1.58%. Este valor a los 30 días aumentó con la incorporación de 40 ton/ha AV en el SNE en un 14.4% y un 12.25% en el SE. A través de la lixiviación provocada mediante los riegos aplicados, a los 30 días de incubación en el SNE con 40 ton/ha de AV se detectó 2.54 ppm de atrazina y 2.60 ppm en el SE. A los 120 días la incorporación de 30 y 40 ton/ha de AV actividad microbiana nativa del suelo medida como consecuencia microbiana. CO 2, C, estimuló la N y en la relación C/N, así como la mayor densidad de la población Los metabolitos encontrados fueron: atrazina desetil-2-Hidroxi (DEHA)(4-amino-2-hidroxi-6-isopropilamino-s-triazina), atrazina desetil (DEA) (2-cloro-4-amino-6- isopropilamino-s-triazina y atrazina desisopropil (DIA)( 2cloro-4-etilamino-6-amino). Se concluye que es necesaria la incorporación de 30 y 40 ton/ha AV para la mineralización (biorremediación) de la atrazina de un suelo agrícola. Palabras clave: mineralización, actividad microbiana, biorremediación. Effect of levels of green manure on the degradation of the atrazine in not sterilized and sterilized soil. ABSTRACT The chemical stability of the atrazine and the mineral inestability of the soil, are factors which are good for the accumulation of the atrazine in the soil, and with this there is an increase of the pollution in the environmental. One possibility to solve this kind of problem is stablish physics and chemical balance in the soil, with the application of green manure (AV) to favor the degradation and/or mineralisation of the atrazine. The objetive of this research was evaluate the effect of the chemical properties of the soil, nature microflora, and the degradation and mineralization of the atrazine when it is applied the AV. The experiment design which was used was chosen at random with a trifactorial arrangement and three repetitions, which cconsisted of not sterilized (SNE) and sterilized soil (SE) polluted with atrazine and mixture with several levels of AV: 0, 20, 30, 40 ton/ha, as well as, the incubated in columns of PVC depending on the studied variable. The results indicate that withing 15 days incubation the atrazine in the SNE and SE was moneralized between 3-9%, except in the SE without AV with only 1.5%. The value (3-9%) increase after 30 days with application of 40 ton/ha of AV for SNE 14.4% and for SE 12.25%. While inthe leachate water affter of 30 days of the incubation the results were inthe SNE2.54 ppm and in the SE 2.60 ppm of atrazine. Finallly, affer 120 days the application of 30 and 40 ton/ha of AV stimulated the microbial activity of soil which was measure as CO2, C, N and in consecuence the relation C/N, as well as, the major densityof the microbial population. The metabolities which were found are: atrazine deetyl-2-hydroxy (DEHA) (4-amine-2-hydroxy-6-isopropylamine-s-triazine), atrazine deetyl (DEA) (2-chloro-4-amine-6- isopropylamine-s-triazine and atrazine deisopropyl (DIA) (2-chloro-4-etylamine-6-amine. As a conclution it is necessary the application of 30 and 40 ton/ha of AV for the mineralization (Biorremediation) of the atrazine in the agricultural soil. Key words: atrazina, mineralisation, microbial activity, biorremediation. V DISCUSIÓN 5.1 Efecto de la incorporación de AV sobre las propiedades químicas del suelo contaminado con atrazina En el SNE la incorporación de concentración C y 30 y 40 ton/ha AV incrementó la N, debido posiblemente al contenido de proteínas de Canavalia ensiformis (Bressani et al., 1987; Díaz et al., 1997 y 1998). Este efecto fue observado por Demetrio et al., (1998), después de 102 días de adicionar los niveles de 30, 40 y 60 ton/ha de C. brasiliensis como AV a un suelo agrícola, equivalente a 560 kg/ha de N incorporado. Además se observó un aumento en la densidad de la poblacion microbiana del suelo, simultáneamente con una elevación de la producción de C02, a este respecto Wagner y Chahal, (1966), Dorán, (1980a; 1980b), Linn y Dorán, (1984) Franzluebbers et al., (1994); Locke y Bryson, (1997) señalan que la incorporación de AV enriquece el suelo con C y N disponible para los microorganismos que habitan en el suelo lo cual ejerce un efecto positivo sobre la densidad de la población en comparación con el suelo sin AV. En el SNE y SE enriquecido con AV y contaminado con atrazina no se detectaron cambios en el pH, en comparación con el suelo sin AV probablemente por la composición química del AV y la falta de tiempo suficiente para su degradación. Mismo que (Paul y ClarK, 1996) sostienen que el proceso de mineralización del AV se da lentamente por la acción enzimática de los microorganismos, que van fraccionando poco a poco las unidades moleculares complejas en unidades cada vez más simples hasta llegar finalmente a la producción de ácidos orgánicos y amonio. En el SNE y SE enriquecido con AV y contaminado con atrazina no se registró diferencia en la concentración de C y N durante los primeros 60 días de incubación en donde la relación C/N fue 10:1, sin embargo a los 120 días, es posible que la incorporación de 30 y 40 ton/ha de AV hayan estimulado la máxima actividad microbiana. A este respecto (Horswell et al., 1997) encontraron que la incorporación de fracciones de raices y el follaje de Pisum sativum L al suelo contaminado con atrazina incrementa la actividad y el crecimiento microbiano estimulado por las concentraciones altas de C y N. El efecto del AV estimuló como se suponía la actividad microbiana como lo reportan Scrase y Elliott, (1998) quienes sostienen que la relación conveniente de C/N está entre 10:1 y 80:1 para que se observe una actividad de mineralización natural de la materia orgánica, misma que incrementa biomasa y el numero de la especies de microorganismos en el suelo, lo que puede resultar un aumento de la degradación de la atrazina (Entry et al., 1995) ya sea en forma directa por acción enzimática o como una reacción cometabólica, polimerización y efectos secundarios propios de la actividad microbiana (Bollag y Liu, 1990). 5.2 Efecto de la incorporación de AV sobre la población heterotrófica microbiana nativa y la producción de C02. En el SNE se observó un incremento en la densidad de la población microbiana nativa por efecto de la incorporación de 30 y 40 ton/ha de AV, el cual proporcionó a los microorganismos el N suficiente para estimular su crecimiento al mismo tiempo que facilito la degradación parcial de la atrazina y con ello eludir el efecto tóxico del herbicida, lo anterior se comprobó por el aumento de la producción de CO2 observado durante los primeros 15 días del experimento, lo cual implica que una parte del AV se mineralizó para influir en la degradación parcial de atrazina. En este sentido Armstrong et al.,( 1965); McCormick y Hiltbold, (1966); Wagner y Chahal, (1966) coinciden que la mineralización de la atrazina está íntimamente relacionada con el contenido y grado de descomposición de la materia orgánica. Ahora bien, con respecto a la producción de CO 2 y la densidad de la población microbiana en el SE evidentemente muestran que los microorganismos agregados por el AV constituían una población de densidad baja, por esto su mineralización y el CO 2 derivado de ello y de la degradación de atrazina requirió el doble del tiempo para alcanzar la misma actividad y densidad de la población observada en el SNE. La incorporación del AV al suelo tuvo un efecto considerable en la dinámica de degradación de la atrazina ya que la adición de 40 ton/ha al SNE registró 14.42% y en el SE 12.25% de mineralización a los 30 días de incubación, No obstante que en este mismo periodo la atrazina fue lixiviada de manera natural en más del 50% de la cantidad inicialmente aplicada, con esto fue alterada su disponibilidad a los microorganismos presentes en el suelo. No obstante, estos resultados superan los obtenidos por Marjorie y Cresci, (1999) quienes reportaron el 1% en condiciones de campo, pero similar a los reportados por (Newcombe y Crowley, 1999; Benoit y Preston, 2000) quienes encontraron el 15% de mineralización. VI CONCLUSIONES En el SNE contaminado con atrazina la incorporación de AV en niveles de 30 y 40 ton/ha aumentó el contenido de C y N orgánico, en consecuencia la relación C/N. Así como el aumento en la densidad de la población microbiana nativa. En tanto que en el SE la adición 40 ton/ha AV, estimulo selectivamente el aumento en la densidad de la población de actinomicetos. No se detecto efecto de la incorporación de ningún nivel de AV sobre a densidad de los hongos, excepto en el SE sin AV en donde se observó la densidad más baja. En el SNE al cuarto día de la incorporación de 30 y 40 ton/ha de AV se estimuló la liberación CO2 por la microflora nativa. En ambas condiciones del suelo la adición de 40 ton/ha de AV estimuló el mayor porcentaje de degradación, mineralización y lixiviación de la atrazina. Los metabolitos detectados como producto de la degradación de la atrazina en el agua lixiviada, SNE y SE en los diferentes niveles de AV a la profundidad de 0-15, 15-30 fueron: atrazina desetil-2-hidroxi (DEHA) (4-amino-2-hidroxi-6isopropilamino-s-triazina), atrazina desetil (DEA) (2-cloro-4-amino –6- isoprilamino-s-triazina) y atrazina desisopropil (DIA)(2-cloro-4-etilamino-6amino –s-triazina). Se sugiere que se evalúe la respuesta de la Canavalia incorporada al suelo como abono verde en sus diferentes estados fenológicos para probar su efecto sobre la degradación y mineralización de atrazina en condiciones de campo. Es necesario evaluar la transformación de la atrazina a través de los horizontes del perfil del suelo tras la incorporación del AV. VI CONCLUSIONES En el SNE contaminado con atrazina la incorporación de AV en niveles de 30 y 40 ton/ha aumentó el contenido de C y N orgánico, en consecuencia la relación C/N. Así como el aumento en la densidad de la población microbiana nativa. En tanto que en el SE la adición 40 ton/ha AV, estimulo selectivamente el aumento en la densidad de la población de actinomicetos. No se detecto efecto de la incorporación de ningún nivel de AV sobre a densidad de los hongos, excepto en el SE sin AV en donde se observó la densidad más baja. En el SNE al cuarto día de la incorporación de 30 y 40 ton/ha de AV se estimuló la liberación CO2 por la microflora nativa. En ambas condiciones del suelo la adición de 40 ton/ha de AV estimuló el mayor porcentaje de degradación, mineralización y lixiviación de la atrazina. Los metabolitos detectados como producto de la degradación de la atrazina en el agua lixiviada, SNE y SE en los diferentes niveles de AV a la profundidad de 0-15, 15-30 fueron: atrazina desetil-2-hidroxi (DEHA) (4-amino-2-hidroxi-6isopropilamino-s-triazina), atrazina desetil (DEA) (2-cloro-4-amino –6- isoprilamino-s-triazina) y atrazina desisopropil (DIA)(2-cloro-4-etilamino-6amino –s-triazina). Se sugiere que se evalúe la respuesta de la Canavalia incorporada al suelo como abono verde en sus diferentes estados fenológicos para probar su efecto sobre la degradación y mineralización de atrazina en condiciones de campo. Es necesario evaluar la transformación de la atrazina a través de los horizontes del perfil del suelo tras la incorporación del AV.