SILODOSINA SILODYX (Recordati) - Bot Plus Web
Anuncio

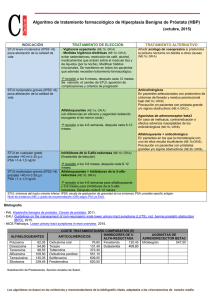
SILODOSINA SILODYX? (Recordati) HIPERPLASIA BENIGNA DE PRÓSTATA La próstata es una glándula, que se sitúa por debajo de la vejiga urinaria de los hombres, rodeando la parte proximal de la uretra. Tiene un peso de aproximadamente 20 g y está constituida por dos partes; una interior (periuretral), de naturaleza glandular, y otra exterior, con contenido fundamentalmente fibromuscular. La principal función fisiológica de la próstata es producir el fluido seminal, aunque también parece ejercer otras actividades, como proteger a la vejiga y al resto del tracto urinario de las infecciones, entre otras. El tejido glandular de la próstata está dividido en tres zonas funcionalmente independientes. El carcinoma y la hiperplasia atípica afectan mayoritariamente a la zona periférica, en tanto que la zona preprostática es la más frecuentemente afectada por la hiperplasia benigna, la enfermedad más frecuente de la próstata. El proceso patológico de la hiperplasia benigna prostática implica en un aumento del número de células normales, no de su tamaño. El correspondiente incremento del tamaño total de la glándula conduce a una excesiva presión sobre la uretra proximal y ello dificulta la micción. Se pueden manifestar dos tipos básicos de síntomas de la hipertrofia prostática benigna: - Síntomas irritativos, relacionados con el almacenamiento de la orina en la vejiga: nicturia1, aumento de la frecuencia de micciones y urgencia de éstas. - Síntomas obstructivos, relacionados con el vaciado de la vejiga: dificultad para comenzar la micción, reducción de la velocidad de micción, sensación de vaciado incompleto de la vejiga, incapacidad para detener bruscamente la micción y, ocasionalmente, retención urinaria completa. La hipertrofia prostática benigna es una enfermedad muy prevalente entre los hombres maduros, aunque ya entre los 30 y los 40 años la prevalencia global es del 8%. A los 40 años un 20% de los hombres la padecen, entre un 40% y un 50% entre los 50 y los 60 años, prevalencia que aumenta hasta más del 80% en los hombres mayores de 80 años. No se ha establecido una relación directa entre el aumento del tamaño prostático y los síntomas asociados a la hiperplasia benigna. Tampoco se conoce con exactitud la causa de la enfermedad pero parece estar estrechamente relacionada con la acción de la testosterona y, muy especialmente, con la de su metabolito biológico, la dihidrotestosterona (DHT) mucho más potente como andrógeno que la propia testosterona. Este metabolito es producido por acción del enzima 5? reductasa. Aunque el papel de los andrógenos como factor causante es todavía hoy objeto de debate, es indudable que juegan un rol, al menos, facilitador del desarrollo de la hiperplasia benigna prostática. En realidad, los pacientes con hiperplasia prostática benigna no presentan niveles elevados de DHT, manteniéndose normales durante el envejecimiento, mientras que los niveles plasmáticos de testostorona disminuyen. Se han descrito dos isoformas del enzima 5? -reductasa. El tipo 1 está presente en la mayoría de los tejidos donde se expresa el enzima, siendo la forma predominante en las glándulas sebáceas. Por su parte, el tipo 2 es la isoenzima dominante en los tejidos genitales, incluyendo la próstata. Una de las cuestiones aparentemente contradictorias de la hiperplasia prostática benigna es que la reducción del tamaño de la próstata no necesariamente implica la resolución de los síntomas que La nicturia supone un aumento de la diuresis durante las horas del sueño nocturno con respecto al volumen de la diuresis de la vigilia. La nocturia supone la necesidad de levantarse durante el sueño nocturno para orinar debida a una hipercontractilidad o hipersensibilidad de la vejiga y/o la uretra. 1 acompañan a la enfermedad. Incluso en muchos pacientes los síntomas, especialmente los de carácter subjetivo, desaparecen o se atenúan de forma espontánea, sin necesidad de ningún tratamiento. El tratamiento del adenoma prostático benigno sigue siendo fundamentalmente quirúrgico, cuando la hiperplasia prostática benigna comienza a provocar manifestaciones clínicas importantes (retención urinaria, infecciones urinarias frecuentes, hidronefrosis, etc). La prostatectomía transuretral presenta una mortalidad muy baja, aunque plantea las incomodidades y complicaciones propias de toda intervención quirúrgica (infecciones, hemorragias, etc.), amén de algunas posibles complicaciones de incidencia variable (disfunción eréctil, incontinencia urinaria, etc.). Estas últimas, junto con la contraindicación quirúrgica, que afecta a un 20-30% de los pacientes, son las que han conducido al desarrollo de una terapéutica farmacológica eficaz. Otras formas de prostatectomía se practican mediante laparotomía o con láser (vaporización fotoselectiva). Como alternativa se practica la incisión transuretral de la próstata, con la que a través de pequeños cortes en el cuello de la vejiga y en la próstata se reduce la obstrucción al flujo de orina. La terapia farmacológica es paliativa y está indicada en manifestaciones leves del cuadro, o para el alivio de la sintomatología a la espera de la intervención, o en pacientes donde la cirugía no esté indicada. Es un tratamiento crónico, cuyo efecto se pierde al ser suspendido. Por otro lado, el desconocimiento de la etiología del cuadro supone un serio inconveniente para el desarrollo de tratamientos eficaces. Los actuales se basan en la consideración de que la disuria asociada a la hipertrofia prostática tiene dos componentes: uno “estático” derivado del aumento de tamaño de la glándula, y otro “dinámico” por aumento del tono del músculo liso del cuello de la vejiga y de la uretra intraprostática. En este sentido, se ha estimado que aproximadamente el 40% del total de la presión uretral en hiperplasia prostática benigna es debida a la activación de receptores ? 1 adrenérgicos. Esto ha determinado la sugerencia de emplear fármacos que bloqueen estos receptores (alfabloqueantes). De hecho, han demostrado incrementar significativamente el flujo urinario en los pacientes tratados, obteniendo un efecto equivalente al 55% del conseguido con la prostatectomía. Estos fármacos presentan la ventaja de reducir la prevalencia de retención urinaria en los casos más avanzados. Por este motivo, se les considera preferibles en general a otros tratamientos farmacológicos de la hiperplasia benigna de próstata. Los alfabloqueantes adrenergicos disminuyen el tono muscular del conducto urinario, reduciendo el obstáculo “dinámico” a la evacuación de la orina. Los bloqueantes específicos ? 1 ofrecen la máxima eficacia con el mínimo de efectos colaterales. Los únicos comercializados en España exclusivamente con esta indicación son alfuzosina, tamsulosina y terazosina, pero se usan también los alfabloqueantes antihipertensivos. De hecho los alfabloqueantes que se toman una vez al día (doxazosina y terazosina) son más convenientes que la prazosina o la alfuzosina, que suelen requerir tres administraciones diarias. La tamsulosina es probablemente el alfabloqueante más experimentado en adenoma prostático, aunque todos parecen equiparables en eficacia y en efectos adversos. La acción antihipertensiva puede ser un beneficio adicional en los hipertensos. En pacientes normotensos el descenso de presión sanguínea es poco pronunciado. El tratamiento consigue un aumento significativo del flujo urinario, y disminución de síntomas obstructivos y, en menor medida, de los irritativos. Su efecto es relativamente rápido (2-3 semanas, tras alcanzar la dosis máxima) y son más eficaces a corto plazo que los inhibidores de la 5? -reductasa. Sin embargo, producen una incidencia relativamente alta (10% o más) de efectos secundarios cardiovasculares que obligan a un ajuste de la dosis. Existe también temor a que el efecto se pierda con el tratamiento continuado (tolerancia farmacológica). La proliferación de tejido prostático parece dependiente de andrógenos, en especial de la dihidrotestosterona (DHT). Esta hormona se produce dentro de la próstata a partir de testosterona exógena. El enzima que lleva a cabo la transformación es la 5? -reductasa. Este enzima permite la con- versión, en la próstata, de testosterona a dihidrotestosterona, mucho más potente que su antecesor. De hecho, la dihidrotestosterona es el principal andrógeno intracelular. La observación de que una deficiencia genética del enzima resultaba en retraso en el desarrollo de la próstata ha llevado a la introducción en terapéutica de inhibidores de la 5? -reductasa, de los cuales se dispone de finasterida y dutasterida . Ambos inducen una deficiencia de dihidrotestosterona (dan lugar a una reducción del 70-95% los niveles de DHT, tanto en suero como en la próstata); en contraposición, los niveles medios de testosterona pueden aumentar ligeramente. Estos fármacos producen una disminución del tamaño de la próstata del orden del 20-25% y con ello la reducción del obstáculo “estático” a la evacuación. Se produce disminución significativa de la sintomatología y aumento del flujo urinario. Parece ser más efectiva en hombres con próstatas grandes. Los efectos adversos parecen mínimos, la acción se mantiene al menos tres años y permiten retrasar la necesidad de realizar una prostatectomía. No obstante, tardan varios meses en manifestar su efecto y producen una reducción del 50% en los niveles plasmáticos de PSA (antigeno específico de próstata), lo que puede interferir con el diagnóstico de procesos prostáticos malignos. Al ser independientes los efectos de los inhibidores de la reductasa y alfabloqueantes, hay datos modernos que apoyan claramente el uso combinado. La terapia hormonal del adenoma prostático benigno se basa en el hecho de que el desarrollo de las partes glandular y fibromuscular de la próstata es estimulado por gonadotropinas y andrógenos. Por ello, se han empleado superagonistas de la gonadorrelina (buserelina, leuprorelina, nafarelina, etc), cuya administración repetida es capaz de anular la liberación de gonadotropinas desde la hipófisis, reduciendo con ello la producción de testosterona en los testículos (se trata, de hecho, de una ablación testicular "química"). Se han obtenido resultados interesantes con leuprorrelina, cuyo uso es capaz de reducir en un 60% el volumen prostático. Sin embargo, los efectos adversos son numerosos (impotencia, disminución de la líbido, etc), requieren administración parenteral o intranasal, que los hacen poco apropiados para la hiperplasia benigna de próstata y, sobre todo, la próstata vuelve a incrementar su volumen tras la suspensión del tratamiento. Algo similar sucede con los antagonistas de los receptores de andrógenos (antiandrógenos), como la flutamida. Su toxicidad es importante. Por estos motivos, los superagonistas y los antiandrógenos son reservados para el tratamiento del carcinoma de próstata. Hay una serie de preparados de origen vegetal que proceden de la medicina popular. Están comercializados en España los extractos de Pygeum africanum y de Serenoa repens, pero se usan también preparados de semilla de calabaza y de diversos pólenes. La acción de estos productos se debe básicamente al contenido en compuestos esteroídicos de acción antiandrogénica. Los extractos vegetales tienen menos ensayos bien controlados que los medicamentos descritos antes. De todas formas hay algunos estudios clínicos controlados, tanto con Pygeum africanum como con Serenoa repens. Concretamente, la evidencia contrastada sugiere que Serenoa repens es capaz de mejorar de forma significativamente superior al placebo los síntomas urológicos (urgencia y nocturia) y el flujo urinario. Asimismo, produce resultados similares a los obtenidos con finasterida, con una incidencia de efectos adversos inferior a esta última. Por lo que se refiere a Pygeum africanum, los datos clínicos indican una reducción media en torno al 20% en la nicturia, mientras que el volumen urinario residual es reducido en torno al 25%, incrementándose en esa misma proporción el flujo máximo urinario, todo ello en relación al placebo. La incidencia de efectos adversos se sitúa en el mismo nivel que el placebo. ACCIÓN Y MECANISMO La silodosina es un agente bloqueante selectivo de los receptores alfa-1A (? 1A) adrenérgicos, autorizada para el tratamiento de los signos y síntomas de la hiperplasia benigna de próstata (HBP). Aproximadamente el 40% del total de la presión uretral en hiperplasia prostática benigna es debida a la activación de receptores ? 1A adrenérgicos. Estos receptores están localizados en el hombre fundamentalmente en la próstata y su cápsula, la base y el cuello de la vejiga urinaria, y la zona prostática de la uretra. Por el contrario, los receptores ? 1B adrenérgicos tienen una distribución fundamentalmente cardiovascular. La silodosina tiene una elevada selectividad para los receptores ? 1A adrenérgicos, frente a los ? 1B, ? 1D y ? 2, mostrando una baja afinidad hacia los receptores ? 2, ? 1, M (colinérgicos), 5-HT1 (serotonérgicos) y D1, D2, D2 y D4 (dopaminérgicos). El bloqueo de los receptores ? 1A adrenérgicos provoca una relajación de las células musculares lisas presentes en la próstata, la vejiga y la uretra, reduciendo con ello la resistencia al flujo de orina desde la vejiga hasta la uretra terminal, pero sin afectar de forma significativa al músculo detrusor, que controla la micción voluntaria. Todo ello se traduce en una mejora de los síntomas irritativos (almacenamiento de la orina) y obstructivos (vaciado de la orina) asociados a la hiperplasia prostática. ASPECTOS MOLECULARES La silodosina está química y farmacológicamente relacionada con otros agentes bloqueantes ? 1A adrenérgicos, muy especialmente con la tamsulosina. Tiene una afinidad relativa hacia los receptores ? 1A adrenérgicos 162 veces mayor que hacia los ? 1B y 55 veces que hacia ? 1D. Este grado de selectividad es superior al mostrado por otros fármacos de la misma familia, como tamsulosina, prazosina o terazosina. No obstante, en términos comparativos, la afinidad absoluta hacia los receptores ? 1A adrenérgicos es mayor con tamsulosina que con silodosina, aunque lo es más que prazosina y terazosina. La afinidad hacia los receptores ? 2 es del mismo orden de magnitud que para ? 1B y ? 1D. Tiene una baja afinidad hacia los receptores ? 2, ? 1, M (colinérgicos), 5-HT1 (serotonérgicos) y D1, D2, D2 y D4 (dopaminérgicos). EFICACIA Y SEGURIDAD CLÍNICAS La eficacia y la seguridad clínicas de la silodosina han sido adecuadamente contrastados mediante ensayos clínicos controlados. Los principales estudios son tres ensayos clínicos de fase 3, dos controlaos con placebo y con un comparador activo (tamsolosina), aleatorizados, doblemente ciegos, multicéntricos, de 12 semanas de duración. Se dio a todos los pacientes la opción de participar en una extensión en una extensión abierta de 40 semanas adicionales de tratamiento con silodosina. Los pacientes eran varones = 50 años, un índice IPSS = 13, un flujo máximo de orina (QMAX) entre 4 y 15 ml y un volumen miccional mínimo = 125 ml. Todos ellos recibieron por vía oral silodosina (8 mg/24 h) o placebo. En el estudio comparativo con tamsulosina, se empleó una dosis de ésta de 0,5 mg/24 h. Como criterio primario de valoración de la eficacia clínica de utilizó la variación del valor IPSS desde antes del tratamiento hasta el final del estudio (12 semanas). La Escala Internacional de Síntomas Prostáticos (International Prostate Symptom Score, IPSS) es el parámetro más utilizado para valorar la intensidad de la clínica de la hiperplasia benigna de próstata. Se trata de un cuestionario que consta de 7 ítems sobre síntomas obstructivos e irritativos (vaciamiento incompleto de la vejiga, frecuencia, flujo intermitente, urgencia, flujo débil, esfuerzo y nocturia). Las seis primeras cuestiones puntúan entre 0 (no, en absoluto) y 5 (casi siempre) según la percepción subjetiva de los síntomas, mientras que en la séptima cuestión el intervalo tiene otro significado: entre 0 (ninguno) y 5 (5 o más veces). La puntuación global máxima de las 7 cuestiones es de 35, valorándose globalmente la sintomatología como leve (0-7 puntos), moderada (8-19) y grave o severa (20-35). A partir de este cuestionario, se obtienen los subíndices de síntomas irritativos (suma de los valores correspondientes a las cuestiones 2, 4 y 7) y de síntomas obstructivos (1, 3, 5 y 6). La IPSS es idéntica a la escala AUASI (American Urological Association Sympton Index), aunque el cuestionario IPSS contiene una pregunta adicional, referida al nivel de calidad de vida específicamente ligada a la hiperplasia benigna de próstata, graduada entre 0 (muy bien o encantado) y 6 (terrible). En este sentido, la afectación de la calidad de vida puede ser ligera (0-2 puntos), moderada (3) o grave o severa (4-6). Como criterios secundarios de eficacia se determinó la variación de la tasa máxima de flujo urinario (QMAX), de las subescalas irritativa y obstructiva del IPSS y los porcentajes de pacientes respondedores, considerando como tales a aquellos con una reducción = 25% del IPSS global o un aumento = 30% del QMAX. Los dos estudios controlados con placebo tienen un diseño idéntico y fueron llevados a cabo en Estados Unidos. El primero de ellos (SI04009; EPAR) fue realizado sobre 461 pacientes con hiperplasia prostática benigna, con una edad media de 64 años (42% > 65 años y 11% > 75); un 88% eran de rara caucásica. Los resultados mostraron una variación estadísticamente significativa de la IPSS global de -6,5 (silodosina, S) vs. -3,6 (placebo, P), del IPSS irritativo de -2,3 (S) vs. -1,4 (P), del IPSS obstructivo de -4,2 (S) vs. -2,2 (P) y del QMAX de +2,2 ml/seg (S) vs. 1,2 (P); el porcentaje de respondedores fue del 52,8% (S) vs. 31,6% (P). El segundo (SI04010; EPAR) fue realizado sobre 462 pacientes con una edad media de 65 años (48% > 65 años y 14% > 75); un 91% eran de rara caucásica. Se observó una variación estadísticamente significativa de la IPSS global de -6,3 (silodosina, S) vs. -3,4 (placebo, P), del IPSS irritativo de -2,4 (S) vs. -1,3 (P), del IPSS obstructivo de -3,9 (S) vs. -2,1 (P) y del QMAX de +2,9 ml/seg (S) vs. 1,9 (P); el porcentaje de respondedores fue del 53,6% (S) vs. 32,8% (P). El análisis conjunto de ambos estudios (Marks, 2009a) agrupó a los 963 pacientes, obteniendo los siguientes resultados: IPSS global de -6,4 (silodosina, S) vs. -3,6 (placebo, P), del IPSS irritativo de -2,3 (S) vs. -1,4 (P), del IPSS obstructivo de -4,0 (S) vs. -2,1 (P) y del QMAX de +2,6 ml/seg (S) vs. 1,5 (P). El tratamiento fue suspendido en el 7,2% (S) y 1,9% (P) debido a la incidencia de eventos adversos. De los 963 pacientes de los dos estudios anteriores, 661 (69%) se incorporaron a una extensión con diseño abierto, recibiendo silodosina durante 40 semanas adicionales (Marks, 2009b). Al final del estudio, la variación de la IPSS fue de -4,2 en los pacientes previamente tratados con placebo (tratamiento de novo) y de -1,6 en aquellos tratados con silodosina anteriormente (tratamiento de mantenimiento). La suspensión del tratamiento durante la extensión en abierto se produjo en el 7,5% de los pacientes tratados de novo vs. el 1,9% en los de mantenimiento. El estudio comparativo con tamsulosina (IT-CL-0215; EPAR) fue realizado en Europa sobre 955 pacientes, con una media de edad de 66 años, 80 kg de peso y 173 cm de altura. Todos eran de raza caucásica. Los resultados mostraron una variación de la IPSS global de -7,0 (S) vs. -6,7(tamsulosina, T) vs. 4,7 (placebo, P), del IPSS irritativo de -2,3 (S) vs. -2,0 (T) vs. -1,4 (P), del IPSS obstructivo de -4,5 (S) vs. -4,2 (T) vs. -2,9 (P), de la calidad de vida (QoL) de -1,1 (S) vs. -1,1 (T) vs. -0,8 (P), y del QMAX de +3,8 ml/seg (S) vs. +3,5 (T) vs. +1,2 (P); el porcentaje de respondedores fue del 66,8% (S) vs. 65,4% (T) vs. 50,8% (P). Todas las diferencias entre silodosina y placebo fueron estadísticamente significativas, excepto en la variación de la QMAX. Ninguna de las diferencias entre silodosina y tamsulosina fueron estadísticamente significativas. En un análisis post-hoc, se determinó el grado de respuesta de los pacientes en función de la intensidad de su sintomatología, observándose variaciones de la IPSS en los menos graves (IPSS basal < 20) de -5,8 (S) vs. -5,4 (T) vs. -3,9 (P), siendo en los pacientes más sintomáticos (IPSS basal = 20) de -8,7 (S) vs. -8,5 (T) vs. -5,8 (P). La extensión en abierto de este último estudio durante 40 semanas adicionales se llevó a cabo en 509 pacientes. A las 14 semanas de la prolongación la variación de la IPSS global fue de -2,7 en los pacientes de novo vs. -0,82 (S) y -0,83 (T) en los sujetos a mantenimiento. Adicionalmente, en un estudio aleatorizado, doblemente ciego y controlado con placebo y con tamsulosina, realizado en Japón (Kawabe, 2006) sobre 457 pacientes = 50 años, IPSS = 8, volumen prostático = 20 ml, QMAX <15 ml/seg y volumen urinario postminccional < 100 ml, se comparó a la silodosina (4 mg/12 h) con tamsulosina (0,2 mg/24 h) y placebo, durante 12 semanas. La variación de la IPSS global fue de -8,3 (S) vs. -6,8 (T) vs. -5,3 (P), la de calidad de vida fue de -1,7 (S) vs. -1,4 (T) vs. -1,1 (P). Por su parte, la incidencia de eventos adversos afectó al 69,7% (S) vs. 47,4% (T) vs. 36,4% (P). Conviene tener presente, no obstante, que la DDD de la tamsulosina es de 0,4 mg, el doble de la dosis utilizada en este estudio; además, se empleó la silodosina en dos dosis diarias de 4 mg, en lugar de una única de 8 mg. En cuanto a los aspectos toxicológicos, la incidencia de reacciones adversas en los ensayos controlados con placebo fue del 28,8% con silodosina y del 9,0% con placebo. El efecto más común fue la eyaculación retrógrada2 (23,6%), seguido a gran distancia por vértigo (2,1%), hipotensión ortostática (1,3%), congestión nasal (1,3%), cefalea (1,3%) y diarrea (1,0%). En el estudio comparativo con tamsulosina, la cefalea fue más común con esta última (2,9% S vs. 5,5% T vs. 4,7% P), pero la eyaculación retrógrada lo fue más con silodosina (14,2% S vs. 2,1% T vs. 1,1% P). ASPECTOS INNOVADORES La silodosina es un agente bloqueante selectivo de los receptores alfa-1A (? 1A) adrenérgicos, autorizada para el tratamiento de los signos y síntomas de la hiperplasia benigna de próstata. El bloqueo de los receptores ? 1A adrenérgicos provoca una relajación de las células musculares lisas presentes en la próstata, la vejiga y la uretra, reduciendo con ello la resistencia al flujo de orina desde la vejiga hasta la uretra terminal, pero sin afectar de forma significativa al músculo detrusor, que controla la micción voluntaria. Todo ello se traduce en una mejora de los síntomas irritativos (llenado de vejiga) y obstructivos (vaciado) asociados a la hiperplasia prostática. La silodosina está química y farmacológicamente relacionada con otros agentes bloqueantes ? 1A adrenérgicos comercializados anteriormente, muy especialmente con la tamsulosina, aunque presenta una mayor selectividad hacia los receptores ? 1A adrenérgicos. Los datos clínicos procedentes de los ensayos clínicos controlados con placebo y con comparador activo (tamsulosina) indican una eficacia claramente superior a la del placebo y no inferior a la de tamsulosina, en el control de los síntomas irritativos y obstructivos asociados a la hiperplasia prostática benigna. Estas diferencias con placebo se hicieron significativas desde la primera semana de tratsamiento. Es importante indicar, no obstante, el alto nivel de respuesta al placebo encontrado en estos estudios comparativos, con tasas de respondedores del 51%, frente al 67% con silodosina y del 65% con tamsulosina. En este punto cabe indicar que la Escala Internacional de Síntomas Prostáticos (International Prostate Symptom Score, IPSS) es una parámetro que orienta tanto sobre la intensidad de los síntomas como sobre la repercusión que estos producen en cada paciente. Sin embargo, la utilización de la escala IPSS no siempre permite establecer una relación directa y objetiva entre la gravedad de los síntomas y el grado de afectación en la calidad de vida (algunos pacientes, con síntomas leves refieren mayor afectación, mientras que otros con síntomas severos los toleran mejor). A pesar de ello, esta escala es la más utilizada internacionalmente y, por ello, facilita la comparación indirecta de los efectos del tratamiento entre diversos fármacos. También se han realizado extensiones abiertas hasta un año de los estudios controlados (diseñados para 12 semanas), que han confirmado la eficacia mantenida de la silodosina (y de la temsulosina), si bien no puede esperarse de este tipo de ensayos (no controlados, por definición) una excesiva fortaleza en sus conclusiones. Desde el punto de vista de la seguridad es, posiblemente, donde puede observarse alguna diferencia - mínima – con los fármacos de la misma familia. En efecto, la silodosina produce una elevada incidencia de eyaculación retrógrada (orgasmo con poca o nula eyaculación de semen), que alcan2 Orgasmo con escasa o nula eyaculación de esperma. zó el 14% en el estudio comparativo con tamsulosina, mientras que ésta se asociaba con tal efecto en el 2%; incluso en estudios controlados con placebo, se ha llegado a una incidencia del 24%. Este efecto es valorado de forma muy diversa por los pacientes, habida cuenta de que la tasa de abandonos del tratamiento por este motivo fue escasa (1,3% vs. 0,3% con tamsulosina). Por el contrario, la silodosina se asocia menos frecuentemente que la tamsulosina a cefalea (2,9% vs. 5,5%). En cuanto a la hipotensión ortostática, la incidencia es equiparable a la del placebo. En definitiva, silodosina se incorpora a un grupo de fármacos, los bloqueantes ? 1 adrenérgicos, con una mayor selectividad frente a los receptores ? 1A, frente a los ? 1b y ? 1D que el resto. Este perfil farmacológico un tanto específico parece tener algo más trascendencia sobre el perfil de los efectos adversos que sobre la eficacia clínica, pero sin que suponga una mejora sustancial en la terapéutica de la hiperplasia prostática benigna. BIBLIOGRAFÍA - Cantrell MA, Bream-Rouwenhorst HR, Hemerson P, Magera JS Jr. Silodosin for benign prostatic hyperplasia. Ann Pharmacother. 2010; 44(2): 302-10. Committee for Human Medicinal Products. European Public Assessment Report (EPAR). Silodyx. EMEA/H/C/1209. European Medicines Agency. http://www.emea.europa.eu/ (visitada el 27 de septiembre de 2010). Consejo General de Colegios Oficiales de Farmacéuticos. BOT+ (actualizado al 27 de septiembre de 2010). www.portalfarma.com. Kawabe K, Yoshida M, Homma Y; Silodosin Clinical Study Group. Silodosin, a new alpha1A-adrenoceptor-selective antagonist for treating benign prostatic hyperplasia: results of a phase III randomized, placebo-controlled, double-blind study in Japanese men. BJU Int. 2006; 98(5): 1019-24. Marks LS, Gittelman MC, Hill LA, Volinn W, Hoel G. Silodosin in the treatment of the signs and symptoms of benign prostatic hyperplasia: a 9-month, open-label extension study. Urology. 2009; 74(6):1318-22. Marks LS, Gittelman MC, Hill LA, Volinn W, Hoel G. Rapid efficacy of the highly selective alpha1A-adrenoceptor antagonist silodosin in men with signs and symptoms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies. J Urol. 2009; 181(6): 2634-40. Schilit S, Benzeroual KE. Silodosin: a selective alpha1A-adrenergic receptor antagonist for the treatment of benign prostatic hyperplasia. Clin Ther. 2009; 31(11): 2489-502. VALORACIÓN SILODOSINA SILODYX (Recordati) Grupo Terapéutico (ATC): G04CA. TERAPIA GENITOURINARIA. Preparados urológicos. Fármacos usados en hipertrofia prostática benigna: bloqueantes alfa-adrenérgicos. Indicaciones autorizadas: Tratamiento de los signos y síntomas de la hiperplasia benigna de próstata (HBP). VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clíni? ca en el tratamiento de las indicaciones autorizadas. FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA Fármaco Prazosina Terazosina Alfuzosina Tamsulosina Medicamento Minipres Hitrin5 Benestan Omnic Laboratorio 3 Nostrum4 Abbott Sanofi Aventis Astellas Año 1979 1990 1993 1997 COSTE DIRECTO DEL MEDICAMENTO Dosis diarias y coste DDD 6 Coste DDD Coste anual Comercializador actual Originalmente, Pfizer. 5 Baja en 2003 6 Dosis Diaria Definida, según la OMS. 3 4 Silodosina 8 mg 0,93 € 338,84 € Tamsulosina 0,4 mg 0,42 € 151,72 € Alfuzosina 7,5 mg 0,35 € 125,93 € Terazosina 5 mg 0,27 € 98,55 €