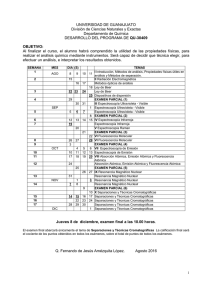
Curso de Química de coordinación
Anuncio

Curso de Química de coordinación Comportamiento espectroscópico Espectroscopía de los compuestos de coordinación Rafael Moreno Esparza (2009-2) 31 mayo 09 Espectroscopía 0 Propiedades espectroscópicas del H Este patrón de líneas oscuras es característico de cada elemento. Y se le conoce como espectro de absorción atómica Por otro lado, si calentamos ese mismo gas, empieza a brillar Y si enfocamos la luz que emite, se observan únicamente líneas brillantes de ciertas longitudes de onda Este patrón de líneas brillantes, también es característico de cada elemento. Y se le conoce como espectro de emisión atómica Entonces, tenemos que cualquier elemento en fase gas, produce dos clases de espectros 31 mayo 09 Espectroscopía 2 En el año de 1900, Max Planck demuestra que los átomos de un sólido caliente, tienen energías que son un múltiplo de una cantidad fija. A esta cantidad de energía la llamó quantum o paquete de energía. energía. Desde antes, se sabía que los gases absorbían o emitían energía en paquetes, es decir estaba cuantizada En tanto que la luz que se producía por medio de un foco, era continua. Sin embargo si interponemos hidrógeno (o cualquier otro elemento) entre el foco y el prisma, la luz resultante no era continua. El espectro observado muestra una serie de líneas obscuras muy angostas, que se conocen como líneas espectrales donde faltanEspectroscopía ciertos colores específicos 1 31 mayo 09 Propiedades espectroscópicas Es decir este comportamiento depende de la manera que lo hagamos interactuar con la radiación electromagnética Si hacemos que la luz pase por donde está el gas obtenemos el espectro de absorción En cambio si le damos suficiente energía, obtendremos el espectro de emisión 31 mayo 09 Espectroscopía 3 1 Propiedades espectroscópicas ¿Pero a qué se debe este fenómeno? Lo podemos atribuir a que los átomos que componen al gas, absorben la luz ¿Y por qué absorben la luz? Sabemos que la radiación es causada por la vibración de las cargas y la rapidez de la vibración determina la longitud de onda. Esto significa que, si solamente ciertas longitudes de onda pueden ser absorbidas o emitidas por el átomo, sus electrones vibran solamente a ciertas frecuencias Los resultados obtenidos del estudio de los espectros de líneas de los elementos no podían explicarse empleando la física clásica. 31 mayo 09 Espectroscopía 4 Modelo del átomo Si consideramos el modelo del átomo propuesto por Rutherford, Rutherford, que era muy popular al principio del siglo XX, al electrón se le consideraba como si estuviera dando vueltas alrededor del núcleo De tal manera que la fuerza centrífuga estuviera balanceada respecto a la atracción coulómbica Entonces, un átomo así debería de ser capaz de absorber o emitir cualquier cantidad de energía De manera que el cambio en su energía meramente alteraría el radio de la órbita Así, los físicos de la época se vieron forzados a considerar desechar por completo este modelo (a pesar de estar tan bien sostenido por la evidencia experimental) O hacerle algunas modificaciones difíciles de digerir 31 mayo 09 El modelo de Bohr Es claro que, sería estúpido proponer que el átomo pudiera contener cualquier energía (tal como lo dicta el modelo planetario) Y a pesar de ello absorber o emitir energía en cantidades especiales y medidas ¿Pero entonces como es un átomo? Pues la alternativa era postular que los electrones en el átomo podían tener solamente ciertos valores de energía Esto implicaba automáticamente, que el átomo podría absorber o emitir únicamente ciertas energías Es decir que al principio del siglo XX, este era un verdadero rompecabezas para los científicos 31 mayo 09 Espectroscopía Espectroscopía 5 El modelo de Bohr Una teoría o un modelo raramente se abandona por completo, a menos que no haya alternativa De hecho el modelo planetario no se abandonará sino hasta que finalmente se desarrolla el modelo cuántico El más simple y sensato de los modelos del átomo basado en el de Rutherford es el de Bohr Afortunadamente, (Niels (Niels Bohr) Bohr) un físico danés, sugiere un cambio en el modelo muy radical Lo radical del modelo, reside en que Bohr propone que para explicar las líneas espectrales, los electrones deben seguir una regla medio mafufa 6 31 mayo 09 Espectroscopía 7 2 El modelo de Bohr Esta regla es que los electrones solo pueden estar en ciertas órbitas especiales y todas las otras órbitas están prohibidas Por lo tanto, los electrones pueden saltar de una órbita a otra y al hacerlo vibran Consecuentemente producen radiación Bohr, Bohr, descubrió que se podía explicar el espectro del hidrógeno cuantitativamente si se consideraba que en el átomo de hidrógeno los electrones se movían en aquellas órbitas especiales donde el momento angular del electrón era un múltiplo de h/2π /2π Es decir que la energía del electrón estaba cuantizada 31 mayo 09 Espectroscopía 8 El modelo de Bohr Esta propuesta tan arbitraria y mafufa en su tiempo, se hace aceptable en parte, ya que consigue salvar el modelo planetario del átomo al menos por un tiempo La evidencia espectroscópica de la estructura en capas de los electrones puede verse en los espectros de líneas Así, en el caso del átomo de hidrógeno, la energía de cada uno de los niveles cuánticos se puede obtener usando esta ecuación: E =− 31 mayo 09 El modelo de Bohr Y para determinar la diferencia de energía entre cualesquiera dos niveles es: Momento angular de los estados del átomo de hidrógeno: Estado p= n(h/2π /2π), n es un entero 31 mayo 09 1(h/2π /2π) 2(h/2π /2π) 2(h/2π /2π) 3(h/2π /2π) 3(h/2π /2π) 3(h/2π /2π) Espectroscopía n2 Espectroscopía 9 El modelo de Bohr De esta manera, este modelo puede racionalizar el comportamiento químico de los elementos, al arreglar a los electrones en capas Es decir, al cuantizar las energías de los electrones en capas discretas (llamadas K, L, M, N, O, etc. etc.), explica las propiedades químicas de los elementos De esta manera tenemos que cuando un átomo se encuentra en su estado basal y lo excitamos usando un haz de luz, solamente ciertas de las longitudes de onda tendrán la energía suficiente para hacer que el electrón pueda pasar a otra órbita Y cuando dejamos de excitarlo, los electrones que se pasaron a una órbita de mayor energía al regresar a su órbita original emiten energía 1 1 E 2 − E1 = hν = hZ 2 2 − 2 n1 n2 1s 2s 2p 3s 3p 3d kZ 2 10 31 mayo 09 Espectroscopía 11 3 El modelo de Bohr Espectroscopía 12 El modelo de Bohr Transiciones del hidrógeno (emisión): En n ∞ 31 mayo 09 UltravioletaEspectroscopía Energía (kJ/mol (kJ/mol) Visible 184 246 276 293 1 984 -1312.0 0 1167 6 5 4 3 2 1230 0 -36.4 -52.3 -82.0 -145.6 -328.0 -1312 14 En n ∞ UltravioletaEspectroscopía Energía (kJ/mol (kJ/mol) Visible 184 246 1 31 mayo 09 276 -1312.0 0 293 6 5 4 3 2 984 0 -36.4 -52.3 -82.0 -145.6 -328.0 1167 Núcleo Capa K, n=1, r=0.529 r=0.529 Å Capa L, n=2, r=2.116 r=2.116 Å Capa M, n=3, r=4.761 r=4.761 Å Capa N, n=4, r=8.464 r=8.464 Å Capa O, n=5, r=13.225 r=13.225 Å 1230 Órbitas de Bohr del hidrógeno 31 mayo 09 El modelo de Bohr Transiciones del hidrógeno (absorción): -1312 13 El modelo de Bohr Conviene aquí aquí comentar que la propuesta de Bohr le abre el camino a la mecánica cuántica, independientemente del hecho de que es incorrecta casi en todos sus detalles Sin embargo es una herramienta que nos permite visualizar mecánicamente mecánicamente el fenómeno espectroscópico Particularmente, porque el modelo no nos da ninguna pista del origen de el enlace químico Además no da ninguna base para entender por que ocurre la cuantización de la energía del electrón Ni tampoco explica la razón por la cual un electrón no irradia energía al estar en movimiento 31 mayo 09 Espectroscopía 15 4 El modelo de Bohr A pesar de este funesto historial, el coraje de reconocer la necesidad de una desviación de la física clásica, le ganó a Bohr un lugar en la historia Todavía hoy, a los estados permitidos, se conocen como estados estacionarios, como los bautizó Bohr A estos estados estacionarios, se les caracteriza por medio del uso de los números cuánticos. Que explican el patrón característico del átomo de H Hasta este momento hemos hablado de los electrones y de las otras partículas subatómicas como si fueran pedacitos de materia duros (¡tienen masa!) como bolas de billar Que además tienen niveles energéticos claramente cuantizados 31 mayo 09 Espectroscopía 16 ¿Partículas u ondas? Así, algunos metales (los alcalinos) pueden emitir electrones si la luz incidente es visible, en cambio otros solo emiten electrones con luz ultravioleta Es decir, cada metal tiene una frecuencia umbral, por debajo de la cual no se produce la emisión de electrones Además Además se ha demostrado experimentalmente que: Que la energía de los electrones emitidos es independiente de la intensidad del haz incidente Que la energía de los electrones emitidos es proporcional a la frecuencia de la radiación incidente Que el número de electrones emitidos por unidad de tiempo es proporcional a la intensidad de la radiación incidente 31 mayo 09 Espectroscopía 18 ¿Partículas u ondas? Los cuales, pueden medirse de manera muy precisa, usando los espectros de emisión y absorción de los elementos Sin embargo, a menudo tienen un comportamiento que no se puede explicar con este modelo Por otro lado, la radiación electromagnética, que tradicionalmente se había percibido como un fenómeno ondulatorio, tiene propiedades que se pueden asociar al comportamiento de las partículas Y además decimos que tiene momento efectivo y que está cuantizada en paquetes llamados fotones Cuando la luz incide en una superficie metálica, se puede producir emisión de electrones A este fenómeno se le conoce con el nombre de efecto fotoeléctrico 31 mayo 09 Espectroscopía 17 ¿Partículas u ondas? Este fenómeno, no puede deducirse de la teoría electromagnética clásica pues según esta, la energía de los electrones debe variar con la intensidad y ser independiente de la frecuencia En 1905, Albert Einstein, Einstein, demuestra que se podían resolver estas dificultades si se aplicaban los postulados de Plank a este fenómeno Para ello, sugiere que en vez de pensar en la luz incidente como un fenómeno ondulatorio, debe considerarse como una corriente de corpúsculos a los que llamó fotones. Cada uno de estos fotones tiene una energía determinada 31 mayo 09 Espectroscopía 19 5 ¿Partículas u ondas? La cantidad de energía de cada fotón está dada según Einstein por esta expresión: E fotón = hν Cuando los fotones golpean la superficie metálica estos, pueden ceder su energía a un electrón del metal Y parte de esta energía la emplea para arrancarlo de la superficie del metal dándole energía cinética. Si la frecuencia es inferior a la umbral, el efecto no se produce Ahora bien, matemáticamente, ya sea que consideremos que los electrones (o la luz) como partículas o como ondas, depende esencialmente de la observación que pretendemos describir 31 mayo 09 Espectroscopía 20 ¿Partículas u ondas? Esta es una propiedad que típicamente se percibe asociada con el comportamiento de las ondas Esto desde el punto de vista de la mecánica clásica, es claramente una contradicción Esta dualidad partícula-onda de las propiedades de los electrones fue expresada por Louis de Broglie De Broglie, Broglie, postula que la materia posee características de onda y de partícula al mismo tiempo Y expresa esta dualidad en una ecuación que ya es muy famosa y se considera muy profunda En esta, la longitud de onda se expresa como una función de la masa y de la velocidad h λ= 31 mayo 09 Espectroscopía mv 22 ¿Partículas u ondas? Así, algunas veces una representación será más útil que la otra, en tanto que en otras ocurrirá lo opuesto Conviene recordar entonces, que cualquiera que sea el modelo matemático empleado, el resultado es una descripción de las propiedades de las propiedades y no de la naturaleza de los electrones o la luz Considerando que es posible pesar a los electrones, lo cual es tradicionalmente una propiedad de las partículas. Resulta muy desconcertante saber que los electrones también pueden hacer cosas (como por ejemplo difractarse) de manera muy similar a la radiación visible o a los Rayos X. 31 mayo 09 Espectroscopía 21 ¿Partículas u ondas? Esto nos sugiere, que las observaciones de comportamiento ondulatorio o de partícula, simplemente se relacionan a diferentes atributos de la materia o de la luz Evidentemente, esto es una idea que genera mucha confusión Para los humanos, todos los días, la experiencia nos sugiere que las cosas son, o bien partículas o bien ondas, nunca ambas ¡Una pelota es una partícula y el sonido es una onda¡ En la práctica por tanto, la dualidad partícula-onda es significativa para entidades muy, muy pequeñas Como por ejemplo, los átomos y las moléculas 31 mayo 09 Espectroscopía 23 6 ¿Partículas u ondas? El obstáculo que se nos presenta para entender su naturaleza se debe a que es difícil relacionar nuestra experiencia cotidiana con la luz y la materia, con la aparente naturaleza conflictiva de las partículas que son tan pequeñas Así, parece ridículo sugerir que la materia que manipulamos cotidianamente puede tener propiedades ondulatorias, pero no lo es El problema descansa en la magnitud de la longitud de onda Para cualquier objeto visible, el tamaño de la longitud de onda es tan pequeño que no puede percibirse Así Así, es posible concluir que longitud de onda efectiva de una partícula es importante únicamente cuando la partícula es muy pero muy pequeña 31 mayo 09 Espectroscopía 24 De órbitas a orbitales de Schröedinger Si en el modelo de Bohr, Bohr, los electrones dan vueltas alrededor del núcleo en órbitas cuantizadas, cuantizadas, el modelo cuántico ya no lo considera así. Antes de discutir este modelo, debemos considerar que: las dos de las piezas de información información más importantes que debemos conocer acerca de un objeto cualquiera son: la posición por una parte y la velocidad (o mas bien el momento) por otra Pero resulta que, no es posible determinar con precisión la posición y el momento de un electrón al mismo tiempo A este fenómeno, se le conoce como principio de incertidumbre de Heisenberg 31 mayo 09 Espectroscopía 26 ¿Partículas u ondas? Consideremos una pelota de baseball, cuya masa es de 150 g y que se mueve a 160 km/h (45 m/s). m/s). Al sustituir esto en la ecuación de de Broglie: : Broglie h 6.63 " 10#34 #35 != = % 9.81 " 10 mv 0.15 $ 45 Esto ¡es muy pequeño! Por otro lado, un electrón que se moviera a la misma velocidad, cuya masa en estado estacionario es de 9.10939 x 10-30 kg tendría una longitud de onda asociada de: −34 λ= h 6.63×10 = ≈ 1.6×10−6 −30 mv 9.10939×10 ⋅ 45 La cual es una longitud de onda mucho más observable experimentalmente 31 mayo 09 Espectroscopía 25 De órbitas a orbitales Esto puede ilustrarse como sigue: Para definir la posición de un electrón, es necesario ver donde está. Para poder ver un objeto, es necesario que la luz que lo ilumine tenga una longitud de onda menor que el tamaño del objeto Como los átomos son mucho menores que la longitud de onda de la luz visible, será necesario emplear radiación con longitud de onda del tamaño de un átomo Estas longitudes de onda están asociadas a radiación electromagnética de gran energía Como la radiación electromagnética tiene también asociado un momento efectivo, al chocar con los electrones, les transferirán parte de ese momento 31 mayo 09 Espectroscopía 27 7 De órbitas a orbitales De manera que el momento original del electrón cambia Así, aunque hemos visto al electrón, al mismo tiempo le hemos cambiado su momento, es decir, nuestra observación hace que las propiedades del objeto cambien Un análisis riguroso de este fenómeno y otros relacionados, muestra que: Al conocer con mayor precisión la posición de un electrón, se conocerá con menor precisión su momento y viceversa Hay un límite con el cual se pueden conocer la posición y el momento de un objeto cualquiera al mismo tiempo y se determina con esta ecuación: h Donde: ∆x ⋅ ∆p ≥ 31 mayo 09 ∆x = incertidumbre en la posición ∆p = incertidumbre en el momento Espectroscopía 4π 28 De órbitas a orbitales De tal manera, que podemos decir que la probabilidad de encontrar al electrón en un sitio particular es lo mismo que hablar de la densidad electrónica de ese punto Entonces, la densidad electrónica o densidad de probabilidad son formas de representar a los electrones en los átomos Y describen a los electrones localizados en una región específica del espacio con una densidad particular en cada punto del espacio Para que el modelo de Bohr funcione, es necesario postular la cuantización de la energía de manera aparentemente arbitraria para que el modelo se ajuste a las observaciones 31 mayo 09 Espectroscopía De órbitas a orbitales Este hecho que pudiera parecer desastroso a primera vista, no lo es Pero si nos obliga a emplear un tratamiento diferente para analizar las propiedades del electrón. Así, en vez de hablar de la posición o de la velocidad de un electrón, hablaremos de la probabilidad de que se encuentre en un lugar en un tiempo determinado Aunque la posición de un electrón no puede definirse exactamente, la probabilidad de encontrarlo si puede calcularse Además, si la probabilidad de encontrar al electrón en un sitio es grande, la densidad electrónica de ese sitio será grande 31 mayo 09 Espectroscopía La ecuación de Schröedinger Es decir, este modelo no explica por que hay niveles energéticos cuantizados Erwin Schröedinger en 1925, propone que la manera más directa de explicar esto era enfatizar la naturaleza ondulatoria del electrón por medio de ecuaciones que describieran las propiedades ondulatorias de los electrones en los átomos Con esto, y mucha intuición, sugiere que un sistema atómico puede tratarse con una ecuación como la siguiente: 2 ∇ ψ+ 30 29 31 mayo 09 8π 2me h2 (E −V ) ψ = 0 Espectroscopía 31 8 La ecuación de Schröedinger Es decir, usó un método llamado mecánica ondulatoria para describir las propiedades de los electrones y sus niveles energéticos (orbitales) empleando ecuaciones de onda Además de los sistemas atómicos, hay muchos otros sistemas mucho más familiares que se describen satisfactoriamente con las ecuaciones de onda Entre estos fenómenos se encuentra el de una cuerda de guitarra que al fijarse en dos extremos, produce únicamente notas de cierta frecuencia (la fundamental y sus harmónicos) Es decir, las vibraciones de una cuerda fija en sus dos extremos, están cuantizadas 31 mayo 09 Espectroscopía 32 La ecuación de Schröedinger Esto, es una consecuencia perfectamente natural, del hecho de ambos extremos de la cuerda estén fijos Por cierto el fijar los extremos de la cuerda constituye lo que llamamos condición a la frontera de la ecuación de onda que describe las notas La ecuación de onda empleada para describir el comportamiento de los electrones en un átomo, requiere de manera similar, la imposición de ciertas condiciones a la frontera perfectamente naturales Esta ecuación de onda que ha causado problemas a muchas generaciones de estudiantes, y seguramente continuará haciéndolo, pero las matemáticas no las vamos a resolver en nuestro curso 31 mayo 09 Las unidades de energía energía (breviario) La energía energía puede expresarse de muchas maneras y existen dos expresiones que nos permiten transformarla de unas unidades a otras libremente. La primera de estas relaciones es: c = νλ Donde c es la velocidad de la luz en el vacío, λ la longitud de onda y ν la frecuencia La segunda de estas relaciones es: E = hν Donde E es la energía de la radiación, h la constante de Plank y ν la frecuencia Y por tanto, la frecuencia y la energía energía son inversamente proporcionales a la longitud de onda. 31 mayo 09 Espectroscopía 34 Espectroscopía 33 Las unidades de energía energía (breviario) Una tabla con las unidades de energía energía más comunes se presenta a continuación: 1.Joule 1.Joule por mol (J/mol): J/mol): Un Joule es la unidad de energía energía del SI definida como: kg• kg•m 2/s2. Dado que las energías asociadas a una sola molécula son extraordinariamente pequeñas usualmente discutimos la energía empleada por una mol de sustancia. 2.N 2.Número de onda (cm (cm-1): También se conoce como centímetros a la menos uno (o recíproco de cm). cm). Estas unidades se obtienen cuando la frecuencia se expresa en hertz (1/s) 1/s) y la velocidad de la luz se expresa en cm/s, cm/s, típicamente se emplea en las diferentes espectroscopias. 31 mayo 09 Espectroscopía 35 9 Comportamiento espectroscópico Las unidades de energía energía (breviario) 3. Caloría por mol (cal/mol): cal/mol): La caloría caloría se define originalmente como la cantidad de energía necesaria para calentar un gramo de agua un grado centígrado. 4. Electrón volt (eV): eV): Se define como la energía obtendrá in electrón al acelerarlo por una diferencia de potencial de in volt. volt. Esta cantidad se emplea preferentemente en las áreas de fisicoquímica y electroquímica. 5. Litros atmósfera (L-atm ): Es una unidad que (L-atm): relaciona presión y trabajo. 31 mayo 09 Espectroscopía 36 Para apreciar la magnitud y como se puede medir el valor de Δο o 10Dq 10Dq;; examinemos un caso sencillo El [Ti(H2O)6]3+, un complejo que en disolución acuosa presenta un color púrpura muy notable Esta propiedad además de caracterizar al complejo cualitativamente, puede hacerlo también cuantitativamente, para ello es necesario medir el espectro de absorción de la disolución El espectro de este en la región del visible, presenta una banda centrada en 499.3 nm, lo cual corresponde a una frecuencia de 20029 cm-1 que a su vez puede transformarse en 239.58 kJ / mol 31 mayo 09 Comportamiento espectroscópico Espectro del [Ti(H2O)6]3+, en agua: 31 mayo 09 Espectroscopía Espectroscopía 37 Comportamiento espectroscópico Para poder explicar este espectro, recurrimos a la teoría del campo cristalino La cual, nos indica que en la configuración d 1 en su estado basal, el electrón ocupará uno de los orbitales degenerados t2g Y que al adquirir energía procedente del haz de luz incidente, empleará esta energía para subir a un estado excitado de energía superior, es decir alguno de los orbitales eg Entonces el color púrpura es el resultado de la absorción de la luz de cierta frecuencia la cual se emplea en la promoción del electrón de un orbital t2g a uno eg 38 31 mayo 09 Espectroscopía 39 10 Comportamiento espectroscópico Interacción luz-electrón, (dependencia del campo): 31 mayo 09 Espectroscopía 40 Comportamiento espectroscópico Esta transición se puede representar así: t2g0 eg1 ← t2g1 eg0 Esta es la más sencilla de las transiciones observables en los elementos de transición, pues dicha transición refleja directamente la diferencia de energía entre los dos estados (basal y excitado) del sistema Cuando el sistema estudiado tiene otras interacciones, por ejemplo entre los electrones que cohabitan en el mismo nivel energético (d (d2 en adelante) , dichas interacciones deberán tomarse en cuenta Hablaremos de ellas más adelante 31 mayo 09 Distorsión tetragonal y espectro Si dos ligantes trans de un octaedro se alejan o se acercan del ion metálico a lo largo de un eje, ocurre una distorsión Tales distorsiones no se ven favorecidas puesto que ordinariamente ello conlleva una pérdida en la energía de enlace Sin embargo, en ciertas situaciones se presenta un efecto que favorece tales distorsiones Se le conoce con el nombre de efecto de Jan-Teller, y está basado en el teorema que dice: una molécula no lineal en un estado electrónico degenerado, debe distorsionarse para disminuir su simetría de manera que pierda la degeneración y disminuya su energía 31 mayo 09 Espectroscopía 42 Espectroscopía 41 Distorsión tetragonal y espectro Este teorema no predice el tipo de distorsión que ocurrirá Una representación intuitiva de este problema, que es quizá más aceptable que el teorema abstracto, surge del hecho de que las configuraciones electrónicas susceptibles a la distorsión (d (d 1 por ejemplo), no son esféricamente simétricas En el caso de una estructura octaédrica, el electrón, presente en uno de los orbitales (d (d z2), repelerá a los ligantes en esa dirección O de otra manera, la electronegatividad del ion metálico respecto a los ligantes será menor en la dirección z que en cualquiera de las direcciones x o y 31 mayo 09 Espectroscopía 43 11 Distorsión tetragonal y espectro A este fenómeno físico se le llama: anisotropía La anisotropía dará como resultado en enlaces más repulsivos en la dirección z y menos repulsivos en las otras Así, los enlaces en el primer caso serán más largos que los demás demás Si el electrón hubiese estado en el orbital dx2-y2 la anisotropía actuaría de manera opuesta, y el acortamiento se presentará en el eje z Esta representación tiene la ventaja de ser fácil de visualizar Aunque no es capaz de darnos los resultados cuantitativos que se obtienen empleando el teorema 31 mayo 09 Espectroscopía 44 Distorsión tetragonal y espectro Así, en el caso de un ion como el [Ti(H2O)6]+3, en un campo octaédrico Con una configuración t2g1 (triplemente degenerada), estará sujeto a la distorsión de JanTeller Dado que según el teorema la triple degeneración está prohibida, se presentará una distorsión Al presentarse la distorsión, el electrón podrá ocupar un nivel energético de menor energía A pesar de que el teorema no indica la dirección en que ocurrirá la distorsión, en este caso es factible ver que la estabilización del electrón es aproximadamente dos veces mayor si hay una compresión que si hay una descompresión Es decir, la EECC será mayor en D4h que en O h 31 mayo 09 Distorsión tetragonal y espectro Cambios en la energía energía de los orbitales debido a una distorsión tetragonal: Espectroscopía 45 Distorsión tetragonal y espectro Por tanto, el espectro de este ion deberá mostrar dos señales (bandas) en vez de una sola En todo caso esta distorsión distorsión provoca que se presente una transición adicional 31 mayo 09 Espectroscopía 46 31 mayo 09 Espectroscopía 47 12 Distorsión tetragonal y espectro La mejor evidencia de la presencia de este efecto viene del estudio estructural de sólidos de Cu(II) Este elemento tiene la configuración d9, en este caso el noveno electrón podrá podrá ocupar tanto el orbital dz2 como el d x2-y2 , haciendo que el sistema esté esté degenerado obligando al complejo a distorsionarse Otra manera de ver este problema es empleando el formalismo del agujero, que describe a este sistema como un d 10 pero con un agujero Este se comporta exactamente como un electrón, excepto que en vez de ocupar el orbital de menor energía flotará hacia el de mayor energía ¡Por cierto! esta descripción permite describir todos los sistemas dn como d 10-n inversos 31 mayo 09 Espectroscopía 48 Distorsión tetragonal y espectro Así el espectro de los complejos tetragonales de Cu(II) puede considerarse como el los de Ti(III) pero invertido 31 mayo 09 Estados atómicos y términos Los estados energéticos de un ion libre: Antes de entrar a la siguiente etapa en el estudio del efecto de los ligantes sobre los iones metálicos, es necesario que examinemos un poco la teoría que se encuentra detrás de los niveles energéticos de un ion en ausencia de los ligantes Para ello es necesario establecer claramente el significado de dos cantidades que serán parte de nuestra discusión a partir de este momento El primero de ellos es la configuración: Es la asignación de un número determinado de electrones a un conjunto de orbitales Así, cuando hay dos electrones en los orbitales d, tendremos la configuración d 2 Que se extiende a cualquier conjunto de orbitales 31 mayo 09 Espectroscopía 50 Espectroscopía 49 Estados atómicos y términos Y el segundo es el Término espectroscópico espectroscópico:: Es un nivel energético de un sistema atómico El cual debe especificarse por su configuración Cada configuración da a lugar a un número de niveles energéticos y por tanto a un número igual de términos La energía de cada una de las transiciones espectrales del átomo de hidrógeno se puede determinar usando la fórmula de Rydberg: Rydberg: 1 1 ν = 109737cm −1 − n 2 n 2 1 2 para n2 > n1, siempre y cuando sean enteros 31 mayo 09 Espectroscopía 51 13 Una pequeña desviación histórica Esta ecuación consta de dos términos, Es práctica común entre los espectroscopistas aplicar esta palabra a las energías asociadas a los estados de un átomo que presenta una transición espectroscópica Entonces, los términos espectroscópicos son en esencia, una descripción abreviada de la energía, el momento angular y la multiplicidad del espín de un átomo en un estado particular De esta manera es conveniente que seamos capaces de especificar la energía, el momento angular y la multiplicidad Con una representación simbólica 31 mayo 09 Espectroscopía 52 Estados atómicos y términos Se puede demostrar, que entre los electrones de una capa semillena ( de valencia) y los de una capa llena (del kernel) no hay otras interacciones además del apantallamiento de la carga nuclear efectiva que estos últimos ejercen sobre los primeros En tanto que, los electrones dentro de una capa semillena en un ion libre, están sujetos a dos perturbaciones: Primeramente está la repulsión interelectrónica La energía de la configuración depende de la manera en que los electrones ocupan los orbitales de la capa (es decir de su simetría simetría)) La repulsión interelectrónica separa a los niveles degenerados 31 mayo 09 Espectroscopía 54 Una pequeña desviación histórica Aunque los términos espectroscópicos se derivan de los orbitales atómicos, el proceso histórico ocurrió al revés Es decir, primero se observaron los estados espectroscópicos S, P, D y F; y se nombraron por las características de las líneas espectrales (S → P) = sharp, (P → S) = principal, (D → P) = diffuse y (F → D) = fundamental Y no fue sino hasta más tarde, que los símbolos s, p, d y f se emplearon para designar los orbitales atómicos 31 mayo 09 Espectroscopía 53 Estados atómicos y términos Además, existe la interacción de los momentos de espín y orbital a través del mecanismo de acoplamiento espín-orbital Este separa a su vez a los estados de diferente ocupación Esto puede representarse con el siguiente esquema: 31 mayo 09 Espectroscopía 55 14 Estados atómicos y términos La separación de una configuración se presenta entonces con diferentes términos cada uno con una energía característica Esta, está está determinada por dos factores: La repulsión repulsión interelectrónica Las interacciones espín-orbital La separación energética debida a la repulsión repulsión electrónica en los iones libres es del orden de los 10000 cm-1 En tanto que las interacciones espín espín orbital son del orden de 1000 cm-1 Dado que la energía energía debida a la repulsión repulsión interelectrónica es un orden de magnitud mayor que las energías de acoplamiento espín-orbital, enfocaremos nuestra atención al primer fenómeno 31 mayo 09 Espectroscopía 56 Estados atómicos y términos Podemos definir un número cuántico L que tiene la misma relación al estado atómico, como la que l tiene a un orbital atómico (L=2 (L=2 describe un estado D) y se determina así: L = l1 −l2 ,l1 −l2 −1,…,l1 −l2 − 2, l1 −l2 De la misma manera que la componente Z del momento orbital de un electrón lz se especifica por el número cuántico ml, la componente Z del momento orbital total Lz se especifica por el número cuántico ML Y también podemos definir entonces la componente Z del momento angular total como: Estados atómicos y términos Para ello debemos recordar las siguientes definiciones: Un término es un nivel energético que surge de una configuración y se caracteriza por: su momento angular orbital total, L , que puede ser cero, o entero positivo y es equivalente a la l del caso monoelectrónico su momento angular de espín total, S, que puede ser cero, entero positivo o semientero, equivalente a la s del caso mono-electrónico. Así tenemos que los átomos que tienen estados S, P, D o F, tienen el mismo momento angular de un electrón en un orbital s, p, d o f en el átomo de hidrógeno 31 mayo 09 Espectroscopía El número posible de valores de ML está dado por: ML = ∑m li = ml + ml + ml + ! + ml 1 2 3 n De la misma manera podemos definir un número cuántico de espín que represente el espín atómico total: S= ∑s i Así para un valor dado de S, habrá 2S+1 estados de espín caracterizados por MS, O M S = S,S −1,S − 2,!,−S M S = ms + ms + ms + ! + ms 1 58 57 Estados atómicos y términos M L = L,L −1,L − 2,!, 0,!,−L 31 mayo 09 Espectroscopía 31 mayo 09 2 Espectroscopía 3 n 59 15 Estados atómicos y términos Ahora bien, el momento angular total de un electrón cualquiera, es la resultante de dos contribuciones: El vector de momento angular orbital Y el vector de momento angular de espín Dado que ambos están cuantizados, podemos definir un nuevo número cuántico j así: j = l +s en virtud de que s = ± ½, ½, es obvio que cualquier valor de l tendrá dos valores de j los cuales serán iguales a l+½ y l−½ 31 mayo 09 Espectroscopía 60 Estados atómicos y términos Ahora, usando este nuevo número cuántico para los estados atómicos, podemos acoplar el momento total angular orbital (L (L) con el momento total de espín (S (S), y obtendremos un número cuántico total atómico (J (J ) así: J = L + S,L + S −1,L + S − 2,!, 0,!, L − S El origen de los valores de J puede concebirse como la resultante de la suma vectorial de las dos contribuciones El número de valores que J puede adquirir cuando L>S será igual a 2 S+1 Un término se etiqueta empleando sus valores de L S y J usando el siguiente esquema: (2S+1)X J 31 mayo 09 Estados atómicos y términos En donde X se etiqueta usando una letra de acuerdo a su valor, así: L= 0 1 2 3 4 5 6 X= S P D F G H I La cantidad 2S+1 se conoce con el nombre de multiplicidad del término y es igual al número de electrones desapareados más uno Los términos se nombran según el valor de S así: S 0 ½ 1 1½ 2 2½ singulete doblete triplete cuarteto quinteto sexteto Finalmente el valor de J se pone como subíndice a la derecha del término 31 mayo 09 Espectroscopía 62 Espectroscopía 61 Estados atómicos y términos Regresemos momentáneamente al mundo real y a los espectros que generaron esta nomenclatura Consideremos las transiciones de un orbital 1s a uno 2p en el hidrógeno Los términos de estas transiciones son: 2S 1/2 2S 1/2 → 2P1/2 → 2P3/2 Debido a que el término 2P1/2 tiene un poco más de energía que el 2P3/2, la línea espectral se divide en dos, es decir se genera un doblete, este, es el origen del uso de la palabrita 31 mayo 09 Espectroscopía 63 16 Asignación de los términos Asignación de los términos Ahora bien, para el B, las subcapas 1s2 y 2s2 tienen L=0, L=0, S=0 y J=0 y por tanto no contribuyen, sin embargo el electrón en 2p1, tiene L=1 y S=½ y J=1 ± ½ Esto nos da los siguientes términos: 2P1/2 y 2P3/2 Hemos visto que el término con que se representa el estado basal del hidrógeno es 2S1/2 Para el átomo de helio, L=0 y S=0 y J=0 entonces el término del estado basal del He será: 1S0 Para el caso del Li y el Be, Be, aprovechamos el hecho de que las capas y subcapas cerradas no contribuyen al término (tal como en el caso del He) He) entonces el Li tiene un estado basal igual al del H (2S1/2) Y como en el Be, Be, L=0 y S=0 y J=0, =0, entonces su estado basal será igual al del He (1S0) 31 mayo 09 Espectroscopía 64 Nótese, que una vez que lleguemos al Ne, Ne, tendremos nuevamente que su estado basal se podrá representar con el término 1S0 (el mismo que el del He) He) Y claro el Na tendrá el mismo que el del Li (2S (2S1/2) Y el Mg el mismo estado basal que el Be (1S 1S ( 0) y así sucesivamente 31 mayo 09 Espectroscopía Asignación de los términos Configuraciones permitidas (Principio de Pauli) Pauli) Para encontrarlas construimos una tabla que muestra todos los posibles arreglos que pueden tener los electrones en los orbitales escogidos En la tabla cada columna contiene al conjunto de orbitales deseados Cada celda puede contener únicamente 0, 1(↑ 1(↑) o 2 (↑↓ (↑↓)) electrones, si son dos deben aparearse Cada columna representa un microestado, cada microestado es una combinación de ML y MS El valor de ML para cada arreglo se encuentra sumando ml y el de MS sumando ms (Ojo: se asigna el valor de +½ a las flechas hacia arriba y – ½ a las flechas hacia abajo) 31 mayo 09 Espectroscopía 66 65 Asignación de los términos Como ejemplo veamos la configuración configuración del C en su estado basal (C=1s (C=1s22s22p2) es decir, p2 Se hace una tabla con todos los arreglos que pueden tener 2 electrones en los orbitales disponibles Como tenemos 3 orbitales p, ml vale+1, vale+1, 0 y -1 ml +1 ↑↓ 0 ↑↓ -1 ↑ ↑ ↑↓ ↑ ↑ ↑ ↑ ↓ ↓ ↓ ↓ ↓ ↓ ↑ ↑ ↓ ↓ ↑ ↑ ↓ ↓ ↓ ↑ ↓ ↑ Se obtiene MS = ∑ms MS 0 0 0 +1 +1 +1 -1 -1 -1 0 0 0 0 0 0 y ML = ∑ m l ML +2 0 -2 +1 0 -1 +1 0 -1 +1 0 -1 +1 0 -1 31 mayo 09 Espectroscopía 67 17 Asignación de los términos Después Después contamos los microestados ML +2 0 -2 +1 0 -1 +1 0 -1 +1 0 -1 +1 0 -1 MS 0 0 0 +1 +1 +1 -1 -1 -1 0 0 0 0 0 0 y los clasificamos en otra tabla de ML x MS estados, según los valores de obtenidos en la tabla anterior En esta, el microestado de la primera columna, tiene ML=+2 y MS=0 y lo MS colocamos en el lugar +1 0 -1 correspondiente, se hace lo mismo -2 para cada -1 microestado ML 0 y de esta manera +1 construímos +2 la nueva tabla 31 mayo 09 Espectroscopía 68 Asignación de los términos Después, separamos de la tabla de microestados los estados atómicos apropiados: Los estados se deben construir tomando en cuenta que el arreglo de microestados debe tener los valores valores apropiados de ML y MS del estado que forman Para ello consideramos que cada estado atómico forma un arreglo de microestados que tiene 2S+1 columnas y 2L+1 renglones Por ejemplo, ejemplo, un estado 3P requerirá requerirá de un arreglo de 3x3 microestados Uno 1D, de una columna de 5 microestados y Un 1S de un solo microestado y así así en cada caso 31 mayo 09 Espectroscopía 70 Asignación de los términos Para asegurar que todos los microestados se han escrito, se recurre a la fórmula siguiente: N = Nl ! x ! (N l − x )! Donde N es el número de microestados asociados a una configuración lx que tiene x electrones en un conjunto de orbitales con un número cuántico azimutal l, donde Nl = 2( 2(2l+1) 2l+1) Es decir el número de combinaciones de ml y ms para un solo electrón en el conjunto de orbitales 31 mayo 09 Espectroscopía 69 Asignación de los términos Entonces de la tabla vemos que hay : +1 ML MS 0 -1 -2 -1 0 +1 +2 3 microestados con ML=0 y MS=0, =0, uno es 1S 5 microestados con ML de +2 a -2, -2, de 1D Resta una matriz de 3x3 es decir un estado 3P Entonces los estados de la configuración configuración p2 son: son: 1S, 1D y 3 P 31 mayo 09 Espectroscopía 71 18 Asignación de los términos ¿Pero y cómo cómo los ordenamos energéticamente? Pues para eso nos acordamos que las interacciones de repulsión separan a los tripletes (sistemas con electrones desapareados) de los singuletes (sistemas con electrones apareados (en el mismo orbital) alrededor de 10000 cm-1 En tanto que el acoplamiento espín-orbital espín-orbital separa un orden de magnitud menos Los términos degenerados 3P se separarán aun más en presencia de un campo magnético A este método se le conoce como acoplamiento de Russel-Saunders y puede emplearse para átomos con mayor número de electrones que el del caso anterior 31 mayo 09 Espectroscopía 72 Asignación de los términos Pero a nosotros lo que nos interesa es lo que les ocurre a los electrones que están están en orbitales d, entonces revisaremos los resultados que se obtienen empleando este método para la serie dn : d 1: ya hemos visto que en este caso hay 10 maneras de poner a un electrón en los cinco orbitales d, por tanto esta configuración únicamente tiene un término 2D Es decir, esta configuración genera un solo término d1 → 2D ML máxima es 2 31 mayo 09 Espectroscopía 74 Asignación de los términos El resultado de este relajo se puede presentar empleando un diagrama como el que se muestra a continuación en lo que llamamos un diagrama de Russell-Saunders: 31 mayo 09 Espectroscopía 73 Asignación de los términos En el caso siguiente las cosas se complican un poco: d 2: hay 45 maneras de poner dos electrones en cinco orbitales, los valores de M L de estos arreglos ocurren el siguiente número de veces: ML = ±4 ssd 1 vez = ±3 ssd 4 veces = ±2 ssd 5 veces = ±1 ssd 8 veces = 0 ssd 9 veces total = ssd 45 veces Después Después de expurgar, expurgar, esta configuración genera: d 2 → 1G(9), (9), 1D(5), (5), 1S(1), (1), 3F(21), (21), 3P(9) 31 mayo 09 Espectroscopía 75 19 Asignación de los términos Asignación de los términos ¿Pero y las demás demás configuraciones es decir, que pasa cuando tenemos las configuraciones d 3 a d 9 , El argumento empleado para asignar los términos de las configuraciones superiores es similar al empleado hasta ahora Aunque evidentemente resulta ser, que entre más electrones tengamos, el problema de la asignación puede convertirse en algo asquerosamente laborioso Espectroscopía 76 Regla de Hund En todo caso, una vez que se han encontrado los términos que surgen de una configuración, se requiere saber algo acerca del orden energético que tienen Para conseguir esto, debemos tomar en cuenta las siguientes reglas: El término más importante será el que tiene la menor energía (estado basal del sistema), esto se decide aplicando las reglas de Hund, Hund, que plantean lo siguiente: El término que tiene la mayor multiplicidad tiende a ser el de menor energía De los términos con igual multiplicidad el de mayor L será el que tenga la menor energía 31 mayo 09 Espectroscopía Configuración Términos s2, p6 y d10 p1 y p 5 p2 y p 4 p3 d1 y d 9 d2 y d 8 d3 y d 7 d4 y d 6 d5 A continuación se presentan los términos encontrados para cada configuración electrónica 31 mayo 09 Términos de las capas llenas y semillenas 78 31 mayo 09 1S 2P 3P, 1D, 1S 4S, 2D, 2P 2D 3F, 3P, 1G, 1D, 1S 4F, 4P, 2H, 2G, 2D, 2F, 2D, 2P 5D, 3H, 3G, 3F, 3F’, 3D, 3P, 3P’, 1I, 1G, 1F, 1D, 1D’ , 1S, 1S ’ 6S, 4G, 4F, 4D, 4P, 2I, 2H, 2G, 2G’, 2F, 2F’ , 2D, 2D’ , 2D”, 2P, 2S Espectroscopía 77 Regla de Hund Así es fácil aunque muy laborioso en ocasiones obtener el estado basal de cada configuración Las energías relativas de los demás estados se pueden calcular empleando argumentos empíricos equivalentes Aunque hemos indicado que para conocer los valores de energía exactos de los desdoblamientos del campo cristalino, debemos considerar las interacciones electrón-electrón, si hay más de uno Hasta este momento, únicamente hemos considerado el llamado caso mono-electrónico aun cuando fuesen muchos los electrones d de los que hablábamos En tanto que hablemos cualitativamente del problema, esto no presenta problemas serios 31 mayo 09 Espectroscopía 79 20 Espectroscopia, un poco más Sin embargo la interpretación cuantitativa requiere de mayor cuidado Examinemos ahora que ocurre con el momento angular total de los diferentes orbitales ocupados por un solo electrón en presencia de un campo: Configuración ML Espín; Multiplicidad Estado s 1: L=0 S=½ ; (2x½+1)=2 ⇒ 2S p1 : L=1 S= ½ ; (2x½+1)=2 ⇒ 2P d1 : L=2 S= ½ ; (2x½+1)=2 ⇒ 2D f 1: L=3 S= ½ ; (2x½+1)=2 ⇒ 2F 31 mayo 09 Espectroscopía 80 Espectroscopia, un poco más Al acercar ligantes (Oh por ejemplo), en cada caso tendremos: s1 (2S): S): es esféricamente simétrico y no se verá afectado por el campo, genera un solo estado p1 (2P): P): si el campo es octaédrico, genera un estado triplemente degenerado,si el campo es de menor simetría puede desdoblarse en varios estados d1 (2D): D): en ausencia de fuerzas externas, el conjunto de cinco orbitales es degenerado y su estado basal es 2D (el electrón puede estar en cualquiera de los cinco orbitales con espín α o β), en presencia de un campo octaédrico, los orbitales degenerados se desdoblan en un triplete y un doblete de mayor energía f1 (2F): F): en un campo octaédrico tendremos dos tripletes y un singuleteEspectroscopía con diferente energía energía 31 mayo 09 81 Espectroscopia, un poco más Entonces los orbitales mencionados se transforman así: Término Campo octaédrico Estados 2S → (A1g) Espectroscopia, un poco más Otros términos términos y la influencia del campo octaédrico Término Ion →Oh Componentes (estados en Oh) S → A1g 2P → (T1u) P → T1u 2D → (T2g ) (E (Eg) D → Eg+T2g F → A2g+T1g+T2g G → A1g+ Eg+T1g+T2g H → Eg+T1g+T1g+ T2g I → A1g+A2g+Eg+T1g+T2g+ T2g 2F → (T1g ) (T2g) (A2g) Es claro que las transformaciones en otros campos serán diferentes, Pero los términos que tienen la misma L, tendrán transformaciones equivalentes Y serán independientes de la multiplicidad 31 mayo 09 Espectroscopía 82 31 mayo 09 Espectroscopía 83 21 Espectroscopia, un poco más Regresamos al problema de las configuraciones dn, en particular al caso d2 En ausencia de un campo, esta configuración presenta dos estados con la misma multiplicidad, 3F y 3P; los demás estados tienen menor multiplicidad y por tanto se encuentran a mayor energía El estado basal debe ser aquel que tiene a los dos electrones en diferentes orbitales Si se aplica un campo octaédrico, estos orbitales deben ser dos de los orbitales t2g Al excitar uno de estos electrones para promoverlo a los orbitales eg, encontramos que existen dos posibilidades 31 mayo 09 Espectroscopía 84 Espectroscopia, un poco más Es decir que el sistema tiene tres transiciones posibles: del estado basal a [(xy [(xy))1(z 2) 1] del estado basal a [(xy [(xy))1(x2-y2)1] y finalmente del estado basal a [eg2] Si regresamos al asunto del desdoblamiento en presencia de un campo octaédrico octaédrico,, recordamos que los orbitales p no cambian ante este, pero los f sí sí Si recordamos que los dos términos términos que surgen de la configuración d2, son F y P, y que estos términos términos se comportan exactamente igual que los estados f y p que surgen de las configuraciones f1 y p1, 31 mayo 09 Espectroscopía 86 Espectroscopia, un poco más La primera puede ser, que el electrón promovido provenga de los orbitales xz o yz, yz, puede pasar: al orbital z2 o al orbital x 2-y 2 Nótese que las dos configuraciones resultantes [(xy [(xy))1( x2-y2)1] y [(xy [(xy))1(z 2) 1] tienen diferente energía, debido a la repulsión ínterelectrónica Pues la primera obliga a los electrones a estar en la misma vecindad (el plano xy) xy) Evidentemente si el electrón procede del orbital xy se puede argüir similarmente que las dos configuraciones resultantes tienen diferentes energía Cuando ambos electrones se promueven (configuración [eg2]), se obtiene un estado energético adicional 31 mayo 09 Espectroscopía 85 Espectroscopia, un poco más De esta manera, el estado F se desdoblará en tres estados [( 3T1g ), ( 3T2g ), ( 3A2g )] En tanto que el P permanecerá como un solo estado, [( 3T1g )] El desdoblamiento de los estados de menor energía de las configuraciones d1 y d2 se muestra a continuación 31 mayo 09 Espectroscopía 87 22 Espectroscopia, un poco más ¿Pero y las demás demás configuraciones? Pues ya hemos visto que los estados de las demás configuraciones serán: d3 (4F, 4P), d4 (5D) y d5 (6S) Si ahora empleamos el formalismo del agujero, donde cada configuración d10-n se trata como si fuera dn invertida debido a que los agujeros tienden a flotar hacia el estado de mayor energía Y dado que los estados de las configuraciones restantes son: d8( 3F, 3P), d7( 4F, 4P) y d6(5D) Notamos de inmediato que los estados de menor energía son todos S, P, D o F; para cualquiera de las configuraciones dn 31 mayo 09 Espectroscopía 88 Espectroscopia, un poco más Por tanto el desdoblamiento de los estados ante un campo octaédrico de los estados de cada configuración, ocurre como se indica a continuación: continuación: las configuraciones d1 y d4 se desdoblan como se muestra en la figura (a (a), en tanto que las configuraciones d6 y d9 como la figura (a (a) pero invertida Las configuraciones d2 y d3 como la figura (b (b), mientras que las configuraciones d8 y d7 como la figura (b (b) pero invertida Finalmente las configuraciones d 0, d 5 y d 10 no se desdoblan pues todas son S 31 mayo 09 Espectroscopia, un poco más Las transiciones posibles de las configuraciones d1 y d2 : 31 mayo 09 Espectroscopía 90 Espectroscopía 89 Espectroscopia, un poco más Ion libre Estado basal 2D d1 3F d2 4F d3 5D d4 6S d5 5D d6 4F d7 3F d8 2D d9 1S d10 31 mayo 09 Complejo Diagrama (t2g)1 a (t2g)2 b (t2g)3 b invertido (t2g)3 (eg)1 a invertido (t2g)3 (eg)2 Sin desdoblamiento (t2g)4 (eg)2 a (t2g)5 (e (eg)2 b (t2g)6 (eg)3 b invertido (t2g)6 (eg)4 a invertido (t2g)6 (eg)5 Sin desdoblamiento Espectroscopía 91 23 Espectroscopia, un poco más Espectroscopia, un poco más 31 mayo 09 Espectroscopía 92 Las reglas de selección Como hemos visto, la estimación de las diferencias de energía entre los varios estados es relativamente simple de hacer Sin embargo, no hemos indicado algo fundamental, esto es, si las transiciones ocurren o no Experimentalmente hemos visto que en muchos de los sistemas electrónicos, el número de estados que encontramos es mucho mayor que el que se requieren para explicar nuestros espectros Para poder entender esto, es necesario conocer las de las reglas que gobiernan estas transiciones Sabemos que la materia puede absorber energía energía siempre y cuando la energía de la radiación sea igual a la diferencia entre los niveles cuantizados de diferentes estados de la sustancia 31 mayo 09 Espectroscopía 94 31 mayo 09 Espectroscopía 93 Las reglas de selección Pero para que ocurra una transición, transición, es decir, para que el componente del campo eléctrico de la radiación se absorba o emita, hay un requisito adicional Este es que la transición energética en la molécula debe estar acompañado por un cambio en su centro eléctrico para que se pueda hacer trabajo eléctrico por el campo electromagnético de la radiación Únicamente si se satisface esta condición, la transición ocurrirá Los requisitos para que ocurran estas transiciones están resumidos en un conjunto de reglas que conocemos como reglas de selección Las cuales, reflejan las restricciones que tienen los átomos o las moléculas en sus cambios de estado 31 mayo 09 Espectroscopía 95 24 Las reglas de selección Entonces, aquellas transiciones que son posibles de acuerdo a estas reglas, las conocemos como transiciones permitidas De hecho, cualquier transición no cumple con estas reglas, se dice que está prohibida Aunque claro, como en la vida, en realidad lo que tenemos es que hay unas transiciones más prohibidas que otras Debe notarse sin embargo que el término término prohibidas se refiere a si se cumplen un conjunto de reglas impuestas por un modelo simple Y aunque este es un buen modelo, pueden ocurrir transiciones a través de mecanismos no considerados en el mismo 31 mayo 09 Espectroscopía 96 Las reglas de selección Primera regla de selección Esta regla indica que para que una transición transición sea permitida debe haber un cambio de 1 en el número cuántico azimutal l, l, es decir D l=±1 Esto significa que, las únicas transiciones permitidas son aquellas donde hay un entre orbitales de diferente subcapa Es decir, si la transición ocurre de orbital s a uno p o de uno p a uno d o de uno d a uno f, la transición está permitida, Cualquier otra combinación combinación está prohibida, esto significa claro que las transiciones entre orbitales d están formalmente prohibidas Aquellas transiciones prohibidas por esta regla se les llama prohibidas por espín espín 31 mayo 09 Espectroscopía 98 Las reglas de selección La intensidad de la absorción absorción o la emisión que acompaña una transición está relacionada a la probabilidad con que ocurre dicha transición Es decir entre más probable sea una transición, más intensa será la emisión o la absorción que la acompaña De esta manera, las transiciones permitidas valores de probabilidad grandes y por tanto tienen asociadas absorciones de mayor intensidad En tanto que las transiciones prohibidas tienen valores de probabilidad pequeños y por tanto dan absorciones de poca intensidad Hay tres reglas de selección relevantes en espectroscopia electrónica 31 mayo 09 Espectroscopía 97 Las reglas de selección Segunda regla de selección (multiplicidad de espín espín)) Esta regla indica que para que una transición transición ocurra el estado final y el inicial deben tener la misma multiplicidad de espín Esto significa que, las únicas transiciones permitidas son aquellas el espín espín total del sistema no cambia, además tal cambio se refiere no solamente a la transición en sí, sino al cambio de espín del propio electrón Es decir, las transiciones permitidas son aquellas que ocurren entre dos estados con la misma multiplicidad Cualquier otra combinación combinación está prohibida 31 mayo 09 Espectroscopía 99 25 Las reglas de selección Tercera regla de selección (de Laporte o de paridad): Esta regla prohíbe las transiciones entre estados con la misma simetría simetría (o paridad) respecto al centro de inversión Esto significa que, las únicas transiciones permitidas son aquellas donde hay un cambio en la paridad Es decir, si la transición ocurre de un estado gerade a uno ungerade o viceversa, la transición está permitida, Pero las transiciones de un estado gerade a uno gerade están prohibidas también lo están las ungerade-ungerade 31 mayo 09 Espectroscopía 100 Las reglas de selección Sin embargo, la espectroscopia óptica no solamente es posible, sino que como hemos visto, es una de las fuentes experimentales que soportan a las teorías de enlace de los complejos El elemento fundamental que permite explicar lo anterior, descansa en el hecho de que las reglas de selección se relajan a través de varios mecanismos, permitiendo así que dichas transiciones ocurran Uno de los mecanismos de relajación de algunas transiciones, se presenta por medio de aquellos movimientos vibracionales que pueden eliminar el centro de simetría de una molécula Y que permiten que las transiciones que de otra manera serian prohibidas sean observables 31 mayo 09 Espectroscopía 102 Las reglas de selección Dado que todos los orbitales d en los complejos centrosimétricos tienen simetría gerade, gerade, esto significa que las transiciones d-d en todas las moléculas octaédricas, están formalmente prohibidas Siendo esto cierto, parece extraño que estemos hablando de la espectroscopia de los compuestos de coordinación, coordinación, pues pues pareciera que esta no es posible Dada esta restricción, pudiera parecer que la espectroscopia UV y visible de los complejos de los metales de transición en entornos octaédricos octaédricos es inexistente Puesto que las transiciones d-d no deberían verse ¿Pero y el color? 31 mayo 09 Espectroscopía 101 Las reglas de selección Una manera en que funciona esto, tiene que ver con los ligantes que rodean al átomo central, si no son idénticos la molécula pierde el centro de inversión y por tanto absorbe O bien porque debido a que la molécula vibra (recuerden que entre mayor sea la temperatura de la disolución mayor energía cinética tendrán las moléculas) de manera que el centro de simetría simetría se elimina temporalmente La interacción interacción entre los modos vibracionales y los electrónicos se llama acoplamiento vibrionico (vibracional-electr ónico)) vibracional-electrónico 31 mayo 09 Espectroscopía 103 26 Las reglas de selección Las reglas de selección Estas transiciones son observables pero débiles, pues el número de moléculas que tienen la conformación asimétrica será una fracción del total Una disolución de la misma concentración de benceno (el (el cual tiene únicamente transiciones permitidas), permitidas), dará dará un espectro fuera de la escala Es decir, en un instante dado, el número de moléculas que han perdido el centro de simetría es mucho menor que el total, típicamente, los complejos octaédricos tienen coeficientes de extinción que van de 1 a 100 dm3/mol cm Como los complejos tetraédricos no tienen centro de simetría, la regla de Laporte se relaja y las transiciones de estos complejos son aproximadamente 100 veces mayores que las de los complejos octaédricos Esto significa que si preparamos una disolución 0.1 de un complejo ML6 su espectro en la región del visible será observable Es decir que sus coeficientes de extinción molar están en un intervalo de 100 a 1000 dm3/mol cm 31 mayo 09 Espectroscopía 104 Ancho de banda Otro factor de importancia que define la espectroscopia electrónica, electrónica, tiene que ver con el ancho de la banda de una transición En general todos los espectros de los compuestos de transición muestran bandas muy anchas Esto también también ocurre porque los complejos vibran, esta vibración, hace que los ligantes se acerquen y se alejen del metal y al hacerlo, provocan que la energía de los orbitales involucrados en la transición cambie Al alejarse, la energía disminuirá y al acercarse crecerá Este efecto es más notable en disolución, pues hay más choques 31 mayo 09 Espectroscopía 106 31 mayo 09 Espectroscopía 105 Espectroscopia, un poco más A continuación continuación los espectros electrónicos de sales de los metales de la primera serie de transición, Titanio (III): d1 31 mayo 09 Espectroscopía 107 27 Espectroscopia, un poco más Vanadio (III) =d =d2 31 mayo 09 Cromo (II) =d =d4 31 mayo 09 Espectroscopía 108 Espectroscopia, un poco más Espectroscopía 110 Espectroscopia, un poco más Cromo (III) =d =d3 31 mayo 09 Hierro (II) =d =d6 31 mayo 09 Espectroscopía 109 Espectroscopia, un poco más Espectroscopía 111 28 Espectroscopia, un poco más Cobalto (II) =d =d7 31 mayo 09 Cobre (II) =d =d9 31 mayo 09 Espectroscopía 112 Espectroscopia, un poco más Espectroscopía 114 Espectroscopia, un poco más Niquel (III) =d =d8 31 mayo 09 Espectroscopía 113 Espectroscopia, un poco más Comparación Comparación de las sales con configuración tipo a: d1 , d4 , d 6 y d 9 31 mayo 09 Espectroscopía 115 29 Espectroscopia, un poco más Comparación Comparación de las sales con configuración tipo b: d2 , d3 , d 7 y d 8 31 mayo 09 Espectroscopía 116 Espectroscopia, un poco más ¿Y la configuración d5? 31 mayo 09 ¡Otra vez las reglas de selección! Vale la pena aquí notar que en el caso de los complejos d5 cuyo estado basal es el único que es un sextuplete, sextuplete, De manera que todas sus transiciones no solamente estarán prohibidas por Laporte, sino también por espín Las transiciones que están doblemente prohibidas serán entonces extremadamente débiles La regla de selección de espín se relaja como resultado del acoplamiento de los momentos de espín y angular de los orbitales dando absorciones observables (2a y 3a serie) 31 mayo 09 Espectroscopía 118 Espectroscopía 117 Espectroscopia, un poco más Tetraédricos, el caso d7 31 mayo 09 Espectroscopía 119 30 Espectroscopia, un poco más Tetraédricos, el caso 31 mayo 09 d8 Espectros de transferencia de carga Ocurren como resultado de un proceso de afinidad electrónica-energía de ionización opuesto al de la formación del enlace Es como si en el NaCl, NaCl, tratásemos de ionizar un electrón del Cl− (-AE) y se lo diésemos al Na+ (-PI) La energía de este proceso es tan grande que solamente se obtiene empleando un fotón de alta energía (región de UV), por eso el NaCl es blanco. Si ahora pensamos en un compuesto que tenga un metal para el que la energía de ionización es mayor, el proceso de regresar el electrón al metal se verá favorecido energéticamente y se requerirán fotones de menor energía Espectroscopía 120 31 mayo 09 Espectros de transferencia de carga Un ejemplo de esto es el MnO4-, que no tiene electrones en d y por tanto no puede tener transiciones tipo d-d Sin embargo, nótese que el estado de oxidación del Mn es de +7, puede decirse que la reacción de oxidación interna (pasar un electrón del O al metal) ocurrirá con un fotón de poca energía, este también es el caso del CrO42Si la terminología iónica nos la tomamos con precaución, rápidamente entendemos que la transferencia ocurre en realidad entre un orbital cuyo carácter es principalmente del ligante y un orbital que tiene carácter metálico 31 mayo 09 Espectroscopía 122 Espectroscopía 121 Espectros de transferencia de carga Espectros del KMnO4 y el K2Cr2O7 31 mayo 09 Espectroscopía 123 31 Espectros de transferencia de carga Y aunque es conveniente etiquetar a la transición en términos de la predominancia de los orbitales, no debemos perder de vista que estos orbitales son combinaciones lineales de los orbitales de ambos el metal y el ligante Las transiciones observadas en este caso, dado que no están prohibidas por ninguna de las reglas, son las más intensas Sus coeficientes de extinción están en el intervalo de 10000 a 30000 dm3/mol cm Entre estas están: las de no enlace del ligante a enlace del metal (eL→ eM), (t (t2 → e) y (e (eM → t2*). 31 mayo 09 Espectroscopía 124 Espectros de transferencia de carga Un ejemplo de los espectros de transferencia de carga lo tenemos en los complejos de piridina que presentamos aquí, aquí, además de las bandas de la piridina aparece una banda muy intensa adicional en 290 y 310 nm [Ir(OH)(NH3)3(py)2]2+ [IrCl2(py)4]+ Piridina 31 mayo 09 Las reglas de selección A continuación, un resumen de lo anterior: ε Tipo de Clase de transición (dm3/mol cm) Complejos cm) complejos d5 Prohibidas por 10-3 a 1 espín y por bajo espín Laporte Prohibidas por complejos 1 a 10 Laporte octaédricos Permitidas por complejos 10 a 100 espín cuadrados Permitidas por complejos 100 a 1000 espín Permitidas tetraédricos por Laporte bandas de 100 a 1000000 transferencia de carga 31 mayo 09 Espectroscopía 126 Espectroscopía 125 Diagramas de Orgel Es muy conveniente contar con una representación pictórica de la información con el efecto de la fuerza del campo Los diagramas de Orgel nos dan un medio muy conveniente de predecir el número de bandas de un compuesto de coordinación Estos diagramas muestran el comportamiento de la energía de los estados en función de la fuerza del campo y son muy sencillos, pues omitimos los estados que tienen multiplicidades diferentes a la del estado basal Y únicamente se consideran los casos de campo débil y dejaremos a los de campo fuerte para después después 31 mayo 09 Espectroscopía 127 32 Diagramas de Orgel 31 mayo 09 Espectroscopía Dq (cm-1) 128 Diagramas de Orgel Y no solamente eso, también es factible presentar los campos tetraédrico y octaédrico de la misma configuración Energía (cm-1) 15000 d1 y d 6 tetraédrico d9 y d 4 octaédrico d1 y d 6 octaédrico d9 y d 4 tetraédrico 10000 5000 2E 2T 2 0 2T -5000 -10000 2E -2000 31 mayo 09 -1000 0 Dq (cm-1) 1000 Espectroscopía 2 2000 130 Diagramas de Orgel Otra característica de estos diagramas es que pueden mostrar tanto el comportamiento de una configuración dn como la de la configuración d10-n al mismo tiempo 15000 d9 octaédrico Energía (cm-1) Energía (cm-1) A continuación el diagrama para una configuración d1, la más sencilla para comprender su funcionamiento Cl−<dtp−<F−<<H 2O<NH3<NH2CH2CH2NH2 En este diagrama 15000 se ve que los diferentes 10000 ligantes separarán 5000 2E a los dos g estados, 0 más, o menos, 2T 2g dependiendo -5000 de su posición en la serie espectroquímica -10000 0 500 1000 1500 2000 2500 d1 octaédrico 10000 5000 2T g 2T 2g 2g 0 -5000 2E -10000 g -2000 31 mayo 09 2E -1000 0 Dq (cm-1) 1000 Espectroscopía 2000 129 Diagramas de Orgel De esta manera, tenemos un método método gráfico que nos presenta cualitativa y cuantitativamente el comportamiento de cada configuración electrónica ante los campos con las dos simetrías que más se presentan Adicionalmente tendremos que si conocemos el valor de ΔO o Δ T de un nuevo compejo, podemos instantaneamente situar al ligante en la serie espectroquímica Desafortunadamente estos diagramas únicamente funcionarán para los compuestos de campo débil y tendremos que emplear diagramas más complicados para los demás A continuación otros diagramas de Orgel 31 mayo 09 Espectroscopía 131 33 El diagrama del Co2+ (d (d7) 4T 1 Diagramas de Orgel =(e g)2(t2g)5 4A Energía (cm-1) 20000 4T 4P 10000 4 T 2=(e g) 3(t 2g) 4 1g 4T 4F 2g 2g Diagramas de Orgel Notamos que el desdoblamiento tetraédrico, es exactamente el inverso al del octaédrico En este se presenta el desdoblamiento de los términos del Co2+, (4F y 4P ) Nótese que aquí también se muestra explícitamente el comportamiento de los estados 4T (F ) y 4T ( P) con mezcla (línea sólida) y sin 1g 1g mezcla (línea punteada) Esto se debe a que como los términos 4T1g tienen la misma simetría, no pueden cruzarse Al aproximarse se mezclan modificando su energía, entre más se aproximen, más se mezclarán =(t2g)4(e g)3 =(t2g)4(e g)3 =(t2g)4(e g)3 0 -10000 4T 2=(e g) 3(t 2g) 4 4T 1g=(t2g) 5(e 2 g) -20000 4A 2=(eg ) 3(t )4 2g -1500 -1000 31 mayo 09 -500 0 500 Dq (cm-1) 1000 1500 Espectroscopía 132 31 mayo 09 Diagramas de Orgel 31 mayo 09 Espectroscopía 134 El diagrama del Ni2+ (d (d8) 1G Energía (cm-1) Al centrar nuestra atención en los términos T1 se puede notar además que debido a que estos dos estados se encuentran más próximos que en el caso octaédrico, se mezclan más Así, las líneas de estos estados tienen mayor curvatura en el caso tetraédrico que en el octaédrico Dado que los diagramas de Orgel, Orgel, solo pueden aplicarse al caso de los complejos de campo débil (alto espín), el estado 2G no se muestra Si añadiéramos al diagrama los estados de bajo espín, veríamos entonces claramente, que al aumentar la fuerza del campo, las configuraciones d4, d 5, d 6 y d7; pueden cambiar de alto espín a bajo espín, como se ha visto cualitativamente Espectroscopía 20000 3P 10000 1D 3F 0 Diagramas de Orgel 3T 1g =(t2g)4(eg)4 3T 2g =(t2g)5(eg)3 3T 5 3 1g =(t2g) (eg) 1E =(t )6(e )2 g 2g g -10000 -20000 3A 500 31 mayo 09 133 1000 Dq (cm-1) 2g =(t2g)6(eg)2 1500 Espectroscopía 135 34 Diagramas de Orgel Un diagrama más general para los complejos O h y Td de campo débil 31 mayo 09 Espectroscopía 136 Diagramas de Tanabe-Sugano Además Además para hacerlos generales habremos de incluir algunos otros parámetros Tomando en cuenta que la repulsión electrónica es la responsable de las diferencias energéticas entre los estados espectroscópicos espectroscópicos (Términos), (Términos), es necesario expresarla por medio de algunos parámetros parámetros que hablen de ella Estos no son más que combinaciones lineales de algunas integrales de coulomb y de intercambio, y se les conoce como los parámetros de Racah B y C Estos, a pesar de poder obtenerse numéricamente, en general se evalúan empíricamente a partir de los espectros de los iones libres 31 mayo 09 Espectroscopía 138 Diagramas de Tanabe-Sugano Los diagramas de Tanabe y Sugano están relacionados con los de Orgel, Orgel, pero incluyen tanto los términos de alto como los de bajo espín Estos diagramas se emplean para tratar el problema de la interpretación del espectro incluyendo ambos campos (fuerte y débil) Pero ahora en vez de graficar la separación separación de los estados directamente en términos de la energía, se considera que el estado basal es el cero y la energía de cada uno de los otros estados se grafica relativa al estado basal Dado que estos diagramas consideran, la correlación que existe entre los estados de alto y bajo espín, es necesario incluir todos los estados del sistema 31 mayo 09 Espectroscopía 137 Diagramas de Tanabe-Sugano Aquí Aquí se presenta una tabla con los valores de B y C para un grupo de metales de transición Carga→ Carga→ 0 Elemento↓ B Elemento↓ 560 Ti V 580 Cr 790 460 Mo 370 W 720 Mn 850 Re Fe 805 Ru 600 Co 780 Ni 1025 Pd Cu 31 mayo 09 +1 +2 +3 B/C B B/C B B/C B B/C 3.3 680 3.7 720 3.7 3.9 660 4.2 765 3.9 860 4.8 3.2 710 3.9 830 4.1 917 4.5 3.9 440 4.5 5.1 4.3 870 3.8 960 3.5 680 1.4 470 4.0 1140 3.2 4.4 870 4.2 1060 4.1 5.4 670 3.5 620 6.5 5.3 880 4.4 1120 3.9 4.1 1040 4.2 1080 4.5 830 3.2 1220 4.0 1240 3.8 Espectroscopía +4 B B/C 1040 4.1 139 35 31 mayo 09 Espectroscopía 140 Diagramas de Tanabe-Sugano Para el caso del compuesto de campo débil, débil, según el diagrama de Orgel, esperaríamos esperaríamos que el estado basal del ion libre 5D, se desdoblara en un estado basal 5T y un estado excitado 5E al incrementar el 2g g campo octaédrico Y que por tanto observaríamos observaríamos una sola transición (banda) en el espectro Recordemos que las transiciones observadas serán únicamente aquellas cuya multiplicidad no cambia Entonces, el diagrama de Tanabe y Sugano que mostremos debe tener una sección sección que contemple esto para el [CoF6]3-, a continuación continuación el diagrama: 31 mayo 09 Espectroscopía 142 Diagramas de Tanabe-Sugano De lo anterior, puede estimarse que B ~1000 cm-1 y C~4B para la mayoría de los metales de transición Ahora bien con objeto de emplear correctamente estos diagramas, estudiaremos un ejemplo en donde presentaremos el diagrama y lo analizaremos En este diagrama solo mostramos unos cuantos términos, los más importantes Nuestro ejemplo serán serán dos complejos de Co3+ el cual tiene la configuración configuración (d 6) Hemos visto que en esta configuración configuración pueden existir complejos tanto de alto como de bajo espín De manera que elegiremos dos ligantes, uno de campo débil (el Fluor) Fluor) y otro de campo fuerte (la etilendiamina) etilendiamina) 31 mayo 09 Espectroscopía 141 Diagramas de Tanabe-Sugano Diagrama de Tanabe y Sugano para la configuración configuración d6 : E/B (cm (cm-1) Diagramas de Tanabe-Sugano Para obtener las diferencias de energía entre estados de diferente multiplicidad, se requieren ambos parámetros B y C (p ej. ej. la diferencia entre las energías entre el 4F y el 2G es 4B+3C) 4B+3C) Y para caracterizar los estados de la misma multiplicidad, el parámetro B basta Entonces, los diagramas de Tanabe y Sugano se se presentan como gráficas gráficas de la energía de separación separación en términos de 10Dq, pero expresados en unidades de E/B y 10Dq/B respectivamente Además para representar exactamente los valores de energía debemos conocer el valor de B/C Al emplear estos diagramas se puede caracterizar espectroscópicamente ahora si, tanto los complejos de alto como los de bajo espín 1H 3F 3G 5D [CoF6]310Dq/B (cm (cm-1) 31 mayo 09 Espectroscopía 143 36 Diagramas de Tanabe-Sugano Claramente, esta primera parte del diagrama muestra que para los complejos de campo débil débil únicamente observaremos una transición Ahora, como resultado del incremento en el campo, el singulete 1I, que tiene mucha mayor energía en el ion libre, se va desdoblando en varios términos uno de los cuales, el 1A1g se estabiliza disminuyendo su energía muy rápidamente Cuando el valor de 10Dq/B llega a 18.5, el estado 1A 1 1g procedente del singulete I se convierte en el estado basal, pues a partir de ese valor es el término que tiene menor energía 31 mayo 09 Espectroscopía 144 Diagramas de Tanabe-Sugano En este lugar el apareamiento electrónico ocurre y se presenta una discontinuidad en el diagrama A partir de este punto, el término 1A1g es el nuevo estado basal en tanto que los términos 5T2g y 5Eg continúan divergiendo al aumentar el campo, incrementando su energía Entonces, dado que la etilendiamina es un ligante de campo fuerte y el complejo de cobalto es diamagnético, diamagnético, el estado basal del complejo de etilendiamina [Co(en) Co(en)3]3+ se encontrará encontrará en el lado derecho del diagrama, esto lo veremos a continuación: 31 mayo 09 Diagramas de Tanabe-Sugano E/B (cm (cm-1) Diagrama de Tanabe y Sugano para la configuración configuración d6 : 1H Diagramas de Tanabe-Sugano Queda entonces claro que para los complejos de alto espín como es el caso del [CoF6]3- los estados que tendrá importancia serán solamente los del quintuplete y por lo tanto solo se verá la transición 5T → 5E 2g g En tanto que para los complejos de bajo espín como es el caso del [Co(en) Co(en)3]3+ , debemos esperar dos transiciones, 1A 1 1 1 1g → T 1g y A 1g → T 2g [Co(en) Co(en)3]3+ [CoF6]310Dq/B (cm (cm-1) 31 mayo 09 145 En realidad se observan un pico y un hombro, debido al efecto de Jahn-Teller, que también es aplicable en este caso 3F 3G 5D Espectroscopía Espectroscopía 146 31 mayo 09 Espectroscopía 147 37 Diagramas de Tanabe-Sugano Incluso, es posible observar además que al incrementar el campo, ambas transiciones incrementen su energía, aunque la segunda lo hará más rápidamente Ajustar el espectro observado de un complejo al diagrama correspondiente de Tanabe Sugano, nos permite obtener los valores de Δ del complejo Además es posible evaluar el parámetro de repulsión electrónica B El valor aparente de este parámetro en los complejos, al cual llamaremos B’, siempre es menor que el del ion libre 31 mayo 09 Espectroscopía 148 Efecto nefelauxético nefelauxético Esto es el resultado de un fenómeno conocido como efecto nefelauxético (expansión de la nube) y que se atribuye a la deslocalización de los electrones en los orbitales moleculares formados por los orbitales del metal y los del ligante Como consecuencia de esta deslocalización, deslocalización, la repulsión electrónica disminuye haciendo que B’ siempre sea menor que B Jørgensen sugiere que este efecto puede calcularse empleando dos parámetros, uno para el metal y otro para el ligante (serie nefelauxética) El efecto total en el complejo es proporcional al producto de ambos parámetros: 1-β 1-β=hL x k M 31 mayo 09 Efecto nefelauxético nefelauxético 149 Espectroscopia, un poco más A continuación un ejemplo numérico, tres complejos de Cr3+: Valores del efecto: Ligante L hL Metal M kM F- 0.8 Mn(II) 0.07 H2O 1.0 V(III) 0.10 NH3 1.4 Ni(II) 0.12 ox2- 1.5 Cr(III) 0.20 en 1.5 Fe(III) 0.24 CN- 2.1 Co(III) 0.33 31 mayo 09 Espectroscopía Espectroscopía 150 31 mayo 09 Espectroscopía 151 38 Espectroscopia, un poco más Estos espectros muestran dos bandas bien definidas y en algunos se detecta la presencia de una tercera Esta banda muy a menudo estará oscurecida por la presencia de lo que se conoce como banda de transferencia de carga, que corresponde a la transferencia de un electrón desde un orbital del ligante a uno del metal Esto se racionaliza pensando que esta banda corresponde a la ionización del ligante y significa que el metal se reduce, esto ocurre a energías menores cuando el metal está en un estado de oxidación mayor y cuando el ligante es más fácilmente oxidable 31 mayo 09 Espectroscopía 152 Espectroscopia, un poco más Para asignar entonces cada una de las bandas a una transición particular, recordamos que el Cr3+ (d (d3), es un 4F, Al estar en un campo octaédrico, se desdoblará en un estado basal 4A2g, y dos estados excitados, 4T 4 2g y T 1g Además, tendremos un tercer estado con la misma multiplicidad 4P, 4T 1g En la figura vemos cada transición transición y su costo energético: energético: 31 mayo 09 Espectroscopia, un poco más Las transiciones observadas serán, ν1 = 4A2g → 4T2g; ν2 = 4A2g →4T1g ν3 = 4A2g → 4T1g(4P) 4P) Ya que las demás están prohibidas A continuación los valores experimentales de ν1, ν2 y ν3 en kk o 1000 x cm-1 Ligante ν1 ν2 ν3 Fluor 14.9 22.7 34.4 oxalato 17.5 23.9 ? etilendiamina 21.8 28.5 ? 31 mayo 09 Espectroscopía 154 Espectroscopía 153 Espectroscopia, un poco más Si regresamos al diagrama tenemos que la primera transición según el diagrama es: ν 1 = 10Dq es decir Δ Crece al pasar de F a en, en, como se esperaba según la serie electroquímica La segunda transición es: ν 2 = 18Dq, Y la tercera transición según la figura debe ser ν 3 = 12Dq + 15B 31 mayo 09 Espectroscopía 155 39 Espectroscopia, un poco más El valor observado de la primera transición, será 10Dq o sea Δ Sin embargo para el caso de F el valor de ν2 debería ser 80% mayor que la de ν1, es decir 26.8kk Por otra parte el de ν3 debería ser 12Dq + 15B, es decir 31.7kk Una vista a la tabla indica que algo anda mal Ligante ν1 ν2 ν3 Fluor 14.9 22.7 34.4 oxalato 17.5 23.9 ? etilendiamina 21.8 28.5 ? 31 mayo 09 Espectroscopía 156 Espectroscopia, un poco más La primera transición (de menor energía) tiene una energía igual a 10Dq, 10Dq, La segunda debería tener una energía de 18Dq si no fuera por que los estados 4T1g procedente del 4F y el 4T1g que viene del 4P tienen la misma simetría y ello hace que se mezclen 31 mayo 09 Espectroscopia, un poco más Esta mezcla será inversamente proporcional a la diferencia de energía entre los estados F y P Como resultado de la mezcla de los estados, el estado 4T1g(4F), tendrá menor energía en tanto que el estado 4T1g(4P), tendrá mayor energía que la que debiera tener si no hubiese ocurrido esta mezcla En el caso del Cr3+, el valor exacto de B es de 918 y C de 4133 cm-1 para el ion libre Usando estos parámetros, podemos comparar los resultados calculados con los obtenidos experimentalmente 31 mayo 09 Espectroscopía 158 Espectroscopía 157 Espectroscopia, un poco más Para mejorar la interpretación debemos hacer dos correcciones, la primera es la mezcla de los estados Y la segunda tiene que ver con que el valor de B para el ion libre, que no es el mismo que de sus complejos debido al efecto nefelauxético Si se conocen las tres transiciones, el valor de B’ se obtiene directamente así: 15B′ = ν3 + ν2 − 3ν1 Así para el caso del F, B′ = 31 mayo 09 34400 + 22700 − 3 ( 14900 ) 15 Espectroscopía = 827cm−1 159 40 Espectroscopia, un poco más Si se desconoce una de las transiciones, todavía podemos obtener el valor de Β’ Para ello empleamos la ecuación que define la razón nefelauxética así, B' β = ν1 = A2g → T2g = 10Dq = ∆o 2 2 ν3 = A2g Por tanto β=0.7 y B’=0.7x918=642 Una vez que se conocen los valores de D y B’ es posible estimar todas las frecuencias de las transiciones de un complejo 31 mayo 09 Espectroscopía 2 1g 2 1 2 Con estas ecuaciones hemos caracterizado por completo nuestro sistema: 160 Espectroscopia, un poco más Exp 34.4 22.7 14.9 I 33.4 + x 26.8 - x 14.9 22.4 14.9 Exp * 23.9 17.5 I 34.8 + x 31.5 - x 17.5 II 38.1 24.0 17.5 Δ=17.5 B’=642 Exp * 28.5 21.8 I 40.0 + x 39.3 - x 21.8 II 46.5 28.7 21.8 Δ=21.8 B’=642 Espectroscopía 1 2 ( ) → T (P) = 7.5B '+ 1.5∆ + ( 225B ' + ( ∆ ) − 18B ' ∆ ) ν2 = A2g → T1g (F) = 7.5B '+ 1.5∆ − 1 225B '2 + ( ∆ ) − 18B ' ∆ 1 − β = hL ⋅ kM = 1.5 × 0.2 = 0.3 [CrF6]3Predicción 12Dq + 15B + x 18Dq-x 10Dq [Cr( Cr(ox) ox)3]3Predicción 12Dq + 15B +x 18Dq-x 10Dq [Cr(en) Cr(en)3]3+ Predicción 12Dq+15B+x 18Dq-x 10Dq Las ecuaciones apropiadas para los complejos octaédricos d3 y d8 que nos permiten calcular las tres frecuencias ν (II en la tabla) son: B Para estimar el valor de β recurrimos a la serie nefelauxética usando los valores apropiados en la ecuación: 31 mayo 09 Espectroscopia, un poco más II Δ=14.9 B’=827 162 31 mayo 09 Espectroscopía 161 Errores del modelo del campo cristalino Aunque la serie espectroquímica racionaliza las diferencias energéticas, energéticas, espectroscópicas y magnéticas de los compuestos de coordinación, Y puede incluso tener cierta capacidad de predicción Presenta dificultades de interpretación muy serias Si el desdoblamiento de los orbitales d , procede únicamente del efecto de las cargas puntuales (iones o dipolos), debería esperarse que los aniones ejercieran el mayor efecto Por lo contrario, los ligantes aniónicos están en el lado bajo de la serie 31 mayo 09 Espectroscopía 163 41 Errores del modelo del campo cristalino Diagramas de Tanabe-Sugano Aún peor, el OH- esta por debajo del H2O a pesar de su carga En tanto que el NH3 que tiene un momento dipolo de µ=4.90x10-30Cm, tiene un mayor efecto que el agua que tiene un momento dipolo de µ=6.17x1030Cm, Es decir el efecto sobre el campo es mayor en el amoniaco a pesar de que sus momentos dipolo están en el orden inverso Esta debilidad de la TCC, sugiere que la suposición de que los ligantes y metales interactuaban de manera puramente electrostática, es cuando menos incompleta 31 mayo 09 Espectroscopía 164 31 mayo 09 Espectroscopía Diagramas de Tanabe-Sugano Diagramas de Tanabe-Sugano La configuración configuración d2 (transiciones) (completa) E/B (cm (cm-1) E/B (cm (cm-1) La configuración configuración d2 1S UV 1S 1G 3P 1D 1G 3P Visible 3F IR 1D 3F 10Dq/B 31 mayo 09 165 (cm (cm-1) Espectroscopía 10Dq/B (cm (cm-1) 166 31 mayo 09 Espectroscopía 167 42 Diagramas de Tanabe-Sugano 2D 2F E/B (cm (cm-1) 2D Diagramas de Tanabe-Sugano La configuración configuración d3 (transiciones) (completa) E/B (cm (cm-1) La configuración configuración d3 UV 2F 2D 2H 3G 4P 2D 2H 3G Visible 4F IR 4P 4F 10Dq/B (cm (cm-1) 10Dq/B (cm (cm-1) 31 mayo 09 Espectroscopía 168 31 mayo 09 Diagramas de Tanabe-Sugano Diagramas de Tanabe-Sugano 3G 3F 3G 3G E/B (cm (cm-1) 1I 1I UV Visible 3F 3G 3H 3H 5D IR 5D 10Dq/B (cm (cm-1) 10Dq/B (cm (cm-1) 31 mayo 09 169 La configuración configuración d4 (transiciones) (completa) E/B (cm (cm-1) La configuración configuración d4 Espectroscopía Espectroscopía 170 31 mayo 09 Espectroscopía 171 43 Diagramas de Tanabe-Sugano La configuración configuración d5 (transiciones) (completa) 2H 4D 4F E/B (cm (cm-1) 2H 4D 4F 2I 4F 4P Diagramas de Tanabe-Sugano 2I E/B (cm (cm-1) La configuración configuración d5 UV 4F 4P Visible 4H 4H 6S IR 6S 10Dq/B (cm (cm-1) 31 mayo 09 Espectroscopía 10Dq/B (cm (cm-1) 172 31 mayo 09 Diagramas de Tanabe-Sugano 31 mayo 09 Diagramas de Tanabe-Sugano E/B (cm (cm-1) 3D 1S 1G 1I 3D 1S 1G 1I 3F 3P 3H 5D 173 La configuración configuración d6 (completa) (completa) E/B (cm (cm-1) La configuración configuración d6 Espectroscopía UV Visible 3F 3P 3H 10Dq/B (cm (cm-1) Espectroscopía IR 5D 10Dq/B (cm (cm-1) 174 31 mayo 09 Espectroscopía 175 44 Diagramas de Tanabe-Sugano De esta manera, si tenemos por ejemplo un complejo de Fe(II) y los ligantes que lo rodean tienen un campo cercano a la región región del círculo y cambiamos la temperatura observaremos un cambio de color y además un cambio en el comportamiento magnético del complejo. En nuestro grupo hemos sintetizado complejos que tienen este comportamiento. Uno de ellos muestra este comportamiento con un cambio de espín al enfriar El otro muestra dos cambios de espín al enfriar El primero es el [Fe(Tpen )] y el otro es un dímero [Fe(Tpen)] 31 mayo 09 Espectroscopía 176 Diagramas de Tanabe-Sugano Comportamiento del [Fe(Tpen )] al enfriar: [Fe(Tpen)] [Fe(Tpen )](ClO ClO4)2 [Fe(Tpen)]( 31 mayo 09 Diagramas de Tanabe-Sugano El dímero dímero tiene un ligante similar al Tpen, Tpen, con un benceno en vez de una piridina, esto es: Espectroscopía 177 Diagramas de Tanabe-Sugano El complejo tiene esta estructura y se comporta así así: [(Bztpen)Fe-NC-N-CN-Fe(Bztpen)](PF6) 3 Además también tiene como puente entre dos Fe una dicianamida: dicianamida: 31 mayo 09 Espectroscopía 178 31 mayo 09 Espectroscopía 179 45 Diagramas de Tanabe-Sugano 3P 3P 2D E/B (cm (cm-1) 3P Diagramas de Tanabe-Sugano La configuración configuración d7 (transiciones) (completa) E/B (cm (cm-1) La configuración configuración d7 2H 3P 2D Visible 2G 2H 3P 2G 3P 4F Espectroscopía IR 4F 10Dq/B (cm (cm-1) 31 mayo 09 180 10Dq/B (cm (cm-1) 31 mayo 09 Diagramas de Tanabe-Sugano Espectroscopía La configuración configuración d8 (transiciones) (completa) 1S 1S 1D 1D 1G 3P UV Visible 1G 3P 3F IR 3F 10Dq/B (cm (cm-1) Espectroscopía 181 Diagramas de Tanabe-Sugano E/B (cm (cm-1) d8 E/B (cm (cm-1) La configuración configuración 31 mayo 09 UV 10Dq/B (cm (cm-1) 182 31 mayo 09 Espectroscopía 183 46