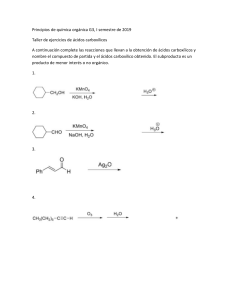
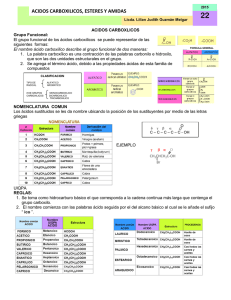
Objetivos: Reconocer un ácido carboxílico, al hacerlo reaccionar con bicarbonato de
Anuncio

COLEGIO SALESIANO EL SUFRAGIO PERIODO 4 Estudiante: ___________________________________________________________ Grado: ONCE Área – asignatura: QUÍMICA. Docente: CAROLINA MONTOYA Fecha: OCTUBRE 2014. Tipo de guía: INFORMACIÓN- EJERCITACIÓN Objetivos: Reconocer un ácido carboxílico, al hacerlo reaccionar con bicarbonato de sodio observando el desprendimiento de gas carbónico (CO2). Determinar las solubilidades en agua y en soluciones básicas de los ácidos carboxílicos Introducción Los ácidos carboxílicos constituyen la clase de ácidos más importantes. Los ácidos carboxílicos se clasifican de acuerdo con el sustituyente unido al grupo carboxilo. Un ácido alifático tiene un grupo alquilo unido al grupo carboxilo, mientras que un ácido aromático tiene un grupo arilo. Los derivados de ácidos orgánicos se originan al reemplazar el grupo–OH de la función carboxilo por otros grupos. Los ácidos carboxílicos son compuestos polares, sus moléculas pueden formar enlaces de hidrógeno entre sí y con el agua, por lo que en general son sustancias con temperaturas de ebullición altas, considerando que los ácidos carboxílicos de bajo peso molecular presentan solubilidad apreciable en el agua. Los ácidos carboxílicos son una combinación entre un grupo carbonilo y otro hidroxilo, que representa un estado de oxidación de un Carbono primario, que sigue inmediatamente al aldehído. El resultado más patente de la combinación de los dos grupos es un tremendo incremento de la acidez del hidroxilo. Aunque la ionización está lejos de ser completa, el grupo carboxilo se ioniza suficientemente en agua para volver rojo al tornasol. Los ácidos forman enlaces de hidrógeno, incluso más fuertes que los de los alcoholes, debido a que sus enlaces O-H están más fuertemente polarizados y el hidrógeno puente puede unirse a un oxígeno carbonílico cargado mucho más negativamente, en lugar de unirse al oxígeno de otro hidroxilo . Los ácidos carboxílicos en estado sólido, líquido e incluso, en cierto grado, en estado de vapor, existen en forma de dímeros cíclicos. Materiales: 9 tubos de ensayo Pinzas Gradillas Agua destilada Etanol o alcohol etílico 9 muestras problema Papel para medir pH Bicarbonato de sodio 1. Propiedades organolépticas. Ácido Olor Color Estado físico 2. Solubilidad en Agua En tres tubos de ensayo agregar 3 muestras de diferentes ácidos, un 1ml en cada tubo, luego agregar 2ml de agua destilada Muestra Medio Solubilidad 3. Solubilidad en alcohol En tres tubos de ensayo agregar 3 muestras de diferentes ácidos, un 1ml en cada tubo, luego agregar 2ml de alcohol etílico o etanol. Muestra Medio Solubilidad 4. Caracterización de ácidos carboxílicos: En 3 tubos de ensayo agregamos 3 muestras: tubo 1: ácido acetilsalicílico, Tubo 2: ácido cítrico, tubo 3: ácido acético. A cada uno le agregamos bicarbonato de sodio. Describir la reacción, copiar los nombres comunes de los ácidos y dibujar sus estructuras. RESPONDER: 1. Que factores afectan la solubilidad. 2. Por qué es importante determinar las propiedades físicas de las sustancias orgánicas