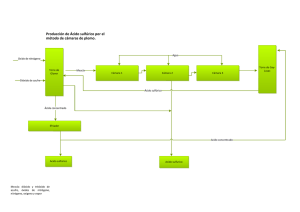
utilización de monensina sódica, en combinación con melaza, úrea
Anuncio

UTILIZACIÓN DE MONENSINA SÓDICA, EN COMBINACIÓN CON MELAZA, ÚREA Y AZUFRE PARA ESTIMULAR GANANCIA DE PESO EN NOVILLOS EN ETAPA DE PRE CEBA. PEDRO ALEXÁNDER FUENTES ALARCÓN UNIVERSIDAD DE LA SALLE FACULTAD DE ZOOTECNIA BOGOTÁ D.C 2006 UTILIZACIÓN DE MONENSINA SÓDICA, EN COMBINACIÓN CON MELAZA, ÚREA Y AZUFRE PARA ESTIMULAR GANANCIA DE PESO EN NOVILLOS EN ETAPA DE PRE CEBA PEDRO ALEXÁNDER FUENTES ALARCÓN 13991015 Trabajo de grado para optar al título de Zootecnista Director CÉSAR JULIO JARAMILLO ISAZA Médico Veterinario zootecnista UNIVERSIDAD DE LA SALLE FACULTAD DE ZOOTECNIA BOGOTÁ D.C. 2006 DIRECTIVAS HERMANO FABIO GALLEGO F.S.C RECTOR HERMANO CARLOS GABRIEL GÓMEZ F.S.C VICE-RECTOR ACADÉMICO HERMANO ÉDGAR FIGUEROA ABRAJIM F.S.C VICE-RECTOR DE PROMOCIÓN Y DESARROLLO HUMANO DR. MAURICIO FERNÁNDEZ FERNÁNDEZ VICE-RECTOR ADMINISTRATIVO DR. IGNACIO PAREJA MEJÍA DECANO FACULTAD DE ZOOTECNIA DR. JOS JUAN CARLOS LECONTE SECRETARIO ACADÉMICO FACULTAD DE ZOOTECNIA III COMITÉ ASESOR DEL TRABAJO DE GRADO FACULTAD DE ZOOTECNIA DOCTOR IGNACIO PAREJA DECANO FACULTAD DE ZOOTECNIA DOCTOR JOS JUAN CARLOS LECONTE SECRETARIO ACADÉMICO FACULTAD DE ZOOTECNIA DOCTOR CESAR JULIO JARAMILLO ISAZA DIRECTOR TRABAJO DE GRADO IV INTRODUCCIÓN .................................................................................................. 15 1. OBJETIVOS ...................................................................................................... 17 1.1 OBJETIVO GENERAL ................................................................................ 17 1.2 OBJETIVOS ESPECÍFICOS....................................................................... 17 2. MARCO DE REFERENCIA .............................................................................. 18 2.1 PROPIEDADES DE LOS IONÓFOROS (MONENSINA SÓDICA) ............. 18 2.1.1 Modo de acción de los ionóforos (monensina sódica).......................... 20 2.1.2 Mecanismo de acción antimicrobiana de los ionóforos. ....................... 21 2.2 METABOLISMO DEL AZUFRE .................................................................. 21 2.2.1 Requerimientos de azufre. ................................................................... 23 2.2.2 Deficiencias de azufre .......................................................................... 23 2.2.3 Excesos de azufre................................................................................ 24 2.3 ÚREA.......................................................................................................... 24 2.3.1 Generalidades ...................................................................................... 24 2.3.2 Síntesis de proteínas a partir de la úrea............................................... 25 2.3.3 Efectos tóxicos ..................................................................................... 26 2.3.4 Tratamiento .......................................................................................... 27 2.3.5 El Amoníaco en el rumen ..................................................................... 27 2.3.6 Suplementación nitrogenada................................................................ 30 2.3.6.1 Nivel de suplementación nitrogenada............................................ 32 2.3.6.2 Suplementación con nitrógeno no proteico (NNP)......................... 33 2.3.6.2.1 Amoniaco. ............................................................................... 33 2.3.6.2.2 Úrea.. ...................................................................................... 33 2.3.6.2.3 Biuret....................................................................................... 33 2.3.6.2.4 Fosfato diamónico................................................................... 34 2.3.6.2.5 Polifosfato amoniaco. .............................................................. 34 2.3.7 Maneras de suministrar la úrea al ganado. .......................................... 34 2.3.7.1 Ensilaje de gramíneas. .................................................................. 34 2.3.7.2 Concentrados comerciales. ........................................................... 34 2.3.7.3 Mezclas sólidas. ............................................................................ 35 2.3.7.4 Mezclas semisólidas...................................................................... 35 2.3.7.5 Mezclas líquidas. ........................................................................... 35 2.3.7.6 Bloques multinutricionales.. ........................................................... 36 2.3.7.7 Agregación a forrajes maduros...................................................... 36 2.3.7.8 Agregación a forrajes verdes. ...................................................... 36 2.3.7.9 Rociado en potreros. ..................................................................... 37 3 METODOLOGÍA................................................................................................ 38 3.1 TIPO DE ESTUDIO..................................................................................... 38 3.2 TRATAMIENTOS........................................................................................ 38 3.3 LOCALIZACIÓN ......................................................................................... 38 3.4 ANIMALES - RAZA ..................................................................................... 39 3.5 TÉCNICAS AUXILIARES............................................................................ 39 3.6 UNIVERSO Y MUESTRA ........................................................................... 40 3.7 MANEJO DE LA SUPLEMENTACIÓN ....................................................... 40 3.8 DISEÑO EXPERIMENTAL ......................................................................... 41 3.9 PROCEDIMIENTO ..................................................................................... 41 3.10 ANÁLISIS ECONÓMICO .......................................................................... 42 3.11 MATERIALES Y EQUIPOS ...................................................................... 42 4. RESULTADOS Y DISCUSIÓN......................................................................... 43 4.1 EFECTO DE LOS TRATAMIENTOS .......................................................... 43 4.2 ANÁLISIS ECONÓMICO ............................................................................ 45 5. CONCLUSIONES............................................................................................. 49 6. RECOMENDACIONES .................................................................................... 51 7. BIBLIOGRAFÍA ................................................................................................ 52 ANEXOS ............................................................................................................... 55 LISTA DE TABLAS Pag. TABLA No 1: Ganancia promedio de peso mensual en cada grupo experimental (Kg. / Mes). 43 TABLA No 2: Ganancia promedio de peso diaria en cada grupo experimental (Kg. / Día). 44 TABLA No 3: Relación costo-beneficio de cada grupo experimental. 45 VII LISTA DE GRÁFICAS Pag. GRÁFICO 1: Análisis económico comparativo entre los cuatro tratamientos utilizados en el experimento VIII 48 REGLAMENTO ESTUDIANTIL ARTICULO 96 Los trabajos de grado no han de contener ideas que sean contrarias a la doctrina de la iglesia católica en asuntos de dogma y moral. ARTÍCULO 97 Ni la universidad, ni el asesor, ni el jurado calificador, son responsables de las ideas expuestas por los graduados. IX AGRADECIMIENTOS El autor expresa sus agradecimientos a: Al doctor César Julio Jaramillo por su colaboración y gentileza en la realización de este trabajo de grado. Desde el inicio de este proyecto su interés y su espíritu investigativo guiaron la clara ejecución del desarrollo experimental, y de su posterior análisis. Al señor Jorge Luis Oñate por su valiosa contribución en el desarrollo de este proyecto pues sin apoyo incondicional y su amplia disposición habría sido imposible cumplir las metas propuestas y obtener los resultados en los que se basa el desarrollo de esta investigación. Al doctor Horacio Moreno por su exigencia, compromiso y respaldo frente al desarrollo experimental de este proyecto, ya que su trabajo proporcionó las condiciones óptimas que rodearon la realización de la investigación. A todo el personal operativo y administrativo de Inversiones Valledupar Ltda., por su atención y entrega hacia la constitución del proceso investigativo ya que gracias a su labor dedicada fue posible desarrollar todas las actividades propuestas para este proyecto. X DEDICATORIA A Dios, a mis padres, hermanos, profesores y amigos que me brindaron su apoyo incondicional. XI RESUMEN Esta investigación se realizó con el fin de evaluar la ganancia de peso en novillos comerciales tipo Pardo por Cebú, en praderas de pasto Estrella (Cynodon nlemfuensis) y kikuyina (Bothriochloa pertusa), suplementado con monensina sódica (Streptomyces cannamonensis) combinada con sal mineralizada, además de úrea y azufre mezclado con melaza. Conjuntamente se evaluó el consumo por animal de cada uno de los aditivos incluidos en la dieta y la relación costo beneficio de cada suplementación. Se conformaron 4 grupos de 20 novillos cada uno, elegidos completamente al azar; grupo experimental 1: mezcla melaza - úrea – azufre 555 gr/animal/día (melaza 90%, úrea 9%, azufre 1%), mas sal mineralizada al 4%; grupo experimental 2: monensina sódica al 2% (300 mg/animal/día), mas sal mineralizada al 4%; grupo experimental 3: monensina sódica al 2% (300 mg/animal/día), mas sal mineralizada al 4%, mezcla melaza úrea – azufre 555 gr/animal/día (melaza 90%, úrea 9%, azufre 1%); grupo control: sal mineralizada al 4%. El consumo de los aditivos utilizados en la dieta se cuantificó diariamente pesando la sal mineralizada y las mezclas suministradas en la mañana, y repitiendo el pesaje en la tarde de la sal mineralizada y las mezclas sobrantes. La fase experimental duró 84 días con intervalos de pesajes cada 28 días. El grupo experimental 1 tuvo una ganancia de peso promedio de 935 gr/animal/día, el grupo experimental 2 obtuvo una ganancia promedio de 1.016 gr/animal/día, el grupo experimental 3 consiguió una ganancia de 990 gr/animal/día, mientras que el grupo control presentó ganancias de 922 gr/animal/día. Los resultados obtenidos se analizaron estadísticamente a través de pruebas de análisis de varianza, con las que se determinó que las ganancias de peso mensuales y diarias entre los grupos evaluados no tuvieron diferencias significativas durante el primer y el segundo mes, ya que la probabilidad de semejanza de las medias de ganancia de peso superaron, con P=0.3050 en el mes uno, y P=0.2663 en el mes dos, el nivel de significancia establecido (α) de P=0.05; por otra parte, en el tercer mes, si se encontraron diferencias significativas entre las ganancias de peso de los grupos experimentales y el grupo de control, ya que la probabilidad de semejanza entre las medias poblacionales es inferior al nivel de significancia seleccionado, con P=0.0028. A la vez se comparó el consumo de cada uno de los aditivos involucrados en cada tratamiento, dando como resultado que en el grupo experimental 1 la sal mineralizada tuvo un consumo de 80 gr/animal/día, y la mezcla melaza, úrea y azufre con 485 gr/animal/día, en el grupo experimental 2 el consumo de sal mas monensina sódica fue de 90 gr/animal/día, mientras que en el grupo experimental 3 el consumo de sal mas monensina sódica fue de 70 gr/animal/día, y la mezcla melaza, úrea y azufre con 472 gr/animal/día, y finalmente el grupo de control registró un consumo de 74 gr/animal/día de sal mineralizada; también se comparó la relación costo beneficio de cada uno de los tratamientos, dando como resultado que en el grupo experimental 1 se registrara una ganancia neta de $2.800.204 por otra parte, el grupo experimental 2 obtuvo una ganancia neta de $3.592.036, de XII igual forma, el grupo experimental 3 presentó una ganancia neta de $2.996.726, por último, el grupo de control consiguió una ganancia neta de $3.294.718. Palabras claves: Monensina sódica, preceba, ganancia de peso, consumo. XIII ABSTRACT This research was performed with the purpose of evaluate the weight gaining in “Brown x Cebú” young bulls, on “Estrella” (Cynodon nlemfuensis) and “Kikuyina” (Bothriochloa pertusa) grass prairies, supplied with sodium monensina (Streptomyces cannamonensis), combined with mineralized salt, besides urea (carbamide) and blended sulfur with molasses. Jointly were evaluated the intake per animal of each one of included additives in the diet, and cost-profit relationship for each supplement. For this research were conformed 4 groups compound by 20 young bulls each one, chosen aleatory; experimental group 1: molasses – carbamide – sulfur mixture, 555 gr/animal/day (molasses 90%, carbamide 9%, sulfur 1%) besides mineralized salt at 4%; experimental group 2: sodium monensin at 2% (300 mg/animal/day), plus mineralized salt at 4%; experimental group 3: sodium monensin at 2% (300 mg/animal/day), plus mineralized salt at 4%, molasses - carbamide – sulfur mixture, 555 gr/animal/day (molasses 90%, carbamide 9%, sulfur 1%); group 4: (control) mineralized salt at 4%. The additives intake used in diet was daily quantified by weighing the mineralized salt and the mixtures given in the morning, and repeating the procedure in the afternoon, with the mineralized salt and the mixtures surpluses. The experimental stage lasted 84 days, with weighing interludes each 28 days. The experimental group 1 obtained a average weight gain of 935 gr/animal/day, experimental group 2 had a average weight gain of 1.016 gr/animal/day, group 3 got a average gain of 990 gr/animal/day, while the control group obtained average gains of 922 gr/animal/day. The obtained results were statistically analyzed through variance analysis testing, which determined that daily and monthly average weight gains between evaluated groups didn’t have significant differences during the first and second month, because average weight gain likeness probability surpass, with P=0.3050 at month 1, and P=0.2663 at month 2, the established significant level (α) of P=0.05; on the other hand, at third month was founded significant differences between average weight gain in experimental groups and control group, because likeness probability of populational average is smaller than established significant level, with P=0.0028. At the same time, was compared each additive intake at every group, giving as a result that mineralized salt intake in group 1 was of 80 gr/animal/day, and the molasses, carbamide and sulfur mixture was 485 gr/animal/day; in group 2, the salt plus sodium monensina intake was 90 gr/animal/day, while in group 3, salt plus sodium monensina intake was 70 gr/animal/day, and molasses, carbamide and sulfur mixture had a intake was 472 gr/animal/day, finally the control treatment had a intake of 74 gr/animal/day of mineralized salt. Also was compared the cost profit relationship of each treatments giving as a result in treatment 1 a net gain of $2.800.204, treatment 2 obtained a net gain of $3.592.036, at the same time, treatment 3 presented a net gain of $2.996.726, while control treatment got a net gain of $3.294.718. Key words: Sodium Monensina, preceba, XIV gain of weight, intake. INTRODUCCIÓN En los sistemas de producción de ceba, es un componente muy importante el tiempo que tome cada etapa para alcanzar el peso apropiado, bien sea para comenzar una nueva etapa o salir al mercado. Teniendo en cuenta que en esta clase de sistemas se maneja la ganancia de peso solamente con el consumo de pasto a voluntad de los animales, este sistema puede tomar mucho tiempo ya que los pastos que se manejan no tienen los nutrientes esenciales requeridos para cubrir los requerimientos de mantenimiento y producción. Un caso de lo mencionado anteriormente se encuentra en el departamento del Cesar, allí, la etapa de preceba es muy larga para alcanzar el peso deseado, lo cual representa pérdidas económicas, ineficiencia en la utilización de los potreros para la alimentación, así como periodos de permanencia mas largos de los animales en los predios. La alimentación de los animales se maneja principalmente con pastos y una pequeña suplementación con úrea y melaza a voluntad durante todo el día. Esta clase de alimentación hace que los animales ganen una pequeña cantidad de peso diario, representando esto un mayor tiempo para llegar a la meta del peso esperado. Anteriormente se realizaron estudios que estimaron por separado los beneficios que aportan compuestos como la monensina sódica, el azufre, la melaza y la úrea, en determinadas etapas de la producción en bovinos, pero hasta el momento no se han integrado estas investigaciones para explorar un modelo de alimentación alternativo el cual sea beneficioso para el productor. Por medio del presente trabajo de investigación se pretende comparar diferentes alternativas en la alimentación de novillos en la etapa de preceba, puesto que ésta es una fase muy importante, que determina en gran medida los rendimientos posteriores que tendrá el animal para su salida final en la etapa de ceba. 15 Como consecuencia de las actuales condiciones del mercado, los productores ganaderos deben ser competitivos tanto en el círculo nacional como extranjero y para esto es necesario explorar alternativas que conduzcan a mantener y mejorar la rentabilidad y competitividad del negocio. 16 1. OBJETIVOS 1.1 OBJETIVO GENERAL Evaluar el efecto de la monensina sódica, el azufre, la melaza y la úrea en la ganancia de peso en novillos en la etapa de preceba 1.2 OBJETIVOS ESPECÍFICOS Evaluar las ganancias de peso obtenidas con la suplementación de monensina sódica, azufre, melaza y úrea. Medir el consumo de la mezcla de cada uno de los tratamientos. Determinar la relación costo beneficio del modelo de alimentación. 17 2. MARCO DE REFERENCIA 2.1 PROPIEDADES DE LOS IONÓFOROS (MONENSINA SÓDICA) La monensina sódica es un compuesto biológicamente activo producido por el organismo Streptomyces cinnamonensis en un proceso de fermentación. Presenta una fórmula empírica C36H16O11Na. Este compuesto es muy poco soluble en agua, y soluble en la mayoría de los solventes orgánicos. La monensina sódica actúa alterando el movimiento de iones a través de la pared celular de las bacterias gram positivas en el rumen. Es necesario señalar que existe una gran diferencia entre organismos gram positivos y gram negativos en lo relativo a la estructura exterior de la pared celular; así, la membrana exterior de las bacterias gram negativas está compuesta por una capa de proteína, lipopolisacaridos y lipoproteínas, que está ausente en las bacterias gram positivas. Esta membrana exterior es impermeable a moléculas de gran tamaño, incluyendo los ionóforos y aún a iones libres presentes en el líquido ruminal (Bergen, 1984). La monensina incrementa la producción de ácido propionico que se forma en el rumen durante la digestión microbiana, teniendo como consecuencia una distribución proporcional de ácido acético y butírico. Estos cambios en la fermentación ruminal han sido observados tanto en el ganado en pastoreo como en ganado confinado recibiendo raciones con alto contenido de grano (Muller, 1978). El aumento en la producción de ácido propiónico resulta en mayor eficiencia energética de la digestión debido a la menor producción de gases de desperdicio, especialmente metano. 18 En resumen, la producción de ácido propiónico en el rumen es mas eficiente que la del acético, y además existe evidencia que el ácido propiónico es utilizado por los tejidos, mas eficientemente que el ácido acético. Finalmente a diferencia de los ácidos acético y butírico, el ácido propionico es el único que puede ser utilizado en gluconeogénesis. Esto último da como resultado mayor cantidad de glucosa disponible por lo que puede ser de gran ventaja energética para el rumiante en un momento dado. (Scott, 1997). El balance de la fermentación supone que un aumento en la producción de propionato tiene que estar acompañado de una disminución en la metanogénesis, como quiera que la formación de estos productos finales está inversamente relacionada. Se observa además que el crecimiento de bacterias que contribuyen a la formación de metano en el rumen Ruminococcus albus, Ruminococcus flavefaciens y Butyrovibrio fibrisolvens, se inhiben en presencia de monensina (Bergen, 1984) La manipulación de la fermentación ruminal tiene como objetivo principal aumentar la formación de ácido propiónico, para reducir la formación de metano (responsable por la pérdida de 2 a 12% de la energía de la comida). Los ionóforos son un tipo de antibiótico que, selectivamente, deprimen o inhiben el crecimiento de microorganismos del rumen. Ellos se producen por varios linajes de Streptomyces, y por lo menos se descubrieron 74 de ellos después del lasalocida, en 1951. Los ionóforos se usaron inicialmente como coccidiostátos para los pollos, pero empezando la década de 1970 empezaron a ser usados en la dieta del rumiante (Bergen, 1984). Las bacterias gram-positivas son las principales responsables de la formación de ácido acético, butírico, fórmico e hidrógeno. Las bacterias que producen el ácido succínico o aquellas que fermentan el ácido láctico son normalmente resistentes a los ionóforos (Scott, 1997). 19 2.1.1 Modo de acción de los ionóforos (monensina sódica) Los ionóforos reducen la degradación de proteína de la comida y pueden reducir la síntesis de proteína microbiana, aumentando la cantidad de proteína de origen alimentario que llega al intestino delgado. El mecanismo mediante el cual la monensina inhibe la degradación de la proteína no está claro. Aunque esa actividad tiene pocas implicaciones para bovinos con dietas altas en grano, los efectos pueden ser significantes para bovinos en crecimiento donde reciben una dieta en base a especies forrajeras (Maas, 2001). Los ionóforos pueden reducir la incidencia de acidosis (a través del aumento del pH ruminal y la inhibición de bacterias que producen ácido láctico), timpanismo y coccidiosis. Aparentemente, la monensina se excreta rápidamente después de la ingestión, con una baja acumulación en los tejidos del animal. Pero existe la posibilidad que la tasa de excreción metabólica se exceda, y los efectos nocivos de la monensina aparecen en animales que reciben una dieta en base a monensina o en seres humanos que hayan consumido tejidos de estos animales (Maas, 2001). Los ionóforos pueden afectar los procesos de la membrana celular en células eucarióticas y de organelas intracelulares (como la mitocondria), sobre todo los sistemas dependientes de conductividad eléctrica, excitabilidad o regulación osmótica. Las células del intestino delgado serían el objetivo inicial probable de la acción de los ionóforos, que pueden alterar la absorción de aminoácidos y azúcares (Novilla, 1992). 20 2.1.2 Mecanismo de acción antimicrobiana de los ionóforos. Los ionóforos obstruyen el transporte de cationes en la membrana de las bacterias gram-positivas, interfiriendo en la absorción de nutrientes para la célula y promoviendo un mayor gasto energético para el mantenimiento del balance osmótico. Como esas bacterias dependen de la fosforilación del substrato para la formación de ATP, ellas tienden el separarse y desaparecer (Bergen, 1984). Las bacterias gram-negativas sufren un aumento en la demanda de energía para el mantenimiento, pero ellas pueden adaptarse (continuando creciendo y/o sobreviviendo) debido a la capacidad de transporte de electrones acoplada a la expulsión del protones y/o síntesis de ATP. Los protozoarios y hongos también son sensibles a los ionóforos (Scoot, 1997). 2.2 METABOLISMO DEL AZUFRE Algunos compuestos de importancia fisiológica en el animal, que contienen azufre son: la insulina, el fibrinógeno, la heparina, condroitina y taurina. La insulina promueve la entrada de aminoácidos a la célula, en particular en el músculo. Estimula la síntesis de glicógeno en el músculo y los síntomas principales de la deficiencia de insulina son poliuria, polidixia, y pérdida de peso a pesar de una ingestión calórica adecuada. La heparina ayuda al revestimiento endotelial de los vasos sanguíneos como también es un anticoagulante. La condroitina se localiza en los sitios de calcificación y ayuda a la formación del cartílago. (Baker, 1997) El azufre es un elemento importante en la síntesis de proteína debido a que dos aminoácidos importantes, metionína y cisteína, contienen azufre. Al igual que para la coagulación de la sangre, funciones endocrinas y de equilibrio ácido-base en el fluido intra y extra celular. (Mcdowell, 1993,) 21 Los rumiantes pueden utilizar eficientemente el sulfato de la dieta para la síntesis de aminoácidos porque, según se ha indicado, el sulfato es reducido a sulfito en el rumen por las bacterias, como se muestra en la figura 1 O-adetil Serina Cisteina Serina SO4 SO3 S2O3 S Cistationina Homocisteína Metionina Metionina La reducción de sulfato a Sulfito se produce con un pH máximo de 6.5. El sulfato se incorpora con mayor rapidez a la cisteína que a la metionina. La incorporación microbiana del sulfato a los aminoácidos es mas rápida con un sustrato de concentrados que de forrajes (Church, 1993). Mediante el metabolismo de las proteínas también se libera sulfuro dietético que puede ser incorporado a la proteína microbiana. El cociente Nitrógeno: Azufre en la proteína microbiana es 14.5:1 (Church, 1993). El sulfuro puede ser absorbido directamente desde el rumen y es absorbido rápidamente desde el intestino delgado. El sulfato presente en el rumen es absorbido a través de la pared del rumen hacia la corriente sanguínea. Parte del sulfato es reciclado desde la sangre hacia el rumen con la saliva. El sulfato no puede ser reducido endógenamente hasta sulfuro. El sulfuro puede ser oxidado hasta sulfato en el hígado, una reacción que es inhibida por el molibdeno. La excreción de sulfato se realiza tanto con la orina como con las heces. Puesto que la mayor parte del azufre del cuerpo se halla en los aminoácidos, no resulta sorprendente que la excreción urinaria de azufre tienda a marchar paralelamente a la excreción urinaria de nitrógeno. Las dietas ricas en proteínas se relacionan con grandes cantidades de azufre y nitrógeno urinario. (Church, 1993) 22 2.2.1 Requerimientos de azufre. Los requerimientos de los minerales son dependientes del nivel de productividad, edad, consumo, raza, adaptación y forma química del elemento. (Church, 1993) El requerimiento de azufre en los rumiantes aún no está bien definido. Entre 0.1 y 0.32% es el requerimiento de azufre estimado para rumiantes en pastoreo, ya que el requerimiento de azufre para una óptima acción microbial parece ser la mayor necesidad de azufre en rumiantes. (Mc.Dowell, 1993) Los requerimientos de azufre en rumiantes se pueden aproximar si consideramos la proporción N: S. El tejido en el ganado vacuno tiene una proporción N: S de 15:1, y se ha demostrado que dietas conteniendo una proporción de 12 a 15: 1 son excelentes para el ganado. (Mc.Dowell, 1993) 2.2.2 Deficiencias de azufre Los signos producidos por las deficiencias de azufre se han descrito como: pérdidas de peso, baja digestibilidad, lagrimación, torpeza, y muerte. En una deficiencia de azufre, la síntesis de proteína microbial es reducida por lo tanto el animal presenta signos de una mala nutrición proteica. La deficiencia de azufre también produce una población microbial que no utiliza el lactato; por lo tanto, ocurre una acumulación de lactato en el rumen, la sangre y la orina. Es difícil diagnosticar una deficiencia especialmente cuando esta se encuentra en el margen. El nivel de sulfato en el suero se ha sugerido como un indicador para detectar la deficiencia de azufre, pero niveles de lactato en la sangre y niveles de azufre podrían ser los indicadores más confiables para determinar el estado del 23 azufre. Una deficiencia de azufre reduce significativamente la población microbiana así como la síntesis y digestión de proteica (NRC, 1996) 2.2.3 Excesos de azufre El ganado vacuno puede tolerar más el azufre proveniente de ingredientes naturales que de sulfatos agregados en las raciones. Niveles excesivos de azufre en la dieta pueden causar una toxicidad severa resultando en signos clínicos tales como: dolor abdominal, crispas musculares, diarrea, deshidratación severa, olor fuerte a sulfuro en el aliento, pulmones congestionados, severa enteritis. En la tabla 6 se muestran algunas tolerancias de minerales en los animales. (Mcdowell, 1993.) 2.3 ÚREA. 2.3.1 Generalidades La úrea es un compuesto nitrogenado no proteico, cristalino y sin color, identificado con la fórmula N2H4CO, elaborada en plantas químicas que producen amoniaco anhidro cuando fijan el nitrógeno del aire a presiones y temperaturas altas. Además de suplemento proteico en los rumiantes, la úrea es utilizada como fertilizante agrícola y en la elaboración de plásticos. Actualmente se presenta en el mercado en formas granulada y perlada, siendo esta última la más recomendada para uso animal por su soltura y facilidad para mezclarla con otros ingredientes (Araque, 1996). Cabe señalar que la úrea ocurre como producto final del metabolismo de nitrógeno en casi todos los mamíferos, incluso en el hombre. La úrea es muy soluble en 24 agua e higroscópica, facilitando la formación de terrones cuando es expuesta al medio ambiente. Debido a su costo, disponibilidad en el mercado y tradición de uso en la alimentación de rumiantes por muchos países alrededor del mundo, la úrea es la más utilizada entre los compuestos nitrogenátios no proteicos (biureta, fosfato diamónico, acetato de amonio, sulfato de amonio y otros). La úrea contiene aproximadamente 46% de nitrógeno, representando 287,50% de proteína equivalente total (Araque, 1996). La úrea es una fuente de nitrógeno para los rumiantes. Sin embargo, su uso depende de la habilidad de la flora microbiana del rumen para incorporarla en la formación de sus propios tejidos. La úrea siempre aporta beneficios al animal, ya que habiendo disponibilidad de forraje (aunque de baja calidad) aumentará el consumo voluntario, así como las tasas de digestión de la fibra y de pasaje del alimento a través del tracto digestivo. Cabe mencionar que el aumento del consumo de pasto seco, induce a los animales a consumir los forrajes y/o pastos menos palatables, favoreciendo así el aprovechamiento de grandes cantidades de material fibroso, generalmente subutilizado durante el verano (Araque, 1996). 2.3.2 Síntesis de proteínas a partir de la úrea Cuando el rumiante consume úrea, primeramente es hidrolizada en amoniaco y anhidro carbónico en el rumen mediante la enzima ureasa que es producida por ciertas bacterias. Por otra parte, los carbohidratos son degradados por otros microorganismos para producir ácidos grasos volátiles y cetoácidos. El amoniaco liberado en el rumen se combina con los cetoácidos para formar aminoácidos, que a su vez se incorporan en la proteína microbiana. Estos microbios son degradados en el último estómago (abomaso) e intestino delgado, siendo digeridos a tal extremo que la proteína microbiana es degradada a aminoácidos libres, para luego ser absorbidos por el animal. Debemos recordar que el amoniaco prácticamente no posee ningún valor nutritivo, pues si éste no es transformado en proteína 25 microbiana, será absorbido por el rumen y eliminado a través del hígado, riñones y finalmente en la orina bajo la forma de úrea. Por otro lado, existe una porción de úrea que regresa al rumen a través de la saliva o su difusión de la sangre al rumen (Araque, 1996). Para que exista la síntesis de la proteína microbiana en el rumen, es necesaria una relación propicia entre la cantidad de N-amoniacal y los compuestos energéticos que se encuentran en la dieta (cereales, melaza, almidón) como fuente energética para los microorganismos del rumen y así poder utilizar eficientemente el amoniaco en la síntesis de aminoácidos. Además, deben estar presentes ciertos minerales como fósforo, azufre, calcio y sodio para que complementen la fermentación ruminal. Por otra parte, es necesario adaptar la flora microbiana a la utilización de la úrea, para que se pueda llevar a efecto tal proceso, requiriendo entre 15 a 25 días, dependiendo de cómo ésta sea suministrada y del estado nutricional del animal (Araque, 1996). 2.3.3 Efectos tóxicos La úrea es degradada en el rumen para liberar amoniaco (NH3), el cual es usado por los microorganismos para producir aminoácidos. Cuando la úrea libera NH3 más rápido de lo que pudiera ser convertido en proteína microbiana, el exceso de amoniaco será absorbido a través de las paredes del rumen y llevado al hígado por la corriente sanguínea, causando una alcalosis, lo cual es una intoxicación por amoniaco. Los síntomas presentados por este tipo de anomalía fisiológica incluyen: 9 Inquietud. 9 Salivación excesiva. 9 Dificultad para respirar. 9 Altera la coordinación motora. 26 9 Tremores musculares. 9 Timpanismo (acumulación de gases en el rumen) 9 Convulsiones. 9 Mugidos. 9 Rigidez en las patas delanteras. 9 Finalmente la muerte (Araque, 1996). 2.3.4 Tratamiento Si no se trata inmediatamente, el animal morirá en un lapso de tres horas. En los bovinos el tratamiento común de la toxicidad amoniacal consiste en suministrar por vía oral una solución de dos a tres litros de vinagre disueltos en 20 -30 litros de agua fresca, antes que el animal alcance la etapa de rigidez muscular (Araque, 1996). 2.3.5 El Amoníaco en el rumen Aproximadamente el 90 % del nitrógeno total presente en el contenido ruminal, se encuentra en forma insoluble. Aproximadamente el 10 % del nitrógeno total, es principalmente nitrógeno amoniacal (el 70 % por término medio), y el resto es una mezcla de aminoácidos libres y péptidos. El amoníaco se encuentra en una concentración que oscila entre 2 y 50 mg por 100 ml, dependiendo de la ración y del tiempo transcurrido desde la ingesta; la concentración máxima de amoníaco se alcanza generalmente unas dos horas después de la ingesta de los alimentos que aportan proteína. El amoníaco es el principal nutriente nitrogenado para las bacterias del rumen; éstas lo utilizan si existen adecuadas fuentes de energía, principalmente hidratos 27 de carbono, para sintetizar los aminoácidos necesarios para cubrir sus propias necesidades proteicas. Se estima que del nitrógeno microbiano del rumen, el 5080 % procede del amoníaco ruminal. Algunas bacterias también pueden obtener hasta el 20 % o el 50 % de su proteína de otras fuentes distintas al amoníaco, como péptidos y aminoácidos (Bondi, 1988). Otras fuentes de amoníaco para el rumen, aparte de la proteína ingerida y degradada, es a partir de la úrea de origen endógeno (a través de un mecanismo de reciclaje endógeno), como de la úrea y otros compuestos de nitrógeno no proteico existentes en los alimentos. La degradación de la úrea hasta amoníaco y dióxido de carbono por la úreasa de origen bacteriano presente en el rumen, es muy rápida. El amoníaco producido en el rumen por encima de la capacidad de los microorganismos para asimilarlo, se absorbe y por sangre, es transportado al hígado y convertido en úrea. Parte del amoníaco libre existente en el rumen se absorbe directamente a través del epitelio del rumen, hasta la sangre; el resto (en la mayoría de los casos, la mayor parte), pasa con los alimentos digeridos hasta el intestino donde es absorbido, llega a la sangre y luego al hígado. La mayor parte de la úrea formada en el hígado se excreta a través de la orina; una parte (hasta el 20 %) es reciclada al rumen con la saliva o por difusión directa desde la sangre a través de la pared del rumen (Bondi, 1988). Hay una relación inversa entre la tasa de transferencia de nitrógeno del plasma al rumen, a través del ciclo "rumino-hepato-salival", y la concentración de amoníaco en el rumen. Sólo en condiciones de bajos niveles de amoníaco en el rumen, son relativamente altos los niveles de nitrógeno endógeno reciclado, que sirve como una fuente secundaria de nitrógeno para los microorganismos y un mecanismo ahorrador de este. Las raciones pobres en nitrógeno provocan un mayor reciclaje y una menor excreción de úrea en orina. En este caso (dietas pobres en nitrógeno), la principal vía de transferencia del plasma al rumen sería a través de 28 la pared ruminal, y la transferencia por la saliva tendría una importancia secundaria (Bondi, 1988). El mecanismo de control de transferencia sería indirecto y estaría involucrada en él una subpoblación de bacterias productoras de ureasa (bacterias adherentes al epitelio ruminal). Entonces las dietas pobres en nitrógeno al provocar una baja concentración de amoníaco en rumen, aumentan la concentración de ureasa en el epitelio y estas incrementarían la difusión de úrea hacia el rumen al transformar la úrea en amoníaco y crear un gradiente adecuado para que se produzca el pasaje por simple difusión de la úrea a través de la pared ruminal. Estas dietas aumentan el reciclaje de nitrógeno porque la baja concentración de amoníaco limita la fermentación microbiana para un nivel energético dado (Bondi, 1988).. De cualquier manera, la cantidad de nitrógeno reciclado está muy por debajo de los requerimientos microbianos. Debido a que hay una correlación negativa entre el nitrógeno de la dieta y el reciclado, la eficiencia de re-utilización de la úrea disminuye a medida que el consumo de nitrógeno con la dieta se incrementa. Como la úrea no se almacena en los tejidos corporales, si no es transferida al tracto digestivo, se excreta en la orina (Stritzler, 1983). En resumen, el amoníaco formado en el rumen puede (Stritzler, 1983): • Incorporarse al protoplasma microbiano, principalmente como proteína. • Ser absorbido por la pared ruminal y pasar al torrente sanguíneo. • Salir del rumen por el orificio retículo-omasal y ser absorbido en el intestino. La absorción de amoníaco a través de la pared ruminal depende casi enteramente de su concentración en rumen, pero solo se produce en presencia de la forma noionizada. Esto depende del PH existente en el rumen (a mayor PH mayor absorción), y si éste es inferior a 7, la absorción a través de la pared del rumen no es tan alta. Los niveles de amoníaco extremadamente altos en el rumen elevan el 29 PH, su absorción y van unidos a altos niveles de amoníaco en sangre; esto provoca una intoxicación por amoníaco que puede llevar a la muerte. Es el caso de una suplementación excesiva con úrea (Stritzler, 1983). Por otra parte, el empleo adecuado de úrea como substituto parcial de la proteína en la nutrición de los rumiantes resulta beneficioso, siempre que se aporte una adecuada energía. 2.3.6 Suplementación nitrogenada Para alcanzar los requerimientos proteicos de animales en crecimiento, en terminación o con altos niveles de producción de leche; es necesario suplementar sus dietas con fuentes exógenas de nitrógeno (Leaver, 1978). Nocek y Russell (1988) establecen que existe una relación entre la suplementación nitrogenada y el consumo de energía, dado que si se favorece la síntesis microbiana por medio de la suplementación proteica, se incrementa la digestibilidad, la tasa de pasaje y el consumo de materia seca (MS); de esta forma se generan mayores cantidades de productos de la fermentación ruminal disponibles para el animal (proteína bacteriana y AGV), por unidad de materia seca consumida y por unidad de tiempo. Existen distintos trabajos en los que se obtuvo respuesta en la performance animal a la suplementación de silo de maíz (como fuente de energía), tanto con nitrógeno no proteico como con nitrógeno proteico (Pate, 1992). Este papel del Nitrógeno como regulador del consumo voluntario también se presenta cuando los animales son alimentados con forrajes de baja calidad (con 50 % o menos de digestibilidad). En estas dietas el déficit de nitrógeno en el rumen puede actuar como factor limitante del consumo de energía porque deprime la digestión de la celulosa. Por otra parte, el consumo de estos forrajes está 30 determinado por la tasa de "vaciado" de forraje del rumen, y debido a la menor actividad bacteriana ésta se encuentra disminuida. La respuesta animal a un aumento en la provisión proteica, generalmente conduce a un aumento en el consumo voluntario, al incrementarse las tasas de digestión y de pasaje del alimento (Stritzler, 1983). Como fue comentado, dentro de la proteína que llega al intestino delgado para ser absorbida y metabolizada por el animal, pueden distinguirse tres tipos: a) proteína bacteriana, b) proteína dietaria y c) nitrógeno de origen endógeno (Astibia, 1984). El nitrógeno endógeno posee una contribución relativamente baja, por lo cual generalmente se lo desprecia, mientras que en animales de altos requerimientos el primer tipo de proteína sólo alcanzaría para cubrir los requerimientos de mantenimiento (Chalupa, 1975). Smith, Broster y Hill (1980) encontraron que en dietas de alto porcentaje de fibra se obtiene mejor respuesta productiva si se suplementa con proteína by-pass. Sin embargo, estos autores señalan que las mejores respuestas atribuidas a la proteína no degradable en rumen podrían deberse, en parte, a que a pesar de la mayor proporción de proteína pasante en la dieta se alcanzó un nivel de amonio ruminal adecuado para el crecimiento microbiano. La proteína puede ser suplementada en dos formas: solubles (mayor degradabilidad ruminal, harinas vegetales y úrea) y menos solubles (menor degradabilidad ruminal, harinas de origen animal como de sangre, de pescado, de plumas, etc.). 31 2.3.6.1 Nivel de suplementación nitrogenada. Santini y Dini (1986) expresan que en dietas con altos niveles de proteína, debe considerarse el exceso de amonio que se genera y que debe ser eliminado. En relación a esto Bunting, Boling y MacKown (1989), al suplementar dietas de concentrados con dos niveles de proteína (18,8 y 10,2 % de proteína bruta sobre la materia seca de la dieta), en vaquillonas Angus, concluyeron que altos niveles de proteína resultan en un leve aumento en el consumo de materia seca, mientras que la retención de nitrógeno (g/día) es significativamente mayor, al igual que la cantidad de nitrógeno urinario y la eficiencia de síntesis de proteína bacteriana (g de proteína bacteriana/100 g de materia orgánica aparentemente fermentada). Sin embargo, el reciclaje de nitrógeno fue mayor en la dieta de menor nivel de suplementación, lo que coincide con la correlación negativa entre la cantidad de N consumido y el reciclaje del mismo que citan Astibia et al. (1982); por lo tanto, la eficiencia de utilización del N (unidad retenida por unidad consumida) disminuiría al incrementarse la cantidad de N consumida. En el trabajo de Bunting et al. (1989), el nivel de proteína de la dieta no afectó la digestibilidad de la materia seca, y la cantidad de proteína bacteriana que alcanzó el abomaso fue similar para los dos tratamientos, lo que indica que el N no fue limitante para el crecimiento bacteriano en la dieta con menor proporción del mismo. La menor eficiencia de utilización del nitrógeno al incrementarse su consumo es explicada por Satter y Roffler (1975), quienes establecen una concentración máxima de amoníaco en el rumen (punto de acumulación de amoníaco), donde todo el amoníaco ruminal que se genera (por desaminación, consumo o reciclaje) es utilizado para la síntesis de proteína bacteriana, obteniéndose, de esta forma, la mayor cantidad de proteína metabolizable (PM) por unidad de proteína consumida. 32 2.3.6.2 Suplementación con nitrógeno no proteico (NNP) 2.3.6.2.1 Amoniaco. Es un gas que, en general, se disuelve en el agua. Es la fuente más barata de nitrógeno que puede utilizarse en la alimentación del ganado, pero, como es tóxica y difícil de manejar, se usa principalmente para aumentar el contenido de nitrógeno de los alimentos pobres en proteína mediante la amonificación en escala industrial. El amoníaco se fija químicamente y no se libera hasta que el pienso fermenta en el rumen (Garriz, 2002). 2.3.6.2.2 Úrea. Es la fuente más barata de nitrógeno sólido. Es un polvo blanco, cristalino y soluble en agua, que se usa como fertilizante y para la nutrición animal. Actualmente se presenta en el mercado en forma granulada y perlada, siendo esta última la más recomendable para el uso animal por su soltura y facilidad para mezclarla con otros ingredientes. La úrea fertilizante, que es más barata, es higroscópica y se cuaja con mucha facilidad, lo que hace difícil mezclarla en los piensos sólidos; sin embargo, puede utilizarse con los piensos si se añade en forma de suspensión o de solución en melaza. Las semillas de algunas leguminosas, especialmente la soja, contiene una enzima, la ureasa, que descompone la úrea y hace inapetecible el alimento. La ureasa queda en gran parte destruida por tratamiento térmico, por el cual los granos y las harinas oleaginosas pueden mezclarse con úrea (Garriz, 2002). 2.3.6.2.3 Biuret. Se produce a partir de la úrea por calentamiento, y contiene un 41 % de nitrógeno. Es apenas soluble en agua y no es tóxico, ya que el amoníaco se libera lentamente en el rumen. Por consiguiente, tiene ventajas concretas en comparación con la úrea para utilizarlo en los piensos secos. Sin embargo, es más caro y hace falta un período de adaptación de 2 semanas a 2 meses, antes que se obtenga una respuesta en la alimentación con biuret. Esta adaptación se pierde rápidamente cuando no se suministra biuret (Garriz, 2002). 33 2.3.6.2.4 Fosfato diamónico. Se trata de un polvo cristalino de color blanco soluble en agua. Contiene 21,4 % de nitrógeno y 23,7 % de fósforo. Tiene la ventaja, con respecto a la úrea, que mejora a la vez el aporte de fósforo (Garriz, 2002). 2.3.6.2.5 Polifosfato amoniaco. Es una fuente corriente de fósforo y de NNP en los suplementos líquidos. Se emplea en forma líquida, ya que tiene la ventaja, que no es corrosivo. Contiene 11 % de nitrógeno y 16,1 % de fósforo (Garriz, 2002). 2.3.7 Maneras de suministrar la úrea al ganado. 2.3.7.1 Ensilaje de gramíneas. Para este fin se pueden agregar entre 5 y 6 kg de úrea (0,5 % sobre base húmeda) por tonelada de material a ser ensilado (maíz, sorgo, pasto de corte) en el momento de llenar el silo y previamente disuelto en 20 kg de melaza. Para este procedimiento, aunque resulte más costoso, se prefiere utilizar el biuret para más seguridad (Araque, 1996). 2.3.7.2 Concentrados comerciales. En los alimentos comerciales balanceados puede ser incluido hasta el 3 % de úrea en su elaboración. El fin principal de su uso es disminuir en gran parte la utilización de proteína en su preparación, tanto de origen animal como vegetal, que son más costosas (Araque, 1996). 34 2.3.7.3 Mezclas sólidas. Es una práctica de administrar úrea acompañada de sales minerales y sal común, representando una manera de disminuir las deficiencias minerales y de nitrógeno a la flora microbiana del rumen. Este tipo de suplementación ha sido usado en otros países, variando considerablemente sus porcentajes y logrando usarse hasta el 45 % de úrea (Araque, 1996). 2.3.7.4 Mezclas semisólidas. Este tipo de suplemento combina úrea, melaza, harina de maíz, sal común y harinas de origen animal para suministrar proteínas, energía y minerales a los animales. La textura de la mezcla viene a jugar un papel muy importante en su consumo por parte de los animales, ya que mientras más pastosa sea la mezcla (contenga menos melaza), ella puede ser suministrada a los terneros de 7 meses de edad sin problemas de sobre consumo. La úrea en este tipo de mezcla puede alcanzar hasta el 10 % (Araque, 1996). 2.3.7.5 Mezclas líquidas. Este tipo de mezcla incluye hasta el 10 % de úrea, en melaza, pero requiere de mayor atención durante el período de adaptación del ganado. Se recomienda disolver la úrea en agua antes de mezclarla con la melaza, con el fin de homogenizar la solución. También se pueden incluir otros ingredientes como sal común, sales minerales y flor de azufre. Para evitar desperdicios de la mezcla y posibles consumos exagerados por los animales, se recomienda usar una rejilla de madera que flote sobre la superficie de la mezcla. También la utilización de un rodillo de madera que gire sobre una varilla metálica que servirá como eje, cubriendo la mayor parte del recipiente con la mezcla. Los suplementos líquidos son baratos, están preparados con ingredientes no costosos y disminuyen los desperdicios. Debido a que contienen melaza, el ganado los consume gradualmente a lo largo de un prolongado período de tiempo. Se evitan problemas de apetecibilidad, de toxicidad y se mejora la utilización; por todo esto es que son muy populares (Araque, 1996). 35 2.3.7.6 Bloques multinutricionales. Constituyen la forma más segura y sencilla de suministrar úrea a los rumiantes en condiciones de campo. En sí, los bloques son un producto alimenticio que posee en su composición los nutrientes básicos que el animal necesita, siendo mezclados, compactados y presentados en forma cúbica o cilíndrica, con un peso que oscila entre 14 y 50 kg. Bajo esta forma de suministro, la úrea puede alcanzar hasta el 15 %. Los bloques que contengan úrea deben verterse dentro de una lata o cajón fuerte, para evitar que los animales lo mordisqueen. Deben también protegerse de las lluvias, de forma que los animales no beban una solución de úrea. Los animales hambrientos de sal pueden inadvertidamente ingerir una dosis excesiva de úrea en su deseo de consumir sal (Araque, 1996). 2.3.7.7 Agregación a forrajes maduros. En este caso se recomienda utilizar úrea al 5 % y aplicar 15 litros de solución por cada 100 kg de forraje, y subsecuentemente mantenerlo cubierto con plástico o bolsas de plástico durante 48 horas. En estos casos es posible utilizar una úrea de categoría fertilizante, que es más barata, si se añade en forma de suspensión o de mezcla en la melaza (Araque, 1996). 2.3.7.8 Agregación a forrajes verdes. Para este fin es utilizada la caña de azúcar o pasto de corte picado, empleándose hasta 800 gr de úrea por cada 100 kg de material verde. Se requiere incrementar paulatinamente la úrea a partir de 200 gr durante la primera semana (Araque, 1996). 36 2.3.7.9 Rociado en potreros. Esta técnica es oriunda de Sud África. El animal aprovecha el nitrógeno incorporado en los potreros de pasto seco durante el verano. La mezcla rociada consiste en úrea al 8 % en melazas. Se utiliza poco por su elevado costo y por su gran desperdicio (Araque, 1996). 37 3 METODOLOGÍA 3.1 TIPO DE ESTUDIO: Experimental aplicado 3.2 TRATAMIENTOS • Tratamiento 1 mezcla melaza - úrea – azufre 555 gr/animal/día (melaza 90%, úrea 9%, azufre 1%), mas sal mineralizada al 4% • Tratamiento 2: monensina sódica al 2% (300 mg/animal/día), mas sal mineralizada al 4%. • Tratamiento 3: monensina sódica al 2% (300 mg/animal/día), mas sal mineralizada al 4%, mezcla melaza - úrea – azufre 555 gr/animal/día (melaza 90%, úrea 9%, azufre 1%) • Tratamiento 4: control, sal mineralizada al 4%. 3.3 LOCALIZACIÓN El proyecto se ubica en la Hacienda Santo Domingo, en la jurisdicción del municipio de Valencia, departamento del Cesar, Colombia; la hacienda se encuentra a una altitud de 169 m.s.n.m., y se registra una temperatura promedio de 27 °C. La hacienda cuenta con una topografía plana, típica de la región caribe colombiana. 38 3.4 ANIMALES - RAZA Se conformaron cuatro grupos de 20 bovinos machos comerciales enteros, con una edad promedio de 10 meses, tipo Pardo por Cebú, con un peso superior a 180 Kg. Al iniciar el experimento los grupos evaluados tenían un peso promedio de 209,05 Kg. para el tratamiento 1 (mezcla melaza, úrea, azufre y sal mineralizada al 4%) 211,55 Kg. para el tratamiento 2 (monensina sódica mas sal mineralizada al 4%), 199,95 Kg. para el tratamiento 3 (mezcla melaza, úrea, azufre mas monensina sódica y sal mineralizada al 4%), y finalmente 192,05 Kg. para el tratamiento testigo. 3.5 TÉCNICAS AUXILIARES Para la recolección de la información, se tuvieron en cuenta las fuentes primarias, las cuales se basaron en observaciones directas durante la ejecución del experimento, estas corresponden principalmente a datos recolectados y almacenados en registros previamente diseñados. Para recoger la información fue necesario conocer todos los datos técnicos y económicos posibles acerca de los animales que fueron sometidos al experimento, en los cuales se destacan el peso individual de los animales antes de iniciar el experimento, los pesos individuales con intervalos de 28 días hasta alcanzar la meta de 300 Kg. donde finaliza la fase de preceba, el peso final, el consumo de los distintos aditivos incluidos en la dieta, al igual que las sal mineralizada. En las técnicas auxiliares de recolección de datos, fueron diseñados registros de fácil lectura e interpretación por cualquier persona (Anexos 7-11), para el seguimiento diario de distintos parámetros como el consumo de sal mineralizada al 4% más monensina sódica, el consumo de la mezcla de melaza, úrea, y azufre, así como el simple consumo de sal mineralizada al 4%, así como el registro para 39 el pesaje de los animales cada 28 días; los distintos tipos de registros se pueden observar en los anexos del presente trabajo donde especifican sus datos correspondientes. Las unidades experimentales se asignaron al azar. Los animales estaban numerados con hierro en dos zonas, la primera en la paleta con números del 1 al 4 que determinaban el tratamiento experimental al cual pertenecían, y la segunda en el lomo, para determinar individualmente el historial y evolución del animal con respecto al tratamiento determinado. Se manejó un proceso de recolección de datos estricto para poder hacer una evaluación estadística y así dar una estimación acertada de los resultados del experimento. 3.6 UNIVERSO Y MUESTRA Cada uno de los cuatro tratamientos incluía un total de 20 animales, que fueron distribuidos al azar para el experimento, los cuatro grupos eran pastoreados paralelamente en el mismo potrero, para dar a los cuatro grupos las mismas condiciones de alimentación. 3.7 MANEJO DE LA SUPLEMENTACIÓN A los cuatro tratamientos se les suministró la misma cantidad diaria de sal mineralizada al 4% (2000 gramos por lote); por otra parte, la mezcla de melaza, úrea, y azufre (555 gr/animal/día melaza 90%, úrea 9%, azufre 1%) se suministró en igual cantidad a los tratamientos 1 y 3; y finalmente se suministró igual cantidad de monensina sódica (300 mg/animal/día) para los tratamientos 2 y 3. Este procedimiento se llevó a cabo durante los 84 días que duró el experimento. 40 3.8 DISEÑO EXPERIMENTAL Para la variable peso corporal y ganancia de peso se utilizó un análisis de varianza en un diseño completamente al azar, con cuatro tratamientos y veinte repeticiones con el siguiente modelo estadístico: Уij = µ +Tί+Єij Уij: son las variables evaluadas: µ: medida general del grupo bajo experimentación. Tί: es el efecto debido a los tratamientos. і=4 Єij: es el error experimental. 3.9 PROCEDIMIENTO Los animales requeridos para este proyecto fueron escogidos en la Hacienda Caracas, la cual, en el modelo de producción establecido por INVERSIONES VALLEDUPAR Ltda., se encarga de la cría; el ganado fue escogido bajo los parámetros de un peso mayor a 180 Kg., un excelente estado sanitario y uniformidad del lote. Posteriormente fueron trasladados a la hacienda Santo Domingo, donde se marcaron por grupos de tratamiento, se purgaron, y dieron inicio a una fase de acostumbramiento. Se conformaron cuatro grupos de 20 animales cada uno. Antes de iniciar el experimento los animales fueron pesados de nuevo para conocer los pesos iniciales y así determinar posteriormente los parámetros requeridos para esta investigación. El pesaje de los animales se llevó a cabo en intervalos de 28 días La mezcla de melaza, úrea, y azufre era preparada en la hacienda Santo Domingo diariamente, para garantizar una mezcla homogénea de los distintos aditivos y así era ofrecido a los animales en melásemos tipo rodillo adquiridos en la ciudad de 41 Valledupar. El suministro era diario, pesando en las horas de la mañana la mezcla ofrecida y repitiendo en la tarde el pesaje del sobrante y por diferencia sacar el consumo del día. Igualmente la sal mineralizada al 4% y la monensina sódica fue suministrada al ganado en saladeros fabricados en la hacienda Santo Domingo. El suministro era diario, pesando en las horas de la mañana la sal ofrecida y repitiendo en la tarde el pesaje del sobrante y por diferencia sacar el consumo del día. 3.10 ANÁLISIS ECONÓMICO El análisis de los resultados que se van a presentar en el desarrollo experimental estará compuesto por la evaluación de la relación costo beneficio de cada tratamiento, en donde se valorará el nivel de inversión en suplementación, la ganancia bruta en los 84 días, y la ganancia neta de cada tratamiento, que se obtiene de la diferencia entre la ganancia bruta y la inversión en suplementación. Por otra parte, se hallarán y se compararán las ganancias netas marginales que se obtienen en la aplicación de cada tratamiento. 3.11 MATERIALES Y EQUIPOS • Corrales. • Bascula. • Melásemos • Saladeros. • Bebederos. • Hierros para el marcaje de los animales. • Gramera electrónica de precisión para el pesaje de la monensina sódica. • Gramera para el pesaje de la sal mineralizada, úrea y azufre. 42 4. RESULTADOS Y DISCUSIÓN 4.1 EFECTO DE LOS TRATAMIENTOS Al transcurrir los 84 días del experimento el peso vivo promedio encontrado fue de 287,7kg para el grupo experimental 1 (mezcla melaza, úrea, azufre y sal mineralizada al 4%), 296,9 Kg. para el grupo experimental 2 (monensina sódica mas sal mineralizada al 4%), 283,1 Kg. para el grupo experimental 3 (mezcla melaza, úrea, azufre mas monensina sódica y sal mineralizada al 4%), 269,6 Kg. para el grupo de control. Tabla 1. Ganancia promedio de peso mensual en cada grupo experimental (Kg. / Mes). Meses TC T1 T2 T3 P<∞ 1 26.95±2.61 26.10±1.84 30.50±1.17 29.5±1.55 0.3050 2 38.85±1.29 34.15±2.52 36.05±0.5 35.75±1.30 0.2663 3 11.65±1.10ª 15.75±1.84b 18.85±0.91b 17.9±1.60b 0.0028 Promedio ± error estándar; el promedio es el resultado de 20 replicas por tratamiento a, b, diferente letra en sentido horizontal expresan diferencias estadísticamente significativas (p<0.05), Duncan. En cuanto al primer mes de iniciado el experimento, se denota en la tabla 1 que no se expresan diferencias estadísticamente significativas (p>0.05) entre grupos experimentales (Anexos 1-3), para el segundo mes se observa un comportamiento similar al primer mes en donde tampoco difieren los grupos experimentales entre si, pero en la etapa final del tratamiento, en el tercer mes, sí se expresan diferencias estadísticamente significativas (p<0.05), en donde los grupos experimentales 1, 2, y 3 no difieren entre si, pero cuando se les compara con el grupo de control se puede observar que hay una mejor respuesta en la ganancia de peso, al incluir ingredientes como melaza, úrea, azufre, y monensina sódica en diferentes proporciones como suplementos alimenticios; La investigación de Chicco, Ríos, Shultz (1985) mostró resultados comparables con los obtenidos en 43 esta evaluación, puesto que allí se encontraron diferencias estadísticamente significativas entre un grupo experimental suplementado con melaza y úrea, y un grupo control en base a pastoreo, incluso, con un nivel de significancia superior (P<0.01) al usado en las pruebas realizadas en el presente trabajo de campo. Tabla 2. Ganancia promedio de peso diaria en cada grupo experimental (Kg. / Día). Meses TC T1 T2 T2 P<∞ 1 0.96±0.09 0.93±0.06 1.08±0.04 1.05±0.05 0.3050 2 1.38±0.04 1.21±0.04 1.28±0.04 1.27±0.04 0.2663 3 0.41±0.03ª 0.56±0.06b 0.67±0.03b 0.63±0.05b 0.0028 Promedio ± error estándar; el promedio es el resultado de 20 replicas por tratamiento a, b, diferente letra en sentido horizontal expresan diferencias estadísticamente significativas (p<0.05), Duncan. El comportamiento de la ganancia de peso diaria de los tres grupos suplementados (Anexos 1-3) se puede catalogar como semejante con los resultados obtenidos en el grupo de control dentro en el primer mes, ya que el análisis de varianza da como resultado P>0.05; Igualmente ocurre en el mes dos, en donde P desciende levemente, pero sigue superando ampliamente el límite de P>0.05. El tercer mes es el que muestra diferencias estadísticas significativas entre los resultados del grupo de control y los grupos suplementados, ya que se encuentra una probabilidad de interrelación muy baja (P<0.05) entre dichos tratamientos, mientras que los tratamientos suplementados no difieren significativamente entre si. Estos resultados permiten tener una visión más amplia del uso de la monensina sódica, pues a diferencia de los estudios de Sabogal (1985) realizados en Montería, Colombia, que consistieron en una ceba de novillos tipo Cebú x Romosinuano con pastoreo rotacional en pradera de pasto angleton suplementado con sorgo molido adicionado con monensina sódica, en los que se obtuvo una ganancia de peso promedio de 0.830 kg/animal/día, 0.09Kg. más que los animales 44 del grupo control que registraron ganancias de 0.740 kg/animal/día; en el presente estudio la monensina sódica es proveída a los animales en la sal mineralizada con resultados muy satisfactorios en cuanto a ganancia de peso y palatabilidad. Se observa una relación directamente proporcional en el comportamiento de ganancia de peso diaria y mensual para el tercer periodo en los grupos experimentales, Por último, cabe destacar los picos de ganancia diaria y mensual de peso promedio que se presentan en el segundo mes de evaluaciones todos los grupos analizados. 4.2 ANÁLISIS ECONÓMICO Tabla 3. Relación costo-beneficio de cada grupo experimental. Inversión en Tratamiento suplementación (84 días) 1 2 3 Control $657.270 $165.564 $664.074 $117.482 Ganancia de Peso promedio; 84 días (Kg.) 78,6 85,4 83,2 77,6 Ganancia (20 animales-84 días) Ganancia Neta $3.457.474 $3.757.600 $3.660.800 $3.412.200 $2.800.204 $3.592.036 $2.996.726 $3.294.718 Los grupos experimentales 1, 2, 3 y Control muestran una diferencia apreciable en lo que a sus costos se refiere. En el grupo experimental 1, en el que se suministró una mezcla de Melaza, Úrea y Azufre junto con la Sal Mineralizada tienen un valor de $391.2 por día, para veinte animales el valor por día de la suplementación es de $7824 y el costo total para un periodo de 84 días para los mismos veinte animales es de $656.880 por animal. Por otro lado cada uno de los animales ganó un total de 76 kilos en promedio, con un valor por kilo de $2220 para una ganancia total de $168.720 en el periodo de preceba. En resumen mientras se invirtió un total de $656.270 se obtuvo una ganancia de $3.457.474 con el aumento de peso de 78,6 kilos por animales en 20 animales en 84 días de preceba lo que arroja una 45 ganancia real de $2.800.204. Marginalmente, la ganancia diaria del grupo, se puede expresar a través del cociente de la ganancia neta y la inversión realizada, y en este caso, se obtiene una ganancia diaria de $4.26 por peso invertido; de igual forma, el porcentaje de la utilidad bruta que se convierte en utilidad neta es del 80.98% . El grupo experimental 2 que se suplementó con Monensina Sódica y Sal Mineralizada tuvo un costo por día de $98.6 por animal, para un total de $1972 por día para los veinte animales y de $165.564 para los mismos veinte animales en el periodo completo de la preceba (84 días).Los animales sometidos a este tratamiento reportaron una ganancia total promedio de 85.4 kilos con un valor por kilo de $2220 para una ganancia total de $189.588 por animal en 84 días. Para este tratamiento la inversión en suplementación fue menor que en el tratamiento 1 en el mismo periodo, $166,320 obteniéndose una ganancia de $3.757.600 con el aumento de peso de los 20 animales en 84 días de preceba. La ganancia real en este tratamiento fue de $3.592.036. Marginalmente, la ganancia diaria del tratamiento, se puede expresar a través del cociente de la ganancia neta y la inversión realizada, y en este caso, se obtiene una ganancia diaria de $21.59 por peso invertido; de igual forma, el porcentaje de la utilidad bruta que se convierte en utilidad neta es del 95.59% . En el tratamiento 3 el suplemento a base de la mezcla de Melaza, Úrea y Azufre, Sal Mineralizada y Monensina Sódica tiene un valor de $395.3 por día por animal, $7906 por veinte animales por día y de $664.074 en los 84 días de la preceba. La ganancia reportada en este tratamiento fue de 83.2 kilos en promedio, con un valor por kilo de $2220 para una ganancia total de $184.704 por animal. Para este tratamiento la inversión en suplementación fue de $664.774 obteniéndose una ganancia de $3.694.080 con el aumento de peso de 83.2 kilos por animal durante la preceba lo que le arroja una ganancia real de $2.996.726 La ganancia marginal de la utilización de este tratamiento es de $3.45 por peso invertido, y la proporción de utilidad bruta conservada en la utilidad neta es de 81.12% 46 Por último el tratamiento 4 suplementado solo con Sal Mineralizada tienen un valor de $70 por día por animal, $1400 por día para veinte animales y el costo total para un periodo de 84 días para los mismos veinte animales es de $117.600. La ganancia de peso durante la preceba para esta grupo de animales fue de 77.5 kilos, con un valor por kilo de $2220 para una ganancia total de $172.050 en el periodo de 84 días por animal. La inversión en suplementación fue de $117.600 mientras la ganancia fue de $3.441.000 con el aumento de peso de 77,5 kilos por animal, para una ganancia neta de $3.294.718, La ganancia marginal de la utilización de este tratamiento es de $28.26 por peso invertido, y la proporción de utilidad bruta conservada en la utilidad neta es de 96.58%; en el gráfico dos se aprecia la ganancia neta de cada tratamiento dando como una opción valida de suplementación, la utilización de monensina sódica mas sal mineralizada (tratamiento dos), como una alternativa valida y viable por sus bajos costos de producción y por el sencillo manejo que requiere para la alimentación de novillos en la etapa de preceba. A continuación se presenta el gráfico 1, el cual permite comparar descriptivamente las diferencias en la relación costo beneficio que se obtuvieron con la utilización de cada uno de los suplementos experimentados 47 Gráfico 1. Análisis económico comparativo e ntre los cuatro grupos utilizados en el experimento $4.000.000 T2 T3 T1 Control Pesos en moneda $3.500.000 $3.000.000 $2.500.000 $2.000.000 $1.500.000 $1.000.000 $500.000 $0 Tratamientos Inversion en suplementacion (84 dias) Ganancia (20 animales-84 dias) 48 Ganancia Neta 5. CONCLUSIONES 9 A lo largo del procedimiento, se pudo comprobar que los suplementos suministrados a los grupos experimentales sí representan una mejor alternativa en lo que se refiere a la ganancia de peso mensual y diaria, ya que se hicieron evidentes, gracias la las pruebas de hipótesis, las diferencias estadísticas significativas entre el grupo control y los grupos experimentales en el tercer mes. 9 Por otra parte, los resultados obtenidos no permiten catalogar algún suplemento como destacable frente al resto de los probados, puesto que no se encontraron diferencias significativas entre estos, La poca variabilidad de los resultados obtenidos con cada suplemento se puede explicar, en parte, a que la dieta base que se suministró a los novillos fue forraje, y teóricamente, ésta no permite obtener los mejores resultados del uso de la monensina sódica para la ganancia de peso, en comparación con modelos de alimentación a base de granos o concentrados. 9 Mediante el análisis económico realizado en este trabajo se puede señalar que la ganancia neta presente en el grupo experimental 2 fue superior, frente a los demás grupos evaluados, lo cual se debe a los bajos costos que representa la utilización de la monensina sódica con respecto al uso de otros suplementos como úrea, melaza o azufre; sin embargo, la comparación porcentual y marginal de los tratamientos realizados muestra que la alternativa mas eficiente económicamente, es la usada en el grupo control, gracias a su bajo costo en inversión y a su tradicional manejo en la finca, que se ve reflejado en ganancias de peso semejantes a las que otorgan el uso de las otras suplementaciones probadas en este estudio. 49 9 El conjunto de resultados obtenidos en este estudio, no permite marcar la superioridad de alguno de los tratamientos probados con respecto al resto, y la preferencia que tenga un productor con respecto a las suplementaciones aquí analizadas dependerá de otros factores, como por ejemplo el modelo de alimentación que desea llevar a cabo en su medio de producción para novillos en la etapa de preceba, o costos de implementación y capacitación asociados con su uso. 50 6. RECOMENDACIONES Se recomienda para trabajos posteriores incrementar el tiempo del tratamiento para llevar a cabo una suplementación completa tanto en la etapa de preceba hasta completar la ceba. Para futuros ensayos es necesario utilizar modelos de alimentación basados en granos y concentrados para determinar la eficiencia nutricional y económica de la monensina sódica en la etapa de preceba. También es recomendable evaluar los costos que se derivan de la implementación de cualquiera de los suplementos nutricionales utilizados en este trabajo, como costos de ejecución, capacitación, sanitarios y productivos. 51 7. BIBLIOGRAFÍA ACEDO - RICO, J. 1997. Utilización de aditivos en piensos para rumiantes: minerales forma orgánica, levaduras, enzimas, ionóforos y otros. ANGELA MARTÍN; BRIAN W. Mc BRIDE; JAN C. PLAIZIER; RANDAL BAGG; TODO DUFFIELD. Evaluation of the effect of the rumensin controlled release capsule (CRC) for the reduction of ruminal acidosis in the transition dairy cow. Ontario. Pag. 2 -19. ARAQUE Cësar. 1996. Uso de la úrea en la alimentación de rumiantes, Revista de difusión de tecnología agrícola y pesquera del FONAIAP, Venezuela. ASTIBIA, O.R.. 1984. Utilización del nitrógeno por el rumiante. Rev. Arg. Prod. Anim. 4(4): 373-384. BAKER DH. 1993. Sulfur in rumiant nutrition. National fed ingredients associaton, Des Moines, Iowa, 122 Pag. BERGEN WG, 1984, Ionophores: Their effects on production efficiency and mode of action, Pag. 58 BERNAL, Eusse. Javier. 1994. Pastos y forrajes tropicales. 3ed. BONDI, A. 1988. Nutrición Animal. Editorial Acribia, S.A. Zaragoza, España. 544 pag. CHURCH D.C. Fundamentos de nutrición y alimentación de animales. Cap. De aditivos alimentarios no nutritivos y estimulantes del crecimiento. Editorial Limusa. México 1993. pag. 259 – 262. 52 GARRIZ Martín. 2002. Suplementación con nitrógeno no proteico en rumiantes; Facultad de Veterinaria de la Univ. de Bs. As. http://www.produccionbovina.com/informacion_tecnica/suplementacion_proteica_y _con_nitrogeno_no_proteico/07-suplementacion_con_nitrogeno.htm; HERNÁNDEZ, Sampiari., FERNANDEZ, Carlos y BATISTA, Pilar. 1991. Metodología de la investigación. Editorial McGraw-Hill. México. LEAVER, J. 1978. Utilization of maize silage by dairy herd replacement. Agricultural Research Council, London; 297-322. LOWE, L.B.; Ryde, W. 1990. Monensina controlled release capsules in bulls grazing improved pastures. New Zeland. MAAS JA. 2001. The effect of season and moensin sodium on the digestive characteristics of autumn and spring pasture fed to sheep. 1052-1058 MAYNARD, Leonard. 1992. Nutrición animal. Editorial McGraw-Hill. 4ta Edición. México. McDONALD. 1999. Nutrición animal. Editorial Acribia S.A. 5ta Edición. MCDOWELL LR. 1993. Minerals for grazing ruminants in tropical regions. Second edition. Bulletin of the Center for Tropical Agriculture. University of Florida. Gainesville, FL. MÉNDEZ, Carlos. 1998. Metodología, guía para elaboración de diseños de investigación en ciencias. Editorial McGraw-Hill. México. MILA, Alberto. 1996. Compendio de pastos y forrajes. Arte y diagramación. 1ra edición. 53 MULLER Roger, 1978, Rumensin technical manual for pasture and range cattle. Elanco products company, Indianapilis NOVILLA, M.N. 1992. The veterinary importance of the toxic syndrome induced by ionophores. Vet. Human Toxicol. 34:66-70. NRC: National Research Council Committee on Animal Nutrition. 1996. Nutrient Requirement of Beef Cattle. 7th Rev PATE, F. M. 1992. Feeding molasses based supplements to the cow-calf herd during the summer. Fla. Cattleman and Livestock J. Vol. 56 (No. 10):54-55. SABOGAL, Roberto. 1985. Evaluación de monensina sódica en el rendimiento de novillos en pastoreo suplementados con sorgo. ICA. Monteria. SCOTT B., Laudert. 1997. Effects of feeding. Rumensin. Free-choice mineral to steers grazing native grass pastures. Elanco Animal Healt.. STRITZLER, N. 1983. Suplementación nitrogenada en forrajes de baja calidad. Rev. Arg. Prod. Anim. Vol. 3, N°4, 283-309. VAN AMBURGH, M. E. 1997. Cornell Nutrition Conference for feed Manufactures. Effects Ionophores on growth and facturation in cattle. Rochester NY. 54 ANEXOS 55 ANEXO 1: ANALISIS DE VARIANZA DE UN FACTOR; MES 1 (kg./mes) RESUMEN Grupos TC T1 T2 T3 Cuenta Suma 20 19 20 20 539 496 610 591 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 256,019387 Error 5206,68947 Total G.L. 3 75 5462,70886 26,95 2,61521359 25,5 25 11,6955907 136,786842 43 7 50 539 20 Varianza 136,786842 64,4327485 27,6315789 48,5763158 C.M.C. Fc. Probabilidad Ft. 85,3397957 1,22928104 0,30505535 2,72658918 69,4225263 Ns. 78 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta Promedio 26,95 26,1052632 30,5 29,55 T1 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T2 26,1052632 1,84152037 28 25 8,02700122 64,4327485 31 10 41 496 19 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T3 30,5 1,17540586 32 35 5,25657483 27,6315789 18 20 38 610 20 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta 29,55 1,55846584 30 35 6,96967114 48,5763158 31 11 42 591 20 ANEXO 2: ANALISIS DE VARIANZA DE UN FACTOR; MES 2 (kg./mes) RESUMEN Grupos TC T1 T2 T3 Cuenta Suma 20 20 20 20 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 229 Error 4315,8 Total 4544,8 38,85 1,29426874 37 35 5,78814578 33,5026316 25 30 55 777 20 Promedio 38,85 34,15 36,05 35,75 3 76 C.M.C. 76,3333333 56,7868421 G.L. Varianza 33,5026316 127,292105 32,1552632 34,1973684 Fc. Probabilidad 1,3442081 0,26637817 Ns. Ft. 2,72494395 79 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta 777 683 721 715 T1 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T2 34,15 2,52281693 35 40 11,2823803 127,292105 47 0 47 683 20 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T3 36,05 1,26797601 36,5 37 5,6705611 32,1552632 20 25 45 721 20 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta 35,75 1,30761937 37 37 5,84785161 34,1973684 22 23 45 715 20 ANEXO 3: ANALISIS DE VARIANZA DE UN FACTOR; MES 3 (kg./mes) RESUMEN Grupos TC T1 T2 T3 Cuenta Suma 20 20 20 20 233 314 377 358 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 614,85 Error 3053,1 Total G.L. 3 76 3667,95 11,65 1,10804475 11 12 4,95532675 24,5552632 20 5 25 233 20 Varianza 24,5552632 68,1157895 16,7657895 51,2526316 C.M.C. Fc. Probabilidad Ft. 204,95 5,10176542 0,00285928 2,72494395 40,1723684 S. 79 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta Promedio 11,65 15,7 18,85 17,9 T1 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T2 15,7 1,84547812 15 15 8,25322903 68,1157895 38 0 38 314 20 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta T3 18,85 0,91558149 17,5 17 4,09460492 16,7657895 15 13 28 377 20 Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta 17,9 1,60082216 16 16 7,15909433 51,2526316 28 10 38 358 20 ANEXO 4: ANALISIS DE VARIANZA DE UN FACTOR; MES 1 (kg./día) RESUMEN Grupos TC T1 T2 T3 Cuenta 20 19 20 20 Suma Promedio Varianza 19,25 0,9625 0,17447301 17,7142857 0,93233083 0,08218463 21,7857143 1,08928571 0,03524436 21,1071429 1,05535714 0,06195959 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 0,32655534 Error 6,64118555 Total G.L. 3 75 6,96774089 78 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta 0,9625 0,09340049 0,91071429 0,89285714 0,41769967 0,17447301 1,53571429 0,25 1,78571429 19,25 20 C.M.C. Fc. Probabilidad Ft. 0,10885178 1,22928104 0,30505535 2,72658918 0,08854914 Ns. T1 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T2 0,93233083 0,06576858 1 0,89285714 0,28667861 0,08218463 1,10714286 0,35714286 1,46428571 17,7142857 19 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T3 1,08928571 0,04197878 1,14285714 1,25 0,18773482 0,03524436 0,64285714 0,71428571 1,35714286 21,7857143 20 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta 1,05535714 0,05565949 1,07142857 1,25 0,24891683 0,06195959 1,10714286 0,39285714 1,5 21,1071429 20 ANEXO 5: ANALISIS DE VARIANZA DE UN FACTOR; MES 2 (kg./día) RESUMEN Grupos TC T1 T2 T3 Cuenta 20 20 20 20 Suma Promedio Varianza 27,75 1,3875 0,04273295 24,3928571 1,21964286 0,16236238 25,75 1,2875 0,04101437 25,5357143 1,27678571 0,04361909 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 0,29209184 Error 5,50484694 Total G.L. 3 76 5,79693878 1,3875 0,04622388 1,32142857 1,25 0,20671949 0,04273295 0,89285714 1,07142857 1,96428571 27,75 20 Fc. Probabilidad Ft. 1,3442081 0,26637817 2,72494395 Ns. 79 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta C.M.C. 0,09736395 0,0724322 T1 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T2 1,21964286 0,0901006 1,25 1,42857143 0,40294215 0,16236238 1,67857143 0 1,67857143 24,3928571 20 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T3 1,2875 0,04528486 1,30357143 1,32142857 0,20252004 0,04101437 0,71428571 0,89285714 1,60714286 25,75 20 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta 1,27678571 0,04670069 1,32142857 1,32142857 0,20885184 0,04361909 0,78571429 0,82142857 1,60714286 25,5357143 20 ANEXO 6: ANALISIS DE VARIANZA DE UN FACTOR; MES 3 (kg./día) RESUMEN Grupos TC T1 T2 T3 Cuenta 20 20 20 20 Suma 8,32142857 11,2142857 13,4642857 12,7857143 ANÁLISIS DE VARIANZA F.V. S.C. Tratamientos 0,78424745 Error 3,8942602 Total G.L. 3 76 4,67850765 0,41607143 0,03957303 0,39285714 0,42857143 0,17697596 0,03132049 0,71428571 0,17857143 0,89285714 8,32142857 20 Varianza 0,03132049 0,08688238 0,02138494 0,06537325 C.M.C. Fc. Probabilidad Ft. 0,26141582 5,10176542 0,00285928 2,72494395 0,05124027 S. 79 ESTADÍSTICA DESCRIPTIVA TC Media Error típico Mediana Moda D.Std. Varianza Rango Mínimo Máximo Suma Cuenta Promedio 0,41607143 0,56071429 0,67321429 0,63928571 T1 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T2 0,56071429 0,06590993 0,53571429 0,53571429 0,29475818 0,08688238 1,35714286 0 1,35714286 11,2142857 20 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta T3 0,67321429 0,03269934 0,625 0,60714286 0,14623589 0,02138494 0,53571429 0,46428571 1 13,4642857 20 Media Error típico Mediana Moda Desviación es Varianza de la Rango Mínimo Máximo Suma Cuenta 0,63928571 0,05717222 0,57142857 0,57142857 0,25568194 0,06537325 1 0,35714286 1,35714286 12,7857143 20 ANEXO 7: REGISTRO CONTROL DE PESO Numero animal Total kg Promedio Kg Ganancia total Kg Ganancia gr/dia Peso 1 Peso 2 Peso 3 Peso 4 ANEXO 8: REGISTRO DE CONSUMO LOTE 1 SAL MINERALIZADA AL 4% + +MELAZA, ÚREA, AZUFRE FECHA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 PESO SAL PESO MELAZA OBSERVACIONES ANEXO 9: REGISTRO DE CONSUMO LOTE 2 SAL MINERALIZADA AL 4% + MONENSINA SÓDICA FECHA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 PESO SAL OBSERVACIONES ANEXO 10: REGISTRO DE CONSUMO LOTE 3 SAL AL 4% + MONENSINA SÓDICA + MELAZA, ÚREA, AZUFRE FECHA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 PESO SAL PESO MELAZA OBSERVACIONES ANEXO 11: REGISTRO DE CONSUMO LOTE 4 GRUPO TESTIGO FECHA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 PESO SAL OBSERVACIONES