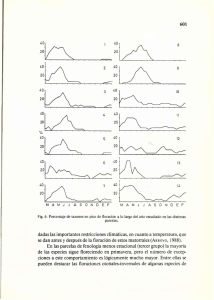
1. Introducción El palto (Persea americana mill.) es un
Anuncio

1 1. Introducción El palto (Persea americana mill.) es un árbol nativo de climas tropicales de América, como el existente en México, Centro América, Colombia, Venezuela, Ecuador y Perú. Es en estas condiciones selváticas, donde el palto logra expresar, de mejor manera, su potencial productivo y cualquier intento de adaptación a otras zonas climáticas, a través de manejos, debe considerar este punto, el origen. Nuestro país en su intento de adaptar esta especie, no se ha quedado atrás, logrando tecnologías de producción que lo posicionan dentro de los tres más importantes productores mundiales. La zona en que este cultivo mejor se ha adaptado, es la quinta región con el 80% de la producción nacional, el 20% restante se encuentra entre las regiones cuarta, metropolitana y sexta. De la gran cantidad de variedades existentes, Hass es la principal, ya que cumple con poseer cualidades organolépticas y nutritivas que la convierten en un producto de alta aceptación en el mercado. Esto se corrobora con el hecho de que hoy en Chile aproximadamente hay 23.000 ha de las cuales el 85% son del cv. Hass. Al igual que en cualquier otro cultivo de aceptación, son objetivos fundamentales, lograr altos volúmenes y constantes en el tiempo, que respondan a las crecientes necesidades del mercado y hacia los cuales, por lo tanto, se deben enfocar los manejos técnicos. El palto al igual que cualquier ser vivo responde frente al medio en el cual se intenta insertar, generando respuestas que no siempre son favorables del punto de vista productivo. Una de estas respuestas fisiológicas es la alternancia. La alternancia o añerismo, es el comportamiento productivo que se caracteriza por la producción de una alta intensidad floral y posterior carga frutal, seguida de una temporada, con baja intensidad floral y carga frutal. Es sabido, que el palto presenta dicha 2 alternancia productiva, lo cual se puede observar en la variación de su floración y producción, de un año a otro. Para lograr un acercamiento a las razones de este comportamiento, se debe estudiar primeramente la floración, conociendo que factores y en que medida la afectan. La floración o su intensidad son expresión de la inducción y de los factores que inciden en esta. Estos factores pueden ser endógenos, como son las reservas, frutos, nutrientes, hormonas y exógenos como el abastecimiento de agua, la temperatura, el fotoperíodo o la luz. En el presente trabajo se estudió tres factores inductivos, como son, la luz, la carga frutal y el rayado de ramas, para determinar en que medida afectan la intensidad floral. De lo anterior, se desprende la siguiente hipótesis: ”la intensidad floral de la temporada siguiente, se ve afectada por la carga frutal presente, iluminación y acumulación de azúcares a través del uso de la técnica de rayado de ramas“. Objetivo general: Determinar el efecto que produce la condición fisiológica en una planta de palto debido a tratamientos de rayado, carga frutal presente (mediante desfrute) e iluminación de brotes sobre la producción de tejido floral en la temporada siguiente. Objetivos específicos: • Determinar el efecto de la totalidad de la carga frutal (mediante desfrute) sobre los parámetros intensidad floral, contenido de azúcar foliar y eficiencia fotosintética. • Determinar el efecto de la iluminación sobre los parámetros intensidad floral, contenido de azúcar foliar y eficiencia fotosintética. • Determinar el efecto del rayado de abril y mayo sobre los parámetros intensidad floral, contenido de azúcar foliar y eficiencia fotosintética. 3 2. Revisión Bibliográfica 2.1. Ciclo fenológico Wolstenholme y Whiley (1990), definen la fenología como la relación entre el clima y fenómenos biológicos periódicos. Los árboles muestran fases de desarrollo (fenofases) a medida que pasa una estación. Hernández (1991), trabajando con el cultivar Hass en la localidad de Quillota. Chile (lat 32,50ºS) señala que el desarrollo vegetativo presentó dos “flush” de crecimiento, uno de mayor intensidad en primavera (8 de octubre al 25 de diciembre) y otro de menor intensidad en verano y otoño (29 de enero al 5 de junio). El desarrollo radicular ocurrió entre el treintiuno de octubre y el dieciséis de junio, mostrando aparentemente un solo “flush” de crecimiento. La floración se concentró entre el 23 de octubre y el 5 de noviembre, paralelamente al “flush” de crecimiento vegetativo de primavera y un escaso desarrollo radicular. 2.2. Floración 2.2.1. Inducción La inducción es un evento que desencadena una serie reacciónes a nivel genético, que resultan en la expresión de genes de la floración, luego de este proceso ocurre la iniciación floral (Davenport, 1986). En la iniciación floral, el ápice cambia del estado vegetativo al estado reproductivo y después de algún punto subsecuente en el desarrollo, el cual varia de acuerdo a la especie, el proceso se hace irreversible. El mismo autor señala que la iniciación de la floración, es la primera expresión fisiológica e histológica del estado inducido. 4 2.2.2. Iniciación de la inflorescencia El incremento de la actividad mitótica en el ápice del brote marca el comienzo de la iniciación floral. La inflorescencia o tallo floral que se forma producto del cambio de un ápice vegetativo a uno reproductivo consta de ejes secundarios o cimas laterales que tienen una gran número de flores (Teliz, 2000). Las inflorescencias son clasificadas en determinadas (terminales) y de mayor abundancia e indeterminadas (Reece, 1942 y Salazar- García et al., 1998). 2.2.3. Factores que promueven la floración Los principales factores que promueven la transición a la floración son: fotoperíodo, temperatura y disponibilidad de agua (Teliz, 2000). En diferentes partes de la planta se perciben los factores que promueven la floración, en tonces son transmitidas señales de larga distancia que se integran, dentro de la planta, lo cual genera una serie de eventos que conducen a la determinación del meristema apical para la floración (Bernier et al., 1993). Aunque no esta claro aun la naturaleza de estas señales transmisibles, existen tres principales teorías que intentan explicar el control químico de la transición a la floración: El concepto del “florigeno /antiflorigeno“ sugiere que son hormonas simples, especificas y universales, que promueven e inhiben la floración, sin embargo aun no pueden ser aisladas (Bernier, 1988). La hipótesis de la “diversión de nutrientes” o control por asimilados plantea que la inducción floral, es un evento que modifica la relación existente entre las fuentes y demandas dentro de la planta, sin que tenga importancia el origen o tipo de evento que lo desencadene, lo que finalmente mejora el aporte nutricional del ápice del brote en comparación a una situación no inductiva. Por lo anterior son importantes aquellos 5 químicos, manejos o factores que favorezcan la movilización de nutrientes a los tejidos meristemáticos apicales o que supriman los “sinks” que compitan por asimilados en el período de la iniciación floral (Sachs, 1977). Por ultimo la teoría “control multifactorial “ postula que son diversos asimilados y fitohormonas los que participan en la inducción floral (Bernier, 1988). 2.3. Fotosíntesis La fotosíntesis, involucra la conversión de energía lumínica, en energía química mediado por moléculas de clorofila sensibles a la luz, en las hojas. El complejo lumínico cosechador involucra distintas y númerosas moléculas de clorofila interceptoras de energía radiante y transfieren ésta a un centro de reacción en el fotosistema II. (PSII). En el corazón del centro de reacción, se encuentra una molécula de clorofila, llamada P680, la cual al ser excitada eleva un electrón a niveles más altos de energía. En condiciones ideales de actividad fotosintética, este electrón reduce a una molécula aceptora, llamada Feofitina, es entonces transferido a lo largo de una serie de transportadores de electrones que incluyen a Qa, Qb, Plastoquinona (PQ) Citocromos (Cyts). Esta transferencia de electrones esta asociada con la producción de una gradiente transtilacoidal de electrones, los cuales pueden ser acoplados a la producción quimiosmotica de ATP (Krause ,1991). Los complejos cosechadores de luz también son responsables por la transferencia de energía a una secunda molécula especializada de clorofila, llamada P700, en el centro del fotosistema I (PSI). Cuando la P700 llega a ser excitada un electrón es elevado a niveles mas altos de energía y este puede ser involucrado en la producción de ATP antes de regresar a un estado oxidado. Este proceso es llamado fotofosforilación no cíclica y, como tal requiere del procesamiento de dos electrones desde dos moléculas de P700. Alternativamente lo electrones pueden reducir la ferredoxina (Fd) la cual esta involucrada en la reducción de NADP a NADPH2. El NADPH2 puede entonces ser usado en la reducción de CO2 a azúcar fosfatos en la llamada reacción oscura de la fotosíntesis (Krause ,1991). 6 Si el electrón liberado desde la P700 es usado últimamente en la reducción de CO2, la P700 queda con una carga negativa. La neutralidad eléctrica de la P700 es restaurada por la aceptación de un electrón liberado desde la P680 en el PSII. Claro, que la pérdida de un electrón desde P680 deja a esta molécula con una carga positiva y en este caso el electrón requerido, para restaurar la neutralidad eléctrica, es derivado desde la partición del agua (Krause, 1991). 2.3.1. Fluorescencia La conversión de energía lumínica en energía química no es un sistema perfecto. Por varias razones los electrones llevados a niveles más altos de energía, son pasados a los aceptores, pero son devueltos a sus moléculas originales sin producción ATP y o NADPH2. Esta energía perdida puede ser manifestada como calor o fluorescencia (Azcon-Bieto et al., 2000a). La fluorescencia clorofílica, es máxima, bajo condiciones de alta luminosidad, cuando la actividad fotosintética es inhibida. Por ejemplo, a una hoja que es expuesta a alta luminosidad después de ser mantenida en condiciones de oscuridad por horas. Durante el período de oscuridad, varias de las enzimas involucradas en el ciclo de Calvin llegan a ser desactivadas y deben ser reactivadas por luz antes de volver a operar (Azcon-Bieto et al., 2000a). Aunque la fluorescencia es una pequeña fracción (3-4%) de la energía total disipada, esta se puede utilizar para conocer la eficiencia en la conversión de energía radiante, debido a que los otros procesos compiten entre si, al cambiar la energia utilizada por estos, dan lugar a cambios en la fluorescencia (Azcon- Bieto et al., 2000). La fluorescencia se origina casi exclusivamente en el PSII. Su emisión y medición nos puede entregar información útil, respecto de la tasa de transporte de electrones, el rendimiento cuántico y la existencia de fotoinhibición en la fotosíntesis. Para dichas mediciones se utilizan equipos portátiles denominados fluorómetros (Azcon-Bieto et al., 2000a). Debido a que la captación de luz por los fotosistemas es mucho más rápida que los siguientes pasos de la cadena transportadora de electrones, las Quinonas de los centros 7 de reacción del PSII. (P680) que estén reducidas no podrán, temporalmente, procesar más energía de excitación procedente de la antenas (centros de reacción “cerrados”), provocando un aumento de la emisión de fluorescencia (Azcon-Bieto et al., 2000a). Posterior a que una hoja ha sido adaptada a oscuridad (dark-adapted), por lo que una alta proporción de los centros de reacción se encuentran abiertos su fluorescencia es mínima (Fo). El fluorómetro emite un pulso de saturación lumínica que cierra los centros de reacción, generando la fluorescencia máxima (Fm). La diferencia entre Fo y Fm constituye la fluorescencia variable, Fv. El valor Fv/ Fm es una estimación del rendimiento cuántico máximo o eficiencia fotosintética máxima del PSII y su disminución es indicativa de daño por fotoinhibición. El fluorómetro también es capaz de realizar mediciones bajo condiciones lumínicas, con la ayuda de luz modulada, obteniendo los parámetros F´m y F. que darán origen al rendimiento cuántico efectivo o eficiencia fotosintética efectiva (Anexo 33). 2.3.2. Crecimiento compensatorio Los organismos vivos frente a una situación de estrés ralentizan sus tasas de crecimiento hasta el momento en que desaparece el factor estresante y vuelven a recuperar las tasas normales de crecimiento, comparables a las de un organismo sin estrés (Retuerto et al., 2003). Las plantas a diferencia de los animales, poseen características fisiológicas y morfológicas que les permiten mostrar un crecimiento compensatorio, aun en presencia del factor que provoca el estrés. Es decir, que en la búsqueda de mantener la homeostasis interna, pueden realizar procesos tales como, trasvases de recursos, modificaciones de tasas de desarrollo vegetativo o de la eficiencia fotosintética (Retuerto et al., 2003). 8 En relación a la tasa fotosintética de una planta estresada ésta muestra niveles elevados de la tasa en comparación a plantas control, proceso conocido como fotosíntesis compensatoria (Nowak y Caldwell, 1984). Esta respuesta puede ser generada por cambios en factores externos (herviborismo) de la planta o bien por cambios fisiológicos, tal como lo plantea la hipótesis fuente – sumidero (Retuerto et al., 2003). La hipótesis fuente–sumidero, señala que las tasas fotosintéticas parecen estar reguladas, en parte, por los cambios en la relación, entre aquellos tejidos que son fuente y sumideros de fotoasimilados. Entonces, cuando disminuye la relación de tejidos fuente con respecto a los sumideros, se produciría un aumento de la eficiencia fotosintética en los tejidos fuente, esto se denomina efecto compensatorio (Neales y Incoll, 1968). 2.4. Alternancia En la mayoría de las especies frutales se ha observado que las producciones en años consecutivos no son regulares. En el manzano así como en perales, ciruelos, damascos, mangos, olivos, naranjos y cítricos ocurre una oscilación anual de las cantidades de fruta cosechada (Callejas y Reginato, 1992). Las razones de este comportamiento aun no están del todo dilucidadas, pero hay acercamientos, al conocer cuales son los factores que participan en este. La magnitud de la alternancia productiva es variable entre las diferentes zonas de producción de paltas. Una alta carga frutal puede afectar al crecimiento vegetativo, disminuyendo el número de flujos vegetativos, y a la floración, retardando el tiempo de antesis y disminuyendo su intensidad (Salazar-García et al.,1998). Cuando se reduce el número de flujos vegetativos 9 se está disminuyendo aún mas la intensidad floral a través de la reducción de sitios (yemas) que pueden resultar en la formación de inflorescencias (Teliz, 2000). Se cree que las hormonas juegan un papel importante en la iniciación floral, ya que tienen el potencial de alterar la expresión del genoma (código genético) (Bower et al., 1990). Para lograr las condiciones apropiadas a la iniciación de las inflorescencias en el palto parece ser que es importante un balance entre las tres principales hormonas, citocininas, ácido absicico y giberelinas (Teliz, 2000). Todas las medidas de manejo en la fruticultura deben tener como objetivo final promover una abundante fructificación, pero regular en el tiempo. Así es posible encontrar en la literatura una serie de medidas de manejo que tienen influencia sobre el añerismo, tales como: la fertilización, el riego, los patrones, el anillado, el uso de reguladores de crecimiento, etc. (Callejas y Reginato, 1992). 2.4.1. Carga frutal Hay una recurrente necesidad de una estrategia correctiva que no reduzca la producción, pero el mecanismo y las bases fundamentales de la fisiología por las cuales la producción de un año afecta la producción del próximo año permanecen desconocidos para el palto, (Lovatt, 2003). Se sabe que la carga frutal es un gran “sink” de modo que el orden de prioridades entre sumideros es típicamente el siguiente: semillas antes que partes pulposas de la fruta, éstas igual a ápices de brotes y hojas, los cuales son mayores que el cambium y este a su vez, antes que almacenaje radicular (Paz-Vega, 1997). En un estudio, en el hemisferio norte, sobre partición de nutrientes en palto variedad Hass árboles off (desfrutados en julio del 2001) produjeron significativamente más estructuras reproductivas y más fruta cuajada para el retorno floral del año 2002 (en promedio de 10 1.33 kg de peso seco/árbol/ mes desde marzo hasta fines de junio del 2003) que árboles que no fueron desfrutados en Julio del 2001 (Lovatt, 2003). La idea de que la carga frutal afecta a la floración inhibiéndola, puede aplicarse a la totalidad del árbol o a ramas de este, siendo además variable entre árboles y ramas. Así mismo cuando una rama posee un cantidad de fruta baja, el desarrollo de las flores en el tiempo, no resulta afectado por la totalidad de la fruta presente en el árbol, de la misma forma que el desarrollo de yemas florales de árboles con alta y baja producción resulta similar (Salazar- García et al., 1998). La competencia entre sitios de demanda puede explicar la relación entre la carga del fruto y la iniciación floral, siendo el fruto el demandante más fuerte. Esto tendría su asidero en que los pequeños primordios florales son muy débiles demandantes, en relación a los frutos en desarrollo, que son un fuerte sink, entonces los frutos estarían tomando los asimilados que le corresponderían a estos débiles primodios florales, sin embargo, también esta la idea, de que hay una razón hormonal para esta inhibición floral, es decir, que las giberelinas producidas por la semilla inhibirían el proceso de iniciación floral (Teliz, 2000). Así como la carga frutal, el tiempo que permanece esta en el árbol también incide sobre la próxima temporada, ya que en el caso, de la práctica cultural de cosecha tardía, se incrementa la materia seca frutal y el contenido de aceite exacerbando la alternancia productiva; mientras cosechas tempranas (no es posible en muchas áreas o años si la fruta no se encuentra madura) o remoción de fruta por poda, química o manual en un árbol con producción “on” reduce la severidad de la alternancia productiva (Lovatt, 2003). Paz-Vega, (1997) sugiere una inhibición del crecimiento de brotes vegetativos en primavera-verano cuando los árboles están cargados con producción “on”, resultando en una reducción de la floración de la siguiente primavera. En relación con el antagonismo de la carga frutal y el crecimiento vegetativo, existen pruebas, como el estudio realizado por Arpaia et al. (1996), quien señala que altas cargas 11 suprimen el crecimiento vegetativo, al igual que Wolstenholme et al. (1990), quienes reportaron, que brotes frutales fueron más cortos 24% y 55% que aquellos no frutales en variedad Hass y Fuerte, respectivamente. Además señala que en climas subtropicales húmedos, de 2 a 4 “flushes” de crecimiento por año pueden ocurrir en brotes no frutales, mientras que brotes frutales pueden tener un “flush” durante la primavera. Salazar-García et al. (1998), y Salazar-García y Lovatt (2000), demostraron que árboles cargados con una alta producción producen brotes vegetativos a expensas de las inflorescencias, contrariamente árboles cargados con una baja producción producen inflorescencias a expensas de brotes vegetativos. Así como el nitrógeno los carbohidratos se ven afectados por la carga frutal tal como lo señala Paz-Vega (1997), al decir que la alta carga frutal en años “on”, resulta en bajas concentraciones de almidón el siguiente invierno y en una tardía floración en primavera, acompañada por muchos nuevos brotes vegetativos. La reciprocidad entre desarrollo de brotes florales y vegetativos en árboles de alta producción versus los árboles de baja producción sugiere que hormonas endógenas en las plantas podrían estar jugando un rol más importante en la alternancia productiva en palto Hass que la disponibilidad recursos (carbohidratos, N u otro nutriente) (SalazarGarcía y Lovatt, 2000). 2.4.2. Iluminación La intensidad y duración de la iluminación son factores que ejercen una importante acción sobre la preparación de la floración (Coutanceau,1964), puesto que es de amplio conocimiento que la floración y fructificación es menos abundante a la sombra que bajo plena luz (Meyer, 1960). Cuando la iluminación en un frutal es baja, para sus requerimientos se puede observar una clara disminución del crecimiento vegetativo, tanto en lo que se refiere al número y la 12 longitud de los brotes, como en cuanto al tamaño de las hojas; resultando en un menor desarrollo del árbol y una menor intensidad en la actividad fotosintética. Cuando se comparan los crecimientos de árboles en zonas con mucho sombreamiento, o baja luminosidad a diferencia de aquellos en zonas soleadas o iluminadas, se puede observar que en zonas sombreadas hay menor crecimiento, de igual forma dentro de un mismo árbol se notan estas diferencias destacando en cuanto a crecimiento, aquellas zonas que más reciben sol, es decir, las partes altas de la planta, las cuales al envejecer tienden a formar copas aparasoladas debido a una falta de renovación del material vegetativo que se origine en las partes internas del árbol (Gil-Albert, 1992). Es así como en el interior de un árbol con numerosas ramificaciones y excesiva densidad de ramillas, la iluminación es deficiente y la floración es nula en su interior, sólo la parte exterior de la canopia con iluminación suficiente presenta floración satisfactoria (Countanceau, 1964). En las hojas de la mayor parte de las especies (probablemente todas) el máximo de actividad fotosintética se alcanza con intensidades lumínicas muy por debajo de la luz solar, investigaciones efectuadas demuestran que muchas de las hojas interiores de un manzano reciben apenas el 1 %, o menos, de la luz solar que reciben las de la periferia, por consiguiente aun bajo luz solar plena, muchas de las hojas de este árbol no sintetizan a su capacidad máxima (Meyer, 1966). El aparato fotosintético de las especies sombratolerantes se satura a menores niveles lumínicos que el de las especies intolerantes, y su menor capacidad fotosintética va acompañada por tasas más bajas de respiración. Estas diferencias implican que el nivel lumínico en el cual las perdidas de carbono son igualadas por la ganancia fotosintética, debería ser menor en especies sombratolerantes. Dicho nivel lumínico se llama punto de compensación lumínica (Marino, 2004). Las especies sombratolerantes han experimentado selección por bajas tasas respiratorias, que reducen el costo energético de mantener sus tejidos en ambientes de baja luminosidad. Sin embargo una baja tasa metabólica va a la mano de una baja 13 capacidad fotosintética, ya que la manutención de grandes cantidades de enzimas fotosintéticas parece involucrar un gran costo energético (Marino, 2004). La falta de luz afecta también a la inducción y diferenciación floral, en razón del bajo nivel de carbohidratos acumulados, y a la propia floración y posterior fructificación (Gil-Albert, 1992). Por otra parte, muchas plantas responden a la longitud del día llamado fotoperíodo; sin embargo, la inducción floral en la mayoría de las especies frutales no es dependiente de este factor (Weastwood, 1982). 2.4.3. Rayado El árbol anillado es aquél que ha sufrido un corte total de su flujo floemático, ya sea por la incisión de una sierra o por la remoción desde su tronco de un cilindro de corteza de ancho variable (Noel, 1970). Cuando no se remueve ninguna “tira” de tejido, el proceso se nombra como rayado (Davie et al.,1995). 2.4.3.1 Fundamentos fisiológicos Fisiológicamente hablando el efecto del anillado consiste en la interrupción del transporte de fotoasimilados y fitohormonas por el floema, a las partes más bajas de la rama. Además no se interrumpe el transporte de savia por la vía xilemática, por lo que la acumulación de fotosoasimilados y la acumulación de auxinas es mayor temporalmente en las ramas anilladas (Davie et al.,1995). Además del aumento de los niveles de carbohidratos el rayado provoca una disminución de los niveles de nitrógeno, calcio y fosfatos, en hojas de ramas rayadas en comparación 14 con no rayadas. Esto debido principalmente a la acumulación de carbohidratos en las hojas, los cuales causaron un 50% de reducción en los contenidos de clorofila (Davie et al., 1995). La tasa fotosintética fue inicialmente reducida cuando el almidón se acumuló en hojas de ramas rayadas. Sin embargo, como los niveles de carbohidratos fueron demandados por frutos en desarrollo la tasa fotosintética se volvió a recuperar (Davie et al., 1995). Las hojas de las ramas anilladas y sin fruta mostraron disminución en la tasa fotosintética dentro de pocos días después del tratamiento. Ramas con fruta tomaron mas tiempo en mostrar una disminución de la tasa fotosintética ( Davie et al.,1995). 2.4.3.2 Efectos El grado de floración general y la intensidad de floración de panículas apicales fueron aumentados significativamente en los árboles tratados con anillado de 2 mm y doble incisión, no presentando diferencias estadísticas entre sí (Berrios, 1995; Lahav et al., 1975). Al anillar, la savia elaborada se acumula en la parte superior de anillo, resultando en un incremento en la diferenciación de yemas, en un adelanto de la floración lo que finalmente incrementa la fructificación (Alvarez de la Peña, 1979). Wolstenholme (1987), señala que el vigor puede ser manipulado, despuntando el crecimiento de primavera o por medio de la realización de un anillado, reduciendo temporalmente la fuerza del crecimiento vegetativo. En la misma línea un estudio realizado por Acevedo (1994), muestra que el anillado produjo brotes menos vigorosos, al final del “flush” vegetativo de verano. Este efecto desvigorizante, es más marcado cuando el rayado se hace en otoño, menos en invierno y casi nulo en primavera (Lahav et. al.,1971a). Esta disminución del vigor se explica, porque al anillar se incrementan los contenidos de elaborados esenciales de las plantas al igual que las sustancias de crecimiento (Lavat, Gefen y Zamet, 1971a). La Auxina, que es la hormona de la 15 dominancia apical y que se produce en los puntos de crecimiento activo (Taiz y Zeiger, 1991), también se comienza a acumular sobre el corte. Los mayores contenidos de carbohidratos y hormonas, provoca que las yemas laterales que se encontraban inhibidas o durmientes broten, pero en crecimientos que tienden a ser cortos pues las reservas acumuladas sobre el anillo bajan rápidamente (Stephenson, Gallagher y Rasmussen, 1989) y las temperaturas bajas inhiben el crecimiento vegetativo (Hernández, 1991;Tapia, 1993). 2.4.3.3 Antecedentes Acevedo (1994), trabajó en Quillota, V Región, Chile, probando el anillado de 2 mm y la doble incisión, realizados a fines de marzo, en paltos rebajados cv. Hass de uno y dos años de edad. Determinó un claro efecto de ambos anillados en mejorar el grado de diferenciación o inducción de las yemas de paltos rebajados mejorando consecuentemente el grado de floración, su intensidad y el número de frutos. (Wilhelmy, 1995) diseñó un ensayo a fin de probar los tratamientos de anillado de 2 mm y de doble incisión, aplicados en enero, febrero, marzo y abril (verano-otoño). Pudo determinar que todos los tratamientos lograron adelantar la diferenciación de las yemas apicales, adelantar la floración (excepto los tratamientos de abril),aumentar el grado de floración general de los árboles y aumentar la intensidad de la floración. Lahav et al. (1972), realizaron rayados en octubre noviembre (antes de inicio de floración) causó floración temprana especialmente en variedad fuerte. Rayado en una fecha más tardía afectó el comienzo de la floración únicamente en el año siguiente. Lahav et al. (1971a) Dos períodos fueron detectados para la realización del anillado en “Fuerte” en California, con una mejor respuesta en otoño. Las ventajas del anillado de primavera parecen ser el de no aumentar el número de frutos pequeños sin semilla, pues la floración no se induce tempranamente, y más rápida cicatrización del rayado debido a las altas temperaturas después del rayado. 16 Lahav et al. (1986), en un intento de acortar el período juvenil de árboles de paltos de tres años de edad, es que se probaron cuatro fechas diferentes de anillado. Anillado temprano en septiembre fue el más efectivo que el tardío o no anillado. Incrementó significativamente la intensidad floral, incremento el porcentaje de plantas que cuajaron de 15 a 66%, y incrementó siete veces el número de frutos cosechados pro planta en comparación con los controles no anillados. El anillado es una forma de incrementar la productividad de muchos árboles. Para las variedades Fuerte y Nabal el anillado de otoño (med-octubre) resultó con las más altas producciones que anillados en invierno, el anillado de primavera fue ocasionalmente efectivo. Anillado de otoño frecuentemente adelanta la floración, algunas veces por dos o tres meses. El efecto del anillado es atribuido al aumento de carbohidratos y al cese temporal del crecimiento vegetativo sobre el anillado. Razeto y Longueira (1986), realizaron un ensayo en un huerto de la variedad "Negra de la Cruz", de nueve años de edad, probando dos épocas de anillado, abril y agosto. Este ensayo, a diferencia de otros, tuvo la particularidad de que la incisión anular se efectuó sobre el tronco y no sobre ramas individuales. Los resultados obtenidos indican que abril es la única fecha que presenta un incremento significativo de la producción, expresado tanto en el peso total cosechado por árbol como en el número de frutos. A su vez, ninguno de los tratamientos tuvo influencia sobre las características de la fruta como peso individual y tamaño. 17 3. Materiales y Métodos 3.1. Ubicación de los ensayos Los ensayos se llevaron a cabo en la parcela “la Fortuna”, sector de Pocochay, (latitud – 32.850° longitud –71.200°), comuna de Quillota, provincia de Quillota, Quinta región de Valparaíso. Es una zona de clima mediterráneo marino, ubicada en una sector prelitoral, en que el relieve de la cordillera de la costa permiten el paso de las brisas costeras que tienen una acción moderadora sobre las condiciones térmicas, de humedad relativa y aminoran la evapotranspiración potencial (Novoa, 1989). 3.2. Desfrute o ensayo de la influencia de los frutos sobre la floración 3.2.1. Influencia sobre la Intensidad floral. Se seleccionaron al azar ocho árboles, de los cuales siete fueron árboles con alta carga frutal “on” y un árbol de baja carga frutal “off”, haciendo un total de ocho tratamientos. Para determinar el efecto de ésta carga frutal en el tiempo, es que se seleccionaron árboles “on”, en los que a su vez se eligió una rama, la que fue desfrutada o tratada, en una fecha determinada. El desfrute corresponde a la eliminación total de fruta en la rama. Las fechas establecidas, para realizar los desfrutes, fueron siete a partir de diciembre del 2005, en que se observaron los primeros frutos cuajados. Existen diversos parámetros de medición de intensidad floral, tales como, n° de flores/panícula (Acevedo, 1994; Wilhelmy, 1995), n° flores/m2 (Mardones, 2004; Castillo, 2002). En el presente estudio en época de floración, se procedió a contar el número de flores por rama, de los ocho tratamientos, relacionándolo con el número de brotes florales, 18 para obtener un valor de intensidad floral (número de flores /número de brotes florales). 3.2.2. Influencia de la carga sobre la eficiencia fotosintética. En cada fecha de desfrute (diciembre, enero, febrero, marzo, abril, mayo, junio), se midió la eficiencia fotosintética, a través de fluorescencia, en hojas de las ramas seleccionadas, para desfrute. De igual forma, para el árbol off. Se seleccionaron hojas adultas (Luz-adaptadas), que luego con el uso del fluorómetro (Minipam-júnior) se midió la fluorescencia máxima (Fm) y la fluorescencia mínima (Fo) de esta condición (luz-adaptación), con lo cual se puede determinar la eficiencia fotosintética (yield fotosintético) o bien rendimiento cuántico, de la siguiente forma: Yield fotosintético: (Fm` – Fo )/ F´m = ∆F/Fm 3.2.3. Efecto de la carga frutal sobre el contenido de azúcares totales. Previo a la floración, en floración y posterior a esta, fueron recolectadas cuatro hojas de los dos árboles correspondientes a cada fecha de desfrute. Posteriormente, en laboratorio se procedió al análisis de las muestras utilizando el método de la Antrona (Anexo 1). 3.3. Sombreamiento o ensayo de la influencia de la iluminación sobre la intensidad floral 3.3.1. Influencia de la iluminación sobre la Intensidad floral De un grupo de árboles off, para evitar influencias de la carga frutal sobre la intensidad floral, se seleccionaron al azar cuatro de estos, destinando dos para mediciones de luz (T1) y dos para mediciones de sombra (T2). A cada árbol con tratamiento de luz le fueron marcados un número de 10 brotes para ser medidos, al igual que los dos árboles con tratamiento de sombra. 19 En época de floración, se realizó una medición del número de flores en cada brote seleccionado, determinando la intensidad floral de estos mediante la relación número de flores /número de brotes florales. 3.3.2. Influencia de la iluminación sobre la eficiencia fotosintética. En cada tratamiento T1 (luz) y T2 (sombra), se midió la eficiencia fotosintética, a través de fluorescencia, en hojas adulta de los brotes seleccionados por tratamiento. La metodología utilizada fue la misma que la señalada en el punto 3.2.2 3.3.3. Efecto de la iluminación sobre el contenido de azúcares Con el objetivo de determinar el efecto de la iluminación en el contenido de azúcares totales antes de floración en floración y después de ésta, es que se ha establecido la siguiente metodología. En cada tratamiento, fueron recolectadas cuatro hojas de 10 brotes. Posteriormente, en laboratorio se procedió al análisis de las muestras utilizando el método de la Antrona (Anexo 1). 3.3.4. Diseño experimental La elección de los árboles del ensayo fue llevado en un DCA, teniendo como unidad muestral, los brotes de cada árbol. Los controles son los brotes sombreados. Los tratamientos corresponden a cada condición, es decir luz y sombra. Las repeticiones son los 10 brotes de cada tratamiento. De lo anterior se desprende que el tamaño de la muestra son 40 brotes. 20 3.4. Rayado o ensayo de la influencia del rayado sobre la intensidad floral 3.4.1. Efecto del rayado sobre la Intensidad floral Se seleccionaron ocho árboles “on”, de los cuales cuatro fueron rayados el 5 de abril (T1), y el 4 de mayo (T2), además de un árbol control sin rayar (T0). En época de floración se realizó un conteo de flores en cada rama anillada, para posteriormente determinar su intensidad floral, mediante la relación número de flores por panícula /número de brotes con panículas. 3.4.2. Efecto del rayado en la eficiencia fotosintética. En cada tratamiento, se midió fluorescencia de hojas, antes del manejo y después de este mensualmente hasta floración. La metodología utilizada es la misma que en el punto 3.2.2 . 3.4.3. Efecto del rayado sobre el contenido de azúcares Con el objetivo de determinar el efecto del rayado en el contenido de azúcares totales antes de floración en floración y después de esta, es que se estableció la siguiente metodología. En cada rama rayada fueron recolectadas cuatro hojas. Posteriormente, en laboratorio se procedió al análisis de las muestras utilizando el método de la Antrona. 21 3.4.4 Diseño experimental La elección de los árboles del ensayo fue llevado en un DCA, teniendo como unidad muestral, la rama rayada de cada árbol. El control fue la rama no rayada. Los tratamientos corresponden a las dos fechas de rayado. Las repeticiones son los cuatro árboles rayados en cada fecha. De lo anterior se desprende que el tamaño de la muestra son ocho ramas rayadas y una no rayada. 22 4. Resultados y Discusión 4.1. Ensayo de la Influencia de la carga frutal sobre la intensidad floral 4.1.1. Influencia de la carga frutal sobre la intensidad floral Cuadro 1. Influencia de la carga frutal sobre la Intensidad floral, desarrollada por fechas de desfrute, en árboles de palto variedad Hass. TRATAMIENTO N° DE FLORES POR RAMA Nº BROTE C/F INTENSIDAD DESFRUTE 1961 32 61,281 Off (s/fruta) Dic (T1) Ene (T2) Feb (T3) Mar (T4) Abr (T5) May (T6) Jun (T7) 2100 1683 1060 750 1200 0 0 38 33 27 11 13 0 0 55,263 51,000 39,259 68,182 92,308 0 0 El nivel de floración resultante de los ocho tratamientos, determinó el índice de intensidad floral, expresada como nº de flores / nº brotes con flor, en sus respectivas floraciones entre septiembre y octubre (Cuadro 1). Las respuestas de los tratamientos pueden ser divididas en aquellas que florecen (Off, T1, T2, T3, T4, T5) y las que no lo hacen (T6, T7). Dentro de los tratamientos que lo hacen, se observó un comportamiento descendente de la intensidad floral en cuatro de ellos y ascendente en dos (Anexo 2). El comportamiento descendente de la intensidad floral se podría explicar en parte, por el fuerte “sink” que ejerce la carga frutal en la distribución de asimilados (Paz-Vega, 1997), suprimiendo a sumideros más débiles, como el crecimiento vegetativo, sobre el cual se da la floración (Wolstenholme et al., 1990; Arpaia et al., 1996). 23 Por esta razón que el tratamiento off muestra una alta intensidad floral en relación con el resto de los tratamientos, ya que al no tener carga frutal, no tiene el factor supresor del crecimiento vegetativo, permitiendo que se desarrolle y genere mas puntos de floración, tal como lo señala Whiley (1990), al reportar, que durante un año de baja carga (Off), hay gran cantidad de brotes, resultando en una gran producción de potenciales puntos florales, la próxima primavera. La disminución de la intensidad floral, en la medida que el desfrute se realiza, más tardíamente, se explica, no sólo por el nivel de carga, sino que también por el tiempo que permanece ésta en el árbol (Lovatt, 2003). Esto coincide con un estudio realizado por Whiley y Saranah (1992), para encontrar el efecto del tiempo de cosecha sobre algunos factores como tamaño del fruto y producción, donde señalan que la producción acumulada de tres años de ensayos, dio significativamente menos fruta para los tratamientos cosechados con mayor contenido de materia seca (30%) comparados con aquellos tratamientos cosechados en estados de madurez más tempranos. Sin embargo, la disminución de la relación, número de flores/número de brotes florales, no esta del todo explicada, ya que, si solo se considera una disminución del número de brotes florales, debiese haber una intensidad ascendente, entonces esto sugiere que la carga frutal en el tiempo, no sólo disminuye o limita el crecimiento vegetativo, medido a través del número de brotes florales, sino que además la disminución de la floración es aun mayor, medida a través del número de flores. Esto coincide con lo señalado por Salazar-García et al. (1998), quien señala que la reducción el número de flujos vegetativos durante un año de alta carga reduce todavía más la intensidad de floración a través de la reducción de sitios (yemas) potenciales para la formación de inflorescencias. Por otra parte, los valores 68,182 y 92,308, ascendentes de los tratamientos de marzo (T4) y abril (T5), respectivamente, se podrían explicar por un aumento del crecimiento vegetativo, correspondiente al “flush” de otoño, que de acuerdo a los resultados, generó mayor cantidad de puntos florales, mientras más se acercaban al pick (marzo-abril), tal 24 vez, en la misma proporción que estos disminuyen, cuando hay menos brotes, como lo señala Salazar-García et al. (1998). No se puede descartar, la intervención de un estimulo medioambiental, que explique sus elevados valores, respecto del tratamiento off, favoreciendo un aumento de la inducción y por consiguiente el número de flores por panícula, tal como un stress hídrico provocado por mal manejo del riego. Si se enfrenta, el comportamiento de la intensidad floral de los tratamientos, con la curva de crecimiento vegetativo en la fenología del palto en Quillota, durante las mismas fechas, se observa una similitud, que pone de manifiesto la relación directa entre floración y crecimiento vegetativo, sugiriendo además que el desarrollo vegetativo aun si es tempranamente favorecido con desfrute, no deja de estar supeditado a las condiciones medioambientales que determinan su comportamiento fenológico (Anexo 3). Respecto a los tratamientos de mayo (T6) y junio (T7), éstos no florecen, lo que se puede deber, al fuerte “sink” que representa la carga frutal presente, reprimiendo incluso el crecimiento de los meristemos de ejes secundarios, tal como ocurriría si las condiciones ambientales, que promueven el crecimiento vegetativo, prevalecieran (Salazar–García et al., 1998) prolongando el “flush” de otoño. Por el contrario, en condiciones óptimas para la floración, como ocurre en árboles off, no hay interferencia en la generación de meristemos de ejes secundarios, resultando en una mayor intensidad floral. Considerando que la inducción en Quillota, es en abril y mayo (Gardiazabal y Rosenberg, 1991) estado que según Buttrose y Alexander, (1978) se ve favorecido por el descenso de las temperaturas, entonces los resultados mostraron, que el momento en que la carga frutal, ejerce este efecto supresor o inhibidor, de tal forma que no hubo floración, coincidiría con la fase 1(S1) y 2(S2) del desarrollo de la inflorescencia, segun Salazar– García et al., (1998) (Anexo 34). Finalmente, y de acuerdo al análisis presentado, se puede señalar, que la influencia de la carga frutal podría ser reversible hasta una fecha anterior al tratamiento de mayo (T6) y junio (T7). 25 4.1.2. Influencia de la carga frutal sobre la eficiencia fotosintética Los datos de eficiencia fotosintética, correspondientes al ensayo de desfrute, se muestran en el Cuadro 2. Cuadro 2. Influencia de la carga frutal sobre la eficiencia fotosintética (Fv/Fm ) foliar, en fechas posteriores al desfrute, desarrollada por fechas de desfrute de ramas de palto variedad Hass. TRATAMIENTO DIC ENE FEB MAR ABR MAY JUN DESFRUTE 0,692 0,758 0,732 0,764 0,759 0,751 0,717 Dic (T1) 0,694 0,751 0,855 0,748 0,630 0,646 Ene (T2) 0,691 0,799 0,728 0,711 0,652 Feb (T3) 0,774 0,779 0,711 0,662 Mar (T4) 0,752 0,698 0,690 Abr (T5) 0,696 0,646 May (T6) 0,664 Jun (T7) 0,738 0,743 0,736 0,740 0,742 0,743 0,716 Off (s/fruta) El Cuadro 2 muestra que luego del desfrute la eficiencia fotosintética (Fv/Fm), se eleva hasta el mes de marzo en los tratamientos T1,T2,T3 y T4, y que posteriormente, hasta el mes de junio, en todos los tratamientos, hay un descenso de los valores de eficiencia fotosintética (Anexo 4-11). La explicación del aumento de la eficiencia fotosintética posterior al desfrute, se puede realizar a través de un proceso llamado, fotosíntesis compensatoria (Nowak y Caldwell, 1984), en que la presencia de fruta como factor de estrés, modifica, al igual que su eliminación (desfrute), la relación de tejidos fuentes-sumideros (Neales y Incoll, 1968), aumentando la eficiencia fotosintética de los tejidos fuente, cuando la relación es desfavorable para estos. Es decir que al realizar el desfrute, la eficiencia fotosintética aumenta, no solo por la eliminación del estrés, tal como lo señala la teoría de crecimientos compensatorios (Retuerto et. al., 2003), sino porque la rama desfrutada se transforma de 26 tejido sumidero a fuente, compensando la disminución de la eficiencia de otras ramas que tienen fruta. El comportamiento sumidero de fotoasimilados, de la carga frutal, generaría de acuerdo a la hipótesis fuente sumidero, un efecto compensatorio de las tasas fotosintéticas, es decir que se observaría una disminución de la eficiencia fotosintética en aquellas hojas de ramas con fruta, lo cual seria compensado por un aumento de la eficiencia fotosintética de ramas sin fruta (Retuerto et al., 2003). Así mismo, se puede observar en el Cuadro de datos, que en cada fecha tratamiento, si se compara las mediciones de ramas desfrutadas con las mediciones de ramas recién desfrutadas, que aun están bajo los efectos de la carga frutal, en el mismo mes, se observa una menor eficiencia de las últimas (Cuadro 2). Esto coincide con el estudio realizado por Obeso et al. (1998) en plantas dioicas de la especie ilex aquifolium, en el cual observa que, ramas sin fruta de planta hembras, poseen elevada eficiencia fotosintética a diferencia de ramas con fruta, las cuales presentan niveles similares a las ramas de plantas machos, que no tienen fruta. La explicación que se sugiere para esta observación, es que la carga frutal o bien los sumideros afectan la utilización de nutrientes, en especial de nitrógeno, por las hojas más cercanas. Se produce una transferencia de nitrógeno de las partes vegetativas a las reproductivas. El nitrógeno puede hacerse disponible incluso a través de la hidrólisis de rubisco, causando una disminución de la eficiencia fotosintética de las hojas más cercanas, mientras las ramas de hojas sin fruta, manifiestan el fenómeno de fotosíntesis compensatoria (Retuerto et al., 2003). El descenso de la eficiencia fotosintética en abril, de todos los tratamientos se podría deber a que, según ciclo fenológico del palto en Quillota, en marzo- abril se presenta el pick otoñal del crecimiento vegetativo y que deacuerdo a la hipótesis fuente- sumidero, estaría actuando como “sink”, aunque menor que la carga frutal, pero de todas formas, provocaría este descenso de la eficiencia fotosintética (Anexo 12-19). 27 En los meses de mayo y junio la eficiencia, de todos los tratamientos, disminuye aun más, lo cual se podría explicar por un efecto térmico, ya que al respecto existen estudios que, señalan a las bajas (12°C) y altas (42°C) temperaturas, como causantes de la disminución de la eficiencia fotosintética. (Groom y Baker, 1992; Maxwell et al., 1994; Tsonev et al., 2000). El pick otoñal y la temperatura, explicarían porque no existe coincidencia entre la curva de crecimiento del fruto y la de eficiencia fotosintética, es decir porque no aumenta la eficiencia fotosintética de ramas desfrutadas, en la medida que aumenta la demanda de los frutos, de otras ramas, según la hipótesis fuente- sumidero (Anexo 12-19). 4.1.3. Influencia de la carga frutal sobre la concentración de azúcar foliar En el Cuadro 3, se presentan los resultados de concentración de azúcares a nivel foliar, de los tratamientos en tres fechas consecutivas, previo a floración, plena floración y posterior a ésta. No existe diferencia entre los tratamientos, respecto de la concentración de azúcares (SST) en las tres fechas de medición. De acuerdo al análisis estadístico, la medición previa a floración no presentan diferencias entre los tratamientos lo cual no coincide con lo señalado por Sholefield (1985), quien en un estudio realizado en cv, Fuerte, utilizando el peso seco por unidad de área foliar, detectó que aquellos árboles con alta carga (on), en época de desborre, tuvieron valores mas altos, que aquellos con baja carga (off) durante el mismo período, seguramente debido a su mayor contenido de azúcares. Así mismo aquellos tratamientos que fueron posteriormente desfrutados tendrían que haber mostrado niveles menores de azúcares al momento de la medición, debido a que las reservas fueron consumidas por el fuerte sumidero, que es la fruta, dejando a las 28 ramas con menor capacidad de recuperar reservas para el período de iniciación floral, floración y cuajado (Davie et al., 1995). Cuadro 3. Influencia de la carga frutal sobre los niveles de azúcares (SST) foliar (mg/ml), en distintas épocas, desarrollada por tratamientos de desfrute, en ramas de árboles de palto variedad Hass. TRATAMIENTO PREVIO PLENA POST DESFRUTE FLORACIÓN FLORACIÓN FLORACIÓN 0,995 a 0,768 a 0,508 a Off (s/fruta) 0,988 a 0,763 a 0,408 a Dic (T1) 0,932 a 0,700 a 0,462 a Ene (T2) 0,918 a 0,736 a 0,453 a Feb (T3) 1,045 a 0,796 a 0,483 a Mar (T4) 1,034 a 0,800 a 0,399 a Abr (T5) 1,136 a 0,846 a 0,477 a May (T6) 1,032 a 0,797 a 0,501 a Jun (T7) Letras iguales no difieren estadísticamente (p<0.05), según test de Tukey Aunque estadísticamente, los tratamientos no presentaron diferencias significativas previo a floración, de igual forma, tuvieron un comportamiento que, si se enfrenta al comportamiento de la intensidad floral, se puede observar una pequeña similitud, que podría estar hablando de una relación directa entre concentración de azúcares y la intensidad floral generada, que a su vez, esta en directa relación con el crecimiento vegetativo sobre el cual se da dicha floración (Anexo 20). Sholefield et al. (1985), no detectó diferencias entre árboles de alta y baja carga, en plena floración y posterior a ésta (cuaja), lo cual coincide plenamente con el ensayo, que no presenta diferencias significativas entre los tratamientos en plena floración y posterior a ésta (Cuadro 3). Al comparar los valores mostrados en las tres épocas, estos muestran un nivel mas elevado previo a la floración, seguido de una disminución en plena floración y otra disminución aun mayor posterior a ésta (Anexo 21). 29 El mayor nivel mostrado en la medición previa a floración, se podría deber a que dentro de las fluctuaciones anuales de los azúcares estudiadas por Arpaia et al. (1999) y González et al. (1998), esta medición coincide con un punto elevado, dentro del descenso del nivel de azúcares totales, después de un pick alcanzado a mediados de invierno. Este descenso seria provocado por el inicio del crecimiento vegetativo a fines de invierno el cual contaba con hojas en proceso de maduración, es decir, en fase de transición de demanda a fuente, utilizando los azúcares producidos para su propio metabolismo. En otros cultivares de palto, esta fase se presenta hasta que la hoja ha alcanzado el 80% de su expansión total, lo que tarda aproximadamente 40 días y la máxima actividad fotosintética se alcanza a los 60 días después de la apertura de la yema (Whiley, 1990). El menor valor de la concentración en plena floración, podría deberse a que existe un fuerte consumo por parte del crecimiento vegetativo, la floración y el inicio del cuajado, que hace descender los valores en todos los tratamientos (González et al., 1998). El valor más bajo de la concentración de azúcares se podría deber a que luego de la gran competencia ocurrida en la etapa anterior, el nivel de azúcares comienza a recuperarse, pero la medición fue hecha cuando aun no se incrementan estos valores, lo que coincide, con lo señalado por Arpaia et al. (1999) y González et al. (1998), quienes señalan que después de que se ha completado el desarrollo vegetativo de primavera, viene un aumento de los azúcares, porque sus hojas comienzan a ser fuente y no demanda de fotosintatos, hasta alcanzar un máximo nivel temprano en verano. Finalmente, se podría esperar que el gasto energético que involucra la presencia de carga frutal, se exprese en la primavera siguiente, mediante una menor intensidad floral de aquellos tratamientos que ahora, muestran mayor intensidad floral y viceversa. 4.2. Ensayo de Influencia de la iluminación sobre la intensidad floral 4.2.1. Influencia de la iluminación sobre la intensidad floral En el Cuadro 7, se presentan los resultados de intensidad floral, correspondientes a los 30 tratamientos de iluminación y sombreado. Contanceau (1964), señala que alta densidad de ramas y hojas, genera deficiente iluminación de la zona interior del árbol, produciendo a su vez escasa o nula floración. Cuadro 7. Influencia de la iluminación sobre la Intensidad floral, desarrollada por tratamiento de luz y sombra en brotes de paltos variedad Hass. TRATAMIENTO luz Sombra Nº DE FLORES Nº BROTES C/F INTENSIDAD 682 4 170,5 0 0 0 Los resultados son claros, donde hubo mayor intensidad lumínica, hubo floración. Aunque aun no esta claro cual es el factor de inducción en paltos, estos resultados llevan a pensar que la luz es un factor importante y al igual que en plantas fotoperiódicas esta cambiaría la fisiología de la hoja, lo cual genera la transmisión de una señal, todavía desconocida, que tiene efecto sobre el ápice del brote (Bernier et al., 1993), desencadenando el proceso de floración. Otra forma de ver es desde el punto de vista fotosintético, donde la luz es la materia prima, para la formación de carbohidratos, los cuales tienen un rol fundamental en la floración (Carrillo, 1995). Algunos autores como Chandler (1962), señalan que el sombreamiento de los tejidos provoca que éstos no acumulen almidón, lo que posiblemente provocaría un descenso en la formación de yemas florales. Azcon-Bieto et al. (2000) agrega por su parte, que existen diferencias en la composición, entre los expuestas al sol y a sombra, tales como contenido de lípidos, almidón, azúcares solubles y cutinas. Las hojas expuestas al sol, además, poseen mayor contenido de nitrógeno, contendido total de clorofila y de rubisco provocando, que a un mismo flujo 31 fotónico, posean mayores niveles de asimilación de CO2, lo que a su vez explica el mayor contenido de almidón. Como los carbohidratos de reserva cumplen un rol fundamental en la floración, que se focaliza en los procesos de diferenciación floral (Wilhelmy, 1995; Acevedo; 1982; Berrios, 1995), entonces se podría decir, que brotes iluminados, pueden florecer mas, que los sombreados debido a que generan mayor cantidad de carbohidratos de reservas. Además, estudios realizados por Azcon-Bieto et al. (2000), señalan que las brotaciones, en sectores iluminados son mayores, en número y longitud, que aquellas donde hay sombra, aumentando los sitios donde florecer. 4.2.2. Influencia de la luz sobre la eficiencia fotosintética En el Cuadro 8 se muestran los resultados de eficiencia fotosintética (Fv/Fm) hojas sometidas condición de luz y sombra, en período de medición desde abril a septiembre. Cuadro 8. Influencia de la iluminación sobre la eficiencia fotosintética (Fv/Fm), desde abril a septiembre, desarrollada por tratamiento de luz y sombra en brotes de palto variedad Hass. FV/FM ∆% LUZ SOMBRA 0,696 0,723 3,71 0,683 0,785 12,98 0,743 0,798 6,82 0,704 0,771 8,71 0,649 0,795 18,37 0,611 0,780 21,66 MES FV/FM Abril May Jun Jul Ago Sep En líneas generales, se observó una menor eficiencia fotosintética de hojas en condición de luz, lo que representa una diferencia promedio de 12.04% desde abril-septiembre, respecto de los valores de eficiencia fotosintética de hojas en condición de sombra. Los meses de abril a julio presentaron la menor diferencia, promediando un 8% en 32 comparación a los meses de agosto y septiembre, que promediaron una diferencia de 20%. Esto se debe a que la fotoinhibición, manifestada en valores menores a 0.75- 0.85, considerados normales en plantas sin estres (Azcon-Bieto, 2000), se acentúa en los meses de mayor intensidad lúminica, acrecentando la diferencia entre la eficiencia fotosintética de hojas en condición de luz y la eficiencia fotosintética de hojas en condición de sombra (Anexo 22 y 23). Estos resultados coinciden con un estudio realizado en Chile por Santa María (2001), en Murtilla demostrando que en plantas bajo condiciones de plena luminosidad se produce una fuerte inhibición de la fotosíntesis, explicada por la relación Fv/Fm, la que presenta valores de 0,4 a 0,62 a diferencia de plantas sombreadas que mostraron valores cercanos al optimo 0,8 lo que sugiere un posible daño estructural del fotosistema II de la planta a plena luminosidad. De igual forma estudios en plantas de poroto, también muestran baja eficiencia fotosintética en condiciones de luminosidad a diferencia de plantas en condiciones de sombra (Pastenes et al., 2005). Budwalda (1995), señala que la eficiencia fotosintética, Fv/Fm, es mayor en hojas sombreadas que iluminadas de peras y manzanas. La razón de que las hojas sombreadas en palto logren tener mayor eficiencia fotosintética que hojas iluminadas, esta en que el palto es un cultivo selvático adaptado a un medio ambiente de semisombra y esta condición es la más “parecida” a su ambiente original. Aunque por lo general las hojas bajo condición de sombra poseen mayor eficiencia fotosintética que en iluminación (Ureña, 1999), esto no quiere decir que puedan generar mayor cantidad de reservas de carbohidratos que las hojas sol, ya que, como es sabido, a un mismo flujo fotónico las hojas de sol poseen mayor asimilación de CO2 (Azcon-Bieto et al., 2000). Es decir, la eficiencia fotosintética, no es más que una medida de la velocidad con que trabajan las hojas bajo un determinado flujo fotónico. Además, las hojas de sol no siempre están con baja eficiencia, ya que estudios como el de Santa María (2001), 33 señalan que la disminución de la eficiencia fotosintética se observa del medio día en adelante, pero durante las primeras horas de la mañana y al atardecer, se observan las máximas eficiencias fotosintéticas, tal como se registro en plantas de poroto y en olivos, bajo condiciones de estrés hídrico (Arenas, 2000; Angelopoulus, 1996). 4.2.3. Influencia del sombreamiento sobre la concentración de azúcares En la Cuadro 9 se presentan los resultados de concentración de azúcares a nivel foliar, de los tratamientos luz y sombra en tres fechas consecutivas, previo a floración, plena floración y posterior a esta. Cuadro 9. Influencia de la iluminación sobre la concentración de azúcares totales (mg/ml) foliar, en tres momentos respecto de la floración, desarrollada por tratamiento de luz y sombra en brotes de paltos variedad Hass. TRATAMIENTO Luz (T1) Sombra (T2) ANTES FLOR 0,800 a 0,670 b PLENA FLOR 0,728 a 0,721 a POST FLOR 0,115 a 0,264 a Letras distintas en una misma columna indican diferencias significativas (p< 0.05), según el test de Tukey. Previo a floración los tratamientos poseen diferencias significativas, siendo los valores de hojas expuestas a la luz, los más altos. Esto se puede deber a que las hojas, al estar bajo condiciones de mayor intensidad lumínica o mayor flujo fotónico aumentan su asimilación de CO2, en el proceso de fotosíntesis (Azcon-Bieto et al, 2000), lo cual resulta en una mayor acumulación de carbohidratos de reserva, que en hojas de sombra. En plena floración y posterior a ésta los tratamientos no presentan diferencias. Esto se puede deber a que los niveles de azúcares foliar previo a floración del tratamiento de luz disminuyen por su consumo en la floración y brotación (González et. al. y Arpaia et al.,1994), haciendo que éstos se acerquen más a los valores del tratamiento de sombra en plena y post-floración. También se puede observar que la concentración de azúcares del tratamiento de sombra muestra una disminución en post floración respecto del valor de plena floración, lo cual se puede deber a que las reservas de hojas iluminadas se 34 hacen insuficientes y se recurren a las de hojas sombreadas, haciéndo disminuir sus reservas. Respecto del comportamiento que muestra cada tratamiento en las tres fechas, se puede decir que en el tratamiento de luz ocurre un descenso de la concentración de azúcares totales en la hoja, desde previa floración hasta post floración coincidiendo con lo señalado por Arpaia et al. (1994) y González et al. (1998), a diferencia del tratamiento de sombra que posee un valor más bajo previo floración (Anexo 24 y 25). 4.3. Ensayo de la Influencia del rayado sobre la intensidad floral 4.3.1. Influencia del rayado sobre la intensidad floral En el Cuadro 4 se muestran los resultados de intensidad floral de las dos fechas de rayado. Existe diferencia entre los tratamientos, siendo el rayado de mayo (T2), el de mayor efecto en aumentar la intensidad floral. El tratamiento de abril (T1) no muestra diferencia significativa con el testigo (T0) (Anexo 26). Cuadro 4. Influencia del rayado sobre la intensidad floral, desarrollada por tratamientos de rayado, en ramas de árboles de palto variedad Hass. TRATAMIENTO N° DE FLORES N° BROTES C/ FLOR INTENSIDAD T0 Abril T1 Mayo T2 785,000 2211,750 5015,5 13,000 31,000 45 60,385 a 71,347 a 110,402 b Letras distintas en la columna indican diferencias significativas (p< 0.05), según el test de Tukey. La mayor intensidad lograda por el tratamiento de mayo (T2) respecto de T0, se puede deber, a que el rayado mejora la diferenciación de yemas, lo cual sugiere que un cierto umbral de carbohidratos, es necesario durante el proceso (Scholefield et al., 1985). 35 La mayor intensidad lograda por T2 respecto de T1, se puede deber a dos razones, por un lado, al efecto desvigorizante del rayado (Wolstenholme, 1987; Acevedo, 1994; Lahav et al., 1971a), que sumado a las bajas temperaturas (Hernández, 1991; Tapia, 1993), interrumpen el desarrollo del crecimiento vegetativo, correspondiente al período final del “flush” de otoño, es decir, que las ramas rayadas en mayo, a diferencia de las ramas rayadas en abril, son interrumpidas más tardíamente, permitiendo que desarrollen mas crecimiento vegetativo, sobre el cual tener puntos florales, la primavera siguiente. Por otro lado el rayado de mayo, pudo haber generado mayor cantidad de yemas diferenciadas, ya que existen antecedentes como los estudios realizados por Berrios (1995) y Acevedo (1994), que señalan, que a partir de junio comienza a haber diferenciación en la zona de Quillota, entonces, considerando, que el tiempo de cicatrización de rayados de 2-3mm, es de tres meses en promedio (Rowlands, 1994; Acevedo, 1994; Trochoulias y O'neill,1976; Lahav et al., 1971b), el rayado de mayo mantuvo más tiempo el nivel de carbohidratos, sobre el anteriormente sugerido umbral, mejorando de esta forma la diferenciación. Por el contrario el rayado de abril termina su efecto cuando la diferenciación estaría comenzando, lo cual explica, porque no hay diferencia entre T1 y T0. 4.3.2 Influencia del rayado sobre la eficiencia fotosintética Los datos de eficiencia fotosintética correspondientes a los tratamientos se muestra en la Cuadro 5. Al analizar los datos de T0 se observa un comportamiento descendente de la eficiencia fotosintética desde mayo hasta agosto, comenzando nuevamente a elevarse el valor en septiembre y octubre (Anexo 27). El árbol control al igual que el resto de los árboles anillados son árboles que poseen alta carga frutal. La carga frutal como lo señala la hipótesis fuente-sumidero genera un aumento de los órganos “sink” que hace disminuir la eficiencia fotosintética de las hojas (Retuerto, 2003). 36 Dentro de este contexto, la eficiencia fotosintética se aminora, en la medida que las hojas tienen que sustentar el “sink” de fotoasimilados que implica la carga frutal en desarrollo, al menos hasta el período de cosecha que corresponde a agosto–septiembre en la zona del ensayo, en que nuevamente recuperarían la eficiencia fotosintética. Cuadro 5. Influencia del rayado sobre la eficiencia fotosintética (Fv/Fm), en los meses posteriores al rayado, desarrollada por tratamiento, en ramas de árboles de palto variedad Hass. RAYADO T0 Abril (T1) Mayo(T2) MAY JUN 0,752 0,696 0,734 0,723 0,722 JUL 0,664 0,674 0,731 AGO 0,646 0,637 0,727 SEP 0,646 0,706 0,675 OCT 0,698 0,755 0,770 Los tratamientos de abril y mayo muestran una tendencia a la disminución de la eficiencia fotosintética, mas clara en abril, hasta los meses de agosto septiembre en que los niveles se elevan nuevamente (Anexo 28 y 29). Esta disminución se podría explicar en parte con la hipótesis fuente-sumidero, ya que hay una serie de estudios que evidencian un efecto del rayado sobre la fotosíntesis y su eficiencia, los cuales podrían explicar, aun más, este comportamiento. Azcon-Bieto et al. (2000), señala que la acumulación de carbohidratos en las hojas, es un fenómeno común, el cual puede ser incrementado de distintas maneras que pueden incluir altas tasas fotosintéticas, bajas demandas “sink” o baja traslocación de asimilados, como la generada por el rayado, en el presente ensayo. El efecto “inmediato“ y más conocido del rayado es la acumulación de azúcares sobre la incisión, los que a su vez están jugando un rol sobre la fotosíntesis y su eficiencia. La hipótesis de inhibición de productos terminados de la fotosíntesis, señala que la acumulación de asimilados puede ser la responsable de la inhibición de la tasa fotosintética neta (Boussingault, 1868). 37 Como consecuencia de esta acumulación de carbohidratos, un estudio realizado por Goldschmidt y Huber. (1992), en plantas hortícolas, señala que la capacidad fotosintética máxima (A max) de las hojas se ve disminuida a los siete días de realizado el rayado. El rayado generó una disminución de la fotosíntesis producto de la acumulación de carbohidratos, pero el nivel fotosintético fue recuperado nuevamente al aumentar el consumo de carbohidratos por parte de los frutos (Davie et al., 1995). En la mismas línea, un estudio realizado por Azcon-Bieto (1983), en plantas de trigo muestran inhibición de la fotosíntesis con la acumulación de azúcares solubles en las hojas, expresado a través de valores reducidos del quantum yield y baja tasa de saturación de CO2 o capacidad fotosintética, lo que sugiere, que la acumulación de carbohidratos impide la producción o consumo de ATP/NADPH y una inhibición en la producción del substrato de la carboxilación la RuBP, respectivamente. Esta idea se conoce con el nombre de hipótesis de la limitación del fosfato (Azcon-Bieto, 1983). Hay que señalar que no se encontró evidencia respecto al tiempo en que se afecta la fotosíntesis por la acumulación de carbohidratos, pero es de suponer, que bajo la hipótesis de crecimientos compensatorios el efecto se mantiene mientras su causa o estimulo (acumulación de carbohidratos) este actuando, ya que como señala (AzconBieto, 1983; Davie et al., 1995) las tasas fotosintéticas se recuperan luego de períodos de oscuridad en que se consumen los carbohidratos, es decir, que aplicado al presente ensayo debiese durar tres meses en promedio, el efecto de los carbohidratos sobre la eficiencia fotosintética, que es el tiempo que demora la cicatrización. Por otro lado, existe otro componente que se afecta por el rayado y que también incide sobre la fotosíntesis, el nitrógeno. Tomer (1977) y Blumendfeld et al. (1975), señalan que dentro de los efectos provocados por el rayado, se encuentra la disminución de los niveles de nitrógeno. 38 El nitrógeno es un factor que puede modificar la capacidad fotosintética y por ende su eficiencia, ya que forma parte de enzimas y la clorofila, existiendo además una fuerte correlación entre el contenido de nitrógeno y la rubisco, ya que aproximadamente cerca del 50% del nitrógeno de una hoja se encuentra en esta proteína en plantas C3 (AzconBieto et al., 2000). En la misma línea Evans (1938), señala que la actividad del RUBP carboxilasa y de la clorofila fue marcadamente proporcional a los contenido de nitrógeno en las hojas y Raymund et al. (1985), que la concentración de nitrógeno en la hoja maximiza la asimilación diaria de CO2. Por lo tanto la disminución de la eficiencia fotosintética también puede ser provocada por una disminución de los niveles de nitrógeno. Lo antes señalado podría explicar el comportamiento descendente de la eficiencia fotosintética de lo tratamientos de abril y mayo, pero no sus niveles mas elevados respecto de T0, ya que si presentan niveles disminuidos de nitrógeno, elevados niveles de carbohidratos y la carga frutal que estarían actuando a favor de una menor eficiencia fotosintética, entonces debiesen mostrar niveles inferiores de eficiencia respecto a T0. 4.3.3. Influencia del rayado sobre la concentración de azúcar foliar En la Cuadro 6 se presentan los resultados de concentración de azúcares a nivel foliar, de los tratamientos (T0, T1, T2) en tres fechas consecutivas, previo a floración, plena floración y posterior a ésta. El Cuadro 6, muestra que hubo influencia del rayado (T1, T2 ) sobre la concentración de azúcar foliar previo a floración. Es posible que, aunque el rayado tenga un período de cicatrización de tres meses promedio (Rowlands, 1994; Acevedo, 1994; Trochoulias y O'neill, 1976; Lahav et. al., 1971b) los niveles de azúcares se hayan mantenido un poco más tiempo, resultando en diferencias significativas con T0, al momento de realizar la medición. 39 Por otro lado estos resultados podrían explicar el comportamiento de la intensidad floral de los tratamientos, revelando que aquellos con mayor concentración de azúcares, previo a floración, resultan en una mayor intensidad floral. Lo cual no quiere decir que se requieran altos niveles de azúcar justo antes de floración, para obtener una alta intensidad floral, si no que estos resultados podrían ser un reflejo de lo que ocurrió durante el período de la diferenciación. Cuadro 6. Influencia del rayado sobre la concentración de azúcar foliar (SST), en tres momentos respecto a la floración, desarrollada por tratamientos aplicados en árboles de palto variedad Hass. TRATAMIENTOS T0 Abril (T1) Mayo (T2) ANTES FLORACIÓN 0,665 a 0,691 b 0,811 c PLENA FLORACIÓN 0,702 a 0,845 a 0,687 a POST FLORACIÓN 0,136 a 0,123 a 0,126 a Letras iguales indican que los tratamientos no difirieron estadísticamente, (p< 0.05) según el test de Tukey. En plena floración y post floración los tratamientos no muestran datos que puedan aclarar el comportamiento observado en la intensidad floral. Por otro lado si se analiza el comportamiento seguido por cada tratamiento, en las tres fechas, se pudo observar tendencia a la disminución de los niveles de azúcares (Anexo 30, 31 y 32). Este comportamiento coincide con lo señalado por Arpaia et al. (1994) y González et al., (1998), que evidencian fluctuaciones de los niveles de carbohidratos en el año, siendo los niveles previos a floración los más altos, seguido de una baja debido al consumo de azúcares por el crecimiento vegetativo y floración de primavera y seguido por niveles más bajos aun, post floración. 40 5. Conclusiones - La carga frutal del palto var. Hass disminuye la intensidad floral, en la medida que más tiempo permanece ésta en el árbol, hasta llegar a una intensidad floral 0. - La carga frutal del palto var. Hass afecta la eficiencia fotosintética (Fv/Fm) y la concentración foliar de azúcares totales. - La iluminación del palto var. Hass afecta la intensidad floral en forma directamente proporcional, llegando a niveles de intensidad floral 0 bajo un régimen de sombra. - La luminosidad del palto var. Hass afecta la eficiencia fotosintética, y la concentración foliar de azúcares totales. - El rayado en mayo del palto var. Hass aumenta la intensidad floral, a diferencia del rayado de abril. - El rayado del palto var. Hass afecta la eficiencia fotosintética y la concentración foliar de azúcares totales. 41 Resumen Para conocer las causas de la alternancia productiva en palto (Persea americana Mill.), es importante comenzar por estudiar la floración, y de qué forma los factores, tales como, la luz, la carga frutal y el rayado de ramas, inciden en la misma, y en la fisiología de la planta. De aquí, que los principales objetivos del estudio, fueron determinar el efecto de la carga frutal presente (mediante desfrute), la iluminación (bajo un régimen de luz y sombra) y el rayado de ramas en dos fechas (abril y mayo) sobre el parámetro intensidad floral y las condiciones fisiológicas de la planta. El estudio fue desarrollado en tres ensayos ubicados en el sector de Pocochay, perteneciente a la ciudad de Quillota, quinta región, Chile. Las variables evaluadas fueron: intensidad floral, medido en cada tratamiento como número de flores totales, en relación al número total de brotes con flor y para medir las condiciones fisiológicas de la planta, se utilizó la eficiencia fotosintética (Fv/Fm) de hojas, medida con fluorómetro (Mini pam- junior), y la concentración foliar de azúcares totales (SST), medida en distintas épocas (previo a floración, en floración y post floración). Se concluyó, que en relación a la carga frutal ésta disminuye la intensidad floral, en la medida que más tiempo permanece en el árbol, hasta llegar a una intensidad floral 0. La iluminación afecta la intensidad floral en forma directamente proporcional, llegando a niveles de intensidad floral 0, bajo un régimen de sombra. Se determinó que el rayado en mayo aumenta la intensidad floral, a diferencia del rayado de abril, que no presenta diferencias con el testigo. 42 Summary In order to know what causes alternate bearing in Hass avocado trees (Persea americana Mill.), It is important to begin by studying the blooming period, and how factors such as light, fruit load, and girdling, influence the alternate bearing and the physiology of the plant. The main objective of this study was to determine the effect factors such as harvest, illumination (beneath a regiment of sunlight and shade), and girdling during two different time periods (April and May) would have on flower intensity and physiological conditions of the plant. This study was developed in three trials held in Chile’s fifth region in a sector of Quillota called Pocochay. The flower intensity was measured at every trial by counting the total number of flowers in relation to the number of branches with flowers. The physiological conditions of the leaves was measured using the photosynthesis efficient (FV/Fm). This is measured with a fluorometro (Mini pam-junior). To measure the physiological conditions of the flowers, the total sugar concentration (SST) of the blossoms was measured at different stages of the blooming cycle (before blooming, during blooming and post-blooming). It was concluded that the fruit load decreases flower intensity. If fruit remains in the tree, blossoms decreases until the tree reaches a flower intensity of 0. The lighting is directly proportional to flower intensity, reaching a level of zero for the flower intensity when there is no sunlight. Girdling enhances flower intensity when done in May. When done in April however, there is no difference between the trees tested and the trees in the control treatment. 43 ANEXO 1. Protocolo azucares totales Antrona Extracción de los azúcares • Extraer los azúcares con una solución de Etanol 80% en un baño a 80ºC por 30 min, a razón de 1,5 mL por 100 mg de muestra en tubos Eppendorf. La muestra debe estar finamente cortada. Colocar de inmediato su 1,5 mL de etanol 80%. Cuando ya estén todas las muestras con su etanol, colocarlas en el baño de agua. • Centrifugar a 12.000g por 15 min a 4ºC y tomar el sobrenadante en otro Eppendorf. Rotular siempre los Eppendorf con el mismo número de la muestra original. • Este sobrenadante (extracto crudo) puede guardarse por algún tiempo en congelador a -15 a -30ºC, pero lo ideal es hacer la prueba de inmediato. Procedimiento • • • • Se debe diluir cada muestra a razón de 20 µL del extracto crudo + 980 µL de agua destilada. Esta mezcla va en un nuevo Eppendorf rotulado con su correspondiente número de muestra. Tomar 200 µL de esta solución diluida y agregarle 2 mL del reactivo de Antrona. Agitar esta mezcla y dejar los tubos tapados incubando por 30 minutos en un baño con agua a 40ºC. Luego leer la absorbancia de la muestra en un Espectrofotómetro a 620 nm (A620). Curva de Calibración Para poder transformar la lectura en una concentración real de azúcares, se debe realizar primero que nada una curva estándar. Esta se realiza con glucosa. Preparar una solución stok de glucosa a razón de 30 mg/mL y preparar unos 10 mL. Luego preparar en Eppendorf cada una de las siguientes concentraciones (1mL) Preparar los puntos de la curva así: Concentración Glucosa Curva Estándar Cantidad Solución Agua destilada Stock 2 0 mg/mL 0 µL 1000 µL 44 0,5 mg/mL 16 µL 984 µL 1,0 mg/mL 33 µL 967 µL 2,0 mg/mL 66 µL 934 µL 3,0 mg/mL 100 µL 900 µL Soluciones a preparar Reactante Antrona Se prepara una solución de Antrona (es un polvo como cristales amarillos) a razón de 0,15 % p/p. en ácido sulfurico diluido al 80%. Posibles cantidades totales a preparar : Acido Sulfurico 98% (de fábrica) 61,22 mL 122,45 mL 408,2 mL al Agua destilada 13,78 mL 25,55 mL 91,8 mL Volumen final Acido Sulf Dil 80% 75 mL 150 mL 500 mL 45 ANEXO 2. Intensidad floral de los tratamientos de desfrute. (n°flores/n°brotes florales) Intens idad floral 100 80 60 40 20 0 O ff T1 T2 T3 T4 T5 T6 T7 Tratamientos ANEXO 3. Intensidad floral desarrollada por fechas de desfrute, en palto variedad Hass & curva de crecimiento vegetativo del palto var. Hass en Quillota. (n°flores/n°brotes florales) Intens idad floral & c urva c rec im iento vegetativo ------------ 100 80 60 40 20 0 O ff T1 Cr e cimie nt o ve ge t at iv o Cic lo f enologic o del palt o c v . Hass, Quillot a. Fuent e:Tapia, 1993 T2 T3 T4 Tratamientos T5 T6 T7 46 ANEXO 4.. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento diciembre. T1 Comportamiento Fv / Fm 0,8 0,8 0,8 0,7 0,7 0,7 0,7 0,7 0,7 Mes DIC ENE FEB MAR ABR MAY JUN ANEXO 5. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento enero. T2 Comportamiento Fv/Fm 1 0,8 0,6 Mes 0,4 0,2 0 ENE FEB MAR ABR MAY JUN 47 ANEXO 6. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento febrero. T3 Comportamiento Fv/Fm 1,0000 0,8000 0,6000 Mes 0,4000 0,2000 0,0000 FEB MAR ABR MAY JUN ANEXO 7. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento marzo. 48 T4 Comportamiento Fv/Fm 0,8000 0,7500 0,7000 Mes 0,6500 0,6000 MAR ABR MAY JUN ANEXO 8. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento abril. T5 Comportamiento Fv/Fm 0,76 0,74 0,72 0,7 0,68 0,66 0,64 Mes ABR MAY JUN ANEXO 9. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento mayo. 49 T6 Comportamiento Fv/Fm 0,7 0,68 0,66 Mes 0,64 0,62 MAY JUN ANEXO 10. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento junio. 50 T7 Comportamiento Fv/Fm 0,8 0,6 Mes 0,4 0,2 0 T7 ANEXO 11. Comportamiento eficiencia fotosintética (Fv/Fm), tratamiento off. OFF Comportamiento Fv/Fm 0,750 0,745 0,740 Mes 0,735 0,730 DIC ENE FEB MAR ABR MAY JUN 51 ANEXO 12. Comportamiento eficiencia fotosintética (Fv/Fm) &crecimiento vegetativo & fruto. T1. crecimiento del Unidades relativas Comportamiento Fv / Fm posterior a desfrute 0,8 0,8 0,7 0,7 0,7 0,7 0,7 0,6 T1 DIC ENE FEB --------- Crecimiento vegetativo MAR ABR MAY JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente: Tapia, 1993 ANEXO 13 Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & fruto. T2 crecimiento del 52 Comportamiento Fv/Fm posterior al desfrute Unidades relativas 1 0,8 0,6 0,4 T2 0,2 0 ENE FEB MAR --------- Crecimiento vegetativo ABR MAY JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta, 1996 Fuente:Tapia, 1993 ANEXO 14. Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & del fruto.T3 crecimiento Comportamiento Fv/Fm posterior al desfrute Unidades relativas 1,0000 0,8000 0,6000 0,4000 T3 0,2000 0,0000 FEB MAR --------- Crecimiento vegetativo ABR MAY x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 JUN 53 ANEXO 15. Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & crecimiento del fruto.T4 ANEXO 16. Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & del fruto.T5 crecimiento Comportamiento Fv/Fm posterior al desfrute Unidades relativas 0,8000 0,7500 0,7000 T4 0,6500 0,6000 MAR ABR MAY --------- Crecimiento vegetativo JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 Unidades relativas Comportamiento Fv/Fm posterior al desfrute 0,76 0,74 0,72 0,7 0,68 0,66 0,64 T5 ABR --------- Crecimiento vegetativo MAY JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 54 ANEXO 17. Comportamiento eficiencia fotosintética (Fv/Fm), & crecimiento vegetativo & crecimiento del fruto.T6 Comportamiento Fv/Fm posterior al desfrute Unidades relativas 0,7 0,68 0,66 T6 0,64 0,62 MAY --------- Crecimiento vegetativo JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 ANEXO 18. Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & fruto. T7 crecimiento del 55 Unidades relativas Comportamiento Fv/Fm posterior al desfrute 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 T7 JUN --------- Crecimiento vegetativo x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 ANEXO 19. Comportamiento eficiencia fotosintética (Fv/Fm), &crecimiento vegetativo & fruto. Off crecimiento del Comportamiento Fv/Fm 0,750 0,740 0,730 OFF 0,720 0,710 0,700 DIC ENE FEB MAR --------- Crecimiento vegetativo ABR MAY JUN x--x--x Crecimiento fruto Ciclo feno lo gico del palto cv. Hass, Quillo ta. Fuente:Tapia, 1993 ANEXO 20. Comportamiento nivel de azucares & Intensidad floral & crecimiento vegetativo 56 Comportamiento intensidad floral & intensidad floral & crecimiento vegetativo 4,0000 3,5000 3,0000 2,5000 Previo floracion Intensidad floral 2,0000 1,5000 1,0000 0,5000 0,0000 Off T1 T2 T3 T4 T5 T6 --- --- Crecimiento vegetativo Fuente: Tapia,1993 T7 57 ANEXO 21. Comportamiento nivel de azucares en tres épocas Nivel de azucares 1,2000 Previo floracion 1,0000 mg/ml 0,8000 plena floracion 0,6000 0,4000 0,2000 post floracion 0,0000 Off T1 T2 T3 T4 T5 T6 T7 ANEXO 22. Influencia de luz, sobre la eficiencia fotosintética (Fv/Fm). Unidades relativas Eficiencia fotosintetica (Fv/Fm) tratamiento luz 0,800 0,750 0,700 mes 0,650 0,600 Abril May Jun Jul Ago 58 ANEXO 23. Influencia de sombra sobre la eficiencia fotosintética (Fv/Fm) Unidades relativas Eficiencia fotosintetica (Fv/Fm) tratamiento sombra 0,850 0,800 0,750 mes 0,700 0,650 Abril May Jun Jul Ago Sep ANEXO 24. Influencia de la luz sobre la concentración de azúcar foliar (Mg/ml). 59 Mg/ml Concentración de azucar foliar tratamiento luz 1 0,5 Fecha 0 previo flor plena flor post flor ANEXO 25. Influencia de T2 sobre la concentración de azúcar foliar (Mg/ml). Mg/ml Concentracion de azucar foliar tratamiento sombra 0,8 0,6 0,4 0,2 0 Fecha previo flor plena flor pos t flor ANEXO 26. Intensidad floral de arboles rayados en dos fechas abril y mayo. 60 I nte ns id ad f lo ral 120,00 b n°flores/n°brotes florales 100,00 80,00 a a 60,00 T mt 40,00 20,00 0,00 T0 T1 T2 ANEXO 27. Influencia de T0 sobre la eficiencia fotosintética. Fv/Fm Eficiencia fotosintetica T0 0,8 0,75 0,7 0,65 0,6 0,55 mes May Jun Jul Ago Sep Oct 61 ANEXO 28. Influencia de T1 sobre la eficiencia fotosintética. Fv/Fm Eficiencia fotosintetica prom edio T1 0,8 0,75 0,7 0,65 0,6 0,55 m es May Jun Jul Ago Sep Oct ANEXO 29.Influencia de T2 sobre la eficiencia fotosintética. Eficiencia fotosintetica promedio T2 0,8 Fv/Fm 0,75 0,7 mes 0,65 0,6 Jun Jul Ago Sep Oct 62 ANEXO 30 . Influencia de T0 sobre la concentración de azúcar foliar. (mg/ml) Mg/ml Concentracion de azucar foliar T0 1,000 0,800 0,600 0,400 0,200 0,000 momento antes plena flor post flor ANEXO 31. Influencia de T1 sobre la concentración de azúcar foliar. (mg/ml) Mg/ml Concentracion de azucar foliar T1 1,000 0,800 0,600 0,400 0,200 0,000 momento antes plena flor post flor 63 ANEXO 32. Influencia de T2 sobre la concentración de azúcar foliar (mg/ml) Concentracion de azucares foliar T2 Mg/ml 0,800 0,600 0,400 momento 0,200 0,000 antes plena flor post flor ANEXO 34. Desarrollo de la inflorescencia de palto cv. Hass. 64 Los numeros (estados 1 al 11) indican los estados progresivos de desarrollo. Abreviaciones: b=escama de la yema; br= bracteola de eje terciario; c= carpelo; i= bractea de inflorescencia; p= periantio; S= eje terciario de la inflorescencia; sb= base de la escama de la yema; st= estambres; t= terciario; tf= flor terminal del eje secundario; v= yema vegetativa Fuente : Salazar-Garcia et al. (1998). 65