PROPIEDADES COLIGATIVAS. I. OBJETIVOS. 1. Definir e
Anuncio

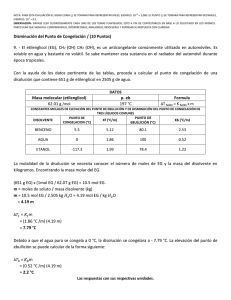
LABORATORIO DE FISICOQUÍMICA DR. ALEJANDRO ORTIZ FERNÁNDEZ PRACTICA N° 3 PROPIEDADES COLIGATIVAS. I. OBJETIVOS. 1. Definir e identificar la importancia de las propiedades coligativas. 2. Ejemplificar experimentalmente la variación del punto de ebullición y del punto de fusión de una disolución 3. Determinar el peso molecular de un soluto mediante la propiedades coligativas de las disoluciones 4. Relacionar la importancia de estas propiedades en la Industria Farmacéutica. II. FUNDAMENTOS Las soluciones diluidas de solutos no-volátiles presentan propiedades muy particulares denominadas propiedades coligativas, las cuales son: a).- Descenso de la presión de vapor del disolvente. b).- Descenso del punto de congelación del disolvente. c).- Aumento del punto de ebullición. d).- Presión osmótica. Estas propiedades dependen únicamente del número de partículas en solución y no de la naturaleza de las mismas. En ésta práctica se emplearán solutos del tipo de no electrolitos ya que los electrolitos al disociarse en solución incrementan el número de partículas y por lo tanto se ven modificadas las propiedades coligativas. Aumento del punto de ebullición de las disoluciones. Las disoluciones que contienen solutos no-volátiles presentan puntos de ebullición más elevados que el disolvente puro. La diferencia entre el punto de ebullición de la solución y el disolvente puro para una presión constante establecida, se conoce como elevación del punto de ebullición que depende de la naturaleza del disolvente y la concentración del soluto, pero es independiente, por lo menos en soluciones diluidas, de la naturaleza del soluto en tanto este no se disocie. Consideremos el diagrama presión de vapor-temperatura que se muestra en la figura 1. Figura 1. Diagrama Presión de vaporTemperatura donde se muestra la línea de equilibrio líquido-vapor para el disolvente puro y la disolución. La curva AB representa la presión de vapor del disolvente puro en función de la temperatura. Como la presión de vapor de la disolución es para todas las temperaturas, menor que la del disolvente, la curva de presión de vapor-temperatura de la disolución debe quedar debajo de la del disolvente puro y esta representada en el diagrama por la curva CD. A fin de alcanzar el punto de ebullición correspondiente a cierta presión externa que se ejerce sobre la solución P°, debe calentarse a temperaturas a las cuales las presiones de vapor respectivas igualan la del confinamiento. El disolvente puede alcanzar la presión P° a la temperatura To, pero la solución debe elevarse a una temperatura mayor que To antes de que se alcance la misma presión. Por lo tanto, para la misma presión externa, la solución debe hervir a una temperatura más elevada que la del disolvente puro; el ascenso del punto de ebullición será entonces ∆Tb=T-To. Cuando aplicamos la ecuación de Clausius-Clapeyron y la Ley de Raoult, es posible deducir una relación entre el ascenso del punto de ebullición de la solución y su concentración. Como los puntos E y F quedan sobre la curva de presión de vapor de la solución, ambos pueden relacionarse mediante la ecuación de Clausius-Clapeyron. ln P º ∆H v = P R ⎡T −T 0 ⎤ ⎢ TT ⎥ ⎣ 0 ⎦ En donde: P y P° son las presiones de vapor de la solución a las temperaturas T y To respectivamente. ∆Hv es el calor de vaporización por mol de disolvente de la solución, si la solución es diluida T es prácticamente igual a To y T•To = To2 ln ∆H v ∆T b P P = − ln = R T 02 Pº Pº Cuando la ley de Raoult se aplica a la solución, tenemos P = x1 = 1 − x 2 Pº x1 = fracción mol del disolvente. x2 = fracción mol del soluto. ln(1 − x 2 ) = − ∆Tb = ∆H v R ⎡ ∆Tb ⎤ ⎢ ⎥ ⎣ T2 º ⎦ 2 RT0 x2 ∆H v Por costumbre, se expresa la concentración en moles de soluto por 1000 g de disolvente, es decir en molalidad (m). Si designamos con x1 al número de moles del disolvente en 1000 g tenemos: x2 = m m ≈ n1 + m n1 Debido a que es una solución diluida, m es pequeño en relación con n1 y puede despreciarse quedando la ecuación como sigue: ⎡ RT 02 ⎤ ∆T b = ⎢ ⎥m ⎣ ∆H v n1 ⎦ Para un disolvente dado, todas las cantidades en el paréntesis de la ecuación anterior son constantes y podemos simplificar como sigue: ∆T b = K b m La constante Kb se denomina también constante molal de elevación del punto de ebullición o constante ebulloscópica. El peso de soluto por 1000 g de disolvente está dado por: 1000 w2= peso del soluto en g w1 = peso del disolvente en g w2 w1 La molalidad de la disolución es: m = 1 0 0 0w w 1M 2 2 donde M2 es el peso molecular del soluto. Relacionando las ecuaciones anteriores obtenemos: ⎛1000w 2 ⎞ ∆T b = K b ⎜ ⎟ ⎝ w 1M 2 ⎠ M2 = 1000w 2 K b w 1∆ T b de aquí, es posible determinar el peso molecular del soluto si conocemos el valor de la constante ebulloscópica del disolvente, así como la variación del punto de ebullición y la concentración molal de la solución. Disminución del punto de fusión. Cuando se disuelve una sustancia en un disolvente líquido, el punto de congelación de la disolución es menor que el del disolvente puro. El descenso en la temperatura de congelación depende del número de moles de soluto disueltos en una cantidad dada de disolvente. Al igual que el incremento en el punto de ebullición, el descenso en el punto de congelación puede determinarse como: ∆Tf = Kfm con: Kf = M0RT02/1000∆Hf donde: Kf = constante crioscópica o constante molal de descenso en el punto de congelación. m = molalidad de la disolución en moles/kg de disolvente. M0 = peso molecular del disolvente R = constante universal de los gases. T0 = punto de congelación del disolvente puro. ∆Hf = entalpía molar de fusión del disolvente puro. III. PROTOCOLO DE INVESTIGACION. 1.- Investigar que es la constante ebulloscópica. 2.- Investigar que es la constante crioscópica. 3.- Explicar a que se le llama disolución hipo-, hiper- e isotónica. 4.- Mencionar por lo menos tres ejemplos de membranas semipermeables. 5.- Elaborar un diagrama de flujo con el procedimiento a seguir durante la práctica. IV. DESARROLLO EXPERIMENTAL. Aumento del punto de ebullición. a) Materiales y reactivos. 2 soportes universales. 2 matraces erlenmeyer. 2 pinzas de tres dedos con nuez. 1 refrigerante Liebig. 1 parrilla eléctrica. 1 bomba para recircular agua 1 termómetro. 1 termómetro diferencial. etilénglicol 1 matraz balón agua destilada 1 juego de conexiones para destilación. b) Secuencia experimental. b.1 Montar el equipo para punto de ebullición de acuerdo con la figura 2. b.2 Determine el punto de ebullición del agua destilada, antes de iniciar el calentamiento agregue perlas de ebullición. b.3 Colocar el agua destilada y el etilénglicol (EG) en un matraz bola, de acuerdo a lo indicado en la tabla y determinar el punto de ebullición de cada disolución. Antes de calentar, añadir perlas de ebullición. b.4 En la siguiente tabla, escribir los resultados obtenidos para cada solución preparada. Tb del agua pura __________________ºC Masa del EG/g Masa del agua/g 2.5 22.5 5.0 20.0 10.0 15.0 Figura 2. Aparato para determinar el incremento del punto de ebullición. Molalidad Tempertura de Mol/kg ebullición/ºC ∆Tb/K Figura 3. Aparato para la determinación del punto de congelación. Descenso en el punto de congelación a) Material y reactivos. Frasco Dewar (termo) de 1 L 1 tubo de ensayo grande con tapón 2 g de urea 1 tubo de ensayo pequeño con tapón agua destilada o desionizada 1 termómetro de -10 a 110 ºC sal de mesa 1 agitador para el tubo pequeño hielo b) Secuencia experimental b.1 Pese el tubo de ensayo pequeño y luego por diferencia pese alrededor de 1 g de urea en él. Añada 10 ml de agua y pese de nuevo. A partir de estas pesadas, determine la concentración molal de la disolución de prueba. b.2 Agite el tubo hasta que se haya disuelto la urea por completo y se tenga una disolución uniforme y transparente. Coloque este tubo dentro del tubo grande, para armar el equipo mostrado en la figura 3. b.3 Tome lecturas de temperatura cada minuto para elaborar la curva de enfriamiento de la disolución (temperatura vs. tiempo). Para evitar el sobre enfriado de la disolución, se debe agitar la disolución continua y vigorosamente con movimientos verticales con una frecuencia de 1 por/seg. El punto de congelación de la disolución se determina de la curva de enfriamiento, justo donde ocurre un cambio drástico de pendiente. Se sugiere graficar en forma simultánea al desarrollo del experimento para poder definir el término de éste. b.4 Se debe repetir el experimento añadiendo 1 g de urea más (debidamente pesado) a la disolución anterior y determinando de nueva cuenta el descenso en la temperatura de congelación. Para este experimento, se utiliza una mezcla refrigerante de hielo-sal. Esta mezcla debe de ser recién preparada para cada corrida. Se mezcla una parte en volumen de sal de cocina (en grano) con cuatro partes en volumen de hielo picado en un recipiente y se deja reposar por un par de minutos y luego se coloca la cantidad adecuada en el frasco Dewar. Peso exacto de la urea (1) __________. Peso exacto del agua (1) _________ Temperatura de congelamiento (1) _______________ Peso exacto de la urea (2) __________. Peso exacto del agua (2) _________ Temperatura de congelamiento (2) _______________ Tiempo (min) Tempe. (°C) Experimento con 1 g de urea Tiempo Tempe. Tiempo Tempe. (min) (ºC) (min) (ºC) Tiempo (min) Tempe. (ºC) Tiempo (min) Tempe. (ºC) Experimento con 2 g de urea Tiempo Tempe. Tiempo Tempe. (min) (ºC) (min) (ºC) Tiempo (min) Tempe. (ºC) V. TRATAMIENTO DE LOS DATOS EXPERIMENTALES. Aumento del punto de ebullición. Consultar de la literatura el valor de Kb para el agua. Determinar el peso molecular experimental del etilénglicol y compararlo con su valor teórico para determinar el error relativo. Descenso en el punto de congelación. Consulte en la literatura el valor de la constante crioscópica del agua y calcule el peso molecular experimental de la urea con uno y con dos gramos, el resultado debe ser consistente. Describir en forma sencilla, la forma de realizar experimentalmente las otras dos propiedades coligativas. VI. CONCLUSIONES. ¿Se cumplieron los objetivos de la práctica? ¿Es adecuado el empleo de las propiedades coligativas para determinar pesos moleculares de solutos? ¿Cuál de los dos métodos proporciona mayor confiabilidad para la determinación del peso molecular de un soluto con bajo peso molecular y cuál de ellos con un soluto de alto peso molecular? ¿Qué sugiere para obtener resultados más confiables? VII. BIBLIOGRAFIA. 1.- G.R. Barrow. Química Física. Ed. Reverté. Barcelona. 1991. 2.- F. Daniels. Curso de Fisicoquímica Experimental, Mc-Graw Hill, Columbia. 1980. 3.- John A. Dean. Lange’s Handbook of Chemistry, Mc-Graw Hill, Columbia, 1973. 4.- The Merck Index, Merck & Co., N. J. USA, 1983. 5.- P. J. Hill, Small Scale Physical Chemistry, cap. 2. Edward Arnold Pubs. London 1966, pp 722. 6.- David P. Schoemaker y Carl W. Garland, Experiments in Physical Chemistry, McGraw-Hill New York, 1962, pp132-141. 7.- P. Ander, y A. Sonesa, Principios de Química, introducción a los conceptos teóricos, Ed. Limusa 1977, México. 8.- R. Chang, Fisicoquímica con aplicaciones a sistemas biológicos, Compañía Editorial Continental, S. A. De C. V. México, 1987.