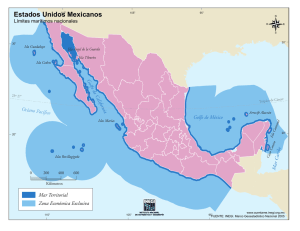
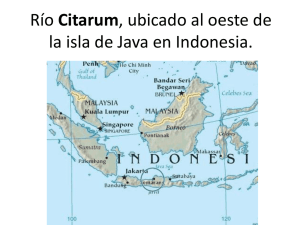
TES 1 - CICIMAR-IPN
Anuncio

IXSTITL’TO POLITECXICO NACIONAL Centro Interdisciplimrio de Ciencias Marinas Departamento de Pesquerías FESOLOGLA DE Sargassunz sinicola (SETCHELL Y GARDlrTER) EN BAHLI MAGDALESA, B.C.S., AIEXICO. E T S 1 S Que como requisito para obtener el grado de MAESTRO P R E S EN E CIENCIAS N T A : IGNACIO SANCHEZ RODRIGUEZ La Paz, B.C.S. Noviembre 1995 INDICE GLOSARIO ......................................................................................................................... i LISTA DE FIGURAS.. ....................................................................................................... iii LISTA DE TABLAS.. .......................................................................................................... v RESUMEN ........................................................................................................................ vi ABSTRACT.. .................................................................................................................... viii 1. INTRODUCCION.. .......................................................................................................... .1 ll. ANTECEDENTES .......................................................................................................... . III. OBJETIVO.. .................................................................................................................. .5 IV. AREA DE ESTUDIO ..................................................................................................... .6 DESCRIPCION DE LAS ESTACIONES DE MUESTREO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . :.6 V. METODOLOGIA ........................................................................................................... 10 MORFOLOGIA.. ............................................................................................................... 10 REPRODUCCION ........................................................................................................... .12 CRECIMIENTO ............................................................................................................... .12 BIOMASA.. ..................................................................................................................... .14 DISTRIBUCION.. ............................................................................................................. .14 TEMPERATURA ............................................................................................................. .15 IRRADIANCIA.. ............................................................................................................... .15 NUTRIENTES ................................................................................................................. .16 VI. RESULTADOS ........................................................................................................... .17 DESCRIPCION MORFOLOGICA.. ..................................................................................... .17 DESCRIPCION MORFOLOGICA DE Sargassum sinkola EN ISLA MAGDALENA.. ................... .19 DESCRIPCION MORFOLOGICA DE Sargassum sinkola EN ISLA MARGARITA ...................... .2 1 1 EPOCA DE REPRODUCCION .......................................................................................... .22 CRECIMIENTO.. ............................................................................................................. .25 CRECIMIENTO PROMEDIO EN FUNCION DE LA LONGITUD PROMEDIO DE Sargassum si-kola EN ISLA MAGDALENA ......................................................................... .2a CRECIMIENTO PROMEDIO EN FUNCION DE LA LONGITUD PROMEDIO DE Sargassum sinicola EN ISLA MARGARITA .......................................................................... .30 BIOMASA. ...................................................................................................................... .30 DISTRIBUCION ............................................................................................................... .32 ALGAS ACOMPAÑANTES ............................................................................................... .36 ALGAS EPíFITAS.. .......................................................................................................... .42 FACTORES AMBIENTALES ............................................................................................ ..4 4 TEMPERATURA ............................................................................................................. .44 IRRADIANCIA ................................................................................................................. .46 NUTRIENTES ................................................................................................................. .49 VII. DISCUSION .............................................................................................................. ,152 DESCRIPCION MORFOLOGICA.. ..................................................................................... .52 REPRODUCCION .............. . ............................................................................................ .54 CRECIMIENTO ............................................................................................................... .56 BIOMASA.. ..................................................................................................................... .60 DISTRIBUCION ............. ................................................................................................... 62 ALGAS ACOMPAÑANTES ............................................................................................... .64 ALGAS EPíFITAS. ........................................................................................................... .64 RELACION DE LOS ORGANISMOS EPIBIONTES Y FITOFAGOS. CON EL DESARROLLO DE Sargassum sinicola.. ................................................................ ..6 5 VIII. CONCLUSIONES.. .................................................................................................... .70 IX. RECOMENDACIONES.. ............................................................................................ .73 X. SUGERENCIAS PARA TRABAJO FUTURO.. ........................................................... .74 . . . . . . . . . . . l?!l’ . . . . í-,‘ . . .RTP3Sí; . . . . ..~..~.. ‘1.. XI. BIBLIOGRAFIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .C. .ENTRO .....Y.YI ARJO . .j$jj CI;Ip\TCIAS T” 4, ‘-‘.jIÍ*L,s 2 ~jvf?‘ :‘ ?i!‘ +A 1, p F“I_ GLOSARIO Aerocisto.- Vesícula llena de gas que sirve de elemento de flotación. Ambiente.- Todos los factores bióticos y abióticos externos a un organismo que lo afectan en cualquier punto de su ciclo vital. Anteridio.- Gametangio que produce gametos masculinos: en los hongos y en las algas es una sola célula. Bentónico.- Que vive asociado ó fijo al fondo de los ambientes acuáticos. Biomasa.- La cantidad de materia viva en un volumen conocido, que puede ser expresada como el peso total de los organismos por unidad de área o volumen. Cauloide.- Organo semejante a un tallo. Conceptáculo.- En algunas feofítas, cavidad del talo en donde se forman gametangios. Criptostomata.- Cada una de las depresiones poco acentuadas que se observan en la superficie del talo de ciertas feofítas. Epífito.- Organismo que crece sobre una planta. sin establecer ninguna relación nutricional con ella. Especie.- Grupo de poblaciones naturales entrecruzadas que están reproductivamente aisladas de otros grupos. Estipe.- Pedúnculo carente de tejido vascular; puede ser unicelular o pluricelular. Fenología.- Estudio de los fenómenos periódicos (estacionales) de la vida animal y vegetal y sus relaciones con el clima. Filoide.- Organo semejante a una hoja. Gametangio.- Célula en el interior de la cual se forman gametos. Háptera.- Organos que, sin ser propiamente raíces, sirven para fijar o afirmar la base de la planta. Litoral.- Zona de aguas relativamente grande poco profundas de los lagos o del mar. en que la luz generalmente penetra hasta el fondo. Masas de agua.- Cuerpo de agua relativamente grande. el cual tiende a retener su identidad y que esta caracterizado por un conjunto particular de temperaturas, salinidades y características químicas. Meiosis.- División reduccional en la cual el número de cromosomas se reduce desde el estado diploide (2n) al haploide (n). i Morfología.- Estudio de la forma! la estructura y el desarrollo de los organismos. Oogonìa.- Gametangio femenino constituido por una sola célula. Parafisas.- Pelo o filamento estéril: en los ascomicetes. hifa estéril existente en el himenio; en las feofitas y en los briofitas. pelo unicelular o pluricelular relacionado con los esporangios 0 con los gamentangios. Perenne.- Dícese de la planta que continúa viviendo a lo largo de vanos años. PIántula.- Planta joven producida por la fusión de gametos. Población.- Grupo de organismos de la misma especie que ocupan una región geográfica más o menos bien definida y exhiben continuidad reproductiva de generación en generación. Receptáculo.- Una área fértil en la cual aparecen gametangios y/o esporangios. Región intermareal.- Parte del fondo marino situada entre el nivel de marea viva alta y el de marea muerta baja. Región submareal.- Porción del mar situada por debajo del nivel inferior de las mareas bajas (nunca expuesta). Reproducción vegetativa.- Reproducción asexual. en la cual los progenitores tienen 1 idéntica constitución gamética que los descendientes. Rizoide.- Filamento unicelular o pluricelular en forma de raíz que une al sustrato algunas plantas no vasculares y los gametofitos de algunas plantas vasculares. Sustrato.- Base o superficie adyacente que actúa de punto de fijación para una planta. ii 25*Id’N 2 5 ’0 0 ’ 24.45’ 2 4.30’ . . ....-. . 2 4.15’ Fig. 1. Localización del sistema lagunar Bahía Magdalena y ubicación de las estaciones de muestreo. (Cl y C2 = zonas de marcado para el estudio de crecimiento). Las estaciones 1: 2. 3 y C que corresponden a el área de Isla Magdalena. se encuentran separadas una de la otra por una distancia que varia entre 3 y 5 km y presentan las siguientes características: Estación 1. Es una playa protegida. arenosa-pedregosa. constituida principalmente de piedras, cantos rodados, guijarros y conchas, de oleaje suave. en tiempo de vientos de otoño e invierno se presentan oleajes fuertes 0 resacas. Estación 2. Es una playa arenosa con rocas grandes dispersas y cantos rodados. en otoño e invierno las piedras quedan completamente cubiertas por arena. el oleaje es moderadamente fuerte por la influencia de los vientos. Estación 3. Esta es una de las estaciones más expuestas al oleaje. es una playa rocosa con declive pronunciado. se aprecian acantilados. rocas con oquedades y proyecciones cortantes, además las rocas están socavadas y forman cuevas. I Estación C,. Es una zona con sustrato pedregoso-rocoso y cantos rodados. Las estaciones 4, 5. 6 y C2 corresponden al área de Isla Margarita. se encuentran separadas una de la otra por una distancia que varia entre 3 y 5 km y presentan las siguientes características: Estación 4. Es una playa rocosa y tendida en forma de plataforma. con acantilados rocas con oquedades. presenta por lo general fuerte oleaje. Estación 5. Es una playa arenosa con rocas y cantos rodados. en el otoño e invierno las rocas quedan completamente cubiertas por arena. el oleaje es moderado durante MS¡ todo el año. Estación 6. Esta es una playa tendida con sustrato arenoso. piedras y cantos rodados, con oleaje fuerte causado por efecto de los vientos de invierno. Estación CZ. Es una zona arenosa-pedregosa con cantos rodados. 8 , 2 4 ’4 0 ’ 24*45’ 1 \ 2 4 ’3 5 ’ 2 4 ’3 0 ’ muJ( 25__-.:y--.. ~. --._ 112’05’ . _ ._,’ . _--._____,,---’ *. BAHIA ‘: --. .~ ,5 :’ M A G D A L E N A ,” , - . .** ’ ‘\ I kn ,_--- _ ’ ’ ’ r /f 10 ,_b, - 4 -_.- -., .> ,_-__ < ‘_ -. ,’ ,’ -_. \ ._’_’ i I’ .Lqi / QFUVAS-PEDREOOSO PEORECOSO-ROCOSO 7 Il”55 ESC:1:852,000 0 lrr*50’ 2 4 ’3 0 ’ I 2 3 2 4 ’3 5 ’ 8 Fig. 2. Batimetria y diferentes tips de sustratcs en Isla b?agdalena y Margarita 2n Gahía Magdalena Ei. C. S. 9 t... ;._:;:::...: .-:.*.._-.: ,._:: .. -:* .:.- ::.;z-;‘.>...:.:_...... p-r’ .. .: ‘: 40m. 2. ._ . : 50cm 1 cl 5Ocm T5 m. 60 m . Transecto 1 I Cuadrante L íig. 3. Método de coiecta por transecto I=_erpendicular a la cesta para cada estación de muestreo (Sáncheql988). 11 fijación. el estipe, los filoides. los receptáculos y los aerocistos. Adicionalmente se hicieron observaciones generales del alga y el tipo de sustrato en que se encontró. REPRODUCCION. Para la determinación de la época de reproducción se tomaron mensualmente, a lo largo del período de investigación. cinco ejemplares colectados al azar en cada localidad de muestreo. A cada ejemplar se le separaron cinco estructuras reproductoras (receptáculos). las cuales fueron procesadas mediante la técnica histológica para cortes en parafina (Gaviño ef al.. 1982). De cada conceptáculo se hicieron 15 cortes sagitales de 6 a 8 ,um de espesor. tiñéndose posteriormente con hematoxilina y eosina (Preece. 1965: De León, 1974). 1 Las observaciones de las laminillas se realizaron con un microscopio compuesto estándar. utilizando un ocular 10x y un objetivo 40x para anteridios y oogonios. Para las mediciones de los conceptáculos. oogonios y anteridios. se utilizó un micrómetro ocular: también se efectuó el conteo de las estructuras reproductoras, contenidas dentro de cada conceptáculo. CRECIMIENTO. Las zonas para el estudio de crecimiento se escogieron por la accesibilidad a la playa. el tipo de sustrato y la presencia de Sargassum. La primera estación (C,) se localiza entre las estaciones 1 y 2, frente a Isla Magdalena, las mediciones mensuales de las algas se efectuaron entre marzo y agosto de 1987; la segunda (C,) se localiza entre las estaciones 5 y 12 6. frente a Isla Margarita, las mediciones mensuales de las algas se efectuaron entre agosto de 1987 y febrero de 1988 (Fig. 1). Debido al deterioro que presentaron las plantas marcadas en Isla Magdalena, en el mes de agosto, por la pérdida de ramas primadas y secundarias, filoides y aerocistos. se decidió cambiar de zona para continuar el estudio de crecimiento con plantas en Isla Margarita. este se realizó de agosro de 1987 a febrero de 1988. siguiendo la misma técnica. Las plantas se marcaron empleando marcas de plástico numeradas del 1 al 100: las cuales se sujetaron con una liga al estipe de la planta, entre el disco de fijación y la primera ramificación primaria. con el fin de identificar la planta con facilidad. Mensualmente se midió su longitud total empleando una cinta métrica. Con los datos de las mediciones de los organismos marcados se calculó la talla ‘* mensual promedio, su máximo y mínimo. A partir de las tallas promedio mensuales. se calculó el crecimiento diario promedio. empleando la siguiente ecuación: c= L; - L, t Donde; C = Crecimiento promedio por día. L. = Longitud de la planta al tiempo t (mm), L, = Longitud inicial de la planta (mmj, t = Número de días entre cada par de mediciones. 13 Para determinar la variación de la tasa de crecimiento. en relación a la longitud de la planta. se correlacionó la longitud promedio de periodos de un mes. con la tasa de crecimiento de cada planta. para cada par de meses de crecimiento y se ajustaron los datos empleando el método de mínimos cuadrados. considerando solo los valores positivos. ya que la disminución en talla (valores negativos) representa pérdida de tejido por la planta. BIOMASA. Para la determinación de la biomasa. se separaron los ejemplares de Sargassum sinicola de las otras especies de algas contenidas en el cuadrante de 0.25 m2, una vez separadas fueron lavadas con agua dulce para eliminar a los organismos epibiontes y las sales! se procedió a pesarias en una balanza granataria con precisión de 0.1 g, para determinar su peso húmedo: posteriormente estas algas fueron expuestas al sol para su secado. una vez secas se obtuvo su peso seco. Los datos mensuales obtenidos en cada una de las estaciones de muestreo. se promediaron para obtener los valores medios mensuales de la biomasa de Sargassum sinkola en la localidad de estudio. DISTRIBUCION. Para ubicar la distribución vertical de esta especie, se trabajó con un cabo de nylon, con el que se midió la distancia desde la costa hasta donde finalizaba el manto de Sargassum. Posteriormente se midió la profundidad y se determinó el tipo de sustrato. 14 TEMPERATURA. Para la medición de la temperatura del agua superficial. se empleó un termómetro de cubeta con precisión de -: O.l”C. se dejó el termómetro de 3 a 5 minutos en el agua con el fin de estabilizar la columna de mercurio con la temperatura del agua. Los datos obtenidos se analizaron con el fin de conocer si existe diferencia entre los meses de muestreo a lo largo del año y entre las estaciones: además se calcularon los promedios de las temperaturas mensuales para cada una de las islas. IRRADIANCIA. La medición de la luz que penetra al agua se efectuó en una zona intermedia de los mantos con un inadiómetro marca Kahl Scientific Instrument corp Model 268 WA 310. La rutina consistió en bajar la fotocelda a profundidades de 0.1. 0.5. 1.0, 1.5 y 2.0 m y en ocasiones 2.5 y 3.0 m. dependiendo de la profundidad. En cada estación se determinó la irradiancia promedio (expresada en W/mz) en la columna de agua, suponiendo un coeficiente de atenuación constante. E(Z) = ETe-” donde: E(z) = es la irradiancia medida a la profundidad z expresado en W/mZ. E, = es la irradiancia medida arriba de la superficie del agua W/m2. k = coeficiente de atenuación de luz difusa rn-‘. = profundidad en metros. 15 NUTRIENTES. En cada estación de muestreo se determinaron mensualmente los nitritos, nitratos y fosfatos: se tomaron muestras de 250 ml de agua de mar de la superficie y del fondo a una profundidad promedio de 5 m, posteiormente las muestras fueron congeladas para su preservación y analizadas en el laboratorio mediante las técnicas espectrofotométricas descritas por Strickland y Parsons (1972). Con los resultados obtenidos. se realizó un análisis de vatíancia de cada nuttiente, para conocer si existe diferencia significativa entre los datos de superficie y fondo. Debido a que no hubo diferencias significativas entre las muestras de superficie y fondo se calculó el promedio. 16 VI. RESULTADOS DESCRIPCION MORFOLOGICA. Al inicio de su desarrollo Sargassum sinicola presentó color verde olivo, un disco de fijación, un cauloide delgado y frágil y varios filoides alrededor de este. No presentó aerocistos, ni estructuras reproductoras: conforme se desarrolló aumento su talla, empezó a formar las ramas secu,ndarias que se dispusieron en fama alterna a lo largo del cauloide, su coloración cambió a café claro. Cuando alcanzó su madurez. los ejemplares de S. sinicola presentaron una talla promedio máxima de 60 cm. un disco de fijación cónico con hápteras, un estípite con cicatrices de 2 a 5 mm de ancho. presentando un aspecto frondoso. De las ramificaciones secundarias se desprenden los filoides que tienen una nervadura central bien diferenciada. el margen es dentado. tienen una longitud de 2 a 8 cm de largo y de 2 a 9 mm de ancho, observándose numerosos aerocistos a partir de la parte media hacia el ápice. los cuales son redondos y miden de 2 a 6 mm de diámetro. Presentan receptáculos dispuestos en la porción terminal del alga que miden de 2 a 9 mm de longitud. abundantes criptostomatas en los filoides. aerocistos y receptáculos (Fig. 4). Al final de su desarrollo el alga empezó a perder estructuras. como filoides, aerocistos. receptáculos y ramas primarias y secundarias: el rizoide y el alga en general. se obscurecieron y se les adhirieron numerosos organismos epibiontes a lo largo del talo y filoides, dándole un aspecto deteriorado. perdiendo todas las partes que la componen. Los receptáculos están compuestos por una corteza y una capa de células cilíndricas con núcleos alargados. fuertemente pigmentados y varias capas de células en forma de celdas. entre estas se desarrollan los conceptáculos de forma más o menos ovalada, que 17 Filoide Receptáculo Criptostomata Aerocisto Ramificación secundaria Ramificación primaria Cauloide Estipe Disco de fijacián 0 1.5 3.0 Fic~. 4. Esquema de un ejemplar de Sdrgossum sinicda (Setche! y Gardner) mostrando sus diferentes estructuras ~xcrfolór;iczs iS2nchez,l988). 18 contienen oogonios o anteridios y parafisas. Los oogonios son de forma ovalada. se observan como una acumulación de pequeños gránulos y se disponen cerca de la pared del conceptáculo. los anteridios son fuertemente basófilos. por lo que se observan teñidos de un color más intenso que las parafisas. los anteridios son alargados y ramificados. DESCRIPCION MORFOLOGICA DE Sargassum sinicola EN ISLA MAGDALENA. En marzo de 1987 el alga presentó 9 cm de longitud en promedio, un disco de fijación. un estipe con ramificaciones primarias y filoides de corta talla. no presentó aerocistos ni reproductores, su coloración fue verde olivo. En abril aumentó su talla a 16 cm. presentando ramificaciones primarias y secundahas bien definidas. filoides alargados y aerocistos en la parte media. pero sin reproductores. su coloración varió entre verde obscuro y café claro. En junio su talla se incremento a 25 cm. se presentó con mayor número de filoides. más frondosa, se tiene presencia de aerocistos y de estructuras reproductoras en su parte media, su coloración cambió a café claro. En julio sigue incrementando su talla a 28 cm. cuenta con aerocistos, estructuras reproductoras, filoides más alargados y su aspecto es más frondoso. empezó a manifestar la presencia de organismos epibiontes como briozoarios etc.. su coloración fue café obscuro. En agosto la población empezó a declinar y a disminuir su talla a 26 cm. y se encontró en su mayoría invadida por organismos epibiontes, con una reducción considerable de aerocistos y de filoides; en esta etapa se inició el envejecimiento de las plantas, va perdiendo estructuras como filoides y ramas secundarias que se van degradando, quedando únicamente el talo completamente colonizado por el briozoario Bugula californica: se observó gran depredación de erizos (Echinometra vanbnrntr) y del opistobranquio (Aplysia californica), considerándose que estas pudieron ser algunas de las causas de la mortalidad de esta especie, en esta localidad (Fig. 5). 19 Al no poder continuar con el estudio de esta especie en esta área debido a que en agosto la mayoría de las algas murieron, se decidió cambiar de área para continuar con dicho estudio. sin embargo. se siguieron realizando observaciones en las algas que quedaron. En el mes de octubre se encontraron pocas algas con escasos filoides y aerocistos, y se encontraban colonizadas por epibiontes desde su base hasta su parte terminal. En diciembre su aspecto fue similar al mes anterior. las plantas se encontraron en mal estado con pérdida de aerocistos y estructuras reproductoras. completamente cubiertas por epibiontes, su color fue casi negro. En enero su aspecto fue de mal estado. con desprendimiento total de filoides. presencia de escasos aerocistos. su talla empezó a declinar. En febrero la talla fue menor y la planta estuvo en su mayor parte desintegrada. DESCRIPCION MORFOLOGICA DE Sargassum sinicola EN ISLA MARGARITA. En agosto de 1987 se encontró a las algas en estado juvenil con una talla promedio de 16 cm. en septiembre presentó las mismas características morfológicas, solamente había cambiando su talla a 26 cm promedio; en octubre con una talla de 28 cm estaba en etapa de madurez: en diciembre alcanzó su talla máxima de 30 cm: presentó pérdida de filoides. estaban ligeramente colonizadas por epibiontes. con disminución de aerocistos y reproductores, mantuvo un color café obscuro. En enero de 1988 se presentó una disminución en su talla a 18 cm! el alga se encontró deteriorada y completamente cubierta por epibiontes, su coloración fue casi negra. En febrero continuó su deterioro. presentó una talla de 15 cm. estuvo cubierta principalmente de briozoarios y otras algas en su mayoría de la división Rhodophyta y la coloración que presentó fue negra: en marzo las algas estuvieron en mal estado: en abril ya se encontró en su última etapa, la población empezó a declinar. 21 unas cuantas plantas estuvieron presentes. no presentó aerocistos. ni reproductores. su color fue negro y se empezó a desintegrar con facilidad; las características morfológicas fueron similares a las de Isla Magdalena. Se observó que para Isla Magdalena las primeras plántulas se presentaron en invierno y su época de madurez se alcanzó en el verano. mientras que para Isla Margarita se observó un desarrollo desfasado suponiéndose que sus primeras plántulas se presentan en el verano y su época de madurez en otoño. EPOCA DE REPRODUCCION. Con respecto a las observaciones de los cortes histológicos. para definir la época de reproducción en las Islas Magdalena y Margarita. se siguió como criterio que Sargassum sinicola alcanza la madurez cuando presenta un número reducido de oogonias (de mayor tamaño ) y un gran número de anteridios (de menor tamaño), por lo que los resultados obtenidos (Tabla 1) muestran que existe diferencia en el comportamiento de Sargassum sinicola. respecto a su época de reproducción en cada una de las dos zonas de estudio. En Isla Magdalena su época de reproducción se detectó en junio y julio de 1987, mientras que en Isla Margatita se presentó de octubre a diciembre de 1987. En el resto del año no se encontraron estructuras reproductoras o bien fueron muy escasas e inmaduras. En la figura 6 se ejemplifica el caso de Isla Magdalena: la figura 6a muestra que dentro del conceptáculo se encuentran oogonias inmaduras y parafisas (abril); en la figura 6b se obsetvan oogonias maduras, más grandes en su tamaño (junio-julio). En la figura 6c se observan anteridios inmaduros dentro del conceptáculo (abril) y en la figura 6d, se observan los antetidios maduros saliendo del conceptáculo (junio-julio). 22 Tabla 1 Resultados de las observaciones de los cortes histológicos de los receptáculos de Sargassum sinícola para definir la época de reproducción. ISLA MAGDALENA. Mar Abr Jun Jul 46.3 47.3 Ago Sep Oct Dic Ene Feb -NP -NP -NP -NP -NP -NP No. de Conceptbculos promedio/laminilla. -NP -NP No. de Anteridios promedio/conceptáculo. -NP -NP 10.8 20.5 -NP -NP -NP -NP -NP -NP Talla media de los Anteridios. -NP -NP 4.7 3.5 -NP -NP -NP -NP -NP -NP No. de Oogonios promedio/conceptáculo. -NP -NP 7.1 3.5 -NP -NP -NP -NP -NP -NP Talla media de los Oogonios. -NP -NP 16.6 22.4 -NP -NP -NP -NP -NP -NP Jun Jul Ago Sep -NP -NP -NP -NP -NP -NP -NP -NP -NP 10.4 18.5 -NP -NP I ISLA MARGARITA No. de Anteridios promedio/conceptáculo. Talla media de los Anteridios. -NP -NP -NP -NP -NP -NP 4.9 4.2 -NP -NP No. de Oogonios promedio/conceptáculo. -NP -NP -NP -NP -NP -NP 14.0 13.0 -NP -NP ~ 23.2 28.4 -NP -NP Talla media de los Oogonios. -NP l NP = No hay presencia de estructuras reproductoras. 23 24 CRECIMIENTO. Variación mensual de la longitud promedio de Sargassum sinicola en Isla Magdalena: A partir de marzo en que presentó una talla de 9 cm! se presentó un incremento de abril a julio. cuando alcanzó la talla máxima promedio de 28 cm> a partir de esta talla. empezó a disminuir a 26 cm en agosto! mes en que se detectó la presencia del briozoario Bugula californica que se mantuvo como epibionte de esta especie. El ramoneo por organismos bentónicos como erizos y opistobranquios contribuyó a que la población de algas empezara a desaparecer y morir casi por completo (Fig. 7). 1 + ISLA MAGDALES’X 1987 -c ISLA1 MARGA(1RITX 1987-88 FIG. 7. Variación de la longitud promedio de Sargassum sinicola en Isla AMagdalena e isla ~Margarita. B C. S Las barras verticales indican el error de la estimación al 95 96. 25 Tabla II Crecimiento diario promedio de Sargassum sinicola en las Islas Magdalena y Margarita, Baja California Sur. ISLA MAGDALENA. MINIMO MEDIA Marzo/Abril 17 mmldía 18 mm/día 19 mm/día AbriVJunio 26 mm/día 27 mmidía 29 mm/día Junio/Julio 4 mmidía 5 mm/día 6 mm/día Julio/Agosto -7 mmidía -4 mm/día -1 mm/día MES MAXIMO * ISLA MARGARITA. r MINIMO MEDIA MAXIMO Agosto/Septiembre 23 mmldía 25 mmldía 26 mm/día Septiembre/Octubre 2 mmfdía 5 mmldía 7 mmidía Octubre/Diciembre -2 mmidía -2.5 mmidía -3 mmidía MES DiciembreiEnero EneroiFebrero -18 mmidía -20 mmidía -22 mmidía - 9 mmidía -14 mmidía -19 mmidía 25 Variación mensual de la longitud promedio de Sargassum sínko/a en Isla Margarita: En agosto los ejemplares marcados se encontraron con una longitud promedio de 16 cm, en septiembre alcanzaron una talla de 27 cm, y su talla máxima se presentó en el mes de diciembre con 30 cm, a partir de enero se presentó una disminución de la talla de S. sinicola, registrándose una talla promedio de 19 cm, en febrero alcanzó un valor promedio de 15 cm, y las plantas empezaron a desaparecer paulatinamente (Fìg. 7). El crecimiento diario promedio, en el período de estudio se muestra en la Tabla ll. Para Isla Magdalena los máximos valores de crecimiento diario se presentaron en abtil-junio (27 mm/día) a partir de este período, disminuye su tasa de crecimiento hasta llegar a valores negativos en julio-agosto (-4 mrn/día) esto es debido a la pérdida de tejido (ramas primarias y secundarias, filoides y aerocistos) (Fig. 8). 25 20 15 k 2 10 E 5 E 5 g 0 -5 -10 -15 -20 -25 -30 MARIABR ABRIJUN JUNEJUL JUL&GO FIG. 8. Crecimiento diario promedio de Sargassum sinicola en Isla Magdalena, B.C.s. 1987 _ 88. 27 * En Isla Margarita se iniciaron las mediciones en el período agosto-septiembre cuando tenían su máxima tasa de crecimiento (25 mm/día) del cido analizado, a partir de esta fecha empieza un período de reducción en la tasa de crecimiento hasta llegar a valores negativos en octubre-diciembre (-2.5 mmidía), este proceso continuó hasta febrero, debido a la pérdida de tejido (Fig. 9). 30 25 20 G G E 15 10 E. 5 e iz g 0 W 5 -!j -10 -15 -20 -25 -30 AGO’-SEP OCf-DIC SEPJOCT DIC-ÉNE ENEfFEB FIG. 9. Crecimiento diario promedio deSargassum sinicola en Isla Margarita, B.C.S. 1987-88 CRECIMIENTO PROMEDIO EN FUNCION DE LA LONGITUD PROMEDIO DE Sargassum sinkola en ISLA MAGDALENA. En la Tabla III se presentan los valores de los coeficientes de regresión para las diferentes funciones (lineal, logarítmica, exponencial y potencial), se observa que en los 28 . Tabla Il1 Coeficientes de correlación de los análisis de regresión del crecimiento promedio en función de la longitud promedio, (-1 valores negativos. Isla Magdalena. regresión lineal regresión logarítmica mar/a br 0.20 0.20 0.15 0.15 abr/jun 0.28 0.26 0.18 0.18 jun/jul 0.22 0.21 0.25 0.23 juVag0 0.07 0.08 0.02 0.03 regresión exponencial regresión . potencial i . Isla Margarita. regresión lineal regresión loclarítmica regresión exgonencfal regresión potencial agokep 0.94 . 0.90 0.93 0.91 sep/oct 0.72 0.69 0.68 0.67 oct/dic (-1 (-1 (-1 (-1 jul/ago (-1 (-1 I-1 (-1 ene/feb (-1 (-1 (-) (-1 29 diferentes meses. el crecimiento promedio en función de la longitud promedio tiene los mejores ajustes (u=O.O5), en el período marzo a abril con la regresión lineal y logarítmica con 0.20 en ambos casos; en abril a junio con la regresión lineal de 0.28: en junio a julio. con la regresión exponencial con 0.25: en los últimos meses al aumentar la longitud promedio disminuye el crecimiento, lo cual se refleja en la presencia de valores negativos. Los valores de r fueron bajos en todos los casos, lo que significa que se encontró muy poca relación; entre la tasa de crecimiento y la longitud promedio y que no se ajusta a alguno de los modelos propuestos. CRECIMIENTO PROMEDIO EN FUNCION DE LA LONGITUD PROMEDIO DE Sargassum sinicola en ISLA MARGARITA. En la Tabla III se presentan los valores de los coeficientes de regresión para las diferentes funciones (lineal, logarítmica. exponencial y potencial), en ella se observa que en los diferentes meses. el crecimiento promedio en función a la longitud promedio tiene los mejores ajustes: en los meses de agosto a septiembre y septiembre a octubre. con la regresión lineal de 0.94 y 0.72 respectivamente. en ambos meses se observa que al aumentar la longitud, aumenta el crecimiento diario promedio de manera directamente proporcional. BIOMASA. La biomasa mensual promedio en Isla Magdalena. presentó los mayores valores en junio (primavera) con un peso húmedo de 2250 g/O.25 m2 ó 9000 g/m2 , las menores biomasas en agosto (verano) con 250 g/0.25mz 8 1000g/m2. De septiembre a enero hay poca 30 variación en el valor de biomasa 800 910.25 m2 ó 3200 g/nY: se observa un incremento en el mes de febrero de 1500 g/0.25m2 ó 6000 gim2. Es importante mencionar que en la estación en que se hizo el estudio de crecimiento (Cl) a partir de septiembre no se tienen resultados de biomasa, sin embargo en las diferentes estaciones de muestreo se encontraron mantos pequeños de Sargassum sinicola en mal estado (Fig. 10). 2500 1 000 300 - PESO HLXIEDO -+ PESO SECO FIG. 10. Variación mensual de la biomasa promedio de Sargassum sinicola en Isla lMagdalen+ B.C.S. 1987-88. En Isla Margarita, la mayor biomasa se presentó en el mes de octubre (otoño) con un peso húmedo de 1700 g/0.25m2 ó 6800 g/m2, los menores valores de biomasa se presentaron en marzo (invierno) con 200 gjO.25 m2 ó 800 g/m2. En el mes de abril no fue posible realizar el muestreo por las condiciones climatológicas que se presentaron en esta zona (Fig. ll). 31 2500 2000 - PESO HUMEDO _+ PESO SECO FIG. ll. Variación mensual de la biomasa promedio de Sargassum sinicola en Isla Marga&+ B.C.S. 1987 - 88. DISTRIBUCION. La distribución vertical que presenta Sargassum sínicola en la bahía, varía en las diferentes áreas y épocas del año, observándose lo siguiente: Para Isla Magdalena, en la estación 1 la distribución de esta especie se presentó de los 15 m a los 45 m de distancia de la costa, a una profundidad mínima de 0.5 m y máxima de 4 m, estuvo presente casi a lo largo de todo el año. Su más amplia distribución se presentó en el mes de julio (verano) y su mínima en el mes de diciembre (invierno) (Fig. 12a). En la estación 2 la distribución que se presentó fue de 10 m de distancia de la costa hasta los 45 m a una profundidad mínima de 1 m y máxima de 4.5 m. Se encontró casi a lo 32 10 1 0 MARABR~.UAGOSEP~D!CEKFEB a).- Estación 1 50 E 1 40! T $0 - i LS n2o10 i 1 ; - 0 f MAR ABR JJN JI AG0 SEP CCT OK: ENE FEB b).- Estación 2 50 - T T 1 1i i i -@- i iSO- i z n2o- d 10 - MAR ABR ..UJN .M_ AG0 SEP OCT IX ENE FEB c).- ?&&ación 3 Fig. 12. Vasiación mensual de la distribución vertical de Sargassum sinicola en las estaciones 1, 2 y 3., Los puntos en la gráfica indican la presencia de la especie (Isla Magdalena, B.C.S.). 33 largo de todo el año, su más amplia distribución se presentó en el mes julio (verano) y su mínima en el mes de diciembre (invierno), (Fig. 12b). En la estación 3 la distribución se presentó de los 15 hasta los 55 m de distancia de la costa y a una profundidad de 0.5 a 4 m, estuvo presente casi a lo largo de todo el año, su más amplia distribución se observó en el mes de julio (verano) y su mínima en el mes de diciembre (invierno), (Fig.12~). Para Isla Margarita la distribución en la estación 4 fue de 20 a 45 m de distancia de la costa y a una profundidad de 0.4 a 2.8 m, estuvo presente en los meses de julio hasta febrero, su más amplia distribución fue en los meses de septiembre y octubre (otoño) y su mínima en los meses de marzo, abril y junio (primavera) (Fig.13a). En la estación 5 la distribución se encontró entre 15 y 50 m de distancia de la costa a una profundidad de 0.5 a 3.5 m, estuvo presente casi todo el año; su más amplia distribución fue en el mes de diciembre (invierno) y su mínima se presentó en el mes de abril (primavera), (Fig. 13b). En la estación 6 la distribución que presentó es de los 20 a 60 m de distancia de la costa y a una profundidad de 0.4 a 3.2 m, estuvo presente casi todo el año; su más amplia distribución se presentó en el mes de agosto (verano) y su mínima en el mes de abril (primavera), (Fig. 13~). El alga café Sagassum sinícola se distribuye en Bahía Magdalena en toda la zona rocosa y pedregosa de las islas que Iímitan la bahía, dominando en la zona infralitoral. En general la distribución de esta especie comprende de los 10 m a los 55 m de distancia de la línea de costa, a una profundidad mínima de 0.5 m y máxima de 4.5 m, esta presente casi a lo largo de todo el año, pero su abundancia varía en relación a la profundidad. En Isla Magdalena, la mayor abundancia se presenta a una distancia de 15 a 55 m de la costa, a 34 oc MARABRJUNJUAGOSEF’OCTMCENRB a).- Estación 4 MAR ABR JUN JJ_ AG0 SEF OCT SC M FEB b).- Estacidn 5 ll: MAR ABR JUN JJL AG0 SEP OCT CC EK FEB c)_- EStaci6n 6 Fig. 13. Variación mensual de la distribución vertical de Sargassum sinicofa en las estaciones 4, 5 y 6. LOS puntos en la gráfica indican la presencia de la especie (Isla Margarita, B.C.S.). 35 una profundidad de 0.5 a 4.5 m, que es también donde Sargassum sinicola alcanza su talla máxima. Su más amplia distribución se presenta en el verano. Con respecto a Isla Margarita, presenta su mayor abundancia a una distancia de 15 a 60 m de la costa, a una profundidad de 0.5 a 3.5 m, donde alcanza sus mayores tallas. en comparación con las que se encuentran a una distancia más cerca de la costa y a menor profundidad. S. sinicola alcanza su máxima distribución en el otoño y a principios de invierno. MACROALGAS ACOMPAÑANTES Y EPIFITAS de Sargassum sinicola EN LAS ISLAS MAGDALENA Y MARGARITA EN BAHIA MAGDALENA, B.C.S. ALGAS ACOMPAÑANTES. Se ha denominado algas acompañantes a aquellas que crecen alrededor de Sargassum sinicola: en los datos obtenidos se observa que son 50 especies de algas acompañantes 36 de las cuales pertenecen de la división Rhodophyta, principalmente especies de las familias: Ceramiaceae, Rhodomelaceae. Corallinaceae. Gracilariaceae e Hypneaceae; algunas de ellas se encuentran durante todo el año. predominan en el verano e invierno. Estas familias se localizaron con mayor frecuencia en Isla Magdalena que en Isla Margarita. De la división Phaeophyta se tienen ocho especies acompañantes pertenecientes a las familias Scytociphonaceae, Dictyotaceae y Alatiaceae. estas estuvieron presentes en las Islas Magdalena y Margarita y se encontraron con más frecuencia en verano e invierno. De la división Chlorophyta se presentaron seis especies acompañantes de las familias Codiaceae y Caulerpaceae. siendo estas las más conspicuas; la mayoría estuvo presente en Isla Margarita, encontrándose principalmente en el verano e invierno. La mayoría de estas algas se colectaron sobre rocas, guijarros y conchas (Tabla IV). 36 Tabla IV Distribución estacional de las macroalgas (Al acompañantes y (E) epífitas, de Sargassum sinicola en Isla Magdalena e Isla Margarita, B.C.S. i: -* Pimavara RHODOPHYTA Verano Acom Epif. 1. Mag. I. Mar Mar Abr Jun Inviarno otoño Jul Ago Sep Oc’ Dic E n e F e b FA MILIA CHAETANGIACEAE Scinaria johnnstoniae X A X BONNEMAISONIACEA E E Falkenbergia hillebrandk’ X X X GELIDACEA E Gelidium rob us tum A X Amphiroa brevanceps A X A. dimorpha A X A. valonioides A A. beauvoisii A x A. vanbossea A X Corallina frondescens A X C. officinalis v. chilensis A x C. vancouvensis A X X CORALLINACEAE E x E X Jania adherens E x Lithoph yllum lichenare E X A Tenarea dispar X X x x x x x. X X X’ x x x x x x x x x X x X Pheoph ylum nicholsii Lithothrix aspergillum X X X X X x x xxx xxx x x x x x x X X E x X X X X X X CR YPTONEMIA CEA E Prionitis cornea A X P. filifornis A x x X H YPNEA CEA E Hypnea johnstonii A E H. spinella A E H. valentiae A E X X X X X 37 X x xx x x x x Tabla IV Distribución estacional de las macroalgas (A) acompañantes y (E) epífitas, de Sargassum sinicola en Isla Magdalena e Isla Margarita, B.C.S. PL OCAMIACEAE Plocamium violoaceum IA I GRACILARIACEAE I Gracilaria pach ydermetica l I subsecundata XIX 1 IA I l I I . I l 1 Invierno A E X Gracilariophila gardneri A X 1 I I l I I I I I-I--I-~-dxl I I I4+I I I l l I I I IXI X X x X , 1 X A x /IIlIIIIIIlI~ I Gigartina canaliculata l I X A I I X G. turgida GIGARTINACEAE I XIXI A G. spinigera G. 1 Oto?¡0 1 Verano Acom Epif. 1. Mag. 1. Mar Mar Abr Jun Jul Ago Sep Oct Dic Ene Feb RHODOPHYTA I 1 Pimavera I I I X CHA MPIA CEA E 1 Cbampk parvula I IEIXIXIXI l I IXI IXIX IXIX I CERA MIA CEA E Gastroclonium parvum I Lomentaria baile yana Antithamnonella breviramosa A X E l x x 1444 x I I x I I I IXI Callithamniom cordatum E X C. paschale E X C. ramossissimum E X Centroceras cla vula tum E x E X C. caudatum E X X C. camouii E X X C. equisetoides E C. fleccidum E C. sinicola E X E X X X x Ceramium affine X X IXI X X X 1 X X x X x x x X x X I C. zacae A x Crouank attenuata E X Griffithsia furcellata E X X X X X x x x x x X X 38 X x X Tabla IV Distribución estacional de las macroalgas (A) acompafiantes y (E) epífitas, de Sargassum sinicola en Isla Magdalena e Isla Margarita, B.6.S. _ Pimavara RHODOPHYTA Oto60 Varan0 lnviamo Acorn Epif. 1. Mag. 1. Mar Mar Abr Jun Jul Ago Sep Oct Dic Ene Feb Anothrlchlum tenue E X X Pleonosporium rhi”*deum E X X E X TTffannielle sn yderiae E X T. saccorhka E x E X A Spyride filamentosa DELESSE’CEAE x x X x X X X . Acrosorium unclnatum ErYduoglossum californicum A-E Taenioma perpusiWm X X E X E X X X DASYACEA E Das ya bailloviana A D. sinicola v. sinicola A X X X X X x x RHODOMELACEAE Htypostphonia tenella E H. verdcillata E - x . X X X X X x Laurencia p a c i f i c a ,._ A X X L. papillosa v. pacifica A X X X L. sinicola A X X x Polysiphonia bajacali E P. johnstonii v. johnstonls E X X P. johnstonii v. concinna E X X P. mollis E X P. scopolorum v. viTlum E X X P. simplex A E TOTAL 36 43 X x x x x x x x x x x X x x x x X X X X X X X X X X 39 Tabla IV Distribución estacional de las macroalgas (A) acompañantes y (E) epífitas, de Sargassum sinico/a en Isla Magdalena e Isla Margarita, B.C.S. Verano ototio Invierno I PHAEOPHYTA FA MILLA . ECTOCARPACBIE Ectocatpw gonodiodes E E. panws E X X X X CORYNOPHLAEACEAE Hincksia mitchelt7ae E Leathesia diffomis E X L. nana E X X X X X X \R SCY-TOS/pHoNA CEA E Colpomenia sinuosa A X X C. tuberctdata A X Hydroclathrus clathratus A X X A X x x xx X X .x x x * x DICTYOTACEA E Dictyota fiabeliata E D. dichotoma X Dicryop ten’s undula ta A X Padina durvillaei A X X x X X X X X X X X X SPHACELARIACAE Sphacehwia furcigera A E X X X X ALARIACEAE E7senia arborea A X X 40 Tabla IV Distribución estacional de las macroalgas (A) acompañantes y (E) epífitas, de Sargassum shicola en Isla Magdalena e Isla Margarita, B.C.S. Pimavera CHLOROPHYTA Verano otono Invierno Acom Epif. 1. Mag. 1. Mar Mar Abr Jun Jul Agc Sep Oct Dic Ene Feb FAMILIA ULVACEAE E Ufva lactuca Entefomotpba compressa CLADOPHORACEAE X X x A X X A X X x X . Cladophora coiumbiana C. graminea E C. microc/edioides E X E X x X X BRYOPSIDACEAE Bryopsis h ypnoides X X X xx x CODIACEA E Hallimeda discoidea A X Codium cuneatum A X X X x x x x DERBESIA CEA E E Derbesia proMica X X CAULERPACEAE Caulerpe sertujarioides A C. vambossea A TOTAL I 6 X X X 15 I 41 x x x x X X x ALGAS EPíFITAS. Las algas epífitas son aquellas que crecen sobre alguna planta en este caso sobre Sargassum sinicola. Se encontraron 55 especies epífitas, 43 de las cuales pertenecen a la división Rhodophyta, encontrándose que las familias Corallinaceae, Ceramiaceae, Champiaceae y Dasyaceae fueron las que presentaron el mayor número de especies epífitas, se localizaron tanto en Isla Magdalena como en Isla Margarita presentándose con mayor frecuencia en verano e invierno. De la división Phaeophyta se encontraron siete especies epífitas, las cuales pertenecen a las familias Ectocarpaceae, Corynophlaeaceae, Dictyotaceae y Sphacelariaceae; se localizaron en las Islas Magdalena y Margarita y están presentes en forma conspicua en el verano e invierno. La división Chlorophyta presentó cinco especies epífitas de las familias Ulvaceae, Cladophoraceae, Btyopsidaceae y Derbesiaceae se localizaron tanto en Isla Magdalena como en Isla Margarita y sus representantes se encontraron en forma muy conspicua en el verano e invierno. Algunas de las algas encontradas como epífitas de Sargassum sinicola, se encontraron también sobre otras algas y viviendo en forma independiente sobre diferentes substratos (Tabla IV). En la Tabla V se observa que la mayor abundancia de especies se presentó en Isla Magdalena en enero y junio, en Isla Margarita en enero y agosto, mientras que el menor número de especies en ambas islas se presentó en abril. La diversidad es similar en ambas islas ya que se presentan en Isla Margatita un total de 67 especies y en Isla Magdalena un total de 66 especies. Se identificaron un total de 94 especies y seis variedades diferentes de algas compartiendo la misma zona cercana a Saqassum; 69 especies y seis vatiedades corresponden a la división Rhodophyta que es la mejor representada, la mayoría de las cuales se pueden ubicar en la categoría de las epífitas, le siguen Phaeophyta con 14 especies y Chlorophyta con Il especies. 42 . Tabla V Número de especies de algas presentes en cada mes en Isla Magdalena e Isla Margarita, B.C.S. NUMERO DE ESPECIES POR MES. , Abr Jun ISLA MAGDALENA 8 6 30 18 21 13 15 14 30 17 ISLA 4 24 19 25 12 13 20 38 20 Mar MARGARITA 6 Jul Ago Sep Oct Dic Ene Feb 4 Tabla VI Número de especies de algas presentes en cada estación del año, en Isla Magdalena e Isla Margarita, B.C.S. PRIMAVERA VERANO OTOÑO INVIERNO ISLA MAGDALENA 39 33 30 41 ISLA MARGARITA 29 36 24 55 43 En la tabla VI se observa el número de especies de algas presentes en cada estación del año para cada una de las islas. Tanto en Isla Magdalena como Isla Margarita el mayor número de especies se presentó en invierno y el menor en otoño. Las algas más conspicuas fueron: Rhodophyta; Amphyroa dmuefii, Corallina fmndensces, Jania adhaerens, tfypnea valentiae, Gracilatia pachydermatica, Champia parvula, Centroceras clavulatum, Chondria califomíca, Lautencia pacifica, Laurencia sinicola y Polisiphonia johnsfonii, Phaeophyta; Colpomenia sinuosa, ffydroclafhnrs clathrãtus, Dictyota flabellata, Padina durvillae y Eisenia arborea. Chlorophyta; Uva lactuca, Bryopsis hypnoides, Codium cuneafum, Caulerpa vanbossea. La división Rhodophyta presentó el mayor número de especies que se encuentran asociadas a Sagassum sinkola. FACTORES AMBIENTALES. TEMPERATURA. La temperatura del agua de mar superficial en ambas islas tienen el mismo comportamiento estacional, en general las temperaturas más bajas ocurren en elinviemoprimavera y las mayores durante el verano-otoño. Sin embargo, considerando el valor promedio, durante el mes de junio las temperaturas llegaron a ser inferiores a las de invierno probablemente debido al transporte de agua profunda hacia la superficie por eventos de surgencia. 44 En Isla Magdalena en junio se registró un valor de 18.O”C, en julio, agosto y septiembre se presentaron las más altas temperaturas alcanzando 28.0% en el último mes. En octubre presentó 26.5%; en enero, febrero, marzo y abril las temperaturas se encontraron entre 19.5% y 2OS”C (Fig. 14). . 29 28 27 26 25 24 c 23 22 21 20 19 18 17 16 + ISLA MAGDALENA e ISLA MARGARITA FIG. 14. Variación mensual de la temperatura promedio de el agua superficial en Bahía Magadalena, B.C.S. 1987 - 88. La temperatura promedio del agua de mar superficial, registrada en Isla Margarita en junio fue de 18S”C, esta se incrementa en julio y agosto. En septiembre, se registraron las más altas temperaturas, alcanzando 29.O”C; en octubre 26.8X, en diciembre 22.5% y de enero a abril las temperaturas se encontraron entre 19.6% y 21.3X (Fig. 14). La mayor diferencia encontrada en cuanto a temperatura entre una isla y la otra fué en el mes de julio; Isla Magdalena presentó temperaturas de í9.5%, e Isla Marganta de 45 23.5%. Pero en general el comportamiento de las cuwas de temperatura a lo largo del año es similar en ambas islas. En relación a la temperatura del agua de mar superficial registrada en la bahía, se observa que en general, a lo largo del año, cerca de la boca existe una diferencia de 5°C mayor en Isla Margarita con respecto a Isla Magdalena. En general en todos los meses muestreados son mayores las temperaturas del agua de mar superficial en Isla Margarita que en Isla Magdalenå con una diferencia de 1°C a 4”C, se considera que esto se debe a que en Isla Magdalena existen profundidades mayores y asi mismo condiciones de surgencias que se prolongan por varios meses En Isla Magdalena la temperatura del agua de mar superficial en la estación de la boca es de 0.7% menor en promedio que el resto de las estaciones de la misma isla. También en Isla Margarita la temperatura promedio de la estación de la boca es de 0.6% menor que en las estaciones más alejadas de la boca, lo que refleja la influencia de masas de agua más oceánicas. IRRADIANCIA. En Isla Magdalena, las mayores intensidades de luz se registraron en abril para la estación 1 (60.90 W/nV), mientras que para la estación 2 (70.20 W/nY) en marzo y en julio para la estación 3 (60.70). Los valores mínimos se presentaron en enero y febrero para la estación 1 y 2 (20.60 W/m2 y 20.50 W/n?) y en octubre para la estación 3 (20.30 W/n?) (Fig. 15). En las mediciones de irradiancia efectuadas en Isla Margarita se encontró que en la estación 4, los máximos valores de intensidad luminosa se presentaron en julio, enero y febrero con un valor de 50.50 W/mZ, y en diciembre se presentó el valor mínimo de 30.60 46 * W/mZ. En las estaciones 5 y 6 , el valor máximo se presentó en enero de 80.40 Wh? y 70.80 W/rrF respectivamente, en junio se registró el valor mínimo de 40.00 W/m2 para la primera y en octubre con 40.20 W/m2 para la segunda. 100 90 80 ‘70 - - - 60 g 50 40 30 20 10 0 FIG. 15 _ Variación mensual de la irradiancia promedio y su desviación estándar en Isla Magdalena, B.C.S. 1987 - 88. La incidencia luminosa promedio en Isla Magdalena presentó sus máximos valores en abril (60.50 W/mz), cuando la temperatura del agua superficial del mar es baja (19ST), presentó concentraciones altas de nutrientes, principalmente de nitratos, su mínimo se . presentó en febrero (20.80 W/mz), con una temperatura del agua superficial del mar de (?8S”C) y la concentración de los nutrientes fueron mínimos para nitritos y fosfatos presentando su máximo los nitratos. En Isla Margarita se observa que los mayores valores de incidencia luminosa se presentan en el mes de enero (70.00 W/rrP), cuando la temperatura 47 del agua superficial se encuentra a 19S”C, en relación con los nutrientes las concentraciones son bajas; el mínimo valor de incidencia luminosa se presentó en junio (30.50 W/nY) cuando la temperatura superficial del agua de mar es de 18S”C y la concentración de los nutrientes son altos para fosfatos y son menores en nitritos y nitratos (Fig. 16). 100 90 . 80 70 n 2 L 60 50 40 30 20 10 0 MhR AkR Jlh’ Jh Am Sl?P OtT Dk ElbE FJ?B FIG. 16. Variación mensual de la irradiancia promedio y su desviación estándar en Isla Margarita, B.C.S. 1987 - 88. Se observaron diferencias entre estaciones en cada isla, en las estaciones que se encuentran cerca de la boca es menor la incidencia luminosa con respecto a las otras estaciones. 48 NUTRIENTES. Los nitritos, nitratos y fosfatos en Bahía Magdalena se determinaron en superficie y fondo (5 m en promedio). Los valores encontrados fueron semejantes, por lo que para definir si existía diferencia entre ellos se hizo un análisis de variancia. Como no se encontró diferencia significativa entre estos valores ((r=O.O5%), en las diferentes estaciones de muestreo a lo largo del año, se decidió trabajar con los promedios de superficie y de fondo de cada mes, para cada estación de muestreo en diferentes épocas del año. En otro análisis de variancia se compararon las diferentes estaciones de muestreo para cada una de las islas encontrando que estas últimas, no son iguales entre si, por lo tanto se decidió agrupar, las estaciones 1, 2 y 3 de Isla Magdalena separadamente de las estaciones 4, 5 y 6 en Isla Margarita, con la finalidad de explicar su comportamiento de acuerdo con las características de la dinámica de las comentes y su situación geográfica. 4.5 4 3.5 3 m I” 2.5 . *NITFuTos + NITR4TOS + FOSFATOS FIG. 17. Variación mensual promedio de los ntientes en Isla Magdalena, B.C.S. 1987 - 88. 49 En las figuras 17 y 18, se presenta la variación de la concentración de nitritos (NO*) en las islas Magdalena y Margarita a lo largo del año. En Isla Magdalena en los meses de marzo a julio los valores oscilaron alrededor de 0.4 pg affl y en Isla Margarita de 0.3 pg affl. En agosto en ambas islas alcanza sus máximas concentraciones; 1.0 pg affl en Isla Magdalena y 1.5 l.Jg affl en Isla Margarita. De septiembre a febrero en ambas islas se observa una tendencia a disminuir oscilando las concentraciones entre los 0.2 y 0.4 pg affl. 5 ? 4.5 4 3.5 3 2 2 2.5 2 1.5 1 0.5 0 ? NITRITOS + NITRATOS 6 FOSFATOS FIG. 18. Variación mensual promedio de los nutrientes en Isla Margarita, B.C.S. 1987 - 88. En las figuras 17 y 18 se presenta la variación de la concentración de los nitratos . (NO& en Isla Magdalena la concentración máxima de 4.2 pg affl, se presentó en abril a partir de este hay una disminución hasta alcanzar el valor mínimo en agosto de 1.0 pg affl, los valores se vuelven a incrementar en octubre, diciembre y febrero. En Isla Margarita de abril a agosto en que alcanza un valor mínimo 1.1 pg affl se presentó una ligera disminución en la 50 agosto en que alcanza un valor mínimo 1.1 pg affl se presentó una ligera disminución en la concentración de los nutrientes, a partir de este punto se incrementó hasta diciembre 2.7 pg affl y alcanza su valor máximo en febrero 4.5 pg affl. Es notorio que en Isla Magdalena de abril a julio presentó un período de concentraciones altas de 3.8-4.2 pg affl y por el contrario en Isla Margarita son menores 1 .l1.4 pg affl. En las figuras í7 y 18, se presentan las concentraciones de fosfatos (PO,) a lo largo del año para las Islas Magdalena y Margarita. En ambas Islas, los fosfatos se incrementaron de marzo a junio, mes en que se alcanzan las máximas concentraciones, de 1.7 pg at/l en Isla Magdalena y de 1.1 pg affl en Isla Margatita. En esta última Isla, se observa una tendencia general de disminución hasta alcanzar el valor mínimo en enero, mientras que en , Isla Magdalena, la concentración disminuye en septiembre y presenta un ligero incremento de octubre a enero. Los resultados indican que en general, hay mayor concentración de nutrientes (NO*, NO3 y PO,) en la zona de Isla Magdalena en comparación con Isla Margarita, aunque esto no se presenta en todos los meses. 51 VII. DISCUSION DESCRIPCION MORFOLOGICA. Se encontró semejanza en las estructuras y cambios morfológicos que presentó Sargassum sinicola con las descripciones de Setchell y Gardner (1924), Dawson (1944), Nonis (1975), Mc Court (1984), Rodríguez (1985), Rocha-Ramírez y Siqueiros-Beitrones (1990) y Núñez-López (1993) para la misma especie; asimismo se presentaron las mismas características morfológicas para esta especie en cada una de las Islas estudiadas. La población de Isla Margarita presentó un retraso en su desarrollo con respecto a Isla Magdalena de aproximadamente cuatro meses, lo cual se puede deber a las diferencias en el comportamiento de los parámetros ambientales en cada zona, que influyen en el desarrollo de la especie. Es común encontrar que el desarrollo de las plantas de Sargassum de un mismo lugar puede ser diferente e incluso trabajando con la misma especie (De Ruyter y Breeman, 1987; Espinoza, 1990; Glenn et al., 1990; Muñetón, 1987, 1989). Esto también esta descrito por Espinoza y Rodríguez (1989) para Sargassum sinkola, en Bahía de La Paz y por Mc Court (1983) para Puerto Peñasco. Núñez-López (1993), en Bahía Concepción B.C.S., identificó un desarrollo desfasado en las plantas de Sargassum sinicola de las diferentes localidades de la bahía (boca, media - y fondo), menciona que las plantas del sur crecen y se desarrollan más rápido y que el desarrollo de Sargassum sigue un gradiente sur-norte a lo largo de la costa occidental de la bahía. 52 Algunos autores como Mc Court (1984), Espinoza y Rodríguez (1989)mencionan que las temperaturas más bajas (18°C - 20°C) favorecen el reclutamiento y desarrollo de Sargassum sinicola, por lo que en Isla Magdalena donde la temperatura es ligeramente más baja (abril-junio) se pueden presentar mejores condiciones para el desarrollo de la especie más temprano en el año, también los valores de nutrientes (nitritos, nitratos y fosfatos) en general son más altos en los primeros meses del año en Isla Magdalena. Asimismo, se presentan condiciones de surgencias en los primeros meses del año (Alvarez-Borrego et al., 1975). Lynn (1987) menciona que la variación estacional de los vientos en la costa oeste de Baja California, tiene un efecto notable sobre las surgencias, ya que estas son más fuertes en los meses de abril y mayo, presentándose el mayor efecto en Isla Magdalena, lo cual puede favorecer el desarrollo más rápido de las algas en esta isla. En cuanto a la irradiancia, se observa que en Isla Magdalena, en los primeros meses alcanza sus mayores valores (60.50 Whr?), lo cual también pudiera ser favorable para desarrollo temprano de las algas en esta isla. Además, la zona de Isla Magdalena esta poco protegida y expuesta a un mayor oleaje a diferencia de Isla Margarita en donde Sargassum sinkola crece en zonas intermareales y agua relativamente protegidas. La radiación solar es considerada como uno de los factores ecológicos más importante en el ambiente marino (Santelices, 1977). La energía luminosa controla las cantidades de materia orgánica sintetizadas y por lo tanto, el metabolismo de las plantas. Un efecto de la radiación solar es el calentamiento diferencial del océano lo cuál controla la distribución de las plantas y tiene un efecto directo sobre todos los procesos metabólicos. . Además, las variaciones en calidad y en cantidad de luz tienen variados efectos sobre las algas bentónicas. Hellebust citado por Santelices (1977) presenta un análisis completo de los efectos de la luz sobre las plantas. Divide los efectos en funcionales y estructurales; los funcionales son tolerancia, actividad metabólica, reproducción y distribución, las respuestas 53 estructurales de las algas a la luz comprenden cambios en tamaño y diferencias morfológicas. Tanto para Isla Magdalena como para Isla Margaeta, se puede suponer que la incidencia luminosa no fue un factor limitante para el desarrollo de Sagassum, ya que estos valores 70.00 W/nY a 30.50 W/mZ, caen en el intervalo de 350-700 nm = 50.00 W/mZ como límites característicos para las algas, y además se encontró que para las Islas Magdalena y Margarita, a una profundidad de cinco metros se presenta una atenuación de luz del 30% a 60% . Con estos porcentajes puede llevar a cabo su ciclo de vida; sin embargo, se considera que las diferencias entre las islas pueden ser uno de los factores que influyen en las diferentes épocas de desarrollo de Sargassum sinkola en Bahía Magdalena. REPRODUCCION. Sargassum sinicola, pertenece al único orden (Fucales) dentro de las algas cafés que no presenta alternancia de generaciones (Chapman, 1973), su reproducción es gamética y externa. Los sexos pueden encontrarse en la misma planta o por separado, Norris (1975), observó que los receptáculos productores de anteridios son largos y delgados, mientras que los de los oogonios son más cortos y gruesos. Sin embargo, Dawson (1944), observo que estas características son difíciles de separar debido a la variabilidad morfológica de los receptáculos que se produce a través de una simple generación diploide. Cada oogonia produce una ovocélula, mientras que los anteridios producen un número determinado de - anterozoides biagelados de forma piriforme (Nomis y Aken, 1985). En este trabajo se confirma lo mencionado por los autores antes señalados, solo se presentó la generación gametofitica en su ciclo de vida, predominaron las formas dioicas, solo en algunos casos se encontraron anteridios y oogonios en la misma planta y asimismo se coincide con Nonis 54 (1975) en que los receptáculos que contienen oogonios son más cortos y gruesos mientras que los que contienen anteridios son mas largos y delgados. El desfasamiento de cuatro meses encontrado en cuanto a la época de reproducción corresponde con el desfasamiento de cuatro meses en el desarrollo que presentaron las plantas entre ambas islas. La época de reproducción en Isla Magdalena se asemeja a lo informado por McCourt (1984), quién encontró que la época reproductiva de S. sínicola en el Golfo de California se presenta a principios del verano; Espinoza y Rodríguez (1987), quienes estudiaron la misma especie en la Bahía de La Paz, B.C.S., encontraron que durante su segundo año de estudio, la época de reproducción se presentó en el verano. La influencia de la temperatura, se refleja en el comportamiento de esta especie de Sargassum, ya que los períodos de máxima reproducción ocurrieron cuando la temperatura del agua de mar estaba aumentando en Isla Magdalena (18 a 19S”C) en junio y julio, mientras que iba disminuyendo en Isla Margarita ( 26.8 a 22S”C) en octubre a diciembre, en ambos casos corresponden con los pen’odos en que no se presentaron altas temperaturas. Los procesos de fotosíntesis, respiración, crecimiento (incluyendo la geminación de la espora) y reproducción son afectados por la temperatura. De todos los factores físicos la temperatura es el dominante, ya que detemina la distribución geográfica de las plantas marinas. La mayoría de los trabajos coinciden en reconocer a este factor como el principal que influye sobre el desarrollo de Sargassum y de las algas en general. L Espinoza y Rodríguez (1987) sugirieron a la luz como a la variable que provoca las diferencias en longitud, en el ciclo y esfuerzo reproductivo de Sargassum sínícola en la Bahía , de La Paz. Rodríguez (1985), encontró en la Bahía de La Paz que los mayores valores de incidencia de luz se presentaron en los meses de marzo a abril, mientras que el valor mínimo se presentó en el mes de agosto, si estos resultados se comparan con los de Bahía 55 Magdalena, coincide únicamente con los encontrados en Isla Magdalena donde también en abril se presentaron los mayores valores. El Sargassum presenta su mayor tasa de crecimiento antes de alcanzar su talla máxima y cuando esta última ocurre, se detecta la mayor cantidad de receptáculos, esto coincide con lo informado por Espinoza y Rodríguez, (1985; 1989) y Espinoza, (1990) para Sargassum sinkola y por Chauhan y Krishnamurthy, (1965); De Wreede, (1976); Mc Court, (1984) para otras especies del género Sargassum. CRECIMIENTO. En Isla Magdalena se observa que durante los primeros meses de desarrollo de las algas se presenta una tendencia a tener una mayor tasa de crecimiento conforme aumenta su longitud. Los coeficientes de correlación obtenidos al relacionar la longitud con la tasa de crecimiento son bajos y existe una amplia variabilidad en los valores obtenidos. Pero en general, los mayores valores de correlación fueron con la regresión lineal, con una tendencia a incrementar la tasa de crecimiento, al aumentar la longitud, en los meses de marzo a junio. A partir del mes de julio esta tendencia cambia de manera inversa, lo que indica que las algas al llegar a una edad determinada, crecen de manera más lenta que las más jóvenes, en este caso los coeficientes de correlación son aún más bajos, ya que además se suma el efecto de la pérdida de tejido en las porciones apicales de las ramificaciones. En el caso de Isla Margarita, a medida que aumenta la tasa de crecimiento de las . plantas aumenta la longitud, esto es más claro durante los primeros meses donde se obtuvo el coeficiente de correlación más alto (r=O.94) para una regresión lineal. Los valores negativos encontrados en las correlaciones son el reflejo del deterioro que presentan las plantas y la pérdida de tejido. Las mayores tasas de crecimiento en Isla Magdalena se 56 presentaron durante (abril a junio) y en Isla Marganta, en agosto a septiembre, cuando la temperatura superficial del agua de mar se encontró entre 275°C y 29.O”C. Para S. sinicola, Rodríguez (1985) menciona que para la Bahía de la Paz, la máxima talla la alcanzó en abril de 63 cm, para el siguiente año en el mismo mes presenta sus tallas máximas de 51 cm, desaparece en septiembre y el crecimiento máximo fue 12 mmidía. Los resultados presentados muestran que casi no existe diferencia en la tasa de crecimiento y talla de Sagassum sinkola en ambas zonas de estudio. En el caso de Isla Magdalena se presentó la mayor tasa de crecimiento de 27 mmidía en abril-junio; mientras que en Isla Margarita fue de 25 mrn/día en agosto-septiembre. La talla máxima fue ligeramente mayor en Isla Margarita (30 cm), respecto a Isla Magdalena (28 cm). Es probable que en Isla Magdalena su crecimiento empiece en enero y finalice en agosto; mientras que en Isla Margarita se presentó una generación que inicia su crecimiento probablemente a partir de junio y finalizó en el mes de febrero. Espínoza y Rodríguez (1989), encuentran para Sargassum sinicola en la Bahía de La Paz una tasa de crecimiento mucho menor (5 mrnidía), Muñetón y Hernández (1993), observaron una tasa máxima de crecimiento en Sargassum hohidum (considerada en sinonimia con Sagassum sinicola Norris, 1975) más alta (9.8 mmldía), esto indica que en Bahía Magdalena se presentan mayores tasas de crecimiento. La talla máxima de Sargassum sinicola en Isla Magdalena fue de 28 cm en julio y para Isla Margarita de 30 cm en diciembre, mientras que la talla máxima encontrada por Espínoza y Rodríguez (1989) fue de 45 cm en los meses de marzo a abril en la Bahía de La . Paz. Núñez-López (1993) encontró tallas promedio de 233.5 cm en primavera en Bahía Concepción. Muñetón y Hernández (1993), para Sargassum hotidum en Bahía de la Paz encuentra ejemplares de 82 an en los meses de marzo a abril, esto indica que en el Golfo de California se presentan mayores tallas de Sargassum en comparación con Bahía Magdalena. 57 McCourt (1984), menciona que Sargassum sínicola MT. comouii alcanza su máxima longitud en los meses de febrero y abril poco antes de que la temperatura empiece a aumentar. En el caso particular de Sargassum sinico/a en Isla Magdalena la talla máxima se presentó de junio a julio cuando se presentan las menores temperaturas superficiales del agua de mar, mientras que para Isla Margarita la talla máxima fue de octubre a diciembre, cuando la temperatura superficial del agua de mar inicia su descenso. Dawes (1974), Prince y O’Neal (1979) y Mc Court (1984), opinan que generalmente las especies de Sargassum que habitan en áreas tropicales y subtropicales son más abundantes y tienen mayor crecimiento en los meses más fríos del año. McCourt op cif., dice que las tres especies de Sargassum estudiadas en el norte del Golfo de California tienen su máximo crecimiento cuando las temperaturas son menores. De Wreede (1978) y Espinoza y Rodríguez (1989) reportan que la temperatura óptima para el crecimiento del género Sargassum es de 24°C. Mientras que Lüning (1990) señala que el intervalo de temperatura óptima para las algas tropicales es de 20°C a 30°C. Las temperaturas encontradas en el presente trabajo en las que se registro su máxima longitud y biomasa están entre los 18°C y 20°C en Isla Magdalena, mientras que en Isla Margarita se presentaron tempetituras de 22S”C a 27.0X. En Isla Magdalena el crecimiento máximo ocurre en los meses abril-junio en que existe tendencia al aumento de la incidencia de luz ( 60.00-60.50 W/mZ), lo cual coincidió con bajas temperaturas del agua de mar de 18°C a 19S”C y concentraciones de nutrientes de 0.3-0.4 pg affl tikritos 3.34.1 pg affl nitratos y 1.1-1.7 pg affl. En Isla Margarita el máximo crecimiento se presentó de agosto-septiembre cuando la incidencia de luz fue de 40.50 . 50.50 Wln?, coincide con temperaturas del agua de mar de 27.5 a 29”C, se presentan concentraciones de ntientes de 1.50.4 pg affl nitritos, 1.2-O-4 vg affl nitratos y 0.7-0.4 pg affl fosfatos. Alvarez-Borrego et al. (1975) observaron respecto a la concentración de nitratos en Bahía Magdalena valores entre 0.5-3.0 pg affl (marzo), 3.CkIO pg affl (junio), 1.0-4.0 vg affl 58 (julio-agosto) y OS-l.5 pg at/l (octubre); esto quiere decir que en la parte oeste de Bahía Magdalena se presentan altas concentraciones cuando las temperaturas del agua son bajas. En Isla Magdalena en 1987-1988 los nitratos presentaron valores que fluctúan de 1.4-4.2 pg at/l (marro), 1.4-3.4 vg at/l (junio), 1.4-3.4 pg at/l (julio-agosto), estos valores son similares a lo informado por los autores antes mencionados para la parte central de la bahía. Guerrero et al. (1988) mencionan una concentración de nutrientes en el mes de junio en la boca de Bahía Magdalena de (N03) 0.32 pg atA, (NOz) 0.39 pg atA y (PO,) 1.25 vg atA, y que se incrementa durante las altas mareas y decrece durante las bajas mareas. Mencionan que en la parte norte del canal se presentan temperaturas altas y las concentraciones de los nutrientes son bajas. Para el mes de junio en Isla Magdalena se encontraron valores de (NOS) 3.40 pg atA, (N02) 0.50 pg at/l y (PO,) 1.60 vg atA, mientras que para Isla Margaita valores de (NOS) 1.40 pg affl, (NO*) 0.30 pg at/l y (PO,) 1.20 pg at/l; se asemejan a lo encontrado por los autores antes mencionados, quienes señalan que Bahía Magdalena es un sistema altamente productivo y que las mareas determinan signifícativamente las variables fisicoquímicas, ya que los nutrientes son abastecidos por las aguas litorales circundantes, encontrándose una relación directa entre las concentraciones de nuttientes y las corrientes de marea. El suministro de nutrientes influye en el crecimiento de las algas y en su rendimiento final. Como en el caso de todas ias algas fijas a un sustrato, la concentración de los nutrientes de las aigas marinas es fomentado por las cotientes de agua que fluyen más allá del,talo, renovando la capa limítrofe a partir de la cual, los nutrientes son absorbidos. 59 BIOMASA. En Isla Magdalena la variación de la biomasa esta relacionada con la época de reclutamiento que ocurre entre enero y febrero, la máxima tasa de crecimiento que se alcanza en el período abril-junio (primavera) y su talla máxima que se presenta de junio a agosto (verano), su valor máximo fué de 2250 910.25 rr? ó 9000 g/m2 en junio, en esta época se presentó una alta incidencia de luz (irradiancia) y una alta concentración de nitratos, la temperatura fué de í8 - 20°C. En Isla Margarita la población de Sargassum fue menos abundante, sus máximos valores se presentaron en octubre (otoño) con una biomasa de 1700 g/O.25 rr? ó 6800 g/ti, las variaciones de biomasa están relacionadas también con la época de reclutamiento, la tasa máxima de crecimiento y talla máxima, sin embargo, la relación con la temperatura del agua de mar, incidencia de luz y la concentración de nutrientes no es clara. La diferencia de la temperatura, los ntientes e irradiancia entre las islas sugiere que estos factores están determinando un patrón de desarrollo de: Sargassum sinkola que presenta un desfasamiento. entre ambas islas. De Wreede (1976), señala que la estacionalidad de la biomasa de Sagassum varía latitudinalmente, sin embargo, el máximo desarrollo se presenta con la temperatura óptima para las plantas, que sucede en diferentes tiempos dependiendo de la especie y la localidad, generalizando dicho autor que las especies tropicales y subtropicales de Saqassum alcanzan su abundancia máxima en los meses fríos . mientras que las de aguas templadas lo logran en los meses cálidos. Tsuda (í972), para Sargassum dupkafum de Guam, menciona que alcanza su máxima biomasa y tamaño en junio (verano) cuando la temperatura es mínima. Yoshìkawa (1985,1986) encuentra para Sargassum spp en la costa de Yoshìro los máximos valores de biomasa cosechable a 60 principios de invierno obteniendo 8900 g y 4300 (peso húmedo)/n?. Trono y Lluisma (1990) en Filipinas encontraron que la mayor biomasa cosechable de Sargassum spp se presenta en invierno con valores de 1500 g (peso húmedo)/W ambos lugares se ubican en lugares tropicales. McCourt (1983) midió la biomasa en términos de porcentaje en Puerto Peñasco y dice que el pico de biomasa para este género ocume en los meses fríos. En Isla Magdalena este mismo comportamiento se presenta en junio (primavera) en donde alcanza su máxima biomasa, cuando la temperatura es menor, no siendo así para Isla Margarita. En otros trabajos realizados en el Golfo de California, Rodríguez (1985) para Sargassum sinkola en la Bahía de La Paz, señala que la máxima biomasa se presenta a principios de verano. Muñetón (1987) encontró que en la Bahía de La Paz, Sargassum honidum tiene una biomasa máxima de 391 g (peso húmedo)/ti en inviemc+primavera. Hemádez-Carmona ef al. (1990) quiénes realizaron una evaluación de Sargassum spp en la Bahía de La Paz, encontraron un valor promedio de biomasa máxima de 7320 g (peso húmedo)/m2 en primavera y Casas-Valdez et al. (1993), realizaron otra evaluación de Sargassum spp en Bahía Concepción B.C.S., obteniendo un valor promedio de biomasa de 3520 g (peso húmedo)/nY en ptimavera. Núñez-López (1993) en un trabajo realizado con Sargassum spp en Bahía Concepción encontró valores máximos de biomasa 5400 g (peso húmedo)/nY en la boca de la bahía en primavera. Isla Magdalena presenta valores máximos de biomasa de 9000 g (peso húmedo)/ti, lo que signífica que esta isla presenta mayores valores de biomasa en comparación a lo encontrado por los autores anteriormente citados. . La relación entre el peso húmedo/peso seco es la cantidad de agua que se pierde después del secado, Sargassum sinico/a presenta una pérdida del 85% agua, quedando 15% en peso seco. 61 Sargassum sinicola se distribuye en Bahía Magdalena en toda la zona rocosa y pedregosa de las islas que limitan la bahía, dominando en la zona infralitoral. En general la distribución de esta especie comprende desde los 10 m de distancia de la línea de costa hasta los 60 m, a una profundidad mínima de 50 cm y máxima de 4.5 m. Está presente casi a lo largo de todo el año, pero & abundancia varía en relación a la profundidad. Es muy frecuente que un tipo dado de sustrato exista solo bajo ciertas condiciones determinadas por otros factores físicos tales como el movimiento del agua (Hartog, 1971). El oleaje en este caso puede haber presentado un efecto en la distribución de Sargassum sinicola en los primeros metros a partir de la línea de costa, ya que esta condición impide la fijación de esta especie, y a partir de los 60 m de distancia ya no se encontró Sargassum por la carencia de sustrato rocoso. Charters et. al. (1972) menciona que la fuerza mecánica impuesta por movimientos de agua fuertes puede dañar seriamente las poblaciones de algas bentónicas. .V1 La susceptibílidad a altas temperaturas también varía con la distribución vertical, en general las algas submareales son menos tolerantes a altas temperaturas que las de la zona intermareal baja o pozas de marea, y estas, a su vez son menos resistentes que las de zonas intennareales más altas (Biebl, 1972). Especialmente en la zona intermareal la temperatura constituye un factor importante en la desecación. La extensión del tiempo de desecación y la velocidad de la pérdida de agua afectan la tolerancia o la resistencia, e influyen directamente . la fisiología y reducen la sobrevivencia (Gessner y Schramm, 1971). Tanto en Isla Magdalena como en Isla Margarita tales efectos pudieron probablemente influir en el desarrollo y distribución de Sargassum siniwla en los primeros metros de distancia de la costa, debido a 62 que la poca profundidad que se presenta hace que se generen altas temperaturas del agua de mar. Bahía Magdalena presenta pleamares máximas de 1.6 m y bajamares mínimas de 2.0 m ocasionando fuertes corrientes por el flujo y reflujo de las aguas al introducirse por los diferentes canales; incluso estas corrientes de marea llegan alcanzar velocidades máximas de hasta 133 cmkeg (Grivel, 1986-1987). Ebling ef al. (1948), mencionan que la zonación de las algas intermareales puede ser modificada por la fuerza de las corrientes de marea, la que es alta en costas con diferenciación topográfica. En estos lugares las velocidades de movimiento de agua pueden ser tan rápidas como 250 cmkeg. Aunque estos son hábitats relativamente protegidos, puede desarrollarse una flora de aguas tranquilas, en los lugares fuera de la corriente que son remplazados por grupos típicos en costas más expuestas en la parte central de la corriente (Bassindale ef al., 1948). Gujanova (1968), encontró que aguas con alta velocidad (250 a 300 cmkeg), llevan a una reducción en el número de especies. Además, las especies sublitorales ocupan un nivel más alto y las intennareales, un nivel más bajo que el habitual. Acosta y Lara (1978) observaron en Bahía Magdalena que las características físico-químicas de superficie y a cinco metros de profundidad son muy variables, debido en gran parte a la velocidad de las corrientes, ya que las variables hidrológicas presentan una periodicidad en general, muy parecida a una curva de marea. [,_bAimismo la velocidad de la corriente ocasionada por un ciclo de marea presenta máximos durante el flujo de 22.5 cmkeg y de 20 cm/seg durante el reflujo o sea, que la velocidad de corriente es relativamente baja; por lo que se pude suponer que no afecta directamente a las - especies submareales, pero si probablemente, a las especies intermareales de las Islas Magdalena y Margarita, lo cual explica porque la presencia de Sargassum es escasa en los primeros 10 metros a partir de la línea costa 63 ALGAS ACOMPAÑANTES Las especies acompañantes de Sargassum sinícola en Isla Magdalena e Isla Margarita fueron 36 Rhodophyta, ocho Phaeophyta y seis Chlorophyta. Se puede observar que en Isla Magdalena, el número de especies es muy similar en invierno y primavera, mientras que en el otoño se presenta el menor número. En Isla Margarita, en verano cuando Sargassum sinicola empieza su crecimiento el número de algas acompañantes es alto (21) al ampliar su distribución y abundancia, disminuye la presencia de algas acompañantes (ll) en otoño y nuevamente en invierno cuando la población de Sargassum sinkola esta en decadencia, se incrementan las algas acompañantes (24). Esto se debe a que al decaer la población, tanto en distribución como en biomasa (al estar terminando su ciclo de vida), deja al descubierto el sustrato donde se encontraba fija y entonces otras especies de algas invaden el sustrato disponible como son cantos rodados, conchas y rocas. ALGAS EPíFITAS. Sobre Sargassum sínicola estuvieron presentes 55 especies epífitas; 43 especies fueron Rhodophytas; siete Phaeophyta y cinco Chlorophyta, estas estuvieron en su mayoría en el verano e invierno. La abundancia de las algas epífitas están muy relacionada con la edad del Sargassum. Cuando se encuentra en su etapa final, se presentan una gran cantidad de especies epífitas, principalmente Rhodophyta que son las más abundantes, esto ocurre normalmente en ambas localidades. Las epífitas presentes en una determinada especie de alga, están estrechamente relacionadas con la textura del huésped (Hartog, 1971); la longevidad del huésped puede ser lo suficientemente grande como para permitir al 64 epífito completar su ciclo vital en este. El tamaño de los órganos de adhesión y el tamaño final del epífito son también importantes y afectan en cierto grado la sobrevivencia del huésped. Las reducciones críticas de la superficie del alga a donde llega la luz o incrementos de peso total o de la superficie total expuesta a las fuerzas mecánicas de las olas pueden resultar en la destrucción tanto del huésped como del epífito (Van der Ben, 1969). En algunos casos, la presencia de una epífita en un huésped puede ser fortuita, sin embargo, en otros existe un alto grado de especificidad, de hecho se sabe que un gran número de especies de algas tienen una forma obligadamente epífita y en muchos casos forman asociaciones permanentes con algunas especies de algas. La mayor parte usan a su huésped como estructura de soporte (Santelices, 1977). Para Sagassum sinicola, cuando se encuentra en fase de crecimiento no hay presencia de epífitas, pero cuando el alga esta madura y tiene sus ramificaciones completas, permite la colonización de epífitas, al ir aumentando el número de estas, hay una reducción considerable de luz que ya no pude aprovechar el alga pero si las epífitas, también al aumentar la biomasa de estas últimas, el Sargassum por efecto de las olas o resacas tiende a desprenderse y morir junto con ellas. RELACION DE LOS ORGANISMOS EPIBIONTES Y F I T O F A G O S , C O N E L DESARROLLO DE Sargassum sinicola. Uno de los elementos importantes que influyó para acelerar la mortalidad de la población de Sargassum sinkola en Isla Magdalena fue la presencia de varias especies de fauna epífita y fitófaga, como fue la incrustación del briozoario Bugula californica y de los depredadores; el opi$tobranquio Aplysía californica y el erizo Echinometra vanbrunti. 65 Los briozoarios son animales coloniales sésiles, (zooides) suelen tener menos de 0.5 mm de longitud, su estructura tiene forma de vaso, la cubierta externa es inerte esta compuesta de quitina y una capa gruesa de carbonato de calcio, son animales marinos muy frecuentes y abundantes, la mayor parte viven en el litoral y se fijan a rocas, conchas y algas (Bames, 1989). Bugula californica afectó directamente a Sargassum sinkola en Isla Magdalena ya que estas incrustaciones invadieron toda la parte externa de la planta como el estipe, ramificaciones secundarias, filoides y aerocistos, por lo que la planta empezó a perder rigidez. Este tipo de organismos ocasionan dos efectos, el primero por la invasión principalmente en los filoides, reduce la captación de luz en la planta y el segundo es el peso del briozoario que hace que la planta se hunda completamente hasta el fondo, haciéndola más vulnerable al ataque de los depredadores bentónicos. Nishihira (1967), en una investigación realizada en Japón, mostró que varias especies de hidrozoarios tienen una preferencia particular para una determinada especie de alga. Mac-Farlane (1952) menciona que los briozoarios pueden instalarse fácilmente en el estipe y filoides multiplicándose y secretando una incrustaC¡ón calcárea. Leighton ef al. (1965) mencionan que una incrustación de briozoarios en Macrocysfis, p u e d e restringir el crecimiento, deformar los tejidos e influir en la fragilidad y la capacidad de ruptura del alga por movimiento del agua. North (1961) demuestra que los briozoarios pueden ser muy dañinos para las praderas de Macrocysfis pyrifera ya que reducen la cantidad de luz que alcanza el alga, disminuyen la velocidad de crecimiento y el valor comercial de la especie. Aguilar-Rosas y Aguilar-Rosas (1990) describen como un bríozoario (conchilla) afecta el valor comercial de un alga roja de importancia económica como el Gelidium. En el caso de Sargassum sinicola se puede mencionar que estas 66 incrustaciones de Bugula californica pueden afectar su aprovechamiento y la calidad de los ficocoloides. En el caso de la depredación por el opistobranquio Aplysia californica y del erizo Echinometra vanbrunfi estos organismos fitófagos contribuyeron a acelerar la mortalidad de la población de Sargassum sinicola ya que al estar en el fondo estos organismos bentónicos pueden depredar más fácilmente al alga: los discos de fijación, los erizos y el resto de la planta, los opistobranquios. Bames (1989) menciona que estos organismos prefieren a las algas para su alimentación. Scagel (1959) y Doty (1971) dicen que estos organismos dependen completamente (directamente e indirectamente) de las algas. Observaciones directas en la población de Macrocysfis pyrifera de California muestran que pueden ser atacadas por el erizo Sfrongylocenfrofus franciscanus. Este organismo se alimenta de los discos y estructuras asociadas cortando los estipes cerca de la base y el disco. Cuando los erizos alcanzan una densidad de 10 individuos/m2 son capaces de impedir el desarrollo de cualquier vegetación. La preferencia del alimento para el opistobranquio esta determinada por algunas particularidades químicas del alga, en el caso de la Aplysía juliana se conoce que existe un estímulo químico. Este opistobranquìo es común en aguas tropicales y es monófago de Uva lacfuca, aunque también puede consumir ocasionalmente otra alga como Fucus (Frings y Frings, 1965). La depredación puede afectar las comunidades produciendo límites espaciales en las poblaciones o limitando la distribución de comunidades completas (Southward, 1958). Paine y Vadas (1969) mencionan que la depredación intermitente de erizos y opistobranquios podría favorecer la diversidad de las especies dentro de una área determinada. 67 Se observó que los individuos en ambas localidades, presentan las siguientes características en común: a) morfológicas; en el disco de fijación, talo, filoides y aerocistos; b) la reproducción es sexual; presentan oogonios y anteridios, su máxima producción de receptáculos es cuando se presentan sus máximas tallas y mayor desarrollo y biomasa, pero en diferente época del año; c) las tallas y tasas de crecimiento; son casi similares entre si y d) la distribución vertical y tipo de sustrato donde se desqrrolla; además de que los cambios morfológicos que presentan a lo largo de su ciclo de vida son similares. El desfasamiento de cuatro meses en la aparición de estas algas en las islas puede deberse a las diferentes condiciones ambientales que influyen sobre ellas en cada zona. También se observó que la época de reproducción fue diferente para cada una de las islas, por lo que podría suponerse que existen dos poblaciones. Odum (1972), define a una población como un grupo colectivo de organismos de la misma especie (en cuyo seno los individuos pueden intercambiar información genética) que ocupa un lugar determinado, que presentan las mismas propiedades (parámetros) en lo que se refiere a los atributos como la densidad, fecundidad, natalidad, mortalidad, edad, crecimiento, reclutamiento, distribución, dispersión y forma de desarrollo. En este trabajo solo se determinó el crecimiento, la distribución y la morfología, las cuales fueron similares en ambas islas. Con referencia a la definición de Odum (op. cit.), es difícil predecir que existe intercambio genético entre las poblaciones de una isla y otra. Neushul (1972) informa que los gametos de Saryassum spp son capaces de nadar por solo 20 minutos y llegan a sobrevivir hasta 48 horas, sin embargo, no se puede afirmar que no existe intercambio genético entre las islas, independientemente de la distancia que las separa, más bien es importante mencionar que los factores físicos y mecánicos juegan un papel importante en l a disttibución y fijación de los gametos, ya que los los factores implicados en la fijación y 68 biología en general de los gametos, no han sido suficientemente estudiados en el campo ni bien entendidos (Neushul op . cit.). Por lo anterior se considera que este estudio, no aporta elementos suficientes para definir la posibilidad de que en estas dos zonas de estudio, se encuentren poblaciones diferentes. De acuerdo con Pielou (1974) el concepto de población no es fácil de definir, pero se acepta que el investigador delimite la población, siempre y cuando se defina con precisión a que se le llama población. 69 VIII. CONCLUSIONES 1. El desarrollo de Sargassum sinicola en Isla Margarita se desfasó cuatro meses con respecto al de la misma especie en Isla Magdalena. 2. Se determinó el ciclo reproductor de Sargassum sinkola en cada una de las dos zonas de estudio: se observaron las oogonias y anteridios maduros, en los meses de junio y julio en Isla Magdalena, mientras que en Isla Margatita de octubre a diciembre. 3. Respecto a la tasa de crecimiento en Isla Magdalena, el valor máximo se presentó en abil-junio (27 mm/día), mientras que para Isla Margarita su máximo fue en agostoseptiembre (25 mm/día). La talla máxima para Isla Magdalena se presentó en julio con 28 cm y para Isla Margarita en diciembre con 30 cm. 4. En Isla Magdalena se encontró que la mayor biomasa se presentó en junio 9000 g/ti (primavera) y la mínima en agosto 1000 g/nY (verano) y para Isla Margarita la mayor biomasa fue en octubre 6800 ghP(otoño) y la mínima en marzo 800 g/ti (primavera). Se presentan mayores valores de biomasa en Isla Magdalena en comparación con Isla Margarita. 5. La variación de la biomasa esta relacionada con la época de reclutamiento, la tasa de crecimiento, talla máxima, sus máximos valores en Isla Magdalena se alcanzaron cuando la temperatura fué menor. 70 11 Una de la causas que contribuyó a que se acelerara el deterioro y desaparición de las algas en Isla Magdalena fue la presencia del briozoario Bugula californica y el ramoneo del erizo Echinomefra vanbrunti y del opistobranquio Aplysia CalZomica, mientras que para Isla Margarita no hubo presencia de estos organismos. En este estudio no se obtuvieron elementos suficientes para definir si Sargassum sinicola oresenta una ó dos ooblaciones en Bahía Maodalena. 72 IX. RECOMENDACIONES. - Es importante complementar el estudio autoecológico con los aspectos, fisiológicos y bioquímicos de las algas con énfasis a estos últimos, aportando información nueva acerca de los efectos del medio marino sobre las algas y de organismos asociados a ellas. - Realizar una evaluación mensual o estacional de los mantos de Sargassum en otras Bahías importantes de la Península de B.C.S., esto con el fin de conocer la biomasa explotable de este recurso con base a su abundancia y distribución, ya que esta especie es de importancia comercial por su contenido de alginatos, manitol, fucoìdinas, antibióticos, fertilizantes y pueden ser utilizados como complemento alimenticio para humanos, aves y ganado. - Es importante que la explotación de este recurso en Bahía Magdalena se realice, cuando las algas de Sargassum sinicola se encuentren en su máxima abundancia (verano y otoño), haya concluido su reproducción de esta manera se podrían obtener los máximos rendimientos sostenidos. 73 X. SUGERENCIAS PARA TRABAJO FUTURO. - Efectuar un nuevo estudio similar al presente, en Bahía Magdalena B.C.S., para comparar los resultados, con el fin de observar si persiste el desfasamiento en el desarrollo de Sargassum sinicola entre ambas islas. - Que se realicen estudios ecológicos sobre las relaciones planta-planta, competencia, sucesión, epifitísmo, relación planta-animal, depredación. - Llevar a cabo estudios Citogenéticos y Bioquímicos para comprobar si existe una población con dos generaciones, una desfasada de la otra, o si existen dos poblaciones de la misma especie en la misma área. - Efectuar un estudio de la factibilidad económica, para la cosecha de las algas. - Realizar un análisis proximal de los componentes químicos de esta especie para proponer alguna alternativa para su aprovechamiento. - Realizar un análisis estacional de la cantidad y calidad de los alginatos que contiene esta especie. . - Realizar un estudio más preciso de la morfología de Sargassum sinicola para no caer en contradicciones taxonómicas. 74 Abbott, I. y G.J. Hollenberg. 1976. Marine algae of California. Stanford Univ. Press. Stanford, California. Xii + 827 pp. Abbott, 1. y J.N. Nonis. 1985. Taxonomy of economìc seaweeds with referente to some Pacific Catibbean specíes. California Sea Grant College Program, La Jolla, California. 167 pp. Acosta, J. y J. Lara. 1978. Resultados físico-químicos en un estudio de variación diurna en el área central de Bahía Magdalena, B.C.S., Ciencias Marinas. 5(q): 37-45. Aguilar-Rosas, R. y L.E. Aguilar-Rosas. 1990. La conchilla contra el Sargazo Rojo. ConCiencia. 1 (5): 5-6. Ang, P.O. Jr. 1985a. Studies on the recruitment of Sagassum spp (Fucales: Phaeophyta) en Bilibago, (Calatagan, Philippines). Exp. Mar. Biol. Ecol. 91: 293-301. Ang, P.O. Jr. 1985b. Regeneration studies of Sagassum siliquosum J. Ag. y Sargassum panículafum J. Ag. (Phaeophyta, Sargassaceae). Bot. Mar. 28 (6): 231-235. Alvarez-Borrego, S., L. A. Galindo Bect y A. Ch. Ban-agán. 1 9 7 5 . Características hidroquímicas en Bahía Magdalena, B.C.S., Ciencias Marinas. 2(2): 94-l 10. Bámes, D.R. 1989. Zoología de los invertebrados Nueva Editorial Interamericana. Quinta edición, México. 826 pp. Bassindale, R., F. J. Ebling, J.A. Kitching y R.D. Purchon. 1948. The ecology of Lough Ine special referente to water current 1. Introduction and Hydrography. J. Ecol. 36: 305 322. 75 Biebl, R. 1972. Temperature resistance of marine algae. Proc. 7th lnt. Seaweed Symposium: 23-28. Brusca, C.R. 1973. Common Intertidal Invertebrates of the Gulf of California. The University of Arizona Press sewnd Edition, U.S.A. 513 pp. Casas-Valdez, M. 1981. Las algas cafés, un recurso potencial para Baja California. Mem. Simp. La Pesca en México. CICIMAR, I.P.N. La Paz B.C.S., México. 130-136. Casas-Valdez, M. 1985. Cuantificación y caracterización parcial de alginatos de algunas especies de algas feofitas de las costas de México. Inv. Mar. CICIMAR. 2 (1): 46-58. Casas-Valdez, M. y G. Hernández. 1982. Avance en el análisis bromatológíco de Sargassum sinicola. Informe Técnico, CICIMAR I.P.N. 10 pp. Casas-Valdez, M. e 1. Sánchez. 1992a. Biomasa wsechable de Sargassum spp en Bahía Concepción B.C.S. México. CICIMAR I.P.N. Boletín No.9.2 pp. Casas-Valdez, M. e 1. Sánchez. 1992b. Algas Marinas en Bahía Concepción B.C.S. México. CICIMAR I.P.N. Boletín No.10 2 pp. Casas-Valdez, M., M. Terrazas y R. García. 1988. Aprovechamiento de las algas marinas Macrocysfis pyrifera y Sargassum spp como fuentes alternas de alimento en explotaciones pecuarias. Informe Técnico, CICIMAR I.P.N. 40 pp. Casas-Valdez, M., 1. Sánchez. y G. Hernández. 1993. Evaluación de Sagassum spp en la costa oeste de Bahía Concepción, B.C.S., México. Inv. Mar. CICIMAR 8 (2): 61-69. Chapman, A.R.O. 1973. A critique of prevailing attitudes towards the control of seaweed zonation on the sea shore. Bot. Mar. 16,80-82. C$NT’RO IN’i’dRL)ISCIPLíNARIO Dli; CIENCIAS MARINAS 76 ‘BIBLBOTECA 1. P. M. DONIKTIVO !’ Charters, A.C., M. Neushul y B.A. Coon. 1972. Effects of water motion on algal spore attachment. Proc. 7th lnt. Seaweed Simposium: 243-247. Chauhan, V.D. y V. Krishnamurthy. 1965. Ecology and seasonal succession of Sargassum swadzi (tum) C. Ag. in Indian waters. Central Salt and Marine Chemicals Research Institute Bhunagar. l-l 1. Dawes, C.J. 1974. Marine algae of the west coast of Florida. University of Miami. Press. Coral Gables, Fla. 201 pp. Dawson, E. Y. 1944. The marine algae of the Gulf of California. Allan Hancock Pacific Expedition. 3: 189-453. De León, R. 1. 1974. Manual de técnicas histológicas. Esc. Nal. Cienc. Biol., I.P.N. México. 34 PP. De Ruyter, VS. y A.M. Breeman. 1987. Population dynamics of tropical intertidal and deep-water population of Sargassum polycemfum (Phaephyceae). Acuatíc Botany. 29: 139-l 36. De Wreede, R. E. 1976. The Phenology of three species of Sargassum (Sargassaceae, fhaeophyfa) in Hawaii. Phycologia. 15 (2): 175183. De Wreede, R. E. 1978. Phenology of Sargassum muficum (Phaeophyta) in the strait of Georgia, British Columbia, Canadá. Synesis. ll: l-9. De Wreede, R. E. 1985. Destructive (Harvest) Samplìng. In: Litter, M.M. (ed), Handbook of phycological methods for macroalgae Cambrige. 23 pp. De Wreede, R.E. y E.C. Jones 1973. New records of Sargassum hawaiiensis Doty y Newhouse (Sargassaceae: Phaeophyta) a deep water species. Phycologia. 12, 59-62. 77 Doty, M.S. 1971. The productivity of bentonic frondose algae at Waikiki Beach 1987-1988. Hawaii Bentonic Science Paper N.- 22: l-l 19. Ebling, F.J., J.A. Kitching, R.D. Purchon y R. Bassindale. 1948. The ecology of the Lough Ine rapids with special referente to water currents. ll. The fauna of Sacchoriza canopy. J. Aním. Ecol. 17: 223-244. Espinoza, J. 1990. Estructura por edades y reproducción de tres poblaciones de Sargassum sinkola (Phaeophyta: Fucales) en la Bahía de La Paz, Golfo de California. Acta Botánica Mexicana. Il: l-9. Espinoza, J. y H. Rodríguez. 1985. Observaciones preliminares de Sargassum sinkola Setchell y Gardner ( Phaeophyta ) en la Bahía de La Paz, Golfo de California. Ciencias Marinas. ll(3): 115120. Espinoza, J. y H. Rodríguez. 1987. Seasonal phenology and reciprocal transplantation of Sargassum sinicola Setchell y Gardner in the Southem Gulf of California. J. Exp. Mar. Biol. Ecol. 110: 183-l 95. Espinoza, J. y H. Rodríguez. 1989. Crecimento de Sargassum sínicola Setchell y Gardner (Phaeophyta) en la parte sur del Golfo de California, México. Ciencias Marinas. 15 (4): 141-149. Frings, H. y C. Frings. 1965. Chemosensory bases of food-finding in Aplysia juliana (Mollusca, Opistobranchia). Biol. Bull. Mar. Biol. Lab., Woods Hole. 128: 21 I-217. . Fritsch, F.E. 1977. The structure and reproduction of algae: foreword, Phaeophyceae, Rhodophyceae, Myxophyceae. Vol. ll. Cambridge University Press, London. 939 pp. Gaviño, G., C. Juárez y H. Figueroa. 1982. Técnicas histológicas selectas de laboratorio y de campo. Ed. Limusa, México. 251 pp. 78 Gessner, F. y W. Schramm. 1971. Salinity. Plants. pp. 705820. En 0. Kinne (ed). Marine Ecology. A comprehensive, integrated treatise on life in oceans and coastal waters . Val. 1 parte 2. Wiley Interscience. Gleen E.P., C.N. Smith y MS. Doty. 1990. Influente of antecedent water temperatures on standing crep of Sargassum sp dominated reef flat in Hawaii. Marine Biology. 105: 323-328. Grivel, P.F. 1986-1987. Calendario gráfico de mareas. Instituto de Geofísica, UNAM. México. 12 PP- Guerrero, G. R., R. Cervantes y A. Jiménez-Illescas. 1988. Nutrient variation during a tidal cycle at the mouth of Coastal Lagoon in the Northwest of México. Indìan J. Mar. Sc¡. 17: 235237. Gujanova, E.E. 1968. The ínfluence of water movement upon the species composition and distribution of the marine fauna and flora throughout the Artic and North Pacific intertidal Zones. Sarsia. 34: 83-94. Guzmán del Proó, S.A., M. Casas-Valdez., A. Díaz C., Ma. L. Díaz L., J. Pineda B. y Ma. E. Sánchez. 1986. Diagnóstico sobre las investigaciones y explotación de las algas marinas en México. lnv. Mar. CICIMAR No. Especial. ll. 3: l-63. Hartog, C. den. 1971. Substratum. Plants. pp. 1277-1289. En 0. Kinne (ed). Marine Ecology. A wmprehensive, integrated treatise of life in oceans and wastal waters. Vol. 1, part 3. wiley Interscience. Hernández-Carmona, G. 1985. Variación estacional del contenido de alginatos en tres especies de Phaeophyta de B.C.S., México. Inv. Mar. CICIMAR l(2): 30-40. Hernández-Carmona, G., M. Casas-Valdez, C. Fajardo L., 1. Sánchez-Rodríguez y E.Y. Rodríguez-Montesinos. 1990. Evaluación de Sargassum spp en la Bahía de La Paz, B.C.S., México. Inv. Mar. CICIMAR 5(l): 11-18. 79 Holguín-Quiñones, 0. 1971. Estudio florístico estacional de las algas marinas de la parte norte de la Bahía de La Paz, B.C.S. Tesis Profesional. Escuela Nacional de Ciencias Biológicas. I.P.N. México, D.F. 115 pp. Huerta, M.L. 1978. Vegetación acuática y subacuática. En: Rzedowski, J. Vegetación de México. Edit. Limusa, México. 328340. Huerta, M.L. y C. Mendoza G. 1985. Las algas marinas de la parte sur de la Bahía de La Paz, B.C.S. Phytologia. 59(l): 35-57. Leighton, D.L., L.G. Jones y W.J. North. 1965. Ecological relation ships between giant kelp and sea urchins in Southem California. Proc. 5th. Int. Seaweed Symposium: 141-153. Lüning, K. 1990. Seaweeds their enviroment bìogeography and physiology. A Wiley-lnterscience Publication. 526 pp. Lynn, R.J. 1967. Seasonal variation of temperature and salinity at 10 meters in the California current. CalCOFI reports vol. XI, July 1963 to 30 de June 1966. 157-l 86, Mac-Farlane, C.I. 1952. Studies on seaweed populations of economic importance in Digby Neck Area, Nova Scotia. Proc. 2nd Int. Seaweed Symposium: 186-191. Manzano, M.R. y E. Rosales G. 1989. Aprovechamiento de las algas marinas Macrocysfis pynfera y Sargassum sinícola en la alimentación humana y animal. Tesis Profesional. Universidad La Salle, México D.F. 109 pp. Mateo-Cid, L.E., 1. Sánchez R., E.Y. Rodríguez y M. Casas-Valdez. 1993. Estudio florístiw estacional de algas marinas de Bahía Concepción B.C.S. México. Ciencias Marinas. . 19(l): 41-60. McCourt, R.M. 1983. Zonation and phenology of three species of Sargassum in the intertidal zone of the northem Gulf of California. PH.D. Thesis Universidad de Atizona U.S.A. 144 PP* 80 McCourt, R.M. 1984. Seasonal pattems of abundance, distributions, and phenology in relation to growth strategies of three Sargassum species. J. Exp. Mar. Bìol. Ecol. 74 (2): 141-156. Muñetón, M. 1987. Fenología de Sagassum honidum en tres localidades en la Bahía de La Paz, B.C.S. México. Tesis Profesional. Universidad Autónoma de B.C.S. La Paz, México. 71 pp. Muñetón, M. 1989. Morfología y época de reproducción de Sargassum honidum (Setchell y Gardner) en la Bahía de La Paz B.C.S. México. lnv. Mar. CICIMAR. 4 (2): 257-266. Muñetón, M. y G. Hernández. 1993. Crecimiento estacional de Sargassum honídum Setchell y Gardner (Phaeophyta) en la Bahía de La Paz, B.C.S. México. Inv. Mar. CICIMAR 8 (1): 23-31. Neushul, M. 1972. Functional interpretation of bentonic marine algal morphology. pp. 46-73. En I.A. Abbott and M. Kurogi (eds.). Contributions to the Systematic of benthic marine algae of the North Pacific. The Japonese Society of Phycology. Kobe. Japan. Nishihira, M. 1967. Observation on the selection on algal substrate by Hydrozoa larvae, Serfu/am//a miurensís in nature. Bull. mar. biol. Stat. Asamushi. 13: 35-48. Norris, J.N. 1975. Marine algae of the northem Gulf of California. Ph D. Thesis, University of California Santa Barbar-a, U.S.A. 575 pp. Norris, R.E. y M.E. Aken. 1985. Marine bentonic algae new to South Africa. S. Afr. J. Bot 51: 55-65. - North, W.J. 1961. Life span of fronds of the giant kelp, Macmcysfis pyrifera. Natura. 190: 1214-1215. 81 Norton, T.A., Mathieson y M. Neushul. 1981. Morphology and Environment. En: Lobban C. S. y M.J. wnne (eds.) The Biology of seaweeds. Black Well Scientific Publications. 421 pp. Núñez-López R. 1993. Biomasa estacional especifica de Sargassum (Sargassaceae: Phaeophyta) en tres zonas de Bahía Concepción, B.C.S. Tesis Profesional. Universidad Autónoma Metropolitana. México D.F. 55 pp. Odum, E.P. 1972. Ecología. (Ed) Interameticana Tercera Edición, México. 637 pp. Paine, R.T. y R.L. Vadas. 1969. The effects of grazing by sea urchins Strongylocentrotus spp, on bentonic algal populations. Limnol. Oceanogr. 14: 710-719. Pielou, E.C. 1974. Popuiation and Community Ecology. Principles and Methods. Science Publishers, Inc. New York. 424 pp. Ptince, J.S. y W. O’Neal. 1979. Tl-te ecology of S a r g a s s u m pterpleumn G r u n o w (Phaeophyceae, Fucales) in the waters off south Florida. 1. Growth, reproduction and population structure. Phycologia. 18 (2): 109-I 14. Preece, A. 1965. Manual for histologic technicians. 2a ed, Little, Brown and Co. Boston. 287 pp. Rocha-Ramírez y Siqueiros-Beltrones. 1990. Revisión de las especies del género Sargassum C. Agardh, registradas para la Bahía de La Paz, B.C.S. México. Ciencias Marinas. 16 (3): 1526. Rodríguez, G.H. 1985. Diferencias de longitud, crecimiento, reproducción y dimensiones de . filoides entre dos grupos poblacionales de Sargassum sinícola (Setchell y Gardner) en la Bahía de La Paz, B.C.S. México. Tesis profesional. Universidad Autónoma de Baja California Sur. La Paz, México. 57 pp. 82 Sánchez, R.I., L.C Fajardo y 0. Pantoja. 1989. Estudio flon’stico estacional de las algas en Bahía Magdalena B.C.S. México. Inv. Mar. CICIMAR 4(l): 35-48. Santelices, B. 1977. Ecología de Algas Bentónicas Matinas. Universidad Pontificia Católica de Chile, Santiago de Chile. 488 pp. Scagel, R.F. 1959. The role of plants in relation to animals in the matine enviroment Mar. Biol., Proc. 20th Biology Colloquium. Oregon State College, April 1959: 929. Setchell, W.A. y N.L. Gardner. 1924. Expedition of the California Academy of Sciences to the Gulf of California in 1921. Proc. Calif. Atad. Sc¡. 12(29): 695-949. Southward, A.J. 1958. The zonation of plants and animals on rocky seashores. Biol. Rev. 33: 137-177. Stephenson, T.A. y A. Stephenson. 1972. Life between tidemarks on rocky shores. Freeman, San Francisco. 425 pp. Strickland, J.D. y R. Parsons. 1972. Practica1 handbook of sea-water analysis. 2a. Ed, Bull. 167. Fisheries Research board Canadá, Ottawa. 311 pp. Taylor, W.R. 1945. Expeditions to the Galapagos Islands. The Univ. South. Cal. Pub. Allan Hancock Pacific Expedìtion. U.S.A. 518 pp. Tsuda, R.T. 1972. Morphological, zonational, and seasonal studies of two species of Sargassum on the reef of Guam. En: K. Nisizawa: (ED.) Proc. Int. Seaweed Symp., 7.40-44. _ Tsuda, R.T. 1974. Seasonal aspects of the Guam Phaeophyta (brown algae) Proc. 2 and Int Coral Reef Commitee, Brisbane. 4347. 83 Trono, G.C. y A.O. Lluisma. 1990. Seasonality of standing crep of Sargassum (Fucales, Phaeophyta) bed in Bolinao, Pangasinan, Philippínes. Develoment ín Hydrobiology. 2041205: 331-338. Van der Ben, D. 1969. Les epiphytes des fevílles de Posidonia .oceanica sur les côtes Francaises de la Méditerranée. Proc. Intl. Seaweed Symp. 6: 79-84. Yoshikawa, K. 1985. Studies on the formation of Sargassum beds. 1. The formation of artificial Sargassum plants C. Agardh. Bull. Nanseí. Reg. Fish. Res. Lab. 18: 1523. Yoshikawa, K. 1986. Studies on the formation of Sargassum beds. ll. The growth of three Sargassaceae by placed blocks on the botton with artificial seedlings and transplanted by matured plants. C. Agardh. Bull. Nanseí. Reg. Fìsh. Res. Lab. 20: 137-143. 84