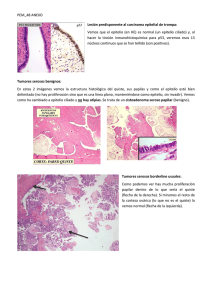
histología y citología avanzada ii
Anuncio

HISTOLOGÍAYCITOLOGÍAAVANZADAII Título original: Histología y Citología avanzada II Autores: José Ángel Alzueta. T.S.S. de Anatomía Patológica y Citología Rogelio Soler Peinado. T.S.S. de Anatomía Patológica y Citología Edita e imprime: FESITESS ANDALUCÍA C/ Armengual de la Mota 37 Oficina 1 29007 Málaga Teléfono/fax 952 61 54 61 www.fesitessandalucía.es Diseño y maquetación: Alfonso Cid Illescas Edición Octubre 2011 ÍNDICE UNIDADDIDÁCTICAI PRESENTACIÓNYMETODOLOGÍADELCURSO 1.1 Sistema de Cursos a Distancia 5 7 1.2 Orientaciones para el estudio 8 1.3 Estructura del Curso 9 UNIDADDIDÁCTICAII RECUERDOHISTOLÓGICO 2.1 Tejido Epitelial 13 15 2.2 Tejido Conjuntivo 29 2.3 Tejido muscular 54 2.4 Tejido nervioso 65 UNIDADDIDÁCTICAIII ESTUDIOSHISTOLÓGICOSYCITOLÓGICOSENGINECOLOGÍA YOBSTETRICIA 79 UNIDADDIDÁCTICAIV ESTUDIOSHISTOLÓGICOSYCITOLÓGICOS DELSISTEMAGLANDULARENDOCRINOYEXOCRINO 201 4. 1. Tiroides y Paratiroides. 203 4.2. Glándulas Salivares. 213 4.3. Glándulas mamarias. 217 UNIDADDIDÁCTICAV ESTUDIOSHISTOLÓGICOSYCITOLÓGICOSDELSISTEMALINFÁTICO 247 UNIDADDIDÁCTICAVI ESTUDIOSHISTOLÓGICOSYCITOLÓGICOS DELSISTEMAREPRODUCTORMASCULINO 283 283 CUESTIONARIO Cuestionario 305 307 UNIDADDIDÁCTICAI PRESENTACIÓNYMETODOLOGÍADELCURSO HistologíayCitologíaavanzadaII Presentación,normasyprocedimientosdetrabajo. Introducción Antes de comenzar el Curso, es interesante conocer su estructura y el método que se ha de seguir. Este es el sentido de la presente introducción. Presentación 1. Sistema de Cursos a Distancia En este apartado aprenderá una serie de aspectos generales sobre las técnicas de formación que se van a seguir para el estudio. 2. Orientaciones para el estudio. Si usted no conoce la técnica empleada en los Cursos a Distancia, le recomendamos que lea atentamente los epígrafes siguientes, los cuales le ayudarán a realizar el Curso en las mejores condiciones. En caso contrario, sólo tiene que seguir los pasos que se indican en el siguiente índice: Se dan una serie de recomendaciones generales para el estudio y las fases del proceso de aprendizaje propuesto por el equipo docente. 3. Estructura del Curso Mostramos cómo es el Curso, las Unidades Temáticas de las que se compone, el sistema de evaluación y cómo enfrentarse al tipo test. 1.1SistemadeCursosaDistancia 1.1.1RégimendeEnseñanza La metodología de Enseñanza a Distancia, por su estructura y concepción, ofrece un ámbito de aprendizaje donde pueden acceder, de forma flexible en cuanto a ritmo individual de dedicación, estudio y aprendizaje, a los conocimientos que profesional y personalmente le interesen. Tiene la ventaja de estar diseñada para adaptarse a las disponibilidades de tiempo y/o situación geográfica de cada alumno. Además, es participativa y centrada en el desarrollo individual y orientado a la solución de problemas clínicos. La Formación a Distancia facilita el acceso a la enseñanza a todos los Técnicos Especialistas/Superiores Sanitarios. 1.1.2CaracterísticasdelCursoydelalumnadoalquevadirigido Todo Curso que pretenda ser eficaz, efectivo y eficiente en alcanzar sus objetivos, debe adaptarse a los conocimientos previos de las personas que lo estudiarán (lo que saben y lo que aún no han aprendido). Por tanto, la dificultad de los temas presentados se ajustará a sus intereses y capacidades. Un buen Curso producirá resultados deficientes si lo estudian personas muy diferentes de las inicialmente previstas. Los Cursos se diseñan ajustándose a las características del alumno al que se dirige. 7 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 1.1.3OrientacióndelosTutores Para cada Curso habrá, al menos, un tutor al que los alumnos podrán dirigir todas sus consultas y plantear las dificultades. Las tutorías están pensadas partiendo de la base de que el aprendizaje que se realiza en esta formación es totalmente individual y personalizado. El tutor responderá en un plazo mínimo las dudas planteadas a través de correo electrónico exclusivamente. Diferenciamos para nuestros Cursos dos tipos de tutores: Académicos. Serán aquellos que resuelvan las dudas del contenido del Curso, planteamientos sobre cuestiones test y casos clínicos. El tutor resuelve las dudas que se plantean por correo electrónico. Orientadores y de apoyo metodológico. Su labor se centrará fundamentalmente en cuestiones de carácter psicopedagógicas, ayudando al alumno en horarios, métodos de trabajo o cuestiones más particulares que puedan alterar el desarrollo normal del Curso. El tutor resuelve las dudas que se plantean por correo electrónico. 1.2Orientacionesparaelestudio Los resultados que un estudiante obtiene no están exclusivamente en función de las aptitudes que posee y del interés que pone en práctica, sino también de las técnicas de estudio que utiliza. Aunque resulta difícil establecer unas normas que sean aplicables de forma general, es más conveniente que cada alumno se marque su propio método de trabajo, les recomendamos las siguientes que pueden ser de mayor aprovechamiento. Por tanto, aún dando por supuestas la vocación y preparación de los alumnos y respetando su propia iniciativa y forma de plantear el estudio, parece conveniente exponer algunos patrones con los que se podrá guiar más fácilmente el desarrollo académico, aunque va a depender de la situación particular de cada alumno y de los conocimientos de la materia del Curso: Decidir una estrategia de trabajo, un calendario de estudio y mantenerlo con regularidad. Es recomendable tener al menos dos sesiones de trabajo por semana. 8 Elegir el horario más favorable para cada alumno. Una sesión debe durar mínimo una hora y máximo tres. Menos de una hora es poco, debido al tiempo que se necesita de preparación, mientras que más de tres horas, incluidos los descansos, puede resultar demasiado y descendería el rendimiento. Utilizar un sitio tranquilo a horas silenciosas, con iluminación adecuada, espacio suficiente para extender apuntes, etc. Estudiar con atención, sin distraerse. Nada de radio, televisión o música de fondo. También es muy práctico subrayar los puntos más interesantes a modo de resumen o esquema. HistologíayCitologíaavanzadaII a) Fase receptiva. Observar en primer lugar el esquema general del Curso. Hacer una composición de lo que se cree más interesante o importante. Leer atentamente todos los conceptos desarrollados. No pasar de uno a otro sin haberlo entendido. Recordar que en los Cursos nunca se incluyen cuestiones no útiles. Anotar las palabras o párrafos considerados más relevantes empleando un lápiz o rotulador transparente. No abusar de las anotaciones para que sean claras y significativas. Esquematizar en la medida de lo posible sin mirar el texto el contenido de la Unidad. Completar el esquema con el texto. Estudiar ajustándose al horario, pero sin imbuirse prisas o impacientarse. Deben aclararse las ideas y fijarse los conceptos. Resumir los puntos considerados primordiales de cada tema. Marcar los conceptos sobre los que se tengan dudas tras leerlos detenidamente. No insistir de momento más sobre ellos. b) Fase reflexiva. Reflexionar sobre los conocimientos adquiridos y sobre las dudas que hayan podido surgir, una vez finalizado el estudio del texto. Pensar que siempre se puede acudir al tutor y a la bibliografía recomendada y la utilizada en la elaboración del tema que puede ser de gran ayuda. Seguir paso a paso el desarrollo de los temas. Anotar los puntos que no se comprenden. Repasar los conceptos contenidos en el texto según va siguiendo la solución de los casos resueltos. c) Fase creativa. En esta fase se aplican los conocimientos adquiridos a la resolución de pruebas de autoevaluación y a los casos concretos de su vivencia profesional. Repasar despacio el enunciado y fijarse en lo que se pide antes de empezar a solucionarla. Consultar la exposición de conceptos del texto que hagan referencia a cada cuestión de la prueba. Solucionar la prueba de cada Unidad Temática utilizando el propio cuestionario del manual. 1.3EstructuradelCurso 1.3.1ContenidosdelCurso 9 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Guía del alumno. Temario del curso en PDF, con un cuestionario tipo test. FORMULARIO, para devolver las respuestas al cuestionario. ENCUESTA de satisfacción del Curso. 1.3.2LosCursos Los cursos se presentan en un archivo PDF cuidadosamente diseñado en Unidades Didácticas. 1.3.3LasUnidadesDidácticas Son unidades básicas de estos Cursos a distancia. Contienen diferentes tipos de material educativo distinto: Texto propiamente dicho, dividido en temas. Bibliografía utilizada y recomendada. Cuestionario tipo test. Los temas comienzan con un índice con las materias contenidas en ellos. Continúa con el texto propiamente dicho, donde se desarrollan las cuestiones del programa. En la redacción del mismo se evita todo aquello que no sea de utilidad práctica. El apartado de preguntas test serán con los que se trabajen, y con los que posteriormente se rellenará el FORMULARIO de respuestas a remitir. Los ejercicios de tipo test se adjuntan al final del temario. Cuando están presentes los ejercicios de autoevaluación, la realización de éstos resulta muy útil para el alumno, ya que: Tienen una función recapituladora, insistiendo en los conceptos y términos básicos del tema. Hacen participar al alumno de una manera más activa en el aprendizaje del tema. Sirven para que el alumno valore el estado de su aprendizaje, al comprobar posteriormente el resultado de las respuestas. Son garantía de que ha estudiado el tema, cuando el alumno los ha superado positivamente. En caso contrario se recomienda que lo estudie de nuevo. Dentro de las unidades hay distintos epígrafes, que son conjuntos homogéneos de conceptos que guardan relación entre sí. El tamaño y número de epígrafes dependerá de cada caso. 10 HistologíayCitologíaavanzadaII 1.3.4SistemadeEvaluación Cada Curso contiene una serie de pruebas de evaluación a distancia que se encuentran al final del temario. Deben ser realizadas por el alumno al finalizar el estudio del Curso, y enviada al tutor de la asignatura, con un plazo máximo de entrega para que pueda quedar incluido en la edición del Curso en la que se matriculó y siempre disponiendo de 15 días adicionales para su envío. Los tutores la corregirán y devolverán al alumno. Si no se supera el cuestionario con un mínimo del 80% correcto, se tendrá la posibilidad de recuperación. La elaboración y posterior corrección de los test ha sido diseñada por el personal docente seleccionado para el Curso con la intención de acercar el contenido de las preguntas al temario asimilado. Es IMPRESCINDIBLE haber rellenado el FORMULARIO y envío de las respuestas para recibir el certificado o Diploma de aptitud del Curso. 1.3.5Fechas El plazo de entrega de las evaluaciones será de un mes y medio a partir de la recepción del material del curso, una vez pasado este plazo conllevará una serie de gestiones administrativas que el alumno tendrá que abonar. La entrega de los certificados del Curso estará en relación con la fecha de entrega de las evaluaciones y NUNCA antes de la fecha de finalización del Curso. 1.3.6Aprendiendoaenfrentarseapreguntastipotest La primera utilidad que se deriva de la resolución de preguntas tipo test es aprender cómo enfrentarnos a las mismas y evitar esa sensación que algunos alumnos tienen de “se me dan los exámenes tipo test”. Cuando se trata de preguntas con respuesta tipo verdadero / falso, la resolución de las mismas está más dirigida y el planteamiento es más específico. Las preguntas tipo test con varias posibles respuestas hacen referencia a conocimientos muy concretos y exigen un método de estudio diferente al que muchas personas han empleado hasta ahora. Básicamente todas las preguntas test tienen una característica común: exigen identificar una opción que se diferencia de las otras por uno o más datos de los recogidos en el enunciado. Las dos palabras en cursiva son expresión de dos hechos fundamentales con respecto a las preguntas tipo test: Como se trata de identificar algo que va a encontrar escrito, no va a ser necesario memorizar conocimientos hasta el punto de reproducir con exactitud lo que uno estudia. Por lo tanto, no debe agobiarse cuando no consiga recordad de memoria una serie de datos que aprendió hace tiempo; seguro que muchos de ellos los recordará al leerlos formando parte del enunciado o las opciones de una pregunta de test. El hecho de que haya que distinguir una opción de otras se traduce en muchas ocasiones en que hay que estudiar diferencias o similitudes. 11 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Habitualmente se les pide recordar un dato que se diferencia de otros por ser el más frecuente, el más característico, etc. Por lo tanto, este tipo de datos o situaciones son los que hay que estudiar. Debe tenerse siempre en cuenta que las preguntas test hay que leerlas de forma completa y fijándose en determinadas palabras que puedan resultar clave para la resolución de la pregunta. La utilidad de las preguntas test es varia: Acostumbrarse a percibir errores de conceptos. Adaptarse a los exámenes de selección de personal. Ser capaces de aprender sobre la marcha nuevos conceptos que pueden ser planteados en estas preguntas, conceptos que se retienen con facilidad. 1.3.7Envío Una vez estudiado el material docente, se contestará la encuesta de satisfacción, la cual nos ayudará para evaluar el Curso, corregir y mejorar posibles errores. Cuando haya cumplimentado la evaluación, envíe las respuestas a la dirección indicada. 12 UNIDADDIDÁCTICAII RECUERDOHISTOLÓGICO HistologíayCitologíaavanzadaII 2.1TejidoEpitelial 2.1.1DefinicióndelTejidoEpitelial. En los tejidos epiteliales, las células están estrechamente unidas entre sí formando láminas. La matriz extracelular es escasa y se ubica por debajo de las de células epiteliales. Ella forma una delgada capa llamada lámina basal. Las células soportan las tensiones mecánicas, por medio de resistentes filamentos proteicos que se entrecruzan, en el citoplasma de cada célula epitelial, formando el citoesqueleto. Para transmitir la tensión mecánica de una célula a las siguientes, estos filamentos están unidos a proteínas transmembrana ubicadas en sitios especializados de la membrana celular. Estas proteínas se asocian, en el espacio intercelular, ya sea con proteínas similares de la membrana de las células adyacentes, o con proteínas propias de la lámina basal subyacente. Los tejidos epiteliales limitan tanto las cavidades internas como las superficies libres del cuerpo. La presencia de uniones especializadas entre sus células permite a los epitelios formar barreras para el movimiento de agua, solutos o células, desde un compartimiento corporal a otro. Un epitelio separa el lumen intestinal de los tejidos subyacentes; y un epitelio separa a la pared intestinal de la cavidad abdominal. La estructura básica de los tejidos epiteliales corresponde a una lámina continua de células estrechamente asociadas entre sí, la que se adhiere a la matriz extracelular subyacente a ella. Existe, sin embargo, una variedad de formas de tejido epitelial, especializada cada una de ellas en una o más funciones específicas. Su función característica es formar barreras selectivas capaces de cubrir las superficies externas del organismo, y delimitar las diferentes superficies internas existentes en los distintos órganos. Son así capaces de modular la relación entre el tejido subyacente al epitelio y el medio que baña su superficie libre. A este gran grupo pertenecen los epitelios de revestimiento. Los epitelios pueden contener células especializadas en sintetizar moléculas específicas y secretarlas hacia la superficie que revisten. Los epitelios también pueden organizarse en glándulas, las que corresponden a estructuras complejas cuyas células están destinadas fundamentalmente a la secreción. A este grupo pertenecen los epitelios glandulares A continuación trataremos en especial a los Epitelios de Revestimiento, considerando los siguientes aspectos: 1. Funciones de los epitelios. 2. Clasificación tradicional. 3. Uniones entre células epiteliales. 4. Epitelios monoestratificados. 5. Polaridad celular en epitelios monoestratificados. 6. Lámina basal. 7. Uniones entre células y matriz extracelular. 15 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.1.2Funcionesquerealizanlosepitelios. Pueden presentar adaptaciones estructurales que les permiten realizar, como función principal, las siguientes tareas específicas: 1. Servir como barrera de protección. 2. Transportar material a lo largo de su superficie. 3. Absorber una solución de agua e iones desde el líquido luminal. 4. Absorber moléculas desde el líquido luminal hacia el tejido subyacente. 5. Sintetizar y secretar material glicoproteico hacia la superficie epitelial. 2.1.2.1Epiteliosquesirvencomobarreradeprotección Estos epitelios están formados por varios estratos de células, de las cuales sólo la primera capa está en contacto con la lámina basal. En este primer estrato se ubican las células troncales y a partir de ellas se forman continuamente nuevas células. Las nuevas células se diferencian mientras migran hacia los estratos más superficiales para reemplazar a las células que enfrentan la superficie libre, las que se desprenden finalmente del epitelio. La estructura del epitelio se mantiene estable gracias a una dinámica bien regulada entre los procesos de proliferación, diferenciación y descamación que enfrentan sus células. El caso más notable lo constituye la epidermis, epitelio plano pluriestratificado cornificado que sirve de protección ante los traumatismos mecánicos y forma una barrera impermeable al agua, capaz de proteger a los organismos terrestres de la desecación. Las células de los estratos más superficiales están rodeadas de un material rico en glicolípidos, sintetizado y secretado por ellas, el cual impide el paso de agua a través de estos espacios intercelulares de este epitelio. Las capas superficiales de células aparecen además como escamas córneas con su citoplasma lleno de manojos de filamentos de queratina asociados a la proteína filagrina. Estos manojos engloban a los organelos que ya no son visibles. 2.1.2.2Epiteliosquetransportanmaterialalolargodesusuperficielibre La superficie de los epitelios que realizan esta función está bañada por un líquido y en la cara luminal de las células presenta numerosos cilios. El epitelio de revestimiento de la tráquea es un buen ejemplo, ya que tanto las partículas y como los microorganismos presentes en el aire inhalado son atrapados en el mucus que baña su superficie y el desplazamiento de ellos es realizado por el movimiento coordinado de sus cilios. El batido de los cilios consiste en un desplazamiento hacia adelante, parecido al golpe de un látigo, que termina con el cilio completamente extendido, perpendicular a la superficie celular, y con su extremo en la capa de mucus (movimiento efectivo) Este movimiento es seguido de una ondulación hacia abajo y atrás (movimiento de preparación) durante la cual el extremo del cilio se aproxima a la superficie celular y el cilio se desplaza cerca de la célula en la capa acuosa de menor resistencia. 16 HistologíayCitologíaavanzadaII Para que se genere una onda organizada de movimiento que permita desplazar a la capa de líquido con las partículas que contenga, el movimiento de los cilios debe estar perfectamente coordinado, tanto en cada célula como entre las células adyacentes. 2.1.2.3Epitelioscapacesdeabsorberaguaeionesdesdeellíquidoluminal El epitelio de revestimiento de la vesícula biliar, responsable de la concentración de la bilis, es un buen ejemplo ya que para ello, absorbe Na+, Cl- y H20 desde la bilis. El epitelio libera hacia el tejido subyacente una solución de cloruro de sodio que es isotónica con la solución que baña su superficie luminal. Las células de este epitelio cilíndrico monoestratificado se caracterizan por: Su membrana plasmática luminal es permeable al agua, sodio y cloruro. La membrana plasmática de sus caras laterales contiene a la Na/K-ATPasa, capaz de transportar activamente sodio desde el citoplasma hacia el espacio intercelular, intercambiándolo por potasio. Esta membrana es además permeable al cloruro y al agua. Contiene abundantes mitocondrias, capaces de sintetizar el ATP necesario para el transporte activo de sodio. Al activarse el transporte activo de sodio, ocurre también la salida de Cl- desde la célula. El aumento de Na+ y Cl- en el espacio intercelular crea un microambiente hipertónico que genera la salida de agua desde el citoplasma. Mientras esta solución fluye por el espacio intercelular hacia la zona basal del epitelio, continúa el arrastre osmótico de agua, hasta que esta solución se hace isotónica con la del contenido luminal. Así la existencia de los espacios intercelulares permite acoplar el transporte activo de Na+ a la absorción de agua. 2.1.2.4Epiteliosqueabsorbenmoléculasdesdeellíquidoluminalhaciael tejidosubyacente. Estos epitelios se caracterizan porque la superficie luminal de las células presenta abundantes microvellosidades. Un caso típico es el epitelio de revestimiento del intestino delgado, en el cual ellas forman la chapa estriada. La existencia de las microvellosidades se traduce en un notable incremento del área de superficie celular expuesta al líquido luminal. La membrana plasmática luminal contiene proteínas que realizan el transporte específico de moléculas. Por ejemplo, la glucosa podrá entrar hacia el citoplasma siempre que sea co-transportadas con Na+. La concentración intracelular de Na se mantiene baja gracias a la Na/K -ATPasa, presente en la membrana celular de las caras laterales, que efectúa el transporte activo de Na+ hacia los espacios intercelulares. 2.1.2.5Epiteliosquesintetizanysecretanmaterialglicoproticohaciasu superficieepitelial Entre las células epiteliales especializadas en la secreción de glicoproteínas un buen ejemplo son las células caliciformes, ubicadas en el epitelio de revestimiento del intestino y la tráquea. Estas células, que funcionan como glándulas unicelulares, se caracterizan por tener en su citoplasma retículo endoplásmico rugoso y un aparato de Golgi muy desarrollado, organizados en forma tal que la secreción de las glicoproteínas ocurre sólo hacia el polo luminal de la célula, donde al hidratarse forman el mucus que baña a la superficie epitelial. 17 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.1.3Epiteliossimplesomonoestratificados La organización estructural básica de los epitelios monoestratificados, les permite especializarse para diversas funciones. El detalle de la organización estructural específica de diferentes epitelios estratificados y seudoestratificados se analizará al estudiar los órganos que los contienen. Al analizar la organización de un epitelio monoestratificado, tal como el epitelio de revestimiento del intestino delgado, destacan los siguientes hechos: Está formado por una sola capa de células, todas ellas cilíndricas. Existen al menos 2 tipos de células formando está única lámina epitelial: células glandulares secretoras de glicoproteinas y células especializadas en la absorción de componentes específicos desde el lumen intestinal hacia el estroma subyacente al epitelio. Las células que forman esta lámina epitelial se caracterizan por presentar una notable polaridad, tanto en la organización intracelular de sus organelos, como en la estructura de su membrana plasmática y en las especializaciones de las distintas superficies celulares. 2.1.4Unionesentrecélulasepiteliales(inrtercelulares) Las células epiteliales forman láminas continuas gracias a que cada célula epitelial tiene, en sus caras laterales, especializaciones que le permiten formar uniones estables con las células adyacentes. Existen tres clases de uniones intercelulares: 1. Uniones de adherencia entre las células, de las cuales existen dos tipos: - Zónulas adherentes o bandas de adhesión, presentes en el borde luminal de células de epitelios monoestratificados. - Desmosomas o máculas adherentes, distribuidos en las caras laterales de las células. 2. Uniones de oclusión del espacio intercelular, ubicadas vecinas al borde luminal de las células. 3. Uniones de comunicación entre los citoplasmas de células vecinas, distribuidas en las caras laterales de células adyacentes. 18 HistologíayCitologíaavanzadaII 2.1.4.1Unionesdeadherencia(odeanclaje), Formadas por: - Glicoproteínas transmembrana, cuyo dominio citoplasmático se asocia a proteínas intracelulares, mientras que su dominio extracelular interactúa con el de otra glicoproteína transmembrana ubicada en la membrana celular asociada al sistema de unión de la célula vecina. - Proteínas de unión intracelular, que conectan a la glicoproteína transmembrana de cada célula, con los elementos del citoesqueleto asociados al sistema de unión. - Filamentos del citoesqueleto asociados a la unión. Su función es formar uniones entre los citoesqueletos de las células epiteliales, permitiendo la transmisión de fuerzas mecánicas a lo largo de la lámina epitelial. Cuando la asociación es entre los microfilamentos de actina estas uniones reciben el nombre de zónulas adherentes o bandas de adhesión. Cuando la asociación es entre los citoesqueletos de filamentos intermedios estas uniones se denominan desmosomas o máculas adherentes 2.1.4.2Zónulasadherentes(obandasdeadhesión): Cada una ellas corresponden a una zona del borde celular lateral de cada célula, vecina a la superficie apical. Se reconocen en corte al microcopio electrónico porque: - Las membranas plasmáticas de células adyacentes corren paralelas, separadas por un espacio de 20 nm, ocupado por el dominio extracelular de las moléculas trasnmembrana de la familia de las caderinas , que en este caso corresponde a la E-caderina; en este espacio ocurre la unión entre las E-caderinas de ambas membranas. - La capacidad de adhesión intercelular celular de las caderinas depende de la presencia de Ca++. Una delgada placa densa a los electrones se asocia a la lámina interna de cada membrana celular; en ella se ubican los dominios intracelulares de las moléculas de caderina, asociadas a las moléculas de catenina las que se unen al citoesqueleto de actina. 19 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Los microfilamentos de actina se unen a a-actinina y vinculina forman un manojo paralelo a la membrana plasmática. A ellos se asocian a las moléculas de cateninas que los anclan lateralmente a las proteínas transmembrana. Su función es unir los citoesqueletos de actina, de las células epiteliales, a través de glicoproteínas transmembrana asociadas entre sí, formando una extensa red transcelular. La zónula adherente contribuye además a la mantención de la forma de la superficie luminal de las células diferenciadas y parece jugar un rol fundamental en la morfogénesis, y en los procesos de cambio en la forma de plegamiento de las láminas epiteliales. 2.1.4.3Desmosomas(máculasadherentes) Estas uniones tienen la forma de un botón (mácula) y se ubican en zonas discretas de los límites intercelulares. En cortes al microscopio electrónico de transmisión un desmosoma se reconoce porque: - Las membrana de las células adyacentes corren paralelas entre sí, separadas por a una espacio de unos 20 nm en el cual presenta una línea densa en su zona media adherida a la cara intracelular de la membrana plasmática se encuentra una gruesa banda llamada placa desmosómica insertos en la placa desmosómica aparecen numerosos filamentos intermedios. - El espacio entre las membranas adyacentes contiene a los dominios extracelulares de las glicoproteínas transmembrana de la familia de las caderinas, llamadas desmogleínas y desmocolinas. Mediante la interacción entre las caderinas que se enfrentan, ocurre la unión en el extracelular de las dos células adyacentes. El mantenimiento de la interacción entre las caderinas depende de la presencia de Ca++. El dominio citoplasmático de las desmogleínas y desmocolinas se ubica en la placa desmosómica. En este sitio se une a proteínas intracelulares llamadas desmoplaquinas y placoglobinas, las que se asocian también con los filamentos intermedios que se insertan en la placa formando una horquilla. Los desmosomas pueden ubicarse vecinos entre sí, en todo el contorno celular que mira hacia los espacios intercelulares. Esto resulta muy evidente en los epitelios pluriestratificados. Su función es mantener unidas a las células del epitelio, asociando los citoesqueletos de filamentos intermedios de las células vecinas, formando así una red transcelular con una alta resistencia a la tracción mecánica. Permite así que las células mantengan su forma y que la lámina epitelial exista en forma estable. 2.1.4.3Unionesdeoclusión:zónulasocluyentes Ellas forman una banda continua en todo el borde apical de las células epiteliales. Se reconocen en cortes perpendiculares, observados al microscopio electrónico de transmisión porque las membranas plasmáticas de las dos células adyacentes parecen fusionarse cerca del borde apical, desapareciendo el espacio intercelular en zonas de 0,1 a 0,3 mm de longitud. El aspecto de esta zona resulta de la existencia de múltiples puntos de contacto entre las láminas externas densas de las membranas celulares. Estos puntos 20 HistologíayCitologíaavanzadaII de contacto resultan de la interacción, en el extracelular, de un tipo especial de proteínas transmembrana llamadas occludinas, que se caracterizan por presentar una zona hidrofóbica en su dominio extracelular, lo que permite la interacción entre dos occludinas que se enfrentan en el espacio intercelular. Esta zona se extiende en forma de cinturón alrededor de todo el perímetro celular, interactuando cada célula con las células adyacentes a ella, cerrándose así el espacio intercelular. En preparaciones por criofractura a través de una zónula ocluyente se observa que las caras de la membrana plasmática presentan una serie de estructuras lineales. En la cara citoplasmática de la membrana, aparecen como cresta o eminencias, mientras que en la cara extracelular de la membrana aparecen como surcos poco profundos. Cada una de estas eminencias lineales está formada por la asociación de sucesivas moléculas de occludinas; mientras que los surcos lineales corresponden a los sitios ocupados previamente por moléculas de occludina que al ocurrir la fractura quedaron en la otra cara de la membrana celular. El número de líneas y su entrecruzamiento varía según el tipo de epitelio. Las células del revestimiento gástrico muestran unas zónulas ocluyentes muy anchas y con muchos puntos de fusión. Las zónulas ocluyentes entre los hepatocitos muestran pocos puntos de fusión y más separados. 21 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.1.4.4Unionesdecomunicación(unionesdehendidura): Estas uniones tienen forma de botón y se distribuyen en forma discreta en los límites intercelulares. Se reconocen en cortes al microscopio electrónico de transmisión porque: Las membranas plasmáticas adyacentes, corren paralelas entre sí, separadas por 20 nm. En cortes adecuados es posible observar que un bandeo fino atraviesa este espacio intercelular. La existencia de estructuras atravesando este espacio se demuestra al marcar con trazadores el espacio intercelular En preparaciones obtenidas por criofractura, la cara citoplasmática de la membrana (cara P) presenta un número variable de partículas que hacen eminencia, mientras que la cara E (extracelular) complementaria muestra un conjunto de invaginaciones cuyo tamaño y disposición concuerdan con la disposición de las partículas en la cara P. Las partículas que se observan en la cara P forman las unidades funcionales de las uniones y se llamadas conexones. Los conexones están formados por 6 proteínas transmembrana llamadas conexinas, las cuales al interactuar entre sí pueden dejar un canal hidrofílico central. Los dominios extracelulares de los conexones pueden interactuar entre sí, uniendo a las células y creando un canal hidrofílico entre los citoplasmas de las células adyacentes. Su función es formar un canal que atraviese las membranas de células vecinas, permitiendo la comunicación entre sus citoplasmas. La apertura del canal, regulando la posición de las conexinas, permite a las células tanto su acoplamiento eléctrico como metabólico. 22 HistologíayCitologíaavanzadaII 2.1.5Clasificacióntradicionaldelosepitelios Considerando el número de capas celulares que forman los distintos tipos de epitelios que existen en el organismo, ellos se subdividen en: - Epitelios simples o monoestratificados: láminas epiteliales formadas por sólo una capa de células. - Epitelios estratificados: formados por dos o más capas celulares. - Epitelios seudo estratificados: son aquellos que parecen estratificados pero todas sus células llegan a la membrana basal mientras que sólo las células más altas forman la superficie luminal. De acuerdo a la forma de sus células se clasifican en: - Planos o escamosos: las células son planas, mucho más anchas que altas. A este tipo corresponde la hoja parietal de la cápsula de los glomérulos renales, el endotelio de los vasos sanguíneos, y el mesotelio del peritoneo. - Cúbicos: sus células tienen un ancho similar a su alto. Se les encuentra, por ejemplo, revistiendo los tubos colectores y los túbulos distales en la médula renal externa. - Cilíndricos: cuyas células tiene un alto mucho mayor que su ancho. A este tipo corresponde el que revisten el lumen de la vesícula biliar, cuyas células realizan la reabsorción de agua y cloruro de sodio, y el epitelio de revestimiento gástrico con células capaces de sintetizar una secreción glicoproteica. 2.1.5.1EpiteliosEstratificados Ellos están formados por un número variable de capas celulares. Las células de capa tienen formas diferentes. El nombre específico del epitelio estratificado se define según la forma de las células vecinas a la superficie: - Estratificados planos: sus células más superficiales son planas, mientras que las adyacentes a la lámina basal son cilíndricas y las células de los estratos intermedios son más bien hexaédricas. Este tipo de epitelio reviste superficie tales como el lumen del esófago. - Estratificados cuboidales: cuyas células superficiales son poliedros con un alto parecido a su ancho. Revisten los conductos interlobulillares de las glándulas salivales. - Estratificados cilíndricos: cuyas células superficiales son poliedros más altos que anchos. Revisten, por ejemplo, los conductos interlobulillares en la glándula mamaria - Epitelios de transición: propios de las vías renales, aparecen estratificados pero su forma cambia según el estado de distensión del lumen del órgano. Aparecen estratificados planos cuando la lámina epitelial esta tensa y como estratificados cuboidales cuando el epitelio está distendido. Ellos parecen, sin embargo corresponder a un tipo especial de epitelio seudo estratificado, que puede modificar la forma de sus células. 23 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.1.5.2Epiteliosseudoestratificados Ellos parecen estar formados por dos o más capas de células. Sin embargo, si bien todas sus células están en contacto con la lámina basal, sólo algunas células llegan hasta el borde luminal. Por ello presentan dos o más filas de núcleos, ubicados a alturas sucesivas en la lámina epitelial. Se les encuentra revistiendo el lumen de la tráquea o de conductos como el epidídimo. La superficie de las células que llegan al lumen presenta, por lo general, diferenciaciones tales como cilios o largas microvellosidades llamadas estereocilios. 2.1.5.3Polaridadcelularenepiteliosmonoestratificados La organización Polarizada de las células que forman la lámina epitelial es una característica fundamental de los epitelios. La manutención de esta propiedad, depende de las interacciones que establecen las células epiteliales tanto entre sí, como con la matriz extracelular de su membrana basal. En las células de los epitelios simples, la polaridad se manifiesta en: - Diferencias en la estructura y en las propiedades de las superficies apical, lateral y basal de cada célula una distribución vectorial de los organelos celulares en el interior del citoplasma, para facilitar mecanismos tales como absorción de iones o la secreción de glicoproteínas. - Una composición molecular de la membrana plasmática que reviste la superficie luminal de las células, diferente a la de la membrana que cubre la superficie lateral y la superficie basal. 2.1.5.4Superficieluminaldelascélulasepiteliales Ella puede presentar especializaciones del citoplasma y de la superficie celular, de acuerdo a la función que desempeña el epitelio. Entre ellas destacan la existencia de prolongaciones digitiformes del citoplasma de la superficie libre, las cuales pueden ser de dos tipos: las microvellosidades y los cilios. 24 HistologíayCitologíaavanzadaII 2.1.5.5Microvellosidades Son particularmente numerosas en aquellos epitelios simples que cumplen funciones de absorción y transporte transepitelial. Los túbulos proximales del riñón (ribete en cepillo) y el epitelio de revestimiento intestinal (chapa estriada) presentan este tipo de diferenciación. Estructura de las microvellosidades Estas estructuras digitiformes miden 0,080 mm de ancho y 1.0 mm de longitud y producen un aumento en la superficie de absorción de alrededor de 20 veces. Al centro de cada microvellosidad se localiza un manojo de 20 a 30 microfilamentos de actina que le sirve de soporte. Estas prolongaciones de la superficie luminal, de 0.08 mm de ancho y 1.0 mm de longitud, poseen un eje de microfilamentos de actina, que les sirve de soporte y les otorga rigidez. Cada microvellosidad posee un manojo de 20 a 30 microfilamentos, que nace en la punta de la microvellosidad y se extiende hacia la corteza celular. Los microfilamentos se disponen con su extremo (+) asociado a la punta de la microvellosidad. Allí se insertan en un material denso, de composición química no establecida. Estos filamentos se mantienen unidos entre sí, a intervalos regulares, a través de dos proteínas ligantes de actina, la villina y la fimbrina. A su vez, el manojo de microfilamentos de actina se une a la membrana de la microvellosidad por puentes laterales formados por miosina-1, a cuya cola se asocian moléculas de calmodulina. Los manojos de filamentos de actina que abandonan la base de las microvellosidades, se anclan en la red terminal. Esta es una región especializada del cortex apical de las células intestinales que contiene, entre otras proteínas citoesqueléticas, una densa malla de espectrina que entrecruza los microfilamentos de manojos adyacentes. Por debajo de esta malla, se dispone una red de filamentos intermedios de citoqueratina, en los cuales se insertan los microfilamentos. El anclaje de los microfilamentos a esta zona le otorga rigidez a las microvellosidades. La membrana que cubre las microvellosidades intestinales es altamente especializada, y presenta una gruesa cubierta extracelular, rica en polisacáridos, denominada cubierta celular o glicocálix. Los carbohidratos, que forman la cubierta celular, corresponden a oligosacáridos presentes en glicolípidos, proteoglicanos y glicoproteínas integrales de la membrana. En el 25 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología caso del epitelio intestinal, algunas glicoproteínas, que forman parte del glicocálix, corresponden a disacaridasas y a g-glutamiltranspeptidasas, enzimas que participan en el proceso digestivo. 2.1.5.6Cilios Los cilios son diferenciaciones de la superficie apical de células presentes en epitelios que participan en el transporte de sustancias a lo largo de la superficie epitelial. Así, los epitelios que tapizan el tracto respiratorio, el útero y el oviducto poseen numerosas células ciliadas. Cada una de estas prolongaciones del citoplasma luminal mide 8 mm longitud y 0.25 mm de diámetro, y contienen un eje de microtúbulos que forma parte del axonema. Estructura molecular de los cilios Los cilios son prolongaciones del citoplasma apical de 8 mm de longitud y 0.25 mm de diámetro, que contiene un eje de microtúbulos llamado axonema. En cada axonema hay un par central de microtúbulos y nueve pares periféricos. Esta disposición 9+2 es característica de los cilios. Mientras que cada microtúbulo del par central es un microtúbulo completo, cada de uno de los dobletes externos se compone de un microtúbulo completo y otro parcial, fusionados de tal manera que comparten parte de su pared. Las proteínas que se asocian a los microtúbulos del axonema, se disponen en forma regular a lo largo de los microtúbulos. Sus principales funciones son: a) Mantener unidos a los microtúbulos que forman el axonema. b) Generar la fuerza que permite el movimiento de inclinación del cilio. Regular la interacción de los componentes del axonema para producir un cambio coordinado en la forma del cilio. La más importante de estas proteínas accesorias es la dineína ciliar, proteína con actividad ATPásica, cuyos brazos laterales se extienden entre los pares de microtúbulos que forman los dobletes externos. Esta proteína es responsable de generar la fuerza de deslizamiento entre los dobletes que permite la inclinación de los cilios. 2.1.5.7Superficielateraldelascélulasepiteliales. En la zona vecina a la superficie del epitelio, la superficie lateral de las células presenta un sistema de uniones intercelulares llamado complejo de unión. Este sistema une a las células entre sí y define las caras luminal y basolateral de cada célula. El complejo de unión está formado por la asociación de tres tipos de uniones intercelulares: 1. La zónula ocluyente o banda de oclusión. 2. la zónula adherente o banda de adhesión. 3. Desmosomas o mácula de adhesión. 26 HistologíayCitologíaavanzadaII La zónula ocluyente juega un rol fundamental en el mantenimiento de una diferencia en la composición molecular de las membranas apical y basolateral. Los lípidos de la lámina interna de la bicapa lipídica difunden lateralmente a través de la zona de oclusión, en cambio los lípidos de la lámina externa no pueden atravesarla. A su vez, las proteínas intrínsecas se desplazan libremente en su dominio de la membrana celular, pero no pueden atravesar la zona de oclusión para pasar al dominio adyacente. Si las uniones estrechas desaparecen, la asimetría en la distribución de moléculas entre las membranas luminal y basolateral desaparece, perdiéndose la organización polarizada de la membrana celular epitelial. 2.1.5.8Superficiebasaldelascélulasepiteliales La superficie basal de las células epiteliales descansa sobre una especialización de la matriz extracelular, denominada lámina basal. Esta estructura se une a la membrana plasmática basal a través de proteínas receptoras específicas, que forman parte de las uniones adherentes de la base. La base de la mayoría de los epitelios, presenta un contorno liso. Sin embargo, los epitelios especializados en el transporte de electrolitos y agua, suelen presentar profundos pliegues basales que permiten la amplificación de la superficie basal. 2.1.5.9Láminabasal Es una especialización de la matriz extracelular, que se ubica entre el epitelio y el tejido conjuntivo subyacente. Las moléculas que la forman son sintetizadas, en forma conjunta, por las células epiteliales y las células conjuntivas subyacente. Al microscopio electrónico de transmisión la lámina basal aparece formada por la lámina densa, delgada capa amorfa que sigue estrechamente el contorno basal de la célula y que aparece separada de la superficie celular por la lámina lúcida o rara. Por debajo de la lámina basal, existe una capa de grosor variable llamada lámina reticular, formada, principalmente, de fibrillas reticulares sintetizadas por células conjuntivas. La asociación de la lámina basal con estas fibrillas colágenas se denomina membrana basal la que es visible al microscopio de luz. En órganos en que los vasos sanguíneos se adosan estrechamente al epitelio, como en el glomérulo renal y en los alvéolos pulmonares, las láminas basales producidas por el endotelio y el epitelio se fusionan. Por convención, la lámina rara vecina al endotelio se le denomina lámina rara interna y la cercana al epitelio lámina rara externa. 2.1.5.10Estructuramoleculardelaláminabasal. La lámina basal es, esencialmente, un retículo laminar de colágeno tipo IV unido a moléculas específicas que le permiten asociarse a las células vecinas y/o a la matriz extracelular. Las moléculas asociadas al colágeno corresponden a glicoproteínas: laminina y entactina, y a proteoglicanos de heparán sulfato, llamados perlecanes. La localización immunocitoquímica de estas moléculas muestra la siguiente distribución en la lámina basal: - El colágeno de tipo IV se ubica en la lámina densa. - Las moléculas de proteoglicano se concentran a ambos lados de la lámina densa. 27 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - La lámina, molécula de 120 nm de longitud, atraviesa ambas láminas. La lámina contribuiría a anclar las células epiteliales a la lámina densa ya que ella tiene sitios de unión para moléculas de integrina de la membrana celular de la base celular, para colágeno de tipo IV y para entactina. - La entactina posee sitios de unión para colágeno tipo IV y laminina. De ahí que se plantee que juega un rol en la asociación de la malla de colágeno tipo IV a laminina. - La fibronectina une la lámina densa a fibrillas colágenas de la lámina reticular. Funciones de la lámina basal Entre las funciones de la lámina basal destacan: a) Sirve de elemento de anclaje para las células epiteliales. b) Participa en la determinación de la polaridad celular. c) Induce diferenciación celular. d) En el glomérulo renal actúa, además, como barrera de filtración selectiva. Uniones adherentes de la base celular a la matriz extracelular. Los epitelios se adhieren al tejido conjuntivo subyacente, a través de la lámina basal. Las macromoléculas que forman a la lámina basal interactúan específicamente con proteínas receptoras específicas presentes en la membrana plasmática de la base celular, las cuales interactúan a su vez en el citoplasma con filamentos del citoesqueleto celular. Cuando la unión está asociada con filamentos intermedios se trata de un hemidesmosoma y cuando es el citoesqueleto de actina el que se ancla en la unión se trata de contactos focales. 2.1.5.11Hemidesmosomas Tal como su nombre lo indica, su ultraestructura es similar a la mitad de un desmosoma sin embargo las moléculas que lo forman son diferentes. Están formados por una placa densa adosada a la membrana celular, en la cual los filamentos intermedios se insertan uniéndose a proteínas de conexión, del tipo de las desmoplaquinas, las cuales se conectan a la porción citoplasmática de las proteínas integrales de la membrana celular, que pertenecen a la familia de las integrinas. La porción extracelular de cada molécula de integrina actúa como receptor capaz de unirse específicamente a moléculas de laminina o a moléculas de colágeno IV de la membrana basal. 2.1.5.12Contactosfocales En este caso son los microfilamentos de actina los que se asocian a la matriz extracelular. Las proteínas de unión transmembrana, que participan en este tipo de unión, son de la familia las integrinas. El dominio intracelular de la integrina se une a traves de una proteina conectora llamada talina, asocia ls proteínas asociadas al microfilamento de actina la vinculina y la a-actinina. El dominio extracelular de la integrina se une a moléculas de la lámina basal. 28 HistologíayCitologíaavanzadaII 2.1.13Plieguesbasales El aumento de la superficie basal, es una característica de las células que realizan absorción activa de Na+, con arrastre osmótico de agua. Las células del túbulo proximal del riñón y las de los conductos excretores de las glándulas salivales, presentan esta diferenciación basal. El ATP necesario, para la actividad de la bomba de Na+, es producido por mitocondrias que se ubican en el citoplasma de los pliegues basales. La disposición paralela de estos organelos, le da un aspecto estriado a la región basal celular. En la membrana plasmática, que reviste las profundas invaginaciones del citoplasma basal, se localiza la (Na-K)-ATPasa, que transporta activamente al Na+ hacia el exterior de la célula. Se crea así una alta concentración de NACl entre los pliegues basales, lo que genera salida de agua por arrastre osmótico. 2.2TejidoConjuntivo 2.2.1Definiciónyfuncionesdelostejidosconjuntivos Los tejidos conjuntivos, derivados del mesénquima, constituyen una familia de tejidos que se caracterizan porque sus células están inmersas en un abundante material intercelular, llamado la matriz extracelular. Existen 2 variedades de células conjuntivas: - Células estables, las que se originan en el mismo tejido y que sintetizan los diversos componentes de la matriz extracelular que las rodea. - Población de células migratorias, originadas en otros territorios del organismo, las que llegan a habitar transitoriamente el tejido conjuntivo. La matriz extracelular es una red organizada, formada por el ensamblaje de una variedad de polisacáridos y de proteínas secretadas por las células estables, que determina las propiedades físicas de cada una de las variedades de tejido conjuntivo. Existen varios tipos de tejidos conjuntivos localizados en diversos sitios del organismo, adaptados a funciones específicas tales como: - Mantener unidos entre sí a los otros tejidos del individuo, formando el estroma de diversos órganos: Tejidos Conjuntivos Laxos. 29 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Contener a las células que participan en los procesos de defensa ante agente extraños: constituyendo el sitio donde se inicia la reacción inflamatoria. Tejidos Conjuntivos Laxos. - Constituir un medio tisular adecuado para alojar células en proceso de proliferación y diferenciación para formar los elementos figurados de la sangre correspondientes a glóbulos rojos y plaquetas, y a los distintos tipos de glóbulos blancos, los que migran luego a los tejidos conjuntivos, para realizar en ellos sus funciones específicas ya sea como células cebadas, macrófagos, células plasmáticas, linfocitos y granulocitos. Tejidos Conjuntivos Reticulares. - Almacenar grasas, para su uso posterior como fuente de energía, ya sea por ellos mismos o para otros tejidos del organismo. Tejidos Adiposos. - Formar láminas con una gran resistencia a la tracción, tal como ocurre en la dermis de la piel, y en los tendones y ligamentos Tejidos Conjuntivos Fibrosos Densos. - Formar placas o láminas relativamente sólidas, caracterizadas por una gran resistencia a la compresión. Tejidos Cartilaginosos. - Formar el principal tejido de soporte del organismo, caracterizado por su gran resistencia tanto a la tracción como a la compresión. Tejidos Óseos. 2.2.2CélulasConjuntivas Las células que están presentes, normalmente, en corresponden a dos grupos distintos: - 30 los tejidos conjuntivos Células propias de cada tipo de tejido conjuntivo, las que constituyen una población celular estable, responsable de la formación y el mantenimiento del tejido al que pertenecen, razón por la cuál se las llama células de sostén. HistologíayCitologíaavanzadaII - Células conjuntivas libres, que han llegado a residir en los tejidos conjuntivos. Estas células se forman en los órganos hematopoyéticos, circulan como glóbulos blancos en la sangre, y migran luego a un tejido conjuntivo en particular, estableciéndose en él. Se distinguen entre ellas: Células de vida media larga, capaces de dividirse en el tejido conjuntivo que habitan: células cebadas y fagocitos mononucleares o macrófagos. Células de vida media corta, que no se dividen, y cuya concentración en una a zona del tejido conjuntivo se relaciona con procesos de defensa del organismo: células plasmáticas, linfocitos y fagocitos porlimorfonucleares. 2.2.2.1Célulaspropiasdelostejidosconjuntivos Las células llamadas estables o de sostén corresponden a un grupo de células diferenciadas cuyo principal rol es producir la matriz intercelular propia de cada tipo de tejido conjuntivo. Ellas se forman a partir de células mesenquimáticas localizadas en los sitios del organismo en que van a formar al tejido conjuntivo. Estas células se caracterizan por encontrarse en proceso de activa diferenciación para sintetizar a la matriz extracelular que caracteriza al tipo de tejido conjuntivo que corresponda. Ellas pueden diferenciarse como: - Fibroblastos - Lipoblastos - Condroblastos - Osteoblastos Se caracterizan, al microscopio de luz, por su basofilia citoplasmática. Poseen un retículo endoplásmico rugoso bien desarrollado, un aparato de Golgi definido y escasas vesículas de secreción, organelos que se relacionan con la síntesis de moléculas 31 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología precursoras del colágeno, elastina, proteoglicanos y glicoproteínas de la matriz extracelular. Cuando estas células se hallan en fase de relativa quiescencia en la matriz extracelular que han formado se las llama: fibrocitos, osteocitos y condrocitos. Los lipoblastos se diferencian posteriormente a células adiposas cuyo principal rol es almacenar grasas. Los Fibroblastos producen los tejidos conjuntivos fibrosos cuya matriz extracelular está constituida por fibras colágenas y fibras elásticas, asociadas a glicosaminoglicanos, proteoglicanos y glicoproteínas. Los Condroblastos producen el tejido cartilaginoso, cuya matriz extracelular se caracteriza por la presencia de una cantidad importante de proteoglicanos asociados a ácido hialurónico y a microfibrillas de colágeno tipo II. Al quedar totalmente rodeados por la matriz cartilaginosa ellos pasan a llamarse condrocitos. Los Osteoblastos producen el tejido óseo, sintetizando el componente orgánico de la matriz extracelular ósea que se caracteriza por un alto contenido en colágeno tipo I, glicosaminoglicanos y gliproteínas. Al quedar totalmente rodeados por la matriz ósea pasan a llamarse osteocitos. Los Lipoblastos producen el tejido adiposo. Ellas se diferencian a células almacenadoras de grasa, sintetizan su matriz extracelular y se rodean de una lámina basal. Ellos pasan así a formar los adipocitos o células adiposas. 2.2.2.2Célulasconjuntivaslibres Estas células se originan en la médula ósea hematopoyética y usan la circulación sanguínea como un medio de transporte hacia los tejidos conjuntivos, donde realizan sus principales funciones. Entre ellas se encuentran las células cebadas(o mastocitos) y los macrófagos (o histiocitos) que son componentes estables del tejido conjuntivo al que llegan. Un grupo distinto lo forman las células plasmáticas, los linfocitos y los granulocitos polimorfonucleares, todos ellos células de vida media relativamente corta y que tienden a concentrarse en las zonas de tejido conjuntivo en que ocurren reacciones relacionadas con la defensa. 2.2.2.3Célulascebadas Son células grandes de forma redondeada (20-30 um) y al microscopio de luz se caracterizan por presentar el citoplasma llena de gránulos basófilos que se tiñen metacromáticamente con azul de toluidina. Su núcleo es esférico y está situado en el centro de la célula. Ellas se ubican de preferencia vecinas a los vasos sanguíneos. Los gránulos contienen heparina, proteoglicano sulfatado de unos 750 kD, que forma la matriz de los gránulos. A esta macromolécula se asocian varias moléculas de bajo peso molecular, cargadas positivamente, como histamina; proteasas neutras, y factores quimiotácticos para eosinófilos y para neutrófilos. Su superficie muestra largas prolongaciones muy finas, su citoplasma contiene pocos organelos y sus gránulos pueden presentar un grado variable de compactación. 32 HistologíayCitologíaavanzadaII En la membrana de las células cebadas se ubican receptores para el fragmento Fc de las IgE, anticuerpos secretadas por las células plasmáticas. Cuando la IgE, anclada en su receptor, se une a su antígeno se produce una señal hacia el citoplasma de la célula cebada que: - Estimula la síntesis de leucotrieno y su liberación hacia el extracelular. - Induce la exocitosis de los gránulos y entre las sustancias liberadas destaca la histamina, que aumenta la permeabilidad de las vénulas, con lo que aumenta el líquido en la matriz extracelular conjuntiva, produciendo edema. Se origina así una reacción de hipersensibilidad inmediata a escasos minutos de haber penetrado el antígeno (alergeno) la que se manifiesta en fenómenos como edema, rinitis alérgica, asma y shock anafiláctico. La principal función de las células cebadas es almacenar los mediadores químicos de la respuesta inflamatoria. Comparten así muchas características con los leucocitos basófilos de la sangre, pero son otra familia celular. 2.2.2.4Macrófagos Son células mononucleadas que se caracterizan por su capacidad de fagocitar y degradar material reticulado. Se originan a partir de células de la médula ósea que dan origen a los monocitos de la sangre los que luego migran desde el lumen de los capilares sanguíneos al tejido conjuntivo donde terminan su diferenciación. Los macrófagos de los tejidos conjuntivos miden entre 10 y 30 um de diámetro y su estructura se modifica según su estado de actividad. Su superficie presenta numerosas prolongaciones digitiformes, su núcleo es indentado, y en su citoplasma presenta numerosas vacuolas endocíticas, lisosomas primarios y fagolisosomas. Tienen un retículo endoplásmico rugoso desarrollado y su aparato de Golgi es prominente. Poseen, además, microtúbulos, filamentos intermedios y microfilamentos de actina. Los macrófagos activados tienen más prolongaciones de membrana, un mayor número de vacuolas, lisosomas, fagosomas y cuerpos residuales. Estas células se reconocen facilmente cuando han fagocitado partículas visibles al microscopio. En respuesta a ciertos procesos infecciosos los macrófagos se pueden fusionar originando células de 20 más núcleos llamadas células gigantes multinucleadas. Bajo estímulos adecuados también modifican su aspecto rodeando materiales extraños y formando las llamadas células epitelioides de cuerpo extraño. Entre sus funciones destacan: - Su alta capacidad fagocítica les permite cumplir un rol importante en la eliminación de microorganismos, tejidos dañados y contaminantes reticulados. - Su capacidad de secretar diversos factores y su participación en la respuesta inmune como células presentadoras de antígeno, se discutirán en el capítulo de Linfático y Defensa Inmune. 33 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.2.2.5Célulasplasmáticas Las células plasmáticas se originan en los tejidos linfáticos por diferenciación de linfocitos B activados y llegan a los tejidos conjuntivos por la circulación sanguínea. En los tejidos conjuntivos su vida media es de 10 a 20 días. Su función es sintetizar y secretar los anticuerpos, moléculas que pertenecen a una familia de proteínas específicas llamadas inmunoglobulinas. Estas células tienen de 10 a 20 um de diámetro, su forma es ovalada con un citoplasma muy basófilo. El núcleo redondo y excéntrico, se caracteriza porque la heterocromatina se dispone como ruedas de carreta. Su citoplasma se caracteriza por un gran desarrollo del retículo endoplásmico rugoso responsable de la basofilia de su citoplasma y por una aparato de Golgi yuxtanuclear muy desarrollado. Los anticuerpos que está sintetizando se pueden localizar inmunocitoquímicas ubicados tanto en el espacio perinuclear, como en las cisternas del retículo endoplásmico rugoso del aparato de Golgi. Normalmente no se observan gránulos de secreción almacenados en el citoplasma de estas células. 2.2.2.6Linfocitos Son leucocitos agranulocitos que juegan un rol fundamental en la respuesta inmune. La mayoría de los linfocitos circulantes son linfocitos pequeños (6-8 um de diámetro). Aunque estructuralmente iguales, mediante marcadores citoquímicos es posible distinguir 3 tipos de linfocitos: linfocitos B, T y nulos. Los linfocitos de los tejidos conectivos corresponden a linfocitos pequeños, de 6 a 8 um de diámetro. Poseen un núcleo ovoide con cromatoma muy condensada y una pequeña cantidad de citoplasma suavemente basófilo. Presentan una superficie irregular debido a la presencia de numerosas proyecciones citoplasmáticas.. El citoplasma contiene escasas mitocondrias, ribosomas libres, cisternas de ergastoplasma, un Golgi pequeño y granos azurófilos. Según la variedad de linfocito de que se trate su vida media celular pueden variar entre unos pocos días hasta meses y años. Su duración como células libres del tejido conjuntivo es en general de pocos días. Cumplen un rol fundamental en la respuesta inmune. Relaciones complejas entre linfocitos B, linfocitos T y células presentadoras de antígeno generan las respuestas de defensa inmune humoral y celular. A su vez, los linfocitos nulos participan en los mecanismos de defensa dando origen a células asesinas. 2.2.2.7Granulocitospolimorfonucleares Corresponden a leucocitos que presentan un núcleo lobulado (polimorfonucleares) y contienen en su citoplasma gránulos específicos. Existen tres tipos: 1. Polimorfonucleares neutrófilos 2. Eosinófilos 3. Basófilos 34 HistologíayCitologíaavanzadaII 1. Polimorfonucleares neutrófilos. Su vida media en los tejidos conjuntivos de 1 a 4 días. Son células de 12 a 15 um de diámetro, cuyo núcleo está formado por 2 a 5 lóbulos de cromatina condensada unidos entre sí. Poseen un abundante citoplasma relativamente pobre en organelos que contiene 2 variedades de gránulos que se tiñen poco con los colorantes usuales. Los gránulos específicos contienen fosfatasa alcalina, colagenasa, lactoferrina y proteínas básicas como lisozima y fagocitinas y los granos azurófilos a lisosomas primarios. El citoplama es en general pobre en otro tipo de organelos. Constituyen un mecanismo de defensa contra la invasión de microorganismos, especialmente bacterias. Fagocitan activamente partículas pequeñas por lo que se les ha llamado fagocitos morfonucleares para distinguirlos de los macrófagos. 2.2.3Matrizextracelular El análisis microscópico de la estructura del material intercelular muestra: - Elementos fibrilares bien estructurados llamados fibras conjuntivas, que pueden ser colágenas, reticulares o elásticas. - Un material poco estructurado al que se denomina sustancia fundamental amorfa. - En los sitios en que la matriz extracelular conjuntiva se asocia a células de otros tejidos se observan las láminas basales. El análisis de la composición molecular del espacio intercelular demuestra que las tres principales clases de macromoléculas extracelulares son: - Cadenas de polisacáridos de la clase de los glicosaminoglicanos, que pueden unirse covalentemente a proteínas, formando macromoléculas más complejas llamadas proteoglicanos. Estas moléculas forman el gel altamente hidratado que constituye la sustancia fundamental en la cuál están embebidas las células y fibras conjuntivas. La fase acuosa del gel de polisacáridos permite una rápida difusión de nutrientes, metabolitos y hormonas entre la sangre y las células titulares. - Proteínas fibrosas que se organizan para formar estructuras bien definidas de la matriz extracelular como son las fibrillas colágenas, la lámina densa de las las láminas basales y las fibras elásticas. - Glicoproteínas de adhesión como fibronectina que asocian entre sí a células, fibras y proteoglicanos del tejido conjuntivo y como laminina que asocia la lámina basal a las células que están rodeadas por ella. Las variaciones en las cantidades relativas de las distintas macromoléculas presentes y en la forma en que están organizadas dan origen a variedades tan diversas de matriz como son la dura matriz extracelular del hueso y la transparente matriz extracelular de la córnea. 2.2.3.1Fibraselásticas Las fibras elásticas se estiran fácilmente y recuperan su longitud original cuando la fuerza deformante ha desaparecido. Al microscopio electrónico aparecen formadas por un componente amorfo rodeado y penetrado por microfibrillas de unos 10 nm de diámetro. 35 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El principal componente de las fibras elásticas es la elastina, material proteico muy insoluble. Se caracteriza por un alto contenido en aminoácidos apolares como prolina y valina y tiene un alto contenido en aminoácidos no cargados como la glicina. Contiene además dos aminácidos exclusivos: desmosina e isodesmosina. La elastina se forma por las interacciones entre moléculas solubles de tropoelastina, proteína de unos 70.000 de PM que contiene el aminacido lisina y carece del aminoácido desmosina. Se ha propuesto que en estado de reposo la hebra polipeptídica rica en aminoácidos apolares se encuentra plegada sobre sí misma y que al tensionar la fibra elástica se induce el estiramiento de esta zona en cada una de las hebras polipeptidica las que son obligadas a ponerse paralelas entre sí, enfrentándose al medio acuoso del extracelular, permaneciendo unidas sólo a nivel de las desmosinas. Al desaparecer la fuerza deformante cada una de estas zonas de las hebras polipeptídicas recuperan su conformación plegada en forma espontáneas y la fibra elástica recupera su longitud inicial. Las microfibrillas tienen como principal componente una glicoproteína llamada fibrilina, rica en aminoácidos hidrofílicos y que contiene residuos de cistina los cuales pueden formar puente disulfuro, estabilizando la estructura de las microfibrillas. En las fibras elásticas juegan un rol estructural, formando una especie de vaina alrededor de la elastina, permitiendo así la formación de estructuras fibrilares elásticas. En ausencia de microfibrillas la elastina se deposita formando láminas elásticas, como ocurre por ejemplo en la pared de las arterias. Estructuras formadas por fibrillas colágenas. Las fibrillas colágenas forman estructuras que se caracterizan por su gran resistencia a las fuerzas de tracción y el modo en que ellas se asocian entre sí varía de un tejido conjuntivo a otro. Ellas son el principal componente de: a) Las fibras colágenas de los tejidos conjuntivos fibrosos. b) Las fibras reticulares. c) Las laminillas colágenas del hueso. Cada fibrilla colágena está formada por la asociación de moléculas de colágeno, proteínas fibrosas de varios tipos, que constituyen más del 25% de la masa proteica total de los mamíferos. Las moléculas de colágeno se asocian formando polímeros que corresponden a las fibrillas colágenas visibles al microscopio electrónico, las cuales pueden tener cientos de mm de largo y presentan una estriación transversal característica repetida cada 67 nm, la que refleja la disposición regularmente espaciada de las moléculas de colágeno. El diámetro de las fibrillas varía entre 10 y 300 nm, según el tipo de colágeno de que se trate. Las moléculas del colágeno son largas y rectas (300 x1, 5 nm), formadas por la asociación en una estructura helicoidal de 3 cadenas polipeptídicas. Cada cadena a contiene unos 100 aminoácidos ordenados como una hélix hacia la izquierda, con 3 aminoácidos por vuelta, correspondiendo siempre glicina al tercer residuo, de manera que cada cadena a está compuesta por una serie de secuencias de la 36 HistologíayCitologíaavanzadaII tripleta -Gly-X-Y- , en la cual X ó Y corresponden con gran frecuencia prolina o hydroxiprolina respectivamente. Existen más de 25 tipos distintos de cadenas a codificadas por genes diferentes, las que se asocian forman unos 15 tipos distintos de moléculas de colágeno. Las moléculas de colágeno de tipo I, II y III, son capaces de interactuar entre sí, asociándose lateralmente en forma estable por uniones covalentes entre residuos de lisina. De hecho, en la matriz extracelular propia del cartílago las fibrillas del colágeno son muy delgadas (10 nm de diámetro) y están formadas por el ensamble de moléculas de colágeno tipo II (formadas por 3 cadenas a1 (II)) (ver tejido cartilaginoso). Las fibras colágenas, de varios mm de grosor, corresponden a la asociación de numerosos manojos de fibrillas de 150 a 300 nm de diámetro formadas por moléculas de colágeno tipo I (2 cadenas a1 (I) y 1 cadena a 2 (I)). Las fibras reticulares, de 0,5 a 2,0 mm de grosor (visibles al ser teñidas con sales de plata), están formadas por manojos de fibrillas de 50 nm diámetro formadas por moléculas de colágeno tipo III (3 cadenas a 1(III)). Las laminillas colágenas óseas, están formadas por la disposición de capas sucesivas de fibrillas de colágeno tipo I. En cada capa las fibrillas están paralelas entre si, pero las capa sucesivas alternaban ordenadamente la orientación de sus fibrillas en ángulos rectos. Una disposición laminillar similar se observa en tejidos fibrosos como la córnea. 2.2.3.2Sustanciafundamental Corresponde a la matriz traslúcida que rodea a células y fibras conjuntivas y que no presenta una organización estructural visible al microscopio de luz. Este componente constituye un gel semisólido, bioquímicamente complejo y altamente hidratado. Las principales macromoléculas que forman la sustancia fundamental corresponden a polisacáridos de la clase de los glicosaminoglicanos, que pueden existir como tales o pueden unirse covalentemente a proteínas, formando macromoléculas más complejas llamadas proteoglicanos. Las glicoproteínas de adhesión: Las glicoproteínas de adhesión de la matriz extracelular se caracterizan por ser moléculas que presentan diversos dominios que les permiten interactuar simultáneamente tanto con componentes de la matriz extracelular como con las células conjuntivas. En esta parte nos referiremos como ejemplo sólo a dos de ellas: la fibronectina que asocian entre sí a células, fibras y proteoglicanos del tejido conjuntivo y la lámina que asocia a células no conjuntivas con las macromoléculas de la lámina basal. 2.2.3.3Glicosaminoglicanos Los glicosaminoglicanos son largas cadenas de polisacáridos no ramificadas formadas por la repetición sucesiva de la unidad de disacáridos formada por: ácido urónico y hexosamina acetilada, la cual puede estar sulfatada. 37 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El ácido hialurónico (hialuronato o hialuronano) es un glicosaminoglicano no sulfatado formado por una secuencia de 25.000 unidades sucesivas de (ácido Dglucouronico- N-acetilglucosamina). Por su riqueza en grupos ácidos está cargado negativamente y tiende a atraer cationes como el Na+ que, al ser osmóticamente activos, atraen agua disponiéndose cada molécula de hialuronato como un ovillo laxamente plegado y altamente hidratado, que ocupa un volumen importante del espacio intercelular. Los glicosaminoglicabos sulfatados no existen en general en forma libre sino asociados a proteínas. Los principales de ellos son: Condroitín sulfato y dermatan sulfato, que se caracterizan por estar formados por una secuencia de 70 a 200 unidades sucesivas de (N-acetil-galactosamina sulfatada y ácido D-glucourónico o L-idurónico). Heparan sulfato formado por una secuencia de 20 a 100 unidades sucesivas de (Nacetil-glucosamina sulfatada y ácido glucourónico o L-idurónico). Keratan sulfato formado por la secuencia un numero variable de unidades de (Dgalactosa y N-acetyl glucosamina sufatada). 2.2.3.4Proteoglicanos Los proteoglicanos son macromoléculas formadas por una proteina central, a lo largo de la cual se asocian, por su extremo terminal, numerosas moléculas de glicosaminoglicanos sulfatados. Existe una enorme varidad de proteoglicanos, dependiendo del tipo y largo de la proteína central y del tipo, número y longuitud de los glicosaminoglicanos asociados a ella. El proteoglicano decorina, que recubrela superficie de las fibrillas colágenas, contienen 1 molécula ya sea de condroitin o de derrmatansulfato, mientras que el proteoglicano aggregacan que es uno de los principales componentes de la matriz extracelular del cartílago presenta alrededor de 100 moléculas de condroitinsulfato y 30 moléculas de keratansulfato unidas a una proteína central de más de 3000 aminoácidos. Existe además la posibilidad de que la sustancia fundamental se organice en agregados moleculares aún mayores ya que los proteoglicanos pueden asociarse por uno de lo extremos de la molécula de proteína central a lo largo del ácido hialurónico, por medios de proteínas globulares de unión. Se forma así la posibilidad de estabilizar la estructura de la sustancia fundamental, la cuál podrá adoptar la consistencia de un gel relativamente fluido como es el caso de los tejidos conjuntivos laxos, o de un gel prácticamente sólido como en el caso del cartílago hialino. La mayoría de las funciones estructurales de los proteoglicanos se relacionan con sus características moleculares: interactúan con cationes y agua, tendiendo a inmovilizarlos, resistiendo muy bien las fuerzas de compresión. El líquido que los rodea constituye el líquido tisular y a través de él fluyen los metablitos y difunden los gases respiratorios. 38 HistologíayCitologíaavanzadaII 2.2.3.5Láminasbasales Son estructuras laminares que corresponden a una forma especializada de la matriz extracelular, que actúan como interfase entre las células de los tejidos epiteliales, musculares y nerviosos en los sitios en que ellas se asocian al tejido conjuntivo. Al microscopio electrónico aparece formada por 2 capas laminares: la que está vecina a la célula es poco densa a los electrones y se denomina lamina rara (o lúcida), la segunda capa es densa a los electrones y se denomina lamina densa, a ella se asocia una tercera capa que contiene fibrillas colágenas llamada lamina fibroreticular y que es continua con la matriz conjuntiva adyacente. Entre las funciones que desempeña la lámina basal se destacará en este momento sólo que ella constituye una interfase te adhesión de modo que las células poseen mecanismos de adhesión para fijarse a la membrana basal y ella a su vez está anclada en la matriz extracelular conjuntiva a las fibrillas colágenas. Las membranas basales están formadas por 4 tipos de moléculas predominantes: colágeno tipo IV, perlecan (proteoglicano de heparan-sulfato), laminina y entactina, además de la fibronectina y del colágeno VII que la asocia a las fibrillas de colágeno III de la lámina fibroreticular. Las moléculas de colágeno tipo IV forman la lámina densa. Ellas difieren de las moléculas de colágeno I, II y III que forman las fibrillas colágenas. Las moléculas de colágeno IV se asocian entre primero entre sí por sus extremos carboxi terminales formando dímeros los cuales a su vez se asocian entre sí lateralmente formando una lámina desde la cual se proyectan perpendicularmente los extremos aminoterminal de las moléculas, los que al interactuar entre sí permiten la unión de láminas sucesivas de las redes planares formadas por los dímeros del colágeno IV. El perlecan es un proteoglicano de heparansulfato, formado por una proteín central de unos 600.000 de PM asociada a entre 2 y 15 cadenas de heparansulfato, el cuál puede interactura directamente con colágeno IV y con laminina. Se concentra hacia la lámina rara. La lámina es una glicoproteína de gran tamaño (850.000) que presenta dominios funcionales que le permiten interactuar con: receptores para lámina de la membrana plasmática de la célula, heparansulfato, colágeno IV y entactina. Puede además interactuar con otras moléculas de lámina por los extremos de sus 4 brazos formando una estructura laminar. Se concentra hacia la lámina rara. La entactina, que es una gliproteina pequeña se asocia a las moléculas de lámina entre sí y con colágeno IV contribuyendo a estabilizar la estructura y la asociación de las láminas rara y densa. 2.2.4Fibroblastosyfibrocitos Es la célula propia de los tejidos conjuntivos fibrosos, cuya principal función es sintetizar y mantener a la matriz extracelular propia del tejido. De acuerdo a su actividad biosintética se pueden distinguir morfológicamente: fibroblastos que corresponden a la célula en un estado de alta actividad fibrocitos que son las células poco activas o en reposo. 39 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los fibroblastos se distinguen estructuralmente por su aspecto fusiforme y su abundante citoplasma basófilo; los fibrocitos son más pequeños y su citoplasma es suavemente acidófilo. La organización ultraestructural de los fibroblastos diferenciados refleja el compromiso de este tipo de células en la síntesis de moléculas que forman la matriz extracelular. Poseen un retículo endoplásmico desarrollado, un Golgi perfectamente definido y escasas vesículas de secreción, organelos que se relacionan con la síntesis de moléculas precursoras del colágeno, elastina, proteoglicanos y glicoproteínas de la MEC. Presentan un desarrollado citoesqueleto de microtúbulos y de microfilamentos de actina implicados en procesos de motilidad celular. Esta propiedad es importante en la cicatrización de heridas, ya que los fibroblastos tienen la capacidad de migrar hacia la zona lesionada, proliferar y producir los componentes de la matriz extracelular. En los tejidos conjuntivos fibrosos reticulares las células propias del tejido, responsable de la síntesis y manutención del estroma reticular reciben el nombre de células reticulares. Este nombre suele inducir a confusión ya que inicialmente se usó para denominar a las células asociadas al estroma reticular, actualmente se distingue la célula reticular propiamente tal de otras células que pueden asociarse al estroma como son por ejemplo los macrófagos fijos. La estructura de las células reticulares es similar a la de los fibroblastos. 2.2.4.1Fibroblastosysíntesisdemicrofibrillascolágenas Los fibroblastos sintetizan y secretan el procolágeno, molécula de mayor tamaño que el colágeno, la cual presenta en ambos extremos una porción no helicoidal. Los pasos intracelulares en el proceso de síntesis de esta molécula impican las siguientes etapas: Producción del mRNA correspondiente al tipo o tipos de cadenas a que se requiera, de acuerdo tipo de colágeno que se va a secretar. Síntesis en ribosomas unidos a membrana e introducción hacia el lumen de cisternas del ergastoplasma de cada cadena pro-a, los cuales además del peptido señal contienen una serie de aminoácidos adicionales llamados propéptidos. En el lumen del ergastoplasma residuos precisos de prolina y lisina son hidroxilados, formando hidroprolinas e hidroxilisinas. Este paso requiere de la presencia de vitamina C. (en el escorbuto, no ocurre la hidroxilación de las prolinas y las cadenas pro-a defectuosas no pueden formas las triple hélix y se degradan inmediatamente). Algunas de las hidroxilisinas son luego glicosiladas. Tres cadenas pro-a hidroxiladas y glicosiladas se acoplan entre sí inicialmente por los propetidos y forman las moléculas de procolágeno: estructuras, helicoidal, triple estabilizada por puentes de hidrógeno, cuyos extremos son más globosos por la presencia de los propéptidos. Estas moléculas se acumulan en el aparato de Golgi y son transportadas en gránulos de secreción hacia la superficie celular liberándose por exocitosis hacia el extracelular. Para que se formen las fibrillas de colágeno a partir de las moléculas de procolágeno secretadas se requieren varios pasos, que dependen de la presencia de enzimas específicas sintetizadas y secretadas por los fibroblastos en el espacio extracelular, que ocupa profundas invaginaciones en la superficie de los fibroblastos. 40 HistologíayCitologíaavanzadaII Las etapas principales son: - Remoción de los propéptidos de las moléculas de procolágeno por acción las procolágeno-peptidasas, eliminándose así los extremos globosos y quedando la molécula de colágeno, de menor peso molecular. Las moléculas de colágeno son menos solubles y tienden a asociarse entre sí por interacciones entre las caras laterales de moléculas vecinas, que se disponen paralelas entre sí pero desplazadas en aproximadamente un quinto de su longitud. - Esta interacción entre moléculas de colágeno se estabiliza por la formación de enlaces covalentes entre los residuos de lisina de las moléculas vecinas, en una reacción compleja que requiere de la enzima lisil-oxidasa. - La resistencia a la tracción de las fibrillas colágenas va a depender del número de enlaces covalentes que existan entre las moléculas paralelas de colágeno. Si se inhibe a la enzima lisil-oxidasa la resistencia a la tracción de la fibrillas disminuye drásticamente y ocurren alteraciones graves en la estructura de los tejidos conjuntivos. Como consecuencia de la polimerización del colágeno quedan a espacios, a largo de la fibrilla en formación, entre los extremos carboxi- y amino- terminales de las sucesivas moléculas de colágeno, Al observar las fibrillas al microscopio electrónico luego de usar tinción negativa, se demuestra la penetración del colorante en los sitios huecos de la fibrilla, que aparecen como un bandeo denso a los electrones mientras que los sitios de total superposición de las moléculas adyacentes no permiten la penetración del colorante y aparecen como un bandeo poco densos a los electrones. Al observar las fibrillas al microscopio electrónico luego de usar tinción negativa, se demuestra la penetración del colorante en los sitios huecos de la fibrilla, que aparecen como un bandeo denso a los electrones mientras que los sitios de total superposición de las moléculas adyacentes no permiten la penetración del colorante y aparecen como un bandeo poco densos a los electrones. La forma en que se van a organizar las fibrillas colágenas en el extracelular depende también de los fibroblastos, ya que estos pueden expresar además otros tipos de colágenos como el colágeno XII (a1 (XII)3) el cuál no forma fibrillas sino que se asocia lateralmente en forma periódica a la superficie de las fibrillas de colágeno I y contribuye a asociarlas entre sí formando manojos paralelos de fibrillas, y las asocia también a otros elementos de la matriz extracelular. 41 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.2.5Variedadesdetejidosconjuntivos 1. Tejido conjuntivo laxo. 2. Tejido conjuntivo fibroso denso. 3. Tejido conjuntivo elástico. 4. Tejido conjuntivo reticular. 5. Tejido adiposo. 6. Cartílago y hueso. 2.2.5.1TejidoConjuntivoLaxo Se caracteriza por la presencia de una población relativamente alta de células residentes, ya sea propias como fibroblastos y adipocitos o migratorias como macrófagos y células cebadas, separadas por la matriz extracelular formada por fibras colágenas y elásticas, laxamente dispuestas en una sustancia fundamental bastante fluida. Las fibras colágenas que predominan están formadas por microfibrillas de colágeno I asociadas a cantidades variables de microfibrillas de colágeno III pero en menor cantidad. Estas fibras colágenas le confieren resistencia a la tracción. Las fibras elásticas, aunque menos abundantes que las de colágeno, cumplen un rol importante ya que le otorgan al tejido la capacidad de retomar su organización original luego de ser traccionado La sustancia fundamental, que ocupa los espacios entre las fibras, tiene como principal componente a grandes moléculas de ácido hialurónico, el cual estabiliza una importante cantidad de agua, adoptando la estructura de un gel poco consistente, de modo que existen innumerables espacios intermoleculares que sirven de reservorio al líquido intersticial ("fluido tisular"). Este fluido facilita la difusión del oxígeno y nutrientes desde los capilares del conjuntivo hacia células de otros tejidos (epitelios, cartílago o músculo) y de los productos de desecho del metabolismo en sentido inverso. 42 HistologíayCitologíaavanzadaII La capacidad de la sustancia fundamental de acumular líquido es la base del proceso llamado edema. Debido a la variedad de células que lo habitan y a la capacidad de acumular líquido proveniente del plasma sanguíneo, el conjuntivo laxo juega un rol muy importante en la iniciación del proceso de defensa orgánica a través de la generación de las respuestas inflamatoria e inmune. 2.2.5.2TejidoconjuntivoFibrosoDenso Presenta un contenido relativamente bajo de células, las que corresponden principalmente a fibroblastos. Su matriz extracelular es muy abundante, y su principal componente son gruesas fibras colágenas. La sustancia fundamental es relativamente escasa, predominando proteoglicanos de dermatan-sulfato. De acuerdo a la forma en que se disponen las fibras de colágeno, se distingue: Tejido conjuntivo denso desordenado. Las fibras colágenas forman una red tridimensional lo que le otorga resistencia en todas las direcciones. Asociada a esta red colágena existen fibras elásticas. Entre las fibras colágenas y elásticas se ubican las células, principalmente fibroblastos y se encuentra por ejemplo en la dermis y formando la cápsula de órganos como los ganglioslinfático y el hígado. Tejido conjuntivo denso ordenado o regular. Las fibras de colágeno se disponen en un patrón definido que refleja una respuesta al la dirección del requerimiento mecánico predominante. Las fibrillas de colágeno tipo I paralelas se asocian entre sí por interacción con moléculas de colágeno tipo XII (a1 (XII)3), lo que le otorga una mayor firmeza. Los fibroblastos son las únicas células presentes y se ubican entre los haces de fibras formando largas líneas paralelas. Estas células poseen escaso citoplasma y presentan un cuerpo celular alargado, con núcleos son alargados y de cromatina condensada. Las estructuras formadas por tejido conjuntivo denso ordenado están adaptadas para oponer una alta resistencia a la tracción ejercida en la dirección en que se disponen las fibras. Tal es el caso de tendones y aponeurosis. 43 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.2.5.3Tejidoconjuntivoelástico Es una variedad de tejido fibroso denso en el cuál las fibras conjuntivas presentes corresponden a fibras o láminas elásticas dispuestas en forma paralela. Los espacios entre las fibras elásticas están ocupados por una fina red de microfibrillas colágenas con unos pocos fibroblastos. El tejido conjuntivo elástico forma capas en la pared de los órganos huecos sobre cuyas paredes actúan presiones desde adentro, como es el caso de los pulmones y de los vasos sanguíneos y forma algunos ligamentos como los ligamentos amarillos de la columna vertebral. 2.2.5.4Tejidoconjuntivoreticular Es una variedad de tejido conjuntivo especializado que forma una malla tridimensional estable, que otorga un soporte estructural a las células migratorias de órganos relacionados directamente con los leucocitos de la sangre como son el bazo, los ganglios linfáticos y la médula ósea hematopoyética. Las células reticulares, que corresponden a fibroblastos especializados, que secretan las microfibrillas de colágeno III las que se asocian en manojos formando las fibras reticulares. Estas se disponen formando una malla fibrilar fina a lo largo de la cual se ubican las células reticulares, cuyos procesos envuelven las fibras reticulares y a la escasa sustancia fundamental. El sistema trabecular formado por la asociación de fibras y células genera matriz con características de esponja en la cual células y fluidos pueden desplazarse. 2.2.5.5Tejidoadiposo Es un tejido conjuntivo especializado en el que predominan las células conjuntivas llamadas adipocitos. Los lipoblastos, células precursoras de adipocitos producen cantidades importantes de colágeno I y III, pero los adipocitos adultos secretan muy bajas cantidades de colágeno y pierden la capacidad de dividirse. El tejido adiposo es uno de los tejidos más abundantes y representa alrededor del 15-20% del peso corporal del hombre y del 20-25% del peso corporal en mujeres. Los adipocitos almacenan energía en forma de triglicéridos. Debido a la baja densidad de estas moléculas y su alto valor calórico, el tejido adiposo es muy eficiente en la función de almacenaje de energía. Los adipocitos diferenciados pierden la capacidad de dividirse; sin embargo, son células de una vida media muy larga y con capacidad de aumentar la cantidad de lípidos acumulados. Además, el tejido adiposo postnatal contiene adipocitos inmaduros y precursores de adipocitos residuales a partir de los cuales pueden diferenciarse adipocitos adicionales. Estos mecanismos se hacen operativos cuando la ingesta calórica aumenta exageradamente. El tejido adiposo se clasifica en adiposo unilocular y el tejido adiposo multilocular, de acuerdo a las características de las células que lo constituyen. Tejido adiposo unilocular Corresponde a la variedad de tejido adiposo más corriente en adultos. Sus células son polihédricas, miden entre 50 y 150 Um de diámetro y contienen una sola gota de lípido que llena todo el citoplasma desplazando los organelos hacia la periferia. Al 44 HistologíayCitologíaavanzadaII microscopio de luz cada célula aparece como un pequeño anillo de citoplasma rodeando una vacuola, resultado de la disolución de la gota lipídica, y que contiene un núcleo excéntrico y aplanado. El MET revela que cada célula adiposa contiene sólo una gota de lípido. En el citoplasma perinuclear se ubican un Golgi pequeño, escasas mitocondrias de forma ovalada, cisternas de RER poco desarrolladas y ribosomas libres. En el citoplasma que rodea la gota de lípido contiene vesículas de REL, algunos microtúbulos y numerosas vesículas de pinocitosis. Tejido adiposo multilocular. Esta variedad de tejido adiposo es de distribución restringida en el adulto. Sus células son poligonales y más pequeñas que las del tejido adiposo unilocular. Su citoplasma contiene numerosas gotas de lípido de diferente tamaño y numerosas mitocondrias con abundantes crestas. Su un núcleo está al centra y es esférico. Este tejido adiposo se asocia con numerosos capilares sanguíneos y se conoce también como grasa parda. En embriones humanos y en el recién nacido, este tipo de tejido adiposo se concentra en la región interescapular y luego en individuos adultos disminuye notablemente. 2.2.5.6CartílagoyHueso Son tejidos conjuntivos que se caracterizan porque sus células están rodeadas de una matriz intercelular sólida y relativamente rígida. La matriz intercelular del cartílago es deformable y puede crecer por depósito de nuevo material en su interior, mientras que la matriz intercelular ósea es más bien rígida y puede crecer sólo por depósito de nuevo material sobre las superficies óseas. Cartílago Está formado por una abundante matriz extracelular en la cuál los condrocitos se ubican en espacios llamados lagunas. Los condrocitos sintetizan y secretan los componentes orgánicos de la matriz extracelular que son básicamente colágeno, ácido hialurónico, proteoglicanos y glicoproteínas, y según las características de la matriz se distingue cartílago hialino y fibroso. Existe además el cartílago elástico en el cuál la elastina forma parte de la matriz extracelular. Los vasos sanguíneos no penetran a la matriz cartilaginosa y los condrocitos se nutren con material que difunde desde de los capilares sanguíneos del tejido conjuntivo adyacente. Cada placa o lámina de tejido cartilaginoso está rodeada por el pericondrio que corresponde a tejido conjuntivo denso en el cuál se distingue una capa externa fibrosa y una capa interna celular en la cual se ubican las células que pueden dar origen a los condroblastos, que corresponden a precursores de los condrocitos y que difieren de ellos solo en su edad y en su mayor actividad de la síntesis de componentes de la matriz intercelular cartilaginosa. Los condroblastos presentan un ergastoplasma y un aparato de Golgi muy desarrollados y presentan vesículas y granos de secreción, lo cuál guarda relación con su rol de sintetizar y secretar los distintos componentes de la matriz extracelular cartilaginosa 45 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología que está formada principalmente por colágeno de tipo II, proteoglicanos de condroitin y keratansulfato, ácido hialurónico y glicoproteínas. Al disminuir su actividad de síntesis disminuye el desarrollo tanto del ergastoplasma como del aparato de Golgi, acumulan glicógeno y lípidos en su citoplasma y se les llama condrocitos. Histogénesis del cartílago El tejido cartilaginoso se origina en el mesenquima, a partir de células mesenquimáticas que se redondean y agrupan en conglomerados con escaso material intercelular entre ellas. Este conjunto de células precartilaginosas se llama blastema. Las células del blastema son inducidas a sintetizar matriz cartilaginosa y a partir de ese momento se les llama condroblastos, ellas se separan progresivamente a medida que aumenta la cantidad de matriz sintetizada y pasan a llamarse condrocitos. El tejido mesenquimático que rodea a la masa condrogénica pasará a constituir el pericondrio. Crecimiento del cartílago Las placas de tejido cartilaginoso pueden aumentar su volumen mediante dos mecanismos: - Crecimiento por aposición. Ocurre desde el pericondrio, en cuya capa celular se localizan células indiferenciadas capaces de dividirse dando origen células que se diferenciaran a condroblastos y que producirán tejido cartilaginoso sobre la superficie del cartílago preexistente, quedando los condroblastos atrapados en la matriz que producen y pasando a ser condrocitos. - Crecimiento intersticial. Ocurre porque los condrocitos son capaces de dividirse y la matriz cartilaginosa es distensible. Las células hijas ocupan inicialmente la misma laguna pero a medida que ellas secretan nueva matriz intercelular se van separando. Estas células hijas pueden volver a dividirse formándose los llamados grupos isógenos, que se encuentran frecuentemente en cartílagos en crecimiento. Tipos de Cartílago I. Matriz intercelular del cartílago hialino II. Cartílago elástico III. Cartílago fibroso o fibrocartílago I. Matriz intercelular del cartílago hialino El colágeno corresponde a alrededor del 40% de los componentes orgánicos de la matriz cartilaginosa. Está organizado principalmente como fibrillas de colágeno II que se disponen como un red laxa en toda la matriz del cartílago hialino. A lo largo de las fibrillas de colágeno II se asocian moléculas de colágeno IX (a1 (IX) a2 (IX) a3 (IX)), de modo que uno de los extremos de cada molécula se proyecta hacia la matriz extracelular circundante. Los principales glicosaminoglicanos corresponden a ácido hialurónico y a proteoglicanos de condroitin y queratán-sulfato. En la matriz cartilaginosa el ácido 46 HistologíayCitologíaavanzadaII hialurónico se asocia a entre 80 a 200 unidades de proteoglicanos, por medio de proteínas de enlace. Los enormes conglomerados de hialuronato están unidos a las fibrillas colágenas por enlaces electrotáticos y puentes cruzados glicoproteicos. Más del 60% del peso neto del cartílago hialino corresponde a agua, gran parte de la cual interactúa con los glicosaminoglicanos, encontrándose parcialmente fijada, sin embargo existen zonas en que la interacción es lo suficientemente laxa como para permitir el flujo de solutos por la matriz cartilaginosa. La gran hidratación y la posibilidad de movimiento de agua son los dos factores que permiten al cartílago su capacidad para soportar la compresión y su recuperación ante la aplicación de cargas variables, como ocurre en los cartílagos articulares. Los proteoglicanos se concentran se en la cápsula o matriz territorial que rodea a cada laguna y de hecho los grupos isógenos están en conjunto rodeados de una zona rica en proteoglicanos, en la cuál son escasas la fibrillas de colágeno II (matriz territorial), a diferencia de lo que ocurre en la matriz localizada entre las células cartilaginosas (matriz interterritorial). La adhesión entre los condrocitos y matriz que los rodea es estabilizada por la condronectina, glicoproteína que se asocia a receptores en la mebrana plasmpatica de las células y a los componentes de la matriz territorial. El cartílago hialino forma el esqueleto provisional durante el desarrollo, las placa epifisiarias durante el crecimiento de los huesos, reviste las superficies articulares en las articulaciones y forma parte de la pared en las grandes vías respiratorias. II. Cartílago elástico Su estructura es parecida a la del cartílago hialino, con una capa de pericondrio asociado y los condrocitos rodeados de la matriz intercelular, pero en su matriz existen además láminas o fibras elásticas. III. Cartílago fibroso o fibrocartílago Contiene condrocitos, generalmente encapsulados en una matriz intercelular parecida a la del cartílago hialino, pero con manojos de fibrillas de colágeno I, orientados en diversas direcciones, ocupando la matriz intercelular. Hueso Estructura y características del tejido óseo El tejido óseo es una variedad de tejido conjuntivo que se caracteriza por su rigidez y su gran resistencia tanto a la tracción como a la compresión. Está formado por la matriz ósea, que es un material intercelular calcificado y por células, que pueden corresponder a: - Osteoblastos: encargados de sintetizar y secretar la parte orgánica de la matriz ósea durante su formación. Se ubican siempre en la superficie del tejido óseo ya que este sólo puede crecer por aposición) - Osteocitos: ubican en calcificado. penetran la responsables del mantenimiento de la matriz ósea, que se cavidades o lagunas rodeadas por el material intercelular La nutrición de los osteocitos depende de canalículos que matriz ósea y conectan a los osteocitos vecinos entre sí y con 47 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología canales vasculares que penetran al hueso o que se ubican en las membranas conjuntivas que revisten la superficie del hueso (periostio y endostio). De hecho ningún osteocito se encuentra a más de una fracción de mm de un capilar sanguíneo. - Osteoclastos: células responsables de la reabsorción del tejido óseo, que participan en los procesos de remodelación de los huesos y pueden encontrarse en depresiones superficiales de la matriz ósea llamadas lagunas de Howship. La matriz intercelular ósea La matriz intercelular ósea está formada por: Matriz orgánica u osteoide que corresponde al 50% del peso seco del hueso. Más del 90% de ella corresponde a fibrillas de colágeno I organizadas en laminillas de unos 5 μm de grosor. En cada laminilla ósea, las fibrillas colágenas están paralelas entre si, pero las laminillas sucesivas alternan ordenadamente la orientación de sus fibrillas en ángulos rectos. Esta disposición alternada de las fibrillas colágenas en laminillas sucesivas destaca particularmente al observar cortes de hueso con microscopía de luz polarizada. El resto de los componentes orgánicos son principalmente glicoproteínas como la osteonectina, proteínas ricas en ácido g-carboxiglutámico como la osteocalcina, y proteoglicanos de condroitín y queratán-sulfato. Son moléculas ricas en grupos ácidos con gran tendencia a asociarse entre sí, capaces de unirse a calcio y que juegan un rol importante en el proceso de mineralización de la matriz ósea. Sales minerales inorgánicas depositadas en el osteoide, que confieren al tejido su rigidez y dureza y actúan como una reserva de sales minerales, sensible a estímulos endocrinos. Las más abundantes son fosfato de calcio amorfo y cristales de hidróxidos de calcio y de fosfato llamados hidroxiapatita (Ca10 (PO4)6(OH)2). Los cristales de hidroxiapatita son aplanados (30 μm por 3 μm) y se adosan a lo largo de las fibrillas colágenas, a intervalos de unos 67 μm. La superficie del cristal está hidratada y existe una vaina de agua e iones rodeándolo, lo que facilita el intercambio de iones entre el cristal y el líquido intersticial. Células del tejido óseo 1. Células osteoprogenitoras. 2. Osteoblastos. 3. Osteocitos. 4. Células de revestimiento óseo. 5. Osteoclastos. 48 HistologíayCitologíaavanzadaII 1. Células osteoprogenitoras Celulas osteoprogenitoras: son células alargadas con citoplasma poco prominente, que proceden de las células mesenquimáticas primitivas y forman una población de células troncales capaces de dividirse y dar origen a células que se diferencian a osteoblastos. 2. b) Osteoblastos Los osteoblastos son células diferenciadas que sintetizan el colágeno y la sustancia fundamental ósea. Cuando están en plena actividad su forma es cuboide con un citoplasma basófilo, que refleja su ergastoplasma muy desarrollado, tienen además un prominente aparato de Golgi. Son células polarizadas que vacían sus productos de secreción por la zona del citoplasma en contacto con la matriz ósea ya formada, (matriz intercelular preósea o osteoide). Los osteoblastos son células poliédricas con largas y delgadas prolongaciones citoplasmáticas que son rodeadas por el osteoide producido y que se asocian mediante uniones de la comunicación (nexos o gap junction) con prolongaciones similares de los osteoblastos vecinos. Los osteoblastos participan también en el proceso de mineralización de la matriz orgánica ya que producen vesículas de matriz, de unos 100nm de diámetro, rodeadas de membrana celular, las que acumulan Ca++ y PO4= y son ricas además en fosfatasa alcalina y pirofosfatasa, enzimas que capaces de generar iones PO4=, elevando su concentración en el medio extracelular y creando centros de nucleación para el deposito de las sales minerales. Los osteoblastos tienen dos destinos posibles: ser rodeados por la matriz ósea que producen y pasan a ser osteocitos o permanecer en la superficie del tejido óseo recién formado, aplanándose y constituyendo las células de revestimiento óseo. 3. Osteocitos Son las células propias del tejido óseo formado. Su citoplasma presenta ergastoplasma, aparato de Golgi y puede presentar lisosomas. Son capaces de sintetizar y de reabsorber, en forma limitada, a componentes de la matriz ósea ("osteolisis osteocítica"), procesos que tienen importancia en la regulación de la calcemia. Cada osteocito, bañado por una delgada capa de líquido tisular, ocupa su laguna y proyecta sus prolongaciones citoplasmáticas por los canalículos, dentro de los cuales, toma contacto con prolongaciones de osteocitos vecinos mediante uniones de comunicación, o con células de revestimiento óseo bañadas por el líquido tisular del tejido conjuntivo que rodea a los capilares sanguíneos. 49 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 4. Células de revestimiento óseo Son células aplanadas que revisten las superficies óseas del interior de los huesos, y en su mayor parte corresponden a osteoblastos inactivos que están asociados entre sí y con prolongaciones de los osteocitos. 5. Osteoclastos Son células móviles, gigantes y multinucleadas y se localizan adosadas a la superficie de tejido óseo que debe ser removido. Se originan por fusión de monocitos que han abandonado la sangre circulante y pertenecen de hecho al sistema de fagocitos mononucleares. Contienen numerosos lisosomas y en la superficie del osteoclasto que esta en contacto con la matriz a remover se distinguen dos zonas distintas: un anillo externo o zona clara que corresponde a una especialización de la superficie celular en que la membrana se asocia estrechamente al hueso que delimita el área que se va a reabsorber, y la región central o borde estriado que presenta profundos repliegues de la superficie celular bajo los cuales de concentran gran cantidad de lisosomas y mitocondrias, además de ergastoplasma y cisternas del Golgi. La membrana de los lisosomas primarios se fusiona con la membrana celular que reviste a los repliegues del borde festoneado, liberando las enzimas lisosomales hacia el exterior y produciendo una acidificación del microambiente que baña al tejido óseo a reabsorber. El borde festoneado contiene además gran cantidad de vesículas endocíticas y lisosomas secundarios, indicando que ocurre además un proceso de fagocitosis del material parcialmente solubilizado por el ambiente ácido y la acción lítica de las enzimas lisosomales. Organización histológica de los huesos En un hueso ya formado la disposición de los componentes del tejido óseo en cada zona de él está en estricta relación con las fuerzas de tracción y compresión a que esa zona está sometida habitualmente. Sin embargo el tejido óseo que se forma primero en el feto y luego en los huesos en desarrollo no se dispone de acuerdo a estos requerimientos mecánicos, sino que constituye un tejido óseo de base llamado hueso primario o reticular ("entrelazado") que posteriormente será reemplazado por el hueso secundario o laminillar. 50 HistologíayCitologíaavanzadaII La principal diferencia entre el hueso reticular y el laminillar radica en la disposición de las fibrillas de colágeno I, las cuales en el hueso primario se disponen en forma de manojos dispuestos en forma irregular. De acuerdo al aspecto macroscópico que presentan se distinguen dos tipos de huesos: - Hueso cortical: formado por tejido óseo compacto. - Hueso esponjoso en el cual el tejido óseo se dispone en trabéculas que delimitan cavidades, en las que se ubica normalmente la médula ósea. En las superficies articulares la capa cortical de hueso compacto está cubierta por una capa de cartílago hialino. El cartílago articular, mientras que el resto de la superficies del hueso están cubiertas por membranas de tejido conjuntivo que forman el periostio y el endostio, en los que existen abundantes vasos sanguíneos que se adosan ya sea a las trabéculas del hueso esponjoso o que penetran en el hueso cortical compacto a través de los conductos de Volkman y de Havers. Estructura del hueso esponjoso o trabecular Están formados por delgadas trabéculas, que, en los huesos ya formados, corresponden a tejido óseo laminillar rodeadas por células de revestimiento óseo. Los osteocitos de las trabéculas óseas se mantienen desde los capilares sanguíneos vecinos ubicados en la médula ósea. La orientación de cada trabécula y la disposición de sus laminillas óseas mineralizadas están determinadas por las tensiones mecánicas locales con el objeto de resistir las compresiones y las tensiones a que es sometida. Si cambia la dirección de los requerimientos mecánicos a que es sometida una trabécula (aumento de peso del individuo, crecimiento u otro) ella debe cambiar su orientación. Remodelación de trabéculas en el hueso esponjoso: El cambio en la forma de una trabécula se realiza mediante dos procesos coordinados que ocurren en zonas precisas de la trabécula a remodelar: - Crecimiento por aposición de la trabécula por acción de los osteoblastos los que depositan laminillas sucesivas de tejido óseo en la zona en que existe un requerimiento mecánico. - Remoción del tejido óseo de la trabécula por acción de los osteoclastos en los sitios en que no está sometida a tracción ni compresión. 51 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología En la diáfisis de los huesos largos el tejido óseo laminillar se organiza en tres formas distintas, formando los: sistemas de Havers, sistemas laminillares interticiales, y sistemas circunferenciales, externo (subperióstico) e interno (subendóstico). Cada sistema de Havers ("osteón") consiste en un largo cilindro hueco cuyas paredes están formadas por un número variable de laminillas óseas concéntricas, dispuestas de tal modo que las fibrillas colágenas paralelas de cada laminilla están orientadas en forma perpendicular a la de las laminillas vecinas, entre las laminillas disponen las lagunas, que contienen los osteocitos, con los canalículos dirigidos de preferencia en forma radial hacia la cavidad central que corresponde al conducto de Havers el cual se comunica con los conductos de Volkman y contiene vasos sanguíneos y nervios, rodeados de escaso tejido conjuntivo laxo. La forma en que se orientan los sistemas de Havers en cada zona del hueso compacto guarda estricta relación con los requerimientos mecánicos a que el hueso está sometido. Si cambian los requerimientos mecánicos se produce su reabsorción parcial o total y la formación de nuevos sistemas de Havers, proceso conocido como remodelación interna del hueso compacto o haversiano. Los sistemas de laminillas interticiales son grupos de laminillas paralelas de forma irregular que ocupan los espacios entre sistemas de Havers y sistemas circunferenciales. Ellos corresponden a restos de sistemas de Havers que han sido parcialmente removidos durante los procesos de crecimiento y de remodelación ósea. Los sistemas de laminillas circunferenciales interno y externo se observan en los huesos que han terminado su proceso de crecimiento y consisten en laminillas óseas paralelas entre sí que forman bandas de grosor variable bajo el periostio y el endostio, recibiendo sus osteocitos su nutrición desde vasos sanguíneos del tejido conjuntivo. Crecimiento de los huesos a) Crecimiento en grosor Ocurre a partir de las células presentes en la capa interna o celular del periostio en la cual existen, adosadas a la capa externa o fibrosa, células osteoprogenitoras las cuales al dividirse originan células que se diferencian a osteoblastos. Los osteoblastos se disponen en la superficie externa del hueso y sintetizan matriz ósea orgánica, la cual poseriormente se mieraliza. Los osteblastos atrapados pasan a formar los osteocitos del nuevo tejido óseo. Mientras ocurre el crecimiento en grosor no se observa el sistema laminillar subperióstico, el cual está bien desarrollado en el hueso adulto. 52 HistologíayCitologíaavanzadaII b) Crecimiento en longitud Ocurre a expensas del cartílago de la placa epifisaria, el cual por prolifera aumentando su longitud por crecimiento intesticial y luego se modifica y es reemplazada por hueso de acuerdo a los pasos del proceso de osificación endocondral. El cartílago hialino normal que se observa en la zona de reposo experimenta luego (bajo en control de la hormona somatotropa) un proceso de multiplicación celular, formando columnas paralelas de células aplanadas en el sentido longitudinal del hueso, tal como se observa en la zona de cartílago seriado. Posteriormente los condrocitos aumentan notablemente su tamaño, acumulando glicógeno y grasa y produciendo colágeno X y fosfatasa alcalina. La matriz cartilaginosa queda reducida a tabiques delgados, tal como se puede observar en la zona de cartílago hipertrófico y posteriormente ocurre la calcificación de la matriz cartilaginosa, debida a la alteración en su composición por la presencia del colágeno X y de fosfatsa alcalina. Luego ocurre la muerte de los condrocitos hipetrofiados, aislados en la matriz calcificada. La matriz calcificada es penetrada por vasos sanguíneos que provienen desde el canal medular y que se acompañan de osteoblastos los cuales se adosan a la superficie de la matriz cartilaginosa calcificada y sintetizan y secretan la matrís ósea orgánica (osteoide). Los osteoclastos que también acompañan a los vasos sanguíneos remueven parte de los tabiques de matriz cartilaginosa calcificada formando grandes cavidades delimitadas por espículas de matriz cartilaginosa que permanecen unidas al cartílago epifisario y que están recubiertas por tejido óseo primario, el cual se hace cada vez más grueso al continuar siendo depositado por los osteoblastos. Las espículas óseas con base cartilaginosa pueden fusionarse con el hueso cortical y posteriormente experimentar remodelación ósea interna, formándose sistemas de Havers. Aumento en diámetro de la diáfisis Este proceso va acompañado generalmente de un aumento también en el diámetro de la cavidad medular razón por la cuál ocurre de hecho un desplazamiento lateral del hueso cortical con un aumento proporcionalmente reducido del grosor de la pared ósea misma. Esto implica la acción coordinada de tres procesos: - Crecimiento en grosor del hueso a expensan de la capa osteogénica del periosti - Absorción desde el endostio, por acción de osteoclastos. - Remodelación interna del hueso cortical para establecer una distribución de sistemas de Havers adecuada al requerimiento mecánico del hueso en cada etapa de su vida. Histogénesis del hueso El tejido óseo se desarrolla siempre por sustitución de un tejido conjuntivo preexistente. Osificación intramembranosa es la forma en la cual el feto forma básicamente los huesos planos. Tiene lugar en condensaciones de tejido mesenquimatico muy vascularizado en las cuáles ciertas células mesenquimáticas se dividen formándose el blastema óseo. 53 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología A partir de estas células se forman los osteoblastos que sintetizan y secretan al osteoide el cuál posteriormente se mineraliza y que va englobando a los osteoblastos los que se transforman en osteocitos. Las trabéculas de hueso primario así formada son posteriormente remodeladas de acuerdo al hueso que pertenezcan. Osificación endocondral Es la forma en la cual el feto forma los huesos largos y cortos. El proceso se produce en la siguiente forma: - Se desarrolla un modelo cartilaginoso que adopta una forma parecida a la del hueso que va a dar origen y que está rodeado de su pericondrio. - En la zona media de la diáfisis se desarrollan en el pericondrio células osteoprogenitoras y de ellas se originan osteoblastos los que producen un collar óseo subperiostico mediante un proceso de osificación directa o membranosa. - Simultáneamente ocurren en el cartílago subyacente, modificaciones similares a los descritos previamente en el cartílago epifisario, formándose un centro de osificación endocondral primario (diafisario). Las espículas óseas formadas sobre restos de la matriz cartilaginosa calcificada se unen al mango de hueso cortical que sigue engrosándose a partir de la capa osteógena del periostio. - Posteriormente se forman centros de osificación secundaria, a nivel del cartílago de las epífisis a partir del cual se formará el hueso esponjoso y cesará primero la osificación endocondral del cartílago hacia las epífisis. El cartílago que permanece constituye la placa cartilaginosa epifisaria o cartílago de crecimiento de los huesos ya formados. 2.3Tejidomuscular 1. Definición de Tejido Muscular 2. Tipos de tejido muscular 3. Músculo cardíaco 4. Músculo liso 5. Regeneración del tejido muscular 2.3.1Definicióndetejidomuscular Este tejido, de origen mesenquimático, está constituido por: 54 - Células musculares (fibras musculares), capaces de generar movimientos al contraerse bajo estímulos adecuados y luego relajarse. - Tejido Conjuntivo estrechamente asociado a las células musculares. Este actúa como sistema de amarre y acopla la tracción de las células musculares para que puedan actuar en conjunto. Además, conduce los vasos sanguíneos y la inervación propia de las fibras musculares. HistologíayCitologíaavanzadaII 2.3.2Tiposdetejidomuscular En los vertebrados, se distinguen 3 tipos de músculo: 1. Esquelético, estriado o voluntario 2. Cardíaco, estriado involuntario 3. Liso, involuntario Cada tipo de músculo tiene células de estructura distinta, adaptadas a su función específica, pero en todos ellos la maquinaria intracelular contráctil está formada por filamentos que se orientan paralelos a la dirección del movimiento. Todas las variedades de células musculares aprovechan la energía química almacenada en el ATP y la transforman en energía mecánica. 2.3.2.1Tejidomuscularesquelético Este tejido está formado por manojos de células cilíndricas (10-100 mm), muy largos (de hasta 30 cm), multinucleado y estriadas transversalmente, llamadas también fibras musculares esqueléticas. Los núcleos de las fibras se ubican vecinos a la membrana plasmática (sarcolema), que aparece delimitada por una lámina basal (lámina externa). El tejido conjuntivo que rodea a las fibras musculares contiene numerosos vasos sanguíneos y nervios y se dispone de manera de transferir, en la forma más efectiva posible, la contracción de las fibras musculares a los sitios de inserción del músculo. Cada fibra muscular recibe una terminación del axón de una neurona motora, formándose en la zona de unión una estructura denominada placa motora. El músculo esquelético se une a los huesos a través de los tendones, estructuras continuas con la envoltura conjuntiva llamada epimisio, que rodea externamente al músculo completo. El tejido conjuntivo penetra al interior del músculo formando el perimisio, que corresponde a delgados septos de tejido conjuntivo que envuelven a manojos o fascículos de fibras musculares. A partir del perimisio, se origina el endomisio formado por delgadas vainas de fibras reticulares que rodean cada una de las fibras musculares. Los vasos sanguíneos penetran al músculo a través de estos septos conjuntivos. La inervación del tejido muscular esquelético se relaciona directamente con la regulación de la contracción de cada fibra muscular y en consecuencia con el estado de tensión del músculo completo. Fibras nerviosas efectoras Fibras alfa: inervan las fibras musculares a través de la placa motora. Dan origen a la unidad motora Fibras g: inervan las fibras intrafusales Receptores sensoriales El tejido muscular esquelético contiene terminaciones nerviosas espirales, sensibles a la distensión y a la tensión. Estas se asocian a un tipo especial de fibras musculares, las fibras intrafusales, para formar un órgano sensitivo: el huso neuromuscular. 55 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Fibras musculares esqueléticas Las fibras musculares esqueléticas se caracterizan por la presencia de estriaciones transversales periódicas. Esta estriación resulta de la existencia en su citoplasma de las miofibrillas estructuras responsables de la contracción muscular. Las miofibrillas son estructuras cilíndricas largas (1 a 3 mm de diámetro) que corren paralelas al eje longitudinal de la célula, y están formados por miofilamentos finos y miofilamentos gruesos, dispuestos en tal forma que inducen la apariencia de bandas claras y oscuras que se repiten a a lo largo de cada miofibrilla, determinando la organización de los sarcómeros. La banda oscura se conoce como banda A (de anisótropa) y la clara como banda I (de isótropa). Cada banda I aparece bisectada por una línea transversal oscura denominada disco o línea Z (de Zwichenscheibe= disco intermedio,). Al centro de la banda A hay una zona más clara que corresponde a la banda H (de Hell = claro) en cuyo centro está la línea M (de Mittellmembran= membrana media). En el citoplasma que rodea a las miofibrillas se disponen tanto las miocondrias como las cisternas del retículo sarcoplásmico a las cuales se asocian los túbulos T, en una organizacion precisa con respecto a los sarcómeros y repetidas a todo lo largo de las células musculares esqueléticas. Estrechamente asociadas a las fibras musculares esqueléticas se encuentran las células satélites, separadas del endomisio por la misma membrana basal que rodea a la fibra muscular. Ellas son células musculares indiferenciadas que juegan un rol importante en el crecimiento y reparación de los músculos 56 HistologíayCitologíaavanzadaII Regulación de la contracción del sarcómero La contracción muscular está regulada por variaciones en los niveles citosólicos de Ca++, los que afectan las interacciones entre las cabezas de miosina y los filamentos de actina a través de las 2 proteínas accesorias asociadas a actina en el filamento fino: tropomiosina y troponina. En el músculo en reposo (concentración citosólica de Ca= 10-7M) la miosina no puede asociarse a la actina debido a que los sitios de unión para las cabezas de miosina en las G-actina, están bloqueados por la tropomiosina. Al aumentar las concentraciones citosólicas de Ca (10-5M), la subunidad TnC de la troponina une Ca, produciéndose un cambio conformacional de la molécula de troponina y el desplazamiento de la molécula de tropomiosina hacia la parte mas profunda de la hendidura de la hélice de actina. Como consecuencia los sitios, en la G-actina, capaces de interactuar con las cabezas de la miosina quedan libres. Las variaciones en las concentraciones citosólicas de Ca se producen en respuesta a los estímulos nerviosos que inducen la contracción muscular y que actúan desencadenando la liberación de Ca desde el retículo sarcoplásmico hacia el citosol. Bases moleculares de la contracción muscular Al inicio del ciclo, la cabeza de la miosina, que carece de un nucleótido unido, se encuentra estrechamente unida al filamento de actina (estado I). La unión de ATP a la cabeza de la miosina, reduce la afinidad de la cabeza de la miosina por la actina (estado II). La hidrólisis parcial del ATP (durante la cual ADP y Pi permanecen unidos a la miosina), activa la cabeza de la miosina, la que experimenta un cambio conformacional y se desplaza respecto del filamento fino (estado III). La miosina activada contacta a una molécula de actina y se une a ella produciéndose la liberación de Pi (estado IV). Una vez unida a actina, la cabeza de la miosina experimenta un nuevo cambio conformacional que se traduce en un desplazamiento del filamento fino y en la liberación de ADP (estado V). De esta manera, cada cabeza de miosina se desplaza hacia el extremo (+) del filamento fino adyacente. Mientras la concentración de Ca++ sea alta y exista ATP disponible, los ciclos de formación de puentes actina-miosina continúan y el sarcómero continúa contrayéndose. En ausencia de ATP, el complejo actina-miosina se estabiliza, fenómeno que explica el "rigor mortis" Estructura de las miofibrillas La unidad estructural y funcional de las células musculares estriadas es el sarcómero, elemento que se repite a lo largo de las miofibrillas. El análisis de la estructura y composición molecular del sarcómero, permite entender el mecanismo de contracción de las fibras musculares estriadas, basado en el deslizamiento de los miofilamentos gruesos sobre los miofilamentos finos. Los filamentos gruesos (de 15 nm de ancho y 1.6 mm de largo) están formados principalmente por miosina y se localizan a lo largo de la banda. Los filamentos finos (de 8 nm de ancho y 1.0 mm de largo) corresponden a microfilamentos de F-actina. Estos anclan en la línea, luego cursan a lo largo de la banda, donde corren paralelos a los filamentos gruesos, terminando a nivel de la banda que contiene sólo filamentos gruesos. 57 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Durante el proceso de contracción, los filamentos finos de los sarcómeros adyacentes son empujados hacia el centro de la banda A, lo que produce el acortamiento del sarcómero. Como consecuencia de este proceso, se oblitera la banda H y disminuye la longitud de la banda I, sin que se modifique la longitud de la banda A. El grado de traslapamiento entre filamentos gruesos y finos explica este fenómeno. Estructura molecular de los miofilamentos y sus interacciones Los filamentos finos están formados por actina, tropomiosina y troponinas, proteínas que se relacionan directamente con el proceso de acortamiento del sarcómero. Los microfilamentos de actina están constituídos por 2 hebras proteicas, que se enrollan para formar una estructura helicoidal doble. Cada hebra corresponde a un polímero de moléculas asimétricas de G actina, lo que otorga a los microfilamentos de actina una polaridad definida. La tropomiosina es una molécula con forma de bastón, de alrededor de 40 nm de longitud, que corresponde a un dímero de 2 cadenas-hélice idénticas, que se enrollan una respecto de la otra para formar filamentos que corren a lo largo de ambos bordes del microfilamento de F-actina. La troponina es un complejo de 3 subunidades que se dispone en forma discontinua a lo largo del microfilamento. El complejo está formado por TnT, que se une fuertemente a la tropomiosina, TnC que une iones calcio y TnI que se une a actina. En los filamentos finos, cada molécula de tropomiosina recorre 7 moléculas de G-actina y tiene un complejo de troponina unido a su superficie. Los filamentos finos de sarcómeros vecinos anclan en la linea Z a través de las proteínas a-actinina y Cap Z, que se unen selectivamente al extremo (+) de los filamentos de actina. La molécula de miosina-II está formada por 2 polipéptidos de 220 kD cada uno (cadenas pesadas) y 4 polipéptidos de 20 kD cada uno (cadenas livianas). Está organizada en 3 dominios estructural y funcionalmente distintos: cabeza, cuello y cola. En el extremo NH2-terminal las 2 cadenas pesadas presentan una estructura globular, llamada cabeza, la que se continúa en una zona con forma de bastón, de unos 150 nm de largo, cuya porción inicial corresponde al cuello de la molécula y el resto a la cola. En el músculo estriado, cada filamento grueso es una estructura bipolar formada por la asociación antiparalela de alrededor de 300 moléculas de miosina-II. La región central del filamento grueso está compuesta de un conjunto de colas dispuestas en forma traslapada y antiparalela. Los filamentos gruesos son simétricos a nivel de la región central desnuda y su polaridad se revierte a ambos lados de esta zona. Las cabezas protruyen del filamento en un ordenamiento helicoidal a intervalos de 14 nm. Los filamentos finos a que se enfrenta cada extremo del filamento grueso están también polarizados. En la molécula de miosina existen dos sitios que pueden experimentar cambios conformacionales: uno a nivel de la unión de la cabeza con la cola y otro a nivel del sitio en que el inicio de la cola se une al cuello de otras moléculas de miosina. Estas modificaciones se relacionan con las interacciones que establece la molécula de miosina con ATP y/o G-actina. 58 HistologíayCitologíaavanzadaII Retículo Sarcoplásmico y túbulos T (túbulos transversos) En el músculo esquelético, cada miofibrilla está rodeada de un elaborado sistema de membranas lisas que corresponden al retículo sarcoplásmico. Estas membranas están alineadas en forma precisa con respecto al patrón de bandeo de las miofibrillas. En la zona de unión de la banda A con la banda I el retículo sarcoplásmico se expande para formar las cisternas terminales. Las 2 cisternas terminales paralelas se asocian estrechamente a un tubo transverso (T), formando un complejo denominado tríada. El sistema de tubos T, está formado por numerosos túbulos continuos con la membrana plasmática (sarcolema) de la célula muscular. Cada uno de estos túbulos corre transversalmente entre 2 cisternas terminales. Aunque las cisternas terminales y el túbulo T están físicamente separados, el espacio entre ellos aparece ocupado regularmente por estructuras que se asocian estrechamente a la membrana de ambos sistemas. La contracción de una fibra muscular requiere de la contracción simultánea de todas sus miofibrillas. La forma y distribución del sistema T permite que la onda de depolarización, responsable de la contracción muscular, se distribuya rápidamente desde la superficie celular hacia el interior del citoplasma alcanzando a cada miofibrilla. La depolarización de la membrana plasmática de la célula muscular, que se propaga a lo largo de los túbulos T, produce la apertura de canales de Ca++ en la membrana del retículo sarcoplásmico y la liberación de Ca++ hacia el citosol. Se piensa que la onda de depolarización induce un cambio conformacional en proteínas sensoras del túbulo T, que se transmite directamente a la proteína que forma los canales de Ca++ del retículo sarcoplásmico. Tipos de fibras musculares esqueléticas Se distinguen 3 tipos de fibras musculares esqueléticas: rojas, blancas e intermedias. Las fibras rojas, que abundan en los músculos rojos, son de diámetro pequeño y contienen gran cantidad de mioglobina y numerosas mitocondrias, que se disponen en filas entre las miofibrillas y en acúmulos por debajo del sarcolema. Los músculos rojos se contraen más lentamente, por lo que se ha asumido que la fibra roja es una fibra lenta. Las fibras blancas, presentes en los músculos blancos, son de diámetro mayor, poseen menor cantidad de mioglobina y un número menor de mitocondrias que se disponen, de preferencia, entre las miofibrillas, a nivel de la banda I. En este tipo de fibras la línea Z es mas delgada que en las fibras rojas. Las fibras intermedias presentan características intermedias entre las otras 2 variedades de fibras, pero superficialmente se asemejan más a las fibras rojas y son más abundantes en los músculos rojos. Poseen un número de mitocondrias equivalente al de las fibras rojas, pero su línea Z es delgada como en las fibras blancas. Placa motora (unión neuromuscular) La membrana plasmática de la célula muscular está electricamente polarizada. Un estímulo apropiado depolariza la membrana y produce la contracción. Normalmente, la depolarización es producida por un estímulo nervioso. El músculo está inervado por terminales nerviosas de neuronas motoras de la médula espinal. En el punto de inervación, el nervio pierde su vaina de mielina, y se asocia a una región especializada de la superficie 59 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología de la fibra muscular, para formar la placa motora. En una fibra muscular esquelética, cada terminal axónico motor forma sólo una placa motora. En la zona de contacto, la terminal axónica forma una dilatación que se aloja en una depresión poco profunda de la superficie de la fibra llamada hendidura sináptica primaria. El sarcolema que reviste la hendidura sináptica primaria muestra numerosos pliegues que constituyen las hendiduras sinápticas secundarias. En la zona de unión, la lámina basal de la célula de Schwann se fusiona con la lámina basal de la célula muscular. Esta cubierta celular fusionada se extiende hacia la hendidura sináptica primaria, separando la fibra nerviosa de la fibra muscular, y penetra al interior de cada hendidura sináptica secundaria. Cuando el potencial de acción alcanza a la placa motora, el neurotransmisor acetilcolina, contenido en las vesículas sinápticas, se libera y difunde a través de la hendidura. Este mediador se une a receptores de acetilcolina presentes en la membrana postsináptica, concentrados principalmente en la entrada de los pliegues sinápticos secundarios, e induce la depolarización del sarcolema que es transmitida a los tubos T. Unidad Motora Se entiende por unidad motora al conjunto de fibras musculares esqueléticas inervadas por ramificaciones del axón de una misma neurona motora y que, en consecuencia, son estimuladas simultáneamente a contraerse. Ramas de una misma motoneurona pueden llegar a inervar hasta 500 fibras musculares. Sin embargo, mientras más fino el movimiento que debe efectuar el músculo, menor es el tamaño de la unidad motora, existiendo situaciones en que cada fibra nerviosa inerva sólo una fibra muscular. Huso Neuromuscular El músculo esquelético posee receptores sensibles a la distensión, que forman parte de un sistema de retroacción para mantener el tono muscular normal. Las fibras sensitivas que entregan información sobre la tensión en el músculo esquelético tienen 2 orígenes: Terminaciones nerviosas encapsuladas que responden a la distensión en el tendón del músculo. Terminaciones nerviosas espirales (fibras aferentes sensitivas), sensibles a la distensión y tensión en fibras musculares especializadas contenidas en un órgano sensorial especial del músculo que se denomina huso muscular. El huso está formado por una cápsula fusiforme de tejido conjuntivo fibroso que rodea a un grupo de 8 a 15 fibras musculares delgadas. Estas fibras se conocen como fibras intrafusales. Se distinguen 2 tipos de fibras intrafusales: - Fibras de la bolsa nuclear fusiformes, con un agregado central de núcleos. - Fibras de cadena nuclear de un ancho uniforme y núcleos dispuestos en cadena. Las fibras intrafusales están inervadas por fibras nerviosas motoras especializadas (fibras eferentes) que ajustan la longitud de estas fibras en función del estado de 60 HistologíayCitologíaavanzadaII distensión del músculo. El estado de distensión es detectado por las terminaciones nerviosas espirales, que forman una envoltura alrededor de las fibras intrafusales y dan origen a las fibras aferentes sensitivas especiales que viajan hacia la médula espinal. 2.3.3Músculocardíaco El músculo cardíaco está formado por células musculares ramificadas, que poseen 1 o 2 núcleos y que se unen entre sí a través de un tipo de unión propia del músculo cardíaco llamada disco intercalar. A diferencia del músculo esquelético, las fibras musculares cardíacas corresponden a un conjunto de células cardíacas unidas entre sí en disposición lineal. Las células musculares cardíacas, de unos 15 m m de diámetro y unos 100 mm de largo, tienen el núcleo ubicado al centro del citoplasma y presentan estriaciones transversales similares a las del músculo esquelético. El retículo sarcoplásmico no es muy desarrollado y se distribuye irregularmente entre las miofibrillas, que no aparecen claramente separadas. Sin embargo, las mitocondrias, que son extremadamente numerosas, están distribuidas regularmente dividiendo a las células cardíacas en miofibrillas aparentes. En el sarcoplasma hay numerosas gotas de lípido y partículas de glicógeno. Con frecuencia las células musculares cardíacas presentan pigmentos de lipofuscina cerca de los polos nucleares. Las células están rodeadas por una lámina externa, comparable a la lámina basal de los epitelios. Existen ciertas diferencias estructurales entre el músculo de los ventrículos y de las aurículas. Las células musculares de las aurículas son mas pequeñas y vecinos al núcleo, en asociación con complejos de Golgi presentes en esa zona, se observan gránulos de unos 0.4 m m de diámetro que contienen el factor natriurético auricular, auriculina o atriopeptina. Estructuralmente, las miofibrillas del músculo cardíaco, son esencialmente iguales a la de las miofibrillas del músculo esquelético. Por otra parte, los túbulos T del músculo cardíaco son de mayor diámetro que los del músculo esquelético y se ubican a nivel del disco Z. Los túbulos se asocian generalmente con una sola expansión de las cisternas del retículo sarcoplasmico. De manera que lo característico del músculo cardíaco son las díadas, compuestas de un túbulo T y de una cisterna de retículo endoplásmico. 2.3.3.1Discosintercalares Los discos intercalares son los sistemas de unión que asocian a las células musculares cardíacas para formar las fibras del miocardio. Estas estructuras se encuentran en regiones de la membrana donde los extremos de dos células se enfrentan y se ubican en lugar de un disco Z. Su nombre deriva del hecho que en cortes longitudinales aparecen como estructuras escaleriformes. Los discos intercalares presentan: - Una porción transversa, en la cual se ubican dos tipos de unión intercelular: fascia adherens y mácula adherens. - Una la porción lateral, que corre paralela a los miofilamentos, en la cuál se ubican uniones de comunicación (nexos o gap junctions). 61 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología La fascia adherens es un tipo de unión propia del corazón, pero su estructura es semejante a la de las zonas de adhesión de los epitelios. Estas estructuras anclan filamentos de actina a la membrana plasmática y también unen las membranas de células adyacentes. De esta manera, asocian el aparato contráctil de cada célula con el de la célula vecina. Su organización molecular es similar a la descrita en el capítulo de epitelios. La mácula adherens corresponde a desmosomas típicos que se ubican en las porciones transversas y paralelas del disco. Estas estructuras anclan los filamentos intermedios de desmina de la fibra cardíaca y participan, junto con la fascia adherens, en la adhesión de las membranas plasmáticas de células vecinas. Las uniones de comunicación (nexos), corresponden a sitios que permiten el paso de iones y moléculas pequeñas desde el citoplasma de una célula a la célula vecina. Su ultraestructura y composición molecular es similar a la de las uniones de comunicación descritas en el capítulo de epitelios. 2.3.4MúsculoLiso El músculo liso está formado por fibras musculares lisas que corresponden a células uninucleadas, delgadas y aguzadas en los extremos, cuya longitud varía entre 20 y 500 mm. Este tipo de músculo forma la porción contráctil de la pared de diversos órganos tales como tubo digestivo y vasos sanguíneos, que requieren de una contracción lenta y sostenida. Las células se organizan en grupos, formando haces, rodeados de tejido conjuntivo fibroso que contiene vasos sanguíneos. El núcleo de las fibras musculares lisas se ubica en el centro de la fibra y los organelos citoplasmáticos tales como mitocondrias, aparato de Golgi, retículo endoplásmico rugoso y ribosomas libres se localizan, mayoritariamente, en la vecindad de los polos nucleares. El resto del citoplasma está ocupado por abundantes miofilamentos finos de actina, una proporción menor de miofilamentos gruesos de miosina, y un citoesqueleto de filamentos intermedios formados por desmina. Existen, también, numerosos cuerpos densos, estructuras que anclan filamentos finos. Las fibras musculares lisas se disponen desplazadas una respecto de la otra, de manera que el extremo delgado de una fibra se ubica vecino a la parte ancha de la fibra vecina. Esta disposición de las fibras y la localización del núcleo en el centro, explica el aspecto del músculo liso en corte transversal. 62 HistologíayCitologíaavanzadaII Las fibras musculares lisas están rodeadas por una lámina basal (lámina externa) comparable a la lámina basal de los epitelios. Por fuera de la lámina externa, se dispone una trama de fibras reticulares. En sitios discretos, las células adyacentes están asociadas por uniones de comunicación ("nexos"), de estructura y función similares a la explicada en tejidos epiteliales. 2.3.4.1Basesestructuralesdelacontraccióndelmúsculoliso El aparato contráctil del músculo liso se contrae más lentamente que el del músculo estriado, pero permite un acortamiento mayor de las fibras musculares lisas. El mecanismo de contracción, en esta variedad de músculo, también se basa en el deslizamiento de los filamentos finos sobre los filamentos gruesos. Los filamentos de actina de las fibras musculares lisas son fáciles de detectar a nivel ultraestructural; en cambio la visualización de los filamentos gruesos requiere de condiciones de fijación especiales, que demuestran que en el músculo liso por cada filamento grueso hay una proporción mucho mayor de filamentos finos (1:14) que la que se observa en el músculo esquelético (1:6). En estas células, la contracción es regulada también por alza en las concentraciones citosólicas de Ca++. Sin embargo, la regulación de la contracción está asociada a miosina y no a actina. Un alza en las concentraciones citosólicas de Ca++ induce la fosforilación de las cadenas livianas de la miosina lo que: - Produce una modificación en la cola de la molécula que permite la formación de filamentos gruesos. - Genera un cambio conformacional en la cabeza que permite su interacción con actina. Los filamentos gruesos preparados in vitro, a partir de miosina de músculo liso, aparecen polarizados en una sola dirección en un lado del filamento y en la dirección opuesta a lo largo del otro lado. En esta configuración no existe una zona libre de puentes, como la que se ve en el filamento grueso del músculo esquelético. Esta disposición tiene la ventaja que actina y miosina pueden interactuar sin interrupción a lo largo de todo el filamento grueso. Cuando la cabeza de la miosina se defosforila, los filamentos se desensamblan y la miosina se disocia de la actina. La fosforilación es catalizada por una enzima (quinasa de la cadena liviana de la miosina) cuya acción requiere de la presencia del complejo Ca-calmodulina. El modelo aceptado de contracción de las fibras musculares lisas establece que manojos de filamentos finos de actina, asociados a filamentos gruesos de miosina, se anclan por un extremo a cuerpos densos adheridos a la membrana plasmática y por el otro a filamentos intermedios no contráctiles a través de cuerpos densos citoplasmáticos. La a-actinina es uno de los componentes de los cuerpos densos. El rol de los cuerpos densos es similar al de los discos Z de las miofibrillas del músculo estriado. Los manojos contráctiles se orientarían oblicuos respecto del eje mayor de la célula, lo que explicaría el acortamiento que experimentan las fibras musculares lisas durante su contracción. En la superficie de las células musculares lisas existen numerosas vesículas membranosas o cavéolas, vecinas a cisternas o túbulos de retículo endoplásmico liso. Se 63 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología cree que este sistema membranoso juega un papel en la captura y liberación de calcio, similar al que desempeña el retículo sarcoplásmico en el músculo estriado. Además de su actividad contráctil, las células musculares lisas tienen la capacidad de sintetizar colágeno tipo III, elastina y proteoglicanos. 2.3.4.2InervacióndelMúsculoLiso El músculo liso está inervado por nervios de los sistemas simpático y parasimpático. Con frecuencia, los axones de los nervios terminan en una serie de dilataciones en el conjuntivo que rodea a las células musculares. Algunas de estas dilataciones axónicas están muy próximas (10-20 nm) a la superficie de la célula muscular dando origen a uniones neuromusculares. De acuerdo a la proporción de células inervadas en un determinado músculo, se distinguen: El tejido muscular liso unitario o visceral, que posee grandes unidades motoras en las que sólo algunas células musculares poseen una unión neuromuscular propia. La excitación se transmite a un número variable de células musculares que no reciben inervación directa, a través de uniones de comunicación (nexos). Esto permite que todas las células musculares de la unidad motora se contraigan o relajen en conjunto. El tejido muscular multiunitario presente en órganos que requieren una modulación precisa del grado de contracción de sus células, como el iris del ojo o las arteriolas. En este tipo de músculo liso, las unidades motoras son pequeñas, predominando aquellas en que existe asociación de sólo una célula muscular con cada terminación nerviosa. 2.3.5RegeneracióndelTejidoMuscular La capacidad de regeneración es diferente en las 3 variedades de músculo. El músculo esquelético tiene la capacidad de regenerar parcialmente a partir de las llamadas células satélite. Estas corresponden a células uninucleadas, fusiformes que yacen dentro de la lámina basal que rodea a cada fibra. Se considera que corresponden a mioblastos que persisten luego de la diferenciación del músculo. Frente a daño muscular u otros estímulos estas células, relativamente escasas, se activan, proliferan y se fusionan para formar nuevas fibras. Un proceso similar es responsable, en parte, de la hipertrofia muscular (aumento de tamaño) que se produce por fusión de estas células con la fibra parenteral, aumentando la masa muscular. El músculo cardíaco no tiene, prácticamente, capacidad de regenerar. Los daños del músculo cardíaco se reparan por proliferación del tejido conjuntivo, produciéndose una cicatriz. El músculo liso tiene también una capacidad de regeneración moderada. Luego de daño muscular, algunas células musculares lisas entran en mitosis y reemplazan el tejido dañado. Si la capacidad de proliferación no es suficiente para reparar el daño, se produce una cicatriz de tejido conjuntivo. Un caso particular de proliferación de células musculares lisas se produce en el útero de animales preñados donde se observa aumento del número de células (hiperplasia) y del tamaño de ellas (hipertrofia). Durante esta etapa, el miometrio presenta numerosas mitosis. De ahí que se acepte que las células musculares lisas mantienen su capacidad mitótica. Por otra parte, en cualquier etapa de la vida los pericitos pueden diferenciarse en células musculares. 64 HistologíayCitologíaavanzadaII 2.4Tejidonervioso 1. Características y funciones básicas 2. Neuronas 3. Tipos de neuronas 4. Estructura celular básica del citoplasma de la neurona 5. Estructura y funciones básicas del axón 6. Transporte axonal 7. Conducción del impulso nervioso 8. Sinapsis 9. Uniones intercelulares de las neuronas 10. Células de sostén 1. Astrocitos 2. Oligodendrocitos 3. Células ependimarias 4. Microglía 5. Células de Schwann 6. Células satélites o capsulares 11. Estructura básica del SNP 12. Estructura básica del SNC 2.4.1Característicasyfuncionesbásicasdeltejidonervioso Se origina desde el ectoderma y sus principales componentes son las células, rodeadas de escaso material intercelular. Las células son de dos clases diferentes: neuronas o células nerviosas y neuroglia o células de sostén. Es el tejido propio del Sistema Nervioso el cuál, mediante la acción coordinada de redes de células nerviosas: 1. Recoge información procedente desde receptores sensoriales. 2. Procesa esta información, proporcionando un sistema de memoria. 3. Genera señales apropiadas hacia las células efectoras. Las células de sostén rodean a las neuronas y desempeñan funciones de soporte, defensa, nutrición y regulación de la composición del material intercelular El Sistema Nervioso Central (SNC), se origina desde el epitelio del tubo neural y su tejido nervioso contiene neuronas, células de neuroglia y capilares sanguíneos que forman la barrera hemato-encefálica. El Sistema Nervioso Periférico (SNP), que conecta los receptores sensoriales con SNC. y a este con las células efectoras, se desarrolla a partir de la cresta neural y sus células se asocian a otros tejidos del organismo. Sin embargo, es una extensión del tejido nervioso del SNC ya que zonas de las neuronas sensitivas y efectoras y todas las interneuronas se encuentran en el SNC, mientras que los ganglios nerviosos y los nervios periféricos corresponden al tejido nervioso propio del SNP. 65 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.4.2Neuronas Son las células funcionales del tejido nervioso. Ellas se interconectan formando redes de comunicación que transmiten señales por zonas definidas del sistema nervioso. Las funciones complejas del sistema nervioso son consecuencia de la interacción entre redes de neuronas, y no el resultado de las características específicas de cada neurona individual. La forma y estructura de cada neurona se relaciona con su función específica, la que puede ser: - Recibir señales desde receptores sensoriales. - Conducir estas señales como impulsos nerviosos, que consisten en cambios en la polaridad eléctrica a nivel de su membrana celular. - Transmitir las señales a otras neuronas o a células efectoras En cada neurona existen cuatro zonas diferentes 1. El pericarion que es la zona de la célula donde se ubica el núcleo, y desde el cuál nacen dos tipos de prolongaciones. 2. Las dendritas que son numerosas y aumentan el área de superficie celular disponible para recibir información desde los terminales axónicos de otras neuronas. 3. El axón que nace único y conduce el impulso nervioso de esa neurona hacia otras células ramificándose en su porción terminal (telodendrón) 4. Uniones celulares especializadas llamadas sinapsis, ubicadas en sitios de vecindad estrecha entre los botones terminales de las ramificaciones del axón y la superficie de otras neuronas. El tamaño de las células nerviosas es muy variable pero su cuerpo celular puede llegar a medir hasta 150 um y su axón más de 100 cm Cada zona de las células nerviosas se localiza de preferencia en zonas especializadas del tejido nervioso. Los cuerpos celulares, la mayor parte de las dendritas y la arborización terminal de una alta proporción de los axones se ubican en la sustancia gris del SNC y en los ganglios del SNP. Los axones forman la parte funcional de las fibras nerviosas y se concentran en los haces de la sustancia blanca del SNC; y en los nervios del SNP 2.4.3Tiposdeneuronas Según el número y la distribución de sus prolongaciones, las neuronas se clasifican en: 66 - Bipolares, que además del axón tienen sólo una dendrita; se las encuentra asociadas a receptores en la retina y en la mucosa olfatoria. - Seudo-unipolares, desde las que nace sólo una prolongación que se bifurca y se comporta funcionalmente cono un axón salvo en sus extremos ramificados en que la rama periférica reciben señales y funcionan como dendritas y transmiten el HistologíayCitologíaavanzadaII impulso sin que este pase por el soma neuronal; es el caso de las neuronas sensitivas espinales. - Multipolares desde las que, además del axón, nacen desde dos a más de mil dendritas lo que les permite recibir terminales axónicos desde múltiples neuronas distintas. La mayoría de las neuronas son de este tipo. Un caso extremo do lo constituye la célula de Purkinje que recibe más de 200.000 terminales nerviosos. 2.4.4Estructuracelularbásicadelcitoplasmadelaneurona Las neuronas son células sintetizadoras de proteínas, con un alto gasto de energía metabólica, ya que se caracterizan por: - Presentar formas complejas y una gran área de superficie de membrana celular, a nivel de la cuál debe mantener un gradiente electroquímico importante entre el intra y el extracelular. - Secretar distintos tipos de productos a nivel de sus terminales axónicos. - Requerir un recambio constante de sus distintos organelos y componentes moleculares ya que su vida suele ser muy larga (hasta los mismos años que el individuo al que pertenecen). Por estas razones: - El núcleo es grande y rico en eucromatina, con el nucléolo prominente. - El ergastoplasma que se dispone en agregados de cisternas paralelas entre las cuales hay abundantes poliribosomas. Al microscopio de luz se observan como grumos basófilo o cuerpos de Nissl, los que se extienden hacia las ramas gruesas de las dendritas. - El aparato de Golgi se dispone en forma perinuclear y da origen a vesículas membranosas, con contenidos diversos, que pueden desplazarse hacia las dendritas o hacia el axón. - Las mitocondrias son abundantes y se encuentran en el citoplasma de toda la neurona. - Los lisosomas son numerosos y originan cuerpos residuales cargados de lipofucsina que se acumulan de preferencia en el citoplasma del soma neuronal. - El citoesqueleto aparece, al microscopio de luz, como las neurofibrilla, que corresponden a manojos de neurofilamentos (filamentos intermedios), vecinos a los abundantes microtúbulos (neurptúbulos). Estos últimos se asocian a proteinas específicas (MAPs: proteínas asociadas a microtúbulos) que determinan que el citoesqueleto de microtúbulos pueda: - Definir compartimentos en el citoplasma neuronal: la MAP-2 se asocia a los microtúbulos del pericarion y dendritas mientras que la proteína tau se asociada a los microtúbulos del axón. 67 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Dirigir el movimiento de organelos a lo largo de los microtúbulos: la kinesina, se desplaza hacia el extremo (+), mientras que la dineína, se desplazan hacia elextremo (-) de los microtúbulos. - Las dendritas nacen como prolongaciones numerosas y ramificadas desde el cuerpo celular, sin embargo en las neuronas sensitivas espinales se interpone un largo axón entre las dendritas y el pericarion. A lo largo de las dendritas existen las espinas dendríticas, pequeñas prolongaciones citoplasmáticas, que son sitios de sinapsis. El citoplasma de las dendritas contiene mitocondrias, vesículas membranosas, microtúbulos y neurofilamentos. - El axón es de forma cilíndrica y nace desde el cono axónico que carece de ergastoplasma y ribosomas. El citoplasma del axón (axoplasma) contiene mitocondrias, vesículas, neurofilamentos y microtúbulos paralelos. Su principal función es la conducción del impulso nervioso Se ramifica extensamente sólo en su región terminal (telodendrón) la que actúa como la porción efectora de la neurona, ya que así cada terminal axónico puede hacer así sinapsis con varias neuronas o células efectoras. 2.4.5Estructurayfuncionesbásicasdelaxón Sus principales funciones son: - El transporte de organelos y moléculas, por el axoplama, entre el pericarion y las ramas del telodendrón. Este es necesario para la mantención del axón y de las células asociadas a él, y para permitir la llegada al pericarion de factores reguladores que modulan su comportamiento. - La conducción del impulso nervioso, como el desplazamiento del potencial de acción generado por cambios en la permeabilidad a iones a lo largo de la membrana celular axonal (axolema) de las fibras nerviosas, en que el axón está rodeado por la vaina de células de sostén. 2.4.6Transporteaxónico El transporte de organelos, enzimas, agregados macromoleculares y metabolitos, es una función de axoplasma en la cuál intervienen directamente los microtúbulos. Ocurre en dos direcciones: - Anterogrado, desde el soma neuronal hacia el telodedrón. - Retrógrado desde los botones terminales hacia el soma neuronal. La velocidad del transporte varía entre: 68 - Un flujo lento de 0,5 um/min, al cual se desplazan agregados moleculares como las sub-unidades proteicas que forman al citoesqueleto axonal. - El flujo rápido anterógrado al cuál los organelos membranosos se transladan a velocidades de unos 300 um/min. HistologíayCitologíaavanzadaII - El flujo rápido retrógrado en el cuál vesículas membranosas provenientes de los botones terminales, son transportados hacia el pericarion a unos 200 um/min. Los transportes axonales rápidos están mediados por la interacción molecular entre microtúbulos y los dos moléculas son capaces de desplazarse a lo largo de los microtúbulos. En el flujo rápido anterógrado es la molécula de kinesina, unida a un receptor en la membrana del organelo transportado que se desplaza, a expensas de ATP, desde el extremo (-) del microtúbulo, ubicado en el pericarion hacia su extremo (+) En el flujo rápido retrógrado es la molécula de dineína citoplasmática (MAP1C) unida a un receptor en la membrana del organelo transportado la que se desplaza interactuando con la tubulina a expensas de ATP, desde el extremo (+) del microtúbulo, ubicado en el terminal axónico hacia su extremo (-) 2.4.7Conduccióndelimpulsonerviosoporelaxón En el SNC los axones están rodeados por la mielina de los oligodendrocitos (fibras nerviosas mielínicas del SNC), mientras que en el SNP pueden estar rodeados, ya sea, por prolongaciones citoplasmáticas de las células de Schwann (fibras amielínicas) o por la mielina las células se Schwann (fibras nerviosas mielínicas del SNP). Los impulsos nerviosos son ondas transitorias de inversión del voltaje que existe a nivel de la membrana celular, que se inician el sitio en que se aplica el estímulo. Cada una de estas ondas corresponde a un potencial de acción. Este proceso es posible porque entre las macromoléculas que, como proteínas integrales, ocupan todo el espesor del axolema se encuentran. La bomba de sodio-potasio, capaz de transportar activamente sodio hacia el extracelular intercambiándolo por potasio. Canales para Na sensibles a voltaje, que determinan en la inversión del voltaje de la membrana ya que al abrirse y permitir la entrada de Na+ hacen que el interior de la membrana se vuelva positiva. Canales para K sensibles a voltaje, cuya activación contribuye al retorno a la polaridad inicial, por salida de iones K desde el interior del axoplasma. En las fibras nerviosas amielínicas el impulso se conduce, como una onda continua de inversión de voltaje hasta los botones terminales de los axones en la forma indicada en el párrafo anterior. La velocidad que es proporcional al diámetro del axón y varía entre 1 a 100 m/s. En las fibras nerviosas mielínicas, el axón está cubierto por una vaina de mielina formada por la aposición de una serie de capas de membrana celular, que actúa como un aislante eléctrico del axón. A lo largo del axón, la mielina está formada por células sucesivas y en cada límite intercelular existe un anillo sin mielina que corresponde al nodo de Ranvier. Es en este sitio donde puede ocurrir flujo de iones a través de la membrana axonal. A nivel de los nodos de Ranvier el axolema tiene una alta concentración de los canales de Na sensibles a voltaje, en consecuencia es una conducción saltatoria del potencial de 69 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología acción ya que la inversión del voltaje inducido a nivel de un nódulo de Ranvier se continúa por propagación pasiva rápida de la corriente por el interior del axón y por el extracelular hasta el nódulo siguiente donde produce la inversión del voltaje. La consecuencia de esta estructura es que en los axones mielínicos la conducción del impulso nervioso es más rápida. La velocidad de conducción del impulso nervioso es proporcional al diámetro del axón y a la distancia entre los nodos de Ranvier. 2.4.8Unionesintercelularesdelasneuronas Las neuronas se asocian entre sí y con otras células en estructuras especializadas que permiten: - Inducir la descarga del impulso nervioso de una neurona sensitiva por asociación de la ramificación terminal periférica de su axón con células epiteliales de los receptores sensoriales. - Estimular la acción de células efectoras de otros tejidos, gracias a la capacidad del terminal axónico de asociarse a estas células. De hecho a este tipo de uniones se les considera un tipo especial de sinapsis química. - Transmitir el impulso nervioso desde una neurona a otra mediante estructuras especializadas, las sinapsis, que se encuentran el sitio de contacto de cada terminal axónico con las dendritas o el pericarion de otra neurona. 2.4.9Sinapsis Conducen el impulso nervioso sólo en una dirección. Desde el terminal presináptico se envían señales que deben ser captadas por el terminal post-sináptico. Existen dos tipos de sinapsis, eléctricas y químicas que difieren en su estructura y en la forma en que transmiten el impulso nervioso. 2.4.9.1Sinapsiseléctricas Corresponden a uniones de comunicación entre las membranas plasmáticas de los terminales presináptico y postsinápticos. Las que al adoptar la configuración abierta permiten el libre flujo de iones desde el citoplasma del terminal presinático hacia el citoplasma del terminal postsináptico. 2.4.9.2Sinapsisquímica Se caracteriza porque las membranas de los terminales presináptico y postsináptico están engrosadas. El espacio intercelular es de 20-30 nm de ancho. El terminal presináptico se caracteriza por contener mitocondrias y abundantes vesículas sinápticas, que son organelos revestidos de membrana que contienen neurotransmisores. Al fusionarse las vesículas sinápticas con la membrana se libera el neurotrasmisor que se une a receptores específicos localizados en la membrana post-sináptica, en la cuál se concentran canales para cationes activados. Al llegar el impulso nervioso al terminal presináptico se induce: la apertura de los canales para calcio sensibles a voltaje, el subir el ncalcio intracelular se activa la exocitosis de las vesículas sinápticas que liberan al neurotransmisor hacia la hendidura sináptica. La unión del neurotrasmisor con su receptor induce en la membrana postsinática la apertura 70 HistologíayCitologíaavanzadaII de los canales para cationes activados, determinando cambios en la permeabilidad de la membrana que pueden: inducir la depolarización de la membrana postsinática: sinápsis exhitatorias; o hiperpolarizar a la membrana postsináticas: sinapsis inhibitorias. La sumatoria de los impulsos excitantes e inhibitorios que llegan por todas las sinapsis que se relacionan con a cada neurona (1000 a 200.000) determina si se produce o no la descarga del potencial de acción por el axón de esa neurona 2.4.10CélulasdeSostén 2.4.10.1Astrocitos Tienen formas estrelladas y presentan largas prolongaciones que se extienden hacia las neuronas y hacia las láminas basales que rodean a los capilares sanguíneos (pies terminales), o que separan al tejido nervioso del conjuntivo laxo de la piamadre, constituyendo la glia limitante. Las prolongaciones de los astrocitos contienen manojos de filamentos intermedios específicos formados por la proteína ácida fibrilar. Se han identificado dos tipos de astroglia: - Astrocitos fibrosos que se asocian de preferencia a las fibras nerviosas de la sustancia blanca. - Astrocitos protoplasmáticos que se concentran de preferencia asociados a los pericariones, dendritas, terminaciones axónicas en la sustancia gris. 2.4.10.2Oligodendrocitos Son más pequeños y con menos prolongaciones que la astroglía. Su núcleo es rico en heterocromatina y su citoplasma contiene ergastoplasma, polirribosomas libres, un aparato de Golgi desarrollado y un alto contenido n microtúbulos, tanto en el citoplasma que rodea al núcleo como en sus prolongaciones. Su función más notable es la formación de la mielina, que rodea a los axones del SNC. El proceso de mielinización del axón por el oligodendrocito es similar al de la célula de Schwann. Sin embargo una oligodendroglia puede formar mielina en cada una de sus prolongaciones que se adhieren inicialmente a un axón, de modo que internodos mielinizados de varios axones dependen un oligodendrocito. 2.4.10.3Célulasependimarias Forman un tipo de epitelio monostratificado que reviste las cavidades internas del SNC que contienen al líquido cefalo raquídeo (ventrículos y conducto del epéndimo). Se unen entre sí por comlejosde unión similares a los epiteliales pero carecen de zona de oclusión, de modo que el líquido cefalorraquídeo se comunica con los espacios intercelulares existentes entre las células nerviosas y las glías. Presentan además largas prolongaciones en su zona basal que se asocian a las prolongaciones de la astroglia y en su superficie apical presenta microvellocidades y cilios. 2.4.10.4Microglía Se caracterizan por ser pequeñas, con un denso núcleo alargado y prolongaciones largas y ramificadas. Contienen lisosomas y cuerpos residuales. Si bien se la clasifica generalmente como célula de la neuroglia ellas presentarnel antígeno común leucocítico y el antígeno de histocompatibilidad clase II, propio de las células presentadoras de antígeno. 71 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.4.10.5CélulasdeSchwann Las células de Schawnn se originan de la cresta neural y acompañan a los axones durante su crecimiento, formando la vaina que cubre a todos los axones del SNP desde su segmento inicial hasta sus terminaciones. Ellas son indispensables para la integridad estructural y funcional del axón. Fibras nerviosas amielínicas Cuando el axón asociado a la célula de Schwann es de pequeño diámetro se aloja en una concavidad de la superficie de la célula de Schawnn, rodeado por espacio intercelular y conectado hacia el exterior mediante el mesaxón. Varios axones pueden estar alojados de esta forma en la misma célula. Fibras nerviosas mielínicas Los axones de mayor diámetro inducen el proceso de formación de la mielina por la célula de Schwann. En las fibras mielínicas cada célula de Schawnn rodea a solo un axón y su vaina de mielina se ubicada vecina al axón con el resto de su citoplasma en la zona externa. Por fuera, la célula de Schawnn se asocia mediante su lámina basal que al endoneuro. El largo de cada célula de Schawnn varía entre 200 -2000 um. Entre las sucesivas células de Schwann existen zonas sin mielina llamadas los nodos de Ranvier. La mielina está compuesta por capas de membrana de la célula de Schwann las cuales se disponen así durante el proceso de mielinización, el cual comienza con la invaginación de un axón superficie de la célula de Schwann, de manera que el axolema se adosa estrechamente a la membrana plasmática de la célula de Schwann por una parte, y las membranas de la célula de Schwann que se enfrentan en el mesaxón. Se produce luego un crecimiento en espiral del citoplasma de la célula de Schwann que se traduce en un crecimiento del mesaxón en forma tal que se enfrentan las membranas plasmáticas de la célula de Schwann por sus caras extracelulares y por sus caras intracelulares. Al fusionare las caras extracelulares se genera la llamada línea interperiodica (línea densa menor) y al desplazarse el citoplasma y fusionarse las caras intracelulares de las membranas se originan las líneas periódicas (líneas densas mayores). El citoplasma de la célula de Schwann permanece: - Junto al axón. - Junto a la superficie externa de la célula. - Entre las lamelas internodales de la mielina: en las cisuras de ScmidtLantermann. A nivel de los nodos de Ranvier, el citoplasma en los extremos celulares de cada vuelta de mielina permanece y no ocurre la fusión de las membranas plasmáticas. La lengueta más externa de la célula de Schwann y su lámina basal cubren al axón en esta zona. 2.4.10.6Célulassatélitesocapsulares Son células pequeñas localizadas en los ganglios, alrededor del pericaron, las dendritas y terminales axónicos. Están rodeadas por lámina basal y separan a las células nerviosas del estroma fibrocolagenoso presente en el tejido propio del SNP. 72 HistologíayCitologíaavanzadaII 2.4.11EstructurabásicadelSNP La unidad estructural es el Fascículo Nervioso formado por fibras nerviosas rodeadas por el perineuro, derivado del tejido conjuntivo. El perineuro está formado por células muy aplanadas las cuales se han diferenciado tomando un aspecto epiteliode, se rodeas de lámina basal y se disponen en capas, entre ellas existe sustancia fundamental con fibrillas de colágeno III y finas fibras elásticas. El perineuro forma una envoltura continua que acompaña a las fibras nerviosas hasta sus terminaciones ya que juega un rol muy importante en la regulación de la composición del medio que rodea a las fibras nerviosas. Al interior del fascículo las fibras nerviosas están rodeadas por el endoneuro, cuyo principal componente son fibrillas de colágeno o III, orientadas paralelas a la s fibras nerviosas y rodeadas de matriz extracelular rica en proteoglicanos. Los fascículos nerviosos pueden agruparse formando los Nervios propiamente tales, en los cuales varios fascículos se agrupan rodeados por el epineuro que es una vaina de tejido conjuntivo que tiende a ser más bien laxo entre los distintos fascículos pero que se hace bastante fibroso en la periferia, estructurando los troncos nerviosos. El epineuro es un tejido conjuntivo corriente, rico en fibroblastos y en fibrillas de colágeno I, que forman fibras colágenas. Los Ganglios Nerviosos corresponden a acúmulos de cuerpos neuronales y prolongaciones nerviosas que en el caso de los ganglios sensitivos y de gran parte de los ganglios del SNS corresponden a órganos esféricos protegidos por cápsulas de tejido conjuntivo de características similares al perineuro y al epineuro. Los cuerpos celulares de las neuronas están rodeados por las células satélites que se asocian a un tejido intesticial de características similares al endoneuro el cual rodea también a las fibras nerviosas dentro del ganglio. Existen además ganglios que se ubican dentro de la pared de ciertos órganos: ganglios intramurales, como es el caso de los plexos mientérico y submucoso del tubo digestivo. 2.4.12EstructurabásicadeltejidonerviosodelSNC La organización de este tejido recuerda su origen epitelial. Se extiende desde los conductos que contienen al líquido céfalo-raquídeo hasta la primera capa de tejido conjuntivo que lo rodea externamente: la piamadre de la cual está separado por una lámina basal. El tipo de organización estructural que define las propiedades del SNC son las complejas redes interneuronales que lo forman ubicándose la mayor parte del cuerpo de estas neuronas en la sustancia gris, proyectándose hacia los axones mielínizados hacia la sustancia blanca, para conectar entre sí a neuronas ubicadas en distintas zonas del encéfalo o la médula espinal. 73 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2.4.12.1Redesneuronales Corteza Cerebelosa La sustancia gris, dispuesta vecina a la superficie externa de las laminillas cerebelosas está formada por neuronas dispuestas en tres capas diferentes: a) La capa externa o molecular. b) La externa o glomerulosa, que contienen neuronas más bien pequeñas. c) Entre ambas se ubica la capa de las células de Purkinje, grandes neuronas dispuestas en una sola capa, cuyas dendritas se proyectan hacia la capa molecular y su axón atraviesas la capa granulosa y se dirige hacia la sustancia blanca ubicada al centro de cada laminilla. La citoarquitectura de las neuronas cerebelosas y la posible interacción entre ellas las estableció el histólogo español Ramón y Cajal usando cortes histológicos teñidos con la técnica de Golgi, mediante la cuál en cada corte se tiñen sólo pocas neuronas pero cada una de ellas se tiñe entera. La observación de muchos cortes de cerebelo en cada uno de los cuales se teñían distintos grupos de neuronas le permitió a Ramón y Cajal realizar los esquemas, vigentes hasta hoy de la estructura de la corteza cerebelosa. Organización tisular propia del tejido nervioso en sustancias gris y blanca. Tejido de la sustancia gris. La ultraestructura de las zonas ya descritas de la corteza cerebelosa permite observar su la organización tisular, en cortes de tejido. Los perfiles membranosos entre las células nerviosas corresponden a prolongaciones de células de neuroglia, entre las cuales especialmente la astroglia tiene una organización muy precisa. Como características generales de la sustancia gris destaca: - Estrecha vecindad entre las membranas de las células nerviosas y las membranas de las células gliales, quedando siempre un espacio delgado de grosor relativamente constante entre ellas, lleno de material extracelular. - Disposición de prolongaciones gliales alrededor de las sinapsis químicas, aislándolas del escaso espacio intercelular. - Concentración de células de astroglia protoplasmática en este tejido. - Dendritas y somas neuronales rodeadas siempre de prolongaciones de oligodendrocitos y astrocitos y separadas por ellas de otras prolongaciones nerviosas, excepto en los sitios de sinapsis. - Capilares sanguíneos rodeados siempre por prolongaciones gliales. - Ausencia de elementos ajenos al tejido derivado del tubo neural, con la única excepción de las células de microglia y de la irrigación. Tejido de la sustancia blanca. Corresponden a fibras nerviosas mielinicas en las cuales los axones muestran su vaina de mielina dependiente de los oligodendrocitos y rodeados por los astrocitos fibrosos, en forma tal que cortes a través de tractos de sustancia blanco muestran como principales componentes a axones con su vaina mielínica, a citoplasma y núcleos de oligodendrocitos y astrocitos fibrosos y a capilares sanguíneos. 74 HistologíayCitologíaavanzadaII 2.4.12.2Receptoressensoriales Son estructuras en las cuales existen células capaces de responder con una gran sensibilidad a señales específicas del entorno, y de transferir la información recibida a terminales nerviosos aferentes al SNC que corresponden a axones de neuronas sensitivas. El proceso que hace que el receptor sensorial responda de un modo útil al estímulo se denomina transducción sensorial. En los quimioreceptores es la unión de un ligando específica a receptores presentes en la membrana celular de la célula sensorial la que determina un cambio en la permeabilidad a cationes de canales sensibles a ligando presentes en su membrana. Esto induce a la célula receptora a generar una señal que modifica la permeabilidad a iones de la membrana de los terminales nerviosos adyacentes a ellas generando eventualmente en ellos un potencial de acción que se transmite hacia el SNC. En los mecanoreceptores es la deformación que experimenta la membrana celular de la célula sensorial la que determina la apertura de canales para cationes, generándose una señal que modifica la permeabilidad a iones de la membrana de los terminales nerviosos adyacentes a ellas generando eventualmente en ellos un potencial de acción que se transmite hacia el SNC. En los fotoreceporess es un cambio inducido por la luz en la estructura de moléculas específicas presentes en membranas de la célula sensorial lo que genera una señal que determina la apertura de canales para cationes en la membrana plasmática de la célula receptora, generándose una señal que modifica la permeabilidad a iones de la membrana de los terminales nerviosos adyacentes a ellas generando eventualmente en ellos un potencial de acción que se transmite hacia el SNC. Corpúsculos de tacto de Merkel (Células de Merkel) Son células capaces de actuar como receptores sensitivos a la presión. Son células especializadas del epitelio estratificado de la epidermis, concentradas en la palma de la mano y la planta de los pies. Las células de Merkel se ubican entre las células de la capa germinativa y se asocian a las células epiteliales vecinas por medio de desmosomas y su citoplasma se caracteriza por su abundancia en filamentos intermedios de citoqueratina. Su cara basal se asocia una terminal nerviosa que adopta una forma de disco y que corresponde a la terminal de una fibra aferente, que corresponde al axón de una neurona sensitiva. 75 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El citoplasma de las células de Merkel es capaz de sintetizar y acumular vesículas membranosas que contienen un material denso a los electrones que contienen cromograninas asociadas a moléculas pequeñas parecidas a las catecolaminas. La célula de Merkel al ser deformada por una compresión la epidermis sería estimulada a liberar sus vesículas que contienen una sustancia capaz de actuar como un neurotransmisor y podría inducir la depolarización del terminal nervioso asociada a ella, la cuál eventualmente generaría la descarga de un potencial de acción en el axón de la neurona sensitiva. Por sus características de ser capaz de liberar una sustancia química capaz de ejercer su acción al unirse un ligando específico en la superficie de la membrana del terminal nervioso se considera que la célula de Merkel pertenece al sistema APUD (o sistema neuroendocrino difuso). Órgano de Corti (oído) Las células receptoras son las célula ciliadas, capaces de traducir el cambios en la posición de sus estereocilios, inducidos desplazamientos de la densa capa de matriz extracelular, la membrana tectoria, en señales eléctricas hacia los termínales sensitivos asociados a ellas. El sitio de transducción de la señal mecánica que determina el cambio en la posición de los estereocilios de modo que estas células epiteliales ricas en estereocilios actúan como mecanorceptores en los cuales la deformación generada por el cambio en la posición de los estereocilios regula el comportamiento de los canales para cationes presentes en la membrana de las células ciliadas y determina la depolarización de la membrana de la célula ciliada la cual se transmite a las terminales nerviosos aferentes al SNC (sensitivas). 76 HistologíayCitologíaavanzadaII Fotorreceptores (retina) Las células fotosensibles de la retina corresponden a células de características algo distintas: los conos y los bastones. La especialización que les confiere el carácter de actuar como receptores de luz es sin embargo compartida por ellas y corresponde a la existencia del llamado segmento externo de las células. Esta zona de la célula parece corresponder a un cilio altamente especializado que presenta una serie de laminillas membranosos en su interior, formadas por vesículas membranosas aplanadas que contienen como molécula integral de su membrana a la rodopsina. Basta la llegada de un fotón a las moléculas de rodopsina para desencadenar una secuencia de reacciones que se traducen finalmente en una activación de los canales a cationes sensibles a ligados en la membrana de conos o bastones la que determina una señal que induce la liberación de vesículas de mediadores químicos hacia los terminales axónicos sensitivos (axones de neuronas horizontales de la retina) de que hacen contacto con la base de las células sensitivas fotosensibles desencadenando en ellas un potencial de acción. 77 UNIDADDIDÁCTICAIII ESTUDIOSHISTOLÓGICOSYCITOLÓGICOSEN GINECOLOGÍAYOBSTETRICIA HistologíayCitologíaavanzadaII OvarioNormal ►Ref.5771b. Son 2 órganos del tamaño y forma aproximados a una almendra. Situados en la aleta posterior del ligamento ancho, a los lados del útero. Su tamaño sufre modificaciones cíclicas, alcanzando su m por. Durante la ovulación y cuando existe el cuerpo amarillo en la gestación. En el corte, se distinguen 2 porciones: A) Cortical: Es blanquecina, constituida por tejido conjuntivo denso, en el cual se alojan los folículos que encierran el plasma germinativo. Se halla revestida por el epitelio ovárico (una capa de células cilíndricas, prismáticas, que descansan sobre una lámina conjuntiva que es la albugínea). En el hilio, el epitelio ovárico se continúa sin transición con el endotelio peritoneal a nivel de la línea de Farre-Waldeyer, lo que hace que sea el único órgano intraperitoneal propiamente dicho. B) Medular: Es rojiza y esta formada por tejido conjuntivomuscular, por ella discurren los vasos y nervios que han penetrado a través del hilio. En la región + interna de la cortical, se encuentran los folículos primordiales. Las gónadas están ricamente irrigadas y los vasos provienen de la arteria ovárica (rama de la aorta), que llega al órgano a través del ligamento infundibuloovárico o pelviano. Después de emitir la tubárica externa, alcanza al ovario y se anastomosa con la rama de la uterina en forma terminal, quedando constituido 1 arco de donde salen numerosas ramas que irrigan al ovario. Cuerpo con forma de almendra, de 4 cms. de eje mayor y 1.5 cms. de grosor, es la única víscera de ubicación intraperitoneal; su superficie está tapizada por el epitelio germinativo en lugar del peritoneo visceral. En el borde anterior del ovario se inserta el mesovario, meso que se extiende hasta la hoja posterior del ligamento ancho del útero. Su polo inferior está conectado al ángulo lateral del útero a través del ligamento uterovárico. Su polo superior está unido a la pared pélvica por el ligamento infundíbulo pélvico, que transporta a los vasos ováricos. A pesar de sus fijaciones, el ovario es relativamente móvil; puede elevarse con el útero y puede ser movido algo durante el examen pélvico. Al corte, el ovario presenta una zona periférica, la corteza, ubicada debajo del epitelio germinativo, la cual contiene a los ovulos en sus distintas etapas de desarrollo; hacia el interior se ubica la médula que contiene tejido fibroso, vasos sanguíneos y nervios. En la niña, la superficie del ovario es lisa y de color rosada; en la mujer postpuberal en cambio aparecen una serie de cicatrices amarillentas, debido a la maduración periódica de los folículos ováricos. Como es sabido, la ovogénesis es un proceso cíclico en el cual cada ovario produce alternadamente, un óvulo cada 28 días. Cuando un folículo ha madurado se aproxima a la superficie del ovario, rompiendose la pared folicular de modo que el óvulo es entregado a la cavidad peritoneal; de allí será tomado por la trompa uterina, y conducido hacia el útero. Después de la ovulación, las paredes del folículo se colapsan y forman el cuerpo amarillo; si se produce embarazo, el cuerpo amarillo persiste y crece merced a la acción hormonal del trofoblasto; si no hay embarazo, el cuerpo amarillo se atrofia y fibrosa formando una cicatriz, el cuerpo albicans. 81 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Folículoprimordial Formado por óvulo rodeado de una capa aplanada de células foliculares, separada del óvulo por una membrana basal. Folículoprimario(yadentrodelciclomenstrual) Por estimulación de la hormona folículo estimulante (FSH) las células foliculares se hacen cuboideas y después se estratifican. Algunas rodean material eosinófilo extracelular, de tipo membrana basal (cuerpos de Call-Exner). Las células granulosas son de tipo epitelial, sin estroma entre ellas, y secretan estrógenos. Por fuera de las células foliculares, las células del estroma ovárico forman una capa adyacente, ricamente vascularizada: la teca interna (células poligonales secretoras de andrógenos), separada de las foliculares por una lámina basal. La teca externa es una banda más densa de células del estroma, fusada, ubicada por fuera de la teca interna. Folículosecundario(antral) Las células foliculares secretan líquido, que se acumula en un espacio entre ellas llamado antro. Las células foliculares que rodean el oocito se disponen en un polo del antro (cúmulo oóforo o prolígero) y se desprenden hacia esta cavidad formando el folículo maduro (folículo de De Graaf), que se aproxima a la superficie ovárica. Ovulación Desprendimiento del oocito, de la zona pelúcida y 1 a 2 capas de células foliculares (zona radiata). La zona pelúcida es un material de tipo de membrana basal producido por las células foliculares y que se encuentra entre el oocito y la corona radiata. Cuerpolúteo El folículo que ovuló constituye el cuerpo lúteo, de contornos festoneados, plegados (signo de ovulación), de pared formada por el resto de las células de la granulosa y tecas y de centro hemorrágico. Tantas células de la granulosa como tecales se luteinizan: se hacen poligonales, aumentan su citoplasma, que aparece eosinófilo pálido, de contenido lipídico, lo que da un color amarillo a la pared del cuerpo lúteo. Las células granulosas luteínicas forman la principal masa del cuerpo lúteo, están completamente luteinizadas a los 4 días de la ovulación y secretan estrógenos y progesterona. Las células tecales luteínicas son más pequeñas y oscuras, secretan progesterona. En el centro el hematoma se organiza y se transforma en una cicatriz de contornos festoneados. El cuerpo lúteo se profundiza en el tejido ovárico a medida que se transforma en el cuerpo albo. Cuerposatrésicos Los folículos que no ovulan y que entraron a la maduración durante el ciclo, en la fase postovulatoria también se luteinizan y en cualquier etapa del desarrollo pueden sufrir atresia (involución): el núcleo del oocito se hace excéntrico y picnótico, algunas células foliculares se desprenden hacia el antro, las células tecales se hipertrofian, se desarrolla tejido granulatorio y vasos entre las células (normalmente no hay estroma entre ellas), se engruesa la lámina basal entre las células de la granulosa y las tecales (lámina vítrea) y se transforma en una pequeña cicatriz. El cuerpo atrésico se diferencia del cuerpo albo en que es más pequeño, presenta membrana vítrea y zona pelúcida, y eventualmente tiene restos del oocito y de células de la granulosa. 82 HistologíayCitologíaavanzadaII ÚteroNormal. ►Ref.5761b. Es un órgano muscular, impar y medio, situado detrás de la vejiga y delante del recto. Consta de tres partes: el cuerpo uterino es la más voluminosa, el cuello y el istmo que está entre las dos anteriores. El útero es un órgano hueco con tres orificios, dos superiores en donde se implantan las trompas (orificios tubáricos) y uno inferior (orificio cervical interno) que se continúa con la luz del cuello uterino que, a través del orificio cervical externo (región del portio), se continúa con la luz de la vagina. La luz del cuello recibe el nombre de canal cervical, y la parte más elevada del cuerpo uterino se llama fondo uterino. Está estructurado histológicamente en tres capas: primero la túnica interna mucosa o endometrio que varía su morfología de acuerdo a la etapa del ciclo menstrual; segundo la túnica muscular intermedia o miometrio; y tercero la túnica externa cerosa o parametrio. El útero tiene como función primordial albergar al óvulo para nutrirlo y protegerlo en sus estadíos de embrión y feto. Situado en la excavación pelviana, el útero, víscera hueca, impar y mediana, es el órgano destinado a albergar y proteger al huevo y luego al feto. Tiene forma de pera achatada. Un estrechamiento circular, situado por debajo de la mitad del órgano, denominado istmo, divide al órgano en 2 porciones: el cuerpo y el cuello, que son fisiológica y patológicamente distintos. La unión de los ejes del cuerpo y cuello, forma 1 ángulo abierto hacia adelante y abajo, de entre 70º y 110º. El cuerpo uterino, de forma triangular, tiene 2 caras y 3 bordes. La cara anteroinferior descansa sobre la cara posterior de la vejiga, con la que forma el fondo de saco vesicouterino, que es virtual cuando el útero mantiene su posición normal en anteversoflexión. La cara posterosuperior se relaciona con las asas del intestino delgado y soporta la presión intraabdominal. El borde anterosuperior o fondo es convexo en los 2 sentidos y su reunión con los bordes laterales constituye los cuernos uterinos, en donde se implantan los ligamentos redondos, las trompas y los ligamentos uteroováricos. Los bordes laterales se relacionan con la porción ascendente de la arteria uterina y a su nivel las 2 hojas serosas que forman el ligamento ancho, se separan para tapizar las caras uterinas anterior y posterior. La cavidad uterina es virtual, de forma triangular. En cada uno de sus ángulos presenta un pequeño orificio que corresponde a la desembocadura de las trompas (orificios uterinos de las trompas); el orificio inferior se continúa con el conducto cervical. El cuello uterino mide 3 cm en tanto que el cuerpo mide 4 cm. Se presenta como un cilindro dividido en dos porciones desiguales por la inserción de la vagina. La porción situada por encima de la vagina (supravaginal) tiene de 15 a 20 mm de longitud y se encuentra en el espacio pelviperitoneal. La cara anterior se relaciona con el bajo fondo vesical. En el útero se reconocen los siguientes segmentos: Fondo, Cuerpo y Cuello. Fondo Porción superior, convexa, cubierta por peritoneo cuyo límite inferior corresponde al plano que pasa a nivel de la desembocadura de las trompas uterinas. 83 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Cuerpo Aplanado en sentido antero posterior, de 6 cms. de alto, presenta una cara anteroinferior o vesical, y una cara posterosuperior en relación con el colon pélvico y asas de ileon. Ambas caras están cubiertas por peritoneo; desde los bordes laterales del cuerpo estas capas peritoneales de unen formando ligamento ancho del útero, que se extiende hasta las paredes laterales de la pelvis. El peritoneo de la cara anterior del útero se refleja sobre la vejiga formando el fondo del saco vesicouterino. El peritoneo de la cara posterior se extiende hacia atrás, cubriendo al cuello uterino, y se refleja sobre el recto formando el fondo del saco rectouterino (de Douglas). El extremo inferior del cuerpo (6mm. aproximadamente), que se ha estrechado en forma importante para continuarse con el cuello del útero recibe el nombre de ISTMO. El cuerpo uterino presenta una cavidad triangular, en la parte alta de ella se abren las trompas uterinas, y en la parte inferior se continúa, a nivel del orificio interno (os), con el conducto del cuello uterino. CuelloUterino Segmento tubular, de 2,5 cms. de largo, es la porción más fija del útero. Forma con el cuerpo el útero un ángulo obtuso, abierto hacia abajo, posición denominada anteflexión uterina. En el cuello se reconoce una porción supravaginal, por sobre la inserción de la vagina, y una porción intravaginal que se proyecta dentro del lumen vaginal, formando con ella un surco circular denominado fornix o fondo de saco vaginal. El conducto cervical se extiende desde el orificio interno, que se abre a la cavidad uterina (os interno), hasta el orificio externo, que se abre en la vagina. (os externo). Estructuralmente el útero presenta: Una cubierta externa, membrana serosa llamada perimetrio, que no es otra cosa que el peritoneo que cubre al útero (Membrana que tapiza las grandes cavidades corporales (toráxica abdominal), constituída en esencia por un epitelio y tejido conjuntivo con vasos sanguíneos y linfáticos). Una capa muscular 84 HistologíayCitologíaavanzadaII lisa, el miometrio, muy desarrollada, con una exquisita irrigación. Una capa mucosa interna, el endometrio, que en la mujer después de la pubertad sufre cambios cíclicos inducidos por las hormonas ováricas, constituyendo el ciclo mestrual (fase proliferativa, estrogénica; fase secretora, progestágena y fase menstrual). La irrigación principal del útero proviene de la arteria uterina, rama de la ilíaca interna, que toma relación con los bordes uterinos y que está contenida entre las hojas del ligamento ancho. Extremadamente tortuosa, esta arteria puede elongarse acompañando al crecimiento del útero gravídico. El útero, está sujeto en posición en parte por pliegues peritoneales y ligamentos y en parte por la presión de los órganos adyacentes. El ligamento ancho es un pliegue doble de peritoneo que se extiende a cada lado del borde externo del útero hacia la pared lateral de la pelvis; a través de él llega la irrigación (arteria uterina) al útero. El ligamento redondo se dirige bajo del ligamento ancho desde el ángulo del útero, atravezando el conducto inguinal hasta el labio mayor de la vulva. El ligamento redondo se divide en bandas fibrosas para insertarse en la tela subcutánea del labio. Desde el cuello uterino se extienden bandas de tejido fibroso hacia la aponeurosis superior del diafragma pélvico formando: Los ligamentos cardinales; que se dirigen hacia la pared lateral de la pelvis; los ligamentos pubucervicales, que se extienden hacia adelante hasta el pubis; los ligamentos uterorectosacros que pasan hacia atrás, hasta el sacro. Estos ligamentos constituyen los ligamentos verdaderos del útero. El útero normalmente se encuentra en anteroversión, es decir recostado sobre la vejiga, formando con la vagina un ángulo de 90° abierto hacia adelante. El útero también está doblado sobre su eje, entre el cuerpo y el cuello hacia adelante, en anteflexión. La citología permite examinar grupos celulares de diferentes partes del organismo, convirtiéndola en una herramienta diagnóstica muy importante para el clínico. Dependiendo del sitio de localización de la tumoración y de las características clínicas adicionales que presente se determinará que método de muestreo es el más conveniente para cada caso. Por lo que hay que tener muy claro, que el éxito del diagnóstico citológico depende en gran medida de la calidad de la muestra obtenida; es decir, de la presencia de material celular suficiente, de la preparación adecuada de los frotis y de su óptima conservación.En general, existen dos grandes métodos de preparación de muestras para su estudio, dependiendo de la cantidad de líquido que presenten. De esta manera tenemos: a) Método directo: Este se emplea cuando la muestra es "celular": Es decir, que presenta muy escasa cantidad de líquido, por lo que el material colectado se coloca directamente sobre un portaobjetos para realizar el frotis. Ejemplos de este método son la punción con aguja fina (PAF), raspados e improntas y las secreciones obtenidas directamente de pezones. b) Método indirecto: En este caso las muestras obtenidas son líquidas y para realizar el frotis es necesario primero concentrar la población celular mediante centrifugación. Ejemplos de este tipo de muestras son las efusiones, orina y lavados. 85 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los raspados pueden realizarse de neoplasias a nivel de piel siempre y cuando esta se encuentre ulcerada, de mucosas u otros órganos y dependiendo de cada caso en particular hay que tener en cuenta las siguientes recomendaciones: a) Si el tumor se encuentra a nivel cutáneo o subcutáneo, pero que crea soluciones de continuidad en la piel, se debe retirar el detrito celular con solución salina fisiológica (el agua rompe las células) y secar con un paño que no suelte pelusa. Posterior a este con una espátula o con el mismo portaobjetos se "raspa" muy suavemente la lesión para obtener una pequeña cantidad de células, que van a depositarse sobre un portaobjetos para realizar el frotis, ya sea por aplastamiento o como se acostumbra para muestras sanguíneas. b) Otra manera de realizar los raspados, es mediante la utilización de hisopos, método que se aplica básicamente para mucosas. El hisopo a utilizar debe humedecerse previamente en solución salina fisiológica; esto es muy importante, pues con este sencillo paso se evita la deshidratación de las células, o que estas sean absorbidas por el hisopo durante el proceso de muestreo; aunque en lesiones muy húmedas (serosanguinolentas o mucoides) este paso no es crítico. Para tomar la muestra basta con frotar suave y firmemente el hisopo sobre el área de interés, para posteriormente deslizarlo con movimientos rotatorios sobre un portaobjetos, fijándola inmediatamente después según el tren de tinción a utilizar. La punción con aguja fina o delgada, también referida como biopsia por aspiración con aguja fina, es la técnica de elección cuando se trata de descartar o evidenciar la presencia de una neoplasia, ya que a diferencia de los métodos anteriores esta proporciona una mayor celularidad que incluye las células neoplásicas, aquellas que provienen del estroma del órgano y las que provienen de la vasculatura. El material requerido para realizar la PAF es el siguiente: - Jeringa de 10 ml con aguja calibre 21 o 22 - Portaobjetos - Portajeringas (no indispensable) - Material para identificar la muestra: puede ser un lápiz diamante o con punta de carburo de tungsteno, o simplemente cinta adhesiva y un lápiz. - Fijador, que puede ser alcohol etílico 96o, o bien fijador en aerosol. a) Procedimiento de muestreo: El procedimiento de muestreo es extremadamente sencillo. Una vez que se ha delimitado la tumoración, se realiza asepsia tal cual se hace en cualquier venopunción, utilizando alcohol etílico 96º o benzal, se deja un pequeño vacío (0.5 ml es suficiente) en la jeringa y se introduce la aguja en la tumoración; en este momento se realiza presión negativa intensa ( él embolo debe llegar a la marca de 8 a 9 ml), la cual se mantiene durante todo el proceso de muestreo y se procede a efectuar movimiento de adelante hacia atrás o "de entrada y salida", procurando que la aguja se mantenga todo el tiempo dentro de la tumoración. Esto es para asegurar extraer suficiente material, mismo que en la mayoría de los casos queda confinado en el cuerpo de la aguja y cubeta de la misma. El tiempo requerido para realizar el muestreo es mínimo (sólo algunos segundos). Una vez que se considera que la PAF ha sido suficiente, se libera la presión negativa y cuando el embolo queda estático se retira la aguja del tumor y se procede a realizar los frotis. Para 86 HistologíayCitologíaavanzadaII hacer mucho más eficiente la toma de muestras existen en el mercado, adaptadores para la jeringa, los cuales facilitan enormemente la obtención rápida de una excelente muestra; estos adaptadores comúnmente se denominan "pistolas portajeringas". b) Elaboración de los frotis: La técnica más empleada para la elaboración de los frotis es la de squash o por aplastamiento. Una vez que la aguja se ha retirado de la tumoración, esta se separa de la jeringa, la cual se llena por completo con aire y posteriormente se vuelve a conectar la aguja (que es la que contiene el material en la mayoría de los casos) y se expele el material sobre un portaobjetos limpio y desengrasado, colocándose un segundo portaobjetos sobre este (A). Una vez hecho esto, por simple adhesión se expande el material sobre el portaobjetos, y en caso de que esto no suceda se puede aplicar presión digital muy suave para que el material se expanda (B). El segundo portaobjetos es deslizado suave y rápidamente sobre el primero (C) y se separan (D); es en este momento en el que se procede a fijar las los frotis. Cabe hacer mención que el paso C proporciona frotis de buena calidad, aunque si se aplica una presión digital excesiva dará como resultado una gran destrucción celular. c) Métodos de fijación: La fijación de los especimenes citológicos depositados en una laminilla es vital para evitar cambios en la morfología celular que indiscutiblemente van a alterar e incluso nulificar la interpretación de los hallazgos microscópicos. Actualmente se utilizan dos métodos de fijación basados en el estatus de hidratación de la célula al momento de la fijación. Cada uno conlleva ventajas y desventajas sobre el otro; sin embargo, no se contraponen, más aún son complementarios. Aunque dependiendo la formación del citopatólogo, este preferirá alguno de los dos, ya que las tinciones y la interpretación de los hallazgos microscópicos son un tanto diferentes entre uno y otro. 1.- Fijación en seco: También denominada fijación al aire, o mal llamada muestras sin fijar. En esta una vez que se ha realizado el frotis se debe secar lo más rápido que sea posible, incluso puede recurrirse a realizar movimientos en abanico. Ya que el frotis se ha secado; es decir, que las células presentes en ese frotis están totalmente secas se procede a aplicar el fijador sobre la laminilla por un periodo no menor a tres minutos. El fijador de elección para estos casos es el metanol. Este tipo de fijación se utiliza primordialmente para tinciones tipo Romanowsky (Wright, Giemsa, Diff-Quik, etc.) 2.- Fijación en Húmedo: También denominada por algunos autores como fijación en alcohol. En este caso, al terminar de realizar el frotis este debe contactar con el fijador en un periodo no mayor a tres segundos, sin permitir que la laminilla se seque. Es decir la célula debe estar perfectamente hidratada al momento que se fija, de ahí el nombre de fijación en húmedo. Si se utiliza alcohol etílico 96º como fijador, la laminilla debe sumergirse en este por un periodo mínimo de quince minutos. Transcurrido este tiempo, la laminilla se saca del fijador y se seca al aire, para ser remitida al laboratorio. El uso de alcohol, es una manera sencilla y económica para fijar los especimenes citológicos, pero no es la única; ya que pueden emplearse fijadores en aerosol, los cuales crean una capa protectora sobre las células, lo que las preserva en óptimas condiciones, sobre todo si las laminillas tardaran varios días en llegar al laboratorio, como es el caso de las muestras remitidas a través del correo o de la mensajería. En este caso, una vez realizado el frotis y antes de que se seque el material, se debe aplicar una capa del aerosol 87 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología sobre la laminilla a una distancia no menor a 20 cm y dejar secar al aire. En el mercado, existen muy diversas marcas de fijadores citológicos en aerosol, conocidos coloquialmente como "cito-spray", los cuales tienen un costo muy accesible. Las muestras fijadas en húmedo son las óptimas para realizar la tinción de Papanicolau, que es la tinción citológica por excelencia. Además de H. - E., y toda la gama de histoquímicas. Cuando la neoplasia se ubica dentro de una cavidad corporal, existe la posibilidad de colectar las células neoplásicas, mediante el examen de la efusión que se genera a partir de la misma. Por lo que como en todo buen material citológico la óptima preservación redituará en un excelente detalle celular. El tiempo transcurrido entre la toma y el procesamiento antes de que sufra deterioro celular es variable pues depende del pH, contenido proteico, actividad enzimática y de la presencia o ausencia de bacterias. Por lo que en la práctica médica es imposible predecir la conjugación de estos factores, aún en líquidos obtenidos del mismo sitio anatómico, por lo que se debe tener en cuenta las siguientes recomendaciones: a) La muestra debe ser colectada en tubos pareados, uno de los cuales debe contener E.D.T.A. como anticoagulante. b) La muestra debe permanecer refrigerada todo el tiempo posterior a la toma. c) El tiempo entre la toma y el procesamiento no debe superar las 24 horas en el caso de las efusiones. d) Si el tiempo de envió supera las 24 horas. La muestra debe prefijarse realizando una dilución 1:10 con alcohol etílico 96º y mantenerse en refrigeración. El examen microscópico del tejido tumoral como tal, aparte de evidenciar la estirpe histológica y grado de malignidad de acuerdo a la morfología celular; permite hacer una evaluación de la arquitectura del tejido, proporcionando datos que nos es posible valorar en un estudio citológico, como es la invasión del estroma por células neoplásicas, la permeación vascular y linfática, el modo de crecimiento de la neoplasia y los bordes quirúrgicos. Por lo que remitir una biopsia en condiciones óptimas de fijación, permitirá una mejor visualización de los cambios en el tejido y así poder establecer con claridad un diagnóstico morfológico definitivo y un pronóstico de sobrevida. Como es bien sabido el fijador de elección para este caso es una solución de formol al 10%. Sin embargo, lo que en la mayoría de los casos se pasa por alto es que este formol debe estar amortiguado a un pH de 7.4. A este pH el proceso de fijación de la muestra es mucho más eficiente y se crean menos artefactos visuales que en una solución de formol que no esté amortiguada. Por lo que queda de manifiesto que el sólo mezclar formol con agua no es suficiente para lograr una óptima fijación. Otro punto muy importante de remarcar es que el tejido que se remitirá al laboratorio debe estar sumergido en suficiente formol en una proporción de 10 a 1. Es decir, por cada volumen de tejido se deben incluir nueve volúmenes de formol; ya que si la proporción de formol es menor, el proceso de fijación será mucho más lento y, en la mayoría de los casos será incompleto; pues sólo se fijará la parte exterior del tejido y el resto sufrirá cambios autolíticos irreversibles. 88 HistologíayCitologíaavanzadaII El tamaño de la pieza quirúrgica se debe valorar para determinar si esta se enviara completa al laboratorio o sólo fragmentos de esta. La mayoría de los patólogos preferimos recibir la pieza completa, ya que esto nos proporciona un panorama más amplio de la neoplasia y nos permite seleccionar las porciones más idóneas del tejido para establecer el diagnóstico. Si se opta por esta opción es conveniente marcar o referir los bordes quirúrgicos, ya sea con hilos de colores o con tinta china. Este último tiene la ventaja de que la delimitación del borde se puede observar microscópicamente. En el caso que no se pueda remitir la pieza quirúrgica completa se deben seleccionar fragmentos representativos las diferentes porciones de la neoplasia. Teniendo en cuenta que como mínimo se debe remitir un fragmento superficial de la neoplasia, de la porción central y otra del borde quirúrgico. Puesto que no sólo es importante establecer el tipo de neoplasia, sino que también debe considerarse si el borde quirúrgico presenta o no células neoplásicas. Dato que es muy importante para determinar si una neoplasia (aunque sea benigna) puede recidivar. Finalmente es muy conveniente recordar que tejidos congelados no sirven para realizar una histopatología, porque las células al congelarse se cristalizan y al descongelarse se rompen, dando imágenes microscópicas que pueden confundir o encubrir el diagnóstico de la neoplasia. MiometrioNormal ►Ref.5780b. Cuello Uterino: Segmento tubular, de 2,5 cms. de largo, es la porción más fija del útero. Forma con el cuerpo el útero un ángulo obtuso, abierto hacia abajo, posición denominada anteflexión uterina. En el cuello se reconoce una porción supravaginal, por sobre la inserción de la vagina, y una porción intravaginal que se proyecta dentro del lumen vaginal, formando con ella un surco circular denominado fornix o fondo de saco vaginal. El conducto cervical se extiende desde el orificio interno, que se abre a la cavidad uterina (os interno), hasta el orificio externo, que se abre en la vagina. (os externo). Estructuralmente el útero presenta: Una cubierta externa, membrana serosa llamada perimetrio, que no es otra cosa que el peritoneo que cubre al útero. Una capa muscular lisa, el miometrio, (El miometrio más eosinófilo y de aspecto fasciculado está compuesto básicamente por músculo liso con una rica trama de arterias y venas. muy desarrollada, con una exquisita irrigación). Una capa mucosa interna, el endometrio, que en la mujer después de la pubertad sufre cambios cíclicos inducidos por las hormonas ováricas, constituyendo el ciclo mestrual (fase proliferativa, estrogénica; fase secretora, progestágena y fase menstrual). El miometrio es el componente muscular del útero y está compuesto por fibras musculares oblicuas que rodean a los vasos sanguíneos. Durante el alumbramiento, estas fibras musculares se contraen y se retraen; el miometrio progresivamente se engrosa y el volumen intrauterino disminuye. La placenta no tiene la propiedad de contraerse y comienza a separarse a medida que la superficie del útero se achica. A medida que se separa la placenta, el útero se hace firme y globuloso, llegando al abdomen y a veces atraviesa la línea media abdominal. El cordón umbilical puede parecer alargado. Este proceso lleva habitualmente 10-30 minutos; si la placenta no se separa dentro de los 30 minutos luego del nacimiento se considera un alumbramiento prolongado. 89 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología EndometrioProliferativoNormal.Útero. ►Ref.5796b. Endometrio en fase progestativa (secretor). Día Caracteres Histológicos 15 Sin cambios. Se necesitan 36 horas para que la progesterona produzca cambios morfológicos. 16 A lo menos 50% de las glándulas con vacuolas infranucleares en lascélulas epiteliales. 17 El 100% de las glándulas con vacuolas infranucleares. Núcleos ordenados en una fila, desplazados hacia tercio medio de la célula por las vacuolas. 18 Vacuolas infranucleares y supranucleares. Escasas mitosis. 19 Núcleos retornados hacia la base, redondeados, vesiculosos, en una fila. Escasas vacuolas. Ausencia de mitosis. 20 Comienzo de secreción al lumen, células con despenachamiento apical. 21 Máxima secreción libre en el lumen. Edema incipiente del estroma. 22 Máximo edema del estroma. Agrandamiento de las células del estroma, aún fusadas. 23 Arteríolas prominentes (crecen 5 veces en longitud y el endometrio, 2 veces en espesor: enrollamiento de arteríolas). Redondeamiento y aumento de tamaño de células del estroma alrededor de arteríolas. 24 Células del estroma se transforman en células predeciduales (aumento del citoplasma, eosinófilo, núcleos redondeados, vesiculosos) alrededor de arteríolas. Se reconocen células del estroma con núcleo hipercromático, irregular y citoplasma con gránulos (granulocitos endometriales). 25 Transformación predecidual focal en la superficie (compacta inicial: discontinua). 26 Compacta continua. Primeros signos de retracción del endometrio (por inicio de involución del cuerpo lúteo). 27 Retracción del endometrio: colapso de glándulas, bordes glandulares internos en dientes de serrucho. 28 Desintegración del retículo del estroma: disgregación del estroma. Descamación del endometrio. Aparición de detritus en lúmenes glandulares. 90 HistologíayCitologíaavanzadaII Alteraciones de la Fase Proliferativa: 1. Por déficit de estimulación estrogénica: atrofia (por ej.: ortoatrofia de la mujer postmenopáusica). 2. Por exceso de estimulación estrogénica: hiperplasia difusa o extensa. EndometrioSecretorioNormal. ►Ref.5793b. El endometrio se divide en endometrio basal y endometrio funcional. El basal no responde a la progesterona y no se descama. A partir de él se regenera la mucosa. El funcional responde a la progesterona y se descama en la menstruación. La mitad superior del endometrio funcional forma la capa compacta en la fase secretora y la inferior, la capa esponjosa. Días 1 a 3 Menstruación y reepitelización. Mecanismo de la menstruación: la caída de los niveles de estrógenos determina disminución del contenido de agua, colapso y contracción de arteríolas con isquemia consecutiva. La caída de los niveles de progesterona determina liberación de relaxina de granulocitos endometriales, lo que lleva a disolución del retículo endometrial y descamación. Día 1: hemorragias en el estroma de la superficie, aún focos de secreción en glándulas colapsadas. Día 2: material hemático, leucocitos y restos de glándulas y estroma. Día 3: regeneración. La reepitelización se realiza desde los fondos glandulares y desde el istmo y cuernos uterinos. Días 4 a 14 Endometrio de la fase estrogénica (proliferativo). Estrógeno (de folículos en desarrollo) estimula la proliferación glandular. Fase proliferativa temprana (4-7 días): endometrio bajo, corresponde a la basal reepitelizada, Escasas glándulas, rectas, de lumen estrecho. Epitelio bajo, núcleos ovalados, estroma laxo Fase proliferativa media (8-10 días): endometrio más alto, glándulas más largas (mayor que el grosor del endometrio: leve tortuosidad), células glandulares cilíndricas más altas, mitosis en glándulas y estroma, edema del estroma, células del estroma más grandes. Fase proliferativa tardía (11-14 días): mayor tortuosidad de glándulas, células epiteliales más altas, con pseudoestratificación de núcleos. Núcleos alargados (en cigarro), hipercromáticos. Estroma sin edema, densamente celular. Día 14 o 15 Ovulación Días 16 a 28 Endometrio de la fase progestativa (secretor). Los cambios secretores se producen por la acción de la progesterona (del cuerpo lúteo). Ellos permiten estimar morfológicamente el día del ciclo en esta fase. 91 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Alteraciones de la Fase Secretora: 1. Ausencia de secreción (ciclo anovulatorio): endometrio proliferativo o hiperplástico. 2. Endometrio mixto (en partes proliferativo, en partes secretor): áreas que no responden a la progesterona. 3. Endometrio secretor desfasado, sincrónico: con secreción retardada (retardo de más de 2 días) en forma homogénea en todo el endometrio. Generalmente se debe a ciclo bifásico (ovulatorio) con ovulación tardía. 4. Endometrio secretor desfasado, asincrónico: con diferencias correspondientes a más de 2 días entre distintas zonas del endometrio. Se debe a insuficiencia del cuerpo lúteo o diferente respuesta de áreas del endometrio. 5. Endometrio secretor con descamación irregular y prolongada (menorragia). La descamación, en vez de completarse en 48-72 horas, dura más. Islotes de endometrio en disolución alternan con otros íntegros secretores. Se produce por retraso en la involución del cuerpo lúteo (quiste del cuerpo lúteo) o por factores locales (leiomiomas, pólipos, y otros). 6. Endometrio disociado: glándulas atróficas y reacción predecidual extensa. Se produce en la administración prolongada de anticonceptivos orales combinados. CanalEndocervicalNormal ► Ref. 7110b. El sitio donde se une el epitelio que cubre el canal cervical (cilíndrico) con el epitelio que cubre el exocérvix (poliestratificado, epidermoide, escamoso) se conoce como zona de transformación. El epitelio endocervical tiene por debajo de él una zona de células basales poligonales ubicadas entre el estroma cervical y el epitelio columnar que se llaman células basales o células de reserva que pueden desarrollarse como epitelio columnar o epitelio escamoso según su capacidad secretora. Las células de reserva se consideran como las encargadas del proceso de metaplasia (reparación) que ocurre en el cérvix para eliminar el tejido endocervical que sale para cubrir el exocérvix. En las recién nacidas, la mucosa endocervical sale del canal y cubre parte del exocérvix por el efecto hormonal placentario; luego en las niñas al no tener el estímulo hormonal, la mucosa endocervical “se mete” al canal. Después por los embarazos nuevamente hay ectopia endocervical que puede intensificarse si hubo desgarro del orificio cervical externo. Los procesos inflamatorios endocervicales aumentan la secreción endocervical que puede macerar el epitelio escamoso y la cicatrización se hace a expensas de mucosa endocervical. Por razones biológicas la mucosa endocervical debe estar dentro del canal cervical; cuando hay ectopia o ectropion la unión escamocolumnar se encuentra lejos del orificio cervical; cuando la mucosa endocervical se encuentra fuera se inicia un proceso reparador; ese tejido endocervical debe ser reemplazado por tejido exocervical. Ese proceso reparador es la metaplasia escamosa. 92 HistologíayCitologíaavanzadaII El punto de unión escamo-columnar con relación al orificio anatómico externo del cérvix se desplaza hacia fuera como ocurre en la infancia, durante el embarazo y la lactancia y durante la postmenopausia la unión escamo-columnar se desplaza hacia adentro del canal cervical. Es muy frecuente que en la mujer adulta, la unión escamocolumnar esté hacia fuera del canal cervical (ectopia, ectropion). Desde la pubertad y a lo largo de la vida de la mujer, cuando el epitelio endocervical se exterioriza, rápidamente el epitelio escamoso trata de cubrir la zona columnar exteriorizada mediante un epitelio de recubrimiento que se llama metaplasia escamosa. En esa zona puede desarrollarse un epitelio anormal displásico o neoplásico. Desde la unión escamo-columnar lejana al orificio cervical se irá cubriendo con nuevo epitelio escamoso hasta ubicar una nueva unión escamo columnar a la altura del orificio anatómico cervical externo. Toda esa zona de nuevo epitelio entre la antigua y la nueva unión escamo columnar es la zona de metaplasia que se llama también zona normal de transformación. ImplantaciónNormal. ►Ref.7117b. PrimeraSemana El desarrollo humano empieza con la fecundación, un gameto masculino se une con otro femenino y forman el Cigoto. El cigoto es una célula totipotente de gran especialización que forma individuos únicos. Tiene cromosomas (23 padre y 23 madre) y va de una célula unicelular a otra multicelular por medio de divisiones. Gametogénesis: - Formación de espermatozoides y óvulos. - Tienen un número haploide ósea la mitad de los cromosomas de la célula madre. - El número de cromosomas se reduce en la Meiosis. Espermatogénesis y Oogénesis: Formación de gametos: prepara las células sexuales para la fecundación. Espermatogénesis (proceso): - Testículo, Espermatogonia (46 XY) - Espermatocito primario (46 XY) - Primera división meiótica (23 X)(23 Y) - Segunda división meiótica (2)(23 X) (2)(23 Y) - Espermiogénesis, espermatozoides normales (2)(23 X) 2(23 Y) - Células de Sertoli: Recubren los tubos seminíferos, apoyan y nutren a las células germinales, regulan la Espermatogénesis. - Epidídimo: Almacena espermatozoides y se hacen maduros. 93 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Espermatozoide Maduro: Cabeza y cola y la unión del cuello, la cabeza contiene el núcleo haploide y el acrosoma (10 enzimas) una de ellas la acrosina facilita la penetración a la corona radiante y la zona pelúcida. La cola le da movilidad y se divide en media principal y final. El cuello controla los latigazos. Oogénesis (proceso): - Ovario, oocito primitivo (46 XX) folículo primario. - Oocito primitivo (46 XX) folículo creciendo. - Oocito primitivo (46 XX) folículo grande y aparece la zona pelúcida. - Primera división meiótica, folículo maduro, cuerpo polar, antro. - Segunda división meiótica (solo fecundado) (23 X), corona radiada, segundo cuerpo polar. Las niñas recién nacidas tienen alrededor de 2millones de oocitos pero solo 40mil evolucionan y muy pocos se fecundan. Meiosis: Hay una primera división donde las células de diploides se vuelven haploides. Cromosomas Homólogos (uno de cada padre). Segunda división meiótica, haploide (23) el número de cromosomas de la célula que penetra aquí es haploide no igual. Distribución de cromosomas maternos y paternos al azar, mezcla de genes. Comparación: Un oocito es grande e inmóvil, mientras que el esperma es pequeño y móvil. El oocito cuenta con la corona radiada, zona pelúcida y un citoplasma. El espermatozoide cuenta con (23 X) y (23 Y), mientras que el oocito solo tiene (23 X) 22 autónomas y uno sexual. Maduración del Espermatozoide: Es necesaria la capacitación, dura 7 horas y consiste en eliminar glucoproteínas y proteínas del acrosoma. No hay cambios solo se vuelven más activos. Se capacitan en el útero o trompas por algo que secreta el aparato femenino. Viabilidad de los Gametos: Los oocitos no pueden fecundarse después de 12 horas de haber salido de los folículos. Los espermatozoides no sobreviven más de 48 horas en el aparato femenino. Fecundación (fases): 94 Pasa el espermatozoide a través de la zona radiada que rodea la zona pelúcida, el acrosoma libera hialuronidasa, también la cola ayuda. HistologíayCitologíaavanzadaII Penetración en la zona pelúcida, el acrosoma libera estereasas, acrosina y neurominidasa, una vez que pasa hay una reacción de zona que no permite el paso de otros. Fusión de las membranas celulares del oocito y el espermatozoide, la cabeza y la cola se une al citoplasma del oocito pero su membrana plasmática queda fuera. Segunda división meiótica del oocito y formación del pro núcleo femenino, penetra el esperma y hay 2da división, oocito maduro y 2do cuerpo polar, descondenzación del pro núcleo femenino. Formación del pro núcleo masculino, núcleo del esperma crece, cola se degenera. Se rompen las membranas entre los pro núcleos, se condensan los cromosomas y se acomodan para una división celular mitótica; la segmentación, combinación 23 cromosomas da cigoto de 46. Segmentación: División mitótica del cigoto que origina blastómeros estos se van haciendo más pequeños con cada división, primero 2 células luego 4, después 8 y así sucesivamente... cuando cambian de forma y se alinean entre si de manera estrecha se llama compactación. Cuando hay de 12 a 15 blastómeros se llama Mórula y tiene una capa externa y otra interna. Blatogénesis: Después que la mórula penetra en el útero aparece un espacio lleno de líquido que se llama cavidad del blastocisto y va eliminando la zona pelúcida. Forma el trofoblasto (parte embrionaria de la placenta) y el Embrioblasto. El embrioblasto se va a la cavidad y el trofoblasto es la pared. El blastocisto se fija en el epitelio endometrial. Trofoblasto conforme me implanta forma el citotrofoblasto (interna) y el sincitiotrofoblasto (externa). El blastocisto se implanta superficialmente en el endometrio. SegundaSemana El disco embrionario bilaminar son dos capas (Epiblasto e Hipoblasto). El disco embrionario origina las capas germinales del embrión (ectodermo, mesodermo y endodermo) También forma la cavidad amniótica, el amnios, el saco vitelino, el tallo de conexión y el saco coriónico. El blastocisto se implanta en el endometrio lentamente y mientras esto sucede se van viendo más el cito y sincitiotrofoblasto. 95 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Cavidad Amniótica, Saco Vitelino y Disco Embrionario Conforme me implanta el blastocisto aparece una cavidad en la más celular interna, es la cavidad amniótica. El amnios encierra esta cavidad. Hay cambios morfológicos en el embrioblasto y forma el disco embrionario que tiene dos capas. El Epiblasto que es el piso de la cavidad amniótica. El Hipoblasto que es el techo de la cavidad exocelómica. La cavidad y membrana exocelomica forma el saco vitelino primario. Células del endodermo extraembrionario. Aparecen lagunas (cavidades) que se llenan con una mezcla de sangre materna, con embriotrofo, un liquido nutritivo. Inicia la circulación útero placentaria. Tapón de cierre dura 12 días en recubrirse. Células deciduales proporcionan protección. Reacción Decidual son los cambios que sufre el blastocisto. Las redes lacunares (primordio del espacio intravenoso de la placenta) fluye sangre materna. A medida que se forma el celoma extraembrionario el saco vitelino disminuye y se forma el saco vitelino secundario o definitivo. del saco vitelino forman el mesodermo Desarrollo del Saco Coriónico Final de la segunda semana salen vellosidades coriónicas primarias. Proliferación de células en citotrofoblasto hacen crecr extensiones hasta el sincitiotrofoblasto. Este crecimiento se debe al mesodermo somático extraembrionario. El mesodermo somático extraembrionario y las dos capas del trofoblasto hacen el CORIÓN (pared del saco coriónico o gestacional). Ahí se suspende embrión y el saco vitelino y amniótico por el tallo de conexión. El celoma extraembrionario se denomina cavidad coriónica. Sitios de Implantación Debe ser en el endometrio en la parte superior-posterior. Hay embarazos ectópicos que son fuera del endometrio (trompas, intestinal...) TerceraSemana Esta semana se caracteriza por: 96 - La aparición de la estría primitiva - Desarrollo del Notocordio - Diferenciación de las 3 capas germinales (Gástrula) HistologíayCitologíaavanzadaII Gastrulación El disco bilaminar se vuelve trilaminar. Inicia la morfogénesis (formación del cuerpo) Es la parte más importante. Surge la estría primitiva (indica el inicio de la gastrulación) en la superficie del Epiblasto. Ectodermo: Forma la epidermis, el sistema nervioso central y periférico, la retina y otras estructuras. Endodermo: Forma los recubrimientos epiteliales de los conductos respiratorios y del aparato digestivo, incluyendo glándulas que desembocan hacia el mismo. También el hígado y páncreas. Mesodermo: Capas musculares lisas, tejido conjuntivo, vasos que riegan tejidos y órganos, células sanguíneas, parte del aparato cardiovascular, médula ósea y esqueleto, músculos estriados y los órganos reproductores y excretores. Estría Primitiva Primer signo de la gastrulación. Situada en el extremo caudal del embrión. Sale con la migración de células del Epiblasto hacia el plano medio del disco embrionario y se alarga formando el nodo primitivo. En la estría se hace un surco primitivo es una pequeña depresión que se llama fóvea primitiva. La estría es el eje cráneo caudal, tiene la superficie dorsal y ventral y los lados derecho e izquierdo. Sale la mesenquima (tejidos de apoyo) Hay mesodermo intraembrionario, Endodermo intraembrionario y ectodermo intraembrionario. Proceso Notocordal Células mesenquimatosas migran en sentido craneal y forman un cordón celular que es el proceso notocordal. Adquiere una luz que es en conducto notocordal. El ectodermo y endodermo crecen hasta alcanzar la placa precordial y la fusión de estas origina la membrana bucofaríngea. Mesodermo cardiógeno, área cardiógena y se desarrolla el primordio del corazón. También se forma la membrana cloacal, y permanece bilaminar junto con la bucofaríngea. Notocordio es el eje, formara el esqueleto axial y es lo que le dará rigidez. 97 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Neurulación Formación de la placa neural y los pliegues neurales, su cierre forma el tubo neural. Placa alargada parecida a una pantufla es la placa neural (encéfalo y médula espinal). Se forma en surco neural por medio de invaginaciones. Pliegues neurales son signos de desarrollo encefálico y forman el tubo neural al desplazarse. Cresta Neural El tubo neural se separa del ectodermo superior y estas células neuro ectodérmicas se llaman células de la cresta neural que forman la cresta neural. Esta forma ganglios sensitivos de los nervios raquídeos y craneales. También las células de la cresta neural forman ganglios raquídeos y del sistema nervioso autónomo y las vainas de nervios meníngeos y médula espinal. Somitas Cuerpos cuboides que están a cada lado del tubo neural. Hay 38 pares al comienzo y acaban de 42 a 44. Forman elevaciones, triangulares. Se utilizan para saber la edad del embrión. Originan la mayor parte del esqueleto axial. Celoma Intraembrionario Primero, es una cavidad en el mesodermo lateral y cardiógeno, luego se hace como herradura, salen dos capas: Capa parietal o Somática: recubre al amnios. Capa Visceral: recubre al saco vitelino. Angiogénesis y Hematogénesis Formación de vasos sanguíneos y de sangre en el embrión, por medio de las células endoteliales. Sistema Cardiovascular Primordial Células mesenquimatosas en el área cardiógena. Tubos cardiacos endoteliales (conductos) que construyen en tubo cardiaco. Primer órgano que funciona. Vellosidades Coriónicas 98 Ramificación, cubren la superficie del saco coriónico. Primarias, secundarias y terciarias. Las terciarias son los vasos sanguíneos. Redes arterio capilares. HistologíayCitologíaavanzadaII VellosidadNormal.Placenta. ►Ref.5256b. En el desarrollo de la placenta se distinguen los siguientes períodos: 1) Prelacunar, hasta el 8º día: capa sólida de trofoblasto, con diferenciación en citotrofoblasto y sinciciotrofoblasto desde el 6º día. 2) Lacunar, del 8º al 13º día: capa trofoblástica en espacios llenos de sangre proveniente de vasos maternos erosionados por el trofoblasto. 3) Estadío vellositario, en que según la estructura de las vellosidades, se distinguen: a. vellosidades primarias, constituidas sólo por trofoblasto (13º-15º día formadas sólo por sinciciotrofoblasto; 15º-18º día, además, por un eje de citotrofoblasto). b. vellosidades secundarias, con eje mesenquimático (18º-21º día); c) vellosidades terciarias, con eje de mesénquima vascularizado (día 21º en adelante). Desde el 2º al 4º mes las vellosidades se arborizan rodeando primero todo el huevo. Las ubicadas en el polo embrionario, hacia la profundidad de la pared uterina, se siguen desarrollando y constituyen el corion frondoso (la futura placenta); las que se ubican en el resto de la superficie involucionan y forman el corion leve. La decidua bajo el corion frondoso es la decidua vera; aquélla situada entre el huevo y la cavidad uterina es la decidua capsular, y la que se encuentra en el endometrio que recubre el resto de la cavidad uterina, donde no se implantó el huevo, es la decidua parietal. A fines del tercer mes están fusionadas la decidua capsular (y corion leve) y la decidua parietal, con obliteración de la cavidad endometrial. Ya se reconoce la placenta (etimológicamente, torta) macroscópicamente constituida. La placenta es un órgano principalmente de origen fetal, con escasos componentes celulares de origen materno (decidua), que cumple las funciones de oxigenación y nutricia, con intercambio de sangre entre el feto y la madre y síntesis de numerosos productos necesarios para el desarrollo fetal. Histología El citotrofoblasto está constituido por células de núcleos relativamente grandes, vesiculosos, y citoplasma claro, de límites netos; presenta actividad mitótica. El sinciciotrofoblasto es la capa periférica que recubre las vellosidades; está formado por células multinucleadas, de núcleos pequeños, densos, citoplasma granular, denso y anfófilo, con algunas vacuolas lipídicas. No presenta mitosis. Al ir avanzando el embarazo disminuye el citotrofoblasto, aunque persiste hasta el final de la gestación. El estroma de las vellosidades maduras contiene abundantes vasos, vecinos al trofoblasto, donde forma la barrera de intercambio con la sangre materna, y, además, contiene histiocitos (células de Hofbauer más numerosas en la placenta joven, son células ovoides, grandes, con un núcleo central redondo y un citoplasma con características ultraestructurales similares a las de los macrófagos. Estas células suelen localizarse en lugares del conectivo, libres de colágeno y rodeadas irregularmente por prolongaciones de fibroblastos). 99 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Se ha reconocido una variedad de trofoblasto con características intermedias entre el citotrofoblasto y el sinciciotrofoblasto: el trofoblasto intermedio. Se ubica tanto en las vellosidades, en forma de una transición entre los otros dos tipos, como fuera de ellas (trofoblasto intermedio extravellositario). Este último cumple funciones muy importantes en el desarrollo de la placenta, se desprende de las vellosidades y reemplaza las células endoteliales de las arterias maternas que irrigan la placenta (trofoblasto endovascular); produce una necrosis fibrinoide de la capa muscular de las arterias y las transforma en vasos de gran capacidad de flujo, pero de baja resistencia, a diferencia de las arterias musculares. Este fenómeno se ha calificado de cambios fisiológicos de las arterias espirales en el embarazo. Al parecer el retardo de crecimiento intrauterino del feto se debe a un desarollo deficiente del trofoblasto intermedio. La placenta es una estructura compleja que desarrolla una doble función: metabólica, esto es, destinada al intercambio nutritivo y respiratorio del feto, y endocrina, pues se comporta como verdadera glándula hormonal y secreta estrógenos, progesterona, gonadotrofina coriónica, occitocina, etc. Constituída morfológicamente por una capa de origen, la decidua y otra de origen fetal, las vellosidades coriónicas, producto de la transformación del trofoblasto. Estas vellosidades repletas de vasos sanguíneos confluyen en el cordón umbilical y penetran en el corazón fetal. La circulación está garantizada durante el embarazo por el gradiente de presión y por las contracciones uterinas. La placenta queda netamente delimitada a partir del tercer mes. Después crece con el feto hasta alcanzar un sexto del peso fetal. La circulación es por difusión simple. El cordón umbilical alcanza unos 50 cm. Pasan por él dos arterias y una vena, que va de la placenta al feto, rica en oxígeno. Hay además tejido conectivo mucoso y se recubre por una sola capa de epitelio. El corión y el amnios son dos membranas envolventes de protección. El corión reviste toda la cavidad uterina, excepto por donde está implantada la placenta. Por dentro se halla el amnios, tapizándolo todo, incluso el cordón umbilical. Por fuera de ellas está caduca (decidua). Estas membranas se desgarran en el momento del parto para dejar paso al feto. Las vellosidades dan una gran superficie de intercambio (10 m2) a la circulación fetal y materna. La sangre llega al feto por las dos arterias umbilicales, se dispersa y es recogida de nuevo por la vena umbilical. La sangre llega a la madre por las ramas de la arteria uterina. Es recogida por las ramas de la vena uterina. El trasiego de ambas circulaciones es muy elevado: 500 mililitros por minuto. Se realiza por diferencia de presión. Antes de la implantación, el mantenimiento de la gestación está asegurado por las hormonas ováricas e hipofisarias. Después de la nidación, por la acción conjugada de las hormonas hipofisarias, ováricas y placentarias. Estas hormonas placentarias son de gran importancia porque han permitido desarrollar las técnicas de diagnosis del embarazo basadas en la presencia de una hormona gonadotrópica en la orina de una mujer gestante. Esta hormona es secretada por el embrión y se encuentra en el corión. 100 HistologíayCitologíaavanzadaII MembranasNormales.Placenta. ►Ref.5813b. Segmentación del cigoto: El óvulo maduro después de la fecundación (en la trompa de Falopio) que se divide en blastómeros (cigoto mórula) llegando al útero donde se transforma en blastocisto donde existe la masa celular interna (da origen al embrión) y la masa externa de células (origen del trofoblasto). Implantación: Ocurre a los 6 días después de la fecundación del óvulo. Antes de la implantación la zona pelúcida desaparece y el blastocisto se adhiere a la superficie endometrial (aposición; blastocisto con 107-256 células) en la parte superior y posterior del útero quedando el blastocisto "enterrado" completamente en el endometrio y las células trofoblásticas internas (citotrofoblasto) ubicadas hacia la periferia forman el sincitiotrofoblasto. A medida que el blastocisto se sigue multiplicando, y el trofoblasto prosigue su crecimiento, aquel ubicado al polo uterino formará la placenta mientras que el relacionado con el endometrio queda cubierto por el corion frondoso, que al ser avascular se convierte en corion liso y conforme avanza el embarazo, la decidua capsular se fusiona con la decidua parietal formando la decidua vera. Trofoblastos precoces: Conforme la invasión endometrial del trofoblasto progresa, los vasos sanguineos maternos se perforan formando lagunas llenas de sangre materna (placentación hemocorioendotelial). Durante la implantación las células endoteliales del útero adquieren un revestimiento interno del endotelio de células derivadas de los citotrofoblastos invasores. Por lo tanto la sangre materna entra al espacio intervelloso a través de las arterias espirales en surtidores similares a los de una fuente y barre y baña el sincitiotrofoblasto. Desarrollo embrionario después de la implantación: A los 7-8 días de desarrollo las células internas (disco embrionario) se diferencian en una placa gruesa, el ectodermo primitivo y una capa endodérmica. Entre el disco embrionario y el trofoblasto aparecen células pequeñas que delimitan lo que será la cavidad amniótica. Capas germinales: La proliferación celular en el disco embrionario marca el comienzo de un engrosamiento de la línea media que señala claramente el eje embrionario y se denomina línea primitiva formando el mesodermo. - Derivan del ectodermo: sistema nervioso, epidermis. - Derivan del endodermo: revestimiento del aparato digestivo, hígado, páncreas, tiroides. - Derivan del mesodermo: la dermis, el esqueleto, los tejidos Conectivos, Sistema Vascular, Aparato urogenital, la mayoría de los músculos lisos. La cavidad que divide posteriormente las capas somáticas y viscerales del mesodermo intraembrionario se llama celoma. 101 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Formación de los somitas: A la tercera semana de la fecundación la línea primitiva se convierte en prominente y se distinguen los extremos cefálico y caudal del embrión. A medida que las células proliferan se desarrolla el surco primitivo en la línea media. Se produce una extensión mayor de la línea media primitiva, la notocorda que constituye la estructura de soporte primordial de las vértebras. La diferenciación de estructuras procede del extremo cefálico a caudal del embrión. La mayor parte de la sustancia del embrión precoz participa en la formación de la cabeza; luego el surco neural. La cavidad del futuro tubo neural está conectada con la luz del futuro tubo digestivo por medio del conducto neuroentérico. A medida que se desarrollan los pliegues neurales, el mesodermo lateral se divide en bloques separados (somitas). Ultraestructura del trofoblasto: Las microvellosidades de la superficie sincitial, y las vacuolas pinocitóticas y las vesículas asociadas se relacionan con las funciones placentarias de absorción y secreción. Desmosomas conectan al citotrofoblasto entre sí y con el sincitio, que no posee membranas plasmáticas completas individuales, por lo que el término barrera debiera ser reemplazado por membrana placentaria. Vellosidades coriónicas: Se distinguen fácilmente desde el día 12 después de la fertilización. Cuando la columna trofoblástica sólida es invadida por un cordón mesenquimático, derivado del citotrofoblasto se forman las vellosidades secundarias. Una vez producida la angiogénesis a partir del mesénquima las vellosidades pasan a ser terciarias. Los senos venosos maternos son perforados pero la sangre materna sólo ingresa sólo el día 14. Al día 17, los vasos fetales se tornan funcionales y se establece la circulación placentaria y la circulación fetoplacentaria se completa cuando los vasos sanguíneos del embrión se conectan con los vasos sanguíneos coriónicos. Durante el embarazo temprano las vellosidades están distribuidas por toda la periferia de la membrana coriónica; macroscópicamente un blastocisto desalojado del endometrio durante este estadío tiene un aspecto velloso. Las vellosidades en contacto con la decidua basal proliferan para formar el corion frondoso, el componente fetal de la placenta, las vellosidades en contacto con la decidua capsular dejan de crecer y degeneran formando el corion liso (o corion leve). Al tercer mes, el corion liso está separado del amnios por la cavidad exocelómica pero posteriormente quedan en íntimo contacto. El corion liso y el amnios forman un amniocorion avascular, sitio importante de transferencia molecular y actividad metabólica; el brazo paracrino del sistema de comunicación materno-fetal. Cotiledones placentarios: Ciertas vellosidades del corion frondoso se extienden desde la placa coriónica hacia la decidua y sirven como vellosidades de anclaje pero otras (la mayoría) se ramifican y terminan libremente en el espacio intervelloso sin llegar a la decidua. A medida que la placenta madura, los cortos troncos tempranos gruesos de las vellosidades se ramifican en vellosidades más pequeñas. Cada uno de los troncos de una vellosidad y sus ramificaciones constituyen un cotiledón o lóbulo placentario, irrigado por una rama de la arteria coriónica y con su vena (1:1:1). 102 HistologíayCitologíaavanzadaII Roturas en la "barrera" placetaria: La placenta no mantiene la integridad absoluta de las circulaciones fetal y materna existiendo pasaje de células en ambas direcciones. (ej en la eritroblastosis fetal) La placenta de término: Tiene un promedio de 185 mm de diámetro y 23 mm de espesor con un volumen de 500 ml y un peso de 508 gramos con amplias variaciones de las medidas. Envejecimiento placentario: Hay una reducción del espesor del sincitio, reducción parcial de las células de Langhans, disminución del estroma, aumento en la cantidad de capilares y aproximación de éstos a la superficie sincitial, engrosamiento de la membrana basal de los capilares y el trofoblasto, obliteración de ciertos vasos fetales, depósito de fibrina en las placas basal y coriónica, y en otros sitios del espacio intervelloso. Circulación fetal: La sangre desoxigenada fetal fluye a la placenta por las 2 arterias umbilicales que se ramifican en la unión del cordón umbilical con la placenta por debajo del amnios y nuevamente en las vellosidades coriales para formar finalmente redes capilares en las divisiones terminales. La sangre con contenido mayor de oxigeno retorna a través de una sola vena umbilical. Las ramas de los vasos umbilicales que cursan a través de la superficie fetal de la placenta (placa coriónica) se denominan vasos coriónicos los cuales responden a sustancias vasoactivas. Las arterias coriónicas siempre cruzan por encima de las venas coriónicas. Tras ingresar a la placa coriónica, las dos arterias umbilicales se anastomosan, luego se separan en la placa coriónica para dar ramas a los cotiledones. Existen 2 patrones diferentes de ramificación: disperso y magistral. Las arterias troncales son ramas de las perforantes de las arterias superficiales que pasan a través de la placa coriónica y cada arteria troncal irriga un cotiledón. La placa coriónica se forma a las 8 — 10 semanas a medida que el mesénquima de las placas amniótica y coriónica primaria se fusionan. Esto se ve acompañado por la expansión de la cavidad amniótica, que también rodea al pedículo de fijación o del cuerpo y la alantoides y se une a estas estructuras para dar origen al cordón umbilical. 103 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Circulación materna: La homeotasis fetal depende de la circulación materno-placentaria por lo que es importante averiguar los factores que regulan el flujo de sangre desde y hacia el espacio intervelloso. La circulación sería de la siguiente forma: La sangre materna ingresa a través de la placa basal y es llevada hacia la placa coriónica por la carga de presión arterial materna antes de que ocurra la dispersión lateral. Después de bañar la superficie externa microvellosa de las vellosidades coriónicas, la sangre materna drena a través de orificios venosos en la placa basal e ingresa a las venas uterinas. Por lo tanto la sangre materna atraviesa la placenta al azar sin conductos preformados, impulsada por la presión arterial materna. En general las arterias espiraladas son perpendiculares, pero las venas son paralelas a la pared uterina una disposición que favorece el cierre de las venas durante la contracción uterina e impide la salida de sangre materna del espacio intervelloso. Las contracciones uterinas provocan disminución del flujo arterial y una detención del venoso. Por lo tanto, los factores que regulan el flujo en el espacio intervelloso son: la presión arterial, la presión intrauterina, el patrón de contracciones y factores que actúan en forma específica sobre la pared arteriolar. El Amnios: Es la membrana fetal más interna de la bolsa de las aguas y se continúa con el líquido amniótico. Es el que proporciona casi toda la resistencia a la tensión de las membranas fetales. Estructura del amnios: Se encuentra compuesta por 5 capas: epitelio cuboideo, membrana basal, capa compacta (compuesta por colágeno), células del mesénquima, zona esponjosa. Es un tejido avascular. Consideraciones del desarrollo: Se forma el día 7 del desarrollo embrionario. Se desarrolla en un pequeño saco que cubre la superficie dorsal del embrión y a medida que crece engloba al embrión y la distensión del amnios la pone en contacto con la superficie interior del corion liso obliterando el celoma extraembrionario. Histiogénesis de las células del amnios: Las células epiteliales derivan del ectodermo fetal (del disco embrionario). Las del mesénquima derivan del mesodermo fetal. Luego se deposita colágeno entre ellas (placa compacta). A las14 semanas de gestación aparecen las células del epitelio. La superficie apical de las células epiteliales está llena de microvellosidades altamente desarrolladas lo que la convierte en un sitio de transferencia entre el líquido amniótico y el amnios. La capa de células mesenquimáticas es la responsable de la resistencia del amnios. Éstas células son además capaces de sintetizar citoquinas (interleuquina-6, 8 y proteína quimiotactica de monocitos-1) que aumentan en respuesta a las toxinas bacterianas. Anatomía del amnios: Tiene 3 partes anatómicamente diferenciables: 104 Amnios reflejo que se fusiona con el corion liso. Amnios placentario que cubre la superficie fetal de la placenta. Amnios umbilical. HistologíayCitologíaavanzadaII Funciones metabólicas del amnios: Está involucrado en el transporte de agua y solutos para mantener la homeostasis del líquido amniótico y produce compuestos bioactivos (péptidos vasoactivos, factores de crecimiento y citoquinas). Péptidos vasoactivos del amnios: Endotelina 1 (potente vasoconstrictor) y proteína relacionada con la hormona paratidoidea (vasodilatador). Existe además una alta tasa de actividad específica de la enzima encefalinasa que degrada la endotelina 1 en el corion liso. Por lo tanto, estos péptidos pueden acceder a la superficie adventicial de los vasos coriónicos de la placenta por lo que el amnios estaría involucrado en la modulación del tono y el flujo sanguíneo de los vasos coriónicos. El epitelio produce también péptido natriurético cerebral (BNP) y hormona liberadora de corticotrofina (CRH) que también son relajantes del músculo liso. Éstos péptidos también actúan en otros tejidos en diversos procesos fisiológicos que incluyen la promoción de la replicación celular y el metabolismo del calcio. Una vez secretados desde el amnios pueden ingresar al líquido amniótico quedando a disposición del feto por medio de la degollación y los movimientos torácicos fetales. Líquido amniótico: En el embarazo de término el volumen promedio es de 1000 cc. Pero es ampliamente variable. Desarrollo del cordón umbilical: Dado que en la embriogénesis, la superficie dorsal crece más rápido que la ventral, en asociación con la elongación del tubo neural, el embrión protruye hacia el saco amniótico, y la parte dorsal del saco vitelino es incorporado en el cuerpo del embrión para formar el intestino. El alantoides se proyecta hacia la base del pedículo de fijación del cuerpo desde la pared caudal del saco vitelino o, más adelante desde la pared anterior del intestino posterior. A medida que avanza el embarazo, el saco vitelino se torna más pequeño y su pedículo resulta relativamente más largo. Aproximadamente al tercer mes de embarazo, el amnios en expansión oblitera el exoceloma, se fusiona con el corion liso y cubre el disco placentario que protruye y la superficie lateral del pedículo de fijación o del cuerpo, el cual entonces se denomina cordón umbilical. El cordón de término normalmente tiene 2 arterias y una vena. Estructura y función del cordón umbilical: Su diámetro es de 0,8 a 2 cms. con una longitud promedio de 55 cms.(30-100 cms.). El plegamiento de los vasos sanguíneos es el causante de la creación de falsos nudos que son en realidad várices. La matríz extracelelar está constituida por la gelatina de Wharton. El diámetro de las 2 arterias es menor que el de la vena. La sangre fluye desde la vena umbilical por 2 vías, el conducto venoso que drena directamente en la vena cava inferior, y las numerosas aberturas más pequeñas hacia la circulación hepática fetal y, por lo tanto con la vena cava inferior vía vena hepática. 105 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología PlatoBasalNormal.Placenta. ►Ref.5094b. Una placenta normal a término es una estructura en forma de disco de aproximadamente 16 a 20 cm de diámetro, y tres o cuatro centímetros de grosor; en su parte más gruesa, con un peso de entre 1/2 kg y 1 kg. Es más delgada en sus bordes, donde se une con el corion, que es una estructura de tipo membranal que recubre toda la superficie interna del útero y contiene al feto y al líquido amniótico. El amnios, una membrana todavía más delgada, que cubre la parte interna del corion. La superficie interna o fetal de la placenta es brillante y lisa, y está atravesada por un gran número de vasos sanguíneos fetales ramificados que se unen en el punto donde se une el cordón umbilical (generalmente el centro de la placenta). El lado materno o uterino de la placenta, que está cubierto por una membrana delgada y escamosa llamada decidua basalis, un desecho del recubrimiento uterino, es rugosa y rojiza y tiene aspecto de carne viva. Si se realiza un corte transversal de la placenta, se observa que su interior está formado por una matriz, con aspecto suave y esponjoso, de la cual se puede exprimir sangre coagulada o semisólida que queda atrapada al separarla de la pared uterina. Un examen detallado muestra que las vellosidades de la placenta y sus ramificaciones forman una masa arborescente dentro del enorme lago sanguíneo del espacio entre vellosidades. Una serie de vellos de anclaje se extienden hacia el exterior desde el lado del feto y se funden con la decidua basalis para mantener la forma del órgano. Otros, con forma de algas flotan libremente en la sangre. Una serie de particiones, que se forman a partir de la cápsula del trofoblasto, se proyectan hacia el espacio entre las vellosidades desde el lado de la decidua y dividen a la placenta en 15 o 20 compartimentos llamados cotiledones. La sangre materna fluye desde los vasos uterinos hacia el lago de sangre entre los vellos. Dentro de cada uno de estos últimos se encuentra una red de vasos sanguíneos que forma parte del sistema circulatorio del feto. La sangre circula por estos vasos gracias al corazón del bebé. La pared de los vasos sanguíneos, el tejido conjuntivo del centro de las vellosidades y la parte del trofoblasto que cubre a los vellos separa los torrentes sanguíneos de la madre y el feto. Esto se conoce como barrera placentaria. A medida que avanza el embarazo, van creciendo los vasos sanguíneos del bebé y el tejido conjuntivo se extiende sobre ellos, haciendo que se fragmente la capa del trofoblasto (Trofoblasto: Doble componente celular: citotrofoblasto y sincitiotrofoblasto, de la placenta.); en consecuencia, la barrera placentaria se hace mucho más delgada. Normalmente, las células sanguíneas y las bacterias no la atraviesan, pero se filtran a través de ella: agua, sal, virus, hormonas y muchas otras sustancias, incluidos un gran número de fármacos. OrganizacióndelaPlacenta Ultraestructura del trofoblasto: Las microvellosidades de la superficie sincitial, y las vacuolas pinocitóticas y las vesículas asociadas se relacionan con las funciones placentarias de absorción y secreción. 106 HistologíayCitologíaavanzadaII Desmosomas conectan al citotrofoblasto entre sí y con el sincitio, que no posee membranas plasmáticas completas individuales, por lo que el término barrera debiera ser reemplazado por membrana placentaria. Vellosidades coriónicas: Se distinguen fácilmente desde el día 12 después de la fertilización. Cuando la columna trofoblástica sólida es invadida por un cordón mesenquimático, derivado del citotrofoblasto se forman las vellosidades secundarias. Una vez producida la angiogénesis a partir del mesénquima las vellosidades pasan a ser terciarias. Los senos venosos maternos son perforados pero la sangre materna sólo ingresa sólo el día 14. Al día 17, los vasos fetales se tornan funcionales y se establece la circulación placentaria y la circulación fetoplacentaria se completa cuando los vasos sanguíneos del embrión se conectan con los vasos sanguíneos coriónicos. Durante el embarazo temprano las vellosidades están distribuidas por toda la periferia de la membrana coriónica; macroscópicamente un blastocisto desalojado del endometrio durante este estadío tiene un aspecto velloso. Las vellosidades en contacto con la decidua basal proliferan para formar el corion frondoso, el componente fetal de la placenta, las vellosidades en contacto con la decidua capsular dejan de crecer y degeneran formando el corion liso(o corion leve). Al tercer mes, el corion liso está separado del amnios por la cavidad exocelómica pero posteriormente quedan en íntimo contacto. El corion liso y el amnios forman un amniocorion avascular, sitio importante de transferencia molecular y actividad metabólica; el brazo paracrino del sistema de comunicación materno-fetal. Cotiledones placentarios: Ciertas vellosidades del corion frondoso se extienden desde la placa coriónica hacia la decidua y sirven como vellosidades de anclaje pero otras (la mayoría) se ramifican y terminan libremente en el espacio intervelloso sin llegar a la decidua. A medida que la placenta madura, los cortos troncos tempranos gruesos de las vellosidades se ramifican en vellosidades más pequeñas. Cada uno de los troncos de una vellosidad y sus ramificaciones constituyen un cotiledón o lóbulo placentario c/u irrigado por una rama de la arteria coriónica y con su vena (1:1:1). Roturas en la "barrera" placetaria: La placenta no mantiene la integridad absoluta de las circulaciones fetal y materna existiendo pasaje de células en ambas direcciones. (Ej. En la eritroblastosis fetal). La placenta de término: Tiene un promedio de 185 mm de diámetro y 23 mm de espesor con un volumen de 500 ml y un peso de 508 gramos con amplias variaciones de las medidas. Envejecimiento placentario: Hay una reducción del espesor del sincitio, reducción parcial de las células de Langhans, disminución del estroma, aumento en la cantidad de capilares y aproximación de éstos a la superficie sincitial, engrosamiento de la membrana basal de los capilares y el trofoblasto, obliteración de ciertos vasos fetales, deposito de fibrina en las placas basal y coriónica, y en otros sitios del espacio intervelloso. 107 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología La superficie fetal de la placenta está cubierta por el amnios, debajo del cual cursan los vasos coriónicos fetales. La superficie materna de la placenta está dividida en lóbulos irregulares por surcos producidos por tabiques consistentes en tejido fibroso con escasos vasos limitados principalmente a la base. Circulación fetal: La sangre desoxigenada fetal fluye a la placenta por las 2 arterias umbilicales que se ramifican en la unión del cordón umbilical con la placenta por debajo del amnios y nuevamente en las vellosidades coriales para formar finalmente redes capilares en las divisiones terminales. La sangre con contenido mayor de oxigeno retorna a través de una sola vena umbilical. Las ramas de los vasos umbilicales que cursan a través de la superficie fetal de la placenta (placa coriónica) se denominan vasos coriónicos los cuales responden a sustancias vasoactivas. Las arterias coriónicas siempre cruzan por encima de las venas coriónicas. Luego de ingresar a la placa coriónica, las dos arterias umbilicales se anastomosan, luego se separan en la placa coriónica para dar ramas a los cotiledones. Existen 2 patrones diferentes de ramificación: disperso y magistral. Las arterias troncales son ramas de las perforantes de las arterias superficiales que pasan a través de la placa coriónica y cada arteria troncal irriga un cotiledón. La placa coriónica se forma a las 8 — 10 semanas a medida que el mesénquima de las placas amniótica y coriónica primaria se fusionan. Esto se ve acompañado por la expansión de la cavidad amniótica, que también rodea al pedículo de fijación o del cuerpo y la alantoides y se une a estas estructuras para dar origen al cordón umbilical. 108 HistologíayCitologíaavanzadaII Circulación materna: La homeotasis fetal depende de la circulación materno-placentaria por lo que es importante averiguar los factores que regulan el flujo de sangre desde y hacia el espacio intervelloso. Según Ramsey la circulación sería de la siguiente forma: La sangre materna ingresa a través de la placa basal y es llevada hacia la placa coriónica por la carga de presión arterial materna antes de que ocurra la dispersión lateral. Después de bañar la superficie externa microvellosa de las vellosidades coriónicas, la sangre materna drena a través de orificios venosos en la placa basal e ingresa a las venas uterinas. Por lo tanto la sangre materna atraviesa la placenta al azar sin conductos preformados, impulsada por la presión arterial materna. En general las arterias espiraladas son perpendiculares, pero las venas son paralelas a la pared uterina una disposición que favorece el cierre de las venas durante la contracción uterina e impide la salida de sangre materna del espacio intervelloso. Las contracciones uterinas provocan disminución del flujo arterial y una detención del venoso. Por lo tanto, los factores que regulan el flujo en el espacio intervelloso son: la presión arterial, la presión intrauterina, el patrón de contracciones y factores que actúan en forma específica sobre la pared arteriolar. ElAmnios Es la membrana fetal más interna de la bolsa de las aguas y se continúa con el líquido amniótico. Es el que proporciona casi toda la resistencia a la tensión de las membranas fetales. Estructura del amnios: Se encuentra compuesta por 5 capas: epitelio cuboideo, membrana basal, capa compacta (compuesta por colágeno), células del mesénquima, zona esponjosa. Es un tejido avascular. Consideraciones del desarrollo: Se forma el día 7 del desarrollo embrionario. Se desarrolla en un pequeño saco que cubre la superficie dorsal del embrión y a medida que crece engloba al embrión y la distensión del amnios la pone en contacto con la superficie interior del corion liso obliterando el celoma extraembrionario. Histiogénesis de las células del amnios: Las células epiteliales derivan del ectodermo fetal (del disco embrionario). Las del mesénquima derivan del mesodermo fetal. Luego se deposita colágeno entre ellas (placa compacta). A las14 semanas de gestación aparecen las células del epitelio. La superficie apical de las células epiteliales está llena de microvellosidades altamente desarrolladas lo que la convierte en un sitio de transferencia entre el líquido amniótico y el amnios. La capa de células mesenquimáticas es la responsable de la resistencia del amnios. Éstas células son además capaces de sintetizar citoquinas (interleuquina-6, 8 y proteína quimiotactica de monocitos-1) que aumentan en respuesta a las toxinas bacterianas. Anatomía del amnios: Tiene 3 partes anatómicamente diferenciables: amnios reflejo que se fusiona con el corion liso; el amnios placentario que cubre la superficie fetal de la placenta y el amnios umbilical. 109 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Funciones metabólicas del amnios: Está involucrado en el transporte de agua y solutos para mantener la homeostasis del líquido amniótico y produce compuestos bioactivos (péptidos vasoactivos, factores de crecimiento y citoquinas). Péptidos vasoactivos del amnios: Endotelina 1 (potente vasoconstrictor) y proteína relacionada con la hormona paratidoidea (vasodilatador). Existe además una alta tasa de actividad específica de la enzima encefalinasa que degrada la endotelina 1 en el corion liso. Por lo tanto, estos péptidos pueden acceder a la superficie adventicial de los vasos coriónicos de la placenta por lo que el amnios estaría involucrado en la modulación del tono y el flujo sanguíneo de los vasos coriónicos. El epitelio produce también péptido natriurético cerebral (BNP) y hormona liberadora de corticotrofina (CRH) que también son relajantes del músculo liso. Éstos péptidos también actúan en otros tejidos en diversos procesos fisiológicos que incluyen la promoción de la replicación celular y el metabolismo del calcio. Una vez secretados desde el amnios pueden ingresar al líquido amniótico quedando a disposición del feto por medio de la degollación y los movimientos torácicos fetales. Líquido amniótico: En el embarazo de término el volumen promedio es de 1000 cc pero es ampliamente variable. CordónUmbilicalyEstructurasRelacionadas Desarrollo del cordón umbilical: Dado que en la embriogénesis, la superficie dorsal crece más rápido que la ventral, en asociación con la elongación del tubo neural, el embrión protruye hacia el saco amniótico, y la parte dorsal del saco vitelino es incorporada en le cuerpo del embrión para formar el intestino. El alantoides se proyecta hacia la base del pedículo de fijación del cuerpo desde la pared caudal del saco vitelino o, más adelante desde la pared anterior del intestino posterior. A medida que avanza el embarazo, el saco vitelino se torna más pequeño y su pedículo resulta relativamente más largo. Aproximadamente al tercer mes de embarazo, el amnios en expansión oblitera el exoceloma, se fusiona con el corion liso y cubre el disco placentario que protruye y la superficie lateral del pedículo de fijación o del cuerpo, el cual entonces se denomina cordón umbilical. El cordón de término normalmente tiene 2 arterias y una vena. Estructura y función del cordón umbilical: Su diámetro es de 0,8 a 2 cms. con una longitud promedio de 55 cms.(30-100 cms.). El plegamiento de los vasos sanguíneos es el causante de la creación de falsos nudos que son en realidad várices. La matríz extracelelar está constituida por la gelatina de Wharton. El diámetro de las 2 arterias es menor que el de la vena. La sangre fluye desde la vena umbilical por 2 vías, el conducto venoso que drena directamente en la vena cava inferior, y las numerosas aberturas más pequeñas hacia la circulación hepática fetal y, por lo tanto con la vena cava inferior vía vena hepática. 110 HistologíayCitologíaavanzadaII PlatoCoriónicoNormal.Placenta. ►Ref.5810b. La unidad estructural básica de la placenta es la vellosidad coriónica; las vellosidades son proyecciones altamente vasculares del tejido fetal alrededor del corion. La capa más exterior del tejido fetal, el corion tiene dos capas: el sincitiotrofoblasto y el citotrofoblasto. El sincitiotrofoblasto está totalmente en contacto directo con la sangre materna en el espacio intervelloso. Las sustancias pasan desde la madre al feto, desde la sangre materna hasta el espacio intravelloso; ahí se cruzan las dos capas de citotrofoblasto, algún tejido conectivo fetal y finalmente la pared capilar fetal. La biopsia de vellosidades coriales debe ser realizada en etapas más tempranas del embarazo que la amniocentesis, usualmente entre la semana 10 y 12 de gestación (calculada desde la fecha de la última regla). Si la fecha de última regla es incierta, este examen puede realizarse al alcanzar la medida céfalo caudal del embrión 3cm. Al realizarse más temprano en el embarazo, permite la detección de errores genéticos en etapas más precoces. La biopsia corial consiste en tomar una muestra muy pequeña del tejido que conforma el corion frondoso o futura placenta. Este tejido de llama Vellosidad Corial y proviene del óvulo fertilizado, por lo que debe tener los mismos genes y cromosomas del feto en formación. Existen dos formas de obtener tejido de la placenta: a través de la vagina o a través del abdomen, dependiendo de la localización de la placenta identificada por evaluación ecográfica previa. Si se selecciona la toma de muestra por vía vaginal, se procederá igual que la toma de muestra para una citología cervico-vaginal (papanicolao), pero con estrictas medidas de asepsia y antisepsia. Luego, un fino y flexible catéter de plástico estéril se introducen a través del cuello uterino y se dirigirá por vía ecográfica al sitio donde esta la placenta en un espacio libre entre el útero y el corion, en donde se pueden encontrar las vellosidades coriales flotando como algas en el mar hasta la semana 12 de la gestación. Finalmente, se toma una pequeña cantidad mediante una suave aspiración. Si se selecciona la vía abdominal, el procedimiento es parecido a la amniocentesis, con la diferencia que la aguja se dirigirá hacia la placenta sin introducirse en la cavidad amniótica. 111 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología AdenocarcinomadeCérvix. ►Ref.5741b. La diseminación del cáncer de cérvix principalmente es por contiguidad, afectando estructuras adyacentes al cuello uterino y metastatiza por vía linfática, en 50 % de los casos a los ganglios paracervicales, hipogástricos, obturadores, iliacos externos y periaórticos. Las metástasis hemáticas afectan principalmente, hígado, pulmón y médula ósea. El cáncer de cérvix evoluciona lentamente a lo largo de muchos años. En el caso de displasia y el carcinoma in situ, no es necesario practicar cirugía radical en todos los casos, numerosas lesiones se localizan por colposcopía y pueden erradicarse por métodos conservadores de láser de CO2 , crioterapia, electrocirugía con asa diatérmica, siempre que sea posible controlar a la paciente mediante citologías periódicas y colposcopía. En su preparación histológica se observan las siguientes características microscópicas: - Nidos, láminas y cordones de células neoplásicas. - Células neoplásicas con discariosis, hipercromasia, pleomorfismo y escaso citoplasma. - Puentes intercelulares y perlas córneas. - Mitosis atípicas y áreas de necrosis. - Invasión del estroma por células neoplásicas. Estadío 0 o carcinoma in situ: El carcinoma in situ es un cáncer muy temprano. Las células anormales se encuentran sólo en la primera capa de células que recubren el cuello uterino, y no invaden los tejidos más profundos del cuello uterino. Estadío I. El cáncer afecta el cuello uterino, pero no se ha diseminado a los alrededores. - I-a: una cantidad muy pequeña de cáncer, sólo visible por microscopio, se encuentra ya en el tejido más profundo del cuello uterino. - I-b: una cantidad mayor de cáncer se encuentra en dicho tejido. Estadío II. El cáncer se ha diseminado a áreas cercanas, pero aún se encuentra en el área pélvica. - II-a: el cáncer se ha diseminado fuera del cuello uterino a los dos tercios superiores de la vagina. - II-b: el cáncer se ha diseminado al tejido alrededor del cuello uterino. Estadío III. El cáncer se ha diseminado a toda el área pélvica. Puede haberse diseminado a la parte inferior de la vagina, o infiltrar los uréteres (los tubos que conectan los riñones a la vejiga). Estadío IV. El cáncer se ha diseminado a otras partes del cuerpo. 112 - IV-a: Diseminación a la vejiga o al recto (organos cerca del cuello uterino). - IV-b: Diseminación a órganos distales como los pulmones. HistologíayCitologíaavanzadaII AdenocarcinomadeEndometrio.Útero. ►Ref.5097b. Nombres alternativos: Adenocarcinoma del endometrio; adenocarcinoma del útero; cáncer uterino; adenocarcinoma endometrial; adenocarcinoma uterino. Causas, incidencia y factores de riesgo: El cáncer endometrial es el tipo más común de cáncer uterino. Aunque no se conoce la causa exacta de este cáncer, parece que los niveles elevados de estrógeno guardan relación con el mismo. Una de las funciones normales del estrógeno es estimular la formación de la pared epitelial del útero. La administración de exceso de estrógenos a animales de laboratorio produce hiperplasia endometrial y cáncer. Las condiciones asociadas a este tipo de cáncer son las siguientes: - Obesidad - Hipertensión - Enfermedad ovárica poliquística El aumento del riesgo también está asociado con: - Nuliparidad (no haber tenido ningún embarazo). - Infertilidad (incapacidad para quedar embarazada). - Menarquia (inicio de la menstruación) precoz. - Menopausia (suspensión de las menstruaciones) tardía. Las mujeres con antecedentes de pólipos endometriales u otros tumores benignos del revestimiento uterino, las mujeres posmenopáusicas con terapia de reemplazo de estrógeno (específicamente cuando no se administra junto con progestina periódica) y las que sufren de diabetes también se encuentran en la categoría de alto riesgo. Es el tumor más frecuente en el tracto genital femenino, y va en aumento. Parece tener relación con la obesidad, nuliparidad y menopausia tardía; y se discute su relación con la hipertensión, diabetes y dietas ricas en grasas. La estrogenoterapia y la patología ovárica productora de estrógenos también tienen un cierto efecto sobre la frecuencia del cáncer de endometrio. Su relación con la hiperplasia endometrial no está clara, pero, al menos en las formas menos agresivas, sí parece haber cierta relación con las hiperplasias atípicas y/o complejas. Suele aparecer en la peri-postmenopáusia, con clínica de sangrado. Macroscópicamente es una masa blanda, frágil, que ocupa en mayor o menor grado la cavidad endometrial. Microscópicamente presenta un patrón glandular. La forma más común, el adenocarcinoma endometrioide, tiene luces similares a las de un endometrio proliferativo, densamente agrupadas, con patrón cribiforme, que presenta focos sólidos y necrosis en las formas menos diferenciadas (grados de diferenciación I al III). Los núcleos oscilan entre la escasa atipia y la atipia prominente, con nucléolos marcados, proporcionando un "grado nuclear", también de I a III, que puede tener más relevancia pronóstica que el grado arquitectural. El adenocarcinoma endometrioide puede tener focos o predominio de células similares a las del endometrio secretor (variante secretora), o células ciliadas (var. ciliada), o arquitectura papiliforme (var. glandulovellosa), o focos de epitelio 113 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología pavimentoso benigno (adenoacantoma), y otras diferenciaciones menos frecuentes, pero ninguna de ellas tiene importancia pronóstica. Además, hay variantes con peor pronóstico como es el adenocarcinoma papilar seroso, que tiene verdaderas papilas, el adenocarcinoma de células claras, el carcinoma adenoescamoso, cuyo componente pavimentoso es claramente maligno, el carcinoma epidermoide y formas mixtas en las que el segundo componente debe constituir, al menos, el 10% del tumor. En el pronóstico de la lesión influyen, entre otros factores, el tipo de tumor, su grado de diferenciación-grado nuclear (en el endometrioide), el acompañamiento por hiperplasia endometrial en el resto de la mucosa, la invasión miometrial, la extensión a cuello y peritoneo, y la permeación vascular-producción de microvascularización por parte del tumor. La citología cervicovaginal no es un método adecuado para controlar la enfermedad (cuando la CCV es positiva la enfermedad suele estar en un estadío avanzado). No obstante, un frotis estrogénico en una mujer postmenopáusica con células endometriales, debe ser tenido como sospechoso, y si el fondo es sucio, como sugerente de malignidad. La citología endometrial del adenocarcinoma de endometrio muestra placas y grupos tridimensionales, papilas y rosetas, y elementos aislados, más numerosos cuanto menos diferenciado sea el tumor. Los citoplasmas suelen estar mal conservados, y son frecuentes las vacuolas intracitoplasmáticas. Hay aumento del tamaño celular, anisocitosis y anisonucleosis, cromatina gruesa y nucléolos prominentes. Un fondo con necrosis, histiocitos y polimorfonucleares es lo normal. La orientación sobre un tipo de carcinoma en particular es aún más difícil, aunque posible. Estadificaión del Carcinoma de Endometrio FIGO Grado ENDOMETRIO TNM No se puede valorar el tumor primario TX No existe evidencia del tumor primario T0 Carcinoma in situ. Carcinoma preinvasor. Estadío 0 G 1 2 3 Los Estadíos 0 no se deben incluir en las estadisticas terapéuticas. Tis Estadío I G 1 2 3 El carcinoma se limita estrictamente al cuerpo del utero. T1 IA G 1 2 3 Carcinoma invasor limitado al endometrio. T1a IB G 1 2 3 Invasión de menos de la mitad del miometrio. T1b IC G 1 2 3 Invasión de más de la mitad del miometrio. T1c 114 HistologíayCitologíaavanzadaII Estadío II G 1 2 3 El tumor invade el cuello del utero, pero no se extiende más alla del utero. T2 IIA G 1 2 3 Afecta exclusivamente las glandulas endocervicales. T2a IIB G 1 2 3 Invasión del estroma cervical. T2b Estadío III Extensión local o regional como se especifica en IIIA, B, y C. G 1 2 3 Extensión fuera del utero pero no fuera de la pelvis T3 y/o N1 verdadera. IIIA El tumor invade la serosa y/o los anexos (extensión directa G 1 2 3 o metastasis) y/o la citología del lavado peritoneal o del líquido de la ascítis es positiva. T3a IIIB G123 El Tumor compromete la vagina (extensión directa o metastasis) T3b IIIC G 1 2 3 Metastasis en ganglios pélvicos y/o paraaórticos. Estadío IV N1 Extensión por fuera de los límites del tracto reproductor o evidente compromiso de la vejiga o mucosa rectal. IVA G123 IVB El tumor invade la mucosa vesical y/o Intestinal. El edema bulloso no autoriza a estadificarlo como Estadío IV - T4 T4 Metastasis a distancia, incluyendo ganglios linfáticos intrabdominales o inguinales. M1 Grados de Diferenciación Histológica - G1: 5% o menos de patrón de crecimientosólido no escamoso o no morular. - G2: 6-50% de patrón de crecimientosólido no escamoso o no morular. - G3: más de un 50% de patrón de crecimientosólido no escamoso o no modular. Estadío I: Es un carcinoma estrictamente confinado al cervíx; debe ser descartada la extensión al cuerpo uterino. - Estadío IA: Carcinoma invasivo identificado únicamente por microscopia. Todas las lesiones gruesas aun con invasión superficial son estadíos de cáncer IB. la invasión esta limitada a la medida de la invasión estromal con un máximo de profundidad de 5mm y ancho no mayor a 7mm. Estadío IA1: Invasión del estroma no mayor de 3mm de profundidad y no mas ancha de 7mm de diámetro. Estadío IA2: Invasión del estroma mayor de 3mm pero no mayor de 5mm en profundidad ni de 7 mm de diámetro. 115 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Estadío IB: Lesiones clínicas confinadas al cervíx o lesiones preclinicas mayores que las del estadío IA. Estadío IB1: Lesiones clínicas no mayores de 4cm. Estadío IB2: Lesiones clínicas mayores de 4 cm. Estadío II: Es un carcinoma que se extiende más allá del cervíx, pero que no se ha extendido dentro de la pared pélvica. El carcinoma compromete vagina pero no supera el tercio inferior. - Estadío IIA: No hay obvio compromiso del parametrio. Comprende el tercio superior de la vagina. - Estadío IIB: hay obvio compromiso parametrial pero no sobre la pared pélvica. Estadío III: Es un carcinoma que se extiende dentro de la pared pélvica. En la examinación rectal, no hay espacio libre de cáncer entre el tumor y la pared pélvica. El tumor compromete el tercio inferior de la vagina. Cursa con hifronefrosis o falla renal a menos que estas sean debidas a otras causas. - Estadío IIIA: No hay extensión en la pared pélvica, pero compromete el tercio inferior de la vagina. - Estadío IIIB: Extensión en la pared pélvica o hidronefrosis con falla renal. Estadío IV: Es el carcinoma que se extiende mas allá de la pelvis verdadero o tiene compromiso clínico de mucosa de la vejiga o del recto. 116 - Estadío IVA: Diseminación dl tumor a órganos pélvicos adyacentes. - Estadío IVB: Diseminación a órganos a distancia. La profundidad de la invasión no debe superar los 5mm, tomando como base el epitelio y también la superficie glandular del cual se origina. El espacio vascular comprende ambos, el venoso y el linfático. HistologíayCitologíaavanzadaII El tipo Histológico es un factor pronostico importante puesto que existen algunos subtipos tumorales que conllevan por si mismos e independientes de otros factores un peor pronóstico. Podemos consideran dentro de los diferentes subtipos Histologicos: Subtipo Incidencia (%) Supervivencia - Ca endometrioide 86 % 93 a 61 % Villoglandular o papilar 47.4% Con metaplasia escamosa 21.7 % Adenoescamoso 6.9 % - Mucinoso 3-9% - Papilar Seroso 4.7% 51% - Célula Clara 5.7% 35% - Mixto (compuesto por varios tipos) - Indiferenciado(C gigante, C fusiforme y C pequeña) - Mulleriano Mixto (con o sin elementos heterólogos) El tipo histológico más frecuente es el Ca endometrioide con patrón villo-glandular o papilar. Los carcinomas de Células Claras y Papilar Seroso son de mal pronóstico y todos se consideran de alto grado de malignidad y solo se gradúan basándose en las características nucleares siendo mayoritariamente grado 2 o 3 nuclear. En el resto de subtipos Histológicos su pronóstico depende más del grado de malignidad que de la variedad del tumor. Es importante diferenciar el Ca endometrioide con patrón papilar del Ca Papilar Seroso puesto que el primero suele ser grado I y por lo tanto de pronóstico excelente. Las papilas que forma el Ca endometrioide son de tallos finos tapizadas por núcleos monomorfos, mientras que en el Papilar Seroso los ejes son gruesos y especialmente las células que tapizan dichas papilas poseen núcleos bizarros y pleomorficos, en ocasiones en "tachuela". El adenocarcinoma con metaplasia escamosa (adenoacantoma) suele ser un Ca bien diferenciado y se debe diferenciar del adenocarcinoma endometrioide glandular con focos sólidos de crecimiento. El adenoacantoma tiene un excelente pronóstico (supervivencia de 87 % a los 5 años) mientras que en el Ca endometrioide con focos sólidos el pronóstico no es tan bueno pues es un Grado II de diferenciación. También es importante separar el adenoacantoma del Ca adenoescamoso. La supervivencia del Ca adenoescamoso está alrededor del 47%, probablemente debido a que en este subtipo el componente glandular posee un grado de diferenciación más alto que en el Ca endometrioide con metaplasia escamosa. A diferencia de lo que ocurre en la gradación de otras neoplasias malignas tales como el Ca de Mama, Próstata o Sarcomas de Partes Blandas, el Grado Histológica en el 117 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Ca de endometrio solamente se basa en la cantidad de componente glandular o patrón sólido que posea la neoplasia, es por esto más adecuado hablar de Grado de Diferenciación Tumoral que de Grado de Malignidad. Se pueden distinguir tres grados de diferenciación: - GI Bien diferenciado (patrón sólido<5%). - GII Moderadamente diferenciado (patrón sólido del 6-50%). - GIII Poco diferenciado (patrón sólido > 50%). El patrón sólido no incluye porción escamosa maligna o morular.Si hay atipia nuclear desproporcionada se ha propuesto que el GI o GII pasen a un grado mas alto. El que se asigne un grado nuclear en el diagnóstico del CA de endometrio ha sido incluido en las recomendaciones recientes de la FIGO. No obstante mientras que la coincidencia interobservadores respecto al tipo histólogico, grado de diferenciación, infiltración miometrial o estadío es bueno, el valor reproductivo del Grado Nuclear es bajo con un coeficiente de correlación de aproximadamente un 0.60 entre diferentes patólogos. Pensamos que esto es corregible si se establecen unos parámetros previos como ocurre en el Ca de mama. - Grado nuclear 1 – Uniforme, nucleolo pequeño, 0 ó mitosis escasas. - Grado nuclear 2 – Mayor variabilidad en tamaño, nucleolo más grande y mitosis ocasionales. - Grado nuclear 3 – Pleomorfismo, anaplasia y abundantes mitosis. Estudios citométricos han demostrado buena correlación entre el grado nuclear subjetivo y el obtenido por morfometria. En estudios multifactoriales en que se estudiaron datos histólogicos (tipo tumoral, grado de diferenciación, grado nuclear), clínicos (estadío) y otros de segunda generación como la presencia de RH, oncogenes o ploidia, fué el estadío de la FIGO junto con el grado nuclear los que presentaron un mayor poder preceptivo respecto a la supervivencia AdenocarcinomaInSitudeCérvix.Útero. ►Ref.5737b. Se definine al adenocarcinoma in situ como un epitelio columnar altamente atípico y no invasor. Puede incluir el epitelio superficial y las criptas. El epitelio normal esta reemplazado por un epitelio atípico que muestra falta de polaridad, aumento en el tamaño nuclear, pleomorfismo monuclear y grumos de cromatina. Las glándulas atípicas son hipercelulares con núcleos de varios niveles dando a las células una apariencia de estratificación. Se ven mitosis en este citoplasma escaso por sobre un densa capa de núcleos. Existe un límite abrupto entre el epitelio normal y el anormal. El término adenocarcinoma in situ debe usarse cuando la arquitectura de las criptas no está muy alterada. Las células que se descaman del adenocarcinoma in situ aparecen como una empalizada con mayor o menor coesividad. Tambien se puede observar pseudoestratificación de los núcleos y formación de rosetas. Las células son columnares. El núcleo es más grande, oval e hipercromático y con gránulos de cromatina. El citoplasma puede ser finamente vaculado o granular. Los frotis a menudo contienen gran un número de eritrocitos. Sincicios, grupos papilares, células pequeñas en grupos apretados, células 118 HistologíayCitologíaavanzadaII aisladas, núcleos gigantes y diátesis tumoral son todos hechos sugestivos de invasión. El Epitelio superficial de la mucosa endocervical, muestra células atípicas, con su polaridad perdida, con variaciones en el tamaño, forma, disposición y coloración de sus núcleos. No suele haber signos de infiltración del estroma. CarcinomaAdenoescamoso.Útero. ►Ref.5759b. Los carcinomas de la vagina son tumores poco comunes que comprenden un 1% a 2% de las malignidades ginecológicas. Pueden ser tratados efectivamente y, cuando se encuentran en etapas tempranas, con frecuencia son curables. La distinción histológica entre el carcinoma celular escamoso y el adenocarcinoma es importante porque los dos tipos representan enfermedades distintas, cada una con una patogénesis diferente y una historia natural distinta. El cáncer vaginal celular escamoso (aproximadamente 85% de los casos) inicialmente se disemina superficialmente dentro de la pared vaginal y más tarde invade los tejidos paravaginales y el parametrio. Las metástasis distantes ocurren más comúnmente en los pulmones e hígado. El adenocarcinoma (aproximadamente 15% de los casos) tiene una incidencia máxima entre los 17 y los 21 años de edad y difiere del carcinoma celular escamoso en un aumento en metástasis pulmonar y compromiso ganglionar supraclavicular y pélvico. Raramente, el melanoma y el sarcoma se describen como cánceres vaginales primarios. El carcinoma adenoescamoso es un tumor raro y agresivo con mezcla epitelial que comprende aproximadamente 1% a 2% de los casos. El pronóstico depende principalmente de la etapa en que se encuentra la enfermedad, pero la supervivencia se reduce en pacientes mayores de 60 años de edad, son sintomáticas al momento del diagnóstico, tienen lesiones del centro y tercio inferior de la vagina o tienen tumores mal diferenciados. Además, se ha encontrado que la extensión de pared vaginal comprometida está significativamente correlacionada con la supervivencia y la etapa de la enfermedad en pacientes con carcinoma de células escamosas. El tipo de célula más común del cáncer endometrial es el adenocarcinoma endometrioide que está compuesto de elementos epiteliales glandulares malignos; la mezcla de metaplasias escamosas es común. Los tumores adenoescamosos contienen elementos malignos de epitelio glandular y escamoso; el carcinoma de células claras y el carcinoma seroso papilar del endometrio son tumores de histología similar a los observados en el ovario y en la trompa de Falopio, y el pronóstico es peor para estos tumores. Raras veces se encuentran tumores mucinosos, escamosos e indiferenciados. A continuación se ofrece una relación de los tipos de cáncer endometrial: 1. Carcinomas de células escamosas. - Carcinoma de células escamosas microinvasivo. - Carcinoma invasivo de células escamosas. - Carcinoma verrugoso. - Carcinoma condilomatoso. - Carcinoma papilar de células escamosas (Transicional). - Carcinoma linfoepiteliomatoso. 119 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2. Adenocarcinomas. - Adenocarcinoma. - Tipo endocervical. - Tipo intestinal. - Tipo anillo de sello. - Adenocarcinoma endometrioide. - Adenocarcinoma endometrioide con metaplasia escamosa. - Adenocarcinoma de células claras. - Adenocarcinoma de mínimas desviaciones. - Adenocarcinoma de mínimas desviaciones. - Tipo endocervical (adenocarcinoma maligno). - Tipo endometrioide. - Adenocarcinoma seroso. - Carcinoma mesonéfrico. - Adenocarcinoma villo-glandular bien diferenciado. 3. Otros tumores epiteliales. - Carcinoma adenoescamoso. - Carcinoma de células cristalinas. - Carcinoma mucoepidermoide. - Carcinoma adenoide quístico. - Carcinoma adenoide basal. - Tumor carcinoide. - Carcinoma de células pequeñas. - Carcinoma indiferenciado. CarcinomadeCélulasClaras.Ovario. ►Ref.5089b. En países desarrollados es el tumor genital invasor más frecuente. Se dan en dos grupos de pacientes: 1. Mujeres perimenopáusicas: generalmente con algún factor de riesgo (obesidad, diabetes, hipertensión, infertilidad), solteras y nulíparas. En este grupo el tumor está relacionado con hiperestrogenismo: a) En mujeres con ciclos anovulatorios. b) Con lesiones ováricas productoras de estrógenos. c) Más síntesis de estrógenos en la hipodermis en mujeres obesas, en la menopausia. 120 HistologíayCitologíaavanzadaII d) Más síntesis de estrógenos a partir de andrógenos suprarrenales. En el 80% de los casos el tumor está limitado al cuerpo uterino y se trata de tumores bien diferenciados o moderamente diferenciados. El hiperestrogenismo se acompaña de hiperplasia del endometrio como lesión preneoplástica. 2. Mujeres postmenopáusicas: de mayor edad; el tumor se desarrolla en ausencia de hiperestrogenismo y de hiperplasia endometrial. Generalmente son menos diferenciados y más agresivos. Morfología: Macroscópicamente el útero puede estar abombado y globoso en tumores grandes, aunque en úteros atróficos también pueden encontrarse carcinomas endometriales extensos. La cavidad endometrial por lo común presenta un aspecto mamelonado, irregular, granuloso en relación con el tumor, que puede estar circunscrito a un foco o abarcar toda la cavidad. Rara vez se trata de una lesión poliposa, sésil que protruye en la cavidad. El tejido tumoral generalmente es blanquecino, blando, a veces hemorrágico. Histológicamente existe un continuo morfológico entre hiperplasias acentuadamente atípicas y carcinomas bien diferenciados, que pueden ser difíciles de diferenciar. En el carcinoma, en general, existen cribas (brotes epiteliales con varios lúmenes sin estroma entre éstos), acentuada irregularidad de las formaciones glandulares e intensa atipia celular. La invasión del miometrio es signo inequívoco de carcinoma. El 75% de los casos corresponden a carcinomas endometrioides. No es redundante hablar de carcinomas endometrioides del endometrio porque puede haber otros tipos histológicos, paramesonéfricos, de adenocarcinomas primarios del endometrio, como el mucosecretor -más frecuentemente endocervical- o seroso papilar -más frecuentemente ovárico. El adenocarcinoma endometrioide tiene un patrón glandular cribiforme, aunque puede ser papilar. Las formaciones glandulares tumorales generalmente presentan borde luminal regular, células cilíndricas de citoplasma denso y estratificación nuclear. En el 25% de los carcinomas endometrioides existen focos de diferenciación escamosa (carcinoma adenoescamoso). En el 25% restante se encuentran otros tipos histológicos: seroso papilar, mucinoso, carcinoma de células claras, carcinoma escamoso puro (raro). El carcinoma del endometrio se disemina como los carcinomas en general: primero, a ganglios linfáticos regionales (pelvianos), después, a más distantes (paraaórticos); localmente se extiende a órganos vecinos, puede haber diseminación transperitoneal, transtubaria y hematógena. Factores pronósticos: Existen dos variables independientes que determinan el pronóstico: 1) Nivel de penetración en el miometrio: si infiltra el 1/3 interno, hay 5% de casos con metástasis ganglionar linfática; si infiltra hasta el 1/3 medio, el porcentaje sube hasta casi el 25%, y si llega al 1/3 externo, las metástasis se encuentran en el 33% de los casos. 121 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 2) Grado de diferenciación: para el carcinoma endometrioide y según la extensión de áreas sólidas, se distinguen el grado 1 (menos de 5% de áreas sólidas) con 80% de sobrevida a 5 años, grado 2 (de 5 a 50% de áreas sólidas) con cerca de 75% de sobrevida a 5 años, y grado. 3) (más de 50% de áreas sólidas) con 50% de sobrevida a 5 años. A mayor grado, más atipias nucleares. Tipos histológicos agresivos son el carcinoma de células claras y el seroso papilar. CarcinomadeCélulasEscamosasdeCérvix.Útero. ►Ref.5109b. El adenocarcinoma del endocérvix es la neoplasia que se origina en la mucosa endocervical. La forma pura es la más frecuente, pero hasta 40% contienen una mezcla de dos ó más subtipos. Mientras que esta afección tiene formas mixtas, no ocurre así con el cáncer del exocérvix, que es primordialmente escamoso. El adenocarcinoma de endocérvix, por tener origen en un sitio oculto a la inspección por especuloscopia o colposcopia evoluciona en forma tórpida y puede pasar desapercibido aun a la toma de la citología; de hecho tiene una forma de crecimiento endofítico, que produce el cuello en barril, y ello demora el diagnóstico Desde el punto de vista anatómico, el útero está constituido por dos elementos, el cuerpo y el cuello o cérvix, que para fines prácticos son considerados como dos órganos independientes. El cérvix, a su vez, se subdivide en: endocérvix y exocérvix. El cérvix es la porción del útero comprendida entre el istmo, que se identifica como orificio cervical interno (OCI), y el sitio de inserción de la vagina, y se subdivide en: endocérvix: que va desde el istmo (OCI) al orificio cervical externo (OCE) y el exocérvix, desde el OCE que corresponde histológicamente a la zona de transformación hasta el sitio de inserción de la vagina en el cérvix (hocico de tenca). El endocérvix forma una cavidad fusiforme revestida por una mucosa con pliegues similares a una hoja de palma (árbol de la vida); mide 2,5 cm, con leves variaciones y está recubierto por un epitelio cilíndrico, pseudoestratificado, con mucificación variada, en el cual las glándulas ramificadas penetran hasta las capas profundas del estroma. Este consta de tejidos conectivos con colágeno, tejido elástico y escasas fibras musculares. La base del epitelio del endocérvix yace sobre una membrana basal muy fina que no se observa al microscopio de luz sino con coloración especial y solo al microscopio electrónico se puede apreciar su integridad. Esquema de los órganos sexuales internos femeninos que destaca las distintas mucosas de recubrimiento: El exocérvix está formado por un epitelio plano de revestimiento, con una membrana basal definida. Histológicamente la mucosa está formada por cuatro capas similares a las del epitelio vaginal (basal, parabasal, intermedia y superficial) que reposan sobre una membrana basal y producen glucógeno. El estroma del exocérvix es similar al de endocérvix. Pero el exocérvix no tiene fibras musculares; además, el epitelio exocervical no tiene glándulas. 122 HistologíayCitologíaavanzadaII Con respecto a los aspectos fisiológicos, el endocérvix comunica el endometrio con la vagina y tiene dos funciones principales, una de tipo esfinteriano pues aunque el OCI carece de un esfínter propiamente dicho y sólo posee algunas fibras musculares, exhibe esta propiedad ya que se relaja por la influencia de los estrógenos y se contrae por acción de la progesterona. La otra función es la de actuar como barrera protectora ante las bacterias que provienen de la vagina, acción que desempeña el moco cervical, el cual, a su vez, favorece la penetración de los espermatozoides gracias a su respuesta a los estrógenos. El moco, además, tiene una función de lubricación. En contraste, el exocérvix al parecer solamente tiene una función de protección. De hecho, el exocérvix se extirpa quirúrgicamente y si se conserva el OCI las funciones del útero quedan indemnes. Al considerar los aspectos embriológicos, es preciso señalar que pese a la controversia, en términos generales se acepta que el endocérvix se forma por la fusión de los conductos de Müller que son de origen mesodérmico, mientras que el epitelio del exocérvix es de origen endodérmico, procedente del seno urogenital, que asciende y tapiza la vagina y el hocico de tenca. Con estas consideraciones creemos que es posible individualizar los dos segmentos de cérvix y mucho más luego de analizar la patología y la clínica de una de las entidades más importantes de este órgano como es el cáncer. Nociones anatomopatológicas Por sus condiciones y tipo de tejidos la patología tumoral del endocérvix solo podrá tener neoplasias de tipo adenomatoso o mixto y el exocérvix solamente carcinomas. El adenocarcinoma del endocérvix, debido a su origen en un sitio oculto, tanto a la especuloscopia como a la colposcopia, tiene una evolución tórpida y puede pasar desapercibido; además, tiene una forma de crecimiento endofítica. El adenocarcinoma es menos frecuente que el carcinoma epidermoide, pero en las últimas tres décadas su progreso ha sido notorio, pues mientras que la incidencia era apenas de 5% en la década de 1950-1960, ascendió a 12% en los siguientes diez años y para la década comprendida entre 1970 y 1980 fue de 20% a 25% e incluso de 34% para algunos autores. Por otra parte, el uso de contraceptivos orales por tiempo prolongado (más de 5 años) está considerado como un factor real que favorece la aparición del adenocarcinoma de endocérvix, lo que no se ha podido comprobar con el carcinoma epidermoide, según diversos estudios publicados. Tal aseveración tiene importancia epidemiológica, aunque los nuevos preparados vengan ahora con minidosis. En cuanto a los factores aparentes, hay que considerar, de un lado, las técnicas de la citología, pues después de que Papanicolaou describiera la técnica de la toma en tres sitios, a saber zona de transformación, exocérvix y el fondo de saco vaginal posterior, y a raíz de los análisis estadísticos de los falsos negativos, se fue mejorando el método. Así, Ayre describió una espátula que raspaba mejor el conducto endocervical; sin embargo, ese método no ha mejorado mucho los resultados. También se han descrito técnicas utilizando el hisopo de algodón, pero sólo con el uso de los escobillones se puede obtener material representativo del endocérvix (Cyto-Brush) la finalidad de hacer esta 123 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología modificación se debió a que los diferentes autores se percataron de que el material obtenido por el método Papanicolaou no incluía el endocérvix. Recientemente han ocurrido dos hechos importantes con relación al tema; el primero es el estudio Connecticut6 y el segundo, la promulgación del sistema Bethesda. Mención especial merece el uso de la coloración del azul-alciano en todas las piezas de histerectomías por cáncer y en las biopsias. Según Buckley, quien usó la coloración mencionada en las piezas de patología de histerectomía, con tal colorante se hacen evidentes las células productoras de moco y es preciso hacer una reclasificación de los tumores en 20%-30% cambiando el diagnóstico de carcinoma escamoso por el de adenocarcinoma adenoescamoso. El hecho de que el carcinoma de cérvix se diagnostique en etapas preinvasoras, en los países desarrollados y que el tratamiento oportuno lleve la mortalidad a cero ha hecho que las cifras de adenocarcinoma aparezcan aumentadas en su apreciación general. OMS) Clasificación histológica de los tumores epiteliales del cérvix (Modificación de la 1. Carcinomas de células escamosas Carcinoma de células escamosas microinvasivo. Carcinoma invasivo de células escamosas. Carcinoma verrugoso Carcinoma condilomatoso Carcinoma papilar de células escamosas (Transicional) Carcinoma linfoepiteliomatoso. 2. Adenocarcinomas Adenocarcinoma Tipo endocervical Tipo intestinal Tipo anillo de sello Adenocarcinoma endometrioide Adenocarcinoma endometrioide con metaplasia escamosa Adenocarcinoma de células claras Adenocarcinoma de mínimas desviaciones Adenocarcinoma de mínimas desviaciones Tipo endocervical (adenocarcinoma maligno) Tipo endometrioide Adenocarcinoma seroso Carcinoma mesonéfrico Adenocarcinoma villo-glandular bien diferenciado 124 HistologíayCitologíaavanzadaII 3. Otros tumores epiteliales Carcinoma adenoescamoso Carcinoma de células cristalinas Carcinoma mucoepidermoide Carcinoma adenoide quístico Carcinoma adenoide basal Tumor carcinoide Carcinoma de células pequeñas Carcinoma indiferenciado. Diagnóstico El curetaje del endocérvix tiene una sensibilidad de 64% (falsos negativos 36%) y por eso es preferible la técnica de la conización, ya sea con el método tradicional o con el aparato de radio cirugía. La clasificación por etapas es la misma utilizada para el carcinoma epidermoide con las correcciones señalas anteriormente. Se han hecho intentos para evaluar por medios citológicos e histológicos la diversidad de cambios celulares de la mucosa glandular (es decir NIC I II y III), pero no hay unanimidad en su identificación e importancia. CarcinomaEndometrioide.Ovario. ►Ref.6165b. Macroscópicamente: El útero puede estar abombado y globoso en tumores grandes, aunque en úteros atróficos también pueden encontrarse carcinomas endometriales extensos. La cavidad endometrial por lo común presenta un aspecto mamelonado, irregular, granuloso en relación con el tumor, que puede estar circunscrito a un foco o abarcar toda la cavidad. Rara vez se trata de una lesión poliposa, sésil que protruye en la cavidad. El tejido tumoral generalmente es blanquecino, blando, a veces hemorrágico. Histológicamente: Existe un continuo morfológico entre hiperplasias acentuadamente atípicas y carcinomas bien diferenciados, que pueden ser difíciles de diferenciar. En el carcinoma, en general, existen cribas (brotes epiteliales con varios lúmenes sin estroma entre éstos), acentuada irregularidad de las formaciones glandulares e intensa atipia celular. La invasión del miometrio es signo inequívoco de carcinoma. El 75% de los casos corresponden a carcinomas endometrioides. No es redundante hablar de carcinomas endometrioides del endometrio porque puede haber otros tipos histológicos, paramesonéfricos, de adenocarcinomas primarios del endometrio, como el mucosecretor -más frecuentemente endocervical- o seroso papilar -más frecuentemente ovárico. El adenocarcinoma endometrioide tiene un patrón glandular cribiforme, aunque puede ser papilar. Las formaciones glandulares tumorales generalmente presentan borde 125 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología luminal regular, células cilíndricas de citoplasma denso y estratificación nuclear. En el 25% de los carcinomas endometrioides existen focos de diferenciación escamosa (carcinoma adenoescamoso). En el 25% restante se encuentran otros tipos histológicos: seroso papilar, mucinoso, carcinoma de células claras, carcinoma escamoso puro (raro). El carcinoma del endometrio se disemina como los carcinomas en general: primero, a ganglios linfáticos regionales (pelvianos), después, a más distantes (paraaórticos); localmente se extiende a órganos vecinos, puede haber diseminación transperitoneal, transtubaria y hematógena. Factores pronósticos: Existen dos variables independientes que determinan el pronóstico: 1) Nivel de penetración en el miometrio: si infiltra el 1/3 interno, hay 5% de casos con metástasis ganglionar linfática; si infiltra hasta el 1/3 medio, el porcentaje sube hasta casi el 25%, y si llega al 1/3 externo, las metástasis se encuentran en el 33% de los casos. 2) Grado de diferenciación: para el carcinoma endometrioide y según la extensión de áreas sólidas, se distinguen el grado 1 (menos de 5% de áreas sólidas) con 80% de sobrevida a 5 años, grado 2 (de 5 a 50% de áreas sólidas) con cerca de 75% de sobrevida a 5 años, y grado 3 (más de 50% de áreas sólidas) con 50% de sobrevida a 5 años. A mayor grado, más atipias nucleares. Tipos histológicos agresivos son el carcinoma de células claras y el seroso papilar. 126 HistologíayCitologíaavanzadaII CarcinomaEscamosoInSitudeCérvix.Útero. ►Ref.5079b. Las displasias son alteraciones en la diferenciación celular del epitelio escamoso situado en el exocérvix a nivel de la zona de transformación la profundidad de las glándulas endocervicales. Se clasifica en leve, moderada y severa con base en la intensidad de las modificaciones a la arquitectura general del epitelio y la morfología de los componentes celulares en los diferentes estratos epiteliales, entre los cambios más frecuentes, figuran: 1. Núcleos desproporcionadamente voluminosos e hipercromáticos. 2. Anomalías de la diferenciación celular. 3. Alteraciones en la maduración de los citoplasmas. 4. Queratinización prematura e inversión de la relación núcleo citoplasma. El seguimiento y análisis estadístico de grandes grupos de población ha permitido determinar que las displasias y el cáncer in situ son precursores del cáncer invasor y cuanto más grave sea el grado de la lesión precursora, más corto será el tiempo y mayor la probabilidad de que se desarrolle un carcinoma infiltrante. El adenocarcinoma in situ de cervix uterino es una lesión rara que constituye entre el 9 y el 25 % de los adenocarcinomas cervicales. Los tipos histológicos que se han descrito más habitualmente son el endocervical, intestinal y endometrioide, sin embargo esporádicamente se ha comunicado algún caso de adenoescamoso y de células claras. Aproximadamente 2/3 de los adenocarcinomas in situ tienen asociado una neoplasia intraepitelial escamosa, que en ocasiones se detecta antes que el adenocarcinoma en las tomas citológica. La hiperplasia microglandular cervical es una lesión benigna pseudotumoral que se ha asociado clínicamente a la toma de anticonceptivos orales y a terapias hormonales sustitutivas, microscópicamente puede plantear problemas de diagnostico diferencial con lesiones glandulares tumorales, pudiendo incluso encontrarse asociadas a adenocarcinomas endocervicales. El carcinoma cervical por su extensión se clasifica en cáncer "in situ" cuando aún no ha rebasado la membrana basal epitelial, por lo que al igual que las displasias no presenta signos clínicos. Su diagnostico se realiza por colpocitología corroborándose con colposcopía y biopsia dirigida. Es carcinoma invasor del cuello uterino cuando rebasa la membrana basal e invade el estroma, macroscópicamente presenta tres cuadros: Exofítico o fungiforme, infiltrativo y ulcerado. Siendo el primero la variante más común. Histológicamente el 90% son de tipo epidermoide, siendo bien diferenciado o G1. Producen queratohialina, perlas corneas y células con aspecto de estrato espinoso. Por el tipo celular pueden ser de células grandes con o sin producción de queratina y de células pequeñas. Y sus grados histológicos se clasifican de acuerdo a la 127 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología diferenciación de sus células. En su preparación histológica se observan las siguientes características microscópicas: 1. Células neoplásicas que ocupan el espesor del epitelio. 2. La membrana basal del epitelio no presenta invasión. 3. Células neoplásicas con discariosis, hipercromasia, atigramiento de la cromatina, pérdida de desmosomas y escasa queratinización. 4. Mitosis atípicas. CistoadenocarcinomaSeroso.Ovario. ►Ref.5137b. Son quísticos y se revisten por un epitelio que se asemeja a un epititelio seudoestratificado, son uniloculares (una sola cavidad), de pared fina conteniendo un líquido acuoso (agua de roca), y con proyecciones papilares. Son bilaterales en un 10 %. Son benignos por lo que no tienen ni necrosis ni hemorragias. Son mas frecuentes entre los 45-50 años. Son de origen celómico al igual que los quistes de inclusión celómica. Los tumores de este grupo también se denominan tumores epiteliales comunes. Son los más frecuentes, constituyen 2/3 de los tumores ováricos en general y 90% de los malignos. Los benignos ocurren principalmente en la 3a y 4a décadas; los malignos, entre los 40 y 60 años de edad. Tumores serosos: Pueden ser benignos, de bajo grado histológico de malignidad o malignos. Benignos: Constituyen el 20% de los tumores benignos del ovario y en el 10% de los casos son bilaterales. Se presentan como una formación quística, un cistoadenoma, frecuentemente unilocular. Pueden alcanzar gran tamaño, más de 20 cm de diámetro, y tener múltiples cavidades a modo de compartimientos: cistoadenoma multilocular (los de gran tamaño rara vez son uniloculares). Las formaciones quísticas serosas benignas de más de 1 cm hoy se consideran cistoadenomas serosos. La cavidad contiene líquido incoloro transparente (seroso). Frecuentemente la superficie interna tiene papilas (cistoadenoma seroso papilar), generalmente éstas son escasas y se ven como pequeñas proyecciones granulares. La superficie interna está revestida de células neoplásticas epiteliales cilíndricas, algunas ciliadas similares a las del epitelio tubario (epitelio seroso) y son normotípicas. Malignos: Corresponden al carcinoma (adenocarcinoma) seroso, papilar, a veces quístico (cistoadenocarcinoma). Es el tumor maligno más frecuente del ovario, representa el 40% de los tumores epiteliales. En el 50% de los casos es bilateral. Estos tumores dan metástasis. Macroscópicamente es frecuente encontrar proyecciones papilares numerosas e irregulares hacia la cavidad, pero estos tumores pueden ser parcial o totalmente sólidos y tener focos necróticos y hemorrágicos y elementos neoplásticos en la superficie externa. 128 HistologíayCitologíaavanzadaII Histológicamente se encuentra invasión del estroma ovárico por brotes epiteliales, que se reconocen por la irregularidad en la interfase epitelio-estroma. El estroma muestra reacción inflamatoria, aspecto mixoideo y a veces focos de luteinización. Las papilas están revestidas por epitelio seroso atípico, frecuentemente con calcificaciones con estratificación concéntrica (cuerpos de psammoma). El grado de diferenciación histológica se define por criterios referentes a la arquitectura tumoral: en el grado 1, las papilas están bien constituidas, con ejes conjuntivos generalmente no ramificados; en el grado 2, en partes no hay patrón papilar, existen zonas densas de papilas adosadas entre sí, muy ramificadas e irregulares; el grado 3 es predominantemente sólido. Tumores limítrofes: Los cistoadenocarcinomas serosos y mucinosos de bajo grado de malignidad tienen un epitelio tumoral con heterotipias, pero no muestran signos de invasión del estroma. Las atipias se caracterizan por: estratificación nuclear en el epitelio, pequeños apilamientos de núcleos que se proyectan hacia el lumen, pleomorfismo nuclear y mitosis. Sin embargo, algunos de estos tumores pueden tener focos de invasión y dar metástasis. Estos criterios están mejor definidos en los tumores serosos, aunque también se ha descrito esta variedad en otros tumores epiteliales del ovario. CistoadenocarcinomaMucinoso.Ovario. ►Ref.7235b. Tumores mucinosos: El producto de secreción de estos tumores originalmente se denominó pseudomucina y por eso se hablaba de tumores pseudomucinosos. A pesar de que existen diferencias histoquímicas con la mucina típica, hoy se considera a este producto como una variedad de mucina y al igual que ésta ese producto está compuesto de proteínas y mucopolisacáridos (glicosaminoglicanos). Corresponden al carcinoma (cistoadenocarcinoma) mucinoso, que constituye 5-10% de los tumores malignos del ovario. En el 25% de los casos son bilaterales. Generalmente son quísticos, pueden tener papilas o ser sólidos. Muestran invasión del estroma ovárico por estructuras glanduliformes neoplásticas y dan metástasis. El grado de diferenciación se define tanto por criterios referentes a la arquitectura tumoral (grado de regularidad de las formaciones glanduliformes) como al grado de atipía celular. En el grado 3 el tumor es predominantemente sólido, con escasas zonas que permitan reconocer diferenciación glandular y secreción. CistoadenomaMucinoso.Ovario. ►Ref.5362b. El producto de secreción de estos tumores originalmente se denominó pseudomucina y por eso se hablaba de tumores pseudomucinosos. A pesar de que existen diferencias histoquímicas con la mucina típica, hoy se considera a este producto como una variedad de mucina y al igual que ésta ese producto está compuesto de proteínas y mucopolisacáridos (glicosaminoglicanos). 129 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Benignos: Representan el 20% de los tumores benignos del ovario y en el 5% de los casos son bilaterales. Se presentan como una formación quística unilocular o multilocular. Los de gran tamaño (se ha descrito de hasta 40 Kg) generalmente son multiloculares. Contienen material mucinoso. La superficie interna por lo común no tiene papilas y es lisa y brillante. La superficie interna está revestida de células neoplásticas epiteliales cilíndricas, normotípicas, mucoides, similares a las del endocérvix. Frecuentemente hay mezcla con otros tumores epiteliales müllerianos, por ejemplo, tumor de Brenner. Malignos: Corresponden al carcinoma (cisto - adenocarcinoma) mucinoso, que constituye 510% de los tumores malignos del ovario. En el 25% de los casos son bilaterales. Generalmente son quísticos, pueden tener papilas o ser sólidos. Muestran invasión del estroma ovárico por estructuras glanduliformes neoplásticas y dan metástasis. El grado de diferenciación se define tanto por criterios referentes a la arquitectura tumoral (grado de regularidad de las formaciones glanduliformes) como al grado de atipía celular. En el grado 3 el tumor es predominantemente sólido, con escasas zonas que permitan reconocer diferenciación glandular y secreción. Tumores Ováricos Primarios Derivados del Epitelio Superficial: a) Serosos. Benignos: Cistoadenoma S. Malignos: (Cistoadeno) carcinoma. b) Mucinosos. Benignos: Cistoadenoma M. Malignos: (Cistoadeno) carcinoma. c) Endometrioides Benignos: Excepcional. Malignos: Carcinoma endometrioide. d) De células claras Benignos: Raro. Malignos: Carcinoma de células claras. e) Epitelio de transición Benignos: Tumor de Brenner. Malignos: Raro. f) T. Epiteliales Müllerianos mixtos . Benignos: Raro. Malignos: C.mucinoso endometrioide de Cel. Claras. Mixtos (componentes no epitelial homólogo o heterólogo, y epitelial). 130 HistologíayCitologíaavanzadaII g) Otros tumores müllerianos Malignos: Sarcoma de tipo estroma endometrial (de bajo grado). Sarcoma de alto grado. Son de origen celómico al igual que los quistes de inclusión celómica. Los tumores de este grupo también se denominan tumores epiteliales comunes. Son los más frecuentes, constituyen 2/3 de los tumores ováricos en general y 90% de los malignos. Los benignos ocurren principalmente en la 3a y 4a décadas; los malignos, entre los 40 y 60 años de edad. Tumores mucinosos: El producto de secreción de estos tumores originalmente se denominó pseudomucina y por eso se hablaba de tumores pseudomucinosos. A pesar de que existen diferencias histoquímicas con la mucina típica, hoy se considera a este producto como una variedad de mucina y al igual que ésta ese producto está compuesto de proteínas y mucopolisacáridos (glicosaminoglicanos). CistoadenomaSeroso.Ovario. ►Ref.5366b. Tumores serosos: Pueden ser benignos, de bajo grado histológico de malignidad o malignos. Benignos: Constituyen el 20% de los tumores benignos del ovario y en el 10% de los casos son bilaterales. Se presentan como una formación quística, un cistoadenoma, frecuentemente unilocular. Pueden alcanzar gran tamaño, más de 20 cm de diámetro, y tener múltiples cavidades a modo de compartimientos: cistoadenoma multilocular (los de gran tamaño rara vez son uniloculares). Las formaciones quísticas serosas benignas de más de 1 cm hoy se consideran cistoadenomas serosos. La cavidad contiene líquido incoloro transparente (seroso). Frecuentemente la superficie interna tiene papilas (cistoadenoma seroso papilar), generalmente éstas son escasas y se ven como pequeñas proyecciones granulares. La superficie interna está revestida de células neoplásticas epiteliales cilíndricas, algunas ciliadas similares a las del epitelio tubario (epitelio seroso) y son normotípicas. Malignos: Corresponden al carcinoma (adenocarcinoma) seroso, papilar, a veces quístico (cistoadenocarcinoma). Es el tumor maligno más frecuente del ovario, representa el 40% de los tumores epiteliales. En el 50% de los casos es bilateral. Estos tumores dan metástasis. Macroscópicamente es frecuente encontrar proyecciones papilares numerosas e irregulares hacia la cavidad, pero estos tumores pueden ser parcial o totalmente sólidos y tener focos necróticos y hemorrágicos y elementos neoplásticos en la superficie externa. Histológicamente se encuentra invasión del estroma ovárico por brotes epiteliales, que se reconocen por la irregularidad en la interfase epitelio-estroma. El estroma muestra reacción inflamatoria, aspecto mixoideo y a veces focos de luteinización. Las papilas están revestidas por epitelio seroso atípico, frecuentemente con calcificaciones con estratificación concéntrica (cuerpos de psammoma). El grado de diferenciación histológica se define por criterios referentes a la arquitectura tumoral: en el grado 1, las papilas están 131 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología bien constituidas, con ejes conjuntivos generalmente no ramificados; en el grado 2, en partes no hay patrón papilar, existen zonas densas de papilas adosadas entre sí, muy ramificadas e irregulares; el grado 3 es predominantemente sólido. Tumores Serosos 1. Benignos: a) Cistoadenoma Seroso. b) Adenofibroma y Cistoadenofibroma. c) Adenofibroma y Cistoadenofibroma Seroso Proliferante. 2. Malignos: a) Carcinoma Seroso de Bajo Potencial de Malignidad (de malignidad “bordeline”). b) Carcinoma Seroso. c) Adenofibroma y Cistoadenofibroma Seroso Maligno. Disgerminoma.Ovario. ►Ref.5359b. También llamado seminoma ovárico. Constituye el 3 a 5% de los tumores malignos del ovario. Ocurre en pacientes adultas jóvenes. En el 85% de los casos es unilateral. Es un tumor sólido, de contornos lobulados, blanquecino amarillento y blando. Histológicamente es similar al seminoma del testículo. Células gigantes del tipo sinciciotrofoblasto se encuentran en 6 a 8% de los casos (producen gonadotrofina coriónica, que puede usarse como marcador serológico en el seguimiento de las pacientes). Es un tumor que se origina en el propio tejido del ovario, (no en su tejido de revestimiento), uni o bilaterales, blandos de superficie lisa Los tumores de células germinales del ovario son neoplasias poco frecuentes y agresivas, constituyen del 5% al 10% de los tumores malignos del ovario. Se observan habitualmente en pacientes jóvenes. Generalmente son unilaterales y curables si se detectan en estadíos tempranos. El disgerminoma es el más frecuente (30-50%) y es el más comúnmente hallado en el embarazo. Tiene predilección por la diseminación linfática y es sensible a la radioterapia y quimioterapia, siendo el esquema de primera línea BEP (bleomicina, etopósido, platino) en aquellas pacientes jóvenes con deseos de preservar la fertilidad. 132 - Tumores derivados de las células germinales: - Teratoma inmaduro. - Disgerminoma. - Carcinoma embrionario. - Tumor del seno endodérmico. - Coriocarcinoma. - Gonadoblastoma. - Tumor mixto de células germinales. - Poliembrioma. HistologíayCitologíaavanzadaII Después de que se ha diagnosticado el tumor de células germinales de los ovarios, se realizan pruebas para determinar si las células cancerosas se han diseminado dentro de los ovarios o a otras partes del cuerpo. El proceso utilizado para determinar si el cáncer se ha diseminado dentro del ovario o a otras partes del cuerpo se denomina clasificación en etapas. La etapa de la enfermedad se determina mediante la información que se reúne del proceso de estadiage. Es importante conocer la etapa de la enfermedad a fin de planear el mejor tratamiento. Se utilizan pruebas determinadas a fin de determinar la etapa. Se utilizan las siguientes etapas para el tumor de células germinales de los ovarios: Etapa I Etapa IA: El cáncer se limita a un solo ovario. Etapa IB: El cáncer se encuentra en ambos ovarios. Etapa IC: El cáncer se encuentra en uno o ambos ovarios y se presenta una de las siguientes situaciones: 1. El cáncer se ha diseminado a una o ambas superficies externas de los ovarios o la cobertura externa del tumor se ha desgarrado 2. Se encuentran células cancerosas en líquido de la cavidad del peritoneo 3. En los fluidos que se recobran de un lavado del peritoneo (tejido que recubre las paredes abdominales y que cubre la mayoría de los órganos en el abdomen). Etapa II Etapa IIA: El cáncer se encuentra en uno o ambos ovarios y se ha diseminado a la pelvis, útero o las trompas de Falopio. Etapa IIB: El cáncer se encuentra en uno o ambos ovarios y se ha diseminado a otros tejidos dentro de la pelvis. Etapa IIC: El cáncer se encuentra en uno o ambos ovarios, se ha diseminado a la pelvis, útero o las trompas de Falopio u otros tejidos dentro de la pelvis y puede presentarse una de las siguientes situaciones: 1. El cáncer se ha diseminado a una o ambas superficies externas de los ovarios 2. La cobertura externa del tumor se ha desgarrado o 3. Se encuentran células cancerosas en líquido de la cavidad del peritoneo o en los fluidos que se recobran de un lavado del peritoneo. Etapa III Etapa IIIA: El cáncer se encuentra en uno o ambos ovarios y en la pelvis, también se encuentran células cancerosas microscópicas en el peritoneo. 133 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Etapa IIIB: El cáncer se encuentra en uno o ambos ovarios y se ha diseminado al peritoneo. Pero los tumores no miden más de 2 centímetros (aproximadamente 3/4 pulgada). Etapa IIIC: El cáncer se encuentra en uno o ambos ovarios y se ha diseminado más allá de la pelvis al peritoneo. Los tumores miden más de 2 centímetros o se encuentra cáncer en los ganglios linfáticos en la pelvis. Cuando el cáncer se ha diseminado a la superficie del hígado o se ha diseminado al intestino delgado o el epiplón (parte del peritoneo que encierra los intestinos) también se considera enfermedad en etapa III. Etapa IV En la etapa IV, el cáncer se encuentra en uno o en ambos ovarios y ha metastizado (diseminado) no solo a la pelvis y el abdomen sino también a otras partes del cuerpo. Se encuentra cáncer en los tejidos del hígado. El Disgerminoma es un tumor generalmente grande, aunque pueden verse algunos de pocos centímetros. Son unilaterales en el 90% de los casos y se presentan con mayor frecuencia en el ovario derecho. Se ha reportado mayor porcentaje de bilateralidad cuando están asociados con Gonadoblastomas. Digerminomas puros son masas nodulares, sólidas y firmes cuando el tamaño es pequeño, y blandos en los de gran tamaño; la superficie es lisa, blanca o blanca grisácea y pueden verse focos de necrosis o hemorragia. Es un tumor encapsulado sólido, aunque raras veces pueden verse pequeñas áreas quísticas. La presencia de estos quistes debe llamar la atención en cuanto a la posibilidad de que existan otros elementos neoplásicos de células germinales asociados al Disgerminoma. Esto es muy importante determinar dadas las implicaciones pronósticas que derivan de estas asociaciones como ser: Teratoma, Tumor del Seno Endodermico, Carcinoma Embrionario y Coriocarcinoma. La asociación con Gonadoblastoma es frecuente. En la gran mayoría de los casos, este tumor no está asociado con manifestaciones endocrinas, pero se han descrito casos ocasionales en que se encontró Gonadotrofina Coriónica Urinaria elevada, test positivo de gestación o signos de pubertad precoz. Es un tumor maligno que puede dar metástasis por vía linfática o diseminarse localmente. Es de crecimiento rápido. Cuando se rompe la cápsula en forma espontánea o durante la cirugía, se presentan implantes tumorales al peritoneo con serias consecuencias pronósticas. Se puede presentar extensión directa del tumor a las estructuras vecinas cuando hay infiltración de la cápsula. Comparando con otros tumores malignos, el Disgerminoma es de comportamiento menos agresivo, además es altamente radiosensible. 134 HistologíayCitologíaavanzadaII Endometriosis. ►Ref.5388b. El nombre viene de la palabra "endometrio", el cual es el tejido que reviste el útero. Es la presencia de tejido endometrial fuera de la cavidad uterina o fuera del endometrio. Sus sinónimos: adenomioma, adenomiosis, endometrioma. Durante el ciclo menstrual regular de una mujer, este tejido se acumula y, es derramado si ella no queda embarazada. Las mujeres con endometriosis desarrollan un tejido afuera del útero que se parece al y actúa como el tejido endometrial, usualmente en otros órganos reproductivos dentro de la pelvis o en la cavidad abdominal. Cada mes, este tejido que está fuera de su lugar, responde a los cambios hormonales del ciclo menstrual acumulándose y desintegrándose justo como lo hace el endometrio, dando como resultado el sangrado interno. A diferencia del fluido menstrual del útero el cual es derramado por el cuerpo, la sangre del tejido que está fuera de su lugar no tiene a donde irse, dando como resultado la inflamación o la hinchazón de los tejidos que rodean la endometriosis. Este proceso puede producir tejido cicatrizante alrededor del área, lo cual puede desarrollarse en lesiones o crecimientos. En algunos casos, particularmente cuando un ovario está envuelto, la sangre puede incrustarse en el tejido donde está localizado, formando ampollas de sangre que pueden rodearse por un quiste fibroso. La etapa de la endometriosis está basada en la localización, cantidad, profundidad y el tamaño de los implantes endometriales. Los criterios específicos incluyen los siguientes: - Avance de la propagación de los implantes. - Estructuras pélvicas involucradas en la enfermedad. - Avance de las adhesiones pélvicas. - El bloqueo de las trompas de Falopio. La endometriosis no es lo mismo que endometritis. La endometriosis es un cuadro totalmente pleomórfico, de acuerdo a la situación o a la extensión que tenga el cuadro. La lesión se caracteriza por tener dos tipos de componentes: 1. Componente glandular. 2. Componente estromal. Estas son características microscópicas de la endometriosis. La otra característica importante, es que biológicamente reaccionan muy bien ante la presencia de hormonas, especialmente frente al estrógeno. Si hablamos de reacción hormonal, decimos que mientras más estrógenos hay, se presentará una mayor reacción endometriósica. La edad media para la presencia de ésta patología, está alrededor de los 37 años. Si bien se han descrito cuadros en mujeres muy jóvenes que están alrededor de los 12 a 15 años, es una entidad excepcional. En la edad menopáusica, también se describen focos endrometriósicos pelvianos, pero no son de hallazgo frecuente, es más, son los resabios de algún foco endometriósico que tuvo la paciente cuando era más joven. 135 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología No tiene una localización definitiva, puede localizarse en cualquier parte del organismo: - En la pelvis se va a encontrar endometriosis miometrial; en el cuello; en la trompa; en el fondo del saco de Douglas y en los ligamentos de sostén del útero. Los lugares de más frecuencia, son el útero, los ovarios y el fondo del saco de Douglas. - En el abdómen: en peritoneo, en el intestino grueso, en el apéndice, ombligo y en cicatrices producidas por cirugías previas. Focos distantes: en pleura y en pulmón. Raro en la mucosa nasal. Por lo que podemos ver, se puede presentar en cualquier órgano que tenga contacto con sangre o con la circulación linfática, por eso que es tan problemático este cuadro. Se clasifica en dos tipos de endometriosis: 1. Endometriosis interna: es la continuación del endometrio: útero, cuello. 2. Endometriosis externa: es aquella que no está en contacto con el endometrio. La etiología es desconocida. Podemos decir que una de las teorías indica que es la presencia de tejido endometrial por fuera de la cavidad uterina a expensa de los conductos de Müller.Otra teoría dice que es la proliferación endofítica del endometrio ortotópico (normal). Otra teoría es la presencia de focos endometriósicos distantes, provenientes de menstruaciones retrógradas, un poco sale por el cuello, el otro poco se introduce a la trompa y ahí se disemina en pelvis. Otra teoría habla de metaplasias celómicas (teoría de Meyer) Finalmente, lo que está confirmado, es que la diseminación y no el origen, ocurre por: - continuidad, - vía hemática, - vía linfática. Habitualmente, la endometriosis es nada más que el encuentro casual de estos focos, ya sea en un acto quirúrgico a cielo abierto o producto de un exámen por laparoscopía, esto cuando la endometriosis no es extensa y tiene focos marcados o porque la mujer está directamente en etapa menopáusica y estos focos endometriósicos no tienen estimulación hormonal, entonces no da sintomatología. Existen algunos endometriosis: síntomas que nos pueden orientar a determinar una 1. Dolor menstrual, el cual se va a ir intensificando con el paso de la regla, y muchas veces este dolor a veces empieza dos y hasta cuatro días antes del inicio de la menstruación, esto es en una endometriosis primaria. Si es secundaria, se va a acompañar de los síntomas que va a producir de acuerdo al órgano donde se encuentre sembrado el foco endometrial. Hay dolor porque produce edema de la zona. Y segundo, porque como 136 HistologíayCitologíaavanzadaII es un tejido endometrial, tiene que tener un sangrado cíclico; entonces pequeños focos dan pequeños sangrados peritoneales, lo que produce irritación peritonial y dolor. 2. La evolución puede ser progresiva, íntegramente dependiente del influjo hormonal, especialmente de estrógenos. La evolución también puede ser nefasta para el paciente, porque si bien el 95% de la patología es un proceso benigno, el porcentaje restante se va a convertir en un carcinoma, especialmente carcinoma de útero. Como la base de toda patología el diagnóstico principal y certero tiene que ser la anamnesis, que va a orientar a pedir algo en especial para que podamos hacer un diagnóstico de endometriosis. El exámen genital es necesario, por tacto vaginal. Se recomienda que el tacto vaginal sea repetido en un solo ciclo. Se debe hacer un exámen pre-menstrual, inter-menstrual y post-menstual. En el tacto se encuentra el foco endometriósico, en especial en personas delgadas, porque la endometriosis no da grandes tumoraciones para que en la palpación podamos encontrar los objetivos. Lo que se encuentra son trompas llenas de nodulaciones o un tumor anexial de mas o menos 6 cm. que corresponde a una endometriosis ovárica. Probablemente si se hace una especuloscopía, vamos a encontrar focos endometriósicos en el cuello. Cuando se está bajo el flujo estrogénico, todos estos nódulos crecen y se hacen más evidentes a la palpación, pasa la menstruación y no vamos a notar absolutamente nada, es por eso que recomiendan hacer varios exámenes ginecológicos, pero generalmente no pueden encontrar nada, es un hallazgo muy casual. Si se sospecha de una paciente con endometriosis, el exámen de elección es la laparoscopía, porque es un exámen fácil de hacer, nos permite visualizar con claridad los focos endometriósicos y por último nos permite obtener una biopsia. El Tratamiento es por cauterización de los focos endometriales que se pueden ver en la extensión de la superficie del cuello. - Retrocervical: Es una zona muy amplia, Se encuentran en el fondo de saco de Douglas, ligamentos uterosacros y en el tabique recto vaginal. La única sintomatología que da es la dismenorrea, no existiendo otra clínica presente. Se la diagnostica mediante el tacto vaginal, donde se encuentra formaciones nodulosas que puede despertar dolor al exámen, se las describe como formas de perdigones diseminadas en toda la región. - Recto: La única modificación que produce es el pujo y tenesmo, como si se tratase de una infección intestinal. El Dx se lo hace por rectosigmoidoscopía, tacto rectal, donde si se trata de una endometriosis externa se puede encontrar el guante manchado de sangre y la palpación de los nódulos, pero si se trata de una endometriosis interna, el único elemento Diagnóstico es la laparoscopía. - Periné: En esta se incluye la endometriosis de la vagina, es nada más el producto de la siembra de ciclos menstruales que arrastran células endometriósicas y se siembran en esta zona. El Diagnóstico es sencillo mediante la inspección de las vesículas de contenido achocolatado. La sintomatología es la dispareunia, sangrado especialmente en las relaciones sexuales. - Vesical: Es una de las más raras de las endometriosis externas y es consecuente con una endometriosis cervical interna. El lugar de predilección para su asentamiento es 137 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología en la cara posteroinferior de la vejiga. La sintomatología es dolor epigástrico, polaquiuria (Síntoma que es fundamental). Diagnóstico mediante la cistoscopía. - Intestinal: El lugar de predilección es el íleon, luego las asas intestinales, y el IG (ciego y recto sigmoide). La endometriosis en el intestino se debe a la diseminación hematógena y linfática. Otra forma de diseminación podría ser la continuidad y por menstruaciones retrógradas. La endometriosis ubicada en el apéndice, es la más problemática, porque la Sintomatología puede ser como la de una apendicitis y no de una endometriosis, entonces el encuentro es casual y solamente en el acto quirúrgico, siendo así un Dx diferencial. Dentro de la endometriosis intestinal, hay un 42 % que se asienta en el recto sigmoide. El Diagnóstico por rectosigmoidoscopía o un tránsito intestinal con contraste, donde se encuentra lo mismo que el signo de Dionici en útero la presencia de divertículos. Endometrosis Exopelvianas: Son las endometriosis que se encuentran más allá de la pelvis como: pleura, pulmón, tejido muscular, hueso, cicatrices de cirugías previas. La sintomatología si se encuentra en pleura y/o pulmón es la hemoptisis, que coincide casi con exactitud con el sangrado menstrual. EstrumaOvárico.Ovario. ►Ref.5369b. El tejido tiroideo que define al estruma, generalmente se encuentra formando parte de un teratoma más complejo. Sólo el 1% de los teratomas presentan un componente teratomatoso de tejido tiroideo; este es similar al tiroides normal. Aunque no es frecuente, se han descrito en los estrumas toda la patología tiroidea, incluyendo carcinomas, linfomas, tiroiditis etc... Un hecho diferencial entre el estruma ovárico y el tiroides es la ausencia de células parafoliculares. Se suelen observar múltiples formaciones foliculares de pequeño tamaño, dispuestas en un estroma laxo. Un ejemplo de teratoma monodermal lo constituye el estruma ovárico, formado por tejido tiroideo. Son tumoraciones unilaterales, con un aspecto macroscópico que plantea diagnóstico diferencial con los tumores quísticos ováricos, fundamentalmente tumores mucinosos. Alcanzan gran tamaño. Su superficie de corte es multiloculada, con material de apariencia mucoide o gelatinosa. Los tabiques son finos, sin crecimientos excrecentes. Los cambios degenerativos, con zonas de necrosis y hemorragia, son frecuentes. La edad media de presentación de estos tumores está entorno a la perimenopausia. Se llama así a un teratoma en el que domina el crecimiento de tejido tiroideo; puede presentarse incluso en ausencia de todos los otros componentes de un Teratoma; representa un Teratoma Monodérmico. Es capaz de ser funcionante y dar origen a un hipertiroidismo; puede también presentar otras alteraciones patológicas de una glándula tiroides como la hiperplasia nodular o difusa, inflamación o tumores malignos. Se presenta entre el 1 al 3% de los teratomas benignos del ovario. Tumores de Céluas Germinales: A. Disgerminoma. B. Tumor del Seno Endodérmico. 138 HistologíayCitologíaavanzadaII C. Carcinoma Embrionario. D. Poliembrioma. E. Coriocarcinoma. F. Teratomas. 1. Inmaduro (sólido, quístico o ambos). 2. Maduro. a. Sólido. b. Quístico. - Teratoma quístico maduro (quiste dermoide). - Teratoma quístico maduro con transformación maligna. 3. Monodérmico o altamente especializado. a. Estruma ovarii b. Carcinoide. c. Carcinoide estrumal. d. Otros. G. Formas Mixtas (de A a F en cualquier combinación). Funisitis.Placenta. ►Ref.5275b. La infección intrauterina se define como la invasión microbiana de la cavidad uterina. Las infecciones intrauterinas pueden subdividirse a su vez en intra o extra amnióticas, según si existe o no invasión del líquido amniótico. En la práctica, usamos el término infección intra-amniótica o invasión microbiana del líquido amniótico para referirnos a la presencia de un cultivo positivo en líquido amniótico (normalmente estéril). La corioamnionitis clínica o infección ovular clínica se refiere a la presencia de un cuadro febril característico de origen uteroplacentario (fiebre asociada a sensibilidad uterina, taquicardia materna y fetal, flujo uterino turbio, elevación del recuento de blancos en sangre materna). En presencia de una infección intrauterina, este cuadro clínico se encuentra presente en alrededor del 15% y 30% de las pacientes con síntomas de parto prematuro y RPM de pretérmino respectivamente, por lo que es un marcador poco sensible del compromiso infeccioso intrauterino. La corioamnionitis histológica se define como la infiltración de las membranas por polimorfonucleares, con distintos grados de exudado subcoriónico y coriónico. El último anexo ovular en comprometerse es el cordón umbilical (funisitis u onfalitis). Etiopatogenia. La ruta de acceso más frecuente para los gérmenes que invaden el líquido amniótico es la vía transcervical. Sin embargo, la diseminación hematógena (típicamente 139 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología producida por Listeria monocytogenes), el acceso por vía canalicular retrógrada (tubaria) y la introducción accidental durante procedimientos invasivos (instalación de catéteres vesico-amnióticos) también pueden causar colonización de la cavidad uterina. El modelo de infección ascendente considera que la invasión microbiana de la cavidad uterina ocurre en cuatro fases: I. Alteración de la microbiología vaginal (por ejemplo, vaginosis bacteriana). II. Extensión al tejido coriodecidual, donde la infección puede producir deciduitis y coriovasculitis (en los vasos fetales coriónicos) o atravesar las membranas (con o sin rotura) hacia la cavidad amniótica. III. Invasión microbiana de la cavidad amniótica, donde los gérmenes pueden provocar daño inflamatorio en otras regiones de los anexos ovulares (membranas, plato corial, cordón umbilical) o extenderse hacia el feto por variadas puertas de entrada. IV. Infección fetal por aspiración y deglución de microorganismos, con desarrollo subsecuente de bronconeumonia congénita, bacteremia, sepsis y daño tisular (por ejemplo, leucomalacia periventricular). Otras manifestaciones de infección fetal directa son otitis, conjuntivitis y onfalitis. Frecuencia. Un 10 a 15% de las pacientes con trabajo de parto prematuro tienen un cultivo positivo en líquido amniótico, pero esta proporción se eleva a un 20-25% en aquellas que efectivamente dan a luz un recién nacido prematuro. La infección intra-amniótica ocurre entre el 30 y 50% de las pacientes con RPM de pretérmino, siendo más frecuente en aquellas que han iniciado trabajo de parto y en pacientes con oligoamnios. Un tercio de las pacientes con infección intra-amniótica tienen bacteremia fetal, mientras que una proporción aún mayor de fetos presenta una respuesta inflamatoria sistémica, caracterizada por dramáticos cambios hematológicos junto con una elevación de las concentraciones de citokinas, factores de crecimiento y metaloproteinasas en plasma fetal. Esta condición fisiopatológica se denomina síndrome de respuesta inflamatoria fetal (ver más adelante). La infección intra-amniótica también ocurre en alrededor de un 30% de las pacientes con RPM de término, pero tanto la respuesta inflamatoria evocada como su asociación con morbilidad infecciosa materna y neonatal son significativamente menos importantes que en embarazos de pretérmino. Microbiología. Los gérmenes más frecuentemente aislados desde el líquido amniótico son colonizadores frecuentes de la vagina. Los micoplasmas (Ureaplasma urealyticum y Mycoplasma hominis) se encuentran presentes en más del 50% de las infecciones intrauterinas, seguido de varias especies de estreptococos aeróbicos y anaeróbicos. Las bacterias gramnegativas y hongos son poco frecuentes. En casi la mitad de los casos, se aísla más de un germen desde la amniótica, hecho que tiene claras implicaciones terapéuticas. Es posible definiciones microbiológicas cualitativas y cuantitativas de las infecciones cambien en un futuro cercano como consecuencia de la introducción de 140 cavidad que las uterinas técnicas HistologíayCitologíaavanzadaII moleculares más sensibles y rápidas como la reacción en cadena de la polimerasa. Ello permitirá, entre otras ventajas, explorar el rol de los virus en pacientes con diversas complicaciones del embarazo. Mecanismo etiopatogénico. La fase I o cervicovaginal de las infecciones del tracto genital femenino es el prerrequisito habitual para el desarrollo de infecciones intrauterinas. Sin embargo, es importante destacar que sólo una proporción escasa de pacientes con infecciones cervicovaginales tendrá un parto prematuro asociado a infección intra-amniótica. Esto significa que la transición entre las fases I y II requiere de la existencia de ciertas condiciones (o deficiencias) todavía no bien comprendidas. Entre estas condiciones pueden mencionarse la incompetencia cervical, deficiencias de la inmunidad local (desnutrición), alteraciones funcionales del mucus cervical (expresión variable de antibióticos naturales denominados defensinas), etc. En el pasado se postuló que el coito podía promover el transporte de gérmenes desde la vagina hasta el espacio coriodecidual, pero hoy existe escepticismo sobre su rol patógeno. Una vez que los gérmenes han alcanzado el espacio coriodecidual (fase II) pueden secretar o inducir la formación de un grupo heterogéneo de productos: 1. Fosfolipasa A y C. Producen clivaje y secreción de ácido araquidónico libre desde las membranas celulares. El ácido araquidónico puede entonces incorporarse a cualquiera de sus tres rutas principales de metabolización: a) vía de la ciclooxigenasa, que conduce predominantemente a la síntesis de prostaglandinas, prostaciclina y tromboxanos. b) vía de la lipooxigenasa, que conduce a la síntesis de leucotrienos, ácido hidroxieicosatetranoico y lipoxinas. c) vía de la epoxigenasa, que conduce a la formación de epóxidos. 2. Lipopolisacárido (endotoxina). También pueden estimular la producción de prostaglandinas por células de las membranas ovulares y la decidua. Las concentraciones de endotoxina en el líquido amniótico están elevadas en pacientes con RPM de pretérmino y trabajo de parto. 3. Colagenasas. Las bacterias son fuentes conocidas de proteasas, incluyendo varios tipos de colagenasas, que pueden actuar directamente sobre las membranas ovulares para promover su rotura. Sin embargo, estudios in vivo demuestran que la sola presencia de gérmenes o productos microbianos no siempre se acompañan de contractilidad uterina o rotura de membranas. Para que ello ocurra, casi siempre es necesario que el huésped (madre o feto) haya montado una respuesta inflamatoria intrauterina. A continuación se describen los componentes más importantes de la respuesta inflamatoria del huésped en el contexto de la infección intrauterina: 1. Citokinas. Las citokinas son un grupo heterogéneo de péptidos y proteínas solubles que actúan como reguladores humorales, modulando la actividad e interacción de las células. Se diferencian de las hormonas porque no son necesariamente producidas por células 141 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología agrupadas en glándulas y porque su espectro de acción (ejercido generalmente en forma paracrina o autocrina) incluye un número mayor de células blanco. Aunque inicialmente se consideró que las citokinas eran de origen primariamente leucocitario y que participaban casi exclusivamente durante procesos inflamatorios, hoy se conoce que son secretadas por muchos tipos celulares y que cumplen un rol en condiciones fisiológicas y patológicas. Las citokinas pueden clasificarse en factores de necrosis (ejemplo: factor de necrosis tumoral a), interleukinas (ejemplo: interleukina-6) y factores de crecimiento (ejemplo: factores estimulantes de colonias). Alternativamente, puede denominárseles citokinas pro-inflamatorias (ejemplo: interleukina 1a) o citokinas inhibitorias (ejemplo: interleukina 10). La tabla I muestra las citokinas más frecuentemente estudiadas en la madre, feto y anexos ovulares y su probable rol en el contexto del parto prematuro. Durante el curso de una infección intrauterina, diversas citokinas pro-inflamatorias (característica-mente el factor de necrosis tumoral y las interleukinas 1, 6 y 8) e inhibitorias (receptor antagonista de la interleukina 1, interleukina 10 y el factor de crecimiento TGF-b) son secretadas por la decidua, membranas y tejidos fetales. Las citokinas pro-inflamatorias son capaces de estimular la producción de prostaglandinas en amnios, corion y decidua y de esta forma promover la aparición de contractilidad uterina. La medición de citokinas en diversos compartimentos puede ser utilizada clínicamente (por ejemplo, interleukina-6 en líquido amniótico). 2. Metaloproteinasas de la matriz (MPM). Las MPMs son una familia de enzimas (colagenasas, gelatinasas y estromalisinas) que requieren de metales pesados (zinc) para degradar macromoléculas de la matriz extracelular. Juegan un importante rol en la morfogénesis, ovulación, implantación, menstruación, angiogénesis, cicatrización, invasión tumoral y metástasis. Diversas citokinas y factores de crecimiento pueden regular la expresión de las MPMs y sus inhibidores. El amnios y el corion pueden producir varios tipos de MPMs y ha sido posible demostrar la elevación de algunas de ellas durante el trabajo de parto, rotura de membranas e infección intra-amniótica (especialmente MMP-2 y MMP-9). 3. Factor de activación plaquetario. Este es un autacoide ampliamente distribuido, con numerosas acciones fisiológicas y fisiopatológicas, las que son reguladas por un inhibidor tipo hidrolasa. Puede estimular la producción de prostaglandinas por el amnios e induce contractilidad uterina. Sus concentraciones están elevadas en el líquido amniótico de pacientes con rotura prematura de membranas de pretérmino e infección intrauterina. 4. Lastasa. Otra enzima capaz degradar componentes de la matriz extracelular es la elastasa leucocitaria, una proteasa sérica cuya actividad es regulada por su propio inhibidor. Ambos han sido aislados desde la mucosa cervical y el líquido amniótico, demostrándose que la infección intra-amniótica produce un dramático incremento en las concentraciones de esta proteasa, sin modificar los niveles de su inhibidor. 142 HistologíayCitologíaavanzadaII HerpesUterino. ►Ref.5105b. El herpes genital es ocasionado por dos virus que pertenecen al grupo herpesvirus hominus, conocidos, respectivamente, como herpes simple tipo 1 (HSV-1) y como herpes simple tipo 2 (HSV-2). El HSV-l es responsable, aproximadamente, del 5 al 10% de los herpes genitales. Ambos virus son transmitidos por contacto sexual. Es normal que ocurra un cruce de infecciones de tipo 1 y 2 durante el contacto sexual oral - genital. La infección inicial de herpes oral ocurre normalmente en la niñez y no está clasificada como una enfermedad de transmisión sexual. El 80% de la población adulta es candidata a portar el HSV-1 y puede haberlo adquirido de una forma no sexual. La incidencia total de herpes genital está estimada en 1 de cada 1000 personas. La infección inicial de HSV-1 o HSV-2 está caracterizada por signos y síntomas sistémicos (por todo el cuerpo) así como también por signos y síntomas locales. Entre los síntomas sistémicos están la fiebre, malestar, dolor generalizado (mialgia) y disminución del apetito. Los síntomas localizados se describen más adelante. Cuando el virus es transmitido por las secreciones de la mucosa oral o genital, la lesión inicial se localiza sobre la región sobre la que se produce la transmisión. Los lugares más habituales son: glande y otras partes del pene, y el escroto en hombres; vulva, vagina y cervix, en mujeres. La boca, ano y cara interna de los muslos puede también ser un sitio de infección en ambos sexos. Antes de la aparición de las ampollas, el individuo infectado experimenta un aumento de sensibilidad, quemazón o dolor en la piel, en el lugar en el cual aparecerán éstas. La piel se enrojece y se llena de múltiples vesículas pequeñas, enrojecidas y llenas de un fluido de color claro amarillento. Las ampollas se rompen dejando llagas dolorosas que, eventualmente, forman una costra y sanan en un periodo de 7 a 14 días. El brote puede estar acompañado de malestar y engrosamiento de los nódulos de la zona inguinal. En las mujeres puede aparecer una descarga vaginal y dolor al orinar (disuria). Los hombres pueden tener disuria si la lesión está cerca de la apertura de la uretra (meato). Una vez que una persona se infecta, el virus se establece en el interior de las células nerviosas fuera del alcance de los anticuerpos. El cuerpo intenta combatirlo pero esta lucha no tiene final. El virus puede, de este modo, permanecer latente (periodo de "latencia") durante un tiempo más o menos extenso, pero repentinamente la infección se reactiva y el individuo tiene otro ataque de dolor y ampollas. Los ataques recurrentes pueden ser raros, ocurriendo sólo una vez al año, o tan frecuentes que los síntomas parecen continuos. Estos ataques recurrentes pueden ser precipitados por muchas causas como la irritación mecánica, la menstruación, la fatiga, las quemaduras del sol y otras. Las infecciones recurrentes en hombres son generalmente más leves y de duración más corta que en mujeres. La investigación sugiere que el virus puede transmitirse a la pareja incluso cuando la enfermedad parece clínicamente ausente, de modo que una pareja sexual sin lesiones aparentes puede transmitir la enfermedad. Una diseminación asintomática puede contribuir realmente más a la diseminación del herpes genital que la misma enfermedad activa. 143 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El virus del herpes es de especial importancia en las mujeres por varias razones. Está implicado en el cáncer de cuello uterino, especialmente cuando está presente en combinación con el virus del papiloma humano (HPV), el virus responsable de las verrugas genitales (condiloma). Para las mujeres embarazadas, la presencia de HSV-1, o de HSV-2 sobre los genitales o en el canal de nacimiento, es una amenaza para el bebé. Tipos: Herpes genital primario: Con frecuencia se observa una placa eritematosa al inicio, que es seguida por vesículas agrupadas, las cuales pueden evolucionar a pústulas; éstas se erosionan conforme se descama la epidermis suprayacente. Las erosiones pueden ampliarse a ulceraciones, las cuales pueden ser costrosas o húmedas. Estos defectos epiteliales sanan en 2 a 4 semanas, a menudo con hipopigmentación o hiperpigmentación posinflamatoria, pocas veces con cicatrización. El área afectada puede ser circunferencial alrededor del pene o puede abarcar la vulva completa. Herpes genital recurrente: Lesiones similares a la infección primaria pero a una escala reducida. Con frecuencia una placa eritematosa de 1 a 2 cm con vesículas. Sana en 1 a 2 semanas. Características: Herpetiforme; es decir, vesículas / erosiones agrupadas. Distribución: Hombres: Infección primaria: glande, prepucio, diáfisis, surco; escroto, muslo, nalgas. Recurrencias: Diáfisis peniana. Mujeres: Infección primaria: labios mayores/menores, perineo, parte inerna de los muslos. Recurrencias: labios mayores/menores. Infección anorrectal: Ocurre en hombres homosexuales (con frecuencia HVS-1); caracterizada por tenesmo, dolor anal, proctitis, descarga y ulceraciones hasta de 10 cm en el canal anal. Signos generales: Ganglios linfáticos inguinales/femorales agrandados, firmes, no fluctuantes, sensibles; por lo general es unilateral. Signos de meningitis aséptica: cefalea, fiebre, rigidez de la nuca, pleocitosis en LCR con contenido normal de glucosa y cultivo positivo para HVS en LCR. Diagnóstico y Diagnóstico Diferencial: Diagnóstico: Sospecha clínica confirmada por la prueba de Tzanck (células gigantes multinucleadas con daño citopático). Diagnóstico diferencial: Chancro sifilítico, erupción por fármacos, chancroide, erosión gonocócida, foliculitis, pénfigo, penfigoide. Exámenes Especiales y de Laboratorio: Prueba de Tzanck: De manera óptima, se obtiene fluido de una vesícula intacta y se realiza un frotis en portaobjetos, se seca y se tiñe ya sea con la tinción de Wright o con Gliemsa. Es positivo si se detectan acantocitos gigantes o acantocitos gigantes 144 HistologíayCitologíaavanzadaII multinucleados. Esta prueba es positiva en el 75% de los casos tempranos, ya sean primarios o recurrentes. Dermatopatología: Degeneración epidérmica balonizante y reticular, acantosis y vesículas intraepidérmicas; cuerpos de inclusión intranucleares, acantocitos gigantes multinucleados; vesículas multiloculares. HiperplasiaSimple.Útero. ►Ref.5749b. En un ciclo menstrual promedio de 28 días, encontramos dos fases: durante las dos primeras semanas hay un incremento de hormonas llamadas estrógenos que estimulan el crecimiento y el número de las células endometriales constituyendo la fase proliferativa. Tras producida la ovulación (alrededor del día 14) los estrógenos descienden y la hormona predominante es la progesterona que estimula la maduración de las células, para que en caso de fecundación haya una correcta implantación del embrión (fase secretoria). De no producirse la fecundación, los ovarios cesan la producción de progesterona alrededor de dos semanas después, dando como resultado la contracción de los vasos sanguineos locales, y disminuyendo así el aporte de oxígeno al endometrio que se desintegra en sus capas superficiales y, que mezclado con la sangre, da origen a la menstruación. Sin embargo, si la fase estrogénica no es seguida por la progestacional, las células del endometrio crecen y se multiplican, fenómeno llamado hiperplasia, estadío fundamental que merece nuestra detección y tratamiento ya que puede ser la precursora del cancer endometrial. Procesos que cursan con alto tenor estrogénico sin ser contrarrestados por suficiente progesterona: Irregularidad menstrual crónica, debida a anovulación. Obesidad. Diabetes. Tumores productores de estrógenos. Disfunciones tiroideas. Enfermedades hepáticas. Terapia de reemplazo estrogénica (parches, comprimidos, gel). Ciertas hierbas que contienen ginseng. Aves de corral alimentadas con estrógenos para estimular su crecimiento (pollo, gallina, pavo, etc). Hiperplasia de endometrio. Diferentes tipos. Según lo explicado anteriormente, los estrógenos estimulan el crecimiento y la multiplicación de las células del endometrio, proceso totalmente revertido con la adición de progesterona. En diversas situaciones descriptas previamente, la fase progestacional está ausente, por lo tanto la acción estimuladora y multiplicadora estrogénica, no tiene freno, dando lugar a un fenómeno denominado hiperplasia. 145 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Cuando las células crecen y se multiplican activamente se denomina hiperplasia simple. Si esta situación continúa, se forman nuevas células y nuevas glándulas, proceso llamada hiperplasia compleja. Estas dos entidades tienen células y glándulas normales aumentadas en número y tamaño. Se denomina atipía celular a ciertos cambios en la célula que no son normales, tales como: núcleos grandes de variable tamaño y forma, aumento de la relación núcleocitopasmática, nucleolos prominentes y cromatina agrupada irregularmente. Cuando en las hiperplasias se hallan estos cambios, ya hablamos de hiperplasia simple o compleja atípicas o de hiperplasia atípica, proceso que engloba a las dos anteriores. Según datos estadísticos, cada proceso tiene un porcentaje diferente de progresar a la malignidad: Corresponde a un aumento de volumen del endometrio por aumento tanto del componente glandular como del estroma. Las glándulas son de tipo proliferativo, pero con mayor estratificación nuclear y más mitosis. El endometrio puede ser normal macroscópicamente o estar engrosado y ser irregular. Se presenta generalmente alrededor de la menopausia y se produce por niveles prolongadamente altos de estrógenos con ausencia o disminución de la actividad progestativa. Da origen a metrorragia. Básicamente existen dos formas de hiperplasia del endometrio: la normotípica y la atípica. Hiperplasia normotípica: Puede interpretarse como la respuesta normal del endometrio a la estimulación estrogénica elevada y mantenida. Esta forma puede ser simple o quística, esta última tiene dilataciones glandulares a veces tan acentuadas que dan aspecto de queso suizo. Es frecuente el hallazgo de metaplasia en la hiperplasia del endometrio: escamosa en el 25% de los casos, tubaria en el 100% de los casos; otras son la mucinosa, la de células claras, y la de células eosinófilas. Todas ellas parecen ser secundarias a hiperestimulación estrogénica. HiperplasiaAtípica.Útero. ►Ref.5753b. El epitelio de revestimiento de la mucosa endometrial está constituido por un tejido conjuntivo mesenquimal o estromal, así como glándulas y sistema vascular que tiene la capacidad de sufrir un proceso de hiperplasia, es decir un aumento de volumen a expensa de un crecimiento de nuevas células.Esta hiperplasia endometrial es consecuencia de un estímulo estrogénico continuo sin oposición de la progesterona. Es más común en la adolesencia que en el climaterio, periodos de vida en que los ciclos anovulatorios son frecuentes. En la adolescencia los ciclos anovulatorios se deben a la inmadures del eje hipotálamo-hipofisis ovario y en la pre-menopausia del climaterio los ovarios no responden normalmente a los estímulos gonadotróficos. Hiperplasia atípica: puede interpretarse como una respuesta anormal del endometrio a la estimulación estrogénica elevada y mantenida. Las glándulas son irregulares; el estroma, escaso. La atipia nuclear está dada por núcleos redondeados, grandes, con cromatina clara y nucléolos prominentes, a diferencia del endometrio proliferativo, que tiene núcleos, hipercromáticos, 146 HistologíayCitologíaavanzadaII alargados, en cigarillo. La hiperplasia atípica es una lesión precancerosa. El riesgo de que se desarrolle un carcinoma es mayor en las hiperplasias con atipias nucleares. La Hiperplasia puede ser localizada (o focal) y difusa que ocupa una gran área de superficie endometrial (hiperplasia difusa). La Hiperplasia Atípica: Se presenta con un acentuado aumento del epitelio glandular y estromal, evidenciandose un gran número de células multinucleadas en estos lugares. La ausencia de esta configuración es denominada Hiperplasia Típica. En resumen las Hiperplasias endometriales se dividen: 1. De acuerdo al tipo histológico: Hiperplasia típica Simple. Quística. Hiperplasia Atípica Leve. Moderada. Severa o cáncer in situ. 2. En cuanto a su extensión: Focal Difusa La hiperplasia endometrial es una proliferación anormal de glándulas y estroma de la mucosa endometrial. Las hiperplasias pueden ser simples, con luces dispersas, a veces quísticamente dilatadas, revestidas por epitelio con escasa poliseriación y con baja tasa mitótica; o complejas, con las luces densamente dispuestas y anguladas en un estroma escaso. Tanto las formas simples como las complejas pueden ser o no atípicas, en las que el epitelio presenta disposición irregular, nucléolos marcados y cromatina gruesa. La hiperplasia compleja se continua de forma casi imperceptible con el adenocarcinoma bien diferenciado, caracterizado por la invasión del estroma periglandular (luces estrechamente adosadas, fibrosis del estroma que hay entre las luces, o necrosis entre las luces). En las hiperplasias, la citología muestra frotis más celulares, con cierta tridimensionalidad, anisocucleosis y nucléolos, en las formas simples. La atipia citológica franca en placas aún cohesivas es indicativa de las formas atípicas. Las diferencias con el adenocarcinoma son los grupos menos cohesivos, con fondo necrótico y sin las placas de estroma que acompañan a las hiperplasias, además de la menor atipia. En términos generales, solo se pueden diagnosticar con certeza el 20-70% de las hiperplasias endometriales mediante el material de citología. Leiomioma.Útero. ►Ref.5076b. Fibroides; fibromioma; leiomioma; mioma. Son tumores benignos formados por tejido muscular y conectivo que se desarrollan en la pared uterina o se adhieren a ella. Se desconoce la causa de los tumores fibroides en el útero, sin embargo, parece que éstos 147 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología aumentan de tamaño cuando se realizan terapias a base de estrógenos (como es el caso de los anticonceptivos orales) o durante el embarazo. El crecimiento de los fibroides parece depender de la estimulación regular por estrógenos. Esta condición casi nunca se manifiesta antes de los 20 años de edad y disminuye después de la menopausia. Mientras una mujer con fibroides esté menstruando, es probable que estos continúen su crecimiento, aunque generalmente a un ritmo bastante lento. Los fibroides pueden ser microscópicos, pero también pueden crecer hasta llenar toda la cavidad uterina y llegar a pesar varios kilos. El fibroide uterino es el tumor pélvico más común y puede presentarse en un 15 a un 20% de mujeres en edad reproductiva y en un 30 a un 40% de mujeres mayores de 30 años. Es posible que se desarrolle un solo fibroide, aunque normalmente se presentan muchos de ellos, los cuales comienzan como pequeños plantones que se diseminan a través de las paredes musculares del útero. Los fibroides crecen lentamente y se vuelven más nodulares, introduciéndose con frecuencia en la cavidad uterina o sobrepasando sus límites normales. Muy de vez en cuando, un fibroide se sujeta a un pedúnculo largo que se encuentra adherido a la parte externa del útero; esto se denomina fibroide pedunculado. Es el tumor uterino más frecuente: ocurre en una de cuatro mujeres en edad fértil. En dos tercios de los casos son múltiples. Aumentan de volumen en el embarazo y disminuyen de tamaño después de la menopausia. Tienen más receptores estrogénicos que el miometrio vecino y una mayor proporción de receptores estrogénicos en relación con receptores de progesterona. Macroscópicamente: Son tumores firmes, blanquecino o rosado grisáceos, fasciculados, bien delimitados y no encapsulados. Pueden ser intramurales (en el espesor del miometrio), que es la localización más frecuente; submucosos, ubicación en que comprimen y atrofian el endometrio, deforman la cavidad endometrial y pueden provocar abortos, y subserosos, ubicación en que pueden ser pediculados o sésiles y desprenderse e implantarse en el peritoneo (leiomioma parásito). Histológicamente: Están hechos de haces de musculatura lisa, desordenados y más celulares que el miometrio normal. Frecuentemente sufren fenómenos degenerativos: necrosis y hemorragia (degeneración roja), especialmente los grandes, además, los que se encuentran en el embarazo y en usuarias de anticonceptivos hormonales. Suele haber reemplazo de miocélulas por fibrosis, a veces, con hialinización (degeneración blanca). Puede haber degeneración quística con líquido seroso o calcificación. 148 HistologíayCitologíaavanzadaII No tienen potencial maligno. Son causa de dolor, metrorragia y abortos. Los leiomiomas son lejos los Tu más frecuentes que afectan al miometrio. Son Tumores benignos de músculo liso, sólidos, bien delimitados. Tienen tamaños variables desde ± 1 hasta 30 cm. En cuanto a la ubicación uno puede dividirlos en 3 partes: Subserosos: debajo de la serosa, habitualmente son pediculados Intramurales: están en el espesor del endometrio Submucosos: bajo la mucosa endometrial. Pueden ser pediculados, rellenar la cavidad e incluso salir por el cuello uterino al igual que los pólipos endometriales. Las complicaciones más frecuentes de los leiomiomas son la hemorragia y la necrosis del tejido miometrial. Esto último se produce porque el pedículo se tuerce e impide el riego sanguíneo. El leiomioma, a diferencia de otros Tu benignos, no tiene cápsula. El tejido endometrial vecino le hace una especie de pseudocápsula. Esto hace que se pueda extirpar fácilmente. El mioma no complicado tiene un aspecto muy homogéneo, el que cambia cuando este se complica, ya sea por hemorragia, involución, infarto, etc. Son blancos, firmes. Hay arremolinados y anacarados también hay paracervicales, que se ubican en el ligamento. El leiomioma puede evolucionar hacia el infarto, donde el tumor se necrosa. Se produce una hemorragia extensa. También puede evolucionar con degeneración hialina. Esta es una involución del leiomioma, donde el tejido. El tejido es reemplazado por áreas de hialinización y edema. Puede producirse por infarto, aterosclerosis, etc. Otra evolución puede ser la calcificación. Se ha postulado su transformación a malignidad. No es tal, ya que el 90% de las mujeres tiene un mioma en algún momento de su vida, y aunque se malignizara un pequeño porcentaje, habría una gran incidencia de leiomiosarcoma, cosa que no ocurre. No tienen potencial maligno. Son causa de dolor, metrorragia y abortos. Leiomiosarcoma.Útero. ►Ref.5120b. Constituyen sólo poco más del 1% de los cánceres uterinos. La razón con los leiomiomas es de 1:800. El recuento de mitosis es el elemento fundamental para el diagnóstico: más de 15 mitosis por 10 campos de aumento mayor. Son altamente agresivos y pueden dar metástasis. De regla son muy celulares, con mitosis atípicas y necrosis. Los tumores de esta estirpe con 2 a 15 mitosis por 10 campos de aumento mayor son de comportamiento biológico intermedio entre leiomioma y leiomiosarcoma. Es una neoplasia que se origina de la musculatura lisa. Es de mal pronóstico. Son friables, habitualmente complicada con hemorragia o necrosis. Es de crecimiento rápido. Lo que da el diagnóstico es la celularidad, con atipia nuclear, alta tasa mitótica. Lo que da mayor valor para el diagnóstico es la atipia y la necrosis. 149 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Existe una tumoraciónde músculo liso que se llama de potencial maligno incierto, en el que hay atipias y necrosis, pero se debe evaluar el número de mitosis para decidir si es o no Leiomiosarcoma. LesiónEscamosaIntraepitelial(SIL).Útero. ►Ref.5825b. Lesión intraepitelial escamosa (SIL, por siglas en inglés) es otro término que se utiliza para describir cambios anormales de las células en la superficie del cuello del útero. La palabra escamosa describe las células que son delgadas, planas y yacen en la superficie de afuera del cuello del útero. La palabra lesión se refiere a tejido anormal. Una lesión intraepitelial significa que las células anormales están presentes solamente en las capas superficiales de las células. Un médico puede describir una lesión intraepitelial escamosa como de grado bajo (cambios tempranos en eltamaño, forma y número de células) o de grado alto (un número grandede células precancerosas que tienen una apariencia bastante diferente a la de las células normales). Neoplasia intraepitelial cervical (CIN, por siglas en inglés) es otro término que se utiliza a veces para describir células anormales. Neoplasia significa un nuevo crecimiento anormal de células. Intraepitelial se refiere a las capas superficiales de las células. El término neoplasia intraepitelial cervical, junto con un número (del 1 al 3), describe qué tanto del cuello del útero contiene células anormales. Las LGSIL del Sistema Bethesda comprenden los cambios celulares producidos por el virus del papiloma humano y las displasias leves o CIN I de anteriores clasificaciones. Las descripciones clásicas de CIN I o displasia leve se refieren a células superficiales o intermedias que contienen núcleo agrandado, irregular con cromatina granular o reticular. No existe nucléolo aparente. La membrana nuclear puede estar levemente lobulada y las binucleaciones son frecuentes. Existe un incremento de la relación N/C y pueden verse halos perinucleares. Los cambios secundarios a la infección por HPV se traducen en dos tipos celulares característicos: Koilocitos: Son células maduras superficiales o intermedias que muestran característicamente una gran cavidad perinuclear. Esta cavidad está muy bien definida, como perfilada, y periférico a ella se encuentra el citoplasma denso como si estuviese todo comprimido y desplazado en una zona estrecha bajo la membrana celular, así con el método de Papanicolau muestra una fuerte tinción cianófila o eosinófila. EL núcleo de los koilocitos muestra varios grados degenerativos, la bi o multinuleación son frecuentes. Si bien no existe moldeamiento como en la infección por HSV, aunque pueden coexistir. Los koilocitos se suelen presentar sueltos no formando grupos. Disqueratinocitos: Son células escamosas queratinizadas que se tiñen de modo intenso, brillante con el OG. Se presentan en grupos tridimensionales y muestran un núcleo vesicular con patrón cromatínico borroso como los koilocitos. Los disqueratinocitos pueden existir en ausencia de infección por HPV, formando perlas o agregados con las células dispuestas en paralelo. Cuando son producidos por HPV existe marcado desorden y pérdida de polaridad en los grupos de estas células 150 HistologíayCitologíaavanzadaII Lesión epitelial de alto grado (HGSIL) En el Sistema Bethesda comprende los cambios antes denominados displasia moderada (CIN II), displasia grave (CIN III) y carcinoma “in situ”. Los frotis se caracterizan por la presencia de células inmaduras de tipo parabasal con aumento de la relación N/C, con núcleo agrandado irregular. La cromatina varía desde granular a irregular con bandas o núcleos hipercromáticos. Los nucléolos no son visibles en general. La membrana nuclear es irregular con angulaciones, dentada, y mal definida.No hay marcada anisocariosis. Se pueden presentar sólas o en “fila india”, siempre sobre fondo limpio si no existe infección concomitante. Debe establecerse el diagnóstico diferencial con la metaplasia escamosa, que presenta relación N/C conservada, con membrana nuclear lisa y bien definida. Células pavimentosas Células escamosas atípicas de significado indeterminado (ASC-US): No puede excluir SIL (ASC-H) Lesiones intraepiteliales escamosas de bajo grado (LSIL) que comprenden HPV, displasia moderada, CIN I Lesiones intraepiteliales escamosas de algo grado (HSIL) que comprende displasia moderada e intensa, CIS, CIN II y CIN III Células de carcinoma escamoso Células cilíndricas Atípicas Células endocervicales Células endometrales Células glandulares Adenocarcinoma in situ Adenocarcinoma (endocervical, endometral, extrauterino, no especificado NOS) SIL BAJO GRADO HPV SIL ALTO GRADO CIN I CIN II CIN III Displasia Leve Displasia Moderada Displasia Grave Carcinoma In situ LuteomaOvárico. ►Ref.5373b. Tumor ovárico, quístico, benigno, derivado del cuerpo lúteo. El cuerpo lúteo normal mide 2 a 3 cm. Signo de ovulación es el festoneamiento de los contornos. El quiste es unilateral; la pared, amarilla, festoneada; el contenido, hemorrágico. Puede tratarse de a) Cuerpo lúteo quístico: cuerpo lúteo mayor de 3 cm en que los fenómenos de organización de la hemorragia cursan normalmente. b) Quiste del cuerpo lúteo: cuerpo lúteo con gran hemorragia central que condiciona un retardo en su organización. Los contornos son festoneados, la pared interna tiene tejido fibroso maduro, pero al centro aún hay hemorragia con escasa organización. 151 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Cuerpo lúteo: El folículo que ovuló constituye el cuerpo lúteo, de contornos festoneados, plegados (signo de ovulación), de pared formada por el resto de las células de la granulosa y tecas y de centro hemorrágico. Tanto las células de la granulosa como tecales se luteinizan: se hacen poligonales, aumentan su citoplasma, que aparece eosinófilo pálido, de contenido lipídico, lo que da un color amarillo a la pared del cuerpo lúteo. Las células granulosas luteínicas forman la principal masa del cuerpo lúteo, están completamente luteinizadas a los 4 días de la ovulación y secretan estrógenos y progesterona. Las células tecales luteínicas son más pequeñas y oscuras, secretan progesterona. En el centro el hematoma se organiza y se transforma en una cicatriz de contornos festoneados. El cuerpo lúteo se profundiza en el tejido ovárico a medida que se transforma en el cuerpo albo. Si se retarda la reabsorción de la hemorragia en la cavidad central después de la ovulación, aparece un contenido líquido rodeado por tenue capa conectiva (producto de la organización retardada) y, por fuera de ésta, una capa ondulada de granulosa luteinizada. La secreción mantenida de progesterona lleva a una descamación irregular y prolongada del endometrio, frecuentemente con fenómeno de Arias-Stella. La complicación de estos quistes es la hemorragia intraperitoneal Otros Tumores benignos del ovario. Tumores No Neoplásicos: A. Quiste de inclusión germinal. B. Quiste folicular. C. Quiste del cuerpo lúteo. D. Luteoma del embarazo. E. Quistes luteínicos de la teca. F. F Ovario escleroquístico. MetaplasiaEscamosa.Útero. ►Ref.5782b. Reacciones proliferativas benignas: Hiperqueratosis. Metaplasia escamosa (madura e inmadura). Metaplasia escamosa atípica. Lo habitual es que la metaplasia se realice a partir de una célula indiferenciada o poco diferenciada, capaz de multiplicarse: a partir de ella se generan células con diferente diferenciación. Por ejemplo, en la mucosa del endocérvix, el proceso de la metaplasia pavimentosa tiene las siguientes fases: a) Aparición de células subcilíndricas («células de reserva»): células cuboideas situadas en una capa por debajo de las células cilíndricas. (Se ha sugerido que estas células subcilíndricas, que normalmente no se observan con microscopía de luz, son las que dan origen a la regeneración ortológica de las células cilíndricas). 152 HistologíayCitologíaavanzadaII b) Hiperplasia de células subcilíndricas: por debajo de las células cilíndricas se observan varias capas de células cuboideas anaplásticas. c) Metaplasia pavimentosa inmadura o incompleta: se desprenden las células cilíndricas, y queda un epitelio anaplástico de varias capas, pero sin estratificación y sin diferenciación hacia células escamosas. d) El epitelio madura y se estratifica; las capas superiores están formadas por células progresivamente aplanadas con núcleos progresivamente picnóticos. Las dos partes anatómicas están delimitadas por el orificio cervical externo: el exocérvix anatómico o porción vaginal del cuello y el endocérvix anatómico o canal cervical. El límite escamo-columnar se localiza en la zona distal del orificio cervical externo, aquí el epitelio maduro cervical columnar se transforma progresivamente a partir de la pubertad, en epitelio pavimentoso más o menos maduro: ”zona de transformación”. La metaplasia escamosas no tiene significación diagnóstica, sólo nos indica que la muestra está correctamente tomada puesto que llega a la zona de transformación, que es el lugar donde teóricamente comienzan las lesiones de cuello uterino. Cuando la metaplasia escamosa es totalmente madura no podemos distinguir las células de las habituales que se descaman. Sólo reconocemos las que presentan maduración incompleta y se caracterizan por: Aspecto parabasal o intermedio bajo. Indice N/C normal. Núcleo redondo u oval con cromatina fina, membrana lisa y nucléolo ocasionalmente presente. Citoplasma denso cianófilo, uniformes en tamaño y forma entre ellas. Se presentan en grupos, placas o cadenas La mucosa del exocérvix consta de un estroma fibromuscular de superficie lisa, y de un revestimiento de epitelio pavimentoso estratificado no cornificado. Este posee un estrato basal, de células con núcleos alargados, perpendiculares a la membrana basal y escaso citoplasma; un estrato parabasal, de células poligonales y mayor cantidad de citoplasma; un estrato intermedio, con células de núcleos ovalados y abundante citoplasma y un estrato superficial, de células dispuestas horizontalmente y núcleos pequeños, hipercromáticos. Esta variación de los caracteres celulares al ascender hacia la superficie, corresponde a una maduración celular. La mucosa del endocérvix tiene un estroma conjuntivo revestido por epitelio cilíndrico simple, mucoide. La superficie es muy irregular, con pliegues y repliegues que en un corte histológico aparecen como glándulas. No siempre hay estricta correspondencia entre las partes anatómicas y la estructura histológica. Ectropión y Entropión: Es la eversión de la mucosa endocervical hacia el exocérvix anatómico. Macroscópicamente se ve como una zona circular rojiza por fuera del orificio externo que parece una erosión debido a la transparencia del epitelio cilíndrico y la hiperemia por leve inflamación. El ectropion es muy frecuente en la mujer en edad fértil y en embarazadas a causa de un aumento de volumen del cuello y de la acción de estrógenos. 153 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Entropion: después de la menopausia, por ortoatrofia, el cuello disminuye de volumen, la mucosa endocervical vuelve al canal e incluso más adentro del orificio externo, por el que se introduce mucosa exocervical. En el ectropion el epitelio cilíndrico es reemplazado por epitelio pavimentoso (metaplasia), lo que se realiza en varias fases: Aparición en el microscopio de luz, de células subcilíndricas (basales o de reserva), hiperplasia de células subcilíndricas, metaplasia inmadura y metaplasia madura. Las células basales son pequeñas, isomorfas, de escaso citpoplasma y núcleos redondeados: su origen no está aclarado. En la metaplasia inmadura hay mayor estratificación epitelial y las células de los estratos superiores tienen más citoplasma que las células basales; no se reconocen aún todos los estratos del epitelio escamoso maduro. En la metaplasia madura el epitelio es similar al del exocérvix histológico. El proceso de metaplasia puede ocurrir en la superficie y en los pliegues o predominantemente en la superficie con oclusión de los repliegues y formación de quistes mucinosos (huevos de Naboth). El reemplazo del epitelio cilíndrico endocervical por epitelio pavimentoso estratificado (metaplasia escamosa) puede ocurrir por otro mecanismo: la epidermización ascendente. En este caso, una erosión o úlcera en la zona de unión del endocérvix y exocérvix histológicos se reepiteliza directamente con epitelio escamoso estratificado, desde el exocérvix, en forma ascendente. La mucosa de transición (zona de transición o de transformación), situada entre la mucosa exocervical y la endocervical, es una mucosa con arquitectura de mucosa endocervical (pliegues y repliegues), pero revestida por un epitelio en cualquiera de las fases de metaplasia pavimentosa. La mucosa de transición en la mujer postmenopáusica generalmente se encuentra en el canal cervical. NeoplasiaMucinosaAtípicaProliferativa.Ovario. ►Ref.5709b. Se originan del Epitelio Peritoneal o Mesotelio que cubre la superficie externa del Ovario. Este epitelio superficial es derivado del epitelio celómico el cual dá origen a los Conductos Müllerianos. Estos conductos son los que originan las Trompas de Falopio, Cuerpo Uterino, Cérvix y tercio superior de la Vagina. Los Tumores Epiteliales constituyen aproximadamente el 80% de todos los tumores ováricos malignos. Se presentan generalmente en mujeres peri y post menopáusicas. La mayor incidencia está en nulíparas e infértiles. Se ha observado asociación con Cáncer de Endometrio y el Carcinoma Seroso Papilar de la Superficie Peritoneal. La bilateralidad es más frecuente en estos tumores que en cualquiera de los otros grupos. Tumores Mucinosos 1. Benignos: a) Cistoadenoma Mucinoso. b) Adenofibroma y Cistoadenofibroma Mucinoso. c) Adenofibroma y Cistoadenofibroma Mucinoso Maligno. 154 HistologíayCitologíaavanzadaII 2. Malignos: a) Carcinoma Mucinoso de bajo potencial de malignidad (de malignidad borderline). b) Carcinoma Mucinoso. c) Adenofibroma y Cistoadenofibroma Mucinoso Maligno. Tumores Proliferantes: Se denominan así aquellos tumores ováricos epiteliales en que se observa una actividad proliferativa epitelial mucho más marcada que un tumor benigno corriente. Puede encontrarse algún grado de atipia y actividad mitótica, pero en menor grado que en los tumores “borderline”. El producto de secreción de estos tumores originalmente se denominó pseudomucina y por eso se hablaba de tumores pseudomucinosos. A pesar de que existen diferencias histoquímicas con la mucina típica, hoy se considera a este producto como una variedad de mucina y al igual que ésta ese producto está compuesto de proteínas y mucopolisacáridos (glicosaminoglicanos). Benignos: Representan el 20% de los tumores benignos del ovario y en el 5% de los casos son bilaterales. Se presentan como una formación quística unilocular o multilocular. Los de gran tamaño (se ha descrito de hasta 40 Kg) generalmente son multiloculares. Contienen material mucinoso. La superficie interna por lo común no tiene papilas y es lisa y brillante. La superficie interna está revestida de células neoplásticas epiteliales cilíndricas, normotípicas, mucoides, similares a las del endocérvix. Frecuentemente hay mezcla con otros tumores epiteliales müllerianos, por ejemplo, tumor de Brenner. Malignos: Corresponden al carcinoma (cistoadenocarcinoma) mucinoso, que constituye 5-10% de los tumores malignos del ovario. En el 25% de los casos son bilaterales. Generalmente son quísticos, pueden tener papilas o ser sólidos. Muestran invasión del estroma ovárico por estructuras glanduliformes neoplásticas y dan metástasis. El grado de diferenciación se define tanto por criterios referentes a la arquitectura tumoral (grado de regularidad de las formaciones glanduliformes) como al grado de atipía celular. En el grado 3 el tumor es predominantemente sólido, con escasas zonas que permitan reconocer diferenciación glandular y secreción. Piosalpinx.TrompasdeFalopio. ►Ref.5378b. Acumulación de pus en la trompa por salpingitis. Del 90 al 95% de todos los casos de enfermedad inflamatoria pélvica (EIP) son causados por los mismos organismos responsables de las enfermedades bacterianas de transmisión sexual (como la clamidia, gonorrea, micoplasma, estafilococo y estreptococo). Aunque la transmisión sexual es la causa más común de esta condición, las bacterias pueden penetrar en el organismo después de una intervención o procedimiento ginecológico, como la implantación de un DIU (dispositivo intrauterino utilizado como anticonceptivo), después de un parto, de un aborto espontáneo (aborto natural), de un aborto electivo o terapéutico o de una biopsia del endometrio. 155 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Salpingitis aguda: Suele iniciarse poco después de la menstruación. Hay dolor abdominal bajo, que aumenta progresivamente con defensa, dolor de rebote y molestias que aumentan al mover el cuello uterino, sólo en caso de que se encuentre de por medio un DIU la afección suele ser bilateral, puede haber vómito, fiebre alta, leucocitosis, y secreción purulenta abundante del cérvix, dolor abdominal de leve a moderado, hemorragia irregular y la secreción vaginal también puede señalar infección. Salpingitis crónica: Puede seguir a un ataque agudo con las consiguientes cicatrices, dolor crónico, irregularidades menstruales, infertilidad. Pueden desarrollarse abscesos en trompas, ovarios o pelvis durante el estadío agudo. Puede ser asintomática durante varios años, y la consecuencia es la infertilidad, secuela común si no se trata a tiempo esta enfermedad. Diagnóstico: Puede haber fiebre, leucocitosis, en el examen pélvico el hallazgo más notable consiste en que la movilización del cérvix o la palpación de los anexos produce dolor intenso, la irritación peritoneal produce con frecuencia dolor abdominal. Se deben descartar las urgencias quirúrgicas especialmente apendicitis y embarazo ectópico. La laparoscopía debe practicarse si por cualquier causa se duda del diagnóstico clínico. Hay tres tipos de procesos inflamatorios de patogenia diferente, que pueden llegar a comprometer varios segmentos del aparato genital femenino y órganos vecinos, como pelvis y peritoneo (enfermedad inflamatoria pelviana). Estos son: gonorrea, infección puerperal y tuberculosis. Gonorrea: El agente etiológico es la Neisseria gonorrhoeae. Se pensaba que la inflamación producida por este agente era específica, sin embargo, hay otros organismos que pueden producir una inflamación similar: infección polimicrobiana (ej. estreptococo-escherichia coli), Chlamydia tracomatis (tipos diferentes de los que producen la linfoadenopatía venérea), Actinomyces israeli (frecuente en uso de dispositivo intrauterino). Es una inflamación ascendente por extensión superficial. Comienza por un foco como uretritis, cervicitis o inflamación de la glándula de Bartholino (no toda inflamación de esta glándula es gonocócica). En las niñas se produce una vulvo-vaginitis, no así en las mujeres, pues en éstas el epitelio es más grueso y resistente. En el adulto se produce una cervicitis y endometritis, pero la lesión más intensa es una endosalpingitis. Se trata de una inflamación fibrinopurulenta, el exudado determina adherencias entre los pliegues tubarios. La organización del exudado deja secuelas con tabiques fibrosos y formación de espacios glanduliformes cerrados: es la salpingitis crónica folicular, en la que hay además infiltración celular linfoplasmocitaria. Una segunda forma evolutiva lleva a la oclusión de la fimbria con acúmulo de exudado purulento en la trompa (piosálpinx). Si la infección cede, se produce proteolisis y absorción del componente orgánico del exudado, así se constituye un hidrosálpinx. Se pueden producir adherencias de la trompa al ovario (sinequias tubo-ováricas) y absceso tubo-ovárico. La inflamación puede propagarse al peritoneo (peritonitis). 156 HistologíayCitologíaavanzadaII Infección Puerpreal: El alumbramiento o desprendimiento placentario (también el aborto provocado y raspado uterino) deja en el útero una superficie interna cruenta, que favorece la infección. Los gérmenes más frecuentes son los estreptococos, estáfiloco, la Escherichia coli y los Clostridia. Estos agentes producen así una endometritis aguda, con compromiso inflamatorio de vasos linfáticos en el miometrio (linfangitis) y de vasos sanguíneos (flebitis y tromboflebitis miometrial). La inflamación se extiende al tejido conjuntivo entre las hojas del ligamento ancho (parametrio) y tejidos blandos intersticiales de la pelvis. Puede producirse una septicemia, a veces, una pioemia o una septicotoxemia. Las superficies mucosas están relativamente poco comprometidas. Tuberculosis: Representa una tuberculosis aislada de los órganos, originada en un foco hematógeno (tuberculosis metastásica). El foco inicial suele estar en el extremo distal de la trompa. La inflamación puede extenderse a otros órganos por contigüidad y por vía linfática. La tuberculosis genital no está especialmente relacionada con la actividad sexual, puede producirse en vírgenes. La salpingitis tuberculosa se presenta en dos formas: 1. La salpingitis nodular, de predominio productivo. 2. La salpingitis caseosa, que habitualmente deja secuelas deformantes. Con mayor frecuencia esta última forma se acompaña de una endometritis tuberculosa, caseosa o productiva, o de una endometritis crónica sin elementos de especificidad. Puede haber compromiso del cuello uterino en forma de una lesión ulcerada o sólo reconocible bajo el microscopio. Por vía linfática se puede comprometer el ovario con lesiones generalmente sólo microscópicas. La inflamación puede extenderse a la serosa uterina y al peritoneo restante, con deformación de las trompas y sinequias tubo-ováricas. La reacción inflamatoria crónica del endometrio puede ser difícil de reconocer aun histológicamente cuando carece de elementos de especificidad. El endometrio rara vez presenta en estos casos ulceraciones o desarrollo de tejido granulatorio. Es normal la presencia en el estroma endometrial de acúmulos linfoides y linfocitos dispersos. El reconocimiento de la endometritis sin elementos de especificidad se basa fundamentalmente en el hallazgo de células plasmáticas. Hidrosalpinx.TrompasdeFalopio. ►Ref.5376b. Colección líquida en una o las dos trompas generalmente secundarias a un piosalpinx. Se producen generalmente por infección. Los factores que la favorecen son los siguientes: 1. El aparato genital femenino representa un sistema tubular relativamente corto a través del cual existe una comunicación directa entre el exterior (por la vagina, de 6 cm de longitud) y la cavidad abdominal. 2. La actividad sexual posibilita la acción de determinados agentes (de transmisión sexual): sífilis, gonorrea, virus papiloma entre otros. 157 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 3. La obstrucción del sistema tubular determina acumulación de secreciones y sangre (hematosálpinx, hematometra, hematocolpos), que a su vez son favorecedoras de la infección. 4. Uso de cuerpos extraños (dispositivo intrauterino). 5. Procedimientos médicos (dilatación del cuello uterino, raspado endometrial). PóliposEndometriales.Útero. ►Ref.5744b. Pólipo endometrial (hiperplasia focal): Los pólipos endometriales son frecuentes; generalmente, sésiles. En el 20% de los casos son mútliples. Se producen alrededor de la menopausia. Por lo común son asintomáticos, pero pueden sangrar. Se desarrollan por estimulación estrogénica prolongada en áreas de endometrio refractarias a la progesterona. De regla el resto del endometrio es proliferativo. Los pólipos generalmente nacen del fondo, es raro que crezcan de la pared lateral. Son de tamaño variable desde milimétricos hasta salir incluso del cuello uterino, pudiendo malinterpretarse como pólipos del cérvix. El pólipo generalmente es una masa brillante, habitualmente con microhemorragias, friable. El pólipo es esponjoso, constituido de glándulas y estroma no muscular (porque es endometrial), entonces su consistencia es menor a un mioma. Se aprecia otra diapo con un pólipo con glándulas tortuosas, dilatadas y áreas más sólidas que corresponden a vasos prominentes. Las glándulas quísticas pueden verse a ojo desnudo. El pólipo no debe ser mirado en menos, en el sentido que puede tener zonas de adenocarcinoma. Así es siempre hay que examinar los pólipos. En general, el pólipo es signo de hiperestrogenismo. QuisteDermoide.Ovario. ►Ref.5355b. Tumor derivado de tejidos embrionarios. Consta de una pared fibrosa tapizada por epitelio y una cavidad que contiene material graso y, frecuentemente, pelo, dientes, trocitos de hueso y cartílago. Se postula que se originan, en último término, a partir de células germinales primordiales que migran durante la embriogénesis desde la pared del saco vitelino hasta el esbozo de las gónadas, siguiendo un trayecto a través del mesenterio del intestino posterior. Esta hipótesis histogenética se basa en los siguientes hechos: 1. La ubicación preponderantemente gonadal de la mayoría de ellos (son más frecuentes en ovario y en testículo). 2. La ubicación de otros en zonas de la línea media del cuerpo, por ejemplo mediastino y retroperitoneo, que pueden corresponder al trayecto de la migración de células germinales. 158 HistologíayCitologíaavanzadaII 3. Se han visto y se han producido experimentalmente pequeños tumores de este grupo en el túbulo seminífero. 4. No puede descartarse la posibilidad de que algunos tumores de este grupo puedan originarse de células somáticas multipotentes. Los principales tumores son los siguientes: a) Indiferenciado: El Disgerminoma es un tumor maligno que se observa en ovario y con mayor frecuencia en el testículo, donde recibe el nombre de seminoma. Los disgerminomas están constituidos por células grandes de citoplasma claro, núcleo grande redondeado con nucléolo prominente: pueden tener importante infiltración linfocitaria del estroma. b) Con diferenciación de tejido extraembrionario: El Coriocarcinoma es un tumor maligno derivado de células germinales, se produce principalmente en el testículo y en el ovario. Su parénquima está constituido por células con diferenciación propia de los elementos epiteliales de la vellosidad corial de la placenta: citotrofoblasto y sinciciotrofoblasto. c) Con diferenciación de tejidos embrionarios: Se reconocen dos variedades: carcinoma embrionario y teratoma. El carcinoma embrionario está constituido principalmente por células inmaduras similares a las de los elementos epiteliales de los órganos del embrión, que se disponen en cordones, túbulos o papilas. El Teratoma es un tumor cuyo parénquima está constituido simultáneamente por una variedad de tejidos, que en conjunto pueden atribuirse a derivados de las tres hojas embrionarias. En partes los tejidos tienden a disponerse esbozando estructuras más complejas (por ejemplo, una mucosa intestinal con muscular de la mucosa). Se reconocen tres formas anatomopatólogicas principales: Teratoma quístico maduro: (Frecuente en el ovario de la mujer adulta). Masa con un gran quiste que ocupa la mayor parte de ella; en su cavidad hay material sebáceo y pelos. La pared, en general de pocos milímetros de espesor, tiene la estructura de piel, con su superficie epidérmica hacia la cavidad. Por este desarrollo preponderante de estructuras cutáneas se le suele denominar quiste dermoide. Los tejidos que componen el tumor son bien diferenciados (maduros o de tipo adulto); aparte estructuras cutáneas se pueden observar muchos otros tejidos, particularmente en un engrosamiento o espolón que hace eminencia hacia la cavidad, en el que con frecuencia hay dientes, cartílago y hueso. Teratoma sólido maduro: Se puede encontrar, por ejemplo, en ovario, testículo, mediastino. Macroscópicamente es sólido, aunque puede tener múltiples quistes de pocos milímetros, generalmente de estructura y consistencia desigual. Microscópicamente, constituido por mezcla de tejidos adultos bien diferenciados. Teratoma sólido inmaduro: Se encuentra principalmente en testículo y región sacra. Está constituido por tejidos poco diferenciados que recuerdan a los del embrión; a veces además de inmaduros algunos tejidos son francamente heterotípicos, con aspecto de sarcoma o de 159 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología carcinoma, según el caso. Los teratomas inmaduros son potencialmente malignos; pueden dar metástasis hematógenas en las que se observa uno o varios de los tejidos que componen el tumor primario. QuisteEndocervical.Útero. ►Ref.6163b. Quistes o folículos debidos a la retención de las secreciones de las glándulas del cervix El canal cervical está recubierto por células glandulares que normalmente secretan moco. Estas glándulas endocervicales pueden llegar a cubrirse de epitelio escamoso normal en un proceso normal llamado metaplasia. Estos nidos de células glandulares (glándulas de Naboth), que se encuentran en el cuello uterino, pueden llenarse de secreciones. A medida que se acumulan las secreciones, se forma una protuberancia lisa y redonda, justo por debajo de la superficie del cuello uterino que puede crecer lo suficiente como para observarse o palparse durante un examen. Cada quiste aparece como una elevación blanca y pequeña, parecida a una espinilla, que puede aparecer sola o en grupo y no es una amenaza para la salud del individuo. Estos quistes son más comunes en las mujeres en edad reproductiva, en especial en las que han tenido hijos. El examen ginecológico revela una pequeña protuberancia lisa y redonda (o grupos de protuberancias) en la superficie del cuello uterino. En raras ocasiones es necesario realizar un examen colposcópico para distinguir un quiste de Naboth de otros tipos de lesiones cervicales. Quistes de retención mucosa: la retención de moco, si es reciente, adquiere un color azulado y si es antigua y densa es amarillento (quistes de Naboth). Los vasos situados entre epitelio y quiste suelen ser muy marcados, ramificados y ocasionalmente ectásicos. SarcomaUterino. ►Ref.6161b. El sarcoma uterino, un tipo de cáncer femenino muy poco común, es una enfermedad en la cual crecen células cancerosas (malignas) en los músculos o en otros tejidos del útero. El sarcoma uterino es diferente al cáncer del endometrio, una enfermedad en la cual las células cancerosas crecen en el recubrimiento del útero. El sarcoma uterino usualmente se presenta después de la menopausia. Si existen signos de cáncer, el médico hará ciertas pruebas para determinar la presencia del mismo, las cuales generalmente comienzan con un examen interno (pélvico). Durante este examen, el médico buscará masas o cambios en la forma de los órganos pélvicos. A continuación, el Citólogo puede hacer una prueba de Papanicolaou, con el uso de un poco de algodón, un palillo de madera o un cepillo pequeño para raspar suavemente el exterior del cuello uterino (la abertura del útero) y la vagina para poder recoger muestras de células. Debido a que el sarcoma uterino empieza en el interior, generalmente este cáncer no aparecerá en la prueba de Papanicolaou. El médico también puede efectuar una dilatación y curetaje (D & C) extendiendo el cuello uterino e insertando un pequeño instrumento en forma de cuchara en el útero para extraer pedazos del recubrimiento del útero. Este tejido se observa luego a través del microscopio en busca de células cancerosas. Constituido por células de escaso citoplasma, núcleo redondeado, ovoideo, y 160 HistologíayCitologíaavanzadaII con abundante proliferación vascular. Pueden ser nodulares o difusos. De bajo grado: menos de 10 mitosis por 10 campos de aumento mayor. Tienen frecuentemente crecimiento intravascular y bordes infiltrantes, a pesar de esto, rara vez dan metástasis. De alto grado: más de 10 mitosis por 10 campos de aumento mayor. Son infiltrantes, tienen acentuadas atipias nucleares, las metástasis son frecuentes. Etapas del sarcoma del útero Una vez que se encuentra el sarcoma del útero, se llevarán a cabo pruebas adicionales para determinar si el cáncer se ha diseminado del útero a otras partes del cuerpo (clasificación por etapas). El médico necesita saber la etapa en que se encuentra la enfermedad para planificar el tratamiento adecuado. Para la clasificación del sarcoma del útero se emplean las siguientes etapas: Etapa I El cáncer sólo se encuentra en la parte principal del útero (no se encuentra en el cuello uterino). El sarcoma en etapa I se limita al cuerpo uterino. Esta etapa representa el 50% de todas las presentaciones. ­ Etapa IA: tumor limitado al endometrio. ­ Etapa IB: invasion a menos de la mitad del miometrio. ­ Etapa IC: invasion a mas de la mitad del miometrio. Etapa II Las células cancerosas se han diseminado al cuello uterino. El sarcoma uterino en etapa II significa que el cancer ha complicado el cuerpo y el cuello uterino, pero no se ha extendido afuera del utero. ­ Etapa IIA: complicacion glandular endocervical unicamente. ­ Etapa IIB: invasion estromatica cervical. Etapa III Las células de cáncer se han diseminado fuera del útero pero no fuera de la pelvis. El sarcoma uterino en etapa III significa extension fuera del útero pero limitada a la pelvis verdadera. ­ Etapa IIIA: el tumor invade serosa y/o anexos y/o citologia peritoneal positiva. ­ Etapa IIIB: metastasis a ganglios linfaticos pelvianos y/o paraaorticos. Etapa IV Las células cancerosas se han diseminado más allá de la pelvis, a otras partes del cuerpo o al recubrimiento de la vejiga (la bolsa que contiene la orina) o del recto. ­ Etapa IVA: invasion tumoral de la vejiga y/o de la mucosa intestinal. ­ Etapa IVB: metastasis distantes, incluyendo los ganglios linfaticos intraabdominales y/o inguinales. 161 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los tipos histologicos más comunes de sarcomas uterinos son carcinosarcoma (sarcomas mesodermicos mixtos - 50%), leiomiosarcoma (30%) y sarcoma estromatico del endometrio (15%). Tecoma–Fibroma.Ovario. ►Ref.5732b. Derivados del Estroma Ovarico: De los cordones sexuales (estroma ovárico específico) Tecoma: Constituye sólo el 0,5% de los tumores ováricos. La mayoría ocurre en mujeres posmenopáusicas. En el 97% de los casos es unilateral y benigno, es bien delimitado, sólido, amarillento. Está hecho de células fusadas con lípidos dentro del citoplasma. Puede tener focos de luteinización (células poligonales, con más citoplasma y lípidos). El tumor puede ser funcionante y producir hiperestrogenismo (riesgo de carcinoma endometrial). Los luteinizados pueden secretar andrógenos. Fibroma: Es el tumor de tejido conjuntivo ovárico más frecuente, representa el 3 a 5% de los tumores ováricos. La mayoría ocurre en mujeres perimenopáusicas. Es un tumor unilateral, bien delimitado, blanquecino, de regla de más de 3 cm y benigno, hecho de células fusadas sin acúmulo de lípidos. No es funcionante y puede asociarse a hidrotórax (en el 1% de los casos, síndrome de Meigs) y ascitis, que desaparecen al extirpar el tumor. El tumor puede interpretarse como un tecoma no funcionante. Tumores del Grupo Tecoma: 1. Tecoma. a) Típico. b) Luteinizado. 2. Fibroma-Fibrosarcoma. a) Fibroma. b) Fibroma celular. c) Fibrosarcoma. 3. Tumor Estromal con elementos menores de los Cordones Sexuales a) Tumor Estromal Esclerosante. b) Inclasificable. Son tumores de una frecuencia similar aunque un poco menor que los Tumores de Células de la Granulosa. Las pacientes son de más edad que las del Tumor de la Granulosa, es raro antes de los 30 años, generalmente se presentan en post menopáusicas. Un alto porcentaje de ellos, son productores de estrógenos. En una serie, se ha comunicado sangramiento uterino en el 60% de las pacientes post menopáusicas y además Carcinoma Endometrial en 21%. Algunos tumores pueden no ser funcionantes o aún androgénicos, presentando virilización. Varían en tamaño desde pequeñas lesiones microscópicas hasta 162 HistologíayCitologíaavanzadaII masas de 20 o más centímetros. Por lo general son unilaterales. Son tumores sólidos, aunque pueden presentar zonas quísticas, tienen un amarillo característico que los diferencia de los fibromas. Casi siempre son benignos, aunque se han publicado casos raros de una variante maligna. Teratoma.Ovario. ►Ref.5390b. Teratos (griego) = monstruo, onkoma (greek) = hinchazón. Es un tumor compuesto de tejidos (ectodermo, mesodermo, endodermo), derivados de las células germinales primordiales. Por eso, el tumor presenta estructuras como hueso, dientes, grasa, piel, pelo, tejido cerebral, etc. Es una verdadera neoplasia porque tiene tejidos formados por más de una capa germinal y es un tumor extraño al órgano donde se ha encontrado. Derivados de Celulas Germinales: Constituyen el 20% de los tumores ováricos. Son el segundo grupo de tumores más frecuentes, después de los epiteliales. Se dan a cualquier edad. Ell 60% de los tumores ováricos en la infancia y adolescencia son de células germinales y 1/3 de estos, malignos. En pacientes adultas el 95% corresponden a teratomas quísticos maduros. Son frecuentes las formas mixtas con diferentes tipos histológicos. Teratoma: Es el tumor germinal más frecuente. Presenta diferenciación en elementos de las tres capas embrionarias: endoderma, mesoderma y ectoderma. Macroscópicamente pueden ser quísticos o sólidos, e histológicamente los tejidos que componen el tumor pueden ser maduros (bien diferenciados, como los tejidos adultos) o inmaduros (como tejidos embrionarios). Son tumores que se componen generalmente de elementos de las tres líneas embrionarias: ectodermo, endodermo y mesodermo. Pueden ser quísticos o sólidos y pueden estar constituidos por tejidos inmaduros o embrionarios o por tejidos maduros de tipo adulto. Su potencial maligno depende de la inmadurez del tejido. La histogénesis de los Teratomas ha sido sujeto de muchas controversias durante años, ahora tienen poca aceptación las dos primeras teorías, las cuales sostenían que los teratomas se originaban de blastómeros separados o de células somáticas aisladas como una anomalía del desarrollo embrionario. Actualmente se acepta la teoría partenogenética de un origen en las células germinales primordiales; esta teoría está sustentada por la distribución anatómica de los tumores, los cuales se presentan a lo largo de la línea de migración de las Células Germinales Primordiales desde el Saco Vitelino hacia las Gónadas Primitivas y por el hecho que estos tumores son más comunes durante los años reproductivos. También se han realizado estudios con técnicas citogenéticas y electroforéticas que han demostrado que estos tumores se originan por partenogénosis de una sola célula germinal haploide después de la primera división meiótica. Se ha demostrado que las células de los Teratomas Ováricos tienen cromatina sexual femenina positiva, mientras que las células de los Teratomas Testiculares son generalmente negativas, pero pueden ser positivas o mixtas. El cariotipo de los Teratomas Ováricos Benignos que se estudiaron fue de 46XX. 163 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Teratoma Maduro: Puede ser: sólido o quístico. Crece lentamente. Los teratomas quísticos son los más comunes, constituyen alrededor del 95% de los teratomas; varían de tamaño desde pocos centímetros a grandes tumores de varios kilos de peso. Han recibido varios nombres como Quiste Dermoide, Teratoma Quístico Adulto, Dermoide y Teratoma Quístico Benigno. Están compuestos de elementos bien diferenciados derivados de las tres láminas germinales, predominando los elementos ectodérmicos. En su forma pura este tumor es siempre benigno, pero ocasionalmente puede sufrir cambios malignos de uno de sus elementos; ocurre aproximadamente en 1 a 2% de los casos. Este tumor puede formar parte de un Tumor Mixto de Células Germinales. A los teratomas sólidos se los llama también Teratoma Sólido Adulto y Teratoma Sólido Benigno; es un tumor germinal; para hacer el diagnóstico de este tipo de teratoma se deben emplear criterios muy rígidos y hacer cortes histológicos de todo el tumor de este grupo. Se relata caso de Adenocarcinoma que nació de un teratoma maduro. Teratoma Inmaduro: Este tumor ocupa el tercer lugar en frecuencia entre los tumores malignos de células germinales. Se componen de tejidos derivados de las tres láminas germinales, son total o parcialmente indiferenciados y deben diferenciarse de los teratomas benignos con cambios malignos focales. Estos últimos se presentan en mujeres más viejas, por lo general luego de un largo periodo asintomático, mientras que la Teratoma Inmaduro por lo general se presenta en niñas, o mujeres jóvenes y asociados con una historia clínica corta. Son tumores sólidos o parcialmente quísticos, de consistencia firme; al corte puede reconocerse tejido óseo o cartilaginoso. El Teratoma Inmaduro es de pronóstico generalmente malo, tiene una evolución rápida, y la probabilidad de metástasis está relacionada directamente al grado del tumor primario; este grado varía: desde muy bien diferenciado o “grado 0” hasta aquellos con grandes cantidades de tejido embrionario inmaduro y gran actividad mitótica que se designa como“grado 3”. El grado de las metástasis también tiene relación con el curso posterior. El Teratoma Inmaduro puede presentarse combinando con otras neoplasias de células germinales como el Tumor del Seno Endodérmico, Disgerminoma, Carcinoma Embrionario, Coriocarcinoma y Poliembrioma. El teratoma quístico maduro es el más frecuente: representan en promedio el 10% de los tumores ováricos (5-25% según las casuísticas). Ocurren a cualquier edad. Predominan los tejidos del ectoderma, como piel, que revisten una cavidad de contenido queratínico. En la cavidad se reconoce un espolón del que nacen frecuentemente estructuras pilosas o dentarias. Entre los tejidos frecuentes están: tejido nervioso, generalmente glial y epitelio ependimario, epitelios de tipo respiratorio y digestivo y diversas estructuras mesodérmicas. Son bilaterales en cerca del 10% de los casos. El teraoma quístico maduro es benigno, pero en un 2% de ellos puede desarrollarse un tumor maligno a partir de alguno de los componentes tisulares (carcinoma espinocelular, carcinoide, adenocarcinoma, carcinoma de tejido tiroideo, sarcoma). Algunos autores incluyen en los teratomas tumores con diferenciación de tejidos de sólo una capa embrionaria, son los llamados teratomas monodérmicos: entre otros: quiste dermoide (sólo piel), carcinoides ováricos puros, struma ovarii (tejido tiroideo exclusivamente). Alrededor del 3% de los teratomas ováricos corresponden a struma 164 HistologíayCitologíaavanzadaII ovarii, aunque el 5-20% de los teratomas con componentes diversos pueden tener tejido tiroideo. Este puede ser funcionante y producir una sintomatología de hipertiroidismo. Al examen macroscópico los teratomas típicamente son grandes. Al corte muestran áreas quísticas y sólidas en proporciones variables. Los quistes pueden estar variables. Los quistes pueden estar revestidos por un tejido blanquecino que remeda piel e incluso pueden contener queratina, material mucinoso o sebáceo. El tejido sólido entre los quistes puede contener cartílago y tejido blanco y blando, remedando al cerebral. El examen microscópico muestra una combinación de elementos de origen endodérmico, ectodérmico y mesodérmico, que pueden ser maduros, inmaduros o ambos. Uno de los componentes del teratoma puede experimentar una transformación maligna y formar cáncer de origen somático, como un carcinoma escamoso, mucinoso o un sarcoma, pero tal fenómeno es más raro en los teratomas testiculares que en los ováricos. Torsión.Ovario. ►Ref.6111b. La torsión de los anexos (Torsión Anexial) corresponde a aproximadamente un 2,7% de todas las emergencias ginecológicas. En la mitad de los anexos en que hay torsión, se observan neoplasias del ovario de hasta 10 a 12 cm de diámetro. El hidrosálpinx, y a veces una trompa o un ovario normales (o ambos) también pueden sufrir torsión. El embarazo es un período donde hay una mayor predisposición a esta complicación, tanto por un útero que crece rápidamente o por una descompresión brusca después del parto. La torsión es menos frecuente en neoplasias gigantes, debido a que tienen poca movilidad. Si no es diagnosticado y tratado a tiempo, puede producir necrosis del anexo, peritonitis e incluso muerte de la paciente. La torsión de los anexos uterinos puede presentarse a cualquier edad pero es más común en la reproductiva. Generalmente, se asocia a patología previa del anexo que precipita la torsión como alteraciones obstructivas, tumorales o adherenciales. La torsión de la trompa, ovario o ambos, sin relación a patología previa, es una entidad rara y difícil de diagnosticar. La torsión aislada de la Trompa de Falopio es una entidad de presentación aún más esporádica, por lo que cobra mayor relevancia. Diversas teorías han sido propuestas para explicar la torsión de un anexo normal; sin embargo, ninguna aislada explica esta entidad en todos los casos: 1. La forma espiral que presenta la Trompa de Falopio durante la vida fetal persiste como una anomalía congénita en la niñez y puede ser un factor contribuyente para la torsión. 2. La trompa y ovario normales tienen una gran movilidad y son capaces de presentar rotación de 90° sin acompañarse de sintomatología. Una trompa anormalmente larga, mesosalpinx o messovario pueden causar excesiva movilidad del anexo y acentuar la torsión. 165 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 3. En presencia de un útero infantil pequeño con un ovario relativamente grande, movimientos bruscos del cuerpo súbitos o de aceleración y desaceleración pueden iniciar la torsión. 4. La teoría hemodinámica propone que las venas del mesosalpinx son mayores y más flexibles que las arterias por lo que en un evento de congestión venosa, éstas pueden asumir un curso espiral y favorecer la torsión 5. La relación de torsión del anexo derecho e izquierdo es de 3:2, por lo que se ha propuesto que el predominio derecho de la torsión puede deberse a la mayor amplitud de la pelvis en este lado, en comparación con el izquierdo que es ocupado por el voluminoso colon sigmoides; la mayor actividad peristáltica del ciego e intestino delgado en el lado derecho en comparación con la menor actividad del colon sigmoides puede ser otro factor que inicie la torsión. 6. La teoría fisiológica propone que existe una alteración en los movimientos peristálticos normales de la trompa que resulta en espasmo y origina la torsión, y probablemente algunos medicamentos pueden causar el espasmo. Es un hallazgo frecuente la presencia de hematosalpinx y torsión de trompas que se asumen como normales; sin embargo, el primero puede ser el causante de la torsión; en lugar de que ésta sea la causante del hematosalpinx. TumordeBrenner.Ovario. ►Ref.5351b. Constituye el 1,5% de los tumores del ovario. Son las más de las veces unilaterales, sólidos, fasciculados. Histológicamente está formado por brotes de epitelio de tipo transicional y un estroma fibroso denso, frecuentemente con calcificaciones distróficas. Los núcleos de las células epiteliales con frecuencia son hendidos (en granos de café). Por lo común son benignos, hay variedades malignas y limítrofes. Tipo de tumor Derivado del epitelio celómico Derivado de las células germinales 166 % Adenocarcinoma seroso Adenocarcinoma mucinoso Adenocarcinoma endometrioide Adenocarcinoma de células claras Tumor de Brenner maligno Cacinoma indiferenciado Tumor mixto mesodérmico Teratoma inmaduro Disgerminoma Carcinoma embrionario Tumor del seno endodérmico Coriocarcinoma Gonadoblastoma Tumor mixto de células germinales Poliembrioma 90 4 HistologíayCitologíaavanzadaII Tipo de tumor % Tumor de la granulosa Tecoma maligno Derivado del estroma gonadal específico Tumor de Sertoli-Leydig 5-10 Ginandroblastoma Tumor de células lipídicas Derivado del estroma gonadal no específico Sarcomas 2 Linfomas Tumor de Krukenberg (desde el intestino Metastásicos Mama Endometrio Linfomas extragonadales Etapa I Tumor limitado a los ovarios. Etapa II Tumor que compromete uno o ambos ovarios y que se extiende a otros tejidos pelvianos. Etapa III Tumor que compromete uno o ambos ovarios con implantes peritoneales fuera de la pelvis y/o ganglios inguinales o retroperitoneales tumorales. Etapa IV Tumor que compromete uno o ambos ovarios con metástasis a distancia (fuera del abdomen). Derrame pleural con células neoplásicas. Metástasis parenquimatosas hepáticas. TumordeCélulasGranulosas.Ovario. ►Ref.5729b. Constituye el 1 a 2% de los tumores ováricos. En el 95% de los casos es unilateral, siempre es maligno, pero de bajo grado. Es un tumor en partes sólido, en partes quístico, de tamaño variable, de 5 a 12 cm de diámetro, formado por células pequeñas similares a las de la granulosa, regulares en forma y tamaño, de núcleos con hendidura (en granos de café). Puede haber formaciones epiteliales que rodean cuerpos de Call-Exner (patrón microfolicular) o ser macrofolicular o trabecular. A veces es funcionante y produce hiperestrogenismo. Macroscópicamente son unilaterales en el 95% de los casos y predominantemente quísticos, pero muestran áreas sólidas blancoamarillentas con hemorragia. Tienen una cápsula bien definida. El examen microscópico es variable, debido a que el tumor de células de la granulosa exhibe células proliferando en una variedad de patrones que se pueden mezclar. El patrón de mejor diferenciación es el folicular, de éste, el patrón microfolicular está caracterizado por la presencia de pequeñas cavidades llamadas Cuerpos de Call Exner (recordando los folículos ováricos), repletas de material eosinofílico. El patrón macrofolicular está constituído por quistes revestidos por células de la granulosa. El diagnóstico histológico se confirma en el caso de los tumores de la granulosa de tipo adulto por la presencia de células de mediano tamaño con escaso citoplasma eosinófilo y núcleos pálidos y hendidos. En el caso de los juveniles, las células exhiben abundante citoplasma y los núcleos son hipercromáticos. 167 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Las células con núcleos bizarros se han relacionado con cambios degenerativos. La luteinización de las células de la granulosa se presenta en aproximadamente el 2 % de los casos. En algunos casos se presentan en combinación con tumores del grupo de los tecomas-fibromas del ovario, esto debido a su histogénesis. Estudios de inmunohistoquímica no han aportado diferencias significativas en los tumores de los cordones sexuales y estroma ovárico. Sin embargo, recientemente se ha descrito el uso de la inhibina como marcador específico para estos tumores. Los factores pronósticos de los tumores de la granulosa incluyen en primer lugar el estadío de presentación, aquellos estadío I tienen 96 % de sobrevida a los 10 años comparado con 26 % en estadíos mayores. La ruptura del tumor también afecta considerablemente el pronóstico, siendo reportada la sobrevida de 85 % a los 25 años para tumores estadío I no rotos, en contraste con 60 % para los tumores rotos en el mismo estadío. El tamaño tumoral menor de 5 cms de tumores estadío I se ha relacionado con una sobrevida excelente ( 100 %), no obstante, pacientes con tumores mayores a 5 cms tienen una sobrevida de 53 % a los 10 años. La correlación del patrón histológico con la sobrevida no ha sido existosa. Se reporta que el patrón sarcomatoide (poco diferenciado) afecta la sobrevida en relación al patrón folicular (bien diferenciado). Estas diferencias, aparentemente, son más relevantes en la sobrevida a los 25 años (29 %) que a los 5 años (82%). La presencia de atipias nucleares y mitosis en más de 2 mitosis por 10 campos de alto aumento, se han reportado en tumores que se presentan en estadíos mayores al estadío I, en estos casos se ha reportado una elevada tasa de recurrencias tempranas. La presencia de células con núcleos bizarros ha sido correlacionada a cambios degenerativos. Los estudios de sobrevida, correlacionando este parámetro, han sido limitados. El caso presentado aquí tiene dos factores pronósticos adversos: el gran tamaño y la ruptura de la cápsula. Es difícil precisar su incidencia ya que muchas veces constituye un tumor mixto al asociarse al Tecoma. Se describen dos subtipos, uno Adulto y otro Juvenil. El Tumor de Células de la Granulosa de tipo Adulto es el más común, representa el 95% de todos los Tumores de Células de la Granulosa. Se presentan en cualquier edad, pero son más frecuentes entre los 30 y 70 años, con una edad media de 50 años. Son raros antes de la pubertad. Un porcentaje no establecido de ellos, son productores de estrógenos. En las niñas, este comportamiento puede producir una pubertad precoz; en la edad fértil y en la post menopausia una hiperplasia endometrial y metrorragia, aunque a veces suele producir amenorrea. Muy rara vez los Tumores de Células de la Granulosa producen andrógenos, estas pacientes se presentan con grados variables de virilización. Los signos morfológicos de hisperestrogenismo se manifiestan en el Endometrio como Hiperplasia, desde Simple hasta Atípica, y Adenocarcinoma. También de ha informado casos de Tumor de Células de la Granulosa con endometrio atrófico y algunos con endometrio de tipo secretor. Macroscópicamente estos tumores varían en tamaño desde nódulos de pocos milímetros que constituyen un hallazgo, hasta tumores de varios kilos. Son bilaterales en en 5% de los casos y unilaterales en el 95%. Pueden ser sólidos o quísticos. Histológicamente se reconoce una amplia variedad de modelos. Cualquiera sea la estructura histológica, el Tumor de Células de la Granulosa tiene potencial maligno, con capacidad de extenderse más allá del Ovario o recurrir después de una extirpación aparentemente completa. La recurrencia puede ser muy tardía, por lo general muchos años después de la operación. 168 HistologíayCitologíaavanzadaII Las metástasis a distancia son raras. Los tumores en Estadío I tienen mejor pronóstico. La rotura del tumor se considera un factor adverso en el pronóstico, aún en los tumores en Estadío I. El tamaño también se lo relaciona con el pronóstico; se ha comunicado una mayor sobrevida para los tumores más pequeños, pero aquí se considera también el estadío. El modelo histológico del tumor, el grado de atipia nuclear y la actividad mitótica también se han correlacionado con el pronóstico. Se ha informado un mejor pronóstico en los tumores con mitosis por 10 campos de gran aumento. TumorMesodérmicoMixtoMaligno.Ovario. ►Ref.7088b. Tumores Mesodérmicos Mixtos son tumores bifásicos compuestos de elementos estromales y epiteliales, muy probablemente se originan del epitelio celómico con participación estromal. En el componente epitelial de estos tumores predominan los elementos endometrioides; se cree también que podrían originarse de una endometriosis preexistente. Imagen macroscópica de un carcinosarcoma mülleriano (tumor mesodérmico mixto maligno) endometrial: La lesión muestra una morfología polipoide y suele ocupar la mayor parte de la cavidad endometrial. Se suelen evidenciar extensos fenómenos de necrosis y hemorragia. Derivado del epitelio celómico: ­ Adenocarcinoma seroso. ­ Adenocarcinoma mucinoso. ­ Adenocarcinoma endometrioide. ­ Adenocarcinoma de células claras. ­ Tumor de Brenner maligno. ­ Cacinoma indiferenciado. ­ Tumor Mixto Mesodérmico. TumorMixtoMülleriano.Útero. ►Ref.5129b. Se da en las mujeres mayores, sobre 60 años. Habitualmente se diagnostica como una gran masa, blanquecina, que ocupa la cavidad y el motivo de consulta habitual es la metrorragia. Histológicamente se presenta como un Tumor con componente epitelial maligno como de adenocarcinoma y componente estromal maligno como de sarcoma y de ahí el nombre de carcinosarcoma. Es raro. La parte de carcinoma es como de un adenocarcinoma endometrioide. La parte de sarcoma es como un sarcoma del estroma del endometrio. A veces, la parte sarcoma tiene otros componentes: puede formar un osteosarcoma, un rabdomiosarcoma, un condrosarcoma El componente sarcomatoso puede ser homólogo (dado por estirpes celulares que se encuentran normalmente en el útero), como sarcoma del estroma endometrial o 169 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología leiomiosarcomatoso, o heterólogo (con otras estirpes celulares), como rabdomiosarcomatoso (el componente heterólogo más frecuente), condrosarcomatoso, osteosarcomatoso o liposarcomatoso. Con frecuencia hay antecedentes de radioterapia. El tumor es altamente agresivo, en especial si es heterólogo. El tumor derivaría de la célula endometrial más primitiva, capaz de diferenciarse en estructuras epiteliales y del estroma. Tumores epiteliales müllerianos mixtos: la combinación más frecuente es: tumor mucinoso, endometrioide y de células claras. Se consideran mixtos sólo si proporciones significativas del tumor corresponden a diferentes tipos histológicos; en caso contrario se catalogan según el componente que predomine. Mixtos malignos: similares al tumor correspondiente del cuerpo uterino, con componente epitelial mülleriano y componente mesenquimático, homólogo o heterólogo. Mesenquimático puro: sarcomas primarios del ovario del tipo del sarcoma del estroma endometrial. Estos últimos dos tipos, a pesar de tener un componente mesenquimático, derivan del epitelio superficial del ovario. Se originarían de células primitivas. Tumores Endometroides: 1. Tumor Endometroide Típico: Benignos: I. Adenofibroma y Cistoadenofibroma Benigno Endometrioide. II. Adenofibroma y Cistoadenofibroma Endometriode Proliferante. Malignos: I. Carcinoma Endometrioide de Bajo potencial de Malignidad (malignidad “borderline”). II. Carcinoma Endometrioide. 2. Tumor Mesodérmico Mixto (Mülleriano) Benigno: I. Adenofibroma. Malignos: I. Adenosarcoma. II. Tumor Homólogo Mesodérmico Mixto (Mülleriano). III. Tumor Heterólogo Mesodérmico Mixto (Mülleriano). ÚteroDidelfo.Útero. ►Ref.6106b. Son poco frecuentes. Sin embargo, si se incluyen las anomalías menores, como duplicación del ostium tubario, pueden encontrarse desde 1 en 500 a 1 en 2000 mujeres. Su importancia es doble: por una parte, frecuente asociación con malformaciones urológicas y, por otra, pueden ser causa de dolores crónicos e infertilidad por obstrucciones (el aparato genital es un sistema tubular). 170 HistologíayCitologíaavanzadaII Disrrafias Corresponden a los diferentes grados de falta de fusión de los conductos paramesonéfricos. La nomenclatura es la siguiente: 1. Utero didelfo (útero doble): es bicorne (dos cuerpos), bicollis (dos cuellos) y dicolpos (dos vaginas). Representa el grado mayor de disrrafia. Es excepcional con doble vulva. 2. Utero bicorne, bicollis, pero con una vagina. Las duplicaciones del cuerpo y cuello se dan en 1: 10000 mujeres. 3. Utero bicorne, unicollis, monocolpos. Puede tener un cuerno secuestrado, sin comunicación con el resto del sistema, por atresia de ese cuerno. 4. Utero arciforme. Con leve depresión en el fondo. Puede haber tabiques, a veces incompletos, en la cavidad endometrial. Otras malformaciones son duplicaciones tubaria o vaginal (de la placa vaginal) y atresias (vaginal, cervical, tubaria, de un cuerno secuestrado). VasosDecidualesNoConvertidos.Placenta. ►Ref.5253b. La placenta es un órgano feto-materno responsable de varias funciones claves durante el embarazo. Es hemocorial. El aumento de la demanda de flujo con el avance del embarazo se debe a la reestructuración de la vascularización uterina. El desarrollo de la circulación placentaria, es decir, la fetoplacentaria y la uteroplacentaria es muy complejo y se interrelaciona. Hay dos tejidos específicos involucrados. Son el sinciciotrofoblasto fetal y las arterias espiraladas de la decidua materna. Las arterias espiraladas son las ramas terminales de las arterias arcuatas, la cadena intermedia deriva su comunicación parcialmente del ovario y de la arteria uterina. En general el sistema deriva su comunicación de cuatro arterias, dos uterinas y dos ováricas. Durante el embarazo, la mayoría de la sangre que fluye por estos vasos deciduales terminales drenan al espacio intervelloso. Cambios estructurales: Los cambios estructurales en la arteria espiralada se dividen en tres fases: preinvasiva, intraluminal y de reemplazo de la pared. Basados en biopsias placentarias, se sugirieron cambios patológicos uniformes, a pesar de haber controversia en este aspecto. Cambios normales: Al principio del embarazo, los vasos espiralados van creciendo hacia la luz, y con el crecimiento del útero, los vasos se hacen rectos con algunas torsiones en ángulo recto. Esto es seguido por una fase preinvasiva donde las células de las arteriolas se apilan en varias capas a veces ocluyendo la luz. La fase intraluminal se da a las 16-20 semanas seguida por un reemplazo de pared donde la capa elástica muscular de las arteriolas es reemplazada por tejido amorfo, fibroso y fibrinoide. Estos cambios vasculares producen una conversión de aproximadamente 100 a 150 arterias espiraladas en arterias uteroplacentarias tortuosas y con mayor distensión. Cada vaso tiene aproximadamente 2 cm de longitud y se comunica con los espacios 171 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología intervellosos. En el cuarto, quinto y sexto mes de embarazo, son 500 a 1, 000 metros de diámetro, pero están parcialmente obliterados por citotrofoblasto. Flujo Sanguíneo Normal y Comportamiento Rheológico: Las arterias y venas maternas están conectadas por el espacio intervelloso. Las arterias espiraladas están perpendiculares y las venas paralelas a la pared uterina. La presión arterial impulsa la sangre materna. Esta fuerza se disipa con la creación de un lago de sangre de 5 mm de diámetro a mitad de camino del plato coriónico. La cercanía de las vellosidades enlentece el flujo de sangre otorgando el tiempo adecuado para el intercambio. Tras el baño, la vellosidad coriónica, la sangre drena por los orificios venosos en el plato basal y entra a las venas de la placenta materna. La presión media a nivel de la arteria espiralada es de 70 a 80 mm.Hg. Luego de entrar al espacio intervelloso la presión baja rápidamente. Llega a 10 mm.Hg en el útero relajado y a 30-50 mm.Hg durante la contracción. La sangre materna pasa finalmente a las venas uteroplacentarias donde la presión no es mayor a 8 mm.Hg. En un embarazo normal, hay un sistema de baja resistencia en la placenta. Endotelio: Las células endoteliales juegan un papel importante en mantener la integridad del compartimento vascular; media la respuesta inmune e inflamatoria y modifica la respuesta contráctil de la capa de músculo liso con vasodilatadores como el EDRF (endothelial derived relaxing factor) y las prostaciclinas. La preeclampsia ha sido relacionada con la disfunción endotelial, bajo EDRF, prostaglandinas y endotelinas altas. Existe la hipótesis de la inhibición del EDRF por la hemoglobina libre. Intervellositis.Placenta. ►Ref.5245b. Se reconocen dos vías principales de infección ovular: la ascendente o transcervical y la hematógena o transplacentaria. Menos frecuentemente se produce por vía transtubaria o por procedimientos de amniocentesis. Las dos vías principales tienen cada una un patrón de inflamación característico. Las consecuencias de la infección ovular son el aborto (embrión o feto de menos de 500 g), mortinatos (fetos de 500 g o más), prematuros y recién nacidos con lesiones y secuelas diversas (sordera, ceguera, malformaciones y otras). Vía ascendente: Generalmente se trata de microorganismos del canal cervical que ascienden y comprometen primero el polo inferior del huevo. El infiltrado inflamatorio se produce primero en las membranas ovulares (amnios y corion, corioamnionitis), después aparece exudado bajo la placa coriónica (inflamación subcoriónica intervellositaria) y en la placa coriónica misma, por último, en el cordón umbilical (onfalitis). El líquido amniótico se contamina y es aspirado por el feto, que sufre infección pulmonar y sepsis. El infiltrado en el espesor del tejido placentario y placa basal es escaso. Hasta las 20 semanas las células polinucleares provienen exclusivamente de la respuesta materna a la quimiotaxis. La corioamnionitis es la forma más frecuente de infección ovular, generalmente es exudativa leucocitaria. Las membranas ovulares aparecen opacas, amarillentas o verdosas (por impregnación con meconio) y de mal olor. El factor predisponente más importante es la ruptura prematura de membranas ovulares, en 172 HistologíayCitologíaavanzadaII estratos socioeconómicos bajos el coito parece jugar también un papel favorecedor de la infección. Los microorganismos más frecuentes son: Escherichia coli, estreptococos, gérmenes anaerobios, Mycoplasma y hongos del género Candida. Vía hematógena: Ocurre en una septicemia materna, los agentes alcanzan la placenta y producen inflamación en el espesor del tejido placentario (inflamación vellositaria). Esta puede ser exudativa, supurada, necrotizante, granulomatosa o proliferativa linfoplasmocitaria. Por lo común, la placenta no muestra alteraciones macroscópicas, a veces está tumefacta, hiperémica y edematosa. Las membranas ovulares no están comprometidas. Puede contaminarse la sangre fetal y producirse una sepsis en el feto. Los agentes pueden ser bacterianos, como Listeria monocytogens (inflamación supurada y granulomatosa), espiroquetas, parásitos, como el Toxoplasma y virales, como el Citomegalovirus. Corioamnionitis.Placenta. ►Ref.5262b. Es una infección de las membranas de la placenta y del líquido amniótico. Puede ocasionar bacteremia, y se debe usualmente a los gérmenes presentes en la vagina en particular E. coli. Se caracteriza por fiebre, aumento del ritmo cardíaco en la madre y el feto, dolor uterino y olor desagradable del líquido amniótico. Corioamnionitis de la madre. Se presenta en un 1 a 2 por ciento de todos los embarazos, pero es mucho más común en los partos prematuros. La corioamnionitis puede causar bacteremia (infección en la sangre) en la madre y provocar un parto prematuro y una grave infección en el neonato. La corioamnionitis también se denomina infección intra-amniótica y amnionitis. Los organismos generalmente responsables de la corioamnionitis son los que normalmente se encuentran en la vagina, incluyendo la Escherichia coli (E. coli). Los estreptococos grupo B también pueden producir la infección. La corioamnionitis se puede desarrollar cuando se produce una ruptura de las membranas (bolsa de líquido amniótico) durante un largo período. Esto permite el ingreso de microorganismos vaginales al útero. Además de los antecedentes médicos y el examen físico completos, la corioamnionitis se diagnostica por los síntomas y mediante análisis de laboratorio para detectar la infección. A veces es necesario controlar el líquido amniótico mediante una amniocentesis (extracción de líquido con una aguja). Coriogioma.Placenta. ►Ref.5250b. Ocurre en 1/20.000 embarazos. Corresponde al tumor maligno derivado del trofoblasto gestacional. Se origina en un embarazo que puede ser molar un embarazo anterior ectópico o normal y también puede originarse de un aborto previo. El 50% de los casos se originan en molas; el 25%, en abortos espontáneos previos y el 22%, en embarazos anteriores ectópicos o normales. El tumor primario suele ser pequeño o inaparente. El tejido tumoral tiene tendencia a la hemorragia y necrosis. 173 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Histológicamente se reconocen citotrofoblasto y sinciciotrofoblasto atípicos con estroma ricamente vascularizado. No se encuentran vellosidades. Hay muy elevadas concentraciones de gonadotrofina coriónica en la sangre. Las metástasis son linfógenas y especialmente, hematógenas, estas últimas ampliamente distribuidas. El 90% de ellas ocurre en el pulmón y el 20-60% en vagina, cerebro e hígado, menos frecuentemente en riñones y otros órganos. El tumor es muy sensible a la quimioterapia, a diferencia de los coriocarcinomas no gestacionales. Corionitis.Placenta. ►Ref.5265b. Se define com Inflamación del corion, que se endurece y engruesa. Es un proceso que sucede en todo el tejido mesenquimático vascularizado, ante la acción de una noxa física, química, o biológica, desencadenando sucesivamente fenómenos vasculares, humorales, exudativos, celulares, reparativos y proliferativos, que tienden a limitar la acción de la noxa. Los epitelios conforman una barrera ante la agresión de la noxa, si bien no en el contexto del fenómeno inflamación. Los epitelios estratificados y transicionales, son un factor de detención de la acción de los agentes agresores, mientras que los epitelios cilíndricos actuan por la secreción mucinosa y por su movilización, y por la acción ciliar, por el mecanismo catarral. Otras acciones de los epitelios de las mucosas, son la liberación de enzimas proteolíticas e inmunoglobulinas producidas por los linfocitos B secretorios y plasmocitos del corion, sobre todo IgA. A continuación explicaremos detalladamte las generalidades de los procesos inflamatorios, aplicables a las distintas patologías. Reacciones Generales del Organismo Fiebre: reacción inespecífica de elevación de la temperatura por sobre los valores fisiológicos, originada por la acción de pirógenos exógenos, virales o bacterianos que actuarían mediando la liberación de pirógenos endógenos (polipéptidos de lisosomas de los neutrófilos y otras células) que actuarían a través de los centros de termorregulación hipotalámicos, asi como también por la producción local de prostaglandinas E1 que por acción sobre centros superiores producirían vasoconstricción, disminución de la pérdida de calor y fiebre. Leucocitosis: Particularmente en algunas infecciones bacterianas. Velocidad de sedimentación globular aumentada. Se origina en la densidad proteica del plasma, especialmente alfa, gamma globulinas y fibrinógeno. Acción hipofisocorticoadrenal. Con secreción aumentada de A.C.T.H. y corticoides, que obrarían inespecificamente como inhibidores de la reacción inflamatoria, bloqueando la exudación de leucocitos, la fagocitosis, disminuyendo la producción de linfocitos y anticuerpos y la fase reparativa de la inflamación. Calor: cuando la inflamación incrementa el aporte de sangre a través de los vasos dilatados, esto podría explicar el aumento de la temperatura. Por otra parte se ha comprobado un incremento del metabolismo en el tejido inflamado, estos tejidos consumen más oxígeno. 174 HistologíayCitologíaavanzadaII Dolor: Podría ser producido por sustancias que se liberan en el tejido inflamado tales como 5-hidoxitriptamina y Bradikinina, que estimularían las terminales nerviosas. La pérdida de la isotonicidad de los fluidos corporales también pueden explicar el dolor,(la alteración del balance de sodio, potasio, calcio e hidrogeniones). La presión es un factor que produce dolor, esto se comprueba cuando se evacuan fluidos o pus de una lesión, el dolor y la sensibilidad inmediatamente disminuyen. Edema: Alteración de la permeabilidad capilar. Fluidos que contienen proteinas, conocidos como exudados, se acumulan en los tejidos formando la pápula, después de injurias leves y tumefacción en lesiones más serias, entre las proteinas se encuentra fibrinógeno y depositos de fibrina. En condiciones normales, solo muy pequeñas cantidades de proteinas pasan al intersticio. Las proteinas que pasan a los tejidos por el incremento de la permeabilidad que se produce durante la inflamación, alteran la presión osmotica en los tejidos y atraen más solutos, aumentando el edema, además se menciona que la presión hidrostática en la microcirculación también está aumentada durante la hiperhemia inflamatoria. Mediadores químicos que aumentan la permeabilidad: A) Proteasas: Plasmina, Kallikreina y factor de permeabilidad de las globulinas. No parecen tener acción directa sobre los vasos, sino a través de la producción de péptidos vasoactivos. Plasmina es una proteasa que está inactiva como precursor plasminogeno, que se activa por dilución o por extracto de tejidos. El kallikreinógeno se activa ante la presencia de enzimas. El factor de permeabilidad de las globulinas es una sustancia que migra con las globulinas alfa o beta y que se acompaña con un factor inhibidor (Pro PF/IPF), es también una proteasa. B) Polipéptidos: Leukotaxina, Bradikinina y Kallidina. La kalikreina rompe un kininogeno, Kallidinógeno en Kallidina, un peptido vaso activo. C) Aminas: Histamina y 5-hidroxitriptamina. Histamina está en los mastocitos, que pueden liberarla sin degranularse, es responsable de la reacción inflamatoria inmediata y podría jugar un rol en la reacción lenta o continua. La enzima productora de histamina es la histidina decarboxilasa. 5-hidroxitriptamina, se almacena en gránulos en las plaquetas, mastocitos y células argentafines, es una sustancia vasoactiva, capaz de producir dolor. D) Otras sustancias: Nucleósidos y Nucleótidos. Inosina, adenosina y guanosina, el ácido adenílico y el nucleótido, ácido inosínico, pueden producir reacción de vasodilatación. Hialuronidasa. Pocos minutos después de la agresión a un tejido se visualiza que la matriz amorfa del tejido conectivo cambia de gel a fluido, debido a la acción de la hialuronidasa que depolimeriza los mucopolisacaridos del tejido conectivo, se acumula en los tejidos inflamados y es activada por algunas bacterias tales como estreptococos, estafilococos y el cl. Welchii. Acido láctico, que se debe a la anaerobiosis podría ser suficiente para incrementar la permeabilidad, el acido láctico puede ser también producido por la migración de leucocitos 175 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología EmbarazoEctópico.TrompasdeFalopio. ►Ref.5380b. El embarazo ectópico es un embarazo que se implanta fuera del útero, por lo general en una de las trompas de Falopio, y comienza a crecer allí. Por lo general, un embarazo ectópico debe terminarse quirúrgicamente. Si el embrión continúa creciendo, puede reventar la trompa de Falopio y producir una hemorragia interna que puede poner en peligro la vida de la mujer. En algunos casos, los embarazos ectópicos pueden tratarse con una terapia con medicamentos. Los embarazos ectópicos son causados por trastornos que obstruyen o retrasan el pasaje de un óvulo fecundado desde las trompas de Falopio hacia el útero. Esto puede deberse a una obstrucción tubárica o a la dificultad del epitelio tubárico para hacer que el huevo se translade hacia la trompa y luego a la cavidad del útero. Algunos embarazos ectópicos pueden tener sus orígenes en anomalías tubáricas congénitas, endometriosis, salpingitis o enfermedad pélvica inflamatoria. Patogenia. Los factores patogenéticos principales son: 1) condiciones ovulares que determinan que el trofoblasto alcance ya en la trompa la capacidad de invasión antes de llegar a la cavidad uterina. El huevo puede migrar hacia la trompa opuesta, con lo que alcanza a haber maduración del trofoblasto. De hecho, en el 20 a 30% de los casos el cuerpo lúteo está en el ovario contralateral. 2) condiciones locales que facilitan la implantación (por ejemplo, focos endometrióticos). 3) condiciones que dificultan la migración del huevo. Así, en el 35 a 45% de los casos se encuentra una enfermedad inflamatoria pelviana con salpingitis crónica. A este último grupo de condiciones pertenecen también: operaciones pelvianas previas, procedimientos diagnósticos anteriores, como histerosalpingografía; tuberculosis genital, dispositivo intrauterino (6 a 20% de los embarazos con dispositivo intrauterino son ectópicos); anticonceptivos orales, que alteran la motilidad ciliar de las trompas y harían más probable un embarazo ectópico. Morfología. La trompa comprometida se ve abombada, rojiza, con hemorragia y vellosidades coriales en su interior; en 2/3 de los casos se reconoce el embrión. Las células de la lámina propia tubaria tienen escasa capacidad de transformación decidual, por eso la decidua que se forma es delgada y no impide la penetración de las vellosidades a la capa muscular. Evolución. Cursa generalmente con hematosálpinx y rotura, en el 75% de los casos la trompa se rompe a las 2 a 6 semanas. A veces hay regresión o aborto tubario a la cavidad abdominal. Excepcional es que el embarazo llegue a término. Embarazo ectópico ovárico: El 50% de estos casos tienen antecedentes de infertilidad y cerca del 20%, uso de dispositivo intrauterino. Se produciría por fertilización del óvulo al salir del folículo o por un óvulo fertilizado que se cae de la fimbria. El ovario aparece ocupado por una masa hemorrágica, con vellosidades coriales y con la trompa intacta. Histológicamente se reconoce tejido ovárico en continuidad con la masa hemorrágica. 176 HistologíayCitologíaavanzadaII Embarazo ectópico intrauterino: Puede ocurrir en el cuerno uterino o en el cuello del útero. En el cuerno puede evolucionar hasta completar 12 semanas. Al romperse se puede lesionar la arteria uterina. En el cuello uterino se manifiesta como un aborto incompleto. Feto.Placenta. ►Ref.6364b. Aborto Espontáneo. Es el embarazo que termina antes de las 20 semanas de gestación, durante el aborto el feto, la placenta y el saco de líquido alrededor del feto son expulsados del útero. El aborto se presenta entre un 15-20% de todos los embarazos, el riesgo disminuye conforme el embarazo progrese, es posible que tanto como el 50% de los abortos ocurren antes de la implantación en el útero, después de la implantación la tasa de pérdida es de 30% (esto es antes de que sea reconocido clínicamente), después de ser reconocido es de 25% y disminuye dramáticamente después de las 8 semanas. Muchas son las causas de abortos las más comúnes son las anomalías cromosómicas, estas cuentan con el 50% de los casos que se producen en el primer trimestre, si el aborto se produce más tarde hay también una tasa alta de anomalías cromosómicas, 30% en el segundo trimestre y 5% en el tercer trimestre. La mayoría de las anomalías cromosómicas encontradas en los abortos espontáneos son las trisomías autosómicas (50% de los especímenes), en el cariotipo la que se ve con más frecuencia en el abortos es 45 XO, la gran mayoría de esas anormalidades genéticas son fenómenos espontáneos aislados. Se conoce bién la relación entre la edad materna y la anormalidad cromosómica, hay un aumento claro en la frecuencia de trisomías principalmente 13, 14, 15, 21 y 22 debido a la edad materna, muchos de esos embarazos terminan en abortos temprano y contribuyen, en forma importante al índice elevado de interrupciones espontáneas en esa población de pacientes. Causas anatómicas. Se estiman ser causantes de abortos recurrentes en el 15% de los casos o anomalías en la circulación como puede ocurrir en presencia de fibromiomas, pólipos y sinequias uterinas (síndrome de Asherman). Las anormalidades del útero pueden producir abortos a repetición, pueden ser congénitas o adquiridas, la congénita más común suele ser el útero doble, el segundo tipo de anormalidades congénitas se presenta por la exposición in útero a dietilestilbestrol (DES). La secuela incluye cuello uterino anormal, útero hipoplásico o en forma de T y pólipos tubarios. Entre las anormalidades uterinas adquiridas se encuentran fibromiomas, sinequias uterinas. La localización y tamaño del mioma es importante como factor pronóstico para el aborto, siendo los submucosos los más peligrosos para el aborto temprano. Causas endócrinas. El defecto de la fase lútea es el factor endócrino más común relacionado con la interrupción recurrente del embarazo, que colleva a un efecto inadecuado de la progesterona sobre el endometrio ya que la producción de esta es necesaria para conservar el endometrio y permitir que el embarazo progrese. La progesterona es producida inicialmente por el cuerpo lúteo del embarazo hasta 7-10 semanas de gestación, luego de 8-10 semanas la fuente primaria de progesterona cambia de cuerpo 177 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología lúteo del ovario a la placenta. Si la cantidad es inadecuada o no es suficientemente activa a nivel endometrial, podrían producirse interrupciones recurrentes del embarazo, esta clase de eventualidad se presenta al principio del embarazo, pudiendo relacionarse con sangrado prolongado en forma de goteo. Se calcula que la frecuencia del defecto es de 35% en los abortos a repetición. La forma de diagnosticar la deficiencia es mediante la biopsia de endometrio obtenida dos a tres días antes de la menstruación esperada. El diagnóstico se establece cuando el desarrollo histológico de la muestra de la biopsia antecede a la fecha menstrual por un lapso superior a 48 horas. Se propuso utilizar los niveles séricos de progesterona durante los días 19, 21 y 24 de la fese lútea, si la progesterona total es menor de 15 ng/ml se sospecha una fase lútea inadecuada. Si se considera una producción inadecuada de progesterona durante la fase lútea del ciclo menstrual, la progesteona ya sea oral, supositorios vaginal o inyección, así como el citrato de clomifeno en la fase folicular son opciones de tratamiento. La progesterona en el embarazo se administra hasta cerca de las 10 semanas de gestación, hasta que la placenta toma la producción de la misma. Causas inmunológicas. Estas causas no son muy comprendidas, las teorías propuestas por las autoridades en este campo están constantemente evolucionando y las mayorías han probado estar incorrectas o incompletas. Las enfermedades autoinmunes juegan un papel en más del 10% de los abortos recurrentes, varios anticuerpos se han relacionados con abortos recurrentes como los anticuerpos contra algunos fosfolípidos, en especial lupus anticoagulantes y anticardiolipinas. El síndrome Antifosfolípidos (APS) es la disfunción autoinmune que está clásicamente relacionada con abortos recurrentes. Está asociada a pérdidas de embarazos en el primer trimestre, trombosis placentaria y placentas pequeñas, la interrupción de la circulación al feto podría ser la razón para las pérdidas fetales. Finalmente una causa controversial de abortos es un desorden Allo-inmune, donde el hombre y la mujer tienen mucho material genético en común, la teoría es que el cuerpo de la madre rechaza el feto de una forma similar a como un paciente rechaza un transplante. Otras causas que pueden contribuir a los abortos son: la edad materna, hay aumento del riesgo cuando aumenta la edad materna, para mujeres de menos de 35 años la tasa de abortos es de 6.4% para 35-40 años es de 14.7% y sobre los 40 años es de 23.1%. Enfermedades maternas debilitantes compromete la función reproductiva ya sea, a través de una disfunción anovolulatoria o un desorden inmunológico. Las mujeres con Diabetes Mellitus insulinodependiente que tienen poco control, tienen una tasa alta de abortos espontáneos mientras que las controladas no tienen un aumento el la tasa. El tabaco está asociado a un aumento de abortos cromosómicamentes normales implicando un efecto directo en el feto en el 30-50% de los casos, aún después de corregir el factor socioeconómico. Toxinas industriales y ambientales asociadas con abortos incluyen el arsénico, benzeno, óxido etileno, formaldehido y el plomo. Hay interés con relación a los gases anestésicos y abortos cuyos hallazgos en la literatura hacen prudente evitar exposiciones intensas. 178 HistologíayCitologíaavanzadaII Las radiaciones durante estudios diagnósticos con un total de exposición de menos de 10 rads se cree que confiere un pequeño aumento en el riesgo de abortos espontáneos. El aborto es común y puede ser causado por muchas causas. Afortunadamente, hay cerca de un 90% de probabilidad de que el próximo embarazo siguiente a un aborto sea normal, pacientes que tienen abortos recurrentes pueden ser tratadas exitosamente y ser capaz de llevar un embarazo al término. Examen Interno: Tras la apertura de las cavidades, la técnica autópsica en pediatría sólo se diferencia de la usada en el adulto en que hay que realizar una meticulosa y ordenada observación in situ antes de eviscerar. Hay que constatar que todos los órganos del tórax y abdomen están presentes (sin olvidar el diafragma) y, que la forma, el tamaño, y la posición de los mismos es la adecuada. Esta primera fase es muy importante pues nos indica si hay que usar, además del método habitual de extracción monobloque (Rokitansky), alguna técnica especial; p.e., si se sospecha malformaciones obstructivas de la vía urinaria hay que extraer también la uretra prostática y peneana en el mismo bloque que los riñones, uréteres y vejiga; o ante un mielomeningocele con sospecha de hipoplasia de fosa posterior y descenso del cerebelo es recomendable realizar la apertura posterior de todo el canal raquídeo. Los órganos, tras la disección, son observados (y fotografiados si presentan anomalías) externamente y al corte, y luego pesados en una báscula con precisión en gramos. Estos pesos hay que compararlos con los esperados en las tablas de normalidad según edad gestacional y peso, para detectar desviaciones de la normalidad. Es recomendable, de manera rutinaria, perfundir con formol los pulmones por la tráquea para conseguir una buena expansión y fijación de los mismos. En caso de cardiopatía congénita, no se separa el corazón de los pulmones, sino que se perfunde el bloque cardiopulmonar con formol por la cava superior, habiendo ligado previamente la cava inferior y todos los vasos del cayado aórtico. Examen Histológico: Sirve tanto para determinar el proceso patológico (infecciones, membranas hialinas, displasias, teratomas, enfermedades de depósito, etc.), como para evaluar si el desarrollo y crecimiento de los órganos es el adecuado a la edad gestacional, por lo tanto, se debe realizar de todos los órganos sin olvidar el estudio del hueso con placa de crecimiento (tibia y costillas), la piel o el músculo estriado. Es cierto que, salvo en aquellas situaciones en que su uso es imprescindible para catalogar el proceso de la enfermedad, el estudio histológico en la autopsia fetal tiene menos importancia que el examen macroscópico. En un muerto anteparto en el que no se han encontrado alteraciones macroscópicas ni radiológicas, el examen histológico fundamental suele ser el de la placenta y no el del niño. Se podría pues, en estos casos, seleccionar, y así reducir, los órganos a estudiar microscópicamente. Sin embargo, nos parece más recomendable estudiar la totalidad de los mismos, por el interés docente que tiene para los más jóvenes el conocer las modificaciones de cada órgano según la edad gestacional. 179 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Existe la opinión de que el estudio histológico no sirve cuando el niño está macerado. Es éste un prejuicio falso porque la estructura general de los tejidos se conserva por mucha autolisis que exista y, una vez que se adquiere el hábito de conocer cómo son los tejidos sin muchos detalles citológicos, sirve para descartar la existencia de anomalías estructurales o para constatar, p.e., la presencia de infecciones, de aspiración de líquido amniótico, de calcificaciones viscerales, etc. Es particularmente importante, en definitiva, para confirmar o no la normalidad estructural. GestaciónMúltiple.Placenta. Ref.6069b. Definición: Es el desarrollo simultaneo de varios fetos. La especie humana e unípara por excelencia por ello todo embarazo multiple debe ser considerado patológico. Frecuencia: 1 de cada 80-120 nacimientos. Su frecuencia ha aumentado por introducción de inductores de la ovulación y fertilizacion in vitro. La Morbimortalidad perinatal es 4 veces más en embarazo dobles que en los únicos. Hay dos Tipos de Embarazos múltiples: Bivitelinos y Univitelinos: 1. Bivitelinos (bicigótos) provienen de la fecundación de dos óvulos distintos. 2. Univitelinos (monocigótos) tienen su origen en un solo óvulo. 1. Bivitelinos (Gemelos desiguales o fraternos): Frecuencia del 75%, se originan del estallido de 2 óvulos en el mismo ciclo ovárico, frecuentemente es por que 2 folículos produjeron 2 óvulos ocasionalmente se da que 1 folículo produzca los dos. - Si los óvulos son fecundados en un mismo coito se denomina Impregnación. - Si los óvulos son fecundados en dos coitos diferentes Subimpregnación. - Si en la Subimpregnación los dos óvulos son del mismo ciclo Superfecundación. - Si los óvulos son de diferente ciclo Superfetación. Bivitelinos (bicigótos): - No son geneticamente identicos - Pueden ser de diferente sexo - Pueden presentar enfermedades connatales diferentes - Poseen cada uno sus membranas ovulares propias (2 cav, amniotica, tabique con 2 corion y 2 amnios) Circulación de cada uno independiente Etiología: es hereditaria estas madres con parto gemeelar bicigoto tienen 2-4 veces mas probabilidad de repetir este fenómeno.Frecuente en la raza negra, muy rara en la amarilla. 180 HistologíayCitologíaavanzadaII 2. Univitelinos (Gemelos identicos o monocogotos). Frecuencia del 25% se originan de la separacion de un solo ovulo fertilizado en dos masas de material embrionario, la separacion incompleta da origen a los siameses. - Son del mismo sexo - Son semejantes entre si física y psíquicamente - Serologia idéntica - Deformidades idénticas Pueden tener 1 o 2 placentas, 1 o 2 corion y amnios (según la edad embrionaria que se produzca la separación). Si la separación se da el 1er día de gestación se forman 2 placentas, 2 coriones, 2 amnios. Bicorionicos Y Biamnioticos, 30% de los univitelinos. Si la separación ocurre antes del 7mo día,(antes de la diferenciacion del amnios) se presenta 1 placenta, 1 corion pero 2 amnios. Monocorial y biamniotico 70% de los univitelinos se da así. Si la separación se lleva acabo entre el 7mo y 13vo día se forma un embarazo univitelino con 1 solo coriom 1 solo amnios y 1 sola placenta. Si la separación se hace despues del dia 13 aparecen las monstruosidades siameses. Toracopago 40% unidos por el torax. Onfalopago 35% unidos por el abdomen. Pigopagos 18% unidos por las nalgas. Craniopago 2% unidos por la cabeza. Isquiopago 6% unidos por el isquion. Etiología: los fetos univitelinos aparecen en todas las razas y son independientes de la herencia. Pueden tener cordones independientes o adherencia entre ambos Puede existir anastomosis entre las circulaciones de ambas placentas, sin las presiones son semejantes en ambas circulaciones (arteria-arteria) no se influyen entre si. Pero si las presiones son distintas (anast, vena-arteria) si se influyen produciendo El Síndrome Transnacional, donde tendremos un feto grande y pletorico (transfundido) y otro pequeño e hipotrofico (feto trasfusor). Al principio del embarazo por casos muy acentuados puede nacer un feto acardico o acardiocefalo. Frecuentemente el feto transfusor muere se momifica y adopta carácter papiraceo (feto papiraceo). Diagnostico diferencial entre univitelinos y bivitelinos: Observacion del sexo de los neonatos y sus membranas ovulares: - Univitelinos bivitelinos. - Igual sexo igual o diferente sexo. - 1 placenta 1 corion 2 coriones 2 placentas. - Igual grupo Sanguineo diferente grupo sanguíneo. - Igual HLA diferentes HLA. - Analogia polosignologica no hay analogía polisignologica. 181 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Gemelos dicigóticos: Dos cigotos completamente distintos, hay dos oocitos que van a ser fecundados por dos espermios, en estos casos se pueden tener dos individuos iguales o distintos, dos hombres o dos mujeres, son genéticamente diferentes. Fueron fecundados el mismo día, entran a la cavidad uterina en forma separada, son dos blastoquistes separados, y se implantan en forma separada, cada embrión va a tener su propio amnios, corion, y placenta. Puede ocurrir que los dos embriones queden muy juntos en el sitio de implantación, y se pueden unir las placentas; la fusión de las placentas no tiene ningún problema si ambos embriones son del mismo sexo, pero si son de distinto sexo, y al compartir la misma sangre, se puede producir la masculinización del embrión hembra por el paso de hormonas a través de la placenta, este fenómeno es más frecuente en animales, pero no es imposible que ocurra en humanos. Gemelos monocigóticos: Vienen de un oocito fecundado por un espermio, el cigoto, se divide en blastómeras, son estas blastómeras las que se separan y forman cada una un cigoto diferente y da origen a un individuo completo. Incluso se puede llegar al estado de mórula y al dividirse ésta de igual forma se obtienen dos individuos completos, se obtienen dos individuos completamente separados, la zona pelúcida tiende a desaparecer en el momento de la implantación y estos individuos que venían “juntos” se separan y se desarrollan sin problemas, pues los dos blastoquistes se formaron antes de la implantación. Se implanta en la pared posterosuperior o anterior, pero nunca en la lateral, pues no hay suficiente espacio. Se tienen dos individuos, con dos amnios, dos coriones y dos placentas. Si se unieran las placentas no habría ningún problema, pues los individuos al ser monocigóticos son del mismo sexo. Puede ocurrir que un feto sea aplastado por el otro, uno predomina respecto al otro, entonces nace uno más grande que el otro. Gemelos provenientes del mismo blastoquiste: El blastoquiste se divide y se forman dos individuos diferentes, comparten el corion y la placenta, no así el amnios. Al estar tan juntos, la zona central el amnios no queda sostenida por el corion, y al ser el amnios una delgada membrana puede romperse, entonces, se fusionan los amnios, y se desprenden las bridas, fibras del amnios, que pueden estrangular alguna parte del feto (dos gemelos monoamnióticos dentro de la misma bolsa coriónica afectados por fuerzas mecánicas). En este caso es más frecuente que el feto que quede en mejor posición aplaste al otro. Un embrión se puede dividir en dos hasta la etapa de blastoquiste tardío, incluso un poco después, cuando ya se ha formado el embrión bilaminar. A pesar de que en esta etapa los dos nudos trofoblásticos no se separen completamente, se obtienen dos embriones bilaminares, que tienen un amnios, un corion y una placenta, al igual que el que se forma en blastoquiste tardío. Pueden nacer sin problemas, pero también puede ocurrir papiráceo (que uno salga medio “arrugadito”, pues fue aplastado por el otro), uno de mayor porte que el otro o que nazcan siameses. En los siameses no se separan completamente los nudos embrionarios, quedan semiunidos, esto ocurre solo en embriones monocigóticos y al estado de blastocito tardío. 182 HistologíayCitologíaavanzadaII Clasificación de siameses: Corioangiófago: Son hermanos de corion. Puede ocurrir que estos hermanos de corion no se desarrollen en forma óptima y solo formen masas amorfas, como los amorfos (valga la redundancia), acárdicos, acéfalos y acórneos (parecen masas tumorales). Llitopedios o papiráceos: monocigóticos. Catadídimos: desdoblados por anterior, es decir, unidos por abajo. Anadídimos: desdoblados por posterior, es decir, unidos por arriba. (Poseen una cabeza, pero dos extremidades). Anacatadídimos: desdoblamiento anterior y posterior. Unidos por la parte central, son los más frecuentes. Parasitarios: uno de los fetos se desarrolla completo y normal, y el otro feto no se desarrolla, pues parte del cuerpo de este último queda unido al otro, y el feto que logró desarrollarse nace con parte de su hermano pegado. (Por ej. las piernas pegadas al abdomen del feto sano). Pueden ser heterotóracopago o heterotóracoadelfo, que es lo mismo (hetero porque son distintos, tóraco porque están unidos por el tórax y adelfo o pago, ambos sinónimos de hermano) Infarto.Placenta. ►Ref.5241b. El infarto es la degeneración y muerte de un tejido y su reemplazo con tejido cicatrizal. A medida que avanza el embarazo se van formando pequeños depósitos amarillentos de fibrina (una proteína fibrosa) producidos por la interferencia con la circulación materna. Por lo general, el feto no se ve afectado por los infartos placentarios, a menos que el proceso sea extenso. En los embarazos normales, las arterias espirales aumentan su diámetro. El endotelio es reemplazo por trofoblasto. La lámina elástica interna y la muscular de la media son reemplazadas por trofoblasto y una matriz amorfa de fibrina. Estos cambios ocurren originariamente en la porción decidual de las arterias espirales, pero se extienden al miometrio a medida que avanza el embarazo, pudiendo llegar incluso a la porción distal de la arteria radial uterina. Se trata de una degeneración fibrinoide del trofoblasto, calcificación e infarto isquémico por oclusión de las arterias espiraladas. Su etiología se halla en cambios asociados con el envejecimiento del trofoblasto y deterioro de la circulación uteroplacentaria. Durante la segunda mitad de la gestación comienza la degeneración sincitial y se forman los nudos sincitiales. En general el estroma vellositario sufre hialinización, luego el sincitio puede romperse y exponer el tejido conectivo directamente a la sangre materna formándose los coágulos y su propagación puede provocar la incorporación de otras vellosidades. Alrededor de la placenta de término existe una zona de degeneración y necrosis (infarto marginal). Por debajo de la placa coriónica se depositan los infartos subcoriónicos Las arterias basales no se encuentran afectadas. Estos cambios morfológicos se consideran como reacción vascular al trofoblasto, que resulta en un aumento de la perfusión del sitio placentario. 183 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología En los vasos de las mujeres con preeclampsia estos cambios fisiológicos no ocurren o están limitados sólo a la porción decidual de ellos. Los segmentos miometriales de las arterias espirales conservan las características no grávidas de la intima y la muscular y su diámetro no es más del 40% de los vasos de embarazos normales. Más aún, algunas arteriolas espirales, basales y radiales en decidua y miometrio están afectadas por una lesión llamada Aterosis Aguda. Los vasos afectados están necróticos y los componentes normales de la pared vascular están reemplazados por material amorfo y células espumosas. Esta lesión se aprecia más claramente en las arterias basales, dado que estas no sufren los cambios normales del embarazo. También está presente en arterias espirales deciduales y miometriales y puede llevar a la oclusión del vaso. Los vasos obliterados corresponden a áreas de infarto placentario. Aunque algunos creen que estos cambios ocurren sólo en preeclampsia, otros sostienen que se presentan también en embarazo que cursan con RCIU sin evidencia de preeclampsia. Alteraciones similares se observan en algunas embarazadas diabéticas. Trombosis.Placenta. ►Ref.5238b. Se denominan así a aquellas enfermedades que son causadas por la formación de un coágulo que no puede ser disuelto y que queda en el vaso sanguíneo de manera constante interrumpiendo la correcta circulación de la sangre e impidiendo, por tanto, el suministro correcto de oxígeno y nutrientes a los tejidos irrigados por ese vaso. Al coágulo que bloquea el flujo sanguíneo se le denomina trombo. Puede haber distintos tipos de enfermedades trombóticas dependiendo de su localización. Por ejemplo, existe la trombosis venosa y la trombosis arterial, que se diferencian por la localización del trombo bien en la circulación venosa (de bajo flujo y presión), bien en la arterial (de alto flujo y presión), respectivamente. La trombosis venosa, a su vez, puede encontrarse en la circulación profunda, generalmente de extremidades inferiores (trombosis venosa profunda), en la circulación superficial de piernas (tromboflebitis), a nivel de las venas que irrigan la retina (trombosis retiniana) o en venas que nutren el cerebro (accidente cerebro-vascular). Una complicación muy frecuente de la trombosis venosa es la formación de émbolos o trombos en movimiento, es decir, el fenómeno por el que el trombo se mueve desde su lugar de formación hacia otra zona de la circulación, alojándose en un vaso sanguíneo donde impide la circulación de la sangre. A este fenómeno se le denomina tromboembolismo o enfermedad tromboembólica, siendo la más frecuente la de localización pulmonar: tromboembolismo pulmonar. En cuanto a la trombosis arterial, uno de los lugares más frecuentes de localización es en las arterias coronarias, los vasos que irrigan y nutren al corazón, de manera que si se produce un trombo a este nivel obstaculizando el flujo sanguíneo y, por tanto, la oxigenación del músculo cardíaco, se producirá una angina de pecho (bloqueo de oxigenación de una zona del corazón sin muerte del tejido cardiaco) o un infarto de miocardio, donde el bloqueo de la oxigenación del músculo cardiaco es permanente provocando la muerte de una zona del mismo. 184 HistologíayCitologíaavanzadaII Aunque existen algunas diferencias en la composición del trombo venoso o del trombo arterial, los mecanismos que ponen en marcha su formación son los mismos. Trombosis en la circulación úteroplacentaria, con la consiguiente inadecuada perfusión sanguínea que lleva a una placentación anómala en el embarazo inicial y posteriormente al infarto placentario. Los pacientes con aPL también presentan evidencia de vasculopatía de las arterias espirales, "aterosis aguda". Los mecanismos patogénicos para la trombosis placentaria son: - Interferencia con fosfolípidos endoteliales y plaquetarios. - Hiperagregabilidad de la membrana plaquetaria inducida por aPL. - Interferencia con la síntesis endotelial de prostaciclina. - Síntesis endotelial incrementada del factor de Von Willebrand y del factor activador plaquetario. - Inhibición de la actividad anticoagulante de las proteínas C y S, y/o antitrombina III sobre los fosfolípidos endoteliales. - Deterioro de la fibrinolísis. Las pacientes presentan episodios de oclusiones de vasos arteriales y venosos, trombóticas y no inflamatorias. Son de grandes vasos como en las trombosis arteriales y venosas profundas de las extremidades y de pequeños vasos en el corazón, retina, hígado, riñón, cerebro; también hay enfermedad hepática venooclusiva, infarto de la suprarrenal e hipertensión pulmonar. Puede ser una enfermedad catastrófica. Abortos recurrentes: Existe una relación estrecha entre la presencia de anticuerpos antifosfolípidos, ACL o anticoagulante lúpico, con pérdidas fetales espontáneas. Los títulos altos de ACL se asocian con mayor riesgo. Las pérdidas fetales son más frecuentes en el 1º y 2º trimestre de embarazo. En el examen de anatomía patológica de esas placentas se observan las vellosidades hipertróficas, trombosis, infartos y endarteritis obliterativas. Trombocitopenia: Es leve, de 70.000 a 120.000 plaquetas por mm3, benigna, y no requiere terapia específica. Livedo reticularis: En la piel se observa un infiltrado solevantado con la apariencia de una red de color azul en piernas, muslos y antebrazos. InserciónVelamentosadelCordónUmbilical. ►Ref.6158b. Normalmente, las venas del feto van de la parte media de la placenta por medio del cordón umbilical hacia el feto. La inserción velamentosa se refiere a que las venas, no protegidas por la sustancia gelatinosa Wharton, cruzan las membranas antes de reunirse en el cordón umbilical. - Inserción marginal: (placenta en raqueta). - Inserción del cordón en el margen placentario. - Inserción velamentosa: 185 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los vasos umbilicales se separan en las membranas a cierta distancia del margen placentario, el que ellos alcanzan rodeados sólo por un pliegue de amnios. Se observa en ± 1% de los partos simples pero con mucha más frecuencia en los gemelares y casi siempre es de regla en los partos triples. Vasa previa: Se asocia con inserción velamentosa cuando alguno de los vasos fetales en las membranas, cruzan la región del orificio cervical interno y ocupan una posición por delante de la presentación. A veces estos vasos pueden visualizarse en forma directa por amnioscopía o pueden ser observados por ecografía. Existe el peligro potencial considerable para el feto, ya que la rotura de membranas puede acompañarse de la rotura de un vaso fetal lo que causa anemia aguda del feto. InclusiónTrofoblástica.Placenta. ►Ref.5140b. La proliferacion excesiva y agresiva de trofoblasto ya sea benigna o maligna es una complicación inusual del embarazo. Pero si se produce adquiere un carácter dramático. La enfermedad trofoblástica gestacional se caracteriza por la proliferación anormal o atípica de las células sinticiales y de Langhas de origen ecto dérmico fetal. Estas neoplasias, se originan en los elementos trofoblasticos del blastocito en desarrollo y conserva ciertas características de la placenta normal. Como tendencias invasoras y capacidad de síntesis de la hormona polipeptidica, gonadotropina corionica humana. Clasificación morfológica de la enfermedad trofoblástica: Hidatidiforme: Constituye aproximadamente el 80% de los tumores del trofoblasto. Es un embarazo intrauterino, excepcionalmente extrauterino, en el que las vellosidades coriales están dilatadas formando quistes. Macroscópicamente aparece como un tejido esponjoso, trabecular, lleno de coágulos y vesículas independientes, de tamaño variable, hasta 2cm de diámetro y que se asemajan a granos de uva. Las vellosidades se presentan con grados variables de proliferación del citotrofoblasto y sinciciotrofoblasto. El embrión puede o no estar presente. Mola hidatidiforme invasora: Constituye aproximadamente el 15% de los tumores del trofoblasto. Es una mola hidatidiforme en la que se reconoce invasión del miometrio en una muestra obtenida por raspado endometrial o histerectomía. Coriocarcinoma: Constituye aproximadamente el 5% de los tumores del trofoblasto. Es un tumor epitelial puro constituido por células de citotrofoblasto y sinciciotrofoblasto. No hay estructuras vellosas. Se observan en forma variable áreas necróticas que pueden estar ausentes. Cuando se presenta en una placenta de término se puede confundir con un infarto placentario. Las raras veces en que se presenta en la trompa, puede simular un embarazo tubario ya que al igual que éste, tiene aspecto de masa hemorrágica y friable. Se calcula que el coriocarcinoma proviene la mitad de las veces de una mola hidatidiforme en un 25% de la placenta de un embarazo de término y en el otro 25% de un aborto. 186 HistologíayCitologíaavanzadaII La enfermedad trofoblástica del embarazo constituye un espectro de tumores y procesos afines, a los tumores que se caracterizan por la proliferación de tejido trofoblástico asociado al embarazo con posibilidades de un empeoramiento maligno. Estas lesiones comprenden a la mola hidatiforme (Parcial o completa). La mola invasora y el codiocaranoma el cual es una lesión frecuentemente maligna y dependiendo de sus características será su manejo y pronóstico. La confirmación diagnóstica es siempre con un estudio biópsico del material obtenido por evacuación uterina y/o raspado (Mola hidatidiforme, Mola invasora, Coriocarcinoma, Tumor del sitio de inserción placentaria). Sin embargo, el diagnóstico patológico no siempre es seguro. Hay casos en que la microscopía no es evidente. En este grupo se incluyen especialmente aquellos casos de restos de aborto con la denominada "degeneración hidrópica de las vellosidades". Estos en realidad no corresponden a una ET si no a restos de aborto retenidos, edematosos por fenómenos inflamatorios. Ante un diagnóstico patológico más bien descriptivo como: "degeneración hidrópica de las vellosidades coriales", "hiperplasia del estroma trofoblástico", "hiperplasia trofoblástica", hiperplasia de las vellosidades", etc., el clínico debe considerar la posibilidad de que realmente se trate de una ET. Se deberá realizar un seguimiento del marcador HCG hasta su desaparición. Si se detecta una curva de HCG anormal, se estará frente a una ET persistente. MolaHidatidiforme.Placenta. ►Ref.5384b. La mola hidatiforme es un espectro de alteraciones caracterizadas por una proliferación anormal del trofoblasto. Es una degeneración quística de las vellosidades coriónicas. En ocasiones, puede presentarse con feto con crecimiento retardado y múltiples anomalías, incluyendo sindactilia e hidrocefalia. Una mola hidatiforme (también llamado embarazo molar) significa que se ha llevado a cabo la unión del esperma y el óvulo, pero no se está desarrollando un feto en el útero. Microscopicamente se observan restos deciduocoriales que se caracterizan por presentar dos poblaciones de vellosidades. Una constituida por vellosidades pequeñas, fibrosas y la otra caracterizada por vellosidades edematosas, de mayor tamaño, de bordes irregulares. Ocasionalmente en algunas de las vellosidades de mayor tamaño se aprecian inclusiones trofoblásticas y múltiples focos de trofoblasto en su superficie. No hay atipia celular. Algunas vellosidades suelen presentar pequeños vasos de tipo capilar y hematies nucleados de origen fetal. Es la enfermedad trofoblástica más frecuente. Aparece entre 11 y 25 semanas de embarazo, en promedio, a las 18 semenas. Ocurre en 1/2.000 embarazos. Es más frecuente en el Oriente. El riesgo de que ocurra esta enfermerdad es mayor en embarazadas menores de 15 años y mayores de 40. El útero se encuentra aumentado de tamaño difusamente, la mayoría de las veces, el aumento de tamaño es de mayor grado que el que corresponde a la edad gestacional, pero en 1/3 de los casos el útero es pequeño. Macroscópicamente se aprecia tumefacción quística de las vellosidades, agrupadas en masas como racimo de uvas. 187 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Un diagnóstico diferencial importante es entre mola y aborto hidrópico con edema villositario. El dato microscópico más útil para separar ambas entidades es la distribución del trofoblasto en la superficie de las vellosidades. En la mola, al menos algunas vellosidades muestran hiperplasia circunferencial de trofoblasto en su superficie, mientras que en el aborto hidrópico el trofoblasto tiene una distribución polar. Ya que la hiperplasia trofoblástica puede ser focal y limitada, sobre todo en el caso de la mola parcial, puede ser necesario realizar corte seriados para encontrarla. Los abortos hidrópicos pueden ser diploides, triploides o aneuploides, por lo que el analisis de la ploida no aporta información para diferenciarlos de la mola. En la mayoría de las ocasiones la muestra de legrado de un aborto hidrópico ocupa uno o dos cassettes de inclusión mientras que en el legrado de una mola produce una muestra más voluminosa. Histológicamente los elementos diagnósticos principales son: edema de las vellosidades y proliferación del trofoblasto, éste con diversos grados de atipias nucleares. Se reconocen los tres tipos de trofoblasto. Las vellosidades tienen un estroma con canales dilatados (cisternas), en el 90% de los casos ellas son avasculares y son de contornos irregulares. Así, todas o la mayoría de las vellosidades están edematosas. La proliferación del trofoblasto es difusa (hay elevada concentración de gonadotrofina coriónica en la sangre). Existe el riesgo de hipertensión arterial precoz del embarazo (preeclampsia). Clasificación citogenética de la mola hidatidiforme: 1. Completa, clásica o anembrionada: Tiene un cariotipo diploide, con ambas dotaciones cromosómicas de origen paterno. Se desarrolla a partir de un óvulo anucleado o con un núcleo inactivo, que es fertilizado por un espermio que duplica su material cromosómico o por dos espermios diferentes. Las molas completas son XX en un 90% y XY en el 10%. Características morfológicas: - No se le reconocen tejidos embrionarios o fetales. - Alteraciones morfológicas se presentan en todo el tejido trofoblástico es decir, en forma difusa o "completa" - Proliferación excesiva del cito y sinciciotrofoblasto (hiperplasia del trofoblasto). - Vellosidades coriales dilatadas con formación de cisternas. - Pleomorfismo nuclear aumentado. - Vasos sanguíneos en las vellosidades están ausentes o colapsados y siempre vacios, lo que sugiere la ausencia de feto y circulación fetal. 2. Mola incompleta, parcial o embrionada: Tiene generalmente un cariotipo triploide (69XXY, 69XYY). La dotación haploide extra, proviene generalmente del padre. El embrión fallece en general antes de la décima semana de gestación. Si sobrevive se trata de mosaicos que puede tener malformaciones múltiples, más frecuentemente aquellas relacionadas con trisomías como hidrocefalia, malformaciones cardíacas, malformaciones urinarias, sindactilia, microftalmia y retardo de crecimiento intrauterino. Generalmente no evolucionan a formas malignas. 188 HistologíayCitologíaavanzadaII Características morfológicas: Se reconoce directa o indirectamente la presencia de un embrión o feto. Alteraciones morfológicas se ven en algunas zonas del tejido trofoblástico. La proliferación del estroma y la formación de cisternas (vellosidades dilatadas) es igual que en la mola completa. Presencia de vasos sanguíneos que contienen glóbulos rojos nucleados (fetales). Vellosidades con borde dentado. Etapas del tumor trofoblástico de gestación: Una vez detectado el tumor trofoblástico de gestación, se harán más pruebas para determinar si el cáncer se ha diseminado desde el interior del útero a otras partes del cuerpo (clasificación por etapas). Las siguientes etapas se emplean para la clasificación del tumor trofoblástico de gestación: 1. Mola hidatiforme: El cáncer se encuentra sólo en el espacio dentro del útero. Si el cáncer se encuentra en el músculo del útero, se denomina una mola invasora (coriocarcinoma destruens). 2. Tumor trofoblástico de gestación de sitio placentario: El cáncer se encuentra en el lugar donde estaba conectada la placenta y en el músculo uterino. - No metastático: Crecimiento de células cancerosas dentro del útero a partir del tejido que ha quedado después del tratamiento de una mola hidatiforme o después de un aborto o parto. El cáncer no se ha diseminado fuera del útero. Metastático, pronóstico favorable: Crecimiento de células cancerosas dentro del útero a partir del tejido que ha quedado después del tratamiento de una mola hidatiforme o después de un aborto o parto. El cáncer se ha diseminado del útero a otras partes del cuerpo. Los tumores trofoblásticos de gestación metastáticos se pueden considerar de pronóstico favorable o de pronóstico grave. El tumor trofoblástico de gestación metastático se considera de pronóstico favorable, si se presentan todos los siguientes factores: 1. Su último embarazo fue hace menos de 4 meses. 2. El nivel de beta gonadotropina coriónica humana (HCG) en la sangre es bajo. 3. El cáncer no se ha diseminado ni al hígado ni al cerebro. Usted no ha recibido quimioterapia anteriormente. 189 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología - Metastático, pronóstico grave: Crecimiento de células cancerosas dentro del útero a partir del tejido que ha quedado después del tratamiento de una mola hidatiforme o después de un aborto o parto. El cáncer se ha diseminado del útero a otras partes del cuerpo. Los tumores trofoblásticos de gestación metastáticos se consideran de pronóstico favorable o de pronóstico grave. El tumor trofoblástico de gestación metastático se considera de pronóstico grave, si se presenta alguno de los siguientes factores: 1. Su último embarazo fue hace más de 4 meses. 2. El nivel de beta gonadotropina coriónica humana (BHCG) en la sangre es alto. 3. El cáncer se ha extendido al hígado o al cerebro. 4. Usted recibió quimioterapia previamente, y el cáncer no desapareció. 5. El tumor apareció después de haber tenido un embarazo normal. 3. Recurrente: La enfermedad recurrente significa que el cáncer ha vuelto a aparecer (recurrido) después de haber sido tratado. Puede volver a aparecer en el útero o en otra parte del cuerpo. El cariotipo en la mola es diploide, 44XX, con todo el material cromosómico derivado de espermatozoides (androgénesis): fertilización por un espermio 22X de un óvulo con cromosomas ausentes o inactivados. Rara vez hay fertilización por dos espermios, cada uno 22X. El embrión muere precozmente y generalmente no se reconoce embrión. Mola parcial o incompleta: Constituye alrededor del 30% de los embarazos molares. El útero rara vez está aumentado de tamaño, la preeclampsia es menos frecuente y más tardía, el alza de las gonadotrofinas es menor. Entre las vellosidades alteradas hay vellosidades normales. Las alteraciones son edema de las vellosidades y proliferación focal del trofoblasto. Las vellosidades tienen contornos muy irregulares, con hendiduras, y frecuentemente hay brotes de trofoblasto inmersos en el estroma y sin conexión con el de la superficie. Estas alteraciones también se encuentran en abortos con cariotipo triploide. El trofoblasto presenta escasas atipias. El cariotipo de esta mola es triploide: 66XXY, resultante de la fertilización de un óvulo 22X (con el material cromosómico completo) por dos espermios (22X y 22Y). El embrión es viable algunas semanas. Histológicamente pueden encontrarse partes del embrión y eritroblastos en las vellosidades.El 8 a 40% de las molas en general pueden progresar a molas invasoras y el 2,5%, a coriocarcinomas. No hay correlación entre el grado de atipia nuclear y el riesgo de progresión de la enfermedad. Se acepta que este riesgo es mayor en las molas completas que en las parciales, en esta última el riesgo alcanzaría a sólo 4%.Mola invasora: Se manifiesta principalmente en la invasión del miometrio por vellosidades completas, también pueden estar comprometidos los parametrios. Hay proliferación del citotrofoblasto y del sinciciotrofoblasto y concentración elevada de gonadotrofina coriónica en la sangre. También se reconoce trofoblasto 190 HistologíayCitologíaavanzadaII intermedio. En alrededor de un 30% de los casos se producen embolias de vellosidades al pulmón o cerebro, pero no se desarrollan como metástasis tumorales. La mortalidad se debe fundamentalmente a complicaciones locales, como ruptura uterina. En la mola invasora existe mayor riesgo de que se desarrolle un coriocarcinoma que en las molas no invasoras. PlacentaMonocoriónicaMonoamniótica ►Ref.6365b. Se entiende por serie teratológica un conjunto de anomalías que pueden concebirse como variantes de un mismo tipo fundamental. Los miembros de la serie están relacionados entre sí por su forma visible, por su configuración. Para definir una serie basta por tanto una relación puramente formal. La importancia de este concepto radica en que entre los miembros de la serie también puede existir una relación patogenética y en tal caso pueden ser explicados por la perturbación, de diverso grado, de un mismo proceso. En un extremo de la serie se tiene entonces la anomalía más tardía y leve; en el otro, la más temprana y grave. El punto inicial del período teratogenético de la más temprana y el punto final de la más tardía, definen el período teratogenético de la serie. La mayor parte de las series teratológicas se caracterizan porque entre dos miembros cualesquiera es concebible una anomalía de transición. Estas series densas se presentan así como un espectro casi continuo de anomalías e indican que el proceso subyacente que se perturba es de carácter continuo. Un ejemplo es la serie de malposiciones de los grandes vasos del corazón, entre ellas la transposición arterial, que se explican por detenciones en diverso grado de la rotación vectorial del bulbo. Otras series son discretas, discontinuas, sin transiciones posibles. Un ejemplo es la de los mellizos monozigóticos en cuanto a la disposición de las membranas: monocoriales monoamnióticos, monocoriales diamnióticos y dicoriales diamnióticos. La perturbación consiste aquí en la separación de la masa embrionaria, y según el momento en que ocurra se dan las variantes indicadas. La discontinuidad se expresa en que es posible caracterizar cada miembro por números enteros (mono-mono, mono- di, di-di). Los gemelos monozigóticos se originan por despegue de algunas células aún totipotentes del embrión hasta el estadío de mórula (dentro de los primeros 3 - 4 días de vida) tendrán cada uno su propio corion y su propia placenta: son los gemelos llamados dicoriales. Cuando, en cambio, tienen origen en la constitución de dos diferentes masas celulares internas en el mismo blastocisto, ellos compartirán en todo caso el mismo corion y la misma placenta, pero podrán crecer en dos sacos amnióticos diferentes (gemelos monocoriales diamnóticos) si la separación de los dos planos de desarrollo ha ocurrido antes del inicio de la formación del amnios (período de gemelación: 5º - 6º día), o bien en un único saco amniótico (gemelos monocoriales monoamnióticos) si la separación ha tenido lugar después de la formación del amnios (período de la gemelación: 7º - 8º días). Si la separación de los planos de desarrollo (discos embrionales trilaminares) es incompleta, se podrá tener aún después del 14º día de desarrollo el raro fenómeno patológico de la formación de los llamados “gemelos siameses” (más o menos 1 en 100.000 partos). 191 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología NecrosisFibrinoide.Placenta. ►Ref.5101b. Necrosis Fibrinoide: Generalidades: Proceso de inhibición intersticial por diversas proteínas plasmáticas, que incluyen la fibrina, albúmina, globulinas, inmunoglobulinas, complemento... producido por un aumento de la permeabilidad vascular o por lesión vascular directa. Recibe el nombre de fibrinoide por su semejanza con la fibrina. - Eosinófila, amorfa, refringente. - Tiñe con los colorantes de la fibrina. Degeneración: Incluye todos los cambios celulares e intersticiales reversibles, secundarios a la actuación de una noxa. Necrosis: Muerte de las partes aisladas del organismo incluyendo la muerte celular y la destrucción completa de la celula. Tipos: 1. Por Lesión Inmunológica: (Depósito Ag-Ac - Lesión vascular). - Colagenosis: LED, Esclerodermina, Dermatomiositis, PAN, A.Reumatoide,... - Fenomenos de Hipersensibilidad tipo III o por inmunocomplejos. 2. Por Lesión Inmunológica: (Aumento de la permeabilidad). 2. a. Fenómenos Inflamatorios. 2. b. Fenómenos Hemodinámicas. Fisiológicos: - Degeneración Fibrinoide de la Placenta. - Estrías de Nitabuch. Patológicos. - Hipertensión Maligna. Degeneración Celular: 192 - Tumefacción turbia. - Degeneración hidrópica. - Degeneración grasa. - Infiltración de sustancias anómalas: Degeneración fibrinoide. Amiloidosis. HistologíayCitologíaavanzadaII Degeneración Intersticial: - - Alteración composición sist. Intersticial: Degeneración Mixoide. Degeneración Asbestiforme. Degeneración Gelatinosa grasa. Alteración de las fibras: Elastosis. Degeneración Hialina. La placenta humana es perfundida por numerosas arterias utero-placentarias (espiraladas) que por la acción del trofoblasto intersticial y endovascular migratorio transforman el lecho arterial uteroplacentario en un sistema de baja resistencia, baja presión y alto flujo. En el embarazo normal, la invasión desidual a cargo de las vellosidades trofoblásticas altera las arterias espiraladas, en las cuales la capa muscular y elástica es reemplazada por fibrina y citotrofoblasto, convirtiendo a estos vasos en conductos gruesos y tortuosos que aumentan la irrigación placentaria. Este proceso ocurre entre la décima (10ª) y decimo-segunda (12ª) semana de gestación. Más tarde, los cambios se extienden a los vasos miometrales hasta llegar a la porción radial de las arterias uterinas, respetando el sector basal. Esta segunda etapa de invasión trofoblástica se produce entre la 14ª y la 20ª semana. En la HIE esas modificaciones están restringidas al segmento desidual de las arterias espiraladas, mientras que el segmento miometral de las mismas conserva las fibras elásticas y musculares. Este defecto de placentación es debido a la inhibición de la segunda onda de migración endovascular del trofoblasto. Así, las arterias espiraladas miometrales conservan su capacidad de respuesta contráctil ante estímulos humorales o nerviosos. Estos cambios patológicos pueden restringir el flujo sanguíneo requerido por la unidad uteroplacentaria en los estadíos más avanzados del embarazo, implicando un aporte fijo que no responde a las demandas, con la consecuente isquemia. Esto explicaría el menor crecimiento fetal (recién nacido de bajo peso) y por ende la mayor morbimortalidad neonatal. Mediante el uso de microscopía electrónica, se afirma que el primer paso en el desarrollo de lesiones vasculares en la PE es el desgarro endotelial con daño secundario de las células miointimales. Esta lesión es finalmente complicada por una aceleración del proceso degenerativo, caracterizada por necrosis fibrinoide, presencia de lípidos y lipófagos e infiltración mononuclear perivascular (Aterosis aguda). PlacentaAcreta. ►Ref.6294b. El acretismo placentario se refiere a la invasión o penetración de la placenta más allá de la superficie endometrial del útero hacia su pared muscular o incluso hasta rebasar su recubrimiento seroso e interesar órganos vecinos como la vejiga. Esta grave 193 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología complicación no se detecta sino hasta el momento del parto o la cesárea cuando se presentan dificultades para el desprendimiento de la placenta. Dependiendo del grado de penetración (acreta, percreta o increta) y de la extensión (toda la placenta o sólo un segmento) generalmente se tiene que realizar histerectomía, es decir, extirpar el útero completo evitando tratar de despegar toda la placenta pues esto sólo producirá mayor hemorragia y agravará el problema. Afortunadamente es una complicación poco frecuente y que se presenta principalmente en los casos de placenta previa; por lo que toda paciente con placenta previa debe saber que existe el riego de esta penetración anormal de la placenta que obligue a quitarle el útero durante la cesárea. Se presentan casos en los que sin existir un problema de penetración excesiva de la placenta o acretismo, hay retención de lóbulos o de fragmentos placentarios lo cual ocasiona hemorragias severas postparto. Esto se previene o se resuelve mediante la revisión manual cuidadosa de toda la cavidad uterina después del alumbramiento. Clasificación: Según profundidad: - Acreta (endometrio) cuando la vellosidad esta firmemente unida al miometrio sin penetrar en él. - Increta (miometrio) cuando la vellosidad se introduce en el miometrio pero no lo atraviesa. - Percreta (serosa y +) cuando la vellosidad atraviesa el miometrio y llega hasta la serosa. Según extensión: - Total cuando abarca toda la superficie de la placenta. - Parcial (2 o + cotiledones) que es lo mas frecuente donde solo abarca algunos sectores. - Focal (un solo cotiledón). Etiología: Placenta previa, Raspado uterino, Cesarea anterior, Extracción manual de placenta, Implantación cornual, Endometritis, Mioma submucoso, Cirugía uterina, Malformación uterina y Sin factor predisponente. Etiopatogenia: Antecedentes de endometritis, legrado, implantación de la placenta sobre una decidua basal defectuosa o ausente. Esto ocasiona que la vellosidad corial crezca poniéndose en contacto directo con la pared muscular uterina y no existe el plano de clivaje formado por la decidua necesario para el desprendimiento. SíndromedeBandaAmniótica. ►Ref.6159b. Esto se produce cuando se forma una banda alrededor de un dedo o extremidad (brazo), provocando problemas que pueden afectar al flujo de sangre y al crecimiento normal. Las constricciones de anillo son congénitas (presentes al nacer) y se presentan en uno de cada 15.000 nacimientos de bebés vivos. Esta condición puede estar asociada con otros problemas tales como los pies zambos, el labio leporino, el paladar hendido u otras 194 HistologíayCitologíaavanzadaII anomalías craneofaciales. La causa de la constricción de anillo es desconocida. Algunas teorías sugieren que la banda amniótica puede causar constricciones de anillo alrededor de un dedo o extremidad. El síndrome de la banda amniótica corresponde a un síndrome extremadamente raro. Puede presentar defectos de localización craneofacial, visceral o en extremidades. Los defectos en extremidades son los más frecuentes y consisten en bandas de contricción digital, amputación, sindactilia, escaras, erosiones y ulceraciones cutáneas. Los defectos craneofaciales son los segundos en frecuencia y se manifiestan como anencefalia, calcificación incompleta del cráneo y deformidades faciales (surcos, deformidad nasal, microftalmia). Este síndrome es secundario a la presencia de bandas constrictoras de membrana amniótica durante el desarrollo embrionario, que impiden el desarrollo normal de las estructuras fetales. Se cree que existe una pequeña proporción de recurrencia en embarazos sucesivos En esta condición, hay cuatro grados de severidad, incluyendo los siguientes: Constricciones simples. Constricciones que provocan deformidades más allá de la constricción. Constricciones que están asociadas con la fusión de partes del dedo. Constricciones tan severas que será necesario amputar parte del dedo. Otros problemas generalizados con el sistema esquelético. RoturadelaPlacenta. ►Ref.5271b. Es la rotura de las membranas corioamnióticas antes del inicio del trabajo de parto. Generalmente se acompaña de salida de líquido amniótico (LA) por genitales. Es un evento que convierte un embarazo normal en una gestación de riesgo para la madre y para el feto. En embarazos de término se presenta en 11% de las pacientes. El 80% de éstas inician espontáneamente el trabajo de parto dentro de las 24 horas de ocurrida la rotura. La RP tiene una incidencia global de 5% y se presenta en 30% de los nacimientos prematuros2. Es de 3% luego de las 32 semanas, de 28% entre las 28 y 31 semanas y de 31% antes de la semana 283. Embriología: Al 7º u 8º día el macizo celular interno se divide en endoblasto y epiblasto. En este último se forma una cavidad tapizada por células llamadas amnioblastos que al diferenciarse constituyen las membranas amnióticas. No se sabe si los amnioblastos se originan del citotrofoblasto o del ectodermo fetal. El amnios aumenta de tamaño hasta rodear al embrión y termina uniéndose al corion en la semana 4ª o 5ª cuando desaparece el celoma extraembrionario. Amnios y corion: El amnios tiene un grosor de 0,02 a 0,5 mm y está formado por una capa de células cúbicas que descansa sobre otra capa de tejido conectivo denso rico en filamentos de colágeno y con alta resistencia. El corion suele ser más grueso, mide 0,04 a 0,4 mm de espesor, pero tiene menor elasticidad. Las membranas corioamnióticas poseen propiedades elásticas que permiten cierto estiramiento o deformidad. Aparentemente dicha condición se cumple por la existencia en cantidad suficiente de colágeno y elastina con un efecto protector dado por el surfactante 195 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología pulmonar. Si por efectos exógenos o endógenos se produce una exigencia extrema de esta propiedad de elasticidad, las membranas pueden romperse. La rotura se localiza generalmente encima del cuello por ser la zona más pobre física y nutricionalmente y estar en la zona más declive. La etiología de la RPM es desconocida en la mayoría de los casos. Sin embargo, se han identificado varias condiciones predisponentes: Alteración de las propiedades físicas de las membranas: El colágeno y la elastina jugarían un rol importante en la mantención de la integridad de la membrana corioamniótica, la que en condiciones normales exhibe un equilibrio entre actividad enzimática proteasa y antiproteasa. La literatura es consistente en señalar que las membranas de los embarazos con RPM son más delgadas y tienen menos elasticidad y resistencia que aquellas que permanecen íntegras hasta su rotura durante el trabajo de parto. Por otra parte, se ha comunicado que las proteasas locales elaboradas por fibroblastos, macrófagos y bacterias, juegan un rol en la remodelación molecular de la membrana corioamniótica. Se ha demostrado que la actividad proteasa está aumentada y que existen bajas concentraciones de alfa 1 antitripsina (A1AT) en el líquido amniótico (LA) de embarazos con RPM. Además, se ha aislado una proteína antiproteasa en orina y pulmón fetales, lo que apoya la idea de una participación fetal en la protección de la integridad de las membranas. Rol de la infección en la rotura prematura de membranas: La rotura de membranas puede resultar de una infección cérvicovaginal o intrauterina. La infección bacteriana, directa o indirectamente (vía mediadores de la respuesta inflamatoria), puede inducir la liberación de proteasas, colagenasas y elastasas, que rompen las membranas ovulares. Los gérmenes pueden alcanzar el LA estando las membranas ovulares rotas o íntegras, pero el oligoamnios favorece la colonización del LA al deprimirse su actividad bacteriostática. La vía de infección puede ser ascendente (a través del canal cervical), hematógena (transplacentaria), canalicular (tubaria) y por medio de procedimientos invasivos (amniocentesis [AMCT], cordocentesis, transfusiones intrauterinas). Infección: La infección es actualmente la causa más analizada porque se la responzabiliza de la mayor parte de los nacimientos pretérmino con y sin rotura de membranas. El mecanismo sería el mismo en ambos casos y la calidad de la membrana es la que definiría cuál se rompe y cuál no. Hay membranas que resisten la infección y terminan con un parto prematuro con bolsa íntegra, mientras que otras se rompen dando el cuadro de RP. Etapas de la infección: Los microorganismos cumplen varios pasos hasta llegar a la RP: 1. La infección cervicovaginal es generada por gérmenes que han sido encontrados posteriormente en el LA: 196 - Neisseria gonorrhoeae - Chlamydia trachomatis - Gardnerella vaginalis - Mycoplasma hominis HistologíayCitologíaavanzadaII - Ureaplasma urealítico - Trichomonas vaginalis - Candida albicans - Estreptococo grupo B - Anaerobios (Fusobacterium) - Estafilococo aureus - Herpes simple Acceden a la cavidad amniótica por: Vía ascendente desde el cérvix o la vagina. Diseminación hematógena a través de la placenta. Vía retrógrada desde el peritoneo por las trompas. Introducción accidental por procedimientos quirúrgicos. La vía ascendente es la más común y se comprueba porque: - Los gérmenes encontrados en el LA son los mismos que se encuentran en el tracto vaginal, - La corioamnionitis histológica es más frecuente en el sitio de rotura que por lo general está vecino al cuello, - En el embarazo gemelar la corioamnionitis histológica se ve sólo en el primer feto. 2. Los gérmenes producen un aumento de los macrófagos que liberan mediadores (citoquinas) generando una respuesta inflamatoria. Estos componentes pueden investigarse en: Sangre Secreciones vaginales y Líquido amniótico. Marcadores Endógnenos de la Inflamación: - Interleukina 1-2-6-8-10 - Factor de necrosis tumoral (FNT) - Factor de activación plaquetaria (FAP) - Factores estimulantes del crecimiento de colonias (CSFs) - Proteína inhibidora de macrófagos 1 alfa (MIP 1 alfa) 3. Los marcadores endógenos de la inflamación estimulan la síntesis de prostaglandinas y aumentan la actividad colagenasa y elastasa. Varios autores han demostrado que los productos bacterianos son una fuente de fosfolipasa A2 y C, pudiendo estimular también por esta vía la producción de prostaglandinas. La presencia de estos factores vuelve al útero más sensible a La ocitocina y Las prostaglandinas E2 y F2 alfa. 197 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología La consecuencia es: Daño en la membrana y Aumento de la contractilidad por la vía de la adenilciclasa. La resistencia de las membranas marcará el camino hacia una RPM o hacia un parto prematuro con bolsa íntegra. Estadíos de la infección: Son las diferentes instancias anatómicas que los gérmenes van invadiendo. Estadío I: excesivo crecimiento de gérmenes facultativos o presencia de gérmenes patológicos en cuello o vagina (vaginitis). Estadío II: los gérmenes ganan la cavidad uteina y se ubican en la decidua (deciduitis). Estadío III: los gérmenes ganan la cavidad (amnionitis), los vasos fetales (coriovasculitis) y/o el corion y el amnios (corioamnionitis). Estadío IV: los gérmenes llegan al feto (neumonitis, bacteriemia, sepsis). Condiciones clínicas asociadas: La mayoría de las "condiciones asociadas a la RPM" determinan una tensión excesiva de las membranas ovulares. Ellas son: ­ Polihidroamnios ­ Embarazo gemelar ­ Malformaciones uterinas ­ Tumores uterinos En el caso de incompetencia cervical, la exposición de las membranas a la flora vaginal y la reaccción de tipo cuerpo extraño generada por el material de sutura utilizado en su tratamiento, pueden favorecer la rotura ovular. Mecanismos similares explicarían el accidente en casos de embarazos con dispositivo intrauterino. El tabaquismo materno aumentaría el riesgo de rotura ovular a través de favorecer la quimiotaxis de neutrófilos que secretan elastasa. Inactivaría además la A1AT, fenómeno cuya intensidad se relaciona directamente con la cantidad de cigarrillos fumados. El diagnóstico es realizado la mayoría de las veces por la propia madre y certificado por el médico al observar el escurrimiento de una cantidad variable de LA por la vagina. En ocasiones es necesario recurrir a procedimientos complementarios. El primero de ellos es la especuloscopía, que permite apreciar salida de LA a través del orificio externo del cuello uterino en forma espontánea o a través de la compresión manual del abdomen materno que moviliza el polo fetal pelviano de modo de facilitar la salida de líquido. Cuando el diagnóstico es evidente, la altura uterina es menor que en los controles previos y las partes fetales se palpan con facilidad. En un número menor de casos deben agregarse a los procedimientos mencionados (anamnesis, examen físico y especuloscopía), otros que a continuación se enumeran: Cristalización en hojas de helecho: la presencia de LA en el contenido del fondo de saco vaginal permite identificar, en un extendido examinado al microscopio de luz, la cristalización característica en forma de plumas, que resulta de la deshidratación de las sales contenidas en el LA. pH del fornix vaginal posterior : el pH vaginal fluctúa normalmente entre 4,5 y 5,5, mientras que el del LA es generalmente de 7. Las membranas ovulares están probablemente rotas si el papel nitrazina señala un pH mayor o igual a 7 (viraje al color azul). 198 HistologíayCitologíaavanzadaII Detección de células de descamación: la piel fetal descama células superficiales que pueden ser detectadas con azul de Nilo al 1%. Dada la evolución de la concentración de células naranjas en el LA, el valor diagnóstico de esta prueba aumenta junto con la edad gestacional, variando desde una sensibilidad de alrededor de 20% a las 32 semanas hasta un 90% en embarazos de término. En nuestro centro no utilizamos este método. Otros: se han descrito otros métodos diagnósticos: Inyección intraamniótica de colorantes (azul de Evans o índigo carmin), cuya detección en la vagina confirma el diagnóstico. No debe usarse azul de metileno. DIAGNOSTICO DIFERENCIAL FRECUENCIA CARACTERISTICA Frecuente Flujo genital blanco amarillento, infeccioso, asociado a prurito. Incontinencia urinaria Frecuente Frecuente en segunda mitad del embarazo, especialmente en multíparas (por relajación perineal y rectocistocele). Descartar ITU. Eliminación tapón mucoso Frecuente Fluido mucoso, sanguinolento. Infrecuente Pérdida brusca de líquido cristalino por vagina. Al examen se observa cavidad pequeña en paredes vaginales (raro). Hidrorrea decidual Infrecuente Primera mitad del embarazo. Líquido claro con tinte amarillo, a veces sanguinolento. Desde espacio entre decidua parietal y refleja, que se fusiona entre las 16 y 18 semanas. Rotura de bolsa amniocorial Infrecuente Raro; de espacio virtual entre corion y amnios; se produce por delaminación de este último. Leucorrea Rotura de quiste vaginal a veces algo Nudo.Placenta. ►Ref.6133b. El cordón umbilical es un cordón blanquecino y brillante de 50-60 cm de largo y un espesor de 1 a 2 cm, con un desarrollo en espiral, que une el feto a la placenta. Contiene en su interior tres vasos: una vena y dos arterias, con la característica especial que la vena conduce sangre arterial (oxigenada) y las arterias llevan a la placenta la sangre venosa fetal (no oxigenada). Si su longitud es menor a 40 cm., se considera un cordón corto, y puede presentar dificultades en el período expulsivo (momento del parto). Cuando la longitud excede los valores normales (puede llegar a medir más de 2 metros), por los movimientos del feto pueden formarse nudos o bien dar lugar a una circular de cordón alrededor del cuello fetal. Cuando por algún factor el cordón pierde su posición habitual, puede descender hasta preceder al feto en el momento del parto, esto se conoce como procidencia del cordón (salida del cordón por el canal vaginal). 199 UNIDADDIDÁCTICAIV ESTUDIOSHISTOLÓGICOSYCITOLÓGICOSDEL SISTEMAGLANDULARENDOCRINOYEXOCRINO HistologíayCitologíaavanzadaII 4.1.TiroidesyParatiroides. TiroidesNormal. ►Ref.0793b. Las glándulas son agrupaciones celulares que segregan substancias que pueden verterse al exterior (glándulas exocrinas) o directamente a la propia sangre (glándulas endocrinas). La mama produce la leche y es una glándula exocrina y las glándulas salivares y las glándulas lacrimales y las glándulas sudoríparas lo son también. Las glándulas suprarrenales, el páncreas en parte, la hipófisis, el tiroides, son glándulas endocrinas, cuya secreción, las hormonas pasan directamente a la sangre. La Endocrinología estudia exclusivamente las glándulas endocrinas. La glándula tiroides normalmente pesa entre 20-25 grs. y se compone de dos lóbulos laterales unidos por uno medio o istmo. Un lóbulo piramidal de tamaño variable se extiende desde el istmo y representa el punto de unión del conducto tirogloso. La consistencia es firme, de color café rojizo, liso. Esta rodeado de una cápsula. Histológicamente el tiroides está compuesto por folículos dispuestos agrupados separados por un estroma con abundante riego sanguíneo. Los folículos están revestidos por células epiteliales cúbicas y contienen coloide, un material proteinaceo compuesto principalmente de tirogiobulina y hormona tiroidea almacenada. Dispuesta entre los foliculos tiroideos están las células C o para foliculares que secretan calcitonina. La función de la glándula tiroides es producir hormona tiroidea las cuáles se encuentran reguladas por la pituitaria a través de la TSH. La mayor producción corresponde a T4 con una proporción de 10:1 con T3. Biopsia de tiroides: la biopsia por aguja fina es muy útil y se realiza con una aguja del 21 que se inserta directamente en el nódulo y el material adquirido se examina citológicamente. Para investigar el funcionamiento de la glándula tiroides se utilizan las determinaciones de: T4-T3: niveles totales en suero por radioinmunoensayo. Es limitado ya que no sólo mide la hormona libre la cual es la activa y los niveles totales de T3 y T4 están influenciados por cambios en los niveles de globulinas ligantes tiroideas, que se encuentran reducidas en enfermedades hepáticas y renales y en ciertos y en ciertas enfermedades congénitas y están elevadas en el embarazo. Captación de Resina de T3: Mide la proteína ligante de tiroides(TBG), el test es útil debido a que puede ser combinado con los niveles totales de T3 y T4 y por cálculo matemático obtener el nivel de T3 y T4 libres en el suero. TBG y T3 y T4 libres, puede ser medidos directamente. TSH: La determinación de TSH es el test más sensible para el diagnóstico de hipotiroidismo primario El tiroides se origina en la base de la lengua y las células que van a formar el tiroides van descendiendo hasta que alcanzan su sitio definitivo y en el cuello. Esto ocurre muy pronto. Alrededor de la 3ª semana del embarazo, comienza la emigración de las células que han de constituir el tiroides. 203 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Lo que interesa es el hecho de que puede producirse una falta de emigración de esas células, o desde el principio o en el camino o quedar restos de ellas en cualquier parte del recorrido. Si las células no emigran y persisten en la base de la lengua, al crecer pueden constituir un Tiroides Lingual. Si hemos comentado la embriología en el aspecto morfológico, es también importante comentar el desarrollo del tiroides en el aspecto funcional. Es decir, cuando empieza a tener su estructura glandular. Y lo que es más importante, cuando empieza a acumular el yodo y cuando empieza a trabajar. El tiroides se desarrolla muy pronto. Aproximadamente a los 30 días del desarrollo del embrión el tiroides aparece como una estructura con dos lóbulos y a los 40 días se interrumpe la conexión que tenia con la base de la lengua, atrofiándose y desapareciendo este hilo de unión. En la 8ª semana empieza a reconocerse la estructura tubular que caracteriza al tejido glandular y entre la 11 y la 12 semana el tiroides del embrión ya concentra yodo y se puede decir que empieza a funcionar. No es preciso que funcione y si no funciona no pasa nada porque la hormona materna atraviesa la placenta y pasa al embrión. Bien, ahora podemos decir que el tiroides es una glándula endocrina, situada en cuello, por debajo del cartílago cricoides, "la nuez de Adán", con forma de mariposa, con dos lóbulos, uno a cada lado, unidos por una zona central que se llama istmo, como lo que une las penínsulas a los continentes. A veces, sobre el istmo, hay una prolongación superior que constituye el lóbulo piramidal. La simetría no es rigurosa, a veces el lóbulo derecho puede ser ligeramente mayor que el izquierdo (hasta 60 mm) y en algunas ocasiones más raras ocurre a la inversa. El tiroides suele ser tener una cierta relación con la talla. En personas altas, en chicas de 1.70 a 1.80, y ya empiezan a verse bastantes, puede tener 60 mm de diámetro longitudinal. El tiroides generalmente no se palpa, salvo en personas que tengan el cuello muy delgado. En primer lugar hay que considerar que incluidas en el tiroides, en su cara posterior, están unas pequeñas glándulas que participan en el metabolismo del calcio y que son las paratiroides. Hay cuatro paratiroides, dos en cada lado, y el cirujano cuando hace una hemitiroidectomía o una tiroidectomía total tiende a respetarlas. Junto al tiroides pasa el nervio recurrente laringeo que enerva las cuerdas vocales. Si en una intervención se secciona este nervio el paciente puede quedar con una ronquera permanente. Volveremos sobre estos temas al hablar de la cirugía. El tiroides tiene una vascularización muy rica. Cada lóbulo está irrigado por dos arterias, la tiroidea superior y la tiroidea inferior. A veces existe también una pequeña arteria que irriga la zona el istmo. Anatomía de la Glándula Tiroides Está envuelta por la cápsula del tiroides, que es una dependencia de la aponeurosis cervical media, sostenida además por 3 ligamentos, uno medio que se extiende de la laringe a la parte media del tiroides y 2 laterales, que van de los lóbulos a la traquea y al cricoides, también sostenida por los vasos tiroideos y sus vainas conjuntivas. De color gris 204 HistologíayCitologíaavanzadaII rosada de 6 a 7cm. de ancho por 3 de alto por 15 a 20 mm de espesor, pesa 25 a 30 gs. Tiene forma de H de concavidad posterior, se divide en istmo y lóbulos laterales. Istmo: Su cara posterior abraza al cricoides y los 2 primeros anillos traqueales, de su borde superior sale la pirámide de Lalouette, resto del conducto tirogloso. Lóbulos laterales: Tienen forma de pirámide triangular. Base a 2 cm por encima del esternón; vértice, en borde posterior del cartílago tiroides, 1/3 medio. Cara interna: abraza la laringe, traquea, faringe y esófago. Cara externa: cubierta por los Músculos Infrahioideos. Cara posterior: en relación con el paquete vasculonervioso del cuello. Por su borde posterointerno está en relación con el nervio recurrente. Las arterias proceden de las 2 arterias tiroideas superiores, ramas de carótida externa, de las tiroideas inferiores, ramas de la subclavia, a veces de la tiroidea media o de Neubauer, que nace de la aorta o del tronco braquiocefálico. Las venas forman un plexo tiroideo, se dividen en: Venas tiroideas superiores, que desembocan en la yugular interna o en el tronco tirolinguofacial. Venas tiroideas inferiores, que van a las yugulares internas y al tronco braquiocefálico y las venas tiroideas medias que desaguan en la yugular interna. Linfáticos: ascendentes, descendentes y laterales. Nervios: simpático cervical, laríngeo superior y recurrente. Región Lateral de Cuello: Músculos Superficiales: Músculo cutáneo del cuello: ancho y delgado, por encima de la aponeurosis cervical superficial, se inserta por abajo en el T.C.S. de la región subclavicular; por arriba en el borde inferior del maxilar. Inervación: rama cérvico-facial del facial. Esternocleidomastoideo: se inserta en el manubrio del esternón, la clavícula y la mastoides. Relaciones: La cara externa, superficial, cubierta por el cutáneo, la vena yugular externa y ramas del plexo cervical superficial. La cara interna está en relación con el paquete vásculo nervioso del cuello. Innervación: espinal y plexo cervical. Músculos InfraHioideos: Esternocleidohioideo: De la extremidad interna de la clavícula y el esternón al hioides. Omohioideo: Músculo digástrico, que va del hueso hioides al omóplato Esternotiroideo: Situado por debajo del esternocleidohioideo, se inserta por debajo en la cara posterior del esternón y primer cartílago costal y por arriba en el cartílago tiroides. Los 3 músculos precedentes están inervados por el asa del hipogloso. 205 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Tirohioideo: Músculo corto, situado por debajo del esternocleidohioideo, va de los tubérculos tiroideos al hioides; inervado por un ramo del hipogloso. Frotis Normal: Las células foliculares se encuentran aisladas, o en pequeños grupos formando folículos más o menos completos, o en amplias placas con áreas vacías que corresponden a espacios foliculares. Muestran núcleo redondeado, cierta anisonucleosis, y cromatina en grumos finos. El citoplasma es escaso y finamente vacuolado. El coloide es azul con MGG, y rosa con Papanicolaou. TiroiditisdeHasimoto. ►Ref.5586b. La tiroiditis crónica (enfermedad de Hashimoto) es una inflamación de la tiroides persistente y de desarrollo lento que a menudo resulta en hipotiroidismo, el cual es el entorpecimiento de la función de la glándula tiroides. Es un bocio difuso, que afecta principalmente a mujeres postmenopáusicas, con destrucción progresiva del epitelio folicular, que puede llevar a hipotiroidismo. Es la principal causa de hipotiroidisimo. Afecta a mujeres más que a hombres (10 veces) y en la edad media. La mayoría de los pacientes con Hashimoto tienen diferentes Ac IgG contra antígenos tiroideos específicos. 1. Anticuerpo Antitiroglobulina (se detecta por inmunofluorescencia). 2. Anticuerpo Antimicrosomales (test de fijación de complemento). 3. Anticuerpo Contra coloide. La relación de estos con la destrucción de las células es incierta. Patología: Glándula agrandada difusamente, firme, gomosa. Cuando la enfermedad progresa la glándula se achica con un tiroides difuso atrófico. Histiógicamente hay evidencia de destrucción de los folículos tíroideos asociados con infiltración linfocitaria de la glándula. , Los folículos linfoides grandes con centros germinales están presentes las células epiteliales que sobreviven están transformadas en células grandes con abundante citoplasma, rosado conocido corno las Células de Hürtle. Luego produce fibras. Estos cambios pero en ausencia de las células de Hürthle ocurren en tiroides y esto se llama Tiroiditis Linfocítica. Sin tratamiento la tiroiditis de Hashimoto lleva a un hipotiroidismo primario Aproximadamente el 5% de los pacientes con la enfermedad de Hashimoto desarrolla una enfermedad maligna del tiroides ya sea un ca papilar o un linforna de Células B. Patogenia: Se han demostrado anticuerpos contra antígenos del epitelio folicular: por una parte, estimularían la proliferación celular (bocio), y, por otra, en conjunto con linfocitos T supresores, producirían una destrucción de las células foliculares (hipotiroidismo). En las últimas fases de la enfermedad puede producirse una atrofia de la glándula. Morfología: Macroscopía: la glándula está difusa y moderadamente agrandada; la cápsula, intacta, el tejido es de consistencia de caucho, rosado pálido. 206 HistologíayCitologíaavanzadaII Histología: Los folículos tiroideos son pequeños, con escaso coloide espeso, células foliculares tumefactas, granulosas, eosinófilas; hay importante infiltración linfocitaria intersticial y abundantes folículos linfáticos con centro germinal evidente. Frotis: linfocitos maduros y activados, blastos dispersos y células plasmáticas. Coloide de fondo y epitelio folicular escasos. Con frecuencia hay placas con transformación oncocítica. El número de histiocitos es muy variable, y, a veces, se observan células gigantes. Hay que controlar el desarrollo de un linfoma. Diagnóstico diferencial: En los linfomas, la celularidad linfoide es más monomorfa. El oncocitoma muestra una población oncocítica relativamente abundante y menos celularidad linfoide. El frotis es muy similar, y, a menudo indistinguible, de la Tiroiditis Linfocitaria Subaguda. Tal como la hiperplasia primaria, la tiroiditis de Hashimoto puede asociarse con otras enfermedades autoinmunes. EnfermedaddeGraves. ►Ref.5644b. Bocio tirotóxico difuso. La enfermedad de Graves es una enfermedad autoinmune (en la cual el sistema inmune se concentra en ciertos tejidos y los ataca) que causa hiperactividad de la glándula tiroides. La enfermedad de Graves es una de las causas más comunes de hipertiroidismo, en el cual la producción de la hormona tiroidea aumenta, presentándose un amplio rango de síntomas que van desde ansiedad e inquietud hasta insomnio y pérdida de peso. Además, los globos oculares pueden comenzar a protruirse (exoftalmos), causando irritación y lagrimeo. La enfermedad de Graves es causada por una activación inadecuada del sistema inmunológico que elige como blanco a la glándula tiroides y ocasiona una sobreproducción de las hormonas tiroideas. Entre los factores de riesgo se puede mencionar el hecho de ser mujer mayor de 20 años, aunque el trastorno puede ocurrir a cualquier edad y puede afectar a los hombres. La enfermedad de Graves se acompaña de prominencia de los ojos (exoftalmos) y visión doble (diplopia). La protuberancia de los ojos se debe al depósito de una sustancia mucosa en los músculos que mueven los globos oculares y alrededor de estos. Esa sustancia puede depositarse en la piel de las pantorrillas. La oftalmopatía (de ophtalmos=ojos y pathos=enfermedad) de Graves, término médico que traduce “enfermedad de los ojos asociada al hipertiroidismo de Graves puede persistir aun después de tratar la hiperactividad de la glándula y requerir tratamiento especial. La glándula está difusamente aumentada de volumen y muy vascularizada. Histológicamente las células epiteliales foliculares están aumentadas de tamaño y número. Los folículos están agrupados apretadamente y delimitados por células epiteliales altas, columnares. El coloide es oscuro. La infiltración linfoide del intersticio es común y están presentes folículos linfáticos con centros germinales. Tratamiento es con drogas antitiroideas, la que causa regresión de estos cambios hiperplásicos. Clínica: Presencia de masa en el cuello. Cambios en los 207 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología ojos, con exosftalmo 70% dado por infiltrado linfoide, edema y depósito de mucopolisacáridos en tejidos blandos de la órbita, y falla en la función muscular. El laboratorio tiene tiroxina libre aumentada, con T4 normal o aumentada, T3 elevada (tírotoxicosis), TSH está aumentada en sangre. La celularidad de los frotis es muy abundante, con anisocitosis. Citoplasmas en "gota de agua", con amplias vacuolas periféricas, a veces ocupadas por coloide muy denso, rosa fuerte con MGG. Núcleos con nucléolo pequeño y prominente. Fondo muy hemático, con moderado número de linfocitos y escaso coloide. La toma de yodo radiactivo da un hipercromatismo nuclear muy llamativo, y el diagnóstico diferencial debe incluir al carcinoma folicular. CarcinomaPapilar.Tiroides. ►Ref.5595b. Carcinoma Papilar: Representa alrededor del 80% de los carcinomas tiroideos. Es más común en mujeres de 30 a 50 años, pero puede presentarse en jóvenes y niños. En general, es un tumor de crecimiento lento: tiene una sobrevida de alrededor de 90% a los cinco años. Morfología: Macroscopía: masa de 2 a 3 cm, mal delimitada, firme, rosado grisácea y granulosa al corte. Histología: Las células neoplásticas pueden formar folículos, pero el rasgo más característico es la presencia de papilas, formadas por un eje conjuntivo revestido por células epiteliales cilíndricas, con núcleos de borde redondeado o irregular, muchos sin cromatina visible (de aspecto vacío). En la mitad de los casos se encuentran cuerpos de psammoma: esférulas calcáreas de estructura laminar concéntrica (grano de arena). Hay celularidad abundante en placas, grupos moruliformes o papilares, y elementos aislados. En las papilas, los núcleos se disponen periféricamente. El citoplasma es amplio, eosinófilo y ocasionalmente con vacuolas. Los núcleos presentan polimorfía variable, con nucléolo pequeño. Hay pseudoinclusiones intranucleares y pliegues de membrana que determinan surcos longitudinales muy característicos, con núcleos en "grano de café" (ambos son considerados marcadores muy importantes para el diagnóstico del carcinoma papilar de tiroides, pero en absoluto son patognomónicos). El fondo de los frotis incluye macrófagos, escasos linfocitos y un coloide denso y filante, rosa con giemsa, con aspecto de "goma de mascar". Los cuerpos de Psammoma suponen una extraordinaria ayuda en el diagnóstico, pero con frecuencia faltan, y normalmente aparecen fragmentados, como placas de material cálcico, próximos a grupos papilares. Cuando están enteros muestran una coloración azulada con el MGG y, cuando están fragmentados, sólo se tiñe su borde de azul intenso, con un centro claro y birrefringente. 208 HistologíayCitologíaavanzadaII Diseminación: 1) El tumor puede ser multifocal en la glándula. 2) Puede invadir la cápsula y partes blandas del cuello. 3) Característicamente se disemina por vía linfática a los ganglios del cuello y mediastino. Las metástasis ganglionares pueden ser sólidas o sufrir transformación quística. En ocasiones la metástasis ganglionar es la primera manifestación de un carcinoma papilar del tiroides de menos de 1 cm de diámetro (carcinoma oculto o incidental). 4) Las metástasis hematógenas son menos frecuentes. Carcinoma Folicular: Representa cerca del 10% de los carcinomas tiroideos. Es más frecuente en mujeres y se presenta a edades más avanzadas que el carcinoma papilar. Se encuentra con mayor frecuencia en áreas geográficas de bocio endémico. En promedio, tiene una sobrevida de 40% a los cinco años. Sin embargo, los con invasión focal microscópica en un pequeño sector de la cápsula (carcinoma folicular mínimamente invasor) tienen una sobrevida similar a la del carcinoma papilar. Morfología Macroscópica: Es un tumor redondeado, la mayoría de las veces, parcialmente encapsulado, gris blanquecino, en partes granular. Histología: Las células se disponen formando folículos, que pueden ser muy bien diferenciados. El estroma es escaso. Diseminación: 1) Invasión local de la cápsula, tiroides y partes blandas adyacentes. 2) Metástasis ganglionares (poco frecuentes). 3) La diseminación hematógena es característica de este tumor. Carcinoma medular: Constituye alrededor del 5% de los carcinomas tiroideos. Se origina en las células parafoliculares (células C) y es levemente más frecuente en mujeres. La sobrevida a los 5 años es de cerca de 40%. Morfología: Macroscopía: mide 2 a 4 cm de diámetro y es mal delimitado. Al corte, varía de color y consistencia rosada grisácea, blanca a blanco grisáceo, firme. Histología: El parénquima tumoral está constituido por brotes sólidos, cordones o trabéculas de células redondas, poligonales o fusadas. El citoplasma es granuloso, con gránulos de tipo secretorio al microscopio electrónico y reacción inmunohistoquímica positiva para calcitonina. El estroma es abundante, con depósitos de amiloide y, frecuentemente, de calcio. La celularidad de los frotis es abundante, con elementos sueltos o laxamente agrupados, uniformes de núcleo y con citoplasmas polimorfos: redondeado, fusiforme o poligonal. Con MGG, y en menor grado también con PAP, se observa en muchos casos 209 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología una fina granulación roja, en el citoplasma. El núcleo es periférico y redondeado, de cromatina en grumo grueso, el nucléolo pequeño y pálido. Son frecuentes las células binucleadas y no raras las multinucleadas. El amiloide, cuando es posible observarlo, se presenta como un material acelular de coloración violeta fuerte, denso, en esférulas y cilindros, que puede teñirse con rojo Congo o con tioflavina. Formas de presentación: Se reconocen una forma esporádica y una forma familiar. La esporádica es más frecuente en pacientes de 35 a 60 años y generalmente es un tumor unilateral. La familiar afecta a pacientes de 15 a 20 años y se presenta como síndrome de neoplasia endocrina múltiple (NEM), que puede asumir dos formas. En una, el tumor se asocia con hiperplasia o tumor de la médula suprarrenal (feocromocitoma) y con hiperplasia o adenoma de glándulas paratiroideas; estos pacientes tienen una alteración en el cromosoma 10. En la otra forma, el carcinoma medular se asocia con hiperplasia o tumor de la médula suprarrenal, ganglioneuromas gastrointestinales y oculares y con alteraciones esqueléticas. Diseminación por vía linfática y venosa: Carcinoma indiferenciado: Representa alrededor del 5% de los carcinomas tiroideos. Es más frecuente en mujeres y, en general, en mayores de 60 años. Son muy pocos los enfermos que sobreviven más de dos años. Morfología: Se trata de un tumor de gran tamaño, heterogéneo, con áreas necróticas y hemorrágicas. Invade rápidamente los tejidos peritiroideos, laringe, tráquea, esófago y ganglios linfáticos. Diseminación: Da metástasis por vía sanguínea, pero generalmente la muerte se produce a consecuencia de la invasión local. Nodulos Tiroideos: Cerca del 10% de los individuos adultos mayores de 40 años tienen nódulos solitarios de la glándula tiroides. De los que se extirpan, alrededor del 60% son nódulos hiperplásticos coloideos, cerca del 30% son adenomas y el 10%, carcinomas. BocioMultinodular.Tiroides. ►Ref.5577b. En un sentido amplio, se define bocio como un aumento de volumen persistente, difuso o localizado, de la glándula tiroides, que puede estar causado por paratrofias (por ej. amiloidosis), hiperplasia, inflamaciones o tumores. Como la causa más frecuente de bocio es la hiperplasia, se suele llamar bocio, en sentido restringido, a las hiperplasias. Hiperplasias del Epitelio Folicular (Bocios en Sentido Restringido): Hiperplasia Primaria: Es un bocio difuso, que ocurre más frecuentemente en mujeres de 30 a 60 años de edad; es la causa más frecuente de hipertiroidismo. Cuando se acompaña de exoftalmo se denomina bocio exoftálmico o enfermedad de GravesBasedow. 210 HistologíayCitologíaavanzadaII Se han demostrado autoanticuerpos antitiroideos en la sangre; éstos reaccionan con el receptor para la hormona tirotropina que poseen en su superficie las células foliculares: algunos receptores están relacionados con estimulación de la proliferación celular (bocio); otros, con la estimulación de la secreción hormonal (hipertiroidismo). La enfermedad de Basedow puede asociarse con atrofia autoinmune de la corteza suprarrenal (enfermedad de Addison primaria) y con anemia perniciosa. El exoftalmo, de mecanismo autoinmune y no consecutivo a hipertiroidismo, está determinado por edema con infiltración linfocitaria del tejido adiposo y músculos periorbitarios. Morfología: Macroscopía: la glándula está difusa y moderadamente aumentada de tamaño (de 40 a 70 g) e hiperémica. Histología: los folículos son de contornos irregulares, están revestidos por células cilíndricas, el coloide es escaso y hay vacuolas cerca del ápice de las células e infiltración linfocitaria del estroma. Hiperplasia secundaria o bocio simple: Se reconocen dos tipos de bocio simple: endémico y esporádico. Causas de bocio endémico 1. Menor aporte de yodo en la dieta. 2. Presencia en el agua de compuestos de súlfuro, calcio o fluor: éstos compiten con el yodo en las reacciones metabólicas. Causas de bocio esporádico 1. Deficiencia de yodo por malos hábitos alimentarios. 2. Defectos enzimáticos hereditarios (bocio dishormogénico). 3. Substancias químicas en medicamentos, como yoduros en expectorantes, sulfonilureas. Patogenia: Por alguna de las deficiencias mencionadas se produce una leve disminución de la producción de hormona tiroidea, la glándula compensa el defecto formando mayor cantidad de hormonas menos efectivas, se produce mayor secreción de hormona tiroestimulante, que da origen a hiperplasia, que en un comienzo es difusa (bocio difuso). Grupos de folículos responden mejor al estímulo y crecen más; otros grupos se rellenan de coloide y se distienden: esto puede originar un nódulo (bocio uninodular) o, en forma más característica, varios nódulos (bocio multinodular). Los nódulos están constituidos por grupos de folículos, en general con mucho coloide, revestidos por epitelio cuboideo o bajo. Los nódulos producen compresión vascular, que determina áreas de de atrofia, hemorragia y fibrosis, con lo que se acentúa el aspecto heterogéneo del órgano. Los bocios difusos y multinodulares de este tipo pueden alcanzar gran tamaño, la glándula hiperplástica puede pesar hasta 1.000 g. Los bocios causan deformación del cuello, que puede llegar a ser antiestética. En general, los pacientes con bocio endémico no presentan cuadro clínico de hipotiroidismo; sin 211 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología embargo, en algunos casos extremos, pueden cursar clínicamente con hipofunción tiroidea. Los frotis son ricos en coloide y pobres en células. El coloide, muy denso, se cuartea con la fijación y tiene coloración azulada con MGG. El epitelio se dispone en grupos foliculares y elementos sueltos, preferentemente en los bordes de la muestra. En el bocio multinodular, los cambios degenerativos se reflejan en la punción, y en lesiones con degeneración quística, se obtiene un líquido amarillo claro o pardoverdoso, y la celularidad está constituida en su mayor parte por histiocitos con material fagocitado sobre fondo seroso con escasos elementos inflamatorios y escaso epitelio en pequeños grupos y en elementos sueltos. Complicaciones: 1. Cuando son de gran tamaño pueden comprimir la tráquea. 2. Los bocios en tiroides mediastínicos también pueden dar sintomatología por compresión. 3. En ocasiones un nódulo puede contener células con alto recambio intrínseco de yoduro, lo que da origen a nódulos hiperfuncionantes, que constituyen la segunda causa de hipertiroidismo. Se llama Bocio Multinodular a un Bocio con varios nódulos y es Normofuncional porque no hay Hipertiroidismo. Si alguno de los nódulos o varios de ellos funcionan de una forma muy activa entonces se trata de un Bocio Multinodular Hiperfuncional. A veces pueden aparecer nódulos en un tiroides de tamaño normal. No seria un Bocio (tiroides aumentado de tamaño), seria una degeneración multinodular. La degeneración multinodular parece ser una enfermedad evolutiva, hay algunos grupos de células en el tiroides que no responden bien al control de la hipófisis y crecen a un ritmo distinto de las células tiroideas normales. Es una enfermedad benigna y es auténticamente excepcional el que pueda degenerar en un Cáncer de Tiroides. Generalmente se diagnostica a partir de los 35 ó 40 años, ya que esas células atípicas tienen un crecimiento muy lento. El diagnóstico se hace porque se note el bulto o porque el médico lo palpe y se confirma de forma muy clara en la gammagrafia (scanning tiroideo). La ecografía sirve para medir el tamaño del tiroides y el de los nódulos, es decir, para controlar la evolución. El Clínico establece por la palpación un aumento de tamaño del tiroides y la presencia de nodulaciones, pero precisa concretar dos problemas: Si se trata de una Hiperplasia Normofuncional y si se trata de una Hiperplasia Multinodular u otro tipo de Hiperplasia. Una simple valoración de los niveles de hormonas tiroideas y TSH le permite comprobar que se encuentra ante una situación normofuncional. Para el establecimiento de las características de la hiperplasia precisa de pruebas instrumentales. AdenomaFolicular.Tiroides. ►Ref.5582b. La mayoría de los tumores primarios de la tiroides son epiteliales: los tumores primarios no epiteliales y las metástasis tiroideas son raras. 212 HistologíayCitologíaavanzadaII Adenoma Folicular: Tumor benigno generalmente único, más común en mujeres jóvenes. Alrededor del 1% de los adenomas son hiperfuncionantes y constituyen la tercera causa de hipertiroidismo. Morfología: Macroscopía: tumor esferoideo, generalmente de 2 a 3 cm de diámetro, rosado pardusco carnoso, con una gruesa cápsula de tejido conjuntivo. Histología: parénquima tumoral formado por folículos de aspecto morfológico y tamaño homogéneos. La cápsula es de grosor uniforme. El tumor comprime el tejido adyacente. Adenoma.Paratiroides. ►Ref.6192b. Los adenomas paratiroideos son tumores benignos (no cancerosos) de las glándulas paratiroides, las cuales están ubicadas en el cuello y ayudan a regular el metabolismo del calcio. Causas, incidencia y factores de riesgo: Este tumor es la causa más común de hiperparatiroidismo que ocasiona niveles elevados de calcio en la sangre (hipercalcemia). Las mutaciones genéticas generalmente son la causa de los adenomas y el mayor riesgo lo tienen las mujeres de más de 60 años e igualmente las personas que hayan tenido exposición a la radiación en la cabeza y el cuello. 4.2.GlándulasSalivares. GlándulaParótidaNormal. ►Ref.7172b. Órgano formado por tejido epitelial que produce una secresión serosa (fluída acuosa) o una secresión mucosa (viscosa, espesa). La glándula salival más voluminosa es la parótida, ubicada por debajo del arco cigomático, por delante de la apófisis mastoides y detrás de la rama del maxilar inferior. Se relaciona con las ramas principales del nervio facial. Dentro de su substancia asciende la arteria temporal superficial. La secreción de la glándula parótida es de tipo seroso (fluída). El conducto parotídeo abandona el ángulo anterosuperior de la glándula, cruza sobre el músculo masetero, perfora el músculo buccinador, y se abre en el vestíbulo bucal, superior frente al segundo molar superior. Frotis normal: Acinis, en globos densamente agrupados, violeta con MGG, con pequeño núcleo más oscuro y redondo; y rosa-azul con Pap, citoplasma vacuolado, núcleo periférico, ovoide y nucléolo redondeado y pequeño. Las células mucosas son vacuoladas, de citoplasma delimitado, y las ductales son eosinófilas, en placas o en pequeños cilindros. Es frecuente el tejido adiposo, y raro el mioepitelio. 213 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología GlándulaSubmaxilarNormal. ►Ref.7187b. La glándula submaxilar produce una secreción salival mixta, serosa y mucosa (viscosa) pero predominantemente seroso. Está por dentro del ángulo del maxilar inferior. Su conducto pasa hacia adelante y adentro, en el piso de la boca, y se abre al lado del frenillo de la lengua. GlándulaSublingualNormal. ►Ref.7184b. La sublingual es la más pequeña de las glándulas salivales. Esta glándula, predominantemente mucosa, está por debajo de la mucosa del piso de la boca. Su secreción salival fluye a través de varios conductos sublinguales separados que se abren en el pliegue sublingual. HiperplasiaLinfoidea. ►Ref.9056b. Hiperplasia linfoidea benigna: Es un tipo de lesión Pseudotumoral, al igual que los Pólipos, quistes, Granuloma maligno Medio facial (granuloma de Stewart), Granulomatosis de Wegener, Displasia, Queratosis, granuloma colesterinico, Glioma nasal, menigocele, meningoencefalocele, etc. Frotis con abundantes linfocitos con elevado número de blastos; elementos mioepiteliales, ductales y acinares, aislados y escasos. A veces, pequeños grupos de histiocitos con linfocitos, plasmáticas, y alguna célula de hábito mioepitelial (nidos epimioepiteliales). Los Tumores que afectan a las Glándulas Salivales son infrecuentes. Existen 5 variedades: Adenoma pleomorfo: Es el tumor más benigno de las glándulas salivales mayores. Es mixto con componentes mixoides, condroides, fibrosos y células atípicas. No llega a afectar al nervio facial. El tratamiento es quirúrgico seguido de radioterapia. Tumor de Warthin: Casi exclusivamente se desarrolla en la parótida. Se trata también de una neoplasia benigna con escaso riesgo de transformación maligna (0.3%). Oncositoma Salival: Infrecuente y raramente maligno. Puede desarrollarse en las glándulas salivales como en la tiroides, paratiroides, hipófisis, riñón y páncreas. El tratamiento de elección es la cirugía con exéresis de la glándula. 214 HistologíayCitologíaavanzadaII Cáncer Salival: Tiene una importante base hereditaria. Existen diversas formas histológicas. Tratamiento: Cirugía - Radioterapia. La quimioterapia tradicional es altamente ineficaz. Actualmente se está utilizando la hipertermia local con microondas más radioterapia ionizante de electrones y fotones. En la forma adenocítica se han obtenido buenos resultados con Tamoxifeno. Es altamente agresivo cuando está localizado en el conducto principal ya que rápidamente da metástasis cervicales. El nervio facial puede estar comprometido lo cual es índice de mal pronóstico. Linfoma Primitivo de la Glándula Parótida: Se desarrolla a partir del tejido linfoide asociado a las mucosas del tubo digestivo, periorbitario, tiroideo, mamas, pulmones y glándulas salivales. Se trata de linfomas de bajo grado constituidos principalmente por linfocitos B y se denominan Maltomas. Se desconoce su origen. Los linfomas parotídeos generalmente son no - Hodgkin y maltomas. No se diferencian del resto de los linfomas. AdenomaPleomórfico. ►Ref.7086b. Adenoma pleomorfo: Es el tumor más benigno de las glándulas salivales mayores. Es mixto con componentes mixoides, condroides, fibrosos y células atípicas. No llega a afectar al nervio facial. El tratamiento es quirúrgico seguido de radioterapia. Tumor de Warthin: Casi exclusivamente se desarrolla en la parótida. Se trata también de una neoplasia benigna con escaso riesgo de transformación maligna (0.3%). Oncositoma Salival: Infrecuente y raramente maligno. Puede desarrollarse en las glándulas salivales como en la tiroides, paratiroides, hipófisis, riñón y páncreas. El tratamiento de elección es la cirugía con exéresis de la glándula. Cáncer Salival: Tiene una importante base hereditaria. Existen diversas formas histológicas. Tratamiento: Cirugía - Radioterapia. La quimioterapia tradicional es altamente ineficaz. Actualmente se está utilizando la hipertermia local con microondas más radioterapia ionizante de electrones y fotones. En la forma adenocítica se han obtenido buenos resultados con Tamoxifeno. Es altamente agresivo cuando está localizado en el conducto principal ya que rápidamente da metástasis cervicales. El nervio facial puede estar comprometido lo cual es índice de mal pronóstico. Linfoma Primitivo de la Glándula Parótida: Se desarrolla a partir del tejido linfoide asociado a las mucosas del tubo digestivo, periorbitario, tiroideo, mamas, pulmones y glándulas salivales. Se trata de linfomas de bajo grado constituidos principalmente por linfocitos B y se denominan Maltomas. Se desconoce su origen. Los linfomas parotídeos generalmente son no - Hodgkin y maltomas. No se diferencian del resto de los linfomas. Este tumor ha recibido numerosos nombres en la literatura (adenoma de células claras, carcinoma de células claras, adenoma rico en glucógeno, mioepitelioma de células claras...). Es un tumor poco frecuente, constituye menos del 1% de los tumores de glándula salival. Es más frecuente en glándula parótida, aunque hay casos descritos en glándulas salivares menores y también en pulmón y mama. Es más frecuente en mujeres (60%), con un pico de incidencia en la 7ª década de la vida. Son tumores bien delimitados total o parcialmente encapsulados. Puede tener diversos patrones de crecimiento pero la 215 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología característica histológica más llamativa es que están constituidos por una doble población celular: células mioepiteliales y células ductales. Las células mioepiteliales o claras se disponen por fuera de las células ductales y suelen ser más numerosas. Inmunohistoquímica: - Células ductales: citoqueratinas, amilasa. - Células claras: S100, actina muscular específica, PGFA, vimentina. En la citología el diagnóstico diferencial puede ser difícil con: - Adenoma pleomorfo. - Adenoma monomorfo. - Carcinoma adenoide quístico. Estos tumores presentan un componente epitelial, estromal y mioepitelial en ocasiones de características citológicas superponibles. En el adenoma pleomorfo el componente mioepitelial puede ser abundante pero se suele encontrar asociado a un estroma mixocondroide. En el adenoma monomorfo y el carcinoma adenoide quístico predomina el componente epitelial, presentan un menor número de células mioepiteliales que se suelen disponer en el background como núcleos desnudos. El diagnóstico histológico no suele ofrecer prolemas debido a la característica arquitectura que presentan estos tumores con una doble población celular. Otros tumores que presentan células claras o células mioepiteliales pero sin la arquitectura típica del carcinoma epi-mioepitelial son: - Carcinoma de conductos terminales. - Carcinoma mucoepidermoide. - Adenocarcinoma de Células Claras. Adenocarcinoma de Células Acinares. El carcinoma epi-mioepitelial es un tumor de bajo grado de malignidad, con capacidad de producir recidivas locales, metástasis ganglionares e incluso metástasis a distancia (pulmón, riñón y cerebro). No se han encontrado características histológicas definitorias de mal pronóstico. Tampoco el análisis de la ploidia nuclear mediante citometría de flujo no ha mostrado resultados concluyentes. EnfermedaddeSjogren. ►Ref.7245b. Se caracteriza por inflamación crónica de las glándulas salivales y lacrimales con disminución de la secreción, por lo que se produce una xerostomia y keratoconjuntivitis sicca. La tríada clásica consiste en: ojos secos, boca seca y artritis reumatoide. Puede presentarse solo o asociado a artritis reumatoidea (10-15%), pseudolinfoma, linfoma, lupus eritematoso generalizado, esclerodermia, polimiositis, cirrosis biliar primaria y angeítis. Inmunológicamente se caracteriza por la presencia de anticuerpos anti-Ro y antiLa. 216 HistologíayCitologíaavanzadaII Morfología: Las alteraciones morfológicas más características se encuentran en las glándulas salivales mayores y menores (estas últimas sirven de sitio para biopsias diagnósticas). Ellas consisten en infiltrado inflamatorio linfoplasmocitario, focal, periductal, con atrofia de los acinos glandulares, hiperplasia del epitelio conductillar y ectasia de los conductos. El infiltrado celular puede ser muy acentuado a medida que transcurre el tiempo, puede constituirse en un pseudolinfoma o degenerar en un linfoma B. Puede existir compromiso de otros órganos, siempre asociado a una disminución de la actividad secretora, por ejemplo, del árbol bronquial con bronquiectasias secundarias, de la mucosa gástrica y del páncreas y de la mucosa nasal, con sangramientos frecuentes. Hay casos con infiltrados inflamatorios redondocelulares acentuados en el intersticio renal, otros con glomerulopatía extramembranosa o glomerulonefritis focal y segmentaria. Es frecuente la acidosis tubular renal y la nefrocalcinosis. La arteritis puede presentarse en diversos órganos. 4.3.Glándulasmamarias. HiperplasiaIntraductal. ►Ref.5467b. Esta patología ocupa el límite entre las lesiones inequívocamente benignas y el carcinoma in situ. Son relativamente raras, se presentaron en el 4% del material de biopsia de patología benigna en la era premamográfica. La incidencia de la HA en biopsias obtenidas como consecuencia de un hallazgo mamográfico, se encuentra en un rango aproximado del 10%. Existen dos formas histológicamente diferentes de HA, denominadas en forma análoga como los carcinomas: “lobulillar” (HAL) y “ductal” (HAD), sin embargo ambas lesiones se originan en las unidades ductolobulillares terminales y están asociadas con un riesgo de carcinoma similar. Si bien la categorización de anormalidades histológicas puede ser fácilmente comparada con cualquier sistema de clasificación, se diferencian en un aspecto importante. En lugar de suponer una progresión gradual o un espectro contínuo desde la ausencia de cambios hasta el Carcinoma in situ, éste enfoque se basa en una clara separación entre el Carcinoma in situ y otros patrones de hiperplasia. Pequeñas lesiones con rasgos de Carcinoma in situ pueden ser reconocibles debido a su escaso tamaño o a la ausencia de rasgos bien desarrollados del Carcinoma in situ. Estos ejemplos de Carcinoma in situ “mal desarrollados” fueron agrupados bajo el nombre de Hiperplasia Atípica. Desde el punto de vista estrictamente histológico, las hiperplasias se definen como un aumento de la cantidad de células en relación con la membrana basal, por consiguiente el aumento de la cantidad de glándulas sin el incremento concomitante en relación con la membrana basal, no constituye una hiperplasia sino más bien una adenosis. Existe consenso en homologar la diferente terminología al referirse a la HA, dejando de utilizarse el término “epiteliosis”, dado que se lo considera un indicador de alteraciones completamente benignas. Esta consiste en la proliferación intraluminal benigna en los conductos y lobulillos diferenciándose del CDIS. Se encuentran artículos en 217 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología la literatura que señalan la caracterización inmunohisto-química comparada con la proliferación intraductal maligna. Las lesiones proliferativas de los conductos propiamente dichos son infrecuentes, siendo la presentación más hallada la papilar, no obstante debe reconocerse el término “hiperplasia ductal” como sinónimo de papilomatosis. Cuando las anormalidades se asemejan a patrones observados en el Carcinoma in situ, éstas lesiones deben ser diferenciadas de las hiperplasias ductales atípicas ya que se toma en consideración que son carentes de un elemento mayor para definirlas como un Carcinoma in situ o presentan características similares a éste pero menos desarrolladas. A éste respecto se señala una revisión de reciente aparición que considera que en los modelos carcinogenéticos de la mama existe una transición del epitelio normal a la aparición del carcinoma através de la hiperplasia atípica y no atípica y del carcinoma in situ. Estas manifestaciones presentan características tanto citológicas como arquitecturales heterogéneas. Una mención especial merece el CLIS y su relación con la HLA. El CLIS se caracteriza por un marcado grado de ocupación, distensión y deformación en más del 50% de los acinos de una unidad lobulillar conformado por una uniforme población de células características. La HLA es reconocida cuando éste compromiso afecta a menos del 50% de los acinos, siendo la lesión desde el punto de vista estructural semejante al CLIS. Los patrones histológicos son por lo general más sutiles en la HLA, y además generalmente no se encuentra el patrón sólido del compromiso ductal hallado frecuentemente en el CLIS. Con respecto a la HDA sé debe tener en cuenta que dado que los criterios diagnósticos derivan de los del CDIS es de fundamental importancia el conocimiento cabal de los mismos para establecer el diagnóstico diferencial entre ambas patologías. Las hiperplasias epiteliales atípicas, presentan un riesgo estimado entre 4-5 veces mayor comparado con la población general. Es importante tener en cuenta que estas lesiones intrínsecamente precancerosas, regularmente se asocian con la recurrencia en el sitio inicial de diagnóstico. Por último se debe tener presente que algunas HDA comparten características similares con el denominado “Carcinoma colgante”. El cáncer mamario es una hiperplasia ductal o lobulillar con atipias en su etapa inicial de evolución biológica; posteriormente, es un Carcinoma in situ en donde hay integridad de la membrana basal que cuando es invadida pasa a ser un carcinoma infiltrante ductal o lobulillar. El foco inicial del carcinoma debe duplicar su volumen más de 30 veces antes de poderse reconocer clínicamente. La fase preclínica tiene una duración hipotética de 8 años (durante ese tiempo llegará a tener una dimensión de un centímetro); la célula tumoral se duplica cada 100 días en promedio. Clasificación Histológica: Se consideran dos tipos histológicos: 1. Frecuentes: carcinoma ductal infiltrante, carcinoma lobulillar infiltrante. 2. Raros: Carcinoma medular, carcinoma tubular bien diferenciado, carcinoma papilar invasor, carcinoma secretorio (juvenil), adenocarcinoma con metaplasia (escamosa, cartilaginosa, ósea, mixta); enfermedad de Paget. 218 HistologíayCitologíaavanzadaII En algunas áreas se pueden observar extensos fenómenos de hiperplasia epitelial, con crecimientos intraluminales, que en algunos casos llegan a ocupar casi totalmente la luz del conducto, con abundantes luces secundarias, generalmente de forma y tamaño irregular. Estas áreas están constituidas por células epiteliales que muestran variación en la forma y tamaño del núcleo: vesiculosos, a veces con algún pequeño nucléolo y ocasionalmente reforzamiento nuclear. Se puede observar también alguna mitosis típica ocasional. En estas áreas de hiperplasia epitelial tanto la oncoproteína p53 como el C-erbB2 suelen ser negativos. Sin embargo, el 80% y el 100% de las células muestran receptores de estrógenos y progesterona respectivamente. Aproximadamente el 4% de las células presentan inmunorreactividad nuclear frente a Ki67. El Fibroadenoma es una de las lesiones que con mayor frecuencia originan un nódulo mamario palpable en mujeres de 25-30 años. Tiempo atrás se decía que era una neoplasia benigna pero hoy se sabe que es una hiperplasia nodular. Da origen a nódulos de 1 a 4 cms, bien delimitados, que al corte se ven blanquecino, anacarado, brillante y con bordes netos. Histológicamente se ve formado por 2 componentes. Uno epitelial, en que aparecen estructuras seudoglandulares (remeda conductos mamarios, no parecen acinos) revestidas por epitelio ductal y un componente estromal, formado por tejido laxo, mixoide, rico en células. Los fibroadenomas pueden cambiar la proporción relativa de cada componente según variables como la edad y el estado hormonal. Los fibroadenomas pueden llegar a malignizarse a partir de su componente epitelial, pero es muy raro (ej. Carcinoma in situ), pero puede ser que haya habido un cáncer primario de antes, por lo que siempre es importante descartar presencia de mitosis sospechosas y atípias Riesgo Relativo del Carcinoma Invasor Por examen Histológico del Tejido Mamario Sin Carcinoma. A) Sin riesgo aumentado: - Cambio apócrino. - Ectasia de los conductos. - Hiperplasia epitelial leve del tipo habitual. B) Riesgo Ligeramente aumentado. - Hiperplasia del tipo habitual moderada. - Adenosis esclerosante. - Papilomatosis florida. C) Riesgo Moderado aumentado. - Hiperplasia atípica. - Lesiones borderline. D) Alto Riesgo: - Carcinoma lobulillar in situ (CLIS). - Carcin oma ductal in situ, no comedociano (CDIS). 219 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología CambioFibroquístico. ►Ref.5492b. Es la enfermedad de la mama femenina mas frecuente de todas. Su etiología parece ser por cambios hormonales ya que se ha observado que su incidencia aumenta hasta la menopausia y casi no se da después de que llega. El Cambio Fibroquístico se desarrolla a partir de una proliferación epitelial de tejido lobulillar (acinos) y conductos lobulillares y una proliferación fibrosa de estroma especializado, dando origen a una masa de espacios quísticos(macro y micro) y tejido fibroso. Según la proporción epitelial y estromal da origen a nódulos sólidos y quísticos dentro de la mama en que se puede palpar un aumento de la nodularidad normal de la mama. Sin embrago, también puede presentarse como un nódulo mamario único. El Cambio Fibroquístico presenta varios patrones histológicos que se diferencian principalmente en el componente epitelial: 1. Acinos hiperplásicos (adenosis o epiteliosis): con hiperplasia habitual o atípica. 2. Adenosis esclerosante: proliferación estromal y de células mioepiteliales que va comprimiendo conductos y los moldea en cordones y laminas que simulan un carcinoma invasor. 3. Metaplasia apocrina: quistes revestidos por epit. Metaplásico del tipo de las glándulas apocrinas normales (recordar que son las que pierden citoplasma al secretar, las otras son las ecrinas). 4. Formación de Macroquistes. 5. Depósitos de Calcio. 6. Fibrosis o hialinizacion mamaria: sustitución del tejido mamario por tejido fibroso denso. 7. Papilomatosis intraductal: hay proliferación de conductos (hiperplasia ductal) que tienen un epitelio que forma papilas. El Cambio Fibroquístico es una gama de patrones histológicos en que van cambiando la proporción de componente epitelial versus estromal y con quistes grandes o pequeños, o epitelios con o sin hiperplasia...etc. El Cambio Fibroquístico predispone en algunos casos al carcinoma, y el riesgo se asocia principalmente con el grado de hiperplasia epitelial (del epit. acinar o ductal), especialmente si este tiene signos de atípia. Sin embrago, el factor que mas predispone a una malignización del Cambio Fibroquístico es el antecedente familiar de cáncer mamario. 220 HistologíayCitologíaavanzadaII Se caracteriza por el desarrollo excesivo del colágeno con esclerohialinosis en sus fibras, mientras que el epitelio canalicular como lobulillar, es atrófico o está ausente. Macroscópicamente se observa como un nódulo constituido por tejido glandular aumentado de consistencia, límites difusos, color blanquecino, sin quistes y que sobresalen del parénquima adyacente. La lesión puede recidivar con caracteres de la lesión original. Se describe como una zona discoide de consistencia netamente aumentada; de bordes poco netos que se pierden en el parénquima circundante y poca movilidad.Su tamaño rara vez, sobrepasa los 5 cm. y es frecuente su bilateralidad (cosa que se observa en la forma difusa pero no en la nodular). Desde el punto de vista clínico existen 3 formas de enfermedad: Forma localizada o nodular: en la que se observa una lesión única, redondeada, de consistencia dura, que sobresale en medio de un tejido glandular de por sí algo indurado (debe diferenciarse de un nódulo dominante displásico en pacientes menores de 40 años, de un bloque fibroquístico en mayores de 45 años, de un fibroadenoma y del carcinoma). Forma difusa: induración de superficie lisa, bordes bastante netos, que compromete apreciable extensión del parénquima mamario, pudiendo predominar en alguno de los cuadrante, aunque suele ser bilateral y puede acompañarse de mastalgia no cíclica. Forma mixta: puede aparecer primero el nódulo de fibrosis y luego hacerse una enfermedad difusa.o a la inversa. CarcinomaDuctalInvasivo. ►Ref.5397b. Es el que se inicia en el conducto mamario pero logra atravesarlo y pasa al tejido adiposo de la mama y luego puede extenderse a otras partes del cuerpo. Es el más frecuente de los carcinomas de mama, se da en el 80% de los casos. El carcinoma mamario es el carcinoma más frecuente en la mujer. La mayoría, cerca del 75%, se observa después de los 40 años de edad. En la mujer premenopáusica, la evolución es evidentemente peor. Se ubica de preferencia en el cuadrante superior externo de la glándula, aquel que contiene la prolongación axilar. Macroscópicamente, se presenta como una masa firme, de tamaño variable, granuloso, de color blanco, seca, con pequeñas estrías o puntos de aspecto cretáceo; la superficie de corte ha sido comparada con la de una pera verde. Su contorno puede ser policíclico o infiltrante. El tipo mucoso (o gelatinoso) es brillante y de él puede escurrir material filante; las formas muy celulares pueden ser de menor consistencia y de color rosado; las formas escirrosas pueden ser de consistencia leñosa. Al microscopio: El carcinoma mamario se clasifica por: grado de diferenciación tubular, irregularidad o atipia de los núcleos, proporción del tejido conjuntivo acompañante, presencia de receptores hormonales, semejanza de las células tumorales con las normales. Tridimensionalidad con células desprendidas en los bordes. Amoldamientos nucleares. Atipia franca, con anisocitosis y anisonucleosis. Núcleos hipercromáticos, cromatina gruesa 221 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología y nucléolos. Multinucleaciones. Citoplasmas vacuolados o con luces. Fondo serohemorrágico, necrótico o inflamatorio. Ausencia de mioepitelio, y grupos de estroma adiposo adherido a grupos tumorales. Según uno de estos criterios se distinguen los carcinomas basándose en el tipo de célula neoplástica, en particular, en carcinomas de conductos y lobulillar. Los carcinomas de células de conductos pueden clasificarse descriptivamente: simple, tubular, sólido, escirroso y papilar, pero esta clasificación es de dudoso valor en cuanto al pronóstico. Prácticamente todos los tipos pueden presentar formas in situ o infiltrante: Tumoración de bordes infiltrantes o pujantes, compuesto por nidos sólidos, amplias placas, cordones o células aisladas que carace de patrón arquitectural correspondiente a cualquier otro tipo de carcinoma invasivo, y se acompaña de desmoplasia estromal. La diferenciación túbulo-glandular es un hecho característico, que junto con el pleomorfismo celular y el número de mitosis, todos ellos de presentación muy variable, sirven para asignar grado tumoral a la lesión. Carcinoma de conductos: Comedocarcinoma. Es un carcinoma de conductos en el que los brotes presentan un foco necrótico central; al comprimir la lesión se obtienen pequeños cilindros de color ocre que recuerdan los comedones (barritos) de la piel. Puede ser in situ o infiltrante. Escirro. Carcinoma en el que el estroma predomina notablemente sobre el parénquima tumoral; es un tumor denso, a veces hialino, muy firme. Sólido. Los elementos epiteliales se disponen en brotes con muy escasa cantidad de tejido conjuntivo. Medular. El estroma exhibe una importante infiltración inflamatoria; son generalmente de tamaño mayor que el promedio y de mejor pronóstico. Mucoso (gelatinoso). Las células neoplásicas, aisladas o en pequeños grupos, se ubican en lagos de material filante, que se tiñe positivamente con PAS. Es de mejor pronóstico. Cribiforme. En carcinomas in situ, el conducto está ocupado por células dispuestas en tubos menores, sin estroma evidente entre los elementos tumorales. Inflamatorio. Corresponde a una permeación tumoral masiva de los vasos linfáticos mamarios originada en un carcinoma mamario. La mama se aprecia firme, eritematosa, con aumento de la temperatura. Es poco frecuente y su pronóstico es pésimo. Los tipos principales de cáncer de mama son el carcinoma ductal in situ, carcinoma ductal invasivo o infiltrante, carcinoma lobular in situ, carcinoma lobular invasivo o infiltrante, carcinoma medular y la enfermedad de Paget en los pezones. CarcinomaIntraductal. ►Ref.5399b. La histología normal de la mama incluye acinos (adenómeros con una capa de células epiteliales), conductos (excretómeros), estroma especializado (laxo) con tejido adiposo y fibroso denso (entre los acinos). Es importante la presencia normal de cels. Mioepiteliales rodeando los adenómeros ya que si no son visibles es un signo muy 222 HistologíayCitologíaavanzadaII sospechoso. Deben recordar que esta histología mamaria va variando según la edad: prepuber, pubertad, adulta, y vejez, según la etapa del ciclo menstrual (mayor desarrollo al final del ciclo), la menopausia y según haya embarazo y lactancia. La glándula mamaria, exocrina, corresponde a una glándula sudorípara (apocrina) modificada. Es sitio frecuente de lesiones inflamatorias, displásticas y tumorales. Son notorios los cambios que experimenta a lo largo de la vida y en dependencia de las distintas situaciones hormonales. Normalmente existen 12 a 20 lóbulos glandulares que se reunen en un número similar de conductos excretores y senos galactóforos que se concentran en una estructura fibromuscular, el pezón. Los lóbulos, a su vez, están constituidos por lobulillos; estas estructuras epiteliales están incluidas en un estroma conectivo laxo intralobulillar hormono-dependiente, diferente del estroma conjuntivo y adiposo perilobulillar restante. Así, la glándula propiamente tal está constituida por conductos que se ramifican en canalículos, los que dan lugar a acinos. Estos son sólidos cuando la glándula está en reposo y muestran un lumen ocupado por secreción durante la lactancia. En la infancia, las ramificaciones de la glándula terminan en los canalículos; en la pubertad se desarrollan los acinos, que quedan en reposo. Con el embarazo se suceden dos fases: la primera es de proliferación, en la que se desarrollan más acinos y más tejido conjuntivo intralobulillar (o periacinoso) y algún infiltrado de células redondas pequeñas; la segunda fase es de secreción (cuando cesa la acción inhibitoria de la placenta) con aparición de lúmenes y secreción. Con la menopausia se produce involución de las estructuras glandulares, con aumento relativo del componente conjuntivo-adiposo. Se ubica de preferencia en el cuadrante superior externo de la glándula, aquel que contiene la prolongación axilar. Macroscópicamente: Se presenta como una masa firme, de tamaño variable, granuloso, de color blanco, seca, con pequeñas estrías o puntos de aspecto cretáceo; la superficie de corte ha sido comparada con la de una pera verde. Su contorno puede ser policíclico o infiltrante. El tipo mucoso (o gelatinoso) es brillante y de él puede escurrir material filante; las formas muy celulares pueden ser de menor consistencia y de color rosado; las formas escirrosas pueden ser de consistencia leñosa. Al microscopio: El carcinoma mamario ha sido clasificado desde muchos puntos de vista: grado de diferenciación tubular, irregularidad o atipia de los núcleos, proporción del tejido conjuntivo acompañante, presencia de receptores hormonales, semejanza de las células tumorales con las normales. Según uno de estos criterios se distinguen los carcinomas basándose en el tipo de célula neoplástica, en particular, en carcinomas de conductos y lobulillar. Los carcinomas de células de conductos pueden clasificarse descriptivamente: simple, tubular, sólido, escirroso y papilar, pero esta clasificación es de dudoso valor en cuanto al pronóstico. Prácticamente todos los tipos pueden presentar formas in situ o infiltrante. Para tener una idea de las patologías mas comunes de la mama, obtenemos lo siguiente: 40% cambios fibroquísticas, 30% sin dg especifico, 13% lesión benigna (inflamatorio), 10% carcinoma, 7% fibroadenoma. 223 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Diseminación del cáncer de mama: Local: - mama adyacente (sana) - piel (lleva a la fijación cutánea) - pectorales Linfática: - ganglios locales y regionales (axilares y cadena mamaria) - vasos linfáticos (afecta el drenaje y produce piel de naranja) Vascular: - hueso, pulmón, pleura y ovario. Factores pronósticos: la importancia de ellos radica en que cánceres de un mismo tipo histológico evolucionan de modo muy distinto en pacientes diferentes. Por lo tanto, ha sido muy útil investigar donde están los factores que determinan las distintas evoluciones del cáncer. Estos son: Presencias de metástasis linfáticas. Tamaño tumoral. Grado histológico (diferenciación). Presencia de permeación vascular. Si hay o no receptores hormonales, es decir, si el tumor responde o no a estímulos hormonales. Es importante notar que todos estos factores están relacionados, ya que un tumor grande, es muy probable que tenga metástasis linfáticas y que tenga permeación vascular y que sea de bajo grado de diferenciación. El único factor que es más independiente la presencia de receptores hormonales, los cuales no dependen del tipo histológico. La importancia de estos receptores a estrogenos, que son detectados por inmunohistoquímica, es que permiten el uso de fármacos antiestrogénicos ya que se asume que el tumor esta creciendo por el estimulo hormonal. Si no tiene receptores simplemente, no se ocupan por que no sirven. Los tumores malignos son entre otros: 224 - Adenocarcinoma. - Carcinoma coloide. - Carcinoma infiltrante. - Carcinoma inflamatorio. - Carcinoma intraductal. - Carcinoma lobular. - Carcinoma medular o circunscrito. - Enfermedad de Pager. - Sarcoma. Cistosarcoma HistologíayCitologíaavanzadaII Estadificación del Cáncer de Mama – FIGO – TNM MAMA TX No se puede valorar el tumor primario T0 No existe evidencia del tumor primario Tis Carcinoma in situ: carcinoma intraductal, carcinoma lobulillar in situ o enfermedad de Paget del pezón sin tumor. T1 Se limita estrictamente a la mama. El tumor es de 2 cm o menor en su mayor dimensión. T1a Tumor de 0,5 cm o menos en su mayor dimensión. T1b Tumor entre 0,5 cm y 1 cm en su mayor dimensión. T1c Tumor entre 1 cm y 2 cm en su mayor dimensión. T2 El tumor es de más de 2 cm pero no superior a 5 cm en su mayor dimensión. T3 El tumor es de más de 5 cm en su mayor dimensión. T4 Tumor de cualquier tamaño con extensión directa a la pared del tórax o a la piel. T4a Extensión a la pared del torax. T4b Edemas (incluyendo piel de naranja) o ulceración de la piel de la mama o nódulos cutáneos satélites limitados a la misma mama. T4c T4a y T4b juntos. T4d Carcinoma inflamatorio de la mama. CarcinomaLobularInfiltrante. ►Ref.5475b. Carcinoma lobular infiltrante (o invasivo) (ILC): Este cáncer comienza en las glándulas mamarias (lóbulos). Puede propagarse a otras partes del cuerpo. Entre el 10% y el 15% de los tumores cancerosos del seno son de este tipo. Cada seno está conformado por numerosos bulbos que producen leche, conocidos como lóbulos, que están conectados por unos conductos al pezón; el resto de la glándula está conformado en su mayoría por grasa, que es la que determina el tamaño del busto, ya que las estructuras productoras de leche son más o menos las mismas en todas las mujeres. A través de ese tejido graso también transcurren otros conductos: los conductos linfáticos. La leche es producida en los lóbulos y por medio de los conductos lácteos llega al pezón. Los conductos linfáticos se encargan de retirar líquido del tejido de sostén de la glándula. Estos drenan linfa o líquido de los tejidos, el cual es retirado del seno y va hacia los ganglios linfáticos y de allí a la circulación general. Los conductos linfáticos confluyen en ganglios linfáticos, pequeñas estructuras con forma de fríjol, que se agrupan y se localizan 225 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología en varias partes del cuerpo, como en axilas, cuello, tórax e ingle, entre otros lugares. Dentro de la mama no hay músculos, están por debajo, separándola de las costillas.La cercanía y relación estrecha entre los lóbulos y los conductos lácteos y los conductos linfáticos, determina que con frecuencia el tumor originado en las células de las estructuras lácateas o glándula mamaria propiamente, invadan o se extiendan a los ganglios linfáticos de la región, que tienen entonces importancia en el diagnóstico de la extensión de la enfermedad. Se ubica de preferencia en el cuadrante superior externo de la glándula, aquel que contiene la prolongación axilar. Macroscópicamente: Se presenta como una masa firme, de tamaño variable, granuloso, de color blanco, seca, con pequeñas estrías o puntos de aspecto cretáceo; la superficie de corte ha sido comparada con la de una pera verde. Su contorno puede ser policíclico o infiltrante. El tipo mucoso (o gelatinoso) es brillante y de él puede escurrir material filante; las formas muy celulares pueden ser de menor consistencia y de color rosado; las formas escirrosas pueden ser de consistencia leñosa. Al microscopio: El carcinoma mamario ha sido clasificado desde muchos puntos de vista: grado de diferenciación tubular, irregularidad o atipia de los núcleos, proporción del tejido conjuntivo acompañante, presencia de receptores hormonales, semejanza de las células tumorales con las normales. Según uno de estos criterios se distinguen los carcinomas basándose en el tipo de célula neoplástica, en particular, en carcinomas de conductos y lobulillar. Los carcinomas de células de conductos pueden clasificarse descriptivamente: simple, tubular, sólido, escirroso y papilar, pero esta clasificación es de dudoso valor en cuanto al pronóstico. Prácticamente todos los tipos pueden presentar formas in situ o infiltrante. Carcinoma lobulillar. Constituye el 10% de los carcinomas; en su forma in situ es relativamente frecuente, típicamente multifocal y bilateral. Parece que puede mantenerse en estas condiciones por largo tiempo; no determina la formación de un nódulo palpable. Al microscopio se reconocen células redondas, regulares, sin grandes atipias, que distienden los conductos que ocupan; no hay inflamación, focos necróticos ni aumento del componente conjuntivo. Cuando se hace infiltrante, las células se disponen en fila india, sin formar brotes, papilas u otras estructuras. La forma infiltrante es de relativamente mejor pronóstico que la forma del carcinoma ductal correspondiente. La celularidad se presenta en forma de elementos aislados (más de la mitad de las células), grupos sincitiales y escasas placas; suele ser abundante, aunque es un dato variable, y tiende a disminuir notablemente con las sucesivas muestras (lo que llega a sugerir falsos positivos). Es un rasgo determinante el núcleo, mucho mayor de lo normal, sin aumento correlativo del citoplasma (desviación de la relación núcleo-citoplasmática). Hay anisocitosis y anisonucleosis, núcleos hipercromáticos, cromatina gruesa (y 226 HistologíayCitologíaavanzadaII pegada a la membrana nuclear), nucléolos prominentes y mitosis. Las células presentan actividad fagocítica, de polinucleares, restos celulares u otras células. Los rasgos degenerativos se traducen en forma de vacuolas citoplásmicas y un fondo del frotis sucio, con sangre y restos celulares. Hay tres tipos específicos: queratinizante, no queratinizante de células grandes y no queratinizante de células pequeñas, que pueden ser reconocidos en el frotis. El carcinoma queratinizante presenta citoplasmas anaranjados, redondeados o alargados y núcleos muy hipercromáticos y pequeños (en tinta china). En el carcinoma no queratinizante de células grandes los citoplasmas son basófilos, azulados, la celularidad presenta mayor agrupación y los núcleos son muy atípicos, con multinucleaciones, macro y multinucléolos, y núcleos desnudos. En el carcinoma no queratinizante de células pequeñas se observan abundantes células relativamente uniformes con escaso citoplasma basófilo o en forma de núcleos desnudos, cuyos núcleos presentan cromatina gruesa e irregular y nucléolos prominentes. CarcinomaLobular. ►Ref.5478b. Es bien conocido por los patólogos que el carcinoma de mama muestra una enorme heterogeneidad morfológica, desde sus estadíos más precoces, lo que ha llevado a la clasificación del mismo en distintos tipos histológicos y grados de diferenciación. Con la introducción de la inmunohistoquímica y más tarde con el uso de otras técnicas moleculares, se ha ido poniendo de manifiesto que los distintos fenotipos del cáncer de mama se encuentran asociados con más frecuencia a determinadas alteraciones moleculares. Así, es bien conocido que entre los carcinomas intraductales, los que poseen amplificación/sobreexpresión de Her2 con mucha frecuencia son carcinomas de alto grado con necrosis (comedocarcinomas), mientras que esta alteración genética es infrecuente en tumores de bajo grado. De la misma manera, los carcinomas ductales bien diferenciados son con frecuencia receptores hormonales positivos y negativos para Her2 o p53, mientras que un patrón contrario es común en los carcinomas grado 3. No obstante, en el cáncer de mama, como en otros tumores epiteliales, y al contrario de lo que ocurre con los linfomas y sarcomas, existen pocas alteraciones moleculares que se asocien de forma específica a tipos histológicos concretos. En esta presentación se desarrollarán dos claros ejemplos de correlación genotipo fenotipo en cáncer de mama; en primer lugar se presentarán los conocimientos actuales acerca de las características de los tumores que se desarrollan en pacientes con carcinoma de mama familiar, en cuyo inicio, por tanto, participa la alteración de genes concretos, algunos conocidos como BRCA1 y BRCA2. En segundo lugar, se expondrá el único ejemplo de tipo histológico asociado a un defecto molecular característico: el carcinoma lobulillar, en cuya iniciación tiene un papel fundamental la inactivación del gen de cadherina E. Características morfológicas de los carcinomas de mama hereditarios Se estima que alrededor del 5-10% de los carcinomas de mama son hereditarios debidos a la mutación en algún gen de alta penetrancia. De estos posibles genes, sólo han sido identificados BRCA1 y BRCA2. Aunque inicialmente se supuso que la mayoría de los carcinomas de mama hereditarios se debían a mutaciones en estos dos genes, estudios más recientes han puesto de manifiesto que sólo en el 25% de familias de alto riesgo existen mutaciones de BRCA1 o BRCA2. 227 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Durante los últimos años se ha demostrado que las características fenotípicas de los carcinomas de mama que se desarrollan en portadoras de mutaciones de BRCA1 y, en menor grado, BRCA2 difieren de las de los carcinomas esporádicos. La posibilidad de reconocer fenotipos distintos desde un punto de vista morfológico no sólo tiene implicaciones biológicas importantes sino que también prácticas. El estudio genético para detección de portadoras de BRCA1 o BRCA2 es caro y requiere mucho tiempo, ya que los genes son de gran tamaño y las mutaciones pueden afectar a cualquier región, lo que obliga a la secuenciación completa de los mismos. Por tanto, es de gran interés poder seleccionar mediante criterios clínico-patológicos que gen estará más probablemente mutado para orientar el estudio genético. Los carcinomas que se desarrollan en portadoras de mutaciones en BRCA1 son los que demuestran un fenotipo más homogéneo y diferente a los tumores esporádicos. Los tumores suelen ser carcinomas ductales infiltrantes pobremente diferenciados, que presentan con frecuencia características (frecuentemente incompletas) de carcinoma medular, tales como los márgenes compresivos, la infiltración linfocitaria y el patrón sincitial. Así mismo, casi las dos terceras partes de los casos son receptores hormonales negativos, muestran alto índice de proliferación y aproximadamente la mitad sobreexpresan p53, habiéndose detectado un mayor número de mutaciones y en localizaciones poco habituales en estos casos. Por el contrario, infrecuentemente los carcinomas BRCA1+ sobrexpresan Her2 y, por tanto, la amplificación de este gen es muy poco común. La importancia del grado histológico y de los receptores hormonales es tal para identificar pacientes BRCA1+, que se ha estimado que la probabilidad de que una mujer con una edad inferior a 35 años con cáncer de mama familiar tenga mutación en este gen es del 25% si el tumor es grado 3 y RE-, mientras que es sólo del 5% en tumores RE+. Este dato tiene también importancia desde el punto de vista de la quimioprevención, ya que se está poniendo de manifiesto que el uso de tamoxifeno o raloxifeno probablemente no reducirá el número de nuevos cánceres en esta población. Los carcinomas BRCA2+, aunque suelen ser con frecuencia de mayor grado histológico que los esporádicos, no muestran claras diferencias en lo que respecta a receptores hormonales y expresión de p53 cuando se comparan con los carcinomas esporádicos de mujeres de edad similar. Al igual que ocurría con tumores BRCA1, los tumores BRCA2 raramente muestran amplificación y sobreexpresión de Her2. Teniendo en cuenta que las dos terceras partes de carcinomas de mama familiares no están asociados a mutaciones de los genes BRCA, la definición de las características de este grupo de pacientes es muy importante ya que nos permitiría ahorrar muchas determinaciones genéticas innecesarias. Los estudios que estamos llevando a cabo ponen de manifiesto que los carcinomas de mama familiares BRCA- son, comparados con los BRCA1, de bajo grado, receptores positivos, con un índice de proliferación (Ki67) que raramente sobrepasa el 5%. El carcinoma lobulillar es el fenotipo asociado a la inactivación de cadherina E La cadherina E es una glucoproteina que participa en la adhesión mediada por calcio entre células epiteliales. El gen que la codifica, CDH1, se localiza en la región 16q21, una de las zonas que más frecuentemente muestra LOH en los carcinomas de mama, al menos en los bien y moderadamente diferenciados. CDH1 se considera un gen supresor 228 HistologíayCitologíaavanzadaII tumoral y la reducción de la expresión de cadherina E se ha relacionado con invasividad, metástasis y mal pronóstico en diferentes tipos tumorales. En el cáncer de mama, la expresión de cadherina E se encuentra reducida en el 50% de los carcinomas ductales infiltrantes y esta reducción se relaciona con el grado. Sin embargo, es muy controvertida la posible relación entre reducción de la expresión de cadherina E y presencia de metástasis o mal pronóstico. La marcada reducción o, más frecuentemente, la completa ausencia de cadherina E es característica del carcinoma lobulillar, aunque algunos casos pueden mostrar niveles ligeramente reducidos de la molécula, que se relocaliza en el citoplasma, perdiéndose la tinción de membrana. La ausencia de cadherina E no sólo es evidente en carcinomas lobulillares infiltrantes clásicos, sino que también ha sido puesta de manifiesto en el carcinoma lobulillar in situ y en todas las variantes histológicas del infiltrante, tales como los carcinomas lobulillares sólidos y pleomóficos. Recientemente, hemos estudiado un grupo de hiperplasias lobulillares atípicas y hemos observado que la ausencia o marcada reducción de cadherina E es un hecho constante. Los mecanismos moleculares que conducen a la alteración de la expresión de cadherina E en los carcinomas lobulillares son diversos. Como en gran número de genes supresores, suele existir una combinación de diferentes alteraciones genéticas tales como mutación, pérdida alélica (LOH) y metilación del promotor. La alteración más común es LOH, que ocurre en alrededor del 75% de los casos. La frecuencia de mutaciones es variable según las series y oscila entre el 15 y el 56% de los tumores. Probablemente, estas diferencias son debidas a la dificultad de detección de mutaciones por dos causas: el marcado entremezclamiento de células tumorales y normales, y la ausencia de zonas "hotspot" de mutaciones en el gen CDH1. Así, es necesario el análisis de sus 16 exones junto con la trancisiones exón-intrón, ya que con relativa frecuencia se producen mutaciones que afectan a las zonas de splicing. Aunque pueden producirse mutaciones missense, con cambio de un solo aminoácido, con más frecuencia ocurren mutaciones que generan proteínas truncadas. Recientemente, se ha analizado la metilación del promotor del gen CDH1 como mecanismo de inactivación en carcinomas lobulillares. La frecuencia de metilación en los dos únicos estudios disponibles es del 40% y 77% respectivamente. Es de destacar que los tres mecanismos descritos han sido demostrados en el componente in situ de algunos carcinomas lobulillares infiltrantes, lo que demuestra su participación en etapas iniciales de estas neoplasias. Para mediar su función adhesiva, la cadherina E requiere el concurso de un grupo de moléculas denominadas cateninas: a-, b-, g- catenina y p120. b- y g- catenina son dos moléculas de la familia armadillo que se unen, de manera mutuamente exclusiva, al dominio de unión a cateninas de la porción intracelular de la cadherina E y median, a través de su interacción con a-catenina, la unión de cadherina E al citoesqueleto de actina. Además, participan en la vía de señalización Wnt e interaccionan con APC. p120, aunque también pertenece a la familia Armadillo, se une al dominio yuxtamembrana de la cadherina E y no interacciona con APC. La función de p120 como molécula moduladora de la función de cadherina E no está claramente definida. 229 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología En el carcinoma lobulillar, la expresión de b- y g- catenina es similar a la de cadherina E, de forma que casi todos los casos muestran total ausencia o intensa reducción en su expresión. Sin embargo, recientemente, hemos tenido la oportunidad de demostrar que la hiperexpresión citoplasmática de p120 es un hecho habitual de los carcinomas lobulillares, que ocurre en el 70% de los casos, independientemente de la variante histológica. Esta situación, por el contrario, es muy infrecuente en carcinomas ductales. Además, la hiperexpresión citoplasmática de p120 es también un hecho precoz, ya que lo hemos observado tanto en carcinomas lobulillares in situ como en hiperplasia lobulillares atípicas. En líneas celulares que no expresan cadherina E, se ha demostrado que la hiperexpresion de p120 se asocia a un fenotipo migratorio debido a que esta molécula modula la actividad de proteínas de la familia de GTPasas Rho. Además, este fenotipo se revierte tras la introducción de cadherina E exógena, que secuestra p120 en la membrana. Estos datos experimentales sugieren que p120 puede ser un mediador de la actividad oncogénica secundaria a inactivación de cadherina E, y que probablemente interviene en el característico patrón infiltrativo del carcinoma lobulillar. Por otro lado, el uso simultáneo de cadherina E y p120 es muy útil en el diagnóstico de lesiones lobulillares dedes su estadíos más precoces. Un dato final de interés es que las mutaciones germinales del gen CDH1 producen carcinoma gástrico familiar de tipo células en anillo de sello. En algunas de estas familias, también ocurren carcinomas lobulillares de mama en las mujeres, aunque con una incidencia menor. Sin embargo, cuando se han estudiado carcinomas de mama familiares de tipo lobulillar, en ausencia de carcinoma gástrico, no se han detectado mutaciones de CDH1 en estos casos. Factores pronósticos Tipo histológico: El carcinoma papilar, medular, coloideo y escirroso son progresivamente peores. Las otras formas se comportan sensiblemente igual y tienen una ubicación cercana al escirroso. Grado histológico: La tendencia a formar glándulas, las atipias nucleares, hipercromatismo e índice mitótico señalan que los tumores más diferenciados muestran una mayor sobrevida. Tamaño del tumor: Mientras más grande es la lesión, peor es el pronóstico, siempre que se mantengan comparables las demás variables. También se observa que a mayor tamaño es más frecuente la existencia de metástasis ganglionares linfáticas y a distancia. Metástasis ganglionares axilares: Existe un cierto paralelismo entre sobrevida y el grado de compromiso de estos órganos. Los ganglios linfáticos axilares se han dividido en niveles según su distancia desde la mama. La inserción del músculo pectoral mayor limita el nivel I. Los ganglios situados bajo el músculo pectoral corresponden al nivel II y el resto, hacia la profundidad de la axila, al nivel III. Mientras más niveles estén comprometidos, peor es el pronóstico. También se ha observado una correlación directa con el número de ganglios metastásicos. 230 HistologíayCitologíaavanzadaII Las lesiones ubicadas en los cuadrantes externos de la mama dan sus metástasis en los ganglios axilares; las lesiones de los cuadrantes internos lo hacen en los ganglios de la cadena mamaria interna, de difícil examen. La segunda vía más frecuente de metástasis es la hematógena: en estos casos las metástasis tumorales se ubican de preferencia en pulmones y huesos, pero pueden encontrarse en hígado, cerebro, suprarrenales, etc. Cáncer de mama etapa 0 (in situ). Las células cancerosas solo se extienden por parte del tejido ductal o lobular de la mama. El lobular in situ aunque no es un verdadero cáncer supone una predisposición a desarrollarlo, el ductal in situ si o es. Etapa I: El tamaño del nódulo canceroso es menos de 2 centímetros y sin extensión a otros tejidos. Etapa II: Si el tamaño del cáncer es menor de 2 cm y se ha extendido a los ganglios de la axila, o cuando el nódulo canceroso es mayor de 2 cm y menor de 5 cm con o sin diseminación a los ganglios de la axila. Etapa III: - Etapa III A: El nódulo canceroso es menor de 5 cm pero se ha extendido a los ganglios de la axila que se encuentran abigarrados y pegados entre sí o a otras estructuras. O bien si es mayor de 5 cm con diseminación axilar. - Etapa III B: El nódulo canceroso se extiende por los tejidos cercanos a la mama, la piel, las costillas, los músculos del tórax o a los ganglios linfáticos de la pared torácica. Etapa IV: Cuando las células cancerosas se han diseminado a otros tejidos del cuerpo (huesos, pulmones, hígado o cerebro), y también localmente a la piel y a los ganglios linfáticos del cuello y clavícula. Cáncer inflamatorio de la mama: Es un tipo concreto y raro de cáncer de mama, la mama tiene aspecto inflamado con rubor y calor con modificaciones de la superficie de la piel. Es muy agresivo y se disemina rápidamente. CarcinomaLobularInSitu.Mama. ►Ref.5543b. Se define como un tumor en el que las células malignas no han sobrepasado la membrana basal del ducto mamario. Forma de presentación del CDIS. La mayoría de CDIS se manifiesta en la actualidad como lesión no palpable de la mama fuera o en el contexto radiológico de microcalcificaciones. Globalmente, estos casos constituyen entre el 20-40% de biopsias dirigidas. Algunos casos pueden ser clínicamente sintomàticos y manifestarse como tumor, telorrea o enfermedad de Paget. 231 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El CDIS se clasifica en diferentes grados de malignidad en base a: estructura, morfología nuclear, presencia de necrosis, la celularidad es más pequeña, en conglomerados e hileras, y abundan los núcleos desnudos. Son muy frecuentes las vacuolas intracitoplasmáticas. Puede necesitar ser diferenciado de adenosis y de linfomas. 1. CDIS alto grado: Atipia citológica y necrosis. CDIS tipo comedo. 2. CDIS grado medio: CDIS tipo cribiforme, micropapilar o sólido, manifiesta atipia celular pero no necrosis o necrosis sin atipias celulares. 3. CDIS bajo grado: CDIS cribiforme y micropapilar con población uniforme de células proliferativas sin atipias ni necrosis. Otra clasificación, que tiene en cuenta factores clínicos y histológicos, es la de Van Nuys. Puntuación 1 2 3 Tamaño <=15 mm 16-40 mm >41 mm Distancia al Margen >=10 mm 1-9 mm < 1mm Histología No comedo No necrosis No comedo Necrosis Comedo-carcinoma PuntuacióN: 3 a 9 Puntuación Grado Tratamiento 3-4 Bajo Sólo escisión 5-7 Medio Escisión + RT 8-9 Alto Mastectomía CarcinomaMedular.Mama. ►Ref.5541b. El carcinoma medular es un tipo histológico de buen pronóstico. Las células neoplásicas están embebidas en un abundante estroma linfoide. Se suelen apreciar grupos de células epiteliales atípicas, de núcleos vesiculosos, y citoplasmas mal definidos en el seno de un estroma con denso infiltrado inflamatorio mononuclear. Los conglomerados son más laxos, con abundantes células aisladas. Son células grandes, de cromatina gruesa y nucléolo muy llamativo. El fondo suele tener muchos linfocitos, lo que obliga a diferenciar un linfoma. La biopsia de ganglio centinela es una técnica que ayuda a determinar si el cáncer se ha diseminado (metástasis) o está limitado localmente. Cuando se detecta un cáncer el siguiente paso suele ser hallar el ganglio linfático más cercano al sitio del tumor y extraerlo para su análisis. El concepto de ganglio “centinela” o el primer ganglio que drena el área cancerosa permite una clasificación más exacta del cáncer y deja los ganglios no afectados para que continúen con la importante función del drenaje de líquidos. 232 HistologíayCitologíaavanzadaII El procedimiento consiste en inyectar un medio de contraste (algunas veces medianamente radioactivo) para señalar el ganglio linfático que se encuentra más cercano al sitio del cáncer. La biopsia de ganglio centinela se usa para clasificar muchas clases de cáncer, incluidos los de pulmón y piel (melanoma). CarcinomaPapilar.Mama. ►Ref.5540b. Los carcinomas de células de conductos pueden clasificarse descriptivamente: simple, tubular, sólido, escirroso y papilar, pero esta clasificación es de dudoso valor en cuanto al pronóstico. Prácticamente todos los tipos pueden presentar formas in situ o infiltrante. Éste es un tipo de carcinoma de mama poco frecuente que invade formando estructuras papilares predominantemente. La arquitectura papilar suele observarse tanto en el componente intraductal como en las metástasis. Histológicamente presenta contornos bien definidos, componente intraductal papilar predominantemente. El componente infiltrante puede tener también patrón cribiforme, tubular o sólido. El tipo celular es el usual o apocrino. Fondo serohemorrágico con agrupaciones de periferia marcada, entre histiocitos, mioepitelio y placas de metaplasia apocrina. La cromatina celular es fina y el nucléolo poco llamativo. 233 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología CarcinomaTubular. ►Ref.5542b. El carcinoma tubular es una variante bien diferenciada de carcinoma constituida por túbulos de forma angulada dispuestos irregularmente en un estroma fibroblástico reactivo. El carcinoma ductal infiltrante de tipo tubular se caracteriza por la formación de túbulos redondeados o angulados, revestidos por una única capa de células epiteliales con atipias leves y separadas por estroma reactivo fibroblástico. ComedoCarcinomaIntraductal. ►Ref.5538b. Las mamas no son más que glándulas sudoríparas altamente especializadas. En el embrión, a la 6ª- 7ª semana de gestación aparece un engrosamiento ectodérmico bilateral que se extiende desde las regiones axilares hasta las regiones inguinales (las llamadas crestas mamarias); en la especie humana esta cresta mamaria desaparece en el embrión con cerca de 15 mm, quedando sólo reducida a la región torácica anterior. La persistencia de esta cresta en la especie humana lleva a la aparición de mamas o pezones supernumerarios en la vida adulta (Polimastia y/o Politelia). Alrededor del 7º mes, ya se formaron los conductos galactóforos y se inicia la formación de los ácinos, estas formaciones constituyen la base de las unidades ductolobulares. En el momento del parto ya se dispone de alrededor de 20 de estas unidades ductolobulares que se permeabilizan en el recién formado complejo areolopezón, terminando estas unidades en un pequeño orificio de la epidermis del pezón. En el parto, el recién nacido, por la acción de la progesterona materna puede presentar congestión mamaria e incluso segregar la llamada “leche de brujas”. Cerca de los 9-10 años aparece una protuberancia retroa-reolar, que es el llamado “botón mamario”, que es la primera señal de crecimiento mamario, esta estructura debe ser respetada y no debe ser sometida a ningún procedimiento quirúrgico porque se corre el riesgo de alterar seriamente el crecimiento mamario. Más tarde, alrededor de los 12 años es que la glándula comienza a presentar un verdadero desarrollo, y a los 13-14 años comienza un intenso crecimiento retroareolar, en vista a su forma definitiva. A pesar de las diferentes formas y volúmenes mamarios, la mama se extiende del 2º al 6º arco costal y entre la línea paraes-ternal y la axilar anterior. Hay que considerar la cola de Spencer o prolongación axilar que tiene una forma cónicopiramidal y que se extiende hasta los límites de la axila, el complejo areola-pezón está implantado a nivel del 5º arco costal y contiene numerosas fibras musculares 234 HistologíayCitologíaavanzadaII lisas cuya función es de proyectar el pezón, por inervación involuntaria, los diversos conductos terminan cada uno en un orificio del pezón. La mama propiamente dicha, está formada por alrededor de 20 unidades lobulares con sus canales excretores, separados unas de otras por fascias de tejido fibroso que unen estas unidades entre sí, son los “Ligamentos de Cooper”. El compromiso de éstos por una lesión maligna, dará los signos de retracción de la piel, tan importante en el diagnóstico clínico del cáncer de mama. El adelgazamiento de éstos, junto a la involución lipomatosa, así como a la pérdida de la elasticidad de la piel, será responsable más tarde de la ptosis mamaria. La irrigación arterial está a cargo de la arteria mamaria interna, ramas de la arteria axilar, así como de ramas de las arterias intercostales. El drenaje venoso comprende un sistema superficial, con las venas toracoepigástricas y el sistema profundo, al que se le atribuye gran importancia en términos de diseminación hematógena del cáncer, sigue básicamente a la irrigación arterial. Así las venas subescapular y laterotorácica drenan en la vena axilar y la vena mamaria interna drena en la vena subclavia. La inervación está a cargo de ramas de los nervios intercos-tales laterales y medianos, de predominio simpático. La iner-vación del pezón es hecha por ramas del 4º nervio intercostal, de predominio sensitivo. El drenaje linfático tiene un papel extremadamente importante en la diseminación de las enfermedades malignas. Toda la mama es muy rica en canales linfáticos. En la zona areolapezón existe una red circunareolar y se consideran básicamente 3 vías de drenaje linfático de la mama: Axilar, Interpectoral y Mamaria Interna. Por la vía Axilar drena cerca del 75% de toda la linfa proveniente de la mama y en la región axilar existen cerca de 30 ganglios linfáticos, distribuidos en tres niveles, situados por debajo de la vena axilar. El Nivel I se encuentra lateralmente y abajo del pectoral mayor. El Nivel II comprende los ganglios situados debajo del pectoral menor. Finalmente el Nivel III se encuentra en el ápex de la axila. Un pequeño porcentaje de linfa es drenada para la región Interpectoral (ganglios de Rotter), situada en el espacio entre los pectorales mayor y menor. Cerca del 20% de la linfa de la mama es drenada a la cadena de la Mamaria Interna, a los ganglios del 2º, 3º y 4º espacios intercostales. A partir del momento en que comienzan a existir variaciones cíclicas hormonales, éstas van a repercutir sobre la mama. Así en la fase luteal del ciclo puede ocurrir retención de líquido, causando ingurgitación, sin que esto produzca alteraciones citológicas o histológicas. En la gravidez y lactancia sí se producen profundas alteraciones, con marcado crecimiento lobular, desarrollándose también nuevas unidades funcionales. La mama aumenta sustancialmente de volumen, debido a retención hídrica, las venas superficiales se tornan más evidentes y la areola y pezón se pigmentan adquiriendo un color más oscuro. La formación de calostro se inicia hacia el 4º mes de gestación y la leche verdadera se comienza a producir al 2º día postparto, por elevación de los niveles de prolactina. Dentro de la patología mamaria en general y del Cáncer de Mama en particular existen dos tipos de clasificación que es imprescindible conocer: 1. Clasificación Patológica de los Tumores. 2. Clasificación Clínica TNM. 235 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Clasificación Patológica: La clasificación de los tumores en general ha evolucionado considerablemente a través de los tiempos, sin embargo la clasificación que se usa hoy en día no difiere mucho en sus características principales de la que se usaba hace mucho tiempo. Entonces como ahora los tumores fueron divididos en grupos de acuerdo a su apariencia, su conducta, su sitio de origen y su tejido de origen. Esta división de los tumores de acuerdo a su tejido de origen rápidamente se convirtió en la principal base de clasificación y desde hace aproximadamente 100 años quedó bien establecida la clasificación de las neoplasias prácticamente tal como la conocemos hoy en día. I. Enfermedad de Paget del Pezón II. Carcinoma de los Conductos Mamarios: A. No Infiltrantes: 1.- Carcinoma Papilar. 2.- Comedocarcinoma. B. Infiltrantes: 1.- Carcinoma Papilar I. 2.- Comedocarcinoma I. 3.- Carcinoma Escirro (marcada Fibrosis). 4.- Carcinoma Medular con infiltración linfocitaria. III. Carcinoma de los Lóbulos Mamarios: A. No Infiltrante. B. Infiltrante. IV. Carcinomas poco frecuentes: 1.- Carcinoma Intraquístico. 2.- Carcinoma de la Glándula Sudorípara. 3.- Carcinoma Espinocelular o Escamoso. Clasificación Clínica En el campo médico en general y en Oncología particularmente, la primera prioridad radica en comparar los resultados de los diferentes procedimientos que emplean las instituciones especializadas en el tratamiento del Cáncer. Para que tal comparación de resultados tenga validez científica cuando se utilizan distintos métodos terapéuticos, existe la imperiosa necesidad de que la evaluación en todos los pacientes se haga en un mismo momento o periodo del transcurso de la enfermedad, es decir, cuando la progresión, extensión, etapa o estadío clínico sea similar. No se puede considerar adecuada la comparación de un cáncer localizado con otro diseminado. 236 HistologíayCitologíaavanzadaII El conocimiento de una clasificación del cáncer de la mama no solamente es útil porque refleja la probable historia natural de la enfermedad, sino que su conocimiento sirve de base para su tratamiento racional, da una idea acerca del pronóstico y permite la comparación de resultados de series diferentes. T Tumor primario Tis Carcinoma preinvasivo (Carcinoma In Situ). Carci-noma Intraductal no infiltrante o Enfermedad de Paget del Pezón sin tumor demostrable (con tumor palpable es clasificada de acuerdo al tamaño del tumor). T0 Tumor no palpable en la mama. T1 Tumor de 2 cm o menos en su diámetro mayor. T1a No mayor de 0,5 cm. T1b Mayor de 0,5 cm pero no más de 1 cm. T1c Mayor de 1cm pero no más de 2 cm. T2 Tumor de más de 2 cm pero no más de 5 cm en su diámetro mayor. T3 Tumor de más de 5 cm en su diámetro mayor T4 Tumor de cualquier tamaño con extensión directa a la pared costal o a la piel T4a Con fijación a la pared costal T4b Con edema, infiltración o ulceración de la piel de la mama. T4c Ambos criterios de T4a y T4b. T4d Carcinoma Inflamatorio. N Ganglios Linfáticos Regionales. NX Ganglios no pueden ser evaluados. N0 Ganglios Homolaterales no palpables. N1 Ganglios axilares metastásicos homolaterales móviles. N2 Ganglios axilares metastásicos homolaterales fijos entre sí o a otras estructuras. N3 Metástasis a la cadena mamaria interna homolateral. M Metástasis a Distancia. MX Metástasis a distancia no puede ser evaluada M0 No existe evidencia de metástasis a distancia. M1 Metástasis a distancia presente. 237 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Una vez evaluada esta clasificación TNM, nos valemos de ella para considerar los 4 Estadíos Clínicos. Estadío I: T1 N0 M0 T0 N1 M0 T1 N1 M0 T2 N0 M0 T2 N1 M0 T3 N0 M0 Estadío II. Estadío III: Cualquier T3 con cualquier N M0 Cualquier T4 con cualquier N M0 Estadío IV: Cualquier T con cualquier N M1 El Comedocarcinoma puede ser clínica y mamográficamente detectable, es cuantitativamente variable, pudiendo ser multicéntrico, adoptar la forma tumoral o difusa, se presenta con mayor frecuencia en la posmenopausia y representa una mortalidad inferior al 1%. Su incidencia se vío aumentada con el advenimiento de la mamografía. Es histológica, radiológica y biológicamente heterogéneo, siendo las lesiones en su mayoría, unicéntricas, raramente extensivas, y con una invasión linfática prácticamente despreciable. Desde el punto de vista histológico se divide en: sólido, micropapilar, papilar, cribiforme, y comedocarcinoma. Es un carcinoma de conductos en el que los brotes presentan un foco necrótico central; al comprimir la lesión se obtienen pequeños cilindros de color ocre que recuerdan los comedones (barritos) de la piel. Puede ser in situ o infiltrante. El DCIS de tipo comedocarcinoma consiste en células cuya citología parece maligna, con la presencia de núcleos de alto grado, pleomorfismo y abundante necrosis luminal central. El comedocarcinoma parece ser un tumor más agresivo y estar asociado con una mayor probabilidad de carcinoma ductal invasor. Las lesiones tipo comedocarcinoma son pleomórficas, de alto grado nuclear, con numerosas mitosis, necrosis central y parecen histológicamente más malignas. En los focos de necrosis suele haber calcificaciones. La visión macroscópica demuestra engrosamiento tisular que a la expresión puede secretar material espeso y blanco amarillento como el que se observa en los comedones, su aspecto es similar a la comedomastitis. Cuando se identifica esta lesión es necesario incluir numerosos cortes con el fin de descartar invasión. También las lesiones de tipo comedocarcinoma expresan mayormente HER2/NEU, tienen alta rata proliferativa medida por timidina marcada y tendencia a microinfiltración. 238 HistologíayCitologíaavanzadaII El alto grado nuclear es la clave histopatológica para identificar el comportamiento agresivo: las lesiones de tipo no comedocarcinoma tienden a ser lo opuesto. El problema de clasificarlas como comedo y no comedocarcinoma es que los patólogos no tienen un acuerdo sobre terminología actual. Se piensa que el grado nuclear es de gran importancia, es mejor marcador biológico que la misma arquitectura y es la llave histológica para expresar agresividad. Fibroadenoma. ►Ref.5470b. Es el tumor benigno más frecuente de la mama. Suele ser un nódulo sólido bien delimitado constituido por tejido fibroso y epitelial. Su capacidad de malignizarse es casi nula. Aparecen habitualmente en pacientes jóvenes. Es una de las lesiones que con mayor frecuencia originan un nódulo mamario palpable en mujeres de 25-30 años. Tiempo atrás se decía que era una neoplasia benigna pero hoy se sabe que es una hiperplasia nodular. Da origen a nódulos de 1 a 4 cms, bien delimitados, que al corte se ven blanquecino, anacarado, brillante y con bordes netos. Histologicamente se ve formado por 2 componentes. Uno epitelial, en que aparecen estructuras seudoglandulares (imita conductos mamarios, no parecen acinos) revestidas por epitelio ductal y un componente estromal, formado por tejido laxo, mixoide, rico en células. Los fibroadenomas pueden cambiar la proporción relativa de cada componente según variables como la edad y el estado hormonal. Abundante celularidad en placas grandes y cohesivas, con epitelio en su periferia y en el fondo de las tomas. Fondo serofibrinoso, límpio. El epitelio es muy regular, con citoplasmas delimitados, núcleos redondeados y a veces un nucléolo. El mioepitelio es de núcleo ovalado, alargado y oscuro. En las formas juveniles, ese mismo epitelio aparece más agrupado, con una cierta tridimensionalidad, pero conservando mioepitelio en la placa o en sus alrededores. Los fibroadenomas pueden llegar a malignizarse a partir de su componente epitelial, pero es muy raro (ej. Carcinoma in situ), pero puede ser que haya habido un cáncer primario de antes, por lo que siempre es importante descartar presencia de mitosis sospechosas y atípias. Tumores Benignos 1. Tumores no Epiteliales. Son semejantes a los que se describen en otras ubicaciones y no poseen características especiales: lipoma, fibroma, angioma, neurofibroma, etc. 2. Tumores Epiteliales. Papiloma (adenoma) de los grandes conductos. 3. Tumores Mixtos. Fibroadenoma: Es la lesión tumoral más frecuente de la mama. Se observa principalmente en mujeres menores de 30 años como un nódulo generalmente único, elástico, desplazable, indoloro, muy bien delimitado. Macroscópicamente es blanco, granuloso o fasciculado, mide entre 1 y 4 cm., puede presentar foquitos calcificados, hialinos, mixoideos o quísticos en forma excepcional. 239 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Durante el embarazo puede aumentar de volumen notablemente; en estas circunstancias puede producirse un infarto con calcificación o hialinización ulteriores. Durante la lactancia, el fibroadenoma participa en el proceso, adquiriendo un aspecto microscópico especial, denominado adenoma de la lactancia. El aspecto microscópico del fibroadenoma es bastante típico: se observa proliferación del doble epitelio canalicular, el que es elongado y deformado por el crecimiento simultáneo del componente conjuntivo laxo, diseñando figuras estelares, lineales, arciformes, etc. La transformación carcinomatosa es excepcional. Una condición nodular de la mama no debida a un cáncer. Existen varios tipos: crónica, difusa, periódica, quística y segmentaria. Es un tumor que tiene doble componente: epitelial y mesenquimal. Se origina en el lóbulo, al producirse proliferación de él; esto explica por qué es más frecuente en mujeres jóvenes y porqué en los raros casos en que da origen a un tumor, sea de tipo lobular in situ. Se han descrito cuatro tipos de fibroadenomas: 1. Fibroadenoma común. 2. Fibroadenoma gigante. 3. Fibroadenoma juvenil. 4. Tumor philodes. No se conoce la etiología, pero debido a que la proliferación lobular es una respuesta a estimulación estrogénica, se supone que es hormono-dependiente Esto explica las recurrencias después de la resección, ya que el estímulo continúa en los lóbulos vecinos. Además se han encontrado más receptores hormonales en el fibroadenoma que en cualquier otra condición benigna del seno. Otras dos características hacen pensar que el fibroadenoma tiene un origen hormonal: el hecho que desaparezca en la menopausia y la circunstancia de que puedan aumentar de tamaño en mujeres que inician reemplazo hormonal. Microscópicamente son tumores muy bien delimitados y de superficie regular, que no infiltran sino que rechazan el tejido vecino. Cuando el fibroadenoma adquiere tamaño mayor de 5 cm se denomina «fibroadenoma gigante» o «tumor philodes». Fibroadenoma gigante: Tumor de rápido crecimiento asimétrico y de alto grado de celularidad estromal, generalmente mayor de 5 cm. Es de infrecuente aparición que predomina en mujeres jóvenes y raza negra. Tumor benigno, encapsulado, con consistencia de tejido mamario normal (lo cual puede dificultar el diagnostico), que desplaza el tejido adyacente distorsionando el seno. La suplencia venosa del fibroadenoma puede incrementar la temperatura local. Tumor Philodes: (cistosarcoma philodes): Tumor de menor prevalencia entre las masas del seno (0.4%). Son masas de crecimiento espectacular alcanzando tamaños superiores a 20 cm. Bien circunscritos, firmes, móviles, elásticos o irregulares, también pueden causar deformidades de la mama, retracción de la piel y el pezón, secreción y necrosis. Histológicamente el tumor philode es 240 HistologíayCitologíaavanzadaII similar al fibroadenoma común pero con más hiperplasia celular, completa encapsulación y proyecciones de tejido de diversos tamaños. La diferencia entre maligno y benigno esta dado por la presencia de atipia celular, anaplasia y el grado de actividad mitótica. Ginecomastia.Mama. ►Ref.5487b. Es el aumento de volumen, de tipo hiperplástico, de la glándula mamaria en el hombre. Antes de los 25 años es de causa hormonal y generalmente representa sólo un problema estético; habitualmente es bilateral. Después de la edad señalada, el aumento, unilateral o bilateral, puede ser causado por una lesión o tumor funcionantes, productores de hormonas (tumores testiculares o suprarrenales, cirrosis hepática, etc.) o bien ser iatrogénico (andrógenos o estrógenos exógenos, etc.). En algunos casos la causa no es aparente (idiopática). Macroscópicamente, se reconoce como una masa discoide firme, subareolar; al corte es muy firme, blanca y densa. Microscópicamente: se observa proliferación de conductos con pliegues del epitelio y presencia de tejido conjuntivo periductal abundante, algo edematoso y mixoideo, que se tiñe de celeste con la técnica histológica habitual. Frotis: Abundantes láminas y grupos tridimensionales, de celularidad uniforme, aunque hay amoldamientos y células hipercromáticas. El fondo tiene pequeños fragmentos de tejido conectivo con fibroblastos fusocelulares. HiperplasiaDuctalAtípica.Mama. ►Ref.5496b. Esta patología ocupa el límite entre las lesiones inequívocamente benignas y el carcinoma in situ. Existen dos formas histológicamente diferentes de HA, denominadas en forma análoga como los carcinomas: “lobulillar” (HAL) y “ductal” (HAD), sin embargo ambas lesiones se originan en las unidades ductolobulillares terminales y están asociadas con un riesgo de carcinoma similar. Si bien la categorización de anormalidades histológicas puede ser fácilmente comparada con cualquier sistema de clasificación, se diferencian en un aspecto importante. En lugar de suponer una progresión gradual o un espectro contínuo desde la ausencia de cambios hasta el Carcinoma in situ, éste enfoque se basa en una clara separación entre el Carcinoma in situ y otros patrones de hiperplasia. Pequeñas lesiones con rasgos de Carcinoma in situ pueden ser reconocibles debido a su escaso tamaño o a la ausencia de rasgos bien desarrollados del Carcinoma in situ. Estos ejemplos de Carcinoma in situ “mal desarrollados” fueron agrupados bajo el nombre de Hiperplasia Atípica. Desde el punto de vista estrictamente histológico, las hiperplasias se definen como un aumento de la cantidad de células en relación con la membrana basal, por consiguiente el aumento de la cantidad de glándulas sin el incremento concomitante en relación con la membrana basal, no constituye una hiperplasia sino más bien una adenosis. 241 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Existe consenso en homologar la diferente terminología al referirse a la HA, dejando de utilizarse el término “epiteliosis”, dado que se lo considera un indicador de alteraciones completamente benignas. Esta consiste en la proliferación intraluminal benigna en los conductos y lobulillos diferenciándose del CDIS. Se encuentran artículos en la literatura que señalan la caracterización inmunohisto-química comparada con la proliferación intraductal maligna. Las lesiones proliferativas de los conductos propiamente dichos son infrecuentes, siendo la presentación más hallada la papilar, no obstante debe reconocerse el término “hiperplasia ductal” como sinónimo de papilomatosis. Cuando las anormalidades se asemejan a patrones observados en el Carcinoma in situ, éstas lesiones deben ser diferenciadas de las hiperplasias ductales atípicas ya que se toma en consideración que son carentes de un elemento mayor para definirlas como un Carcinoma in situ o presentan características similares a éste pero menos desarrolladas. A éste respecto se señala una revisión de reciente aparición que considera que en los modelos carcinogenéticos de la mama existe una transición del epitelio normal a la aparición del carcinoma através de la hiperplasia atípica y no atípica y del carcinoma in situ. Estas manifestaciones presentan características tanto citológica, como arquitecturales heterogéneas. Una mención especial merece el CLIS y su relación con la HLA. El CLIS se caracteriza por un marcado grado de ocupación, distensión y deformación en más del 50% de los acinos de una unidad lobulillar conformado por una uniforme población de células características. La HLA es reconocida cuando éste compromiso afecta a menos del 50% de los acinos, siendo la lesión desde el punto de vista estructural semejante al CLIS. Los patrones histológicos son por lo general más sutiles en la HLA, y además generalmente no se encuentra el patrón sólido del compromiso ductal hallado frecuentemente en el CLIS. En el caso de H.Epitelial Atípica se aprecia mayor aumento de placa de células epiteliales con límites precisos sin superposición: núcleos grandes, hipercromáticos, sin nucleolos evidentes, cromatina granular y con escasos citoplasmas eosinófilos. Con respecto a la HDA sé debe tener en cuenta que dado que los criterios diagnósticos derivan de los del CDIS es de fundamental importancia el conocimiento cabal de los mismos para establecer el diagnóstico diferencial entre ambas patologías. Las hiperplasias epiteliales atípicas, presentan un riesgo estimado entre 4-5 veces mayor comparado con la población general. Es importante tener en cuenta que estas lesiones intrínsecamente precancerosas, regularmente se asocian con la recurrencia en el sitio inicial de diagnóstico. Generalidades: Se considera que aquellas mujeres sometidas a biopsia por patología benigna presentan mayor riesgo de desarrollar un cáncer de mama que la población general. La presencia de calcificaciones o quistes en ausencia de enfermedad proliferativa no supone un incremento del riesgo. 242 HistologíayCitologíaavanzadaII Enfermedades benignas y riesgo: En función del tipo de patología mamaria benigna detectado en la biopsia, el riesgo de cáncer de mama varía considerablemente: 1. Sin incremento de riesgo (lesiones no proliferativas): Adenosis, Ectasia ductal, Hiperplasia epitelial moderada. 2. Pequeño incremento del riesgo (enfermedad proliferativa sin atipias): Hiperplasia epitelial florida. 3. Moderado incremento del riesgo: Hiperplasia ductal atípica, Hiperplasia lobulillar atípica. 4. Alto riesgo: Carcinoma ductal in situ, Carcinoma lobulillar in situ. 5. Enfermedades proliferativas con atipias. Hiperplasia ductal atípica: Las anomalías suelen localizan a nivel de los ductos mamarios, y comienzan a semejarse a los patrones observados en el carcinoma in situ sin llegar al diagnóstico inequívoco de éste, en cuanto a los rasgos cualitativos de patrones intercelulares y citológicos. La hiperplasia atípica: Se caracteriza por mostrar diversos grados de atipia celular y arquitectónica. Es la alteración asociada con la mayor posibilidad de Carcinoma de mama. Hiperplasia Lobular atípica: En esta variedad las anomalías celulares se localizan en los lóbulos mamarios. MetaplasiaGlandular. ►Ref.5481b. Se denomina metaplasia a la transformación o reemplazo de un tejido adulto en otro de la misma clase. Por ejemplo, la metaplasia pavimentosa o escamosa del epitelio respiratorio de los bronquios en fumadores o en bronquios que drenan cavernas tuberculosas; metaplasia pavimentosa del cuello uterino; metaplasia pavimentosa del mesotelio; metaplasia pavimentosa del urotelio en la litiasis; metaplasia intestinal de la mucosa gástrica en la gastritis crónica; metaplasia gástrica en la mucosa del esófago («esófago de Barrett»); metaplasia glandular en epitelio de la vejiga; metaplasia ósea en cartílagos de la laringe; metaplasia ósea en cicatrices («hueso de jinete» en el espesor de los músculos aductores). Causas: a) Irritación. Ejemplos: la litiasis en la metaplasia pavimentosa del urotelio. El reflujo de jugo gástrico ácido en la metaplasia glandular del esófago. b) Sustancias químicas. Ejemplos: metaplasia bronquial en los fumadores; la administración de nitrosamina en animales de experimentación determina la diferenciación de las células acinares pancreáticas hacia hepatocitos. El exceso de vitamina A en la dieta produce metaplasia mucosa del epitelio pavimentoso. 243 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología c) Estrógenos: un exceso de estrógenos produce metaplasia pavimentosa del epitelio cilíndrico del endocérvix y de la próstata. d) Déficit de vitamina A: produce metaplasia pavimentosa en epitelios de la nariz, bronquios, epitelios secretores de glándulas lacrimales y salivales. Patogenia: Lo habitual es que la metaplasia se realice a partir de una célula indiferenciada o poco diferenciada, capaz de multiplicarse: a partir de ella se generan células con diferente diferenciación. a) Aparición de células subcilíndricas (“células de reserva”): células cuboideas situadas en una capa por debajo de las células cilíndricas. (Se ha sugerido que estas células subcilíndricas, que normalmente no se observan con microscopía de luz, son las que dan origen a la regeneración ortológica de las células cilíndricas). b) Hiperplasia de células subcilíndricas: por debajo de las células cilíndricas se observan varias capas de células cuboideas anaplásticas. c) Metaplasia pavimentosa inmadura o incompleta: se desprenden las células cilíndricas, y queda un epitelio anaplástico de varias capas, pero sin estratificación y sin diferenciación hacia células escamosas. d) El epitelio madura y se estratifica; las capas superiores están formadas por células progresivamente aplanadas con núcleos progresivamente picnóticos. La metaplasia en que un tejido maduro se transforma directamente en otro debido a la transformación de sus células maduras en otras células maduras distintas, es probablemente excepcional. En algunos casos uno puede explicarse la metaplasia como proceso adaptativo (hacia epitelio pavimentoso más resistente) ante condiciones ambientales irritativas, aunque con detrimento de las funciones específicas del epitelio reemplazado. En otras, por ejemplo en la metaplasia glandular de la vejiga (“cistitis glandular”) no aparece claro que se trate de un mecanismo adaptativo. La metaplasia es teóricamente reversible si cambian las condiciones que la producen. 244 HistologíayCitologíaavanzadaII PapilomaIntraductal. ►Ref.5537b. Tumores epiteliales. Papiloma (adenoma) de los grandes conductos. Es un tumor subareolar que corresponde a una proliferación de los elementos epiteliales, sin atipias, pero con importante alteración de la arquitectura: hay formación de papilas que distienden los conductos, lo que puede dar la impresión de malignidad. Se reconocen, sin embargo, el doble estrato epitelial, la persistencia de un eje conjuntivo-vascular en las papilas y la ausencia de focos de necrosis. Se considera que corresponde una mastopatía fibroquística en que se afectan los grandes conductos. Clínicamente se reconoce un nódulo palpable subareolar y, frecuentemente, hay sangramiento por el pezón, en mujeres en la tercera a quinta décadas de la vida. No debe confundirse con el carcinoma papilar de los conductos. Schwannoma. ►Ref.6152b. Histológicamente son lesiones dérmicas o subcutáneas, de límites imprecisos, encapsuladas, compuestas por una proliferación de células de Schwann, fibroblastos perineurales y endoneurales. Es evidente su relación con pequeñas fibras nerviosas. Las células tumorales son elongadas, con núcleo hipercromático, distribuidos en delgados fascículos ondulados. Se han descrito las siguientes variantes clínico-patológicas: neurofibroma mixoide, neurofibroma paciniano y neurofibroma epitelioide. Tumor raro, asintomático, que deriva de las células de Schwann en la vecindad de un nervio periférico. Aparece en la cuarta y quinta décadas de la vida. Predomina en cabeza, cuello y extremidades. Generalmente es único. Las formas múltiples suelen asociarse a neurofibromatosis de von Recklinghausen. Anatomopatológicamente son lesiones subcutáneas, encapsuladas, caracterizadas por presentar un doble patrón histológico llamados áreas de Antoni A y B. Las áreas de Antoni A forman el componente celular de la lesión. Son células fusiformes cuyos núcleos se disponen en algunas zonas en empalizada formando dos filas paralelas separadas por las prolongaciones de las células de Schwann originando los cuerpos de Verocay. Las áreas de Antoni B son mucho menos celulares, predominando un estroma mixoide laxo con vasos sanguíneos y células inflamatorias crónicas. Se han descrito las siguientes variantes: schwannoma celular, melanótico y plexiforme. 245 UNIDADDIDÁCTICAV ESTUDIOSHISTOLÓGICOSYCITOLÓGICOS DELSISTEMALINFÁTICO. HistologíayCitologíaavanzadaII BazoNormal. ►Ref.5180b. Es el órgano linfoide secundario más voluminoso y, lo mismo que los ganglios, también tiene una función de filtro, ya que sus células pueden llevar a cabo la fagocitosis los antígenos y las células propias dañadas que circulan en la sangre. Además, el bazo contiene células (APC) que se ocupan de la presentación de los determinantes antigénicos y una abundante cantidad de linfocitos T y B. Durante el desarrollo embrionario, el bazo tiene una actividad hematopoyética importante, la cual puede conservarse en la vida adulta de algunas especies de animales mamíferos. El bazo está rodeado por una cápsula de tejido conectivo que contiene fibras de músculo liso. El tejido conectivo de la cápsula penetra al interior del órgano formando trabéculas. El tejido conectivo de las trabéculas del bazo sostiene las ramas de la arteria aferente que se van ramificando y forma una red vascular muy importante que está rodeada por células linfoides. Los linfocitos periarteriolares constituyen la pulpa blanca, la cual contiene linfocitos T en la zona periarteriolar más interna y linfocitos B en su porción externa. Los linfocitos B pueden organizarse en folículos linfoides, con un centro germinativo, que se forman alrededor de una arteriola central. Sin embargo, la actividad proliferativa de los linfocitos B del bazo no resulta tan intensa como la que tienen los linfocitos B de los centros germinativos localizados en los ganglios. Probablemente esto sucede a causa de que el bazo no recibe un flujo de antígenos tan importante como el de los ganglios. Al final de las arteriolas esplénicas más pequeñas se pierde el tejido linfoide que las rodea y cada una de ellas se divide hasta formar varios capilares venosos que se comunican con los senos venosos que constituyen la pulpa roja. En el interior de los senos venosos de la pulpa roja se encuentran células con una actividad similar a la de los macrófagos y con una apariencia de células dendríticas ya que tienen numerosas prolongaciones citoplásmicas. Los macrófagos de los senos venosos fagocitan los antígenos particulados, principalmente aquellos que están opsonizados, pero también fagocitan los eritrocitos dañados o envejecidos que circulan con la sangre. En una zona intermedia, localizada entre la pulpa blanca y la pulpa roja, se encuentra una región conocida como zona marginal. Esta última zona recibe los linfocitos y los antígenos que vienen con la sangre y posteriormente, al cabo de varias horas, los deja pasar hasta la pulpa blanca. En la zona marginal también abundan las células fagocíticas presentadoras de antígenos. El desarrollo embrionario del bazo se inicia alrededor de la quinta semana, por diferenciación mesenquimatosa del meso-gastrio dorsal entre el estómago y páncreas, migran y se fusionan estos remanentes mesenquimatosos dando lugar al bazo, sin embargo algunos de ellos en ocasiones no se llegan a fusionar con la masa principal dando lugar a la presencia de bazos accesorios hasta en un 30% de casos, en lugares cercanos a él y hasta tan distantes como en la pelvis. El bazo es una glándula vascular sanguinea, segundo órgano más grande del sistema reticulo-endotelial, es de color rojo vinoso, con forma de un gran grano de café, su direción es oblicua, eje mayor se inclina de arriba abajo, de atrás adelante y de dentro 249 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología afuera. Con una cisura medial en su cara interna, su dimensión es de 11 cm de largo, 7 de ancho y 4 de espesor, pese de 100 a 150 grs. Se encuentra situado en el cuadrante superior izquierdo y posterior del abdomen (región supramesocolica del abdomen) cubierto por la caja torácica (9a. a llva. costillas). Es pues un organo toracoabdominal. Con una cara convexa en contacto con el hemidiafragma izquierda y una cara cóncava en relación con la curvatura mayor del estómago, conserva su posición por 5 ligamentos suspensorios: 1. Ligamento esplenodiafragmático: une el bazo al diafragma; 2. Ligamento esplenocólico: une al bazo con el ángulo esplénico del colon; 3. Ligamento preesplénico: une el bazo (polo inferior e hilio) al ligamento gastrocólico, estos tres ligamentos son muy poco vascularizados; 4. Ligamento esplenogástrico, doble pliegue peritoneal que une la curvatura mayor del estómago al hilio esplénico por donde transcurren los vasos cortos del estómago; y 5. Ligamento esplenorenal, doble pliegue peritoneal que va de la cola del páncreas al hilio esplénico conteniendo la arteria y vena esplénica así como la cola del páncreas. Celda Esplénica El bazo está alojado en un intersticio constituido en tres de sus lados por el diafragma, especie de un nicho cóncavo. Hacia dentro, la celda frénica no esta cerrada; corresponde a la cara posterior del estómago y a la cola del pancreas. Arteria esplénica Rama mayor del tronco celíaco, tortuosa, transcurre por el borde posterosuperior del páncreas, da la arteria gastro-epiploica izquierda y luego se divide en 5 a 6 ramas, dos que alimentan la curvatura mayor gástrica, la polar superior que da los vasos cortos al estómago e irriga el polo superior del bazo, las restantes van directamente al bazo. Vena esplénica Resulta de la confluencia de 5 a 6 vasos venosos esplénicos y transcurre por el borde posterosuperior del páncreas al que le forma un surco, es más lineal que la arteria y recibe la vena gastroepiploica izquierda, vasos gástricos, pancreáticos y duodenales, se une a la vena mesentérica inferior a nivel del cuerpo del páncreas y a nivel del cuello del mismo órgano a la mesentérica superior formando la vena porta. Linfáticos Transcurren paralelos a los vasos esplénicos, a lo largo de ellos existen numerosos ganglios linfáticos. Configuración interna El bazo está constituido por una cápsula de 1 a 2 mm de espesor que rodea la pulpa, de su superficie externa se prolonga dentro de ella en un entramado de tejido conjuntivo trabecular que subdivide al órgano en pequeños compar-timentos y le da la armazón. 250 HistologíayCitologíaavanzadaII Fisiología El bazo se define como “lecho capilar especializado” y su importancia radica en ser parte importante del sistema reticulo- endotelial y su posición en la circulación venosa portal.La función normal del bazo es menos importante que su hiper-función. Se le reconocen funciones como: - Eritropoyética: Durante el quinto al octavo mes de gestación cumple una función activa en la formación de eritrocitos y leucocitos. - De reservorio: Por su microcirculación este órgano es un filtro complicado y vigilante de las células de la sangre. Los eritrocitos, cuya vida dura 120 días, transcurren 2 días dentro de la pulpa esplénica, el bazo normal contiene 25 cc de eritrocitos pero relativamente pocos se eliminan durante su paso por él. Las plaquetas y leucocitos recubiertos con anticuerpos también son eliminados por el bazo. Las plaquetas en circunstancias normales viven unos l0 días en la circulación, en estado normal se secuestra en el bazo un tercio del fondo común de plaquetas. La acción del bazo que origina la reducción patológica de elementos celulares circulantes sanguíneos es por tres mecanismos: 1. Destrucción esplénica excesiva de elementos celulares. 2. Producción en el bazo de un anticuerpo que origina la destrucción de células sanguíneas, 3. Inhibición esplénica de la médula ósea que causa insuficiente maduración y liberación celulares, esta última en la mayor parte de los casos es la menos importante. Elaboración de anticuerpos El bazo participa en respuestas inmunitarias específicas e inespecíficas. La properdina y la tufsina sintetizadas en el bazo son opsoninas. La properdina puede iniciar la vía alternativa de activación del complemento para estimular la destrucción bacteriana y de células extrañas o anormales. La tufsina se une a los granulocitos para promover la fagocitosis. En los centros germinales del bazo se produce inmunoglobulina M IgM. Consideraciones Diagnósticas El bazo normalmente no es palpable, para hacerlo debe haber aumentado un tercio de su tamaño, ocasionalmente es percutible y se hará en la línea axilar interna, a nivel de la 9a., 10a., y 11a. costillas. La valoración de la función en hiperesplenismo es efectuada en la sangre periférica, con el recuento de hematíes, leucocitos y plaquetas, los que pueden estar disminuidos exclusivamente o todos ellos. La destrucción eritrocítica importante se manifiesta con ictericia por aumento de la bilirrubina indirecta (liposoluble), por consiguiente sin coluria. Puede medirse la vida media del eritrocito con Cr51, para conocer la magnitud de la hemólisis. La valoración de la supervivencia de leucocitos y plaquetas no tiene un método clínicamente práctico. 251 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Para valorar la trombocitopenia, un aspirado de médula ósea indicará con la abundancia de megacariocitos una producción adecuada de plaquetas. El bazo está constituido por una cápsula fibrosa que lo delimita, una pulpa blanca que constituye el compartimento linfoide del bazo y una pulpa roja constituida por estructuras vasculares mayoritariamente. La pulpa blanca: Consiste en áreas foliculares ricas en células B y en las vainas linfoides periarteriolares ricas en células T. Vainas linfoides periarteriolares ricas en células T: Es la contrapartida esplénica de la región paracortical de los GL y se encuentran rodeando las arterias esplénicas desde su salida de las trabéculas fibrosas. Las células T, de composición y fenotipo similar a aquellas del paracórtex del GL, predominan en estas áreas que también contienen CDI y macrófagos. Las vainas linfoides se atenúan cuando los vasos arteriales se transforman en arteriolas. Folículos de Células B primarios y secundarios: Los folículos primarios y secundarios se localizan frecuentemente en los puntos de división arterial, en la periferia de la zona T y tienen idéntica citología y fenotipo que los folículos primarios y secundarios del GL. Porque el bazo es parte del sistema vascular más que del sistema inmune y carece de linfáticos aferentes está relativamente protegido de los antígenos exógenos. Esta es la razón por la que el bazo del adulto normal tiene un mayor número de folículos primarios que de secundarios. La zona marginal, que rodea el folículo primario y la zona del manto de los folículos secundarios, consiste en una zona de células linfoides de mediano tamaño con un citoplasma claro prominente. La cromatina nuclear de las células de la zona marginal es algo menos densa que la de los linfocitos. Los linfocitos de la zona marginal se encuentran mezclados con un número variable de células plasmáticas, células T y macrófagos y expresan inmunoglobulinas de superficie con cadenas pesadas delta. Estas células típicamente tienen receptores para la porción Fc de las IgG y se tiñen para los receptores del complemento I y II (CD35 y CD21) y para la fosfatasa alcalina. Al contrario que los linfocitos del manto, las células B de la zona marginal carecen generalmente de la expresión de la isoforma CD45 reconocida por el antígeno KiB3 así como de CD23. Algunas células linfoides de tamaño intermedio pueden ser identificadas también en las placas de Peyer infiltrando el epitelio que cubre los folículos. Las células B de la zona marginal pueden ocasionalmente verse en el GL, particularmente en el mesenterio donde colecciones de estas células pueden polarizarse hacia el seno subcapsular. Pulpa roja: La pulpa esplénica es roja debido a su gran volumen de eritrocitos. Esta zona está compuesta por cuatro estructuras vasculares: 1) Vasos arteriales finos y no anastosmosados. 2) Una red reticular que consiste en placas de tejido celular que se encuentra entre las sinusoides y que comprende los cordones esplénicos. 3) Vasos venosos grandes y de pared fina; 4) Venas de la pulpa que drenan los sinusoides. 252 HistologíayCitologíaavanzadaII Sinusoides: La red reticular consiste en un sistema que se ramifica de cordones que se encuentran entre los senos. Después que la arteria central da ramos para la pulpa blanca y la zona marginal, los troncos principales corren por el interior de los cordones de la pulpa roja, ramificándose en vasos finos y rectos que no presentan anastomosis (penicilli) y que se abren directamente al interior de la red reticular de los cordones. Poco antes que terminen estos pueden tener una cubierta de macrófagos. Esta cubierta puede tener eritrocitos, granulocitos y otras células sanguíneas. Estas cubiertas bien desarrolladas pueden contener muchos macrófagos esplénicos que poseen una capacidad fagocítica extraordinaria y que son probablemente los sitios de aclaramiento (limpieza) de partículas sanguíneas y pueden incluso controlar el flujo sanguíneo esplénico. Estas cubiertas de macrófagos no están totalmente desarrolladas en el hombre y las funciones de aclaramiento del bazo son también realizadas por los macrófagos de la zona marginal y de la pulpa roja. Los cordones de la pulpa roja también contienen células linfoides con predominio de células CD8+ y de Natural Killer. Senos: Los senos están cubiertos por células endoteliales separadas por hendiduras y rodeadas por fibras en anillo características y fibras que se unen. Las células endoteliales contienen complejos de unión y yacen sobe una membrana basal fenestrada. Se tiñen para marcadores endoteliales así como para CD8. NóduloLinfáticoNormal. ►Ref.5666b. Córtex: El córtex del GL muestra agregados linfoides denominados folículos linfoides, que pueden mostrar una porción central más clara denominada Centro germinal (CG), y una zona más periférica denominada manto. Los folículos sin CG se denominan folículos primarios (FP) y los que si lo presentan secundarios (FS). Estos folículos son áreas ricas en células B. 253 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Anticuerpo B Centro germinal B Manto/ Folicul B Zona Marginal T T Paracórtex Intrafolicular Macrófagos Dendríticas Foliculares Dendríticas Interdigitantes CD20 (L26) + + + - - - - - CD75w (LN1) + - + - - - - - CD43(MT1,Leu22) - + - + + - - - CD10 (CALLA,J5) + - - - - - - - CD5 - + - + + - - - IgD - + - - - - - - bcl-2 - + + + - - - - CD21 (CR2) - + + -/+ -/+ - + - S-100 - - - - - - - + CD68 (KP1) - - - - - + - - Lisozima - - - - - + - - a -1-AT y a -1AQT - - - - - + - - CD 45RB (ALC) + + + + + -/+ - - CD45RO (UCHL1) - - - + + -/+ - - HLA-DR + + + -/+ac -/+ac + + + Los FP están cosntituídos por células B predominantemente maduras y que no han sido estimuladas recientemente por Ags. Expresan Ig de superficie (l o k) con cadenas pesadas (m o d). Los FS se desarrollan en respuesta a la estimulación antigénica y en ellos las Células B proliferan y dan origen a una prole de células que producen Acs con una alta afinidad para los Ags. La zona del manto está constiuída por células B de morfología y fenotipo similar a los linfocitos B del folículo primario. En contraste con las célulasB del CG, éstas expresan inmunoglobulinas de superficie, carecen de cadena J y presentan un bajo índice proliferativo. También expresan CD21, CD32, CD35 y bcl-2 y no expresan CD10 ni CD38. Paracórtex: Las áreas parafoliculares o Paracórtex son las situadas entre los folículos de células B y la médula del GL y están ocupadas predominantemente por linfocitos T, en su mayoría CD4+. En los GL no estimulados, estas células T tienen la apariencia de linfocitos pequeños y son citológicamente indistinguibles de los linfocitos B de los FP o de los de la zona del manto de los FS. 254 HistologíayCitologíaavanzadaII Cuando se produce la estimulación antigénica, el número de células T grandes aumenta y el paracórtex muestra un aspecto moteado al examen con bajos aumentos. Con estimulaciones antigénicas intensas, como ocurre en la infección por el virus de Epstein-Barr, el paracórtex puede contener inmunoblatos B infectados por virus así como un número grande de células T immunoblásticas reactivas. También se encuentran vénulas de endotelio alto y células dendríticas interdigitantes (CDI), siendo estas últimas las encargadas de presentar los Ags al linfocito T helper nativo iniciando las respuestas de las células T a Ags proteicos que se encuentran en el ganglio. Las CDI tienen un núcleo irregular, pálido, vesicular y citoplasma abundante y claro que muestra interdigitaciones con linfocitos T a través de largos procesos citoplásmicos finos. L Las CDI tienen un marcado parecido fenotípico con las células presentadoras de Ags de la piel (Cél. de Langerhans). Derivan de la MO, expresan numerosos marcadores mielomonocíticos y expresan una positividad nuclear fuerte para la proteína S-100. Médula: La médula es la porción más central y próxima al hilio. Los cordones medulares son la porción de la médula ocupada por linfocitos y que corresponden a la porción más central (medular) del componente linfoide del GL donde predominan los linfocitos B y las células plasmáticas. También se observan senos linfáticos medulares así como estructuras vasculonerviosas Inmunofenotipo de los diferentes componentes celulares del Ganglio Linfático. TimoNormal. ►Ref.5184b. Organo linfoide irreemplazable, pues su función es generar en forma exclusiva linfocitos T. Luego estos linfocitos salen a la circulación, se van y anidan en los órganos linfoides, en ciertos sectores llamados sectores o zonas timo, dependientes. Estos todavía no están funcionando pues deben ser estimulados por macrófagos para diferenciarse. Cuando son estimulados actúan como células de rechazo, además son el nexo entre macrófagos y linfocitos B. En el timo hay linfoblastos, pero además en los órganos linfoides, donde los linfocitos T se diferencian. El timo se ubica detrás del mango esternal. En el niño es muy grande, en los adultos es más pequeño, pero sigue activo toda la vida. Tiene una cápsula que emite tabiques muy irregulares. Tiene lóbulos, y los sectores más pequeños se llaman lobulillos timicos. En este parénquima encontramos células reticuloepiteliales que mantienen uniones solo en sus extremos y generan espacios, donde están los linfoblastos; como estos maduran y se diferencian, también encontramos linfocitos. Este tejido está muy concentrado en las zonas periféricas de los lobulillos, y a medida que se van formando linfocitos T, estos se mueven a la zona central, donde hay menos células, porque van saliendo células a través de venulas postcapilares, que tienen 255 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología epitelio cúbico simple, con núcleos redondos y pared gruesa; los linfocitos pasan a través del endotelio y se van a ubicar en los órganos linfoides. En el timo hay unos cuerpos de Hassal o laminares, que son degeneración del tejido típico del timo descrito más arriba. El timo genera linfocitos para todas las estructuras, al azar, por lo que algunos tienen receptores en sus membranas para células del propio organismo; estos linfocitos son destruidos por macrófagos en el timo, antes de que pasen a la circulación, cuando esto no funciona, se generan enfermedades conocidas como autoinmunes. Se entregan linfocitos con receptores para todo tipo de moléculas, incluso las que hoy día no existen, de esa manera el timo está preparado para el futuro; esto permite que el organismo se vaya adaptando a nuevas condiciones del medio. Timoma. ►Ref.6174b. El Timoma Hamartomatoso Ectópico (THE), representa el extremo benigno (de tipo hamartomatoso), de un espectro de cuatro entidades clinicopatológicas relacionadas, que incluyen tumores del cuello y la glándula tiroides con diferenciación tímica, formando parte de una familia de tumores originados de tejido tímico ectópico o remanentes de las bolsas branquiales, que retienen el potencial de diferenciación hacia las estructuras del timo. Las otras tres entidades han sido definidas como Timoma Ectópico Cervical, Tumor Epitelial Fusado con Diferenciación Símil Tímica, y Carcinoma de Diferenciación Símil Tímica; los dos últimos representan las variantes malignas del espectro inicialmente mencionado. Exponemos en esta comunicación, un caso de THE, entidad extremadamente infrecuente. Macroscopia: Tumor bien delimitado, con ligera lobulación, de crecimiento expansivo y superficie lisa. Al corte se observa colorido amarillento, con aspecto de tejido adiposo, entremezclado con tractos blanquecinos sólidos y pequeñas cavidades quísticas periféricas. Microscópicamente: Destaca un predominio de tejido adiposo maduro y un componente de elementos fusocelulares distribuidos en fascículos, dispuestos "al azar", y en otras áreas configurando imágenes con la apariencia de "un enrejado". Los núcleos suelen ser ovales o elongados, a veces ondulados, con cromatina fina y nucléolos inconspicuos. Los citoplasmas pálidos y en ocasiones acidófilos. Patrón en cordones, y como revestimiento de las estructuras quísticas, descriptas en la macroscopia, que correponden a corpúsculos de Hassall. Con la coloración de PAS, se demuestra que el contenido intraquístico corresponde a material mucinoso, similar al encontrado en las luces de los corpúsculos de Hassal normales del timo. El tricrómico resalta el entramado fibroplásico que forma parte de la lesión. La IHQ muestra positividad para Citoqueratina, tanto en los fascículos fusocelulares como en las áreas fenotípicamente epiteliales. La vimentina se expresó en el componente estromal. 256 HistologíayCitologíaavanzadaII Una vez detectado el timoma maligno, se hacen más pruebas para determinar si las células cancerosas se han diseminado a otras partes del cuerpo. Este procedimiento se denomina clasificación por etapas. El médico necesita saber la etapa en la que se encuentra la enfermedad para planear el tratamiento adecuado. Estas etapas se pueden emplear para clasificar el timoma maligno: Etapa I - El cáncer se encuentra solo dentro de la glándula del timo y su bolsa. Etapa II - El cáncer ha invadido la grasa circundante o el revestimiento de la cavidad pulmonar. Etapa III - El cáncer ha invadido los órganos que se encuentran cerca del timo. Etapa IVa - El cáncer se ha diseminado mayormente a la bolsa situada alrededor del corazón o a la que está situada alrededor de los pulmones. Etapa IVb - El cáncer se ha diseminado mayormente a través de los vasos que transportan la sangre o la linfa. El timoma maligno en etapa I también se conoce como timoma maligno no invasor. El timoma maligno entre las etapas II y IVb también se conoce como Timoma Maligno Invasor. El Timoma Hamartomatoso Ectópico (THE), está caracterizado por una mezcla de elementos tisulares con resabios de tejidos tímicos involutivos, donde destacan como rasgos más representativos el aspecto en "enrejado", otorgado por una proliferación de células epiteliales fusadas, intimamente entremezcladas con abundante tejido adiposo maduro. Además la presencia de quistes con revestimiento epitelial escamoso, como expresión de la dilatación de conductos de Hassall, junto a corpúsculos remanentes y nidos de epitelio escamoso maduro, y un inmunofenotipo característico para estructuras epiteliales y mesenquimales; entre las que se encuentran células mioides. La multiplicidad de tipos epiteliales en la lesión, puede simplemente reflejar el potencial de diferenciación del endodermo branquial. La proliferación del epitelio hamartomatoso y de células oxifílicas, se presenta en ocasiones. A este respecto, corresponde desde luego, establecer una serie de diagnósticos diferenciales, entre los que se incluyen: el tumor mixto de origen en glándulas salivales o sudoríparas, tumores de las vainas de los nervios periféricos, carcinomas de células fusadas y sarcoma sinovial. Este último tumor se distingue por la alta celularidad, la hipercromasia nuclear, la rareza de la diferenciación escamosa y por la inmunorreactividad solamente focal o "en parches" para la citoqueratina en el componente celular fusado. El diagnóstico diferencial con el timolipoma se establece principalmente por la diferente localización anatómica, en el mediastino anterosuperior, y porque el componente tímico habitualmente es un resabio de estructuras normales del órgano adulto. 257 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Adenocarcinoma.Bazo. ►Ref.6513b. Neoplasias esplénicas primarias: a) De tipo Hematológico. b) No Hematológicas. Fondo Limpio con escasa o nula necrosis. Celularidad en agrupaciones tridimensionales formando papilas, acinos o pequeñas placas. En la forma bronquioloalveolar agrupaciones de 10-12 células sin acusada atipia. Citoplasma abombado, claro, vacuolado. Núcleos redondos u ovales, grandes e hipercromáticos. En ocasiones rechazado por la existencia de grandes vacuolas mucosas intracitoplasmáticas. Nucléolo prominente, en ocasiones múltiple. Cromatina granular, fina, de distribución irregular. AnemiaFalciforme.Bazo. ►Ref.6381b. La anemia drepanocítica o de células falciformes (CF) es una enfermedad de la sangre, que se hereda y produce anemia crónica y frecuentes dolores. La anemia drepanocítica compromete los glóbulos rojos, o hemoglobina, y su capacidad de transportar oxígeno. Las células normales de hemoglobina son lisas, redondas y flexibles, como la letra "O", por lo que se pueden desplazar fácilmente por los vasos del cuerpo. Por el contrario, las células falciformes (drepanocitos) de hemoglobina son rígidas y pegajosas, y adoptan la forma de una hoz o letra "C" cuando pierden el oxígeno. Estas células falciformes tienden a aglutinarse y no pueden moverse fácilmente a través de los vasos sanguíneos. Las aglutinaciones producen un bloqueo y detienen el movimiento de la sangre normal y sana que transporta oxígeno. Este bloqueo es el que provoca las dolorosas y nocivas complicaciones de la anemia drepanocítica. Las células falciformes sólo viven unos 15 días, mientras que la hemoglobina normal puede vivir hasta 120 días. Además, las células falciformes corren riesgo de ser destruidas por el bazo debido a su forma y rigidez. El bazo es un órgano que ayuda a filtrar la sangre de infecciones y las células falciformes se atascan en este filtro y mueren. Debido a la reducción del número de células de hemoglobina que circulan en el cuerpo, una persona con anemia drepanocítica padece de anemia crónica. El bazo también sufre daños, ya que las células falciformes bloquean las células sanas que transportan oxígeno. Sin un bazo que funcione normalmente, estas personas tienen mayores probabilidades de contraer infecciones. Las variedades más comunes del gen de la célula falciforme son: Rasgo drepanocítico: El niño es portador del gen defectuoso, HbS, pero también tiene algo de hemoglobina normal, HbA. Ésto se denomina HbAS. Los niños que tienen el rasgo drepanocítico normalmente no presentan ningún síntoma de la enfermedad. Puede producirse una anemia leve. 258 HistologíayCitologíaavanzadaII En situaciones estresantes, intensas, de cansancio extremo, de hipoxia (bajo nivel de oxígeno) y, o de infección severa puede producirse el bloqueo de la hemoglobina defectuosa y esto puede provocar algunas complicaciones asociadas con la anemia drepanocítica. Anemia drepanocítica: La mayoría o toda la hemoglobina normal (HbA) del niño, está cambiada por hemoglobina falciforme (HbS). Ésto se denomina HbSS. Es la forma más común y más severa de las variedades de células falciformes. Estos niños padecen una serie de complicaciones por causa de la forma y el espesor de dichas células. La anemia severa y crónica es también una característica común de los niños que tienen HbSS. Anemia drepanocítica - de hemoglobina C: El niño tiene HbS y HbC. Esto se denomina HbSC. La hemoglobina C genera el desarrollo de glóbulos rojos, denominados dianocitos. Si la persona tiene un poco de hemoglobina C y de hemoglobina normal, no tendrá ningún síntoma de anemia. Sin embargo, si la hemoglobina falciforme S se combina con el dianocito, puede producirse alguna anemia de leve a moderada. Estos niños a menudo sufren algunas de las complicaciones asociadas con la HbSS, o anemia drepanocítica, pero en un grado más leve. Las crisis vasooclusivas (bloqueo del flujo sanguíneo porque las células falciformes se atascan en los vasos sanguíneos), el daño a órganos a causa de bloqueos repetidos y anemia, y un alto riesgo de infección son rasgos similares de la HbSS y la HbSC. Anemia drepanocítica - de hemoglobina E: Esta variedad es similar a la anemia drepanocítica tipo C excepto en que se ha sustituido un elemento en la molécula de hemoglobina. Esta variedad se ve a menudo en las poblaciones del sudeste asiático. Algunos niños que tienen la enfermedad de hemoglobina E no presentan síntomas. Sin embargo, en determinadas condiciones, como cansancio extremo, hipoxia, infección grave y, o ferropenia (deficiencia de hierro) puede desarrollarse anemia de leve a moderada. Hemoglobina S - beta talasemia: Consiste en la herencia de los dos genes, el de las células falciformes y el de la talasemia. El trastorno produce síntomas de anemia moderada y muchas de las mismas patologías asociadas con la anemia drepanocítica, en un grado más leve. Secuestro esplénico (acumulación) - crisis resultado de la acumulación de células falciformes en el bazo. Esto puede producir una disminución repentina de hemoglobina y poner en peligro la vida si no se trata rápidamente. El bazo también puede aumentar de tamaño y doler como consecuencia del aumento del volumen de sangre. Después de episodios repetidos de secuestro esplénico, se forman cicatrices en el bazo, el cual queda permanentemente dañado, y posterior "autoesplenectomía" por episodios repetidos de infarto esplénico que provocan calcificación y fibrosis. 259 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Infarto.Bazo. ►Ref.6012b. Los infartos anémicos se producen en órganos con irrigación de tipo arboriforme (terminal). A ellos pertenece el corazón, el riñón y el bazo. El infarto en estos órganos presenta sin embargo un aspecto hemorrágico en las primeras 24 horas. Ello se debe a la extravasación de sangre contenida en los vasos que se necrosan. A partir del segundo día, a medida que se reabsorbe esta sangre, van apareciendo los caracteres macroscópicos típicos de la necrosis de coagulación. Se trata por lo tanto de un componente hemorrágico inicial y sólo pasajero, que no quita el carácter de anémico de estos infartos, puesto que a la zona comprometida no sigue llegando sangre. En la substancia blanca cerebral el infarto anémico no alcanza a aparecer hemorrágico ni siquiera al comienzo debido a que los vasos son poco numerosos. El bazo cumple una importante función en cuanto al control de los procesos infecciosos sobre todo contra gérmenes capsulados. En pacientes infecciosos con el tiempo desarrollan áreas importantes de infarto que son sustituidas por zonas de necrosis y cicatrización. Perdiendo el bazo su capacidad para la opsonización y función del sistema retículo endotelial. TIEMPO MACRO 5-6 h 1-3 días 4º día 1ª semana (inicio) 1ª-2ª semana 2ª-3ª sem 3ª-4ª semana (1er mes) más de 3 meses MICRO Necrosis: n. pignótico, acidófilo. blanco-amarillo + hemorragia Necrosis, hiperemia, exudación (polis, rbc). Línea periférica amarilla Polis en la periferia. Todo amarillo Polis todo infarto. Lisis de las células necróticas. El halo rojo periférico disminuye de tamaño Tejido con granulación en periferia y reabsorción del tejido necrótico. Todo Rojo Tejido con granulación exterior por todo el infarto. Gris gelatinoso y deprimido Disminuyen la vascularización y las células del tejido con granulación. Amentan las fibras. Cicatriz blanca y firme Cicatriz fibrosa Sarcoidosis.Bazo. ►Ref.6329b. Es una enfermedad de causa desconocida en la cual se produce una inflamación a nivel de los ganglios linfáticos, los pulmones, el hígado, los ojos, la piel y otros tejidos. Es una enfermedad relativamente común, que se caracteriza por granulomas no caseificantes en practicamente cualquier tejido, que consisten en una especie de nódulos compuestos 260 HistologíayCitologíaavanzadaII por un tejido celular específico; estos granulomas pueden estar presentes en otras enfermedades, por lo tanto no son específicos de la enfermedad. Se desconoce la causa de esta enfermedad, pero dentro de las probables se pueden mencionar: respuesta de hipersensibilidad, predisposición genética, infección o productos químicos. En esta enfermedad, las muestras de tejido de los órganos involucrados evidencian racimos de células del sistema inmunológico (como las células macrófagas, linfocitos y células gigantes multinucleadas). Estos racimos se denominan granulomas. Diagnóstico: IgG y calcio elevados, radiografia de tórax, y para confirmar se hace biopsia hepática y ganglionar (granulomas no caseificantes). La respuesta granulomatosa sugiere una reacción mediada por el sistema inmunitario. Entre todas las alteraciones inmunitarias figuran: Alveolitis linfocitaria. Con aumento de células T CD4 activadas (aumento producción de IL-2) y macrófagos alveolares activados (aumento de producción de IL-1) Linfopenia absoluta por disminución de células T circulantes Células T colaboradoras activadas y producción de citocinas que segregan mediadores que atraen monocitos que serán los responsables de la formación del granuloma. Morfología: No hay alteraciones macroscópicas a parte de la viceromegalia. Son característicos de los granulomas microscópicos compuestos de histiocitos, células epitelioides que forman acúmulos, frecuentemente con células gigantes multinucleadas, la necrosis central es rara, tb son frecuentes los cuerpos de Schaumann y los cuerpos asteroides. Traumatismo.Bazo. ►Ref.6127b. Traumatismo penetrante Por arma de fuego o por heridas punzopenetrantes, en cuadrante superior del abdomen, flanco izquierdo o trans-torácicas, en el 30% de estos casos se encuentran lesiones concomitantes de estómago, páncreas, riñón, pulmón izquierdo y vasos del hilio. En esplenoportografías se presenta sangrado persistente en pacientes con menos de 70000 plaquetas o tiempo de protrombina 20% superior al normal. Traumatismo no penetrante Por trauma directo o por accidente de tránsito, son las más frecuentes, pero se acompañan de menos lesiones de órganos vecinos. Patología Pueden encontrase lesiones esplénicas como laceraciones lineales y estelares, desgarros… Heridas por punción (armas o costillas). Hematomas intraesplénicos o subcapsulares. 261 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Arrancamineto de su pedículo o laceración de vasos gástricos cortos. Casi todas las lesiones son transversales motivadas por la arquitectura interna del órgano dispuesta en plano transverso. Esplenosis Es el autotransplante de tejido esplénico o fragmentos de bazo traumatizado en la superficie peritoneal que genera adherencias y puede causar obstrucción intestinal. Clasificación del trauma del bazo: Grado 1: Consiste en rotura capsular superficial lineal o hematoma subcapsular, sin daño significativo del parénquima. Grado 2: Formadas por roturas profundas únicas o múltiples al nivel de los polos. Grado 3: Constituida por roturas profundas que llegan al hilio esplénico o que afectan vasos mayores. También cuando el bazo está fragmentado. Subclasificación: a) Asociadas con lesiones intraabdominales. b) Asociadas con lesiones extraabdominales. I. Hematoma Subcapsular, no expansivo, <10% superficie. Laceración Desgarro capsular, no sangrante, <1 cm profundidad del parénquima. II. Hematoma Subcapsular, no expansivo, 10-50% superficie. Intraparenquimal, no expansivo, < 2 cm diámetro. Laceración Desgarro capsular, sangrado activo. III. Hematoma Subcapsular, >50% superficie, expansivo. Ruptura de hematoma subcapsular, sangrante. Hematoma intraparenquimal expansivo > 2 cm. Laceración >3 cm profundidad del parénquima. IV. Hematoma Ruptura de hematoma intraparenquimal sangrante. Laceración con compromiso de vasos hiliares o segmentarios con desvascularización > 25% del órgano. V. Laceración Injuria vascular hiliar que desvasculariza el bazo. Los traumatismos esplénicos se pueden asociar a lesiones intraabdominales como el hígado, estómago, páncreas, riñón e intestino y a lesiones extraabdominales como cráneo, tórax, pelvis y extremidades; dicha asociación aumenta la morbilidad y mortalidad, por lo cual esta subclasificación tiene importancia, pues objetivamente se puede determinar que la asociación del bazo con otros órganos eleva el riesgo de complicaciones y muerte. 262 HistologíayCitologíaavanzadaII CentroGerminal.NódulosLinfáticos. ►Ref.5667b. El CG presenta una zona clara y una zona oscura: La zona oscura es la zona más cercana al área paracortical, es rica en centroblastos (células grandes). La zona clara, está generalmente polarizada hacia el sitio de entrada de Ags como el seno subcapsular y es rica en centrocitos (células pequeñas hendidas), células dendríticas y linfocitos T CD4+ (helper/inductores). Ambas zonas poseen macrófagos con cuerpos tingibles. Las células dendríticas foliculares, que residen en los centros germinales, presentan los Ags sobre su superficie y su función es la de activar selectivamente las células B para que se unan al Ag con una alta afinidad. Las células del CG carecen de expresión de proteína bcl-2 pero si expresan CD10. Las células plasmáticas totalmente diferenciadas se desarrollan fuera de los centros germinales y pueden emigrar a otros tejidos fuera del GL. AdenocarcinomaMetastásico.NódulosLinfáticos. ►Ref.7248b. Clásicamente se ha hablado de adenocarcinoma para designar solamente a los carcinomas con formación de estructuras neoplásicas tubulares. Aunque este criterio persiste en la terminología médica habitual, el concepto de adenocarcinoma tiende a ser más amplio, incluyendo tumores como el carcinoma de células en anillo de sello, debido a caracteres secretorios identificables en la célula neoplásica aislada. Los tumores tubulares son aquellos en los que las células epiteliales neoplásicas se disponen de un lumen, formando estructuras cilíndricas huecas más o menos irregulares y ramificadas, remedando conductos o glándulas. Las estructuras tubulares neoplásicas están rodeadas por el estroma. Las células neoplásicas de los adenomas y de los adenocarcinomas tienen caracteres de diferenciación, morfológicos y funcionales, similares a los del correspondiente tejido normal. Macroscópicamente: Los adenomas en el espesor de glándulas son redondeados, bien delimitados. Los de mucosas se presentan en forma de "pólipo". Pólipo es un término descriptivo que se refiere a una formación redondeada solevantada circunscrita en una mucosa; puede tener una base ancha (pólipo sésil) o estar provisto de un delgado tallo (pólipo pediculado). Un pólipo puede corresponder a una malformación, a un proceso inflamatorio, a una hiperplasia focal o a una neoplasia. HiperplasiaFolicular.NódulosLinfáticos. ►Ref.5655b. Las hiperplasias reactivas son proliferaciones benignas de células de uno o más de los diferentes compartimientos anatómicos e inmunológicos de los tejidos linfoides. Así, las hiperplasias pueden comprometer los folículos, que son zonas B, las áreas 263 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología interfoliculares o paracorticales que son timo dependientes (células T) o las células de los senos que pertenecen al sistema macrófago-monocitoide. La plasmocitosis de los cordones medulares, que suele acompañar a la hiperplasia folicular, es también un signo de respuesta de células B. Las proliferaciones en la región paracortical a menudo son hiperplasias T, aunque pueden ser también proliferaciones de células B que han migrado a esta zona a partir de centros foliculares estimulados. El estímulo para las hiperplasias no se conoce, pero muchas de ellas son resultado de agentes bacterianos o virales o de sus productos. El aspecto morfológico de las diversas hiperplasias, aun de aquéllas debidas a los mismos estímulos, varía con la edad, capacidad inmunológica y contacto previo con el agente. Además, el cuadro histopatológico varía con el tiempo de exposición y la duración del estímulo. Los caracteres morfológicos comunes de las hiperplasias son: conservación de la arquitectura fundamental del ganglio, expansión de alguna de las zonas o compartimientos del ganglio, y proliferación policlonal de los elementos linfoides o de estirpe macrofágica. Formas histopatológicas de la hiperplasia: Se distinguen cuatro: folicular, interfolicular, sinusal y mixta. Hiperplasia folicular En ella predomina la hiperplasia de los folículos linfáticos. Ejemplos son la hiperplasia folicular inespecífica, la enfermedad de Castleman. - Hiperplasia folicular inespecífica. Es manifestación intensa de una respuesta de linfocitos B ante un estímulo, con aumento de volumen de ganglios regionales. Muy común en niños y en adolescentes. En la mayoría de los casos no se detecta la causa. Cuando es muy intensa en adultos, debe pensarse en la posibilidad de SIDA, artritis reumatoide o sífilis. Macroscopía: Ganglio aumentado de tamaño, generalmente entre 1,5 y 2,5 cm.; en casos excepcionales puede medir más de 4 cm. Se reconoce aumento en el número y tamaño de los folículos. Microscopía: variación en la forma de los folículos, centros germinales presentes, bien delimitados, se puede acompañar de abundante infiltración de plasmocitos en los cordones medulares. - Hiperplasia gigante de ganglios linfáticos (enfermedad de Castleman) No tiene preferencia por sexo ni edad. Más común en el mediastino, pero pueden afectarse otros grupos ganglionares o tejidos linfoides. A veces se acompaña de anemia, fiebre, hipergamaglobulinemia, que desaparecen al remover la lesión. Macroscopía: Caracterizada por una masa localizada de 1,5 a 16 cm., que impresiona como neoplásica. Microscopía: la masa está constituida por tejido linfoide con numerosas formaciones pequeñas como folículos. En cada una de éstas destaca un capilar que lo penetra desde su periferia: las células son linfocitos pequeños dispuestos concéntricamente. En raras ocasiones el cuadro histopatológico es el de una hiperplasia folicular inespecífica con centros germinales. En las escasas ocasiones en que la lesión se 264 HistologíayCitologíaavanzadaII presenta como un aumento de volumen ganglionar generalizado, debe investigarse la posibilidad de SIDA. Hiperplasia interfolicular Hay hiperplasia linfoide de la zona parafolicular, con linfocitos, inmunoblastos y plasmocitos; folículos linfáticos poco aparentes. Ejemplos: hiperplasia interfolicular en infecciones virales, postvacuna, reacción a la terapia con difenilhidantoína, lupus eritematoso. Hiperplasia sinusal (histocitosis de los senos) Los senos marginales y medulares del ganglio linfático, que están ensanchados, aparecen rellenos de macrófagos, derivados de las células litorales. Ejemplos: ganglios que drenan los miembros, ganglios que drenan órganos con cáncer, en particular mamario. En anemias hemolíticas y post transfusión, histiocitosis sinusal con hemosiderina y eritrocitos en el citoplasma. Hiperplasia mixta Hay hiperplasia folicular e interfolicular; a veces se agrega la hiperplasia sinusal. Ejemplos: mononucleosis infecciosa, toxoplasmosis. - Mononucleosis infecciosa. Enfermedad linfoproliferativa benigna, autolimitada, causada por el virus de Epstein-Barr. En la mayoría de los países, en particular en condiciones de subdesarrollo, hay una infección primaria por virus Epstein Barr, generalmente asintomática, que deja inmunidad. Adolescentes o adultos jóvenes de mejor condición socio-económica, que no han sufrido la infección en la infancia, pueden contagiarse por la saliva (enfermedad del beso). El virus penetra en la faringe y se replica en el epitelio faríngeo, provocando fiebre, faringitis, aumento de volumen generalizado de ganglios linfáticos y aparición en la sangre de células linfoides atípicas. Patogenia: El virus se une a los linfocitos B por los receptores de superficie; se integra al genoma y transforman una pequeña proporción de las células B que se multiplican (hiperplasia). Las células B estimulan intensa respuesta de células T, en forma de células linfoides atípicas T o inmunoblastos T; éstos son citotóxicos: destruyen las células B y cesa la infección. Microscopía: Los ganglios presentan hiperplasia folicular e interfolicular; en los seños pueden observarse las células linfoides atípicas, algunas a veces binucleadas, que pueden confundirse con las células de Reed-Sternberg de la enfermedad de Hodgkin. Hiperplasia Linfatica Extraganglionar (Pseudolinfoma). Hiperplasia folicular en tejidos linfoides extraganglionares, que pueden confundirse macroscópicamente con neoplasias. Ejemplos: pólipos linfoides del intestino, pseudolinfoma gástrico, pseudolinfomas orbitario, cutáneo y pulmonar. 265 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Linfoadenopatia Angioinmunoblastica: La linfoadenopatía angioinmunoblástica es una hiperplasia de células linfoides que determina un aumento de volumen generalizado de los ganglios linfáticos. Se acompaña de hepato-esplenomegalia, lesiones maculopapulares de la piel, fiebre y baja de peso. La lesión es poco frecuente; predomina en ancianos. Generalmente es idiopática; otras veces es secundaria a medicamentos, por ejemplo la penicilina. Microscopía: Arquitectura ganglionar borrada por una proliferación difusa policlonal de linfocitos, plasmocitos e inmunoblastos, con infiltración de eosinófilos. Los vasos sanguíneos del ganglio son prominentes, con ramificación arboriforme. Se observa depósito de material PAS positivo intersticial, constituido por inmunoglobulinas y restos celulares. Puede haber un infiltrado celular similar en otros órganos. Ej: médula ósea, piel. Evolución: alrededor del 20% de los pacientes se recuperan. En otros, la proliferación celular evoluciona hacia un linfoma inmunoblástico. Otros desarrollan una deficiencia inmunológica progresiva que lleva a la muerte por infección. Linfoma. ►Ref.5674b. Los síndromes linfoproliferativos son enfermedades que se originan en linfocitos T o B. Son de las enfermedades hematológicas malignas que mejor han respondido a los tratamientos, presentando mejor respuesta la Leucemia linfoblástica aguda (LLA) del niño entre 2 y 8 años, no así la del adulto, y el Linfoma de Hodgkin (LH). La causa de estas enfermedades no es conocida, pero se han asociado fuertemente a infecciones por virus, los que producirían daño del material genético celular y desencadenarían estas patologías. La Enfermedad o Linfoma de Hodgkin (LH) se caracteriza por ser muy sintomática, se presenta en forma febril. Se puede encontrar, generalmente en personas entre 20 y 40 años, existiendo un pequeño aumento en las personas de edad mayor. Los Linfomas No Hodgkin (LNH) son un grupo más grande de enfermedades, se presentan en niños en forma poco frecuente aumentando su frecuencia progresivamente con la edad. Se ha observado, en los últimos años, que la frecuencia de LH no ha variado en los últimos 40 años, en cambio los LNH han aumentado, al igual que los mielomas, posiblemente por el aumento de afecciones virales y estimulaciones antigénicas, tóxicos ambientales, todo esto sin considerar la patología del SIDA puesto que estos pacientes presentan mayor riesgo de desarrollar enfermedades neoplásicas y entre ellas los linfomas. Estas enfermedades (linfomas) se presentan con algunas características comunes como el aumento de tamaño de los ganglios, adenopatías. Características de los ganglios patológicos: 1. Mayores de 1 cm. de diámetro. 2. Presentes por más de 6 semanas (por un período menor puede ser un "ganglio infeccioso"; bacterias, virus o enfermedades inflamatorias como LES, AR). 266 HistologíayCitologíaavanzadaII 3. De consistencia gomosa. 4. Indoloros. 5. No adheridos a la piel ni a planos profundos, generalmente. 6. No desaparecen con la administración de antiinflamatorios o antibióticos. Recordad: los ganglios patológicos por metástasis son duros, se adhieren a planos profundos. En TBC los ganglios comprometidos se adhieren a la piel. Las localizaciones más frecuente de estas adenopatías es en las regiones cervicales posteriores y supraclaviculares, para ambos tipos de linfomas. Ante la sospecha de un linfoma, el diagnóstico se hará con la biopsia del ganglio más grande, porque puede ser que los ganglios satélites no estén comprometidos. Se biopsian ganglios de cuello y axila, no inguinales, a manos que este sea francamente patológico, porque estos pueden ser reacciones inflamatorias en que la biopsia no de diagnóstico. Etapificación: Examenes previos: Hemograma, el que puede mostrar: Anemia si la MO (médula ósea) está infiltrada. Linfopenia en LH, hay déficit en la inmunidad celular. En LH hay una transformación de un ganglio, de un linfocito o monocito (no se sabe) neoplásico, pero no hay una proliferación de linfocitos. Puede haber un hemograma normal en una etapa inicial. Linfocitosis en LNH que tienen infiltrada la MO. Eosinofilia en LH. El LH rara vez infiltra la MO, generalmente da anemia, linfopenia y eosinofilia, significando que hay una alergia a algo (textual). LNH pueden tener linfocitos anormales en la sangre por su diseminación hematógena, en cambio el LH no. VHS aumentada principalmente en el LH, en LNH no aumenta tanto. Con todos estos exámenes vamos a realizar la Etapificación clínica: (LH y LNH). Etapa I: compromiso de 1 grupo ganglionar, puede ser 1 ó 2 ganglios vecinos. Ej.: cervicales o supraclaviculares. Etapa II: compromiso de 2 grupos ganglionares. Ej.: supraclavicular y cervical, cervicales (bilateral). Etapa III: ganglios arriba y abajo del diafragma. El bazo se considera 1 ganglio. Etapa IV: compromiso ganglionar además de compromiso extraganglionar; MO, hígado, SNC. LINFOMA CD45 -Positivo -Puede ser negativo en linfomas con diferenciación plasmocitoide (Ig), linfoma linfoblástico T (CD1a, TdT), LACG (CD30, pan-T, pan-B) TUMOR NO LINFOIDE -Negativo 267 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología CK -Negativo -Muy raros linfomas pueden ser CK + (LACG , plasmocitoma) -Positivo en carcinomas. -Sólo CK de BPM (CK18) en carcinoma neuroendocrino, hepatocelular y de céls. Renales. -Mesoteliomas, sarc. y cordoma pueden ser CK +. S-100 -Negativo -Excepcionalmente linfoma positivo. -Positivo en melanoma y tumores de origen neural. -Puede ser positivo en gran número de tumores, incluyendo carcinoma de mama, sarcomas, etc. CD30 -Positivo en LACG -Negativo -Puede observarse tinción citoplásmica de intensidad variable en céls. Plasmáticas, algunos ca. y melanoma. Este tipo de tinción también aparece en LACG de fenotipo B y otros LNH. Frotis monomorfos (salvo la enf. de Hodgkin), de elementos sueltos. La adecuada tipificación del linfoma suele requerir una toma de biopsia, básicamente por que la arquitectura sólo es posible verla de esa forma, y porque las numerosas técnicas de inmunohistoquímica precisan un material adecuado. - Enfermedad de Hodgkin: células de Reed-Sternberg (y sus variantes, como las células de Hodgkin), histiocitos, polimorfonucleares (especialmente eosinófilos), células plasmáticas. - Linfomas “no Hodkin, de bajo grado”: población monomorfa de linfocitos pequeños, normalmente no hendidos, con escaso citoplasma y cromatina gruesa. No suele haber muchas mitosis ni fondo necrótico. - Linfomas “no Hodgkin, de alto grado”: población monomorfa de linfocitos grandes, de nucléolo prominente, con alta tasa mitótica. LinfomadeBurkitt. ►Ref.5682b. Definición: El linfoma de Burkitt es un tumor de la glándula linfática clasificado como un tipo de linfoma no Hodgkin. Nombres alternativos: Linfoma de las células B; linfoma de alto grado de células B; linfoma de células pequeñas. El linfoma africano de Burkitt está estrechamente relacionado con el virus EpsteinBarr (VEB), la principal causa de mononucleosis infecciosa. La forma americana del linfoma de Burkitt tiene una relación menos estrecha con el VEB. Ambos tipos de tumor se derivan de una línea de células inmunológicas llamadas linfocitos B. El linfoma de Burkitt se puede notar inicialmente como una inflamación de los ganglios linfáticos del cuello o debajo de la mandíbula. Con frecuencia, estos nódulos son indoloros. Estos ganglios linfáticos inflamados a menudo son indoloros y crecen muy rápidamente. La enfermedad puede iniciarse en otras regiones del cuerpo. La causa del linfoma de Burkitt no se conoce, pero en el linfoma de tipo africano existe una fuerte asociación con una infección temprana en la niñez por el virus EpsteinBarr. 268 HistologíayCitologíaavanzadaII LinfomadeHodgkins. Ref.5509b. Los tejidos linforreticulares comprenden los ganglios linfáticos, bazo, timo, los tejidos linfoides asociados con el tubo digestivo, la médula ósea en su función no hematopoyética, y linfocitos y macrófagos esparcidos en el organismo. Reúne a linfocitos y sus derivados (el sistema linfoide) y los macrófagos (el sistema fagocítico-mononuclear). El tejido hematopoyético ocupa la médula ósea; está formado por las células que dan origen a los eritrocitos, granulocitos, monocitos y plaquetas. Los tumores de tejidos linforreticulares y hematopoyéticos son prácticamente todos malignos. Hay tres grupos principales de neoplasias: linfoma, leucemia y mieloma. Linfoma: Los linfomas (linfomas malignos) son un grupo de tumores que se originan en ganglios linfáticos, a veces pueden tener un origen extraganglionar como tubo digestivo, pulmón, piel bazo, médula hematopoyética, dondequiera que se encuentre tejido linfoide asociado a las mucosas. La célula tumoral del linfoma prolifera determinando un borramiento de la arquitectura del ganglio, que aparece macroscópicamente aumentado de tamaño, blando o a veces firme, al corte de color rosado y consistencia como de carne de pescado crudo. El linfoma se va extendiendo a otros grupos ganglionares vecinos, después a los alejados. Luego se extiende al bazo, hígado, médula ósea y otros órganos en forma de tumores metastásicos. Hay dos grupos principales de linfoma: el linfoma de Hodgkin y linfoma noHodgkin. Linfoma de Hodgkin o Enfermedad de Hodgkin: En el linfoma de Hodgkin el parénquima tumoral está constituido por dos tipos de células de origen linfoide: las células de Hodgkin, que son grandes (alrededor de 20 micrones) con citoplasma relativamente abundante, núcleo grande vesiculoso, redondeado o irregular, membrana nuclear gruesa por marginación de cromatina y nucléolo prominente. Las células de Reed-Sternberg: gigantes (mayores de 50 micrones) con citoplasma abundante; en su forma característica tienen dos núcleos grandes vesiculosos con membrana nuclear gruesa; cada uno tiene un nucléolo prominente; los nucléolos están ubicados en una misma línea en un área vecina de ambos núcleos. El hallazgo de células de Reed-Sternberg características es necesario para hacer el diagnóstico de enfermedad de Hodgkin. En el linfoma de Hodgkin suele haber predominio del estroma y las células neoplásicas no siempre son muy abundantes. El estroma está constituido principalmente por linfocitos pequeños; además se observan plasmocitos, granulocitos eosinófilos, histiocitos y fibras colágenas. Reed-Sternberg 269 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Se reconocen cuatro variedades histológicas principales de linfoma de Hodgkin. En orden de mejor a peor pronóstico son las siguientes: predominio linfocítico, esclerosis nodular, celularidad mixta y depleción linfocítica. Suele haber una relación entre la variante histológica y el grado de diseminación de la neoplasia en el momento del diagnóstico. La clasificación por etapas es el proceso mediante el cual se determina si el tumor se ha propagado y, si lo hizo, hasta dónde. Existen diversos síntomas para determinar las etapas del linfoma de Hodgkin. Uno de los métodos para determinar la etapa del linfoma Hodgkin es el siguiente: Etapa I - Por lo general involucra a una sola región o estructura del ganglio linfático. Etapa II - Involucra a dos o más regiones o estructuras de ganglios linfáticos en el mismo lado del cuerpo. Etapa III - Involucra a las regiones o estructuras de ganglios linfáticos en ambos lados del cuerpo y se puede clasificar aún más en función de los órganos y las áreas afectadas. Etapa IV - Involucra a la enfermedad en otras áreas (metástasis) además de la implicación del sistema linfático. Linfoma de Hodgkin (Enfermedad de Hodgkin) Linfoma de Hodgkin nodular abundante en linfocitos. Linfoma de Hodgkin clásico: A. Esclerosis nodular. B. Linfoma de Hodgkin clásico rico en linfocitos. C. Linfoma de Hodgkin de Celularidad mixta. D. Linfoma de Hodgkin con depleción de linfocitos Microscópicamente las cuatro formas se resumen: I. II. 270 Predominio Linfocítico 6%, - Benignos ++ - Linfocitos +++ - Células reticulares atípicas + - Células Reed-Sternberg + - Abdominal - Difusa Celularidad Mixta 23%, - Benigno + - Linfocitos + - Células plasmáticas, Eosinófilos, Histiocitos - Células Reticulares Atípicas + - Células Reed-Sternberg +++ - Abdominal - (Fibrosis mínima o ausente) HistologíayCitologíaavanzadaII III. Deplección Linfocítica 2%, Maligna, Viejos, Estadío IVB - Linfocitos +,+/- - Células reticulares atípicas +++ (Forma reticular) - Células Reed-Sternberg +++ - Fibrosis +++ - Hialina (Fibrosis Difusa). - Acelular (Fibrosis Difusa). - Amorfa (Fibrosis Difusa). Esclerosis Nodular 68% Benigna +++ Mujeres jovenes Localización: Mediastino. Esclerosis: inicia vasos, confluente, nodularidad Birrefringente. Celularidad: - Predominio Linfocítico. - Celularidad Celularidad Mixta. - Deplexión Linfocítica. - Eosinífilos de la Esclerosis Nodular (no en celularidad mixta). Células de Reed-Sternberg: Origen Célula B → ME ribosomas libres Inmunoperoxidasa. → Inmunoglobulinas Célula histiocitaria →Fagocitar Ig, reabsorber. pasivamente Célula T: CD3, CD5, TCR-B y CD2 Células interdigitadas: HLA-DR Valor Diagnóstico Contexto de Hodgkin Otras Inmunoblásticas Megacariocitos Melanomas Una vez diagnosticada Patólogo puede diagnosticar infiltración → Enfermedad de Hodgkin órganos solo células de Hodgkin. Etiología Asociación →Genes Virus EB, 40-50% casos en células RS y ARN 100% 271 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología LinfomaLinfoblástico. ►Ref.5675b. Conocido también como Linfoma linfocítico, linfoma histiocítico o linfoma linfoblástico Existen tres tipos principales de linfoma no Hodgkin infantil: Linfoma Linfoblastico, Linfoma de Celulas Pequenas no Segmentadas (ya sea linfoma Burkitt o linfoma no Burkitt) y Linfoma de Celulas Grandes. En el linfoma no-Hodgkin el tejido tumoral está constituido casi exclusivamente por las células neoplásicas; el estroma es muy escaso. En general, en cada linfoma hay un solo tipo de célula tumoral, la que corresponde a alguna etapa de diferenciación de las células linfoides. Sin embargo, estas células malignas no expresan por completo el fenotipo normal y suele haber diferencias en la distribución de los antígenos de diferenciación que caracterizan a cada tipo de célula linfoide normal. Alrededor de dos tercios de los linfomas no-Hodgkin corresponden a proliferación de células derivadas de linfocitos B; el resto corresponden principalmente a células linfoides de estirpe T. Las células neoplásicas del linfoma no-Hodgkin infiltran el ganglio linfático y borran así su arquitectura normal. La infiltración puede ser uniforme en todo el ganglio (linfoma difuso), o bien pueden formar múltiples acúmulos esferoideos que remedan folículos linfáticos (linfoma nodular). Hay varios subtipos de linfomas no-Hodgkin, que se clasifican según el tipo de célula tumoral. El tipo de célula determina la gravedad del linfoma, por lo que se reúnen en tres grupos según el grado histológico de malignidad. Ejemplos de linfoma no-Hodgkin: Existen muchos tipos de linfomas no Hodgkin. Gracias a los avances en biología molecular, en inmunohistoquímica, en técnicas de imagen y medicina nuclear y en estudios farmacológicos se han desarrollado espectacularmente el diagnóstico y el tratamiento en los últimos diez años. A pesar de lo amplias que son las clasificaciones, existen algunas enfermedades linfoproliferativas que no han sido incluidas en ningún grupo. Éstas son la tricoleucemia, la leucemia linfática crónica o la micosis fungoide. Linfomas de bajo grado: A) Linfoma maligno linfocítico de célula pequeña compatible con leucemia linfática crónica plasmocitoide. B) Linfoma maligno folicular de células pequeñas hendidas predominantes. C) Linfoma maligno folicular mixto. Células pequeñas hendidas y células grandes. Linfomas de grado intermedio: A) linfoma maligno folicular predominando las células grandes. B) Linfoma maligno difuso de células pequeñas hendidas. C) Linfoma maligno difuso mixto de células pequeñas y grandes, con esclerosis y componente epitelioide. D) Linfoma maligno difuso de células grandes, hendidas y no hendidas. 272 HistologíayCitologíaavanzadaII Linfomas de alto grado: A) Linfoma maligno de células grandes, inmunoblástico: - Plasmocitoide. - De célula clara. - Polimorfo. - Con componente célula epitelioide. B) Linfoma linfoblástico: - "Convoluted". - "Non convoluted". C) Linfoma maligno: - Células pequeñas no hendidas. - De Burkitt. Miscelánea: - Compuesto. - Micosis fungoide. - Histiocítico. - Plasmocitoma extramedular. - Inclasificable. Aun la etiología de los LNH es desconocida, sin embargo ciertos estados de inmunodeficiencia adquiridos o congénitos, agentes infecciosos, agentes químicos y físicos, se han asociado a una mayor incidencia de estos tumores. a) Inmunodeficiencia: En estados de inmunodeficiencia la permanente desregulación inmune, asociado a la exposición crónica de antigenos, aumenta el riesgo de desarrollar LNH secundario. Enfermedades Congénitas como – Sd. Ataxia-Telangectasia, Sd. Wiscott-Aldridge, Sd. Linfoproliferativo asociado a cromosoma X, tienen una alta incidencia de LNH B de alto grado. De la misma forma inmunodeficiencia asociado a drogas o infecciones también presentan mayor incidencia. b) Enfermedades Autoinmunes: Enfermedades tales como el Sd.Sjogren, Tiroiditis de Hashimoto, Enfermedad Celiaca, promueven el desarrollo de tejido linfoide asociado a mucosas (MALT) y aumentan el riesgo de LNH tipo B. No ha sido posible demostrar riesgo similar en pacientes con AR o LES. c) Agentes Infecciosos (además de VIH): Helicobacter Pylori La infección por este germen a nivel del estomago conlleva con el desarrollo de gastritis crónica y MALT con alta asociación a Linfoma Gástrico. Virus Epstein-Barr: Este virus infecta e inmortaliza a los Linfocitos B, su infección tiene alta asociación con el Linfoma de Burkitt y tumores de células B en pacientes inmunocomprometidos. Retrovirus tipo C: originalmente aislado en pacientes con Linfoma de Células T de adulto. 273 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología d) Agentes Químicos y Físicos: Alta incidencia de Linfomas so ha observado en pacientes con exposición a radiaciones intensas: (Bomba atómica o explosión de reactores), así mismo en pacientes sometidos a Quimioterapia, especialmente con agentes alquilantes, el dasarrollo de estos tumores es mas frecuente. Neoplasias de Cels. B. Linfoma Linfoblástico precursor de Células B. Linfoma Linfocitico Pequeño Leucemia Prolinfocitica Linfoma Linfoplasmatico Linfoma Esplénico de zona marginal Leucemia de Células Velludas Linfoma Extranodal de la zona marginal Linfoma de las Células del Manto Linfoma Folicular Linfoma Nodal de la zona marginal Linfoma Difuso de Células Grandes Linfoma de Burkitt Plasmocitoma Mieloma Múltiple Neoplasias de Cels. T. Leucemia Promielocitica Leucemia Linfocitica de Células Grandes Leucemia de Células NK Linfoma extranodal nasal Mucosis Fungoide Linfoma Primario Cutáneo Anaplastico de Células Grandes Linfoma Subcutáneo tipo Paniculitis Linfoma Intestinal Linfoma Hepato Esplénico Linfoma AngioInmunoblastico Linfoma Periférico Linfoma Anaplastico de Células Grandes , tipo sistémico Linfoma de Células T del Adulto. El linfoma linfoblástico, esta incluido según las clasificaciones como linfoma no Hodgkin de alto grado de malignidad. Esta entidad esta estrechamente relacionada con la leucemia linfática aguda, de tal manera que inicialmente se penso que se trataba de una misma entidad. Citológicamente sus células son de aspecto blástico, con núcleo grande, cromatina finamente granulada, varios nucleolos, membrana nuclear convoluta, escaso citoplasma y elevado índice mitótico. Generalmente Tdt positivas. Aunque normalmente se trata de células T, en algunos casos el inmunofenotipaje las ha identificado como Pre-B o B. El linfoma linfoblástico posee una gran capacidad de diseminación, afectando con gran rapidez al SNC, a médula ósea y sangre periférica. Diferencias entre linfoma de Hodgkin y linfoma no-Hodgkin: Se considera que las variedades del linfoma de Hodgkin son manifestaciones de una misma enfermedad (enfermedad de Hodgkin). Los distintos linfomas no-Hodgkin serían diferentes enfermedades. El linfoma de Hodgkin se disemina en forma ordenada: de un grupo ganglionar a los otros, según la disposición de la circulación linfática; luego al bazo, hígado, médula hematopoyética, etcétera. Los linfomas no-Hodgkin se diseminan en orden no siempre predecible. Ambas clases de linfoma comprometen de preferencia grupos ganglionares centrales o axiales (cervicales, mediastínicos); sin embargo, en los linfomas no-Hodgkin se comprometen con cierta frecuencia ganglios periféricos (inguinales, axilares). El linfoma de Hodgkin casi nunca compromete el anillo de Waldeyer y los ganglios mesentéricos. Los linfomas no-Hodgkin pueden afectarlos. Aunque la gran mayoría de todos los linfomas 274 HistologíayCitologíaavanzadaII son de origen ganglionar, los linfomas no-Hodgkin a veces tienen un origen extraganglionar; los linfomas de Hodgkin casi nunca. La presencia de este linfoma se sospecha cuando aparece un ganglio linfático agrandado de tamaño sin una causa justificada, desde el cual la enfermedad se extiende hacia los ganglios linfáticos adyacentes y posteriormente se disemina por la sangre. El estudio histológico por medio del microscopio revela las células de Reed-Sternberg, características de esta afección. LinfomaMalignoFoliculardeCélulasPequeñasHendidas. ►Ref.5663b. El sistema linforreticular (SLR) comprende todos los tejidos hemopoyéticos y retículoendotelial. Pero, segúnse emplea generalmente y de modo específico, el término hace referencia sólo a una porción de los elementos celulares móviles y fijos, encargados de la defensa del organismo: los macrófagos, los elementos retículoendoteliales y los tejidos linfáticos funcionalmente relacionados cuyo papel biológico consiste en eliminar, neutralizar o secuestrar patógenos de producción endógena o exógenos, para lo cual se necesita una extensa variedad de interacciones celulares. Presntan f ondo escasamente necrótico. Células sueltas, rara vez agrupadas, en regueros. Citoplasma muy escaso, basófilo. Núcleo redondo-oval, pequeño o de talla media, hipercromático. Nucléolo pequeño y poco visible. Cromatina granular y de distribución uniforme. El progreso del conocimiento de la fisiopatogenia del sistema linfoide ha permitido a los patólogos, clasificar los LNH en diferentes subgrupos. Estas clasíficaciones tienen 2 objetivos fundamentales: Agrupar estas entidades desde el punto de vista morfológico, por criterios citohistológicos precisos, basados en el aspecto fenotípico. Definir entidades con características clínicas y evolutivas particulares como pueden ser el riesgo de enfermedad extraganglionar, diseminación a médula ósea (MO) o sistema nervioso central (SNC), permitiendo así un adecuado estadiamiento, tratamiento y pronóstico. La histopatología es un factor determinante en la selección del tratamiento y el pronóstico: a linfomas menos agresivos corresponden sobrevidas superiores; los % más altos de curaciones se encuentran en los linfomas agresivos. Este parámetro esta intimamente relacionado con la etapa clínica, y entre ambos y el estado general, deciden la conducta terapéutica. Linfomas de bajo grado: A) Linfoma maligno de linfocitos pequeños. (Compatible con la leucemia linfática crónica plasmocitoide). B) Linfoma maligno folicular predominantemente hendidas. (Áreas difusas, esclerosis). a células C) Linfoma maligno folicular mixto células pequeñas hendidas y (áreas difusas, esclerosis). pequeñas grandes 275 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Linfomas de Grado Medio: A) Linfoma maligno folicular predominantemente de células grandes (áreas difusas, esclerosis). B) Linfoma maligno difuso de células pequeñas hendidas (esclerosis). C) Linfoma maligno difuso mixto de células grandes y pequeñas (esclerosis y componente de células epitelioides). D) Linfoma maligno difuso de células grandes (células hendidas y no hendidas, esclerosis). Linfomas de Algo Grado: A) Linfoma maligno de células grandes, inmunoblástico (plasmocitoide, células claras, polimorfo, componente epitelioide). B) Linfoma maligno linfoblástico (células hendidas y no hendidas). C) Linfoma maligno de células pequeñas no hendidas (Burkitt, áreas foliculares). Misceláneos: Compuestos: - Micosis fungoides - Histiocítico - Plasmocitoma - No clasíficable - Otros. Leucemias y Linfomas crónicos: - Leucemia linfática crónica tipo T o B - Leucemia prolinfocitaria B o T - Linfomas de pequeñas células linfocitarias o linfoplasmocitaria - Leucemia a tricoleucocitos. Linfomas ganglionares o extraganglionares de presentación indolente Linfomas foliculares Linfomas T epidermotrópicos: MF y SS Linfomas de la zona marginal - Linfomas MALT (Mucosa Associate Linfoid Tissue) - Linfoma B monocitoide - Linfomas esplénicos con o sin linfocitos vellosos Linfomas de células del manto. Linfomas ganglionares o extraganglionares de presentación agresiva 276 HistologíayCitologíaavanzadaII Linfomas B de células grandes Linfomas T periféricos Linfomas de células grandes anaplásicas T o nulo. Leucemias o Linfomas agudos Leucemias o linfomas linfoblásticos Leucemias o Linfomas de Burkitt Leucemia/Linfoma de células T Diagnóstico Diferencial Características Morfológicas y Arquitecturales. Hiperplasia Folicular Arquitectura conservada (CD20, CD3) Distribución de los folículos irregular. Densidad folicular baja (30x unidad de área) Celularidad polimórfica. Índice proliferativo alto (Ki67) Céls. interfoliculares normales (CD21) Linfoma Folicular Arquitectura normal alterada. Distribución de los folículos uniforme. Densidad folicular alta (47x unidad de área) Celularidad monomórfica. Índice mitótico bajo. Céls. Interfoliculares atípicas. Ig Único marcador específico. Policlonal. Monoclonal CD10 Tinción del centro germinal débil y poco uniforme. Centros germinales uniformemente positivos. CD45RA (MT2) Negativo Positivo (50%) bcl-2 Negativo Positivo Debe recordarse incluir en el diagnóstico diferencial linfoma de células del manto, asi como que el diagnóstico primario de linfoma folicular no debe hacerse sobre tejidos extranodales. Ocasionalmente, tras los estudios pertinentes, los hallazgos no son concluyentes, en cuyo caso puede ser prudente considerar el caso como hiperplasia folicular atípica. Desde el punto de vista inmunohistoquímico, la restricción de cadenas ligeras es el único marcador específico. Con respecto al bcl-2, actualmente existen disponibles anticuerpos monoclonales que funcionan perfectamente en parafina, sobre todo si se utiliza algún sistema de desenmascaramiento antigénico por calor (microondas u olla a presión). La tinción positiva ocurre a nivel citoplásmico, observándose por regla general una expresión fuerte en el interior de los folículos neoplásicos y sólo algunas células positivas en los folículos reactivos, correspondientes a linfocitos T. No obstante, es preciso 277 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología considerar que existe un número de linfomas foliculares negativo para bcl-2, tanto mayor, cuanto más células grandes componen el tumor. Además es preciso no interpretar erróneamente folículos primarios con tinción positiva como tumorales. La expresión de CD10 es característica del linfoma folicular, aunque su mayor utilidad es en la diferenciación con otros tipos de linfoma. LinfomaMalignoDifusodeCélulasPequeñasHendidas. ►Ref.5669b. Hiperplasia Difusa Atípica Linfoma Difuso Mixto Entidades - Infecciones virales (CMV, mononucleosis infecciosa,...) - Situaciones post transplante - Hipersensibilidad a drogas - Angiomatosis bacilar - Linfadenopatía angioinmunoblástica. - Linfoma pleomórfico de céls.T - Enfermedad de Hodgkin - Inmunocitoma con presencia de blastos (subtipo polimórfico) - LBRCT - Linfoma de tipo MALT con presencia de céls. Grandes. - LLC con céls. R-Soides, o abundantes parainmunoblastos. Reticulina - Arquitectura preservada. - Arquitectura alterada. Ig (H /L ) -Policlonal - Monoclonal en inmunocitoma y linfoma tipo MALT. CD20 - Acentuación de la arquitectura preservada. - Patrón específico LBRCT CD3 De ayuda para localizar céls. T reactivas. Comparar con CD5, CD10 y CD 43. Policariocitos reactivos positivos. CD5 - Mayoría de céls. B negativas. - Positivo en LLC-B con céls. R-Soides o abundantes parainmunoblastos. CD10 - Centros germinales residuales débilmente teñidos. - Positividad en centros germinales de linfomas de las células del centro folicular (con componente difuso). CD43 - Mayoría de céls. B negativas. - Policariocitos reactivos positivos. - Positivo en LLC-B y 40% linfomas tipo MALT. CD30 - Positividad en escasas células aisladas. - Céls. de R-S positivas en enf. de Hodgkin. CD20/CD45RO - Inmunoblastos reactivos pertenecientes a diferentes líneas celulares. - Céls. grandes tumorales pertenecientes a una sola línea celular (B o T). CD15 - Céls. R-Soides negativas (pueden ser positivas las infectadas por CMV). - Céls. R-S generalmente positivas en enf. de Hodgkin. 278 HistologíayCitologíaavanzadaII La ausencia de atipicidad, con células grandes con características de inmunoblastos reactivos, admitiendo células reedsternbergoides, diferencia la hiperplasia difusa de las células claras, atípicas, con pliegues nucleares y cromatina grosera de los linfomas. En el linfoma difuso mixto, el componente de células pequeñas puede ser de forma predominante o exclusiva de carácter reactivo. Asi pues, insistiremos aquí en que el diagnóstico de linfoma debe hacerse en base a datos morfológicos y la subclasificación del linfoma, de interés pronóstico, es la que se beneficiará del estudio inmunofenotípico. No obstante, los resultados IHQ pueden ser equívocos o difíciles de interpretar y, en estos casos, puede ser útil contar con la opinión de un experto hematopatólogo. Con frecuencia, la evolución clínica es aclaradora en pocos días o semanas. LinfomadeCélulasGrandes. ►Ref.5678b. Es un linfoma de células T compuesto por células linfoides grandes con citoplasma abundante y pleomórfico, con núcleo a menudo en forma de herradura. Las células son CD30+. La mayoría de los casos son ALK+ (anaplastic large cell lymphoma kinase protein), aunque los casos ALK- también se incluyen en esta categoría. Este tipo de linfoma debe distinguirse del linfoma anaplásico cutáneo y de otros subtipos de linfoma T ó B de rasgos anaplasicos y/o expresión de CD30. Presentan fondo necrótico, con abundantes células sueltas y grupos sincitiales sin evidencia de diferenciación escamosa, glandular o de células pequeñas. Celularidad muy abundante. Citoplasma basófilos o eosinófilos, de bordes imprecisos, en ocasiones amplios y claros (el carcinoma indiferenciado de células claras). Núcleos grandes, en ocasiones gigantes y múltiples Nucléolo grande e irregular y ocasionalmente múltiple. Cromatina granular, fina con condensaciones irregulares. Representan aproximadamente el 3% de todos los linfomas no-Hodgkin en adultos y el 10-30% de los linfomas infantiles. El tipo ALK+ es más frecuente en menores de 30 años y predomina en varones. La forma ALK negativa es más frecuente en mayores, sin diferencia entre sexos. No se han demostrado agentes causales o factores predisponentes. Generalmente ALK+ se produce frecuentemente tanto afectación ganglionar como extranodal. Los órganos extranodales más frecuentemente afectados son: piel, hueso, tejidos blandos, pulmón e hígado; la afectación intestinal y de sistema nervioso central es rara. En el grupo de pacientes ALK negatvo, la afectación extranodal es menos frecuente. La mayoría de los pacientes presentan enfermedad avanzada, con síntomas sistémicos (sobretodo fiebre elevada) y afectación extranodal. La médula ósea está infiltrada en un elevado número de casos. Los casos ALK+ presentan un amplio espectro morfológico. Sin embargo todos los caso contienen una proporción variable de células con núcleos excéntricos conforma de herradura o arriñonados, y a menudo con una región eosinófila cerca del núcleo. Las células tumorales tienen un citoplasma más abundante que las de otros tipos de linfomas. Se reconocen 3 variantes: a) Común (70%), b) Linfohistiocítica (10%) y c) De células pequeñas (5-10%). Los casos ALK- son menos característicos.En el inmunofenotipo se aprecia positividad de CD30 en la membrana celular y en la región del Golgi, siendo más intensa en las células grandes. La expresión ALK se detecta en el 60-85% de los casos, citoplásmica y/o nuclear. La expresión ALK es casi específica de este tumor. La mayoría son 279 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología EMA+. La gran mayoría expresan uno o más antígenos de células T, aunque algunos casos pueden ser "null cell". Son negativas para EBV. LinfomaMalignodeCélulasGrandes. ►Ref.5679b. Denominado también: Linfoma Maligno No Hodgkin de Células Grandes, Inmunoblástico B. Entre los que encontramos: - Plasmocitoide. - De célula clara. - Polimorfo. - Con componente célula epitelioide. En el linfoma no-Hodgkin el tejido tumoral está constituido casi exclusivamente por las células neoplásicas; el estroma es muy escaso. En general, en cada linfoma hay un solo tipo de célula tumoral, la que corresponde a alguna etapa de diferenciación de las células linfoides. Sin embargo, estas células malignas no expresan por completo el fenotipo normal y suele haber diferencias en la distribución de los antígenos de diferenciación que caracterizan a cada tipo de célula linfoide normal. Alrededor de dos tercios de los linfomas no-Hodgkin corresponden a proliferación de células derivadas de linfocitos B; el resto corresponden principalmente a células linfoides de estirpe T. Las células neoplásicas del linfoma no-Hodgkin infiltran el ganglio linfático y borran así su arquitectura normal. La infiltración puede ser uniforme en todo el ganglio (linfoma difuso), o bien pueden formar múltiples acúmulos esferoideos que remedan folículos linfáticos (linfoma nodular). MelanomaMetastásico.NódulosLinfáticos. ►Ref.6380b. El melanoma es un tumor maligno de los melanocitos. La mayoría de los melanomas se localizan en la piel y menos frecuentemente en mucosas, pero dado el origen de los melanocitos -derivan de la cresta neural-, pueden observarse en otras localizaciones como retina y meninges donde también migran los melanocitos. Los melanocitos derivan de la cresta neural y durante el desarrollo embriológico se diferencian hacia melanoblastos y migran hacia la piel. Tras alcanzar la dermis migran a la epidermis o el folículo piloso y se diferencian hacia melanocitos epidérmicos o foliculares, o se quedan en la dermis y se diferencian hacia Nevomelanocitos. Las funciones de los melanocitos epidérmicos es la de producir melanina y transferirla a los queratinocitos que los rodean. Además de la función de producir melanina los melanocitos dan lugar a uno de los tumores más frecuentes del organismo: los nevus melanocíticos. El melanoma tiene un comportamiento biológico que determina el pronóstico ya que presenta dos fases de crecimiento, una radial (intaepidérmica) y otra vertical (intradérmica). 280 HistologíayCitologíaavanzadaII En la fase de crecimiento radial, que puede durar meses o años, la tumoración está limitada a la epidermis sin presentar capacidad de producir metástasis, en esta situación la extirpación quirúrgica es curativa. En la fase de crecimiento vertical, la tumoración invade la dermis con la capacidad de producir metástasis linfáticas o sanguíneas. Este crecimiento del melanoma maligno hace necesario que una vez se establece el diagnóstico, tenga que establecerse en que fase de crecimiento se encuentra, con la finalidad de establecer el pronóstico y el tratamiento. El estudio histológico del melanoma muestra en las fases iniciales una proliferación de melanocitos atípicos limitada a la epidermis (in situ), con presencia de melanocitos en todos los niveles epidérmicos. Los melanocitos atípicos se disponen individualmente y en nidos de tamaño y forma heterogénea. A medida que la lesión progresa puede existir afectación de dermis observándose células tumorales sueltas y en nódulos de tamaño y forma variable. Las células del melanoma son de morfología variable, cuboidales o fusiformes y suelen mostrar ausencia de maduración nuclear (reducción del tamaño nuclear en profundidad) así como mitosis y necrosis celular. Los melanomas se acompañan de una respuesta inflamatoria con presencia de infiltrado inflamatorio de predominio linfo-histiocitario que puede ser variable en su distribución e intensidad. Otro hallazgo histológico característico del melanoma es la observación de fenómenos de regresión histológica que consiste en la presencia de un denso infiltrado inflamatorio con presencia de melanofagos y áreas variables de fibrosis dérmica. La regresión histológica se correlaciona con la presencia clínica de áreas claras en las lesiones de melanoma. Existen datos histológicos que son importantes de cara a conocer el pronóstico de un melanoma entre los que se incluyen el grosor en milímetros del tumor (índice de Breslow), la presencia de ulceración, el número de mitosis y la presencia de satelitosis e invasión vascular. El carcinoma espinocelular (CEC), es una neoplasia de las células queratinizantes, que pueden mostrar características malignas, incluyendo anaplasia, crecimiento rápido, invasión local y potencial metastásico. Es el segundo cáncer más frecuente después del carcinoma basocelular. Los individuos con mayor predisposición a desarrollar un CEC son aquellos más expuestos a las quemaduras solares y que tienen dificultades para broncearse. También están más expuestos los pacientes en tratamiento inmunosupresor después de algún transplante de órgano, pacientes expuestos al arsénico y pacientes con psoriasis tratados con luz ultravioleta. Presentación clínica: El CEC se presenta como una mácula o pápula levemente solevantada roja hiperqueratósica ubicada preferentemente en áreas expuestas al sol, pero puede presentarse también en cualquier localización. El CEC in situ tiende a aparecer en asociación con lesiones de queratosis actínica preexistente. La enfermedad de Bowen representa un CEC in situ con características microscópicas especiales, que puede presentarse en cualquier localización. El CEC puede clasificarse en 4 grados de diferenciación de acuerdo al porcentaje de células diferenciadas, siendo grado 1 el que tiene un 75% de las células diferenciadas. El pronóstico empeora con el mayor grado de diferenciación. La invasión en profundidad también es significativa para determinar el riesgo de recurrencia. 281 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los CEC tienen una tendencia variable de producir metástasis a los linfonodos regionales. Los tumores ubicados en áreas de inflamación crónica, tienen un 10 a 30% de probabilidades de producir metástasis linfáticas, mientras que los que no se relacionan con áreas de inflamación crónica tienen cifras que fluctúan entre 0,05 y 16%. Un 5 a 10% de los CEC que producen metástasis, lo pueden hacer hacia las vísceras por vía intravascular. También tienen la posibilidad de diseminarse por vía neural hacia el sistema nervioso central. Los tumores mayores de 2 cm de diámetro, duplican su probabilidad de recurrencia de 7,4 a 15,2%. Los tumores menores de 4 mm de espesor tienen un bajo riesgo de metástasis (6,7%) comparado con un 45% para los tumores mayores de 4 mm. Hay que tener en cuenta cuatro hechos peculiares que pueden ocurrir en los melanomas: 1. En presencia de metástasis extensas el tumor primario puede ser pequeño y ubicado en zonas ocultas, por ejemplo, interdigital. 2. Aun en presencia de metástasis, el tumor primario puede involucionar espontáneamente y en su lugar sólo se encuentra fibrosis y macrófagos con melanina. 3. Las células del tumor primario o de las metástasis pueden no contener melanina («melanoma amelánico»): se demuestran los melanosomas al microscopio electrónico. 4. Las células del parénquima tumoral pueden ser cuboídeas como las de un carcinoma, fusadas remedando un sarcoma, o acentuadamente anaplásticas o polimorfas como las de cualquier tumor maligno indiferenciado. 282 UNIDADDIDÁCTICAVI ESTUDIOSHISTOLÓGICOSYCITOLÓGICOSDEL SISTEMAREPRODUCTORMASCULINO HistologíayCitologíaavanzadaII TestículosNormales. ►Ref.5790b. Son glándulas ovales pares que miden cerca de 5 cm de longitud y 2.5 cm de diámetro, cada testículo pesa entre 10 y 15 gramos, estos se desarrollan en la parte alta de la pared abdominal posterior del abdomen y por lo general comienzan su descenso hacia el escroto a través del canal inguinal durante la segunda mitad del séptimo mes del desarrollo fetal. Los testículos están cubiertos por una membrana serosa que se conoce como túnica vaginal, una prolongación del peritoneo en forma de saco que se forma durante el descenso de los testículos. En la parte interna de la túnica vaginal se encuentra una capa blanca de tejido fibroso denso, que se conoce como túnica albugínea y que se extiende hacia dentro dividiendo cada testículo en una serie de compartimientos internos que se denominan lóbulos. Cada uno de los 200 a 300 lóbulos contiene de uno a tres conductos enrollados que producen espermatozoides por medio de la espermatogenesis y que se llaman túbulos seminíferas. EpidídimoNormal. ►Ref.5783b. Cuerpo de forma semilunar situado en la parte superior del testículo, formado por el conjunto de conductos seminíferos enrollados y que continua con el conducto deferente. Está formado por tres partes: la cabeza, el cuerpo y la cola. Contribuye al almacenamiento y a la maduración de los espermatozoides. Desde el punto de vista funcional los conductos del epidídimo son el sitio de maduración de los espermatozoides, los cuales requieren entre 10 y 14 días para terminar su maduración. Los conductos del epidídimo también almacenan espermatozoides y los expulsan hacia la uretra durante la eyaculación mediante contracciones peristálticas de su músculo liso. Los espermatozoides pueden permanecer almacenados en los conductos del epidídimo por mas de cuatro semanas después de este tiempo se expulsan fuera del epidídimo o se reabsorbenDesde los testículos el esperma llega al epidídimo, órgano constituido por un tubo enrollado de 7 m de longitud, ubicado sobre el testículo. Los espermatozoides carecen de movilidad cuando entran al epidídimo y adquieren esa capacidad sólo después de estar allí 18 hs. Desde el epidídimo, el esperma pasa al conducto deferente, donde en su mayor parte queda almacenado. El conducto deferente es una extensión, apretadamente enrollado, del epidídimo, va desde el testículo hacia el interior de la cavidad abdominal, junto a arterias, nervios y una envoltura de tejido conjuntivo, constituye el cordón espermático. Dentro de la pared posterior de la cavidad 285 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología abdominal estos cordones, provenientes uno de cada testículo, rodean a la vejiga y se unen con los conductos seminales para luego entrar a la uretra. El corte de los conductos deferentes (vasectomía) ofrece un método relativamente seguro y casi indoloro de control de la natalidad. La uretra, que corre a través de la glándula prostática (próstata) y termina en el extremo del pene, sirve para la excreción de orina y para la eyaculación del esperma. PróstataNormal. ►Ref.8232b. Organo compuesto por glándulas y estroma, ambos íntimamente unidos y delimitados por la cápsula prostática común. Tiene forma de castaña o triángulo achatado en su base o cara superior. Pesa 20 a 25 g y mide 3 x 4 x 2,5 cm en el hombre adulto. Está alojada en el compartimiento o nicho prostático inmediatamente por debajo de la vejiga, en relación con la cual se halla su base o cara superior. Su extremo opuesto, más aguzado, el ápex o vértice prostático, termina junto al segmento distal de la uretra prostática en la aponeurosis perineal media. En la próstata se distinguen tres zonas: a) zona de transición, correspondiente al 10% de la glándula, ubicada en la base y en relación con la uretra y vejiga. b) zona central, correspondiente al 20% de la glándula, ocupa la base en relación con las vesículas seminales. c) zona periférica, correspondiente al resto de la glándula (70%). La zona central probablemente es de origen wolffiano, mientras que las zonas de transición y periférica derivan de evaginaciones de la uretra proximal, de origen cloacal. Estas últimas dos zonas se consideran el sitio de origen del adenocarcinoma de la próstata. Las arterias que irrigan la próstata nacen de la arteria ilíaca interna o arteria hipogástrica. Los linfáticos drenan hacia los ganglios ilíacos externos, hipogástricos medios e inferiores, sacros laterales y prevesicales. Las glándulas de la próstata están formadas en su mayor parte por células secretoras, de las que derivan los adenocarcinomas, que son los tumores más frecuentes de este órgano. Dichas células secretan fosfatasa ácida y poseen antígeno prostático específico, utilizado en la identificación de tumores derivados de estas células. Desde los 30 años en adelante, se producen en la próstata diversas alteraciones histológicas, como atrofia focal, fibrosis periglandular e inflamación crónica focal, alteraciones que afectan preferentemente la zona periférica. AbscesoTesticular. ►Ref.7054b. El absceso del testículo es un proceso infeccioso poco frecuente del testículo. Puede ocurrir como complicación de una punción, una biopsia o traumatismo del escroto en pacientes inmunodeprimidos. Se acompaña de un derrame de la vaginal (hidrocele, piocele o hematocele) que aumenta el volumen y sensibilidad de las bolsas. El proceso infeccioso debe ser tratado con orquidectomía y drenaje del lecho cruento. 286 HistologíayCitologíaavanzadaII Clínicamente se caracteriza por un aumento importante del volumen testicular, con signos inflamatorios testiculares, e intenso dolor. La afectación del estado general está presente con fiebre y nauseas y la elevación del testículo (signo de Prehn) calma el dolor. El cordón espermático habitualmente es sensible a la palpación y suele estar tumefacto. Casi siempre suele existir un hidrocele reactivo. Los análisis de sangre suelen mostrar leucocitosis y neutrofilia (indicadores de infección). Inflamaciones Pueden ser producidas por variados agentes: bacterias, hongos, virus, etc. La inflamación testicular más frecuente es la orquitis urleana, que se presenta en más de un tercio de los pacientes a raíz de una parotiditis viral. Puede ser causa de infertilidad. En general, las demás inflamaciones testiculares son secundarias a epididimitis agudas o crónicas, como por ejemplo, la tuberculosa, sifilítica, micótica y las producidas por brucellas o parásitos (schistosoma). Aunque poco frecuentes, las inflamaciones granulomatosas y la malacoplaquia del testículo y epidídimo deben tenerse presentes para no confundirlas con lesiones tumorales. El absceso tiende a drenar por sí solo, pero en determinados casos es necesario practicar un drenaje quirúrgico. Adenocarcinoma.Próstata. ►Ref.5402b. El cáncer de la próstata es muy frecuente, se presenta en el 25% de los hombres sobre los 50 años y en el 80% de los mayores de 90.De todos los tumores de la próstata los más frecuentes son los carcinomas y de éstos, el adenocarcinoma, que corresponde a más del 90% de los tumores malignos del órgano. El adenocarcinoma se origina en la zona periférica, aunque ocasionalmente se desarrolla de la zona de transición. Deriva de los acinos glandulares (carcinoma acinar), muy pocos, no más del 3%, lo harían de los conductos glandulares (carcinoma ductal). En el 85% de los casos es un carcinoma multifocal o extenso, en menos del 10% es uninodular. Formas o categorías del carcinoma de próstata: 1) Carcinoma clínicamente manifiesto: el diagnóstico se establece clínicamente, por examen físico, signos de estenosis u obstrucciones uretrales, hematuria, etc. 2) Carcinoma oculto: descubierto por sus metástasis antes que el tumor primario, 287 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 3) Carcinoma incidental (subclínico): clínicamente silente, descubierto casualmente en el examen microscópico de tejido prostático resecado bajo el diagnóstico de enfermedad no maligna. 4) Carcinoma latente: descubierto en autopsias. El carcinoma incidental y el latente parecen tener una frecuencia mucho mayor que el carcinoma manifiesto y el oculto. Por lo tanto, aparentemente existe sólo un pequeño porcentaje de cánceres que progresan y se diseminan. El porqué de esta agresividad selectiva se desconoce por completo. Estadíos del cáncer de la próstata: Es de gran importancia pronóstica determinar en la forma más precisa posible el estadío en que se encuentra el carcinoma de la próstata, para lo cual el mejor método es el examen morfológico. Los estadíos básicos son cuatro: Estadío I Carcinoma incidental (sin manifestaciones clínicas). Estadío II Carcinoma dentro de la cápsula prostática. Estadío III Carcinoma con extensión extracapsular, sin metástasis. Estadío IV Carcinoma con metástasis. Cada uno de estos estadíos se subdivide en dos atendiendo al grado de diferenciación histológica, número de focos y extensión del carcinoma, eventual infiltración de órganos vecinos (vesículas seminales, uretra, vejiga, pelvis) y sitio de las metástasis. En la evaluación de las metástasis ganglionares linfáticas son importantes el número de ganglios comprometidos y el tamaño de aquellas. Los estadíos que se encuentran más frecuentemente en las resecciones quirúrgicas son el III (45%) y el IV (57%). El paciente con tumor en el estadío inicial (IA1) tiene igual sobrevida que la población general. Clasificación: De todas las clasificaciones actualmente en uso para determinar el grado de malignidad histológica del carcinoma prostático, una de las más apropiadas es la de Gleason. Según ésta se distinguen 5 tipos histológicos, que van desde un adenocarcinoma tubular bien diferenciado, de crecimiento expansivo (tipo 1) hasta uno muy poco diferenciado e infiltrante (tipo 5). Los tipos más frecuentes son el 3 y el 4, que en conjunto tienen una frecuencia relativa de cerca de 60% y corresponden a un adenocarcinoma tubular moderadamente diferenciado y poco diferenciado, respectivamente. El grado de Gleason está dado por suma de los dos tipos predominantes en cada caso. Los grados 8, 9 y 10 tienen metástasis ganglionares regionales en más del 90% de los casos y son los de peor pronóstico. Los grados 2, 3 y 4 no tienen metástasis y son de muy buen pronóstico. Neoplasia intraepitelial: En la próstata existe también el carcinoma in situ y microfocos de atipías celulares dentro de las glándulas sin signos de invasión, que se observan frecuentemente en próstatas con cáncer. La etapa que sigue al carcinoma in situ es la del carcinoma microinvasor, sólo excepcionalmente observado en la próstata. 288 HistologíayCitologíaavanzadaII Otros tipos histológicos: Mucho menos frecuentes como cáncer primario de la próstata son el carcinoma de epitelio de transición, el carcinoma epidermoide y el carcinosarcoma. Entre los sarcomas están el leiomiosarcoma, rabdomiosarcoma y fibrosarcoma, todos éstos muy poco frecuentes. Metástasis del cáncer de la próstata: Ellas se realizan por vía linfática o hematógena. La invasión de estos sistemas puede ser precoz (inclusive, aunque excepcionalmente, en el carcinoma incidental A1). Pero corrientemente existen más metástasis en tumores de mayor tamaño. Las metástasis hematógenas a los huesos pueden producirse sin una concomitante diseminación linfática. Las metástasis más frecuentes son las ganglionares linfáticas regionales (ganglios obturadores, hipogástricos e ilíacos). Las metástasis óseas más frecuentes son las de la pelvis, cuerpos vertebrales, fémur y costillas. Las viscerales más frecuentes son las de pulmones, hígado y glándulas suprarrenales. Las metástasis son de gran importancia en el cáncer de la próstata, ya que, con pocas excepciones, de ellas depende la mortalidad. Las determinaciones serológicas, de antígeno prostático, y fosfatasa ácida prostática son de gran utilidad para el diagnóstico clínico del cáncer o de metástasis. Compromiso tumoral secundario en la próstata: La invasión de la próstata por otros cánceres es por extensión: en el carcinoma de epitelio de transición de la vejiga, cáncer del recto y en el de las vesículas seminales, este último muy raro. Ocasionalmente se produce un compromiso aislado de la próstata en linfomas, metástasis de melanoma, de carcinoma broncogénico y del estómago. EpididimitisTuberculosa.Epidídimo. Ref.8216b. La epididimitis o inflamación del epidídimo, puede aparecer en forma aguda o establecerse en forma atenuada y crónica. Frecuentemente la epididimitis se asocia a una prostatitis. Para que el epidídimo (y el deferente) se inflamen es necesario causas predisponentes y causas determinantes. Las causas predisponentes son las que provocan obstrucción o reflujo epididimario. La causa predisponente más frecuente es la prostatitis. Las causas determinantes pueden ser infecciosas o no infecciosas. Las causas no infecciosas pueden ser irritantes llevados por la orina. Las causas infecciosas pueden ser bacterianas o no bacterianas. La epididimitis aguda se inicia en forma unilateral aunque puede seguir en forma "basculante" pasando al otro epidídimo después que el que ha iniciado la enfermedad ha evolucionado a la cicatrización. Determinadas areas del abdomen son consideradas para el no informado como relacionadas con diferentes órganos del aparato urinario. 289 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Una vejiga distendida con orina puede ser palpada en la zona baja del abdomen y confundida con un tumor intestinal, un fibroma uterino, un quiste de ovario o un quiste hidatídico. Los tumores de la vejiga, pueden ser palpados sólo si son voluminosos y la maniobra se ejecuta bajo anestesia general o peridural. La piel del escroto puede ser asiento de formaciones anormales de origen epitelial de carácter inflamatorio o tumoral. Los forúnculos y los abscesos de piel, son procesos inflamatorios molestos o dolorosos de fácil diagnóstico. Las coberturas del escroto pueden estar comprometidas por procesos inflamatorios profundos como la tuberculosis del epidídimo que se fistuliza a la piel como una induración que fija al epidídimo. La epididimitis o inflamación del epidídimo, puede aparecer en forma aguda o establecerse en forma atenuada y crónica. Frecuentemente la epididimitis se asocia a una prostatitis. Para que el epidídimo (y el deferente) se inflamen es necesario causas predisponentes y causas determinantes. Las causas predisponentes son las que provocan obstrucción o reflujo epididimario. La causa predisponente más frecuente es la prostatitis. Las causas determinantes pueden ser infecciosas o no infecciosas. Las causas infecciosas pueden ser bacterianas o no bacterianas. La epididimitis aguda se inicia en forma unilateral aunque puede seguir en forma "basculante" pasando al otro epidídimo después que el que ha iniciado la enfermedad ha evolucionado a la cicatrización. La epididimitis aguda debe ser diferenciada del varicocele. La causa más frecuente de una epididimitis aguda puede ser la complicación de un cateterismo de la uretra o una sonda en permanencia. El principal síntoma de la epididimitis aguda es la masa palpable y dolorosa a la altura del epidídimo en el interior del escroto. Se acompaña de postración y sindrome febril. La infección puede ser de tipo inespecífico (por bacilo coli, proteus, etc.) o específico (por tuberculosis, sífilis o brucelosis), Las epididimitis crónicas, pueden ser la evolución de una forma aguda, o ser una forma atenuada y crónica desde su comienzo. La epididimitis tuberculosa dejada a su evolución, tiene tendencia a fistulizar a la pared del escroto, indurando la zona de abocamiento al exterior. La epididimitis debe ser diferenciada de una orquitis, un tumor del testículo, una torsión del cordón espermático y de una torsión de una hidátide de Morgagni. TumorAdenomatoide.Epidídimo. ►Ref.5785b. Los tumores testiculares son poco frecuentes, sobre todo en niños y en mayores de 50 años. En su gran mayoría son malignos, pero el grado de malignidad es muy diferente según cuál sea el tipo histológico. El 95% deriva de células germinales primordiales (gonocito fundamental). 290 HistologíayCitologíaavanzadaII DuplicaciónPeneana. ►Ref.8034b. La duplicación peneana es una muy rara malformación en la que hay 4 tipos diferentes: Pene biido: Es el pene que se observa asociado a la extrofia cloacal. En realidad son 2 "inipenes" (cada uno de los cuales tiene un cuerpo cavernoso y un hemiglande). En los casos de estrofio cloacal lo más habitual es resecar un enipene y transformar el otro es clítoris, adoptando luego es sexo femenino (por medio de orquiectomia vaginoplastia - hormonoterapia). Pene accesorio: Pene pequeño y ectopico que se observa en inserto en el cuerpo peneano o en el perineo. En general carece de una uretra y basta su simple extirpación para que sea normal. Completa: Hay doble tallo peneano y doble glande al igual que doble uretra, una de las cuales puede ser atresica además cada tallo peneano tiene dos cuerpos cavernosos. Incompleta: Hay doble glande con un mismo tallo peneano, puede haber doble uretra pero a menudo una de ellas es atresica o simplemente hay una sola uretra. Seminoma.Testículo. ►Ref.6187b. Tumores de Celulas Germinales: Cada uno de los cuatro tipos básicos, el seminoma, carcinoma embrionario, teratoma y coriocarcinoma, puede tener variedades y darse en diversas combinaciones con los demás tipos. Según la extensión del tumor y eventuales metástasis se distinguen tres estadíos: Estadío I: Tumor confinado al testículo. Estadío II: Tumor con metástasis ganglionar linfática infradiafragmática. Estadío III: Tumor con metástsis supradiafragmática o viscerales o ambas. Seminoma: El nombre de este tumor deriva de la palabra semen. Corresponde a la mitad de los tumores de células germinales del testículo. Se distinguen tres grados de diferenciación: 1) Bien diferenciado o tipo I (10%). 2) Moderadamente diferenciado o tipo II, forma más frecuente (60%). 3) Mal diferenciado o tipo III o seminoma atípico (28%). Existe otra variedad, muy poco frecuente, el seminoma espermatocítico (2%). 291 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología El seminoma típico está formado por brotes de células tumorales grandes, de núcleo poco denso en cromatina, con nucléolo prominente, citoplasma claro y contornos celulares no bien definidos. Entre estos brotes hay infiltrados intersticiales linfocitarios. Puede haber algunas células intersticiales secretoras de gonadotropina coriónica humana, cuya localización celular habitual es el sinciciotrofoblasto. Al corte del parénquima testicular se observa una tumoración de bordes expansivos, con una superficie de corte homogenea, de color blanco y de consistencia blanda. Microscópicamente: Se caracteriza por una proliferación difusa, densamente celular, que se caracteriza por la presencia de células de distintos tamaños y ocasionales células gigantes multinucleadas. La población más abundante está constituida por células de pequeño tamaño que recuerdan a linfocitos. No se suele observar infiltración linfoide ni presencia de granulomas. En el examen histológico se observan células redondas de citoplasma claro, dispuestas difusamente en nidos o cordones separados por un estroma colágeno, el cual casi siempre está infiltrado por linfocitos, con formación de folículos o células plasmáticas. En ocasiones pueden observarse granulomas, que cuando son muy abundantes pueden ocasionar un diagnóstico erróneo de tuberculosis o sarcoidosis. Rara vez las células neoplásicas pueden adoptar formas semejantes a glándulas o estructuras tubulares. El aspecto macroscópico del seminoma clásico es característico: Una masa bien circunscrita con una superficie uniforme, blanca y lobulada. El tejido neoplásico puede ser suave o firme, dependiendo de la cantidad de células tumorales y estroma fibroso. En ocasiones pueden observarse grandes áreas de necrosis. La mayoría de los tumores están confinados al testículo, pero la extensión al epidídimo o cordón espermático ocurre en 8% de los casos. Este tumor es altamente radiosensible. La sobrevida a los 5 años para el estadío I es de 100%; para el estadío II, 95%, y para el estadío III, 90%. Según experiencias recogidas en decenios anteriores, hasta el 40% de los seminomas puros pueden tener metástasis ganglionares linfáticas regionales en el momento de la consulta. En estudios recientes en algo más del 20% de los enfermos con seminoma hay niveles sanguíneos elevados de gonadotropina coriónica humana, subunidad beta, lo que puede ser útil para el seguimiento de los pacientes y para evaluar el resultado terapéutico. OrquitisGranulomatosa.Testículos. ►Ref.6231b. Definición: Es la inflamación de uno o ambos testículos, causada con frecuencia por infección. Nombres alternativos: Infección del testículo; Epidídimo-orquitis. Pueden ser producidas por variados agentes: bacterias, hongos, virus, etc. La inflamación testicular más frecuente es la orquitis urleana, que se presenta en más de un tercio de los pacientes a raíz de una parotiditis viral. Puede ser causa de infertilidad. 292 HistologíayCitologíaavanzadaII En general, las demás inflamaciones testiculares son secundarias a epididimitis agudas o crónicas, como por ejemplo, la tuberculosa, sifilítica, micótica y las producidas por brucellas o parásitos (schistosoma). Aunque poco frecuentes, las inflamaciones granulomatosas y la malacoplaquia del testículo y epidídimo deben tenerse presentes para no confundirlas con lesiones tumorales. Hipospadia.Pene. ►Ref.6449b. Las malformaciones congénitas del aparato genitourinario son las más frecuentes en el ser humano. Si bien se producen durante la vida intrauterina, muchas de ellas no se expresan hasta la vida adulta o son ignoradas por completo. Se conoce su existencia cuando por la gravedad o magnitud comprometen la vida o cuando se complican de infección, litiasis, hematuria o deterioro de la función renal; esto puede ocurrir en cualquier etapa de la vida. Muchas de ellas no tienen tratamiento o sólo puede buscarse el alivio sintomático, pero otras pueden ser corregidas si se las busca y diagnostica en el período antenatal, neonatal, en la infancia, juventud y en el adulto. Para ello es fundamental conocerlas ya que los medios de diagnóstico por imágenes actuales permiten una exploración precisa en la mayoría de los casos. Las malfomaciones en la uretra son infrecuentes y debe tenerse presente que existe una variedad amplia que sólo mencionaremos: Duplicidad vesical, con un uréter en cada vejiga. Tabiques completos e incompletos. Vejiga en reloj de arena. También la persistencia del uraco puede dar origen a divertículos, quiste y fístula de origen uracal. En todos ellos se sitúan a nivel de la cúpula de la vejiga y llegan al ombligo. Todas estas anomalías tienen en común la falta de obliteración del uraco. Cada 40.000 nacimientos y en proporción de 3 mujeres para un hombre se presenta la extrofia vesical, en que la vejiga y uretra están totalmente abiertas y fusionadas con la piel de la pared abdominal anterior, que compromete también a la pelvis ósea que presenta falta de fusión del pubis a nivel de la sínfisis. Puede haber otras malformaciones asociadas de genitales, imperforación anal, espina bífida y duplicación uterina. Existe falta de esfínter vesical. La corrección de esta malformación es un desafío muy complejo y hay diferentes pasos a cumplir. La uretra masculina es también asiento de fallas en el desarrollo: epispadias en que falta el techo de la uretra y tiene un origen similar a la extrofia vesical, menor en su magnitud. Hipospadia mucho más frecuente, en la cual la uretra desemboca en la cara ventral a diferentes niveles: perineal, scrotal, penescrotal, mesopeneano, siendo las más frecuentes las subcoronales y del glande. En todas ellas el meato uretral está insinuado y ciego. El meato hipospádico es estenótico y entre él y el glande hay una cuerda que dobla el pene con incurvación ventral. El niño debe orinar sentado en las formas más acentuadas, por ello es necesaria la corrección del defecto antes de la edad escolar. La hipospadia no corregida puede ser causa de infertilidad. El tratamiento es quirúrgico y busca corregir la incurvación del pene y llevar la uretra hasta lo más próximo al glande, para lo cual se usan diferentes técnicas de cirugía plástica que utilizan piel o mucosas para formar la neouretra. Muchas veces se requiere de varios tiempos operatorios. 293 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Hiperplasia.Próstata. ►Ref.6637b. Durante la pubertad, la glándula prostática experimenta un rápido desarrollo, que posteriormente continúa en forma más lenta hasta la tercera década de vida a una velocidad de 1,6 g por año. Si bien posteriormente el crecimiento es mucho más lento, estimado en 0,4 g por año, éste permanece hasta la novena década. El crecimiento prostático tiene tres componentes con distinto grado de participación en cada individuo: Crecimiento a partir del estroma. Crecimiento glandular. Crecimiento de elementos musculares. El crecimiento muscular se desarrolla a partir de la musculatura lisa que rodea la uretra. El estroma envuelve la zona periuretral, pero se encuentra en toda la próstata, de modo que su crecimiento la afecta difusamente. El crecimiento glandular puede predominar en la zona de transición de la glándula y también más lateralmente o en la región parauretral. A partir de los cuarenta años se desarrollan nódulos de tejido hiperplástico formados por proporciones variables de los tres componentes señalados. Así, desde el punto de vista histológico se pueden distinguir al menos los siguientes cinco tipos de hiperplasia prostática benigna: 1. Estromal 2. Fibromuscular 3. Muscular 4. Fibroadenomatosa 5. Fibromioadenomatosa En los hombres entre los 50 y 70 años, la masa hiperplástica e hipertrófica de la próstata está formada en un 14% por nódulos y en un 86% es difusa, que ocurre principalmente en la zona de transición. En las primeras fases de la hiperplasia predomina ampliamente el componente estromal de la zona de transición, donde actuarían al menos tres factores con acción inductora mesenquimatosa embrionario-símil: Factor básico de crecimiento fibroblástico (bFGF). Factor de crecimiento transformador tipo B1 (TGF-B1). Factor de crecimiento tranformador tipo B2 (TGF-B2) Los tres factores, perfectamente identificados, actúan sinérgicamente llevando el estroma a un estado mesenquimático. Además bFGF es mitogénico, lo que significa crecimiento glandular; éste es regulado por TGF-B2. Es de conocimiento muy antiguo que para que haya hiperplasia prostática benigna es indispensable la presencia del testículo, lo que afirma la participación de los andrógenos, ya sea en forma directa, permisiva o activadora, como es la acción del KGF (keratinocitic growth factor), que es el primer factor probado como estimulante del crecimiento epitelial prostático. Además se necesita de tiempo, es decir, envejecimiento. El 294 HistologíayCitologíaavanzadaII fenómeno histológico de hiperplasia prostática benigna, es propia del hombre que envejece. Existen otros factores conocidos que intervienen en la génesis de la hiperplasia prostática benigna, como factor del plasma testicular y epidídimario y el NAFT (non androgenic testis factor), que están en el líquido seminal y en alguna forma relacionados a la espermatogénesis. La exposición ocasional del tejido prostático a estos mitógenos influye en la hiperplasia prostática benigna. La investigación deberá permitir un mejor conocimiento de la participación de factores como: Matriz extracelular (mesénquima). Población de las stem cells. Proliferación celular. Apoptosis. Interacciones entre el estroma y el epitelio. El conocimiento de los factores preponderantes en la hiperplasia prostática benigna de un determinado individuo, nos podría llevar a una acción preventiva y terapéutica específica para cada caso. La investigación de la biología molecular podría proporcionar este conocimiento. Clínica El fenómeno de la hiperplasia prostática benigna (HPB) es de lenta instalación, de diferente intensidad de acuerdo a la edad, con predominio de algunos de los cinco tipos histológicos señalados y con características topográficas singulares en su crecimiento y otras propias de cada individuo, todo lo cual explica la variabilidad en la clínica. La historia clínica tipo obedece a dos factores: Obstrucción anatómica a nivel de la uretra prostática. Un componente dinámico a nivel de la musculatura lisa prostática. En una primera fase de la enfermedad no hay traducción sintomática, ya que el detrusor es capaz de compensar con una mayor fuerza contráctil el aumento de la resistencia al flujo urinario de la uretra prostática. En la medida que la obstrucción progresa, el detrusor pierde la capacidad de compensarla, aparecen los síntomas de "prostatismo". Hiperplasia Nodular de la Prostata Morfología Es un aumento de tamaño de la zona de transición y de la región periuretral proximal, debido a un proceso hiperplástico expansivo del tejido glandular y del estroma. Macroscópicamente muestra un aspecto multinodular, dado por nódulos blanquecino amarillentos de 1 a 10 mm de diámetro, y, entre ellos, por bandas de tejido fibroso o fibrohialino. La zona periuretral hiperplástica macroscópicamente es blanquecina y lisa por estar compuesta preponderantemente de tejido fibromuscular. 295 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Los nódulos pueden ser fibrosos, fibromusculares, musculares, fibroglandulares o fibromioglandulares. Estos últimos son los más frecuentes. Si tienen muchas glándulas muestran un aspecto poroso o esponjoso y ellas pueden contener cuerpos amiláceos o concreciones. La consistencia de la glándula hiperplástica es menor de la que suele tener el cáncer de la próstata. Patogenia y Presentación La patogenia de la hiperplasia prostática probablemente está relacionada con trastornos hormonales que consisten en una disrregulación entre andrógenos y estrógenos. De hecho, la mayor frecuencia de la hiperplasia prostática coincide con la aparición de la menopausia masculina. Se presenta por sobre los 40 años y afecta al 80% de los hombres mayores de 70 años. Complicaciones La complicación de la hiperplasia de la próstata es, en mayor o menor grado, la obstrucción urinaria. Esto ocasiona retenciones permanentes de orina en la vejiga que provocan hipertrofia e hiperplasia de la pared vesical con formación de pseudodivertículos, reflujo con hidroureteronefrosis e infecciones frecuentes. OrquitisAguda.Testículos. ►Ref.8237b. La inflamación del contenido escrotal plantea un problema de diagnóstico en el escroto agudo principalmente con la torsión funicular. La infección aislada del testículo es rara, siendo más frecuente la presentación en forma de orquiepididimitis. Predomina en hombres jóvenes sexualmente activos y en ancianos con infección urinaria pero se puede producir a cualquier edad. La causa más frecuente de la inflamación del contenido escrotal es la infección. Así en los jóvenes prepuberales los gérmenes más frecuentes son las enterobacterias aunque sobre factores predisponentes como son las malformaciones congénitas (válvulas uretrales, abombamiento ectópico de un uréter a vesícula seminal). En el adolescente es causa frecuente la orquitis en el transcurso de una parotiditis. En los varones jóvenes menores de 40 años es la causa infecciosa con mucho lo más frecuente, sobre todo enterobacterias (E. coli, Proteus Mirabilis, Klebsiella pneumoniae) y gérmenes de transmisión sexual como Neisseria gonorrheae, Mycoplasma, pero sobre todo la Chlamydia tracomatis, y cocos gram positivos como estafilococos aureus. Por encima de los 40 años a la causa infecciosa se suele añadir una obstrucción urinaria distal, tuberculosis, reflujo urinario posterior a la prostatectomía transuretral, y la reacción granulomatosa por el tratamiento del cáncer vesical superficial con bacilo de Calmette Guerin (BCG). En la exploración física, el escroto se observa edematoso, tenso y enrojecido, el cordón se palpa engrosado y doloroso, siendo muy dolorosa la palpación, y difícil de distinguir el límite entre escroto y epidídimo en casos evolucionados. El signo de Prehn, al elevar el testículo afecto produce mejoría del dolor, es positivo. La transiluminación del escroto es negativa a no ser que exista un hidrocele reactivo, en tal caso será positiva. En cuanto a los estudios complementarios habrá que realizar analítica de orina, cultivo de orina, y de semen y de secreción uretral si la hubiere, cultivo de Lowenstein y 296 HistologíayCitologíaavanzadaII tinción de Ziehl-Nielsen tanto en orina como en semen e inmunofluorescencia para Chlamydia, además de antibiograma. También es necesario realizar hemograma, hemocultivos seriados, una bioquímica sanguínea que incluya urea, creatinina e iones. En el sedimento de orina nos mostrará piuria en la mayoría de las ocasiones, discreta piuria sin bacteriemia en las ETS y piuria franca con urocultivo positivo en caso de gérmenes gram negativos, aunque también podremos encontrar a pacientes con sedimento urinario negativo. En el hemograma es frecuente leucocitosis con desviación a la izquierda. MetaplasiaEscamosaProstática. ►Ref.8238b. La gran mayoría de los tumores originados del epitelio de la vejiga son carcinomas de células transicionales (90%), existen unos menos frecuentes como el escamoso, que se ve básicamente en pacientes con limitaciones crónicas, con metaplasia escamosa del endotelio y los adenocarcinomas, que se ven en pacientes con cistitis quística y en pacientes con dexostrofia (anormalidad de la vejiga). Es una patología estrógeno dependiente de origen endógeno (tumor testicular) o exógeno (administración de estrógenos). Las células cilíndricas del epitelio glandular se transforman en células escamosas, queratinizadas y de núcleos picnóticos. La descamación de estas células puede obstruir los canalículos dando lugar a la formación de quistes. El diagnóstico se logra por examen del fluido prostático: Células queratinizadas, irregulares, con núcleos picnóticos, acidófilas. La fertilidad esta seriamente afectada. El tratamiento consiste en eliminar la fuente de estrógenos. Si es por tumor testicular (tumor de las células de Sertoli) la orquiectomia es la solución. No es una patología frecuente. InfartoTesticular. ►Ref.8242b. Es un cuadro secundario a otras entidades que se presenta con inflamación y dolor. El cuadro inicial puede ser una torsión testicular, pero está descrito también en pacientes con anemia de células falciformes o por émbolos sépticos durante una endocarditis bacteriana. Están comprobados en cuadros de orquitis isquémica secundaria a orquiepididimitis infecciosa severa. Infarto es la necrosis del parénquima y estroma en un territorio vascular producida por isquemia. La necrosis del estroma se acompaña de destrucción del material intercelular. La palabra infarto viene del latín infarcire, que significa rellenar (infarctum = rellenado). En efecto, en un infarto anémico reciente la zona comprometida aparece tumefacta como rellena de fibrina. El infarto es por lo tanto una lesión que se da sólo a nivel de órgano o de estructuras compuestas organoides, como una mucosa. No pueden infartarse células o tejidos aislados. El concepto, además, lleva implícita una determinada patogenia: la isquemia. Las torsiones testiculares, producidas por actividad física violenta o condicionadas por tumores o anomalías congénitas, pueden conducir a necrosis del testículo y de sus anexos. 297 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología La Torsión del Cordón Espermático suprime el aporte sanguíneo al testículo y las estructuras que lo rodean dentro del escroto. En general después de las 6 hrs de isquemia testicular se ha perdido la capacidad espermatogénica y después de 10 hrs la función endocrina. Por lo tanto, una torsión después de las 10 hrs se considera no viable, ya no se espera recuperar el testículo afectado (destorsión) sino eliminarlo, por lo que la cirugía se puede realizar algunas horas después (Orquiectomía). CarcinomaEmbrionario.Testículos. ►Ref.8260b. Corresponde al 25% de los tumores germinales del testículo. El tumor está constituido por elementos epiteliales y mesenquimáticos embrionarios inmaduros, que representan componentes del ectoderma, mesoderma o endoderma y componentes extraembrionarios del saco vitelino, del mesénquima primitivo y del trofoblasto. Cualquiera de estos componentes puede predominar en un determinado tumor. El 75% de los carcinomas embrionarios producen a-feto-proteína. Esta substancia se produce normalmente en el hígado fetal y tracto gastrointestinal y no se la encuentra nunca en seminomas ni coriocarcinomas puros. El 80% de los carcinomas embrionarios producen gonadotropina coriónica humana (subunidad beta) relacionada con la presencia de trofoblasto. El poliembrioma, una variedad poco frecuente, se caracteriza por los llamados cuerpos embriodes, constituidos por una placa epitelial semejante a un disco embrionario ubicada junto a una cavidad revestida de epitelio de saco vitelino. En general, el 60% de los carcinomas embrionarios tienen metástasis ganglionares linfáticas regionales en el momento del diagnóstico. Clasificación de los Tumores Tumores de Células Germinales de un solo Tipo Histológico: Seminoma. Seminoma espermatocítico. Carcinoma embrionario. Tumor de saco vitelino. Poliembrioma. Coriocarcinoma. Teratoma. Tumores de Células Germinales de más de un Tipo Histológico: Carcinoma embrionario y teratoma. Coriocarcinoma y otros. Otras combinaciones. Neoplasia Intratubular de Células Germinales (Carcinoma In Situ). Tumor de los Cordones Sexuales y del Estroma: Tumor de células de Leydig, Sértoli, granulosa, mixtos, y otros 298 HistologíayCitologíaavanzadaII Tumor de Células Germinales y de los Cordones Sexuales y Estroma: Gonadoblastoma, otros. Carcinoide. Tumores Misceláneos y de los Anexos testiculares: Tumor adenomatoide, mesotelioma, tumor de rete testis, tumor de Brenner, tumor de tejidos blandos rabdomiosarcoma) Tumores No Clasificables. Lesiones Pseudotumorales: Quiste epidérmico, orquitis, malacoplaquia, lipogranuloma, restos adrenales, etc. TumordeSenoEndodérmico.Testículos. ►Ref.8261b. Carcinoma embrionario: Hay dos presentaciones, la del adulto o carcinoma embrionario y la infantil o tumor del Saco de Yolk (tumor del saco vitelino o también Tumor del Seno Endodérmico). La forma infantil es el más frecuente tumor testicular en los niños. Cuando se presenta en adultos habitualmente no lo hace en forma pura y acompaña a otros tumores. No es infrecuente que presente hemorragia intratumoral y necrosis. Un 59% se presenta con metástasis al momento del diagnóstico. El síntoma más frecuente del tumor testicular es el aumento de volumen indoloro, irregular y duro del testículo. Este aumento habitualmente es gradual y progresivo. Esta masa indolora no se transilumina, y con frecuencia produce la sensación de peso. Es infrecuente la consulta por dolor testicular y cuando esta aparece (10%) se debe a hemorragia intratesticular o necrosis. Habitualmente se trata de un individuo sano que tuvo este hallazgo de masa indolora y que el paciente relaciona con algún evento traumático reciente, sin embargo no guarda ninguna relación y éste fue sólo lo que motivó el autoexamen testicular y el hallazgo. En el examen macroscópico: Típicamente se observa una masa de 2 a 4 cm en diámetro que generalmente reemplaza a la mayor parte del parénquima testicular. El tejido es sólido, blando, blanco, gris o amarillo pálido. El patrón histológico que se observa con mayor frecuencia es el reticular o microquístico, caracterizado por una matriz laxa de espacios irregulares revestidos por células planas o cuboidales de aspecto primitivo. En muchos casos se pueden observar papilas solitarias, con un centro formado por tejido conectivo con vaso central, que se proyecta en un espacio; estas estructuras se denominan cuerpos de ShillerDuval y son característicos del tumor de senos endodérmicos. Otros patrones morfológicos son el sólido, vacuolado, glandular y papilar, microquístico, polivesicular y parietal. Las células en las áreas sólidas pueden mostrar un citoplasma claro y abundante. 299 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología En el patrón vacuolado, las células muestran grandes vacuolas, en ocasiones remedando la apa-riencia de un liposarcoma. Los quistes que se presentan en el TSE son de diversos tamaños y están revestidos por células cúbicas y planas. Otros patrones morfológicos son el sólido, vacuolado, glandular y papilar, microquístico, polivesicular y parietal. Las células en las áreas sólidas pueden mostrar un citoplasma claro y abundante. Un rasgo morfológico no característico pero generalmente presente en el TSE es la presencia de estructuras redondas, eosinófilas y PAS positivas, denominados glóbulos hialinos. En algunos casos de tumores avanzados las manifestaciones pueden ser derivadas de la diseminación extratesticular como retroperitoneo, con dolor lumbar o hemorragia digestiva alta cuando hay infiltración duodenal o del intestino delgado. La hemoptisis puede ser una manifestación secundaria cuando existe compromiso pulmonar metastásico. Un 14% presenta síntomas derivados del tumor metastásico (32% de los pacientes tienen metástasis al momento del diagnóstico). Los marcadores testiculares son un elemento muy útil tanto como elemento diagnóstico, de etapificación potencial, de seguimiento o monitorización y por último como índice pronóstico en los tumores testiculares. Estos marcadores son la gonadotrofina coriónica humana (GCH) que tiene un peso molecular de 38.000 dalton y una vida media corta de 24 a 36 horas. Es producida por los elementos trofoblásticos del tumor. La alfafetoproteína (aFP) que tiene un peso molecular de 70.000 dalton y una vida media de 5 a 7 días. Se la relaciona al componente extraembrionario del saco vitelino. Por último, la deshidrogenasa láctica (LDH) es una enzima con un peso molecular de 134.000 dalton, que como sabemos tiene 5 isoenzimas y su elevación si bien es bastante inespecífica es un índice indirecto del grado de diseminación. Los marcadores por lo tanto son útiles en el: 1. Diagnóstico, ya que se alteran precozmente con 103 células tumorales y para que un tumor sea detectable con un método de imágenes se requieren 105 células. También pueden orientar el tipo celular ya que permite demostrar la presencia de elementos no seminomatosos en los seminomas puros (elevación de la afeto proteína. Así también en el caso de los coriocarcinomas siempre tienen elevados la gonadotrofina coriónica y en valores habitualmente altos. 2. Etapificación, un 90% de los estadíos avanzados tienen marcadores positivos y solo un 10% son negativos en un estadío III. Después de la orquidectomía niveles altos sugieren tumor residual. 3. Monitorización del tratamiento ya que permite evaluar recidivas, ante la elevación de marcadores que se habían negativizado. 4. Indice pronóstico. La LDH está aumentada en un 7% de los estadíos I, 38% de los estadíos II y 81% de los estadíos III. 300 HistologíayCitologíaavanzadaII Marcadores Tumorales, según el Tipo Histológico Seminoma: GCH (+) 25% aFP (- ) Carcinoma Embrionario: GCH (+) 80% aFP (+) 75% Teratoma: GCH (+) 25% aFP (+) 37% Coriocarcinoma: GCH (+) 100% aFP (- ) Diseminación de los Tumores Testiculares: La diseminación es básicamente por vía linfática, de ahí la importancia del estudio de imágenes del retroperitoneo. Primaria: Linfática (excepto coriocarcinoma) a ganglios entre T1 y L4, pero se concentran bajo los pedículos renales, posteriormente a los ilíacos comunes y externos ipsilaterales. Secundaria: Hematógena (pulmón, hígado, cerebro, riñón y huesos). En general, los tumores derechos dan metástasis ganglionares retroperitoneales a los dos lados de la aorta, los izquierdos al lado izquierdo, por ello la diseminación ganglionar dependerá del testículo afectado. Etapificación: La etapificación de los tumores testiculares es clínica y de laboratorio, sin embargo, dependiendo del tipo histológico la etapificación, puede ser también quirúrgica (tumores no seminomatosos). Etapificación Clínica de los Tumores Testiculares Estadío I Tumor limitado al testículo. Sin compromiso linfático. Estadío II Cualquier tumor testicular con: IIA) Ganglios retroperitoneales < 2 cm. IIB) Ganglios retroperitoneales >2 cm - <5 cm IIC) Ganglios retroperitoneales >5 cm. Estadío III Ganglios a ambos lados del diafragma o elevación persistente de marcadores tumorales (sin elevación previa a orquidectomía). Estadío IV Metástasis a distancia. 301 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología Generalidades: Las neoplasias testiculares son tumores relativamente poco frecuentes, con una incidencia aproximada de 1-2 por cada 100.000 habitantes. El 95% de las neoplasias testiculares son tumores derivados del parénquima (línea germinal), seminomas y no seminomas, el resto corresponde a tumores derivados de la línea no germinal (células de Leydig, Sertoli y gonadoblastomas). Aunque la causa de estos tumores es desconocida se han planteado factores congénitos y adquiridos. Existe una historia familiar en el cáncer testicular hasta en un 16% de los casos. Los estrógenos durante la gestación aparecen como un factor de riesgo conocido de criptorquidea, la cual aumenta el riesgo potencial de desarrollar esta neoplasia, así también el trauma y la infección han sido señalados como factores adquiridos, aunque no se han logrado demostrar. Los hallazgos del examen testicular no guardan una relación directa con el tipo histológico ni con grado de diseminación ya que a pesar de estar ampliamente diseminado el tumor primario puede no ser palpable en el testículo. La forma de presentación patológica en más del 40% de los casos es de histología mixta. Las metástasis pueden cambiar la histología del tumor primario (generalmente a formas más malignas). La presencia de tumores bilaterales sincrónicos o asincrónicos es poco frecuente; sin embargo, ésta puede ser del 1-2% de los pacientes con tumores testiculares, siendo también mayor el riesgo en pacientes con testículos no descendidos. La presentación bilateral es más frecuente en los seminomas. Es importante tener presente que los tumores de células germinales también pueden originarse en otros tejidos, en su forma extratesticular, especialmente retroperitoneo y en sitios de línea media (área sacrocoxígea, mediastino anterior y región pineal). La vía de diseminación habitual, como ya hemos dicho es linfática, y su diseminación local es infrecuente ya que la túnica albugínea constituye una barrera natural para la diseminación tumoral. El antecedente de cirugía inguinal o cuando el tumor compromete la vaginal, es importante ya que altera la vía de diseminación linfática habitual (diseminación inguinal). Clasificación Clínica de los tumores testiculares y frecuencia de presentación: 1. Tumores de células germinales (96%). I) Seminoma 35-50% II) Carcinoma embrionario 25%. Compuesto de células epiteliales primitivas. III) Teratoma 5%. Compuesto de tejidos derivados de las 2 ó 3 capas primitivas del embrión. IV) Coriocarcinoma. Compuesto por citotrofoblasto sinciciotrofoblasto. Metástasis vía hematógena. 2. Tumores del estroma gonadal (2%). I) Tumor de Leydig. II) Tumor de Sertoli. III) Gonadoblastoma. 3. Metástasis 302 y HistologíayCitologíaavanzadaII Clasificación Histógica: I) Seminoma. II) Carcinoma embrionario, solo o con seminoma. III) Teratoma, solo o con seminoma. IV) Teratoma con carcinoma embrionario o con teratocarcinoma con o sin seminoma. V) Coriocarcinoma solo o con seminoma o carcinoma embrionario o ambos. 303 CUESTIONARIO HistologíayCitologíaavanzadaII Cuestionario 1. Los Leiomiomas o miomas se caracterizan por…Señala la opción falsa: a. Son tumores firmes, de color blanquecino o rosáceo. b. Se presentan fasciculados y bien delimitados. c. Se presentan encapsulados. 2. Las características microscópicas en el Carcinoma Escamoso In Situ de Cérvix son…Señala la opción falsa: a. Células neoplásicas que ocupan el epitelio. b. Invasión de la membrana basal. c. Células neoplásicas con discariosis e hipercromasia. 3. De las siguientes afirmaciones, señala la opción falsa: a. Las vellosidades coriónicas se distinguen desde el día 30 después de la fertilización. b. Las vellosidades en contacto con la Decidua Basal proliferan para formar el corion frondoso. c. Las vellosidades en contacto con la Decidua Capsular degeneran formando el corion liso. 4. La Necrosis Fibrinoide de la Placenta se caracteriza por…Señala la opción correcta: a. Se presenta eosinófila y amorfa. b. Se tiñe con los colores de la fibrina. c. Todas son correctas. 5. ¿Qué es Hepetiforme?: a. Con forma de Herpes. b. En forma de vesículas agrupadas. c. Defectos epiteliales. 6. Acerca del Leiomiosarcoma…Señala la opción falsa: a. El diagnóstico se basa en la atipia y la necrosis. b. Presentan gran celularidad. c. No son excesivamente agresivos. 307 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 7. La Enfermedad Trofoblástica Gestacional se caracteriza por…Señala la opción falsa: a. Proliferación atípica de las Células Sinticiales. b. Se originan en los elementos trofoblásticos del Blastocito. c. Presenta Degeneración Hidrotópica de las vellosidades. 8. De las siguientes afirmaciones, señala la opción falsa: a. Los cambios en la Arteria Espiralada se compone de cuatro fases. b. La fase intraluminal de los cambios de la Arteria Espiralada comienza a los 116 días de embarazo. c. Al principio del embarazo, los vasos espiralados van creciendo hacia la luz. 9. De las siguientes afirmaciones, señala la opción falsa: a. El Citotrofoblasto está constituido por células de núcleos grandes yesiculosos. b. El Sincitrofoblasto es la capa periférica que recubre las vellosidades placentarias, y presenta células mononucleadas, de núcleo pequeño y citoplasma granular y antófilo. c. El estroma de las vellosidades placentarias maduras contiene abundante vasos y células de Hofbauer. 10. De las siguientes afirmaciones sobre la Funisitis, señala la opción falsa: a. Se define como una invasión microbiana de la cavidad uterina. b. La ruta de infección más frecuente es la vía hematógena. c. El modelo de infección ascendente presenta cuatro fases. 11. De las siguientes afirmaciones sobre el Disgerminoma, señala la opción falsa: a. Generalmente es bilateral. b. Es un tumor sólido de contornos lobulados. c. Presenta un color blanco amarillento. 12. En el caso del Estruma Ovárico, señala la opción falsa: a. Son lesiones unilaterales. b. Presentan un aspecto mucoide o gelatinoso. c. Suelen ser de pequeño tamaño. 13. La mola hidatidiforme se caracteriza por: a. Proliferación anormal de trofoblasto. b. Degeneración quística de las vellosidades coriónicas. c. Todas son correctas. 308 HistologíayCitologíaavanzadaII 14. Macroscópicamente el Teratoma presenta: a. Gran tamaño. b. Áreas quísticas y sólidas. c. Todas son correctas. 15. El Carcinoma de Próstata…Señala la opción falsa: a. Presenta cuatro categorías. b. Si se presenta dentro de la cápsula prostática afirmaremos que se halla en el estadío I. c. Si el carcinoma presenta extensión extracapsular sin metástasis, se halla en el estadío III. 16. El Tumor Philoides…Señala la opción falsa: a. Es uno de los de mayor prevalencia. b. Alcanzan tamaños superiores a los 20 cm. c. Presentan un aspecto firme, elástico e irregular. 17. De las siguientes afirmaciones sobre la metaplasia glandular (mama), señala la opción falsa: a. Puede ser causad por un déficit de vitamina B. b. Se suele producir a partir de una célula indiferenciada o poco diferenciada. c. Presencia de Células de Reserva. 18. ¿Qué células forman parte, principalmente, del parénquima tumoral, en el caso del Linfoma de Hodgkin?: a. Reed-Sternberg. b. Reed-Sternberg y Células de Hodgkin. c. Células de Hodgkin. 19. ¿Cuál es el origen de las Células de Reed-Sternberg?: a. Células B y T. b. Célula Histiocitaria. c. Todas son correctas. 20. El Bocio…Señala la opción falsa: a. El Bocio difuso presenta folículos de contornos irregulares revestidos por células cilíndricas. b. Los nódulos en el caso del Bocio Multinodular están compuestos por grupos de folículos y abundante coloide. c. El frotis se presenta rico en coloide y alta celularidad. 309 TécnicoSuperiorSanitariodeAnatomíaPatológicayCitología 21. La Enfermedad de Graves…Señala la opción falsa: a. Es una enfermedad autoinmune. b. Provoca hipotiroidismo. c. Histológicamente presenta células epiteliales foliculares aumentadas de tamaño. 22. Morfológicamente el Linfoma Folicular se caracteriza por: a. Estructura Conservada. b. Distribución irregular de los folículos. c. Celularidad monomórfica. 23. El Plasmocitoide se considera: a. Linfoma de Grado Intermedio. b. Linfoma maligno de Células Grandes. c. Linfoma Linfoblástico. 24. El Adenocarcinoma In Situ de Cérvix…Señala la opción falsa: a. Se puede observar pseudoestratificación nuclear. b. Las células son columnares. c. El citoplasma siempre es vacuolado y granular. 25. El miometrio…Señala la opción falsa: a. Se compone de una capa muscular lisa. b. Es eosinófilo y de aspecto fasciculado. c. Contiene fibras musculares perpendiculares. 26. La Metaplasia Escamosa del útero…Señala la opción falsa: a. Se produce a partir de una célula poco diferenciada. b. En la Metaplasia pavimentosa incompleta queda un epitelio anaplásico de varias capas estratificado. c. Bajo las células cilíndricas se pueden observar células cuboideas anaplásicas. 27. El Sistema nervioso fetal deriva de: a. Del Ectodermo. b. Del Mesodermo. c. Del Endodermo. 28. Si observamos el bazo de color rojo, y muestra tejido con granulación exterior por toda la zona infartada, podemos asegurar que se produjo: a. Hace una o dos semanas. b. Hace de quince a veinticinco días. c. Hace más de tres meses. 310 HistologíayCitologíaavanzadaII 29. Cuando se produce una inserción del cordón umbilical en el margen placentario, se denomina. a. Placenta en raqueta. b. Placenta Acreta. c. Placenta Velamentosa. 30. Cuando la vellosidad placentaria se introduce en el miometrio, sin atravesarlo, se denomina: a. Placenta Acreta. b. Placenta Increta. c. Placenta Percreta. 311