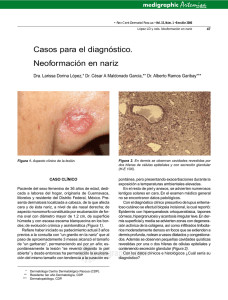
descarga - Dermatología Pediátrica Latinoamericana
Anuncio

Dermatología Pediátrica Latinoamericana ISSN 1812 - 903X Volumen 05 Número 2 MAYO -AGOSTO 2007 ÓRGANO OFICIAL DE LA SOCIEDAD LATINOAMERICANA DE DERMATOLOGÍA PEDIÁTRICA C O N T E N I D O ARTÍCULO DE REVISIÓN Edema agudo hemorrágico del lactante. Reporte de un caso Piel, desnutrición y enfermedad digestiva Liz María Domínguez, Olga Aldama,Victoria Rivelli, Graciela Gorostiaga, Gloria Mendoza,Arnaldo Aldama ..... 121 Mariela Tavera .............................................................................. 81 ARTÍCULOS ORIGINALES Estudio de casos de urticaria anular aguda en pacientes hospitalizados en el servicio de Dermatología del Instituto de Salud del Niño durante el período 2003 al 2004 Felipe Velásquez, César Gutiérrez, Héctor Cáceres, Rosalía Ballona, Rosa Castro, Iris Kikushima, Rosario Torres .............................................................................. 93 Loxocelismo en niños hospitalizados, Perú 1970- 1990 Ciro Maguiña, Rosa Mangiante, Fernando Osores, Herminio Hernández .................................................................. 98 Liquen plano en niños en la consulta de Dermatología Pediátrica del Hospital Universitario de Caracas, 1989 a 2003 Ana María Sáenz de Cantele, Antonietta Cirocco, Adriana Falco, Adriana Gómez, Alejandra Vivas, María del Pilar Silva, Francisco González ............................ 107 REPORTE DE CASOS Hamartoma fibrolipomatoso precalcáneo congénito y síndrome de Ehlers-Danlos (tipo vascular) ¿existe una verdadera asociación? Mario Marini, María Luisa Raspa, Gisela Duhm, María Fernanda Greco ............................................................. 110 Piloleiomioma simulando morfea en un niño Ana Elisa Kiszewski, Cláudia Schermann Poziomczyk, Nelson Ricachnevski, Roque Furian ...................................... 116 Sarna costrosa en un lactante desnutrido Elisa Fontenelle, Andrea Dale Figueiredo Roisman, Ana Paula Moura de Almeida ...................................................125 Nocardiosis cutánea primaria, reporte de un caso Margarita Larralde, Begoña Gomar, Paula Bosch, Magdalena Sojo .......................................................................... 130 HAGA SU DIAGNÓSTICO ¿Qué síndrome es? Margarita Larralde, María Eugenia Abad, María Magdalena Sojo ................................................................133 CORRELATO CLÍNICO PATOLÓGICO Placa equimótica indurada, con hipertricosis y sudoración Rosalía Ballona ............................................................................ 136 TERAPÉUTICA Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt María Rosa Cordisco, Alejandro Olivera, Agustina Lanoël, Paola Stefano, Aurora Feliu Torres, Gabriela Sciuccati, Patricia Bellani, Daniel Wright, Julio Goldberg,Adrián Martín Pierini ......................................139 REVISTA DE REVISTAS Dr. Felipe Velásquez ................................................................... 147 75 Dermatología Pediátrica Latinoamericana COMITÉ EDITORIAL EDITOR JEFE Héctor Cáceres Ríos Médico Asistente del Servicio de Dermatología Instituto Nacional de Salud del Niño EDITORES PRINCIPALES Dermatología Pediátrica Latinoamericana Órgano oficial de la Sociedad Latinoamericana de Dermatología Pediátrica Volumen 05 Número 2 MAYO - AGOSTO 2007 Dermatología Pediátrica Latinoamericana es la Revista Oficial de la Sociedad Latinoamericana de Dermatología Pediátrica, y su objetivo es difundir y promover los trabajos de investigación dermatológica pediátrica y otros artículos de divulgación del conocimiento de esta importante sub-especialidad de la dermatología en el ámbito latinoamericano, dirigido a dermatólogos y pediatras latinoamericanos. EDICIÓN CUATRIMESTRAL ISSN 1812-903X Rosalía Ballona Chambergo Jefe del Servicio de Dermatología Instituto Nacional de Salud del Niño Rosa Inés Castro Rodríguez Médico Asistente del Servicio de Dermatología Instituto Nacional de Salud del Niño José Catacora Cama Jefe del Servicio de Dermatología Hospital Guillermo Almenara Irigoyen -EsSalud Celia Moisés Alfaro Médico Asistente del Servicio de Dermatología Hospital Edgardo Rebagliati Martins - EsSalud Gadwyn Sánchez Félix Jefe del Servicio de Dermatología Hospital Edgardo Rebagliati Martins - EsSalud EDITORES ASOCIADOS Giuliana Castro Vargas Médico Asistente del Servicio de Dermatología Hospital Nacional Alberto Sabogal Sologuren - EsSalud Verónica Galarza Sánchez Médico Asistente del Servicio de Dermatología Hospital Nacional Sergio Bernales - EsSalud Úrsula Rivas Vega Médico Dermatólogo de Consulta Privada Felipe Velásquez Valderrama Médico Asistente del Servicio de Dermatología Instituto Nacional de Salud del Niño COMITÉ ASESOR Los artículos para publicación, libros de revisión, revista para canje y la correspondencia serán dirigidos al Comité Editorial: Dermatología Pediátrica Latinoamericana Av. Santa Cruz 647, Lima 18 - Perú Telefax: (51-1) 221-4003 Correo electrónico: [email protected] Todos los derechos son reservados, ninguna parte de esta publicación puede ser reproducida, almacenada o transmitida en cualquier forma. PRE PRENSA - IMPRESIÓN Grambs Corporación Gráfica S.A.C. Telf. (51-1) 471-9304 COPYRIGHT © Sociedad Latinoamericana de Dermatología Pediátrica Av. Santa Cruz 647 Lima 18 - Perú Telefax: (51-1) 221-4003 Correo electrónico: [email protected] PÁGINA WEB Sociedad: www.sladp.org Revista: www.dplat.org Editada e Impresa en Lima - Perú. 78 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Ramón Ruiz-Maldonado (México) Francisco Bravo Puccio (Perú) Silmara Cestari (Brasil) María Rosa Cordisco (Argentina) Carola Durán Mckinster (México) Francisco González Otero (Venezuela) Evelyne Halpert Ziskiend (Colombia) María Isabel Herane (Chile) Juan Honeyman Mauro (Chile) Iris Kikushima Yokota (Perú) Margarita Larralde (Argentina) María de la Luz Orozco (México) Silvia Pueyo (Argentina) Rosario Torres Iberico (Perú) Enrique Úraga Pazmiño (Ecuador) Jairo Victoria Chaparro (Colombia) EDITOR ONLINE Gustavo Borja Velezmoro TRADUCCIÓN Elizabeth Cabrera (USA) REVISOR César Gutiérrez Villafuerte DISEÑO - DIAGRAMACIÓN Gilberto Cárdenas Llana ARTŒCULO DE REVISI N Piel, desnutrición y enfermedad digestiva Mariela Tavera1 1 Dermatología Pediátrica, Clínica Reina Sofía y Clínica del Country. Bogotá, Colombia. Dermatol Pediatr Lat 2007; 5(2): 81-92. Resumen La piel es un órgano muy importante pues nos brinda información visual indispensable para el diagnóstico de múltiples enfermedades. Muchas de éstas afectan el aparato digestivo con repercusión en la piel, otras, afectan la piel y dan signos y síntomas en el aparato digestivo.Así mismo, la deficiencia de nutrientes, calorías, vitaminas y elementos esenciales en el organismo se manifiestan en la piel, el pelo, las uñas y las mucosas brindándonos así todas las herramientas necesarias para el correcto diagnóstico y tratamiento apropiado. Palabras clave: Desnutrición; Manifestaciones cutáneas; Tracto digestivo; Vitaminas. Abstract The skin is a very important organ as it provides indispensable visual information for the diagnosis of multiple diseases. Many of these affect the digestive tract with repercussion on the skin, while others compromise the skin and give signs and symptoms in the alimentary tract. In the same way, the deficiency of nutrients, calories, vitamins and essential elements in the organism, have manifestations on the skin, hair, nails and mucosal membranes, providing all the tools that are necessary for a correct diagnosis and appropriate treatment. Key words: Malnutrition; Cutaneous manifestations; Digestive tract; Vitamins. Introducción La piel es claro reflejo del funcionamiento del organismo, y por esto muchas enfermedades se manifiestan en ella. Las alteraciones de la piel pueden ser el componente principal o manifestaciones secundarias de enfermedades que comprometen principalmente el tracto digestivo. Es por esto que en repetidas ocasiones podemos hacer el diagnóstico de enfermedades internas con la semiología dermatológica y realizar estudios complementarios para llegar al diagnóstico de enfermedades sistémicas que aún no se han manifestado clara- mente. Iniciaremos esta revisión analizando las manifestaciones cutáneas de la desnutrición en sus diferentes tipos (marasmo y kwashiorkor) ya que ésta es un problema importante en nuestros países y además porque son muchas las enfermedades que pueden conducir a estos estados. Posteriormente describiremos algunas patologías dermatológicas que pueden tener en su evolución repercusión en el tracto digestivo y por último mencionaremos enfermedades del tracto digestivo que pueden tener manifestaciones cutáneas asociadas. En el cuadro 1 se resume las enfermedades cutáneas y las manifestaciones gastrointestinales. Correspondencia: Dra. Mariela Tavera Calle 125 # 20-59 Consultorio 201. Bogotá-Colombia. Correo electrónico [email protected] Recibido: 30/10/07 Aprobado: 27/11/07 81 Piel, desnutrición y enfermedad digestiva Cuadro 1. Asociación entre enfermedades cutáneas y gastrointestinales. S ndrome o enfermedad cut nea Pseudoxantoma el stico S ndrome de Rendu-Osler-Weber Hemangiomatosis neonatal difusa S ndrome blue rubber nevus S ndrome de Ehlers-Danlos (tipo IV) Cutis laxa Neurofibromatosis S ndrome de Gardner S ndrome de Peutz-Jegher Enfermedad de Cowden S ndrome de Ruvalcaba-Myhre-Smith Dermatitis herpetiforne Acrodermatitis enterop tica Escleredema Mastocitosis Porfirias Enfermedad de Fabry P rpura de Henoch-Sch nlein S ndrome de hiperinmunoglobulinemia D Epidermolisis ampollar P nfigo Penfigoide ampollar Enfermedad intestinal inflamatoria (enfermedad de Crohn y colitis ulcerativa) Enfermedad de Crohn Enfermedad celiaca Diarrea intratable Signos y s ntomas gastrointestinales Hemorragia Hemorragia Hemorragia, obstrucci n Hemorragia, obstrucci n Perforaci n gastrointestinal, hemorragia Divert culos gastrointestinales, hernias Ulceraci n, sangrado, obstrucci n, v lvulos, perforaci n, intususcepci n. P lipos gastrointestinales P lipos hamartomatosos (ulceraci n) P lipos P lipos Malabsorci n Malabsorci n Disfagia Dolor abdominal Dolor abdominal Dolor abdominal Dolor abdominal, hemorragia Dolor abdominal, diarrea, v mito Estenosis esof gica Estenosis esof gica Estenosis esof gica Eritema nodoso, pioderma gangrenoso, liquen nitidus, liquen plano, eritrodermia exfoliativa, poliarteritis nodosa, psoriasis, vit ligo,eritema polimorfo, urticaria, vasculitis leucocitocl stica Lesiones periorales y orales, lesiones perianales, placas n dulo-ulceradas Eritema nodoso Dismorfismo, alteraciones estructurales del pelo Desnutrición - manifestaciones cutáneas “La desnutrición en los niños en el siglo XX es el flagelo de los países en desarrollo y la vergüenza de los países desarrollados” R. Ruiz-Maldonado. Marasmo El marasmo resulta de la deficiencia severa de proteínas y calorías por tiempo prolongado. Ocurre por la reducción del 40-50% en el peso corporal pero sin edema periférico. El paciente luce emaciado debido a la pérdida de tejido celular subcutáneo, atrofia muscular y de órganos, dando la apariencia de “huesos forrados en piel”1. Son niños irritables y apáticos. Los ojos agrandados, la presencia de lanu- 82 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 go y la pérdida de almohadillas de grasa bucal dan la característica “facies de mico”1,2. La piel es fina, seca, laxa, arrugada y ocasionalmente presenta descamación fina e hiperpigmentación3; a nivel de glúteos la piel cuelga de manera redundante debido a la pérdida de grasa subcutánea (Fig. 1). El pelo es seco, fino, frágil, de crecimiento lento y caída fácil. A la microscopía se ha encontrado ausencia de pelos en anágeno con relativa M. Tavera dos que confluyen dando origen a la “piel en mosaico” o “dermatitis en pintura esmaltada” de predominio en área del pañal, tronco, codos, rodillas y tobillos5. Pocos días después descaman observándose zonas hiperpigmentadas rodeadas de áreas hipopigmentadas dando la apariencia de “pintura descascarada”, siendo típica en la región frontal y zonas húmedas así como en las prominencias óseas; hay respeto de la cara, manos y pies. La despigmentación puede ser por interrupción en la melanogénesis o déficit de fenilalanina. Fig. 1. Marasmo, “piel colgante”. atrofia del bulbo, gran cantidad en telógeno, fracturas pilosas y disminución en el diámetro de los tallos pilosos1. Las uñas son delgadas, de crecimiento lento y presentan fisuras. Una característica importante es el bajo nivel de zinc sérico. Los pacientes con kwashiorkor presentan la dermatosis característica incluso con áreas ulceradas que simulan quemaduras de segundo grado que llevan a sobreinfección bacteriana o por Cándida. Se ha visto que el signo de “la pintura descascarada” severa no siempre es de mal pronóstico, así mismo, hay niños que fallecen sin haber desarrollado dicha dermatosis6. En niños con piel clara existe craquelamiento de la piel en piernas, muslos y espalda (Fig. 2); los casos severos muestran fisuras lineales en los pliegues por la presión constante en axilas, región poplítea, antecubital, interdigital, prepucio y en la parte medial de los labios, especialmente el inferior5. Kwashiorkor Existe retardo del crecimiento, alteraciones psicomotoras, anorexia, apatía, irritabilidad, edema generalizado o localizado dando unas facies de “luna” con aumento de las almohadillas de grasa bucales y parotiditis4. El niño no sonríe y si lo hace es signo de recuperación. Algunas alteraciones gastrointestinales incluyen diarrea e hígado graso. El principal hallazgo cutáneo es la despigmentación, siendo más notoria en pacientes de piel oscura. Inicialmente hay una palidez circumoral o en las piernas y las cicatrices pierden su pigmento; posteriormente aparecen placas eritemato-violáceas de bordes netos y sobreeleva- Fig. 2. Kwashiorkor, piel craquelada. En el cabello existe una decoloración rojo-café e incluso gris-blanco con arrancamiento fácil y sin dolor, hipotriquia, sequedad y los rizos cuando están presentes se alisan y se ven muchas escamas (pelo crujiente). El signo de la bandera refleja periodos de desnutrición que Dermatol Pediatr Lat Vol 5 Nº 2, 2007 83 Piel, desnutrición y enfermedad digestiva alternan con periodos de ingesta adecuada formando bandas claras y oscuras respectivamente. En la biopsia se observa pocos pelos en anágeno, incrementados los bulbos en telógeno y numerosas fracturas de los tallos pilosos1. Las pestañas son dispersas, largas y rectas con apariencia de “palo de escoba”4 y en otros casos descritos son largas y crespas7. En la cara y parte posterior del cuello se evidencia importante lanugo. A nivel de las uñas se describen cambios de engrosamiento, pérdida del brillo, débiles, delgadas, anoniquia y bandas transversas por alteraciones metabólicas en la matriz. En las mucosas se describe queilitis angular, queilosis y estomatitis asociada a déficit de riboflavina, además de glositis con ausencia de papilas. También existe xeroftalmia y vulvovaginitis. En la biopsia de piel se ve hiperqueratosis con paraqueratosis, atrofia de la capa granulosa y espinosa, así como palidez de los queratinocitos en la parte superior de la epidermis e infiltrado perivascular superficial linfocitario5. Estudios ultraestructurales de la piel despigmentada muestran menor espesor de la capa de Malpighi comparada con sujetos normales, probablemente secundario a cambios en la cinética de la migración celular en el kwashiorkor y la longitud de los desmosomas en menor grado asociada a la fragilidad de la epidermis8. Las alteraciones cutáneas más frecuentes en 100 niños mexicanos con kwashiorkor fueron3: “piel barniz brillante” 64%, máculas eritemato-pigmentadas 48%, piel xerótica o en “pintura descascarada” 28%, hipocromía residual 21%, descamación en escama grande 18%, hipercromía 11% y eritema 11%. En el 75% de los casos se observó sobreinfección bacteriana y por Candida. En el cuadro 2 se resume las lesiones cutáneas primarias y secundarias presentes en el kwashiorkor. El eritema es ocasionado por vasodilatación y está presente en zonas de fricción, no produce prurito. La atrofia está dada por piel seca y delgada debido a la ingesta inadecuada de nutrientes. La púrpura se ve en casos severos de desnutrición y se presenta por incremento 84 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Cuadro 2. Lesiones primarias y secundarias en kwashiorkor (Ruiz-Maldonado3). Lesiones primarias Eritema Lesiones secundarias Hiperpigmentaci n Descamaci n Atrofia Necrosis Hipo o hiperpigmentaci n Xerosis Descamaci n Momificaci n P rpura Da o epid rmico de la permeabilidad vascular. La necrosis se asocia a severidad con infecciones sistémicas concomitantes dejando la piel oscura con signo de Nikolsky positivo. El tratamiento va encaminado a mejorar el estado nutricional del paciente. Recordemos que en la desnutrición también hay déficit multivitamínico y de elementos esenciales (Cuadro 3). En la fase aguda de las lesiones se recomienda la aplicación de ungüentos lubricantes, dar el tratamiento específico para las infecciones bacterianas y por Cándida, y medidas generales para evitar trauma agudo en la piel así como en zonas de presión. Dermatitis herpetiforme (DH) Es una enfermedad vesicoampollar, subepidérmica, autoinmune, muy rara en la edad pediátrica. Forma parte del espectro de enfermedades con sensibilidad al gluten igual que la enfermedad celiaca9; la relación con esta última es tan grande, que actualmente se le considera la enfermedad celiaca de la piel10.A pesar de que los síntomas gastrointestinales en la DH son raros, cerca del 89% de ellos presentan atrofia vellosa yeyunal9. Existen pocos estudios de prevalencia, y menos en la edad pediátrica, en parte por la confusión con otras dermatosis ampollares antes del empleo rutinario de la inmunofluorescencia; su frecuencia aproximada es de 1:10 000 perso- M. Tavera Cuadro 3. Hipovitaminosis y manifestaciones dermatológicas. Deficiencia de vitaminas y elementos esenciales Vitamina A Vitamina B1 (tiamina) Vitamina B2 (riboflavina) Vitamina B3 (niacina) Vitamina B6 (piridoxina) Vitamina B12 (cianocobalamina) Vitamina C ( cido asc rbico) Vitamina D Vitamina H (biotina) Vitamina K Hierro Cobre Selenio Manganeso nas. El 10% de los pacientes presenta la enfermedad antes de los 16 años11 y es muy rara antes de los dos años de edad; en el 75% de los casos ocurre entre los dos y siete años aunque hay un caso reportado a los 10 meses de edad9 y un caso visto personalmente en una lactante de dos meses de edad. En menores de 20 años afecta más a las mujeres que a los hombres con relación 3:210,11. La DH es producida por una reacción intestinal al gluten; éste corresponde a una fracción proteica que permanece después de que a la harina se le ha eliminado el exceso de almidón. El trigo, la cebada y el centeno son considerados fuentes principales de gluten11; otros alimentos implicados son el bulgur (tipo de trigo utilizado en el tabule), el kamut (utilizado en comidas procesadas como pastas y cereales), el matzo (tipo de pan que se consume en las festividades judías) y el millet (para la fabricación de pudines, panes y ponqués). El gluten desencadena varios eventos inmunológicos en donde la IgA, la IL8, factores estimulantes de colonias de los granulocitos (GM_CSF), linfocitos T CD4 y antí- Manifestaciones dermatol gicas Piel seca, descamativa, arrugada (dermomalacia), p pulas foliculares con tap n querat sico central en superficies extensoras (frinoderma), cabello escaso y fr gil Estomatitis, glositis Lengua lisa, rojo-purp rica, perleche, queilosis, descamaci n seborreica perinasal, periorbicular, en orejas y genitales (s ndrome oro- culo-genital) Pelagra, eritema sim trico en zonas expuestas a luz, queilitis, glositis, inflamaci n perianal y vaginal Queilosis, glositis, dermatitis tipo seborreica centrofacial Hiperpigmentaci n de pliegues en flexi n, de manos y plantas, nudillos, u as y cavidad oral, macroglosia, cabello gris Escorbuto, queratosis folicular, hemorragia perifolicular, enc as sangrantes edematosas, estomatitis, hemorragias mucocut neas Alopecia Alopecia, cabello hipopigmentado, eczema perinasal y peribucal P rpura Glositis, queilosis, coiloniquia Pili torti, tricorrexis nodosa, moniletrix, hipopigmentaci n Discromotriquia, cambios en u as Dermatitis transitoria, crecimiento lento del pelo, discromotriquia genos como la transglutaminasa epidérmica y/o tisular (TTG) conducen a la activación de citoquinas, metaloproteinasas (sustancias que rompen tejido conectivo en la unión dermo-epidérmica con formación de ampollas) y activación del sistema humoral con la consecuente producción de IgA dirigidos contra la gliadina, endomisio y autoantígenos como la TTG. Por todo esto, en la unión dermoepidérmica se deposita IgA por algún factor desencadenante (sol, trauma, yodo) con posterior activación del complemento9,10. Recientemente se demostró que la transglutaminasa 3 (TG3) es el mayor autoantígeno reconocido en las lesiones cutáneas de la DH9. Existe una alta incidencia de HLA-B8, DR3, DQw2 y con los alelos DQA1 y B1 del cromosoma 69,11. Las manifestaciones clínicas son inicialmente pápulas urticariformes que se agrupan con pequeñas vesículas formando el patrón herpetiforme característico. Las lesiones son intensamente pruriginosas y por esto es más frecuente ver excoriaciones y costras que las vesículas intactas; las lesiones están distribui- Dermatol Pediatr Lat Vol 5 Nº 2, 2007 85 Piel, desnutrición y enfermedad digestiva das en las superficies extensoras (hombros, codos, antebrazos, glúteos, rodillas, nuca, cuero cabelludo y ocasionalmente cara y mucosa oral). En los niños un signo característico es la presencia de lesiones hemorrágicas palmoplantares; 10% de los casos presentan nódulos y pápulas no pruriginosas en sitios atípicos como glúteos, cara y orejas9. La enfermedad es crónica y 15% presenta remisión espontánea y el resto diferentes grados de severidad. Además de la clínica, la patología muestra ampollas subepidérmicas, microabscesos en la punta de las papilas dérmicas, infiltrado de PMN con predominio de neutrófilos y eosinófilos en 25% de los casos12. Gracias a la inmunofluorescencia directa (IFD) se ha logrado distinguir esta enfermedad de otros cuadros ampollares (enfermedad ampollar crónica de la infancia o dermatosis ampollar IgA lineal, etc.). Los hallazgos patognomónicos están dados por depósitos granulares de IgA en la UDE y en la punta de las papilas dérmicas de la piel perilesional9,11,12. La inmunofluorescencia indirecta (IFI) se realiza en suero de pacientes con DH con dieta con gluten para Ac para EMA (Ac endomisio), presentando una sensibilidad de 90% y especificidad de 96%9. El test de autoanticuerpos circulantes IgA contra TTG por ELISA en pacientes con DH no tratados presenta una sensibilidad de 89.1% y especificidad de 97.6%, es útil para monitorizar la respuesta terapéutica y el cumplimiento de dieta libre de gluten9. El diagnóstico diferencial debe realizarse con escabiosis, dermatitis atópica invertida, enfermedades ampollares autoinmunes, prúrigo crónico y eritema multiforme. Más del 80% de los pacientes mejoran con la dieta libre en gluten de sus molestias cutáneas y gastrointestinales; los niños responden a la dieta presentando mejoría de las lesiones cutáneas en promedio a los 11 meses9. Acrodermatitis enteropática (AE) Enfermedad autosómica recesiva con defectos en el transporte y absorción del zinc (Zn), 86 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 caracterizada por la triada de dermatitis acral, diarrea y alopecia; sin embargo, solo el 20% de los pacientes la presenta en forma completa13. Existe otra forma adquirida y transitoria por deficiencia nutricional de Zn. Se han reportado casos con clínica de AE asociados a concentraciones bajas de Zn en la leche materna14. Se pone de manifiesto cuando se inicia la ablactancia y en los niños alimentados con fórmula después de cuatro a diez semanas cuando se agotan las reservas de Zn. Existe una absorción alterada de este oligoelemento a través de las células Paneth del intestino delgado causada por un defecto genético en la producción, estructura o función de un ligando de bajo peso molecular secretado por el páncreas; este ligando se une al Zn en el lumen intestinal y lo transporta a la mucosa13,15. El gen de la AE ha sido localizado en la región 8q24.3 y en el gen SLC39 A416. Las lesiones son eczematosas, periorificiales y acrales, progresan hacia vésico-ampollas y pústulas, y con el tiempo se ven psoriasiformes. Inician en mejillas y mentón con placas en forma de herradura pudiendo comprometer áreas periorbiculares con eritema y erosiones15.También hay compromiso nasal y peribucal. En el área del pañal se observa un eritema bien demarcado con escama en los bordes de las lesiones. Las manos y los pies también son afectados con dermatitis brillante, eritematosa, paroniquia y lesiones anulares con descamación en collarete14. Existen factores agravantes como la Cándida, infecciones bacterianas (estafilococo, Pseudomona y Klebsiella sp)13. Otros hallazgos dermatológicos son pelo fino y quebradizo con adelgazamiento progresivo hasta la alopecia total después de varias semanas, y cambios estructurales del tallo piloso (estriaciones transversas, pseudomoniletrix, divisiones longitudinales, etc.)17.A la microscopía con luz polarizada se describe una banda clara y oscura, “banda-cebra”14. En uñas existe distrofia ungueal, onicolisis y líneas de Beau (por detención en el crecimiento de las uñas) visibles de tres a cuatro semanas después del inicio del suplemento de Zn cuando el crecimiento de las uñas se restablece17. La curación de las heridas es lenta. M. Tavera La diarrea es la manifestación más variable (intermitente o ausente) y conlleva a disbalance hidroelectrolítico y pérdida de nutrientes. También se presentan anorexia, hipogeusia, estomatitis, perleche, hiposmia, falla pondoestatural, fotofobia gradual, blefaritis, conjuntivitis, irritabilidad, apatía, hipogonadismo y atrofia testicular13,14. El diagnóstico es clínico y se confirma con concentraciones bajas de Zn (<50ug/ml; normal 70-110ug/ml) y puede haber disminución de la fosfatasa alcalina, metaloenzima dependiente de Zn18. con náuseas y vómitos; la mitad de los pacientes presenta hematoquezia o melenas22. La púrpura palpable es característica y es esencial para el diagnóstico, las lesiones se ubican más en zonas de presión (glúteos y superficies extensoras); la presencia de ampollas y ulceraciones está descrita en algunos casos (Fig. 3). En la experiencia personal referimos dos niños con PHS con presencia de ampollas hemorrágicas en tronco y en extremidades y los dos desarrollaron hipertensión arterial, a diferencia de los referidos por Saulsbury20 quien concluye que las ampollas no tienen ningún significado desde el punto de vista pronóstico. El diagnóstico diferencial debe hacerse con dermatitis seborreica, deficiencia de biotinidasa, malnutrición, epidermolisis ampollar, deficiencia de ácidos grasos esenciales y fibrosis quística ya que la AE-like puede ser un signo de malabsorción en esta enfermedad19. El tratamiento es el sulfato de Zn 1-3mg/kg/día o hasta 2-5mg/kg/día; la duración del tratamiento es prolongada; se deberá reajustar la dosis durante el embarazo y adolescencia. Algunos eventos adversos por el Zn son vómito, náuseas, hemorragias y disminución en niveles de cobre relacionados con alteraciones en el sistema inmune. Púrpura de Henoch-Schönlein (PHS) Es una vasculitis sistémica de pequeños vasos que se caracteriza por púrpura palpable, dolor abdominal y sangrado digestivo, artritis y/o artralgias y nefritis; la artritis y el dolor abdominal pueden preceder a la púrpura en el 25 a 50% de los pacientes20. Se considera una enfermedad por complejos inmunes con depósitos de IgA en los diferentes órganos, desencadenada por infecciones por estreptococo, Micoplasma,Yersinia, virus Epstein-Barr, varicela y se conocen dos casos en niños asociados a infección por hepatitis A21. Cerca del 50-70% de los pacientes desarrollan compromiso gastrointestinal dado por edema y hemorragia o pancreatitis aguda; el dolor abdominal es tipo cólico, empeora con las comidas y se asocia Fig. 3. Púrpura de Henoch-Schönlein, vesículas hemorrágicas en pies. Se ha reportado un caso interesante en un niño de ocho años quien presentó dolor abdominal, vómito y diarrea sanguinolenta, cinco días después ascitis e íleo paralítico y derrame pleural bilateral, y tres días después hace un edema escrotal y lesiones petequiales abdominales que ya hicieron pensar en PHS; sin lesiones cutáneas, artritis o hematuria es más difícil llegar al diagnóstico23. Mastocitosis Enfermedad con un espectro amplio de presentación de causa exacta desconocida; recientemente, la mastocitosis de la niñez se ha relacionado con la mutación del c-kit proto-oncogen Gln 839-Lys24. La variedad de mastocitosis cutánea difusa (MCD) con infiltrado de mastocitos en piel con edema, engro- Dermatol Pediatr Lat Vol 5 Nº 2, 2007 87 Piel, desnutrición y enfermedad digestiva samiento y presencia de ampollas hemorrágicas y erosiones que causan prurito intenso junto con la variedad sistémica (MS) pueden ocasionar síntomas sistémicos; esta última presenta infiltrado de mastocitos en al menos dos órganos con o sin compromiso cutáneo. Las dos formas son raras en niños. Después de la piel y los huesos, el tracto gastrointestinal puede ser el más comprometido, especialmente en adultos. Los síntomas más comunes en niños son dolor abdominal tipo calambre, náusea, vómito y diarrea que puede ser continua y acompañada de esteatorrea resultando en malabsorción por el aumento de mastocitos en la lámina propia del intestino delgado y secundariamente a niveles circulantes de mediadores inflamatorios y niveles de histamina que incrementan la secreción ácida con presencia de úlcera, hemorragia o perforación25,26. Otros síntomas asociados durante los episodios de liberación de histamina son flushing, urticaria, eritema, irritabilidad, taquicardia e hipotensión. Estas formas de mastocitosis se deben distinguir de otras patologías ampollares como síndrome estafilocóccico de piel escaldada, epidermolisis ampollar y eritema multiforme ampollar, entre otras. El tratamiento va encaminado a aliviar los síntomas con antihistamínicos anti H1 y anti H2. Escleredema El escleredema, de etiología desconocida, consiste en una induración de la piel y el tejido subcutáneo, de aparición súbita, simétrica y progresiva que compromete cuello, hombros, tronco y brazos, aunque puede comprometer cara y piernas. En la edad pediátrica más del 30% se presenta en niños menores de 10 años siendo más frecuente el de inicio agudo; desencadenado por infecciones estreptocócicas como faringoamigdalitis, otitis media, escarlatina, neumonía, piodermitis, infecciones dentales y otras como influenza, sarampión, difteria, etc.27; también se ha relacionado a traumas o golpes. Su curso es benigno y de resolución 88 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 espontánea entre seis semanas a dos años28. Existe un infiltrado del tracto gastrointestinal alto con limitación para movimientos de la lengua, disfagia y alteraciones en el peristaltismo29. La biopsia de piel muestra engrosamiento de la dermis reticular con edema de las fibras colágenas; con la coloración Alcian blue se observa mucina en la dermis. No existe un tratamiento único establecido, se ha empleado penicilina a dosis altas, corticoides sistémicos (pulsos de dexametasona 2mg/kg/día por tres días por mes)29, metotrexato, penicilamina y ciclosporina A, esta última con buenos resultados en la experiencia personal con dos pacientes. Síndrome de hiperinmunoglobulinemia D El síndrome de hiperinmunoglobulinemia D y fiebre periódica, también conocido como HIDS (hyperImmunoglobulinemia D syndrome), es autosómico recesivo y cursa con periodos febriles de tres a siete días, recurrentes (cada cuatro a ocho semanas)30. Generalmente el primer episodio febril ocurre antes del primer año de vida acompañado de linfadenopatías, compromiso articular, dolor abdominal severo, vómito, diarrea y en más del 80% de los casos con lesiones cutáneas polimorfas (urticariformes y maculopapulares diseminadas)31. Los síntomas clínicos pueden preceder el aumento de la IgD32. Los niveles de IgD son >100UI/ml ó 14mg/dl, pero no todos los pacientes la elevan y el 80% de los pacientes tienen incremento de la IgA33. Las lesiones en piel se presentan en el 80% de los pacientes durante los ataques febriles y además de las formas mencionadas hay casos de púrpura reportados en el 12% de los pacientes; la púrpura de Henoch-Schönlein ha aparecido como complicación en varios de los casos de HIDS33. Recientemente se identificó una mutación en el gen MVK que codifica la mevalonato kinasa30,31,33. La IgD juega papel en la memoria inmunológica y la regulación inmune; se han visto elevadas las concentraciones de interferón gamma (IFN) e interleuquina 6 (IL-6) así como M. Tavera la IgA34. Están descritos tratamientos con colchicina, ciclosporina A, metilprednisolona e hidrocortisona con resultados variables. obstrucciones esofágicas o duodenales y hay casos que nacen con atresia pilórica con muy pobre pronóstico35,36. Wallerstein y cols.37 informan dos casos con EA, atresia pilórica y uropatía obstructiva. Epidermolisis ampollar (EA) Es un grupo de enfermedades genéticas de la piel en donde se forman lesiones ampollares en sitios de trauma menor (Fig. 4); existen tres grandes grupos según donde se encuentre la alteración de la membrana basal: simple (EAS), de unión (EAU) y distrófica (EAD). La presentación clínica varía según el tipo y combinación de la mutación y desde luego de los genes afectados. La EAU y la EAD se pueden asociar a síntomas gastrointestinales. A su vez existen variantes en los tres grupos mencionados. Fig. 4. Epidermolisis ampollar, ampolla extensa en dorso de pie de recién nacido. EAU: Presenta la variante Herlitz en donde los hemidesmosomas están reducidos en número y severamente hipoplásicos, ocurre en el 50% de todos los casos de EA, hay compromiso severo de piel y mucosas y es letal. La boca y faringe están severamente afectadas produciendo dolor e incapacidad para la alimentación y por lo tanto falla en el progreso nutricional. Presentan fisuras anales, retención fecal y constipación. Generalmente mueren en los primeros dos años de vida por obstrucción respiratoria, sepsis y malnutrición. Otra variante es la EAU con obstrucción pilórica, también letal, generalmente en prematuros con múltiples defectos epiteliales; a veces presentan EAD: Las ampollas ocurren justo debajo de la lámina densa en la zona de membrana basal. Tiene tipo de herencia autosómica recesiva y se han encontrado mutaciones en el gen COL7ª1 para el colágeno VII en brazo corto del cromosoma 336. Las ampollas predominan en sitios de golpe y fricción. Las alteraciones en el tracto digestivo vienen dadas por disfagia secundaria a estrechez esofágica, fibrosis en la cavidad oral, contracción de la apertura faríngea y oral así como por fijación de la lengua; la presencia de ulceraciones en la boca dificulta la masticación y deglución lo que lleva a malnutrición. El reflujo gastroesofágico es común en los niños con EAD y contribuye a la disfagia, a mayores síntomas de las úlceras orales y esofágicas, y acelera la estrechez de éste. Las fisuras anales producen dolor que favorecen la retención fecal llevando a estreñimiento. Son frecuentes las caries dentales y la pérdida de dientes. Todo esto lleva a anorexia secundaria comprometiendo aún más el estado nutricional de los pacientes. No hay tratamiento específico para la EA. Se recomiendan cuidados generales de la piel, control del dolor, manejo de las complicaciones como estreñimiento, anemia y enfermedad ocular, tratamiento odontológico y nutricional; se han desarrollado métodos para aliviar problemas nutricionales como dilataciones esofágicas y gastrostomías así como el aporte de vitaminas, minerales, hierro y Zn y en algunos casos soporte nutricional36,38. Enfermedad inflamatoria intestinal La enfermedad de Crohn y la colitis ulcerativa conforman la enfermedad inflamatoria intestinal con múltiples manifestaciones de tipo reactivo como úlceras aftosas, vasculitis, pioderma gangrenoso (PG), eritema multiforme, urticaria y eritema nodoso (EN)39. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 89 Piel, desnutrición y enfermedad digestiva Las lesiones de piel en la enfermedad de Crohn pueden ser inespecíficas; el EN está presente en el 7% de los pacientes generalmente en miembros inferiores; el PG afecta al 1.4% de los pacientes y la estomatitis aftosa a más del 20% en forma de pequeñas ulceraciones lineales en los labios, encías, paladar y úvula; existen otras manifestaciones inespecíficas dadas por la presencia de psoriasis, vesicopústulas como variante del PG y vitíligo. Dentro de las manifestaciones específicas se incluyen la enfermedad perioral con hiperplasia gingival, queilitis, edema de labios y pioestomatitis vegetante (pústulas en la mucosa oral); la enfermedad perianal es quizás la más frecuente con presencia de fibromas, fisuras, fístulas y abscesos, y la enfermedad de Crohn que afecta otros sitios diferentes o contiguos al tracto gastrointestinal (miembros inferiores, abdomen, cara, glúteos, escroto, pene). La mal llamada enfermedad de Crohn metastásica, es rara y su morfología muy variada (placas, nódulos y úlceras)40,41. La biopsia de piel muestra granulomas no caseificantes de células gigantes y epitelioides rodeadas de infiltrado mononuclear39. El EN se puede asociar además de la enfermedad inflamatoria intestinal al la enfermedad celiaca, que es una condición destructiva del intestino delgado inducida por la gliadina, fracción proteica del gluten; se manifiesta a edad temprana con diarrea crónica, distensión abdominal, esteatorrea y pérdida de peso, pero algunos pacientes pueden tener mínimos síntomas. Otras lesiones en piel asociadas a la enfermedad celiaca son la DH, dermatosis IgA lineal, urticaria crónica, ictiosis, enfermedad de Behçet, entre otras42. Síndrome de Peutz-Jeghers Enfermedad heredada en forma autosómica dominante con expresividad variable y cuya característica es la pigmentación y los pólipos gastrointestinales. Se ha detectado la mutación del gen LBK1/STK11 que codifica la serina treonina kinasa en el brazo corto del cromosoma 1943-45. La incidencia es de 1 en 120 000 nacidos vivos sin predilección racial. 90 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Las manifestaciones clínicas se caracterizan por la presencia de léntigos café oscuros a negros de 1-5mm, presentes o no desde el nacimiento, en labios (especialmente el inferior), mucosa oral (también en paladar y encías) y piel perioral, palmas, plantas, dedos, codos y más raro en región perianal y periumbilical44; también se han descrito pigmentaciones en las láminas ungueales. Los pólipos pueden preceder las lesiones pigmentadas o éstas pueden existir sin pólipos gastrointestinales; dichos pólipos son hamartomas con gran componente de músculo liso, ubicados en yeyuno, íleo, duodeno, colon, recto y estómago; se manifiestan con dolor abdominal, obstrucción, intususcepción y sangrado. Más del 50% de los pacientes presenta síntomas antes de los 20 años45. El riesgo de carcinoma gastrointestinal es mayor, así como el de ovario, cérvix, testículos, mama, páncreas y vesícula. El tratamiento depende de la manifestación de los pólipos; la remoción se hace idealmente por vía endoscópica. Diarrea intratable de la infancia La diarrea intratable de la infancia fue descrita en 1968 y es considerada un diagnóstico de exclusión. Se caracteriza por la presencia de diarrea persistente a pesar del reposo intestinal, lo que obliga a periodos largos de nutrición parenteral. Existen varios casos descritos donde además de la diarrea de tipo secretor desarrollan cirrosis, hay dismorfismo facial y cambios estructurales en los tallos pilosos; puede haber inmunodeficiencia celular y humoral46. Referencias bibliográficas 1. Cabrera HN, Gómez ML, Javier MI. El Síndrome MEP (Síndrome de Malnutrición EnergéticoProteico). Arch Argent Dermatol. 1990;XI:117-25. 2. Prendiville JS, Manfredi LN. Skin Signs of Nutritional Disorders. Semin Dermatol. 1992;11:88-97. M. Tavera 3. Ruiz-Maldonado R, Becerril-Chinu G. Skin Manifestations of Malnutrition. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.93-113. 4. Olumide YM. Nutritional Dermatosis in Nigeria. Int J Dermatol. 1995;34:11-6. 5. Nieves DS, Goldsmith LA. Skin Lesions in Nutritional, Metabolic And Heritable Disorders. In: Freedberg IM, Eisen AZ, Wolff K, Austen KF, Goldsmith LA, Katz SI, editors. Fitzpatricks Dermatology in General Medicine. New York: McGraw-Hill; 2003. p.1399-411. 6. Latham MC. The Dermatosis of Kwashiorkor in Young Children. Semin Dermatol. 1991;10:270-2. 7. Darwin R, Harahap M,Tja Kradinata D. Skin changes in Protein Calorie Deficiency Malnutrition. Int J Dermatol. 1970;9:247-52. 8. Burg G, Bergner T. Pigmentary Disorders Associated with Nutritional Deficiency States. Clin Dermatol. 1989;7:36-43. 9. Nicolas MEO, Krause PK, Gibson LE, Murray JA. Dermatitis herpetiformis. Int J Dermatol. 2003;42:588-600. 10. Vergara J, Díaz R. Dermatitis herpetiforme. Semergen. 2004;30:279-85. 11. Leonard JN. Dermatitis herpetiformis. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.724-730. 12. Marietta E, Black K, Camilleri M, Krause P, Rogers RS, David C, Pittelkow MR, Murray JA. A new model for dermatitis herpetiformis that uses HLADQ8 transgenic NOD mice. J Clin Invest. 2004;1090-97. 13. Perafán-Riveros C, Sayago LF, Fortes AC, Sánches JA.Acrodermatitis Enterophatica: Case Report and Review of the Literature. Ped Dermatol. 2002;19:426-31. 14. Neldner KH. Acrodermatitis Enteropathica and other Zinc-Deficiency Disorders. In: Freedberg IM, Eisen AZ,Wolff K,Austen KF, Goldsmith LA, Katz SI, editors. Fitzpatricks Dermatology in General Medicine. New York: McGraw-Hill; 2003. p.1412-18. 15. Krafk BR. Eczematous Disorders. In: Eichenfield LF, Frieden IJ, Esterly NB, editors. Textbook of Neonatal Dermatology. Philadelphia: WB Saunders; 2001. p.241-59. 16. Nakano A, Nakano H, Nomura K, Toyomaki Y, Hanade K. Novel SLC39A4 Mutations in Acrodermatitis Enterophaqtica. J Invest Dermatol. 2003;120:963-6. 17. Sarkany RPE, Breathnoch SM, Seymour CA, Weismann K, Burns DA. Metabolic and Nutritional Disorders. In: Burns T, Breathnach S, Cox N, Griffiths C, editors. Rook’s Textbook of Dermatology. Oxford: Blackwell Science; 2004. p. 57.1-57.124. 18. Wahrman JE, Honig PJ. Clinical Features and Differential Diagnosis. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p. 143-52. 19. Patrizi A, Bianchi F, Neri I, Specchia F. Acrodermatitis Enterophatica-like Eruption:A sign of Malabsortion in Cystic Fibrosis. Ped Dermatol. 2003;20:187-88. 20. Saulsbury FT. Hemorrhagic Bullous Lesions in Henoch-Schonlein Purpura. Ped Dermatol. 1998;15:357-9. 21. Islek I, Kalayci AG, Gök F, Muslu A, Dilber C. Henoch-Schönlein purpura associated with hepatitis A infection. Ped Int. 2003;45:114-6. 22. Rabinowitz LG. Henoch-Schönlein Purpura. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.1564-68. 23. Mrusek S, Krüger M, Kleinschmidt M, Brondis M. Henoch-Schönlein purpura. Case report. Lancet. 2004;363:1116. 24. Kawar AJ, Sandhu K. Cutaneous Mastocytosis in children: An Indian Experience. Ped Dermatol. 2005;22:87-9. 25. Gysel DV, Oranje A. Mastocytosis. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science 2000. p.600-9. 26. Powell DW.Approach to the Patient With Diarrhea. In: Yamada T, Powell DW, Silverstein FE, editors. Textbook of Gastroenterology. Philadelphia: J.B. Lippincott Company; 1995. p.813-63. 27. Alp H, Orbak Z, Aktas A. Scleredema adultorum due to streptococcal infection. Pediatrics Internacional. 2003;45:101-3. 28. Dogra S, Sanjeeu H, Kanwar AJ. Dexamethasone Pulse Therapy for scleredema. Ped Dermatol. 2004;21:280-281. 29. Morrell DS, Challgren E, Nijhawan A, Olson J, Laumann A, Medenica M, et al. Two cases for Diagnosis: Asymmetric Childhood Scleredema or Stiff Skin Syndrome? Ped Dermatol. 2003;20:350-5. 30. Yoshimura K, Wakiguchi H. Hyperimmunoglobulinemia D Syndrome. Pediatric Internacional. 2002;44:326-7. 31. Aubin F. Le CINCA Syndrome: une maladie de description française, a vocation internationale. Ann Dermatol Venereol. 1999;126:307-8. 32. Haraldsson A, Weemaes CMR, Jonasdottir S, Olafsson O,Van de Wiel G, Göertz J, et al. Serum Immunoglobulin D in Infants and children. Scand J Immunol. 2000;51:415-8. 33. Wickiser JE, Soulsbury FT. Henoch-Schönlein Purpura in a Child with Hyperimmunoglobulinemia D and Periodic Fever Syndrome. Ped Dermatol. 2005;22:138-41. 34. Drenth JPH, Powell RJ. Hyperimmunoglobulinemia D syndrome. Lancet. 1995;345:445-6. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 91 Piel, desnutrición y enfermedad digestiva 35. Anton-Lamprecht I. Prenatal Diagnosis of Inherited Skin Disorders. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.1358-94. 36. Atherton DJ. Epidermolysis Bullosa. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.1075-1100. 37. Wellerstein R, Klein ML, Genieser N, Pulkkinen L, Uitto J. Epidermolysis Bullosa, Pyloric Atresia and Obstructive Uropathy: A report of Two Case Reports with Molecular Correlation and Clinical ManageMent. Ped Dermatol. 2000;17:286-9. 38. Fox AT,Alderdice F,Atherton DJ.Are children with Recessive Dystrofic Epidermolysis Bullosa of Low Birthweigth?. Ped Dermatol. 2003;20:303-6. 39. Zone JJ. Cutaneous Disease Associated with Gastrointestinal Abnormalities. In: Callen JP, Jorizzo JL, Greer KE, Penneys NS, Piette WW, Zone JJ. Dermatological Signs of Internal Disease. Philadelphia:W.B Saunders; 2001. p.219-32. 40. Wiss K. Sarcoidosis, Pyoderma Gangrenosum, Crohn`s Disease and Granulomatous cheilitis. In: 92 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 41. 42. 43. 44. 45. 46. Harper J, Oranje A, Prose N, editors. Oxford: Blackwell Science; 2000. p.1549-63. Graham RM, Cox NH. Systemic Disease and the skin. In: Burnes T, Breathnach S, Cox N, Griffiths C, editors. Rook´s Textbook of Dermatology. Oxford: Blackwell Science; 2004. p. 59.1-59.75. Várkonyi A, Kirschner A, Endreffy E,Túris S, Karg E. Erythema Nodoso in Association with Celiac Disease. Ped Dermatol. 2004;21:227-30. Harper J. Genetic Diseases wich Predispose to Malignancy. In: Harper J, Oranje A, Prose N, editors. Textbook of Pediatric Dermatology. Oxford: Blackwell Science; 2000. p.1350-7. Eichenfield LF, Gibbs NI. Hyperpigmentation Disorders. In: Eichenfield LF, Frieden IJ, Esterly NB, editors. Textbook of Neonatal Dermatology. Philadelphia:W.B. Saunders; 2001. p.93-113. Bishop P, Loftis S, Nowicky M. What Syndrome is this? Ped Dermatol. 2004;21:503-5. Landers MC, Schroeder TL. Intractable Diarrhea of Infancy with Facial Dysmorphism, Trichorrexis Nodosa and Cirrhosis. Ped Dermatol. 2003;20:432-5. ARTŒCULO ORIGINAL Estudio de casos de urticaria anular aguda en pacientes hospitalizados en el servicio de Dermatología del Instituto de Salud del Niño durante el período 2003 al 2004 Felipe Velásquez1, César Gutiérrez2, Héctor Cáceres1, Rosalía Ballona1, Rosa Castro1, Iris Kikushima1, Rosario Torres1 Servicio de Dermatología del Instituto Nacional de Salud del Niño, Lima, Perú. 2 Sección de Epidemiología del Instituto de Medicina Tropical “Daniel A. Carrión”, UNMSM, Lima, Perú. 1 Dermatol Pediatr Lat 2007; 5(2): 93-97. Resumen La urticaria aguda en niños es una entidad frecuente, sin embargo su incidencia no está bien establecida. Una variante es la urticaria anular aguda o gigante que ha sido caracterizada en varios trabajos. Objetivo: Caracterizar la urticaria anular aguda en el Instituto Nacional de Salud del Niño. Material y métodos: Estudio observacional no concurrente de serie de casos. Se revisaron historias clínicas de pacientes hospitalizados del servicio de Dermatología del Instituto Nacional de Salud del Niño, Lima-Perú, con criterios de inclusión y exclusión. Resultados: Se hallaron 27 niños con diagnóstico de urticaria anular aguda, las lesiones más frecuentes fueron las placas violáceas y manchas residuales. El área más afectada fue el tórax y dentro de los factores desencadenantes más importantes se encontró el uso de furazolidona en el 59% de los casos. Conclusiones: La urticaria anular aguda o gigante es una reacción de hipersensibilidad con características propias asociada en un alto porcentaje al uso de furazolidona. Palabras clave: Urticaria; Urticaria anular aguda; Urticaria gigante; Furazolidona; Niños. Abstract Acute urticaria in children is a frequent disorder; however its incidence has not been established. Annular acute urticaria or giant urticaria is a variant which has been reported in several surveys. Objetive: Characterize acute annular urticaria at Instituto Nacional de Salud del Niño, Lima-Peru. Methods: Observational non-concurrent series of cases. We reviewed the medical records of hospitalized patients at Dermatology Service, Instituto Nacional de Salud del Niño, with inclusion and exclusion criteria. Results: We found 27 children with diagnosis of acute annular urticaria; the most frequent lesions were lilaceous plaques and residual patches.The most frequently affected area was chest and the most important triggering factor was the use of furazolidone. Conclusions: Acute annular urticaria is a hypersensitivity reaction with special characteristics, which is associated in a high percentage to use of furazolidone. Key words: Urticaria; Annular acute urticaria; Giant urticaria; Furazolidone; Children. Correspondencia: Dr. Felipe Velásquez Instituo Nacional de Salud del Niño Av. Brasil 600. Lima-Perú Correo electrónico [email protected] Recibido: 15/05/07 Aprobado: 17/07/07 93 Estudio de casos de urticaria anular aguda en pacientes hospitalizados Introducción La urticaria es una enfermedad inflamatoria reactiva vascular caracterizada por la presencia de prurito y habones transitorios recidivantes; afecta a niños como primer episodio el que generalmente es leve1-3. Del 15% al 20% de los niños han tenido un episodio de urticaria al llegar a la adolescencia4; por otro lado existe una asociación entre urticaria aguda y atopía en más del 50% de casos1. Se define como urticaria aguda cuando la duración del cuadro es menor de 6 semanas. Existen formas anulares, geográficas, hemorrágicas e incluso asociadas a angioedema2. Se ha reportado un tipo especial de urticaria en niños, la que se ha denominado anular aguda (UAA) o gigante, asociada al uso de furazolidona5,6. Presentamos este estudio de serie de casos cuyo objetivo fue el de describir las características de la UAA en el Instituto Nacional de Salud del Niño (ISN), Lima-Perú. Material y métodos Se desarrolló un estudio observacional no concurrente de serie de casos. Se revisaron las historias clínicas de los pacientes hospitalizados con diagnóstico de UAA ingresados al servicio de Dermatología del Instituto Nacional de Salud del Niño (ISN), Lima-Perú, durante el período de enero del 2003 a diciembre del 2004. Se consignaron los siguientes datos: edad, sexo, lugar de procedencia, edad de inicio de enfermedad, factores desencadenantes, tipo de lesiones clínicas, topografía de las lesiones, terapia recibida y estancia hospitalaria. Los criterios de inclusión establecidos fueron: - Paciente pediátrico con erupción macular, papular o ronchas eritematosas figuradas, de tono violáceo, localizadas o generalizadas y de tamaño mediano o grande con síntomas variables. - Paciente con tiempo de enfermedad menor de seis semanas. Como criterio de exclusión se estableció la presencia de enfermedades sistémicas que comprometieran la vida. 94 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 El análisis estadístico consistió en una fase descriptiva mediante la presentación de distribuciones de frecuencia y medidas de resumen para las variables cuantitativas. Luego se procedió a una fase de análisis inferencial, comparando variables cuantitativas mediante la prueba t de student y U de Mann-Whitney dependiendo de la forma de distribución; las variables cualitativas fueron comparadas mediante la prueba exacta de Fisher. El nivel de significación empleado en las pruebas estadísticas fue del 5%. El programa usado fue el SSPS10. Resultados Se hallaron 27 niños con diagnóstico de UAA o gigante durante el periodo de estudio. El promedio de edad de los pacientes fue de 1.9±1.1 años, con un rango entre 9 meses y 4 años 9 meses. En cuanto al sexo, la distribución fue similar, 14 casos fueron niños (51.9%) y 13 niñas (48.1%). No se observó diferencia en la distribución de las edades según sexo (p= 0.92). El tiempo enfermedad se consideró como el tiempo trascurrido entre el inicio de síntomas y la fecha de hospitalización, expresándose en días. El promedio del tiempo de enfermedad fue de 3.3 días, con una mediana de 3 días, presentando un caso hasta 21 días de enfermedad. Sin tomar en cuenta este dato extremo, el 50% de los casos llegaron a consulta con un tiempo de enfermedad entre 3 y 4 días. Las lesiones más frecuentes fueron las placas eritematosas violáceas (59.3%) (Fig. 1.), seguidas de los habones gigantes eritematosos y las máculas eritematosas violáceas policíclicas (37% cada uno) (Fig. 2). En la tabla 1 podemos apreciar los tipos de lesiones que presentaron los pacientes. Tabla 1.Tipo de lesiones presentadas por los pacientes con urticaria anular aguda, ISN, 2003-2004. Tipo de lesi n Frecuencia Placas eritematosas viol ceas Habones gigantes eritematosos M culas eritematosas viol ceas polic clicas M culas hipercr micas Ronchas polic clicas viol ceas 16 10 10 5 1 Porcentaje 59.3 37.0 37.0 18.5 3.7 F. Velásquez, C. Gutiérrez, H. Cáceres, R. Ballona, R. Castro, I. Kikushima, R. Torres y dolor articular. La localización del edema más frecuente fue en pies y manos, mientras que el prurito fue principalmente leve. La fiebre, el dolor articular y la irritabilidad se presentaron en la minoría de los casos (Tabla 2). Tabla 2. Signos y síntomas en los pacientes con urticaria anular aguda, ISN, 2003-2004. Fig. 1. Placas eritematosas con centro violáceo en abdomen. Fig. 2. Placas eritematosas policíclicas en miembros inferiores. La localización principal fue en el tronco (tórax y abdomen), siendo la región menos afectada el cuello. En la figura 3 se aprecia la frecuencia de compromiso según áreas corporales. 70 60 Porcentaje 50 Signos y s ntomas Edema Edema de pies Edema de manos Edema de labios Edema de p rpados Prurito Leve Moderado Severo Fiebre Dolor articular Irritabilidad Frecuencia Porcentaje 6 4 1 1 22.2 14.8 3.7 3.7 14 4 1 5 1 1 51.9 14.8 3.7 19.2 3.7 3.7 Las principales infecciones concomitantes fueron las diarreas (sin fiebre 48.1% y con fiebre 18.5%). También se presentaron asma o síndrome obstructivo bronquial agudo (11.1%), tos y rinorrea (3.7%) y faringitis (3.7%). Entre los factores desencadenantes analizados, tenemos fármacos y algunos alimentos. El más frecuente fue la furazolidona, siendo el siguiente el trimetropim-sulfametoxazol. El listado completo de factores desencadenantes se aprecia en la tabla 3. Tabla 3. Factores desencadenantes en los pacientes con urticaria anular aguda, ISN, 2003-2004. 40 69.2% 61.5% 30 53.8% 20 34.6% 30.8% 10 15.4% 0 Tórax Abdomen Miembros inferiores Cara Miembros superiores Cuello Fig. 3. Localización de las lesiones presentadas por los pacientes con urticaria anular aguda, ISN, 2003-2004. Se evaluó la presencia de edema y prurito en estos pacientes, además de fiebre, irritabilidad Factores desencadenantes Furazolidona Trimetoprim-sulfametoxazol Amoxicilina Ibuprofeno Alimentos marinos Paracetamol Ceftriaxona Dexametasona Dicloxacilina Eritromicina Frecuencia 16 6 3 3 2 2 1 1 1 1 Porcentaje 59.3 22.1 11.1 11.1 7.4 7.4 3.7 3.7 3.7 3.7 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 95 Estudio de casos de urticaria anular aguda en pacientes hospitalizados Los niños estuvieron hospitalizados en promedio 4.1±1.9 días, con un rango entre uno y nueve días. El 50% de los pacientes estuvo hospitalizado entre 3 y 5 días. No hubo diferencia estadísticamente significativa en la duración de la estancia hospitalaria entre los pacientes que presentaron prurito y quienes no (p= 0.71). Tampoco hubo diferencia entre quienes presentaron y no presentaron edema (p= 0.68). Sí hubo diferencia según la presencia de habones gigantes eritematosos (p= 0.026), tal como se aprecia en la figura 4. 10 Estancia hospitalaria 8 6 4 2 0 No Sí Habones gigantes eritematosos Fig. 4.Tiempo de hospitalización según la presencia de habones gigantes eritematosos, pacientes con urticaria anular aguda, ISN, 2003-2004. En relación al uso de furazolidona, no hubo diferencia estadísticamente significativa en el promedio de estancia hospitalaria (p= 0.38). Tampoco se encontró asociación entre el antecedente de consumo de este fármaco y placas eritematosas violáceas (p= 0.26), habones gigantes eritematosos (p= 1.00), máculas eritematosas violáceas policíclicas (p= 0.26), máculas hipercrómicas (p= 0.37), ni habones policíclicos violáceos (p= 1.00). Discusión La UAA o urticaria gigante es una reacción de hipersensibilidad, considerada por algunos autores como un subtipo de urticaria aguda que se presenta en infantes y niños pequeños; se caracteriza por habones policíclicos, anulares o arciformes6-8.A menudo este tipo de urti- 96 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 caria puede ser confundida con eritema multiforme o reacción tipo enfermedad del suero. Un reciente trabajo ha propuesto el término de urticaria multiforme para diferenciarla de las otras patologías8. El promedio de edad de nuestros pacientes fue de 1.9 años, similar a los casos presentados por Tamayo6. El tiempo de enfermedad de nuestros pacientes fue de 3.3 días, que coincide con el tiempo de enfermedad reportado por Shah8. Legrain fue uno de los primeros en describir este subtipo como lesiones de aspecto hemorrágico de centro violáceo1. Nuestros pacientes presentaron lesiones policíclicas (59.3%), eritematosas y violáceas, y manchas hipercrómicas residuales; estas últimas no han sido descritas previamente. En la literatura Hurwitz9 y Weston y Lane10 han descrito este tipo de lesiones a las que denominaron “urticaria gigante” donde la diferencia con el eritema multiforme consiste en que las lesiones urticarianas duran corto tiempo. Los reportes previos han descrito edema de labios, párpados y pies en la mayoría de pacientes2,3,6-8, en nuestro reporte hemos hallado 44.4% de pacientes con edema tanto de pies, manos, párpados y labios. El 70% de nuestros pacientes presentó prurito (en su mayoría leve), menor a lo reportado por Shah8. Síntomas como fiebre, dolor articular e irritabilidad se presentaron en siete pacientes. Los factores desencadenantes más importantes fueron el uso de antibióticos como la furazolidona (59.3%), trimetoprimsulfametoxazol (22.1%), amoxicilina e ibuprofeno (11.1%), alimentos marinos (7.4%); este último no había sido reportado hasta la fecha. Cabe destacar que nuestra serie de casos concuerda con la de Tamayo que reporta como principal factor precipitante de la UAA a la ingesta de furazolidona (67%)6. Se requieren más estudios clínicos y de laboratorio para definir si la UAA es una entidad propia o forma parte del espectro clínico de la urticaria aguda. F. Velásquez, C. Gutiérrez, H. Cáceres, R. Ballona, R. Castro, I. Kikushima, R. Torres Referencias bibliográficas 1. Legrain V, Taieb A, Sage T, Malevill J. Urticaria in infants.A study of forty patients. Pediatr Dermatol. 1990;7:101-7. 2. Mortureux P, Leaute-Labreze C, Legrain-Lifermann V, Lamireau T, Sarlangue J,Taieb A.Acute urticaria in infancy and early childhood: a prospective study. Arch Dermatol. 1998;134(3):319-23. 3. Aoki T, Kojima M, Horiko T.Acute urticaria: history and natural course of 50 cases. J Dermatol. 1994;21:73-77. 4. Waring R, Champion RH. Types and incidence of urticaria. En: Rook A, ed. Major problems in Dermatology. Londres:WB Saunders; 2001. p.10-14. 5. Kaupinen K, Juntunen K, Lanki H. Urticaria in children. Retrospective evaluation and follow up. Allergy. 1984;39:469. 6. Tamayo-Sanchez L, Ruiz-Maldonado R, Laterza A. Acute Annular Urticaria in Infants and Children. Pediatr Dermatol. 1997;14(3):231-4. 7. Carder K. Hipersensitivity reactions in neonates and infants. Dermatol Ther. 2005;18:160-75. 8. Shah K, Honig P,Yan A. Urticaria multiforme:A case series and review of acute annular urticarial hypersensitivity syndromes in children. Pediatrics. 2007;119(5):1177-83. 9. Hurwitz S. Clinical Pediatric Dermatology, 2nd ed. Philadelphia:WB Saunders; 1993:516-7. 10. Weston WL, Lane AT.Vascular reactions: urticaria, the erythemas and purpuras. En: Color Textbook of Pediatric Dermatology. St. Louis: Mosby Year Book; 1991. p.161-5. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 97 ARTŒCULO ORIGINAL Loxocelismo en niños hospitalizados, Perú 1970- 1990 Ciro Maguiña1,2, Rosa Mangiante2, Fernando Osores2, Herminio Hernández3. 1 Departamento de Enfermedades Infecciosas Tropicales y Dermatológicas, Hospital Nacional Cayetano Heredia. Lima, Perú. 2 Instituto de Medicina Tropical Alexander Von Humboldt, Universidad Peruana Cayetano Heredia. Lima, Perú. 3 Departamento de Pediatría, Hospital Nacional Cayetano Heredia. Lima, Perú. Dermatol Pediatr Lat 2007; 5(2): 98-106. Resumen Objetivo: Describir las características clínicas de los casos de loxocelismo en niños. Material y métodos: Estudio descriptivo retrospectivo, que incluye a todos los niños hospitalizados con diagnóstico de alta de loxoscelismo en el servicio de Pediatría del Hospital Nacional Cayetano Heredia entre 1970 y 1990, y los servicios de Medicina, Cirugía y Nefrología del Instituto Nacional de Salud del Niño entre 1980 y 1990, Lima-Perú. Resultados: Se incluyeron 89 casos (56.1% varones), el grupo más afectado (38.2%) tenía entre 5 y 10 años. Las regiones corporales comprometidas en orden de frecuencia fueron cabeza y el cuello (32.6%), miembros superiores (26.9%) e inferiores (23.6%), tórax y abdomen (12.4%) y genitales (4.5%). Los primeros signos y síntomas se presentaron durante las primeras 24 a 48 horas del accidente. Las complicaciones sistémicas más importantes fueron anemia hemolítica (49.4%) e insuficiencia renal aguda (37.1%). El 43.8% presentó la forma cutánea y el 56.2% la víscero-hemolítica (18.0% de letalidad para esta forma). La mortalidad fue mayor en niños menores de un año. Conclusiones: La presentación de sintomatología fluctúa entre las 24 a 48 horas siguientes a la mordedura. La forma víscero-hemolítica no fue un evento infrecuente. El único factor de riesgo aparente para mortalidad fue tener una edad menor de un año. Palabras clave: Aracnidismo; Loxocelismo víscero-hemolítico; Loxocelismo cutáneo; Niños; Hospitalización. Abstract Correspondencia Dr. Ciro Maguiña Vargas Instituto de Medicina Tropical Alexander Von Humboldt Av. Honorio Delgado 430, San Martín de Porres, Lima-Perú. Correo electrónico [email protected] Recibido: 15/04/07 Aprobado: 27/06/07 98 Objective: To describe the clinical features of loxoscelism in children. Methods: Retrospective descriptive study, that included all children admitted as in-patients because of loxocelism at the Hospital Nacional Cayetano Heredia from 1970 to 1990, and at Instituto de Salud del Niño between 1980 to 1990 in Lima-Peru. The clinical files were reviewed. Results: 89 were included (56.1% males).The most affected age-group (38.2%) was between 5 and 10 years old.The most frequently affected areas of the body were: head and neck (32.6%), upper extremities (26.9%), inferior extremities (23.6%) thorax and abdomen (12.4%) and genitals (4.5%).The first signs and symptoms appeared during the first 24 to 48 hours of the accident. The most important systemic complications were hemolytic anemia (49.4%) and acute renal failure (37.1%). 43.8% of patients presented the cutaneous form and 56.2% the visceral-hemolytic (18% of lethality). Mortality was greater in smaller children. Conclusions: The onset of disease fluctuates between 24 and 48 hours following the bite. The visceralhemolytic form was infrequent. The sole apparent risk factor for mortality was age less than one year old. Key words: Aracnidism; Visceral-hemolytic loxoscelism; Cutaneous loxoscelism; Children; Hospitalization. C. Maguiña, R. Mangiante, F. Osores, H. Hernández Introducción El loxoscelismo es un cuadro clínico producido por la mordedura de arañas del género Loxosceles sp, arácnidos de cuerpo pequeño y color marrón oscuro a negro, en cuyo cefalotórax se aprecia una figura semejante a un violín invertido1. A nivel mundial se han descrito más de 70 especies. En América Latina la especie más común es L. laeta, aunque también se encuentran otras como L. rufipes, L arizonica, L. gaucho y L. rufenses. En EEUU la especie más corriente es L. reclusa1, mientras que en el Perú se han identificado a L. laeta y L. rufipes como agentes causales más frecuentes distribuidas a lo largo de la costa, sobretodo en áreas urbano marginales, y zonas rurales donde se les encuentra en lugares secos sombreados2-4. Estos arácnidos son conocidos también popularmente con los términos de “araña casera” o “araña de los rincones” por hallarse en zonas oscuras y poco aseadas de las habitaciones, como esquinas de los cuartos, detrás de cuadros, muebles, en las hendiduras de los techos y los guardarropas. Suelen esconderse en las ropas y calzados sirviéndoles de refugio durante el día. Su comportamiento es tímido, solitario y nocturno. En el veneno de estas arañas se han identificado diversas enzimas (hialuronidasa, esfingomielasa, ATPasa y proteasas), todas ellas responsables de la necrosis y de la actividad coagulante in vitro5-12. Los cuadros de loxocelismo especialmente por mordedura de L. laeta pueden producir diversos síndromes clínicos, que van desde una forma cutánea que se manifiesta por lesiones locales eritematosas y edematosas que evolucionan a equímosis con presencia de flictenas hemorrágicas que llevan posteriormente a la necrosis con esfacelación y formación de cicatriz1, y otra forma sistémica o víscerohemolítica1,4, que asociada al compromiso cutáneo presenta hemólisis intravascular, ictericia, anemia aguda, hemoglobinuria y en los casos más severos insuficiencia renal aguda (IRA) y coagulación intravascular diseminada (CID). Síntomas generales como fiebre, escalofríos, erupción cutánea, náuseas y vómitos tam- bién han sido descritos1. Por otro lado se postula que el loxoscelismo es mucho más severo y letal en los niños que en los adultos2,13. El objetivo de este estudio fue describir las características clínicas de los casos pediátricos de loxocelismo hospitalizados en dos hospitales de la ciudad de Lima, Perú. Material y métodos El presente estudio descriptivo y retrospectivo, incluyó a todos los niños hospitalizados con un rango de edad entre 15 días y 15 años, cuyo diagnóstico de alta fue loxoscelismo en los servicios de Pediatría del Hospital Nacional Cayetano Heredia (HNCH) entre los años 1970 a 1990, y servicios de Medicina, Cirugía y Nefrología del Instituto Nacional de Salud del Niño (ISN) entre 1980 a 1990, ambos situados en la ciudad de Lima, Perú. La recolección de datos consistió en la revisión de las historias clínicas. Los pacientes con antecedente de mordedura de araña compatible con loxocelismo fueron clasificados como de la forma cutánea cuando la historia clínica del paciente describía edema, eritema, placa violácea, flictenas y necrosis; y como forma sistémica cuando sumado a la lesión cutánea se encontraron evidencias de anemia hemolítica, hemoglobinuria, ictericia e insuficiencia renal. Se elaboró una base de datos en el programa Excel y el análisis descriptivo consistió en la presentación de distribuciones de frecuencia. Resultados Se estudiaron retrospectivamente las historias clínicas de 89 pacientes pediátricos con diagnóstico al alta de loxoscelismo, 34 provenientes del HNCH y 55 del ISN. Del total de historias clínicas, 50 (56.2%) correspondieron a pacientes de sexo masculino y 39 (43.8%) fueron del sexo femenino. El grupo etario afectado más frecuentemente fue entre cinco y diez años, representando el 38.2% del total de pacientes, siendo el promedio de edad siete años. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 99 Loxocelismo en niños hospitalizados Los pacientes procedieron de zonas urbanas, urbano-marginales y rurales en un 47.2%, 40.4% y 12.4% respectivamente. En el 52.8% de los casos no se encontraron datos sobre las actividades del paciente al momento de la mordedura; sin embargo, en los pacientes en quienes se consignó este antecedente fue durante el sueño el momento más frecuente (37.8%), seguido del juego (35.7%), al momento de vestirse (14.3%) y en áreas de trabajo (11.9%). El mayor número de casos correspondió a los meses del verano, alcanzando un máximo en el mes de marzo, para luego disminuir gradualmente hasta un mínimo entre julio y septiembre en concordancia con la estación de invierno. En el 38.2% de los casos la araña fue observada por el paciente o sus familiares, pero en ninguno fue llevada para su identificación por el personal médico. Con respecto al lugar de mordedura, la región corporal más frecuentemente comprometida correspondió a la cabeza y el cuello (32.6%), seguido de los miembros superiores (27.0%) e inferiores (23.6%), tórax-abdomen (12.4%) y genitales (4.4%). Es importante resaltar que la mitad de los pacientes mordidos en la cabeza y cuello se encontraban durmiendo al momento del accidente, y que el 60% de los pacientes mordidos en los miembros superiores se encontraba jugando. El 30% de los niños menores de un año fueron mordidos durante el sueño y 27.3% de los niños entre cinco y diez años sufrieron el accidente durante el juego. El tiempo transcurrido entre el momento de la mordedura y la aparición de los síntomas y signos fue variable con un promedio de 2.3 horas, por lo que en la mayoría de los casos la manifestación de enfermedad se hizo evidente durante las primeras 24 horas. Las formas cutáneas y víscero-hemolíticas se presentaron en el 43.8% y 56.2% respectivamente. Los signos y síntomas locales dentro de las 24 a 48 horas fueron: edema, eritema y dolor, flictenas, placa violácea livedoide, equímosis, prurito y necrosis (Fig. 1 y 2). Sólo en el 38.2% las lesiones evolucionaron en el tiempo hacia la necrosis, llevando a la formación de escaras en el 17.9% del total de casos. Los signos y síntomas generales 100 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 más frecuentes en las primeras 48 horas fueron fiebre, hematuria, malestar general e ictericia, siendo menos frecuentes las náuseas, vómitos, compromiso de conciencia, cefalea, dolor abdominal y erupción cutánea (Tabla 1). Fig. 1. Placa livedoide. Fig. 2. Úlcera extensa. Las complicaciones sistémicas en orden de frecuencia fueron anemia hemolítica, insuficiencia renal aguda, metabólicas, sepsis y convulsiones (Tabla 2). Los datos de laboratorio al ingreso guardaron cierta relación con la forma clínica (Tabla 3), así en la forma víscero-hemolítica los valores de hematocrito, urea, creatinina, bilirrubina, leucocitos y abastonados mostraron una mayor alteración que en la forma cutánea. En relación a los exámenes de orina, la única alteración detectada en los pacientes con la forma cutánea fue la leucocituria (12.8%), mientras que en los niños con la forma víscero-hemolítica se observó hemoglobinuria (58%), hematuria (44%) y proteinuria (34%). C. Maguiña, R. Mangiante, F. Osores, H. Hernández Tabla 1. Inicio y duración de los signos y síntomas locales y generales. 24 horas 48 horas Duración (días) Signos y síntomas n % n % rango media Locales • Edema • Eritema • Dolor • Flictena • Equimosis/placa livedoide- violácea • Prurito • Necrosis • Escara 82 73 66 23 30 23 2 0 92.1 85.4 74.2 25.8 33.7 25.8 2.2 0 85 83 69 37 48 24 8 2 95.5 93.2 77.5 41.6 53.9 26.9 8.9 2.2 1 - 24 1 - 24 1 -11 2 - 17 1-17 1-7 1 - 46 3 – 38 6.9 6.7 4.5 4.5 4.5 1.7 8.5 12.0 Generales • Fiebre • Hematuria macroscópica • Malestar general • Ictericia • Náuseas y vómitos • Compromiso de conciencia • Cefalea • Dolor abdominal • Erupción cutánea general 49 29 27 19 20 11 2 4 2 55.0 32.6 30.3 21.3 22.5 12.4 2.2 4.5 2.2 55 36 32 30 23 17 8 4 3 61.8 40.4 35.9 33.7 25.8 19.1 8.9 4.5 3.4 1 -12 1-8 1-9 2 - 15 1-6 1-9 1-3 1-2 1-4 2.8 3.6 3.1 4.3 2.0 2.5 1.7 1.8 1.8 Tabla 2. Complicaciones sistémicas. Complicación Frecuencia Porcentaje del total Porcentaje de la forma sistémica 44 33 9 7 4 49.4% 37.1% 10.1% 7.8% 4.5% 88% 66% 18% 14% 8% Anemia hemolítica Insuficiencia renal aguda Metabólicas Sepsis Convulsiones Del grupo de pacientes que desarrollaron la forma víscero-hemolítica, fallecieron nueve, con una tasa de letalidad del 18%, mientras que en el grupo que presentaron sólo la forma cutánea, no se registró ningún deceso. Las complicaciones sistémicas más frecuentes en los pacientes fallecidos fueron anemia hemolítica (100%), insuficiencia renal aguda (67.4%) y sepsis (55.5%), siendo en estos casos el lugar más frecuente de la mordedura la región tóraco-abdominal (55.5%). El sexo masculino, la localización en tórax y abdomen de la mordedura de la araña, la fiebre, el malestar general, los vómitos, las flictenas y la leucocitosis se presentaron con mayor frecuencia en las formas víscero-hemolíticas (Tabla 4). Tabla 3. Resultados de laboratorio de acuerdo a la forma clínica. Examen Hematocrito (%) Creatinina (mg/dl) Urea (mg/dl) Bilirrubina indirecta (mg/dl) Leucocitos (cel/mm3) Abastonados (cel/mm3) Cutánea Víscero- hemolítica Promedio Mínimo Máximo Promedio Mínimo Máximo 32.4 0.6 28.7 0.79 12 531 683.4 10 0.21 10.6 0.2 4 300 0 43 0.9 61 1.5 28 000 2 576 27.1 1.4 76.1 3.1 15 936 1 299.93 6 0.2 20.8 0.2 3 800 0 46 6.3 550 15.2 41 000 6 240 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 101 Loxocelismo en niños hospitalizados Tabla 4. Asociación de frecuencia observada entre las características y las formas clínicas por loxocelismo. Porcentaje Víscero-hemolítica Cutánea Valor p (chi cuadrado) Sexo masculino 64.0 46.2 0.092 Edad < 1 año 12.0 12.8 1.000 Mordedura en tórax y abdomen 22.0 0.0 0.002 Accidente en mes caluroso 68.0 61.5 0.526 Características Sin tratamiento previo 46.0 46.2 0.988 Inicio de síntomas 68.0 71.8 0.699 Fiebre 66.0 41.0 0.019 Malestar general 38.0 17.9 0.039 Somnolencia 18.0 5.1 0.104 Cefalea 2.0 2.6 1.000 Vómitos 34.0 7.7 0.003 Equimosis 10.0 5.1 0.460 Flictena 16.0 38.5 0.016 Necrosis 2.0 2.6 1.000 Dolor abdominal 6.0 2.6 0.628 Atención médica 50.0 59.0 0.399 Leucocitosis 74.0 53.8 0.048 Abastonados > 500 64.0 51.3 0.227 En relación al uso de suero anti-loxocélico, en ningún caso se había administrado dicho biológico antes de la hospitalización del paciente, y durante la misma sólo el 21.3% lo recibió. Nueve pacientes que desarrollaron la forma víscero-hemolítica fallecieron, de estos únicamente cuatro (44%) recibieron suero antiloxocélico. Discusión Si bien el loxocelismo ha sido objeto de varios estudios importantes en nuestro país13-16, así como en otras naciones tales como Chile17-20 y EEUU21-24; el conocimiento a nivel de grupos de pacientes pediátricos ha sido limitado1. Por tal motivo decidimos realizar un estudio descriptivo de tipo retrospectivo en pacientes exclusivamente pediátricos, cuya característica común fue el haber estado hospitalizados con diagnóstico de loxocelismo. Un dato epidemiológico importante de este estudio, es que sólo un 38% de los pacientes 102 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 manifestó el antecedente de haber visto a la araña, lo cual es una limitación crítica para el diagnóstico de loxocelismo; esto se agrava aún más, si tenemos en cuenta que en la mayoría o el total de veces el arácnido no es llevado para su identificación por el personal de salud; y si es llevado por lo general se encuentra totalmente alterado por aplastamiento o fricción, lo que concuerda con otros estudios previos2,6,19,25. En cuanto a la procedencia, en nuestro estudio el 87% de los pacientes provenían de áreas urbanas o urbano-marginales, lo que demuestra que esta entidad es frecuente en grupos pediátricos de áreas urbanas sin necesidad del antecedente de salida al campo o zonas rurales. En concordancia a lo mencionado, existen estudios en población general que indican que el 80% de las mordeduras ocurren en el ambiente intradomiciliario25,26, sobre todo en el dormitorio25, similar a lo hallado en nuestro estudio, explicado principalmente por el hecho que la araña Loxosceles posee hábitos noctur- C. Maguiña, R. Mangiante, F. Osores, H. Hernández nos tanto intradomiciliarios como extradomiciliarios1,6.Así, los accidentes ocurren preferentemente en la casa durante el momento de despertarse y al vestirse, sin embargo, también pueden ocurrir durante la actividad exploratoria del niño en el juego, como se observó en un grupo importante de pacientes. La frecuencia entre varones fue ligeramente mayor, posiblemente debido a una mayor curiosidad por los artrópodos en el sexo masculino a dichas edades. El grupo etario más afectado se concentró entre los 5 y 10 años (38.2%); estos hallazgos concuerdan con otros estudios realizados en población pediátrica3,27, lo cual sugiere que en este rango de edad existe un mayor riesgo de sufrir loxocelismo, posiblemente relacionado a las características conductuales de curiosidad y exploración propias del niño a esa edad, lo que aumenta la probabilidad de encuentros accidentales con arañas del género Loxosceles en rincones oscuros, armarios, cocinas, cajones, alacenas y grietas de las paredes2,3. Por otro lado, para explicar la menor frecuencia observada en niños menores de dos años se sugiere que generalmente las madres son más cuidadosas con el aseo del lugar de sueño de los niños pequeños. Así, en los niños menores de dos años la mayoría de accidentes ocurrieron durante el sueño con lesiones en la cabeza, cuello o miembros superiores, mientras tanto en los niños entre dos y cuatro años el accidente ocurrió con una frecuencia similar tanto durante el sueño como el juego, comprometiendo generalmente los miembros superiores. En el grupo entre cinco y diez años, la actividad más frecuente al momento del accidente fue la de estar jugando; siendo las regiones anatómicas más afectadas los miembros superiores e inferiores. Con relación al lugar de la mordedura, las regiones anatómicas mayormente comprometidas en nuestro estudio fueron la cabeza y cuello (32.6%) seguidas de los miembros superiores e inferiores (27% y 23.6% respectivamente), lo cual difiere de otras series publicadas28, por lo que no hay una clara asociación entre la región anatómica comprometida y alguna característica particular como dormir o jugar. También es importante señalar, a pesar que en nuestro estudio no se documen- ta, que es poco frecuente encontrar las huellas de la mordedura ocasionada por el arácnido y que la evolución a una forma grave víscerohemolítica es independiente de la extensión de la lesión dérmica29,30. En nuestra serie, al igual que otros estudios31,32, los signos y síntomas más frecuentes fueron el edema leve, eritema, dolor y fiebre; estos aparecieron en su mayoría dentro de las primeras 24 horas, aunque en algunos casos la aparición de los mismos se prolongó hasta cumplidas las 48 horas de la mordedura, lo cual también concuerda con lo descrito por Schenone y cols.20. El edema leve se presentó en el 95.5% y generalmente duró hasta el sétimo día, en algunos casos su duración se prolongó hasta por 24 días. La fiebre tuvo una duración máxima de nueve días, asociada a malestar general. Náuseas y vómitos también fueron descritos durante las primeras 24 horas en un 22.5% y persistieron como máximo seis días. La equímosis/placa livedoide, que es un signo clínico muy importante para el diagnóstico, no suele manifestarse durante las primeras horas coincidiendo con lo hallado en nuestra serie, en que apareció entre las 24 a 48 horas alcanzando niveles de compromiso del 33.7% y 53.9% respectivamente. Es importante resaltar que el análisis profundo de los datos consignados en las historias demostró que un 15.7% de las lesiones descritas como equimóticas, realmente fueron placas livedoides. Este error de identificación creemos que es producto de la inexperiencia de los examinadores quienes pueden confundir la placa livedoide con una placa violácea o una equimosis u otra lesión en estadios tempranos. El 26.9% de los pacientes de esta serie presentó prurito local, lo que coincide con lo encontrado por Maguiña y cols.33,34 donde este síntoma (local y generalizado) se halló en 25% de los pacientes, mientras que Schenone y cols.20 encuentran que sólo 1.5% de sus pacientes lo presentan. Con relación a la necrosis leve superficial esta fue observada como una manifestación inicial Dermatol Pediatr Lat Vol 5 Nº 2, 2007 103 Loxocelismo en niños hospitalizados en el 8.9% durante las primeras 48 horas. Sólo en el 38.2% de los pacientes la lesión evolucionó hacia la necrosis, la cual se presentó con mayor frecuencia en el quinto día de ocurrido el accidente; estos hallazgos son similares a los reportados por otros autores23,32-34. La forma víscero-hemolítica se presentó en 56.2% de los pacientes con manifestaciones generales intensas asociadas a la presencia de hematuria (72%), ictericia (60%) y compromiso de conciencia (34%). En general, estas manifestaciones tuvieron una duración máxima de ocho días para la hematuria y quince para la ictericia.Ambas manifestaciones se iniciaron frecuentemente antes de las 48 horas y su duración promedio fue de cuatro días; se debe mencionar que 7.6% de los pacientes presentaron estos signos después de las 48 horas de evolución. De esta manera la forma clínica víscero-hemolítica constituyó un evento común en nuestra serie concordando con otros estudios3,22,34. Cuando realizamos una comparación entre los pacientes con las formas cutáneas y víscerohemolítica, los factores aparentemente relacionados con una mayor probabilidad de desarrollar esta última fueron en orden de importancia mordedura en tórax y abdomen, fiebre, náuseas y vómitos en las primeras 24 horas5. No existen reportes en la literatura que evalúen los factores de riesgo para el desarrollo de la forma víscero-hemolítica del loxoscelismo (LVH); aunque Schenone y cols.20 sostienen que el sitio de la mordedura no guarda relación con la aparición de LVH. Estudios experimentales en animales6,8 sugieren que la presentación de LVH podría estar en relación directa con la cantidad de veneno inoculada, por otro lado se piensa que la mordedura en zonas de la piel más irrigada condicionaría una mayor difusión del veneno y por consiguiente al desarrollo de la forma sistémica. En el caso del inicio de fiebre, náuseas y vómitos en las primeras 24 a 48 horas, éstas probablemente reflejen una mayor sensibilidad inflamatoria del organismo ante el veneno y por lo tanto un mayor riesgo de complicaciones sistémicas. 104 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 La tasa de mortalidad en nuestro estudio fue de 13.5%, encontrándose dentro del rango reportado por otros estudios realizados en población pediátrica que fluctúan entre 4%3 y 16.4%28. La mortalidad guardó una clara relación con la severidad de las complicaciones principalmente la presencia de insuficiencia renal26. También observamos una mayor mortalidad en los niños de un año o menos. Consideramos que ésta obedece a la relación entre el volumen de veneno inoculado y la superficie o masa corporal del paciente, relación que debe ser mayor en pacientes menores de un año; esta hipótesis puede ser objeto de futuras investigaciones. El uso de suero anti-loxocélico continúa siendo un tema de controversia. Si bien se puede aplicar en las primeras 24 horas, no existen estudios sólidos caso-control que fundamenten su uso. De nueve pacientes fallecidos, cuatro que no fueron dializados recibieron suero antiloxocélico, sin que esto modificara el desenlace. Si bien el número es pequeño, se puede plantear como hipótesis para estudios posteriores que el suero no confiere protección total contra la forma visceral. Este estudio constituye un aporte de la experiencia de veinte años en el manejo de casos de loxocelismo en dos importantes centros hospitalarios del Perú, el ISN y el HNCH. En el HNCH son tratados aproximadamente 40 casos anuales; 10 de ellos con cuadro cutáneo-sistémico o víscero-hemolítico33; estos últimos siempre han sido manejados en forma agresiva, y ante la presencia del síndrome de hipercatabolia se ha procedido a dializarlos precozmente, con lo que la mortalidad ha disminuido casi a cero34, lo que revela que el manejo precoz e integral del LVH salva vidas y reduce la morbilidad. En conclusión, el cuadro clínico por mordedura de Loxoceles sp. es un evento con graves consecuencias para la salud del niño afectado, el cual frecuentemente es traído a la consulta médica horas después de producida la mordedura, por lo que el personal de salud debe C. Maguiña, R. Mangiante, F. Osores, H. Hernández estar familiarizado con la clínica de esta entidad y posibles diagnósticos diferenciales ante la ausencia de antecedentes epidemiológicos sólidos. Finalmente planteamos la hipótesis de que cuando la zona de mordedura inflingida por la araña Loxoceles sp. se produce a nivel de tórax o abdomen, el riesgo de presentar LVH es mayor, más aún si se asocia a fiebre, náuseas y vómitos. 11. 12. 13. Agradecimientos Nuestros agradecimientos a todos los médicos de los diversos servicios del Instituto Nacional de Salud del Niño y del Hospital Nacional Cayetano Heredia por su apoyo para que este estudio se concretara. 14. 15. 16. Referencias bibliográficas 17. 1. Zavaleta A. Loxoscelismo, un problema de salud en el Perú. Bol Of Sanit Panam. 1987;103:378-86. 2. Sanabria H, Zavaleta A. Aspectos epidemiológicos del loxoscelismo en el Perú. Diagnóstico. 1987;20:54-7. 3. Zavaleta R,Alvarado G. Loxoscelismo en niños: algunos aspectos clínicos y epidemiológicos en el Hospital Belen de Trujillo. Diagnóstico. 1987;20:84-6. 4. Figueroa C, Cuenca R, Bejar H, Morales R. Loxoscelismo. A propósito de un caso clínico. Rev San Fuerzas Policiales. 1988;49:180-2. 5. Yarlequé A, Heredia V, Arbaiza E, Zavaleta A. Estudios electroforéticos y acción procoagulante del veneno de Loxosceles laeta. Diagnóstico. 1986;17:39-45. 6. Zavaleta A, Castro de la Mata O, Salas M, Castro de la Mata R, Yarlequé A. Proyecto cooperativo interuniversitario UPCH-UNMSM. Loxoscelismo experimental: aspectos farmacológicos y anatomopatológicos. Diagnóstico. 1984;14:163-73. 7. Yarlequé A, Heredia V, Arbaiza E, Campos S, Zavaleta A. Contenido proteico y actividades enzimáticas presentes en el veneno de la araña casera (Loxosceles laeta). Diagnóstico. 1985;17:5-9. 8. Gómez G. Zavaleta A, Castro de la Mata R, Arana M,Yarleque A. El conejo: un modelo experimental de loxoscelismo cutáneo viscerohemolítico. Diagnóstico. 1986;18:65-73. 9. Paredes R. Loxoscelismo experimental: efectos sobre el sistema de coagulación sanguínea. Diagnóstico. 1987;20:50-3. 10. Heredia V,Arbaiza E,Venegas J,Yarlequé A, Zavaleta A. Aportes al estudio de las acciones proteolítica, 18. 19. 20. 21. 22. 23. 24. 25. 26. procoagulante y caracterización electroforéticca de las proteínas de dos extractos tóxicos de veneno de Loxosceles laeta. Bol Chil Parasitol. 1989;44:8-16. Gebel HM, Finke JH, Elgert KD, Campbell BJ, Barret JT. Inactivation of complement by Loxosceles reclusa spider venom. Am J Trop Med Hyg. 1979;28:756-62. Elgert KD, Ross MA, Campbell BJ, Barret JT. Inmunological studies of brown recluse spider venom. Infect Immun. 1974;10:1412-9. Kemper R. Insuficiencia renal aguda por loxoscelismo: estudio de 14 casos presentados en el Hospital Cayetano Heredia. Tesis de bachiller en Medicina, Facultad de Medicina Alberto Hurtado. Lima: UPCH; 1987. Pesce H, Lumbreras H. Aracnidismo en Lima por Loxosceles laeta. Rev Med Per. 1954;31(1):3. Félix R, Alavena R, Mayorga G, García C, Prialé C. Mordedura de araña Loxosceles en pacientes pediátricos. Rev San F Polic. 1984;48:43-6. Maguiña C,Alvarez H,Terashima A, Falconi E, Legua P, Fernández E, et al. La dapsona (DDS) en loxoscelismo cutáneo. Diagnóstico. 1987;20:58-64. Irribarren O, Pérez J, Kinast C,Valencia V, Cario M. Loxoscelismo en la provincia de Valdivia (X Región). Estudio clínico de nueve casos. Bol Chil Parasitol. 1987;42:68-71. Schenone H, Rubio S, Villaroel F, Rojas A. Epidemiología y curso clínico del loxoscelismo. Estudio de 133 casos causados por la mordedura de la araña de los rincones. Bol Chil Parasitol. 1975;30:6-17. Schenone H, Saavedra T, Rojas A, Villaroel F. Loxoscelismo en Chile. Estudios Epidemiológicos, Clínicos y experimentales. Rev Inst Med Trop Sao Paulo. 1989;31:403-15. Schenone H, Rubio S, Saavedra T, Rojas A. Loxoscelismo en pediatria. Región Metropolitana, Chile. Rev Chil Pediatr. 2001;72:100-9. Rees R, Campbell D, Rieger E, King LE. The diagnosis and treatment of brown recluse spider bites. Ann Emerg Med. 1987;16:945-9. Rees RS, Fields JP, King LE Jr. Do brown recluse spider bites induce pyoderma gangrenosum?. South Med J. 1985;78:283-7. DeLozier JB, Reaves L, King LE Jr, Rees RS. Brown recluse spider bites of the upper extremity. South Med J. 1988;81:181-4. King LE Jr, Rees RS. Dapsone treatment of a brown recluse bite, JAMA. 1983;250:648. Valverde J.Aspectos clínicos y epidemiológicos del loxoscelismo, Hospital Regional Docente de Trujillo, enero 2001 a noviembre 2003. Folia Dermatol. 2003;14:15-9. Zavaleta A, Maguiña C. Clínica y terapéutica del loxoscelismo en el Perú. www.venenonemia.org. 2003. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 105 Loxocelismo en niños hospitalizados 27. Gonzáles D, García Z, Chang F, Situ R, Torres Z. Compromiso renal en loxoscelismo. Diagnóstico. 1982;9:42-6. 28. Vela J, Hermoza M, Meléndez A. Loxoscelismo en niños:Algunos aspectos clínicos y epidemiológicos en el HGRBDT 1964 - 1979.Trabajo de investigación presentado al I Congreso Regional de Medicina.Trujillo, Perú. 1979. 29. Quintana CJ, Otero PR. Envenenamiento aracnídico en las Americas. Revisión de Temas. 2002;5:1-3. 30. Vetter RS, Visscher PK. Bites and stings of medically important venomous arthropods. Int J Dermatol. 1998;37:481-96. 31. Hurtado VJG, Sotelo CN, Ibarra SR. Envenenamiento por Loxosceles reclusa (araña “parda”). Rev Mex Ped. 2005;72:85-8. 106 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 32. Quero HA, Zárate AR, Pérez BA. Aracnoidismo necrótico. Bol Méd Infant Méx. 2004;61:160-3. 33. Maguiña C, Hinojosa JC, Gutiérrez R, Henríquez C, Ugarte C. Enfermedades por artrópodos. Parte I: Loxoscelismo cutáneo y cutáneo-visceral en el Perú. 2004;14:134-9. 34. Maguiña C, Osorio R, Hinojosa JC, Guerra O. Aspectos clínicos del loxoscelimo en pacientes internados en el Hospital Nacional Cayetano Heredia. XXII Congreso Nacional de Medicina Interna, Libro de resúmenes, octubre 2002, resumen 374. ARTŒCULO ORIGINAL Liquen plano en niños en la consulta de Dermatología Pediátrica del Hospital Universitario de Caracas, 1989 a 2003 Ana María Sáenz de Cantele1, Antonietta Cirocco1, Adriana Falco2, Adriana Gómez3, Alejandra Vivas3, María del Pilar Silva3, Francisco González4. 1 Dermatóloga, Profesora Asistente de la Cátedra de Dermatología del Hospital Universitario de Caracas, Universidad Central de Venezuela. 2 Médico Interno, Servicio de Medicina Interna del Hospital Pérez de León, Caracas. 3 Médico Interno, Servicio de Medicina Interna del Hospital Universitario de Caracas, Universidad Central de Venezuela. 4 Jefe de la Consulta de Dermatología Pediátrica, Profesor Asistente de la Cátedra de Dermatología del Hospital Universitario de Caracas, Universidad Central de Venezuela. Dermatol Pediatr Lat 2007; 5(2): 107-109. Resumen Objetivo: Determinar los casos de liquen plano en edades pediátricas que acudieron al servicio de Dermatología del Hospital Universitario de Caracas entre 1989 y 2003. Métodos: Estudio analítico retrospectivo clínico de una muestra de pacientes pediátricos con diagnóstico de liquen plano a partir de los archivos del laboratorio de histopatología. Las variables analizadas fueron edad, sexo, diagnóstico clínico, distribución y morfología de las lesiones, y evolución. Resultados: Se encontró un total de 58 casos de liquen plano en niños entre 18 meses y 12 años. Hubo un predominio del sexo femenino (58%). La edad promedio de presentación fue de ocho años. La mayoría de los pacientes presentó la variante de liquen plano clásico. La localización más común fue en los miembros inferiores. Sólo en un caso se observó compromiso mucoso. Conclusiones: Las características halladas en los pacientes estudiados concuerdan en forma general con lo reportado en la literatura. Palabras clave: Liquen plano; Niños. Abstract Objective:To identify cases of lichen planus in pediatric patients who attended the service of Dermatology at Hospital Universitario de Caracas from 1989 to 2003. Methods: A retrospective analytic study of a sample of pediatric patients with a diagnosis of lichen planus from the archives of the histopathology.The variables studied were age, sex, clinical diagnosis, distribution and morphology of lesions, and evolution. Results: We found a total of 58 cases of lichen planus in children between 18 months and 12 years of age. There was a predominance of females (58%).The average age of presentation was eight years. Most of the patients had classical lichen planus.The most common location was on the lower limbs. Mucosal involvement was observed in only one case. Conclusions:The features found in the patients studied where consistent with those previously reported in the literature. Key words: Lichen planus; Children. Correspondencia: Dr. Felipe Velásquez Instituo NaCorrespondencia: Dra. Ana Sáenz de Cantele Servicio de Dermatología, Piso 8 Hospital Universitario de Caracas Universidad Central de Venezuela - Caracas, 1053. Correo electrónico: [email protected] Recibido: 31/05/07 Aprobado: 27/06/07 107 Liquen plano en niños Introducción El liquen plano (LP) es una dermatosis inflamatoria, aguda o crónica, que a afecta la piel, membranas mucosas o ambas, y que se caracteriza por la aparición de pápulas poligonales brillantes y pruriginosas, de superficie plana y coloración rosa-violácea, y de pápulas reticuladas de color blanco-lechoso, en la boca. La etiología es idiopática en la mayor parte de los casos, pero es evidente que la inmunidad celular desempeña un papel importante. La mayoría de los linfocitos del infiltrado son células CD8+ y CD45Ro+. Se reporta que sólo el 1-4% del total de casos de liquen plano corresponde a niños. Existe poca literatura con respecto a la epidemiología, características clínicas, curso y pronóstico de esta enfermedad en este grupo etario. Empero, en reportes de África Occidental e India, es bastante frecuente en niños y jóvenes, comprendiendo 17% de los casos que se presentan antes de los 20 años de edad en una serie1,2. El presente estudio retrospectivo tiene como finalidad describir los casos de liquen plano en edades pediátricas que acudieron al servicio de Dermatología del Hospital Universitario de Caracas, durante el lapso comprendido entre 1989 y 2003. Material y métodos Se utiliza como técnica de investigación un estudio analítico retrospectivo, con muestra tomada a partir de los archivos del laboratorio de histopatología, para así determinar el número de pacientes con edades comprendidas entre los cero y 12 años, con diagnóstico definitivo de LP, desde 1989 hasta 2003. Se diseñó una hoja de registro ad hoc como instrumento de recolección en la que se recogían las variables: edad, sexo, diagnóstico clínico, distribución y morfología de las lesiones, y evolución. Los datos fueron analizados en base a frecuencias y porcentajes. 108 meses y 12 años, con un promedio de ocho años. Se reportan 34 casos del sexo femenino (58%) y 24 casos del sexo masculino (42%). La región anatómica más comúnmente afectada fue los miembros inferiores (48.3%), seguida por los miembros superiores (31.0%), tronco (24.1%) y cara (15.5%). La variante clínica predominante fue el LP clásico con 39 casos (67.2%) (Fig. 1), seguida por el LP pigmentario con ocho casos (13.89%), LP atrófico con cinco casos (8.6%), un caso de LP actínico y un caso de LP en mucosa oral exclusivamente. Fig. 1. Lesiones típicas de liquen plano clásico en región de la muñeca. El total de las biopsias obtenidas reveló hiperqueratosis, hipergranulosis focal, acantosis irregular y degeneración de la capa basal con infiltrado liquenoide de linfocitos; hallazgos cónsonos con el diagnóstico de LP. Discusión Resultados El liquen plano (LP) es una enfermedad dermatológica poco frecuente en niños y la incidencia en la edad pediátrica se desconoce1,2. Otzas y cols. describen en Turquía una incidencia de 2-3% en niños3; por otra parte Handa y cols. en un estudio realizado en la India reportan que el LP correspondió al 2.5% de los casos de la consulta pediátrica4. En un período de 13 años, se registró 58 casos de LP en niños, con un rango de edad entre 18 En el presente estudio se observó que el LP tiene predominio en el sexo femenino lo cual Dermatol Pediatr Lat Vol 5 Nº 2, 2007 A. Sáenz, A. Cirocco, A. Falco, A. Gómez, A. Vivas, M. Silva, F. González. coincide con otros estudios5 aunque algunos autores no encuentran diferencias en sus series1,2,6. El promedio de edad de 8 años es comparable con otros trabajos1,6. El LP afectó con más frecuencia los miembros inferiores, al igual que en otros reportes7-10. La variante clínica más común fue la de LP clásico (67.2%), esto se corresponde con la literatura revisada1,2, donde se observan pápulas de 12mm de diámetro, poligonales, aplanadas, violáceas, con escamas finas y adherentes y líneas en su superficie de color blanco-grisáceo (estrías de Wickham) distribuidas simétricamente en piernas, muñecas y parte baja del tronco. En segundo lugar se observó como forma clínica más frecuente el LP pigmentario (13.8%). Este tipo de liquen se desarrolla particularmente en grupos étnicos como asiáticos e indios, que se caracterizan por máculas redondas, marrón-negruzco, sin borde activo, predominantemente en cara y cuello. Estas lesiones son asintomáticas generalmente aunque un tercio de ellos puede manifestar sensación urente o de prurito local. El estudio histopatológico es semejante al de liquen plano, pero con frecuencia, solo presenta hiperqueratosis, epidermis adelgazada, degeneración hidrópica de la capa basal con incontinencia pigmentaria e infiltrado linfocítico perivascular; estos hallazgos se asemejan al del eritema discrómico perstans. En tercer lugar de frecuencia como variante clínica, se tiene el LP atrófico (8.6% de nuestra serie), que se diferencia de otros trabajos donde apenas se observa en un 2.2%.1 Esta es una variante rara y se caracteriza por la presencia de pápulas o placas blanco azuladas bien delimitadas, que con frecuencia se desarrollan en miembros inferiores y tronco, aunque en nuestro estudio, no se presentó en una localización preferencial. En el diagnóstico histopatológico, se observa adelgazamiento de la epidermis y pérdida de las crestas interpapilares. Obtuvimos un caso de LP actínico, al igual que en otros estudios1, el cual afecta con frecuencia a los niños y jóvenes, donde se describen cuatro formas clínicas: anular, en placa, discró- mica y pigmentada. Las más frecuentes son las anulares, observando placas eritemato-marrones; se caracterizan por depresión central marrón y borde elevado que semejan un granuloma anular. La variante discrómica consiste de pápulas confluentes blancuzcas, y la forma pigmentada de máculas hiperpigmentadas que semejan un melasma. El compromiso en mucosas en edades pediátricas es infrecuente, lo que pudimos constatar en nuestro trabajo. Sin embargo, en el trabajo de Sharma y cols1, que es uno de los reportes más grandes de liquen plano en niños, se obtuvo un gran número de pacientes con lesiones en mucosa oral y ellos hacen la observación de que esto fue debido a la minuciosa evaluación, durante el período de seguimiento. La afectación ungueal que se ve sólo en 1 al 10% de los pacientes con liquen plano, no se manifestó en nuestros pacientes. Referencias bibliográficas 1. Sharma R, Maheshwari V. Childhood lichen planus: a report of fifty cases. Pediatr Dermatol. 1999; 16:345-8. 2. Nanda A, Al-Ajmi HS, Al.Sabah H, Al-Hasawi F, Alsaleh QA. Childhood lichen planus: a report of 23 cases. Pediatr Dermatol. 2001; 18:1-4. 3. Oztas P, Onder M, Ilter N, Oztas MO. Childhood lichen planus with nail involvement: a case. Turk J Pediatr. 2003; 45:251-3. 4. Handa S, Sahoo B. Childhood lichen planus: a study of 87 cases. Int J Dermatol. 2002 ; 41:423-7. 5. Kumar V, Garg BR, Baruah MC, Vasireddi SS. Childhood lichen planus. J Dermatol. 1993; 3:175-7. 6. Kanwar AJ, Handa S, Ghosh S, Kaur S. Lichen planus en childhood: a report of 17 patients. Pediatr Dermatol. 1991; 4: 288-91. 7. Boyd AS, Neldner KH. Lichen planus. J Am Acad Dermatol. 1991; 25:593-619. 8. Pusey WA. Lichen planus in an infant less than six months old.Arch Dermatol Syphil. 1929; 19:671-2. 9. Brice SL, Barr RJ, Rattet JP. Childhood lichen planus--a question of therapy. J Am Acad Dermatol. 1980; 3:370-6. 10. Sánchez MR. Cutaneous diseases in Latinos. Dermatol Clin. 2003; 21:689-97. 11. Kanwar AJ, Dogra S, Handa S, Parsad D, Radotra BD. A study of 124 Indian patients with lichen planus pigmentosus. Clin Exp Dermatol. 2003; 28:481-5. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 109 REPORTE DE CASOS Hamartoma fibrolipomatoso precalcáneo congénito y síndrome de Ehlers-Danlos (tipo vascular) ¿existe una verdadera asociación? Mario Marini1, María Luisa Raspa2, Gisela Duhm2, María Fernanda Greco3. 1 Jefe del Servicio de Dermatología del Hospital Británico y Profesor Titular de Dermatología, Facultad de Medicina, Universidad de Buenos Aires, Argentina. 2 Médico de Planta del Servicio de Dermatología del Hospital Británico, Buenos Aires, Argentina. 3 Médico de Planta del Servicio de Pediatría del Hospital Británico, Buenos Aires, Argentina. Dermatol Pediatr Lat 2007; 5(2): 110-115. Resumen El hamartoma fibrolipomatoso congénito precalcáneo es una rara malformación congénita publicada sólo como esporádica y no asociada con ninguna otra enfermedad o anormalidad. Reportamos dos nuevos casos, el segundo de los cuales, no obstante, se presentó asociado con síndrome de Ehlers-Danlos tipo vascular. Palabras claves: Hamartoma fibrolipomatoso congénito precalcáneo; Síndrome de Ehlers-Danlos. Abstract A review of the literature revealed that precalcaneal congenital fibrolipomatous hamartoma is a rare congenital malformation reported only as sporadic and is not associated with any other disease or abnormatility. We report two new cases, the second of which, however, is associated with Ehlers-Danlos syndrome, vascular type. Key words: Precalcaneal congenital fibrolipomatous hamartoma; Ehlers-Danlos síndrome. Introducción Correspondencia Dra. María Luisa Raspa Raulet 48. CABA. Argentina Correo electrónico [email protected] Recibido: 01/06/07 Aprobado: 11/07/07 110 El hamartoma fibrolipomatoso congénito precalcáneo (HFCP) es una patología benigna poco frecuente, que raramente es mencionada en la literatura. Por lo general está presente desde el nacimiento, aunque puede desarrollarse más tardíamente. La clínica del HFCP es característica. Las lesiones son nódulos blan- dos, poco salientes, asintomáticos, bilaterales, simétricos, de aproximadamente 1cm de diámetro y ubicados en la región plantar media de los talones. Presentamos dos pacientes con HFCP. Destacamos, en el segundo de los casos, la presencia de rasgos clínicos compatibles con el síndrome de Ehlers-Danlos (tipo vascular). M. Marini, M. Raspa, G. Duhm, M. Greco. Casos clínicos Caso 1. Se trata de una niña argentina, de tres años, que presenta desde el nacimiento una lesión nodular en región precalcánea de ambos pies.Al practicarse el examen clínico se observa una lesión blanda, ligeramente saliente, de color piel, bilateral, simétrica, de 0.8cm de diámetro. El cuadro es asintomático y no interfiere con la marcha (Fig. 1). No se realizó biopsia por considerársela innecesaria. Fig. 2. Nódulos blandos, bilaterales, simétricos localizados en región precalcánea de ambos pies. Fig. 1. Lesión nodular blanda en región precalcánea. Caso 2. Se trata de una paciente argentina de cuatro años. Por ser una niña adoptada no están disponibles los antecedentes familiares. Los hallazgos clínicos son similares al caso 1: nódulos blandos, color piel, bilaterales, simétricos, de 1cm de diámetro, localizados en la región precalcánea de ambos pies (Fig. 2). Se observa además piel facial fina y lisa, con transparencia de vasos, ojos grandes y profundos y nariz fina. La elasticidad lingual le permite tocarse la punta de la nariz (signo de Gorlin) (Fig. 3). En tórax, abdomen y miembros, se observa la transparencia de vasos sanguíneos de tonalidad azulada (Fig. 4) e hiperqueratosis por roce sobre ambos maléolos externos. Puede constatarse hiperflexibilidad articular (Fig. 5), hiperelasticidad cutánea y fragilidad capilar frente a traumatismos leves con tumefacción y hematomas a predominio de cara anterior de ambas pantorrillas (Fig. 6). Refiere epistaxis. El examen cardiológico y traumatológico no mostró particularidades. El examen histopatológico no fue realizado. Fig. 3. Apariencia facial característica y marcada elasticidad lingual (Signo de Gorlin). Fig. 4. Detalle de tórax; transparencia de vasos de tonalidad azulada. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 111 Hamartoma fibrolipomatoso precalcáneo congénito y síndrome de Ehlers-Danlos sias, se observaron adipocitos maduros rodeados por fibras colágenas y elásticas normales, con un componente edematoso intersticial. Fig. 5. Hiperflexibilidad articular e hiperelasticidad cutánea. En 1998, Eichenfield y cols.3 presentaron tres nuevos pacientes en el VIII Congreso Internacional de Dermatología Pediátrica, bajo la denominación de pápulas podálicas similares a las piezogénicas congénitas. Posteriormente, se describe, además, como nódulos plantares anteromediales de la niñez4 y nódulos plantares adiposos congénitos bilaterales5. Esta patología, presente desde el nacimiento, muestra una clínica característica y el examen histopatológico es usualmente innecesario, aunque indicado en caso de dudas6. El estudio histopatológico muestra la presencia de tejido adiposo maduro envuelto predominantemente en vainas de fibras colágenas que ocupan dermis media y profunda7. Fig. 6. Tumefacción y hematomas sobre cara anterior de pantorrillas y transparencia de vasos sanguíneos. En dos años de seguimiento, las lesiones podálicas se mantuvieron estables y no dificultaron la marcha. Discusión El HFCP es un desorden de curso benigno y poco frecuente. Rara vez reportado, ha recibido numerosas denominaciones, por lo general confusas o inexactas. Fue descrito por primera vez por Larralde, Ruiz León y Cabrera en 1990 como pápulas podálicas en el recién nacido1. Con posterioridad, en 1996, Larregue y cols.2 publicaron cinco nuevos pacientes y acuñaron el término de HFCP en el V Congreso Internacional de Dermatología Pediátrica, por lo siguientes motivos: - Los nódulos son congénitos o pueden observarse con posterioridad. - La localización es precalcánea. - En los pocos casos en que se tomó biop- 112 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 La patogénesis es desconocida. Larregue y cols.2 consideran que estos nódulos son el resultado de una regresión incompleta del tejido fetal ya que el talón del feto presenta una hipertrofia hipodérmica fisiológica. Otros autores sostienen que el sistema trabecular de la planta del pie se desarrolla en el estado fetal, pero se completa sólo en los últimos meses del embarazo o en los primeros meses posteriores al nacimiento1. Entre los diagnósticos diferenciales se describen: fibromatosis juvenil, particularmente el fibroma aponeurótico plantar, el hamartoma fibroso de la niñez7 y pápulas piezogénicas1. Si bien la frecuencia de esta patología es de carácter esporádico, se han verificado tres miembros de una familia en dos generaciones; este hecho sugiere una herencia autosómica dominante8. Poco se conoce sobre el curso natural del HFCP, pero se supone que puede persistir hasta la adultez8, observándose un crecimiento lento y proporcional al del niño. No es posible afirmar, hasta la fecha, que exista una condición asociada1-3. No obstante, el M. Marini, M. Raspa, G. Duhm, M. Greco. caso 2 plantea la necesidad de nuevas observaciones. Llaman la atención en este paciente las manifestaciones clínicas compatibles con el síndrome de Ehlers-Danlos (SED), probablemente, el tipo vascular (OMIM #130050). El SED integra un grupo heterogéneo de enfermedades del tejido conectivo, caracterizadas por hiperlaxitud articular, presenta también hiperextensibilidad de la piel y fragilidad de los tejidos. Se debe a defectos en las enzimas encargadas de la síntesis de colágeno. El SED es una enfermedad generalmente subdiagnosticada. La categorización de los síndromes de Ehlers-Danlos comenzó a finales de los años 60 y se formalizó en la clasificación de Berlín9. Fue evidente que estos criterios establecidos y publicados en 1988 no discriminaban entre los distintos tipos de SED y otras enfermedades fenotípicamente relacionadas. La clasificación actual realizada en Villefranche-Sur-Mer, Francia10, está basada principalmente en la causa de cada tipo, considerando aspectos clínicos, genéticos y bioquímicos. Esta clasificación simplifica al SED en seis tipos principales (Cuadro 1). Para cada tipo se han definido criterios mayores y menores. Los tipos más frecuentes son el tipo hiperlaxitud, el clásico y el vascular10. Cuadro 1. Clasificación de los síndromes de Ehlers-Danlos (adaptado de: Beighton P, De Paepe A, Steinmann B, et. al. Ehlers-Danlos Syndromes: revised nosology,Villefranche. Am J Med Genet. 1997;77:31-7). Clasificación moderna (Villafranche) Clasificación antigua (Berlín) Clásico Gravis (SED I) Mistis (SED II) Hiperlaxitud Hiperlaxo (SED III) Vascular Arterial-Equimótico (SED IV) Cifoescoliosis Ocular-Escoliosis (SED VI) OMIM* Herencia 130000 130010 AD** AD 130020 AD 130050 (225350) 225360 AD 225400 (229200) AR† Artrocalasia Artrocalasia Congénita Múltiple (SED VIIA y VIIB) 130060 AD Dermatosparaxis Dermatosparaxis humana (SED VIIC) 225410 AD Otras formas SED ligado al cromosoma X (SED V) 305200 XL‡ Periodontal (SED VIII) 130080 AR SED déficit en fibronectina (SED X) 225310 ? Síndrome de hiperlaxitud articular familiar (SED XI) 147900 AD SED progeroide 130070 ? -- -- Formas Inespecíficas * Hasta la fecha se han descrito miles de rasgos mendelianos y de alteraciones genéticas causantes de patología que se detallan en una base de datos que se denomina OMIM (Online Mendenlian Inheritance In Man). ** AD: autosómica dominante. † AR: autosómica recesiva. ‡ XL: herencia ligada al cromosoma X. El SED tipo vascular (OMIN #130050) está causado por defectos en la estructura de la cadena proa 1 del colágeno tipo III que codifica el gen COL 3A1 del Cr 2q3111. Se hereda en forma autosómica dominante. Para su diagnóstico existen criterios mayores y menores: - - Criterios mayores: piel transparente y fina, fragilidad y/o roturas arteriales, intestinales, y/o uterinas, equimosis muy extensas y apariencia facial característica. Criterios menores: acrogeria, hiperlaxitud de pequeñas articulaciones, roturas de ten- Dermatol Pediatr Lat Vol 5 Nº 2, 2007 113 Hamartoma fibrolipomatoso precalcáneo congénito y síndrome de Ehlers-Danlos dones y músculos, pie zambo equinovaro, aparición precoz de venas varicosas, fístulas arteriovenosas, neumotórax/neumohemotórax, recesión gingival e historia familiar positiva. La presencia de dos o más criterios mayores es altamente predictiva del diagnóstico y se recomiendan pruebas de laboratorio. Los métodos de laboratorio incluyen: 1) la demostración anormal del colágeno tipo III producido por fibroblastos que causan una secreción defectuosa, sobremodificación post-transacional, inestabilidad termal, y/o sensibilidad a las proteasas; y 2) la demostración de una mutación en el gen COL3A111. La apariencia facial es característica, existe una disminución en el tejido adiposo subcutáneo, particularmente en la cara y las extremidades. La hiperlaxitud articular está limitada, generalmente, a los dedos. Las roturas arteriales tienen un pico de incidencia en la tercera y cuarta década, aunque pueden ocurrir antes y son causa de muerte repentina. Las arterias de tamaño mediano son las que se afectan más frecuentemente. El dolor agudo abdominal (difuso o localizado) es una presentación frecuente de roturas arteriales o intestinales y debe investigarse con urgencia, utilizando técnicas no invasivas. La red venosa subcutánea es particularmente evidente en el pecho y el abdomen. El diagnóstico de este tipo de SED es difícil en los niños en ausencia de historia familiar. Los embarazos pueden complicarse con roturas uterinas intra-parto y hemorragias pre y/o postparto. También son frecuentes las roturas vaginales y/o perineales durante el parto. Las complicaciones durante y después de la cirugía son frecuentes y severas (p.e. dehiscencia de la herida). A nivel dermatológico, presentan piel lisa, suave, aterciopelada y muy frágil; cicatriza con lentitud y dificultad dejando amplias cicatrices atróficas con aspecto de papel de pergamino. Los hematomas son frecuentes frente a mínimos traumatismos. Son características las arrugas epicánticas y las pápulas piezogénicas, que son pequeñas hernias de tejido graso, que aparecen en la 114 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 parte lateral y media del pie cuando se está parado y desaparecen cuando cesa la presión al levantarlo. Generalmente son asintomáticas, aunque pueden llegar a ser dolorosas. Un signo de hiper-elasticidad de los tejidos es la habilidad de extender la lengua hasta tocar la nariz (signo de Gorlin). El pronóstico del SED no está alterado, salvo en el tipo vascular, que debido a las rupturas arteriales, intestinales y/o uterinas presenta una expectativa de vida de aproximadamente cuarenta años. No existe una terapéutica específica que modifique la evolución natural del SED. El único tratamiento es el sintomático y será diferente dependiendo de la afección en la persona. Respecto de las articulaciones, se puede mejorar su estabilidad con ejercicios que fortalezcan los músculos, evitando los ejercicios de carga. Se aconsejan regulares controles oftalmológicos y dentales. Es importante el consejo genético y eventual diagnóstico prenatal para el correcto asesoramiento de estos pacientes. Conclusiones Presentamos dos niñas con hamartoma fibrolipomatoso precalcáneo congénito. Esta patología es benigna, poco frecuente y escasamente publicada en la literatura internacional. Resaltamos la importancia del diagnóstico clínico. Aconsejamos, además, no efectuar estudios ni tratamientos agresivos, ya que la patología no compromete la marcha. La segunda paciente presentó, también, características clínicas del síndrome de Ehlers-Danlos, con dos criterios mayores y uno menor. Debido a la falta de sus antecedentes familiares, planteamos futuros estudios moleculares para confirmar el diagnóstico y realizar el necesario asesoramiento genético. En toda la bibliografía consultada hasta el presente, no encontramos referencias sobre mal- M. Marini, M. Raspa, G. Duhm, M. Greco. formaciones ni otros hallazgos clínicos asociados con el HFCP. En cuanto a la revisión bibliográfica realizada sobre el síndrome de Ehlers Danlos, tampoco se han hallado descripciones referentes a la presencia de HFCP. Por el contrario, hay referencias sobre la existencia de pápulas piezogénicas, asintomáticas o dolorosas en el SED. De lo anteriormente expuesto, es lícito plantear si es ésta una verdadera asociación, o bien su presencia es meramente casual. Consideramos necesarias nuevas observaciones que nos permitan dilucidar esta asociación. 4. 5. 6. 7. 8. Referencias bibliográficas 1. Larralde de Luna M, Ruiz León J, Cabrea HN. Pápulas podálicas en el recién nacido. Med Cut ILA. 1990;18:9-12. 2. Larregue M, Vabres P, Echard P, Cambazard F. Precalcaneal Congenital Fibrolipomatous Hamartoma. Presented at the V International Congress of Pediatric Dermatology, Rotterdam, September 1996. 3. Eichenfield LF, Cunningham BC, Friedlander SF. Congenital Piezogenic - like pedal papules. 9. 10. 11. Presented at the VIII International Congress of Pediatric Dermatology, Paris, May 1998. Jacob CI, Kumm RC. Benign Anteromedial Plantar Nodules of Childhood: A Distinct Form of Plantar Fibromatosis. Pediatr Dermatol. 2000; 17: 472-4. España A, Pujol RM, Idoate MA, et al. Bilateral congenital adipose plantar nodules. Br. J Dermato.l 2000; 142: 1262-4. Cambiaghi S, Galloni Ch, Restano L, Cavalli R. Precalcaneal Congenital Fibrolipomatous Hamartoma. Case Report. Intern J Dermatol. 2006; 45:1202-3. Ortega-Monzó C, Molina-Gallardo I, MonteagudoCastro C, et. al. Precalcaneal Congenital Fibrolipomatous Hamartoma: a report of four cases. Pediat. Dermatol. 2000; 17: 429-31. Meyer P, Soennichsen H, Buchenau W. Autosomal Dominant Precalcaneal Congenital Fibrolipomatous Hamartoma. Pediat. Dermotol. 2005;22(4):355-6. Beighton P, De Paepe A, Danks D, et al. International nosology of heritable disorders of connective tissue, Berlín. Am J Med Genet. 1988;29:581-94. Beighton P, De Paepe A, Steinmann B, et. al. EhlersDanlos Syndromes: revised nosology, Villefranche. Am J Med Genet. 1997;77:31-7. Steinmann B, Royce PM, Superti-Furga A. The Ehlers-Danlos Syndrome. En: Royce PM, Steinmann B eds. Connective Tissue and its Heritable Disorders: Molecular, Genetic and Medical Aspects.Wiley-Liss, New York. 1993. p. 351-407, Dermatol Pediatr Lat Vol 5 Nº 2, 2007 115 REPORTE DE CASOS Piloleiomioma simulando morfea en un niño Ana Elisa Kiszewski1, Cláudia Schermann Poziomczyk2, Nelson Ricachnevski3, Roque Furian4. 1 Dermatóloga Pediatra, Sección Dermatología Pediátrica del Hospital da Criança Santo Antônio, ISCMPA. Porto Alegre, RS, Brasil. 2 Residente en Dermatología, Consultorio de Dermatología Sanitaria, Porto Alegre, RS, Brasil. 3 Dermatólogo, Sección Dermatología Pediátrica del Hospital da Criança Santo Antônio, ISCMPA. Porto Alegre, RS, Brasil. 4 Patólogo, Laboratorio de Patología da ISCMPA, Porto Alegre, RS, Brasil. Dermatol Pediatr Lat 2007; 5(2): 116-120. Resumen Los piloleiomiomas son tumores cutáneos raros que tienen origen en el músculo erector del pelo. Presentamos el caso de un niño de tres años de edad con una placa indurada en el glúteo izquierdo, asintomática, que estuvo presente desde los tres meses de edad. El examen anatomopatológico mostró un piloleiomioma. Este tumor benigno es raro en niños y suele ser confundido con otras dermatosis. En este artículo revisamos los casos pediátricos publicados y los aspectos genéticos actuales de esta enfermedad. Además, llamamos la atención para el diagnóstico diferencial con otras patologías en la edad pediátrica. Palabras clave: Leiomioma; Piloleiomioma; Tumor de músculo liso. Abstrat Piloleiomyomas are rare benign smooth muscle tumors arising from the aerector pili muscles in the skin. We describe a three year-old boy presenting with an asymptomatic hard plaque on the left gluteus, which was present since 3 months of age.The anatomopathological examination evidenced a piloleiomyoma.There are few previous reports of piloleiomyomas in children and so they are frequently confounded with other disorders. In this paper, we review the literature on the pediatric cases reported and the current genetics aspects of this disease. Moreover, we make the differential diagnosis with other entities in children. Keywords: Leiomyoma; Piloleiomyoma; Smooth muscle tumor. Introducción Correspondencia: Dra. Ana Elisa Kiszewski Bau Rua Barão do Amazonas 412/704. Porto Alegre, RS. Brasil CEP 90870-000 Correo electrónico: [email protected] Recibido: 10/06/07 Aprobado: 07/08/07 116 El piloleiomioma es una neoplasia benigna, dolorosa, descrita por primera vez por Virchow en 1854. El tumor está compuesto por células musculares lisas derivadas del músculo erector del pelo1,2. Al contrario de los angioleiomiomas, estos tumores son poco frecuentes y suelen consistir en lesiones de localización dérmica, aisladas y dolorosas, ubicadas más comúnmente en la cara extensora de las extremidades3. Los piloleiomiomas pueden ser solitarios, pero en hasta un 80% de los casos son múltiples3,4. Estos tumores pueden ocurrir en cualquier edad e incluso ser congénitos; sin embargo, son más frecuentes en el adulto joven3,5-7. Caso clínico Paciente de sexo masculino, de tres años de edad, quien acude a la consulta externa del Hospital da Criança Santo Antonio- ISCMPA en Porto Alegre, Brasil, con placa indurada en A. Kiszewski, C. Schermann, N. Ricachnevski, R. Furian región glútea izquierda que se extendía al surco interglúteo del mismo lado. Los padres notaron la lesión a los tres meses de edad. La lesión presentaba un crecimiento proporcional al del niño. Al examen, la placa medía 5.3cm x 2.5cm en su mayor diámetro, acompañada de una lesión satélite de 1cm de diámetro. La lesión tenía aspecto esclerodermiforme y no era dolorosa. El diagnóstico inicial fue esclerodermia en placa o nevus del tejido conectivo. No fueron encontradas otras anormalidades en el examen físico y no había historia de lesiones cutáneas similares en los familiares del nino, tampoco había historia familiar de miomatosis uterina. Fig. 1. Placa de piel indurada en glúteo. Los límites de la lesión fueron marcados con una pluma para su mejor definición. La cicatriz circular marca el lugar de la biópsia. Fig. 2. Ultrasonido mostrando lesión intradérmica hipoecoica, delimitada por las flechas. Fig. 3. La fotografía muestra el tumor dérmico con fibras musculares lisas, eosinofílicas, mezclados con haces colágenos (H/E 200x). El ultrasonido del área afectada mostró una lesión intradérmica hipoecoica, sin evidencia de colección líquida o de flujo sanguíneo (Fig. 2). La biopsia incisional de la lesión mostró un tumor dérmico, compuesto por haces de células fusiformes con citoplasma eosinofílico sin atipias celulares, siendo la immunohistoquímica positiva para actina-músculo-liso y desmina (Fig. 3 y 4). La immunohistoquímica para proteína S100 fue negativa. El niño fue observado durante un año, posteriormente se solicitó evaluación por cirugía plástica para el tratamiento respectivo. Discusión Se han utilizado diferentes clasificaciones para los leiomiomas. Según el origen de las células Fig. 4. Immunohistoquímica para el anticuerpo monoclonal actina-músculo-liso (40x). musculares lisas, se dividen en: piloleiomiomas, leiomiomas genitales, angioleiomiomas genitales y leiomiomas con diferentes elementos mesenquimatosos2-4. Si consideramos el número de lesiones, podemos dividirlos en dos grupos: leiomiomas solitarios y leiomiomas múlti- Dermatol Pediatr Lat Vol 5 Nº 2, 2007 117 Piloleiomioma simulando morfea en un niño ples. A su vez pueden ser zonales, lineales o agrupados en una placa, o diseminados por amplias superficies de la piel (leiomiomatosis miliar)8. Finalmente, según el momento de la aparición, podemos dividir estos tumores en congénitos (muy raros) y adquiridos. Las lesiones adquiridas suelen ser esporádicas o familiares. En la presentación familiar, generalmente las lesiones son múltiples. En los hombres las lesiones son con frecuencia solitarias y en mujeres son a menudo múltiples3-5,9,10. Clínicamente, los piloleiomiomas surgen como pápulas de consistencia firme, cuya coloración varía desde el color de la piel hasta rosado o rojo-castaño. Son variables en tamaño, pero en general son menores de 15mm de diámetro6,11,12. El crecimiento es lento y casi nunca se ulceran13. Es frecuente que el paciente refiera episodios de dolor en el sitio de la lesión, principalmente al tacto, frío o por razones emocionales3,4,8. Las zonas más comprometidas son las extremidades, principalmente regiones proximales y extensoras de los miembros. Las lesiones múltiples unilaterales o diseminadas son más frecuentes que las solitarias14,15. Los leiomiomas cutáneos múltiples pueden presentarse como lesiones difusas, simétricas, segmentarias o en banda y aún siguiendo líneas de Blaschko3,5,10.A pesar de las características típicas del tumor, el diagnóstico clínico es realizado raramente11,16. En el caso presentado, la única alteración encontrada fue la induración cutánea. Esta parece ser una presentación excepcional8. La leiomiomatosis cutánea y uterina múltiple (OMIM 150800) es una enfermedad genética, trasmitida por un gen autosómico dominante. Todos los casos familiares descritos son múltiples17,18. Además, recientemente, han sido descritas diferentes formas de cáncer renal en asociación con esta enfermedad. Este síndrome es ahora referido como leiomiomatosis hereditaria y cáncer renal (OMIM 605839). Ambas resultan de mutaciones heterozigóticas en células germinales del gen de la fumarato hidratasa, que puede funcionar como un gen supresor tumoral10. Como existe la asociación entre piloleiomioma y miomatosis uterina, las mujeres deben ser examinadas en busca del tumor9,17-20. No hay referencia en la literatura que apoye la existencia familiar del piloleiomioma solitario21. En nuestra revisión encontramos solamente nueve casos de piloleiomiomas en niños6,7,15,22,23 y la mayor parte de ellos fueron múltiples (77%), muy probablemente heredados (Tabla 1). Es probable que muchos casos no sean reportados, dificultando un análisis exacto de esta patología en la edad pediátrica. En las series publicadas la frecuencia de casos pediátricos varió de 5 al 20% (Tabla 2). Los datos disponibles sugieren una distribución muy similar entre ambos sexos, sea en las lesiones solitarias o múltiples11,12,21. Entre los nueve casos reportados, cuatro fueron niñas y tres niños, en los demás, el sexo no fue descrito6,7,15,22,23. Otra observación es la tendencia a ser múltiples, al contrario de lo que ocurre en adultos (Tabla 1). Tabla 1. Características clínicas de los piloleiomiomas en nueve pacientes pediátricos. Caso 118 Sexo Edad de inicio Edad de diagnóstico (años) Localización Número de lesiones Referencia 1 Femenino 1 año 37 Antebrazo Múltiples 6 2 Masculino Desde la niñez 63 Brazos e tronco Múltiples 6 6 3 Masculino Desde la niñez 25 Antebrazo Múltiples 4 Femenino Congénito 10 Nariz y labio superior Múltiples 6 5 Femenino 4 años 24 Antebrazo Múltiples 15 6 Femenino Congénito 1 Axila Solitario 7 7 ? En el primer año ? ? Múltiples 22 8 ? En el primer año ? ? Múltiples 22 9 Masculino 3 meses 2 Brazo Múltiples 23 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 A. Kiszewski, C. Schermann, N. Ricachnevski, R. Furian Tabla 2. Piloleiomiomas en pacientes pediátricos. Numero de casos estudiados Número de casos en niños Ormsby, 1925 21 4 6 Jansen, 1952 6 1 15 Autor, año de publicación Referencia Montgomery & Winkelmann, 1959 23 1 7 Fisher, 1963 22 2 22 Hendersen, 1997 1 1 23 La histopatología del piloleiomioma es bastante característica y muestra un tumor dérmico mal delimitado, integrado por haces entrelazados de fibras musculares lisas, eosinofílicas, mezclados con haces colágenos. Las fibras musculares son rectas o discretamente onduladas y contienen un núcleo delgado y muy largo. Ni pleomorfismo ni figuras mitóticas son visualizados1. En la immunohistoquímica estas células son positivas para actina-músculo-liso y desmina2,9 y negativa para proteína S-10012,24,25. Los piloleiomiomas son tumores típicamente benignos. Debido al hecho de que pueden ser dolorosos y porque hay relatos de degeneración maligna, la escisión quirúrgica es recomendada. Desgraciadamente, las recidivas son frecuentes3,9. Nuevas lesiones pueden aparecer cercanas a la lesión retirada o en otro lugar, después de la cirugía3,6,7,11,14. No hay datos del seguimiento de los pacientes pediátricos. En conclusión, existen pocos casos reportados de piloleiomiomas en niños y no hay datos de seguimiento. El caso presentado es de especial interés pues además de simular una esclerodermia en placa, tuvo su aparición muy temprano, lo que también nos hizo pensar en tumores congénitos. Por tratarse de una lesión única y sin historia familiar de leiomiomas, pensamos que se trataba de la forma solitaria. Cuando el piloleiomioma es solitario, el diagnóstico diferencial incluye otros tumores dolorosos como neuroma, espiroadenoma écrino, angiolipoma y tumor glómico. Cuando es asintomático el diagnóstico diferencial incluye el dermatofibroma, neurofibromas, granulomas a cuerpo extraño, quistes e histioci- tomas3. Las formas congénitas deben ser diferenciadas del hamartoma de músculo liso congénito y del dermatomiofibroma26,27. Otros diagnósticos diferenciales en niños incluyen el nevus de tejido conectivo, esclerodermia y leiomiosarcoma8. El tratamiento de estas lesiones depende del número y su sintomatología. Referencias bibliográficas 1. Elder DRE, Bernett LMG. Lever´s histopathology of the skin. 9th ed. Philadelphia, PA: LippincottWilkins,2005; p.1078-82. 2. Serra-Baldrich, Tribó-Boixareu MJ. Tumores benignos del músculo liso. Act Dermatológ. 1997;819:567-71. 3. Morales-Barreara ME, Galván-Soria LA, SantaColoma JN, Ramos-Garibay AR. Piloleiomiomas multiples. Presentación de un caso. Rev Cent Dermatol Pascua. 2001;10: 138-40. 4. Díaz-Ceballos MEG, Mandujano-Álvarez GJ, CruzOrtiz H, Ríos-Ávila ME. Piloleiomiomas multiples. Informe de un caso. Rev Med Hosp Gen Mex. 2006;69:96-8. 5. Revollar Y, Paredes A, Palomino V, Vicuña C, Sánchez G, Coronado J. Leiomiomatosis cutánea y uterine: síndrome de Reed. Dermat Peru. 2005;15:241-4. 6. Ormsby OS. Leiomyoma cutis. Arch Dermatol Syphilol. 1925,11:466-80. 7. Montgomery H, Winkelmann RK. Smooth-muscle tumors of the skin.Arch. Dermatol. 1959,79:32-41. 8. Del Pozo J, Martínez W, Iglesias-Pin M, YebraPimentel MT, Almagro M, Peña C, et al. Piloleiomiomas cutáneos múltiples, no familiares. Revista Internacional de Dermatología y Dermocosmética Clínica. 2001;4:455-7. 9. Suziki HS, Cavalin LC,Werner B, Sato MS, Brenner FM. Caso para Diagnóstico. An Bras Dermal. 2007;82:190-2. 10. Badeloe S, van Geel M, van Steensel MA, Bastida J, Ferrando J, Steijlen PM, et al. Diffuse and Segmental Dermatol Pediatr Lat Vol 5 Nº 2, 2007 119 Piloleiomioma simulando morfea en un niño 11. 12. 13. 14. 15. 16. 17. 18. 19. 120 variants of cutaneos leiomyomatosis: novel mutations in the fumarate hydratase gene and review of literature. Exp Dermatol. 2006;15:735-41. Raj SMD, Calonje E, Kraus M, Kavanagh G, Newman PL, Fletcher C. Cutaneous pilar leiomyoma. Clinicopathologic analysis of 53 lesions in 45 patients. Am J Dermatopathol. 1997;19:2-9. Yokoyama R, Hashimoto H, Daimaru Y. Superficial leiomyomas - a clinicopathologic study of 34 cases. Acta Pathol Jpn. 1987;37:1415-22. Harford RR,Vidmar DA, Cobb MW, Miller ML. An atypical piloleiomyoma presenting as a nonhealing ulcerated nodule. Cutis. 1996;57:168-70. Stout AP. Solitary cutaneous and subcutaneous leiomyoma. Am J Cancer. 1937;29:435-69. Jansen LH. Leiomyoma cutis. Acta Derm Venerelo. 1952;32:40-50. Lupton GP, Naik DG, Rodman OG. An unusual congenital leiomyoma. Pediatr Dermatol. 1986;3:158-60. Pugnaire F. Familial multiple cutaneous leiomyomas. Dermatology. 1995;191:295-8. Koepfler HW, Krafchuk J, Derbes V, et al. Hereditary multiple leiomyoma of the skin. Am J Hum Genet. 1958;10:48-52. Alper M, Parlak AH, Kavak A, Aksoy KA. Bilateral multiple piloleiomyomas on the breast. Breast. 2004;13:146-8. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 20. Mezzadra G. Leiomioma cutaneo multiplo ereditario: studio de un caso sistematizzato in soggetto maschile appartenente a famiglia portatrice di leiomiomatosi cutanea e fibromatosi uterina. Minerva Dermatol. 1965;40:388-93. 21. Heatley MK, Walsh MY. Solitary cutaneous leiomyomata: a clinicopathological study of 28 cases. Ulster Med J. 1989,58:166-7. 22. Fischer WC, Helwig EB. Leiomyomas of the skin. Arch. Dermatol. 1963,88:510-20. 23. Hendersen CA, Ruban E, Porter DI. Multiple leiomyomata presenting in child. Pediatr Dermatol. 1997;14:287-9. 24. Maresca A, Gagliano C, Marcuzzi. Leiomyoma of the hand:a case report. Chir Main. 2005;24:193-5. 25. Rose C, Brocker, EV. Dermatomyofibroma: case report and review. Pediatric Dermatol. 1999;16:459-69. 26. Patrizi A, Vespignani MF, Rizzoli L, Passarini B. An asymptomatic abdominal nodule in a 5-year-old boy. Pediatr Dermatol. 1999;16:154-6. 27. Palit A, Inamadar AC, Athanikar SB, Sampagavi VV, Deshmukh NS, Yelikar BR. Hyperpigmented patch on the trunk of a neonate. Congenital smooth muscle hamartoma (CSMH) or congenital arrector pili hamartoma. Indian J Dermatol Venereol Leprol. 2005;71:217-8. REPORTE DE CASOS Edema agudo hemorrágico del lactante. Reporte de un caso Liz María Domínguez1, Olga Aldama1,Victoria Rivelli2, Graciela Gorostiaga2, Gloria Mendoza3, Arnaldo Aldama4. 1 Residente de Dermatología, Hospital Nacional de Paraguay. 2 Dermatóloga, Hospital Nacional de Paraguay. 3 Dermatopatóloga, Hospital Nacional de Paraguay. 4 Jefe del Servicio de Dermatologia, Hospital Nacional de Paraguay. Dermatol Pediatr Lat 2007; 5(2): 121-124. Resumen El edema agudo hemorrágico del lactante es una vasculitis aguda leucocitoclástica de pequeños vasos, de curso benigno, autolimitado, que afecta sobre todo a niños menores de dos años de edad. Se caracteriza por lesiones cutáneas con morfología anular o en escarapela, en cara y extremidades, además de edema de las zonas afectadas, sin embargo se conserva el buen estado general de los pacientes. Se consideran como probables desencadenantes las infecciones y la administración de ciertos medicamentos, incluso vacunaciones. Se presenta el caso de un lactante de 18 meses de edad que inicia su cuadro en forma súbita luego de un proceso infeccioso de vías aéreas superiores. Palabras clave: Edema agudo hemorrágico del lactante; Púrpura de Seildmayer; Vasculitis en la infancia. Abstract Acute hemorrhagic edema of infancy is a benign variant of leukocytoclastic vasculitis, self-limited condition that affects mainly children under 2 years old. It is characterized by cutaneous lesions with a cockade or target-like pattern, located on the face and limbs, and a variable degree of edema in affected areas; however the general health status is generally preserved.We describe the case of an 18 month old boy whose clinical picture started soon after an upper respiratory tract infection. Key words: Acute hemorrhagic edema of infancy; Seildmayer purpura; Vasculitis of infancy. Introducción El edema agudo hemorrágico del lactante (EAHL) es una vasculitis cutánea de pequeños vasos, de curso benigno, y que afecta sobre todo a niños menores de dos años de edad. Se manifiesta clínicamente por la aparición de lesiones cutáneas purpúricas con una morfología en cucarda o escarapela que se localizan preferentemente en la cara y en las extremidades1,2. Aunque la primera descripción de un caso de EAHL se atribuyó a Snow en 1913, fueron Finkelstein en 1938 y Seildmayer un año después los que permitieron caracterizar nosológicamente a esta enfermedad1,2.Esta entidad se caracteriza por la aparición súbita de fiebre, Correspondencia: Dra. Liz M. O. Domínguez L. Combatientes del Chaco 529, Fernando de la Mora. Asunción-Paraguay Correo electrónico: [email protected] Recibido: 14/05/07 Aprobado: 21/06/07 121 Edema agudo hemorrágico del lactante. lesiones cutáneas purpúricas y grados variables de edema en las regiones afectadas, es típica la ausencia de afección sistémica y la espectacularidad de las manifestaciones cutáneas que contrasta con el buen estado general del paciente2. Las lesiones cutáneas se inician como pápulas eritematosas o eritemato-purpúricas que rápidamente experimentan un crecimiento centrífugo y forman placas de varios centímetros de diámetro que tienen una morfología arciforme o anular con los bordes festoneados que recuerdan a la escarapela3. De forma más rara se han descrito variantes necróticas ampollares. Las lesiones involucionan espontáneamente en una a tres semanas y desaparecen sin dejar cicatriz1,3,4. neas eritematosas asintomáticas y edema, localizadas en rostro y extremidades, de siete días de evolución. La madre refiere que tres días antes de las lesiones en piel presentó tos con expectoración amarillenta, fiebre y le administró ácido acetil salicilico 125mg. Al examen físico: paciente febril en buen estado general, que al examen dermatológico presenta placas eritematosas redondeadas en mejillas, edema de rostro y dorso de manos, también se constatan orejas eritematosas levemente infiltradas. En muslos y piernas múltiples lesiones anulares purpúricas con centro pálido y bordes eritematosos (cucardas) (Fig. 1-2). La etiología no ha sido aún aclarada del todo, en más del 60% de los casos existe el antecedente de procesos infecciosos de vías aéreas superiores, bronquitis, otitis y conjuntivitis; habiéndose aislado en algunos casos diversos gérmenes (estreptococos, estafilococos, Mycoplasma, herpes virus, adenovirus)2,3,5. En el contexto de estas infecciones es frecuente la administración de antibióticos, antipiréticos, expectorantes, etc. que no pueden descartarse como factores etiopatogénicos y en algunos casos se ha descrito el antecedente de vacunaciones (trivalentes, antipoliomielitis)2,3,5. Todos estos factores podrían actuar desencadenando una reacción de hipersensibilidad mediada por inmunocomplejos circulantes y depósito de complemento (reacción tipo III de Gell y Coombs), que ocasiona en última instancia el daño vascular2,3. Fig. 1. Placas eritematosas redondeadas en mejillas. Se presenta un caso de EAHL de inicio súbito luego de un proceso infeccioso de vías aéreas superiores y uso de ácido acetil salicílico. Caso clínico Paciente lactante mayor de 18 meses de edad, procedente de área rural. Es admitido al servicio de Pediatría del Hospital por lesiones cutá- 122 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Fig. 2. Múltiples lesiones anulares purpúricas con centro pálido y bordes eritematosos. L. Domínguez, O. Aldama, V. Rivelli, G. Gorostiaga, G. Mendoza, A. Aldama. Estudios complementarios. Hemograma: leucocitos 17 000 (N 58%, L 42%, E 0%), eritrocitos 4 610 000, Hg 9.1g/dl (anemia microcítica hipocrómica), plaquetas 622 000. PCR: 16 (normal < 8); Test de Guayaco: negativo; examen de orina simple: proteína (+). Infome anatomo-patológico: En la dermis vasculitis leucocitoclástica con necrosis fibrinoide de las paredes vasculares, neutrófilos con leucocitoclasia y extravasación de eritrocitos; eosinófilos en gran cantidad (Fig. 3). Inmunofluorescencia directa: IgG, IgA y C3 positivos; C1q e IgM negativos. Fig. 3. Vasculitis leucocitoclástica: necrosis fibrinoide de paredes vasculares, neutrófilos con leucocitoclasia y extravasación de eritrocitos (H/E 400X). Fue tratado con antihistamínicos observándose remisión de las lesiones en una semana dejando solo hiperpigmentación (Fig. 4). Los estudios laboratoriales se normalizaron posteriormente. Discusión El EAHL es una vasculitis leucocitoclástica de pequeños vasos, se presenta generalmente en niños entre 4 y 24 meses de edad, aunque ha sido reportado un caso en neonato4,5. A pesar del carácter agudo, la extensión del proceso y lo llamativo del cuadro clínico, el EAHL suele seguir una evolución benigna. La fiebre desaparece a los dos o tres días y el proceso se limita en un periodo de una a tres semanas2,5. La causa del EAHL es desconocida. Se trata de una vasculitis mediada por inmunocomplejos, probablemente precipitada por infecciones de vías respiratorias superiores, por la administración de ciertos medicamentos, incluso vacunaciones recientes. Estos antecedentes pueden ser identificados hasta en un 75% de los casos5,6. El patrón anatomopatológico de la lesión cutánea corresponde a una vasculitis leucocitoclástica con o sin necrosis fibrinoide. La inmunoflurescencia directa muestra depósitos de C3, IgM, IgG y en ocasiones IgA dentro de los vasos dérmicos o en su proximidad7,8, tal como fueron observados en este caso, con excepción de IgM. Los diagnósticos diferenciales a tener en cuenta son sepsis meningocóccica, lesiones por maltrato, eritema multiforme, enfermedad de Kawasaki y urticarias con patrón hemorrágico1,6,8. Sin embargo, el principal diagnóstico diferencial se plantea con la púrpura de Schönlein-Henoch (PSH) (Cuadro 1)6,8. Otros autores consideran que el EAHL y la PSH son manifestaciones clínicas de una misma enfermedad que comparten una base anatomopatológica y se diferencian por la edad de aparición, el cuadro clínico y el pronóstico8. Fig. 4. Lesiones en remisión. El EAHL no tiene tratamiento específico, se aconseja tener una conducta expectante ante el curso clínico benigno y autolimitado de la enfermedad. La administración de corticoides y antihistamínicos parece no alterar el curso evolutivo1,9. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 123 Edema agudo hemorrágico del lactante. Cuadro 1. Aspectos diferenciales entre EAHL y PSH. Característica EAHL PSH Edad < 2 años > 3 años Lesiones cutáneas Púrpura en escarapela Lesiones polimorfas (habones, petequias) Síntomas acompañantes Febrícula Artralgias, hematuria, proteinuria, dolor abdominal Localización de lesiones Cara y extremidades Extremidades Pronóstico Excelente Variable Biopsia Vasculitis leucocitoclástica Vasculitis leucocitoclástica Inmunofluorescencia Depósito de C3, C1q, IgM, y/o fibrina e IgG IgA, C3 y fibrina Agradecimiento A la Dra. Beatriz Di Martino O. quien realizó los estudios de inmunofluorescencia. Referencias bibliográficas 1. Martin JM, Jordá E, Monteagudo C, Alonso V, Pereda C, Ramon D . Edema agudo hemorrágico del lactante. Piel. 2005;20(4):167-71. 2. García-Patos V, Pujol RM, Querol J, Solis MJ, Oliva E, De Moragas JM. Edema agudo hemorrágico del lactante. Med Cut ILA. 1994;(22):151-4. 3. Emerich P, Neves A, Machado I, Fagundes S, Almeida P. Edema agudo hemorrágico de la infancia. Dermatol Pediatr Lat. 2005;3(3):234-8. 4. Kanflanka JM, Vivanco López A, Muñoz Bernal JA, Landa Maya J, Albisu Andrade Y. Edema agudo hemorrágico del lactante. Revisión bibliográfica. Bol S Vasco-Nav Pediatr. 2004;37:13-6. 124 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 5. Criado PR, Sakai Valente NJ, Jardim Criado RF, Sittart JA, Sawaya S. Edema agudo hemorrágico do lactente. An bras Dermatol. 1996;71(5):403-6. 6. Guerrero-Fernández J. Edema hemorrágico agudo del lactante. Disponible en: Wedpediatrica.com/casosped/250500-sol.htm 7. Goldaracena P, Pérez F. Edema agudo hemorrágico del lactante. Arch arg pediatr. 2004;102(1):72-3. 8. Garcia Calatayud S, Lozano de la Torre MJ, De las Cuevas Terán I, Mirones Martínez Y, Fernández Llaca H. Edema agudo hemorrágico del lactante. Aportación de dos nuevos casos. Bol Pediatr. 1994;35:339-43. 9. Pueyo S. Edema agudo hemorrágico del lactante. Púrpura de Finkelstein. En: Pueyo S, Valverde R. Dermatología neonatal.1ª ed. Buenos Aires; 2005. p. 229-30. REPORTE DE CASOS Sarna costrosa en un lactante desnutrido Elisa Fontenelle1, Andrea Dale Figueiredo Roisman2, Ana Paula Moura de Almeida3. 1 Socia Efectiva de la Sociedad Brasilera de Dermatologia, Responsable del Consultorio Externo de Dermatología Pediátrica de la Santa Casa de la Misericordia de Río de Janeiro; Dermatóloga del Hospital Municipal Jesús. 2 Profesora Asistente del Departamento de Patología de la Universidad Federal de Río de Janeiro, Maestrado en la Universidad Federal Fluminense, Médica del Hospital Municipal Jesús. 3 Alumna de Post-grado del 2º año de Dermatología de la Policlínica General de Río de Janeiro. Dermatol Pediatr Lat 2007; 5(2): 125-129. Resumen La sarna costrosa o sarna noruega es una forma de escabiosis altamente contagiosa, debido al gran número de parásitos en la piel, como resultado de una falla de la respuesta inmune del huésped. A diferencia de la forma clásica, el prurito es menos intenso y las pápulas eritematosas, así como los túneles escabióticos pueden estar en pequeño número o ausentes. En los casos generalizados puede haber desarrollo de linfadenopatía e infección secundaria con evolución a sepsis u otra complicación grave. Reportamos el caso de un lactante de cinco meses de edad, desnutrido, con cuadro de sarna costrosa asociado a alteraciones significativas en los exámenes físico y de laboratorio. Palabras clave: Escabiosis; Sarna costrosa; Desnutrición. Abstract The crosted or norwegian scabies is a highly contagious form of scabies, given great number of parasites in the skin, resultant of an imperfection of the immune deffense of the host. In this clinic presentation, pruritus is less intense and eritematous papules as well as linear burrows can occur in small number or exactly absent. In generalized cases it can have the development of adenopathy and secondary infection can occur being able to evolve for sepse or serious other complications. We report the case of an infant of 5 months of age, malnourished, with crosted scabies associated with significative alterations in the physical and laboratorial examinations. Key words: Scabies; Crusted scabies; Malnourished. Introducción La sarna costrosa o sarna noruega es una forma de escabiosis altamente contagiosa debido al gran número de Sarcoptes scabiei infestando la epidermis. Es considerada una afección rara que compromete, en general, pacientes con respuesta inmune alterada. Ocurre con mayor frecuencia en personas añosas y pacientes con retardo mental, además de inmunocomprometidos e individuos con condiciones sanitarias precarias. Se caracteriza por intensa reacción hiperqueratósica a la presencia del ácaro, lo que torna difícil su tratamiento. Pacientes con sarna costrosa son frecuentemente la fuente de epidemias en hospitales, debido a falla en el diagnóstico. Reportamos un caso de sarna costrosa en un lactante de cinco meses de edad, desnutrido, y con alteraciones significativas en los exámenes físico y de laboratorio. Correspondencia Dra. Elisa Fontenelle Rua Almirante Guillobel nº 32 apt 202 Lagoa Rio de Janeiro - RJ - Brasil Correo electrónico [email protected] Recibido: 17/07/06 Aprobado: 03/08/07 125 Sarna costrosa en un lactante desnutrido Reporte de caso Lactante de sexo masculino, de cinco meses de edad, residente en Mesquita - Río de Janeiro, Brasil. Derivado por médico pediatra con diagnóstico de “dermatitis seborreica grave”. El niño era producto de un embarazo controlado, nació por cesárea, prematuro (siete meses de gestación), siendo el parto precipitado por una caída de escalera. Lactante con alimentación compuesta por leche materna asociada a complemento (crema de arroz y leche de vaca). A los dos meses de edad aparecieron lesiones cutáneas que fueron tratadas con benzoato de bencilo, sin mejoría. Al examen físico, el lactante se presentaba desnutrido, con peso de 2.47kg (abajo del percentilo 5 en la curva de seguimiento pondoestatural del prematuro), irritado, lloroso y pálido. En la evaluación dermatológica presentaba cabellos ralos y secos, áreas de hiperqueratosis con fisuras sobre una base eritrodérmica, onicodistrofia e hiperqueratosis palmo-plantar (Fig. 1-3). Un hermano y la madre presentaban lesiones típicas de escabiosis. Fig. 1. Paciente desnutrido con lesiones hiperqueratósicas y cabello escaso. Se indicó internamiento con aislamiento de contacto y medidas generales, vaselina líquida, permetrina 5% y oxacilina endovenosa. El examen microscópico de las escamas reveló gran cantidad de ácaros, vivos y muertos 126 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Fig. 2. Hiperqueratosis con fisuras sobre una base eritrodérmica. Fig. 3. Hiperqueratosis plantar. (Fig. 4). Hubo caída de las escamas, edema periorbitario y adenomegalias generalizadas. Los exámenes de laboratorio mostraron: leucocitos 20 100 (segmentados 22%, monocitos 8.6%, bastones 10%, basófilos 0.3%, linfocitos 35.8% y eosinófilos 21.6%), hematocrito 19.8%, hemoglobina 6.3g/dl,VCM 80.6fL, HCM 25.6pg, RBC 2.5, plaquetas 571 000,VHS 80mm 1ªh, glicemia 121g/dL, proteínas totales 3.5g/dl (VR=6.2-7.9) y albúmina 1.85g/dl (VR=3.54.8), TGO 37.5 y TGP 27.4, fosfatasa alcalina 206, Na+ 145, K+ 4.3, Ca+2 1.29, VDRL: no reactiva, HIV negativo y HTLV I/II negativos. Presentaba también IgA 89.1, IgG1 444, IgG2 164, IgG3 49.3, IgG4 43.6, C3 67 y C4 16.5. Los hemocultivos fueron negativos y la eletroforesis de proteínas fue normal. La radiografía de tórax mostró acentuada desmineralización de estructuras óseas de la parrilla costal y hallazgos compatibles con neumonía. Las ecografías abdominal y de vías urinarias fueron normales. E. Fontenelle, A. D. Figueiredo, A. Moura Discusión Fig. 4. Sarcoptes scabiei identificado al examen microscópico de las escamas. Luego del resultado de los exámenes fue indicada transfusión de concentrado de glóbulos rojos, reposición de albúmina y se inició esquema de vancomicina asociada a cefepime. A pesar de las nuevas medidas, el niño evolucionó con cianosis, dificultad respiratoria, hipoalbuminemia sostenida y paro cardiorrespiratorio que fue rápidamente revertido, siendo colocado en ventilación mecánica y recibiendo infusión de aminas vasoactivas. Se introdujo nuevo esquema antimicrobiano con ciprofloxacina, meropenem y anfotericina B. La evaluación gastroenterológica (alfa1-antitripsina, tránsito intestinal, grasa en materia fecal) no demostró alteraciones que justifiquen la hipoalbuminemia. Luego de 40 días de internamiento en unidad de terapia intensiva (UTI), el lactante presentó mejoría importante recibiendo el alta y pase para sala (Fig. 5). Fig. 5. Evolución favorable del paciente con remisión de las lesiones. La sarna costrosa o sarna noruega fue inicialmente descrita en 1848 por Danielssen y Boeck que consideraron la enfermedad como una forma de lepra endémica en Noruega. En 1951, la etiología fue correctamente atribuida al Sarcoptes scabiei. Debido al país en que fue descubierta, fue llamada sarna noruega. A pesar de que esta denominación es aún comúnmente utilizada, debería ser sustituida, ya que no hay una relación directa con Noruega, siendo el término preferible sarna costrosa1. La forma costrosa de escabiosis es altamente contagiosa ya que hay un gran número de parásitos infestando la epidermis. Se estima que pacientes con la forma clásica de escabiosis tienen menos de 15 Sarcoptes scabiei y es necesario en promedio 15 a 20 minutos de contacto íntimo para la transferencia del ácaro de una persona a otra. Por otro lado, millares de ácaros están presentes en la piel hiperqueratósica y escamosa de los pacientes con sarna costrosa, siendo entonces el diagnóstico precoz de esta entidad crucial para el control de la infestación2. La presencia de esa gran cantidad de Sarcoptes scabiei resulta de una falla de la respuesta inmune del huésped en controlar la proliferación del ácaro en la piel, resultando en una hiperinfestación y reacción inflamatoria e hiperqueratósica concomitante. Dos estudios mostraron relación del antígeno HLAA11 con la susceptibilidad a la escabiosis. Un aumento estadístico en la interleuquina 4 (IL4) fue recientemente demostrado, lo cual puede ser un factor contribuyente en la hiperproliferación cutánea de la sarna costrosa. Fue previamente demostrado que la IL-4 puede estimular la proliferación de los queratinocitos y los niveles de esta interleuquina están elevados en los pacientes con psoriasis, en forma semejante a lo que ocurre en la forma costrosa de escabiosis1. Pacientes con determinadas condiciones o desórdenes están predispuestos a desarrollar una sarna costrosa. Individuos inmunocomprometidos y debilitados como infectados por el Dermatol Pediatr Lat Vol 5 Nº 2, 2007 127 Sarna costrosa en un lactante desnutrido virus de la inmunodeficiencia humana (VIH) y HTLV-I/II, con neoplasias hematológicas, transplantados, pacientes recibiendo corticoterapia prolongada, síndrome de Down y añosos están con riesgo aumentado debido a que su respuesta inmune está debilitada2. Una incapacidad del acto del rascado y de provocar una excoriación en respuesta al prurito puede ser un mecanismo plausible para el aumento de incidencia de la sarna costrosa en pacientes con síndrome de Down y retardo mental, ya que la excoriación ayuda a remover el parásito y a destruir su túnel1. Otra explicación para la ocurrencia de sarna costrosa en algunos pacientes sería la modificación de la respuesta del huésped debido a malnutrición, lo que parece haber ocurrido en el caso descrito. En todo el mundo, la desnutrición es la causa más común de inmunodeficiencia. Ésta afecta a la inmunidad celular, la función leucocitaria, al sistema del complemento, los anticuerpos y la producción de citoquinas. La desnutrición y la infección tienen generalmente una relación recíproca de agravamiento3. Consideramos que la desnutrición proteico-calórica fue la causa de la inmunodeficiencia en el caso reportado. Ésta, juntamente con la exposición al ácaro, culminó en la ocurrencia de la sarna costrosa. El cuadro dermatológico llevó a la aparición de linfadenopatía generalizada, eosinofilia y eritrodermia, que agravó la hipoalbuminemia ya presente por la desnutrición. A pesar de esos factores precipitantes, hay reportes de la forma costrosa de escabiosis ocurriendo en inmunocompetentes4. En cuanto la forma clásica de escabiosis tiene áreas características de compromiso (espacios interdigitales, pliegues, puños, abdomen, axilas, glúteos y mamas), la forma costrosa puede afectar casi todas las áreas del cuerpo4. Las características clínicas de la forma costrosa también difieren de la forma clásica, siendo necesario establecer el diagnóstico diferencial con otras enfermedades como psoriasis, verrugas y dermatitis seborreica, frecuentes en los pacientes con SIDA. Generalmente se presenta clínicamente como placas o nódulos 128 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 costrosos e hiperqueratósicos de distribución acral, afectando principalmente las manos, pies, pabellones auriculares y áreas de trauma. Otras áreas del cuerpo como el rostro, cuello y tronco también pueden estar afectados por lesiones descamativas.Al contrario de la forma clásica, el prurito es menos intenso y las pápulas eritematosas y túneles pueden estar en pequeño número, ausentes u ocultos bajo las espesas costras. En casos generalizados puede haber desarrollo de linfadenopatía e infección secundaria, particularmente por Staphylococcus aureus o Streptococcus pyogenes pudiendo evolucionar a sepsis u otra complicación grave con efecto letal1,5. El diagnóstico de la forma costrosa de escabiosis está basado en los hallazgos clínicos característicos y en la identificación del Sarcoptes scabiei, sus huevos o materia fecal por el examen directo, o a través de la biopsia de piel. Hallazgos de laboratorio como niveles elevados de anticuerpos circulantes tipo IgG, IgA e IgE, así como eosinofilia periférica pueden ayudar al diagnóstico1. El tratamiento de la sarna costrosa consiste en erradicar el ácaro, controlar los síntomas y evitar la infección secundaria. En general, esta forma de escabiosis es resistente a la terapéutica tópica aislada1. El benzoato de bencilo al 25% es un tratamiento tópico efectivo y barato, además de la permetrina al 5% ó el azufre. De gran importancia es la necesidad de precauciones respecto al contacto durante el período de hospitalización. Aplicaciones repetidas de escabicidas son necesarias para erradicar el ácaro. Agentes queratolíticos como el ácido salicílico al 5-10% ó la urea al 40% pueden ser utilizados para facilitar la remoción de la piel hiperqueratósica, posibilitando la penetración del medicamento, con atención al potencial de absorción dependiendo de la extensión de piel afectada por el riesgo de intoxicación. En las afecciones extensas, se deja que durante los baños se haga la remoción de las costras. También se ha utilizado la aplicación tópica semanal de permetrina por seis semanas en el tratamiento de la sarna noruega. El uso de ivermectina ha sido exitoso E. Fontenelle, A. D. Figueiredo, A. Moura en el tratamiento y control de la escabiosis, principalmente de la forma costrosa6. Se indica una dosis inicial de 200ug/kg, la cual debe ser repetida cada una o dos semanas, completando un total de dos o tres dosis2,7. 3. 4. 5. Referencias bibliográficas 1. Guldbakke KK, Khachemoune A. Crusted Scabies: A Clinical Review. J Drugs Dermatol. 2006;5:221-7. 2. Wong SS, Woo PC and Yuen K. Unusual Laboratory Findings in a Case of Norwegian 6. 7. Scabies Provided a Clue to Diagnosis. J Clin Microb. 2005;43:2542-4. Roitt I, Brostoff J, Male D. Imunologia. Ed.Manole, 6ªEd, 2003. Paller AS, Mancini AJ. Hurwitz Clinical Pediatric Dermatology. Elsevier Saunders, 3rd Ed, 2006. Tran L, Siedenberg E, Corbett S. Crusted (Norwegian) Scabies. J Emerg Med. 2002;22:285-7. Elmogy M, Fayed H, Marzok H, Rashad A. Oral ivermectin in the treatment of scabies. Int J Dermatol. 1999;38:926-30. Dunne CL, Malone CJ,Whitworth JA.A field study of the effects of ivermectin on ectoparasites of man.Trans R Soc Trop Med Hyg. 1991;85:550-1. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 129 REPORTE DE CASOS Nocardiosis cutánea primaria, reporte de un caso Margarita Larralde1, Begoña Gomar2, Paula Bosch3, Magdalena Sojo4. 1 Jefa de Dermatología del Hospital Alemán, Profesora adjunta de Dermatología UBA, Directora de la Carrera de Dermatología Pediátrica UBA, Hospital Ramos Mejía, Buenos Aires, Argentina. 2 Becaria de 2do año de la Carrera de Dermatología Pediátrica, Hospital Ramos Mejía, Buenos Aires, Argentina. 3 Médica residente de 3er año, Servicio de Dermatología del Hospital Privado de Córdoba, Alumna del Postgrado en Dermatología de la Universidad Católica de Córdoba, Argentina. 4 Cursante de 3er año de la Carrera de Dermatología Pediátrica, Hospital Ramos Mejía, Buenos Aires, Argentina. Dermatol Pediatr Lat 2007; 5(2): 130-132. Resumen La nocardiosis ocurre principalmente como una infección oportunista en adultos inmunocomprometidos; aunque ha sido reportada en pacientes sanos y en niños. Presentamos el caso de un varón de once años, sano, con lesión cutánea de seis meses de evolución a nivel de miembro inferior derecho y muñeca izquierda, sin tratamiento previo, en cuyo cultivo desarrolló Nocardia. Se inició manejo con trimetropin-sulfametoxazol con excelente evolución a los tres meses de tratamiento. Palabras clave: Nocardia; Niños; Piel. Abstract Nocardiosis occurs mainly as an opportunistic infection in immunosuppressed patients, although it has been reported on healthy patients and children. We report an 11-year-old immunocompetent boy with a 6-month history of skin lesion on the rigth leg and left wrist. Skin biopsy and cultures was performed and Nocardia was isolated.Treatment with trimethoprim- sulfamethoxazole was started, achieving significant improvement within 3 months. Key words: Nocardia; Children; Skin. Introducción Correspondencia Dra. Begoña Gomar Correo electrónico [email protected] Recibido: 25/06/07 Aprobado: 25/07/07 130 La nocardiosis es causada por una bacteria Gram positiva, aerobia, filamentosa, débilmente ácido alcohol resistente, perteneciente al orden de los Actinomicetales; saprófito de la microflora de la tierra1,2. Las especies que pueden infectar humanos son Nocardia asteroides y Nocardia brasiliensis. La primera en la mayoría de los casos muestra compromiso pulmo- nar y sistémico; la segunda se asocia a lesiones cutáneas y linfadenitis3. Este microorganismo es inhalado en partículas de polvo, pudiendo causar infección pulmonar o sistémica. La infección cutánea primaria puede ser producida por inoculación directa o introducción traumática de la Nocardia. Presentamos el caso de un paciente de once años de edad, sano, con lesión cutánea de seis meses de evolución en cuyo cultivo desarrolló Nocardia. M. Larralde, B. Gomar, P. Bosch, M. Sojo Caso clínico Paciente masculino de 11 años de edad, sin antecedentes patológicos personales ni familiares de relevancia.Acude a la consulta de dermatología pediátrica por presentar cuadro de seis meses de evolución caracterizado por lesiones cutáneas a nivel de miembro inferior derecho y muñeca izquierda, sin compromiso del estado general. Las lesiones iniciaron a nivel del tercio inferior de la pierna derecha y aproximadamente en dos meses se extendieron hasta la rodilla. Al examen físico se encontraba en buen estado general, presentaba en la pierna derecha varias placas, que seguían un trayecto lineal ascendente, la de mayor diámetro a nivel de tercio superior de la tibia, eritemato-violáceas, de bordes bien definidos y elevados, induradas, con leve descamación superficial y asintomáticas (Fig. 1). En la rodilla derecha observamos placa eritematosa, con edema y dolor a la palpación, de dos días de evolución y con centro costroso el cual había supurado (Fig. 2); se palparon pequeñas adenopatías en área inguinal derecha, móviles e indoloras. En la muñeca izquierda presentaba dos placas pequeñas, violáceas, induradas y asintomáticas (Fig 3). Fig. 2. Placa eritematosa en rodilla. Fig. 3. Placas violáceas en muñeca izquierda. una pequeña colonia blanco tiza con micelios aéreos de apariencia yesosa, compatible con Nocardia (Fig 4). Se inició terapéutica con trimetoprim-sulfametoxazol, con buena respuesta luego de tres meses de tratamiento. Fig. 1. Nódulos eritematosos de disposición lineal en miembro inferior derecho. Fig.4. Cultivo con crecimiento de colonia blanco tiza, compatible con Nocardia. Se realizaron tres biopsias de piel y se enviaron muestras a microbiología y anatomía patológica. La biopsia reportó dermatitis espongiótica eccematosa sin evidencia de granuloma específico. Microbiología informó la presencia de estructuras filamentosas de tipo arracimado débilmente ácido alcohol resistentes a la coloración de Kinyoun y en el cultivo en medio de Saboraud+Lactrimel sin antibióticos,se desarrolló Discusión La nocardiosis ocurre, en la mayoría de los casos, como una infección oportunista en pacientes inmunocomprometidos, aunque puede verse en pacientes sanos y menos frecuentemente en niños1,4. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 131 Nocardiosis cutánea primaria Se observan tres cuadros clínicos: infección pulmonar, luego de la inhalación de partículas de polvo contaminado; infección cutánea y subcutánea localizada; y una forma diseminada caracterizada por extensión hematógena de los microorganismos a cerebro, ojo, huesos articulaciones, corazón, riñones y otros órganos, incluyendo la piel5. generación. Una mejoría clínica es evidente dentro de los siete a diez días luego del inicio de la terapéutica dependiendo de la localización, extensión y el estado inmune del paciente; las formas cutáneas curan exitosamente en un período que va desde uno a tres meses de tratamiento, necesitando una terapia más prolongada en el caso del micetoma. La nocardiosis cutánea primaria y el síndrome linfocutáneo son más frecuentes en pacientes adultos. La infección en huéspedes sanos es poco frecuente, pero se ha observado un actual incremento en su incidencia, esto podría deberse a una mejoría de los métodos diagnósticos y a un mayor índice de sospecha6. Comunicamos el caso de un niño con una patología cutánea de baja frecuencia en este grupo etario y en pacientes cuya inmunidad no se encuentra alterada. Consideramos que tanto pediatras y dermatólogos deben estar al tanto de esta entidad y de sus diferentes presentaciones clínicas, para así poder sospecharla, diagnosticarla e implementar un tratamiento adecuado temprano, previniendo de esta manera formas diseminadas, acompañadas de una innecesaria morbilidad y un peor pronóstico. La nocardiosis cutánea primaria presenta tres tipos de manifestaciones clínicas diferentes: 1. En la infección cutánea primaria aguda; la lesión es precedida por la inoculación del agente por vía traumática, manifestándose como celulitis, pioderma, pústulas o abscesos localizados, similares clínicamente a lesiones causadas por organismos piógenos comunes. Puede desarrollar un síndrome linfocutáneo, cuadro que imita clínicamente a la esporotricosis7. 2. La nocardiosis cutánea primaria crónica o micetoma, también sigue a la inoculación del actinomiceto en la piel o tejido subcutáneo y podría representar el estadio final de la infección cutánea primaria aguda. La lesión inicial notada por el paciente es generalmente un pequeño nódulo de origen traumático. La lesión se disemina en los tejidos adyacentes profundos o linfocutáneos, aumentando su tamaño y abriéndose hacia la superficie formando tractos sinuosos y causando importante edema. 3. La infección primaria por Nocardia, tanto respiratoria como cutánea, puede diseminarse por vía hematógena y llevar a una forma extrapulmonar de la enfermedad. El trimetoprim-sulfametoxazol (TMP-SMX) es el antibiótico de elección, aunque también se pueden utilizar el imipenem, minociclina, amoxicilina-clavulanato y cefalosporinas de 3ra 132 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Referencias bibliográficas 1. Kumar TS, Scott JX, Viswanathan S, Agarwal I, Raj PM, Lalitha MK. Cervicofacial nocardiosis in an immunocompetent child. Acta Paediatr. 2005;94:1342-3. 2. Benes J,Viechova J, Picha D, Horova B, Zatloukal P. Disseminated Nocardia asteroides infection in an immunocompetent woman following an arm injury. Infection. 2003;31:112-4. 3. Law BJ, Marks MI. Pediatric nocardiosis. Pediatrics. 1982;70:560-5. 4. Woods GL. Susceptibility testing for Mycobacteria. Clin Infect Dis. 2000;31:1209-15. 5. Apisarnthanarak A, Razavi B, Bailey T. Disseminated Nocardia asteroides presenting as pulmonary non-caseating granulomas in a patient with Waldenstrom macroglobulinemia. Infection. 2002;30:38-40. 6. Fergie JE, Purcell K. Nocardiosis in South Texas children. Pediatr Infect Dis J. 2001;20:711-4. 7. Lopes JO, Bassanesi MC, Alves SH, Salla A, Benevenga JP, Castro MS. Cutaneous Nocardia asteroides infection of nontraumatic origin. Rev Inst Med Trop Sao Paulo. 1994;36:403-8. HAGA SU DIAGN STICO ¿Qué síndrome es? Margarita Larralde1, María Eugenia Abad2, María Magdalena Sojo2 1 Jefa del Servicio de Dermatología del Hospital Alemán, Buenos Aires, Argentina. Jefa de la Sección Dermatología Pediátrica del Hospital JM Ramos Mejía, Buenos Aires, Argentina. 2 Médica de la Sección Dermatología Pediátrica del Hospital JM Ramos Mejía, Buenos Aires, Argentina. Dermatol Pediatr Lat 2007; 5(2): 133-135. Presentación de caso clínico Paciente de dos días de vida que es examinado por interconsulta en la Unidad de Cuidados Intensivos Neonatales, donde se encontraba internado por dificultad respiratoria y retardo de crecimiento intrauterino. El niño era producto del primer embarazo de una pareja no consanguínea. El embarazo fue controlado y transcurrió sin complicaciones. Los padres eran sanos, no había historia familiar de enfermedades relevantes. El parto fue vaginal, sin complicaciones. Fue un recién nacido de término. El niño presentó al nacer una placa alopécica con fondo erosionado, de forma triangular, de 3x2cm de diámetro, cubierta parcialmente por una costra negruzca, localizada en el vértex. Dicha lesión se encontraba rodeada por venas con importante dilatación (Fig. 1).Además se constató la presencia de otras tres placas de características similares pero de menor tamaño, localizadas en zona parietal derecha (Fig. 2). El niño presentaba además máculas eritematovioláceas surcadas por algunas telangiectasias en la piel que circunda las lesiones previamente descritas. En tronco y extremidades se podían observar máculas eritematosas con un patrón reticulado (Fig. 3 y 4). Se solicitaron radiografías de cráneo y tórax, y ecografías cerebral y abdominal que fueron Fig. 1. Placa alopécica con fondo erosionado en vértex, rodeada por venas dilatadas. Fig. 2. Placas de características similares en zona parietal derecha. Fig. 3. Máculas eritematosas con un patrón reticulado en abdomen y miembros inferiores. Fig. 4. Máculas eritematosas con patrón reticulado en tronco inferior y pierna izquierda. normales. En el ecocardiograma se constató la presencia de un ductus arterioso persistente e hipertensión pulmonar leve. El resto del examen físico y estudios complementarios fueron normales. ¿Cuál es su diagnóstico? Correspondencia Dra. Margarita Larralde Acevedo 1070 (1828), Banfield Buenos Aires, Argentina Correo electrónico [email protected] Recibido: 05/04/07 Aprobado: 25/05/07 133 ¿Qué síndrome es? Síndrome de ADAMS-OLIVER El síndrome de Adams-Oliver (SAO) fue descrito por primera vez por Adams y Oliver en 1945, quienes reportaron la asociación de aplasia cutis congénita en cuero cabelludo con anomalías transversales de los miembros en tres generaciones de una familia, demostrando un patrón de herencia autosómico dominante con expresividad variable intrafamiliar1. Posteriormente se sucedieron varias publicaciones con casos esporádicos y casos familiares, que se caracterizan por una gran variabilidad tanto intrafamiliar como interfamiliar. La herencia autosómica recesiva también ha sido demostrada2-4. Hasta la actualidad no ha podido ser detectada la alteración genética causante de este cuadro. Las manifestaciones clínicas más características del síndrome son la aplasia cutis y las anomalías distales transversales de los miembros. La aplasia cutis congénita se presenta en aproximadamente el 75% de los pacientes. Las lesiones suelen ser únicas y de gran tamaño, pudiendo llegar a comprometer todo el cuero cabelludo. También pueden presentarse lesiones pequeñas y localizadas en otras regiones del tegumento5. A nivel del cuero cabelludo comprometen más frecuentemente el vértex y el sector parietal6. La aplasia cutis congénita se puede asociar con defectos óseos subyacentes, pudiendo en casos severos manifestarse con acrania7. Las manifestaciones cardiovasculares, que se ven en el 15-20% de los casos, consisten en anomalías de los septum interventricular e interauricular, tetralogía de Fallot, coartación de aorta, válvula aórtica bicúspide, estenosis de venas pulmonares, doble tracto de salida del ventrículo derecho, atresia tricúspide, hipoplasia de ventrículo derecho y ductus arterioso persistente5,6,8,9. El cutis marmorata telangiectásico congénito y la dilatación y tortuosidad de las venas del cuero cabelludo se presentan en el 12-20% de los casos5. 134 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Los defectos distales y transversales de las extremidades son las manifestaciones más frecuentes del síndrome, se presentan en el 84% de los pacientes afectados. En general son asimétricos y más frecuentes en los miembros inferiores, y van desde una hipoplasia ungueal, sindactilia, braquidactilia, polidactilia o ectrodactilia, hasta una ausencia de mano, pie o miembro5. Otras manifestaciones menos frecuentes son: tetillas supernumerarias, criptorquidia, microftalmia, pelo lanoso, paladar hendido, doble sistema colector, hemihipoplasia facial, hipertelorismo, epicantus, hepatoesclerosis, bandas de constricción, malformación arterio-venosa pulmonar y malformaciones del sistema nervioso central5,6,9-11. La patogenia de este síndrome no está aclarada completamente, y el defecto genético subyacente aún no ha sido determinado. Tanto las manifestaciones mayores del SAO, como la presencia de cutis marmorata telangiectásico congénito, dilatación de venas del cuero cabelludo y otras anomalías en los vasos, avalan la “teoría vascular”. Se propone que una interrupción en la irrigación durante la 6a a 8a semana de gestación debido a inestabilidad hemodinámica o a alteraciones estructurales de los vasos de pequeño calibre, sería la responsable de los defectos transversales de los miembros. Recientemente, Patel y cols.12 hallaron en la histopatología de dos pacientes ausencia de pericitos en sectores con dilatación vascular, y aumento de pericitos en sectores de estenosis vascular, sugiriendo que una alteración en los pericitos sería el mecanismo subyacente de la vasculopatía observada en el SAO. Presentamos un paciente con cuatro lesiones de aplasia cutis congénita en cuero cabelludo, asociadas a cutis marmorata telangiectásico congénito, dilatación de venas del cuero cabelludo, ductus arterioso persistente e hipertensión pulmonar, sin antecedentes familiares positivos para SAO. El manejo multidisciplinario de este síndrome, los estudios complementarios para descartar defectos asociados y el asesoramiento genético son de importancia en el abordaje de este cuadro. M. Larralde, M. Abad, M. Sojo Referencias bibliográficas 1. Adams FH, Oliver CP. Hereditary deformities in man due to arrested developement. J Hered. 1945;36:3-7. 2. Klinger G, Merlob P. Adams-Oliver syndrome: autosomal recessive inheritance and new phenotyic-antropometric findings. Am J Med Genet. 1998;79:197-9. 3. Tekin M, Bodurtha J, Ciftçi E, Arsan S. Further family with possible autosomal recessive inheritance of Adams-Oliver syndrome. Am J Med Genet. 1999;86:90-1. 4. Ünay B, Sarici SU, Gül D,Akin R, Gökçay E.AdamsOliver syndrome: further evidence for autosomal recessive inheritance. Clin Dysmorphol. 2001;10:223-5. 5. AL-Sanna´a N, Adatia I, Teebi A. Transverse limb defects associated with aorto-pulmonary vascular abnormalities: vascular disruption sequence or atypical presentation of Adams-Oliver syndrome? Am J Med Genet. 2000;94:400-4. 6. Pousti TJ, Bartlett RA. Adams-Oliver syndrome: genetics and associated anomalies of cutis aplasia. Plast Reconstr Surg. 1997;100:1491-6. 7. Chitayat D, Meunier C, Hodgkinson K, Robb L, Azouz M. Acrania: a manifestation of the AdamsOliver syndrome.Am J Med Genet. 1992;44:562-6. 8. Sankhyan N, Kaushal RK, Jaswal RS. Adams-Oliver syndrome: a case with complete expression. J Dermatol. 2006;33:435-6. 9. Pouessel G, Dieux-Coeslier A,Wacrenier A, Fabre M, Gottrand F. Association of Adams-Oliver syndrome and hepatoportal sclerosis: an additional case. Am J Med Genet A. 2006;140:1028-9. 10. Maniscalco M, Zedda A, Faraone S, de Laurentiis G, Verde R, Molese V, et al. Association of AdamsOliver syndrome with pulmonary arterio-venous malformation in the same family: a further support to the vascular hypothesis. Am J Med Genet. 2005;136A:269-74. 11. Savarirayan R, Thompson EM, Abbott KJ, Moore MH. Cerebral cortical dysplasia and digital constriction rings in Adams-Oliver syndrome. Am J Med Genet. 1999;86:15-9. 12. Patel MS,Taylor GP, Bharya S,AL-Sanna´a N,Adatia I, Chitayat D, et al. Abnormal pericyte recruitment as a cause for pulmonary hypertension in AdamsOliver syndrome. Am J Med Genet. 2004;129A:294-9. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 135 CORRELATO CLŒNICO PATOL GICO Placa equimótica indurada, con hipertricosis y sudoración Rosalía Ballona1 Jefa del Servicio de Dermatología, Instituto de Salud del Niño, Perú. 1 Dermatol Pediatr Lat 2007; 5(2): 138-140. Presentación de caso Lactante varón de un mes y diez días de vida, producto de tercera gestación, con control prenatal adecuado, nace por cesárea (iterativa), peso adecuado para la edad gestacional, Apgar 9-9; sin traumatismos al nacer; portador de comunicación interventricular. gioendotelioma kaposiforme (HK). Los resultados de laboratorio muestran hemoglobina de 8.4mg/dl y plaquetas en valores normales. Presenta lesión equimótica que compromete desde línea media clavicular derecha hasta columna vertebral del mismo lado, de 20x10cm, coincidente con trauma leve (roce con el cuerpo de hermano de dos años) (Fig. 1). Fig. 2. Evolución de la lesión con acentuación del color. En el estudio histopatológico se observa una proliferación vascular hasta planos profundos, con tendencia a adoptar un patrón lobulillar (Fig. 3) y que a mayor aumento se evidencia que son glomeruloides; la luz vascular es estrecha con células endoteliales aplanadas, hay escaso colágeno circundante, no hay componente inflamatorio y no se visualiza atipia (Fig. 4). Correspondencia Dra. Rosalía Ballona Instituto de Salud del Niño Av. Brasil 600 Breña Lima, Perú Correo electrónico [email protected] Recibido: 24/04/07 Aprobado: 14/06/07 136 Fig. 1. Placa equimótica en espalda. La lesión evoluciona con aumento de tamaño y consistencia, además de acentuación de color a violáceo intenso, sin causarle molestias (Fig. 2). Se considera el diagnóstico clínico de heman- Un mes después de la biopsia y sin ningún tipo de tratamiento, la lesión empieza a involucionar en forma rápida y progresiva: pierde totalmente la coloración, se mantiene la consistencia indurada y aparece en esa zona una importante hipertricosis evidenciándose además R. Ballona y la clínica residual (hipertricosis y sudoración) con los hallazgos histopatológicos, llegamos al diagnóstico final de hemangioma en penacho o angioma “tufted”. Discusión Fig. 3. Proliferación vascular lobulillar hasta planos profundos. H/E 10X. Fig. 4. Numerosos canales vasculares estrechos. H/E 40X. sudoración intensa permanente. En dos oportunidades en presencia de fiebre por procesos virales, se evidencia reaparición del color violáceo en la zona afectada (Fig. 5). Haciendo el correlato de los hallazgos de involución espontánea con reactivación posterior El angioma “tufted” (TA) o hemangioma en penacho es una rara proliferación angiomatosa cutánea benigna que se presenta con mayor frecuencia en los primeros años de vida1, 2. Fue descrito por primera vez como tal en 1989 por Wilson-Jones y Orkin, aunque lesiones idénticas fueron reportadas previamente como angioblastomas en 1949 por Nakagawa2 y como hemangiomas capilarmente progresivos en 19713. El 50% de casos se presenta antes de los cinco años de vida y aproximadamente el 15% son congénitos4, raramente puede presentarse en la edad adulta5. Clínicamente las lesiones pueden ser máculas, pápulas o placas de color piel normal, eritematosas, eritemato-violáceas o parduzcas, infiltradas y de localización frecuente en cuello, zona escapular y hombros, pero puede ocurrir también compromiso de extremidades2. Se asocia con aumento local de la temperatura, hiperhidrosis e hipertricosis (lanugo o vellos) y ocasionalmente a dolor 4. Son de crecimiento lento y progresivo, pueden involucionar en años, sin embargo el color oscuro persistente en la zona afectada asociado a fastidio es característico de TA6. El fenómeno de Kasabach Merrit (KM) puede presentarse en el TA como una complicación importante7, aunque en la mayoría de casos no son coagulopáticos8. La histopatología del TA es clásica, son característicos los lóbulos de capilares que comprometen la dermis pudiendo llegar hasta tejido celular subcutáneo; y la luz vascular estrecha con células endoteliales fusiformes aplanadas. Existe colágeno normal que rodea a los lóbulos dando aspecto de “bala de cañón”, en ausencia de infiltrado inflamatorio y atipia celular2. En el caso reportado, la forma de inicio y las características de la lesión sugirieron el diagnós- Fig. 5. Reaparición de lesiones secundarias a fiebre. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 137 Placa equimótica indurada, con hipertricosis y sudoración tico de HK; éste compromete preferentemente tronco, cursa con evolución rápida y benigna excepto cuando la localización es retroperitoneal y mediastinal que puede comprometer órganos vitales y se asocia con el fenómeno de KM8. Lo destacable del presente caso fue el buen estado general del niño y la anemia leve que no guardaba relación con la expresión de la lesión. del TA a mayor coalescencia de sus lóbulos se acerca más a HK. El uso de anticuerpo monoclonal D2-40 como marcador selectivo de endotelio linfático está permitiendo diferenciar hemangiomas capilares,TA y HK9. Estas dificultades en el diagnóstico han sido observadas con estas lesiones llegándose a la propuesta, cada vez más aceptada y demostrada, desde el punto de vista histopatológico, que ambos cuadros pertenecen al espectro de una misma entidad10. El TA está representado por múltiples lóbulos celulares que ocupan todo el espesor de la dermis y se extienden al tejido celular subcutáneo. Cada lóbulo está constituido por células endoteliales que se disponen formando remolinos concéntricos (aspecto en penacho) con colágeno circundante, mientras que el HK está compuesto de grandes nódulos bien definidos, coalescentes que contienen células fusiformes balonadas en fascículos; aparentan una luz central con microtrombos, y pueden infiltrar libremente las fibras de colágeno y el tejido adiposo11, lo que sugiere que TA y HK no son entidades independientes y que la histopatología representa patrones de crecimiento y transición en el desarrollo de la misma entidad. El HK es la consecuencia de la coalescencia de los lóbulos del TA9-11. Se han reportado hallazgos histopatológicos de estas dos entidades en la lesión de un paciente en diferentes momentos de su evolución11. Otras sugerencias son que TA es una variante de HK, o que puede ser la forma leve de HK11,12. 1. Wilson-Jones E. Malignant vascular tumours. Clin Exp Dermatol. 1976;1:287-312. 2. Wilson-Jones E, Orkin M. Tufted angioma (angioblastoma). J Am Acad Dermatol. 1989;20:214-25. 3. Macmillan A, Champion RH. Progressive capillary haemangioma Br J Dermatol. 1971;85:492-3. 4. Heagerty AH, Rubin A, Robinson TW. Familial tufted angioma. Clin Exp Dermatol. 1992;17:344-5. 5. Hebeda CL, Scheffer E, Starnink TM. Tufted angioma of late onset. Histophatlogy. 1993;23:191-3. 6. Mahendran R,White SI, Clark AH, Sheehan-Dare R. Response of childhood tufted angioma to the pulsed-dye laser. J Am Acad Dermatol. 2002;47:620-2. 7. Enjolras O,Wassef M, Mazoyer E, et al. Infants with Kasabach- Merritt syndrome do not have 'true' hemangiomas. J Pediatr. 1997;130:631-40. 8. Gruman A, Liang MG, Mulliken JB, Fishman SJ, Burrows PE, Kozakewich HP, et al. Kaposiform hemangioendothelioma without Kasabach-Merritt phenomenon. J Am Acad Dermatol. 2005;52:616-22. 9. Arai E, Kuramochi A, Tsuchida T, Tsuneyoshi M, Kage M, Fukunaga M, et al. Usefulness of D2 40 immunohistochemistry for differentiation between kaposiform hemangioendothelioma and tufted angioma. J Cutan Pathol. 2006;33:492-7. 10. Brasanac D, Janic D, Boricic I, Jovanovic N, Dokmanovic L. Retroperitoneal kaposiform hemangioendothelioma with tufted angioma-like features in an infant with Kasabach-Merritt syndrome. Pathology International. 2003;53:627-31. 11. Northa PE,Wanerd M, Buckmillerb L, James Ch A, Mihm MC Jr.Vascular tumors of infancy and childhood: beyond capillary hemangioma. Cardiovascular Pathology. 2006;15:303-17. 12. Enjolras O, Mulliken JB, Wassef M, et al. Residual lesions after Kasabach-Merritt phenomenon in 41 patients. J Am Acad Dermatol. 2000;42:225-35. 13. McKenna KE, McCusker G. Spontaneous regression of a tufted angioma. Clin Exp Dermatol. 2000;25(8):656-8. 14. Browning J, Frieden I, Baselga E, Wagner A, Metry D. Congenital, self-regressing tufted angioma. Arch Dermatol. 2006;142(6):749-51. 15. Ishikawa K, Hatano Y, Ichikawa H, Hashimoto H, Fujiwara S. The spontaneous regression of tufted angioma. A case of regression after two recurrences and a review of 27 cases reported in the literature. Dermatology. 2005;210(4):346-8. La evolución del TA con regresión completa y sin tratamiento ha sido descrita en población infantil13, así como presentación congénita con involución espontánea y sin secuelas14. La evolución clínica similar a la de nuestro paciente (dos recurrencias) puede ocurrir hasta en el 86% de casos en tiempo variable15. La finalidad de esta presentación es apreciar que estas dos entidades,TA y HK, pertenecen al mismo espectro y que en la histopatologia 138 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Referencias bibliográficas TERAP UTICA Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt María Rosa Cordisco1, Alejandro Olivera1, Agustina Lanoël1, Paola Stefano1, Aurora Feliu Torres2, Gabriela Sciuccati2, Patricia Bellani3, Daniel Wright3, Julio Goldberg4, Adrián Martín Pierini1. 1 Servicio de Dermatología, Hospital Nacional de Pediatría Juan P. Garrahan, Buenos Aires, Argentina. 2 Servicio de Hematología, Hospital Nacional de Pediatría Juan P. Garrahan, Buenos Aires, Argentina. 3 Servicio de Neonatología, Hospital Nacional de Pediatría Juan P. Garrahan, Buenos Aires, Argentina. 4 Servicio de Anatomía Patológica, Hospital Nacional de Pediatría Juan P. Garrahan, Buenos Aires, Argentina. Dermatol Pediatr Lat 2007; 5(2): 139-146. Resumen El fenómeno de Kasabach-Merrit (FKM) es una coagulopatía por consumo que se presenta en las primeras semanas de la vida. Se caracteriza por presentar coagulopatía por consumo, con trombocitopenia y anemia hemolítica microangiopática, asociado a un tumor vascular. El objetivo de este trabajo es presentar tres pacientes con tumores vasculares que manifestaron FKM y fueron tratados con vincristina como droga de segunda línea, atendidos en el Servicio de Dermatología del Hospital de Pediatría J. P. Garrahan. Dos pacientes presentaron el tumor al nacimiento y otro a partir de los dos meses de vida. Dos fueron niñas y uno varón.Todos los pacientes tenían una trombocitopenia severa (3 000/mm_), bajos niveles de fibrinógeno y dimero D elevado. Los tumores estaban localizados en región proximal de miembro inferior, tronco y miembro superior, y región cervical. Ninguno de nuestros pacientes tuvo compromiso de órganos internos. El diagnóstico histológico en dos de ellos fue de hemangioendotelioma kaposiforme (HEK). Los corticoides fueron el tratamiento de primera linea: metilprednisona 3mg/kg/día por vía oral. En un paciente el tumor continuó creciendo a pesar de haber asociado interferón alfa 2 a la corticoterapia y realizarle secundariamente una embolización. Dada la falta de respuesta clínica y hematológica, se decidió iniciar tratamiento con vincristina 1mg/m2/dosis/IV semanal. Todos los pacientes normalizaron los parámetros hematológicos, con franca mejoría clínica, dos pacientes a la quinta y otro a la sexta dosis de vincristina, con involución gradual del tamaño del tumor. Ninguno de los pacientes presentó complicaciones secundarias al tratamiento ni recidivas de su enfermedad a la fecha. La duración promedio de tratamiento fue de 35±6 días. Podemos concluir que el uso de vincristina es considerado en la actualidad una droga de segunda línea en el tratamiento de tumores vasculares con FKM. Palabras clave: Fenómeno de Kasabach-Merritt; Tumor vascular; Hemangioendothelioma Kaposiforme; Vincristina. Abstract Kasabach-Merritt phenomenon (KMP) is a consumptive coagulopathy that typicallly presents in the first few weeks of life. It is characterized by a triad of vascular tumor, thrombocytopenia and coagulopathy. We reviewed the clinical and hematologic data and response to therapeutic with vincristine in three patients who had a vascular tumor and KMP at the Dermatology Department of Hospital de Pediatría J. P. Garrahan. Correspondencia Dra. María Rosa Cordisco Hospital de Pediatría Prof. Dr. J.P. Garrahan Buenos Aires, Argentina Correo electrónico: [email protected] Recibido: 02/07/07 Aprobado: 10/08/07 139 Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt Tumors were present at birth in two patients and in one at two months old. Two were girls and one was a boy. All patients had severe thrombocytopenia (Lowest platelets count 3 000/mm_), consumption of fibrinogen and lower D-dimer levels.Tumors were localized on proximal lower limb, trunk and upper limb and cervical area. None of our patients had internal involvement. Histopathology finding in two of them was kaposiform hemangioendothelioma. First line of treatment was prednisolone 3-5mg/kg/day. In one patient the tumor size continued to increase in spite of simultaneous treatment with corticosteroid and interferon alfa-2a plus embolization. After corticosteroids treatment failure, correction of coagulopathy and tumor regression occurred in our three patients after 5 to 6 doses of vincristine 0.5-1mg/m_ IV weekly with almost complete tumor regression and correction of coagulopathy.The average duration of treatment was 35±6days. None of the patients developed complications due to this intervention nor experienced recurrence of the tumor. The use of vincristine is currently a second line treatment of vascular tumors with KMP. Key words: Kasabach-Merritt phenomenon; Vascular tumor; Kaposiform hemangioendothelioma; Vincristine. Introducción El fenómeno de Kasabach-Merritt (FKM) es un fenómeno biológico caracterizado por la presencia de un tumor vascular asociado a trombocitopenia severa y anemia hemolítica microangiopática, que conlleva al desarrollo de una coagulopatía por consumo. Este fenómeno está asociado con una alta tasa de morbi-mortalidad del 20-30%1,2. Más del 80% de los casos se desarrollan en el primer año de vida y en el 50% al nacimiento1,2. Kasabach y Merrit describieron en 1949 el primer caso de un infante con una masa congénita de rápido crecimiento asociada con trombocitopenia, púpura, anemia hemolítica y coagulopatía; estos autores consideraron que se trataba de un hemangioma capilar, por lo cual durante muchísimos años se interpretó el FKM como una complicación de los “grandes hemangiomas infantiles”. Sin embargo, en 1997 Enjolras y cols. y Sarkar y cols.1,2 reconocieron que el FKM no era una complicación de los hemangiomas de la infancia sino de otros tumores vasculares como el hemangioendotelioma kaposiforme (HEK) y el angioma “tufted”. Existen dos objetivos terapéuticos: en primer lugar, el control de la coagulopatía y trombocitopenia y, por otro lado, la erradicación del tumor. Numerosos regímenes terapéuticos han sido ensayados con resultados inconstantes. La elección de las distintas modalidades 140 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 terapéuticas es empírica y ningún tratamiento es universalmente beneficioso, debiendo adecuarse a cada paciente y situación clínica3. Varias alternativas terapéuticas han sido utilizadas, sin una clara evidencia de la superioridad entre una u otra, debido al escaso número de pacientes y a la necesidad de utilizar diferentes terapéuticas dado la alta tasa de mortalidad de esta patología4. Agentes antifibrinolíticos2, inhibidores de la agregación plaquetaria5, radioterapia6,7, cirugía8,9, embolización2-10, corticoides sistémicos11,12, interferón alfa 2a13,14 y agentes quimioterápicos, incluyendo vincristina15, han sido utilizados. El objetivo de nuestro trabajo es evaluar los hallazgos clínicos, estudios por imágenes, de laboratorio e histopatología de los pacientes que presentaron tumores vasculares con FKM y requirieron tratamiento con vincristina en el Hospital Nacional de Pediatría Juan P. Garrahan, Buenos Aires, Argentina. Casos clínicos Caso clínico 1. Niña, recién nacida de término y peso adecuado para edad gestacional, que ingresa a los 25 días de vida por una tumoración presente desde el nacimiento, con aumento de tamaño y consistencia, de superficie lisa y brillante, tensa, abollonada, con extensos fenómenos hemorragíparos, que comprometía muslo hasta región perineal y M. Cordisco, A. Olivera, A. Lanoël, P. Stefano, A. F. Torres, G. Sciuccati, P. Bellani, D. Wright, J. Goldberg, A. Pierini. vulva (Fig. 1). Al ingreso presentaba como parámetros de laboratorio: hemoglobina 5.5g/dl, recuento plaquetario 3 000/mm3, tiempo de protrombina 38%, KPTT 136 segundos, fibrinógeno 46mg/dl y dímero D 64ug/ml. La ecografía cerebral y abdominal, el ecocardiograma y el fondo de ojo fueron normales. La RMI evidenció una formación heterogénea que invadía en forma local al tejido celular subcutáneo y el músculo (Fig. 2 y 3). Requirió numerosas transfusiones de plaquetas, crioprecipitados y concentrado de facto- res. Comenzó tratamiento con metilprednisona 3mg/kg/día por vía oral. A los siete días de tratamiento, debido a la presencia de sepsis por estafilococo dorado y empeoramiento de su coagulopatía, comienza con interferón alfa 2a 3 000 000U/m2/dosis por vía endovenosa, cumpliendo 90 días de tratamiento. La paciente desarrolló insuficiencia cardíaca congestiva, decidiéndose realizar embolización del tumor. Dada la escasa respuesta al tratamiento instaurado, se inicia vincristina 1mg/m2/dosis semanal por vía endovenosa. Requirió seis dosis para mejorar su coagulopatía, con disminución gradual de la tumoración durante el tratamiento y continuó haciéndolo luego del mismo. Actualmente, presenta tumor residual que compromete porción del muslo afectado (Fig. 4), confirmado por imágenes, pero no ha vuelto a presentar signos de coagulopatía a la fecha. No presentó ningún efecto adverso referido a la medicación. Fig. 1. Caso 1 (pre-tratamiento): tumor de superficie lisa y brillante, duro, con fenómenos hemorragíparos alrededor del mismo. Fig. 4. Caso 1 (post-tratamiento): Tumor disminuido de tamaño, con zonas de ulceración y púrpura de bordes netos circundando a la lesión. Fig. 2. RMI T1 coronal sin contraste.Tumor hipointenso. Fig. 3. RMI T1 coronal con contraste. Realce heterogéneo, áreas focales con imágenes de mayor vascularización y otras focales quísticas. Caso clínico 2. Niña, producto de embarazo no controlado, recién nacida de término y peso adecuado para edad gestacional, que ingresa a las 48 horas de vida por presentar una tumoración congénita cervico-facial derecha, rojoviolácea, de bordes netos y consistencia dura, que se extiende hacia mejilla derecha por delante y región occipital por detrás (Fig. 5). Además, presentaba ictericia generalizada y palidez marcada de mucosas. Hallazgos de laboratorio al ingreso: hemoglobina 7g/dl, recuento de plaquetas 5 000/mm3, tiempo de protrombi- Dermatol Pediatr Lat Vol 5 Nº 2, 2007 141 Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt na 60%, KPTT 42 segundos, fibrinógeno 56mg/dl, dímero D 4ug/ml. Ecografía cerebral, abdominal, ecocardiograma y fondo de ojo fueron normales. La RMI informó una formación heterogénea, con numerosas estructuras con vacío de señal por flujo en su interior, que reforzaban con contraste, y otras con señal intermedia. Dado el estado crítico de la paciente no se realizó estudio histológico de la lesión hasta finalizado el tratamiento, que posteriormente confirmó el diagnóstico de HEK. Fig. 6. Caso 2 (post-tratamiento): Tumor, de menores dimensiones, blando y con leve eritema en superficie. Fig. 5. Caso 2 (pre-tratamiento): Tumor rojo-violáceo, de bordes imprecisos y consistencia dura. Inició tratamiento desde el ingreso con metilprednisona 3mg/kg/día por vía oral, además de soporte con transfusiones de plaquetas y crioprecipitados.A los ocho días, debido al deterioro clínico de la niña por la presencia de celulitis y progresión de la coagulopatía, se decide comenzar con vincristina 1mg/m2/dosis semanal por vía endovenosa. La paciente requirió cinco dosis de vincristina, con las cuales resolvió completamente su coagulopatía y disminución franca de la tumoración, pero con persistencia de la misma hasta la fecha (Fig. 6). No presentó efectos adversos relacionados con la medicación utilizada ni recidiva de la coagulopatía. Caso clínico 3. Niño, segundo gemelar, sin antecedentes perinatológicos de relevancia, que presenta desde los dos meses de vida una mácula eritematosa a nivel del hombro sobre cicatriz de vacunación con BCG. Requirió dos internamientos previos por tumefacción de dicha lesión, interpretándose el cuadro como 142 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 celulitis versus becegeítis, recibiendo antibióticos por vía parenteral y descartando tuberculosis por catastro y cultivo de la lesión. A la edad de seis meses, comienza en forma repentina con aumento de tamaño y consistencia de la lesión, formando una tumoración eritemato-violácea, indurada por sectores, que se extendía desde el brazo derecho con compromiso del hombro y axila hasta el pectoral homolateral, e inmovilización del miembro afectado (Fig. 7). Datos del laboratorio al ingreso: hemoglobina 7g/dl, recuento de plaquetas 16 000/mm3, tiempo de protrombina 54%, KPTT 70seg, fibrinógeno 87mg/dl, dímero D 64ug/ml. La ecografía abdominal y cerebral, el ecocardiograma y el fondo de ojo fueron normales. Se realizó RMI que evidenció una formación que comprometía partes blandas y músculo. La biopsia confirmó el diagnóstico de HEK. Fig. 7. Caso 3 (pre-tratamiento): Tumor eritemato-violáceo, indurado por sectores, con inmovilización del miembro afectado. M. Cordisco, A. Olivera, A. Lanoël, P. Stefano, A. F. Torres, G. Sciuccati, P. Bellani, D. Wright, J. Goldberg, A. Pierini. Requirió transfusiones de plaquetas y crioprecipitados, iniciando tratamiento con metilprednisona 3mg/kg/día por vía oral, presentando mejoría clínica y aumento progresivo del recuento plaquetario a los dos días de tratamiento. Sin embargo, a los 12 días de iniciado el tratamiento con corticoides, presenta expansión del tumor y nuevos signos de coagulopatía por consumo, motivo por el cual comienza tratamiento con droga de segunda línea: vincristina 1mg/m2/dosis semanal por vía endovenosa. El paciente presentó disminución paulatina del tamaño del tumor y resolución de su complicación hematológica al término de la quinta dosis. Completó en total siete pulsos de vincristina y actualmente se encuentra en seguimiento, sin signos de coagulopatía, con persistencia de mínima lesión tumoral limitada a la región axilar (Fig. 8). Todos nuestros pacientes presentaron el tumor vascular antes de los dos meses de vida. Dos eran de sexo femenino y uno masculino. Los tumores comprometían la región cervicofacial, cintura escapular y pelviana, con afección Fig. 8. Caso 3 (post-tratamiento): Tumor, de menores dimensiones, con eritema violáceo por sectores y recuperación de la movilidad del miembro afectado. del miembro correspondiente. Ninguno presentó compromiso de órganos internos. Dos de ellos desarrollaron la coagulopatía asociada desde el nacimiento y otro a los seis meses de vida. Se realizó estudio histopatológico a dos de los pacientes, uno durante el FKM y otro en forma diferida dado el estado crítico del paciente. El diagnóstico en ambos fue de HEK (Tabla 1, Fig. 9 y 10). Fig. 9. En dermis profunda se observa una proliferación de células que delimitan luces vasculares, adoptando una forma lobular. H/E 40X. Fig. 10. Células de aspecto fusiforme dispuestas en paralelo que delimitan luces vasculares estrechas, con eritrocitos en su interior. H/E 100X. Tabla 1. Datos clínicos e histológicos, pacientes con tumores vasculares con fenómeno de Kasabach-Merritt. Caso Sexo 1 2 3 Femenino Femenino Masculino Edad de aparición del TV1 Nacimiento Nacimiento Dos meses Localización del TV Muslo Cervico-facial Hombro, axila y brazo Edad de inicio del FKM2 20 días 2 días 6 meses Diagnóstico histológico HEK3 HEK 1 TV: tumor vascular 2 FKM: fenómeno de Kasabach-Merritt 3 HEK: hemangioendotelioma kaposiforme. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 143 Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt El recuento de plaquetas previo al inicio del tratamiento con vincristina fue de 12000 a 13000/mm3; el promedio de fibrinógeno 88mg/dl (rango entre 78 y 101) y lo tres pacientes presentaban dímero D elevado. Se realizó RMI a los tres pacientes, todos presentaron como hallazgos compartidos una formación con compromiso difuso de partes blandas, isointensa al músculo en T1 e hiperintensa en T2. Los tres pacientes comenzaron tratamiento como droga de primera línea con metilprednisona a 3mg/kg/día por vía oral. Dada la falta de respuesta clínica y hematológica, se decidió iniciar tratamiento con vincristina a 1mg/m2/dosis semanal por vía endovenosa. Uno de ellos, previo a la incorporación de esta droga, requirió interferón alfa 2a y embolización del tumor. La duración promedio del tratamiento fue 35±6 días. Esto corresponde a respuesta terapéutica en un paciente a la sexta dosis de vincristina y otros dos a la quinta dosis (Fig. 11). Los tres pacientes presentaron una evidente disminución del tamaño del tumor durante el 250000 Caso 1 Caso 2 Caso 3 Recuento plaquetario 200000 150000 100000 50000 0 Inicio 1º 2º 3º 4º 5º 6º Semana de tratamiento con vincristina Fig. 11. Recuperación del recuento plaquetario según dosis de vincristina recibidas. tratamiento con vincristina, que no pudo conseguirse con los anteriores tratamientos recibidos, y persistió la involución gradual durante sus controles. La recuperación del recuento plaquetario por encima de 20000/mm3 (plaquetopenia severa) fue de tres semanas para los tres pacientes y por encima de 150000/mm3 (límite inferior normal) fue de seis semanas para un paciente y cuatro semanas para los otros dos (Tabla 2). El tiempo de seguimiento de los pacientes desde que comenzaron tratamiento con vincristina fue entre 14 y 29 meses. Ningún paciente presentó complicaciones secundarias al tratamiento ni recidivas de su enfermedad a la fecha. Discusión Dada la multiplicidad de tratamientos utilizados para el FKM y la ausencia de clara evidencia de utilidad de uno frente a otro, el tratamiento de éste se basa en la prueba terapéutica de un agente y si no se obtienen resultados, rotar a otro16. Sin lugar a dudas, todos estos pacientes requieren internamiento inmediato necesitando en muchos casos reposición de plaquetas, glóbulos rojos, concentrado de factores y/o crioprecipitados destinados a corregir las alteraciones hematológicas que ponen en peligro la vida del paciente. Los corticoesteroides son utilizados como droga de primera línea de tratamiento médico seguido o en combinación con antiagregantes plaquetarios y/o interferón alfa 2a. Sin embar- Tabla 2. Evolución y tiempo de respuesta clínica y hematológica, pacientes con tumores vasculares con fenómeno de Kasabach-Merritt tratados con vincristina. Caso 1 2 3 144 Disminución de la lesión durante y al final del trtamiento Sí Sí Sí Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Persistencia de lesiones al final del tratamiento 29 meses 14 meses 15 meses Recuento plaquetario inicial 3 000/mm3 5 000/mm3 16 000/mm3 Recuperación (semanas) >20 000 >150 000 3 3 3 6 4 4 M. Cordisco, A. Olivera, A. Lanoël, P. Stefano, A. F. Torres, G. Sciuccati, P. Bellani, D. Wright, J. Goldberg, A. Pierini. go, debido a las complicaciones neurológicas relacionadas al interferón, el uso de otros agentes terapéuticos como la vincristina y otros quimioterápicos están ganando terreno, para lograr frenar el crecimiento tumoral14. Es lógico que tumores con rápido crecimiento con actividad angiogénica acelerada respondan a la quimioterapia, especialmente aquellos considerados como tumores de bajo grado de malignidad como el HEK17. Así, se ha utilizado como monodrogra ciclofosfamida18 y en combinación con otros vincristina, actinomicina y ciclofosfamida19. Hasta el año 2002, existían publicaciones aisladas respecto al uso de vincristina en FKM20-22. Pero ese mismo año, Haisley-Royster y cols.15 publicaron una revisión multicéntrica de 15 pacientes con FKM tratados con vincristina, presentándola como una posibilidad terapéutica de relativa eficacia, sin bien, hacen falta estudios prospectivos para validarlo. En nuestro estudio hemos podido destacar que el diagnóstico histopatológico de las biopsias quirúrgicas realizadas en dos de nuestros pacientes fue de HEK, y no verdaderos hemangiomas de la infancia1,2. Sus características clínicas también nos permiten diferenciar estos dos tumores vasculares. Los HEK son congénitos y se encuentran presentes al nacimiento17. Son tumores de mayor consistencia y la piel que comprometen se torna purpúrica y edematosa. Tienen un crecimiento rápido, de semanas a escasos meses y predilección por tronco, extremidades y retroperitoneo23,24. Si bien ninguno de nuestros pacientes presentó compromiso interno, al igual que otras publicaciones1, todos presentaron los aspectos señalados para este tipo de tumor. Consumo de factores de la coagulación con moderada plaquetopenia suele ser también una complicación de las malformaciones venosas o venolinfáticas de bajo flujo25,26.También se han publicado algunos casos de hemangiomas congénitos rápidamente involutivos (RICH) asociado a trombocitopenia, bajos niveles de fibrinógeno y dímero D elevados, aunque estas alteraciones resuelven espontáneamente sin tratamiento27,28. En la actualidad, sabemos que el HEK y no los hemangiomas de la infancia son los que desarrollan FKM1,2,29, el cual está caracterizado por la presencia de una trombocitopenia severa (<20 000/mm3)1,2,4, disminución del fibrinógeno y aumento de los niveles de dímero D. Todos nuestros pacientes presentaron trombocitopenia severa asociada a consumo de factores, previo al inicio del tratamiento. El HEK también puede ser distinguido de los hemangiomas de la infancia por sus características de patrón de crecimiento infiltrativo, endotelio ahusado o fusiforme, microtrombos y presencia de hemosiderina17. Este tumor vascular presenta semejanzas histológicas con el angioma “tufted” en asociación con vasos simil-linfáticos, y se ha llegado a postular que forman parte de un mismo espectro de tumores vasculares1,2,30. Considerándose en la actualidad que HEK y el angioma “tufted” son los tumores en los cuales se desarrolla el FKM. La vincristina fue utilizada en nuestro trabajo como droga de segunda línea de tratamiento en pacientes no respondedores a los corticoesteroides. En coincidencia con el estudio de Haisley-Royster y cols.15, el uso de vincristina permitió arribar a la normalización del recuento plaquetario en todos los pacientes y resolución definitiva de la coagulopatía por consumo, sin evidencias a la fecha de recidivas.A la vez, si bien se evidenció una disminución de la tumoración en todos los pacientes durante el tratamiento, y aún después de la finalización de los pulsos del mismo, la respuesta clínica fue más lenta en comparación con la respuesta hematológica. La droga fue bien tolerada por todos los pacientes, sin manifestación de efectos adversos. Por todo lo expuesto, aportamos tres casos nuevos de tumores vasculares que manifestaron FKM y fueron tratados con vincristina de manera exitosa, complementando los estudios ya realizados. Queda pendiente la posibilidad de nuevos trabajos prospectivos que avalen en forma definitiva nuestros hallazgos. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 145 Tratamiento con vincristina de tres tumores vasculares con fenómeno de Kasabach-Merritt Referencias bibliográficas 1. Sarkar M, Mulliken JB, Kozakewich HP, Robertson RL, Burrows PE. Thrombocytopenic coagulopathy (Kasabach-Merritt phenomenon) is associated with Kaposiform hemangioendothelioma and not with common infantile hemangioma. Plast Reconstr Surg. 1997;100(6):1377-86. 2. Enjolras O, Wassef M, Mazoyer E, Frieden IJ, Rieu PN, Drouet L, et al. Infants with Kasabach-Merritt syndrome do not have "true" hemangiomas. J Pediatr. 1997;130(4):631-40. 3. Maguiness S, Guenther L. Kasabach-merritt syndrome. J Cutan Med Surg. 2002;6(4):335-9. 4. Hall G. Kasabach-Merritt syndrome:pathogenesis and management. Br J Haematol. 2001;112(4):851-62. 5. Dresse M, David M, Hume H, Blanchard H, Russo P, Van Doesberg N, et al. Succesful treatment of Kasabach-Merritt syndrome with prednisone and epsilon-aminocaproic acid. Pediatr Hematol Oncol. 1991;8, 329-34. 6. Hesselmann S, Micke O, Marquardt T, Baas S, Bramswig J, Harms E, at al. Kasabach-Merritt syndrome: a review of the therapeutic options and a case report of successful treatment with radiotherapy and interferon alpha. Br J Radiol. 2002;75(890):180-4. 7. Atahan I, Cengiz M, Ozyar E, Gurkaynak M. Radiotherapy in the management of KasabachMerritt syndrome: a case report. Pediatr Hematol Oncol. 2001;18(7):471-6. 8. Drolet B, Scott L, Esterley N, Gosain A. Early surgical intervention in a patient with KasabachMerritt phenomenon. J Pediatr. 2001;138(5);756-8. 9. Zukerberg LR, Nickoloff BJ,Weiss SW. Kaposiform hemangioendothelioma of infancy and childhood. An aggressive neoplasm associated with KasabachMerritt syndrome and lymphangiomatosis. Am J Surg Pathol. 1993;17(4):321-8. 10. Sato Y, Frey E, Wicclund B, Kisker C, Smith W. Embolization therapy in the management of infantile hemangioma with Kasabach-Merritt syndrome. Pediatr Radiol. 1987;17:503-4. 11. Ozxoylu S. Megadose methylprednisolone for Kasabach-Merritt syndrome. Eur J Pediatr. 2003;162(7-8):562. 12. El-Dessouky M,Azmy A, Raine P,Young D. J Pediatr Surg. 1998;23,109-111. 13. Deb G, Jenkner A, De Sio L, Boldrini R, Bosman C, Standoli N, et al. Spindle cell (Kaposiform) hemangioendothelioma with Kasabach-Merritt syndrome in an infant: successful treatment with alpha-2A interferon. Med Pediatr Oncol. 1997;28(5):358-61. 14. Biban P. Kasabach-Merritt syndrome and interferon alpha: still a controversial issue. Arch Dis Child. 2003;88(7):645-6. 15. Haisley-Royster C, Enjolras O, Frieden IJ, Garzon M, Lee M, Oranje A, et al. Kasabach-Merritt phenomenon: a retrospective study of treatment with vincristine. J Pediatr Hematol Oncol. 2002; 24(6):459-62. Erratum in: J Pediatr Hematol Oncol. 2002; 24(9):794. 146 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 16. Shin H, Ryu K,Ahn H. Stepwise multimodal approach in the treatment of Kasabach-Merritt syndrome. Pediatr Int. 2000; 42(6):620-4. 17. Lyons LL, North PE, Mac-Moune Lai F, Stoler MH, Folpe AL, Weiss SW. Kaposiform hemangioendothelioma: a study of 33 cases emphasizing its pathologic, immunophenotypic, and biologic uniqueness from juvenile hemangioma. Am J Surg Pathol. 2004;28(5):559-68. 18. Blei F, Karp N, Rofsky N, Rosen R, Greco MA. Successful multimodal therapy for kaposiform hemangioendothelioma complicated by Kasabach-Merritt phenomenon: case report and review of the literature. Pediatr Hematol Oncol. 1998;15(4):295-305. 19. Hu B, Lachman R, Phillips J, Peng SK, Sieger L. Kasabach-Merritt syndrome-associated kaposiform hemangioendothelioma successfully treated with cyclophosphamide, vincristine, and actinomycin D. J Pediatr Hematol Oncol. 1998;20(6):567-9. 20. Payarols J, Mansferrer J, Bellvert C. Treatment of lifre threatening hemangiomas with vincristine. N Engl J Med. 1995;333:69 21. Vin-Christian K, McCalmont TH, Frieden IJ. Kaposiform hemangioendothelioma. An aggressive, locally invasive vascular tumor that can mimic hemangioma of infancy. Arch Dermatol. 1997;133(12):1573-8. 22. Moore J, Lee M, Garzon M, Soffer S, Kim E, Saouaf R, et al. Effective therapy of a vascular tumor of infancy with vincristine. J Pediatr Surg. 2001;36(8):1273-6. 23. Cooper JG, Edwards SL, Holmes JD. Kaposiform haemangioendothelioma: case report and review of the literature. Br J Plast Surg. 2002;55(2):163-5. 24. Beaubien ER, Ball NJ, Storwick GS. Kaposiform hemangioendothelioma: a locally aggressive vascular tumor. J Am Acad Dermatol. 1998;38(5 Pt 2):799-802. 25. Mazoyer E, Enjolras O, Laurian C, Houdart E, Drouet L (2002) Coagulation abnormalities associated with extensive venous malformations of the limbs: differentiation from Kasabach-Merritt syndrome. Clin Lab. 26. Mazereeuw-Hautier J, Syed S, Leisner RI, Harper JL. Extensive venous/lymphatic malformtions causing life-threatening haematological complications Br J Dermatol. 2007; 157:558-63. 27. Hosono S, Ohno T, Kimoto H, Nagoshi R, Shimizu M, Fuyama Y, et al. Successful transcutaneous arterial emboli<ation of a giant hemangioma associated with high output cardiac failure and Kassabach Merrit syndrome in a neonate: a case report J perinat Med. 1999; 27:399-403. 28. Baselga E.,Garzón M,.Blei F, Cordisco M. Rapid Involuting Congenital Hemangioma associated with coagulopathy : Seven new cases. In press. 29. Mendoza A, Tamayo L, Sanz C, Maldonado R. Histopathology of vascular lesions found in Kasabach-Merritt syndrome: review based on 13 cases. Ped Dev Path. 2000;556-60. 30. Enjolras O, Mulliken JB, Wassef M, Frieden IJ, Rieu PN, Burrows PE, et al. Residual lesions after Kasabach-Merritt phenomenon in 41 patients. J Am Acad Dermatol. 2000;42(2 Pt 1):225-35. Revista de Revistas Dr. Felipe Velásquez Vitíligo infantil: características clínico epidemiológicas Silva C, Pereira L, Gontijo Bernardo, et al. An Bras Dermatol. 2007;82:47-51. Los autores mencionan que el vitíligo es una enfermedad que afecta entre 0.5 a 4% de la población mundial. El 75% de los casos ocurre dentro de los primeros 10 años de edad. Hay pocos estudios en niños en Brasil. Objetivo: Evaluar las características clínico epidemiológicas del vitíligo en la infancia. Métodos: Se realizó un estudio descriptivo en 73 niños con vitíligo vistos en la consulta externa del servicio de dermatología pediátrica del Hospital Das Clinicas Universidad Federal Minas Gerais. Se evaluó variables como sexo, edad de inicio y terapia, área de superficie corporal afectada, tipo clínico, localización, asociación con enfermedad auto inmune, historia familiar de vitíligo y terapia inicial. Para el análisis estadístico se uso frecuencia y promedios y se comparó por el método de varianza. Resultados: Predominio de mujeres (60.3%), la edad de inicio de enfermedad fue de 5.7 años. En la mayoría de casos (71.8%) la superficie corporal afectada fue del 1% y el tipo localizado fue el más frecuente (76.7%). El área más comúnmente afectada fue la cabeza. Historia familiar de vitíligo se observó en un 30.1% de los pacientes. Hipotiroidismo se detectó en un paciente y 11% de los reportados tuvieron antecedentes familiares de enfermedades autos inmunes. La terapia inicial fue corticoides tópicos. Conclusiones: los hallazgos presentados en este reporte son similares a los reportados en otros lugares. No hay nada concluyente, solo es una observación de sus casos. Acné vulgar: un estudio para evaluar un tratamiento oral con ácidos grasos esenciales, usando análisis clínico, digital y patológico Costa A, Alchorne M, Michalany N, et al. An Bras Dermatol. 2007;82:129-34. Los autores indican que la relación entre acné vulgar, alimentos y ácidos grasos es desconocida, sin embargo los ácidos grasos son importantes en la patofisiología del acné vulgar. Objetivos:Verificar la respuesta clínica del acné vulgar con uso de ácidos grasos esenciales y establecer el mejor método de evaluación. Métodos:Tomaron parte 31 pacientes voluntarios, a 16 de ellos (51.6%) se les dio ácidos grasos esenciales y al resto placebo. Se realizó examen clínico, evaluación auto voluntaria, imagen digital y evaluación patológica, tanto antes como después del tratamiento. Resultados: No hubo diferencias en la evaluación subjetiva y digital entre los grupos placebo y control. Hubo una pequeña mejora en el examen patológico pero sin significancia estadística. El análisis digital y patológico mostró correlación (p= 0.002). Conclusiones: Se requieren más estudios con poblaciones grandes para evaluar el beneficio clínico. El análisis auto evaluación y digital no fueron suficientes para indicar la mejor terapéutica entre producto y placebo para acné vulgar. La correlación entre análisis patológico y digital parece ser la mejor forma de evaluar la calidad de la terapia y el examen patológico parece ser el mejor método sensible para evaluar el régimen terapéutico. Dermatol Pediatr Lat Vol 5 Nº 2, 2007 147 Revista de revistas Escala de Impacto de la Dermatitis Atópica en la infancia. Confiabilidad, discriminación y validez concurrente y respuesta Chamlin S, Lai J, Cella D, et al. Arch Dermatol. 2007;143:768-72. El objetivo del estudio fue evaluar la confiabilidad, discriminación y validez concurrente y respuesta al test-retest de la Escala de Impacto de la Dermatitis Atópica en la Infancia (CADIS) que es una escala de calidad de vida con cinco dominios. El diseño fue un estudio prospectivo, longitudinal. Hubo un total de 301 padres de niños menores de seis años con dermatitis atópica. Los participantes completaron el CADIS, preguntas socio demográficas y clínicas al ser enrolados para el estudio y a la cuata semana de seguimiento. La severidad de la enfermedad fue medida usando el score de dermatitis atópica (SCORAD). Los resultados fueron que de un total de 301, completaron el estudio 270 y de estos 84% completaron el seguimiento de las cuatro semanas. Coeficientes de correlación intra clase del score CADIS al enrolamiento y a las 48 horas varió de 0.89 a 0.95. Correlaciones entre CADIS y SCORAD demostraron que a dermatitis más severa peor calidad de vida. El puntaje de los cinco dominios del CADIS significativamente diferenció pacientes en cada nivel de severidad como medida por el índice SCORAD (p< 0.01). Los participantes que calificaron a sus niños como mejorados a la cuarta semana tuvieron mejor puntaje CADIS que aquellos que indicaron igual síntomas o empeoramiento (p<0.05). Como conclusiones se refieren los autores que estos datos confirman la confiabilidad validez concurrente y validez discriminativa del CADIS. Además la evaluación respuesta demuestra que el CADIS mide exactamente cambios en quienes hay mejoría de la enfermedad 148 Dermatol Pediatr Lat Vol 5 Nº 2, 2007 Microsporum canis: reporte de un brote en un colegio primario Grills C, Bryan P, O'Moore E, Venning V. Aust J Dermatol. 2007;48:88-90. El M. canis ee el hongo causante de al menos 10% de tiñas capitis en el Reino Unido. La transmisión es por vía directa con un animal infectado y hay raros reportes de brotes. Este reporte presentado muestra un brote en la un clase de una escuela primaria de transmisión humanohumano de un caso que aparentemente adquirió la enfermedad al llegar al Reino Unido. No hubo mejoría clínica con el tratamiento con terbinafina a la cuarta semana, así que se tuvo que cambiar a griseofulvina. El equipo de salud hizo una evaluación a todos los miembros de la clase y confirmó casos quienes fueron tratados con griseofulvina. Los compañeros de clase y hermanos usaron por recomendación champú con sulfuro de selenio o ketoconazol. Cutis vertici gyrata: tres casos con diferente etiología que demuestra el sistema de clasificación Larsen F, Birchall N. Austr J Dermatol. 2007;48:91-4. El cutis vertici gyrata describe una condición del cuero cabelludo donde hay pliegues convolucionados y hendiduras profundas que semejan la superficie de la corteza cerebral. Los autores presentan tres casos de cutis vertici gyrata que demuestra la actual clasificación. El primer caso descrito fue la forma adquirida no esencial primaria que apareció en una niña de 11 años con retardo mental. El segundo caso fue la forma primaria no esencial congénita en un niño con síndrome de Noonan la que ha sido raramente descrita anteriormente. El último caso fue descrito en un paciente varón de 27 años con eccema discoide. Para el manejo según los autores es importante comprender la etiología de esta entidad. Instrucciones para publicación La revista “Dermatología Pediátrica Latinoamericana” es el órgano oficial de la Sociedad Latinoamericana de Dermatología Pediátrica y es la encargada de difundir y promover el conocimiento de ésta importante subespecialidad de la dermatología en el ámbito latinoamericano. PREPARACIÓN DEL ARTÍCULO: Los artículos serán considerados para publicación como artículos de revisión, artículos originales, reporte de casos, cual es su diagnóstico, correlato clínico patológico y artículos misceláneos. Los artículos deberán ser inéditos excepto en la forma de resúmenes y no deben de haber sido enviados simultáneamente a otras revistas. Aceptado el artículo se considerará como propiedad intelectual de la revista de la Sociedad Latinoamericana de Dermatología Pediátrica y no podrá ser reproducida sin el consentimiento expreso de los editores. Todos los artículos serán revisados por el Comité Editorial y/o el Comité Asesor, y en algunos casos por Expertos a solicitud del Comité. El informe final de su aceptación y los aspectos pendientes de edición serán comunicados al autor principal en un plazo de dos semanas desde su recepción. El autor principal a su vez dispondrá de dos semanas para reenviar el trabajo al Comité Editorial. Los autores son los responsables del contenido de los artículos. FORMATO DEL ARTÍCULO: El artículo deberá ser escrito a doble espacio, usando un margen de 4 cm, sobre papel bond blanco resistente A4, no autoborrable, acompañar con dos juegos de copias de alta calidad, el autor deberá tener una copia para su referencia; acompañar las copias de un disquete debidamente grabado en word y los gráficos en excel para sistema operativo Windows. Título: Debe ser breve no exceder de 45 letras y espacios, con el listado de los autores y sus grados y títulos, además de afiliación institucional. Deberá figurar también el nombre y dirección del autor encargado de recibir la correspondencia. Resumen: No debe ser mayor de 200 palabras, debiendo incluir el trabajo resumido en sus aspectos importantes, siendo imprescindibles los resultados y las conclusiones. Debe haber un resumen equivalente en inglés. Se incluirán las palabras claves (key words) en un número no mayor de cinco. Texto: Este debe ir en la secuencia convencional de introducción, material y métodos, resultados y discusión; agradecimientos, referencias bibliográficas, tablas, figuras y leyendas. Todas las tablas y figuras deben ser citados en orden de su aparición en el texto, numerándolos de manera secuencial. Referencias: Deben ser numeradas consecutivamente, con números arábigos en superíndice en el orden en que aparecen en el texto. La referencia citada deberá seguir las convenciones de “The National Library of Medicine” y el Index Medicus. Todas las referencias deben ser verificadas por los autores. Tablas: Deben ser escritas a doble espacio en hojas separadas y numeradas consecutivamente dentro del texto, las tablas deben llevar sus respectivos números y títulos, todas las abreviaciones deben de ser explicadas al pie de la tabla. Figuras: Cada figura debe tener su correspondiente leyenda escrita a doble espacio, las figuras deben ir con un papel engomado al dorso(post it) con los datos del artículo y el autor, así como una flecha indicando la parte superior de la figura. Las figuras deben llevar sus respectivas leyendas en un papel separado escrito a doble espacio y numeradas conforme aparecen en el texto. Fotos clínicas: En aquéllas donde se puede reconocer la identidad del paciente se debe contar con el consentimiento firmado por el paciente o su representante autorizando la publicación de la misma. Las microfotografías de cortes histológicos deberán indicar el método de tinción. Recomendaciones varias: Usar pesos y medidas del sistema métrico decimal, y los medicamentos deben ir con el nombre genérico o denominación común internacional, pudiendo agregarse el nombre de marca. La gramática y la sintaxis deben corresponder al español y al portugués cuando fuera necesario, en caso de usar abreviaciones deben seguir las recomendaciones del Council of Biology Editors style. Todo trabajo para su publicación debe dirigirse a la siguiente dirección: Revista Dermatología Pediátrica Latinoamericana Av. Santa Cruz 647 Lima 18 - Perú Telefax: (51-1) 221-4003 Correo electrónico: [email protected] Dermatol Pediatr Lat Vol 5 Nº 2, 2007 149