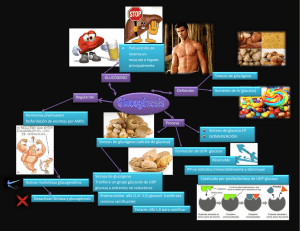
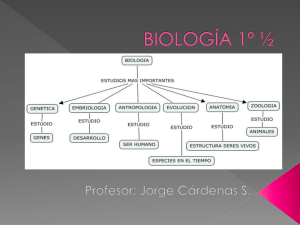
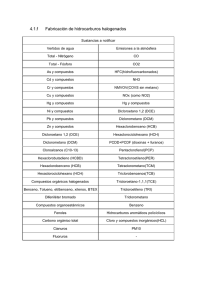
Lelli, Sandra Marcela. 2013 02 26 - Biblioteca Digital de la Facultad
Anuncio

Cómo se altera el metabolismo y transporte de glucosa en porfiria experimental crónica y aguda. Una aproximación mecanística Lelli, Sandra Marcela 2013 02 26 Tesis Doctoral Facultad de Ciencias Exactas y Naturales Universidad de Buenos Aires www.digital.bl.fcen.uba.ar Contacto: [email protected] Este documento forma parte de la colección de tesis doctorales y de maestría de la Biblioteca Central Dr. Luis Federico Leloir. Su utilización debe ser acompañada por la cita bibliográfica con reconocimiento de la fuente. This document is part of the doctoral theses collection of the Central Library Dr. Luis Federico Leloir. It should be used accompanied by the corresponding citation acknowledging the source. Fuente / source: Biblioteca Digital de la Facultad de Ciencias Exactas y Naturales - Universidad de Buenos Aires UNIVERSIDAD DE BUENOS AIRES Facultad de Ciencias Exactas y Naturales Departamento de Química Biológica Cómo se altera el metabolismo y transporte de glucosa en porfiria experimental crónica y aguda. Una aproximación mecanística. Tesis presentada para optar al título de Doctor de la Universidad de Buenos Aires en el área de Química Biológica. LIC. SANDRA MARCELA LELLI Director de Tesis: Dra. Leonor Carmen San Martín de Viale. Director Asistente: Dra. Marta Blanca Mazzetti. Consejero de Estudios: Dra. Elba Vazquez. Laboratorio de Disturbios Metabólicos por Xenobióticos, Salud Humana y Medio Ambiente. (DIMXSA- QB66). Departamento de Química Biológica, FCEyN- UBA. Buenos Aires, 2012 CÓMO SE ALTERA EL METABOLISMO Y TRANSPORTE DE GLUCOSA EN PORFIRIA EXPERIMENTAL CRÓNICA Y AGUDA. UNA APROXIMACIÓN MECANÍSTICA. Este trabajo de Tesis fue realizado utilizando ratas Wistar como animales de experimentación y drogas tales como el hexaclorobenceno para inducir una porfiria crónica, y la 2-alil-2-isopropilacetamida junto con el 3´,5´-dietoxicarbonil-1,4dihidrocolidina, para modelar una porfiria aguda. Se logró así relacionar ambas patologías modeladas con importantes alteraciones en diversos aspectos del metabolismo de los hidratos de carbono (rutas anabólicas y catabólicas del glucógeno, de la glucosa y su transporte), del metabolismo oxidativo (que lleva a la producción de especies reactivas de oxígeno, ROS), del triptófano (TRP) y de los glucocorticoides (GC) (niveles, síntesis y receptores), todos ellos campos que han sido muy poco estudiados en las porfirias. Se establecen además inter-relaciones e inter-regulaciones metabólicas y hormonales entre el metabolismo del hemo (que es donde las fallas generan la porfiria), los metabolismos recién mencionados, el de los GC y la insulina, con particular atención en la actividad de la fosfoenolpiruvato-carboxiquinasa (PEPCK), enzima regulatoria clave de la gluconeogénesis. Así los disturbios hormonales y metabólicos encontrados en los modelos tanto de porfiria crónica como aguda, confluyen y dan cuenta de un descenso en la disponibilidad de glucosa en el hepatocito que modularía la porfiria, exacerbando la enzima regulatoria del camino del hemo, ALA-sintetasa. Por otro lado sustentarían el porqué del efecto benéfico de la administración de glucosa en la terapia de las porfirias, especialmente de la porfiria aguda, que es la más crítica y provoca un riesgo de vida. Asimismo, es de destacar el efecto benéfico de la melatonina, reportado en el presente trabajo, en los tres metabolismos investigados para la porfiria aguda. Así como la importante disrupción hormonal que se reporta a nivel de los GC tanto a nivel plasmático como en su síntesis adrenal y receptores hepáticos en el modelo crónico de porfiria cutanea tarda. También es mencionable la contribución de las ROS, TRP y GC al descenso de la PEPCK. Los resultados de esta Tesis tienen implicancias en el campo de la toxicología, medicina y de la química biológica. Palabras claves: porfiria, glucosa, glucocorticoides, triptófano, ROS, PEPCK. ii HOW METABOLISM AND TRANSPORT OF GLUCOSE ARE ALTERED IN CHRONIC AND ACUTE EXPERIMENTAL PORPHYRIA. A MECHANISTIC APPROACH. This Thesis work was performed using Wistar rats as experimental animals and drugs such as hexachlorobenzene to induce chronic porphyria, and 2-allyl-2isopropylacetamide combined with 3',5'-diethoxycarbonyl-1,4-dihydrocollidine to model acute porphyria. Thus, both modeled pathologies were related with significant alterations in several aspects of carbohydrates metabolism (catabolic and anabolic pathways of glycogen, glucose and its transport), of oxidative metabolism (which leads to production of reactive oxygen species, ROS), of tryptophan (TRP) and glucocorticoids (GC) (levels, synthesis and receptor), all fields that have been very poorly studied in porphyrias. In addition, metabolic and hormonal inter-relations and inter-regulations were established between heme metabolism (where defects generate porphyria), the metabolisms above mentioned, that of GC and insulin, with particular attention on phosphoenolpyruvate carboxykinase (PEPCK) activity, key regulatory enzyme of gluconeogenesis. Thus, hormonal and metabolic disturbances found in experimental models of both chronic and acute porphyria, converge and account for a decrease in the availability of glucose in the hepatocyte that would modulate the porphyria, exacerbating the regulatory enzyme of heme pathway, ALA-synthase. Furthermore they could explain why the beneficial effect of the glucose administration in the therapy of porphyrias, especially of acute porphyria, which is the most dangerous since it is a life-threatening disease. It is also noteworthy the beneficial effect of melatonin, observed in three metabolisms investigated in acute porphyria, here reported. Just as the important hormonal disruption found at the level of GC, both in plasma as well as in the adrenal synthesis and hepatic receptors in chronic model of porphyria cutanea tarda. Also worth of mentioning is the contribution of ROS, TRP and GC to the PEPCK decrease. The results of this Thesis have implications in fields of toxicology, medicine and biological chemistry. Keywords: porphyries, glucose, glucocorticoids, tryptophan, ROS, PEPCK. iii Agradecimientos Una etapa muy ardua de mi vida hoy está concluyendo. Estuve rodeada de gente que hizo más fácil el camino, que me acompañó, aconsejó y empujó hacia el frente. Gente a la que no quiero dejar de agradecerle con todo mi corazón por haber estado tan cerca durante estos años de trabajo y vida... ... A la Dra. San Martín de Viale, por brindarme la posibilidad de trabajar en su laboratorio, por su dirección y supervisión en la labor de Tesis y en particular, por sus consejos dados desde el corazón que fueron y siguen siendo, de gran valor para mí. ... A la Dra. Mazzetti, por permitirme trabajar con ella y desarrollar parte importante de mi trabajo de Tesis a su lado; y sobre todo por darme un sincero apoyo moral en los momentos difíciles. ... A la UBA, por el otorgamiento de las becas que me permitieron desarrollar este trabajo de Tesis. ... A la gente del Dpto. de Química Biológica, por darme el lugar físico y el tiempo necesario para realizar mi trabajo. A Martín y Ayelén, por su enorme colaboración respecto a temas académicos y administrativos. ... A mis queridísimas Doctoras y amigas: Adriana, Silvia, Nora y María del Carmen, por brindarme todos sus conocimientos, para que a lo largo de estos años, pudiera adquirir importante aprendizaje y criterio para “comprender” el trabajo de laboratorio e investigación. ... A la memoria de la Dra. M. Cristina Taira, que estará por siempre en mi corazón. ... A Carmen A. Aldonatti, por las innumerables tareas como Técnica en las que ha colaborado en mi trabajo, por ser mi mejor compañía en el laboratorio, pero sobre todo, por el cariño que me dio y sigue dándome como amiga. ... A mis chiquis, amiga/os y compañera/os que conocí trabajando en las largas jornadas del Labo: Moni, Juli, Gise y Fede… a los que quiero muchísimo! ... A todas las que de una u otra manera ayudaron en este trabajo siendo mis compañeras de pasillo, las Doctoras Silvina Gazzaniga, Claudita Martini, Gaby Chaufan, Mary Tomio y M. del Carmen Vila, por aportar siempre su mejor consejo cuando les fue requerido de mi parte. ...en lo personal, al apoyo incondicional de mi entrañable familia: Papá y Mamá ante todo, hermanos, sobrinos, suegros, cuñados y a los más gloriosos amigos: Tere, Ri, Ale, Fred, Gabita y Adrián! Pero sé que nunca hubiese logrado terminar sola con esta enorme tarea, sin la pasión y el esfuerzo que juntos y a la par pusieron por mí, estos dos amores inconmensurables: Marcelo y Damián ♥ A todos, ¡Muchas Gracias! iv No te rindas, Aún estás a tiempo, De alcanzar y comenzar de nuevo, Aceptar tus sombras, Enterrar tus miedos, Liberar el lastre, Retomar el vuelo. No te rindas, Que la vida es eso, Continuar el viaje, Perseguir tus sueños, Destrabar el tiempo, Correr los escombros, Y destapar el cielo... Fragmento de “No te Rindas”, de M. Benedetti. Dedicada a mi Papá y a toda mi gente amada. v Las siguientes publicaciones son parte de los resultados presentados en esta Tesis: Lelli SM., Mazzetti MB., San Martín de Viale LC. (2001) Melatonin, carbohydrates and experimental acute porphyria. Biocell; Supl. II, 25: 100. Mazzetti MB., Taira MC., Lelli SM., San Martín de Viale LC. (2004) Hexachlorobenzene impairs glucose metabolism in a rat model of porphyria cutanea tarda: a mechanistic approach. Archives of Toxicology; 78: 25-33. Taira MC., Mazzetti MB., Lelli SM., San Martín de Viale LC. (2004) Glycogen metabolism and glucose transport in experimental porphyria. Toxicology; 197: 165-175. Lelli SM., San Martín de Viale LC., Mazzetti MB. (2005) Response of glucose metabolism enzymes in an acute porphyria model. Role of reactive oxygen species. Toxicology; 216: 48-58. Lelli SM., Ceballos NR., Aldonatti CA., Mazzetti MB., San Martín de Viale LC. (2007) Hexachlorobenzene as hormonal disruptor- Studies about glucocorticoids: their hepatic receptors, adrenal synthesis and plasma levels in relation to impaired gluconeogenesis. Biochemical Pharmacology; 73: 873-879. Lelli SM., Mazzetti MB., San Martín de Viale LC. (2008) Hepatic alteration of tryptophan metabolism in an acute porphyria model. Its relation with gluconeogenic blockage. Biochemical Pharmacology; 75: 704-712. vi INDICE DE CONTENIDOS I- ABREVIATURAS ............................................................................................................. xii 1- INTRODUCCIÓN GENERAL ....................................................................................... 17 1.1. METABOLISMO DEL HEMO - PORFIRIAS HUMANAS Y EXPERIMENTALES ...... 17 1.1.1. Metabolismo del hemo – Su regulación y alteraciones................................................. 17 1.1.2. Alteraciones en el camino del hemo. Porfirias crónicas y agudas ................................ 22 1.1.3. Porfirias experimentales inducidas por compuestos porfirinogénicos. ......................... 28 1.1.4. HCB -Mecanismo porfirinogénico. Efectos sobre CYP y su metabolismo. ................. 31 1.1.5. AIA. Mecanismo porfirinogénico: sus efectos sobre CYP y sobre el ALA-S .............. 38 1.1.6. DDC. Mecanismo porfirinogénico: sus efectos sobre CYP y sobre la FQ ................... 41 1.2. METABOLISMO DE LOS HIDRATOS DE CARBONO, SU REGULACIÓN ................ 42 Generalidades.......................................................................................................................... 42 1.2.1 Metabolismo de la glucosa ........................................................................................ 44 1.2.2 Gluconeogénesis: Las enzimas claves. ...................................................................... 46 1.2.3 Glucólisis: descripción de los pasos de la vía. ........................................................... 53 1.2.3.1. Paso final de la Glucólisis. Regulación de la piruvato quinasa (PK) ................... 55 1.2.4. Glucogenogénesis y glucógenolisis: GS y GP como enzimas claves ........................ 58 1.2.5. Glucocorticoides: Regulación sobre el metabolismo de hidratos de carbono............ 61 1.2.6. Porfirias y su relación con el metabolismo de los hidratos de carbono. ...................... 63 1.3. ESTRÉS OXIDATIVO ........................................................................................................ 64 1.3.1. Radicales libres y especies reactivas de oxígeno (ROS)............................................... 64 1.3.2. Toxicidad de xenobióticos mediada por especies reactivas .......................................... 69 1.3.3. Toxicidad sobre las macromoléculas mediadas por ROS. ............................................ 70 1.3.2.1. Reacciones sobre proteínas, DNA, glúcidos y lípidos. .......................................... 70 1.3.4. Sistemas de defensas antioxidantes .............................................................................. 71 1.3.5. La melatonina como atrapante. ..................................................................................... 73 1.4. TRIPTÓFANO ..................................................................................................................... 75 1.4.1. Sus metabolitos. Caminos de degradación. ................................................................... 75 1.4.2. Importancia de los metabolitos del TRP ....................................................................... 78 1.4.3. Acción del TRP sobre el metabolismo de los hidratos de carbono ............................... 82 2- OBJETIVOS ..................................................................................................................... 85 2.1. OBJETIVOS GENERALES ................................................................................................ 85 2.2. OBJETIVOS PARTICULARES .......................................................................................... 85 2.2.1 Objetivos particulares: Modelo de porfiria crónica por intoxicación con HCB ............ 85 2.2.2 Objetivos particulares: Modelo de porfiria aguda generada con AIA/DDC .................. 85 3- MATERIALES Y MÉTODOS ....................................................................................... 90 3.1. ANIMALES ......................................................................................................................... 90 3.2. DROGAS Y REACTIVOS. ................................................................................................. 90 3.2.1- Equipos ......................................................................................................................... 92 vii 3.3. TÉCNICAS Y TRATAMIENTOS SOBRE ANIMALES DE EXPERIMENTACIÓN ...... 93 3.3.1. Drogado de animales - Modelo de Porfiria Crónica por HCB. ..................................... 93 3.3.2. Drogado de animales - Modelo de Porfiria Aguda por AIA/DDC ............................... 93 3.3.3. Tratamiento con Melatonina, como antioxidante preventivo. ...................................... 94 3.4 DETERMINACIONES HEPÁTICAS- PREPARACIÓN DEL TEJIDO. ............................ 96 3.4.1. Determinación de actividades enzimáticas del camino del hemo. .............................. 100 3.4.1.1. Actividad hepática de la 5-aminolevulínico-sintetasa (ALA-S)........................... 100 3.4.1.2. Actividad Uroporfirinógeno-decarboxilasa (URO-D) ........................................ 100 3.4.1.3 Actividad ferroquelatasa (FQ) ............................................................................. 102 3.4.2. Contenido de intermediarios hepáticos del camino del hemo. .................................... 103 3.4.2.1. Contenido hepático de ALA y PBG ..................................................................... 103 3.4.2.2. Contenido de porfirinas hepáticas ...................................................................... 103 3.4.3. Determinación de actividades enzimáticas hepáticas-Gluconeogénesis y Glucólisis. 104 3.4.3.1. Actividad fosfoenolpiruvato carboxiquinasa (PEPCK) ....................................... 104 3.4.3.2. Actividad piruvato carboxilasa (PC) .................................................................. 104 3.4.3.3. Actividad glucosa-6-fosfatasa (G6Pasa) ............................................................. 105 3.4.3.4. Actividad piruvato quinasa (PK) ......................................................................... 106 3.4.4. Contenido de glucógeno hepático ............................................................................... 106 3.4.5. Transporte de glucosa por tejido hepático- Captación por el hepatocito .................... 107 3.4.6. Determinación de actividades enzimáticas del metababolismo del glucógeno........... 108 3.4.6.1. Actividad de la Glucógeno Sintetasa (GS) .......................................................... 108 3.4.6.2. Actividad de la Glucógeno Fosforilasa (GP) ...................................................... 108 3.4.7. Determinación de parámetros de estrés oxidativo. ..................................................... 109 3.4.7.1. Determinación de la peroxidación lipídica por TBARS ..................................... 109 3.4.7.2. Concentración de proteínas carboniladas........................................................... 110 3.4.8. Actividades de las defensas antioxidantes .................................................................. 110 3.4.8.1. Actividad superóxido dismutasa (SOD) .............................................................. 110 3.4.8.2 Actividad Catalasa (CAT) .................................................................................... 111 3.4.9. Determinación de receptores de glucocorticoides (GR) ............................................. 112 3.4.10. Determinación de metabolitos hepáticos del TRP por HPLC................................... 113 3.3.11- Enzimas del camino quinurenérgico: actividad de la TRP pirrolasa. ....................... 113 3.5 DETERMINACIONES URINARIAS ................................................................................ 114 3.5.1. Contenido de intermediarios del camino del hemo- ALA, PBG y porfirinas ............. 114 3.5.1.1. ALA y PBG en orina ............................................................................................ 114 3.5.1.2. Porfirinas urinarias de ratas ............................................................................... 115 3.5.2. Determinación de parámetros de estrés oxidativo (QL) ............................................. 115 3.6 DETERMINACIONES PLASMÁTICAS .......................................................................... 116 3.6.1. Contenido de glucosa plasmática ................................................................................ 116 3.6.2. Determinación de insulina plasmática ........................................................................ 116 3.6.3. Determinación de corticosterona plasmática. ............................................................. 116 3.7 DETERMINACIONES EN OTROS TEJIDOS .................................................................. 117 3.7.1. Determinación de la captación de glucosa en grasa parda, timo y bazo .................... 117 3.7.2. Determinación de insulina pancreática en islotes de Langerhans ............................... 118 3.7.3. Determinación de corticosterona en glándulas adrenales. .......................................... 119 3.7.4. Determinación de proteínas ........................................................................................ 120 3.8. ANÁLISIS ESTADÍSTICOS ............................................................................................. 120 4- RESULTADOS ............................................................................................................... 122 viii 4.1. MODELO DE PORFIRIA HEPÁTICA CRÓNICA POR HCB ................................. 122 ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL? .................................................................................................................. 122 4.1.1. Parámetros hepáticos y actividad enzimática clave del camino del hemo. ................. 122 4.1.2. Intermediarios del camino del hemo en orina. Determinación de porfirinas. ............. 123 EN BUSCA DE ALTERACIONES PROVOCADAS SOBRE EL METABOLISMO DE LA GLUCOSA EN ESTA PCT EXPERIMENTAL ................................................................ 125 4.1.3. Niveles plasmáticos de glucosa y contenido de glucógeno hepático. ........................ 125 4.1.4. Actividades enzimáticas del metabolismo de la glucosa ............................................ 127 ¿EXISTIRÁ VARIACIÓN EN LA CAPTACIÓN DE GLUCOSA DE RATAS TRATADAS CON HCB, EN LOS DIVERSOS TEJIDOS ESTUDIADOS? .......................... 131 4.1.5. Perturbaciones del transporte de glucosa en órganos y tejidos. .................................. 131 4.1.5.1. Captación de glucosa por el tejido hepático ....................................................... 132 4.1.5.2. Captación de glucosa por otros tejidos: grasa parda, timo y bazo..................... 132 ¿HAY CAMBIOS EN EL METABOLISMO DEL GLUCÓGENO DEBIDOS A LA ACCIÓN DEL HCB? ................................................................................................................ 136 4.1.6. Metabolismo del glucógeno. Niveles y actividades enzimáticas .............................. 136 4.1.6.1. Contenido hepático de glucógeno ....................................................................... 136 4.1.6.2. GS - Síntesis del glucógeno ................................................................................ 137 4.1.6.3. GP - Degradación del glucógeno ........................................................................ 138 EN BUSCA DE LAS CAUSAS DEL DESCENSO DE LA PEPCK Y LA GP: ¿SE DEBERÁ A INTERFERENCIAS EN EL SISTEMA REDOX? ..................................... 140 4.1.7. Parámetros de estrés oxidativo- Producción de ROS.................................................. 140 4.1.7.1. Peroxidación lipídica en tejido hepático ............................................................. 141 4.1.7.2. Quimioluminiscencia urinaria (QL) .................................................................... 143 ¿EXISTEN ALTERACIONES DEL ESTADO HORMONAL QUE REGULA EL METABOLISMO DE LA GLUCOSA? ESTUDIOS SOBRE GC E INSULINA. ................. 143 4.1.8. Determinación del nivel de insulina en plasma y secreción pancreática .................... 143 4.1.9. Glucocorticoides plasmáticos (CORT), receptores (GR) y síntesis adrenal ............... 145 4.1.9.1 Concentración de CORT vs. Porfirinas. .............................................................. 145 4.1.9.2 Análisis del número y afinidad de los GR hepáticos. ........................................... 146 ESTUDIANDO LA RAZÓN DE LA CAÍDA EN LA CONCENTRACIÓN DE CORT POR EFECTO DEL HCB. ¿SERÁ DEBIDO A DEFECTOS EN SU SÍNTESIS ADRENAL? ...... 148 PERTURBACIONES EN EL METABOLISMO DEL TRIPTÓFANO EN ESTE MODELO DE PCT EXPERIMENTAL POR HCB.................................................................. 149 4.1.10. Contenido hepático de triptófano .............................................................................. 149 4.1.11. Metabolitos hepáticos del TRP medidos por HPLC. ................................................ 149 4.1.11.1. Cromatogramas de elución. .............................................................................. 149 4.2. MODELO DE PORFIRIA HEPÁTICA AGUDA POR AIA/DDC ............................. 151 ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL DE PORFIRIA HEPÁTICA AGUDA? ..................................................... 151 4.2.1. Actividades enzimáticas y precursores del camino del hemo. .................................... 151 4.2.1.1 La actividad ALA-S es dosis dependiente ............................................................ 151 4.2.1.2 Actividad Ferroquelatasa (FQ) ........................................................................... 152 ix 4.2.1.3 Contenidos hepáticos de ALA y PBG dosis dependiente ...................................... 153 ALTERACIONES PROVOCADAS EN EL METABOLISMO DE LA GLUCOSA: GLUCONEOGÉNESIS, GLUCÓLISIS. ................................................................................. 155 4.2.2. Actividades enzimáticas de la gluconeogénesis.......................................................... 155 4.2.2.1. Fosfoenolpiruvato carboxiquinasa (PEPCK)..................................................... 156 4.2.2.2. Glucosa 6 fosfatasa (G6Pasa) ............................................................................ 157 4.2.3. Glucólisis- Piruvato Quinasa (PK).............................................................................. 158 DAÑOS PROMOVIDOS EN EL METABOLISMO DEL GLUCÓGENO ............................. 159 4.2.4. Niveles de glucógeno y actividades enzimáticas de su metabolismo ......................... 159 4.2.4.1. Glucógeno hepático total..................................................................................... 159 4.2.4.2. Glucógeno Sintetasa (GS) ................................................................................... 160 4.2.4.3. Glucógeno fosforilasa (GP) - Degradación del glucógeno ................................. 161 4.2.5. Transporte de glucosa en tejido hepático .................................................................... 162 EN BUSCA DE LAS CAUSAS DEL DESCENSO DE PEPCK Y GP- INTERFERENCIAS EN EL SISTEMA REDOX ....................................................................................................... 163 4.2.6. Producción de especies reactivas de oxígeno (ROS)- Estrés oxidativo. ..................... 163 4.2.6.1. Peroxidación lipídica en tejido hepático ............................................................ 163 4.2.6.2. Carbonilación de proteínas en tejido hepático ................................................... 165 4.2.6.3- Quimioluminiscencia urinaria (QL).................................................................... 166 4.2.7. Actividades de las defensas antioxidantes .................................................................. 167 4.2.7.1. Actividad superóxido dismutasa (SOD) .............................................................. 167 4.2.7.2. Actividad catalasa (CAT) .................................................................................... 168 MELATONINA COMO ANTIOXIDANTE PREVENTIVO A LA INTOXICACIÓN. ......... 169 PERTURBACIONES EN EL METABOLISMO DEL TRP EN ESTE MODELO DE PORFIRIA AGUDA ................................................................................................................. 171 4.2.8 Camino serotoninérgico ............................................................................................... 172 4.2.9. Enzimas del camino quinurenérgico. Actividad de la TRPp. ..................................... 172 5- DISCUSIÓN .................................................................................................................... 175 5.1. MODELO DE PORFIRIA CRÓNICA POR HCB. ...................................................... 175 ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO DE PORFIRIA CRÓNICA EXPERIMENTAL POR HCB? .......................................................... 175 ALTERACIONES PROVOCADAS SOBRE EL METABOLISMO DE LA GLUCOSA EN ESTE MODELO DE PCT EXPERIMENTAL ................................................................... 177 VARIACIÓN EN LA CAPTACIÓN DE GLUCOSA POR DIVERSOS TEJIDOS DE RATAS TRATADAS CON HCB ............................................................................................. 180 CAMBIOS EN EL METABOLISMO DEL GLUCÓGENO DEBIDOS A LA ACCIÓN DEL HCB .................................................................................................................................. 181 LAS CAUSAS DEL DESCENSO DE LA PEPCK Y LA GP: INTERFERENCIAS EN EL SISTEMA REDOX ................................................................................................................... 183 ALTERACIONES DEL ESTADO HORMONAL. ESTUDIOS SOBRE GLUCOCORTICOIDES E INSULINA ................................................................................... 186 x PERTURBACIONES EN EL METABOLISMO DEL TRIPTÓFANO EN ESTE MODELO DE PCT EXPERIMENTAL POR HCB.................................................................................... 192 CONCLUSIÓN PARA EL MODELO DE PORFIRIA HEPÁTICA CRÓNICA POR HCB .. 193 5.2. MODELO DE PORFIRIA HEPÁTICA AGUDA POR AIA/DDC ............................. 196 ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL DE PORFIRIA HEPÁTICA AGUDA? ..................................................... 196 ALTERACIONES EN LAS ENZIMAS CLAVES DEL METABOLISMO DE LA GLUCOSA. ............................................................................................................................... 198 DAÑOS SOBRE EL METABOLISMO DEL GLUCÓGENO. ............................................... 199 OTRA POSIBLE CAUSA DEL DESCENSO DE PEPCK y GP - INTERFERENCIAS EN EL SISTEMA REDOX ......................................................... . ........................................... 201 MELATONINA COMO ANTIOXIDANTE PREVENTIVO EN LA INTOXICACIÓN AGUDA POR AIA/DDC. ......................................................................................................... 205 PERTURBACIONES EN EL METABOLISMO DEL TRP EN ESTE MODELO DE PORFIRIA AGUDA ................................................................................................................. 207 6- CITAS BIBLIOGRÁFICAS ........................................................................................... 213 xi i- ABREVIATURAS 1,3 diPGA 2-AAF 5-COOH´gen 5-HIAA 5-HT 5-HTRP 6-COOH´gen 7-COOH´gen 7-COOH 8-COOH 8-OH-dG AAD AAT ACTH AD-P ADP AIA ALA ALA-D ALA-S ALAS-1 ALAS-2 AMP AMPc ANOVA ATP Bapp BSA CAT CoA COPRO COPROgen III CORT CPH CPK CPM CPO CRH CS CYP DDC DEX 1,3 Difosfoglicerato 2-Acetilaminofluoreno Penta-Carboxiporfirinógeno 5-Hidroxindolacético Serotonina o 5-Hidroxitriptamina 5-Hidroxitriptófano Hexa-Carboxiporfirinógeno Hepta-Carboxiporfirinógeno Firiaporfirina Uroporfirina 8-Hidroxi-2´-Desoxiguanosina Aminoácidos Aromáticos Decarboxilasa Alanina Aminotransferasa Hormona Adrenocorticotropina Porfiria por Deficiencia de ALA-D Adenosina Difosfato 2-Alil-2-Isopropil-Acetamida Ácido -Aminolevulínico -Aminolevulínato-Dehidrasa -Aminolevulínato-Sintetasa Gen Ubicuo de -Aminolevulínato-Sintetasa Gen Eritrocitario de -Aminolevulínato-Sintetasa Adenosina Monofosfato Adenosina Monofosfato Cíclica Análisis de Varianza de una Vía Adenosina Trifosfato Número Aparente de Sitios de Unión Albumina de Suero Bovina Catalasa Coenzima A Coproporfirina Coproporfirinógeno III Corticosterona Coproporfiria Hereditaria Creatina Fosfoquinasa Cuentas por Minuto Coproporfirinógeno Oxidasa Hormona Liberadora de Corticotropina Citrato Sintasa Citocromo P450 3´,5´-Dietoxicarbonil-1,4-Dihidrocolina Dexametasona xii DHAP pDMAB DMEM DMSO DNA DNPH DRE DTT EDTA ENO1 E.S. ETC FB FGI FQ F1,6BP F2,6BP F6P FBPasa1 FFA G1P G6P G6Pasa G6PDH GAP GAPD GC dGDP GDP GK GlnIII GP GR Gris GS GSH GTP H2O2 HCB HEP HEPES HEPTA HK HMB HO HPA HPLC Dihidroxiacetona Fosfato para-Dimetilamino Benzaldehído Medio Dubelco-Eagle Modificado Dimetilsulfóxido Ácido Desoxiribonucleico 2,4-Dinitro Fenilhidrazina Elementos de Respuesta a Dioxina Ditiotreitol Acido Etilendiamino-Tetracético Enolasa1 Error Estandar Cadena de Transporte de Electrones Fenobarbital Fosfoglucoisomerasa Ferroquelatasa Fructosa-1,6-Bifosfato Fructosa-2,6-Bifosfato Fructosa-6-Fosfato Fructosa-1,6-Bifosfatasa Ácidos Grasos Libres Glucosa-1-Fosfato Glucosa-6-Fosfato Glucosa-6-Fosfatasa Glucosa-6-Fosfato-Deshidrogenasa Gliceraldehído-3-Fosfato Gliceraldehído-3-Fosfato-Deshidrogenasa Glucocorticoides 2´Deoxiguanosina 5´Difosfato Guanosina-Difosfato Glucoquinasa Glucógeno Tipo III de Hígado Glucógeno Fosforilasa Receptores de GC Griseofulvina Glucógeno Sintetasa Glutation Reducido o γ-Glutamil-Cisteinil-Glicina Guanosina Trifosfato Peróxido de Hidrógeno Hexaclorobenceno Porfiria Hepato Eritropoyética Ácido Hidroxietil Piperazina Etano Sulfónico Heptacarboxiporfirina Hexoquinasa Hidroximetilbilano Hemo Oxigenasa Eje Hipotalamo-Pituitario-Adrenal Cromatografía Líquida de Alta Resolución xiii IDH IDO i.p. α-KDH Kdapp LDH LOOHLPL MAO MDBs MDA MDH Mel mRNA NAD NADH NADP(H) n.d. 1 O2 O2• O3 OH• PAHs PAI PBG PBGasa PBG-D PC PCE PCT PDH PEP PEPCK PFK PGI PGK PGM Pi PK PKA PKL PKM PKR PLC PMSF PPE PPO Isocitrato Deshidrogenasa Indolamina extrahepática 2,3-Dioxigenasa Intraperitoneal α-Cetoglutarato Deshidrogenasa Constante Aparente de Disociación Lactato Deshidrogenasa Hidroperóxido Lipoproteína Lipasa Mono Amino Oxidasa Cuerpos de Mallory-Denk Malondialdehído Malato Deshidrogenasa Melatonina Ácido Ribonucleico Mensajero Nicotinamida Adenina Dinucleótido Nicotinamida Adenina Dinucleótido (reducido) Nicotinamida Adenina Dinucleótido Fosfato (reducido) No Determinado Oxígeno Singulete Radical Superóxido Ozono Radical Hidroxilo Hidrocarburos Aromáticos Polihalogenados Porfiria Aguda Intermitente Porfobilinógeno Porfobilinogenasa Porfobilinógeno-Deaminasa Piruvato Carboxilasa Porfiria Congénita Eritropoyética Porfiria Cutánea Tarda Piruvato Deshidrogenasa Fosfoenolpiruvato Fosfoenolpiruvato Carboxiquinasa Fosfofructoquinasa Fosfo Gluco (-hexosa) Isomerasa Fosfoglicerato-Quinasa Fosfoglicerato-Mutasa Fosfato Inorgánico Piruvato Quinasa Proteínquinasa A Piruvato Quinasa, isoforma Hepática Piruvato Quinasa, isoforma Muscular Piruvato Quinasa, isoforma Eritrocitaria Fosfolipasa C Fluoruro de Fenilmetilsulfonilo (Inhibidor de Proteasas) Protoporfiria Eritropoyética Protoporfirinógeno-IX-Oxidasa xiv PROTO IX PROTOgen IX PV QL RE RIA RNS RO• ROO• ROS RXR SA s.c. SDH SNC SOD SPB TBA TBARS TCA TCDD TDO TG TPI TPD TRIS TRP TRPp UDP-GA UDP-Glu UGT URO URO-D UROgen I UROgen III URO–S UTP UTPG Vf VHC VIH Protoporfirina-IX Protoporfirinógeno-IX Porfiria Variegata Quimioluminiscencia Urinaria Retículo Endoplásmico Radioinmunoensayo Especies Reactivas de Nitrógeno Radical Alcoxilo Radical Peroxilo Especies Reactivas de Oxígeno Receptor de Ácido Retinoico – Xenobióticos Succinil Acetona Subcutáneo Succinato Deshidrogenasa Sistema Nervioso Central Superóxido Dismutasa Proteína Específica de Pegado a la Serotonina Ácido Tiobarbitúrico Sustancias Reactivas al Ácido Tiobarbitúrico Ácido Tricloroacético 2,3,7,8-Tetracloro-Dibenzo-p-Dioxina L-triptófano 2,3-dioxigenasa (TRPp) Triglicéridos Triosafosfato Isomerasa Triosafosfato Deshidrogenasa Tris-Hidroximetil-Aminometano Triptófano Triptófano Pirrolasa Uridina Dinucleótido Fosfato -Ácido Glucurónico Uridina Dinucleótido Fosfato –Glucosa UDP Glucuronosil Transferasa Uroporfirina Uroporfirinógeno Decarboxilasa Uroporfirinógeno I Uroporfirinógeno III Uroporfirinógeno-Sintetasa Uridina Trifosfato UTP-Glucosa Volumen Final Virus de Hepatitis tipo C Virus de Inmunodeficiencia Humana xv Introducción 1 - INTRODUCCIÓN GENERAL A continuación y previo al desarrollo del trabajo experimental, se definen conceptos necesarios para introducir al lector de manera teórica, en aquellos temas que se relacionan con este estudio. Se señala una descripción de los metabolismos del hemo, hidratos de carbono y triptófano; estrés oxidativo, sistemas de defensas antioxidantes y atrapantes; las porfirias que se generan por las diferentes fallas metabólicas; además de los modelos de intoxicación en ratas utilizados para generar las porfirias experimentales, que serán la base para el desarrollo de esta Tesis. 1.1. METABOLISMO DEL HEMO - PORFIRIAS HUMANAS Y EXPERIMENTALES 1.1.1. Metabolismo del hemo – Su regulación y alteraciones El hemo es una molécula esencial para los organismos aeróbicos, que tiene un rol fundamental en varias reacciones biológicas tales como transporte de oxígeno, respiración, detoxificación de drogas y señales de transducción (Ponka, 1999). La función de la molécula de hemo está determinada por las propiedades de las proteínas a las cuales se une. Interacciona con varias apo-proteínas inactivas, proporcionando la funcionalidad a las hemoproteínas resultantes. En la hemoglobina y mioglobina el hemo transporta y almacena oxígeno respectivamente, mientras que en los citocromos, está involucrado en el transporte de electrones, generación de energía y diversas transformaciones químicas. En catalasas y peroxidasas, el hemo interviene en la degradación de peróxidos y por ende en las diferentes reacciones biológicas en las que participa el peróxido de hidrógeno (Adak el al., 1998). Además, el hemo es indispensable para otros sistemas enzimáticos, tales como la ciclooxigenasa y la óxido nítrico sintetasa (Seed & Willoughby, 1997). Controla la expresión de numerosas proteínas tales como globina, citocromos, mieloperoxidasa, hemooxigenasa (HO), receptores de transferrina y las enzimas del camino de su síntesis (Gidari & Levere, 1977). 17 Introducción Figura 1.1: Molécula del hemo, donde se ve la estructura tetrapirrólica, con un átomo de hierro coordinado en el centro de la misma. El hemo es un tetrapirrol con un hierro coordinado (Figura 1.1). El ochenta a noventa por ciento de hemo total en mamíferos, se sintetiza en las células eritroides para incorporarse en la hemoglobina, luego que éstas se diferencian. La regulación de la biosíntesis del hemo en estas células involucra el gen de la δ-aminolevulinato sintetasa (ALA-S) eritrocitaria o ALAS-2. En ausencia de hierro, el mRNA de ALAS-2 es bloqueado y el transporte de la enzima hacia la matriz mitocondrial inhibido (Ponka, 1999). Cuando los eritrocitos maduran, tanto la síntesis de hemo como de hemoglobina cesa. En contraste, el gen ALAS-1, está ubicuamente expresado, dado que todas las células nucleadas tienen la necesidad de sintetizar hemo para los citocromos respiratorios. El grueso del hemo no eritrocitario, se produce en el hígado para generar diferentes hemoproteínas, en especial el citocromo P450 (CYP). Cualquier deficiencia o exceso de hemo es tóxico para la célula hepática, por tanto la producción tiene que ser controlada finamente, sobre todo por su paso limitante, el de la enzima ALA-S. Por consiguiente, el gen ALAS-1 hepático se regula de diversas maneras para asegurarse niveles adecuados de hemo intracelular (May et al., 1995). En el tejido hepático, la actividad de ALA-S está reprimida por el producto final hemo (Srivastava et al., 1988; Meguro et al., 1995), camino regulado por retroalimentación negativa, por lo que ésta es considerada como una enzima reguladora del metabolismo. Por el contrario, en células eritroides, la actividad es refractaria o se ve incrementada por el hemo (Hoffman et al., 1980). Por tanto, los mecanismos de regulación son diferentes según el tejido. Así, se muestran diferencias en la regulación transcripcional y su transporte. También hay diferencias en los pesos moleculares 18 Introducción (Watanabe et al., 1983) y en las propiedades catalíticas (Bishop et al., 1990) e inmunológicas (Yamamoto et al., 1986) entre las isoenzimas de ALA-S en los tejidos eritroide y hepático. Se han identificado tres potenciales puntos de regulación del hemo sobre el ALA-S hepática: (a) nivel transcripcional; (b) por desestabilización del mRNA de ALA-S; y (c) en la modulación de su entrada a la mitocondria (May et al., 1995). En su síntesis están involucradas ocho enzimas, de las cuales la primera y las tres últimas son mitocondriales, mientras las restantes son citosólicas (Figura 1.2). Se han descripto mutaciones en todos los genes que codifican para las enzimas biosintéticas del hemo, excepto para ALAS-1, y a las enfermedades resultantes se las conoce como porfirias (Elder, 1998a). Dependiendo del defecto enzimático específico, se puede observar el desarrollo de diversas patologías, con patrones de superproducción, acumulación, y excreción de intermediarios de la síntesis del hemo. Las enzimas del camino han sido estudiadas intensivamente, y en los últimos años se determinaron las estructuras cristalinas de cada una ellas y se clonaron todos los genes involucrados, como se describe a continuación. El primer paso del camino metabólico del hemo, es la condensación de la glicina y el succinil-CoA para formar la molécula de ALA (Figura 1.2). Esta reacción es la etapa limitante en la velocidad de síntesis de la vía. Está catalizada por la enzima ALA-S (EC.2.3.1.37) ubicada en la matriz mitocondrial, cuya actividad es regulada por el pool de hemo libre intracelular (Astner et al., 2005). El ALA formado es transportado activamente al citoplasma y mediante una reacción catalizada por la ALA-Dehidrasa (ALA-D; EC.4.2.1.24), dos moléculas de ALA se condensan para forman el monopirrol porfobilinógeno (PBG) (Batlle & Stella, 1978; Sassa 1982, 1998). Según su estructura cristalina, la enzima ALA-D es un tetrámero de homodímeros, con ocho subunidades y un sitio activo por dímero (Frankenberg et al., 1999) que requiere ocho átomos de zinc, uno por subunidad, cuatro esenciales para la catálisis, mientras que los otros cuatro estabilizan la estructura terciaria (Batlle et al., 1967; Batlle & Stella, 1978; Fukuda et al., 1988). En todos los tejidos la actividad del ALA-D es mucho mayor que la del ALA-S y en humanos está codificada por un solo gen, localizado en el cromosoma 9 (Potluri et al., 1987). 19 Introducción Figura 1.2: Camino biosintético del Hemo, con sus enzimas e intermediarios. A: acetilo, M: metilo, P: propilo, V: vinilo; Las flechas indican el orden en que cada grupo acetilo se convierte a metilo en cada paso de decarboxilación por acción de la Uroporfirinógeno-Decarboxilasa (URO-D). ALA: ácido δaminolevulínico; PBG: porfobilinógeno; 7-COOH´gen: hepta-carboxiporfirinógeno; 6-COOH´gen: hexa-carboxiporfirinógeno y 5-COOH´gen: penta-carboxiporfirinógeno. Cuatro moléculas de PBG luego se condensan en forma repetitiva cabeza-cola, con eliminación de amonio, para formar un tetrapirrol lineal inestable denominado hidroximetilbilano (HMB). Esta reacción es catalizada por la enzima PorfobilinógenoDeaminasa (PBG-D; EC.4.3.1.8). El gen que la codifica contiene 15 exones, y mapea en el cromosoma 11 (Wang et al., 1981; Gill et al., 2009). 20 Introducción El HMB sirve como sustrato para la Uroporfirinógeno III-Sintetasa (URO-S; EC.4.2.1.75) o Isomerasa, que cataliza la conversión del tetrapirrol a Uroporfirinógeno III (UROgen III) por inversión del anillo D del HMB, seguido por el cierre del macrociclo en forma asimétrica (Stella et al., 1971). También puede ocurrir la ciclación simétrica espontánea del HMB pero su producto, el UROgen I, es fisiológicamente inactivo y sólo se acumula en el organismo en condiciones patológicas. La URO-S humana, según su estructura cristalina es un homodímero, codificado por un único gen con 10 exones localizado en el cromosoma 10 (Aizencang et al., 2000; Mathews et al., 2001). El complejo de ambas enzimas, Deaminasa e Isomerasa, se conoce con el nombre de Porfobilinogenasa (PBGasa) (Llambías & Batlle, 1971; Mazzetti & Tomio, 1988, 1990, 1993, 1997). El UROgen III se convierte en coproporfirinógeno III (COPROgen III) por la decarboxilación secuencial de cuatro grupos acetilos. La decarboxilación del UROgen III comienza en el anillo asimétrico D y procede en el sentido de las agujas del reloj formando intermediarios de siete, seis, cinco y cuatro carboxilos (Batlle & Grinstein, 1962; San Martín de Viale & Grinstein, 1968a; Jackson et al., 1976). Esta reacción es catalizada por la enzima Uroporfirinógeno-Decarboxilasa (URO-D; EC.4.1.1.37) cuya estructura es un homodímero, con un sitio activo en cada monómero (San Martín de Viale, 1969; Straka & Kushner, 1983; Whitby et al., 1998; Chaufan et al., 2005). En humanos la codifica un único gen en el cromosoma 1 (Dubart et al., 1986). El UROgen I también puede ser decarboxilado a COPROgen I en etapas, como la serie isomérica III, pero a menor velocidad así como también lo hace el UROgen II y IV (San Martín de Viale et al., 1976). La serie isomérica I se acumula en ciertas porfirias (San Martín de Viale & Grinstein., 1968b). Sólo el isómero COPROgen III puede continuar en el camino de la síntesis del hemo. El COPROgen III es transportado a la mitocondria, y allí la enzima Coproporfirinógeno-Oxidasa (CPO; EC.1.3.3.3) decarboxila oxidativamente dos grupos propiónicos en las posiciones 2 y 4 de los anillos A y B para dar dos grupos vinilo, produciendo el Protoporfirinógeno IX (PROTOgen IX) (Batlle et al., 1965; Jackson et al., 1980). La enzima está localizada en el espacio intermembrana de la mitocondria, y existen formas oxígeno dependiente y oxígeno independiente que catalizan la misma 21 Introducción reacción (Sorianello & Mazzetti, 2000a; 2000b). Los mamíferos y otros eucariotas superiores utilizan solamente la forma oxígeno dependiente. La enzima es un homodímero (Martasek et al., 1997) y el gen que la codifica está localizado en el cromosoma 3 (Cacheux et al., 1994) El PROTOgen IX se oxida a protoporfirina IX (PROTO IX) por la acción de la enzima Protoporfirinógeno IX-Oxidasa (PPO; EC.1.3.3.34). La eliminación de los seis hidrógenos requiere oxígeno como aceptor de electrones terminal. La enzima se sintetiza en el citosol y luego es transportada a la superficie exterior de la membrana mitocondrial interna. Funciona como un homodímero y el gen humano de la PPO se localiza también en el cromosoma 1 (Roberts et al., 1995). La última etapa de este camino ocurre en la superficie interna de la membrana mitocondrial, donde la enzima Ferroquelatasa (FQ; EC.4.99.1.1), cataliza la inserción de un ión ferroso en el anillo porfirínico de la PROTO IX (Ríos de Molina et al., 1989). La FQ humana es un homodímero oligomérico, sulfhidrílica y está asociada a la membrana mitocondrial interna (Harbin & Dayley, 1985). El gen humano de FQ fue clonado y mapeado en el cromosoma 18 (Whitcombe et al., 1991). Una vez formada la molécula de hemo su destino será, como ya fue señalado, formar parte de las diferentes hemoproteínas, como la hemoglobina, mioglobina, grupo prostético de los citocromos y enzimas tales como peroxidasas, catalasa, triptófano pirrolasa, etc. 1.1.2. Alteraciones en el camino del hemo. Porfirias crónicas y agudas Las porfirias son fallas comúnmente hereditarias del metabolismo del hemo, conforman un conjunto heterogéneo de enfermedades metabólicas con expresión clínica variada y se originan como consecuencia de la hipoactividad congénita o adquirida de alguna de las enzimas que participan de este camino metabólico. Según cual sea la enzima del camino dañada, es el tipo de porfiria que se origina. Bioquímicamente, las porfirias se caracterizan por la producción excesiva de porfirinas o sus precursores. Existen dos tipos de manifestaciones clínicas que pueden presentarse separada o 22 Introducción conjuntamente: ataques neuro-viscerales agudos, asociados con el incremento de ALA y PBG; y/o signos cutáneos que resultan de la fotosensibilización de las porfirinas acumuladas, en circulación o depositadas en la piel. Se han descripto mutaciones en todos los genes que codifican para las enzimas biosintéticas del hemo menos para el de ALAS-1, y las enfermedades que resultan de estas mutaciones se las conoce en general como porfirias (Elder, 1998a). En la forma eritroide-específica del gen ALAS-2, se han encontrado mutaciones, generando en algunos casos anemia sideroblástica ligada al cromosoma X. Las porfirias y otros trastornos afines, están asociados con deficiencias de las otras siete enzimas y se ha caracterizado detalladamente la patología para cada una de ellas (Batlle, 1997; Schüller & Enriquez de Salamanca, 2000) 1. Porfiria por Deficiencia de ALA-D (AD-P o Porfiria de Doss). Es una porfiria hepática rara, producida por la deficiencia autosómica recesiva de la enzima ALA-D. Las manifestaciones clínicas de estos pacientes son variadas. En unos casos, el cuadro clínico reproduce al de la porfiria aguda intermitente y en otros, se expresa en forma de una poli-neuropatía motora. En esta variedad de porfiria no existen lesiones hepáticas. La excreción urinaria de ALA está elevada pero la de la PBG es normal (Gross et al., 1998). 2. Porfiria Aguda Intermitente (PAI). Es una enfermedad hepática originada por la deficiencia congénita de la PBG-D. Se transmite de forma autosómica dominante con penetrancia variable y se caracteriza clínicamente por originar crisis agudas intermitentes de síntomas abdominales y neuro-psíquicos y por la excreción urinaria elevada de ALA y PBG. Es una de las porfirias más graves que puede llevar al coma y a la muerte. Tampoco en esta forma de porfiria existen lesiones hepáticas (Song et al., 2009). En nuestro país la PAI es la porfiria hepática aguda más frecuente, con una prevalencia de 1/125.000 (Parera et al., 2003). 3. Porfiria Congénita Eritropoyética (PCE o Porfiria de Günther). Es una porfiria por deficiencia muy profunda de la actividad de la URO-S. Se caracteriza bioquímicamente por una elevadísima excreción urinaria de porfirinas de la serie isomérica I (San Martín de Viale & Grinstein, 1968b). Se la considera extremadamente rara. Es la menos frecuente (300 casos en todo el mundo). La herencia es de carácter 23 Introducción autosómico recesivo. Los síntomas se presentan en los primeros meses de vida. Las lesiones son intensas, con dolorosas erosiones y cicatrizaciones reiteradas que pueden terminar en atrofia epidérmica, esclerodermia, destrucciones óseas y cartilaginosas, por lo que se la conoce también como porfiria mutilante. Otro signo característico es la eritrodoncia (coloración marrón oscuro de los dientes de leche, por el acúmulo de porfirinas). En ocasiones coexiste con una anemia hemolítica (Madan et al., 2007). En general se practica esplenectomía durante el tratamiento. 4. Porfiria Cutánea Tarda (PCT) es una enfermedad de etiología heterogénea, originada por una baja actividad de la enzima URO-D. Esta enzima es la responsable de que el uroporfirinógeno (UROgen) III y también de las series I, II y IV (Aragonés et al., 1972), pierdan sucesivamente un carboxilo de cada uno de sus cuatro radicales acetilos de sus anillos pirrólicos, comenzando por el D y siguiendo el movimiento de las agujas del reloj (Figura 1.2). Consecuentemente se acumulan porfirinas, preferentemente uroporfirina (URO), hepta-carboxiporfirina (HEPTA) y COPRO en hígado y piel, lo que a su vez se traduce clínicamente en una hipersensibilidad del órgano a la luz y a los microtraumatismos (Anderson, 2007). Es la forma de porfiria más frecuente, aunque su prevalencia varía mucho de un país a otro. En varios países europeos se sitúa alrededor de 1/5.000 habitantes, mientras que en los Estados Unidos es de 1/25.000. Su incidencia en Inglaterra es de 2 a 5/1.000.000/año. Dentro de las porfirias cutáneas, la PCT es la porfiria más frecuente en la Argentina (1/37.000) (Méndez et al., 2005). La enfermedad es más usual en los hombres que en las mujeres. Cuando ocurre en ellas, es común que estén sometidas a tratamiento con estrógenos. Otros factores desencadenantes y/o exacerbantes, aparte de los estrógenos son: el alcohol, la sobrecarga de hierro, los compuestos clorados (San Martín de Viale, 1979; Smith & De Matteis, 1990). Se han diferenciado tres formas etiopatogénicas principales de PCT: Tipo I o esporádico. Representa el 70 al 80% de todos los casos. Es de aparición tardía, no existen antecedentes familiares y la actividad de la enzima está disminuida sólo en el hígado. En esta forma de porfiria no se han identificado mutaciones genéticas que justifiquen la baja actividad enzimática. La causa del defecto enzimático en este tipo de PCT es oscura. Se supone que la siderosis, la toma de estrógenos, el alcohol, el tabaco, la infección por el virus de 24 Introducción la hepatitis C (VHC) y el de la inmunodeficiencia humana (VIH) o la existencia de una hepatopatía crónica, son factores implicados en este defecto (Egger et al., 2002). En la mayoría de los pacientes con PCT, existen indicios de un metabolismo anormal del hierro. Se supone que el hierro puede determinar la formación del radical hidroxilo (OH•) y que éste contribuye a la oxidación del UROgen a URO y determina la formación de inhibidores, aún no caracterizados de la URO-D. Los hidrocarburos aromáticos polihalogenados (PAHs) actuarían como inductores de la isoforma CYPIA2, la cual oxidaría el UROgen a URO y daría lugar también a la formación de inhibidores de la URO-D. El alcohol podría contribuir favoreciendo el depósito de hierro, induciendo la formación de especies reactivas de O2 (ROS) de los CYP o como causante de hepatopatía. El mecanismo de esta relación con el descenso de la actividad de la URO-D es incierto. En raras ocasiones, varios pacientes de la misma familia presentan una porfiria con estas mismas características. En estos casos se habla de PCT del tipo III. Se desconoce la naturaleza del defecto hereditario responsable de este tipo de PCT. Tipo II o familiar. Enfermedad autosómica dominante. Representa el 2030% de todos los casos. En estos pacientes la actividad URO-D está disminuida al 50% de su actividad normal, no sólo en el hígado sino también en el resto de los tejidos, incluídos los hematíes. Afecta a varios miembros de una misma familia, aunque su penetrancia es baja, por lo que su expresión clínica ocurre sólo en el 10% de los casos. El descenso de actividad de la URO-D en la PCT del tipo II se justifica por la existencia de mutaciones en el gen de esta enzima, que determinan que su cantidad en tejidos esté muy disminuida. Entre estos enfermos, se han identificado al menos 115 mutaciones diferentes en el gen de URO-D (http://www.hgmd.cf.ac.uk/ac/index.php) localizado en el cromosoma 1p34. La mayoría de esas mutaciones son puntuales, aunque también hay algunas deleciones e inserciones. La presencia de siderosis, abuso alcohólico, tabaco, estrógenos, etc, contribuye también a favorecer la expresión clínica de esta enfermedad (Medina et al., 2000). La Porfiria Hepato-Eritropoyética (HEP) de Piñol-Aguadé representa la variedad homocigótica o doble heterocigótica, de la PCT del tipo II. En ella, la actividad de la URO-D es extremadamente baja 25 Introducción (con un remanente del 3-27%), no sólo en el hígado sino también en la médula ósea (Lim & Poh-Fitzpatrick, 1984). Tipo tóxica. En el hombre se han descripto casos, a veces con carácter epidémico, de PCT en sujetos expuestos a diferentes agentes químicos como hidrocarburos aromáticos polihalogenados (hexaclorobenceno, HCB; 2,3,7,8tetraclorodibenzo-p-dioxina: TCDD; di- y tri-clorofenol). Estas sustancias pueden inhibir la URO-D y son capaces de reproducir la enfermedad en animales de experimentación (De Matteis, 1998; Billi et al., 2000b; Rozman et al., 2001; Cochón et al., 2005; San Martín de Viale, 2007) 5. Coproporfiria hereditaria (CPH). Es una porfiria poco frecuente determinada genéticamente, heredada con carácter autosómico dominante, originada por la deficiencia de la CPO mitocondrial. Clínicamente se expresa por cuadros agudos similares a los que aparecen en la PAI y en algunas ocasiones, por lesiones cutáneas parecidas a las de la PCT. Es característico que la COPRO en heces esté muy elevada (Lee et al., 2005). 6. Porfiria Variegata (PV). La PV es una enfermedad autosómica dominante originada por un descenso de la actividad de la PPO, que se expresa clínicamente por fotosensibilidad de la piel, crisis agudas neuroviscerales y por excreción fecal elevada de PROTO IX, COPRO III y porfirina-X (Qin et al., 2011). En estos enfermos, no suele haber lesiones hepáticas. Es una enfermedad frecuente en la población blanca de Sudáfrica y en el norte de Europa. En Argentina, está entre las dos porfirias agudas más frecuentes, luego de la PAI, y su frecuencia es de 1/600.000 (Parera et al., 2003). 7. Protoporfiria Eritropoyética (PPE). La PPE es una porfiria hereditaria producida por una actividad deficiente de la ferroquelatasa (FQ), última enzima de la biosíntesis del hemo. Como consecuencia se produce la acumulación de PROTO IX en piel, médula ósea, eritrocitos, plasma, hígado y heces (Kappas et al., 1989). Las dos manifestaciones clínicas más importantes son la fotosensibilidad y la enfermedad hepatobiliar, ambas asociadas a las anormalidades bioquímicas. 26 Introducción Las porfirias denominadas agudas (AD-P, PAI, CPH, PV) son las más riesgosas, pues pueden llevar a desenlaces fatales y son las más susceptibles al desencadenamiento y exacerbación por drogas y factores metabólicos. Estos pueden disparar manifestaciones clínicas, como resultado de un desbalance por la enzima deficiente en la vía (San Martín de Viale, 2007). Todas son hepáticas, inducibles y se caracterizan por síndromes neuro-psiquiátricos con manifestaciones desde depresión hasta franca psicosis, acompañadas por severos dolores abdominales, disturbios motores, parálisis respiratoria y colapso cardiovascular (Kappas et al., 1995). El síndrome neuropsiquiátrico ocurre solamente en porfirias en las cuales hay inducción del ALA-S hepático y consiguiente aumento del ALA y PBG. Los ataques característicos se precipitan por drogas tales como barbitúricos, ayuno y hormonas (Elder, 1998a; Thadani et al., 2000; Thunell, 2000). Los ataques de porfiria hepática aguda inducible se tratan generalmente discontinuando la exposición a los agentes de precipitación, con infusiones de hemo, y/o sobrecarga de carbohidratos. El hemo reprime directamente su propia biosíntesis en un proceso de retroalimentación negativa (May et al., 1995). Los carbohidratos se dan típicamente como infusión de glucosa concentrada, y los mecanismos subyacentes de su efecto benéfico, aun no se han comprendido. Dentro de las porfirias hepáticas crónicas, la PCT es el tipo más difundido y se caracteriza por excreción urinaria aumentada de porfirinas altamente carboxiladas: uroporfirinas (8-COOH) y firiaporfirinas o hepta-carboxiporfirinas (7-COOH), fotosensibilidad en las áreas expuestas de la piel, hiperpigmentación e hipertricosis entre otras (Kappas et al, 1995). Aunque no está definitivamente probado, personalidades históricas parecen haber sufrido de porfiria, incluyendo al Rey George III (Macalpine & Hunter, 1966), Friedrich Wilhelm I de Prussia (Pierach & Jennewein, 1999), y Vincent van Gogh (Loftus & Arnold, 1991). En la Figura 1.3 pueden verse distintos tipos de porfirias con sus respectivos bloqueos enzimáticos, tanto en porfirias hereditarias como en adquiridas por inducción con diferentes drogas. Dependiendo específicamente del defecto enzimático, se pueden 27 Introducción observar diversos patrones de superproducción, acumulación, y excreción de intermediarios de la biosíntesis del hemo. 1.1.3. Porfirias experimentales inducidas por compuestos porfirinogénicos. La capacidad de una droga para precipitar una porfiria depende de su capacidad para iniciar la transcripción de ALA-S y para inhibir su control fisiológico por retroalimentación negativa, que se realiza mediante el pool de hemo regulatorio (San Martín de Viale, 2007). Desde hace más de medio siglo es sabido que ciertas drogas pueden alterar la regulación de la biosíntesis del hemo en el hígado de animales de laboratorio y humanos (Nielsen, 1953) causando una condición de porfiria hepática que se caracteriza por la acumulación de metabolitos de dicho camino, como son las porfirinas y los precursores ALA y PBG. Como resultado de la acción de algunos de estos compuestos, se produce una disminución de los depósitos de hemo hepático, por aumento en su degradación o represión de su síntesis, lo que causa acumulación y excreción en exceso de algunos intermedios del camino. Por tanto, se genera una deficiencia aguda de hemo, marcada de-represión de la enzima ALA-S y exacerbación de la producción de precursores del camino en el hígado, generando ataques de porfiria (Tschudy & Bonkowsky, 1972). Juegan un papel central las enzimas dependientes del CYP. Más de la mitad de las drogas prescriptas, son metabolizadas por oxidación en el hígado a través de un sistema de oxidasas de función mixta, entre las cuales las enzimas CYP son miembros importantes. Xenobióticos tóxicos son también metabolizados por este sistema esencial para la supervivencia de todos los organismos. Dentro de la familia de los CYP existen entre 30 y 100 diversos subtipos, todas con diferentes afinidades por su sustrato. Las isoenzimas encargadas de metabolizar xenobióticos, pertenecen a las familias de los CYP 1, 2, 3 y 4, varios de los cuales responden a la asociación de un ligando con el incremento de sus velocidades de transcripción (Dickins, 2004). Otras sustancias actúan como sustratos suicidas dando origen a la destrucción de la enzima CYP y de su componente hemo (Marks, et al., 1988, Ortiz de Montellano & Correia, 1995). Hay así 28 Introducción drogas que tienen capacidad para inducir y otras de destruir los CYP, en base a ello se las clasifica. Otro factor importante es la lipofilicidad de la droga, para atravesar las membranas lipídicas y alcanzar el retículo endoplásmico y así los CYP. Figura 1.3: Mecanismo porfirinogénico de drogas a través de su interacción con el CYP y bloqueos enzimáticos en porfirias humanas. AD-P: Porfiria por deficiencia de ALA-D; AIA: 2-alil-2isopropilacetamida; ALA-S: ácido δ-aminolevulínico (ALA)-sintetasa, ALA-D: ALA-dehidrasa; CAR: Receptor Constitutivo de Androstano; CPH: Coproporfiria Hereditaria; DDC: 3´,5´-dietoxicarbonil-1,4dihidrocolidina; FB: fenobarbital; FQ: ferroquelatasa; HCB: hexaclorobenceno; HPE: Porfiria Hepato Eritropoyética; PAI: Porfiria Aguda Intermitente; PBG-D: porfobilinógeno-deaminasa; PCE: Porfiria Congénita Eritropoyética; PCT: Porfiria Cutánea Tarda; PPE: Protoporfiria Eritropoyética; PV: Porfiria Variegata; PXR: Receptor de Pregnano-Xenobióticos; RXR: Receptor de ácido RetinoicoXenobióticos; URO-D: uroporfirinógeno-decarboxilasa. Desde hace más de cien años se sabe que ciertas drogas precipitan ataques de esta enfermedad. Se trata, no sólo de drogas terapéuticas, sino también de drogas de uso industrial o doméstico. El concepto de inducción química de la porfiria se originó a partir de 1889, cuando se comenzaron a utilizar el sulfonal, trional y tetronal como sedantes, lo que provocó un brote masivo de porfiria aguda, enfermedad hasta entonces desconocida (With, 1971). Más tarde se desencadenaron casos semejantes, y aún fatales 29 Introducción de dicha enfermedad, con la administración de barbitúricos y altas dosis de Sedormid (Schmid & Schwartz, 1952), pasando luego por los episodios masivos de Turquía ocurridos durante 1956, en los que el HCB indujo cuatro mil casos de PCT por ingestión de pan contaminado (San Martín de Viale, 1979; Gocmen et al., 1989). Un logro muy importante en la elucidación del mecanismo de inducción de porfirias por drogas, fue el hallazgo de Granick & Urata (1963) que encontraron la actividad hepática de la enzima ALA-S francamente aumentada en una porfiria experimental causada por 3´,5´-dietoxicarbonil-1,4-dihidrocolidina (DDC), hallazgo que luego se extendió a la porfiria experimental causada por 2-alil-2-isopropilacetamida (AIA) (Marver et al., 1966) y por otras drogas (Nakao et al., 1967; De Matteis & Gibbs, 1972). La enzima ALA-S es el paso limitante del camino y también el sitio donde el hemo ejerce su control por un mecanismo de retroalimentación negativa (Sassa & Granick, 1970). El mecanismo por el cual cada una de las diferentes drogas estimula la actividad del ALA-S hepático no es completamente claro. Hay que hacer una especial distinción entre drogas que aumentan marcadamente la actividad de esta enzima e inducen porfiria y otras que causan poca estimulación de su actividad, sin un acúmulo importante de porfirinas en hígado (De Matteis, 1971). Ejemplos de drogas del primer grupo, son los compuestos porfirinogénicos AIA, DDC y griseofulvina (Gris). En la fracción microsomal del hígado se observa una caída transitoria en la concentración del CYP y del hemo luego de la administración de alguna de estas drogas en animales de experimentación, que coincide con el aumento de la actividad de la enzima ALA-S. Esto sugiere que dichas drogas porfirinogénicas pueden estimular marcadamente la actividad de la enzima por disminución de la concentración del hemo hepático, de tal modo que reducirían el normal control por retroalimentación. Con el compuesto porfirinogénico AIA, se sabe que la pérdida del hemo es debida por un lado, al aumento de su destrucción y por el otro, a la conversión del mismo en pigmentos verdes (De Matteis, 1971; Meyer & Marver, 1971). El grupo alilo de la molécula de esta droga parece ser importante tanto en la destrucción del hemo hepático como en la inducción de la actividad de ALA-S, posiblemente luego de su metabolización, en un derivado reactivo (Abbritti & De Matteis, 1972). Aunque en la 30 Introducción fracción microsomal es donde se da la mayor destrucción del hemo, también ha sido observada su desaparición en la fracción citosólica y mitocondrial, lo que concuerda con el hallazgo de inducción de la actividad de ALA-S por AIA en ambos sitios (Hayashi et al., 1969). 1.1.4. HCB -Mecanismo porfirinogénico. Efectos sobre CYP y su metabolismo. Figura 1.4: Estructura química del HCB Químicamente la sigla HCB, corresponde a la denominación del hexaclorobenceno (C6Cl6) como se ve en la Figura 1.4. Es un hidrocarburo aromático policlorado, altamente lipofílico, producido como un sub-producto o impureza en la fabricación de compuestos clorados y de varios pesticidas registrados (ATSDR, 2002). El HCB se halla entre los más persistentes contaminantes ambientales que pueden viajar miles de millas (Fisher, 1999), y se bioacumula en el ambiente, en animales y en humanos (Courtney, 1979). Tanto en humanos (intoxicaciones accidentales), como en animales (modelos experimentales de PCT), se ha visto que este compuesto clorado genera una importante inhibición de la enzima URO-D (San Martín de Viale et al., 1975, 1977), lo que conlleva a un bloqueo del camino del hemo, con inducción de la actividad ALA-S y acúmulo de precursores, especialmente de porfirinas altamente carboxiladas (8-y 7COOH) de la serie isomérica III (San Martín de Viale et al., 1970; Elder et al., 1976, Wainstok de Calmanovici et al., 1984). Nuestro laboratorio fue el primero en demostrar dicho bloqueo, punto clave de la desregulación del camino del hemo, en este tipo de porfirias inducidas. 31 Introducción Una llamativa evidencia epidemiológica fue encontrada en estudios hechos sobre una población expuesta vía oral, al HCB en Turquía. En los años cercanos a 1950, la ingestión de pan hecho de granos que habían sido tratados con HCB, causó una epidemia en esta región. La dosis ingerida de HCB fue estimada en el un rango de 0,05– 0,2 g/día, equivalente a 0,7–2,9 mg/kg/día para una persona de mediana edad. Un índice extremadamente alto de mortalidad (del 95%) ocurrió en infantes por debajo de los 2 años de edad, que habían sido amamantados con leche de las madres que habían ingerido el pan contaminado. Los infantes envenenados exhibieron una condición conocida como pembe yara o "daño rosa" debido a las lesiones de piel. Las muertes infantiles fueron asociadas sobre todo a fallas cardio-respiratorias. HCB ha demostrado ser causa de muerte, y puede generar perturbaciones a diversos niveles (Ezendam et al., 2004). Se registraron efectos inmunotóxicos no solo en las víctimas del envenenamiento turco, sino también en trabajadores ocupacionalmente expuestos en Brasil. Niveles elevados de IgM e IgG fueron observados, así como deterioro de la función granulocítica (Queiroz et al., 1998). Un número limitado de estudios ocupacionales ha asociado la inhalación del HCB con efectos en el hígado, específicamente con porfirinas aumentadas y en mayor grado con carcinoma hepatocelular (Sunyer et al., 2002), efectos inmunológicos (actividad disminuida de neutrófilos, inmunoglobulinas aumentadas y susceptibilidad a infección), efectos renales, como la microproteinuria (Queiroz et al., 1997; Seldén et al., 1999) y efectos en tiroides (niveles disminuidos de tiroxina con hipotiroidismo, bocio y cáncer de la tiroides) y desarrollo deteriorado de habilidades locomotoras en infantes. En ratas, el HCB induce porfiria hepática y efectos neurotóxicos (Courtney, 1979), además de efectos sobre el sistema reproductivo (Jarrell et al., 1998), la función tiroidea (Kleiman de Pisarev et al., 1990), y el sistema inmune (Vos, 1986; Michielsen et al 1999). Los órganos blancos más sensibles son el hígado, ovario y el sistema nervioso central. Estudios con animales de investigación indican que la absorción de HCB por ingestión a través de la vía gastrointestinal es variable, dependiendo del solvente utilizado como vehículo para su administración. En vehículos acuosos la absorción es de alrededor de un 6 %, mientras que con vehículos aceitosos la absorción puede llegar 32 Introducción hasta un 82 %. El HCB es particularmente tóxico para el feto y posteriormente para el neonato, a través de la ingestión de leche materna (ATSDR, 1996). Una vez absorbido, el HCB se distribuye en órganos y tejidos con alto contenido lipídico, aumentando su concentración con el correr de los años por bioacumulación. Es lentamente metabolizado a pentaclorofenol por el sistema hepático del CYP en sus isoformas 3A1, A2 y A4 (den Besten et al., 1993), conjugado con glutation (GSH) para dar pentaclorotiofenol, o declorinado reductivamente para formar pentaclorobenceno. El pentaclorofenol se convierte posteriormente en tetraclorohidroquinina (Mehmood et al., 1996). La eliminación del HCB del organismo, se produce por vía urinaria, mayoritariamente como metabolitos del mismo, siendo el pentaclorofenol (en un 50%) y el pentaclorobenceno (en un 25%) los predominantes. En menor medida se encuentran metabolitos como el tetraclorobenceno, tetraclorofenoles, tetraclorohidroxiquinonas, y triclorofenol, entre otros (ATSDR, 1996). Estudios en seres humanos y en animales sostienen claramente que el HCB causa porfiria. En mujeres embarazadas que habían sido expuestas al igual que en niños, se evidenció sugestiva pero no concluyentemente, altas incidencias de abortos y de bebes muertos durante el parto. De igual manera se ha estimado en estudios animales que las ratas en desarrollo expuestas de forma crónica exhibieron una respuesta aumentada similar a los animales adultos; y que las ratas expuestas de manera aguda exhibieron porfiria aún hasta 500 días después de la exposición. No se encuentra descripto ningún estudio respecto a efectos sobre la salud en seres humanos o en animales expuestos por la piel al HCB. Varios estudios realizados en animales han demostrado la capacidad del HCB, como del TCDD y otros bifenilos policlorados, para inducir una porfiria que se asemeja a la PCT humana (De Matteis et al, 1961; San Martín de Viale et al., 1970; San Martín de Viale et al., 1977; Smith & De Matteis, 1980; Elder, 1998b). El hígado es el órgano blanco de la acción porfirinogénica del HCB, y es sobre todo en este órgano donde el HCB induce la acumulación de porfirinas altamente carboxiladas, debido a la una marcada reducción en la actividad de la enzima URO-D (San Martín de Viale et al., 1970; Elder et al., 1976; San Martín de Viale et al., 1976a, 1976b, 1977). Al respecto, cabe mencionar que las ratas hembras son mucho más sensibles que los machos a los 33 Introducción efectos porfirinogénicos del HCB (San Martín de Viale et al., 1970; Smith et al., 1979; Wainstok de Calmanovici et al., 1991). En relación a ello, nuestro laboratorio fue el primero en demostrar la dependencia de sexo para la inducción de porfiria por HCB. Sobre el tema, se ha informado que el 17-β-estradiol y las drogas que contienen estrógenos, juegan un papel relevante en el desarrollo de la porfiria inducida por HCB en ratas (San Martín de Viale et al., 1968, 1976a; Grant et al., 1975; Smith & Francis, 1981). El grupo de investigación de Legault et al. (1997), demostró que el dimorfismo sexual en la porfiria inducida por HCB en ratas, está relacionado con la presencia de 17-β-estradiol y que ambos sexos tienen la capacidad para responder cuando está presente el estado hormonal adecuado. Los autores sugieren que la hormona actúa exacerbando la inhibición URO-D. Además, se ha informado que hembras pertenecientes a diferentes cepas de ratas, no son igualmente susceptibles para adquirir porfiria inducida por HCB (Wainstok de Calmanovici et al., 1989; Legault et al., 1997). Como ya es conocido, el hierro juega un rol en el desarrollo de la porfiria inducida por HCB (De Matteis & Stonard, 1977; Smith et al., 1979). Así, el contenido de hierro hepático se incrementa en el tratamiento de ratas con HCB (Hanstein et al., 1981; Wainstok de Calmanovici et al., 1985). La sobrecarga de hierro acelera y exacerba la porfiria inducida por HCB (Taljaard et al., 1971; Smith & Francis, 1983). Además el más alto contenido de hierro no hémico, ha sido señalado como la causa de la susceptibilidad diferente entre dos cepas de ratas para adquirir porfiria por HCB (Smith et al, 1979). Otro rasgo característico de esta porfiria experimental es el gran retraso en su desarrollo (Courtney, 1979; Stonard et al., 1998). Además, el HCB es un inductor de las isoenzimas del CYP (Wainstok de Calmanovici et al., 1984), que participan en el sistema de metabolización de drogas (ATSDR, 2002) y ha sido demostrado que después de un largo plazo de exposición, el HCB produce hepatomas, hemangio-hepatomas y carcinoma hepatocelular en varios especies de roedores (Smith & Cabral, 1980; Smith et al., 1985; Ertürk et al., 1986). Se ha obtenido una gran cantidad de información sobre los efectos del HCB en el metabolismo del hemo (Mylchreest & Charbonneau, 1977; Gocmen et al., 1986; Billi de Cattabi et al., 2000a) y si bien el mecanismo de acción de este fungicida en la inducción de la porfiria no es totalmente claro, se conoce bastante 34 Introducción del mismo. Para que el HCB ejerza su acción porfirinogénica, es decir produzca porfiria, es necesario que se metabolice a través del CYP (Wainstok de Calmanovici et al., 1984). Y como ya se ha mencionado, la enzima blanco del HCB en la biosíntesis del hemo, es la URO-D. El bloqueo de la URO-D es debido a la acción de un inhibidor de esta enzima. Ríos de Molina et al., (1980) fueron los primeros en informar su presencia. Deriva del UROgen por oxidación de las ROS. El hierro y la isoforma CYP1A2 están involucrados en este proceso. El inhibidor tiene bajo peso molecular (PM < 2.000), no tiene espectro ni fluorescencia de porfirinas (Billi de Catabbi, Fuentes, San Martín de Viale, no publicado). Es más polar que las porfirinas, ya que tiene cargas negativas. Su estructura no está definida. Ha habido varias propuestas para este: oligopirrol poli-carboxilado, di-o tetrahidroporfirinas, uroporfirina peroxilada y/o hidroxilada (Cochón et al., 2005). El inhibidor se une a las argininas que están relacionadas con la actividad de la URO-D, a través de sus cargas negativas, alterando la adecuada orientación para la decarboxilación (Ríos de Molina et al., 1980; Billi de Catabbi, 1999). Así, bloquea el acceso de los sustratos a las histidinas del sitio activo de la URO-D, enmascarando la carga positiva que es necesaria para que el UROgen se una a la enzima. Sobre esta base, el mecanismo de la porfiria inducida por HCB sería el siguiente: HCB dispararía un proceso de oxidación centrado en el hierro celular hepático junto con la inducción de CYP1A (Smith & De Matteis, 1980), que oxidarían al UROgen transformándolo en uroporfirina y en el inhibidor de URO-D (Fig.1.5). En este sentido, se informó que el CYP1A2 es esencial en el proceso que conduce a la porfiria inducida por HCB y que la contribución de otras formas del CYP (2B y 3A) inducidas por esta droga, parece ser mínima (Sinclair et al., 2000). Se han propuesto dos fases en este mecanismo de inducción de esta porfiria experimental (Stonard et al., 1998): (a) una etapa temprana relacionada con la oxidación de UROgen a uroporfirina (CYP-dependiente); (b) una etapa posterior relacionada con la oxidación del UROgen a inhibidor de la URO-D, CYP-dependiente (asistida por hierro). Además, se ha propuesto que el HCB puede actuar como una droga soluble en lípidos que se une a citocromos y no se metaboliza rápidamente, por lo tanto produce desacoplamiento en la cadena de transporte de electrones (ETC) de la actividad 35 Introducción monooxigenasa, favoreciendo consecuentemente la producción de ROS (Ferioli et al., 1984). Al respecto, Billi de Catabbi et al., (1997) detectaron aumentos en los niveles de las ROS en fases tempranas de la intoxicación por HCB. Estas ROS atacan al UROgen dando el inhibidor, que causa la inhibición de la actividad URO-D y produce peroxidación sobre los lípidos. Estas ROS podrían también contribuir al descenso de URO-D por el ataque a su estructura proteica, oxidando las histidinas del sitio activo, distorsionando así el centro activo de la enzima (Chaufan et al., 2005). Todo esto produciría la acumulación de UROgen que es secundaria y es consecuencia de la inhibición de URO-D, incrementando la oxidación del UROgen y la generación del inhibidor, logrando finalmente una inhibición de URO-D auto-perpetúante (Elder, 1998b). De este modo, en etapas posteriores se produce un incremento en los niveles de porfirinas, ya que la ruta metabólica del hemo se desregula, debido a que el descenso en la actividad de URO-D supera el 50%, produciendo así una inducción de la enzima ALA-S, enzima regulatoria y limitante del camino del hemo (Wainstok de Calmanovici et al., 1984). Esta situación da lugar a una fuerte acumulación de UROgen que no es metabolizada, sino que es fácilmente oxidada en el ambiente oxidativo creado por el HCB (Figura 1.5). El tiempo necesario para llegar a este proceso auto-perpetuante estaría relacionado y explicaría el retraso en el establecimiento y aparición de la porfiria inducida por HCB (Billi de Catabbi et al., 2000a). Este retraso es un rasgo característico de dicha porfiria experimental. El ambiente oxidativo provocado por HCB no sólo ataca al UROgen sino también a otros blancos celulares como lípidos, produciendo peroxidación; al DNA, dando lugar a derivados como la 8-OH-desoxiguanosina (Horváth et al., 2001); y proteínas, produciendo su carbonilación (Berlett & Stadtman, 1997). 36 Introducción Sustratos endógenos (Uro´ gen ?) (CYP 1A2 + Fe3+) Figura 1.5: Esquema del mecanismo porfirinogénico propuesto para el HCB (modificado a partir de Billi et al., 1997) CYP: citocromo P-450; ROS: especies reactivas de oxígeno; s: semanas desde el tratamiento con HCB; (-) regulación negativa; Flechas hacia arriba: incrementos inducidos por HCB; Flechas hacia abajo: disminuciones inducidas por HCB en niveles o actividades. En cuanto a los daños irreversibles producidos por HCB, se ha informado que la inactivación de URO-D es auto-perpetuante a menos que la formación de ROS sea prevenida por la remoción del hierro (Elder, 1998b). En este sentido, cabe mencionar 37 Introducción que el tratamiento con desferrioxamina, un quelante de hierro, mejora notablemente el cuadro bioquímico de la porfiria inducida por HCB (Wainstok de Calmanovici et al., 1986). El metabolismo del hemo y en especial la enzima URO-D, están implicados en la génesis de la manifestación clínica de este tipo de porfiria. Las alteraciones causadas por el fungicida en el metabolismo de otros compuestos tales como lípidos han sido también investigadas en un modelo experimental de PCT (Billi de Catabbi et al., 1997) afectando a fosfolípidos y eicosanoides (Billi de Catabbi et al., 2000a, 2005; Cochon et al., 2001, 2005). El HCB afecta también a proteínas unidas a membrana y produce cambios en la fosforilación de las mismas (Randi et al., 1998). Por otra parte Kleiman de Pisarev et al., (1990) informan que el tratamiento con HCB afecta la función tiroidea y el metabolismo de la tiroxina. Sin embargo, poco se sabe sobre el efecto que el HCB tiene en metabolismo de los hidratos de carbono. Si consideramos todo lo antedicho, el efecto de esta droga porfirinogénica en diversos metabolismos y dado que el HCB genera una porfiria experimental similar a la causada por TCDD, otros bifenilos policlorados y a la PCT humana, parece importante analizar la relación entre la porfiria y las alteraciones causadas por esta droga en diversas etapas del metabolismo glucídico. 1.1.5. AIA. Mecanismo porfirinogénico: sus efectos sobre CYP y sobre el ALA-S. Figura 1.6: Estructura química de la 2-alil-2-isopropilacetamida. La 2-alil-2-isopropilacetamida (AIA; C8H15NO, PM: 141,21) es una acetamida que contiene un grupo alilo (Figura 1.6) y causa una importante destrucción del hemo hepático, particularmente del hemo del CYP (De Matteis, 1971; Smith & De Matteis, 38 Introducción 1980) por N-alquilación de su grupo prostético (hemo), convirtiéndolo en pigmentos verdes anormales llamados N-alquil-porfirinas. Se sabe que el AIA en roedores induce una patología química que modela una porfiria aguda humana (Granick, 1966; Marver et al., 1966). Este desarreglo en el metabolismo de las porfirinas se produce por el agotamiento del hemo y como consecuencia de este agotamiento, el aumento de la actividad ALA-S por su derepresión (Moses et al., 1970; Meyer & Marver, 1971; Whiting & Granick, 1976). Esto lleva a la acumulación de los precursores ALA y PBG en el hígado y excreta en exceso de los mismos en orina, generándose así un modelo de porfiria aguda en animales (Smith & De Matteis, 1980; Marks et al., 1988). El ALA-S se considera que es la principal enzima regulatoria de la biosíntesis de porfirinas (Tschudy et al., 1972), y su inducción eleva la concentración de ALA muy por encima de los valores normales. La siguiente enzima en la secuencia metabólica, el ALA-D, transforma el exceso de ALA en PBG, con el resultado neto de un aumento en la concentración de los dos precursores porfirínicos, parte de los cuales se excreta en la orina. En 1973, Tomaro & Frydman describen por primera vez a la enzima PBG oxigenasa y su inducción por AIA. Este novedoso tipo de oxidasa aislada a partir de fuentes vegetales y animales, oxida el PBG a 5-oxo-2-hidroxi-PBG, un metabolito que no sigue el camino de las porfirinas. La PBG-oxigenasa aislada de hígado de rata o bien de germen de trigo, se describió como una proteína catiónica, dependiente de hierroazufre que presenta una cinética alostérica y una estructura multimérica. La administración de AIA por tanto, no sólo induce el ALA-S en ratas, sino que también induce la PBG-oxigenasa. La máxima inducción de esta última, es coincidente en el tiempo con el pico de excreción del PBG, y tiene una separación temporal de la máxima actividad del ALA-S. Los datos sugieren que la inducción secuencial de ALAS y PBG-oxigenasa podría implicar una respuesta metabólica para el problema de la formación excesiva de PBG en inducción experimental por AIA. Otros investigadores han demostrado en tratamientos realizados sobre embriones de pollo, que el AIA, el DDC y el fenobarbital (FB) promueven niveles extremadamente 39 Introducción elevados de ALA-S, acumulación de porfirinas y marcada elevación en el nivel del CYP, (Brooker et al., 1983). El mismo trabajo muestra, que por criterios físicos e inmunológicos, la isoforma CYP inducida por dichos fármacos es idéntica. Datos de hibridación demostraron que el mRNA inducido es idéntico a la sonda de cDNA clonada para realizar el estudio. Los 3 fármacos, aunque estructuralmente diferentes, inducen las misma isoforma de CYP, llamada 2H10. El 2-acetilaminofluoreno (2-AAF), que es un potente hepatocarcinógeno, induce la actividad de la CYP monoxigenasa y en gran medida es similar a la inducida por el tratamiento con las drogas antedichas (Gupta & Abou-Donia, 1998). Esto es de particular importancia en estudios donde se observa cómo las drogas precipitan ataques de porfiria hepática aguda y se está trabajando en avanzar sobre la investigación del mecanismo molecular del efecto de diversas drogas de uso farmacéutico en dichas inducciones. También Schoenfeld et al., (1985) realizaron un estudio en células hepáticas de embriones de pollo, y observaron que existía una reducción en presencia de glucosa, de la inducción del ALA-S por AIA. Asimismo, Rose et al., (1961) encontraron que altas dosis de glucosa prevenían el desarrollo de la porfiria experimental inducida por AIA, mientras que la grasa no tenía efecto alguno. Polo et al., (1988) publicaron un modelo de porfiria aguda con inhibición de la enzima PBG-D por AIA y glicerina, pero los animales morían en el transcurso de una hora. Luego se desarrolló un modelo de porfiria a largo plazo, mediante la administración de los mismos fármacos que utilizó Polo (AIA y glicerina) pero en dosis más bajas para evitar la precoz mortalidad de los animales. Se encontró que la administración del compuesto porfirinogénico AIA a ratas macho Wistar (1 dosis/7 días/4 semanas) no constituía un modelo experimental aceptable de porfiria aguda intermitente (PAI) ya que no conseguía provocar hipoactividad de la enzima PBG-D. En otros aspectos, Lafta et al., (2008) indagaron acerca del efecto de la acetamida, en la absorción de hierro en ratones. Se investigó que tanto el AIA como la succinil acetona (SA), tienen efectos característicos sobre el metabolismo del hemo. La SA, es un metabolito anormal de la vía metabólica de la tirosina, y se produce en exceso en pacientes con tirosinemia hereditaria tipo-1. Se comprobó que la inhibición de la síntesis del grupo hemo con SA, se asocia con un aumento de la absorción de hierro, 40 Introducción mientras que la estimulación de la síntesis del hemo con AIA se asocia con una disminución de la absorción del mismo. Los cambios en los niveles de ALA parecen funcionar como moduladores en la absorción de hierro, pero el mecanismo de este efecto queda aún sin esclarecerse. 1.1.6. DDC. Mecanismo porfirinogénico: sus efectos sobre CYP y sobre la FQ Figura 1.7: Estructura química del DDC El 3´,5´-dietoxicarbonil-1,4-dihidrocolidina (DDC, C14H21NO4; PM 267,32), es un compuesto que contiene grupos metílicos (Figura 1.7) y produce una disminución significativa en el pool de hemo y un aumento de la actividad ALA-S, que conduce también a la acumulación del precursor de la vía, ALA. Posee la propiedad combinada de destruir selectivamente al CYP por N-alquilación de su grupo prostético hemo, convirtiéndolo a N-metil protoporfirina, y de impedir la síntesis de hemo causando la acumulación de PROTO IX. En efecto, esa misma N-metil-PROTO es la que actúa como poderoso inhibidor a nivel de la actividad FQ, enzima terminal de la síntesis (Marks et al., 1988). Se ha comprobado que el que metila, es el grupo 4-Me del DDC. Como consecuencia, hay inducción de ALA-S, acumulación y excreción en exceso de PROTO, así como también de precursores, por lo que su uso estaría modelando una porfiria aguda del tipo PV (Smith & De Matteis, 1980; Marks et al., 1988). Comparte el mismo mecanismo porfirinogénico y modela el mismo tipo de porfiria que la griseofulvina (Gris), ya que se ha sugerido que uno de los grupos metilos de la molécula de Gris cumpliría también la misma función anteriormente indicada (Navone et al., 1991). Estos tóxicos actúan como sustratos suicidas del CYP porque son sustratos y producen un inhibidor para la misma enzima que las metaboliza (Ortiz de Montellano & Correia, 1983). 41 Introducción Embriones de pollo, ratas, ratones y conejos, han sido usados para ensayar la capacidad porfirinogénica de diferentes drogas. El embrión de pollo in ovo ha sido muy usado para este fin, ya que se ha sugerido que refleja mejor la susceptibilidad humana a la exacerbación de la porfiria clínica por drogas, que las especies mamíferas (Cochón et al., 1997). La administración a embriones de pollo, ratas o ratones de pequeñas dosis de DDC junto con el compuesto a ser examinado, ha sido usada por ciertos investigadores como un modelo muy sensible para estudiar la capacidad porfirinogénica de diversas drogas (Cochón et al., 1997). Los inactivadores irreversibles del CYP actúan por unión covalente del inhibidor, o del fragmento derivado de él, al nitrógeno pirrólico del grupo prostético hemo de la enzima. Esta N-alquilación del hemo autocatalizada, es el resultado del metabolismo oxidativo de los CYP por olefinas terminales como AIA, secobarbital y los compuestos con grupos alilos, como dialilsulfuro y dialilsulfona que dan origen a los históricos pigmentos verdes que fluorescen rojo, y también del metabolismo de los acetilenos terminales, dihidropiridinas como (DDC) y dihidroquinolinas, alquil y aril hidracinas e hidrazonas (San Martín de Viale, 2007). Además, la intoxicación con DDC imita las alteraciones hepatocelulares asociadas al alcoholismo y se caracteriza por la aparición de agregados citoplásmicos de distintos tamaños (cuerpos de Mallory-Denk, o MDBs) que contienen proteínas del citoesqueleto (Denk et al, 2000; Zatloukal et al., 2007; Cochón et al., 2010). Alteraciones del citoesqueleto muy similares a las observadas en la hepatitis alcohólica humana, también puede ser inducida en ratones por intoxicación crónica con Gris, la otra droga porfirinogénica recién nombrada (Denk et al, 1975; Katsuma et al, 1987). 1.2. METABOLISMO DE LOS HIDRATOS DE CARBONO, SU REGULACIÓN Generalidades Las cuatro clases principales de moléculas orgánicas en sistemas vivos son las proteínas, los lípidos, los ácidos nucleicos y los carbohidratos. Estos últimos forman el grupo de compuestos orgánicos más abundantes de la naturaleza, y casi todos los 42 Introducción organismos los sintetizan y metabolizan (Wade, 2005). El término carbohidrato se debe a que los azúcares más simples tienen la fórmula empírica CnH2nOn, (con n ≥ 3), lo que sugiere que los átomos de carbono están de alguna manera combinados con el agua. Así, los químicos se refieren a estos compuestos como hidratos de carbono o carbohidratos. Las plantas verdes y las bacterias los producen en el proceso de fotosíntesis, durante el cual absorben el CO2 del aire y por acción de la energía solar generan principalmente glucosa, necesaria para producir energía en forma de ATP. En las plantas, la celulosa es el principal polisacárido estructural. En los animales invertebrados, la quitina es el principal componente del exoesqueleto. Y en los vertebrados, las capas celulares de los tejidos conectivos también contienen hidratos de carbono. De los glúcidos más sencillos (monosacáridos), el más importante es la glucosa (Figura 1.8). De fórmula C6H12O6, la glucosa es un sólido cristalino de color blanco que se caracteriza por tener una función hidroxilo (-OH) típica de los alcoholes, en cada uno de los carbonos excepto en el primero, donde aparece una función aldehído (Ghazarian et al., 2011). La glucosa, se oxida para formar CO2 y agua, suministrando energía para todos los procesos celulares (síntesis, movimiento celular, transporte, etc.). Figura 1.8: Estructuras en cadena recta y en anillo del la α-D y β-D glucosa. La glucosa es el principal combustible de los músculos y otras partes del organismo y se metaboliza para obtener energía a través de la respiración celular. Está presente en todas las células, desde los microorganismos hasta los vertebrados superiores. La regulación de su concentración y distribución constituye uno de los procesos más importantes que hace posible la vida. Tanto las plantas como los animales, pueden unir numerosas moléculas de glucosa para formar moléculas de almacenamiento de energía más grandes. Sin embargo, las moléculas de glucosa pueden estar enlazadas también para formar una 43 Introducción variedad de otras macromoléculas. La celulosa, por ejemplo, se compone de moléculas de glucosa unidas entre sí a través de enlaces β-1,4-glucosídicos. También, como en el caso del almidón, las glucosas pueden estar unidas a través de enlaces α-1,4; mientras que los enlaces glucosídicos de glucógeno son del tipo α-1,4 y α-1,6. El glucógeno es la principal forma en que se almacena la glucosa en vertebrados tanto en el hígado como en el tejido muscular esquelético. Se encuentra en mayor proporción en el primero (hasta 6% de su peso) y en el músculo, que rara vez excede el 1%. Sin embargo, debido a su mayor masa, el músculo almacena tres a cuatro veces más cantidad de glucógeno como reserva que el hígado. Su estructura es muy semejante a la amilopectina, salvo que es mucho más ramificado (una ramificación cada 8 o 12 unidades de glucosa (Figura 1.9). Figura 1.9: Estructura básica del glucógeno, un polímero ramificado de α-glucosas con uniones α-1,4 donde las cadenas laterales se encuentran cada 8-12 moléculas de la cadena lineal, unidas en forma α- 1,6. Cuando existe una disminución significativa de glucosa en sangre, el glucógeno es degradado por medio de una serie de enzimas, para cubrir las necesidades energéticas del organismo. El metabolismo hepático y en menor grado el renal de grasas y ciertas proteínas, generan energía para el desarrollo de la gluconeogénesis, proceso por el cual se sintetizan moléculas de glucosa partiendo de precursores no glucídicos en animales en estado de ayuno, sin más reservas de glucógeno por degradar. 1.2.1 Metabolismo de la glucosa La homeostasis de la glucosa está finamente regulada para satisfacer las demandas energéticas durante los ciclos de ayuno/alimentación en los animales. Aunque la grasa y las proteínas se pueden movilizar desde el tejido adiposo y el músculo para suministrar energía a diversos órganos durante ayunos prolongados, las células rojas de la sangre y el cerebro necesitan de la glucosa como fuente de combustible. Durante condiciones de 44 Introducción alimentación, la insulina se secreta desde las células β-pancreática en respuesta al elevado nivel de glucosa en plasma. Las células β-pancreática poseen una maquinaria que sensa rápidamente el aumento de glucosa en plasma durante el período posprandial. Esta maquinaria incluye canales de potasio sensibles al ATP que proporcionan factores de acoplamiento, para gatillar la exocitosis de insulina (Maechler & Wollheim, 2001). El pegado de la insulina al receptor en la membrana plasmática de las células blanco, es decir, del músculo, tejido adiposo e hígado, resulta en la rápida absorción de glucosa en estas células (Saltiel & Kahn, 2001). En el músculo esquelético, la glucosa se almacena en forma de glucógeno a través de la glucogenogénesis, mientras que en el tejido adiposo, la glucosa se convierten en triglicéridos a través de la síntesis de ácidos grasos de novo. En el hígado, la insulina inhibe la glucógenolisis y la gluconeogénesis mientras que estimula la glucólisis y la síntesis de glucógeno y triglicéridos (Saltiel & Kahn, 2001). Por lo tanto, el resultado de la acción de la insulina es la reducción de los niveles plasmáticos de glucosa en el cuerpo. Durante la inanición, cuando el nivel de glucosa es bajo, las células α-pancreáticas secretan el glucagón que estimula la movilización de la grasa del tejido adiposo hacia el músculo esquelético para la βoxidación. En el hígado, el glucagón y los glucocorticoides (GC) estimulan la glucogenólisis para suministrar glucosa a las células rojas de la sangre y el cerebro, mientras que el efecto a largo plazo de estas hormonas, es la estimulación de la gluconeogénesis hepática (Jiang & Zhang, 2003). Varios grupos de investigación han demostrado que el hígado, además de ser un órgano que genera glucosa, también es un órgano que la capta, en respuesta a un aumento de la concentración de azúcar en sangre por sobre los niveles fisiológicos. Al consumir glucosa, y luego de la absorción de la misma por diferentes tejidos, aproximadamente el 60% quedará almacenada en el hígado para su posterior utilización (Ferrannini et al., 1980). Una vez que la glucosa es incorporada en el hígado o tejido muscular, lo hace como glucosa 6-fosfato (G6P), este es el paso inicial en el metabolismo de la glucosa. La fosforilación para formar G6P está catalizada por la enzima hexoquinasa (HK; EC.2.7.1.1). 45 Introducción 1.2.2 Gluconeogénesis: Las enzimas claves. La gluconeogénesis es la formación de glucosa a partir de precursores no glucosídicos como el piruvato, lactato, glicerol y aminoácidos glucogénicos, excepto la leucina y la lisina (Fig. 1.10). Esta vía bioquímica se produce principalmente en el hígado y es esencial para la supervivencia durante el ayuno, tratando de mantener con ello, las concentraciones de glucosa en sangre dentro de los límites fisiológicos para el funcionamiento óptimo de todo el organismo. También juega un papel importante en la eliminación de lactato y el mantenimiento de la disponibilidad de glucosa durante el ejercicio (Corssmit et al., 2001). El principal punto de entrada a esta vía es el piruvato, que en la mitocondria se carboxila a oxalacetato. En el citosol, el oxalacetato se descarboxila y fosforila para formar fosfoenolpiruvato (PEP). Cualquiera de los intermediarios del ciclo de Krebs se puede utilizar como fuente de carbono para esta vía metabólica. Los ácidos grasos de cadena impar proporcionan un esqueleto de carbonos que derivarán en acetil-CoA y succinil-CoA (este último es sustrato gluconeogénico, por ser intermediario del ciclo de Krebs). Algunos tejidos, requieren un aporte continuo de glucosa. Esta se obtiene a partir del glucógeno proveniente del hígado, el cual solo puede satisfacer dichas necesidades durante el tiempo que tarda en agotarse dicho polisacárido alli almacenado (aproximadamente entre 8-10hs). Posteriormente, comienza la formación de glucosa por neosíntesis, a partir de sustratos diferentes al glucógeno. 46 Introducción Figura 1.10. Vías gluconeogénica/glucolítica y el ciclo de los ácidos tricarboxílicos (TCA). El lactato y la alanina, productos de la glucólisis anaeróbica y la degradación de proteínas, se convierten a piruvato que luego es carboxilado por la piruvato carboxilasa (PC) a oxalacetato. El oxalacetato se convierte en malato por la malato deshidrogenasa mitocondrial (MDH) en el ciclo de los TCA. El malato mitocondrial pasa al citoplasma donde se oxida a oxalacetato por la MDH citosólica dependiente de NAD. El malato se convierte finalmente en fosfoenolpiruvato (PEP) por la fosfoenolpiruvato carboxiquinasa (PEPCK). La conversión de múltiples pasos desde el PEP al producto final glucosa, a través de la inversión de las reacciones de la glucólisis, requiere de las enzimas gluconeogénicas, fructosa-1,6-bisfosfatasa (FBPasa1) y glucosa-6-fosfatasa (G6Pasa), para evitar las reacciones glucolítica catalizadas por la fosfofructoquinasa (PFK) y hexoquinasa (HK). El glicerol obtenido a partir de la hidrólisis de los triglicéridos (TG) también puede entrar en la vía de la gluconeogénesis a través de la conversión a dihidroxiacetatofosfato (DHAP). ALT, alanina-aminotransferasa; CS, citrato sintasa; G3P (o GAP), gliceraldehído-3-fosfato; IDH, isocitrato deshidrogenasa; α-KDH, α-cetoglutarato deshidrogenasa; LDH, lactato deshidrogenasa; PDH, complejo piruvato deshidrogenasa; PK, piruvato quinasa; SDH, succinato deshidrogenasa; FFA, ácidos grasos libres. Se destacan algunas de las enzimas de la gluconeogénesis en violeta y de las glucolíticas en rojo (Adaptado de Jitrapakdee, 2012). 47 Introducción La gluconeogénesis requiere cuatro enzimas adicionales que evitan las tres reacciones irreversibles catalizadas por las enzimas glucolíticas: piruvato quinasa (PK; EC.2.7.1.40); fosfofructoquinasa-1 (PFK1; EC.2.7.1.11) y hexoquinasa (HK; EC.2.7.1.1). Estas cuatro enzimas gluconeogénicas son la piruvato carboxilasa (PC; EC.4.6.1.1); la fosfoenolpiruvato carboxiquinasa (PEPCK; EC. 4.1.1.32); la fructosa1,6-bisfosfatasa (FBPasa-1; EC.3.1.3.11), y la glucosa-6-fosfatasa (G6Pasa; EC.3.1.3.9). La gluconeogénesis y la glucólisis están normalmente reguladas en forma recíproca, de modo que una de las vías está detenida cuando la otra está muy activa. La actividad de esta vía va a depender principalmente de la concentración de glucagon circulante. Esta hormona posee la capacidad de estimular su actividad mediante el despliegue de 3 reacciones: i- Cambios en los efectores alostéricos: en presencia del glucagon se disminuye la concentración de la fructosa-2,6-bisfosfato (F2,6-BP), por lo que se inhibe la PFK1 y se activa la FBPasa1, esto se debe a la fosforilación ejercida por parte de la proteinquinasa A (PKA) sobre la enzima PFK-2 (EC.2.7.1.105). En cambio, cuando la glucosa abunda, el nivel elevado de F2,6-BP inhibe la gluconeogénesis y activa la glucólisis. ii- Modificaciones covalentes de la actividad enzimática: el glucagon desencadena el aumento de la concentración de AMPc; por lo que se impulsa la actividad quinasa de las proteínas dependientes de AMPc. Así, se fosforila la PK inactivandola, permitiendo de esta forma dirigir el PEP hacia la síntesis de glucosa. iii- Inducción de la síntesis de enzimas: El glucagon estimula la actividad de la PEPCK gracias a que favorece el incremento de la trascripción del gen que codifica para dicha enzima. De igual forma cobra gran importancia en la regulación de la gluconeogénesis, la disponibilidad de sustratos específicos de este proceso: i- Disponibilidad de sustrato: ante la concentración disminuida de insulina, se produce la movilización de aminoácidos que provienen de las proteínas musculares que van serán utilizados como precursores de la gluconeogénesis. 48 Introducción ii- Activación alostérica por acetil–CoA: la acetil-CoA en el período de ayuno favorece la activación alostérica de la PC, debido a que en el hígado se acumulan ácidos grasos como resultado de la lipólisis excesiva en tejido adiposo. Así, se aumenta la formación de acetil-CoA por la acción de la beta oxidación de estos ácidos. iii- Inhibición alostérica por el AMP: activa la PFK1 e inhibe a la F1,6-BPasa. Elevadas concentraciones de AMP estimulan así la ruta de la glucólisis. Algunas enzimas que participan en la vía glucolítica, también lo hacen en la gluconeogénesis, pero ambas rutas se diferencian por tres reacciones irreversibles que utilizan enzimas específicas en cada proceso. En la gluconeogénesis, estas reacciones son las que catalizan la: i) conversión de piruvato a PEP (a través de PC y PEPCK); ii) la conversión de G6P a glucosa (por la G6Pasa); y iii) la de F1,6BP a F6P (por la acción de la FBPasa 1). i-Conversión de piruvato a PEP (a través de las enzimas PC y PEPCK) El oxalacetato es intermediario en la producción del PEP en la gluconeogénesis. La conversión de piruvato a PEP se lleva a cabo en dos pasos (Fig 1.11). La enzima que cataliza esta primera reacción es la PC, una enzima alostérica que se encuentra en la mitocondria. Esta, cataliza la reacción de piruvato (derivado de la alanina, vía AAT, o del lactato, mediante la LDH y CO2), para dar oxalacetato (Utter & Keech, 1960). Este paso requiere energía, la cual queda disponible por hidrólisis de un ATP. La PC de diversos orígenes, como ya fue explicado es activada alostéricamente por acetil-CoA (Scrutton et al., 1965). Cuando hay más acetil-CoA del necesario para mantener el ciclo del ácido cítrico, el piruvato se dirige hacia la gluconeogénesis. El ion magnesio y la biotina son necesarios para una catálisis eficaz. La biotina, enlazada covalentemente con la enzima, reacciona con el CO2, que se une de manera covalente. Después el CO2 se incorpora al piruvato, formando así el oxalacetato. 49 Introducción Fig 1.11. Las dos etapas en la conversión del piruvato a PEP; la primera implica la carboxilación del piruvato a oxalacetato consumiendo ATP y realizada por la enzima PC; luego la decarboxilación y fosforilación del oxalacetato hacia PEP, consumiendo GTP, por la enzima PEPCK. Esta enzima también juega funciones no gluconeogénicas, tal como la lipogénesis y la gliceroneogénesis en tejido adiposo blanco (Reshef et al., 2003); la síntesis de glutamato en astrocitos (Hertz et al., 1999) y la secreción de insulina en células β-pancreáticas inducidas por glucosa (Jitrapakdee et al., 2006, 2008; Hasan et al., 2008). En la rata y el ratón, el gen de la PC está regulado por dos promotores alternativos (Jitrapakdee et al., 1997, 2001), mientras que en humanos (Wang et al., 2008) el gen está regulado por tres promotores. El uso de promotores alternativos resulta en la producción de transcriptos alternativos con diferentes regiones 5´ no codificantes (Jitrapakdee et al., 1997, 2001). En las ratas, el promotor proximal se activa bajo condiciones gluconeogénicas y lipogénicas (en hígado y tejido adiposo, respectivamente), mientras que el promotor distal se activa durante la secreción de insulina inducida por glucosa en células β-pancreáticas (Jitrapakdee et al., 1998). La enzima PEPCK, realiza el segundo paso, catalizando la conversión de oxalacetato a PEP (Hanson & Reshef, 1997). Esta reacción también incluye la hidrólisis de un nucleósido-trifosfato, en este caso el GTP en vez del ATP. Hay dos formas de PEPCK, la citosólica y la mitocondrial, que son codificadas por dos genes nucleares diferentes (Hanson & Reshef, 1997). La PEPCK mitocondrial convierte fácilmente el oxalacetato formado en la mitocondria a PEP. Con el fin que el oxalacetato entre en el citosol, donde es sustrato para la PEPCK citosólica, éste es 50 Introducción convertido primero en malato por la malato deshidrogenasa (MDH; EC.1.1.1.37) mitocondrial. El malato es exportado al citosol, donde se convierte de nuevo a oxalacetato por la MDH citosólica. Se propone que la PEPCK mitocondrial sostiene la gluconeogénesis a partir del lactato, mientras que la PEPCK citosólica lo haría a partir de los aminoácidos glucogénicos (Hanson & Reshef, 1997). A diferencia de la mayoría de las enzimas metabólicas, PEPCK no está sujeta a regulación alostérica u otra del tipo postraduccional, sino que es controlada de forma multi-hormonal a nivel transcripcional, como se evidencia por la presencia de elementos de respuesta en su promotor a insulina, que inhibe la síntesis proteica; y a glucocorticoides, cAMP y hormona tiroidea que la activan (Hanson & Reshef, 1997; Yang et al, 2009a, 2009b). En contraste con la PEPCK citosólica, la regulación de la transcripción en la PEPCK mitocondrial es casi desconocida. ii-Conversión de G6P a glucosa (a través de la enzima G6Pasa) El sistema enzimático de la glucosa-6-fosfatasa (G6Pasa) comprende: la actividad fosfatasa con su sitio activo sobre el lado citosólico; el transportador de la G6P (T1); el transportador de la glucosa (T2) y el transportador del fosfato inorgánico (T3), los cuales están unidos al retículo endoplásmico (RE) (Mithieux, 1997). La importancia de su localización microsomal está dada por la función característica del hígado y riñón, que es sintetizar glucosa para exportarla a los tejidos a través de la circulación sanguínea. El transportador T1, funciona trasladando G6P del citosol al RE. La G6Pasa cataliza la hidrólisis dependiente de Mg2+, partiendo de G6P para dar glucosa y Pi, en lo que es la etapa final de la gluconeogénesis. La glucosa es luego transportada por el RE y la membrana plasmática, a través del transportador T2, liberando desde éste la glucosa a circulación. La G6Pasa se expresa predominantemente en el hígado y el riñón, pero también puede expresarse a menor nivel en los intestinos. Al igual que PEPCK, la G6Pasa está regulada a nivel transcripcional, pero no post-traduccional. El promotor de la G6Pasa contiene múltiples sitios de unión a factores/co-activadores de transcripción sensibles a hormonas (Hutton & O'Brien, 2009). 51 Introducción La regulación de la gluconeogénesis hepática se puede controlar a través de mecanismos pre- y post-traduccionales. Los controles post-traduccionales incluyen la regulación del suministro de sustrato y la regulación alostérica de la actividad enzimática, mientras que el control pre-traduccional se consigue a través de factores de transcripción que median la activación y la represión de genes que codifican a las enzimas gluconeogénicas (Corssmit et al, 2001) La expresión de los mRNA que codifican estos diversos factores de transcripción y sus actividades, está controlada por insulina y glucagón, lo que explica por qué la gluconeogénesis en si, esté hormonalmente regulada. Han sido identificados sitios de unión para múltiples factores de transcripción en regiones promotoras de genes que codifican para las enzimas gluconeogénicas, lo que sugiere la interacción cooperativa de los factores de transcripción durante el ayuno, induciendo el aumento de la expresión génica de la gluconeogénesis (Klover & Mooney, 2004). iii-Conversión de F1,6BP a F6P (a través de la enzima FBPasa 1) La reacción en la glucólisis llevada a cabo por la fosfofructoquinasa 1 (PFK1; EC. 2.7.1.11) es esencialmente irreversible, debido a que está impulsada por la transferencia de un fosfato del ATP. La reacción que tiene lugar en la gluconeogénesis para evitar este paso, consiste en una simple reacción hidrolítica, catalizada por la fructosa-1,6 bisfosfatasa (FBPasa 1) que permite la conversión de F1,6BP a F6P. La enzima tiene múltiples subunidades y requiere de la presencia de Mg2+ para su actividad, constituyendo uno de los lugares de control donde se regula la ruta de la gluconeogénesis. La FBPasa-1 se expresa principalmente en la hígado y es inhibida alostéricamente por fructosa-2,6-bisfosfato, que es producida por el complejo enzimático bifuncional fosfofructoquinasa2/fructose-2,6-bisfosfatasa (PFK-2; EC.2.7.1.105/ FBPasa-2; EC. 3.1.3.46) (O'Brien & Granner, 1996). Aunque las regiones promotoras del gen de la FBPasa-1 han sido clonadas, la información disponible es limitada con respecto a los elementos que actúan en cis, y que median la regulación transcripcional de esta enzima bajo diversas condiciones fisiológicas (El-Maghrabi et al, 52 Introducción 1991; Herzog et al, 2000). La F6P formada en la reacción experimenta posteriormente la isomerización a G6P por la acción de la fosfoglucoisomerasa (PGI; EC.5.3.1.9). Entonces, las hormonas que regulan esta ruta metabólica son: el glucagón, la insulina y las catecolaminas, y lo hacen controlando la expresión génica de algunas enzimas claves. El glucagón durante el ayuno, estimula esta vía aumentando la expresión de la PEPCK y de la FBPasa1, e inhibiendo la expresión de la PFK1, PK y la PFK2, mientras que la insulina, inhibe a estas últimas ante el aumento en la ingesta de alimentos. El efecto de las catecolaminas depende del estado nutricional del organismo. La inanición aumenta la acetil-CoA que estimula la PC y por lo tanto la gluconeogénesis; la elevación de alanina y glutamina estimulan también esta vía. El cortisol aumenta la disponibilidad de sustrato y la F2,6BP inhibe a la FBPasa1. 1.2.3 Glucólisis: descripción de los pasos de la vía. La glucólisis es el primer paso de la respiración celular y consiste en una serie de reacciones que ocurren en el citoplasma de la célula y por las cuales, a partir de una molécula de glucosa, se producen dos moléculas de piruvato. Todos los organismos llevan a cabo este proceso. La glucólisis se divide en dos partes; en la primera la molécula de glucosa se divide en dos moléculas de gliceraldehido-3-fosfato (GAP) y en la segunda estas dos moléculas se convierten en dos moléculas de piruvato (Figura 1.12). Durante la glucólisis se producen dos moléculas de ATP. A esta vía también se la conoce como ciclo de Embden-Meyerhof. Está catalizada por 11 enzimas, todas de localización citoplasmática. En los primeros pasos se requiere del aporte de energía, abastecido por el acoplamiento con el sistema ATP/ADP. El ATP reacciona con la glucosa desprendiéndose un grupo fosfato que se ensambla para producir G6P + ADP. Esta reacción es catalizada por la enzima, hexoquinasa (HK-GK, EC.2.7.1.1). La molécula se reorganiza en un anillo pentagonal, con ayuda de la enzima fosfoglucoisomerasa (PGI, EC.5.3.1.9), obteniéndose F6P. La reacción puede seguir ambas direcciones, dependiendo de las concentraciones de los intermediarios. La siguiente acción es catalizada por una 53 Introducción enzima alostérica fosfofructoquinasa (PFK1), para dar la F1,6BP. El ATP actúa como efector alostérico, inhibiéndo la actividad enzimática. Figura 1.12 Camino de la glucólisis: La glucólisis es una via metabólica en la que un mol de glucosa es catabolizado a dos moles de piruvato, NADH y ATP: Glucosa + 2ATP + 2NAD++ 2Pi -> 2 Piruvatos + 4ATP + 2NADH + 2H+. En condiciones aerobicas, el piruvato se oxida adicionalmente por enzimas mitocondriales a CO2 y H2O. La glucólisis puede ser separada generalmente en dos fases, la de generación de precursores y la de producción de energía. La primera fase utiliza dos moles de ATP para convertir la glucosa en fructosa-1,6-bisfosfato. En la segunda fase, la fructosa-1,6-bifosfato es convertida adicionalmente por etapas en piruvato con la producción de cuatro moles de ATP y dos moles de NADH. ENO1, enolasa1; GAPD, gliceraldehido-3-fosfato deshidrogenasa; GPI, glucosa-6- fosfato isomerasa; HK, hexoquinasa; LDH, lactato dehidrogenasa; PFK, fosfofructoquinasa; PGK, fosfoglicerato quinasa; PGM, fosfoglicerato mutasa; PK, piruvato quinasa; TPI, triosa fosfo isomerasa. 54 Introducción La interacción entre la PFK1 y la F6P es el principal mecanismo regulador de la glucólisis. Si existe ATP en cantidades adecuadas para la vida normal de la célula, este inhibe la actividad de la enzima cesando la producción de ATP y se conserva la glucosa. Si la concentración de ATP es baja, la enzima se desinhibe y continúa la degradación de la glucosa. Luego la F1,6-BP se escinde en dos moléculas de tres carbonos cada una: la dihidroxiacetona fosfato (DHAP) y el gliceraldehído 3-fosfato (GAP). Ambas son isómeros que pueden transformarse una en otra por acción de una enzima fosfogluco-(hexosa)-isomerasa (PGI; EC.5.3.1.9). Toda la DHAP se convierte eventualmente en GAP. A partir de este punto en las reacciones, debemos multiplicar por dos los productos obtenidos para tener en cuenta el destino de una molécula de glucosa. Cada GAP se oxida, con ayuda de la enzima gliceraldehido 3-fosfato deshidrogenasa (GAPD, EC.1.2.1.9), la cual reduce el NAD+ en NADH. Esta es la primera reacción en la que la célula obtiene energía conservándose parte de ella en la unión de un grupo fostafo con GAP, el que se transforma en 1,3-difosfoglicerato (1,3diPGA). La enzima fosfoglicerato quinasa (PGK, EC.2.7.2.3) libera un fosfato del 1,3diPGA, generando una molécula de ATP. Como esta reacción es muy exergónica, impulsa a todas las reacciones previas para que avancen. El grupo fosfato remanente se transfiere de la posición 3 a la 2 mediante la acción enzimática de la fosfogliceromutasa (PGM, EC.5.4.2.1). Se pierde una molécula de agua del compuesto y mediante este reordenamiento interno, la molécula con ayuda de la enzima enolasa (ENO1; EC.4.2.1.11) concentra energía en la vecindad del grupo fosfato. El fosfato se transfiere a una molécula de ADP, obteniéndose una molécula de ATP y un piruvato. Esta reacción, catalizada por la piruvato quinasa (PK), impulsa a las dos reacciones precedentes. Así, de una molécula de glucosa se obtiene de forma neta, dos moléculas de ácido pirúvico, dos moléculas de ATP y dos moléculas de NADH. 1.2.3.1. Paso final de la Glucólisis. Regulación de la piruvato quinasa (PK) Las reacciones catalizadas por la HK, PFK1 y PK suceden con pérdida de energía libre. Estos pasos exergónicos de la glucólisis, son los candidatos ideales en la regulación de la vía. De hecho, estudios in vitro han demostrado que las tres enzimas 55 Introducción están alostéricamente controladas (Pinilla et al., 1982). Sin embargo la regulación de la HK, no es un punto de control tan importante para la glucólisis. Esto es debido al hecho de que grandes cantidades de G6P derivan directamente de la degradación del glucógeno (el mecanismo predominante de entrada de carbohidratos a la glucólisis desde el músculo esquelético) y por lo tanto, la reacción de dicha enzima es prácticamente redundante. Como fue explicado precedentemente, la piruvato quinasa (PK; EC. 2.7.1.40), cataliza la transformación de PEP y ADP, en piruvato y ATP (Kayne, 1973). La enzima, que aparece en todas las células vivas, es clave en esta ruta primordial del metabolismo de carbohidratos. La regulación de la PK es muy importante para frenar la glucólisis, cuando el ATP se encuentra en suficiente concentración para abastecer las necesidades celulares, con el fin de poder activar la gluconeogénesis (Valentini et al., 2000). Existen cuatro isoformas distintas de PK en los tejidos humanos (Hall & Cottam 1978; Consler et al., 1989) codificados por dos genes diferentes. Uno se encuentra en el cromosoma 1, identificado como el gen PKLR (Tani et al., 1987) y expresado en el hígado como proteína PKL y en eritrocitos como PKR. La expresión de ambas proteínas es dependiente de elementos promotores tejido-específicos, sobre dicho gen (Kahn, 1998). El otro gen de la PK está localizado en el cromosoma 15 y codifica dos proteínas identificadas como PKM1 y PKM2. La designación PKM refleja el hecho de que a la enzima se la pensó originalmente como una expresión específica de músculo. Las dos isoformas PKM, son el resultado del splicing alternativo del gen PKM (Noguchi et al., 1986). Ahora se sabe que la mayoría de los tejidos expresan tanto la isoforma PKM1 como PKM2. PKM1 se encuentran en numerosos tejidos diferenciados normales, mientras que PKM2 se expresa en la mayoría de las células proliferativas. Todos los tipos de cáncer que han sido examinados para la expresión PK, muestran el patrón de expresión de la isoforma PKM2. En efecto, la expresión de PKM2 genera una vía diferenciada de oxidación de la glucosa a lactato en células cancerosas (Zwerschke et al., 1999; Oehler et al., 2000). El isoforma PKL hepática ha sido la más estudiada in vitro. Esta enzima es inhibida por ATP y acetil-CoA y es activada por F1,6BP (Kawaguchi et al., 2001). La 56 Introducción inhibición de la PK por ATP es similar al efecto del ATP en la PFK1. La unión del ATP al sitio de regulación, reduce su afinidad por el PEP (Mattevi et al., 1996). La enzima hepática también es controlada a nivel de síntesis. El aumento de la ingestión de hidratos de carbono induce a la síntesis de PKL que produce elevados niveles de la misma en las celulas (Bizeau et al., 2001). Con dietas ricas en carbohidratos, se puede inducir hasta 10 veces la concentración de PK, en comparación con dietas pobres en carbohidratos. La regulación de PKL es característica de un tejido gluconeogénico, y se regula a través de la fosforilación por la PKA o fosfoquinasa A. Sin embargo las isoenzimas tipo M, no se ven afectadas por ese mecanismo. Como consecuencia de estas diferencias, los niveles de glucosa en sangre y las hormonas asociadas pueden regular el balance de la gluconeogénesis y de la glucólisis hepática, mientras que el metabolismo muscular no se vería afectado. La deficiencia de PK, debida a una mutación genética, origina alteraciones, únicamente en el metabolismo de los eritrocitos, porque estas células no son capaces de compensar el defecto enzimático aumentando la síntesis de enzima mutada ni utilizar otras rutas degradativas (Demina et al., 1999). Los eritrocitos de los individuos afectados tienen una capacidad reducida para producir ATP y por lo tanto no tiene suficiente ATP para realizar actividades tales como bombeo de iones o mantener el equilibrio osmótico. Estos eritrocitos tienen una vida media corta, debido a la fácil lisis. La deficiencia de PK es la causa más común de anemia hemolítica hereditaria esferocítica (Barociani & Beutler, 1993) La isoenzima PK hepática está regulada por fosforilación, efectores alostéricos, y modulación de la expresión génica (Muñoz & Ponce, 2003). Los efectores alostéricos más importantes son la F1,6BP, que estimula la actividad PK disminuyendo su Km para PEP y para el efector negativo ATP. La PK hepática se fosforila y se inhibe por la PKA, y por lo tanto está bajo control hormonal similar a la PFK2. Condiciones extracelulares que conducen a la fosforilación e inhibición de PK hepática, tales como la baja glucosa sanguínea y los altos niveles de glucagón circulante no inhiben la enzima muscular (Hall & Cottam, 1978). El resultado de esta regulación diferencial es que las hormonas como el glucagón y la epinefrina favorecen la gluconeogénesis por inhibición de la 57 Introducción glucólisis hepática, mientras que a la vez, la glucólisis muscular puede proceder de acuerdo con las necesidades en sus condiciones intracelulares. 1.2.4. Glucogenogénesis y glucógenolisis: GS y GP como enzimas claves. La acumulación de glucógeno, es la respuesta fisiológica en mamíferos al aumento de la concentración de glucosa en sangre, que se produce después de cada comida. Este se almacena principalmente en el hígado y el músculo esquelético (Roach, 2002). De acuerdo al contenido de carbohidratos ingeridos, la gluconeogénesis se suprime, y el exceso de glucosa se metaboliza o almacena (Cahill, 1970). La glucogenogénesis es la ruta por la cual se sintetiza el glucógeno. Es la vía bioquímica que permite la incorporación de nuevas unidades de glucosa provenientes de la dieta a la molécula creciente de glucógeno, es bien conocida e implica la acción de variadas y sucesivas enzimas. Este proceso se lleva a cabo en el citosol, siendo su principal sustrato la G6P, requiere de la energía aportada por el ATP y la uridina trifosfato (UTP). Se inicia con la conversión de la G6P en G1P, consumiendo una molecula de ATP, acción catalizada por la enzima PGM. Posteriormente se sintetiza la UDP-glucosa (UDPG) a partir de G1P y UTP, por acción de la UDP-glucosa fosforilasa. La glucógeno sintasa (GS; EC.2.4.1.11), cataliza la adición de residuos de glucosa al extremo no reductor de una cadena de glucógeno naciente, a través de enlaces α-1,4-glucosídicos, utilizando la UDPG como sustrato. La elucidación de este mecanismo le valió al Dr. Luis F. Leloir el premio Nobel de 1970 (Leloir et al., 1959; Leloir & Goldberg, 1960).Tradicionalmente, esta enzima, que cataliza el paso clave de la síntesis, se ha considerado como la que ejerce el máximo control de la vía metabólica. De hecho, la actividad GS está altamente regulada a través de fosforilaciones en múltiples sitios y efectores alostéricos (Bollen, 1998) principalmente por la G6P (Villar-Palasi & Guinovart, 1997). La reacción catalizada por la GS además, es la limitante de velocidad para la síntesis de glucógeno en todos los órganos (Roach et al., 1998). Sin embargo, algunos investigadores han demostrado que el control de almacenamiento del glucógeno no reside exclusivamente en la GS y que otros factores también deben ser considerados (Ferrer et al., 2003). Luego, la enzima ramificante genera enlaces α1-6 sobre la cadena principal. Estas ramificaciones permiten la formación de nuevos extremos no reductores, que aceleran la 58 Introducción síntesis de glucógeno debido a que hay una mayor cantidad de aceptores de residuos glucósidos. Por otra parte, una mayor cantidad de terminaciones no reductoras también contribuye a una degradación de glucógeno más rápida, puesto que existe una mayor cantidad de terminaciones por las cuales iniciar la degradación. Figura 1.13 -Glucogenogénesis: Se inicia con la conversión de la G6P en G1P, acción catalizada por la enzima fosfoglucomutasa (PGM). Posteriormente se sintetiza la UDP-glucosa (UDPG) a partir de G1P y UTP, por acción de la UDP-glucosa pirofosforilasa. La glucógeno sintasa (GS), cataliza la adición de residuos de glucosa al extremo no reductor de una cadena de glucógeno naciente, a través de enlaces α1,4-glucosídicos, utilizando la UDP-glu como sustrato. La glucógenolisis es la vía de degradación del glucógeno. La glucógeno fosforilasa (GP; EC 2.4.1.1) cataliza el primer paso del camino y se encarga de atacar enlaces exoglucosídicos. Por degradación del mismo se genera glucosa-1-fosfato (G1P) desde la unión terminal α-1,4 glucosídica (Livanova et al, 2002) y esta reacción se expresa como: 59 Introducción (α-1,4 glucosido)n + Pi ↔ (α-1,4 glucosido)n-1 + G1P La GP no es capaz de romper más allá de los puntos de ramificación α1-6. Para ello el proceso des-ramificador requiere la actividad catalítica de la glucotransferasa que elimina tres residuos de glucosa y transfiere este trisacárido intacto al extremo de alguna otra ramificación externa. El residuo de glucosa queda unido a la cadena por un enlace α1-6; este enlace se rompe por la actividad α1-6 glucosidasa. La síntesis y degradación del glucógeno están controladas coordinadamente por una cascada amplificadora disparada por hormonas, de modo que la GS es inactiva cuando la GP es activa, y viceversa. Ambas enzimas están controladas por fosforilación y por interacciones alostéricas no covalentes. En un estado de buena alimentación, la GS es activada alostéricamente por la G6P, la que provoca un reordenamiento conformacional exponiendo simultáneamente los residuos fosforilados de la proteína GS. La desfosforilación de estos residuos produce una enzima activa, que ya no necesita la presencia de G6P para mantener su conformación funcional. (Ferrer et al., 2003). La GP hepática se activa por transfosforilación debida a la PKA, en presencia de magnesio. Esta activación es acelerada varias veces por el monofosfato cíclico de adenosina (AMPc). El glucágon y la adrenalina triplican la formación de AMPc, por lo tanto activan la GP hepática, lo que explica los potentes efectos glucógenoliticos de dichas hormonas. La epinefrina (adrenalina), insulina y glucagón también regulan la GP mediante sistemas de amplificación por segundos mensajeros que están ligados a la proteína-G. La adrenalina activa la adenilato ciclasa a través de receptores transmembrana acoplados a Gs, los cuales activan la enzima para aumentar la concentracion intracelular de AMPc. El AMPc se une y libera una forma activa de la PKA. Luego, la PKA fosforila una fosforilasa- b-quinasa (dando la forma fosforilasa-aquinasa, activa), que a su vez, fosforila a la GP-b (inactiva), transformándola en la GP-a (activa). Esta fosforilación se realiza sobre la serina 14 de la GP. La desactivación se produce mediante una fosforilasa-fosfatasa específica. En el hígado, el glucagón también activa otro receptor asociado a la proteína G, que desencadena una cascada diferente, dando lugar a la activación de la fosfolipasa C (PLC). La PLC indirectamente provoca la liberación de calcio del retículo endoplásmico de los hepatocitos hacia el citosol. La mayor disponibilidad de calcio, pega la subunidad 60 Introducción de calmodulina para activar también la fosforilasa b-quinasa. La fosforilasa-a-quinasa, activa así a la GP, en la misma forma que se mencionó anteriormente. 1.2.5. Glucocorticoides: Regulación sobre el metabolismo de hidratos de carbono. La secreción de glucocorticoides (GC) por la corteza suprarrenal está bajo el control de un sistema de retroalimentación neuroendocrino, el eje hipotalamo-pituitarioadrenal (HPA). La activación del eje HPA comienza con la secreción hipotalámica de la hormona liberadora de corticotropina (CRH); la activación de la transcripción génica en la pituitaria en respuesta a CRH; la secreción de la hormona adrenocorticotropina (ACTH) y la estimulación de la síntesis adrenal de los GC por inducción con ACTH. Los GC, a su vez, inhiben la expresión génica y la secreción de CRH a nivel hipotalámico, e interfieren con la transcripción y secreción de ACTH en la hipófisis anterior (Drouin et al., 1989; Cole et al., 1995; Raber, 1998; Malkoski & Dorin, 1999) estableciendo de ese modo un bucle de retroalimentación reguladora. Los niveles bajos de glucosa en plasma durante el ayuno y el ejercicio desencadenan una serie de señales hormonales que promueven un cambio en el uso de energía de todo el cuerpo. Junto a una caída en los niveles de insulina, las hormonas contra-reguladoras ganan el control metabólico. Estas son principalmente la hormona peptidica glucagón, liberada de las células α de los islotes pancreáticos; y los GC suprarrenales liberados a la circulación (Unger & Orci, 1981; Andrews &Walker, 1999) que antagonizan las acciones de la insulina (Saltiel, 2001). Una de las características destacadas del metabolismo hepático es la capacidad para la neosíntesis de glucosa, la gluconeogénesis durante el ayuno, a fin de proporcionar la glucosa a los tejidos extrahepáticos, tales como eritrocitos, médula renal, y cerebro (Consoli, 1992). Durante el ayuno, los ácidos grasos libres (FFA) y los precursores de aminoácidos se canalizan en la vía gluconeogénica que comprende, como ya fue descripto, varios pasos bioquímicos en la conversión de piruvato a glucosa. Las principales enzimas reguladoras son la PC, que convierte el piruvato en oxalacetato, la PEPCK que promueve la descarboxilación de oxalacetato a PEP, y, finalmente la 61 Introducción G6Pasa, que hidroliza la G6P en glucosa libre y fosfato inorgánico (Pilkis & Granner, 1992; Hanson & Reshef, 1997; Nordlie et al., 1999; Saltiel, 2001). En condiciones normales, la expresión de la forma citosólica de PEPCK es inducida en respuesta al ayuno a través del glucagón y los GC, mientras que una ingesta de carbohidratos genera un aumento concomitante de los niveles de insulina en plasma, disminuyendo fuertemente la velocidad de neosíntesis. La regulación hormonal de la transcripción del gen PEPCK por el glucagón, actua a través del cAMP, mientras que los GC y la insulina por otro lado, son el eje principal regulador de la actividad PEPCK en respuesta a la transición entre el ayuno y la alimentación (Loose et al., 1985; Hanson & Reshef, 1997). Por otra parte la G6Pasa, que cataliza la conversión de G6P a la glucosa libre, representa el paso final en la vía gluconeogénica y al mismo tiempo, controla la liberación hepática de glucosa proveniente de la glucógenolisis (Barthel & Schmoll, 2003). Consistentemente con su función, la interrupción de la actividad G6Pasa conduce a una hipoglucemia grave (Lei et al., 1996). Durante décadas fue conocido, que la expresión del gen de la subunidad catalítica de esta enzima es inducida por GC, ya que una adrenalectomía interrumpe la expresion del gen (Oishi et al, 2005). En el tratamiento de hepatocitos aislados, los GC conducen a la inducción del mRNA de la G6Pasa, efecto generado en las proximidades de la región 5´ de su gen (Garland, 1988; Schmoll et al., 1999; Vander Kooi et al., 2005) Son variadas por lo tanto, las funciones que los GC ejercen sobre la gluconeogénesis. Básicamente son funciones de estimulación, como se ha visto en humanos, donde en el cortisol de hepatocitos se aumenta la actividad de las enzimas que convierten aminoácidos en glucosa (la activación es a nivel transcripcional), y además provoca la movilización de aminoácidos desde los tejidos extrahepáticos, lo que aumenta la cantidad de material para llevar a cabo la gluconeogénesis. Por otra parte, la glucólisis celular se ve inhibida, ya que los GC deprimen la oxidación de NADH, que es necesario para permitir que esta vía se lleve a cabo con más facilidad y rapidez. Sobre el metabolismo de proteínas los GC también generan su efecto a través de: 1) la disminución de la reserva proteica de casi todas las células del cuerpo, 62 Introducción exceptuando las del hígado, por una disminución en la síntesis y un aumento del catabolismo de las proteínas celulares; 2) la estimulación del transporte de aminoácidos hacia las células hepáticas y el aumento de enzimas para el anabolismo proteico. Las proteínas del plasma que se sintetizan en el hígado y luego pasan a la sangre, aumentan al igual que las proteínas hepáticas (Heszele & Price, 2004; Glass, 2005); 3) la disminución del transporte de aminoácidos hacia las células musculares y otras células extrahepáticas (disminuye la concentración de aminoácidos y la síntesis de proteínas). Otros efectos de los GC también se dan sobre el metabolismo de lípidos hepáticos y son: 1) aumento de la síntesis de triglicéridos, 2) disminución de la oxidación de los ácidos grasos, 3) acumulación de lípidos en el hígado (Cole et al., 1982). La acumulación intra-citoplasmática de triglicéridos también se puede observar en hepatocitos aislados cuando se los expone a GC (Mendoza-Figueroa et al., 1988; Giudetti & Gnoni, 1998). Consistentemente, la adrenalectomía en ratas inhibe sustancialmente la acumulación hepática de triglicéridos, en particular en respuesta a una dieta alta en grasas, y el efecto puede ser fácilmente invertido por terapia de reemplezo de GC (Mantha et al., 1999). Mientras que los GC aumentan la lipólisis mediante la inducción de lipasa sensible a GC (Slavin et al., 1994) y reducen la lipoproteína-lipasa (LPL) en los depósitos de grasa periférica, promueven la diferenciación de pre-adipocitos, y por tanto la hipertrofia celular en la grasa central (Samra et al., 1998; Seckl et al., 2004) 1.2.6. Porfirias y su relación con el metabolismo de los hidratos de carbono. Como ya fue explicado en el capítulo anterior, las porfirias son un grupo heterogéneo de enfermedades metabólicas con manifestaciones principales tales como: ataques agudos, dolores neuro-viscerales y/o alteraciones o daños dermatológicos. En la experiencia de trabajo de Bonkovsky & Barnard (2000), la mayoría de los pacientes remitidos con diagnóstico presuntivo de "porfiria" no tenían porfiria, sino síndromes de otras etiologías asociados con aumentos leves, no específicos de la excreción urinaria de porfirinas (porfirinurias secundaria). El manejo de las porfirias agudas o inducibles, depende de la prevención o el rápido tratamiento ante los ataques 63 Introducción agudos. En este último, se incluye la administración de analgesia; hematina intravenosa y por lo menos de 300 g/día de carbohidratos. En PCT activa, la tarea consiste en lograr la reducción del hierro por flebotomía terapéutica; dieta alta en carbohidratos y la inmediata supresión de factores que precipitan o exacerban el cuadro, especialmente alcohol y estrógenos. Como se puede observar, en los diferentes tipos de porfirias, el manejo nutricional es parte esencial en la rehabilitación del cuadro. Esto da idea del efecto benéfico que la ingesta de carbohidratos tiene, y por lo tanto la presunción de la existencia de alguna alteración de su metabolismo en diversos casos de porfirias. En relación al trabajo de Schoenfeld et al., (1985) realizado en células hepáticas de embriones de pollo, se observó que existía una reducción en la inducción del ALA-S por el AIA en presencia de glucosa. La fructosa y diversas sustancias gluconeogénicas, incluyendo aminoácidos gluconeogénicos, tuvieron un efecto similar. La leucina, que es puramente cetogénica, no apaciguó la inducción del ALA-S. Los autores concluyeron que los efectos benéficos de las proteínas en los ataques agudos de porfiria hepática, probablemente son debidos a sus propiedades gluconeogénicas y que la G6P, es el agente activo que lleva a este efecto benéfico, al igual que el descripto como “efecto glucosa”. 1.3. ESTRÉS OXIDATIVO 1.3.1. Radicales libres y especies reactivas de oxígeno (ROS). Se consideran radicales libres a todas aquellas moléculas que en su estructura atómica presentan uno o más electrones desapareados o impares en el orbital externo. Es una entidad química que, contrariamente a la tendencia espontánea de los electrones localizados en los átomos y moléculas para formar pares, tiene electrones desapareados. Esta configuración espacial los hace muy inestables, extraordinariamente reactivos y de vida efímera. Poseen una enorme capacidad para combinarse inespecíficamente con la diversidad de moléculas integrantes de estructura celular: carbohidratos, lípidos, 64 Introducción proteínas, ácidos nucleicos y derivados de cada uno de ellos (Halliwell & Gutteridge, 1999, Valko et al. 2004). Los radicales libres se generan continuamente como productos del metabolismo normal de la célula, y son inactivados por un conjunto de mecanismos enzimáticos o de atrapamiento. En las células de mamíferos, bajo condiciones aeróbicas, la participación del oxígeno en reacciones de óxido-reducción (redox) es inevitable. El oxígeno molecular es fundamentalmente birradical, ya que tiene 2 electrones no apareados en su orbital externo, ambos con el mismo spin (giro paralelo), impidiendo así que capte 2 electrones simultáneamente en las reacciones en las que interviene. El oxígeno solo puede participar en reacciones univalentes y aceptar los electrones de uno en uno (Halliwell & Gutteridge, 1999). La mayor parte del oxígeno utilizado por el organismo humano es reducido a agua por acción del complejo citocromo-oxidasa de la cadena respiratoria mitocondrial. La reacción involucra 4 pasos univalentes desde los cuales pueden escapar sus intermediarios: radical superóxido (O2• -), peróxido de hidrógeno (H2O2) y radical hidroxilo (OH•), (Reilly & Bulkley, 1990). Estos intermediarios, en condiciones normales, quedan unidos al sitio activo de la citocromo-oxidasa y no difunden al resto de la célula. El término especies reactivas de oxígeno (ROS) usualmente se refiere a los radicales O2• -, OH•, peroxilo (ROO•), alcoxilo (RO•) pero también incluye especies no radicales como ácido hipocloroso (HClO), cloraminas, oxígeno singulete (1O2), ozono (O3) y H2O2. Este último no es estrictamente un radical libre, pero por su capacidad de generar al OH• en presencia de metales como el hierro, se lo incluye como tal. Las especies reactivas de nitrógeno (RNS) están implicadas en modificaciones oxidativas de proteínas y lipoproteínas de bajo peso molecular, a través de procesos que pueden ser independientes de la peroxidación lipídica producida por ROS (Alderton et al., 2001; Poli et al., 2004). Las ROS y RNS son generadas intracelularmente y extracelularmente. Intracelularmente como consecuencia de la actividad metabólica de mitocondrias, microsomas y peroxisomas que involucran varios sistemas enzimáticos. Extracelularmente son liberadas por células inflamatorias y macrófagos presentes en los tejidos. 65 Introducción La sangre, cumple entre otras funciones la de transportar oxígeno desde los pulmones hasta los tejidos, y es aquí donde el O2 actúa como sustrato en diversas reacciones bioquímicas intracelulares desencadenando una gran producción de H2O2 y O2• -, entre otras ROS. La mitocondria constituye la fuente principal de radicales libres. Este fenómeno se efectúa a nivel de la cadena de transporte de electrones, que es la última etapa de producción de protones de alta energía, y cuyo pasaje a través de la membrana interna mitocondrial genera un gradiente eléctrico que aporta la energía necesaria para formar el ATP. En este proceso de fosforilación oxidativa, el oxígeno actúa como aceptor final de electrones. Una consecuencia directa de este proceso es que entre los nutrientes iniciales y la generación de energía final, se forman varias moléculas con diferente grado de oxidación. Algunas de ellas pueden entregar 1 ó 2 electrones al oxígeno y producir intermediarios parcialmente reducidos (Turrens, 1994). Los peroxisomas son organelas del citosol muy ricas en oxidasas que generan H2O2, la cual es depurada por enzimas específicas como la catalasa (CAT). Los leucocitos polimorfonucleares poseen en sus membranas la enzima NADPH-oxidasa generadora de O2, que en presencia de hierro se transforma en la especie altamente tóxica, el OH•. Esta situación se da particularmente en los procesos inflamatorios (Markert et al., 1984). Los radicales libres se forman, en condiciones fisiológicas, en proporciones controlables por los mecanismos de defensa celulares. En situación patológica, esta producción se incrementa sustancialmente, ingresándose al estado de “estrés oxidativo”. Los factores que llevan a esta situación pueden ser químicos, como el aumento de metales pesados, xenobióticos, drogas y componentes del tabaco; físicos: radiaciones UV, hiperoxia; y orgánicos o metabólicos: dieta hipercalórica, dieta insuficiente en antioxidantes, diabetes, procesos inflamatorios, fenómenos de isquemia-reperfusión, traumatismos y ejercicios extenuantes. Radical superóxido El radical superóxido (O2• -) se forma por adición de un electrón a una molécula de oxígeno. Las fuentes más importantes son la cadena de transporte de electrones 66 Introducción (ETC) en la mitocondria, el retículo endoplasmático y el cloroplasto (Halliwell & Gutteridge, 1999; Inoue et al., 2003). En la mitocondria, se produce por la fuga de electrones en reacciones mediadas por la ubiquinona (Q10) y sus complejos enzimáticos. También es generado por numerosas enzimas oxidativas como la NADPH-oxidasa, xantina-oxidasa, aldehído-oxidasa, las flavín-deshidrogenasas y las peroxidasas (Li & Jackson, 2002; Inoue et al., 2003). Su amplia capacidad oxidante lo hace capaz de oxidar polifenoles, catecolaminas, lactato deshidrogenasa unida a NADH, etc. (Bielski & Chan, 1973; Fridovich, 1989) Además, puede inactivar algunas enzimas como la CPK o la CAT (Pigeolet et al., 1990). En solución acuosa el radical superóxido es capaz de reaccionar consigo mismo, dando una reacción de dismutación: O2• - + O2• - + 2H+ H2O2 + O2 La enzima superóxido dismutasa (SOD), presente en muchos organismos, elimina el O2• -, catalizando la reacción anterior. Es esta transformación la que potencia su toxicidad, ya que el O2• - reacciona con el H2O2 en presencia de hierro o cobre dando lugar al radical hidroxilo (OH•), muy reactivo en la llamada reacción de Haber-Weiss (Liochev & Fridovich, 2002) (Fe/Cu) H2O2 + O2• - O2 + OH• + OH - Peróxido de hidrógeno El peróxido de hidrógeno (H2O2) se produce en todos los sistemas que generan - O2• pero existen también enzimas que llevan a cabo la reducción divalente del oxígeno sin mediación de este radical, como la acil-CoA-oxidasa, la NADH oxidasa, la glutation oxidasa y el sistema xantina/xantina-oxidasa entre otras (Moldovan & Moldovan, 2004; Jezek & Hlavatá, 2005). 67 Introducción El H2O2 puede inactivar enzimas, como la GAPD, oxidando grupos tiólicos llevando a la célula a una deficiencia de ATP por inhibición de la glucólisis (Brodie & Reed, 1987; Hyslop et al., 1988). Puede además, oxidar piruvato, glioxilato o 2oxoglutarato (Andrae et al., 1985). En presencia de trazas metálicas (Cu, Fe, Co) se produce la reacción de Fenton (Stohs & Bagchi, 1995), dando lugar al radical HO• a partir de H2O2. (Cu/Fe/Co) 2+ Fe + H2O2 Fe3+ +OH + OH• - Por ser una molécula pequeña y relativamente estable posee una gran capacidad de difundir y atravesar membranas celulares (Halliwell, 1990). La disponibilidad de trazas de metales, una vez dentro de la célula, potencia los efectos deletéreos del H 2O2 mediados por la producción de OH•, causando daño aún en lugares alejados de donde se originó. Radical hidroxilo El radical hidroxilo (OH•) es el radical libre más reactivo que se conoce y es capaz de dañar a la mayoría de las moléculas que se encuentran en las células (Pastor et al., 2000). Es tan reactivo que solamente existe como tal durante pocos microsegundos (10-9s). Tiene una distancia de difusión pequeña y se combina rápidamente con moléculas vecinas, comenzando una serie de reacciones en cadena que pueden atacar a todas las moléculas presentes en la célula incluyendo al DNA y generando mutaciones. El daño biológico causado por el radical mejor caracterizado, es la peroxidación lipídica (Aruoma et al., 1989). Se acepta que la mayor parte del daño celular causado por el radical O2• - y el H2O2 deriva de la conversión de éstos al OH• mediante la reacción de Harber Weiss (Halliwell & Gutteridge, 1999). La reacción de Fenton, requiere cantidades submicromolares de hierro. La reacción puede ser catalizada por otros metales divalentes como el cobre, aunque el agente más importante en la producción del radical OH• in vivo es el Fe2+ (Liochev & Fridovich, 2002). 68 Introducción Oxígeno singulete El oxígeno singulete (1O2) posee una configuración electrónica de alta energía. Por ello la vida media de esta especie es corta, sobre todo en solución acuosa, pues pierde rápidamente su energía. Sin embargo en medios hidrofóbicos, como membranas celulares, este tiempo se prolonga, pudiendo reaccionar con ácidos grasos poliinsaturados, formando peróxidos lipídicos. 1.3.2. Toxicidad de xenobióticos mediada por especies reactivas. La mayoría de los xenobióticos que ingresan a un organismo, se transforman en metabolitos más polares y estables por medio de las enzimas que los metabolizan y luego se excretan del mismo. Sin embargo, algunos xenobióticos sufren una activación metabólica generando especies reactivas capaces de unirse covalentemente a proteínas, DNA y otras biomoléculas (Kumar & Surapaneni, 2001; O’Brien et al., 2005; Rousu et al., 2009). Aunque la relación mecanística entre dichos metabolitos reactivos y la toxicidad de algunos xenobióticos es aun muy difusa, existen evidencias que sugieren la asociación entre ambas (Rousu et al., 2009; Wen & Flitch, 2009). En general, los metabolitos reactivos se clasifican en fuertes y débiles. Las especies reactivas débiles más comunes incluyen a los epóxidos, α y β-carbonilos insaturados, quinonas, quinona-iminas, metiluros de quinona-imina, isotiocinatos, episulfonio y otros (Ma & Subramanian, 2006; Tang & Lu, 2010). Los aldehídos e iones de imino pertenecen al grupo de las especies reactivas fuertes. Los metabolitos más reactivos son tan inestables que no pueden ser detectados directamente. El GSH y sus análogos se utilizan comúnmente como atrapantes de especies débiles (Evans et al, 2004; Gan et al., 2005; Soglia et al., 2006; Leblanc et al., 2010). Las especies fuertes pueden ser atrapadas por semicarbazidas, metoxilamina e iones cianuro (Kalgutkar et al., 2002; Argoti et al., 2005). La reacción de algunos atrapantes con los metabolitos reactivos forman aductos muy estables. 69 Introducción 1.3.3. Toxicidad sobre las macromoléculas mediadas por especies reactivas. 1.3.2.1. Reacciones sobre proteínas, DNA, glúcidos y lípidos. En 1954 se propuso por primera vez, que los radicales libres eran agentes tóxicos y generadores de enfermedades (Gerschman et al., 1954). Por la alta inestabilidad atómica, los radicales libres colisionan con una biomolécula y le sustraen un electrón, oxidándola, perdiendo de esta manera su función específica celular. Las especies reactivas se unen a proteínas, rompen las cadenas de DNA, reaccionan con componentes vitales de la célula y atacan los dobles enlaces de los ácidos grasos polinsaturados enclavados en la estructura de los fosfolípidos de membranas. Las proteínas pueden ser críticamente modificadas por metabolitos reactivos, lo que lleva a alterar procesos biológicos, resultando en toxicidad directa, hecho demostrado por necrosis de tejidos y/o apoptosis (Evans et al., 2004). Por acción de las ROS, en las proteínas se oxidan preferentemente los aminoácidos fenilalanina, tirosina, triptófano, histidina y metionina. Como consecuencia de ello se forman entrecruzamientos de cadenas peptídicas, fragmentación de proteínas y formación de grupos carbonilos que impiden el normal desarrollo de sus funciones específicas. Entre los aminoácidos que se oxidan dando lugar a grupos carbonilos se encuentran lisina, prolina y arginina; el contenido en carbonilos de las proteínas se puede emplear como un indicador de daño oxidativo a las mismas (Grimsrud, 2008). La unión de especies reactivas a los ácidos nucleicos tiene el potencial de producir genotoxicidad (Koc & Swenberg, 2002; Farmer et al., 2005). El daño al DNA produce bases modificadas, con serias consecuencias en el desarrollo de mutaciones y carcinogénesis, o la pérdida de expresión por daño al gen específico. El oxígeno es capaz de adicionarse a las bases o al azúcar del DNA formando el radical peroxilo, que genera un gran número de productos por las posteriores reacciones de estas especies radicales del DNA. También se forman puentes cruzados DNA-proteína. La modificación oxidativa más frecuente suele darse a nivel de la guanosina, dando lugar a la 8-hidroxi-2’-deoxiguanosina (8-OH-dG). Su importancia reside en su poder mutagénico, ya que durante la replicación producirá transversiones G-T (Kasai & Nishimura, 1984; Shibutani et al., 1992). El daño al DNA ha sido observado en un gran 70 Introducción número de líneas celulares procedentes de mamíferos, expuestas a estrés oxidativo. Este daño incluye roturas de doble y simple cadena, deleciones, cambio de bases, daño oxidativo, e incluso aberraciones en los cromosomas (Halliwell & Auroma 1991). Los hidratos de carbono reaccionan fácilmente con los radicales OH•. La glucosa constituye un secuestrante del radical superóxido, al retenerlo e impedir su acción sobre otras moléculas. La manosa y el manitol son secuestrantes del radical hidroxilo. Por ello, se ha observado que diversos polisacáridos pueden actuar como agentes protectores celulares. El daño oxidativo a los glúcidos tiene importancia cuando se trata de polisacáridos de función estructural, ya que los polisacáridos son despolimerizados por los radicales libres (Borel et al., 1988) dando lugar a procesos degenerativos. La oxidación de lípidos (ácidos grasos polinsaturados) por los radicales libres produce una reacción en cadena en la que el ácido graso al oxidarse, se convierte en radical de ácido graso, con capacidad de oxidar a otra molécula vecina. En este proceso, conocido como peroxidación lipídica, se dañan las estructuras ricas en lípidos como las membranas celulares y las lipoproteínas. El hierro libre (Fe2+) acelera la descomposición de lípidos a hidroperóxidos (LOOH-) en compuestos tales como radicales alcoxilos (RO•) y peroxilos (ROO•) y malondialdehído (MDA). Estos compuestos son los productos finales de la descomposición peroxidativa de ácidos grasos poliénicos (Halliwell & Chirico, 1998); son muy reactivos, y pueden oxidar grupos tioles de la célula a distancia de donde se produjo la injuria inicial. La peroxidación lipídica por tanto, puede propagarse a través de la célula, resultando en una disrupción de la membrana lipídica, a veces lejos del sitio en donde se originó la formación de dichas especies. 1.3.4. Sistemas de defensas antioxidantes La aparición de ROS y RNS es una característica de la vida aeróbica. La existencia y desarrollo de células en un ambiente oxidante no sería posible sin poderosos mecanismos de defensa frente a dichas especies. Halliwell & Gutteridge (1999) definen como antioxidante a toda sustancia que hallándose presente en bajas concentraciones con respecto a las biomoléculas oxidables, retarda o previene la 71 Introducción oxidación de dichos sustratos. La función primaria de los antioxidantes es asegurar que las concentraciones de radicales libres en la célula se mantengan bajas. Los mecanismos antioxidantes se pueden dividir en dos categorías: no enzimáticos y enzimáticos. Los mecanismos enzimáticos catalizan o aceleran reacciones químicas que utilizan sustratos que a su vez reaccionan con radicales libres o que actúan específicamente sobre determinadas especies reactivas. La enzima CAT, está presente en células de plantas, animales y en bacterias aeróbicas (Mates et al., 1999). En animales se encuentra especialmente concentrada en eritrocitos y en hígado, localizada principalmente en los peroxisomas. Cataliza la reacción de descomposición del H2O2 para dar H2O y O2. Es de gran importancia en el metabolismo de las ROS y se puede considerar como secuestrante de radicales libres, aunque el H2O2 no sea estrictamente un radical. La cinética de esta enzima no obedece a un patrón normal, es una enzima no saturable por sustrato, y existe una rápida inactivación a concentraciones de H2O2 mayores que 0,1 M (Aebi, 1984). Por otra parte, la superóxido dismutasa (SOD) es una metaloenzima que cataliza muy eficientemente la dismutación del radical O2• - a O2 y H2O2. Se han descripto tres tipos de SOD (Landis & Toser, 2005). Todas ellas catalizan la misma reacción con un mecanismo idéntico, pero se diferencian en el metal presente en su centro activo. Esta enzima destruye el O2• - con una elevada velocidad de reacción, por sucesivas oxidaciones y reducciones del ion del metal de transición presente en su sitio activo (Mates et al., 1999). La Cu/Zn-SOD se encuentra en el citoplasma de todas las células eucariotas. Tiene un peso molecular de 32 kD con dos subunidades, que poseen un sitio activo con un átomo de cobre, la de actividad catalítica, y otro de zinc, que estabiliza la estructura (Halliwell & Gutteridge, 1999, Mates et al., 1999). Es una enzima muy estable, lo que facilita su aislamiento pero es fuertemente inhibida por cianuro, lo que la diferencia del resto de las SOD. La Mn-SOD es una proteína cuyo peso molecular es de 40 kD. En organismos bacterianos suele tener 2 subunidades. También se ha aislado en organismos superiores pero tan sólo de matriz mitocondrial (Wolin, 2000). En estos organismos posee 4 subunidades, es mucho más lábil que la Cu/Zn-SOD y no se inhibe por cianuro. La Mn72 Introducción SOD es una de las enzimas antioxidantes más efectiva que tiene acción antitumoral (Behrend et al., 2003). La SOD extracelular (EC-SOD) es una glicoproteína secretoria, tetramérica que contiene cobre y zinc, tiene elevada afinidad por ciertos glucosaminoglicanos como la heparina (Mates et al., 1999). En tejido de mamíferos esta regulación ocurre primariamente de manera coordinada por citoquinas, antes que como una respuesta individual de la célula ante los oxidantes (Valko et al., 2006). Otras clases de SOD incluyen: la Fe-SOD que es similar a la Mn-SOD pero se encuentra casi exclusivamente en procariotas y algas, y la Ni-SOD descubierta en Streptomyces y cianobacterias (Barondeau et al., 2004). Los mecanismos no enzimáticos involucran moléculas de bajo peso molecular (como GSH, ácido úrico, ácido dihidro-lipoico, metalotioneína, ubiquinol y melatonina) con un gran poder reductor, por lo tanto con propiedades antioxidantes. Estos compuestos al colisionar con las ROS y/o RNS les ceden un electrón oxidándose a su vez, y transformándose en un radical débil no tóxico. Estos tipos de antioxidantes actúan como verdaderos “atrapantes” de radicales libres. Se los puede clasificar como endógenos, sintetizados por la misma célula, o exógenos a los que ingresan a través de la cadena alimentaria. 1.3.5. La melatonina como atrapante. La N-acetil-5-metoxitriptamina, comúnmente conocida como melatonina (Mel) es un producto de síntesis de la glándula pineal de los vertebrados. La vía de síntesis de la Mel ha sido bien descripta, como así también los mecanismos neurales que rigen la producción pineal de la misma (Reiter, 1991). La Mel tiene un gran número de funciones fisiológicas, incluyendo la regulación de los ritmos circadianos (Kennaway & Wright, 2002), efectos oncostáticos (Blask et al., 2002), de estimulación del sistema inmune (Guerrero & Reiter, 2002) y funciones anti-inflamatorias (Cuzzocrea & Reiter, 2002). Incluso más tarde, y algo inesperadamente, la Mel fue identificada como un potente atrapante directo de radicales libres (Tan et al., 2002) y antioxidante indirecto 73 Introducción (Rodríguez et al., 2004). Lo que parece particularmente inusual es la alta eficacia que posee la Mel como protectora contra las especies reactivas del oxígeno (ROS) y del nitrógeno (RNS). En contraste a muchos otros antioxidantes, cruza todas las barreras fisiológicas-morfológicas, es decir la hemato-encefálica y la placenta, y se distribuye a lo largo de todas las células (Rodríguez et al., 2004). Tras la oxidación, la melatonina se convierte a su vez en otros compuestos antioxidantes tales como la 3hidroximelatonina cíclica, la N1-acetil-N2-formil-5-metoxiquinuramina y la N1-acetil5-metoxiquinuramina (Reiter et al., 2007). Por lo tanto, la Mel se considera como un antioxidante de amplio espectro aún más potente que el GSH en la neutralización de los radicales libres, que puede proteger las membranas celulares contra el daño oxidativo de manera muy eficaz (Reiter et al., 1997). Con las numerosas investigaciones realizadas en los últimos años, ya no cabe duda acerca de su capacidad para reducir el daño molecular resultante por las especies reactivas tóxicas, ROS y RNS (Hardeland et al., 1995; Acuña-Castroviejo et al., 2002; Tan et al., 2002). La reducción de los niveles circulantes de Mel también exacerba el daño oxidativo a los tejidos que están sometidos a un aumento del estrés oxidativo (Reiter et al., 1999). También ha demostrado eficacia para reducir la toxicidad de ciertas drogas y en algunos casos mejorar su actividad (Reiter et al., 2002), para reducir la severidad y el grado de daño de los tejidos después de isquemia/reperfusión en el cerebro y otros órganos (Cheung, 2003), para prevenir cambios degenerativos en el SNC en los modelos de la enfermedad de Alzheimer (Pappolla et al., 2000) y en el Parkinson (Antolín et al., 2002), para reducir el daño de radicales al DNA que puede llevar al cáncer (Reiter et al., 1998), y en muchas otras situaciones. Diversas funciones de la Mel accionan en la reducción del estrés oxidativo. En este punto, se desconoce cuál de las múltiples acciones de la misma, es decir, si captación de radicales libres, la estimulación de las enzimas antioxidantes, el aumento de la eficacia de la cadena de transporte de electrones mitocondrial, la reducción de la fuga de electrones, o la mejora de la eficiencia de otros antioxidantes, son más importante en la contribución a su alta eficacia (Reiter et al., 2003). 74 Introducción 1.4. TRIPTÓFANO (TRP). El triptófano (TRP) es un aminoácido esencial en los mamíferos, que debe ser adquirido a través de la dieta, ya que su síntesis no puede ser realizada por animales. El TRP es el cuarto aminoácido menos abundante de los necesarios para la síntesis proteica. Esto significa que cuando el suministro de triptófano es bajo en comparación con otros aminoácidos esenciales, esto limita la síntesis de proteínas y, finalmente, la tasa de crecimiento. Es precursor de sustancias biológicamente importantes, como la serotonina (5-HT), un neurotransmisor producido principalmente en el intestino y también en las plaquetas y en el cerebro. También se generan a partir de él, la hormona pineal melatonina (Mel), el ácido nicotínico, las coenzimas NAD, las melaninas, alcaloides indólicos y la fitohormona ácido 3-indolacético (Musajo & Bena, 1964; Price et al., 1965; Wolf, 1974; Peters, 1991). 1.4.1. Sus metabolitos. Caminos de degradación. El TRP en mamíferos puede ser metabolizado (Figura 1.11) por tres diferentes rutas: a) por la vía de la transaminación o ruta indólica, convirtiendo el TRP a indol, que luego se puede excretar en orina como indoxilsulfato (Diesbach & Wiederkehr, 1945); b) por la ruta serotoninérgica que conduce a la formación de serotonina (5-HT) a través del 5-hidroxitriptófano (5-HTRP; Rimington et al., 1948). En esta ruta, el 5HTRP se forma en un primer paso por la acción de la L-triptófano hidroxilasa [Ltriptófano tetrahidrobiopterina oxígeno oxidorreductasa (ó 5-hidroxilasa), EC 1.14.16.4] y después la decarboxilasa de aminoácidos aromáticos (AAD), la convierte en 5-HT. Se ha sugerido que menos del 1% de triptófano ingerido se utiliza en la conversión a serotonina (Wolf, 1974). Un dato importante a tener en cuenta, es el publicado por Llambías et al. (2003) que muestra un aumento significativo en la excreción urinaria de 5-HT y del ácido 5-hidroxindolacético (5-HIAA), el principal metabolito de 75 Introducción degradación de la serotonina, en ratas porfíricas intoxicadas con el xenobiótico HCB y que este incremento solo sucede bajo condiciones de luz (Llambías et al., 2007). c) por la vía quinurenérgica, para la formación de formilquinurenina, por acción de la triptófano pirrolasa o L-triptófano 2,3-dioxigenasa, [TRPp o TDO; EC.1.13.11.11] (Bearcroft et al., 1995) y por la indolamina extrahepática 2,3-dioxigenasa (IDO, también llamada indol 2,3-dioxigenasa). Ambas enzimas catalizan la misma reacción de escisión del anillo de pirrol y de inserción del oxígeno molecular en L-triptófano, pero por diferentes mecanismos. La TDO se expresa solo en el hígado de mamíferos y es sustrato específica, mientras que IDO se expresa ubicuamente en todo el cuerpo, excepto el hígado, y tiene una mayor variedad de sustratos (Thackray et al. 2008). La TDO o TRPp hepática requiere oxígeno molecular para su actividad, y es inducida por su propio sustrato (TRP), los GC y su cofactor, el grupo hemo (Knox & Auerback, 1955; Badawy & Evans, 1975). Esta enzima que tiene un rápido recambio (Feigelson & Greengard, 1961; Schimke et al., 1965; Badawy & Evans, 1975), es la enzima de velocidad limitante en la degradación del TRP (Knox, 1951¸ 1966) y está fuertemente regulada por el pool de hemo (Bissell & Hammaker, 1977; Badawy, 1978; Correia & Burk, 1978). Es muy activa en ratas, por lo que parece ser un buen modelo animal para el estudio del metabolismo del TRP a lo largo de la vía de la quinurenina, tanto en condiciones fisiológicas como patológicas (Allegri et al., 2003). Se encontraron también que ciertas drogas porfirinogénicas alteran la actividad de TRPp, tales como las dibenzo dioxinas policloradas (Fan & Rozman, 1994; Weber et al., 1994), griseofulvina, colidinas y acetamidas alquil-sustituídas, además de drogas que exacerban la porfiria, como el fenobarbital y la carbamazepina (Badawy, 1978; Morgan & Badawy, 1992) 76 Introducción Figura 1.11: Caminos de degradación del triptófano (TRP). a) vía de la transaminación o ruta indólica, b) ruta serotoninérgica que da la formación de serotonina (5-HT), por la acción de la L-triptófano hidroxilasa, y la amino ácido decarboxilasa (AAD), c) vía quinurenérgica hepática, para la formación de formilquinurenina por acción de TRPp o TDO (triptófano pirrolasa o L-triptófano 2,3-dioxigenasa).PLP: fosfato de piridoxal. 77 Introducción 1.4.2. Importancia de los metabolitos del TRP Serotonina La serotonina (5-HT) es un potente vasoconstrictor encontrado principalmente en cerebro, tejido intestinal, plaquetas sanguíneas y mastocitos. Cuando ocurre una herida y hay sangrado, al agregarse las plaquetas liberan varias sustancias fisiológicamente activas incluyendo la serotonina y el tromboxano-A2 que estimulan la vasoconstricción. Luego las plaquetas agregadas y el tejido dañado inician el proceso de coagulación sanguínea (Voet & Voet, 1995a). La serotonina es un vasoconstrictor que estimula también la contracción uterina. En el metabolismo del cerebro, la serotonina es un neurotransmisor. Juega un importante papel regulatorio en el sistema nervioso. En cerebro, se encuentra mayormente unida a una proteína adherente específica (SBP o Serotonin Binding Protein). Ciertas drogas que producen marcada alteración en la actividad del sistema nervioso central, son potentes antagonistas de la serotonina in vitro. Así la administración de reserpina, droga que disminuye la actividad del sistema nervioso central en el hombre, aumenta la excreción urinaria de serotonina y de su principal producto metabólico 5-hidroxindolacético (5-HIAA) (White et al. 1964a) La 5-HT es una amina aromática, pertenece a la familia de las indolaminas, aislada del suero (serum; de aquí el nombre serotonina) que tiene un importante efecto hipertensor. Se distribuye ampliamente entre animales, plantas y en el hombre. Se sintetiza a partir del TRP, y dado que la indolamina es una sustancia hidrofílica, como tal no puede cruzar la barrera hematoencefálica por lo tanto, toda la serotonina neuronal del sistema nervioso central es sintetizada localmente. La biodegradación de la 5-HT, se lleva a cabo tanto a nivel intracelular como en la hendidura sináptica, dando origen a su principal metabolito inactivo, el ácido 5-hidroxindolacético, por la acción enzimática de la monoaminooxidasa (MAO). Una vía alternativa que cobra gran importancia en la fisiopatología de las psicosis, es la síntesis de quinureínas a partir de la serotonina y sus derivados. Otro metabolito de importancia es el acido 5-OH-3-metilindol, producto de la metilación del ácido 5-hidroxindolacético, cuya aparición en niveles significativos podría correlacionarse con sintomatología de base epiléptica. La síntesis puede 78 Introducción aumentar de forma marcada, bajo condiciones que requieren un continuo suministro del neurotransmisor por un incremento de la actividad neuronal. El aumento de la síntesis tiene una absoluta dependencia del Ca+2 extracelular. Como con otros transmisores amino biogénicos, la 5-HT es almacenada primariamente en vesículas y es liberada por un mecanismo exocitótico. Esto es necesario para proteger la indolalquilamina de degradación intraneuronal por la MAO. También, las vesículas sinápticas serotoninérgicas, contienen una proteína específica que se adhiere a la 5-HT con gran afinidad (SPB). La SPB está contenida en neuronas serotoninérgicas. La serotonina es liberada de la SPB por un proceso dependiente del Ca+2. No existe un receptor único para serotonina, sino más bien ha sido descrita toda una superfamilia de receptores (siete) con funciones específicas en las áreas pre- y postsinápticas. Entre ellos, el 5-HT 1A en las neuronas presinápticas y el 5-HT 2A en las postninápticas, están asociados a la apertura de los canales K+, a la inhibición de adenilciclasa y a la hidrólisis de fosfoinositol a través de una proteína G. La 5-HT puede actuar como un neuromodulador. La actividad de 5-HT en la sinapsis se termina, primariamente, por su captación en terminales serotoninérgicos, mediante la unión de estas moléculas a proteínas específicas de transporte. En cuanto a las implicaciones funcionales de la serotonina, los receptores 5HT1A están presenten en alta densidad en áreas del cerebro que son componentes del sistema límbico, implicado en la modulación de la emoción. Participa en el control hipotalámico de la secreción pituitaria, particularmente en la regulación de prolactina, ACTH, y hormona del crecimiento. Se ha implicado a la serotonina en el sueño. Se ha propuesto que el papel de las neuronas centrales serotoninérgicas es coordinar la actividad del sistema nervioso, fijar el tono de actividad en conjunción con el nivel de activación del organismo. También parece estar implicada en la regulación de ritmos circadianos. Se ha visto que la serotonina inhibe la toma de comida, tiene efectos anoréxicos. Estos efectos hipofágicos son más pronunciados en ratas hembras, un efecto de potencial relevancia para los trastornos de la alimentación en humanos. 79 Introducción El control de entrada del dolor parece depender de la liberación de serotonina, que facilita la producción de endomorfinas medulares. Su disminución sería responsable de la sintomatología depresiva. En pacientes con depresión se constata disminución del triptófano libre plasmático. La disminución de la transmisión serotoninérgica en estados depresivos es avalada por la disminución del ácido 5-HIAA en líquido cefalorraquídeo. En estados depresivos la recaptura de serotonina está disminuida. Se ha involucrado también la neurotransmisión serotoninérgica en la regulación de la ansiedad. De este modo regula la timia, el sueño, actividad sexual, apetito, ritmos circadianos, funciones neuroendocrinas, temperatura corporal, dolor, actividad motora y funciones cognitivas. La disminución del 5-HIAA en líquido cefalorraquídeo es un marcador de hostilidad. En los mecanismos fisiológicos de la alimentación se hallan involucrados los receptores de la serotonina: 5HT1a (en la hiperfagia) y 5HT1c/2 (en la anorexia). Además, es la responsable de la modulación inhibitoria del consumo de hidratos de carbono. Por lo tanto el TRP, y los inhibidores selectivos de la recaptura de serotonina son útiles en el tratamiento de la bulimia y otros trastornos de la alimentación. En las toxicomanías y el alcoholismo están involucrados los receptores 5-HT2. El alcohol y la cocaína son agonistas del mismo. En la migraña se utiliza terapéuticamente un agonista del receptor de serotonina, 5HT1d. Serotonina e indolacético dan cuenta de una fracción significativa del triptófano degradado. Un segundo e importante camino metabólico es el quinurenérgico, iniciado por la TRPp o TDO que resulta en una serie de sub-productos, uno de los cuales es el glutaril-CoA, que aparece en orina en cantidades variables y la suma de todos ellos da cuenta del total del metabolismo del triptófano. De los muchos productos formados, los fisiológicamente usados son: el neurotransmisor serotonina, el glutarilCoA que es metabolizado a acetil-CoA, la vitamina ácido-nicotínico, usada para la biosíntesis del NAD, en menor cantidad la alanina que se forma como sub-producto de estas reacciones y la hormona melatonina (White et al., 1964c). Melatonina Como ya fue dicho, la melatonina es una neurohormona con propiedades antioxidantes (Reiter, 2005) que regula el reloj biológico del organismo, con eficacia en 80 Introducción el combate contra el insomnio, el cáncer, el envejecimiento, la hipertrofia de próstata, la depresión, el colesterol, la hipertensión, la osteosporosis, las cataratas y la epilepsia. Se ha manifestado como un poderoso impulsor del sistema inmunológico, como antioxidante y como regenerador de la actividad sexual (Reiter, 1988; Pierpaoli & Regelson, 1995; Stevens, 1996). Es producida principalmente en la glándula pineal, pero otros órganos como hígado, riñón, retina, adrenal, timo, tiroides, páncreas y ovario también la producen. Tiene una función relevante en la fisiología circadiana, sus niveles fluctúan con los ciclos del día y la noche, con mayores niveles durante ésta última. En el cerebro actúa como inductor del sueño, ralentizando la actividad cerebral y determinando el ciclo sueño-vigilia (Dawson & Encel, 1993). En el corazón y el sistema circulatorio reduce la formación de coágulos, lo cual a su vez disminuye la posibilidad de infartos y trombosis (Reiter et al., 2005). En el intestino facilita la absorción de minerales y nutrientes contenidos en los alimentos. En el sistema reproductor regenera la actividad sexual, regulando su funcionamiento (Tamarkin et al., 1985). En todo el cuerpo, la melatonina actúa directamente sobre las células como un poderoso antioxidante, protegiéndolas de los radicales libres (Reiter, 1993). La melatonina mejora la eficiencia del sistema inmunitario aumentando las defensas naturales, preservándonos de las enfermedades en general y en particular de aquellas típicas del envejecimiento como cáncer, patologías cardiovasculares y en enfermedades auto-inmunes (Regelson & Pierpaoli, 1987; Lissoni et al., 1991; Reiter et al., 1994, 2005). La melatonina juega un papel decisivo en la asimilación del zinc por el organismo, aminora el proceso de calcificación y restaura la actividad del timo (Stevens, 1996). El zinc es importante para el mantenimiento del sistema inmune y hay relación entre los niveles de zinc y la producción de células-T por el timo (Poon et al., 1994). El déficit de melatonina produce insomnio y depresión y parece acelerar el envejecimiento. Indolacético El triptófano por transaminación produce el indol-3-pirúvico y éste, por decarboxilación oxidativa, genera el indol 3-acético. El indolacético está presente en pequeñas cantidades en la orina normal y en cantidades incrementadas en la orina de pacientes con pelagra, enfermedad causada por la falta de niacina (Vitamina B3) o de 81 Introducción triptófano en la alimentación. En plantas este compuesto funciona como auxina, una hormona de crecimiento (White et al., 1964b). 5-Hidroxindolacético (5-HIAA) Aproximadamente 7mg de 5-HIAA es excretado en orina normal por día. Se ha estimado que 3% del triptófano dietario es metabolizado por esta vía. En pacientes con cáncer, cerca de 400 mg de este compuesto son excretados por día; su excreción también aumenta en alcaptonuria, una enfermedad congénita caracterizada por la acumulacion de ácido homogentísico, que deriva de la tirosina o fenilalanina como consecuencia de la falta de la enzima homogentísico-dioxigenasa (White et al., 1964b; Voet & Voet, 1995b). En los primeros años de vida no hay síntomas más que la excreción de este ácido, pero con los años (edad adulta) puede aparecer pigmentación anormal en la piel, los cartílagos y otros tejidos conectivos ú ocronosis (White et al., 1964c). 1.4.3. Acción del TRP sobre el metabolismo de los hidratos de carbono En 1955, por primera vez se demostró que la administración de TRP a ratas normales daba como resultado hipoglucemia (Gullino et al., 1955). Esto ha sido confirmado en general en muchos otros estudios (Diengott et al., 1956; Gagliardino et al., 1971; McDaniel et al., 1973), aunque hay considerables variaciones entre los distintos informes, en particular en relación a los tiempos utilizados e intensidad de la hipoglucemia, y sobre todo en las conclusiones sobre el mecanismo que da tal efecto. Es poco probable que el TRP en sí mismo, sea la causa directa de la hipoglucemia. Jinks et al., (1957) afirman que varios metabolitos indólicos también podrían provocar disminuciones en las concentraciones de glucosa en sangre, y atribuyen estas acciones a las variaciones en la disponibilidad de insulina en circulación. En contraste, demostraciones hechas por otros grupos (Ray et al, 1966; Veneziale et al., 1967) afirman que la síntesis de glucosa en hígado aislado y perfundido se inhibe por el TRP y por metabolitos derivados de la vía quinurenérgica. Sugieren además, que la hipoglucemia en un animal puede ser causada por alteraciones en la 82 Introducción gluconeogénesis, deterioro a su vez derivado del aumento en la concentracion hepática del quinolinato (Ray et al., 1966; McDaniel et al., 1973). Esta hipótesis se apoya en las observaciones de que la administración in vivo de quinolinato, produce cambios en los metabolitos hepáticos similares a los observados después de tratamiento con TRP (Williamson et al., 1971; Spydervold et al., 1974) También hay informes donde se describe que no solo altera la gluconeogénesis, sinó inclusive la formación de glucógeno (Smith & Pogson 1977) En un estudio del papel de las monoaminas intracelulares en la regulación de la secreción de insulina, Lundquist et al., (1971) encontraron que la administración de bajas dosis de 5-HT en ratones pretratados con un inhibidor de la MAO, provocaba una hipoglucemia profunda en animales que habían sido previamente alimentados. Este efecto es suprimido por los inhibidores de la descarboxilasa de aminoácidos aromáticos (AAD) y por los antagonistas de la acción de la 5-hidroxitriptamina o serotonina (Furman, 1974). Esto sugiere que la 5-HT intracelular puede ser el agente activo en la promoción de la hipoglucemia en estas condiciones. El efecto del TRP, sin embargo, se diferencia del de 5-HTRP en que sólo este último se encontró eficaz en animales diabéticos (Furman, 1974). El metabolismo de los carbohidratos y sus procesos de control varían de una especie a otra en mamíferos (Hanson, 1974; Elliott & Pogson, 1977) y se debe tener cuidado en la extrapolación de estudios en ratas, o cualquier otra especie, con el hombre. El descubrimiento de que el quinolinato, metabolito de la vía de la TRPp, inhibe la enzima PEPCK de la gluconeogénesis, ha sido usado como una herramienta muy útil para la inhibición selectiva de esta enzima. La especificidad de acción, ha llevado a estudiar a través de dicha herramienta el papel de la PEPCK en la regulación de la gluconeogénesis. Se sabe que el quinolinato inhibe la gluconeogénesis a partir del lactato en mayor medida que desde el piruvato (Gabbay, 1985). 83 OBJETIVOS 2. OBJETIVOS 2.1. OBJETIVOS GENERALES Se propone como objetivo general, investigar las alteraciones del metabolismo de la glucosa y de su regulación, en dos modelos de porfiria inducidos con drogas, uno crónico por administración de HCB (PCT) y otro agudo por intoxicación con AIA/DDC, que den cuenta del efecto benéfico que tiene la administración de glucosa en porfirias humanas y experimentales, dada que es muy escasa la bibliografía científica al respecto. Este trabajo de investigación implica el estudio del metabolismo de los glucocorticoides (GC), de la insulina, del triptófano (TRP) y del estado oxidativo en general. 2.2. OBJETIVOS PARTICULARES 2.2.1 Objetivos para el modelo de porfiria crónica por hexaclorobenceno (HCB). A continuación se describen los objetivos particulares para el modelo de porfiria crónica por HCB, realizando un estudio comparativo entre animales tratados con HCB vs animales controles, en función de las semanas transcurridas desde la intoxicación. 1.- Confirmar el efecto porfirinogénico del HCB en el camino del hemo en ratas Wistar hembras, a través de la evaluación de la URO-D y porfirinas hepáticas y urinarias; es decir, validar el modelo propuesto para la Tesis. 2.- Investigar la existencia de disturbios en las rutas anabólicas y catabólicas de la glucosa mediante el estudio de sus niveles plasmáticos, así como en las actividades de enzimas hepáticas de la gluconeogénesis (PEPCK, PC y G6Pasa) y de la glucólisis (PK). 85 OBJETIVOS 3.-Analizar si la intoxicación producida por HCB genera perturbaciones del transporte de glucosa en hígado y otros tejidos, utilizando para ello un análogo de glucosa marcada no metabolizable (3-O-metil d-3H-glu). 4.- Evaluar si el tratamiento con el xenobiótico promueve daños en los procesos de síntesis y degradación del glucógeno, a través de la determinación de sus niveles hepáticos, así como de sus enzimas claves: GS para glucogenogénesis y GP para glucógenolisis. Investigar alteraciones en factores regulatorios de la PEPCK y GP 5.- Investigar si hay interferencias en el sistema redox y en la producción de ROS y relacionarlos con las producidas en el metabolismo glucídico, midiendo peroxidación lipídica en hígados, quimioluminiscencia espontánea en orinas (QL) en paralelo con las enzimas claves del metabolismo de hidratos de carbono. 6.- Determinar si en este tipo de porfiria existen alteraciones del estado hormonal que regula el metabolismo de la glucosa, estudiando nivel plasmático de glucocorticoides (GC), el número y la afinidad de los receptores hepáticos de GC (GR) y la biosíntesis de GC en tejido adrenal en presencia y ausencia de ACTH. Todo ello en relación a las alteraciones del camino del hemo y a la actividad de PEPCK, que está regulada positivamente por GC y negativamente por insulina. 7.- Estudiar el efecto de la droga porfirinogénica HCB sobre los niveles plasmáticos de insulina y sobre el patrón de secreción pancreática de esta hormona estimulada por glucosa, en relación a biomarcadores del camino del hemo y parámetros claves del metabolismo glucídico, atendiendo que la insulina regula negativamente a PEPCK y GP. 86 OBJETIVOS 8.- Explorar algunos aspectos del metabolismo del triptófano (TRP) en relación a esta porfiria y al metabolismo de la glucosa. Esto, teniendo en cuenta que la administración de TRP resulta en hipoglucemia y que la presencia de algunos de sus metabolitos de degradación daña la gluconeogénesis y la formación de glucógeno. 2.2.2. Objetivos particulares: Modelo de porfiria aguda generada con AIA/DDC Se describen aquí los objetivos particulares para el modelo de porfiria hepática aguda, realizado a través del estudio comparativo de animales tratados con 2-alil 2-isopropilacetamida (AIA) y 3´,5´-dietoxicarbonil-1,4dihidrocolidina (AIA/DDC) vs controles, en función de dosis crecientes de la droga porfirinogénica AIA. 1.- Investigar cómo se desregula el camino del hemo en este modelo experimental de porfiria hepática aguda por la acción de dosis crecientes de AIA y una dosis fija de DDC determinando las actividades de ALA-S (enzima regulatoria del camino) y FQ (enzima particularmente afectada por acción del DDC), y el contenido de los precursores ALA y PBG en el hígado. 2.- Indagar en esta porfiria inducida por AIA/DDC la existencia de fallas en las rutas anabólicas y catabólicas de la glucosa, mediante el estudio de las actividades de enzimas hepáticas de la gluconeogénesis (PEPCK y G6Pasa) y de la glucólisis, PK. 3.- Determinar si el tratamiento con ambas drogas promueve daños en los procesos de síntesis y degradación del glucógeno a través de sus enzimas claves: GS para la glucogenogénesis y GP para la glucógenolisis, así como en niveles hepáticos de glucógeno. 87 OBJETIVOS 4. Analizar si la intoxicación producida por el tratamiento con AIA/DDC genera perturbaciones del transporte de glucosa en hígado, usando un análogo de glucosa marcada no metabolizable (3-O-metil d-3H-glu). 5. En la búsqueda de interferencias en el sistema redox, evaluar el daño a lípidos y proteínas en hígado, la presencia de quimiolumiscencia espontánea en orina asociada a estrés oxidativo y las actividades hepáticas de enzimas antioxidantes SOD y CAT. Todo ello en animales tratados con AIA/DDC, con diferentes dosis de AIA y en relación a las actividades de PEPCK y de GP. 6. Investigar si la melatonina (Mel) administrada previamente a la intoxicación de los animales, puede modular los efectos producidos por el AIA/DDC sobre el ambiente oxidativo, la biosíntesis de la glucosa y el camino del hemo; es decir, si puede modular o prevenir la porfiria aguda inducida por estas drogas. 7. Explorar la existencia de perturbaciones en el metabolismo hepático del TRP en este modelo de porfiria aguda, midiendo la concentración de serotonina (5-HT); los niveles del TRP y además la actividad de la enzima TRPp en sus tres formas: holo-enzima, apo-enzima y enzima total. Todo ello en relación a biomarcadores de porfiria y al metabolismo de la glucosa, a los fines de interrelacionar dichos disturbios. 88 Materiales y Métodos 3. MATERIALES Y MÉTODOS 3.1. ANIMALES Para todas las experiencias de esta Tesis, se utilizaron ratas hembra de la cepa Wistar. Sus pesos corporales al comienzo de cada experiencia rondaron entre los 190 y 210g. Los animales fueron adquiridos aproximadamente a los dos meses de edad (150170g) en el Bioterio de la Comisión Nacional de Energía Atómica (CONEA, EzeizaArgentina). Luego se mantuvieron hospedados hasta su utilización en el Bioterio Central de la Facultad de Ciencias Exactas y Naturales-UBA, bajo condiciones de temperatura constante (22 °C) y ciclos de luz controlados (12 h luz-12h oscuridad, con luz desde las 06:00 a las 18:00 h), en jaulas de acero inoxidable con acceso a comida (Purina, dieta 3) y agua ad libitum. Los procedimientos que involucraron animales, tanto cuidado como uso, fueron llevados a cabo de acuerdo con las guías internacionales (Guide for the Care and Use of Laboratory Animals, National Research Council, USA, 1996; The Council of the European Communities Directive, 86/609/ECC), como con las nacionales (Comité de Uso de Animales de la Asociación Argentina de Especialistas en Animales de Laboratorio, AADEALC). 3.2. DROGAS Y REACTIVOS. El hexaclorobenceno de grado comercial (HCB) fue proporcionado gentilmente por Compañía Química S.A. (BA, Argentina). El aceite de maíz Mazola con el que se administró el HCB, se compró localmente. La 2-alil-2-isopropilacetamida (AIA) fue donada por Roche Company (Basel, Suiza). El 3´,5´-dietoxicarbonil-1,4-dihidrocolidina (DDC) fue comprado a Aldrich Chemical Company Inc. (Milwaukee, WI., USA). La colagenasa se obtuvo a través de Serva Feinbiochemica (Heidelberg, Alemania). La 125 I-insulina monoiodinada de cerdo, fue obtenida en CENEXA (Facultad de Medicina, Universidad Nacional de la Plata, Argentina) y el antisuero de coballo contra la insulina porcina fue donado por el Dr. R. Gutman, del Hospital 90 Materiales y Métodos Italiano, (BA., Argentina). Este antisuero fue suficientemente no específico para permitir ser desplazado por la insulina de rata. El estándar de insulina de rata fue obtenido a través de Novo Research Laboratories (Bagsvaerd, Dinamarca). El antisuero contra la corticosterona (CORT) fue proporcionado atentamente por el Dr. Celso Gomez Sanchez, (University of Mississippi Medical Center MS., USA) La 3-O-[metil-3H]-glucosa (1 mCi/ml, 60–90 Ci/mmol), [3H]-corticosterona (76,5 Ci/mmol) y [3H]-DEX (35 Ci/mmol) fueron comprados a NEN Life Science Products Inc. (Boston, MA., USA). El cocktail de centelleo OptiPhase Hi Safe 3 fue provisto por Wallac Scintillation Products (Turku, Finlandia). El medio modificado Eagle-Dulbecco en polvo (DMEM) fue comprado a GIBCO (NY, USA). La Uroporfirina III se obtuvo a través de Porphyrin Products, Logan, (UT., USA). El clohidrato de guanidina se compró a Invitrogen (CA., USA). Se utilizó para la medición de glucosa en plasma el Kit Wiener Enzimático de Glicemia, Laboratorios Wiener (Rosario, Argentina). El ácido ascórbico, ácido delta-aminolevulínico (ALA), ácido tiobarbitúrico (TBA), adenocorticotrofina (ACTH), 5’-adenosina monofosfato (AMP), citocalasina B, citrato-liasa (CL), coenzima A (CoA), 2’-deoxiguanosina 5’-difosfato (dGDP), dexametasona (DEX), epinefrina, fosfoenol-piruvato (PEP), fosfotransacetilasa, glucógeno tipo III de hígado de conejo (GlnIII), glucosa-1-fosfato (G1P), heparina, lactato deshidrogenasa (LDH), málico dehidrogenasa (MDH), malondialdehido (MDA), Melatonina (Mel), NADH, piruvato, albumina de suero bovina (BSA), resinas de intercambio Dowex 1 y Dowex 50W y otros reactivos, enzimas y sustratos, se compraron a través de Sigma-Aldrich Chemical Co. (STL., USA). El resto de las drogas utilizadas, fueron las de mayor grado de pureza disponible en el mercado local. 91 Materiales y Métodos 3.2.1- Equipos Todos los homogenatos se realizaron con un homogeneizador Potter-Elvehejm (USA). Cuando hubo que sonicar muestras se utilizó un homogeneizador Ultrasónico 4710 Perkin Elmer 450 (Waltham, MA., USA). Las centrifugaciones se efectuaron de acuerdo a las condiciones necesitadas y la fracción a obtener, en una centrífuga de mesa Presvac (BA., Argentina), en una microcentrífuga Sartorius modelo 1-14, en una centrífuga refrigerada Sorvall RC5C y/o en una ultracentrífuga Beckman XL 90 (Brea, CA., USA). Las mediciones espectrofotométricas se llevaron a cabo en un espectrofotómetro SHIMADZU UV 160ª (Kyoto, Japón). Se llevaron a cabo diferentes filtraciones en columnas de Dowex 1, Dowex 50W y Sephadex G25. Para realizar las determinaciones por HPLC, las muestras se filtraron a través de filtros Millipore SJHU013NS para luego ser inyectadas en una columna de HPLC µBondapack C18 (300 x 3,9 mm) Waters (Milford, MA., USA) adosada a un cromatógrafo Spectra SERIE Thermo Separation Products, (Waltham, MA., USA) Modelo P200, con detector de fluorescencia FL 2000 (Waters Corp. Milford, MA., USA) e integrador Data Jet, de Thermo Separation Products. Para cuantificar el transporte de 3H-Glu en los tejidos, para los ensayos por RIA y para medir quimioluminiscencia urinaria (QL), se utilizó un contador líquido de centelleo Beckman LS-3150P (Brea, CA., USA), que solo fue operado en modo out-offcoincidence, cuando se realizó la cuantificación de QL. Para la obtención de agua destilada y desionizada (Milli-Q) se utilizaron un destilador y desionizador marca Millipore (Billerica, MA., USA). 92 Materiales y Métodos 3.3. TÉCNICAS Y TRATAMIENTOS SOBRE ANIMALES DE EXPERIMENTACIÓN 3.3.1. Drogado de animales - Modelo de Porfiria Crónica por HCB. Los animales utilizados en el modelo de intoxicación crónica por HCB fueron aleatoriamente separados en cada experiencia en dos grupos: el grupo control (n = 30) y el grupo tratado con HCB (n = 30). En este esquema de drogado, las ratas del grupo HCB recibieron sólo 500 mg de la droga/kg peso corporal en cinco dosis consecutivas diarias de 100 mg/kg peso corporal, disuelto en aceite de maíz (1% p/v) por intubación gástrica (Legault et al., 1997; Mylchreest & Charbonneau, 1997). Se ha demostrado que este protocolo induce una porfiria totalmente desarrollada en un lapso de tiempo bien definido y predecible (Mylchreest & Charbonneau, 1997). La principal ventaja de este modelo de intoxicación respecto del continuo (Billi de Catabbi et al., 1997), es que involucra una exposición mínima al HCB (menor tiempo y menor dosis). El tratamiento con HCB no causó muertes, síndromes neurológicos detectables, ni sufrimiento en los animales. Las ratas del grupo control recibieron sólo el aceite de maíz como vehículo (10 ml/kg peso corporal) durante esos mismos 5 días. Todos los animales fueron privados de la comida 24 h antes de ser sacrificados, pero se les permitió libre acceso al agua de los bebederos. Se consideró como tiempo 0, el momento en que se administró la 5ta dosis consecutiva de HCB en aceite por intubación gástrica y en las semanas sucesivas a partir de ese tiempo inicial, seis ratas de cada grupo (tratadas con HCB y controles) fueron utilizadas para las determinaciones, que en lo sucesivo se detallarán. 3.3.2. Drogado de animales - Modelo de Porfiria Aguda por AIA/DDC Los animales utilizados en el modelo de intoxicación aguda, por administración concomitante de AIA y DDC, fueron aleatoriamente separados para cada experiencia en cuatro grupos. 93 Materiales y Métodos Para este esquema de drogado, el AIA fue disuelto en solución salina (1,5-2%, p/v) (De Matteis, 1970) y el DDC (utilizado en una dosis única de 50mg/kg peso corporal) fue disuelto en aproximadamente 2,5 ml de aceite de maíz (De Matteis et al., 1973). Ambas soluciones fueron preparadas justo antes de ser administradas a los animales. Las ratas fueron ayunadas 8 h antes de la intoxicación con ambas drogas. El AIA fue inyectado subcutáneamente (s.c.) en tres dosis diferentes según los grupos, mientras que concomitantemente, el DDC fue inyectado intraperitonealmente (i.p.) en la dosis antedicha. Así, los animales se dividieron en los siguientes grupos: L (100 mg AIA/kg peso corporal + 50mg DDC/kg peso corporal), M (250 mg AIA/kg peso corporal + 50mg DDC/kg peso corporal), y H (500 mg AIA/kg peso corporal + 50mg DDC/kg peso corporal). El grupo Control (C) recibió solo los vehículos: solución salina vía s.c. y aceite de maíz vía i.p. Estas dosis de AIA y DDC también fueron usadas por otros grupos de investigación (De Matteis, 1970; De Matteis et al., 1973) para obtener modelos de porfiria en ratas. Las ratas tuvieron un ayuno total de 24h (8h antes del drogado y 16h después del tratamiento) antes de ser sacrificadas, aunque con libre acceso a los bebederos de agua. En las determinaciones en las que se necesitó la orina total, se colectó durante las 16 h posteriores a la intoxicación, utilizando jaulas metabólicas individuales para cada animal. 3.3.3. Tratamiento con Melatonina, como antioxidante preventivo. Otros animales también utilizados en el modelo de intoxicación aguda, por administración concomitante de AIA y DDC, fueron aleatoriamente separados para cada experiencia en cuatro grupos: C (grupo Control), Mel (grupo Melatonina), I+Mel 94 Materiales y Métodos (grupo intoxicado con AIA/DDC junto al tratamiento con Melatonina) e I (grupo intoxicado con AIA/DDC). La melatonina (Mel) fue inyectada en dos de los grupos de animales con una concentración de 10 mg/kg de peso corporal, i.p. 3 veces al día (a las 8, 12 y 16hs) durante los 2 días previos a la intoxicación con AIA (300 mg/kg. pc, s.c.) y DDC (50 mg/kg. pc, i.p.). El grupo Control (C) recibió solo los vehículos de las drogas y del protector Mel. Figura. 3.1. Esquema del protocolo de pre-tratamiento con Melatonina vía i.p. sobre ratas intoxicadas con AIA/DDC y Controles. C, ratas Control (inyectadas con vehículos de Mel i.p. y vehículos de AIA s.c. y DDC i.p.) I, rata intoxicada con AIA/DDC 300/50 mg por kg peso (inyectada con vehículos de Mel i.p.) Mel, rata pre-tratada con Mel. i.p. 48h (3 dosis cada 4 hs) y 24 horas (3 dosis cada 4 hs) antes del sacrificio e inyectada con vehículos de AIA s.c. y DDC i.p. I+Mel, rata intoxicada con AIA s.c. y DDC i.p. y pre-tratada con las 6 dosis de Mel. i.p. 48 y 24 horas antes del sacrificio. Los vehículos de las diferentes drogas, se representan como líneas verticales negras; la intoxicación con AIA/DDC como rectángulos rojos y las dosis del tratamiento con Mel, como rectángulos verdes. Para este esquema de drogado, el AIA y DDC fueron disueltos y administrados a los animales como se describe en el punto anterior. La melatonina fue disuelta en solución salina justo antes de ser administrada i.p. a los animales de los grupos correspondientes (Mel y I+Mel). A los grupos C e I se los inyectó i.p. en los mismos horarios solo con el vehículo de Mel (1 ml de solución salina). Las dosis fueron basadas 95 Materiales y Métodos en estudios sobre ratas tratadas con melatonina como protector y reductor de la toxicidad producida por ciertas drogas (Reiter et al., 2000) Las ratas fueron ayunadas durante 24h (8h antes del drogado y 16h después del tratamiento) antes de ser sacrificadas, aunque con libre acceso a los bebederos de agua. Las mediciones fueron hechas 16h post-intoxicación. En las determinaciones en las que se necesitó la orina total, se colectó durante las 16h posteriores a la intoxicación, utilizando jaulas metabólicas individuales para cada animal, provistas de bebederos con agua. 3.4 DETERMINACIONES HEPÁTICAS- PREPARACIÓN DEL TEJIDO. Las ratas se sacrifican por decapitación a los tiempos establecidos para cada modelo. Todos los ensayos fueron llevados a cabo en ratas con un período total de ayuno de 24h, salvo en los dos lotes de 5 animales cada uno, que se utilizaron para determinar el efecto de la comida vs el ayuno en las determinaciones enzimáticas hepáticas de PEPCK, PK, PC y G6Pasa. Los hígados de los animales recién sacrificados, fueron perfundidos con solución salina a 4°C, inmediatamente removidos, pesados y homogenizados en un homogeneizador Potter-Elvehejm utilizando diferentes buffers y proporciones de ellos para cada una de las determinaciones que abajo se detallan. Todos los procedimientos fueron llevados a cabo a 4°C. Para la determinación tanto de la ferroquelatasa hepática (FQ), como la de URO-D, el tejido se homogeneizó en KCI 0,154 M (1g de tejido se llevó a 5 ml), se centrifugó a 700 x g por 15 minutos y el sobrenadante así obtenido se centrifugó a 11.000 x g por 20 min en centrífuga Sorvall. El sobrenadante fue usado como fuente de enzima para la determinación de URO-D (previo pasaje por columnas de Sephadex G25, como se describirá en detalle en el ítem 3.4.1.2) y el pellet obtenido luego de esta última centrifugación se lavó con un pequeño volumen de KC1 0,154 M y se volvió a centrifugar a 11.000 x g por 20 min. Las mitocondrias así obtenidas se congelaron a -20°C por 24-48 hs antes de ser utilizadas para la medición de la FQ. 96 Materiales y Métodos Para la determinación del contenido de ALA y PBG en hígado, así como para la determinación de la actividad enzimática de ALA-S, el hígado fue homogenizado en proporción 1:3 (p/v) en un buffer Tris–HCl 0,1mM, NaCl 0,9% y 0,5mM EDTA, pH 7,4. Para la determinación del contenido de porfirinas, los homogenatos se prepararon con KCl 0,154M en una proporción 1:5 (p/v). Para la determinación de las actividades PEPCK y G6Pasa, 1 gramo de hígado fue homogeneizado en 3 volúmenes de sacarosa 0,25M. El homogenato se centrifugó por 20 min a 11.000 x g en una centrífuga Sorvall para precipitar el debris celular y las mitocondrias. El sobrenadante obtenido fue centrifugado durante 1 hora a 100.000 x g en la ultracentrífuga Beckman, separando nuevamente pellet (fracción microsomal) y sobrenadante (fracción soluble o citosol). Esta fracción soluble fue utilizada para realizar las determinaciones de actividad enzimática de la PEPCK, mientras que la fracción microsomal se resuspendió en sacarosa 0,25M + 1 mM EDTA, pH 7 (1 ml/gramo tejido), y se guardó a -20°C toda la noche, descongelándose luego para la determinación de la actividad de G6Pasa. Para la determinación de la actividad de PK se realizó un homogenato 1:4 en buffer Tris–HCl 50mM, 0,1M KCl, 5mM MgSO4, 1mM EDTA, pH 7,5 conteniendo 0,2mM de fructosa-1,6-difosfato y 10mM de β-mercaptoetanol. Las determinaciones enzimáticas se realizaron en sobrenadantes preparados por un único paso de centrifugación del homogenato durante 1 h a 100.000 x g. Para la determinación de la actividad de PC se realizó un homogenato 1:5 en buffer Tris-acetato 50mM, 5mM de MgSO4, 5mM de EDTA, pH 6,5; sonicando sobre hielo 3 veces por 20 seg cada vez, con el fin de liberar las enzimas asociadas a partículas y ultra-centrifugando a 100.000 x g por una hora para obtener la fracción soluble necesaria para dicha determinación. Se realizaron además, homogenatos 1:10 con ácido perclórico 6% para el análisis del contenido de glucógeno hepático. Luego de calentar y centrifugar a 11.000 x g por 20 min, el sobrenadante se precipitó con 2 volúmenes de etanol helado. El 97 Materiales y Métodos precipitado luego se disolvió en agua para que el contenido de glucógeno sea determinado como equivalentes de glucosa. Para la medición de la captación de glucosa por el hepatocito, se cortaron 4 porciones de 0,25 g de hígado en cubos de 2mm de lado, que luego fueron incubadas en 4 cajas de Petri de 10 ml con 1 ml de DMEM en cada una durante 5 min a 37°C. El transporte de glucosa y el binding no específico fue definido como los eventos que ocurren en presencia 1 μM de citocalasina B agregada durante dicha incubación. Para la determinación de las enzimas glucógeno-sintetasa (GS) y glucógenofosforilasa (GP), los hígados se homogenizaron en 3 volúmenes de sacarosa 0,25M + 1mM EDTA. El homogenato se centrifugó durante 10 min a 2.000 x g en una centrífuga de mesa, se descartó el debries celular y el sobrenadante resultante, fue utilizado en las determinaciones. Para la determinación de peroxidación lipídica en tejido hepático el contenido de TBARS se ensayó a partir de un homogenato 1:10 en KCl 154mM. También fueron utilizadas las fracciones microsomales y mitocondriales de ese mismo homogenato para poder determinar en qué sub-fracción se generaba más daño a lípidos. La obtención de mitocondrias y microsomas se realizaron a través del fraccionamiento subcelular por centrifugaciones diferenciales descripto en ítems anteriores (preparación de fracción citosólica en medición para la actividad de PEPCK). Brevemente, se podría describir este fraccionamiento como una sedimentación de la fracción mitocondrial por centrifugación a 11.000 x g durante 20min a partir del homogenato descripto para esta determinación, y separación de la fracción citosólica de la microsomal, por una ultracentrifugación a 100.000 x g por 1 h. Para ensayar el contenido de proteínas carboniladas en el citosol, se utilizó una pequeña porción de la misma fuente enzimática que se preparó para PEPCK, conteniendo 2mg de proteínas (aproximadamente en un volumen de 200 μl). Para la medición de las actividades CAT y SOD total, los hígados fueron homogeneizados (1:10 p/v) en una solución conteniendo 140mM KCl en un buffer 25mM de fosfato de potasio pH 7,4 y luego centrifugado a 900 x g por 15 min. El 98 Materiales y Métodos sobrenadante resultante (una suspensión con organelas) fue utilizado para realizar las determinaciones enzimáticas. En los ensayos para determinar el binding de los receptores de glucocorticoides (GR), los hígados de animales previamente adrenalectomizados (48h antes) fueron rápidamente removidos al sacrificar los animales, cortado en pequeñas piezas y lavado con buffer GR a 4 °C repetidas veces (10 mM Hepes + 5 mM EDTA, 10% glicerol (v/v), 20mM Na2MoO4, 2mM DTT y 0,1mM PMSF a pH 7,4) y homogenizado en una proporción de 2g de tejido en 3ml de dicho buffer (1:1,5 p/v). La fracción citosólicas soluble, fue preparada a partir del homogenato por centrifugaciones diferenciales. Luego de sedimentar la fracción mitocondrial por centrifugación a 11.000 x g durante 20 min., la fracción citosólica fue separada de la microsomal por una ultracentrifugación a 100.000 x g por 1 h. El contenido de triptófano y/o serotonina en tejido hepático fue determinado realizando un homogenato en ácido perclórico 0,6M en proporción 1:4 (p/v), protegiendo en todo momento tanto el órgano como el homogenato de la luz, para no producir degradación de estos aminoácidos y sus metabolitos. El homogenato se centrifugó inmediatamente durante 20 min a 11.000 x g y el sobrenadante resultante se filtró a través de filtros Millipore SJHU013NS para luego ser inyectados en una columna de HPLC Waters µBondapack C18. La actividad de la triptófano pirrolasa (TDO o TRPp) hepática fue determinada en homogenatos de hígado realizados en menos de 3 min de sacrificado el animal, en 6,5 volúmenes de buffer 140mM KCl 2,5mM NaOH protegiendo tanto el órgano como el homogenato de la luz para no producir degradación de los metabolitos involucrados en esta determinación. 99 Materiales y Métodos 3.4.1. Determinación de actividades enzimáticas del camino del hemo. 3.4.1.1. Actividad hepática de la 5-aminolevulínico-sintetasa (ALA-S). Aproximadamente 1 g de tejido se homogeneizó con solución que contiene buffer Tris-HCL 10 mM (pH 7,4), NaCl 0,9% y EDTA 0,5 mM de tal forma de obtener 3 ml de homogenato/g de hígado. La actividad de ALA-sintetasa se ensayó en los homogenatos por el método de Marver et al., (1966). La mezcla de incubación contiene 0,5 ml de homogenato, 0,5 ml de glicina 0,4 M, 0,2 ml de EDTA 0,1 M, 0,8 ml de buffer Tris-ClH 0,2 M (pH 7,2) en un volumen final de 2 ml. Se incubó a 37°C durante 1 h al aire y con agitación. Se desproteinizó con 0,5 ml de TCA 25% en frío y se centrifugó a 1.500 rpm en centrífuga de mesa por 15 min. Se pirrolizó el ALA usando 1 ml del sobrenadante obtenido de cada tubo más 1 ml de buffer acetato de sodio 0,1 M pH 4,6 y 50 μl de acetilacetona, vortexeando hasta lograr la integración de todos los componentes y calentando a 100°C por 10min. Se agregó luego de enfriar 2 ml de reactivo de Ehrlich a cada tubo, vortexeando nuevamente. Luego de pasados 7 min a temperatura ambiente (y antes de los 15 min), el producto (ALA pirrolizado) se determinó espectrofotométricamente a 553 nm, restando la absorbancia de los blancos respectivos, con un M de 6,1 x 10 4 nM-1. cm-1 para el ALA. (Mauzerall & Granick, 1956). El reactivo de Ehrlich fue preparado en el momento de su uso con 0,4g de paradimetilamino benzaldehído (pDMAB) + 12 ml de acético glaciar + 3,4 ml de ácido perclórico 70% y llevado a 20 ml de volumen final con acético glaciar. 3.4.1.2. Actividad Uroporfirinógeno-decarboxilasa (URO-D) La actividad de la enzima URO-D fue medida de acuerdo al trabajo descripto por Wainstok de Calmanovici et al., (1984) con modificaciones más recientes según describe Chaufan et al., (2002). 100 Materiales y Métodos El substrato de la reacción, el uroporfirinógeno III se obtuvo reduciendo la uroporfirina III (Porphyrin Products) con amalgama de sodio al 3% (preparada según el método de San Martín de Viale, 1970) a uroporfirinógeno III que fue utilizado inmediatamente luego del filtrado (Mauzerall & Granick, 1958). La incubación fue llevada a cabo en una mezcla (Vf: 1,5 ml) conteniendo: buffer fosfato de potasio 0,067 M pH 6,8; 1 mM de GSH reducido; 0,1 mM EDTA; usando 4 µM de uroporfirinógeno III como sustrato y aproximadamente 200 µl de citosol (previamente filtrado en Sephadex G25 para sacar las porfirinas en caso de animales tratados) como fuente enzimática (conteniendo 3 mg prot/ml). Los ensayos se llevaron a cabo de manera anaeróbica y en oscuridad, a 37°C por 30 min con agitación mecánica. La reacción se detuvo reoxidando el porfirinógeno en presencia de luz y luego desproteinizando. Las porfirinas formadas fueron separadas por cromatografía líquida de alta resolución (HPLC) en un cromatógrafo de la SERIE Spectra (Thermo Separation Products) Modelo P200, a través de una columna Waters µBondapack C18 de fase reversa (300 x 3,9 mm) y luego cuantificadas como porfirinas libres, a través de un detector de fluorescencia Waters FL 2000, seleccionando para la detección 404nm como longitud de onda de excitación y 618nm como longitud de onda de emisión tal como lo describen Lim et al., (1983). Los solventes utilizados en el gradiente de elución, fueron acetonitrilo y buffer acetato de amonio 1 M, pH 5,16. Fue utilizado un gradiente lineal de 10% a 30% de acetonitrilo en buffer acetato de amonio (v/v) durante 15 min, seguido por una elución isocrática con 30% de acetonitrilo en buffer acetato de amonio por otros 15 minutos (Lim et al., 1983), siendo la velocidad de flujo de aproximadamente de 1ml/min. Para realizar los cálculos de los nmoles detectados se utilizaron los coeficientes determinados previamente en el laboratorio, considerando la concentración de porfirinas como el área bajo la curva de retención vs nmoles de porfirinas. El valor para copro´gen fue: 4,4 x 10-4 nmoles/área. Luego se expresó la actividad de la enzima, convirtiendo el área integrada como nmoles de COPROgen III formado/mg proteína.hora. 101 Materiales y Métodos 3.4.1.3 Actividad ferroquelatasa (FQ) La actividad enzimática de la FQ se determinó en las fracciones mitocondriales previamente obtenidas por centrifugación diferencial del homogenato antes descripta y congeladas a -20°C. La solución de PROTO IX, utilizada como sustrato, se preparó según lo describen Porra & Jones (1963). Para conocer la concentración de la solución de PROTO IX se hizo una dilución conveniente con HC1 5% y se midió la absorbancia a 407,5 nm. Se utilizó un mM de 275. Luego la protoporfirina fue disuelta de manera de obtener una solución madre 1mM en buffer Tris HCl 40 mM pH 8,2 con el agregado de Tween 80 al 2% (p/v). Para determinar la actividad de ferroquelatasa, el medio de incubación contenía en un volumen final de 3,2 ml: 100 nmoles de PROTO IX, 200 nmoles de SO4Fe (preparado en agua al momento de usarse), 30 µmoles de succinato de sodio, 140 µmoles de buffer Tris HCl pH 8,2 y 0,8 ml de la suspensión de las mitocondrias (correspondientes a 8 mg de proteínas microsomales). Este y los blancos de sustrato (sin PROTO IX) se incubaron a 37°C durante 1h en oscuridad. Al finalizar la incubación se adicionaron, sobre hielo y bajo campana, 1 ml de piridina y 0,5 ml de NaOH 1N. Pasados otros 20 min se agregó en los tubos 1 ml de agua. La mezcla se dividió en dos cubetas, en una se agregó una punta de espátula de Na2S204 y en la otra 50 µl de K3[Fe(CN)6] 3 mM y se midió la diferencia de absorbancia del hemocromógeno oxidado y reducido (Porra & Jones, 1963). La formación de producto fue calculada con la diferencia de absorbancias (A556nm-A538nm) entre el máximo de la banda a (556 nm) y el mínimo entre las bandas alfa y beta (538 nm) restando los valores del blanco para cada caso. El valor usado para mM fue de 12,5. 102 Materiales y Métodos 3.4.2. Contenido de intermediarios hepáticos del camino del hemo. 3.4.2.1. Contenido hepático de ALA y PBG Para determinar los contenidos de ALA y PBG, una porción de homogenato hepático completo fue desproteinizada con 0,6M de TCA y centrifugada por 15 min a 1.500 x g según la técnica de Marver et al., (1966). Entre 0,5-1 ml de sobrenadante se ajustaron a pH 5,5–6,0 con HCl. El contenido fue determinado esencialmente por el método de Piper et al., (1973). Para ello se utilizaron dos columnas de intercambio iónico; el PBG fue eluído de una columna Dowex 1 con ácido acético 1N, mientras que el ALA se eluyó de una columna Dowex 50W con acetato de sodio 1M luego de remover la urea en un primer paso con agua. El ALA pirrolizado (ver técnica para determinación del producto en el ensayo de ALA-S) y el PBG se midieron espectrofotométricamente a 553 nm, con un M = 6,1 x 104 nM-1.cm-1 para el PBG utilizando el reactivo de Ehrlich, como describe Mauzerall & Granick (1956). 3.4.2.2. Contenido de porfirinas hepáticas El contenido de porfirinas fue determinado espectrofotométricamente en porciones de 0,1–0,5 ml de homogenatos hepáticos como porfirinas totales libres en 5% (p/v) HCl. Esto se hace luego de precipitar las proteínas y la extracción cuantitativa de las porfirinas determinadas con la adición de 5 volúmenes de acetato de etilo/ ácido acético (3:1 v/v) y la posterior transferencia de las porfirinas al HCl 5%, como describe San Martín de Viale et al., (1977). El contenido total de porfirinas fue determinado espectrofotométricamente usando la corrección de la fórmula de Rimington & Sveinsson, (1950) para compensar la absorción inespecífica de fondo. Para ello se hacen lecturas de absorbancia a 3 diferentes longitudes de onda, la del máximo de Soret (Amax), 380 y 430 nm y se calcula la Acorr mediante las expresiones: A= 2.Amax - (A380 + A430); Acorr = A/K 103 Materiales y Métodos donde K es el factor de corrección. Para determinar K (1,844), se utilizaron curvas de calibración para uroporfirinas, coproporfirinas y protoporfirinas en 5% de HCl. (Tomio et al., 1970). 3.4.3. Determinación de actividades enzimáticas hepáticas. Gluconeogénesis y Glucólisis. 3.4.3.1. Actividad de fosfoenolpiruvato carboxiquinasa (PEPCK) La actividad de la enzima gluconeogénica PEPCK fue medida de acuerdo con el método de Petrescu et al., (1979) usando 2’-deoxiguanosina 5’-difosfato (dGDP) como nucleótido sustrato, y midiendo la oxidación del NADH. La mezcla de reacción contenía en 1 ml: 50 mM de buffer Tris-HCl pH 7,4 + 20 mM de bicarbonato de sodio (saturado con CO2) + 0,5 mM de PEP + 1 mM de MnCl2 + 2 unidades de MDH en Tris y 0,1 mM de NADH en Tris. Alícuotas de 20 µl de fracción citosólica fueron utilizadas en cada ensayo. GTP + oxalacetato ↔ GDP + PEP + CO2 La reacción fue iniciada con el agregado de 0,2 mM de dGDP y la cinética seguida entre 2 y 5 min, mientras la actividad se mantuvo lineal. El oxalacetato formado durante la reacción enzimática reversa fue espectrofotométricamente determinado, observando desaparición en el tiempo de la absorbancia a 340 nm (cinética) por NADH en presencia de MDH. La reacción se llevó a cabo a temperatura ambiente, y se utilizó un M para el NADH de 6,22 x 109 μM-1.cm-1. Los resultados de la actividad PEPCK se expresaron como nmoles de NADH oxidado.min-1.mg proteínas-1. 3.4.3.2. Actividad de piruvato carboxilasa (PC) La actividad de la enzima gluconeogénica PC fue determinada por el método de Berndt et al., (1978). La mezcla de incubación de 1,2 ml de volumen total contenía: 200 µmol de buffer Tris HCl pH 8,0; 4 µmol de piruvato; 2 µmol ATP; 10 µmol de MgCl2; 30 µmol 104 Materiales y Métodos de KHCO3; 10 µmol acetil-fosfato; 1 µmol de CoA; 4 U de CS y 20 U de fosfotransacetilasa. En los ensayos controles, el piruvato no fue agregado. Una alícuota de 50 µl de sobrenadante conteniendo aproximadamente 0,15 mg de proteínas fue utilizada para iniciar la reacción inversa y catalizar la formación de oxalacetato a partir del piruvato en una incubación de 30 min a 37 °C. Inmediatamente el oxalacetato formado se transformará en citrato por acción del citrato sintetasa (CS), la fosfotransacetilasa, el ATP y la acetil-CoA. El citrato fue determinado luego de otros pasos de precipitación de proteínas y centrifugación, mediante su clivaje a acetato y oxalacetato; y éste último reducido con MDH en presencia de NADH. Los cambios de absorbancia fueron medidos espectrofotométricamente a 340 nm, como se describió anteriormente para la determinación de PEPCK. La reacción se llevó a cabo midiendo la cinética de desaparición del NADH por 2 min a temperatura ambiente, con un M = 6,22 x 10 9 μM-1. cm-1 para el NADH Los resultados de la actividad PC se expresaron como μmoles de NADH oxidado. min-1.mg proteínas-1. 3.4.3.3. Actividad de glucosa-6-fosfatasa (G6Pasa) La actividad de G6Pasa fue medida siguiendo la técnica de Baginski et al., (1974) a través del fosfato inorgánico liberado del sustrato utilizado (G6P). Una alícuota de 50 µl de suspensión microsomal hecha con el pellet de la centrifugación a 100.000 x g resuspendido en 1ml de sacarosa 0,25 M + EDTA 1mM (conteniendo aproximadamente 40 µg de proteínas), fue incubada con 450 µl de reactivo conteniendo G6P 0,1M; histidina 35mM; agua y EDTA 10 mM (en proporción 2: 5: 1: 1) a pH 6,5; en baño con agitación a 37 °C por 30 min. Todos los ensayos se realizaron por duplicado. Los blancos de reactivos se hicieron remplazando la suspensión microsomal por agua y los blancos de muestra remplazando el reactivo de G6P por agua. La reacción se frena a los 30 min con 2,5 ml TCA 8%. Luego se centrifuga por 15 min a 5.000 x g y el sobrenadante se usa en la medición del fosfato inorgánico liberado (Pi). 105 Materiales y Métodos El fosfato se determinó espectrofotométricamente a 660 nm por el color del complejo de fosfo-molibdato formado, usando como reactivo reductor una parte de acido ascórbico 10% (p/v) en 6 partes de molibdato de amonio 3,6 mM (0,42% p/v en SO4H2 1N). Así se incuban 50 μl del sobrenadante con 700 μl de reactivo reductor y 250 μl de agua, por 20 min en baño con agitación a 45°C (Ayes, 1966). Se utilizó un M = 4,25 x 109. M-1. cm-1 para el Pi. Los resultados de la actividad G6Pasa se expresaron como μmoles de Pi.min-1.mg proteínas-1. 3.4.3.4. Actividad de piruvato quinasa (PK) La actividad de la enzima glucolítica PK fue medida de acuerdo a la técnica descripta por Imamura & Tanaka (1982) por el método acoplado de NADH-LDH. Cada ml de la mezcla de ensayo contenía: 50 µmoles de buffer Tris HCl pH 7,5; 0,1 mmoles de KCl; 5 µmoles de MgSO4; 0,5 µmoles de F1,6BP; 2 µmoles de ADP; 2 µmoles de PEP; 0,18 µmoles de NADH y 8 U de LDH. En los ensayos controles, el PEP no fue agregado. Una alícuota de 10 µl del sobrenadante conteniendo aproximadamente 30 µg de proteínas fue utilizada para iniciar la reacción en la cubeta del espectrofotómetro conteniendo 1ml de la mezcla de reacción preincubada para obtener una temperatura entre 25 y 37 °C. La actividad PK fue medida por el piruvato formado a partir del PEP + ADP el cual se redujo con LDH en presencia de NADH. La reacción se llevó a cabo midiendo la cinética de desaparición del NADH por 2 min a dicha temperatura, con un M = 6,22 x 10 9. μM-1. cm-1 para el NADH. Los resultados de la actividad PK se expresaron como μmoles de NADH oxidado. min-1. mg proteínas-1. 3.4.4. Contenido de glucógeno hepático El glucógeno fue determinado realizando un homogenato hepático 1:10 (p/v) en ácido perclórico 6% como se describe en el trabajo de Taira et al., (2004). Este 106 Materiales y Métodos homogenato fue calentado a 100°C por 5 min, luego enfriado y centrifugado a 10.000 x g por 20 min. Con el sobrenadante obtenido, el glucógeno fue tratado en frío con 1,3 volúmenes de etanol 96%, y se permitió el precipitado durante toda una noche en heladera. El precipitado fue luego disuelto en agua, y el glucógeno determinado a través de la reacción de fenol-ácido sulfúrico para la determinación de azúcares de acuerdo al protocolo de Dubois et al., (1956) utilizando fenol al 5% en agua y ácido sulfúrico 96% (en proporción 1:1:5) y midiendo absorbancia de la muestra a 490nm. Fue realizada previamente una curva de calibración con glucosa, donde se obtuvo un factor de 0,491 μmoles de equivalentes de glucosa/ml de mezcla de reacción para este método. Los resultados fueron expresados como μmoles equivalentes de glucosa (contenidos en el glucógeno) /g tejido hepático. 3.4.5. Transporte de glucosa por tejido hepático- Captación por el hepatocito La captación de la glucosa por el hepatocito fue medida usando un análogo de glucosa marcada no metabolizable 3-O-(metil d3H)-glucosa tal como lo describe Enan et al., (1992). Una porción de 0,25g de hígado fue incubada en 1 ml de DMEM por 5 min a 37 °C, antes del agregado de 1 µCi de 3-O-(metil-d-3H)-glucosa (2,5 ng por ensayo) Luego de 30 min de incubación a 37°C, se determinó el transporte de glucosa, removiendo el medio y lavando el tejido tres veces con 1 ml de DMEM helado. El tejido se transfirió a un vial que contenía líquido de centelleo OptiPhase Hi-Safe 3, y luego de un tiempo de espera de 3hs la radioactividad incorporada fue medida en el contador de centelleo Beckman. Tanto el transporte como el binding no específico de glucosa fueron definidos como los eventos ocurridos en presencia de 1 µM de citocalasina B con lo que se incubó el tejido 20 min antes del agregado del radioactivo. 107 Materiales y Métodos La captación de glucosa fue entonces calculada restando a los dpm totales correspondientes a las muestras, los dpm de aquellas que contenían citocalasina B, sustancia que inhibe el transporte de glucosa activo al interior de la célula. El resultado fue expresado como pg de glu captada/g tejido. 3.4.6. Determinación de actividades enzimáticas del metabolismo del glucógeno. 3.4.6.1. Actividad de la Glucógeno Sintetasa (GS) La actividad de la GS fue medida usando el ensayo colorimétrico de Leloir and Goldemberg (1960). La mezcla de incubación contenía 5mM de UDP-glucosa, 10mM de G6P, 5mM de EDTA, 0,8% de GlnIII, 0,15M de buffer glicina pH 8,5 y el sobrenadante de 2.000 x g como fuente enzimática. Luego de 30 min de incubación at 37 °C, la actividad de la GS fue frenada por calentamiento a 100 °C durante 4 min (Graham & Whistler, 1976), y el UDP liberado fue estimado con el agregado a muestras, estándares y blancos de: 0,25µmol PEP diluído en KCl 0,4M; 2,5 µmol PK diluída en MgSO4 0,1M. Luego de incubar por 15 min a 37°C se agrega 150µl DNPH 0,1% en 2N HCl. A los 5 min, se adicionan 200µl NaOH 10N y 1,1ml EtOH 95% para evitar la turbidez por el glucógeno. Finalmente se centrifugó y se leyeron los sobrenadantes a 520nm. Los resultados se expresaron como nmoles de UDP.g hígado-1.min-1. 3.4.6.2. Actividad de la Glucógeno Fosforilasa (GP) Esta actividad enzimática fue ensayada de acuerdo con el método de Newman & Armstrong (1978). Las concentraciones finales de los reactivos en el ensayo fueron 50 mM de G1P, 1% de Gln III, 0,15 M de NaF, 1 mM de 5-AMP, 0,5M de Na2SO4, en buffer citrato pH 6,5 y el sobrenadante de 2.000 x g como fuente enzimática. La actividad se midió como la tasa de liberación de fosfato inorgánico después de 15 minutos de incubación a 37°C. El fosfato se determinó espectrofotométricamente a 660 nm por el color del complejo de fosfo-molibdato formado, usando como reactivo reductor una parte de acido ascórbico 10% (p/v) en 6 partes de molibdato de amonio 3,6 mM (0,42% p/v en 108 Materiales y Métodos SO4H2 1N). Así se incuban 50 μl del sobrenadante con 700 μl de reactivo reductor y 250 μl de agua, por 20 min en baño con agitación a 45°C (Ayes, 1966). Se utilizó un M= 4,25 x 10 9 M-1.cm-1 para el Pi. Los resultados de la actividad GS se expresaron como nmoles de Pi. min-1. g hígado-1. 3.4.7. Determinación de parámetros de estrés oxidativo. 3.4.7.1. Determinación de la peroxidación lipídica por TBARS El malondialdehído (MDA) se ensayó como describe el método que utiliza Ennamany et al., (1995) al extraer con butanol el complejo rojo que se genera entre el MDA y el ácido tiobarbitúrico para evitar la interferencia por porfirinas endógenas. En tubos de ensayo de 10 ml de capacidad, se añaden respectivamente 100 µl de muestras problema (microsomas, mitocondrias u homogenato entero, de acuerdo a la determinación a realizar), 100 µl de H2O destilada (muestra blanco), o 100 µl de solución control (muestra control) y a continuación los siguientes reactivos en el orden que se describe: 1,5 ml de TBA 0,8%; 0,2ml de SDS 8,1%; 1,5ml de acético 20% ajustando pH por encima de 3.0 y llevando a Vf:4ml con agua destilada. Esta mezcla de reacción se mantiene 60 minutos a 5º C. Transcurrido este tiempo, se lleva a ebullición en un baño de agua a una temperatura entre 95 y 100 ºC durante 60 minutos, para desarrollar la máxima coloración en todas las muestras. Los tubos se tapan con bolas de cristal como condensadores para evitar pérdidas de líquido por evaporación. Una vez finalizada la reacción, se procede a la extracción de los complejos con 2,5 ml de una solución de n-butanol piridina (15:1 v/v) y 0,5 ml de agua destilada, enfriando previamente los tubos en un baño de hielo. Tras mezclar y centrifugar a 4.000 x g. durante 10 minutos, las capas superiores o sobrenadantes se recogen en un tubo limpio y se procede a la lectura de las 109 Materiales y Métodos absorbancias a 532 nm, frente a un blanco de reactivos utilizando un M= 1,56 x 105 M−1 cm−1 (Ohkawa et al., 1979). 3.4.7.2. Concentración de proteínas carboniladas Se realizó un homogenato 1:10 con 50mM de buffer fosfato conteniendo 1mM de EDTA, luego se centrifugó durante 60 minutos a 100.000 xg. Los grupos carbonilos formados en el citosol fueron cuantificados agregando 1ml de 10mM de DNPH en 2M HCl a un volumen de citosol conteniendo 2mg de proteínas (200 µl aproximadamente). Se mantuvo a temperatura ambiente y oscuridad durante 1 hora, agitando en vortex cada 10 minutos. Las muestras fueron precipitadas con TCA 20% (concentración final) y centrifugadas a temperatura ambiente durante 5 minutos. El pellet se lavó dos veces con TCA 10% y luego tres veces con 1ml de etanol: acetato de etilo (1:1) para remover el DNPH libre. Los pellets fueron resuspendidos en 1ml de clorhidrato de guanidina 6M (pH 2,3) durante 15 minutos a 37ºC, agitando con vortex. El contenido de carbonilos se determinó midiendo la absorbancia a 390nm con un M = 2,2 x 104 M-1.cm-1 (Levine et al., 1994). La concentración de proteínas para el ensayo de proteínas carboniladas fue determinada mediante una curva realizada con seroalbúmina bovina solubilizada en clorhidrato de guanidina y leída a 280 nm junto con las muestras (Reznick & Paker, 1994) 3.4.8. Actividades de las defensas antioxidantes 3.4.8.1. Actividad superóxido dismutasa (SOD) La actividad de la SOD fue determinada por la tasa de autoxidación de la epinefrina a adenocromo (Misra & Fridovich, 1972). De esta manera, se define una 110 Materiales y Métodos unidad como la cantidad de SOD necesaria (o mg proteína necesarios) para inhibir la autoxidación del 50% de la epinefrina. Se comienza con un homogenato 1:10 en buffer fosfato de Na 50 mM pH 7,4; 1mM EDTA y se centrifuga a 5.500 x g por 15 min. Se toma el sobrenadante y se reserva en frío y oscuridad hasta su uso. Se colocan en la cubeta 2,85 ml de buffer glicina 50 mM, pH 10,2 y 100 μl de buffer fosfato 20 mM, pH 7,4 y se le agregan 50μl de solución de epinefrina 60 mM. Luego se mezcla por inversión o con una pequeña espátula de plástico y se mide la autoxidación de la epinefrina hasta los 810 seg. Se toma luego la pendiente de la parte lineal de la curva (que ronda aproximadamente un valor de 0,024). Se repite el procedimiento con la muestra variando el volumen de tal forma de obtener un 50% de inhibición (aproximadamente 10μl para las ratas controles). La solución de sustrato se prepara con epinefrina en HCl 20 mM (si es epinefrina base libre se debe disolver en HCl 10 mM). Se debe siempre controlar que el pH quede en 2. El M = 2,6 x 103 M-1.cm-1 de la epinefrina a 270 nm y se utiliza para medir la concentración en la muestra. Se mide la formación de adenocromo a 485 nm con un M = 4,5 x 103 M-1.cm-1. Ue/mg prot = 1/ mg de proteína necesarios para lograr el 50% de inhibición. 3.4.8.2 Actividad Catalasa (CAT) La actividad CAT fue medida registrando la diferencia en la absorbancia del H2O2 a 240 nm durante 1 min (Chance et al., 1979). Se hace un homogenato 1:10 en buffer fosfato de sodio 50 mM pH 7,4 + 1 mM EDTA; se centrifuga durante 20 min a 5.500 xg. Se toma el sobrenadante y se diluye al medio (0,5 ml) con buffer fosfato de sodio 50 mM pH 7,4 + 1 mM EDTA (0,5 ml) y se le agrega 125 µl Tritón X-100 al 20%. Se enfría a 0 ºC durante 5 min y se usa como fuente de enzima. Se prepara la solución de sustrato, que consiste en H2O2 en buffer fosfato de sodio 50 mM pH 7,4. Para 20 ml de buffer se agregan aproximadamente 14 μl H 2O2 111 Materiales y Métodos 60%. Según el catálogo de Sigma, la absorbancia a 240 nm debe estar entre 0,52 y 0,55 y en general las mediciones realizadas dieron entre 0,50 y 0,53. Se colocan en la cubeta 2,99 ml de la solución del sustrato y se le agregan 10μl de solución de enzima. Se mezcla en la misma cubeta por inversión con parafilm y se mide la pendiente de la curva utilizando el programa Catalasa del espectrofotómetro (240 nm, 0,6-0,3 rango, 1-60 seg). Si el Δ Abs/min es mayor a 0,07 conviene utilizar menos enzima. Se utilizó el M = 4 x 10-2 mM-1.cm-1 para el H2O2. Los resultados se expresan como μmoles de H2O2/ min.mg prot. 3.4.9. Determinación de receptores de glucocorticoides (GR) Para los ensayos de binding, los hígados de los animales previamente adrenalectomizados (48 h antes y ayunados por 24 h) se retiraron inmediatamente luego de sacrificarlos, se cortaron en trozos pequeños, se enjuagaron repetidas veces con buffer GR enfriado en hielo (que consta de 10 mM de Hepes + 5 mM de EDTA, 10% (v/v) de glicerol, 20 mM de Na2MoO4, 2 mM de DTT y 0,1 mM de PMSF, pH 7,4) y se homogeneizaron (650 mg de tejido/ ml) en el mismo buffer. La fracción citosólica se preparó a partir del homogenato, por centrifugación diferencial. Después de la sedimentación de la fracción mitocondrial a 11.000 x g durante 20 min, la fracción citosólica se separó de la fracción microsomal como sobrenadante de la centrifugación a 100.000 x g durante 60 min. Todos los pasos se llevaron a cabo a 4°C. El binding se determinó por triplicado empleando 400-600 mg proteínas citosólicas y 1,25 nM de 3H-DEX en buffer GR. Los parámetros de binding se obtienen por el desplazamiento de la unión específica de la 3H-DEX con siete concentraciones de DEX no marcadas (0,5-100 nM). Todas las incubaciones se llevaron a cabo en un volumen final de 0,5 ml a 4 °C. Después de alcanzado el equilibrio, el remanente de 3H-DEX fue eliminado mediante la adición de un volumen igual de carbón-dextran en buffer fosfato salino, pH 7,4 (2%:0,2%). La unión específica se calcula restando la unión no específica obtenida en 112 Materiales y Métodos muestras paralelas después de la adición de un exceso de DEX no marcada. Las constantes aparentes de disociación (Kdapp) y el número aparente de los sitios de unión (Bapp) fueron obtenidos empleando el Programa de ligandos (Software David Rodbard, NIH). Todas las determinaciones se llevaron a cabo en el mismo momento del día para evitar la influencia de las variaciones por el fotoperíodo (Pozzi et al., 1997). 3.4.10. Determinación de metabolitos hepáticos del TRP por HPLC Las muestras de hígado de ratas normales y tratadas se prepararon de acuerdo al método de Wolf & Kuhn (1983) detallado por Llambías et al., (2003). Brevemente, una alícuota del sobrenadante del homogenato a 12.000 x g se mantuvo a 4-8°C en la oscuridad hasta su uso. Todas las muestras se filtraron utilizando filtros Millipore SJHU013NS con un tamaño de poro de 0,45 mm antes de ser inyectada en una columna de HPLC Waters µBondapack C18 reversa (300 x 4,6 mm diámetro interno) Un cromatógrafo líquido de la SERIE Spectra Modelo P200 y un detector de fluorescencia Waters FL 2000 con una longitud de onda de excitación de 290 nm y una longitud de onda de emisión de 330 nm, se utilizó para determinar el TRP y el contenido de serotonina (5-HT) mediante una corrida con solución isocrática de acetato de sodio 40 mM a pH 3,5 siguiendo el método descrito por Moran & Fitzpatrick (1999). Las soluciones fueron filtradas a través de filtros de 0,45mm y el agua milliQ o el buffer degaseados con burbujeo en He. La velocidad de flujo utilizada fue de 1,0 ml/min. La columna se operó a temperatura ambiente y el detector fue fijado en el rango 0–20. Todos los cromatogramas, tiempos de retención y áreas debajo de los picos fueron analizadas con un integrador Data Jet que se programó con atenuación de 8 y velocidad de graficado de 0,25 cm/min. 3.3.11- Enzimas del camino quinurenérgico: actividad de la TRP pirrolasa. El homogenato fue realizado en una proporción 1:6,5 g hígado/buffer de homogenato (140mM de KCl y 2,5mM de NaOH). Inmediatamente entre los 4-8 min después de extraer el hígado y hacer el homogenato, se tomaron 0,5 ml para la reacción. 113 Materiales y Métodos Estos tiempos se estrechan así, para proteger tanto al hígado como al homogenato de la luz. La mezcla de reacción contenía 40 ml de buffer fosfato 0,2M pH 7; 50 ml de H2O y 10 ml de TRP 0,03 M en buffer (todo hecho por duplicado, más los blancos a tiempo 0) . Luego se procedió a dividir en 2 cada ensayo y agregarle a cada mitad: 100 µl hematina 2 µM en NaOH 0,1M o solo 100 µl NaOH 0,1M. Se midió a 365 nm y se expresó como µmol quinurenina/hora.g hígado. La medición de la actividad enzimática se determinó mediante la formación de quinurenina a partir de L-TRP en homogeneizados de hígado ya sea en ausencia (actividad holoenzima) o presencia (actividad enzimática total) de hematina. La actividad de la apoenzima, calculada por diferencia, se utilizó entonces para medir la relación de actividad entre holoenzima/ apoenzima, que indica el grado de saturación de hemo de la apoenzima. La actividad se midió en presencia de L-TRP como se describe por Badawy & Evans (1975). 3.5 DETERMINACIONES URINARIAS 3.5.1. Contenido de intermediarios del camino del hemo- ALA, PBG y porfirinas 3.5.1.1. ALA y PBG en orina Los ensayos para ALA, PBG y porfirinas se realizaron con muestras de orina de 24 horas (o 16 hs según el tratamiento realizado). Se determinó en porciones de 0,3-1 ml de orina, esencialmente por el método de Piper et al., (1973). Luego de una centrifugación a 500 x g por 15 min, el sobrenadante se ajustó a pH 5,5–6,0 con HCl. Se utilizaron dos columnas de intercambio iónico por separado, el PBG se eluyó de una columna Dowex 1 con ácido acético 1N y el ALA se eluyó de una columna Dowex 50W con acetato de sodio 1M, después de eliminar la urea en un primer paso con agua. El ALA pirrolizado y el PBG se midieron espectrofotométricamente a 553 nm, con un M = 6,1 x 104 nM-1.cm-1 para el PBG utilizando el reactivo de Ehrlich, como describe Mauzerall & Granick (1956). 114 Materiales y Métodos La recuperación del ALA, el PBG y las porfirinas por estos procedimientos fueron 95, 98 y 90% respectivamente 3.5.1.2. Porfirinas urinarias de ratas La orina se recolectó utilizando jaulas metabólicas y se determinaron las porfirinas de acuerdo con la metodología de Piper et al., (1973) con modificaciones (Wainstok et al., 1984) La orina se homogeneizó y se mantuvo congelada hasta su evaluación realizada con el uso de una columna de resina de intercambio Dowex 1. Entre 0,3-1 ml de muestras de orina se utilizaron en cada determinación y se eluyeron las porfirinas de la columna con 10% (p/v) de HCl El contenido total de porfirinas fue determinado espectrofotométricamente usando la corrección de la fórmula de Rimington & Sveinsson, (1950) para compensar la absorción inespecífica de fondo. Para ello se hacen lecturas de absorbancia a 3 diferentes longitudes de onda, la del máximo de Soret (Amax), 380 y 430 nm y se calcula la Acorr mediante las expresiones: A= 2.Amax - (A380 + A430); Acorr = A/K donde K es el factor de corrección. Para determinar K (1,844) se utilizaron curvas de calibración para uroporfirinas y coproporfirinas en medio ácido. Los coeficientes de absorción se utilizaron para calcular las porfirinas libres totales, como valores medios (Tomio et al., 1970; Tomio & San Martín de Viale, 1972) 3.5.2. Determinación de parámetros de estrés oxidativo (QL) La orina total se recogió empleando jaulas metabólicas durante las 16hs post intoxicación en el caso de la intoxicación aguda, y 24 hs en el caso de las ratas intoxicadas con HCB. 115 Materiales y Métodos Las orinas así recolectadas se homogeneizaron y se mantuvieron congeladas hasta la evaluación. El total de la quimioluminiscencia urinaria (QL) se midió como lo describió Ríos de Molina et al., (1998). Alícuotas de 1 ml de orina se centrifugan a 500 x g durante 10 min. En un contador de centelleo líquido Beckman LS-3150P, operado en el modo out-offcoincidence, se realizó la cuantificación de QL, expresándola como CPM x 10-3 para el volumen total de orina. 3.6 DETERMINACIONES PLASMÁTICAS 3.6.1. Contenido de glucosa plasmática Los niveles de glucosa en ayunas en plasma, fueron determinados utilizando un Kit enzimático de glucemia (Wiener Laboratorio, Rosario, Santa Fe, Argentina) tal cual se lo utilizó en el trabajo de Mazzetti et al., (2004). 3.6.2. Determinación de insulina plasmática La insulina normal plasmática se midió por radioinmunoensayo (RIA) a través del método de Herbert et al., (1965). Se utilizó 125 I-insulina monoiodada de cerdo. El antisuero de cobayo antiporcino contra insulina fue suficientemente inespecífico como para permitir el desplazamiento de la insulina de rata. Este antisuero mostró reactividad con insulina normal, pero no con proinsulina o insulina glicosilada. 3.6.3. Determinación de corticosterona plasmática. La sangre se centrifugó a 5.000 x g durante 10 minutos para obtener la fracción plasmática. Las muestras de plasma se mantuvieron a -20 °C hasta el ensayo. Los 116 Materiales y Métodos ensayos se realizaron usando un Kit 125 I-RIA para ratas y ratones de Biomedicals ICN. (MP Biomedicals, Costa Mesa, CA., USA.) Los niveles plasmáticos de corticosterona (CORT) se midieron mediante RIA como se describió previamente (Gomez-Sanchez et al., 1975; Denari & Ceballos, 2005). El plasma se extrajo dos veces con éter etílico, se evaporó y volvió a disolver en buffer borato 100 mM, gelatina 0,1%, a pH 8,0. Las pérdidas durante todo el procedimiento se calcularon en muestras paralelas mediante la adición de [3H]-CORT. El antisuero contra CORT se utilizó en una dilución final de 1:22,500. La reactividad cruzada con la aldosterona fue inferior a 0,1% (Gomez Sanchez et al., 1975). La reactividad cruzada con otros esteroides fueron: desoxicorticosterona (0,34%), testosterona (0,10%), progesterona (0,02%), y menos de 0,01% para todos los demás esteroides ensayados. La sensibilidad del ensayo fue de 50 pg/ml. Coeficientes intra e inter-ensayo de variación fueron menores de 8% y 12%, respectivamente. La concentración de la CORT se ensayó por triplicado. CORT se expresa como microgramos de hormona por cada 100 ml de plasma (µg/100 ml). 3.7 DETERMINACIONES EN OTROS TEJIDOS 3.7.1. Determinación de la captación de glucosa en grasa parda, timo y bazo La captación de la glucosa por estos otros tejidos (adiposo, timo y bazo) fue medida usando un análogo de glucosa marcada no metabolizable, 3-O-(metil-d-3H-glu) tal como lo se describe para el tejido hepático (Enan et al., 1992). Una porción de 0,25g de tejido fue incubada en 1 ml de DMEM por 5 min a 37 °C, antes del agregado de 1 µCi de 3-O (metil-d-3H)-glucosa (2,5 ng por ensayo) Luego de 30 min de incubación a 37°C, se determinó el transporte de glucosa, removiendo el medio y lavando el tejido dos veces con 1 ml de DMEM helado. El tejido 117 Materiales y Métodos se transfirió a un vial que contenía líquido de centelleo OptiPhase Hi-Safe 3, y la radioactividad incorporada fue medida en un contador de centelleo Beckman. El transporte de glucosa no específico y el binding fueron definidos como el evento ocurrido en presencia de 1 µM de citocalasina B. La captación de glucosa fue entonces calculada restando a los dpm totales correspondientes a las muestras, los dpm de aquellas que contenían citocalasina B. 3.7.2. Determinación de insulina pancreática en islotes de Langerhans Los islotes de Langerhans se obtuvieron a partir de páncreas de rata tratados con colagenasa, de acuerdo con el método de Lacy & Kostianovsky (1967). La perfusión de islotes se llevó a cabo de acuerdo con Burr et al., (1969) con ligeras modificaciones de Basabe et al., (1986). Fueron utilizados la totalidad de los islotes del páncreas de cada animal (sacrificados en la 6ª semana de intoxicación con HCB y controles). Se realizaron perfusiones de los islotes de Langerhans y a partir de ellos se cuantificó la secreción de la insulina. Para evaluar la secreción de insulina a partir de islotes pancreáticos perfundidos, se integró el área bajo las curvas de la secreción. Las muestras de los minutos 1 y 2 se utilizaron para la determinación de línea de base. Un estímulo de glucosa de 16,5 mM se añadió al buffer de perfusión entre los minutos 3 y 40. El primer pico de secreción se integró entre los 3 y 7 minutos, y el segundo pico entre los 8 y 40 minutos de perfusión. Este experimento se llevó a cabo con los animales tratados con HCB en la 6ª semana vs los animales controles. Las muestras fueron recogidas después de un período de recuperación inicial de 15 min en tubos que contenían 0,2 ml de EDTA 0,25 M. Luego fueron de inmediato congelados a -20 °C hasta su determinación con el método por inmunoensayo de Herbert et al., (1965). En este ensayo, el uso del carbón-dextran 80 (peso molecular promedio), permite la adsorción casi instantánea de la insulina libre, pero no así de la insulina unida a 118 Materiales y Métodos su anticuerpo. El uso de este carbón revestido con dextrano, hace más sencillo y más rápido el inmunoensayo en líquidos biológicos, donde se utilizan diferentes diluciones del radioisótopo. 3.7.3. Determinación de corticosterona en glándulas adrenales . Las glándulas suprarrenales se obtuvieron de animales controles y tratados con HCB. Las ratas fueron adrenalectomizadas 48 hs antes de ser sacrificadas. Primeramente se determinó el peso del animal y se administró una solución por vía intraperitoneal de anestésico pentobarbital sódico (40 mg/kg p.c.). Se esperaron unos minutos hasta completar el efecto esperado y con el animal anestesiado, se practicó una incisión longitudinal en la piel y el tejido subcutáneo del dorso en una línea imaginaria entre la última costilla y la columna, haciendo antes la asepsia de la región con solución de iodo. La glándula suprarrenal está ubicada generalmente en el lado anterior del riñón, cerca de la grasa perirrenal. Utilizando una pinza anatómica se pellizcó y arrastró la grasa perirrenal suavemente a través de la incisión. Con la ayuda de unas tijeras delicadas de punta roma, se corta la grasa por debajo de la glándula suprarrenal y riñón, procediendo a la separación de la misma. Las suprarrenales fueron rápidamente colocadas en solución fisiológica enfriada en hielo. Durante la cirugía, se debe mantener el tejido expuesto humedecido en solución salina. Los tejidos seccionados y la piel se suturan con hilo, hasta cerrar la incisión. Se repitió el mismo procedimiento para la ablación de la glándula contralateral. Los animales fueron provistos durante las 48h siguientes con dos bebederos, uno con agua y otro con solución fisiológica Cada adrenal fue cortada en cuatro piezas aproximadamente iguales. El tejido fue incubado en 2 ml de medio de Krebs-Ringer-glucosa que contiene Hepes 10 mM (pH 7,4) en presencia y ausencia de 1 UI de ACTH. Las incubaciones se llevaron a cabo a 37 °C con agitación continua en atmósfera de aire y se detuvieron después de 1 h por el enfriamiento de las muestras 119 Materiales y Métodos sobre hielo. Los medios de incubación fueron rápidamente separados y se almacenaron a -20 °C hasta el momento de la determinación de corticosterona por RIA (GomezSanchez et al., 1975). 3.7.4. Determinación de Proteínas La concentración de proteínas fue determinada de acuerdo con el método de Lowry et al., (1951), para realizar los cálculos en cada ensayo mediante una curva con albúmina de suero bovina (BSA). La concentración de proteínas para el ensayo de proteínas carboniladas fue determinada mediante una curva realizada con seroalbúmina bovina solubilizada en clorhidrato de guanidina y leída a 280 nm junto con las muestras (Reznick & Paker, 1994). 3.8. ANÁLISIS ESTADÍSTICOS Los resultados se expresan como la media ± error estandar (E.S). Los parámetros de binding, Kdapp y Bapp fueron obtenidos empleando el Programa de ligandos (Software David Rodbard, NIH). Antes del análisis estadístico de los datos se probaron la normalidad y la homocedasticidad con los test de Lilliefors y Bartlett, respectivamente. Los datos no transformados fueron probados para los modelos de uno o dos sitios. Los datos en los estudios donde se analizó respuesta en el tiempo fueron sometidos a análisis de varianza de una vía (ANOVA) y diferencias significativas entre las medias por el test-F de Fisher, utilizando el Programa BioStat. En todos los casos, el valor de 0,05 fue utilizado como nivel de significancia, por debajo del cual se rechazó la hipótesis nula de igualidad. Las comparaciones múltiples de medias entre grupos de tratamientos (post ANOVA), fueron realizadas mediante el Test de Tukey-Kramer, a través del Programa BioStat, Multiple Comparisons Mode. 120 Resultados 4. RESULTADOS 4.1. MODELO DE PORFIRIA HEPÁTICA CRÓNICA POR HCB Con el fin de caracterizar el modelo de porfiria hepática crónica por la administración de HCB en ratas Wistar, y de establecer si este pesticida induce daño hepático, se evaluaron las alteraciones producidas en diversos metabolismos (el de la glucosa, hemo, TRP entre otros). Con tal propósito se investigó el efecto producido por la administración de HCB a lo largo de las semanas subsiguientes a la intoxicación, sobre diversos parámetros y en diferentes órganos y fluídos. ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL? 4.1.1. Parámetros hepáticos y actividad enzimática clave del camino del hemo. En roedores, el HCB produce inhibición de la actividad de la uroporfirinógeno decarboxilasa (URO-D) y la consiguiente alteración del camino biosintético del hemo, que se manifiesta bioquímicamente con la sobreproducción de porfirinas. En la manifestación de estas características de la porfiria inducida por HCB, que semeja en gran medida a una porfiria cutánea tarda (PCT), existe un tiempo de retardo típico. Luego de realizar un esquema de 5 días de intoxicación con el xenobiótico, la administración se discontinúa y los efectos de ésta se observan a lo largo de las semanas, comenzando a ser notorios en algunos casos, pasada la 2ª semana y llegando a acentuarse, más allá de la 9ª semana post tratamiento (más de 2 meses de interrumpida la intoxicación). Con el propósito de evaluar el impacto del HCB sobre la enzima del camino del hemo que es clave en este tipo de porfiria, se midió el efecto del tratamiento sobre la actividad hepática de la URO-D, que genera coproporfirinógeno (COPROgen) como producto final de la decarboxilación, y cuya actividad es expresada como formación de nmoles de COPROgen III/ mg. hora. 122 Resultados Como puede verse en la Figura 4.1, el HCB promueve la disminución de la actividad de URO-D, incluso desde la 2ª semana de tratamiento con un 43% de inhibición comparado con su control (132 ± 6,2 vs 76 ± 3,1 nmol COPROgen/ mg. h) y va creciendo a medida que el tiempo post-tratamiento progresa. La URO-D va perdiendo dramáticamente su actividad (hasta un 90-95% de inhibición) entre la 5ª y 6ª semana de intoxicación. A su vez, las porfirinas (Figura 4.1) comienzan a acumularse en el hígado durante la 3ª semana (7,3 ± 2,8 vs 3,2 ± 1,7 µg porfirinas/g hígado, como valor control). Los niveles de porfirina se convierten en estadísticamente significativos respecto al control durante la 5ª semana y alcanzan notables incrementos a partir la semana 6 (más de 50 veces). Los animales tratados con HCB de acuerdo con el programa de intoxicación discontinua, desarrollaron así una porfiria bien definida. De hecho, una gran cantidad de porfirinas se acumularon en el hígado a la 6ª semana de la intoxicación (2,9 ± 1,1 como valor control vs. 148 ± 12 µg /g de tejido fresco). Teniendo en cuenta que estos parámetros bioquímicos son considerados como marcadores efectivos de la inducción de porfiria y persistencia del HCB, se puede asegurar que este modelo representa una porfiria crónica experimental del tipo PCT, de acuerdo a experiencias anteriores en nuestro laboratorio (Billi de Catabbi et al., 2000;. Billi de Catabbi et al., 2005). 4.1.2. Intermediarios del camino del hemo en orina. Determinación de porfirinas. El análisis de las porfirinas totales en la orina de ratas tratadas con HCB (3 ± 0,82 µg/ 24 h, como valor control promedio) mostró un aumento de 15 veces y hasta aproximadamente 50 veces entre la 4ª y 8ª semana respectivamente (Figura 4.2). Este importante incremento de la excreta de porfirinas indica que, una verdadera porfiria se desarrolla en los animales tratados con HCB. Tanto las porfirinas hepáticas como urinarias, presentaron un máximo de absorción de 406-407nm en la banda de Soret, indicativo de porfirinas altamente carboxiladas (8- y 7-COOH). 123 Resultados Porfirinas (mg/g hígado) 160 90 Porfirinas Actividad URO-D 75 140 120 60 100 45 80 60 30 40 20 15 0 0 Control 2da 3ra 5ta Actividad URO-D (nmol COPROgen/h.mg) 180 6ta Tiempo (semanas) Figura 4.1 Efecto de hexaclorobenceno (HCB) sobre la uroporfirinógeno decarboxilasa hepática (URO-D) a lo largo del tiempo post-intoxicación, y en paralelo, el contenido de porfirinas hepáticas. La actividad URO-D se expresa como nmol COPRO´gen/mg proteínas.hora y el contenido de porfirinas como µg porfirinas/g hígado fresco. Cada barra representa la media ± E.S. de diez animales. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F (Fisher) Diferencias significativas respecto a los valores del grupo control (P <0,05) La Figura 4.2 muestra también que la intoxicación por HCB fue eficaz y que la acumulación de porfirinas una vez que se inicia, continúa en aumento durante varias semanas después de terminado el tratamiento. 124 Resultados 160 Porfirinas urinarias (µg/24 hs) control 140 HCB 120 100 80 60 40 20 0 2da 4ta 6ta 8va Tiempo (semanas) Figura 4.2. Efecto del hexaclorobenceno (HCB) sobre la concentración de porfirinas en orina a lo largo del tiempo post intoxicación. Cada barra representa la media ± E.S. de seis animales. La concentración se expresa como µg de porfirinas altamente carboxiladas/ 24 h. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F (Fisher) Diferencias significativas respecto a los valores del grupo control (P <0,05) EN BUSCA DE ALTERACIONES PROVOCADAS SOBRE EL METABOLISMO DE LA GLUCOSA EN ESTA PCT EXPERIMENTAL 4.1.3. Niveles plasmáticos de glucosa y contenido de glucógeno hepático. El nivel de glucosa en plasma muestra una importante disminución a causa del tratamiento con HCB (7,8 ± 0,62 nmol glu/l, como valor control promedio) y es estadísticamente significativo ya en la 3ª semana, alcanzando los valores más bajos (40% de pérdida) en el tiempo más crítico posterior al drogado, que se visualiza en la Figura 4.3, durante la 6ta semana. 125 Resultados 9 Control HCB Glucosa plasmática (mmol glucosa/l) 8 7 6 5 4 3 2 1 0 0 2 4 6 8 Tiempo (semanas) Glucógeno hepático (µmol glu/g tejido hepático) Figura 4.3: Efecto del hexaclorobenceno (HCB) sobre la concentración de glucosa plasmática a lo largo del tiempo. Cada punto en los gráficos representa la media ± E.S. de diez animales. La concentración se expresa como mmol de glucosa/ litro. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F (Fisher) Diferencias significativas respecto a valores de ratas control (P <0,05) 20 18 16 14 12 10 8 6 4 2 0 Control HCB 0 2 4 Tiempo (semanas) 6 8 Figura 4.4: Efecto del hexaclorobenceno (HCB) sobre el contenido de glucógeno hepático a lo largo del tiempo. Cada punto en los gráficos representa la media ± E.S. de diez animales. La concentración se expresa como µmol de glucosa/ g tejido hepático. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F (Fisher) Diferencias significativas respecto a valores de ratas control (P <0,05) 126 Resultados El HCB afectó también de manera significativa el contenido de glucógeno hepático (3,9 ± 0,81 µmol glu/g tejido como valor control promedio), promoviendo una acumulación del polisacárido desde la 2ª semana post-tratamiento y alcanzando en la 6ª semana, valores de más de tres veces respecto al control (Figura 4.4). 4.1.4. Actividades enzimáticas del metabolismo de la glucosa Los índices de la gluconeogénesis y la glucólisis, se pueden estimar por ejemplo, midiendo la actividad de las enzimas claves de ambas vías: PEPCK, PC y G6Pasa para la gluconeogénesis y PK como ejemplo de enzima clave del último paso de la vía glucolítica. Como primer paso, las actividades de las enzimas gluconeogénicas (PEPCK, PC, y G6Pasa) se determinaron en los hígados de las ratas con o sin período de ayuno de 24 h. En la Tabla IV.1, se muestra claramente que las ratas Wistar hembras utilizadas a lo largo de estos experimentos, exhiben un 40-60% de aumento en las actividades enzimáticas con un período de 24 h de inanición. Tabla IV.1. Respuesta de las actividades de enzimas gluconeogénicas al ayuno PC(a) Estado mmol/min.mg) Sin ayuno Ayuno 24 h PEPCK (a) G6Pasa(a) (nmol/min.mg) mmol/min.mg) 0,135±0,028 8,01±0,46 0,353±0,031 0,210±0,038* 11,12±0,84* 0,574±0,033* Tabla IV.1 (a) Los resultados son expresados como las medias ± ES de cinco animales en cada grupo. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F * Diferencia significativa respecto a las no ayunadas, P<0.05 Por otra parte, la actividad específica de PEPCK exhibe una disminución dependiente del tiempo, como consecuencia de la intoxicación por HCB (Figura 4.5). 127 Resultados Los resultados muestran que la inhibición alcanzada de la enzima es de alrededor del 55% en la 5ª semana de tratamiento post-fungicida (promedio grupo control: 10,57 ± 0,84 mol NADHox/min.mg proteína), momento en que las porfirinas se acumulan notablemente en el hígado (Figura 4.1). Asimismo el HCB promueve una disminución precoz de la actividad específica de PC (Figura 4.6), que se profundiza, avanzando en el tiempo transcurrido posttratamiento (promedio grupo control: 0,22 ± 0,04 mmol NADHox/min.mg proteína). Una pérdida de hasta un 60% de esta actividad enzimática, se observa en períodos de tiempo más largos. Actividad PEPCK (mol/min.mg proteína) 14 12 control HCB 10 8 6 4 2 0 2da 3ra 5ta Tiempo (semanas) 6ta Figura 4.5: Efecto del hexaclorobenceno (HCB) sobre la actividad de la fosfoenol-piruvato carboxiquinasa (PEPCK) hepática a lo largo del tiempo. Cada barra representa la media ± E.S. de diez animales. La actividad se expresa como nmol de NADH oxidado/min. mg proteína (realizado por reacción acoplada). Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. Diferencias significativas respecto a valores de ratas control (P <0,05) 128 Resultados Siguiendo con el estudio de las enzimas gluconeogénicas, la intoxicación con el xenobiótico, muestra una inhibición temprana de la actividad específica de la G6Pasa Actividad de PC hepática (mmol/min.mg) 0,3 control HCB 0,25 0,2 0,15 0,1 0,05 0 2da 3ra 5ta 6ta Tiempo (semanas) Figura 4.6: Efecto del hexaclorobenceno (HCB) sobre las actividad de la enzima piruvato carboxilasa hepática (PC) a lo largo del tiempo. Cada barra representa la media ± E.S. de diez animales. La actividad se expresa como µmol de NADH oxidado/min. mg proteína (para el sistema por acoplamiento). Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F Diferencias significativas respecto a valores de ratas control (P <0,05) donde en la 2ª semana se aprecia un 25% de inhibición (Figura 4.7). Este efecto se mantiene constante hasta la 5ª semana. A partir de entonces, se calcula una pérdida aún mayor de dicha actividad gluconeogénica (37%) cuando las ratas mostraron estar claramente porfíricas (promedio grupo control: 0,57 ± 0,04 mmol Pi/min.mg proteína). Pasando al camino de degradación de la glucosa, la actividad específica de la PK no se vio afectada de manera significativa (Figura 4.8) en los tiempos post-tratamiento 129 Resultados ensayados (promedio grupo control: 0,55 ± 0,15 mmol NADH oxidado/min.mg proteína; promedio grupo tratado con HCB: 0,53 ± 0,14 mmol NADH oxidado/min.mg proteína) control Actividad de G6Pasa hepática (mmol/min.mg proteína) 0,7 HCB 0,6 0,5 0,4 0,3 0,2 0,1 0 2da 3ra 5ta 6ta Tiempo (semanas) Figura 4.7: Efecto del hexaclorobenceno (HCB) sobre la actividad de la enzima glucosa 6-fosfatasa hepática (G6Pasa) a lo largo del tiempo. Cada barra representa la media ± E.S. de diez animales. La actividad se expresa como µmol de fosfato inorgánico/min. mg proteína. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F Diferencias significativas respecto a valores de ratas control (P <0,05) Los resultados muestran que las actividades de las tres enzimas gluconeogénicas disminuyen en respuesta al tratamiento con HCB (30 a 55% para PEPCK, 31 a 42% para G6Pasa, y el 50% para PC). La actividad PEPCK disminuyó en todas las semanas del tratamiento así como la G6Pasa, mientras que la actividad de la PC se redujo a partir de la 5ª semana de tratamiento. La enzima de la glucólisis PK, no mostró diferencias 130 Resultados significativas entre las actividades de los dos lotes de animales en cualquiera de los tiempos medidos. control 0,7 HCB Actividad de la PK hepática (mmol/min.mg) 0,6 0,5 0,4 0,3 0,2 0,1 0 2da 3ra 5ta 6ta Tiempo (semanas) Figura 4.8: Efecto del hexaclorobenceno (HCB) sobre la actividad de la enzima piruvato quinasa hepática (PK) a lo largo del tiempo. Cada barra representa la media ± E.S. de diez animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La actividad se expresa como µmol de NADH oxidado/min. mg proteína. Los detalles experimentales se describen en la sección 3, Materiales y Métodos. ¿EXISTIRÁ VARIACIÓN EN LA CAPTACIÓN DE GLUCOSA DE RATAS TRATADAS CON HCB, EN LOS DIVERSOS TEJIDOS ESTUDIADOS? 4.1.5. Perturbaciones del transporte de glucosa en órganos y tejidos. Con el fin de analizar si la intoxicación producida por HCB generaba alguna alteración en la absorción de glucosa, dado que esta alteración se había informado para otros compuestos clorados con capacidad porfirinogénica similar al HCB (por ejemplo 131 Resultados para el 2-3-7-8-tetraclorodibenzo-p-dioxina; TCDD), la captación de 3-O-metil-3H-Dglucosa fue medida a diferentes tiempos post-tratamiento en diversos órganos de ratas tratadas con HCB y de ratas control. 4.1.5.1. Captación de glucosa por el tejido hepático Como se describe en la Figura 4.9, los animales tratados con HCB mostraron una menor captación de glucosa por el hígado en comparación con los controles (promedio grupo control: 430 ± 57 pg/g hígado.30 min), con descensos a lo largo de todas las semanas estudiadas. La disminución observada desde la 3ª a la 9ª semana fue estadísticamente significativa (50% respecto al control). 4.1.5.2. Captación de glucosa por otros tejidos: grasa parda, timo y bazo Para el estudio de posibles alteraciones en la absorción de glucosa por otros tejidos distintos del hígado, la captación de glucosa se midió en la grasa abdominal, timo y bazo. Los resultados en la Figura 4.10 mostraron que la absorción de glucosa en el tejido adiposo de ratas tratadas con HCB aumentó ligeramente en la semana 5 y también posteriormente, siendo los incrementos más importantes observados entre la 7ª y 9ª semana con aproximadamente un 75 y 125% de incremento respectivamente (promedio grupo control: 110 ± 12 pg/g hígado.30 min). En el caso del timo y bazo, por el contrario, la captación de glucosa fue muy baja en los animales tratados con HCB en todos los tiempos ensayados. Los niveles disminuyeron de 40 a 70% en el timo (promedio grupo control: 142 ± 15 pg/g hígado.30 min; Figura 4.11) y de 40 a 60% en el bazo (promedio grupo control: 111 ± 13 pg/g hígado.30 min; Fig. 4.12). 132 Resultados Control HCB Captación de 3-O- 3H-metil Glu (pg/g hígado/30 min) 600 500 400 300 200 100 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.9: Efecto del hexaclorobenceno (HCB) sobre la incorporación de glucosa marcada radioactivamente en tejido hepático a lo largo del tiempo. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La captación se expresa como pg 3-O-(metil-3H-glucosa) incorporada/(g tejido. 30 min). Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Diferencias significativas respecto a valores de ratas control (P <0,05) 133 Captación de 3-O- 3H-metil Glu (pg/g grasa/30min) Resultados 250 Control HCB 200 150 100 50 0 0 1 2 3 4 5 6 Tiempo (semanas) 7 8 9 Fiura. 4.10: Efecto del hexaclorobenceno (HCB) sobre la incorporación de glucosa en tejido graso, marcada radioactivamente a lo largo del tiempo. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La captación se expresa como pg 3-O-(metil-3H-glucosa) incorporada/ (g tejido. 30 min). Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Diferencias significativas respecto a valores de ratas control (P <0,05) 134 Resultados Control HCB Captación de 3-O-metil 3H-Glu (pg/g timo/30 min) 180 160 140 120 100 80 60 40 20 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.11: Efecto del hexaclorobenceno (HCB) sobre la incorporación de glucosa marcada radioactivamente en timo a lo largo del tiempo. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La captación se expresa como pg 3-O-(metil-3H-glucosa) incorporada/ (g tejido. 30 min). Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Diferencias significativas respecto a valores de ratas control (P <0,05) 135 Resultados Control HCB Captación de 3-O- 3H-metil Glu (pg/g bazo/30 min) 140 120 100 80 60 40 20 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.12: Efecto del hexaclorobenceno (HCB) sobre la incorporación de glucosa marcada radioactivamente en bazo a lo largo del tiempo. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La captación se expresa como pg 3-O-(metil-3H-glucosa) incorporada/ (g tejido. 30 min). Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Diferencias significativas respecto a valores de ratas control (P <0,05). ¿HAY CAMBIOS EN EL METABOLISMO DEL GLUCÓGENO DEBIDOS A LA ACCIÓN DEL HCB? 4.1.6. Metabolismo del glucógeno. Niveles y actividades enzimáticas de síntesis y degradación. 4.1.6.1 Contenido hepático de glucógeno Con el objeto de determinar si el HCB es capaz de producir alteraciones en el contenido hepático de glucógeno, la concentración de este polisacárido fue medida en 136 Resultados hígado de ratas tratadas con HCB a diferentes tiempos. La Figura 4.13 muestra un ligero incremento de los niveles de glucógeno en ratas tratadas con HCB. Aun cuando esa diferencia no fue muy importante durante la primera etapa del tratamiento (3ra a 5ta semana), fue siendo cada vez más y más significativa en las siguientes semanas. Así el incremento de los niveles de glucógeno en el lote de ratas tratadas con HCB fue 2,5 veces mayor que las ratas control en la semana 7 y llegó a 3 veces en la semana 9 post intoxicación (grupo control: 3,9 ± 1,2 vs 12,2 ± 2,3 µmol glu/g hígado). 4.1.6.2. GS – Síntesis del glucógeno Los niveles de las enzimas que son responsables de la degradación y la síntesis del glucógeno (glucógeno fosforilasa, GP y glucógeno sintetasa, GS) se determinaron con el fin de dilucidar si el tratamiento con HCB produce cambios en estas actividades enzimáticas, teniendo en cuenta el aumento de los niveles de glucógeno (Figura 4.13). Los efectos del HCB sobre la actividad de GS se muestran en la Figura 4.14. Un aumento de la actividad enzimática se puede observar desde la 5ª a la 9ª semana, en la que los valores de ratas tratadas con HCB fueron 3-4 veces más altos que los del grupo control (grupo control: 4,2 ± 1,2 vs 16,1 ± 2,3 nmol UDP/g hígado.min). Por otro lado, una ligera disminución se detectó en las semanas 7ª y 9ª con respecto a la 5ª, pero la actividad se mantuvo todavía muy aumentada (3 veces) respecto al control. Este aumento correlaciona ligeramente con el contenido de glucógeno observado en las ratas tratadas con HCB, ya que el aumento del glucógeno es importante a partir del 7ª semana, mientras que el aumento de la actividad de la GS es importante a partir de la 5ª semana. 137 Glucógeno hepático (mmol glu/g hígado) Resultados 16 Control HCB 14 12 10 8 6 4 2 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.13: Efecto del hexaclorobenceno (HCB) sobre el contenido de glucógeno hepático a lo largo del tiempo transcurrido post-intoxicación. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. El contenido hepático de glucógeno fue aislado por precipitación con etanol y se cuantificó por la reacción de fenol-acido sulfúrico. Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se expresaron como µmoles de glucosa/ g de hígado Diferencias significativas respecto a valores de ratas control (P <0,05) 4.1.6.3. GP - Degradación del glucógeno La actividad de la glucógeno fosforilasa (GP), enzima responsable de la degradación del glucógeno en respuesta a la intoxicación con la droga se muestra en la Figura 4.15. Se puede observar que la actividad enzimática en el hígado de animales tratados con HCB siempre es marcadamente menor que en los controles en todo el tiempo ensayado, y que la reducción en los niveles de su actividad enzimática era variable en los diferentes tiempos. La reducción de la actividad fue estadísticamente 138 Resultados 20 Control HCB Glucógeno Sintetasa (mol UDP/g hígado/min) 18 16 14 12 10 8 6 4 2 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.14: Efecto del hexaclorobenceno (HCB) sobre la actividad de GS a lo largo del tiempo transcurrido post-intoxicación. Cada punto representa la media ± E.S. de seis animales. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. La actividad GS fue determinada usando UDP-glu como sustrato y midiendo la cantidad de UDP liberado en el ensayo de P.K. Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se expresaron como nmoles de UDP liberado /g de hígado/min Diferencias significativas respecto a valores de ratas control (P <0,05) significativa durante las semanas 5, 7 y 9 (75%) respecto a los valores del grupo control (4,8 ± 0,8 vs 1,2 ± 0,6 nmol Pi/g hígado.min). Las Figuras 4.14 y 4.15, muestran el aumento de la actividad GS y la disminución de la actividad de la GP, lo que podría explicar el aumento en el contenido de glucógeno (como ya se observó en la Figura 4.13). 139 Resultados 8 Control HCB Glucógeno Fosforilasa (nmol Pi/g hígado/min) 7 6 5 4 3 2 1 0 0 1 2 3 4 5 6 7 8 9 Tiempo (semanas) Figura 4.15. Efecto del hexaclorobenceno (HCB) sobre la actividad de la glucógeno fosforilasa hepática en el tiempo transcurrido post-intoxicación. Cada punto representa la media ± E.S. de seis animales. La actividad GP fue determinada como el fosfato liberado (Pi) a partir de la glucosa-1-P y el glucógeno usando como fuente enzimática sobrenadante de 2.000 x g de los correspondientes homogenatos. Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. Los datos se expresaron como nmoles de Pi /g de hígado.min. Diferencias significativas respecto a valores de ratas control (P <0,05) EN BUSCA DE LAS CAUSAS DEL DESCENSO DE LA PEPCK Y LA GP: ¿SE DEBERÁ A INTERFERENCIAS EN EL SISTEMA REDOX? 4.1.7. Parámetros de estrés oxidativo- Producción de ROS. Teniendo en cuenta: 1) que se ha propuesto que el HCB puede actuar como una droga soluble en lípidos que se une a los citocromos y que no es rápidamente 140 Resultados metabolizada, desacoplando así la cadena de transporte de electrones de la actividad mono-oxigenasa y consecuentemente favoreciendo la producción de especies de oxígeno reactivas (ROS) (Ferioli et al., 1984); 2) que las ROS son capaces de oxidar lípidos, proteínas, hidratos de carbono o ácidos nucleicos, inactivando funciones celulares claves (Halliwell & Gutteridge, 1999); 3) que se ha reportado que la quimioluminiscencia urinaria espontánea puede constituir un método rápido, simple y sensible para evaluar disturbios asociados con estrés oxidativo (Ríos de Molina et al, 1998); se midieron en los lotes tratados con HCB y en los controles, peroxidación lipídica en hígados y quimioluminiscencia espontánea en orinas, para evaluar estos parámetros de estrés oxidativo en este modelo experimental y poderlos relacionar con las alteraciones producidas en el metabolismo de los hidratos de carbono. 4.1.7.1. Peroxidación lipídica en tejido hepático Como puede verse en la Tabla IV.2, la peroxidación de los lípidos medida a través del contenido de malondialdehido (MDA), aumentó como resultado del tratamiento con el fungicida a cada tiempo ensayado, tanto en homogenato como en la fracción microsomal hepática. Estos niveles de aumento en la 2ª semana, se mantienen altos en las semanas intermedias, y muestran un fuerte incremento al final del tiempo medido, posterior a la intoxicación con HCB. Dichos incrementos observados en la semana 6ª fueron de 65 % y de 400% para homogenato y microsomas respectivamente. Es de destacar que todos los valores obtenidos para los animales tratados en todas las semanas y en las 2 fracciones subcelulares fueron estadísticamente superiores a los controles (220,6 nmol MDA/g.h para homogenato hepático y 22,4 nmol MDA/g.h para fracción microsomal hepática). 141 Resultados Tabla IV.2 Tratamiento Tiempo (semanas) Control Efecto hexaclorobenceno (HCB) sobre el contenido de malondialdehído (MDA) en el tiempo. MDA en homogenato MDA en fracción microsomal (nmol de MDA /g hígado.h) (nmol de MDA / mg proteínas.h) 220,6 ± 13,8.. 22,4 ± 3,4.. 2 249,4 ± 15,3* 30,0 ± 5,6* 3 254,5 ± 12,1* 35,5 ± 2,6* 5 278,8 ± 12,5* 37,3 ± 1,0* 6 363,5 ± 41,2* 111,9 ± 24,6* Tabla .IV.2. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. Los resultados se expresan como la media ± E.S. de diez animales en cada grupo. Quimoluminiscencia urinaria diaria (cpm totales x 10-3) * Diferencia significativa respecto al grupo de animales control, p <0,05. 350 300 CONTROL HCB 250 200 150 100 50 0 2da 3ra 4ta 6ta Tiempo (semanas) Figura 4.16. Eefecto del hexaclorobenceno (HCB) sobre la quimioluminiscencia urinaria diaria en las semanas ensayadas. Cada punto representa la media ± E.S. de diez animales. Los detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F. Los datos se expresaron como cpm totales x 10-3 (en los ml totales de orina diaria). Diferencias significativas respecto a valores de ratas control (P <0,05) 142 Resultados 4.1.7.2. Quimioluminiscencia urinaria Las mediciones de quimioluminiscencia urinaria total diaria (Figura 4.16) muestran que este parámetro crece en función del tiempo luego del tratamiento con HCB en el grupo de animales tratados. Todos los aumentos son estadísticamente significativos respecto de los controles (valor control medio: 71,7 cpm x 10-3) a partir de la 2ª semana, donde los valores de los animales tratados superan al doble el de los animales control. En la 6ª semana, estos aumentos superan en 4 veces a los del control. ¿EXISTEN ALTERACIONES DEL ESTADO HORMONAL QUE REGULA EL METABOLISMO DE LA GLUCOSA? ESTUDIOS SOBRE GC E INSULINA. Teniendo en cuenta que el tratamiento con HCB produce un bloqueo de la PEPCK y de la GP (Figuras 4.5 y 4.14); que la PEPCK está regulada positivamente por GC y negativamente por insulina; que GP está activada por glucagón y epinefrina mientras que insulina disminuye su actividad; pareció interesante estudiar el efecto de la droga porfirinogénica HCB sobre los niveles plasmáticos de insulina y sobre el patrón de secreción pancreática de esta hormona proteica estimulada por glucosa, así como sobre el nivel plasmático de GC, el número y afinidad de los receptores hepáticos de GC (GR) y sobre la biosíntesis de GC en tejido adrenal con el objeto de encontrar las causas potenciales de los decrementos de PEPCK y GP a través de sus moduladores hormonales que llevarían a una menor disponibilidad de glucosa en el hepatocito. 4.1.8. Determinación del nivel de insulina en plasma y secreción pancreática. Como puede verse en la Figura 4.17, los animales tratados con HCB mostraron niveles de insulina plasmática menores (2-4 veces menos) que los animales del grupo control (promedio grupo control: 22,1± 2 µU/ml plasma) La disminución en el nivel plasmático de dicha hormona se incrementa a medida que la intoxicación con HCB se hace más evidente (Figura 4.17). 143 Resultados El HCB no parece afectar de forma significativa la secreción de insulina de islotes pancreáticos de Langerhans, perfundidos y estimulados con glucosa, ensayados durante las semanas 3 y 6 del tratamiento. Los islotes perfundidos mostraron un patrón bifásico de secreción de insulina similar, tanto para los animales del grupo control como para aquellos tratados, como puede verse en la Fig.4.18, donde se muestra el patrón de secreción de animales ensayados en la 6ª semana. A pesar de que la diferencia no fue estadísticamente significativa, los datos provenientes de animales tratados con HCB se mantuvieron, en general, ligeramente por debajo que los de animales controles. Control HCB Insulina plasmática (mU/ml) 30 25 20 15 10 5 0 1 2 3 4 5 6 7 Tiempo (semanas) Figura 4.17: Efecto del hexaclorobenceno (HCB) sobre los niveles de insulina plasmática en las semanas ensayadas.Cada punto representa la media ± E.S. de diez animales luego de transcurridos los diferentes tiempos post tratamiento. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se expresaron como µU/ml plasma. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el F-Test Diferencias significativas respecto a valores de ratas control (P <0,05) 144 Resultados Secreción insulina (mU/min.islote) 8 Control HCB 7 6 5 4 3 2 1 0 0 10 20 30 40 50 Tiempo (minutos) Figura 4.18: Efecto del hexaclorobenceno (HCB) sobre la curva de secreción de insulina de los islotes pancreáticos de Langerhans de ratas, perfundidos y estimulados con glucosa (ensayados durante la 6ta semana). Cada punto representa la media de las determinaciones de insulina ± E.S. de diez animales en cada punto del tiempo, después del estímulo con la glucosa. Las muestras de los minutos 1 y 2 fueron utilizadas para la determinación de la línea de base. Un estímulo de 16,5 mM de glucosa se añadió al tampón de perfusión entre los 3 y 40 minutos. El primer pico secretor fue integrado entre los 3 y 7 minutos, y el segundo pico entre los 8 y 40 minutos de perfusión. Este experimento fue llevado a cabo con los islotes de animales tratados con HCB en la semana 6. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se expresaron como µU/min.islote. Los análisis estadísticos en los datos de secreción de insulina fueron estudiados a través de ANOVA y su significancia con el Test de Scheffe 4.1.9. Glucocorticoides plasmáticos (CORT), receptores (GR) y síntesis adrenal 4.1.9.1 Concentración de corticosterona plasmática vs. Porfirinas. Con el fin de determinar si el HCB es capaz de producir alteraciones en el contenido de glucocorticoides (GC) en coincidencia con el inicio de la porfiria, la concentración de corticosterona (CORT) se midió en el plasma de ratas tratadas con HCB y ratas control a diferentes tiempos (2, 4, 6 y 8 semanas) en paralelo con la determinación del contenido de porfirinas urinarias ya mostradas en la Figura 4.2. 145 Resultados El análisis de la orina de ratas tratadas con HCB mostró un importante incremento de la excreta de porfirinas desde la 4ta a la 8va semana (40-130 µg/orina 24h respecto de los valores control: 2-4 µg/orina 24h), lo que indica una significativa porfiria desarrollada en los animales tratados con HCB. Con ello se demuestra también que la intoxicación por HCB fue eficaz y que la acumulación de porfirinas una vez que se inicia, continúa en aumento durante varias semanas después de terminado el tratamiento. La Figura 4.19, muestra que después del tratamiento con HCB, a las 2 semanas se puede observar una caída significativa en el nivel plasmático de CORT (disminución del 23%) en comparación con los animales tratados con vehículo (valor medio controles: 12,4 ± 0,4 µg/100 ml plasma). Esta reducción en los valores plasmáticos de CORT alcanza el máximo después de la 4ª semana (58%), permaneciendo constante a partir de ésta, hasta la 8ª semana. 4.1.9.2 Análisis del número y afinidad de los GR hepáticos. Para analizar el efecto del tratamiento con HCB sobre la respuesta hepática a los GC, el número y la afinidad de los GR fue analizada en cada condición experimental. La Tabla IV.3 describe cómo el tratamiento HCB produce una pérdida rápida y significativa en el número de GR citosólicos. También muestra que la afinidad de los receptores de glucocorticoides (GR, Kdapp) permanece constante durante todo el tratamiento, mientras que el número de sitios de binding (Bapp) disminuye significativamente desde la 2ª (16%), a la 4ª (40%), y a la 8ª (52 %) semana en comparación con los animales control. 146 Resultados control HCB Nivel de corticoides en plasma (mg/100ml) 14 12 10 8 6 4 2 0 2da 4ta 6ta Tiempo (semanas) 8va Fiura 4.19: Efecto del hexaclorobenceno (HCB) sobre los niveles de corticosterona plasmáticos en los tiempos ensayados. Cada barra representa la media ± ES de determinaciones realizadas por duplicado en cuatro animales. Los niveles de CORT plasmáticos fueron medidos por RIA. Los datos se sometieron a análisis de varianza de una vía ANOVA y las diferencias entre las medias se realizaron por el Test-F Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los datos se expresan como µg CORT/ 100 ml de plasma. Diferencias significativas respecto a valores de ratas control (P <0,05) Tabla IV.3 -Parámetros de afinidad y “binding” de los receptores de GC (GR) Semana 2 4 8 Grupo Control Kdapp 3,24± 0,02 HCB 3,35± 0,26 Bapp 523,1± 4,3 453,9± 23* Control 3,31± 0,03 533,0± 19 HCB Control 3,58± 0,33 3,50± 0,39 332,2± 14* HCB 3,42± 0,59 267,9± 12* 567,1± 8,9 Tabla IV.3: Los parámetros de “binding” (Bapp), fueron obtenidos por desplazamiento de la [ 3H]-DEX (1,25nM) de pegado específico, con diferentes concentraciones de DEX no marcada radioactivamente (0,5 a 100nM). Las experiencias fueron desarrolladas con un rango de entre 400-600µg de proteínas citosólicas en buffer GR. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los valores representan la media de determinaciones por triplicado realizadas en cuatro ratas por grupo ± E.S. Los Kdapp y Bapp fueron calculados usando un programa de ligandos. El Kd app fue expresado en 10-10 M y el Bapp en fmol/mg proteína. *Diferencias significativas respecto a valores de ratas control, p<0,05. 147 Resultados ESTUDIANDO LA RAZÓN DE LA CAÍDA EN LA CONCENTRACIÓN DE CORT POR EFECTO DEL HCB. ¿SERÁN DEBIDOS A DEFECTOS EN SU SÍNTESIS ADRENAL? Con el fin de comprobar si la disminución en el CORT plasmático podría deberse a un daño en la producción de CORT por la glándula suprarrenal, se estudió la biosíntesis de CORT en presencia y ausencia de ACTH. La Tabla IV.4 muestra que, de la 4ª semana en adelante, la capacidad de biosíntesis basal de las glándulas suprarrenales de los animales intoxicados con HCB está notablemente disminuida (46% y 51% en las semanas 4 y 8, respectivamente). Tabla IV.4 - Producción de CORT basal y estimulada con ACTH, en adrenales Tratamiento CORT (pg/ml) Semana 2 4 8 Grupo Control -ACTH 135± 24 +ACTH 945± 61 HCB Control HCB Control 141± 38 158± 44 86± 23* 149± 42 923± 39 998± 41 679± 42* 1012± 82 HCB 73± 15* 457±56* Tabla IV.4: Las adrenales fueron obtenidas de los animales controles y de los tratados con HCB. El tejido fue incubado en ausencia (-ACTH) y presencia de 1nM (+ACTH). Las incubaciones se llevaron a cabo a 37°C y se frenaron luego de una hora por enfriamiento rápido. El medio fue inmediatamente separado y guardado a -20°C hasta la determinación de CORT por RIA. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los valores representan la media de experiencias por duplicado realizadas con cuatro animales por grupo ± E.S. * Diferencias significativas respecto a animales controles, p<0,05. Un grado similar de deterioro (porcentajes semejantes de disminución) provocado por el tratamiento con HCB, se observó en ensayos estimulados con ACTH. Por otra parte se registraron los pesos de las glándulas suprarrenales y éstos no fueron significativamente modificados [controles: 35,2 ± 1,3 mg; tratados con HCB: 36.7 ± 1,6 mg (8ª semana)] lo que sugiere que las diferencias en la producción de CORT no son debidas a una disminución en el peso de las glándulas. 148 Resultados PERTURBACIONES EN EL METABOLISMO DEL TRIPTÓFANO EN ESTE MODELO DE PCT EXPERIMENTAL POR HCB Teniendo en cuenta que la administración de triptófano (TRP) resulta en hipoglucemia y la presencia de sus metabolitos de las rutas serotoninérgica y quinurenérgica dañan la gluconeogénesis y la formación de glucógeno (Veneziale et al.,1967; Elliot et al.,1976; Smith and Pogson, 1977) y que una de las enzimas de la ruta quinurenérgica es una hemoproteína; es decir, que hay interconexiones entre los metabolismos del hemo, de los hidratos de carbono y del triptófano, se quisieron investigar algunos aspectos del metabolismo del triptófano en relación a esta porfiria y al metabolismo de la glucosa. 4.1.10. Contenido hepático de triptófano (TRP) Las ratas controles exhibieron un contenido de TRP de 7,42 ± 0,61 µg/g de hígado. Las ratas tratadas con HCB durante las semanas 2, 3 y 5 mostraron valores similares de este compuesto indólico (7,98 ± 0,41 µg /g hígado) a los del grupo control en hígado. En tratamientos de HCB más largos (6-8 semanas) se advierte un aumento moderado y estadísticamente significativo en los niveles del triptófano (10,55 ± 0,37 µg/g hígado), que supera los valores de control en aproximadamente el 20%. 4.1.11. Metabolitos hepáticos del TRP medidos por HPLC. 4.1.11.1. Cromatogramas de elución. En las Figuras. 4.20 y 4.21 se muestran cromatogramas típicos de elución en HPLC del triptófano y sus metabolitos de degradación en extractos de hígados obtenidos de ratas normales (y/o porfíricas, sacrificadas durante las semanas 2, 3 y 5 de intoxicación con HCB). 149 Resultados Figuras 4.20 y 4.21. Dos diagramas de extractos de hígados corridos en HPLC, utilizando como fase movil Acetato: Metanol en proporción 65:32 (ver descripción en el texto y en Materiales y Métodos) Los tiempos de retención para los estándares en minutos fueron de: 9,71min para la serotonina o 5-hidroxitriptamina (5-HT) y 13,75 min para el triptófano (TRP), en tanto que el resto de los metabolitos [5-hidroxindolacético (5-HIAA), 5-hidroxitriptofol (5-HTOL), quinurenina, etc.] no fueron señalados a través de estándares ni determinados (n.d.). Las corridas mostradas en las figuras, se llevaron a cabo con fase móvil compuesta de 10mM de acetato de sodio pH 4,5+ metanol, en una relación 65:35. Los cálculos para 5-HT y TRP no mostraron variaciones significativas en los tiempos ensayados para ratas intoxicadas con HCB vs ratas controles. Las ratas en general (controles e intoxicadas con HCB por 2, 3 y 5 semanas) exhibieron un contenido de TRP promedio de 7,983 ± 0,41 µg/g de hígado y de 5-HT promedio de 3,682± 0,11 µg/g de hígado. Estudios de nuestro laboratorio hechos en colaboración con Llambías et al., (2003, 2004), muestran un moderado aumento en el contenido de TRP hepático más alla de las 6 semanas de tratamiento con HCB (aproximadamente un 20% de diferencia entre ratas tratadas vs controles). 150 Resultados 4.2. MODELO DE PORFIRIA HEPÁTICA AGUDA POR AIA/DDC ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL DE PORFIRIA HEPÁTICA AGUDA? 4.2.1. Actividades enzimáticas y precursores del camino del hemo. Los cambios en la biosíntesis de porfirinas fueron estudiados utilizando diferentes dosis de AIA/DDC, para evaluar sus efectos sobre algunos parámetros claves del metabolismo del hemo, en este modelo de intoxicación aguda. Por lo tanto, las actividades de ALA-S (enzima regulatoria del camino) y FQ (enzima particularmente afectada por acción del DDC), y el contenido de los precursores ALA y PBG en el hígado fueron estudiados. 4.2.1.1 La actividad ALA-S es dosis dependiente Para la determinación de las siguientes actividades se utilizó un esquema de drogado de animales, que brevemente se describe a continuación, y se puede ampliar consultando la sección 3 de Materiales y Métodos. Los animales fueron inyectados por vía subcutánea (s.c.) con tres dosis diferentes de AIA y por vía intraperitoneal (i.p.) con una dosis única de DDC, resultando en los siguientes grupos: grupo L (100 mg AIA + 50 mg de DDC/kg de peso corporal), grupo M (250 mg AIA + 50 mg de DDC/kg de peso corporal), y grupo H (500 mg AIA + 50 mg de DDC/kg de peso corporal). El grupo control (grupo C) sólo recibió los vehículos: solución fisiológica, sc. y aceite de maíz, ip. Otros detalles experimentales se describen en la sección 3. Como puede verse en la Figura 4.22, la administración de AIA/DDC aumenta la actividad de ALA-S hasta en un 300% en el grupo H (500 mg de AIA + 50 mg de DDC/kg de peso corporal), y este aumento es estadísticamente diferente a los grupos C (control), L (100 mg AIA + 50 mg de DDC/kg de peso corporal) y M (250 mg de AIA + 50 mg de DDC/kg de peso corporal). El valor medio de ratas controles es de 23,4 ± 4 µmol ALA/mg.h. 151 Resultados ALA-S (mmol/mg proteína.h) 120 100 80 60 40 20 0 Grupo C Grupo L Grupo M Grupo H Figura 4.22 - Efecto del tratamiento con AIA/DDC sobre la actividad de ALA-S de acuerdo a las dosis de AIA utilizada. El desarrollo de la porfiria fue estimado midiendo la actividad de la enzima ALA-S. Los animales fueron inyectados por vía subcutánea (sc) con tres dosis diferentes de AIA y por vía intraperitoneal (ip) con una dosis única de DDC, resultando en los siguientes grupos: L (100 mg AIA + 50 mg de DDC/kg de peso corporal), M (250 mg AIA + 50 mg de DDC/kg de peso corporal), y H (500 mg AIA + 50 mg de DDC/kg de peso corporal). El grupo control (grupo C) sólo recibió los vehículos: solución fisiológica, sc. y aceite de maíz, ip. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La actividad ALA-S, se expresa como µmol/ mg de proteína. hora. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. P <0,05 es significativamente diferente del grupo C P <0,05 es significativamente diferente del grupo L. 4.2.1.2 Actividad Ferroquelatasa (FQ) Por otro lado, teniendo en cuenta que el DDC afecta particularmente la actividad de la enzima que sintetiza hemo a partir de hierro y PROTO IX, fue medida la actividad de la FQ. Como era de esperar, dado que la dosis de DDC inyectada fue fija para todos los grupos tratados, la actividad de esta enzima disminuyó alrededor del 50% en todos ellos, con respecto al control (1,34 ± 0,2 nmol hemo/mg prot.h) (Figura 4.23) 152 Resultados FQ (nmol hemo/mg proteína.h) 2 1,6 1,2 0,8 0,4 0 C L M H Figura 4.23: Efecto del tratamiento con AIA/DDC sobre la actividad de ferroquelatasa (FQ) de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La actividad ferroquelatasa, se expresa como nmol de hemo/ mg de proteína. hora Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. P <0,05 es significativamente diferente del grupo C. 4.2.1.3 Contenidos hepáticos de ALA y PBG dosis dependiente El efecto del tratamiento sobre los precursores del camino de hemo en el hígado se describe en las siguientes dos figuras. Ambos precursores, ALA (Figura 4.24) y PBG (Figura 4.25), se incrementaron en todos los grupos ensayados (L, M y H) cuando fueron comparados con los valores del control (8,2 ± 0,8 nmol ALA/g hígado y 0,4 ± 0,1 nmol PBG/g hígado). Los porcentajes de ALA aumentaron en un 25, 250 y 280%, así como el PBG, donde los incrementos fueron del 650, 3900, y 5000% para los grupos L, M y H, respectivamente. 153 Resultados 35 ALA hepático ( nmol/ g) 30 25 20 15 10 5 0 C L M H Figura 4.24 - Efecto del tratamiento con AIA/DDC sobre el contenido de ALA hepático de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 25. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los contenidos de ALA hepáticos son expresados como nmol /g de hígado fresco. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. P <0,05 es significativamente diferente del grupo C P <0,05 es significativamente diferente del grupo L. Los contenidos de ALA y PBG hepáticos en el grupo H se vieron incrementados en comparación con el control, y fueron estadísticamente diferente tanto del grupo L como del control. Además, el contenido de PBG en el grupo H fue estadísticamente diferente al grupo M. 154 Resultados PBG hepático (nmol/g) 20 16 12 8 4 0 C L M H Figura 4.25 - Efecto del tratamiento con AIA/DDC sobre el contenido de PBG hepático de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Los contenidos de ALA y PBG hepáticos son expresados como nmol /g de hígado fresco. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. P <0,05 es significativamente diferente del grupo C P <0,05 es significativamente diferente del grupo L. P <0,05 es significativamente diferente de M. ALTERACIONES PROVOCADAS EN EL METABOLISMO DE LA GLUCOSA: GLUCONEOGÉNESIS, GLUCÓLISIS. 4.2.2. Actividades enzimáticas de la gluconeogénesis Para evaluar el impacto de las drogas porfirinogénicas en estudio sobre el camino de síntesis de glucosa, se midieron las actividades de dos enzimas claves y 155 Resultados regulatorias de este camino como son la fosfoenolpiruvato-carboxiquinasa (PEPCK) y la glucosa 6-fosfatasa (G6Pasa). 4.2.2.1. Fosfoenolpiruvato carboxiquinasa (PEPCK) La Figura 4.26, muestra la actividad de PEPCK, enzima que transforma oxalacetato en PEP, medida en el hígado de animales tratados con diferentes dosis de AIA/DDC, así como en los controles. Después de 16 h de tratamiento, la actividad PEPCK sufrió un 30 y 24% de inhibición en los grupos H y M, respectivamente, en comparación con los controles (valor: 10,1 ± 0,8 nmol NADHox /mg prot. min) y dichos valores fueron estadísticamente diferentes de los grupos C y L. PEPCK (nmol NADHox/mg prot.min) 12 10 8 6 4 2 0 Grupo C Grupo L Grupo M Grupo H Figura 4.26: Efecto dosis-respuesta sobre la actividad de la fosfoenolpiruvato carboxiquinasa (PEPCK) hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.16. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La actividad PEPCK es expresada como nmol NADHox/mg de proteína.min. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. P <0,05 es significativamente diferente del grupo C P <0,05 es significativamente diferente del grupo L. 156 Resultados 4.2.2.2. Glucosa 6 fosfatasa (G6Pasa) Asimismo se estudió el efecto de AIA/DDC sobre la enzima que libera glucosa y fósforo a partir de G6P, la glucosa 6-fosfatasa (G6Pasa). La Figura 4.27, muestra la actividad de G6Pasa, medida en el hígado de animales tratados con diferentes dosis de AIA/DDC, así como en los controles. La actividad solo tuvo un 12% de inhibición significativa en el grupo H, en comparación con los animales controles (valor medio controles: 0,17 ± 0,02 µmol Pi/mg prot.min). G6Pasa (µmol Pi/mg prot.min) 0,2 0,16 0,12 0,08 0,04 0 Grupo C Grupo L Grupo M Grupo H Figura 4.27 - Efecto dosis-respuesta sobre la actividad de la glucosa 6 fosfatasa (G6Pasa) hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La actividad G6Pasa es expresada como µmol Pi/mg de proteína. min. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. P <0,05 es significativamente diferente del grupo C. 157 Resultados 4.2.3. Glucólisis- Piruvato Quinasa (PK) También se quiso investigar si estaba afectado el camino de degradación de la glucosa y para ello se evaluaron los cambios observados en una de las enzimas regulatorias, la PK. La Figura 4.28 muestra la actividad de la misma, medida en el hígado de animales tratados con diferentes dosis de AIA/DDC, así como en los controles. La actividad tuvo una inhibición importante en todos los grupos, y estadísticamente significativa en comparación a los animales controles (0,34 ± 0,08 µmol NADHox /mg. min), llegando en algunos casos al 50%. PK (µmol NADHox/mg prot.min) 0,5 0,4 0,3 0,2 0,1 0 Grupo C Grupo L Grupo M Grupo H Figura 4.28: Efecto dosis-respuesta sobre la actividad de la piruvato quinasa (PK) hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal como se describe en la Fig. 4.22. Otros detalles experimentales se describen en sección 3 Materiales y Métodos. La actividad PK es expresada como µmol NADHox/mg de proteína.min. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. Los valores entre los grupos L, M y H no fueron estadísticamente significativos entre si, pero si diferentes al grupo C. P <0,05 es significativamente diferente del grupo C. 158 Resultados DAÑOS PROMOVIDOS EN EL METABOLISMO DEL GLUCÓGENO 4.2.4. Niveles de glucógeno y actividades enzimáticas de su metabolismo Monitoreando las alteraciones provocadas en el proceso de almacenamiento de glucosa en el hígado por el tratamiento con AIA/DDC se exploraron los contenidos de glucógeno y las actividades de las enzimas responsables de su síntesis y degradación: glucógeno sintetasa (GS) y glucógeno fosforilasa (GP) respectivamente. 4.2.4.1. Glucógeno hepático total Como puede verse en la Fig. 4.29 el tratamiento porfirinogénico con AIA/DDC incrementó los depósitos de glucosa en el hígado. Así el aumento de los niveles de glucógeno hepático fue para la dosis mayor (H) de 4 veces respecto al control (valor grupo C: 4,9 ± 0,3 µmol glucosa/g hígado) mientras que en la dosis M y L también fue evidente con incrementos de 3 y 2,5 veces respectivamente. Glucógeno (µmol glucosa/g hígado) 20 16 12 8 4 0 Grupo C Grupo L Grupo M Grupo H Figura 4.29: Efecto del tratamiento con AIA/DDC sobre el contenido de glucógeno hepático total de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. El contenido de glucógeno hepático es expresado como µmol glucosa /g de hígado fresco. Los valores representan la media de experiencias por duplicado realizadas con seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. P <0,05 es significativamente diferente del grupo C P <0,05 es significativamente diferente del grupo L. 159 Resultados 4.2.4.2. Glucógeno Sintetasa (GS) La Figura 4.30 muestra que la GS, enzima encargada de sintetizar glucógeno, aumenta ligeramente en hígado de ratas tratadas con sendos xenobióticos. Es también dosis dependiente y se incrementa en un 28% en el grupo que recibe la dosis mayor de AIA, siendo los valores de este grupo (H) estadísticamente diferentes no sólo de los controles (valor grupo C: 98,4 ± 7 nmol UDP liberado/mg.h) sino también de los grupos M y L. GS (nmol UDP liberado/ mg.h) 160 140 120 100 80 60 40 20 0 Grupo C Grupo L Grupo M Grupo H Figura 4.30 - Efecto dosis-respuesta sobre la actividad de la Glucógeno sintetasa (GS) hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. La actividad GS fue determinada usando UDP-glu como sustrato y midiendo la cantidad de UDP liberado en el ensayo de PK. La actividad GS es expresada como nmol UDP liberado/mg de proteína.h. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. P <0,05 es significativamente diferente del grupo de M. 160 Resultados 4.2.4.3. Glucógeno fosforilasa (GP) - Degradación del glucógeno Estudiando la enzima de velocidad limitante de la degradación del glucógeno, se vio que el tratamiento porfirinogénico empleado produjo importantes alteraciones en esta enzima. Como puede verse en Figura 4.31 la actividad de GP también mostró una disminución estadísticamente significativa de alrededor del 53% y del 38% en el grupo H con respecto al grupo C y grupo L (2,24 ± 0,22 y 1,73 ± 0,21 nmol Pi/g.min, respectivamente). En el grupo M, GP sufrió 36% de inhibición en comparación con C. GP (nmol Pi/g higado.min) 3 2,5 2 1,5 1 0,5 0 Grupo C Grupo L Grupo M Grupo H Figura 4.31 - Efecto dosis-respuesta sobre la actividad de la Glucógeno fosforilasa (GP) hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. La actividad GP fue determinada como el fosfato liberado (Pi) a partir de la glucosa-1-P y glucógeno, usando como fuente enzimática sobrenadante de 2.000 x g de los correspondientes homogenatos. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La actividad GP es expresada como nmoles Pi/ g de hígado.min P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. 161 Resultados 4.2.5. Transporte de glucosa en tejido hepático Otro aspecto que se quiso explorar fue el de la captación de glucosa por el hígado, a los fines de ver si había alguna interferencia en el proceso de transporte del azúcar, como consecuencia del tratamiento con AIA/DDC. De esa forma se observó que en animales porfíricos, la captación de glucosa (figura 4.32) mostró un aumento dependiente de la dosis (50% a la dosis máxima) es decir, la célula hepática de dichos animales estaría captando más glucosa. 180 Captación de 3H-Glu (pg glucosa/ g hígado) 160 140 120 100 80 60 40 20 0 Grupo C Grupo L Grupo M Grupo H Figura 4.32 - Efecto dosis-respuesta sobre la captación de glucosa hepática por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La captación de la 3H-glu es expresada como pg Glu/ g de hígado fresco P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. 162 Resultados EN BUSCA DE LAS CAUSAS DEL DESCENSO DE PEPCK Y GP- INTERFERENCIAS EN EL SISTEMA REDOX 4.2.6. Producción de especies reactivas de oxígeno (ROS)- Estrés oxidativo. Para determinar el efecto de las especies reactivas de oxígeno (ROS) y el daño que puede causar este tratamiento en biomoléculas esenciales, tales como los lípidos, se midió la producción de sustancias reactivas al ácido tiobarbitúrico (TBARS) en dos fracciones hepáticas: homogenato total de hígado y microsomas hepáticos, que es la fracción subcelular de este tejido más rica en membranas. 4.2.6.1. Peroxidación lipídica en tejido hepático La peroxidación lipídica medida en homogenatos como TBARS exhibió un aumento significativo, por acción de las drogas porfirinogénicas, en el grupo L (22%), grupo M (40%) y en el grupo H (72%) con respecto al grupo control (128 ± 10 nmol MDA/ g hígado fresco. hora), mostrando un comportamiento droga-dependiente de las dosis (Figura 4.33). En comparaciones múltiples entre los grupos analizados, salvo en el grupo L cuyos aumentos sólo difirieron estadísticamente del control, los aumentos registrados en los grupos M y H fueron estadísticamente significativos y diferentes de cualquiera de los otros grupos y entre sí. Por otra parte se quiso analizar el daño producido no sólo en homogenato total sino en la fracción microsomal, como arriba se mencionó. En la tabla IV.5, pueden verse los resultados obtenidos en forma comparativa. En dicha tabla se observa un aumento significativo tanto en la fracción microsomal, como en el homogenato, se ve también que el incremento depende de la dosis, que el aumento más significativo fue en la fracción microsomal y que éste supera en aproximadamente cuatro veces al registrado en el homogenato total. Así, en el homogenato, las TBARS aumentan con respecto al control en los grupos L, M, y H, como fue mencionado para la figura 4.33, mientras que en los valores de fracción microsomal los aumentos fueron del 75, 150, y 330%, respectivamente, para dichos grupos, y en todos los casos estadísticamente significativos. 163 Resultados TBARS (nmol MDA/g higado.hora) 250 200 150 100 50 0 Grupo C Grupo L Grupo M Grupo H Figura 4.33 - Efecto dosis-respuesta sobre la peroxidación lipídica en homogenato hepático por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizadas. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La peroxidación es expresada como nmol MDA formado/ g de hígado fresco. hora P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. P <0,05 es significativamente diferente del grupo de M. Tabla IV.5. Peroxidación lipídica como formación de TBARS en homogenatos y microsomas hepáticos de ratas tratadas con AIA/DDC vs ratas controles. TBARS en homogenato TBARS en microsomas Grupos (nmol MDA/g hígado fresco. h) (nmol MDA/mg proteínas. h) C 128 ± 10 20 ± 5 L 156 ± 12* 35 ± 3* M 179 ± 13*,# 50 ± 8*,# H 220 ± 12*,#,§ 86 ± 9*,#,§ Tabla IV.5. El malondialdehido (MDA) se evalúa como TBARS. Los animales fueron inyectados tal cual se describe en la Fig. 4.22. La peroxidación en homogenato es expresada como nmol MDA/ g de hígado fresco. hora. La peroxidación en microsomas es expresada como nmol MDA/ mg de proteínas. hora. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de TukeyKramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. *P < 0,05 es signif. diferente respecto a C; #P < 0,05 es signif. diferente respecto a L.; § P < 0,05 es signif. diferente respecto a M` 164 Resultados 4.2.6.2. Carbonilación de proteínas en tejido hepático Así como se evaluó el daño a lípidos producido por el ambiente oxidativo generado por el tratamiento, se quiso investigar el correspondiente daño a proteínas. A tal fin se determinó la carbonilación de las proteínas, ya que las ROS son las responsables de la carbonilación y del daño sobre las proteínas de membrana. Como muestra la Figura 4.34, después de 16 h del tratamiento, las proteínas citosólicas carboniladas sufrieron importantes aumentos de 2,3 y 3 veces en los grupos M y H respectivamente, estadísticamente significativos en comparación con el grupo control C (1,4 ± 0,3 nmol carbonilos/ mg), y el grupo L (Figura 4.34). nmol carbonilos/mg proteínas 8 6 4 2 0 Grupo C Grupo L Grupo M Grupo H Fig. 4.34 - Efecto dosis-respuesta sobre el contenido de carbonilos citosólicos hepático por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe la Fig. 4.22. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La carbonilación es expresada como nmol carbonilos/ mg prot. P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. 165 Resultados 4.2.6.3- Quimioluminiscencia urinaria (QL) Teniendo en cuenta que se ha reportado que la quimioluminiscencia urinaria espontánea puede constituir un método rápido, simple y sensible para evaluar disturbios asociados con estrés oxidativo (Ríos de Molina et al., 1998) se midió en los lotes tratados con AIA/DDC y en los controles, quimioluminiscencia espontánea en orinas para evaluar estos parámetros de estrés oxidativo en este modelo experimental y poderlos relacionar con las alteraciones producidas en el metabolismo de los hidratos de carbono. En lo que respecta a la quimioluminiscencia urinaria, los valores mostraron un aumento estadísticamente significativo, del 127% en el grupo L [(116,8 ± 38) × 103 cpm] y 205% en el grupo M [(156,2 ± 60) x 103 cpm] con respecto al control [(51,7 ± 25) × 103 cpm], (Figura 4.35). Por otro lado, los animales tratados con la dosis más altas (grupo H) cayeron en un sueño profundo debido al tratamiento y por tanto, el volumen de excreción urinaria no fue suficiente para realizar la determinación de quimioluminiscencia. Quimioluminiscencia urinaria (cpm. 10 3) 240 200 160 120 80 40 0 Grupo C Grupo L Grupo M Grupo H Fig. 4.35 - Efecto dosis-respuesta sobre la quimioluminiscencia urinaria diaria por el tratamiento con AIA/DDC, de acuerdo a las dosis de AIA utilizada. Los animales fueron inyectados tal cual se describe la Fig. 4.22. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. La quimioluminiscencia es expresada como cpm x 10 3/ ml orina24 h P <0,05 es significativamente diferente del grupo C. 166 Resultados 4.2.7. Actividades de las defensas antioxidantes Los sistemas enzimáticos de defensas (Figuras 4.36 y 4.37) mostrados a través de las actividades de superóxido dismutasa (SOD) y catalasa (CAT), respectivamente, fueron medidas en los hígados de animales tratados con AIA/DDC y en los controles. 4.2.7.1. SOD Como puede verse en la figura 4.36, la actividad de SOD responde positivamente al estrés oxidativo. Así ella aumentó 235% en el grupo H, el 41,6% en el grupo M, y el 19% en el grupo L, con respecto al grupo control (11,4 ± 2 U SOD/ mg. min). U SOD/mg proteína.min 45 36 27 18 9 0 Grupo C Grupo L Grupo M Grupo H Figura 4.36. Dosis-respuesta de la actividad de SOD por el tratamiento con AIA/DDC. Los animales fueron inyectados con las mismas dosis indicadas en la Fig. 4.22. Cada barra representa la media ± E.S. de seis animales. El contenido se expresó como U/mg proteína. min para la actividad SOD (donde una U es definida como la cantidad de enzima necesaria para inhibir el 50% de la autoxidación de la epinefrina).Las comparaciones múltiples entre grupos se realizaron usando la prueba de TukeyKramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. P <0,05 es significativamente diferente del grupo de M. 167 Resultados 4.2.7.2. CAT La actividad de CAT (Figura 4.37) por el contrario, sufrió 24, 11 y 9% de inhibición en los mismos grupos, respectivamente. Tanto SOD y CAT mostraron un comportamiento droga dependiente, estadísticamente significativo de la dosis en comparaciones múltiples entre grupos analizados (valor C: 57,9±2µmol H2O2/mg. min). mm H2O2/mg proteína.min 70 60 50 40 30 20 10 0 Grupo C Grupo L Grupo M Grupo H Figura 4.37: Dosis-respuesta de la actividad de CAT por el tratamiento con AIA/DDC. Los animales fueron inyectados con las mismas dosis indicadas en la Fig. 4.22. Cada barra representa la media ± E.S. de seis animales. El contenido se expresó como µmol H2O2 consumido/ mg proteína. min. Las comparaciones múltiples entre grupos se realizaron usando la prueba de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. P <0,05 es significativamente diferente del grupo C. P <0,05 es significativamente diferente del grupo de L. P <0,05 es significativamente diferente del grupo de M. 168 Resultados MELATONINA COMO ANTIOXIDANTE PREVENTIVO A LA INTOXICACIÓN. Por otra parte se quiso investigar si la melatonina (Mel), que deriva del camino serotoninérgico del triptófano y de la que se ha reportado capacidad atrapante de radicales libres y antioxidante, puede modular los efectos producidos por el tratamiento con AIA/DDC sobre el ambiente oxidativo, la biosíntesis de la glucosa y el camino del hemo; es decir si puede modular la porfiria aguda inducida por estas drogas en ratas intoxicadas. A tal efecto, se midieron en el modelo de intoxicación aguda como parámetros del camino del hemo e indicadores de porfiria: los precursores ALA y PBG en orina y las enzimas hepáticas ALA-S (regulatoria del camino) y FQ (enzima blanco de la acción del DDC); como parámetros de la gluconeogénesis hepática: las enzimas claves y regulatorias: PEPCK y G6Pasa; y como marcador de estrés oxidativo: la peroxidación lipídica mediante la estimación de los TBARS en el homogenato total y en microsomas de hígado. Todos estos parámetros se midieron en lotes de animales que fueron aleatoriamente separados para cada experiencia en cuatro grupos: C (grupo Control), Mel (grupo Melatonina), I+Mel (grupo intoxicado con AIA/DDC junto al tratamiento con Melatonina) e I (grupo intoxicado con AIA/DDC). La Mel fue inyectada en dos de los grupos con una concentración de 10 mg/kg de peso corporal, 3 veces al día (en los horarios de las 8, 12 y 16hs) durante los 2 días previos a la intoxicación, disuelta en solución salina justo antes de ser administrada ip. a los animales de los grupos correspondientes, tal como se describe en Materiales y Métodos. La intoxicación fue llevada a cabo con AIA y DDC (300 mg/kg. pc, sc. + 50 mg/kg. pc, ip.) luego del pretratamiento de 2 días con Mel en los grupos correspondientes. El grupo Control (C) recibió solo los vehículos de las drogas y del protector Mel. Las ratas tuvieron un ayuno total de 24h (8h antes del drogado con AIA/DDC y 16h después del mismo) antes de ser sacrificadas, aunque con libre acceso a los bebederos de agua. Las mediciones fueron hechas 16h post-intoxicación. Los resultados obtenidos pueden verse en la Tabla IV.6. 169 Resultados Tabla IV.6: Acción de melatonina (Mel) sobre parámetros del camino del hemo, de la biosíntesis de glucosa y del estrés oxidativo en modelo de porfiria aguda. Parámetro (frac. hepática) Melatonina (Mel) AIA/DDC (I) AIA/DDC+ Mel (I+Mel) ALA orina 113±9 237±14 * # 179±12 * # § PBG orina 64±15 * 456±29 * # 331±22 * # § ALA-S (homogenato) 106±13 426±27 * # 320±21 * # § FQ (mitocondrias) 98±15 29±4 * # 33±5 * # PEPCK (citosol) 124±11 45±5 * # 70±6 * # § G6Pasa (microsomas) 83±12 85±7 * 92±7.... *# TBARS (homogenato) 98±10 145±11 TBARS (microsomas) 96±5 121±9 * # 124±10 * # § 94±7 § Tabla IV.6. Cada valor representa el porcentaje de aumento o disminución de contenidos o actividades ensayadas respecto al valor control (100%). Los animales fueron inyectados tal cual se describe el texto precedente, en cuatro grupos: C (control) Mel (melatonina i.p.10mg/k pc, 6 veces en 2 días previos a la intoxicación); I: intoxicados con AIA/DDC (300mg/k peso corporal + DDC 50 mg/k peso corporal) y por último I+Mel: grupo pre-tratado por 2 días con Mel y luego intoxicados con AIA/DDC en igual concentración que grupo I. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. Las comparaciones múltiples entre grupos de tratamientos fueron realizadas mediante el Test de Tukey-Kramer. Las actividades y contenidos de los valores controles fueron: Contenido de ALA en orina, valor control 6µg ALA /24 h Contenido de PBG en orina, valor control 1,93µg PBG /24 h Actividad de ALA-S, valor control 24 µmol ALA/mg prot.h Actividad de FQ, valor control 1,28 nmol piridin.hemocromógeno/mg prot.h Actividad de PEPCK, valor control 9,7 nmoles NADH consumidos/ mg prot.min Actividad de G6Pasa, valor control 0,574µmoles Pi / mg prot.min TBARS h valor control 228 nmoles MDA / g hígado. h TBARS microsomas valor control 20 nmoles MDA / mg prot. h Los valores representan la media de experiencias por duplicado de seis animales por grupo ± E.S. Las comparaciones múltiples entre grupos fueron realizadas a través del Test de Tukey-Kramer. * P < 0.05 es significativamente diferente respecto a C. # § P < 0.05 es significativamente diferente respecto a Mel. P < 0.05 es significativamente diferente respecto a I. En cuanto a la excreta de los precursores ALA y PBG por orina el tratamiento con Mel tuvo un efecto positivo, particularmente notorio para el PBG, disminuyendo de forma considerable la acumulación característica de estos metabolitos del camino del hemo como consecuencia del tratamiento con AIA/DDC (Tabla IV.6). Estas 170 Resultados disminuciones fueron del 25% para el ALA y de 28% para el PBG. La administración de melatonina sola modificó los valores normales de excreción de ambos metabolitos provocando una disminución marcada en los niveles de PBG (36%). Como puede verse en dicha tabla, Mel atenuó a un 75% la inducción de la enzima regulatoria del camino del hemo (ALA-S) promovida por AIA/DDC y la melatonina sola no tuvo efecto sobre dicha enzima. Por otra parte, se observó muy ligero efecto benéfico de la Mel sobre la inhibición producida por las drogas porfirinogénicas en la actividad de FQ, que no llega a ser estadísticamente significativo. La melatonina per se tampoco afectó la actividad de esta enzima que sintetiza hemo. Como puede observarse además en la misma Tabla IV.6, la administración de Mel tuvo también un efecto benéfico a nivel de las enzimas de la biosíntesis de glucosa. En efecto, su administración conjunta con AIA/DDC restauró en un 25% la actividad de PEPCK que había sido dañada en un 55% por el tratamiento porfirinogénico y recuperó en un 8% la actividad de la G6Pasa, que había perdido 15% de su actividad por acción del AIA/DDC. La administración del compuesto indólico solo, no modificó sustancialmente la actividad de la PEPCK ni de la G6Pasa. Asimismo se observó que el estrés oxidativo mejoró como consecuencia de la administración conjunta de Mel + AIA/DDC respecto al producido por las drogas porfirinogénicas solas, tanto en homogenato como en microsomas. En efecto, como puede verse en la Tabla IV.6, en homogenato la producción de TBARS disminuyó en un 15%, producción que estuvo aumentada en un 45% por el tratamiento porfirinogénico solo. Similarmente en microsomas la Mel redujo en un 22% los TBARS producidos por acción de las drogas AIA/DDC. La administración de Mel sola no modificó la peroxidación lipídica en ninguna de las 2 fracciones subcelulares ensayadas. PERTURBACIONES EN EL METABOLISMO DEL TRP EN ESTE MODELO DE PORFIRIA AGUDA Para evaluar el impacto de este tratamiento porfirinogénico sobre el metabolismo del triptófano (TRP) y las rutas serotoninérgica y quinurenérgica, se 171 Resultados estudió el hígado, midiendo la concentración de serotonina (5-HT); los niveles del TRP y además la actividad de la triptófano pirrolasa (TRPp). 4.2.8 Camino serotoninérgico Como se muestra en la Tabla IV.7, el tratamiento combinado con AIA/DDC promueve una disminución en el nivel de serotonina, que fue más marcado en dosis altas (20% en el grupo M, y 38% en el grupo H) y significativamente diferente al grupo control. La disminución en el nivel de 5-HT en el grupo H fue estadísticamente diferente respecto a la del grupo M. Por otro lado, la concentración hepática de TRP aumentó un 23% en la dosis más alta ensayada con respecto al grupo C. Tabla IV.7 Niveles hepáticos de Serotonina (5-HT) y Triptófano (TRP) de ratas tratadas con AIA/DDC vs ratas controles. 5-HT hepático TRP hepático Grupos (µg/g hígado fresco) (µg/g hígado fresco) C 0,682 ± 0,051 7,981 ± 0,362 L 0,630 ± 0,045 8,225 ± 0,303 M 0,546 ± 0,039* 9,030 ± 0,491 H 0,421 ± 0,030 * , #, § 9,872 ± 0,624 * ,# Tabla IV.7. Cada valor representa la media ± E.S. de seis animales. Las ratas fueron inyectadas y divididas en los grupos detallados en la Fig. 4.22. El contenido de TRP y 5-HT es expresado como mg TRP o 5-HT/g hígado fresco. Las comparaciones múltiples entre grupos fueron realizadas a través del Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. * P < 0,05 es significativamente diferente respecto a C. # § P < 0,05 es significativamente diferente respecto a L. P < 0,05 es significativamente diferente respecto a M. 4.2.9. Enzimas del camino quinurenérgico. Actividad de la TRPp. La vía de degradación del TRP se ensayó midiendo la actividad hepática de la enzima TRPp. Los resultados demostraron que había un aumento marcado y estadísticamente significativo en la actividad de todas sus formas (holo, apo, y enzima total), y que era dependiente de la dosis respecto al grupo control. La actividad fue medida en presencia o ausencia de hemo exógeno. 172 Resultados La Tabla IV.8 muestra un aumento del 30, 70, y 120% para las tres especies enzimáticas holo, total, y apo-TRPp, respectivamente, en la dosis media ensayada (grupo M), y 90, 150, y 230% de aumento respectivamente, en la dosis mayor de AIA (grupo H). Los valores de actividad de todas las especies de la enzima, tanto en la dosis más alta y mediana analizadas (los grupos H y M) fueron significativamente diferentes de los medidos respecto al control y la dosis más baja (grupo L), con excepción de la actividad de la holoenzima en el grupo M. Además, la actividad de la apoenzima (apoTRPp) en el grupo H también fue significativamente diferente de la observada en el grupo M. Como también puede verse en la Tabla IV.8, el tratamiento con AIA/DDC provoca una reducción dosis-dependiente en el grado de saturación de la enzima (holoenzima/ apoenzima). Esta disminución fue del 10; 40 y 42% para los grupos L, M y H, respectivamente, cuando los valores medios fueron comparados con los del control. La pérdida del grado de saturación del hemo observada en los dos grupos, M y H es estadísticamente significativa cuando se compara tanto con el C como con el grupo L Tabla IV.8. Síntesis de quinurenina generada por la triptófano pirrolasa (TRPp) en presencia o ausencia de hemo exógeno. Holoenzima TRPp total Apoenzima Holoenzima/ (µmol quinurenina (µmol quinurenina (µmol quinurenina apoenzima formada/g hígado) formada/g hígado) formada/g hígado) (unidades) 3,07 ± 0,14 5,51 ± 1,02 2,44 ± 0,89 1,25 ± 0,18 3,29 ± 0,19 6,17 ± 0,67 2,87 ± 0,47 1,14 ± 0,15 4,04 ± 0,69* 9,48 ± 1,41*,# 5,43 ± 1,37*,# 0,74 ± 0,14*,# 5,81 ± 1,04*,# 13,87 ± 1,54*,# 8,06 ± 1,31*,#,§ 0,72 ± 0,09*,# Tabla IV.8. Cada valor representa la media ± E.S. de seis animales. Las ratas fueron inyectadas y divididas en los grupos detallados en la Fig. 4.22. Enzima Total: actividad en presencia de hemo exógeno. Holoenzima: actividad en ausencia de hemo exógeno. Apoenzima: diferencia entre la enzima total y la holoenzima. Grado de saturación del hemo: relación entre holoenzima/apoenzima. Las actividades fueron expresadas como µmol quinurenina formada/g hígado fresco. Las comparaciones múltiples entre grupos fueron realizadas a través del Test de Tukey-Kramer. Otros detalles experimentales se describen en la sección 3 Materiales y Métodos. * P < 0.05 es significativamente diferente respecto a C. # § P < 0.05 es significativamente diferente respecto a L. P < 0.05 es significativamente diferente respecto a M. 173 Discusión 5. DISCUSIÓN 5. 1. MODELO DE PORFIRIA CRÓNICA POR HCB. Con el fin de caracterizar el modelo de porfiria experimental inducido por hexaclorobenceno (HCB) en ratas hembras de la cepa Wistar; de establecer si este xenobiótico generaba alteraciones en el metabolismo de la glucosa y si estas alteraciones eran debidas a variaciones en la capacidad de los tejidos para transportar glucosa, a interferencias debidas al estado oxidativo, a cambios en el estado hormonal o en el metabolismo del triptófano; se evaluaron cada una de las modificaciones producidas sobre dichos parámetros, causadas por la administración del xenobiótico en función de las semanas transcurridas desde el inicio de la intoxicación. ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO DE PORFIRIA CRÓNICA EXPERIMENTAL POR HCB? Como ya es sabido, en ratas, ratones, conejos, cobayos y aves (aunque los más utilizados son las ratas y los ratones) el HCB produce inhibición de la actividad de la uroporfirinógeno-decarboxilasa (URO-D) y la consiguiente alteración del camino biosintético del hemo, manifestada bioquímicamente con la sobreproducción de porfirinas (Billi de Catabbi et al., 2000; Billi de Catabbi et al., 2005). Así, la administración de HCB a ratas, constituye un muy buen modelo para mimetizar una porfiria cutanea tarda (PCT) humana (San Martín de Viale et al., 1970). La droga induce al citocromo P450 (CYP) (Wainstok de Calmanovici et al., 1984), que en su metabolismo oxidativo y debido a su lenta metabolización, desacopla la cadena de transporte de electrones microsomal (ETC) con producción de especies reactivas de oxígeno (ROS) que generan un inhibidor de la URO-D a partir de su sustrato, UROgen. (Figura 1.5, pág 37), (Ríos de Molina et al., 1980; Billi de Catabbi et al., 1997, 1999). Como consecuencia de este bloqueo enzimático, se produce una desregulación del camino metabólico del hemo, con sobreproducción de intermediarios (Cochón et al., 2005; San Martín de Viale, 2007). 175 Discusión La principal ventaja del modelo crónico de intoxicación utilizado en el presente trabajo es que, a diferencia de los protocolos de administración continua, involucra una mínima exposición al HCB, utilizando tiempos de drogado cortos y dosis más bajas. A pesar de la menor cantidad en la administración del fungicida, el desarrollo de la porfiria con este esquema de intoxicación fue logrado de manera similar al obtenido con el de tratamiento continuo, durante todo el procedimiento del estudio (Wainstok de Calmanovici et al., 1984). De hecho, las 3 ó 4 semanas transcurridas desde finalizado el drogado hasta el inicio fehaciente de la porfiria, se correspondieron de manera análoga en ambos esquemas, hecho que también concuerda con los resultados publicados por Mylchreest & Charbonneau (1997), donde observaron una acumulación de porfirinas hepáticas del mismo orden en tiempos similares, con aumentos significativos desde la 3ª semana, respecto al control. De acuerdo con los parámetros determinados en la sección resultados de esta Tesis, se puede concluir que este esquema discontinuado de intoxicación con HCB, genera claramente una porfiria establecida. La reducción de la actividad de URO-D tiene descensos significativos a partir de la 2ª semana desde el inicio del estudio, mientras que el acúmulo de porfirinas se hace notorio recién en la 4ª y 5ª semana, tiempos que refieren a incrementos significativos de las porfirinas urinarias y hepáticas, respectivamente. Así, se puede asegurar que este modelo utilizado representa muy bien una porfiria crónica experimental, del tipo PCT. La intoxicación por HCB fue eficaz y la acumulación de porfirinas una vez que se inicia, continúa en aumento durante varias semanas después de terminado el esquema de drogado (Billi de Catabbi et al., 2000a). Así, la masiva sobreproducción de porfirinas altamente carboxiladas (8- y 7- COOH) alcanzó aquí un 5000% de incremento para las porfirinas hepáticas y un 3700% de incremento para las porfirinas urinarias, como consecuencia del drástico bloqueo enzimático sobre la URO-D (95%), en cuanto a pérdida de la actividad, provocada por el xenobiótico HCB. La actividad URO-D de este trabajo se evaluó en el citosol hepático, utilizando UROgen III como sustrato y expresando la actividad como la cantidad de COPROgen III formado. El UROgen residual, los compuestos intermediarios de la decarboxilación (7COOH´gen, 6- COOH´gen 5-COOH´gen) y el producto final COPROgen, fueron separados por HPLC después de la oxidación en presencia de luz a sus correspondientes 176 Discusión porfirinas. Y aunque la formación de cada una de las porfirinas intermedias fue corroborada en los cromatogramas, no se incluyen en la expresión de la actividad UROD, ya que la actividad por la suma de 7- + 6- + 5-COOH´gen + COPROgen es menos sensible a la disminución de la actividad enzimática, que la expresada como cantidad de COPROgen formado (solo producto final). Esto se debe a que la primera etapa de decarboxilación del UROgen hacia el 7-COOH´gen es rápida, y que luego éste es muy lentamente decarboxilado hasta el producto final. ALTERACIONES PROVOCADAS SOBRE EL METABOLISMO DE LA GLUCOSA EN ESTE MODELO DE PCT EXPERIMENTAL En este área muy poco estudiada y casi carente de antecedentes, la presente Tesis muestra en animales porfíricos, importantes disturbios metabólicos tanto en los caminos anabólicos como catabólicos de la glucosa. Se observó un definido bloqueo en la gluconeogénesis, determinado en 3 de sus enzimas claves, que vieron sus actividades disminuidas en un 55% para la fosfoenolpiruvato carboxiquinasa (PEPCK), 50% para la piruvato carboxilasa (PC) y en un 42% para la glucosa-6-fosfatasa (G6Pasa). PEPCK y PC, las enzimas reguladoras de la vía, fueron afectadas de una manera dependiente del tiempo transcurrido y de la evolución hacia un estado porfírico, como consecuencia del tratamiento con HCB. Es interesante que la G6Pasa sea la única enzima gluconeogénica de las investigadas en esta Tesis, que se encuentra adosada a membrana, y cuya actividad no depende de una regulación alostérica ni hormonal (Hers & Hue; 1983). Además, los datos de estudios por spín label, sugieren que la molécula de HCB se incorpora entre las cadenas de ácidos grasos de los lípidos de las membranas (Kószó et al., 1982) y así es posible que el HCB, mediante la modificación del ambiente lipídico, afecte la actividad de la G6Pasa, y reduzca de este modo su actividad. Por otra parte, la cantidad de HCB que la membrana es capaz de absorber se completa velozmente, lo que explicaría porqué la actividad de G6Pasa se reduce tan rápidamente en el tiempo de estudio, y esta reducción se mantiene constante durante las semanas subsiguientes al tratamiento con HCB. 177 Discusión En refuerzo a estos disturbios, se determinó un descenso del 30% en los niveles plasmáticos de glucosa y una disminución del 50% en la captación de glucosa por el hígado. La captación fue también disminuida en timo y en bazo. Por otra parte, no se vio afectada la PK, enzima determinada para evaluar la glucólisis durante el tratamiento con HCB. Como se mostró en la sección resultados, en la Tabla IV.1, las 24 h de ayuno inducen fuertemente las actividades de las enzimas gluconeogénicas en la cepa de ratas Wistar utilizada, tal como se había informado previamente para la cepa Sprague-Dawley en un modelo de intoxicación con TCDD (Weber et al., 1991). Vale la pena mencionar que la disminución aquí hallada de la actividad PEPCK promovida por el HCB en la 6ta semana, supera la respuesta de inhibición de la misma utilizando la dosis máxima de TCDD descripta en el trabajo de Fan & Rozman (1995). Se sabe que el HCB y el TCDD (ambos xenobióticos policlorados) afectan la biosíntesis del hemo (Marks et al., 1982), por un mecanismo similar (Cochón et al., 2005). Los resultados aquí presentados añadirían a esta característica común, otra característica metabólica, ya que ambos productos químicos afectan la vía de los hidratos de carbono y su regulación, además de la ruta de síntesis del hemo. En un estudio sobre el efecto de la TCDD en el metabolismo de los hidratos de carbono, se sugirió que dado que la PK era parte de una vía glucolítica y que su actividad elevada estimula la glucólisis del PEP (mientras que una actividad reducida permite al piruvato entrar en el camino de la gluconeogénesis) sería posible que el TCDD inhibiera la gluconeogénesis por inducción de la actividad de PK (Weber et al., 1991). Basados en el paralelismo que en algunos aspectos se puede hacer entre el HCB y el TCDD, se podría haber esperado un comportamiento similar aplicable para ambos tóxicos. Sin embargo, en su conjunto, las dos enzimas no respondieron al tratamiento con HCB de acuerdo con el patrón de alteración esperado por los estudios con TCDD. Los resultados presentados demuestran claramente que la reducción inducida por HCB de la gluconeogénesis no está relacionada con una preponderancia de la glucólisis, ya que la actividad de la enzima glucolítica clave PK no se vio afectada en los animales aquí intoxicados. 178 Discusión Puesto que las enzimas gluconeogénicas, especialmente la actividad de PEPCK, depende de un mecanismo hormonal muy complejo, es posible que el HCB reduzca la gluconeogénesis a través de hormonas reguladoras o a través del TRP y su metabolitos aumentados en este modelo y en el de TCDD (Unkila et al., 1995; Llambías et al., 2003). Se sabe que los metabolitos del TRP, alteran la gluconeogénesis en este nivel enzimático (Veneziale et al, 1967; Correia & Lunetta, 1989) y por otra parte, es posible que puedan contribuir al descenso de PEPCK el estrés oxidativo que provoca el HCB, como se discute más adelante. Por otra parte, los contenidos de glucosa plasmática disminuidos y los de glucógeno hepático aumentado, serían resultantes de la reducción de la gluconeogénesis junto a un almacenamiento incrementado de glucosa y a una menor liberación de glucosa de sus depósitos (Esquema Integratorio 1, pág. 184). Este trastorno generalizado en el metabolismo de los hidratos de carbono, conduce a los hepatocitos porfíricos a tener un menor nivel de glucosa libre disponible, y dado que la glucosa reprime la actividad ALA-S (Tschudy et al., 1964), sus bajos contenidos llevarían a la de-represión de esta enzima, lo que favorece su inducción, hecho que se demostró para el HCB (Wainstok de Calmanovici et al., 1984). Esta “derepresión” se sumaría a la que produce la depleción de hemo inducida por el tratamiento con la droga HCB. En esta porfiria se postula así una doble “de-represión” de ALA-S, una mediada por la disminución del pool de hemo y otra por la disminución de la glucosa disponible (Esquemas Integratorio 2. 194). Esta condición de glucosa endógena deprimida también nos ayuda a entender porqué las altas dosis de glucosa exógena (en las dietas) suprimirían el efecto porfirinogénico del HCB (Ivanov et al., 1976). Los resultados contribuyen a la comprensión del efecto protector y modulador que las dietas ricas en hidratos de carbono tienen en las porfirias hepáticas (Kappas et al., 1995). Otros estudios en conejos intoxicados, demostraron que una dieta con alto contenido de grasas y proteínas incrementan el efecto tóxico del HCB y que por el contrario, las dietas altas en carbohidratos suprimen al mismo (Ivanov et al., 1986). 179 Discusión VARIACIÓN EN LA CAPTACIÓN Y TRANSPORTE DE GLUCOSA POR DIVERSOS TEJIDOS DE RATAS TRATADAS CON HCB El transporte de la glucosa juega un papel vital en el suministro de energía a la célula, así como en la regulación del metabolismo celular. En el tejido adiposo, por ejemplo, este transporte controla la relación entre la lipólisis y la lipogénesis, y en el hepatocito, el metabolismo de la glucosa, el glucógeno y en la síntesis de ácidos grasos. Los animales tratados con HCB mostraron una menor captación de glucosa por el hígado en comparación a los controles, con descensos en todas las semanas estudiadas. La disminución observada a partir de la 3ª semana fue estadísticamente significativa y alcanza un 50% en el máximo tiempo estudiado, 9ª semana, respecto al control. Aquí se demostró que en ratas hembras de la cepa Wistar tratadas con HCB, el transporte de glucosa en el hígado, bazo y el timo disminuye, mientras que aumenta solo en el tejido adiposo. Estas observaciones sugieren que los posibles cambios en el metabolismo de la glucosa inducidos por HCB no se limitan a un tejido particular, sino que afectan vías metabólicas activas de diversos órganos y tejidos, tal como la gluconeogénesis, glucógenolisis y glucogenogénesis, en acuerdo con lo enunciado en el trabajo de Weber et al., (1987) para ratas intoxicadas con TCDD. La reducción de la absorción de glucosa parece ser un hecho común a la acción de compuestos clorados. De hecho se informó que en la preincubación de células disociadas de corteza cerebral de ratas tratadas con lindano, disminuyó el transporte de glucosa (Pulido et al., 1990) y que el dicloro-difenil-tricloroetano y el diclorodifenildicloro-etileno inhiben el transporte de glucosa activo en el intestino delgado de ratas tratadas (Iturri & Wolff, 1982). Se han corroborado diferencias de comportamiento entre tejido adiposo y otros tejidos en la captación de glucosa en ratas intoxicadas con TCDD, de acuerdo con lo informado por Gorski et al., (1988) o por Liu & Matsumura (1995) sobre la síntesis in vivo de los ácidos grasos. 180 Discusión En resultados obtenidos por Mylchreest & Charbonneau (1997) se evaluó la distribución del HCB en tejido adiposo y hepático, luego de 24 días después de suspendida la administración del 14C-HCB a ratas tratadas con el mismo protocolo que el presentado aquí en esta Tesis, y la persistencia del tóxico hallada fue del 70% y 50% respectivamente para ambos tejidos. Dichos resultados sugieren que las alteraciones encontradas en el presente trabajo se deben a la presencia física de la droga, más que a una posible respuesta adaptativa del tejido al exceso de la misma. La vida media del HCB se ha estimado en 57 días después de un proceso acumulativo de dosis de 840 mg/kg p.c. y 150 días después de una dosis acumulada de 5.250 mg/kg p.c. (KuiperGoodman et al., 1977; Koss et al., 1978). El aumento de la captación de glucosa en el tejido adiposo sería una de las causas de la reducción en la concentración de la glucosa libre en sangre, y podría explicar el aumento del metabolismo de los ácidos grasos en estas células, que conduce a incrementar los depósitos de grasa, observación característica en las intoxicaciones con HCB (Böger et al., 1979; Courtney, 1979; Kószó et al., 1982) CAMBIOS EN EL METABOLISMO DEL GLUCÓGENO DEBIDOS A LA ACCIÓN DEL HCB Respecto al metabolismo del glucógeno, se observó un importante bloqueo en la glucógenolisis, es decir de la liberación de glucosa de sus depósitos, llevada a cabo por la glucógeno fosforilasa (GP) que vio su actividad dañada en un 75% como consecuencia del tratamiento porfirinogénico con HCB. A su vez ese tratamiento de los animales provocó una estimulación de la síntesis del glucógeno, ya que se observó un incremento en la actividad de la glucógeno sintetasa (GS) del 300 % en los animales porfíricos. Todo esto da cuenta del incremento observado en los niveles hepáticos de glucógeno en estos animales, que fueron 3 veces superiores al de los animales control. Los resultados presentados a lo largo de esta Tesis, muestran que el contenido de glucógeno hepático aumenta después del tratamiento con HCB. Christian et al., (1986) también informaron un incremento del contenido de glucógeno hepático como consecuencia de un tratamiento con otro xenobiótico tan relacionado al HCB, como el 181 Discusión TCDD. En estudios hepáticos ultraestructurales realizados en ratas tratadas con HCB, se encontró que productos de almacenamiento, que muy probablemente se trataría de glucógeno, remplazaban amplias zonas del retículo endoplasmático liso (Mollenhauer et al., 1975). También han sido observadas extensas áreas del citoplasma de la zona intermedia de los hepatocitos, que contienen numerosas partículas de glucógeno, mientras que habría un bajo número de estas partículas en la zona centrilobular de los mismos hepatocitos (Böger et al., 1979). Sin embargo y contrariamente, Correia & Lunetta (1989) encontraron en su trabajo, una menor cantidad de glucógeno en el hígado de ratas porfíricas tratadas con fenobarbital y un análogo de la dietoxicarbonil-1,4-dihidrocolidina (DDC). Otra disminución del glucógeno se detectó también en ratas después de 8 y 16 semanas de tratamiento con TCDD (Weber et al., 1983) mientras que descensos similares fueron observados en ratones intoxicados con TCDD (Vos et al., 1974). Se informó además, que la administración de bifenilos policlorados reduce la cantidad de glucógeno en ratones (Nishizumi, 1970) y ratas (Kasza et al., 1976). Sobre la base de estos resultados contrapuestos, se puede presumir que no hay una respuesta claramente definida en los niveles de glucógeno por el tratamiento con diferentes compuestos clorados, aunque todos ellos posean capacidad porfirinogénica. Los resultados aquí expuestos muestran que, desde las primeras etapas del tratamiento, hubo un incremento en los niveles de glucógeno, probablemente debido al aumento de la actividad de la GS, observado en las primeras semanas de la administración del xenobiótico y a una menor degradación a través de la actividad disminuida de la GP, que contribuyen en su conjunto, al aumento de los niveles de este polisacárido observado en ratas tratadas bajo el presente esquema de intoxicación con HCB. Para analizar cómo la perturbación del metabolismo del glucógeno y la glucosa influencian el desarrollo de esta porfiria, dos hechos deben ser tenidos en cuenta. En primer lugar, que la glucosa reprime la inducción del ALA-S y en segundo lugar, que el HCB altera el metabolismo del glucógeno, como se demuestra en esta Tesis, generando una mayor acumulación de éste, debido a un desequilibrio entre la biosíntesis (aumento) 182 Discusión y las enzimas de degradación de glucógeno (disminución), lo que conduciría en conjunto, a una reducción de la glucosa hepática disponible. Los niveles reducidos de glucosa, serían entonces consecuencia de una disminución de la gluconeogénesis, junto con un almacenamiento de glucosa aumentado, que no afecta la glucólisis (Esquema Integratorio 1, pág. 184). Este trastorno en el metabolismo de los hidratos de carbono conduce al hepatocito porfírico a tener un menor nivel de glucosa libre. Dado que la glucosa reprime la inducción de el ALA-S (Tschudy et al., 1964; Giger & Meyer 1981; Schoenfeld et al., 1985), y que existe una reducción en la glucosa disponible durante el tratamiento como consecuencia de los disturbios en su metabolismo, su almacenamiento y transporte; el ALA-S se de-reprime sumándose de forma deletérea, a la inducción que esta enzima presenta por el tratamiento con HCB (Wainstok et al., 1984). Por lo tanto, todo lo antedicho contribuiría a describir el cuadro bioquímico de esta porfiria, que constituiría un "efecto glucosa negativo" sobre la enzima clave ALA-S. También explicaría el efecto beneficioso que la administración exógena de glucosa tiene en las porfirias hepáticas. LAS CAUSAS DEL DESCENSO DE LA PEPCK Y LA GP: INTERFERENCIAS EN EL SISTEMA REDOX Teniendo en cuenta que el HCB puede actuar como una droga soluble en lípidos que se une a los citocromos, desacoplando así la cadena de transporte de electrones (ETC) y consecuentemente favoreciendo la producción de ROS (Ferioli et al., 1984); y que esas ROS son capaces de oxidar lípidos, proteínas, hidratos de carbono y ácidos nucleicos (Figura 1.5, pág 37), inactivando funciones celulares claves (Halliwell & Gutteridge, 1999); se estudió en ratas tratadas con HCB, la peroxidación lipídica en hígados a través de la formación de TBARS y la QL espontanea en orinas. Así se pudieron evaluar algunos parámetros de estrés oxidativo en este modelo experimental para relacionarlos con las alteraciones producidas en el metabolismo de los hidratos de carbono. 183 Discusión Esquema Integratorio 1: El presente esquema muestra los disturbios que provoca la administración de HCB en el metabolismo hepático de la glucosa y su transporte; y en el “status” hormonal de GC e insulina, resultante de alteraciones provocadas en su síntesis adrenal y pancreática respectivamente. SNC: sistema nervioso central; ACTH: hormona adenocorticotrófica; CYP: citocromo-P450; PTH: hormona paratiroidea; GR: receptor de glucocorticoides; UGT: UDP-glucuronosil-transferasa; IDE: enzima degradadora de insulina; flechas al costado de los compuestos indican incrementos o decrementos en niveles o actividad; (≈): no hay variaciones significativas. Puede verse el descenso de glucosa como consecuencia del bloqueo gluconeogénico (PC, PEPCK y G6Pasa disminuidas) y glucógenolitico (GP disminuída), del aumento de su depósito como glucógeno (GS incrementada), de un menor transporte; todo ello revelado en niveles plasmáticos de glucosa reducidos. Se esquematiza la disrupción hormonal que provoca HCB en la síntesis adrenal de los GC a nivel de 11-/21-hidroxilasas CYP (hemo) dependientes (disminuidas) a través de su efecto en el camino del hemo, así como en la degradación hepática (UGT) aumentada. Ambos efectos llevan a la reducción de niveles sanguíneos de corticosterona. El HCB provoca una caída en los niveles plasmáticos de insulina, debido posiblemente a una actividad incrementada de IDE hepática estimulada por Ca ++ como consecuencia del efecto del HCB en ese metabolismo, no estando significativamente afectada la secreción pancreática. 184 Discusión Las TBARS medidas, aumentaron como resultado del tratamiento con el fungicida en todos los tiempos ensayados, tanto en homogenato como en la fracción microsomal hepática. Los valores obtenidos en ratas tratadas, fueron estadísticamente superiores en cada una de las semanas estudiadas. Las mediciones de QL urinaria total diaria, muestran que este parámetro crece en función del tiempo de tratamiento transcurrido, siendo los aumentos estadísticamente significativos desde las primeras semanas. En este campo, los resultados mostraron importantes alteraciones en dicho metabolismo, con un definido estrés oxidativo y grandes incrementos en la producción de ROS. Así se documentaron aumentos del 400% para la peroxidación lipídica en la fracción hepática microsomal y de más del 300% para la quimioluminiscencia urinaria espontánea, en ratas porfíricas por HCB. El deterioro de la gluconeogénesis (especialmente en la actividad de PEPCK) y la variación asociada en los niveles de glucosa causados por el tratamiento HCB, podrían ser consecuencia del estrés oxidativo producido por el fungicida. Los aumentos en las TBARS y QL aquí reportados reflejan el estrés oxidativo y la producción de radicales libres causados por la lenta metabolización del HCB (Ferioli et al., 1984). Estos resultados concuerdan con los informes anteriores realizados en nuestro laboratorio (Billi de Catabbi et al., 1997; Ríos de Molina et al., 1998). Teniendo en cuenta que la disminución de la PEPCK y la generación de radicales libres causados por el fungicida porfirinogénico (HCB) se producen en una forma más o menos sincronizada y que ambos se hacen evidentes en la segunda semana, podría ser que la reducción de la PEPCK fuese debida también al accionar de estas especies reactivas de oxígeno (ROS) (Esquema Integratorio 2, pág 194) Este efecto puede ejercerse a nivel del DNA, afectando la expresión del gen de la PEPCK y reduciendo así los niveles de sus mRNA, como se ha informado en la intoxicación con TCDD (Stahl et al., 1993) o actuar directamente sobre la actividad enzimática de la proteína, como se publicó en el caso de otras proteínas (Wolff & Dean, 1986). 185 Discusión Habría que considerar que el estrés oxidativo juega un papel importante en la regulación celular, modulando a través de radicales libres, las actividades de las quinasas y las fosfatasas, que actúan sobre los factores de transcripción (Guyton et al., 1996). Por otra parte, el factor nuclear NF-1, implicado en la transcripción de la PEPCK (Hanson & Reshef, 1997) parece ser particularmente sensible al estrés oxidativo (Morel & Barouki, 1998). El estrés oxidativo producido por el HCB puede modificar además el DNA y por lo general producir 8-OH-dG (Horváth et al. 2001), lo que provoca efectos nocivos (Cheng et al., 1992) que afectan el proceso de transcripción. Se podría postular así, que los radicales libres producidos en exceso por el estrés oxidativo proveniente de la intoxicación con HCB, podrían reducir la PEPCK, tal vez alterando su expresión genética, ya sea directamente sobre el DNA, o indirectamente sobre factores de transcripción a través fosforilaciones quinasa-dependientes. La disminución de GP podría deberse a la acción deletérea de las ROS, aquí incrementadas, sobre la proteína enzimática como se discute en detalle más abajo (pag 201). Ello atendiendo a la secuencia aminoacídica de GP que tiene en su sitio activo amino ácidos susceptibles de oxidación y a que se sabe que ROS dañan a las proteínas (Halliwell & Gutteridge, 1999). ALTERACIONES DEL ESTADO HORMONAL. ESTUDIOS SOBRE GLUCOCORTICOIDES E INSULINA En la presente Tesis se informó que el tratamiento con HCB ocasiona notables daños en ambas hormonas regulatorias del metabolismo hidrocarbonado. Un disturbio sumamente importante fue el hallado tanto en los niveles plasmáticos de glucocorticoides (GC) que se vieron drásticamente reducidos (60%), como en el número de receptores hepáticos de GC que experimentaron una baja del (50-60%) manteniendo su afinidad, así como también en la producción adrenal de GC que estuvo notablemente deprimida (51%) tanto en presencia como en ausencia de ACTH. 186 Discusión Existen diversos parámetros que son determinantes para establecer el nivel de acción a nivel biológico de los GC. Sin lugar a dudas, los niveles plasmáticos de GC, son un punto importante a tener en cuenta, pero el número y la afinidad de los receptores hepáticos de GC también son aspectos relevantes, particularmente cuando se estudia el efecto de un contaminante como el HCB en el metabolismo de la glucosa y los daños producidos en el hígado por este xenobiótico. Este fungicida induce una disminución significativa en la corticosterona plasmática (CORT), de acuerdo con los resultados reportados por Foster et al., (1995) para ratas Sprague-Dawley ovariectomizadas. Al respecto, este mismo equipo de trabajo informó que la mayor disminución en la CORT se produce en la dosis más baja ensayada (1mg HCB/kg/día durante 30 días en el agua de bebida). Resultados similares mostraron una alteración de los niveles de CORT para otro plaguicida clorado, el TCDD, que promueve un aumento en los niveles de GC tan tempranos como a 4 días desde el inicio del tratamiento (Gorski et al; 1988) Sin embargo, la CORT circulante disminuye antes de que sea detectado un deterioro significativo de la capacidad de biosíntesis adrenal, lo que sugiere que otros factores diferentes de la biosíntesis adrenal podrían estar involucrados. En un artículo anterior, San Martín de Viale et al. (1976) reportaron un aumento en la actividad hepática de la UDP-glucuronosil-transferasa (UGT) en ratas porfíricas por HCB. Así, es posible especular que una mayor tasa de degradación hormonal hepática podría ser la responsable de la disminución de la CORT a través de la formación de conjugados con UDP-ácido glucurónico (UDP-GA) por la acción de UGT (Esquemas Integratorios 1 y 2, pág 184, 194). Otra explicación involucra la globulina transportadora de corticoides (CBG). Esta proteína se une con los GC con alta afinidad y por lo tanto podría regular la disponibilidad de la CORT. La unión de CORT a CBG puede servir como un buffer tisular contra los efectos potencialmente perjudiciales de la CORT elevada mediante la regulación de la disponibilidad de la hormona libre a los tejidos target, o alterando las tasas de clearence de la CORT (Breuner & Orchinik, 2002; Yding Andersen, 2002). Por otra parte, un comportamiento similar se ha descrito para la hormona tiroidea en ratas tratadas con HCB, en las que el nivel de la T4 en suero disminuye 187 Discusión como consecuencia de un aumento en la degradación provocado por el incremento de la deshalogenación de la T4 hepática (Kleiman de Pisarev et al., 1990). Sin embargo, a mayores tiempos de intoxicación con HCB (más allá de 4 semanas) la disminución en el nivel de CORT podría atribuirse tanto a la degradación hepática como a una función adrenal alterada. En cuanto a la biosíntesis adrenal disminuida por el tratamiento con HCB, la disponibilidad del colesterol, precursor biosintético de las hormonas esteroideas, no parece ser responsable de dicha disminución. En efecto, en ratones, se ha informado que la concentración de colesterol en plasma se incrementa por el tratamiento con HCB, así como por otras drogas porfirinogénicas tales como la alil-isopropilacetamida (AIA) y la griseofulvina (Wada et al., 1969). Este estudio muestra también que el HCB provoca una disminución de la capacidad biosintética de la glándula adrenal, probablemente debido a la falla de una o más enzimas esteroidogénicas (CYP C21-hidroxilasa y/o C11-hidroxilasa) sin modificar el peso de la glándula (Esquema Integratorio 1, pág 184). En este sentido, vale la pena mencionar que los bifenilos policlorados, que comparten con HCB la característica común de ser compuestos clorados porfirinogénicos, producen una disminución en la CYP C21-hidroxilasa suprarrenal, cuando se administra a los cobayos (Goldman & Yawetz, 1992). Esta enzima tiene un papel clave en la biosíntesis de GC. El efecto de HCB en la biosíntesis adrenal podría ser la respuesta de esta glándula a la acumulación del fungicida. De hecho Foster et al., (1993), informó niveles residuales de HCB en la glándula adrenal, superiores a los detectados en hígado y en suero. Además de los efectos sobre CORT, el HCB también promueve una disminución temprana e importante en el número de GR hepáticos (50-60%) sin afectar su constante de disociación. Estos resultados coinciden con los descritos previamente en ratones (Stohs et al., 1990) y en ratas hembras Sprague Dawley, (Sunahara et al., 1989) tratadas con TCDD, droga relacionada con el HCB. Después del tratamiento de un día, la TCDD también reduce la capacidad de unión de los GR hepáticos (38-50%), sin que ello afecte el Kdapp (Sunahara et al, 1989; Stohs et al., 1990). Por otra parte, en estos documentos, los valores de Bmax observados fueron de 300 (fmol/mg) en ratones HRS/J y de 400 (fmol / mg) en ratas Sprague-Dawley hembras. El número de GR hepáticos concuerda con lo aquí informado para ratas Wistar hembras (500 fmol / mg). Como en los GR de 188 Discusión hígados de ratones (2 nM) y ratas Sprague-Dawley (0,5 nM), los valores de Kdapp para las ratas Wistar hembras fueron de alrededor de 3 nM. Teniendo en cuenta que la respuesta temprana de la CORT a la intoxicación HCB precede al efecto sobre la actividad PEPCK hepática regulada por GC, es posible especular que la disminución de la enzima gluconeogénica podría ser una consecuencia de la disrupción hormonal temprana causada por HCB sobre los niveles de CORT y sus receptores. Por lo tanto, en esta porfiria experimental el efecto negativo que ejerce el HCB sobre la PEPCK a través de los GC y sus receptores, podría sumarse al efecto que tienen las ROS sobre esta enzima como se detalló más arriba (Esquema Integratorio 2, pág 194). En lo que respecta a la insulina los niveles plasmáticos de esta hormona se vieron marcadamente disminuidos (65%). Sin embargo, la secreción de insulina por el páncreas fue normal y no se mostró afectada en islotes de Langerhans perfundidos y estimulados con glucosa tanto en las semanas 3ª como 6ª del estudio (Esquema Integratorio 1, pág 184). Uniendo esto último con los datos del comportamiento de las enzimas del metabolismo de la glucosa, se demuestra que tanto la tasa de gluconeogénesis como los niveles plasmáticos de insulina son deteriorados ante el tratamiento con HCB. Estos resultados no concuerdan con los esperados, dado el conocido efecto regulador que tiene la insulina sobre la gluconeogénesis. Los altos niveles de insulina debieran inhibir la gluconeogénesis (Granner & Andreone, 1985). Sin embargo ambos parámetros en este estudio decrecen. El hecho de que el nivel normal de la insulina en plasma fue menor en los animales tratados con HCB que en controles y que el patrón de secreción de insulina en páncreas sin embargo es similar a los controles, sugiere que no hay alteración primaria en el mecanismo de secreción de la insulina causada por el tratamiento. Por el contrario los cambios inducidos por HCB en la homeostasis de la insulina serían una respuesta compensatoria del organismo para estimular la gluconeogenesis. Una respuesta similar fue informada para estos parámetros en un modelo de TCDD, droga que está mecanísticamente relacionada con el HCB (Gorski & Rozman, 1987). Para resolver esta 189 Discusión aparente paradoja, en su trabajo Weber et al. (1991) han propuesto que los cambios en las actividades enzimáticas gluconeogénicas preceden a los cambios hormonales. Considerando que la insulina deprime la PEPCK en el hígado, los disturbios que se promueven por el HCB sobre el estatus de esta hormona, no serían la causa primaria de la reducción de la actividad de PEPCK observada en animales tratados con HCB. Por el contrario los cambios inducidos por HCB en la homeostasis de la insulina serían, como se dijo, una respuesta compensatoria del organismo para estimular la gluconeogénesis. La disminución de insulina observada en plasma podría deberse quizás a un incremento en la degradación hepática de la hormona proteica, más que a la formación de insulina glicosilada teniendo en cuenta al bajo tenor de glucosa hallado. A este respecto, se ha informado que la hiperglucemia es responsable de la glucosilación de la insulina (Abdel-Wahab et al., 1996) Con respecto a la degradación de la insulina, se ha informado que es un proceso secuencial de etapas múltiples, que involucra endocitosis, clivajes, reducción de puentes disulfuro y multiples proteolisis, siendo la enzima que degrada la insulina (IDE) el mecanismo enzimático primario para iniciar la degradación celular de la misma (Duckworth et al., 1998). Esta IDE hepática es una proteasa activada por Ca++ (Ryan et al., 1985). Andrews et al., (1988) observaron además, que el HCB afecta el metabolismo del calcio promoviendo su acumulación, mediante la 1,25-diOH-vitamina D3 y la hormona paratiroidea (PHT), cuyos niveles están aumentados significativamente en ratas intoxicadas con HCB. Con esos datos podría hipotetizarse, que los niveles disminuidos de insulina plasmática del presente trabajo podrían ser reflejo de una degradación incrementada de esta hormona, como consecuencia de la activación de IDE por concentraciones incrementadas de Ca++, promovidas por el pesticida clorado HCB (Esquema Integrador 1, pág 184). La perturbación que el HCB produce en el estado hormonal es un proceso temprano, no sólo para la CORT (Foster et al., 1995), sino también para la T4 (Kleiman de Pisarev et al., 1990). El efecto sobre los niveles plasmáticos se alcanza después de dos semanas de finalizada la intoxicación, es decir, antes del disturbio general que provoca 190 Discusión el HCB en el camino del hemo. De hecho, la alteración en la biosíntesis del hemo es evidente recién a partir de la 4ª semana cuando el efecto es determinado por el aumento de las porfirinas urinarias marcadoras del inicio y el desarrollo de porfiria, como también se ha descripto en otros trabajos con ratas Wistar (Kleiman de Pisarev et al., 1990; Billi de Catabbi et al.; 2000) donde una disminución significativa de URO-D también se observó en paralelo a los mismos tiempos. En consecuencia es interesante destacar que los resultados aquí presentados, trabajando con la misma cepa de ratas y bajo las mismas condiciones experimentales, podrían indicar que el nivel de CORT es un biomarcador más sensible para la determinación de la intoxicación por HCB, que el aumento en la excreción de porfirinas o la disminución de la actividad enzimática de URO-D. El papel de los glucocorticoides y de sus receptores en el bloqueo de la gluconeogénesis, fue así estudiado en el modelo de PCT por HCB. Este estudio se realizó en el hígado de animales previamente adrenalectomizados y porfíricos (pasadas las 8 semanas desde el tratamiento) y en relación con el efecto que el HCB tiene sobre la actividad de la enzima PEPCK. Los resultados muestran que el compuesto clorado HCB interfiere severamente con el metabolismo de los GC, y con su acción mediada por los receptores. Estas alteraciones estarían relacionadas con la disminución de la PEPCK. Por lo tanto, la reducción de los niveles plasmáticos de CORT, de su síntesis adrenal y la merma del número de receptores, contribuirían a la disminución de esta enzima y al bloqueo gluconeogénico relacionado que el tóxico provoca. En resumen, esta parte del trabajo, muestra que el xenobiótico HCB, además de producir graves disturbios en la vía del hemo dando lugar a una porfiria, promueve una alteración hormonal de GC temprana e importante que resulta en un bloqueo de la gluconeogénesis. De hecho, el xenobiótico provoca un descenso drástico en la síntesis adrenal y en el nivel circulante de CORT, así como en el número de sus receptores hepáticos. Esta alteración hormonal podría contribuir al control negativo de la síntesis de glucosa a través de la regulación de la PEPCK, modulando la porfiria (Esquema Integratorio 2, pág 194). 191 Discusión Además, los disturbios promovidos por el HCB, también contribuyen a aumentar el conocimiento sobre el desarreglo hormonal producido por este xenobiótico de alta persistencia. PERTURBACIONES EN EL METABOLISMO DEL TRIPTÓFANO EN ESTE MODELO DE PCT EXPERIMENTAL POR HCB Puesto que ya se ha demostrado que la administración de TRP resulta en hipoglucemia y que el TRP y sus metabolitos alteran la gluconeogénesis hepática (Smith & Pogson, 1977), otro posible agente responsable de la disminución de la gluconeogénesis podría ser dicho compuesto. Sin embargo, la cinética de alteración en las actividades de las enzimas gluconeogénicas (PEPCK, PC y G6Pasa) y la del TRP no son coincidentes. El aumento de TRP sólo fue observado en las últimas semanas del tratamiento con HCB y podría ser debido a la marcada desregulación en la vía metabólica del hemo, observada a estos tiempos como consecuencia de una disminución drástica y sostenida en la actividad URO-D. Este hecho podría causar una disminución en los niveles de hemo y esa disminución provocaría una reducción en la actividad de TRP pirrolasa, ya que es una enzima cuyo grupo prostético es el hemo. Sabiendo que la actividad de la TRPp es el paso limitante que regula la disponibilidad fisiológica general del TRP, su descenso podría generar un aumento de tal aminoácido. A este respecto, Weber et al. (1992) encontraron una fuerte disminución de la actividad TRPp en el hígado de las ratas tratadas con TCDD, con un aumento concomitante de los niveles plasmáticos de TRP y una disminución de la actividad PEPCK. Por lo tanto, si el TRP contribuye a la disminución de la PEPCK, de alguna manera estaría involucrado en las fases más tardías de la intoxicación con el fungicida. Así, el TRP añadiría su efecto a la acción ejercida por el resto de los factores antes mencionados. 192 Discusión CONCLUSIÓN PARA EL MODELO DE PORFIRIA HEPÁTICA CRÓNICA POR HCB El HCB bloquea la síntesis de glucosa, la liberación de glucosa desde sus depósitos hepáticos, el transporte de glucosa al hígado y aumenta el almacenamiento de glucosa como glucógeno. Todos estos disturbios contribuyen y llevan a una menor disponibilidad de glucosa del hepatocito y a una menor concentración de glucosa plasmática. Las posibles causas del descenso en su neosíntesis, podrían ser los múltiples efectos negativos promovidos por el HCB sobre la PEPCK y ejercidos: 1) a través de los GC y sus receptores (debido a la falta de estímulo por los niveles deprimidos en ambos parámetros); 2) a través de ROS (debido al efecto deletéreo ejercido por su incremento); 3) en menor medida a través de TRP (debido al efecto inhibitorio del TRP aumentado). El HCB podría también perturbar directamente la neosíntesis actuando sobre la G6Pasa, dado que esta enzima está asociada a membrana y el HCB se incorpora entre las cadenas de ácidos grasos de las membranas lipídicas. Se postula que la disminución provocada por el HCB sobre la capacidad biosintética de los GC de la glándula adrenal, podría ser debido a una falla en alguna de las enzimas esteroideogénicas, como la CYP C21-hidroxilasa o C11-hidroxilasa, claves en la biosíntesis de los GC. Disturbio que estaría provocado por el HCB, que se acumula en glándula adrenal más que en hígado. La respuesta más temprana de los GC respecto a las porfirinas urinarias y a la URO-D, los constituye como biomarcadores más sensibles que los del camino del hemo, preferentemente a nivel de corticosterona en plasma (CORT), para determinar una intoxicación por HCB. Con respecto a la insulina, los disturbios provocados por el HCB en el status de esta hormona, sugerirían que no son la causa primaria de la actividad reducida de la PEPCK. Por el contrario los cambios inducidos por HCB en la homeostasis de la insulina, serían una respuesta compensatoria del organismo para estimular la gluconeogenesis y se deberían posiblemente a un incremento de la enzima que degrada insulina como consecuencia de la activación de IDE por concentraciones incrementadas de Ca++, promovidas por el pesticida clorado HCB. 193 Discusión Esquema Integratorio 2: Esquema que muestra las acciones directas e indirectas del tratamiento con HCB en distintas rutas metabólicas (hemo, hidratos de carbono, TRP, GC, cadena de transporte de electrones y producción de ROS). Muestra la doble de-represión del ALA-S por la disminución de hemo y de la glucosa y la triple contribución de ROS, TRP y GC al descenso de PEPCK. ETC: cadena de transporte de electrones; UGT: UDP-glucuronosil-transferasa; CYP: citocromo-P450; ROS: especies reactivas de oxígeno; TRP: triptófano; TRPp: TRP pirrolasa; GC: glucocorticoides; flechas al costado de los compuestos indican incrementos o decrementos en niveles o actividad; (≈): no hay variaciones significativas. El HCB se une al CYP, desacopla la ETC de la actividad de monooxigenasa y favorece la producción de ROS que por un lado generan al inhibidor de la URO-D, por oxidación del URO´gen, inhibiendo así el camino del hemo (pool de hemo reducido) y de-reprimiendo a la ALA-S produciendo porfiria. Por otro lado las ROS contribuyen al descenso de PEPCK, a la peroxidación de lípidos y a la dismuinución de GP. El hemo reducido lleva por un lado a una TRPp disminuida y al aumento de TRP que a su vez contribuye al descenso de PEPCK. Por otro lado esa reducción en el hemo lleva a CYP reducido y a una síntesis disminuida de GC-CYP dependiente. A esta disminución de GC se suma el aumento de su degradación que produce la UGT estimulada por HCB. Los GC disminuidos contribuyen al descenso de PEPCK. El descenso de glucosa por bloqueo de la PEPCK, PC y G6Pasa, el bloqueo glucógenolitico (GP) y el aumento de la glucogenogénesis (GS) llevan a la de-represión de la ALA-S que se suma a la derepresión provocada en esta enzima por la caída de hemo. 194 Discusión Se sugiere que la PEPCK podría estar reducida por acción de las ROS incrementadas, alterando quizás la transcripción génica de la enzima, actuando ya sea directamente sobre el DNA o indirectamente sobre factores de transcripción a través de fosforilaciones dependientes de kinasas. Respecto al acúmulo de TRP podría ser debido a una baja actividad de TRPp (primer paso de la vía quinurenérgica), ya que la TRPp es una enzima hémica y la síntesis de hemo está sumamente deteriorada en animales porfíricos por HCB, debido al drástico bloqueo (95%) que la droga produce sobre la URO-D y que lleva a la masiva sobreproducción de porfirinas hepáticas altamente carboxiladas y al agotamiento de los depósitos de hemo. Dado que la glucosa reprime el ALA-S, los niveles bajos de glucosa aquí reportados, modularían en consecuencia a esta porfiria, exacerbándola. El decremento de la glucosa ejercería un efecto “de-represor” sobre la sintetasa (ALA-S), enzima regulatoria del camino del hemo, y esta “de-represión” se sumaría a la que produce el agotamiento del hemo inducido por el tratamiento con la droga HCB. En esta porfiria se postula entonces, una doble “de-represion” de ALA-S, una mediada por la depleción de hemo y otra por la disminución de la glucosa (Esquema Integratorio 2). Estos resultados contribuyen a comprender el efecto terapéutico, preventivo y modulador del tratamiento de las porfirias hepáticas humanas y experimentales con glucosa y/o dietas ricas en carbohidratos. 195 Discusión 5.2. MODELO DE PORFIRIA HEPÁTICA AGUDA POR AIA/DDC ¿CÓMO SE DESREGULA EL CAMINO DEL HEMO EN ESTE MODELO EXPERIMENTAL DE PORFIRIA HEPÁTICA AGUDA? El modelo de porfiria hepática inducido por AIA y DDC que se discute en esta parte de la Tesis, demostró ser capaz de promover una clara porfiria aguda. Esto se evidencia en la alteración de la biosíntesis del hemo, con la característica acumulación de sus precursores: ALA, mostrando un incremento del 280% y PBG uno de 5000% en cuanto a contenidos hepáticos. Todo ello acompañado de una definida desregulación del camino del hemo, evidenciada por un aumento del 300% de su enzima clave y regulatoria, ALA-S. Esta desregulación fue consecuencia de dos acciones paralelas, por un lado, un bloqueo del 50% producido por el DDC sobre la actividad de la enzima FQ, que es la encargada de insertar una molécula de hierro a la protoporfirina IX para sintetizar el grupo hemo; y por otro lado, de la degradación incrementada del pool de hemo por acción tanto del AIA, como del DDC. Ambas acciones producen depleción de hemo en la célula y así una marcada de-represión de ALA-S. La respuesta de los parámetros estudiados fue dosis-dependiente y los porcentajes indicados corresponden a la mayor dosis utilizada. Ambas drogas porfirinogénicas, AIA y DDC, agotan el pool de hemo libre provocando un desequilibrio en su camino biosintético. El AIA, actúa a través de la Nalquilación del grupo hemo, generando N-alquil-PROTO “pigmentos verdes” que conducen al proceso suicida e irreversible de la inactivación del CYP (Esquema Integratorio 3). En este proceso, el grupo hemo del CYP se destruye y en consecuencia, el hemo libre disminuye, al intentar compensar dicha pérdida (Smith & De Matteis, 1980; Ortiz de Montellano & Mico, 1981). Por su parte, el DDC, produce destrucción del hemo por N-alquilación, a traves del grupo 4-Me que metila y conduce a la formación N-metil-PROTO, y al mismo tiempo, reducción de la síntesis del hemo por acción de esa N-metil-PROTO que actúa como un poderoso inhibidor de la actividad FQ, enzima de su síntesis (Marks et al., 1988), (Esquema Integratorio 3). 196 Discusión A su vez, Whiting & Granick (1976) han demostrado que, en un modelo generado en hígado de embrión de pollo después de 18h de la intoxicación con una combinación de estas mismas drogas, se puede inducir un incremento de 600 veces la actividad de ALA-S. Como fue desarrollado en la introducción de esta Tesis, las porfirias agudas en humanos (AD-P, PAI, CPH, PV) son las más susceptibles al desencadenamiento y exacerbación por drogas y factores metabólicos, pudiendo disparar así sus manifestaciones clínicas (Elder, 1998a; Thadani et al., 2000; Thunell, 2000). Como resultado, se produce una disminución de los depósitos de hemo hepático, por aumento en su degradación o represión de su síntesis, lo que causa inducción del ALA-S hepático y consiguiente aumento de precursores de la vía. Por tanto, en comparación al modelo animal aquí presentado, en las porfirias humanas se genera también una deficiencia aguda de hemo, marcada de-represión de la enzima ALA-S y exacerbación de la producción de precursores del camino en el hígado, generando ataques de porfiria (Tschudy & Bonkowsky, 1972). En este trabajo, se presenta un modelo animal, que si bien no mimetiza desde el punto de vista bioquímico con exactitud a una porfiria hepática aguda humana de las descriptas, semeja con bastante fidelidad las características de las porfirias agudas en general, en cuanto a alteraciones enzimáticas (ALA-S y FQ) y aumento de precursores. De hecho, los primeros informes sobre la PV humana, describían una inhibición de la actividad FQ y aumento de precursores de la vía por desregulación de ALA-S (Cole & Marks, 1984). Las drogas porfirinogénicas AIA y DDC pueden por tanto estimular marcadamente la actividad de la enzima ALA-S por disminución del pool de hemo hepático, reduciendo su control normal por retroalimentación (Moses et al., 1970; Meyer & Marver, 1971; Whiting & Granick, 1976) lo que lleva a la acumulación de los precursores ALA y PBG en el hígado y excreta en exceso de los mismos en orina, generándose así un modelo de porfiria aguda en animales (Smith & De Matteis, 1980; Marks et al., 1988). 197 Discusión ALTERACIONES EN LAS ENZIMAS CLAVES DEL METABOLISMO DE LA GLUCOSA. El hígado juega un papel importante en la homeostasis de la glucosa en sangre, mediante el mantenimiento de un equilibrio entre la degradación y la producción de glucosa, a través de la glucólisis, glucógenolisis y la síntesis de glucosa de novo (Hers, 1990; Nordlie et al., 1999). El modelo agudo aquí presentado fue muy útil para relacionar este tipo de porfiria con las alteraciones de las enzimas claves del metabolismo de la glucosa: PEPCK y G6Pasa para la gluconeogénesis; y PK para la glucólisis. La capacidad del AIA junto al DDC para generar porfiria se evidenció en la inducción del ALA-S, que fue dependiente de la dosis y estadísticamente significativa en cada una ellas. Acompañando esta inducción, se observó una disminución notable y también dosis dependiente de las enzimas citosólicas PEPCK y PK, y una más leve y observada solo en la dosis más alta, sobre la actividad microsomal de la enzima gluconeogénica G6Pasa. Si bien se existe una reducción de ambas actividades gluconeogénicas, que por sí solas podrían conducir a una disminución de la glucosa disponible en el hepatocito, también se comprobó un deterioro en la actividad de la enzima glucolítica PK. Los resultados sugerirían que dicha merma se da en contraposición a la primera, para no exacerbar aun más la falta de glucosa, contrarrestando y/o balanceando en parte el bloqueo gluconeogénico recién descripto. Estos resultados demuestran por primera vez, que la alteración causada por el AIA/DDC sobre esta enzima clave de la glucólisis, daría lugar a un efecto compensatorio sobre la disponibilidad de la glucosa hepática en animales intoxicados. Retomando el tema del desbalance gluconeogénico, la enzima PEPCK mostró también actividad deficiente en un modelo, en el que la administración de fenobarbital (inductor hepático del CYP) y 3´,5´-dicarbetoxi-2,6-dimetil-4-etil-1,4-dihidropiridina (inhibidor suicida del CYP) causó una brusca merma del pool de hemo hepático (Correia & Lunetta, 1989). Dicho modelo presenta un patrón de acumulación de intermediarios gluconeogénicos proximales a la PEPCK, como el malato y el aspartato 198 Discusión que se vieron incrementados de manera significativa, mientras que los intermediarios distales fueron suprimidos totalmente. Como se expuso en el capítulo precedente, la PEPCK también mostró una menor actividad en la intoxicación crónica con el fungicida HCB. En ese caso, el efecto del tiempo transcurrido desde la intoxicación con el xenobiótico sobre la actividad enzimática, mostró una disminución temprana, que se intensificó en el tiempo. Stahl et al., (1993) también informaron una disminución de la PEPCK hepática en ratas tratadas con otra droga porfirinogénica, como el TCDD, debido a una reducción en los niveles de sus mRNA. Una de las probables causas de disminución en las actividades enzimáticas en este modelo agudo, podría deberse a un estado alterado del estrés oxidativo, hecho que será discutido mas abajo en el ítem referente a las interferencias en el sistema redox. DAÑOS SOBRE EL METABOLISMO DEL GLUCÓGENO. Como fue reportado en la sección Resultados de esta Tesis, también se observaron alteraciones de las enzimas del metabolismo del glucógeno, lo que generó niveles aumentados en el contenido de glucógeno hepático de hasta 4 veces respecto al control, en la dosis más alta de AIA/DDC utilizada. Además se observa que este aumento del contenido de glucógeno hepático resulta dependiente de las dosis administradas, lo que conduciría a una menor disponibilidad de glucosa libre. Asimismo se observó que las actividades de estas enzimas del metabolismo del glucógeno, las involucradas en su síntesis y en su degradación, fueron también dependientes en función de la dosis de las drogas porfirinogénicas administradas. La más afectada fue la enzima glucógenolitica, glucógeno fosforilasa (GP) que disminuye al 50% en la dosis máxima; y en menor grado la enzima glucógenogenica, glucógeno sintetasa (GS) que aumenta un 30% a igual dosis. En cuanto a estas enzimas, no hay informes anteriores sobre la determinación de sus actividades en modelos de porfiria aguda. Estos efectos, estimulador para la síntesis y depresor para la degradación, se 199 Discusión corresponden con el aumento tan marcado de los niveles de glucógeno hepático, que aquí se describen. Por otra parte, la captación de glucosa en tejido hepático, mostró de igual forma un incremento dependiente de la dosis, que alcanzó un 50% de aumento para la dosis máxima ensayada. Es decir, la célula hepática captaría más glucosa para intentar contrarrestar los defectos mencionados en los ítems anteriores (aumento en la actividad de GS, descenso en la actividad de GP y descenso en enzimas de la gluconeogénesis: PEPCK y G6Pasa). En la discusión acerca del modelo de porfiria crónica causada por la administración de HCB a ratas Wistar, estas enzimas glucógenolitica y glucógenogenica, GP y GS respectivamente, también mostraron una variación similar en sus actividades, al compararlas con los animales controles. Por otra parte, en estudios ultraestructurales de tejido hepático de ratas tratadas con HCB, se observó un cambio importante en las regiones celulares que normalmente contienen retículo endoplásmico liso. La proliferación del mismo se asoció a tratamientos con dosis bajas de HCB, mientras que el aumento de productos de almacenamiento sustituyendo al retículo, se observó en dosis mayores de HCB (Mollenhauer et al., 1975). También se observó que numerosas partículas de glucógeno aparecieron en extensas áreas del citoplasma de los hepatocitos situados en la zona intermedia, mientras que sólo pocas monopartículas de glucógeno fueron depositadas en la zona centrilobullar (Böger et al., 1979). Estos informes demuestran que en el modelo de HCB, hay un aumento del glucógeno hepático. Estos resultados demuestran por primera vez, que los daños causados por el tratamiento con AIA/DDC en la síntesis y en la liberación de glucosa de sus depósitos, llevaría a un déficit en la disponibilidad de glucosa hepática libre en los animales tratados. Cooperan a este déficit las alteraciones vistas en la gluconeogénesis. En un intento por compensar la baja de glucosa, los animales porfíricos reducen a la mitad la actividad glucolítica de PK y tratan de captar más glucosa. 200 Discusión OTRA POSIBLE CAUSA DEL DESCENSO DE PEPCK y GP - INTERFERENCIAS EN EL SISTEMA REDOX Teniendo en cuenta que el ALA es capaz de generar radicales libres y especies reactivas de oxígeno (ROS) que actúan como pro-oxidantes tanto in vivo como in vitro y que el AIA/DDC produce aumento del ALA en hígado, se estudió la producción de ROS en busca de las causas del descenso de PEPCK y GP. Los incrementos hallados y aquí presentados en relación a los marcadores del estado oxidativo fueron múltiples: aumento en el contenido de proteínas carboniladas, aumento en las TBARS, aumento en la quimiolumiscencia urinaria (QL) y aumento en la respuesta antioxidante de SOD. Todos estos incrementos confirman el estrés oxidativo e indican que la acumulación de ALA, proveniente de la desregulación de la ALA-S, promueve un ambiente oxidativo en los animales con esta porfiria aguda por AIA y DDC. En este sentido se observó, que el estrés oxidativo puede ser desencadenado por exceso de ALA, tanto en el caso de una porfiria aguda intermitente (PAI), como en el envenenamiento accidental por plomo (Bechara, 1996). En base a los patrones similares que exhiben tanto las actividades enzimáticas de PEPCK y GP como los marcadores de estrés oxidativo medidos, en sus respuestas a las diferentes dosis de AIA/DDC, se sugiere un vínculo entre las ROS y los decrementos de PEPCK y GP. Considerando la relación dosis-respuesta observada en la carbonilación de proteínas citosólicas y en las actividades enzimáticas de PEPCK y GP (enzimas citosólicas) en el tratamiento con AIA/DDC, se sugiere que el decremento de dichas actividades enzimáticas podrían deberse en parte al daño oxidativo que sufren sus estructuras proteicas durante la carbonilación de las mismas que se vio aumentada. A ese respecto, en lo concerniente a GP, como puede verse en figura 5.1, la lys 681 responsable del binding de fosfato de piridoxal (cofactor necesario para la actividad enzimática) y las Cys 109 y 143, implicadas en la asociación de las subunidades que permiten una conformación proteica activa de la GP, serían aminoácidos blancos para la carbonilación. 201 Discusión Figura 5.1. Secuencia aminoacídica de la GP de tejido hepático de rata: Se indican los aminoácidos Cys (C109, C143) y Lys (K681) importantes para la estructura y catálisis, que serían target de carbonilación (Schiebel et al., 1992). Esta carbonilación de GP en sitios clave para su función enzimática llevaría a la disminución de su actividad en los animales tratados con AIA/DDC tal como se determinó experimentalmente. Por lo tanto, el ALA acumulado produciría radicales libres que afectarían negativamente la estructura y actividad GP, impidiendo la disponibilidad de glucosa libre a partir de sus depósitos. Quizás sea este uno de los defectos subyacentes de los pacientes con porfiria aguda, que hace que la administración exógena de glucosa los beneficie. 202 Discusión Los descensos que aquí se presentan en el modelo de AIA/DDC, están en concordancia con los alcanzados por otras drogas, tales como las recién mencionadas, HCB y TCDD (mostrado en la primer parte de la discusión; Stahl et al., 1993). De acuerdo con estos resultados, las disminuciones observadas en el modelo agudo, darían lugar a una disponibilidad insuficiente de glucosa dentro del hepatocito. En el desarrollo de esta Tesis se mostró por otra parte, que la actividad CAT sufrió una disminución leve, pero estadísticamente significativa, debido a la reducción del pool de hemo libre provocada por ambas drogas. Esto era de esperarse, si se consideraba la naturaleza de dicha enzima, dado que la CAT es una hemoproteína (Price et al., 1962). Esa depleción de hemo no le permite así a esta enzima expresar su respuesta antioxidante. Respecto a la PEPCK, se sugiere que el decremento de su actividad enzimática podría deberse en parte al daño oxidativo que sufre su estructura proteica al ser carbonilada por parte de las ROS. En este sentido, PEPCK es susceptible de sufrir el proceso de carbonilación de proteínas debido a la composición de su sitio activo, rico en aminoácidos propensos a este tipo de modificación oxidativa como son Arg, Lys, y Thr, altamente conservados en una variedad de especies (Figura 5.3; Aich et al., 2003). Además, también se encuentran otros aminoácidos que sufren reacciones de oxidación directa por ROS como la fenilalanina. Por otra parte, los grupos carbonilos pueden ser introducidos a las proteínas a través de una reacción secundaria de las cadenas laterales nucleofílicas de los aminoácidos Cys, His, Lys, con aldehídos producidos por la formación de TBARS durante la peroxidación lipídica (Dalle-Donne et al., 2003). El aumento de peroxidación lipídica que se observa en este modelo, avala también el estrés oxidativo en esta porfiria aguda inducida y contribuye a que se produzca el evento de carbonilación mencionado anteriormente. 203 Discusión Figura 5.2: Grupos carbonilos, aldehídos y cetonas se genereran a partir de las cadenas laterales de las proteínas cuando son oxidadas (especialmente sobre las Pro, Arg, Lys, y Thr) Dalle-Donne et al., (2003) Los resultados demuestran por primera vez, que las alteraciones causadas por el AIA/DDC en enzimas claves relacionadas con la glucosa, implicadas en la síntesis y en su liberación, darían lugar a un déficit en la disponibilidad de glucosa de los hepatocitos de los animales tratados. Por lo tanto, en los pacientes que padecen porfiria hepática aguda, el estrés oxidativo causado por la gran acumulación de ALA, actuaría sobre la estructura de las proteínas de enzimas claves del metabolismo de los hidratos de carbono, disminuyendo en definitiva, la cantidad de glucosa hepática disponible. Figura 5.3. Secuencia aminoacídica comparativa de la enzima PEPCK de: C. glutamicum; citosol hepático humano; citosol hepático de rata y de E. coli. Los residuos subrayados están localizados en el sitio activo de la PEPCK, los cuales están muy conservados tanto en la forma GTP-dependiente como en la ATP-dep. de E. coli. Los residuos de fenilalanina subrayados y en Itálica (F517, F525, F530) forman el bolsillo de binding conservado de la forma GTP-d. Aich et al., (2003). 204 Discusión Aquí también se demuestra que las ROS, generadas a partir de la acumulación del ALA tienen un efecto perjudicial sobre los lípidos, y especialmente sobre los lípidos de la membrana microsomal, actuando de la misma forma en la que sucede la pérdida de la actividad PEPCK. Este bloqueo, junto con el deterioro de la actividad glucógenolitica GP, promueve una baja de la glucosa hepática generado por las drogas AIA/DDC. MELATONINA COMO ANTIOXIDANTE PREVENTIVO EN LA INTOXICACIÓN AGUDA POR AIA/DDC. La melatonina (Mel) es un conocido antioxidante, secuestrante de radicales libres y efectivo agente protector en numerosas patologías experimentales (Reiter, 1998a y 1999; Ng et al., 2000; Reiter et al., 2000). Se ha observado que la Mel es un efectivo atrapante de radicales hidroxilo y radicales peróxido generados durante la oxidación de los lípidos. Además, puede estimular la actividad de algunas enzimas antioxidantes (Reiter et al., 1997a, 2000). Estas funciones están favorecidas por la facilidad con que atraviesa las barreras morfo-fisiológicas y penetra en las células y en compartimientos subcelulares (Reiter et al., 1997b, 2000). Por lo tanto, era de esperar que la administración de Mel resultara beneficiosa para el tratamiento de la sintomatología hepática aguda en animales porfíricos. Se decidió así, investigar la capacidad de la Mel para revertir y/o prevenir el daño causado en diversas vías metabólicas por la intoxicación con AIA/DDC. La Mel per se no produjo modificaciones en los parámetros estudiados. No fueron alterados ni el camino del hemo (salvo que redujo levemente al PBG eliminado por orina), ni las enzimas del metabolismo de la glucosa, ni la peroxidación lipídica hepática. Sin embargo la administración de la hormona Mel previa a la intoxicación de ratas con AIA/DDC muestra un claro efecto benéfico en los tres metabolismos investigados. Así en el camino del hemo, se reporta un descenso en la excreción de precursores ALA y PBG del 25 y 28% respectivamente, una disminución de la inducción de la enzima regulatoria ALA-S del 30% y una reversión parcial de la 205 Discusión inhibición de la FQ. La administración de Mel tuvo también un efecto benéfico a nivel de las enzimas de la biosíntesis de glucosa. En efecto, su administración conjunta con AIA/DDC restauró en un 25% la actividad de PEPCK y recuperó en un 8% la de la G6Pasa. Asimismo se observó que el status oxidativo mejoró como consecuencia de la administración conjunta de Mel + AIA/DDC respecto al producido por las drogas porfirinogénicas solas, tanto en homogenato como en microsomas, alrededor de 20% en ambos casos. La administración de la hormona previa a la intoxicación de ratas con AIA/DDC, logró una reducción significativa de la excreta de ALA y PBG por orina, si bien no se alcanzó una reversión completa. También la actividad de ALA-S inducida por las drogas se redujo cuando la Mel fue suministrada preventivamente, aunque la reversión de la de-represión de esa enzima causada por la intoxicación aguda fue parcial. En diversas publicaciones se ha indicado que la Mel es un atrapante de radicales libres y un potente antioxidante (Reiter, 1998a; Hardeland et al., 2003; Hardeland & Pandi-Perumal, 2005; Tan et al., 2007), y en esta parte del estudio se pudo comprobar una sustancial recuperación en las actividades de las enzimas gluconeogénicas PEPCK y G6Pasa, que puede hacer suponer que la Mel es capaz de restablecer el mecanismo de defensa antioxidante de la célula y ejercer un efecto protector sobre las enzimas, tanto citosólicas como microsomales, contra el daño inducido por las drogas utilizadas. Todos estos resultados nos hablan del papel e importancia de las especies reactivas en el desarrollo de la porfiria y en los disturbios ocasionados en el metabolismo de los hidratos de carbono, así como del efecto benéfico de la Mel que fue un efectivo protector para el hígado de las ratas y podría ser usado como co-tratamiento en pacientes con porfiria aguda. 206 Discusión PERTURBACIONES EN EL METABOLISMO DEL TRP EN ESTE MODELO DE PORFIRIA AGUDA En el desarrollo de esta Tesis también se demostró, que el tratamiento combinado con AIA/DDC deteriora la ruta serotoninérgica del metabolismo del triptófano (TRP), causando una disminución en el nivel de serotonina (5-HT) y concomitante aumento en el contenido hepático de TRP. Al respecto, se ha demostrado que la administración del TRP resulta en hipoglucemia y que el TRP y sus metabolitos alteran la gluconeogénesis hepática (Smith & Pogson, 1977), mientras que los niveles de TRP hepático aumentan significativamente en ratas porfíricas por HCB (Llambías et al., 2003). Esta acumulación moderada de TRP, llevaría al aumento de la enzima triptófano pirrolasa (TRPp). Así, se ha informado que el TRP produce un incremento vía sustrato de la TRPp, que involucra la reducción en la degradación de la apoenzima prexistente, pero con una velocidad de síntesis normal (Schimke et al., 1965; Knox, 1966; Badaway & Evans, 1975). Los efectos causados por este moderado aumento en la concentración hepática de TRP in vivo, tal como es observado aquí, junto a la activación de la enzima TRPp in vitro (Knox, 1966), sugieren que ambos eventos están involucrados en la conjugación del hemo con la apoenzima y la subsecuente reducción de la holoenzima oxidada. Luego de iniciada dicha conjugación, el TRP mantiene la forma activa y la protege contra las enzimas de degradación, disminuyendo la disociación de la holoenzima en hemo y apoenzima inactiva. Estos hechos favorecen a la TRPp sobre otras proteínas, en la competencia por el grupo prostético. Esto conduce a un aumento en la actividad de la holoenzima, como se observa en este modelo de ratas porfíricas tratadas con AIA/DDC. Se puede especular que el tratamiento con AIA/DDC aumenta la síntesis de la apoenzima y por consiguiente su actividad. Esta especulación se basa en las siguientes consideraciones: (a) la propuesta de que el TRP aumenta la TRPp con una tasa normal de síntesis de enzima, (b) los resultados que muestran que el tratamiento con AIA/DDC promueve el aumento de actividad de la apoenzima más que de la holoenzima o la enzima total, y (c) informes anteriores que muestran que la apo-TRPp tiene una vida 207 Discusión media corta (cuatro veces más corta que la holoenzima) y por lo tanto es una especie altamente susceptible a moduladores de la síntesis de proteínas (Badaway & Evans, 1975; Correia & Burk, 1978). En los ensayos realizados en este trabajo, se mostró un aumento dependiente de la dosis en todas las formas de TRPp, las activas (holo y total) y la inactiva (apo), y una disminución en el grado de saturación de la enzima por el hemo, como consecuencia del tratamiento combinando con AIA/DDC. Estos resultados concuerdan con los de Badawy & Evans (1973), quienes informaron que la administración de estas drogas porfirinogénicas solas y en una dosis fijas (AIA, 400 mg/ kg p.c. o DDC, 150 mg/ kg p.c.) a ratas macho Wistar aumentaban la actividad total de la TRPp y simultáneamente generaban una disminución de la saturación por hemo sobre la apoenzima recién formada. Sin embargo, la administración de 3´,5´-dicarbetoxi-2,6-dimetil-4-etil-1,4dihidropiridina (DDEP, análogo del DDC, inhibidor suicida del CYP y destructor agudo de hemo) junto con el fenobarbital (FB, inductor hepático del CYP) probó reducir la actividad de la TRPp (Correia & Lunetta, 1989). Esta discrepancia puede atribuirse al hecho de que, aunque las sustancias porfirinogénicas DDEP y FB producen agotamiento del pool de hemo, no promueven acumulación hepática de TRP como en el presente modelo de porfiria. En lugar de TRP, que como se discutió anteriormente exacerba la TRPp, estas drogas provocaron una acumulación hepática de 5-HT. En la ruta serotoninérgica por lo tanto, estas drogas tienen un efecto diferente que el del AIA/DDC. Los datos muestran que la TRPp se incrementa en todas sus formas, mientras que la saturación de la enzima por hemo se reduce, lo que parece ser una paradoja, considerando la naturaleza hemo-proteica de la enzima TRPp y el efecto destructor que tienen las drogas porfirinogénicas utilizadas sobre el hemo, para generar esta porfiria hepática aguda. Con esta disminución del hemo, de hecho, podría esperarse que se reduzca la actividad de la TRPp en lugar de aumentarse. El AIA incrementa la destrucción del hemo hepático, y el DDC por un lado promueve la inhibición de la FQ, lo que acarrea una disminución en la síntesis del grupo 208 Discusión hemo y por otro, exacerba la degradación del mismo (Smith & De Matteis, 1980; Litman & Correia, 1983). A pesar de la disminución en el pool de hemo, el aumento en la síntesis de la apoenzima provocado por esta intoxicación da cuenta de la baja saturación de la enzima por el hemo y de la formación aumentada de holoenzima, con el fin de competir con otras proteínas que requieren este tipo de complejo porfirínico como grupo prostético. La mayor formación de holoenzima es también una consecuencia del múltiple y positivo efecto del aumento del TRP. En el modelo de porfiria aquí estudiado, el metabolismo del TRP está incrementado hacia la ruta quinurenérgica, la vía del NAD, mientras que se ve reducido hacia la ruta serotoninérgica. Los resultados mostraron una mayor formación de quinurenina en animales porfíricos, lo que acuerda con trabajos previos que informaron que los pacientes con porfiria, presentan una mayor excreción urinaria de metabolitos del TRP de la vía quinurenérgica (Price, 1961). El patrón de excreción de los metabolitos en orina reportado por Price (1961) es consistente con una mayor actividad de la TRPp, que conduce a una deficiencia funcional de la vitamina B6, manifestada en la excreción anormal de algunos metabolitos implicados en reacciones catalizadas por enzimas que requieren fosfato de piridoxal a lo largo de la ruta metabólica (Badaway & Evans, 1973). Además, se ha informado que las ratas con deficiencia de piridoxina, excretan cantidades anormalmente grandes de quinurenina y ácido xanturénico (White et al., 1964). Ello es debido a que se vería afectada por la deficiencia vitamínica, la enzima quinureninasa que trabaja con fosfato de piridoxal y es la encargada de la degradacion de quinurenina (Fig.1.11, Pag 75). Dado que los resultados aquí obtenidos indican: que la formación de quinurenina es mayor en animales porfíricos (90% de incremento), que la quinurenina vía 3-hidroxiantranilato forma quinolinato, y que el TRP podría inhibir la gluconeogénesis al ser convertido en ácido quinolínico (compuesto cuya complejo ferroso coordinado inhibe a la PEPCK, Veneziale et al., 1967), podría especularse que el bloqueo de la PEPCK inducido por el AIA/DDC sería causado por el ácido quinolínico generado a partir de TRP (Esquema Integratorio 3. Pág 210). Resultados de nuestro laboratorio demuestran que el nivel total NAD se ve incrementado por el tratamiento con AIA/DDC en este mismo modelo de porfiria (Faut, 2007). Esto podría reflejar el aumento del nivel de quinolinato, dado que el NAD se forma a partir quinolinato, a través del ácido nicotínico (Esquema Integratorio 3). 209 Discusión Esquema Integratorio 3: Esquema que muestra las acciones directas e indirectas del tratamiento con AIA/DDC en distintas rutas metabólicas (hemo, hidratos de carbono, TRP y producción de ROS). Muestra la doble de-represión del ALA-S por la disminución de hemo y de la glucosa; y la contribución de ROS y TRP al descenso de PEPCK. GP: glucógeno fosforilasa; GS: glucógeno sintetasa; Gly: glicina; ALA-S: aminolevulinato-sintetasa; PBG: porfobilinógeno; Proto IX: protoporfirina IX; PEPCK: fosfoenolpiruvato carboxiquinasa; CYP: citocromo-P450; ROS: especies reactivas de oxígeno; flechas al costado de los compuestos indican incrementos o decrementos en niveles o actividad. El AIA/DDC se une al CYP, generando N-alquil y N metil porfirinas a partir del CYP, reduciendo así el pool de hemo y de-reprimiendo a la enzima ALA-S, generando una porfiria aguda con acumulación de precursores ALA y PBG. El acúmulo de ALA genera ROS, que junto al aumento del TRP y sus metabolitos de la vía quinurenérgica, contribuyen al descenso de PEPCK. El descenso de glucosa por bloqueo de la PEPCK y el bloqueo glucógenolitico (GP) llevan a la de-represión de la ALA-S que se suma a la de-represión provocada en esta enzima por la caída de hemo. 210 Discusión CONCLUSIÓN PARA EL MODELO DE PORFIRIA HEPÁTICA AGUDA POR AIA/DDC El esquema Integratorio 3 resume los efectos directos e indirectos del tratamiento con AIA/DDC en diferentes rutas metabólicas como la del TRP y la vía hemo, la generación de ROS y su impacto sobre el bloqueo gluconeogénico de la PEPCK y glucógenolitico de la GP, tendientes a disminuir la glucosa. Los descensos observados en este modelo agudo sobre la gluconeogénesis; en la actividad glucógenolitica de GP y en el marcado incremento de los depósitos de glucógeno hepáticos, conduciría a un déficit de disponibilidad de glucosa libre, lo que se intenta compensar de forma parcial en animales tratados, reduciendo a la mitad la actividad glucolítica de PK e intentando aumentar la captación de glucosa por dicho tejido. Por otra parte, los marcadores del estado oxidativo fueron múltiples: aumento en el contenido de proteínas carboniladas, de la peroxidación lipídica, de la QL y de la respuesta antioxidante de SOD. Todos estos incrementos confirman el estrés oxidativo e indican que la acumulación de ALA, proveniente de la desregulación de la ALA-S, promueve un ambiente oxidativo en los animales con esta patología aguda, lo que sugiere un posible daño en las estructuras de las enzimas disminuidas. Asimismo, la acción directa del TRP sobre PEPCK no podía ser descartada, aunque influirá seguramente en menor grado, ya que la cantidad de TRP acumulada es inferior a la de sus metabolitos derivados. La administración de la hormona melatonina previa a la intoxicación de ratas con AIA/DDC muestra un claro efecto benéfico en tres de los metabolismos investigados. Así en el camino del hemo, se observó un descenso en la excreción de precursores ALA y PBG, una disminución de la inducción de la enzima regulatoria ALA-S y una reversión parcial de la inhibición de la FQ. Además, su administración conjunta con AIA/DDC restauró parcialmente las actividades de dos enzimas gluconeogénicas. Se observó también una mejora en las defensas antioxidantes de la célula, tanto en homogenato como en microsomas hepáticos. 211 Discusión Así, Mel se comportó como un efectivo protector para el hígado de las ratas y podría ser usado como co-tratamiento en pacientes con porfiria aguda. En síntesis, respecto al bloqueo gluconeogénico producido por el tratamiento con AIA/DDC, contribuyen al descenso de PEPCK, la acción de las ROS, el ácido quinolínico y en menor grado el TRP. Respecto del bloqueo glucógenolitico, el descenso de GP sería consecuencia del daño estructural ocasionado por las ROS. De esta forma, en este modelo de porfiria aguda las drogas administradas producen un disturbio primario en el camino del hemo que lleva a la depleción del mismo y como consecuencia a la inducción del ALA-S y de la porfiria. A estos disturbios deben añadirse las alteraciones no reportadas previamente, en el metabolismo de los hidratos de carbono, del triptófano y metabolismo oxidativo que concurren para determinar una baja en la disponibilidad de glucosa libre. Esta baja de glucosa de-reprime a la ALA-S exacerbando la porfiria. Es decir, habría una doble de-represión de la ALA-S, una por depleción de hemo y otra provocada por la baja de glucosa (Esquema Integratorio 3). El mecanismo a través del cual el deterioro de la neosíntesis y liberación de glucosa se produce, proporcionaría la base molecular para explicar el rol benéfico que juega la administración de carbohidratos a pacientes que sufren de porfirias hepáticas agudas (Doss et al., 1985; Kappas et al., 1995), que en algunos casos se describió como el tratamiento que salva la vida de estos pacientes (Tschudy, 1968; Bonkowsky, 1982). También sería útil para explicar el hecho de que el alto consumo de glucosa en animales previene la aparición de porfiria experimental por AIA (Rose et al., 1961), y para comprender mejor las inter-relaciones e inter-regulaciones metabólicas entre la glucosa, el hemo y metabolismo del TRP. 212 Citas Bibliográficas 6. CITAS BIBLIOGRÁFICAS Abbritti G. & De Matteis F. (1972) Decreased levels of cytochrome P-450 and catalase in hepatic porphyria caused by substituted acetamides and barbiturates. Importance of the allyl group in the molecule of the active drugs. Chem Biol Interact.; 4:281-286. Abdel-Wahab YH., O'Harte FP., Ratcliff H., McClenaghan NH., Barnett CR., Flatt PR. (1996) Glycation of insulin in the islets of Langerhans of normal and diabetic animals. Diabetes; 45: 1489-1496. Acuña-Castroviejo D., Escames G., Carozo A., Leon J., Khaldy H., Reiter RJ. (2002) Melatonin, mitochondrial homeostasis and mitochondrial-related diseases. Curr Topics Med Chem.; 2: 133–52. Adak S., Bandyopadhyay U., Bandyopadhyay D., Banerjee RK. (1998) Mechanism of horseradish peroxidase catalyzed epinephrine oxidation: obligatory role of endogenous O2- and H2O2. Biochemistry; 37: 16922-16933. Aebi H. (1984) Catalase in vitro. Methods Enzymol.; 105: 121-126. Aich S., Imabayashi F., Delbaere L. (2003) Expression, purification and characterization of a bacterial GTP-dependent PEP carboxykinase. Protein Exp. Purif.; 31: 298–304. Aizencang G., Solis C., Bishop DF., Warner C., Desnick RJ. (2000) Human uroporphyrinogenIII synthase: genomic organization, alternative promoters, and erythroid-specific expression. Genomics; 70: 223–231. Alderton WK., Cooper CE., Knowles RG. (2001) Nitric oxide synthases: structure, function and inhibition. Biochem J.; 357: 593–615. Allegri G., Ragazzi E., Bertazzo A., Costa CVL., Rocchi R. (2003) Tryptophan metabolism along the kynurenine pathway in rats. In: Allegri G, Costa CVL, Ragazzi E, et al, editors. Developments in tryptophan and serotonin metabolism. New York 7 Kluwer/Academic Plenum Publishers. pp. 481–496. Anderson K. (2007) The porphyrias. In: Goldman L, Ausiello D, Eds. Cecil Medicine. 23rd ed. Philadelphia, Pa: Saunders Elsevier; chap 229. Andrae U., Singh J., Ziegler-Skylakakis K. (1985) Pyruvate and related aketoacids protect mamalian cells in culture against hydrogen peroxide-induced cytotoxicity. Toxicol Lett.; 28: 93-98. Andrews JE., Courtney KD., Donaldson WE. (1988) Impairment of calcium homeostasis by hexachlorobenzene (HCB) exposure in Fischer 344 rats. J Toxicol Environ Health.; 23: 311-320. Andrews RC. & Walker BR. (1999). Glucocorticoids and insulin resistance: old hormones, new targets. Clin Sci.; (Lond) 96: 513–523. 214 Citas Bibliográficas Antolín I., Mayo JC., Sainz RM., del Brio ML., Herrera F., Martin V., Rodriquez C. (2002) Protective effect of melatonin in a chronic experimental model of Parkinson’s disease. Brain Res.; 943: 163-73. Aragonés A., García RC., San Martín de Viale LC., Tomio JM., Grinstein M. (1972) Estudios de la transformación de uroporfirinógenos en coproporfirinógenos por decarboxilasas de eritrocitos de pollo e hígado de rata. Anales Asoc Quím Arg.; 60: 239-248. Argoti D., Liang L., Conteh A., Chen L., Bershas D., Yu CP., Vouros P., Yang E. (2005) Cyanide trapping of iminium ion reactive intermediates followed by detection and structure identification using liquid chromatography-tandem mass spectrometry (LCMS/MS) Chem Res Toxicol.; 18: 1537–1544. Aruoma OI., Halliwell B., Laughton MJ., Quinlan GJ., Gutteridge JM. (1989) The mechanism of initiation of lipid peroxidation. Evidence against a requirement for an iron(II)-iron(III) complex. Biochem J.; 258: 617-620. Astner I., Schulze JO., Van Den Heuvel JJ., Jahn D., Schubert W., Heinz DW. (2005) Crystal structure of 5-aminolevulinate synthase, the first enzyme of heme biosynthesis, and its link to xlsa in humans. Embo J.; 24: 3166-3177. ATSDR (Agency for Toxic Substances and Disease Registry) (1996) Toxicological profile for Hexachlorobenzene. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry. ATSDR (Agency for Toxic Substances and Disease Registry) (2002) Toxicological profile for Hexachlorobenzene, Atlanta, GA.U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry. Ayes, BN. (1966) Assay of inorganic phosphate, total phosphate and phosphatases. In: Neufeld, E.F., Ginsburg, V. (Eds.), Methods in Enzymology, vol. VIII. Carbohydrate Metabolism, Part E. Academic Press, New York, pp. 115-118. Badawy AA. & Evans M. (1973) The effects of chemical porphyrogens and drugs on the activity of rat liner tryptophan pyrrolase. Biochem J.; 136: 885–892. Badawy AA. & Evans M. (1975) Regulation of rat liver tryptophan pyrrolase by its cofactor haem: experiments with hematin and 5-aminolaevulinate and comparison with the substrate and hormonal mechanisms. Biochem J.; 150: 511–520. Badawy AA. (1978) Tryptophan pyrrolase, the regulatory free haem and hepatic porphyrias. Early depletion of haem by clinical and experimental exacerbators of porphyria. Biochem J; 172: 487–494. Baginski ES., Foa PP., Zak B. (1974) Glucose-6-phosphatase. In: Bermeyer HU (ed) Method of enzymatic analysis, 2nd edn, vol 1, Verlag Chemie/Academic Press, Weinheim, New York, pp 876-880. Barociani L. & Beutler E. (1993). Analysis of pyruvate kinase deficiency mutations that produce nonspherocytic hemolytic anemia. Proc Natl Acad Sci.; USA 90: 4324–4327. Bartlett, GR. (1959) Phosphorus assay in column chromatography. J. Biol. Chem., 234: 466468. 215 Citas Bibliográficas Batlle AMC. (1997) Aspectos clínicos, bioquímicos y biología molecular. Acta Bioquim Clin Latinoam.; Supl 3. Ed. Federación Bioquim. Pcia. Buenos Aires. Batlle AM. & Grinstein M. (1962) Porphyrin biosynthesis. Phyriaporphyrinogen III, a normal intermediate in the biosynthesis of protoporphyrin 9. Biochim Biophys Acta; 62: 197200. Batlle AM. & Stella AM. (1978) Delta aminolaevulinate dehydratase: its mechanism of action. Int J Biochem.; 9: 861-864. Batlle AM., Benson A., Rimington C. (1965) coproporphyrinogenase. Biochem J.; 97: 731-740. Purification and properties of Batlle AM., Ferramola AM., Grinstein M. (1967) Purification and general properties of sigmaaminolaevulate dehydratase from cow liver. Biochem J.; 104: 244-249. Basabe JC., Karabatas LM., Arata M., Pivetta OH., Cresto JC. (1986) Secretion and effect of somatostatin in early stages of the diabetic syndrome in C57BL/KsJ-mdb mice. Diabetologia. 29: 485-488. Bearcroft CP., Farthing MJG., Perrett D. (1995) Determination of 5-hydroxytryptamine, 5hydroxyindoleacetic acid and tryptophan in plasma and urine by HPLC with fluorimetric detection. Biomed Chromatogr.; 9: 23–27. Bechara EJ. (1996) Oxidative stress in acute intermittent porphyria and lead poisoning may be triggered by 5-aminolevulinic acid. Braz. J. Med. Biol. Res.; 29: 841–851. Behrend L., Henderson G., Zwacka RM. (2003) Reactive oxygen species in oncogenic transformation. Biochem Soc Trans.; 31: 1441-1444. Berlett BS. & Stadtman ER. (1997) Protein oxidation in aging, disease, and oxidative stress. J Biol Chem., 272: 20313 -20316. Berndt J., Messner B., Still, J. (1978) Optical assay of pyruvate carboxylase in crude liver homogenate. Anal Biochem 86: 154-158 Bielski BH. & Chan PC. (1973) Enzyme-catalyzed free radical reactions with nicotineamideadenine nucleotides. I. Lactate dehydrogenase-catalyzed chain oxidation of bound NADH by superoxide radicals. Arch Biochem Biophys.; 159: 873-879. Billi de Catabbi S., Sterin-Speziale N., Fernandez MC., Minutolo C., Aldonatti C., San Martin de Viale L. (1997) Time course of hexachlorobenzene-induced alterations of lipid metabolism and their relation to porphyria. Int J Biochem Cell Biol; 29: 335–344. Billi de Catabbi S., Wainstok de Calmanovici R., Minutolo C., Aldonatti C., San Martín de Viale LC. (1999) Porphyria induced hepatic porphyrinogen carboxy-lyase inhibitor and its interaction with the active site (s) of the enzyme. Biochem Mol Biol Internat.; 47: 945956. Billi de Catabbi SC., Aldonatti C., San Martín de Viale LC. (2000a) Heme metabolism after discontinued hexachlorobenzene administration in rats: possible irreversible changes and biomarker for hexachlorobenzene persistence. Comp Biochem Physiol C.; 127: 165-175. 216 Citas Bibliográficas Billi de Catabbi SC., Faletti A., Fuentes F., San Martín de Viale LC., Cochón AC. (2005) Hepatic arachidonic acid metabolism is disrupted after hexachlorobenzene treatment. Toxicol Appl Pharmacol; 204: 187-195. Billi de Catabbi SC., Setton-Advruj CP., Sterin-Speziale N., San Martín de Viale LC., Cochón AC. (2000b) Hexachlorobenzene-induced alterations on neutral and acidic sphingomyelinases and serine palmitoyltransferase activities. A time course study in two strains of rats. Toxicology; 149: 89-100. Billi de Catabbi SC. & San Martín de Viale LC. (1994) Studies on the active centre(s) of rat liver porphyrinogen carboxy-lyase. In vivo effect of hexachlorobenzene on decarboxylation site(s) of porphyrinogens. Int J Biochem.; 26: 595-600. Bishop TR., Frelin LP., Boyer SH. (1990) Isolation and characterization of a rat deltaaminolevulinate dehydratase processed pseudogene. Genomics; 7:629-632 Bissell DM. & Hammaker LE. (1977) Effect of endotoxin on tryptophan pyrrolase and deltaaminolevulinate synthase: evidence for an endogenous regulatory haem fraction in rat liver. Biochem J; 166: 301–304. Bizeau ME., Short C., Thresher JS., Commerford SR., Willis WT., Pagliassotti MJ., (2001) Increased pyruvate flux capacities account for diet-induced increases in gluconeogenesis in vitro. Am J Physiol.; 281: 427-433. Blask DE., Sauer LA., Dauchy RT. (2002) Melatonin as a chronobiotic/anticancer agent: Cellular, biochemical, and molecular mechanisms of action and their implications for circadian-based therapy. Curr Topics Med Chem.; 2: 113–32. Böger A., Koss G., Koransky W., Nauman R., Frenzel H. (1979) Rat liver alterations after chronic treatment with hexachlorobenzene. Virchows. Arch. A: Pathol. Anat. Histol.; 382: 127–137. Bollen M., Keppens S., Stalmans W. (1998) Specific features of glycogen metabolism in the liver. Biochem J.; 336: 19-31. Bonkovsky HL. & Barnard GF. (2000) The Porphyrias. Curr Treat Options Gastroenterol.; 3: 487-500. Bonkowsky HL. (1982) Porphyrin and heme metabolism and the porphyrias. In: Zakim D, Boyer TD, editors. Hepathology: a textbook of medicine. Philadelphia: Saunders; pp. 352–396. Borel JP., Monboise JC., Bellon G. (1988) Inflammation, collagene et radicaux libres ocygénés. Med Sci., 5:304-311. Breuner CW & Orchinik M. (2002) Plasma binding proteins as mediators of corticosteroid action in vertebrates. J Endocrinol; 175: 99–112. Brodie AE. & Reed OJ. (1987) Reversible oxidation of glyceraldehyde 3-phosphate dehydrogenase thiols in human lung carcinoma cells by hydrogen peroxide. Biochem Biophys Res Commun.; 148: 120-125. 217 Citas Bibliográficas Brooker JD., Srivastava G., Borthwick IA., May BK., Elliott WH. (1983) Evidence that 2-Allyl2-isopropylacetamide, phenobarbital and 3,5-diethyoxycarbonyl-1,4-dihydrocollidine induce the same cytochrome P450 mRNA in chick embryo liver. Eur J Biochem.; 136: pp. 327–332. Burr IM., Balant L., Stauffacher W., Renold AE., Grodsky G. (1969) Dynamic aspects of proinsulin release from perifused rat pancreas. Lancet 2: 882-883 Cacheux V., Martasek P., Fougerousse F., Delfau MH., Druart L., Tachdjian G., Grandchamp B. (1994) Localization of the human coproporphyrinogen oxidase gene to chromosome band 3q12. Hum Genet.; 94: 557-559. Cahill GF. Jr. (1970) Starvation in man. N Engl J Med.; 282: 668–675. Chance B., Sies H., Boveris A. (1979) Hydroperoxide metabolism in mammalian organs. Physiol Rev. 59: 527-605 Chaufan G., Corvi M., Armesto A., San Martín de Viale LC., Luquet C, Ríos de Molina MC. (2002) Comparative studies between the uroporphyrinogen decarboxylase comming from rat liver and crab hepatopancreas. Comp. Biochem. Physiol. B Biochem Mol Biol 133: 251-256 Chaufan G., Corvi M., San Martín de Viale LC., Cárdenas ML., Ríos de Molina MC. (2005) Abnormal kinetic behavior of uroporphyrinogen decarboxylase obtained from rats with hexachlorobenzene-induced porphyria. J Biochem Mol Toxicol.; 19: 19-24. Cheng KC., Cahill DS., Kasai H., Nishimura S., Loeb LA. (1992) 8-hydroxy-guanine, an abundant form of oxidative DNA damage caused G fi T and A fi C substitutions. J Biol Chem.; 267: 166–172 Cheung RTF. (2003) The utility of melatonin in reducing cerebral damage resulting from ischemia and reperfusion. J Pineal Res.; 34: 153–60. Christian BJ., Menahan LA., Peterson RE. (1986) Intermediary metabolism of the mature rat following 2,3,7,8-tetrachlorodibenzo-p-dioxin treatment. Toxicol Appl Pharmacol.; 83: 360-378. Cochón AC., Aldonatti C., San Martín de Viale LC., Wainstok de Calmanovici R. (1997) Evaluation of the porphyrinogenic risk of antineoplastics. J Appl Toxicol; 17:171-177. Cochón AC., Mazzetti MB., San Martín de Viale LC. (2005) How hexachlorobenzene impacts biochemistry - Recent studies in several tissues. Trends Cell Mol Biol.; 1: 15-34 Cochón AC., Miño LA., de Viale LC. (2010) Early increases in transglutaminase activity and polyamine levels in a Mallory-Denk body mouse model. Toxicol Lett.; 199: 160-165. Cochón AC., San Martín de Viale LC., Billi de Catabbi SC. (2001) Phospholipid alterations elicited by hexachlorobenzene in rat brain are strain-dependent and porphyriaindependent. Comp Biochem Physiol C Toxicol Pharmacol.; 130: 199-207. Cole SP. & Marks GS. (1984) Ferrochelatase and N-alkylated porphyrins. Mol Cell Biochem.; 64: 127–137. 218 Citas Bibliográficas Cole TG., Wilcox HG., Heimberg M. (1982) Effects of adrenalectomy and dexamethasone on hepatic lipid metabolism. J Lipid Res.; 23: 81–91. Cole TJ., Blendy JA., Monaghan AP., Krieglstein K., Schmid W., Aguzzi A., Fantuzzi G., Hummler E., Unsicker K., Schutz G. (1995). Targeted disruption of the glucocorticoid receptor gene blocks adrenergic chromaffin cell development and severely retards lung maturation. Genes Dev.; 9: 1608–1621 Consler TG., Woodard SH., Lee JC. (1989) Effects of primary sequence differences on the global structure and function of an enzyme: a study of pyruvate kinase isozymes. Biochemistry; 28: 8756-8764. Correia M. & Lunetta J. (1989) Acute hepatic heme depletion: impaired gluconeogenesis in rats. Semin Hematol.; 26: 120–127. Correia MA. & Burk RF. (1978) Rapid stimulation of hepatic microsomal heme oxygenase in selenium-deficient rats. An effect of phenobarbital. J Biol Chem; 253: 6203–6210. Corssmit E., Romijn J., Sauerwein H. (2001) Regulation of glucose production with special attention to nonclassical regulatory mechanisms: a review. Metabolism; 50: 742-755. Courtney KD. (1979) Hexachlorobenzene, HCB: A review. Environ Res.; 20: 225-266. Cuzzocrea S. & Reiter RJ. (2002) Pharmacological actions of melatonin in acute and chronic inflammation. Curr Topics Med Chem.; 2: 153-166. Dalle-Donne I., Rossi R., Giustarini D., Milzani A., Colombo R. (2003) Protein carbonyl groups as biomarkers of oxidative stress. Clin Chim Acta; 329: 23–38. Dawson D. & Encel N. (1993) Melatonin and sleep in humans. J Pineal Res.; 15: 1-12. De Matteis F. & Gibbs A. (1972) Stimulation of liver 5-aminolaevulinate synthetase by drugs and its relevance to drug-induced accumulation of cytochrome P-450. Studies with phenylbutazone and 3,5-diethoxycarbonyl-1,4-dihydrocollidine. Biochem J.; 126: 11491160 De Matteis F. & Stonard M. (1977) Experimental porphyrias as models for human hepatic porphyrias Semin Hematol.; 14: 187-192. De Matteis F. (1970). Rapid loss of cytochrome P-450 and haem caused in the liver microsomes by the porphyrinogenic agent 2-allyl-2-isopropilacetamide FEBS Lett. 6: 343-345 De Matteis F. (1998) Porphyria Cutanea Tarda of the toxic and sporadic varieties. Clin Dermatol.; 16: 265-275 De Matteis F., Abbritti G., Gibbs AH. (1973) Decreased liver activity of porphyrin–metal chelatase in hepatic porphyria caused by 3,5-diethoxycarbonyl-1,4-dihydrocollidine. Studies in rats and mice. Biochem. J. 134: 717-727 De Matteis F., Prior BE., Rimington C. (1961) Nervous and biochemical disturbances following hexachlorobenzene intoxication. Nature; 191: 363-366. De Matteis F. (1971) Drugs and porphyria. S Afr Med J.; 25: 126-133. 219 Citas Bibliográficas Demina A., Varughese KI., Barbot J., Forman L., Beutler E. (1999) Six previously undescribed pyruvate kinase mutations causing enzyme deficiency. Blood; 92: 647-652. Den Besten C., Bennik MH., Bruggeman I., Schielen P., Kuper F., Brouwer A., Koeman JH., Vos JG., Van Bladeren PJ. (1993) The role of oxidative metabolism in hexachlorobenzene-induced porphyria and thyroid hormone homeostasis: a comparison with pentachlorobenzene in a 13-week feeding study. Toxicol Appl Pharmacol.; 119: 181-194. Denari D. & Ceballos NR. (2005) 11beta-hydroxysteroid dehydrogenase in the testis of Bufo arenarum: changes in its seasonal activity. Gen Comp Endocrinol. 143: 113-120 Denk H., Gschnait F., Wolff K. (1975) Hepatocellular hyalin (Mallory bodies) in long term griseofulvin-treated mice: a new experimental model for the study of hyalin formation. Lab Invest.; 32: 773-776. Denk H., Stumptner C., Zatloukal K. (2000). Mallory bodies revisited. J Hepatol.; 32: 689-702. Dickins M. (2004) Induction of cytochromes P450. Curr Top Med Chem.; 4: 1745-1766. Diengott D., Mirsky IA., Perisutti G. (1956) The hypoglycemic and insulinase inhibitory action of L-tryptophan. Endocrinology; 59: 369-379. Diesbach H. & Wiederkehr FX. (1945) Indirubine et indileucine. Helv Chim Acta.; 28: 690-700. Doss M., Sixel-Dietrich F., Verspohl F. (1985) ‘Glucose effect’ and rate limiting function of uroporphyrinogen synthase on porphyrin metabolism in hepatocyte culture: relationship with human acute hepatic porphyrias. J Clin Chem Clin Biochem.; 23: 505–513. Drouin J., Trifiro MA., Plante RK., Nemer M., Eriksson P., Wrange O. (1989). Glucocorticoid receptor binding to a specific DNA sequence is required for hormone-dependent repression of pro-opiomelanocortin gene transcription. Mol Cell Biol.; 9: 5305–5314 Dubart A., Mattei MG., Raich N., Beaupain D., Romeo PH., Mattei JF., Goossens M. (1986) Assignment of human uroporphyrinogen decarboxylase (URO-D) to the p34 band of chromosome 1, Hum Genet.; 73: 277-279. Dubois M., Gilles KA., Hamilton JK., Rebers PA., Smith F. (1956) Colorimetric method for determination of sugar and related compound. Anal Chem 28: 350-356. Duckworth WC., Bennett RG., Hamel FG., (1998) Insulin Degradation: Progress and Potencial Endocr Rev.; 19: 608-624. Egger NG., Goeger DE., Payne DA., Miskovsky EP., Weinman SA., Anderson KE. (2002) Porphyria cutanea tarda: multiplicity of risk factors including HFE mutations, hepatitis C, and inherited uroporphyrinogen decarboxylase deficiency. Dig Dis Sci.; 47: 419-426. Elder GH. (1998a) Genetic defects in the porphyrias: types and significance. Clin Dermatol.; 16: 225-233. Elder GH. (1998b) Porphyria cutanea tarda. Semin Liver Dis.; 18: 67-75. 220 Citas Bibliográficas Elder GH., Evans JO., Matlin SA. (1976) The effect of the porphyrogenic compound, hexachlorobenzene, on the activity of hepatic uroporphyrinogen decarboxylase in the rat. Clin Sci Mol Med.; 51: 71-80. Elliott KR. & Pogson CI. (1977) The effects of starvation and experimental diabetes on phosphoenol-pyruvate carboxykinase in the guinea pig. Biochem J.; 164: 357-361. Elliott KR., Pogson CI., Smith SA. (1976) Effects of tryptophan on gluconeogenesis in the rat and the guinea pig. Biochem Soc Trans.; 4: 1048-1049. El-Maghrabi MR., Lange A., Kümmel L., Pilkis S. (1991) The rat fructose-1,6-bisphosphatase gene. Structure and regulation of expression. J Biol Chem.; 266: 2115-2120. Enan E., Liu PCC., Matsumura F. (1992). 2,3,7,8-Tetrachlorodibenzo-p-dioxin causes reduction of glucose transporting activities in the plasma membranes of adipose tissue and pancreas from the guinea pig. J. Biol. Chem. 267: 19785-19791. Ennamany R., Marzetto S., Saboreaud D., Creppy EE. (1995) Lipid peroxidation induced by bolesatine, a toxin of Boletus Satanas: implications in m5dC variation in Vero cells related to inhibition of cell growth. Cell. Biol. Toxicol. 11: 347-354 Ertürk E., Lambrecht RW., Peters HA., Cripps DJ., Gocmen A., Morris CR., Bryan GT. (1986) Oncogenicity of hexachlorobenzene. IARC Sci Pub.; 77: 417-423. Evans DC., Watt AP., Nicoll-Griffith DA., Baillie TA. (2004) Drug-protein adducts: an industry perspective on minimizing the potential for drug bioactivation in drug discovery and development. Chem Res Toxicol.; 17: 3-16. Ezendam J., Staedtler F., Pennings J., Vandebriel RJ., Pieters R., Harleman JH., Vos JG. (2004) Toxicogenomics of subchronic hexachlorobenzene exposure in Brown Norway rats. Environ Health Perspect.; 112: 782-791. Fan F. & Rozman KK. (1994) Relationship between acute toxicity of 2,3,7,8tetrachlorodibenzo-p-dioxin (TCDD) and disturbance of intermediary metabolism in the Long–Evans rat. Arch Toxicol; 69: 73–78. Fan F. & Rozman KK. (1995) Short- and long-term biochemical effects of 2,3,7,8tetrachlorodibenzo-p-dioxin in female Long-Evans rats. Toxicol Lett., 75: 209-216 Farmer PB., Brown K., Tompkins E., Emms VL., Jones DJ., Singh R., Phillips DH. (2005) DNA adducts: mass spectrometry methods and future prospects. Toxicol Appl Pharmacol.; 207: 293-301. Faut M. (2007) Catabolismo de los hidratos de carbono y estrés oxidativo en un modelo de porfiria aguda en ratas. Tesina de Licenciatura para acceder al Título de Licenciada en Cs. Biológicas. FCEN-UBA. Argentina Feigelson P. & Greengard O. (1961) A microsomal iron-porphyrin activator of rat liver tryptophan pyrrolase. J Biol Chem.; 236: 153-157. Ferioli A., Harvey C., De Matteis F. (1984) Drug-induced accumulation of uroporphyrin in chicken hepatocyte cultures. Structural requirements for the effect and role of exogenous iron. Biochem J.; 224: 769-777. 221 Citas Bibliográficas Ferrannini E., Wahren J., Felig P., DeFronzo RA. (1980) The role of fractional glucose extraction in the regulation of splanchnic glucose metabolism in normal and diabetic man. Metabolism; 29: 28-35. Ferrer JC, Favre C, Gomis RR, Fernández-Novell JM, García-Rocha M, de la Iglesia N, Cid E, Guinovart JJ (2003). Control of glycogen deposition. FEBS Lett.; 546: 127-132. Fisher BE. (1999) Most unwanted. Environ Health Perspect.; 107: 18-23. Foster WG., Mertineit C., Yagminas A., McMahon A., Lecavalier P. (1995) The effects of hexachlorobenzene on circulating levels of adrenal steroids in the ovariectomized rat. J Biochem Toxicol; 10: 129-135. Foster WG., Pentick JA., McMahon A., Lecavalier PR. (1993) Body distribution and endocrine toxicity of hexachlorobenzene (HCB) in the female rat. J Appl Toxicol; 13: 79–83. Frankenberg N., Erskine PT., Cooper JB., Shoolingin-Jordan PM., Jahn D., Heinz DW. (1999) High resolution crystal structure of a Mg2+-dependent porphobilinogen synthase. J Mol Biol.; 289: 591-602. Fridovich I. (1989) Superoxide dismutases. J Biol Chem.; 264: 7761-7764. Fukuda H., Paredes SR., Batlle AM. (1988) Active site histidine in pig liver aminolevulic acid dehydratase modified by diethylpyrocarbonate and protected by Zn2+ ions. Comp Biochem Physiol B.; 91: 285-291. Furman BL. (1974) The hypoglycaemic effect of 5-hydroxytryptophan. Br J Pharmacol; 50: 575-580. Gabbay RA. (1984) Quinolinate inhibition of gluconeogenesis is dependent on cytosolic oxalacetate concentration. An explanation for the differential inhibition of lactate and pyruvate gluconeogenesis. FEBS Lett.; 189: 367-372. Gagliardino JJ., Zieher LM., Iturriza FC., Hernández RE., Rodríguez RR. (1971) Insulin release and glucose changes induced by serotonin. Horm Metab Res.; 3: 145-150. Gan J., Harper TW., Hsueh MM., Qu Q., Humphreys WG. (2005) Dansyl glutathione as a trapping agent for the quantitative estimation and identification of reactive metabolites. Chem Res Toxicol.; 18: 896–903. Garland RC. (1988) Effect of insulin on the induction by dexamethasone of glucose-6phosphohydrolase and translocase activities in cultured hepatoma cells. Biochem Biophys Res Commun.; 153: 307–312. Gerschman R., Gilbert Dl., Nye SW., Dwyer P., Fenn Wo. (1954) Oxygen poisoning and XIrradiation. A mechanism in common. Science; 119: 623-626. Ghazarian H., Idoni B., Oppenheimer SB. (2011) A glycobiology review: Carbohydrates, lectins and implications in cancer therapeutics. Acta Histochemica.; 113: 236-247. Gidari AS. & Levere RD. (1977) Enzymatic formation and cellular regulation of heme synthesis. Semin Hematol.; 14: 145-168. 222 Citas Bibliográficas Giger U. & Meyer UA. (1981) Induction of delta-aminolevulinate synthase and cytochrome P450 hemoproteins in hepatocytes culture: effect of glucose and hormones J Biol Chem.; 256: 11182-11190. Gill R., Kolstoe SE., Mohammed F., Al D-Bass A., Mosely JE., Sarwar M., Cooper JB., Wood SP., Shoolingin-Jordan PM. (2009) Structure of human porphobilinogen deaminase at 2.8 A: the molecular basis of acute intermittent porphyria. Biochem J.; 420: 17-25. Giudetti AM. & Gnoni GV. (1998) Short-term effect of dexamethasone on fatty acid and cholesterol synthesis in isolated rat hepatocytes. Biochem. Mol Biol Int.; 44: 515–521. Glass DJ. (2005) Skeletal muscle hypertrophy and atrophy signaling pathways. Int. J. Biochem Cell Biol.; 37: 1974–1984. Gocmen A., Peters HA., Cripps DJ., Bryan GT., Morris CR. (1989) Hexachlorobenzene episode in Turkey. Biomed Environ Sci.; 2: 36-43. Gocmen A., Peters HA., Cripps DJ., Morris CR., Dogramaci I. (1986) Porphyria turcica: hexachlorobenzene-induced porphyria. IARC Sci Publ.; 77: 567-573. Goldman D. & Yawetz A. (1992) The interference of polychlorinated biphenyls (Aroclor 1254) with membrane regulation of the activities of cytochromes P-450 C21 and P-450(17) alpha-lyase in guinea-pig adrenal microsomes. J Steroid Biochem Mol Biol.; 42: 37–47. Gomez-Sanchez C., Murry BA., Kem DC., Kaplan NM. (1975) A direct radioimmunoassay of corticosterone in rat serum. Endocrinology 96: 796-798 Gorski JR. & Rozman K. (1987) Dose-response and time course of hypothyroxinemia and hypoinsulinemia and characterization of insulin hypersensitivity in 2,3,7,8tetrachlorodibenzo-p-dioxin (TCDD)-treated rats. Toxicology; 44: 297-307. Gorski JR., Muzi G., Weber LW., Pereira DW., Iatropoulos MJ., Rozman K. (1988). Elevated plasma corticosterone levels and histopathology of the adrenals and thymuses in 2,3,7,8tetrachlorodibenzo-p-dioxin-treated rats. Toxicology; 53: 19–32. Graham TL. & Whistler RL. (1976) Uridine 5′-(5-thio-α-d-glucopyranosyl pyrophosphate): chemical synthesis and activation of rat liver glycogen synthetase. Biochemistry 15: 1189-1194. Granick S. & Urata G. (1963) Increase in activity of alpha-aminolevulinic acid synthetase in liver mitochondria induced by feeding of 3,5-dicarbethoxy-1,4-dihydrocollidine. J Biol Chem.; 238: 821-827. Granick S. (1966) The induction in vitro of the synthesis of delta-aminolevulinic acid synthetase in chemical porphyria: a response to certain drugs, sex hormones, and foreign chemicals. J Biol Chem.; 241: 1359-1375. Granner DK. & Andreone TL. (1985) Insulin modulation of gene expression. Diabetes Metab Rev. 1985; 1: 139-170. Grant DL., Shields JB., Villeneuve DC. (1975) Chemical (HCB) porphyria: effect of removal of sex organs in the rat. Bull Environ Contam Toxicol.; 14: 422-425. 223 Citas Bibliográficas Grimsrud PA., Xie H., Griffin TJ., Bernlohr DA. (2008) Oxidative stress and covalent modification of protein with bioactive aldehydes. J Biol Chem.; 283: 21837-21841. Gross U., Sassa S., Jacob K., Deybach JC., Nordmann Y., Frank M., Doss MO. (1998) 5Aminolevulinic acid dehydratase deficiency porphyria: a twenty-year clinical and biochemical follow-up. Clin Chem.; 44: 1892-1896. Guerrero JM. & Reiter RJ. (2002) Melatonin-immune system relationships. Curr Topics Med Chem.; 2: 167-180. Gullino P., Winitz M., Birnbaum SM., Cornfield J., Otey MC., Greenstein JP. (1955) The toxicity of individual essential amino acids and their diastereomers in rats and the effect of blood sugar levels. Arch Biochem Biophys.; 58: 253-255. Gupta RP. & Abou-Donia MB. (1998) Cytochrome P450 enzymes in chickens: characteristics and induction by xenobiotics. Comp Biochem Physiol C: Pharmacol Toxicol Endocrinol.; 121: 73-83 Guyton KZ., Gorospe M., Kensler TW., Holbrook NJ. (1996) Mitogen-activated protein kinase (MAPK) activation by butylated hydroxytoluene hydroperoxide: implications for cellular survival and tumor promotion. Cancer Res.; 56: 3480-3485. Hall ER. & Cottam GL. (1978) Isozymes of pyruvate kinase in vertebrates: their physical, chemical and immunological properties. Int J Biochem.; 9: 785-793. Halliwell B. & Auroma OI. (1991) DNA damage by oxygen derived species. Its mechanism of action and measurement in mammalian systems. FEBS Lett.; 281: 9-19. Halliwell B. & Chirico S. (1998) Lipid Peroxidation: its mechanism measurement, and significance. Am J Clin Nutr.; 57: 715-725. Halliwell B. (1990) How to characterize a biological antioxidant. Free Rad Res Comm.; 9: 1-32 Halliwell B. & Gutteridge JMC. (1999) Free Radicals in Biology and Medicine, 3rd ed. London Oxford University Press, Oxford, England, pp. 450–622. Halliwell B. (1990) How to characterize a biological antioxidant. Free Rad Res Comm.; 9: 1-32 Hanson RW. & Reshef L. (1997) Regulation of phosphoenolpyruvate carboxykinase (GTP) gene expression. Ann Rev Biochem.; 66: 581–611. Hanson RW. (1974) The choice of animal species for studies of metabolic regulation. Nutr Rev.; 32: 1-8. Hanstein WG., Heitmann TD., Sandy A., Biesterfeldt HL., Liem HH., Müller-Eberhard U. (1981) Effects of hexachlorobenzene and iron loading on rat liver mitochondria. Biochim Biophys Acta; 678: 293-299. Harbin B. & Dayley H. (1985) Orientation of ferrochelatase in bovine liver mitochondria. Biochem.; 24: 366-370. 224 Citas Bibliográficas Hardeland R. & Pandi-Perumal SR. (2005) Melatonin, a potent agent in antioxidative defense: actions as a natural food constituent, gastrointestinal factor, drug and prodrug. Nutr Metab (Lond); 2: 1–15. Hardeland R., Balzer I., Poeggeler B., Fuhrberg B., Uria H., Bahrmann G., Wolf R., Meyer TJ., Reiter RJ. (1995) On the primary functions of melatonin in evolution: mediation of photoperiodic signals in unicell, photoxidation, and scavenging of free radicals. J Pineal Res.; 18: 104-111. Hardeland R., Coto-Montes A., Poeggeler B. (2003) Circadian rhythms, oxidative stress, and antioxidative defense mechanisms. Chronobiol Int.; 20: 921–962. Hasan NM., Longacre MJ., Stoker SW., Boonsaen T., Jitrapakdee S., Kendrick MA. (2008) Impaired anaplerosis and insulin secretion in insulinoma cells caused by siRNA mediated suppression of pyruvate carboxylase. J Biol Chem.; 283: 28048-28059. Hayashi N., Yoda B., Kikuchi G. (1969) Mechanism of allylisopropylacetamide-induced increase of delta-aminolevulinate synthetase in liver mitochondria. IV. Accumulation of the enzyme in the soluble fraction of rat liver. Arch Biochem Biophys.; 131: 83-91. Herbert V., Lau K., Gottlieb CW. (1965) Coated charcoal immunoassay of insulin. J Clin Endocrinol Metab 25: 1375-1384 Hers HG. & Hue L. (1983) Gluconeogenesis and related aspects of glycolysis. Annu Rev Biochem.; 52: 617-653. Hers HG. (1990) Mechanisms of blood glucose homeostasis. J Inherit Metab Dis.; 13: 395–410. Hertz L., Dringen R., Schousboe A., Robinson SR. (1999) Astrocytes: glutamate producers for neurons. J Neurosci Res.; 57: 417-428. Herzog B., Waltner-Law M., Scott DK., Eschrich K., Granner DK. (2000) Characterization of the human liver fructose-1,6-bisphosphatase gene promoter. Biochem J.; 351: 385-392. Heszele MF., Price SR. (2004) Insulin-like growth factor I: the yin and yang of muscle atrophy. Endocrinology; 145: 4803–4805. Hoffman R., Ibrahim N., Murnane MJ-, Diamond A., Forget BG., Levere RD. (1980) Hemin control of heme biosynthesis and catabolism in a human leukemia cell line Blood.; 56: 567-570. Horváth ME., Faux SP., Smith AG., Blázovics A., Van der Looij M., Fehér J., Cheeseman KH. (2001) Vitamin E protects against iron-hexachlorobenzene induced porphyria and formation of 8-hydroxydeoxyguanosine in the liver of C57BL/10ScSn mice. Toxicol Lett.; 122: 97-102. Hutton JC. & O’Brien RM. (2009) glucose-6-phosphatase catalytic subunit gene family. J Biol Chem.; 284: 29241-29245. Hyslop PA., Hinshaw DB., Halsey WA. Jr, Schraufstatter IU., Sauerheber RD., Spragg RG., Jackson JH., Cochrane CG. (1988) Mechanisms of oxidant-mediated cell injury. The glycolytic and mitochondrial pathways of ADP phosphorylation are major intracellular targets inactivated by hydrogen peroxide. J Biol Chem.; 263: 1665-1675. 225 Citas Bibliográficas Imamura K. & Tanaka T. (1982) Pyruvate kinase isozymes from rat. In: Wood, W.A. (Ed.), Methods in Enzymology, vol. 90. Carbohydrate Metabolism, Part E. Academic Press, New York, pp. 150-165. Inoue M., Sato EF., Nishikawa M., Park AM., Kira Y., Imada I., Utsumi K. (2003) Mitochondrial generation of reactive oxygen species and its role in aerobic life. Curr Med Chem. 10: 2495-2505. Iturri SJ. & Wolff D. (1982) Inhibition on the active transport of d-glucose and l-tyrosine by DDT and DDE in the rat small intestine. Comp. Biochem. Physiol.; 71: 131–134. Ivanov E., Savov G., Adjarov D. (1986). Changes in some intestinal enzyme activities in experimental hexachlorobenzene-induced porphyria and modifying effects of diet. In: Morris, C.R., Cabral, J.R.P. (Eds.) Hexachlorobenzene, Proceedings of an International Symposium, IARC Scientific Publication, vol. 77. pp. 611–618. Ivanov DE., Chernev K., Adjarov D., Krustev L., Georgiev G. (1976) In: Doss, M. (Ed.), Porphyrins in Human Diseases. 1st. International Porphyrin Meeting on Porphyrins in Humans Diseases, Karger, Basel, 438-444. Jackson AH., Sancovich HA., Ferramola AM., Evans N., Games DE., Matlin SA., Elder GH., Smith SG. (1976) Macrocyclic intermediates in the biosynthesis of porphyrins. Philos Trans R Soc Lond B Biol Sci.; 273: 191-206. Jackson AH., Jones DM., Philip G., Lash TD., Batlle AM., Smith SG. (1980) Synthetic and biosynthetic studies of porphyrins, Part IV. Further studies of the conversion of corporporhyrinogen-III to protoporphyrin-IX: mass spectrometric investigations of the incubation of specifically deuteriated coproporhyringen-III with chicken red cell haemolysates. Int J Biochem.; 12: 681-688. Jarrell J., Gocmen A., Foster W., Brant R., Chan S., Sevcik M. (1998) Evaluation of reproductive outcomes in women inadvertently exposed to hexachlorobenzene in southeastern Turkey in the 1950s. Reprod Toxicol., 12: 469-476. Jezek P. & Hlavatá L. (2005) Mitochondria in homeostasis of reactive oxygen species in cell, tissues and organism. Int J Biochem Cell Biol.; 37: 2478-2503. Jiang G. & Zhang BB. (2003) Glucagon and regulation of glucose metabolism. Am J Physiol Endocrinol Metab.; 284: 671-678. Jinks R., Mirsky IA., Perisutti G. (1957) The hypoglycemic action of metabolic derivatives of L-tryptophan by mouth. Endocrinology; 60: 318-324. Jitrapakdee S. (2012) Transcription factors and coactivators controlling nutrient and hormonal regulation of hepatic gluconeogenesis Int J Biochem Cell Biol.; 44: 33-45 Jitrapakdee S., Booker GW., Cassady AI., Wallace JC. (1997) The rat pyruvate carboxylase gene structure: alternate promoters generate multiple transcripts with the 5´-end heterogeneity. J Biol Chem.; 272: 20520-20528. Jitrapakdee S., Gong Q., MacDonald MJ., Wallace JC. (1998) Regulation of rat pyruvate carboxylase gene expression by alternate promoters during development, in genetically obese rats and in insulin-secreting cells. J Biol Chem.; 273: 34422-34428. 226 Citas Bibliográficas Jitrapakdee S., Maurice MS., Rayment I., Cleland WW., Wallace JC., Attwood PV. (2008) Structure, mechanism and regulation of pyruvate carboxylase. Biochem J.; 413: 369-387. Jitrapakdee S., Petchamphai N., Sunyakumthorn P., Wallace JC., Boonsaeng V. (2001) Structural and promoter regions of the murine pyruvate carboxylase gene. Biochem Biophys Res Commun.; 287: 411-417. Jitrapakdee S., Vidal-Puig A., Wallace JC. (2006) Anaplerotic roles of pyruvate carboxylase in mammalian tissues. Cell Mol Life Sci.; 63: 843-854. Kahn A. (1998) From the glycogenic function of the liver to gene regulation by glucose. C R Seances Soc Biol Fil.; 192: 813-827. Kalgutkar AS., Dalvie DK., O’Donnell JP., Taylor TJ., Sahakian DC. (2002) On the diversity of oxidative bioactivation reactions on nitrogen-containing xenobiotics. Curr Drug Metab.; 3 :379-424. Kappas A., Sassa S., Galbraith RA., Nordmann Y. (1989) The porphyrias. In: Stanbury JB, Wyngaarden JB, Fredrickson DS (Eds.). The Metabolic Basis of Inherited Disease McGraw-Hill, New York, pp. 1305-1365. Kappas A., Sassa S., Galbraith RA., Nordmann Y. (1995) The Porphyrias in Metabolic and molecular basis of inherited disease, Scriver, C.R., Beaudet, A.L., Sly W.S., Valle, D., Stanbury, J.B., Wibgaarden, J.B., and Fredickson, DS (Eds). McGrac-Hill, New York, 2103- 2159 Kasai H. & Nishimura S. (1984) Hydroxylation of deoxyguanosine at the C-8 position by ascorbic acid and other reducing agents. Nucleic Acids Res.; 12: 2137-2145. Kasza L., Weinberger MA., Carter C., Hinton DE., Trump BF., Brouwer EA. (1976) Acute, subacute, and residual effects of polychlorinated biphenyl (PCB) in rats. Part II. Pathology and electron microscopy of liver and serum enzyme study. J. Toxicol. Environ. Health.; 1: 689–703. Katsuma Y., Swierenga SHH., Khettry U., Marceau N., French SW. (1987) Changes in the cytokeratin intermediate filament cytoskeleton associated with Mallory body formation in mouse and human liver. Hepatology; 7: 1215-1223. Kawaguchi T., Takenoshita M., Kabashima T., Uyeda K. (2001) Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation /dephosphorylation of the carbohydrate response element binding protein. Proc Natl Acad Sci.; USA 98: 1371013715. Kayne FJ. (1973) Pyruvate kinase. In: Boyer, P.D. (Ed.), The Enzymes, Vol. VIII. pp. 353-382. Kennaway DJ. & Wright H. (2002) Melatonin and circadian rhythms. Curr Topics Med Chem.; 2: 199-209. Kleiman de Pisarev DL., Rios de Molina MC., San Martin de Viale LC. (1990) Thyroid function and thyroxine metabolism in hexachlorobenzene-induced porphyria. Biochem Pharmacol.; 39: 817-825. 227 Citas Bibliográficas Klover PJ. & Mooney RA. (2004) Hepatocytes: critical for glucose homeostasis. Int J Biochem Cell Biol.; 36: 753-758. Knox WE. & Auerback VR. (1955) The hormonal control of tryplophan peroxidase in the rat. J Biol Chem; 214: 307-313. Knox WE. (1951) Two mechanisms which increase in vivo the liver tryptophan peroxidase activity: specific enzyme adaptation and stimulation of the pituitary adrenal system. Br J Exp Pathol.; 32: 462-469. Knox WE. (1966) The regulation of tryptophan pyrrolase activity by tryptophan. Adv Enzyme Regul; 4: 287–297. Koc H. & Swenberg JA. (2002) Applications of mass spectrometry for quantitation of DNA adducts. J Chromatogr B Analyt Technol Biomed Life Sci.; 778: 323-343. Koss G., Seubert S., Seubert A., Koransky W., Ippen H. (1978) Studies on the toxicology of hexachlorobenzene. III. Observations in a long-term experiment. Arch Toxicol. 40: 285294. Kószó F., Horvath LI., Simon N., Siklosi C., Kiss M. (1982) The role of possible membrane damage in porphyria cutanea tarda: a spin label study of rat liver cell membranes. Biochem Pharmacol; 31: 11–17. Kuiper-Goodman T., Grant DL., Moodie CA., Korsrud GO., Munro IC. (1977) Subacute toxicity of hexachlorobenzene in the rat. Toxicol Appl Pharmacol. 1977; 40: 529-549. Kumar GN. & Surapaneni S. (2001) Role of drug metabolism in drug discovery and development. Med Res Rev.; 21: 397-411. Lacy PE. & Kostianovsky M. (1967) Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes 16: 35-39 Laftah AH., Simpson RJ., Peters TJ., Raja KB. (2008) The effect of haem biosynthesis inhibitors and inducers on intestinal iron absorption and liver haem biosynthetic enzyme activities. Toxicol Appl Pharmacol.; 229: 273-280. Leblanc A., Shiao TC., Roy R., Sleno L. (2010) Improved detection of reactive metabolites with a bromine-containing glutathione analog using mass defect and isotope pattern matching. Rapid Commun Mass Spectrom.; 24: 1241-1250. Lee DS., Flachsova E., Bodnarova M., Demeler B., Martasek P., Raman CS. (2005) Structural basis of hereditary coproporphyria. Proc Natl Acad Sci USA; 102: 14232-14237. Legault N., Sabik H., Cooper SF., Charbonneau M. (1997) Effect of estradiol on the induction of porphyria by hexachlorobenzene in the rat. Biochem Pharmacol.; 54: 19-25. Lei KJ., Chen H., Pan CJ., Ward JM., Mosinger Jr. B., Lee EJ., Westphal H., Mansfield BC., Chou JY. (1996) Glucose-6-phosphatase dependent substrate transport in the glycogen storage disease type-1a mouse. Nat Genet.; 13: 203–209. Leloir LF. & Goldemberg SH. (1960). Synthesis of glycogen from uridine diphosphate glucose in liver. J Biol Chem.; 235: 919-923. 228 Citas Bibliográficas Leloir LF., Olavarria JM., Goldemberg SH., Carminatti H. (1959) Biosynthesis of glycogen from uridine diphosphate glucose. Arch Biochem Biophys.; 81: 508-520. Levine RL., Williams JA., Stadtman ER., Shacter E. Carbonyl assays for determination of oxidatively modified proteins. L. Packer (Ed.), Methods in Enzymology, vol. 233: Oxygen Radicals in Biological Systems, Academic Press, San Diego (1994), pp. 346-357 Li CY. & Jackson RM. (2002) Reactive species mechanisms of cellular hypoxia-reoxygenation injury. Am J Physiol - Cell Physiol.; 282: 227-241. Lim CK., Rideout JM., Wright DJ. (1983) Separation of porphyrins isomers by highperformance liquid chromatography. Biochem J 211: 435-438 Lim HW. & Poh-Fitzpatrick MB. (1984) Hepatoerythropoietic porphyria: A variant of childhood-onset porphyria cutanea tarda: Porphyrin profiles and enzymatic studies of two cases in a family. J Am Acad Dermatol.; 11: 1103-1111. Lissoni P., Barni S., Cattaneo G., Tancini G., Esposti G., Esposti D., Fraschini F. (1991) Clinical results with the pineal hormone melatonin in advanced cancer resistant to standard antitumor therapies. Oncology; 48: 448-450. Litman DA. & Correia MA. (1983) L-Tryptophan: a common denominator of biochemical and neurological events of acute hepatic porphyria? Science; 222: 1031–1033. Liu PCC. & Matsumura F. (1995) Differential effects of 2,3,7,8- tetrachlorodibenzo-p-dioxin on the adipose- type and braintype glucose transporters in mice. Mol. Pharmacol.; 47: 65–73. Livanova NB., Chebotareva NA., Eronina TB., Kurganov BI. (2002) Pyridoxal 5'-phosphate as a catalytic and conformational cofactor of muscle glycogen phosphorylase B. Biochemistry; 67: 1089-1098. Llambías EBC. & Batlle AM. (1971) Porphyrin biosynthesis. 8. Avian erythrocyte porphobilinogen deaminase-uroporphyrinogen 3 cosynthetase, its purification, properties and the separation of its components. Biochim Biophys Acta.; 227: 180-191. Llambías EBC., Aldonatti C., San Martín de Viale LC. (2003) Tryptophan metabolism via serotonin in rats with hexachlorobenzene experimental porphyria. Biochem Pharmacol.; 66: 35–42. Llambías EBC., Mazzetti MB., Lelli SM., Aldonatti C., San Martín de Viale LC. (2004) Tryptophan metabolism and chronic hepatic porphyria. Biocell; (Supl.) 28: 68 CB-P57. Llambías EBC., Mazzetti MB., Lelli SM., Aldonatti C., San Martín de Viale LC. (2007) Melatonin formation in pineal gland from rats with hexachlorobenzene experimental porphyria. Int J Toxicol., 26: 545-551. Loftus LS. & Arnold WN. (1991) Vincent van Gogh's illness: acute intermittent porphyria? BMJ.; 303: 1589-1591. Loose DS., Cameron DK., Short HP., Hanson RW. (1985) Thyroid hormone regulates transcription of the gene for cytosolic phosphoenolpyruvate carboxykinase (GTP) in rat liver. Biochemistry; 24: 4509–4512. 229 Citas Bibliográficas Lowry O., Rosebrough N., Farr A., Randall R. (1951) Protein measurement with the folinphenol reagent. J. Biol. Chem. 193: 265-275. Lundquist I., Ekholm R., Ericson LE. (1971) Monoamines in the pancreatic islets of the mouse. 5-hydroxytryptamine as an intracellular modifier of insulin secretion, and the hypoglycaemic action of monoamine oxidase inhibitors. Diabetologia; 7: 414-422. Ma S. & Subramanian R. (2006) Detecting and characterizing reactive metabolites by liquid chromatography/tandem mass spectrometry. J Mass Spectrom.; 41: 1121-1139. Macalpine I. & Hunter R. (1966) The "insanity" of King George 3rd: a classic case of porphyria. Br Med J.; 1: 65-71. Madan P., Schaaf CP., Vardhan P., Bhayana S., Chandra P., Anderson KE. (2007) Hans Gunther and his disease. Photodermatol Photoimmunol Photomed.; 23: 261-263. Maechler P. & Wollheim CB. (2001) Mitochondrial function in normal and diabetic beta-cells. Nature.; 414: 807-812. Malkoski SP. & Dorin RI. (1999) Composite glucocorticoid regulation at a functionally defined negative glucocorticoid response element of the human corticotropin-releasing hormone gene. Mol Endocrinol.; 13: 1629–1644. Mantha L., Palacios E., Deshaies, Y. (1999) Modulation of triglyceride metabolism by glucocorticoids in diet-induced obesity. Am J Physiol.; 277: R455–R464. Markert M., Andrews PC., Babior BM. (1984) Measurement of O2- production by human neutrophils. The preparation and assay of NADPH oxidase-containing particles from human neutrophils. Methods Enzymol.; 105: 358-365. Marks GS., McCluskey SA., Mackie JE., Riddick DS., James CA. (1988) Disruption of hepatic heme biosynthesis after interaction of xenobiotics with cytochrome P-450. FASEB J.; 2: 2774–2783. Marks TA., Gerling FS., Staples RE. (1982) Teratogenic evaluation of epichlorohydrin in the mouse and rat and glycidol in the mouse. J Toxicol Environ Health.; 9: 87-96. Martasek P., Camadro JM., Raman CS., Lecomte MC., Le Caer JP., Demeler B., Grandchamp B., Labbe P. (1997) Human coproporphyrinogen oxidase. Biochemical characterization of recombinant normal and R231W mutated enzymes expressed in E. coli as soluble, catalytically active homodimers. Cell Mol Biol.; 43: 47–58. Marver HS., Tschudy DP., Perlroth MG., Collins A. (1966) Delta-aminolevulinic acid synthetase. I. Studies in liver homogenates. J Biol Chem.; 241: 2803-2089. Mates JM., Perez-Gomez C., De Castro IN. (1999) Antioxidant enzymes and human diseases, Clin Biochem.; 32: 595-603. Mathews MA., Schubert HL., Whitby FG., Alexander KJ., Schadick K., Bergonia HA., Phillips JD., Hill CP. (2001) Crystal structure of human uroporphyrinogen III synthase. Embo J.; 20: 5832-5839. 230 Citas Bibliográficas Mattevi A., Bolognesi M., Valentini G. (1996) The allosteric regulation of pyruvate kinase. FEBS Lett. 389: 15-19. Mauzerall D. & Granick S. (1956) The occurrence and determination of delta-amino-levulinic acid and porphobilinogen in urine. J Biol Chem. 219: 435-446. Mauzerall D. & Granick S. (1958) Porphyrin biosynthesis in erythrocytes. III. Uroporphyrinogen and its decarboxylase. J Biol Chem. 232: 1141-1162 May BK., Dogra SC., Sadlon TJ., Bhasker CR., Cox TC., Bottomley SS. (1995) Molecular regulation of heme biosynthesis in higher vertebrates. Prog Nucleic Acid Res Mol Biol.; 51: 1-51. Mazzetti MB., Taira MC., Lelli SM., Dascal E., Basabe JC., San Martín de Viale LC. (2004) Hexachlorobenzene impairs glucose metabolism in a rat model of porphyria cutanea tarda: a mechanistic approach. Arch Toxicol; 78: 25–33. Mazzetti MB. & Tomio JM. (1988) Characterización of Porphobilinogen Deaminase from rat liver. Biochem Biophys Acta.; 957: 97-104. Mazzetti MB. & Tomio JM. (1990) Kinetic and molecular parameters of human hepatic Porphobilinogen Deaminase. Biochem Internat.; 21: 463-471. Mazzetti MB. & Tomio JM. (1993) Human Porphobilinogen Deaminase. Isolation and purification of hepatic isoform. An Asoc Quím Argent.; 81: 381-389. Mazzetti MB. & Tomio JM. (1997) Studies on the catalitic activity of human hepatic porphobilinogen deaminase. Biochem Mol Biol Int.; 42: 685-692. McDaniel HG., Boshell BR., Reddy WJ. (1973) Hypoglycemic action of tryptophan. Diabetes; 22: 713-718. Medina E., Carbajal B., Ponce C., Sandoval N., Valladares E. (2000) The Porphyrias. Rev Med Hond.; 68: 16-24. Meguro K., Igarashi K., Yamamoto M., Fujita H., Sassa S. (1995) The role of the erythroidspecific delta-aminolevulinate synthase gene expression in erythroid heme synthesis. Blood; 86: 940-948. Mehmood Z., Williamson MP., Kelly DE., Kelly SL. (1996) Metabolism of organochlorine pesticides: the role of human cytochrome P450 3A4. Chemosphere; 33: 759-769. Méndez M., Rossetti MV., Batlle AM del C., Parera VE. (2005) The role of inherited and acquired factors in the development of porphyria cutanea tarda in the Argentinean population. J Am Acad Dermatol; 52: 417-424. Mendoza-Figueroa T., Hernandez A., De Lourdes Lopez FM., Kuri-Harcuch W. (1988) Intracytoplasmic triglyceride accumulation produced by dexamethasone in adult rat hepatocytes cultivated on 3T3 cells. Toxicology; 52: 273–286. Meyer UA. & Marver HS. (1971) Porphyrin biosynthesis. Enhancement of the fractional catabolic rate of microsomal haem in chemically induced porphyria. S Afr Med J.; 25: 175-177. 231 Citas Bibliográficas Michielsen CC., Van Loveren H., Vos JG. (1999) The role of the immune system in hexachlorobenzene induced toxicity. Environ Health Perspect.; 107: 783-792. Misra HP. & Fridovich I. (1972) The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J Biol Chem. 247: 3170-3175. Mithieux G. (1997) New knowledge regarding glucose-6 phosphatase gene and protein and their roles in the regulation of glucose metabolism. Eur J Endocrinol.; 136: 137–145. Moldovan L. & Moldovan NI. (2004) Oxygen free radicals and redox biology of organelles. Histochem Cell Biol.; 122: 395-412. Mollenhauer HH., Jhonson JH., Younger RL., Clark DE. (1975) Ultrastructural changes in liver of the rat fed hexachlorobenzene, Am J Vet Res.; 36: 1777-1781. Moran GR. & Fitzpatrick PF. (1999) A continuous fluorescence assay for tryptophan hydroxylase. Anal Biochem. 266: 148-152. Morel Y. & Barouki R. (1998) Down-regulation of cytochrome P450 1A1 gene promoter by oxidative stress. Critical contribution of nuclear factor 1. J Biol Chem., 273: 2696926976. Morgan CJ. & Badawy AA. (1992) Effects of acute carbamazepine administration on haem metabolism in rat liver. Biochem Pharmacol; 43: 1473–1477. Muñoz ME. & Ponce E. (2003) Pyruvate kinase: current status of regulatory and functional properties. Comp Biochem Phys B.; 135: 197-218 Musajo L. & Benassi CA. (1964) Aspects of disorders of the kynurenine pathway of tryptophan metabolism in man. Adv Clin Chem.; 7: 63-135. Mylchreest E. & Charbonneau M. (1997) Studies on the mechanism of uroporphyrinogen decarboxylase inhibition in hexachlorobenzene-induced porphyria in the female rat. Toxicol Appl Pharmacol.; 145: 23-33. Nakao K., Wada O., Takaku F., Sassa S., Yano Y., Urata G. (1967) The origin of the increased protoporphyrin in erythrocytes of mice with experimentally induced porphyria. J Lab Clin Med.; 70: 923-932. Navone NM., Buzaleh AM., Polo CF., Afonso SG., Vázquez ES., Batlle AM. (1991) The effect of griseofulvin on the heme pathway -II. An exhaustive analysis during short and longterm challenge. Gen Pharmacol.; 22: 1179-1183. Newman JD. & Armstrong JM. (1978) On the activities of glycogen phosphorylase and glycogen synthase in the liver of the rat. Biochim. Biophys. Acta. 544: 225-233 Ng TB, Liu F, Zhao L. (2000) Antioxidative and free radical scavenging activities of pinealindoles. J Neural Transm.; 107: 1243–1251. Nielsen E. (1953) Porphyria due to drugs; preliminary report. Ugeskr Laeger.; 115: 1616-1618. Nishizumi, M. (1970) Light and electron microscope study of chlorobiphenyl poisoning: in mouse and monkey liver. Arch Environ Health.; 21: 620–632. 232 Citas Bibliográficas Noguchi T., Inoue H., Tanaka T. (1986) The M1- and M2-type isozymes of rat pyruvate kinase are produced from the same gene by alternative RNA splicing. J Biol Chem.; 261:1380713812. Noguchi T., Yamada K., Inoue H., Matsuda T., Tanaka T. (1987) The L- and R-type isozymes of rat pyruvate kinase are produced from a single gene by use of different promoters. J Biol Chem.; 262: 14366-14371. Nordlie RC., Foster JD., Lange AJ. (1999) Regulation of glucose production by the liver. Annu Rev Nutr.; 19: 379–406. O’Brien PJ., Siraki AG., Shangari N. (2005) Aldehyde sources, metabolism, molecular toxicity mechanisms, and possible effects on human health. Crit Rev Toxicol.; 35: 609-662. Oehler R., Weingartmann G., Manhart N., Saizer U., Meissner M., Schlegel W. (2000) Polytrauma induces increased expression of pyruvate kinase in neutrophils. Blood; 95: 1086-1092. Ohkawa H., Ohishi N., Yagi. K. (1979) Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal. Biochem. 95: 351-358. Oishi K., Amagai N., Shirai H., Kadota K., Ohkura N., Ishida N. (2005) Genome-wide expression analysis reveals 100 adrenal gland-dependent circadian genes in the mouse liver. DNA Res.; 12: 191–202. Ortiz de Montellano PR. & Correia MA. (1995) Inhibition of Cytochrome P450 enzymes. In P.R. Ortiz de Montellano (Ed.), Cytochrome P450: Structure, mechanism and biochemistry, 2da Ed. NuevaYork: Plenum Press, 305-364 Ortiz de Montellano PR. & Mico BA. (1981) Destruction of cytochrome P-450 by allylisopropyl-acetamide is a suicidal process. Arch Biochem Biophys. ; 206 : 43–50. Pappolla MA., Chyan YJ., Poeggeler B., Frangione B., Wilson G., Chiso J., Reiter RJ. (2000) An assessment of the antioxidant and antiamyloidogenic properties of melatonin: Implications for Alzheimer’s disease. J Neural Transm.; 107: 203-231. Parera VE., De Siervi A., Varela LS., Rossetti MV., Batlle A. (2003) Acute Porphyrias in the Argentinean population. A review. Cell Mol Biol.; 49: 493-500. Pastor N., Weinstein H., Jamison E., Brenowitz M. (2000) A detailed interpretation of OH radical footprints in a TBP-DNA complex reveals the role of dynamics in the mechanism of sequence-specific binding. J Mol Biol.; 304: 55-68. Peters JC. (1991) Tryptophan nutrition and metabolism: an overview. In: Schwarcz R, et al, editors. Kynurenine and serotonin pathways. New York 7 Plenum Press. pp. 345-358. Petrescu I., Bojan O., Saied M., Barzu O., Schmidt F., Kuhnle HF. (1979) Determination of phosphoenolpyruvate carboxykinase activity with deoxyguanosine 5′-diphosphate as nucleotide substrate Anal. Biochem. 96: 279-281. Pierach CA. & Jennewein E. (1999) Friedrich Wilhelm I and porphyria. Sudhoffs Arch.; 83: 5066. 233 Citas Bibliográficas Pierpaoli W. & Regelson W. (1995) The melatonin miracle, nature´s age-reversing, diseasefighting, sex-enhancing hormone. Simon & Shuster, New York, 1995. Pigeolet E., Corbisier P., Houbion A., Lambert D., Michiels C., Raes M., Zachary MO. (1990). Superoxide dismutase, and catalase inactivation by peroxides and oxygen derived free radicals. Mech Age Oev.; 1: 283-297. Pilkis SJ. & Granner DK. (1992) Molecular physiology of the regulation of hepatic gluconeogenesis and glycolysis. Annu Rev Physiol.; 54: 885–909. Pinilla M., Pérez-Artes E., Roncales P., Tejero C., Luque J. (1982) Glycolytic regulatory enzymes in erythrocytes, reticulocytes and immature bone marrow cells of rats. Rev Esp Fisiol.; 38: 97-100. Piper WN., Condie LW., Tephly TR. (1973) The role of substrates for glycine acyltransferase in the reversal of chemically induced porphyria in the rat Arch. Biochem. Biophys. 159: 671-677 Poli G., Leonarduzzi G., Biasi F., Chiarpotto E. (2004) Oxidative stress and cell signalling. Curr Med Chem.; 11: 1163-1182. Polo C., Navone N., Afonso S., Buzaleh AM., Schoua E., Vazquez E., Batlle A. (1988) Allylisopropylacetamide and glycerine reproduce clinical and biochemical manifestations of acute intermittent porphyria in mice. Med Sci Res.; 15: 1335-1336. Ponka P. (1999) Cell biology of heme. Am J Med Sci.; 318: 241-256. Poon AM., Liu ZM., Pang CS., Brown GM., Pang SF. (1994) Evidence for a direct action of melatonin on the immune system. Biol Signals.; 3: 107-117. Porra RJ. & Jones OT. (1963) Studies on ferrochelatase. I. Assay and properties of ferrochelatase from a pig-liver mitochondrial extract. Biochem. J. 87: 181-185 Potluri VR., Astrin KH., Wetmur JG., Bishop DF., Desnick RJ. (1987) Human deltaaminolevulinate dehydratase: chromosomal localization to 9q34 by in situ hybridization. Hum Genet.; 76: 236–239. Pozzi AG., Lantos CP., Ceballos NR. (1997) Subcellular localization of 3 beta hydroxysteroid dehydrogenase isomerase in testis of Bufo arenarum H. Gen Comp Endocrinol. 106: 400406. Price JM. (1961) Some effects of chelating agents on tryptophan metabolism in man. Fed Proc; 20: 223–226. Price JM., Brown RR., Yess N. (1965) Testing the functional capacity of the tryptophan–niacin pathway in man by analysis of urinary metabolites. Adv Metab Disord.; 2: 159-225. Price VE., SterlingWR., Tarantola VA., Hartley Jr. RW., Rechcigl Jr. M. (1962). The kinetics of catalase synthesis and destruction in vivo. J Biol Chem.; 237: 3468–3475. Pulido, JA., del Hoyo N., Perez-Albarsanz MA. (1990) Effects of lindane on the glucose metabolism in rat brain cortex cells. Life Sci.; 47: 1099–1107. 234 Citas Bibliográficas Qin X., Tan Y., Wang L., Wang Z., Wang B., Wen X., Yang G., Xi Z., Shen Y. (2011) Structural insight into human variegate porphyria disease. Faseb J.; 25: 653-654. Queiroz ML., Bincoletto C., Perlingeiro RC., Quadros MR., Souza CA. (1998) Immunoglobulin levels in workers exposed to hexachlorobenzene. Hum Exp Toxicol.; 17: 172-175. Queiroz ML., Bincoletto C., Perlingeiro RC., Souza CA., Toledo H. (1997) Defective neutrophil function in workers occupationally exposed to hexachlorobenzene. Hum Exp Toxicol.; 16: 322-326. Raber J. (1998). Detrimental effects of chronic hypothalamic-pituitary-adrenal axis activation. From obesity to memory deficits. Mol Neurobiol. 18: 1–22. Randi AS., Sancovich HA., Ferramola de Sancovich AM., Loaiza A., Krawiec L., Kleiman de Pisarev DL. (1998) Hexachlorobenzene-induced alterations of rat hepatic microsomal membrane function. Toxicology; 125: 83-94. Ray PD., Foster DO., Lardy HA. (1966) Paths of carbon in gluconeogenesis and lipogenesis. IV. Inhibition by L-tryptophan of hepatic gluconeogenesis at the level of phosphoenolpyruvate formation. J Biol Chem.; 241: 3904-3908. Regelson W. & Pierpaoli W. (1987) Melatonin: a rediscovered antitumor hormone? Its relation to surface receptors; sex steroid metabolism, immunologic response, and chronobiologic factors in tumor growth and therapy. Cancer Invest.; 5: 379-385. Reilly PM. & Bulkley GB. (1990) Tissue injury by free radicals and other toxic oxygen metabolites. Br J Surg.; 77: 1324-1325. Reiter R. (1988) Neuroendocrinology of Melatonin en Melatonin, Clinical Perspectives. Philbrick DRS Oxford. Oxford University Press. Reiter RJ. (1991) Pineal melatonin: Cell biology of its synthesis and of its physiological interactions. Endocrine Rev.; 12: 151-180. Reiter RJ. (1993) Interactions of the pineal hormone melatonin with oxygen-centered free radicals: a brief review. Brazilian J Med Biological Res.; 26: 1141-1155. Reiter RJ. (1998a) Oxidative damage in the central nervous system: protection by melatonin. Prog Neurobiol.; 56: 359–384. Reiter RJ. (1998b) Melatonin, active oxygen species and neurological damage. Drug News Perspect. 11: 291–296. Reiter RJ. (1999) Oxidative damage to nuclear DNA: amelioration by melatonin. Neuroendocrinol Lett.; 10: 145–150. Reiter RJ., Carneiro RC., Oh CS. (1997a) Melatonin in relation to cellular antioxidative defense machanisms. Horm Metab Res.; 29: 363-372. Reiter RJ., Tan D., Poeggeler D., Menendez-Pelaez A., Chen L., Saarela S. (1994) Melatonin as free radical scavenger: Implications for aging and aging-related diseases. Annals NY Ac. Sciences.; 721: 1-12. 235 Citas Bibliográficas Reiter RJ., Tan DX., Kim SJ., Manchester LC., Qi W., Garcia JJ., Cabrera JC., El-Sokkary G., Rouvier-Garay V. (1999) Augmentation of indices of oxidative damage in life-long melatonin deficient rats. Mech Ageing Dev.; 110: 157-173 Reiter RJ., Tan DX., Kim SJ., Qi W. (1998) Melatonin as a pharmacological agent against damage to lipids and DNA. Proc West Pharmacol Soc.; 41: 229-236. Reiter RJ., Tan DX., Maldonado MD (2005) Melatonin as an antioxidant: physiology versus pharmacology. J Pineal Res.; 39: 215-216. Reiter RJ., Tan DX., Manchester LC., Qi W. (2001) Biochemical reactivity of melatonin with reactive oxygen and nitrogen species: A review of the evidence. Cell Biochem Biophys.; 34: 237-256. Reiter RJ., Tan DX., Mayo JC., Sainz RM., Leon J., Czarnochi Z. (2003) Melatonin as an antioxidant: biochemical mechanism and pathophysiol implications in human: a review Acta Biochim Pol.; 50: 1129-1146 Reiter RJ., Tan DX., Osuna C., Gitto E. (2000) Actions of melatonin in the reduction of oxidative stress. J Biomed Sci.; 7: 444–458. Reiter RJ., Tan DX., Pilar TM., Flores LJ., Czarnocki Z. (2007) Melatonin and its metabolites: new findings regarding their production and their radical scavenging actions. Acta Biochim Pol.; 54: 1-9. Reiter RJ., Tan DX., Sainz RM., Mayo JC. (2002c) Melatonin: Reducing the toxicity and increasing the efficacy of drugs. J Pharm Pharmacol.; 54: 299-321. Reiter RJ., Tang L., García JJ., Muñoz Hoyos A. (1997b) Pharmacological actions of melatonin in oxigen radical pathophysiology. Life Sci.; 60: 2255-2271. Reiter RJ., Tan DX., Osuna C., Gitto E. (2000) Actions of melatonin in the reduction of oxidative stress: A review. Journal of Biomedical Science 7: 444-458. Ren S. & Correia MA. (2000) Heme: a regulator of rat hepatic tryptophan 2,3-dioxygenase? Arch Biochem Biophys.; 377: 195-203. Reshef L., Olswang Y., Cassuto H., Blum B., Croniger CM., Kalhan SC. (2003) Glyceroneogenesis and the triglyceride/fatty acid cycle. J Biol Chem.; 278: 30413-30416. Reznick AZ. & Packer L. (1994) Oxidative damage to proteins: spectrophotometric method for carbonyl assay. L. Packer (Ed.), Methods in Enzymology, vol. 233: Oxygen Radicals in Biological Systems, Academic Press, San Diego. pp. 357-363. Rimington C. & Sveinsson SL. (1950) The spectrophotometric determination of uroporphyrin. Scand J Clin Lab Invest. 2: 209-216. Rimington C., Holiday ER., Jope EM. (1948) Indigoid pigments derived from pathological urine. Biochem J.; 40: 669-677. Ríos de Molina MC., Suarez Lissi MA., Armesto A., Lafourcade C., Lissi E. (1998) Rat urinary chemiluminiscence. Biolumin Chemilumin.; 13: 63–68 236 Citas Bibliográficas Ríos de Molina MC., Wainstok de Calmanovici R., San Martín de Viale LC. (1980) Investigations on the presence of porphyrinogen carboxy-lyase inhibitor in the liver of rats intoxicated with hexachlorobenzene. Int. J. Biochem.; 12: 1027-1032. Ríos de Molina MC., Taira MC., San Martín de Viale LC. (1989) Liver ferrochelatase from normal and hexachlorobenzene porphyric rats. Studies on their properties. Int J Biochem.; 21: 219-225. Roach PJ. (2002) Glycogen and its metabolism, Curr. Mol. Med.; 2: 101–120. Roach PJ., Cheng C., Huang D., Lin A., Mu J., Skurat AV., Wilson W., Zhai L. (1998) Novel aspects of the regulation of glycogen storage. J Basic Clin Physiol Pharmacol.; 9, 139151. Roberts AG., Whatley SD., Daniels J., Holmans P., Fenton I., Owen MJ., Thompson P., Long C., Elder GH. (1995) Partial characterization and assignment of the gene for protoporphyrinogen oxidase and variegate porphyria to human chromosome 1q23. Hum Mol Genet.; 4: 2387-2390. Rodríguez C., Mayo JC., Sainz RM., Antolin I., Herrera F., Martin V., Reiter RJ. (2004) Regulation of antioxidant enzymes: a significant role of melatonin: a mini review. Pineal Res.; 36: 1-9. Rose JA., Hellman ES., Tschudy DP. (1961) Effect of diet on induction of experimental porphyria. Metabolism; 10: 514-521. Rousu T., Pelkonen O., Tolonen A. (2009) Rapid detection and characterization of reactive drug metabolites in vitro using several isotope-labeled trapping agents and ultra-performance liquid chromatography/time-of-flight mass spectrometry. Rapid Commun Mass Spectrom.; 23: 843-855. Rozman KK., Doull J., Hayes WJ. Jr. (2001) Chapter 1 - Dose, Time, and Other Factors Influencing Toxicity Handbook of Pesticide Toxicology (Second Edition), Vol 1: pp 193. Ryan MP., Gifford JD., Solomon SS., Duckworth WC. (1985) The Calcium Dependence of Insulin Degradation by Rat Skeletal Muscle. Endocrinology; 117: 1693-1698. Saltiel AR. (2001). New perspectives into the molecular pathogenesis and treatment of type 2 diabetes. Cell.; 104: 517–529. Saltiel AR. & Kahn CR. (2001) Insulin signalling and the regulation of glucose and lipid metabolism. Nature.; 414: 799-806. Samra JS., Clark ML., Humphreys SM., MacDonald IA., Bannister PA., Frayn KN. (1998) Effects of physiological hypercortisolemia on the regulation of lipolysis in subcutaneous adipose tissue. J Clin Endocrinol Metab.; 83: 626–631 San Martín de Viale LC. (1970) Biosíntesis del Hemo. Purificación y caracterización de las porfirinas urinarias en porfiria humana y experimental. Porfirinógenos de 5- y 6-COOH (Isómero III) como intermediarios normales en la biosíntesis del hemo. Tesis para optar al título de Doctora en Química, QB. FCEyN.UBA 237 Citas Bibliográficas San Martín de Viale LC. (1979) Drogas porfirinogénicas. Efecto adverso de ciertas drogas sobre el cuadro clínico y bioquímico de la porfiria. La Semana Médica; 155: 95-105. San Martín de Viale LC. (2007) Drogas y Porfirias. En reconocimiento al Dr. Juan M. Castagnino: Industria & Química; 357: 26-32. San Martín de Viale LC. & Grinstein M. (1968a) Porphyrin Biosynthesis IV: 5- and 6-COOH porphyrinogens (type III) as normal intermediates in haem biosynthesis. Biochem et Biophys Acta.; 158: 79-91. San Martín de Viale LC. & Grinstein M. (1968b) Porfiria eritropoyética humana. Estudio químico sobre la naturaleza de las porfirinas urinarias. Actas del Primer Congreso Latinoam. Bioquím. Clín.; 2: 241-248. San Martín de Viale LC., Aragonés A., Tomio JM. (1976) Tetrapyrroles as substrates and inhibitors of porphyrinogen carboxy-lyase from rat liver. Acta Fisiol Latinoamer.; 26: 403-414. San Martín de Viale LC, García RC, Kleiman-Pisarev D, Tomio JM, Grinstein M (1969). Studies on uroporphyrinogen decarboxylase from chicken erythrocytes. FEBS Letters; 5: 149-152 San Martín de Viale LC., Ríos de Molina M del C., Wainstok de Calmanovici R., Tomio JM. (1977) Porphyrins and porphyrinogen carboxy-lase in hexachlorobenzene-induced porphyria. Biochem J.; 168: 393-400. San Martín de Viale LC, Tomio JM, Ferramola AM, Sancovich HA, Tigier HA (1976a) Experimental porphyria induced in rats by hexachlorobenzene. Studies on enzymes associated with haem pathway. The effect of 17β estradiol. First International Porphyrin Meeting: Porphyrins in Human Diseases. Freiburg (1975) publicado por Karger Basel 1976, 1: 453-458. San Martín de Viale LC., Ríos de Molina MC., Wainstok de Calmanovici R., Tomio JM. (1976b). Experimental porphyria induced in rats by hexachlorobenzene. Studies on stepwise decarboxylation of uroporphyrinogen and phyriaporphyrinogen "in vivo" and "in vitro" in several tissues. Porphyrins in Human Diseases. Freiburg (1975) publicado por Karger Basel 1976, Freiburg 1: 445-452 San Martín de Viale LC., Ríos de Molina MC., Wainstok de Calmanovici R., Tomio (1977) Porphyrins and Porphyrinogen carboxy-lyase in hexachlorobenzene induced porphyria. Biochem J.; 168: 393-400. San Martín de Viale LC., Russo MC., Grinstein M. (1968) Porfiria experimental en ratas inducidas por hexaclorobenceno - Efecto de 17 β estradiol. Actas del Primer Congreso Latinoam Bioquím Clín.; 1: 168-174. San Martín De Viale LC., Tomio JM., Ferramola de Sancovich AM., Sancovich HA., Tigier HA. (1976) Experimental porphyria induced in rats by hexachlorobenzene-studies on enzymes associated with haem pathway- effect of 17-betaoestradiol. In: Doss M, editor. Proceedings of the first international porphyrin meeting: porphyrins in human diseases. pp. 453–458. 238 Citas Bibliográficas San Martín de Viale LC., Viale A., Nacht S., Grinstein M. (1970) Experimental porphyria induced in rats by hexachlorobenzene. A Study of the porphyrins excreted by urine. Clin. Chim. Acta.; 28: 13-23 Sassa S. & Granick S. (1970) Induction of -aminolevulinic acid synthetase in chick embryo liver cells in cluture. Proc Natl Acad Sci USA.; 67: 517-522. Sassa S. (1982) Delta-aminolevulinic acid dehydratase assay. Enzyme; 28: 133-145. Sassa S. (1998) ALA-D porphyria. Semin Liver Dis.; 18: 95-101. Schiebel K., Perkel E., Mayer D. (1992) The nucleotide sequence of rat liver glycogen phosphorylase cDNA. Biochim Biophys Acta.; 1130: 349–351. Schimke RT, Sweeney EW, Berlin CM. (1965) The roles of synthesis and degradation in the control of rat liver tryptophan pyrrolase. J Biol Chem.; 240: 322–331. Schmid R. & Schwartz S. (1952) Experimental porphyria. III. Hepatic type produced by Sedormid. Proc Soc Exp Biol Med.; 81: 685-689. Schmoll D., Wasner C., Hinds CJ., Allan BB., Walther R., Burchell A. (1999) Identification of a cAMP response element within the glucose-6-phosphatase hydrolytic subunit gene promoter which is involved in the transcriptional regulation by cAMP and glucocorticoids in H4IIE hepatoma cells. Biochem J.; 338: 457–463. Schoenfeld N., Greenblat Y., Epstein O., Beigel Y., Atsmon A. (1985) Impairment of induction of delta-aminolevulinic acid synthase by glycogenic aminoacids and carbohydrates in vitro., Metabolism.; 34: 106-111. Schüller A, Enriquez de Salamanca R (2000) Metabolismo de las porfirinas y porfirias. Ed. Complutense. Madrid. España. Scrutton MC., Keech DB., Utter MF. (1965) Pyruvate carboxylase. IV. Partial reactions and the locus of activation by acetyl-coenzyme A. J Biol Chem.; 240: 574-581. Seckl JR., Morton NM., Chapman KE., Walker BR. (2004) Glucocorticoids and 11betahydroxysteroid dehydrogenase in adipose tissue. Recent Prog Horm Res.; 59: 359–393. Seed MP. & Willoughby DA. (1997) COX-2, HO NO! Cyclooxygenase-2, heme oxygenase and nitric oxide synthase: their role and interactions in inflammation. BIRAs Symposium, Saint Bartholomew's Hospital, London, 26 April 1996. Inflamm Res.; 46: 279-281. Seldén AI., Floderus Y., Bodin LS., Westberg HB., Thunell S. (1999) Porphyrin status in aluminum foundry workers exposed to hexachlorobenzene and octachlorostyrene. Arch Environ Health.; 54: 248-253. Shibutani S., Takeshita M., Grollman AP. (1991) Insertion of specific bases during DNA synthesis past the oxidation-damaged base 8-oxodG. Nature; 349: 431-434. Sinclair PR., Gorman N., Walton HS., Bement WJ., Dalton TP., Sinclair JF., Smith AG., and Nebert DW. (2000) CYP1A2 is essential in murine uroporphyria caused by hexachlorobenzene and iron. Toxicol Appl Pharmacol.; 162: 60-67. 239 Citas Bibliográficas Smith AG. & Cabral JR. (1980) Liver-cell tumours in rats fed hexachlorobenzene. Cancer Lett.; 11: 169-172. Smith AG. & De Matteis F. (1980) Drugs and the hepatic porphyrias. Clin Haematol.; 9: 399425. Smith AG. & De Matteis F. (1990) Oxidative injury mediated by the hepatic cytochrome P-450 system in conjunction with cellular iron. Effects on the pathway of haem biosynthesis. Xenobiotica; 20: 865-877. Smith AG. & Francis JE. (1981) Increased inhibition of hepatic uroporphyrinogen decarboxylase by hexachlorobenzene in male rats given the oestrogenic drugs diethylstilboestrol and chlorotrianisene. Biochem Pharmacol.; 30: 1849-1853. Smith AG. & Francis JE. (1983) Synergism of iron and hexachlorobenzene inhibits hepatic uroporphyrinogen decarboxylase in inbred mice. Biochem J.; 214: 909-913. Smith AG., Cabral JR, De Matteis F. (1979) A difference between two strains of rats in their liver non-haem iron content and in their response to the porphyrogenic effect of hexachlorobenzene. Chem Biol Interact.; 27: 353-363. Smith AG., Francis JE., Dinsdale D., Manson MM., Cabral JR. (1985) Hepatocarcinogenicity of hexachlorobenzene in rats and the sex difference in hepatic iron status and development of porphyria. Carcinogenesis; 6: 631-636. Smith SA. & Pogson CI. (1977) Tryptophan and the control of plasma glucose concentrations in the rat. Biochem J.; 168: 495-506. Soglia JR., Contillo LG., Kalgutkar AS., Zhao S., Hop CE., Boyd JG., Cole MJ. (2006) A semiquantitative method for the determination of reactive metabolite conjugate levels in vitro utilizing liquid chromatography-tandem mass spectrometry and novel quaternary ammonium glutathione analogues. Chem Res Toxicol.; 19: 480-490. Song G., Li Y., Cheng C., Zhao Y., Gao A., Zhang R., Joachimiak A., Shaw N., Liu ZJ. (2009) Structural insight into acute intermittent porphyria. Faseb J.; 23: 396-404. Sorianello EM. & Mazzetti MB. (2000a) Function and structure of rat hepatic Coproporohyrinogen Oxidase. Comp Biochem Physiol B Biochem Mol Biol.; 127: 155164. Sorianello EM. & Mazzetti MB. (2000b) Simple and rapid method for the determination of Coproporphyrinogen Oxidase” J Biochem Biophys Methods.; 45: 75-86. Spydervold OS., Zaheer-Baquer N., McLean P., Greenbaum AL. (1974) The effect of quinolinic acid on the content and distribution of hepatic metabolites. Arch Biochem Biophys.; 164: 590-601. Srivastava G., Borthwick IA., Maguire DJ., Elferink CJ., Bawden MJ., Mercer JF., May BK. (1988) Regulation of 5-aminolevulinate synthase mRNA in different rat tissues. J Biol Chem.; 263: 5202-5209. 240 Citas Bibliográficas Stahl BH., Beer DG., Weber LWD., Rozman K. (1993) Reduction of hepatic phosphoenolpyruvate carboxykinase (PEPCK) activity by 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) is due to decreased mRNA levels. Toxicology; 79: 81-95. Stella AM., Parera VE., Llambías EB., Batlle AM. (1971) Pyrrylmethane intermediates in the synthesis of uroporphyrinogen 3 by soybean callus porphobilinogenase. Biochim Biophys Acta; 252: 481-488. Stevens N. (1996) El milagroso poder de la melatonina. Editorial Sirio SA. Málaga.España. Stohs SJ., Abbott BD., Lin FH., Birnbaum LS. (1990) Induction of ethoxyresorufin-Odeethylase and inhibition of glucocorticoid receptor binding in skin and liver of haired and hairless HRS/J mice by topically applied 2,3,7,8- tetrachlorodibenzo-p-dioxin. Toxicology.; 65: 123–136. Stonard MD., Poli G., De Matteis F. (1998) Stimulation of liver heme oxygenase in hexachlorobenzene-induced hepatic porphyria. Arch Toxicol.; 72: 355-361. Straka JG. & Kushner JP. (1983) Purification and characterization of bovine hepatic uroporphyrinogen decarboxylase. Biochemistry; 22: 4664-4672. Sunahara GI., Lucier GW., McCoy Z., Bresnick EH., Sanchez ER., Nelson KG. (1989) Characterization of 2,3,7,8-tetrachlorodibenzop-dioxin-mediated decreases in dexamethasone binding to rat hepatic cytosolic glucocorticoid receptor. Mol Pharmacol.; 36: 239–247. Sunyer J., Herrero C., Ozalla D., Sala M., Ribas-Fitó N., Grimalt J., Basagaña X. (2002) Serum organochlorines and urinary porphyrin pattern in a population highly exposed to hexachlorobenzene. Environ Health.; 1:1-8. Taira MC., Mazzetti MB., Lelli SM., San Martín de Viale LC. (2004) Glycogen metabolism and glucose transport in experimental porphyria. Toxicology; 197: 165–175. Taljaard JJ., Shanley BC., Joubert SM. (1971) Decreased uroporphyrinogen decarboxylase activity in experimental symptomatic porphyria. Life Sci., 10: 887-893. Tamarkin L., Baird CJ., Almeida OF. (1985) Melatonin: a coordinating signal for mammalian reproduction? Science.; 227: 714-720. Tan DX., Manchester LC., Terron MP., Flores LJ., Reiter RJ. (2007) One molecule, many derivatives: A never-ending interaction of melatonin with reactive oxygen and nitrogen species? J Pineal Res.; 42: 28–42. Tan DX., Reiter RJ., Manchester LC., Yan MT., El-Sawi M., Sainz RM., Mayo JC., Kohen R., Allegra M., Hardeland R. (2002) Chemical and physical properties and potential mechanisms: Melatonin as a broad-spectrum antioxidant and free radical scavenger. Curr Topics Med Chem.; 2: 181–198. Tang W. & Lu AY. (2010) Metabolic bioactivation and drug-related adverse effects: current status and future directions from a pharmaceutical research perspective. Drug Metab Rev.; 42: 225-249. 241 Citas Bibliográficas Tani K., Fujii H., Tsutsumi H., Sukegawa J., Toyoshima K., Yoshida MC., Noguchi T., Tanaka T., Miwa S. (1987) Human liver type pyruvate kinase: cDNA cloning and chromosomal assignment. Biochem Biophys Res Commun.; 143: 431-438. Thackray SJ., Mowat CG., Chapman SK. (2008) Exploring the mechanism of tryptophan 2,3dioxygenase. Biochem Soc Trans.; 36: 1120-1123. Thadani H., Deacon A., Peters T. (2000) Diagnosis and management of porphyria. BMJ.; 320: 1647-1651. Thunell S. (2000) Porphyrins, porphyrin metabolism and porphyrias. I. Update. Scand J Clin Lab Invest.; 60: 509-540. Tomaro ML. & Frydman RB. (1977) Porphobilinogen oxygenase induction by 2-allyl-2isopropylacetamide treatment. FEBS Lett.; 84: 29-32. Tomio JM. & San Martín de Viale LC. (1972) Metabolismo del camino biosintético del hemo. I- Acido 5-aminolevulínico y porfobilinógeno: Propiedades y métodos para su determinación en orina. Bioq. Clin. 6:217-245 Tomio JM., García RC., San Martín de Viale LC., Grinstein M. (1970) Porphyrin biosynthesis VII- Porphyrinogen carboxy-lyase from avian erythrocytes. Purification and properties. Biochim. Biophys. Acta 198: 353-363 Tschudy DP. & Bonkowsky HL. (1972) Experimental porphyria. Fed Proc.; 31: 147-159. Tschudy DP. (1968) Clinical aspects of drug reactions in hereditary hepatic porphyria. Ann N Y Acad Sci; 151: 850–860. Tschudy DP., Welland F., Collins A., Hunter G. (1964) The effect of carbohydrate feeding of delta-aminolevulinic acid synthetase. Metabolism.; 13: 396-406. Turrens J. (1994) Fuentes intracelulares de especies oxidantes en condiciones normales y patológicas. Antioxidantes y Calidad de Vida 1: 16-19. Unger RH. & Orci L. (1981a) Glucagon and the A cell: physiology and pathophysiology. N Engl J Med.; 304: 1575–1580. Unkila M., Ruotsalainen M., Pohjanvirta R., Viluksela M., McDonald E., Tuomisto JT., Rozman, K., Tuomisto, J. (1995). Effect of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) on trypthophan and glucose homeostasis in the most TCDD susceptible and most TCDDresistant species, guinea pigs and hamsters. Arch. Toxicol.; 69: 677–683. Utter MF. & Keech DB. (1960) Formation of oxaloacetate from pyruvate and carbon dioxide. J Biol Chem; 235: 17-18. Valentini G., Chiarell L., Forti R., Speranz ML., Galizzi A., Mattevi A. (2000) The allosteric regulation of pyruvate kinase. J Biol Chem.; 275: 18145-18152. Valko M., Izakovic M., Mazur M., Rhodes CJ., Telser J. (2004) Role of oxygen radicals in DNA damage and cancer incidence. Mol Cell Biochem.; 266: 37-56. 242 Citas Bibliográficas Vander Kooi BT., Onuma H., Oeser JK., Svitek CA., Allen SR., Vander Kooi CW., Chazin WJ., O’Brien RM. (2005) The glucose-6-phosphatase catalytic subunit gene promoter contains both positive and negative glucocorticoid response elements. Mol Endocrinol.; 19: 3001–3022. Veneziale CM., Walter P., Kneer N., Lardy HA. (1967) Influence of L-tryptophan and its metabolites on gluconeogenesis in the isolated, perfused liver. Biochemistry; 6: 21292138. Villar-Palasi C. & Guinovart JJ. (1997) The role of glucose 6-phosphate in the control of glycogen synthase FASEB J.; 11: 544-558. Voet D. & Voet J. (1995a) Biochemistry. John Wiley and Sons, Inc. 2nd Edition. Cap. 34. Mol Physiology.; pp. 1196-1197. Voet D. & Voet J. (1995b) Biochemistry. John Wiley and Sons, Inc. 2nd Edition. Cap. 24. Metabolic breakdown of individual amino acids. pp. 748. Vos JG. (1986) Immunotoxicity of hexachlorobenzene. In: Hexachlorobenzene: Proceedings of an International Symposium (Morris CR, Cabral JR, Eds). IARC Sci Publ.; 77: 347-356. Vos JG., Moore JA., Zinkl JG. (1974) Toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in C57B1/6 mice. Toxicol Appl Pharmacol.; 29: 229–241 Wada O., Toyokawa K., Urata G., Yano Y., Nakao K. (1969) Cholesterol biosynthesis in the liver of experimentally induced porphyric mice. Biochem Pharmacol.; 18: 1533–1535. Wade LG Jr. (2005) Organic chemistry. Prentice-Hall Inc. 6 edition (February 1, 2005) 1328 pages. Wainstok de Calmanovici R., Billi de Catabbi SC., Aldonatti CA., San Martín de Viale LC. (1989) Influence of the strain of rats on the induction of hexachlorobenzene induced porphyria, Int J Biochem.; 21: 377-381. Wainstok de Calmanovici R., Billi SC., Aldonatti CA., San Martín de Viale LC. (1986) Effect of desferrioxamine on the development of hexachlorobenzene-induced porphyria. Biochem Pharmacol.; 35: 2399-2405. Wainstok de Calmanovici R., Cochón AC., Aldonatti C., Cabral JR., San Martín de Viale LC. (1991) Sex comparison of heme pathway in rats bearing hepatic tumors. Tumori; 77: 379384. Wainstok de Calmanovici R., Ríos de Molina MC., San Martín de Viale LC. (1985) The role of iron in the hexachlorobenzene induced porphyria. I. Studies on different types of iron and its relation with the porphyrinogen carboxylyase decrease. Acta Physiol Pharmacol Latinoam.; 35: 481-491. Wainstok de Calmanovici R., Ríos de Molina MC., Taira de Yamasato MC., Tomio JM., San Martín de Viale. (1984) Mechanism of hexachlorobenzene- induced porphyria in rats. Effect of phenobarbitone pretreatment. Biochem J.; 218: 753-763. 243 Citas Bibliográficas Wang AL., Arredondo-Vega FX., Giampietro PF., Smith M., Anderson WF., Desnick RJ. (1981) Regional gene assignment of human porphobilinogen deaminase and esterase A4 to chromosome 11q23 leads to 11qter. Proc Natl Acad Sci USA; 78: 5734-5738. Wang D., Yang H., De Braganca KC., Lu J., Shih LY., Briones P. (2008) The molecular basis of pyruvate carboxylase deficiency: mosaicism correlates with prolonged survival. Mol Genet Metab.; 95: 31-38. Watanabe N., Hayashi N., Kikuchi G. (1983) delta-Aminolevulinate synthase isozymes in the liver and erythroid cells of chicken. Biochem Biophys Res Commun.; 113: 377-383. Weber G., Luzi P., Resi L., Tanganelli P., Lovati MR., Poli A. (1983) Natural history of TCDDinduced liver lesions in rats as observed by transmission electron microscopy during a 32week period after a single intraperitoneal injection. J. Toxicol. Environ. Health.; 12: 533– 540. Weber LW., Palmer CD., Rozman K. (1994) Reduced activity of tryptophan 2,3-dioxygenase in the liver of rats treated with chlorinated dibenzo-p-dioxins (CDDs): dose–responses and structure–activity relationship. Toxicology; 86: 63–69. Weber LWD., Greim H., Rozman KK. (1987) Metabolism and distribution of [14C]- glucose in rats treated with 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). J. Toxicol. Environ. Health.; 22: 195–206. Weber LWD., Lebofsky M., Greim H., Rozman K., (1991) Key enzymes of gluconeogenesis are dose-dependently reduced in 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD)-treated rats. Arch Toxicol.; 65: 119–123. Weber LWD., Lebofsky M., Stahl BU., Kettrup A., Rozman K. (1992) Comparative toxicity of four chlorinated dibenzo-p-dioxins (CDDs) and their mixture. Part III: Structure-activity relationship with increased plasma tryptophan levels, but no relationship to hepatic ethoxyresorufin o-deethylase activity. Arch Toxicol.; 66: 484-488. Wen B. & Fitch WL. (2009) Analytical strategies for the screening and evaluation of chemically reactive drug metabolites. Expert Opin Drug Metab Toxicol.; 5: 39-55. Whitby FG., Phillips JD., Kushner JP., Hill CP. (1998) Crystal structure of human uroporphyrinogen decarboxylase. Embo J.; 17: 2463-2471. Whitcombe DM., Carter NP., Albertson DG., Smith SJ., Rhodes DA., Cox TM. (1991) Assignment of the human ferrochelatase gene (FECH) and a locus for protoporphyria to chromosome 18q22. Genomics; 11: 1152-1154. White A., Handler P., Smith EL. (1964a) Amino acids metabolism—metabolic fates of amino acids. In: White A, Handler P, Smith EL, Eds. Principles of Biochemistry. New York: McGraw-Hill;. pp. 539–557. White A., Handler P., Smith EL. (1964b) Amino acid metabolism-Aminoacids as precursors of some nitrogenous compounds. Chapt. 26 In: White A., Handler P., Smith EL., eds. Principles of Biochemistry. New York: McGraw-Hill; pp. 527-538. 244 Citas Bibliográficas White A., Handler P., Smith EL. (1964c) Amino acid metabolism-Metabolic fates of amino acids. In: White A., Handler P., Smith EL., eds. Principles of biochemistry. New York: McGraw-Hill; Chapt. 27. pp. 539-557. Whiting MJ. & Granick S. (1976) Delta-Aminolevulinic acid synthase from chick embryo liver mitochondria. I. Purification and some properties. J Biol Chem.; 251: 1340-1346. Williamson DH., Mayor F., Veloso D. (1971) Regulation of gluconeogenesis (Soling, H.-D. & Willms, B., eds.), pp. 92-98, Academic Press, New York and London. With TK. (1971) Acute porphyria, toxic and genuine in the light of history. A re-evaluation of sulphonal-trional porphyria, the first pharmakon-provoked inborn error of metabolism. Dan Med Bull.; 18: 112-121. Wolf H. (1974) Studies on tryptophan metabolism in man. Scand J Clin Lab Invest.; 136: 1-186. Wolf WA. & Kuhn DM. (1983) Simultaneous determination of 5-H TRP, its amino acid precursors and acid metabolite in discrete brain regions by HPLC with fluorescence detection. J Chromatog. 275: 1-9 Wolff SP. & Dean RT. (1986) Fragmentation of proteins by free radicals and its effect on their susceptibility to enzymic hydrolysis. Biochem. J., 234: 399-403. Wolin MS. (2000) Interaction of oxidant with vascular signaling systems. Arterioscler Tromb Vasc Biol.; 20: 1430-1442. Yamamoto M., Fujita H., Watanabe N., Hayashi N., Kikuchi G. (1986) An immunochemical study of delta-aminolevulinate synthase and delta-aminolevulinate dehydratase in liver and erythroid cells of rat. Arch Biochem Biophys.; 245: 76-83. Yang J., Kalhan SC., Hanson RW. (2009a) What is the metabolic role of phosphoenolpyruvate carboxykinase? J Biol Chem.; 284: 27025-27029. Yang J., Reshef L., Cassuto H., Aleman G., Hanson RW. (2009b) Aspects of the control of phosphoenolpyruvate carboxykinase gene transcription. J Biol Chem.; 284: 27031-27035. Yding Andersen C. (2002) Possible new mechanism of cortisol action in female reproductive organs: physiological implications of the free hormone hypothesis. J Endocrinol.; 173: 211–217. Zatloukal K., French SW., Stumptner C., Strnad P., Harada M., Toivola DM., Cadrin M., Omary MB. (2007) From Mallory to Mallory-Denk bodies: what, how and why? Exp Cell Res.; 313: 2033-2049. Zwerschke W., Mazurek S., Massimi P., Banks L., Eigenbrodt E. (1999) Modulation of the type M2 pyruvate kinase activity by the human papillomavirus type 16 E7 oncoprotein. Proc Natl Acad Sci.; USA 96: 1291-1296. 245