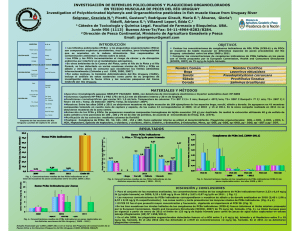
manuscrito final
Anuncio

RELACIÓN DE CONCENTRACIONES RESIDUALES DE UNA MEZCLA DE PLAGUICIDAS ORGANOCLORADOS Y POLICLOROBIFENILOS CON LA CONCENTRACIÓN DE HORMONAS SEXUALES DE DOS POBLACIONES DE Crocodylus moreletii. TESIS QUE PRESENTA BIÓL. MAURICIO GONZÁLEZ JÁUREGUI PARA OBTENER EL GRADO DE MAESTRO EN CIENCIAS MANEJO DE FAUNA SILVESTRE Xalapa, Veracruz, México 2008 Aprobación final del documento final de tesis de grado: “RELACIÓN DE CONCENTRACIONES RESIDUALES DE UNA MEZCLA DE PLAGUICIDAS ORGANOCLORADOS Y POLICLOROBIFENILOS CON LA CONCENTRACIÓN DE HORMONAS SEXUALES DE DOS POBLACIONES DE Crocodylus moreletii”. Director : Dra. Carolina Valdespino Quevedo ________________________ Comité Tutorial: M.C. Gustavo Aguirre León ________________________ Dr. Jaime Rendón von Osten ________________________ Dr. Arturo Salame Méndez ________________________ Dra. Eugenia Judith Olguín Palacios ________________________ Jurado: Agradecimientos Al Consejo Nacional de Ciencia y Tecnología y al Instituto de Ecología A.C. por la oportunidad y la beca otorgada para la realización de los estudios de Maestría y el apoyo para la realización del trabajo de campo. Al Laboratorio de Contaminación e Impacto Ambiental del Centro de EPOMEX por el apoyo en el análisis de contaminantes organoclorados y al Laboratorio de Endocrinología Reproductiva de la UAM-Iztapalapa por el apoyo en el análisis de muestras de plasma. Al Centro de Estudios Tecnológicos del Mar 02, por las facilidades para el manejo y toma de muestras de sus cocodrilos en cautiverio. A mi Comité Tutorial, Dra. Carolina Valdespino Quevedo por su Dirección y apoyo todo el tiempo; Al M.C. Gustavo Aguirre León por sus atinados comentarios; y en especial al Dr. Jaime Rendón von Osten por todo el apoyo y ayuda prestada a la realización de este trabajo. Al Dr. Arturo Salame Méndez y a la Dra. Eugenia Olguín Palacios, por sus atinados comentarios y su participación como jurados de esta tesis. A mis amigos y compañeros de campaña; Javier Omar Gómez, Sergio Padilla y Ernesto Perera, que sin su ayuda no hubiera sido posible realizar esta tesis. A mis grades amigos: Adriana, Alejandra, Armando, Carlos, César, Cinthya, Dulce, Lalo, Laura, Miguel, Natalia, Negro, Paco, Ramón y todos aquellos que ocupan un lugar importante en mi vida. Y en especial a mi familia, que siempre me han apoyado en todo. A mis Padres Guadalupe y Raúl A Alejandra, Daniel y Diego A Arlyn y Sofia DECLARACIÓN Excepto cuando es explícitamente indicado en el texto, el trabajo de investigación contenido en esta tesis fue efectuado por el Biól. Mauricio González Jáuregui como estudiante de la Maestría en Ciencias en Manejo de Fauna Silvestre entre septiembre de 2004 y agosto del 2008, bajo la supervisión de la Dra. Carolina Valdespino Quevedo. Las investigaciones reportadas en esta tesis no han sido utilizadas anteriormente para obtener otros grados académicos, ni serán utilizadas para tales fines en el futuro. Candidato: _____________________________ Director de tesis: _____________________________ CONTENIDO Lista de Cuadros ................................................................................................. 8 Lista de Figuras .................................................................................................. 9 Resumen ............................................................................................................ 10 1. Introducción ............................................................................................. 11 1.1 POCs México. ............................................................................................ 13 1.2 Dispersión de POCs y PCBs. .................................................................... 14 1.2.1 Dispersión Regional. ........................................................................... 14 1.2.2 Dispersión Global. ............................................................................... 17 1.3 Efectos Secundarios de POCs y PCBs...................................................... 18 1.4 Desorganizadores Endocrinos y Cocodrilos. ............................................. 21 1.5 Hormonas Esteroides Sexuales................................................................. 22 1.5.1 Andrógenos. ........................................................................................ 24 1.5.2 Estrógenos. ......................................................................................... 24 1.5.3 Comportamiento y Esteroides Sexuales. ............................................. 25 1.6 Cocodrilo de Pantano. ............................................................................... 26 1.6.1 Distribución. ......................................................................................... 26 1.6.3 Descripción Física. .............................................................................. 28 1.6.4 Reproducción. ..................................................................................... 28 1.6.5 Dispersión............................................................................................ 29 1.6.6 Hormonas en Cocodrilos. .................................................................... 29 1.6.7 POCs en C. moreletii. .......................................................................... 30 2. Objetivos .................................................................................................. 33 2.1 General. ..................................................................................................... 33 2.2 Específicos. ............................................................................................... 33 3. Hipótesis ................................................................................................... 34 4. Métodos .................................................................................................... 35 4.1 Áreas de estudio. ....................................................................................... 35 4.2 Colecta de muestras. ................................................................................. 37 4.2.1 Sedimentos.......................................................................................... 37 4.2.2 Cocodrilos............................................................................................ 38 4.2.2.1 Cocodrilos Silvestres. .................................................................... 38 4.2.2.2 Cocodrilos de Criadero.................................................................. 40 4.3 Análisis de muestras. ................................................................................. 40 4.3.1 POCs y PCBs en Sedimento. .............................................................. 40 4.3.2 POCs y PCBs en Tejido Graso............................................................ 41 4.3.3 Hormonas Esteroides. ......................................................................... 42 4.4 Análisis de Datos. ...................................................................................... 43 4.4.1 POCs y PCBs en Sedimento. .............................................................. 43 4.4.2 POCs y PCBs en Tejido Graso............................................................ 44 4.4.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos........................... 44 6 4.4.4 Hormonas Esteroides. ......................................................................... 44 4.4.5 POCs, PCBs y Hormonas en Cocodrilos. ............................................ 45 5. Resultados................................................................................................ 46 5.1 POCs y PCBs en Sedimento. .................................................................... 46 5.2 POCs y PCBs en Cocodrilos. .................................................................... 48 5.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos. ................................ 51 5.4 Hormonas Esteroides. ............................................................................... 52 5.5 POCs, PCBs y Hormonas en Cocodrilos. .................................................. 55 5.5.1 Machos. ............................................................................................... 55 5.5.2 Hembras. ............................................................................................. 57 6. Discusión .................................................................................................. 59 6.1 POCs y PCBs en Sedimentos. .................................................................. 59 6.2 POCs y PCBs en Cocodrilos. .................................................................... 61 6.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos. ................................ 64 6.4 Hormonas Esteroides. ............................................................................... 66 6.5 POCs, PCBs y Hormonas en Cocodrilos. .................................................. 68 7. Conclusiones ........................................................................................... 72 8. Literatura Citada ...................................................................................... 74 7 Lista de Cuadros Cuadro 1 Clasificación de algunos contaminantes en cuatro categorías de acuerdo a su movilidad en función del coeficiente de partición aire-octanol, presión de vapor y la temperatura de condensación. Modificado de Wania y Mackay (1996). .......................................................................................................... 18 Cuadro 2 Concentraciones promedio de plaguicidas (ng/ml) registrados en suero de A. mississippiensis juveniles en el lago Apopka, Florida (Guillette et al., 1999a). ...................................................................................................................... 22 Cuadro 3 Relación de POCs y PCBs cuantificados en este estudio, agrupados por características químicas. .............................................................................. 43 Cuadro 4 Sumatorias de las concentraciones (ppm de peso seco) de POCs y PCBs detectados en sedimentos de Río Champotón y los Petenes ( N.D.= no detectado). .................................................................................................... 46 Cuadro 5 Número total de individuos capturados durante el estudio. .......................... 49 Cuadro 6 Sumatorias de las concentraciones (ppm de tejido graso) de los POCs y PCBs detectados en tejido graso de C. moreletii (N.D.= no detectado, Champ=Río Champotón, Pet=Los Petenes, Cet=CETMar 02)..................... 50 8 Lista de Figuras Figura 1 Transporte y distribución regional de plaguicidas en las cuatro principales compartimientos agua, tierra, aire y biota. Modificado de Majewski y Capel (1995). ........................................................................................................ 15 Figura 2 Distribución de Crocodylus moreletii, en los estados de la costa del Golfo de México y el Caribe, Belice y Norte de Guatemala. ..................................... 27 Figura 3 Áreas de estudio, (a) Región de los Petenes, (b) Río Champotón. ............ 36 Figura 4 Concentraciones medias de POCs y PCBs en sedimento de Río Champotón y los Petenes........................................................................... 48 Figura 5 Concentraciones medias (ppm) de POCs y PCBs en tejido graso de C. moreletii. ..................................................................................................... 51 Figura 6 Concentraciones bioacumuladas medias de POCs y PCBs por sexo. Barras: error estándar. ............................................................................................ 53 Figura 7 Concentraciones medias de testosterona (ng/mL) y error estándar por sexo. ................................................................................................................... 54 Figura 8 Concentraciones promedio de testosterona (ng/mL) y error estándar por etapa reproductora y grado de madurez a) machos, b) hembras. ............. 54 Figura 9 Concentraciones medias de estradiol (pg/mL) y error estándar por sexo. . 54 Figura 10 Concentraciones medias de estradiol (ng/mL) y error estándar por etapa reproductora y grado de madurez a) machos, b) hembras. ....................... 55 Figura 11 Concentración media de testosterona (escala logarítmica) según grado de madurez una vez anulado el efecto de los POCs y los PCBs. Barras: Intervalo de confianza (0.95). ..................................................................... 56 Figura 12 Concentración media de estradiol (escala logarítmica) según el grado de madurez una vez anulado el efecto de los ΣHCHs Barras: Intervalo de confianza (0.95). ......................................................................................... 57 9 Resumen Se cuantificaron residuos de algunos plaguicidas organoclorados (POCs) y policlorobifenilos (PCBs) en 22 muestras de sedimento de un sitio conservado, la región de los Petenes y un sitio transformado, el Rio Champotón en Campeche, México. Se cuantificaron también en tejido graso de 37 individuos de Crocodylus moreletii que habitan en estos sitios y en un criadero en la Ciudad de Campeche. Los sedimentos presentaron los POCs siguientes: ΣHCH (6.01 ppm), Σdrines (0.56 ppm), Σheptacloros (0.09 ppm), Σendosulfanes (0.19 ppm), ΣDDTs (0.37 ppm) y ΣPCBs (0.89 ppm), Las concentraciones de ΣHCHs fueron mayores en Nortes y las de Σheptacloros en secas. Para los ΣPCBs, las concentraciones mayores se registraron en el Río Champotón. En el tejido graso de los cocodrilos se determinaron ΣHCH (0.12 ppm), Σdrines (0.09 ppm), Σendosulfanes (0.02 ppm), ΣDDTs (0.14 ppm) y ΣPCBs (0.16 ppm) sin encontrarse relación con la concentración de estos compuestos en sedimentos. Las concentraciones medidas no difirieron entre sexos. Contrario a lo que se pensaba, los cocodrilos del criadero presentan PCBs bioacumulados. La concentración promedio de estradiol en plasma de C. moreletii fue de 30.7 pg/mL para las hembras y 29.35 pg/mL para los machos. La de testosterona fue de 0.876 ng/mL para las hembras y 2.419 ng/mL para los machos, difiriendo significativamente así como entre machos juveniles y adultos. Mientras que en las hembras, la testosterona covarió con los ΣPCBs y el estradiol con los ΣHCHs, en los machos, la testosterona no covarió con ninguno de los POCs ni con los ΣPCBs, y el estradiol solo lo hizo marginalmente con los ΣHCHs y los Σdrines. Nuestros resultados indican que tanto la zona conservada (los Petenes) como la transformada (Río Champotón) contienen POCs y PCBs acumulados en los sedimentos, aunque las concentraciones son mayores en la zona transformada para algunos de ellos. Las mediciones de contaminantes en sedimento no permiten determinar cuál población de cocodrilos se encuentra en un mayor riesgo, debido a varias razones: 1) la porción en sedimento no está disponible para ser consumida por los cocodrilos; 2) las concentraciones en sedimento cambian a través del año mientras que las de los cocodrilos son la suma de su historia de vida y 3) es posible que las hembras desechen algunos contaminantes previamente bioacumulados durante la reproducción. 10 1. Introducción Los plaguicidas organoclorados (POCs) y los Policlorobifenilos (PCBs) son compuestos químicos complejos con esqueletos de carbono e hidrógeno y la presencia de radicales de cloro que, por sus propiedades físico-químicas, tienen una gran persistencia en el ambiente, resistiendo la degradación química, biológica (por microorganismos) o fotolítica (Wu et al., 2000a; Lintelmann et al., 2003). Los POCs y los PCBs son compuestos liposolubles, lo que les confiere la característica de ser bioacumulables en los tejidos de seres vivos, transitando por la trama trófica sin eliminarse y generando un efecto de biomagnificación en los niveles tróficos más altos (Delany et al., 1988; Wu et al., 2000b; Lintelmann et al., 2003; Gordon et al., 2004). Desde 1995, el Programa de Medio Ambiente de las Naciones Unidas determinó un grupo de Compuestos Orgánicos Persistentes (COPs) prioritarios y los denominó la “docena sucia”. Este grupo de compuestos incluyen ocho plaguicidas: aldrín, clordano, DDT, dieldrín, endrín, heptacloro, mirex y toxafeno; dos compuestos químicos industriales: policrorobifenilos (PCBs) y hexaclorobenceno (HCB); y dos subproductos de producción no intencional: dioxinas y furanos. Los POCs, que incluyen el hexaclorobenceno, dicloro-difenil-tricloroetano (DDT) y sus metabolitos, aldrín, dieldrín, clordano, heptacloro, toxafeno y mirex, fueron usados para el control de fauna nociva en la agricultura y de vectores de enfermedades tales como el paludismo, la malaria y el dengue; extendiéndose su uso rápidamente por todo el planeta a partir de la Segunda Guerra Mundial (Myers et al., 2003). 11 Por su parte, los PCBs son producto de actividades industriales que por sus propiedades de fluidos aislantes y no inflamables, han sido usados ampliamente en transformadores y capacitores eléctricos, balastros de lámparas fluorescentes, líquidos para intercambio de temperaturas, tintas de impresión, fluidos hidráulicos, pinturas marinas y papel carbón desde la década de 1940 (ATSDR, 2000; UNEP, 2002). Muchos de estos compuestos fueron desarrollados específicamente para bloquear el funcionamiento de plantas y animales indeseables, y algunos de ellos han tenido consecuencias fisiológicas no previstas en especies para las cuales no fueron elaborados (Propper, 2005). La detección de estos efectos deletéreos sobre la salud del hombre y de la fauna en países desarrollados ocurrió ya en la década de los 40s (Carson, 1962) y resultó en la prohibición del uso de estos compuestos (Risebrough et al., 1968). Sin embargo, a pesar de esta prohibición, los compuestos organoclorados se siguen detectando en tejidos animales de todos los niveles tróficos tales como los mejillones pardos (Perna perna) (Sokolowski et al., 2004), tortugas marinas (Caretta caretta) (Keller et al., 2004), delfines manchados (Stenella attenuate) (Liu et al., 2003) y osos polares (Ursus maritimus) (Oskam et al., 2004) sin que se tenga una clara medida del grado de afectación en poblaciones naturales (Delany et al., 1988; Skaare et al., 1991; Gordon et al., 2004; Keller et al., 2004). Los efectos de estos compuestos sobre la fisiología y la adecuación de los individuos, así como la dinámica de las poblaciones, y el funcionamiento último de los ecosistemas, aún no se conocen de manera detallada (Propper, 2005). 12 1.1 POCs México. En los países tropicales, enormes cantidades de sustancias químicas son usadas rutinariamente en la agricultura, la minería, el almacenamiento de cosechas y el control de vectores de enfermedades (Lacher y Goldstein, 1997), a tasas similares o incluso mayores que las de países desarrollados (Castillo y Ruepert, 1997). Mientras que en los países industrializados se imponen restricciones en el uso de plaguicidas, las regulaciones en la producción, distribución, aplicación y desecho de estos químicos en los trópicos no está formalmente legislado o no es adecuadamente vigilado (Wu et al., 2000b). Además, muchos plaguicidas prohibidos en países industrializados aún están disponibles sin restricción en los trópicos y siguen siendo usados sin un control apropiado (Wania y Mackay, 1996; Wu et al., 2000b). En México se desconocen los volúmenes exactos de POCs que se han aplicado, pero hasta antes de 1989, los principales plaguicidas que se utilizaban con fines agrícolas incluían al aldrín (1,000 t/año), el endrín (15,000 t/año), el dieldrín (en cantidades variables), el lindano (80 t/año) y el DDT (200 t/año) (Botello et al., 1996). En 1992 se programó la aplicación de 100,000 kg de DDT para el control de vectores de enfermedades como el paludismo. Veinticinco por ciento de esta cantidad se aplicó en el estado de Campeche (Benitez y Bárcenas, 1996). En cuanto a los PCBs se sabe que en 1995 existían en México 12,400 toneladas de estos compuestos y para el 2001 se habían exportado 8,361 toneladas de PCBs para ser destruidos en Alemania, España y Estados Unidos (UNEP, 2002). 13 1.2 Dispersión de POCs y PCBs. A pesar de la prohibición del uso de POCs en un gran número de países, estos compuestos siguen siendo detectados alrededor del mundo, incluso en regiones remotas en donde nunca fueron usados. Debido a sus características físico-químicas, estos compuestos pueden viajar miles de kilómetros desde el punto en que fueron liberados a través del aire, el agua o la biota (Majewski y Capel, 1995; Wania y Mackay, 1996). Por lo tanto, en un ecosistema en el cual existe una serie de rutas interconectadas, los contaminantes se mueven entre cuatro principales compartimientos: aire, agua, suelo y biota, de manera que una descarga de contaminantes en cualquier compartimiento resulta en la contaminación de los demás (Burton, 2002). 1.2.1 Dispersión Regional. El movimiento de los POCs y PCBs a nivel regional está dado por el transporte de compuestos volatilizados a través de las corrientes de aire, también pueden ser depositados sobre el suelo o los cuerpos de agua por la precipitación pluvial que los arrastra desde la atmósfera. Otra vía por la cual los POCs y PCBs pueden trasladarse a través de los ecosistemas es por medio de las escorrentías que erosionan los suelos de campos de cultivo, zonas industriales y urbanas, o pueden ser consumidos y bioacumulados por la biota (Majewski y Capel, 1995). Sin embargo, el transporte de estos compuestos se encuentra fuertemente ligado al movimiento de los sedimentos (Ongley, 1997). Los sedimentos son materiales depositados en el fondo de los cuerpos de agua como producto de la denudación de 14 tierra firme y son un compartimento ambiental que funciona como reservorio o depósito de diversos compuestos (Figura 1). La contribución de los sedimentos como reservorio y medio de transporte de POCs y PCBs está vinculada al tamaño de las partículas que lo componen y al volumen de materia orgánica que contienen (Meyers, 1997; Ongley, 1997). Figura 1 Transporte y distribución regional de plaguicidas en las cuatro principales compartimientos agua, tierra, aire y biota. Modificado de Majewski y Capel (1995). Para la materia orgánica su capacidad de reservorio se liga a sus propiedades adsorbentes. Con la materia orgánica los plaguicidas como los PCBs se mueven a través de las cuencas por medio del transporte eólico o la escorrentía (Kordel et al., 1997). Estos movimientos consisten en lo siguiente: el material particulado de la 15 superficie terrestre es arrastrado por los movimientos de agua a manera de manto (escorrentías difusas) o en una serie de corrientes menores que origina cárcavas (escorrentías concentradas) que drenan hacia el cuerpo de agua principal de la cuenca. La acumulación de materia orgánica y, por ende, de compuestos orgánicos persistentes, son función de las características propias de cada sistema. Por ejemplo, en un bosque de manglar en el que se acumulan grandes cantidades de materia orgánica (producidas localmente o aportadas por ecosistemas vecinos), el potencial de acumulación de POCs y PCBs es alto; mientras que en ríos caudalosos, en los cuales los sedimentos son arrastrados hasta el mar, el potencial de retener y almacenar estos compuestos es reducido. Los POCs y PCBs acumulados en la materia orgánica del sedimento se encuentran a disposición (biodisponibilidad) de los organismos detritívoros, los cuales los introducen a la trama trófica, constituyendo otro medio de dispersión y trasporte de los POCs y PCBs (Figura 1). Debido a que pasan sin degradarse por cada nivel de la trama trófica (lo que se conoce como bioacumulación), estos compuestos se encuentran almacenados en concentraciones cada vez mayores, siendo los depredadores tope como osos, cocodrilos y aves de rapiña, los que registran las mayores concentraciones de estos compuestos (Campbell, 2003; Ashpole et al., 2004; Sepúlveda et al., 2004; Sokolowski et al., 2004; Sakellarides et al., 2006). Las aves que dependen de los humedales, por ejemplo, son susceptibles a la bioacumulación de contaminantes vía el alimento, ya que su dieta es amplia e incluye vertebrados e invertebrados (Sakellarides et al., 2006). Al ser depredadores tope 16 usualmente registran concentraciones relativamente altas de POCs y PCBs (Liu et al., 2003; Muñoz Cifuentes et al., 2003). El movimiento de estas aves entre ecosistemas (manglares, pantanos, islas, playas y lagunas costeras) involucra el traslado de los contaminantes bioacumulados de un ecosistema a otro. 1.2.2 Dispersión Global. Debido a que los POCs y los PCBs son compuestos semi-volátiles pueden viajar grandes distancias por medio de las corrientes de aire que los arrastran, los depositan en el suelo y los vuelven a volatilizar de tal modo que pueden afectar sitios distantes del lugar donde se emitieron (EPA, 2002). Los POCs y PCBs pueden volatilizarse y depositarse en ciclos entre el aire, agua y suelos a temperatura ambiente. Los compuestos con mayor volatilidad y peso molecular bajo tienden a permanecer en el aire y migrar rápidamente hasta los polos. Los POCs y PCBs con menores coeficientes de volatilidad tienden a separarse e ir viajando en pequeños ciclos, acumularse en agua, suelo o vegetación próximos al sitio de descarga. Este proceso es análogo a una separación cromatográfica en la que compuestos con diferentes volatilidades, migran a diferentes distancias y velocidades (Wania y Mackay, 1996). La distancia, tiempo y velocidad de migración de estos compuestos depende de sus características fisicoquímicas, principalmente de su volatilidad (Cuadro 1). La forma de expresar la volatilidad de un compuesto es mediante la constante de Henry, la cual considera la presión de vapor, la solubilidad en agua, el peso molecular de cada 17 compuesto y el coeficiente de partición octanol-agua, que es una medida de cómo una sustancia química puede distribuirse en dos solventes inmiscibles (Majewski y Capel, 1995; Wania y Mackay, 1996). Cuadro 1 Clasificación de algunos contaminantes en cuatro categorías de acuerdo a su movilidad en función del coeficiente de partición aire-octanol, presión de vapor y la temperatura de condensación. Modificado de Wania y Mackay (1996). Relativamente baja movilidad Baja movilidad Log coeficiente de partición aire-octanol (K0A) Log Presión de vapor (PL) Temperatura de condensación (TC) Clorobencenos PCBs Plaguicidas Organoclorados Relativamente alta movilidad alta movilidad 10 8 6 -4 -2 0 30°C -10°C -50°C 8 a 10 Cl 4 a 8 Cl 5 a 6 Cl 1 a 4 Cl mirex DDTs, clordanos HCHs, dieldrin 0 a 4 Cl 0 a 1 Cl De acuerdo con Wania y Mackay (1996) los POCs y los PCBs viajan grandes distancias y sugieren que los compuestos de moléculas relativamente poco complejas, como los HCHs, pueden alcanzar y depositarse en latitudes polares, mientras que aquellos compuestos con moléculas más complejas, como el DDT, tienden a acumularse en latitudes menores. Compuestos de moléculas aún más complejas como el mirex y los PCBs de más de 8 radicales cloro tienden a permanecer y acumularse cerca de la fuente de liberación. 1.3 Efectos Secundarios de POCs y PCBs. Como se mencionó antes, los POCs y los PCBs se han relacionado con efectos negativos en una gran variedad de especies pertenecientes prácticamente a todos los niveles tróficos y grupos de vertebrados (Propper, 2005). 18 La exposición por períodos breves a concentraciones altas de plaguicidas puede causar enfermedad o muerte. Son casos conocidos los de peces muertos por residuos de plaguicidas acarreados a estanques, arroyos y ríos por la corriente superficial; otro ejemplo es el de aves muertas por alimentarse de cultivos o insectos tratados con plaguicidas e incluso por el consumo directo de gránulos (pellets) de estos (Whitford et al., 1994). Los efectos de este tipo de envenenamiento son principalmente neurotóxicos, ocurren durante un tiempo corto, son geográficamente localizados y se asocian con un plaguicida o una mezcla comercial de éstos. La exposición de fauna silvestre a plaguicidas por períodos prolongados a concentraciones bajas causa envenenamiento crónico y su efecto en el ambiente no está aún claramente establecido (Myers et al., 2003) pero su efecto sobre la reproducción parece ser una constante. El efecto de los POCs sobre especies de fauna para las que no habían sido diseñados, se dio a conocer por primera vez hacia finales de la década de 1960 en aves (Ratcliffe, 1967; Jensen, 1972). Estos reportes indicaban que los censos de huevos rotos en nidos de halcones (Falco peregrinus), halconcillos (Accipiter nisus) y águilas (Aguila chrysaetos) mostraban un incremento significativo en su número a partir de 1950. Asimismo, el cociente peso/tamaño de huevos de aguiluchos y halcones decreció significativamente entre 1947 y 1950 de manera sincrónica, rápida y amplia en Inglaterra. Este decremento parecía deberse a una pérdida de carbonato de calcio en el cascarón que resultaba en la ruptura del huevo al ser empollado. En un análisis de posibles causas descartaron enfermedades, envejecimiento, falta de alimento y los factores genéticos debido a lo extenso del problema, tanto geográficamente como en términos de especies afectadas. Dado que el metabolismo 19 del calcio en aves es controlado por estrógenos, cualquier sustancia que interfiera con su regulación metabólica podría estar ocasionando el daño. Finalmente, debido a que existía una relación entre los primeros registros de estos efectos y los años en que se inició y extendió el uso de PCBs e insecticidas como el p,p’ DDT, el p,p’ DDE, el gamma HCH, el aldrín, dieldrín y heptacloro, así como de fungicidas y herbicidas conteniendo cloro, mercurio, fósforo y azufre (Lockie y Ratcliffe, 1964; Moore, 1965; Ratcliffe, 1967), se determinó que estos compuestos podrían ser los causantes. A partir de entonces, muchos trabajos han demostrado que los contaminantes organoclorados afectan numerosas variables reproductoras de la fauna silvestre. Por ejemplo, en mamíferos se ha reportado que el p,p’-DDE, los PCBs y sus metabolitos se encuentran relacionados con criptorquidismo en pumas de Florida (Felis concolor coryi) (Facamire et al., 1995), con la masculinización de hembras de osos polares (Ursus maritimus) (Wiig et al., 1998), con el decremento de la fecundidad, así como la implantación fallida de embriones (Reijnders, 1986) y la esterilidad en focas (Helle, 1980) en el Mar de Wadden (Phoca vitulina) y el Báltico (Phoca hispida). En aves se reporta, por ejemplo, una reducción en la tasa de eclosión del águila cola blanca del Báltico (Haliaeetus albicilla) (Jensen, 1972; Helander et al., 1982), la formación de parejas hembra-hembra y el adelgazamiento del cascarón de huevos de gaviota en los Estados Unidos (Larus occidentalis y L. argentatus (Fry y Toone, 1981). Estos últimos casos están relacionados principalmente con DDT y PCBs. Para reptiles se ha encontrado una reducción en las tasas de eclosión, un incremento de anormalidades en el desarrollo (Bishop et al., 1991) y la feminización en tortugas (Chelydra serpentina serpentina) (De Solla et al., 1998) también relacionados 20 principalmente con PCBs, DDE y otros compuestos organoclorados. La mayor parte de estos trabajos se han basado en el análisis de residuos de POCs, PCBs y otros contaminantes en tejidos, sin embargo, pocos trabajos consideran en sentido integral las concentraciones ambientales de POCs y PCBs con los efectos de la acumulación de estos contaminantes en los tejidos (Hopkins, 2006). Dado que los POCs como los PCBs alteran las concentraciones hormonales, en particular las concentraciones de estrógenos, y por tanto las variables reproductoras reguladas por estas hormonas, estos contaminantes pueden tener un efecto a largo plazo en el tamaño de una población y en su crecimiento (Matter et al., 1998; Guillette et al., 1999b) .Efecto que ha resultado en la designación de los compuestos orgánicos persistentes como los POCs y PCBs con el nombre de Desorganizadores Endócrinos, esto es, una sustancia o mezcla de sustancias exógenas que alteran la función del sistema endócrino y, consecuentemente, causa efectos adversos en la salud de un organismo, en su progenie o en su (sub)población (CSTEE, 1999). 1.4 Desorganizadores Endocrinos y Cocodrilos. El efecto como desorganizador endocrino ha sido ampliamente demostrado en el caimán americano (Alligator mississippiensis). Para esta especie se han documentado alteraciones en los sistemas reproductor y endocrino en individuos que habitan lagos del centro de Florida en Estados Unidos (Facamire et al., 1995; Guillette et al., 1996; Matter et al., 1998; CSTEE, 1999; Guillette et al., 1999a; Guillette et al., 2000; Gunderson et al., 2004; Milnes et al., 2004). En el lago Apopka en Florida, una población de caimanes, expuesta a una mezcla de contaminantes asociados con la agricultura (insecticidas, herbicidas y fertilizantes); al control de vectores de 21 enfermedades y a productos industriales (PCBs), ha sido estudiada intensamente. En esta población se ha encontrado un decremento de juveniles de hasta el 90%; un decremento en la viabilidad de huevos y en la sobrevivencia de crías; y anormalidades en el desarrollo que incluyen hipospadia, alteración en la síntesis gonádica de esteroides sexuales; y modificación en las tasas de estrógenos/andrógenos en machos como en hembras (Gross et al., 1994; Guillette et al., 1994; Woodward y David, 1994; Guillette et al., 1996; Guillette et al., 1997; Guillette et al., 1999a; Guillette et al., 1999b; Pickford et al., 2000; Gunderson et al., 2004). En suero de juveniles se han detectado plaguicidas como el p,p’-DDE, el dieldrín, el endrín, el mirex y el DDT, además de PCBs (Cuadro 2), los cuales se relacionan con un decremento en la concentración de testosterona (Guillette et al., 1999a) y un incremento en la concentración de estradiol en machos (Guillette et al., 1999b). Las hembras, por su parte presentan un decremento en la concentración tanto de testosterona como de estradiol (Gunderson et al., 2004). Cuadro 2 Concentraciones promedio de plaguicidas (ng/mL) registrados en suero de A. mississippiensis juveniles en el lago Apopka, Florida (Guillette et al., 1999a). Dieldrin Endrin Mirex Oxiclordano Trans-nonaclor o,p' DDT o,p' DDE p,p' DDE Machos 1.68 1.43 0.28 0.39 0.39 0.45 rastros 7.35 Hembras 2.87 1.19 0.34 0.63 0.91 0.70 0.62 17.98 1.5 Hormonas Esteroides Sexuales. Las hormonas son moléculas producidas y secretadas por las glándulas endocrinas que envían instrucciones a células de órganos específicos del cuerpo. Estas instrucciones controlan una gran variedad de procesos biológicos que incluyen el 22 crecimiento, los movimientos del corazón, el ciclo menstrual, el hambre y el comportamiento (Lombardi, 1998). Las hormonas se clasifican de acuerdo a su estructura química y el modo en que viajan por el torrente sanguíneo (Nelson, 2000) en: a. Hormonas derivadas de aminoácidos. Son almacenadas en las células endocrinas y son hidrosolubles. Un ejemplo es la epinefrina. b. Hormonas polipeptídicas. Son hidrosolubles y consisten en largas cadenas de aminoácidos (alrededor de 200). Un ejemplo es la insulina. c. Hormonas esteroides. Son liposolubles y tienen una estructura química de tres anillos con seis carbonos y un anillo con cinco (ciclopentanoperhidrofenantreno). El principal precursor de estas hormonas es el colesterol y son sintetizadas y secretadas principalmente por las gónadas y las adrenales. Para fines del presente estudio, las hormonas de interés son los esteroides sexuales como los andrógenos (uno de los cuáles es la testosterona) y los estrógenos (como el estradiol, en este caso). En todos los vertebrados los esteroides sexuales son producidos principalmente por las gónadas (Norman y Litwarck, 1987; Lombardi, 1998). Los esteroides sexuales son transportados a través del flujo sanguíneo hasta las células blanco unidos a proteínas hidrosolubles como la globulina y la albúmina. Al ser liposolubles, se mueven fácilmente a través de la membrana celular y no pueden ser almacenadas, por lo que tienen que ser liberadas inmediatamente después de ser producidas (Nelson, 2000). 23 La transición que ocurre al alcanzar la madurez sexual, la de un individuo del estado no reproductor al reproductor o la que ocurre cada año al inicio en la temporada reproductora, son inducidas por factores ambientales epigenéticos (químicos, visuales, táctiles, sociales, térmicos) favorables que son transducidos en la síntesis y secreción de hormonas esteroides sexuales (Nelson, 2000), promoviendo el inicio de la reproducción (Bronson y Heideman, 1994). 1.5.1 Andrógenos. Estas hormonas tienen diversas funciones fisiológicas y de comportamiento: Son necesarias para la espermatogénesis; el mantenimiento del tracto genital masculino y el de los órganos sexuales accesorio; también son responsables de la aparición de los caracteres sexuales secundarios masculinos (Ramenofsky, 1984). Los andrógenos también tienen implicaciones en el comportamiento sexual, incluyendo el cortejo, la cópula, la agresividad y otros comportamientos sociales (Nelson, 2000). 1.5.2 Estrógenos. Los estrógenos tienen efectos en una amplia gama de procesos en ambos sexos: regulan el metabolismo del calcio, los niveles de grasa; tienen participación en el balance de sales y agua; entre otros. Los estrógenos, en hembras, intervienen en la aparición de los caracteres sexuales, regulan los ciclos reproductores, el comportamiento sexual y el maternal (Johnson y van Tienhoven, 1980). Las concentraciones de estrógenos varían en función de factores externos e internos (temperatura ambiente, fase lunar, ciclos de luz solar, presencia de parejas potenciales). En vertebrados, la exposición a largo plazo a estrógenos incrementa el 24 riesgo de cáncer (Wolff et al., 2000; Snedecker, 2001) y en machos, en etapas embrionarias produce el desarrollo de caracteres y órganos femeninos (feminización) (Nelson, 2000). A pesar de las funciones aparentemente disociadas entre hembras y machos, los esteroides sexuales poseen una estructura química similar y su biosíntesis está integrada de modo que cada esteroide puede ser una prohormona en la ruta metabólica hacia algún otro esteroide (Griffin y Ojeda, 1988). Por ejemplo, la pregnenolona, hormona precursora de la progesterona es convertida en andrógenos (uno de los cuáles es la testosterona), y éstos en estrógenos tanto en los ovarios como en los testículos. De este modo los dos sexos difieren en las concentraciones de sus esteroides sexuales, pero tanto estrógenos, como progesterona y testosterona pueden encontrarse en la circulación sanguínea de hembras y machos de una especie (Lombardi, 1998; Nelson, 2000). 1.5.3 Comportamiento y Esteroides Sexuales. Los esteroides sexuales tienen un efecto sobre el comportamiento de un organismo porque una vez liberados al torrente sanguíneo llegan a células sensoriales, cerebrales o motoras y provocan cambios en su funcionamiento, lo que facilita el desempeño de conductas específicas (Beach, 1976; Nelson, 2000). Por ejemplo, en aves, los estrógenos promueven la conducta de nidificación (Farner y Wingfield, 1980) y en los cánidos, la receptividad durante el celo (Asa, 1997; Valdespino et al., 2002). La testosterona, en cambio, está relacionada con agresión asociada a la reproducción, como la defensa del territorio o el resguardo de la pareja contra otros machos (Wingfield y Marler, 1988). En este sentido, la conducta de cuidado paternal en machos, requiere 25 que las concentraciones de testosterona disminuyan para que la agresión desaparezca y el macho no ataque a las crías (Farner y Wingfield, 1980; Hegner y Wingfield, 1987). Por lo tanto, dado que los esteroides sexuales se liberan al torrente sanguíneo, la obtención de una muestra de sangre seguida de métodos analíticos apropiados, permite conocer las concentraciones de esteroides de un individuo en un momento determinado. Al mismo tiempo, un seguimiento longitudinal de los cambios de concentraciones de esteroides en sangre (perfil hormonal característico de hembras y machos) a lo largo del tiempo, aunado al registro de su comportamiento, permite la definición de concentraciones características de diferentes estados de la vida reproductora de un animal (Beach, 1976; Brown, 1985; Ketterson et al., 1991; Lasley y Kirkpatrick, 1991; Ketterson y Nolan-Jr, 1992; Reburn y Wynne-Edwards, 1999; WynneEdwards y Reburn, 2000). 1.6 Cocodrilo de Pantano. 1.6.1 Distribución. El cocodrilo de pantano (Crocodylus moreletii), es una especie que habita en arroyos, ciénagas, lagunas, en ríos de corriente lenta y rara vez en ríos caudalosos. Es común encontrarlo tanto en aguas claras como turbias, con abundante vegetación. Se distribuye desde el centro de Tamaulipas, Veracruz, Tabasco, Campeche, Yucatán y Quintana Roo en México, así como en Belice y el Norte de Guatemala (Figura 2). Dada su distribución, puede considerarse como especie cuasi-endémica a México por lo que tiene prioridad de conservación, además (SEMARNAT, 2000). 26 de potencial de aprovechamiento Figura 2 Distribución de Crocodylus moreletii, en los estados de la costa del Golfo de México y el Caribe, Belice y Norte de Guatemala. El estado de Campeche se encuentra en el centro de la distribución natural de C. moreletii y prácticamente en cualquier cuerpo de agua (efímero o permanente) se encuentran individuos de esta especie. 1.6.2 Estatus. C. moreletii se encuentra en la Norma Oficial Mexicana (NOM-059-ECOL-2001) dentro de las especies sujetas a protección especial. Para CITES, se encuentra en el Apéndice I y según la Lista Roja de IUCN es una especie que se encuentra en riesgo bajo y que su conservación depende de la conservación de sus hábitat. En la zona central de su distribución, la piel de C. moreletii fue una importante fuente de ingresos para pobladores dedicados a la peletería (SEMARNAT, 2000). Sin embargo, con la reducción del tamaño de las poblaciones y con los reglamentos actuales para su aprovechamiento y comercio, ésta es una actividad que actualmente 27 se desarrolla solo de manera clandestina. Aunado a esto, la destrucción masiva de su hábitat impide la recuperación de muchas poblaciones naturales. 1.6.3 Descripción Física. La principal característica que distingue a C. moreletii es el hocico alargado, 1.5 veces más largo que ancho. Los ojos, los oídos y las narinas se encuentran en el plano superior de la cabeza permitiendo su funcionamiento como órganos sensoriales aunque el cocodrilo permanezca con el cuerpo completamente sumergido. El tamaño máximo aproximado de un cocodrilo de pantano adulto es de 3.50 m, con un promedio de 2.00 a 2.50 m. Los neonatos, cuando nacen, miden de 22 a 29 cm de longitud. 1.6.4 Reproducción. Esta especie no presenta dimorfismo sexual en ninguna etapa de su vida aunque aparentemente los machos son mayores que las hembras. Sin embargo, machos y hembras, alcanzan la madurez sexual después de los 7 años de vida, cuando tienen al menos 1.5 m de longitud (Casas-Andreu y Rogel-Bahena, 1986; Platt, 1996; Platt y Thorbjarnarson, 2000; Álvarez del Toro y Sigler, 2001). En particular, en el Estado de Campeche, México, la estación reproductora inicia con el cortejo y apareamiento en febrero. La nidificación ocurre entre mayo y julio y la eclosión se da entre julio y octubre (Casas-Andreu y Rogel-Bahena, 1986; SEMARNAT, 2000; Álvarez del Toro y Sigler, 2001). Estos eventos se encuentran fuertemente ligados a los cambios ambientales (precipitación y fluctuación de los niveles de los ríos 28 y lagunas) y a la capacidad de los cocodrilos para percibir estos cambios, regulando su ciclo reproductor (Lance, 1987). En C. moreletii como en los otros crocodilianos, la determinación sexual se da a partir de la temperatura durante el primer tercio del periodo de incubación, produciéndose 100% de hembras si la temperatura se encuentra entre 30 y 32°C y 100% machos si la temperatura es mayor o igual a 34°C (Aguilar-Miguel, 1995; Lance, 1997; Aguilar-Miguel et al., 1998; Murray, 2004). 1.6.5 Dispersión. En general, C. moreletii es una especie poco estudiada (Perez-Higareda et al., 1995; SEMARNAT, 2000; Wu et al., 2000a; Álvarez del Toro y Sigler, 2001; Rainwater et al., 2002; Stafford et al., 2003) pero es muy probable que presente un patrón similar al de los sistemas poligínicos de otros vertebrados en el cual los machos tienden a dispersarse a mayor distancia, mientras que las hembras, filopátricas, permanecen cerca del lugar de nacimiento (Johnson y Gaines, 1990; Davies, 1991; Wu et al., 2000a). En apoyo de esta suposición, se ha descrito que los machos de C. johnstoni del Río Lynd de Australia, se dispersan de dos a tres veces más lejos que las hembras (Tucker, 1998) y que las hembras de C. acutus y C. intermedius muestran fidelidad por el sitio de anidación (Thorbjarnarson y Hernández, 1993; Casas-Andreu, 2003). 1.6.6 Hormonas en Cocodrilos. En cocodrilos, como en otros organismos en los que el sexo de los embriones no se encuentra predeterminado genéticamente sino que es definido por las condiciones ambientales durante la incubación, las hormonas esteroides, y principalmente los 29 estrógenos, juegan un papel importante aún cuando este papel no es completamente claro (Lance, 1997). Las hormonas intervienen tanto en la determinación del sexo; la diferenciación sexual del embrión; así como en el crecimiento y desarrollo del organismo una vez que ha nacido (Lance, 1997; Salame-Méndez y Villalpando-Fierro, 1998). En cuanto al crecimiento y desarrollo, el papel de la testosterona aún no es completamente claro (Pickford et al., 2000). Sin embargo, en machos adultos, existe un incremento de esta hormona en plasma en la etapa reproductora y un decremento en la etapa de nidificación y de puesta de huevos (Lance, 1987; Ponce-Campos et al., 2002). Por otra parte, los estrógenos y en particular el estradiol, tienen un gran número de funciones reguladoras de procesos fisiológicos tales como la del metabolismo del calcio y el balance de sales; así como la regulación de los ciclos reproductivos y el comportamiento maternal (Johnson y van Tienhoven, 1980). En A. mississippiensis y en C. acutus se ha registrado que durante la etapa reproductora existe un incremento en las concentraciones de estradiol en plasma (abrilmayo) y un decremento en la etapa de nidificación y cuidado del nido (Lance, 1987; Lance, 1997; Ponce-Campos et al., 2002). 1.6.7 POCs en C. moreletii. En relación con las concentraciones de POCs en cocodrilos de pantano, se ha registrado endosulfan II (1 ng/g), endrín (5 ng/g), metoxicloro (108 ng/g), p,p’ DDD (8 ng/g), p,p’ DDE (103 ng/g) y p,p’ DDT (15 ng/g) en huevos de C. moreletii en Belice (Wu et al., 2000b; Wu et al., 2000a; Wu et al., 2006). En Costa Rica se registró p,p’ DDE (340.2 ng/g), p,p’ DDT (254.8 ng/g), dieldrín (8.8 ng/g), endrín (229.8 ng/g) y metoxicloro 30 (533.8 ng/g) en escamas de C. acutus (Rainwater et al., 2007). Sin embargo no existen trabajos relacionados con estos POCs y hormonas de C. moreletii. Dados los antecedentes reportados en A. mississippiensis como la probable relación de los POCs con el tamaño y forma del pene; las anormalidades gonádicas; la variación en las concentraciones de hormonas esteroides; y la viabilidad de los embriones (Woodward y Jennings, 1993; Gross et al., 1994; Guillette et al., 1994; Guillette et al., 1996; Guillette et al., 1999a; Guillette et al., 1999b; Campbell, 2003; Gunderson et al., 2004), es de esperar que en C. moreletii en México haya también algún efecto nocivo causado por plaguicidas. Debido a que los cocodrilos son animales longevos (Webb et al., 1983), las repercusiones de estos cambios provocados por agentes químicos no se verán de forma inmediata. Un cocodrilo infértil o con un funcionamiento reproductor ineficiente (sea a través de un comportamiento de apareamiento inadecuado, a través de niveles de esteroides que no permitan la liberación de gametos, que provoquen infertilidad de los óvulos o la formación de embriones con defectos (Guillette et al., 1994; Guillette et al., 1996; Guillette et al., 1997; Guillette et al., 1999a; Guillette et al., 1999b; Gunderson et al., 2004), puede subsistir por muchos años en su hábitat. Muchos autores han enfatizado la dificultad de la obtención de parámetros demográficos de cocodrilos (Webb y Smith, 1987) tales como la sobrevivencia y la tasa reproductora (Hines y Abercrombie, 1987) de ahí que, el conocimiento de las tendencias en la dinámica de una población sea difícil de determinar. La única manera de detectar un funcionamiento inadecuado de la función reproductora es a través de estudios que tengan ese objetivo, en animales de la talla y los hábitos de estos 31 depredadores, estos estudios son extremadamente difíciles en estado silvestre (Webb y Messel, 1977; Messel et al., 1981; Webb y Smith, 1987) Un cocodrilo que haya bioacumulado compuestos orgánicos que pueden afectar su reproducción llegará a la etapa de adulto después de varios años y sobrevivirá por largo tiempo, pero su adecuación (descendencia y sobrevivencia de la misma) (Futuyma, 1998), será baja. Dado el estatus de “en peligro” de C. moreletii (Groombridge, 1987), monitoreos que se enfoquen en la presencia/ausencia de la especie en sitios contaminados o transformados resultará en datos alentadores. Sin embargo, la falta de reproducción conducirá a la disminución paulatina de una población y la eventual extinción. Por lo antes mencionado, en este trabajo se trató de comprobar si los individuos de C. moreletii de dos cuerpos de agua sometidos a un efecto diferencial de plaguicidas debido a las características de la región circundante, presentan bioacumulación diferencial de POCs y PCBs en sus tejidos y si hay un efecto medible sobre las concentraciones de esteroides sexuales. 32 2. Objetivos 2.1 General. Comparar la contaminación por algunos POCs y PCBs en dos cuerpos de agua del estado de Campeche y establecer si la misma tiene un efecto sobre la concentración de esteroides sexuales de Crocodylus moreletii. 2.2 Específicos. 2.2.1 Determinar y comparar la concentración de POCs y PCBs en sedimentos del Río Champotón y en la región de los Petenes. 2.2.2 Determinar y comparar la bioacumulación de POCs y PCBs en C. moreletii de cada uno de estos dos sitio y de un criadero. 2.2.3 Determinar si las concentraciones bioacumuladas por C. moreletii se relacionan con las medidas en el sedimento de cada sitio y si existen diferencias entre sexos. 2.2.4 Determinar si las concentraciones de hormonas sexuales (testoterona y estradiol) de C. moreletii machos y hembras varían a través del ciclo reproductor. 2.2.5 Determinar si los POCs y PCBs bioacumulados tienen efecto sobre la concentración de hormonas sexuales de C. moreletii hembras y machos que puedan afectar su desempeño reproductor. 33 3. Hipótesis 3.1 Debido al uso de plaguicidas en cultivos y zonas urbanas, el Río Champotón, que está influenciado por una mayor actividad antropogénica, presentará mayores concentraciones de POCs y PCBs en sedimento que los Petenes. 3.2 Las concentraciones de contaminantes en tejido graso de C. moreletii de Río Champotón serán mayores que las de cocodrilos de tejido graso de cocodrilos de los Petenes y ambas serán mayores que las de tejido graso de cocodrilos del criadero. 3.3 Dado que los cocodrilos machos presentan una conducta de dispersión mayor que las hembras, las concentraciones de POCs y PCBs bioacumuladas en tejido graso de los machos, tendrán una menor relación con las concentraciones acumuladas en los sedimentos del sitio en que sean capturados que las hembras. 3.4 Las concentraciones de esteroides sexuales (estradiol y testosterona) serán mayores durante la etapa de apareamiento y descenderán posteriormente en la de nidificación, puesta de huevos y cuidado de las crías. 3.5 La concentración de esteroides sexuales será afectada por la bioacumulación de POCs y PCBs. La testosterona en machos y hembras con presencia de contaminantes en tejido graso será menor que la de hembras y machos sin contaminantes. La concentración de estradiol será mayor en machos y en hembras con contaminantes que en cocodrilos sin contaminantes bioacumulados. 34 4. Métodos 4.1 Áreas de estudio. El Río Champotón se encuentra localizado en el estado de Campeche entre las coordenadas geográficas 19°16’ y 19°22’ latitud Nor te y 90°43’ y 90°27' longitud Oeste. Es un río perenne de aproximadamente 47 km con un recorrido general de Este a Oeste que drena una cuenca de 650km2. El clima predominante en la región es cálido subhúmedo con lluvias en verano (1100 a1500 mm anuales), temperatura promedio anual de 26 a 28°C (Arriaga et al., 2002). El río present a una típica circulación de flujo de dos capas y un marcado gradiente de salinidad que oscila con el sentido natural de las mareas, la descarga se ha estimado en 0.2 x 109 m³/año de acuerdo con las cifras de la Secretaría de Recursos Hidráulicos (Yañez-Arancibia et al., 1982). La principal actividad en la cuenca es la agricultura. El Río Champotón es considerado por la Comisión Nacional para el Uso y Conocimiento de la Biodiversidad (CONABIO) como región hidrológica prioritaria, amenazada por la transformación de ecosistemas. La principal problemática que presenta el río es la modificación del entorno (cambio de uso de suelo, la contaminación por aguas residuales domésticas y descargas del ingenio azucarero “La Joya”) (Figura 3) (Arriaga et al., 2002). La zona de colecta de los Petenes se encuentra localizada las coordenadas geográficas 20°32’ y 20°42’ latitud Norte; y 90°20’ y 90°30' longitud Oeste. Esta zona se ubica en la frontera administrativa de dos áreas naturales protegidas, la Reserva de la Biosfera “Los Petenes” y la Reserva de la Biosfera “Ría Celestún”, estas dos reservas 35 a b Figura 3 Áreas de estudio, (a) Región de los Petenes, (b) Río Champotón. constitullen un macizo bien conservado de playas, ciénegas y manglares. Esta región se encuentra salpicada de islas de vegetación de forma circular arbolada (manglar o selva) inmersa en una matriz de vegetación herbácea, de manglar disperso o de selva estructuralmente más baja. El término Petén se refiere a los islotes de vegetación que generalmente están asociados a un relieve o al afloramiento de agua dulce que forman pequeñas corrientes superficiales perennes. El clima predominante en la zona es cálido subhúmedo con lluvias en verano. La temperatura y precipitación media anuales varían de 27.8°C y 725.5 mm (con un gradiente entre los 700 y los 800 mm), hasta 26.4°C y 1,049.7 mm (CONANP, 2006). 36 Otras muestras se obtuvieron de animales mantenidos en la Unidad de Manejo para la Conservación y Aprovechamiento Sustentable de la Vida Silvestre del Centro de Estudios Tecnológicos del Mar (CETMar), 02, Campeche. Esta UMA se encuentra localizada en el límite sur de la Reserva de la Biósfera de Los Petenes, en la ciudad de Campeche, punto intermedio entre los dos sitios de colecta (Figura 3). Las muestras de este sitio se tomaron como referencia, asumiendo que corresponderían a animales sin impacto por residuos de POCs o PCBs. 4.2 Colecta de muestras. La colecta de muestras de tejido graso y sangre de C. moreletii y de muestras de sedimentos se realizó en dos épocas climáticas, correspondientes a la época de nortes (octubre-diciembre de 2005) y a la época seca (marzo-mayo de 2006). Estas fechas corresponden aproximadamente con dos momentos contrastantes dentro del ciclo reproductor de C. moreletii en la región de estudio: la anidación (abril a mayo) y la etapa post-eclosión (de octubre a diciembre) (Álvarez del Toro y Sigler, 2001). 4.2.1 Sedimentos. Para determinar los residuos de POCs y PCBs en sedimento, se obtuvieron 11 muestras de los sitios de estudio (5 en Río Champotón y 6 en los Petenes, ver Figura 3) en octubre del 2005 y la misma cantidad en abril del 2006. Cada muestra de sedimento fue tomada del fondo del cuerpo de agua mediante una draga manual de acero inoxidable. Las muestras fueron colocadas individualmente en papel aluminio, rotuladas e introducidas en bolsas plásticas y trasladadas en hielo al laboratorio en donde fueron mantenidas a -20°C hasta ser analizadas. 37 4.2.2 Cocodrilos. Las mediciones de POCs y PCBs se efectuaron en tejido graso y las de hormonas en plasma de C. moreletii. 4.2.2.1 Cocodrilos Silvestres. Para colectar las muestras de los animales silvestres, se realizaron búsquedas intensivas durante 4 noches en cada uno de los sitios de estudio entre octubre y noviembre del 2005 y el mismo número de noches entre marzo y abril de 2006. En el Río Champotón, los recorridos se realizaron a bordo de una lancha de fibra de vidrio de 16 pies de eslora con un motor fuera de borda de 40 hp; los recorridos fueron de aproximadamente 24 km iniciando en la localidad denominada Canasayab y finalizando en la desembocadura del río Champotón. En los Petenes el recorrido de aproximadamente 30 km se hizo a bordo de una camioneta por la carretera iniciando en el balneario “El Remate” y concluyendo en el poblado de Isla Arena. Los muestreos se iniciaron una hora después de la puesta de sol en ambos sitios ya que por la noche es más fácil la ubicación de los animales debido a que el tapetum lucidum del ojo de los cocodrilos está bien desarrollado y puede observarse al incidir una luz sobre la abertura pupilar (Messel et al., 1981). Los animales fueron localizados con ayuda de una lámpara de mano de 1,000,000 de candelas y lámparas de cabeza de baja intensidad. Las capturas se hicieron con lazos de cable de acero y pértigas de aluminio. Al momento de la captura, se registró la posición geográfica con un GPS (siglas en inglés 38 para Sistema Global) para tener la ubicación precisa del cocodrilo capturado y relacionarla con el sitio más cercano donde el sedimento había sido muestreado. Para su identificación, dada una posible recaptura, los animales se numeraron por medio del corte de las crestas de las escamas caudales con un bisturí. Las escamas de la línea simple representan las centenas, las crestas dobles representan las decenas y las unidades (izquierdo y derecho respectivamente), lo que permite marcar hasta 999 ejemplares. 4.2.2.1.1 Tejido Graso. Para efectuar evaluaciones de plaguicidas y policlorobifenilos bioacumulados por los animales, se empleó el tejido graso contenido en las secciones de las escamas obtenidas al marcar a los individuos. Estas muestras fueron colocadas en papel aluminio, rotuladas y guardadas en bolsas plásticas con cierre hermético. Las muestras fueron mantenidas en hielo durante su transporte al laboratorio y una vez ahí mantenidas a -20°C. 4.2.2.1.2 Sangre. Inmediatamente después de la captura se tomó una muestra de sangre (5mL aproximadamente) del seno postcraneal con una jeringa desechable con aguja de calibre 22G. La sangre fue inyectada en un tubo Vacutainer con heparina de litio. Una vez rotulado el tubo, se conservó en hielo para su transporte al laboratorio. En el laboratorio, la sangre fue centrifugada a 3000 rpm por 5 minutos y posteriormente el plasma fue retirado con ayuda de una micropipeta con puntas desechables. El plasma 39 fue vertido en un criovial de 4 mL y congelado a -20°C hasta su envío y análisis en el Laboratorio de Endocrinología Reproductiva de la UAM-Iztapalapa. 4.2.2.1.3 Sexado y Datos Morfométricos. Antes de liberar a cada cocodrilo, se procedió a su sexado por tacto de la cloaca. Se midió la talla (largo total, largo hocico-cloaca) con un flexómetro y se pesó con un dinamómetro de resorte. Cada individuo fue liberado en el mismo lugar en donde fue capturado. 4.2.2.2 Cocodrilos de Criadero. Muestreos idénticos a los antes descritos se efectuaron en la Unidad de manejo para la conservación y aprovechamiento sustentable de la vida silvestre (UMA) “CETMar 02, Campeche” Clave: INE/CITES/DGVS-CR-IN-0519-CAMP/99 donde se mantienen individuos de C. moreletii en cautiverio. Las muestras de los animales mantenidos en cautiverio, fueron colectadas en una noche en cada periodo de muestreo. El muestreo estuvo dirigido a individuos de talla mayor a 1.5 m, asumiendo que en vida silvestre, al alcanzar esa talla ya cuentan con la edad suficiente (7 años) para ser considerados como adultos reproductores. 4.3 Análisis de muestras. 4.3.1 POCs y PCBs en Sedimento. Las muestras de sedimento fueron analizadas en el Laboratorio de Contaminación e Impacto Ambiental del Centro EPOMEX de la Universidad Autónoma 40 de Campeche. Las muestras se sometieron a un proceso de extracción y purificación antes de su análisis por cromatografía de gases. El análisis se efectuó de acuerdo a métodos estandarizados de UNEP/IOC/IAEA (1988) en un cromatógrafo (Varian 3800) de gases con detector de captura de electrones. Para la identificación de plaguicidas organoclorados se usó una mezcla de estándares que contenían α, β, γ, y δ HCH, heptacloro, aldrín, epóxido de heptacloro, endosulfan I, dieldrín, p,p DDE, endrín, endosulfan II, endrín Aldehído, p,p DDD, endosulfan sulfato y p,p DDT (Ultra Scientific, Inc.® Organochlorine Pesticide Mixture); mientras que para la identificación de PCBs se usaron los congéneros: 2,4',5triclorabifenilo; tetraclorobifenilo, 2,4,4'-triclorobifenilo, 2,2',5,5'-tetraclorobifenilo, 2,2',4,5,5'-pentaclorobifenilo, 2,2',4,4',5,5'-hexaclorobifenilo, 2,2',3,5'- 2,3',4,4',5-pentaclorobifenilo, 2,2',3,4,4',5'-hexaclorobifenilo, 2,2',3,3',4,4',5,5'- octaclorobifenilo, 2,2',3,4,4',5,5'-heptaclorobifenilo y 2,2',3,3',4,4',5,5'-octaclorobifenilo (SUPELCO® 47927 CEN PCB Congener Mix-1). 4.3.2 POCs y PCBs en Tejido Graso. Las muestras de tejido graso de los cocodrilos fueron analizadas en el Laboratorio de Contaminación e Impacto Ambiental del Centro EPOMEX de la Universidad Autónoma de Campeche donde fueron sometidas a un proceso de extracción y purificación de los compuestos con hexanos antes de su análisis por cromatografía. El análisis de las muestras de tejido graso se realizó de acuerdo con el método descrito por Bagar y col. (1999), que consiste en una homogenización del tejido en sulfato de sodio anhidro, extracción con hexano:acetona (1:1) y análisis en un 41 cromatógrafo de gases (Varian 3800) con detector de captura de electrones. Para la identificación de los residuos de POCs y PCBs se emplearon los mismos procedimientos y estándares que se usaron para los sedimentos. 4.3.3 Hormonas Esteroides. De cada una de las muestras de plasma se valoraron, por duplicado, las concentraciones de testosterona y estradiol utilizando la técnica de inmunoensayo enzimático (EIA). Se emplearon estuches (kits) de Diagnostic Systems Laboratories, Inc®, (Webster, Texas) y la concentración de cada hormona se determinó mediante un espectrofotocolorímetro (Microplate Reader, MR600, Dynatech Product®). Previo al análisis de las muestras se realizaron evaluaciones de los kits para constatar linealidad y especificidad de los antisueros para testosterona (T) y estradiol (E2) con la finalidad de corroborar (validar) lo especificado por el fabricante de los estuches para suero humano, y así usarlo en suero de la especie en estudio. Con este fin se realizaron ensayos tanto con las disoluciones de la hormona provistos en el estuche como con estándares de T y E2 (Sigma-Aldrich, y Steraloids, Inc.) previamente purificados. El porcentaje de la recuperación (linealidad) para T fue de 94.5 ± 0.88, y el de E2 89.4 ± 2.4. Por su parte, el porcentaje de reactividad cruzada (especificidad) en el laboratorio para el antisuero de T fue de 100 contra el antisuero para T y de 0.64 ± 2 para E2, mientras que los referidos por el fabricante son de 100 para T y 0.4 para E2. La especificidad del antisuero contra E2 fue 100 y T fue no detectada (ND). Por último, la sensibilidad (concentración mínima detectable) del ensayo para T fue de 40 pg y para E2 de 7 pg. 42 4.4 Análisis de Datos. 4.4.1 POCs y PCBs en Sedimento. Los residuos de POCs y PCBs fueron analizados como grupos de plaguicidas utilizando sumatorias de los compuestos específicos de acuerdo a la clasificación incluída en el (Cuadro 3). Se encontraron seis grupos de acuerdo a sus características químicas: ΣHCHs, ΣHeptacloros, ΣDrines, ΣEndosulfanes, ΣDDTs y ΣPCBs. Cuadro 3 Relación de POCs y PCBs cuantificados en este estudio, agrupados por características químicas. ΣHCHs ΣHeptacloros ΣDrines ΣEndosulfanes ΣDDTs α HCH heptacloro aldrín endosulfan I p, p’ DDD β HCH epoxido de heptacloro dieldrín endosulfan II p, p’ DDE γ HCH endrin endosulfan sulfato p, p’ DDT δ HCH endrín aldehído ΣPCBs 2,4',5triclorabifenilo 2,4,4'triclorobifenilo 2,2',5,5'tetraclorobifenilo 2,2',3,5'tetraclorobifenilo 2,2',4,5,5'pentaclorobifenilo 2,3',4,4',5pentaclorobifenilo 2,2',4,4',5,5'hexaclorobifenilo 2,2',3,4,4',5'hexaclorobifenilo 2,2',3,3',4,4',5,5'octaclorobifenilo 2,2',3,4,4',5,5'heptaclorobifenilo 2,2',3,3',4,4',5,5'octaclorobifenilo La comparación de las concentraciones de cada uno de estos compuestos en los sedimentos de los dos sitios de estudio se llevó a cabo con ANDEVAs de dos vías (factores: sitio y época) de los datos transformados a rangos que es un procedimiento sugerido para análisis de datos donde hay muchos ceros pero se desea utilizar estadística paramétrica en las comparaciones (Conover y Iman, 1981). 43 4.4.2 POCs y PCBs en Tejido Graso. Las concentraciones de los compuestos en tejido graso de los animales de los diferentes sitios (Champotón, Petenes y CETMar) fueron transformadas a rangos del mismo modo que se hizo con los datos de sedimento y se compararon con ANDEVAs de dos vías (factores: sitio y sexo). 4.4.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos. Para determinar si las diferencias entre sexos en términos de la conducta de dispersión podrían relacionarse con diferencias en la acumulación de POCs y PCBs de los dos sexos, se llevaron a cabo análisis de covarianza. Para estos análisis se utilizó la concentración de cada compuesto medida en sedimento de la localidad más cercana al sitio de captura del animal como covariable y la medida del mismo compuesto en tejido de los animales como variable dependiente mientras que el sexo fue el factor a probar. Se hipotetizaba que la filopatría en los cocodrilos hembra se reflejaría en un coeficiente de covarianza de mayor significancia que en los machos. 4.4.4 Hormonas Esteroides. Para probar si existían diferencias en la concentración de hormonas en relación al sexo, se usó un análisis de varianza (ANDEVA) para la testosterona y otro para el estradiol previa transformación de los datos a logaritmos. En cuanto a las diferencias relacionadas con el grado de madurez y entre etapas reproductoras de C. moreletii, se usó un ANDEVA de dos vías para cada sexo y cada hormona por separado. Para lo anterior, las muestras de plasma fueron clasificadas según la longitud total de los cocodrilos, en dos grados de madurez (subadultos ≤1.5m y 44 adultos>1.5m) (Platt, 1996; Platt y Thorbjarnarson, 2000; Platt et al., 2006). Las concentraciones de cada hormona se transformaron a logaritmos y los factores usados fueron el grado de madurez (adultos y subadultos) y la etapa reproductora (anidación y post-eclosión). 4.4.5 POCs, PCBs y Hormonas en Cocodrilos. Para probar si existía alguna relación entre los residuos de POCs y PCBs en tejido graso y las hormonas esteroides en plasma de cada animal (esto es, si los contaminantes actúan como desorganizadores endocrinos), se efectuaron análisis de covarianza. La concentración de POCs y PCBs, transformada a rango, correspondió a la covariable de las concentraciones de cada hormona medida en el individuo correspondiente transformada a logaritmo. El factor a probar fue el grado de madurez. Cada sexo y hormona se analizó por separado. En el caso de encontrarse una covariación significativa entre cada grupos de POCs o PCBs y hormonas, se realizaron correlaciones de cada grado de madurez por separado (adultos y subadultos) para determinar si existía alguna relación diferencial entre dicho grado de madurez. 45 5. Resultados. 5.1 POCs y PCBs en Sedimento. De los compuestos considerados, en el presente estudio se detectaron 13 plaguicidas y 9 congéneros de PCBs en el sedimento de los sitios de estudio. De los cinco puntos muestreados en el Río Champotón, se encontraron ΣPCBs en todas las muestras en ambas épocas, los ΣHCHs se encontraron en cuatro muestras (4/5) en la época de nortes y en dos (2/5) en la época seca; Σendosulfanes en dos (2/5) en la época de nortes y en ninguna en la época seca (0/5); Σdrines una en la época de nortes (1/5) y dos en la época seca (2/5), y ΣDDTs en una (1/5) tanto en la época de nortes como en la época seca. Los Σheptacloros solo fueron detectados en la época seca en una muestra (1/5) (Cuadro 4). Secas Nortes Secas Nortes Cuadro 4 Sumatorias de las concentraciones (ppm de peso seco) de POCs y PCBs detectados en sedimentos de Río Champotón y los Petenes ( N.D.= no detectado). Champotón 1 Champotón 2 Champotón 3 Champotón 4 Champotón 5 Champotón 1 Champotón 2 Champotón 3 Champotón 4 Champotón 5 Petenes 1 Petenes 2 Petenes 3 Petenes 4 Petenes 5 Petenes 6 Petenes 1 Petenes 2 Petenes 3 Petenes 4 Petenes 5 Petenes 6 Σ HCHs Σheptacloros Σ Σ Drines Σendosulfanes Σ N.D. N.D. N.D. 2.1612 N.D. 39.3657 0.1442 0.0727 N.D. N.D. N.D. 7.7471 N.D. N.D. 70.1215 2.1409 Σ DDTs N.D. 0.1379 N.D. N.D. Σ PCBs 1.2181 4.6297 2.9278 7.7221 0.036 0.0512 0.0924 0.2155 0.6973 0.2323 0.0066 0.1734 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.5752 N.D. N.D. N.D. N.D. N.D. 1.4948 5.9108 N.D. 2.0328 0.5048 0.5172 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 3.3924 1.8772 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 1.3194 1.288 0.3832 0.3083 1.9354 0.6011 N.D. N.D. N.D. N.D. N.D. N.D. 3.9455 2.0003 4.2904 N.D. N.D. N.D. N.D. 0.5157 0.0315 N.D. N.D. N.D. N.D. N.D. 0.5684 0.5271 N.D. N.D. N.D. N.D. 0.3377 0.3097 N.D. N.D. N.D. N.D. 0.6491 0.5323 0.2637 0.6549 N.D. 1.0529 0.0665 0.4325 0.1379 0.5037 46 En el Norte de la Reserva de la Biosfera de los Petenes se encontraron ΣHCHs en cuatro de seis muestras (4/6) en la época de nortes y en cinco (5/6) en la época seca; ΣPCBs en tres muestras (3/6) en la época de nortes y cinco (5/6) en la época seca; ΣDDTs en una muestra (1/6) en nortes y en tres (3/6) en secas; Σdrines en una muestra (1/6) en nortes y en dos (2/6) en la seca; Σheptacloros en ninguna muestra (0/6) en nortes y en tres (3/6) en la época seca y Σendosulfanes en una (1/6) en nortes y en ninguna (0/6) en la seca (Cuadro 4). Σdrines, Σendosulfanes y ΣDDT medidos en sedimento no presentaron concentraciones significativamente distintas entre sitios ni entre épocas. En tanto las concentraciones de ΣHCHs presentaron diferencias significativas entre épocas (F(1,18)=6.006, p=0.025). Una prueba de Tukey indicó que las diferencias se debían a concentraciones mayores en Río Champotón en la época de nortes (Q= 17.00, p=0.043). Del mismo modo, para los Σheptacloros se encontraron diferencias entre épocas (F(1,18)=5.27, p=0.033) registrándose las mayores concentraciones en la época seca en ambos sitios (Q= 0.195, p=0.027). En cuanto a los ΣPCBs, se encontraron diferencias significativas entre sitios (F(1,18)=8.44, p=0.0.009), con mayores concentraciones en Río Champotón en la época de nortes (Q=17.8, p=0.019) (Figura 1). 47 ΣHeptacloros en Sedimento 0.3 20 0.25 0.2 15 ppm ppm ΣHCHs en Sedimento 25 10 0.15 0.1 5 0.05 0 0 Lluvias Secas Lluvias Río Champotón Secas Lluvias Los Petenes Secas Los Petenes ΣEndosulfanes en Sedimento 1.5 0.5 1.2 0.4 0.9 0.3 ppm ppm Lluvias Río Champotón ΣDrines en Sedimento 0.6 0.3 0.2 0.1 0 0 Lluvias Secas Lluvias Río Champotón Secas Lluvias Los Petenes ΣDDTs en Sedimento ppm 0.4 0.2 0 Secas Río Champotón Lluvias Secas Los Petenes ΣPCBs en Sedimento 0.6 Lluvias Secas Río Champotón 0.8 ppm Secas Lluvias Secas 3.5 3 2.5 2 1.5 1 0.5 0 Lluvias Los Petenes Secas Río Champotón Lluvias Secas Los Petenes Figura 4 Concentraciones medias de POCs y PCBs en sedimento de Río Champotón y los Petenes 5.2 POCs y PCBs en Cocodrilos. Se capturaron un total de 37 ejemplares, 18 en la época de nortes (8 Petenes, 2 Champotón y 8 en el CETMar) y 19 en la época seca (9 Petenes, 4 Champotón y 6 en el CETMar). La talla (largo hocico-cloaca) promedio de los individuos capturados fue de 79.74 cm (Cuadro 5). 48 Cuadro 5 Número total de individuos capturados durante el estudio. Localidad n ♀:♂ Largo Hocico-Cloaca (cm) Champotón Petenes Cetmar 6 17 14 1:1 5:12 9:5 DE 26.5 15.5 10.6 72.4 64.9 99.6 Rango 42 37.4 81.5 108 99.1 118 Del total de 37 muestras de tejido graso colectadas y analizadas, se detectaron ΣHCHs en seis individuos (2 en Río Champotón y 4 en los Petenes); Σdrines en 3 individuos (1 en Río Champotón y 2 en los Petenes); ΣDDTs en 2 individuos (1 en Río Champotón y 1 en los Petenes) y Σendosulfanes en una muestra (en los Petenes). Los ΣPCBs fueron detectados en 3 muestras de Río Champotón, 8 muestras de los Petenes y 7 muestras del CETMar. En el CETMar los ΣPCBs son los únicos compuestos registrados en tejido graso de cocodrilos (Cuadro 6). Los compuestos más frecuentes en el total de las muestras fueron los ΣPCBs, presentándose en el 48.6% de las muestras de tejido graso de cocodrilo. Los ΣHCHs se presentaron en el 16%, los Σdrines en el 8%, los ΣDDTs en el 4%, los Σendosulfanes en el 1% y los Σheptacloros en ninguna muestra. De las concentraciones de plaguicidas y policlorobifenilos en tejido graso, los ΣHCHs presentaron diferencias significativas (F(2,31)=5.58, p=0.008) entre las concentraciones promedio de los sitios (CETMar=0.00µg/g; Petenes=0.1028 µg/g; Champotón=0.1609 µg/g) registrando las menores concentraciones en el CETMar. Sin embargo estos mismos compuestos no difieren entre sexos (F(1,31)=2.54, p=0.12). Los Σdrines, Σendosulfanes, ΣDDTs y ΣPCBs no presentaron diferencias entre sitios (F(2,31)=1.37, p=0.26; F(2,31)=0.18, p=0.83; F(2,31)=1.05, p=0.36; F(2,31)=0.05, p=0.95, respectivamente) ni entre sexos (F(1,31)=0.16, p=0.68; F(1,31)=0.16, p=0.68; F(1,31)=2.40, 49 p=0.13; F(1,31)=0.025, p=0.87;). No se registraron Σheptacloros en ninguna muestra (Figura 5). Cuadro 6 Sumatorias de las concentraciones (ppm de tejido graso) de los POCs y PCBs detectados en tejido graso de C. moreletii (N.D.= no detectado, Champ=Río COPs Champotón, Pet=Los Petenes, Cet=CETMar 02). Champ2♀ Champ4♀ Champ6♀ Pet2♀ Pet8♀ Pet10♀ Pet11♀ Pet12♀ Cet1♀ Cet3♀ Cet4♀ Cet5♀ Cet6♀ Cet10♀ Cet11♀ Cet12♀ Cet13♀ Champ1♂ Champ3♂ Champ5♂ Pet1♂ Pet3♂ Pet4♂ Pet5♂ Pet6♂ Pet7♂ Pet9♂ Pet13♂ Pet14♂ Pet15♂ Pet16♂ Pet17♂ Cet2♂ Cet7♂ Cet8♂ Cet9♂ Cet14♂ Σ HCHs Σ Heptacloros Σ Drines Σ Endosulfanes Σ DDTs Σ PCBs 0.237 N.D. N.D. N.D. N.D. 0.00595 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.5469 0.5062 N.D. 0.9942 N.D. N.D. N.D. N.D. N.D. N.D. 0.2487 0.11385 0.0159375 N.D. N.D. N.D. N.D. N.D. N.D. 0.158 N.D. N.D. N.D. N.D. 0.645 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.02925 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.024 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.02925 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.7287 N.D. 0.3082 N.D. 1.2445 0.037575 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.5362 N.D. 0.7801 0.3456 2.0125 0.03675 1.25715 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.01275 0.07655 0.05985 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.00645 N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. N.D. 0.00606429 0.00645 0.00606429 50 SHCH en Tejido Graso SDDT enTejido Graso 0.8 2.5 2 ppm ppm 0.6 0.4 0.2 1.5 1 0.5 0 0 CETMar Champotón Petenes CETMar Sdrines en Tejido Graso Petenes SPCBs enTejido Graso 1.2 0.3 1 0.25 0.2 ppm 0.8 ppm Champotón 0.6 0.15 0.4 0.1 0.2 0.05 0 0 CETMar Champotón Petenes CETMar Champotón Petenes Sendosulfanes enTejido Graso 0.4 ppm 0.3 0.2 0.1 0 CETMar Champotón Petenes Figura 5 Concentraciones medias (ppm) de POCs y PCBs en tejido graso de C. moreletii. 5.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos. En ningún caso se encontró que las concentraciones de los compuestos analizados en el tejido graso de cocodrilos covariaran significativamente con las concentraciones de estos compuestos en sedimentos (ΣHCHs F(1,20)=1.07, p=0.31; Σdrines F(1,20)=0.84, p=0.36; Σendosulfanes F(1,20)=0.10, p=0.75; ΣDDTs F(1,20)=1.31, p=0.26; ΣPCBs F(1,20)=2.31, p=0.14). Y al considerar esta covariación tampoco se encontraron diferencias de su bioacumulación en cada sexo (ΣHCHs F(1,20)=2.84, 51 p=0.10; Σdrines F(1,20)=0.004, p=0.95; Σendosulfanes F(1,20)=0.55, p=0.46; ΣDDTs F(1,20)=1.17, p=0.14; ΣPCBs F(1,20)=0.10, p=0.74) ) (Figura 6). 5.4 Hormonas Esteroides. La concentración promedio de testosterona en machos de C. moreletii fue de 2.419 ng/mL (DE=3.085), mientras que para las hembras fue de 0.876 ng/mL (DE=1.457). Estas concentraciones difieren significativamente entre sexos (F(1,36)=4.60, p=0.04) (Figura 7). En machos, la concentración de testosterona fue significativamente mayor en los adultos que en los subadultos (F(1,16)=9.17, p=0.008) y no se registraron diferencias por etapa reproductora (F(1,16)=0.23, p=0.63). En cuanto a las hembras, la concentración de testosterona no presentó diferencias significativas de acuerdo al grado de madurez (F(1,13)=0.26, p=0.61) ni a la etapa reproductora (F(1,13)=0.07, p=0.40) (Figura 8). La concentración promedio de estradiol en machos fue de 29.35 pg/ml (DE=39.56) y de 30.7 pg/ml (DE=27.58) para las hembras y éstas concentraciones no difieren significativamente entre sexos (F(1,36)=0.590, p=0.44) (Figura 9). Tampoco se encontraron diferencias significativas en las concentraciones de estradiol de acuerdo al grado de madurez ni la etapa reproductora para ninguno de los dos sexos (Machos: grado de madurez F(1,13)=1.13, p=0.30; etapa reproductora F(1,13)=2.61, p=0.12. Hembras: grado de madurez F(1,13)=0.33, p=0.57; etapa reproductora: F(1,13)=0.46, p=0.50) (Figura 10). 52 .3 .2 .2 HCHs (ppm) drines (ppm) .3 .1 0.0 N= .05 .1 15 8 Machos Hembras 0.0 N= .4 15 8 Machos Hembras .04 DDTs (ppt) .03 .02 .2 .1 .01 0.00 N= 15 8 Machos Hembras 0.0 N= 15 8 Machos Hembras .4 .3 PCBs (ppm) endosulfanes (ppm) .3 .2 .1 0.0 N= 15 8 Machos Hembras Figura 6 Concentraciones bioacumuladas medias de POCs y PCBs por sexo. Barras: error estándar. 53 3.5 Testosterona (ng/mL) 3.0 2.5 2.0 1.5 1.0 .5 0.0 N= 20 17 Machos Hembras Figura 7 Concentraciones medias de testosterona (ng/mL) y error estándar por sexo. a) b) 7 3 6 3 Testosterona (ng/mL) 4 3 2 2 2 1 Adultos 1 Adultos 1 0 Subadultos -1 N= 4 6 Anidación 7 Subadultos 0 N= 3 Posteclosión 4 5 Anidación 5 3 Posteclosión Figura 8 Concentraciones promedio de testosterona (ng/mL) y error estándar por etapa reproductora y grado de madurez a) machos, b) hembras. 40 Estradiol (pg/mL) Testosterona (ng/mL) 5 30 20 10 N= 20 17 Machos Hembras Figura 9 Concentraciones medias de estradiol (pg/mL) y error estándar por sexo. 54 a) b) 60 80 50 70 60 Estradiol (pg/mL) Estradiol (pg/mL) 40 30 20 10 Adultos Subadultos 4 6 Anidación 7 40 30 Adultos 20 0 -10 N= 50 10 Subadultos 0 N= 3 Posteclosión 4 5 Anidación 5 3 Posteclosión Figura 10 Concentraciones medias de estradiol (ng/mL) y error estándar por etapa reproductora y grado de madurez a) machos, b) hembras. 5.5 POCs, PCBs y Hormonas en Cocodrilos. 5.5.1 Machos. En los machos, las concentraciones de la testosterona y estradiol cuantificadas, no covarían con ninguno de los compuestos bioacumulados medidos en el presente estudio (testosterona vs: ΣHCHs F(1,17)=2.38, p=0.14; Σdrines F(1,17)=2.38, p=0.14; Σendosulfanes F(1,17)=1.12, p=0.30; ΣDDTs F(1,17)=2.38, p=0.14; ΣPCBs F(1,17)=0.34, p=0.85. Estradiol vs: ΣHCHs F(1,17)=3.43 p=0.08; Σdrines F(1,17)=3.68, p=0.07; Σendosulfanes F(1,17)=2.89, p=0.10; ΣDDTs F(1,17)=3.68, p=0.07; ΣPCBs F(1,17)=0.01, p=0.94). Sin embargo, las concentraciones de testosterona difieren según el grado de madurez independientemente de los POCs o PCBs bioacumulados en el tejido. (ΣHCHs F(1,17)=11.07, p=0.004; Σdrines F(1,17)=11.39, p=0.004; Σendosulfanes F(1,17)=11.27, p=0.004; ΣDDTs F(1,17)=11.39, p=0.004; ΣPCBs F(1,17)=9.49, p=0.007) (Figura 11), mientras que el estradiol no difiere en relación con el grado de madurez (ΣHCHs 55 F(1,17)=0.39, p=0.53; Σdrines F(1,17)=0.491, p=0.49; Σendosulfanes F(1,17)=1.01, p=0.32; ΣDDTs F(1,17)=0.491, p=0.49; ΣPCBs F(1,17)=0.308, p=0.58). Σdrines ΣHCHs 1.0 0.8 0.6 Testosterona 0.4 0.2 0.0 -0.2 -0.4 -0.6 -0.8 -1.0 -1.2 Adultos Adultos Subadultos Σendosulfanes Subadultos ΣDDTs 1.0 0.8 0.6 Testosterona 0.4 0.2 0.0 -0.2 -0.4 -0.6 -0.8 -1.0 -1.2 Adultos Subadultos Adultos Subadultos ΣPCBs 1.0 0.8 0.6 Testosterona 0.4 0.2 0.0 -0.2 -0.4 -0.6 -0.8 -1.0 -1.2 Adultos Subadultos Figura 11 Concentración media de testosterona (escala logarítmica) según grado de madurez una vez anulado el efecto de los POCs y los PCBs. Barras: Intervalo de confianza (0.95). 56 5.5.2 Hembras. En estas, la testosterona covaría significativamente con los ΣPCBs (F(1,14)=4.75, p=0.04) y el estradiol covaría con los ΣHCHs (F(1,14)=5.14, p=0.04). Ni la testosterona ni el estradiol covarían con el resto de los compuestos medidos (testosterona vs: ΣHCHs F(1,14)=2.60, p=0.12; Σdrines F(1,14)=1.08, p=0.31. Estradiol vs: Σdrines F(1,14)=0.11, p=0.68; ΣPCBs F(1,14)=1.85, p=0.19). La concentración de estradiol registra diferencias significativas marginales en relación al grado de madurez una vez que se anula el efecto (covarianza) de la concentración de ΣHCHs (F(1,17)=4.24, p=0.05) (Figura 12). Con el resto de los compuestos no se presenta diferencia significativa entre el grado de madurez (testosterona: ΣHCHs F(1,14)=0.26, p=0.12; Σdrines F(1,14)=0.57, p=0.46; ΣPCBs F(1,14)=0.39, p=0.84. Estradiol: Σdrines F(1,14)=0.415, p=0.53 ΣPCBs F(1,14)=1.07, p=0.31). ΣHCHs 2.0 1.8 Estradiol 1.6 1.4 1.2 1.0 0.8 0.6 0.4 Adultas Subadultas Figura 12 Concentración media de estradiol (escala logarítmica) según el grado de madurez una vez anulado el efecto de los ΣHCHs Barras: Intervalo de confianza (0.95). 57 La testosterona no se correlaciona con los ΣPCBs si se considera el grado de madurez por separado (adultas: R2=,0.43 p=0.24; subadultas: R2=0.55, p=0.15) ni el estradiol con los ΣHCHs en el mismo sentido (adultas: no se registran ΣHCHs; subadultas: R2=0.58, p=0.12). 58 6. Discusión 6.1 POCs y PCBs en Sedimentos. Los compuestos más abundantes en los sedimentos de la región parecen ser los ΣPCBs ya que cuando menos uno de sus congéneros se encontró en cada muestra de sedimento del Río Champotón y en el 63% de las muestras de los Petenes. El segundo grupo de compuestos en frecuencia de aparición fueron los ΣHCHs que se presentaron en el 75% de las muestras de los Petenes y en el 60% de las muestras de Río Champotón. Dado que en ninguno de los sitios existen fuentes puntuales de contaminación de por POCs o PCBs, probablemente los plaguicidas organoclorados son incorporados a estos sistemas a partir del arrastre de sedimentos de las zonas de cultivo por los escurrimientos pluviales, mientras que los ΣPCBs pueden ser incorporados por los sistemas de drenaje y el arrastre de materiales de zonas urbanas y suburbanas. La deposición atmosférica puede ser otra vía de ingreso de plaguicidas y PCBs a estos sistemas acuáticos (Van Zoest y Van Eck, 1990; Sanders et al., 1996). En el Río Champotón, el principal aporte de plaguicidas parece ser el arrastre de sedimentos de las zonas de cultivo asociadas al ingenio azucarero “La Joya” aledañas al río, principalmente en época de nortes. Mientras que en los Petenes, los datos sugieren que el principal aporte de plaguicidas es la deposición atmosférica, ya que no existen actividades humanas importantes en la zona ni corrientes de agua que drenen zonas de cultivo o zonas urbanas de importancia. 59 En el Río Champotón, las concentraciones de algunos plaguicidas como los ΣHCHs, así como las concentraciones de ΣPCBs resultaron ser mayores durante la época de nortes. Esto probablemente se debe a que el aporte de materia orgánica por parte del arrastre de sedimentos de las zonas agrícolas de los márgenes del Río Champotón, así como de la zona urbana y suburbana de la ciudad del mismo nombre, es la principal fuente de entrada de estos contaminantes al sistema que tiene una corriente mayor cuando las lluvias son abundantes. ΣDrines, Σendosulfanes y ΣDDT tienen concentraciones similares en el sedimento de ambos sitios lo que sugiere que el movimiento regional, a través de sedimentos o global, por medio de la volatilización en el aire de estos compuestos, homogeneíza sus concentraciones (Park et al., 2002). Los Σheptacloros, debido a su baja movilidad en el ambiente vía volatilización por su estructura compleja y radicales cloro (Wania y Mackay, 1996), tienden a concentrarse en la materia orgánica y ser transportados por las corrientes en los cuerpos de agua (Majewski y Capel, 1995). En este sentido, en época de secas, estos compuestos tienden a acumularse en el fondo de los cuerpos de agua, mientras que en nortes, las corrientes tienden a erosionar la materia orgánica del fondo de los cuerpos de agua y con ella los compuestos almacenados y finalmente transportarlos al mar. El aporte vía atmósfera parece tener un papel importante en ambos sitios, ya que se registran concentraciones importantes de los compuestos de estructura más simple y pesos moleculares bajos (por ejemplo los HCHs y PCBs con menos de 4 radicales de cloro) los cuales pueden volatilizarse con mayor facilidad y sedimentarse con las precipitaciones pluviales en sitios lejanos a sus fuentes de origen (Daly et al., 2007). 60 Este hecho sugiere que aún las zonas que pudieran considerarse como libres de contaminantes por localizarse lejos de centros urbanos o zonas de cultivo importantes, como sería el caso de los Petenes, podrían ser receptores pasivos de estos contaminantes. 6.2 POCs y PCBs en Cocodrilos. El 51% de las muestras de tejido graso analizadas no presentaron ninguno de los compuestos medidos en este estudio. Un individuo macho (LT=1.26m) de los Petenes presentó cinco de los grupos (ΣHCHs, Σdrines, Σendosulfanes, ΣDDTs y ΣPCBs) y una hembra (LT=1.27m) de Río Champotón tres de ellos (ΣHCHs, Σdrines y ΣPCBs). El resto de las muestras registraron la presencia de un solo grupo de los compuestos considerados. Cabe mencionar que los ΣPCBs se presentaron en aproximadamente la mitad de los cocodrilos muestreados. En el presente estudio, a nivel regional, el grupo de compuestos con mayor frecuencia en las muestras fueron los ΣPCBs (48.6%). Sin embargo, las concentraciones registradas en los cocodrilos no varían entre los sitios de muestreo ni entre sexos. En contraste, los ΣHCHs se ubicaron en el segundo lugar de aparición (16.2%) pero su concentración si difiere entre sitios, siendo menor en los animales del CETMar. Esta diferencia en las concentración de contaminantes acumulados en los cocodrilos silvestres (Río Champotón y los Petenes) con los mantenidos en cautiverio (CETMar) puede atribuirse a la gran variedad de presas de las que se alimentan los cocodrilos en vida silvestre (Platt et al., 2006) como son insectos, crustáceos, anfibios, 61 peces, reptiles y pequeños mamíferos, en contraste con la mono-dieta a base de sobrantes de pescado de consumo humano de los cocodrilos del CETMar. Es posible también que el estado de salud general y las reservas energéticas (Sakellarides et al., 2006) de los animales silvestres y los cautivos sean distintas. En el caso de los ΣHCHs, probablemente la diferencia que existe entre las concentraciones en cocodrilos de vida silvestre y de cautiverio se debe a que la alimentación de los cocodrilos silvestres, sobre todo en las primeras etapas de desarrollo, se compone principalmente de invertebrados como crustáceos con hábitos detritívoros o cercanos a éstos en la trama trófica, lo que introduce compuestos disponibles localmente como los ΣHCHs en este caso. Por otra parte, la ausencia de diferencias significativas en la concentración de Σdrines, Σendosulfanes, ΣDDTs y ΣPCBs, en tejidos de C. moreletii en estado silvestre de ambas poblaciones y de los mantenidos en cautiverio, sugiere que la fuente de contaminación se encuentra disponible de las tres poblaciones muestreadas. Por lo anterior, se puede pensar que los peces demersales que usan los humedales costeros en alguna etapa de su ciclo de vida, son los responsables de introducir estos contaminantes a los ambientes costeros, hábitat de los cocodrilos. Una gran variedad de especies de peces demersales, pasan la mayor parte de su ciclo de vida en la plataforma continental del Golfo de México, en donde se encuentra la industria petrolera. Aunado al hecho de que los ΣPCBs, son relativamente poco volátiles, tienden a permanecer en sitios cercanos a las fuentes de contaminación y por esta razón probablemente se encuentran disponibles para ser consumidos por los peces en esta zona marina. 62 Estos peces son ampliamente usados para el consumo humano y la elaboración de alimentos balanceados para la engorda de diferentes animales domésticos como aves de corral y ganado vacuno. También son presa de cocodrilos adultos, así como de algunos mamíferos medianos que a su vez, también pueden ser presa de los cocodrilos, resultando en la bioacumulación de los PCBs. Rainwater y colaboradores (2007) reportan concentraciones en escamas caudales de C. acutus en Costa Rica de 0.37 µg/g (peso húmedo) de Σdrines y 0.60 µg/g (peso húmedo) de ΣDDTs. Mientras que Delany y colaboradores (1988) reportan en tejido muscular de Alligator mississipiensis en Florida, Estados Unidos, concentraciones máximas de 1.0 µg/g (peso seco) de ΣHCHs; 3.0 µg/g (peso seco) de Σdrines; 2.8 µg/g (peso seco) de ΣDDTs; y 33.0 µg/g (peso seco) de ΣPCBs. Al comparar los datos anteriores con los obtenidos en el presente estudio (valores máximos en peso seco registrados en este estudio: 0.72 µg/g ΣHCHs, 0.99 µg/g Σdrines, 2.01 µg/g ΣDDTs y 1.25 µg/g ΣPCBs), se observa que hay un gradiente aparente de incremento en las concentraciones de estos contaminantes en depredadores tope desde el sitio de menor latitud al de mayor latitud (bajas concentraciones en Costa Rica, concentraciones medias en Campeche, México y altas concentraciones en Florida, EE.UU.). Este aparente patrón concuerda con el modelo de dispersión de los contaminantes organoclorados a través de la atmósfera de zonas intertropicales a zonas polares en pequeños ciclos (Wania y Mackay, 1996). Muestreos en otros puntos de distribución, ampliando este gradiente, podrían ser de utilidad en la comprobación de este modelo. 63 Mientras tanto, los resultados sugieren que las diferentes especies de cocodrilos pueden quizás asociarse con la contaminación diferencial en las distintas localidades y en este sentido, los sitios de trabajo en Campeche parecerían tener concentraciones intermedias de contaminantes respecto de Costa Rica y Florida en EE.UU. De interés particular es la comparación de concentraciones de DDT máximas detectadas en este trabajo ya que las mismas son hasta 3 veces mayores que las encontradas en tejido de C. acutus en Costa Rica (Rainwater et al 2007), aún cuando se supone que está prohibido su uso. En estudios realizados con suero de Alligator mississipiensis se reportan valores del orden de 0.2 a 18 ng/mL (0.0002 a 0.018 µg/mL) (Guillette et al., 1999a) de algunos de los compuestos cuantificados en tejido graso en este trabajo. La diferencia con los valores encontrados en el presente estudio, así como con los trabajos realizados por Rainwater y colaboradores (2007) y Delany y colaboradores (1988) correspondientes a escamas caudales y tejido muscular, es debida a que en éstos, se cuantifica la bioacumulación de estos compuestos mientras que en el primero se considera sólo las concentraciones en circulación en el momento de obtener la muestra. 6.3 POCs y PCBs en Sedimento y Tejido de Cocodrilos. Aun cuando la concentración de ΣHCHs y ΣPCBs en sedimento es mayor en Río Champotón que en los Petenes en la época de nortes particularmente, esto no se ve reflejado en la concentración de estos mismos compuestos en tejido graso de cocodrilo, en las que no existe diferencia entre ambos sitios. 64 Es probable que la permanencia de los sedimentos transportando plaguicidas y PCBs de las tierras agrícolas adyacentes al Río Champotón durante los Nortes sea temporal y que los acumulados en la materia orgánica no logren estar biodisponibles para los organismos detritívoros que los introducen a la trama trófica (Campbell, 2003; Ashpole et al., 2004; Sepúlveda et al., 2004; Sokolowski et al., 2004; Sakellarides et al., 2006) o, en su caso, que los cocodrilos estén haciendo escaso uso de invertebrados bentónicos en su alimentación con lo cual no bioacumulan los ΣHCHs y ΣPCBs proveniente del sedimento. En este sentido las concentraciones de POCs y PCBs en sedimento no covariaron con las concentraciones en tejido graso de hembras y machos de C. moreletii. Dado que, además, no se encontraron diferencia en la bioacumulación de POCs y PCBs entre sexos, la conducta filopátrica de las hembras y la de dispersión de los machos en busca de territorios desocupados (Tucker et al., 1998) no tienen un efecto sobre las concentraciones de compuestos organoclorados acumulados en cocodrilos de ambos sexos, al menos en cuanto se considera la concentración de POCs y PCBs en sedimento, como una medida de la presencia en una localidad determinada. Estudios futuros deberán llevar a cabo una evaluación de POCs y PCBs biodisponibles (en las presas potenciales). De este modo, por la amplitud de su dieta y su longevidad, además de la capacidad dispersora de los POCs y PCBs a través de la atmósfera, los cocodrilos podrían funcionar como indicadores de la contaminación a la que una localidad determinada ha sido expuesta históricamente, más que un indicador de un microambiente. 65 6.4 Hormonas Esteroides. Las concentraciones de testosterona y estradiol en cocodrilos machos y hembras no mostraron diferencias entre las etapas reproductoras muestreadas, pero las concentraciones promedio sugieren una tendencia. En machos la menor concentración de testosterona se registra durante la época de nidificación, actividad en la cual la testosterona no tiene un papel claramente definido, y un incremento en la etapa post-eclosión. Este incremento puede estar relacionado con el reinicio del comportamiento territorial presentado por los machos en la etapa no reproductora y la de cortejo (Lance, 1987; Wingfield y Marler, 1988; Nelson, 2000; Álvarez del Toro y Sigler, 2001). Esta tendencia en las concentraciones de testosterona en machos, concuerda con lo reportado por Lance (1987) con Alligator mississippiensis que presentan un incremento del andrógeno en la etapa posterior a la eclosión (agosto y septiembre) con respecto a la etapa de anidación (junio y julio). En el caso de las hembras, la testosterona presenta su mayor concentración en la etapa de nidificación, tiempo en el cual existe competencia por los sitios de anidación. En tanto en la etapa posterior a la eclosión, la concentración de testosterona se mantiene relativamente baja, concordando con la reducion de la agresividad y el cuidado maternal de las crías (Lance, 1987; Nelson, 2000). Sin embargo, las mayores concentraciones promedio de testosterona registradas en este trabajo (3.04 ng/mL, n=10) para la etapa post-eclosión son menores a las reportadas para A. mississippiensis (>30 ng/mL, n=13) (Lance, 1987). Estas diferencias pueden deberse a diferencias propias de las especies o al grado de madurez de los individuos capturados en cada estudio. 66 Por su parte, el estradiol presenta una aparente tendencia inversa a la testosterona, es decir, en machos se registra un incremento en la concentración del estradiol en la etapa de anidación, disminuyendo durante la etapa post-eclosión. En las hembras, el incremento en la concentración de estradiol es registrado en la etapa posteclosión, mientras que el decremento en la concentración de estradiol en plasma se encuentra relacionado con el incremento de otras hormonas como la progesterona, que regula el desarrollo de los huevos; y posteriormente la prolactina, relacionada con la incubación (Lance, 1987; Norman y Litwarck, 1987; Ketterson y Nolan-Jr, 1992). Las concentraciones de estradiol en hembras de C. moreletii varían de manera similar a las hembras de A. mississippiensis y C. acutus que presentan las menores concentraciones en época de nidificación (Lance, 1987; Ponce-Campos et al., 2002). No debería descartarse que, diferencias entre etapas reproductoras en estradiol, pudiera estar enmascarada por el reducido número de capturas de hembras adultas en ambas etapas. Pero también es claro que para ambos esteroides sexuales los valores más importantes se encuentran asociados con el inicio de la etapa reproductora (Bronson y Heideman, 1994; Nelson, 2000), que para la especie en estudio es en el mes de febrero, momento que no fue muestreado en este trabajo. En los machos, la concentración de testosterona fue mayor en los adultos que en los subadultos lo cuál se explica porque los andrógenos regulan la espermatogénesis y tienen implicaciones en el comportamiento sexual, incluyendo el cortejo, la cópula y la agresividad, conductas ajenas a los individuos inmaduros (Ramenofsky, 1984; Wingfield y Marler, 1988; Nelson, 2000). Para el estradiol, no se encontraron diferencias entre hembras con 67 diferente grado de madurez lo cuál nuevamente pudiera ser resultado del reducido número de hembras adultas capturadas. Cabe mencionar que el número de capturas de C. moreletii fue relativamente bajo debido, probablemente, a que en el Río Champotón existe un tráfico permanente de pequeñas embarcaciones pesqueras y una persecución constante de estos reptiles por pequeños productores acuícolas. En los Petenes, mientras tanto, el área de muestreo se encuentra a la orilla de la carretera que lleva al poblado de Isla Arena por lo que los cocodrilos se mantienen en un estado de alerta permanente y tienen un comportamiento defensivo que les lleva a evitar el encuentro con humanos; ante cualquier perturbación por tanto, se ocultan en sus cuevas, por lo que su encuentro y captura durante la realización de este trabajo fue difícil. Aunado a lo anterior, durante la época de anidación, las hembras tienden a retirarse a lugares inaccesibles y ocultos entre la vegetación para construir sus nidos reduciendo la probabilidad de su detección y captura, por lo que el número de muestras de hembras adultas en esta época es aún más escaso. 6.5 POCs, PCBs y Hormonas en Cocodrilos. En los machos, ni la testosterona ni el estradiol covariaron con los plaguicidas ni los PCBs. Sin embargo el estradiol presenta una covarianza marginal con los ΣHCHs (p=0.08) drines (p=0.07) y los ΣDDTs (p=0.07). Mientras que, en las hembras, el estradiol covaría con los ΣHCHs (p=0.04) y la testosterona con los ΣPCBs (p=0.04). Este efecto androgénico de los ΣPCBs y estrogénicos de los ΣHCHs en las hembras, se 68 presenta de forma independiente del grado de madurez y no es significativo para los adultos o subadultos por separado. Los resultados obtenidos en este estudio sugieren un efecto estrogénico relacionado con los residuos de plaguicidas, particularmente con los ΣHCHs para ambos sexos, lo cual ha sido documentado principalmente en crías y juveniles de diversas especies de fauna (De Solla et al., 1998; ATSDR, 2000; Guillette et al., 2000; Campbell, 2003; Gordon et al., 2004). Al mismo tiempo, el hecho de que la concentración de testosterona en hembras de C. moreletii covariara con la concentración de ΣPCBs, pero no en machos, sugiere un efecto diferencial de estos compuestos entre sexos. Resaltando que no existe información en la literatura sobre dicho efecto. Guillette y colaboradores (1999a) no encontraron relación significativa en las concentraciones de DDTs y PCBs en plasma con los esteroides sexuales de Alligator mississippiensis. Sin embargo, en otros trabajos se ha encontrado que las concentraciones de testosterona se reducen al 70% y que las hembras presentan concentraciones más elevadas de estradiol en lagos con altas concentraciones de plaguicidas organoclorados (Guillette et al., 1994; Guillette et al., 1996; Guillette et al., 1999a; Gunderson et al., 2004). El efecto estrogénico de los plaguicidas ΣHCHs en ambos sexos y el incremento de la testosterona relacionado con los ΣPCBs en las hembras, pueden tener importantes repercusiones en el desempeño sexual de estos animales. Ya se ha reportado que afectan la determinación y diferenciación sexual de los embriones (Lance, 1997; Aguilar-Miguel et al., 1998); alteran la proporción de sexos de la 69 población (Gross et al., 1994); afectan el desarrollo de los individuos hacia el estado reproductor (Guillette et al., 1994; Guillette et al., 1996; Guillette et al., 1999b; Gunderson et al., 2004) y el número de individuos que tendrá éxito en la reproducción (Ferguson, 1985; Lance, 1987; Guillette et al., 1994; Guillette et al., 1996; Lance, 1997; Wiig et al., 1998; Guillette et al., 1999a; Guillette et al., 1999b; Nelson, 2000; Campbell, 2003; Gunderson et al., 2004). Se ha indicado que la acumulación de algunos compuestos orgánicos en tejido graso no es necesariamente peligrosa para los cocodrilos (Hopkins, 2000) y que pueden tener un efecto diferenciado entre épocas del año. Esto es, cuando se reduce la alimentación (noviembre a enero) y se eleva el consumo de reservas energéticas (en forma de grasa), los compuestos son liberados al torrente sanguíneo elevando sus concentraciones y produciendo efectos estrogénicos en esa etapa del año (Norstrom y Muir, 1994). Con los datos obtenidos en el presente estudio, no es posible establecer cuál es el efecto que tienen los plaguicidas organoclorados y PCBs en la reproducción. Sin embargo, existe evidencia que la transferencia de estos compuestos de la madre a los embriones (Ferguson, 1985) tiene un efecto en la determinación del sexo de la progenie produciendo alteraciones en la proporción de sexos de la población (Gross et al., 1994; Facamire et al., 1995; Guillette et al., 1997; Nelson, 2000; Wu et al., 2000b; Wu et al., 2006). Por lo tanto, esta línea de investigación debe continuarse en futuros estudios. De forma natural, existe un balance en el desarrollo de los vertebrados, el cual está en función de las señales apropiadas producidas por las hormonas, la alteración en el tiempo, lugar, receptor o en la concentración de la propia hormona involucrada en un 70 proceso determinado y si se altera, se pueden producir variaciones e incluso interrumpir los procesos involucrados. Directa o indirectamente, estos mecanismos, se encuentran relacionados con la reproducción (fertilidad, cortejo, cuidados parentales), por lo que la variación o interrupción en los procesos de desarrollo (efecto próximo), repercuten en procesos reproductivos como la supresión de comportamiento reproductivo o parental teniendo consecuencias sobre el éxito de la población (efecto último) (Johnson y van Tienhoven, 1980; Nelson, 2000; Valdespino et al., 2002; Selcer, 2006; Willingham, 2006). Aunado a esto, el efecto de otros factores próximos como el cambio climático y su probable efecto en la determinación del sexo (alterando la proporción sexual de la población) y la pérdida de hábitat óptimos con la consiguiente reducción en el tamaño poblacional (Selcer, 2006), no sólo pueden tener efectos indirectos, sino también pueden tener efectos sinérgicos sobre la viabilidad de la población. 71 7. Conclusiones 1. Como se esperaba, en el Río Champotón se encuentran las mayores concentraciones de POCs y PCBs en sedimento, aun cuando ésto sólo es en época de nortes. Aunado a esto, la bioacumulación de estos contaminantes en C. moreletii no responde exactamente a su acumulación en sedimentos y la diferencia entre el comportamiento de dispersión de hembras y machos de esta especie tampoco explica la variación en las concentraciones de POCs y PCBs bioacumulados. 2. De cualquier manera, el sedimento se puede considerar como un indicador de la disponibilidad ambiental de compuestos orgánicos persistentes como los POCs y los PCBs hacia los niveles tróficos inferiores y éstos a su vez introduciéndolos en las tramas tróficas del sistema, bioacumulándolos y poniéndolos a disposición de los consumidores. Pero es claro, en este estudio, que los cocodrilos no están consumiendo organismos que se alimentan directamente de detritus y que, en realidad, estos depredadores tope son indicadores del estado general de una localidad, más que del estado de un microambiente. 3. En cuanto a las hormonas sexuales, las concentraciones de éstas no difieren entre las etapas reproductoras muestreadas, pero la tendencia observada responde a que los cambios más importantes en las concentraciones de las hormonas evaluadas ocurrieron previos al periodo de muestreo (al inicio de la etapa de apareamiento). 4. Los plaguicidas organoclorados, en particular los HCHs, tienen un efecto estrogénico, mientras que los PCBs tienen un efecto androgénico en hembras, lo que sugiere un efecto diferenciado de estos compuestos entre sexos. 72 5. Por otra parte, los POCs y PCBs analizados en este trabajo, cuando se encuentran acumulados en tejido graso, aparentemente no tiene efecto directo en las concentraciones de hormonas esteroides en cocodrilos. Sin embargo, estos contaminantes “atrapados” en las reservas calóricas, pueden entrar en el torrente sanguíneo en el momento en que el individuo hace uso de dichas reservas, como en el caso de poca disponibilidad de alimento o en la reproducción. 6. El efecto indirecto de los POCs y PCBs en la permanencia de la población es desconocido debido a la longevidad de estos organismos y el lento recambio de reproductores. Sin embargo, es recomendable establecer un programa de monitoreo a mediano plazo para constatar si existe o no, algún efecto negativo. 7. La mayor parte de los estudios realizados con la bioacumulación de contaminantes orgánicos persistentes en tejidos de reptiles generalmente no proveen información acerca de sus concentraciones en suelos, agua o sedimentos, así como tampoco de los efectos de estos contaminantes en la reproducción, desarrollo, comportamiento y sobrevivencia de los organismos (Hopkins, 2006). 8. El principal aporte de este trabajo es la aproximación integral a la cuantificación de los compuestos orgánicos persistentes en cocodrilos, considerando desde su disponibilidad ambiental, hasta su efecto en los organismos. 73 8. Literatura Citada Aguilar-Miguel, X. 1995. Efecto de la temperatura de incubación sobre la determinación del sexo en Crocodylus acutus y C. moreletii. Boletín de la Sociedad Herpetológica Mexicana 6:43. Aguilar-Miguel, X., J. Herrera-Muñoz, H. Merchant-Larios y G. Casas-Andreu. 1998. Efecto de la temperatura de incubación sobre la actividad esteroidogénica en Crododylus acutus y C. moreletii. Revista de la Sociedad Mexicana de Historia Natural 48:95-103. Álvarez del Toro, M. y L. Sigler. 2001. Los Crocodylia de México. IMERNAR, PROFEPA, México. Arriaga, L., V. Aguilar y J. Alcocer. 2002. Aguas continentales y diversidad biológica de México. . Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México. Asa, C. S. 1997. Hormonal and experimental factors in the expression of social and parental behavior in canids. en N. G. Solomon y J. A. Frech, editores. Cooperative breeding mammals. Cambridge Univ. Press., Cambridge. Ashpole, S. L., C. A. Bishop y R. J. Brooks. 2004. Contaminant Residues in Snapping Turtle (Chelydra s. serpentina) Eggs from the Great Lakes–St. Lawrence River Basin (1999 to 2000). Archives of Environmental Contamination and Toxicology 47:240-252. ATSDR. 2000. Polychlorinated Biphenyl (PCB) Toxicity. Case Studies In Environmental Medicine:40. Bargar, T. A., C. Sills-McMurry, R. L. Dickerson, W. Rhodes, E. y G. P. Cobb. 1999. Relative distribution of polychlorinated biphenyls among tissues of neonatal American alligators (Alligator mississippiensis). Archives of Environmental Contamination and Toxicology 37:364-368. Beach, F. 1976. Sexual attractivity, proceptivity, and receptivity in female mammals. Horm. Behav. 7:105-138. Benitez, J. A. y C. Bárcenas. 1996. Patrones de uso de los plaguicidas en la zona costera del Golfo de México. Pages 155-167 en A. V. Botello, J. A. Rojas Galaviz, J. A. Benitez y D. Zárate-Lomelí, editores. Golfo de México, Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. EPOMEX Serie Científica 5. Universidad Autónoma de Campeche, Mèxico. Bishop, C. A., R. J. Brooks y J. H. Carey. 1991. The case for a cause-effect linkage between environmental contamination and development in eggs of the common snapping turtle (Chelydra s. serpentina) from Ontario, Canada. Journal of Toxicology and Environmental Health 33:594-596. Botello, A., V., G. Ponce Vélez, A. Toledo, G. Díaz González y S. Villanueva. 1996. Ecología, Recursos Costeros y Contaminación en el Golfo de México. Pages 666 en A. V. Botello, J. A. Rojas-Galaviz, J. A. Benitez y D. Zárate Lomelí, editores. 74 Golfo de México, Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. Universidad Autónoma de Campeche-EPOMEX, Campeche. Bronson, F. H. y P. D. Heideman. 1994. Seasonal regulation of reproduction in mammals. Pages 541-583 en E. Knobil y J. D. Neill, editores. The Physiology of Reproduction. Raven Press Ltd., New York, EUA. Brown, R. E. 1985. Hormones and parental behavior in vertebrates. American Zoologist 25:895-910. Burton, G. A. J. 2002. Sediment quality criteria in use around the world. The Japanese Society of Limnology:6-75. Campbell, K. R. 2003. Ecotoxicology of crocodilians. Applied Herpetology 1:45-163. Carson, R. L. 1962. Silent Spring. Houghton Milfflin, Boston. Casas-Andreu, G. 2003. Ecología de la anidación de Crocodylus acutus (Reptilia: Crocodylidae) en la desembocadura del Río Cuitzmala, Jalisco, México. Acta Zoologica Mexicana (n.s.) 89:111.128. Casas-Andreu, G. y A. Rogel-Bahena. 1986. Observaciones sobre los nidos y las nidadas de Crocodylus moreletii en México. Anales del Instituto de Ciencias del Mar y Limnologia, Universidad Nacional Autonoma de Mexico 13:323-330. Castillo, L. E. y C. Ruepert. 1997. Ecotoxicology and pesticides in tropical aquatic ecosystems of Central America. Environmental Toxicology and Chemistry 16:4151. CONANP. 2006. Programa de Conservación y Manejo de la Reserva de la Biósfera Los Petenes. CONANP-SEMARNAT. Conover, W. J. y R. L. Iman. 1981. Rank transformation as a bridge between parametric and nonparametric statistics. The American Statistician 35:124-133. CSTEE. 1999. Opinion on Human and Wildlife Health Effects of Endocrine Disrupting Chemicals, with Emphasis on Wildlife and on Ecotoxicology Test Methods. Pages 96 en. Group on Endocrine Disrupters of the Scientific Committee on Toxicity, Ecotoxicity and the Environment (CSTEE). Daly, G. L., Y. D. Lei, C. Teixeira, D. C. G. Muir, L. Castillo y F. Wania. 2007. Accumulation of current-use pesticides in neotropical montane forests. Environmental Science and Technology 41:1118-1123. Davies, N. B. 1991. Mating systems. Pages 263-294 en J. R. Krebs y N. B. Davies, editores. Behavioral Ecology: an evolutionary approach. Blackwell, Oxford. De Solla, S. R., C. A. Bishop, G. Van Der Kraak y R. J. Brooks. 1998. Impact of Organochlorine contamination on levels of sex hormones and external morphology of common snapping turtles (Chelydra serpentina serpentina) in Ontario, Canada. Environmental Health Perspectives 106:253-260. Delany, M. F., J. U. Bell y S. F. Sundlof. 1988. Concentrations of contaminants in muscle of the American alligator in Florida. Journal of Wildlife Diseases 24:62-66. 75 EPA. 2002. Persistent organic pollutants: A global issue, a global response. United States Environmental Protection Agency, EPA 160-F-02-001:23. Facamire, C. F., T. S. Gross y L. J. J. Guillette. 1995. Reproductive impairment in the Florida panther: nature or nurture? Environmental Health Perspectives 103:79-86. Farner, D. S. y J. C. Wingfield. 1980. Reproductive endocrinology of birds. Ann. Rev. Physiol. 42:457-472. Ferguson, M. W. J. 1985. Reproductive biology and embryology of the crocodilians. Pages 327-491 en C. Gans y F. Billet, editores. Biology of the Reptilia. Wiley, New York. Fry, C. M. y C. K. Toone. 1981. DDT-Induced Feminization of Gull Embryos. Science 213:922-924. Futuyma, D. J. 1998. Evolutionary Biology. Sinauer Associates, Sunderland, Massachusetts. Gordon, J. D., A. C. Chu, M. D. Chu, M. S. Denison y G. C. Clark. 2004. Detection of estrogen receptor endocrine disruptor potency of commonly used organochlorine pesticides using the LUMI-CEL ER bioassay. Developmental and Reproductive Toxicity 66:3009-3015. Griffin, J. E. y S. R. Ojeda. 1988. Endocrine physiology. Oxford Univ. Press., New York, EUA. Groombridge, B. 1987. Distribution and Status of World Crocodilians. Pages 9-21 en G. J. W. Webb, S. C. Manolis y P. J. Whitehead, editores. Wildlife Management: Crocodiles and Alligators. Surrey Beatty and Sons Pry Limited-Conservation Commission of the Northern Territory. Gross, T. S., L. J. J. Guillette, H. F. Percival, T. S. Masson, G. R. Matter y A. R. Woodward. 1994. Contaminant-induced reproductive anomalies in Florida. Comp. Path. Bull. 26:6-8. Guillette, L. J., J. W. Brock, A. A. Rooney y A. R. Woodward. 1999a. Serum Concentrations of Various Environmental Contaminants and Their Relationship to Sex Steroid Concentrations and Phallus Size in Juvenile American Alligators. Archives of Environmental Contamination and Toxicology 36:447-455. Guillette, L. J., D. A. Crain, M. P. Gunderson, S. A. E. Kools, M. R. Milnes, E. F. Orlando, A. A. Rooney y A. R. Woodward. 2000. Alligators and Endocrine Disrupting Contaminants: A Current Perspective. American Zoologist 40:438-452. Guillette, L. J., Jr., T. S. Gross, T. S. Masson, G. R. Matter, H. F. Percival y A. R. Woodward. 1994. Developmental abnormalities of the gonad and abnormal sex hormone concentration in juvenile alligators from contaminated and control lakes in Florida. Environmental Health Perspectives 102:680-688. Guillette, L. J. J., D. A. Crain, A. A. Rooney y A. R. Woodward. 1997. Effect of acute stress on plasma concentrations of sex and stress hormones in juvenile alligators living in control and contaminated lakes. Journal of Herpetology 31:347-353. 76 Guillette, L. J. J., D. B. Pickford, D. A. Crain, A. A. Rooney y H. F. Percival. 1996. Reduction in penis size and plasma testosterone concentration in juvenile alligators living in a contaminated environment. General and Comparative Endocrinology 101:32-42. Guillette, L. J. J., A. R. Woodward, D. A. Crain, D. B. Pickford, A. A. Rooney y H. F. Percival. 1999b. Plasma steroid concentration and male phallus size in juvenile alligators from seven Florida lakes. General and Comparative Endocrinology 116:356-372. Gunderson, M. P., D. S. Bermudez, T. A. Bryan, S. Degala, T. M. Edwards, S. A. E. Kools, M. R. Milnes, A. R. Woodward y L. J. J. Guillette. 2004. Variation in sex steroid and phallus size in juvenile American alligator (Alligator mississippiensis) collected from 3 sites witting the Kissmmee-Everglades drainage in Florida (USA). Chemosphere 56:335-345. Hegner, R. E. y J. C. Wingfield. 1987. Effects of experimental manipulation of testosterone levels on parental investment and breeding success in male house sparrows. Auk 104:462. Helander, B., M. Olsson y L. Reutergard. 1982. Residue level of organochlorine and mercury compounds in unhatched eggs and the relationships to breeding succes in white-tailed sea eagles in Sweden. Holarctic Ecol 5:349-366. Helle, E. 1980. Lowered reproductive capacity in female ringed seals (Phoca hispida) in the Bothnian Bay, northern Baltic Sea, with special reference to uterine occlusions. Annales Zoologici Fennici 17:147-158. Hopkins, W. A. 2000. Reptile toxicology: challenges and opportunities on the last frontier in vertebrate ecotoxicology. Environmental Toxicology and Chemistry 19:23912393. Hopkins, W. A. 2006. Use of tissue residues in reptile ecotoxicology: a call for integration and experimentalism. Pages 35-62 en S. C. Gardner y E. Oberdörster, editores. Toxicology of Reptiles. Taylor & Francis. Jensen, S. 1972. The PCB story. Ambio 1:123-131. Johnson, A. L. y A. van Tienhoven. 1980. Plasma concentrations of six steroids and LH during the ovulatory cycle of the hen, Gallus domesticus. Biology of Reproduction 23:286-393. Johnson, M. L. y M. S. Gaines. 1990. Evolution of dispersal: theoretical models and empirical test using birds and mammals. Annual Review of Ecology and Systematics 21:449-480. Keller, J. M., J. R. Kucklick y P. D. MacClellan-Green. 2004. Organochlorine contaminants in Longgerhead Sea Turtle blood: extraction techniques and distribution among plasma and red blood cells. Archives of Environmental Contamination and Toxicology 46:254-264. Ketterson, E. y V. Nolan-Jr. 1992. Hormones and life histories: an integrative approach. Am. Nat. 140:s33-s62. 77 Ketterson, E., V. J. Nolan, L. Wolf, C. Ziegenfus, A. M. Dufty, G. F. Ball y T. S. Johnsen. 1991. Testosterone and avian life histories: the effect of experimentally elevated testosterone on corticosterone and body mass in dark-eyed juncos Horm. Behav. 25:489-503. Kordel, W., M. Dassenakis, J. Lintelmann y S. Padberg. 1997. The importance of natural organic material for environmental processes in waters and soils. Pure and Applied Chemistry 69:1571-1600. Lacher, T. E. y M. I. Goldstein. 1997. Tropical ecotoxicology status and needs. Environmental Toxicology and Chemistry 16:100-111. Lance, V. 1987. Hormonal control of reproduction in crocodilians. Pages 409-415 en G. J. W. Webb, S. C. Manolis y P. J. Whitehead, editores. Wildlife Management: Crocodiles and Alligators. Surrey Beatty and Sons Pry Limited-Conservation Commission of the Northern Territory. Lance, V. A. 1997. Sex Determination in Reptiles: An Update. American Zoologist 37:504-513. Lasley, B. L. y J. F. Kirkpatrick. 1991. Monitoring ovarian function in captive and freeranging wildlife by means of urinary and fecal steroids. J. Zool. Wildl. Med. 22:23-31. Lintelmann, J., A. Katayama, N. Kurihara, L. Shore y A. Wenzel. 2003. Endocrine disruptors in the environment. Pure and Applied Chemistry 75:631-681. Liu, L.-L., S.-J. Chen, L.-S. Chou, C.-D. Dong y C.-W. Chen. 2003. Accumulation of Butyltin Compounds in the Pantropical Spotted Dolphin, from the Coasts of Taiwan. Journal of Food and Drug Analysis 11:320-323. Lockie, L. N. y D. A. Ratcliffe. 1964. Insecticides and Scottish Golden Eagles. Br. Birds:89-102. Lombardi, J. 1998. Comparative Vertebrate Reproduction. Kluwer Academic Publishers, Boston, EUA. Majewski, M. S. y P. D. Capel. 1995. Pesticides in the atmosphere - distribution, trends, and governing factors. Ann. Arbor. Press, Inc., Chelsea, Mich. Matter, J. M., D. A. Crain, C. Sills-McMurry, D. B. Pickford, T. R. Rainwater, K. D. Reynolds, A. A. Rooney, R. L. Dickerson y L. J. J. Guillette. 1998. Effects of endocrine-disrupting contaminants in reptiles: alligators. Pages 267-287 en R. J. Kendall, R. L. Dickerson, J. P. Giesy y W. P. Suk, editores. Principles and processes for evaluating edocrine disruption in wildlife. SETAC Press. Messel, H., G. C. Vorlicek, A. G. Wells y W. J. Green. 1981. Surveys of tidal rivers systems in the northern territory of Australia and their Crocodile population. Pergamon Press, Sydney. Meyers, P. A. 1997. Organic geochemical proxies of paleocenographic. Organic Geochemistry 27:213-250. 78 Milnes, M. R., D. Allen, T. A. Bryan, C. D. Sedacca y L. J. J. Guillette. 2004. Developmental effects of embryonic exposure to toxaphene in the American alligator (Alligator mississippiensis). Comparative Biochemistry and Physiology 138:81-87. Moore, N. W. 1965. in birds - a review of the situation in Great Britain in 1965. Bird Study:222-252. Muñoz Cifuentes, J., H. Becker, U. Sommer, P. Pacheco y R. Schlatter. 2003. Seabierd eggs as bioindicators of chemical contamination in Chile. Environmental Pollution:123-137. Murray, J. D. 2004. Temperature-Dependent Sex Determination (TSD): Crocodilian Survivorship. Pages 551 en Mathematical Biology. An Introduction. Springer. Myers, J. P., L. J. J. Guillette, P. Palanza, S. Parmigiani, S. H. Swan y F. S. Vom Sall. 2003. The emerging science of endocrine disruption. en A. Zichichi, editor. International Seminar on Nuclear War and Planetary Emergencies 28th Session, Erice, Italy. Nelson, R. J. 2000. An introduction to behavioral endocrinology, 2da edición. Sinauer Associates, Inc. Norman, A. W. y G. Litwarck. 1987. Hormones. Acad. Press., Orlando, EUA. Norstrom, R. J. y D. C. G. Muir. 1994. Chlorinated-hydrocarbon contaminants in Artic marine mammals. Science of the Total Environment 154:107-128. Ongley, E. D. 1997. Lucha contra la contaminación agrícola de los recursos hídricos. (Estudio FAO Riego y Drenaje 55). FAO. Oskam, I. C., E. Ropstad, E. Lie, A. E. Derocher, O. Wiig, E. Dahl, S. Larsen y J. U. Skaare. 2004. Organochlorines affect the steroid hormone cortisol in free-ranging polar bears (Ursus maritimus)al Svalbard, Norway. Journal of Toxicology and Environmental Health, Part A 67:959-977. Park, J.-S., T. L. Wade y S. T. Sweet. 2002. Atmospheric deposition of PAHs, PCBs, and organochlorine pesticides to Corpus Christi Bay, Texas. Atmospheric Environment 36:1707-1720. Perez-Higareda, G., A. Rangel-Rangel, D. Chiszar y H. M. Smith. 1995. Growth of Morelet's crocodile (Crocodylus moreletii) during the first three years of life. Zoo Biology 14:173-177. Pickford, D. B., L. J. J. Guillette, D. A. Crain, A. A. Rooney y A. R. Woodward. 2000. Plasma Dehydrotestosterona concentration and phallus size in juvenile American alligator (A. mississippiensis) from contaminated and reference populations. Journal of Herpetology 34:233-239. Platt, S. G. 1996. Ecology and status of a Morelet's crocodile in Belize. Clemson University. Platt, S. G., T. R. Rainwater, A. G. Finger, J. B. Thorbjarnarson, T. A. Anderson y S. T. McMurry. 2006. Food habits, ontogenetic dietary partitioning and observations of 79 foraging behavior of Morelet´s crocodile (Crocodylus moreletii) in Northern Belize. Herpetological Journal 16:281-290. Platt, S. G. y J. B. Thorbjarnarson. 2000. Population status and conservation of Morelet´s crocodile, Crocodylus moreletii, in northern Belize. Biological Consevation 96:21-29. Ponce-Campos, P., V. Lance y S. M. Huerta-Ortega. 2002. Reproductive Cycle of the American Crocodile and its Environmental Influences. Preliminary Results. Pages 416 en Crocodiles. Proceedings of the 16th Working Meeting of the Crocodiles Specialist Group, IUCN. The World Conservation Union, Gland Switzerland and Cambridge UK. Propper, C. R. 2005. The Study of Endocrine-Disrupting Compounds: Past Approaches and New Directions. Integrated Comparative Biology 45:194-200. Rainwater, T., B. M. Adair, S. G. Platt, T. A. Anderson, G. P. Cobb y S. T. McMurry. 2002. Mercury in Morelet's crocodile eggs from Northern Belize. Archives of Environmental Contamination and Toxicology 42:319-324. Rainwater, T. R., T. H. Wu, A. G. Finger, J. E. Cañas, L. Yu, K. D. Reynolds, G. Coimbatore, B. Barr, S. G. Platt, G. P. Cobb, T. A. Anderson y S. T. McMurry. 2007. Metals and organochlorine pesticides in caudal scutes of crocodiles from Belize and Costa Rica. Science of the Total Environment 373:146-156. Ramenofsky, M. 1984. Agonistic behavior and endogenous plasma hormones in Japanese quail. Animal Behavior 32:698-708. Ratcliffe, D. A. 1967. Decrease in eggshell weight in certain bird of prey. Nature Lond. 215:208-210. Reburn, C. J. y K. E. Wynne-Edwards. 1999. Hormonal changes in males of naturally biparental and uniparental mammal. Horm. Behav. 35:163-176. Reijnders, P. J. H. 1986. Reproductive failure in common seals feeding on fish from polluted coastal waters. Nature 324:456-457. Risebrough, R. W., S. G. Peakall y N. M. Kirven. 1968. Polychlorinated biphenyls in the global ecosystem. Nature 220:1098-1101. Sakellarides, T. M., I. K. Konstantinou, D. G. Hela, D. Lambropoulou, A. Dimou y T. A. Albanis. 2006. Accumulation profiles of persistent organochlorines in liver and fat tissues of various waterbird species from Greece. Chemosphere 63:1392-1409. Salame-Méndez, A. y I. Villalpando-Fierro. 1998. La diferenciación sexual en vertebrados: Hipótesis y teorías. Acta Zoologica Mexicana (n.s.) 73:89-110. Sanders, G., T. Hamilton-Taylor y k. C. Jonh. 1996. PCB and PAH dynamics in a small rural lake. Environmental Science and Technology 30:2950-2966. Selcer, K. W. 2006. Reptile Ecotoxicology: Studying the Effects of Contaminants on Populations. Pages 267-297 en S. C. Gardner y E. Oberdörster, editores. Toxicology of Reptiles. Taylor & Francis. 80 SEMARNAT. 2000. Proyecto para la conservación, manejo y aprovechamiento sustentable de los Crocodylia en México (COMACROM), México. Sepúlveda, M. S., J. J. Wiebe, D. C. Honeyfield, H. R. Rauschenberger, J. P. Hinterkopf, W. E. Johnson y T. S. Gross. 2004. Organochlorine Pesticides and Thiamine in Eggs of Largemouth Bass and American Alligators and Their Relationship with Early Life-stage Mortality. Journal of Wildlife Diseases 40:782-786. Skaare, J. U., K. Ingebrigtsen, A. Aulie y T. I. Kanui. 1991. Organochlorines in crocodile eggs from Kenya. Bulletin of Environmental COntamination and Toxicology 47:126130. Snedecker, S. 2001. Pesticides and breast cancer risk: a review of DDT, DDE and dieldrin. Environmental Health Perspectives 109 (supl. 1):35-47. Sokolowski, A., A. S. Bawazir y M. Wolowicz. 2004. Trace Metals in the Brown Mussel Perna perna from the Coastal Waters Off Yemen (Gulf of Aden): How Concentrations Are Affected by Weight, Sex, and Seasonal Cycle. Archives of Environmental Contamination and Toxicology 46:67-80. Stafford, P., J., S. T. McMurry, T. R. Rainwater, D. Ray, A., L. D. Densmore III y B. Barr. 2003. Morelet´s Crocodile (Crocodylus moreletii) in the Macal River waatershed, Maya Mountains, Belize. Herpetological Bulletin:15-23. Thorbjarnarson, J. B. y G. Hernández. 1993. Reproductive ecology of the Orinoco crocodile (Crocodylus intermedius) in Venezuela. II. Reproduction and social behavior. Journal of Herpetology 27:371-379. Tucker, A. D., H. I. McCallum, C. J. Limpus y K. R. McDonald. 1998. Sex-biased dispersal in a long-lived polygynous reptile (Crocodylus johnstoni). Behavioral Ecology and Sociobiology 44:85-90. UNEP. 2002. Regionally based assessment of persistent toxic substances, North America regional report. Global Environment Facility. UNEP/IOC/IAEA. 1988. Determination of DDT´s and PCB´s in selected marine organisms by capillary column gas chromatografy. Reference methods for marine pollution studies No. 40. United Nation Environment Programme, Nairobi. Valdespino, C., C. S. Asa y J. E. Bauman. 2002. Estrous circles, copulation, and pregnancy in the Fennec fox (Vulpes zerda). J. mammal. 83:99-109. Van Zoest, R. y G. T. M. Van Eck. 1990. Behavior of a particulated polyclorinated biphenyls and polycyclic aromatic hydrocarbons in Sheldt estuary Netherlands Journal of Sea Research 26:89-96. Wania, F. y D. Mackay. 1996. Tracking the Distribution of Persistent Organic Pollutants. Environmental Science and Technology 30:390-396. Webb, G. J. W., R. Buckworth y S. C. Manolis. 1983. Crocodylus johnstoni in the McKinlay River area, N.T. III. Growth. Movement and the population age structure. . Australian Wildlife Research 10. 81 Webb, G. J. W. y J. W. Messel. 1977. Crocodile capture techniques. Journal of Wildlife Management 41:572-575. Webb, G. J. W. y A. M. A. Smith. 1987. Life History Parameters, population dynamics and the management of crocodilians. Pages 199-210 en G. J. W. Webb, S. C. Manolis y P. J. Whitehead, editores. Wildlife Management: Crocodiles and Alligators. Surrey Beatty and Sons Pry Limited-Conservation Commission of the Northern Territory. Whitford, F., B. Miller, M. Jones y L. Bledsoe. 1994. Pesticides and Wildlife: An introduction to Testing, Registration, and Risk Management. Purdue Pesticide Programs Bulletin 30:39. Wiig, O., A. E. Derocher, C. M. M. y J. U. Skaare. 1998. Female pseudohermaphrodite polar bears at Svalbard. Journal of Wildlife Diseases 34:792-796. Willingham, E. 2006. Developmental and reproductive effects. Pages 149-171 en S. C. Gardner y E. Oberdörster, editores. Toxicology of Reptiles. Taylor & Francis. Wingfield, J. C. y P. Marler. 1988. Endocrine basis of communication: reproduction and aggression. Pages 1647-1677 en E. Knobil y J. D. Neill, editores. The physiology of reproduction. Raven, New York, EUA. Wolff, M., A. Zeleniuch-Jaquotte, N. Dubin y P. Tiniolo. 2000. Risk of breast cancer and organochlorine exposure. Cancer Epidemiology, Biomarkers and Prevention 9:271277. Woodward, A. R. y D. R. David. 1994. Alligators, prevention and control of wildlife damage. en. Woodward, A. R. y H. F. Jennings. 1993. Low clutch viability of American alligators on LAke Apopka. Florida Sci. 56:52-63. Wu, T. H., J. E. Cañas, T. R. Rainwater, S. G. Platt, S. T. McMurry y T. A. Anderson. 2006. Organochlorine contaminants in complete clutches of Morelet’s crocodile (Crocodylus moreletii) eggs from Belize. Environmental Pollution 144:151-157. Wu, T. H., T. R. Rainwater, S. G. Platt, S. T. McMurry y T. A. Anderson. 2000a. DDE in Eggs of Two Crocodile Species from Belize. Journal of Agricultural and Food Chemistry 48:6416-6420. Wu, T. H., T. R. Rainwater, S. G. Platt, S. T. McMurry y T. A. Anderson. 2000b. Organochlorine contaminants in Morelet's crocodile (Crocodylus moreletii) eggs from Belize. Chemosphere 40:671-678. Wynne-Edwards, K. E. y C. J. Reburn. 2000. Behavioral endocrinology of mammalian fatherhood. Trends in Ecology and Evolution 15:464-468. Yañez-Arancibia, A., F. Amezcua-Linares y M. Tapia-García. 1982. Prospección ictioecológica del estuario del Río Champotón, Campeche, verano de 1978 nota científica. Anales del Instituto de Ciencias de Mar y Limnología 1:395-399. 82