Tejido adiposo dentro de los nervios periféricos. Un estudio en
Anuncio

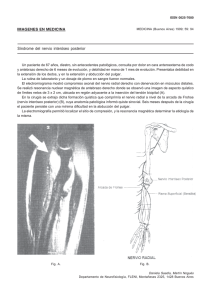
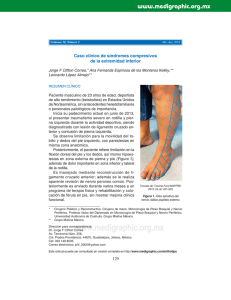
www.neurorgs.com - Unidad de Neurocirugía RGS (Rev. Esp. Anestesiol. Reanim. 2002; 49: 397-402) ORIGINAL Tejido adiposo dentro de los nervios periféricos. Un estudio en nervio ciático humano M. A. Reinaa, A. Lópezb, J. A. De Andrés*,c Servicio de Anestesiología y Reanimación del Hospital de Móstoles y del Hospital Montepríncipe. Madrid. *Servicio de Anestesiología, Reanimación y Terapéutica del Dolor. Consorcio Hospital Universiario de Valencia. Resumen OBJETIVO: Describir la distribución de las células adiposas intraneurales y su relación con los fascículos en una porción de nervio periférico involucrada habitualmente en la realización de un bloqueo anestésico del miembro inferior. MATERIAL Y MÉTODO: Con el microscopio electrónico de barrido se estudiaron muestras de nervio ciático en el extremo amputado de un miembro inferior en 3 pacientes. Las muestras fueron obtenidas en el ángulo superior de la fosa poplítea, a 10-15 cm de la línea de flexión de la rodilla. RESULTADOS: Durante la disección las muestras de nervio ciático, se observaban como un solo tronco, sin embargo al estudiar los cortes por microscopia se observó una clara división de los componentes de ambas ramas unidas por un tejido de sostén. El nervio ciático a este nivel tenía forma ovalada y medía 6,5 a 7,5 mm por 3,6 a 3,9 mm. El espesor del tejido adiposo entre los fascículos fue variable, de 0,5 mm en las zonas centrales y de 0,2 mm en las zonas periféricas. Los adipocitos tenían un tamaño similar, su diámetro medía 40 micrones. Los adipocitos estaban todos vacíos, porque las vacuolas grasas habían sido eliminadas durante el proceso de fijación. El tejido adiposo estaba distribuido dentro del epineuro formando cubiertas adiposas alrededor de los fascículos de forma aislada o alrededor de un grupo de fascículos. CONCLUSIONES: El tejido adiposo ubicado dentro de un nervio estaba distribuido alrededor de los fascículos, formando fundas adiposas que separaban a los fascículos entre sí. El espesor de estas fundas adiposas no era igual entre los diferentes fascículos. La unión intercelular hace posible que se forme una lámina compacta de adipocitos, que podría retrasar la difusión de anestésicos locales inyectados en la proximidad de un nervio y consecuentemente podría interferir en las características del bloqueo anestésico. Palabras clave: Nervio periférico. Tejido adiposo. Microscopia electrónica de barrido. Adipose tissue withing peripheral nerves. A study in the human sciatic nerve Summary AIM: To describe the distribution of intraneural adipose cells in relation to nerve fascicles in a portion of peripheral nerve usually involved in accomplishing an anesthetic blockade of a lower extremity. METHOD: Using a scanning electron microscope, we studied sciatic nerve samples from the point of amputation of a lower limb of three patients. The samples were obtained at the upper angle of the popliteal fossa, 10-15 cm cephalad to the knee joint line. RESULTS: During dissection of the sciatic nerve samples, we observed a solitary trunk, but examination of the crosssections under the microscope revealed the components of two clearly separated branches joined by supporting tissue. The sciatic nerve had an oval form in the portion under study, measuring 6,5 to 7,5 mm by 3,6 to 3,9 mm. Between the fascicles, the adipose tissue varied in thickness from 0,5 mm in the central zones to 0,2 mm in the peripheral zones. The adipocytes, which were all similar in the size with diameters of 40 microns, were empty, as a result of elimination of the lipid vacuoles during fixation. The adipose tissue was distributed inside the epineurium to surround isolated fascicles or groups of fascicles. CONCLUSIONS: The adipose tissue inside a nerve surrounded the fascicles to form adipose sheaths that separated the fascicles from one another. The thicknesess of these adipose sheaths varied from one fascicle to another. Cells join to make it possible to create a compact adipose sheet that can delay the diffusion of local anesthetic injected near a nerve and that can therefore interfere with the characteristics of an anesthetic blockade. Key words: Peripheral nerve. Adipose tissue. Scanning electron microscopy. Médico Adjunto. Jefe del Servicio. Profesor Asociado de Anestesiología. Jefe de la Unidad Multidisciplinar de Tratamiento del Dolor. a b c Correspondencia: Miguel Angel Reina Perticone Valmojado, 95 1º B 28047 Madrid. E-mail: [email protected] Aceptado para su publicación en septiembre de 2002. 23 Introducción En relación con los bloqueos nerviosos periféricos, ha sido siempre de interés poder conocer el inicio, extensión, calidad y duración de un bloqueo anestésico, variables que dependen en última instancia de la distribución 397 www.neurorgs.com - Unidad de Neurocirugía RGS Rev. Esp. Anestesiol. Reanim. Vol. 49, Núm. 8, 2002 y la desaparición de los fármacos del lugar de inyección1. Sin embargo, el conocimiento de la biodisponibilidad local y de la cinética de los anestésicos locales durante un bloqueo anestésico es en gran parte teórica y se basa más en cambios témporo-espaciales del efecto anestésico, que en medidas de la concentración intraneural, perineural y en tejidos próximos del fármaco administrado1. El detallado conocimiento anatómico de los componentes no neurales ubicados dentro de un nervio, los cuales según su naturaleza pueden interferir en mayor o menor medida con la difusión de los anestésicos locales, puede ayudar a comprender el destino de las soluciones anestésicas administradas y la variabilidad de situaciones clínicas, que a veces encontramos después de un bloqueo anestésico. No es infrecuente que al realizar un bloqueo periférico, después de administrar una dosis habitual de anestésicos locales con una técnica correcta, la latencia sea mayor o la duración pueda ser breve o excesivamente prolongada a la esperada. Las células adiposas forman parte de los componentes no neurales dentro de los nervios periféricos y su estudio podría tener interés al representar una barrera lipídica que puede interactuar con las soluciones anestésicas inyectadas en su proximidad. Hasta ahora, el microscopio óptico ha permitido estudiar las características del tejido adiposo entre los fascículos y las técnicas especiales de tinción han ayudado a identificar a este tejido, con todo, esta técnica no ha aportado datos de cómo los adipocitos se organizan alrededor de cada uno de los fascículos. La microscopia electrónica de barrido es una técnica que ha sido poco usada en la investigación del tejido adiposo, no obstante, nos podría permitir estudiar a los adipocitos de forma individual y conjunta desde una perspectiva tridimensional, determinando con precisión los límites de dichas células y los espesores que pueden ocupar. El objetivo de este estudio fue describir la presencia y distribución de las células adiposas intraneurales y su relación con los fascículos nerviosos en una porción de nervio periférico involucrada habitualmente en la realización de un bloqueo anestésico del miembro inferior. Material y método Con la aprobación del comité de ética para la realización de este trabajo y con el consentimiento de los pacientes obtenido por el Servicio de Cirugía para la amputación del miembro inferior y su futura incineración, se realizó una amputación supracondílea en tres pacientes de 68, 74 y 76 años, en los cuales por su enfermedad, diagnóstico y evolución estaba indicada dicha cirugía. En el miembro amputado, en el extremo 398 supracondíleo se tomaron muestras de nervio ciático antes de ser enviado a su incineración. Los pacientes presentaban lesiones isquémicas en el pie y no eran portadores de enfermedades infecciosas o enfermedades que pudieran afectar al sistema nervioso central o periférico, salvo la vasculopatía propia de la edad y su enfermedad vascular isquémica. Las muestras fueron obtenidas en el ángulo superior de la fosa poplítea, a 10-15 cm cefálico a la línea de flexión de la rodilla, donde el nervio ciático se divide en sus dos ramas: la rama interna, el nervio ciático poplíteo interno y la rama externa, el ciático poplíteo externo. La muestra inicial tomada en cada paciente medía entre 5 y 6 cm de longitud. Se descartaron los extremos del nervio que pudieran estar afectados por la manipulación instrumental o manual durante la cirugía o la disección posterior al procedimiento quirúrgico. Se estudiaron cortes transversales al eje del nervio cada 4-6 mm. Entre los parámetros evaluados se estudió la forma y tamaño de los adipocitos, la variabilidad de tamaño entre estos, la existencia o ausencia de material interpuesto entre las células adiposas y la organización y cantidad de adipocitos que forman el espesor del tejido adiposo alrededor de los fascículos. Microscopia electrónica de barrido La muestras después de su extracción se sumergieron en una solución amortiguadora de fosfatos a pH hístico. A continuación se cortaron muestras más pequeñas que fueron sumergidas en una solución de glutaraldehído al 2,5% en solución amortiguadora fosfato a pH 7,3 ± 0,02 durante 4 horas a 4ºC. Las muestras fueron deshidratadas por inmersión en soluciones de concentración crecientes de acetona desde 50 hasta 100%. La acetona fue eliminada con dióxido de carbono al alcanzar su punto crítico a 31ºC y a una presión de 73,8 bares dentro de una cámara de deshidratación correspondiente a un equipo Balzers CPD 030-Critical Point Dryer. Las muestras se trataron con una microcapa de carbono, con un espesor menor de 200 Amstrong en un equipo Balzers MED 010 Mini Deposition System y después fueron metalizadas con una microcapa de oro en un Equipo SCD 004 Balzers Sputter Coater. La observación y fotografía de las muestras se realizó en un microscopio JEOL JSM 6400 Scanning Microscope. Resultados Se estudiaron los tres nervios ciáticos de cada uno de los tres pacientes, que de forma macroscópica se 24 www.neurorgs.com - Unidad de Neurocirugía RGS M. A. REINA ET AL.– Tejido adiposo dentro de los nervios periféricos. Un estudio en nervio ciático humano TABLA I Dimensiones del nervio ciático a 14 cm del pliegue de flexión de la rodilla Nervio ciático Componente poplíteo interno Componente poplíteo externo Componente intermedio Paciente 1 Paciente 2 Paciente 3 7,5 x 3,6 mm 3,4 x 3,7 mm 3,7 x 2,5 mm 1,3 mm 6,5 x 3,9 mm 4,1 x 3,1 mm 1,6 x 2,1 mm 0,3 mm 6,5 x 3,8 mm 4,1 x 3,4 mm 1,6 x 2,5 mm 0,5 mm visualizaron como un solo tronco. No obstante, al estudiar los cortes por microscopia electrónica, se observó una clara división de los componentes de ambas ramas, unidas por tejido de sostén. La sección del nervio ciático a ese nivel tenía forma ovalada y medía 6,5 a 7,5 mm por 3,6 a 3,9 mm (Figura 1). Los fascículos estaban agrupados en un componente interno de mayor tamaño que se correspondía con los fascículos del nervio ciático poplíteo interno y otro componente de menor extensión donde se encontraban los fascículos del nervio ciático poplíteo externo (Tabla I). Entre ambos, un tercer componente conjuntivo, en su mayoría de células adiposas. La superficie de cada fascículo se presentaba como una superficie lisa por efecto del corte con bordes bien delimitados. El diámetro de los fascículos variaba entre 0,25 mm y 0,80 mm (Figura 2). Los vasos de mayor diámetro se encontraron dentro del componente intermedio y medían alrededor de 1,2 mm (Figura 1). El tejido adiposo se distribuía entre los fascículos separándolos en grupos. El espesor del tejido adiposo entre los fascículos fue variable, de 0,5 mm en las zonas centrales y de 0,2 mm en las zonas periféricas. Pocas Fig. 1. Nervio ciático completo. Corte transversal a 14 cm del pliegue de flexión de la rodilla. Macroscópicamente es un solo tronco nervioso, microscópicamente se encuentran agrupados los fascículos que van a dar origen al nervio ciático poplíteo interno y al nervio ciático poplíteo externo. El tejido adiposo tiene la apariencia de un panel de abejas y rodea a los fascículos. Microscopia electrónica de barrido. Ampliación 12x. Barra: 1 mm. 25 veces pudimos comprobar tejido adiposo dentro de los fascículos. Por cada milímetro de espesor de tejido adiposo ubicado alrededor de los fascículos se podían contar entre 22 y 26 adipocitos en línea (Figuras 1 y 3). Microscópicamente, los adipocitos tenían un tamaño similar, su diámetro era próximo a 40 micrómetros (Figuras 4). Los adipocitos estaban todos vacíos, porque las vacuolas de grasa habían sido eliminadas Fig. 2. Imagen parcial del nervio ciático. El corte de los fascículos se observa como una superficie continua y rugosa en la que no pueden identificarse los axones. Los fascículos están rodeados de una estructura laminar que se corresponde con el perineuro. La imagen compacta de los fascículos es un artefacto de técnica producida durante el corte que sirve para identificar con mayor facilidad a los adipocitos que los rodean y que presentan una estructura en panal de abeja. En la figura pueden identificarse con precisión los límites de cada uno de los adipocitos. Microscopia electrónica de barrido. Ampliación 50x. Barra: 100 micrómetros. 399 www.neurorgs.com - Unidad de Neurocirugía RGS Rev. Esp. Anestesiol. Reanim. Vol. 49, Núm. 8, 2002 durante el proceso de fijación (Figuras 4 y 5). Al perder la vacuola que ocupaba todo su interior, el aspecto esférico propio de los adipocitos estaba modificado. La membrana plasmática de los adipocitos presentaba ondulaciones periódicas (Figura 4). El citoplasma extremadamente delgado tenía aproximadamente 0,3 µm de espesor. En la mayoría de los adipocitos, la membrana plasmática de células contiguas estaban adheridas entre sí y no se interponía ningún material entre ellas (Figura 4). En un número menor de adipocitos, había fibras de colágeno y capilares entre las células. El tejido adiposo estaba distribuido de forma tal dentro del epineuro, que formaba cubiertas adiposas alrededor de los fascículos de forma aislada o alrededor de un grupo de fascículos. En el espesor del epineuro se encontraron vasos de diferentes calibres (Figura 4). Fig. 4. Imagen parcial del nervio ciático. Detalle de vasos rodeados por células adiposas. Microscopia electrónica de barrido. Ampliación 50x. Barra: 100 micrómetros. Discusión Fig. 3. Imagen parcial del nervio ciático. Detalle de los adipocitos a mayor aumento. Las vacuolas grasas están ausentes en las muestras porque fueron eliminadas por efecto de la acetona durante su preparación. Microscopia electrónica de barrido. Ampliación 300x. Barra 100 micrómetros. 400 El nervio ciático se encuentra por debajo de la fascia poplítea y por fuera de la línea medial. En la zona proximal de la fosa poplítea y aproximadamente a 13 cm del pliegue de la rodilla, el nervio ciático se divide en nervio tibial o ciático poplíteo interno y en nervio peroneo común o ciático poplíteo externo2. Con la idea de bloquear al nervio ciático previo a su división, Singelyn3 ha usado una vía alta de abordaje, situando al punto de punción a 10 cm cefálico al pliegue de la rodilla, introduciendo una aguja con una inclinación de 45º y una profundidad de 4-5 cm por debajo de la piel. De esta forma el punto de contacto con el nervio se produce aproximadamente a 12 cm proximal al pliegue de la rodilla. La zona del nervio ciático donde se han tomado las muestras para este estudio, coincide con el punto de bloqueo recomendado por Singelyn. Es decir que cuando se usa esa técnica de abordaje, la distribución fascicular y de tejido adiposo en el punto 26 www.neurorgs.com - Unidad de Neurocirugía RGS M. A. REINA ET AL.– Tejido adiposo dentro de los nervios periféricos. Un estudio en nervio ciático humano Fig. 5. Imagen parcial del nervio ciático. Detalle de los fascículos. Ampliación 50x. Barra: 100 micrómetros. de contacto con la aguja es similar al presentado en este trabajo, teniendo por tanto una correlación clínica, las descripciones morfológicas realizadas. En nuestras muestras, a esa distancia del pliegue de la rodilla, el nervio ciático se presentaba como un tronco único cuando lo observábamos durante la disección. Sin embargo, el nervio ciático puede dividirse en sus dos ramas terminales en cualquier punto entre el plexo sacro y la articulación de la rodilla. Por regla general, lo hace en el tercio medio del fémur, con menos frecuencia en un punto más proximal a ese punto y de forma excepcional tan abajo como en la fosa poplítea. En un 10% de los casos, las dos ramas pueden estar bien definidas desde el comienzo, como troncos nerviosos independientes, aunque contiguos. Previa a su división macroscópica, las ramas nerviosas ya están divididas desde un punto de vista histológico, con un epineuro independiente pero con una adventicia epineural común2. Respecto al diámetro de los fascículos del nervio ciático a este nivel, nuestros resultados (Figura 2) coinciden con los obtenidos por Sunder27 land4, quien comprobó valores que podían variar entre 0,056 a 0,742 mm. Microscópicamente los adipocitos maduros tienen un tamaño similar, su forma es esférica, miden alrededor de 120 micrones5 y su citoplasma está comprimido contra la periferia por una gran vacuola de grasa. En nuestras muestras, las células adiposas intraneurales presentaban un aspecto en "panal de abejas". La vacuola grasa que contenían cada uno de los adipocitos había sido eliminada durante la preparación de las muestras, y sólo quedaba la estructura de citoplasma que la rodeaba. Los adipocitos vacíos de grasa medían aproximadamente 40 micrones de diámetro y los límites de estas células no presentaban un aspecto esférico completo al no existir la presión que ejercería la vacuola de grasa sobre el delgado citoplasma limitante. Esta situación justificaba que la lámina esférica de citoplasma presentaba ligeros pliegues y ondulaciones y que su diámetro fuese inferior al descrito por otros autores5. La unión entre célula y célula formaba una lámina compacta de adipocitos que rodeaba a algunos grupos de fascículos, esta funda de tejido adiposo podría dificultar la difusión de anestésicos locales inyectados en la proximidad del nervio. Respecto a las medidas de espesores de tejido adiposo alrededor de los fascículos, estas fueron hechas sobre adipocitos sin la vacuola grasa, por lo cual los espesores "in vivo" serían tres veces mayores si consideramos que la relación de diámetros entre adipocitos con y sin vacuola grasa es de 120/40. Sunderland estudió cortes histológicos en diferentes nervios4,6-8. Cuando analizó el nervio ciático a nivel del tercio medio del muslo, encontró tejido adiposo bien delimitado en el 64% de las muestras; poco delimitado en el 18%, y cantidades insignificantes4 en el 18%. También encontró gran cantidad de tejido adiposo entre ambas ramas. La microscopia electrónica de barrido nos ha permitido definir con mayor claridad cuál es la distribución de los adipocitos en relación con los fascículos de un nervio y plantear hipótesis sobre las implicaciones que estos hallazgos podrían tener. Debemos considerar, que de la misma forma que el patrón intraneural de los fascículos varía cada pocos mm de distancia9, el espesor del tejido adiposo que separa a los fascículos y en parte los envuelve también podría variar a lo largo del mismo, aunque nosotros no pudimos comprobar este aspecto, al no estudiar al nervio en toda su longitud. Entre las limitaciones de este estudio, debemos mencionar que sólo se analiza al tejido adiposo intraneural en una pequeña porción del nervio ciático, en un número limitado de pacientes de edad avanzada, pero debemos considerar, que el objetivo de este estudio no fue generalizar estos resultados a todos los 401 www.neurorgs.com - Unidad de Neurocirugía RGS Rev. Esp. Anestesiol. Reanim. Vol. 49, Núm. 8, 2002 pacientes sino presentar una nueva idea, consistente en que el tejido adiposo intraneural se organiza como una estructura determinada, que no había sido considerada hasta ahora. En relación a la patología vascular de los pacientes estudiados, debemos considerar que la cantidad de tejido adiposo en el espesor de estas fundas lipídicas podría estar influido por las afecciones vasculares, como también podría estar influido este espesor en otros pacientes portadores de patologías metabólicas. Con todo, estas patologías no ponen en duda la existencia de estas fundas lipídicas que envuelven a los fascículos y que pueden tener unas dimensiones determinadas. En concordancia con los resultados obtenidos, la microscopia electrónica de barrido podría ser una técnica idónea para estudiar la distribución del tejido adiposo en los diferentes nervios. En cuanto a la implicación clínica que pueden tener los resultados de este estudio, debemos pensar que cuando realizamos un bloqueo anestésico periférico, e introducimos un volumen anestésico a pocos milímetros del nervio, el tejido adiposo que rodea a los fascículos podría interferir sobre las soluciones depositadas influyendo sobre la latencia del bloqueo anestésico dado el mayor o menor efecto barrera. Los anestésicos locales más liposolubles, en parte, pueden acumularse en el tejido adiposo intraneural y actuar sobre la duración del bloqueo, al producirse una liberación prolongada y sostenida del fármaco hacia los fascículos más próximos. Otro aspecto a considerar, es la ubicación de los vasos intraneurales de mayor tamaño, los cuales pueden encontrarse dentro del nervio en la zona de tejido adiposo ubicada entre las ramas interna y externa (Figura 1) y que pueden ser puncionados sin mediar una respuesta parestésica que nos prevenga. En resumen, el tejido adiposo ubicado dentro de un nervio puede agregar variables no predecibles en la realización de un bloqueo anestésico, no consideradas hasta la fecha. Las técnicas actuales de bloqueo nos llevan a introducir una aguja según referencias anatómicas y con la ayuda de la neuroestimulación, a zonas 402 muy próximas a un nervio, sin embargo es difícil poder precisar con exactitud donde está ubicada la punta de la aguja en relación con la estructura neural a bloquear. Esto lleva a que el epicentro de la solución inyectada pueda estar más o menos próxima a un grupo fascicular u a otro, los cuales pueden estar más o menos protegidos por fundas de tejido adiposo. En un futuro, las técnicas de localización nerviosa por ecografía10 posiblemente nos proporcionarán más información tanto de la estructura nerviosa que deseamos bloquear, como de las estructuras adyacentes que puedan tener implicación en el resultado final de la técnica, consiguiendo mediante un mejor conocimiento anatómico y una aproximación optimizada, el mejor resultado de nuestra técnica de bloqueo nervioso. BIBLIOGRAFÍA 1. Turcker GT, Mather LE. Properties, absorption, and disposistion of local anesthetic agents. En: Cousins MJ, Bridenbaugh PO. Neural blockade in clinical anesthesia and management of pain. Filadelfia, Lippincott-Raven, 1998. p. 55-95. 2. Haro F, Rodríguez García J, Miguel R, De Andrés JA. Anestesia de plexos y regional intravenosa. En: Torres LM, Ed . Tratado de Anestesia y Reanimación. Madrid, Arán Ediciones, 2001. p. 1211-1258. 3. Singelyn FJ, Gouverneur JM, Gribomont BF. Popliteal sciatic nerve block aided by a stimulator: a reliable technique for foot and ankle surgery. Reg Anesth 1991; 16: 278-281. 4. Sunderland S. The adipose tissue of peripheral nerves. Brain 1945; 68: 118-122. 5. Napolitano L. The fine structure of adipose tissues. En: Reynold AE, Cahill GF, ed. Handbook of physiology, Section 5 Adipose tissue. Washington DC, American Physical Society. 1965; 109-123. 6. Sunderland S, Ray LJ. The intraneural topography of the sciatic nerve and its popliteal divisions in man. Brain 1948; 71: 242-258. 7. Sunderland S. The intraneural topography of the radial, median and ulnar nerves. Brain 1945; 68: 243-255. 8. Sunderland S. The connective tissues of peripheral nerves. Brain 1965; 88: 841-854. 9. Reina MA, López A, Villanueva MC, De Andrés JA, León GI. Morfología de los nervios periféricos, de sus cubiertas y de su vascularización. Rev Esp Anestesiol Reanim 2000; 47: 464-475. 10. Sala-Blanch X, De Andrés JA. Anestesia de plexo: ¿Cómo mejorar la localización nerviosa? Ultrasonografía. En: De Andrés JA, Ed. Puesta al día en anestesia regional y tratamiento del dolor IV. Barcelona, MRA Ed., 2001. p: 147-166. 28