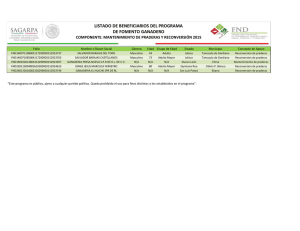
evaluacion de modelos de crecimiento e implementacion del
Anuncio

EVALUACION DE MODELOS DE CRECIMIENTO E IMPLEMENTACION DEL SISTEMA DE FRACCIONAMIENTO DE PROTEINAS Y CARBOHIDRATOS DE CORNELL EN LAS PASTURAS DEL CIC SANTA MARIA PARA LA OPTIMIZACION DEL SISTEMA DE ALIMENTACION DEL GANADO DE LECHE CARLOS EDUARDO ESPINOSA MARTINEZ ARNULFO ANTONIO USUGA ARANGO UNIVERSIDAD DE LA SALLE FACULTAD DE ZOOTECNIA BOGOTA D.C. 2008 1 EVALUACION DE MODELOS DE CRECIMIENTO E IMPLEMENTACION DEL SISTEMA DE FRACCIONAMIENTO DE PROTEINAS Y CARBOHIDRATOS DE CORNELL EN LAS PASTURAS DEL CIC SANTA MARIA PARA LA OPTIMIZACION DEL SISTEMA DE ALIMENTACION DEL GANADO DE LECHE CARLOS EDUARDO ESPINOSA MARTINEZ 13011055 ARNULFO ANTONIO USUGA ARANGO 13012020 Trabajo de grado presentado como requisito parcial para optar por el titulo de Zootecnista Director Abelardo Conde Pulgarin UNIVERSIDAD DE LA SALLE FACULTAD DE ZOOTECNIA BOGOTA D.C. 2008 2 DIRECTIVAS HERMANO CARLOS GABRIEL GOMEZ RESTREPO F. S. C. RECTOR HERMANO FABIO CORONADO PADILLA F. S. C. VICERRECTOR ACADEMICO HERMANO CARLOS ALBERTO PABON MENESES F. S. C. VICERRECTOR DE PROMOCION Y DESARROLLO HUMANO HERMANO MANUEL CANCELADO JIMENEZ F.S.C. VICERRECTOR DE INVESTIGACION Y TRANSFERENCIA DOCTOR MAURICIO FERNANDEZ FERNANDEZ VICERRECTOR ADMINISTRATIVO DOCTORA PATRICIA INES ORTIZ VALENCIA SECRETARIA GENERAL DOCTOR RAFAEL IGNACIO PAREJA MEJIA DECANO DOCTOR JOS LECONTE SECRETARIO ACADEMICO 3 APROBACION _______________________________________ DOCTOR RAFAEL IGNACIO PAREJA MEJIA DECANO _______________________________________ DOCTOR JOS LECONTE SECRETARIO ACADEMICO _______________________________________ DOCTOR ABELARDO CONDE PULGARIN DIRECTOR TRABAJO DE GRADO _______________________________________ DOCTORA OLGA XIMENA AGUILAR GALVIS JURADO _______________________________________ DOCTOR JUAN FERNANDO VELA JIMENEZ JURADO 4 AGRADECIMIENTOS Los autores expresan sus agradecimientos a: Dios, por darnos la oportunidad y la fuerza para poder dar por terminada esta etapa de nuestras vidas y de esta forma conquistar una meta y el tan anhelado sueno de ser profesionales. La Facultad de Zootecnia de la Universidad de La Salle y sus directivos por el apoyo y el respaldo durante la realización de este proyecto y todo el tiempo que estuvimos en la universidad ayudándonos a nuestra formación profesional y personal. Doctor Abelardo Conde, Zootecnista, Director de tesis, por su colaboración, entrega, confianza y ayuda en la realización de este trabajo compartiendo y transmitiéndonos sus conocimientos durante el desempeño de este proyecto Doctora Liliana Betancourt, Zootecnista, MSc Nutrición, Codirectora de tesis, por su apoyo incondicional, amabilidad, buena disposición y por compartir con nosotros todo sus conocimientos. Nidia Rojas, Química Industrial, por su colaboración dentro de la parte práctica del laboratorio Doctora Autora Cuesta, Bióloga MSc. Nutrición animal, Directora del laboratorio de nutrición de la universidad UDCA por su incondicional apoyo y gran colaboración en el desempeño de este proyecto. Margot Arévalo, Química Industrial Especialista en Nutrición animal. Álvaro López, Químico industrial. Doctor Luis Carlos Arreaza, por su aporte intelectual como investigadores 5 DEDICATORIA CARLOS EDUARDO ESPINOSA M ARTINEZ: A Dios por ser la luz que ilumina mi camino, por ser mi guía y por darme la fuerza necesaria para vivir el día a día y levantar cuando caigo y ayudarme a comenzar de nuevo. A mi madre por hacerme la persona que soy y por la formación que me dio, por sus sabios concejos, por su apoyo incondicional y por luchar siempre por mi y estar siempre a mi lado. A mi padre por cada una de las enseñanzas, comprensión y por ser ese gran amigo que esta conmigo cuando lo necesito y a veces sin ni siquiera decir una palabra demostrarme su cariño. A Curt por su apoyo incondicional, cariño y brindarme tantas oportunidades para triunfar en la vida. A mis abuelos por ser otros padres para mi, por ese gran amor que me han brindado toda la vida y por tanta sabiduría que me han dado durante toda mi vida. A todos aquellos que de una u otra forma han hecho parte de mi vida y me han hecho entender que se debe luchar por lo que se quiere sin importar lo que pase y a aquellas personas que intervinieron para la realización de este trabajo de tesis. 6 ARNULFO ANTONIO USUGA ARANGO: A mi padre quien de quien aprendí el significado del trabajo duro y los valores primordiales que trato de proyectar hacia el mundo. A la memoria de mi madre quien desde el cielo siempre ha acompañado mis pasos. A mis hermanas, Nancy y Liliana, junto quienes he superado los momentos mas difíciles de mi vida y siempre han sido mi principal punto de apoyo para mi toma de decisiones. A Dios porque siempre he sentido su presencia a mi lado cuando el camino parece estar mas difícil. A todos mis amigos y compañeros de estudio para quienes espero que este trabajo se convierta en una herramienta adecuada a sus necesidades laborales. 7 TABLA DE CONTENIDO Pag. RESUMEN ABSTRACT INTRODUCCION 1 1. OBJETIVOS 3 1.1. OBJETIVO GENERAL 3 1.2. OBJETIVOS ESPECIFICOS 3 2. REVISION DE LITERATURA 4 2.1. GENERALIDADES DE LOS PASTOS 4 2.1.1. Pasto Kikuyo (Penisetum Clandestinum) 4 8 2.1.2. Pasto Raygrass (Lolium sp .) 5 2.1.3. Pasto Azul Orchoro (Dactylis Glomerata) 7 2.2. RENOVACION DE PRADERAS 7 2.3. TASA DE CRECIMIENTO DE LOS FORRAJES 8 2.4. CUANTIFICACION DE FORRAJES 11 2.4.1. Medición de los forrajes 11 2.4.2. Muestreo por doble rango visual 12 2.4.3. Medición de los componentes de forraje disponible 12 2.4.4. Medición de la composición botánica de la pradera 13 2.5. MODELO CNCPS (Cornell Net Carbohydrate and Protein System) 14 9 2.5.1. Fracciones de Carbohidratos 17 2.5.2. Fracciones de Proteínas 19 2.5.3. Desarrollo del Modelo 21 2.6. DEGRADABILIDAD RUMINAL 27 2.6.1. Degradabilidad In Sacco 29 2.6.2. Descripción de la técnica de la degradabilidad In Sacco 29 2.7. IMPORTANCIA DEL NITROGENO UREICO EN LECHE 34 2.7.1 Origen y significancia del MUN 34 2.7.2. Relación entre MUN y producción 35 2.7.3. Toma de Muestras, análisis e interpretación 35 3. MATERIALES Y METODOS 38 10 3.1. UBICACIÓN DEL PROYECTO 38 3.2. DISENO EXPERIMENTAL 39 3.3. MONITOREO MEDIO AMBIENTAL 40 3.4. PERIODOS DE MUESTREO 40 3.5. DEFINICION PERIODOS DE LLUVIAS Y SEQUIA 41 3.6. DEFINICION PRADERAS RENOVADAS Y NO RENOVADAS 42 3.7. MUESTREO PARA EL CRECIMIENTO DE LAS PRADERAS 42 3.8. ANALISIS PARA EL CRECIMIENTO (Incluidas todas las praderas) 44 3.9. ANALISIS PARA EL CRECIMIENTO (Praderas Renovadas y no Renovadas) 45 3.10. DEFINICION DEL MODELO DE CRECIMIENTO 11 46 3.11. MUESTREO PARA EL FRACCIONAMIENTO DE CORNELL 47 3.12. FRACCIONAMIENTO DE CARBOHIDRATOS Y PROTEINAS 48 3.13. ANALISIS REALIZADOS 49 3.14. DEGRADABILIDAD RUMINAL (in sacco) 49 3.14.1. Degradabilidad de la materia seca 49 3.14.2. Degradabilidad de FDN y RIE 50 4. DISCUSIÓN DE RESULTADOS 53 4.1. CRECIMIENTO DE LAS PRADERAS (Periodo de lluvias y sequía) 53 4.2. PRUEBAS DE HOMOGENEIDAD E INDEPENDENCIA (Periodo de lluvias y sequía) 54 4.2.1. Pruebas de homogeneidad 54 4.2.2. Pruebas de Independencia 55 12 4.3. PRUEBAS DE HOMEGENEIDAD E INDEPENDENCIA (PraderasRenovadas y no Renovadas) 55 4.3.1. Pruebas de homogeneidad 55 4.3.2. Pruebas de Independencia 56 4.4. DEFINICION DEL MODELO 57 4.5. MODELOS APLICADOS DURANTE EL PERIODO DE LLUVIAS 58 4.5.1. Modelo Gompertz 58 4.5.2. Modelo Logistic 60 4.5.3. Modelo Cacho 62 4.6. MODELOS APLICADOS DURANTE EL PERIODO DE SEQUIA 63 4.6.1. Modelo Gompertz 63 13 4.6.2. Modelo Logistic 64 4.6.3. Modelo Cacho 65 4.7. MODELOS APLICADOS EN PRADERAS RENOVADAS 66 4.7.1. Modelo Gompertz 66 4.7.2. Modelo Logistic 67 4.7.3. Modelo Cacho 69 4.8. MODELOS APLICADOS EN PRADERAS NO RENOVADAS 69 4.8.1. Modelo Gompertz 69 4.8.2. Modelo Logistic 70 4.8.3. Modelo Cacho 72 14 4.9. SELECCIÓN DEL MODELO 72 4.9.1. Definición de puntos críticos 73 4.10. APLICACIONES PRÁCTICAS 79 4.11. OTROS MODELOS 80 4.12. FRACCIONAMIENTO DE CARBOHIDRATOS Y PROTEINAS 80 4.12.1. Interaccion edad de rebrote y manejo de praderas 81 4.12.2. Edad de Rebrote 83 4.12.3. Praderas Renovadas y no Renovadas 85 4.13. INTEPREATACION DEL DISENO ESTADISTICO 88 4.14. MODELO DE LA OPIMIZACION DE LA ALIMENTACION 90 4.14.1. Aplicaciones practicas de la optimización 92 15 4.15. DEGRADABILIDAD RUMINAL (in sacco) 92 4.16. FRACCIONAMIENTO DE CARBOHIDRATOS 95 4.17. PREDICCION DE LA RESPUESTA ANIMAL 100 4.18. SIMULACION ANIMAL 101 4.19. MODELO DE OPTIMIZACION DE LA RESPUESTA ANIMAL 103 4.19.1. Identificación, respuesta, factores y niveles 103 4.19.2. Planteamiento del diseño y modelo estadístico. 104 4.19.3. Justificación del modelo. 105 4.19.4. Supuestos del modelo. 106 4.19.5. Caso 45 a 52 días. 106 4.19.6. Caso 45 a 59 días. 110 16 4.19.7. Análisis de los resultados. 112 4.19.8. Definición del modelo. 113 CONCLUSIONES 114 BIBLIOGRAFIA 117 ANEXOS 128 17 INDICE DE TABLAS Pag. Tabla 1. Valor nutritivo del pasto Kikuyo en Cundinamarca. 5 Tabla 2. Valor nutritivo de los pastos Boxer y Aubade. 6 Tabla 3. Comparación de algunos de los factores considerados en la estimación del valor proteico por distintos sistemas. 16 Tabla 4. Interpretación de resultados de análisis de MUN en vacas lecheras. 37 Tabla 5. Definición del periodo de sequia. 41 Tabla 6. Definición del periodo de lluvias. 41 Tabla 7. Clasificacion de praderas renovadas y renovadas. 45 Tabla 8. Distribucion de cortes en las praderas. 49 18 Tabla 9. Produccion de biomasa durante el periodo de lluvias en Valores s/ms/m2. 53 Tabal 10. Produccion de biomasa durante el periodo de sequia en Valores s/ms/m2. 54 Tabla 11. Linearizacion para el modelo Gompertz según curve expert periodo de lluvias. 59 Tabla 12. Linearizacion para el modelo Logistico según curve expert periodo de lluvias. 61 Tabla 13. Linearizacion para el modelo Gompertz según curve expert periodo de sequia. 64 Tabla 14. Linearizacion para el modelo Logistico según curve expert periodo de sequia. 65 Tabla 15. Linearizacion para el modelo Gompertz según curve expert Praderas renovadas. 67 19 Tabla 16. Linearizacion para el modelo Logistico según curve expert Praderas renovadas. 68 Tabla 17. Linearizacion para el modelo Gompertz según curve expert Praderas no renovadas. 70 Tabla 18. Linearizacion para el modelo Logistico según curve expert Praderas no renovadas. 71 Tabla 19. Definición del modelo por error cuadrático medio. 72 Tabla 20. Valores calculados de la primera derivada y porcentaje de madurez entre los días 28 y 42 del crecimiento de las praderas. 76 Tabla 21. Información del nivel de clase (SAS). 81 Tabla 22. Valores promedio de las fracciones de carbohidratos y proteínas. 81 20 Tabla 23. Valores promedio de las fracciones de carbohidratos y proteínas según la edad de rebrote. 84 Tabla 24. Valores promedio de las fracciones de carbohidratos y proteínas según el manejo de las praderas. 86 Tabla 25. Ecuaciones obtenidas con el modelo de optimización. 90 Tabla 26. Niveles de significancia sobre el valos critico de t. 91 Tabla 27. Resultados de degradabilidad (in sacco) en praderas no renovadas. 93 Tabla 28. Resultados de degradabilidad (in sacco) en praderas renovadas. 94 Tabla 29. Fraccionamiento de carbohidratos en praderas no renovadas. 98 Tabla 30. Fraccionamiento de carbohidratos en praderas renovadas. 99 Tabla 31. Respuesta productiva del hato del CIC Santa María bajo el modelo. 101 21 Tabla 32. Datos de producción de leche; respuesta obtenida de acuerdo a cada una de las condiciones experimentales establecidas. 107 Tabla 33. Matriz de diseño, cálculos para estimar el valor de los factores. 108 Tabla 34. Estimación de los efectos y su significancia. 109 Tabla 35. Intervalos de confianza de los efectos. 110 Tabla 36. Matriz de diseño, cálculos para estimar el valor de los factores. 111 Tabla 37. Estimación de los efectos y su significancia. 111 Tabla 38. Intervalos de Confianza de los efectos. 112 22 INDICE DE FIGURAS Pag. Figura 1. Características de las fracciones de carbohidratos. 18 Figura 2. Estructura de Carbohidratos. 19 Figura 3. Características de las fracciones proteicas. 20 Figura 4. Estructura de las proteínas en el CNCPS . 21 Figura 5. Representación grafica de los diferentes tiempos en que tiene lugar la degradación de la proteína. (Ørskov, 1988). 33 Figura 6. Edades determinadas para el fraccionamiento de carbohidratos y proteínas. 47 Figura 7. Curvas de crecimiento durante el periodo de lluvias. 58 Figura 8. Curvas de crecimiento durante el periodo de sequia. 58 23 Figura 9. Valores observados vs valores estimados con el modelo Gompertz matemático y por curve expert. 60 Figura 10. Valores observados vs valores esperados estimados con el modelo Logístico matematico y mediante curve expert. 61 Figura 11. Valores observados vs valores estimados con el modelo Cacho. 63 Figura 12. Valores observados vs valores esperados estimados con el modelo Gompertz matematico y de curve expert. 64 Figura 13. Valores observados vs valores esperados estimados con el modelo Logistico matematico y de curve expert. 65 Figura 14. Valores observados vs valores esperados estimados con el modelo de Cacho. 66 Figura 15. Valores observados vs valores esperados estimados con el modelo Gompertz matemático y según curve expert. 67 Figura 16. Valores observados vs valores esperados estimados con el modelo Logistico. 68 24 Figura 17. Valores observados vs valores esperados estimados con el modelo de Cacho. 69 Figura 18. Valores observados vs valores esperados estimados con el modelo Gompertz matematico y de curve expert. 70 Figura 19. Valores observados vs valores esperados estimados con el modelo Logistico matematico y de curve expert. 71 Figura 20. Valores observados vs valores esperados estimados con el modelo Cacho. 72 Figura 21. Derivada (dP/dt) vs biomasa (g). 75 Figura 22. Línea tangente al punto de inflexión y valor del punto delta. 78 Figura 23. Promedios estadísticos de la interacción edad de rebrote y manejo de praderas. 83 Figura 24. Promedios estadísticos según la edad de rebrote. 84 Figura 25. Promedios estadísticos según el manejo de las praderas. 86 25 Figura 26. Interacción Hemicelulosa. 89 Figura 27. Interacción FDN. 89 Figura 28. Degradación de MS, FDN y RIE en praderas no renovadas con 45 días de recuperación. 95 Figura 29. Degradación de MS, FDN y RIE en praderas no renovadas con 52 días de recuperación. 96 Figura 30. Degradación de MS, FDN y RIE en praderas no renovadas con 59 días de recuperación. 96 Figura 31. Degradación de MS, FDN y RIE en praderas renovadas con 45 días de recuperación. 97 Figura 32. Degradación de MS, FDN y RIE en praderas renovadas con 52 días de recuperación. 97 Figura 33. Degradación de MS, FDN y RIE en praderas renovadas con 59 días de recuperación. 98 26 RESUMEN El objetivo de este trabajo consiste en comparar los cambios en el crecimiento y en las diferentes fracciones de carbohidratos y proteínas entre praderas renovadas y no renovadas del CIC Santa María de La Universidad de la Salle. Se analizaron 6 pasturas diferentes, tres de ellas fueron renovadas antes del inicio del trabajo y a las otras tres no se les realizo ningún tipo acondicionamiento ni manejo . Se realizo un muestreo durante un periodo de lluvias y otro durante un periodo de sequías, lo anterior con el fin de medir el desempeño de dos modelos de crecimiento matemáticos y seleccionar cual de ellos se adecuaba mejor a las condiciones medio ambientales de la finca, estos modelos fueron comparados con los modelos contenidos en el programa Curve Expert versión 3.0 para medir su desempeño. Se realizaron aforos semanales para llevar un control de crecimiento de las pasturas según la época del año y a partir del día 45 y por tres periodos de corte separados por 7 días, se llevaron muestras a laboratorio para realizar los análisis de fraccionamiento de Carbohidratos y Proteínas Netos de Cornell, posterior a esto, se hicieron pruebas de digestibilidad in Sacco con 5 tiempos de incubación (0, 6, 24, 48 y 72 horas) en un Toro Holstein. Los datos obtenidos se llevaron a una simulación por el software CNCPS V 6.1 para predecir la respuesta animal a esa dieta y ver su comportamiento, posterior mente se hizo una optimización por superficies de respuesta para cuantificar como afectaba la producción en la finca al modificar cualquiera de las variables evaluadas para la producción de las pasturas. Con este trabajo esperamos contribuir en la investigación de manejo de praderas para un mejor desempeño y optimización de las explotaciones y mejorar así la productividad de nuestro sector agropecuario. 27 ABSTRACT The aim of this study is to compare changes in the growth and in the different fractions of carbohydrates and proteins between renewable and non-renewable pastures in La Salle University’s CIC Santa Maria. We analyzed 6 different pastures; three of them were renovated before starting the work and the other three stayed without any change or handling. We performed a sampling over a period of rain and another one for a period of drought, this was in order to measure the performance of tow mathematical conditions of the property, these models of growth and select which one is suited better to the environmental conditions of the property, these models were compared with those models contained in the program Curve Expert version 3.0 to measure their performance. The Aforos were conducted weekly to keep track of growth of pastures depending on the season and starting on day 45 by cutting three periods separated by 7 days, we took samples to laboratory for Carbohydrates and Protein Net Cornell Fraction analysis, after this, we made digestibility tests in sacco with 5 incubations times (0, 6, 24, 48 and 72 hours) in a Holstein bull. The data obtained were taken to a simulation made with the software CNCPS V 6.1 to predicted the animal response under that diet and watch their behavior, later we made an optimization by surfaces responses to a quantify how it affects the productions in the farm to modify any of the evaluated variables for the production pastures. With this work we hope to contribute in the research of the management of grassland for a better performance and development of the farm to improve the productivity of our agricultural sector. 28 INTRODUCCION Durante las últimas décadas hemos visto una nueva tendencia en los sistemas productivos agropecuarios, pues se ha cambiado de ese modelo de importación de tecnologías que implicaba cambiar algunos factores de nuestro medio agroecológico, generando altos costos y haciendo imposible la competitividad, hacia una adaptación racional de tecnologías, que permita que sean ellas quienes se adapten a nuestro medio. Sin embargo en algunos sectores como el de la ganadería, y ante las nuevas perspectivas de globalización e integración de mercados, se deben intensificar en estos, esfuerzos de competitividad y una solución a ello es justamente el mejoramiento de las prácticas de alimentación animal. En las ganaderías especializadas de la Sábana de Bogotá se tiene como base de la alimentación el forraje, sobre este se suplementa con alimentos comerciales que poco se adecuan a las necesidades reales de los animales, generando con ello perdidas económicas y fisiológicas que no solo aparecen por los costos de estos concentrados, sino que también pueden influir en el rendimiento productivo y reproductivo de los animales. Para hacer más productiva nuestra ganadería, debemos tener clara la idea de que somos un país tropical y que nuestros sistemas alimenticios no se pueden basar en la suplementacion de cereales pues aparte de los altos costos que estos tienen, tenemos la responsabilidad ética de impedir que nuestros animales compitan contra nuestra población por los alimentos. Debemos optimizar nuestras ventajas productivas como país tropical, lo que le permite a nuestros pastos crear un volumen de biomasa abundante el cual necesariamente ha de convertirse en nuestra principal fuente de obtención de carne y leche para la alimentación humana. 29 Con base en esta clara necesidad, necesitamos optimizar la utilización de los nutrientes de estos pastos y es en este punto donde el CNCPS se convierte en una herramienta con alto grado de aplicabilidad. Una dieta formulada bajo el modelo CNCPS, permite evaluar y corregir las pérdidas minimizando la contaminación gaseosa producida por el rumiante y aumentando la producción, mediante un mejor aprovechamiento de los alimentos ofrecidos, basándose en sus respectivos análisis correlacionándolos con el potencial productivo de la especie. De ahí, la importancia de este sistema como herramienta prominente que nos permite simular la respuesta animal sugiriendo un mejor aprovechamiento de los forrajes, los suplementos y el potencial genético de la especie, todo con el propósito de obtener un producto de mejor calidad maximizando los indicadores de sostenibilidad y competitividad de la explotación. 30 OBJETIVOS OBJETIVO GENERAL Comparar los cambios en el crecimiento y en las diferentes fracciones de carbohidratos y proteínas entre praderas renovadas y no renovadas del CIC Santa María de La Universidad de la Salle. OBJETIVOS ESPECIFICOS Determinar un modelo de crecimiento matemático que se ajuste al desarrollo fisiológico de la pradera en términos de biomasa por unidad de tiempo. Evaluar los cambios en las fracciones de carbohidratos y proteínas basados en la edad de rebrote y el efecto de renovación y no renovación de las praderas del CIC Santa María. Predecir la actividad ruminal y metabólica, y la respuesta animal bajo el modelo CNCPS en condiciones especificas de trópico alto en el CIC Santa María. Establecer alternativas de alimentación con base en suplementos no comerciales que se adecuen a las condiciones específicas de producción optimizando la respuesta animal. 2. REVISION DE LITERATURA 31 2.1. GENERALIDADES DE LOS PASTOS 2.1.1. Pasto Kikuyo (Pennisetum Clandestinum) Es originario de África, es una especie perenne que se ha convertido en uno de los pastos preponderantes en la Sábana de Bogotá. Posee unos rizomas gruesos y suculentos que pueden alcanzar hasta un metro de largo, su sistema radicular se inserta profundamente en el suelo para optimizar la absorción de nutrientes y adicionalmente en los nudos de los rizomas se forman otras raíces superficiales que se extienden por el suelo dando un mayor poder de absorción. En algunas praderas con un buen sistema de manejo, los tallos crecen erectos y suelen alcanzar alturas hasta de 60 cm. A partir de allí lanzan unas hojas en forma de lanzas que se extienden otros 25 – 20 cm, incrementando el área de absorción de energía solar para sus procesos de fotosíntesis. Es un pasto competitivo, que al estar en mezcla con otras especies vegetales eleva su tamaño para poder absorber la mayor cantidad posible de radiación solar. Según Bernal (2003) la producción de forraje depende en gran parte de la fertilidad y la humedad del suelo. Con practicas de manejo adecuadas, se han obtenido mas de 20 ton/ha al año de heno de buena calidad. Calidad del forraje La calidad del forraje es buena cuando se rompe el césped regularmente y se abona bien, es rico en proteínas y posee una elevada digestibilidad Tabla 1. Valor nutritivo del pasto kikuyo en Cundinamarca. 32 % MS PC DIVMS FDN FDA H/LOSA C/LOSA LIGNINA E.D. E.M. 40 días 11.89 41.59 63.84 36.64 27.20 25.42 7.5 2.10 1.72 50 días 14.63 53.42 65.56 31.78 33.88 24.38 4.9 2.66 2.18 60 días 16.62 79.18 57.48 32.70 24.78 26.76 4.2 3.25 2.66 Mezclas 17.96 77.85 54.28 31.74 22.54 31.74 4.5 3.12 2.56 a Pastos y Forrajes Tropicales, Producción y Manejo. Javier Bernal Eusse 4 Ed. 2.1.2. Pasto Raigrass Llolium hibridum) El nombre genérico de raigrás se aplica primordialmente a dos especies cultivadas del genero Lolium. Una de estas especies, el Lolium multiflorum se conoce como raigrás anual o italiano y el Lolium perenne como raigrás ingles o perenne. De estas dos especies se han seleccionado muchos cultivos y se han hecho cruces que han dado origen a un gran número de híbridos y variedades que reciben distintos nombres comerciales. Dentro de las muchas especies de pastos empleadas en clima frio, se destacan actualmente los raigrases tetraploides. Estos materiales fueron desarrollados mediante un sistema especial que duplica el número de cromosomas (los portadores de la herencia), de los tipos comunes de raigrass. Dentro de los tetraploides obtenidos se seleccionan aquellos que presentan mejores características (Bernal, 2003). Fue introducida en Colombia en 1976 y desde entonces se ha venido ensayando a nivel experimental y comercial obteniéndose rendimientos promedio mayores que los progenitores (italiano e inglés), sus hojas y tallos son más largos y más suculentos; son más apetecibles, lo que hace que los animales lo consuman más. Crece bien en alturas comprendidas entre 2000 y 3000 m.s.n.m.. Requiere suelos de fertilidad alta y media y un pH entre 5.5 y 7.0, de textura franca, aunque tolera suelos pesados. Es exigente en humedad y es resistente a la acción de las 33 heladas. Se caracteriza porque crece en matojos, tiene un sistema radicular amplio y superficial; sus hojas son anchas de color verde intenso, glabro y suculento; los tallos florales casi no poseen las hojas; la inflorescencia es en espiga de 25 a 40 cm de largo, con 15 a 30 espiguillas de 4 a 5 florecillas cada una (Estrada, 2001, citado por Barrera y Pinilla 2006) Calidad y producción Es un pasto con un elevado valor nutricional, aunque este depende en gran medida del manejo dado al pasto y de la edad a la cual se coseche. Para obtener una buena producción de raigráss es necesario hacer algunas enmiendas al suelo y diseñar un programa de fertilización con elementos mayores y menores de acuerdo a los análisis de suelos y forrajes de cada zona (Bernal, 2003). Tabla 2. Valor nutritivo de los pastos bóxer y aubade en Colombia. Variedad Edad Días PC DIVMS FDN FDA H/losa Celulosa Lignina % MS 25 21,2 87,56 51,14 28,5 22,64 21,5 4 35 19,1 82,3 49,92 34,44 15,48 24,4 5 45 17,2 76,74 48,48 36,06 12,42 24,02 5,4 55 14 76,06 46,94 33,98 12,94 25,12 5,7 Heno 16,7 80,84 54,09 35,58 18,5 26,18 6,3 32 28 89,06 46,64 22 22,64 17,36 3,1 Aubade 40 18,8 86,55 45,48 29,78 15,7 22,44 5,5 (Anual) 45 11 87,6 47,46 25,55 17,65 22,05 3,5 60 12,3 67,1 60,57 27,78 18,14 22,98 4,8 Bóxer (Perenne) Pastos y Forrajes Tropicales, Producción y Manejo. Javier Bernal Euuse (1985) Los tetraploides anuales se caracterizan por su rápido establecimiento y abundante producción de forraje durante los primeros meses después de 34 establecida la pradera, su duración varia entre 18 a 30 meses, en condiciones normales. Los tetraploides perennes producen menos inicialmente, pero la duración de la pradera es mayor, pudiendo llegar hasta 48 meses en buenas condiciones de producción (Estrada, 2001). 2.1.3. Pasto azul orchoro (Dactylis glomerata) Puede adaptarse en alturas comprendidas entre 1500 y 3100 metros sobre el nivel del mar, pero en alturas inferiores a 2000 metros su producción en muy escasa; en limite de los paramos crece bien, pero su desarrollo es muy lento, produce bien en casi toda clase de suelos, pero sus rendimientos son mucho mayores en suelos fértiles, profundos y bien drenados. Es originario de Eurasia y el norte de África (Bernal, 2003). Es perenne, de crecimiento robusto, crece en manojos esparcidos en las praderas donde se destaca por su coloración y su altura. Posee unos tallos florales que alcanzan hasta 1.3 metros de largos; muchos tallos, hojas plegadas y vainas comprimidas; su inflorescencia es notoria sobresaliendo por encima de los demás tallos en forma de racimos de espiguillas reducidas. Sus raíces penetran el suelo a bastante profundidad lo cual lo hace soportar con mayor fortaleza tiempos prolongados de sequia. 2.2. RENOVACION DE PRADERAS La intervención mecánica para renovar praderas degradadas puede desarrollarse mediante varias operaciones, las cuales dependen de la condición de la pastura, del suelo y de las condiciones agro climáticas del lugar. Aunque se han usado rastras de discos y otros implementos tradicionales para la renovación, algunos 35 implementos que no invierten el perfil del suelo, y que están basadas en herramientas verticales consiguen mejores resultados. Una pastura sin renovación decrece su rendimiento con el tiempo hasta cuando la producción no es suficiente o las especies remanentes no son tomadas por los animales por cambios en la composición botánica. La degradación no se puede recuperar naturalmente. A menudo el mal manejo es la causa. Así están la baja o nula fertilización de mantenimiento, corte tardío, pastoreo o conducción de maquinaria en condiciones húmedas, sobre pastoreo, el uso sistemático de implementos de discos, el tráfico de maquinaria o el pastoreo intensivo que crean capas compactas de suelo las cuales reducen la velocidad de infiltración e incrementan la superficie de escorrentía, con lo cual hay menor cantidad y calidad de forraje (Lozano, 2004). 2.3. TASA DE CRECIMIENTO DE LOS FORRAJES El estudio de sistemas de pastoreo y las evaluaciones de las alternativas manejadas estratégicamente pueden ser significativas ayudadas por modelos de simulación. Por ejemplo, presentan modelos dinámicos de forraje basados en la edad y en el peso de diferentes componentes (hojas, tallos y materia orgánica) (Cacho, 1993). Bajo una situación de pastoreo, los retos de diseñar estrategias nutricionales aumentan. Manejar pastoreo implica la aparición de más interacciones en el sistema que dificultan entender como van a ser las corrientes de salida (en este caso crías y leche). Los animales tienen un potencial de producción y comen para alcanzar este potencial. Cuando el alimento es suministrado en situaciones de estabulación, el animal simplemente consume un alimento ofrecido de acuerdo a 36 sus requerimientos nutricionales. Bajo estas circunstancias, los retos se resumen en balancear una ración apropiada. Pero en pastoreo, es necesario tener en cuenta el efecto del volumen de los forrajes en limitar el consumo voluntario. Suministrar forrajes con un alto contenido de fibra, va a limitar que el animal ingiera la cantidad de energía que requiere. Otro factor relevante en la alimentación de bovinos en pastoreo es la disponibilidad de pasto y el efecto del pasto residual sobre la recuperación de la pradera. La disponibilidad de forraje se modifica en una explotación por medio de diferentes estrategias de manejo de praderas (rotación, pastoreo continuo). Estas afectan el crecimiento y acumulación de forraje, al igual que la calidad del mismo. La curva de crecimiento de forraje de acuerdo a diferentes condiciones climáticas y de manejo definen cual debe ser el momento de la cosecha para obtener mayor producción de materia seca (volumen) en el año, al evitar que esta curva de crecimiento alcance la asintota, en la cual el uso de recursos no se logra depositar más materia seca, debido a que en este punto, la tasa de muerte de material vegetal y de crecimiento se igualan. En este mismo punto, la lignificación del forraje disminuye la calidad (contenido de energía por unidad de volumen) (Cacho O.J. 1993). El crecimiento de pasto puede ser representado por una ecuación de crecimiento sigmoidea logística. Una ecuación de este tipo, debe tener tres parámetros que se pueden estimar estadísticamente de resultados experimentales o de forma algebraica de modelos fisiológicos de simulación. Estos parámetros se relacionan con capacidad máxima de producción de una pradera, tasa de crecimiento de acuerdo a variables climáticas y a factores inherentes al crecimiento de cada especie forrajera. Cuando una pradera esta bien establecida, y es pastoreada y luego se deja crecer libremente, el acumulo de masa vegetal va a ser lenta inicialmente, en la medida 37 en que las reservas vegetales sean movilizadas para reconstruir el área de las hojas. La tasa de crecimiento de la planta aumenta en la medida que crece el área con capacidad fotosintética. En la medida en que las plantas crecen, la sombra comienza a tener efecto y se disminuye la tasa de acumulación de masa vegetal. Cuando el tejido senece, la tasa de acumulación neta tiende a cero. Esta ecuación se puede representar como: dY Y 2 ⎛ Y max − Y ⎞ G= =α ⎟ ⎜ dt Y max ⎝ Y ⎠ γ Donde Y representa acumulación de materia seca y Ymax representa la capacidad máxima de la pradera para acumular materia seca, donde tejido no fotosintético ha incrementado al punto que las pérdidas respiratorias igualan las ganancias. Entonces, Ymax representa la producción potencial de forraje. Este parámetro cambia con diferentes condiciones climáticas. Cerca al ecuador, es de esperarse que Ymax sólo sea afectado significativamente por niveles de precipitación. El parámetro α determina el nivel máximo de crecimiento. Mientras que el parámetro γ es especifico para cada especie y determina cuando una planta alcanza la tasa máxima de crecimiento. Un manejo de praderas eficaz y efectivo y una correcta carga animal, son necesarios para maximizar la viabilidad económica de la empresa ganadera. Planear y presupuestar la oferta y la demanda de nutrientes asegura que se utilice al máximo el pasto, por medio de pastoreo o cosecha para conservación (Van Houtert M.F.J and Sykes A.R. 1999). 2.4. CUANTIFICACION DE FORRAJES 38 La lechería especializada en la Sabana de Bogotá se desarrolla en explotaciones ganaderas en donde tradicionalmente se han utilizado recursos genéticos animales de alta producción, los cuales se caracterizan por demandar alta cantidad y calidad de nutrientes en la dieta para satisfacer sus necesidades diarias y lograr no solo altas producciones sino cumplir con otras funciones igualmente importantes como la reproducción. 2.4.1. Medición de los forrajes Según (Estrada , 2001), los métodos de muestreo para estimar la disponibilidad del forraje se pueden dividir en dos grandes grupos: Método destructivo Son aquellos en los que la cantidad de forraje se mide por corte manual o mecánico, mientras que en los no destructivos se miden o estiman algunas variables de la vegetación que se pueden relacionar con cantidad. En los métodos destructivos se puede utilizar desde el corte manual (tijeras, hoz), hasta el corte con equipos mecánicos. Tipos de muestreo destructivo: Al azar. Al azar dirigido. Al azar dirigido estratificado. Método no destructivo Este método trata de corregir las dificultades que se presentan en el método destructivo, por utilizar las estimación visual como instrumento principal, aun cuando estos métodos no son muy exactos, permite aumentar la precisión dado que es posible realizar un gran número de observaciones. 39 Tipos de muestreo No destructivos Doble Rango Visual Botanal 2.4.2. Muestreo por doble rango visual Es un método en el cual se combina las observaciones visuales con los valores obtenidos en los cortes. Este método estima el forraje disponible visualmente mediante 50 o más marcos por hectárea colocados en forma aleatoria o siguiendo una división transversal al potrero o a la parcela transepto; en ellos se da una calificación de 1 a 5, donde 1 representa menos forraje y 5 mas forraje. Se utilizan como referencia 5 puntos previamente seleccionados y debidamente identificados, los cuales representan la escala o rango (1 a 5) que contienen las variaciones de forraje disponible en la pastura. Una vez hechas las lecturas visuales, los puntos o marcos de referencia se cortan, se pesan y se secan. Con los valores del forraje disponible en los 5 marcos, se construye una regresión lineal (y = a + bx) que sirve para estimar la disponibilidad del forraje (y) partiendo de las lecturas visuales (x). 2.4.3. Medición de los componentes de forraje disponible La estimación de los componentes del forraje disponible (materia verde en base seca, materia inerte o muerta, hoja y tallo) puede hacerse por separación manual del material cortado o por métodos indirectos. Separación manual Exige, muchas veces, tomar submuestras del forraje en los marcos utilizados para medir la disponibilidad del forraje, procurando realizar la separación antes de secar el forraje. El forraje obtenido con los marcos debe mezclarse bien y dividirse en cuatro, de los cuales se sacan las submuestras cuyo tamaño fluctúa entre 300 40 y 500 gramos de forraje. Como una alternativa, la separación de hojas y tallos para su uso en análisis químico se pueden hacer en el campo en muestras cortadas sin marco a una altura definida. Métodos indirectos Consiste en medir en el forraje algún constituyente que se halle en diferente concentración en cada uno de los componentes que se quiere separar. Este principio ha sido utilizado para estimar la proporción de M.V.S. y de materia inerte mediante la medición de pigmentos solubles en alcohol o de la clorofila. 2.4.4. Medición de la composición botánica de la pradera La composición botánica de una pastura puede estimarse haciendo mediciones de los siguientes factores: Número o densidad de plantas. Cobertura de las especies. Pesaje de las especies presentes. El número de plantas por unidad de área y la cobertura de las especies son mediciones muy utilizadas para evaluar el establecimiento y la persistencia de gramíneas y leguminosas en pasturas experimentales. El pesaje de las especies que conforman la vegetación es una medida muy objetiva para determinar la composición botánica de la pradera. Sin embargo es un método muy laborioso pues la separación debe hacerse, generalmente, en forma manual. Para agilizar ese trabajo se recomienda hacer la separación en submuestras representativas (500 g) de forraje cosechado en marcos, y preferiblemente antes de secar las muestras. Una gran ventaja posee el método del muestreo por doble rango visual el cual permite estimar el forraje disponible y la composición botánica en una sola 41 operación. En general el éxito de este método para estimar disponibilidad y la composición botánica se basa en el entrenamiento de los observadores. Debe, por tanto, calibrarse el método haciendo que cada observador califique un número determinado de marcos y que su resultado se compare con aquellos obtenidos por corte y separación manual de las especies en los mismos marcos (Estrada, 2001). 2.5. MODELO CNCPS (CORNELL NET CARBOHYDRATE AND PROTEIN SYSTEM) El sistema de valoración protéica y energética desarrollado por la Universidad de Cornell, conocido como "Cornell Net Carbohydrate and Protein System (CNCPS)" es un modelo con varios niveles de agregación que, al igual que otros recientes sistemas de valoración europeos (ARC, 1980, 1984; INRA, 1978, 1988; AFRC, 1993) y americanos (NRC, 1985), permite predecir los rendimientos productivos del ganado vacuno a partir del contenido en ingredientes de su dieta. Pero, a diferencia de estos últimos, el CNCPS no está específicamente diseñado para el racionamiento sino para comprobar la idoneidad de dietas previamente formuladas. Es decir, permite valorar la adecuación de una dieta previamente establecida para unas condiciones de producción determinadas. En este sentido, ofrece una detallada información sobre factores limitantes del metabolismo ruminal y adecuación del aporte de nutrientes, incluyendo aminoácidos limitantes, que puede resultar sumamente útil para valorar estrategias de formulación y elaborar hipótesis de trabajo (Guada, 1996). El sistema CNCPS esta integrado por una serie de submodelos que valoran, respectivamente, el contenido de carbohidratos y proteína disponibles en la dieta (Sniffen et al., 1992), los procesos de fermentación y síntesis de proteína microbiana (Russell et al., 1992), las necesidades energéticas y proteicas del ganado vacuno (Fox et al,. 1992) y el aporte y necesidades de aminoácidos (O’Connor et al., 1993). Las características propias de estos submodelos hacen 42 del sistema una herramienta versátil, que integra una serie de variables como las diferencias de razas, precocidad y aspectos de la termorregulación las cuales juegan un papel preponderante en lo relacionado con las necesidades del animal lo cual supone en este submodelo un importante esfuerzo en la sistematización de estos datos, además destacan por su originalidad los submodelos dedicados al aporte de nutrientes y el metabolismo ruminal, y por su carácter innovador el submodelo de estimación de aportes y necesidades de aminoácidos, debido al importante papel de estos en los aspectos productivos y reproductivos del hato El sistema de carbohidratos y proteínas netos de cornell (CNCPS) es un modelo matemático utilizado para evaluar la alimentación y el desempeño del animal, este fue desarrollado con base en la función ruminal, crecimiento microbial, digestión y paso del alimento y fisiología animal. Siendo cuantificadas algunas variables especificas en el manejo en campo como las medio ambientales y la alimentación, predicciones mas exactas de crecimiento y producción de leche del ganado y excreción de nutrientes en diversas situaciones de producción en cuanto sea posible (Fox et al, 2004). En la tabla 3 se resumen las principales diferencias de los tres modelos de valoración proteína en comparación con el CNCPS, recientemente el submodelo ruminal ha sido ampliado incorporando la posibilidad de predecir la producción y absorción de ácidos grasos volátiles, y mejorar la estimación del pH ruminal (Pitt et al., 1996), sin embargo estos datos se omiten dado que aun esta pendiente su integración al modelo de rendimientos. Es de notar que el CNCPS a diferencia de los otros sistemas tiene en cuenta la degradabilidad de cinco fracciones proteicas lo cual le permite hacer un calculo mas exacto de la cinetica de las proteínas en el tracto digestivo y disminuye el margen de error en la predicción del comportamiento de las mismas 43 Tabla 3. Comparación de algunos de los factores considerados en la estimación del valor proteico por distintos sistemas. AFRC SISTEMA DE VALORACIÓN INRA NRC CNCPS Estimación de la degradabilidad Fracciones proteicas consideraras 3 3 3 5 Cinética de degradación (kd) + + + + Velocidad de paso (kp) variable + + + Estimación de la síntesis microbiana Sustrato energético EMF Efecto de kp Empírica MOF TDN CHOF Empírica Mecanística Compartimentación microbiana + N reciclado (% de N ingerido) 15 10-70 Efecto de la fuente de N + Efecto del Ph + Efecto de los iónoforos + Proteína microbiana verdadera 0,75 0,8 0,8 0,85 Digestibilidad de N microbiano 0,85 0,8 0,8 0,75 Digestibilidad de N degradado var. var. 0,8 var. Perfil aminoacidico + Utilización de la proteína metabolizable Mantenimiento 1 est. 0,67 0,67 Crecimiento 0,59 0,68 - 0,4 0,5 0,75 - 0,4 Lactación 0,68 0,64 0,65 0,65 (Guada, 1996) EMF: energía metabolizable fermentable MOF: materia orgánica fermentable CHOF: carbohidratos fermentables 44 2.5.1. Fracciones de Carbohidratos. El valor energético de la dieta se expresa convencionalmente en términos de energía metabolizable (EM) o energía neta (EN). Estas unidades describen la energía disponible por el animal y son útiles para comparar la adecuación de los aportes con las necesidades, pero resultan poco apropiadas como índices de la energía disponible por los microorganismos del rumen. La energía de las heces, orina y metano, que se sustraen de la energía bruta para estimar la EM, supone una pérdida de energía para el animal pero no para los microorganismos ruminales. De hecho, parte de la energía fecal se encuentra en forma de cuerpos y restos microbianos procedentes del ciego y rumen. A su vez, parte de la energía eliminada en forma de orina procede del metabolismo orgánico de la proteína microbiana absorbida, mientras que el metano es un producto del metabolismo energético bacteriano (Guada, 1996). El CNCPS valora el aporte de energía al rumen en términos de carbohidratos estructurales (CS) y no estructurales (CNS), basándose en el esquema de fraccionamiento de la fibra de Goering y Van Soest, (1970). Los CS corresponden con la fibra neutro detergente (FND), corregida sustrayendo su contenido en N × 6,25, mientras que los CNS comprenden el resto de los carbohidratos (azucares, almidón, fructazas, galactanas, pectinas y B-glucanos) estimados por la diferencia entre el contenido de materia orgánica y los CS, la proteína y el extracto etéreo. Cada una de estas fracciones (CS y CNS), define un conjunto heterogéneo de compuestos por lo que se subdividen en un total de 4 fracciones con distintas características en cuanto a su degradabilidad. 45 Figura 1. Características de las fracciones de carbohidratos A cada subfraccion se le atribuye un ritmo de degradación (kd), característico de cada alimento (Sniffen et al 1992), que junto con una estimación del tiempo de retención del contenido digestivo ruminal o ritmo fraccional de transito (kp), permite estimar la proporción de cada fracción que es degradada en el rumen (kd / (kd + kp)) o que lo abandona sin sufrir degradación (kp / (kd + kp) (Sniffen y Robinson, 1987). Cada fracción de carbohidratos degradada en el rumen constituye, por lo tanto, un sustrato de fermentación microbiana que proporciona energía a un ritmo definido por su velocidad de degradación (Kd). Determinación de las fracciones de carbohidratos (Hall, et al 1997) estiman la solubilidad de la fibra como un cambio de peso del 90% entre el residuo extraído en etanol (RIE) y la extracción con solución detergente neutra. La fermentación de compuestos solubles en etanol (azucares, ácidos orgánicos, oligosacáridos de cadena corta y aminoácidos) puede estimarse mediante la sustracción de curvas entre RIE y el material entero. La fracción B1 es insoluble en etanol y la proporción de fermentación se puede estimar mediante la correspondiente sustracción entre las curvas de RIE y FDN. 46 ¾ Fracción A: ME – EIR ¾ Fracción B1: EIR – FDN ¾ Fracción B2: % FDN ¾ Fracción C: Lignina × 2,4 Cuando se determinan las fracciones A y B1 por diferencia, estas fracciones contienen aminoácidos y proteínas que en fermentación van a producir gas. Cuando la proteína es fermentada en ausencia de carbohidratos, se maximiza la desaminación. Del gas proveniente de la proteína, únicamente la mitad del volumen producido es equivalente a la cantidad de carbohidratos. Feed CHO Sugars Ethanol Insoluble Residue (EIR) Starch Pectins (NDSF) NDF ADF ND-AD Cel. A B1 B2 Lig. C Figura 2. Estructura de los carbohidratos en el CNCPS 2.5.2. Fracciones de Proteínas En el CNCPS, se diferencian tres fracciones nitrogenadas. El NNP (Fracción A), que es utilizado exclusivamente en forma de NH3, la proteína verdadera potencialmente degradable (Fracción B) y la proteína no degradable e indigestible en el intestino, por estar ligada a la fibra ácido detergente (Fracción C). A su vez, la fracción B se subdivide en otras tres que se caracterizan por su diferente ritmo de degradación (Kd) y de paso (Kp), ello permite estimar el aporte de N utilizable 47 por los microorganismos en formas de NH3 y péptidos o aminoácidos, así como la proporción de proteína que escapa sin ser degradada (Guada, 1996). Figura 3. Características de las fracciones protéicas El sistema de carbohidratos y proteínas netos de cornell (CNCPS) es un modelo matemático utilizado para evaluar la alimentación y el desempeño del animal, este fue desarrollado con base en la función ruminal, crecimiento microbial, digestión y paso del alimento y fisiología animal. Siendo cuantificadas algunas variables especificas en el manejo en campo como las medio ambientales y la alimentación, predicciones mas exactas de crecimiento y producción de leche del ganado y excreción de nutrientes en diversas situaciones de producción en cuanto sea posible (Fox et al, 2004). 48 Feed N Buffer soluble TP Buffer soluble N NPN A Borate-phosphate buffer insoluble N NDF soluble N B1 B2 NDIN ND-AD ADIN B3 C Figura 4. Estructura de las proteínas en el CNCPS 2.5.3. Desarrollo del modelo. Para formular raciones con el CNCPS, información sobre los animales, alimentos, manejo y condiciones medio ambientales son requeridas. La estructura del CNCPS contiene varios submodelos con diferentes niveles de agregación cada uno. Algunos son relativamente mecanísticos, mientras otros son básicamente empíricos. Estos modelos se clasifican según su función fisiológica en: ¾ Mantenimiento. ¾ Crecimiento. ¾ Gestación. ¾ Lactancia. ¾ Reservas corporales. ¾ Consumo voluntario y composición. ¾ Fermentación ruminal. ¾ Digestión intestinal. ¾ Metabolismo. ¾ Excreción de nutrientes. 49 MANTENIMIENTO La energía disponible para funciones productivas depende de la proporción de energía consumida que debe ser utilizada para requerimientos de mantenimiento y es considerada en primer orden para evaluar la dieta y el desempeño animal. Los requerimientos para mantenimiento se calculan para raza, estado fisiológico, actividad, excreción de urea, estrés de calor o frió y efectos de aclimatación. En crecimiento la energía neta para mantenimiento (ENm) se ajusta utilizando la escala de condición corporal de 1-9 en ganado de carne y de 1-5 para leche. La ENm para toros se incrementa en 15% y se reduce en 10% para todas las razas Bos indicus. Para requerimientos de proteína de mantenimiento, el CNCPS asume que esta es igual a la suma de proteína de descamación, proteína urinaria y proteína fecal, de acuerdo con (NRC, 2000) y esta se denomina proteína metabolizable (PM). CRECIMIENTO La energía y la proteína para crecimiento incluyen ajustes para efectos de peso corporal, tasa de ganancia, composición química de la ganancia y peso adulto (NRC, 2000, 2001). Un sistema de escalas para tamaño basado en la relación de peso actual / peso adulto, se utiliza para predecir la composición de la ganancia (agua, grasa, proteína). El peso en ayuno es ajustado a un peso equivalente a un animal de referencia estándar en el mismo estado de crecimiento. En vacas de carne el peso maduro es definido como el peso en el cual un incremento en la masa corporal no contiene ganancia neta de proteína (solo incremento de grasa), condición que ocurre a los 4 años de edad; a una condición de 5 en vacas de carne y de 3 en vacas de leche. Para animales de sacrificio en crecimiento, el peso maduro es el peso esperado a una composición final esperada. Para novillas de reemplazo se asume 478kg. 50 Para novillos, toros y hembras de engorde es 400, 478, 435, respectivamente a una composición final de 22%, 25% o 28% de grasa corporal (NRC 2000), lo cual esta asociado al grado de marmoreo respectivamente. Para animales de engorde en crecimiento se realizan ajustes por el uso de anabólicos, de acuerdo a la guía del NRC 2000, si los implantes son estrogénicos o androgénicos y de acuerdo al tiempo de uso y al nivel energético en la dieta. La energía Neta para ganancia (ENg) se basa en relaciones empíricas descritas por NRC. El CNCPS, usa la energía disponible para ganancia, corregida por ENm y peso corporal, ajustada al animal de referencia estándar, para predecir la ganancia diaria de peso. Una vez determinada la energía requerida, la cantidad de proteína (MP) requerida se calcula. GESTACIÓN El CNCPS calcula los requerimientos para gestación y ganancia de peso para crecimiento del útero grávido, basándose en el peso al nacer esperado y el día de gestación actual. LACTANCIA La energía y la proteína requeridas para producción de leche son calculadas, de acuerdo a la producción actual y sus componentes. La proteína cruda en leche es convertida a proteína verdadera según la expresión: “% proteína cruda * 0,93”. Si no se tienen los valores de proteína y grasa en leche, el CNCPS, calcula los requerimientos con valores por defecto. La energía metabolizable para leche se calcula de la energía en leche con una eficiencia de 0,644. La proteína metabolizable (PM) requerida para leche es calculada del rendimiento en leche y el contenido de PC en leche y la PM es convertida con una eficiencia de 0.65. Como la producción de leche en vacas de carne no es medida normalmente, los requerimientos para lactancia se calculan de acuerdo a edad de la vaca, tiempo al 51 pico de lactación, pico producción esperado basado en raza y peso al destete de la cría, día de lactancia, duración de la lactancia, contenido de grasa en leche, sólidos en leche y proteínas en concordancia con NRC 2000. RESERVAS CORPORALES El submodelo para cálculo de reservas en el CNCPS usa la condición corporal (BCS) para el manejo de las reservas de energía, desde que se sabe que hay cambios significativos en agua y grasa corporal a través de la lactancia (Andrew, et al, 1994). La base de datos en el submodelo asume un peso de referencia (en ayuno) de 642kg a una condición 5 (1-9), con un valor de 44 kg por cada punto de condición (6.85% del peso promedio). Cambios en BCS son sumados o restados a la condición actual, para calcular la energía y la proteína ganada o perdida. En el modelo la eficiencia de uso de la EM para reservas en lactancia es 0.75 y 0,644 la eficiencia para lactancia como producción. CONSUMO DE MATERIA SECA El suministro de nutrientes en el CNCPS se calcula partiendo del consumo actual de materia seca (MS). Cuando este no se conoce, situación común para animales en pastoreo, el submodelo proporciona ecuaciones empíricas para predecir el consumo. Las ecuaciones se desarrollaron específicamente para los tres tipos de ganado: ganado de carne (NRC, 2000), ganado de leche (Milligan, et al 1981) y doble propósito (Traxler et al., 1998). Para todos los tipos, cada ecuación hace ajustes por efecto de temperatura ambiente y de acuerdo al estado fisiológico. FERMENTACIÓN RUMINAL CNCPS al igual que NRC 2000 y 2001 tienen dos niveles de agregación para solucionar las dietas. El nivel 1 esta dirigido a condiciones donde los alimentos no 52 están totalmente caracterizados y el usuario no esta familiarizado con el modelo. El nivel 2 es para usuarios con suficiente información sobre la composición nutricional del alimento y tienen un entendimiento adecuado de cómo usar el submodelo de rumen. 53 El nivel 1 calcula los nutrientes digestibles totales (NDT) y PM con ecuaciones empíricas basadas en los desarrollos de Weiss (1993) y NRC (2001). En el nivel 2, los NDT disponibles ruminalmente y la PM son derivados mecanísticamente a partir de las tasas de degradación (Kd) y de pasaje (Kp). El modelo calcula los agregados de componentes que son degradados y que pasan al tracto posterior de acuerdo a las velocidades de fermentación y de flujo, utilizando la relación simple Kd / (Kd+Kp). El alimento no digerido en el rumen pasara sin degradarse al intestino, donde será o no digerido, de acuerdo a una tasa específica de digestión intestinal. Este sistema asume varias condiciones para operar correctamente (Fox, et al 2004) 1.) Kd es de primer orden simple. 2.) Cada componente en el alimento opera como “pool” simple. 3.) Los microorganismos ruminales siempre están en exceso. 4.) No existe un tiempo de retardo (lag) al iniciar la fermentación. 5.) Kp depende del consumo de MS y del contenido de fibra en detergente neutro (FDN) efectivo (peFDN) 1 peFDN: El porcentaje de FDN que es capaz de estimular la masticación, la rumia y la motilidad ruminal y se define como el tamaño de partícula que NO pasa por una malla de 1.18 mm. Crecimiento microbial en el nivel 2 de CNCPS El modelo asume que solo hay dos conjuntos de bacterias: Bacterias fibrolíticas (fermentadoras de carbohidratos estructurales). 54 Bacterias amilolíticas (fermentadoras de carbohidratos solubles). En el CNCPS la eficiencia de síntesis de cada grupo de bacterias es estimada en función de los requerimientos de mantenimiento y crecimiento, de la tasa de degradación del sustrato, utilizando al modelo de Pirt citado por Guada (1996), en el cual la tasa de fraccional de crecimiento, se sustituye por la tasa fraccional de degradación del sustrato. 1/Y = Km /Kd+1 /Kg Siendo: Y: Eficiencia neta de crecimiento: (g bacterias /g sustrato). Km: Requerimientos de mantenimiento: (g sustrato /g Bacterias /hora). Kd: Tasa de degradación sustrato: (g /hora). Kg: Eficiencia máxima de crecimiento: (g bacterias /g sustrato). DIGESTIÓN INTESTINAL El sistema utiliza coeficientes de digestibilidad medidos experimentalmente, para la predicción de la digestibilidad intestinal y perdidas fecales. La precisión de los estimados de digestión depende de que también sean predichas las cantidades de carbohidratos y proteínas no degradadas en el rumen. Según (Fox, et al 2004), en la mayoría de los alimentos casi el 75% es degradado o digerido en el rumen. Para la principal fracción de los forrajes que es el carbohidrato B2, se le asignó una digestibilidad intestinal de 20%. Para otras fracciones como carbohidratos B1 los valores fluctúan de acuerdo al consumo, tipo de grano y el grado de procesamiento entre 30 y 90%. 55 Las fracciones proteicas B1, B2 y B3 asumen una digestibilidad intestinal de 100, 100 y 80% respectivamente. En este aspecto las tasas de degradación de las fracciones proteicas se han tomado siempre de la literatura y mediante cálculos. No se ha establecido una técnica de laboratorio, similar a la de carbohidratos (Pell et al., 1993), para determinar la velocidad de degradación de cada fracción proteica. EXCRECIÓN DE NUTRIENTES El CNCPS originalmente no consideraba la excreción de nitrógeno (N), fósforo (P) y otros minerales (Fox et al., 2000), sin embargo, debido a la creciente presión por la conservación del ambiente, especialmente suelos y aguas, se adicionó un módulo para estimar la excreción de estos elementos y asociarlo a los modelos de 2 manejo integral de la finca (CuNMPS ) para el manejo completo de los nutrientes tanto en el hato como en los cultivos de forrajes y otros. La excreción total de N es dividida en N fecal y N urinario y la excreción de fósforo es calculada después de la estimación del contenido de P en productos (leche, tejidos y gestación) (Fox et al., 2004). 2.6. DEGRADABILIDAD RUMINAL Los métodos de laboratorio para estimar el valor nutritivo de los alimentos se han mejorado desde las primeras ideas en 1725, cuando los alimentos para rumiantes eran evaluados como Unidades de Paja (Blaxter, 1986). Inicialmente, las técnicas fueron diseñadas para caracterizar el valor nutritivo más que para predecir la producción de los animales. La mejoría de los métodos de evaluación de alimentos tiene que seguir los nuevos conceptos de la química y la fisiología animal, así como los nuevos conocimientos de la microbiología del rumen y otros campos afines del saber (Flatt, 1988). 56 La evaluación de los alimentos debe definir las características de los forrajes que determinan la producción animal, por ejemplo, la ganancia de peso, la producción de leche, el crecimiento de la lana, etc. (Blümmel, et al 1997). De particular relevancia es la predicción del consumo, el cual es un importante aspecto relacionado con el uso de los forrajes. En la práctica, la predicción del consumo de forrajes aún presenta dificultades (Blümmel y Becker, 1997). El desarrollo futuro de los sistemas de evaluación debe incorporar nueva información de la relación entre los productos finales de la digestión y la producción de los animales, así como información del metabolismo animal y microbiano, la composición de los alimentos y el efecto de los factores de la utilización de alimentos (Flatt, 1988). Un adecuado análisis dietético de cualquier tipo necesita que los métodos empleados identifiquen los componentes químicos con la clasificación nutritiva (Van Soest y Robertson, 1985). Otros procedimientos son utilizados también; el análisis proximal y su procedimiento alternativo para la fibra bruta (Van Soest,1967; Goering y Van Soest, 1970; Van Soest, 1983, 1994), así como modernos métodos instrumentales (absorción atómica con inducción de plasma, espectroscopia cercana al infrarrojo, electroforesis, microscopia electrónica); la prueba de solubilidad de la proteína, la técnica de digestibilidad in vitro (Tilley y Terry, 1963), el método enzimático (Jones y Hayward, 1975), la técnica de simulación del rumen, RUSITEC (Czerkawski y Brekenridge, 1977), así como la técnica de producción de gas in vitro (Menke et al, 1979; Menke y Steingass,1988). 2.6.1. Degradabilidad in sacco 57 La técnica basada en el uso de bolsas de nylon que contiene el sustrato en estudio e incubadas en el rumen con el propósito de estudiar la degradación de la fibra, no es nueva. Inicialmente, se emplearon bolsas de seda (Quin et al., 1938), pero mas tarde fueron sustituidas por fibras sintéticas, que son totalmente resistentes a la degradación microbiana. Meherz y Ørskov, 1977, sugirieron el empleo de bolsas de nylon como método rutinario para determinar la velocidad de degradación de las proteínas de los forrajes y los suplementos proteicos. En este método, un número variable de bolsas se incuban en el rumen durante diferentes periodos de tiempo, de tal forma que puede conocerse el ritmo de degradación. (Van Soest, Mertens y Deimum 1978 y Ørskov, Reid y Kay 1988) han sugerido el uso de los datos de la cinética de degradación para mejorar la estimación del valor nutritivo de los alimentos, cuando se utilizan tanto métodos in vitro como in sacco. Este enfoque dinámico mejoró marcadamente el potencial de esta técnica, como fue demostrado por Ørskov, Hovell y Mould 1980, en la evaluación de forrajes. 2.6.2. Descripción de la técnica de la degradabilidad in sacco El método in sacco, también denominado de la bolsa de nylon o in situ, tiene como objetivo fundamental medir la desaparición de materia seca y orgánica, el nitrógeno u otro nutriente de los alimentos sometidos al efecto del ambiente ruminal; para ello los alimentos son colocados en bolsas que se incuban en el rumen, a través de una cánula permanente en el saco dorsal de este órgano (Pedraza, 2001). El tamaño recomendable de las bolsas de nylon deberá ser de 20 a 40 µm, lo que proporciona orificios de aproximadamente 400 a 1600 µm2. El tamaño de las bolsas y la cantidad de muestra serán, aproximadamente de 140 × 90 mm y 3 a 5 gramos de materia seca, respectivamente. La relación entre el tamaño de la bolsa y la muestra es muy importante. La cantidad de muestra y el tamaño de la bolsa dependen, en buena medida, de la cantidad de los restos necesarios para los 58 análisis posteriores. Deberá procurarse el libre movimiento del material incubado dentro de la bolsa, de tal forma que evite la formación de pequeños microambientes dentro de la bolsa, lo que determina una baja repetitibilidad de los resultados. La relación entre el tamaño de la bolsa y la cantidad de muestra a utilizar, podrá también ser ajustada de acuerdo con el tamaño de la cánula ruminal. Para las medidas mencionadas anteriormente, el diámetro de la cánula ruminal deberá ser de alrededor de 40 a 50 mm (Ørskov, 1988). Preparación de las muestras para la incubación Las muestras para la incubación deben ser representativas del material en la forma como este hubiese llegado al rumen si hubiese sido consumido por el animal. Por lo tanto, el material ideal para la incubación podría ser una muestra del material degluido por un animal provisto de una cánula esofágica. Localización de las bolsas en el rumen Las bolsas deben quedar ancladas con cuerdas de nylon de 50 cm o más a la cánula. Esa longitud permite a las bolsas moverse libremente en el rumen, tanto entre la fase liquida como la fase solida. (Ørskov, 1988). Tiempo de incubación de las bolsas en el rumen El tiempo necesario para la degradación completa varia según el tipo de alimento por incubar, y por tanto, los tiempos intermediarios también deben variarse. Para medir la tasa de degradación en un amplio intervalo de tiempo (Ørskov et al., 1980). Como guía general los periodos de incubación que se requieren son: Concentrados: 12 a 36 horas. Forrajes alta calidad: 24 a 60 horas. Forrajes de baja calidad: 48 a 72 horas. 59 Las bolsas, una vez extraídas del rumen, deben lavarse, a mano para eliminar las partículas y microorganismos (Michalet-Doreau y Ould-Bah, 1992). Al menos dos bolsas con la muestra a analizar deben ser lavadas para determinar las pérdidas en material altamente soluble y finas partículas que escapan de las mismas. El lavado en máquinas disminuye las variaciones dentro de cada laboratorio, si se compara con el lavado manual. Empleo de la técnica in sacco La degradabilidad efectiva, el grado de digestión, el tiempo de retardo (fase lag), la tasa de digestión y la digestibilidad potencial son importantes características de digestión del forraje, que se pueden estimar cuando se calcula la cinética ruminal, usando la técnica in sacco, al medir la desaparición del alimento en las bolsas de nylon incubadas en el rumen en diferentes periodos. Tales características pueden utilizarse para predecir el valor nutritivo más acertadamente y comparar la utilidad de los forrajes en las dietas para rumiantes. La desaparición del material en la hora cero se estimo en las bolsas sin incubar en el rumen, lavándolas de la misma manera que las de los demás periodos. El porcentaje de la desaparición se estimo usando la siguiente ecuación (Ramirez, 2003): Degradabilidad Aparente (Peso inicial – Peso final) --------------------------------- × 100 (Peso inicial) 60 Para determinar las características de la digestión los porcentajes de desaparición de cada fracción evaluada se usan en la siguiente ecuación para determinar la degradabilidad efectiva o verdadera: Y = a + b (1 – e-ct) Donde (Y), es la cantidad de sustrato degradado en el tiempo (t), y a, b y c son constantes de la ecuación exponencial. Donde a es un intercepto que representa la porción de material solubilizado al inicio de la incubación (tiempo 0), b es la porción de la muestra lentamente degradada en el rumen, c es la tasa constante de desaparición de la fracción b, y t es el tiempo de incubación. La magnitud de degradación de la proteína dependerá del tiempo que permanezca en el rumen, por lo que (Ørskov y McDonald, 1979) definen la degradabilidad efectiva de la proteína, P, como: P = a + [bc / (c+r)] [1 - e - (lc+r) t]. En el cual r es la velocidad de pasaje del rumen al omaso. Como el tiempo de incubación se incrementa, la fracción de proteína que permanece en el rumen cae a cero, conjuntamente con la velocidad de degradación, P puede entonces definirse como: P = a + bc / (c + r) En esta ecuación a es la proteína inmediatamente degradada y bc / (c + r) la fracción lentamente degradable. El valor de r puede ser determinado por tratamiento con dicromato a la proteína. También se puede calcular la degradabilidad efectiva (DE) del nitrógeno utilizando los parámetros de degradabilidad en combinación con la tasa de flujo ruminal de pequeñas partículas (k); la ecuación es la siguiente: DE= a + ((bc) / (c+k)). 61 Figura 5. Representación grafica de los diferentes tiempos en que tiene lugar la degradación de la proteína. (Ørskov, 1988) Los valores de a, b y c son la base para determinar el potencial alimenticio de los forrajes, así como para recomendar las estrategias de alimentación. El potencial alimenticio indica el consumo de energía digestible relativo al mantenimiento de un bovino de carne de razas europeas (Ørskov, 1993; IFRU, 1997). Este potencial puede equipararse a un índice, valor que indica el consumo relativo o productividad posible de los alimentos. Mayor información se necesita para sostener este enfoque; no obstante, parece ser prometedor al analizar información de diferentes lugares con grandes diferencias de recursos alimenticios y tipos de animales (Ørskov, 1998). 62 2.7. IMPORTANCIA DEL NITROGENO UREICO EN LECHE El nitrógeno ureico en leche, conocido comúnmente como MUN (sigla del nombre en ingles, Milk Urea Nitrogen), por su fácil análisis en muestras de leche ha cobrado importancia como herramienta diagnostica de la eficiencia de utilización del nitrógeno y de ciertos trastornos del comportamiento reproductivo de la vaca lechera. En zonas lecheras de Colombia los forrajes de alto contenido proteico, especialmente raigrases y kikuyo, constituyen el mayor aporte en la ración diaria de las vacas lecheras. En algunos casos llegando a ser la única fuente de alimento. La disponibilidad de forrajes para pastoreo en todas las épocas del año constituye una ventaja competitiva grande en comparación con la situación de otros países. Los consumos diarios de nitrógeno parecen superar las necesidades de las vacas lecheras generando excesos que constituyen desperdicios innecesarios de alimento y potenciales problemas de contaminación de aguas (Peña, 2001) 2.7.1. Origen y significado del MUN El MUN es el resultado de la difusión el contenido de urea del suero sanguíneo a traves de las células secretoras de la glándula mamaria constituyendo una fracción variable del nitrógeno total en la leche. Su contenido representa alrededor del 50% del nitrógeno no proteico y alrededor del 2.5% del nitrógeno total (DePeters y Ferguson, 1992). El nitrógeno de la leche esta presente en tres fracciones principales: Caseína, que constituye el 77.9%, Nitrógeno de la proteína del suero, que representa el 17.2% y el NNP que es el 4.9% (Cerbulis y Farrel, 1975). Estas fracciones pueden cambiar de acuerdo a la temperatura, enfermedades, número de partos, días en lactancia y nutrición (DePeters y Cant, 1992). 63 Las dietas de alto contenido proteico tienden a presentar niveles altos de MUN debido, de una parte, a la mayor degradación de la proteína en el rumen, mayor producción de amoniaco y mayor conversión de amoniaco a urea en el hígado de la vaca. De otra parte, la dieta de un nivel alto en proteína tiene normalmente una alta contribución de aminoácidos para absorción en el intestino, los cuales contribuyen una alta proporción de la urea luego de la animación en el hígado (Peña, 2001). 2.7.2. Relación entre MUN y producción El nitrógeno no solamente es uno de los componentes principales de la ración para vacas lecheras sino también es uno de los componentes más costosos en términos económicos. Tanto su exceso como su deficiencia en la dieta diaria tienen repercusiones negativas sobre el comportamiento productivo de las vacas lecheras haciendo ineficientes los procesos digestivos, metabólicos y de síntesis de la leche. El primer aporte de amoniaco se produce en el rumen cuando los microorganismos no tienen la suficiente energía para utilizar el exceso de N del alimento. El segundo aporte se presenta con la desanimación del exceso de aminoácidos absorbidos en el intestino delgado, luego de un flujo del rumen superior a las necesidades del animal (Peña, 2001). 2.7.3. Relación entre MUN y reproducción Algunos problemas reproductivos de los hatos lecheros como bajas tasas de concepción, repetición de calores, aumentos en los días abiertos y en los servicios por concepción se han asociado con los niveles de nitrógeno de la dieta (Carroll et al., 1988; Ferguson y Chalupa, 1989; Canfield et al., 1990). 64 Los niveles altos de urea en el suero se han correlacionado con infertilidad en algunos casos (Ferguson et al., 1986). La alteración reproductiva puede ser causada por la urea, el amoniaco u otros compuestos nitrogenados no identificados que pueden afectar el óvulo, el espermatozoide o los embriones jóvenes. Se ha demostrado que la urea es tóxica para el espermatozoide y el óvulo (Dasgupta et al., 1970 ; Umezaki y Fordvey-Lettlage, 1975) y puede causar aborto cuando se inyecta intraamniótica. 2.7.4. Toma de muestras, análisis e interpretación La determinación del MUN como herramienta para analizar el comportamiento productivo y reproductivo de las vacas, así como la eficiencia de utilización del N en la ración, es muy útil para optimizar el uso de los recursos en las explotaciones lecheras. Las concentraciones de MUN se pueden utilizar para monitorear la proteína de la dieta porque: El exceso de nitrógeno afecta la función reproductiva probablemente por la acción de la urea en el tracto urogenital (Carroll et al., 1988). El consumo excesivo de proteína incrementa los requerimientos de energía en 13.3 Kcal/g de exceso de N (NRC, 1989). El suplemento proteico es costoso. El exceso de N tiene un impacto ambiental negativo. Como métodos disponibles para determinar el MUN se pueden utilizar tiras reactivas, para uso en el campo, las cuales presentan datos semicuantitativos en forma inmediata. También se utiliza la determinación por NIR, por química húmeda, por colorimetría y por digestión enzimática y análisis químico. Estos últimos como métodos cuantitativos de laboratorio. 65 Para un análisis de laboratorio se deben tomar dos muestras de 50 ml del tanque colector de leche y enviarlas en un frasco de vidrio o plástico adecuadamente rotulado al laboratorio correspondiente. Estas muestras se deben tomar de la leche del ordeño de la tarde. El resultado obtenido servirá para complementar un diagnóstico general del hato (Peña, 2001). Las muestras refrigeradas se pueden mantener de un día para otro sin ningún problema. En caso de tenerlas por más tiempo se recomienda agregar 1 ml de agua oxigenada por muestra de 50 ml (Peña, 2001). Para la interpretación de resultados, teniendo en cuenta los datos publicados hasta ahora sobre MUN, se recomiendan los siguientes criterios: Tabla 4. Interpretación de resultados de análisis de MUN en vacas lecheras. CONTENIDO DE MUN (mg/dl) CALIFICACIÓN INTERPRETACIÓN <9 Deficiente Insuficiente N en la dieta. Afecta producción 9 – 12 Bueno Buen uso del N. Puede afectar producción 12 – 15 Excelente Optimo nivel para producción y reproducción 15 – 18 Bueno Uso sub-óptimo del N. Sin efecto adverso en reproducción. 18 – 21 Regular Desperdicio de N. Puede afectar reproducción > 21 Deficiente Exceso de N. Afecta reproducción. El MUN es un índice muy importante como herramienta diagnóstica, pero requiere de otros como la condición corporal de las vacas, nivel de producción y composición de la dieta para hacer más efectivo su uso (Peña, 2001). 66 3. MATERIALES Y METODOS 3.1 UBICACIÓN DEL PROYECTO El estudio se realizó en el CIC Santa María de la Universidad de La Salle dedicado a la producción de leche especializada, ubicado en el municipio de Sopo (Cundinamarca) ubicado a 2580 m.s.n.m. Según (Vaca M., (2003) las condiciones meteorológicas sitúan al municipio de Sopo y la cuenca del rio Teusacá en el área de los andes colombianos- cordillera oriental, donde las precipitaciones están gobernadas principalmente por la Zona de Confluencia Intertropical (ZCIT), fenómenos de tipo convectivo y otros fenómenos locales. El clima es frio al ubicarse entre los 2000 y 3000 m.s.n.m (Bernal, 2004). La temperatura varia entre 14 y 10 °C y las precipitaciones varían entre 700mm y 900mm anuales con un régimen pluviométrico bimodal caracterizado por 2 periodos lluviosos al año uno cada semestre separados por periodos de relativa sequia (Vaca M. 2003). Según registro de la estación San Pedro se tienen 109 días con lluvia al año. Las características físicas de la región presentan una biotemperatura de bosque húmedo montañoso. La intensidad lumínica varia entre 200 y 500 lux según las mediciones hechas durante el estudio, para la velocidad de los vientos, se toma como representativo el valor dado por la estación Guaymaral que reporta una velocidad media de 1.8 m/s puesto que el municipio no cuenta con una medición valida. (Vaca M., 2003) Por todas estas características, la finca Santa María esta calificada según Holdridge como bosque seco montano bajo. 67 3.2 DISEÑO EXPERIMENTAL Se seleccionaron 6 potreros al azar de una población de 24 potreros los cuales cumplen un ciclo de rotación de acuerdo con el sistema de manejo de la finca. En este análisis se buscaba evaluar si había alguna diferencia significativa en la interacción de las edades y el tipo de manejo dado a cada pastura, para lo cual se selecciono un diseño estadístico factorial con dos factores: 1) Tipo de manejo Renovados No Renovados 2) Edad de desarrollo de la pastura 45 días 52 días 59 días Con tres replicas consistentes en tres potreros mejorados y tres potreros no mejorados El modelo aplicado: Yijk = µ + αi + βj + β(ij)+Eijk Donde: Yijk: Variables: Pc, P A (NNP), P B1, P B2, P B3, P C, FDN, FDA, Lignina, Celulosa, Hemicelulosa y Sílice. µ: Promedio general. αi: Efecto del manejo implementado en la pradera. 68 βj: Efecto de la edad de desarrollo. β(ij): Efecto de la interacción entre αi y βj. Eijk: Error experimental. 3.3. MONITOREO MEDIO AMBIENTAL Se realizó un monitoreo de variables medio ambientales durante los periodos de muestreo, dentro del cual se evaluaron las siguientes variables: Intensidad Lumínica (Lux). Temperatura (Máxima y Mínima) (ºC). Velocidad del Viento (Km/h). Humedad Relativa (%). Precipitación (ml). Las instalaciones del CIC contaban con pluviómetro y termómetro de máximas y mínimas, el luxómetro (Intensidad Lumínica), el termohigrómetro (Humedad Relativa) y el anemómetro (Velocidad del Viento) que fueron facilitados por la Universidad de La Salle (Laboratorio de Nutrición Animal). La recolección de los datos se hizo de manera programada con los días de la toma de muestras (cada 8 días), para las variables de temperatura, humedad relativa, velocidad del viento e intensidad lumínica. 3.4. PERIODOS DE MUESTREO Se evaluaron las praderas del CIC Santa María en dos periodos, los cuales comprendían lluvias y sequias. El periodo de sequia fue evaluado entre el 7 de marzo y el 25 de mayo del año 2006 y el periodo de lluvias entre el 25 de mayo y el 11 de agosto del mismo año. De esta manera se obtuvo un total de 79 días de evaluación para los dos periodos. Este análisis se contempla para la definición de 69 un modelo de crecimiento que se adecue a las praderas de la finca teniendo en cuenta las principales variables ambientales que pueden influir en la finca además del manejo dado a la pradera. Para el fraccionamiento de carbohidratos y proteínas se recolectó solamente muestras durante el periodo de sequia, pues las condiciones climáticas presentadas durante el primer periodo de muestreo deterioraron las características del material obtenido pudiendo de esta forma afectar los resultados de este análisis 3.5. DEFINICION DE PERIODO DE LLUVIAS Y SEQUIAS Se definieron las épocas de lluvias y sequia, según los datos de precipitación obtenidos durante el desarrollo del proyecto. Para el periodo de sequia las precipitaciones fueron menores a 100 cm3: Tabla 5. Definición del periodo de lluvias. MES Junio Julio Agosto ml/mes 46 100 97 Para el periodo de lluvias las precipitaciones fueron mayores a 100 cm3: Tabla 6. Definición del periodo de sequia. MES Marzo Abril Mayo Ml/mes 120 137 156 70 3.6. DEFINICION DE PRADERAS RENOVADAS Y NO RENOVADAS Con base a la información aportada por el CIC Santa María, previo al inicio del periodo de muestreo, se realizó la renovación de praderas a los potreros 5, 6 y 7 dentro de la rotación establecida por el CIC. A los potreros 8, 9 y 10 no se les realizó ninguna práctica de renovación. La renovación de las praderas consistió en un solo paso de tractor con un implemento de arado de cincel con el objetivo de romper capas compactadas, permitir el desarrollo de las raíces, oxigenar y aumentar la capacidad de almacenamiento de agua por parte del suelo. Se incorporó semilla de leguminosa trébol rojo (Trifolium repens) y de una especie de raigrás (Lolium spp) para aumentar el contenido proteico de las praderas. Adicionalmente y paralelo a este trabajo se realizó la siembra de algunas especies arbóreas en los cercados. 3.7. MUESTREO PARA EL CRECIMIENTO DE LAS PRADERAS Periódicamente se muestrearon 6 potreros establecidos en su mayoría con pasto kikuyo, y una mezcla de raigrases y leguminosas como trébol rojo. Para determinar la cantidad de biomasa disponible en el potrero se aplicó la metodología de aforo conocida como doble rango visual. (Estrada, 2004) Inicialmente se registró la cantidad de biomasa en forraje verde. Los muestreos se realizaron cada 8 días, hasta alcanzar un total de 59 días de recuperación de la pradera en cada potrero. Para el desarrollo del muestreo se tuvo que dotar la finca con equipos y herramientas de trabajo de la siguiente manera: 71 Demarcación y clasificación de los 6 potreros. Adquisición de equipos: Medición climática (Anemómetro, termohigrómetro y luxómetro). Peso (Balanza). Elaboración de marcos de 50 × 50 cm en tubo de pvc. Compra de materiales varios (bolsas, marcadores, fotocopias). Se determinaron a simple vista las áreas más bajas y más altas dentro de la pradera teniendo en cuenta la altura del pasto. De esta manera se pudo establecer la calificación de 1 a 5, siendo 1 el más bajo y 5 el más alto dentro del área del marco. Se realizó un formato en el cual se registraban los datos de cada potrero en una edad específica. Una vez establecida la calificación, se realizaron las observaciones visuales, haciendo 50 lanzamientos en forma aleatoria en toda el área del potrero. Luego se realizaron los respectivos muestreos por duplicado para cada calificación teniendo en cuenta la calificación desde 1 hasta 5, colocando estas muestras en una bolsa de plástico previamente marcadas y pesadas. Después las bolsas se pesaban en la balanza, esto para obtener resultados de producción de biomasa en relación al tiempo; en forraje verde y materia seca. Las muestras se llevaron al laboratorio de nutrición animal de la Universidad de La Salle para seguir el procedimiento de obtención de materia seca. Obtención de materia seca El material que ingresaba al laboratorio, se trasladó a bolsas de papel debidamente marcadas con el número del potrero y la edad de rebrote del mismo. 72 Se pesaron las bolsas vacías y la cantidad de forraje. Se marcaron las bolsas. Se colocaron las bolsas de papel con el material incluido en la estufa a 62ºC durante 24 horas. Luego de 24 horas, se sacaron y se dejaron enfriar en un desecador por 10 minutos. Cada bolsa se pesó en una balanza. Se obtuvieron los datos finales para MS. 3.8. ANALISIS PARA EL CRECIMIENTO (Incluidas todas las praderas) La información fue organizada por periodos de muestreo con la correspondiente edad de rebrote en valores de g/MS/m2 así: 1. Evaluación durante periodos de lluvias y sequia. 2. Evaluación en praderas renovadas y no renovadas. Se aplicó una prueba de homogeneidad, a los datos de las evaluaciones obtenidas durante el muestreo del periodo de lluvias y sequia, tomando 6 potreros, utilizando una prueba Chi cuadrado con 5 grados de libertad (Barrera y Pinilla, 2007). Se determinaron las siguientes hipótesis: Ho: Las 6 praderas son homogéneas. Ha: Por lo menos una pradera no es homogénea. Para determinar si las variables edad de rebrote expresada en días y biomasa expresada en g/MS/m2 eran independientes se aplicó a la totalidad de los datos de la evaluación del periodo de lluvias y sequia una prueba de independencia, para lo cual se estructuró una tabla de contingencia con 3 clases para la edad y 5 para la biomasa, se utilizó la prueba de Kruskal Wallis para determinar el valor de Chi 73 calculado. Este último valor se comparó con el Chi de tabla correspondiente a 5 grados de libertad. Se determinaron las siguientes hipótesis: Ho: Las variables biomasa medida en g/MS/m2 y tiempo de rebrote o recuperación expresado en días son independientes. Ha: Las variables de biomasa medida en g/MS/m2 y tiempo de rebrote o recuperación expresado en días no son independientes. 3.9. ANALISIS PARA EL CRECIMIENTO (praderas renovadas y no renovadas) La información fue organizada de acuerdo a la actividad realizada de mejoramiento del suelo, composición botánica de las praderas y oferta forrajera así: Tabla 7. Clasificación de praderas renovadas y no renovadas. PRADERAS RENOVADAS NO RENOVADAS 5 8 6 9 7 10 Para evaluar el comportamiento de los datos de cada grupo, se aplicaron las pruebas de homogeneidad e independencia anteriormente descritas. Las pruebas se aplicaron utilizando la prueba de Chi cuadrado con 2 grados de libertad para los dos grupos. 74 3.10. DEFINICION DEL MODELO DE CRECIMIENTO La evaluación se realizó en dos épocas del año con diferente precipitación y en praderas con manejos diferenciales de labranza. Los datos, organizados como se explica anteriormente, fueron graficados en Excel buscando definir su tendencia y a su vez indagar en un modelo sigmoideo que podría definir el comportamiento biológico de la pradera con relación a los datos obtenidos en campo. Estos valores fueron comparados con las predicciones elaboradas por la ecuación generada en el programa curve expert 1.3 producido por Daniel Hymas (1995, 1997) el cual contempla algunas variaciones de los modelos originales y sus ecuaciones se presentan a continuación Se evaluaron tres modelos sigmoideos: 1. Modelo Gompertz. Matemático P(t) = exp (a/b – (a/b – LnP0) exp b × t Curve expert 2. Modelo Logístico. Matemático P(t) = aP0 / (bP0 + (a – bP0) e – at) Curve expert 3. Modelo Cacho. P(t) = Pmax / (1 + b × tk) Los datos fueron linearizados para definir los parámetros de a y b, para posteriormente obtener los datos esperados y ser comparados con los datos 75 observados dentro de las mismas edades de la evaluación, de esta forma se calculó el error cuadrático medio. El modelo con menor error cuadrático medio fue seleccionado como el mayor ajuste con respecto a los datos observados. El modelo seleccionado fue definido a través de sus diferentes parámetros que se explicaron desde el punto de vista biológico buscando generar mayor entendimiento y su aplicación practica en la optimización de sistemas de producción (Barrera y Pinilla, 2007). 3.11. MUESTREO PARA FRACCIONAMIENTO DE CORNELL Se tomaron 3 muestras por potrero cada una de 45, 52 y 59 días de rebrote para posteriormente analizar las fracciones de carbohidratos y proteínas contenidas en los pastos, según la técnica para el fraccionamiento de carbohidratos y proteínas de (Licitra, 1996). Figura 6. Edades determinadas para el fraccionamiento de carbohidratos y proteínas. 45 52 59 El muestreo se realizó de la misma manera mencionada anteriormente para crecimiento (Estrada, 2002), con la diferencia en las edades de rebrote de cada pradera, que fueron las que se determinaron para realizar el fraccionamiento de carbohidratos y proteínas como datos necesarios para la simulación del software CNCPS. Procedimiento de muestreo 76 Se le hizo un seguimiento a cada pradera en los días de rebrote. Se tomaron submuestras dentro de cada pradera abarcando la totalidad de esta en forma de zig zag. Luego se mezclaron las submuestras para hacer una muestra homogénea o pull. Después de establecer la muestra homogénea, se realizó un cuarteo, para obtener la muestra definitiva a utilizar en el laboratorio. Se obtuvieron 1000 g de la muestra final de forraje verde, que debía ser llevada al laboratorio de nutrición animal de la Universidad de La Salle para seguir con el procedimiento de análisis de Cornell, de acuerdo con la metodología propuesta por (Licitra,1996). 3.12. FRACCIONAMIENTO DE CARBOHIDRATOS Y PROTEINAS Preparación de las muestras Como las muestras obtenidas en campo, debían ser sometidas al proceso de obtención de materia seca (MS); estas llegaban como forraje verde al laboratorio, luego del proceso de MS, se molieron en una criba de 2mm y se empacaron en bolsas de papel debidamente marcadas con la edad de corte y el número del potrero. De esta manera se obtuvieron 18 muestras para analizar por duplicado bajo los protocolos de (Licitra, 1996). Tabla 8. Distribución de cortes en las praderas. Pradera # Edad Corte Praderas Renovadas 77 5 45, 52, 59 6 45, 52, 59 7 45, 52, 59 Praderas No Renovadas 8 45, 52, 59 9 45, 52, 59 10 45, 52, 59 3.13. ANALISIS REALIZADOS Se hicieron análisis para Pc (Kjeldahl), Fracción soluble, Fracción insoluble, FDN, FDA, Lignina, Celulosa, Hemicelulosa y Sílice (Van Soest, 1991), fracciones proteicas A, B1, B2, B3 y C (Licitra, 1996) y fracciones de carbohidratos A, B1, B2 y C (Doane et al, 1997). 3.14. DEGRADABILIDAD RUMINAL (in sacco) La determinación de la degradabilidad ruminal se realizó en las instalaciones de la Universidad de Ciencias Aplicadas y Ambientales (UDCA) bajo la dirección y apoyo del laboratorio de nutrición animal. 3.14.1. Degradabilidad de la Materia Seca (MS) Para un mejor manejo de las muestras dentro del laboratorio, se realizó un pull por cada edad de corte de la siguiente manera: De la muestra seca y molida. Se pesaron en cantidades iguales 100 g de muestra de cada grupo, es decir de praderas renovadas y no renovadas. Para una muestra general de 300 g por grupo. Se mezclaron para hacer una muestra homogénea en una bandeja debidamente marcada con la respectiva edad de corte. 78 De esta manera se obtuvieron 6 muestras generales para la determinación de degradabilidad ruminal (in sacco) evaluando cinco tiempos de incubación diferentes (0, 6, 24, 48 y 72 horas) de las praderas renovadas y no renovadas. Muestras de 5 gramos para cada edad de corte se incubaron por duplicado en bolsas Ankom de 20 × 10 cm y poro de 53 micras, debidamente pesadas y marcadas, utilizando un toro holstein no mayor de 60 meses con cánula ruminal y alimentado con pasto kikuyo en pastoreo. Las incubaciones se repitieron durante 4 días para todos los tiempos. Un total de 12 bolsas por tiempo. Después de 72 horas las bolsas fueron extraídas del rumen del animal canulado para posterior lavado homogéneo con agua fría hasta la no aparición de turbidez en esta. Luego se secaron en horno a 65 ºC por 48 horas. Fuera del horno se dejaron enfriar a temperatura ambiente dentro de un desecador, para posterior pesado en balanza analítica. Por diferencia de pesos inicial y final se determinó la degradabilidad aparente del material analizado. La degradabilidad efectiva se determinó con el software Fit Curve (NEWAY). 3.14.2. Degradabilidad FDN y RIE Para la determinación de las facciones de los carbohidratos, existen dos métodos de análisis. El primero, es mediante la producción de gas in vitro y el segundo análisis, es la determinación de la degradabilidad in situ o in sacco, el cual fue aplicado para esta investigación. Para la determinación de las fracciones de carbohidratos, fue necesario realizar un proceso de preparación de las muestras ex ante así: Preparación de FDN 79 De la muestra seca y molida. Se pesaron 16,66 g en cantidades iguales de cada grupo, es decir praderas renovadas y no renovadas. Se mezclaron en una bandeja para obtener una muestra homogénea. Se obtuvieron 6 bolsas con muestra de 50 g. La muestra se introdujo en bolsa Ankom de 20 × 10 cm pesadas y marcadas respectivamente con la edad de corte. A cada bolsa se le realizó el proceso de Fibra Detergente Neutro (FDN). Luego de una hora en ebullición, se secaron en un horno a 65 ºC durante 48 horas. Posteriormente se pesaron para la determinación de FDN. Una vez el material se encontraba completamente seco se determinó el porcentaje de FDN (Van Soest, 1991), se llevaron las muestras a su respectiva determinación de la degradabilidad ruminal (in sacco) del FDN. El proceso de incubación y retiro de las muestras se realizó igualmente como se describió en la degradabilidad de la materia seca, teniendo en cuenta los mismos tiempos de incubación. La diferencia la hizo la cantidad de material utilizado y el número de repeticiones para este análisis que fueron 2 g de muestra y dos repeticiones por cada tiempo de incubación evaluado, de esta manera el número de bolsas incubadas por tiempo fue de 12. Preparación de RIE De la muestra seca y molida. Se pesaron 16,66 g en cantidades iguales de cada grupo, es decir praderas renovadas y no renovadas. Se mezclaron en una bandeja para obtener una muestra homogénea. Se obtuvieron 6 bolsas de 50 g. 80 La muestra se introdujo en bolsa Ankom de 20 × 10 cm pesadas y marcadas respectivamente con la edad de corte. A cada bolsa se le realizó el proceso de RIE. Se solubilizaron en etanol al 80% durante 4 horas. Al terminar la solubilización, se secaron en un horno a 65 ºC durante 48 horas. Posteriormente se pesaron para la determinación de RIE. Una vez el material se encontraba completamente seco se determinó el porcentaje de RIE. Se llevaron las muestras a su respectiva determinación de la degradabilidad de RIE. El proceso de incubación y retiro de las muestras se realizó igualmente como se describió en la degradabilidad de la materia seca, teniendo en cuenta los mismos tiempos de incubación. La diferencia la hizo la cantidad de material utilizado y el número de repeticiones para este análisis que fueron 2 g de muestra y dos repeticiones por cada tiempo de incubación estudiado; de esta manera el número de bolsas incubadas por tiempo fue de 12. Según Doane et al (1997), las tasas de degradación de las fracciones A y B1 de los carbohidratos no pueden ser asiladas ni fermentadas por si solas, por consiguiente las diferencias entre MS y RIE y entre RIE y FDN, generaron curvas definidas para las fracciones A (azucares y ácidos orgánicos) y B1 (almidones y pectinas) respectivamente. Para la determinación de la fracción B2 de los carbohidratos se tomo el valor en porcentaje (%) de la fibra detergente neutro (FDN) y para la fracción C el valor de lignina multiplicado por una constante de 2,4. 4. RESULTADOS Y DISCUSION 4.1 CRECIMIENTO DE LAS PRADERAS (periodo de lluvias y sequia) 81 Los datos de las tablas 9 y 10 presentan los valores observados durante los periodos de muestreo. Tabla 9. Producción de biomasa durante el periodo de lluvias en valores de g/MS/m2. EDAD (días) PRADERAS 5* 6* 7* 8** 9** 10** 7 32,55 24,78 31,78 18,82 21,78 25,76 15 62,71 58,76 65,78 43,23 45,47 46,54 22 85,62 77,67 78,85 60,54 66,15 68,78 30 110,28 98,78 115,89 87,78 77,23 61,78 37 145,87 135,27 156,78 115,89 110,42 108,78 44 187,54 178,89 191,08 155,87 151,89 145,67 52 214,34 205,78 223,76 182,89 182,78 161,67 59 255,76 245,87 267,78 218,78 214,78 197,89 *potrero mejorado **potrero no mejorado (los números de los potreros corresponden a la nomenclatura de la finca) Tabla 10. Producción de biomasa durante el periodo de sequia en valores de g/MS/m2. EDAD (días) PRADERAS 5* 6* 7* 8** 9** 10** 7 44,29 42,86 59,42 29,82 31,49 32,13 15 78,66 71,36 78,99 43,23 45,47 46,54 82 22 100,64 107,42 102,97 60,54 66,15 62,86 30 132,78 125,65 136,85 69,91 77,23 73,62 37 210,97 201,18 235,54 97,53 110,42 108,94 44 318,53 327,77 327,92 183,98 197,33 197,32 52 356,26 405,95 397,50 222,39 247,11 238,23 59 462,13 472,24 512,65 314,97 358,74 327,59 *potrero mejorado **potrero no mejorado (los números de los potreros corresponden a la nomenclatura de la finca) 4.2. Pruebas de homogeneidad e independencia (periodo de lluvias y sequia) 4.2.1. Pruebas de homogeneidad Se aplicaron pruebas de homogeneidad para todas las praderas evaluadas durante los periodos de lluvias y sequia, las cuales arrojaron valores estadísticos de prueba de H= 2,02 y H= 5,33 para el periodo de lluvias y sequia respectivamente. Las pruebas de homogeneidad e independencia para el periodo de lluvias se presentan en el anexo A y B. Estos valores fueron comparados con la tabla de X2 con 5 grados de libertad, los valores encontrados con significancia de α 0,05, 0,025 y 0,01 fueron 11,07, 12,83 y 15,08 respectivamente para los dos periodos. Como los valores de H fueron inferiores a los tabulados con X2 se acepta la hipótesis nula Ho, es decir; Las 6 praderas evaluadas durante los periodos de lluvias y sequia son homogéneas. 4.2.2. Pruebas de independencia Esta prueba se realizó entre las variables biomasa en g/MS/m2 con cinco intervalos y periodo de recuperación de las praderas con tres intervalos, definidos según los valores de producción de forraje verde y días de recuperación 83 evaluados en campo. Las pruebas de homogeneidad e independencia para el periodo de sequia se presentan en el anexo A y B. Se obtuvieron valores de H= 34 y H= 41,45 para los periodos de lluvias y sequia respectivamente. Estos valores fueron comparados con la tabla de X2 con 5 grados de libertad, los valores encontrados con significancia de α 0,05, 0,025 y 0,01 fueron 11,07, 12,83 y 15,08 respectivamente para los dos periodos. Como los valores de H fueron superiores a los tabulados con X2 se rechaza la hipótesis nula Ho y acepta la Ha, es decir; Las variables de biomasa medida en g/MS/m2 y tiempo de rebrote o recuperación expresado en días no son independientes. 4.3 PRUEBAS DE HOMOGENIDAD E INDEPENDENCIA (praderas renovadas y no renovadas) 4.3.1. Pruebas de homogeneidad Se aplicaron pruebas de homogeneidad para las praderas evaluadas durante el periodo de lluvias y sequia con diferente manejo de mejoramiento del suelo, praderas renovadas y no renovadas, las cuales arrojaron valores estadísticos de prueba de H= 0,26 y H= 0,035 para el periodo de lluvias en praderas renovadas y no renovadas respectivamente. Las pruebas de homogeneidad e independencia para las praderas renovadas y no renovadas anexo C. Para el periodo de sequia los valores estadísticos de prueba fueron H= 0,14 y H= 0,26 en praderas renovadas y no renovadas respectivamente. Estos valores fueron comparados con la tabla de X2 con 2 grados de libertad, los valores encontrados con significancia de α 0,05, 0,025 y 0,01 fueron 15,59, 11,98 y 13,81 respectivamente para los periodos de lluvias y sequia con manejo diferencial de mejoramiento del suelo. 84 Como los valores de H fueron inferiores a los tabulados con X2 se acepta la hipótesis nula Ho, es decir; Las 6 praderas evaluadas durante los periodos de lluvias y sequia con manejo diferencial de mejoramiento del suelo son homogéneas. 4.3.2. Pruebas de independencia Esta prueba se realizó entre las variables biomasa en g/MS/m2 con tres intervalos y periodo de recuperación de las praderas con tres intervalos, definidos según los valores de producción de forraje verde y días de recuperación evaluados en campo. Se obtuvieron valores de H= 32,25 para los periodos de lluvias y sequia con manejo de renovación y no renovación de praderas. Estos valores fueron comparados con la tabla de X2 con 2 grados de libertad, los valores encontrados con significancia de α 0,05, 0,025 y 0,01 fueron 15,59, 11,98 y 13,81 respectivamente para los dos periodos con sus tratamientos respectivos. Como los valores de H fueron superiores a los tabulados con X2 se rechaza la hipótesis nula Ho y acepta la Ha, es decir; Las variables de biomasa medida en g/MS/m2 y tiempo de rebrote o recuperación expresado en días no son independientes. 4.4. DEFINICION DEL MODELO Las figuras 7 y 8 corresponden al desarrollo fisiológico de las praderas evaluadas durante los periodos de lluvias y sequia, obteniendo así, una tendencia clara a modelos sigmoideos. De acuerdo a lo reportado por Guille (2004), la biomasa y los 85 órganos muestran un crecimiento sigmoidal, en el cual se determina un periodo caracterizado por el incremento en la tasa de crecimiento seguido por otro periodo con disminución de la misma. De acuerdo con lo anterior se realizó una revisión de los modelos sigmoidales que mejor podrían ajustar a los datos recolectados durante el estudio. Se evaluaron tres modelos: Gompertz, Logístico y una derivación del modelo Logístico, propuesta por Cacho (1997). Para ellos los modelos fueron linearizados con el fin de calcular los valores de a y b en la función lineal y así utilizarlos en la función original con el fin de calcular los valores estimados del modelo (Barrera y Pinilla, 2007). CRECIMIENTO DE LAS PRADERAS 300,00 250,00 PRADER A5 PRADER A6 PRADER A7 PRADER A8 MS/m2 200,00 150,00 100,00 50,00 0,00 7 17 27 37 47 Edad Rebrote (dias) 57 Figura 7. Curvas de crecimiento durante el periodo de lluvias. 86 CRECIMIENTO DE LAS PRADERAS 600,00 500,00 400,00 MS/m2 PRADERA 5 PRADERA 6 PRADERA 7 PRADERA 8 300,00 200,00 100,00 0,00 7 27 Edad Rebrote (dias) 47 Figura 7. Curvas de crecimiento durante el periodo de sequia. Para una mejor interpretación de los resultados obtenidos en el desarrollo de este estudio de definieron los modelos sigmoidales tomando los dos periodos de evaluación (lluvias y sequia) y los dos tratamientos (praderas renovadas y no renovadas), así: 1. Periodos de lluvias. 2. Periodo de sequia. 3. Praderas renovadas. 4. Praderas no renovadas. 4.5. MODELOS EVALUADOS DURANTE EL PERIODO DE LLUVIAS Durante este periodo de evaluación, se aplicaron los tres modelos previamente descritos (Gompertz, Logístico y Cacho), con sus respectivas ecuaciones y formas lineales. 4.5.1. MODELO GOMPERTZ Se evaluó el modelo Gompertz bajo la siguiente formula general: 87 P (t) = exp (a / b – (a / b – Ln P0) exp bt Donde: P (t): Biomasa en el tiempo (t). a y b: Parámetros del modelo obtenidos por linearización P0: Biomasa en el tiempo cero Todo el proceso matemático de linearizacion del modelo para encontrar los parámetros y definirlo se encuentra en el anexo D. La función lineal quedo definida como: Y = -0,035x + 0,204 (R2 = 0,918) Tomando de la función lineal, los valores a = 0,204 y b = 0,035, se definió la función del modelo Gompertz. Con los valores de los datos observados y esperados se estimo el error cuadrático medio, el cual fue de 82,08. En el caso del modelo por curve expert los valores arrojados fueron los siguientes Tabla 11. Linearizacion para el modelo Gompertz según curve expert periodo de lluvias. curve expert a 493,58006 b 1,2224382 c 0,02544811 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración Mediante estos valores la ecuación se hace mas precisa y al calcular el error cuadrático medio, este se reduce a 16,032. La figura 9 representa los valores de crecimiento de las praderas, ajustando los fenómenos expresados. 88 250,00 200,00 150,00 observad os 100,00 modelo matemat ico 50,00 0,00 1 2 3 4 5 6 7 8 9 Figura 9. Valores observados vs valores estimados con el modelo Gompertz matemático y por curve expert 4.5.2. MODELO LOGISTICO Se evaluó el modelo Logístico bajo la siguiente formula general: P (t) = aP0 / (bP0 + (a – bP0) exp – at) Donde: P (t): Biomasa en el tiempo. a y b: Parámetros del modelo obtenidos por linearización P0: Biomasa en el tiempo cero. La función lineal quedo definida como: Y = 0,000x + 0,081 (R2 = 0,729) Tomando los valores de a y b de la función lineal siendo a = 0,081 y b = 0,000, se definió la función del modelo Logístico. Con los datos observados y estimados se calculo el error cuadrático medio el cual fue de 22229,81. En el caso del modelo fabricado por curve expert, las constantes arrojadas fueron las siguientes: 89 Tabla 12. Linearizacion para el modelo Logistico según curve expert periodo de lluvias. curve expert a 305,68451 b 13,945704 c 0,0634508 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración Con estos valores el cálculo del error cuadrático medio arroja un valor menor y fue de 21,91 La figura 10 representa un comportamiento inadecuado de la función Logística original, lo que permite asegurar que este modelo no se ajusta a las necesidades fisiológicas del desarrollo optimo de la pradera. En el caso de la ecuación del programa curve expert, se puede ver que ajusta perfectamente al crecimiento observado Figura 10. Valores observados vs valores esperados estimados con el modelo Logístico matematico y mediante curve expert 90 4.5.3. MODELO CACHO Este modelo contempla una modificación de la función Logística (Cacho, 1993), quien afirma que tiene tres parámetros y que se puede estimar estadísticamente de resultados experimentales o en forma algebraica de modelos de simulación fisiológica (Barrera y Pinilla, 2007). La función general responde a la siguiente formula: P (t) = Pmax / (1 + b × tk) Donde: Pmax: Máxima producción sustentable de forraje. b y k: Parámetros del modelo bajo las condiciones de b > 0 y k > -1. t: Tiempo Los valores de Pmax, b y k, fueron estimados utilizando el soporte logístico (software) Curve Expert 1.3 producido por Daniel Hymas (1995, 1997), usando la función User Defined Model (Barrera y Pinilla, 2007). Los valores estimados fueron para Pmax = 19692,67; b = 10319,56 y k = -1,1774. Se observa en la figura 13 un buen ajuste del modelo sigmoideo con relación al crecimiento evaluado de las praderas. La función matemática aportada por Cacho (1993) arroja un cuadrático medio bajo. 91 250,00 Biomasa g/MS/m2 200,00 150,00 OBSERVADO S 100,00 50,00 0,00 0 7 15 22 30 37 44 52 Tiempo (dias) Figura 11. Valores observados vs valores estimados con el modelo Cacho. 4.6 MODELOS APLICADOS DURANTE EL PERIODO DE SEQUIA 4.6.1 MODELO GOMPERTZ Todo el proceso matematico de linearizacion del modelo para encontrar los parámetros y definirlo se encuentra en el anexo E. La función lineal quedo definida como: Y = -0,014X + 0,117 (R2 = 0,433) Tomando de la función lineal, los valores a = 0,117 y b = 0,014, se definió la función del modelo Gompertz. Con los valores de los datos observados y esperados se estimo el error cuadrático medio, el cual fue de 213,42. En el caso de la estimación del error cuadrático medio utilizando la ecuación de curve expert el error cuadrático fue 198,41 utilizando los siguientes valores 92 Tabla 13. Linearizacion para el modelo de Gompertz según curve expert periodo de sequia. curve expert a 5309,725 b 1,7231749 c 0,013241799 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración 450,00 400,00 350,00 300,00 250,00 200,00 150,00 100,00 50,00 0,00 OBSERVADOS ESPERADOS curve expert 1 2 3 4 5 6 7 8 9 Figura 12. Valores observados vs valores esperados estimados con el modelo Gompertz matematico y de curve expert 4.6.2. MODELO LOGISTICO La función lineal quedo definida como: Y = -4E-05X + 0,052 (R = 0,102) Tomando los valores de a y b de la función lineal siendo a = 0,052 y b = -4E-05, se definió la función del modelo Logístico. Con los datos observados y estimados se calculo el error cuadrático medio el cual fue de 5627,90 para el caso del modelo según curve expert arrojo un error cuadrático de 179.22 utilizando los siguientes datos: 93 Tabla 14. Linearizacion para el modelo Logistico según curve expert periodo de Sequia. curve expert a 804,34672 b 35,014771 c 0,060622136 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración La figura 16 representa un comportamiento inadecuado de la función Logística matematica, lo que permite asegurar que este modelo no se ajusta a las necesidades fisiológicas del desarrollo optimo de la pradera. 700,00 600,00 500,00 400,00 OBSERVADOS 300,00 ESPERADOS 200,00 curve expert 100,00 0,00 1 2 3 4 5 6 7 8 9 Figura 13. Valores observados vs valores esperados estimados con el modelo Logistico matematico y de curve expert. 4.6.3. MODELO CACHO Todo el proceso matematico de linearizacion del modelo para encontrar los parámetros y definirlo se encuentra en el anexo E. 94 Por este modelo se obtuvo un error cuadratico medio de 418.24, la figura 17 permite concluir que el modelo no se ajusta a el crecimiento observado en las praderas Biomasa g/MS/m2 500,00 400,00 300,00 200,00 OBSERVADOS 100,00 ESPERADOS 0,00 1 2 3 4 5 6 7 8 Tiempo (dias) Figura 14. Valores observados vs valores esperados estimados con el modelo de Cacho. 4.7 MODELOS APLICADOS EN PRADERAS RENOVADAS 4.7.1. MODELO GOMPERTZ Todo el proceso matematico de linearizacion del modelo para encontrar los parámetros y definirlo se encuentra en el anexo F. La función lineal quedo definida como: Y = -0,018X + 0,141 (R2 = 0,565) Tomando de la función lineal, los valores a = 0,141 y b = -0,018, se definió la función del modelo Gompertz. Con los valores de los datos observados y esperados se estimo el error cuadrático medio, el cual fue de 510,73. Los resultados obtenidos mediante la ecuación utilizada por curve expert arroja error cuadrático medio de 216,49 utilizando los siguientes valores: 95 Tabla 15. Linearizacion para el modelo de Gompertz según curve expert praderas renovadas. curve expert a 2141,6085 b 1,5320187 c 0,01928196 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración La figura 15 representa los valores de crecimiento de las praderas, ajustando los fenómenos expresados. 600 500 400 OBSERVADOS 300 ESPERADOS 200 curve expert 100 0 0 7 15 22 30 37 44 52 59 Figura 15. Valores observados vs valores esperados estimados con el modelo Gompertz matemático y según curve expert. 4.7.2. MODELO LOGISTICO La función lineal quedo definida como: Y = -1E-04X + 0,067 (R2 = 0,600) Tomando los valores de a y b de la función lineal siendo a = 0,067 y b = -1E-04, se definió la función del modelo Logístico. Con los datos observados y estimados se 96 calculo el error cuadrático medio el cual fue de 2825,47. Con los datos calculados con curve expert se obtuvo un error cuadrático medio de 177,88 utilizando los siguientes valores Tabla 16. Linearizacion para el modelo Logistico según curve expert praderas renovadas. curve expert a 731,61376 b 28,137955 c 0,06759593 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración La figura 16 representa un comportamiento inadecuado de la función Logística matematica, lo que permite asegurar que este modelo no se ajusta a las necesidades fisiológicas del desarrollo optimo de la pradera por el contrario la ecuación de curve expert presenta un adecuado comportamiento.. 600 500 400 OBSERVADOS 300 ESPERADOS 200 curve expert 100 0 0 7 15 22 30 37 44 52 59 Figura 16. Valores observados vs valores esperados estimados con el modelo Logistico. 97 4.7.3. MODELO CACHO Todo el proceso matemático de linearización del modelo para encontrar los parámetros y definirlo se encuentra en el anexo F. Biomasa g/MS/m2 600 500 400 300 OBSERVADOS 200 ESPERADOS 100 0 7 15 22 30 37 44 52 59 Tiempo (dias) Figura 17. Valores observados vs valores esperados estimados con el modelo de Cacho. 4.8 MODELOS APLICADOS EN PRADERAS NO RENOVADAS 4.8.1. MODELO GOMPERTZ Todo el proceso matemático de linearización del modelo para encontrar los parámetros y definirlo se encuentra en el anexo G. La función lineal quedo definida como: Y = -0,009X + 0,086 (R2 = 0,157) Tomando de la función lineal, los valores a = 0,086 y b = -0,009, se definió la función del modelo Gompertz. Con los valores de los datos observados y esperados se estimo el error cuadrático medio, el cual fue de 10027,72. En el caso de la ecuación del programa curve expert el error cuadrático medio fue de 194,91 utilizando los siguientes valores 98 Tabla 17. Linearizacion para el modelo de Gompertz según curve expert praderas no renovadas. a = b = c = curve expert 8787,1683 1,8726154 0,0115437 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración En la figura 18 Se observa que el modelo matematico de gompertz no se ajusta adecuadamente a la curva de crecimiento de la pradera, lo cual si ocurre con el modelo modificado con curve expert 400 350 300 250 OBSERVADOS 200 150 ESPERADOS 100 curve expert 50 0 0 7 15 22 30 37 44 52 59 Figura 18. Valores observados vs valores esperados estimados con el modelo Gompertz matematico y de curve expert. 4.8.2. MODELO LOGISTICO La función lineal quedo definida como: Y = -9E-05X + 0,056 (R2 = 0,268) Tomando los valores de a y b de la función lineal siendo a = 0,056 y b = -9E-05, se definió la función del modelo Logístico. Con los datos observados y estimados se 99 calculo el error cuadrático medio el cual fue de 27012,67. Para el caso de el modelo contenido en curve expert, el error cuadrático medio fue de 157,97 con los siguientes datos Tabla 18. Linearizacion para el modelo Logistico según curve expert praderas no renovadas. curve expert a = 2140,8362 b = 107,47855 c = 0,050573084 A: peso adulto B: fuerza genética de aceleración C: fuerza genética de desaceleración La figura 19 representa un comportamiento inadecuado de la función Logística, lo que permite asegurar que este modelo no se ajusta a las necesidades fisiológicas del desarrollo optimo de la pradera. 400 350 300 250 OBSERVADOS 200 ESPERADOS 150 curve expert 100 50 0 0 7 15 22 30 37 44 52 59 Figura 19. Valores observados vs valores esperados estimados con el modelo Logistico matematico y de curve expert. 100 Biomsa g/MS/m2 4.8.3. MODELO CACHO 400 350 300 250 200 150 100 50 0 OBSERVADOS ESPERADOS 7 15 22 30 37 44 52 59 Tiempo (dias) Figura 20. Valores observados vs valores esperados estimados con el modelo Cacho. 4.9. SELECCIÓN DEL MODELO La selección del modelo se realizó con base en el menor promedio del error cuadrático medio, lo cual se resume en la tabla 19. Tabla19. Definición del modelo por error cuadrático medio Gompertz Gompertz logistic logistic curve matematico curve expert matematico expert Lluvia 82,08 16,03 27986,18 21,91 Sequia 213,42 198,41 5627,90 179,22 renovado 510,73 278,34 2825,47 228,70 no renovado 10027,72 194,91 27012,67 157,97 promedio 2708,49 171,92 15863,06 146,95 cacho 31,32 418,24 80593,65 31863.04 27014,40 En la tabla 19 se nota que en general los modelos modificados por curve expert tienen un menor error cuadrático medio, siendo el de mayor aproximación a los datos reales el modelo logístico. La desviación de los datos calculados por los 101 métodos matemáticos se atribuye a que los periodos de muestreo no se hicieron a distancias similares de tiempo, generando esto un error en la derivada que es tomada como una variable a calcularse por todos los modelos. Los diseños de curve expert corrigen este problema generando curvas de crecimiento muy parecidas a los datos obtenidos en campo. Según los resultados obtenidos en la evaluación de los modelos sigmoidales durante los periodos de lluvias y sequia y manejos de renovación y no renovación de praderas, se seleccionó el modelo matemático de Gompertz aplicado al periodo de sequia, siendo este de mayor ajuste y mejor interpretación de los procesos fisiológicos de las praderas, teniendo en cuenta las adversidades climáticas como precipitaciones elevadas e inundaciones que pudieron generar un detrimento en el desarrollo de las praderas evaluadas, no se hizo parametrizacion de los demás periodos de muestreo ni tratamientos, puesto que los errores cuadráticos y la desviación de las curvas esperadas y observadas eran demasiado grandes como para que tuviesen algún valor de correlacion. se puede también explicar el pobre desempeño de los modelos por la mezcla de forrajes y el crecimiento acelerado de arvenses que se vieron favorecidas por las condiciones climaticas. 4.9.1. Definición de puntos críticos La función de crecimiento representada para el caso de las praderas en estudio por un modelo sigmoideo, está definida por varios puntos críticos. De acuerdo con (Serrano, 2000) los principales puntos críticos del modelo Gompertz son el punto de inflexión, el peso adulto y el valor delta. Gille, (2007) señala que en las funciones sigmoideas, la primera porción de la curva en general corresponde a un crecimiento exponencial, igualmente, anota que existe un periodo final de esta porción exponencial en la cual la tasa de crecimiento es máxima; posterior a esta última, la función se expresa con una disminución en la tasa de crecimiento. El punto de cambio de máxima tasa de 102 crecimiento a disminución en la tasa de crecimiento se le conoce como punto de inflexión. Desde otra perspectiva el punto de inflexión es el momento y peso en el cual la curva deja de ser cóncava y pasa a ser convexa. El peso adulto en los modelos de crecimiento corresponde al peso en g o Kg en el cual un ser vivo deja de crecer. Para el caso del crecimiento de las praderas Cacho (1993) lo define como punto de máxima producción sustentable de biomasa en el pasto, que fisiológicamente corresponde al punto en que el desarrollo de nuevos rebrotes de la planta se equilibran con la cantidad de hojas que han llegado a la secuencia haciendo que la capacidad fotosintética sea mínima y por lo tanto la planta deje de crecer. El valor de Y max en la función de Gompertz se puede calcular con la fórmula: Y max = exp (a/b) Para el caso de las praderas evaluadas correspondió a un valor de 339,87 g/m2. Para establecer la edad al punto de inflexión en el modelo Gompertz fue necesario calcular y graficar la primera derivada de la función. En términos prácticos esta última corresponde a la tasa de crecimiento del pasto en g/m2/día. La derivada de la función Gompertz responde a la forma general: dP/dt = P(a-b LnP) 103 6,00 5,00 dP/dt 4,00 3,00 2,00 1,00 0,00 0,00 100,00 200,00 300,00 400,00 Tiempo (dias) Figura 21. Derivada (dP/dt) vs biomasa (g). La figura 21 presenta la gráfica correspondiente a la primera derivada de la función Gompertz vs la biomasa. Si f está dentro de los reales y es una función definida dentro de un conjunto factible, el punto en donde la primera derivada es igual a cero, debe ser un punto máximo o un punto mínimo, (Restrepo, 2007). Para el caso actual corresponde al valor de la tasa máxima de crecimiento, es decir el momento en el cual se alcanza la mayor la producción sustentable de biomasa en g/m2/día de acuerdo a lo expresado por Cacho, (1993). La tabla 23 muestra los valores de la tasa de crecimiento diario calculados a través de la primera derivada. Se puede observar que los valores de la derivada se encontraban en aumento hasta el día 33, momento en que ocurre el punto de inflexión y la derivada inicia su descenso a partir del día 34. De esta forma se pudo definir que la edad al punto de inflexión fue 33 días. 104 Tabla 20. Valores calculados de la primera derivada y porcentaje de madurez entre los días 28 y 42 del crecimiento de las praderas. Edad (días) Peso (g) dP/dt % madurez 28 103,79 4,31 30,54 29 108,11 4,33 31,81 30 112,45 4,35 33,09 31 116,81 4,37 34,37 32 121,18 4,37 35,66 33 125,56 4,38 36,94 34 129,94 4,37 38,23 35 134,30 4,36 39,52 36 138,66 4,35 40,80 37 143,00 4,33 42,08 38 147,33 4,31 43,35 39 151,62 4,28 44,61 40 155,89 4,25 45,87 41 160,13 4,22 47,11 42 164,33 4,18 48,35 De la misma manera se pudo definir cual fue la cantidad de biomasa en la cual ocurrió el punto de inflexión, conocida como peso al punto de inflexión (PPI), el cual para el caso de las praderas en estudio correspondió a un valor de 125,56 g. El valor exacto del PPI se pudo calcular con la fórmula: PPI = Peso adulto / e Donde: PPI = Peso al punto de inflexión. e = Número neperiano o eureliano. 105 El resultado final para el PPI para los pastos fue de 125,03 g. El valor de la tasa máxima de crecimiento TMC se pudo estimar al observar en los datos calculados el mayor valor derivado en la tabla 23, que correspondió a 4,38 g/m2/día; después de este valor se observa que la derivada inicia el descenso. Según lo reportado por Talero y Afanador, (2004), los modelos de crecimiento Logístico y Gompertz tienen puntos de inflexión fijos con respecto a la madurez fisiológica. La madurez se calcula con la fórmula % de madurez = (P (t) / Y max) × 100 Donde: P (t) = Peso en el cual se desea calcular su madurez Y max = Peso adulto Para el caso de Gompertz el punto de inflexión ocurre cerca del 36.94 % del peso adulto, es decir de la madurez, (Gille, 2004). Esta situación se pudo verificar con los cálculos presentados en la tabla 23. En el modelo logístico el punto de inflexión ocurre siempre en el 50% de la madurez. Las diferencias en el momento en que ocurre el punto de inflexión entre las funciones Gompertz y Logística marca la diferencia fundamental de cual modelo ajusta mejor para determinadas especies o condiciones de crecimiento de evaluación. Por tanto, se puede reconocer que el modelo que mejor puede ajustar dependerá de la precocidad de la especie o variedad y de las condiciones ambientales en las que se verifica el crecimiento. El valor delta en el cual fisiológicamente marca la finalización del periodo de estructuración biológica y metabólica de un ser vivo, fue calculado al trazar una línea tangente al punto de inflexión y calcular el valor en que esta línea tangente 106 atraviesa el eje X. La figura 22 presenta la línea tangente y la ubicación del punto delta. 1450,00 1350,00 1250,00 1150,00 1050,00 950,00 850,00 750,00 650,00 550,00 450,00 350,00 250,00 150,00 50,00 ‐50,00 0 50 100 BIOMASA 150 TANGENTE 200 250 300 Figura 22. Línea tangente al punto de inflexión y valor del punto delta. El punto delta se calculó con la fórmula: Delta = -Intercepto / Pendiente Para calcular el intercepto de la línea tangente (LT) se utilizó la fórmula: Intercepto LT = PPI - (EPI × TMC) Intercepto LT = - 19,38 Pendiente: La inclinación en la línea tangente es igual a la TMC por que en el punto de inflexión la derivada de la línea tangente es igual a la derivada de la línea de crecimiento. 107 Delta = 4,43 días Fisiológicamente significa que en promedio el pasto terminó su estructuración biológica y metabólica el día 4. 4.10. APLICACIONES PRÁCTICAS El modelo definió los valores o puntos críticos, de los cuales se puede generar información precisa sobre el manejo adecuado en términos de producción de biomasa sobre las praderas del CIC Santa María. Debido a las inclemencias climáticas que se presentaron durante los periodos de muestreo, lluvias fuertes y frecuentes, que posteriormente produjeron inundaciones en las praderas, disminuyendo así la producción de materia verde o forraje, igualmente alterando los valores de materia seca, por la excesiva humedad y reacción adversa de las especies forrajeras establecidas; los valores encontrados en la definición del modelo sigmoideo de Gompertz no correspondieron a los esperados en este trabajo, El periodo de recuperación y de oferta forrajera a los animales del CIC Santa María es de 60 días. Según Bernal (2004) la edad adecuada para pastorear una pradera establecida en su mayoría con pasto kikuyo es de 63 días, edad en la cual el material vegetal termina su proceso de estructuración ofreciendo una producción optima de forraje en términos de biomasa. Con el modelo se puede predecir día por día la cantidad de biomasa disponible en el sistema, de tal forma que se puede definir en forma dinámica la capacidad de carga en cada potrero (Kg de peso vivo / hectárea) mejorando la eficiencia de uso de las pasturas. Conociendo la cantidad de biomasa diaria real g/m2 en el potrero durante todo el periodo de recuperación, al igual que la cantidad de biomasa generada 108 diariamente (g/m2/día) se puede implementar un sistema de fertilización o renovación de praderas bajo el concepto de agricultura de precisión en donde los valores citados anteriormente calculen las cantidades de fertilizantes necesarias y el momento óptimo de aplicación con el fin de evitar excesos en el uso de estos últimos, los cuales causan aumento en los costos de mantenimiento ambiental principalmente por excesos de fósforos y nitrógenos en suelos y aguas. 4.11. OTROS MODELOS Se evaluaron los modelos sigmoideos (Gompertz, Logístico y Cacho) para el periodo de lluvias, praderas renovadas y no renovadas, los cuales arrojaron datos inadecuados debido a las condiciones adversas que se presentaron durante el periodo de muestreo. 4.12. FRACCIONAMIENTO DE CARBOHIDRATOS Y PROTEINAS Para el desarrollo del modelo estadístico, fue necesario utilizar el software estadístico SAS, el cual nos permitió establecer las diferencias significativas de forma dinámica, interactuando las diferentes edades de corte con los manejos de renovación y no renovación de praderas. A la vez se estableció un modelo matematico de optimización que nos permitia comparar las diferencias y conocer mediante ecuaciones en que valor cuantitativo en que afectaba la calidad nutricional de la pradera por la toma de alguna decisión sobre edad de corte o a la renovación de los potreros. En el anexo H, se encuentra el flujograma de proceso para la determinación de las fracciones de carbohidratos y proteínas según Licitra (1996). Los valores obtenidos del fraccionamiento de carbohidratos y proteínas fueron organizados por edad de rebrote y pradera evaluados. Para el ingreso de los datos al software SAS, fue necesario estructurar una tabla con información del nivel de 109 clase, la cual estableció nombres estadísticos específicos para las variables evaluadas. Tabla 21. Información del nivel de clase (SAS). FORMACION DEL NIVEL DE CLASE Clase Niveles Valores Edad 3 1, 2, 3 45, 52, 59 Manejo 2 1, 2 Renovados, No Renovados Observaciones 18 4.12.1. Interaccion edad de rebrote y manejo de praderas. En la tabla 25 se muestran los valores promedios del fraccionamiento de carbohidratos y proteínas interactuando las tres edades de rebrote y los dos tratamientos evaluados. Se presentaron diferencias significativas (P < 0,05) en las fracciones de FDN y Hemicelulosa. Tabla 22. Valores promedio de las fracciones de carbohidratos y proteínas. EDAD / MANEJO FRACCION 45 d*r 45 d*nr 52 d*r 52 d*nr 59 d*r 59 d*nr PROBABILIDAD Pc 21,76±0,33 17,41±0,39 18,91±0,96 16,04±0,11 17,89±0,40 15,40±0,04 0.1634 0,015±0,001 0,013±0,001 0,017±0,002 0,014±0,001 0,014±0,001 0,011±0,001 0.8839 P B1 38,29±1,36 37,07±0,77 37,89±1,12 40,20±0,66 38,89±2,38 46,22±3,20 0.1043 P B2 23,13±0,38 29,2±2,35 21,81±0,35 27,09±1,81 20,64±0,44 25,05±3,30 0.9038 P B3 20,98±0,87 29,72±0,68 24,15±0,98 20,44±0,78 24,32±3,02 18,02±2,02 0.1493 PC 17,56±1,97 12,98±2,04 16,11±1,85 12,24±2,86 16,11±3,15 10,67±2,02 0.9472 FDN 63,67±0,60 66,8±0,85 63,71±0,79 60,94±0,58 60,19±1,82 56,77±1,42 0.0226 FDA 30,2±1,01 32,34±0,67 33,21±0,48 33,04±0,13 31,97±1,43 33,35±0,42 0.3768 LIGNINA 3,07±0,51 3,54±1,17 4,05±0,58 2,24±0,60 4,14±0,82 3,97±2,05 0.5788 CELULOSA 7,84±0,86 7,3±1,47 10,87±0,72 8,99±0,55 10,82±0,28 11,87±1,32 0.3442 H/LOSA 33,46±0,79 34,46±0,62 30,5±1,32 27,90±0,85 28,22±0,44 23,41±1,00 0.0131 SILICE 0,12±0,06 0,97±0,30 0,15±0,03 0,62±0,09 0,06±0,01 0,96±0,10 0.2801 P A (NNP) d: días de crecimiento r: potrero renovado nr potrero no renovado 110 Los valores obtenidos del fraccionamiento de carbohidratos y proteínas en este estudio no pueden ser comparados con la biblioteca de forrajes del CNCPS, debido a que este no determina ni evalúa el pasto kikuyo. FDN (Fibra Detergente Neutro) Datos no publicados por Corpoica (Tibaitatá), reportan 59% de FDN con un promedio de 65 muestras en pasto kikuyo y Bernal (2004) reporta 57,48% de FDN en praderas establecidas con pasto kikuyo con 60 días de recuperación. No se encontraron datos específicos del contenido de FDN en praderas renovadas y no renovadas. El crecimiento máximo microbiano tiene lugar generalmente a un pH entre 6,5 – 6,8 que se mantiene estable gracias a la capacidad tampón de la saliva, cuya secreción es estimulada por la ingestión de fibra que favorece la masticación y la rumia. En dietas ricas en carbohidratos fermentables, la ingestión de fibra puede resultar insuficiente para tamponar la masiva producción de ácidos grasos volátiles y el pH desciende por debajo de 6,0 – 6,2, inhibiendo el crecimiento microbiano, especialmente la flora celulolítica, probablemente debido al gasto extra de energía para adaptarse a las condiciones de un bajo pH ruminal. El CNCPS tiene en cuenta este efecto, corrigiendo la eficiencia de síntesis microbiana en función del contenido en FDN de la dieta, como índice del pH ruminal. Se estima que es necesario un contenido mínimo de FDN del 20% para evitar depresiones microbianas en un 2,5% por cada unidad porcentual de disminución en el contenido en el FDN (Guada, 1996). HEMICELULOSA Esta porción de los forrajes, no es tenida en cuenta por el CNCPS, por lo tanto no la determinan. 111 Bernal (2004), reporta valores de hemicelulosa de 24,78% en praderas establecidas con pasto kikuyo con una edad de rebrote de 60 días. De acuerdo a lo reportado por Estrada (2001), la lignina por estar ligada químicamente a la hemicelulosa y celulosa, reduce significativamente la digestibilidad de estas. 70 60 50 45 DIAS RENOVADO 40 45 DIAS NO RENOVADO 30 52 DIAS RENOVADO 20 52 DIAS NO RENOVADO 10 59 DIAS RENOVADO SILICE H/LOSA LIGNINA CELULOSA FDA P C FDN P B3 P B2 P B1 P A NNP PC 0 59 DIAS NO RENOVADO Figura 23. Promedios estadísticos de la interacción edad de rebrote y manejo de praderas El software SAS, permite obtener estos resultados de tratamientos con interacción entre ellos y también por tratamientos individuales. 4.12.2. EDAD DE REBROTE. Los resultados del diseño estadístico tomando únicamente la edad de rebrote de las praderas, arrojaron diferencias significativas (P < 0,05) en las fracciones de Proteína cruda (Pc), Fibra Detergente Neutro (FDN), Celulosa y Hemicelulosa. 112 Tabla 23. Valores promedio de las fracciones de carbohidratos y proteínas según la edad de rebrote. EDAD FRACCION 45 52 59 PROBABILIDAD PC 19,58±1,00 17,45±0,77 16,65±0,58 0.0002 P A NNP 0,014±0,0004 0,015±0,0008 0,012±0,0008 0.0706 P B1 31,68±0,76 39,05±0,77 42,56±2,42 0.0536 P B2 26,17±1,72 24,45±1,44 22,85±1,78 0.2355 P B3 20,85±0,49 22,29±1,00 21,17±1,96 0.5854 PC 15,27±1,62 14,17±1,75 13,39±2,06 0.7339 FDN 65,24±0,84 62,33±0,75 58,48±1,28 0.0002 FDA 31,27±0,72 33,13±0,22 32,66±0,73 0.0975 LIGNINA 3,30±0,57 3,14±1,38 4,05±0,98 0.6842 CELULOSA 7,57±0,76 9,93±0,58 11,35±0,64 0.0066 H/LOSA 33,96±0,49 29,20±0,83 25,83±1,17 <.0001 SILICE 0,55±0,23 0,38±0,11 0,51±0,20 0.5040 70 60 50 40 30 20 10 0 45 52 59 Figura 24. Promedios estadísticos según la edad de rebrote. 113 PROTEINA CRUDA (Pc) Esta fracción de nitrógeno total presenta una esperada disminución con relación a la edad de rebrote, siendo un comportamiento indirectamente proporcional; es decir, la calidad nutricional (en este caso la Pc) disminuye al aumentar el tiempo de desarrollo del pasto. Según Corpoica (datos no publicados), con un promedio de 62 muestras de pasto kikuyo, se encontró una proteína cruda de 15,39%, siendo este valor menor a los determinados en este estudio. La determinación de la proteína cruda (Pc), para efectos de simulación animal en el CNCPS v 6.1, no es relevante, ya que este aplica el fraccionamiento del nitrógeno total dependiendo de la velocidad de degradación de cada una de las fracciones. CELULOSA Al igual que la hemicelulosa, la celulosa esta químicamente ligada a la lignina haciendo parte de la composición estructural de la pared celular de las plantas, es claro, que con un mayor desarrollo de la planta aumente la cantidad de esta fracción, haciendo de este un forraje poco digestible por los rumiantes. 4.12.3. PRADERAS RENOVADAS Y NO RENOVADAS Los resultados presentaron diferencias significativas (P < 0,05) en las fracciones de Proteína Cruda (Pc), Proteína A (NNP), Proteína B2, Proteína B3, Proteína C, Hemicelulosa y Sílice. 114 Tabla 24. Valores promedio de las fracciones de carbohidratos y proteínas según el manejo de las praderas. MANEJO FRACCION RENOVADAS NO RENOVADAS PROBABILIDAD PC 19,52±0,66 16,28±0,31 <.0001 P A NNP 0,015±0,0006 0,013±0,0006 0.0193 P B1 38,36±0,86 41,16±1,65 0.0854 P B2 21,86±0,41 27,12±1,41 0.0043 P B3 23,15±1,09 19,73±0,55 0.0126 PC 16,59±1,22 11,96±1,21 0.0340 FDN 62,52±0,83 61,51±1,54 0.2835 FDA 31,79±0,81 32,91±0,27 0.1163 LIGNINA 3,75±0,036 3,25±0,75 0.5860 CELULOSA 9,84±0,6 9,39±0,89 0.5744 H/LOSA 30,73±0,98 28,59±1,49 0.0078 SILICE 0,11±0,02 0,85±0,11 <.0001 70 60 50 40 30 renovados 20 no renovados 10 SILICE H/LOSA CELULOSA LIGNINA FDA FDN P C P B3 P B2 P B1 P A NNP PC 0 Figura 25. Promedios estadísticos según el manejo de las praderas. 115 PROTEINA A (NNP) Esta fracción, también conocida como Nitrógeno No Proteico (NNP), representa un porcentaje menor comparada con las demás fracciones de nitrógeno. Datos no publicados (Corpoica, Tibaitatá), encontraron una valor de NNP en 23 muestras de pasto kikuyo de 5,81, siendo este valor mas alto que el obtenido en este estudio pudiéndose presentar errores en la determinación en el laboratorio. Las praderas renovadas arrojan mayor presencia de esta fracción, debido a la inclusión de mayor oferta de nitrógeno en las praderas, como lo son las leguminosas, en este caso el trébol rojo. PROTEINA B2 Constituida por proteína verdadera soluble de degradación intermedia en el rumen. PROTEINA B3 De degradación lenta y también conocida como Nitrógeno Insoluble en Detergente Neutro (NDIN). Según Lagunez (1999) un aumento en la fracción NDIN puede reducir notablemente la disponibilidad de PM para la producción de leche. los valores de esta fracción deben estar correlacionados con la energía metabolizable disponible para la producción de leche, parámetro que se afecta notoriamente por la presencia de lignina. Altos niveles de lignina disminuyen la disponibilidad de carbohidratos estructurales y por ende disminuye la energía metabolizable para la producción de leche. (Barrera y Pinilla, 2007) Datos no publicados por Corpoica (Tibaitatá) de NDIN es de 24,74% con una promedio de 22 muestras de pasto kikuyo, datos superiores a los encontrados en este estudio. 116 PROTEINA C Es la fracción que se considera no degradable en el rumen como en el intestino (Barrera y Pinilla, 2007) y se conoce también como Nitrógeno Insoluble en Detergente Acido (ADIN). Chamorro (2006), reporta valores hasta de 10,28% de esta fracción en pasto kikuyo en la Sabana de Bogotá. Lagunez et al (1999) reporta valores de la fracción C en 15 pastos tropicales desde 3.5 hasta 8.6%. Corpoica (Tibaitatá), datos no publicados, reporta valores de 7,16% con 21 muestras promedio. 4.13. INTERPRETACION DEL MODELO ESTADISTICO. La utilización del software SAS, permite obtener información de manera clara y precisa, para efecto del estudio realizado a las praderas del CIC Santa María, se puede evidenciar que los contenidos de Fibra Detergente Neutro (FDN) encontrados en las praderas con 52 días de recuperación presentan valores de 63 y 60% con manejos de renovación y no renovación respectivamente, valores que según la literatura se encuentran dentro del rango optimo para ser ofrecido. Con relación a las otras edades de 45 y 59 días de recuperación, los valores aumentan para la primera con 63% y 66% de FDN con manejo de renovación y no renovación respectivamente, y disminuyen en la segunda con valores de 60% y 56% de FDN con manejo de renovación y no renovación de praderas respectivamente. 117 40 35 30 25 20 RENOVADOS 15 NO RENOVADOS 10 5 0 45 52 59 Figura 25. Interacción Hemicelulosa 68 66 64 62 60 58 56 54 52 50 renovados no renovados 45 52 59 Figura 26. Interacción FDN Las figuras 25 y 26 representan los resultados de la interacción de las fracciones de FDN y Hemicelulosa basados en la edad de recuperación y los manejos diferenciales de renovación y no renovación de praderas. La tendencia es clara y fisiológicamente adecuada, a medida que aumenta el desarrollo de la pradera (días de recuperación), los aportes nutricionales de esta disminuyen de forma proporcional. 118 4.14. MODELO DE OPTIMIZACION DE LA ALIMENTACION El modelo de optimización se aplico con el fin de comparar las diferencias obtenidas en el modelo factorial y tener un dato cuantitativo de estas diferencias para permitir una adecuada toma de decisiones en el manejo de los potreros. Los datos calculados son los que presentan diferencias significativas en alguno de los tratamientos o en la interacción de los mismos. En la tabla 25 se muestran las ecuaciones que señalan el efecto del la edad de corte y el tratamiento de renovación sobre el promedio de las variables evaluadas. El modelo de optimización se utilizo para todas las variables que mostraron alguna diferencia significativa por cualquiera de los tratamientos. Tabla 25. Ecuaciones obtenidas con el modelo de optimización PERIODO PC FDN CELULOSA H/LOSA PA NNP PB 2 PB 3 PC SILICE ecuación s 45-52 Y=18,54 - 1,05*A + 1,8*Bs - 0,37*ABns 45-59 Y=18,12 - 1,47*As + 1,71*Bs - 0,47*ABs 45-52 Y=63,79 - 1,45*As -0,09*Bns + 1,48*ABs 45-59 Y=61,86 - 3,38*As + 0,07*Bns + 1,64*ABs 45-52 Y=8,76 + 1,38*As + 0,61*Bns + 0,33*ABns 45-59 Y=9,46 + 1,89*As - 0,13*Bns - 0,40*ABns 45-52 Y=31,58 - 2.38*As + 0,40*Bns + 0,90*ABns 45-59 Y=29,89 - 4,07*As + 0,95*Bs + 1,45*ABs 45-52 45-59 45-52 45-59 45-52 45-59 45-52 45-59 45-52 45-59 Y=0,02 +0,0006*Ans + 0,0011*Bns + 0,0002*ABns Y=0,01 - 0,0008*Ans + 0,0012*Bs + 0,0003*ABns Y=25,31 - 0,86*Ans -2,84*Bs + 0,20*ABns Y=24,51 - 1,66*As -2,62*Bs + 0,41*ABns Y=21,58 + 0,72*Ans + 0,99*Bs + 0,86 *ABs Y=21,02 + 0,16*Ans + 1,64 *Bns + 1,51*ABns Y=14,73 - 0,55*Ans + 2,11*Bns - 0,18*ABns Y=14,33 - 0,94*Ans + 2,50*Bns + 0,21*ABns Y=0,47 - 0,08*Ans - 0,33*Bs + 0,09*ABns Y=0,53 - 0,02 *Ans - 0,44 *Bs - 0,02 *ABns Y=variable evaluada A= efecto atribuido a la diferencia en la edad de corte B: efecto atribuido a el tratamiento de renovación AB: efecto atribuido a la interacción entre edad y tratamiento de renovación Ns: no hay diferencia significativa S:diferencia significativa 119 La tabla 26 muestra los niveles de significancia del efecto de alguna modificación en la edad de corte o el tratamiento de renovación para las praderas obre el valor critico de T Tabla 26. Niveles de significancia sobre el valos critico de t PERIODO PC FDN CELULOSA H/LOSA PA NNP PB 2 PB 3 PC SILICE tA tB s tAB s -1,34ns 45-52 -3,82 45-59 -9,00s 10,48s -2,86s 45-52 -4,05s -0,26ns 4,11s 45-59 -5,32s 0,11ns 2,59s 45-52 2,45s 1,25ns 0,69ns 45-59 3,47s -0,24ns -0,74ns 45-52 -5,65s 0,95ns 2,13ns 45-59 -10,95s 2,56s 3,90s 45-52 45-59 45-52 45-59 45-52 45-59 45-52 45-59 45-52 45-59 1,06ns -1,75ns -1,14ns -1,62s 1,72ns 0,20ns -0,49ns -0,80ns -0,98ns -0,20ns 1,83ns 2,66s -3,76s -2,56s 2,37s 2,00ns 1,90ns 2,13ns -4,06s -5,36s 0,25ns 0,61ns 0,26ns 0,40ns 2,06s 1,84ns -0,16ns 0,18ns 1,14ns -0,19ns t critico 2,306 6,55 tA: valor critico de la diferencia de edad tB: valor critico del tratamiento de renovación tAB: valor critico de la interaccion de edad y el tratamiento de renovación s: diferencia significativa ns: no hay diferencia significativa 120 4.14.1 APLICACIONES PRACTICAS DE LA OPTIMIZACION Los datos contenidos en las tablas 25 y 26 Permiten cuantificar la viariacion que se obtendrá en tanto a los componentes nutricionales de las pasturas del CIC Santa María, al modificar la edad de corte y el manejo de la pradera, adicionalmente mide el efecto que tendrá la interaccion entre estas dos variables. Con estos datos se permite una adecuada toma de desiciones, para asi mejorar los índices productivos de la finca y la eficiencia en la utilización de los recursos disponibles para la alimentación animal. 4.15. DEGRADABILIDAD RUMINAL (in sacco) El objetivo de la aplicación de degradabilidad ruminal (in sacco) fue el de estimar el tiempo de retención del contenido digestivo ruminal o tasa fraccional de transito (kp) y el ritmo de degradación (kd). Así mismo, mediante la sustracción de curvas de las fracciones evaluadas de MS, FDN y RIE determinar los contenidos de las fracciones de carbohidratos A, B1, B2 y C y la velocidad de degradación específica necesaria para la simulación de la respuesta animal. Para el desarrollo de este proyecto, fue necesario ajustar la degradabilidad aparente obtenida directamente de los resultados de campo realizados en las instalaciones de la UDCA, utilizando el software NEWAY FIT CURVE (aplicación de Excel) el cual determina la degradabilidad efectiva mediante la ecuación propuesta por Ørskov (1988) así: Y = a + b (1 – e –ct) Donde: Y: Porcentaje de degradación acumulada en el tiempo (t). a: Intercepto de la curva de degradación cuando t = 0 (Degradación inicial). 121 b: Fracción degradada por acción de los microorganismos. c: Tasa de degradación, horas. t: Tiempo de incubación en el rumen, horas. e: Base de los logaritmos naturales. En las tablas 27 y 28 se muestran los valores observados vs los valores ajustados de la degradabilidad ruminal (in sacco) utilizando la aplicación FIT CURVE en cinco tiempos de incubación. Tabla 27. Resultados de degradabilidad (in sacco) en praderas no renovadas. MS FDN RIE Tiempo Observados Ajustados Observados Ajustados Observados Ajustados 45 DIAS 0 33,44 34,0 4,3 5,5 6,8 7,5 6 46,86 42,8 12,89 11,9 10,7 9,7 24 59,31 58,5 28,33 26,3 14,23 14,4 48 71,18 74,2 34,12 37,9 17,48 18,0 72 87,06 85,6 46,13 44,3 20,19 19,8 52 DIAS 0 31,89 33,6 10,7 10,1 10,15 11,9 6 45,75 42,9 14,23 15,7 19,44 16,8 24 59,51 60,7 31 29,3 25,6 26,1 48 70,81 71,6 40,3 41,8 29,87 31,8 72 76,89 76,0 50,6 50,0 35,45 34,0 59 DIAS 0 29,27 29,3 19,56 21,0 11,3 12,4 6 34,75 34,4 28,24 26,4 17,75 16,3 24 46,74 47,7 39,6 39,2 24,6 24,4 48 62,46 61,4 48,47 50,1 28,56 30,2 72 71,18 71,6 57,54 56,6 33,9 32,9 122 En el trabajo experimental realizado por Barrera y Pinilla (2007) se encontró en una mezcla de dos variedades de pasto raigrass (aubade y bóxer) una degradabilidad de materia seca (MS) de mas del 50% en un tiempo de incubación de cero horas. Para este estudio en praderas no renovadas, se encontró, para la misma fracción, una degradabilidad mínima de 33,44% en cero horas y máxima de 87,06% en 72 horas de incubación, mostrando un incremento proporcional al desarrollo en días de la pradera. Lo que implica la baja solubilidad de los componentes de la pradera, involucrando de forma directa la ineficiente utilización de los componentes de la misma Tabla 28. Resultados de degradabilidad (in sacco) en praderas renovadas. MS FDN RIE Tiempo Observados Ajustados Observados Ajustados Observados Ajustados 45 DIAS 0 35,98 36,4 6,1 6,8 8,4 8,4 6 49,24 49,0 15,9 14,9 10,7 10,7 24 71,14 69,1 31 30,8 15,1 15,1 48 71,73 77,6 39,6 40,9 17,9 17,9 72 83,72 79,8 46 45,1 19,1 19,1 52 DIAS 0 34,11 34,7 5,6 5,6 13,2 12,8 6 46,44 45,6 14,8 14,8 16,3 17,0 24 65,05 64,6 31,3 31,3 24,9 24,4 48 71,94 74,1 40,3 40,3 28,2 28,2 72 78,61 77,1 43,4 43,4 29,2 29,4 59 DIAS 0 32,91 34,0 22,7 23,2 11,2 12,4 6 45,25 43,5 28,6 28,1 17,75 15,8 24 61,08 61,5 39,6 39,1 22,92 23,6 48 70,92 72,0 47,1 48,2 29,93 30,2 72 76,88 76,0 53,9 53,3 34,31 34,0 123 La baja solubilidad encontrada en este estudio, se le atribuye a la variedad de especies forrajeras encontradas durante el periodo de muestreo, entre las cuales se encontraron, en su mayoría kikuyo, seguido en orden de menor presencia raigrass y trébol rojo. Adicionalmente, las inclemencias climáticas y la poca capacidad de drenaje del terreno, favorecieron el crecimiento de algunas especies de arvenses que poblaron gran parte de las praderas. Que por la diferente composición y comportamiento de crecimiento de todas y cada una de ellas podrían modificar notoriamente los resultados obtenidos. En el anexo I, se encuentra los resultados de la degradabilidad ruminal empleando el software NEWAY. 4.16. FRACCIONAMIENTO DE CARBOHIDRATOS Según Doane et al (1998) la estimación de las fracciones A y B1 se hizo mediante diferencia de curvas tomando los porcentajes de degradación ajustados obtenidos en los análisis de MS, FDN y RIE. Cuando se determinan las fracciones A y B1 por diferencia, existen aminoácidos y proteínas contenidos en estas, los cuales si son fermentados, la degradabilidad aumenta levemente. Cuando la proteína es fermentada en ausencia de carbohidratos ocurre una máxima desamimación. FRACCIONES DEGRADADAS (45 DIAS) Degradacion (%) 100,0 80,0 60,0 40,0 20,0 0,0 0 6 24 Tiempo (horas) MS FDN 48 RIE 72 Figura 28. Degradación de MS, FDN y RIE en praderas no renovadas con 45 días de recuperación. 124 FRACCIONES DEGRADADAS (52 DIAS) Degradacion (%) 80,0 60,0 40,0 20,0 0,0 0 6 24 Tiempo (horas) MS FDN 48 RIE 72 Figura 29. Degradación de MS, FDN y RIE en praderas no renovadas con 52 días de recuperación. FRACCIONES DEGRADAS (59 DIAS) Degradacion (%) 80,0 60,0 40,0 20,0 0,0 0 6 MS 24 Tiempo (horas) FDN 48 RIE 72 Figura 30. Degradación de MS, FDN y RIE en praderas no renovadas con 59 días de recuperación. Las figuras 28, 29 y 30 muestran la tendencia de degradación de las fracciones de MS, FDN y RIE para las praderas no renovadas, en las cuales se observa una mayor degradabilidad en la MS con relación a RIE, lo que indica una presencia absoluta de la fracción A de los carbohidratos. 125 Degradacion (%) FRACCIONES DEGRADADAS (45 DIAS) 90,0 80,0 70,0 60,0 50,0 40,0 30,0 20,0 10,0 0,0 0 6 24 Tiempo (horas) MS FDN 48 72 RIE Figura 31. Degradación de MS, FDN y RIE en praderas renovadas con 45 días de recuperación. Degradacion (%) FRACCIONES DEGRADADAS (52 DIAS) 90,0 80,0 70,0 60,0 50,0 40,0 30,0 20,0 10,0 0,0 0 6 24 Tiempo (horas) MS FDN 48 72 RIE Figura 32. Degradación de MS, FDN y RIE en praderas renovadas con 52 días de recuperación. 126 FRACCIONES DEGRADADAS (59 DIAS) 80,0 Degradacion (%) 70,0 60,0 50,0 40,0 30,0 20,0 10,0 0,0 0 6 24 Tiempo (horas) MS FDN 48 72 RIE Figura 33. Degradación de MS, FDN y RIE en praderas renovadas con 59 días de recuperación. Según Doane et al (1998), la determinación de las fracciones de carbohidratos se realiza mediante la sustracción de las curvas de los materiales evaluados. De esta manera se obtuvieron los valores de cada una de las fracciones de carbohidratos tomados del tiempo de incubación 0 porque los demás valores representan la tasa de degradación en cinco tiempos diferentes de las mismas. Tabla 29. Fraccionamiento de carbohidratos en praderas no renovadas. PRADERAS NO RENOVADAS FRACCIONAMIENTO DE CARBOHIDRATOS Edad (días) Fracción A % Fracción B1 % Fracción B2% Fracción C 45 26,5 2,0 5,5 11,9 52 21,8 1,8 10,1 4,1 59 16,9 0,0 21,0 10,7 127 Tabla 30. Fraccionamiento de carbohidratos en praderas renovadas. PRADERAS RENOVADAS FRACCIONAMIENTO DE CARBOHIDRATOS Edad (días) Fracción A % Fracción B1 % Fracción B2% Fracción C 45 28,0 1,6 6,8 7,2 52 21,9 7,2 5,6 9,2 59 21,5 0,0 23,2 14,1 Las tablas 29 y 30, presentan el fraccionamiento de carbohidratos contenidos en las praderas con manejo de labranza (renovadas y no renovadas). En general, la fracción A, correspondiente a los azucares, presentaron un contenido bajo con relación al estudio realizado por Barrera y Pinilla (2007), disminuyendo su concentración de manera proporcional a medida que la edad de la pradera avanza. Para la fracción B1 se presentó un aumento en el tratamiento de praderas renovadas a la edad de 52 días de recuperación, pero disminuye su concentración debido a la acelerada degradación de los almidones; entre tanto la fracción B2, aumenta proporcional al desarrollo de la pradera, lo que indica que la digestibilidad de la fibra digestible contenida en la pradera del CIC Santa María, podría aumentar significativamente prolongando su paso o haciendo mas eficiente la síntesis de bacterias fermentadoras de carbohidratos, esto se logaría con un perfecto balance entre energía y proteína. La porción no digestible o fracción C de los carbohidratos presenta una tendencia clara a aumentar su contenido cuando aumenta la edad de desarrollo de la pradera, tendencia clara, ya que estos componentes están ligados a la lignina, inhibiendo la digestibilidad de los componentes estructurales de la planta. 128 4.17. PREDICCION DE LA RESPUESTA ANIMAL Las simulaciones se corrieron con el software CNCPS (Cornell Net Carbohydrate and Protein System) versión 6.1, desarrollado por la Universidad de Cornell (Fox et el, 2000) para la valoración de dietas y predecir el desempeño productivo del ganado vacuno a partir del contenido de sus ingredientes, bajo unas condiciones medio ambientales previamente monitoreadas durante los periodos de muestreo y productivas determinadas. La simulación se realizó con un hato lechero en Sopo (Cundinamarca) en el CIC Santa María de La Universidad de La Salle. Para la simulación se tomo el hato del CIC Santa María, con vacas de raza holstein comercial de 50 meses de edad, vacías, con un peso de 550 kg, en la tercera lactancia, en el primer y segundo tercio de la lactancia, con una producción diaria de 17,5 kg/vaca/día, las cuales se encontraban en pastoreo rotacional en praderas con mejoradas con mezcla de kikuyo, raigrass y trébol rojo y praderas no mejoradas con pasto kikuyo. Se tomaron las muestras de los pastos de 59 días de desarrollo de los dos tratamiento (praderas mejoradas y no mejoradas), las cuales presentaron significativas en el modelo estadístico en la interacción del manejo realizado y la edad de recuperación de las praderas, evaluadas en cuanto al fraccionamiento de proteínas pero con cambios apreciables en los niveles de FDN, se ingresaron los valores obtenidos del fraccionamiento de carbohidratos y proteínas así como las tasas de degradación de las fracciones A, B1 y B2 de carbohidratos. Los valores nutricionales que no se determinaron en este estudio por su complejidad en los análisis, fueron obtenidos de la base de datos del sistema CNCPS para el pasto thymoty, ya que este no evalúa en ninguno de sus análisis el pasto kikuyo (degradabilidad de las fracciones proteicas, disponibilidad de macro y micro minerales, disponibilidad de aminoácidos y vitaminas). 129 4.18. SIMULACION ANIMAL Se corrieron simulaciones para la edad de corte de 59 días en los dos tratamiento (praderas renovadas y no renovadas), por separado y se realizó el análisis de la dinámica ruminal de acuerdo a las salidas del modelo. Los resultados de la simulación realizada a las paraderas del CIC Santa Maria usando el CNCPS v 6.1 se encuentran en el anexo J. Tabla 31. Respuesta productiva del hato del CIC Santa María bajo el modelo CNCPS VARIABLE SEGÚN CNCPS 59 DÍAS 59 DÍAS NO RENOVADOS RENOVADOS Producción de leche por EM 14,6 21,9 24,6 37,1 Total EM disponible (Mcal/día) 29,74 38,39 MUN (mg/dl) 4,6 12,2 Costo Urea (Mcal/día) 0,36 1,03 pH Ruminal 6,46 6,46 Leche : Alimento 1,21 1,46 N excretado (g) 208 355 P excretado (g) 4,9 10 disponible para leche (Kg/día) Producción de leche por PM disponible para leche (Kg/día) La tabla 31 presenta la simulación realizada a las praderas del CIC Santa María en praderas con manejo diferencial de renovación y no renovación de praderas, en la cual se expresa la respuesta fisiológica por parte del animal para cumplir con sus requerimientos nutricionales de producción y mantenimiento. 130 En la simulación realizada a las praderas no renovadas, se observa un valor de MUN bajo, el cual afecta de manera importante el proceso metabólico y productivo de los animales, haciendo ineficiente el contenido de nitrógeno aportado por las praderas. La producción de leche predicha, para ambos casos, tomando los valores de EM son los mas ajustados con la producción real del CIC Santa María, teniendo que consumir mas en las praderas renovadas para ser convertidas en leche, con una relación alimento : leche de 1,46. No se ajustaron suplementos debido a que en las praderas no renovadas la producción de leche es óptima, teniendo en cuenta el valor bajo de MUN atribuido al mismo manejo de labranza. Para el caso de las praderas renovadas, el valor de MUN predicho, se encuentra dentro del rango ideal, es decir; no afecta la producción ni la reproducción de los animales. 131 4.19. MODELO DE OPTIMIZACION DE LA RESPUESTA ANIMAL Con el fin de integrar todas las variables que componen el presente trabajo, se realizo un modelo matematico factorial para evaluar la respuesta animal a los diferentes tratamientos evaluados en el CIC Santa María, tiempo de recuperación de las praderas y tipo de manejo de las mismas El tipo de manejo y la edad óptima de recuperación de una pastura utilizada como fuente primordial de alimento para la producción en un sistema de lechería especializada en trópico Alto Colombiano, regularmente se realiza por métodos empíricos o por costumbre de los encargados del sistema, lo cual no garantiza la utilización de la pastura en el mejor momento de su calidad nutricional, de tal forma que se logre la optimización de la producción de leche. Debido a lo anterior, se planteo un diseño factorial en el que se evalúa la producción de leche por hectárea variando la edad de recuperación del pasto y el manejo de los potreros (renovados y no renovados). 4.19.1. Identificación, respuesta, factores y niveles Respuesta: Producción de leche en Litros /hectárea Factores: a- Edad de recuperación del potrero ( Tiempo transcurrido entre el pastoreo de un potrero y su próxima utilización) b- Tipo de manejo (si el potrero fue renovado o no) Renovación de un potrero: procedimiento por el cual se da aireación del potrero con un implemento agrícola denominado cincel y se procede a abonar y encalar. Niveles: a. La edad se manejo a tres niveles: A. 45 días B. 52 días y C. 59 días 132 b. El tipo de manejo dos niveles A. No renovado B. Renovado Clasificar los factores y justificar A. Edad de recuperación: En la práctica dependiendo de la cantidad de animales y la capacidad de recuperación del potrero usualmente se pastorean desde un mínimo de 45 días hasta 59 días, sin que haya un criterio adecuado de uso B. Tipo de manejo Se cree que la renovación de l potrero mejora la calidad pero no ha sido corroborado con datos de calidad nutricional aplicando el modelo Cornell, usado en el presente estudio 4.19.2. Planteamiento del diseño y modelo estadístico. Para el caso en que se tienen tres niveles se realizó una doble comparación de dos niveles A- Tiempo 45 y 52 días Tipo: No renovado y renovado. B- Tiempo 45 y 59 días Tipo: No renovado y renovado Para cada comparación estadísticamente se trabajo un Diseño factorial 2 2 Modelo: El modelo de regresión planteado para predecir la desviación de la producción de leche fue: Lineal múltiple con interacción, de la forma: Y= βo + β1*X1+ β2*X2+ β1*X1*X2 + Є 133 Donde: Y: Y estimado (producción de leche en litros / hectárea día) βo : β1*X1 Media : Efecto del factor tiempo de recuperación β2*X2: : Efecto del factor tipo de manejo β1*X1*X2 Efecto de la interacción e la interacción entre tiempo de recuperación y Tipo de manejo Usualmente los parámetros desconocidos βi se denominan coeficientes de regresión Є: constituye la componente aleatoria del modelo. Representa el efecto de aquellos factores que no se han tenido en cuenta en la experimentación o el efecto de aquellos presentes en el estudio pero que no se han podido estar adecuadamente con el modelo seleccionado. el error 4.19.3. Justificación del modelo. El modelo describe la producción de leche como dependiente de dos factores el primero de ellos el tiempo de recuperación de la pradera y el segundo tipo de manejo de la misma, es decir de acuerdo al problema analizado se asume que el investigador cree que los dos principales factores que tienen que ver con la producción de leche por hectárea por día en la explotación son estos dos. Aquellos efectos que pueden influir la Producción de leche que no están siendo estudiados estarán dentro de la componente aleatoria o el error Є. 134 Si el error es mayor a la componente sistemática significará que los factores seleccionados no son apropiados para describir la variabilidad de la producción de leche 4.19.4.Supuestos del modelo: Se parte de unos supuestos en el modelo los cuales deben ser verificados con el fin de comprobar la idoneidad del mismo y son: a. El valor esperado de los residuos debe ser igual a cero E (e) = 0 Al ajustar cualquier modelo lineal, el análisis de los residuos del modelo de regresión es necesario para determinar la idoneidad del modelo ( Montgomery, 1991) b. La varianza de los residuos debe ser constante V(e)= Varianza= constante c. La correlación de los residuos debe ser cero Correlación (ei; ej) = 0 d. Los residuos deben corresponder a una distribución normal Cálculos de los factoriales. Datos originales: La tabla 32 presenta los datos originales de producción de leche de acuerdo a los días de recuperación y la condición de potrero: renovado o sin renovar 4.19.5. Caso 45 a 52 días Para el primer caso 45 a 52 días se establecieron las siguientes codificaciones 135 FACTORES A (EDAD) -1 1 Días 45 52 B ( t manejo) -1 1 NR R Tabla 32. Datos de producción de leche; respuesta obtenida de acuerdo a cada una de las condiciones experimentales establecidas EDAD DE RECUPERACION (días) 45 45 45 45 45 45 52 52 52 52 52 52 59 59 59 59 59 59 TIPO DE MANEJO R R R NR NR NR R R R NR NR NR R R R NR NR NR Producción de leche (Kg./Ha/Día) 23,93 26,76 26,13 13,29 12,73 15,73 24,72 27,85 17,06 17,59 19,13 19,35 27,08 29,36 35,08 18,73 23,09 22,84 NR: No renovado R: Renovado La tabla 32 muestra la matriz de diseño factorial 22 y los respectivos cálculos. Cada condición experimental contó con tres replicas Y11, Y22, Y33, se calcularon los promedios y la varianza, posterior a ello se calculó el valor de los efectos y se estableció la hipótesis. Se puede observar que para la condición experimental 136 renovado y 52 días, su tercera replica genera una varianza muy alta, seria importante evaluar si hay algún problema de muestreo con este dato. La comprobación de los supuestos del modelo de optimización de la respuesta animal se encuantra en el anexo K. Hipótesis: Ho: EFhat = 0 La tabla 33 presenta el valor estimado de los efectos EF hat. Igualmente se calculó el S pool (varianza residual) SR2 Con este valor se calcula al valor estimado de los efectos VEF hat VEF hat = 4SR2/N y el nivel de significancia de los efectos Tabla 33. Matriz de diseño, cálculos para estimar el valor de los factores EFECTOS I 1 1 1 1 A -1 1 -1 1 B -1 -1 1 1 AB 1 -1 -1 1 Y11 13,29 17,59 23,93 24,72 Y12 12,73 19,13 26,76 27,85 Y13 15,73 19,35 26,13 17,06 y PROM VARIANZA A 13,92 2,54 -13,92 18,69 0,92 18,69 25,60 2,21 -25,60 23,21 30,82 23,21 81,42 2,38 137 B -13,92 -18,69 25,60 23,21 16,20 AB 13,92 -18,69 -25,60 23,21 -7,17 Tabla 34. Estimación de los efectos y su significancia FUENTE EF hat MEDIA 20,36 EDAD 1,19 TIPO DE MANEJO 8,10 V EF hat Grados de liberdad N-C 3.0407 12-4= 8 T crítico Tc= t8;95% A dos colas Tc = 2.30 Tcalculado P value 0,6814 0,514873 4,6457 0,001654 -2,0562 0,073791 -3,59 NTERACCION A*B La tabla 34 muestra el nivel de significancia de los valores. La media siempre es significativa; Para el caso del efecto del Factor edad de recuperación, no se encontró diferencias estadísticamente significativos (p>0.05). Esto también puede ser corroborado por dos formas adicionales a. El t calculado es menor al t critico lo que significa que el valor es frecuente, por tanto no es significativo b. Al establecer los intervalos de confianza para este efecto Tiempo Intervalo de confianza= EF hat ± 2 SEF hat Los Intervalos de confianza que no contienen cero son estadísticamente significativos 138 Tabla 35. Intervalos de confianza de los efectos FUENTE MEDIA Efecto A Efecto B Efecto AB EF hat 20,36 1,19 8,10 -3,59 Intervalo de confianza ( ) -4,85245 7,22876 si cero 2,060356 14,1416 no cero -9,6262 2,45502 si cero Para el caso del Efecto tipo de manejo se encontró que era estadísticamente significativa (p<0.05) y para el efecto interacción A*B no presenta diferencias significativas (p>0.05). Explicando los resultados se puede establecer que el uso de la pastura a un mayor tiempo de recuperación entre 45 a 52 días no presenta ningún efecto, pero que la renovación del potrero este presenta efectos positivos sobre la producción de leche 4.19.6.Caso 45 a 59 días Para el primer caso 45 a 59 días se establecieron las siguientes codificaciones FACTORES A (EDAD) Días B ( t manejo) Las tablas -1 45 -1 NR 1 59 1 R 36, 37 y 38 utilizando el mismo esquema de cálculo y análisis presentan los resultados del análisis factorial. 139 Tabla 36. Matriz de diseño, cálculos para estimar el valor de los factores EFECTOS CE 1 2 3 4 y A B AB Y11 Y12 Y13 PROM VARIANZA A B 1 -1 1 1 13,29 12,73 15,73 13,92 2,54 13,92 13,92 1 1 1 -1 18,73 23,09 22,84 21,55 5,99 21,55 21,55 1 -1 1 -1 23,93 26,76 26,13 25,60 2,21 25,60 25,60 1 1 1 1 27,08 29,36 35,08 30,51 17,02 30,51 30,51 91,59 12,54 20,64 I AB 13,92 21,55 25,60 30,51 -2,73 Tabla 37. Estimación de los efectos y su significancia FUENTE EF hat MEDIA 22,90 EDAD 6,27 TIPO DE MANEJO INTERACCIO N A*B V EF hat Grados de liberdad N-C 12-4= 8 2,313 T crítico Tc= t8;95% A dos colas Tc = 2.30 P value 4,1223 0,0033 10,32 6,7861 0,0001 -1,37 -0,8981 0,3954 La tabla 37 muestra el nivel de significancia de los valores. La media siempre es significativa. 140 Tcalculado Para el caso de los efecto de los Factores A. edad de recuperación, y B Tipo de manejo se encontraron diferencias estadísticamente significativos (p<0.05). Esto también puede ser corroborado por dos formas adicionales a. El t calculado es mayor al t critico lo que significa que el valor es infrecuente, por tanto es estadísticamente significativo b. Al establecer los intervalos de confianza para los efecto Tiempo y tipo de manejo Intervalo de confianza= EF hat ± 2 SEF hat Tabla 7 Los Intervalos de confianza que no contienen cero son estadísticamente significativos. Tabla 38. Intervalos de Confianza de los efectos FUENTE EF hat Intervalo de confianza MEDIA 22,90 ( ) Efecto A 6,27 1,001 11,538 no cero Efecto B 10,32 5,0522 15,589 no cero Efecto AB -1,37 -6,6343 3,9026 si cero 4.19.7. Análisis de los resultados Los resultados de la valoración del factorial con dos edades 45 y 59 días y dos tipos de manejo No recuperado y recuperado, muestra que estos dos factores son estadísticamente significativos, mientras que el efecto de la interacción no es significativo. En la práctica significa que al modificar la edad y renovar los potreros se encuentran resultados positivos en el aumento de la producción de leche por hectárea día para el tipo de pasto evaluado. 141 4.19.8. Definición del modelo. De acuerdo al modelo planteado: Y= βo + β1*X1+ β2*X2+ β1*X1*X2 + Є Utilizando los resultados estadísticos se excluye de la componente sistemática al termino correspondiente a la interacción, el único que no fue estadísticamente significativo (p>0.05). De estas formas se estableció el modelo en: MODELO Y=22,90 +6,27A +10,32 B Debido a que al establecer los niveles a los respectivos factores se tienen dos niveles al pasar de -1 hasta 1 los términos de los factores se dividen en dos El Modelo ajustado queda así: MODELO AJUSTADO Y=22,90 +3,13A +5,16 B 4.19.9. Decodificación del Modelo Como el modelo esta codificado se procedió a decodificarlo. El modelo final decodificado fue: Yhat = 15.47 + 0.8957*A + 5.16* B La interpretación del modelo es que al aumentar la edad de recuperación de 45 a 59 días se incrementa la producción en 0.8957 litros de leche por hectárea por día, mientras que el renovar los potreros como factor de manejo de la pastura aumenta la producción de leche en 5,16 litros /ha /día. 142 CONCLUSIONES Y RECOMENDACIONES Según la producción de biomasa por unidad de tiempo, el modelo matemático de crecimiento que mejor ajustó en las praderas del CIC Santa María fue el de Gompertz en época de lluvias. El modelo Gompertz, ajusta sobre su forma natural presentada con el software Curve Expert, el cual determina sus propios parámetros de a, b y c, presentando mayor relación de los datos observados y los esperados. De acuerdo al modelo sigmoideo, el peso al punto de inflexión se definió a los 33 días de rebrote, momento en el cual la pradera obtiene su crecimiento exponencial. Debido a las difíciles condiciones climáticas que se presentaron durante el desarrollo del proyecto como precipitaciones excesivas que ocasionaron inundaciones en las praderas; los resultados obtenidos para la definición de los modelos de crecimiento no fueron los más adecuados, por ende, se realizaron comparaciones con modelos ya descritos y definidos con Curve Expert. Con la implementación del SAS como herramienta estadística, se logro manipular la información obtenida del fraccionamiento de carbohidratos y proteínas de manera racional, obteniendo así, resultados con interacción sobre la edad de desarrollo y tipo de manejo. En la interacción de la edad de desarrollo con el tipo de manejo, se obtuvieron diferencias significativas (P < 0,05) en las fracciones de FDN y Hemicelulosa, aunque esta ultima no sea valorada por el CNCPS. 143 Con base a la edad de desarrollo, se obtuvieron diferencias significativas (P< 0,05) en las fracciones de Proteína Cruda (Pc), FDN, Celulosa y Hemicelulosa, lo que en la práctica significa que estas fracciones se modifican notablemente en la medida que la edad de la pastura avanza. Dependiendo del tipo de manejo que se le dio a las pasturas como renovación y no renovación, se encontraron diferencias significativas (P< 0,05) en las fracciones de Proteína Cruda (Pc), P A (NNP), Proteína B2, Proteína B3, Proteína C, Hemicelulosa y Sílice, lo que refleja una clara variación en los contenidos de las diferentes fracciones de nitrógeno y compuestos de la pared celular de las plantas, haciendo de estas praderas forrajes con limitantes nutricionales teniendo en cuenta practicas de renovación de praderas. La simulación predijo, un balance nutricional adecuado, basado en los niveles de MUN y la producción de leche predicha por EM y PM. No se formularon suplementos, ya que la respuesta animal fue adecuada en un hato lechero bajo estas condiciones de pastoreo, lo que en términos prácticos refleja de las praderas del CIC Santa María, un manejo acorde de praderas con periodos de recuperación y manejo óptimos. Existe un dato atípico en la ultima replica de la condición experimental renovado y 52 dias el cual incremento la varianza, es importante revisar si hay problemas de muestreo Se encontraron efectos significativos para la edad de recuperación y el tipo de manejo en las pasturas, en términos prácticos realizar tratamiento de renovación de las pasturas y utilizarla a una edad de 59 días para obtener mayor producción de leche 144 El modelo final decodificado fue: Yhat = 15.47 + 0.8957*A + 5.16* B lo que significa que renovar los potreros incrementa la producción de leche en 5,16 litros /ha/día. y permitir un periodo de recuperación del potrero más prolongado hasta los 59 días, incrementa la producción en 0.8957 litros /ha/día. El modelo de regresión lineal múltiple con dos variables cumplió con los supuestos que determinan la idoneidad del modelo a excepción de la distribución de la varianza homogénea que no se pudo validar por poco número de datos Al realizar el análisis de varianza para validar el modelo de regresión lineal múltiple se encontró que este modelo no es el mejor y que podría estar mejor representado por un modelo de segundo orden, es decir presentar curvatura lo que puede señalar que se esta cerca de un óptimo. Como se sospecha de presencia de curvatura, modelo de segundo orden se recomienda desarrollar un diseño como el composite desing el cual serviría para definir un optimo, máximo producción de leche /ha/día Del análisis de los supuestos se detecto que es importante la aleatorización del orden de muestreo de los potreros en cada una de las fechas de valoración por que es posible que por cansancio si siempre se inicia por los mismos potreros al final existirá un error repetido en los datos 145 BIBLIOGRAFIA Ainslie, S. J., Fox D.G., Perry T.C., Ketchen D.J. and Barry M. C.1993 J. Anim. Sci. 71: 1312-1319. Andersen, R. y Sower J. A. 1968. Optimum condition for bonding of plant phenols to insoluble polyvinylpyrrolidone. Phytochem, 7:293-301. Andrew, S.M., Waldo D.R., Erdman, R,A. 1994. Direct analysis of body composition of dairy cows at three physiological stages J. Dairy Sci 77,3022-3033. AOAC. 1995. Oficial methods of analyses 965,16 of the asocciation of oficial agricultural chemists (AOAC) 16 th edition. AOAC internation suite 400, 2200 wilson boulevard Arlington Virginia 22201-3301 USA. Arreaza Luis Carlos. 2002. Manejo de la proteína en la producción del Ganado bovino, fraccionamiento de la proteína cruda e indicadores en la formulación de raciones para rumiantes. Arreaza Luis Carlos. 2004. Utilización del sistema CNCPS como herramienta de soporte para la investigación en forrajes tropicales, programa de fisiología y nutrición animal, CI Corpoica, Tibaitatá. Balcells J., Guada J.A., Castrillo C. y Gasa J. 1993. Brit. J. Nutr. 69: 721-732. Bernal, Eusse Javier. 2003. Pastos y forrajes tropicales. Pastos clima frío. 4 Edición. P. 529- 540. Bladen, H.A.M.P. Bryant y R.N. Doetach. 1961. A study of bacterial species fron the rumen which produce ammonia fron protein hydrolizate appl microbial 9:175 146 Blanco Gloria Milena, Chamorro Diego R, Arreaza Luis Carlos. 2005. Predicción de la respuesta productiva en bovinos lecheros suplementados con ensilaje de Sambucus Peruviana, Acacia Decurrens y avena sativa usando el modelo cornell net carbohydrate and protein system (CNCPS). Revista Corpoica vol 6, # 2. Blaxter, K. L. 1986. An historical perspective: The development of methods for assessing nutrient requirements. Proceedings of the Nutrition Society, 45: 177-183. Blümmel, M. and Becker, K. 1997. The degradability characteristics of fiftyfour roughages and roughage neutral-detergent fiber as described by in vitro gas. Blümmel, M., Makkar H. P. S., Chisanga G., Mtimuni J. and Becker K. 1997. The prediction of dry matter intake of temperate and tropical roughages from in vitro digestibility/gas production data, and the dry matter intake and in vitro digestibility of African roughages in relation to ruminant live weight. Animal Feed Science Technology, 69: 131-141. Bruni, M. A. and Chilibroste P. 2000. Simulación de la digestión ruminal por el método de la producción de gas. Congreso de la Asociación Latinoamericana de Producción Animal (ALPA). Bueno, I. C. S., Adbala A. L., Cabral S. L. S., Vitti D. M. S. S., Owen E., Mauricio R. M., Givens I., Sutton J. D. and Mould F. L. 1999. Comparison of inocula from sheep and cattle for the in vitro gas production technique under tropical conditions. Proceedings of the British Society of Animal Science, Scarbouroug, UK. p. 151. 147 Cacho, O. J. 1993. A practical equation for pasture growth under grazing. Grass and forage science vol 48 p 387 – 394. Canfield, P. J., B. A. Barton, G. W. Anderson and R. D. Smith. 1990. Effects of excess degradable protein on postpartum reproduction and energy balance in dairy cows. S. Dairy Sci. Carrol, D. J., B. A. Borton G. W. Anderson and R. D. Smith. 1988. Influence of protein intake and feeding strategy and reproductive performance of dairy cow. S. Dairy Sci. Castellanos Peña Francisco. 1998. Importancia del nitrógeno ureico de la leche como índice para evaluar la eficiencia productiva y reproductiva de las vacas lecheras. Ed Purina, Colombia S. A. Cuesta, A y Laredo, M.A. 1988. Amonificacion de subproductos agrícolas, En: Gabado de doble propósito CRECED-PNR, La dorada pàg 230-246. Cuesta, A y Laredo, M.A. 1988. Tabla de contenido nutricional en pastos y forrajes de Colombia ICA-Colanta. Segunda edición corregida en Bogotá. Czerkawski, J. W. and Breckenridge G. 1977. Design and development of a long-term rumen simulation technique (Rusitec). Br. J. Nutr., 38: 371- 383. D. C. Church, W. G. Pond and K. R. Pond. 2002. Fundamentos de nutrición y alimentación de animales. 2 ed. D. G. Fox, C. J. Sniffen, J. D. O'Comor, and P. J. Van Soest. 1992. System for Requirements J. B. Russell A Net Carbohydrate and Protein Evaluating Cattle Diets: III. Cattle v and Diet Adequacy' J. Anim. Sci. 70:3578-3596 148 Davies, Z. S., Brooks E., Theodorou M. K., Griffith G. W. and Merry R. J. 1999. Effect of inoculant and enzyme aditives on fermentation characteristics and gas production of grass silage. Proceedings of the British Society of Animal Science, Scarbouroug, UK. p. 145. Deaville, E. R. and Givens D. I. 1998. Estimation of rumen degradable organic matter of forages using different techniques. Proceedings of the British Society of Animal Science. Scarborough, p. 57. Estrada Álvarez Julián. 2001. Pastos y forrajes para el trópico colombiano. Cuantificación de los forrajes. p. 417-426 Ferguson, J. D. and W. Chalupa. 1989. Impact of protein nutrition and reproduction in dairy cows. S. Dairy Sci. Flatt, W. P. Feed evaluation Systems. 1988. Historical Background. World Animal Science. Disciplinary Approach B4. (Edited by E. R. Ørskov). Elsevier Science Publishers. pp. 1-22. Fox, D.G. L.O. Tedesschi T.P. Tylutky J.B. Russell, M.E.Amburgh, L.E. Chace A.N. Pell, T.R. Overton. 2004. The cornell carbohydrate and protein system model for evaluating herd nutrition and nutrient excretion. Anim Feed Sci . Technol. 112, 29-78 Fox, D.G. L.O. Tedesschi T.P. Tylutky J.B. Russell, M.E.Amburgh, L.E. Chace, Overton, A.N. Pell, T.R. Russell J.B. 2000. The net carbohydrate and protein system for evaluating herd nutrition and nutrient excretion . Model documentation Mimeo No 213, Animal science Department, Cornell University, Ithaca N.Y. 149 Gerson, T., King A. S. D., Kelly K. E. and Kelly W. J. 1988. Influence of particle size and surface area on in vitro rates of gas production, lipolysis of triacylglycerol and hydrogenation of linoleic acid by sheep rumen digesta or Ruminococcus flavefaciens. J. agric. Sci., 110: 31-37. GILLE U. W. E. , 2004 Analysis of growth. En www.uni-leipzig. de/~vetana/growthe.htm Consultado en mayo 5 de 2007. Goering, H.K. and Van Soest P.J. 1970. Forage fiber analyses. Agricultural Handbook n°379. Agricultural Research Service. US Department of Agriculture, Washington D.C. Guada J. A. 1996. Madrid. XII Curso de especialización FEDNA, características del sistema de cornell (CNCPS) como modelo de valoración proteica y energética para rumiantes, departamento de producción animal y ciencia de alimentos de la universidad de Zaragoza. Hammond C. Andrew. 1998. Use of BUN and MUN as guides for protein and energy supplementation in cattle. Revista Corpoica, Vol 2 # 2, junio. Hungate, R.E. 1966. The rumen and its microbes. Academic Press. New York. IFRU (International Feed Resources Unit). A Report 1991-1997. Rowett Research Institute. Aberdeen, UK. p. 7,1997. J. B. Russell, J. D. O’Connor, D. G. Fox, P. J. Van Soest, C. J. Sniffen. Cornell University, Ithaca, 1992. A net carbohydrate and protein system for evaluation cattle diets: I Ruminal Fermentation. 150 Jones, D. I. H. and Hayward, M. Y. 1975. The effects of pepsin pre-treatment of herbage on the prediction of dry matter digestibility from solubility in fungal cellulase solution. J. Sci. Food Agric., 26: 711-718. Leng, R.A. 1990 Factors affecting the utilization of poor quality forages by ruminants particulary under tropical conditions . Nutrition research reviews, 3: 277303. Licitra, G., T. M. Hernandez, and P. J. Van Soest. 1996. Standardization of procedures for nitrogen fractionation of ruminant feeds. Anim. Feed Sci. Technol. 57:347-358. Ling, J.R and P.J. Buttery. 1978 the simultanens use of ribonucleic acid di omino pimelico acid and amino ethylphosphoric acid as markers of microbial nitrogen at the duodenum of ships B.R. J. NUTR 39:185. Mauricio, R. M., Mould F. L., Owen E., Dahona M. S. and Theodorou M. K. 1999. Effect of reducing the interval of recording from three to one hour on gas production profiles in the semiautomated technique using a presure transducer. Proceedings of the British Society of Animal Science, Scarbouroug, UK. p. 148. Mehrez, A.Z. and Orskov , E.R. 1977. J. agri. Sci., Comb 88, 645-650. Menke, K. H. and Steingass H.1988. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid. Animal Research and Development. Vol. 28, pp. 7-55. Menke, K. H., Raab L., Salewski A., Steingass H., Fritz D. and Schneider W. 1979. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro. J. agric. Sci., 93: 217-222. 151 Milligan, R.A; Chace L.E. Sniffen C.J., Knon blauch W.A. 1981, L.E.A. st , Cost balanced dayri ration ani Sci mimeo 54. Connell University Ithaca. NRC. 2000. Nutrient Requirements for Beef Cattle (7th Ed.). National Academy Press, Washington, DC. NRC. 2001. Nutrient Requirements for Beef Cattle (8th Ed.). National Academy Press, Washington, DC. O'Connor, C. J. Sniffen D. G. Fox and W. Chalupa. 1993. A Net Carbohydrate and Protein System for Evaluating Cattle Diets: IV. Predicting Amino Acid Adequacy J. Anim. Sci.. 71:1298-1311. Ørskov, E. R. 1988. Nutrición proteica de los rumiantes. Ed Acribia. Ørskov, E. R. 1993. Appropriate roughage evaluation systems and its relevance to upgrading, and supplementation and evaluation of animal potential. In: Increasing livestock production through utilization of local resources. Proceedings of the International Conference on Increasing Livestock Production through Utilization of Local Resources. October 18-22. Beijing, China. Bureau of Animal Production and Health. Ministry of Agriculture. Ørskov, E. R., Hovell F. D. Deb. and Mould F. L. 1980. The use of the nylon bag technique for the evaluation of feedstuffs. Tropical Animal Production, 5: 195-213. Ørskov, E. R., Reid G. W. and Kay M. R. 1988. Prediction of intake of cattle from degradation characteristics of roughages. Animal Production, 46: 29-34. 152 Ørskov, E. R.1997. Feed evaluation with emphasis on fibrous roughages and fluctuating supply of nutrients: a review. Small Ruminant Research, 28, pp. 1-8, 1998. production and their relationship to voluntary feed intake. British Journal of Nutrition, 77: 757-768. Pedraza, Oliviera Redimio. 2001. Estimación del valor nutritivo de los alimentos para rumiantes con énfasis en las técnicas in sacco y de producción de gas in vitro, vol 13 No 1 2001:46. Pirt, S.J. 1965. Proceedings of the Royal Society of London, Ser. B, 163: 224-231. Pitt R.E., Van Kessel J.S., Fox D.G., Pell A.N., Barry M.C. and Van Soest P.J. 1996. J. Anim. Sci. 74: 226-244. Quin, J.I. Van der wath, J.G and Myberg. 1938, Ondersteport, J. vet Sci anim ind II, 341-360. Ramírez, Roque Gonzalo. 2003. Nutrición de rumiantes, sistemas extensivos. Ed trillas. Restrepo, Mauricio López. 2007. Herramientas de Modelación. Facultad de Ingeniería Universidad de la Sabana. 60 p. Russell, J.B. and Baldwin R.L. 1979. Appl. and Environ. Microbiol. 37: 537-543. Russell, J.B. and Dombrowski D.B. 1980. Appl. and Environ. Microbiol. 39: 604 - 610. Russell, J.B. and Strobel H.J. 1993. Quantitative aspects of Ruminant Digestion and Metabolism Ed. J.M. Forbes, J. France. CAB International. Wallingford, UK. pp.165-186. 153 Russell, J.B., C.J. Sniffen and P.J. Van Soest. 1983, effect of carbohydrate limitation on degradation and utilitation of casein by mixed rumen bacteria , dary Sci 67:987. Russell, J.B., O'connor J.D., Fox D.G., Van Soest P.J. and Sniffen C.F. 1992. J. Anim. Sci. 70: 3551-3561. Rymer, C. and Givens D. I. 1999. Predicting the apparent disappearance of starch in the rumen of cows from the in vitro gas production profile of their diet. Proceedings of the British Society of Animal Science, Scarbouroug, UK. p. 157. Schofield, P. and Pell A. N. 1995. Measurement and kinetic-analysis of the neutral detergent-soluble carbohydrate fraction of legumes and grasses. J. Anim. Sci., Vol. 73, pp. 3455 – 3463. Serrano, Jason Torres. 2000. Modelos de simulación aplicados al análisis de la función de crecimiento en la producción de carne de cerdo.. Universidad Nacional de Colombia Facultad de Medicina Veterinaria y de zootecnia Tesis de grado Zootecnia Bogota D.C. 200p. Sniffen, C.J. and Robinson P.H. 1985. Dairy Sci. 70: 425-441. Sniffen, C.J., O'connor J.D., Van Soest P. R., Fox D.G. and Russell J.B. 1992. J. Anim. Sci. 70: 3562-3577. Sniffen, J. D., O'Connor P. J., Van Soest D. G, Fox, and J. B. Russell. A Net Carbohydrate and Protein System for Evaluating Cattle Diets: 11. Carbohydrate and Protein Availability J. Anim. Sci. 1992. 70:3562-3577. 154 Stefanon, B., Pell A. N. and Schofield P. 1996. Effect of maturity on digestion kinetics of watersoluble and water-insoluble fractions of alfalfa and brome hay. J. Anim. Sci., Vol. 74, No. 5, pp. 1104 – 1115. Strobel, H.J. and Russell J.B. 1986. J. Dairy Sci. 69: 2941-2947. Talero, C. y Afanador. 2004. Modelos matemáticos no lineales para el análisis de la curva de crecimiento sigmoidal y de la producción de pollas Isa Brown, a partir de la décima semana de edad, en condiciones del trópico alto Colombiano. Tesis de grado Zootecnia Facultad de Medicina Veterinaria y zootecnia Universidad Nacional de Colombia Bogotá. Tamminga, S. 1979 .Protein degradation in the forest machs off rumiants. J Any Sci 49 : 1615. Theodorou, M. K., Willians B. A., Dhaona M. S., Mcailan A. B. and France J. 1994. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminants feeds. Animal Feed Science and Technology, 48: 185-195. Tilley , J. and Terry, K. 1963. A two stages techniques for the in vitro digestion of forage crops: Journal of the British Grassland Society 18(2):131-163. Traxler, M.J.; Fox D.J. , Van Soest P.J. , Pell and Blas Cano C.E., Llana D.P.D. Maure, J.E., R.P. Llana, M. Velez and Florez. 1998, Predicting forage indigestible FDN fron lignine concentration . J. ani Sci 76:1469-480. Van Houtert M.F.J, and Sykes A.R. 1999. Enhancing the Profitability of Pasturebased Dairy Production in the Humid Tropics through Improved Nutrition. Preventive Veterinary Medicine , no. 38: 147-57. 155 Van Soest, P. J. 1967. Development of a comprehensive system of feed analysis and its application to forages. J. Anim. Sci., 26: 119. Van Soest, P. J. 1983. Nutritional Ecology of the Ruminant. O & B Books, Inc. Corvallis, Oregon. USA, p. 76-78,105, 231, 236. Van Soest, P. J. Nutritional Ecology of the Ruminant. 1994. Second Edition. Cornell University Press, Ithaca, N. Y., USA. 476p. Van Soest, P. J. and Robertson J. B. 1985. Analysis of forages and fibrous foods. A Laboratory Manual for Animal Science 613. Report of Research of the Cornell University Agricultural Experiment Station. pp. 2-3, 35. Van Soest, P. J., J. B. Robertson, and B. A. Lewis. 1991. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J. Dairy Sci. 74: 3583-3597. Van Soest, P. J., Mertens D. R. and Deimum B. 1978. Preharvest factors influencing the voluntary feed intake of forages. J. Anim. Sci., 47: 712-721. Van, Soest P. J. 1994. Nutritional Ecology of the Ruminant (2nd Ed.). Cornell University Press, Ithaca, NY. Weiss, W.D. 1993. Predicting energy valves of feeds J.Dairy Sci 76:1802-1811. 156 ANEXOS 157 ANEXO A Pruebas de homogeneidad e independencia (Periodo de Lluvias) Prueba de Homogeneidad Edad (días) PRADERAS 5 6 7 8 9 10 7 6 3 5 1 2 4 15 13 10 14 7 8 9 22 20 18 19 11 15 12 30 24 22 26 21 17 16 37 30 28 33 27 25 23 44 38 35 39 32 31 29 52 42 41 45 37 36 34 59 Suma de posiciones RJ 47 46 48 44 43 40 COMBINADOS 220 203 229 180 177 167 1176 Promedio de posiciones Total de datos 27,5 25,38 28,63 22,5 22,13 20,88 8 8 8 H 2 X 8 2,02 (gl,alfa) gl 5 0.05 11,07 0.25 12,83 0.01 15,08 158 8 8 147 48 Prueba de Independencia FRECUENCIAS OBSERVADAS Días/Biomasa 1-120 121-240 241-360 1 , 22 18 0 0 18 23-44 9 9 0 18 45-59 0 9 3 12 27 18 3 48 FRECUENCIAS ESPERADAS 10,13 6,75 1,13 10,13 6,75 1,13 6,75 4,50 0,75 X2 tabla (gl alfa) gl 5 0.05 11,07 0.025 12,83 0.01 15,08 ESTIMADO X2 6,13 6,75 1,13 0,13 0,75 1,13 6,75 4,50 6,75 159 ANEXO B Pruebas de homogeneidad e independencia (Periodo de Sequia) Prueba de Homogeneidad Edad (días) PRADERAS 5 6 7 8 9 10 7 6 4 9 1 2 3 15 17 14 18 5 7 8 22 20 22 21 10 12 11 30 26 25 27 13 16 15 37 32 31 34 19 24 23 44 38 40 41 28 30 29 52 42 45 44 33 36 35 59 46 47 48 37 43 39 COMBINADOS Suma de posiciones RJ 227 228 242 146 170 163 1176 Promedio de posiciones Total de datos 28,375 28,5 30,25 18,25 21,25 20,375 8 8 8 8 H 5,33 2 X (gl,alfa) Gl 5 0.05 11,07 0.25 12,83 0.01 15,08 160 8 8 147 48 Prueba de Independencia FRECUENCIAS OBSERVADAS Días/Biomasa 1-120 121-240 241-360 361-480 481-600 1 , 20 12 0 0 0 0 12 21-40 12 6 0 0 0 18 41-60 0 5 8 4 1 18 24 11 8 4 1 48 FRECUENCIAS ESPERADAS 6,00 2,75 2,00 1,00 0,25 9,00 4,13 3,00 1,50 0,38 9,00 4,13 3,00 1,50 0,38 ESTIMADO X2 6,00 2,75 2,00 1,00 0,25 1,00 0,85 3,00 1,50 0,38 9,00 0,19 8,33 4,17 1,04 X2 tabla gl 0.05 0.025 0.01 (gl alfa) 5 11,07 12,83 15,08 161 ANEXO C Pruebas de homogeneidad e independencia (Praderas Renovadas y No Renovadas) 1. Praderas Renovadas (Periodo de Lluvias) Prueba de Independencia EDAD REBROTE 5 6 7 7 32,55 24,78 31,78 15 62,71 58,76 65,78 22 85,62 77,67 78,85 30 110,28 98,78 115,89 37 145,87 135,27 156,78 44 187,54 178,89 191,08 52 214,34 205,78 223,76 59 255,76 245,87 267,78 FRECUENCIAS OBSERVADAS Dias/Biomasa 1-120 121-240 241-360 1 - 22 9 0 0 9 23 - 44 3 6 0 9 45 - 59 0 3 3 6 12 9 3 24 FRECUENCIAS ESPERADAS 3,38 0 0 1,13 2,25 0 0 0,75 0,75 162 ESTIMADO X2 9,38 0,00 0,00 3,13 6,25 0,00 0,00 6,75 6,75 X2 tabla (gl alfa) gl 2 0.05 15,59 0.025 11,98 0.01 13,81 Prueba de Homogeneidad EDAD REBROTE 5 6 7 a b c 7 32,55 24,78 31,78 15 62,71 58,76 65,78 22 85,62 77,67 78,85 30 110,28 98,78 115,89 37 145,87 135,27 156,78 44 187,54 178,89 191,08 52 214,34 205,78 223,76 59 255,76 245,87 267,78 EDAD REBROTE a b c 7 3 1 2 15 5 4 6 22 9 7 8 30 11 10 12 37 14 13 15 44 17 16 18 52 20 19 21 59 23 22 24 163 SUMA RJ 102 PROMEDIO 92 106 300 12,75 11,5 13,25 38 TOTAL DATOS 8 8 H 0,26 X^2 (gl,alfa) gl 2 0,05 15,59 0,025 11,98 0,01 13,81 8 24 2. Praderas No Renovadas (Periodo de Lluvias) Prueba de Independencia EDAD REBROTE 8 9 10 7 18,82 21,78 25,76 15 43,23 45,47 46,54 22 60,54 66,15 68,78 30 87,78 77,23 61,78 37 115,89 110,42 108,78 44 155,87 151,89 145,67 52 182,89 182,78 161,67 59 218,78 214,78 197,89 FRECUENCIAS OBSERVADAS Días/Biomasa 1-120 121-240 241-360 1 - 22 9 0 0 9 23 - 44 6 3 0 9 0 6 0 6 15 9 0 24 45 - 59 164 FRECUENCIAS ESPERADAS 3,38 0,00 0,00 2,25 1,13 0,00 0,00 1,50 0,00 ESTIMADO X2 9,38 0,00 0,00 6,25 3,13 0,00 0,00 13,50 0,00 X2 tabla (gl alfa) gl 2 0.05 15,59 0.025 11,98 0.01 13,81 Prueba de Homogeneidad 8 9 10 EDAD REBROTE d e f 7 18,82 21,78 25,76 15 43,23 45,47 46,54 22 60,54 66,15 68,78 30 87,78 77,23 61,78 37 115,89 110,42 108,78 44 155,87 151,89 145,67 52 182,89 182,78 161,67 59 218,78 214,78 197,89 165 EDAD REBROTE d e f 7 1 2 3 15 4 5 6 22 7 9 8 30 12 11 10 37 15 14 13 44 18 17 16 52 21 20 19 59 24 23 22 SUMA RJ 102 101 97 PROMEDIO 300 12,75 12,625 12,125 38 TOTAL DATOS 8 8 X2 (gl,alfa) gl 2 0.05 15,59 0.25 11,98 0.01 13,81 8 24 3. Praderas Renovadas (Periodo de Sequia) Prueba de Independencia EDAD REBROTE 5 6 7 7 44,289 42,865 59,423 15 78,660 71,357 78,989 22 100,639 107,419 102,965 30 132,785 125,650 136,852 37 210,968 201,175 235,537 44 318,535 327,775 327,915 52 356,264 405,949 397,497 59 462,133 472,236 512,648 166 FRECUENCIAS OBSERVADAS Días/Biomasa 1-120 121-240 241-360 361-480 481-600 1 - 22 9 0 0 0 0 9 23 - 44 0 6 3 0 0 9 45 - 59 0 0 0 5 1 6 9 6 3 5 1 24 FRECUENCIAS ESPERADAS 3,38 0,00 0,00 0,00 0,00 0,00 2,25 1,13 0,00 0,00 0,00 0,00 0,00 1,25 0,25 ESTIMADO X2 9,38 0,00 0,00 0,00 0,00 0,00 6,25 3,13 0,00 0,00 0,00 0,00 0,00 11,25 2,25 X2 tabla (gl alfa) gl 2 0.05 15,59 0.025 11,98 0.01 13,81 167 Prueba de Homogeneidad 5 6 7 EDAD REBROTE a b c 7 44,29 42,86 59,42 15 78,66 71,36 78,99 22 100,64 107,42 102,97 30 132,78 125,65 136,85 37 210,97 201,18 235,54 44 318,53 327,77 327,92 52 356,26 405,95 397,50 59 462,13 472,24 512,65 EDAD REBROTE a b c 7 2 1 3 15 5 4 6 22 7 9 8 30 11 10 12 37 14 13 15 44 16 17 18 52 19 21 20 59 22 23 24 SUMA RJ 96,00 98 106 PROMEDIO 12 TOTAL DATOS 8 H 2 12,25 13,25 38 8 0,14 X (gl,alfa) gl 2 0.05 15,59 0.25 11,98 0.01 13,81 168 300 8 24 4. Praderas No Renovadas (Periodo de Sequia) Prueba de Independencia EDAD REBROTE 8 9 10 7 29,825 31,491 32,132 15 43,232 45,470 46,543 22 60,537 66,151 62,862 30 69,908 77,229 73,623 37 97,526 110,415 108,936 44 183,979 197,329 197,318 52 222,394 247,107 238,234 59 314,974 358,742 327,586 FRECUENCIAS OBSERVADAS Días/Biomasa 1-120 121-240 241-360 361-480 481-600 1 - 22 9 0 0 0 0 9 23 - 44 6 3 0 0 0 9 45 - 59 0 2 4 0 0 6 15 5 4 0 0 24 FRECUENCIAS ESPERADAS 3,38 0,00 0,00 0,00 0,00 2,25 1,13 0,00 0,00 0,00 0,00 0,50 1,00 0,00 0,00 ESTIMADO X2 9,38 0,00 0,00 0,00 0,00 6,25 3,13 0,00 0,00 0,00 0,00 4,50 9,00 0,00 0,00 169 X2 tabla (gl alfa) gl 2 0.05 15,59 0.025 11,98 0.01 13,81 Prueba de Homogeneidad 8 9 10 EDAD REBROTE d e f 7 29,82 31,49 32,13 15 43,23 45,47 46,54 22 60,54 66,15 62,86 30 69,91 77,23 73,62 37 97,53 110,42 108,94 44 183,98 197,33 197,32 52 222,39 247,11 238,23 59 314,97 358,74 327,59 EDAD REBROTE d e f 7 1 2 3 15 4 5 6 22 7 9 8 30 10 12 11 37 13 15 14 44 16 18 17 52 19 21 20 59 22 24 23 SUMA RJ 92,00 106 102 PROMEDIO 12 TOTAL DATOS 8 170 300 13,25 12,75 38 8 8 24 H 0,26 2 X (gl,alfa) gl 2 0.05 15,59 0.25 11,98 0.01 13,81 ANEXO D. Linearización, parametrización y definición de los modelos evaluados durante el periodo de lluvias. 1. Modelo Gompertz Tiempo p Días 0 14,41 2,67 Curve Expert 16,55 7 25,91 2,62 0,10 3,25 28,80 8,33 28,64 7,43 15 53,75 3,13 0,06 3,98 48,60 26,50 52,40 1,82 22 72,93 2,95 0,04 4,29 70,94 3,96 78,66 32,79 30 97,99 3,73 0,04 4,58 101,41 11,71 112,45 209,15 37 128,83 5,04 0,04 4,86 131,29 6,04 143,00 200,80 44 168,49 4,42 0,03 5,13 162,96 30,59 172,60 16,91 52 195,20 4,33 0,02 5,27 199,86 21,71 203,66 71,56 59 233,48 3,75 0,02 5,45 231,63 3,41 227,63 dp/dt 1/(p)*dp/dt LN P J^2 Gompertz 14,41 16,032 P: Cantidad de biomasa en MS observada. dp/dt: Derivada de la biomasa en el tiempo. LnP: Logaritmo natural de la biomasa. Curve Expert: Estimación según Gompertz del programa curve expert. Gompertz: estimación según Gompertz con la ecuación original J^2: Error cuadrático medio. 171 J^2 34,13 82,08 Con los valores calculados de LnP y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b para el modelo matemático. 0,12 1/(p)*dp/dt 0,1 y = -0,0351x + 0,2042 R² = 0,9181 0,08 0,06 0,04 0,02 0 0 2 4 Series1 Ln P 6 Lineal (Series1) 2. Modelo Logístico. Tiempo (días) 0 14,41 p 1/(p)*dp/dt Curve Expert 20,45 J^2 Logístico J^2 14,41 0 7 25,9117 0,10 30,74 23,31 25,06 0,72 15 53,749 0,06 47,88 34,40 46,60 51,10 22 72,9348 0,04 68,65 18,39 78,70 33,25 30 97,9917 0,04 99,30 1,70 138,21 1617,60 37 128,834 0,04 131,02 4,79 215,59 7527,38 44 168,49 0,03 164,79 13,69 315,93 21738,27 52 195,203 0,02 201,82 43,76 445,53 62665,26 59 233,477 0,02 229,82 13,34 553,27 102269,71 21,91 27986,18 P: Biomasa observada (g/m2) Logístico: Modelo Logístico estimado por la ecuación original Curve Expert: Modelo logístico estimado por el programa curve expert J^2: Error cuadrático medio 172 Con los valores calculados de P (peso) y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 0,12 0,1 1/(p)*dp/dt y = -0,0003x + 0,0815 R² = 0,7299 0,08 0,06 0,04 0,02 0 0,00 50,00 100,00 150,00 200,00 250,00 Ln P Series1 Lineal (Series1) 3. Modelo Cacho. Tiempo P Modelo J^2 7 25,91 18,85 49,91 15 53,75 46,17 57,45 22 72,93 72,38 0,31 30 97,99 104,11 37,47 37 128,83 133,08 17,99 44 168,49 162,94 30,77 52 195,20 198,01 59 233,48 229,38 16,78 (días) 7,85 31,22 2 P: Biomasa observada MS (g/m ). J^2: Error cuadrático medio. Modelo: Logístico modificado por Cacho (1993). 173 ANEXO E. Linearización, parametrización y definición de los modelos evaluados durante el periodo de sequia. 1. Modelo Gompertz. Tiempo p (días) 0 19,21 7 40,00 dp/dt 1/(p)*dp/dt Curve Expert 2,77 0,07 J^2 LN P Gompertz J^2 19,59 0,15 2,96 19,21 0 32,17 61,41 3,69 31,80 67,25 15 60,71 2,90 0,05 53,74 48,50 4,11 53,44 52,88 22 83,43 2,80 0,03 80,71 7,40 4,42 80,42 9,06 30 102,67 5,16 0,05 122,93 410,43 4,63 122,47 391,90 37 160,76 11,15 0,07 171,57 116,91 5,08 170,58 96,44 44 258,81 10,03 0,04 232,49 692,61 5,56 230,35 809,86 52 311,24 9,95 0,03 318,40 51,27 5,74 313,79 6,51 59 408,05 5,99 0,01 408,47 0,18 6,01 400,31 60,01 198,41 213,42 P: Cantidad de biomasa en MS observada. dp/dt: Derivada de la biomasa en el tiempo. LnP: Logaritmo natural de la biomasa. Modelo: Estimación según Gompertz. Modelo curve expert: estimación de Gompertz según la ecuación de curve expert J^2: Error cuadrático medio. 174 Con los valores calculados de LnP y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 1/(p)*dp/dt 0,08 0,06 Series1 0,04 y = ‐0,0149x + 0,02 0,1177 R² = 0,4335 0 0 Lineal (Series1) 5 10 2. Modelo Logistico. Tiempo Curve p 1/(p)*dp/dt (días) Expert 0 19,21 22,33 J^2 Logistico J^2 9,77 19,21 0 7 40,00 0,07 33,65 40,43 27,82 148,42 15 60,71 0,05 53,25 55,55 42,64 326,29 22 83,43 0,03 78,65 22,81 62,27 447,88 30 102,67 0,05 120,40 314,03 96,78 34,76 37 160,76 0,07 170,54 95,72 143,98 281,60 44 258,81 0,04 234,42 594,82 217,79 1682,78 52 311,24 0,03 322,13 118,66 361,37 2513,10 59 408,05 0,01 406,38 592,34 33960,48 2,79 179,22 5627,90 P: Biomasa observada (g/m2) Modelo: Logístico estimado matemáticamente Modelo curve expert: logístico estimado según la ecuación de curve expert J^2: Error cuadrático medio 175 Con los valores calculados de P (peso) y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 1/(p)*dp/dt 0,08 y = ‐4E‐05x + 0,0524 R² = 0,1023 0,06 Series1 0,04 Lineal (Series1) 0,02 0 0,00 200,00 400,00 3. Modelo Cacho. Tiempo p Modelo (días) 0 19,21 J^2 7 40,00 9,48 931,77 15 60,71 36,57 582,72 22 83,43 71,88 133,30 30 102,67 123,91 450,85 37 160,76 178,63 319,35 44 258,81 241,14 312,16 52 311,24 321,23 99,88 59 408,05 398,17 97,64 418,24 Biomasa observada MS (g/m2). J^2: Error cuadrático medio. Modelo: Logístico modificado por Cacho (1993). 176 ANEXO F. Linearización, parametrización y definición de los modelos aplicados en praderas renovadas. 1. Modelo Gompertz. Tiempo p (días) 0 19,21 7 dp/dt 1/(p)*dp/dt 0,078 Curve Expert 20,943 J^2 LN P Gompertz 3,00 2,96 19,21 0 37,565 127,54 3,89 34,22 214,20 48,86 3,808 15 76,34 3,654 0,048 66,957 87,96 4,34 60,92 237,48 22 103,67 3,695 0,036 103,708 0,00 4,64 94,68 80,95 30 131,76 7,481 0,057 159,873 790,22 4,88 147,05 233,58 37 215,89 13,784 0,064 221,854 35,53 5,37 205,87 100,39 44 324,74 11,378 0,035 295,388 861,60 5,78 276,98 2281,15 52 386,57 10,506 0,027 392,083 30,39 5,96 372,51 197,80 59 482,34 7,434 0,015 485,823 12,14 6,18 467,19 229,54 278,34 P: Cantidad de biomasa en MS observada. dp/dt: Derivada de la biomasa en el tiempo. LnP: Logaritmo natural de la biomasa. Modelo: Estimación según Gompertz. J^2: Error cuadrático medio. 177 J^2 510,73 Con los valores calculados de LnP y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 1/(p)*dp/dt 0,10 0,08 y = ‐0,0188x + 0,1414 R² = 0,5652 0,06 Series1 Linea… 0,04 0,02 0,00 0,00 5,00 10,00 2. Modelo Logístico. Tiempo Curve p 1/(p)*dp/dt (días) Expert 0 19,21 25,11 J^2 Logistico J^2 34,79 19,21 0 7 48,86 0,08 39,48 87,94 30,19 348,63 15 76,34 0,05 65,28 122,32 50,00 693,69 22 103,67 0,04 99,41 18,22 76,50 738,48 30 131,76 0,06 155,55 565,91 120,96 116,79 37 215,89 0,06 221,21 28,30 174,49 1714,63 44 324,74 0,04 300,15 604,72 241,29 6963,51 52 386,57 0,03 398,25 136,53 328,51 3371,03 59 482,34 0,02 480,85 2,22 405,97 5831,55 228,705785 2825,47 P: Biomasa observada (g/m2) Modelo: Logístico estimado matemáticamente Modelo curve expert: logístico estimado con curve expert J^2: Error cuadrático medio 178 Con los valores calculados de P (peso) y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 0,1 0,08 1/(p)*dp/dt y = ‐1E‐04x + 0,0671 R² = 0,6007 0,06 Series1 Linea… 0,04 0,02 0 0,00 200,00 400,00 600,00 3. Modelo Cacho. Tiempo p Modelo (días) 0 19,21 J^2 7 48,86 15,24 229,74 15 76,34 52,91 2794,80 22 103,67 98,66 9726,48 30 131,76 162,95 26534,59 37 215,89 228,27 52078,16 44 324,74 301,00 90577,16 52 386,57 392,11 153728,08 59 482,34 478,02 228486,54 80593,65 Biomasa observada MS (g/m2). J^2: Error cuadrático medio. Modelo: Logístico modificado por Cacho (1993) 179 ANEXO G. Linearización, parametrización y definición de los modelos aplicados en praderas no renovadas. 1. Modelo Gompertz. tiempo p (días) 0 19,21 Curve Expert 2,96 13,14 J^2 Gompertz 36,83 19,21 dp/dt 1/(p)*dp/dt LN P J^2 7 31,15 1,725 0,055 3,44 21,77 87,88 23,15 63,98 15 45,08 2,136 0,047 3,81 36,97 65,82 29,08 255,93 22 63,18 1,900 0,030 4,15 56,53 44,28 36,01 738,54 30 73,59 2,829 0,038 4,30 88,23 214,32 46,75 720,11 37 105,63 8,521 0,081 4,66 126,10 419,21 59,70 2109,48 44 192,88 8,686 0,045 5,26 175,31 308,71 77,45 13323,59 52 235,91 9,393 0,040 5,46 247,61 136,78 106,47 16754,11 59 333,77 4,537 0,014 5,81 326,66 50,56 143,43 36228,31 194,915049 P: Cantidad de biomasa en MS observada. 10027,72 dp/dt: Derivada de la biomasa en el tiempo. LnP: Logaritmo natural de la biomasa. Modelo: Estimación según Gompertz. J^2: Error cuadrático medio. Con los valores calculados de LnP y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 1/(p)*dp/dt 0,1 y = ‐0,0092x + 0,0863 R² = 0,1578 Series1 0,08 0,06 0,04 Lineal (Series1) 0,02 0 0 5 180 10 2. Modelo Logístico. Tiempo Curve p 1/(p)*dp/dt (días) Expert 0 19,21 19,74 J^2 Logístico 0,28 19,21 J^2 7 31,15 0,06 28,01 9,86 19,22 142,26 15 45,08 0,05 41,70 11,41 19,24 668,03 22 63,18 0,03 58,93 18,09 19,25 1930,44 30 73,59 0,04 87,12 183,20 19,26 2951,35 37 105,63 0,08 122,02 268,75 19,27 7456,98 44 192,88 0,05 169,74 535,23 19,28 30133,99 52 235,91 0,04 244,71 77,43 19,30 46921,74 59 333,77 0,01 332,51 1,58 19,31 98883,93 157,97 27012,67 P: Biomasa observada (g/m2) Modelo: Logístico estimado J^2: Error cuadrático medio Con los valores calculados de P (peso) y 1/(P)*dp/dt se construyó la ecuación lineal con el fin de obtener los valores de a y b. 0,1 y = ‐9E‐05x + 0,0564 R² = 0,2684 1/(p)+dp/dt 0,08 Series1 0,06 0,04 Lineal (Series1) 0,02 0 0,00 200,00 181 400,00 3. Modelo Cacho. Tiempo p Modelo (días) 0 19,21 J^2 7 31,15 4,52 19,97 15 45,08 20,93 436,24 22 63,18 45,14 2034,67 30 73,59 83,94 7040,24 37 105,63 127,49 16234,33 44 192,88 179,80 32310,48 52 235,91 249,97 62467,46 59 333,77 320,17 102497,87 31863,03 Biomasa observada MS (g/m2). J^2: Error cuadrático medio. Modelo: Logístico modificado por Cacho (1993) 182 ANEXO H Flujo grama de proceso para la determinación de las fracciones de proteína y carbohidratos según Licitra (1996). 183 Análisis Químicos El sistema de evaluación CNCPS asume que los alimentos están compuestos de proteínas, carbohidratos, grasas, ceniza y agua. ¾ Materia Seca (MS). AOAC, 1980. ¾ FDN y Lignina. Van Soest et al, 1991. ¾ Nitrógeno total por macro o micro Kjeldahl. AOAC, 1995. ¾ Nitrógeno insoluble en FDN y FDA. Van Soest et el, 1991. ¾ Ceniza. AOAC, 1995. Del flujograma del proceso para la determinación de las fracciones de proteínas y carbohidratos según el sistema de Cornell (CNCPS): NDPI: Nitrógeno insoluble en detergente neutro. ADPI: Nitrógeno insoluble en detergente acido. NCS: Carbohidratos no estructurales. H: Hemicelulosa. C: Celulosa. L: Lignina. AIA: Ceniza insoluble en detergente ácido. FDN: Fibra de detergente neutra. FDA: Fibra de detergente ácida. DETERMINACIÒN DE PROTEINA CRUDA (KJELDAHL) El nitrógeno en su forma orgánica se oxida a sulfato de amonio por digestión con acido sulfúrico concentrado. El sulfato de amonio producido en la digestión en presencia de solución de hidróxido de sodio concentrada, pone en libertad el amoniaco el cual se recoge sobre una solución de ácido Bórico. 184 El Borato de amonio producido se titula con HCL al 0,1N. Este método determina el nitrógeno total en forma de amonio de los alimentos, sin diferenciar si proviene de proteínas o de otra fuente proteica. En las condiciones en que se realiza la prueba, no determina el contenido de nitrógeno en forma de nitratos o nitritos. Reacciones para la determinación de proteína 1. Digestión Catalizador Muestra (N org) + H2SO4 NH4SO4 + CO2 + H2O 2. Destilación Vapor de Agua NH4SO4 + NaOH 40% H3BO4 + NH3 + H2O + NaSO4 3. Titulación NH4BO4 HCl + H3BO4 Equipos: • Balanza analítica. • Tubos de digestión para kjeldahl. • Digestor para análisis kjeldahl. • Destilador. • Erlenmeyer. • Vasos de precipitado. • Agitador magnético. • Bureta. 185 Reactivos: • Acido Sulfúrico concentrado (H2SO4). • Catalizador (Tabletas de kjeldahl). • Hidróxido de Sodio del 60%. • Indicador (Acido Borico H3BO4). • Acido clorhídrico 0.1 N (HCl). • Agua destilada. Digestión ¾ Pase la muestra seca por el molino con una criba de 1mm. ¾ Pese 1 g de la muestra en un tubo de digestión para kjeldahl, adicione una tableta catalizadora y 10 ml de acido sulfúrico (H2SO4) concentrado. ¾ Caliente en el digestor primero a una temperatura moderada hasta que la formación de la espuma cese y después a modo de mantener una ebullición activa aumente la temperatura hasta que la solución clarifique. ¾ Mantenga el proceso de digestión por tiempo de 15 a 20 minutos después de alcanzar este punto. ¾ Deje enfriar y siga a destilar. Destilación ¾ Adicione 5 ml de acido bórico, con indicador a un erlenmeyer de 50 ml, acondicione el destilador, asegúrese que la punta del condensador quede totalmente sumergido en el acido bórico. ¾ Ponga el tubo de digestión para kjeldahl en el destilador. ¾ Adicione el hidróxido de sodio (NaOH). ¾ Destile hasta obtener una solución de color azul, aproximadamente 150 ml. ¾ Baje el erlenmeyer, luego retire el tubo de digestión. 186 ¾ Agite la manguera del destilador dentro del erlenmeyer para que el residuo de la destilación quede dentro de la muestra a titular. Titulación ¾ Ponga a funcionar el agitador magnético y titule el contenido del erlenmeyer con la solución 0.1 N de ácido clorhídrico hasta el cambio de color del indicador, de azul a rosado. ¾ Lea el volumen de acido estándar necesario para neutralizar la determinación del blanco. NOTA: debe hacer un blanco; es decir, en un tubo de digestión agregar solo los reactivos y realizar el mismo procedimiento, es necesario para la determinación en los cálculos. Cálculos: % N = (ml HCl muestra – ml HCl blanco) × 0,1 × 0,014 / peso muestra × 100 En donde 9 ml HCl muestra: cantidad de acido utilizado en la titulación de la muestra. 9 ml HCl blanco: cantidad de acido utilizado en la titulación del blanco. 9 0,1N: normalidad del HCl. 9 0,014: miliequivalentes del N. 9 Peso muestra: peso de la muestra que se analiza. 9 100: el valor se obtiene como porcentaje (%) % Pc = % N × 6,25 9 % N: valor obtenido en la ecuación anterior. 9 6,25: factor proteico. 187 DETERMINACION DE PROTEINA SOLUBLE EN BUFFER (B1) Pese 2,5 g de muestra y colóquela en un dedal previamente pesado y marcado. Equipos: • Dedales. • Agitador mecánico. • Beaker. • Pipetas. • Tubos de digestión. Reactivos (preparación solución buffer) • Fosfato monobásico de sodio (NaH2PO4), 12,20gr. • Tetraborato de sodio (Na2B4O7), 9,4gr. • Terbutanol, 100 ml. • Para una solución final de 1000 ml. Determinación ¾ Ubique los dedales dentro de cada beaker con 50 ml de solución buffer. ¾ Active el agitador mecánico, 4 rpm durante 150 minutos. ¾ Al finalizar el proceso, lave cada dedal con 50 ml de agua destilada haciendo presión sobre el mismo en otro beaker, previamente marcado. ¾ A este residuo, se le hace proteína (kjeldahl), destilación y titulación. ¾ El valor obtenido es la fracción B1 de la proteína. DETERMINACION DE LAS FRACCIONES SOLUBLE E INSOLUBLE Luego de la solubilización de la muestra en solución buffer, se obtienen los valores de la fracción soluble e insoluble de la muestra. 188 ¾ Retire el dedal luego de lavarlo con agua destilada. ¾ Ponga el dedal a secar en estufa a 62 ºC durante 24 horas. ¾ Retire el dedal de la estufa y póngalo en un desecador. ¾ Pese y realice los cálculos. DETERMINACION DE PROTEINA A NNP De la solución final que se obtuvo de buffer 100 ml, se pasaron 50 ml a otro beaker marcado como TCA. Equipos • Beaker • Tubos de ensayo • Centrífuga • Pipetas • Tubo digestión Reactivos • Azida de sodio al 10% • TCA al 10% • Estas soluciones se prepararon por separado. Procedimiento ¾ En el beaker, marcado como TCA, agregar 50 ml de la solubilización. ¾ Agregar 10 ml de la solución TCA y 1 ml de la solución azida de sodio. ¾ Agitar hasta obtener una solución homogénea (con agitadores para cada muestra). ¾ Marcar los tubos de ensayo. 189 ¾ En cada tubo de ensayo marcado respectivamente, agregar 10 ml de cada beaker. ¾ Poner en la centrífuga durante 20 minutos. ¾ Tomar 10 ml de cada tubo sin dejar que el residuo precipitado se mezcle, y llevar a un tubo de digestión previamente marcado. ¾ Realizar el procedimiento de Kjeldahl para NNP. DETERMINACION DE FRACCION PROTEICA B3 O NITROGENO INSOLUBLE EN SOLUCION FIBRA DETERGENTE NEUTRO (NDIN) El NDIN o NIFDN es el nitrógeno asociado con la fibra detergente neutro o pared celular (celulosa, hemicelulosa y lignina). Es normalmente proteína unida a la pared celular, la cual incluye también el nitrógeno indigestible encontrado en el residuo ácido del detergente. Se continúa en proceso con los dedales en los cuales se pesó la muestra original después de realizar la solubilización en el buffer y se procesa como la determinación de FDN. Este cuantifica los componentes de la pared celular y divide la materia seca, al punto que separa los constituyentes nutricionales solubles y accesibles de los que no son totalmente aprovechables. Procedimiento ¾ Obtenga el peso de la muestra procedente de la solubilización en Buffer (sin retirarla del dedal). ¾ Ubique los dedales en beaker de berzelius. ¾ Adicione 100 ml de detergente neutro por cada uno de los dedales. ¾ Lleve a reflujo y deje una hora en ebullición a temperatura baja. ¾ Eleve la temperatura para que la solución hierva a un nivel constante. ¾ Lave la muestra con agua caliente aproximadamente 80ºC. ¾ Lave la muestra con alcohol y seque a 65ºC por 48 horas. ¾ Enfrié en el desecador y pese. 190 ¾ De cada dedal saque 0,2 gr para proteína. ¾ Realice el procedimiento de Kjeldahl para B3. DETERMINACION DE FRACCION PROTEICA C O NITROGENO INSOLUBLE EN SOLUCION FIBRA DETERGENTE ACIDO (ADIN) El ADIN o fracción C es el nitrógeno que no se puede extraer completamente de la pared celular de las plantas. Es una parte central del nitrógeno residual, resistente indigestible y asociado con la lignina, aún en forrajes frescos que no contienen taninos. Si estos están presentes se incrementa la posibilidad de encontrar más proteína insoluble asociada con la pared celular. Procedimiento ¾ Obtenga el peso de la muestra más el dedal procedente de la determinación de FDN. ¾ Deposítela en un beaker de berzelius. ¾ Adicione100 ml de detergente acido por cada uno de los dedales. ¾ Lleve a reflujo deje una hora en ebullición a temperatura baja. ¾ Eleve la temperatura para que la solución hierva a un nivel constante. ¾ Lave la muestra con agua caliente aproximadamente 80ºC. ¾ Lave la muestra con alcohol y seque a 65ºC por 48 horas. ¾ Enfrié en el desecador y pese. ¾ De cada dedal saque 0,2 para proteína. ¾ Realice el procedimiento de Kjeldahl para C. DETERMINACIÓN DE LIGNINA La determinación de la lignina por medio del permanganato, permite la determinación de la celulosa y cenizas insolubles. La determinación de cenizas 191 insolubles es una manera de estimar el contenido de sílice que en muchos forrajes es factor determinante en la reducción de la digestión. Los materiales que interfieren con la determinación, se separan con la preparación de la FDA que esta compuesta principalmente por lignina, celulosa, minerales insolubles. La lignina se oxida con una solución de acido acético amortiguada con permanganato de potasio conteniendo hierro trivalente y plata monovalente como catalíticos. Los óxidos de manganeso y hierro que se depositan, se disuelven con una solución alcohólica de acido oxálico y clorhídrico, permaneciendo la celulosa y los minerales insolubles. El contenido de lignina se determina con base a la perdida de peso de la muestra, ocasionado por los tratamientos que ha sido sometida; mientras que la celulosa se termina en base a la perdida de peso de la muestra al ser incinerada. El residuo de cenizas consiste principalmente de sílice y gran parte del material no silicato residual que puede eliminarse por medio de lavado con acido hidrobromico concentrado. Equipos • Crisoles • Horno • Desecador • Agitadores • Bandeja Reactivos • Permanganato de potasio saturado: Disolver 50 g de KMnO4 grado reactivo por litro de agua destilada, mantener la solución protegida de la luz solar directa. 192 • Solución buffer de lignina: Para preparar un litro de solución, disolver 6 g de nitrato ferrico monohidratado (Fe (NO3)3 9 H2O) y 0.15 g de nitrato de plata en 100 ml de agua destilada. Combinar esta mezcla con 500 ml de acido acético glacial y 5 g de acetato de potasio. Agregar 400 ml de alcohol butílico terciario y mezclar la solución. • Solución de permanganato combinado: Antes de ser usada la solución, mezclar el permanganato de potasio saturado con la solución buffer de lignina en la relación de 2:1 por volumen. La porción no utilizada de esta mezcla puede mantenerse por una semana en refrigeración en ausencia de la luz. Esta solución puede utilizarse si mantiene el color morado y esta libre de precipitado. • Solución desmineralizadora: Por cada litro de solución, disolver 50 g de acido oxálico dihidratado en 700 ml de alcohol etílico de 95%, agregar 50 ml de acido clorhídrico concentrado (aproximadamente 12 N) y 250 ml de agua destilada y luego mezclar. • Alcohol etílico del 80%: Para un litro mezclar 155 ml de agua destilada y 845 ml en alcohol etílico del 95%. Procedimiento ¾ Las muestras a analizar se tomaron como residuo de FDA. ¾ Colocar los crisoles que contienen el residuo de FDA en una bandeja de poca profundidad que tenga aproximadamente una capa de 1 cm de espesor de agua fría. La fibra de los crisoles no se debe mojar. ¾ Agregar a los crisoles aproximadamente 25 ml de la solución combinada de permanganato de potasio sin llenarlos demasiado. Ajustar el nivel de agua en la bandeja a manera de reducir la corriente de paso de la solución a través de los crisoles. 193 ¾ Colocar un agitador de vidrio en cada crisol con el objeto de revolver el contenido, deshacer los grumos y bañar todas las partículas que se adhieren a las paredes internas del crisol con la solución de permanganato. ¾ Dejar los crisoles por 90 minutos aproximadamente a temperatura de 20 a 25 grados centígrados si fuera necesario, una cantidad adicional de la solución combinada de permanganato. Hay que recordar que el color morado lo debe conservar constantemente. ¾ Trasladar los crisoles a la bomba de vacio y filtrar toda la porción requerida remanente. ¾ No lave la muestra. ¾ Colocar seguidamente los crisoles en bandejas, llenarlos hasta la mitad con la solución mineralizadora. ¾ Transcurridos 5 minutos, filtrar la solución líquida remanente y volver a llenar hasta la mitad con la misma solución. ¾ Se debe tomar la precaución de evitar el derrame debido a la producción de espuma. ¾ Repetir la adición de la solución desmineralizadora por tercera vez si se nota que el filtrado del segundo tratamiento se encuentra de color café oscuro. ¾ Lavar las paredes internas de los crisoles con una corriente fina de la solución desmineralizadora contenida en una botella de lavado por compresión, hasta que el color de la fibra sea blanco. El tiempo total necesario en este paso es de 20 a 30 minutos. ¾ Llenar y lavar el contenido de los crisoles con alcohol etílico del 80%; filtrar y repetir este lavado por dos veces consecutivas. ¾ Secar los crisoles durante la noche a 105 grados centígrados de temperatura, dejar enfriar en un desecador y pesar. 194 El contenido de lignina se calcula en base a la perdida en peso original de la fibra obtenida por el método acido detergente. DETERMINACIÓN DE CELULOSA ¾ Para obtener el contenido de celulosa incinere a 500 ºC durante 3 horas el residuo de las muestras procedentes de la determinación de la lignina. ¾ Deje enfriar en el desecador y pese. DETERMINACIÓN DE SÍLICE La determinación de cenizas insolubles es una manera de estimar el contenido de sílice. ¾ El contenido de sílice se obtiene mediante la percolación del residuo de ceniza en los crisoles, con ácido Bromhídrico del 48% hasta desaparición total del color. ¾ Lave la muestra con alcohol etílico o acetona, filtre e incinere a 500 ºC por 3 horas. ¾ Enfríe en desecador y pese. 195 ANEXO Degradabilidad ruminal usando el software NEWAY. Rumen Degradability Calculation Sample Name: MS 45 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Time 0 6 24 48 72 36,7 78,4 0,014 #¡VALOR! 4 Degradability parameters 37,3 Degradability of water insoluble (%) 100,0 Potential degradability (%) 0,014 Rate constant (fraction/h) Lag time (h) 29,7 #¡VALOR! Measured Fitted 33,4 34,0 46,9 42,8 59,3 58,5 71,2 74,2 87,1 85,6 Effective degradability Outflow rate (fraction/h) 0,02 0,05 0,08 196 62,7 Washing loss (%) Effective Degradability(%) 74,4 65,2 63,4 Rumen Degradability Calculation Sample Name: MS 52 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 33,6 45,4 0,038 14,30 5 62,7 Washing loss (%) Degradability of water insoluble (%) 79,0 Potential degradability (%) 0,038 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 2,67 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 31,9 33,6 0,02 68,9 45,8 42,9 0,05 64,5 59,5 60,7 0,08 63,3 70,8 71,6 76,9 76,0 197 16,3 Rumen Degradability Calculation Sample Name: MS 59 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 29,3 71,5 0,012 2,33 5 62,7 Washing loss (%) Degradability of water insoluble (%) 100,0 Potential degradability (%) 0,012 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,08 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 29,3 29,3 0,02 68,0 34,8 34,4 0,05 63,3 46,7 47,7 0,08 62,8 62,5 61,4 71,2 71,6 198 37,3 Rumen Degradability Calculation Sample Name: FDN 45 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 5,5 46,8 0,025 23,94 5 62,7 Washing loss (%) Degradability of water insoluble (%) 52,3 Potential degradability (%) 0,025 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 3,46 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 4,3 5,5 0,02 30,7 12,9 11,9 0,05 23,9 28,3 26,3 0,08 20,1 34,1 37,9 46,1 44,3 199 -10,4 Rumen Degradability Calculation Sample Name: FDN 52 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 10,1 55,6 0,018 8,08 5 62,7 Washing loss (%) Degradability of water insoluble (%) 65,7 Potential degradability (%) 0,018 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 2,01 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 10,7 10,1 0,02 62,7 14,2 15,7 0,05 62,7 31,0 29,3 0,08 62,7 40,3 41,8 50,6 50,0 200 3,0 Rumen Degradability Calculation Sample Name: FDN 59 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 21,0 45,3 0,022 8,89 5 62,7 Washing loss (%) Degradability of water insoluble (%) 66,3 Potential degradability (%) 0,022 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 2,11 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 19,6 21,0 0,02 62,9 28,2 26,4 0,05 62,7 39,6 39,2 0,08 62,7 48,5 50,1 57,5 56,6 201 3,6 Rumen Degradability Calculation Sample Name: RIE 45 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 7,5 14,3 0,027 1,95 5 62,7 Washing loss (%) Degradability of water insoluble (%) 21,8 Potential degradability (%) 0,027 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 0,99 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 6,8 7,5 0,02 15,8 10,7 9,7 0,05 13,3 14,2 14,4 0,08 10,0 17,5 18,0 20,2 19,8 202 -40,8 Rumen Degradability Calculation Sample Name: RIE 52 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 11,9 23,6 0,039 16,17 5 62,7 Washing loss (%) Degradability of water insoluble (%) 35,5 Potential degradability (%) 0,039 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 2,84 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 10,2 11,9 0,02 25,9 19,4 16,8 0,05 22,7 25,6 26,1 0,08 21,0 29,9 31,8 35,5 34,0 203 -27,2 Rumen Degradability Calculation Sample Name: RIE 59 DIAS NO RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 12,4 23,1 0,031 6,95 5 62,7 Washing loss (%) Degradability of water insoluble (%) 35,5 Potential degradability (%) 0,031 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,86 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 11,3 12,4 0,02 24,9 17,8 16,3 0,05 20,9 24,6 24,4 0,08 18,7 28,6 30,2 33,9 32,9 204 -27,2 Rumen Degradability Calculation Sample Name: MS 45 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 36,4 44,2 0,056 54,12 5 62,7 Washing loss (%) Degradability of water insoluble (%) 80,6 Potential degradability (%) 0,056 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 5,20 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 36,0 36,4 0,02 72,3 49,2 49,0 0,05 66,9 71,1 69,1 0,08 64,7 71,7 77,6 83,7 79,8 205 17,9 Rumen Degradability Calculation Sample Name: MS 52 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 34,7 43,8 0,048 8,11 5 62,7 Washing loss (%) Degradability of water insoluble (%) 78,5 Potential degradability (%) 0,048 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 2,01 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 34,1 34,7 0,02 70,0 46,4 45,6 0,05 65,3 65,1 64,6 0,08 63,8 71,9 74,1 78,6 77,1 206 15,8 Rumen Degradability Calculation Sample Name: MS 59 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 34,0 44,5 0,040 6,29 5 62,7 Washing loss (%) Degradability of water insoluble (%) 78,5 Potential degradability (%) 0,048 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,77 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 32,9 34,0 0,02 69,0 45,3 43,5 0,05 64,6 61,1 61,5 0,08 63,3 70,9 72,0 76,9 76,0 207 15,8 Rumen Degradability Calculation Sample Name: FDN 45 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 6,8 41,4 0,036 4,02 5 62,7 Washing loss (%) Degradability of water insoluble (%) 48,2 Potential degradability (%) 0,036 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,42 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 6,1 6,8 0,02 28,6 15,9 14,9 0,05 22,1 31,0 30,8 0,08 18,6 39,6 40,9 46,0 45,1 208 -14,5 Rumen Degradability Calculation Sample Name: FDN 52 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 5,6 39,4 0,044 0,00 5 62,7 Washing loss (%) Degradability of water insoluble (%) 45,1 Potential degradability (%) 0,044 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 0,04 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 5,6 5,6 0,02 32,0 14,8 14,8 0,05 24,8 31,3 31,3 0,08 18,3 40,3 40,3 43,4 43,4 209 -17,6 Rumen Degradability Calculation Sample Name: FDN 59 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 23,2 37,0 0,023 2,26 5 62,7 Washing loss (%) Degradability of water insoluble (%) 60,2 Potential degradability (%) 0,023 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,06 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 22,7 23,2 0,02 48,1 28,6 28,1 0,05 40,5 39,6 39,1 0,08 35,4 47,1 48,2 53,9 53,3 210 -2,5 Rumen Degradability Calculation Sample Name: RIE 45 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 8,4 11,5 0,036 0,00 5 62,7 Washing loss (%) Degradability of water insoluble (%) 19,9 Potential degradability (%) 0,036 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 0,03 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 8,4 8,4 0,02 16,4 10,7 10,7 0,05 13,3 15,1 15,1 0,08 11,4 17,9 17,9 19,1 19,1 211 -42,7 Rumen Degradability Calculation Sample Name: RIE 52 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 12,8 17,1 0,047 0,95 5 62,7 Washing loss (%) Degradability of water insoluble (%) 29,9 Potential degradability (%) 0,047 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 0,69 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 13,2 12,8 0,02 29,6 16,3 17,0 0,05 24,1 24,9 24,4 0,08 21,0 28,2 28,2 29,2 29,4 212 -32,7 Rumen Degradability Calculation Sample Name: RIE 59 DIAS RENOVADAS Fitted parameters a b c Sum of square No observ RSD Degradability parameters 12,4 27,1 0,022 5,91 5 62,7 Washing loss (%) Degradability of water insoluble (%) 39,5 Potential degradability (%) 0,022 Rate constant (fraction/h) Lag time (h) Time of incubation (h) 1,72 Effective degradability Time 0 6 24 48 72 Meassured Fitted Outflow rate (fraction/h) Effective Degradability(%) 11,2 12,4 0,02 25,3 17,8 15,8 0,05 20,9 22,9 23,6 0,08 17,6 29,9 30,2 34,3 34,0 213 -23,1 214 ANEXO J Simulación de la respuesta animal con el programa Cornell Net Carbohydrate and Protein System 59 días Praderas Renovadas. CNCPS v. 6.1 215 Simulación de la respuesta animal con el programa Cornell Net Carbohydrate and Protein System Praderas No renovadas 59 días. CNCPS v. 6.1 216 ANEXO K Comprobación de los supuestos del modelo de optimización de la respuesta animal Calculo de residuos A B MODELO REAL RESIDUOS Aleatorio (estimado) (Observado) (e) 1 -1 -1 14,60 13,29 1,310715 2 2 1 -1 20,87 18,73 2,143199 12 3 -1 1 24,93 23,93 0,999707 3 4 1 1 31,20 27,08 4,118775 8 5 -1 -1 14,60 12,73 1,872443 1 6 1 -1 20,87 23,09 -2,218853 9 7 -1 1 24,93 26,76 -1,833626 5 8 1 1 31,20 29,36 1,83064 7 9 -1 -1 14,60 15,73 -1,123442 4 10 1 -1 20,87 22,84 -1,962262 11 11 -1 1 24,93 26,13 -1,203997 6 12 1 31,20 35,08 -3,889699 10 1 0,04 El valor esperado de los residuos debe ser igual a cero E (e) = 0 Grafico de los residuos en función de los valores reales ei= ei (Yi hat ) se puede observar que los residuos se distribuyen aleatoriamente y que no siguen un patrón determinado de comportamiento. Lo que valida el primer supuesto del modelo. 217 6 4 2 0 ‐20,00 ‐4 ‐6 10,00 20,00 30,00 40,00 ei = ei (Yi ). Donde Yi = Observados y ei = residuales La varianza de los residuos debe ser constante V(e)= constante Se presenta la distribución de los residuos de acuerdo a los valores de estimados del modelo. Aparentemente la varianza se amplia al final, lo que podría invalidar este supuesto; pero, en realidad se tiene muy pocos datos para realizar esta conclusión. La correlación de los residuos debe ser cero Correlación (ei; ej) = 0 Como se observa en la figura 3 no existe ninguna tendencia en los datos. Este punto sirvió para entender que en futuras investigaciones es importante en cada fecha distribuir aleatoria mente el muestreo de los potreros. Se piensa que el cansancio de los evaluadores puede influir en el registro de información y si esto se da siempre con la misma distribución puede generar problemas en la información final. 218 6 ei 4 2 0 10,00 ‐2 Yi hat 15,00 20,00 25,00 30,00 35,00 ‐4 ‐6 Distribución de los residuales (ei) respecto a los valores estimados del modelo Yi hat Los residuos deben corresponder a una distribución normal. Se presenta los cálculos para evaluar la normalidad de los residuos y la figura 4 presenta el resultado. Los residuos se distribuyen a lado y lado de la recta mostrando normalidad. 219 Cálculos para verificar normalidad de los residuos ORDEN ‐6,00 XJ ZJ ZJ 1 -3.89 0.042 -1.731664396 2 -2.22 0.125 3 -1.96 0.208 -0.812217801 4 -1.83 0.292 -0.548522283 5 -1.20 0.375 -0.318639364 6 -1.12 0.458 -0.104633456 7 1.00 0.542 0.104633456 8 1.31 0.625 0.318639364 9 1.83 0.708 0.548522283 10 1.87 0.792 0.812217801 11 2.14 0.875 1.15034938 12 4.12 0.958 1.731664396 ‐4,00 ‐2,00 2 1,5 1 0,5 0 ‐0,5 0,00 ‐1 ‐1,5 ‐2 -1.15034938 2,00 4,00 6,00 Distribución normal de los residuos En general el modelo cumple los cuatro supuestos necesarios Se puede entonces deducir que el modelo cumple en forma general con los cuatro supuestos básicos necesarios. El diseño del experimento no permite seguir con la comprobación de si existe curvatura o no para determinar el optimo, por que para encontrar modelos de 220 segundo orden (con curvatura) necesito más de seis puntos y aquí solo se cuenta con cuatro en total. Prueba de la regresión. Por ultimo se hizo necesario hacer la prueba de regresión Hipótesis Ho: El modelo no explica la variación de los datos Todos los βj= 0 Ha: El modelo explica bien la variación de los datos Algún βj diferente 0 Estadísticamente se esta comprobando si el modelo global es mayor que el ruido (error experimental) Para el caso de la prueba de hipótesis Fobs << Fp-1,n-1 F observado << F critico, se rechaza la Hipótesis nula. El error es mayor al calculado. Es decir que un modelo de primer orden no es el mejor y es posible que exista un modelo de segundo orden que haga una mejor predicción de los datos, lo que significa que puede encontrarse curvatura y existir un óptimo de producción de leche. 221 Análisis de Varianza para el modelo FUENTE Βo hat EF hat CM REG CM ERROR GRADOS DE LIBERTAD F OBS CM REG CM ERROR FCRITICO F p-1,n-p 22,90 3,13 β1 hat P-1 β2 hat 5,16 1,86567 0,305299 61,109743 N- P 222 4,06618 ANEXO L Praderas Renovadas. Praderas No Renovadas. 223 Periodo de Lluvias. Periodo de Sequia. 224 Arvenses encontradas por inundaciones. Forrajes encontrados en algunas de las Praderas. 225 Tubos de digestión para fraccionamiento de Proteína y Carbohidratos. Digestor. 226 Bolsas Ankon utilizadas para degradabilidad in sacco. Toro utilizado para la degradabilidad in sacco. 227 228 229 230