TIPOS DE REACCIONES QUÍMICAS labo y ejercicios de bal
Anuncio
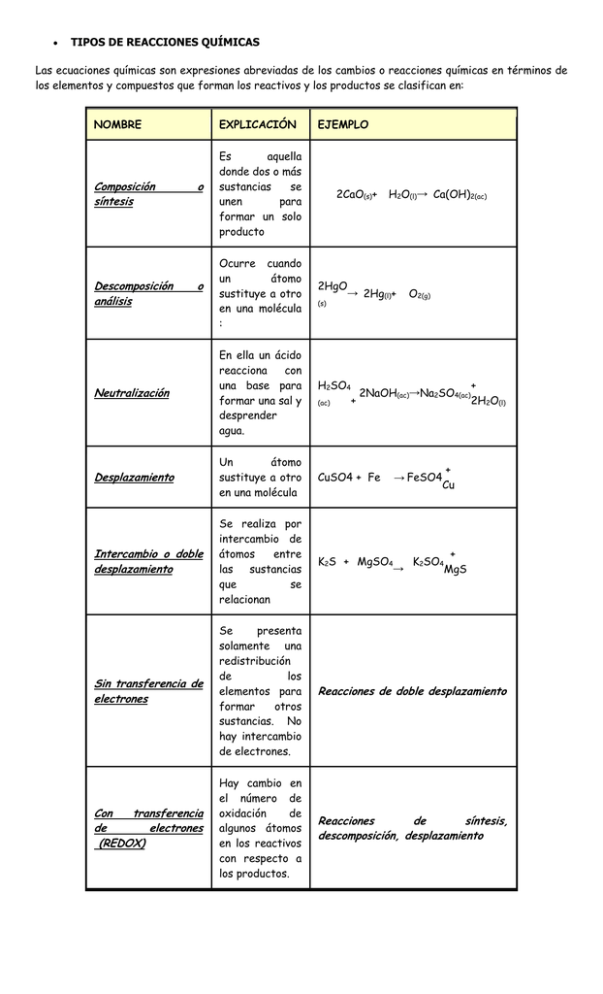
TIPOS DE REACCIONES QUÍMICAS Las ecuaciones químicas son expresiones abreviadas de los cambios o reacciones químicas en términos de los elementos y compuestos que forman los reactivos y los productos se clasifican en: NOMBRE EXPLICACIÓN Composición síntesis Es aquella donde dos o más sustancias se unen para formar un solo producto 2CaO(s)+ Ocurre cuando un átomo sustituye a otro en una molécula : 2HgO → 2Hg(l)+ Descomposición análisis o o EJEMPLO (s) H2O(l)→ Ca(OH)2(ac) O2(g) Neutralización En ella un ácido reacciona con una base para formar una sal y desprender agua. Desplazamiento Un átomo sustituye a otro en una molécula CuSO4 + Fe Intercambio o doble desplazamiento Se realiza por intercambio de átomos entre las sustancias que se relacionan + K2S + MgSO4 K2SO4 → MgS Sin transferencia de electrones Se presenta solamente una redistribución de los elementos para formar otros sustancias. No hay intercambio de electrones. Reacciones de doble desplazamiento Con transferencia de electrones (REDOX) Hay cambio en el número de oxidación de algunos átomos en los reactivos con respecto a los productos. Reacciones de síntesis, descomposición, desplazamiento H2SO4 (ac) + 2NaOH(ac)→Na2SO4(ac) + 2H2O(l) + → FeSO4 Cu Reacción endotérmica Reacción exotérmica Es aquella que necesita el suministro de calor para llevarse a cabo. Es aquella que desprende calor cuando se produce. 2NaH 2Na(s)+ H2(g) 2C ( ΔH=54.85 +H2(g)→C2H2 grafito) kcal (g) MATERIAL NECESARIO: Tubos de ensayo en gradilla, pinzas de madera, cápsula de porcelana y mechero Bunsen. PRODUCTOS NECESARIOS: Carbonato de cobre (II) sólido, disolución de ácido clorhídrico concentrado (12 M), zinc metálico, disolución de sulfato de cobre (II) 1 M, clavos o arandelas de hierro, disolución de nitrato de plomo (II) 0,05 M; disolución de ioduro de potasio (I) 0,5 M y cinta de magnesio. PROCEDIMIENTO: Se van a realizar cinco experiencias diferentes: 1- Se colocan en un tubo de ensayo dos clavos de hierro o bien unas arandelas y luego se añade sobre ellos la disolución de sulfato de cobre (II) hasta que los cubra por completo. Al cabo de una media hora se tira con cuidado la disolución del tubo de ensayo y se observa el aspecto que han tomado los clavos de hierro o las arandelas. 2 - Se añaden a un tubo de ensayo unos 3 cm3 de la disolución de nitrato de plomo (II).0,05 M (unos 3 cm de altura en el tubo de ensayo) y a continuación se dejan caer DOS gotas de la disolución de ioduro de potasio (I) apareciendo un precipitado. Observar su color y aspecto. Se calienta éste hasta su disolución y se deja en la gradilla para que se enfríe lentamente observando la evolución del sistema. 3 - Se coloca en un tubo de ensayo bien seco una cierta cantidad de carbonato de cobre (II) (aproximadamente hasta 1 cm de altura) y se somete a calefacción, observando qué sucede. 4 - Se añaden a un tubo de ensayo 3 cm3 de ácido clorhídrico concentrado y después se introduce en dicho tubo un pedazo de zinc, observando qué sucede. 5 - Se toma un pedazo de cinta de magnesio con una pinza de madera y se enciende acercándolo a la llama de un mechero de Bunsen. Una vez encendida la cinta de magnesio y después de que arda en su totalidad, se deja caer el residuo sobre un papel o una cápsula de porcelana limpia. 6. El metanol CH3OH, también llamado alcohol de quemar, es altamente tóxico, y reacciona con oxígeno produciendo dióxido de carbono y agua. a) Escribí y balanceá la ecuación de la reacción. b) Indicá qué nombre recibe este tipo de reacción CUESTIONES: 1- Escribe y ajusta las ecuaciones químicas correspondientes a todos los procesos ensayados. 2- Clasifica las experiencias de acuerdo con el tipo de reacción que tiene lugar en ellas. 3- Pon otro ejemplo de cada uno de los tipos de reacción diferente al dado en la explicación y al ensayado 4. Clasifique las siguientes reacciones como uno de los cinco tipos de reacciones descritos. a. b. c. d. e. f. g. 2 H2 + O2 2 H2O H2CO3 + 2 Na Na2CO3 + H2 Ba(OH)2 H2O + BaO Ca(OH)2 + 2 HCl 2 H2O + CaCl2 CH4 + 2 O2 CO2 + 2 H2O 2 Na + Cl2 2 NaCl Cl2 + 2 LiBr 2 LiCl + Br2 5. balancea por oxido- reducción las siguientes ecuaciones 1. KMnO4 + HCl KCl + MnCl2 + H2O + Cl2 Al + H2SO4 H2 + Al2(SO4)3 2. 3. Zn + AgNO3 Zn(NO3)2 + Ag 4. Zn + HCl ZnCl2 + H2 5. HNO3 + H2S NO + S + H2O 6. KI + H2SO K2SO4 + I2 + H2S + H2O 7. Cr2O3 + Na2CO3 + KNO3 CO2 + Na2CrO4 + KNO2 8. Cu + HNO3 Cu(NO3)2 + NO + H2O 9. Fe2SO4 + KMnO4 + H2SO4 K2SO4 + MnSO4 + Fe(SO4)3 + H2O 10. C + HNO3 CO2 + NO2 + H2O 11. KMnO4 + H2SO4 + Sb K2SO4 + MnSO4 + Sb2O3 + H2O 12. HClO3 + C2O4H2 HCl + CO2 13. MnSO4 + Na2CO3 + O2 CO2 + Na2SO4 + Na2MnO4 14. As2O3 + H2SO4 + Zn AsH3 + H2O + ZnSO4 15. KMnO4 + FeSO4 + H2SO4 K2SO4 + MnSO4 + Fe2(SO4)3 + H2O 16. KCN + Co(CN)2 + HCN K3Co(CN)6 + H2 17. NH4NO3 N 2O + H 2O Complete el siguiente cuadro # 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Ecuacion Element o que oxida Element o que reduce Agente oxidant e Agent e reduct o Electron es perdido Electron es ganados
