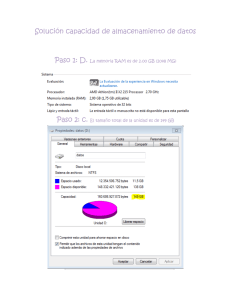
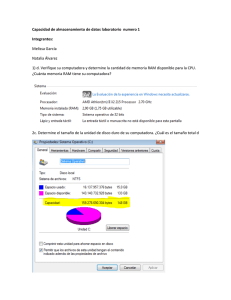
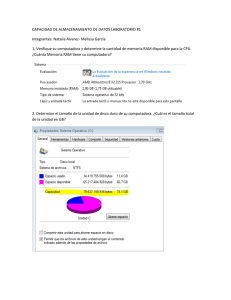
Análisis de los Factores que influyen en la notificación de RAM en la
Anuncio

Universidad de Navarra Facultad de Farm acia Unidad Docente de Farm acia Práctica Análisis de los factores que influyen en la notificación de sospechas de reacciones adversas a medicamentos en farmacia comunitaria en Navarra. Implementación y evaluación de una estrategia de mejora. Memoria presentada para aspirar al grado de Doctor. Marta Irujo Lizaur Pamplona, Septiembre 2008 D.ª Berta Lasheras Aldaz, Doctora en Farmacia, Profesora Ordinaria de Farmacología en la Universidad de Navarra y Directora de la Unidad Docente de Farmacia Práctica, y D.ª Guadalupe Beitia Berrotarán, Doctora en Farmacia, Profesora Adjunta de la Unidad Docente de Farmacia Práctica de la Universidad de Navarra, CERTIFICAN: Que D.ª Marta Irujo Lizaur ha realizado el trabajo de investigación titulado “Análisis de los factores que influyen en la notificación de sospechas de reacciones adversas a medicamentos en farmacia comunitaria en Navarra. Implementación y evaluación de una estrategia de mejora” bajo nuestra dirección y que la presente memoria corresponde fielmente a los resultados obtenidos. En cumplimiento de la normativa vigente, nos complace informar favorablemente la presentación de esta Tesis Doctoral ante el Tribunal que se designe. Pamplona, septiembre de 2008. Las Directoras de la Tesis: Dra. Berta Lasheras Aldaz Dra. Guadalupe Beitia Berrotarán Agradecimientos Agradecimientos Estoy segura de que estas letras no van a poder expresar fielmente el agradecimiento por tantas y tantas cosas recibidas, y por todas las personas que han contribuido a que yo las recibiera. No obstante, lo intentaré… En primer lugar, a mis directoras, Berta y Guadalupe, por tantas cosas… Por apostar por mi e impulsarme en el comienzo de mi carrera profesional. Por su confianza. Por el apoyo y la ayuda recibida en cada momento. Por la formación que me han proporcionado que sin duda abarca múltiples aspectos, y especialmente por el cariño que me han dado estos años. A Idoia por compartir no sólo las horas de trabajo, sino la vida. Por nuestras conversaciones profundas en ratos perdidos. Por el apoyo, los consejos y, por supuesto, las risas. A Elena, por todas las horas que hemos pasado juntas que han sido muchísimas. Por tantas y tantas conversaciones de todo un poco. Por compartir los sueños, ilusiones, etc., y por los buenos ratos “ociosos”, de risas y de cotilleo que hemos pasado en nuestro “agujero”. Y, cómo no, a Maryluz por su compañía, su cariño y por tantas historias con las que nos deleita cada día. A todas os guardo un lugar especial en mi corazón. Al equipo de Farma que ha estado tan presente y tan cerca en todo momento. Primero, en los cafés y después, sobretodo en los momentos de celebración. Por vuestra compañía y, sobre todo, los largos ratos de conversación tan característicos de este departamento. A los bedeles, que son la primera cara alegre o triste en encontrarte cada mañana a la entrada. En especial a “Peque” por recibirnos y despedirnos todos los días con la mejor de sus sonrisas y todo el cariño del mundo. Y en general, a todas las personas con las que he tenido relación durante estos años en la Universidad. Por otra parte, a todos aquellos que han contribuido directamente a que este trabajo saliera adelante. Al Centro de Farmacovigilancia de Navarra, en especial a Juan Carlos. Por su atención, su interés, su apoyo y su inmejorable disposición desde el planteamiento de este trabajo y porque sin su colaboración y ayuda no hubiera sido posible realizarlo. Al Centro de Información de Medicamentos del Colegio de Farmacéuticos de Navarra: Mª Puy, Pili, Arantza, Eva y Mónica. Por su apoyo y la ayuda prestada en general, y en particular para la realización de este trabajo de investigación en el que su colaboración ha sido muy importante. A Maira, Adolfo y Sonia por su asesoramiento y ayuda en la publicación de la primera parte del trabajo, especialmente a Maira por su colaboración en el diseño y análisis de los datos. También a Ángel Sobrino, del Departamento de Educación, y a José Javier Sánchez y María del Mar Grandío, de la Facultad de Comunicación, por introducirme en el apasionante y desconocido mundo de la metodología cualitativa. Finalmente, y Agradecimientos de forma muy especial, a los farmacéuticos comunitarios participantes cuya colaboración ha sido decisiva. También a mis amigas y sus respectivos: Elena, Cris y Jordi, Iranzu, Ana y Javi, Sandra y Javi, Kontxi, Elena, Zuru e Íñigo, Adri y Oscar, Cris e Ignacio, Maider y Josema. Gracias por todos los ratos que hemos pasado juntos y que espero que sigamos pasando muchos años. Por el apoyo que me habéis dado en todo momento y por el cariño que demostráis cada día aunque sea en la distancia. Y a ti, Zuru, ¡mucho ánimo que ya no te queda nada! Y, cómo no, a mi familia, que indudablemente ha sido lo más importante en estos cuatro años y en los 23 anteriores. A mis padres, a quienes debo todo y sin los que no habría llegado hasta aquí. Por su apoyo, su ayuda, y su entrega incondicional a pesar de no entender muy bien dónde me había metido, ni para qué, ni por qué no me ponía a trabajar de una vez… A Bea y Javi por su alegría, sus tonterías y, en especial, por las actuaciones con las que nos deleitan continuamente. Al otro Javi por aguantarlas tan dignamente y entrar a formar parte de ellas. Tiene su mérito ser el primero en atreverse a entrar en esta familia tan particular… A los tres, mil gracias por la distracción y el apoyo especialmente en los momentos difíciles. Y para Julián, casi no tengo palabras… Gracias por aquel café que fue el comienzo del proyecto que tenemos entre manos y por hacer que cada día sea especial. Abreviaturas Abreviaturas LISTADO DE ABREVIATURAS AEMPS Agencia Española de Medicamentos y Productos Sanitarios CAFV Centros Autonómicos de Farmacovigilancia CHMP Committee for Medicinal Products for Human Use CIM Centro de Información de Medicamentos COF Colegio Oficial de Farmacéuticos CSMUH Comité de Seguridad de Medicamentos de Uso Humano DE Desviación Estándar € Euros EE.UU. Estados Unidos de América EMEA Agencia Europea de Medicamentos Etc. Etcétera FDA Food and Drug Administration FEDRA Farmacovigilancia Española, Datos de Reacciones Adversas G1 Grupo focal número 1 G2 Grupo focal número 2 G3 Grupo focal número 3 IC 95% Intervalo de Confianza del 95% IL Illinois Inc. Incorporated Nº Número OMS Organización Mundial de la Salud OR Odds Ratio PRM Problema Relacionado con Medicamentos Abreviaturas RAM Reacción Adversa a Medicamentos RIC Rango Intercuartílico S.A. Sociedad Anónima SEFV Sistema Español de Farmacovigilancia SPSS Statistical Package for the Social Sciences UK£ Libras esterlinas U.S.A. United States of America WHO World Health Organization ÍNDICE Índice I. INTRODUCCIÓN 1. Los riesgos asociados a los medicamentos 19 21 1.1. El daño de los medicamentos desde una perspectiva histórica 21 1.2. Las reacciones adversas a los medicamentos 23 1.3. El impacto de las reacciones adversas a medicamentos 25 1.4. Monitorización de la seguridad de los medicamentos 26 2. La farmacovigilancia – Vigilancia de la seguridad de los medicamentos 30 2.1. Objetivos de la farmacovigilancia 31 2.2. Participantes en la farmacovigilancia 31 2.3. Organización de la farmacovigilancia 32 2.3.1. Farmacovigilancia internacional: Programa OMS de Vigilancia Farmacéutica Internacional 32 2.3.2. Farmacovigilancia nacional 37 3. Identificación de los riesgos de los medicamentos 3.1. 48 La notificación espontánea de sospechas de RAM 48 3.1.1. ¿Quién debe notificar? 50 3.1.2. ¿Qué se debe notificar? 51 3.1.3. ¿Cómo se debe notificar? 52 3.1.4. ¿Dónde se debe notificar? 53 3.1.5. Resultado de la notificación espontánea de RAM: generación de una alerta 54 4. El farmacéutico y la farmacovigilancia 56 4.1. Identificación de casos de RAM 58 4.2. Identificación y/o seguimiento de pacientes expuestos 58 4.3. Prevención de riesgos de los medicamentos 59 5. La infranotificación de sospechas de reacciones adversas 5.1. 5.2. 61 Causas de infranotificación 62 5.1.1. Modelo teórico mixto de los factores que condicionan las actitudes de los profesionales sanitarios en la notificación de sospechas de RAM 63 Incremento de la notificación de sospechas de RAM 64 Índice 6. La notificación de sospechas de reacciones adversas a medicamentos desde Farmacia Comunitaria en Navarra 66 6.1. Notificaciones procedentes de farmacia comunitaria 66 6.2. Programa de Consulta y Dispensación Farmacéutica del Colegio Oficial de Farmacéuticos de Navarra 68 II. PLANTEAMIENTO Y OBJETIVOS 71 III. MATERIAL Y MÉTODOS 75 1. Características generales del estudio 77 1.1. Diseño 77 1.2. Ámbito y población 77 1.2.1. Análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario 78 1.2.2. Iniciativas propuestas: implementación y valoración 79 Técnicas empleadas 79 1.3.1. La encuesta como metodología 79 1.3.2. El grupo focal como metodología 80 1.3.3. Listas de distribución on-line 80 Periodo del estudio 82 1.3. 1.4. 2. Análisis de los factores que influyen en la notificación de sospechas de RAM en farmacia comunitaria en Navarra 2.1. 83 La encuesta 83 2.1.1. Recogida de datos: el cuestionario 83 2.1.2. Análisis de la información 85 El grupo focal 87 2.2.1. Captación de participantes 87 2.2.2. Desarrollo de las sesiones 88 2.2.3. Análisis de las sesiones 89 3. Implementación de una estrategia de mejora 90 2.2. 3.1. Curso-taller de utilización de la tarjeta amarilla 90 3.1.1. Objetivos específicos del curso-taller 90 3.1.2. Organización 90 3.1.3. Ponentes 91 Índice 3.2. 3.1.4. Sesiones 91 3.1.5. Material utilizado 92 Lista de distribución on-line de farmacovigilancia 93 3.2.1. Inscripción en la lista 93 3.2.2. Características de la lista 93 3.2.3. Administración y coordinación de la lista 94 4. Valoración de la estrategia de mejora 4.1. 4.2. 4.3. IV. Curso-taller de utilización de la tarjeta amarilla 95 4.1.1. Evaluación de los resultados de la formación 95 4.1.2. Proceso de recogida de datos 96 4.1.3. Los cuestionarios utilizados 96 4.1.4. Análisis de la información 98 Lista de distribución on-line de farmacovigilancia 99 4.2.1. Valoración de la actividad de la lista 99 4.2.2. Valoración de la satisfacción y utilidad de la lista por los usuarios 100 Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria 101 4.3.1. Análisis estadístico 103 RESULTADOS 1. Análisis de los factores que influyen en la notificación de sospechas de RAM en farmacia comunitaria en Navarra 1.1. 1.2. 1.3. 95 105 107 La encuesta 107 1.1.1. Detección de sospechas de RAM en la práctica profesional del farmacéutico 110 1.1.2. Historia notificadora del farmacéutico 110 1.1.3. Actitudes y conocimientos 110 1.1.4. Sugerencias de los farmacéuticos 114 El grupo focal 114 1.2.1. Factores intrínsecos 115 1.2.2. Factores extrínsecos 122 1.2.3. Comportamiento del farmacéutico 132 1.2.4. Sugerencias de mejora 132 Iniciativas propuestas tras el análisis 133 Índice 2. Implementación y evaluación de una estrategia de mejora 2.1. 2.2. 2.3. V. 134 Curso-taller de utilización de la tarjeta amarilla 134 2.1.1. Datos socio-demográficos de los asistentes 134 2.1.2. Cuestionarios de evaluación de la actividad formativa 135 Lista de distribución on-line de farmacovigilancia 145 2.2.1. Los miembros de la lista 145 2.2.2. Valoración de la actividad de la lista 146 2.2.3. Valoración de la satisfacción y utilidad de la lista por los usuarios. Cuestionario de valoración 150 Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria. 151 2.3.1. Contribución del farmacéutico comunitario 151 2.3.2. Actividad notificadora del farmacéutico comunitario 153 2.3.3. Implicación del farmacéutico comunitario en el Sistema de Notificación 155 DISCUSIÓN 1. Análisis de los factores que influyen en la notificación de sospechas de RAM en farmacia comunitaria en Navarra 163 165 1.1. La encuesta 165 1.2. El grupo focal 169 2. Implementación y evaluación de una estrategia de mejora 174 2.1. Curso-taller de utilización de la tarjeta amarilla 174 2.2. Lista de distribución on-line de farmacovigilancia 179 2.3. Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria 181 VI. CONCLUSIONES 185 VII. BIBLIOGRAFÍA 191 Índice VIII. ANEXOS 205 - ANEXO I: La tarjeta amarilla 207 - ANEXO II: Cuestionario utilizado con los cambios sugeridos en la prueba piloto 209 - ANEXO III: Carta informativa dirigida a los farmacéuticos 211 - ANEXO IV: Tríptico informativo sobre el curso-taller 213 - ANEXO V: Documento de acreditación de la Comisión de Formación Continuada de Navarra 215 - ANEXO VI: Diapositivas del curso y enunciados de los casos prácticos 217 - ANEXO VII: Guía de notificación farmacéutico 227 - ANEXO VIII: Tríptico explicativo dirigido a pacientes 269 - ANEXO IX: Cuestionario de conocimientos previo al cursotaller (Pre-test) 271 - ANEXO X: Cuestionario de conocimientos posterior al cursotaller (Post-test) 273 - ANEXO XI: Cuestionario de satisfacción del curso-taller 275 - ANEXO XII: Solicitud de alta en la lista de distribución 277 - ANEXO XIII: Mensaje informativo acerca de la lista de distribución 279 - ANEXO XIV: Cuestionario de transferencia del curso-taller 281 - ANEXO XV: Cuestionario distribución de de valoración RAM de dirigida la lista al de 283 I. INTRODUCCIÓN Introducción 1. 21 LOS RIESGOS ASOCIADOS A LOS MEDICAMENTOS 1.1. El daño de los medicamentos desde una perspectiva histórica Desde muy antiguo es bien sabido que los medicamentos son capaces de aliviar o curar enfermedades aunque también de producir efectos perjudiciales. En el código de Hammurabi (2050 a.C.) ya se recogen casos de médicos que eran castigados si causaban daño con los tratamientos farmacológicos. Por otro lado, Paracelso (14931541) estableció que, dependiendo de la dosis administrada, todas las sustancias químicas pueden actuar como venenos. Además, a lo largo de la historia se han mostrado numerosos ejemplos de los efectos perjudiciales de los medicamentos al ser utilizados en el ser humano. Entre ellos destacan, por su repercusión, los siguientes: las 109 muertes súbitas asociadas al uso del anestésico cloroformo en 1864(1); la muerte de más de 100 personas, la mayoría niños, debido al uso de dietilenglicol como excipiente en la preparación de un elixir de sulfonamida en los Estados Unidos, en 1937(2). Como consecuencia de las muertes ocasionadas por el cloroformo, en 1877 fue creado un comité para el estudio de dicho suceso dando lugar a la primera experiencia documentada sobre farmacovigilancia. El dietilenglicol tuvo repercusiones más importantes, provocando la creación de la primera agencia reguladora de medicamentos que aparece en el mundo, la Food and Drug Administration norteamericana (FDA), con el fin de establecer normas legales para supervisar la seguridad de los medicamentos antes de su distribución. No obstante, fue necesario que ocurriese una tragedia de magnitudes muy importantes para que se tomara verdadera conciencia de los efectos nocivos de los medicamentos como un problema de salud pública. En un clima de gran confianza en los medicamentos y en la capacidad del hombre para combatir las enfermedades, tiene lugar en Alemania, hacia 1960, una epidemia de una malformación congénita que hasta entonces era extremadamente rara, llamada focomelia. Esta malformación se caracterizaba por una aplasia de los huesos largos de las extremidades, de tal Introducción 22 modo que las manos y los pies venían a nacer directamente de las cinturas escapular y pelviana, a modo de aletas de foca (Figura 1). Figura 1: Casos de focomelia en niños nacidos de madres que tomaron talidomida. En 1958 se describía el primer caso y en 1961, eran ya 477 los niños afectados por esta malformación(3). Más tarde, empezaron a describirse casos también en Reino Unido y Australia. Se estima que nacieron en todo el mundo más de 10.000 niños malformados, la mitad de los cuales murieron por malformaciones incompatibles con la vida. El primer comentario sobre el posible agente causal fue publicado, el 16 de diciembre de 1961, por el pediatra australiano Dr. W.G. McBride en la revista The Lancet bajo la forma de carta al director(4). Dicha carta sugería una relación entre el consumo de talidomida y la aparición de malformaciones congénitas. La talidomida estaba siendo comercializada en aquellos años en Europa y Australia debido a que poseía una potencia hipnótica similar a los barbitúricos pero con toxicidad aguda más baja. Su uso se recomendaba incluso en niños y también en mujeres embarazadas, aprovechando en ellas un efecto antiemético. Posteriormente, un pediatra alemán, el Dr. W. Lenz, informó en la misma revista acerca de 52 malformaciones en hijos de madres que habían tomado talidomida(5). Tras la realización de un estudio de casos y controles, Lenz concluyó que realmente existía una asociación entre el medicamento y las malformaciones. En 1962 se retiraba el medicamento en Alemania y sucesivamente en otros países como Reino Unido, Canadá, o España. Además, a raíz de este suceso los gobiernos Introducción 23 y autoridades sanitarias tomaron medidas al respecto. Ejemplos de esto son: la exigencia a las compañías farmacéuticas de pruebas más exhaustivas de toxicidad en animales; la realización de ensayos clínicos controlados como herramienta básica para demostrar la eficacia y seguridad de los nuevos medicamentos; y la propuesta de diversas estrategias para evitar accidentes similares, que tomaron cuerpo en lo que hoy conocemos como farmacovigilancia. 1.2. Las reacciones adversas a los medicamentos “Una reacción adversa es cualquier respuesta a un medicamento que sea nociva y no intencionada, y que tenga lugar a dosis que se apliquen normalmente en el ser humano para la profilaxis, el diagnóstico, o el tratamiento de enfermedades, o para la restauración, corrección o modificación de funciones fisiológicas”. Esta es la definición que establece la Organización Mundial de la Salud (OMS) para el término de Reacción Adversa a Medicamentos (RAM) (6) , y es también como viene recogida en el Real Decreto 1344/2007, por el que se regula la farmacovigilancia de medicamentos de uso humano en España(7). Pueden distinguirse dos grandes tipos de RAM siguiendo la clasificación de Rawlins y Thompson(8): las RAM de tipo A (del inglés Augmented) y las de tipo B (del inglés Bizarre). Sus características más importantes se exponen en la Tabla I. Tabla I: Clasificación de RAM y sus características Tipo A (Augmented) Tipo B (Bizarre) • Relacionadas con el mecanismo de acción • No relacionadas con el mecanismo de acción • Dependientes de la dosis • No dosis-dependientes • Predecibles • Impredecibles • No graves • Graves (a veces mortales) • Frecuentes • Infrecuentes • Conocidas antes de la autorización • Suelen no autorización (8) Fuente: Rawlins MD, Thompson JW. Mechanisms of adverse drug reactions . ser conocidas antes de la Introducción 24 Las de tipo A serían aquellas RAM explicables por el mecanismo de acción farmacológica del medicamento y que, por tanto, tendrían una relación directa con la dosis, es decir, serían el resultado de una acción y un efecto farmacológicos exagerados, por otra parte normales, de un fármaco administrado a las dosis terapéuticas habituales. Algunos ejemplos serían la hipotensión ortostática producida por ciertos antihipertensivos, la hemorragia por anticoagulantes o la irritación gastrointestinal debida al uso de AINE. Las de tipo B, en cambio, no serían explicables por el mecanismo de acción del fármaco y aparecerían con independencia de las dosis administradas siendo, por lo tanto, atribuibles a una respuesta idiosincrásica del organismo. Por lo tanto, son efectos que no son de esperar sobre la base de las propiedades farmacológicas de un medicamento administrado a las dosis terapéuticas habituales. Las reacciones anafilácticas y, en general, las mediadas por mecanismos inmunológicos, serían un ejemplo de este tipo de reacciones. Esta clasificación explica, de forma sencilla, el problema de la predicción de los efectos adversos. Por ejemplo, las pruebas de toxicidad en animales pondrán de manifiesto básicamente las RAM de tipo A, y no todas, sino aquellas que sean objetivables; reacciones de carácter subjetivo como las alucinaciones o la alteración del gusto, pasarán desapercibidas. Para las RAM de tipo B su capacidad predictiva es aún menor. Así, durante un ensayo clínico lo que debe esperarse es poner de manifiesto la mayoría de las RAM de tipo A, pero sólo aquellas de tipo B que sean frecuentes, que ocurran tras periodos cortos de exposición y que no sean específicas de subpoblaciones con escasa o ninguna representación en los ensayos clínicos. Aunque ésta sea la clasificación más utilizada y aceptada, algunos autores(9,10,11) han propuesto incluir en la misma otros tipos de reacciones: tipo C (Chronic), D (Delayed), E (End of Use) y F (Unexpected Failure of Therapy). En esta nueva clasificación se contemplan, además de las reacciones de tipo A y B, aquellas que aparecen tras la administración crónica de un medicamento (C), un tiempo después de la administración (D), como consecuencia de la supresión de la administración (E), y debido a interacciones (F). Introducción 25 1.3. El impacto de las reacciones adversas a medicamentos El cálculo de una cifra de aparición de RAM resulta muy difícil, prácticamente imposible, ya que la mayoría de estas reacciones no se comunican. A pesar de esto, en las últimas décadas, se ha venido mostrando a través de diversos estudios, que la morbilidad y mortalidad asociada a los medicamentos es un problema de gran magnitud en los sistemas sanitarios por sus repercusiones sociales y humanas, constituyendo uno de los mayores problemas de salud pública. Tanto es así que un metanálisis(12) estimó que en el año 1994, en los Estados Unidos, se habrían producido alrededor de 2,2 millones de RAM graves. De ellas, 106.000 provocaron la muerte. Este informe situó las RAM entre las mayores causas de mortalidad en ese país, posicionándolas alrededor del 4º-6º lugar. Así las RAM, como causa de mortalidad, estarían por detrás de enfermedades como la cardiopatía isquémica, el cáncer o el accidente cerebrovascular, en una posición similar a las enfermedades pulmonares y los accidentes, y por delante de la neumonía y la diabetes. A las miles de muertes originadas por RAM cada año, habría que añadir además la cifra de pacientes que sufren alguna RAM. En diversas ocasiones estos pacientes se ven obligados a ingresar en un centro hospitalario por este motivo. El porcentaje de ingresos debidos a RAM es muy variable de unos estudios a otros. Según un metaanálisis(13) realizado sobre 68 estudios publicados conteniendo datos acerca de ingresos hospitalarios relacionados con RAM y datos sobre el número total de pacientes hospitalizados, el porcentaje de pacientes hospitalizados debido a una RAM oscilaba entre el 0,2% hasta el 41.3%. Lazarou y col.(12), en su metanálisis, calcularon que el 4,7% de ingresos hospitalarios estaban originados por RAM graves y el 0,13% por RAM fatales, es decir, que produjeron la muerte. Un estudio realizado en el Reino Unido en 2004(14) llevó a cabo un análisis prospectivo para determinar la causa del ingreso de 18.820 pacientes hospitalizados a lo largo de un periodo de seis meses. Hubo 1.225 ingresos relacionados con RAM (el 80% de ellos debidos directamente a dichas reacciones), lo cual supone una prevalencia del 6,5%. Más de un 2% de pacientes ingresados por una RAM murieron, lo que suponía el 0,15% de todos los ingresados. Además la mayoría de las RAM eran predecibles según el Introducción conocimiento 26 existente de farmacología de los medicamentos y muchas representaban interacciones conocidas, por lo tanto es probable que fueran prevenibles. Finalmente, también debe tenerse en cuenta que las RAM suponen un coste para los Servicios de Salud. El coste anual de los ingresos relacionados con RAM para el Servicio Nacional de Salud de Reino Unido, se estimó en UK£ 466 millones (€ 706 millones) (14). 1.4. Monitorización de la seguridad de los medicamentos Actualmente se exige realizar una serie de controles y de comprobaciones que aseguren que los medicamentos son de buena calidad, seguros y eficaces antes de proceder a su comercialización. Además, para su comercialización, deben ser autorizados por una autoridad sanitaria reguladora. En España, la autoridad sanitaria competente en esta materia es la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Las diferentes pruebas a las que se someten los medicamentos antes de la comercialización, y que constituyen la Fase de Pre-comercialización del desarrollo del medicamento (Figura 2), son las siguientes: 1. Etapa de experimentación preclínica con animales 2. Etapa I del Ensayo Clínico 3. Etapa II del Ensayo Clínico 4. Etapa III del Ensayo Clínico Introducción 27 Etapa I Etapa III 20-50 voluntarios sanos para reunir datos preliminares. Experimentación en animales para el estudio la toxicidad aguda, las lesiones orgánicas, dependencia de la dosis, el metabolismo, cinética, la carcinogenicidad y mutagenicidad/teratogenicidad. Experimentación preclínica con animales de la la la Etapa I 250-4.000 pacientes en grupos más heterogéneos, para determinar la seguridad y eficacia a corto plazo. Etapa II Etapa IV 150-350 enfermos para definir las recomendaciones sobre seguridad y posología Etapa II Estudios posteriores a la aprobación sobre determinadas cuestiones de seguridad. Etapa III Etapa IV Post-aprobación Notificación Espontánea Registro Desarrollo Fuente: Organización Mundial de la Salud. Perspectivas políticas de la OMS sobre medicamentos Figura 2: Post-aprobación (15) . Desarrollo clínico de los medicamentos En el transcurso de estas pruebas pre-comercialización se comprueban la eficacia y seguridad a corto plazo del medicamento en un número determinado de personas cuidadosamente seleccionadas. Generalmente los ensayos clínicos proporcionan abundante información sobre la eficacia de un medicamento en determinada enfermedad y sobre los perjuicios que puede ocasionar. Sin embargo, esta información, reunida durante la fase de precomercialización, es inevitablemente incompleta con respecto a las posibles reacciones adversas. Esto se debe a lo siguiente: - las pruebas en animales son insuficientemente predictivas de la seguridad en seres humanos, - los pacientes se seleccionan y se limitan en número en los ensayos clínicos, las condiciones de uso difieren de las de la práctica clínica habitual y la duración de los ensayos es limitada, Introducción - 28 la información, a menudo, es incompleta o no se dispone de información sobre: reacciones adversas graves e infrecuentes, toxicidad crónica, uso en grupos especiales (niños, ancianos o mujeres embarazadas), o respecto a interacciones farmacológicas - la exposición a un medicamento de un número limitado de personas (menos de 5.000, siendo en ocasiones apenas 500) permite detectar únicamente las RAM más frecuentes. Por consiguiente, es necesario realizar una cuidadosa vigilancia de los pacientes así como recolectar más datos científicos tras la comercialización de los medicamentos. Este aspecto de la vigilancia de los medicamentos es lo que se denomina vigilancia post-comercialización o simplemente farmacovigilancia. Dentro de la Fase de post-comercialización (Figura 2) se encuentran, entre otros, la Etapa IV de los ensayos clínicos y la Notificación Espontánea de sospechas de RAM, los cuales permiten estudiar la eficacia y seguridad de los medicamentos en sus condiciones reales de uso. Esta fase permite obtener más información sobre la utilización de los medicamentos en grupos de población concretos, en especial niños, mujeres embarazadas y ancianos, y sobre el nivel de eficacia y seguridad que ofrece un producto tras largo tiempo de utilización ininterrumpida, sobre todo combinado con otros medicamentos. La experiencia demuestra que gran número de efectos adversos, de interacciones (con alimentos u otros fármacos) y de factores de riesgo, no salen a la luz hasta que el medicamento lleva cierto tiempo en el mercado. Algunos ejemplos de reacciones adversas detectadas tras la comercialización del medicamento se muestran en la Tabla II. Introducción 29 Tabla II: Ejemplos clásicos de reacciones adversas graves e inesperadas Medicamento Reacción adversa Aminofenazona (antiinflamatorio) Alteraciones de los glóbulos blancos: Agranulocitosis Cloranfenicol (antibiótico) Alteraciones de la sangre: Anemia aplásica Clioquinol (antibiótico tópico cutáneo) Alteraciones visuales: Neuropatía mieloóptica Estolato de Eritromicina (antibacteriano) Hepatitis colestática Fluotano (anestésico) Hepatitis hepatocelular Metildopa (antihipertensivo) Anemia hemolítica Anticonceptivos orales Tromboembolias (coágulos sanguíneos) Practolol (antihipertensivo) Ascitis (acumulación de líquido en el abdomen) Reserpina (antihipertensivo) Depresión Estatinas (control del colesterol) Degeneración muscular: Rabdomiólisis Talidomida Malformaciones congénitas Fuente: Organización Mundial de la Salud. Seguridad de los Medicamentos (16) . Introducción 2. 30 LA FARMACOVIGILANCIA – VIGILANCIA DE LA SEGURIDAD DE LOS MEDICAMENTOS Con el fin de prevenir o reducir los efectos nocivos para el paciente, y mejorar así la salud pública, es fundamental contar con mecanismos que evalúen y controlen el nivel de seguridad que ofrece el uso clínico de los medicamentos, lo que en la práctica supone tener en marcha un sistema bien organizado de farmacovigilancia. La farmacovigilancia es un elemento clave para que los sistemas de reglamentación farmacéutica, la práctica clínica y los programas de salud pública resulten eficaces. Así, la farmacovigilancia de medicamentos de uso humano se define como ‘actividad de salud pública que tiene por objetivo la identificación, cuantificación, evaluación y prevención de los riesgos asociados al uso de los medicamentos una vez comercializados’, tal y como relata el Real Decreto 1344/2007 en su artículo 1(7). Los procesos que integran dicha actividad (Figura 3) son: (1) el análisis del riesgo (identificación estimación evaluación) y (2) la gestión del riesgo (medidas administrativas comunicación del riesgo estrategias de prevención): (1) Análisis del Riesgo (2) Gestión del Riesgo Identificación del riesgo Medidas reguladoras Cuantificación del riesgo Comunicación del riesgo Evaluación aceptabilidad del riesgo Estrategias de prevención de riesgos Fuente: Madurga M, De Abajo FJ. Farmacovigilancia: análisis y control de los riesgos de los medicamentos Figura 3: Proceso de análisis y gestión de riesgos en farmacovigilancia (17) . Introducción 31 2.1. Objetivos de la farmacovigilancia Los objetivos de la farmacovigilancia son básicamente cuatro: 1. Identificar los efectos indeseados anteriormente no descritos o desconocidos. 2. Cuantificar el riesgo. 3. Proponer medidas de salud pública para reducir la incidencia. 4. Informar a los prescriptores, otros profesionales sanitarios, las autoridades sanitarias y el público. En definitiva, la farmacovigilancia pretende proporcionar de forma continuada la mejor información posible sobre la seguridad de los medicamentos. Esto posibilita adoptar las medidas oportunas y, de este modo, asegurar que los medicamentos disponibles en el mercado presenten una relación beneficio-riesgo favorable para la población en las condiciones de uso autorizadas. 2.2. Participantes en la farmacovigilancia Con el fin de hacer frente a los riesgos derivados del uso de los medicamentos, es necesaria una colaboración estrecha y eficaz entre las principales instancias que intervienen en el control de la seguridad de los medicamentos (Tabla III). Los responsables en este terreno deben trabajar concertadamente para anticipar, describir y satisfacer las demandas y expectativas del público y de los administradores sanitarios, planificadores, políticos y profesionales de la salud. Sin embargo, es necesaria la existencia de mecanismos sólidos e integrados que hagan posible esta colaboración. El principal obstáculo suele radicar en la falta de formación, recursos, apoyo político y, sobre todo, infraestructura científica. Entender y afrontar esos problemas es un requisito previo indispensable para el desarrollo científico y práctico de la farmacovigilancia en el futuro. Introducción 32 Tabla III: Principales instancias que intervienen en el control de la seguridad de los medicamentos Administraciones Profesionales de la salud Industria Pacientes Hospitales universitarios Fuente: y establecimientos Consumidores Asociaciones médicas y farmacéuticas Medios de comunicación Centros de información sobre productos tóxicos y medicamentos Organización Mundial de la Salud Organización Mundial de la Salud. Perspectivas políticas de la OMS sobre medicamentos (15) . 2.3. Organización de la farmacovigilancia 2.3.1. Farmacovigilancia internacional: Programa OMS de Vigilancia Farmacéutica Internacional 2.3.1.1. Historia del Programa de Vigilancia Farmacéutica Internacional La historia de la farmacovigilancia internacional comenzó hace más de treinta años. En la decimosexta Asamblea Mundial de la Salud, celebrada en 1963 (18) , se acordó una resolución para iniciar un proyecto de viabilidad de un sistema internacional de vigilancia de las reacciones adversas a los medicamentos que se inició en 1968. Esta resolución fue la base del Programa de Vigilancia Farmacéutica Internacional de la OMS. El objetivo del Programa de Vigilancia Farmacéutica Internacional (o Programa Internacional de Farmacovigilancia) era desarrollar un sistema, aplicable en el ámbito internacional, para la detección de RAM. El proyecto piloto se aplicó en 10 países, todos ellos desarrollados, que disponían de sistemas nacionales de notificación de RAM. Posteriormente, el programa se ha ampliado mucho a medida que se han ido creando centros nacionales de farmacovigilancia en otros países para registrar las RAM. En abril de 2008 ya eran 86 los países incorporados al Programa como Introducción 33 miembros oficiales, a los que hay que sumar otros 31 países que están como miembros asociados(19) (Figura 4). Países miembros oficiales (86) Países miembros asociados (31) Países no miembros (19) Fuente: Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional (sitio web) Figura 4: Países participantes en el Programa OMS de Vigilancia Farmacéutica Internacional (actualizado en abril de 2008) Este desarrollo se debe, en gran medida, a la presencia en el país de un organismo regulador de medicamentos con la voluntad y el potencial de reaccionar frente a las señales que surgen del centro y de tomar las medidas reguladoras apropiadas. La OMS considera vital este aspecto, que un sistema de farmacovigilancia esté apoyado por un organismo regulador. Introducción 2.3.1.2. 34 Actividad del Programa de Vigilancia Farmacéutica Internacional La tarea más importante del Programa de Vigilancia Farmacéutica Internacional, es identificar lo más pronto posible las “señales” de que un medicamento pueda tener problemas relacionados con su seguridad. La OMS define esas “señales” como la notificación de una posible relación causal entre un medicamento y un evento adverso, que no haya sido detectada anteriormente. Las RAM notificadas en cada país son enviadas por los centros nacionales de farmacovigilancia al Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional, radicado en Uppsala (Suecia). Los informes quedan registrados en la base de datos de RAM (Vigibase), que contiene más de 3 millones de registros, constituyendo así la fuente más exhaustiva de información internacional sobre RAM Informes (Figura 5). Año Fuente: Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional (sitio web) (19) Figura 5: Número acumulado de informes recibidos por la OMS hasta 2006 Introducción 35 El Centro Colaborador de la OMS analiza los informes contenidos en la base de datos con el objeto de: - reconocer con celeridad señales que indiquen reacciones adversas de gravedad a algún medicamento; - evaluar los peligros; - investigar los mecanismos de acción para contribuir a la elaboración de medicamentos más seguros y eficaces. Por mediación de un Comité Consultivo, la OMS ejerce un importante papel de asesoramiento especializado sobre todos los temas relativos a la seguridad farmacéutica. El Comité sirve también para favorecer políticas y actuaciones coherentes entre los Estados Miembros y asesorar a los que puedan verse afectados por medidas adoptadas en otro país. El éxito del Programa OMS de Vigilancia Farmacéutica Internacional depende por completo de la aportación de los centros nacionales de farmacovigilancia, cuyo capital común de experiencia y competencia ha sido esencial para el continuo avance del programa de la OMS y de la farmacovigilancia en su conjunto. Lo ideal sería que cada país contara con un centro de farmacovigilancia. En los inicios del Programa, un sistema de farmacovigilancia a nivel nacional seguía un modelo exclusivamente centralizado y se basaba en un único centro nacional recogiendo notificaciones de los profesionales sanitarios del país. Ahora, no obstante, muchos países prefieren un sistema más descentralizado, con un centro nacional funcionando como el punto de referencia de unos centros regionales o locales. Varios países están en proceso de puesta en marcha de sus sistemas de acuerdo a este modelo y algunos países con una larga experiencia en farmacovigilancia están cambiando sus programas a modelos de organización descentralizada. Es importante que las “señales” identificadas se conviertan rápidamente en decisiones políticas a nivel nacional para salvaguardar la seguridad de los pacientes. Introducción 36 2.3.1.3. Resultados de la farmacovigilancia internacional: algunos ejemplos La retirada de la cerivastatina (15,20) La cerivastatina fue aprobada como hipolipemiante, por primera vez, en Reino Unido en 1997. Posteriormente, se autorizó su uso en los países pertenecientes a la Unión Europea a través del procedimiento de reconocimiento mutuo. En concreto, en España se comenzó a comercializar en abril de 1998. Antes de finales del año 2000, ya se habían notificado al Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional de Uppsala (Suecia), un total de 549 casos de rabdomiólisis asociados a este fármaco. Se observó un mayor riesgo en aquellos pacientes que recibían la dosis completa (0,8 mg/día) y en los que utilizaban de forma concomitante gemfibrozilo, otro hipolipemiante del grupo de los fibratos. En noviembre de 1999, en los Estados Unidos, se modificó la información sobre este medicamento para hacer constar en ella una contraindicación del uso combinado de cerivastatina y gemfibrozilo. Esta misma medida fue adoptada en Canadá en marzo de 2000. En Australia se tomó una decisión similar en febrero de 2001, y se lanzó un aviso para alertar a los prescriptores de la posibilidad de que se produjera rabdomiólisis con todas las estatinas. En junio de 2001 se adoptaron medidas reguladoras de alcance paneuropeo para declarar contraindicado el uso simultáneo de cerivastatina y gemfibrozilo. El 8 de agosto de 2001 el fabricante, el laboratorio farmacéutico Bayer S.A., retiró voluntariamente la cerivastatina (Baycol®, Lipobay®) del mercado alegando que incrementaba el riesgo de rabdomiólisis, especialmente en combinación con gemfibrozilo (Lopid®). Introducción 37 La retirada de la veraliprida La veraliprida, un fármaco con actividad antidopaminérgica, estaba indicada en el tratamiento de sofocos y de las manifestaciones psicofuncionales de la menopausia. Fue autorizado en España en el año 1983. El Sistema Español de Farmacovigilancia, había recibido varias notificaciones de sospechas de RAM psiquiátricas (fundamentalmente depresión, ansiedad y síndrome de retirada) y de tipo neurológico (discinesia, trastornos extrapiramidales, parkinsonismo), algunas de ellas graves. Las reacciones adversas de tipo neurológico aparecen durante el tratamiento, mientras que las psiquiátricas también pueden aparecer como reacciones de retirada al finalizar un ciclo de tratamiento, o interrumpir el mismo. Tras evaluar el balance beneficio-riesgo de este medicamento en sus indicaciones autorizadas, el Comité de Seguridad de Medicamentos de Uso Humano (CSMH) de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) concluyó que dicho balance era desfavorable y recomendó la suspensión de comercialización de la veraliprida (Agreal®). Esta medida se hizo efectiva en junio de 2005(21). La medida adoptada en España, desencadenó una serie de acciones reguladoras en otros países en los que la veraliprida era comercializada, con el fin de reducir el riesgo de desarrollo de reacciones adversas en los pacientes. Como consecuencia, la Comisión Europea pidió al Committee for Medicinal Products for Human Use (CHMP) de la Agencia Europea de Medicamentos, evaluar el balance beneficio-riesgo de este medicamento y dar una opinión en torno a esta cuestión. El CHMP concluyó que los beneficios de este medicamento no superaban los riesgos y recomendó la retirada de veraliprida del mercado europeo en julio de 2007(22,23). 2.3.2. Farmacovigilancia nacional 2.3.2.1. Necesidad de una vigilancia a nivel nacional La farmacovigilancia es necesaria en cada país ya que hay diferencias entre países (y aún entre regiones en algunos países) en la manifestación de reacciones adversas a medicamentos y otros problemas relacionados con los medicamentos. Introducción 38 Todo esto puede ser debido a diferencias en: - la producción de medicamentos, - la distribución y el uso (por ejemplo, indicaciones, dosis, disponibilidad), - la genética, la dieta, las tradiciones de la población, - la calidad y la composición (excipientes) de los productos farmacéuticos fabricados localmente, - el uso de medicamentos no-ortodoxos (por ejemplo, plantas medicinales) que pueden presentar problemas toxicológicos, cuando se usan solos o en combinación con otros medicamentos. Los datos que proceden del propio país o región pueden tener una mayor relevancia y valor educativo, y pueden estimular la toma de decisiones reguladoras en el ámbito nacional. La información obtenida de un determinado país puede no ser relevante para otras partes del mundo donde las circunstancias sean diferentes. Sin embargo, en algunos casos puede ser útil conocer lo que ocurre en otros países con relación a la seguridad de los medicamentos con el fin de detectar lo antes posible circunstancias similares y tomar medidas al respecto. Para que el Programa Internacional de Farmacovigilancia de la OMS proporcione información sobre posibles aspectos de seguridad de medicamentos que aún no se hayan detectado en el país, cada país debe aportar información sobre las reacciones adversas detectadas en su territorio. En conclusión, los medicamentos comercializados necesitan una vigilancia continua en cada uno de los países. 2.3.2.2. La farmacovigilancia en la política farmacéutica nacional Los elementos esenciales en la política farmacéutica para llevar a cabo dicha vigilancia en un país, serían los siguientes: • Creación de sistemas nacionales de farmacovigilancia encargados de notificar los episodios de RAM, que comprendan centros de farmacovigilancia de ámbito nacional y, cuando convenga, regional. Introducción • 39 Elaboración de legislación y/o reglamentación sobre el control de los medicamentos. • Formulación de una política nacional que contemple costos y presupuestos, así como mecanismos de financiación. • Formación continua del personal de salud sobre seguridad y eficacia de las farmacoterapias. • Suministro de información actualizada a los profesionales y consumidores acerca de las RAM. • Seguimiento de la incidencia de la farmacovigilancia mediante indicadores de funcionamiento y de resultados. Así, es competencia de los gobiernos nacionales crear un organismo nacional de reglamentación farmacéutica y designar un centro oficial para el estudio de las reacciones adversas con el fin de velar por el suministro de medicamentos seguros, eficaces y de calidad y por su correcta utilización. La colaboración pluridisciplinar reviste gran importancia y, en este sentido, es especialmente necesario crear vínculos entre los diversos departamentos del ministerio de salud y también con otros sectores interesados, por ejemplo la industria farmacéutica, las universidades, las organizaciones no gubernamentales o los colegios profesionales que intervengan en labores de formación sobre el uso racional de los medicamentos y el control de la farmacoterapia. 2.3.2.3. La farmacovigilancia en España (a) Antecedentes y evolución En España, los primeros pasos para organizar un programa de farmacovigilancia se dan en 1973 con la publicación de una Orden del Ministerio de la Gobernación, al que pertenecía la Dirección General de Sanidad, el departamento gubernativo que en aquel momento abordaba temas de salud pública(24). Esta Orden sentaba las bases para un sistema de farmacovigilancia organizado. Sin embargo los resultados fueron muy pobres: alrededor de 200 notificaciones en 12 años. Cabe pensar que el hecho de que la administración sanitaria no se dotara de una estructura técnica adecuada para cumplir las finalidades que la orden le encomendaba, junto con una Introducción 40 baja concienciación social y profesional con respecto a las RAM, así como un formulario y procedimiento de notificación complejo y poco ágil, determinaron esta baja tasa de notificación. Durante este periodo de tiempo surgieron iniciativas particulares. Entre ellas, la que posteriormente tuvo continuidad fue el Programa de Notificación Voluntaria del Servicio de Farmacología Clínica del Hospital Vall d'Hebrón de Barcelona. En 1982, con ayuda del Fondo de Investigaciones Sanitarias de la Seguridad Social, se inició este programa en el ámbito geográfico de Cataluña. En 1983, el Ministerio de Sanidad y Consumo asumió la financiación del programa y designó a la División de Farmacología Clínica de la Universidad Autónoma de Barcelona como Centro Nacional para su participación en el Programa Internacional de Farmacovigilancia de la OMS. A su vez, se solicitó la visita de un experto de la OMS en temas de medicamentos con el fin de valorar las necesidades para la expansión del sistema en todo el ámbito del territorio español. Esta visita tuvo lugar en marzo de 1984. El experto de la OMS sugería el establecimiento de dos fases: un primer periodo de tres años para la adquisición de experiencia y valoración de la viabilidad del proyecto; y una fase posterior de generalización del programa a todo el país. A partir de estas indicaciones, en 1985 el Ministerio de Sanidad y Consumo adoptó una serie de iniciativas: 1) Crear un presupuesto específico para farmacovigilancia. 2) Establecer como programa base un sistema de notificación voluntaria de sospechas de RAM que posteriormente pudiera completarse con métodos específicos de farmacovigilancia. 3) Diseñar y emplear un formulario de notificación sencillo y flexible, que resultara cómodo para el notificador, inspirado en el ' yellow card'empleado en diferentes países con sistemas similares. En España este formulario es la ‘tarjeta amarilla’. 4) Realizar una experiencia piloto del programa en Cataluña, Navarra y Cantabria. 5) Dotar a la administración sanitaria de una infraestructura técnica en farmacovigilancia. Introducción 41 6) Crear un Comité de Expertos que sirviera de órgano consultivo y asesor del Ministerio de Sanidad y Consumo en materia de farmacovigilancia. Con este fin, se creó en 1985 la Comisión Nacional de Farmacovigilancia. La Comisión comenzó a funcionar en 1987. Los resultados de la fase piloto fueron esperanzadores, por lo que se avanzó en la voluntad de extender el programa al conjunto del Estado Español. A tal fin, el Consejo Interterritorial del Sistema Nacional de Salud aprobó en 1988 el establecimiento de un programa permanente de farmacovigilancia que trabajase con una metodología científica única y en el que colaborasen las administraciones central y autonómicas del Estado. Esto se puede considerar el acta de nacimiento del Sistema Español de Farmacovigilancia, con su estructura actual. En la misma reunión se tomaron varias decisiones que marcaron la línea de desarrollo posterior del sistema: - La primera fue optar por un modelo descentralizado, acorde con la estructura autonómica del Estado. Con ello se creaban centros especializados en farmacovigilancia con plenitud de competencias técnicas en cada Comunidad Autónoma, con proximidad a los profesionales sanitarios y pacientes, y con fácil acceso a las autoridades sanitarias autonómicas. De esta manera se obtendría una mayor eficiencia tanto en la detección de los problemas de seguridad de los medicamentos, como en la divulgación de los mismos en el entorno práctico de utilización. - En segundo lugar, se decidió iniciar las actividades con un programa de farmacovigilancia no estructurada, como es el de la notificación espontánea de sospechas de RAM, considerado como programa base de los sistemas nacionales y del Programa Internacional de Farmacovigilancia de la OMS. Este tipo de programa permite una rápida implicación de los profesionales sanitarios en las actividades de farmacovigilancia, ya que las acciones requeridas no difieren de la práctica clínica habitual, y favorece el establecimiento de relaciones permanentes con los mismos en materia de seguridad de medicamentos. Para la notificación espontánea se utiliza un formulario, la tarjeta amarilla, de fácil cumplimentación por parte del notificador, y que aporta una cantidad importante de información, sin que se precise mucho tiempo para rellenarlo. Introducción 42 (b) Organización de la farmacovigilancia en España En España la farmacovigilancia se articula en torno a dos instituciones básicas: (1) el Sistema Español de Farmacovigilancia, que agrupa los esfuerzos de las Comunidades Autónomas y de la Agencia Española del Medicamento en esta materia, y (2) el Comité de Seguridad de Medicamentos de Uso Humano, un órgano consultivo de la Agencia Española del Medicamento(25). Además, para adoptar una visión más completa de la farmacovigilancia en España, habría que añadir las variadas proyecciones internacionales, en especial en el ámbito europeo (Figura 6). Fuente: Rodríguez JM, Aguirre C, García M, Palop R. Farmacovigilancia (26) . Figura 6: Organización del Sistema Español de Farmacovigilancia Introducción • 43 El Sistema Español de Farmacovigilancia El Sistema Español de Farmacovigilancia (SEFV) integra las actividades que las Administraciones Sanitarias realizan en España para recoger, elaborar y, en su caso, procesar la información sobre RAM(17). Se coordina por el Ministerio de Sanidad y Consumo, a través de la Agencia Española del Medicamento (AEMPS). El proceso de recogida de información del SEFV (Figura 7) comienza con los profesionales sanitarios. Éstos notifican las sospechas de RAM mediante tarjetas amarillas o a través de revistas médicas, las cuales son revisadas periódicamente. También los laboratorios farmacéuticos, cumpliendo las normativas europeas y españolas sobre farmacovigilancia, notifican (en un plazo de 15 días) las sospechas de RAM graves que reciben de los profesionales sanitarios, de la literatura científica y de los estudios que se realicen, a la AEMPS y al órgano competente en farmacovigilancia de la comunidad autónoma correspondiente en donde suceda la notificación. La información procedente de los profesionales y de la industria, es procesada por cada Centro Autonómico de Farmacovigilancia o por el Centro Coordinador (División de Farmacoepidemiología y Farmacovigilancia de la AEMPS), y se carga en la base de datos del SEFV, denominada FEDRA (Farmacovigilancia Española, Datos de Reacciones Adversas). La División de Farmacoepidemiología y Farmacovigilancia de la AEMPS coordina todas las actividades del SEFV, administra la base de datos y actúa de interlocutor con la industria farmacéutica y los organismos internacionales, básicamente la Agencia Europea de Medicamentos (EMEA) y el Centro Colaborador del Programa Internacional de Farmacovigilancia de la Organización Mundial de la Salud, ubicado en Uppsala (Suecia). La base de datos FEDRA, que se puso en marcha en 1990, permite acumular la información que se notifica, una vez evaluada y codificada. La información contenida en esta base de datos es accesible a tiempo real desde todos los Centros de Farmacovigilancia, siendo una herramienta fundamental para la generación de señales por parte de los técnicos del sistema. Introducción 44 Figura 7: Recogida de información del SEFV Los Centros Autonómicos de Farmacovigilancia El SEFV se organiza mediante centros, ubicados en cada una de las 17 Comunidades Autónomas, de las cuales dependen orgánicamente. La incorporación de todas las Comunidades Autónomas no tuvo lugar hasta 1999, a excepción de Ceuta y Melilla cuyos profesionales se han incorporado recientemente a través de un procedimiento de colaboración de cada una de las Unidades de Farmacia de las dos Ciudades Autónomas, con la División de Farmacoepidemiología y Farmacovigilancia. Se puede consultar el directorio de Centros del SEFV en la página de la AEMPS: http://www.agemed.es/actividad/alertas/docs/dir-serfv.pdf Todos los Centros Autonómicos de Farmacovigilancia (CAFV) integran el Comité Técnico de Farmacovigilancia, foro de discusión científica sobre nuevas señales, aspectos metodológicos, etc. La coordinación se realiza a través de la División de Farmacoepidemiología y Farmacovigilancia de la AEMPS (adscrita a la Subdirección General de Medicamentos de Uso Humano). Los CAFV centran su actividad en la interlocución con los profesionales sanitarios de su correspondiente área. Este acercamiento al profesional de la salud es el que justifica en gran medida este sistema descentralizado. Introducción 45 La actividad principal de los CAFV consiste en proporcionar a los profesionales sanitarios los medios para notificar las sospechas de RAM, y en crear el ambiente científico apropiado para conseguir su colaboración en la identificación de nuevas RAM. En este sentido, los centros editan y distribuyen los formularios de notificación, las tarjetas amarillas. Estos formularios, con franqueo en destino, facilitan a los profesionales sanitarios la notificación de sospechas de RAM. Hoy en día, los CAFV también ofrecen, entre otros servicios, números de teléfono, de fax, direcciones de correo electrónico, o páginas en Internet con el fin de facilitar la notificación. Además de esto, también publican boletines periódicos con información sobre farmacovigilancia y divulgan las decisiones reguladoras tomadas por motivos de seguridad. De esta forma, contribuyen a mejorar el conocimiento y la formación de los profesionales de la salud que manejan los medicamentos. Asimismo, los Centros organizan, colaboran y participan en cursos, conferencias, sesiones, etc., sobre farmacovigilancia que se llevan a cabo en universidades, centros de salud, hospitales, asociaciones científicas y colegios profesionales. Por otra parte, desde la entrada en vigor, en julio de 2002, del Real Decreto 711/2002(27), los Centros Autonómicos de Farmacovigilancia reciben, evalúan y cargan en FEDRA los casos de sospechas de RAM que comunican los laboratorios farmacéuticos además de los comunicados por los profesionales sanitarios. • El Comité de Seguridad de Medicamentos de Uso Humano El Comité de Seguridad de Medicamentos de Uso Humano (CSMUH) es un órgano colegiado, que asesora a la AEMPS en materia de seguridad de medicamentos. En su seno se evalúan los problemas de seguridad que surgen con los medicamentos comercializados, proponiendo medidas encaminadas a reducir el riesgo detectado(25). Tal como establece el Estatuto de la AEMPS, cuando el Comité recomienda que se lleve a cabo una modificación sustancial, revocación o suspensión de la autorización de comercialización de una especialidad farmacéutica, es competencia de la Secretaría el informar de oficio al laboratorio farmacéutico interesado sobre su derecho a audiencia ante el Comité. En caso de que el laboratorio farmacéutico Introducción 46 desee ejercer este derecho es convocado a la reunión del Comité, en la que debe realizar una exposición oral sobre el asunto objeto de debate. Los acuerdos que se hayan alcanzado en el seno del Comité, una vez adoptados por la dirección de la AEMPS, se notifican por escrito a los laboratorios farmacéuticos afectados para su ejecución. Además de la evaluación de la relación beneficio-riesgo de medicamentos, motivada por problemas de seguridad, el Comité tiene otras funciones entre las que pueden citarse las siguientes: proponer estudios e investigaciones en materia de farmacovigilancia; colaborar en la coordinación, planificación y desarrollo del Sistema Español de Farmacovigilancia y en la evaluación de estudios postautorización; y prestar asesoramiento técnico a los representantes de la AEMPS que asisten a los grupos de trabajo y reuniones de la Unión Europea sobre asuntos de farmacovigilancia. (c) Resultados de la actividad del Sistema Español de Farmacovigilancia Después de más de 20 años de actividad del SEFV, el número de notificaciones de sospechas de RAM comunicadas cada año ha crecido notablemente. La evolución de las notificaciones recibidas por el SEFV, desde sus inicios y hasta marzo de 2007, se muestra en la Figura 8. Hasta marzo de 2007, se recogieron un total de 121.023 notificaciones de sospechas de RAM. Las RAM evaluadas como “leves” o “moderadas”, representan alrededor del 60% del total, y las “graves”, el 40% restante. En relación al tipo de notificaciones, la mayor parte, alrededor del 75%, se han realizado a través de la tarjeta amarilla. El resto de notificaciones procede de métodos como estudios postautorización o de fase IV, revisión de ingresos en urgencias hospitalarias, etc.(28) Introducción Fuente: 47 Agencia española de medicamentos y productos sanitarios. El Sistema Español de Farmacovigilancia de (28) medicamentos de uso humano: datos del programa de notificación espontánea 2005 y 2006 . Figura 8: Evolución anual de las notificaciones del SEFV (d) La integración internacional España, como miembro de la Unión Europea, debe hacer partícipe a los demás Estados Miembros de todos aquellos problemas de seguridad relacionados con medicamentos en los que pueda verse involucrado al menos otro país de la Unión. Existe un foro de discusión, el Pharmacovigilance Working Party, constituido por expertos en farmacovigilancia de todas las agencias reguladoras nacionales, y el Comité de Especialidades Farmacéuticas de la Unión Europea (Committe of Proprietary Medicinal Products), al que notifica el primero, y en el que se adoptan las decisiones de alcance comunitario(26). Además, España forma también parte del Programa Internacional de Farmacovigilancia de la OMS, junto a más de 100 países(19) y, como tal, envía periódicamente todas las notificaciones de RAM detectadas en nuestro país (incluidas en la base de datos FEDRA) a la base de datos informatizada de la OMS en Uppsala, llamada Vigibase. Introducción 3. 48 IDENTIFICACIÓN DE LOS RIESGOS DE LOS MEDICAMENTOS El análisis de riesgos realizado en farmacovigilancia se inicia con la identificación de los mismos. La identificación de los riesgos de los medicamentos es la detección de nuevos problemas de seguridad desconocidos antes de la comercialización del medicamento, o al menos, las sospechas razonables de su existencia. Existen diversos métodos que permiten realizar esta identificación de riesgos: Notificación Espontánea de sospechas de reacciones adversas por parte del profesional sanitario, Estudios de seguimiento de medicamentos o estudios post-autorización, Estudios de utilización de medicamentos, Vigilancia caso-control (registro de casos en bases datos sanitarias), Estadísticas de morbi-mortalidad,… De todos ellos, la notificación espontánea de sospechas de reacciones adversas por parte del profesional sanitario, ha demostrado ser el método más eficiente para la detección de nuevos problemas de seguridad, así como para la toma de medidas reguladoras o administrativas. 3.1. La notificación espontánea de sospechas de RAM La notificación espontánea de sospechas de RAM consiste en la notificación, por parte de los profesionales sanitarios, de sospechas de reacciones adversas a medicamentos, al Centro Autonómico de Farmacovigilancia correspondiente. El Sistema de Notificación es especialmente útil para detectar señales de reacciones adversas raras, graves o inesperadas. En el caso de reacciones adversas menos raras, pueden utilizarse otros muchos métodos como los ensayos clínicos o los estudios de cohortes. Introducción 49 Este sistema pretende lo siguiente: a) facilitar al profesional la notificación mediante un formulario sencillo, que contenga todos los aspectos informativos relevantes, b) recoger y validar dicha información, c) y registrarla en una base de datos común que posibilite la generación de “señales”. En todo el proceso se asegura la confidencialidad tanto del paciente como del notificador. La notificación espontánea presenta ciertas ventajas, pero también algunas limitaciones (Tabla IV). Como principales ventajas destacan su sencillez y su carácter universal, puesto que potencialmente abarca a toda la población, a todas las RAM y a todos los medicamentos desde el comienzo de su comercialización. Sin embargo, la escasa notificación de RAM, también llamada infranotificación, constituye el principal inconveniente de este sistema. Esta circunstancia hace que el número de casos registrados sobre una asociación medicamento-reacción represente sólo una pequeña parte de lo que existe en la realidad. Tabla IV: Ventajas y limitaciones de la notificación espontánea Ventajas • Método sencillo • Incluye a toda la población • Rapidez en la detección • Incluye a todos los medicamentos desde el comienzo de su comercialización • No interfiere con los hábitos de prescripción • Permite detectar reacciones adversas poco frecuentes Fuente: Limitaciones • La infranotificación. sensibilidad • La tasa de notificación no es constante • Difícil detección de RAM de aparición retardada • No se pueden cuantificar incidencias • Sesgo de selección. Medicamentos nuevos Rodríguez JM, Aguirre C, García M, Palop R. Farmacovigilancia (26) . Disminuye la Introducción 50 Es importante subrayar que, a pesar de todas las limitaciones de las que adolece el Sistema de Notificación a través de tarjeta amarilla, su contribución en España ha sido fundamental, y prácticamente única, en todos los riesgos identificados por el SEFV que han dado lugar a la retirada del medicamento. 3.1.1. ¿Quién debe notificar? Los profesionales que trabajan en la asistencia sanitaria como los médicos de familia o de atención primaria, médicos especialistas, farmacéuticos, etc., son la fuente de información predilecta en farmacovigilancia. No obstante, otros profesionales sanitarios también deben comunicar las experiencias relevantes que conozcan. Adicionalmente, los farmacéuticos y enfermeros pueden jugar un papel importante en la estimulación de la notificación y en el suministro de información adicional (por ejemplo, de medicación concomitante y uso previo de medicamentos). El Real Decreto 1344/2007, de 11 de octubre, por el que se regula la farmacovigilancia de medicamentos de uso humano(7), así como la Ley 29/2006 de garantías y uso racional de medicamentos y productos sanitarios(29), establecen la obligación de los profesionales sanitarios de notificar todas las sospechas de RAM de las que tengan conocimiento durante su práctica habitual, enviándolas rápidamente al órgano competente en farmacovigilancia de la Comunidad Autónoma correspondiente, mediante el formulario de recogida de sospechas de RAM, la tarjeta amarilla. Es importante señalar que al profesional sanitario únicamente se le solicita comunicar la sospecha de que el medicamento haya podido participar en la aparición de cualquier cuadro clínico, no una reacción adversa confirmada. El Centro correspondiente es quien se encargará posteriormente de evaluar el grado de relación causal entre medicamento y reacción, de acuerdo con el algoritmo oficial del Sistema Español de Farmacovigilancia. Introducción 51 3.1.2. ¿Qué se debe notificar? Según la OMS(30) debe notificarse lo siguiente: − Todas las sospechas de RAM, incluso las de poca importancia, de medicamentos nuevos (< 5 años en el mercado). − Las sospechas de RAM graves o inesperadas, de medicamentos ya conocidos. Las reacciones conocidas y las de poca importancia de estos medicamentos también deberían notificarse pero tienen menos interés. − La sospecha de un incremento en la frecuencia de una RAM ya conocida. − Todas las sospechas de RAM asociadas a interacciones medicamentomedicamento, medicamento-alimento, o suplementos medicamento-alimento. − Las RAM en casos de especial interés como son el abuso de fármacos y el uso de medicamentos durante el embarazo (teratogenicidad) y la lactancia. − Las RAM asociadas a la retirada de medicamentos. Aunque no sean propiamente RAM, también se pueden notificar aquellas reacciones debidas a sobredosis, a errores de medicación y a falta de eficacia o defectos en los productos farmacéuticos. En general los Centros Autonómicos de Farmacovigilancia, conscientes de la sobrecarga de trabajo en todos los ámbitos asistenciales, dan prioridad a la notificación de todas las sospechas de RAM de medicamentos nuevos (< 5 años en el mercado) y, del resto de medicamentos, las RAM graves y/o inesperadas. Se entiende por RAM grave, cualquier reacción adversa que: - ocasione la muerte, - pueda poner en peligro la vida, - exija hospitalización o prolongue la hospitalización, - constituya una anomalía congénita o defecto de nacimiento, - o cualquier otra que se considere importante desde el punto de vista médico. Introducción 52 Una RAM inesperada sería cualquier reacción adversa cuya naturaleza, gravedad o consecuencias no sean coherentes con la información descrita en la ficha técnica. 3.1.3. ¿Cómo se debe notificar? La notificación se realiza a través de un formulario de notificación, la tarjeta amarilla (Figura 9; ANEXO I), donde el profesional debe incluir la información que en él se solicita. En la tarjeta amarilla se distinguen cuatro bloques: 1. Datos del paciente: nombre (o iniciales), sexo, edad, peso. 2. Datos sobre el/los medicamento(s) sospechoso(s): nombre, dosis diaria y vía de administración, fechas de inicio y fin de tratamiento, motivo de prescripción. 3. Datos sobre los síntomas o signos adversos: descripción (naturaleza, localización, intensidad, características), fecha de inicio, evolución y desenlace (si lo hubiese). 4. Datos acerca del profesional notificador: profesión, nombre, dirección, población, teléfono y firma. Los datos que se envían son confidenciales. La tarjeta amarilla se encuentra disponible tradicionalmente en formato papel, la cuál contiene la dirección del Centro y está preparada para franquear en destino, de forma que no suponga ningún coste para el notificador. Actualmente, con el fin de facilitar al máximo dicha tarea al notificador, los Centros de Farmacovigilancia disponen, en sus páginas web, de la tarjeta amarilla en formato electrónico. Asimismo, el profesional puede comunicar sus sospechas de RAM a través de otras vías como el teléfono, fax o correo electrónico, siempre y cuando sean facilitados los datos que se solicitan en la tarjeta amarilla. Introducción 53 Figura 9: Modelo de “tarjeta amarilla” utilizado en el SEFV 3.1.4. ¿Dónde se debe notificar? En España, al existir una organización descentralizada, las sospechas de RAM detectadas por los profesionales sanitarios, deben ser puestas en conocimiento del Centro Autonómico de Farmacovigilancia correspondiente. Esta recogida de datos de forma regional permite optimizar las notificaciones en número y en calidad. Además facilita las relaciones entre el personal del centro y los profesionales sanitarios, que son los notificadores, lo cuál permite la estimulación a la notificación de los mismos. El Centro de Farmacovigilancia, tras la recepción de la notificación, generalmente envía al notificador información de retorno, con una fotocopia de la tarjeta enviada, y un breve informe sobre la evaluación de la reacción adversa y de las medidas a tomar. Introducción 54 3.1.5. Resultado de la notificación espontánea de RAM: generación de una alerta Alerta o señal se define como ‘la información comunicada de una posible relación causal entre un acontecimiento adverso y un medicamento, cuando previamente esta relación era desconocida o estaba documentaba de manera incompleta’(30). Habitualmente se requiere más de una notificación para generar una señal, dependiendo de la gravedad del acontecimiento y de la calidad de la información. Las señales de alarma surgen de la acumulación, en número mayor al esperado, de notificaciones espontáneas sobre algún medicamento o problema concreto, y también de la aparición de fenómenos nuevos o graves. Para detectar estas circunstancias, la información contenida en la base de datos del Sistema Español de Farmacovigilancia es evaluada periódicamente por los técnicos del SEFV con el fin de identificar, de forma precoz, posibles problemas de seguridad derivados del uso de los medicamentos y generar señales de alerta. Dichas señales son discutidas en las reuniones del Comité Técnico de Farmacovigilancia, donde también se debe valorar la pertinencia de proponerlas, como asunto para discusión, en el Comité de Seguridad de Medicamentos de Uso Humano. Cuando un Centro Autonómico de Farmacovigilancia considera que la señal que ha generado constituye un problema inminente de salud pública, debe ponerlo en conocimiento inmediato de todos los Centros Autonómicos y de la AEMPS a través de la División de Farmacoepidemiología y Farmacovigilancia. En la Tabla V se describen algunos de los riesgos identificados por el SEFV que dieron lugar a la retirada del medicamento correspondiente. La identificación del riesgo y la decisión de retirada se realizaron, en todos los casos (quizás con la excepción de la cinepazida), sobre la base de la notificación espontánea mediante tarjeta amarilla, sin que otros métodos de farmacovigilancia con mayor fuerza de asociación en términos epidemiológicos contribuyeran a la generación de la alerta o a la decisión. Introducción 55 Tabla V: Algunos riesgos identificados por el SEFV que dieron lugar a la retirada del medicamento Medicamento Problema - Bendazaco - Hepatotoxicidad - Cápsulas Dr. Bogas® - Hipertiroidismo - BIOSTAR® crema - Quemaduras locales - Cerivastatina - Rabdomiolisis - Cincofeno - Hepatotoxicidad - Cinepazida - Agranulocitosis - Droxicam - Hepatotoxicidad - Ebrotidina - Hepatotoxicidad - Glafenina - Hipersensibilidad - Gangliósidos - Síndrome Guillain-Barré Fuente: Rodríguez JM, Aguirre C, García M, Palop R. Farmacovigilancia (26) . Introducción 4. 56 EL FARMACÉUTICO Y LA FARMACOVIGILANCIA En España, a finales del año 2006, había más de 40.000 farmacéuticos trabajando en 20.741 oficinas de farmacia o farmacias comunitarias(31), las cuáles son centros sanitarios privados de interés público concertadas con el Sistema Nacional de Salud. Los farmacéuticos, como el resto de profesionales sanitarios, están llamados a colaborar en las actividades de farmacovigilancia. En sucesivas normas se ha solicitado la colaboración de estos profesionales en tareas de farmacovigilancia. La Ley 14/1986, General de Sanidad(32), ya en su artículo 99, establecía la obligación de “comunicar los efectos adversos causados por medicamentos” para todos los profesionales sanitarios y para los fabricantes e importadores. Esta obligación se ratificó en sucesivas leyes como la Ley 25/1990 del medicamento(33) o la actual Ley 29/2006 de garantías y uso racional de medicamentos y productos sanitarios(29). También el Real Decreto 711/2002(27), y el reciente Real Decreto 1344/2007(7), por el que se regula la farmacovigilancia de medicamentos de uso humano, indican el deber de todos los profesionales sanitarios de comunicar las sospechas de reacciones adversas de las que tengan conocimiento y que pudieran haber sido causadas por medicamentos. El Real Decreto 1344/2007(7), por el que se regula la farmacovigilancia de medicamentos de uso humano, desarrolla el capítulo VI de la Ley 29/2006 de garantías y uso racional de los medicamentos y productos sanitarios(29). En él se detallan las obligaciones de los profesionales sanitarios, y por lo tanto también del farmacéutico comunitario, en materia de farmacovigilancia: a. Notificar las sospechas de reacción adversa de los medicamentos autorizados, incluidas las de aquellos que se hayan utilizado en condiciones diferentes a las autorizadas y las de medicamentos no comercializados en España pero que se haya autorizado su importación según el artículo 24.4 de la Ley 29/2006, de 26 de julio. Estas notificaciones se enviarán lo más rápidamente posible al órgano competente en materia de farmacovigilancia de la comunidad autónoma correspondiente a su ámbito asistencial, mediante el formulario de recogida de sospechas de reacciones adversas («tarjeta amarilla»). Introducción 57 Se dará prioridad a la notificación de las reacciones adversas graves o inesperadas de cualquier medicamento y las relacionadas con los medicamentos nuevos identificados por el triángulo amarillo descrito en el artículo 8.2. Cuando las sospechas de reacción adversa sean consecuencia de un error de medicación, según la definición que aparece en el artículo 2.ñ), se podrá realizar la notificación siguiendo procedimientos especiales que se acordarán por el Comité Técnico del Sistema Español de Farmacovigilancia y que se recogerán Farmacovigilancia en del el documento Sistema Español de de «Buenas Prácticas de Farmacovigilancia de medicamentos de uso humano». b. Conservar la documentación clínica de las sospechas de reacciones adversas a medicamentos, con el fin de completar o realizar el seguimiento, en caso necesario. c. Cooperar con el Sistema Español de Farmacovigilancia de medicamentos de uso humano, proporcionando la información necesaria que éstos les soliciten para identificar, caracterizar o cuantificar reacciones adversas o para ampliar o completar la información sobre sospechas de reacciones adversas notificadas. d. Mantenerse informados sobre los datos de seguridad relativos a los medicamentos que habitualmente prescriban, dispensen o administren, y llevar a cabo en su ámbito asistencial las medidas de prevención de riesgos que se establezcan en la ficha técnica del medicamento, incluyendo las medidas formativas e informativas a los usuarios. e. Colaborar con los planes de gestión de riesgos, en particular de los medicamentos calificados como de especial control médico. f. Colaborar con los responsables de farmacovigilancia de los titulares de autorizaciones de comercialización, en caso de una sospecha de reacción adversa a uno de sus medicamentos, aportando la información que se precise para su posterior notificación al Sistema Español de con la Agencia Española de Farmacovigilancia por parte del titular. g. Colaborar, en calidad de expertos, Medicamentos y Productos Sanitarios y los órganos competentes de las Introducción 58 comunidades autónomas, en la evaluación de los problemas de seguridad de los medicamentos de uso humano. 4.1. Identificación de casos de RAM Una de las actividades de farmacovigilancia en las que participa el farmacéutico es la identificación de casos de RAM, la cuál se realiza normalmente a través del Sistema de Notificación Espontánea de sospechas de RAM. Durante el año 2003, se recibieron, a nivel nacional, unas 9.200 notificaciones en total, de las cuales 1.794 (19,5%) procedían de las oficinas de farmacia(17). La participación del farmacéutico de oficina de farmacia en la notificación de RAM es de gran importancia al ser un punto estratégico desde el que se pueden identificar RAM de cualquier medicamento, incluidos los medicamentos sin prescripción médica(34), así como posibles interacciones entre tratamientos prescritos por diferentes especialistas, y los problemas relacionados con productos dietéticos y plantas medicinales(35). Por su continuo contacto con los pacientes, a través de los medicamentos, las oficinas de farmacia son un lugar privilegiado para la detección y notificación de RAM. Sin embargo, muchas veces el farmacéutico se encuentra con que su capacidad de detección de reacciones adversas es inferior a la del médico, lo cuál no significa que sea imposible hacerlo en todos los casos. Muchas veces no podrá identificar una RAM, pero sí podrá detectar signos y síntomas para alertar al médico de familia, con el que debería colaborar estrechamente. En cualquier caso, si el farmacéutico recibe información del paciente y datos de un posible efecto relacionado con el uso de un medicamento, debe reunir la información necesaria y notificar dicha sospecha a su Centro Autonómico correspondiente mediante la tarjeta amarilla. 4.2. Identificación y/o seguimiento de pacientes expuestos El seguimiento de pacientes, el cuál se puede realizar desde la oficina de farmacia, es un buen procedimiento para detectar problemas relacionados con los medicamentos, incluidas las RAM. En este proceso se pueden recopilar datos Introducción 59 demográficos del paciente, así como de los medicamentos dispensados, lo cual constituye una información de gran utilidad epidemiológica que permite obtener información fiel a la realidad. Además, a través de las oficinas de farmacia, colaborando de forma coordinada y mantenida, es posible identificar rápidamente amplias cohortes de pacientes que reciben un determinado medicamento. En ocasiones se han llevado a cabo programas de seguimiento de efectos adversos a ciertos medicamentos en las oficinas de farmacia, coordinados desde los colegios profesionales, en colaboración a veces con Centros de Farmacovigilancia. Un ejemplo de esto son los estudios de utilización de medicamentos realizados, desde hace unos años, en la Comunidad de Aragón entre farmacéuticos comunitarios, el Colegio Oficial de Farmacéuticos de Zaragoza y el Centro de Farmacovigilancia de Aragón(36). Este tipo de actividades de seguimiento son de gran utilidad para poder conocer mejor la realidad acerca del perfil de reacciones adversas de los medicamentos. 4.3. Prevención de riesgos de los medicamentos La prevención de riesgos asociados a los medicamentos constituye el fin último de la farmacovigilancia. En definitiva, sólo se puede prevenir lo que se conoce. La información que proporciona el farmacéutico comunitario al paciente durante su ejercicio profesional, para evitar efectos adversos conocidos, también forma parte de la farmacovigilancia. Esta actividad de educación sanitaria en medicamentos a la población, obliga al farmacéutico a mantenerse informado continuamente sobre los aspectos de seguridad de los medicamentos que tan rápidamente se renuevan. Así, este profesional tiene un importante papel en este campo de informar al paciente sobre los efectos adversos a los medicamentos (cómo evitarlos, qué hacer si aparecen,…), completando la labor del médico de Atención Primaria. En definitiva, el farmacéutico comunitario, dada su formación centrada en el estudio del medicamento, y gracias a su contacto permanente con la población consumidora de medicamentos, tiene un papel de gran importancia en el campo de los Introducción 60 medicamentos, incluyendo todo lo relacionado con la seguridad de los mismos. Además, diversos estudios defienden la capacidad del farmacéutico para notificar sospechas de RAM y la utilidad y el valor de sus notificaciones como fuente de información en el campo de la farmacovigilancia, complementando así la notificación de otros profesionales sanitarios(37,38,39). Introducción 5. 61 LA INFRANOTIFICACIÓN DE SOSPECHAS DE REACCIONES ADVERSAS La infranotificación de sospechas de RAM hace referencia a una menor notificación de la que cabría esperar, es decir, no se notifican todas las RAM que tienen lugar en la realidad. Este hecho limita la capacidad del sistema en cuanto a la detección y cuantificación de los problemas de seguridad asociados al uso de los medicamentos; puede retrasar la detección de señales y ocasionar una subestimación de la magnitud de un problema. Sin embargo, en la detección de señales no sólo es importante la cantidad de notificaciones, sino también la pertinencia de los casos notificados y la calidad de los datos. La infranotificación de sospechas de RAM por parte de los profesionales sanitarios, es un fenómeno común en todos los países(40). Es difícil, sin embargo, corregirla ya que su amplitud es desconocida y muy variable. Incluso en los centros de farmacovigilancia ya establecidos la proporción de reacciones graves notificadas puede no ser superior al 10%(41). Además, una revisión sistemática de estudios que proporcionaban una estimación numérica de infranotificación, señalaba que la tasa mediana de infranotificación, obtenida a través de los 37 estudios revisados, era del 94%(42). Varios de los países que participan desde hace años en el Programa Internacional de Farmacovigilancia de la OMS reciben 200 o más notificaciones de reacciones adversas por millón de habitantes anualmente, remitidas, aproximadamente, por el 10% de los médicos del país(40). En otros países, no obstante, las tasas de notificación son mucho más bajas. En la Figura 10 se muestran las notificaciones medias (entre los años 2002 y 2006) enviadas anualmente desde diferentes países participantes en el Programa de la OMS. Introducción Fuente: 62 Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional (sitio web) Figura 10: (19) Notificaciones medias (2002-2006) anuales por millón de habitantes enviadas a Vigibase desde diferentes países En el año 2006 la tasa de notificación en España se situó en 230 casos por millón de habitantes(28). A pesar de que el SEFV mantiene unas tasas de notificación anuales que sitúan a España entre los 10 ó 12 primeros países del mundo en cuanto a índice de actividad del Sistema(43), existe una amplia infranotificación derivada, al menos en parte, de la escasa participación de los profesionales sanitarios. 5.1. Causas de infranotificación Los factores que originan la infranotificación de RAM por parte de los profesionales sanitarios han sido objeto de diversos estudios realizados en diferentes países. Desde hace años, se vienen señalando algunas posibles causas de esta baja notificación. Ya en 1976, Inman describió las causas de infranotificación de los profesionales sanitarios(44), las cuales constituyen los denominados “siete pecados capitales del notificador” (Tabla VI). Posteriormente, otros autores han tratado también de identificar estas causas, entre las que se incluyen la no-percepción de la importancia de la contribución personal al conocimiento de la seguridad de los medicamentos, la falta de información, la inseguridad en la identificación de RAM, Introducción 63 una relación inapropiada con el paciente, la falta de tiempo, la falta de interés, el temor a medidas legales, ausencia de incentivos económicos, la no disponibilidad de formularios de notificación, etc.(45-65) Tabla VI: Los siete pecados capitales del potencial notificador, según Inman 1. Complacencia o falsa idea de que únicamente se comercializan medicamentos seguros 2. Miedo a sufrir denuncias por parte de los pacientes 3. Culpabilidad al pensar que el daño del paciente se debe al medicamento prescrito 4. Ambición de recoger y publicar series de casos 5. Ignorancia del procedimiento 6. Vergüenza a notificar meras sospechas 7. Pereza, una mezcla de falta de tiempo, falta de interés y falta de tarjetas amarillas Fuente: Inman WHW. Assessment of drug safety problems (44) . La mayoría de los estudios realizados, tanto en España como en otros países, acerca del estudio de las causas de infranotificación o de los factores que influyen en ella, han sido orientados al colectivo médico (45-49,51-54,58,61,62,66-70) , siendo menos frecuentes los realizados en farmacéuticos, en particular en farmacéuticos comunitarios (50,55,56,60,63-65). En concreto, en España, existen algunos trabajos publicados que analizan los motivos de infranotificación de RAM o factores asociados(52,54,58,66,70). Sin embargo, además de ser escasos, se refieren al colectivo médico y se han desarrollado en las comunidades de Madrid, Galicia y Cataluña. No se han encontrado estudios similares dirigidos al farmacéutico comunitario en España. 5.1.1. Modelo teórico mixto de los factores que condicionan las actitudes de los profesionales sanitarios en la notificación de sospechas de RAM En el año 2004, con el fin de explicar el comportamiento del profesional sanitario con relación a la notificación de RAM, se propuso un modelo: “el modelo teórico mixto de los factores que condicionan las actitudes de los profesionales sanitarios en la notificación de sospechas de RAM”(71). Introducción 64 Este modelo surge de la combinación de otros dos: (1) el modelo conocimientosactitudes-prácticas, el cuál explicaría la influencia de la formación de los profesionales sobre la adquisición de hábitos en ciencias de la salud, y (2) el modelo de satisfacción de necesidades, que explicaría la influencia de los factores de su entorno profesional. Según el modelo teórico propuesto, el hábito de notificar es considerado como resultado de los factores considerados intrínsecos, relativos al conocimiento y actitud del farmacéutico, y de los factores extrínsecos, condicionados por el sistema de trabajo y de la interacción con el entorno profesional (Figura 11). MODELO DE CONOCIMIENTO-ACTITUD-PRÁCTICA Formación Universidad Canales de información Conocimiento sobre RAM MODELO DE SATISFACCIÓN DE NECESIDADES Relación con la industria farmacéutica Relación con la administración sanitaria Actitud a adoptar en notificación de RAM Hábitos de notificación Fuente: Relación con los pacientes Herdeiro MT, Polónia J, Gestal-Otero JJ, Figueiras A. Factors that influence spontaneous reporting of adverse (71) drug reactions: a model centralized in the medical professional . Figura 11: Modelo teórico mixto de los factores que condicionan las actitudes de los profesionales sanitarios en la notificación de RAM 5.2. Incremento de la notificación de sospechas de RAM La mejora de las tasas de notificación es un tema que continua siendo discutido a través de reuniones de grupos de expertos y estudiado mediante trabajos de investigación. Introducción 65 En general, se han identificado varios aspectos sobre los que se podría incidir con el fin de incrementar las notificaciones de sospechas de RAM en aquellos países dotados de un Sistema de Notificación Espontánea. Entre los más relevantes estarían el conocimiento, o la formación relacionada con farmacovigilancia, y la concienciación de los profesionales sanitarios acerca de la importancia de notificar y de su responsabilidad como notificadores. Además, se ha señalado la idoneidad de diseñar estrategias combinadas que modifiquen tanto factores intrínsecos (el conocimiento y las actitudes) como factores extrínsecos (relación entre el profesional sanitario y sus pacientes, y con el Sistema Nacional de Salud y la industria farmacéutica), para mejorar la participación de los profesionales sanitarios en el sistema de notificación de sospechas de RAM(71). Una de las estrategias que contribuyen al incremento de las notificaciones, es la instauración de un Centro Regional de Farmacovigilancia. Se ha visto que en aquellas zonas donde existe un centro de estas características, el cual se ocupa de las notificaciones locales y de realizar actividades que contribuyan a la formación y concienciación de los profesionales de su zona, las tasas de notificación resultan superiores respecto a áreas donde no hay un centro de estas características(72). Asimismo, se han contemplado otro tipo de estrategias, de naturaleza pasiva, dirigidas a incrementar las notificaciones. Entre ellas están la inclusión de tarjetas amarillas en los tacos de recetas que distribuye la Seguridad Social a los médicos(73), el “feedback” con el notificador(74), la dotación de incentivos económicos(75,76), los recordatorios, la distribución de boletines u hojas informativas, de folletos, de tarjetas amarillas, etc.(47,68,77) Finalmente, varios estudios han mostrado la efectividad de intervenciones educativas sobre la tasa y la calidad de las notificaciones de los profesionales sanitarios(47,68,77-80), en algunos casos en combinación con estrategias pasivas como la distribución de material impreso(81,82). Introducción 6. LA 66 NOTIFICACIÓN ADVERSAS A DE SOSPECHAS MEDICAMENTOS DE REACCIONES DESDE FARMACIA COMUNITARIA EN NAVARRA 6.1. Notificaciones procedentes de farmacia comunitaria En la Comunidad Foral de Navarra, entre los años 2000 y 2005, la contribución del farmacéutico comunitario en Navarra se situaba en torno al 8,8 % de media sobre el total de notificaciones recibidas en el Centro de Farmacovigilancia de Navarra, según datos del propio centro. El año en que se obtuvo el mayor porcentaje de notificaciones procedentes de farmacia comunitaria corresponde al 2004 con un 12,8% de notificaciones respecto al total. La evolución de notificaciones de este profesional en dicha Comunidad Autónoma entre los años 2000 y 2005, se muestra Número de notificaciones en la Figura 12. 500 400 300 200 100 0 2000 2001 2002 2003 2004 2005 Año Notificaciones totales Notificaciones de farmacéuticos comunitarios Fuente: Centro de Farmacovigilancia de Navarra Figura 12. Evolución de las notificaciones procedentes de farmacia comunitaria en Navarra, entre los años 2000 y 2005. Un estudio publicado en 2004, en el que colaboraba la OMS(83), investigaba la implicación de los farmacéuticos en la notificación de RAM en los diferentes países participantes en el Programa de Vigilancia de la OMS. Según este estudio, entre los países con mayor contribución del farmacéutico en la notificación de RAM (>20% de Introducción 67 RAM procedentes de farmacéuticos) se encontraba España. Los mayores porcentajes de notificaciones por parte de farmacéuticos, tanto hospitalarios como comunitarios, recibidas a través de tarjeta amarilla se encontraban en Canadá (88,3%), Australia (40,3%), Holanda (40,2%) Japón (39%), España (25,9%) y Portugal (23,4%). Este estudio se realizó sobre las notificaciones enviadas en el año 2001. Las notificaciones procedentes del farmacéutico comunitario en España durante ese mismo año, constituyeron el 18,2% del total de notificaciones recibidas en dicho país. En Navarra, sin embargo, ese porcentaje se reducía al 3,7%. Por otra parte, si analizamos las tasas de notificación por millón de habitantes, Navarra sería una de las Comunidades Autónomas con mayores tasas de notificación en nuestro país. Tomando como referencia el año 2003, la tasa de notificación en ese año en Navarra fue de 543 notificaciones/ millón de habitantes, frente a las 215 notificaciones/ millón de habitantes generadas en todo el territorio nacional. Igualmente la tasa de notificación del farmacéutico comunitario en Navarra, superaría a la española. En el año 2003, el farmacéutico comunitario envió en Navarra 62,2 notificaciones/ millón de habitantes, mientras que en España, en general, se recibieron 27,5 notificaciones/ millón de habitantes procedentes de la farmacia comunitaria. Sin embargo, habría que tener en cuenta en este dato que la mayor concentración de oficinas de farmacia se da en Navarra y que, por lo tanto, la población navarra tendría una mayor cobertura farmacéutica que otras comunidades. Actualmente en esta Comunidad hay alrededor de 1041 habitantes por farmacia, siendo la media nacional de 2143 habitantes/farmacia. No obstante, hay que considerar también el número de farmacias que generan notificaciones, el cuál resulta bastante reducido teniendo en cuenta el número total de farmacias existentes en Navarra. Según datos del Centro de Farmacovigilancia de Navarra, sólo 42 oficinas de farmacia generaron entre los años 2003 y 2005 (ambos inclusive), 115 notificaciones, siendo el número medio de farmacias en Navarra, en esos 3 años, de 536. Por lo tanto, las notificaciones procedentes de oficina de farmacia en Navarra son escasas y también son pocas las farmacias que realizan este tipo de actividad. Puesto que existen estudios a nivel internacional que confirman que una mayor participación del farmacéutico comunitario puede tener un papel importante en la Introducción 68 mejora de la infranotificación de RAM(84), sería interesante analizar aquellos factores que interfieren en la notificación de sospechas de RAM, y buscar iniciativas que pudieran incrementar la notificación por parte del farmacéutico comunitario. 6.2. Programa de Consulta y Dispensación Activa del Colegio Oficial de Farmacéuticos de Navarra En el año 2002 el Colegio Oficial de Farmacéuticos (COF) de Navarra diseñó un programa de atención farmacéutica, el cuál abordaba los procedimientos de dispensación y consulta, con el fin de mejorar la calidad de la actuación farmacéutica en dichos procesos y de que el profesional que así lo deseara pudiera acceder al seguimiento farmacoterapéutico a través de este programa(85). Se pretendía, además, implantar y mejorar un Sistema de Calidad en el Proceso de Atención Farmacéutica. Intervenciones Farmacéuticas identificadas como sospechas de RAM Del total de intervenciones recibidas en el marco de dicho programa (n=1544), desde su comienzo en el año 2002, 470 corresponden a sospechas de RAM. En definitiva, alrededor del 30% de las intervenciones farmacéuticas registradas, corresponden a RAM o sospechas de RAM. Este hecho pone de manifiesto la gran capacidad del farmacéutico para detectar sospechas de RAM desde su puesto de trabajo, y por lo tanto, para notificar dichas sospechas. Influencia del Programa sobre la notificación de sospechas de RAM mediante tarjeta amarilla Desde que en 2002 se instauró el Programa de Consulta y Dispensación Activa, se observa que las notificaciones procedentes de farmacéuticos de oficina de farmacia han seguido una tendencia creciente hasta el año 2004 (Figura 12). Tras analizar las notificaciones recibidas en el Centro de Farmacovigilancia, que proceden de farmacia comunitaria, en los últimos 2 años (2006 y 2007), se observa que en torno al 40-50% de las notificaciones de farmacia comunitaria proceden de Introducción 69 farmacéuticos que participan activamente en el programa. Por lo tanto, dicha actividad podría estar influyendo positivamente en la notificación de sospechas de RAM de los farmacéuticos comunitarios de Navarra. Finalmente, resulta importante señalar el decisivo papel que juegan los profesionales sanitarios en la farmacovigilancia, dado que son ellos, junto con los pacientes, los protagonistas del sistema actualmente más eficiente para la detección de nuevos problemas de seguridad de los medicamentos comercializados: el Sistema de Notificación Espontánea de sospechas de RAM. Por tanto, si ellos no se implican en dicho sistema, serán ocultados numerosos problemas de seguridad de medicamentos, algunos leves y otros desgraciadamente graves, que llegarán a afectar a infinidad de personas. Así, la promoción de la participación de dichos profesionales en el sistema repercutirá de forma positiva sobre la información disponible acerca de los riesgos asociados a los medicamentos y, en consecuencia, sobre la seguridad de los pacientes. II. PLANTEAMIENTO Y OBJETIVOS Planteamiento y objetivos 73 Desde hace años se han venido realizando estudios en diferentes países con el fin de identificar los motivos de infranotificación de sospechas de RAM de los profesionales sanitarios y los factores asociados a este fenómeno(44-70). En España los estudios publicados a este respecto son escasos y se dirigen exclusivamente al colectivo médico(52,54,58,66,70). Por otra parte, existen numerosos trabajos que defienden la necesidad de poner en marcha estrategias con el fin de mejorar la participación de los profesionales sanitarios en el Sistema de Notificación Espontánea(42,49,52-59,61-64,70,71). Objetivo general: El objetivo general del estudio consiste en el análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario en Navarra, para promover el incremento de la participación de dicho profesional en el Sistema de Notificación Espontánea. Objetivos específicos: Para la consecución del objetivo planteado, se definen los siguientes objetivos específicos: 1. Identificar y analizar los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario, ya sean elementos que dificultan (barreras), o que resultan de ayuda (facilitadores) en la notificación de estos acontecimientos. 2. Implementar iniciativas dirigidas a facilitar la incorporación de la detección y notificación de sospechas de RAM en la actividad diaria del farmacéutico comunitario a través de la modificación de los conocimientos, creencias, actitudes y comportamientos identificados como influyentes en la notificación. 3. Evaluar las iniciativas llevadas a cabo para mejorar la notificación de sospechas de RAM desde la Farmacia Comunitaria en la Comunidad Foral de Navarra, en términos de reacción, aprendizaje, conducta y resultados. III. MATERIAL Y MÉTODOS Material y métodos 77 1. CARACTERÍSTICAS GENERALES DEL ESTUDIO 1.1. Diseño Se escogió la combinación de metodología cuantitativa, la encuesta, y de metodología cualitativa, el grupo focal, para el análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario. La utilización de al menos 2 métodos, generalmente cualitativo y cuantitativo, para el análisis de un problema específico recibe el nombre de triangulación metodológica(86). De esta forma se pretende incrementar la validez de los resultados y mitigar los problemas de sesgo(87). Tras el análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario, se percibió la necesidad incrementar la formación y concienciación de los farmacéuticos en este ámbito. Para ello, se desarrollaron las siguientes iniciativas: un curso-taller de utilización de la tarjeta amarilla y una lista de distribución on-line de farmacovigilancia. Finalmente, se procedió a la valoración de las iniciativas implementadas, para lo cuál se utilizaron como métodos la encuesta, el análisis de los mensajes generados a través de la lista de distribución y el análisis de las notificaciones recibidas en el Centro de Farmacovigilancia de Navarra y procedentes de farmacia comunitaria. 1.2. Ámbito y población El presente trabajo se realizó en la Comunidad Foral de Navarra, tomando como población el conjunto de farmacéuticos comunitarios que ejercen su actividad profesional en oficina de farmacia en dicha Comunidad Autónoma. En diciembre de 2005 había 546 oficinas de farmacia en Navarra, en las cuáles trabajaban un total de 802 farmacéuticos, según datos del Colegio Oficial de Farmacéuticos de Navarra. Material y métodos 78 1.2.1. Análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario La población objeto de estudio se fraccionó en 2 grupos: (a) El grupo de casos, formado por farmacéuticos “notificadores”. Fueron considerados como tales aquellos farmacéuticos que habían enviado durante los 3 años anteriores, 2003, 2004 y 2005, al menos 2 tarjetas amarillas al Centro de Farmacovigilancia de Navarra. En total, 20 farmacéuticos. (b) El grupo de controles, compuesto por farmacéuticos considerados “nonotificadores”, es decir, aquellos que no habían notificado ninguna vez en los 3 años previos. Un total de 762 farmacéuticos. Fueron excluidos del estudio aquellos farmacéuticos que únicamente habían notificado una vez en el periodo comprendido entre 2003 y 2005 (n=20). Esto se debe a que una sola notificación en tres años se consideró insuficiente para admitir a estos farmacéuticos como “notificadores” y suficiente como para no poderlos considerar “no-notificadores”. La selección de la muestra se realizó siguiendo una serie de criterios que fueron diferentes para la encuesta y para los grupos focales: Encuesta: El grupo de casos, al que pertenecían sólo 20 farmacéuticos, fue seleccionado en su totalidad. Del grupo de controles, formado por 762 farmacéuticos, se escogieron 60 por aleatorización simple. Así, fueron seleccionados 3 controles por caso. Grupos focales: Del total de farmacéuticos de Navarra, se seleccionaron aquellos que, en general, mostraban un alto grado de implicación y de disponibilidad para la realización de diferentes actividades propuestas, y que además pudieran facilitarnos la máxima información. Material y métodos 79 En total, fueron 27 los farmacéuticos seleccionados, los cuales se distribuyeron en 3 sesiones grupales diferentes: - Grupo 1 (G1): 9 farmacéuticos no-notificadores con poca y mediana experiencia (≤ 5 años) en oficina de farmacia. - Grupo 2 (G2): 9 farmacéuticos no-notificadores con una mayor experiencia (> 5 años) en oficina de farmacia. - Grupo 3 (G3): 9 farmacéuticos notificadores con una mayor experiencia (> 5 años) en oficina de farmacia. 1.2.2. Iniciativas propuestas: implementación y valoración Las iniciativas propuestas fueron ofertadas por igual a todos los farmacéuticos comunitarios dado que se consideró necesario que todos ellos tuvieran la oportunidad de formarse en este tema y de tomar conciencia de la importancia de la notificación. La valoración de estas iniciativas se realizó, por tanto, en aquellos farmacéuticos que participaron en dichas actividades. 1.3. Técnicas empleadas 1.3.1. La encuesta como metodología La encuesta es un método de investigación que puede ser de tipo cuantitativo y/o cualitativo. Consiste en formular una serie de preguntas, previamente establecidas, a las personas implicadas en el tema de estudio. Se caracteriza por hacer la recogida de datos a través de cuestionarios, también llamados formularios autoadministrados, y/o entrevistas. El cuestionario es un documento que contiene las preguntas escritas y puede administrarse por correo o personalmente. Requiere que la persona que responde entienda bien las preguntas(88). Material y métodos 80 1.3.2. El grupo focal como metodología El grupo focal es un método de investigación cualitativo. Se trata de un tipo de entrevista en grupo que aprovecha la comunicación entre los participantes en la investigación con el fin de generar datos. Al igual que las entrevistas de grupo, sirve para recoger datos de varias personas simultáneamente y de forma rápida utilizando, además, la interacción entre los componentes del grupo como parte del método. Durante el transcurso de la sesión, el investigador hace preguntas a los participantes y ellos se animan a hablar al resto del grupo haciendo preguntas, intercambiando anécdotas, y comentando su experiencia y puntos de vista. Es un método especialmente útil para explorar conocimientos, experiencias y actitudes. Permite estudiar no sólo aquello que las personas piensan, sino también por qué piensan así(89). 1.3.3. Listas de distribución on-line(90) Una «lista de distribución» es un conjunto de direcciones de correo electrónico asociadas a una única dirección de correo. De forma que cuando uno de los miembros de la lista envía un mensaje a la dirección de correo de la lista, éste es distribuido automáticamente a todas las demás. Normalmente se utilizan para enviar ciertos mensajes o anuncios con un contenido de interés general para todos los miembros de la lista. Sirven para canalizar información de interés, articular grupos y para trabajos en grupo. En definitiva, se trata de un grupo de personas que se intercambian mensajes sobre una temática particular, compartiendo sus conocimientos y debatiendo temas de interés común, y que forman una Comunidad Virtual. Las listas suelen estar administradas o gestionadas por un administrador quien se encarga de dar de alta o de baja a los usuarios, de chequear las direcciones erróneas, de verificar que se haga buen uso de la lista, de definir la política de acceso y archivo de la lista, etc. Material y métodos 81 Además, pueden existir uno o varios coordinadores, cuya función principal es hacer que se respeten las normas mínimas, además de fomentar y estimular la participación de los usuarios en la lista. Las ventajas que presenta esta herramienta son las siguientes: − Los mensajes se reciben directamente en el buzón de correo electrónico de cada uno de los miembros de la lista − Existen administradores que pueden tomar acciones ante elementos que desvirtúen el foro − Los miembros saben quien lee sus mensajes − Los servidores optimizan la carga del buzón del usuario − Los servidores implementan herramientas que impiden la distribución masiva de mensajes enviados a muchas listas − Los servidores implementan algoritmos para optimizar el tráfico internacional Tipos de listas según el nivel de acceso: En función de la categoría de usuarios que tienen acceso a la lista, se pueden distinguir los siguientes tipos: a. Pública o abierta. Accesible a cualquier usuario. b. Privada o cerrada. De acceso restringido a las direcciones de correo electrónico dadas de alta en la lista. c. Moderada. Los mensajes son leídos por una persona (moderador/editor) que se encarga de ordenarlos para, periódicamente, enviarlos en formato de revista. d. Peered. Corre en paralelo en múltiples máquinas con el objetivo de compartir la carga de usuarios y mejorar el rendimiento. Un mensaje enviado a una lista peered es propagado a las demás listas peered. En general, se pueden distinguir dos tipos de listas en función de las personas que pueden hacer los envíos: (1) Boletín. Sólo el propietario de la lista puede hacer envíos. (2) Foro. Cualquier miembro de la lista puede escribir. Material y métodos 82 1.4. Periodo del estudio El estudio se realizó en el periodo comprendido entre diciembre de 2005 y mayo de 2008, según el siguiente cronograma: Diciembre 2005: Prueba piloto del cuestionario utilizado para el análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario. Enero y febrero 2006: Administración del cuestionario diseñado para el análisis de los factores que influyen en la notificación de sospechas de RAM del farmacéutico comunitario. Junio y septiembre 2006: Desarrollo de las 3 sesiones de grupos focales. Abril 2007: Realización del curso-taller de utilización de la tarjeta amarilla, en Pamplona (23 abril) y Tudela (25 abril), y valoración del mismo en términos de satisfacción y aprendizaje. Mayo 2007: Implementación de la lista de distribución on-line de farmacovigilancia, la cual continua desde entonces en funcionamiento. Octubre 2007: Valoración de la transferencia a la práctica diaria de los conocimientos adquiridos en el curso-taller. Mayo 2008: Valoración de la satisfacción y utilidad con relación a la lista de distribución y valoración de la repercusión de las actividades implementadas (curso-taller y lista) sobre las notificaciones de sospechas de RAM. Material y métodos 83 2. ANÁLISIS DE LOS FACTORES QUE INFLUYEN EN LA NOTIFICACIÓN DE SOSPECHAS DE RAM EN FARMACIA COMUNITARIA EN NAVARRA 2.1. La encuesta La encuesta diseñada para analizar los factores que influyen en la notificación de sospechas de RAM, se realizó personalmente y a través de cuestionarios. 2.1.1. Recogida de datos: el cuestionario 2.1.1.1. Prueba piloto del cuestionario Tras diseñar el cuestionario dirigido al análisis de los factores que influyen en la notificación de sospechas de RAM, se procedió a la realización de una prueba piloto con el fin de adaptarlo a la población objeto de estudio y a los objetivos propuestos. En la prueba colaboró un grupo de 15 farmacéuticos comunitarios escogidos según varios criterios: su experiencia laboral en oficina de farmacia, su participación en el sistema de notificación de RAM, la localización de la oficina de farmacia, el tipo de población atendida, etc., formando así un grupo heterogéneo cuya aportación hizo posible perfeccionar el cuestionario en algunos aspectos que no estaban del todo claros, que necesitaban ser más desarrollados, etc. El cuestionario que fue finalmente utilizado, señalando los cambios sugeridos en la prueba piloto, se muestra en el ANEXO II. 2.1.1.2. Proceso de recogida de datos Primeramente, se envió a los farmacéuticos seleccionados una carta informativa (ANEXO III) acerca de la existencia de dicho estudio y de sus objetivos, resaltando su colaboración en el mismo como un aspecto especialmente importante. Además, a los farmacéuticos del grupo de casos se les llamó por teléfono con el fin de comprometerles más firmemente en el estudio, tratando de asegurar así su participación. Material y métodos 84 Posteriormente, se proporcionó a los farmacéuticos el cuestionario diseñado a tal efecto (ANEXO II). En todos los casos fue administrado personalmente por el investigador principal, quien solicitaba al farmacéutico responder al cuestionario sin ninguna intervención por su parte. Los cuestionarios fueron codificados y se garantizó la confidencialidad a los respondedores según la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal(91). La aceptación para participar en el estudio y la respuesta al cuestionario propuesto, tras haber recibido información acerca del mismo, fueron considerados el consentimiento informado del encuestado. De los 80 farmacéuticos seleccionados (20 casos y 60 controles), 78 aceptaron participar en el estudio (18 casos y 60 controles). 2.1.1.3. El cuestionario utilizado El cuestionario que finalmente fue utilizado, ocupaba una extensión de 1 página, por las dos caras, y contenía 48 ítems agrupados en diferentes áreas: (i) Información personal y profesional (14 preguntas) (ii) Actitudes y creencias vinculadas a la notificación espontánea de sospechas de RAM (5 preguntas) (iii) Habilidades profesionales relacionadas con la notificación espontánea de sospechas de RAM (4 preguntas) (iv) Motivos por los que no ha notificado alguna sospecha de RAM con tarjeta amarilla (16 preguntas) (v) Utilización del Sistema de Notificación con tarjeta amarilla (3 preguntas) (vi) Conocimientos básicos acerca de la notificación de sospechas de RAM (4 preguntas) (vii) Sugerencias para incrementar la notificación de sospechas de RAM del farmacéutico comunitario (2 preguntas, una de ellas abierta) Esta estructura permitía, por un lado, conocer el perfil de la persona encuestada (sexo, edad, experiencia en oficina de farmacia, categoría laboral, lugar de realización de los estudios de farmacia, participación en actividades prácticas y de formación relacionadas con farmacovigilancia), así como su contexto laboral (personal en activo, área rural o urbana, tipo de población atendida y relación Material y métodos 85 profesional con médicos de atención primaria o especializada) y su comportamiento en la práctica habitual en la farmacia comunitaria relacionado con la detección y notificación de sospechas de RAM (integración de la detección de RAM, sospecha y comunicación de RAM y vías de comunicación de RAM utilizadas). Por otra parte, servía para valorar algunas barreras que influyen en la escasa notificación del farmacéutico, incluyendo aquí los motivos que ellos mismos declaran, su actitud hacia la notificación de RAM y acerca del papel del farmacéutico en ella, y ciertas creencias erróneas y conocimientos básicos para la notificación. Además, daba la posibilidad de recoger sugerencias para aumentar la participación del farmacéutico en el Sistema de Notificación de sospechas de RAM. Las preguntas incluidas en el cuestionario se formularon tomando como base el modelo teórico mixto de los factores que condicionan el comportamiento del profesional sanitario en la notificación de sospechas de RAM(71), así como otros estudios publicados previamente acerca de los profesionales sanitarios y su notificación(46,48-62,66). Algunos de estos estudios utilizaban cuestionarios validados(61,62). Además, las razones para no haber notificado alguna sospecha de RAM fueron basadas también en “los siete pecados capitales del notificador” establecidos por Inman(44). A las preguntas acerca de las actitudes y creencias relacionadas con la notificación de sospechas de RAM, el farmacéutico debía responder expresando su grado de acuerdo en una escala Likert de 5 puntos, siendo 1 “total desacuerdo” y 5 “total acuerdo”. El resto de preguntas contenidas en el cuestionario eran en su mayoría de respuesta múltiple y, en algunos casos, preguntas abiertas. 2.1.2. Análisis de la información La información contenida en los cuestionarios cumplimentados se recogió en una base de datos creada en SPSS (versión 15.0), programa utilizado también en el análisis posterior de los datos. Material y métodos 86 2.1.2.1. Definición de variables En el análisis de los datos se utilizaron dos variables que deben ser definidas para la correcta comprensión de los resultados obtenidos de estos cuestionarios: El conocimiento del farmacéutico es una variable cuantitativa discreta, con valores comprendidos entre 0 y 4 puntos, calculada a partir de la suma de la puntuación obtenida en las cuatro preguntas acerca de los conocimientos básicos para notificar. El número de notificaciones de RAM es el número de tarjetas amarillas recibidas en el Centro de Farmacovigilancia de Navarra entre 2003 y 2005. 2.1.2.2. Análisis estadístico Las comparaciones se realizaron mediante el test de Chi-cuadrado y el test exacto de Fisher, en el caso de variables categóricas, y se utilizaron la U de MannWhitney y el test de Student para la comparación de variables cuantitativas. Con el fin de analizar la asociación entre las variables independientes y el hecho de haber notificado al menos 2 veces durante el periodo comprendido entre 2003 y 2005, se recurrió a la regresión logística. En el análisis multivariante se hizo un ajuste por las variables registradas en el cuestionario y que mostraron significación estadística en un análisis crudo previo. Los resultados se expresan como Razones de Odds (OR) con su correspondiente intervalo de confianza del 95% (IC 95%). El coeficiente de correlación de Spearman se utilizó para evaluar la asociación entre el conocimiento del farmacéutico (puntos obtenidos en las preguntas acerca de conocimiento básico), y el número de notificaciones de RAM realizadas. Los valores de p que se presentan son bilaterales. Se consideró como estadísticamente significativo un valor de p<0,05. Los análisis fueron realizados mediante el paquete estadístico SPSS versión 15.0 (SPSS Inc., Chicago, IL, USA). Material y métodos 87 2.2. El grupo focal(92) Se recurrió al grupo focal como complemento a la encuesta en el análisis de los factores que influyen en la notificación de sospechas de RAM, con el fin de profundizar en el estudio de conocimientos, actitudes y comportamientos relacionados con la notificación, puesto que la encuesta presenta limitaciones a la hora de identificar y analizar estos factores en su conjunto. Asimismo, con esta técnica se pretendía recoger posibles iniciativas que pudieran motivar e incrementar la participación de estos profesionales en el Sistema de Notificación de sospechas de RAM. 2.2.1. Captación de participantes Con el fin de obtener el máximo número de participantes en las sesiones programadas, se estableció contacto telefónico con los farmacéuticos seleccionados en dos ocasiones: I. En el primer contacto, se proponía al farmacéutico participar en las sesiones de grupo como parte del trabajo de investigación que se estaba llevando a cabo. Además, se le informaba acerca de: a) El tema de investigación. Información básica y descripción general. b) Su valiosa aportación en este trabajo. c) Las personas seleccionadas como participantes dentro de su grupo. d) El incentivo ofrecido. e) La duración de la sesión, etc. Finalmente, se sugería al farmacéutico fecha, hora y lugar de la sesión, y se agradecía su colaboración en el estudio y/o la atención prestada. II. En el segundo contacto, realizado en fechas próximas a la realización de la sesión, se recordaba al farmacéutico su compromiso de participar en el estudio así como la fecha, hora y lugar de la sesión de grupo acordadas en el contacto previo. Tras este proceso de captación, asistieron a las sesiones 11 farmacéuticos en total: 4 en el Grupo 1, 4 en el Grupo 2, y 3 en el Grupo 3. Los Grupos 1 y 2 eran de farmacéuticos “no-notificadores” y el Grupo 3, de farmacéuticos “notificadores”. Material y métodos 88 La aceptación de la participación en el estudio y la asistencia a las sesiones, tras haber recibido información acerca de dicho estudio, se consideraron el consentimiento informado para la participación en el mismo. Finalmente, la información obtenida en las sesiones fue tratada de forma anónima. 2.2.2. Desarrollo de las sesiones 2.2.2.1. Personal y recursos Los recursos considerados necesarios para el transcurso de las sesiones fueron: una habitación con mesa y sillas adecuadas a la actividad y al número de participantes, una grabadora para registrar las sesiones, y café y pastas como incentivo además de un pequeño obsequio que se entregó al finalizar la sesión en señal de agradecimiento por participar. Por otra parte, como personal se contaba con un moderador y un ayudante: - El moderador, que era el investigador principal, dirigía el curso de las sesiones, siguiendo la ruta de preguntas prevista, a la vez que llevaba la conversación y anotaba lo que se iba hablando y percibiendo durante cada sesión. Las intervenciones del moderador consistían básicamente en suscitar comentarios para descubrir las opiniones y actitudes de los participantes, en animar a compartir pensamientos, sentimientos, experiencias, etc. a través de preguntas abiertas(93). - El ayudante o auxiliar, se encargaba de tomar notas de campo, de grabar correctamente y de que hubiera disponibilidad de café y pastas durante cada sesión. 2.2.2.2. Estructura de las sesiones(94) El investigador principal, cuyo papel era el de moderador, introducía brevemente al inicio de cada sesión la situación actual con relación a las notificaciones procedentes de farmacia comunitaria en Navarra y exponía los objetivos del estudio. A continuación, hacía una serie de preguntas abiertas a los participantes con el fin de responder a los objetivos propuestos. Estas preguntas versaban sobre su experiencia en la oficina de farmacia en relación con las RAM, insistiendo especialmente en las dificultades para detectar y notificar RAM halladas Material y métodos 89 en la práctica diaria, y en las actividades o iniciativas que pudieran motivarles a participar más en el Sistema. La guía de la entrevista, o ruta de preguntas, se expone a continuación: (a) Preguntas de apertura. Presentación de cada participante: nombre, lugar de trabajo, años de experiencia en oficina de farmacia. (b) Preguntas de introducción. Comentarios sobre cuál es la contribución del farmacéutico comunitario en la seguridad de los medicamentos en su actividad diaria. (c) Preguntas de transición. Puesta en común de sus experiencias con relación a RAM en la oficina de farmacia. (d) Preguntas clave. Opiniones o pensamientos sobre el Sistema de Notificación de RAM, su papel en el mismo, las dificultades que encuentran, incentivos para participar más, etc. (e) Pregunta final. Identificación de la mayor limitación para notificar una RAM y de aquello que más les motivaría a notificar a cada uno de ellos. Para terminar la sesión, el investigador resumía lo hablado durante la sesión, asegurándose de no dejarse nada importante, y preguntaba a los participantes si les gustaría añadir algún otro comentario. La duración de las sesiones fue de unos 90 minutos. 2.2.3. Análisis de las sesiones(95) Las conversaciones fueron grabadas en una cinta de cassette y se transcribieron literalmente. El análisis se basó en el material grabado y transcrito, así como en las notas de campo tomadas en cada sesión por el moderador y por el auxiliar. Tras realizar una lectura preliminar de las transcripciones, se elaboraron las categorías de análisis y se codificaron las transcripciones. Finalmente se realizó un análisis de contenido de cada grupo y de las categorías definidas. Los resultados obtenidos se organizaron en base al modelo teórico mixto de los factores que condicionan el comportamiento del profesional sanitario en la notificación de sospechas de RAM(71). Material y métodos 90 3. IMPLEMENTACIÓN DE UNA ESTRATEGIA DE MEJORA Como respuesta a los resultados obtenidos previamente al analizar los factores que influyen en la notificación de sospechas de RAM de los farmacéuticos comunitarios en Navarra, se puso en marcha una estrategia de mejora que consistía en un cursotaller de utilización de la tarjeta amarilla y una lista de distribución on-line de farmacovigilancia. 3.1. Curso-taller de utilización de la tarjeta amarilla 3.1.1. Objetivos específicos del curso-taller Con esta iniciativa se pretendían alcanzar los objetivos específicos que se exponen a continuación: 1. Concienciar al farmacéutico acerca de la importancia de las RAMs, así como de su detección y notificación. 2. Concienciar al farmacéutico acerca de la importancia de su colaboración en el Sistema Español de Farmacovigilancia como notificador y de su obligación como tal. 3. Dar a conocer el funcionamiento y organización del Sistema Español de Farmacovigilancia y la gestión de las notificaciones. 4. Transmitir los conocimientos básicos necesarios para notificar sospechas de RAM mediante la tarjeta amarilla (quien, qué, cómo y dónde notificar) y tratar de corregir las creencias erróneas identificadas en el análisis previo. 5. Desarrollar en los alumnos las habilidades necesarias para cumplimentar y enviar la tarjeta amarilla. 3.1.2. Organización La organización del curso-taller corresponde a Dª Marta Irujo Lizaur, contando con la colaboración del Centro de Farmacovigilancia de Navarra y del Centro de Información de Medicamentos del Colegio Oficial de Farmacéuticos de Navarra. Material y métodos 91 Este curso, incluido en la oferta formativa del Colegio Oficial de Farmacéuticos de Navarra del año 2007 (ANEXO IV: tríptico informativo), como curso de Formación Continuada, fue acreditado con 0,36 créditos de Formación Continuada del Sistema Nacional de Salud (ANEXO V: Documento de acreditación de la Comisión de Formación Continuada). 3.1.3. Ponentes Las sesiones fueron impartidas por el responsable del Centro de Farmacovigilancia de Navarra, D. Juan Carlos Tres Belzunegui, y por la investigadora en formación que realizó el estudio de investigación previo a dicho curso, Dª Marta Irujo Lizaur. 3.1.4. Sesiones 3.1.4.1. Lugar, fecha y hora de las sesiones Se impartieron 2 sesiones en diferentes lugares, Pamplona y Tudela, con el fin de no limitar la formación a los farmacéuticos de Pamplona y comarca. La primera sesión tuvo lugar en Pamplona, el día 23 de abril de 2007, en el salón de actos del Colegio Oficial de Farmacéuticos de Navarra, en horario de 14.30h a 16.30h. La segunda se impartió en Tudela, el día 25 de abril de 2007, en la sede del Colegio Oficial de Médicos de Navarra en Tudela, también en horario de 14.30h a 16.30h. 3.1.4.2. Estructura de las sesiones La estructura de las sesiones seguía el siguiente esquema: 1. Introducción. Definiciones: Farmacovigilancia, RAM. Tipos de RAM. 2. Justificación de la farmacovigilancia - Datos sobre impacto de RAM (morbilidad, mortalidad, coste) - Limitaciones de los ensayos clínicos - Ejemplos de RAM Material y métodos 92 3. Programa de la OMS de Vigilancia Internacional. Sistema Español de Farmacovigilancia: - Comienzo farmacovigilancia: Programa de la OMS. - Aplicación en España: Sistema Español de Farmacovigilancia. Estructura y organización, papel de los profesionales sanitarios (importancia y obligatoriedad). 4. Detección y Notificación de RAM desde la oficina de farmacia - Información básica: quién debe notificar, qué notificar, cómo notificar, dónde notificar. - Exponer las creencias erróneas detectadas en este colectivo y corregirlas. De forma especial, insistir en que basta con la sospecha para notificar y en que, a pesar de no tener la totalidad de los datos, envíen la tarjeta amarilla. - Diferenciar RAM de Problemas Relacionados con Medicamentos (PRM). Hacer también distinción entre el Programa de consulta y dispensación activa del COF y el Sistema de Notificación con tarjeta amarilla. - Analizar una serie de casos prácticos, debatiendo la actuación del farmacéutico en cada caso (mandar o no la tarjeta amarilla) y exponiendo aquellas dudas o preguntas que surgen en la práctica. Breve explicación del estudio de investigación previo “Factores que influyen en la baja notificación de RAM en farmacia comunitaria en Navarra” y de sus resultados, justificando así la realización de este curso-taller y la lista de distribución on-line de farmacovigilancia. 3.1.5. Material utilizado Inmediatamente antes del comienzo del curso, se entregó a los asistentes el siguiente material de apoyo: 1. Diapositivas del curso y enunciados de los casos prácticos (ANEXO VI) 2. Guía de Notificación de RAM dirigida al farmacéutico (ANEXO VII) 3. Tríptico explicativo dirigido a pacientes (ANEXO VIII) 4. Tarjetas Amarillas (ANEXO I) Material y métodos 93 Además de este material, se entregaron los cuestionarios para la valoración del curso y un documento para solicitar el alta en la lista de distribución on-line de farmacovigilancia. El cuestionario de conocimientos previo, Pre-test, (ANEXO IX) se encontraba a la vista junto con el resto de documentación del curso. En cambio, el cuestionario de conocimientos posterior, Post-test, (ANEXO X) y el cuestionario de satisfacción (ANEXO XI) se entregaron, dentro de un sobre cerrado, junto con el documento de solicitud de alta en la lista de distribución (ANEXO XII), con el fin de poder valorar adecuadamente la satisfacción y los conocimientos de los alumnos después de la sesión. Además, los cuestionarios de conocimientos contenían ya un código, de forma que posteriormente pudieran emparejarse el pre-test y el post-test de cada uno de los alumnos garantizando la confidencialidad de los respondedores. 3.2. Lista de distribución on-line de farmacovigilancia Con esta herramienta se pretendía crear un entorno que hiciera posible un intercambio de mensajes, entre los farmacéuticos inscritos, en torno a las RAM y su detección y notificación, de forma que los miembros de la lista pudieran compartir inquietudes, conocimientos, opiniones, experiencias, etc., con relación a este tema. 3.2.1. Inscripción en la lista La actividad se ofreció a través de dos vías diferentes: 1. En el curso-taller. 2. Por medio de un mensaje de correo electrónico enviado a todos los colegiados del COF de Navarra (ANEXO XIII). Los farmacéuticos podían inscribirse rellenando el documento de solicitud de alta en la lista de distribución que se entregó en el curso-taller (ANEXO XII), o bien enviando un mensaje de correo electrónico a la dirección establecida para administrar la lista. 3.2.2. Características de la lista La lista de distribución on-line de farmacovigilancia es de tipo “foro” y de ámbito “privado”, es decir, cualquier persona inscrita puede enviar mensajes y el acceso está restringido a los miembros de esta lista, que son aquellos farmacéuticos de Navarra que solicitaron participar en esta actividad. Material y métodos 94 3.2.3. Administración y coordinación de la lista Se dispone de una persona encargada de administrar y coordinar la lista, la investigadora principal del trabajo, que asume las funciones que se citan a continuación: a. Dar de alta a los farmacéuticos que deseen participar, o de baja, a los que, por el contrario, quieran abandonar la lista. b. Detectar direcciones erróneas y solicitar las direcciones válidas correspondientes. c. Garantizar que se haga buen uso de la lista. d. Resolver las dudas o problemas que surjan con relación a la lista e. Recoger las sugerencias propuestas por los miembros de la lista para la mejora de la detección y notificación de sospechas de RAM (sesiones de formación, elaboración de materiales, etc.) f. Recordar a los miembros de la lista su responsabilidad, como profesionales sanitarios, de notificar las sospechas de RAM que detectan en su práctica diaria. g. Enviar información de interés relacionada con seguridad de medicamentos, reacciones adversas y otros temas relacionados con la farmacovigilancia. Material y métodos 95 4. VALORACIÓN DE LA ESTRATEGIA DE MEJORA 4.1. Curso-taller de utilización de la tarjeta amarilla 4.1.1. Evaluación de los resultados de la formación La actividad formativa impartida se valoró bajo la perspectiva de los cuatro niveles de Kirkpatrick sobre evaluación de resultados de la Formación Continua(96). Kirkpatrick propone evaluar la formación valorando los siguientes niveles: • Nivel 1: Reacción. Se mide cuál es la reacción de los participantes ante la acción formativa, es decir, su satisfacción global con todos y cada uno de los aspectos más importantes (materiales, organización, profesor…). • Nivel 2: Aprendizaje. Se mide el cambio de actitudes, la adquisición o ampliación de conocimientos y habilidades o destrezas tras la asistencia a la acción formativa. • Nivel 3: Conducta. Mide el grado en que se ha producido un cambio en la conducta del participante como consecuencia de haber asistido a la acción formativa. • Nivel 4: Resultados. Mide los resultados finales obtenidos como consecuencia de asistir a una acción formativa, es decir, el impacto de la formación impartida sobre una organización y/o la sociedad en general. Estos niveles constituyen los escalones de una cadena causal probabilística, de forma que los eslabones de la cadena son causas necesarias probables pero no causas suficientes, dado que influyen otros elementos y campos que quedan fuera de la formación impartida. Así, para lograr un cambio a través de acciones formativas, previamente deberá conseguirse un cambio conductual o de comportamiento en los destinatarios de dichas acciones. Este cambio de conducta sólo será posible si se ha logrado una transmisión de conocimientos y una adquisición de habilidades. Además este aprendizaje es más probable cuando el participante valora positivamente la organización, el profesorado, el material, el contenido…, en definitiva, el desarrollo o ejecución de la acción formativa(97). Material y métodos 96 4.1.2. Proceso de recogida de datos Se utilizaron tres tipos diferentes de cuestionarios con el fin de valorar los niveles 1 (reacción), 2 (aprendizaje) y 3 (conducta). De esta forma se evaluaron la satisfacción de los asistentes respecto al curso-taller, el conocimiento adquirido durante dicha actividad y la transferencia de conocimientos y actitudes a la práctica diaria. Estos cuestionarios fueron administrados a los asistentes al curso-taller en diferentes momentos: - Cuestionario de Satisfacción: al final de la sesión de formación. - Cuestionario de Conocimientos (pre-test y post-test): antes de la actividad formativa (pre-test) y después de la misma (post-test). - Cuestionario de Transferencia: a los 6 meses de haber realizado el cursotaller. El nivel 4 (resultados) fue valorado por medio de un análisis de las notificaciones de sospechas de RAM (ver punto 4.3). 4.1.3. Los cuestionarios utilizados (i) Cuestionario de Satisfacción Se centra en la valoración, por parte del participante, del proceso o ejecución de la acción formativa con el fin de valorar la gestión y ejecución de la misma, la pertinencia de dicha acción y la previsión de nuevas necesidades de formación, además de prever la utilidad de la acción para la mejora del desempeño de su trabajo. El cuestionario de satisfacción utilizado (ANEXO XI) contenía 21 ítems para la valoración de Contenidos, Profesorado, Metodología didáctica, Organización, y Satisfacción general. Los asistentes debían expresar su grado de acuerdo con cada uno de estos ítems sobre una escala Likert de 10 puntos, donde el 1 expresaba “total desacuerdo” y el 10, “total acuerdo”. Además, incluía un apartado destinado a observaciones con relación al curso (pregunta abierta) y una pregunta acerca del deseo de continuar recibiendo acciones formativas relacionadas con farmacovigilancia y sugerencias al respecto (pregunta abierta). Material y métodos 97 Por otro lado, también se recogieron algunos datos acerca del farmacéutico asistente: género, edad, categoría laboral y años de experiencia laboral en oficina de farmacia. (ii) Cuestionario de Conocimientos Valora si los asistentes han adquirido los conocimientos previstos durante la acción formativa. Para ello, se administraron dos cuestionarios de idéntico contenido en cuanto a preguntas sobre conocimientos relacionados con la farmacovigilancia y la notificación de sospechas de RAM. Uno de ellos era cumplimentado antes de impartir la formación, el llamado pre-test (ANEXO IX), y el otro, el post-test (ANEXO X), se cumplimentaba después de dicha formación. Estos cuestionarios contenían 15 ítems relacionados con el conocimiento transmitido durante la sesión formativa. 11 de estos ítems constituían afirmaciones acerca de conocimientos generales sobre la farmacovigilancia y la notificación de sospechas de RAM, ante las que los asistentes debían determinar si eran verdaderas, falsas, o si no estaban seguros de cuál era la respuesta acertada. Los 4 ítems restantes consistían en preguntas de respuesta múltiple (5 opciones de respuesta) relacionadas más concretamente con los conocimientos básicos necesarios para notificar sospechas de RAM: quién, qué, cómo y dónde notificar. Finalmente, al igual que en el cuestionario de satisfacción, se recogieron algunos datos acerca del farmacéutico encuestado: género, edad, categoría laboral y años de experiencia laboral en oficina de farmacia. Estos datos únicamente fueron solicitados en el pre-test. (iii) Cuestionario de Transferencia Se trata de valorar en qué medida se ha producido una transferencia de lo aprendido al puesto de trabajo, es decir, si los asistentes al curso han aplicado los conocimientos adquiridos en su actividad profesional. Este tipo de valoración suele realizarse a los 3 o 6 meses después de la acción formativa. En nuestro caso fue administrado a los 6 meses del curso-taller, en octubre de 2007, a través de correo electrónico. A aquellos farmacéuticos que no habían Material y métodos 98 respondido a este primer envío, se volvió a enviar el cuestionario 2 semanas más tarde. Finalmente, pasado un mes del primer envío, se hizo un recordatorio telefónico a los participantes con el fin de obtener una mayor tasa de respuesta. El cuestionario de transferencia utilizado (ANEXO XIV) contenía 16 ítems. El encuestado debía indicar, sobre una escala Likert de 5 puntos, donde el 1 expresaba “total desacuerdo” y el 5 “total acuerdo”, su grado de acuerdo con las afirmaciones propuestas. Estas afirmaciones versaban sobre actitudes, habilidades y comportamientos, relacionados con la detección y notificación de sospechas de RAM con tarjeta amarilla, que podían haberse derivado de la acción formativa. En este tipo de cuestionario no se solicitaron datos propios del farmacéutico. 4.1.4. Análisis de la información La información contenida en los cuestionarios cumplimentados se recogió en una base de datos creada en SPSS (versión 15.0), y se analizó posteriormente con dicho programa. Para cada ítem valorado en los cuestionarios se calculó, en el caso de variables cualitativas, el porcentaje de respuestas correctas, y para las variables cuantitativas, se determinó el rango de valores mínimo-máximo y la mediana (P25;P75) de puntos obtenidos. Las comparaciones se realizaron mediante el test de Wilcoxon para datos emparejados en la comparación de variables cuantitativas discretas en muestras dependientes; el test de McNemar para datos emparejados, en el caso de variables cualitativas en muestras dependientes; y la U de Mann-Whitney, en el caso de variables cuantitativas ordinales en muestras independientes. Los valores de p que se presentan son bilaterales. Se consideró como estadísticamente significativo un valor de p<0,05. Material y métodos 99 4.2. Lista de distribución on-line de farmacovigilancia. 4.2.1. Valoración de la actividad de la lista Se llevó a cabo un análisis de la actividad registrada en la lista durante los 12 primeros meses de funcionamiento de la misma. Para ello, se registraron una serie de indicadores relativos a la actividad de la lista y a la procedencia y contenido de los mensajes distribuidos a través de la misma: Indicadores de actividad de la lista - Número de usuarios - Número total de mensajes - Número de mensajes mensuales - Número de mensajes por usuario - Porcentaje y número de usuarios activos - Número de mensajes por usuario activo Indicadores de procedencia de los mensajes - Centros de trabajo generadores de mensajes: categoría y número - Distribución de los mensajes en función del ámbito laboral de los usuarios activos: categoría, número y porcentaje que representa. Indicadores de contenido de los mensajes - Distribución por tipo de mensaje. Se consideraron 5 categorías de mensajes: (1) comentarios relacionados con la seguridad de medicamentos, (2) casos detectados desde el ámbito asistencial del farmacéutico y comentarios consecuentes, (3) mensajes recordatorios, (4) temas relacionados con la lista (instrucciones de funcionamiento, etc.), y (5) otros. En dichas categorías se han distribuido la totalidad de mensajes generados en la lista. Material y métodos 100 4.2.2. Valoración de la satisfacción y utilidad de la lista por los usuarios Una vez más, se utilizó la metodología de la encuesta para valorar la satisfacción y la utilidad de la lista desde el punto de vista de los usuarios de la misma. En esta ocasión se empleó una herramienta web de encuestas on-line(98), la cual permite elaborar encuestas, enviarlas y obtener la información correspondiente de forma rápida y sencilla. 4.2.2.1. Proceso de recogida de datos La recogida de datos se llevó a cabo a través de cuestionarios on-line. Los usuarios de la lista podían acceder al cuestionario a través de un link situado en un mensaje de correo electrónico, enviado por medio de la lista. Este mensaje se envió 3 veces en total, con una semana de separación entre cada envío, con el fin de obtener una mayor tasa de respuesta. Los cuestionarios cumplimentados se recibían, de forma anónima, en la plataforma on-line. 4.2.2.2. El cuestionario utilizado El cuestionario de valoración de la lista (ANEXO XV) constaba de 11 afirmaciones acerca de la satisfacción y utilidad de la lista. Los respondedores debían indicar su grado de acuerdo con estas afirmaciones en una escala Likert de 10 puntos. Además, incluía una pregunta abierta para que pudieran expresar sugerencias u observaciones con relación a la lista de distribución, y por último, se preguntaba acerca de su voluntad de continuar con esta actividad. 4.2.2.3. Análisis de la información La información contenida en el cuestionario administrado se recogió en una base de datos creada en SPSS (versión 15.0), y se analizó también con dicho programa. Para cada ítem contenido en el cuestionario se determinaron el rango de valores mínimo-máximo y la mediana (P25;P75) de puntos otorgados. Material y métodos 101 4.3. Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria El impacto de las actividades realizadas (curso-taller y lista de distribución) sobre las notificaciones de sospechas de RAM de farmacia comunitaria en Navarra, fue valorado a través del registro y análisis de las notificaciones de sospechas de RAM procedentes del ámbito de la oficina de farmacia, recibidas en el Centro de Farmacovigilancia de Navarra, durante los 12 meses siguientes a la implementación de dichas actividades. Se analizó la contribución del farmacéutico comunitario al Sistema de Notificación, la actividad notificadora del mismo y su implicación en el Sistema, así como la repercusión de las actividades implementadas sobre estos aspectos. Para ello, se estudió lo siguiente: Contribución del farmacéutico comunitario al Sistema de Notificación o Evolución de la contribución del farmacéutico comunitario, al Sistema de Notificación Espontánea en Navarra, desde enero de 2003 hasta abril de 2008. o Contribución de los farmacéuticos comunitarios participantes en las actividades, a las notificaciones enviadas desde farmacia comunitaria durante los 12 meses siguientes a la implementación de las actividades (mayo de 2007 - abril de 2008). Actividad notificadora del farmacéutico comunitario o Evolución de la tasa de notificación, por 1000 farmacéuticos-mes, desde enero de 2003 hasta abril de 2008. La tasa de notificación, por 1000 farmacéuticos-mes, resulta del cociente entre el número de notificaciones procedentes de farmacéuticos, en un mes, y el número de farmacéuticos en ese mes, multiplicado por 1000. Material y métodos 102 o Evolución de la tasa de notificación, por 1000 farmacéuticos-año, desde enero de 2003 hasta abril de 2008. La tasa de notificación, por 1000 farmacéuticos-año, resulta del cociente entre el número de notificaciones procedentes de farmacéuticos, en un año, y el número de farmacéuticos en ese año, multiplicado por 1000. o Tasa de notificación, por 1000 farmacéuticos-año, en los 12 meses de estudio, en cada grupo: participantes y no participantes, respecto al año anterior (2006). o Número de notificaciones por farmacéutico notificador en el grupo de participantes y en el resto de farmacéuticos. Implicación del farmacéutico comunitario en el Sistema de Notificación o Porcentaje de oficinas de farmacia desde las que se envían notificaciones desde enero de 2003 hasta abril de 2008. o Asociación entre participar en las actividades y ser notificador durante los 12 meses siguientes a la implementación de las actividades. o Incidencia acumulada de “nuevos notificadores” en los 12 meses de estudio, respecto al año anterior (2006). Se consideran “nuevos notificadores” a aquellos farmacéuticos que notifican durante los 12 meses de estudio y que no habían notificado en los 3 años anteriores. La incidencia acumulada de “nuevos notificadores” corresponde al cociente entre los farmacéuticos “nuevos notificadores” y la población en riesgo de convertirse en “nuevo notificador”, es decir, el número de farmacéuticos que no notifican en los 3 años previos. o Asociación entre la participación en las actividades y la aparición de “nuevos notificadores” durante los 12 meses siguientes a la implementación de las actividades. Material y métodos 103 4.3.1. Análisis estadístico Se utilizó la regresión logística para analizar la asociación entre la participación en las actividades y el hecho de haber notificado durante los 12 meses siguientes, es decir, entre mayo de 2007 y abril de 2008, tanto en conjunto como por periodos de 4 meses. En el análisis multivariante se hizo un ajuste por aquellas variables consideradas de influencia en la notificación (“ser notificador en los 3 años anteriores” y “ser miembro activo del Programa de consulta y dispensación activa”), las cuales mostraban significación estadística en el análisis crudo previo. De la misma manera, se estudió la asociación entre participar en las actividades y ser “nuevo notificador”, ajustando únicamente por la variable “ser miembro activo del Programa de consulta y dispensación activa”. Los resultados se expresan como Razones de Odds (OR) con su correspondiente intervalo de confianza del 95% (IC 95%). Los valores de p que se presentan son bilaterales. Se consideró como estadísticamente significativo un valor de p<0,05. Los análisis fueron realizados mediante el paquete estadístico SPSS (versión 15.0). IV. RESULTADOS Resultados 107 1. ANÁLISIS DE LOS FACTORES QUE INFLUYEN EN LA NOTIFICACIÓN DE SOSPECHAS DE RAM EN FARMACIA COMUNITARIA EN NAVARRA 1.1. La encuesta En total fueron recogidos 78 cuestionarios (18 de casos y 60 de controles). Así, la tasa de respuesta del grupo de casos fue del 90% y la de controles del 100%. En la Tabla I se muestran las características personales y profesionales de los farmacéuticos encuestados, así como algunas características relevantes con relación al centro de trabajo de los mismos. Entre estas características se identifican como factores asociados a la notificación de sospechas de RAM, en un análisis crudo, las siguientes: una mayor edad, una mayor experiencia profesional como farmacéutico comunitario, la participación en el programa de consulta y dispensación activa, y la participación en actividades de formación continuada en detección y resolución de PRMs. Sin embargo, tras hacer un ajuste por las variables significativas halladas en el análisis crudo, ninguna de las variables citadas anteriormente se identificó como predictor independiente de la notificación de sospechas de RAM. Ver Tabla II. Resultados 108 Tabla I. Características personales y profesionales de los farmacéuticos y características a de la Oficina de Farmacia Variables Casos (n=18) Controles (n=60) Valor p crudo Características personales y profesionales de los farmacéuticos Sexo (%) − Hombre 16,7 15,0 − Mujer 83,3 85,0 43,43 (11,99) 37,56 (16,14) 0,019 c 12,00 (14,00) 0,041c Edad (años) [mediana (RIC)] Experiencia profesional en Oficina de Farmacia (años) [mediana (RIC)] 16,50 (14,25) 1,000 d Categoría laboral (%) − Farmacéutico titular 94,4 74,6 − Farmacéutico adjunto 5,6 25,4 − Universidad de Navarra 77,8 51,7 0,060 d Programa de dispensación y consulta (%) 72,2 31,6 0,002 b Formación Continuada [últimos 3 años] (%) 94,4 71,7 0,057 d − Atención Farmacéutica 83,3 66,7 0,174 b − Detección y resolución de PRM 94,4 38,3 <0,001 b − Farmacovigilancia 22,2 15,0 0,483 d 3,00 (1,00) 2,00 (2,00) 0,075 c 100,0 86,7 0,187 d − Niños y adolescentes (0-18 años) 11,1 21,7 0,498 d − Adultos jóvenes (19-35 años) 5,6 16,7 0,441 d − Adultos (36-65 años) 77,8 60,0 0,168 b − Ancianos (>65 años) 61,1 63,3 0,864 b 0,098 d Universidad (%) Características de la Oficina de Farmacia Número de trabajadores [mediana (RIC)] Área geográfica (%) − Urbana Población predominantee (%) Relación profesional con médicos de Atención Primaria o Especialistas (%) − No 16,7 15,0 − Sí 83,3 85,0 1,000 d a Los resultados se expresan como porcentajes para variables categóricas, y como medianas (rango intercuartílico) para variables continuas b Chi2 test c U. Mann-Whitney test d Test exacto de Fisher e Categorías mutuamente no excluyentes PRM = Problemas Relacionados con Medicamentos; RIC = Rango Intercuartílico. Resultados Tabla II. Características asociadas a la notificación de sospechas de RAM Notificaciones (2003-2005)a Características Edad (años) [mediana (RIC)] Experiencia laboral como farmacéutico (años) [mediana (RIC)] Casos (n=18) Controles (n=60) ≥ 2 notificaciones 0 notificaciones 43,43 (11,99) 16,50 (14,25) Análisis ajustadob Análisis crudo OR (IC 95%) Valor p OR (IC 95%) Valor p 37,56 (16,14) 1,06 (1,01-1,11) 0,031 1,13 (0,93-1,37) 0,209 12,00 (14,00) 1,06 (1,00-1,12) 0,035 0,93 (0,76-1,13) 0,462 Participación en el programa de dispensación y consulta farmacéutica (%) 72,2 31,6 5,63 (1,74-18,20) 0,004 2,04 (0,17-25,03) 0,576 Recibir formación continuada en detección y resolución de PRM (%) 94,4 38,3 27,35 (3,41-219,53) 0,002 9,40 (0,23-389,25) 0,238 Coniderar frecuentemente la posibilidad de encontrar una RAM cuando atiende a un paciente que refiere síntomasc (%) 66,7 35,0 3,71 (1,22-11,32) 0,021 1,54 (0,26-8,97) 0,631 Olvidar notificar una sospecha de RAM (%) 33,3 5,0 9,50 (2,08-43,41) 0,004 5,58 (0,68-45,89) 0,110 Desacuerdo con: “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente” (%) 44,4 8,3 8,80 (2,39-32,45) 0,001 18,91 (1,92-186,34) 0,012 3,25 (0,25) 2,75 (1,25) 9,29 (2,12-40,71) 0,003 12,98 (1,04-162,50) 0,047 Puntuación en las preguntas sobre conocimientos básicos [mediana (RIC)] a Los resultados se expresan como porcentajes para variables categóricas, y como medianas (rango intercuartílico) para variables continuas. b Análisis multivariante ajustando por todas las variables de la tabla. c Se considera frecuentemente si a la pregunta de “Ante un síntoma referido por un paciente, ¿se plantea que puede ser una RAM?”, responde “muchas veces” o “siempre”. PRM = Problemas Relacionados con Medicamentos; RAM = Reacciones Adversas a Medicamentos; RIC = Rango Intercuartílico; OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. 109 Resultados 110 1.1.1. Detección de sospechas de RAM en la práctica profesional del farmacéutico La totalidad de farmacéuticos encuestados se había planteado en alguna ocasión la posibilidad de hallar una RAM ante un síntoma referido por un paciente. Sin embargo, los pertenecientes al grupo de casos mostraron considerar esta posibilidad más frecuentemente que los controles (ver Tabla II). Además, casi la totalidad de los encuestados reconoció haber detectado alguna vez una sospecha de RAM (casos: 100%; controles: 95%). 1.1.2. Historia notificadora del farmacéutico En el momento en que un farmacéutico detecta una sospecha de RAM, en general, la forma de comunicación más utilizada, en ambos grupos, es la derivación del paciente al médico (casos: 83,3%; controles: 81,7%). La comunicación directa al médico constituye una actuación menos extendida (casos: 55,6%; controles: 53,3%) y lo es mucho menos la comunicación de este tipo de eventos a la industria farmacéutica (casos: 33,3%; controles: 8,3%). La tarjeta amarilla, como medio de comunicación de las sospechas de RAM detectadas había sido utilizada, como es lógico, por el 100% de casos. Y también el 23,3% de los controles (n=14) admitía haberla utilizado en alguna ocasión, aunque se trataba de notificaciones previas al año 2003. De aquellos que habían utilizado alguna vez la tarjeta amarilla, el 66,7% de casos (n=12) y el 50% de controles (n=7) reconocieron que no habían encontrado dificultades relacionadas con la utilización de este formulario. 1.1.3. Actitudes y conocimientos A pesar de que casi la totalidad de farmacéuticos del grupo control había detectado alguna vez una sospecha de RAM (95%), únicamente el 23,3% había utilizado la tarjeta amarilla para comunicar este evento. Las principales razones que llevan a los farmacéuticos, tanto notificadores como no-notificadores, a no notificar las sospechas de RAM detectadas, se muestran en la Figura 1. De todas ellas, el Resultados 111 “olvido” es la única que muestra una asociación significativa con la notificación de Farmacéuticos (%) sospechas de RAM (ver Tabla II). 55,6% 66,7% 60,0% 36,7% 35,0% 27,8% 33,3% ** 16,7% 18,3% 22,4% 10,2% 5,0% RAM leve RAM conocida Inseguridad causalidad Olvido Falta de tiempo Otras razones Casos (2 o más notificaciones entre 2003 y 2005) Controles (ninguna notificación entre 2003 y 2005) ** p<0,01 RAM = Reacciones Adversas a Medicamentos Figura 1. Razones para no notificar sospechas de RAM Asimismo, fueron valoradas algunas actitudes y creencias del farmacéutico, relacionadas con la notificación de sospechas de RAM, solicitando al encuestado expresar su grado de acuerdo en una escala Likert de 5 puntos (1: total desacuerdo; 5: total acuerdo), con relación a 5 afirmaciones propuestas. Ver Tabla III. Resultados Tabla III. Actitudes y creencias relacionadas con la notificación de sospechas de RAM en una escala Likert de 5 puntosa Afirmaciones Casos Controles (n=18) [media (DE)] (n=60) [media (DE)] OR (IC 95%) Valor p Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente 3,28 (1,708) 4,02 (1,017) 0,64 (0,43-0,96) 0,032 Todas las RAM graves son detectadas antes de la comercialización del medicamento 2,11 (1,132) 1,97 (0,890) 1,17 (0,68-2,02) 0,568 La notificación de RAM constituye una contribución importante al conocimiento de la seguridad de los medicamentos 4,72 (0,575) 4,53 (0,873) 1,45 (0,62-3,39) 0,396 El farmacéutico comunitario es una figura importante en la detección de RAM 4,67 (0,485) 4,23 (0,963) 2,39 (0,92-6,25) 0,074 Considero la detección y notificación de RAM como una función importante del farmacéutico comunitario 4,50 (0,618) 4,30 (0,908) 1,39 (0,66-2,90) 0,384 a Los resultados se expresan como medias (desviación estándar) RAM = Reacciones Adversas a Medicamentos; DE = Desviación Estándar; OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. 112 Resultados 113 En general, la mayoría de los encuestados estaba de acuerdo con las afirmaciones acerca de la importancia del Sistema de Notificación Espontánea y de su papel como notificadores en dicho sistema, mostrando así una actitud positiva hacia la notificación de sospechas de RAM. Además, gran parte de los farmacéuticos de ambos grupos mostraban su desacuerdo con la siguiente afirmación: “Todas las RAM graves son detectadas antes de la comercialización del medicamento” (76,3% de los controles, 83,3% de los casos). Por otra parte, eran pocos los que expresaban desacuerdo con la afirmación siguiente: “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente”. Ver Tabla II. En cuanto al conocimiento básico necesario para notificar sospechas de RAM a través del Sistema de Notificación Espontánea (quién, qué, cómo y dónde notificar), se observó que los farmacéuticos poseían unos niveles aceptables de conocimiento. Ambos grupos superaban los 2 puntos (de mediana), en un rango de puntuación entre 0 y 4 puntos, siendo la puntuación del grupo de casos superior a la de controles (mediana de casos: 3,25; mediana de controles: 2,75; p=0,004). Además, se encontró una correlación positiva entre la puntuación obtenida y el número de notificaciones (Coeficiente de correlación= 0,387; p=0,001). Por otra parte, una elevada proporción de farmacéuticos (75,6%) no era consciente de la posibilidad de utilizar tarjeta amarilla electrónica, teléfono o e-mail para notificar, además de la tarjeta amarilla convencional. Adicionalmente, el 31,7% de controles no sabía que la tarjeta amarilla debe enviarse al Centro de Farmacovigilancia de su Comunidad Autónoma, frente al 100% de casos que sí lo sabía. Los factores que mostraron ser predictores independientes de la notificación de sospechas de RAM en el modelo multivariante fueron: estar en desacuerdo con la afirmación “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente” y obtener una mayor puntuación en las preguntas sobre conocimiento básico (Tabla II). Resultados 114 1.1.4. Sugerencias de los farmacéuticos Desde ambos grupos se solicitaba formación relacionada con la detección y notificación de RAM. Los farmacéuticos del grupo de controles mostraban un interés algo mayor (91,7%) que los del grupo de casos (83,3%). Con relación a la pregunta abierta contenida en el cuestionario acerca de cómo se podría mejorar su participación en el Sistema, se recibieron múltiples respuestas. Las sugerencias no sólo iban dirigidas a los farmacéuticos, sino también a médicos, pacientes y el Sistema de Notificación. En general, lo más demandado era lo siguiente: formación en notificación de RAM para farmacéuticos, y concienciación, tanto de farmacéuticos como de médicos y pacientes, sobre la importancia del Sistema de Notificación. 1.2. El grupo focal De los 11 farmacéuticos participantes en los grupos, 9 eran mujeres (82%) y sólo 2 eran hombres (18%). Sus edades estaban comprendidas entre los 24 y los 55 años, siendo la mediana de la edad de 27 años. Su experiencia laboral en oficina de farmacia era de entre 1 a 34 años con una mediana de 4 años. En cuanto al cargo que desempeñaban en la oficina de farmacia, 5 eran titulares (45%) y 6 adjuntos (55%). Los resultados obtenidos en los grupos focales se organizaron en base al modelo teórico mixto de los factores que condicionan el comportamiento del profesional sanitario en la notificación de sospechas de RAM(71). Según este modelo, el hábito de notificar RAM es considerado como resultado de los factores considerados intrínsecos, relativos al conocimiento y actitud del farmacéutico, y de los factores extrínsecos, condicionados por el sistema de trabajo y de la interacción con el entorno profesional. Así, las barreras y los facilitadores para la notificación de sospechas de RAM, identificadas durante las sesiones, se clasificaron en factores intrínsecos y en factores extrínsecos. Resultados 115 1.2.1. Factores intrínsecos Dentro de los factores intrínsecos, se distinguieron los siguientes puntos: 1. Formación del farmacéutico en farmacovigilancia; 2. Conocimiento relacionado con el Sistema de Notificación y su funcionamiento; 3. Actitud del farmacéutico en cuanto a la prioridad que otorga el tema. En la Matriz textual 1 y la Matriz textual 2, se resumen los factores intrínsecos identificados como barreras y facilitadores, respectivamente. 1.2.1.1. Factores intrínsecos como barreras en la notificación 1.2.1.1.1. Formación del farmacéutico en farmacovigilancia La formación que recibe el farmacéutico con relación a la farmacovigilancia durante la licenciatura, aunque está presente, es más bien escasa. Parece que en alguna asignatura se ha tratado de forma superficial, pero no se le ha dado la importancia que merece el tema en cuestión. Incluso, durante las Estancias “A mi me suena que se nos explicó en clase, pero… ¡no se le dio mucha importancia! Es verdad que hay muchas cosas que tampoco te enseñan a hacer en la universidad y que las aprendes a hacer en las prácticas. Pero…por lo menos, el decirte lo importante que es… Yo noto falta en la concienciación.” (G2) “A mí, en la farmacia, no me lo enseñaron.” (G2) Tuteladas (prácticas profesionales realizadas por los alumnos al término de sus estudios y que constituyen la formación práctica del alumno en el ámbito asistencial), en general, no se forma al alumno en farmacovigilancia desde las oficinas de farmacia. En este periodo de formación práctica, no sólo no se transmite la importancia que tiene el Sistema de Farmacovigilancia y su participación en él, sino que tampoco se muestra qué es una tarjeta amarilla, cuál es su utilidad o cómo se utiliza. “En alguna farmacia, el de prácticas debió preguntar: ‘¿Y esto?’ – ‘Eso me lo mandan pero no es necesario mandarlo’. En muchas farmacias no saben ni para qué es ¡porque nunca han mandado ninguna!” (G3) “Yo no sabía dónde tenía que mandarlo o qué hacer... Además, como no es algo que me haya tocado o que haya visto,…si alguien me hubiera dicho: ‘oye, pues ahora lo tienes que mandar aquí’…” (G1) Resultados 116 1.2.1.1.2. Conocimiento relacionado con el Sistema de Notificación y su funcionamiento El farmacéutico “no-notificador”, a pesar de conocer la existencia de la tarjeta amarilla, en muchos casos desconoce la importancia, el funcionamiento, los objetivos o la utilidad del Sistema de Notificación, así como los aspectos que resultan básicos a la hora de notificar, siendo éstos: quién, qué, cómo, y dónde notificar. “falta…motivación en el tema, conocer las repercusiones que tienen las RAM… ¡ver que sirve para algo!” (G2) “Yo sé que existe la tarjeta amarilla, pero… ¡no tenemos ni idea de cómo hay que utilizarla!” (G1) “Muchas veces no sabes hasta qué punto notificar o no notificar” (G2) “Yo no tengo claro qué es lo que tengo que notificar. Si es lo que viene ya en el prospecto, o tiene q ser una reacción…rara, …” (G2) “Yo cuando me he encontrado con alguna reacción adversa, ¡no sabía dónde mandar o qué hacer con ello!” (G1) También se puso de manifiesto la existencia de: Confusión entre los conceptos de Problema Relacionado con Medicamentos (PRM) y Reacción Adversa a Medicamentos (RAM) y entre los diferentes programas o sistemas existentes para la comunicación de dichos acontecimientos. Desconocimiento acerca de la disponibilidad de tarjetas amarillas en su centro de trabajo, así como de la localización de las mismas en dicho lugar. Desconocimiento de vías de notificación diferentes de la tarjeta amarilla convencional (en papel), posiblemente más sencillas y/o cómodas para el farmacéutico. “(Ante la pregunta de cómo actúan ante una RAM) Primero te aseguras que es de la RAM y si se puede conectar con el médico, se le llama, se le explica y que evalúe el tratamiento o a ver qué le parece a él, y luego se manda al colegio.” (G1) “…se confunden mucho PRMs con reacciones adversas, o sea, hay gente que lo toma todo igual, entonces…” (G3) “Se supone que la tenemos, pero no sabemos dónde…” (G1) “He estado trabajando en muchas farmacias y nunca me han dicho: ‘aquí están las TAs’ o ‘aquí tienes Internet para mandar un mail y notificarlo a un centro’. Me dicen dónde está cualquier cosa, pero ningún farmacéutico me ha mencionado nada de eso.” (G2) “¡Ah! pues sabiendo q está por Internet… bueno, ¡yo no sabía q estaba!” (G2) “Yo nunca he tenido muy claro cómo tengo que notificar” (G2) Resultados 117 Asimismo se detectaron una serie de creencias erróneas entre los farmacéuticos nonotificadores: a. “Para notificar una reacción adversa, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente” “Primero te aseguras de que es una RAM…” (G1) “A mí el otro día me pasó con una señora. Últimamente está con la tensión bastante alta. Nunca había tenido alta la tensión, y ella se ha notado que a partir de un tratamiento antidepresivo, estaba notando la tensión alta. Entonces yo apunté todo, todos los datos,… He estado mirando y tal, pero claro, yo tampoco sé hasta qué punto eso puede ser una RAM cuando es una persona que está en tratamiento antidepresivo, ¡y que en el momento que estaba hablando conmigo estaba muy nerviosa!... ¿Hasta qué punto es una reacción adversa por la medicación que ella estaba tomando? ¡Porque ella lo ha notado a raíz de tomar esa medicación! O, es a consecuencia de que ella está depresiva, de que tiene ese estrés, de que está más nerviosa, … Entonces claro, ahí… ¿Cómo puedo llegar a detectar si es por eso, o no es por eso?” (G1) “Siempre te queda la duda… ¿Habrá sido el medicamento, o…?” (G2) b. “En el Centro de Farmacovigilancia se van a reír o van a pensar mal del farmacéutico si éste manda una reacción adversa que es muy obvia o si lo que “Y muchas veces igual es que…lo relleno, ¿y qué? ‘¡Buah! mira el tonto este que me manda que con esta pastilla se ha puesto a sudar’… ” (G2) era “Al final sí que pasan cosas y yo me digo: ‘Es que esto, si lo mando y no es, ya dirán: esta tonta…’ ” (G2) c. “No sirve de nada notificar una reacción adversa que “Nosotros, cuando tuvimos el problema ese gordo con el lansoprazol (una chica con unas diarreas muy fuertes por un lansoprazol genérico), al final se solucionó y vimos que…no me acuerdo qué hablamos… pero fue un caso entre no sé cuantos mil y que sí que se conocía. Entonces, dijimos: ‘bueno… pues no lo mandamos’. ” (G1) identifica como reacción adversa, no lo realmente” ya está descrita en el prospecto del medicamento, es decir, que sea conocida” “Y a veces, claro, el prospecto es tan amplio… que te dicen: ‘provoca malestar general’ y ¿A qué se refiere con malestar general? ¿Mareo, vómitos,…? Entonces, yo me pregunto: ¿Para qué voy a notificar una cosa que Resultados 118 parece que ya está ahí?” (G2) d. “Es mejor hablar con el médico y/o paciente para solucionar el problema”. “Yo me he encontrado con un montón de casos, que sí que podía haber mandado la tarjeta amarilla, o haber avisado y tal… Pero, sin embargo, se arregla más hablando directamente con el médico” (G1) “Yo le digo al paciente: ‘Mira, vete al médico y que te cambie’. Como él sí le puede dar… Al final, vas un poco a lo práctico, más que a lo que se debería hacer.” (G2) e. “Tras detectar una reacción adversa, basta con comunicarla al Centro de Información de Medicamentos (CIM) del Colegio de Farmacéuticos y ahí se encargarán” “Yo me quedo con la conciencia tranquila porque yo lo mando aquí (al Colegio) y digo: ‘¡pues ya se encargarán!’.” (G1) “Primero te aseguras que es de la RAM y si se puede conectar con el médico, se le llama, se le explica y que le evalúe el tratamiento… o a ver qué le parece a él… Y luego, se manda aquí al Colegio.” (G1) 1.2.1.1.3. Actitud del farmacéutico en cuanto a la prioridad que otorga el tema Se observó, de forma generalizada, la predisposición del farmacéutico por intentar solucionar los problemas de los pacientes. Además, algunos farmacéuticos expresaban tener miedo o cierto reparo a notificar al Centro de Farmacovigilancia algo de lo que no tienen seguridad, o que parece muy obvio, o que no es correcto,… y también a solicitar al paciente los numerosos datos contenidos en la tarjeta amarilla. “Es que, al final, por lo que tú estás preocupado es por resolverle al paciente el problema en el momento. Y más si tiene un problema de salud grave. Con eso, es como que ya has hecho tu parte.” (G2) “En el fondo es que te da miedo notificar una cosa y meter la pata, porque estamos inseguros” (G3) “¿Y la reacción q tiene cuando yo le digo que igual ha podido ser esto? Es que es difícil hacerles entender y que luego tengan paciencia para contarte…Porque, claro, ¡en la TA te piden bastantes datos! Qué medicación toma actualmente, qué no sé qué, cuándo la toma… (G2) Resultados 119 1.2.1.2. Factores intrínsecos como facilitadores en la notificación 1.2.1.2.1. Formación del farmacéutico en farmacovigilancia En general, en los grupos se percibió la idea de que, aunque de forma superficial, desde la Universidad se transmiten conocimientos relacionados con la farmacovigilancia. Asimismo, en las Estancias Tuteladas, en algún caso se enseña al alumno qué es una tarjeta amarilla, para qué “Yo una vez di una clase de la tarjeta amarilla… sé que se nos explicó para qué era…igual no cómo se rellena, pero…para qué era, sí. Y que nos han enseñado una foto de la TA,… ¡eso seguro! No sé si era en Farmacia Clínica…Pero en la farmacia, no.” (G2) “Yo creo que me lo enseñaron en las Estancias Tuteladas…” (G2) sirve, cómo se utiliza,… Sin embargo, parecen ser casos poco frecuentes. 1.2.1.2.2. Conocimiento relacionado con el Sistema de Notificación y su funcionamiento Con relación al conocimiento de los profesionales en este tema, se observó que todos conocían la existencia de la tarjeta amarilla y del Sistema de Farmacovigilancia para el “Yo sé que existe la tarjeta amarilla, pero… ¡no tenemos ni idea de cómo hay que utilizarla!” (G1) medicamentos “Sé de la existencia de la tarjeta amarilla, pero nunca he mandado una porque no sé cómo hacerlo” (G2) Por otra parte, durante las sesiones, los participantes, “Yo me acuerdo que cuando la charla esa… ¡luego rellenabas todas!” (G3) control de la seguridad de los comercializados. concretamente notificadora, aquellos que tenían experiencia manifestaron que un mayor conocimiento sobre notificación de RAM influía positivamente sobre su motivación en este ámbito y, como consecuencia, sobre la notificación de RAM. “…que de vez en cuando vengan de farmacovigilancia y que nos den una charla…¡Eso te motiva!” (G3) Resultados 120 1.2.1.2.3. Actitud del farmacéutico en cuanto a la prioridad que otorga el tema En general, se pudo observar una actitud positiva hacia la detección y la notificación de RAM, que contribuye a la aceptación y valoración del sistema de notificación mediante tarjeta amarilla. Sin embargo, no se mostraba como una condición suficiente para adquirir el hábito de notificar. Según lo discutido en los grupos, parece claro que el farmacéutico debería asumir esta actividad como obligatoria, integrada en el conjunto de actividades que se desarrollan en la oficina de farmacia. “¡Es que es importante! Los laboratorios registran los medicamentos con unos datos y ficha técnica, y dicen: ‘efectos adversos: un 1 por diez mil no sé cuántos ciento cincuenta mil tiene dolor de cabeza. Pero claro, esa estadística esta hecha en base al ensayo clínico de registro, ¡y son 40 estudiantes supersanos! Entonces ¿qué pasa? En cambio, el porcentaje de efectos adversos es un motivo como para hacer notificación siempre, aunque sean conocidas, ¿eh?” (G3) “Tenemos que comprometernos. Con la intención, no vale. O sea, un compromiso firme. Porque con la intención, se va a quedar ahí.” (G1) “Tendríamos que integrarlo en la práctica habitual, como algo normal. Y eso lo tenemos que hacer por nuestra parte. Q si le quieres echar la culpa al paciente porque se asusta o porque tal…pero… En el fondo, somos nosotros” (G2) Resultados 121 Matriz textual 1. Factores Intrínsecosa como barreras en la notificación de sospechas de RAM del farmacéutico comunitario, identificados mediante la técnica del grupo focal. FORMACIÓN Falta de formación con relación a la notificación de sospechas de RAM en los estudios de grado. CONOCIMIENTO Desconocimiento del Sistema de Notificación de RAM (objetivos, utilidad, funcionamiento, importancia). Desconocimiento sobre: QUÉ se notifica, CÓMO se usa la tarjeta amarilla, DÓNDE se manda. Desconocimiento de la existencia de la tarjeta amarilla electrónica y de otras posibilidades de notificación. Confusión entre los conceptos de PRM y RAM, y sobre la forma de comunicar estos acontecimientos. Desconocimiento de la disponibilidad y/o localización de tarjetas amarillas en su centro de trabajo. Creencias erróneas: Para notificar una reacción adversa, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente. Es mejor hablar con el médico y/o paciente para solucionar el problema. En el Centro de Farmacovigilancia se van a reír o van a pensar mal del farmacéutico si éste manda una RAM muy obvia o si no es realmente una RAM. No sirve de nada notificar una RAM que ya esté descrita en el prospecto del medicamento. Tras detectar una RAM, basta con comunicarla al Colegio y ahí se encargarán. ACTITUD Es prioritaria la solución de los problemas del paciente frente al registro y comunicación de los problemas identificados. Miedo a quedar mal ante el Centro de Farmacovigilancia. Aprensión por tener que preguntar al paciente los datos requeridos. a Factores Intrínsecos: aquellos factores, relacionados con la formación del farmacéutico, que condicionan los conocimientos del mismo acerca de la notificación de sospechas de RAM, y a su vez, generan en él ciertas actitudes hacia la notificación que se traducirán en un determinado comportamiento. RAM= Reacciones Adversas a Medicamentos; PRM= Problemas Relacionados con Medicamentos Matriz textual 2. Factores Intrínsecosa como facilitadores en la notificación de sospechas de RAM del farmacéutico comunitario, identificados mediante la técnica del grupo focal. FORMACIÓN CONOCIMIENTO En la etapa universitaria han tomado cierto contacto con la farmacovigilancia. Conocen la existencia de la Tarjeta Amarilla. La asistencia a charlas o cursos de farmacovigilancia aumenta su conocimiento, motivación y, como consecuencia, sus notificaciones. ACTITUD Actitud positiva hacia lo notificación de sospechas de RAM. El farmacéutico debería considerar la notificación como una actividad “obligatoria”, integrada en el conjunto de actividades que desarrolla en la farmacia. a Factores Intrínsecos: aquellos factores, relacionados con la formación del farmacéutico, que condicionan los conocimientos del mismo acerca de la notificación de sospechas de RAM, y a su vez, generan en él ciertas actitudes hacia la notificación que se traducirán en un determinado comportamiento. RAM= Reacciones Adversas a Medicamentos Resultados 122 1.2.2. Factores extrínsecos Los factores extrínsecos, se agruparon en 5 categorías: 1. Paciente; 2. Oficina de farmacia; 3. Organización colegial; 4. Sistema de Notificación de sospechas de RAM; 5. Médico. En la Matriz textual 3 y en la Matriz textual 4, se resumen los factores extrínsecos identificados como barreras y facilitadores, respectivamente. 1.2.2.1. Factores extrínsecos como barreras en la notificación 1.2.2.1.1. Paciente Pacientes no-colaboradores El farmacéutico se encuentra a menudo con pacientes que se muestran no-colaboradores. Hay muchos pacientes que dificultan al farmacéutico la recogida de información acerca de su estado de salud, de la efectividad y seguridad de sus tratamientos, etc., impidiendo así la identificación de problemas relacionados con medicamentos, incluidas las reacciones adversas. En concreto en el momento de rellenar la tarjeta amarilla, en numerosas ocasiones, los pacientes se muestran “…Depende mucho de la persona que tengas delante. De lo que te quiera contar,… y si se quiere ir… o si le importa lo que le vayas a decir tú… Tú ya intentas tirar, pero no siempre te dicen.” (G1) “Pero yo creo que hay mucha gente que le ocurre que es reacia a contarte: ‘pues me está pasando esto…’ ” (G1) “Muchas veces vienen a la farmacia, y si les tienes que entretener diez minutos… ‘oye, que no, ¡que yo me iba ya! ¡Que tengo que coger el autobús!’” (G3) reacios a facilitar los datos solicitados en ella. Pacientes mayores El farmacéutico encuentra una dificultad añadida para la identificación de RAM en pacientes mayores. Esto se debe a que la polimedicación y la pluripatología de este tipo de pacientes, pueden enmascarar y confundir a la hora de identificar posibles RAM. Además, las personas mayores tienden muchas veces a expresar dolencias que no están padeciendo realmente, o a exagerar lo que sienten porque necesitan hablar, que se les escuche, etc. “En muchos casos es como muy…difícil. Más que todo porque personas mayores que están polimedicadas, que seguro tienen interacciones y todo, igual no expresan que les haya ocurrido algo...” (G1) “Yo tengo mucha gente mayor…y es que basta que les hagas un poco de caso…y ¡bueno! ¡Tienen todo lo malo del mundo! …porque están solos, quieren hablar…” (G1) Resultados 123 Subjetividad del paciente En numerosas ocasiones el farmacéutico se encuentra ante situaciones en las que no está claro si lo que cuenta el paciente es “fiable”, es decir, si el paciente transmite su sintomatología real. Como se ha comentado en el apartado anterior, este hecho es frecuente en el trato con personas mayores. “A veces cuando hablo con los pacientes, realmente no sé hasta qué punto me están diciendo cosas objetivas o ellos añaden, o… lo ven de una manera subjetiva y no sé si es verdad. No porque me mientan, sino porque ellos lo sienten de una manera que se me hace difícil creer que les ha pasado eso.” (G2) “Hay gente que le duele la cabeza porque ha oído que…” (G1) 1.2.2.1.2. Oficina de farmacia Tipos de RAM detectadas Las reacciones adversas que, en general, se recomienda notificar (graves, desconocidas y de medicamentos nuevos) no son detectadas habitualmente desde la farmacia. Las graves no se identifican de forma frecuente dado que, cuando estas reacciones aparecen, el paciente suele acudir a urgencias o directamente al médico. “Es que como no les ves cosas graves… En la farmacia ves un dolor de cabeza… (G2) “Y nuevas,… nuevas desconocidas, pues es muy raro. O sea, que ver reacciones adversas sí, pero…” (G3) “Las graves, ya no son tan frecuentes. Esas, son las que al final van al médico.” (G2) Volumen de trabajo y actividades prioritarias El volumen de trabajo existente en la oficina de farmacia, conduce a que el farmacéutico priorice unas actividades sobre otras, quedando la notificación en un lugar desfavorecido en comparación con el resto de actividades a desarrollar en la farmacia. “Si no hay clientes esperando, tienes siempre doscientas cosas detrás para hacer” (G1) “Al final lo único que te piden es que presentes factura a fin de mes, y todo lo que hagas de más es un esfuerzo añadido, y al final te quemas. Es un trabajo que tienes que hacer añadido…y que…tampoco, si no lo haces no pasa nada.” (G3) “Yo sé que existe pero a lo mejor en las farmacias en las que he estado, o el personal con el que he trabajado, no le hemos dado importancia o hemos pasado de ello.” (G2) “Yo creo que si no hay tiempo, es porque no tienes tanto interés en sacarlo. Porque tienes tiempo en la vida para lo que… Vamos, que cada uno también prioriza, ¿no?” (G2) Resultados 124 Acceso a datos del paciente La inaccesibilidad a la historia clínica y farmacoterapéutica de los pacientes constituye otra barrera que dificulta la identificación de RAM. “Es que, salvo que tengas la receta en la mano,… ¡Y no tienes prácticamente datos…!” (G3) “El médico tiene todos esos datos disponibles. Nosotros, a pesar de ser sanitarios, parece que somos vendedores a efectos de esto. Entonces no tenemos los datos de la persona, salvo que hagas ficha, que hagas seguimiento,… Entonces sí sería maravilloso, pero lo cierto es que no…” (G3) Localización y disponibilidad de tarjetas amarillas La no disponibilidad de tarjetas amarillas en el lugar de “Se supone que la tenemos pero no sabemos dónde…” (G1) trabajo es un hecho que lleva al farmacéutico a dejar la “Yo no sé dónde está, ¡No sé dónde tengo la TA!” (G2) notificación para más adelante con el consecuente olvido o “Hay gente que es que no ha visto una tarjeta amarilla en su vida, no sabe ni donde la guardan, …” (G3) dejadez, que derivarán en la no-notificación. 1.2.2.1.3. Organización colegial Consultas al CIM Normalmente, cuando un farmacéutico identifica una posible RAM que le llama la atención, lo primero que hace es consultar al CIM. “Una chica que llevaba 18 días con diarrea, le habían hecho coprocultivos y de todo, y le empezamos a preguntar qué tomaba. Entonces, preguntamos al CIM …” (G1) “En mi farmacia nos ocurrió un caso… Preguntamos al CIM y nos dijeron…” (G1) Programa de Consulta y Dispensación Activa Los farmacéuticos que colaboran en el Programa de Consulta y Dispensación Activa del Colegio, al relatar su comportamiento con relación a las sospechas de RAM, expresaron que, en algunas ocasiones, esta actividad “sustituía” al Sistema de Notificación de RAM con tarjeta amarilla. En algunos casos, se observó que este hecho se derivaba de la existencia de cierta confusión entre la comunicación a través de dicho programa y la notificación de RAM con tarjeta amarilla. Así, algunos de ellos afirmaban que cuando detectaban una sospecha de RAM, lo comunicaban a través del Programa de Consulta y Dispensación Activa, porque creían que era así como se comunicaba ese tipo de “Yo al colegio, siempre.” (G1) las mando “A mi por ejemplo me pasa que, al participar en el programa de PRMs, muchas veces en vez de rellenar la tarjeta amarilla…” (G2) “Sí, nosotras sí que mandamos reacciones adversas… Igual todos los meses no porque tampoco tienes. Unos meses tienes más, otros meses tienes menos… Pero sí, lo del colegio sí, lo de los PRMs sí.” (G1) “También hace mucho el programa este de detección de PRMs… Claro, la gente dice: ‘¡Bah! Total, ya lo mando a los PRMs…. pues ya está…” (G3) “Normalmente abres fichas o la mandas al Colegio (programa de PRMs) porque es una como de las ya sabidas…” (G3) Resultados 125 eventos. Otros, en cambio, sabiendo que las sospechas de RAM había que notificarlas con tarjeta amarilla al Centro de Farmacovigilancia de Navarra, las comunicaban al CIM. De estos últimos, algunos pensaban que si lo comunicado fuera susceptible de ser notificado con tarjeta amarilla, lo tramitaría el Colegio de Farmacéuticos, y otros, que desde el Colegio les aconsejarían notificar. Finalmente, los del grupo de notificadores, que conocen las RAM que se recomienda notificar, envían normalmente al CIM las que son conocidas, es decir, las que ya están descritas en el prospecto o la ficha técnica del medicamento. Esto se debe a que no las consideran prioritarias en la notificación. 1.2.2.1.4. Sistema de Notificación de sospechas de RAM Voluntariedad del sistema Se señaló en los diferentes grupos, la limitación que supone el que se trate de un sistema “altruista”, es decir, en el que la notificación del farmacéutico dependa de su buena voluntad para participar, constituyendo además un trabajo añadido para el notificador. “Yo creo que en la detección de RAM, el farmacéutico tiene que tener un componente altruista… es decir, ayudo porque sí… que no todos tenemos.” (G1) “El problema es que todo lo que se hace que no sea estrictamente facturar o vender, es porque tú quieres. Porque, por lo general, no te compensa. Entonces, ¿qué pasa? que no es una obligación. Si yo tuviera la obligación, lo mismo de presentar la facturación de mes, la obligación de notificar todas, entonces lo haría porque forma parte de mi trabajo. Pero es voluntarioso totalmente… Entonces ¿que pasa? Que vas y vienes… oscilas.” (G3) Datos solicitados Otra dificultad mencionada frecuentemente con relación al Sistema de Notificación, es que son muchos los datos que se deben solicitar al paciente para completar la tarjeta amarilla. “Alguna vez que me acuerdo de notificar, vienen un montón de datos que tengo que pedirle al paciente, pero ¡ya se me ha ido antes de rellenar la tarjeta!” (G2) “El completar los datos es una dificultad que te puede hacer dejarlo. A mi me ha pasado que vas a notificar y…’¡si no tengo ni el nombre!’ “ (G3) Resultados 126 1.2.2.1.5. Médico Aunque no sea imprescindible la colaboración de este profesional para notificar lo que se detecta desde la oficina de farmacia, una mala o nula relación con el médico puede determinar que en algún caso no se envíe la tarjeta amarilla por falta de datos, o por miedo a que, a través del paciente, se entere de que el farmacéutico haya “diagnosticado” el “Muchas veces los farmacéuticos hablamos con los médicos, pero como no hay buena relación, como que se…” (G3) “Parece que aunque notifiques y hables con el médico, finalmente éste se va a enterar. Entonces, igual al médico le parece que…’¿y ésta por qué se mete donde no le llaman?” (G3) problema del paciente como RAM y lo haya notificado. 1.2.2.2. Factores extrínsecos como facilitadores en la notificación 1.2.2.2.1. Paciente Pacientes colaboradores Afortunadamente, el farmacéutico también cuenta con pacientes que colaboran con él en la identificación y la resolución de sus problemas de salud. Estos son pacientes que confían en su farmacéutico y no ponen resistencia a proporcionarle sus datos, generalmente por ser clientes habituales de la farmacia. “Depende mucho de la clientela que tengas. Si tienes una clientela fija que confía mucho en ti y que acude a ti antes que al médico, pues con esa persona sí que se puede hablar y que te cuente…” (G1) “A un cliente de toda la vida que ya conoces, que sabes su nombre,… le puedes preguntar lo que quieras” (G3) Necesidades relacionadas con los pacientes Por otra parte, en uno de los grupos surgió la inquietud de promover entre los pacientes la notificación como una actividad habitual de la farmacia. Además, los participantes mostraban la necesidad del farmacéutico de mejorar en habilidades de comunicación con el paciente. “Yo cuando fui a rellenar la tarjeta, te pedían datos del paciente que tienes que poner. Igual habría que hacerles ver a los pacientes que es algo normal” (G2) “Deberíamos aprender a decirle al paciente estas cosas…” (G2) “…Y no tenemos práctica para pedir datos al paciente, ni nos sentimos cómodos…” (G3) Resultados 127 1.2.2.2.2. Oficina de farmacia Tipos de RAM El tipo de reacciones adversas que se detectan con mayor frecuencia desde la farmacia, normalmente suelen ser leves, conocidas y muchas veces relacionadas con la piel. Según los participantes es fácil detectar las RAM que se manifiestan en la piel, dado que en la oficina de farmacia se consultan mucho los problemas de piel y se solicitan muy frecuentemente productos dermatológicos. “Generalmente, la mayoría de cosas son o dolor de cabeza, o una erupción cutánea, o dolor de estómago,… (leves) Yo creo que no hay día que no entre alguien y diga: ‘es que tomo esto, y estoy cansado’, o... ¡De esas, casi todos los días hay! Y claro, ¡todas están ya en el prospecto!” (G2) “¿Sabes que pasa? que son todas conocidas…” (G3) “Por ejemplo con las cremas es muy fácil porque se aplica la crema y se ve. En piel es muy fácil.” (G2) Se pueden detectar, además, RAM leves y conocidas con cierta frecuencia. Incluso las RAM graves son a veces comunicadas por el paciente al farmacéutico, por lo tanto, éste podría también notificarlas. Herramientas de ayuda Entre los elementos o herramientas que pudieran ser de utilidad al farmacéutico para facilitarle la notificación, los farmacéuticos “notificadores” señalaban la idoneidad de “A mi la ISO me exigió tener una notificación por trimestre. Y cuando al tiempo vino la auditora a revisarme, hacía una por trimestre” (G3) disponer de un sistema de calidad que les “obligara” a notificar con cierta frecuencia, dada la positiva experiencia de algunos de ellos. Por otra parte, también se identificaron el seguimiento farmacoterapéutico de pacientes, o la participación en estudios de seguimiento de RAM en grupos de medicamentos, como herramientas de ayuda para la notificación. “Yo cuando empecé a hacer seguimiento, las tarjetas amarillas iban completas porque, claro, ¡tienes la ficha del paciente con todo!” (G3) “Igual sería bueno, para acostumbrarnos, centrarnos en un grupo de medicamentos y detectar RAM de ese grupo. Y luego, extendernos a otros.” (G2) Resultados 128 1.2.2.2.3. Organización Colegial Programa de Consulta y Dispensación Activa Gracias al Programa de Consulta y Dispensación Activa que se puso en marcha en el Colegio de Farmacéuticos en el año 2002, los farmacéuticos parecen ser algo más conscientes de la existencia de PRM (incluidas las RAM) y de su capacidad para detectarlos desde la oficina de farmacia. Asimismo, parece que les ayuda a comunicar y registrar aquello que detectan en su práctica diaria de forma más o menos rutinaria. Además, en algunas ocasiones, desde el “Con lo de los PRMs, ¡salían un montón de reacciones adversas!” (G2) “A nosotros nos ha pasado esta semana con una señora, que cuando se tomaba el Calcium Sandoz Forte, se le empezaban a revolver las tripas y… una diarrea… Lo comunicamos al CIM y nos han dicho que nos van a mandar la tarjeta amarilla para que lo notifiquemos” (G1) “Como en el caso del Programa de los PRMs. Si estás en el Programa, sabes que tienes que comunicar como mínimo un PRM al mes. Entonces, ya tienes ese tema entre tus objetivos y te obligas a hacerlo.” (G3) Centro de Información de Medicamentos se aconseja al farmacéutico notificar con la tarjeta amarilla una RAM comunicada a este programa. De esta manera, el farmacéutico está siendo sensibilizado y estimulado para detectar y notificar las RAM que surgen en su práctica diaria. Por otra parte, según apuntaban los participantes durante las sesiones, el hecho de tener el compromiso de colaborar en el programa incentiva al farmacéutico a participar en el mismo. 1.2.2.2.4. Sistema de Notificación de sospechas de RAM Disponibilidad de tarjetas amarillas En general, los farmacéuticos manifestaban la existencia de una buena disponibilidad de tarjetas amarillas por parte del Centro de Farmacovigilancia, siendo muy bien valorada la tarjeta amarilla electrónica, entre aquellos que la conocían, dada la facilidad de acceso y de envío. “Sí, sí,… A mi, me llega a casa y la veo, y digo: ‘Ah, mira, la Tarjeta Amarilla, y la guardo’ ” (G1) “A mí me suelen llegar las tarjetas amarillas en un sobre” (G2) “¡Por Internet es superfácil! Se rellena en un momento. Metes <tarjeta amarilla Navarra> en Google y te aparece” (G3) Resultados 129 Información, formación y motivación Aquellos farmacéuticos que habían asistido a alguna charla formativa de farmacovigilancia impartida por el personal del Centro de Farmacovigilancia, los cuales pertenecían al grupo de “notificadores”, afirmaban que además de aportarles formación sobre el tema e información actualizada sobre RAM, les motivaba a notificar. Asimismo, se valoró muy positivamente la información que desde el Centro envían al notificador tras notificar mediante la tarjeta amarilla. “Si te dan una charla contándote que se han mandado tantas notificaciones, que han sido de estos medicamentos, haciendo un resumen un poco, pues parece como que te obligas más, como que te motivas mucho más” (G3) “Yo me acuerdo que después de una charla de farmacovigilancia, cuando detectaba reacciones adversas, aunque fueran conocidas las notificaba” (G3) “Cuando notificas, si quieres, te mandan información sobre el tema: si a alguien le ha pasado, si suele ser frecuente… Suele ser información de artículos en inglés… ¡está muy bien!” (G3) Funcionamiento Finalmente, aquellos farmacéuticos que habían contactado en algún momento con el Centro de Farmacovigilancia a través de la notificación (grupo de “notificadores”), “La verdad es que en el Centro de Farmacovigilancia funcionan de maravilla. Siempre que llamas, contestan, te mandan información…” (G3) coincidían en su excelente funcionamiento. Señalaban, además, que la atención prestada en el mismo es muy satisfactoria y que la respuesta es muy rápida en el momento en que se consulta una duda o se manda una tarjeta amarilla. 1.2.2.2.5. Médico En general, se percibió en los grupos la opinión de que una buena relación con el médico facilitaría la notificación. Este tipo de relación posibilitaría al farmacéutico contar con la colaboración de este profesional para obtener información relacionada con el paciente y su medicación, y valorar conjuntamente la posibilidad de estar ante una RAM. No obstante, éste no parece ser un elemento determinante en la notificación. “Es muy triste que no podamos llamar al médico y decirle: ‘oye, creo que es por tal medicamento. ¿Por qué no hacemos la prueba de quitar todos los medicamentos…? Eso sería lo que deberíamos hacer, una mayor colaboración médicofarmacéutico’ ” (G3) “No cabe duda que una mejor relación con el médico agilizaría la notificación” (G3) Resultados 130 Matriz textual 3. Factores Extrínsecosa como barreras en la Notificación de sospechas de RAM del farmacéutico comunitario, identificados mediante la técnica del grupo focal. PACIENTES Pacientes no colaboradores Personas mayores, polimedicación. debido a su pluripatología y Subjetividad del paciente al relatar su sintomatología. OFICINA DE FARMACIA Normalmente no se observan RAM graves y/o desconocidas Gran volumen de trabajo y priorización de otras actividades en la farmacia Inaccesibilidad a datos del paciente Localización de tarjetas amarillas desconocida o inexistente ORGANIZACIÓN COLEGIAL Se consulta con el Centro de Información de Medicamentos en el momento de detectar una posible RAM, pero no con el Centro de Farmacovigilancia Se comunican RAM a través del Programa de Consulta y Dispensación Activa del COF en vez de utilizar la tarjeta amarilla. SISTEMA DE NOTIFICACIÓN Voluntariedad del Sistema (altruismo) (Centro de Farmacovigilancia) Muchos datos solicitados en la tarjeta amarilla MÉDICO Mala integración del farmacéutico en el equipo de Atención Primaria, de forma específica con el médico. a Factores Extrínsecos: aquellos factores, asociados a la interacción del farmacéutico con su entorno, que influyen en la relación conocimientos-actitudes-prácticas. RAM= Reacciones Adversas a Medicamentos; COF= Colegio Oficial de Farmacéuticos Resultados 131 Matriz textual 4. Factores Extrínsecosa como facilitadores en la Notificación de sospechas de RAM del farmacéutico comunitario, identificados mediante la técnica del grupo focal. PACIENTES Pacientes colaboradores Se debe promover entre los pacientes la notificación como una actividad normal en la farmacia. El farmacéutico debería mejorar comunicación con el paciente OFICINA DE FARMACIA Detección habitual de manifestadas en piel. RAM en leves habilidades y conocidas, de y A veces, conocimiento de RAM graves que ha sufrido un paciente en un momento dado. El farmacéutico debería notificar estas RAM aunque no hubiera sido él quien detectó la RAM. Un Sistema de calidad en la farmacia “obligaría” a notificar RAM periódicamente. El seguimiento farmacoterapéutico permite disponer de más datos y facilita la identificación de RAM. La participación en estudios de seguimiento de RAM en grupos de medicamentos, ayudaría al farmacéutico a estar más alerta ante las RAM, facilitando la detección y notificación de las mismas. ORGANIZACIÓN COLEGIAL El Programa de consulta y dispensación activa, sensibiliza al farmacéutico sobre la existencia de RAM y lo estimula a registrar y comunicar lo que detecta en su práctica diaria. SISTEMA DE NOTIFICACIÓN Existe una buena disponibilidad de Tarjetas Amarillas por parte del Centro de Farmacovigilancia. (Centro de Farmacovigilancia) Las charlas o cursos impartidos por el Centro de Farmacovigilancia, aporta formación e información actualizada sobre RAM, motivando la notificación. El funcionamiento del Centro de Farmacovigilancia está muy bien valorado. MÉDICO a Una buena relación con el médico correspondiente, facilitaría la notificación. Factores Extrínsecos: aquellos factores, asociados a la interacción del farmacéutico con su entorno, que influyen en la relación conocimientos-actitudes-prácticas. RAM= Reacciones Adversas a Medicamentos; Resultados 132 1.2.3. Comportamiento del farmacéutico El comportamiento del farmacéutico ante las sospechas de RAM, se considera influenciado tanto por factores intrínsecos como por factores extrínsecos. Todos ellos, condicionan su actuación tal y como se expresa en la Figura 2. Figura 2. Factores que condicionan el comportamiento del farmacéutico comunitario ante la sospecha de reacciones adversas a medicamentos (RAM). 1.2.4. Sugerencias de mejora Durante las conversaciones de los diferentes grupos surgieron y se discutieron una serie de iniciativas o actividades que podrían llevarse a cabo con el fin de incrementar las notificaciones de este grupo de profesionales. Estas iniciativas se dirigían, por un lado, al farmacéutico y, por otro, a los pacientes. Resultados 133 En primer lugar, se señaló la necesidad de recordar al farmacéutico su deber de notificar las sospechas de RAM detectadas en su práctica diaria, de informarle acerca de la tarjeta amarilla y del Sistema de Notificación, de concienciarle de la importancia de su aportación como notificador, y de ayudarle a adoptar un compromiso firme en esta actividad. Con relación a los pacientes, se manifestó la idoneidad de normalizar esta actividad entre los mismos y de informarles adecuadamente acerca de dicha actividad en el momento de rellenar una tarjeta amarilla. 1.3. Iniciativas propuestas tras el análisis A partir del análisis realizado con la encuesta y los grupos focales, y tras valorar las ideas propuestas por los farmacéuticos para incrementar la notificación de sospechas de RAM, se propusieron las siguientes iniciativas: 1. Impartir un curso de farmacovigilancia básico y eminentemente práctico (Curso-taller de utilización de la tarjeta amarilla). 2. Poner a disposición de los farmacéuticos una guía para la notificación de RAM desde la oficina de farmacia, con un protocolo normalizado de trabajo para la notificación (ANEXO VII). Esta guía formaba parte del material entregado en el curso. 3. Distribuir trípticos explicativos que faciliten la solicitud de datos a los pacientes por parte del farmacéutico (ANEXO VIII), los cuales también constituían material para el curso. 4. Poner en marcha una campaña de sensibilización dirigida al farmacéutico, incluyendo en ella recordatorios periódicos (lista de distribución on-line de farmacovigilancia). Resultados 134 2. IMPLEMENTACIÓN Y EVALUACIÓN DE UNA ESTRATEGIA DE MEJORA 2.1. Curso-taller de utilización de la tarjeta amarilla Los asistentes al curso-taller fueron un total de 27 farmacéuticos repartidos en dos sesiones. A la primera sesión, celebrada en Pamplona, acudieron 17 personas, y a la segunda, en Tudela, 10. 2.1.1. Datos socio-demográficos de los asistentes La proporción de mujeres y hombres era de 25:2. Las edades estaban comprendidas entre un mínimo de 25 años y un máximo de 61 % farmacéuticos años, siendo la mediana de edad 32,5 años (P25: 29,75; P75: 45,50) (Figura 3). 60% 40% 20% 0% 25-34 35-44 45-54 55-64 Años Figura 3. Edad de los farmacéuticos participantes en el curso-taller De los farmacéuticos asistentes, un 62,5% eran titulares y un 37,5% eran adjuntos. Los años de experiencia en oficina de farmacia estaban comprendidos entre los 2 y los 37 años siendo la mediana de edad 8 años (P25:5,00; P75:18,75) (Figura 4). % farmacéuticos Resultados 135 60% 40% 20% 0% 0-9 10 19 20-29 30-39 Años Figura 4. Experiencia profesional en oficina de farmacia de los farmacéuticos participantes en el curso-taller 2.1.2. Cuestionarios de evaluación de la actividad formativa Los criterios de inclusión para la valoración de los cuestionarios del curso fueron: completar el cuestionario por las dos caras y en el cuestionario de conocimientos, además, haber respondido al pre-test y al post-test. 2.1.2.1. Cuestionario de Satisfacción Se valoraron 22 cuestionarios, los cuales correspondían al 81,5% del total de asistentes al curso. Los resultados obtenidos a partir de estos cuestionarios se muestran en la Tabla IV y en las Figuras 5a, 5b, 5c, 5d y 5e. Resultados 136 Tabla IV. Satisfacción de los asistentes al curso-taller medida sobre una escala Likert de 10 puntos ÍTEMS Rango valores (mín-máx) Puntos obtenidos 5-10 7,00 (6,00; 8,00) a CONTENIDOS El contenido del curso ha satisfecho mis necesidades de formación El contenido teórico del curso me ha parecido adecuado 5-10 7,00 (6,00; 8,00) El contenido práctico del curso me ha parecido adecuado 5-10 7,50 (6,00; 8,25) PROFESORADO Profesor 1 Dominio/conocimiento de la materia 6-10 9,00 (8,00; 9,25) La capacidad de transmisión y exposición ha sido idónea 4-10 7,50 (6,75; 9,00) Motiva y despierta el interés en las materias que imparte 4-10 8,00 (6,75; 9,00) Responde adecuadamente a las cuestiones planteadas 6-10 8,50 (8,00; 9,25) Evaluación global del formador 6-10 8,00 (7,00; 9,00) Dominio/conocimiento de la materia 7-10 8,50 (8,00; 9,00) La capacidad de transmisión y exposición ha sido idónea 7-10 8,00 (8,00; 9,25) Motiva y despierta el interés en las materias que imparte 6-10 8,50 (7,75; 9,00) Responde adecuadamente a las cuestiones planteadas 5-10 8,00 (8,00; 9,00) Evaluación global del formador 6-10 8,00 (7,75; 9,00) Profesor 2 METODOLOGÍA Los medios técnicos utilizados me han parecido adecuados 6-10 8,00 (7,00; 9,00) Los casos prácticos me han parecido útiles para el aprendizaje 5-10 8,00 (7,00; 9,00) ORGANIZACIÓN La información previa sobre el curso ha sido adecuada 6-10 8,00 (7,75; 9,00) La distribución de contenidos en el curso ha sido buena 6-10 8,50 (7,00; 9,00) La duración del curso era adecuada para los contenidos impartidos 4-10 8,00 (6,00; 9,00) SATISFACCIÓN GENERAL Mis expectativas iniciales se han cumplido 6-10 8,00 (7,00; 9,00) Las enseñanzas recibidas me parecen útiles en el puesto de trabajo 6-10 8,50 (7,00; 9,00) Satisfacción general 6-10 8,50 (7,00; 9,00) a Los resultados se expresan como mediana (P25;P75). Resultados 137 Puntuación (medianas) 10 8 6 4 2 0 Contenido Curso Figura 5a. Contenido Teórico Curso-taller. Valoración del CONTENIDO Profesor1 10 Puntuación (medianas) Contenido Práctico Profesor2 * 8 6 4 2 0 Dominio materia Transmisión y exposición Motivación Responde Evaluación global adecuadamente *p<0,05 (Test U. Mann-Whitney) Figura 5b. Curso-taller. Valoración del PROFESORADO Resultados Puntuación (medianas) 138 10 8 6 4 2 0 Medios técnicos Casos prácticos Figura 5c. Curso-taller. Valoración de la METODOLOGÍA Puntuación (medianas) 10 8 6 4 2 0 Información previa Distribución contenido Duración Puntuación (medianas) Figura 5d. Curso-taller. Valoración de la ORGANIZACIÓN 10 8 6 4 2 0 Cumplimiento expectativas Utilidad enseñanzas Satisfacción general Figura 5e. Curso-taller. Valoración de la SATISFACCIÓN GENERAL Resultados 139 Observaciones y sugerencias Las observaciones fueron escasas. Únicamente el 9% de los respondedores (n=2) indicaron alguna observación. Por un lado, agradecían que el curso se hiciera en Tudela, y por otro, manifestaban el deseo de que el curso hubiera sido más extenso para poder desarrollar más el tema. En cuanto a las sugerencias propuestas, ante la pregunta de si les gustaría continuar recibiendo formación relacionada con la farmacovigilancia, el 72,7% contestó afirmativamente. 2.1.2.2. Cuestionario de Conocimientos Se valoraron 18 pares de cuestionarios de conocimientos (pre/post), los cuales correspondían al 66,67% del total de los asistentes al curso. Los resultados obtenidos a partir de estos cuestionarios se muestran en las Tablas Va, Vb y Vc, y en las Figuras 6a, 6b y 6c. Tabla Va. Respuestas correctas a las afirmaciones contenidas en el cuestionario de conocimientos antes y después del curso-taller Afirmaciones a b Pre-testa Post-testa Valor pb Afirmación 1 11,1 27,8 0,250 Afirmación 2 100 100 1,000 Afirmación 3 44,4 83,3 0,016 Afirmación 4 94,4 100 1,000 Afirmación 5 66,7 100 0,063 Afirmación 6 100 94,4 1,000 Afirmación 7 27,8 77,8 0,004 Afirmación 8 55,6 83,3 0,063 Afirmación 9 83,3 94,4 0,625 Afirmación 10 38,9 100 0,001 Afirmación 11 55,6 55,6 1,000 Los resultados se expresan como porcentaje de respuestas correctas Test de McNemar para datos emparejados Afirmación 1: La OMS define Reacción Adversa a Medicamentos (RAM) como “cualquier efecto no intencionado de un producto farmacéutico que se produzca con dosis normalmente utilizadas en el hombre, y que esté relacionado con las propiedades farmacológicas del medicamento”. Afirmación 2: Los Problemas Relacionados con Medicamentos (PRM) y las Reacciones Adversas a Medicamentos (RAM) son conceptos equivalentes. Afirmación 3: Se ha estimado que las RAM están entre las 6 primeras causas de mortalidad en los EEUU. Afirmación 4: Los ensayos clínicos aportan información completa sobre las RAM. Afirmación 5: Actualmente, el método más eficiente para la identificación de riesgos previamente no conocidos de los medicamentos, es la Notificación Espontánea de sospechas de RAM. Resultados 140 Afirmación 6: La Notificación Espontánea de sospechas de RAM permite detectar nuevos problemas de seguridad asociados a los medicamentos y canalizar toda la información disponible, a partir de la cuál puedan tomarse medidas informativas o reguladoras. Afirmación 7: Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente. Afirmación 8: Las RAM graves ya se conocen antes de la comercialización del medicamento. Afirmación 9: Los datos a incluir en la tarjeta amarilla son relativos al paciente, al/los medicamento/s sospechoso/s, al acontecimiento adverso, y al notificador. Afirmación 10: La Tarjeta Amarilla no debe enviarse en caso de no cumplimentar todos los campos contenidos en ella. Afirmación 11: España es uno de los países participantes en el Programa de Vigilancia Internacional de la OMS. Tabla Vb. Puntuación en las preguntas sobre conocimientos básicos antes y después del curso-tallera Pre-test b Post-test b Valor p c Quién 1,00 (0,75; 1,00) 1,00 (1,00; 1,00) 0,059 Qué 1,00 (1,00; 1,00) 1,00 (1,00; 1,00) 0,655 Cómo 0,50 (0; 0,75) 1,00 (0,50; 1, 00) 0,001 Dónde 1,00 (1,00; 1,00) 1,00 (1,00; 1,00) 0,317 Preguntas a b c Las puntuaciones pueden tomar valores entre 0 y 1 punto Los resultados se expresan como mediana (P25;P75) Test de Wilcoxon para datos emparejados Tabla Vc. Puntuación obtenida en el cuestionario de conocimientos, antes y después del curso-taller, en sus diferentes secciones y en total Pre-test Afirmaciones a Preguntas básicas Total a c b Rango valores (mín-máx) Puntos obtenidosd 3-10 7,00 (6,00; 7,50) 2-4 5,50-13,75 Post-test Rango valores (mín-máx) Puntos obtenidosd Valor pe 8-11 9,00 (9,00; 9,50) 0,001 3,25 (2,75; 3,75) 2,75-4 3,75 (3,50; 4,00) 0,001 10,00 (9,00; 10,50) 11,75-15 12,50 (12,25; 13,25) 0,001 Las puntuaciones correspondientes a las afirmaciones pueden tomar valores entre 0 y 11 puntos Las puntuaciones correspondientes a las preguntas básicas pueden tomar valores entre 0 y 4 puntos c Las puntuaciones totales del cuestionario pueden tomar valores entre 0 y 15 puntos d Los resultados se expresan como mediana (P25; P75). e Test de Wilcoxon para datos emparejados b Resultados 141 Respuestas correctas (%) Pre-test Post-test ** 100% * 80% ** 60% 40% 20% 0% 1 2 3 4 5 6 7 8 9 10 11 Afirmaciones * p<0,05; ** p<0,01 Figura 6a. Curso-taller. Respuestas correctas a las AFIRMACIONES en el pre-test y el post-test. Puntuación (mediana) Pre-test Post-test ** 1 0,8 0,6 0,4 0,2 0 QUIÉN QUÉ CÓMO DÓNDE Preguntas básicas ** p<0,01 Figura 6b. Curso-taller. Puntuación obtenida en las PREGUNTAS BÁSICAS en el pre-test y el post-test. Resultados 142 Pre-test Puntuación (mediana) 14 ** 12 10 Post-test ** 8 6 ** 4 2 0 AFIRMACIONES PREGUNTAS TOTAL **p<0,01 Figura 6c. Curso-taller. PUNTUACIÓN TOTAL obtenida en el pre-test y el post-test Resultados 143 2.1.2.3. Cuestionario de Transferencia Se recogieron 14 cuestionarios, los cuales correspondían al 52% del total de los asistentes al curso. Los resultados obtenidos a partir de estos cuestionarios se muestran en la Tabla VI y las Figuras 7a y 7b. Tabla VI. Respuesta a las afirmaciones propuestas en el Cuestionario de Transferencia Afirmaciones Rango valores (mín-máx) Puntos obtenidos a 1. Ahora soy más consciente que antes de la importancia de mi contribución al conocimiento de la seguridad de los medicamentos, a través de la notificación con tarjeta amarilla 3-5 4,00 (3,00; 4,00) 2. Soy más consciente de mi responsabilidad profesional ante la notificación de RAM 3-5 4,00 (3,00; 4,00) 3. Estoy más alerta ante situaciones que pudieran estar asociadas a RAM 3-5 4,00 (3,50; 4,00) 4. He adquirido unas pautas para detectar las RAM 1-4 3,00 (1,50; 4,00) 5. He adquirido unas pautas para notificar las RAM 1-5 4,00 (3,00; 4,00) 6. He adquirido mayor soltura en la cumplimentación de tarjetas amarillas 2-5 3,00 (2,00; 3,50) 7. He adquirido mayor soltura en la comunicación con el paciente en situaciones de sospecha de RAM 2-5 3,00 (3,00; 4,00) 8. Ha aumentado la frecuencia con la que valoro si detrás de un síntoma referido por un paciente puede haber una RAM 2-5 4,00 (3,00; 4,00) 9. Hago más preguntas que antes a los pacientes para determinar si un síntoma es una sospecha de RAM 1-5 4,00 (3,00; 4,00) 10. Detecto un mayor número de RAM que antes desde mi puesto de trabajo 1-4 3,00 (2,00; 3,00) 11. Notifico un mayor número de RAM que antes desde mi puesto de trabajo 1-3 1,00 (1,00; 1,50) 12. He mejorado la localización de las tarjetas amarillas en la farmacia (más accesibilidad) 1-5 3,00 (1,50; 3,00) 13. Me preocupo más de tener un mínimo de tarjetas amarillas a mano 1-5 2,00 (2,00; 2,50) 14. Ahora notificaría con tarjeta amarilla electrónica 1-5 4,00 (2,00; 5,00) 15. Han aumentado mis relaciones con el personal del Centro de Farmacovigilancia 1-4 2,00 (1,50; 2,50) 16. He integrado en mi práctica diaria, entre mis funciones como farmacéutico de oficina de farmacia, la detección y notificación de RAM 1-5 3,00 (2,50; 3,00) a Los resultados se expresan como mediana (P25;P75). Resultados Respuesta (%) 144 84,6% 80% 71,4% 71,4% 60% 46,2% 40% 21,4% 14,3% 14,3% 8,3% 14,3% 20% 0% 35,7% 28,6% 0% 0% 0% 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Afirmaciones Total Desacuerdo Desacuerdo Respuesta (%) Figura 7a. Expresión de desacuerdo con las afirmaciones propuestas en el Cuestionario de Transferencia del curso-taller 76,9% 80% 57,1% 60% 57,1% 57,1% 57,1% 50,0% 42,9% 40% 28,6% 21,4% 20% 0% 57,1% 50,0% 15,4% 14,3% 14,3% 14,3% 0% 1 2 3 4 5 Acuerdo 6 7 8 9 10 11 12 13 14 15 16 Total acuerdo Afirmaciones Figura 7b. Expresión de acuerdo con las afirmaciones propuestas en el Cuestionario de Transferencia del curso-taller Resultados 145 2.2. Lista de distribución on-line de farmacovigilancia La lista de distribución comenzó su actividad en mayo de 2007 con un total de 58 miembros, en su mayoría farmacéuticos comunitarios. A pesar de que esta lista en su origen iba dirigida únicamente a farmacéuticos comunitarios, dado el interés que mostraron otros profesionales farmacéuticos por estar inscritos en ella, se aceptaron las solicitudes de farmacéuticos de otros ámbitos profesionales advirtiéndoles de antemano acerca de la orientación comunitaria de la lista. 2.2.1. Los miembros de la lista De los 58 miembros, 51 corresponden a farmacéuticos/as comunitarios/as, 2 farmacéuticas hospitalarias, 2 farmacéuticas del Departamento de Salud (Gobierno de Navarra), 1 farmacéutica del Centro de Información de Medicamentos (Colegio Oficial de Farmacéuticos de Navarra), 1 médico responsable del Centro de Farmacovigilancia de Navarra, y 1 farmacéutica de la Unidad Docente de Farmacia Práctica que hace las funciones de administración y coordinación de la lista. • Farmacéuticos comunitarios Entre los farmacéuticos comunitarios miembros de la lista, hay un 80,4% de mujeres y un 19,6% de hombres. Además, el 84,3% son titulares de oficina de farmacia frente al 15,7% de adjuntos. Atendiendo a su participación en el estudio realizado previamente, a través de encuestas y de grupos focales, un 23,5% había participado en dicho estudio o lo había hecho alguien de su farmacia. Además, un 39,2% había asistido al curso-taller de utilización de la tarjeta amarilla. Resultados 146 2.2.2. Valoración de la actividad de la lista 2.2.2.1. Indicadores de actividad Los indicadores de actividad de la lista se exponen en la Tabla VII y el flujo de mensajes, a lo largo de los primeros 12 meses de actividad, se representa en la Figura 8. Tabla VII. Figura 8. Indicadores de actividad de la lista Nº usuarios 58 Nº total de mensajes 24 Nº de mensajes mensuales 2 Nº de mensajes por usuario 0,41 Porcentaje de usuarios activos (n) 15,5% (n=9) Nº de mensajes por usuario activo 2,67 Mensajes generados en la lista de distribución (mayo 2007-abril 2008) Resultados 147 2.2.2.2. Indicadores de procedencia de los mensajes Los mensajes distribuidos a través de la lista procedían de la administradora y coordinadora de la lista, así como de farmacéuticos inscritos procedentes de diferentes ámbitos profesionales. Los indicadores de procedencia de los mensajes generados se muestran en la Tabla VIII y el flujo de mensajes a lo largo de los meses, según su origen, queda representado en la Figura 9. Tabla VIII. Indicadores de procedencia de los mensajes Indicador n Centros de trabajo generadores de mensajes 8 - Administración/coordinación lista 1 Oficina de farmacia 5 Colegio profesional (CIM) 1 Farmacia hospitalaria 1 Distribución de mensajes en función del ámbito laboral - n % Administración/coordinación lista 14 58,33 Oficina de farmacia 6 25 Colegio profesional (CIM) 3 12,5 Farmacia hospitalaria 1 4,17 CIM = Centro de Información de Medicamentos Resultados 148 Nº mensajes 3 2,5 2 1,5 1 0,5 ab ril m ay o ju ni o ju lio ag os se to pt ie m br e oc t no ubr vie e m di bre cie m br e en er o fe br er o m ar zo 0 Meses 2007 Administradora Lista 2008 Farmacéutico/a OF Farmacéutico/a H CIM Farmacéutico/a OF= Farmacéutico/a de oficina de farmacia; Farmacéutico/a H= Farmacéutico/a de hospital; CIM = Centro de Información de Medicamentos Figura 9. Mensajes generados en la lista de distribución (mayo 2007-abril 2008) según su origen 2.2.2.3. Indicadores de contenido de los mensajes Los mensajes enviados desde la coordinación de esta actividad eran enviados una vez al mes alternando un mensaje recordatorio acerca de la importancia de notificar, con un mensaje informativo, bien sobre algún caso de RAM concreto, o bien sobre algún tema interesante relacionado con la seguridad de los medicamentos o la notificación de sospechas de RAM. Por otra parte, los mensajes relacionados con el correcto funcionamiento de esta herramienta se enviaban también desde la administración/coordinación de la lista. Los mensajes enviados por otros miembros de la lista, eran casos que ellos mismos habían detectado en su centro de trabajo (en todos los casos de oficina de farmacia), comentarios acerca de los casos enviados, e incluso opiniones relacionadas con la seguridad de ciertos medicamentos. Resultados 149 La Tabla IX y la Figura 10 muestran la categoría de los mensajes distribuidos a través de la lista. Tabla IX. Indicadores de contenido de los mensajes Categoría de mensaje n % • Comentarios relacionados con la seguridad de medicamentos 10 41,67 • Casos detectados desde el ámbito asistencial del farmacéutico y comentarios consecuentes 5 20,83 • Mensajes recordatorios 5 20,83 • Temas relacionados con la lista (instrucciones de funcionamiento, etc.) 3 12,5 • Otros 1 4,17 6 Nº mensajes 5 4 3 2 1 ab ril ar zo m se pt ag os to ie m br e oc tu br no e vie m br e di ci em br e en er o fe br er o ju lio ju ni o m ay o 0 Meses 2007 2008 Lista Seguridad medicamentos Recordatorios Otros Figura 10. Casos detectados y comentarios Mensajes generados en la lista de distribución (mayo 2007-abril 2008) según su categoría Resultados 150 2.2.3. Valoración de la satisfacción y utilidad de la lista por los usuarios. Cuestionario de Valoración. Se recogieron 18 cuestionarios procedentes de farmacéuticos comunitarios, los cuales correspondían al 35,3% del total de miembros de la lista pertenecientes al ámbito de oficina de farmacia. Los resultados obtenidos a partir de estos cuestionarios se muestran en la Tabla X. Tabla X. Valoración de la lista de distribución por los farmacéuticos comunitarios, medida sobre una escala likert de 10 puntos ÍTEMS Rango valores (mín-máx) Puntos a obtenidos 1. La información que envía el administrador de la lista, me parece interesante 6-10 8,50 (7,00; 9,25) 2. Los recordatorios que envía el administrador de la lista, me resultan útiles 3-10 8,00 (7,00; 9,00) 3. Los mensajes enviados por los miembros de la lista, me parecen interesantes 6-10 8,00 (7,75; 9,00) 4. En general, los mensajes recibidos me han parecido adecuados 6-10 8,00 (8,00; 9,25) 5. Mis expectativas iniciales se han cumplido 5-10 8,00 (6,75; 9, 00) 6. Estoy satisfecho/a con esta actividad 6-10 8,00 (7,00; 9,00) 7. Me ayuda a estar más alerta ante situaciones que pudieran estar asociadas a RAM 5-10 8,00 (7,75; 10,00) 8. Me sirve para tener más presente que debo notificar las sospechas de RAM 5-10 9,00 (8,00; 10;00) 9. Desde que comenzó la lista, hago más preguntas a los pacientes para determinar si un síntoma pudiera ser una RAM 1-10 8,00 (6,00; 8,25) 10. Desde que comenzó la lista, detecto un mayor número de RAM desde mi puesto de trabajo 1-9 6,00 (5,00; 7,25) 11. Desde que comenzó la lista, notifico un mayor número de RAM desde mi puesto de trabajo 1-8 5,00 (1,75; 6,00) SATISFACCIÓN UTILIDAD a Los resultados se expresan como mediana (P25;P75). RAM = Reacción Adversa a Medicamentos Resultados 151 2.3. Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria Un total de 59 farmacéuticos comunitarios, lo cual supone alrededor del 6% del total de farmacéuticos comunitarios en Navarra en el momento del estudio, participaron en alguna de las actividades ofertadas, bien en el curso-taller, bien en la lista de distribución o en ambas actividades. La distribución de los farmacéuticos participantes en función de la actividad se muestra en la Figura 12. Participantes en LISTA 54% Participantes en CURSO-TALLER y LISTA 32% 14% Participantes en CURSO-TALLER Figura 12. Distribución, en porcentajes, de los farmacéuticos comunitarios participantes en función de la actividad realizada. 2.3.1. Contribución del farmacéutico comunitario Entre mayo de 2007 y abril de 2008, es decir, 12 meses tras la implementación de las actividades, se recibieron en el Centro de Farmacovigilancia de Navarra un total de 35 notificaciones procedentes de farmacia comunitaria, lo cuál representa el 8,9% de las notificaciones totales recibidas durante ese periodo de tiempo en el Centro (n=393). La evolución de la contribución del farmacéutico comunitario al Sistema de Notificación Espontánea en Navarra, desde enero de 2003 hasta abril de 2008, se muestra en la Figura 13. Resultados 152 Intervención Notificaciones (%) 100 80 88,5 87,2 91,6 93,0 91,1 11,5 12,8 8,4 7,0 8,9 2003 2004 2005 2006 60 40 20 0 Periodo Notificaciones del farmacéutico comunitario Figura 13. Mayo2007 -abril2008 Notificaciones de otros profesionales Evolución de la contribución del farmacéutico comunitario al Sistema de Notificación Espontánea en Navarra, desde enero de 2003 hasta abril de 2008. La distribución de las notificaciones enviadas por farmacéuticos comunitarios al Centro de Farmacovigilancia de Navarra, durante los 12 meses siguientes a la implementación de las actividades (mayo 2007 - abril 2008), en función de la participación del farmacéutico notificador en dichas actividades, se expone en la Figura 14. Participantes en LISTA 40,0% Participantes 57,1% 42,9% No participantes 42,9% No participantes 2,8% 14,3% Participantes en CURSO-TALLER Figura 14. Participantes en CURSO-TALLER y LISTA Distribución, en porcentajes, de las notificaciones de farmacéuticos comunitarios, entre mayo de 2007 y abril de 2008, en función de la participación del farmacéutico notificador en las actividades propuestas. Resultados 153 2.3.2. Actividad notificadora del farmacéutico comunitario Los farmacéuticos comunitarios enviaron al Centro de Farmacovigilancia de Navarra, durante los 12 meses de estudio tras la implementación de las actividades, un total de 35 notificaciones. La Figura 15 representa la tasa de notificación, por 1000 25 Intervención 20 15 10 Mar Nov En 2008 Jul Sep May Mar Nov En 2007 Jul Sep May Mar Nov En 2006 Jul Sep Mar May Nov En 2005 Jul Sep Mar May En 2004 Sep Nov Jul En 2003 0 Mar 5 May Tasa de notificación farmacéuticos-mes, desde enero de 2003 hasta abril de 2008. Mes Tasa de notificación (por 1000 farmacéuticos-mes) Figura 15. Evolución de la tasa de notificación, por 1000 farmacéuticos-mes, de farmacéuticos comunitarios desde enero de 2003 hasta abril de 2008. La tasa de notificación, tras la implementación de las actividades, ascendió a 35 Tasa de notificación (por 1000 farmacéuticos-año) notificaciones por 1000 farmacéuticos-año (Figura 16). 60 50 49 Intervención 53 45 40 31 30 35 20 10 0 2003 2004 2005 Periodo Figura 16. 2006 Mayo 2007 -Abril 2008 Evolución de la tasa de notificación, por 1000 farmacéuticos-año, desde enero de 2003 hasta abril de 2008. Resultados 154 Por otra parte, la tasa correspondiente al grupo de participantes, en ese mismo año, es de 339 notificaciones por 1000 farmacéuticos-año, frente a 16 de los no participantes. No obstante, las tasas alcanzadas en el año 2006 por los farmacéuticos pertenecientes a estos mismos grupos, son de 254 notificaciones, en el grupo de participantes, y de 16,6 notificaciones, en el grupo de no participantes respectivamente. Por tanto, se observa un incremento del 33,5% en el grupo de participantes frente a un descenso del 3,6% en el grupo de no participantes. Las tasas de ambos grupos de farmacéuticos, en el año 2006 y en los 12 meses comprendidos entre mayo de 2007 y abril de 2008, se muestran en la Figura 17. Tasa de notificación (por 1000 farmacéuticos-año) Intervención 400 300 339 254 200 100 16,6 0 Farmacéuticos participantes Año 2006 Figura 17. 16 Farmacéuticos no participantes Mayo 2007-Abril 2008 Tasa de notificación, por 1000 farmacéuticos-año, en 2006 y en los 12 meses comprendidos entre mayo de 2007 y abril de 2008, en función de la participación en las actividades ofertadas. En cuanto al número de notificaciones por notificador, la media es de 2 en el grupo de participantes, frente a 1,15 en el grupo de no participantes. La Figura 18 representa el número de farmacéuticos comunitarios notificadores, participantes y no participantes, en función del número de notificaciones enviadas, durante los 12 meses comprendidos entre mayo de 2007 y abril de 2008. Resultados Número de notificadores 155 16 14 12 10 8 6 4 2 0 1 Notificación No participantes Figura 18. 2 Notificaciones 3 Notificaciones Número de notificaciones Participantes Número de farmacéuticos comunitarios notificadores, participantes y no participantes, en función del número de notificaciones enviadas entre mayo de 2007 y abril de 2008. 2.3.3. Implicación del farmacéutico comunitario en el Sistema de Notificación Las 35 notificaciones recibidas en el Centro de Farmacovigilancia de Navarra, durante los 12 meses de estudio, fueron enviadas por 23 farmacéuticos comunitarios, lo cual supone alrededor del 2,4% del total de farmacéuticos comunitarios en Navarra en el momento del estudio. De ellos, 10 habían participado en alguna actividad y 13 en ninguna de ellas. La distribución del conjunto de farmacéuticos comunitarios notificadores según su participación en las actividades propuestas, se muestra en la Figura 19. Participantes 43,4% Participantes en LISTA 30,4% 8,7% 56,6% No participantes Figura 19. 56,6% No participantes Participantes en CURSO-TALLER y LISTA 4,3% Participantes en CURSO-TALLER Distribución de los farmacéuticos comunitarios notificadores, según su participación en las actividades propuestas Resultados 156 Los 23 farmacéuticos notificadores correspondían a 22 oficinas de farmacia diferentes, que suponen el 3,92% del total de oficinas de farmacia en Navarra en el momento del estudio (n=561). La proporción de oficinas de farmacia desde las que se enviaron notificaciones desde enero de 2003 hasta abril de 2008, se representa en la Figura 20. Asimismo, se muestra el porcentaje de oficinas de farmacia cuyo notificador había participado en las actividades propuestas, en el periodo comprendido entre mayo de 2007 y abril de 2008. Farmacias notificadora s (%) Intervención 4 3,63% 4,01% 3,92% 3,16% 3 2,55% 1,78% Farmacéuticos Farmacéuticos participantes Farmacéuticos no participantes 2 2,14% 1 0 2003 2004 2005 Periodo Figura 20. 2006 Mayo 2007 -Abril 2008 Evolución del porcentaje de farmacias desde las que se envían notificaciones, desde enero de 2003 hasta abril de 2008. Al estudiar la asociación entre participar en las actividades y notificar en los 12 meses siguientes, ajustando por las variables que podrían estar influyendo en esta relación (“ser notificador en los 3 años anteriores” y “ser miembro activo del Programa de consulta y dispensación activa”), se observó que los participantes en alguna de las actividades ofertadas presentaban una ventaja de notificar superior respecto a los que no participaron en ellas (OR: 7,71 [IC 95%:2,90-20,48]). En concreto, los participantes en la lista de distribución tienen una ventaja de notificar frente a no notificar 12,49 veces superior respecto a los no participantes. Asimismo las variables “ser notificador en los 3 años anteriores” y “ser miembro activo del Programa de consulta y dispensación activa”, aunque en menor medida, también mostraron influir en la notificación durante los meses estudiados (Tabla XI). Resultados 157 Tabla XI. Participación en las actividades y notificación en los 12 meses siguientes Mayo 2007-Abril 2008 Características Notificador (n=23) a b Análisis crudo No notificador (n=970) OR (IC 95%) Análisis ajustado Valor p OR (IC 95%) Valor p Participante en actividades: Curso (sólo) 4,3 (1) 0,72 (7) 10,12 (1,16-88,25) 0,036 7,84 (0,80-76,64) 0,077 Lista (sólo) 30,4 (7) 2,6 (25) 19,84 (7,29-53,98) <0,001 12,49 (4,09-38,21) <0,001 Curso + Lista 8,7 (2) 1,75 (17) 8,34 (1,74-39,83) 0,008 2,41 (0,37-15,46) 0,355 Notificador (3 años anteriores) 43,5 (10) 4,3 (42) 16,99 (7,05-40,99) <0,001 7,98 (2,87-22,17) <0,001 Activo en programa consulta y dispensación 30,4 (7) 3,7 (36) 11,35 (4,40-29,31) <0,001 4,17 (1,27-13,70) 0,019 de a Los resultados se expresan como porcentajes (n). b Análisis multivariante ajustando por todas las variables de la tabla. OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. Por otra parte, si examinamos el efecto de las actividades durante ese año, subdividido en periodos de 4 meses, se observa lo siguiente (Tabla XII): - Entre el 1º y 4º mes (mayo-agosto de 2007), se muestra la influencia positiva de participar en la lista de forma aislada y de participar en el curso y la lista conjuntamente, sobre la notificación. - Entre el 5º y 8º mes (septiembre-diciembre de 2007), únicamente se observa la influencia de la participación en el curso de formación de forma aislada. - Entre el 9º y 12º mes (enero-abril de 2008), se observa nuevamente el efecto positivo de la participación en la lista de forma aislada, aunque éste es de menor magnitud que el observado en los 4 primeros meses. La influencia de haber notificado en los años previos se pone de manifiesto entre el 1º y 4º mes y entre el 9º y el 12º mes, siendo su efecto superior durante el último periodo. En cambio, el efecto de la participación en el programa de consulta y dispensación activa sobre notificar, se observa únicamente entre el 5º y 8º mes. Análisis ajustadob Análisis crudo Mayo 2007-Agosto 2007a Notificador (n=11) No notificador (n=982) OR (IC 95%) Valor p OR (IC 95%) Valor p Curso (sólo) 0 (0) 0,81 (8) -------- -------- -------- -------- Lista (sólo) 54,5 (6) 2,6 (26) 71,62 (16,97-302,16) <0,001 47,05 (10,41-212,72) <0,001 Curso + Lista 18,2 (2) 1,7 (17) 36,51 (5,73-232,75) <0,001 13,53 (1,60-114,65) 0,017 Notificador (3 años anteriores) 45,5 (5) 4,8 (47) 16,58 (4,88-56,29) <0,001 4,71 (1,06-20,83) 0,041 Activo en programa consulta y dispensación 36,4 (4) 4,0 (39) 13,82 (3,88-49,18) <0,001 3,72 (0,68-20,32) 0,130 Notificador (n=4) No notificador (n=989) OR (IC 95%) Valor p OR (IC 95%) Valor p Curso (sólo) 25 (1) 0,7 (7) 66,57 (5,39-821,61) 0,001 57,46 (2,36-1399,70) 0,013 Lista (sólo) 0 (0) 3,2 (32) -------- -------- -------- -------- Curso + Lista 25 (1) 1,8 (18) 25,89 (2,24-298,62) 0,009 3,47 (0,24-50,98) 0,364 Notificador (3 años anteriores) 25 (1) 5,2 (51) 6,13 (0,63-59,98) 0,119 1,27 (0,1-16,55) 0,853 Activo en programa consulta y dispensación 75 (3) 4 (40) 71,18 (7,24-699,47) <0,001 56,11 (4,15-759,15) 0,002 Notificador (n=13) No notificador (n=980) OR (IC 95%) Valor p OR (IC 95%) Valor p Curso (sólo) 0 (0) 0,8 (8) -------- -------- -------- -------- Lista (sólo) 30,8 (4) 2,9 (28) 14,68 (4,26-50,55) <0,001 6,82 (1,66-28,03) 0,008 0 (0) 1,9 (19) -------- -------- -------- -------- 53,8 (7) 4,6 (45) 24,24 (7,83-75,09) <0,001 16,16 (4,54-57,46) <0,001 23 (3) 4,1 (40) 7,05 (1,87-26,62) 0,004 2,17 (0,44-10,67) 0,339 Resultados Tabla XII. Participación en las actividades y notificación entre mayo de 2007 y abril de 2008, en periodos de 4 meses. Participante en actividades: de Septiembre-Diciembre 2007 Participante en actividades: de Enero-Abril 2008 Participante en actividades: Curso + Lista Notificador (3 años anteriores) Activo en programa consulta y dispensación de 158 a Los resultados se expresan como porcentajes (n). b Análisis multivariante ajustando por todas las variables de la tabla. OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. Resultados 159 Nuevos notificadores Durante los 12 meses siguientes a la implementación de las actividades, se observó la aparición de 15 “nuevos notificadores” de los 23 farmacéuticos comunitarios que habían notificado en ese periodo de tiempo. La incidencia acumulada de farmacéuticos comunitarios “nuevos notificadores”, tomando como periodo de seguimiento los 12 meses transcurridos entre mayo de 2007 y abril de 2008, es de 1,66%, siendo el 0,63% correspondiente a farmacéuticos participantes y el 1,03% a otros farmacéuticos. La incidencia acumulada de farmacéuticos comunitarios “nuevos notificadores” en los 12 meses mencionados y Periodo en el año 2006, se expone en la Figura 21. Incidencia Acumulada (%) 2006 Nuevos notificadores Nuevos notificadores no participantes 0,49% Nuevos notificadores participantes Mayo07 -abril08 1,03% 0 0,2 0,4 0,6 0,8 0,63% 1 1,2 1,4 1,6 1,66% Intervención 1,8 Incidencia acumulada (%) Figura 21. Incidencia acumulada (%) de nuevos notificadores entre mayo de 2007 y abril de 2008, y en el año 2006. Al estudiar la asociación entre participar en las actividades y convertirse en “nuevonotificador” en los 12 meses siguientes, ajustando por la variable considerada como influyente en esta relación, “ser miembro activo del Programa de consulta y dispensación activa”, se observó que tanto la participación en la lista de distribución como en el curso-taller influían positivamente en la aparición de nuevos notificadores. Asimismo, el hecho de ser miembro activo del Programa de consulta y dispensación activa, aunque en menor medida, también se identificó como una variable de influencia (Tabla XIII). Resultados 160 Tabla XIII. Participación en las actividades y ser “nuevo-notificador” en los 12 meses siguientes. Mayo 2007-Abril 2008 Características a Nuevonotificador No nuevonotificador (n=15) (n=978) b Análisis crudo OR (IC 95%) Análisis ajustado Valor p OR (IC 95%) Valor p Participante en actividades: Curso (sólo) 6,7 (1) 0,7 (7) 14,68 (1,63-131,95) 0,016 11,83 (1,21-115,85) 0,034 Lista (sólo) 26,7 (4) 2,9 (28) 14,68 (4,26-50,55) <0,001 11,83 (3,27-42,73) <0,001 Curso + Lista 6,7 (1) 1,8 (18) 5,71 (0,69-47,47) 0,107 2,49 (0,25-24,57) 0,434 26,7 (4) 4,0 (39) 8,75 (2,67-28,73) <0,001 5,72 (1,51-21,70) 0,010 Activo en programa consulta y dispensación de a Los resultados se expresan como porcentajes (n). b Análisis multivariante ajustando por todas las variables de la tabla. OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. Al examinar dicha asociación durante los 4 primeros meses (Tabla XIV), se observa que nuevamente la participación en la lista de distribución presenta un efecto positivo sobre la aparición de nuevos notificadores, el cual es superior al calculado para los 12 meses. Además, la participación en el curso y la lista presenta una asociación significativa con la notificación que es de menor magnitud que la anterior y que desaparece al valorar el efecto durante 12 meses. Por último, la participación de forma aislada en el curso no muestra tener ningún efecto durante los 4 primeros meses. El 46,7% (n=7) de los “nuevos notificadores” identificados durante el año en estudio comienzan su actividad notificadora durante los 4 primeros meses tras la implementación de las actividades. De ellos, el 71,4% (n=5) son farmacéuticos participantes en alguna de las actividades. Tabla XIV. Participación en las actividades y ser “nuevo-notificador” en los 4 meses siguientes. Mayo 2007-Agosto 2007 a Nuevonotificador No nuevonotificador (n=7) (n=986) Curso (sólo) 0 (0) Lista (sólo) Curso + Lista Características Análisis crudo b Análisis ajustado OR (IC 95%) Valor p OR (IC 95%) Valor p 0,8 (8) --------- --------- --------- --------- 57,1 (4) 2,8 (28) 66,57 (11,70-378,72) <0,001 57,47 (9,80-336,99) <0,001 14,3 (1) 1,8 (18) 25,89 (2,24-298,62) 0,009 14,97 (1,04-216,13) 0,047 28,6 (2) 4,2 (41) 9,22 (1,74-48,95) 0,009 3,47 (0,50-24,16) 0,209 Participante en actividades: Activo en programa consulta y dispensación de a Los resultados se expresan como porcentajes (n). b Análisis multivariante ajustando por todas las variables de la tabla. OR = Odds Ratio; IC 95% = Intervalo de Confianza del 95%. Resultados 161 Entre el 5º y 8º mes y entre el 9º y 12º mes, no se observa asociación entre la participación en las actividades y la aparición de nuevos notificadores. V. DISCUSIÓN Discusión 165 1. ANÁLISIS DE LOS FACTORES QUE INFLUYEN EN LA NOTIFICACIÓN DE SOSPECHAS DE RAM EN FARMACIA COMUNITARIA EN NAVARRA 1.1. La encuesta La tasa de respuesta a la encuesta fue del 97,5% (90% para los casos y 100% para los controles). Se trata de una tasa superior a la obtenida en estudios similares(4854,56-63) , debido probablemente a que los cuestionarios fueron administrados de forma personal. Esta parte del estudio, realizada con la metodología de la encuesta, señala la gran importancia del conocimiento del farmacéutico como factor influyente en la notificación de sospechas de RAM. Así, la puesta en marcha de estrategias de formación dirigidas a modificar ciertas creencias erróneas y actitudes, a transmitir el conocimiento básico para notificar, y a promover una “cultura notificadora” entre estos profesionales, podría mejorar las tasas de notificación. Los resultados de esta encuesta coinciden con datos obtenidos en estudios similares realizados en farmacéuticos comunitarios, farmacéuticos hospitalarios y médicos, y que se encuentran disponibles en la literatura científica(49,50,52-55,57-63,65). La edad y la experiencia profesional como farmacéutico comunitario, son factores con influencia en la notificación de sospechas de RAM, de forma que a medida que aumentan la edad y los años de experiencia, la probabilidad de notificar es superior. Esta tendencia también ha sido descrita en otros dos estudios(50,57). Por otra parte, parece existir cierta asociación entre haber recibido formación relacionada con la detección y resolución de PRMs y la notificación de sospechas de RAM. La influencia de la formación sobre la notificación de sospechas de RAM también se ha descrito en otros tres estudios de este tipo realizados en farmacéuticos comunitarios(65) y hospitalarios(57,59). En países como Holanda, donde los farmacéuticos están muy motivados para notificar RAMs, se ha podido constatar que estos profesionales consideran la notificación como una parte importante de su trabajo como farmacéuticos(60). Según nuestro estudio, los farmacéuticos del grupo control, los cuales están menos motivados para notificar que los del grupo de casos, no integran la notificación en su Discusión 166 práctica diaria. Este comportamiento podría ser modificado mediante la aportación de formación práctica en esta área, dado que el farmacéutico debería incluir la notificación en el conjunto de sus actividades profesionales. Casi la totalidad de los encuestados había detectado alguna vez una RAM, lo cual muestra la capacidad de los farmacéuticos para detectar este tipo de eventos desde la oficina de farmacia. Sin embargo, no están acostumbrados a notificar aquello que detectan, a través del Sistema de Notificación Espontánea. En general, tienden a derivar al paciente al médico en el momento en que detectan una sospecha de RAM, delegando la notificación en este profesional. Únicamente se ha encontrado un estudio en el cuál se observaba este mismo comportamiento por parte de farmacéuticos jóvenes(50). Esta forma de actuar fue identificada como un aspecto susceptible de ser mejorado mediante algún tipo de intervención. Teniendo en cuenta la relativa baja tasa de notificación desde la oficina de farmacia en Navarra, los farmacéuticos de esta Comunidad tienen, sorprendentemente, una actitud positiva hacia la notificación de RAM, actitud que también recogen otros estudios(52,55,60,65). Los “siete pecados capitales del notificador” descritos por Inman en 1976, como razones para no notificar las sospechas de RAM por parte de los profesionales sanitarios(44), en su mayoría no son reconocidos por los farmacéuticos encuestados como razones que les conduzcan a no notificar. En este sentido, al igual que en un estudio realizado en farmacéuticos en Portugal(63), nuestros farmacéuticos no incluyen entre estas razones, las relacionadas con la actividad profesional, ni las asociadas al uso de la tarjeta amarilla. Así, los motivos señalados más frecuentemente corresponden a: “se trataba de una RAM leve”, “se trataba de una RAM conocida”, la Inseguridad (“No estaba seguro de que la reacción estuviera causada por el uso de un medicamento concreto”) y el Letargo o dejadez (“olvido de notificar la RAM” y “falta de tiempo”). Estos hallazgos son similares a los obtenidos en estudios de este tipo en médicos y farmacéuticos de otros países(49,53,55,60-62). Por otra parte, el “Olvido de notificar una RAM” se encuentra asociado a la notificación, como se muestra en la Tabla II. Esto puede explicarse si tenemos en cuenta que los casos, al ser más conscientes de su responsabilidad hacia la notificación de RAM, cuando detectan una sospecha saben que deben notificarla e Discusión 167 incluso seguramente su intención sea esa, pero puede que finalmente lo olviden. Por otro lado, los controles no olvidarán notificar debido a que, probablemente, no serán conscientes de su deber de notificar este tipo de acontecimientos. La razón identificada como Inseguridad (“No estaba seguro de que la reacción estuviera causada por el uso de un medicamento concreto”) se deriva de la existencia de una creencia errónea entre los farmacéuticos, asociada a la no notificación: “Para notificar hay que estar seguro de que la reacción está causada por el uso de un medicamento concreto”. Esto muestra que la Ignorancia constituye una de las causas de la no notificación a pesar de no haber sido identificada propiamente por nuestros farmacéuticos. La actitud de “notificar sólo si se tiene la seguridad de que un medicamento es la causa” es habitual en farmacéuticos(50,59,60,63) y en médicos(49,53,54,58,61,62), tal y como afirman varios autores. Una vez más, la Ignorancia se identifica como un factor que obstaculiza la notificación de sospechas de RAM, al observar la existencia de correlación entre la puntuación obtenida en conocimientos básicos y el número de notificaciones enviadas. Aunque los farmacéuticos saben que la tarjeta amarilla en papel es el formulario diseñado par notificar RAM, desconocen la existencia de otras vías de comunicación, lo cuál ha sido también determinado en estudios de estas características(61). Adicionalmente, la falta de conocimiento respecto a dónde notificar, no debería ser un impedimento para notificar ya que el destinatario aparece en la propia tarjeta. Sin embargo, este desconocimiento sobre el sistema y su actividad podría tener alguna repercusión en la notificación. Por tanto, otro aspecto sobre el que habría que intervenir sería el conocimiento, es decir, proporcionar información sobre la actividad del Sistema de Notificación, concienciando de esta manera a los farmacéuticos sobre la importancia de sus notificaciones. Con el fin de incrementar la participación de los farmacéuticos en el Sistema de Notificación de sospechas de RAM, ellos mismos ven necesaria una mayor formación y concienciación. Esto sugiere que la formación proporcionada actualmente, tanto en los estudios de la licenciatura como a nivel de post-grado, pueden ser insuficientes o que sería necesario poner en marcha otro tipo de Discusión 168 estrategias para conseguir incrementar el conocimiento y la motivación de estos profesionales. A raíz de este trabajo, y de acuerdo con el modelo de “conocimientos-actitudesprácticas” (71) y otros estudios publicados(53,54,57-59,62,63,65,81), proponemos que la modificación de algunas actitudes y del conocimiento, así como de la relación con el entorno profesional, podría mejorar la participación de los farmacéuticos en el Sistema de Notificación Espontánea(81). La principal limitación de este estudio es el pequeño tamaño de muestra tomado para ambos grupos, el cuál venía determinado por el reducido número de casos en la zona. Este hecho puede haber conducido a una baja potencia estadística para detectar asociaciones, ocasionando una falta de hallazgos con relación a algunos factores. Sin embargo, la tasa de respuesta obtenida es bastante elevada, lo cual reduce la probabilidad de posibles sesgos de selección. Otra limitación es que el cuestionario no fue validado previamente a la realización del estudio. No obstante, se realizó una prueba piloto para adaptarlo a la comprensión de los farmacéuticos y se basó en cuestionarios utilizados con el mismo objetivo y con los que se obtuvieron resultados satisfactorios. Adicionalmente, la utilización de una escala visual analógica para valorar las actitudes, en vez de una escala Likert de cinco puntos, es posible que hubiera permitido la detección de pequeñas diferencias entre algunas actitudes de los farmacéuticos tal y como se observa en otros estudios(58,63). Por otra parte, el análisis multivariante incluía variables altamente correlacionadas entre sí (por ejemplo: edad y experiencia profesional), siendo el índice de condición superior a 30. Sin embargo, tras aplicar otra regresión logística multivariante manteniendo aquellas variables que, estando correlacionadas, tenían un mayor coeficiente de determinación en el análisis crudo (edad y mayores puntuaciones en preguntas) y aquellas que no estaban correlacionadas, los resultados obtenidos muestran una magnitud de efecto similar pero con asociaciones estadísticamente significativas. En conjunto, debido al problema de la colinealidad, no podemos asegurar la asociación independiente de las variables incluidas en el modelo. Finalmente, se estimó necesario ampliar este trabajo de tipo cuantitativo, mediante la utilización de una técnica de investigación cualitativa a fin de explicar adecuadamente el fenómeno en estudio. Discusión 169 1.2. El grupo focal Las sesiones de grupos focales llevadas a cabo, han permitido identificar y analizar las barreras y los facilitadores que encuentra el farmacéutico comunitario de Navarra en la notificación de sospechas de RAM. La información obtenida a través de estos grupos complementa y refuerza el trabajo previo, realizado mediante la encuesta, acerca de los factores que influyen en la baja notificación de RAM en la misma población de estudio(99). La coincidencia con los resultados obtenidos en el trabajo cuantitativo previo, aporta validez a la investigación realizada. Existen numerosos trabajos publicados, la mayoría realizados mediante encuestas, con relación a conocimientos, actitudes y opiniones de los profesionales sanitarios ante la notificación de sospechas de RAM (46,48-65,67-70,99,100) . La mayor parte de ellos, se centran en el profesional y contemplan casi exclusivamente lo que denominamos factores intrínsecos. En este trabajo, mediante grupos focales, además de estos factores intrínsecos que condicionan el comportamiento del farmacéutico ante la notificación de RAM, se han tenido en cuenta otros factores externos, denominados factores extrínsecos, que influyen a su vez sobre los anteriores. Estos son: el paciente, otros profesionales sanitarios (en este caso el médico), el centro de trabajo (la oficina de farmacia), la Organización Colegial y el Sistema de Notificación de sospechas de RAM. Por otra parte, la utilización de metodología cualitativa en este ámbito, la cual resulta poco frecuente en este tipo de estudios, permite profundizar en el comportamiento del farmacéutico con relación a la notificación de sospechas de RAM así como en los factores que influyen en el mismo. Barreras De las barreras identificadas, una de las más importantes es la falta de formación adecuada en materia de farmacovigilancia, lo cual coincide con lo hallado en el trabajo previo(99). Igualmente, en un gran número de estudios el conocimiento se considera un factor determinante en la notificación de RAM por parte de los profesionales sanitarios(51-53,55-59,62-65,67,69,70,80,100). El desconocimiento acerca del Sistema de Notificación: cuáles son los objetivos, cómo funciona, cómo está organizado, etc., así como otros aspectos que resultan básicos a la hora de notificar: quién debe notificar, qué debe notificarse, cómo o dónde hacerlo, constituye una Discusión 170 realidad común entre los profesionales sanitarios. Tanto es así, que un mayor conocimiento acerca de estos aspectos básicos fue identificado como un factor asociado a la notificación de sospechas de RAM en esta población de farmacéuticos, tras hacer un análisis multivariante(99). Se han identificado una serie de creencias erróneas, consideradas especialmente importantes por sus repercusiones y por su grado de generalización entre los farmacéuticos: “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente” Esta creencia, presente en los farmacéuticos no-notificadores, también identificada en el trabajo previo(99) y en otros estudios similares(49,51,70), conduce a estos profesionales a no notificar sospechas debido a la inseguridad de que se trate de una RAM. “En el Centro de Farmacovigilancia se van a reír o van a pensar mal del farmacéutico si éste manda una RAM que es muy obvia o si lo que identifica como RAM, no lo era realmente”. Esta creencia, extendida entre nuestros farmacéuticos, y que no fue identificada previamente, se relaciona con el miedo a hacer el ridículo y con la inseguridad acerca de la identificación de la RAM. No obstante, aquellos trabajos que contemplan el miedo o la preocupación por enviar una notificación inapropiada(59) o por quedar en ridículo(51,68) como razones para no notificar una RAM, afirman que son escasos los profesionales que así lo consideran. “Es mejor hablar con el médico y/o paciente para solucionar el problema”. Esta creencia lleva al farmacéutico a contactar con el médico directamente o a través del paciente, lo cuál se ha podido observar de forma generalizada entre nuestros profesionales, tanto en este estudio con grupos focales como en el realizado a través de la encuesta(99). Sin embargo, no se ha visto descrita en estudios similares. Así, la actitud predominante en el farmacéutico es la de priorizar la solución de los problemas de los pacientes por considerar más útil y eficaz actuar de esta forma, Discusión 171 dejando de lado el registro y la comunicación de estos hechos que son tan frecuentes en la oficina de farmacia. Esta actitud de servicio es comprensible dado el marco de trabajo del farmacéutico, aunque el solucionar los problemas no debería excluir su comunicación. Destaca también la actitud de no notificar si únicamente se tiene una sospecha y no una RAM confirmada, derivada de las creencias anteriormente citadas. Ésta es una actitud muy presente entre los profesionales sanitarios, según lo indican varios estudios publicados anteriormente(49,51,53,54,56-58,60-64,69,70,99,100). Después del farmacéutico, el paciente, el cuál no fue contemplado en el trabajo previo, constituye el segundo factor a tener en cuenta como barrera. La falta de colaboración por su parte y la inaccesibilidad a su historia clínica, contribuyen a que el farmacéutico no detecte posibles RAM y no pueda notificar por falta de información. Los estudios que identifican a los pacientes como un factor influyente en la notificación de los profesionales sanitarios, hacen referencia al “miedo a romper la confidencialidad del paciente” como factor que puede reducir la notificación de sospechas de RAM(51,57,70). En cuanto al centro de trabajo, la oficina de farmacia, todos los profesionales coincidían en que la existencia de un elevado volumen de trabajo, orientado en gran medida al público, conduce a priorizar la atención al paciente frente a la identificación y notificación de RAM. La sobrecarga de trabajo, y derivada de ésta la falta de tiempo, como barrera en la notificación de RAM, es común a médicos y farmacéuticos pertenecientes a diferentes entornos(46,49,51-53,55,57-59,65,67,69,70,99). En cuanto al Sistema de Notificación de sospechas de RAM, aspecto no contemplado en el trabajo previo, lo más destacado es su carácter voluntario o “altruista”, intrínseco al propio sistema. Debido a esto, la notificación del farmacéutico depende en última instancia de su buena voluntad para participar, constituyendo además un trabajo añadido para el mismo. Por tanto, resulta muy fácil caer en la desmotivación y priorizar la realización de actividades económicamente productivas. De todo lo anterior se desprende la idea de que la notificación de sospechas de RAM por parte del farmacéutico, realmente no es considerada como una actividad más y/o como una prioridad dentro del conjunto de actividades que se desarrollan en Discusión 172 una oficina de farmacia. Por ello, no queda tiempo para notificar, se olvida, etc., y en consecuencia, el comportamiento que adopta el farmacéutico normalmente no incluye la notificación. Por lo tanto, esta priorización de ciertas actividades explicaría algunos de los motivos, indicados en el estudio previo(99), por los que los farmacéuticos no notifican cuando sospechan o detectan una RAM. Así, entre los motivos identificados en esta población de farmacéuticos(99), el “letargo o dejadez” y “la detección de RAM leves y/o conocidas”, podrían explicarse a partir de esta actitud. En Navarra, los farmacéuticos tienen muy integrado el comportamiento de contactar con el Centro de Información de Medicamentos en el momento en que les surge alguna duda con relación a los medicamentos. De la misma manera, cuando observan una posible reacción adversa, tienden a adoptar este mismo comportamiento. Sin embargo, la sospecha se queda normalmente a ese nivel y, en numerosas ocasiones, no llega a notificarse con tarjeta amarilla. Lo mismo ocurre con el Programa de Consulta y Dispensación Activa. Las RAM, o sus sospechas, son comunicadas a través de dicho programa pero la mayoría de ellas no llegan a ser notificadas con tarjeta amarilla. Finalmente, el médico como barrera en la notificación, que tampoco fue abordado en el estudio previo, no ejerce una influencia negativa importante. Facilitadores Entre los facilitadores identificados en las sesiones, destaca la importancia que tienen las charlas o cursos de formación en farmacovigilancia como fuente de información, de formación y de motivación para notificar sospechas de RAM. La necesidad de asistir a programas formativos en farmacovigilancia como parte de la formación de post-grado, es un hecho ampliamente descrito a través de diferentes estudios(53-59,62-65,67,80,99-102). Adicionalmente, se detecta la necesidad de incorporar formación en farmacovigilancia en los programas de pre-grado(53,58,62,64,101,103,104). Por otra parte, la adopción de un compromiso con el Sistema de Notificación por parte del farmacéutico, podría resultar positivo dada la experiencia obtenida con otras actividades en las que se requiere este compromiso. Así, actividades como el Programa de Consulta y Dispensación Activa del Colegio de Navarra, los programas de seguimiento de RAM en grupos de medicamentos, o la implantación de un Discusión 173 sistema de calidad en la oficina de farmacia, son un ejemplo de cómo el compromiso con la actividad ayuda a adquirir el hábito de hacer registros y, en algunos casos, de comunicar los eventos detectados. En cuanto al paciente, para facilitar la comunicación de datos por su parte, es decir, su colaboración, sería necesario disponer de herramientas de ayuda para informar adecuadamente al mismo acerca del Sistema de Notificación, además de que el farmacéutico mejore en habilidades de comunicación con el paciente. El Programa de Consulta y Dispensación Activa del Colegio de Navarra, parece ser un estímulo para registrar los PRMs, entre ellos las RAM, y comunicarlas a dicho Programa. Sin embargo, a pesar de recomendar desde ahí la notificación con tarjeta amarilla de las sospechas de RAM comunicadas al Programa, son pocas las que llegan al Centro de Farmacovigilancia. Finalmente, una buena comunicación entre médico y farmacéutico, lógicamente sería de ayuda a la hora de consultar datos del paciente, dudas acerca de la posible relación medicamento-reacción, etc. Desgraciadamente, la relación entre ambos profesionales no suele ser de estas características. En resumen, esta parte del trabajo de tipo cualitativo, profundiza en los factores intrínsecos y extrínsecos que constituyen barreras y facilitadores en la notificación de sospechas de RAM por parte de los farmacéuticos comunitarios de la Comunidad Foral de Navarra. Coincidiendo con los resultados obtenidos en la parte cuantitativa de esta investigación(99), el conocimiento inadecuado con relación a la notificación de sospechas de RAM, así como la escasa motivación del farmacéutico para notificar, se identifican como las barreras más importantes. Por el contrario, la formación y la concienciación del farmacéutico con relación a la notificación de sospechas de RAM, se muestran como los mayores facilitadores. Así, la realización de actividades dirigidas a mejorar el conocimiento y la motivación del farmacéutico con relación a la notificación de sospechas de RAM, podría repercutir en una mayor participación de este colectivo profesional en el Sistema de Notificación. Las limitaciones de este estudio son las propias de la metodología cualitativa, entre las que está la imposibilidad de generalizar los resultados obtenidos a la población general(105). Probablemente un mayor número de participantes habría aportado mayor validez al estudio. No obstante, la reiteración de opiniones y actitudes a lo Discusión 174 largo de los diferentes grupos, el llamado fenómeno de saturación, refleja la no necesidad de tomar un mayor número de grupos. Por otra parte, la elevada coincidencia con los resultados obtenidos anteriormente aporta validez a esta parte de la investigación realizada con grupos focales. 2. IMPLEMENTACIÓN Y EVALUACIÓN DE UNA ESTRATEGIA DE MEJORA 2.1. Curso-taller de utilización de la tarjeta amarilla El número de asistentes a las sesiones celebradas fue más bien escaso (n=27), representando únicamente alrededor del 2,8% de farmacéuticos de Navarra. A pesar de la gran demanda de formación dirigida a la notificación de sospechas de RAM, percibida en el análisis anterior, la escasa asistencia al curso-taller ofertado refleja un bajo interés por la farmacovigilancia en general, y la notificación en particular. Datos socio-demográficos de los asistentes Aunque los asistentes eran de edades variadas, más de la mitad eran jóvenes, ya que se encontraban en el rango de 25 a 34 años, y por lo tanto, con una experiencia profesional también baja, de entre 0 y 9 años. Estos datos muestran un mayor interés por la formación y/o la farmacovigilancia por parte de aquellos farmacéuticos más jóvenes y con menor experiencia profesional. La categoría laboral de los asistentes, con mayor predominio de titulares frente a adjuntos (62,5% de titulares y 37,5% de adjuntos), prácticamente refleja la proporción real de farmacéuticos en cada categoría (65% de titulares y 35% de adjuntos). No es así en el caso de la relación hombres/mujeres, ya que en el curso hubo una menor representación masculina. Cuestionarios de evaluación de la actividad formativa La tasa de respuesta a los cuestionarios entregados durante las sesiones, satisfacción y conocimiento, no fue del 100% debido probablemente a que algunos tuvieron que marcharse rápidamente y no habrían podido responder a los mismos al finalizar la sesión, y a que se excluyeron aquellos cuestionarios cuya Discusión 175 cumplimentación no fue completa debido a que algunos asistentes no habrían dado la vuelta al documento. En cuanto al cuestionario de transferencia, su tasa de respuesta resultó ser menor a la de los anteriores ya que no fue administrado de forma personal. A pesar de ello, la tasa de respuesta resulta satisfactoria puesto que recoge la respuesta de, al menos, el 50% de los asistentes al curso. Cuestionario de Satisfacción En general, los asistentes mostraron una elevada satisfacción con el curso-taller impartido, dado que la puntuación otorgada para la totalidad de ítems es igual o superior a 7 puntos, de mediana, sobre 10. Las cuestiones que fueron valoradas con una menor puntuación (7 puntos de mediana), dentro del conjunto de ítems contemplados, corresponde a “el contenido del curso ha satisfecho mis necesidades de formación” y “el contenido teórico del curso me ha parecido adecuado”. Este dato podría estar indicando la inadecuación del contenido de la sesión a las necesidades de los farmacéuticos y por lo tanto, la existencia de necesidades de formación que no fueron cubiertas con el curso impartido. Sin embargo, una puntuación de 7 puntos, no deja de ser una valoración positiva sobre la cuestión. Por otra parte, el contenido del curso no era algo estático, sino que los asistentes lo iban orientando, a lo largo de la sesión, hacia sus necesidades de formación por medio de sus intervenciones. En cuanto al ítem mejor valorado, con una mediana de 9 puntos, se refiere al “dominio/conocimiento de la materia” de uno de los ponentes del curso-taller, el cuál efectivamente corresponde al experto en el tema en cuestión, dado que su actividad laboral se sitúa en el Centro de Farmacovigilancia de Navarra. No obstante, al comparar las puntuaciones medianas de los ponentes con relación a este ítem (9 frente a 8,50), la diferencia no resulta ser estadísticamente significativa. Por el contrario, se observa una diferencia en las puntuaciones obtenidas por ambos ponentes en cuanto a la capacidad de transmisión y exposición de la materia, siendo mejor valorado este ítem en el segundo ponente (p<0,05). Esta diferencia, aunque de pequeña magnitud (7,50 frente a 8), refleja también la experiencia docente del mismo, cuya actividad laboral se enmarca en la Universidad. Discusión 176 Cuestionario de Conocimientos Por medio de la valoración de los conocimientos antes y después del curso, podemos evaluar la utilidad de la formación en cuanto a conocimiento se refiere. La puntuación total obtenida después de la sesión, de 2,5 puntos de diferencia (de mediana) con la de antes de la sesión, resultó ser significativa (p=0,001), lo cual es indicativo del incremento de conocimiento de los asistentes con la sesión impartida, y en consecuencia, de la adecuada transmisión de estos conocimientos por parte de los ponentes. Asimismo, el incremento de conocimiento en cada una de las secciones que conformaban el cuestionario (afirmaciones y preguntas básicas) también se muestra al obtener diferencias estadísticamente significativas (p=0,001) tras aplicar los correspondientes test estadísticos. Al analizar con más detalle cada afirmación o pregunta, se observó en qué aspectos se produjo mayor cambio en cuanto a conocimiento se refiere. La mayoría de las afirmaciones (8 de 11) obtuvieron un porcentaje de respuesta correcta superior en el post-test que en el pre-test. Únicamente en 3 de ellas no se dio este cambio positivo, de las cuáles 2 permanecieron con igual porcentaje y 1 sufrió un ligero descenso. Las afirmaciones que mostraron diferencias estadísticamente significativas antes y después, fueron las siguientes: • Afirmación 3: “Se ha estimado que las RAMs están entre las 6 primeras causas de mortalidad en los EE.UU.” (Respuesta: verdadero) • Afirmación 7: “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente.” (Respuesta: falso) • Afirmación 10: “La Tarjeta Amarilla no debe enviarse en caso de no cumplimentar todos los campos contenidos en ella.” (Respuesta: falso) La primera de ellas, muestra el impacto de las RAM en términos de mortalidad. Así, el conocimiento de este dato debería conducir a una mayor concienciación con respecto a la repercusión de las RAM sobre la salud pública y, como consecuencia, a la notificación de las sospechas detectadas. Discusión 177 La segunda, corresponde a una cuestión de la que generalmente no se tiene un conocimiento adecuado y que fue identificada como una creencia errónea en el análisis previo al curso. Pensar de forma errónea que “Para notificar una RAM, hay que estar seguro de que existe relación causal entre un medicamento y la reacción observada en el paciente”, reduce la notificación únicamente a las reacciones identificadas como RAM, lo cual ocurre en muy escasas ocasiones a no ser que ya se encuentren identificadas y, como consecuencia, las sospechas no serían notificadas. El cambio en esta creencia, detectado tras la asistencia al curso, constituye un resultado muy positivo dado que resulta indicativo de la eliminación, en la mayoría de los asistentes, de una de las barreras identificadas previamente y que mostró ser un predictor independiente de la notificación(99). Finalmente, la tercera, “La Tarjeta Amarilla no debe enviarse en caso de no cumplimentar todos los campos contenidos en ella”, alcanza el 100% de respuestas correctas tras la asistencia al curso, siendo la diferencia antes y después superior respecto a las afirmaciones anteriormente citadas (38,9%; 100%). El hecho de no disponer de la totalidad de datos solicitados en la tarjeta amarilla conduce a muchos farmacéuticos a no notificar la sospecha o la RAM detectada, según se detectó en las sesiones de grupos focales. El cambio positivo observado con relación a esta afirmación, al igual que en el caso anterior, eliminaría uno de los motivos o barreras que obstaculizan la notificación, contribuyendo así a facilitar la notificación de estos farmacéuticos. Las preguntas básicas, en general, fueron respondidas de forma correcta por la mayoría de los asistentes. La puntuación, antes y después, prácticamente no experimentó cambios para 3 de las 4 preguntas, siendo la mediana de 1 punto, que es la puntuación máxima posible. Únicamente en una de ellas, que hace referencia a cómo notificar, la mediana de puntuación resultó ser superior tras el curso-taller, siendo las diferencias estadísticamente significativas (p=0,001). Resaltar que el desconocimiento respecto a las diferentes vías existentes para notificar, observado en el análisis mediante la encuesta y los grupos focales, mejora tras la realización de la actividad formativa. La mejoría observada en cuanto al conocimiento básico para notificar, constituye un resultado valorado muy positivamente dado que una mayor puntuación en estas Discusión 178 preguntas fue identificado como un predictor independiente de la notificación en el análisis previo (99). Cuestionario de Transferencia El análisis de los cuestionarios de transferencia analizados, nos permite valorar la utilidad del curso-taller, en términos de cambio de actitud y de comportamiento, al poner en práctica los conocimientos adquiridos durante el curso-taller. Las afirmaciones que más destacan por obtener un mayor grado de acuerdo entre los respondedores (“Ahora notificaría con tarjeta amarilla electrónica”, “Estoy más alerta ante situaciones que pudieran estar asociadas a RAMs”, “He adquirido unas pautas para notificar las RAMs”, “Ahora soy más consciente que antes de la importancia de mi contribución al conocimiento de la seguridad de los medicamentos, a través de la notificación con tarjeta amarilla”, “Soy más consciente de mi responsabilidad profesional ante la notificación de RAMs”), muestran la repercusión positiva de los conocimientos adquiridos durante el curso-taller, sobre los farmacéuticos asistentes. De acuerdo con el resultado obtenido, el curso-taller ha provocado ciertos cambios de actitud dado que se ha incrementado, entre los farmacéuticos, la predisposición para detectar sospechas y para notificarlas de forma electrónica, así como la concienciación acerca de la importancia de la contribución individual y de su responsabilidad profesional como farmacéuticos en este ámbito. Por otra parte, ha permitido la adopción de una serie de pautas a seguir en caso de detectar una sospecha. Aunque en menor medida, ya que no hubo un acuerdo tan generalizado, también parece que se ha conseguido un cambio de comportamiento con relación a la detección de sospechas de RAM y a la comunicación con el paciente en casos de sospecha. Sin embargo, no se ha observado un cambio de actitud con relación a la disponibilidad de tarjetas amarillas en el centro de trabajo, lo cual no es de extrañar ya que la intención de los farmacéuticos es notificar con tarjeta amarilla electrónica, por lo tanto, no tendría demasiada importancia. Discusión 179 La positiva influencia de un curso de formación en farmacovigilancia en la mejora de actitudes y conocimientos, se muestra igualmente en estudios publicados con anterioridad(106). No obstante, a pesar de haber modificado tanto actitudes como comportamientos que, en principio, deberían facilitan la notificación, el curso-taller no parece haber incrementado la actividad notificadora por parte de los farmacéuticos asistentes, al menos en los primeros 6 meses posteriores al curso, según los indican las respuestas a este último cuestionario. 2.2. Lista de distribución on-line de farmacovigilancia El número de farmacéuticos comunitarios inscritos en la lista de distribución (n=51), que representa alrededor del 5,3% de farmacéuticos comunitarios de Navarra, a pesar de ser superior al número de asistentes al curso-taller no deja de ser una cifra baja. Valoración de la actividad de la lista Los indicadores de actividad ponen de manifiesto el escaso flujo de mensajes en la lista, así como la existencia de un reducido número de personas que envían mensajes. Esta aparente escasa participación constituye uno de los principales problemas de este tipo de actividades, en las que normalmente existe una pequeña minoría activa. Algunos autores sostienen que sólo alrededor del 8-9% de usuarios participa de forma activa en las listas(107), frente a una mayoría que participa leyendo los mensajes. No obstante, la escasa participación de los miembros de la lista no resulta indicativo de un bajo interés o de una baja utilidad para los usuarios de la misma. Se observa que los mensajes distribuidos a través de la lista son de procedencias muy diversas. Sin embargo, la administración/coordinación de la lista constituye el ámbito desde el que se han enviado mayor número de mensajes. A continuación, destacan los farmacéuticos de oficina de farmacia, cuya participación se ha realizado de forma intermitente a lo largo de los meses. Discusión 180 En cuanto al contenido de los mensajes distribuidos, destacan los comentarios relacionados con la seguridad de medicamentos, con un pico en el mes de abril de 2008. Valoración de la satisfacción y utilidad de la lista por los usuarios. Cuestionario de Valoración. La tasa de respuesta al cuestionario (35,3%) se considera baja aunque suficiente para conocer a grandes rasgos la opinión de los usuarios de la lista con relación a su satisfacción y a la utilidad de la misma. Los resultados obtenidos a partir de estos cuestionarios reflejan un grado de satisfacción con la actividad claramente alto, tanto de forma general como de forma específica respecto a los diferentes mensajes distribuidos a través de la lista. En cuanto a la utilidad de esta actividad, en general, se observa una mayor variabilidad de respuestas especialmente con relación a los ítems: “Desde que comenzó la lista, detecto un mayor número de RAM desde mi puesto de trabajo” y “Desde que comenzó la lista, notifico un mayor número de RAM desde mi puesto de trabajo” cuyas puntuaciones medias resultan ser las más bajas. En concreto, la menor puntuación media es la correspondiente a la de notificar un mayor número de RAM desde el comienzo de la lista. Sin embargo, es en este ítem en el que existe una mayor variabilidad de respuesta dado que hay farmacéuticos que declaran que no notifican más frente a otros que sí. Por otra parte, se observa un elevado grado de acuerdo con relación a los siguientes ítems: “Me ayuda a estar más alerta ante situaciones que pudieran estar asociadas a RAM” “Me sirve para tener más presente que debo notificar las sospechas de RAM” “Desde que comenzó la lista, hago más preguntas a los pacientes para determinar si un síntoma pudiera ser una RAM” Destaca el alto grado de acuerdo obtenido con el ítem “Me sirve para tener más presente que debo notificar las sospechas de RAM”, cuya puntuación mediana es la máxima obtenida, lo cuál pone de manifiesto la utilidad de los recordatorios enviados periódicamente desde la administración de la lista. Discusión 181 En definitiva, estos resultados muestran la utilidad de la lista en cuanto a mantener en los farmacéuticos una actitud de búsqueda de posibles RAM y cierto grado de concienciación con relación a la detección y notificación, que en algunos casos se traduce en una mayor detección y, aunque en menor medida, también en una mayor notificación de sospechas de RAM. 2.3. Impacto del curso-taller y la lista de distribución sobre la notificación de sospechas de RAM de farmacia comunitaria Dada la baja proporción de farmacéuticos participantes en las actividades propuestas, respecto al total de farmacéuticos comunitarios de Navarra, es lógico que la repercusión de las mismas sobre las notificaciones de farmacia comunitaria, medida tanto en porcentaje de notificaciones sobre el total como en tasa de notificación, prácticamente no sea apreciable de forma global. No obstante, al comparar los dos grupos de farmacéuticos, participantes y no participantes, con respecto a las notificaciones enviadas a lo largo de los 12 meses siguientes a la implementación de las actividades, se observa una mayor actividad notificadora por parte del grupo de participantes. Además, este efecto resulta superior durante los primeros 4 meses. Estos hallazgos concuerdan con estudios similares según los cuales la implementación de una estrategia formativa en farmacovigilancia produce un incremento de la tasa y, en algunos casos, también de la calidad de las notificaciones de los profesionales sanitarios(47,68,77-82), siendo el efecto de este tipo de intervenciones limitado en el tiempo(80-82). En cuanto a la tasa de notificación, superior en el grupo de participantes frente al de no participantes, habría que tener en cuenta que la tasa de notificación del grupo de participantes ya era mayor, respecto al otro grupo, en el año anterior (2006). Por tanto, los farmacéuticos que participaron en las actividades, como es lógico, tendrían una mayor motivación para notificar, que los del grupo de no participantes, ya que algunos de ellos ya notificaban antes de la implementación de las actividades. No obstante, la tasa de notificación se incrementó en un 33,5% en el grupo de participantes. De las diferentes modalidades de participación en las actividades (curso, lista, curso y lista), únicamente la participación en la lista de distribución de forma aislada Discusión 182 muestra una asociación estadísticamente significativa con el hecho de notificar en los 12 meses de seguimiento. El efecto de la lista sobre la notificación resulta especialmente importante en los primeros 4 meses y sigue manteniendo cierto efecto positivo, aunque de menor magnitud, en los últimos 4 meses. Estos datos parecen indicar que la lista, al ser una actividad que se realiza de forma continuada, podría tener un efecto más prolongado en el tiempo que otro tipo de actividad más puntual como es un curso de formación. En cambio, a pesar de que el curso de formación, con o sin lista, parece influir positivamente sobre la notificación, especialmente durante los primeros meses, no se detecta una asociación estadísticamente significativa en el conjunto de los 12 meses. Por otra parte, parece que las actividades han contribuido a incrementar la incidencia de nuevos notificadores, observándose también un efecto mayor en los primeros 4 meses. En concreto la participación en la lista de distribución, de forma aislada, es la modalidad que muestra un mayor efecto sobre la aparición de nuevos notificadores. El hecho de que las actividades incrementen la incidencia de nuevos notificadores resulta de gran importancia puesto que el haber notificado previamente parece influir positivamente sobre la notificación. Así, los farmacéuticos que tras la participación en las actividades se han convertido en nuevos notificadores, es probable que notifiquen más fácilmente en un futuro próximo. En cuanto a las oficinas de farmacia desde las que se envían notificaciones, se ha incrementado el porcentaje de las mismas respecto al año anterior, modificando la tendencia decreciente observada en los últimos años, posiblemente debido a la participación de algunos farmacéuticos en las actividades propuestas. Por tanto, parece que las actividades implementadas, han conseguido incrementar la actividad notificadora de los farmacéuticos participantes, así como implicar a nuevos farmacéuticos y a un mayor número de oficinas de farmacia en el Sistema de notificación de sospechas de RAM. Como limitaciones habría que considerar, por un lado, el escaso número de farmacéuticos participantes en las actividades ofertadas, lo cual puede haber conducido a una baja potencia estadística dificultando la correcta detección de asociaciones. Por otro lado, puesto que la elección de participar en alguna de las Discusión 183 actividades parte de los propios farmacéuticos, no se garantiza la adecuada distribución de los factores que pueden influir en la notificación de sospechas de RAM, en los diferentes grupos. Por tanto, no podemos atribuir el efecto encontrado únicamente a la participación en las actividades desarrolladas. Finalmente, a pesar de estas limitaciones, parece que las iniciativas implementadas han tenido un efecto positivo en aquellos farmacéuticos participantes en las mismas, especialmente en el caso de la lista de distribución para la cual el efecto observado, en general, ha sido mayor. VI. CONCLUSIONES Conclusiones 187 1. El análisis inicial de las notificaciones de sospechas de reacciones adversas a medicamentos (RAM), recibidas en el Centro de Farmacovigilancia de Navarra, pone de manifiesto una baja participación por parte del farmacéutico comunitario. Únicamente 20 de los 802 farmacéuticos comunitarios en activo, al comienzo del estudio, habían enviado 2 o más notificaciones durante los 3 años previos al mismo. No obstante, la práctica totalidad de los participantes en el estudio había detectado en alguna ocasión una sospecha de RAM. 2. El estudio de los factores que influyen en la notificación del farmacéutico comunitario, realizado en el estudio de casos y controles mediante la encuesta, permite concluir lo siguiente: 2.1. La edad y experiencia profesional del farmacéutico, así como la participación en actividades formativas en detección y resolución de problemas relacionados con medicamentos, se muestran como factores asociados positivamente a la notificación de sospechas de RAM. Otros factores asociados fueron: considerar la posibilidad de la existencia de RAM, tener el conocimiento básico para notificar y saber que no hace falta tener seguridad acerca de la relación causal entre un medicamento y la reacción observada en el paciente. De ellos, únicamente los 2 últimos factores se identificaron como predictores independientes tras realizar un análisis multivariante. Por tanto, destaca la gran importancia del conocimiento como factor influyente en la notificación. 2.2. Los motivos para no notificar sospechas de RAM, declarados por los farmacéuticos, se refieren a la consideración de RAM como leves o conocidas, a la “inseguridad” en la relación causal medicamentoreacción adversa y al “letargo o dejadez”. 3. La información emergente de las sesiones de grupos focales, realizadas como complemento a la encuesta, confirma que una de las principales barreras en la notificación de sospechas de RAM es el conocimiento insuficiente o inadecuado relacionado con la notificación. Además, se identifican como barreras la escasa motivación del farmacéutico, la falta de Conclusiones 188 datos del paciente, el elevado volumen de trabajo en la oficina de farmacia, y el carácter voluntario del sistema de notificación. Entre los facilitadores destacan la formación específica en materia de farmacovigilancia, la concienciación en este ámbito, así como la disponibilidad de herramientas de ayuda y el desarrollo de habilidades de comunicación para obtener la información necesaria del paciente. 4. La estrategia de mejora implementada consistió en la realización de un cursotaller de utilización de la tarjeta amarilla y de una campaña de sensibilización realizada a través de una lista de distribución on-line. Únicamente el 6% de los farmacéuticos comunitarios de Navarra participó en estas actividades. De ellos, el 14% participó en el curso-taller, el 54% en la lista de distribución, y el 32% participó en ambas actividades. 5. La valoración del curso-taller en términos de reacción, aprendizaje y conducta permite extraer las siguientes conclusiones: 5.1. Los asistentes muestran una elevada satisfacción con el curso-taller impartido, dado que la puntuación otorgada a la totalidad de ítems, en el cuestionario de satisfacción, es igual o superior a 7 puntos sobre 10. 5.2. El conocimiento relacionado con la notificación aumenta significativamente tras la realización del curso-taller. Esta actividad proporciona un mayor conocimiento acerca de la importancia de las RAM y del modo de comunicarlas. Además permite corregir falsas creencias que inciden en la baja notificación. 5.3. Transcurridos 6 meses de la realización del curso-taller, los farmacéuticos manifiestan una mejor actitud para la detección de sospechas de RAM y una mayor concienciación acerca de su contribución y de su responsabilidad en farmacovigilancia. Además, afirman haber adquirido habilidades para notificar las sospechas de RAM y una preferencia por la utilización de la tarjeta amarilla electrónica. Conclusiones 189 6. Los participantes en la lista de distribución manifiestan una elevada satisfacción con esta actividad. Reconocen la utilidad de la misma para mantenerse alerta ante posibles RAM y una mejor disposición para notificarlas. 7. El impacto de la estrategia de mejora sobre la notificación de sospechas de RAM se reflejó en un incremento de la tasa de notificación del 33,5% en el grupo de participantes respecto al año anterior. Igualmente se observa una mayor incidencia en la aparición de nuevos notificadores y un mayor porcentaje de farmacias notificadoras, lo cuál puede atribuirse a la participación en las actividades propuestas. 8. La lista de distribución se muestra como la actividad con mayor efecto sobre la notificación en los 12 meses siguientes, especialmente en los primeros 4 meses. El curso-taller, en cambio, muestra una influencia de menor magnitud y más limitada en el tiempo. No obstante, ambas actividades están asociadas a la aparición de nuevos notificadores en los 12 meses siguientes. 9. En resumen, este estudio documenta los factores que facilitan y dificultan la notificación de sospechas de RAM por el farmacéutico comunitario. Pone de manifiesto la importancia y la necesidad de una adecuada formación en farmacovigilancia, tanto en el pre-grado como en el post-grado. Muestra, además, el efecto positivo de la formación en materia de farmacovigilancia sobre el conocimiento, la actitud y el comportamiento del farmacéutico con relación a la notificación de sospechas de RAM. La concienciación del farmacéutico acerca de la importancia de su contribución en el sistema, se muestra también como un aspecto relevante para la incorporación de la notificación de sospechas de RAM a su práctica diaria. La realización de actividades de sensibilización dirigidas al farmacéutico resultan de ayuda para tomar conciencia y recordar su responsabilidad como notificador. VII. BIBLIOGRAFIA Bibliografía 193 1. McKendrick JG, Coats J, Newman D. Report of the action of anaesthetics. BMJ. 1880;2:957 2. Ballentine C. Taste of Raspberries, Taste of Death. The 1937 Elixir Sulfanilamide Incident. FDA consumer magazine, June 1981 [online]. Disponible en: http://www.fda.gov/oc/history/elixir.html [consulta: 4 diciembre 2006] 3. Laporte JR, Tognoni G. Principios de epidemiología del medicamento. 2ª edición. Barcelona: Masson-Salvat; 1993 4. McBride WG. Thalidomide and congenital abnormalities. Lancet. 1961;2:1358 5. Lenz W. Thalidomide and congenital abnormalities. Lancet. 1962;1:45 6. Organización Mundial de la Salud. The importance of pharmacovigilance: safety monitoring of medicinal products [online]. Ginebra: Organización Mundial de la Salud; 2002. Disponible en: http://whqlibdoc.who.int/hq/2002/a75646.pdf [consulta: 23 octubre 2006] 7. Real Decreto por el que se regula la farmacovigilancia de medicamentos de uso humano. RD. N.º 1344/2007 (11 octubre 2007). Boletín Oficial del Estado núm.262 de 1 de noviembre de 2007 [online]. Disponible en: http://www.boe.es/boe/dias/2007/11/01/pdfs/A44631-44640.pdf [consulta: 5 noviembre 2007] 8. Rawlins MD, Thompson JW. Mechanisms of adverse drug reactions. En: Davies DM, editores. Textbook of adverse drug reactions. Oxford: Oxford University Press; 1991. p.18-45 9. Grahame-Smith DG, Aronson JK. Adverse drug reactions. In: The Oxford textbook of clinical pharmacology and drug therapy. Oxford: Oxford University Press; 1984. p.132-57 10. Royer RJ. Mechanism of action of adverse drug reactions: an overview. Pharmacoepidemiol Drug Saf. 1997;6(Suppl 3):S43-S50 11. Hartigan-Go KY, Wong JQ. Inclusion of therapeutic failures as adverse drug reactions. En: Aronson JK, editores. Side effects of drugs, annual 23. A worldwide yearly survey of new data and trends in adverse drug reactions. Amsterdam: Elsevier; 2000. p.27-33 Bibliografía 194 12. Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalised patients. JAMA. 1998;279:1200-5 13. Beijer HJM, Blaey CJ. Hospitalisations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci. 2002;24:46-54 14. Pirmohamed M, James S, Meakin S, Green C, Scott AK, Walley TJ, Farrar K, Park BK, Breckenridge AM. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ. 2004;329:15-9 15. Organización Mundial de la Salud. Perspectivas políticas de la OMS sobre medicamentos. La farmacovigilancia: garantía de seguridad en el uso de los medicamentos [online]. Ginebra: Organización Mundial de la Salud; 2004. Disponible en: http://www.who-umc.org/graphics/7127.pdf [consulta: 23 octubre 2006] 16. Organización Mundial de la Salud. Seguridad de los Medicamentos. Nota descriptiva. Organización Mundial de la Salud. 2005 Sept; Núm. 293 17. Madurga M, De Abajo FJ. Farmacovigilancia: análisis y control de los riesgos de los medicamentos. Auladelafarmacia. 2004;1:10-28 18. Organización Mundial de la Salud. Handbook of resolutions and decisions of the World Health Assembly and Executive Board, Vol 11948-1972. Ginebra: Organización Mundial de la Salud, 1973. WHA16.36 Clinical and pharmacological Evaluation of Drugs 19. Organización Mundial de la Salud. The WHO Collaborating Centre for International Drug Monitoring [sitio web]. Uppsala, Centro Colaborador de la OMS para la Vigilancia Farmacéutica Internacional. Disponible en: http://www.who-umc.org/ [consulta: 20 mayo 2008] 20. Organización Mundial de la Salud. Safety Information. WHO international drug monitoring: cerivastatin and gemfibrozil [online]. WHO Drug Information. 2002;16(1):8-11. Disponible en: http://www.who.int/druginformation/vol16num1_2002/vol16-1.pdf [consulta: 23 octubre 2007] Bibliografía 195 21. Agencia española de medicamentos y productos sanitarios. Comunicación sobre riesgos de medicamentos para profesionales sanitarios. Suspensión de comercialización de veraliprida (Agreal) [online]. Ref: 2005/11. 20 mayo de 2005. Disponible en: http://www.agemed.es/actividad/alertas/docs/NI_200511.pdf [consulta: 23 octubre 2007] 22. Agencia europea para la evaluación de medicamentos. European medicines agency recommends withdrawal of medicinal products containing veralipride [online]. Press release. London, 23 July 2007. Doc. Ref. EMEA/299873/2007. Disponible en: http://www.emea.europa.eu/pdfs/general/direct/pr/29987307en.pdf [consulta: 23 octubre 2007] 23. Agencia europea para la evaluación de medicamentos. Questions and answers on the recommendation to withdraw the marketing authorisation of veralipride [online]. London, 23 July 2007. Doc. Ref. EMEA/299468/2007. Disponible en: http://www.emea.europa.eu/pdfs/human/opinion/29946807en.pdf [consulta: 23 octubre 2007] 24. Orden de 12 de noviembre de 1973 sobre farmacovigilancia. Boletín Oficial del Estado núm.287 de 30 de noviembre de 1973 [online]. Disponible en: http://www.boe.es/boe/dias/1973/11/30/pdfs/A23190-23191.pdf [consulta: 5 noviembre 2007] 25. De Abajo FJ, Montero D, Madurga M, Palop R. Análisis y gestión de riesgos en farmacovigilancia. Organización de la farmacovigilancia en España. En: García AG, Gandía L, editores. El ensayo clínico en España. Madrid: Farmaindustria; 2001. p.191-216 26. Rodríguez JM, Aguirre C, García M, Palop R. Farmacovigilancia. En: Bonal J, Domínguez-Gil A, Cinta M, Napal V, Valverde E, editores. Farmacia hospitalaria. 3ª ed. [online]. Doyma; 2002. p. 575-98. Disponible en: http://sefh.interguias.com/libros/tomo1/Tomo1_Cap2-10.pdf octubre 2006] [consulta: 23 Bibliografía 196 27. Real Decreto por el que se regula la farmacovigilancia de medicamentos de uso humano. RD. N.º 711/2002 (19 julio 2002). Boletín Oficial del Estado núm.173 de 20 de julio de 2002 [online]. Disponible en: http://www.boe.es/boe/dias/2002-07-20/pdfs/A26876-26882.pdf [consulta: 23 octubre 2006] 28. Agencia española de medicamentos y productos sanitarios. El Sistema Español de Farmacovigilancia de medicamentos de uso humano: datos del programa de notificación espontánea 2005 y 2006 [online]. Disponible en: http://www.agemed.es/actividad/documentos/infoInteres/home.htm [consulta: 3 julio 2007] 29. Ley de garantías y uso racional de los medicamentos y productos sanitarios. L. N.º 29/2006 (26 julio 2006). Boletín Oficial del Estado núm.178 de 27 de julio de 2006 [online]. Disponible en: http://www.boe.es/boe/dias/2006/07/27/pdfs/A28122-28165.pdf [consulta: 10 octubre 2006] 30. Organización Mundial de la Salud. Safety of medicines. A guide to detecting and reporting adverse drug reactions. Why professionals need to take action [online]. Ginebra: Organización Mundial de la Salud; 2002. Disponible en: http://whqlibdoc.who.int/hq/2002/WHO_EDM_QSM_2002.2.pdf [consulta: 20 abril 2006] 31. Consejo General de Colegios Oficiales de Farmacéuticos. Estadísticas Colegiados 2006 [online]. Disponible en: www.portalfarma.com/pfarma/taxonomia/general/gp000016.nsf/voDocumento s/46DCBC7AAE516EADC/ [consulta: 7 noviembre 2007] 32. Ley General de Sanidad. L. N.º 14/1986 (25 abril 1986). Boletín Oficial del Estado núm.101 de 29 de abril de 1986 [online]. Disponible en: http://www.boe.es/boe/dias/1986/04/29/pdfs/A15207-15224.pdf [consulta: 5 noviembre 2007] 33. Ley del medicamento. L.N.º 25/1990 (20 diciembre 1990). Boletín Oficial del Estado núm.306 de 22 de diciembre de 1990 [online]. Disponible en: http://www.agemed.es/actividad/legislacion/espana/docs/RCL_1990_26432006-3.pdf [consulta: 5 noviembre 2007] Bibliografía 197 34. Sinclair HK, Bond CM, Hannaford PC. Pharmacovigilance of over-the-counter products based in community pharmacy: a feasible option? Pharmacoepidemiol Drug Saf. 1999;8:479-91 35. Barnes J. Pharmacovigilance of herbal medicines: a UK perspective. Drug Saf. 2003;26:829-51 36. Navarro MC, García M, Higueras MI, Cuchí T, Bartolomé M. Programa de farmacovigilancia en oficinas de farmacia: estudio de utilización de Moxifloxacino. Pharm Care Esp. 2004;6:22-7 37. Roberts PI, Wolfson DJ, Booth TG. The role of pharmacists in adverse drug reaction reporting. Drug Saf. 1994;11:7-11 38. Ahmad SR, Freiman JP, Graham DJ, Nelson RC. Quality of adverse drug experience reports submitted by pharmacists and physicians to the FDA. Pharmacoepidemiol Drug Saf. 1996;5:1-7 39. Gedde-Dahl A, Harg P, Stenberg-Nilsen H, Buajordet M, Granas AG, Horn AM. Characteristics and quality of adverse drug reaction reports by pharmacists in Norway. Pharmacoepidemiol Drug Saf. 2007;16(9):999-1005 40. Organización Mundial de la Salud. Vigilancia de la seguridad de los medicamentos. Guía para la instalación y puesta en funcionamiento de un Centro de Farmacovigilancia [online]. Ginebra: Organización Mundial de la Salud; 2001. Disponible en: http://www.who-umc.org/graphics/4808.pdf [consulta: 30 octubre 2007] 41. Rawlins MD. Pharmacovigilance: paradise lost, regained or postponed? J Royal Coll Physicians. 1995;29:41-9 42. Hazell L, Shakir SA. Under-reporting of adverse drug reactions: a systematic review. Drug Saf. 2006;29(5):385-96 43. Madurga M, De Abajo FJ, Martín Serrano, G, Montero D. El Sistema Español de Farmacovigilancia. En: Grupo IFAS, editores. Nuevas perspectivas de la farmacovigilancia en España y en la Unión Europea. Madrid: Jarpyo Editores; 1998. p.37-61 Bibliografía 198 44. Inman WHW. Assessment of drug safety problems. In: Gent M, Shigmatsu I, editors. Epidemiological issues in reported drug-induced illnesses. Hamilton (Ontario): McMaster University Library Press; 1976:17-24 45. Leiper JM, Lawson DH. Why do doctors not report adverse drug reactions? Neth J Med. 1985;28(12):546-50 46. Rogers AS, Israel E, Smith CR, Levine D, McBean AM, Valente C, Faich GA. Physician knowledge, attitudes and behaviour to reporting adverse drug events. Arch Intern Med. 1988;148:1596-600 47. Scott HD, Thacher-Renshaw A, Rosenbaum SE, Waters WJ, Green M, Andrews LG, Faich GA. Physician reporting of adverse drug reactions. Results of the Rhode Island Adverse Drug Reaction Reporting Project. JAMA. 1990;263:1785-8 48. Bateman DN, Sanders GLS, Rawlins MD. Attitudes to adverse drug reaction reporting in the Northern Region. Br J Clin Pharmacol. 1992;34:421-6 49. Belton KJ, Lewis SC, Payne S, Rawlins MD, Wood SM. Attitudinal survey of adverse drug reaction reporting by medical practitioners in the United Kingdom. Br J Clin Pharmacol. 1995;39:223-6 50. Generali JA, Danish MA, Rosenbaum SE. Knowledge of and attitudes about adverse drug reaction reporting among Rhode Island pharmacists. Ann Pharmacother. 1995;29(4):365-9 51. Belton KJ. Attitude survey of adverse drug-reaction reporting by health care professionals across the European Union. Eur J Clin Pharmacol. 1997;52:4237 52. Serrano Cózar G, Esteban Calvo C, Gijón Porta JA, Vaquero Turiño I, Vázquez Burgos MI, Ibáñez Ruiz C, Frias Iniesta J. Reacciones adversas a medicamentos y programa de notificación espontánea: una encuesta de opinión a médicos de atención primaria. Aten Primaria. 1997;87:780–4 53. Eland IA, Belton KJ, Van Grootheest AC, Meiners AP, Rawlins MD, Stricker BHCh. Attitudinal survey of voluntary reporting of adverse drug reactions. Br J Clin Pharmacol. 1999;48(4):623-7 Bibliografía 199 54. Figueiras A, Tato F, Fontainas J, Gestal-Otero JJ. Influence of physicians’ attitudes on reporting adverse drug events. Med Care. 1999;37(8):809-14 55. Green CF, Mottram DR, Raval D, Proudlove C, Randall C. Community pharmacists’ attitudes to adverse drug reaction reporting. Int J Pharm Pract. 1999;7:92-9 56. Houghton J, Woods F, Davis S, Coulson R, Routledge PA. Community pharmacist reporting of suspected ADRs: attitudes of community pharmacists and general practitioners in Wales. Pharm J. 1999;263:788-91 57. Sweis D, Wong ICK. A survey on factors that could affect adverse drug reaction reporting according to hospital pharmacists in Great Britain. Drug Saf. 2000;23:165-72 58. Figueiras A, Tato F, Fontainas J, Takkouche B, Gestal-Otero JJ. Physicians’ attitudes towards voluntary reporting of adverse drug events. J Eval Clin Pract. 2001;7(4):347-54 59. Green CF, Mottram DR, Rowe PH, Pirmohamed M. Attitudes and knowledge of hospital pharmacists to adverse drug reaction reporting. Br J Clin Pharmacol. 2001;51(1):81-6 60. Grootheest AC van, Mes K, Jong-van den Berg LTW de. Attitudes of community pharmacists in the Netherlands towards ADR reporting. Int J Pharm Pract. 2002;10:267-72 61. Hasford J, Goettler M, Munter KH, Müller-Oerlinghausen B. Physicians' knowledge and attitudes regarding the spontaneous reporting system for adverse drug reactions. J Clin Epidemiol. 2002;55(9):945-50 62. Herdeiro MT, Figueiras A, Polónia J, Gestal-Otero JJ. Physicians’ attitudes and adverse drug reaction reporting: a case-control study in Portugal. Drug Saf. 2005;28(9):825-33 63. Herdeiro MT, Figueiras A, Polónia J, Gestal-Otero JJ. Influence of pharmacists’ attitudes on adverse drug reaction reporting: a case-control study in Portugal. Drug Saf. 2006;29(4):331-40 Bibliografía 200 64. Aziz Z, Siang TC, Badarudin NS. Reporting of adverse drug reactions: predictors of under-reporting in Malaysia. Pharmacoepidemiol Drug Saf. 2007;16:223-8 65. Granas AG, Buajordet M, Stenberg-Nilsen H, Harg P, Horn AM. Pharmacists’ attitudes towards the reporting of suspected adverse drug reactions in Norway. Pharmacoepidemiol Drug Saf. 2007;16(4):429-34 66. Torelló Iserte J, Castillo Ferrando JR, Laínez MM, García Morillas M, Arias Gonzalez A. Reacciones adversas a medicamentos notificadas por los médicos de atención primaria de Andalucía. Análisis de la infranotificación. Aten Primaria. 1994;13(6):307–11 67. McGettigan P, Feely J. ADR reporting: opinions and attitudes of medical practitioners in Ireland. Pharmacoepidemiol Drug Saf. 1995;4:355-8 68. McGettigan P, Golden J, Conroy RM, Arthur N, Feely J. Reporting of ADR by hospital doctors and the response to intervention. Br J Clin Pharmacol. 1997;44(1):98-100 69. Bäckström M, Mjörndal T, Dahlqvist R, Nordkvist-Olsson T. Attitudes to reporting ADR in northern Sweden. Eur J Clin Pharmacol. 2000;56:729-32 70. Vallano A, Cereza G, Pedròs C, Agustí A, Danés I, Aguilera C, Arnau JM. Obstacles and solutions for spontaneous reporting of adverse drug reactions in the hospital. Br J Clin Pharmacol. 2005;60(6):653-8 71. Herdeiro MT, Polónia J, Gestal-Otero JJ, Figueiras A. Factors that influence spontaneous reporting of adverse drug reactions: a model centralized in the medical professional. J Eval Clin Pract. 2004;10:483-9 72. Report of an Independent Review of Access to the Yellow Card Scheme [online]. London: TSO; 2004. Disponible en: www.mhra.gov.uk/home/groups/commsic/documents/websiteresources/con2015008.pdf [consulta: 22 noviembre 2007] 73. Castel JM, Figueiras A, Pedros C, Laporte JR, Capella D. Stimulating adverse drug reactions reporting: effect of a drug safety bulletin and of including yellow cards in prescription pads. Drug Saf. 2003;26(14):1049-55 Bibliografía 201 74. Wallerstedt SM, Brunlöf G, Johansson ML, Tukukino C and Ny L. Reporting of adverse drug reactions may be influenced by feedback to the reporting doctor. Eur J Clin Pharmacol. 2007;63(5):505-8 75. Bäckström M, Mjörndal T. A small economic inducement to stimulate increased reporting of adverse drug reactions – a way of dealing with an old problem? Eur J Clin Pharmacol. 2006;62:381-5 76. Feely J, Moriarty S, O' Connor P. Stimulating reporting of adverse drug reactions by using a fee. BMJ. 1990;300:22-3 77. Fincham J. A statewide program to stimulate reporting of adverse drug reactions. J Pharm Pract. 1989;2(4):239-44 78. Nazario M, Feliú JF, Rivera GC. Adverse drug reactions: the San Juan Department of Veterans Affairs Medical Center experience. Hosp Pharm. 1994;29(3):244-6, 249-50 79. Clarkson A, Ingleby E, Choonara I, Bryan P, Arlett P. A novel scheme for the reporting of adverse drug reactions. Arch Dis Child. 2001;84:337-9 80. Bracchi RC, Houghton J, Woods FJ, Thomas S, Smail SA, Routledge PA. A distance-learning programme in pharmacovigilance linked to educational credits is associated with improved reporting of suspected adverse drug reactions via the UK yellow card scheme. Br J Clin Pharmacol. 2005;60:221-3 81. Figueiras A, Herdeiro MT, Polonia J, Gestal-Otero JJ. An educational intervention to improve physician reporting of adverse drug reactions. A cluster-randomized controlled trial. JAMA. 2006;296(9):1086-93 82. Herdeiro MT, Polónia J, Gestal-Otero JJ, Figueiras A. Improving the reporting of adverse drug reactions. A cluster-randomized trial among pharmacists in Portugal. Drug Saf. 2008;31(4):335-344 83. Grootheest AC van, Olsson S, Couper M, Jong-van den Berg LTW de. Pharmacists' role in reporting adverse drug reactions in an international perspective. Pharmacoepidemiol Drug Saf. 2004;13: 457-64 84. Grootheest AC van, Puijenbroek EP van, Jong-van den Berg LTW de. Contribution of pharmacists to the reporting of adverse drug reactions. Pharmacoepidemiol Drug Saf. 2002;11(3):205-10 Bibliografía 202 85. Armendáriz E, Godino M, Pérez MP, Ardanaz MP, Viamonte A. Intervenciones farmacéuticas. Programa de Consulta y Dispensación Activa para la Oficina de Farmacia. Pamplona: Colegio Oficial de Farmacéuticos de Navarra; 2007. 86. Morse JM. Approaches to qualitative –quantitative methodological triangulation. Methodology Corner. Nurs Res. 1991;40(2):120-3 87. Blaikie NWH. A critique of the use of triangulation in social research. Qual Quant. 1991;25:115-36 88. Ministerio de Trabajo y Asuntos Sociales. NTP 283: Encuestas: metodología para su utilización [online]. Disponible en: http://www.mtas.es/insht/ntp/ntp_283.htm [consulta: 6 octubre 2005] 89. Morgan DL. The focus group guidebook. Focus group kit, volume 1. Thousand Oaks, CA: Sage Publications; 1998 90. Sanz de las Heras J. Servicio de Listas de Distribución de RedIRIS. RedIRIS, Boletín de la red nacional de I+D [online]. 1995, n.33, p.26-34. Disponible en: http://www.rediris.es/rediris/boletin/33/enfoque2.html [consulta: 13 noviembre 2007] 91. Ley orgánica de protección de datos de carácter personal. L. N.º 15/1999 (13 diciembre 1999). Boletín Oficial del Estado núm.298 de 14 de diciembre de 1999 [online]. Disponible en: http://www.boe.es/boe/dias/1999/12/14/pdfs/A43088-43099.pdf [consulta: 5 noviembre 2007] 92. Morgan DL. Planning focus groups. Focus group kit, volume 2. Thousand Oaks, CA: Sage Publications; 1998 93. Krueger RA. Moderating focus groups. Focus group kit, volume 4. Thousand Oaks, CA: Sage Publications; 1998 94. Krueger RA. Developing questions for focus groups. Focus group kit, volume 3. Thousand Oaks, CA: Sage Publications; 1998 95. Krueger RA. Analyzing and reporting focus group results. Focus group kit, volume 6. Thousand Oaks, CA: Sage Publications; 1998 Bibliografía 203 96. Kirkpatrick DL. Evaluación de acciones formativas: los cuatro niveles. 1ª edición 1994. Barcelona: EPISE-Gestión 2000; 1999 97. Instituto Nacional de Administración Pública. Guía para la Evaluación de los Resultados de la Formación [online]. Madrid, 2003. Disponible en: http://www.formacioncontinua.inap.map.es/portal/NuevaWeb/info/documentos/ publicaciones/GUIA%20EVALUACION%20de%20RESULTADOS.pdf [consulta: 25 octubre 2006] 98. EncuestaFacil.com [página web]. Madrid: Encuesta Fácil, SL. Disponible en: http://www.EncuestaFacil.com 99. Irujo M, Beitia G, Bes-Rastrollo M, Figueiras A, Hernández-Díaz S, Lasheras B. Factors that influence under-reporting of suspected adverse drug reactions among community pharmacists in a Spanish region. Drug Saf. 2007;30(11):1073-82 100. Li Q, Zhang SM, Chen HT, Fang SP, Yu X, Liu D, Shi LY, Zeng FD. Awareness and attitudes of healthcare professionals in Wuhan, China to the reporting of adverse drug reactions. Chin Med J. 2004;116(6):856-61 101. Shankar PR, Subish P, Mishra P, Dubey AK. Teaching pharmacovigilance to medical students and doctors. Indian J Pharmacol. 2006; 38(5):316-9 102. Organización Mundial de la Salud. Improved ADR reporting: Report from working groups at the twenty-sixth annual meeting of National Centres, WHO International Drug Monitoring Programme, 8-10 December 2003. WHO Pharmaceuticals Newsletter No. 1, 2004 [online]. Disponible en: www.who.int/medicines/publications/newsletter/en/news2004_1.pdf [consulta: 22 noviembre 2007] 103. Meyboom R, Olsson S, Thorogood M. Teaching pharmacovigilance. En: Mann RD, Andrews EB, editores. Pharmacovigilance. Chichester: John Wiley and Sons; 2002. p.506-8 104. Cox AR, Marriott JF, Wilson KA, Ferner RE. Adverse drug reaction teaching in UK undergraduate medical and pharmacy programmes. J Clin Pharm Ther. 2004;29(1):31-5 Bibliografía 105. 204 Fern EF. Advanced Focus Group Research. Thousand Oaks, Calif: Sage; 2001 106. Evaluation of a training course on pharmacovigilance in Sub-Saharan Africa. Pharmacoepidemiol Drug Saf. 2000;9(2):133-8 107. Feliu, V. Evolución y dinámica de las listas. Boletín de la RedIRIS [online]. Diciembre 1998-Enero 1999. Número 46-47, p.99-106. Disponible en: http://www.rediris.es/list/propi/arti/nv98/evolistas/evolucion-listas.html [consulta: 5 mayo 2008] VIII. ANEXOS Anexos ANEXO I: La tarjeta amarilla 207 Anexos 208 Anexos ANEXO II: 209 Cuestionario utilizado con los cambios sugeridos en la prueba piloto Anexos 210 Anexos ANEXO III: Carta informativa dirigida a los farmacéuticos 211 Anexos 212 Anexos ANEXO IV: Tríptico informativo sobre el curso-taller 213 Anexos 214 Anexos ANEXO V: 215 Documento de acreditación de la Comisión de Formación Continuada de Navarra Anexos 216 Anexos 217 ANEXO VI: Diapositivas del curso y enunciados de los casos prácticos Anexos 218 Anexos 219 Anexos 220 Anexos 221 Anexos 222 Anexos 223 Anexos 224 Anexos 225 Anexos 226 Anexos 227 ANEXO VII: Guía de notificación de RAM dirigida al farmacéutico Anexos 228 Anexos 229 Anexos 230 Anexos 231 Anexos 232 Anexos 233 Anexos 234 Anexos 235 Anexos 236 Anexos 237 Anexos 238 Anexos 239 Anexos 240 Anexos 241 Anexos 242 Anexos 243 Anexos 244 Anexos 245 Anexos 246 Anexos 247 Anexos 248 Anexos 249 Anexos 250 Anexos 251 Anexos 252 Anexos 253 Anexos 254 Anexos 255 Anexos 256 Anexos 257 Anexos 258 Anexos 259 Anexos 260 Anexos 261 Anexos 262 Anexos 263 Anexos 264 Anexos 265 Anexos 266 Anexos 267 Anexos 268 Anexos ANEXO VIII: Tríptico explicativo dirigido a pacientes 269 Anexos 270 Anexos 271 ANEXO IX: Cuestionario de conocimientos previo al curso-taller (Pre-test) Anexos 272 Anexos 273 ANEXO X: Cuestionario de conocimientos posterior al curso-taller (Post-test) Anexos 274 Anexos ANEXO XI: Cuestionario de satisfacción del curso-taller 275 Anexos 276 Anexos ANEXO XII: Solicitud de alta en la lista de distribución 277 Anexos 278 Anexos ANEXO XIII: Mensaje informativo acerca de la lista de distribución 279 Anexos 280 Anexos ANEXO XIV: Cuestionario de transferencia del curso-taller 281 Anexos 282 Anexos ANEXO XV: Cuestionario de valoración de la lista de distribución 283