Bollgard II OECD MON-15985-7
Anuncio
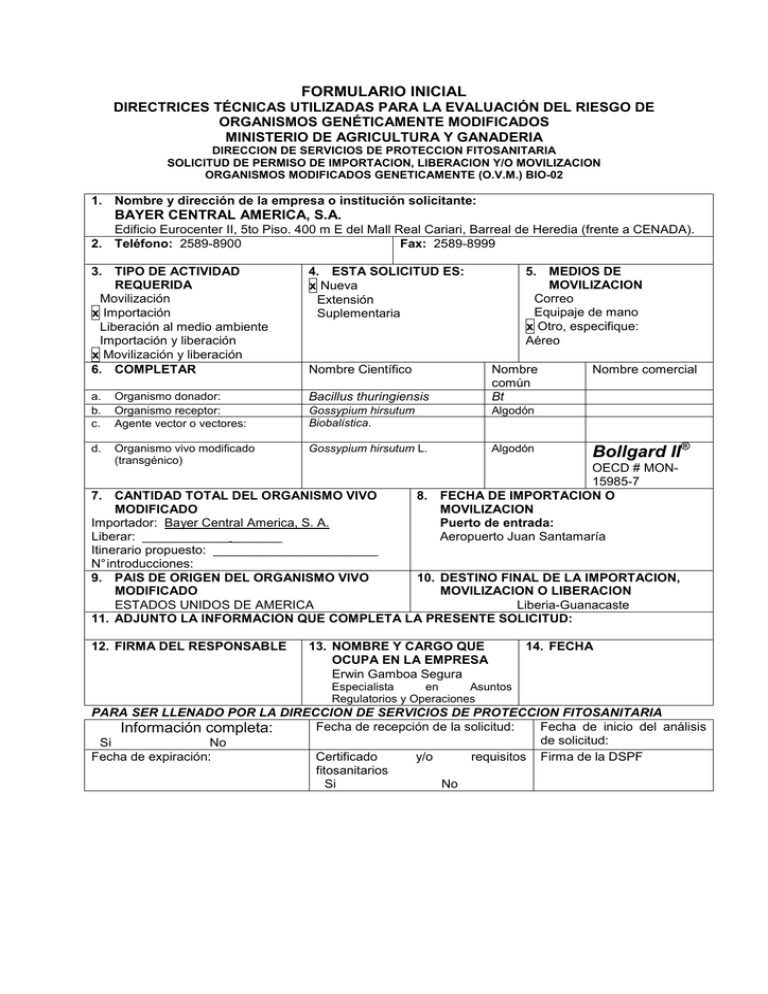
FORMULARIO INICIAL DIRECTRICES TÉCNICAS UTILIZADAS PARA LA EVALUACIÓN DEL RIESGO DE ORGANISMOS GENÉTICAMENTE MODIFICADOS MINISTERIO DE AGRICULTURA Y GANADERIA DIRECCION DE SERVICIOS DE PROTECCION FITOSANITARIA SOLICITUD DE PERMISO DE IMPORTACION, LIBERACION Y/O MOVILIZACION ORGANISMOS MODIFICADOS GENETICAMENTE (O.V.M.) BIO-02 1. Nombre y dirección de la empresa o institución solicitante: BAYER CENTRAL AMERICA, S.A. Edificio Eurocenter II, 5to Piso. 400 m E del Mall Real Cariari, Barreal de Heredia (frente a CENADA). 2. Teléfono: 2589-8900 Fax: 2589-8999 3. TIPO DE ACTIVIDAD REQUERIDA Movilización x Importación Liberación al medio ambiente Importación y liberación x Movilización y liberación 6. COMPLETAR 4. ESTA SOLICITUD ES: x Nueva Extensión Suplementaria a. b. c. Organismo donador: Organismo receptor: Agente vector o vectores: Bacillus thuringiensis Gossypium hirsutum Biobalística. Algodón d. Organismo vivo modificado (transgénico) Gossypium hirsutum L. Algodón Nombre Científico 5. MEDIOS DE MOVILIZACION Correo Equipaje de mano x Otro, especifique: Aéreo Nombre común Bt Nombre comercial Bollgard II® OECD # MON15985-7 8. FECHA DE IMPORTACION O MOVILIZACION Puerto de entrada: Aeropuerto Juan Santamaría 7. CANTIDAD TOTAL DEL ORGANISMO VIVO MODIFICADO Importador: Bayer Central America, S. A. Liberar: ____________ _______ Itinerario propuesto: _______________________ N° introducciones: 9. PAIS DE ORIGEN DEL ORGANISMO VIVO 10. DESTINO FINAL DE LA IMPORTACION, MODIFICADO MOVILIZACION O LIBERACION ESTADOS UNIDOS DE AMERICA Liberia-Guanacaste 11. ADJUNTO LA INFORMACION QUE COMPLETA LA PRESENTE SOLICITUD: 12. FIRMA DEL RESPONSABLE 13. NOMBRE Y CARGO QUE OCUPA EN LA EMPRESA Erwin Gamboa Segura 14. FECHA Especialista en Asuntos Regulatorios y Operaciones PARA SER LLENADO POR LA DIRECCION DE SERVICIOS DE PROTECCION FITOSANITARIA Fecha de recepción de la solicitud: Fecha de inicio del análisis Información completa: de solicitud: Si No Fecha de expiración: Certificado y/o requisitos Firma de la DSPF fitosanitarios Si No INDICE FORMULARIO INICIAL .......................................................................................................................................... 1 INFORMACION COMPLEMENTARIA DE LA SOLICITUD:................................................................................... 3 PARTE A: DATOS GENERALES DEL SOLICITANTE ..................................................................................... 3 1. 2. 3. 4. 5. Nombre, dirección particular, número telefónico, número de cédula y curriculum de la persona responsable. ............................................................................................................................ 3 Nombre, dirección del importador y/o fabricantes. ........................................................................ 3 Nombre, dirección y número telefónico de otras personas involucradas en los ensayos. .................. 3 Nombre, dirección y número telefónico de la(s) persona(s) que haya(n) desarrollado o facilitado el organismo vivo modificado. ....................................................................................................... 4 Nombres científicos, comunes, comerciales y todas las designaciones para identificar el o los organismos receptores, agentes vectores empleados en la construcción de cada organismo vivo modificado. .............................................................................................................................. 5 PARTE B: MOVILIZACIÓN................................................................................................................................. 5 1. 2. 3. 4. 5. Descripción del envase o empaque que se usará para movilizar el producto................................... 5 Cantidad de organismo vivo modificado a movilizar, calendario propuesto de movilización .............. 5 Descripción del sustrato que acompaña al organismo vivo modificado durante su movilización y una descripción detallada del método que se empleará para su construcción. ...................................... 5 Ruta de movilización, desde el lugar de origen hasta su destino propuesto, incluyendo destinos intermedios y destinos finales. ................................................................................................... 5 Descripción del procedimiento y medidas de bioseguridad que deben ser utilizadas para prevenir el escape y diseminación del organismo vivo modificado durante su movilización .............................. 5 PARTE C: INFORMACION ESPECIFICA DEL ORGANISMO VIVO MODIFICADO ........................................ 6 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Objetivo o propósito de la introducción, movilización y/o liberación al medio ambiente del organismo vivo modificado. ....................................................................................................................... 6 Descripción del material antes de la modificación genética: Ciclo de vida con énfasis especial sobre autocruzas, polinización, hábitat, especies silvestres y distribución de estas, mecanismos y frecuencia de autocruzas con miembros de la especie y especies filogenéticamente cercanas, y cuando se trate de organismos de origen microbiano: Ciclo de vida, características de patogenicidad, hospederos, descripción de etapas de desarrollo (inóculo, tipos de inoculo, penetración, etc.) diseminación, invernación e interacción con otros microorganismos. ............................................. 6 Descripción de las características genéticas del organismo donador, organismo receptor y vector, así como el país y localidad de origen.............................................................................................. 8 Descripción de la modificación actual o anticipada conferida por el material genético incorporado en el organismo vivo modificado y de como difiere del organismo no modificado. Anexar mapas de dicha construcción genética. ...................................................................................................... 9 Explicar detalladamente la biología molecular del sistema (p.e. donador-receptor-vector) que sustenta la obtención del producto manipulado. ........................................................................ 12 Declaración sobre la existencia del impacto potencial en el medio ambiente que se pueda derivar de la liberación del organismo. ..................................................................................................... 17 Debe señalarse detalladamente el diseño experimental propuesto para la liberación al medio ambiente y sistema de producción ........................................................................................... 18 Cantidad total del organismo vivo modificado genéticamente que se va a liberar y que cantidad se utilizará para cada ensayo en caso de que se establezcan varios. Elaborar un calendario en el que se indiquen las prácticas agronómicas (p.e. siembra, transplante) y ensayos propuestos. ............. 18 Anexar un mapa del sitio del ensayo indicando localización geográfica y la localidad exacta donde se establecen los ensayos del organismo vivo modificado, tomando en cuenta lo siguiente: .................. Detallar los procedimientos y medidas de bioseguridad que se usarán para prevenir la contaminación, escape y diseminación sin control del producto. ................................................. 19 Descripción detallada del método propuesto de disposición final del organismo vivo modificado al término del experimento, así como la disposición final o limpieza de otros materiales que hayan tenido contacto con el material transgénico durante el ensayo. ................................................... 19 Historial de liberaciones anteriores, indicando: lugar, número de permiso y fecha de autorización...44 2 INFORMACION COMPLEMENTARIA DE LA SOLICITUD: PARTE A: DATOS GENERALES DEL SOLICITANTE 1. Nombre, dirección particular, número telefónico, número de cédula y curriculum de la persona responsable. Responsable Técnico: Erwin Gamboa Segura Residencias Piedra y Navarro, Casa No. 3, 25 m N. del Puente sobre Río Seco, Los Ángeles, Cartago. Tel. 8932-2770, céd 1-949-744 Responsable Legal: Omar Arias López Del Final del Boulevard de Rohrmoser 500 mts. Norte, Tel. 88210889, céd 1-594-353 2. Nombre, dirección del importador y/o fabricantes. BAYER CENTRAL AMERICA, S.A. Edificio Eurocenter II, 5to Piso. 400 m E del Mall Real Cariari, Barreal de Heredia (frente a CENADA). Cédula Jurídica: 3-101-534305. 3. Nombre, dirección y número telefónico de otras personas involucradas en los ensayos. Art Simpson, Director Cotton Supply Chain 3223 South Loop 289, Suite 325. Lubbock, Texas 79423. EEUU. Tel. 806-765-8844 Ali Scott, Gerente de Asuntos Regulatorios para las Américas. 2 T.W. Alexander Drive, Research Triangle Park, NC 27709. EEUU. Tel. 919-549-2159 Steve Miller, Parent Seed Cotton Supply Chain # 7 Seed Plant Road. Stoneville, MS 38776. EEUU. Tel. 662-686-2334 Omar Arias López, Gerente Técnico Regional CA & C Del Final del Boulevard de Rohrmoser 500 mts. Norte, Tel. 88210889 Compañía contratada para la producción de semillas Compañía: Responsable Legal: Responsable Técnico: Teléfonos: e-mail: Semillas Olson James Olson, Adam Olson, 2665-1671 [email protected] Responsable de Bayer a contactar en caso de accidente o imprevisto: Erwin Gamboa, Oficinas Centrales Bayer. Tel. 8932-2770 / 2589-8962 3 4. Nombre, dirección y número telefónico de la(s) persona(s) que haya(n) desarrollado o facilitado el organismo vivo modificado. ® EL GEN BOLLGARD II Monsanto 700 Chesterfield Village Parkway North St. Louis Missouri, USA. Teléfono: 001(314) 537-6547 Fax: 001(314) 537-6047 LA SEMILLA Bayer Cropscience -David Becker Route 1, Box 152. Lubbock, TX USA Tel: 001(806)762-6021. Bayer Cotton Seed International -Steve Hague Transgenic Cotton Breeder 117 Kennedy Flat Rd Leland, MS 38756 Tel:001-662-686-9235 Cell: 001-662-822-352 Bayer Cropscience -Linda Trolinder-Wright Cotton Trait Manager, Breeding and Product Development Rt 1 Box 152 Lubbock, Texas 79401 Tel 001-806-762-6021 Fax 001-806-763-2564 Bayer CropScience y BCSI Internacional son filiales de la compañía Bayer en el desarrollo del producto y se encuentran en Texas y Mississippi, Estados Unidos. 4 5. Nombres científicos, comunes, comerciales y todas las designaciones para identificar el o los organismos receptores, agentes vectores empleados en la construcción de cada organismo vivo modificado. La presente Solicitud de Permiso de Importación, Liberación y/o Movilización de O.V.M. ® comprende el siguiente material: Algodón Bollgard II. El identificador único OECD a nivel mundial para este evento es: OECD # MON-15985-7. El ® nombre de este evento dentro de la compañía es Algodón Bollgard II. Nombre Científico Nombre Común a. Organismo donador b. Organismo receptor c. Vector o agente vector d. Organismo regulado Bacillus thuringiensis ® Algodón Bollgard (Gossypium hirsutum L.) Se transformo mediante biobalística. Vector creado: pB1579 Gossypium hirsutum L. Bt ® Algodón Bollgard ® Algodón Bollgard II PARTE B: MOVILIZACIÓN 1. Descripción del envase o empaque que se usará para movilizar el producto. Envases: La semilla se envía usualmente en una bolsa doble de polietileno o, dependiendo de la cantidad, dentro de sobres embalados dentro de una caja. Todos los contenedores o envases, sean cajas, sobres o bolsas, contarán con etiquetas que identifican claramente el producto que contienen, siguiendo el formato Bio-04 según el Artículo 122 del Reglamento Nº 26921 a la Ley Fitosanitaria 7664. 2. Cantidad de organismo vivo modificado a movilizar, calendario propuesto de movilización Información disponible en el registro de este evento. 3. Descripción del sustrato que acompaña al organismo vivo modificado durante su movilización y una descripción detallada del método que se empleará para su construcción. El material transgénico será transportado en forma de semilla. No habrá ningún sustrato ni otro material biológico que acompañe al producto manipulado durante su movilización. 4. Ruta de movilización, desde el lugar de origen hasta su destino propuesto, incluyendo destinos intermedios y destinos finales. Toda la semilla que ingresa viene en envases contenedores de plástico con su respectiva etiqueta. En dicha etiqueta se indica el número y/o nombre del material o línea que contiene y que se trata de material regulado. Esta identificación se mantendrá durante todo el proceso del ensayo. En caso de no poder sembrar inmediatamente después de que el material sea trasladado al sitio del ensayo, el mismo se almacenará en la Planta de Bayer en Liberia hasta el momento de la siembra. Todo el material a ser importado provendrá de los Estados Unidos y llegará por vía aérea al Aeropuerto Juan Santamaría. 5 5. Descripción del procedimiento y medidas de bioseguridad que deben ser utilizadas para prevenir el escape y diseminación del organismo vivo modificado durante su movilización Embarque de semillas: Las semillas serán transportadas en sacos de papel o bolsas de alta resistencia sellados herméticamente para prevenir cualquier derrame desde el origen hasta el sitio de su liberación en campo. Al documentar los embarques de semilla, se harán todas las especificaciones pertinentes a la compañía transportadora para que el material sea manipulado con cuidado y evitar rompimiento de los sacos. En caso de derrame accidental de semilla durante el transporte, la empresa transportadora tendrá indicaciones para que se recoja la semilla derramada y mantengan el material bajo resguardo hasta que Bayer sea notificado y en conjunto con las autoridades reguladoras de Costa Rica se tomen las medidas conducentes. Todos los sacos con semilla estarán debidamente etiquetados en forma visible para prevenir cualquier confusión en su manejo. PARTE C: INFORMACION ESPECÍFICA DEL ORGANISMO VIVO MODIFICADO 1. Objetivo o propósito de la introducción, movilización y/o liberación al medio ambiente del organismo vivo modificado. El único objetivo de la introducción del organismo vivo es el incremento de semilla para luego exportar ésta a su país de origen. No se van a realizar cruces de ningún tipo ni cualquier otra actividad diferente al incremento de semilla con este material en Costa Rica. 2. Descripción del material antes de la modificación genética: Ciclo de vida con énfasis especial sobre autocruzas, polinización, hábitat, especies silvestres y distribución de estas, mecanismos y frecuencia de autocruzas con miembros de la especie y especies filogenéticamente cercanas, y cuando se trate de organismos de origen microbiano: Ciclo de vida, características de patogenicidad, hospederos, descripción de etapas de desarrollo (inóculo, tipos de inoculo, penetración, etc.) diseminación, invernación e interacción con otros microorganismos. El cultivo del algodonero (Gossypium hirsutum L.). El algodón ha sido cultivado en climas tropicales y subtropicales del mundo desde tiempos prehistóricos. Aunque las especies de algodón silvestre en la mayoría de los casos son perennes, las especies de algodón domesticadas son cultivadas generalmente como cultivos anuales. En el ámbito mundial el algodón es la fuente de fibra más importante para la industria textil y la segunda fuente de aceite de origen vegetal, ubicándose después de la soya. Origen y especies del género Gossypium. Las especies silvestres y cultivadas del género Gossypium pertenecen a la familia Malvaceae. Este género contiene 50 especies con un número cromosómico básico de 13. De las especies descritas, 45 son diploides (2n=2x=26) y se agrupan en siete genomas designados como A, B, C, D, E, F, y G. Las especies diploides con los genomas A, B, E, o F son originarias de Africa o Asia y se les conoce como especies del Viejo Mundo, las cuales están estrechamente relacionadas. Las especies diploides con los genomas C o G son originarias de Australia. Las especies diploides que contienen el genoma D son originarias del hemisferio occidental y se les conoce como especies del Nuevo Mundo. Los cromosomas en el genoma D son más pequeños que los cromosomas de los otros genomas (Poehlman y Sleper, 1995). Además de las 45 especies diploides, existen cinco especies alotetraploides (2n=4x=52) originarias del Nuevo Mundo, de las cuales cuatro son originarias del continente Americano y una de Hawaii. Las especies alotetraploides contienen la combinación de los genomas AADD y tienen 26 cromosomas largos y 26 cromosomas chicos, aunque existe algún traslape en tamaño entre los cromosomas de los genomas A y D. El origen genético de las especies alotetraploides fue 6 demostrado experimentalmente cruzando G. arboreum (genoma A), especie diploide cultivada en la India, y G. thurberi (genoma D), especie diploide silvestre de América, y duplicando los cromosomas del híbrido estéril con colchicina. El híbrido anfidiploide (AADD, 2n=4x=52) produjo híbridos fértiles cuando fue cruzado con especies tetraploides americanas. Dos especies diploides y dos tetraploides de Gossypium son las especies cultivadas actualmente: • • • • G. herbaceum L., (2n=2x=26) genoma A, cromosomas largos, G. arboreum L., (2n=2x=26) genoma A, cromosomas largos, G. hirsutum L., (2n=4x=52) genoma AD, 26 cromosomas chicos y 26 cromosomas largos, y G. barbadense L., (2n=4x=52) genoma AD, 26 cromosomas chicos y 26 cromosomas largos. G. hirsutum es la principal especie de algodón cultivado y representa aproximadamente el 90% de la producción mundial de fibra y aceite de algodón. Floración y polinización del algodón Las flores del algodonero son bisexuales; nacen en las axilas foliares a lo largo de las ramas fructíferas. Cada rama puede producir hasta 10 botones. Cada flor está compuesta por un cáliz tubular, ligeramente pentalobulado, corola de cinco grandes pétalos que son de color blanco cremoso por las mañanas, color que cambia gradualmente a púrpura, después de ser fecundada. El gineceo está formado por un ovario súpero, con tres a cinco carpelos unidos cada uno con dos a siete óvulos; el estilo termina en un estigma lobulado. El androceo es un tubo corto que se inicia en la base del gineceo envolviéndolo, dando origen en toda su longitud -, a estambres filamentosos que terminan en anteras bilobuladas. Cada botón floral está protegido por tres a cinco brácteas triangulares formando lo que se conoce comúnmente como cuadros. Las brácteas persisten hasta la maduración del fruto. Un día antes de la antesis emerge la corola de los cuadros, en el día de la antesis la corola abre y ocurre la liberación de polen. El algodón se considera una especie autógama. La polinización ocurre durante unas pocas horas de la mañana del día de la apertura de la flor. La corola se torna de color rojo un día después de la antesis y más tarde se cae de la planta. El periodo de floración puede ser de 20 días en promedio. Potencial de polinización cruzada El potencial de polinización cruzada o ¨outcrossing¨ puede definirse como la habilidad de los genes de escapar hacia parientes silvestres del algodón. El flujo de genes puede ocurrir de manera vegetativa, por semilla o por polen. La propagación vegetativa es poco común para el algodón y la dispersión de semillas por viento y animales es raramente exitosa debido a las propiedades de la estructura del capullo. El polen de algodón no se transfiere por el viento debido a su naturaleza grande, pesada y pegajosa (Niles y Feaster, 1984). La polinización cruzada natural se debe al traslado del polen por insectos, siendo las abejas los polinizadores más importantes de algodón (McGregor, 1976). Algunos estudios de polinización cruzada sugieren que el movimiento de polen disminuye muy rápido a medida que aumenta la distancia a la fila donde se encuentra el polen marcado, y la transferencia de polen más allá de 12 metros es muy baja. Vaissière (1990) preparó un estudio conteniendo una revisión de la literatura sobre polinización de algodón y un resumen de su estudio, “Dispersión y Traslado de Polen en Algodón Upland”, conducido en Texas en 1983. (Ver folio 000204 a 000214). El estudio de Texas se llevó a cabo utilizando una línea macho estéril rodeada por plantas masculinas fértiles. Se suministraron sesenta colonias de abejas. Los resultados mostraron que el traslado de polen en algodón upland disminuye en proporción a la inversa de la distancia a la fila polinizadora más cercana y no hubo un traslado significativo de polen más allá de los 12 metros. Meredith y Bridge (1973) no detectaron outcrossing entre plantas adyacentes en un estudio realizado en Stoneville, MS; el límite aproximado de detección para el tamaño de la muestra y los métodos fue de aproximadamente 0.046%. En otros estudios 7 mencionados por Hutmacher, et al., (2006), se reafirma que la frecuencia de polinización cruzada natural disminuye conforme aumenta la distancia entre las plantas donadoras y receptoras. Según estos autores, se ha visto que la frecuencia de polinización cruzada natural puede disminuir desde 2,17% en hileras adyacentes a 1,42 en hileras con 2 m de separación y cero en hileras a 10 m de distancia. A pesar de que no se cuenta con datos de estudios hechos a nivel local, estas investigaciones sugieren que independientemente de la localidad, se mantiene la tendencia de disminución del porcentaje de polinización cruzada conforme aumenta la distancia desde la fuente de polen. Según la base de datos del INBio, a la fecha en Costa Rica se han identificado ocho especimenes de Gossypium hirsutum y un espécimen de G. barbadense en la Vertiente Pacífica (http://www.inbio.ac.cr/bims/k03/p13/c045/o0250/f01572/g008192/s024849.htm). Sin embargo, ninguno de estos hallazgos se reporta en la localidad donde se realizarán los ensayos. Ya se ha iniciado el levantamiento de especies vegetales asociadas al cultivo de algodón en las áreas de siembra y producción y sus alrededores. Estos estudios se completarán en coordinación con el Programa de Biotecnología y los expertos aprobados por las autoridades pertinentes. Es experiencia de Bayer que, por razones climáticas y condiciones de suelo, cualquier semilla de algodón remanente germinaría en el campo fuera de época de cultivo y se eliminará durante la época de monitoreo. De no ser así, se pudriría en el suelo y por lo tanto quedaría sin viabilidad. En el caso de nuestros ensayos, el algodón será plantado en áreas más bajas que los alrededores (lowland) 0-100 msm, rodeado ya sea por pastizales o por árboles. Los cerros y la vegetación circundante actuarán como barreras naturales al flujo de polen, en caso que algo de polen fuera a ser transportado por el viento, aunque como ya se mencionó, naturalmente el polen de algodón no se transporta de esta forma. 3. Descripción de las características genéticas del organismo donador, organismo receptor y vector, así como el país y localidad de origen. El organismo donador es la bacteria Bacillus thuringiensis. Esta bacteria habita de manera natural en el suelo y produce una proteína (endotoxina) que actúa específicamente sobre las larvas de insectos lepidópteros al destruir su sistema digestivo. El gen cry1Ac contenido dentro del vector PV-GHBK04 fue construido combinando los primeros 1398 nucleótidos del gen cry1Ab (correspondientes a los aminoácidos 1 a 466) (Fischhoff et al., 1987) con los nucleótidos número 1399 a 3534 del gen cry1Ac (correspondientes a los aminoácidos 467 a 1178) (Adang et al., 1985). La proteína producida por este gen se clasifica como Cry1Ac, ya que si bien es el resultado de la fusión de dos porciones de proteínas Cry diferentes, la mayoría corresponde a la proteína Cry1Ac. El gen cry2Ab en el evento Bollgard II es una versión optimizada sintéticamente del gen de Bacillus thuringiensis subsp. kurstaki. La optimización fue necesaria para proveerle al gen las secuencias reguladoras que permitieran su expresión en la planta de algodón. La proteína Cry2Ab tiene un tamaño de 633 aminoácidos, con una masa aproximada de 71 kDa (Widner and Whiteley, 1990; Dankocsik et al., 1990). Se introdujo además un aminoácido adicional para crear un sitio de clivaje para una enzima de restricción con fines de clonado. La proteína Cry2Ab está presente como un producto estable en las plantas de algodón transgénico. La cepa kurstaki de Bacillus thuringiensis produce dos clases de proteínas insecticidas (deltaendotoxinas), denominadas P1 y P2 en base a sus pesos moleculares relativos. La proteína Cry1Ac pertenece a la clase P1. Las proteínas P1 tienen un peso molecular que varía entre 130.000 a 140.000 daltons y están compuestas por 1100 a 1200 aminoácidos. La proteína Cry2Ab tiene 633 aminoácidos y una masa aproximada de 71 kDa. 8 Organismo vector: Las plantas fueron transformadas utilizando la técnica de “biobalística” ® ® introduciendo el gen Bollgard II en plantas de algodón de la variedad Bollgard DP 50 B. Gen marcador nptII: El gen nptII funciona como un marcador de selección dominante en los estadios iniciales de selección de células vegetales luego de la transformación en laboratorio (Horsch et al., 1984; DeBlock et al., 1984). La enzima NPTII utiliza ATP para fosforilar neomicina y la kanamicina relacionada, inactivando por lo tanto estos antibióticos aminoglicósidos y previniendo que los mismos maten a las células que producen NPTII. El único propósito de insertar el gen nptII en las células de algodón con el gen cry1Ac es tener un método efectivo de selección de células que contienen el gen insecticida. Por lo tanto, las células seleccionadas para regeneración de plantas que contienen el gen cry1Ac también contienen el gen nptII. La proteína Neomicina Fosfo transferasa II (NPTII) es ubicua en el ambiente y se encuentra en microbios presentes en alimentos y dentro del sistema digestivo humano (Flavell et al., 1992; Calgene, Inc., 1993). No posee actividad pesticida y no es tóxica para ninguna especie. Gen uidA: El gen de ß-glucuronidasa, uidA, también conocido como gen gus o gusA, deriva de Escherichia coli cepa K12 (Jefferson, et al., 1986). La secuencia ha sido caracterizada totalmente y se encuentra disponible en el GenBank (Jefferson, et al., 1986; Schlaman et al., 1994). Este gen codifica para la enzima ß-D-glucuronidasa (GUS). La ß-D-glucuronidasa es una exohidrolasa que cataliza la hidrólisis de un rango de ß-glucuronidos en sus correspondientes ácidos y aglicones (Oshima et al., 1987), incluyendo el sustrato artificial pnitrofenil-ß-D-glucuronida. La hidrólisis de este compuesto cromogénico libera una tintura azul que funciona como un marcador visible mesurable en el proceso de transformación de plantas (Jefferson et al., 1987). La bioquímica y actividad catalítica de esta proteína han sido meticulosamente estudiadas (Wang y Touster, 1972). ® El organismo receptor es la planta de algodón Bollgard variedad DP 50 B. Variedades que funcionan como posibles receptores finales pueden ser Sicot71 y 02S176. Los organismos donador, vector y receptor fueron colectados en los Estados Unidos. La construcción del vector y la semilla transgénica de algodón fueron desarrollados por la Compañía Monsanto en sus Laboratorios de Chesterfield Village ubicados en St. Louis Missouri, E.U.A. 4. Descripción de la modificación actual o anticipada conferida por el material genético incorporado en el organismo vivo modificado y de como difiere del organismo no modificado. Anexar mapas de dicha construcción genética. ® El algodón Bollgard resistente a insectos fue desarrollado, aprobado y consecuentemente comercializado desde 1996 en los Estados Unidos. Este algodón que contienen el gen Cry1Ac fue retransformado mediante la tecnología de aceleración de partículas (biobalística) para introducirle el gen Cry2Ab, ampliando el espectro de control de plagas y contribuyendo a retardo de desarrollo de resistencia en los insectos a las toxinas de Bacillus thuringiensis. 9 nptII P-E35S uidA ori-pUC B1579 8723 bp NOS 3' NOS 3' P-E35S cryX Mapa de la construcción genética del plásmido B1579 utilizado para introducir el gen Cry2Ab en ® plantas de algodón portadoras del gen Bollgard . Descripción de los elementos genéticos en el vector B1579 Elemento genético NptII cryX (Cry2Ab) UidA ori-Puc P-E35S Nos 3’ Descripción Marcador de selección en plantas para resistencia a kanamicina proveniente del transposón Tn 5 de E. coli δ-endotoxina de Bacillus thuringiensis Gen β-glucuronidasa de E. coli usado como marcador visual para identificar plantas transformadas Origen de replicación bacteriano Promotor 35S del CaMV (virus del mosaico de la coliflor) con la región potenciadora duplicada. Secuencia de terminación del gen de la nopalina sintetasa de Agrobacterium tumefaciens 10 Mapa de la construcción genética de PV-GHBK04 11 Mapa de la construcción genética de PV-GHBK11 Las variedades de algodón Bollgard®II no presentan ninguna diferencia en el manejo agronómico, morfología, desarrollo fenológico y calidad de fibra respecto a sus progenitores recurrentes convencionales, excepto por la siguiente característica: La expresión de las proteínas insecticidas Cry1Ac y Cry2Ab altamente específicas para el control de larvas de algunas especies de insectos lepidópteros de importancia económica en el cultivo del algodonero: complejo bellotero (Heliothis virescens Fabricius y Helicoverpa zea Boddie), gusano rosado (Pectinophora gossypiella Saunders), gusano soldado (Spodoptera exigua Hubner) y gusano cogollero (Spodoptera frugiperda Smith) (http://bch.cbd.int/database/recordv4.shtml?documentid=43298). 5. Explicar detalladamente la biología molecular del sistema (p.e. donador-receptorvector) que sustenta la obtención del producto manipulado. Sistema de Transformación El evento Bollgard II fue generado utilizando el sistema de transformación de aceleración de partículas. El plásmido vector, PV-GHBK11, contiene dos casetes adyacentes de expresión en plantas: el gen de interés, cry2Ab, y el gen del marcador medible uidA, el cual codifica para la proteína GUS. El gen de interés y el gen marcador fueron purificados de la estructura del vector a través del corte del mismo con la endonucleasa de restricción KpnI (Ausubel et al., 1987) y separado subsecuentemente y purificado en base a diferencias de tamaño por HPLC. Este fragmento lineal se designa PV-GHBK11L. El ADN lineal purificado, PV-GHBK11L, fue luego precipitado en partículas de oro, con las cuales se transformó tejido de algodón por el método de aceleración de partículas. Estabilidad de la inserción: 12 La incorporación del DNA externo dentro del genoma vegetal puede ser confirmado por el análisis de hibridación Southern (Southern, 1975). Los nuevos indicadores exhiben fenotipos dominantes y son heredados de una forma Mendeliana (DeBlock, et al., 1984; Horsch, et al., 1984). Los genes insertados forman una nueva e intrínseca parte del DNA cromosómico vegetal, el cual permanece estructuralmente estable a través de la meiosis y es transmitido en la semilla. Las plantas transformadas regeneradas son fenotípicamente normales y fértiles. La incorporación estable de genes externos en el genoma de las plantas de algodón fue demostrado por Monsanto usando el análisis Southern, ensayos bioquímicos y análisis genético Mendeliano estándar. Inserto PV-GHBK04 (Bollgard) Se realizaron análisis de ADN para caracterizar el ADN-T insertado: número de insertos (número de eventos de integración), número de copias (número de copias de ADN-T en un locus genético particular) e integridad del inserto (tamaño del gen, composición y acoplamiento). La caracterización se realizó por análisis de Southern blot en ADN genómico de tejido de hojas de plantas de algodón control (Coker 312) y Bollgard. Los análisis genéticos demuestran que se insertaron dos copias de ADN-T en un arreglo cabeza-acola dentro del genoma de algodón para producir las líneas Bollgard. Uno de los insertos de ADN-T, de aproximadamente 8.2 Kb de tamaño, contiene la secuencia completa del gen cry1Ac y del gen nptII (sin la región ori322) y el segundo inserto, de aproximadamente 1.7 Kb de tamaño máximo, contiene la porción 3’ del gen cry1Ac que no puede ser activa como insecticida ya que no contiene la región 5’ activa insecticida del gen cry1Ac. Se demostró que los dos insertos están unidos y esto está sustentado por los datos de segregación en retrocruzamientos con líneas comerciales. Inserto PV-GHBK11 Se realizaron análisis de Southern blot para determinar el número de insertos, el número de copias y para confirmar la ausencia de secuencias derivadas de la estructura del plásmido PV-GHBK11. Adicionalmente, se verificaron las uniones inserto-planta 5’ y 3’ utilizando la reacción de PCR. Los datos muestran que el evento Bollgard II contiene una inserción de ADN del fragmento lineal de PV-GHBK11. El inserto contiene una copia de cada uno de los casetes cry2Ab y uidA. La región codificante cry2Ab y el casete están completos; sin embargo, el sitio de restricción luego de la secuencia de poliadenilación NOS 3’ en el casete no está presente. Las secuencias de la región codificante uidA y su sitio de poliadenilación NOS 3’ también están completas; sin embargo, 260 pb del extremo 5’ del promotor CaMV 35S del casete uidA no están presentes en el inserto del casete del gen uidA. El promotor e35S es aún funcional pese a su truncamiento, tal como se demostró por la producción de la proteína GUS. Este evento no contiene ninguna secuencia detectable derivada de la estructura del plásmido PV-GHBK11. Por lo tanto se puede concluir que en el evento Bollgard II se producen las proteínas Cry2Ab y GUS completas como resultado de la integración del segmento de ADN derivado del plásmido PV-GHBK11, hecho que fue efectivamente comprobado. Análisis de las secuencias de ADN de la planta flanqueantes del inserto Se realizó un análisis de PCR sobre ADN genómico para confirmar las secuencias de unión insertoplanta en los extremos 5’ y 3’ del algodón Bollgard II. Tal como se esperaba, las muestras no transgénicas no produjeron productos por PCR cuando se utilizaron los sets de primers 5’ o 3’. La muestra DP50B (evento control cry1Ac) no dio productos con ninguno de los pares de primers, tal como se esperaba. Un evento alternativo cry2Ab, 15813 (evento diferente al Bollgard II), tampoco dio ningún producto cuando se utilizó el par de primers. El evento Bollgard II dio los productos de los tamaños esperados de 230 pb en el extremo 5’ utilizando los primers A y B y 869 pb para el extremo 3’ utilizando los primers C y D. Este análisis de PCR confirmó las secuencias de los bordes 5’ y 3’ del evento Bollgard II. 13 Métodos de detección Para la detección de este material en laboratorio, la empresa cuenta con técnicas de PCR para determinar la presencia del material genético insertado en estos eventos. Para la detección a campo, se pueden utilizar kits comerciales de tiras de flujo lateral (QuickStix®) que permiten identificar de forma rápida y confiable el algodón Bollgard®II a partir de muestras de tejido y semilla. Este método identifica específicamente las proteínas Cry1Ac/Cry2Ab que expresa el algodón Bollgard®II. Este método está disponible públicamente y puede ser consultado en la siguiente dirección: http://www.envirologix.com/artman/publish/cat_index_5.shtml Genes de resistencia a antibióticos Gen marcador nptII: El gen nptII funciona como un marcador de selección dominante en los estadios iniciales de selección de células vegetales luego de la transformación en laboratorio (Horsch et al., 1984; DeBlock et al., 1984). La enzima NPTII utiliza ATP para fosforilar neomicina y la kanamicina relacionada, inactivando por lo tanto estos antibióticos aminoglicósidos y previniendo que los mismos maten a las células que producen NPTII. El único propósito de insertar el gen nptII en las células de algodón con el gen cry1Ac es tener un método efectivo de selección de células que contienen el gen insecticida. Por lo tanto, las células seleccionadas para regeneración de plantas que contienen el gen cry1Ac también contienen el gen nptII. La proteína Neomicina Fosfo transferasa II (NPTII) es ubicua en el ambiente y se encuentra en microbios presentes en alimentos y dentro del sistema digestivo humano (Flavell et al., 1992; Calgene, Inc., 1993). No posee actividad pesticida y no es tóxica para ninguna especie. Gen marcador bacteriano aad: el gen aad se encuentra bajo el control de su propio promotor bacteriano, lo cual provee un marcador de selección para las manipulaciones genéticas en hospedantes bacterianos. El gen aad codifica para la enzima 3”(9)-O-aminoglycosido adenyltransferasa (AAD), la cual permite la selección de bacterias conteniendo el plásmido PVGHBK04 en medio conteniendo espectinomicina o estreptomicina. El gen aad está bajo el control de un promotor bacteriano y análisis de ELISA desarrollados para la proteína AAD no pudieron detectar su presencia en el algodón Bollgard. Gen cry1Ac: La proteína Cry1Ac expresada por el gen cry1Ac es una proteína insecticida, cuyos efectos son específicos para insectos lepidópteros. Esta proteína solo es efectiva como proteína insecticida cuando la misma es ingerida por insectos con un intestino con pH usualmente alcalino y estructuras específicas en la membrana del intestino para unir la toxina. Las delta-endotoxinas son descriptas como pro-toxinas, las cuales son procesadas por proteasas del intestino de los insectos en toxinas más pequeñas activas contra los insectos (Höfte et al., 1986). Este centro resistente a la degradación por tripsina actúa uniéndose selectivamente a sitios específicos localizados en la membrana apical de las células del intestino medio de especies de insectos susceptibles. Luego de la unión, se forman poros que interrumpen el flujo de iones en el intestino medio, causando la destrucción del recubrimiento del intestino y la muerte eventual. (Schnepf et al., 1998) La función del gen y su proteína en las plantas es otorgarle a la planta resistencia natural contra insectos lepidópteros. La composición del gen es la siguiente: PE35S:cry1Ac:7S3’. Esos elementos permiten la expresión del gen en plantas. Gen cry2Ab: La proteína Cry2Ab tiene un alto grado de similitud de secuencia (97%) con la proteína Cry2Aa producida en los productos comerciales B.t.k. Las proteínas producidas en estos productos tienen una historia establecida de seguridad ambiental, tal como fue documentado en el EPA 1998 Registration Eligibility Decisión Document (EPA, 1998). El mecanismo de acción de la proteína Cry2Ab es similar al descripto para la proteína Cry1Ac (ver respuesta anterior). 14 La función del gen y su proteína en las plantas es otorgarle a la planta resistencia natural contra insectos lepidópteros. La composición del gen es la siguiente: PE35S:PetHSP70leader:EPSPS/CTP2:cry2Ab:NOS3’. Esos elementos permiten la expresión del gen en plantas. Segregación: en la ¡Error! No se encuentra el origen de la referencia. se presentan datos de segregación para plantas R1 (progenie del transformante inicial, el cual es denominado R0) y la progenie de plantas R1. Estos resultados son consistentes con una fuerte unión entre los dos eventos de inserción conteniendo una sola copia activa del gen cry1Ac. Estabilidad de la transferencia: la estabilidad del gen cry1Ac fue demostrada durante cuatro generaciones de retro cruzas derivadas de la línea Bollgard en varias líneas de cultivares elite. El test de Chi cuadrado para segregantes BC3F1, BC3F2 y BC3F3 fue el esperado. El test de Chi cuadrado para el test de la progenie BC3F2 (segregación esperada de 1 homocigota:2 heterocigotas) fue significativa a P=0.05 pero no a P=0.01. Por definición, una desviación del cociente de esta magnitud es esperable en aproximadamente un 5% de los casos. Por lo tanto, este resultado es debido probablemente a un muestreo al azar. Adicionalmente, los resultados de la progenie R1 fueron los esperados. En realidad, los resultados dieron un ajuste perfecto. En resumen, los datos de los análisis genéticos del algodón Bollgard demuestran que se introdujo una sola copia activa y una copia parcial inactiva del gen cry1Ac dentro del genoma de algodón en dos sitios fuertemente unidos y que la integridad de esta inserción se mantuvo durante la transferencia. El gen de cry1Ac segregó de manera consistente con dos eventos de inserción fuertemente unidos y fue transferido de manera estable con el cruzamiento. Los datos de las retro cruzas demostraron además la estabilidad de la transferencia de generación en generación. Para determinar la estabilidad del evento Bollgard II por generaciones, se realizaron una serie de testeos de progenie en base a ELISA cualitativo de Cry2Ab de cuatro generaciones. La significancia estadística para los datos de segregación se determinó utilizando un análisis de Chi cuadrado. Todas las generaciones segregaron tal como se esperaba para un sitio único de inserción. La progenie R1 de Bollgard II presentó la proporción esperada de 3:1 con respecto a la detección de la proteína Cry2Ab. Las progenies del evento Bollgard II retro cruzadas con cultivares comerciales de algodón dieron las proporciones esperadas de 1:1 con respecto a la proteína Cry2Ab. El análisis de Chi cuadrado de los resultados de segregación mostró que el patrón de segregación fue consistente con un sitio único activo de inserción dentro del genoma de algodón y segrega de acuerdo a la genética Mendeliana. Estos datos confirman que el ADN insertado dentro del evento Bollgard II contiene un inserto de ADN en un locus simple que segrega de acuerdo a las leyes de genética Mendeliana y por lo tanto permanece establemente integrado en el genoma de la planta por sucesivas generaciones de auto fecundación y retro-cruzas. Persistencia de la proteína Cry1Ac y Cry2Ab en el medio ambiente Se determinó el destino en el ambiente de la proteína Cry1Ac midiendo la velocidad a la cual se disipa la bioactividad de la proteína Cry1Ac cuando la misma es adicionada al suelo como proteína pura y como un componente de tejido de algodón resistente a insectos. La bioactividad de la proteína Cry1Ac purificada se disipa con una vida media estimada de 9.3 a 20.2 días, dependiendo de la dosis. La bioactividad de la proteína Cry1Ac adicionada al suelo como 0.01 g polvo de tejido por gramo de suelo seco como componente del algodón Bollgard II, se disipa con una vida media estimada de 41 días. Los resultados de este estudio sugieren que la proteína Cry1Ac se degradará fácilmente (con una vida media estimada en 41 días) cuando la misma es incorporada al suelo como un componente postcosecha de las plantas de algodón. La vida media medida de la proteína Cry1Ac purificada en el suelo es comparable a la medida para preparaciones microbianas de Bacillus thuringiensis kurstaki (West, 1984; Pruett et al., 1980). Sobre las plantas de algodón transformadas y sus cruces 15 En las plantas transformadas no se encuentra presente ninguna secuencia nucleotídica correspondiente al sitio ori de replicación bacteriana proveniente de ninguno de los plásmidos de transformación. Cantidad de proteína total de cada gen Cry1Ac, NPTII, AAD Se evaluaron los niveles de proteínas expresadas (Cry1Ac, NPTII y potencialmente AAD) en hojas jóvenes (plántulas de 3-6 semanas) y tejido de semilla utilizando los métodos de ELISA y Western blot. Además, se recolectaron plantas maduras justo antes de la defoliación y cosecha para establecer la consistencia de la expresión a través de la estación de crecimiento y para estimar la cantidad de proteínas Cry1Ac y NPTII que podrían llegar a ingresar al medio ambiente al final de la estación de crecimiento. La expresión de la proteína Cry1Ac también se evaluó en néctar y polen de la línea Bollgard II (cultivada en invernadero). Hojas jóvenes y Semilla: los datos muestran que las proteínas Cry1Ac y NPTII se expresan a niveles extremadamente bajos y relativamente constantes en hoja y semilla de algodón Bollgard II (menos de 2 µg/gramo de peso seco de Cry1Ac y menos de 4 µg/gramo de peso seco de NPTII en hoja y tejido de la semilla, respectivamente). Tal como se predijo, no se detectó AAD ni en hoja ni en tejido de la semilla de la línea Bollgard. Planta entera: los niveles de proteínas Cry1Ac y NPTII en tejido de plantas enteras fueron mucho menores, en base a peso fresco, que en tejido de hojas jóvenes. Las proteínas Cry1Ac y NPTII presentaron una concentración de aproximadamente 0.044 y 0.57 µg/gramo de peso fresco (respectivamente) en la línea de algodón Bollgard madura. Néctar y Polen: los niveles de proteína Cry1Ac medidos en polen (11.5 ng/g peso fresco de polen) y néctar (<1.6 ng/g peso fresco de néctar) fueron extremadamente bajos. Cry2Ab, GUS Se evaluaron los niveles de proteína Cry2Ab en brotes nuevos de hojas recolectados durante la estación de crecimiento, planta completa, polen y semilla de algodón utilizando métodos de ELISA validados. Se detectó la proteína Cry2Ab en el evento Bollgard II en niveles bajos en varios tejidos vegetales varias veces a lo largo de la estación de crecimiento. Los niveles de proteína Cry2Ab en hojas jóvenes fueron consistentes en todos los lotes y localidades, con un rango que varió entre 20,1 a 33,3 µg/g tpf (total peso fresco), y una media a través de todas las localidades de 23,8 µg/g tpf ± 6,3 µg/g tpf. El nivel medio de producción de proteína Cry2Ab en muestras de hojas alcanzó un máximo a los 55 días luego de la siembra y subsecuentemente declinó durante la estación de cultivo a una media de 16,7 µg/g tpf a los 108 días luego de la siembra. No se detectó proteína Cry2Ab en la línea control DP50B o DP50 no transgénica en ninguna localidad (LOQ=2,5 µg/g tpf). Los niveles de proteína Cry2Ab en tejido de semilla de algodón también fueron consistentes a lo largo de todas las localidades, variando desde 31,8 a 50,7 µg/g tpf, con una media de 43,2 ± 5,7 µg/g tpf. No se detectó proteína Cry2Ab en la línea control DP50B o DP50 no transgénica. En tejidos de planta entera, los niveles medios de proteína Cry2Ab fueron 8,80 ± 1,2 µg/g tpf, con un rango entre localidades de 7,28 – 10,46 µg/g. No se detectó proteína Cry2Ab en la línea control DP50B o DP50 no transgénica. En polen, la proteína Cry2Ab no fue detectada por sobre el límite de detección del ensayo (0,25 µg/g) en ninguna localidad en ninguna de las muestras testeadas o control. Los niveles de proteína GUS se midieron en brotes de hojas nuevos y en semilla de algodón utilizando un método validado de ELISA. La proteína GUS en el evento Bollgard II se detectó en niveles bajos en estos tejidos vegetales. Los niveles de producción de proteína GUS en hojas jóvenes variaron de 51,7 a 176 µg/g tpf, con una media entre todas las localidades de 106 ± 32 µg/g. No se detectó proteína GUS en las líneas control DP50B o DP50 no transgénica. 16 En resumen, los niveles de proteínas Cry2Ab y GUS expresados en tejidos de algodón Bollgard II son bajos. Las muestras control de todos los tejidos estuvieron bajo el límite de detección para ambas proteínas Cry2Ab y GUS, tal como se esperaba debido a la ausencia del inserto genético. Eefectos aditivos, antagonistas o de sinergismo de las proteínas bioinsecticidas en los insectos blanco Los dos tipos de proteínas Cry presentes en el algodón Bollgard II pertenecen a clases de proteínas Cry diferentes, por lo que no se esperan efectos antagonistas o de sinergismo. El evento Bollgard II provee un control equivalente o aún mayor para el control de las principales plagas de insectos del algodón (tobacco budworm, pink bollworm y cotton bollworm), con un control adicional de plagas esporádicas tales como beet y fall armyworm. Cambios genotípicos (silenciamiento, sobreexposición) como fenotípicos en la planta final en comparación con los eventos individuales. No existe evidencia disponible que indique la ocurrencia de cambios genotípicos o fenotípicos adicionales a los esperados en la planta final en comparación con los eventos individuales. Salvo por la característica introducida de resistencia a insectos lepidópteros, la línea Bollgard II es equivalente a su contraparte convencional no transgénica. 6. Declaración sobre la existencia del impacto potencial en el medio ambiente que se pueda derivar de la liberación del organismo. No se esperan efectos en insectos no blanco que pudieran derivar de la liberación del OGM en el sitio específico. Sólo se espera que ocurra el impacto deseado (control) sobre los insectos lepidópteros. (Ver folio 000038 a 000078). Debido a que se ha demostrado que las proteínas B.t.k. presentes en la naturaleza son virtualmente no toxicas para peces, aves, insectos no blanco, mamíferos y otras especies no blanco y que la exposición de estas especies no es esperable debido a sus preferencias alimenticias, no se esperan efectos adversos para la fauna silvestre (posibles depredadores y organismos herbívoros) ni para la salud de los trabajadores. Se realizaron observaciones sobre las características agronómicas, de enfermedades y susceptibilidad a plagas del evento Bollgard II por tres años en más de 200 ensayos en campo en los Estados Unidos, además de numerosos estudios en invernadero y laboratorio. Todos los parámetros agronómicos medidos del evento Bollgard II se encuentran dentro del rango normal de variabilidad observado en variedades de algodón convencionales, salvo la diferencia intencional en el control de insectos lepidópteros. No se esperan impactos en el medio ambiente que pudieran derivar de la liberación del OGM en el sitio específico más allá del impacto deseado sobre los insectos lepidopteros. La combinación de las proteínas Cry2Ab y Cry1Ac, ambas con sitios de acción diferentes en los insectos blanco, provee una herramienta adicional para controlar el desarrollo de resistencia en los mismos a cualquiera de ambas proteínas. Cualquier insecto blanco que generara resistencia a una de las dos proteínas, aún sería controlado de manera efectiva por la otra proteína presente en el evento Bollgard II. Además, es altamente improbable que se genere resistencia en un área tan pequeña. En el improbable caso que algún insecto generara resistencia, la vegetación en los alrededores hace de hospedante y cumple la misma función que un área de refugio. 17 La proteína Cry1Ac expresada en el algodón Bollgard II muestra un rango muy estricto de especificidad para insectos lepidópteros y no posee efectos nocivos para organismos no blanco. Se encuentra disponible una gran cantidad de información sobre preparaciones microbianas conteniendo las proteínas Bacillus thuringiensis kurstaki, incluyendo la proteína Cry1Ac. La literatura ha establecido que las proteínas B.t.k.: • Son extremadamente selectivas para insectos lepidópteros (MacIntosh et al., 1990; Klausner, 1984; Aronson et al., 1986; Dulmage, 1981; Whitely and Schnepf, 1986). • Se unen específicamente a receptores en el intestino medio de insectos Lepidópteros (Wolfersberger et al. 1986; Hofmann et al. 1988ª; Hofmann et al. 1988b; Van Rie, et al. 1989; Van Rie, et al., 1990) • No tienen efectos nocivos sobre insectos benéficos no blanco, incluyendo predadores y parasitoides de insectos lepidópteros o abejas mellíferas (Apis mellifera) (Flexner et al., 1986; Krieg and Langenbruch, 1981; Cantwell et al., 1972; EPA, 1988; Vinson, 1989; Melón and Cozzi, 1989). Con respecto a la proteína Cry2Ab, se realizaron observaciones extensivas de insectos durante los ensayos de los años 1998 y 1999. El monitoreo se realizó en forma semanal desde la aparición de las infestaciones de larvas de lepidópteros. Los insectos blanco monitoreados fueron Heliothis virescens, Helicoverpa zea, Pectinophora gossypiella, Spodoptera frugiperda, Spodoptera exigua, Spodoptera ornithogolli, Psuedoplusia includens, Trichoplusia ni, Lygus lineolaris, Anthonomus grandis y Aphis spp. 7. Debe señalarse detalladamente el diseño experimental propuesto para la liberación al medio ambiente y sistema de producción Información disponible en el registro de este evento. 8. Cantidad total del organismo vivo modificado genéticamente que se va a liberar y que cantidad se utilizará para cada ensayo en caso de que se establezcan varios. Elaborar un calendario en el que se indiquen las prácticas agronómicas (p.e. siembra, transplante) y ensayos propuestos. Información disponible en el registro de este evento. 9. Anexar un mapa del sitio del ensayo indicando localización geográfica y la localidad exacta donde se establecen los ensayos del organismo vivo modificado, tomando en cuenta lo siguiente: Cuando varias construcciones genéticas sean probadas en diferentes localidades, indicar cuales construcciones son probadas para cada sitio. Cuando varios ensayos son aplicados para la misma localización, indicar la localidad específica para cada ensayo. Describir los usos que ha tenido o tienen los terrenos aledaños y el lugar donde se establecen los ensayos. En caso de organismos vivos modificados anexar un listado y descripción de las plantas tanto silvestres como cultivadas filogenéticamente relacionadas a la planta que pudiera ser receptores de polen transgénico. Especificar cuales son las dimensiones y área que ocupan los ensayos (no incluyendo bordes e hileras de material no modificado genéticamente). Así como descripción de los lugares de distribución del organismo vivo modificado (p.e. invernadero, laboratorio, cámaras de crecimiento). Información disponible en el registro de este evento. 18 10. Detallar los procedimientos y medidas de bioseguridad que se usarán para prevenir la contaminación, escape y diseminación sin control del producto. Durante todo el proceso, personal de Bayer mantendrá una estricta supervisión, a la vez se procederá a capacitar a los trabajadores y otros involucrados para que estos velen por las medidas de seguridad necesarias. Todo el material que se importe será sembrado en los campos que para ese fin se escogieron, en el caso de eliminar plantas estas serán desvitalizadas por labranza, herbicida o por eliminación manual, recogidas en sacos de polipropileno e incineradas en el mismo campo donde se plantó. Todo el material cosechado será transportado en sacos de polipropileno cerrados desde el campo, contenidos estos en un vagón (trailer) o camión totalmente cerrados, los cuales serán escoltados por otro vehículo donde sus ocupantes velarán por evitar una diseminación. Todos los tractores e implementos que ingresen en el campo serán profundamente limpiados antes y después de ingresar al campo, será rutinaria la inspección de estos equipos. 11. Descripción detallada del método propuesto de disposición final del organismo vivo modificado al término del experimento, así como la disposición final o limpieza de otros materiales que hayan tenido contacto con el material transgénico durante el ensayo. Toda la semilla cosechada será exportada hacia Los Estados Unidos y los rastrojos serán destruidos. Durante la estación lluviosa los campos permanecerán en barbecho o con arroz, donde se les mantendrá roturados eliminando así las plantas voluntarias, si las condiciones del tiempo no permiten roturar se procederá a controlar plantas voluntarias con aplicaciones de herbicidas hormonales o mediante control manual. Todos los equipos que ingresen en los campos plantados serán limpiados antes de abandonar estos campos. Para esto el personal de Bayer establecerá un sistema de inspección de equipos y se mantendrán capacitaciones periódicas en Bioseguridad al personal involucrado. El personal que trabaje con ese material estará previamente capacitado por personal debidamente autorizado por el Programa de Biotecnología, con la actualización de los protocolos de bioseguridad de la compañía. 12. Historial de liberaciones anteriores, indicando lugar, numero de permiso y fecha de autorización En Costa Rica se aprobó la siembra regulada en 1998 desde entonces se ha continuado plantando. En relación a las autorizaciones concedidas a Monsanto en los Estados Unidos para la realización de pruebas de campo con estos eventos por parte del USDA, se puede acceder directamente a través del sitio en internet http://www.nbiap.vt.edu/cfdocs/fieldtests1.cfm (en la página incluir la lista de “organism” y cuando ésta se despliega seleccionar “cotton”). LUGAR Australia Estados Unidos Brasil China Costa Rica (Eval. Riesgo) Burkina Faso India Sud Africa PERMISO DIR 012-2002 00-342-01p 1832/2009 AGC(2006)052 ID registro BCH: 43298 FECHA DE AUTORIZACIÓN 2002 2002 2009 2008 2006 2003 19 BIBLIOGRAFÍA Adang, M.J. et al., 1985. “Characterized Full-length and Truncated Plasmid Clones of the Cristal Protein of Bacillus thuringiensis subsp. kurstaki HD-73 and Their Toxicity to Manduca sexta”, Gene 36:289-300 Aronson, A.I., et al., 1986. “Bacillus thuringiensis and Related Insect Pathogens”, Microbiol., Rev. 50:1-24. Calgene, Inc. 1993. kanR gene: Safety and Use in the Production of Genetically Engineered Plants. Conversion of Request for an Advisory Opinion to a Food Additive Petition for aminoglycoside 3’phosphotransferase II in Tomatoes, Cotton, and Oil Seed Rape. FDA Docket Number: 90A-0416. Cantwell, G.E., et al., 1972. “Are Biological Insecticides Harmful to the Honey Bees” Am. Bee J. 112:294-296. Christou, P., D. E. McCabe, and W. F. Swain 1988. Stable transformation of soybean callus by DNAcoated gold particles. Plant Physiology, 87:671-674. Dankocsik, D., et al., 1990. Activation of a cryptic crystal protein gene of Bacillus thuringiensis subspecies kurstaki by gene fusion and determination of the crystal protein insecticidal specificity. Molecular Microbiology 4(12):2087-2094. De Block, M. et al., 1984. Expression of Foreign Genes in Regenerated Plants and in Their Progeny. EMBO J. 3:1681-1689. DeBlock, M., Herrera-Estrella, L., Van Montagu, M., Schell, J., and Zambryski, P. 1984. “Expression of foreign genes in regenerated plants and in their progeny”, EMBO J. 3:1681-1689. Dulmage, H.T. 1981. In “Microbial Control of Pests and Plant Diseases 1970-1980”. (ed. Burges, H.D.) pp. 193-222, Academic Press, London. EPA. 1988. Guidance for the Reregistration of Pesticide Products Containing Bacillus thuringiensis as the Active Ingredient. NTIS PB 89-164198 EPA. 1998. R.E.D. Facts: Bacillus thuringiensis. EPA 738-F-98-001. Fischhoff, D.A. et al., 1987. Insect Tolerant Transgenic Tomato Plants. Bio/Technology 5:807-813. Flavell, R.B., et al., 1992. Selectable Marker Genes: Safe for Plants? Bio/Technology 10:141-144. Flexner, J.L. et al. 1986. “The Effects of Microbial Pesticides on Non-Target Beneficial Arthropods”, Agric. Ecosys. Environ. 16:203-254. Geiser, M., et al., 1986. “The Hypervariable Region in the Genes Coding for Entomopathogenic Cristal Proteins of Bacillus thuringiensis: Nucleotide Sequence of the kurhd1 Gene of subsp Kurstaki HD1”, Gene 48:109-119. Hofmann, C. et al., 1988a. “Binding of the Delta Endotoxin from Bacillus thuringiensis to BrushBorder Membrane Vesicles of the Cabbage Butterfly (Pieris brassicae)”, Eur. J. Biochem. 173:8591. 20 Hofmann, C. et al., 1988b. “Specificity of B. thuringiensis Delta-Endotoxins is Correlated with the Presence of High Affinity Binding sites in the Brush Border Membrane of Target Insect Midguts”, Proc. Natl. Acad. Sci. USA 85:7844-7848. Höfte, H., de Greve, H., Seurinck, J., Jansens, S., Mahillon, J., Ampe, C., Vandekerckhove, J., Vanderbruggen, H., van Montagu, M., Zabeau, M., Vaeck, M. 1986. Structural and functional analysis of a cloned delta endotoxin of Bacillus thuringiensis berliner 1715. Eur. J. Biochem. 161, 273-280. (MRID 464551-02). Horsch, R.B. et al., 1984. Inheritance of Functional Foreign Genes in Plants. Science 223:496:498. Horsch, R.B., Fraley, R.T., Rogers, S. G., Sanders, P.R., Lloyd, A. and Hoffmann, N. 1984. Inheritance of functional foreign genes in plants. Science 223:496-498. Hutmacher, R. Vargas, R., Wright, S. 2006. Methods to enable the coexistance of diverse cotton production systems. Agricultural Biotechnology in California Series. Publication 8191. 6 pp. Jefferson, R.A. et al., 1986. ß-Glucuronidasa from Escherichia coli as a gene-fusion marker. Proc. Natl. Acad. Sci. USA 83:8447-8451. Jefferson R.A. et al., 1987. GUS Fusions : ß-D-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. The EMBO Journal 6 (13):3901-3907. Jefferson, R. A, S. M. Burgess, and D. Hirsch. 1986. β-Glucuronidase from Escherichia coli as a gene-fusion marker. Proc. Natl. Acad. Sci. USA 83:8447-8451. Kareiva P., Morris W., Jacobi C. 1994. Studying and managing the risk of cross-fertilization between transgenic crops and their wild relatives. Molec. Ecology. 3. 15-21. Klausner, A. 1984. “Microbial Insect Control”, Bio/Technology 2:408-419 Krieg, A. and Langenbruch, G.A. 1981. “Susceptibility of Arthropod Species to Bacillus thuringiensis”, In “Microbial Control of Pests and Plant Diseases”, (ed. H. D. Burges) pp. 837-896. Academic Press, London. MacIntosh, S.C. et al., 1990. Specificity and efficacy of purified Bacillus thuringiensis proteins agains agronomically important insects. J. Invert. Path. 56:258-266. McCabe, D. E., W. F. Swain, B. J. Martinell, and P. Christou. 1988. Stable transformation of soybean (Glycine max) by particle acceleration. Bio/Technology, 6:923-926. Melón, B.E. and Cozzi, E.M. 1989. In “Safety of Microbial Insecticides”, (eds. Laird, M., Lacey, L.A. and Davidson, E.W.) pp. 150 m-167. CRC Press, Boca Raton, FL. Meredith W.R., Bridge R.R. 1973. Natural crossing in cotton Gossypium hirsutum L. in the delta of Mississippi. Crop Sci. 13. 551-552. Oshima, A. et al., 1987. Cloning, sequencing and expression of cDNA for human ß-glucuronidase. Proc. Natl. Acad. Sci. USA 84:685-9. Perlak, F.J. et al., 1990. “Insect Resistant Cotton Plants”, Bio/Technology 8:939-943. Perlak F.J. et al., 1991. “Modification of the Coding Sequence Enhances Plant Expression of Insect Control Protein Genes”, Proc. Natl. Acad. Sci. USA 88:3324-3328. Pruett, C., et al, 1980. “Effect of Exposure to Soil on Potency and Spore Viability to Bacillus thuringiensis”. J. Invert. Pathol. 35:168-174. Schlaman, H.R. et al., 1994. Nucleotide sequence corrections of the uidA open reading frame enconding beta-glucuronidase. Gene 138:259-260. 21 Schnepf, E., Crickmore, N., Van Rie, J., Lereclus, D., Baum, J., Feitelson, J., Zeigler, D.R. and Dean, D.H. (1998). Bacillus thuringiensis and its pesticidal crystal proteins. Microbiology and Molecular Biology Reviews 62, No. 3, 775-806. (MRID 464551-02)] Southern, E.M. 1975. “Detection of specific sequences among DNA fragments separated by gel electrophoresis”, J. Mol. Biol. 98:503-517. Van Rie, J., et al., 1989. Specificity of Bacillus thuringiensis delta-Endotoxins, Importante of Specific Receptors on the Brush Border Membrana of the Mid-Gut of Target Insects. Eur. J. Biochem. 186:239-247. Van Rie, J., et al., 1990. Receptors on the Brush Border Membrana of the Insect Midgut as Determinants of the Specificity of Bacillus thuringiensis Delta-Endotoxins. Appl. Environ. Microbiol. 56:1378-1385. Vinson, S.B. 1990. “Potential Impact of Microbial Insecticides on Benefical Arthropods in the Terrestrial Environment”. In “Safety of Microbial Insecticides, (eds. Laird, M., Lacey, L.A. and Davidson, E.W.) pp. 43-64. CRC Press, Boca Raton, FL. Wang, C.C. and O. Touster. 1972. Studies of Catalysis by ß-Glucuronidase: the effect of structure on the rate of hydrolysis of sybstituted phenyl ß-D-glucopyranosiduronic acids. J. Biol. Chem. 247:2650-2656. West, A.W. 1984. Fate of the Insecticidal, Proeinaceous Parasporal Crystal of Bacillus thuringiensis in Soil. Soil Biol. Biochem. 16:357-360. Whitely, H.R. and Schnepf, H.E. 1986. “The Molecular Biology of Parasporal Crystal Body Formation in Bacillus thuringiensis”. Ann. Rev. Microbiol. 40:549-576. Widner, W.R. et al., 1990. Location of the Dipteran Specificity Region in a Lepidopteran-Dipteran Crystal Protein from Bacillus thuringiensis. J. Bacteriol. June: 2826-2832. Wolfersberger, M.G., et al., 1986. In “Bacterial Protein Toxins” (eds. Falmagne, P., et al) pp 237-238. Fisher, New York. 22 23