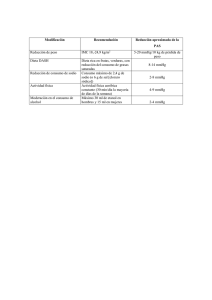
IV PRIODO Complete la siguiente tabla teniendo en cuenta la
Anuncio

IV PRIODO 1. Complete la siguiente tabla teniendo en cuenta la información suministrada en la misma y utilizando adecuadamente la formula correspondiente a los datos entregados en la misma. FORMULA P1 345mmHg ? 123mmHg --789mmHg T1 33°C 28°C 17°C ? ? V1 1232 mL 889mL --345mL 1234mL 2. Una muestra de monóxido de carbono ocupa 250 L. a una temp. de 100 ºC. Calcule la temperatura del gas cuando este posee 140 L. 3. ¿Cuál será la temperatura final de un gas que se encuentra en un recipiente que inicialmente tenía 34 L a 45 °C y su volumen final fue de 23 L? 4. Un gas está en un recipiente de 2 L a 20 °C y 560 mmHg ¿a qué temperatura llegara el gas si aumenta la presión interna hasta 760 mmHg? 5. Una masa gaseosa ocupa un volumen de 5.2 L a 12 °C y 4520 mmHg. ¿Cuál es el volumen del gas si la temperatura aumenta a 38 °C y la presión se incrementa al doble de la inicial? 6. Una masa de gas nitrógeno a una presión de 760 mm Hg y a una temperatura de 77°C, ocupa un volumen de 12,31. El volumen de dicho gas cuando su temperatura es de 27°C es: A. 18,45 l B. 8,20 l C. 4,10 l D. 36,90 l 7. Jerry infló un globo cuya capacidad es de 650mL al nivel del mar (760 mmHg), y se desplazó 7.8 Km. En la nueva región, la presión es 1350 mmHg. Siendo la temperatura constante, ¿Cuál es el volumen final del globo? 8. Una nuestra de aire ocupa 3800 mL cuando la presión es 980 mmHg. a. ¿Qué volumen ocupa a 6.6 Atm. b. ¿Qué presión se requiere, para poder comprimirlo a 75 mL? (La temperatura se mantendrá constante). 9. Determinar el volumen de un gas que contiene 432g de permanganato de potasio, a un temperatura de 16 ºC, y una presión de 623 mmHg. P2 ? 234mmHg ? --18g CO2 T2 45°C --34°C 18°C --- V2 980 mL 234mL --435mL --- 10. A que temperatura se encuentra un recipiente que presenta un volumen de 980mL, una presión de 789 mmHg, ya que este recipiente posee 98.36g de ácido sulfúrico. 11. Una masa gaseosa ocupa un volumen de 5.2 L a 12 °C y 4520 mmHg. ¿Cuál es el volumen del gas si la temperatura aumenta a 38 °C y la presión se incrementa al doble de la inicial? 12. Teniendo en cuenta la información de la tabla determinar Nombre Ácido Sulfúrico Agua Permanganato de Potasio Hidróxido de Sodio Nitrato Férrico Ácido Acético a. b. c. d. e. Formula H2SO4 H2 O KMnO4 NaOH Fe(NO3)3 C2H2O2 Peso 98g 18g 158g 40g 242g 58g Porcentaje referido a la masa de una solución que contiene 18g de NaCl y 77g de Agua Concentración molar de una solución que contiene 38g de ácido sulfúrico y 980mL de solución Fracción molar de una solución que contiene 33g de nitrato férrico y 108g de agua Concentración molal de una solución que contiene 12g de permanganato de potasio y 765g de solución El vinagre es una solución de ácido acético en agua. Por cada 75 g de ácido acético (C2H2O2) se tiene una concentración 2,3 M. que volumen se necesita para esta cantidad de soluto. 13. Si cierta masa de gas, a presión constante, llena un recipiente de 20 litros de capacidad a la temperatura de 124ºC, ¿qué temperatura alcanzará la misma cantidad de gas a presión constante, si el volumen aumenta a 30 litros? 14. Si 20 litros de aire se colocan dentro de un recipiente a una presión de 1 atm, y se presiona el gas hasta alcanzar el valor de 2 atm. ¿Cuál será el volumen final de la masa de aire si la temperatura se mantiene constante? 15. Si el volumen resulta ser de 4 litros y la temperatura 20ºC, y calentamos el aire hasta 200ºC ¿cuál será el Volumen de aire (del recipiente)?. ¿Y si lo enfriamos hasta 0ºC