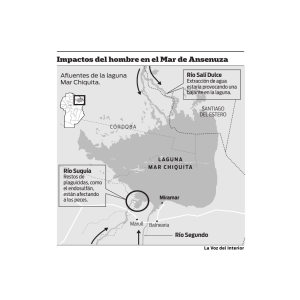
Bases para la conservación y manejo de la - unesdoc
Anuncio

U r u g u a y BASES PARA LA CONSERVACION Y MANEJO DE LA PUNA Y CORDILLERA FRONTAL DE ARGENTINA. EL ROL DE LAS RESERVAS DE BIOSFERA Editores Jorge Luis Cajal Javier García Fernández Rodolfo Tecchi Fundación para la Conservación de las Especies y del Medio Ambiente Editores: CAJAL, Jorge Luis Biólogo. Presidente del Comité Científico de la Fundación para la Conservación de las Especies y del Medio Ambiente (FUCEMA). Con experiencia en haber dirigido proyectos científicos en las reservas de biosfera de San Guillermo, Laguna Blanca y Laguna de Pozuelos. Miembro de la Comisión Mundial de Areas Protegidas (CMAP) de la UICN. GARCIA FERNANDEZ, Javier Biólogo. Coordinador del Proyecto Nacional de Conservación de la Biodiversidad de la Argentina (GEF-Comité Argentino de la UICN-PNUD). Miembro del Comité Redactor del Documento Introductorio al II Congreso Mundial de Reservas de la Biosfera, Sevila, 1995. TECCHI, Rodolfo Biólogo. Coordinador del Programa de Ecología Regional del Instituto de Biología de la Altura, Universidad Nacional de Jujuy. Miembro del Comité Consultivo sobre Reservas de Biosfera del Programa MAB-UNESCO. La obra fue realizada en el marco del Programa de Participación 96/97 de la UNESCO AGRADECIMIENTOS Especialmente a María Inés Di Somma, por haber colaborado activamente en las tareas logísticas de la obra y haber dedicado gran esfuerzo en transcribir los diferentes capítulos. Impreso en 1998 por la Oficina UNESCO (Uruguay) ISBN 92-9089-062-2 Fotos Tapa: Reserva de Biosfera Laguna de Pozuelos - Vicuñas Reserva de Biosfera Laguna Blanca, Catamarca - Producto de las huertas familiares Reserva de Biosfera San Guillermo INDICE Presentación........................................................................................... 5 SECCION I EL ESCENARIO: LA PUNA Y CORDILLERA FRONTAL Capítulo 1: Las unidades morfoestructurales, el clima, la vegetación y las poblaciones humanas en la Puna y Cordillera Frontal............................9 Capítulo 2: Las áreas naturales protegidas en la región andina correspondientes a la Puna y Cordillera Frontal........................................................................25 SECCION II ESTUDIOS SOBRE LA VEGETACIÓN Y LA FAUNA EN LA PUNA Y CORDILLERA FRONTAL Capítulo 3: La vegetación en la Reserva de Biosfera Laguna de Pozuelos....................43 Capítulo 4: Los artrópodos en la Reserva de Biosfera Laguna de Pozuelos...................61 Capítulo 5: Herpetofauna.................................................................................................75 Capítulo 6: La avifauna andina........................................................................................81 Capítulo 7: Una especie frágil: el ñandú petizo..............................................................103 Capítulo 8: Aves de laguna: los flamencos. Estrategias de la alimentación en grupos multiespecíficos.....................................................115 Capítulo 9: Patrón de uso de habitat en roedores cricétidos en la Reserva de Biosfera Laguna de Pozuelos..........................................131 Capítulo 10: Uso de habitat por vicuñas y guanacos en la Reserva de Biosfera San Guillermo....................................................143 Capítulo 11: Densidad poblacional y dinámica de los grupos familiares de guanacos y vicuñas en la Reserva de Biosfera San Guillermo..............167 Capítulo 12: El mayor carnívoro de los Andes: el puma..................................................175 Capítulo 13: La comunidad de carnívoros en la Reserva de Biosfera Laguna de Pozuelos....................................................................................181 Capítulo 14: Camélidos silvestres y mortalidad por tormentas de nieve en la Cordillera Frontal de la Provincia de San Juan.........................189 Capítulo 15: Densidad, biomasa y diversidad de mamíferos en la Puna y Cordillera Frontal.............................................................................197 SECCION III LA PRODUCCION EN LA PUNA Capítulo 16: Una propuesta de innovación metodológica en la determinación de los caracteres morfológicos y morfométricos en la población de camélidos sudamericanos domésticos en la cuenca de la Laguna de Pozuelos...........................................................................223 Capítulo 17: Análisis del mercado de pelos finos de camélidos sudamericanos de la Argentina...................................................................233 Capítulo 18: La frontera agropecuaria en un humedal del altiplano argentino................257 SECCION IV CONSERVACION EN LA PUNA Y CORDILLERA FRONTAL Capítulo 19: La conservación de los camélidos silvestres en la Puna y Cordillera Frontal......................................................................................273 Capítulo 20: Potencial de conservación y factores de amenaza en la Puna y Cordillera Frontal.........................................................................297 Capítulo 21: Las Reservas de Biosfera en el contexto de la conservación de la diversidad biológica de la región.........................................................307 BIBLIOGRAFIA..................................................................................... 319 La presente obra reúne una serie de trabajos científicos realizados en las tres Reservas de Biosfera de la Red Mundial del Programa El Hombre y la Biosfera (MAB) de UNESCO, ubicadas en el altiplano y Cordillera Frontal de la Argentina. Se trata de las Reservas de Biosfera de San Guillermo, Laguna Blanca y Laguna de Pozuelos. Las distintas contribuciones se han ordenado en cuatro secciones. En la primera se describe el escenario natural en el que se han designado las tres reservas. Se resumen las principales características ambientales, de las áreas naturales protegidas y de las comunidades rurales que allí se asientan. En la segunda sección se presentan trabajos con importantes datos de campo sobre los componentes bióticos de las Reservas y su entorno. Se reúnen trabajos inéditos y actualizaciones de otros ya publicados anteriormente, pero cuya inclusión se resolvió en la medida en que completan una visión acabada de las cualidades de los ecosistemas estudiados y sus componentes. La tercera sección brinda información sobre aspectos productivos, principalmente los referidos a la actividad ganadera. Finalmente la última sección comprende contribuciones acerca de las formas actuales de conservación, sus fortalezas y debilidades y las perspectivas hacia el futuro. Una de las tres funciones de las Reservas de Biosfera es la logística y dentro de ésta la de facilitar actividades que generen un mayor conocimiento de los componentes y procesos que tienen lugar en los ecosistemas protegidos, para sustentar mejores y más efectivas medidas de conservación. Esto ha sido ratificado en el Marco Estatutario y en la Estrategia de Sevilla, surgidos del Congreso Mundial de Reservas de Biosfera organizado por la UNESCO, en 1995, en esa ciudad española. La presente obra apunta en este sentido, pues reúne la mayor parte de los aportes científicos realizados hasta el presente en estas tres Reservas de Biosfera que han sido designadas en ecosistemas de montaña de la Argentina. La categoría de Reserva de Biosfera, sigue siendo en el presente el aporte más apropiado para alcanzar el equilibrio en el difícil juego de los distintos intereses por la conservación de la naturaleza y por el aprovechamiento de los recusos naturales. Estas Reservas son, en síntesis, una adecuada forma práctica de abordar el concepto del desarrollo sustentable. Rodolfo Tecchi Miembro del Comité Consultivo sobre Reservas de Biosfera del Programa MAB - UNESCO. EL ESCENARIO: PUNA Y CORDILLERA FRONTAL CAPITULO 1 LAS UNIDADES MORFOESTRUCTURALES, EL CLIMA, LA VEGETACION Y LAS POBLACIONES HUMANAS EN LA PUNA Y CORDILLERA FRONTAL Jorge Luis Cajal 1 Unidades morfoestructurales de la región En la región andina de Argentina se encuentran dos unidades morfoestructurales bien definidas geológicamente: la Puna y la Cordillera Frontal (Fig. 1). Según Bonaparte (1978) la Puna argentina representa el extremo sudoriental de la faja andina denominada altiplano, con alturas que superan los 3.000 msnm. La Puna está surcada por cadenas montañosas y volcanes que se elevan hasta más de 6.000 msnm, con cuencas endorreicas que han originado grandes lagunas como la de Pozuelos, en la Provincia de Jujuy y numerosos salares como las Salinas Grandes y Olaroz en la Provincia de Jujuy, de Arizaro, Pocitos y Antofalla en las Provincias de Salta y Catamarca. 1 FUCEMA. Pringles 10 (1183) Buenos Aires, Argentina. Capítulo 1: Las unidades morfoestructurales 10 Al oeste, la Puna argentina está separada de la chilena por las altas cumbres que definen el límite internacional con Chile, al este por la Cordillera Oriental y las Sierras Pampeanas, al norte se continúa con la Puna boliviana y al sur su límite varía según los autores. Para González Bonorino terminaría en las Sierras de Fiambalá, Catamarca (27° 15’ S); para Turner en el borde austral de la Cordillera de Buenaventura, Catamarca (26° 45’ S), mientras que para González y Aceñolaza llegaría hasta el noroeste de la Provincia de La Rioja (28° 30’ S) (Bonaparte, 1978). La Cordillera Frontal se encuentra al este de la Cordillera Principal, en forma de una franja de dirección norte-sur de unos 50-70 km de ancho, desde el límite sur de la Puna hasta el río Diamante (34° 40’ S) en el centro oeste de la Provincia de Mendoza. En su extremo norte la Cordillera Frontal y la Precordillera se confunden en una unidad morfoestructural, hacia el Sur adquieren su individualidad pero preservando diversos rasgos comunes en su constitución geológica. En la Provincia de San Juan se las nota claramente separadas. Desde Cacheuta en la Provincia de Mendoza (33° S) hacia el Sur falta la Precordillera, con lo cual la Cordillera Frontal se presenta como el cordón andino más oriental. Para una descripción detallada de la geomorfología y estratigrafía de ambas unidades ver Bonaparte (1978). Los cambios durante el Pleistoceno han llevado a postular como hipótesis que los ciclos interglaciales ocurridos dieron lugar al escenario típico para la especiación, tanto de la flora como de la fauna (Vuilleumier, 1971; Vuilleumier y Simberloff, 1980). Esto habría posibilitado el posterior contacto de las especies y el alto grado de simpatría que se observa en algunos taxones (ver Capítulos 6 y 15). Clima El clima de la puna es seco y frío, con grandes contrastes de temperatura entre el día y la noche. Las precipitaciones invernales son en forma de nevada y granizada y las estivales son básicamente pluviales. Las precipitaciones pluviales disminuyen en general de Norte a Sur y de Este a Oeste (Cabrera, 1968) (Fig. 2). Según Frenguelli (1928), el examen climatológico de la Puna de Atacama lleva a suponer que los Capítulo 1: Las unidades morfoestructurales 11 actuales salares han sido cuencas lacustres similares a las que todavía existen en la parte húmeda del Altiplano. Este autor alertaba sobre una progresiva desertización desde el sudoeste hacia el nordeste como consecuencia de una tendencia a menores precipitaciones pluviales. Igarzábal (1991) refiriéndose a la laguna de Pozuelos (Jujuy), señala que hasta la década de los años 50, la laguna registró ligeras expansiones que no se repitieron hasta el presente (1991), desde entonces ocurrieron diversas contracciones, con desecamientos parciales, o casi totales, que repercutieron en la flora y la fauna. El mismo autor señala similares características que acompañaron a la evolución de la laguna de Guayatayoc (50 km al sur de Pozuelos), a la que converge la más extensa red hidrográfica de la Puna, pero que en la actualidad está afectada por un avanzado proceso de desecamiento. En relación con las precipitaciones, Cabrera (1968) define tres zonas bien marcadas: la Puna húmeda, situada en la parte septentrional y oriental con abundantes ríos y lagunas (400 mm); la Puna seca, situada al sur y al oeste de la anterior, con ríos y lagunas pero también con salares (100-400 mm); y la Puna desértica o de Atacama situada en la parte occidental y austral, donde no hay ríos ni lagunas, solamente vegas y grandes salares (< 100 mm). En la Cordillera Frontal, las precipitaciones no tienen un comportamiento homogéneo, las mismas presentan dos regímenes: uno hacia el oeste donde se encuentran las grandes alturas de neta influencia pacífica, con precipitaciones invernales (abril-agosto, con máximas precipitaciones en mayo-junio del orden de 75 mm) en forma de nevada y granizada y sequía estival (precipitaciones inferiores a 10 mm/ mes) debido al desplazamiento de la circulación general hacia el sur, que determina la prevalencia del cinturón tropical de alta presión con sequía en el oeste (alta cordillera) y otro en el este con precipitaciones (alturas más bajas) del orden de 10 a 25 mm/mes (noviembre-marzo). El total de precipitaciones es de 400-500 mm/año en el oeste y de 100-200 mm/año en el este. La presencia de cuerpos de agua permanente se debe a las precipitaciones invernales en la alta cordillera y a su posterior deshielo (Cajal et al., 1981). A diferencia de la Puna, las nevadas en la Cordillera Frontal son importantes con características excepcionales por su intensidad en determinados años. En la Puna, tomando los datos de la Cuenca de Pozuelos (Tecchi, 1992), la temperatura media anual en el fondo de la cuenca es de 9° C. En sitios a mayor altitud (> 4500 msnm), disminuye a registros entre 0° y 4° C. La amplitud térmica diaria, que es una de las principales características del clima, puede alcanzar los 30° C. Capítulo 1: Las unidades morfoestructurales 12 En la Cordillera Frontal, la media anual oscila entre los 5° C en la parte baja del este y -5° C en los altos del oeste. El mes más frío es julio con medias inferiores a los -15° C al oeste y 0° C al este, mientras que el mes más cálido es enero, que presenta una media entre los 10° C y 15° C al este y 0° C al oeste. Los vientos en la Puna (tomando la información de la cuenca de Pozuelos), son secos fríos e intermitentes. Soplan principalmente a mediodía a una velocidad promedio de 20 a 30 km/h (Igarzábal, 1974). En la Cordillera Frontal, los vientos son muy fuertes, predominando los provenientes del noroeste. En las zonas de las altas cumbres dominan los vientos intensos de la atmósfera libre durante todo el año, pudiendo alcanzar los 200 km/h (Cajal et al., 1981). Otros vientos típicos de estos ambientes, que ocurren principalmente sobre territorio de San Juan, son las brisas de montaña y valle y el Zonda (Prohaska, 1962). Debe decirse que en toda esta amplia región comprendida por al Puna y Cordillera Frontal, las estaciones meteorológicas permanentes son escasas. Vegetación Las comunidades vegetales de la Puna son bastantes homogéneas a lo largo de todo el territorio, manteniéndose en las partes más secas las mismas comunidades de las partes húmedas, aunque más empobrecidas (Cabrera, 1968). Fitogeográficamente la Puna alcanza los 33° S (Hunziker, 1952). Cabrera (1958, 1968) diferencia dos provincias fitogeográficas: la Puneña entre los 3.000 y 4.300 msnm y la Altoandina (> 4.300 msnm) (BOX 1). La provincia fitogeográfica puneña se caracteriza por la dominancia de los hemicriptófitos y la gran abundancia de los nanofanerófitos y terófitos. Las comunidades más importantes son las siguientes: 1.- Fabiana densa, Psila boliviensis y Adesmia horridiscula; 2.- Psila boliviensis; 3.- Parastrephia lepidophylla; 4.- Festuca spp (en suelos húmedos y salobres); 5.- Pennisetumm spp (en suelos arenosos y húmedos). Estas cinco comunidades principales comprenden una mezcla de arbustos y gramíneas incluyendo en algunos lugares los bosquecillos compuestos por el género Polylepis. Capítulo 1: Las unidades morfoestructurales 13 BOX 1 El escenario se ubica en las siguientes provincias y distritos fitogeográficos de Cabrera (1976): Provincia Puneña Provincia Altoandina Distrito Altoandino Quechua (límite con Bolivia hasta San Juan). Se corresponde con las siguientes ecoregiones de Dinerstein et al. (1995): Pastizales montanos de los Andes centrales Puna de los Andes centrales (Central Andean Puna) Puna árida de los Andes centrales (Central Andean dry Puna) Evolutivamente la Puna y Cordillera Frontal están estrechamente relacionadas con la Patagonia, encontrándose géneros vegetales comunes (Adesmia, Chuquiraga, Fabiana, Lepidophyllum, Nardophyllum). También presentan conexiones con la región fitogeográfica del Monte. La región bajo estudio, correspondiente a la Puna y parte de la Cordillera Frontal, cubre aproximadamente una superficie de 152.000 km2, el 5 % del territorio nacional continental, abarcando parte de las provincias de Jujuy, La provincia Altoandina, presenta además de los hemicriptófitos dominantes, una gran abundancia de caméfitos y geófitos. Existen tres comunidades principales: 1.- Festuca y Poa, cojines de Azorella y Adesmia la presencia Deyeuxia; 2.- Stipa frígida, en zonas secas; 3.-Oxychloe y Carex, características de las vegas altoandinas Como ya se dijera, la provincia fitogeográfica puneña y la altoandina se prolongan más hacia el sur, llegando hasta el norte de la Provincia de Mendoza. Roig (1960) sugiere considerar como un distrito diferente la Capítulo 1: Las unidades morfoestructurales 14 vegetación de tipo puneño que se encuentra en la Precordillera de San Juan y en el extremo norte de Mendoza (ver Cabrera, 1971; 1976). Hunziker (1952) define las siguientes comunidades para la cordillera de la Provincia de La Rioja: 1.- Ephedra breana, Junella seriphioides, Nardophyllum armatum y Lampaya schickendantzii; 2.- Ephedra multiflora; 3.Ephedra breana. En esta región se nota la ausencia de varias dominantes de las comunidades más septentrionales y la presencia, como dominantes, de especies no muy abundantes en el norte. Entrando en territorio de San Juan, se repiten los elementos vegetales del Dominio Andino, presentándose también, el Dominio Chaqueño con su provincia fitogeográfica del Monte, aunque con escasa importancia areal. Esta ocupa una estrecha faja sobre el límite oriental, desde las cotas inferiores de la misma (> 2.000 hasta los 3.100 msnm), penetrando en las alturas mayores por las quebradas y los valles de ríos y arroyos. La fisonomía dominante en éstas áreas es la del matorral ralo, con un estrato herbáceo de muy baja densidad o inexistente. Los arbustos son por lo general bajos, de 0,60 a 1,50 m de altura. Las especies dominantes son nanofanerófitos resinosos, de hojas pequeñas, áfilos o parcialmente áfilos, principalmente Zigophyllaceas del género Larrea (L. nitida y L. divaricata), que le dan su nombre a la comunidad (jarillal). Otra especie de la misma familia, Bulnesia retama (retamo) componente de la comunidad típica (Hunziker, 1952) sólo llega hasta los 2.700 msnm, no encontrándose a mayores alturas. Esta comunidad no habita suelos con elevado tenor salino, siendo reemplazada allí por especies arbustivas tolerantes como Suaeda divaricata, Allenrolfea vaginata (jumes) y Atriplex lampa (zampa) (Hunziker, 1952). En las alturas superiores a los 2.900 msnm comienzan a aparecer, en transición, especies arbustivas de los pisos inferiores de la provincia puneña, como la solanacea Fabiana denudata (tola o pichanilla), la verbenácea Acantholipia riojana y la compuesta Artemisia mendozana (ajenjo). Esta transición correspondería a la denominada “estepa de arbustos bajos” de Morello (1958). A partir de los 3.200 msnm aproximadamente comienza a predominar la vegetación puneña. Las alturas máximas de esta provincia fitogeográfica corresponden a los 3.600 a 3.700 msnm. La comunidad clímax presenta una asociación en la que predominan los nanofanerófitos de 0,50 a1,50 m de altura, por lo general espinosos, con resinas, de hojas coriaceas, pilosas, pequeñas o reducidas a escamas. Las dominantes son solanaceas del Capítulo 1: Las unidades morfoestructurales 15 género Lycium (L. chilensis principalmente), conocidas como pinchaguas, leguminosas como Adesmia (A. horrida, A. pinnifolia) conocidas como acerillos, compuestas como Senecio oreophyton (chachacoma), acompañadas en el estrato herbáceo por hemicriptófitas del género Stipa. En los llanos o altipampas, a los 3.200 msnm aproximadamente, aparece Fabiana denudata junto a Stipa spp, Adesmia horrida, Lycium spp y Mahiueniopsis glomerata (quisco). A mayores alturas, Stipa spp es dominante en las laderas, mientras que en los llanos además de Stipa spp se hallan Adesmia horrida, A. pinnifolia, Mahiueniopsis glomerata, Atriplex spp, Artemisia mendozana, Verbena spp, Senecio spp. En las vegas que aparecen en el fondo de los valles, en cauces de ríos y arroyos, o donde existen manantiales, domina la gramínea hemicriptófita Festuca scirpifolia y la juncácea geófita Juncus balticus. Son frecuentes además, las gramíneas Hordeum halophillum (hemicriptófito), Distichlis humilis (geófito) y Muhelembergia asperifolia (geófito). A partir de los 3.500 hasta los 3.700 msnm comienza la “estepa abierta xerófila de la provincia altoandina” (Hunziker, 1952), la que se extiende hasta el límite altitudinal de la vegetación (4.300-4.700 msnm). Dominan las gramíneas de 10 a 25 cm de altura, que forman matas globosas muy esparcidas, y las caméfitas pulvinadas o en placas. Los arbustos están frecuentemente orientados en el sentido de la pendiente y son muy abundantes las matas circulares o semicirculares originadas por procesos de criofluxión, por efectos de la nieve y acumulación de sedimentos (Ruíz Leal, 1959). Las gramíneas dominantes pertenecen al género Stipa (S. chrysophylla, S. frigida, S. speciosa). Son hemicriptófitos que dejan grandes espacios de suelo desnudo entre matas. Son también muy abundantes los caméfitos como la leguminosa Adesmia nanolignea y Calceolaria pinifolia. En las vegas, con las características descriptas para la provincia puneña, hay predominancia de juncáceas como Oxychloe spp. Características adaptativas de la vegetación Según Ruthsatz y Movia (1975), los factores ecológicos más activos Capítulo 1: Las unidades morfoestructurales 16 en las estepas andinas son: la disponibilidad de agua, las heladas intensas y frecuentes y el pastoreo de herbívoros domésticos. La fenología o estructura externa de las plantas, muestra, en respuesta, las tendencias que resumimos a continuación: 1. Formación de un sistema radical profundo Esta adaptación está relacionada obviamente con la búsqueda de agua en capas profundas del suelo, y es según Ruthsatz y Movia (1975), un carácter constante en la mayoría de las especies leñosas y las gramíneas perennes del área noroeste de Jujuy. En La Rioja y San Juan es igualmente frecuente en los nanofanerófitos situados en la parte este de la región, con especies pertenecientes a la provincia fitogeográfica del Monte o de transición entre ésta y la Puna. Se trata, en muchos caos, de las xerófitas perennes no suculentas de Morello (1958), como por ejemplo Larrea divaricata. Esta característica no es privativa de estos tipos biológicos, sino que puede encontrarse en caméfitos como Adesmia nanolignea y suculentas como Mahiueniopsis glomerata. 2. Almacenaje de agua en tejidos y órganos Esta característica es común a todas las cactáceas e hierbas perennes existentes en la Puna de Jujuy, Salta y Catamarca. A este grupo pertenecen también todas las especies que tienen raíces reservantes, rizomas, tubérculos y bulbos. En San Juan y La Rioja, las cactáceas no representan una parte importante de la vegetación, a excepción del cactus Mahiueniopsis glomerata, muy abundante en algunos llanos. Esta cactácea posee una raíz que almacena bastante agua, además de lo que acumula parte aérea. Son por el contrario, abundantes las plantas que poseen bulbos, tubérculos y raíces o rizomas engrosados y cuya parte aérea muere anualmente. 3. Reducción de la superficie foliar Esta característica, que según Ruthsatz y Movia (1975) es válida para la mayoría de las especies leñosas del noroeste de Jujuy, es igualmente trasladable al área de San Juan. Es una adaptación frente a las condiciones de aridez y también a las bajas temperaturas. Las xerófitas xeromorfas de Morello (1958), con hojas permanentes, son típicas representantes de esta estrategia. Frecuentemente se agregan otras características, como gran cantidad de resinas, orientación para evitar la insolación directa, Capítulo 1: Las unidades morfoestructurales 17 cutícula gruesa, entre otras. Esta estrategia llevada a su gran extremo, implica la transferencia de la función fotosintética de las hojas a los tallos y ramas. Como ejemplos pueden mencionarse, la micrófilas: Larrea divaricata, L. nítida, Lycium chilensis; las parcialmente áfilas: Bulnesia retama y las áfilas: Fabiana denudata y Ephedra breana. Esta situación también se presenta en la mayoría de los nanofanerófitos no áfilos. Como ejemplos se pueden mencionar a Lycium spp, las cuales, según su ubicación altitudinal, pierden su follaje con mayor o menor rapidez. Estas plantas son similares a las terófitas, en el sentido de que pasan el período crítico en estado de dormancia, pero difieren de éstas en que soportan más tejido en la época seca y que pueden responder con mayor celeridad al retorno de la época húmeda (Solbrig et al., 1977). 4. Muerte de la parte aérea en la época seca o fría del año Las hemicriptófitas y geófitas son abundantes dentro de la región puneña, la muerte de la parte aérea, aparece estar más ligada al frío que a la falta de agua. Entre estas especies se encuentran las plantas más consumidas durante el verano por parte de camélidos silvestres y ganado doméstico, como Sphaeralcea mendocina, Pachylaena atriplicifolia, Hoffmansegia spp, y los coirones Stipa frigida y S. speciosa, que son intermedias entre las anuales y los arbustos perennes deciduos. 5. Muerte de la planta entera en la época seca o fría del año Pasan las estaciones desfavorables bajo la forma de semillas, por lo que según Solbrig et al. (1977), tienen mayores probabilidades de supervivencia en área secas o con lluvias no predecibles, en relación a los bulbos o rizomas. 6. Reducción de altura y aumento de la densidad del follaje En la región puneña y altoandina (principalmente en ésta última), se encuentran gran cantidad de plantas en cojín, en placas y arbustos enanos. Esta estrategia obedecería por un lado, a la acción desecante de los vientos, y por otra, estaría ligado a la disminución de la temperatura con la altura. La mayor densidad del follaje, garantizaría la conservación de la humedad acumulada debajo. Los efectos de las fuertes heladas se compensaría por el calentamiento más rápido a nivel de la superficie del Capítulo 1: Las unidades morfoestructurales 18 suelo (Ruthsatz y Movia, 1975). Inventarios de vegetación El catálogo de la flora descripto por Cabrera (1958) para la región puneña y altoandina de las provincias de Jujuy, Salta y Catamarca, indica la presencia de 664 especies, de las cuales 650 son plantas vasculares (Tabla 1). La Provincia de San Juan cuenta con un exhaustivo inventario de su flora incluida el área correspondiente a la Cordillera Frontal (Kiesling, 1994). En el BOX 2 se indica los usos de los principales géneros de plantas. Tabla 1 Distribución de las especies vegetales según las formas de vida de Raunkiaer para la Puna de la Provincia de Jujuy (Ruthzat y Movia, 1975). Altoandina Puna 182 317 Microfanerófitas (%) 0 0,6 Nanofanerófitas (%) 5,5 16,1 Caméfitas (%) 11,5 8,2 Hemicriptófitas (%) 58,8 44,2 Geófitas (%) 25,8 9,6 Terófitas (%) 5,5 13 Suculentas (%) 0,5 6,3 0 1,2 100 100 Especies Epífitas (%) Porcentaje (%) Las poblaciones humanas La densidad humana en las áreas rurales de la Puna y Cordillera Capítulo 1: Las unidades morfoestructurales 19 BOX 2 Usos históricos y presentes de especies vegetales silvestres y domésticas Hay detectadas más de 15 géneros de plantas empleadas con fines medicinales en la Puna argentina (Cabrera, 1958). Entre las principales se pueden mencionar las siguientes: Rica-rica (Acantholippia); Lampaya (Lampaya); Arca yuyo (Chenopodium); Airampu (Opuntia); Pingo pingo (Ephedra); Bailabuen (Haplopappus); Copa-copa (Artemisia); Chachacoma (Senecio); Poposa (Warneria). Especial atención merecen tres grupos vegetales, dos árboles: Queñoa (Polylepis) y Churqui (Prosopis ferox) y los arbustales de tola (Parastrephia, Fabiana), por el intenso uso al que han estado sujetas desde tiempos pretéritos hasta el presente. Rotondaro (1994) describe las siguientes especies vegetales que se utilizan para la construcción: troncos de Queñoa para dinteles, postes y vigas, arbustos leñosos para base de techos (Parastrephia, Baccharis, Fabiana), paja para adobe y techos (Stipa, Festuca). La madera de Queñoa se ha venido utilizando como combustible doméstico y como fuente de energía en minas y panaderías, también se la usa para varillas de cercos y para tallas. La tola, por su biomasa, constituye una fuente de combustible muy buscada localmente, Las cactáceas del género Trichocereus se utiliza como material de construcción (marcos, puertas, vigas) (Braun Wilke, 1991). La agricultura se encuentra restringida a pequeñas huertas cercanas a las viviendas. Se produce quinoa (Chenopodium quinoa); papa (Solanum indigenum); habas (Vicia faba), especie exótica de Eurasia; maíz (Zea mays); alfalfa (Medicago sativa), especie exótica utilizada como forraje (Cabrera, 1958; Ruthsatz y Movia, 1975. Capítulo 1: Las unidades morfoestructurales 20 Frontal no supera 1,7 habitante/km2, encontrándose las mayores densidades en Jujuy (0,7 - 1,5 hab/km2), disminuyendo en Salta y Catamarca (0,1 hab/km2) para ser nula en La Rioja y San Juan En su mayor parte la población rural es de raíz indígena (Paz, 1991). Como ocurre en muchas áreas de Argentina, la tendencia de las poblaciones humanas es la de emigrar hacia los principales centros urbanos, lo cual lleva a mostrar una tendencia de crecimiento negativa. En la región andina, la migración es por busca de trabajo y/o estudio, representa una de las estrategias supervivencia para los habitantes rurales. La ruptura del esquema socio-económico tradicional y la destrucción de las economías regionales producen drenaje permanente de población tanto masculina como femenina. Contrariamente a lo que podría pensarse, las situaciones de extrema pobreza dificultan la migración o no la estimulan (Forni, 1990). La actividad económica sobresaliente de la población rural es la ganadería extensiva. La característica principal de la actividad ganadera es la estrategia de “hatos múltiples” criándose simultáneamente ovinos, camélidos, caprinos y en menor medida bovinos (de variedad “criolla”, completándose el cuadro con asnales (en muchos sitios existen poblaciones asilvestradas) (García Fernández y Tecchi, 1991). El principal componente de la ganadería es la de brindar fibra y alimento, y el mismo animal como objeto de intercambio. Prácticamente el ganado constituye el único bien económico no monetario, acumulable y que, por lo tanto, permite la capitalización del poblador rural (Forni, 1990). La situación actual del sector agrícola de la Puna argentina se la podría considerar como una economía en el límite de la subsistencia (BOX 3). La minería, limitada históricamente a ciertos centros dispersos, ha tenido un gran auge en los últimos años con el asentamiento de grandes empresas mineras multinacionales, en distintas localidades de la Puna y la Cordillera Frontal. Capítulo 1: Las unidades morfoestructurales 21 BOX 3 Estructura social y productiva en comunidades pastoriles de la Puna de la Provincia de Catamarca. Localidades de La Lomita (Laguna Blanca) y El Peñón, 400 personas agrupadas en 65 unidades familiares (Forni, 1990). Ocupación del jefe de familia Criador - pastor Otros 92 % 8% Causas predominantes de migración Trabajo Estudios Casamiento 67 % 24 % 9% Ubicación de los corrales para el ganado doméstico Casa 32 % Casa-campo 24 % Campo 30 % Sin corrales 14 % Uso de corrales Sin corrales Cultivo Ganado Ganado-cultivo 14 % 25 % 26 % 35 % Cultivos en huertas familiares No cultivan Cultivan 22 % 78 % Importancia de diferentes cultivos Maíz Papas Habas Alfalfa Quinoa 16 % 25 % 27 % 28 % 4% Capítulo 1: Las unidades morfoestructurales 22 Edad en que comenzó a trabajar el jefe de familia 6-9 años 24 % 10-14 años 48 % > 15 años 28 % Primera ocupación del jefe de familia Pastor-Criador Zafrero Peón Minero Hilador Telero Otros 41 % 13 % 7% 20 % 7% 5% 7% Distribución porcentual de ganado doméstico Llamas 14 % Ovejas 52 % Cabras 27 % Asnales 5% Vacunos 1,5 % Mulas 0,5 % Capítulo 1: Las unidades morfoestructurales 23 Fig. 1 - Distintas unidades morfoestructurales de la Cordillera de los Andes Fuente: Bonaparte (1978) Capítulo 1: Las unidades morfoestructurales 24 Fig. 2 - Climatogramas correspondientes a tres localidades de la Puna argentina Fuente: Cabrera (1968) Capítulo 1: Las unidades morfoestructurales 25 CAPITULO 2 LAS AREAS NATURALES PROTEGIDAS EN LA REGION ANDINA CORRESPONDIENTES A LA PUNA Y CORDILLERA FRONTAL Jorge Luis Cajal 1 Las áreas naturales protegidas existentes al presente en la Puna y Cordillera Frontal fueron creadas en función de la conservación de la vicuña, dentro del marco del Convenio Internacional de la Vicuña, suscrito por Argentina. Bolivia, Chile, Ecuador y Perú (ver Capítulo 19). En la Tabla 1 se indica la situación de las áreas protegidas dentro de la región 2. FUCEMA. Pringles 10 (1183) Buenos Aires, Argentina. 1 2 En 1992 mediante Decreto N° 2213 se estableció en tierras fiscales de la Provincia de Jujuy, Departamento de Susques, la Reserva Altoandina de la Chinchilla de 1.197,30 Km2. La misma, que tiene como objetivo la protección de poblaciones relictuales de Chinchilla brevicaudata, no ha sido considerada en el presente Capítulo por tratarse hasta la fecha de una reserva “en el papel”. Capítulo 2: Las áreas naturales 26 Capítulo 2: Las áreas naturales Tabla 1 Distribución y estado de las áreas protegidas de la región andina Provincia Sup. de la región andina dentro de la provincia (km2) Densidad humana (ind./km2) Sup. áreas proteg. (km2) Porcentaje en relación a la región andina (%) N° de Situación áreas proteg. Actividad predominante San Juan 13624* 0,0 8600 63 1 2 minería La Rioja 11779* 0,0 3400 29 1 1 minería Catamarca 51091** 0,1 4870 10 1 2 pastoril Salta 36290** 0,1 14400 40 1 1 minería/pastoril Jujuy 37757** 0,1-1,5 5600 15 2 3 pastoril/minería Ref.: * = Cordillera Frontal; ** = Puna y Altoandino; Columna 7: 3=por lo menos el 50 % de las áreas protegidas están o han estado vigiladas; 2=por lo menos el 25 % de las áreas protegidas están o han estado medianamente vigiladas; 1=virtualmente ningún porcentaje de área protegida ha estado o está vigilada. 27 En las cinco provincias mencionadas hay seis áreas naturales protegidas (tres de las cuales son Reservas de Biosfera), dentro de la región andina. Las mismas suman 36.870 km2, esto es el 24 % de la región considerada. La tenencia de la tierra dentro de las áreas naturales protegidas de la región andina San Guillermo El título de origen es un acto real, conocido como merced de Pasos y Ejidos a la Villa San José de Jachal del año 1753, destinado a “campo de veranada y cazadero de vicuñas”. En 1824 en calidad de tierra fiscal, es vendido por el propio gobernador de San Juan al ciudadano de La Rioja, coronel Facundo Quiroga. A partir de ese momento sigue la línea histórica, agregándose otras operaciones de venta hasta llegar al tiempo presente, donde existen varios condominios, y propietarios individuales (ausentistas), algunos derechosos con superposición de títulos. Algunos condominios van desapareciendo, encontrándose algunos expedientes de apremio por impuestos no pagos, pero desconociéndose los resultados (Díaz Costa, 1989). En 1976 la Provincia declara de interés público y sujeto a expropiación el área correspondiente a la reserva, pero al no publicarse el edicto para comunicar a los interesados, los fondos de la expropiación depositados sufren una importante desvalorización monetaria, quedando la situación sin definirse. En 1989, una ley de “necesidad y urgencia” remitida por el ejecutivo provincial a la legislatura propone, reducir la superficie de la reserva a 10.000 ha. Esta ley es modificada por la Cámara de Diputados de San Juan, estableciéndose, luego de un profundo debate, en 875.000 ha la superficie de la reserva. Laguna Blanca La reserva se constituyo en terrenos de propiedad privada. Una porción menor corresponde a una familia que ha fraccionado su propiedad por herencia. El resto forma parte de una antigua estancia que en 1970 fue adquirida por un ex trabajador, devenido en importante comerciante con el transcurso de los años, que no reside en el lugar, aunque lo visita frecuentemente en su condición de comerciante, y que mantiene relaciones con los pastajeros mediante contratos de pastaje y dominio precario. Este Capítulo 2: Las áreas naturales 28 propietario donó al estado provincial parte de su propiedad (2.000 ha) para la instalación de la infraestructura de la reserva (Forni et al., 1987). Laguna de Pozuelos Respecto a la tenencia de la tierra dentro de la reserva se presentan tres situaciones (García Fernández, 1991): a) tierras fiscales de la Provincia, con ocupantes que tienen reconocimiento de sus vecinos para el uso, de modo consuetudinario, de los sectores que ocupan; b) propietarios con títulos legales; c) arrendatarios, que en su mayoría eran ocupantes tradicionales de tierras compradas por los propietarios señalados en el punto anterior. También hay pobladores sin tierra, que constituyen la principal mano de obra asalariada del sistema pastoril imperante. Las reservas de Laguna Brava (La Rioja), Los Andes (Salta) y Olaroz (Jujuy), corresponden a tierras fiscales, de propiedad de las respectivas provincias. Descripción de las áreas naturales protegidas o reservas presentes en la región, siguiendo el ordenamiento planteado por Lucas (1992), indicándose además su ubicación en las categorías definidas en el IV Congreso Mundial sobre Areas Protegidas y Parques Nacionales (BOX 1). BOX 1 Categoría I.- Reserva Natural Estricta/ Area Virgen Categoría II.- Parques Nacionales Categoría III.-Monumento Natural Categoría IV.- Area de Manejo de Especies/ Habitats Categoría V.- Paisaje Marino/ Area Marina Protegida Categoría VI.- Area Protegida con Manejo de Recursos Fuente: Miller (1996) Capítulo 2: Las áreas naturales 29 1.- Nombre y año de creación Laguna de Pozuelos. 1980 2.- Categoría (la laguna de Pozuelos: III; el resto de la Reserva: VI) Reserva de la Biosfera. (1991). Sitio RAMSAR (Convención sobre Humedales de Importancia Internacional como Habitat de Aves Acuáticas). La laguna es Monumento Natural de la Administración de Parques Nacionales. 3.- Ubicación 22°30’ S y 66° W, Provincia de Jujuy 4.- Características ambientales La Laguna de Pozuelos corresponde a uno de los principales bolsones o cuencas endorreicas del altiplano argentino. Corresponde a la Puna húmeda. Dentro de la reserva se encuentran presentes cinco principales ambientes morfodinámicos (Cendrero et al., 1993): laguna y paleolaguna, piedemonte, relieve volcánico, sierras orientales, sierras occidentales (macizo principal y valles fluviales). En las partes bajas de la cuenca, la vegetación dominante está constituida por pastizales de Stipa ichu y Festuca crysophylla y arbustales de Parastrephia lepidophylla. Las laderas montañosas rocosas están ocupadas por arbustales de Fabiana densa, Baccharis boliviensis y B. incarum, mientras que en las laderas protegidas del viento, se destacan los bosques abiertos de Polylepis tomentella. En ambos tipos de laderas son frecuentes las cactáceas Mahiueniopsis glomerata, Orocereus trolii y Opuntia soehrensii. Se encuentran representados tres pisos ecológicos; “Janca”, sobre los 4600 msnm, “Puna”, entre 3800 y 4600 msnm y “Suni” entre 3300 y 3800 msnm (Tecchi, 1992). Las precipitaciones pluviales presentan un promedio de 350 mm/año, principalmente entre diciembre y marzo. En otoño e invierno las heladas nocturnas son bastantes frecuentes y las nevadas son esporádicas. Capítulo 2: Las áreas naturales 30 5.- Valores naturales Importantes poblaciones de vicuña y ñandú petizo, importante avifauna de laguna (tres especies de flamencos en densidades importantes, área de nidificación). 6.- Valores culturales Riqueza arqueológica prehispánica, riqueza histórica. 7.- Población humana De los numerosos bolsones o cuencas del altiplano argentino, la de Pozuelos es la área rural mas densamente poblada. Dentro de la Reserva viven aproximadamente 5.000 habitantes (año 1996) (1,5 hab/km2). 8.- Actividad económica Dentro de la Reserva hay 450 unidades productivas dedicadas a la cría de ganado cuyo número de cabezas asciendo a 120.000 aproximadamente, entre ovinos, caprinos, vacunos y llamas. La cría de llamas es una actividad de menor importancia que la de ovinos (relación ovino/llama, 6:1). Históricamente el impulso del Estado Argentino en la Puna, tanto en extensión agropecuaria (cultivos de pasto llorón) como en inversiones directas, ha estado dirigido a la expansión y mejoramiento de la cría de ovinos (García Fernández y Tecchi, 1989). 9.- Area 380.000 ha. 10.- Tenencia de la tierra Fiscal/privado. La tierra privada se encuentra parcialmente parcelada (cercos alambrados y de pircas de barro y piedra) 1.- Nombre y año de creación. Capítulo 2: Las áreas naturales 31 Olaroz-Cauchari. 1981 2.- Categoría (IV) Reserva provincial 3.- Ubicación 24° S y 66° 50’ W, Provincia de Jujuy 4.-Características ambientales Corresponde a la puna seca de Cabrera (1958). Con alturas promedio de 4.000 msnm. presenta importantes salares que ocupan el 30 % de la superficie de la Reserva. La cuenca presenta en la zona pedemontana una vegetación de tipo matorral donde se destacan los tolares: Parastrephia lepidophylla, Bacharis incarum. El fondo de la cuenca presenta parches de esporal (Penicetum chilensis), con importantes áreas de suelo desnudo 5.- Valores naturales Presencia de importantes poblaciones de vicuñas y ñandú petizo. 6.- Valores culturales Comunidad pastoril con alto grado de aislamiento. 7.-Población humana Tiene baja densidad humana estable. Dentro de la Reserva viven 50 pobladores (año 1987) (0,03 hab/km2). 8.- Actividad económica Pastoril (ovejas, cabras y en menor medida, llamas). También hay actividad minera de tipo artesanal, principalmente en las áreas adyacentes a la reserva. 9.- Area 180.000 ha 10.- Tenencia de la tierra Fiscal/provincial. 1.- Nombre y año de creación. Laguna Blanca. 1979 Capítulo 2: Las áreas naturales 32 2.- Categoría (VI) Reserva de la Biosfera (1982). 3.- Ubicación 26°40’ S y 67°30’ W, Provincia de Catamarca 4.- Características ambientales Con 196 mm/año de precipitación pluvial, la Reserva esta comprendida dentro de la Puna seca. Tiene características similares a la Puna de la Provincia de Jujuy, con estepas de pastizales relativamente importantes de Stipa, Festuca y Panicum. De acuerdo a la biomasa vegetal, se definieron, ocho zonas ambientales, teniendo en cuenta la aptitud forrajera: aptitud forrajera muy alta (2,13 %), alta (12,31 %), media (10,09 %), baja (39,13 %), muy baja (19,01 %), grandes alturas (15,40 %), lagunas (0,65 %), sin información (3,41 %) (Forni, 1990). 5.- Valores naturales > 5 variedades de maíz, > 10 variedades de papa, poblaciones importantes de vicuña y ñandú petizo, avifauna de laguna (flamencos). 6.- Valores culturales Actividad textil artesanal (hilado y confecciones a partir de fibras de llamas y ovejas),tradición de teleras. La presencia de áreas húmedas y fértiles ha permitido históricamente el asentamiento humano. Esto esta demostrado por antiguas ruinas de construcciones indígenas y por la existencia actual de una población ganadera con transhumancia. La presencia de un templo, de mediados del siglo XIX, señala la antigua importancia del lugar como punto intermedio para el arreo de ganado y producción de mulas con destino a Chile y Bolivia (Forni et al., 1987). 7.-Población humana Dentro de la reserva viven aproximadamente 300 habitantes (año 1990). La población presenta un alto grado de Capítulo 2: Las áreas naturales 33 aislamiento y dispersión (0,06 hab/km2). 8.- Actividad económica Los asentamientos humanos se dedican a la actividad pastoril y cultivos caseros de especies tales como maíz, habas y papas, para el autoconsumo y producción de semillas. Hay 29 unidades productivas dedicadas a la cría de ganado cuyo número de cabezas asciende a 4.100, entre ovinos, caprinos, vacunos, asnales y llamas (Forni, 1990). A pesar de la importancia de la ganadería, sus derivados (hilado, tejidos) no rinde a los productores una ganancia que permita acumulación. 9.- Area 487.000 ha 10.- Tenencia de la tierra Fiscal/privado 1.- Nombre y año de creación. San Guillermo. 1972 2.- Categoría (IV) Capítulo 2: Las áreas naturales 34 Reserva de la Biosfera (1980). Se encuentra en tratativas la inclusión de una porción de su territorio como Parque Nacional. 3.-Ubicación 29°10’ S y 69°20’ W, Provincia de San Juan 4.-Características ambientales Situada en la Cordillera Frontal, sus alturas oscilan desde los 2.100 msnm (quebradas de acceso) a 6.000 (grandes alturas). Las precipitaciones hacia el oeste de la reserva son invernales en forma de nevada y granizada, mientras que al este, a menores alturas, son pluviales y estivales. La precipitación pluvial presenta un promedio de 150 mm/año. Fitogeográficamente, la Reserva presenta atributos tanto altoandinos como puneños, además de cuñas (quebradas de acceso) correspondientes al Monte. Aproximadamente el 30 % de su territorio presenta características limitantes para la vida vegetal y animal (grandes alturas >5.000 msnm). Dentro de la reserva se definieron cuatro asociaciones ambientales. Estas representan unidades cartográficas definidas como áreas caracterizadas por un patrón recurrente de formas del terreno, suelo y vegetación. Estas son: a) sucesión de cordones montañosos disectados por arroyos encajonados y con presencia de pequeños llanos (53,3 %), b) áreas planas o grandes llanos constituidos por depósitos de bolsón (16,1 %), c) valles situados entre los grandes ríos (2.100-2.700 msnm), con paredes de pendiente abrupta y vegetación correspondiente al Monte y transición (1,7 %), d) grandes alturas por arriba del límite de vegetación (> 4.500 msnm) (28,8 %) (Cajal et al., 1981; Cajal, 1989). 5.- Valores naturales Presencia de una original herpetofauna, localizada y con elevado endemismo (Cei et al., 1983). Importantes poblaciones de vicuñas y guanacos. Fuente de aguas Capítulo 2: Las áreas naturales 35 termales. 6.- Valores culturales Riqueza arqueológica correspondientes a culturas prehispánicas 7.- Población humana No existen asentamientos humanos estables. 8.- Actividad económica Hasta principios de la década del 40, el lugar servía de pastoreo (veranada) y de tránsito hacia Chile, para el ganado ovino y bovino, llegando a soportar en promedio 5.000 ovejas y 1.000 bovinos por año, principalmente sobre los pastizales de vega (Cajal et al., 1981). A partir de la época mencionada dicha actividad cesó totalmente. En la actualidad hay una importante actividad de prospección minera. 9.- Area 860.000 ha 10.- Tenencia de la tierra. Fiscal/privado. 1.- Nombre y año de creación Laguna Brava. 1980 2.- Categoría (IV) Reserva provincial Capítulo 2: Las áreas naturales 36 3.- Ubicación 28° 30’ S y 69° W, Provincia de La Rioja 4.- Características ambientales Situada en la Cordillera Frontal, presenta alturas promedio superiores a los 4.000 msnm. Tiene características altoandinas en su totalidad, con presencia de lagunas. Más del 50 % de su territorio presenta factores limitantes para el desarrollo de la vida vegetal y animal (grandes alturas, llanos áridos prácticamente sin cobertura vegetal. 5.- Valores naturales Avifauna de lagunas (flamencos), poblaciones de vicuñas. 6.- Valores culturales Riqueza arqueológica prehispánica. Presencia de antiguos refugios del siglo pasado a lo largo de la antigua ruta utilizada para el traslado de ganado en pie hacia Chile 7.- Población humana. No existen asentamientos humanos estables. 8.- Actividades económicas Hasta principios de la década del 40 era lugar de tránsito de ganado en pie hacia Chile. En la actualidad hay una importante actividad de prospección minera. 9.- Area 340.000 ha 10.- Tenencia de la tierra Fiscal. Propiedad de la Provincia. Parte del territorio se entrega en concesión para emprendimientos mineros. 1.- Nombre y año de creación Los Andes. 1980 2.- Categoría (VI) Reserva provincial Capítulo 2: Las áreas naturales 37 3.- Ubicación 24° 30’ S y 67° 10’ W, Provincia de Salta 4.- Características ambientales Situada en la Puna seca y desértica, la reserva presenta importantes salares que ocupan el 21 % de su territorio. Las precipitaciones tienen un promedio de 103 mm/año (localidad de San Antonio de los Cobres), en los salares (localidad de Olacapato), las medias son de 50 mm/año. En las partes correspondientes a los grandes salares, las precipitaciones se reducen a un mínimo. El 68 % del territorio de la reserva pertenece a la provincia fitogeográfica Puneña, y el 32 % a la Altoandina. En la provincia puneña se encuentran las siguientes comunidades climáxicas (Cabrera, 1958): Asociación de: Fabiana densa - Adesmia horridiuscula; Psila caespitosa - Distichlis humilis; Lycium humili - Distichlis humilis; Ephedra breana - Stipa leptostachya; Consocies de: Festuca scirpifolia; Atriplex microphylla (cachiyuyo); Pennisetum chilense (esporal). En la provincia altoandina se encuentra la Asociación de Festuca ortophylla, Festuca crysophylla y Poa gymnantha. 5.- Valores naturales Poblaciones de vicuña, avifauna de lagunas. 6.- Valores culturales Riqueza arqueológica prehispánica 7.- Población humana En la reserva viven 2.200 habitantes (1980) (0,1 hab/km2) 8.- Actividades económicas Los asentamientos humanos estables se dedican principalmente a la minería y a la ganadería extensiva (llamas, ovinos), existen aproximadamente 20.000 cabezas entre llamas, ovinos, caprinos y asnales. Turismo en desarrollo debido al ferrocarril. No hay agricultura. Capítulo 2: Las áreas naturales 38 9.- Area 1.440.000 ha. 10.- Tenencia de la tierra Fiscal. Propiedad de la Provincia Las áreas naturales protegidas en la región, han tenido y tienen un desarrollo desigual, en relación a su grado de implementación y a las inversiones recibidas por parte del Estado Nacional y de las administraciones provinciales. No obstante, a pesar de las falencias mencionadas y la situación de desamparo de algunas reservas, las áreas protegidas son representativas de la flora, fauna y paisaje de la Puna y Cordillera Frontal. Mejorando la situación de las reservas existentes mas la implementación de la recientemente creada (Reserva Altoandina de la Chinchilla) en la Provincia de Jujuy, la región presentaría un aceptable sistema de áreas naturales protegidas. Capítulo 2: Las áreas naturales 39 Fig. 1 - Ubicación de las áreas naturales protegidas Capítulo 2: Las áreas naturales 40 Reserva de Biosfera Laguna Blanca, Catamarca. Templo de mediados del Siglo XIX. Reserva de Laguna Brava, La Rioja. Refugio del Siglo XIX para los arreos del ganado hacia Chile. Capítulo 2: Las áreas naturales 41 ESTUDIOS SOBRE LA VEGETACION Y LA FAUNA EN LA PUNA Y CORDILLERA FRONTAL Capítulo 2: Las áreas naturales 43 CAPITULO 3 LA VEGETACION EN LA RESERVA DE BIOSFERA LAGUNA DE POZUELOS * Stella Maris Bonaventura 1 Rodolfo Tecchi 2 Dorita Vignale 3 Introducción Desde el punto de vista fitogeográfico la vegetación de la Cuenca de la Laguna de Pozuelos pertenece al Dominio Andino-patagónico, Provincia Puneña (Cabrera, 1971). La formación vegetal dominante corresponde a una estepa arbustiva (Cabrera y Willink, 1973), siendo predominantes las hemicriptófitas y nanofanerófitas (Cabrera, 1968). Ruthsatz (1977) dividió la vegetación andina en cuatro pisos altitudinales de acuerdo con el clima, * 1 2 3 Originalmente publicado en Vegetatio (1995) Depto. Cs. Biológicas, Fac. Cs. Exactas y Naturales, UBA, 4° piso, Pab. II, Ciudad Universitaria, (1428) Buenos Aires, Argentina). Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. Fac. Ciencias Agrarias, UNJu, Alberdi 47, (4600) San Salvador de Jujuy, Argentina. Capítulo 3: La vegetación 44 fisonomía y fitosociología: a) el piso subnival (> 4.900 msnm); b) el piso altoandino (4.100-4.900 msnm); el piso puneño o Puna (3.200-4.100 msnm) y el piso prepuneño o Prepuna (2.000-3.200 msnm). La formación vegetal dominante en la Puna corresponde a un arbustal deciduo subdesértico abierto, encontrándose ocasionalmente ensambles vegetales de especies siempreverdes. Estas formaciones fueron incluidas por Ruthsatz (1977) dentro de un esquema fitosociológico en el cual se incluyeron Alianzas, Subalianzas y Asociaciones. Sin embargo, la vegetación puneña adyacente a la Laguna de Pozuelos no fue intensamente muestreada por la citada autora. Esta área presenta características distintivas respecto al resto de la Puna: un bajo grado de aridez (Igarzábal, 1991), extensas superficies ocupadas por pastizales, elevada actividad ganadera y una importante ocupación humana (Cendrero et al. 1993). Recientemente Cendrero et al. (1993) han llevado a cabo estudios sobre diagnóstico ambiental para la planificación y el manejo de la Reserva, donde se incluye el mapeo de Unidades Morfodinámicas en base a la litología, depósitos superficiales y cobertura vegetal. Sin embargo, se hace necesario una clasificación y descripción más detallada de la vegetación de la Reserva para el diseño de estrategias de preservación y manejo y para la planificación del uso de la tierra. El objetivo del presente Capítulo es presentar los estudios sobre clasificación y descripción de las comunidades vegetales de la Cuenca de Pozuelos como así también los análisis sobre distribución de dichas comunidades en relación con factores edáficos y ambientales. Métodos Procedimiento de muestreo Dentro del área de estudio situada en la parte central de la Reserva se definieron 40 sitios de muestreo de 100 m2 (área mínima). Estos sitios fueron ubicados a lo largo de un gradiente altitudinal, siguiendo transectas o “gradsect” (Gillison y Brewert, 1985). Las transectas se ubicaron desde la Sierra de Escaya (este) hasta las Sierras de Rinconada (oeste) (Fig. 1). En cada sitio de muestreo se estimó la abundancia de especies de acuerdo con la escala de cobertura-abundancia de Braun-Blanquet modificado por Westhoff y Maarel (1978). Asimismo se registró la altitud, pendiente y orientación utilizando altímetro, clinómetro y compás Capítulo 3: La vegetación 45 respectivamente. Cada sitio fue ubicado en una de las siguientes Unidades Morfodinámicas presentes en la transecta (Cendrero et al. 1993): depósitos del paleolago, depósitos antiguos lacustres, conos aluvionales, glacis principales, depósitos de derrames aluviales recientes, superficies de colmatación, pendientes suaves, pendientes rocosas moderadas, pendientes moderadas con coluvio, pendientes abruptas, cuestas, superficie con sedimento lacustre y terraza aluvial. En cada sitio de muestreo, se realizaron calicatas para determinar la profundidad del suelo. Se colectaron muestras de suelo del horizonte superficial para análisis químicos y granulométricos. La acidez del suelo (pH) fue determinada en una solución de suelo fresco en agua (1:2,5 suelo/agua). Se midió la materia orgánica (MO%) mediante el método de Walkley-Black. Se midió la conductividad eléctrica (CE, mmmhos/cm) en extractos de suelo saturado. La capacidad del intercambio catiónico (CIC, meq/100 gr) fue analizada mediante el sobrenadante del suelo con acetato de amonio nitrogenado (1N, pH 7), y la cantidad de iones de amonio retenidos en el suelo fue medida mediante el método de digestión semimicro de Kjeldahl. El contenido intercambiable de Na+ (Na+, %) fue determinado mediante espectrofotometría después de la extracción mediante una solución de acetato de amonio N a pH 7. La arcilla (%) y arena (%) fueron medidas mediante el método de la pipeta. Para determinar gradientes posibles de vegetación se aplicó el análisis de componentes principales (ACP). Valores alfanuméricos de cobertura-abundancia fueron transformados en valores numéricos de 1 a 9 (Maarel, 1979). Los datos de suelo fueron tratados mediante el análisis de componentes principales. Las relaciones entre ordenación de plantas, ordenación de suelo y variables ambientales fueron relacionadas mediante comparación visual de ordenación y análisis de regresión. Se aplicó a los datos florísticos el análisis de indicador de especies de dos vías (TWINSPAN) (Hill, 1979), para obtener una primera aproximación del ensamble vegetal en el área. Utilizando el método TWINSPAN, se dividió el gradiente florístico en tipos de comunidad. Resultados Capítulo 3: La vegetación 46 Clasificación La clasificación fue llevada a cabo hasta la obtención de nueve grupos (después de cuatro niveles de división). Grupo 1. Las especies características de éste grupo son Polylepis tomentella (el único árbol que crece en el área de estudio), Colletia spinosissima y Chersodoma argentina. Este grupo de especies aparece en laderas rocosas moderadas con orientación NE o E (laderas calientes). Otras especies en ésta área incluye dos arbustos (Fabiana densa y Baccharis boliviensis) y varias cactáceas (Maihueniopsis glomerata, Oreocereus trollii y Opuntia soehrensii). La cobertura media es del 82 %. Grupo 2. Caracterizada por la presencia de B. boliviensis y la ausencia de las especies características del grupo 1. Una especie muy frecuente es F. densa. Este grupo aparece en laderas con diferentes gradientes de pendiente (moderado, suave y fuerte), cuestas, superficies de colmatación y conos aluvionales. Otras especies típicas en estos habitats incluyen Menodora pulchella, Alternanthera sp., Evolvulus sericeus, Dalea hofstenii, Hypochoeris elata, Lepidium elata, Dichondra argentea y Eryoneuron avenaceum. Al igual que el grupo 1, las cactáceas (Maihuentopsis boliviana, M. glomerata y O. trollii) son frecuentes en este grupo. La cobertura media es del 30 %. Grupo 3. Este grupo se caracteriza por la presencia de Stipa ichu y la ausencia de B. boliviensis. Se las encuentra en los conos aluvionales y depósitos de derrame recientes en el piedemonte. Especies tales como Parastrephia lepidophylla, Bouteloua simplex, Eragrostis nigricans, Muhlenbergia peruviana y Portulaca rotundifolia son frecuentes en este tipo de vegetación. La cobertura media es del 73 %. Grupos 4 y 5. Ambos grupos se caracterizan por la presencia de valores de alta cobertura para P. lepidophylla (25 % - 50 %) y por la ausencia de B. boliviensis y S. ichu. El grupo 4 se caracteriza por la presencia de Aristida amplexifolia, Hypochoeris meyeniana y B. simplex. Además de las especies mencionadas, Microchloa indica, E. nigricans y Astragalus garbancillo son comunes en este tipo de vegetación. En el grupo 5 falta A. amplexifolia, H. meyeniana y B. simplex. Otras especies en el grupo 5 incluyen Adesmia horrida y Aristida pubescens, las cuales están ausentes en el grupo 4. La cobertura media del grupo 4 es del 46 %, mientras que el grupo 5 presenta coberturas medias del 71 %. La erosión es más seria en aquellos sitios correspondientes al grupo 4 que en los correspondientes al Capítulo 3: La vegetación 47 5. Ambos grupos se encuentran en los conos aluvionales, laderas suaves, depósitos antiguos lacustres y depósitos del paleolago. Grupo 6. Este grupo se caracteriza por la presencia de Baccharis incarum con rangos de cobertura de 8 % a 25 %. Tambien es frecuente P. lepidophylla pero con valores de coberturas inferiores al 5 %. Las especies A. amplexifolia, Stipa bomani, A. garbancillo y H. meyeniana son comunes en este grupo. Se las encuentra en diferentes unidades morfodinámicas incluyendo conos aluvionales, glacis principales, depósitos del paleolago y pendientes suaves cubiertas por coluvios. La cobertura media correspondiente a este grupo es del 51 %. Grupos 7 y 8. Ambos grupos aparecen alrededor de la laguna y se caracterizan por la ausencia de Festuca weberbaueri y la presencia de Festuca crysophylla. El grupo 7 se caracteriza por la presencia de Conyza artemisiaefolia y Trifolium amabile además de F. crysophylla, las dos primeras asociadas con depósitos antiguos lacustres y sedimentos lacustres. El grupo 8 está solamente caracterizado por F. crysophylla. Este grupo aparece en los depósitos del paleolago, en depósitos antiguos lacustres y en los sedimentos lacustres. Especies comunes a ambos grupos son Distichlis spicata, Muhlenbergia fastigiata, Hordeum muticum, Stipa saltensis y A. garbancillo. La cobertura media fue superior en el grupo 7 (98 %) en relación al grupo 8 (80 %). Grupo 9. La especie característica de este grupo es F. weberbaueri. Este grupo aparece en la terraza aluvial localizada a 3.850 msnm. Otras especies en ésta área incluyen T. amabile, M. fastigiata, E. nigricans, H. meyeniana y P. lepidophylla. La cobertura media para este grupo es del 51 %. Ordenación Se aplicó el análisis de componentes principales (ACP) a una matriz completa con datos florísticos (40 sitios x 50 especies). Los primeros cuatro ejes derivados del ACP fueron estimados para el 45 % de la variación entre sitios (eje 1: 17 %; eje 2: 12,5 %; eje 3: 9,2 %; eje 4: 6,3 %). El eje 1 estuvo altamente asociado con la pendiente (r = 0,74; P<0,001). Este eje mostró altos valores para sitios con pendientes mayores al 20 %, los cuales se caracterizan por la presencia de P. tomentella y algunos arbustos (Ch. argentina, C. spinosissima, F. densa y B. boliviensis). Capítulo 3: La vegetación 48 Las cactáeceas son frecuentes (M. glomerata, O. trollii, O. soehrensii), estos sitios se corresponden bien con los grupos 1 y 2 de la clasificación florística. En el extremo negativo del eje 1 hay sitios que presentan una tendencia gradual a mostrar pendientes suaves (1 a 10 %). Estos sitios se caracterizan por la presencia de dos arbustos (B. lepidophylla y B. incarum) y algunas gramíneas (M. fastigiata, F. crysophylla y S. ichu). Otras especies frecuentes son A. amplexifolia, Portulaca andina y T. amabile. El eje 1 refleja la principal variación florística del área, con ensambles vegetales que se encuentran en pendientes abruptas con suelo rocoso a ensambles que usualmente se encuentran en pendientes suaves con suelos profundos. El eje 1 muestra el siguiente gradiente florístico: bosque abierto estepa arbustiva estepa arbustiva + pastizal P. tomentella ri B. boliviensis, F. densa P. lepidophylla, B. incarum, F. crysophylla, S. ichu, F. weberbaue- El eje 1 está asociado con el gradiente en riqueza de especies (r = 0,41; P<0,01). La riqueza de especies es mayor en aquellos sitios localizados en pendientes abruptas en relación con aquellos otros localizados en pendientes suaves. Los ejes 2, 3 y 4 muestran un gradiente combinado con aquellos sitios correspondientes a la vegetación de estepa arbustiva (P. lepidophylla o B. incarum) o pastizales. Por esta razón, se decidió realizar un segundo análisis tomando solamente en consideración los 23 sitios que corresponden al tipo de vegetación mencionado la cual se presenta en laderas con ≥ 10 %.de pendiente. Matriz con datos florísticos correspondientes a 23 sitios Se aplicó el ACP a la matriz (23 sitios x 37 especies). Los primeros cuatro ejes fueron determinados y estimados para el 47 % de la variación entre sitios (eje 1: 16,2 %; eje 2: 121,1 %; eje 3: 9,3 %; eje 4: 9,3 %). A lo largo del eje 1, el pastizal de F. crysophylla se ubicó en el extremo positivo, mientras que los diferentes tipos de estepa arbustiva y Capítulo 3: La vegetación 49 pastizal de S. ichu, se agruparon en el extremo negativo. El pastizal de F. weberbaueri mostró valores intermedios. El eje 2 mostró altos valores para los sitios dominados por F. weberbaueri, E. nigricans y P. lepidophylla. El eje 3 mostró valores positivos para los sitios dominados por A. amplexifolia y S. saltensis. A lo largo del eje 4, los pastizales de S. ichu se ubicaron en las partes bajas, mientras que la estepa arbustiva dominada por B. incarum se agrupó en las partes altas. La estepa arbustiva donde P. lepidophylla es abundante dio valores intermediarios. Los principales tipos de vegetación y sus especies asociadas se cubrieron con los ejes 1 y 4 (Figs. 2 y 3). Matriz con datos de suelo correspondientes a 23 sitios Se aplicó el ACP a la matriz (23 sitios x 8 variables). Los dos ejes derivados del análisis fueron estimados para el 81,6 % de la variación entre sitios (eje 1: 51,2 %; eje 2: 30,4 %). El eje 1 contrasta los altos valores porcentuales de arena contra los altos valores porcentuales de arcilla. El eje 2 representa la salinidad, expresada por altos contenidos de Na+ y valores altos de pH y conductividad eléctrica. En la Fig. 4 se muestra la posición de cada variable del suelo a lo largo de los ejes 1 y 2. En la Fig. 5 se muestra la ordenación de los 23 sitios y los ejes 1 y 2, para las variables del suelo. Los sitios pertenecientes a los grupos florísticos 4, 5 y 6 forman una nube con una no clara segregación entre los mismos, mientras que la segregación de los grupos florísticos 3, 7, 8 y 9 es mucho más evidente. Asociación entre vegetación y ordenación del suelo Los ejes derivados del ACP realizado en las matrices con los datos florísticos y del suelo fueron comparados mediante análisis de regresión. El eje 1 correspondiente al suelo mostró alta asociación con el eje 1 (r = 0,51; P<0,02) y con el eje 4 (r = -0,48; P<0,05) correspondietes a la vegetación. El eje 2 correspondiente al suelo mostró una relación significativa Capítulo 3: La vegetación 50 con el eje 1 (r = 0,47; P<0,02) y eje 3 (r = -0,42; P<0,05) correspondientes a la vegetación. Estos resultados indican la existencia de una estrecha asociación entre los factores del suelo y las comunidades de plantas. La vegetación de tipo estepa-arbustiva crece en suelos arenosos. En los suelos arenosos profundos la especie dominante es P. lepidophylla (Grupos 4 y 5), mientras que en suelos arenosos menos profundos la especie dominante es B. incarum. La especie P. lepidophylla se presentó con coberturas menores al 5 % (Grupo 6). La comunidad de pastizales se encuentra en suelos arcillosos: El pastizal de F. crysophylla (Grupos 7 y 8) crece en suelos pedregosos con alta salinidad, mientras que los pastizales de F. weberbaueri (Grupo 9) y S. ichu (Grupo 3) crecen en suelos arcillosos con baja salinidad (Tabla 1). Discusión Los resultados indican que dentro de la Cuenca de Pozuelos la variación en composicion de especies de los ensambles vegetales está fuertemente relacionada con el substrato. Dentro de las variables ambientales, la pendiente se destaca como el mejor predictor de variación en la vegetación. Los grupos 1 y 2 se encuentran en sitios donde las pendientes superan el 20 %, mientras que los grupos 3, 4, 5, 6, 7, 8 y 9 se encuentran en sitios con pendientes más suaves. No obstante, los mejores indicadores de distribución de los últimos grupos mencionados son las variables relacionadas con la textura del suelo, el contenido de Na+ y la conductividad eléctrica. Todas estas variables están asociadas con los diferentes regímenes de agua de los sitios. Las diferencias en disponibilidad de agua aparecen como la principal causa de las diferencias en la distribución de la vegetación. Las áreas rocosas producen escorrentía que se infiltran a través de acuíferos, mientras que el excedente fluye hacia zonas bajas. Este proceso, sumado al agua contribuida por los acuíferos provenientes de las montañas y la presencia de suelos profundos contribuyen a una alta disponibilidad de agua en las partes bajas, tanto en la cuenca como en los valles. Esto determina condiciones más favorables de agua en estos habitats en relación con las áreas rocosas situadas a mayores altitudes. El gradiente altitud-rocosidad repite, a menor escala, el gradiente de humedad NE-SO de la región andina. Las lluvias son mayores en el NE y Capítulo 3: La vegetación 51 disminuyen hacia el SO (Cabrera, 1957; Ruthsatz, 1977). Este gradiente puede ser observado desde los sitios rocosos a mayores alturas hacia sitios no rocosos a niveles altitudinales menores dentro de los valles y la cuenca. Los sitios rocosos están dominados por arbustos deciduos (F. densa, B. boliviensis y Anthobryum triandrum), mientras que en las zonas más bajas predominan los arbustos perennes (B. incarum, A. horrida, A. spinosissima y M. pulchella). Una excepción a éste patrón es el bosque abierto de P. tomentella, un árbol que crece en áreas rocosas. Estas áreas con P. tomentella presentan características que la diferencian de otras áreas rocosas: tienen mayor humedad en el suelo, una orientación este y protección contra el viento. Estas características determinan condiciones favorables para el crecimiento de Polylepis. Fernández (1970) y Lieberman (1986) observaron una distribución similar de Polylepis en relación con los mismos factores microclimáticos. Festuca weberbaueri es una especie dominante en la base del valle localizada a 3850 msnm. Esta especie es reemplazada en la base de la cuenca por F. crysophylla en aquellos sectores con suelos de alto contenido de Na+ y alta conductividad eléctrica. Lo mencionado no indica una “preferencia” de F. crysophylla por estos tipos de suelos, sino una mayor adaptación en relación a otras especies, para sobrevivir en los mismos. Stipa ichu predomina en aquellos sitios con suelos de bajo contenido de Na+ y baja conductividad eléctrica.La disponibilidad de agua ha sido considerado por Ruthsatz (1977) como el principal factor que determina la distribución de las comunidades vegetales en el NO de la región andina argentina. La relación entre rocosidad y riqueza de especies ha sido observada en el Desierto de Sonora (Mexico) y en la región del Monte (Argentina) (Barbour y Diaz, 1973). La rocosidad puede tener un efecto adicional sobre la estructura de las comunidades vegetales, brindando protección y cobertura a las semillas y aumentando el cambio de “status” de algunas especies (Ezcurra et al., 1987). Otro factor que puede tener un efecto sobre la estructura de las comunidades es el pastoreo de ovejas y llamas, y el uso de arbustos y Polylepis como madera y combustible (Ruthsatz, 1974; Ruthsatz y Movia, 1975). Las comunidades vegetales de la Puna del noroeste argentino fueron incluidas por Ruthsatz (1977) en un esquema fitosociológico que comprende una Alianza, dos Subalianzas y cinco Asociaciones. Los grupos mencionados en el presente estudio pueden solamente ser incluidos parcialmente en dicho esquema. Las mayores coincidencias se encontraron entre los grupos 1, 2, 4, 5 y las Asociaciones de Fabiana densa-Baccharis boliviensis y Parastrephia lepidophylla. El bosque abierto de Polylepis incluida en la Capítulo 3: La vegetación 52 Subasociación Polylepis dentro de la Asociación F. densa-B. boliviensis, muestra una estrecha correspondencia con el grupo 1 reconocido en Pozuelos, siendo éste último caracterizado por las mismas especies. No obstante, el porcentaje de cobertura total fue más alta en el grupo 1 (82 %) que en la Subasociación (57 %). Ambas comunidades vegetales tienen en común seis especies. La estepa arbustiva de P. lepidophylla (grupos 4 y 5) reconocidas en el presente estudio está muy próxima a la Subasociación Típica de la Asociación de P. lepidophylla, ambas comunidades se caracterizan por las mismas especies y presentan 13 especies en común. No obstante, los porcentajes de la cobertura total fueron superiores en los grupos 4 y 5 (46 % y 71 % respectivamente) con respecto a la Subasociación (44 %). Otras dos comunidades estrechamente relacionadas son el grupo 2 y la Subasociación Típica de la Asociación F. densa-B. boliviensis. Ambas comunidades se caracterizan por las mismas especies, teniendo en común 16 especies. Con respecto a los porcentajes de cobertura total, los valores fueron similares, 30 % para el grupo 2 y 34 % para la Subasociación. Asimismo, el grupo 2 también está estrechamente relacionado con la Unidad Florística F. densa-B. boliviensis reconocida por Villagrán et al., (1981) para el altiplano del norte de Chile, encontrándose al igual que las anteriores, caracterizada por las mismas especies. Sin embargo, los pastizales encontrados en el área de Pozuelos están ausentes del esquema fitosociológico de Ruthsatz (1977) para el altiplano del noroeste argentino. Los mismos se encuentran en otro piso puneño, el piso altoandino localizado entre los 4.100 a 4.900 msnm, estando éstos, caracterizados por Festuca orthophylla, Festuca scirpifolia y otras gramíneas. Otros estudios de vegetación han señalado la ausencia de pastizales en la Puna. Villagrán et al. (1981) señalan que en el norte de Chile los pastizales se encuentran en el piso altoandino. Cabrera (1968) ubica los pastizales de F. crysophylla y F. orthophylla en la provincia altoandina (> 4.300 msnm). El menor grado de aridez que presenta el piso altoandino con respecto al piso puneño (Cabrera, 1957; Ruthsatz, 1977) podría ser un importante factor para el crecimiento de los pastizales en el primero. Probablemente, la presencia de éste tipo de comunidades en Pozuelos podrían estar asociado con el bajo grado de aridez de ésta localidad respecto al resto de la Puna (Igarzabal, 1991). Otra comunidad del piso puneño que no está presente en el esquema fitosociológico de Ruthsatz (1977) es la estepa arbustiva de B. incarum (grupo 6). Dicha comunidad fue incluida en una asociación perteneciente al piso altoandino. Sin embargo, Cabrera (1957) reconoce la existencia de Capítulo 3: La vegetación 53 la estepa arbustiva de B. incarum en la provincia de la Puna. La comparación entre el ensamble de plantas en el piso puneño de Chile (Villagrán et al. 1981) y Argentina (Ruthsatz, 1977 y el presente estudio), muestra un marcable contraste en complejidad florística entre los dos sectores. En el sector chileno la complejidad fue menor que en el sector argentino, donde nueve grupos (el presente estudio) y una Alianza, dos Subalianzas y cinco Asociaciones (Ruthsatz, 1977) fueron reconocidos. La menor heterogeneidad en el sector chileno podría estar asociado con las mayores condiciones xerícas debido al Desierto de Atacama (Villagrán et al., 1981). La falta de niveles taxonómicos en el esquema fitosociológico de Ruthsatz en concordancia con los grupos 3, 6, 7, 8 y 9 reconocidos en la cuenca de Pozuelos podrían deberse al hecho de que ésta área fue escasamente muestreada por la mencionada autora. Esto se desprende de observar la ubicación de los censos realizados por Ruthsatz (1977) donde se definieron los tipos de vegetación del noroeste de Argentina. Consideramos que incluir estos grupos en el esquema de Ruthsatz sería una contribución al mismo y permitiría brindar una visión más completa de la vegetación de la Puna. Capítulo 3: La vegetación Tabla 1 Grupo 3 Arena rango x ES Arcilla rango x ES Profundidad del suelo rango x ES MO rango x ES pH rango x ES CE rango x ES Na+ rango x ES CIC rango x ES 4-5 45-88 58,8 8,46 9-30 23,80 4,93 6 68-85 76,50 2,22 7-15 12,33 1,30 7-8 75-81 79,00 2,12 7-18 11,00 2,48 9 35-85 54,00 8,44 11-33 24,60 4,30 56-58 56,67 0,67 21-23 22,00 0,58 30-100 86,00 14,00 0,65-3,40 2,24 0,65 5,50-6,80 6,22 0,45 0,16-0,18 1,18 0,01 1,30-6,20 2,82 1,01° 17,60-44,20 31,18 7,91 20-100 38,33 12,49 0,40-2,68 1,19 0,37 5,50-6,60 6,25 0,24 0,16-3,20 0,71 0,50 1,20-18,50 4,97 2,75 6,90-17,60 11,73 1,74 5-50 16,25 11,25 0,40-0,80 0,65 0,09 5,20-6,80 6,02 0,39 0,20-0,30 0,22 0,03 1,30-6,10 3,95 1,57 6,0-14,20 9,18 1,84 70-100 94,00 6,00 0,54-4,29 1,71 0,67 5,30-8,50 7,08 0,74 0,20-9,75 4,63 1,93 4,70-68,50 29,62 14,86 6,30-21,60 16,72 3,34 68-70 69,00 0,58 2,30-2,50 2,40 0,06 6,00-6,10 6,03 0,03 1,20-1,22 1,21 0,01 1,80-1,90 1,83 0,03 18,80-14,00 13,90 0,06 54 Capítulo 3: La vegetación Rangos de valores absolutos, media (x) y error standard (ES) de las variables del suelo obtenidas de los suelos provenientes de los Grupos 3, 4-5, 6, 7-8 y 9 localizados en sitios con pendientes < 10 % 55 Capítulo 3: La vegetación Fig. 1- Mapa con la localización de la vegetación, suelo y sitios de muestras ambientales. 56 Fig. 2 - Análisis de componentes principales para 23 sitios con pendientes <10%, eje 1 y 4. Capítulo 3: La vegetación 57 Fig. 3 - Ordenación de especies, ejes 1 y 4. Los números indican las especies con valores más elevados: 1. Festuca crysophylla, 2. Distichlis spicata, 3. Hordeum musticum, 4. Astragalus micranthelus, 5. Conyza artemisiaefolia, 6. Trifolium amabile, 7. Muhlenbergia fastigiata, 8. Deyeuxia heterophylla, 9. Festuca weberbaueri, 10. Festuca scirpifolia, 11. Hypochoeris meyeniana, 12. Stipa bomani, 13. Baccharis incarum, 14. Aristida amplexifolia, 15. Tetraglochin cristatum 16. Adesmia horrida, 17. Astragalus garbancillo, 18. Pycnophyllum molle, 19. Eragrostis nigricans, 20. Maihueniopsis glomerata, 21. Microchloa indica, 22. Parastrephia lepidophylla, 23. Aristida pubescens, 24. Portulaca andina, 25. Muhlenbergia peruviana, 26. Bouteloua simplex, 27. Portulaca rotundifolia, 28. Stipa ichu. Capítulo 3: La vegetación 58 Fig. 4 - Ordenación de variables del suelo, ejes 1 y 2. Los números indican las variables del suelo: 1. materia orgánica, 5. pH, 2. capacidad del intercambio iónico, 6. conductividad eléctrica, 3. arcilla, 7. contenido de Na+, 4. profundidad del suelo, 8. arena. Capítulo 3: La vegetación 59 Fig. 5 - Ordenación de sitios con pendientes < 10% en las variables del suelo, ejes 1 y 2. Los símbolos representan los grupos 3, 4, 5, 6, 7, 8 y 9. Capítulo 3: La vegetación 61 CAPITULO 4 LOS ARTROPODOS EN LA RESERVA DE BIOSFERA LAGUNA DE POZUELOS I - Diversidad de taxones Martha Arce de Hamity 1 Estela Neder de Román 1 Introducción Dentro de la diversidad biológica, los vertebrados y plantas superiores representan un pequeño porcentaje, con respecto al multiforme universo de seres de pequeño y muy pequeño tamaño representado por invertebrados, plantas inferiores y microorganismos. Se estima que hay descritas a lo máximo 43.000 especies de vertebrados, mientras que, únicamente en insectos, alcanza o supera al millón. Estimaciones recientes establecen que el número total de invertebrados en todo el planeta, sería de unos 30 a 50 millones de especies diferentes. Se conoce la importancia de algunos grupos de estos organismos en la economía y salud de los seres humanos, así como también la forma en que afectan a plantas y animales domésticos, pero es considerable el desconocimiento que se tiene acerca de la biología, ecología, bioquímica y 1 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. Capítulo 4: Los artrópodos 62 genética de la mayoría de los componentes del micromundo. Su extraordinaria abundancia y variedad, no debe hacer pensar que son indestructibles, ni mucho menos que durarán eternamente (Giacchi, 1994). Los artrópodos se encuentran bien representados y distribuidos en los diferentes ambientes de la región puneña. Constituyen una parte fundamental de la composición, estructura y función del ecosistema (Mani, 1962, 1968; Arce et al., 1993; Neder y Arce, 1991). El objetivo del presente capítulo es mostrar la diversidad de taxones, la abundancia relativa y el rol trófico de los artrópodos en la Cuenca de Pozuelos. Métodos Entre los años 1991 y 1992 se realizaron muestreos de artrópodos, recolectándose un total de 170 muestras distribuidas en 17 unidades ambientales, a lo largo de una transecta de 40 km de longitud, entre los 3.600 a 4.150 msnm. Los artrópodos fueron muestreados utilizando trampas pitfall, que consisten en recipientes de plástico con una solución de alcohol al 70% enterradas al ras del suelo. En cada sitio se instaló una línea de 10 trampas separadas cada 10 m. Finalizado el muestreo las trampas fueron llevadas al laboratorio donde se procedió al contaje y determinación taxonómica de los ejemplares capturados. Resultados Se contabilizaron 2.342 individuos, de los cuales 2.127 resultaron insectos. Se determinaron 220 especies distribuidas entre las siguientes clases taxonómicas: Arachnida, 12; Insecta, 205; Collembola, 2 y Chilopoda, 1 (Tabla 1 - Figura 1). Evaluando el tipo de alimentación de las distintas especies de artrópodos registrados en la Cuenca de Pozuelos, podemos establecer las siguientes relaciones porcentuales: especies fitófagas: 76%; carnívoras: 15%; detritívoras: 1%; parasitoiede: 8%. Dentro de los artrópodos, los insectos constituyen el 93% de las especies presentes y con respecto a la totalidad de los individuos muestreados, el 91% estuvo constituido por insectos. Capítulo 4: Los artrópodos 63 Tabla 1 Clases y Ordenes de Artrópodos registrados en la Cuenca de Pozuelos Clase Orden Comentarios Arachnida Comprende fundamentalmente quelicerados terrestres carnívoros. Dentro de la Clase, el Orden mejor representado es Araneae, con nueve especies, le siguen el Orden Solifugae con dos y Acarina con una especie de suelo y dos ectoparásitos. Araneae En Pozuelos se registraron nueve especies de arañas pero con escasa abundancia de individuos. La Familia Salticinae es la mejor representada, entre los 3650 y 3950 msnm, en estepas con pastizales y arbustivas. Solifugae Si bien no presentan en Pozuelos gran diversidad específica ni abundancia de individuos, son arácnidos característicos de las regiones áridas y desérticas. En la Cuenca se las encuentra entre los 3700 (tolares) y 4150 msnm (estepas de altura). Acarina En Pozuelos se registró una especie de suelo y dos ectoparásitos de camélidos, ovejas y ñandúes. Los ácaros del suelo están distribuidos y son frecuentes en todas las unidades ambientales. Los ácaros ectoparásitos son las garrapatas de ovejas y camélidos del género Amblyoma sp (Ixodidae) y ácaros causantes de la sarna sarcoptica en camélidos y otros animales (Sarcoptes sp.). Collembola En las regiones áridas, su presencia es indicadora de microclimas húmedos. En Pozuelos se los encuentra frecuentemente entre 3650 y 3950 msnm, registrándose la mayor abundancia sobre las vegas y pastizales. Chilopoda Litobiomorfa En Pozuelos se la encuentra ocasionalmente. Insecta En Pozuelos es la Clase que presenta la mayor diversidad específica (205 especies) y la mayor abundancia. El Orden Diptera es el de mayor diversidad específica, en cambio el Orden Hymenoptera es el que registra el mayor número de individuos (Figs. 1 y 2). De las 87 especies encontradas en Pozuelos, 19 corresponden al Suborden Nematocera, estando estrechamente ligados al tamaño del espejo de agua de la laguna y sus afluentes, todos ellos tienen larvas acuáticas que se alimentan de algas y vegetales. Los adultos hembras pueden ser hematófagos o ingerir líquidos vegetales. La Familia Phoridae también está bien representada con Diptera Capítulo 4: Los artrópodos 64 seis especies y abundancia de individuos. Las larvas viven en materia vegetal en descomposición o animales muertos, algunos son mirmecofilos. La Familia Tachinidae, presenta varias especies pero escasa abundancia de individuos, sus larvas son por lo general parásitos. Otras Familias registradas son: Chloropidae, Sarcophagidae, Anthomyiidae, Otitidae, todas con larvas saprófitas y Asilidae, Familia netamente predadora. Hymenoptera Este grupo de insectos es el segundo en diversidad (51 especies) y es el que registra las mayores abundancias de individuos dentro de Pozuelos. Se destaca la Familia Formicidae con 20 especies, incluye los Géneros Solenopsis con especies carnívoras, Pheidole con especies granívoras y Camponotus con especies fitófagas. Las Familias Eulophidae, Chalcididae, Braconidae, Plastygasteridae, Ceraphronidae, incluyen 17 especies parasitoides. Las Familias Pompilidae y Sphecidae incluyen especies predadoras. Coleoptera En Pozuelos se encuentran 26 especies. Se destacan las siguientes Familias: Carabidae de hábitos predadores, Staphylinidae, la mayoría son predadores sobre colembolos y hormigas, otros viven en materia orgánica en descomposición; Nitidulidae, con gran variedad de hábitos aunque predominan los fitofagos, es una familia típica de ambientes de altura; Curculionidae, fitófaga; Chrysomelidae, fitófaga; Meloidae con el Género Pseudomolos, característico de los desiertos, sus larvas se alimentan de huevos y langostas. Lepidoptera En Pozuelos se recolectaron 15 especies de mariposas. La mayor diversidad la presentan las polillas, cuyos tamaños varían de 3 a 10 mm de largo. Se las encuentra sobre arbustos de Baccharis a los 3650 msnm y en estepas arbustivas hasta los 4150 msnm. En las vegas, a los 3900 msnm, se encontró una especie de Nymphalidae, llamativa por su colorido y tamaño. Larvas de lepidópteros se encontraron sobre arbustales y pastizales, entre los 3700 y 3950 msnm. Homoptera Netamente fitófagos, casi todos pertenecientes a la Familia Cicadellidae. Viven principalmente sobre arbustos de Baccharis. Thysanoptera Chupadores de líquidos y vegetales, con dos especies, poco abundantes en individuos. Viven principalmente sobre Polylepis. Orthoptera Familia Acrididae. Viven en pastizales y arbustales entre los 3750 y 3950 msnm. Capítulo 4: Los artrópodos 65 Fig. 1 - Porcentaje de especies de insectos por órdenes Fig. 2 - Densidades de artrópodos en % Referencia de las abreviaturas utilizadas en las figuras del presente Capítulo. Dip: Diptera; Hym: Hymenoptera; Col: Coleoptera; Lep: Lepidoptera; Het: Heteroptera; Hom: Homoptera; Ort: Ortoptera; Coll: Collembola; New: Neuroptera; Thy: Thysanoptera; Ara: Araneae; Sol: Solifuga; Aca: Acarina; Chi: Chilopoda Capítulo 4: Los artrópodos 66 II - Adaptaciones de los insectos a la altura Estela Neder de Román 1 Martha Arce de Hamity 1 Los factores que actúan en los desiertos de altura como la Puna son entre otros, los siguientes: disminución de la presión atmosférica, hipoxia, alta transparencia en el aire, aridez, incremento en la intensidad de los rayos ultravioletas con marcada insolación y radiación, amplias diferencias en las temperaturas atmosféricas y del suelo y un elevado porcentaje de evaporación. Los vientos son prácticamente constantes, su velocidad actúa contrariamente a la insolación ya que de ello resulta una considerable baja en la temperatura atmosférica. Todos estos factores condicionan la vida, induciendo a los seres vivos a ajustes fisiológicos que se manifiestan en características morfológicas que determinan a su vez, la adaptación al ambiente. Los insectos no escapan a estas especializaciones. 1 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. Capítulo 4: Los artrópodos 67 No todos los insectos que se encuentran en las altas montañas pueden ser considerados como típicos de altura. Muchos son llevados desde pisos altitudinales más bajos hasta las altas montañas por acción del viento, llegando a las alturas de manera accidental. Sin embargo, hay otros, verdaderos residentes que se crían y reproducen en las grandes alturas y no se reúnen con los insectos de lugares más bajos. Estas son las verdaderas especies autóctonas de las alturas denominados insectos hipsobiontes o insectos de altura (Mani, 1962, 1968). Resulta dificultoso, sino imposible, afirmar con certeza que una simple característica en la organización morfológica de un insecto es una respuesta o especialización a la altura. La atrofia alar, típica de altura, también se presenta en los insectos de planicies bajas, donde está asociada al dimorfismo sexual o al modo de vida sedentario. El melanismo, observado en los insectos de pisos altitudinales bajos, alcanza su máxima expresión en el conocido “melanismo industrial” de los grandes centros urbanos de Europa, este melanismo se manifiesta en el oscurecimiento de las mariposas, como una adaptación de estos insectos a la contaminación del aire. En las alturas le sirve para protegerse contra los efectos de los rayos ultravioletas, cuya acción contribuye a la producción de estos pigmentos. La atrofia alar, el frío atmosférico y la hibernación prolongada retardan la metamorfosis y en consecuencia causa reducción en el tamaño de los insectos de altura, permitiéndoles resguardarse en refugios con condiciones microclimáticas óptimas. Asimismo, se produce un aumento en el número de setas que cubren el cuerpo retardando de esta manera la evaporación. Mientras que en las zonas bajas la mayoría de los insectos son fitófagos, en las alturas el porcentaje de estos insectos no supera el 30%. El resto de las especies de altura encontradas se alimentan de detritos orgánicos, carroña o son activos predadores. En las alturas los insectos generalmente son univoltinos, pero hay especies que requieren dos o tres años para producir una generación. Capítulo 4: Los artrópodos 68 La predominante falta de vuelo, por reducción o ausencia de alas, la pronunciada geofilia, los hábitos geobiontes, la restricción en el desarrollo y en el movimiento durante el breve verano en las alturas sumada a las condiciones típicas de estos ambientes, son los factores que gobiernan la distribución de los insectos. Con el incremento de la altura, se observa una progresiva y rápida caída en la abundancia de las especies de insectos con la desaparición de especies típicas de las zonas bajas y su reemplazo por otras especies de insectos. Esta distribución vertical es inseparable de la distribución horizontal, que no es aleatoria sino que es del tipo contagiosa con una tendencia a la agregación. La diversidad de habitats condiciona la formación de manchones localizados en áreas bien definidas determinadas por las características topográficas. La localización como la discontinuidad favorecen el aislamiento. El material obtenido dentro de la Cuenca de Pozuelos permite inferir que dicha Cuenca presenta insectos típicos de zonas bajas hasta los 3650 msnm. A partir de ese nivel altitudinal, las características morfológicas comienzan a evidenciarse en respuesta a la altura. En Hemiptera (Miridae) y en algunos Hymenopteros (Aculeata) se observa una reducción en el tamaño de las alas, con formas braquipteras y apteras. En Himenopteros parasitoides (Chalcidoidea), el tamaño corporal se reduce a menos de la mitad del logrado en las zonas bajas. La aparición de la Familia Nitidulidae (Coleoptera), típica de zonas de altura, también fue registrada en la Cuenca de Pozuelos. Lo mencionado indica una situación transicional de los insectos por acción de los factores ambientales, donde comienzan a manifestarse las características propias de las comunidades de altura. En la Cuenca de Pozuelos aún no se encontraron los verdaderos insectos hipsobiontes. Los muestreos realizados hasta los 4150 msnm, por lo tanto, resulta necesario continuar la toma de muestras a fin de poder delimitar la distribución altitudinal de cada una de las familias de insectos, y ver la posibilidad de establecer bioindicadores altitudinales como así también la aparición de nuevas especies con adaptaciones al riguroso ambiente de altura. Capítulo 4: Los artrópodos 69 III.- Diversidad de artrópodos en sitios seleccionados de la Cuenca de Pozuelos Martha Arce de Hamity 1 Estela Neder de Roman 1 Stella Maris Bonaventura 2 y Rodolfo Tecchi 1 Métodos Sitios considerados: 10 Características físicas ambientales: En cada sitio se midió la altitud, pendiente y orientación, definiéndose clases de rocosidad de acuerdo con el tamaño de rocas y piedras presentes en la superficie del suelo. Se tomaron muestras de suelo para su análisis (Capítulo 3). 1 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina 2 Depto. Cs. Biológicas, FCEN, UBA, 4° piso, Pab. II, Ciudad Universitaria, (1428) Buenos Aires, Argentina. Capítulo 4: Los artrópodos 70 Unidades de vegetación, cobertura y densidad de plantas: En cada sitio se registró las especies de plantas vasculares presentes. Se calculó la abundancia de cada especie mediante el método de Braun-Blanquet modificado por Maarel (1979). Se realizaron censos de vegetación para medir el porcentaje de la cobertura vegetal (Capítulo 3). Método de captura de artrópodos: Se muestrearon artrópodos utilizando trampas pitfall (presente Capítulo, 4.I). Densidad de artrópodos: Tasa de captura x 100 trampas/noche (índice de densidad relativa). Diversidad de artrópodos: Indice de Shannon-Weaver, D = -∑ p i . log p i donde p i es la proporción de la densidad promedio de la especie i en relación a la densidad promedio total. Resultados Capítulo 4: Los artrópodos 71 Capítulo 4: Los artrópodos 72 Capítulo 4: Los artrópodos 73 Capítulo 4: Los artrópodos 74 Capítulo 4: Los artrópodos 75 CAPITULO 5 HERPETOFAUNA I. Anfibios de la Reserva de la Biosfera Laguna de Pozuelos: Lista comentada y clave para su identificacion Marco Vaira 1 Introducción La composición de anfibios de las regiones andina y altoandina de Argentina ha sido resumida por Cei (1980, 1987). Sin embargo, dentro de los estudios recientemente desarrollados sobre la fauna terrestre de la Puna, la batracofauna ha recibido una atención limitada. Además, en la mayoría de los casos los estudios se restringen a la puna chilena (Veloso et al., 1982; Valencia et al., 1982) con escasas menciones al sector argentino (Valencia et al., 1992). Cei et al (1983) en un trabajo sobre herpetofauna de San Guillermo (Cordillera Frontal), menciona a Bufo spinolosus, como el único anfibio presente en la mencionada Reserva (Tabla 1). El estudio sobre la batracofauna de la Reserva de Biosfera Laguna de Pozuelos, en particular, solo registra un antecedente previo (Valencia et al., 1992) aunque la lista no ha sido completa. 1 Museo de Cs. Naturales, Univ. Nacional de Salta, Mendoza 2, (4400) Salta, Argentina. Capítulo 5: Herpetofauna 76 La presente revisión se ha llevado a cabo sobre la base de material recolectado en 1990 y 1991 por investigadores del Programa de Ecología Regional del Instituto de Biología de Altura de la Universidad Nacional de Jujuy, y por el autor durante una campaña especialmente realizada en el mes de marzo de 1993. Todo el material fue revisado y contrastado con especímenes depositados en el Museo de la Fundación Miguel Lillo, de Tucumán. Este trabajo intenta definir una lista actualizada de la batracofauna de la Cuenca de Pozuelos, una breve diagnosis y una clave artificial para la rápida identificación de los anuros en el campo. Por ello los caracteres seleccionados para las determinaciones sólo se limitan a aquellos observables en material vivo y a ojo desnudo. Taxas Observados Las cuatro especies registradas representan a dos familias y tres géneros (Tabla 1): Leptodactylidae: Pleurodema cinerea Pleurodema marmorata Telmatobius marmoratus sbsp. Bufonidae: Bufo spinolosus Todos los ejemplares de Telmatobius provenientes de la zona han sido descriptos como Telmatobius marmoratus. Sin embargo, el género necesita una profunda revisión por lo que se ha optado por indicarlo como T. marmoratus subespecie (Lavilla, com.pers.). Capítulo 5: Herpetofauna 77 Procedencia de los ejemplares colectados Río Corral Blanco, a espaldas del Cerro Médanos: P. cinerea, T. marmoratus. Río San Francisco y Río Santa Catalina: P. cinerea, B. spinolosus. Ciénego de Toquero: P. cinerea, B. spinolosus. Rio Santo Domingo, en las cercanías de la Escuela Santo Domingo: P. cinerea, T. marmoratus, B.spinolosus Diagnosis Pleurodema cinerea Cope, 1877. Dorso amarronado con manchas oscuras alargadas, bordeadas de claro. Glándulas lumbares con mancha negro brillante sobre un fondo claro. Cara oculta del muslo y la ingle anaranjado amarillento. Tímpano visible. Hocico corto. Cabeza ancha. Ojos anterolaterales. Pleurodema marmorata (Duméril y Bibron, 1841). Dorso amarillento verdoso o amarronado con manchas marrón oscuro. Vientre blanco. Sin glándulas lumbares. Tímpano pequeño. Hocico redondeado. Cabeza larga. Ojos prominentes, laterales. Telmatobius marmoratus (Duméril y Bibron, 1841). Dorso amarronado o grisáceo con manchas irregulares mas oscuras. Parte inferior del vientre y patas color anaranjado amarillento. Hocico redondeado. Cabeza aplanada. Ojos laterodorsales Bufo spinolosus Wiegmann, 1834. Piel dorsal glandular y verrucosa con espinas queratinosas, aunque es común observar en las mismas poblaciones otros individuos (por lo general hembras) con el dorso medianamente liso, amarronado u oliva y manchado irregularmente. Vientre liso muy plegado en algunas zonas. Los juveniles Capítulo 5: Herpetofauna 78 presentan las palmas y plantas amarillentas. CLAVE PARA LA IDENTIFICACIÓN DE LOS ANFIBIOS DE LA RESERVA DE BIOSFERA LAGUNA DE POZUELOS 1. a.- Presencia de glándulas parotoides ....................... Bufo spinolosus b.- Ausencia de glándulas parotoides..................................................2 2. a.- Glándulas lumbares evidentes.........................Pleurodema cinerea b.- Sin glándulas lumbares evidentes..................................................3 3. a.- Membrana interdigital desarrollada en miembros posteriores.................Telmatobius marmoratus sbsp. b.- Dedos de los pies con reborde cutáneo, nunca con membrana interdigital............... Pleurodema marmorata Tabla 1 Especies presentes en Pozuelos y San Guillermo Taxa Pozuelos Leptodactylidae Pleurodema cinerea + Pleurodema marmorata + Telmatobius marmoratus + Bufonidae Bufo spinolosus + Capítulo 5: Herpetofauna San Guillermo + 79 II. Un comentario general sobre los reptiles de la Puna y Cordillera Frontal Jorge Luis Cajal 1 Cuando se transita bajo exposición solar, por los llanos y roquedales andinos, los iguánidos se destacan por su frecuencia de aparición y de observación. Esto en alguna medida, refleja la importancia de ésta herpetofauna en los desiertos de altura. Cei (1993) hace referencia a la elevada especiación y diferenciación de los iguánidos del género Liolaemus en los relieves puneños. De acuerdo con el mencionado autor, en la Puna “sensu strictus” de las provincias de Jujuy, Salta y Catamarca se encuentran 10 especies de iguánidos, destacándose el género Liolaemus con nueve especies y Phymatura con una especie (Tabla 1). Estudios realizados en la Reserva de Biosfera San Guillermo (Cordillera Frontal), entre los años 1982 y 1983 determinaron una interesante herpetofauna localizada y con elevado endemismo (Cei et al., 1983). Estos estudios permitieron identificar dos especies nuevas de Liolaemus: L. eleodori y L. sp. Esta última no determinada en su momento por falta de material suficiente, pero aparentemente relacionada por su lepidosis al grupo psamófilo anomalus. También se determinó una especie de Phymatura, P. punae sp nov, forma vicaria de Phymatura palluma de Uspallata, Mendoza. Asimismo, se registró la presencia de Liolaemus elongatus, no conocida hasta ese momento al norte de Uspallata, Mendoza y del raro 1 FUCEMA. Pringles 10, (1183) Buenos Aires, Argentina Capítulo 5: Herpetofauna 80 Pristactylus scapulatus, iguanoide anoloide de costumbres crepusculares difíciles de ver y de capturar. Esta última especie, presenta un gran interés debido a su característica de relicto y por la distribución discontinua que presenta el género al cual pertenece (Cei et al., 1983) (Tabla 1). Conclusión Los iguánidos, con 15 especies registradas, constituyen el grupo sobresaliente de la herpetofauna andina, caracterizada por sus endemismos y distribución discontinua dentro de la región. En este marco, la Puna “sensu strictus” difiere de la Cordillera Frontal en cuanto a composición de especies. Al presente los conocimientos sobre la biología de la mayoría de las especies presentes son nulos o escasos (Cei, 1993), no obstante, la importancia que tienen dentro del ecosistema andino. Tabla 1 Especies de iguánidos en la región andina Especies Puna (1) Liolaemus dorbigni + L. nigriceps + L. orientalis chlorostictus + L. andinus + L. poecilochromus + L. multicolor + L. irregularis + L. ornatus + L. constanzae + L. eleodori L. elongatus L. sp. + Phymatura antofagastensis + P. punae Pristidactylus scapulatus Ref.: (1) altiplano de Jujuy, Salta y Catamarca; (2) San Guillermo, San Juan. Capítulo 5: Herpetofauna Cordillera Frontal (2) + + + + 81 CAPITULO 6 LA AVIFAUNA ANDINA Jorge Luis Cajal 1 Introducción Entre los estudios pioneros sobre la avifauna puneña se destacan los de Chapmann (1921, 1926), quién se refirió al origen y distribución de las especies. Posteriormente, Pearson y Ralph (1978) estudiaron la biomasa de aves a diferentes niveles de altitud en la Puna y otras localidades del Perú. Vuilleumier y Simberloff (1980) realizaron comparaciones biogeográficas entre especies de la Puna y el Páramo, incluyendo en sus estudios la localidad argentina de Mina Aguilar (23° 20’ S en la Provincia de Jujuy). Finalmente se destacan los estudios de Vuilleumier (1983) y Fjeldsa (1985) quienes analizaron el origen, evolución y situación de la avifauna puneña. El presente capítulo vuelca los resultados de estudios sobre diversidad de especies de aves realizados entre 1981 y 1983 en tres reservas (San Guillermo, Laguna Brava y Laguna Blanca) y en la localidad de Antofagasta 1 FUCEMA. Pringles 10, (1183) Buenos Aires, Argentina Capítulo 6: La avifauna andina 82 de la Sierra, Catamarca. Las mencionadas localidades comprenden tanto la Puna sensu strictus como la Cordillera Frontal. Métodos Un total de 100.000 ha fueron cubiertas en cada reserva desde 1981 a 1983 durante las estaciones de verano e invierno. En Antofagasta de la Sierra fue estudiada exclusivamente la laguna del mismo nombre (26° 20’ S, 67° 30’ W, 325 ha de espejo de agua y 700 ha de orilla y ladera volcánica). Sesenta días de observación efectiva fueron dedicados en cada localidad hasta que se juzgó haberse registrado entre el 80 y 90 % de las especies esperadas para la región en base a Olrog y Capllonch (1986). Las observaciones fueron acompañadas de capturas vivas mediante redes de niebla. La determinación de las especies estuvo a cargo de Claes Olrog quien participó en las mencionadas campañas de estudio. Las especies de aves fueron ubicadas en los diferentes biotopos presentes de acuerdo a los definidos por Vuilleumier y Simberloff (1980) para la región puneña: 1. Lagos y lagunas con o sin juncáceas en las orillas (Laguna Blanca, Laguna Brava, Antofagasta de la Sierra). 2. Ríos permanentes con bancos de grava y arena (San Guillermo, Laguna Brava, Laguna Blanca). 3. Llanos áridos de pendientes suaves con pastizal (San Guillermo, Laguna Brava, Laguna Blanca). 4. Llanos áridos o laderas de poca pendiente con tola (tolares) (Laguna Blanca). 5. Prados pantanosos en suelos planos o sobre laderas de diferentes pendientes, pastizal húmedo y denso (vegas) (San Guillermo, Laguna Brava, Laguna Blanca, Antofagasta). 6. Laderas rocosas con canto rodado, incluyendo tanto pastizal como arbustal (San Guillermo, Laguna Brava, Laguna Blanca, Antofagasta). Capítulo 6: La avifauna andina 83 7. Salares con vegetación abierta y baja en los márgenes. (Laguna Brava, Laguna Blanca). 8. Tundra con Distichia, Azorella, vegetación de turbera (no incluida en ninguna de las localidades estudiadas). 9. Bosquecillos de Polylepis (no incluidas en las localidades estudiadas, biotopo presente en la puna de Jujuy). Las especies registradas fueron tabuladas en zonas de vida (Puna y altoandino, subtropical. tropical, templado, general y visitante migratorio), de acuerdo con Olrog (1984). Para San Guillermo, Laguna Brava y Laguna Blanca se categorizaron cuatro parámetros de nicho a saber: 1) Habitat (llanos, laderas rocosas, vegas, lagunas y ríos permanentes), para ésta categoría se tuvo en cuenta que hay especies que ocupan mas de un tipo de habitat (ej.: Muscisaxila spp en llanos y laderas rocosas, etc.); 2) Hábitos, teniendo en cuenta la forma y el tiempo dedicado por cada especie para obtener alimento (terrestre o principalmente terrestre, volador, acuático, limnícola); 3) Alimentación (herbívoro, omnívoro, carnívoro/carroñero, insectívoro, granívoro, frugívoro); 4) Tamaño corporal de acuerdo con la distancia pico-cola (>80 cm, 40-80 cm, 20-40 cm, <20 cm (Olrog, 1984; Araya y Millie, 1986). Se analizó el porcentaje de simpatría entre especies congéneres relacionadas, teniendo en cuenta lo discutido por Vuilleumier y Simberloff (1980), para distintas localidades de la Puna y el Páramo. Los casos de coparticipación de habitat entre especies emparentadas fueron tabuladas para las tres reservas. Se definió coparticipación de habitat como el uso del mismo habitat y sitio. Los casos donde las especies de aves usaban los mismos habitats pero en sitios diferentes (ausencia de superposición), no fueron considerados. Vuilleumier y Simberloff (1980) definieron como “buenos” casos de coparticipación de habitat aquellos casos donde las especies simpátridas presentes en pares o tripletes representan taxones estrechamente relacionados dentro de sus respectivos géneros. Resultados y discusión Capítulo 6: La avifauna andina 84 Diversidad de especies Se registraron un total de 79 especies para las localidades estudiadas. De éstas, nueve resultaron de distribución restringida a la región puneña y altoandina (Tablas 1 y 2). El número de especies comunes a las tres reservas fue de 14, esto es el 18 % en relación al total registrado. La Puna sensu strictus presenta mayor número de especies que la Cordillera Frontal (Fig. 1). La cantidad de especies registradas constituyó el 68 % de las especies esperadas (116 entre especies endémicas, migratorias y de distribución general) para la región de acuerdo con Olrog (1984) y Olrog y Capllonch (1986). La cantidad de días efectivos de observación por localidad (60), dan garantías de no haber submuestreado las áreas de estudio. Al respecto, Vuilleumier y Simberloff (1980) consideran una curva especies-días que permiten conocer el número de días necesarios en orden de registrar entre el 80 a 90 % de las especies presentes. Estos autores, para las distintas localidades que estudiaron señalan que entre siete a 30 representan el mínimo número de días para que un observador entrenado alcance la asíntota de la curva y sean prácticamente completos. Simpatría El porcentaje de simpatría entre especies congéneres fue del 33 %, 35 %, y 36 % en San Guillermo, Laguna Brava, y Laguna Blanca, respectivamente. De acuerdo con Vuilleumier y Simberloff (1980), el porcentaje de simpatría de especies congéneres relacionadas es bastante similar en el Páramo y la Puna, del 30 al 36 %, similar rango al encontrado para las tres localidades andinas argentina (Tabla 4). Una mención especial, merecen dos géneros subcines insectívoros (Geositta y Upucerthia) y dos géneros oscines granívoros (Phrygilus y Sicalis), de los cuales se ha planteado una radiación adaptativa paralela en relación con las formas de sus picos (Olrog, 1979). Estos géneros presentan hábitos terrestres, y viven en superposición (Tabla 3), en llanos con pastizales y laderas rocosas con suelos arenosos o pedregosos (Fig. 2). Si bien la exacta selección de alimento por parte Capítulo 6: La avifauna andina 85 de estas aves se desconoce, las diferencias en forma que presentan sus picos, ha llevado a plantearse que dichas especies no compiten entre si en aquellos lugares donde conviven, encontrándose una suave superposición en aquellos casos de especies con similar pico (Olrog, 1979). Estudios detallados sobre hábitos alimenticios de aves en pastizales y estepas arbustivas han demostrado que las diferentes especies que coexisten (con diferencias en tamaño corporal y forma de pico), muestran alta superposición en sus dietas (Wiens, 1977). Parecería (según éste autor), que especies que coexisten responden de manera oportunista y de igual manera hacia el tipo de alimento que aparece como mas disponible en un momento dado. La región andina ofrece un interesante campo de estudio en las aves (principalmente en Furnariidae, Tyrannidae y Emberizidae), en relación a la competencia, utilización de recursos y coexistencia entre especies ecológicamente similares. Distribución en parche Se entiende especies distribuidas en parche aquellas que faltan en uno o más áreas dentro de su normal rango de distribución geográfica y de habitat (Vuilleumier y Simberloff, 1980). Diferentes especies observadas en las localidades estudiadas muestran una distribución en parche. De siete especies correspondientes a las zonas de vida de Olrog (1984) Templado/Puna y Puna/Altoandino observadas en San Guillermo pero no en Laguna Blanca (Tabla 1), solamente Polyborus megalopterus no tiene distribución en parche. Phrygilus dorsalis no pudo ser ubicada en ninguno de los tipos de distribución que estamos discutiendo, por falta de información. Las otras (Circus cinereus, Phegornis mitchelii, Thinocorus rumicivorus, Fulica cornuta y Muscisaxicola alpina) tendrían una distribución en parche. Vuillleumier y Simberloff (1980) han confirmado este tipo de distribución para las tres primeras especies y como posible para Fulica cornuta. Muscisaxicola alpina es considerada como de distribución continua pero con interrogantes. Esta especie, que en San Guillermo ocupa iguales habitats (pastizales, roquedales) que sus congéneres (M. albilora, M. frontalis, M. macloviana y M. maculirostris), no presenta superposición con las mencionadas especies dentro de la Reserva. De acuerdo a lo observado la especie podría ser considerada como de distribución en parche. De las 13 especies correspondientes a las zonas de vida TemplaCapítulo 6: La avifauna andina 86 do/Puna y Puna/Altoandino que se observaron en Laguna Blanca pero no en San Guillermo, (Tabla 1), Podiceps occipitalis, Anas cyanoptera y Oreopholus ruficollis son mencionadas por Vuilleumier y Simberloff (1980) como especies distribuidas en parche, incluyendo en la misma categoría a Muscisaxicola flavinucha pero con interrogantes. Un caso dudoso, difícil de incluir en alguna de las categorías fue Oxiura ferruginea. De acuerdo con nuestras observaciones ésta especie y M. flavinucha podrían ser consideradas como de distribución en parche. El resto de las especies (Vanellus resplendens, Recurvirostra andina, Thripophaga modesta, Anas puna, Fulica americana) tienen, según los mencionados autores, distribución continua. El hecho de no estar presentes en San Guillermo se debería no a razones de distribución en parche, sino a que el área de distribución de éstas especies no llega hasta esas latitudes dentro de la región andina argentina (Olrog, 1984). Comentarios finales Los cambios ocurridos durante el Pleistoceno podrían explicar la presente distribución de la avifauna andina. El ascenso de la cordillera de Los Andes durante el Pleistoceno temprano (preglacial) dio lugar a la formación de la Puna como una unidad continua, ocupándose los nuevos habitats así formados a partir de distintas rutas de colonización. Luego se produjo el avance del período glacial, dividiéndose la Puna en distintas porciones como consecuencia de la aparición de lagos y montañas glaciales, restringiéndose de esta manera el área disponible y dando lugar a la fragmentación de las poblaciones de aves. Es durante este período de aislamiento que se supone ocurrieron los procesos de diferenciación. Finalmente durante el período interglacial (tiempo presente) la Puna vuelve a ser una superficie continua como consecuencia de la desaparición de las barreras, permitiendo de ésta manera, el contacto de las especies y dando como resultado el grado de simpatría que se puede observar en la actualidad (ver Vuilleumier y Simberloff, 1980; Vuilleumier, 1983). Con respecto a la avifauna acuática, Fjeldsa (1985) dice que probablemente han emigrado hacia la región andina luego de la época glacial, según éste autor, la colonización de los Andes fue casi unidireccional desde las tierras bajas del sur, lo cual ha determinado que hacia el norte se de una marcada disminución de taxones de aves adaptadas a los ambientes áridos. Si bien la región no presenta marcadas barreras ecológicas, existe un gradiente longitudinal, desde condiciones desérticas en el oeste hacia condiciones húmedas en el este y norte (Fjeldsa, 1985; Capítulo 1). FjeldCapítulo 6: La avifauna andina 87 sa (1985) destaca a los humedales como ambientes muy particulares y diferentes entre si (lagunas salobres, lagunas de agua dulce, amplios bofedales, vegas con cursos de agua permanente y partes temporariamente inundables, salares, ciénegos de altura, lagunas estériles de altura) dentro de la aparente uniformidad que presentan los pastizales y otros habitats semidesérticos de la Puna. Para éste autor, el distrito de los lagos y lagunas en la Puna presenta uno de los espectáculos más característicos de la avifauna acuática del continente (Capítulo 8). La presencia de especies como indicadoras de biodiversidad continuará constituyendo una importante soporte para los inventarios, monitoreos y esfuerzos de valoración ambiental (Noss, 1990). En la región andina hay muchos grupos de aves, tales como ñandúes, perdices, flamencos, gansos, patos, cóndores, halcones, águilas y lechuzas que pueden justificar los esfuerzos de conservación, incluyendo tareas de monitoreo intensivo (Fig. 3). Alguno de estos grupos caen en las categorías de especies carismáticas (de valor simbólico para parte de la opinión pública) y vulnerables (especies raras, genéticamente impredecibles, de baja fecundidad, dependiente de recursos en parche e impredecibles, extremadamente variables en densidad, perseguidas o en peligro de extinción ) (Noss, 1990). En la Puna existe un endemismo de aves relativamente alto (BOX 1), sin embargo con la excepción de Plegadis ridgwayi y Gallinago andina, dicho endemismo existe a nivel subespecífico. Muchas de las subespecies andinas difieren de las poblaciones de pisos altitudinales mas bajos en tamaño (son mas grandes), debido posiblemente a una evolución adaptativa a las condiciones climáticas de altura y mantenida por falta de flujo genético a través de ecotonos bien marcados presentes a lo largo de las pendientes andinas (Fjeldsa, 1985). La región andina norte de Argentina representa una de las 221 áreas del mundo con endemismos de aves de alta prioridad de acuerdo con el grado de amenaza, importancia y necesidad de áreas protegidas (Bibby et al., 1992). En la actualidad hay una necesidad de mapear la biodiversidad mundial. En éste marco, las aves juegan un rol destacado para la determinación de prioridades en relación con la conservación de la biodiversidad. Capítulo 6: La avifauna andina 88 BOX 1 Endemismos en la Puna americana Endemismos muy localizados: Rollandia microptera en el área del lago Titicaca; Podiceps taczanowskii y la subespecie tuerosi de Laterallus jamaicensis en el área del lago Junín; Fulica cornuta en humedales de la puna desértica. Endemismos bastante localizados Phoenicoparrus andinus y P. jamesi, Endemismos que habitan sobre amplias porciones de la Puna: Plegadis ridgwayi, Anas puna, Charadrius alticola, Recurvirostra andina, Gallinago andina. Endemismos que extienden sus rango hacia las partes altas del sur de los Andes: Chloephaga melanoptera, Phegornis mitchellii, Larus serranus. Especies de amplia distribución en tierras bajas con subespecies puneñas moderadamente bien definidas: Anas cyanoptera, Pardirallus sanguinolentus, Gallinula chlorpus, Phleocryptes melanops, Tachuris rubrigastra, Cistothorus platensis, Agelaius thilius. Fuente: Fjeldsa (1985). Capítulo 6: La avifauna andina Tabla 1 Listado de familias y especies registradas en cuatro localidades andinas Familia Especie Habitat Habito Alimentación Rheidae Pterocnemia pennata Tinamidae Tinamotis pentlandii Ll-Lr-Ve T O 400-800 Nothura ornata Nothura pentlandii + + + + + + P Te/P Te Podicipedidae Podiceps occipitalis L A C 200-400 Podiceps rolland + + + + Te/P S/Te Ardeidae Nycticorax nycticorax + G Threskiornithidae Plegadis ridgwayi + Te/P H >800 + + + L A I >800 + + + + + Te/P L A I >800 + + + + P L A I >800 + + + + P 89 Capítulo 6: La avifauna andina Te/P Phoenicopterus chilensis Phoenicoparrus andinus Phoenicoparrus jamesi T Zonas de vida + Phoenicpteridae Ll-Lr-Ve Tamaño E (1) SG LBr LBl AS corporal (mm) Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Tamaño E (1) SG LBr LBl AS corporal (mm) Anatidae Cathartidae Falconidae Cloephaga melanoptera L-R T H 400-800 + + + + + Lophonetta specularoides L-R A H-I 400-800 + + + + + Anas flavirostris L-R A H-I 400-800 + + + + + Anas georgica L-R A H-I 400-800 + + + + Anas puna L-R A H-I 400-800 + + + Anas cyanoptera L-R A H-I 400-800 + + + Anas sibilatrix L-R A H-I 400-800 + + Oxyura ferruginea L-R A H-I 400-800 + + + Netta erythropthalma + Cathartes aura + Vultur gryphus Ll-Lr-Ve V C >800 + + + + + Falco femoralis Ll-Lr-Ve V C 200-400 + + + + + Falco sparverius Ll-Lr-Ve V C 200-400 + Falco peregrinus Ll-Lr-Ve V C 400-800 + Spiziapteris circumcinctus (*) + Polyborus megalopterus Ll-Lr-Ve V C 400-800 + + + Polyborus plancus Ll-Lr-Ve V C 400-800 + + Accipitridae Buteo polysoma Ll-Lr-Ve V C 400-800 Circus cinereus Ll-Lr-Ve V C 400-800 Buteo poecilochrus Geranoaetus melanoleucus Zonas de vida Te/P Te/P Te S/Te Te/p Te/P Te Te/P Te/P G Te/P G G Te S/Te Te/P G + + + + + + + + Te/P Te/P P + T/Te Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Tamaño E (1) SG LBr LBl AS corporal (mm) + + + + + + + Zonas de vida Strigidae Bubo virginianus Lr-Ve V C 400-800 Asio flammeus Ll-Lr-Ve V C 200-400 Athene cunicularia Caprimulgidae Caprimulgus longirostris Ll-Lr-Ve V I 200-400 + + + Laridae Larus serranus Ve-L-R Li C 400-800 + + + Charadriidae Rallidae Charadrius alticola Ve Li I <200 Oreopholus ruficollis Ve Li I 200-400 Vanellus resplendes Ve Li I 200-400 Phegornis mithellii Ve Li I Gallinula chloropus L-R A H-I 200-400 Fulica americana L-R A H-I 400-800 Fulica cornuta L-R A H-I 400-800 Fulica gigantea L-R A H-I 400-800 Rallus sanguinolientus Scolopacidae Calidris bairdii Ve Li I <200 + + Gallinago andina + VM Te/P Recurvirostridae Recurvirostra andina Ve Himantopus melanurus Ve + Te/P + S/Te Psittacidae Bolborhynchus aymara Ll-Lr V G-F <200 Bolborhynchus aurifrons + Te + + + + + + + + + + + + + + + + + + + + + + + + Li I 400-800 + + Li I 400-800 + + + G G G G P P Te/P Te/P Te/P G Te/P P P G Te/P Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Tamaño E (1) SG LBr LBl AS corporal (mm) + + + + Zonas de vida Columbidae Metriopelia aymara Ll-Lr T G <200 Metriopelia melanoptera Ll-Lr T G 200-400 Metripelia ceciliae Metripelia morenoi P Thinocoridae Attagis gayi Thinocorus orbignyanus Thinocorus rumicivorus Apodidae Aeronautes andecollus + Te Trochilidae Oreotrochilus leucopleurus Oreotrochilus estella Patagonas gigas + + + Te Te/P Te Picidae Colaptes rupicola + Te/P + + + + + Te Te/P Te Ll T G 200-400 + + + + Te/P Ll T G 200-400 + + + + Te/P Ll T G <200 + + Te/P Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Furnariidae Tamaño E (1) SG LBr LBl AS corporal (mm) Geositta cunicularia Ll-Lr T I <200 + + + + Geositta punensis Ll-Lr T I <200 + + + + + Geositta isabellina Ll-Lr T I <200 + Geositta rufipennis Ll-Lr T I <200 + + + Geositta tenuirostris + Thripophaga modesta Ll-Lr T I <200 + + Thripophaga dorbignyi Ll-Lr T I <200 + + Thripophaga steinbachi + Thripophaga anthoides + Thripophaga maculicauda + Leptosthenura aegithaloides Ll-Lr T I <200 + + + Upucerthia ruficauda Ll-Lr T I 200-400 + + + + Upucerthia dumetaria Ll-Lr T I 200-400 + + + + Upucerthia validirostris Ll-Lr T I 200-400 + + + Upucerthia andaecola Ll-Lr T I 200-400 + + + Cinclodes atacamensis Ll-Lr T I 200-400 + + + + Cinclodes fuscus + Zonas de vida Te/P P Te Te Te/P Te/P Te Te Te/P Te/P Te/P Te/P Te Te Te/P Te/P Te/P Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Tamaño E (1) SG LBr LBl AS corporal (mm) Tyrannidae Muscisaxicola flavinucha Ll-Lr T I <200 + Muscisaxicola capistrata Ll-Lr T I <200 + Muscisaxicola albilora Ll-Lr T I <200 + + + + Muscisaxicola alpina Ll-Lr T I <200 + + Muscisaxicola frontalis Ll-Lr T I 200-400 + + Muscisaxicola macloviana Ll-Lr T I <200 + Muscisaxicola maculirostris Ll-Lr T I <200 + + Muscisaxicola rufivertex + Muscisaxicola juninensis + Lessonia rufa Ve T I <200 + + + Agriornis montana Lr T I 200-400 + + + Agriornis andicola + Agriornis microptera Lr T I 200-400 + + Ochthoeca cenanthoides + Ochthoeca leucophrys + Tachuris rubrigastra + Anairetes parulus + Mimidae Mimus dorsalis + Zonas de vida Te/P Te/P Te/P Te/P Te Te Te Te/P Te/P Te Te/P Te/P Te Te Te G S/Te Te Tabla 1 (Continuación) Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Familia Especie Habitat Habito Alimentación Tamaño E (1) SG LBr LBl AS corporal (mm) Hirundinidae Riparia riparia Atticora melanoleuca Notiochelidon cyanoleuca Troglodytidae Turdidae Turdus chiguanco Motacillidae Emberizidae Anthus correndera Ll T I <200 Anthus hellmayri Ll T I <200 Anthus furcatus Anthus bogotensis Catamenia analis Catamenia inornata Sicalis olivascens Ll-Lr T G <200 Sicalis auriventris Ll-Lr T G <200 Sicalis lutea Sicalis uropygialis Diuca diuca Diuca speculifera Idiopsar brachyurus Zonas de vida Ll-Lr V I <200 + VM Ll-Lr V I <200 + + Te Ll-Lr V I <200 + + + G Cistothorus platensisLl-Lr T I <200 + + G T G + + Ll-Lr 200-400 + + + + + + + + + + + + + + + + + + + + + Te S/Te S/Te S/Te/P Te/P Te Te Te Te Te/P Te/P Te P Te/P Tabla 1 (Continuación) Familia Especie Habitat Habito Alimentación 96 Capítulo 6: La avifauna andina Listado de familias y especies registradas en cuatro localidades andinas (Continuación) Tamaño E (1) SG LBr LBl AS corporal (mm) Zonas de vida Phrygilus gayi Ll-Lr T G <200 Phrygilus atriceps Phrygilus fruticeti Ll-Lr T G <200 Phrygilus unicolor Ll-Lr T G <200 Phrygilus dorsalis Ll-Lr T G <200 Phrygilus plebejus Ll-Lr T G <200 Phrygilus alaudinus Aimophila strigiceps Junco capensis Ve-Ll T G <200 + + + + + + + + + + + + + + + + + + + + Te Te/P Te Te Te/P Te Te S G Carduelidae Carduelis atratus Carduelis uropygialis Carduelis crassirostris + + + Te/P Te/P Te/P Icteridae Molothrus bonariensis + G Total especies 116 51 25 62 32 Ref.: SG: San Guillermo; LBr: Laguna Brava; LBl: Laguna Blanca; AS: Laguna de Antofagasta de la Sierra; (1): listado mencionado para la región puneña y altoandina, según Olrog (1984) y Olrog y Capllonch (1986); (*) Fue observado un solo ejemplar, posiblemente habría extraviado su rumbo; Columna 3 (Habitat), Ll: llano y laderas no rocosas; Lr: laderas rocosas; Ve: vegas; L: lagunas; R: ríos. Columna 4 (Habitos), T: terrestre; V: volador; A: acuático; Li: limícola. Columna 4 (Alimentación), H: herbívoro; O: omnívoro; C: carnívoro o carroñero; I: insectívoro; G: granívoro; F: frugívoro. Columna 12, Te: Templado; P: Puna y altoandino; G: general; VM: visitante migratorio; S: subtropical; T: tropical. Tabla 2 Número de biotopos considerados de aves y número de especies en las cuatro localidades estudiadas. Se señala especialmente los passeriformes subcines y oscines por estar bien representados en los espacios abiertos de la Puna y Cordillera Frontal (Olrog, 1976) Localidad Altitud media (msnm) Biotopos N° de especies considerados Zonas de vida T/P y P F+T+E 3450 4 51 26 23 Laguna Brava 4200 6 25 17 4 Laguna Blanca 3300 7 62 29 19 Antofagasta (1) 3200 3 32 22 10 Ref.: F: Furnariidae; T: Tyrannidae; E: Emberizidae; Te/P: templado y puna; P: puna y altoandino; (1): solamente se considera la laguna y el área correspondiente a la perilaguna (ver texto). 97 Capítulo 6: La avifauna andina San Guillermo 98 Tabla 3 Coparticipación de habitat entre especies congéneres simpatridas (pares o tripletes de especies). Géneros San Guillermo Laguna Brava Anas flavirostris georgica Polyborus megalopterus plancus flavirostris georgica puna megalopterus plancus Falco Agriornis Laguna Blanca femoralis sparverius microptera* montana* Metripelia aymara melanoptera Thinocorus orbignyanus* rumicivorus* orbignyanus* rumicivorus* Geositta cunicularia* cunicularia* punensis* punensis* rufipennis aymara melanoptera cunicularia* punensis* rufipennis Upucerthia ruficauda dumetaria ruficauda dumetaria validirostris andaecola Muscisaxicola albilora frontalis maculirostris albilora flavinucha capistrata Sicalis olivascens auriventris Phrygilus gayi unicolor* dorsalis* Ref.: gayi plebejus fruticeti * significa buenos casos según Vuilleumier y Simberloff (1980). Capítulo 6: La avifauna andina Tabla 4 Lagunas de la Puna y Cordillera Frontal con datos censales de flamencos Provincia Localidad Laguna Sup. (ha) msnm 12/81 1/82 2/78 12/81 12/81 2/82 12/81 12/81 10/78 5/81 1/82 3/82 2/83 3/84 5/81 1/82 3/82 2/83 3/82 3/84 4/81 5/81 1/82 2/82 3/82 2/83 10/78 5/81 P. chilensis P. jamesiP. andinus 997 223 2 4 31 17 2 2 320 0 0 150 0 47 269 (1) 0 0 0 0 2 2 0 280 40 950 (2) 110 34 0 400 326 505 0 2 0 0 0 32 0 10 78 99 Capítulo 6: La avifauna andina San Juan San Guillermo La Hualca 500 4118 Macho <300 4140 Muerto Los Mogotes <300 4215 Lagunita <100 4200 Los Bueyes <200 3980 La Paila <200 4030 La Rioja Lag. Brava Veladero 700 3840 Verde 600 4110 Mulas 650 4000 Muertas Lag. Brava 5800 4230 El Leoncito 700 3900 Censo Tabla 4 (Continuación) 100 Capítulo 6: La avifauna andina Lagunas de la Puna y Cordillera Frontal con datos censales de flamencos Provincia Localidad Laguna Sup. (ha) msnm Catamarca Lag. Blanca Lag. Blanca 3000 3180 Antofagasta Antofagasta 300 3200 Colorada 150 3500 Jujuy Susques Vilama 8700 4600 Censo 5/78 8/78 2/79 10/81 6/82 10/85 2/86 10/81 6/82 7/82 6/80 2/93 (6) P. chilensis P. jamesiP. andinus 14 (3) 38 (4) 75 42 (5) 11 1500 0 273 27 20 3 12 0 64 119 277 480 42 0 6 137 661 Ref.: (1): 46 adultos y 223 pichones, 270 nidos activos; (2): P. jamesi en grupos separados con respecto a las otras dos especies, P. andinus mezclaco con P. chilensis; (3) se encontraron 13 ejemplares muertos; (4): 17 adultos y 21 pichones; (5): 34 adultos y 8 pichones; (6): Fuente Nicolossi (1993). Para la Laguna de Pozuelos ver Capítulo 8. 101 Fig. 1 - Número de especies y familias de aves en localidades de la Puna y Cordillera Frontal Fig. 2 - Número de ejemplares contabilizados en una porción del área nuclear de San Guillermo (1500 km2) Capítulo 6: La avifauna andina 102 Llamas y Piuquenes Reserva de Biosfera Laguna Blanca (Catamarca) Flamencos en lagunas de la Puna Capítulo 6: La avifauna andina 103 CAPITULO 7 UNA ESPECIE FRAGIL: EL ÑANDU PETIZO Jorge Luis Cajal 1 El ñandú petizo, subespecie Pterocnemia pennata garleppi (Chubb), habita las estepas desérticas de la región andina (Olrog, 1968, 1978, 1984) 2 Poco se ha estudiado sobre su ecología y dinámica poblacional (Handford y Mares, 1985). El presente capítulo tiene como objetivo volcar la información sobre uso de habitat, dieta y situación poblacional del ñandú petizo originada a partir de los estudios realizados en San Guillermo y otras localidades de la región andina (Cajal, 1988). Métodos Entre enero de 1977 a septiembre de 1984 se realizaron observaciones en San Guillermo, que comprendieron 420 días y 2.100 horas durante verano e invierno. Estas observaciones se realizaron cubriendo una superficie de 577.700 ha. 1 2 FUCEMA. Pringles 10, (1183) Buenos Argentina Se registraron los siguientes datos: Aires, número de animales, ubicación, Originalmente publicado en Biological Conservation (1988) Capítulo 7: El ñandú petizo 104 tamaño del grupo, sexo. Se utilizó el censo completo por sectores (Cajal, 1988). Los censos fueron realizados por parte de dos grupos de observadores compuestos por dos personas cada uno, , mediante automotor y/o mulares, utilizando binoculares 7 x 35. Los dos grupos de censo cubrieron simultáneamente los límites de los sectores (definidos por características físicas tales como ríos, cumbres y laderas), a fin de evitar el doble conteo, debido al posible movimiento de las aves de un sector a otro como consecuencia de la presencia humana. Se realizaron censos de ñandúes (censos completos y mediante transectas) en sectores situados en las localidades de Laguna Brava (La Rioja), Laguna Blanca y Antofagasta de la Sierra (Catamarca). Para la Laguna de Pozuelos y Susques (Jujuy), se consideraron los datos censales recabados por García Fernández et al. (1989) y Nicolossi (1994). En San Guillermo, se registró la vegetación perenne en el área donde los ñandúes eran observados. Se muestrearon las unidades vegetales mediante el uso de cuadrados. La elección de los sitios de muestreo fue determinado de acuerdo a la uniformidad de la vegetación y topografía. Se seleccionó un total de 29 sitios tomándose al azar una cantidad de 22 cuadrados de muestreo en cada uno de ellos, registrándose la cobertura vegetal (superficie del área cubierta por cada planta). Para determinar la selección de habitat por parte de los ñandúes, se consideraron dos principales ambientes: laderas y llanos. Se colectaron muestras de heces para el análisis microscópico a fin de determinar las preferencias alimentarias (Dusi, 1949). Cada muestra fue triturada y preparada en glicerina. A partir de cada una de las muestras, se tomaron dos submuestras a fin de ser analizadas de manera sistemática mediante microscopio de 100 x aumento. Para cada slide preparado con heces, se ubicaron bajo el microscopio, diez campos de observación, examinándose en los mismos, la presencia de fragmentos identificables de las distintas especies vegetales (epidermis de células, estomas, tricomas). Se determinó la frecuencia de presencia de éstos fragmentos, calculándose el porcentaje de densidad relativa, mediante la densidad de partículas de cada especie de planta dividida por el número total de partículas de todas las especies detectadas. Para mayor información sobre análisis microscópico de heces ver Stewart (1967), Zyznar y Urness (1969), Anthony y Smith (1974). Capítulo 7: El ñandú petizo 105 Se prepararon slides de referencia para cada especie vegetal presente en las áreas de estudio (Storr, 1961; Latour y Pelliza, 1981). A nivel cualitativo, las muestras de heces fueron examinadas a simple vista y con lupa. Para determinar las preferencias alimentarias se utilizó el test de Student Newman-Keuls para comparación múltiples de medias (Sokal y Rohlf, 1979) y el test de Kolmogorov-Smirnov (Siegel, 1983). Resultados y Discusión Número y densidades En la tabla 1 se indican los números máximos de ñandúes observados por censo en sectores ubicados en las distintas localidades consideradas, y en la Fig. 1 se indican las densidades y sus tendencias. Esta tabla y figura muestran que las poblaciones de ñandúes presentan bajas densidades, considerables fluctuaciones y en muchos casos una tendencia a disminuir. Para Chile, hay referencias sobre bajas densidades y fluctuaciones en las poblaciones de Pterocnemia pennata (J. Rottmann, com. per.). Dentro de las localidades ubicadas en la Puna sensu strictus, las densidades más altas fueron registradas en la Provincia de Jujuy; Cuenca de Pozuelos, (0,52 ñ/km2),y Olaroz (0,41 ñ/km2). En las localidades de Catamarca (Antofagasta de la Sierra, Laguna Blanca), las densidades no superaron los 0,12 ñ/km2. En la Cordillera Frontal, las densidades registradas fueron aún menores. En San Guillermo entre los años 1978 - 1993 las densidades oscilaron entre los 0,01 a 0,03 ñ/km2. En Laguna Brava no se registraron poblaciones estables de ñandúes, esporádicamente se observaron ejemplares en los llanos más bajos limítrofes con San Guillermo. Densidades superiores se registran en la Precordillera y ecotono. En un llano situado a 2.600 msnm (El Leoncito) situado en la Precordillera de la Provincia de La Rioja se contabilizó una densidad de 0,67 ñ/km2 (año 1980) densidades similares se registraron en la Precordillera de San Juan. Capítulo 7: El ñandú petizo 106 Selección de habitat No se determinó ninguna preferencia significativa por algún habitat en especial dentro de San Guillermo (t =1,38; gl = 31; P>0,05). Los ñandúes utilizan indistintamente tanto los llanos (pastizales de Stipa spp y arbustales bajos de Adesmia spp) como las laderas rocosas y no rocosas (arbustales de Lycium spp y Adesmia spp principalmente, con baja cobertura de Stipa spp.). En esta reserva, las máximas alturas con presencia de ñandúes alcanzaron los 3.860 msnm. García Fernández et al. (1989), han señalado a las estepas arbustivas y con pastizales, como lugar preferencial de actividad de los ñandúes, en la Cuenca de Pozuelos y Olaroz. No obstante, según los mencionados autores, el parcelamiento de la tierra con alambrados y empircados, limita la disposición de los ñandúes en la Cuenca. En Laguna Blanca la máxima altitud donde fueron observados ñandúes fue de 3.820 msnm. Como ya se mencionara, en Laguna Brava con alturas por arriba de los 3.800 msnm no fueron observadas poblaciones estables. En la Cordillera Frontal el límite superior de distribución de Pterocnemia pennata garleppi se encuentra por debajo de los 4.000 msnm, mientras que en la Puna alcanza los 4.000 msnm (Olaroz). Dentro de la Prepuna y ecotono, esta subespecie se encuentra entre los 2.000 y 3.000 msnm. Organización social Los machos de Pterocnemia pennata son apenas más grandes que las hembras (Handford y Mares, 1985), por lo tanto resulta muy difícil distinguir los sexos en el campo (ver Olrog, 1968). Handford y Mares (1985) describen cinco clases de grupos sociales para Rhea americana: grupos de hembras con uno o más machos, machos solitarios, grupos de ejemplares inmaduros y no reproductivos, machos únicos con crías y grupos grandes de ejemplares más algún macho solitarios para ambas especies (Rhea y Pterocnemia) en invierno. En San Guillermo, Laguna Blanca y la Cuenca de Pozuelos se registraron grupos sociales dentro de un rango de 1 a >10 individuos, tanto en verano como en invierno. Los ejemplares solitarios es la unidad más común observada en las dos reservas primero mencionadas (Fig. 2 y 3). Capítulo 7: El ñandú petizo 107 En Pozuelos, los individuos estuvieron mejor repartidos entre los grupos constituidos por más de dos ejemplares (Fig. 4). En San Guillermo, la relación media de cría/adulto fue de 0,12 en enero; 0,05 en febrero y marzo; 0,06 en abril. En los restantes meses no fueron observados pichones o crías. En Pozuelos se registró una relación cría/adulto de 0,25 para diciembre-enero, y de 0,11 para febrero-marzo. De acuerdo con observaciones propias y de pobladores rurales, la nidificación ocurre entre octubre y fines de noviembre, durando el tiempo de incubación 40 días. Dieta Se analizaron un total de 18 muestras de heces provenientes de distintos lugares de San Guillermo, registrándose las siguientes plantas en orden de importancia: Stipa spp (54 %); Adesmina pinnifolia (14,7 %); Acantholipia riojana (10 %); Adesmia spp (9,7 %); Lycium spp (4,4 %); Dicotiledonea indeterminada (2,9 %); Glandularia aff. sulphurea (1,8 %); Mahiueniopsis glomerata (1,3 %); Hoffmansegia minor (0,9 %); Verbena seriphioides (0,3 %) (Fig. 5). Se determinaron los siguientes fragmentos de plantas: hojas, Stipa spp, Hoffmansegia minor, Lyicum spp, Adesmia pinnifolia, Atriplex spp, Acantholipia riojana; semillas, Acantholipia riojana; flores, Verbena seriphioides; frutos, Lycium spp, Adesmia spp; espinas de cactáceas, Mahiueniopsis glomerata. En algunas muestras se detectaron pequeñas piedras. Los resultados de los muestreos de vegetación y presencia de especies de plantas en la dieta se muestran en la Tabla 2. Teniendo en cuenta las plantas perennes presentes en el campo (% de cobertura) y registradas en la dieta, se definieron tres bloques (rango de frecuencia de acuerdo con el test de Kolmogorov-Smirnov): bloque 1 = Mahiueniopsis, Verbena; bloque 2 = Adesmia, Acantholipia, Lycium; y bloque 3 = Stipa (ver la Tabla 2). No se estableció ninguna preferencia por algún bloque de plantas en particular (D = 0,222; P>0,20), sin embargo, Adesmia pinnifolia y Acantholipia riojana constituyen dos importantes ítems en la dieta del ñandú petizo, pero muestran un bajo porcentaje de cobertura en los censos de vegetación. Estas dos especies vegetales se encuentran distribuidas en pequeños manchones y fueron raramente registradas en los cuadrados Capítulo 7: El ñandú petizo 108 de muestreo. Conclusión Como se mencionara en el título del presente capítulo, el ñandú petizo andino es una especie frágil. Esta afirmación está basada en varios factores: Estudios realizados en Rhea americana (Reboreda y Fernández, 1996), señalan el elevado costo que implica la incubación en ésta especie, con lo cual solamente aquellos machos con un nivel apropiado de reservas, estarían en condiciones de reproducirse, dándose por lo tanto en las poblaciones, una baja proporción de machos nidificantes. Por lo tanto, el tamaño efectivo de las poblaciones es sensiblemente menor al tamaño real, lo cual resultaría en una mayor pérdida de variabilidad genética. Asimismo, como consecuencia de abandonos de nidos, pérdida de huevos durante la incubación, fallas de eclosión y mortalidad de pichones, solamente un 5 % de los huevos de Rhea americana, producen juveniles de un año de edad. Este comportamiento reproductivo que presenta Rhea americana debe ser tenido en cuenta para la conservación de Pterocnemia pennata, especie está emparentada con la primera y donde los estudios en relación a los temas mencionados, son nulos. Si a lo mencionado se le agrega, lo observado en Pterocnemia dentro de la región andina: bajas densidades naturales, fluctuaciones poblacionales y con tendencias en algunos casos a disminuir, predación natural (zorros, zorrinos, hurones, pumas, armadillos, aves) y predación antrópica (recolección de huevos), se puede concluir que para evitar que esta situación de fragilidad no se convierta en una pérdida irreversible, resulta necesario encarar a corto plazo medidas de protección y manejo especial de la especie dentro de la región. Capítulo 7: El ñandú petizo 109 Tabla 1 Superficie cubierta por los censos y número máximo de ejemplares observados para las distintas localidades de la región andina. msnm Localidad Sup. (km2) considerada N° máximo registrado por censo San Guillermo 5.770 > 3.000 200 Laguna Brava 3.400 > 3800 < 20 Laguna Blanca 1.000 3.200 100 Antofagasta 1.250 3.700 150 Los Andes 750 > 3.200 < 20 Olaroz 260 4.000 107 Pozuelos 853 3.600 160 Capítulo 7: El ñandú petizo Tabla 2 Porcentaje de la cobertura vegetal y su presencia en la dieta del ñandú petizo. Especies vegetales (1) Stipa speciosa, S.frigida, S.leptostachya Lycium chañar, L. chilensis, L. fuscum Adesmia horrida Presencia de especies vegetales en la dieta Cobertura (%) 43,10 Especies vegetales (2) Media (Y) (3) LSR (4) Stipa spp. 2,21 21,40 Adesmia pinnifolia 1,29 0,300 14,30 Adesmia spp. 1,16 0,360 Adesmia nanolignea 4,60 Acantholipia riojana 1,04 0,400 Atriplex deserticola 4,20 Lycium spp. 0,92 0,420 Fabiana denudata 3,80 Dicotiledonea ind. 0,90 0,450 Chuquiraga histrix 2,70 Glandularia aff. sulphurea 0,83 0,460 Tetraglochin alatum 1,80 Mahiueniopsis glomerata 0,76 0,470 Verbena aff. seriphioides 1,70 Hoffmansegia minor 0,75 0,487 Mahiueniopsis glomerata 1,40 Verbena aff. seriphioides 0,74 0,497 Senecio oreophyton 0,40 Ephedra sp. 0,40 Adesmia sp. 0,15 Adesmia pinnifolia 0,05 Ref.: (1): Composición de la vegetación en relación a las especies perennes (ver Cajal et al. 1981); (2): Especies vegetales anuales y perennes presentes en la dieta agrupadas de acuerdo con su valor medio; (3): Frecuencia transformada a √ y + 0,5 , n = 18; (4): LSR es el mínimo rango significativo, P = 0,05; v = 120 gl; Q = 4.560. 110 Capítulo 7: El ñandú petizo Composición de especies vegetales 111 Fig. 1 - Densidades de Pterocnemia en la Puna y Cordillera Frontal Fig. 2 - Dieta del ñandú petizo en San Guillermo Capítulo 7: El ñandú petizo 112 Fig. 3 - Ñandúes. Pozuelos. Verano, n=60; Invierno, n=30 Fig. 4 - Ñandúes. San Guillermo. Verano, n=139; Invierno, n=46 Capítulo 7: El ñandú petizo 113 Fig. 5 - Ñandúes. Laguna Blanca. Verano, n=34 Ñandú petizo en la Puna de Jujuy Capítulo 7: El ñandú petizo 115 CAPITULO 8 AVES DE LAGUNA: LOS FLAMENCOS. ESTRATEGIAS DE LA ALIMENTACION EN GRUPOS MULTIESPECIFICOS Virginia Mascitti 1 Introducción El área de distribución de los flamencos sudamericanos, Phoenicopterus chilensis, Phoenicoparrus andinus y Phoenicoparrus jamesi, se superpone en la región Sur de los Andes Centrales. P. chilensis es la única especie cuya distribución geográfica excede la zona de simpatría. Los dos Phoenicoparrus presentan distribuciones más restringidas en relación a climas más áridos y temperaturas más frías, pero P. jamesi es el de distribución más estrecha ubicándose siempre a mayor altitud que los demás. Los flamencos son aves de gran porte, filtradoras por excelencia y se alimentan del plancton de las lagunas que habitan. Se los encuentra en ambiente salinos, de aguas someras y con escasa vegetación. Una de sus características es la formación de grandes agrupaciones, tanto para la actividad de alimentación como para la nidificación (Allen, 1956). En los lagos de Kenya (Africa) se registraron grupos de forrajeo de Phoeniconaias minor de hasta 915.000 individuos (Olgivie y Olgivie, 1986). Para Phoeni1 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. El presente trabajo forma parte de la Tesis Doctoral de la autora Capítulo 8: Los flamencos 116 copterus ruber ruber, en Yucatán (México) se mencionan agrupaciones de hasta 2500 flamencos (Arengo y Baldassarre, 1995). El forrajeo en grupos puede explicarse considerando las relaciones de costo-beneficio, implicadas en este comportamiento. Al respecto Schmitz y Baldassarre (1992) proponen que los grandes grupos de alimentación permiten un aumento en la eficiencia de forrajeo y una ganancia en la eficacia biológica individual, por disminución de la predación sobre los integrantes del grupo. Sin embargo, ninguno de los trabajos anteriores contempla la formación de grupos multiespecíficos como ocurre en las lagunas altoandinas, si bien la estrategia de forrajeo es la misma, son otros los interrogantes ecológicos que pueden plantearse en esta situación. En primer lugar es necesario conocer en que proporción contribuye cada especie a la formación del grupo. Por otra parte deben considerarse los desplazamientos de las especies de un ambiente a otro, ya que en el caso de los flamencos sudamericanos sólo P. chilensis nidifica en Argentina y los Phoenicoparrus son visitantes estacionales, que tienen sus áreas de cría a mayor altitud. De este modo, es importante examinar las variaciones estacionales en las composición de especies y tamaño de las agrupaciones. Si se considera además, que los ambientes andinos son de estacionalidad marcada y presentan dos temporadas, seca y húmeda, claramente definidas es útil establecer la relación entre los cambios del habitat y la disponibilidad de recursos y la composición y abundancia de las especies de flamencos. Aún así, queda por considerar que ocurre en el interior de los agrupaciones multiespecíficas con las interacciones entre las especies que forman los grupos. En este sentido podría plantearse la segregación por microhabitat de forrajeo, que es una de las estrategias más comunes usadas por las aves para evitar la competencia (Poysa, 1983; DuBowy, 1989). Estos interrogantes fueron analizados para las tres especies de flamencos sudamericanos en la Laguna de Pozuelos. Este cuerpo de agua está ubicado en el Noroeste de Argentina, en el altiplano de la provincia de Jujuy a 3.600 msnm y a 66 ° 00’ de longitud Oeste y 22° 19’ de latitud Sur. Pozuelos es una típica laguna de altura, de 6.000 ha de superficie en épocas de laguna plena y sujeta a expansiones y retracciones estacionales debidas a las lluvias, que son exclusivamente estivales. Además de los cambios estacionales en el volumen del cuerpo de agua se registran otros fenómenos menos predecibles, como las sequías, que pueden conducir a la completa desecación de la laguna (Igarzábal, 1974). Capítulo 8: Los flamencos 117 Métodos Composición y abundancia de los grupos de forrajeo: variaciones estacionales y relaciones con los cambios del habitat y la disponibilidad de recursos Para determinar las variaciones estacionales de abundancia relativa y composición de especies de flamencos, se realizaron muestreos estacionales en tres áreas de trabajo previamente seleccionadas. Las áreas de muestreo se ubicaron en la orilla Este (Pozuelos), Norte (Península) y Oeste (Lagunillas) de la Laguna. Un área alternativa ubicada al Sur (Río Cincel), fue utilizada cuando no se pudo acceder al Oeste (Fig. 1). El trabajo de campo se desarrolló estacionalmente entre el invierno de 1990 y el otoño de 1992. Los flamencos fueron contados desde puntos fijos sobre la orilla, con telescopio con lente de aproximación y medidor de ángulo de barrido. En todos los casos se contó un grupo completo de flamencos, diferenciando especies. La superficie del espejo de agua, fue obtenida de una imagen LANDSAT de marzo de 1986. Para 1990-1991, se consideró la misma superficie y para el año siguiente, fue estimada a partir de recorridos realizados a pie y en vehículo. La abundancia relativa de alimento se determinó en forma estacional en cada una de las áreas de muestreo. Se tomaron muestras de agua y sedimentos sobre una transecta perpendicular, comprendida entre la orilla y los 210 m, hacia el centro de la laguna, que fue identificada como el habitat de alimentación de los flamencos. La oferta fue discriminada en diatomeas del agua (N° cels./litro), diatomeas de los sedimentos (N° cels/gramo) y zooplancton (N° indiv./litro). El análisis cuantitativo de diatomeas del agua y sedimentos se realizó usando el método de la alícuota (Batarbee, 1986), a partir del recuento de 200 a 1000 valvas por preparado. Para la abundancia relativa de zooplancton se consideró en forma conjunta, copépodos, cladóceros y ostrácodos, contando la totalidad del material obtenido. Selección de microhabitats de forrajeo dentro de los grupos multiespecíficos Capítulo 8: Los flamencos 118 En cada grupo de flamencos se registró la profundidad de forrajeo de cada especie. La misma fue identificada durante el conteo por observación directa de la altura del agua en las patas de los flamencos. De este modo pudieron reconocerse cuatro microhabitats de forrajeo: 1.-Agua al pie (2 cm) ; 2.-Agua a la mitad del tarsometatarso (2-13 cm); 3.-Agua sobre la articulación intertarsal (13-26 cm) y 4.-Agua por encima de la articulación intertarsal y hasta el extremo proximal de la tibia-tarso (26-50 cm). Análisis de los datos La prueba no-paramétrica de Kruskall-Wallis fue utilizada para comparar el tamaño de los grupos de flamencos muestreados en el primero y segundo año de trabajo y la abundancia relativa de alimento. Para evaluar si los flamencos seleccionan alguna profundidad particular de forrajeo, se realizaron correlaciones no-parámetricas (Spearman), entre la abundancia de flamencos registrados a cada profundidad, en las tres áreas de muestreo, y las profundidades de cada microhabitat. La frecuencia de uso de cada microhabitat de alimentación fue analizada, para cada especie, usando la prueba de ANOVA, previa normalización logarítmica de los datos. Resultados Composición y abundancia de los grupos de forrajeo: variaciones estacionales y relaciones con los cambios del habitat y la disponibilidad de recursos En las Figs. 2 y 3, se observan los resultados de los muestreos realizados. En 1990-1991, la temporada seca (invierno-primavera) fue la de mayor abundancia de flamencos. P. chilensis fue la especie dominante en invierno en el este y oeste de la laguna, y en el oeste y noroeste en primavera. P. jamesi estuvo presente en mayor proporción durante el invierno y P. andinus en primavera. En la temporada húmeda (verano-otoño) la especie más abundante fue P. chilensis , mientras que los dos Phoenicoparrus fueron escasos. En verano 1991, se observó una importante colonia de cría de P. chilensis en el noroeste de la laguna, con 5.000 pares nidificantes. La misma fue destruida a fin del verano por una fuerte tormenta de granizo Capítulo 8: Los flamencos 119 y la mayor parte de los flamencos abandonaron el área. En la estación siguiente, otoño 91, se realizaron muestreos en las áreas consideradas y un censo del número total de flamencos de la laguna en el que se registraron 5003 P. chilensis, 846 P. andinus, 814 P. jamesi y 454 flamencos que no pudieron ser identificados, reuniendo un total de 7.117 individuos. En el segundo año, 1991-1992, el tamaño de los grupos de forrajeo fue significativamente menor que en el año anterior (K-W= 6,16; P< 0,01), y se registraron cambios en la composición de especies. Del mismo modo que en el año anterior, P. chilensis fue la especie de mayor abundancia relativa en todas las estaciones menos en invierno, en que fue ligeramente superada por P. andinus. P. jamesi fue más abundante en primavera y no se encontró presente en ninguno de los muestreos de invierno. La abundancia relativa de P. andinus presentó menos variaciones que en el año anterior. Su proporción fue más estable durante las cuatro estaciones consideradas. Entre 1990-1991 y 1991-1992, la sequía que afecta la cuenca provocó modificaciones en el ciclo estacional de retracción y expansión de la superficie del espejo de agua. En el primer año, la superficie de la laguna fue estimada en 6.000 ha y el perfil estacional de profundidad del agua respondió a lo esperado en relación a las lluvias estivales. En la temporada seca (invierno y primavera), la profundidad promedio del habitat de forrajeo de los flamencos, fue menor (Fig. 4) que la registrada en el período húmedo (verano y otoño). Al año siguiente, la superficie de la laguna se reduce (4.000 ha en invierno 91 y 2.100 ha en verano 92) y el ciclo estacional de retracción expansión cambia (Fig. 5). Para el otoño 92 se registró un perfil de profundidad semejante al de primavera 90. Las lluvias del verano 92, no fueron suficientes para lograr la recuperación y la mayor profundidad promedio se obtuvo en invierno 91. Como consecuencia de los cambios de volumen del cuerpo de agua, la oferta de alimento para los flamencos presentó variaciones en los distintos años de trabajo. La abundancia de diatomeas del agua fue significativamente mayor (K-W= 5,33; P<0,02), en 1990-1991, con respecto a 1991-1992, pero no se encontraron diferencias significativas entre esos años, para las diatomeas de los sedimentos y el zooplancton. Selección de microhabitats de forrajeo dentro de los grupos multiespecíficos Capítulo 8: Los flamencos 120 La Fig. 6 muestra el porcentaje de uso de microhabitat de forrajeo en las áreas muestreadas, en las temporadas seca y húmeda. P. chilensis estuvo positivamente asociado con los microhabitats de forrajeo de mayor profundidad a lo largo del primer año, 1990-1991, (rs=0,40; P<0,002) y en las temporadas seca 90 y húmeda 91 (rs = 0,47; P<0,02 y rs = 0,34; P<0,05). No se detectó asociación estadísticamente significativa entre esta especie y la profundidad de forrajeo en 1991-1992. La asociación de P. jamesi con la profundidad fue estadísticamente significativa y negativa en las dos temporadas de 1990-1991, (rs = -0,86; P<0,00001 y rs = -0,73; P< 0,00001) y a lo largo del año (rs =-0,73; P<0,00001). En 1991-1992, esta especie fue muy escasa y no utilizó el microhabitat de 26-50 cm de profundidad durante la temporada seca 91 mientras que en la húmeda 92 sólo se encontró forrajeando en orillas a 2 cm de profundidad. P. andinus no presentó asociación estadísticamente significativa con la profundidad de los microhabitats de forrajeo, en ninguno de los dos años considerados. La abundancia promedio de cada especie entre los microhabitats fueron comparadas utilizando la prueba de ANOVA. En la temporada seca 90, P. chilensis usó significativamente menos (F= 9,282; P<0,001) el microhabitat de forrajeo de orilla (0-2 cm). Las profundidades más usadas por esta especie fueron las de 13-26 cm y 26-50 cm. En la temporada húmeda 91 estos mismos dos microhabitats, fueron significativamente más usados (F=4,509; P<0,05) por P. chilensis. Durante la temporada seca del año siguiente, 1991-1992, no se encontraron diferencias significativas en el uso de los microhabitat de forrajeo, y el más usado fue el de 13-26 cm de profundidad. En el período húmedo 92 P. chilensis usó significativamente más, ( F = 7,141; P<0,01) las profundidades de forrajeo de 13-26 cm. P. andinus fue la especie con preferencias menos marcadas para microhabitat de forrajeo. En la temporada seca 90 presentó diferencias estadísticamente significativas, usando en mayor proporción (F= 3,060; P<0,05) el microhabitat de 13-26 cm de profundidad. En las temporadas seca y húmeda 91, no se registraron diferencias significativas, pero los microhabitat más usados por esta especie fueron los de 2-13 cm y 13-26 cm de profundidad. En la temporada húmeda 92, el microhabitat más usado fue el de 2-13 cm de profundidad (F= 3,715; P< 0,05). P. jamesi prefirió forrajear en los microhabitat de orilla en los dos Capítulo 8: Los flamencos 121 años considerados. En la temporada seca 90, no utilizó el microhabitat de 26-50 cm y presentó diferencias estadísticamente significativas, usando en mayor proporción (F = 8,649; P<0,001) los microhabitats de 0-2 cm y 2-13 cm de profundidad. Durante el segundo año de trabajo, 1991-1992, P. jamesi fue muy escaso, en la temporada seca 91 no se registraron diferencias significativas para el uso de microhabitat de forrajeo, pero usó en mayor proporción el de 0-2 cm y no utilizó el de 26-50 cm. En la temporada húmeda 92 se lo encontró forrajeando exclusivamente el las orillas con profundidad de 0-2 cm. Discusión Composición y abundancia de los grupos de forrajeo: variaciones estacionales y relaciones con los cambios del habitat y la disponibilidad de recursos La abundancia relativa de cada especie de flamenco, registrada durante los muestreos, coincide con los resultados del censo llevado a cabo por Hurlbert (1978) en Pozuelos y con el propio realizado en otoño 1991. Del mismo modo, las fluctuaciones estacionales de abundancia, guardan relación con lo observado en otras lagunas de su área de distribución (Bucher, 1992; Parada Meyer, 1988). Estos antecedentes y las observaciones propias para Pozuelos, permitieron reconstruir un patrón estable de abundancia y composición de especies, sujeto a los cambios entre temporadas seca y húmeda. P. chilensis fue la especie dominante y es la única que nidifica en Pozuelos (Mascitti y Nicolossi, 1992). La mayor abundancia de las dos especies de Phoenicoparrus se observó durante la temporada seca de 1990 y 1991 coincidiendo con su descenso a menores altitudes durante el invierno, en busca de climas menos rigurosos. Su proporción disminuyó en la época húmeda, cuando ambos flamencos se dirigen hacia las lagunas del altiplano chileno y boliviano, donde crían (Parada Meyer, 1988). El patrón propuesto se alteró durante el invierno 91, cuando la proporción de P. andinus superó ligeramente a la de P. chilensis. Este resultado podría explicarse en relación a la destrucción de la colonia de cría de P. chilensis que llevó a la mayor parte de los individuos a abandonar la laguna. La reducción del tamaño de los grupos en el segundo año de trabajo, Capítulo 8: Los flamencos 122 puede tener dos interpretaciones, o bien el número total de individuos se reduce, o es el tamaño de los grupos el que disminuye, y los flamencos forman más grupos con menos individuos en cada uno. Esta última interpretación parece poco probable, considerando que los grandes grupos multiespecíficos contribuyen a aumentar la eficiencia de forrajeo (Schmitz y Baldassarre, 1992). Es así que, aunque la comparación se establece sobre la base de tamaños muestrales, es más probable que la reducción del número total de individuos, sea la estrategia seguida por la comunidad. Los cambios de abundancia registrados en la comunidad parecen estar más asociados a la reducción de la superficie del cuerpo de agua que a otros parámetros. Durante el segundo año la oferta de alimento no fue el parámetro más afectado por la sequía, ya que aunque las diatomeas del agua son menos abundantes, su proporción no varía en los sedimentos y tampoco cambia significativamente la abundancia de zooplancton. El perfil estacional de profundidades presentó variaciones, pero se mantuvo la oferta de microhabitats de forrajeo a distinta profundidad. En este sentido, la reducción de la superficie del cuerpo de agua de 6.000 ha en el primer año a 4.000 ha en invierno 91 y 2.100 ha en verano 92, parece ser el cambio más relacionado con la disminución del número de flamencos en la laguna. La asociación positiva entre los flamencos y la superficie de las lagunas que habitan fue previamente corroborada, usando los datos de Hurlbert (1978, 1981), a nivel de todas las lagunas que comprende su área de distribución en el Sur de los Andes Centrales (Mascitti y Caziani, 1995). Las lagunas con gran superficie, ofrecen a los flamencos mayor disponibilidad de habitat, pero además facilitan la formación de grandes grupos multiespecíficos, que aumentan la eficiencia en la obtención de alimento. Frente a una laguna de superficie reducida por la sequía, la estrategia más probable es el desplazamiento de los flamencos hacia otra lagunas, dentro del mosaico de habitats de la región. Este comportamiento responde a las observaciones realizadas por otros autores (Johnson, 1984; Olgivie y Olgivie, 1986) para explicar la disminución del número de flamencos en lagunas con escasa oferta de alimento. Del mismo modo, cuando el recurso que escasea es el habitat, las especies pueden seleccionar otras lagunas con mayor disponibilidad de superficie. Una relación asociada a las anteriores es que al aumentar el número de individuos en la laguna, aumenta el tamaño de los grupos de forrajeo. Bildstein et al., 1993 encontraron que el incremento en el número de individuos dentro de los grupos de forrajeo de Phoenicopterus ruber determina cambios en el modo de obtención de las presas. Particularmente el tiempo de búsqueda de presas, con la cabeza hacia abajo se intensifica, indicando Capítulo 8: Los flamencos 123 disminución del alerta de los flamencos frente a los predadores. Junto con las relaciones entre el tamaño de los grupos de forrajeo y la superficie de los cuerpos de agua, otras variables del ambiente como la distribución y abundancia del alimento, pueden influir en el tamaño y disposición de los grupos de forrajeo. En Pozuelos, se verificó que los grupos de mayor tamaño se disponen en los parches de habitat de mayor calidad promedio, con respecto a la oferta de presas por tamaño que está disponible para filtrar (Mascitti, 1996). Arengo y Baldassarre (1995), encontraron que los grupos de forrajeo de Phoenicopterus ruber ruber en Yucatán, se distribuyen de acuerdo con el modelo de selección libre del habitat (Fretwell y Lucas, 1970), forrajeando en las áreas de mayor densidad de alimento, hasta que la abundancia de recursos disminuye y los individuos se redistribuyen en otras áreas. En ese mismo trabajo, también se registró un incremento del tamaño de las agrupaciones, al aumentar el número total de flamencos en el estuario. La relación entre las áreas de mayor oferta de alimento y las agrupaciones más numerosas verificada en Pozuelos, concuerda parcialmente con lo observado por Arengo y Baldasarre (1995). El tamaño de los grupos de flamencos fue mayor durante la temporada seca 90, cuando la frecuencia relativa de individuos fue la más alta registrada en Pozuelos, sugiriendo una respuesta densodependiente positiva, para la selección del habitat de forrajeo. Además, de igual modo que el trabajo de Arengo y Baldassarre (1995), los grupos más grandes se asociaron a las áreas con mayor de oferta de presas. Sin embargo, la metodología empleada no permite asegurar que la distribución se ajuste al modelo de selección libre del habitat, ya que las observaciones de campo se realizaron en forma puntual, en cada estación del año, y los grupos no fueron seguidos en intervalos breves de tiempo para analizar los cambios de distribución entre los diferentes parches. A pesar de esto, ciertas proposiciones asociadas al modelo de Fretwell y Lucas, parecen cumplirse en Pozuelos. Este modelo asume, que la proporción de individuos en cada parche de habitat está en relación a la calidad de los recursos en ese parche (Kacelnick et al., 1992), tal como fue registrado para las especies de Pozuelos. De este modo, la distribución y el tamaño de los grupos provee información de la localización del alimento y de la calidad del parche (Clark y Mangel, 1984). Selección de microhabitats de forrajeo dentro de los grupos multiespecíficos Capítulo 8: Los flamencos 124 El gradiente de profundidades es una medida del microhabitat, muy usada en los estudios de nicho de aves acuáticas. La partición del habitat por profundidades constituye una unidad natural, que permite comprender mejor las diferencias en el forrajeo, ya que estas son analizadas en una escala similar a la que utilizan las aves (Morse, 1990). En Pozuelos se observó cierta preferencia por distintas profundidades de forrajeo para cada especie. P. chilensis fue la especie más asociada a los microhabitat de mayor profundidad. En el otro extremo, P. jamesi prefirió forrajear en las orillas y P. andinus presentó preferencias intermedias a las de los otros dos flamencos. Hurlbert y Keith (1979) también encontraron segregación espacial dentro de los grupos de forrajeo de los flamencos sudamericanos, pero estos autores limitan su análisis a la disposición espacial de los individuos en los lagos y lagunas del altiplano, sin considerar que ésta puede ser el reflejo de la partición del recurso en el nicho de microhabitat. La diferenciación por profundidades puede ser el mecanismo usado por los flamencos para disminuir la interacciones en los grandes grupos de forrajeo y aumentar la eficiencia en la obtención de alimento. Pero además debe tenerse en cuenta que la diferenciación observada, incluye sólo una parcialidad del espacio del nicho de las especies y puede ser el reflejo de los que ocurre en otras dimensiones. De este modo, deberían incluirse en el análisis otras dimensiones del nicho, como la trófica, para lograr una visión completa de las estrategias que favorecen la convivencia de las tres especies de flamencos sudamericanos en Pozuelos. Conclusión En la Laguna de Pozuelos las grandes agrupaciones de flamencos están integradas por las tres especies presentes en Sudamérica. Las fluctuaciones estacionales registradas permitieron establecer un patrón de abundancia y composición de especies que responde a los cambios estacionales entre temporadas seca y húmeda y a los desplazamientos de los flamencos. P. chilensis es la especie dominante y se encuentra presente durante todo el año en Pozuelos. Los dos Phoenicoparrus son más abundantes durante la estación seca (invierno y primavera), a comienzos del verano se dirigen a mayores altitudes donde crían. La disposición de los grupos sobre la superficie del espejo de agua es consistente con algunas de las predicciones del modelo de selección Capítulo 8: Los flamencos 125 libre del habitat (Fretwell y Lucas, 1970). El tamaño de los grupos de forrajeo se incrementó con el aumento de la abundancia poblacional y la tendencia a formar grandes grupos se verificó durante la temporada 1990 en coincidencia con la mayor abundancia relativa de las tres especies. La alimentación en grupos es usada como estrategia para aumentar la eficiencia de forrajeo (Schmitz y Baldassarre, 1992), a su vez las interacciones competitivas que pudieran resultar de este comportamiento son evitadas, al menos en parte, por el uso de distintas profundidades o microhabitats de forrajeo para cada especie. Capítulo 8: Los flamencos 126 Fig. 1 - Mapa de ubicación de las áreas de muestreo en la Laguna de Pozuelos Capítulo 8: Los flamencos 127 Fig. 2 - Proporción de especies de flamencos en los grupos de forrajeo muestreados en 1990-1991. Las tres barras en cada estación representan las orillas este, noroeste y oeste respectivamente. Fig. 3 - Proporción de especies de flamencos en los grupos de forrajeo muestreados en 1991-1992. Las tres barras en cada estación representan las orillas este, noroeste y oeste respectivamente. Capítulo 8: Los flamencos 128 Fig. 4 - Perfil estacional de profundidades del habitat de alimentación de los flamencos en la Laguna de Pozuelos, 1990-1991. Fig. 5 - Perfil estacional de profundidades del habitat de alimentación de los flamencos en la Laguna de Pozuelos, 1991-1992 Capítulo 8: Los flamencos 129 Capítulo 8: Los flamencos Fig. 6 - Porcentaje de uso de microhabitat de forrajeo. 130 Vista general de la Laguna desde la Banda Este, cerca de la localidad de Pozuelos Reserva de Biosfera Laguna de Pozuelos. Flamencos Capítulo 8: Los flamencos 131 CAPITULO 9 PATRON DE USO DE HABITAT EN ROEDORES CRICETIDOS EN LA RESERVA DE BIOSFERA LAGUNA DE POZUELOS Stella Maris Bonaventura 1, Rodolfo Tecchi 2, Víctor Cueto 3, María Isabel Sánchez López 3 Introducción Los estudios sobre estructura de la comunidad han sido focalizados principalmente en patrones de partición de recursos para explicar la coexistencia de especies ecológicamente similares (revisión de Schoener, 1974). Las comunidades de roedores fueron intensamente estudiadas en los principales ecosistemas áridos de América del Norte y a partir de ellos se propusieron distintos mecanismos de coexistencia entre los cuales podemos mencionar separación de dieta (Reichman, 1975), selección de 1 2 3 Depto. Cs. Biológicas, FCEN, UBA, 4o. piso, Pab. II, Ciudad Universitaria, (1428) Buenos Aires, Argentina. Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Angel Gallardo 470 (1405) Buenos Aires, Argentina. Capítulo 9: Roedores cricétidos 132 habitat (Rosenzweig y Winakur, 1969; M’Closkey, 1981), comportamiento (Bowers et al., 1987), selección de tamaño de manchones (Price, 1978; Reichman y Oberstein, 1977). Los patrones de uso de microhabitats en roedores muestran que la mayoría de ellos usan algunos microhabitas más frecuentemente que otros (Brown y Lieberman, 1973; Larsen, 1986; Price, 1978; Price y Waser, 1985; Rosenzweig, 1973; Stamp y Ohmart, 1978), sugiriendo que perciben los microhabitats como cualitativamente diferentes. Los factores que influyen en esta respuesta diferencial a los microhabitats son tema de discusión (Mares, 1983; Price y Brown, 1983). La selección natural podría favorecer a aquellos individuos que seleccionan y explotan habitats en los cuales las diferencias entre costos/beneficios y riesgos son máximas (Partridge, 1978). Factores tales como competencia, predación, estructura del habitat y abundancia de alimento pueden afectar la calidad del habitat y con ello influir en el patrón de uso de los habitats de los roedores. Dichos factores podrían no ser necesariamente mutuamente excluyentes sino que por el contrario, operarían simultáneamente (Price y Brown, 1983). La importancia de dichos factores sobre las comunidades de roedores de regiones áridas y semiáridas de América del Sur fueron analizados, a distinta escala, en numerosos estudios (Iriarte et al., 1989; Kelt et al., 1996; Meserve et al., 1996; Ojeda, 1989; Pearson y Ralph, 1978; Simonetti, 1989). El objetivo del presente Capítulo es presentar los estudios sobre el patrón de uso del habitat de pequeños roedores en la Reserva de Biosfera Laguna de Pozuelos y analizar las interrelaciones que existen entre dicho patrón y las características del habitat. Métodos Procedimiento de muestreo: roedores Los roedores fueron muestreados durante 1991 en 10 sitios de la Reserva de Biosfera Laguna de Pozuelos. Los sitios están ubicados a lo largo de un gradiente altitudinal (Fig. 1) y representan las principales unidades de vegetación presentes en la Reserva (Bonaventura et al., 1995). En cada sitio se estableció una grilla de 49 estaciones de muestreo (7 filas por 7 columnas) distantes 10 m una de otra. Este diseño de muestreo permite detectar el uso de habitat y las preferencias de los roedores independientemente de la abundancia de los mismos y del tipo o disposición espacial de los habitats (Price y Kramer, 1984). En cada estación se instaló una trampa Sherman cebada con pasta de maní. Las grillas funcionaron durante tres Capítulo 9: Roedores cricétidos 133 noches consecutivas, siendo las trampas revisadas todas las mañanas. Para cada ejemplar capturado se registró la especie, el sexo, las longitudes cabeza-cuerpo y cola y el peso corporal. La densidad de roedores fue estimada mediante la tasa de captura por 100 trampas/noche. Habitat En cada sitio se estimó, simultáneamente con los muestreos de roedores, la altitud, la pendiente, la rocosidad, la fauna de artrópodos caminadores y el banco de semillas del suelo. La altitud y la pendiente se midieron utilizando un altímetro y clinómetro, respectivamente. La rocosidad se estimó visualmente como el porcentaje de suelo cubierto por clastos. Se consideraron dos categorías de rocosidad: 1) más del 50 % de la superficie cubierta por clastos menores de 10 cm de diámetro y 2) más del 50 % cubierta por clastos mayores de 10 cm. Los artrópodos fueron muestreados mediante 10 trampas de captura contínua, dispuesta al azar dentro de la grilla. La abundancia se expresó como la tasa de captura por 100 trampas/noche. El banco de semillas se estimó a partir de 10 muestras de suelo dispuestas al azar dentro de la grilla; la densidad se expresó por m2. Además, cada sitio fue asignado a una de las siguientes unidades de vegetación (Bonaventura et al., 1995): 1.- Arbustales de Baccharis boliviensis - Fabiana densa; 2.- Bosques abiertos de Polylepis tomentella; 3.- Pastizales de Stipa ichu - Festuca sp; 4.- Arbustales de Parastrephia lepidophylla; 5.- Arbustales de Baccharis incarum. Análisis de datos Los sitios fueron ordenados mediante análisis de correspondencia canónico (ACC), el cual combina ordenamiento y análisis de regresión múltiple (ter Braak, 1988), usando CANOCO (canonical community ordenation). La ventaja de esta técnica de ordenación es que los ejes son elegidos en relación a las variables ambientales medidas imponiendo la restricción de que los ejes deben ser combinaciones lineales de las variables ambientales (análisis directo del gradiente). Además del ACC, las unidades fueron ordenadas utilizando análisis de correspondencia (AC, análisis indirecto del gradiente). La comparación de ambos ordenamientos permite ver si los gradientes composicionales son explicados por las variables ambientales. Para cuantificar la importancia relativa de las características del habitat y de la competencia en la abundancia y distribución de los roedores se Capítulo 9: Roedores cricétidos 134 utilizó el análisis de regresión múltiple por pasos (Dueser y Porter, 1986). Resultados Durante el estudio se capturaron tres especies de roedores: Phyllotis darwini, Calomys lepidus y Akodon albiventer. Otros dos pequeños mamíferos capturados, Galea musteloides y Thylamys pusilla, no fueron incluidos en el análisis debido a sus bajos números (6 % del total de capturas). Las abundancias de las tres especies presentaron importantes diferencias entre sitios (=habitats) (Fig. 2). Akodon. albiventer fue capturado en la mayoría de los sitios muestreados, mientras que las capturas de P. darwini y C. lepidus fueron más restringidas, mostrando un bajo grado de superposición. La mayoría de los sitios (60%) fueron habitados por dos especies, lo cual difiere significativamente de lo esperado por el azar (distribución de Poisson; X2 = 7,76; gl: 2). Phyllotis darwini-C. lepidus fue el único par de especies que mostró una correlación negativa y significativa entre sus tasas de capturas (r = -0,76; P<0,05). Los resultados del análisis de regresión múltiple por pasos (Tabla 1) indican que la distribución de ambas especies está fuertemente influenciada por las características del habitat (R2 habitat), siendo la contribución de la competencia (R2 especies) nula. En los otros pares de especies las correlaciones no fueron significativas (A. albiventer-C. lepidus: r = 0,20, P>0,05; P. darwini-A. albiventer: r = 0,26, P>0,05). Los resultados de los análisis de correspondencia indican que si bien los autovalores del ACC fueron menores que los obtenidos del AC, los coeficientes de correlación entre los ejes de ambos ordenamientos indican que las características del habitat estudiadas fueron relevantes en la explicación de la variación composicional de los roedores (Tabla 2, Fig. 3). El eje 1 del ACC explicó el 92 % de la varianza en el promedio pesado de las especies y mostró una alta correlación especie-ambiente (r = 0,97; P<0,05). Dicho eje estuvo correlacionado positivamente con la pendiente (r = 0,90; P<0,05) y la rocosidad (r = 0,87; P<0,05). El eje 1 refleja un gradiente de sitios ubicados en áreas con pendiente abrupta y rocosa a sitios planos o con pendientes muy suaves. En los primeros predomina P. darwini, mientras que en los segundos la especie dominante es C. lepidus. El eje 2 del ACC explicó el 8 % de la varianza en el promedio pesado de las especies y mostró una correlación especie-ambiente de 0,96 (P<0,05). Dicho eje estuvo correlacionado positivamente con la abundancia de artróCapítulo 9: Roedores cricétidos 135 podos (r = 0,66; P<0,05) y negativamente con la abundancia de semillas (r = -0,67; P<0,05). El eje 2 indica que los sitios difieren en cuanto a la abundancia y tipo de alimento. C. lepidus fue más abundante en los sitios con alta abundancia de semillas, mientras que A. albiventer predomina en sitios con mayor abundancia de artrópodos. Discusión Los resultados presentados muestran que los habitats difieren en la combinación de sus características bióticas y abióticas y que los roedores perciben claramente tales diferencias. C. lepidus y P. darwini fueron más restrictivas que A. albiventer en cuanto al tipo de habitat usados. P. darwini usó preferentemente habitats abruptos y rocosos, C. lepidus habitats planos o con pendientes suaves y A. albiventer fue común en ambos tipos de habitats. Esto coincide con estudios previos donde se indica que P. darwini y C. lepidus fueron frecuentes en habitats similares (Mares, 1980; Mercado Tudor, 1991; Pearson y Ralph, 1978). El uso diferencial de los habitas observado en este trabajo está asociado con las características morfológicas (Tabla 3) de las especies (test de independencia: X2 = 22,99; P<0,05; gl: 2). La mayor longitud del pie y de la cola permitirían que P. darwini sea más eficiente que C. lepidus en el uso de habitats con pendientes pronunciadas y rocosas. En base al patrón de uso del habitat observado en este estudio podríamos considerar a A. albiventer como sustrato-generalista y a C. lepidus y P. darwini como sustrato-especialista. En otras áreas desérticas (ver Klet et al., 1996; Abramsky y Sellah, 1982) se observó que la distribución local de pequeños mamíferos está fuerte o directamente limitada por el sustrato. Ahora bien, dentro de los habitats usados por las especies se observaron variaciones importantes en sus tasas de captura. La mayor captura de C. lepidus y A. albiventer se registró en los habitats donde algunos de sus ítems alimenticios preferidos (semillas y artrópodos respectivamente,) fueron más abundantes (Tabla 3), sugiriendo que las poblaciones de ambas especies están limitadas por la disponibilidad de alimento. Simonetti (1989) observó que la preferencia de los roedores (granívoros e insectívoros) por microhabitats arbustivos estaba asociado con la mayor abundancia de alimento. En cuanto P. darwini, dado que sus habitats preferidos presentan en general una baja cobertura vegetal, posiblemente el grado de rocosidad Capítulo 9: Roedores cricétidos 136 podría ser un factor importante en la determinación de la abundancia de esta especie ya que construye sus nidos debajo de las rocas (Mares, 1977 y el presente estudio) y utiliza los huecos y entre y dentro de ellas como refugio contra la predación (observado en el presente estudio), particularmente de los carnívoros (zorros y gatos) que viven preferentemente en las zonas montañosas de la Reserva y cuya dieta está integrada por un alto porcentaje de pequeños roedores (Capítulo 13). Pearson y Ralph (1978) señalan la importancia de la oferta de refugio para P. darwini y en un estudio posterior (Meserve et al., 1996) se indica que la predación tiene efectos muy importantes sobre sus números poblacionales. Se sugiere que la mayor abundancia de P. darwini en los habitats más rocosos estaría relacionada con una mayor disponibilidad de sitios para la nidificación y mayor protección contra la predación. La mayoría de los sitios estuvieron habitados por dos especies. Un patrón similar fue observado en otros ecosistemas desérticos de América, donde los números modales son de dos (América del Sur) o de tres especies (América del Norte) (Marquet, 1994). Para los desiertos de América del Norte, Bowers y Brown (1982) indican que la coexistencia de roedores granívoros de similar tamaño corporal es menos frecuente que las esperada por el azar, sugiriendo que con ello evitarían la competencia por alimento. Del presente estudio surgió un patrón distinto (Fig. 2), posiblemente debido a la ausencia de roedores estrictamente granívoros (Kelt et al., 1996), aunque hay un alto grado de granivoría (Tabla 3). Las combinaciones más frecuente de especies fueron P. darwini-A. albiventer y A. albiventer-C. lepidus, las cuales incluyen especies con marcadas diferencias alimenticias (Tabla 3). Estas combinaciones indicarían la existencia de un mecanismo de coexistencia basado en la separación de la dieta. Este mecanismo fue observado en otros roedores del desierto (Reichman, 1975). La baja frecuencia de la combinación P. darwini-C lepidus podría ser interpretada como el resultado de distintas preferencias de habitats y no de la competencia actual (Tabla 2). Como ambas especies son similares en cuanto a dieta y horario de actividad (Tabla 3) y están relacionadas filogenéticamente (Reig, 1986) la segregación de habitat podría ser consecuencia de interacciones competitivas en el pasado (Connel, 1980). De acuerdo con Pimm y Rosenzweig (1981), cuando la competencia es fuerte la selección natural favorecería a aquellos genotipos que solo usan los habitats para los cuales ellos están mejor ajustados. De esta forma potenciales competidores evitan la competencia. La competencia, en tiempo pasado, entre especies ecológicamente similares pudo haber causado una fuerte selección en contra del uso de habitats similares en roedores de desierto (Abramsky y Sellah, 1982). Capítulo 9: Roedores cricétidos 137 Los resultados de este estudio sugieren que el tipo de sustrato, la disponibilidad de alimento, de sitios de nidificación y refugios son factores importantes en la determinación del patrón de uso actual del habitat de los roedores. Sin embargo, sería necesario la realización de experimentos de laboratorio y campo para conocer el papel que desempeñan los factores mencionados en la comunidad. Tabla 1 Autovalores de los ejes 1 y 2 de los análisis de correspondencia canónicas (ACC) y análisis de correspondencia (AC). Ejes Autovalores AC r ACC 1 0,61 0,57 1,00* 2 0,11 0,05 1.00* Ref.: r = coeficiente de correlación de Sperman entre los ejes 1 y 2 del AC con los ejes 1 y 2 del ACC; * = P<0,001. Tabla 2 Coeficientes de correlación semiparcial múltiple para las variables del habitat (R2 habitat) y las especies (R2 especies) R2 total (1) R2 habitat (2) P. darwini 100 62,87 C. lepidus 100 62,87 Variable dependiente R2 especie (3) Diferencia (2)-(3) Porcentaje (2)-(3)/(1) 0,00 62,87 62,87 0,00 62,87 62,87 Capítulo 9: Roedores cricétidos 138 Capítulo 9: Roedores cricétidos Tabla 3 Horario de actividad, tipo de locomoción, dieta y medidas corporales de P. darwini, C. lepidus y A. albiventer. A. albiventer C. lepidus P. darwini Horario de actividad diurno nocturno nocturno (1) Tipo de locomoción terrestre terrestre trepador (2) I/O (2) G/H (3) G (4) (2) Dieta Longitud pata (mm) ) (1 Longitud cabeza-cuerpo (mm) (5) n Longitud cola (mm) (5) n Peso corporal (gr) (5) n Ref.: (1) (1) (2) 21,67 16,33 27 101,34±1,13 85,19±0,73 114,52±2,50 34 16 19 67,26±0,81 44,19±0,63 104,94±2,23 34 16 19 25,32±0,84 15,13±0,57 36,15±2,22 34 34 34 n = número de ejemplares considerados; I/O = insectívora/omnívora; G/H = granívora/herbívora; G = granívora; (1): Pearson (1951); (2): Ojeda y Mares (1989); (3): Bonaventura (Com. Per.); (4) Pearson y Ralph (1978); (5): especímenes adultos capturados en la Puna durante 1991. 139 Capítulo 9: Roedores cricétidos Fig. 1.- Ubicación geográfica del área de estudio y de los sitios muestreados en la Reserva de Biosfera Laguna de Pozuelos 140 Capítulo 9: Roedores cricétidos Fig. 2.- Distribución y abundancia de Phyllostis darwini, Calomys lepidus y Akodon albiventer en los 10 sitios muestreados en la Reserva de Biosfera Laguna de Pozuelos 141 Capítulo 9: Roedores cricétidos Fig. 3.-Diagrama de ordenamiento de los ejes 1 y 2 obtenidos del análisis de correspondencia canónicas. Las flechas indican la dirección y fuerza de las variables del habitat significativas 143 CAPITULO 10 USO DE HABITAT POR VICUÑAS Y GUANACOS EN LA RESERVA DE BIOSFERA DE SAN GUILLERMO Jorge Luis Cajal 1 Introducción Las altipampas de la puna han sido mencionadas por Koford (1957) como lugar preferido de las vicuñas (Vicugna vicugna) debido, según el autor, a que allí crecen las hierbas verdes que constituyen su principal alimento. Esta fue una de las primeras referencias sobre uso de habitat por parte de esta especie. Posteriormente, Raedeke (1978) y Franklin (1982, 1983) describen las condiciones del ambiente para el guanaco (Lama guanicoe) en el sur de Chile. Franklin (1983) y Hofmann et al. (1983) identifican los tipos de habitat y vegetación para la vicuña en Pampa Galeras, Perú. Pujalte y Reca (1985) discuten los posibles parámetros ambientales que definirían la distribución de vicuñas y guanacos en Argentina. Estos autores señalan que mientras las vicuñas prefieren ambientes abiertos, en los cuales las leñosas se presentan a lo sumo como arbustos, los guanacos además de ocupar preferentemente los espacios abiertos, también se extienden sobre unidades leñosas, sean éstas arbustivas y boscosas abiertas (abras o pastizales del Chaco) o cerradas (bosque de Tierra del Fuego y caldenales de La Pampa). Con respecto a la alimentación, las primeras informaciones provie1 FUCEMA, Pringles 10, (1183), Buenos Aires, Argentina. Originalmente publicado en Vida Silvestre Neotropical (1989) Capítulo 10: Vicuñas y guanacos 144 nen de observaciones directas realizadas en el campo (Pearson, 1951; Kodford, 1957). Estos autores mencionan los géneros Calamagrostis, Festuca, Poa y Stipa como los principales componentes de la dieta de la vicuña en Perú. Raedeke (1978, 1980) utiliza por primera vez el análisis de muestras de rumen para el guanaco de Magallanes, Chile. Estos trabajos así como los de Simonetti y Fuentes (1985) para la parte central de Chile y Amaya (1985) para Patagonia, Argentina, señalan a las gramíneas como el constituyente básico en la alimentación del guanaco. Otros estudios realizados en la parte noroeste de Patagonia (Bahamonde et al. 1986), en el ecotono entre el bosque de Nothofagus y la estepa, indican a los árboles y arbustos como el principal componente de la dieta de esta especie. En lo que respecta a la estructura social, tanto la vicuña como el guanaco presentan como característica común los siguientes agrupamientos sociales: grupos familiares, tropas de machos y machos solitarios (Kodford, 1957; Franklin, 1974, 1982, 1983; Raedeke, 1978; Cajal, 1983). En cuanto a la territorialidad, el guanaco presenta un comportamiento mas flexible que la vicuña. Una discusión detallada sobre el tema puede encontrarse en Franklin (1974, 1982, 1983) y Wilson y Franklin (1985). El presente capítulo analiza la composición de la dieta y uso de habitat en vicuña y guanaco, tanto a nivel de especie como agrupamiento social, en la Reserva de Biosfera San Guillermo. Esta Reserva constituye el límite sur de la distribución de la vicuña en simpatría con el guanaco. Hay varios trabajos sobre interacción interespecífica entre poblaciones simpátridas de pequeños mamíferos (Grant, 1978) pero estos estudios son escasos en grandes mamíferos (Smith, 1987). Con respecto a los camélidos, Raedeke (1982) ha señalado la competencia y el desplazamiento del guanaco por parte de la oveja en Tierra del Fuego, Chile. No obstante, hay una falta de estudios detallados sobre la relación guanaco-vicuña en lugares donde ambas especies coexisten. Métodos Censos Capítulo 10: Vicuñas y guanacos 145 Se definieron cinco sectores o unidades de censo en la Reserva San Guillermo cubriendo un total de 185.000 ha y cuyos límites se fijaron de acuerdo a características naturales del terreno (río, cumbre, quebrada, etc). Cada sector fue recorrido en vehículo automotor y/o mular durante verano (enero, febrero y marzo) e invierno (julio y agosto), registrándose la siguiente información: especie, agrupamiento social, número de animales por agrupamiento social y ubicación. Los estudios fueron realizados desde enero de 1978 hasta septiembre de 1984, comprendiendo 420 días y 2.100 h de observación. Desde enero hasta agosto de 1978 se estudió con mayor detalle en una misma área de 357 ha, el patrón de uso de habitat por parte de guanacos. Para censar los animales se utilizó el conteo directo y completo por sectores de acuerdo a los discutido por Hofmann et al. (1983) y Cajal (1987). Con la ayuda de los guardafaunas se recorrieron simultáneamente los límites de los sectores adyacentes como forma de evitar contar más de una vez los mismos animales, ya que éstos podían desplazarse de un sector a otro en respuesta a la presencia humana. De acuerdo con la toponimia, los cinco sectores elegidos fueron los siguientes: 1) Los Hoyos; 2) Huesos Quebrados; 3) Los Leones; 4) Batidero; 5) Infiernillo (Fig. 1). El primero y el tercero resultaron ser los mas homogéneos por corresponder a la asociación ambiental grandes llanos. Todos tenían acceso a fuentes de agua permanente (Cajal et al., 1981; Pujalte et al., 1983). Descripción de las comunidades vegetales Se registró la oferta de las plantas perennes mediante el método de los cuadrados. La elección de cada sitio para el muestreo estuvo de acuerdo con la uniformidad de la topografía y vegetación. Un total de 29 sitios repartidos entre los cinco sectores fueron seleccionados, tomando en cada uno de los mismos 22 cuadrados al azar de 4 m2 cada uno. Se consideró la cobertura como la proporción de terreno ocupado por la proyección vertical de las partes aéreas de cada planta, expresándose esta medida como porcentajes de la superficie total. Patrones en el uso de habitat La ubicación de los grupos sociales en los diferentes habitats al iniciarse cada observación permitió relacionar los grupos familiares, las Capítulo 10: Vicuñas y guanacos 146 tropas de machos y los machos solitarios de vicuña y guanaco en verano e invierno con cada uno de los habitats mencionados. Estos datos fueron tratados mediante la prueba de independencia para tablas multifactoriales y prueba a priori de particiones, utilizando el estadístico G, a un nivel de significancia de α=0,05 (Sokal y Rohlf, 1981). Los datos de invierno y verano fueron analizados separadamente. Luego se procedió a investigar las interacciones de dos factores dentro de los niveles de especie, grupo social y habitat. Como uso de habitat era la pregunta principal del problema, el mismo no fue considerado en este caso. Las otras alternativas eran: examinar preferencia entre especies dentro de los grupos sociales o examinar preferencia entre grupos sociales dentro de las especies. Se eligió la primera realizándose para ello análisis de dos factores: tres para los datos de invierno y tres para los del verano. Los datos de invierno fueron modificados reemplazándose el 0 por 1 (Ln(0) = valor indefinido), esto permitió el uso de la prueba de la G, debiéndose interpretar los resultados como conservadores. Se analizó la relación número de camélidos vs. sector de censo mediante el programa de computadora MCHETV aplicable a la prueba de uniformidad de medias asumiendo varianzas heterogéneas, según el método Games and Howell (Sokal y Rohlf, 1981). También se analizó el uso de cada sector por parte de vicuñas y guanacos mediante el estadístico t. Patrones en el uso de habitat por guanacos En el sector Huesos Quebrados se definió un área con presencia exclusiva y permanente de guanacos con el objetivo de determinar cual habitat utilizaban más. De acuerdo a la interpretación de foto aérea, en el área estaban representados: 1) una vega encajonada que cubría 12 ha (3 %); 2) laderas rocosas que totalizaban 229 ha (64 %); 3) un pequeño llano de 38 ha (11 %) y 4) una ladera no rocosa de 78 ha (22 %) utilizada por los guanacos como dormidero. A cada uno de los grupos sociales de guanacos observados se le asignó un número. Esta individualización fue posible mediante la identificación de los animales que constituían cada grupo, marcas naturales en los individuos, ubicación según la hora del día y constancia en la observación (Franklin, 1983; Wilson y Franklin, 1985). Se individualizaron seis grupos familiares estables que totalizaban 43 animales al iniciarse el estudio. Los períodos de muestreo sumaron 240 h y fueron de 15 min. a distintas horas del día, al azar y desde un mismo punto de observación. Se utilizó el estadístico t para el tratamiento de los datos. También se consideró el índice de preferencia discutido por Duncan (1983), Pi = Ui/Ai, donde Ai = porcentaje del área de estudio cubierta por Capítulo 10: Vicuñas y guanacos 147 el habitat i, y Ui = porcentaje de todas las observaciones registradas en dicho habitat i. Alimentación En los cinco sectores previamente definidos se muestrearon conjuntos de bosteaderos para la recolección de heces. También se recolectaron rúmenes de camélidos encontrados muertos por causas naturales (congelamiento, predación). Es posible que plantas que sean fácilmente digeribles estén mal representadas en las heces. Del mismo modo, plantas de baja digestibilidad (principalmente perennes) puedan estar sobreestimadas. De ahí que puedan surgir sesgos al tomar muestras de rúmenes y heces. Con respecto a esto, Stewart (1970) se refiere al caso de plantas que aparecen en rúmenes pero no en heces. No obstante, este autor no ve como única causa a las diferencias en digestibilidad de las plantas. Hansen et al. (1973) dicen que la asimilación de plantas muy digeribles reduce el tamaño de los fragmentos de dichas plantas, pero el número total de los mismos no decrece significativamente. Por otra parte, los trabajos de Anthony y Smith (1974) en Odocoileus, de Smith y Shandruk (1979) en Antilocapra y de Seegmiller y Ohmart (1981) en Ovis revelaron similar composición de especies vegetales en muestras de heces y rúmenes. Teniendo en cuenta lo mencionado y constatando que todas las especies vegetales determinadas en los rúmenes de los camélidos también aparecían en sus heces, se decidió incorporar ambos tipos de muestras en los análisis. Esto permitió además discriminar con claridad el origen de las muestras en aquellos lugares con importante superposición de vicuñas y guanacos y donde los bosteaderos eran utilizados en común por individuos de ambas especies. Para esto último también se esperaba que un animal depositara sus heces para inmediatamente recolectarlas. De cada rúmen y conjunto de bosteaderos se obtuvieron dos submuestras de 100 g cada una para su posterior análisis microscópico (Dusi, 1949), tomándose como referencia un muestrario de la epidermis de las plantas existentes en el área de estudio (Storr, 1961). Las submuestras fueron trituradas en un mortero, obteniéndose a partir de cada una de las mismas dos placas conteniendo los fragmentos de las plantas en glicerina, las cuales fueron sistemáticamente examinadas bajo microscopio a 100 aumentos. Se consideraron 10 campos por placa identificándose en las mismas las plantas presentes y determinándose su frecuencia absoluta a partir de sus correspondientes fragmentos (células de la epidermis, estomas, tricomas, etc). Las frecuencias absolutas fueron transformadas a √ Y+0,5 para reducir el efecto de los números enteros y ceros, permitiéndose de esta manera Capítulo 10: Vicuñas y guanacos 148 el análisis mediante un ANOVA. También se aplicó la prueba de StudentNewman-Keuls (Sokal y Rohlf, 1981) para las comparaciones múltiples entre medias de frecuencia de plantas presentes en la dieta de vicuñas y guanacos. Para una discusión detallada sobre la técnica mencionada para el análisis de dieta ver Stewart (1967), Zyznar y Urness (1969) y Anthony y Smith (1974). Para determinar valor forrajero de los llanos y laderas rocosas se tomaron al azar muestras de plantas situadas en distintos sitios, incluyendo las fuentes de agua o vegas, para su posterior análisis de los constituyentes orgánicos (AOAC, 1965). Se utilizó el test de igualdad de medias de dos muestras cuyas varianzas se supone que son desiguales (Sokal y Rohlf, 1981), a fin de compara la presencia de estos constituyentes en los dos ambientes considerados: llano vs. ladera rocosa. RESULTADOS Tipos de habitats Se determinaron tres tipos de habitats: 1) Llanos. En general con tapiz vegetal escaso, siendo comunes coberturas inferiores al 5 % y escasas las que llegan al 10 %. Predominan los pastizales y comunidades con presencia conspicua de suculentas en los llanos más pedregosos, y en aquellos con mayor pendiente dominan las formas arbustivas. Las gramíneas características son Stipa frígida y Stipa cfr. speciosa (“coirones”), la suculenta que se destaca es el cactus Mahiueniopsis glomerata, los arbustos están representados por Adesmia horrida, Lycium chañar y Lycium cfr. chilense. Además existen caméfitos en placas como Adesmia nanolignea y numerosos geófitos y terófitos como Sphaeralcea mendozana, Phacelia sinuata y Chenopodium sp. En este habitat se encuentran depresiones inundables o vegas, en parte salinizadas, con cursos de agua en general permanentes y suelos con predominancia de materia orgánica poco alterada. La vegetación es herbácea en forma de césped almohadillado o en cojines. Se encuentran principalmente geófitos como Oxychloe spp y vegetación graminoide de altura intermedia como Deyeuxia sp, Festuca cfr. scirpifolia y Juncus balticus. 2) Laderas no rocosas. En general de pendientes suaves y pastizal Capítulo 10: Vicuñas y guanacos 149 muy bajo con sinusia leñosa de arbustos deciduos y cojines además de hemicriptófitos y caméfitos principalmente. Las plantas perennes más importantes son Stipa frígida, Stipa cfr. speciosa, Adesmia horrida y Adesmia nanolignea. En éste habitat se incluyen las vegas presentes denominadas “vegas colgantes” de características similares a las vegas que se encuentran en los llanos. 3) Laderas rocosas. Presentan afloramientos rocosos y barrancas en general con pendientes pronunciadas. La vegetación es predominantemente herbácea. Sobre 3.900 msnm la misma es muy baja, con presencia de geófitos como Nototriche spp y Chaetanthera spp. Debajo de 3.900 msnm la vegetación está constituida principalmente por Lycium cfr. fuscum, Fabiana denudata, Lycium chañar y Adesmia horrida. El pastizal está representado por gramíneas bajas de Stipa spp. Hábitos alimentarios en vicuñas y guanacos Fueron analizadas un total de 24 submuestras de vicuña y 60 de guanaco provenientes de 17 rúmenes y 25 bosteaderos, determinándose un total de 20 plantas diferentes de las cuales 12 resultaron comunes para ambas especies (Tabla 1, Figs. 2 y 3). Las diferencias entre las frecuencias de las plantas utilizadas en común por parte de vicuñas y guanacos resultaron significativas para Stipa spp, Sphaeralcea mendozana y Oxychloe spp, no encontrándose diferencias para el resto de las mismas (Tabla 1). La prueba de comparaciones múltiples entre especies vegetales ordenadas de acuerdo a la magnitud de sus frecuencias medias en la dieta mostraron que Stipa constituye, en las dos especies de camélidos, el conjunto más importante, separado claramente de las demás plantas. Las diferencias aparecen en el segundo conjunto de plantas constituyendo Oxychloe y Nasella las segundas en orden de importancia en vicuña y guanaco, respectivamente (Tabla 2). Los censos de vegetación demostraron una presencia importante del género Stipa el cual representó más del 40 % de la cobertura total (Fig. 4). En la dieta del guanaco aparece una mayor diversidad de plantas (Tablas 1 y 2, Fig. 2), como consecuencia de hábitos más generalistas que la vicuña. Asimismo, en la dieta de ambas especies se destacan la cactácea Mahiueniopsis y los arbustos del género Adesmia y Verbena. Las plantas perennes y anuales obtenidas en los llanos y laderas rocosas para determinar sus constituyentes orgánicos se indican en la Tabla 3. La presencia de proteína no resultó ser significativamente diferente (ts Capítulo 10: Vicuñas y guanacos 150 = 1,51; P = 0,05) entre los llanos (x = 1,05; DE = 0,77; n = 19) y laderas (x = 1,87; DE = 2,72; n = 27). Tampoco la presencia de grasas resultó ser diferente (ts = 0,62; P = 0,05) entre los llanos (x = 1,55; DE = 1,13; n = 18) y laderas (x = 1,78; DE = 1,27; n = 25). Por el contrario, los hidratos de carbono tuvieron una presencia significativamente mas importante (ts = 2,31; P = 0,05) en las laderas (x = 68,96; DE = 12,01; n = 27) que en los llanos (x = 56,18; DE = 21,89; n = 19) debido a la mayor abundancia de arbustos leñosos en estas laderas. Patrones en el uso de habitat En la Tabla 4 se indica la ubicación de los distintos grupos sociales de vicuña y guanaco en verano e invierno dentro de los tres habitats considerados. Los datos mostraron interacciones significativas luego del análisis de tres factores. Esto fue tanto para el invierno (G = 17,034; P = 0,00216; gl: 4) como para el verano (G = 21,496; P = 0,00033; gl: 4). Las interacciones de preferencia entre grupos familiares de vicuña y guanaco dieron resultados significativos, tanto para el invierno (G = 15,0811; P = 0,00068; gl: 2) como para el verano (G = 10,7852; P = 0,00487; gl: 2). También para los machos solitarios de ambas especies los resultados fueron significativos tanto para el invierno (G = 7,6691; P = 0,02154; gl: 2) como para el verano (G = 7,2222; P = 0,02678; gl: 2). Por el contrario, las comparaciones de preferencia entre las tropas de machos de vicuña y guanaco no dieron resultados significativos ni para el invierno (G = 5,3409; P = 0,06789; gl: 2) ni para el verano (G = 4,3574; P = 0,11132; gl: 2). Los análisis entre los cinco sectores de la reserva en relación al número de camélidos presentes en cada uno de ellos mostraron que, para el guanaco, Huesos Quebrados es significativamente diferente a Infiernillo. Los demás sectores no mostraron ser diferentes para esta especie. Por el contrario, para la vicuña Los Hoyos resultó ser significativamente diferente a todos los demás y, a su vez, Huesos Quebrados diferente a Batidero e Infiernillo (Tablas 5 y 6), En relación al uso de los mencionados sectores por parte de ambas especies tomadas en conjunto, se determinó que utilizan de manera significativamente diferente Huesos Quebrados (t = 4,374; P<0,01; gl: 6) y muy significativamente diferente Infiernillo (t = 7,504; P<0,001; gl: 6), no encontrándose diferencias significativas (P = 0,05; 6 g.l.) en los restantes sectores, (Los Hoyos: t = 1,798; Los Leones: t = -1,542; Batidero: t = -0,880). En el área definida por la foto aérea en el sector Huesos Quebrados, Capítulo 10: Vicuñas y guanacos 151 se obtuvo una media de 54 guanacos por observación. Esto se debió a que otros grupos familiares, tropas de machos y machos solitarios entraron en el área de manera transitoria, principalmente durante el invierno. Estos animales en algunos días llegaron a superar los 100 ejemplares y también fueron incluidos en las observaciones. Los guanacos mostraron preferencia significativa por el llano como lugar de actividad diaria (G = 5,02; P<0,001; gl: 71). Asimismo el índice de preferencia por el llano resultó ser de 6,24 (68,7 %/11,0 %) y por las laderas rocosas 0,36 (31,3 %/86,0 %). Discusión Uso de habitat y sectores Las interacciones significativas entre especie, grupo social y habitat encontradas para verano e invierno indican que por lo menos un grupo social de alguna de las especies tiene diferentes preferencias de habitat con respecto a la otra. Efectivamente, las interacciones significativas de preferencia entre grupos familiares de vicuña y guanaco en verano e invierno señalan que los mismos utilizan de manera diferente los habitats en ambas estaciones del año. Lo mismo se comprobó entre los machos solitarios de ambas especies. Por el contrario, las comparaciones de preferencia entre las tropas de machos de vicuña y guanaco no dieron resultados significativos ni para el verano ni para el invierno, lo cual indica que estos grupos sociales tienen la misma respuesta todo el año frente a los habitats disponibles. Esto podría deberse en parte a la mayor plasticidad de los guanacos, quienes en su mayoría, y a diferencia de las vicuñas que permanecen en sus lugares, se desplazan durante el invierno hacia lugares de menor altitud para protegerse de los rigores invernales, invirtiéndose la dirección de este movimiento en el verano. Como consecuencia de estos desplazamientos, los grupos familiares de vicuña, al disponer durante el invierno de mayor espacio vacío, ocupan los llanos con mayor intensidad. Esto indica su preferencia por los mismos ya que resultan más convenientes que los ambientes rocosos y quebrados durante los temporales de nieve que ocurren periódicamente en la cordillera. En los espacios abiertos la nieve se acumula menos y se disipa más rápidamente que en los otros ambientes. Wiens (1976) diferencia la selección de habitat verdadera que surge de la comparación y elección entre distintas alternativas, de la correlación de habitats, causada por factores externos que obligan a los individuos a distribuirse de determinada manera. Discriminar estas causas resulta Capítulo 10: Vicuñas y guanacos 152 tarea difícil por las dificultades para realizar experimentos en el campo (Partridge, 1978). Las mediciones realizadas en vegetación mostraron que, si exceptuamos las vegas, las laderas rocosas presentan mayor diversidad y cobertura que los llanos. No obstante, no se encontraron diferencias en cuanto a contenido de proteínas, constituyentes importantes para el crecimiento y productividad de los animales. Franklin (1983) afirma que la calidad de habitat no depende solamente de la existencia de buen forraje, sino también de la accesibilidad al agua. Esto nos lleva entonces a considerar la vegetación en combinación con las formas de terreno, los factores climáticos y a la disponibilidad de agua para explicar la distribución de los animales. Tanto los sectores Huesos Quebrados como Infiernillo presentaron las mayores cobertura de vegetación y también las mayores densidades de camélidos (Fig. 4). No obstante, al tomar cada especie por separado, el peso relativo que cada una aporta para establecer dichas densidades difiere según el sector. Huesos Quebrados es el sector en donde se destacan los guanacos (mayo densidad y estabilidad, menor fluctuación), presentándose las vicuñas marginalmente. A su vez Infiernillo es el sector que tiene mayor densidad y estabilidad de vicuñas, mientras que los guanacos presentan grandes fluctuaciones anuales en sus números. Es decir, la vicuña presenta sus densidades más importantes en aquellos sectores donde los rangos de altura están sobre los 3.600 msnm y decrece hacia aquellos donde las alturas son menores (< 3.400 msnm), cortándose abruptamente en Los Hoyos. La separación por altura puede ser la clave para entender el uso del espacio por parte de estas dos especies. Al respecto resulta interesante destacar la actitud de vicuñas y guanacos en relación a Los Hoyos, un llano con alturas relativamente bajas y con escasa diversidad y cobertura vegetal (Fig. 4). Los resultados mostraron que pese a la escasa presencia de vicuñas, no se trata de un sector significativamente diferente para ambas especies. Una explicación estadística podría provenir de la gran variabilidad observada en el número de guanacos entre los diferentes años, la cual incluye la posibilidad de no encontrar ningún animal (sea guanaco o vicuña) en un determinado momento. No hay razón aparente para suponer que el mencionado sector no pueda ser ocupado por un mayor número de vicuñas como respuesta a fenómenos climáticos que obliguen a los animales a trasladarse hacia lugares no habitados normalmente y/o al hecho provocado por aumentos en sus densidades. Al respecto, Wiens (1976) afirma que la dispersión de una especie de grano grueso (como la vicuña) se restringe al principio a los habitats preferidos, pero tiende hacia Capítulo 10: Vicuñas y guanacos 153 una mayor uniformidad a medida que aumenta su densidad poblacional. De acuerdo con los resultados obtenidos, se hace evidente que los espacios abiertos (llanos) en la reserva San Guillermo, constituyen los lugares más utilizados por los camélidos silvestres. Las laderas rocosas y quebradas son ocupadas de manera secundaria. Valor de la vegetación Las vicuñas y los guanacos obtienen un importante porcentaje de sus dietas a partir de plantas utilizadas en común, destacándose entre las mismas las gramíneas del género Stipa. En este punto se debe considerar un problema metodológico. Stewart (1967) y Zyznar y Urness (1969) se han referido al hecho que en los análisis microscópicos de epidermis algunas especies vegetales se fragmentan más rápidamente que otras y, en consecuencia, parecen más importantes aunque en la realidad sean consumidas en igual o menor proporción que otras. Tal sería el caso, según los autores, de las gramíneas perennes. La presencia de arbustos en la dieta de ambas especies corroboran las observaciones de campo, las cuales señalan a las vicuñas y guanacos también como ramoneadores además de pastar (Franklin, 1983; Pujalte y Reca, 1985; Raedeke y Simonetti, 1988). La vegetación en calidad y cantidad resulta un parámetro importante a tener en cuenta para esperar mayor o menor densidad de herbívoros. No obstante, con la información obtenida hasta el presente en San Guillermo, ni la diversidad, la cobertura, o el valor forrajero, explican de por sí la preferencia por determinado habitat de parte de los animales. El resultado del análisis de la dieta podría ser más adecuado para constatar si alguna especie vegetal en particular actúa como limitante de la distribución. La presencia de la juncácea Oxychloe como segundo componente de importancia en la dieta de la vicuña y presente únicamente en las vegas de altura, podría indicar que esta planta tiene un papel destacado en la distribución de la especie. El tema merece una mayor investigación. Encuentros agonísticos Interacciones interespecíficas de tipo agonístico y/o territorial entre especies relacionadas que se superponen pueden influir en la distribución de los animales sobre los diferentes habitats (Wiens, 1976; Patridge, 1978). Capítulo 10: Vicuñas y guanacos 154 Durante el presente estudio se observaron encuentros agonísticos en 73 ocasiones: el 84 % de los cuales fueron intraespecíficos y el 16 % interespecíficos. Los encuentros interespecíficos consistieron en : guanaco macho familiar vs. vicuña macho solitario y vicuña macho familiar vs. guanaco macho solitario. El tipo de comportamiento de los diferentes grupos sociales (territorial en grupos familiares y machos solitarios, no territorial y mayor movilidad en las tropas de machos), podría marcar en parte las diferencias en relación al uso de habitat. De acuerdo con Wilson (1980), la presencia de actos territoriales tanto intra como interespecíficos, es una de las condiciones para que especies relacionadas puedan coexistir. Esta podría ser una de las razones que explicaría la simpatría y convivencia de dos especies emparentadas como la vicuña y el guanaco en la reserva San Guillermo. Zonificación de la reserva en base al uso de habitat por parte de los camélidos Para definir la zonificación de la reserva en función de los camélidos silvestres debe tenerse en cuenta: su topografía, con especial atención a la amplitud de las variaciones altimétricas, su geomorfología y su vegetación, considerando las preferencias alimentarias discutidas en relación a los habitats utilizados con mayor frecuencia. Con respecto a estos últimos debe destacarse la preferencia de ambas especies por los llanos, los cuales representan aproximadamente el 31 % de la superficie habitable de la reserva. De acuerdo a estas consideraciones se puede establecer como zona núcleo o central a los sectores Infiernillo (3.730-3.750 msnm), Los Leones (3.450-3.650 msnm) y Huesos Quebrados (3.400-3.560 msnm). Huesos Quebrados y Los Leones representan un área de altitud homogénea (no se considera la cumbre de algunos cerros) y coexistencia de las dos especies en densidades aproximadamente constantes y no muy diferentes entre si. Esto permitiría dedicar la zona a investigaciones con la facilidad de que ambas áreas son contiguas y representan todos los ambientes propios de esa zona altitudinal. Sin embargo, al considerar también la zona del Infiernillo se observa que las densidades relativas de cada especie se invierten. La diferencia altitudinal entre ésta última y las dos anteriores podría ser una de las causas de dicha diferencia. Dado que los tres sectores se encuentran adyacentes en forma Capítulo 10: Vicuñas y guanacos 155 sucesiva de norte a sur, y teniendo en cuenta la ausencia de actividad humana estable (las explotaciones mineras se encuentran situadas fuera de los límites de los sectores considerados), el establecimiento de una zona nuclear que comprenda los sectores Infiernillo, Los Leones y Huesos Quebrados (el 10 % de la superficie total de la reserva) resulta conveniente. El resto de la Reserva (con presencia de emprendimientos mineros) podrá actuar, en una primera definición, como zona de amortiguación y con proyección hacia los asentamientos humanos estables situados en pisos altitudinales mas bajos que hoy se encuentran fuera de los límites de la Reserva (Chinguillo, Colanguil, Angualasto, Rodeo). Capítulo 10: Vicuñas y guanacos Tabla 1 Comparación de los distintos ítems que constituyen la dieta de vicuña y guanaco Stipa Festuca Gramínea ind. 1 Gramínea ind. 2 Deyeuxia Muehlembergia Juncus Oxychloe Sphaeralcea Glandularia Verbena Dicotiledóneas ind. Nasella Huarpea Crucífera ind. Mahiueniopsis Atriplex Adesmia Azorella Malesherbia Vicuña Frecuencia DE media (1) (n=12) 2,96 1,01 0,88 - - - 1,09 1,78 1,25 0,90 0,75 0,95 - 0,78 0,82 0,85 - 0,94 - - 1,37 0,77 0,57 - - - 0,73 1,21 0,62 0,35 0,15 0,36 - 0,25 0,28 0,47 - 0,36 - - Guanaco Frecuencia DE media (1) (n=30) 3,63 0,85 0,94 0,73 0,79 0,91 1.03 1,01 0,90 0,84 0,77 0,76 1,19 - 0,86 0,79 0,74 0,88 0,76 0,74 0,74 0,47 0,57 0,09 0,27 0,46 0,63 0,57 0,40 0,31 0,34 0,16 0,60 - 0,52 0,29 0,16 0,48 0,18 0,16 Valor F P 4,25 0,61 0,57 - - - 0,15 11,00 4,68 0,30 0,04 5,38 - - 0,04 0,25 - 0,15 - - 0,05 ns ns ns 0,01 0,05 ns ns 0,05 ns ns ns - Ref.: (1) = Datos transformados (√ Y+0,5) a partir de la frecuencia absoluta; DE = Desviación Estándar; n = número de muestras (bosteaderos y rúmenes); ns = no significativo; ind. = indeterminado 156 Capítulo 10: Vicuñas y guanacos Especies Vegetales 157 Tabla 2 Frecuencia media de los distintos vegetales que constituyen la dieta de vicuña y guanaco en la Reserva San Guillermo. Las medias están dispuestas por orden de magnitud y las líneas al lado de dichos datos representan conjuntos de medias no significativas (según el procedimiento de Student-NewmanKeuls, a = 0,05). Especies Vegetales Vicuña Q.05 (13, 143) Frecuencia LSR media (Y) Stipa 2,96 Oxychloe 1,78 0,54 Sphaeralcea 1,25 0,64 Juncus 1,09 0,71 Festuca 1,01 0,75 Dicotiledónea ind. 0,94 0,79 Adesmia 0,94 0,81 Glandularia 0,90 0,84 Gramínea ind. 1 0,88 0,86 Mahiueniopsis 0,85 0,87 Crucífera ind. 0,82 0,89 Huarpea 0,78 0,90 Verbena 0,75 0,92 Guanaco Q.05 (19, 551) Especies Vegetales Frecuencia media (Y) LSR Stipa Nasella Juncus Oxychloe Gramínea ind. 1 3,63 1,19 1,03 1,01 0,22 0,26 0,29 0,94 0,31 Muehlembergia Sphaeralcea Adesmia Crucífera ind. Festuca Glandularia Deyeuxia Mahiueniopsis Verbena Dicotiledónea ind. Azoerella Atriplex Malesherbia Gramínea ind. 2 0,91 0,90 0,88 0,86 0,85 0,84 0,79 0,79 0,77 0,33 0,34 0,35 0,35 0,36 0,37 0,37 0,38 0,38 0,76 0,76 0,74 0,74 0,39 0,40 0,40 0,40 0,73 0,41 Ref.: LSR = mínimo rango significativo; Y= media obtenida con los datos transformados, √ Y+0,5; ind. = indeterminado Capítulo 10: Vicuñas y guanacos Tabla 3 Porcentaje de constituyentes orgánicos y cenizas de plantas presentes en San Guillermo. Los análisis fueron realizados por el Laboratorio de Análisis Biológicos (LAB) de la Secretaría de Agricultura, Ganadería y Pesca de la Nación. Llano (1) Especies Proteína Grasa Vegetales Ladera rocosa (1) Hidratos Cenizas Proteína Grasa de Carbono Hidratos Cenizas de Carbono Stipa speciosa 1,17 0,79 69,74 26,83 0,58 1,13 77,61 12,89 Stipa frigida 0,35 0,86 74,68 14,59 10,21 4,34 3,52 69,15 Stipa crysophila 0,27 0,92 78,09 11,33 Festuca scirpifolia 0,37 0,57 1,17 76,84 10,89 Hordeum halophylum 1,64 1,75 62,85 23,37 Deschampsia sp 2,99 0,86 58,76 27,50 Distichlis humilis 1,14 1,72 0,87 21,78 20,66 7,06 7,86 Scirpus sp 0,93 2,30 73,21 11,33 Juncus balticus 0,97 1,23 82,08 4,05 Heleocharis sp Muehlembergia 0,73 1,64 54,74 33,50 0,60 1,20 20,77 5,97 1,28 1,79 69,33 18,99 0,27 1,25 20,94 24,81 0,27 1,50 57,17 28,13 asperifolia Sphaeralcea mendozana Pastos Hierbas Tabla 3 (Continuación) Llano (1) Especies Proteína Grasa Vegetales Glandularia Ladera rocosa (1) Hidratos Cenizas Proteína Grasa de Carbono 9,14 1,44 Hidratos Cenizas de Carbono 2,34 4,02 71,60 10,45 63,37 13,99 Phacelia sinuata 1,70 0,31 47,93 39,84 Huarpea andina 1,17 3,63 68,83 15,02 Calandrina picta 2,24 2,81 69,22 11,24 Nicotiana sp 2,13 2,70 33,26 16,47 Senecio sp 2,12 1,06 73,02 11,25 sulphurea 0,44 2,57 65,10 18,13 Malesherbia lirana 0,01 1,83 74,01 10,93 Ipomopsis sp 1,94 0,42 71,66 10,05 Crucífera ind. 1,35 1,07 69,82 14,92 Ephedra breana 0,33 0,69 26,91 10,21 Lycium fuscum 5,22 1,67 76,71 7,23 Adesmia horrida 0,90 5,04 80,68 Fabiana denudata 0,07 3,06 76,63 2,45 Atriplex sp 0,62 54,05 29,29 0,45 11,85 Ref.: (1) = Se incluyen plantas de vegas de llanos y vegas colgantes. Arbustos 160 Tabla 4 Número de grupos sociales de vicuña y guanaco observados en los diferentes habitats de la Reserva San Guillermo. Habitats Invierno Grupo familiar Tropa de machos Macho solitario Verano Grupo familiar Tropa de machos Macho solitario V G V G V G V G V G V G A B C 69 (+) 36 (-) 55 (-) 74 (+) 11 (-) 25 (+) 145 (-) 148 (+) 381 (-) 204 (+) 113 (+) 105 (-) 16 (-) 33 (+) 16 (+) 23 (-) 7 (+) 10 (-) 58 (+) 30 (-) 97 (-) 69 (+) 24 (-) 47 (+) 9 (-) 9 (+) 15 (+) 7 (-) 6 (-) 0 (-) 23 (-) 34 (+) 80 (+) 34 (-) 21 (-) 26 (+) Valor G 15,08 s 5,34 ns 7,67 s 10,79 s 4,36 ns 7,22 s Ref.: V = vicuña; G = guanaco; s = significativo; ns = no significativo; (+) = desviación positiva con respecto a lo esperado; (-) = desviación negativa con respecto a lo esperado; A = llano + vega en llano; B = ladera no rocosa; C = ladera rocosa + vega colgante. Tabla 5 Número de vicuñas y guanacos en diferentes sectores de la Reserva San Guillermo durante el período 1978-1984. Sector Especie Los Hoyos Huesos Quebrados Los Leones Batidero Infiernillo Vicuña Guanaco Vicuña Guanaco Vicuña Guanaco Vicuña Guanaco Vicuña Guanaco Año y número de animales 1978 1979 1980 1981 1982 1 41 197 441 363 553 644 877 883 411 0 126 288 630 374 435 664 363 828 143 0 36 245 445 473 374 865 288 837 116 0 74 379 789 484 367 855 33 1021 180 0 142 248 863 790 673 1171 816 1257 243 Capítulo 10: Vicuñas y guanacos 1983 0 71 459 682 884 501 718 1349 1533 286 1984 0 688 599 649 1164 372 719 751 847 340 Tabla 6 Diferenciación de los distintos sectores por parte de vicuñas y guanacos según el programa de MCHTV (Games & Howell); k: 5; gl: 6; P = 0,05. Prueba entre todos los pares de sectores para el guanaco Prueba entre todos los pares de sectores para la vicuña G & H Valor Q Sectores G & H Valor Q 1 vs 5 0,798 4,820 ns 1 vs 2 6,367 5,305 s 1 vs 3 3,053 4,790 ns 1 vs 3 5,626 5,305 s 1 vs 4 2,497 4,750 ns 1 vs 4 11,642 5,305 s 1 vs 2 4,456 4,614 ns 1 vs 5 10,082 5,305 s 5 vs 3 3,729 4,508 ns 2 vs 3 2,378 4,800 ns 5 vs 4 2,292 5,100 ns 2 vs 4 5,239 4,530 s 5 vs 2 5,475 4,614 s 2 vs 5 5,922 4,756 s 3 vs 4 0,995 5,100 ns 3 vs 4 1,175 4,700 ns 3 vs 2 2,357 4,574 ns 3 vs 5 2,483 4,520 ns 4 vs 2 0,018 4,900 ns 4 vs 5 1,819 4,610 ns Ref.: 1 = Los Hoyos; 2 = Huesos Quebrados; 3 = Los Leones; 4 = Batidero; 5 = Infiernillo; ns = no significativo; s = signifi- 161 Capítulo 10: Vicuñas y guanacos Sectores 162 Fig. 1 - Asociaciones ambientales y sectores de censo en la Reserva San Guillermo. 1 = Sucesión de cordones montañosos disectados por arroyos encajonados y con presencia de pequeños llanos; 2 = Areas Grandes llanos; 3 = Valles estrechos con pendientes abruptas correspondientes a la provincia fitogeográfica del Monte; 4 = Grandes alturas por arriba del límite de vegetación; LH = Los hoyos; HQ = Huesos Quebrados; LL = Los Leones; B = Betidero; I = Infiernillo. Las letras se encuentran ubicadas en el centro aproximado de cada sector. Capítulo 10: Vicuñas y guanacos 163 Capítulo 10: Vicuñas y guanacos Fig. 2 - Dieta de camélidos silvestres en San Guillermo 164 Fig. 3 - Dieta de vicuñas y guanacos. Porcentaje de plantas utilizadas en común (baras de abajo). El esquema de la figura fue extraído de Stoddart et al. (1975). Capítulo 10: Vicuñas y guanacos 165 Capítulo 10: Vicuñas y guanacos 167 CAPITULO 11 DENSIDAD POBLACIONAL Y DINAMICA DE LOS GRUPOS FAMILIARES DE GUANACOS Y VICUÑAS EN LA RESERVA DE BIOSFERA DE SAN GUILLERMO Jorge Luis Cajal 1 Stella Maris Bonaventura 2 Introducción La estructura social de las poblaciones animales y particularmente el tamaño de los grupos familiares que la componen, han sido tenidas en cuenta por la sociobiología, porque reflejan la forma y la magnitud de las interacciones individuales en relación con la historia evolutiva y las respuestas a las características ambientales (Wilson, 1980). En los camélidos silvestres sudamericanos (Vicugna vicugna y Lama guanicoe) se encuentran los siguientes grupos sociales: a) grupo familiar, integrado por un macho dominante o “relincho”, las hembras y sus crías; b) grupo de machos solteros (adultos y juveniles); c) machos solitarios (adultos y juveniles), (Kodford, 1957; Raedeke, 1978; Franklin, 1981, 1983; Cajal, 1989). 1 FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. 2 Depto. Cs. Biológicas, FCEN-UBA, 4º piso, Pab. II, Ciudad Universitaria, (1428) Buenos Aires, Argentina. Capítulo 11: Densidad poblacional 168 Para el guanaco, se ha señalado además, grupos constituidos únicamente por hembras y grupos mixtos (Franklin, 1983). Los trabajos sobre socioecología de vicuña y guanaco, fueron realizados en alopatría: la vicuña en Pampa Galeras, Perú; el guanaco en el sur de Chile (Franklin, 1983). En el presente Capítulo se estudia de manera comparada la estructura social en condiciones de simpatría. Wiens (1977) refiriéndose a estudios sobre interacciones de especies que coexisten, dice que las variaciones ambientales pueden actuar produciendo cambios en la distribución y abundancia de las poblaciones, y si éstas poblaciones son estudiadas en breves lapsos de tiempo, se pueden obtener conclusiones erróneas, por lo tanto, para obtener conclusiones válidas, los estudios poblacionales comparados deben ser de larga duración. En el presente capítulo se analizan datos de campo correspondientes a siete años. El objetivo del mismo es analizar, en condiciones de simpatría, los tamaños de los grupos familiares de guanaco y vicuña y sus variaciones en relación a los cambios anuales de las densidades poblacionales. Las preguntas a responder son: a) ¿los grupos familiares de ambas especies difieren en cuanto al tamaño?; b) ¿el tamaño de dichos grupos varía a lo largo del tiempo? y c) ¿el tamaño del grupo familiar está relacionado con la densidad poblacional? Métodos Procedimiento de muestreo Durante el período 1978 a 1984 y en 1993 se estimaron anualmente los números poblacionales de vicuña y guanaco mediante censos directos y completos en sectores ubicados dentro de la reserva San Guillermo (Cajal, 1989, 1991). El área total muestreada fue de 2.150 km2 (Fig. 1). Con los números poblacionales por año (de 1978 a 1984) se hizo una regresión lineal para cada especie a fin de obtener la tasa exponencial de crecimiento observada (r) (Caughley, 1978). Sincrónicamente con los censos (con excepción del año 1984) se registró el número y tamaño de los grupos familiares de ambas especies. Las diferencias de tamaño entre años y especies fue analizado mediante análisis de ANOVA de dos vías (especie x año). Capítulo 11: Densidad poblacional 169 Resultados Durante el período 1978-1983 el tamaño promedio del grupo familiar de las vicuñas y su DE fue de 6,8±3,2 individuos, registrándose los valores más bajos en 1982 y 1983 (6,6 y 6,3 individuos respectivamente) y los más altos en 1978 y 1981 (7,4 individuos). En los guanacos el tamaño promedio del grupo familiar fue de 8,6±5,2, registrándose el mayor tamaño en 1979 (9,7 individuos). En el resto de los años, el tamaño osciló entre 8,1 y 8,4 individuos (Tabla 1). El tamaño del grupo familiar del guanaco fue significativamente mayor que el de la vicuña, no registrándose diferencias significativas entre años ni en el término de la interacción (Tabla 2). Con respecto a los números poblacionales de vicuña y guanaco, ambas especies mostraron un incremento de sus densidades durante el período 1978-1984 (Fig. 2). La tasa exponencial de crecimiento observada (r) para ambas especies fue la siguiente: vicuña, r = 0,1761; guanaco, r = 0,0996. No se encontraron diferencias significativas (F = 3,614; P = 0,06587; gl: 2, 10) entre los coeficientes de regresión (r) de ambas especies. Tanto la vicuña como el guanaco, mostraron similar tendencia de crecimiento poblacional. En ninguna de las dos especies las variaciones en los tamaños de los grupos familiares registrados durante el período 1978-1983 estuvieron correlacionadas significativamente con los cambios registrados en sus densidades durante el mismo período (vicuña: r = -0,75; P>0,05; gl: 5); guanaco: r = 0,18; P>0,10; gl: 5). Discusión Tamaño del grupo social Si bien el tamaño medio del grupo familiar del guanaco resultó significativamente superior al de la vicuña, el tamaño de los grupos familiares de ambas especies mostró un patrón constante durante el período de estudio. Crook (1992) atribuye un papel preponderante al presupuesto energético en la optimización del tamaño del grupo social. La intercepción entre las curvas de rendimiento energético del área de actividad y de los requerimientos energéticos del grupo social determina el tamaño óptimo del grupo social. Además, este tamaño óptimo está determinado por la suma máxima de los componentes de la aptitud genética (Wilson, 1980). Capítulo 11: Densidad poblacional 170 Wilson (1980) también señala que el tamaño del grupo social debe ser lo bastante pequeño como para superar los períodos más prolongados de escasez de recursos. Al respecto Franklin (1983) dice que un macho jefe territorial con un grupo familiar pequeño, puede defender una pequeña pero a la vez completa porción del ambiente. Dentro del patrón constante mencionado para los grupos familiares de vicuña y guanaco, el tamaño medio del grupo familiar de la primera especie resultó inferior al de la segunda. Esta diferencia podría atribuirse a las condiciones evolutivas e históricas (diferentes centros de distribución) de ambas especies (Cajal, 1991), y a la mayor flexibilidad del guanaco respecto a la vicuña en lo relacionado al comportamiento social y ocupación de ambientes (Franklin, 1983; Cajal, 1989). No obstante, el tema merece ser estudiado con mayor detalle a fin de obtener conclusiones válidas al respecto. Tamaño del grupo social y densidad En el área de estudio, el tamaño medio del grupo familiar de la vicuña fue de 6,8 ejemplares y no varió con el aumento de la densidad (Tabla 1, Fig. 2). Koford (1957) observó en Pampa Galeras, Perú, grupos familiares de vicuña de similar tamaño (7 individuos) en áreas de baja densidad poblacional. Posteriormente en la misma localidad y coincidente con el incremento poblacional de la vicuña, Franklin (1981) determinó un tamaño medio del grupo familiar territorial y permanente de 6,1 individuos entre 1968 y 1971. Hofmann et al. (1983) registraron una media de 5,3 individuos por grupo familiar según datos correspondientes a ocho años de observación (1974 a 1980). Tomando de los últimos autores las medias anuales de los grupos familiares entre los años 1974 a 1980 y los datos sobre número poblacional para el mismo período (Norton-Griffiths y Torres, 1980), se observó una correlación significativa y negativa entre el tamaño de los grupos familiares y la densidad de las vicuñas (r = -0,65; P>0,05; gl: 6). Con respecto al guanaco, no hay estudios que permitan correlacionar en otras áreas el tamaño del grupo familiar vs. la densidad. Franklin (1981, 1983), señala en base a censos realizados durante el verano en Torres del Paine, Chile, un tamaño medio del grupo familiar de 16 individuos, determinando además en Tierra del Fuego, Chile, grandes variaciones estacionales en grupos familiares sedentarios, (2,9 en invierno; 9,2 en primavera; 12,8 en verano; 9,5 en otoño). En San Guillermo no fueron observadas variaciones estacionales tanto en el guanaco como en la vicuña, coincidente con lo observado para la vicuña en Pampa Galeras Capítulo 11: Densidad poblacional 171 por Franklin (1981). Los resultados a partir de los datos de Pampa Galeras para la vicuña podrían indicar la existencia de un umbral de densidad a partir del cual se observa una reducción del tamaño del grupo familiar al incrementar la densidad poblacional. Es posible que en San Guillermo la falta de respuesta del tamaño del grupo familiar frente al aumento de la densidad se deba a que la misma no alcanzó el umbral de densidad para que la población responda disminuyendo el tamaño del grupo como una forma de ajuste entre los requerimientos energéticos del grupo y la oferta energética del ambiente. Frente a la mayor demanda de los recursos existen diferentes mecanismos para contrarrestar el aumento de las densidades, tales como la dispersión hacia otras áreas (Cajal, 1989) y/o menor producción de crías. Hofmann et al. (1983), han señalado que los años de baja precipitación y escasez de recursos alimentarios, provocan en las vicuñas reducciones en la relación crías/hembras, como consecuencia de la reabsorción de embriones, interferencias en la ovulación, abortos y menor vigor de las crías. Tal como se anticipara en trabajos anteriores (Cajal, 1989), se observó en años recientes una expansión de vicuñas hacia otros sectores previamente no ocupados por la especie dentro de la reserva. En efecto, como se señala en los resultados del presente trabajo, durante el periodo 1978-1984 las poblaciones de vicuña mostraron un incremento de sus densidades con una tasa de incremento exponencial observada de r = 0,18. Asimismo, los censos correspondientes a 1983 y 1993 permitieron estimar la tasa máxima de expansión unidireccional hacia el sur de la reserva en 2,5 km/año (distancia en km/tiempo en años, según lo propuesto por Caughley, 1978). Comparando la proyección teórica del incremento para años posteriores con las densidades reales obtenidas en 1993, se observó una desaceleración de la tasa de incremento de la vicuña (I% 1978/84 = 18,6 %; I% 1984/93 = 2,3 %), debido a restricciones ambientales y como consecuencia, a expansiones hacia otros sitios. Si bien para las condiciones ambientales de San Guillermo, no se observaron cambios significativos de composición en los grupos familiares de ambas especies, entre los diferentes años estudiados, en un futuro se podría esperar una reducción del tamaño de los grupos familiares, como respuesta dependiente de la densidad, cuando se supere cierto umbral de la misma y existan barreras físicas a la dispersión o que los habitats óptimos disponibles estén ocupados. Capítulo 11: Densidad poblacional 172 Tabla 1 Tamaño promedio ± DE del grupo familiar de vicuñas y guanacos registrado en el período 1978-1983 en la reserva San Guillermo. Vicuña Guanaco Año x±DE n x±DE n 1978 7,379±4,050 132 8,140±4,257 57 1979 6,915±3,335 177 9,724±6,448 87 1980 6,819±3,150 298 8,354±5,383 130 1981 7,439±3,595 66 8,500±4,364 34 1982 6,613±3,080 439 8,430±4,881 235 1983 6,270±2,802 185 8,810±5,338 79 1993 6,188±2,704 224 8,054±5,066 37 n: número de grupos familiares. Tabla 2 Análisis de varianza de dos vías para examinar los efectos del año y la especie sobre el tamaño del grupo familiar en la reserva San Guillermo durante el período 1978-1983. Fuente g.l. ms Años 5 0,0060 0,85 0,51 Especies 1 0,1486 20,89 0,00001 Especies x años 5 0,0036 0,50 0,6193 Error 1907 Transformación: 1/x. Capítulo 11: Densidad poblacional F 0,0071 P 173 Capítulo 11: Densidad poblacional Fig. 1 - Tendencias poblacionales en vicuña y guanaco. San Guillermo. Area nuclear (2100 km2) 174 Nevadas en la Cordillera Frontal Capítulo 11: Densidad poblacional 175 CAPITULO 12 EL MAYOR CARNIVORO DE LOS ANDES: EL PUMA Jorge Luis Cajal 1 Nidia López 2 Introducción Entre los trabajos que hacen referencia al puma (Puma concolor) en Argentina figuran Cabrera y Yepes (1940), quienes brindan un pormenorizado relato de sus costumbres, destacándolo como el carnívoro de mayor distribución geográfica de América. Cabrera (1961) describe todo lo referente a la sistemática de la especie, señalando cómo la adaptación del puma a los distintos ambientes explica su gran diversidad subespecífica. Olrog y Lucero (1981) actualizan la distribución geográfica y muestran cómo la especie ha desaparecido de la zona este de Argentina como consecuencia de la presión humana. El objetivo del presente capítulo es de brindar información sobre predación de vicuñas y guanacos por parte del puma, como así también señalar los lugares de su actividad dentro de la reserva San Guillermo. Existe escasa información sobre este tema en 1 FUCEMA, Pringles 10, (1483) Buenos Aires, Argentina 2 Moreno 623, (1636) Buenos Aires, Argentina. Originalmente publicado en la Revista Chilena de Historia Natural Capítulo 12: El Puma 176 América del Sur, destacándose los trabajos de Wilson (1984) y Yañez et al. (1986), quienes cuantifican hábitos alimentarios y actividad de éste félido en la región austral de Chile. Métodos Durante el período 1978-1984, se registraron observaciones directas del puma y distintos signos de su actividad, tales como huellas, heces y presas muertas (principalmente restos de vicuñas y guanacos). Estos fueron vertidos en un mapa de la reserva con sus respectivas asociaciones ambientales (Fig. 1). Cada vez que se encontraron camélidos muertos en el campo se tomó la siguiente información: fecha, especie, edad (cría o adulto), sexo, grado de nutrición, causas probables de la muerte y ubicación, discriminando el ambiente entre cursos de agua o vegas, quebradas, laderas rupestres y llanos (Cajal et al., 1981). Para estimar el grado de nutrición se obtuvieron índices a partir de la textura y color de la grasa de la médula ósea del fémur (Kirkpatrick, 1980). Este método, no obstante ser bastante subjetivo, fue elegido por la rapidez con que permite realizar evaluaciones en el campo. Asimismo se procedió a abrir la piel de las presas muertas a la altura del cuello para constatar señales de uñas por su parte interna como manera de confirmar la predación por puma. Debido a las intensas nevadas de 1984, las cuales provocaron un impacto en las poblaciones de camélidos (muerte por congelamiento y movimientos grupales) (ver Capítulo 14), los datos de ese año y del período anterior fueron analizados por separado. El grado de nutrición de los camélidos encontrados muertos fue medido solamente para 1984. Ubicando los distintos signos de actividad sobre una grilla constituida por cuadrados de 160 km2 que cubrían las áreas recorridas de la reserva se definió el centro matemático de actividad (Lehner, 1979). Las heces recolectadas fueron analizadas utilizando como principal referencia la “Guía para el reconocimiento microscópico de los pelos de los mamíferos de la Patagonia” de Chehebar y Martin (1988). Resultados y Discusión Entre 1978 y 1984 fueron observados 12 ejemplares de puma (7 adultos y 5 juveniles) y 258 camélidos fueron encontrados muertos en el campo, de los cuales 40 (15,5 %) se atribuyeron al accionar del puma (Tabla 1). Se determinó el grado de nutrición en 51 cadáveres, encontrándose que 17 (33 %) correspondían al 0 de la escala de color y textura, es decir, estaban mal nutridos; 14 (27 %) cayeron en la escala intermedia (1-2) y 20 Capítulo 12: El Puma 177 (40 %) mostraron un grado de nutrición normal (escala 3). Las nevadas excepcionales también afectaron a los depredadores; durante el invierno de 1984 se encontraron dos zorros y un puma muertos por congelamiento (Fig. 1). En las muestras de heces analizadas (n = 10) se encontraron los siguientes componentes en orden de importancia según la frecuencia de aparición: pelos de guanacos y vicuñas, restos de huesos no identificables, pasto, restos de cáscara de huevos, piedras, plumas, hojas, coleópteros, larvas de insectos, pelos de roedor. La preferencia del puma por los vertebrados grandes aparece mencionada en la mayor parte de la literatura sobre el tema. Anderson (1983), en un listado confeccionado en base a 32 trabajos sobre análisis de estómagos y heces de pumas realizados por distintos autores y en distintos lugares de América del Norte, destaca a los ciervos como el principal alimento (100 % de presencia en las muestras) seguidos por cabras y ovejas (47 % de presencia). Los roedores y pequeños mamíferos en general representan apenas un 3 % del total de presas. No es de extrañar, entonces, que los camélidos constituyan parte importante de la dieta del puma en San Guillermo. Comparando con la dieta del puma en Pozuelos (Capítulo 13), se puede apreciar una dieta de tipo oportunista con preferencia por las presas de tamaño grande (Tabla 2). En San Guillermo no se encontró en el puma preferencia por determinada edad o sexo de camélidos (X2 = 2,61; gl: 2; P>0,20). Para establecer la frecuencia esperada en la prueba mencionada se consideró para vicuñas y guanacos las relaciones medidas en el campo (ver Capítulo 14). Considerando en una tabla de contingencia la totalidad de los camélidos muertos (por puma y por otras causas) y la frecuencia esperada, calculada sobre la base de los totales de filas y columnas, se encontró (X2 = 8,72; gl: 1.; P<0,01) que los guanacos son proporcionalmente más comidos por el puma que las vicuñas. En la Tabla 1 figuran los guanacos como el constituyente principal de las presas capturadas entre 1978 y 1983 y a la inversa en 1984, donde prácticamente todas las presas son vicuñas. Esto se relaciona con la utilización diferencial de habitat por parte de las dos especies de camélidos, según las condiciones climáticas y época del año. Los guanacos son menos específicos que las vicuñas en cuanto a elección de ambiente; por lo tanto, además de los denominados llanos, también ocupan lugares quebrados y rocosos, constituyendo de esta manera una importante presa del puma en años que podrían llamarse normales. Por el contrario, cuando la totalidad Capítulo 12: El Puma 178 de los llanos se cubre de nieve por varios días como consecuencia de fuertes y continuos temporales, las vicuñas se ven obligadas a trasladarse también a áreas más protegidas (como por ejemplo, quebradas y laderas rocosas a niveles altitudinales más bajos), aumentando así su vulnerabilidad hacia este predador. Wilson (1984) refiriéndose a Torres del Paine, Chile, dice que el tipo de ambiente juega un papel destacado en la capacidad del puma para cazar guanacos, además, señala que en las épocas invernales los movimientos en el guanaco llevan a aumentar su vulnerabilidad frente a los pumas. En San Guillermo los despojos de camélidos predados por el puma fueron encontrados en los siguientes ambientes: 13 (33 %) en vegas; 19 (48 %) en quebradas; 2 (5 %) en laderas rocosas y 6 (15 %) en los llanos. Calculando la frecuencia esperada sobre la base de encontrar los camélidos distribuidos de manera igual en los cuatro ambientes (suposición moderada, puesto que en la realidad ambas especies prefieren los llanos, ver Capítulo 10), se determinó (X2 = 14,4; gl: 3; P<0,05), preferencia de los pumas por las quebradas y vegas para capturar a sus presas, sugiriendo que la conducta de refugio y búsqueda de agua de sus presas aumenta su vulnerabilidad a la depredación por pumas. Tabla 1 Causales de mortandad en vicuña y guanaco Período Causa de mortandad Vicuña Guanaco Total 1978-83 puma 2 20 22 congelamiento - - - desconocida 19 36 55 1984 puma 16 2 18 congelamiento 87 15 102 desconocida 45 16 61 Capítulo 12: El Puma 179 Tabla 2 Porcentaje de ítems presa en la dieta comparada del puma para Pozuelos (n=37; Capítulo 13) y San Guillermo (n=10) y oferta en términos de biomasa y presencia. Claramente se puede apreciar una dieta oportunista con preferencia por las presas de tamaño grande. Pozuelos (δ=0,002 ind./km2) ítems (%) San Guillermo (δ=0,002 ind./km2) Biomasa ítems (%) Biomasa (kg./km2) (kg./km2) Ganado doméstico (1) 46 1349 - - Vicuña 8 40 30 102 Guanaco - - 40 156 Roedores 8 +(=) 9 +(=) Vizcacha 14 +(=) 8 +(=) Liebre europea 6 +(>) - +(<) Reptiles 2 +(=) - +(=) Insectos 2 +(=) 1 +(=) Aves y huevos 3 +(>) 1 +(<) Felinos 1 + - - Miscelánea 10 11 Ref.: (1): bovinos (4 %), caprinos (4 %), equinos (7 %), ovinos (18 %), llamas (10 %); +: presencia de presas; (=): se supone oferta similar; (>): oferta superior; (<): oferta inferior; -: ausencia de la presa. Capítulo 12: El Puma 180 Fig. 1 - Reserva San Guillermo: Ubicación de los signos de actividad del puma en relación con la densidad de camélidos Capítulo 12: El Puma 181 CAPITULO 13 LA COMUNIDAD DE CARNIVOROS EN LA RESERVA DE BIOSFERA LAGUNA DE POZUELOS Pedro G. Perovic 1 Introducción Los carnívoros se destacan por su rol en controlar las poblaciones de las especies presa (Schaller, 1967; Smuts, 1978) dentro de las cuales se incluyen aquellas consideradas como “perjudiciales” para las actividades agropecuarias. También inciden sobre el comportamiento de las presas (Rice, 1986; Schaller, 1972) y posiblemente en la dispersión de semillas (Herrera, 1989) Las diferencias en factores tales como alimentación, tiempo y espacio suelen utilizarse para describir la estructura de la comunidad (Schoener, 1974; Jacksic et al., 1980; Sunquist et al., 1989). Estudios realizados en cinco especies de carnívoros que viven en simpatría en Venezuela, señalan que la separación ecológica está relacionada con la diferencia en la dieta. A su vez, el grado de superposición de la dieta está principalmente relacionado con la oferta de presas (Sunquist et al., 1989). 1 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina Capítulo 13: Comunidad de carnívoros 182 Según Seidensticker (1976) y Wilson (1975), la abundancia y la disponibilidad de diferentes tamaños de presas, es de gran importancia para la estabilidad y la complejidad de la comunidad de carnívoros. Asimismo, la configuración del ambiente tiene influencia sobre la abundancia relativa y el comportamiento de los carnívoros (Rabinowitz y Walker, 1990). En la Reserva de Biosfera Laguna de Pozuelos se encuentran las siguientes especies de mamíferos carnívoros: Pseudalopex culpaeus (zorro colorado); Pseudalopex griseus (zorro gris); Galictis cuja (hurón); Conepatus chinga (zorrino común o andino); Oncifelis geoffroyi salinarum (gato); Oncifelis colocolo (gato del pajonal); Oreailurus jacobita (gato andino); Puma concolor (puma). El objetivo del presente Capítulo es presentar los estudios realizados sobre la comunidad de éstos carnívoros, su dieta y densidades dentro de la Reserva de Biosfera Laguna de Pozuelos. Métodos Entre los años 1992 a 1995 se realizaron en la Cuenca de Pozuelos, estudios de campo en carnívoros. Los mismos cubrieron una superficie de 1.100 km2 correspondientes a la parte oeste y sur de la Reserva. Dentro del área de estudio se consideraron tres pisos altitudinales: a) zona baja (3600-3900 msnm) con actividad antrópica relativamente alta (ganadería, pasturas implantadas y presencia de asentamientos humanos); b) zona intermedia (3900-4000 msnm), con actividad antrópica suave (ganadería, presencia de asentamientos humanos); c) zona alta (4200-4600 msnm) con actividad antrópica relativamente baja (ganadería estacional). La longitud de separación entre los diferentes pisos altitudinales fue de aproximadamente 35 a 40 km (Fig. 1). Para la determinación de la actividad diaria, densidad y composición del ensamble, se definieron transectas donde se ubicaron estaciones odoríferas según Novaro y Funes (1991), completándose ésta actividad con tareas de recorrido y avistaje. Para la determinación de la dieta se procedió al análisis de fecas según Corbett (1989) y Reynolds y Aebischer (1991). Resultados Capítulo 13: Comunidad de carnívoros 183 Actividad diaria Zorros: De acuerdo con lo observado, P. culpaeus tiene principalmente actividad diurna y crepuscular mientras que P. griseus tiene actividad durante la noche. Gatos: O. jacobita mostró actividad diurna (n = 5), nunca fue observado durante la noche. Los otros gatos solamente fueron observados al crepúsculo. Zorrinos: Son esencialmente crepusculares y nocturnos. Su actividad parece tener un pico a la media noche (23,00 hs). Hurones: Son diurnos, con un posible máximo de actividad a la mañana y después del mediodía, a las horas de mayor insolación. Puma: Desarrolla sus actividades principalmente desde el atardecer hasta media mañana. Es frecuente observarlo durante el día, principalmente durante la estación seca (marzo-octubre). Si bien se ha mencionado a la separación temporal como un condicionamiento para la convivencia de distintas especies de carnívoros, en la Puna parece haber una tendencia a aprovechar las horas del día. Esto podría estar relacionado con las condiciones climáticas de la región (Capítulo 1). Densidades y ensamble La composición del ensamble de carnívoros varía con la altitud y las actividades antrópicas (uso de la tierra). Las dos especies de zorros mostraron diferencias en sus densidades respecto a la altitud. En las zonas altas (4.000 msnm) el zorro colorado presenta sus mayores abundancias, mientras que el zorro gris disminuye en abundancia con la altura, no siendo registrado a los 4.500 msnm. Tomando ambas especies en su conjunto se obtuvo una densidad media de 0,12 ind./km2 para la totalidad del área de estudio, esta cifra es inferior a la señalada por otros autores para el zorro colorado; en ambientes similares y con presencia de caza: 0,15 ind./km2 (Novaro y Funes, 1990), y 0,72 ind./km2 (Crespo y De Carlo, 1963). El puma está ausente en aquellas zonas bajas con actividad antrópica relativamente alta. Su densidad aumenta a partir de las zonas Capítulo 13: Comunidad de carnívoros 184 intermedias hacia las altas. Se encontró una densidad media de 0,002 ind./km2 para el área de estudio, cifra similar a la encontrada en San Guillermo (Capítulo 15). Con respecto a los gatos, O. colocolo y O. jacobita son más abundantes en las zonas altas respecto a las bajas, mientras que O. geoffroyi se la encuentra en las zonas bajas, estando ausente en las zonas altas. No se obtuvieron datos suficientes para calcular la densidad de éstos gatos. Los hurones y zorrinos se encuentran tanto en las zonas bajas como intermedias, siendo su presencia ocasional en las zonas altas. Las actividades humanas no parecen tener un impacto negativo en éstos grupos. En la zona de altitud intermedia, se encuentran presentes todas las especies de carnívoros mencionadas, no descartándose que la ausencia de algunas de las especies en las zonas bajas ( ej. Puma) se deba a un desplazamiento como consecuencia de la mayor acción antrópica (Fig. 2). Dieta Los principales componentes de la dieta de los zorros fueron los roedores (35 %), liebres (23 %) y crías de animales domésticos, ovejas (19 %) y llamas (1 %) (Perovic y Tecchi, en prep.). Al ser los zorros predadores oportunistas, la dieta reflejaría las variaciones locales en cuanto a disponibilidad de presas. El puma aprovecha una gran variedad de presas, desde pequeños roedores (8 %), vizcachas (14 %), vicuñas (8 %), hasta ovejas (18 %) y llamas (10 %). En la Cuenca de Pozuelos, los animales domésticos conforman el 46 % de la dieta del puma. En los gatos (sin poderse discriminar feca por especie), se encontró que el principal componente de la dieta está conformada por pequeños roedores (45 %) y vizcachas (24 %) (Tabla 1) Con respecto a los otros carnívoros (hurones y zorrinos) solo se contó con información proveniente de aquellos avistajes, donde fueron observados alimentándose de animales muertos (llamas y vicuñas), huevos de aves o capturando presas (ctenómidos, pequeños roedores, reptiles e insectos). Capítulo 13: Comunidad de carnívoros 185 Conclusión Históricamente los mamíferos carnívoros han sido perseguidos porque las actividades pecuarias los han considerado y consideran como predadores del ganado doméstico y aves de corral. También tuvieron una importante presión de caza debido a la demanda de pieles. Con el avance de las actividades humanas hay una disminución de muchas especies silvestres de las cuales se alimentaban los carnívoros. Esta disminución de especies silvestres presa y el aumento del ganado, llevó a que los carnívoros se volcaran a las nuevas presas más fáciles y abundantes de obtener. Los carnívoros grandes como por ejemplo el puma tienen un efecto, aún a bajas densidades, relativamente importante sobre el ganado doméstico. Así lo manifiestan los pobladores rurales y así lo indican sus dietas. Sin embargo, estos pueden afectar positivamente a sus presas si depredan sobre otros predadores que también se alimentan de estas presas (Palomares et al., 1995). Si bien, la mayoría de las actividades humanas causan un efecto negativo sobre los carnívoros, su impacto es variable según la especie (Bisbal, 1993). En algunas zonas y bajo ciertas pautas de manejo, las actividades humanas no son necesariamente incompatibles, con la conservación de mamíferos carnívoros (Yalden, 1993). Los carnívoros al tener un amplio territorio de acción, con algunas especies muy especializados e incidir sobre la abundancia y comportamiento de las poblaciones presa, ofrecen un buen motivo para conservarlos y estudiarlos (Rabinowitz y Walker, 1990) y para entender el funcionamiento y estructura de este importante grupo. Las Reservas de Biosfera serían un sitio óptimo de control y experimentación, en especial para el grupo de los mamíferos carnívoros, ya que en ellas se prevé tanto el desarrollo como la conservación. Tabla 1 Número de veces que aparece una presa determinada en las distin- Capítulo 13: Comunidad de carnívoros 186 tas muestras de fecas de zorros sin diferenciar (P. culpaeus, P. griseus); de gatos sin diferenciar (O. jacobita, O. geoffroyi, O. colocolo), y puma (P. concolor). Presa/Predador N° de muestras Zorros Puma 17 37 Llamas 1 4 Ovinos 9 7 Caprinos 2 Equinos 3 Vicuña 4 Ctenómidos 46 Gatos 2 1 Roedores 10 5 3 Vizcacha 6 4 5 10 3 3 Félidos 1 Aves 9 7 2 Huevos 5 3 3 Reptiles 4 1° 1 Insectos 5 2 1 Frutos y vegetales 8 4 1 Misceláneas 1 3 4 Liebre (1) Ref.: (1) = las aves presas determinadas fueron ñandúes (Pterocnemia), keu (Tinamotis), flamencos (Phoenicopteridos), y gallaretas (Fulica). Capítulo 13: Comunidad de carnívoros 187 Fig. 1 - Reserva de Biosfera Laguna de Pozuelos. Los distintos sombreados, de oeste a este, indican la zona baja, intermedia y alta (ver Texto). Capítulo 13: Comunidad de carnívoros 188 Fig. 2 - Uso de la tierra, altitud y frecuencia de presencia de carnívoros. Zorro colorado Capítulo 13: Comunidad de carnívoros 189 CAPITULO 14 CAMELIDOS SILVESTRES Y MORTALIDAD POR TORMENTAS DE NIEVE EN LA CORDILLERA FRONTAL DE LA PROVINCIA DE SAN JUAN Jorge Luis Cajal 1 Ricardo Ojeda 2 Introducción Entre las causas de mortandad de los camélidos silvestres sudamericanos se han mencionado enfermedades, falta de alimento, predación por zorros, pumas, cóndores, perros, rayos, nieve, accidentes y causas desconocidas (Pearson, 1951; Koford, 1957; Raedeke, 1978; Franklin, 1982; Hofmann et al., 1983; Yañez et al., 1986; Cajal y López, 1987). Sin embargo, el efecto de eventos climáticos impredecibles sobre sus poblaciones ha sido poco analizado. Estos fenómenos, cuyo efecto está asociado a parámetros tales como tamaño poblacional, tamaño de área, tipo de ecosistema y otros, adquieren especial significancia en la conservación biológica (Schaffer, 1981; Soulé, 1983;). 1 FUCEMA, Pringles 10, (1183), Buenos Aires, Argentina. 2 Unidad Zool. & Ecol. Animal, IADIZA, C.C. 507, (5500) Mendoza, Argentina. Capítulo 14: Catástrofes naturales 190 La Puna americana y la Cordillera Frontal argentina (> 3.000 msnm), presenta marcada estacionalidad, bajo régimen de precipitaciones (Cabrera, 1958; 1968; Capítulo 1) y reducida productividad (aproximadamente entre 280 - 370 kg de materia seca/ha/año) (Hofmann et al., 1983; Cajal, 1991). A esto se agregan fenómenos climáticos como tormentas de nieve y sequías, que actúan como factores de presión, afectando la estructura y organización social de las poblaciones. Durante el año 1973 se registraron intensas nevadas en la región cordillerana del centro oeste de Argentina. En esa oportunidad se encontraron congregaciones de hasta 200 guanacos muertos, en ambientes de quebradas, posiblemente como consecuencia de haber quedado bloqueados por la nieve (Sánchez Eleodoro, com. pers.). En este capítulo se discuten las excepcionales nevadas de julio de 1984 en la región cordillerana argentina, y sus efectos sobre las poblaciones de vicuña (Vicugna vicugna) y guanaco (Lama guanicoe). Métodos Durante el mes de julio de 1984 se realizaron dos censos aéreos (avión CESSNA IV - IM2206), uno durante el temporal (17 de julio) y otro inmediatamente después de ocurrido (26 de julio). Un área de aproximadamente 2.800 km2 de la reserva San Guillermo, subdividida en siete sectores, fue cubierta (Fig. 1). Los censos tuvieron el objetivo de contar y ubicar a los animales como así también determinar la distribución y porcentaje de cobertura de nieve caída. Se utilizó el método de censo total por parcelas (sectores). En base a la información brindada por estos vuelos, se precisaron los sitios donde serían arrojados fardos de forraje a nivel experimental, como manera preventiva de disminuir la mortandad por falta de alimento. De esta manera se suministraron 8.000 kg de forraje (alfalfa) por aire utilizando un avión Focker, y 34.000 kg por vía terrestre. La misma superficie cubierta por el avión fue simultáneamente recorrida por tierra con el objetivo de detectar los animales muertos. En cada caso se registró la siguiente información: fecha, ubicación, edad (cría o adulto), sexo, grado de nutrición, y causa de muerte. El grado de nutrición fue estimado mediante índices a partir de la textura y color de la grasa de la médula ósea del fémur (Kirkpatrick, 1980; Cajal y López, 1987; Capítulo 12). Capítulo 14: Catástrofes naturales 191 En diciembre de 1984 se realizó un censo de camélidos en todos los sectores de la reserva que contaban con información previa de número y distribución, a fin de analizar los cambios ocurridos como consecuencia del temporal. La metodología para contar los camélidos fue el censo completo por sectores (Hofmann et al., 1983; Cajal, 1991). El mismo implicó un recuento total en cada sector por parte de dos grupos de guardafaunas en mula. Estos grupos recorrían los límites entre sectores de manera simultánea a fin de eliminar el doble conteo por movimientos de los animales a la presencia humana. Las pruebas de X2 y G fueron empleadas para determinar mortandad diferencial por sexo, edad o habitat. Para establecer la frecuencia esperada, se consideraron los promedios de las relaciones de sexo y edad (cría/adulto) medidas en el campo durante seis años (1978 - 1983). Resultados Se encontraron 181 camélidos muertos en el campo: 148 vicuñas (82 %) y 33 guanacos (18 %) (Tabla 1). Se pudo sexar el 30 % de los cadáveres de vicuña (44), de los cuales 32 eran machos y 12 hembras. Considerando como hipótesis nula la relación de sexo promedio observada en el campo en seis años previos (macho/hembra = 1,44; DE = 0,29), Tabla 3), no se encontraron diferencias significativas de mortandad por sexo (X2 = 3,38; gl: 1; P>0,05). Considerando las vicuñas, el temporal afectó significativamente más a los juveniles (54) que a los adultos (31) (X2 = 71,08; gl: 1; P<0,001), tomando como hipótesis nula la relación promedio juvenil/adulto registrada en los seis años previos (0,24; DE = 0,04; Tabla 2). Estos análisis no se realizaron en guanacos por falta de número suficiente de muestras respecto a ésta especie. Los ambientes fueron discriminados en quebradas, llanos y vegas. La distribución de los animales encontrados muertos en éstos tres ambientes resultó independiente de las especies (G = 0,20; gl: 2; P>0,50). Considerando la totalidad de los cadáveres de vicuña y guanaco (99 en quebradas, 38 en llanos y 44 en vegas), la vulnerabilidad de estos animales fue significativamente mayor en ambientes quebrados (X2 = 37,50; gl: 2; P<0,001). La frecuencia esperada se calculó sobre la base de encontrar los camélidos distribuidos de manera uniforme en los tres ambientes, suposición moderada puesto que ambas especies prefieren los llanos (Cajal, 1989; Capítulo 10). Capítulo 14: Catástrofes naturales 192 Se determinó el grado de nutrición en 51 cadáveres. El 40 % mostró un grado de nutrición normal (categoría 3 de la escala de color y textura de la médula ósea), el 27 % un grado intermedio (categoría 1 -2), y el 33 % mal nutridos (categoría 0) (Cajal y López, 1987; Capítulo 12). En todos los casos los rúmenes estaban completos y en varios se pudo apreciar la presencia de plantas poco palatables, como Senecio sp, en el interior de la boca. Los resultados obtenidos en los censos terrestres y aéreos se indican en la Tabla 3. El suministro de forraje coincidió con la retirada gradual de la nieve. La vicuña mostró preferencia por los fardos desarmados y esparcidos, mientras que los guanacos comieron indistintamente fardos desarmados como enteros. En los sectores donde la nieve se había retirado totalmente, las pasturas naturales fueron preferidas al forraje suministrado artificialmente. Discusión Los efectos de los temporales de nieve u otros eventos impredecibles sobre las poblaciones de grandes herbívoros representan un factor de mortandad natural con implicancias sobre la estructura social y poblacional de las mismas. Distintas adaptaciones tales como el espesor del pelo que actúa como aislante, reducción de la tasa metabólica, cambios en el comportamiento, catabolismo de la grasa corporal, no suelen ser suficientes garantías de sobrevivencia, principalmente cuando los temporales son prolongados (Mautz, 1980). No se encontró diferencias significativas de mortandad por sexo en vicuñas. Considerando los ungulados de América del Norte, se ha registrado una mayor mortandad de machos durante inviernos rigurosos en el alce (Alces alces) (Lent, 1974) y en el pronghorn (Antilocapra americana) (Martinka, 1967). Estos autores mencionan como causa, la reducción de las reservas energéticas en los machos como consecuencia de la “brama”. El efecto de los temporales de nieve también ha sido analizado en relación a la mortandad de caballos salvajes (Equus caballus) en el desierto de la Gran Cuenca de América del Norte (Berger, 1983). Estos caballos con una estructura social similar a la de los camélidos silvestres sudamericanos presentaron un patrón en las congregaciones de animales muertos que no coincidía con la estructura social real. En San Guillermo, se encontró Capítulo 14: Catástrofes naturales 193 que los camélidos muertos por congelamiento presentaban una proporción significativamente alta de vicuñas y de juveniles, no coincidiendo con los conocimientos previos que se tenía del número poblacional de vicuñas y guanacos y de la estructura grupal de ambas especies. Las nevadas afectaron en mayor medida a las vicuñas que a los guanacos. Asimismo, a diferencia de años anteriores (Cajal y López, 1987; Capítulo 12), la predación por parte de pumas fue superior sobre vicuñas que sobre guanacos (Tabla 1). Esto se debió a que, durante el comienzo del período invernal, los guanacos dada su mayor plasticidad por habitat y migraciones locales, se desplazan normalmente hacia lugares más bajos y protegidos dentro de la misma reserva (Cajal, 1989), de ahí su menor vulnerabilidad en comparación con las vicuñas. Si bien en oportunidad de estas intensas nevadas las vicuñas también realizaron movimientos de desplazamiento hacia lugares más protegidos, lo hicieron con retardo. Las nevadas de 1984 en la reserva San Guillermo y su relación con la mortandad directa e indirecta de 181 camélidos silvestres deben ser analizadas en relación a los atributos ecológicos de las especies. Mientras el guanaco tiene una distribución geográfica amplia (en varios habitats: puna, prepuna, patagonia, bosque chaqueño), territorio temporario y migraciones locales estacionales, la vicuña ocupa una menor superficie de distribución (restringida al habitat de puna), con territorialidad permanente y movimientos locales reducidos (Franklin, 1982). Durante julio de 1984 se encontró en el campo el doble de cadáveres de camélidos con respecto a lo encontrado para la misma área en seis años anteriores (Cajal y López, 1987). Esto demostraría los efectos directos e indirectos de un temporal de nieve excepcional. En relación a la población previamente censada en el área, la mortandad representó un 4,5 % de la población local de vicuñas y un 1,0 % de guanacos. En los censos realizados durante ese mismo año después de la nevada (diciembre de 1984), se observó un leve descenso en el número de animales (Cajal, 1991) (Tabla 3), lo cual reflejaría las consecuencias residuales del temporal. Poco es lo que sabemos sobre los efectos de las nevadas en el tiempo, en cuanto a recursos forrajeros disponibles, cambios en la composición social, efecto en la preñez, nacimientos y demografía en general. Diferentes estudios recientes hacen referencia al cambio climático global (Peters y Darling, 1985; Murphy y Weiss, 1992). Estos cambios Capítulo 14: Catástrofes naturales 194 climáticos amenazan seriamente la supervivencia de las especies cuya distribución se encuentra restringida tanto a “habitats insulares” como a reservas biológicas, como por ejemplo, en el caso de muchos mamíferos del hemisferio boreal que habitan picos montañosos (Mc Donald y Brown, 1992). Por lo tanto, resulta indudable que los eventos climáticos de carácter catastrófico deberían ser considerados dentro de los planes de manejo de las especies silvestres, entre ellas, de los camélidos silvestres. Tabla 1 Mortandad en camélidos silvestres durante las tormentas de nieve de julio de 1984 en la reserva San Guillermo. Puma Vicuña Desconocidas Total 16 87 45 148 2 15 16 33 18 102 61 181 Guanaco Total Congelamiento Tabla 2 Composición de sexo y edad de la población de vicuñas en el área núcleo de la reserva San Guillermo. Año Tamaño de la muestra Macho/Hembra Juvenil/Adulto 1978 1529 1,31 1979 2021 1,49 0,26 0,25 1980 3456 1,42 0,21 1981 788 1,36 0,25 1982 4143 1,09 0.29 1983 2214 1,96 0,19 x=1,44 x=0,24 DE=0,29 DE=0,04 Capítulo 14: Catástrofes naturales Tabla 3 Censos aéreos y terrestres en diferentes sectores de San Guillermo. Censo Aéreo 1° Vuelo, 17/julio/84 (3600-3800m/ 160 nudos) Sector y altura en msnm Cobertura Vicuña Guanaco nieve (%) Censo Terrestre 2° Vuelo, 26/julio/84 (3600-3800m/ 130 nudos) Cobertura Vicuña nieve (%) Diciembre 1983 Guanaco Diciembre 1984 Vicuña Guanaco Vicuña Guanaco 50 0 1 20 0 7 10 228 0 0 B(3150)* 85 45 118 20 31 95 0 71 0 688 C(3450)* 95 37 35 30 91 18 229 844 360 630 D(3500) 95 13 40 30 119 16 884 501 1164 372 E(3700) 80 120 8 30 138 0 1533 286 847 340 F(3300)* 50 170 17 20 154 69 701 1208 719 751 G(3100) 0 610 985 0 295 710 2 336 227 48 Totales 455 995 1204 828 915 3359 3474 3317 2829 195 Capítulo 14: Catástrofes naturales A(3200)* Ref.: A=El Fierro; B=Los Hoyos; C=Caserón y La Aspera; D=Rincón del Río y Los Leones; E=Infiernillo; F=Batidero; G=Potrerillo. * = Sitios donde se suministró alimento artificialmente. 196 Fig. 1 - Ubicación de San Guillermo en la Cordillera Frontal de la Provincia de San Juan. Sobre imagen LANDSAT del 17 de agosto de 1981, durante una temporada invernal con nevadas “normales”. A-G: Sectores donde fueron realizados los censos aéreos y terrestres. A = El Fierro, B = Los Hoyos, C = Caserón y La Aspera, D = Rincón del Río y Los Leones, E = Infiernillo, F = Batidero, G = Potrerillos. Capítulo 14: Catástrofes naturales 197 CAPITULO 15 DENSIDAD, BIOMASA Y DIVERSIDAD DE MAMIFEROS EN LA PUNA Y CORDILLERA FRONTAL Jorge Luis Cajal 1 Stella Maris Bonaventura 2 Introducción La densidad, biomasa y diversidad, permiten ver la incidencia de las diferentes especies dentro del ecosistema. En el caso particular de la biomasa, su medición resulta apropiada para determinar la dominancia relativa de las especies dentro de la comunidad y también, como indicadora de la capacidad de carga (Eisenberg y Thorington, 1973; Eisenberg et al, 1979). Dichos parámetros, además juegan un rol destacado como indicadores para el seguimiento de la biodiversidad a nivel de composición, estructura y función de dos niveles de organización: poblaciones y comunidades (Noss, 1990). El valor del seguimiento tiene importancia por la biodiversidad per se y para la medición del cambio ambiental a fin de tomar aquellas medidas preventivas y correctivas en función de la conservación. El objetivo del presente capítulo es presentar y analizar el inventario, 1 FUCEMA, Pringles 10, (1183), Buenos Aires, Argentina. 2 Depto. Cs. Biológica, FCEN-UBA, 4º piso, Pab. II, Ciudad Universitaria, (1428) Buenos Aires, Argentina. Capítulo 15: Diversidad de mamíferos 198 densidad, biomasa y diversidad de mamíferos presentes en las Reservas de Biosfera y otras áreas provinciales protegidas de la Puna y Cordillera Frontal, a fin de mostrar un cuadro de situación analizar los patrones de distribución entre las dos unidades morfoestructurales y establecer las bases para una posible utilización de los mamíferos como especies indicadoras para su seguimiento, en el marco de las necesidades para la estrategia de conservación en la región. Métodos A los efectos del análisis, se dividieron los mamíferos en función del peso en tres categorías: micromamíferos (< 100 gr); medianos (100 gr - 1000 gr); y macromamíferos (> 1000 gr). Entre 1978 y 1992 se muestreo la fauna de mamíferos pequeños (micromamíferos) y medianos mediante grillas de captura viva (con trampas Sherman) en la Laguna de Pozuelos (1.470 trampas-noches) , San Guillermo (552 trampas-noches), Laguna Brava (270 trampas-noches) y Laguna Blanca (150 trampas-noche). En la Laguna de Pozuelos se muestrearon los siguientes ambientes: a) pastizales de Stipa ichu (Ichu); b) arbustales de Fabiana densa y Baccharis boliviensis; c) arbustales de Parastrephia lepidophylla (tolares); d) arbustales de Baccharis incarum; e) bosques abiertos de Polylepis tomentella; f) pastizales de Festuca crysophylla; g) yaretales de Azorella sp. (yareta). Además de los habitats mencionados se realizaron muestreos en ambientes con alta perturbación antrópica como laderas con F. densa y B. boliviensis, degradadas por sobrepastoreo de ganado doméstico (ovejas, caprinos, llamas) y pasturas de pasto llorón (Eragrostis curvula), implantadas sobre tolares de P. lepidophylla. En San Guillermo los ambientes muestreados fueron: a) llanos con pastizales de Stipa frigida, Stipa cfr. speciosa y Adesmia nanolignea; b) laderas rocosas con arbustales de Lycium chilense y Adesmia nanolignea; c) laderas no rocosas con arbustales de Lycium cfr. fuscum, Fabiana denudata, Adesmia horrida; d) vegas dominadas por Festuca crysophylla y Juncus balticus (Cajal, 1989). En el inventario, se consideraron las especies registradas en los regurgitados de Bubo virginianus, Ahene cunicularia, y Asio flameus (Pardiñas com.per.), en las observaciones y capturas manuales. La densidad, biomasa y diversidad de micromamíferos fueron calculados para los diferentes habitats presentes en la Laguna de Pozuelos Capítulo 15: Diversidad de mamíferos 199 y San Guillermo, tomando ambas localidades como representativas de la Puna y Cordillera Frontal respectivamente. La densidad (ind./ha) se estimó como contaje directo de los animales capturados, la biomasa (gr/ha) fue calculada en base a los pesos corporales de los individuos capturados multiplicado por la densidad y la diversidad de especies se calculó mediante el índice de Shannon-Weaver3; D = - ∑ p i . log p i, donde p i es la proporción de la biomasa promedio de la especie i en relación a la biomasa promedio total. Entre 1980 y 1982 se completó el registro de mamíferos medianos muestreando las cuevas activas de ctenómidos (en las Reservas de San Guillermo, Laguna Brava y Laguna Blanca), cubriendo los llanos, vegas, laderas rocosas y no rocosas. Se capturaron ejemplares para su determinación sistemática mediante trampas de captura tipo cepo. Entre 1978 y 1993 se realizaron censos directos de macromamíferos (Cajal y López, 1987; Cajal, 1989 y 1991; Capítulos 10 , 11 y 12). La densidad (ind./km2) se estimó a partir del número de animales contabilizados por unidad de superficie. Para el calculo de la biomasa (kg/km2), en el caso de los camélidos silvestres, se discriminó entre animales adultos y crías (< 6 meses de edad), tomándose la relación cría/adulto = 0,24 (Cajal y Ojeda, 1994; Capítulo 14). Para el resto de las especies la biomasa se calculó a partir de mediciones de peso, propias y de la bibliografía (Pearson, 1951; Redford y Eisenberg, 1989). La comparación de la fauna de mamíferos (ausencia/presencia) entre las distintas localidades consideradas, se realizó utilizando el índice de similitud de Jaccard. Resultados y Discusión 3 Se ha alertado sobre las diferentes interpretaciones que se le da a los índices de diversidad, lo que ha llevado a que la diversidad de especies sea en muchos casos, un concepto vacío de contenido (Hurlbert, 1971; Noss, 1990). En el presente trabajo hemos utilizado el índice de Shannon, dentro de los varios existentes derivados de la teoría de la información, porque lo hemos considerado útil para los fines comparativos, ya que el índice mencionado es de uso común en los estudios sobre el tema. Capítulo 15: Diversidad de mamíferos 200 Inventario de especies En las tres Reservas de la Biosfera y en la provincial de Laguna Brava se registraron 30 especies (29 nativas y una introducida) correspondientes a 13 familias (Tabla 1). En dicha Tabla figuran además de las especies cuya presencia fue confirmada mediante muestreos, aquellas especies citadas por la bibliografía (Redford y Eisenberg 1992; Olrog 1976). El porcentaje de especies nativas registradas (29) en relación a la totalidad de las citadas (33) resultó porcentualmente elevada (88 %). En base a lo registrado, la fauna de mamíferos de la Puna y Cordillera Frontal representa el 8 % de la fauna total de mamíferos de la República Argentina. El número de especies y familias fue mayor en la Puna que en la Cordillera Frontal. Esta disminución estuvo parcialmente asociada, dentro de las unidades morfoestructurales, con el aumento de la latitud debido a la existencia de otros factores ambientales como la altitud y condiciones climáticas que limitarían la oferta de alimento y refugio dando como resultado una marcada disminución en la riqueza de especies a latitudes intermedias (28 S) (Fig. 1). El 34 % de las especies registradas está constituida por micromamíferos (< 100 gr; muridos y marsupiales), el 28 % por medianos (100 - 1000 gr; cavidos, abrocomidos, octodontidos, chinchíllidos = Ch. brevicaudata, ctenomidos y dasipodidos) y el 38 % por macromamíferos (> 1000 gr; chinchíllidos = L. viscasia, félidos, cánidos, mustélidos y camélidos). Solamente tres especies (10%) superan los 10 kg de peso. Cuando se efectúan los inventarios de especies, y se los compara con listados bibliográficos de trabajos sistemáticos, surge la pregunta sobre que porcentaje de las especies realmente presentes están incluidas en dichos inventarios, y que porcentaje falta aún por determinar. Es sabido que por diversas causas, (sistema y esfuerzo de trampeo y otros imponderables), no todas las especies realmente presentes pueden ser registradas. Determinar el porcentaje de especies no descriptas en relación a las registradas resulta difícil de medir debido a la carga de subjetividad que el planteo encierra, no obstante, para el presente caso de estudio, el universo registrado está muy próximo al universo de lo posible, dado el importante esfuerzo de captura y detección realizado (ver Apéndice y BOX 1, en presente Capítulo). Capítulo 15: Diversidad de mamíferos 201 Vuilleumier y Simberloff (1980), dicen que no siempre uno puede establecer inequívocamente, que una especie está ausente de un lugar dado porque su habitat está ausente, del mismo modo, la presencia del habitat preferido por una determinada especie no quiere decir que la misma se encuentre (ej.: posiblemente A. andinus en Laguna de Pozuelos). De la Tabla 1 se desprenden los siguientes patrones de distribución entre la Puna y Cordillera Frontal: Seis especies (21 %) y seis géneros (25 %) resultaron comunes en las cuatro localidades estudiadas. Estas especies son: Phyllotis darwini, Eligmodontia puerulus, Lagidium viscasia, Puma concolor, Pseudalopex culpaeus y Vicugna vicugna. Considerando los micromamíferos, los marsupiales faltan en la Cordillera Frontal mientras que los múridos están representados en ambas unidades con un recambio de especies. Considerando los mamíferos medianos, los abrocómidos, chinchíllidos (Ch. brevicaudata, ver Apéndice) y ctenómidos son comunes a ambas unidades, mientras que en la Cordillera Frontal faltan grupos enteros como los octondontidos, cavidos y dasipodidos. Es decir que en ésta última unidad morfoestructural faltan aquellos mamíferos medianos de macronicho terrestre que son más dependientes de la biomasa vegetal aérea y de la presencia de refugios en relación con los macronichos saxátil (chinchíllidos, abrocomidos) y cavador (ctenomidos). Considerando los macromamíferos, faltan en la Cordillera Frontal los gatos (tres especies) y en gran medida los mustélidos (dos especies, la presencia de Galictis cuja en San Guillermo es ocasional). Son comunes a ambas unidades además de L. viscasia, los cánidos de hábitos no estrictamente carnívoros (son también omnívoros y carroñeros, principalmente el zorro gris), los grandes herbívoros (vicuña y guanaco) y los grandes carnívoros (puma) cuyo componente principal de sus dietas está basado en los anteriores inmediatos (Capítulo 12). Ahora bien, la vicuña y el guanaco tienen patrones de distribución diferente; mientras que en la Cordillera Frontal ambas especies coexisten en densidades similares, en la Puna sensu strictus falta el guanaco (su presencia es marginal). Esta diferencia en el patrón se debería a diferentes centros de origen y rutas de dispersión (Cajal, 1991). De acuerdo con el índice de similitud de Jaccard y considerando Capítulo 15: Diversidad de mamíferos 202 exclusivamente los micromamíferos, Laguna de Pozuelos aparece como una localidad diferente a las demás, mientras que teniendo en cuenta todos los mamíferos, San Guillermo y Laguna Brava presentan altos valores de similitud por tratarse posiblemente de Reservas contiguas (Tabla 2). La Reserva Laguna de Pozuelos presenta una gran complejidad ambiental dentro de la región, presenta importantes variaciones topográficas en cortas distancias, las precipitaciones pluviales son relativamente altas (350 mm/año) y tiene gran diversidad de comunidades vegetales en términos comparativos (Capítulo 3). No es casual que dentro de la Puna argentina sea una de las localidades con importantes asentamientos humanos, con apreciable ganadería (sobrepastoreo en algunos sitios) y con importante conversión de tierras (pasto llorón) (Capítulo 18) Distribución, densidad, biomasa y diversidad de micromamíferos en San Guillermo y Laguna de Pozuelos Los resultados presentados indican que las comunidades de roedores de Laguna de Pozuelos y San Guillermo muestran diferencias en la composición de especies (Tabla 3). Akodon andinus y A. boliviensis solo fueron capturadas en San Guillermo, en habitats de vegas (22 ind/ha) y rocosos (4.2 ind./ha), respectivamente. Akodon albiventer solo fue registrada en Laguna de Pozuelos cubriendo un amplio rango de habitats, con densidades que oscilan entre 1.4 y 8.2 ind./ha. Phyllotis darwini y C. lepidus fueron comunes a ambas Reservas; la primer especie ocupa preferentemente los habitats rocosos, con densidades que oscilan entre 2 y 33 ind./ha, mientras que la segunda especie ocupa los habitats no rocosos (llanos o con pendientes suaves) y cuyos valores de densidad oscilan entre 2 y 3.4 ind./ha. Eligmodontia puerulus fue capturada en San Guillermo en habitats rocosos con una densidad de 2.3 ind./ha, mientras que en Pozuelos su presencia fue registrada a partir de los regurgitados de lechuzas. En Pozuelos, la mayoría de los ambientes están habitados por dos o tres especies (exceptuando la yareta), presentado valores de diversidad que oscilan entre 0,81 y 1,25. En San Guillermo la mayor riqueza de especies se registró en las laderas rocosas; en los llanos no se registraron micromamíferos y solo una especie en la laderas arbustivas no rocosas. En las vegas se capturó una sola especie (A. andinus) y se detectó la presencia de otra, N. ebriosus. En la Puna peruana Pearson y Ralph (1978) encontraron valores Capítulo 15: Diversidad de mamíferos 203 de diversidad de micromamíferos no muy alejados a los encontrados en microhabitats similares de la Puna argentina: Yareta: índice de diversidad = 0,68 (2 especies); Tola: índice de diversidad = 1,50 (6 especies, incluyendo Ctenomys y Abrocoma); Ichu = índice de diversidad = 1,41 (5 especies) (comparar con Tabla 3). Comparando la diversidad de micromamíferos entre los diferentes habitats de la Puna (Pozuelos) respecto a la Cordillera Frontal (San Guillermo), un primer elemento que se desprende es la mayor diversidad que presenta la primera respecto a la segunda, debido a la presencia en Pozuelos de una mayor variedad de microhabitats con por lo menos dos especies. Entre los ambientes de Pozuelos y San Guillermo existe una diferencia apreciable en cobertura vegetal en favor de los primeros tal como se desprende de la Tabla 3. Los grandes llanos en San Guillermo, definidos dentro de la asociación ambiental del mismo nombre como los pequeños llanos definidos dentro de la asociación ambiental “sucesión de cordones montañosos” (Cajal et al 1981) ocupan el 25 % de la Reserva. A esto hay que agregarle las grandes alturas sobre el límite de la vegetación que ocupan el 30 % de la Reserva. Tanto en los primeros ambientes (< 5 % de cobertura vegetal) como los segundos la diversidad en micromamíferos es cero. Quedan las laderas no rocosas, incluidas en la asociación ambiental “sucesión de cordones montañosos” (11 %) con una especie de micromamífero y las laderas rocosas con micromamíferos (> 1) que ocupan menos del 10 % de la Reserva. Las vegas, ambientes de alta cobertura vegetal y con la presencia de dos micromamíferos, ocupan menos del 3 %, (en Laguna Brava las condiciones climáticas y de aridez son más extremas). Esto nos está diciendo que los ambientes con micromamíferos son poco representativos dentro de la matriz ambiental de la Cordillera Frontal. Lo mencionado podría explicar la ausencia de los gatos, de hábitos estrictamente carnívoros y cuyo componente principal de sus dietas está constituido por los roedores (Capítulo 13) y de los mustélidos de hábitos preponderantemente carnívoros4. Mares et al. (1985), basándose en Arnold (1972) afirman que la presencia y diversidad de los carnívoros dependen en gran medida de la diversidad de las presas. La cantidad de vegetación como así también el número disponible de refugios pueden influenciar la presencia de especies de micromamíferos o el número de individuos presentes, no obstante, resulta difícil constatar 4 Galictis cuja fue observado ocasionalmente en San Guillermo, en cuevas de Ctenomys fulvus alimentándose de ésta especie. Capítulo 15: Diversidad de mamíferos 204 si la respuesta es función directa de la vegetación o si por el contrario la combinación de factores climáticos y características no bióticas conjuntamente con la vegetación regulan las poblaciones a través de otros canales (Pearson y Ralph, 1978). Pearson y Ralph (1978) no encontraron correlación entre las variables ambientales (diversidad de especies vegetales) y el número de especies (o diversidad) de mamíferos, pero si, cierta correlación entre el número de especies de mamíferos y altitud. Meserve y Glantz (1978), en la costa norte de Chile, encontraron correlación entre el número de especies de mamíferos y algunas variables ambientales tales como precipitación y cobertura herbácea. Al respecto Vuilleumier (1980) plantea la necesidad para futuros estudios, de caracterizar con precisión los tipos de vegetación dentro y entre distintas localidades, en orden de poder cuantificar la vaga noción de “diversidad de habitat”. Ejemplos de perturbación antrópica Cuando los ambientes son perturbados ya sea por reemplazo de la vegetación natural por cultivos o por sobrepastoreo se observan cambios en la flora y fauna. Esta situación fue observada en dos ejemplos tomados en Laguna de Pozuelos. El reemplazo de los tolares de P. lepidophylla por pasto llorón dio como resultado una disminución en la diversidad vegetal y de artrópodos y un incremento de la densidad, biomasa y diversidad de roedores. En dichas pasturas, la densidad de A. albiventer y C. lepidus alcanzó valores de 16,63 y 20,41 ind./ha respectivamente. En el arbustal de F. densa y B. boliviensis sobrepastoreado se observó una comunidad de artrópodos y roedores empobrecida. Se capturó una sola especie de micromamífero: A. albiventer, la cual presentó una densidad y biomasa de 2,04 ind./ha y 44,0 gr/ha respectivamente (Tabla 4). En relación con las modalidades de conversión de habitats en la Puna, podemos hablar de un cambio abrupto en el caso del cultivo de pasto llorón y de un cambio gradual en el caso del sobrepastoreo. En el primer caso nos encontramos con una mayor disponibilidad de biomasa vegetal de gramíneas en relación con el ambiente natural original. El aumento de la disponibilidad de semillas por m2 podría explicar las mayores densidades de Calomys lepidus por tratarse de una especie granívora. En el pasto llorón se destaca la presencia de artrópodos caminadores, principalmente se destaca la dominancia de Collembola. La gran abundancia de A. albiventer podría explicarse en relación a la abundancia de este artrópodo. Capítulo 15: Diversidad de mamíferos 205 Al respecto, en las comunidades naturales la densidad de A. albiventer es mayor en aquellos sitios donde Coleóptera, Heteróptera, Collembola y Chilopoda son más abundantes (Capítulos 4 y 9). En el segundo caso (sobrepastoreo) se produce una disminución de la cobertura vegetal (disminución de refugios y alimento), con lo cual lleva a una marcada disminución de diversidad de micromamíferos (desaparecen P. darwini y T. pusilla), quedando como único micromamífero dominante A. albiventer. Biomasa de macromamíferos y ctenómidos en San Guillermo Los macromamíferos conjuntamente con los ctenómidos ocupan (con distinto grado de intensidad) la totalidad de los ambientes señalados para San Guillermo (llanos, laderas rocosas y no rocosas, vegas, es decir ocupan macrohabitats). A excepción de las vegas que presentan coberturas vegetales del 90-100 %, los otros macrohabitats presentan rangos de cobertura vegetal entre el 2 al 10 %. Mas del 80 % de la biomasa está constituida por los camélidos silvestres. Los ctenómidos también son importantes en cuanto a su aporte a la biomasa general, (con valores de 61,10 kg/km2 representan casi un 20 %), ocupan el tercer lugar después de guanacos y vicuñas (Tabla 5). El grupo de los ctenómidos puede ser considerado como clave tanto en la Puna como en la Cordillera Frontal. Su importante biomasa, amplia distribución y efectos ambientales, refleja la preponderancia del macronicho cavador dentro del ecosistema andino (Pearson, 1951; Pearson y Ralph, 1978). Al respecto, los últimos autores refiriéndose a los ambientes de Tola en la Puna peruana, mencionan que los Ctenómidos presentan una biomasa de 29,6 kg/km2, cinco veces superior a la sumatoria de todos los demás ratones presentes. Si bien la Puna y Cordillera Frontal representa una región con baja diversidad relativa de especies existen herbívoros como los camélidos silvestres de tamaño grande, con altas densidades relativas y tasas de incremento poblacional (Cajal, 1991). Esta es una de las razones que justifican considera a vicuñas y guanacos como especies claves de la región. Como conclusión y teniendo en cuenta lo mencionado por Vuilleumier y Simberloff (1980), se puede decir tanto los factores ecológicos cuyos efectos actúan en tiempos de corta duración como los históricos (cambios climáticos en el Pleistoceno y sus efectos sobre la vegetación) Capítulo 15: Diversidad de mamíferos 206 que actúan en tiempos de larga duración han jugado sus roles de manera mancomunada durante todo el tiempo, dando lugar a los patrones actuales de distribución discutidos en el presente trabajo. Los mamíferos como posibles indicadores para el seguimiento de la biodiversidad en la región andina Noss (1990) describe cinco categorías de especies que pueden garantizar los esfuerzos de conservación, incluyendo el seguimiento intensivo: a) Indicadores ecológicos: especies que permiten detectar los efectos de la perturbación en la abundancia de otras especies con requerimientos de habitat similares. b) Especies claves: aquellas de incidencia notable en el ecosistema y sobre las cuales la diversidad de una gran parte de la comunidad depende. c) Especies paraguas: aquellas de distribución amplia, y donde los esfuerzos de conservación sobre las mismas implica la conservación de los diferentes habitats y otras especies dentro de su rango de distribución. Debe aclararse que ésta categoría resulta apropiada siempre que se mantenga la estructura y función del ecosistema; existe un límite, dado por el crecimiento poblacional, por encima del cual, el criterio de especie paraguas pierde su significado. d) Especies carismáticas: aquellas sensibles o simbólicas para la opinión pública. e) Vulnerables: aquellas especies que son raras, de baja tasa reproductiva, distribuidas en parche, perseguidas, al borde de la extinción y/o sensibles a los distintos factores de amenaza. Si bien tradicionalmente los vertebrados han sido utilizados como indicadores ecológicos del cambio y calidad ambiental, han aparecido posiciones críticas que cuestionan la utilidad y eficacia de estos indicadores. Según Landres et al. (1988), estos índices o indicadores pueden justificarse para analizar la calidad ambiental únicamente en aquellos casos donde la información no pueda ser obtenida por otros medios. De no tomarse los recaudos en relación a lo apuntado, el uso de mamíferos como indicadores Capítulo 15: Diversidad de mamíferos 207 ecológicos puede resultar redundante Los indicadores ecológicos pueden ser utilizados para el seguimiento del estado de factores ambientales, de las tendencias poblacionales de otras especies y/o de las condiciones del habitat. En los casos donde la densidad de determinadas especies aumenta en respuesta a las condiciones ambientales, dichas especies pueden brindar información de las condiciones de habitat. Landres et al. (1988), alertan sobre el uso indiscriminado de especies como bioindicadoras, al respecto, especies que son de interés público por razones socioeconómicas y políticas, no pueden ser confundidas con especies bioindicadoras, dado que sus densidades poblacionales y distribución son afectadas por los diferentes planes de manejo, de ahí que indiquen poco, más allá de su presencia. En esta situación podría colocarse a los camélidos silvestres, no obstante su rol como especies claves y carismáticas dentro del ecosistema andino. En la Puna y Cordillera Frontal los micromamíferos en base a su abundancia y capturabilidad podrían ser utilizados como bioindicadores de ciertos cambios ambientales por acción antrópica (ej.: sobrepastoreo). En la Tabla 6 se indican aquellas especies a tener en cuenta, en base a sus características, para futuros monitoreos en el marco de la conservación de la biodiversidad. Apéndice: Comentarios generales Registro de especies Merece discutirse el concepto cualitativo de abundancia y rareza de es- Capítulo 15: Diversidad de mamíferos 208 pecies. Se pueden definir tres categorías de rareza o baja abundancia: a) Cuando la rareza no está relacionada con las actividades humanas, siendo la misma, una característica natural de la especie. b) Cuando la rareza es una afirmación subjetiva, originada por los deficientes sistemas de detección utilizados. c) Cuando la rareza es claramente el resultado de la presión humana directa y /o modificación de habitat. Las categorías (a) y (b), referidas fundamentalmente a los roedores resultan difíciles de discriminar. Ej.: Auliscomys, Neotomys, Octodontomys, Abrocoma. En la tercer categoría (c), se encontrarían aquellas especies que han tenido o tienen importancia económica por su piel, fibra o alimento. Ej.: Chichilla brevicaudata, O. colocolo, O. jacobita, especies que han sido cazadas históricamente por su piel (Mares y Ojeda en prensa). Abrocoma cinerea En Jujuy, solamente fue muestreada la cuenca de Pozuelos, quedando sin muestrear las grandes alturas, de ahí posiblemente, su ausencia en el listado de la Tabla 1, esta especie tiene alta probabilidad de estar presentes a mayores alturas dentro de la localidad. Al respecto, Olrog (1976) menciona como localidad de la especie al cerro Casabindo a 4.800 msnm, en la Provincia de Jujuy. Probablemente se subestime la presencia de esta especie en la región. En Laguna Blanca y Laguna Brava la especie fue observada a >4.000 msnm. En San Guillermo solamente pudo ser capturado un solo ejemplar, no obstante el importante esfuerzo de captura. Pearson (1951) dice que estos animales son difíciles de ser inducidos a caer en trampas con cebo. Akodon andinus Es otra especie no capturada en la cuenca de Pozuelos, en este caso podría realmente no encontrarse en la localidad, de acuerdo con la opinión de investigadores (Reig, com.per.). Phyllotis darwini La especie se destaca por su alta capturabilidad. Presentó la mayor frecuencia de captura en San Guillermo (49 %) y fue la segunda después de A. albiventer en Laguna de Pozuelos (35 %). Capítulo 15: Diversidad de mamíferos 209 Chinchilla brevicaudata De acuerdo con informantes locales, quedarían algunas poblaciones relictuales en ambientes rocosos de altura (> 4.000 msnm) en Salta, y Catamarca, y en grandes alturas en la localidad de Susques, Jujuy. Durante el transcurso de los estudios de campo se constataron cueros de ejemplares capturados en el oeste de Catamarca próximo a la frontera con Chile y en la localidad de Socompa, Salta. Señales de actividad (heces frescas) fueron detectadas en Laguna Brava, La Rioja (> 4.000 msnm), como así también restos de trampas construidas en piedra que testimonian la pasada actividad de caza con fines comerciales (Ojeda y Mares, 1989). El alto grado de aislamiento de las poblaciones (distribución en parche), sumado a la caza comercial hasta fines de la década del 20, ha llevado a que la especie sea muy rara en la actualidad, quedando limitada a pocas poblaciones relictuales con alto grado de aislamiento. La distribución de esta especie estaría limitada por la tensión de vapor (12-14 milibares) y la temperatura (< 25°C) (Martiarena, com.per.). Lagidium viscasia La vizcacha fue observada con frecuencia en laderas y afloramientos rocosos como así también en vegas adyacentes a las formaciones mencionadas. La especie no ha sido considerada para los cálculos de densidad en la Tabla 5, pese a caer en la categoría de macromamífero, debido a que la misma de macronicho saxátil ocupa determinados microhabitats (afloramientos rocosos adyacentes a vegas) no fue censada. Al respecto, Pearson y Ralph (1978) también omitieron en su estudio incluir a la especie porque les resultó imposible calcular sus densidades. En un trabajo anterior, Pearson (1951), menciona para la localidad de Caccachara, altiplano del Perú, una densidad de 1 vizcacha/10 ha (0,1 indiv./ha). Chaetophractus vellerosus Se suele confundir Ch. vellerosus con Ch. nationi, al respecto, Redford y Eisenberg (1992), citando a Wetzel (1985) dicen que hace falta mayor cantidad de especímenes para avalar la validez de Ch. nationi como especie diferenciada o como Capítulo 15: Diversidad de mamíferos 210 una subespecie de altura de Ch. vellerosus. Conepatus chinga Algunos autores consideran al C. chinga como C. rex (ver Redford y Eisenberg, 1992). Zorros y mustélidos Los mismos fueron incluidos en los registros cuando se realizaban los censos de camélidos silvestres en San Guillermo. Si bien su observación se vio facilitada por las características topográficas del terreno (espacios abiertos, buena visibilidad), no se hicieron censos específicos para los mismos. Los números de ejemplares contabilizados mediante estos registros de avistaje, deben ser considerados como conservadores. En la cuenca de Pozuelos (Capítulo 13), utilizando como método el sistema de estaciones odoríferas, se midió una densidad general (incluyéndose el zorro colorado y el gris), de 0,12 zorros/km2. Puma concolor En San Guillermo se determinó una densidad de un puma cada 464 km2, similar a lo encontrado para Pozuelos (Capítulo 13). Russell (1980) señala para nueve localidades de Estados Unidos con características ambientales muy diferentes entre si, un rango de 1 ind/26 km2 a 1 indiv./261 km2. Según el mencionado autor, el área de actividad para animales residentes es de 40 a 80 km2 por hembra y de 65 a 90 km2 por macho, habiéndose registrado para ejemplares machos, áreas de actividad de 450 a 650 km2. Los machos residentes no ocupan la misma área, pero el área de las hembras pueden superponerse al del macho residente y a otras hembras. El principal factor que limita la densidad de los machos residentes es la presencia de otros machos adultos residentes, y a su vez, la presencia de hembras reproductivas residentes limitan la presencia de otras hembras. Sullivan y Shaffer (1975) señalan que en habitats óptimos de América del Norte, ocho pumas, considerados como ‘población mínima viable, deberían requerir un área mínima de 760 km2. De acuerdo con los datos de densidad obtenidos, tanto Capítulo 15: Diversidad de mamíferos 211 la Cuenca de Pozuelos como San Guillermo presentarían poblaciones mínimas viables de éste carnívoro. BOX 1 Comentarios de Olrog (1976) sobre algunas especies mencionadas para la región pero no registradas en el presente estudio Akodon jelskii: “Especie característica del altiplano de Jujuy, donde habita en zonas con rocas y piedras de mucha altura a 4.500 msnm... (Ann. Mag. Nat. Hist., 1913)”. Phyllotis caprinus: “Esta especie ocurre en la alta Cordillera de Los Andes de Jujuy entre aproximadamente 2.200 y 4.600 m de altura. Muy parecido a P. darwini de la misma zona, habita en terrenos más rocosos. Localidad en Argentina: Tilcara, Jujuy.” Andinomis edax: “Esta especie grande y robusta habita en terrenos arbustivos de cierta altura y por general cerca de ríos y riachos, aparentemente es en cierto grado arborícola. En Jujuy, Salta y Tucumán entre 2.000 y 3.000 m de altura...(Anal. Mus. Arg. Cienc. Nat, 1935).” Phyllotis osilae: “Caracterizada por su gran tamaño, esta especie habita en pajonales de mucha altura a 4.500 msnm. Montañas del centro de Jujuy y Salta. Ann. Mag. Nat. HIst., 1912).” Chinchillula sahamae: “Habita los mismos lugares de Phyllotis y Lagidium o a mayores alturas. Es principalmente nocturno y rupícola.” Capítulo 15: Diversidad de mamíferos Tabla 1 Lista de mamíferos registrados en la Puna y Cordillera Frontal, señalándose el peso promedio del adulto y el macronicho. Se incluye información correspondiente a Los Andes, Salta en base a Ojeda y Mares (1989) Latitud Familia Especie Masa Peso Loc. Dieta Activ. P(1) (gr) 22°S Po(2) 24°S LA(3) 26°S 28°S 29°S LBl(4) LBr(4) SG(4) Muridae Neotomys Mi 23 T H D/N + + ebriosus Chinchillula M 140 T H N + sahamae Auliscomis Mi 39 T O/H D/N + +* sublimis Andinomix edax Mi 58 T H N + + Phyllotis darwini Mi 45 Tr H/G N + + + + + Phyllotis osilae Mi 57 Tr H/G N + Phyllotis caprinus Mi Tr H/G N + Eligmodontia Mi 16 Tr H/I N + +* + + + puerulus Calomys sp Mi +* Calomys lepidus Mi 25 T G N + + + Akodon andinus Mi 21 T O N + + + + Akodon albiventer Mi 25 T I/O D + + + Akodon boliviensis Mi 13 T I/O D/N + Akodon jelskii Mi T I/O D/N + Cavidae Microcavia M 110 T H D + + + shiptoni Galea musteloides M 226 T H D + +** ChinchillidaeChinchilla M 400 Sx H N + ? brevicaudata Lagidium viscasia Ma 1900 Sx H D/N + + + + + Abrocomidae Abrocoma cinerea M 160 Sx H D + + + + Octodontidae Octodontomys M 158 Tr H N + +** + gliroides + + + + + + + + Tabla 1 (Continuación) Lista de mamíferos registrados en la Puna y Cordillera Frontal, señalándose el peso promedio del adulto y el macronicho. Se incluye información correspondiente a Los Andes, Salta en base a Ojeda y Mares (1989) (Continuación) Latitud Familia Especie Masa Peso Loc. Dieta Activ. P(1) (gr) CtenomydaeCtenomys opimus M Ctenomys fulvus M Didelphidae Thylamys pusilla Mi Dasypodidae Chaetophractus M vellerosus Felidae Oreailurus jacobita Ma Oncifelis geoffroyi Ma Oncifelis colocolo Ma Puma concolor Ma Canidae Pseudalopex Ma culpaeus Pseudalopex Ma griseus Mustelidae Conepatus chinga Ma Galictis cuja Ma Camelidae Vicugna vicugna Ma Lama guanicoe Ma Leporidae Lepus europaeus (5)Ma 300 235 18 450 Cv Cv Tr T/Cv 4000 2230 2950 38000 8000 T T T T T 4600 T 2240 1200 40000 75000 2500 T T T T T 22°S Po(2) 24°S LA(3) 26°S 28°S 29°S LBl(4) LBr(4) SG(4) H H I O D/N D/N N D/N + + + + + + + + + + + + C C C C C D/N D/N D/N D/N D/N + + + + + + + + + + + + + + + + + + + + + + C/Cr/O D/N + + + + D/N + + + + D/N + D + + + + + D + + + D/N + + + + + + + C/O C H H H + Ref.: (1): Redford y Eisenberg (1992), Olrog (1976); (2): Bonaventura y Tecchi, (com.per.), Perovic, (Capítulo 13); (3): Ojeda y Mares (1989); (4) Cajal, (com.per.); (5): especie exótica en expansión. La información de las columnas 4, 5, 6, 7 y 8 fue obtenida mediante muestreos de captura, observaciones directas y de regurgitados de Athene cunicularia (*), de Bubo virginianus (**) y Asio flameus (Pardiñas com. per.). Mi: micromamíferos; M: mamíferos medianos; Ma: macromamíferos; T: terrestres; Tr: trepador; Cv: cavador; Sx: saxícola; H: herbívoro; C: carnívoro; Cr: carroñero; I: insectívoro; G: granívoro; F: frugívoro; O: omnívoro; D: diurno; N: nocturno. 214 Tabla 2 Indice de similitud de Jaccard. Parte de arriba de la tabla está referida a los múridos exclusivamente, la parte inferior a todos los mamíferos. Rf.: Po=Pozuelos; LA=Los Andes; LBl= Laguna Blanca; LBr=Laguna Brava; SG=San Guillermo. Po LA LBl LBr SG Po xxxx 37,5 28,6 33,33 33,33 LA 50,0 xxxx 60,0 50,0 37,5 LBl 33,33 54,55 xxxx 75,0 50,0 LBr 21,43 38,46 44,44 xxxx 66,67 SG 26,67 33,33 36,36 77,78 xxxx Capítulo 15: Diversidad de mamíferos Tabla 3 Densidad (d=indiv./ha), biomasa (b=gr/ha) y diversidad de micromamíferos en habitats de Laguna de Pozuelos y San Guillermo. Pozuelos Cobertura vegetal (%) Pa 95 Pb 34 Pc 67 Akodon albiventer δ β 2,0 69,4 1,4 34,8 8,2 8,2 2,8 206,4 181,6 55,6 Akodon boliviensis δ β Akodon andinus δ β Eligmodontia puerulus δ β Calomys lepidus δ β Phyllotis darwini δ β 8,2 163,3 Thylamys pusilla δ β 0,4 36,7 2,0 67,3 Pd 57 Pe 92 3,4 2,0 47,6 34,7 2,0 89,8 Sa 4 Sb 4 Sc 10 Sd (1) 100 4,1 110,2 2,0 26,5 8,3 166,7 2,3 37,3 2,3 58,2 24,0 984,8 Indice diversidad 0,830 0,876 1,252 0,812 0,918 - - - 0,802- 2 1 0 1 2 2 2,3 32,9 1482,7 58,2 1574,4 3 24,0 - 21,9 460,3 136,7 234,8 254,0 306,2 222,2 136,7 984,8 - 2 6,1 4,2 54,4 4,1 3 11,1 Pg 37 β total 460,3 N° especies 11,6 12,2 Pf 100 δ total 1,000 10,0 San Guillermo 39,4 21,9 3 2 Ref.: Pa=Stipa ichu; Pb=arbustal de Fabiana densa y Baccharis boliviensis; Pc=arbustal de P. lepidophylla; Pd=arbustal de Baccharis incarum; Pe=bosque de Polylepis; Pf=pastizales de Festuca crysophylla; Pg= Yareta; Sa=pastizal de Stipa (llano); Sb=arbustal de Adesmia y Lycium con pastizal de Stipa (ladera no rocosa); Sc=arbustal de Lycium y Adesmia (ladera rocosa); Sd=vega; (1)= No se pudo establecer la densidad de Neotomys ebriosus por no caer en las trampas. 215 Capítulo 15: Diversidad de mamíferos Tabla 4 Ladera original→ Ladera Tolar→ sobrepastoreada Pasto llorón Cobertura vegetal (%) 31,97 16,67 75 50 Diversidad vegetal 0,60 0,49 0.60 0,36 Diversidad de artrópodos 0,95 0,58 1,73 1,03 Akodon albiventer δ β 1,36 34,79 2,04 44,00 8,16 206,41 16,33 436,73 Phyllotis darwini δ β 8,16 163,28 Thylamys pusilla δ β 0,45 36,74 Calomys lepidus δ β 3,43 47,63 20,41 300,00 Biomasa total (gr/ha) 234,81 44,00 254,04 736,73 Indice de Shannon 0,830 0 0,876 0,906 216 Capítulo 15: Diversidad de mamíferos Comparación de dos casos de modificación ambiental por acción antrópica: Modificación de un arbustal de Fabiana densa y Baccharis boliviensis (3.900 msnm, 22° de pendiente) por sobrepastoreo y modificación de un tolar de Parastrephia lepidophylla por implantación de pasto llorón (Eragrostis curvula). La ladera sobrepastoreada se encuentra muy empobrecida, con presencia de los arbustos originales muy esparcidos y con importantes señales de impacto animal (heces, pisoteo, ramoneo). La especie dominante en la pastura implantada es el pasto llorón con un 50 % de cobertura. Las otras especies presentes en el cultivo fueron Aristida sp., Portulaca sp. y Tetraglochin ameghinae. 217 Tabla 5 Biomasa de macromamíferos y ctenómidos presentes en San Guillermo Especie Peso (kg) (ind./km2) Galictis cuja* 1,20 Pseudalopex griseus (1) 4,60 Pseudalopex culpaeus (1) 8,00 Puma concolor (2) 38,00 Ctenomys fulvus (3) 0,24 Vicugna vicugna (4) adultos 40,00 crías 10,00 Lama guanicoe adultos 75,00 crías 15,00 Densidad (kg/km2) Biomasa (en %) Biomasa 0,001 0,001 0,001 0,005 0,005 0,002 260,00 3,00 2,40 0,59 2,47 1,99 0,48 0,040 0,076 61,10 101,90 96,00 5,90 156,40 149,20 7,20 0,04(5) 319,52 100 Total 19,12 31,89 48,95 Ref.: * especie ocasional; (1): En Pozuelos se registró una densidad tomando ambas especies en conjunto de 0,12 zorros/km2 lo que daría una biomasa de 0,76 kg/km2 (Capítulo 13); (2): En Pozuelos se registró similar densidad y biomasa de pumas (Capítulo 13); (3): El cálculo fue realizado tomando las densidades estimadas por Reca (1989) a partir de censos de cuevas activas en un ambiente de llano. Pearson y Ralph (1978) estimaron una biomasa de C. opimus de 29,6 kg/km2 para ambientes de Tola en la Puna peruana; (4): La biomasa de vicuñas en Pozuelos es de 40 kg/km2, no obstante considerando los animales domésticos la biomasa de herbívoros en ésta localidad (1.349 kg/km2) supera ampliamente a San Guillermo (Capítulo 19); (5): Considerando todos los carnívoros presentes. Capítulo 15: Diversidad de mamíferos 218 Tabla 6 Categorización de especies de mamíferos para su monitoreo, a fin de detectar y/o predecir situaciones de alerta y cambios ambientales. Categoría Especies Posibles indicadores ecológicos P. darwini Claves Ctenomys spp V. vicugna Paraguas V.vicugna Carismáticas V. vicugna Raras Ch. brevicaudata Capítulo 15: Diversidad de mamíferos A. albiventer T. pusilla L. guanicoe L.guanicoe A. cinerea (?) 219 Capítulo 15: Diversidad de mamíferos Fig. 1 - Número de especies y familias de mamíferos en relación con la latitud sur 220 Ctenomys fulvus en San Guillermo Chinchillón en vegas Reserva de Biosfera San Guillermo Capítulo 15: Diversidad de mamíferos 221 LA PRODUCCION EN LA PUNA Capítulo 15: Diversidad de mamíferos 223 CAPITULO 16 UNA PROPUESTA DE INNOVACION METODOLOGICA EN LA DETERMINACION DE LOS CARACTERES MORFOLOGICOS Y MORFOMETRICOS EN LA POBLACION DE CAMELIDOS SUDAMERICANOS DOMESTICOS EN LA CUENCA DE LA LAGUNA DE POZUELOS Hugo Eduardo Lamas 1 Introducción El presente capítulo se refiere al trabajo sobre camélidos domésticos que se ejecuta en la Reserva de Biosfera de la Laguna de Pozuelos como ámbito geográfico y se encuentra incluido en los objetivos del Programa de Ecología Regional (PER) del Instituto de Biología de la Altura (INBIAL) de la Universidad Nacional de Jujuy. El PER en su conjunto está integrado por un equipo interdisciplinario de investigadores quienes desempeñan tareas de investigación y desarrollo en el área desde 1985. 1 Instituto de Biología de la Altura, UNJu, Av. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina Capítulo 16: Propuesta de innovación 224 Es justamente a través de la cría y producción de los camélidos sudamericanos domésticos que el PER propone un polo de desarrollo para la región. El presente trabajo de investigación, cuenta con el apoyo material, humano y técnico de Instituto de Biología de la Altura (Universidad Nacional de Jujuy), el Laboratorio de Fibras Animales de la Cátedra de Zootecnia II de la Facultad de Ciencias Agropecuarias (Universidad Católica de Córdoba), el Consejo Federal de Inversiones y la Cátedra de Producción de Rumiantes Menores de la Facultad de Ciencias Veterinarias (Universidad Nacional de La Pampa). Los Camélidos Sudamericanos Los Camélidos Sudamericanos comprenden las especies silvestres (Vicugna vicugna y Lama guanicoe) y las domésticas (Lama pacos y Lama glama). Dentro de los camélidos domésticos es bien difundida la diferenciación en especies, variedades y morfotipos, no existiendo aún evidencias concretas que permitan separar claramente a los mismos en grupos bien destacados. Así mientras algunos autores reconocen la existencia de dos especies distintas: llamas y alpacas, otros opinan que se trataría de una sola especie con diferencias morfológicas. Por otra parte si existieran las dos especies dentro de cada grupo se hacen nuevas divisiones. Así se habla de alpacas huacaya y suri, otros agregan a un tercer tipo denominado chili (Valjalo Cepeda, 1964). Para diferenciarlas, Huanca (1990), hace referencia a tres puntos principales: 1. Contornos: En la suri son lineales y angulosos dando sensación de gran delicadeza, en cambio las huacayas presentan contornos curvos y armoniosos. 2. Tamaño: La huacaya es de mayor talla o alzada que la suri. 3. Vellón: El vellón de la suri está formado por mechas de fibras ordenadas en rulos lacios, paralelos a la superficie del cuerpo. En promedio es más fino, más pesado y brillante. En cambio el huacaya es esponjoso con crecimiento perpendicular al cuerpo donde se pueden observar “rizos” en la fibra que son indicadores de finura. Capítulo 16: Propuesta de innovación 225 En la llama se identifican dos tipos principales de animales: el tipo Q’ara, “sin lana”, que se caracteriza por tener la cara descubierta y un desarrollo limitado de su fibra, y el tipo Ch’aku o “lanuda” que produce mayor cantidad de fibras y presenta la cara cubierta de lana (Carpio, 1990). La llama Q’ara o kara recibe otras denominaciones: gala, gara, llama fina, llama guanaco, llama carguera, ocaya, kcara sullo, ocara, pelada. La llama Ch’aku se conoce también como tampulli, tapada, peluda o choko, chaco, tkaja, tapa, milluayoc, lacho. Romero (1927) las clasificó como longimorfas y brevimorfas a Q’ara y Ch’aku respectivamente. Cardozo (1954) divide a las llamas entre las que “tienden a la braquimorfia” (formas rechonchas, acortadas, brevilíneas) siendo al mismo tiempo concavilíneas (perfil corto con vellón abundante), en contraste con otras que “tienden a la dolicomorfia” (formas esbeltas, alargadas, longilíneas). El tipo lanudo se caracteriza por una cobertura de vellón a lo largo de todo el cuerpo así como en el pescuezo y la parte de las extremidades. El vellón es además uniforme y suave al tacto (Cardozo, 1954; Vidal, 1967; Calle, 1982). En el tipo K’ara el vellón es menos abundante en especial en el cuello y las extremidades, las fibras se extienden a la frente y sale de las orejas pero nunca en las piernas. El vellón muestra claramente dos capas, una de fibras gruesas (pelos) y otra inferior (vellón), de mayor densidad y fibras finas. Las fibras gruesas emergen agrupadas en mechas puntiagudas formando una capa rala que en conjunto da un aspecto de un vellón desuniforme el cual normalmente no se esquila (Vidal, 1967). Presenta ausencia de fibras en cara y pierna. Dicho autor se refiere además a un tercer tipo de llama a la cual denomina intermedia con características medias entre ambas. Por otra parte las especies de camélidos domésticos presentan cruzas interespecíficas fértiles y viables. son: 1. Las distintas cruzas entre los domésticos y sus denominaciones Huarizo: llama macho x alpaca hembra. Capítulo 16: Propuesta de innovación 226 2. Misti: alpaca macho x llama hembra. Como resultado de estas cruzas encontramos animales con un tipo intermedio en caracteres entre la llama y la alpaca, de mediano tamaño con alzada más cercana a la llama, con un vellón que tiene fibras de mayor grosor que el de las alpacas pero más finas que las de la llama. Además en el vellón de estos huarizos o mistis es dable observar fibras insurgentes aisladas del tipo llama entremezcladas con las fibras finas propias de la alpaca (Calle Escobar, 1982). En cuanto a la metodología empleada para alcanzar resultados en las determinaciones morfométricas Maquera Llano (1991) señala las condiciones para una adecuada lectura de las mensuras. Los elementos empleados para las mediciones son: cinta métrica y regla Vernier, estableciendo a su vez en 12, las lecturas de interés. En camélidos silvestres para un trabajo similar, Larrieu et al. (1982) para guanacos, señalan que las medidas pueden ser tomadas utilizando alambre de cobre, calibre, elementos para las mismas medidas y en lo posible realizadas siempre por el mismo operador. Se ha podido establecer que la mayoría de los autores asignan una estrecha relación en cuanto al tipo de vellón producido por cada tipo de camélidos domésticos. Por otra parte, algunos trabajos realizados por investigadores argentinos señalan que en el pastoreo de camélidos domésticos en la Puna Argentina no se encuentran dos grupos bien definidos (alpacas y llamas) lo que es típico del altiplano peruano (García Fernández et al., 1989). En un relevamiento realizado en el área propuesta para el trabajo, se ha encontrado una mayor frecuencia de vellones del tipo huacaya, pero existe también animales del tipo suri y chili, encontrándose además animales del tipo llama en menor medida (Frank et al., 1991). En función de estas observaciones y otras realizadas fundamentalmente en la Cuenca de la Laguna de Pozuelos y en menor medida en el resto de país, Frank y Bollati (en prensa) agrupan para la Argentina siete tipos de vellón distintos que autores peruanos y bolivianos adjudican a la alpacas más los tipos de vellón adjudicados a las llamas. En efecto, trabajando en base a esta clasificación, durante el muestreo de vellones (Lamas, 1993), se pudo apreciar animales que presentaban a simple vista notables diferencias morfológicas y morfométricas, estableciéndose además cierta relación entre estas características y el Capítulo 16: Propuesta de innovación 227 tipo de vellón producido, realizándose sobre estos animales los primeros registros fotográficos. Tal apreciación coincide con la realizada por Bustinza (1987), Calle Escobar (1982), Marquera Llano (1991) entre otros. Dada esta gran variabilidad de formas y medidas entre los distintos animales resulta importante incorporar al estudio de estos camélidos domésticos un sistema de diferenciación basado en un patrón gráfico confeccionado a partir de las características morfológicas y morfométricas con el objeto de dilucidar que tipo de animales en realidad se distribuyen en la Cuenca de la Laguna de Pozuelos. Por otra parte permitiría establecer estándares de morfotipos para alcanzar determinados fines económicos como producción de carne, lana, transporte o escena. Con éstos aportes se pretende documentar información en forma escrita y fotográfica sobre el tema y paralelamente reunir información básica para posteriores investigaciones más profundas. Asimismo, los valores presentados, en combinación con estudios genéticos, podrán ser de utilidad en definiciones más complejas como establecer determinaciones taxonómicas. A. Para caracterizar una forma cuali-cuantitativa generalizadora y sentar bases concretas para la discusión sobre la población de camélidos argentinos domésticos en la Cuenca de la Laguna de Pozuelos se plantea el presente trabajo con los siguientes objetivos. B. Descripción morfológica y morfométrica de los distintos tipos de camélidos domésticos que se encuentran en la Puna Jujeña. C. Descripción integral de los vellones de los distintos animales considerados. D. Clasificación de los distintos tipos en base a características morfológicas, morfométricas y características cuali-cuantitativas del vellón. E. Estudiar la persistencia de las diferencias de los distintos tipos de animales a lo largo de la vida del animal (repetibilidad). F. Confección de un patrón fotográfico para los caracteres cualitativos que definen los tipos de camélidos domésticos de la Puna Jujeña. Capítulo 16: Propuesta de innovación 228 Planteo de la metodología de trabajo 1. Elección de los animales para el muestreo Tiene por finalidad determinar la zona adecuada dentro de la Cuenca de Pozuelos la cual presenta la mayor amplitud de caracteres en la población de camélidos domésticos sometidos al mismo sistema de manejo y que a la vez, por una cuestión de distancia, permitan ejecutar el trabajo en tiempo y espacio. 2. Trabajos de campo 2.1. Elección de los animales para el muestreo Sobre la población total de camélidos domésticos en el sector elección de 400 animales. Descripción de los mismos a través de la toma de los siguientes datos: √ Propietario √ Edad √ Lugar √ Sexo √ Fecha √ Tipo de esquila √ Suavidad al tacto √ Tipo de vellón Elección de hembras que, por lo menos, hayan tenido una parición y machos enteros en edad de servicio. Con edades entre los dos a cinco años. En base a los datos mencionados, confección de una primera planilla descriptiva. 2.2. Relevamiento fílmico tomas: Registro fílmico de cada uno de los 400 animales con las siguientes √ Frente cuerpo. √ Perfil cuerpo. √ Rostro. √ Perfil craneal √ Parte posterior del cuerpo. Cada registro, de un minuto de duración, y con una distancia determinada de toma que permita apreciar en su totalidad las caracterísCapítulo 16: Propuesta de innovación 229 ticas corporales como así también aquellas correspondientes a rostro y cabeza.(filmadora de video GR-AX7 BKU VIDEO MOVIE con cassettes TDK E-HG TC-30 VHS C). 2.3. Descripción de los caracteres cuantitativos de los animales muestreados. Con los animales muestreados, confección de una segunda planilla, registrándose en la misma, los caracteres cuantitativos. Utilización de la metodología descripta por Maquera Llano (1991) para la toma de las medidas morfométricas a realizar sobre cada animal. Para ello los animales se mantienen parados sobre piso compactado, uniforme y nivelado, sujetos con la ayuda de dos personas, uno sujetando el cuello y la otra la región posterior, empleándose una regla de Vernier, una regla común, alambre de cobre y cinta métrica. Utilización del mismo elemento y el mismo operado para cada medida. Estas medidas son: √ Largo de cabeza. √ Altura de cabeza. √ Perímetro de la cabeza. √ Largo de oreja. √ Largo de cuello. √ Altura de la cruz. √ Distancia base de cola a encuentro. √ Altura de tórax. √ Perímetro toráxico. √ Largo de cuerpo. √ Largo de cola. √ Largo de pata. √ Ancho región posterior. 2.4. Extracción muestra de vellón Extracción en cada animal de una muestra de fibra con el objeto de confirmar en laboratorio la estimación realizada en campo en cuanto al tipo de vellón. Las muestras una vez extraídas se envasan en bolsitas identificando las mismas, debidamente. Capítulo 16: Propuesta de innovación 230 Determinación sobre estas muestras en laboratorio de los caracteres cuali-cuantitativos del vellón para aquellos animales representativos de los grupos de camélidos domésticos establecidos. 3. Trabajo de gabinete 3.1. Copiado y compaginado de las filmaciones Compaginado y compilado de las filmaciones originales en cassettes TDK E-HG T 120 VHS NORMAL para constituir un archivo definitivo de imágenes y poder estudiar en detalle a cada animal. Esta copia definitiva constituye el 1° archivo fílmico de los animales estudiados en el trabajo. Realización sobre este archivo, el estudio de los caracteres cualitativos. 3.2. Determinaciones cualitativas Determinación para cada caso y a partir de los cinco registros fílmicos sobre cada animal las siguientes características: √ Tipo de oreja. √ Tipo de cabeza. √ Perfil fronto nasal. √ Tipo de cuello. √ Grado de cobertura en cara y extremidades. √ Tipo de perfil en grupa. √ Tipo de línea medio dorsal. √ Perfil total del animal. 3.3. Registros gráficos Confección a partir de las imágenes fílmicas de los patrones tipos para cada ítem determinado anteriormente. Representación de éstos patrones gráficamente a través de dibujos. 3.4. Primera estimación de tipos de camélidos domésticos En base a los datos morfométricos y la información de los caracteres cualitativos reunidos en los patrones gráficos agrupación de los animales muestreados en tipos definidos estableciendo para cada uno de ellos su Capítulo 16: Propuesta de innovación 231 caracterización y diferenciación entre grupos. 3.5. Registros fotográficos y muestreo de fibra de aquellos casos más representativos Elección de los 80 casos más representativos para cada grupo de animales y realización de las siguientes operaciones: 3.5.1. Registros fotográficos Toma fotográfica en cada uno de los 80 animales de su perfil para confeccionar un registro fotográfico (cámara ZENIT 12 XP dotado de ZOOM VIVITAR 70-210 mm). Traducción de los registros gráficos de las variables cualitativas en un patrón fotográfico. 3.5.2. Peso del vellón Esquila de cada animal seleccionado para obtener el peso de vellón y cantidad comercial en relación al bordel. 3.5.3. Repetibilidad Con el objeto de determinar la repetibilidad, los animales esquilados el primer año vuelven a ser esquilados por segunda vez al año siguiente, estableciendo la correlación entre estas medidas repetidas sobre los mismos individuos en dos momentos diferentes de su vida. 4. Trabajo de Laboratorio Realización sobre los animales seleccionados en función de su representatividad por tipo de camélidos domésticos, determinaciones en laboratorio para caracterizar su vellón. Tales determinaciones son: √ Identificación del tipo de mecha. √ Determinación del largo de mecha. √ Diámetro promedio de fibra. √ Grado de medulación total. Capítulo 16: Propuesta de innovación 232 √ Grado de medulación continua. √ Largo individual de fibra. √ Gráfico de distribución de frecuencias de largo de fibra. √ Relación largo de fibra primaria/largo de fibra secundaria. Toma de fotografías sobre distintos grados de medulación y disposición de los patrones cuticulares ( microscopio OPTIP HOT-2 dotado de una cámara NIKON FX-35A). 5. Estimación final de los tipos de Camélidos domésticos A partir del primer agrupamiento de animales realizados en base a sus caracteres cuali-cuantitativos y contando con los datos de laboratorio en cuanto a los caracteres del vellón realización de un agrupamiento definitivo. Capítulo 16: Propuesta de innovación 233 CAPITULO 17 ANALISIS DEL MERCADO DE PELOS FINOS DE CAMELIDOS SUDAMERICANOS DE LA ARGENTINA Juan Javier García Fernández 1 Introducción El aprovechamiento sustentable de los camélidos sudamericanos, tanto domésticos como silvestres, despierta interés creciente como alternativa de uso del suelo en las extensas altiplanicies andinas. Todo intento real y concreto de manejo de recursos naturales renovables debe contemplar las posibilidades ciertas de que los mercados locales e internacionales absorban los bienes producidos en las cantidades disponibles y a precios atrayentes. De no ser así, las expectativas de los pastores del altiplano y de los propios organismos de conservación se pueden ver frustradas duramente. 1 FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. Originalmente publicado por la Fundación para la Conservación de las Especies y el Medio Ambiente (FUCEMA) (1992), en el marco del Programa para la Mejora en la Producción de Pelos Finos de Camélidos Argentinos, impulsado conjuntamente por la Comunidad Económica Europea y la República Argentina. Capítulo 17: Análisis del mercado 234 El objetivo del presente capítulo es reunir la información disponible sobre el mercado de pelos finos de camélidos, tanto domésticos como silvestres, en la Argentina, particularmente en relación con las economías de la región andina. Se desea así ofrecer un panorama completo sobre la oferta actual de estas fibras en el País, sobre cuya base deberán plantearse metas de superación y promoción tanto de la cría como de la comercialización de los camélidos y sus productos. Accesoriamente se incluyen algunos datos sobre mercados, tanto europeos como de otros países productores, como así también, ciertos datos esenciales para apoyar el análisis de la producción local. Estado y utilización actual del recurso Camélidos silvestres: Vicuñas La vicuña se ha recuperado lenta pero constantemente en los últimos 25 años, gracias al establecimiento de reservas, la vigilancia de las mismas y al control del comercio de productos furtivos. Se estima que el comercio ilegal remanente está nutrido de animales cazados fuera de las reservas provinciales, principalmente en Catamarca, donde hay una fuerte tradición de hilado y tejido manual. En Jujuy también se conocen casos de artesanías recientes de vicuña, pero la dimensión del fenómeno no es grande. El principal mercado del País, la ciudad de Buenos Aires, fue fiscalizada con intensidad durante el período 1989-1991. En varios casos fueron analizadas muestras de ponchos y chalinas vendidas como “de vicuña” en comercios porteños. Los análisis efectuados por el Centro de Investigaciones Textiles del Instituto Nacional de Tecnología Industrial, dieron resultados negativos, tratándose de pelo de llama mezclado con lana y en algún caso directamente fibras sintéticas (Marino, en prensa). El comercio internacional está prohibido en virtud de la Convención CITES, de especies amenazadas. Chile y Perú han presentado planes de manejo racional de la vicuña, que han sido aprobados por ese orga- Capítulo 17: Análisis del mercado 235 nismo. En consecuencia pueden exportar solamente productos de vicuña realizadas a partir de pelo procedente de esquila de animales vivos. No disponemos de cifras de exportación, si es que alguna se ha realizado en ese contexto. Sería interesante recabar esa información, así como los precios que se obtendrían, ya que pueden ser indicativos para una futura producción regulada de la especie en Argentina. Las estimaciones más recientes indican una población total mínima de vicuñas en la región andina argentina (ver Capítulo 18). Camélidos silvestres: guanacos El guanaco tiene una distribución mucho más amplia que la vicuña. Las estimaciones sobre población total para el País son antiguas, pero las ordenes de magnitud son comparables: 578.000 (Cajal, 1983); de 552.000 a 771.000 (Garrido, 1985). Una revisión general puede consultarse en Cajal y Amaya (1985) y Rabinovich et al. (1987). De todas maneras, si bien el número poblacional total es muy superior al de vicuñas, las perspectivas son preocupantes, ya que hay opinión concordante en el sentido que el guanaco está decreciendo en la Patagonia. La falta de vigilancia y regulaciones efectivas en algunas provincias, así como la existencia de escasísimas superficies bajo conservación en la Meseta Patagónica representan un riesgo permanente para la especie. De hecho algunas poblaciones importantes de la precordillera y cordillera frontal están protegidas en San Guillermo y ciertas localidades de San Juan y Mendoza, pero estas poblaciones no superan el 3 % de la población total estimada para el País cuyos núcleos principales se encuentran en la Patagonia. La especie está incluida en la Convención CITES, pero en el Apéndice II, es decir que su comercio se permite si se cumplen ciertas regulaciones contempladas por la Convención. La poca demanda de su piel por parte de la industria peletera europea en los últimos cinco años ha hecho disminuir el incentivo económico para el “chulengueo” (caza de crías recién nacidas). Hacia fines de la década de los años 70 la exportación de pieles de guanaco promediaba 70.000 ejemplares/año. Capítulo 17: Análisis del mercado 236 En el trienio 1988-1990, la exportación de pieles y confecciones peleteras correspondió a 40.273 ejemplares, es decir un promedio anual de 13.424, cinco veces menos que una década atrás y con una tendencia decreciente (Fig. 9). Lamentablemente, la totalidad del pelo de guanaco exportada desde la Argentina procede de animales cazados. No hay prácticas habituales ni esporádicas de esquila viva. No se conoce si ese pelo proviene de “chulengos” o de adultos. Suponiendo que sea de adultos, ya que el valor de su piel para peletería es escaso, y estimando que se obtienen 500 gramos de pelo por animal, en el trienio considerado se habría exportado fibra equivalente a 9.500 individuos (Fig. 9). Resta conocer tres puntos importantes sobre este particular: a) Si al haber demanda de pelo se aumenta la presión de caza, o por el contrario, en base a la cantidad de pieles disponibles se “arma” una oferta limitada. b) En que medida las propiedades del pelo procedente del animal muerto y “barraqueado” difieren en calidad y propiedades textiles del procedente de esquilas vivas. c) Si el mercado internacional absorbería cantidades mayores de pelo de guanaco a precios similares a los vigentes. Dado el alto precio que alcanza el pelo de guanaco en el mercado internacional (Fig. 3, 11 y 16), sería conveniente generar una oferta previsible de fibra homogénea y de alta calidad en base a la esquila de animales vivos, superándose así también las posibles objeciones al aprovechamiento en base exclusivamente a animales muertos. Camélidos domésticos La cantidad total de ganado camélido en la Argentina es de aproximadamente 150.000 animales, distribuidos principalmente en el altiplano de Jujuy (100.000), Catamarca (30.000) y Salta (15.000). Capítulo 17: Análisis del mercado 237 A diferencia de lo que se encuentra por ejemplo en el Perú, donde se diferencian netamente alpacas y llamas, ocupando ambientes diferenciados y para distintos propósitos, en la Argentina es común que dentro de un mismo rebaño coexistan ambos morfotipos y sus gradaciones intermedias. Esta situación presenta ventajas y desventajas. Entre las primeras, debe mencionarse que hay en la Argentina un interesante y muy variado “pool” genético de camélidos domésticos, con ejemplares que presentan excelentes diámetros de fibra, siendo comunes valores de menos de 24 micrones, es decir que corresponden a la fracción más fina de la clasificación comercial peruana (“superfina”: 21-24 mic.). La principal desventaja está dada por la heterogeneidad de finuras e incluso de colores dentro de cada rebaño, lo cual dificulta la clasificación y desmerece el precio que puede obtener el productor. Otra diferencia con los rebaños peruanos es que en Argentina predominan las capas de color marrón (en sus distintas tonalidades, desde castaños claros o bayos hasta café), y los colores combinados, mientras que el blanco es menos frecuente y el negro más escaso aún. La atomización de la oferta en manos de miles de pequeños productores esparcidos a lo largo de 100.000 km2 de altiplano dificulta la conformación de lotes importantes de producto de finuras y colores similares. Los camélidos domésticos (al igual que los ovinos) son animales de doble propósito. Su carne también es utilizada por el productor, principalmente para autoconsumo. La carne de camélidos no es ubicada en el mercado regional con facilidad, por lo cual un productor “especializado” en este ganado obtendría un menor crédito económico que otro especializado en ganado ovino criollo. Para una revisión sobre el tema puede consultarse García Fernández y Tecchi (1991). Los canales comerciales Capítulo 17: Análisis del mercado 238 Pelo de guanaco El pelo de guanaco se comercializa del mismo modo que otros productos de la fauna silvestre, como cueros o pieles. Los cazadores venden localmente (en almacenes zonales o pequeños acopios) las pieles. Por lo general no se reúnen lotes de varios cazadores, sino que cada uno los vende por separado. El precio es fijado por el acopiador, quien tiene en cierto modo su oferta “cautiva”, ya que difícilmente el cazador acuda a otro comprador más alejado o distinto del habitual. En ocasiones, los propios acopiadores recorren las zonas rurales, “levantando” todos los productos que haya disponibles en cada finca, incluso lana, cueros ovinos, pieles de zorros y zorrinos, etc. Estos comerciantes menores venden a su vez los lotes mayores que han reunido a las barracas, que por lo general están localizadas en pueblos de relativa importancia, cabeceras de departamentos, etc. Finalmente, las pieles son compradas por comerciantes de Buenos Aires, quienes deben proveerse de un documento legal (guía de tránsito) que indica que dichas pieles han sido obtenidas de acuerdo a las leyes provinciales. Las guías de tránsito deben estar firmadas por un funcionario provincial que tenga su firma registrada ante la Dirección de Fauna y Flora Silvestre de la Nación. Este último organismo regula el comercio en la Ciudad de Buenos Aires y es quien autoriza las exportaciones de estos productos, ya sean pieles o pelos. Como se dijo más arriba, no hay operaciones de esquila de animales vivos. El pelo se obtiene pelando la piel, pero esa tarea no la hace el cazador, sino que recién se efectúa cuando el exportador compra las pieles. No se conoce que haya utilización de estas fibras por la industria textil local. Respecto a la cantidad de pelo que se obtiene de cada piel, la bibliografía cita diversos valores (Rabinovich et al., 1987; Cajal y Amaya, 1985), desde 250 hasta 500 gramos. Los valores menores corresponden a animales en cautiverio o semicautiverio, esquilados anual o bianualmente. Ya que el pelo que se Capítulo 17: Análisis del mercado 239 comercializa proviene de animales muertos, es razonable suponer que se obtiene la cifra máxima (500 gr/individuo), por lo que hemos empleado ese valor para los cálculos presentados en la Fig. 9. Pelo de camélidos domésticos La comercialización del pelo de llama sigue caminos similares a los de lana ovina criolla producida en el altiplano. Todos los años cada productor ofrece al mercado un volumen de pelo procedente de la esquila de parte de sus majadas. Son pocos los productores que realizan una esquila anual sistemática de todo su plantel. Así, los lotes conformados son bastante heterogéneos, no sólo en finura y color, sino también en largo de mechas. El producto de la esquila sigue alguno de los siguientes caminos: a) Parte del producido se destina al trabajo artesanal a nivel familiar, variando de acuerdo a que se trate de zonas de pastores-artesanos, o pastores estrictos. En áreas del Departamento de Yavi, Provincia de Jujuy, se ha calculado que un 16 % del pelo de llama y un 14 % de la lana ovina es utilizada en el nivel artesanal familiar. Otras zonas, como el perilago de la Cuenca de Pozuelos, está conformada por pastores estrictos, que sólo eventualmente hilan para su propia vestimenta. b) En las zonas de fuerte tradición hilandera o “telera”, como Barrancas, en Jujuy; Belén, en Catamarca; o San Antonio de los Cobres, en Salta, las familias artesanas deben proveerse de fibra extra, procedente de los grupos de pastores. c) El grueso de la producción de fibra de la región si bien se comercia en mercados locales, es finalmente absorbida o bien por algunas industrias textiles ubicadas en la periferia de la región (Santa María, en Catamarca y San Salvador de Jujuy) o bien por comerciantes de Buenos Aires. En este último caso, se destina principalmente a la exportación. Modalidades de acopio y venta Capítulo 17: Análisis del mercado 240 La esquila se realiza en la Puna a mediados de la primavera, principalmente desde fines de octubre hasta comienzos de diciembre. Además el productor ha ido guardando a lo largo del año la fibra de los animales faenados para su propio consumo y, en el caso de los ovinos, la de los animales faenados para los mercados zonales. Los productores ubicados en zonas de acceso relativamente fácil realizan su producción en algunos de los acopios regionales. Los acopiadores que hemos registrado son: 1. La Quiaca (Puna de Jujuy): * Sr. Morales * Sr. Zoraide * Sr. Chaille 2. Abra Pampa (Puna de Jujuy) * Sr. Puca Belén (Precordillera de Catamarca) * Sr. Pachado Desde luego que hay numerosos pequeños acopios locales, pero todos ellos finalizan vendiendo a alguno de los arriba mencionados. En La Quiaca, el tercer domingo del mes de octubre, con ocasión de una celebración tradicional, la Manka Fiesta, se concentran productores de muy alejadas zonas de la Provincia de Jujuy y Salta, quienes llevan consigo buena parte de su producción anual, que se realiza en este mercado. En esta celebración suele fijarse el precio de referencia para el resto de la temporada. Todo productor que no concurre se informa igual rápidamente del precio de “la Manka” y si bien puede aceptar precios menores, esa será su principal guía. Durante la realización de la Manka Fiesta (una semana) operan mecanismos de mercado típicos, con oscilaciones del precio de la lana y Capítulo 17: Análisis del mercado 241 del pelo de acuerdo a la oferta y demanda. Si hay órdenes de compra firmes de los exportadores, suele ir subiendo el precio desde el primer domingo al siguiente. En caso contrario, en años flojos, el precio inicial es muy bajo y se mantiene o incluso desciende de acuerdo a los volúmenes ofrecidos. El mercado de pelo de llama es enormemente oligopsónico, ya que hay sólo tres destinos posibles para volúmenes importantes de fibra: 1. La planta textil de Santa María, que si bien se abastece principalmente con fibra de Catamarca, recurre al mercado jujeño por lotes de fibra de colores claros. 2. Algún eventual comprador de países vecinos, Perú principalmente, que entran fundamentalmente cuando el precio es relativamente bajo (ver en Fig. 6 la aparición de ventas al Perú). Por cierto que las ventas de este tipo difícilmente se registran ya que pasan la frontera de modo ilegal. 3. La firma Leers, de Buenos Aires. En años “buenos” casi todos los acopiadores compran para esta firma, algunos de ellos incluso reciben financiamiento previo con ocasión de la Manka Fiesta. No hay venta cooperativa organizada. Los intentos en este sentido no han prosperado, debido a dificultades en la clasificación de los lotes y al largo plazo transcurrido hasta la venta efectiva. Dado que dichas experiencias se hicieron en contextos de alta inestabilidad macroeconómica y tasas inflacionarias desusadas, el productor medio se vio perjudicado prefiriendo una venta a menor precio pero al contado. De todos modos, la venta en modo cooperativo necesitaría de un mayor contacto con el usuario final del producto. Para que este sistema funcione, el productor debe obtener un precio superior al que obtendría por si mismo. Han habido experiencias exitosas en otras regiones del País con cooperativas laneras, pero el mercado presenta más canales alternativos. En lo que toca al pelo de camélidos domésticos, si el comprador final es casi exclusivamente uno, es lógico que no se sienta atraído a pagar un precio sustancialmente mayor por algunos lotes que serán de todos modos relativamente chicos. Capítulo 17: Análisis del mercado 242 Ninguna institución crediticia oficial, ni provincial ni nacional, ha decidido nunca financiar este tipo de acopio comunitario. Una cooperativa o centro ganadero de la mejor zona de la Puna, como la de Cieneguillas, no está en condiciones de reunir más de 3.000 kilos de fibra entre sus asociados, mientras que en la Manka Fiesta un comprador puede obtener con facilidad una cantidad de fibra diez veces mayor, comprada a centenares de pequeñísimos productores a menor precio. Un refuerzo de esta situación está originado en el escaso valor agregado al producto final que trae aparejado que el comprador tenga poco interés por fibras seleccionadas y clasificadas. Recién en los últimos años, gracias al esfuerzo de promoción del grupo de investigadores y extensionistas del PROMECA, se ha logrado, en unos pocos casos, que compradores puntuales de pequeñas cantidades de pelo hayan pagado precios diferenciados por lotes de alta calidad. Precios al productor No ha habido registros fiables de precios pagados al productor por el pelo de camélidos en las provincias de origen. Los comentarios de diversos informantes coinciden en que “en cierto momento”, hasta los primeros años de la década de los 80, el precio del pelo de llama al barrer duplicaba al de la lana de oveja criolla de la Puna. Sin embargo, desde que comenzamos nuestros relevamientos de campo, en 1987, los valores de ambas fibras se han mantenido en una relación 1 : 1. Los precios relevados (Manka Fiesta) en distintos años son: AÑO 1987 Capítulo 17: Análisis del mercado U$S 1,50 243 1987/88 1,20 1988/89 1,00-1,20 1991/92 0,50-0,80 En estos mismos períodos, lotes pequeños (hasta 1.000 Kg) de fibra de color blanco se han vendido a U$S 2,00-2,50, con un máximo de U$S 3,50. En ocasión de la Manka Fiesta de 1987, estimamos que los tres acopiadores de La Quiaca compraron un total de 120 Tn de fibra, de las cuales aproximadamente la sexta parte correspondió a pelo de llama. La mayoría de los productores ofrecían lotes de menos de 100 kilos entre lana y pelo, que se les compraba indistintamente al mismo precio, con la única excepción de la lana negra que se pagaba al 50 % más cara. Todas las operaciones fueron pagadas al contado, estimándose por lo tanto que cerca de 1.200 productores recibieron un total de U$S 180.000 de los acopiadores. Por lo tanto, al menos para la zona de influencia de La Quiaca, hemos constatado que hasta los productores más pequeños y alejados realizan su producción principalmente en el mercado monetario, y no en forma de trueques, como se citaba con frecuencia en la literatura. Exportación Pelo de guanaco Todas las operaciones comerciales de exportación de pelo de guanaco realizadas a lo largo de varios años, han sido efectuadas por una única firma (el Grupo Leers, constituido por dos empresas: Pelama, en la provincia de Chubut y Gustavo Leers, en Buenos Aires). Son ellos mismos quienes se ocupan de pelar las pieles. En la Fig. 9 se aprecia que el pelo es el tercer rubro de importancia entre las exportaciones de subproductos de guanaco. Sin embargo, en el año 1987, récord en este sentido, el pelo exportado (7.400 Kg) implica 15.000 ejemplares. Desde un punto de vista de una utilización sostenible Capítulo 17: Análisis del mercado 244 de este recurso natural, esa cifra parece a priori preocupante. El pelo de guanaco se exporta en bruto, no ha habido elaboración de tops, ni venta de pelo ya lavado. En la Fig. 1 se muestra la evolución de los volúmenes de exportación en los últimos 20 años. Puede apreciarse que hay fuertes oscilaciones. Las razones de esa variación se pueden deber más a que las cantidades absorbidas por la industria europea son muy chicas, ya que se lo emplea para ciertas mezclas (“blends”), que a una falta de producto a ofrecer. Por ejemplo, en los primeros seis meses de 1992, no se realizaron operaciones, y no hay pedidos firmes hasta este momento (T. Magnus, com.pers.). Sin embargo, la fibra de guanaco está considerada como excelente por la industria europea, al menos a juzgar por diferentes informes que hemos consultado, realizados por industriales europeos y consultores técnicos (Smith, 1987; Textil Outlook International, 1986). La Fig. 8 muestra los países de destino del pelo de guanaco para el periodo 1988-1991. Los precios, por su parte (ver Fig. 3) han experimentado una fuerte alza, que se sostiene en los últimos siete años. Los precios pagados en puerta de fábrica en Europa, según lo informa Smith (1987) por pelo de guanaco son por mucho los más altos de entre todos los pelos especiales, duplicando o triplicando al de cashmire (Fig. 16). Esos precios se justifican por la extremada finura de su fibra, que es comparable a la de vicuña, aunque algunos autores las consideran por igual (Fig. 15). Pelo de camélidos domésticos El pelo de llama, tal como se lo denomina comercialmente en el País, es comercializado al exterior desde el descubrimiento del pelo de alpaca por la industria inglesa, a mediados del siglo pasado. En la Fig. 2 se muestran las exportaciones de pelo de llama en bruto, mientras que la evolución de los precios y el valor total de estas exportaciones se presentan en las Figs. 3 y 5 respectivamente Capítulo 17: Análisis del mercado 245 Si bien de la Fig. 2 se percibe una merma sustancial de la exportación, debemos hacer una salvedad debida a la metodología empleada para el estudio. Desde muchos años atrás, el pelo de llama en bruto (sin cardar ni peinar) es distinguible con facilidad en las estadísticas oficiales de exportación, ya que le corresponde un número exclusivo de posición arancelaria (código aduanero). En los últimos años, la principal firma exportadora comenzó a producir tops de pelo de llama, por lo que eso explica parte de la merma de exportación de pelo en bruto, aunque no toda. Lamentablemente, la Aduana reúne en un único código o posición arancelaria los tops de todos los pelos finos (mohair, llama, conejo, etc), por lo tanto no puede conocerse de esas fuentes el volumen de tops de llama exportados. Para adentrar en esa problemática, hemos registrado las exportaciones de tops de pelos finos entre 1988 y 1991, las que se exhiben en la Fig. 10, en su mitad izquierda. Para 1990, si conocemos las exportaciones de tops de llama, que alcanzaron 34.988 Kg, de los cuales 8.200 fueron combinados (90 % llama, 10 % cabra) y el resto solo de llama (Fig. 13). Es decir que el 15 % de los tops de pelos finos exportados han sido de llama en ese año. Esto coincide con los valores que estima la propia exportadora, la cual sostiene que el 90 % de los tops exportados son de mohair y el 10 % de llama (T. Magnus, com. pers.). Los precios han oscilado desde U$S 2,73/Kg para el top mezcla hasta U$S 2,85/Kg para los de llama puros. En 1992, se han exportado en los primeros seis meses 35.000 Kg de tops de llama, sin que haya pedidos registrados para el resto del año (ibídem). En la Fig. 6 se indican los destinos del pelo de llama en bruto, y en la Fig. 10 los de los tops de pelos finos en general. Puede apreciarse que a partir de 1982, el Reino Unido desaparece como comprador de pelo en bruto, como consecuencia lógica del conflicto bélico con la Argentina. Sin embargo, del detalle de 1990, apreciamos que 20.100 Kg de tops de llama se destinaron al mercado inglés. La Fig. 10 indica a Alemania como principal mercado, pero parte de las exportaciones a ese país figuran así a nivel oficial, porque se desembarcan en el puerto de Bremen, pero Capítulo 17: Análisis del mercado 246 son adquiridas por una firma inglesa, mayorista, que revende a industrias del Reino Unido e Italia. Otro elemento a considerar, cuando se analiza la evolución de los precios de las exportaciones argentinas, es que debido a las diferentes y oscilantes políticas fiscales, ha habido periodos dominados por reembolsos a la exportación y otros dominados por quitas o retenciones, provocando respectivamente sobre y subfacturaciones (García Fernández, 1991). Para analizar las variaciones reales del precio, hemos expresado esos precios en comparación al de guanaco, ya que suponemos que sobre ambos han influido de modo similar las oscilaciones fiscales. En la Fig. 4 se presentan los resultados. Efectivamente, el mejor precio real habría sido el del período 1980-1984, que coincide con los precios al productor puneño que duplicaban al de lana ovina, según hemos considerado más arriba. En la Fig. 7 analizamos la dispersión de los precios de las exportaciones según el país de destino. Para cada año, conocemos el promedio por país y el promedio general anual, y hemos cotejado cada valor por país y año mediante: (Xi - X)/X obteniendo así un coeficiente comparable año a año. Obviamente, el coeficiente encubre situaciones provocadas por el volumen exportado a cada país. Un país que sea un fuerte comprador llevará el promedio anual a cifras próximas a su precio de compra. Sin embargo, los resultados presentados en la Fig. 7 permiten ver tendencias del mercado a lo largo de 15 años. Calidades Existe, de acuerdo a lo señalado, una única firma exportadora de tops de llama. Sin embargo, el producto ofrecido es de calidad bastante baja, siendo tops de colores sin mayor clasificación. Aparentemente habrían abandonado los esfuerzos por clasificar, que no fueron comercialmente exitosos (T. Magnus, com. pers.). Si comparamos los precios de exportación de tops de llama con los de importación de tops de alpaca llegados a la Argentina, vemos que el precio de estos últimos triplica al de llama (Fig. 11). El precio CIF de alpaca (tops) ha venido en alza en el período 1988Capítulo 17: Análisis del mercado 247 1991 (Fig. 12). Es necesario señalar que las importaciones de tops, si bien son escasas (Fig. 10), están indicando que algunas industrias argentinas están produciendo hilados o prendas con pelos finos. Los tops llegados al país son principalmente de alpaca peruana y en menor medida de mohair elaborado en Italia. Por lo tanto, si la industria está en condiciones de absorber algunos volúmenes de tops, o incluso de fibras finas en bruto (70 Tn en 1991, por poco más de un millón de dólares) es lícito preguntarse porqué razones no absorben cantidades sustanciales de fibra de camélidos domésticos producida en el País, tanto en bruto, como en tops. Quizás del análisis de la maquinaria de la industria instalada pueda surgir alguna luz sobre el particular. Por el momento no ocuparemos de señalar que no hay máquinas que hagan dehairing, esencial para producir tops de muy alta calidad, para industrias de productos exclusivos. Capítulo 17: Análisis del mercado 248 Fig. 1 - Exportaciones argentinas de pelo de guanaco (1970-1991) Fig. 2 - Exportaciones argentinas de pelo de llama sin cardar ni peinar (1975-1991) Capítulo 17: Análisis del mercado 249 Fig. 3 - Variación del precio del pelo de camélidos Fig. 4 - Variación de precios relativos de pelo de llama y guanaco (período 1970-1991) Capítulo 17: Análisis del mercado 250 Capítulo 17: Análisis del mercado Fig. 5 - Valor total de las exportaciones de pelo de llama y guanaco. Sin procesamiento industrial (1975-1991) 251 Fig. 6 - Destino de las exportaciones de pelo de llama sin cardar ni peinar (1975-1991) Fig. 7 - Análisis de la dispersión de los precios del pelo de llama por país de destino (1976-1991) Capítulo 17: Análisis del mercado 252 Fig. 8 - Destino de las exportaciones de pelo de guanaco (1988-1991) Fig. 9 - Exportaciones totales de guanaco 1988-1990 (Expresadas en miles de individuos) Capítulo 17: Análisis del mercado 253 Fig. 10 - Exportaciones e importaciones de tops de pelos finos (1968-1991) Fig. 11 - Precios de importación y exportación de diversos pelos finos (FOB y CIF Buenos Aires - 1990) Capítulo 17: Análisis del mercado 254 Fig. 12 - Precios de las importaciones argentinas de tops de alpaca procedentes de Perú (1988-1991) Fig. 13 - Composición de las exportaciones de pelo de llama (en kilogramos) Capítulo 17: Análisis del mercado 255 Fig. 14 - Rango de finuras de las principales fibras animales especiales Fig. 15 - Rango de finuras de las principales fibras animales especiales Capítulo 17: Análisis del mercado 256 Capítulo 17: Análisis del mercado Fig. 16 - Rango de precios de las principales fibras animales especiales (en puerta de fábrica en Escocia, julio 1987) 257 CAPITULO 18 LA FRONTERA AGROPECUARIA EN UN HUMEDAL DEL ALTIPLANO ARGENTINO Rodolfo Tecchi 1 Juan Javier García Fernández 2 Introducción Los Andes Centrales, que alcanzan su mayor expresión areal en Perú y Bolivia, se extienden hacia el Sur hasta ocupar un sector importante del noroeste de Argentina definiendo en su territorio una zona altiplánica singular. Sobre estas tierras altas se dispone una intrincada red de serranías subparalelas y transversales que determinan la formación de numerosas cuencas endorreicas. Estas áreas intermontanas, de acuerdo a ciertas variaciones climáticas dentro de un régimen regional arídico, pueden estar ocupadas en sus posiciones mas bajas por extensos salares o bien por cuerpos de agua someros que responden al tipo de lagunas en bolsón (Ringuelet, 1962). 1 2 Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. Trabajo presentado ante la III Conferencia Internacional sobre Humedales, Conservación y Desarrollo: El Uso Sostenido. Proyecto “Ecosistemas terrestres y acuáticos altoandinos” MAB-UNESCO-OEA. Capítulo 18: La frontera agropecuaria 258 Dentro de esta zona, en particular en la Provincia de Jujuy (Fig. 1), se encuentran dos comarcas lagunarias extensas: la cuenca de Guayatayoc-Salinas Grandes y la Laguna de Pozuelos. En estos ecosistemas la actividad humana productiva es casi exclusivamente pastoril, siguiendo el sistema trashumante tradicional en el mundo andino (Flores Ochoa, 1977); en este caso con un hato compuesto, principalmente, por ovinos y llamas. Las labores agrícolas se reducen a sólo algunas huertas familiares ubicadas en ciertos enclaves favorecidos. Desde hace aproximadamente un cuarto de siglo, en la cuenca de Pozuelos, cuyo espejo de agua se encuentra dentro de un área declarada Monumento Natural (Capítulo 2), se ha desarrollado la implantación de pasturas exóticas con el consecuente cambio del paisaje natural. En el presente trabajo se caracteriza esta innovación como un caso particular de avance de la frontera agropecuaria dentro de un ecosistema con ciertas cualidades de fragilidad. Las fuertes limitaciones ambientales que poseen los ecosistemas altiplánicos para el desarrrollo agrícola, se ven atenuadas en algunas áreas por factores íntimamente ligados a la presencia del humedal. De esta manera se hace preciso un análisis cuidadoso de las condiciones ecológicas generales en las que se desenvolverá el crecimiento y transformación de la actividad humana tradicional. Características ecológicas del área En la Fig. 2 se muestra un detalle de la cuenca de la Laguna de Pozuelos. El fondo del bolsón se halla a 3.600 msnm y las serranías circundantes mas altas llegan a superar los 4.500 msnm. Formada a partir de los movimientos tectónicos del ciclo Andico desde el Terciario al Pleistoceno inferior, esta comarca ha mantenido rasgos lacustres desde tiempos geológicos hasta la actualidad en la que sólo se encuentra un cuerpo de agua salobre, somero, con una profundidad de 1,5 m y un promedio de 0,5 m (Igarzábal, 1974). Este ecosistema se halla dentro del piso altitudinal “puna” en sentido amplio (Troll, 1968), y en forma mas restringida comprende partes de los Capítulo 18: La frontera agropecuaria 259 geosistemas suni y puna de Dollfus (1981). De todos modos una aplicación directa de las definiciones de los pisos ecológicos para los Andes Centrales, en el caso del altiplano argentino resulta de difícil correlación debido a la compleja conformación de ambientes (Tecchi, 1988). A los fines del presente trabajo, quizás sea el clima el elemento ecológico regional mas significativo por sus implicancias agropecuarias. La cuenca de Pozuelos, de casi 4.000 km2 de superficie, se halla bajo un clima frío y seco, con radiación solar intensa, gran amplitud térmica diaria y notable contraste pluviométrico estacional entre un invierno sin lluvias y un corto verano húmedo. La temperatura media anual varía con la altitud entre 8°C en las partes mas bajas de la cuenca hasta menos de 3°C a mayores altitudes. Las precipitaciones comienzan a producirse aproximadamente en el mes de octubre y se pueden prolongar hasta marzo o abril. La dinámica principal que las regula es el movimiento de masas de aire húmedo que provienen desde el anticiclón del Atlántico, y que cruzan las extensas llanuras y sabanas descargando gran parte de su humedad. Sobre las vertientes orientales de los Andes se reactiva su capacidad generadora de precipitaciones por fenómenos orográficos (Bianchi, 1981). Al llegar a la comarca de Pozuelos ya han vuelto a perder su humedad, pero aún así ocurren importantes lluvias, particularmente en los faldeos orientados hacia el este (Capítulos 1 y 2). En el área de interés las precipitaciones medias anuales varían entre los 300 y 500 mm, con grandes diferencias interanuales. En líneas generales, en el altiplano circundante la humedad desciende de EN a SO, desde 500 a menos de 100 mm anuales. No existe un buen registro de datos pluviométricos en la cuenca y prácticamente no hay información sobre temperaturas. De todos modos a partir de la interpretación de datos termográficos de estaciones vecinas y con registros pluviométricos de dos estaciones de la cuenca y observaciones efectuadas en una localidad de la parte mas árida de la puna argentina se ha elaborado una estimación del balance hídrico con el método de Thornthwaite (Tabla 1). Los vientos son fuertes y turbulentos, con velocidades frecuentes de 20 a 30 km/h y predominantemente del cuadrante oeste. Estas características aumentan las cualidades de sequedad del medio. Capítulo 18: La frontera agropecuaria 260 Las heladas son casi diarias en el invierno y comunes en el resto del año. Periódicamente la región se ve afectada por períodos plurianuales de sequía que producen efectos negativos sobre la actividad agropecuaria. La Laguna de Pozuelos posee límites imprecisos, variando la extensión del espejo de agua entre el ninal del verano (110 km2) y la terminación de la estación seca, llegando a veces hasta la total evaporación como consecuencia de las sequías persistentes. Los suelos de mayor aptitud para el uso agrícola se disponen sobre amplios abanicos aluviales que unen los bloques que contornean la cuenca con el fondo de ésta, correspondiendo al grupo de xerosales. Asimismo en la zona perilagunar se encuentran suelos de condiciones regulares. Los primeros poseen hasta 2 m de profundidad, texturas medias a gruesas, y la napa freática fluctuante puede hallarse a sólo 50 cm de la superficie. Sobre los sedimentos finos, algo arcillosos, del área circundante del espejo de agua se desarrollan suelos de menor calidad que suelen presentarse húmedos durante todo el año por efectos de una napa freática superficial a subsuperficial. El volumen de agua que puede almacenar la laguna, aún en su momento de mayor extensión, al final de la época húmeda, no supera los 75 millones de m3. Esto comparado con los 325 millones de escorrentía, que es posible estimar que han circulado hacia el espejo de agua al terminar el verano, dan sustento a lo postulado por Muhlhauser (1987) en el sentido de considerar a la Laguna de Pozuelos como un nivel aflorante de un acuífero de mayores proporciones y singular importancia para la dinámica del ecosistema. En el perfil de la Fig. 3, se muestra las principales asociaciones vegetales en relación a distintos niveles de la cuenca. Aquí es necesario destacar que tres de ellas se encuentran vinculadas a la presencia de humedad permanente. En las partes altas suelen presentarse las vegas, ricos pastizales que se mantienen a expensas de afloramientos de agua en las cabeceras de pequeñas cuencas secundarias. Por otra parte en el área perilagunar, sobre suelos siempre húmedos, se desarrolla un pastizal, dominado por Festuca, de mas de 40 cm de altura. Finalmente a medida que se retrae el espejo de agua por evaporación en la estación seca, se desarrolla una asociación denominada localmente “colcha”, conformada por un césped de Distichlis que crece sobre el suelo que se va descubriendo y la singular hidrofitia que permanece como resaca sobre las costas. Capítulo 18: La frontera agropecuaria 261 Actividad humana y estado de los recursos naturales La actividad productiva casi exclusiva es el pastoreo de ovinos y camélidos y a veces, caprinos y bovinos. Solamente algunos emprendimientos mineros aislados completan la producción en la cuenca. El pastoreo sigue un sistema tradicional de trashumancia (Merlino et al., 1978) con el objeto de aprovechar estacionalmente los pastos de las distintas unidades de ambiente. Por lo general, las vegas de altura y pastizales circundantes son utilizados en invierno, mientras que en el estío los rebaños se encuentran en quebradas intermontanas y conos aluviales aprovechando el forraje de las estepas arbustivas favorecidas por las lluvias. Sólo en el área de Pozuelos, se ha descripto una inversión de este ciclo, al mantenerse los hatos ganaderos en los pastizales perilagunares en el invierno para luego ascender a las quebradas interserranas (García Fernández et al., 1985). La densidad de la población humana (1,5 hab/km2) es tres veces mayor en esta cuenca que el promedio de la zona rural altiplánica argentina. La unidad productiva es de tipo familiar, y por lo general abarca una extensión de territorio que permite el acceso a las diversas áreas de pastoreo estacionales. La carga animal varía alrededor de una media de 1,4 unidades ovinas/ha, lo cual se halla por encima de lo recomendable para la región (0,5 u.o./ha) (Alzerreca, 1982; Varano et al., 1984). Esto se relaciona con el estado de los recursos naturales ya que el sobrepastoreo facilita el accionar de agentes erosivos, principalmente viento y agua (Capítulos 15 y 19). En la Fig. 4 se muestra las relaciones más importantes del ecosistema estudiado. A partir de mediados de la década del 60, a través de planes gubernamentales de promoción del desarrollo y con el fin de mejorar las condiciones de producción pecuaria, se han introducido técnicas de implantación de pasturas exóticas tales como el pasto llorón (Eragrostis curvula) y avena (Medicago sativa). En la actualidad se han roturado y sembrado más de Capítulo 18: La frontera agropecuaria 262 10.000 ha en la cuenca, ocupando los mejores suelos y reemplazando la estepa arbustiva de los sectores distales de los conos aluviales. Esta acción se ha acompañado con la introducción de reproductores ovinos de mayor calidad en la producción de carne y lana en relación con los animales criados tradicionalmente. La cuenca de Pozuelos como frontera agropecuaria Comúnmente la frontera agrícola se ha relacionado con importantes movimientos de población migrante bajo formas de campesinos pioneros (Monbeig, 1981). Sin embargo, en el caso aquí estudiado la cualidad que define la frontera es el cambio en la producción que trae como consecuencia cierta transformación en el paisaje original (Adámoli et al., 1980). Se acepta que la actividad de pastoreo tradicional ha producido, en tiempos históricos, variaciones paulatinas en la composición de la vegetación de estos ecosistemas altiplánicos sudamericanos (Ruthsatz, 1983); y sin duda la introducción de ovinos ha causado, desde la época colonial, un impacto significativo en los recursos naturales (Posnansky, 1982). Dentro de la cuenca de Pozuelos nos encontramos por debajo del límite altitudinal del cultivo de la región (Tecchi et al., 1986), concepto que en los Andes se halla íntimamente relacionado a la frontera agrícola. Cardich (1980) ha estudiado, en la cuenca del Lago Titicaca, en Perú, con una de las mas altas densidades de población rural en el altiplano, la evolución que la frontera del cultivo ha tenido en los últimos 4.300 años. También en este caso un área de humedal, aunque con suficiente extensión del cuerpo de agua como para influir por si mismo en las condiciones climáticas microrregionales, se convierte en punto central de la dinámica de la frontera agropecuaria. La presencia de la Laguna de Pozuelos se halla vinculada tanto a características geomorfológicas como a las cualidades climáticas benignas, principalmente en lo referido a las precipitaciones. Asimismo esta Laguna le ha conferido al área peculiaridades ecológicas que han favorecido el crecimiento de recursos forrajeros de gran valor y a la vez crea condiciones ambientales propicias para la introducción de pasturas alóctonas. En la Tabla 1 se muestra que en las estaciones de la cuenca, el Capítulo 18: La frontera agropecuaria 263 almacenaje de agua en los suelos (aun estimándolo en un máximo de 100 mm) permite reducir el fuerte déficit hídrico a solamente cuatro a cinco meses del año en contraste con sectores de la “puna árida” donde el período es de apenas un mes. Estas características refuerzan la importancia que posee en el área del espejo de agua y en su vecindad este acuífero. De todos modos también se comprueba la fragilidad ecológica del sistema estudiado tal como lo muestra la variabilidad interanual que puede ocurrir en las precipitaciones. Además tanto la aparición algo temprana como el retraso de las lluvias producen efectos importantes sobre la productividad de una comunidad vegetal ajustada a un ciclo de vida particular (Ruthsatz et al., 1984). Esta labilidad ecosistémica unida a condiciones de relativamente poco disturbio, caracterizan a la sustitución de la vegetación natural por forrajeras alóctonas como un avance de la frontera agropecuaria sobre un área aun no incorporada a una explotación intensiva. Conclusión Aún con la incorporación de solamente el 3 % de su superficie a la siembra de pasturas, la cuenca de la Laguna de Pozuelos representa un caso singular de avance de la frontera agropecuaria en el altiplano, en un sector sometido hasta ahora a una acción humana que, respondiendo a un sistema tradicional de pastoreo, ha sido poco disruptiva del medio. La presencia del cuerpo de agua le confiere a la comarca características especiales que la transforman en un área propicia para la consolidación de esta frontera como forma de avance de un uso intensivo del suelo. Hasta el presente no se había considerado la posibilidad de esta incorporación de nuevas fronteras en el altiplano en los próximos diez años (Gligo et al., 1981) cuando aparece como fenómeno mas visible el avance sobre tierras aun incultas en las quebradas templadas y en las sabanas y bosques pedimontanos. Los autores concluyen que es posible caracterizar como un incremento del uso intensivo de recursos naturales a los fenómenos producidos en el humedal estudiado y consecuentemente es recomendable atender los efectos ecológicos que, en estos enclaves de tierras altas favorecidos, pueden tener a mediano plazo las acciones de reemplazo de las formaciones vegetales autóctonas. Capítulo 18: La frontera agropecuaria Tabla 1 Comparación de balances hídricos estimados para dos estaciones pluviométricas de la cuenca de Pozuelos y una de la “puna árida” EP E F M A M J J A S O N D An. 70,7 61,5 63,0 53,8 31,3 14,8 15,5 27,9 45,0 62,1 67,6 76,5 589,7 S 154,5 103,9 63,6 4,2 1,5 3,2 0 0 2,2 10,2 40,2 109,5 493,0 P C 124,2 102,8 52,0 7,3 5,9 7,2 0 0,3 6,0 11,7 30,7 94,9 443,0 P U 94,4 36,8 7,6 0,9 1,8 0,3 0 0 0,8 1,7 4,3 35,7 184,3 Ac S 100 50,4 20,6 9,0 0 0 0 0 0 33,0 Ac C 71,9 100 88,4 41,9 16,5 8,9 0 0 0 0 0 18,4 Ac U 23,7 0 0 0 0 0 0 0 0 V S 7,1 V V 100 100 0 0 0 35,7 64,2 100 100 86,7 100 100 100 100 84,0 42,8 69,2 C 38,5 23,1 53,8 100 100 100 100 100 100 100 84,6 69,2 69,2 U 55,5 66,6 100 100 100 100 100 100 100 100 100 78,0 100 Ref.: EP: evapotranspiración potencial (mm); P: precipitación media (mm); Ac: acumulación estimada en el suelo (mm); V: porcentaje de ocurrencia de valores menores a la evapotranspiración potencial (%); S: Santa Catalina; C: Cieneguilla; U: Susques. Elaborado con datos pluviométricos correspondientes al período 1970/74, Dirección de Hidráulica de la Provincia de Jujuy. 265 Capítulo 18: La frontera agropecuaria P 266 Fig. 1 - Cuencas endorreicas principales de la Provincia de Jujuy Capítulo 18: La frontera agropecuaria 267 Fig. 2 - Cuenca de Pozuelos Capítulo 18: La frontera agropecuaria 268 Capítulo 18: La frontera agropecuaria FORMACIONES ESPECIES PRINCIPALES 0 1 2 3 4 5 6 7 8-9 10 Midrofitia “Colcha” Pastizal perilagunar Pastizal implantado Estepa arbustiva Estepa arbustiva Estepa arbustiva Estepa arbustiva Vega Bosque de Queñoa Miriophylum elainoides - Chara vulgaris Distichlis humilis Festuca sp. - Distichlis sp. - Poa sp. Eracrostis curvula - Medicago sativa Parastrephia lepidiophylla - Festuca sp. Fabiana densa - baccharis boliviensis Baccharis boliviensis - Adesmia sp. - Opuntia sp. Fabiana densa - Stipa sp. - Poa sp. - Baccharis sp. Distichlis humilis - Juncus sp. - Muhlenbergia sp. Polylepis tormentella Fig. 3 - Perfil de la cuenca y asociaciones vegetales principales 269 Fig. 4 - Esquema de las relaciones principales en el ecosistema Laguna de Pozuelos. (García Fernández et al. 1989) Capítulo 18: La frontera agropecuaria CONSERVACION EN LA PUNA Y CORDILLERA FRONTAL 272 Vicuñas Reserva de Biosfera Laguna de Pozuelos, Jujuy Llamas en el altiplano de Jujuy Capítulo 19: Conservación de camélidos 273 CAPITULO 19 LA CONSERVACION DE LOS CAMELIDOS SILVESTRES EN LA PUNA Y CORDILLERA FRONTAL I - Situacion de la vicuña en la region. Pautas para su manejo Jorge Luis Cajal 1 Juan Javier García Fernández 1 Rodolfo Tecchi 2 Introducción Marco general La vicuña (Vicugna vicugna) es uno de los pocos ejemplos donde prohibiciones oficiales sobre su caza y comercialización, permitieron la recuperación de la especie en gran parte de su área de distribución en América del Sur (BOX 1). Esta situación contrasta con otros casos donde 1 2 FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. Instituto de Biología de la Altura, UNJu, Avda. Bolivia 1663, (4600) San Salvador de Jujuy, Argentina. Extracto de la obra “Situación de la vicuña en la República Argentina. Lineamientos para un programa nacional de manejo”. FUCEMA. 1997. Capítulo 19: Conservación de camélidos 274 las prohibiciones gubernamentales no salieron de la formalidad del papel escrito. Al respecto, el solo hecho de restringir la apropiación del recurso puede en muchos casos no ser suficiente para una recuperación real de las poblaciones, a niveles en los que la probabilidad de extinción disminuya ciertamente. Las acciones administrativas mas elementales son de carácter prohibicionista o restrictivo. Muchos países prohiben genéricamente la caza, captura y comercio de las especies listadas como amenazadas o vulnerables. Otros directamente prohiben todo uso de todas las especies del país sin distinción. En general, los países que han adoptado este último esquema de acción como Brasil o Perú, tienen serias dificultades para aplicar en la práctica las prohibiciones estrictas que figuran en el papel. La lógica que subyace en esas leyes es que para conservar una especie basta con restringir el derecho de apropiación. La prohibición de la caza y comercio de especies amenazadas no es suficiente en la mayoría de los casos. Aunque la fiscalización sea eficiente (lo cual es materia opinable), varias especies regresionan por modificación de su habitat u otras causas, sin que haya actos de caza furtiva o comercio alguno (García Fernández, 1995). res: El éxito en la conservación de la vicuña se debió a varios facto- 1. El establecimiento de un convenio internacional (Convenio de la Vicuña) suscrito por Bolivia y Perú en 1969, con la posterior adhesión de Argentina en 1971, de Chile en 1972 y Ecuador en 1979 (Cajal, 1983). 2. Este Convenio de protección y manejo fue una herramienta catalizadora para que los distintos países del área implementaran acciones para la conservación de la especie, fundamentalmente a través de la implementación de áreas naturales protegidas, con sistemas de controles a campo. Fue un ejemplo de política regional consensuada donde los estados realizaron inversiones para la conservación de un recurso natural compartido. 3. La vicuña, especie endémica de la región andina, ha sido percibida como una especie clave de la región. Es uno de los herbívoros silvestres que aportan una importante biomasa para la región (ver Capítulo 14). Históricamente formó parte de la cultura y economía local (Forni, 1985). 4. Las medidas de conservación tuvieron éxito dado que en gran medida fueron aceptadas y acatadas por las comunidades rurales locales (Temas, 1986). Capítulo 19: Conservación de camélidos 275 5. Representa una especie «carismática» y «paraguas» en el sentido dado al término por Noss (1990). Etapas de conservación de la vicuña en Argentina En Argentina podemos definir tres etapas en relación a la vicuña: 1. Epoca previa a 1977. Sin controles ni planes de manejo, existencia de caza furtiva y sin datos confiables sobre situación de poblaciones. No obstante existía un rico historial normativo en lo referente a la especie (Martelli, 1985) 2. Período 1977 a 1984. Se implementan las reservas andinas, realizándose tareas sistemáticas de censos poblacionales y control sobre la caza furtiva en el marco del Proyecto Conservación y manejo de los camélidos silvestres en las provincias de San Juan, La Rioja y Catamarca apoyado por el Programa Nacional de Recursos Naturales Renovables de la Secretaría de Ciencia y Técnica (SECYT) y los respectivos gobiernos provinciales. 3. Período 1985 al presente. Aparecen grandes falencias que atentaron contra la continuidad de los trabajos de conservación, surgiendo grandes altibajos en el control del furtivismo. Las tareas de censo se discontinúan y se relaja la presencia de guardafaunas en las reservas. Ante las falencias apuntadas existen áreas en las que el furtivismo aumentó como lógica consecuencia, incentivado además por una mayor oferta de animales. Esto ha sido comprobado en distintos viajes de campo y reflejado en recientes notas de la prensa. La principal causa de los problemas descriptos fue la falta de inversiones adecuadas tanto a nivel provincial como nacional y falta de políticas y de programas (nacionales o provinciales) para el sector. Esta situación fue crudamente planteada en varias importantes reuniones: la II REUNIÓN Multisectorial sobre Camélidos Sudamericanos (san Salvador de Jujuy, noviembre de 1989; la V Reunión Nacional de la Vicuña (San Juan, agosto de 1989); la III Reunión Multisectorial sobre Camélidos Sudamericanos (Belén, Catamarca, octubre de 1989) y en la Reunión constitutiva de la Comision Nacional de Camelidos (Santa María, Catamarca, agosto de 1990). En todos los encuentros mencionados se planteó como tema prioritario la actualización de los censos poblacionales que permitan conocer Capítulo 19: Conservación de camélidos 276 fehacientemente el número de vicuñas a nivel nacional, comprometiéndose todos los organismos públicos y privados intervinientes a aunar esfuerzos para retomar las tareas de campo y mejorar los controles sobre el furtivismo. Sin embargo, hasta la fecha no se ha modificado sustancialmente dicha situación con la excepción de Pozuelos y Olaroz en la provincia de Jujuy. Paradójicamente, a partir de 1990, comienzan a surgir propuestas para el aprovechamiento comercial de la especie. A raíz de lo descripto, los objetivos del presente capítulo son: actualizar los datos sobre la situación de la vicuña en toda su área de distribución en la Argentina y llamar la atención sobre la urgente necesidad de delinear un programa nacional de conservación y de utilización de la vicuña. BOX 1 La vicuña en la América Andina: situación poblacional El área de distribución de la vicuña en América del Sur ocupa 500.000 km2 en cifras redondas. Según estimaciones anteriores (Torres, 1992; Cajal, 1991), la población rondaba los 140.000 - 160.000 ejemplares. El 78 % de dicha cantidad se encontraba dentro de áreas naturales protegidas o reservas (Cajal, 1991). En base a información mas reciente la situación poblacional sería la siguiente (Tabla 1). Distribución de la vicuña El área de distribución actual de la vicuña en la Puna y parte de la Cordillera Frontal (norte de San Juan), comprende 92.000 km2 en cifras redondas. Tomando como base el mapa de vegetación de Hueck y Seibert (1972), la vicuña ocupa entre los 3.000 y 4.600 msnm, seis fisonomías diferentes de vegetación: halofítica, vegas, estepas graminosas, praderas, estepas arbustivas y estepas arbustivas abiertas en parte con cactáceas columnares y tolares. Capítulo 19: Conservación de camélidos 277 Tabla 1 Números poblacionales en los países andinos País N° vicuñas Argentina Sup. (km2)(3) Autor/año 25.438(1) 36125 Presente trabajo 12.047 99704 Villalba (1992) Chile 26.336 26350 Araya y Contreras (1994) Bolivia Ecuador 522(2) 540 INRENA (1994) Perú 66.559 65981 INRENA (1994) Total 130.891 228700 Ref.: (1): Se trata de números poblacionales definidos (NPD) y posibles (NPP) , ver texto; (2): A partir de planteles introducidos provenientes de Chile, Bolivia y Perú; (3) Superficies cubiertas por los censos y/o correspondientes a los números poblacionales estimados. Situación poblacional de la vicuña Metodología empleada Para el análisis del estado poblacional de la especie se consultaron y analizaron en detalle cuatro fuentes de información: a) Las informaciones propias a partir de relevamientos realizados en terreno, utilizando la metodología del censo completo por sectores y transectas; b) Los formatos o planillas de campo donde los diferentes equipos provinciales de censo volcaron los números contabilizados en distintos momentos y localidades (censo completo por sectores); c) Los datos registrados por informantes calificados en distintos sitios del área de distribución procesados por el banco de datos de avistajes de fauna silvestre de la Fundación para la Conservación de las Especies y el Medio Ambiente (FUCEMA), Capítulo 19: Conservación de camélidos 278 d) Las estimaciones brindadas por las provincias y trabajos de relevamiento ocasional realizados por distintos investigadores. Los datos de las planillas censales (tanto propias como la de los guardafaunas provinciales) fueron ajustados a los diferentes sectores y sitios luego de que los mismos fueran mapeados con el objetivo de obtener la superficie para los cálculos de la densidad y poder hacer comparables los datos para el cálculo de las tasas de cambio poblacional. Las planillas censales discriminan los siguientes ítems: Número de machos, hembras y crías; número de grupos familiares; número de tropas de machos; número total de machos en dichos grupos; número de individuos solitarios; número de individuos en grupos no diferenciados; número total de vicuñas. En los casos donde surgen dificultades en la determinación del sexo, generalmente en grupos constituidos únicamente por adultos, los mismos son volcados en las planillas como grupos no diferenciados. Adicionalmente se puede obtener el tamaño medio de los grupos familiares (Capítulo 11). De acuerdo con la información disponible se discriminaron los datos, de acuerdo a la confiabilidad de los mismos, en tres categorías: 1. Números poblacionales definidos (NPD). Cuando los datos provienen de censos realizados según la metodología de censo completo y directo por sectores o mediante muestreos con transectas, y han sido chequeados a nivel primario (formatos de campo con los datos brutos referidos a cada sitio o sector). Estos datos son considerados de alta confiabilidad. 2. Números poblacionales probables (NPP). Cuando los datos no han sido chequeados a nivel primario. Son considerados de confiabilidad media. 3. Números poblacionales especulativos (NPE). Cuando no hay datos de campo, las cifras son simples presunciones u obtenidas mediante encuestas u otros métodos indirectos. Son considerados de baja confiabilidad. Para el cálculo de la sumatoria de los números poblacionales (NPD, NPP, NPE), se consideró para cada sector o localidad el censo y/o información correspondiente al último año de datos disponibles. Capítulo 19: Conservación de camélidos 279 Situación y tendencias La situación actual de la vicuña en Argentina, se puede ilustrar a través de tablas con dos entradas, donde se presenta el número de animales censados por año y por localidad/sector/sitio. Aparece entonces un mosaico de celdas llenas (donde hay datos, el número contabilizado) y vacías (sin datos). Este mosaico refleja el grado de intensidad y continuidad de los censos poblacionales en las distintas localidades y sectores desde el año 1978 al presente. En algunos sectores, la periodicidad e intensidad de los censos permitieron además obtener parámetros poblacionales básicos, como la tasa de incremento anual (I %), y la tasa exponencial de crecimiento observada (r) (Cajal, 1991; Capítulo 11). En la Tabla 2, se indica la situación de la vicuña en distintas localidades a lo largo de su rango de distribución, y en la Fig. 1, las tendencias poblacionales en términos de densidad. Los números poblacionales definidos (NPD) suman 18.947 vicuñas, para una superficie de 36.195 km2. Considerando la sumatoria de las columnas de la tabla 6 (NPD + NPP + NPE), referida a los números poblacionales, y luego de calcular las diferencias correspondientes para cada fila de la tabla, se obtiene una cifra estimativa de 35.019 vicuñas para Argentina. Factores a tener en cuenta para el manejo de la vicuña: Distribución ecológica y uso de habitat La distribución de la vicuña no resulta homogénea (Cajal 1989; 1991). Existen amplias áreas (interior de grandes salares, alturas por arriba del límite de vegetación, >5000 msnm, llanos de extrema aridez, prácticamente sin vegetación, pendientes abruptas con alto grado de rocosidad) que no son utilizadas por las vicuñas. De hecho, en Olaroz, Los Andes, Laguna Brava y San Guillermo, las áreas no habitables por vicuñas, representan el 30%, el 21%, el 50% y el 30% respectivamente (Cajal, 1991). Dado la distribución heterogénea de la vicuña dentro de la región, como así también sus diferentes densidades según las áreas (Tabla 2), no resultan adecuadas las extrapolaciones. De acuerdo a lo mencionado y considerando las perspectivas futuras de la especie en cuanto a su manejo, debe tenerse en claro que existen extensas áreas dentro de su Capítulo 19: Conservación de camélidos 280 Capítulo 19: Conservación de camélidos Tabla 2 Números poblacionales de vicuña en distintas localidades Provincia Localidad Grado de Superficie NPD NPP NPE Densidad manejo (km2) Bruta (V/km2) San Juan San Guillermo (FZN) San Guillermo (ZN) RB RB 6450 2150 1399 6053 0,2 2,8 La Rioja Laguna Brava (ß) Estanzuela (ß) RP AL 3400 225 532 1100 94 0,2 0,4 Catamarca Laguna Blanca (1) Laguna Blanca (2) Antofagasta Aguas Calientes (3) (ß) RB RB ALCE AL 1000 3771 3870 2000 1850 705 1000 150 241 3,8 Salta Los Andes (ß) Dto Los Andes RP AL 14400 1030 15200 2000 500 0,4 1,6 Tabla 2 (Continuación) Números poblacionales de vicuña en distintas localidades Provincia Localidad Grado de Superficie NPD NPP NPE Densidad Bruta (V/km2) Jujuy 1,2 0,2 3,1 Olaroz Vilama (ß) Pozuelos (4) Sta Victoria (5) Palca de Aparzo (5) Caballo Muerto (5) Abra de Zenta (5) Casa Colorada (5) Chañi (5) Salinas Grandes (6) Guayatayoc (6) Vicuñayoc-Colorado-Larca (5) RP AL RB AL AL AL AL AL AL AL AL AL 1800 2075 6500 (5) 590 (5) 970 147 (7) 877 2750 546 268 558 295 385 350 690 180 316 110 1589 568 ? 67 ? 83 ? 5100 Ref.: ZN= zona nuclear; FZN= fuera de la zona nuclear; RB=reserva de la biosfera; AL= área libre sin control; RP=reserva provincial; ALCE=área libre con control esporádico; NPD=número poblacional definido; NPP=número poblacional probable; NPE=número poblacional especulativo; (1)= Sector Laguna Blanca; (2)= reserva de Laguna Blanca excluido el sector del mismo nombre; (3)= Fra, 1996; (4)= sectores de Pan de Azúcar, Yoscaba, Pasajes, Pozuelos, Sta Catalina y Carahuasi; (5)= Cabezas, 1994; (6)= Contados desde la ruta, 1994; (7)= Perovic, 1996. La columna referida a la densidad esta sacada en base a los NPD; (ß): Zonas “calientes” donde hay caza furtiva. La misma ha sido detectada a través de despojos de animales cazados encontrados en el campo, datos de informantes y distancia de fuga de los animales > 500m. En la región de Vilama, en la frontera lindante con Bolivia, los cazadores provenientes de dicho país, arrean los animales desde el lado argentino al boliviano para cazarlos, inclusive con el apoyo de camiones para transportar los cueros. 281 Capítulo 19: Conservación de camélidos manejo (km2) 282 área de distribución que por sus condiciones limitantes para la vida (y/o por no corresponder a los habitas preferidos) no van a ser ocupadas por las vicuñas (salvo como lugares de tránsito o de manera esporádica) aún con el aumento de sus densidades. En cuanto al uso de habitat, los estudios realizados en San Guillermo señalan que los lugares preferenciales (o permanentes de actividad) están constituidos por los llanos, laderas no rocosas de pendiente suave y vegas (Cajal, 1989; ver Capítulo 10). Mapeando éstas áreas ocupadas por las vicuñas nos permite discriminar la densidad bruta de la densidad ecológica (BOX 2). De esta manera y de acuerdo a los últimos años censados en el área nuclear de la Reserva San Guillermo, la densidad bruta de 2,8 indiv./km2 se convierte en una densidad ecológica de 3,8 indiv./km2 para los mismos sectores. Para el futuro manejo de la vicuña, independientemente de que sistema productivo se adopte, se debe trabajar en base a las densidades ecológicas, teniendo en cuenta además, la heterogeneidad ambiental en los casos de uso compartido con el ganado doméstico o con otros herbívoros silvestres como el guanaco. Dos temas son importantes ha tener en cuenta para el manejo futuro de la especie: la heterogeneidad ambiental y el uso de habitat por parte de la misma. La primera es importante en aquellas localidades donde la vicuña comparte el mismo territorio con el ganado doméstico bajo un sistema de crianza extensivo pastoril. BOX 2 La densidad bruta o cruda, se refiere a la población total presente en términos de área base total considerada, no esta corregida a las preferencias de habitat. La densidad ecológica se refiere a las densidades calculadas a partir del área base total pero corregida según las preferencias de habitat, incluye solamente aquellos habitats utilizados por la especie en cuestión.(Ver Eisenberg et al., 1979). Capítulo 19: Conservación de camélidos 283 En la Fig. 3 se indica la biomasa de los grandes herbívoros (silvestres y domésticos) en relación con la capacidad de carga (K) en las tres reservas de la biosfera presentes en la región: Pozuelos, Laguna Blanca y San Guillermo. La capacidad de carga fue definida a partir de la relación lineal de COE aplicada por Rabinovich et al. (1991) para Laguna Blanca (BOX 3)3: BOX 3 Relación lineal de COE Y = -1,2202 + 1,75596 X (r =0,894); n=24), donde: Y es el log. decimal de la biomasa de herbívoros (kg/km2); X es el log. decimal de las precipitaciones (mm/año) la estimación de K es a partir de la biomasa de herbívoros/ peso promedio del adulto Si bien, la utilización de las fórmulas mencionadas para el cálculo de la K permite a nivel teórico una rápida comparación y sacar conclusiones generales (este es el objetivo de su inclusión en el presente trabajo), las mismas deben tomarse con precaución para los fines prácticos. El modelo de Coe y sus modificaciones tiende a sobrevalorar la biomasa por unidad de precipitaciones en áreas pobres en nutrientes (Kreuter y Workman, 1994). Determinar la capacidad de carga o de pastoreo a los fines de manejo no resulta tarea sencilla. Al respecto, deben considerarse un conjunto de factores tales como las fluctuaciones del clima, las variaciones en la producción de forraje y su grado de palatabilidad, variaciones en las preferencias por 3 Se consideraron aquellos sectores con mayores densidades y los cuales han sido censados periódicamente: zona nuclear de San Guillermo (2150 Km2); sector Lag. Blanca en la reserva del mismo nombre (1000 Km2); sectores de Pan de Azúcar, Yoscaba, Pasajes, Pozuelos, Sta Catalina y Carahuasi en Pozuelos (900 Km2). Para Laguna Blanca, Rabinovich et al (1991) menciona una K de menor valor (310 Kg/Km2) debido a que dichos autores tomaron una media de precipitaciones de menor valor (130 mm/año). Capítulo 19: Conservación de camélidos 284 parte de los animales, características particulares de los diferentes sitios, entre otros. Una vez definidos los sitios en base a sus particularidades, la estimación de K para cada uno de los mismos debe monitorearse periódicamente a fin de ajustar los datos a una realidad cambiante. Sistemas productivos posibles en relación con la utilización de la vicuña Para definir un sistema productivo basado en poblaciones de vicuñas silvestres se deben considerar las siguientes variables: Situación legal a nivel nacional e internacional; mercado actual y potencial y el cálculo del costo/beneficio; usuarios (sectores rurales) y distribución de los beneficios; sistemas de control y fiscalización existentes; disponibilidad de datos de base; las características biológicas de la especie. La demanda campesina Las comunidades rurales, principalmente aquellas que presentan alto grado de aislamiento han percibido a la fauna circundante como una oportunidad de aumentar su dieta proteica y/o sus ingresos. En muchos casos las medidas conservacionistas implican una privación de recursos para una parte de la población rural. Por otra parte, en su relación con el ganado doméstico, los pastores evalúan positivamente mas la cantidad que la calidad, al estar la cantidad en una economía de trueque tradicional asociada con poder (Forni, 1985, 1987). En la Puna sectores campesinos están planteando la necesidad de ser recompensados por las externalidades que les ocasiona las medidas proteccionistas de la vicuña, principalmente debido al uso en común con el ganado doméstico de las pasturas naturales, planteamiento que se hace cada vez mas insistente a medida que las poblaciones de vicuña se incrementan. Estos sectores plantean la necesidad de tener una salida redituable con la utilización de la especie. El costo-beneficio Dentro de la perspectiva de la utilización de la vicuña, el beneficio neto que se puede obtener por cada unidad de esfuerzo, es función de la densidad y del esfuerzo de captura, del precio de los productos en el mercado y de los costos generales operativos. Existe una densidad mínima por debajo de la cual el operativo para la utilización de la especie resulta Capítulo 19: Conservación de camélidos 285 antieconómica. Hofmann y Otte (1983) calculan esta densidad mínima en 10 vicuñas por km2 en la Puna. Rabinovich et al (1991) desarrollan un modelo de saca considerando los beneficios y las densidades (equivalentes vicuña/km2) tomando como base 8 vic/km2. La prohibición de comerciar todo producto de la vicuña, tiene antigua data. Esta situación alimentó las especulaciones en cuanto al valor de éstos animales, principalmente en lo referente a su fibra. No obstante, se disponen de algunas aproximaciones. Al respecto, para Rabinovich et al. (1991), el valor monetario de una vicuña adulta alcanzaría los 64 U$S, según la siguiente discriminación: 19 U$S por la fibra (75 U$S el kg de fibra con una producción de 0,25 kg/individuo); 10 U$S para la carne (20 kg/individuo a 0,50 U$S el kg); 35 U$S por el cuero (Tabla 3). Los modelos Respecto a la utilización de la vicuña, se han desarrollado modelos de simulación a partir de los parámetros poblacionales de la especie. Uno de los modelos (Rabinovich et al., 1985; 1987), hace énfasis en la maximización de los beneficios netos a partir de poblaciones de vicuñas bajo utilización mediante el sistema de capturas con redes tipo mangas, esquila viva y posterior suelta al medio natural. Corresponde al sistema de rodeo estacional de poblaciones silvestres. Este sistema esta restringido a situaciones con cierta disponibilidad de tecnología (unidades de captura, corrales de encierre temporarios), abundante mano de obra y capacidad de inversión. Esta planteado dentro de un contexto de libre mercado donde la tasa de descuento juega un rol importante. El otro modelo (Rabinovich et al., 1991), esta basado en la utilización de la vicuña por parte de una típica comunidad rural de la puna catamarqueña (Laguna Blanca), de economía austera, con baja capacidad de inversión de capital y alto grado de aislamiento. Este modelo relaciona los posibles beneficios obtenidos a partir de la saca de vicuñas con las otras actividades económicas vigentes (sistema pastoril basado en llamas y ovinos) y la educación rural. Contempla mejorar la renta de los campesinos y permitirles invertir en sus actividades económicas tradicionales. Se sustenta en el modelo logístico, asumiendo una máxima cosecha sostenida en base a la capacidad de carga del ambiente. Corresponde al sistema de cosecha o saca. Capítulo 19: Conservación de camélidos 286 Tabla 3 Valor aproximado de la vicuña Producto Top Fibra (*) 75 U$S/kg Otros productos carne 0,50 U$S/kg cuero 35 U$S/unid. Turismo (-) (-) Valor ambiental (-) (-) Valor del ejemplar 64 U$S Ref.: (-) La vicuña no ha generado a la fecha una corriente turística específica, tampoco es percibida desde el punto de vista ambiental a nivel de opinión pública. No obstante, es posible que sea valorizada en estos aspectos en un futuro. (*) Hay una reactivación de la demanda internacional de pelos finos (Ver García Fernández, 1992; Capítulo 17) Las características ecológicas de la especie en relación a los posibles sistemas productivos Las vicuñas se caracterizan por ser los mamíferos mas estrictamente territoriales que se conocen, conservando como norma harenes anuales (Wilson, 1980). La estructura social de la especie resulta determinante al momento de establecer el sistema productivo mas conveniente. La caza tradicional con fines comerciales y sin regulación (acceso abierto) ha sido la causa de la declinación de la vicuña hasta el momento en que se implementaron las medidas conservacionistas (1977). Con estos antecedentes no deberíamos ser muy optimistas en plantear un sistema productivo basado en la caza o saca de animales, dado las dificultades para garantizar los resguardos necesarios. No obstante, si consideramos la ecuación diferencial que expresa la tasa de crecimiento de las poblaciones (dN/dt) y la curva logística de crecimiento basada en la expresión anterior, vemos que existe un límite al crecimiento (dN/dt=O) dado por el término capacidad de carga (K). Esto nos dice que la saca es posible a determinados niveles (cosecha sostenida) y que la no saca no implica acumulación de animales mas allá de una determinada densidad umbral. En áreas bajo manejo con estricto control y activa participación de los sectores rurales, un sistema productivo basado en la saca puede ser posible dentro de pautas Capítulo 19: Conservación de camélidos 287 razonables, si se determina la cosecha sostenible y la máxima cosecha sostenible de manera flexible, esto es, adaptando anualmente estos parámetros a partir de una sólida información periódica de base. Frente a situaciones de alta densidad o sobreabundancia animal en ambientes con oferta escasa de recursos alimentarios, las poblaciones animales tienden a autorregularse, pero en muchos casos a un costo elevado (deterioro genético y/o ambiental) y generando conflictos sociales (competencia con las comunidades rurales). Este tema de la sobreabundancia animal y sus efectos ambientales ha sido abordado de manera polémica respecto a la utilización de la vicuña en Pampa Galeras, Perú (Jewell y Holt, 1981). Para especies del tamaño de la vicuña no hay hechos probados que permitan afirmar un deterioro ambiental como consecuencia del aumento de las densidades. Al respecto, las poblaciones desarrollan diferentes mecanismos para contrarrestar situaciones de altas densidades, tales como modificación en los tamaños de los grupos sociales, dispersión hacia otras áreas y/o menor producción de crías (Capítulo 11). Hofmann et al (1983) han señalado que los años de baja precipitación y escasez de recursos alimentarios, provoca en las vicuñas reducciones en la relación cría/hembra como consecuencia de la reabsorción de embriones, interferencia en la ovulación, abortos y menor vigor en las crías, implicando esto un costo (o despilfarro) energético elevado. Estas situaciones podrían desembocar también en daños ambientales en los casos donde existe dificultad para la expansión debido a la presencia de barreras físicas o porque los ambientes óptimos estén ya ocupados por la propia vicuña u otros herbívoros. La realidad indica que la saca de animales resulta una respuesta adecuada de manejo bajo las circunstancias mencionadas párrafos arriba. No obstante, la saca debe ser planteada para un cierto umbral poblacional dentro de un marco de política planificada, previniendo y adelantándose a posibles situaciones de emergencia ecológica y de conflictos sociales. En la vicuña la saca de animales se puede considerar perfectamente como un sistema productivo viable para una localidad determinada y a cierto umbral poblacional. Esto permitiría alcanzar dos objetivos compatibles con la conservación: Mantener poblaciones saludables (reduciendo los costos energéticos y de tiempo) y a la vez brindar incentivos económicos (ganancias monetarias) a las comunidades rurales que conviven con la especie. Con respecto al rodeo, captura de ejemplares y esquila viva (manejo estacional de rebaños), Hofmann y Otte (1983) son pesimistas con respecto a la viabilidad económica de este sistema. Los mencionados autores Capítulo 19: Conservación de camélidos 288 plantean que operaciones de este tipo (rodeo, captura y esquila) sirven para demostrar la factibilidad técnica de los mismos y para programas de repoblación, pero de ninguna manera deberían esperarse beneficios económicos a corto plazo con bajas densidades de animales. Desde la sexta conferencia de las partes de CITES (donde se aprobó la transferencias de poblaciones al Apéndice II, y la utilización en base a la captura y esquila viva) a la fecha transcurrieron nueve años sin haberse concretado dentro de los países andinos, ninguna experiencia exitosa a nivel comercial de esquila viva de vicuñas. No obstante, a nivel experimental hubo resultados alentadores, como lo prueban las diferentes experiencias realizadas en Chile, Perú y Bolivia en la captura de ejemplares, para su traslado e introducción en los páramos de Ecuador o en la captura de ejemplares para su esquila y acopio de fibra (Perú, 1988; Rodríguez y Nuñez, 1989; Yaringano, 1989; Nuñez, 1993), por lo tanto, pensamos que el sistema mencionado puede resultar factible en la puna, en aquellas localidades con determinado nivel de densidad, con la participación de los pobladores rurales y asociaciones locales y el apoyo del gobierno nacional y provincial (ver Hudson, 1989). Con respecto al sistema de criaderos (condiciones de cautividad o bajo estricto encierro) se deben hacer algunas consideraciones. En los herbívoros domésticos, dado el largo proceso de su domesticación, se logra mayor producción por individuo y mayor tolerancia a las altas densidades (producción intensiva), permitiendo asimismo el aprovechamiento de las pasturas de alta productividad primaria mediante el pastoreo intensivo. No ocurre lo mismo con la mayoría de los herbívoros silvestres. Para el caso particular de la vicuña, su crianza en cautividad se enfrenta a obstáculos importantes, como consecuencia de su organización social, y su comportamiento territorial y reproductivo (Hofmann y Otte, 1983). La crianza de vicuñas bajo cerco puede prosperar hasta un cierto límite, cuando los potreros de encierre son los suficientemente extensos como para permitirles a los animales desarrollar sus pautas de comportamiento, tal como fue desarrollado en sus inicios por el Ing. Víctor Cabezas en la Estación Experimental de Abra Pampa (INTA-Jujuy). No obstante, emprendimientos similares por parte de los productores puneños resultan muy dificultosos por su baja capacidad de inversión y los costos que el emprendimiento implica (alambrados, apotreramiento, entre otros). Algunas medidas planteadas como la castración de machos, tal lo propuesto por técnicos del Instituto Nacional de Tecnología Agropecuaria (INTA) respecto a la cría de dicha especie bajo encierre en Abra Pampa, no resulta una medida ni ecológicamente conveniente ni públicamente aceptada. Capítulo 19: Conservación de camélidos 289 Ejemplos asociativos En 1984 se inicia en Laguna Blanca, Catamarca una experiencia piloto con la participación de la comunidad local (90 hogares, con 450 habitantes) para la formulación de un proyecto de conservación y desarrollo de tecnologías innovadoras que tenía como objetivo: a) mejorar las condiciones de vida de la población rural; b)conservar y utilizar racionalmente los recursos naturales y c) impulsar la autogestión comunitaria. También se desarrolla el Proyecto de Tecnología Apropiadas para la Mujer Campesina (Comisión Interamericana de Mujeres de la Organización de Estados Americanos [OEA], el Centro de Estudios e Investigaciones Laborales [CEIL] y la Dirección de Ganadería de la Provincia, que contemplaba: a) huertas comunitarias; b) sanidad animal; c) mejoramiento del sistema de riego; d) artesanías y e) conservación de la vicuña. Si bien estos proyectos discontinuaron, dejaron antecedentes entre los pobladores rurales para la protección de la vicuña, su futura utilización, el manejo del ganado doméstico y el desarrollo de huertas comunitarias (Temas, 1986; Forni, 1987; 1990). A fines de 1990 se crea en la Provincia de Jujuy, la Corporación para el Desarrollo de la Cuenca de Pozuelos (CODEPO, 1993), como organismo autárquico y autónomo, destinado a coordinar, promover y ejecutar tanto las acciones de mejoramiento económico general como las de conservación de la naturaleza que puedan llevarse a cabo en la zona del altiplano. Este organismo es encabezado por un directorio que cuenta con un 66 % de productores de la zona. Se completa la dirección, con representantes del gobierno provincial, de la Universidad Nacional de Jujuy y la Administración de Parques Nacionales. La CODEPO tiene atribuciones amplias para coordinar, estudiar, apoyar y ejecutar todas las acciones de desarrollo que convengan para elevar las condiciones de vida de las 400 familias que componen la población local. Además puede iniciar todas las vinculaciones que sea menester para promocionar la mejor comercialización de los productos agropecuarios. Finalmente posee la personería suficiente para contraer compromisos ante los organismos internacionales de fomento y cooperación. Estos dos ejemplos asociativos, mas allá de la discontinuidad del primero y de los avatares institucionales del segundo, representan una buen marco para el manejo de la vicuña. Conclusión con vistas al futuro Capítulo 19: Conservación de camélidos 290 La conservación (con todos sus altibajos y falencias apuntadas) de la vicuña como especie clave de la región ha permitido de hecho la conservación de paisajes, habitats, comunidades y otras especies en amplias áreas de la región andina (especie “paraguas”). Se ha llegado a un punto de inflexión donde se presenta el desafío de dar un salto cualitativo en la situación e iniciar la etapa de utilización en determinadas localidades y en beneficio de las comunidades rurales allí asentadas. El fortalecimiento de la conservación y el uso sustentable de la vicuña permitirá, además de garantizar la supervivencia de la especie, sentar las bases para mantener bajo conservación diferentes especies y habitats. Dado el desarrollo desigual debido a las diferencias ambientales, sociales y/o institucionales, la propuesta debe ser acorde con el grado de presencia de los pobladores rurales y sus demandas (usuarios), con las densidades y tendencias poblacionales de la vicuña y la disponibilidad ambiental (sustentabilidad ecológica) y con el compromiso y fortalecimiento de la conservación y el manejo de parte de las instituciones administrativas provinciales y nacionales (sustentabilidad institucional en el sentido de Charles, 1996). De la Fig. 2 se desprenden algunas consideraciones para el manejo de la especie. Presentada la vicuña como una real alternativa de obtención de renta por parte de las comunidades rurales y percibida así por parte de las mismas, los límites para su aprovechamiento estaría dado por la capacidad de carga del ambiente y por la presencia de otros herbívoros (domésticos y silvestres), en este sentido cabrían dos alternativas: a) mantener las densidades de herbívoros domésticos a los niveles actuales, permitiendo que las poblaciones de vicuña aumenten hasta un cierto nivel (dado por la K), o b) disminuir la carga de animales domésticos en aras de aumentar las densidades de vicuñas hasta un nivel mas alto (siempre dentro de la K). Lo último dependerá del valor real de la vicuña y de cambios en las pautas culturales-productivas de los pobladores, lo cual lo torna al presente como una alternativa difícil de alcanzar. Las pasturas implantadas de pasto llorón en Pozuelos como los intentos de establecer cultivos familiares bajo cerco de alfalfa en Laguna Blanca pueden resultar medidas convenientes en la medida que éstas contribuyen a lograr mayor provisión forrajera y su acumulación para las épocas desfavorables, con lo cual llevaría a disminuir la presión sobre las pasturas naturales y a una menor competencia entre ganado doméstico y vicuña. Capítulo 19: Conservación de camélidos 291 La implementación de un sistema productivo depende de las densidades poblacionales de vicuña y de las necesidades de las comunidades rurales que conviven con la especie. Estas situaciones pueden darse en determinadas localidades, por lo cual no es necesario alcanzar un nivel optimo poblacional en todo el área de distribución, para iniciar una etapa de aprovechamiento. Al presente se encuentran importantes densidades en el área nuclear de la reserva San Guillermo (San Juan), Sector Laguna Blanca correspondiente a la reserva del mismo nombre (Catamarca), en la cuenca de Pozuelos (Jujuy) y en Olaroz-Cauchari (Jujuy). La primera no presenta asentamientos humanos estables y en las restantes mencionadas, los asentamientos rurales son escasos o relativamente importantes. Como ya se mencionara Hoffamm y Otte (1983), mencionan una densidad óptima de 10 vicuñas /km2 para plantearse un sistema de aprovechamiento, no obstante, estas densidades deben tomarse como flexibles, en la medida que se definan los usuarios, y la sustentabilidad ecológica y económica para cada localidad específica. De acuerdo a lo mencionado, el sector Laguna Blanca y la cuenca de Pozuelos (posiblemente también Olaroz) podrían a corto plazo pasar a áreas bajo utilización. San Guillermo en San Juan si bien tiene densidades importantes, el hecho de la inexistencia de asentamientos humanos estables en el área, no plantea una situación inmediata de aprovechamiento comercial de la especie, salvo en lo referente al posible turismo en la región, o a la posibilidad de extender la Reserva de la Biosfera a los pisos altitudinales mas bajos con asentamientos humanos. En éste último caso, además del turismo se podría plantear a determinados niveles de densidad y expansión un aprovechamiento de la especie que beneficie a los pobladores rurales de las localidades adyacentes a la Reserva. Capítulo 19: Conservación de camélidos 292 Fig. 1 - Densidades de vicuña y sus tendencias en las áreas naturales protegidas Fig. 2 - Biomasa de camélidos silvestres y ganado doméstico en relación con la capacidad de carga (K) Capítulo 19: Conservación de camélidos 293 II - La situacion del guanaco Jorge Luis Cajal El guanaco es el otro gran herbívoro de la región andina que coexiste con la vicuña en la Cordillera Frontal y en sitios de la Puna adyacentes a las áreas ecotonales. Esta especie tiene una amplia distribución dentro del territorio nacional, desde el nivel del mar hasta los 4.600 msnm. (Reca y Pujalte, 1985). Dentro de la región andina ocupa los mismos tipos de vegetación (Hueck y Seibert, 1972), que la vicuña, no obstante el patrón de distribución es diferente. En lo referente a la Puna sensu strictus, el guanaco se presenta en el extremo este, con una pequeña superposición con la vicuña en los faldeos y piedemonte de las Sierras de Santa Victoria a los 23° 37´ S (Jujuy) y en el Abra de Acay (Salta). A partir de la Cordillera de Buenaventura (Catamarca), el guanaco presenta mayor superposición con la vicuña encontrándose su máxima expresión en la Cordillera Frontal, al norte de la Provincia de San Juan (29° S). Pese a lo mencionado en algunas publicaciones (Franklin, 1982), no hay una segregación de ambas especies debido a la altura (ver Reca y Pujalte, 1985; Capítulos 10 y 14). Capítulo 19: Conservación de camélidos 294 Densidades Utilizando la misma metodología que para la vicuña, se vuelca en la Tabla 1 los números poblacionales contabilizados de guanacos en la región. En la Fig. 1 se indica las tendencias poblacionales en la Cordillera Frontal (ver capítulo 11). En base a los datos obtenidos en las localidades mencionadas se puede estimar una cantidad de 11.000 guanacos para la región considerada, tomando esta cifra como poblaciones mínimas. Debe considerarse que los guanacos a diferencia de la vicuña muestra mayor flexibilidad en sus movimientos a larga distancia, habiéndose observado desplazamientos estacionales hacia y desde los pisos altitudinales mas bajos (Precordillera) en las áreas marginales del sudeste de la puna catamarqueña y en localidades como Laguna Brava y en sectores de San Guillermo adyacentes a las quebradas de acceso. Esto lleva a relativizar las densidades obtenidas de manera esporádica y puntual en áreas próximas a las zonas ecotonales. Los sistemas productivos discutidos para la vicuña también pueden ser considerados para el caso del guanaco en aquellas localidades con densidades apropiadas. Tabla 1 Número poblacionales de guanaco en distintas localidades Provincia Area Sup. NDP NPP considerada (km2) Densidad bruta (G/km2) San Juan San Guillermo (ZN) 2150 4943 2,47 San Guillermo (FZN) 6450 1320 2000 0,29 La Rioja Laguna Brava (ß) 3400 415 1000 0,12 Catamarca Aguas Calientes (ß) 150 250 800 0,6 Salta Los Andes (ß) 1440 40 300 0,03 Jujuy Sta Victoria y otras (ß) (1) ? 2000 Ref.: (1)= Fra, 1996; ZN= zona nuclear; FZN= fuera de la zona nuclear; (ß)= “zonas calientes”, donde hay caza furtiva Capítulo 19: Conservación de camélidos 295 Capítulo 19: Conservación de camélidos Fig. 1 - Densidades de guanacos 297 CAPITULO 20 POTENCIAL DE CONSERVACION Y FACTORES DE AMENAZA EN LA PUNA Y CORDILLERA FRONTAL Jorge Luis Cajal 1 En la 1a. Reunión del Grupo de Trabajo de los Andes de la UICN (La Paz, Bolivia, 1993) se discutieron los lineamientos para el desarrollo del Programa Integrado de Conservación Ambiental y Desarrollo Sustentable de la Cordillera de Los Andes. De este evento surgieron compromisos nacionales para la preparación de un cuadro de situación y líneas de acción referida a esta vasta región a nivel continental. En este marco y tomando como base los criterios definidos por Olson y Dinerstein (1994), se realizó un ejercicio para cuantificar el potencial de conservación y los factores de amenaza dentro de la Puna y Cordillera Frontal en Argentina (Cajal, 1994). Tomando como marco lo mencionado, el presente Capítulo tiene como objetivo mostrar de manera sintética la situación de la Puna y parte de la Cordillera Frontal a nivel cualitativo y ordenada en base a diferentes criterios a fin de visualizar sus perspectivas futuras. Para los pastizales montanos (región de la Puna y Altoandina), Dinerstein et al. (1995) definen el estado de conservación como vulnerable, las características biológicas como sobresaliente y la conservación de la biodiversidad a nivel regional como de máxima prioridad. 1 FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. Capítulo 20: Potencial de conservación 298 A continuación los criterios sobre el potencial de conservación y los factores de amenaza para esta importante porción de la región andina. A. Potencial de conservación de la región Criterio A1. Proporción de porciones (blocks) con habitats no modificados y grado de contiguidad. Una de las características de la Cordillera Frontal y Puna argentina, a lo largo de toda su extensión, es la de mantener grandes extensiones poco modificadas, con grandes porciones remanentes de habitats originales (wilderness lands). Al respecto los mapas a escala 1:2.000.000 (carta de navegación aérea JNC-91, 2 ed.), desarrollados por el Sierra Club, tomando unidades a escala de 400.000 ha, muestran importantes porciones de “áreas silvestres” o “wilderness” dentro de la región considerada, éstas comprenden 14.000 km2 en cifras redondas, es decir el 9 % de la Puna y parte de la Cordillera Frontal desde el norte de San Juan hasta Jujuy (World Wilderness Inventory South America, 1988; McClosky y Spalding, 1989). Si bien las porciones consideradas para la región andina de Argentina por éstos trabajos, pueden tomarse como conservadoras, dada la escala utilizada, los mismos brindan una idea de las áreas remanentes con habitats no modificados en la región. Habría que desarrollar en un futuro éstos mapas pero tomando unidades a menor escala (ej.: unidades de 100.000 ha). Criterio A2. Red de áreas protegidas La efectividad de las reservas o áreas naturales protegidas dependen de ciertas variables a saber: diseño; tamaño; representatividad; y viabilidad de poblaciones silvestres. Existe una vasta literatura referida al diseño de reservas en base a reglas geométricas derivadas de la teoría biogeográfica (Mc Arthur y Wilson, 1967; Diamond, 1975). Considerando áreas totales similares para ambientes homogéneos tenemos; a) una superficie grande es mejor que una pequeña (efecto área); b) una reserva continua es mejor que una fragmentada (efecto borde); c) fragmentos próximos resultan en general mas convenientes que fragmentos lejanos (efecto distancia); d) fragmentos agrupados resultan mas convenientes que aquellos dispuestos de manera lineal (efecto distancia); e) la existencia de corredores que conectan fragmentos reducen la tasa de extinción; f) un diseño circular es mejor que otros diseños (efecto península) (Bunell, 1978). Capítulo 20: Potencial de conservación 299 Se coincide de manera unánime que las reservas deben ser grandes, pero pocos autores mencionan dimensiones (Sullivan y Shaffer, 1975). En la región andina nos encontramos con reservas relativamente grandes, pero tomando a las mismas de manera individual, vemos que no encierran la totalidad de la diversidad de especies presentes en la región. Es decir cada una de estas reservas no son de por sí representativas de la totalidad del universo andino. Esto se ha podido apreciar en los Capítulos 5, 6 y 14, respecto a vertebrados terrestres y sus variaciones en número de especies respecto a la latitud y altitud. La región andina se caracteriza por presentar alta diversidad de biotopos, distribución en parche de muchas de sus especies, variaciones latitudinales y altitudinales en cuanto a presencia de taxones. En este marco el diseño de áreas protegidas que se ajusta a estas características en función de la representatividad, es el de varias reservas de tamaño menor serán más efectivas que una única reserva de tamaño equivalente. Esto se cumple en gran medida en la Puna y Cordillera Frontal, con la existencia de seis unidades de conservación, incluyendo las tres Reservas de Biosfera. Si bien estas reservas fueron creadas por las administraciones provinciales en función de la protección de la vicuña (capítulos 2 y 19), de hecho han permitido mantener bajo conservación a otras especies presentes con sus correspondientes biotopos. Este diseño actual de las reservas representa una buena base para el futuro de acuerdo con lo mencionado por Lester y Myers (1990) en relación con el seguimiento del cambio climático y la diversidad biológica. Criterio A3. Manejo de áreas protegidas Este criterio se refiere a la continuidad de los trabajos en el tiempo, al grado de protección, a las inversiones por parte de las autoridades administrativas, al soporte legal y técnico, a la infraestructura instalada y al grado de zonificación en función al manejo. Los diferentes capítulos de la presente obra, reflejan los trabajos de investigación, y las tareas de censo y monitoreo realizadas durante un período de tiempo importante (de 1978 al presente), dentro de las Reservas de Biosfera, principalmente en San Guillermo y Pozuelos y en menor medida en Laguna Blanca. Estos trabajos representan una buena base para el manejo futuro, más allá de las discontinuidades, lagunas en el conocimiento y falencias apuntadas. También reflejan la disparidad de las reservas en cuanto a su implementación y grado de conocimiento (Capítulo 2). Capítulo 20: Potencial de conservación 300 En San Guillermo, se realizaron importantes trabajos de investigación censos y monitoreo (Capítulos 7, 10, 11, 12 y 14) durante el periodo 1978-1984, encontrándose al presente con un grado nulo de control. La situación de Laguna Brava y Los Andes resulta más dramática ya que el grado de control ha sido y es nulo y los trabajos de investigación, escasos. En las otras reservas (Pozuelos, Olaroz, Laguna Blanca), el grado actual de control es considerado como insuficiente (Burkart et al., 1997), aunque se han realizado importantes trabajos en las áreas biológicas, sociales y productivas principalmente en la Cuenca de Pozuelos. B. Factores de amenazas Criterio B1. Pérdida y tasa de conversión de habitat en la región Se define conversión de habitat como la tasa de modificación de los habitats originada como consecuencia de: a) roturación de tierras; b) asentamientos humanos; c) minería; d) agricultura; e) pastoreo con implantación de especies exóticas y alto grado de pastoreo que impide el retorno de la vegetación original. En la Cordillera Frontal (San Juan, La Rioja) hay una baja tasa de conversión de habitat. Las variables a, b, d, e, no operan. La excepción es la variable c (minería) con gran expansión en los últimos años. En la Puna de Catamarca, y Salta se presentan las variables b, c, y e pero a baja intensidad. La variable a (roturación de tierras) se da principalmente en Catamarca pero a nivel estrictamente familiar, lo cual puede considerarse como irrelevante(Capítulo 1). En la Puna de Jujuy, se dan de manera mas importante las variables a, b, e y en menor medida la variable c. La variable a y e se da con los cultivos de pasto llorón, los cuales si bien por una parte ocasiona pérdida de diversidad (artrópodos, roedores, Capítulo 15), por otro lado aumenta la productividad del área (aumento de biomasa de semillas y de especies silvestres asociadas con ese tipo de alimentación) y tiene el potencial de minimizar las pérdida de suelo debido al sobrepastoreo en tierras naturales. En la actualidad los factores mas importantes de conversión de habitat para toda la región andina argentina estaría dado por el desarrollo de la minería (picadas de prospección, establecimientos bajo explotación) y el desarrollo de carreteras hacia la vecina República de Chile. Capítulo 20: Potencial de conservación 301 Criterio B2. Grado de fragmentación de habitat Se define fragmentación de habitat como la separación de porciones o blocks dentro del mosaico de habitats originales como consecuencia de la agricultura intensiva, campos de pastoreo con alta densidad de ganado, centros urbanos y rurales, caminos y vías férreas, áreas con alto grado de degradación como consecuencia del sobrepastoreo. Dinerstein et al (1995) consideran índices de conectividad entre fragmentos o porciones a partir de sistemas de información geográfica (SIG) y modelos de funciones lineales. Si bien para la región andina argentina, no se han obtenido los mencionados índices a partir del SIG, se está en condiciones de afirmar que la región presenta un grado de fragmentación de habitat relativamente suave: esto es, alta conectividad, baja fragmentación, siendo la dispersión a grandes distancias todavía posible a lo largo de gradientes altitudinales, latitudinales y climáticos (ver Dinerstein et al., 1995). Criterio B3. Presión de pastoreo Se ha mencionado cambios en las fisonomías vegetales como consecuencia del pastoreo de ganado doméstico. Según Morello (1985) citado por Braun Wilke (1991), el sobrepastoreo constante de parte de ovejas, llamas y asnales, exacerbado por las sequías periódicas, ha estimulado la expansión de los tolares a costa de las gramíneas o pajonales, siendo el tolar poco estable como sistema ecológico, susceptible a la erosión hídrica y eólica, debido al sustrato edáfico suelto. Dentro de la puna y principalmente en la Provincia de Jujuy, el sobrepastoreo se presenta en “parches”. Hemos visto en el Capítulo 15, como el sobrepastoreo causa pérdida de diversidad en artrópos y roedores y los demás elementos asociados. Asimismo, la presión del pastoreo intensivo sobre orillas de algunas lagunas (Pozuelos, Laguna Blanca, Antofagasta de la Sierra) incide en su productividad y afecta la nidificación de distintas especies de aves. No obstante, dada la envergadura presente de éste factor de amenaza, se está en condiciones de revertir la situación con un manejo inteligente del ganado doméstico y de algunos herbívoros silvestres (ej.: vicuña, guanaco) (Capítulo 19). Teniendo en cuenta la actividad ganadera pasada y presente en la región, se puede ubicar a Jujuy (0,23/ha de carga ganadera), y especialmente a la Cuenca de Pozuelos con niveles altos de pastoreo, a Salta y Catamarca con niveles moderados de intensidad de pastoreo y a La Rioja y San Juan con bajo o nulo nivel de pastoreo por parte de ganado doméstico. Capítulo 20: Potencial de conservación 302 Criterio B4. Densidad poblacional humana en la región La Puna de la Provincia de Jujuy es el área más densamente poblada, no obstante, no supera una densidad de 1,5 hab./km2. En total hay una población de 18.000 habitantes en las áreas rurales y 10.000 en los centros urbanos de la región (García Fernández y Tecchi, 1991). La densidad poblacional en la Puna de Salta y Catamarca es menor (0,1 hab./km2) y nula en La Rioja y San Juan. Colocar a la población humana como factor de amenaza puede resultar discutible. La población humana como factor de amenaza para la biodiversidad puede ser correcta, si tomamos algunas realidades a nivel global, donde las densidades humanas por encima de la capacidad de carga del ambiente, sumado al uso de tecnología no apropiadas, y a un grado de elevada marginalidad y pobreza, pueden efectivamente destruir el ambiente. Hay muchos ejemplos mundiales que lo atestiguan. No obstante, la población humana no siempre debería ser considerada como factor de amenaza. Si consideramos la Cuenca de Pozuelos y la experiencia pasada de Laguna Blanca, resulta evidente que la presencia humana no significa necesariamente una amenaza para la conservación, en la medida que la misma sea de alguna manera integrada a la estrategia de conservación. Cuando dicha integración ocurre, la propia población local resulta un reaseguro para evitar ciertas prácticas negativas sobre el ambiente. Por otra parte, las áreas deshabitadas, pero abandonadas a su suerte, resultan mas vulnerables frente a cualquier esquema de desarrollo impactante, además de convertirse en cotos de caza furtivos sobre la vida silvestre. En la región andina argentina, las mejores situaciones desde el punto de vista de la conservación se encontraron en aquellas localidades con población humana integrada de alguna manera (participación comunitaria) a los programas de conservación (Pozuelos, Laguna Blanca), o en aquellas localidades deshabitadas pero con presencia estatal a través de controles (San Guillermo, durante el periodo, 1977-1984). Las peores situaciones fueron encontradas en aquellas localidades deshabitadas y abandonadas (Laguna Brava), o con presencia humana y ausencia de controles y programas de desarrollo y conservación (Los Andes). Criterio B5. Esquemas de desarrollo planteados para la región En la actualidad existen dos actividades de desarrollo planteadas para la región: la minería y la obra pública (carreteras). De no tomarse los debidos recaudos para mitigar los efectos negativos de tales emprenCapítulo 20: Potencial de conservación 303 dimientos (picadas sobre el terreno, contaminación de aguas, conversión de habitats, caza furtiva), a través de correctas evaluaciones del impacto ambiental, éstas actividades pueden ser de alto riesgo, dado la fragilidad del ecosistema andino y baja tasa de recuperación natural. Criterio B6. Explotación de especies silvestres En las áreas pobladas de la Puna se da una importante explotación de especies vegetales, principalmente leñosas como la queñoa y arbustos varios (tolares, acerillos), como fuente de combustible y otros usos. Esto ha llevado a la reducción del área de distribución de las especies principalmente la correspondiente al género Polylepis. Con respecto a la fauna, la región se caracterizó históricamente por la caza de vicuñas. Por ejemplo, en Catamarca hasta la década del 50, Laguna Blanca era un importante centro de acopio y tráfico de cueros de vicuña, tanto de las obtenidas localmente y de las provincias vecinas como de los provenientes de Chile. Esto fue la base que permitió al corredor Belen-Antofagasta de la Sierra convertirse en el centro del tejido artesanal de la Provincia de Catamarca y en gran medida de la región puneña. En el Capítulo 19. se mencionan las zonas calientes donde hay caza furtiva de vicuñas en la actualidad, no obstante, la caza furtiva no es de alta magnitud, encontrando la especie mencionada a nivel regional en recuperación o estable. Otros grupos que históricamente fueron cazados por su cuero fueron los zorros y felinos. En la actualidad estas prácticas existen a muy baja escala. Un caso particularmente grave lo representa la chinchilla, especie históricamente cazada con intensidad y donde hasta la fecha no hay síntomas de recuperación (Capítulo 15). Si bien la caza de la chinchilla no existe desde hace aproximadamente 40 años como actividad, su recuperación a partir de las poblaciones relictuales no se ha dado debido a la distribución en parche que presentaban a lo largo de su área de distribución, con alto grado de aislamiento entre las poblaciones. Un tema importante se refiere a la recolección de huevos para el consumo local, principalmente sobre el ñandú petiso, especie frágil en la región (Capítulo 7). Según la lista roja de mamíferos y aves amenazados de la Argentina (FUCEMA, 1997) y considerando las especies inventariadas para la región nos encontramos con la siguiente situación (Tabla 1): Criterio B7. Situación política-económica-social Capítulo 20: Potencial de conservación 304 Este criterio está íntimamente relacionado con el criterio A3, no obstante amerita destacar su inclusión como factor de amenaza, dado que la continuidad institucional es un factor de éxito en relación con la conservación y la sustentabilidad de la región, por el contrario la discontinuidad institucional resulta un factor de fracaso. Los cambios políticos acaecidos en las distintas administraciones provinciales a lo largo de los años, el diferente grado de motivación por el problema ambiental de parte de los funcionarios, el diferente soporte técnico y financiero de las administraciones la disparidad en la incorporación de las comunidades rurales locales en programas productivos y de conservación y el diferente grado de sensibilidad ambiental de parte de las poblaciones humanas a nivel provincial ha llevado a un desarrollo desigual respecto a la conservación en la región. La situación actual de la región y de sus áreas naturales protegidas deben enmarcarse en el contexto político y económico dado por la reforma del estado. Si bien esta reforma y reestructuración se ha dado con mayor énfasis en el Estado Nacional (Burkart et al., 1997), en las provincias se ha manifestado en la reducción o ausencia de inversiones en materia de conservación, habiéndose en muchos casos desmantelado las dependencias provinciales encargadas de las áreas naturales protegidas. Capítulo 20: Potencial de conservación Tabla 1 Grado de amenaza de aves y mamíferos de la región andina argentina Familias Total Especies amenazadas especies CR (2) EP Vu (3) Especies no amenazadas Rbdc (4) DI (6) Rbpv (5) Rbpm 33 79 0 0 4 (5%) 0 3 (4%) 70 (89%) 2 (2%) Mamíferos 12 29 1 (3%) 0 3 (10%) 1 (3%) 1 (3%) 21 (71%) 3 (10%) Ref.: CR= En peligro crítico; EP= En peligro: Vu= Vulnerable; RBdc= Riesgo bajo, dependiente de la conservación; Rbpv= Riesgo bajo, potencialmente vulnerables; Rbpm= Riesgo bajo, preocupación menor; DI= Datos insuficientes; (1)= Corresponde al listado de especies registradas y potenciales; (2)= Chinchilla brevicaudata; (3)= Calomys lepidus, Oncifelis colocolo, Pseudalopex culpaeus, Agriornis andicola, Netta erythrophtalma, Phoenicoparrus andinus, Ph. jamesi; (4)= Vicugna vicugna; (5)= Lama guanicoe, Pterocnemia pennata, Fulica cornuta, Phegornis mitchelli, (6)= Oreailurus jacobita, Conepatus chinga, Microcavia shiptoni, Muscisaxicola capistrata, Ochthoteca oenanthoides Fuente: FUCEMA (1997) 305 Capítulo 21: Innovación conceptual Aves (1) 307 CAPITULO 21 LAS RESERVAS DE BIOSFERA EN EL CONTEXTO DE LA CONSERVACION DE LA DIVERSIDAD BIOLOGICA DE LA REGION Juan Javier García Fernández 1 ANTECEDENTES Las Reservas de Biosfera como innovación conceptual. Hacia 1968 se comenzó a definir el perfil de lo que daría en llamarse el Programa El Hombre y la Biosfera (MAB, por sus siglas en inglés) impulsado por la UNESCO a partir de 1971. El programa abarcaba toda la agenda sobre la relación entre las sociedades humanas y la naturaleza. Fue pensado y diseñado principalmente por investigadores científicos, pero no sólo de las ciencias naturales sino también de las ciencias sociales. Pretend’a comprender las bases del sustento humano tanto en las zonas menos pobladas del globo como en las megalópolis, y actuar procurando armonizar la conservación del medio con el desarrollo social y humano. Una de las principales ramas del Programa MAB fue su sección VIII, las Reservas de la Biosfera. Comprender el impacto que significó el Programa MAB supone hacer un importante esfuerzo retrospectivo, trasladándonos a un momento en el que coexistían vigorosos el Estado de Bienestar y las utopías trans1 FUCEMA, Pringles 10, (1183) Buenos Aires, Argentina. Capítulo 21: Innovación conceptual 308 formadoras. Pensado en Europa tras el mayo francés, no puede extrañar que el Programa MAB quisiera superar la concepción rectora en ese entonces, que era la de conservar muestras de la naturaleza intocada, para ser apreciadas por pequeñas elites urbanas. El MAB desarrolló, en oposición a ese modelo, otra visión donde la naturaleza podía ser a la vez usada y conservada por los propios habitantes locales y grupos de interés. La ciencia y la tecnología actuando al servicio de esos actores, permitirían rescatar prácticas apropiadas en desuso, o bien sugerir nuevas técnicas que serían testadas, y eventualmente adoptadas, en las áreas seleccionadas al efecto por cada país. Esas áreas serían las Reservas de la Biosfera, las que deberían tener una zona nuclear de singular valor biológico, prácticamente intangible, un área de transición para experimentación y demostración del manejo sugerido, y una zona de amortiguación entre ambas. Un esquema sencillo y vigoroso, tan atractivo como flexible. Decenas y luego cientos de grupos de investigación científica, instituciones de administración de la naturaleza y las áreas protegidas, entidades no gubernamentales y gobiernos locales se apropiaron de esa herramienta y la trasladaron al terreno con mayor o menor fortuna a lo largo y ancho del globo. La consigna no escrita, parafraseando a Schümacher (1978), parecía ser: “lo local es hermoso”. Con la simple invitación a armonizar entre las necesidades de desarrollo social y económico de las comunidades rurales y la conservación de la naturaleza y sus recursos, la UNESCO se había instalado en una posición de claro liderazgo conceptual a nivel mundial en la temática. Las Reservas de Biosfera de la Puna y la Cordillera Frontal de la Argentina Otra caracerística interesante del surgimiento de las Reservas de Biosfera en muchas latitudes, e indudablemente en la Argentina, fue que las iniciativas para incorporar un área a esta red surgían invariablemente de grupos de trabajo en el terreno, que veían en esta concepción una forma concreta para plasmar lo que el sentido común dictaba: considerar a las sociedades humanas como parte integrante del sistema ecológico. En particular esta concepción se mostraba especialmente atractiva Capítulo 21: Innovación conceptual 309 en zonas productivamente marginales, allí donde hubiera elementos naturales sobresalientes que era menester preservar, sin que las sociedades humanas se perjudicaran por ello, por lo que había que sentar las bases para restablecer la alianza entre la conservación y las personas. La Puna y la Cordillera Frontal de la Argentina reunían las condiciones ideales para aprovechar esta nueva concepción. Zonas ricas en componentes naturales, con baja densidad poblacional humana, dedicada casi toda ella a actividades productivas tradicionales, y con algunos recursos sobreexplotados en el pasado (las vicuñas, principalmente). Se había establecido una notable red de extensas reservas provinciales surgidas en el marco del Convenio de Conservación y Manejo de la Vicuña, pero que eran institucionalmente débiles. Su debilidad se derivaba principalmente de la necesidad de dar respuesta a los diferentes actores sociales a los que se les había prometido desarrollo basado en la conservación. Las Reservas de Biosfera ofrecían el marco teórico y práctico adecuado a ese fin. Así en 1980 se constituye la RB San Guillermo, en 1982 la RB Laguna Blanca y finalmente, en 1991, la RB Laguna de los Pozuelos. En dos de ellas, Laguna Blanca y Laguna de los Pozuelos, se llevaron a cabo las primeras y principales experiencias de manejo participativo de áreas protegidas en el país, y si bien discontinuas en el tiempo, constituyen aún dos de los mejores ejemplos de acciones de armonización entre conservación y desarrollo en áreas rurales en la Argentina. Algunas de las fortalezas y debilidades de esas experiencias se resumen en la Tabla 1. Para analizar cual puede ser el rol que estas reservas pueden cumplir hacia el futuro, es necesario en primer lugar analizar brevemente la evolución que han seguido los conceptos y las prácticas sobre la conservación de la naturaleza y el manejo de las áreas protegidas en los últimos años. La conservación de la biodiversidad en el nuevo contexto internacional Capítulo 21: Innovación conceptual 310 tabla 1 fortalezas-debilidades Capítulo 21: Innovación conceptual 311 Desde el surgimiento del concepto de Reserva de Biosfera, sus principales innovaciones fueron ganando espacios y voluntades, de forma tal que hoy día aspectos tales como la necesidad de involucrar a las poblaciones locales en el manejo de áreas protegidas, la utilidad de zonas de amortiguación, etc, son concepciones aceptadas de modo universal. Hasta que punto se lo cumple realmente es otro tema, pero es indudable que conforman lo que se da en llamar “best practice”. El año 1992 trajo consigo dos hitos de importancia para instalar estas concepciones en la corriente central del pensamiento sobre el tema: 1. Por una parte en la Cumbre de las Naciones Unidas sobre Medio Ambiente y Desarrollo realizada en Rio de Janeiro en 1992 (o Cumbre de la Tierra) se acordó al desarrollo sostenible como nuevo paradigma ambiental. Concordantemente se firmó el Convenio sobre Diversidad Biológica, instrumento legal vinculante en el que se incorpora el concepto de uso sustentable, el rescate de los conocimientos tradicionales para el manejo de los recursos biológicos, y sobretodo el reconocimiento de que para el éxito en la conservación de la naturaleza no basta establecer áreas protegidas y defenderlas de agresiones externas, sino que debe procurarse integrarlas en esquemas integradores de manejo. 2. A la vez, durante el Congreso Mundial de Parques Nacionales y Areas Protegidas, llevado a cabo en Caracas, Venezuela, también en 1992, todas las preocupaciones estuvieron centradas en ampliar el concepto de área protegida hacia las características tempranamente señaladas por el Programa MAB. Los problemas de comanejo, participación comunitaria, áreas de amortiguamiento, uso sostenible dentro de reservas, manejo de conflictos, etc, fueron los que concitaron mayor atención, y el Plan de Acción surgido de ese Congreso está enteramente permeado de lo que podríamos llamar la concepción MAB (McNeely et al., 1994)2 . La identidad de las Reservas de Biosfera 2 En el trabajo citado puede consultarse el Plan de Acción de Caracas, en sus páginas 373 a 379. Capítulo 21: Innovación conceptual 312 Con posterioridad, hacia 1995, se realizó en Sevilla, España, la Segunda Conferencia Internacional sobre Reservas de Biosfera. Los objetivos del encuentro fueron tres: 1) revisar el Plan de Acción que se había trazado en la Primera Conferencia Internacional, en Minsk, Bielorrusia, en 1984; 2) definir los contenidos centrales de un Estatuto de Reservas de Biosfera; y 3) adoptar una nueva planificación estratégica de las Reservas de Biosfera, la Estrategia de Sevilla. Si bien se trataba de un encuentro decenal previsto tiempo atrás, la reunión en Sevilla de más de 500 especialistas en Reservas de Biosfera de todo el mundo, permitió revisar los desafíos que surgían de ese contexto internacional cambiante. La principal lección de este encuentro se puede resumir del siguiente modo: √ la modalidad de manejo surgida a partir de las RB fue tan exitosa que se han adoptado muchos de sus supuestos para manejar cientos de áreas protegidas con pobladores dentro o en áreas vecinas a ellas. √ sin embargo, la generalización de estos criterios puede hacer que las RB pierdan lo que era su carácter distintivo. √ para evitarlo, se recomendó reforzar la identidad a partir de la pertenencia a la Red Mundial de RB, para lo cual se adoptaron estatutos más rígidos. √ a la vez, se reconoció que las RB podían servir como sitios de puesta en práctica de varios de los mecanismos previstos en el Convenio sobre Diversidad Biológica. Dos de las principales oportunidades que ofrece la aplicación del Convenio sobre Diversidad Biológica a las RB son: 1) la puesta en práctica de modelos de planeamiento bioregional, y 2) el mapeo de incentivos y la experimentación con estas herramientas. En los párrafos siguientes se analizan con detalle estas posibles áreas de atracción de las que puede depender la vigencia real de las RB en el futuro. El planeamiento bioregional y el futuro de las Reservas de Biosfera. Capítulo 21: Innovación conceptual 313 Pese a los años transcurridos desde la formulación del concepto de Reserva de Biosfera, ha demostrado mantener un vigor importante ante la dinámica cambiante de los procesos internacionales y nacionales de conservación de la diversidad biológica. En las conceptualizaciones más recientes y abarcadoras sobre la planificación de la conservación, se hace hincapié en el nivel de paisajes, o lo que es similar, en el nivel de ecosistemas a escala de bioregión. Se destaca que las áreas protegidas de diferentes categorías de manejo existen dentro de una variada matriz de paisajes que se encuentran bajo regímenes productivos. La conservación de la diversidad biológica a largo plazo depende finalmente de las características de esa matriz (Miller, 1996). Estas concepciones se han construido a partir de los conocimientos recientes sobre biogeografía de islas, biología de la conservación y ecología del paisaje. La viabilidad de numerosas poblaciones y comunidades biológicas a largo plazo depende del grado de conectividad que se mantenga a través de la matriz productiva determinada por distintas modalidades de uso de la tierra. En estos modelos, la conectividad podría ser reforzada principalmente aprovechando los ejes naturales que conforman ríos y arroyos, salares, cadenas de montañas o humedales. Para alcanzar niveles adecuados de planeamiento bioregional existen diferentes instrumentos y modalidades concretas en uso y experimentación en el mundo, que van desde los proyectos integrados de conservación y desarrollo (ICDP) hasta las propias Reservas de Biosfera. En las representaciones gráficas de la planificación bioregional, la base sigue siendo la de las Reservas de Biosfera, con su esquema clásico de tres niveles de intervención creciente, desde el núcleo hasta la zona de transición.3 Lo que agrega el enfoque del planeamiento a nivel de bioregión es el “fondo” sobre el cual las RB actúan, poniendo su acento novedoso en la matriz y la conectividad a través de ella. Este esquema teórico trasladado al caso concreto de la Puna y Cordillera Frontal de la Argentina muestra lo siguiente: existen tres Reservas de Biosfera, ubicadas dos de ellas en los puntos extremos de la 3 Ello se ha reconocido expresamente en el Primer Congreso Latinoamericano de Parques Nacionales y otras Areas Protegidas, realizado en Santa Marta, Colombia, en 1997. Ahí se adoptó la Declaración de Santa Marta, en la que se menciona especialmente a las Reservas de Biosfera como mecanismo institucional idóneo para establecer acuerdos voluntarios de cooperación entre los interesados y los afectados para el manejo de bioregiones. Capítulo 21: Innovación conceptual 314 gran ecorregión, y la tercera en una ubicación intermedia. En la matriz de paisaje hay otras varias reservas cuyo aporte real a la conservación a escala bioregional es muy disímil. En tanto algunas tienen un funcionamiento mínimamente adecuado, muchas otras no han pasado de su fase de declaración legal (ver capítulo 2 ). ¿Cuál es en este marco el rol diferencial que pueden jugar las RB hacia el futuro? Para que las RB mantengan una identidad y función claras, el centro de su acción debe estar en las llamadas zonas de transición. Si de conservar una muestra de ambientes en modo estricto se trata, las áreas protegidas de categorías I y II (Reservas Estrictas y Parques Nacionales o provinciales de acuerdo a la nomenclatura de la UICN), pueden hacerlo con igual o mayor éxito. Las zonas “buffer” son las menos precisas en la práctica, ya que suele no estar claro en ninguna RB qué puede hacerse allí que no en las zonas de transición. Estas últimas, en cambio, son las ideales para probar modos productivos que permitan aumentar la generación de riqueza y bienestar para la gente local, manteniendo las funciones y procesos ecológicos y continuando la provisión de servicios ambientales. Como ejemplos de acciones en las zonas de transición en la Puna pueden mencionarse de modo no exhaustivo: experiencias de mejoramiento de ganado camélido, ovino o caprino; procesos cooperativos de esquila, clasificación y comercialización de pelos y lanas; desarrollar procesos comunitarios de aprovechamiento de la esquila de vicuñas; desarrollar mejoras en la tecnología constructiva con materiales locales; aumentar la eficiencia energética de las cocinas para disminuir el consumo de leña por unidad familiar; lograr mejoras en los procesos y especialmente en los diseños de los tejidos artesanales; desarrollar acuerdos de bioprospección con consentimiento comunitario y esquemas de distribución de beneficios transparentes; fortalecer capacidades de las instituciones comunitarias para estos u otros logros; desarrollar esquemas de gestión participativa, etc. Algunas de estas prácticas se han desarrollado en algunas RB con mayor o menor suerte, y es lo que explica que esas experiencias concretas hayan concitado genuino interés nacional e internacional. Sin embargo persisten numerosos interrogantes hacia el futuro. Uno de los principales está relacionado con la utilidad de las Reservas de Biosfera para la aplicación de esquemas o baterías de incentivos en sus zonas de transición. Capítulo 21: Innovación conceptual 315 Las Reservas de Biosfera como áreas de experimentación para la aplicación de incentivos económicos Idealmente, la Zona de Transición de una Reserva de Biosfera bien diseñada debe estar conformada por tierras de propiedad privada (si son de propiedad pública, debe haber regímenes de concesiones de uso, tales como extracción forestal, pastaje, permisos de pesca artesanal, etc, en favor de particulares o comunidades). En tal sentido, la Zona de Transición de una RB no suele tener un régimen de tenencia de la tierra diferente a las zonas vecinas a ella (lo que hemos dado en llamar la matriz del paisaje a una escala bioregional). En consecuencia, las facultades del Estado (sea nacional o provincial) para establecer restricciones especiales de uso en las Zonas de Transición se ve limitada. De no ser así, cualquier afectado podría presentar un recurso jurídico argumentando que las restricciones que se le desean aplicar le generan un tratamiento desigual ante la ley respecto a sus vecinos cuyas tierras caen por fuera de la RB. En la última década ha perdido respaldo el argumento por el cual el Estado podría perjudicar intereses privados sin compensación en función de un interés social, en nuestro caso la conservación de la diversidad biológica, o más genéricamente, la protección del medio ambiente. ¿Cómo es esto posible? ¿Porqué disminuyen esas facultades del Estado en un momento en que la legislación de protección ambiental crece a nivel mundial, nacional y provincial? En realidad, esa disminución es sólo aparente. Nunca, en un Estado de derecho, hubieran podido restringirse las facultades de alguien respecto de su propiedad por el sólo hecho de que algún planificador diseñara una reserva que la involucrara. Aunque parezca contradictorio para los espíritus “progresistas”, el Estado sólo puede imponer dichas restricciones sobre tierras privadas si se da alguna de las dos siguientes situaciones, ambas poco elegantes. La primera ocurre cuando no existen mecanismos jurídicos independientes del poder político, y por lo tanto de nada vale interponer una acción jurídica. La segunda, mucho más común, e igualmente penosa, ocurre cuando el afectado pertenece a un sector socialmente débil, se trate de minorías étnicas, sectores culturalmente marginados, o para decirlo sin eufemismos, cuando los afectados son pobres. En este dilema se basa la cantilena del conservacionismo antiguo contra las comunidades locales, indígenas, campesinos, etc. Capítulo 21: Innovación conceptual 316 Por lo tanto, desde la óptica de la doctrina MAB, si se desea que el manejo en las Zonas de Transición realmente sea demostrativo hacia su entorno, y que se ganen voluntades para adoptar esos manejos sugeridos, el esquema debe basarse más en incentivos que en restricciones. No se trata de que se niegue acá la posibilidad o la base jurídica de aplicar restricciones para preservar servicios ambientales de interés común, simplemente se subraya que en caso de aplicarse, dichas restricciones deben ser las mismas tanto dentro como fuera de la Zona de Transición. En caso contrario, la declaración de una Reserva de Biosfera sería percibida por el poblador como un castigo, en vez que como una fuente de oportunidades. Sin embargo no siempre resulta claro qué son los incentivos que deberían aplicarse. Una primera forma de verlos consiste en aplicar subsidios monetarios directos o indirectos. Esta modalidad puede ser muy arriesgada. Debe ser analizada con gran detalle y empleada sólo tras sólidos estudios económicos. Entre los ejemplos que dimos en la Tabla 1, el caso de la RB Laguna Blanca, donde se incorporó a un alto número de pastores tradicionales como empleados públicos provinciales para la atención de la propia reserva, fue un subsidio indirecto, que trajo consecuencias indeseables para el manejo, tales como el abandono de los modos tradicionales de vida, y la dependencia de un flujo de fondos externo, difícil de sustentar en la realidad. Un segundo tipo de caso consiste en la aplicación de incentivos vía disminución del cobro de gravámenes. Esta modalidad, que también implica un costo fiscal para el Estado que debe ser analizado con mesura4 , no resulta práctica en zonas como la Puna y Cordillera Frontal, donde muy pocos pobladores, si es que alguno, pagan impuestos. Otra vía de acción posible consiste en remover incentivos que 4 Por ejemplo, en la Reserva de Biosfera Yabotí, en la provincia de Misiones, que comprende grandes extensiones forestales en tierras privadas, se eliminaron los gravámenes provinciales y municipales a la tierra. El propósito era disminuir la presión sobre los bosques, ya que los propietarios de tierras debían sacar madera para cumplir con el pago de altos impuestos (U$S 3 /ha). Sin embargo, la desgravación también disminuyó sensiblemente la recaudación de impuestos del municipio más pobre de Misiones, afectando por lo tanto, de modo indirecto, a los habitantes más carenciados del mismo, que son quienes se benefician de la inversión municipal en alimentos, salud, infraestructura, educación, etc. Capítulo 21: Innovación conceptual 317 están actuando en sentido contrario al buscado, es decir, aquellos que favorecen la pérdida de biodiversidad, degradación de los suelos, etc. Puede ser común que haya programas de incentivos a la forestación que llevan al reemplazo de la cubierta vegetal original por cultivos de especies exóticas de alto rendimiento. En otros casos, programas de incentivo al empleo comunitario pueden subsidiar acciones de desmonte, en vez que a la reforestación. En estos casos, si bien siempre habrá afectados, en este caso los que se beneficiaban de ese incentivo “ambientalmente perverso”, se produce un ahorro fiscal que puede redirigirse hacia acciones “ambientalmente virtuosas”, en las que idealmente habría otros o los mismos beneficiarios. Sin embargo, lo más común en regiones como las que se analizan en este libro es que los incentivos más frecuentes consistan en programas de asistencia técnica, principalmente agropecuaria. Durante años existió el Programa Andino, con sede en La Quiaca, mediante el cual se fomentó la implantación de pasturas en el altiplano y la introducción de ovinos mejorados. Posteriormente, los esfuerzos de asistencia se dirigieron preferencialmente a la mejora del ganado camélido y a la introducción y difusión de técnicas de selección, esquila, clasificación y comercialización de sus fibras. Tanto el mapeo de incentivos como la experimentación con los mismos reconocen escasos antecedentes en la región y en el país. lo mismo puede decirse respecto al planeamiento bioregional. Sin embargo, los actores involucrados en el manejo de Reservas de Biosfera están dirigiendo su atención a la aplicación práctica de estas técnicas, de las que dependerá que las Reservas de Biosfera andinas de la Argentina mantengan su sitial preferencial y su prestigio ganado como demostradoras de manejo innovador entre las áreas protegidas a nivel nacional. Capítulo 21: Innovación conceptual 321 Abramsky, Z. y C. Sellah. 1982. Competition and the role of habitat selection in Gerbillus allenbyi and Meriones tristrami: a removal experiment. Ecology, 63: 1242-1247. Adámoli, J y P. Fernández. 1980. Expansión de la frontera agropecuaria en la cuenca del Plata: antecedentes ecológicos y socioeconómicos para su planificación. En: Estilos de desarrollo y medio ambiente en América Latina (Sunkel y N. Gligo eds.). PCE, México. Allen, R. 1956. The flamingos: Their life history and survival. Res. Rep. 5, National Audobon Society, NY. Alzérreca, A. 1982. Recursos forrajeros nativos y la desertificación de las tierras altas de Bolivia. pp. 23-42. En: Ecología y recursos naturales en Bolivia (Centro Portales ed.), Cochabamba, Bolivia. Amaya, J. 1985. Dieta de los camélidos sudamericanos. pp. 69-77. En: Estado actual de las investigaciones sobre camélidos en la República Argentina, (J. Cajal y J. Amaya eds.), Secretaría de Ciencia y Tecnología, Buenos Aires, Argentina. Anderson, A. 1983. A critical review of literature on puma (Felis concolor). Special Report Nº 54. Colorado Division of Wildlife, Colorado. Anthony, R. G. y N. S. Smith. 1974. Comparison of rumen and fecal analysis to describe deer diets. J.Wildl.Mgmt, 38: 535-540. AOAC. 1965. Official methods of analysis of the Association of Official Analytical Chemists. 10th de. Assoc. Off. Anal. Chem., Washington DC. Araya, B. y J. Mille. 1986. Guía de campo de las aves de Chile. Univ. de Valparaíso, Santiago de Chile. Arce de Hamity, M., L. Neder de Roman y R. Tecchi. 1993. Comunidades de artrópodos de la Cuenca de Pozuelos. XVI Reunión Argentina de Ecología, Jujuy, Argentina. Arengo, F. y G. Baldasarre. 1995. Effects of food density on the behaviour and distribution of non-breeding american flamingos in Yucatan, Mexico. The Condor, 97: 325-334. Bibliografía 322 Bahamonde, N., S. Martin y A. P. Sbriller. 1986. Diet of guanaco and red deer in Neuquen Province, Argentina. J. Range Magmt., 39: 22-24. Barbour, M. y D. Díaz. 1973. Larrea plant communities on bajada and moisture gradients in the United States. Vegetatio, 28: 335-352. Barquez, R. 1983. La distribución de Neotomys ebriosus THOMAS en la Argentina y su presencia en la Provincia de San Juan (Mammalia, Rodentia, Cricetidae). Historia Natural, 3 (22): 189-191. Batarbee, E. 1986. Diatom analysis. pp. 527-570. En: Handbook of Holocene Palaeoecolgy and Palaeohydrology (B. Berglund ed.) J. Wiley & Sons Ltd., NY. Bekoff, M., T. Daniels y J. Gittleman. 1984. Life history patterns and the comparative social ecology of carnivores. Annual Reviews Ecology Sistematic, 15: 191-232. Berger, J. 1983. Ecology and catastrophic mortality in wild horses: implications for interpreting fossil assemblages. Science, 220: 14031404. Bianchi, A. 1981. Las precipitaciones en el noroeste argentino. INTA, Buenos Aires, Argentina. Bibby, C., N. Collar, J. Crosby, M. Heath, Ch. Imboden, T. Johnson, A. Long, A. Stattersfield y S. Thirgood. 1992. Putting biodiversity on the map: Priority areas for global conservation. International Council for Bird Preservation, Cambridge, UK. Bisbal, F. 1993. Impacto humano sobre los carnívoros de Venezuela. Studies on Neotropical Fauna and Environment, 28: 145-156. Bonaparte, J. 1978. El mesozoico de América del Sur y sus tetrápodos. Opera Lilloana 26. Univ. Nac. de Tucumán, Fund. Miguel Lillo, Tucumán, Argentina. Bonaventura, S., R. Tecchi y D. Vignale. 1995. The vegetation of the Puna Belt at Laguna de Pozuelos Biosphere Reserve in northwest Argentina. Vegetatio, 119: 23-31. Bibliografía 323 Bowers, M. y J. Brown. 1982. Body size and coexistence in desert rodents: chance or community structure? Ecology, 63: 391-400. Bowers, M., D. Thomson y J. Brown. 1987. Foraging and microhabitat use in desert rodents: the role of dominant competitor. Oecologia, 72: 77-82. Braun Wilke, R. 1991. Tres recursos leñosos: Queñoa, Churqui y Tola. pp. 43-50. En: La Reserva de la Biosfera Laguna de Pozuelos. Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi eds.). Instituto de Biología de Altura, UNJU, UNESCOMAB, Montevideo. Brown, J. y G. Lieberman. 1973. Resource utilization and coexistence seedeating in sand dune habitat. Ecology, 54: 788-797. Bucher, E. 1992. Population and conservation status of flamingos in Mar Chiquita, Cordoba, Argentina. Colonial Waterbirds, 15(2): 179-184. Bunnell, F. 1978. Constraints of small populations. pp. 264-287. En: Working Meeting of the IUCN Survival Service Commission, Deer Specialist Group, (IUCN ed.), IUCN, Morges, Suiza. Burkart, R., J. García Fernández y A. Tarak. 1997. Informe Nacional sobre las áreas protegidas de Argentina. I Congreso Latinoamericano de parques nacionales y otras áreas protegidas, Santa Marta, Colombia. Adm. de Parques Nacionales, Buenos Aires, Argentina. Buxton, A. 1986. Luxury fibres. Textil Outlook International, The Economist Publications Ltd. Cabezas, R. 1987. Evolución de la población de vicuñas en la Reserva de fauna Olaroz-Cauchari, Departamento de Susques. Dir. de Bosques, Caza y Pesca, Jujuy, Argentina. _________ 1994. Informe sobre la vicuña en Jujuy. Dir. Gral. de Recursos Naturales Renovables, Jujuy, Argentina. Mimeografiado. Cabrera, A. L. 1958. La vegetación de la puna argentina. Revista de Investigaciones Agrícolas, T XI (4), Ministerio de Agricultura y Ganadería, Buenos Aires, Argentina. Bibliografía 324 Cabrera, A. 1961. Los félidos vivientes de la República Argentina. Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Ciencias Zoológicas 5: 161-247 ___________ 1968. Geo-ecología vegetal de las regiones montañosas de las américas tropicales. Colloquium Geographicum, 9: 91-116. ___________ 1971. Fitogeografía de la República Argentina. Boletín de la Soc. Argentina de Botánica, 14: 1-42. Cabrera, A. L. 1976. Regímenes Fitogeográficos Argentinos, Enciclopedia Argentina de Agricultura y Jardinería. T. 2, Facsimil 1, Ed. ACME, Buenos Aires, Argentina. Cabrera, A. y A. Willink. 1973. Biogeografía de América Latina. OEA. Serie de Biología. Monografía Nº 13. Cabrera, A. y J. Yepes. 1940. Mamíferos sudamericanos. Compañía Argentina de Editores, Buenos Aires, Argentina. Cajal, J. 1983. La vicuña en Argentina, pautas para su manejo. Interciencia, 8(1): 19-22. _______ 1988. The lesser Rhea in the Argentine Puna Region: Present situation. Biol. Conserv., 45: 1-11. _______ 1989. Uso de habitat por vicuñas y guanacos en la Reserva San Guillermo, Argentina. Vida Silvestre Neotropical. 2: 21-31. ______ 1991. An integrated approach to the management of wild camelids in Argentina. pp. 305-321. En: Latin American Mammalogy. History, Biodiversity, and Conservation (M. Mares y D. Schmidly eds.), University of Oklahoma Press. ______ 1994. Programa integrado de conservación ambiental y desarrollo sustentable de la Cordillera de Los Andes. FUCEMA, Buenos Aires, Argentina. Cajal, J. y N. López. 1987. El puma como depredador de camélidos silvestres en la Reserva San Guillermo, San Juan, Argentina. Revista Chilena de Historia Natural, 60: 87-91. Bibliografía 325 Cajal, J. y R. Ojeda. 1993. Camélidos silvestres y mortalidad por tormentas de nieve en la Cordillera Frontal de la Provincia de San Juan, Argentina. Mastozoología Neotropical, 1(1): 81-88. Cajal, J., A. Reca y J. Pujalte. 1981. La reserva provincial San Guillermo y sus asociaciones ambientales. Secretaría de Ciencia y Tecnología, Buenos Aires, Argentina. Calle Escobar, E. 1982. Producción y mejoramiento de la alpaca. Banco Agrario del Perú, Lima, Perú. Cardich, A. 1980. El fenómeno de las fluctuaciones de los límites superiores del cultivo en los Andes: su importancia. Relaciones, 14(1): 7-31. Cardozo, A. 1954. Los Auquénidos. Centenario ed., La Paz, Bolivia. Carpio, M. 1990. Camélidos y socio-economía andina. Producción de Rumiantes Menores: Alpaca. SR-CRSP, 5-17. Caugley, G. 1978. Analysis of vertebrate populations. John Wiley & Sons, NY. Cei, J. M. 1993. Reptiles del noroeste, nordeste y este de la Argentina. Herpetofauna de las selvas subtropicales, puna y pampas. Museo Regionale di Scienza Naturali, Monografía XIV, Torino, Italia. Cei, J. M., R. Etheridge y F. Videla. 1983. Especies nuevas de iguanidos del noroeste de la Provincia de San Juan (Reserva Provincial San Guillermo), Argentina. Deserta, 7: 316-323, Mendoza, Argentina. Cendrero, A., J. Díaz, D. González, V. Mascitti, R. Rotondaro y R. Tecchi. 1993. Environmental diagnosis for planning and management in High Andean Region: The Biosphere Reserve of Pozuelos. J. Envir. Manag. 17: 683-703. Chapman, F. M. 1921. The distribution of bird life in the Urubamba Valley of Peru. U.S. Natl. Mus. Bull., 117: 1-138. _____________ 1926. The distribution of bird life in Ecuador: A contribution to the origen of andean bird life. Bull. Am. Mus. Nat. Hist., 55: 1-784. Bibliografía 326 Charles, A. 1994. Towards sustainability: The fishery experience. Ecological Economics, 11(3): 201-211. Clark, C. y M. Mangel. 1984. Foraging and flocking strategies: information in an uncertain environment. Amer. Nat. 123: 629-641. CODEPO. 1993. Corporación para el Desarollo de la Cuenca de Pozuelos. Documento Nº 1, Jujuy, Argentina. Connel, J. 1980. Diversity and coevolution of competitors, or the ghost competition past. Oikos, 35: 131-138. Corbett, L. 1989. Assesing the diet of dingoes from feces: a comparison of 3 methods. J. Wildl. Mgmt, 52(2): 343-346. Crespo, J. y J. De Carlo. 1963. Estudio de una población de zorros colorados, Dusicyon culpaeus (Molina), en el oeste de la Provincia del Neuquén. Rev. Mus. Arg. Cs. Nat. “Bernardino Rivadavia”. Ecología 1(1): 1-15. Crook, J. H. 1972. Sexual selection dimorphism, and social organization in the primates. pp. 231-281. En: Sexual selection and the descent of man (B. Campbell ed.), UK. Diamond, J. 1980. The island dilemma: Lessons of modern biogeographic studies for the design of natural reserves. Biol. Conserv., 7: 129146. Diaz Costa, L. 1989. Se define el futuro de San Guillermo. Diario de Cuyo (1/3/89), San Juan, Argentina. Dinerstein, E., D. Olson, P. Graham, A. Webster, S. Primm, M. Bookbinder y G. Ledec. 1995. Una evaluación del estado de conservación de las ecorregiones terrestres de América Latina y el Caribe. WWF, Banco Mundial. Washington D.C. Dollfus, C. 1981. El reto del espacio andino. Inst. de Estudios Peruanos, Lima, Perú. Dubowy, P. 1989. Waterflow communities and seasonal environments: Bibliografía 327 Temporal variability in interespecific competition. Ecology, 69(5): 1439-1453. Dueser, R. y J. Porter. 1986. Habitat use by insular small mammals: relative effects of competition and habitat structures. Ecology, 67: 195-201. Duncan, P. 1983. Determinants of the use of habitat by horses in a Mediterranean Wetland. Anim. Ecology, 52: 93-109. Dusi, J. L. 1949. Method for determination of food habits by plants: Microtechniques and histology and their applications to cottontail rabbits in Ohio. J. Wildl. Mgmt., 13: 295-298. Eisenberg y Thorington. 1973. A preliminary analysis of a neotropical mammal fauna. Biotropica, 5(3): 150-161. Eisenberg, J., M. O’Connell y P. August. 1979. Density, productivity, and distribution of mammals in two venezuelan habitats. pp. 187-207. En: Vertebrate ecology in the northern neotropics (J. Eisenberg ed.). Smithsonian Institution Press, Washington DC. Ezcurra, E., M. Equihua y J. López-Portillo. 1987. The desert vegetation of El Pinacate, Sonora, Mexico. Vegetatio, 71: 49-60. Fernández, J. 1970. Polylepis tomentella y su orogenia reciente. Bol. Soc. Geo. Arg., 13: 15-30. Fjeldsa, J. 1985. Origin, evolution, and status of the avifauna of andean wetlands. Ornithological Monographs, 36: 85-112. Flores Ochoa, J. 1977. Pastores de alpacas en los Andes. pp. 11-49. En: Pastores de Puna (J. Flores Ochoa ed.). Inst. de Estudios Peruanos (IEP), Lima, Perú. Forni, F. 1981. Laguna Blanca, una comunidad de pastores de llamas en la puna catamarqueña. Boletín CEIL, Buenos Aires, 7: 23-27. ______ 1990. Proyecto de Investigación y Desarrollo. Organización laboral de comunidades marginadas involucradas en proyectos de ecodesarrollo. CEIL-CONICET, Buenos Aires. Bibliografía 328 Forni, F., M. I. Tort y L. Pessina. 1987. El establecimiento de una reserva de vida silvestre en una comunidad de pastores de altura (Laguna Blanca-Departamento Belén-Catamarca). Boletín CEIL, Buenos Aires, 15: 17-27. Fra, E. 1996. Expedición Andes 96. Dir. de Ganadería y Fauna. Catamarca, Mimeografiado. Frank, E., V. Wehbe, H. Lamas, R. Tecchi, G. Bollati, R. Santos, R. Bercesa, E. Unzaga y M. Molina. 1991. Determinación de las características físicas del vellón de Camélidos Sudamericanos domésticos en las Provincias de Catamarca y Jujuy. Resultados preliminares. VII Convención Internacional en Camélidos Sudamericanos. Jujuy, Argentina. Franklin, W. L. 1974. The social behaviour of the vicuña. pp. 477-487. En: The behaviour of ungulates and its relation to management (V. Geist y F. Walther, eds). IUCN, Morges, Suiza. Franklin, W. 1982. Biology, ecology and relationship to man of the South America camelids. pp. 457-484. En: Mammalian Biology in South America (M. Mares y H. Genoways, eds.). Pymatuning Laboratory of Ecology, University of Pittsburgh, Special Publication Series, Vol.6, Pittsburgh. _________ 1983. Contrasting socioecologies of south america’s wild camelids: The vicuña and the guanaco. pp. 180-213. En: Advances in the study of mammalian behaviour (J. Eisenberg y D. Kleiman, eds). Spec. Publ. Amer. Soc. Mamm., 7: 1.753. Frenguelli, J. 1928. Acerca del origen de los salares de la región de los desiertos de la Puna de Atacama. Anal. Soc. Est. Geogr. GAEA, 3(1): 167-186. Fretwell, S. y H. Lucas Jr. 1970. On territorial behaviour and other factors influencing habitat distribution in birds. I Theoretical Development. Acta Biotheor., 19: 16-36. FUCEMA. 1997. Libro Rojo. Mamíferos y Aves Amenazados de la Argentina. FUCEMA-Adm. de Parques Nacionales, Buenos Aires, Argentina. Bibliografía 329 García Fernández, J. 1991. Pastoreo, economía familiar y medio ambiente en la cuenca de Laguna de Pozuelos. pp. 121-135. En: La Reserva de la Biosfera Laguna de Pozuelos: Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi eds), Univ. Nacional de Jujuy. UNESCO-MAB, Montevideo. _______________ 1995. El rol de acciones afirmativas de conservación y la necesidad de una ley de especies amenazadas. Primeras Jornadas Preparatorias de la Legislación sobre Biodiversidad, Honorable Senado de la Nación, FUCEMA, Buenos Aires, Argentina. García Fernández, J. y R. Tecchi. 1991. La Reserva de la Biosfera Laguna de Pozuelos: Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi eds), Univ. Nacional de Jujuy. UNESCO-MAB, Montevideo. ___________________________ 1991. Economía y medio ambiente: Análisis de los factores que impiden la expansión de la cría de llamas en la Provincia de Jujuy. pp. 137-151. En: La Reserva de la Biosfera Laguna de Pozuelos: Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi eds), Univ. Nacional de Jujuy. UNESCO-MAB, Montevideo. García Fernández, J., R. Tecchi y M. Rabey. 1985. La ganadería de llamas en el altiplano jujeño. Seminario Taller Inv. Atropol. Ecol. Integer. Sur Andes Centrales, UNESCO, Huacalera, Jujuy, Argentina. García Fernández, J., D. González, R. Rotondaro y R. Tecchi. 1988. La unidad productiva doméstica y la relación hombre-naturaleza en una cuenca del altiplano jujeño. Contrib. PER., 1, Univ. Nac. de Jujuy-UNESCO, Jujuy, Argentina. Garrido, J. 1985. La utilización del guanaco (Lama guanicoe, Muller). Su situación en Argentina. Conferencia Internacional sobre Camélidos Sudamericanos, Cuzco, Perú. Giacchi, J. 1994. Biodiversidad: los organismos inferiores también existen. Hocicos, Bol. Informativo de FUCEMA Nº 2, Buenos Aires, Argentina. Gillison, A. y K. Brewet. 1985. The use of gradient directed transects or gradsects in natural resource surveys. J. Envir. Manag., 20: 103-127. Bibliografía 330 Grant, P. R. 1978. Competition between species of small mammals. pp. 38-51. En: Populations of small mammmals under natural conditions, (D. P. Snyder, ed.). Univ. of Pittsburgh. Handford, P. y M. Mares. 1985. The mating systems of ratites and tinamous: an evolutionary perspective. Biol. J. Linn. Soc., 25: 77-104. Hansen, R. M., D. G. Peden y R. W. Rice. 1973. Discerned fragments in feces indicates diet overlap. J. Range Mgmt., 26: 103-105. Herrera, C. 1989. Frugivory and seed dispersal by carnivorous mammals, and associated fruit characteristics in undisturben Mediterranean habitats. Oikos, 55: 250-262. Hill, M. 1979. TWINSPAN. A Forran program for arranging multivariate data in an ordered two-way table by classification of the individuals and attributes. Ecology and Systematics, Cornell Univ. Ithaca, NY. Hofmann, R. y K. Otte. 1983. Consideraciones sobre el manejo de los camélidos silvestres en la Argentina. Secretaría de Ciencia y Tecnología, Buenos Aires, Argentina. Hofmann, R., K. Otte, C. Ponce y M. Rios. 1983. El manejo de la vicuña silvestre. Sociedad Alemana de Cooperación Técnica (GTZ), Echborn, Alemania. Hudson, R. 1989. History and Technology. pp. 11-25. En: Wildlife Production Systems (R. Hudson, K. Drew y L. Baskin eds.). Cambridge University Press. Hueck, K. y P. Seibert. 1972. Vegetations karte von Sudamerika. Gustav Fischer Verlag, Stuttgart. Hunziker, J. 1952. Las comunidades vegetales de la cordillera de La Rioja. Rev. de Investigaciones Agrícolas, 6: 167-196, Buenos Aires. Hurlbert, S. 1978. Anden lake and flamingo investigation. Technical Reports Nº 1, Nat. Geographic Society. _________ 1979 The mesurement of niche overlap and some relatives. Bibliografía 331 Ecology, 59(1): 67-77. _________ 1981. Andean lake and flamingo investigation. Technical Reports Nº 2, Nat. Geographic Society. Hurlbert, S. y J. Keith. 1979. Distribution and spatial patterning of flamingos in the Andean Altiplano. The Auk, 96: 328-342. Igarzábal, A. 1974. La Laguna de Pozuelos y su ambiente salino (Departamento de Rinconada, Provincia de Jujuy). IDIA, supl. 34: 12-32. ___________ 1991. Caracterización evolutiva y morfológica de la Laguna de Pozuelos. pp. 23.31. En: La Reserva de la Biosfera Laguna de Pozuelos: Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi eds.). UNESCO-MAB, Montevideo. INRENA. 1994. Evaluación poblacional de vicuñas a nivel nacional. Ministerio de Agricultura, Inst. Nac. de Recursos Naturales, Lima, Peru. Iriarte, J., L. Contreras y F. Jaksic. 1989. A long-term study of a small mammal assemblaje in the central chilean matorral. J. Mammal., 70: 79-87. Jaksic, F., R. Schlatter y J. Yañez. 1980. Feeding ecology of central chilean foxes Dusicyon culpaeus and Dusicyon griseus. J. Mammal., 61: 254-260. Jewell, P. y S. Holt. 1981. Problems in management of locally abundant wild mammals. Academic Press. Johnson, A. 1984. Population studies and conservation of greater flamingos in the Camarge. Rev. Ecol. (Terre Vie), 44: 49-63. Kacelnick, A., J. Krebs y C. Bernstein. 1992. The ideal free distribution and predator-prey populations. Trends Ecol. Evol., 7: 50-55. Kelt, D., J. Brown, E. Heske, P. Marquet, S. Morton, J. Reid, K. Rogovin y G. Shenbrot. 1996. Ecology, 77(3): 746-761. Kiesling, R. 1994. Flora de San Juan, República Argentina. VI, Vázquez Mazzini ed., Buenos Aires. Bibliografía 332 Kirpatrick, R. L. 1980. Physiological indices in wildlife management. pp. 99-112. En: Wildlife Management Techniques Manual (Schemmitz S.D. ed.). The Wildlife Society, Washington DC. Koford, C. 1957. The vicuña and de puna. Ecological Monographs, 27: 153-219. Kreuter, U. y J. Workman. 1994. Costs of overstocking on cattle and wildlife ranches in Zimbabwe. Ecological Economics, 11(3): 237-248. Lamas, H. 1993. Caracterización y diferenciación del tipo de fibra y tipo de vellón en camélidos sudamericanos domésticos. 1º Informe, Beca de Iniciación, CONICET. Landres, P., J. Verner y J. Thomas. 1988. Ecological uses of vertebrate indicator species: A critique. Conservation Biology, 2(4): 316-328. Larriau, E., R. Bigatti y N. Oporto. 1982. Somatometría en guanacos de Rio Negro. En: Anatomía en borrador. Hemisferio Sur S.A, 3(9): Larsen, E. 1986. Competitive release in microhabitat use among coexisting desert rodents: A natural experiment. Oecologia, 69: 231-237. Latour, M. y A. Pelliza. 1981. Clave para la determinación de la dieta de herbívoros en el noroeste de Patagonia. Revista de Investigaciones Agropecuarias, Instituto Nacional de Tecnología Agropecuaria (INTA), 16: 109-157. Lehner, P. 1979. Handbook of ethological methods. Garland STPM Press, NY. Lent, P. 1974. A review of rutting behavior in moose. Nature Canada, 101: 307-323. Lester, R. y J. Myers. 1993. Global warming, climate disruption, and biological diversity. pp. 177-221. En: Audubon Wildlife Report, Nat. Audubon Society,NY. Liberman, C. 1986. Microclima y distribución de Polylepis tarapacana en el parque Nacional del Nevado de Sajama, Bolivia. Doc. Phytosociologiques, 10: 235-272. Bibliografía 333 Lucas, P. H. 1992. Protected Landscapes. A guide for policy-makers and planners. IUCN, Chapman & Hall, NY. Maarel, E. van der. 1979. Transformation of cover-abundance values in phytosociology and its effects on community similarity. Vegetatio, 39: 97-114. Mac Arthur, R y E. Wilson. 1967. The theory of island biogeography. Monog. in population biology, Princeton Univ. Press, NY. Mani, M. 1962. Introduction to high altitude entomology. Methuen Co. Lda. _______ 1968. Ecology and biogeography to high altitude insects. E. Schimitschek Gottingen ed. Maquera Llano, F. 1991. Persistencia fenotípica y caracterización de tipos de llama Kara y lanuda. Tesis de Magister Scient. en Producción Animal. Univ. Agraria La Molina, Lima, Perú. Mares, M. 1977. Water balance and other ecological observations on three species of Phyllotis in northwestern Argentina. J. Mammal., 58: 514-520. _________ 1980. Convergent evolution among desert rodents: A global perspective. Bull. of Carnegie Mus. of Nat. Hist., 16: 1-51. _________ 1983. Desert rodent adaptation and community structure. Great Basin Nat. Mem., 7: 30-43. Marquet, P. 1994. Diversity of small mammmals in the Pacific Coastal Desert of Peru and Chile and in the adjacent Andean area: Biogeography and community structure. Aust. J. Zool., 42: 527-542. Martelli, H. 1985. Política, administración y derecho sobre camélidos en la Argentina. pp. 221-388. En: Estado actual de las investigaciones sobre camélidos en la República Argentina (J. Cajal y J. Amaya eds.). Secretaría de Ciencia y Tecnología, Buenos Aires, Argentina. Martinka, C. 1967. Mortality of northern Montana pronghorns in a severe winter. J. Wildl. Mgmt., 31: 159-164. Bibliografía 334 Mascitti, V. 1996. Partición del Recurso en la comunidad de flamencos de la Laguna de Pozuelos, Jujuy, Argentina. Tesis Doctoral, FCEyNUniv.de Buenos Aires. Mascitti, V. y G. Nicolossi. 1992. Nidificación del flamenco común (Phoenicopterus chilensis) en la Laguna de Pozuelos, Puna de Jujuy. El Hornero, 13(3): 240-242. Mascitti, V. y S. Caziani. 1995. La retracción de la Laguna de Pozuelos (Argentina) y los cambios asociados a la comunidad de aves acuáticas. Resúmenes del III Simposio Internacional de Manejo Sustentable y Desarrollo de áreas frágiles: Ecosistemas de Montaña en los Andes. Huarina, Bolivia. Mautz, W. W. 1980. Nutrition and carrying capacity. pp. 321-348. En: Big Game of North America (J. Schmidt y D. Gilbert eds.), Stackpole books, Washington DC. Mc Closkey, R. 1981. Microhabitat use in coexisting desert rodents. The role of population density. Oecologia, 50: 310-315. Mc Closkey, J. y H. Spalding. 1989. A reconnaissance-level inventory of the amount of wilderness remaining in the world. AMBIO 18(4): 221-227. Mc Donald, K. y J. Brown. 1992. Using montane mammals to model extinctions due to global change. Conservation Biology, 6(3): 409-415. McNeely, J.; J. Harrison y P. Dingwall, eds. (1994) Protecting nature: Regional reviews of protected areas, IUCN, Gland. Mercado Tudor, I. 1991. Dos roedores simpátricos en el Valle de la Paz: Análisis de la morfología molar y dieta. Ecología en Bolivia, 18: 28-43. Merlino, R. y M. Rabey. 1978. El ciclo agrario-ritual en la puna argentina. Relaciones, 12: 47-70. Meserve, P., J. Gutiérrez, J. Yunger, L. Contreras y F. Jaksic. 1996. Role of biotic interactions in a small mammal assemblage in semiarid Chile. Ecology, 77(1): 133-148. Bibliografía 335 Miller, K. 1996. En busca de un nuevo equilibrio. Lineamientos para incrementar las oportunidades de conservar la biodiversidad a través del manejo biorregional. World Resources Institute, Washington. Monbeig, P. 1981. Les mouvements pionniers en Amérique Latine. En: Les phenomènes de frontière dans les Pays Tropicaux. IHEAL, Paris. Morello, J. 1958. La provincia fitogeográfica del Monte. Opera Lilloana, 2: 1-155. Morello, J. 1983. Consecuencias ambientales de anomalías climáticas en el altiplano peruano boliviano. Informe para la Misión CEPALPNUMA, sobre catástrofes naturales en Perú, Bolivia y Ecuador. FLACSO, Buenos Aires. Morse, D. 1990. Food explotation by birds: Some current problems and future goals. Studies in Avian Biology, 13: 134-143. Muhlhauser, H. 1987. Delimitación, caracterización y uso de ecosistemas acuáticos y terrestres en cuencas lacustres altoandinas de Argentina y Chile. Estado actual del conocimiento de ecosistemas acuáticos. Seminario Taller Model. Metodol. Interdis. Estud. Ecosistemas Altoandinos, UNESCO, Buenos Aires. Murphy, D. y S. Weiss. 1992. Predicting the effects of climate change on biological diversity in western North Amercia: species losses and mechanisms. pp. 355-368. En: Consequences of the greenhouse effect for biological diversity, (R. Peters y T. Lovejoy, eds.). Yale University Press, New Haven, Connecticut. Nader de Roman, L. y M. Arce de Hamity. 1991. Estudios preliminares de la fauna de artrópodos de la puna jujeña. II Congreso Argentino de Entomología La Cumbre, Córdoba, Argentina. Nicolossi, G. 1992. Informe de censos de vicuña y suri realizados en la Cuenca de Laguna de los Pozuelos. Adm. de Parques Nacionales, Buenos Aires. Nicolossi, G. 1993. Informe del censo de vicuñas en la Cuenca de Pozuelos. CODEPO-Adm. de Parques Nacionales, Jujuy. Mimeografiado. Bibliografía 336 Norton-Griffiths, M. y H. Torres. 1980. Evaluation of ground and aerial census work on vicuña in Pampa Galeras, Peru. Report to the World Wildlife Foundation and the International Union for the Conservation of Nature (WWF-IUCN), Gland, Suiza. Noss, F. 1990. Indicators for monitoring biodiversity: A hierarchical approach. Conservation Biology, 4: 355-364. Novaro, A. y M. Funes. 1991. Evaluación de la densidad de zorros: Diseño, técnicas de campo y análisis de los datos. Program for Studies in Tropical Conservation, University of Florida-Dirección de Ecología, Provincia de Neuquén. Nuñez, E. 1993. Contribución del Gobierno de Chile. Proyecto reintroducción vicuñas bolivianas en Ecuador. Ministerio de Agricultura-CONAF, Chile. Ojeda, R. 1989. Small mammal responses to fire in the Monte Desert, Argentina. J. Mammal., 70: 416-420. Ojeda R. y M. Mares. 1989. A biogeographic analysis of the mammals of Salta province, Argentina. Patterns of species assemblage in the neotropics. Special Publications, Texas Tech Univ. Press, 27: 1-59. Olgivie, M. y C. Olgivie. 1986. Flamingos. Alan Sutton Publishing Limited. Brunswick Road Gloucester. Olrog, C. C. 1968. Las aves sudamericanas, una guía de campo. Univ. Nacional de Tucuman-Instituto Miguel Lillo, Tucumán. _________ 1976. Distribución bioecológica de los mamíferos del noroeste argentino. Mimeografiado. _________ 1978. Nueva lista de la avifauna argentina. Ministerio de Cultura y Educación, Fundación Miguel Lillo, Opera Lilloana, 27, Tucumán. _________ 1979. A comparison of suboscine and oscine radiation. pp. 1262-1267. En: Symposium on speciation in South America, Inst. Bibliografía 337 Miguel Lillo, Tucumán. __________ 1984. Las aves argentinas: una guía de campo. Administración de Parques Nacionales, Buenos Aires. Olrog, C. y M. Lucero. 1981. Guía de mamíferos argentinos. Fundación Miguel Lillo, Tucumán. Olrog, C. C. y P. Capllonch. 1986. Bio-ornitología Argentina. Historia Natural, 2, Suplemento especial, Corrientes. Olson, D. y E. Dinerstein. 1994. Assessing the conservation potential and degree of threat among ecoregions of Latin America and the Caribbean: A proposed landscape ecology approach. LATEN Nota de difusión 10, Banco Mundial, Departamento Técnico, Unidad Ambiental. Palomares, F., P. Gaona, P. Ferreras y M. Delibes. 1995. Positive effects on game species of top predators by controlling smaller predators populations: An example with Lynx, Mangooses and Rabbits. Conservation Biology, 9(2): 295-305. Parada Meyer, M. 1988. Flamencos en el norte de Chile: decrementos invernales y proposición de movimientos migratorios. I Taller Internacional de Especialistas en Flamencos Sudamericanos. CONAF-NYZS, San Pedro de Atacama, Chile. Partridge, L. 1978. Habitat selection. pp. 351-376. En: Behavioural ecology, an evolutionary approach, (J. R. Krebs y N. B. Davies, eds.). Blackwell Sci. Pub., Oxford. Paz, G. 1991. Campesinos propietarios en la Puna de Jujuy: Yoscaba a fines del siglo XIX. pp. 107-120. En: La Reserva de la Biosfera Laguna de Pozuelos: Un ecosistema pastoril en los Andes Centrales (J. García Fernández y R. Tecchi, eds). UNESCO-MAB, Montevideo. Pearson, O. P. 1951. Mammals in the highlands of southern Peru. Bulletin of the Museum of Comparative Zoology, 106(3): 117-174. Pearson, O. y C. Ralph. 1978. The diversity and abundance of vertebrates along an altitudinal gradient in Peru. Mem. Mus. Hist. Nat. “Javier Prado”, Lima, 18: 1-97. Bibliografía 338 Perú. 1988. IV Reunión Técnica del Convenio para la Conservación y Manejo de la Vicuña. Informe Final, Ministerio de Agricultura, Proyecto Especial Utilización Racional de la Vicuña, Lima, Perú. Perú. 1993. Informe oficial del Gobierno del Perú a la XIII Reunión Ordinaria del Convenio para la Conservación y Manejo de la Vicuña, Tacna, Perú. Peters, R. y J. Darling. 1985. The greenhouse effect and nature reserves. BioScience, 35: 707-717. Pimm, S. y M. Rosenzweig. 1981. How competitors should compete. Oikos, 42: 349-354. Posnansky, M. 1982. Los efectos sobre la ecología del Altiplano de la introducción de animales y cultivos por los españoles. pp. 13-22. En: Ecología y recursos naturales en Bolivia (Centro Portales ed.), Cochabamba, Bolivia. Poysa, H. 1983. Resource utilization and guild structure in a waterfowl community. Oikos, 40: 295-307. Price, M. 1978. Seed dispersion preferences of coexisting desert rodent species. J. Mammal., 59: 624-626. _______ 1978. The role of microhabitat in structuring desert rodent communities. Ecology, 59: 910-921. Price, M. y J. Brown. 1985. Patterns of morphology and resource use in North American desert rodent communities. Great Basin Nat. Mem., 7: 117-134. Price, M. y K. Kramer. 1984. On measuring microhabitat affinities with special reference to small mammals. Oikos, 42: 349-354. Price, M. y N. Waser. 1985. Microhabitat use by heteromyid rodents: Effects of artificial seed patches. Ecology, 66: 211-219. Prohaska, F. 1962. Algunos aspectos del clima de la Alta Cordillera y de la Puna Argentina. Publ. Inst. Suelos y Agrot., Nº 79, Buenos Aires. Bibliografía 339 Pujalte, J. y A. Reca. 1985. Vicuñas y guanacos, distribución y ambientes. pp. 25-49. En: Estado actual de las investigaciones sobre camélidos en la República Argentina (J. Cajal y J. Amaya, eds). Secretaría de Ciencia y Tecnología, Buenos Aires, Argentina. Rabinovich, J., M. Hernández y J. Cajal. 1985. A simulation model for the management of vicuña populations. Ecological Modeling, 30: 275-95. ________________________________ 1987. Un modelo de simulación para el manejo de poblaciones de vicuña. En: Técnicas para el manejo de la vicuña (H. Torres ed.). UICN-PNUMA, Morgues, Suiza. Rabinovich, J., A. Capurro y L. Pessina. 1991. Vicuña use and the bioeconomics of an andean peasant community in Catamarca, Argentina. En: Neotropical Wildlife Use and Conservation (J. Robinson y K. Redford, eds.). The Univeristy of Chicago Press. Rabinowitz, A.y S. Walker. 1990. The carnivore community in a dry tropical forest mosaic in Huai Kha Khaeng Wildlife Sanctuary, Thailand. Journal of Tropical Ecology, 7: 37-47. Raedeke, K. 1978. El guanaco de Magallanes, Chile: Distribución y biología. Corporación Nacional Forestal (CONAF), Santiago de Chile. _________ 1980. Food habits of the guanaco (Lama guanicoe) of Tierra del Fuego, Chile. Turrialba, 30: 177-181. _________ 1982. Habitat use by guanacos (Lama guanicoe) and sheep on common range, Tierra del Fuego, Chile. Turrialba, 32: 309-314., Raedeke, K. J. y J. A. Simonetti. 1988. Food habits of Lama guanicoe in the Atacama Desert of Northern Chile. J. Mammal., 69(1): 198-201. Reboreda J. y G. Fernández. 1996. Estudios sobre ecología del comportamiento en el ñandú (Rhea americana). En: Programa Nacional de Conservación y Manejo del ñandú (Rhea americana) en la República Argentina (J. Cajal y J. García Fernández eds.). FUCEMA-CITES, Buenos Aires. Reca, A. 1989. Relevamiento de un llano, Reserva San Guillermo, San Juan. Tesis Doctoral, Univ. Nac. de Buenos Aires. Redford, K. y J. Eisenberg. 1992. Mammals of the Neotropics. The southern Bibliografía 340 cone. V. 2, University of Chicago Press. Reichman, O. 1975. Relation of desert rodent diets to available resource. J. Mammal., 56: 731-751. Reichman, O. y D. Oberstein. 1977. Selection of seed distribution types by Dipodomys merriami and Perognathus amplus. Ecology, 58: 636-643. Reig, O. 1986. Diversity patterns and differentiation of High Andean rodents. pp. 404-438. En: High Altitude Tropical Biogeography (M. Vuilleumier y M. Monasterio, eds.). Oxford University Press. Reynolds, J. y N. Aebischer. 1991. Comparison and quantification of carnivore diet by faecal analysis: A critique, with recomendations, based on a study of the fox Vulpes vulpes. Mammals Review 21(3): 97-122. Rice, C. 1986. Observations on predators and prey at Eravikulam National Park, Kerala. Journal of the Bombay Natural History Society, 83(2): 283-305. Ringuelet, R. Ecología acuática continental. EUDEBA ed., Buenos Aires. Rodriguez, R. y E. Nuñez. 1989. Informe a la X Reunión de la Comisión Técnica-Administradora del Convenio para la Conservación y Manejo de la Vicuña. Ministerio de Agricultura-CONAF, Chile. Roig, F. 1960. Bosquejo fitogeográfico de las provincias de Cuyo. Comité Nacional para el estudio de los problemas de las regiones áridas y semiáridas. Subcomité Zona Cuyo, Mendoza, Publ. Nº 3: 1-33. Romero, E. 1927. Llamas y alpacas, vicuñas y guanacos. Imp. Gurfinkel, Buenos Aires. Rosenzweig, M. 1973. Habitat selection experiments with a pair of coexisting heteromyid rodent species. Ecology, 54: 111-117. Rosenzweig, M. y J. Winakur. 1969. Population ecology of desert rodent communities: Habitat and environmental complexity. Ecology, 50: 558-572. Bibliografía 341 Rotondaro, R. 1994. Construir viviendas con recursos naturales y tecnología tradicional. Desarrollo Agroforestal y Comunidad Campesina, 11: 8-11, Salta. Ruiz Leal, A. 1959. El desarrollo de estructuras subcirculares en algunas plantas. Rev. Agron. Noroeste Argentino, 3: 83-138. Ruthsatz, B. 1974. Los arbustos de las estepas andinas del Noroeste Argentino y su uso actual. Bol. Soc. Arg. Bot. 16: 27-46. __________ 1977. Pflanzengesellschaften und ihre lebensbedingungen in den Andinean Halbwusten Nordwest-Argentiniens. Dissert. Bot. 39: 1-39. __________ 1983. Der Einflub des Menschens auf die vegetation semiarider bis arider tropischer Hoch gebirge am Beispiel der Hochanden. Ber. Deutsch. Bot. Ges. Bo. 96: 533-576. Ruthsatz, B. y C. Movia. 1975. Relevamiento de las estepas andinas del noroeste de la Provincia de Jujuy. Fundación para la Educación, la Ciencia y la Cultura, Buenos Aires. Ruthsatz, B. y V. Hofmann. 1994. Die verbreitung un C-4 Pflanzen un den semiarider arider NW Argentiniens. Phytocoenol. 12(2-3): 219-249. Schaffer, M. 1981. Minimum population sizes for species conservation. BioScience, 31: 131-134. Schaller, G. 1967. The deer and the tiger: A study of wildlife in India. University of Chicago Press, Chicago. _________ 1979. The Serengeti Lion. University of Chicago Press, Chicago. Schaller, G. y R. Junrang. 1988. Effects of a snowstorm on tibetan antelope. J. Mammal., 69(3): 631-634. Schmitz, R. y A. Baldassarre. 1992. Correlates of flock size and behaviour of foraging american flamingos following Hurricane Gilbert in Yucatan, Mexico. The Condor, 92: 260-264. Bibliografía 342 Schoener, T. 1974. Resource partitioning in ecological communities. Science, 185: 27-39. Schumacher, E. 1978. Lo pequeño es hermoso. Herman Blume eds. Madrid. Seegmiller, R. F. y R. D. Ohmart. 1981. Ecological relationships of feral burros and desert bighorn sheep. Wildl. Monogr., 78: 1-58. Seidensticker, J. 1976. On the ecological separation between tigers and leopards. Biotropica, 8: 225-234. Siegel, S. 1983. Estadística no paramétrica aplicada a las ciencias de la conducta. Trillas, 2º ed., México. Simonetti, J. 1989. Microhabitat use by small mammals in central Chile. Oikos, 56: 309-318. Simonetti, J. A. y E. R. Fuentes. 1986. Guanacos versus cabras y conejos como moduladores del matorral de Chile Central. pp. 76-87. En: Actas de la IV Convención Internacional sobre Camélidos Sudamericanos (C. Venegas y C. Cunazza, eds.). Punta Arenas, Chile. Smith, G. 1987. Processing of speciality animal fibres. Int. Symp. on Speciality Animal Fibres, Aachen, 26. Smith, W. P. 1987. Dispersion and habitat use by sympatric Columbian white-tailed deer an Columbian black-tailed deer. Mammalogy, 68(2): 337-347. Smith, D. R. y L. J. Shandruk. 1979. Comparison of fecal, rumen and utilization methods for ascertaining pronghorn diets. J. Range Mgmt., 32: 275-279. Smuts, G. 1978. Interrelations between predators, prey, and their environment. BioScience, 28(5): 316-320. Sokal, R. y J. Rohlf. 1981. Biometry. W. H. Freeman & Co., San Francisco. Solbrig, O., M. Barbour, J. Cross, G. Goldstein, C. Lowe, J. Morello y T. Yang. 1977. The strategies and community patterns of desert plants. Bibliografía 343 pp. 67-106. En: Convergent Evolution in Warm Desert, (G. Orians y O. Solbrig eds.). Dowden, Hutchinson and Ross, Stroudsburg. Soule, M. 1983. What do we really know about extinction? pp. 111-124. En: Genetics and conservation: a reference for managing wild animal and plant populations (C. Schonewald-Cox, S. Chambers, B. Mac Bryde y L. Thomas eds.). Benjamin-Cummings, Menlo Park, California. Stamps, N. y R. Ohmart. 1978. Resource utilization by desert rodents in the lower Sonoran Desert. Ecology, 59: 700-707. Stewart, D. R. 1967. Analysis of plant epidermis in faeces: A technique for studying the food preferences of grazing herbivores. J. Appl. Ecol., 4: 83-111. __________ 1970. Survival during digestion of epidermis from plants eaten by ungulutes. Rev. Zool. Bot. Afr., 82(2): 343-348. Stoddart, L. A., A. D. Smith McGraw-Hill, 3º ed. y T. W. Box. 1975. Range Management. Storr, G. M. 1961. Microscopie analysis of faeces, a technique for ascertaining the diet of herbivorous mammals. Austral. J. Biol. Sci., 14: 157-164. Sullivan, A. y M. Shaffer. 1975. Biogeography of the Megazoo. Science, 189: 13-17. Sunquist, M., F. Sunquist y D. Daneke. 1989. Ecological separation in a Venezuelan Llanos carnivore community. Advances in Neotropical Mammalogy, 197-232. Tecchi, R. 1992. Unidades de ambiente en una cuenca altoandina: Laguna de Pozuelos, Jujuy, Argentina. pp. 49-59. En: Ecosistemas Altoandinos de Argentina y Chile, (R. Tecchi y A. Veloso eds.). Memorias 3, Inst. de Biología de la Altura, Univ. Nac. de Jujuy, Argentina. Tecchi R y A. Veloso. 1992. Ecosistemas Altoandinos de Argentina y Chile. Programa de ecología regional . Memorias 3. Inst. de Biología de la Altura, Univ. Nac. de Jujuy, Argentina. Tecchi, R., M. Bianchini, M. Rabey y R. Rotondaro. 1986. Asentamiento agrícola en el límite superior del cultivo en los Andes Centrales Bibliografía 344 argentinos. Comechingonia, 3(6): 21-28. TEMAS. 1986. La tecnología y la vida de un pueblo de la puna. Rev. Temas, Petroquímica Gral Mosconi, 34: 29-31, Buenos Aires. ter Braal, C. 1988. CANOCO: A FORTRAN program for cannonical commu- nity ordenation by correspondance analysis, a principal components and redundancy analysis (Versión 2.1). Agricultural Math. Group., Wageningen, The Netherlands. Torres, H. 1992. South American Camelids. An Action Plan for their Conservation. SSC-IUCN-WWF-Sultanato de Oman, Gland, Suiza. Troll, C. 1968. The Cordillera of the Tropical Americas: aspects of climate phytogeographical and agrarian ecology. Geoecol. Mount. Reg. Tropic. Amer. Bonn. Turner, J. C. 1964. Descripción de la hoja geológica 2b, La Quiaca. Inst. Nac. Geol. Min., Buenos Aires, 3: 1-109. Turner, J. C. 1973. Descripción geológica de la Hoja 11 d, Laguna Blanca, Provincia de Catamarca. Escala 1: 200.000, Ministerio de Industria y Minería, Buenos Aires. Valencia, J., A. Veloso, M. Salaberry. 1982. Nicho trófico de los heerpetozoos del transecto Arica-Chungará. pp. 296-292. En: El hombre y los ecosistemas de montaña (A. Veloso y L. Bustos eds.). MAB-6, Vol. 1. Veloso, A., M. Salaberry, J. Navarro, P. Iturra, J. Valencia, M. Penna, N. Diaz. 1982. Contribución sistemática al conocimiento de la Herpetofauna del extremo norte de Chile. pp. 135-167. En: El hombre y los ecosistemas de montaña (A. Veloso y L. Bustos eds). MAB-6, Vol. 1. Vidal, S. 1967. La crianza de la llama y algunas características de su fibra. Tesis Univ. Nacional Agraria La Molina, Lima, Perú. Villagrán, C., E. Armesto y M. Arroyo. 1981. Vegetation in a High Andean transect between Turi and Cerro León in Northern Chile. Vegetatio, 48: 3-16. Bibliografía 345 Villalba, L. 1992. Bolivia. pp. 10-13. En: South American Camelids. An Action Plan for their Conservation. (H. Torres, ed.). SSC-IUCNWWF-Sultanato de Oman. Gland, Suiza. Vorano, A. y J. Bertoni. 1984. Parámetros biológicos y productivos de la llama (Lama glama Cuvier) en pastizal natural de la puna con suplementación y diferente carga. Rev. Arg. Producción Animal, 4(3): 325-342. Vuilleumier, F. 1983. The origin of high andean birds. Nat. Hist., 90: 5057. Vuilleumier, F. y D. Simberloff. 1980. Ecology versus history as determinants of patchy and insular distribution in high andean birds. pp. 235-379. En: Evolutionary biology (M. Hecht, W. Steere y B. Wallace, eds.). Plenum Publishing Corporation. Westhoff, V. y E. van der Maarel. 1978. The Braun-Blanquet approach. pp. 287-399. En: Classification of plant communities (R. Whittaker ed.). The Hague. Wiens, J. 1977. On competition and variable environments. American Scientist, V. 65: 590-597. Wilson, D. 1975. The adequacy of body size as a niche difference. Am. Nat., 109: 769-784. Wilson, E. 1980. Sociobiologia, la nueva síntesis. OMEGA S. A. Barcelona. Wilson, P. 1984. Puma predation on guanacos in Torres del Paine National Park, Chile. Mammalia, 4: 515-522. Wilson, P. y W. Franklin. 1985. Male group dynamics and inter-male aggressions of guanacos in Southern Chile. Z. Tierpsychol., 69: 305-328. Yalden, D. 1993. The problem of reintroducing carnivores. Symposia of the Zoological Society of London. pp. 289-306. En: Mammals as predators (Dunstone N. y M. Gorman, eds.). Oxford Science Publications, Oxford, UK. Bibliografía 346 Yañez, J., J. Cardenas, P. Gezelle y F. Jaksic. 1986. Food habits of the southermost mountain lions (Felis concolor) in South America: Natural versus livestocked ranges. J. Mammal., 67(3): 604-606. Yaringano, M. 1985. Aporte de la República del Perú al Programa de reintroducción de vicuñas en el páramo del Chimborazo de Ecuador. Ministerio de Agricultura, Proyecto Especial Utilización Racional de la Vicuña, Lima, Perú. Zyznar, E. y P. Urness. 1969. Qualitative identification of forage remnants in deer feces. J. Wildl. Mgmt., 33: 506-510. Bibliografía