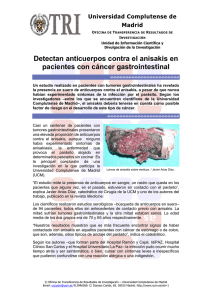
UNIVERSIDAD DE MÁLAGA FACULTAD DE MEDICINA
Anuncio

MENU SALIR UNIVERSIDAD DE MÁLAGA FACULTAD DE MEDICINA DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR SENSIBILIZACIÓN A Anisakis simplex EN MÁLAGA. ESTUDIO EN PACIENTES CON URTICARIA AGUDA RECIDIVANTE. Tesis doctoral presentada para aspirar al grado de Doctor en Medicina y Cirugía por el Licenciado Salvador Fernández Meléndez. Málaga, 1999. MENU SALIR MIGUEL MORELL OCAÑA, CATEDRÁTICO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR DE LA FACULTAD DE MEDICINA DE LA UNIVERSIDAD DE MÁLAGA, CERTIFICA QUE: D. Salvador Fernández Meléndez ha realizado bajo mi dirección los trabajos conducentes a la presente Tesis Doctoral con el título de: "Sensibilización a Anisakis simplex en Málaga. Estudio en pacientes con urticaria aguda recidivante". A la vista de la redacción del texto correspondiente y creyendo que reune los requisitos legales para su lectura y defensa, expido el presente certificado en Málaga, a de de 1999. Fdo.: Miguel Morell Ocaña MENU SALIR JUAN JESÚS GARCÍA GONZÁLEZ, DOCTOR EN MEDICINA, JEFE DE LA SECCIÓN DE ALERGOLOGÍA DEL HOSPITAL REGIONAL UNIVERSITARIO "CARLOS HAYA", CERTIFICA QUE: D. Salvador Fernández Meléndez ha realizado bajo mi dirección los trabajos conducentes a la presente Tesis Doctoral con el título de: "Sensibilización a Anisakis simplex en Málaga. Estudio en pacientes con urticaria aguda recidivante". A la vista de la redacción del texto correspondiente y creyendo que reune los requisitos legales para su lectura y defensa, expido el presente certificado en Málaga, a once de Mayo de 1999. Fdo.: Juan Jesús García González MENU SALIR Agradecimientos: A mis directores de tesis, Profesor Doctor Miguel Morell Ocaña y Doctor Juan Jesús García González, por su continuado estímulo y apoyo. A la enfermera Dña. María Angustias Negro, sin cuyo esfuerzo y dedicación este trabajo no hubiera sido posible. A los Doctores López Giménez y Castell Monsalve por sus enseñanzas en la identificación del parásito Anisakis simplex. Al Doctor Borja Bartolomé por su inestimable ayuda en la realización de los estudios in vitro. Al Doctor Jose Francisco Fernández Meléndez, por su ayuda en el tratamiento de las imágenes de Anisakis simplex. A D. Marino Castillo Cabezas por su ayuda en el tratamiento estadístico de los datos. A todos mis compañeros y amigos de la Sección de Alergología del Hospital Regional Universitario "Carlos Haya". MENU SALIR A Fany, Raquel y Víctor MENU SALIR ¡Honremos la primavera eterna de la vida que todo lo creó!; hasta lo minúsculo tiene su creación merecida sólo la forma se perdió. De estirpes nacen estirpes Que alcanzan mayor perfección; De especies nacen especies, millones de años de resurrección. ¡Alégrate tú que tuviste la suerte de participar como flor en su primer abril y, en honor a lo eterno, el día disfrutar como ser humano y de poner tu grano en la tarea de la eternidad; pequeño y débil inhalarás un único soplo del día que no acaba jamás! Bjørnstjerne Bjørson. "Psalmo II". MENU SALIR INDICES I MENU SALIR INDICE GENERAL INDICES……………………………………………………………………………………….I INDICE GENERAL…………………………………………………………………………..II INDICE DE FIGURAS……………………………………………………………………..VII INDICE DE GRÁFICOS…………………………………………………………………..VIII INDICE DE TABLAS……………………………………………………………………….IX JUSTIFICACIÓN …………………………………………………………….……………..XI INTRODUCCIÓN……………………………………………………….……………………1 1. -Anisakidosis: una historia reciente………………………………….…………2 2. - Descripción del parásito Anisakis simplex…………………………………....3 2.1. -Taxonomía………………………………………………………………3 2.2. - Morfología…………………………………….………………………..5 2.3.- Ciclo vital del parásito Anisakis simplex …………….…………….12 3.- Epidemiología de la Anisakidosis……………………………………………..15 4. - Etiopatogenia de la Anisakidosis……………………………………………..17 5. -Manifestaciones clínicas…………………………………………….…………18 5.1.- Anisakidosis gástrica…………………………………………………18 5.1.1.- Anisakidosis gástrica aguda……………………………….18 5.1.2.- Anisakidosis gástrica crónica……………………………...19 5.2.- Anisakidosis intestinal………………………………………………..19 5.2.1. - Anisakidosis intestinal aguda……………………………..19 5.2.2. - Anisakidosis intestinal crónica………………….………...20 5.3. - Pseudoterranovosis………………………………………………….21 5.4. - Anisakidosis extragastrointestinal………………………………….21 5.5. - Hipersensibilidad a proteínas de Anisakis simplex………………21 5.5.1.- Características clínicas…………………………………….22 6.- Métodos diagnósticos ……………………………………………….…………24 6.1. -Diagnóstico de la Anisakidosis……………………………………...24 6.1.1. - Diagnóstico de imagen…………………………………………24 6.1.1.1.-Hallazgos endoscópicos……….....……………………...25 II MENU SALIR 6.1.1.2. - Hallazgos radiológicos…………………………………..26 6.1.1.3. - Hallazgos ecográficos…………………………………..26 6.1.2. - Diagnóstico seroinmunológico………………………………..27 6.1.2.1. - Inmunodifusión radial…………………………………..27 6.1.2.2. - Radioinmunoensayo………………………….………..28 6.1.2.3. - Enzimoinmunoensayo………………………………….28 6.1.3. - Diagnóstico Histopatológico…………………………………...30 6.2. - Diagnóstico de hipersensibilidad a Anisakis simplex………….32 6.2.1. - Pruebas in vivo……………………………………….…………32 6.2.1.1. - Pruebas cutáneas……………………………………….32 6.2.1.2. - Métodos de pruebas cutáneas…………………………33 6.2.1.3. - Pruebas de exposición………………………………….33 6.2.2. - Pruebas in vitro…………………………………………………33 6.2.2.1. - Determinación de IgE específica………………………33 6.2.2.2. - Determinación de IgG específica………………………34 6.2.2.3. - Liberación de histamina de basófilos………………….34 6.2.2.4. - Detección IgE específica por Inmunoblotting…………35 7. - Profilaxis………………………………………………………………………………...36 8.- Tratamiento……………………………………………………………………………...37 MATERIAL Y MÉTODOS…………………………………………………………………39 1. - Prevalencia de infestación por Anisakis simplex en pescados…………….…….40 1.1. - Material usado…………………………………………….…………..40 1.2. - Recogida de muestras……………………………………………….40 1.3. - Método de estudio……………………………………………………41 2. -Pacientes…………………………………………………………………….…………..41 3. - Controles………………………………………………………………………………..42 4. - Pruebas cutáneas……………………………………………………………………...44 5. - Pruebas in vitro…………………………………………………………………………44 5.1. - Determinación IgE específica…………………………….………...45 5.2. - Determinación IgE total……………………………………………..45 5.3. - Detección IgE específica mediante Inmunoblotting……………...45 III MENU SALIR 5.3.1. - SDS-PAGE………………………………………………………45 5.3.2. - Inmunoblotting…………………………………………………..47 6. - Análisis estadísticos…………………………………………………………………...48 7.- Soporte informático……………………………………………………………………..48 RESULTADOS……………………………………………………………………………..49 1.- Selección de pacientes y controles…………………………………………………...50 2. - Prevalencia de infestación por Anisakis simplex en pescados…………………...59 2.1. - Prevalencia de infestación en Micromesistius poutassou……….59 2.2. - Prevalencia de infestación en Engraulis encrasicholus………….61 2.3. - Prevalencia de infestación en Merlucius merlucius………………62 2.4. - Prevalencia de infestación en Trachurus trachurus……………...62 2.5. - Prevalencia de infestación en Scomber scombrus………………65 2.6. - Prevalencia de infestación en Sardina pilchardus………………..65 2.7. - Prevalencia de infestación en Lophius piscatorius……….………68 2.8. - Prevalencia de infestación en Lóligo vulgaris…………….………68 2.9. - Prevalencia de parasitación en conjunto………………….………71 2.10. - Intensidad de parasitación……………………………….………..73 2.11. - Localización anatómica de los parásitos………………………...75 2.12. - Variaciones estacionales en la intensidad de parasitación……77 3. - Hábitos de consumo de pescado…………………………………………………….79 4.- Pruebas cutáneas…………………………………………………………….………...81 4.1. - Grupo de pacientes………………………………………………….81 4.2. - Grupo de controles…………………………………………………..85 5. - Determinación de IgE específica………………………………………….………….88 5.1. - Grupo de pacientes……………………………………………….…88 5.2. - Grupo de controles…………………………………………………..94 6. -Determinación IgE total………………………………………………………………...95 7. -SDS-PAGE Inmunoblotting……………………………………………….…………...97 8. -Evolución clínica de los pacientes sensibilizados………………………….……...107 9. -Análisis estadístico de los resultados……………………………………………….109 DISCUSIÓN………………………………………………………………………………..117 IV MENU SALIR 1. - Estudio de parasitación de los pescados por Anisakis simplex…………………118 2. -Estudio de sensibilización al parásito Anisakis simplex…………………………..124 CONCLUSIONES…………………………………………………………………………133 BIBLIOGRAFÍA…………………………………………………………………………...136 V MENU SALIR INDICE DE FIGURAS Figura 1. - Situación taxonómica de Anisakis simplex…………………………………..4 Figura 2. - Región anterior. Protuberancia labial………………………………………...6 Figura 3. - Región anterior. Protuberancia labial………………………………………...6 Figura 4. - Región anterior. Diente apical……………………………………….………..7 Figura 5. - Región anterior. Protuberancia labial………………………………………...7 Figura 6. - Diagnóstico diferencial morfológico entre Anisakis simplex, Pseudoterranova y Contracaecum……………………………………………….………..8 Figura 7. - Región ventricular y ventrículo esofágico……………………………………9 Figura 8. - Esófago y ventrículo esofágico…………………………………….…………9 Figura 9. - Ventrículo esofágico……………………………………………….………….10 Figura 10. - Ventrículo esofágico…………………………………………………………10 Figura 11. - Región caudal con mucrón…………………………………………………11 Figura 12. - Ciclo vital del parásito Anisakis simplex………………………….……….14 Figura 13. - Cuestionario Anisakis. Hábitos de consumo de pescado………….……42 Figura 14. - SDS-PAGE…………………………………………………………………...97 Figura 15. - SDS-PAGE Inmunoblotting en condiciones reductoras………………..100 Figura 16. - SDS-PAGE Inmunoblotting en condiciones no reductoras……………103 VI MENU SALIR INDICE DE GRÁFICOS Gráfico 1. - Domicilio grupo de pacientes……………………………………………….54 Gráfico 2. - Domicilio grupo de controles………………………………………………..58 Gráfico 3. - Prevalencia de parasitación por Anisakis simplex en las diferentes especies de pescado estudiadas…………………………………………………………72 Gráfico 4. - Intensidad de parasitación en el conjunto de muestras parasitadas.….73 Gráfico 5. - Intensidad media de parasitación en las diferentes especies de pescado estudiadas………..…………………………………………………….……………………74 Gráfico 6. - Localización anatómica de los parásitos en conjunto……………………75 Gráfico 7. - Localización anatómica de los parásitos en las diferentes especies de pescado estudiadas………………………………………………………………………..76 Gráfico 8. - Variaciones estacionales en la intensidad media de parasitación……..78 Gráfico 9. - Hábitos de consumo de pescado…………………………………………..80 Gráfico 10. - Resultado del procesamiento de casos………………………….……..114 Gráfico 11. - Resultado del procesamiento de casos………………………….……..116 VII MENU SALIR INDICE DE TABLAS Tabla I. - Número de casos publicados de Anisakidosis en el mundo……………….16 Tabla II. - Características de la muestra de pacientes………………………….……...50 Tabla III. - Características de la muestra de controles…………………………………55 Tabla IV. - Prevalencia de infestación en Micromesistius poutassou………….……..60 Tabla V. - Prevalencia de infestación en Engraulis encrasicholus…………………..61 Tabla VI. - Prevalencia de infestación en Merlucius merlucius………….……………63 Tabla VII. - Prevalencia de infestación en Trachurus trachurus………….…………..64 Tabla VIII. - Prevalencia de infestación en Scomber scombrus……………………...66 Tabla IX. - Prevalencia de infestación en Sardina pilchardus…………………………67 Tabla X. - Prevalencia de infestación en Lophius piscatorius…………………………69 Tabla XI. - Prevalencia de infestación en Lóligo vulgaris……………….…………….70 Tabla XII. - Resultado de las pruebas cutáneas en el grupo de pacientes………….81 Tabla XIII. - Pruebas cutáneas en los pacientes positivos a Anisakis simplex……...84 Tabla XIV. - Resultado de las pruebas cutáneas en el grupo de controles…….……85 Tabla XV. - Resultado de la determinación de IgE específica en los pacientes…….89 Tabla XVI. - Estadística descriptiva de la determinación de IgE específica a Anisakis simplex en el grupo de pacientes…………………………………….…………………..91 Tabla XVII. - Resultado de la determinación de IgE específica en el grupo de pacientes sensibilizados a Anisakis simplex………………………………………….…92 Tabla XVIII. - Comparación de resultados de IgE específica y pruebas cutáneas positivas en el grupo de pacientes…………………………………………….…………93 Tabla XIX. - IgE específica positiva a Anisakis simplex en el grupo de controles……………………………………………………………………………………..94 Tabla XX. - Estadística descriptiva de la determinación de IgE específica a Anisakis simplex en el grupo de controles………………………………………………………….95 Tabla XXI. - Determinación IgE total en el grupo de pacientes…………………….…96 Tabla XXII. - Resultados del SDS-PAGE………………………………………………..98 Tabla XXIII. - Resultados del SDS-PAGE Inmunoblotting en condiciones reductoras…………………………………………………………………...……………..101 Tabla XXIV. - Resultados del SDS-PAGE Inmunoblotting en condiciones no reductoras………………………………………………………………...………………..104 VIII MENU SALIR Tabla XXV. - Características clínicas de los pacientes sensibilizados……….…….108 Tabla XXVI. - Comparación de resultados de estudios de parasitación de pescados por Anisakis simplex………………………………………………………………………121 IX MENU SALIR JUSTIFICACIÓN X MENU SALIR Desde que a finales de la década de los cincuenta, autores holandeses y japoneses describieron por primera vez una nueva parasitosis, la Anisakiasis o Anisakidosis (término preferido en la actualidad), producida por la ingestión de pescado infestado por el parásito Anisakis simplex, el número de casos ha ido aumentando paulatinamente en todo el mundo. No obstante, los casos publicados de Anisakidosis en nuestro país, han sido escasos, debido a nuestra cultura culinaria, exenta casi por completo de recetas de pescado crudo. Pero en los últimos años, está aumentando el número de casos publicados de Anisakidosis, por un lado debido a los cambios de hábitos de consumo de pescado influenciados por la cocina oriental, siendo bastante frecuente la presencia de platos de pescado ahumado, marinado o crudo en la carta de los restaurantes españoles. Por otro lado, cada vez se realiza con más frecuencia endoscopias de urgencia ante casos de abdomen agudo compatibles con anisakidosis gástrica, por lo que puede afirmarse que se diagnostica más porque el clínico tiene en cuenta esta entidad en el diagnóstico diferencial. En mil novecientos noventa y cinco, el grupo de Alergología del Hospital Santiago Apóstol de Vitoria, publicó nuevos datos clínicos relacionados con la ingestión de pescado infestado por Anisakis simplex : la ingesta de aquéllos, producía síntomas presumiblemente IgE-mediados, tales como Anafilaxia, o urticaria-angioedema, por hipersensibilidad a las proteínas del mencionado parásito y no al pescado. Estos síntomas, se producían aún cuando el pescado se consumía cocinado normalmente. Con estos antecedentes, en la primavera de mil novecientos noventa y seis, decidimos llevar a cabo un estudio de sensibilización a Anisakis simplex en nuestro medio, especialmente en un subgrupo de pacientes de difícil diagnóstico etiológico: aquéllos con historia clínica de urticaria aguda recidivante no filiada. Estos pacientes suponen el doce por ciento del total, con una clara tendencia a aumentar en los últimos cinco años y sólo se obtiene un diagnóstico etiológico en el ocho ó diez por ciento de los casos, suponiendo una patología frustrante para el alergólogo y el paciente. A la vista de los resultados obtenidos por autores del País Vasco y Madrid, en los que hablaban de elevados porcentajes de sensibilización en este subgrupo de XI MENU SALIR pacientes, y dado el alto consumo de pescado de nuestra población, esperábamos encontrar resultados alentadores. Por otro lado, necesitábamos saber si el pescado consumido habitualmente en nuestro medio, estaba infestado por Anisakis simplex y en tal caso, cuáles eran las especies más infestadas. Nunca se había hecho un estudio parecido en nuestra ciudad, ni siquiera en nuestra Comunidad Autónoma, por lo que nos apoyamos en dos trabajos realizados hasta esa fecha: Uno realizado por autores gallegos en mil novecientos ochenta y nueve y otro realizado en la Comunidad Manchega por el Ministerio de Sanidad y Consumo en mil novecientos noventa y cuatro. El estudio se realizó en la consulta externa que la Sección de Alergología disponía en el Centro de Especialidades "José Estrada", dependiente del Hospital Regional Universitario "Carlos Haya". Se hizo de esta manera porque el personal que la atendía (médico y enfermera) era siempre el mismo, por lo que no había variaciones en la metodología de trabajo. Por otro lado, se aseguraba que el muestreo era verdaderamente consecutivo y un mejor seguimiento de los pacientes dado el fácil acceso al citado Centro. En cuanto a la recogida de muestras de pescado, se eligieron dos mercados representativos de nuestra ciudad: Atarazanas y Nuestra Señora del Carmen, que ofrecían en todo momento las especies que se querían estudiar. Así pues, nuestros objetivos fueron: 1.- Establecer la presencia o ausencia de Anisakis simplex en los pescados de consumo más frecuente de nuestro entorno. 2. - Establecer la prevalencia de infestación en las especies de mayor consumo. 3.- Establecer la presencia o ausencia de sensibilización a proteínas de Anisakis simplex en una muestra de pacientes con urticaria aguda recidivante. 4. - Comparar estos resultados con un grupo control. 5.- Realizar un seguimiento clínico de los pacientes sensibilizados. XII MENU SALIR INTRODUCCIÓN 1 MENU SALIR 1. - ANISAKIDOSIS: UNA HISTORIA RECIENTE Durante la década de los cincuenta, los autores japoneses, Ishikura y Asanuma1 , observaron en el pueblo pescador de Iwanai, un tipo de ileitis terminal con una clínica e histología diferente a las conocidas. Estos autores, publicaron ocho casos recogidos durante el año de 1955. En 1959, publicaron treinta casos2 de esta extraña ileitis terminal, que ellos consideraban diferente porque vieron una reacción tisular de tipo alérgico con una extensa infiltración eosinófílica. En algunas preparaciones histológicas, se vieron cortes transversales de lo que parecía un gusano, tipo nematodo, pero no se identificaron. En 1960, Van Thiel y colaboradores3, autores holandeses, encontraron larvas de un nematodo en la pared intestinal de un paciente que padeció un cuadro de abdomen agudo tras la ingestión de arenques crudos. La larva se identificó como Eusutoma rotundatum y puede considerarse como la primera vez que un ejemplar de Anisakis simplex fue identificado como agente causal de un cuadro de larva migrans visceral. En 1962, esta nueva enfermedad fue denominada anisakiasis4, término modificado en la actualidad por el de anisakidosis, que emplearemos en este trabajo. Posteriormente, en 1968 y con el desarrollo de la endoscopia gástrica, Namiki y colaboradores5 fueron los primeros que extirparon ejemplares de Anisakis simplex de la pared gástrica de pacientes infestados. Poco a poco, se fueron describiendo casos de anisakidosis en todo el mundo: en Francia, el primer caso descrito corresponde a Calvet6, que describió un caso de granuloma eosinofílico ileal; en Estados Unidos el primer caso fue publicado por Pinkus7 en 1975 y en nuestro país no ha sido hasta 1991 cuando se publicó el primer caso de Anisakidosis, con un cuadro clínico de apendicitis aguda y síntomas reumatológicos asociados8. En general, los casos de anisakidosis se han incrementado en todo el mundo, tal vez debido en parte, al desarrollo de la endoscopia digestiva9 y por otro lado al aumento de consumo de platos preparados con pescado crudo (adobo, escabeche, ceviche, carpaccio, arenque verde, sashimi, sushi, sunomono, poki, lomi-lomi y otros) en todos los países occidentales10. 2 MENU SALIR 2. - DESCRIPCIÓN DEL PARÁSITO Anisakis simplex. Genéricamente podemos decir que Anisakis simplex es un parásito nematodo habitual del tracto digestivo de mamíferos marinos, con un ciclo vital muy complejo y cuya ingestión accidental por el hombre al comer pescado crudo o poco cocinado, puede producir diferentes síndromes clínicos, fundamentalmente la Anisakidosis e Hipersensibilidad. También pueden producirlo otros parásitos del mismo género: Pseudoterranova y Contracaecum. 2.1. – TAXONOMÍA. La descripción taxonómica de Anisakis simplex es compleja, y aún en la actualidad existe confusión y discrepancia entre los diferentes autores11, 12, 13 . Generalmente, se acepta la clasificación de Gibson14 publicada en 1983. Anisakis simplex estaría incluido en la clase Nematoda, subclase Secernentea, orden Ascaridida, suborden Ascaridina, superfamilia Ascaridoidea (Heterocheiloidea), familia Anisakidae (Heterocheilidae). Esta familia, comprende 24 géneros; la mayoría de ellos descritos deficientemente. El género Anisakis, se sitúa en la subfamilia Anisakinae, junto con los géneros Pseudoterranova y Contracaecum. Dentro del género Anisakis, se reconocen cuatro especies: Anisakis simplex (Anisakis marina), Anisakis physeteris, Anisakis tipica y Anisakis schupakovi (Figura 1). 3 MENU SALIR Figura 1. – Situación Taxonómica de Anisakis simplex CLASE……………..Nematoda SUBCLASE…………Secernentea ORDEN………………Ascaridida SUBORDEN………….Ascaridina SUPERFAMILIA……..Ascaridoidea (Heterocheiloidea) FAMILIA………………Anisakidae (Heterocheilidae) SUBFAMILIA…………..Anisakinae GÉNEROS.………………Anisakis Pseudoterranova Contracaecum ESPECIES……………Anisakis simplex Anisakis physeteris Anisakis tipica Anisakis schupakovi 4 MENU SALIR 2.2.- MORFOLOGÍA. Anisakis simplex es un gusano nematodo, de color blanquecino y consistencia elástica que tiene una longitud variable, entre 15 y 30 mm y un grosor que oscila entre los 0.25 y 0.50 mm. Está recubierto de una cutícula que presenta estriaciones transversales y presenta en su interior una musculatura longitudinal. Tiene una cavidad simple con un tubo digestivo cilíndrico que termina en un orificio anal 15, 16 situado en la región ventral . Para una mejor descripción de su morfología, se divide en tres regiones: 1) Región anterior. En esta región, encontramos como características morfológicas la existencia de una boca triangular con un diente anteroventral (diente boreal o apical). Esta característica, es lo que los distingue de otros nematodos de la familia Heterocheilidae. Alrededor de la boca, existen tres protuberancias labiales, dos subventrales y otra dorsal, entre las cuales se localiza el poro excretor12, 16, 17. (Ver en páginas siguientes las Figuras 2, 3, 4, 5). 5 MENU SALIR Figura 2.: Región anterior. Protuberancia labial. (x 10). (Tinción con Fucsina básica) Figura 3.: Región anterior. Protuberancia labial. (x 10). 6 MENU SALIR Figura 4. Región anterior. Diente apical (x 10) Figura 5. Región anterior. Protuberancia (x 10) 7 MENU SALIR 2) Región ventricular (Figuras 6, 7, 8, 9, 10). En esta región se encuentra el tubo digestivo que tiene una configuración específica. En primer lugar, el esófago que consta de un preventriculo (esófago muscular) y un ventrículo esofágico (esófago glandular) y posteriormente el intestino. La morfología del ventrículo esofágico, es específica de este género, ya que carece de ciego paraesofágico (el cual existe en el género Pseudoterranova) y de apéndice ventricular, como en el género Contracaecum (Figura 6). Así pues, El ventrículo esofágico de Anisakis simplex es liso, carece de apéndices y es más largo que ancho11, 15, 16. Figura 6. Diagnóstico diferencial morfológico entre Anisakis simplex (A), Pseudoterranova (B) y Contracaecum (C). (da: Diente apical; v: Ventrículo esofágico; e: esófago; cp: Ciego paraesofágico; av: Apéndice ventricular). da da e e cp v v av A B C 8 MENU SALIR Figura 7. Región ventricular y ventrículo esofágico (x 10) Figura 8. Esófago y ventrículo esofágico (x 10) 9 MENU SALIR Figura 9. Ventrículo esofágico (x 10) Figura 10. Ventrículo esofágico (x 10) 10 MENU SALIR 3) Región caudal (Figura11). La región caudal, es cónica, provista de una espina o mucrón característico. El recto, está rodeado de tres glándulas rectales (dos dorsales y una ventral) que no son siempre visibles a microscopía óptica y sólo aparecen en el tercer estadío larvario (L3)15, 16 , 17, 18 . Figura 11. Región caudal con mucrón (x 40). 11 MENU SALIR 2.3. CICLO VITAL DEL PARÁSITO Anisakis simplex. El ciclo vital de Anisakis simplex, es muy complejo, y aún no está bien aclarado11,19. En general, se acepta que el primer estadio larvario (L1) se encuentra en los huevos eliminados en las heces de los hospedadores definitivos, que son fundamentalmente los mamíferos marinos (cetáceos y pinnípedos) tales como las ballenas, focas, leones marinos, delfines, etc. Estos huevos tienen 20 aproximado de 40x50 micras un tamaño y se han reconocido veintiséis especies de cetáceos y doce de pinnípedos como hospedadores de Anisakis simplex21. Estos animales infestados, se distribuyen por los mares de todo el mundo, pero fundamentalmente se encuentran en las aguas más frías22, 23 . Los huevos, a bajas temperaturas (5º- 7ºC) eclosionan en unos 20-27 días y se libera el parásito en forma de segundo estadio larvario (L2), con un tamaño de 355 micras24, 20. Esta larva, ya muestra un diente apical en la extremidad anterior y un anillo nervioso, siendo muy activas en el agua del mar, pudiendo sobrevivir 6-7 semanas a temperatura de 5-7ºC24. Estas larvas son ingeridas por pequeños crustáceos (fundamentalmente Eufausiidos) que forman el Krill oceánico (Thysanoessa inermis, Thysanoessa longicaudata, Meganyctiphanes norvegica)25 y que constituyen los principales hospedadores intermediarios11, 19, 26, 27 . Posteriormente, en el hemocele de estos crustáceos, la larva se desarrolla y se convierte en L3 (tercer estadio larvario) con una longitud de 6 mm 11, 28 siendo ingeridos por multitud de peces teleósteos y calamares en mares de todo el mundo, que constituyen los hospedadores paraténicos. Estos hospedadores, actúan como meros transportadores de la larva, ya que no ocurre ninguna transformación larvaria en ellos11,19, 20 ni siquiera cuando peces o calamares de pequeño tamaño infestados son ingeridos por peces de tamaño mayor, siendo capaz la larva de reinfestar a éstos últimos. Esto ha podido verificarse experimentalmente29. La ingesta de estos peces infestados por los mamíferos marinos, que actúan como hospedadores definitivos, supone el desarrollo del cuarto estadio larvario (L4) y posteriormente se convierten en adultos, sexualmente activos, diferenciándose en machos y hembras, con la consiguiente producción de huevos y el inicio de un nuevo ciclo11, 15, 19, 30 (Figura 11). El ser humano, es un hospedador accidental al ingerir pescado infestado de larvas de Anisakis simplex en su tercer estadio larvario (L3), pero no se desarrolla a 12 MENU SALIR forma adulta11, 19, 20. Estos parásitos, se encuentran pues con frecuencia en los intestinos y vísceras de numerosas especies de peces (sobre todo en el hígado) y permanecen vivos cuando el pez muere31, 19 . En algunas especies (Scomber scombrus), se observa un fenómeno de migración de las larvas a la musculatura perivisceral cuando los peces permanecen mucho tiempo sin eviscerar, pero no se observa en otras especies de alta tasa de infestación (Micromesistius poutassou). Parece que esto está relacionado con la cantidad de lípidos en el tejido muscular de determinadas especies31, 32 . Otros autores sin embargo, han observado este fenómeno de migración en bacaladillas (Micromesistius poutassou)15, por lo que el tema es controvertido. También se ha sugerido que los crustáceos eufausiidos y quizás otros crustáceos, serían infectivos también para los hospedadores definitivos11. Así, por ejemplo, se han encontrado ejemplares de Anisakis simplex en el interior de la ballena azul (Balaenoptera musculus) que se alimenta exclusivamente de eufausiidos23, 33. Por otro lado, también se ha observado en alguna ocasión parásitos en su cuarto estadio larvario (L4) en el interior de peces34. Aunque la mayoría de las veces, los peces infestados con Anisakis simplex son de origen marino, también se ha descrito el parásito en peces de agua dulce35, y otros animales (ranas36, tortugas17, pájaros piscívoros11, 37 , nutrias38 y gatos39). 13 MENU SALIR Figura 12. Ciclo vital del parásito Anisakis simplex. Hospedadores definitivos Hombre Mamíferos marinos L3 L4 Huevos Huevos L1 Peces teleósteos y L2 ? Calamares (L3) Hospedadores paraténicos L2 libres Hospedadores intermediarios Eufausiidos L2 L3 14 MENU SALIR 3. – EPIDEMIOLOGÍA DE LA ANISAKIDOSIS. Dentro del término anisakidosis, se incluyen los síndromes clínicos producidos por los géneros Anisakis simplex, Pseudoterranova (Pseudoterranovosis) y Contracaecum40. La inmensa mayoría de los casos, se dan en el Japón, habiéndose publicado cerca de trece mil casos entre anisakidosis gástrica, anisakidosis intestinal, pseudoterranovosis gástrica y pseudoterranovosis intestinal. En el resto de los países, el número de casos publicados no supera en mucho los quinientos (Tabla I). Como puede verse, en Japón la anisakidosis gástrica es mucho más frecuente que la intestinal (alrededor del 71%), mientras que en el resto de los países, ocurre lo contrario, siendo mucho más frecuente la anisakidosis intestinal (alrededor del 75%)41. La razón de esta diferencia parece deberse al uso rutinario de la gastroscopia de urgencia en Japón, mientras que esta práctica es poco habitual en países de Europa y América9. 15 MENU SALIR TABLA I. Número de casos publicados de anisakidosis en el mundo Anisakis simplex Pseudoterranova País Gástrica Intestinal Gástrica Intestinal Total JAPON 11.629 567 335 HOLANDA 3 289 292 ALEMANIA 13 71 84 FRANCIA 19 19 1 USA 12 24 11 COREA 6 3 12.531 39 2 49 1 10 BELGICA 9 9 UK 2 1 3 15 1 22 ESPAÑA 6 CHILE 1 2 3 CANADA 1 2 3 SUECIA 1 ISRAEL 2 N.ZELANDA TAHITI TOTAL 2 2 1 1 3 1 1 13.052 16 MENU SALIR 4. – ETIOPATOGENIA DE LA ANISAKIDOSIS. Como hemos comentado, la infestación humana por el parásito Anisakis simplex en su tercer estadio larvario (L3), se produce por la ingesta de pescado crudo o semicocinado. Los experimentos realizados con animales, muestran que tanto las larvas vivas como las muertas, producen reacciones inmunes en el huésped a su paso por el tubo digestivo42, 43 . También se ha observado que penetran más fácilmente la pared intestinal que la gástrica y el número total de larvas que penetran la mucosa está entre 1/3 y 1/4 del total41. Estudios realizados en conejos, han mostrado como en la primera infección, la larva puede permanecer viva unos siete días, pero en una segunda infección, muere al segundo día, produciéndose una severa reacción inmunológica tipo granulomatosa. Además, a mayor número de larvas que penetran la pared intestinal, la respuesta inmune es más intensa44. En humanos, la infección primaria del tracto digestivo, rara vez puede verse ya que no causa síntomas, ó éstos son muy leves e inespecíficos. En una posterior reinfección, al penetrar el parásito la mucosa del estómago e intestino, estimula la formación de granulomas o abscesos que se caracterizan por necrosis, hemorragia y masiva infiltración eosinofílica con exudado fibrinoso41, 45. En esta invasión tisular, está implicada la producción de proteasas por el parásito46 que han sido identificadas como una proteasa “tripsina-like” y una metaloaminopeptidasa. Estas enzimas, degradan glucoproteínas y colágeno, pero no la elastina; por otro lado, la tripsina tiene regiones estructuralmente similares a la tripsina de los mamíferos47. También se ha demostrado una actividad anticoagulante expresada como prolongación del tiempo de protrombina, en los productos de excreción-secreción de Anisakis simplex48. Los fenómenos de hipersensibilidad juegan un papel importante en la anisakidosis, estando implicados mecanismos tipo I (IgE-mediados) y mecanismos tipo III (mediados por inmunocomplejos)49. Por otro lado, las secreciones proteicas de las larvas y sus componentes somáticos, poseen una potente actividad quimiotáctica para los eosinófilos. De este modo, la infestación primaria daría lugar a síndromes clínicos insidiosos e inespecíficos mientras que la infestación secundaria daría lugar a síndromes clínicos agudos41, 49. Las complicaciones infecciosas son raras en la anisakidosis, no observándose bacterias en las lesiones ni en el fluido recogido en laparotomías o endoscopias41. 17 MENU SALIR 5. –MANIFESTACIONES CLÍNICAS. Anisakis simplex es responsable de dos síndromes clínicos bien diferenciados: Hipersensibilidad a proteínas del mismo y la infestación o anisakidosis. Esta última, dependiendo de la localización de la lesión, se divide en gástrica, intestinal y ectópica o extragastrointestinal. Todas estas formas de anisakidosis, pueden ser agudas o crónicas, tanto desde el punto de vista clínico como histopatológico9, 50. 5.1. - ANISAKIDOSIS GÁSTRICA. La anisakidosis gástrica, es la forma más frecuente en Japón, con un 71% de los casos. Las larvas del parásito una vez ingeridas y por acción de sus enzimas, penetran la mucosa gástrica, fundamentalmente a nivel del fundus. La anisakidosis gástrica, puede ser clasificada en dos tipos: aguda o fulminante, que es la forma más frecuente y crónica o insidiosa. 5.1.1. -ANISAKIDOSIS GÁSTRICA AGUDA. Las manifestaciones clínicas más frecuentes de esta forma de anisakidosis, son: - Dolor abdominal: El dolor abdominal está presente en el 100% de los casos de anisakidosis gástrica fulminante. Suele empezar entre 3-5 horas después de la ingesta del pescado y en el 80% de los casos dentro de las primeras 24 horas. La intensidad del dolor es variable, desde leve hasta severo y la localización es en el 50% de los casos epigástrico; en el 40% difuso por todo el abdomen y en el 10% en región umbilical. Muchas veces, los pacientes con este cuadro clínico y si el dolor es severo, son intervenidos quirúrgicamente con diagnóstico de abdomen agudo51, 52. - Náuseas y vómitos: Las náuseas están presentes en el 68% de los pacientes y los vómitos en el 39%, estando asociados al dolor abdominal. A veces, se observa hematemesis (en un 7%) y suelen ser casos de presentación muy aguda. Este síntoma puede confundirse con una úlcera sangrante ser tratado con gastrectomía51, 53. - Distensión abdominal: Está presente en el 30% de los casos, afectándose sobre todo la región epigástrica aunque a veces se presenta infraumbilical. 18 MENU SALIR - Diarrea: Se observa en el 19% de los pacientes; es de característica acuosa, con una media de tres deposiciones al día. - Urticaria: Aparece en aproximadamente el 10% de los pacientes y suele acompañarse de dolor abdominal y náuseas. - Dolor torácico: Se observa en el 49% de los pacientes, siendo de características isquémicas51 y a veces puede ser severo, de forma que algunos autores japoneses incluyen la anisakidosis gástrica en el diagnóstico diferencial del dolor torácico agudo54. En cuanto a las exploraciones complementarias, puede encontrarse febrícula de unos 37.5ºC en el 11% de los casos, leucocitosis en el 55% de los casos (en ningún caso sobrepasa los 18.000/mm3) siendo rara la eosinofilia. En caso de aparecer ésta, no sobrepasa el 8%. 5.1.2. -ANISAKIDOSIS GÁSTRICA CRÓNICA. Puede pasar desapercibida, dado que en muchos casos los síntomas son leves con dolor abdominal sordo y difuso, náuseas y anorexia que no obliga al paciente a consultar. Puede diagnosticarse incluso 2-3 meses tras la ingesta, observando las formaciones granulomatosas por endoscopia. 5.2. -ANISAKIDOSIS INTESTINAL. Es la forma más frecuente de la enfermedad en países occidentales, mientras que en Japón no superan el 30% del total de casos diagnosticados50. Al igual que la anisakidosis gástrica, se divide en aguda y crónica, dependiendo de su presentación clínica. 5.2.1. -ANISAKIDOSIS INTESTINAL AGUDA. Es la forma de presentación más frecuente, iniciándose los síntomas en las primeras 48 horas en un 61% de los casos. En un 45% de los casos intestinales agudos, se practica laparatomía quirúrgica, mientras que en el resto se tratan con terapia conservadora. Los síntomas más frecuentes en esta presentación, son: - Dolor abdominal: Es el síntoma más común, aunque puede estar ausente. Esto depende de si la larva de Anisakis penetra la pared intestinal ó permanece en ella. En el primer caso, el paciente permanece asintomático o el dolor desaparece 19 MENU SALIR rápidamente mientras que en el segundo supuesto, aparecería dolor abdominal agudo. La localización del dolor es variable, pero en la mayoría de los casos afecta a la región umbilical y fosa ilíaca derecha, pudiendo simular cuadros de apendicitis8, 50, 55 . - Náuseas y vómitos: Aparecen en el 25% de los casos, aunque en las series de enfermos de Ishikura alcanza el 70% de los casos50. - Distensión abdominal: Se manifiesta en el 61% de los casos, y puede deberse a meteorismo debido al engrosamiento de la pared intestinal y disminución de la luz o a la ascitis, que tiene importancia en el diagnóstico como veremos más adelante. -Estreñimiento: Es un síntoma bastante frecuente en la anisakidosis intestinal, y se debe al engrosamiento de la pared intestinal con la consiguiente formación de un ileo obstructivo. Cuando aparece, puede ayudarnos a establecer la extensión de la enfermedad. En casos muy esporádicos se encuentra sangre en heces, secundario a peritonitis bacteriana por perforación intestinal. - Lengua saburral: Se describe como característico de la anisakidosis intestinal la lengua saburral blanca, apareciendo en el 72% de los casos50. - Defensa muscular abdominal: No es muy frecuente, aunque en un 35% puede aparecer simulando un cuadro de apendicitis o ileo obstructivo agudo, no teniendo una localización específica el punto doloroso a la palpación. Hajime Ishikura refiere que la localización del punto doloroso más frecuente es en fosa ilíaca derecha (incluyendo el punto de McBurney) y en región umbilical (54% y 35% de los casos respectivamente). En cuanto a los hallazgos objetivos que podemos encontrar, son pocos específicos y dado que suele ser un cuadro quirúrgico, nunca se miden. Así por ejemplo, no suele haber fiebre, ni leucocitosis ni (sorprendentemente) eosinofilia. Ésta sí está presente en el líquido ascítico, con un contenido de eosinófilos mayor del 30%. 5.2.2. -ANISAKIDOSIS INTESTINAL CRÓNICA. Suele cursar de forma asintomática y el diagnóstico suele ser casual en el transcurso de una laparotomía por otras causas. 20 MENU SALIR 5.3.- PSEUDOTERRANOVOSIS. La pseudoterranovosis, producida por Pseudoterranova decipiens, es rara, habiéndose descrito 335 casos de pseudoterranovosis gástrica en Japón, 11 en Estados Unidos, 1 en Reino Unido, 1 en España, 2 en Chile y 2 en Canadá. De la forma intestinal sólo se han descrito dos casos en Estados Unidos y uno en Corea (ver Tabla I). En Japón, todos los casos se han dado en el norte del país (Tohoku y Hokkaido), ya que en esta zona es típico el sashimi de tiburón, animal frecuentemente infestado por Pseudoterranova decipiens9, 41. Los síntomas clínicos son más leves que los producidos por Anisakis simplex y no hay publicaciones de casos de penetración de la pared intestinal. 5.4. -ANISAKIDOSIS EXTRAGASTROINTESTINAL. También denominada ectópica o heteróloga. Se han publicado 117 casos en Japón. Se ha descrito en localizaciones diversas: úvula, amígdalas, cavidad pleural, ovario, páncreas, hígado, mesenterio, nódulos linfáticos, tejido subcutáneo, mucosa oral, mucosa faríngea y esófago, siendo la localización más frecuente ésta última, con 24 casos publicados9 , 56 5.5. -HIPERSENSIBILIDAD A PROTEÍNAS DE Anisakis simplex. En 1989, los autores japoneses Kasuya, Hamano e Izumi, describieron por primera vez un caso clínico de anafilaxia por probable alergia o hipersensibilidad a Anisakis simplex57. Se trataba de una mujer de 35 años que experimentó un cuadro de disnea, tos, hinchazones y urticaria generalizada dos horas después de haber comido caballa marinada. Estos autores realizaron pruebas cutáneas con técnica de escarificación a diferentes pescados (incluido caballa) y otros alimentos, con resultado negativo. Las pruebas cutáneas preparadas con un extracto del parásito a una concentración de 2.8 mg/ml, fueron positivas. Los autores concluyeron: “parece que una nueva enfermedad, alergia a Anisakis, debe ser reconocida. Este potente 21 MENU SALIR alergeno, puede llegar a ser un problema mundial, al menos para las personas que coman pescados de mar”. Al año siguiente, en 1990, estos mismos autores publicaron once casos de pacientes con clínica de urticaria tras ingesta de caballa58. En este nuevo trabajo, también realizaron pruebas cutáneas y obtuvieron resultados positivos en todos los pacientes con extracto proteico de Anisakis simplex mientras que ninguno reaccionó con extracto de caballa. Los autores concluyen que los casos corresponderían a pacientes con alergia a Anisakis simplex y teorizan que el antígeno del parásito sería termoestable, ya que dichos pacientes habían comido el pescado cocinado. En 1995, autores españoles del Hospital Santiago Apóstol de Vitoria, publicaron una serie de diez pacientes con clínica de hipersensibilidad inmediata a Anisakis simplex, confirmando el diagnóstico con tests in vivo e in vitro. Por otro lado, demostraron que el alergeno responsable era termoestable, pues el extracto alergénico fue testado tras congelación, tras calentarlo a 40º durante 10 minutos y tras llevarlo a ebullición durante 20 minutos. No hubo diferencias significativas en el tamaño de las pápulas obtenidas con los diferentes extractos. Estos autores concluyen que las proteínas alergénicas de Anisakis simplex son termoestables, y que dependerían de la estructura primaria (determinantes antigénicos 59 secuenciales) . 5.5.1. – CARACTERÍSTICAS CLÍNICAS. La manifestación clínica más frecuente es la aparición de urticaria y/o angioedema entre quince minutos y seis horas después de haber tomado pescado infestado. Estos episodios de urticaria, suelen ser recidivantes y se acompañan de síntomas gastrointestinales en un 40% de los casos59, 60, 61 , 62, 63, 64, 65 . La prevalencia de síntomas cutáneos (urticaria y/o angioedema), varía según las series, oscilando entre el 100%59, 60 y el 78%65. En una serie de cien pacientes con urticaria aguda idiopática, se encontró una prevalencia de sensibilización del 22%, aunque sólo fueron diagnosticados de hipersensibilidad a Anisakis simplex un 8%64. Así pues, este alergeno tendría una importancia similar a algunos alergenos alimentarios como causa de urticaria aguda. La hipersensibilidad a Anisakis simplex también puede manifestarse como un cuadro de anafilaxia, que suele ser de características severas, con una prevalencia 22 MENU SALIR que oscila entre el 25% y 50% de los casos según las series65, 60. Así, el primer caso bien documentado de hipersensibilidad a Anisakis simplex, se trataba de una paciente con diagnóstico inicial de anafilaxia recidivante idiopática66. Las características clínicas, son indistinguibles de otro cuadro de anafilaxia, si bien es característico la presencia de síntomas digestivos agudos inespecíficos (náuseas, vómitos, diarrea) así como una llamativa epigastralgia intensa, que despierta al paciente (si el pescado infestado se consumió en la cena)59. También se han descrito recientemente otros cuadros clínicos de hipersensibilidad a Anisakis simplex, en forma de conjuntivitis ocupacional en un paciente pescadero67, asma ocupacional en dos pacientes (pescadero y manipulador de harinas de pescado respectivamente)68 y dermatitis de contacto69. 23 MENU SALIR 6. –MÉTODOS DIAGNÓSTICOS. La aproximación diagnóstica a los diferentes síndromes producidos por Anisakis simplex, es diferente bien se trate de infestación (Anisakidosis) o hipersensibilidad. En ambos casos, es fundamental realizar una detallada historia clínica con el objeto de evidenciar el consumo de pescado por el paciente antes del inicio de los síntomas. El intervalo de aparición de los mismos, es variable; así, en la anisakidosis depende de la localización del parásito (gástrica o intestinal), siendo mayor el intervalo en esta última (24-48 horas)70. En cuanto a los síntomas de hipersensibilidad, la aparición puede ser inmediata (quince minutos) o tardía (hasta seis horas después)59, 60, 65 . También ha de recogerse en la historia clínica qué pescado se ha consumido y si se ha cocinado o no. Por otro lado, el conocimiento de las especies con mayor índice de infestación en el entorno del paciente, puede resultar de gran ayuda en la aproximación diagnóstica. De forma didáctica, dividiremos los métodos diagnósticos en dos apartados: diagnóstico de anisakidosis y diagnóstico de hipersensibilidad a proteínas de Anisakis simplex. 6.1. –DIAGNÓSTICO DE LA ANISAKIDOSIS. La aproximación diagnóstica de la anisakidosis es variable dependiendo de dos factores: presentación clínica y localización del parásito. En la actualidad, disponemos de tres métodos diagnósticos: a) Diagnóstico de imagen. b) Diagnóstico seroinmunológico c) Diagnóstico histopatológico 6.1.1. –DIAGNÓSTICO DE IMAGEN. La endoscopia es el método diagnóstico de elección en las formas clínicas agudas de anisakidosis, sobre todo en la gástrica5, 9, 71 . A este nivel, el parásito se localiza fundamentalmente en el fundus y curvatura mayor, mientras que a nivel intestinal prácticamente todos los casos, se localizan en íleon terminal, entre la válvula de Bauhin y cien centímetros en sentido proximal9, 71 . Esto hace que la endoscopia diagnóstica en la anisakidosis intestinal, es técnicamente muy difícil, por lo que el diagnóstico definitivo solo puede hacerse mediante estudio histopatológico 24 MENU SALIR de la pieza quirúrgica. También son de ayuda los hallazgos radiológicos y los análisis serológicos, como comentaremos más adelante. 6.1.1.1. – HALLAZGOS ENDOSCÓPICOS. a) Anisakidosis gástrica aguda. En esta forma clínica, la endoscopia hay que realizarla precozmente, con el objeto de extraer al parásito usando las pinzas de biopsia del aparato. Puede observarse la larva del parásito penetrando la mucosa gástrica, moviéndose activamente en forma sigmoide. Es característico el color blanquecino de la larva de Anisakis simplex lo que la diferencia de la larva de Pseudoterranova que es más larga y ancha y de color amarillo o marronáceo. Posteriormente, la larva se mueve lentamente y se estira y contrae rítmicamente. El lugar de penetración está edematoso, acompañado de una hipervascularización variable, dependiendo del intervalo de la infestación y de la respuesta inmunitaria frente al parásito. Puede verse ocasionalmente erosiones y sangrados de la mucosa gástrica, pero es menos frecuente que en la forma intestinal. También puede observarse engrosamiento de los pliegues de la mucosa gástrica con cambios edematosos en las zonas cercanas al lugar de la penetración5, 9, 71, 72. b) Anisakidosis gástrica crónica. En estadios crónicos, puede observarse en el área afectada erosiones o úlceras con diferente grado de edema en la superficie o bien zonas localizadas de induración. En otros casos puede observarse una tumoración nodular. Estos hallazgos endoscópicos, pueden confundirse con un carcinoma gástrico ( tipo IV de Borrman) o con una úlcera gástrica9, 72. c) Anisakidosis aguda intestinal. En esta forma clínica, la endoscopia carece de utilidad y el diagnóstico se realiza identificando la larva en la pieza quirúrgica o mediante estudio histopatológico como comentaremos más adelante. 25 MENU SALIR d) Anisakidosis crónica intestinal. No es de utilidad la endoscopia en esta presentación clínica y muchas veces el hallazgo es casual, en el transcurso de una laparotomía por diferentes causas73. 6.1.1.2. – HALLAZGOS RADIOLÓGICOS. La exploración radiológica, no es de elección en las formas gástricas, aunque puede dar alguna información en las formas intestinales y así evitar la exploración quirúrgica. El método utilizado es el tránsito gastrointestinal con contraste de bario. a) Anisakidosis gástrica. Los hallazgos radiológicos en la anisakidosis gástrica aguda, son secundarios al edema de la mucosa y defectos de relleno filiformes de unos tres centímetros de longitud que corresponden a la larva del parásito74. b) Anisakidosis intestinal. En este caso, los hallazgos radiológicos son secundarios a la intensa edematización de la pared: engrosamiento de los pliegues, signo de la “huella de pulgar”, desaparición de los pliegues de Kerckring, aspecto de la mucosa en diente de sierra y estrechamiento irregular de la luz intestinal, sobre todo a nivel de íleon terminal. En casos muy excepcionales, puede demostrarse la presencia del parásito en la lesión75, 76. Estos hallazgos pueden confundirse con una enfermedad de Crohn, Isquemia intestinal, Enteritis eosinofílica, Tuberculosis intestinal o Neoplasia75. 6.1.1.3. – HALLAZGOS ECOGRÁFICOS. La ecografía puede usarse como alternativa al estudio radiológico, ya que es un método seguro y no invasivo. Se ha usado sobre todo para el diagnóstico de la anisakidosis intestinal, con objeto de evidenciar inflamación de las asas intestinales. El signo ecográfico más frecuente es el engrosamiento de la pared intestinal, considerado patológico a partir de 4 mm. En esta enfermedad, se ha descrito 26 MENU SALIR engrosamiento de la pared intestinal que varía entre 5 y 15 mm77. Otros hallazgos ecográficos que pueden verse son la retención de líquido ascítico y el engrosamiento de los pliegues de Kerckring. No obstante, todos los hallazgos ecográficos son inespecíficos y han de valorarse conjuntamente con los hallazgos clínicos y serológicos del paciente77. 6.1.2. –DIAGNÓSTICO SEROINMUNOLÓGICO. Aunque el diagnóstico de sospecha de la anisakidosis aguda ha de basarse fundamentalmente en la historia clínica del paciente, muchas veces el diagnóstico definitivo es difícil, sobre todo en las formas clínicas intestinales o ectópicas en las que no es útil la endoscopia. Se complica aún más en las formas crónicas, que como hemos visto presenta una sintomatología vaga e inespecífica. En todas estas situaciones, los métodos de diagnóstico seroinmunológico, son de gran utilidad. Se han descrito varios métodos de diagnóstico serológico que describimos a continuación. 6.1.2.1. INMUNODIFUSIÓN RADIAL. La inmunodifusión radial está basada en la reacción de precipitación descrita por Ouchterlony, siendo una de las primeras reacciones antígeno-anticuerpo documentadas. La técnica, se realiza en un medio sólido, como el agar, que permite la difusión de las moléculas proteicas. En este gel, el suero problema se disuelve homogéneamente y el antígeno se coloca en un pocillo en el centro del gel. El antígeno se desplaza por el gel, siendo fijados por los anticuerpos; al principio, estos complejos antígeno-anticuerpo son solubles y siguen difundiendo hasta que se unen a una cantidad de anticuerpo suficiente para precipitar, formando un anillo alrededor del pocillo78, 79 . Este método, ha sido descrito para el diagnóstico de anisakidosis sobre todo por autores franceses80. Sin embargo, es lento y laborioso, analiza un número limitado de muestras y presenta una baja sensibilidad. Además, en el citado trabajo en el que se analizaron sueros de cuatro pacientes, se encontró reactividad cruzada con antígenos de Ascaris suum, Toxocara canis y Loa loa, es decir, es poco específico. 27 MENU SALIR 6.1.2.2. – RADIOINMUNOENSAYO. Se ha descrito este método serológico usando la técnica de RAST (del inglés radioallergosorbent test), por Desowitz y colaboradores81. Este autor, obtenía un extracto alergénico de Anisakis simplex con una concentración proteica de 2 mg/ml y después acoplaba el antígeno a discos de celulosa activados con bromuro de cianógeno y realizaba el RAST según metodología descrita previamente por Wide en 1967 y perfeccionada por Ceska en 1972: estos discos se incuban con el suero del paciente para permitir que los anticuerpos específicos se unan al antígeno. Posteriormente se lavan para retirar las sustancias no adheridas y se añade anti-IgE marcada con Yodo radiactivo (I125); se incuban en cámara húmeda, se vuelve a lavar para eliminar elementos no fijados y se mide la radiación en un contador gamma82, 83 . Este autor, analizó cinco sueros procedentes de enfermos japoneses diagnosticados de anisakidosis histológicamante y encontró resultados positivos en todos ellos, comparando los resultados con sueros controles. No obstante, también resultó positivo en sueros procedentes de niños asmáticos sin clínica de parasitosis conocida, por lo que resultaba un test sensible pero poco específico. 6.1.2.3. –ENZIMOINMUNOENSAYO. En 1986, el grupo japonés de Hajime Ishikura, inició los estudios conducentes al desarrollo de un test serológico específico para detectar antígenos de Anisakis simplex. En primer lugar, desarrollaron anticuerpos monoclonales que detectaran específicamente antígenos de Anisakis simplex y no tuviesen reactividad cruzada con otros parásitos relacionados taxonómicamente84. Estos autores desarrollaron siete anticuerpos monoclonales que llamaron An1…. An7 y demostraron que reaccionaban específicamente con Anisakis simplex y no reaccionaban con otros parásitos (Pseudoterranova decipiens, Toxocara cati, Trichinella spiralis, Ascaris suum, Echinococcus multilocularis, Dirofilaria immitus). Posteriormente, analizaron la localización de los antígenos de Anisakis simplex detectados por dichos anticuerpos monoclonales y vieron que An2 reconocía todos los antígenos distribuidos en diferentes estructuras del parásito (músculo, pared intestinal, etc.) con un peso molecular entre 40 y 46 kDa. Por otro lado, este anticuerpo era capaz también de reconocer antígenos de excreción-secreción de Anisakis simplex, por lo que los autores concluyeron que el anticuerpo monoclonal 28 MENU SALIR An2 era muy potente y específico de especie por lo que podría ser usado para desarrollar un test serológico en anisakidosis9, 84. Posteriormente, estos autores desarrollaron un test de enzimoinmunoensayo tipo ELISA (de las iniciales inglesas enzyme-linked immunosorbent assay) usando el anticuerpo monoclonal An285, 86 . La técnica de enzimoinmunoensayo, es similar al RAST, solo que en vez de marcar el anticuerpo (anti-IgE, Anti-IgG) con isótopos, se marca con enzimas y después se añade un substrato que reacciona con la enzima y produce color que puede medirse por espectrofotometría. Tiene la ventaja con respecto al RAST en que no hay que manejar isótopos, los reactivos son más estables y no hay problemas con los deshechos radiactivos87. Usando esta técnica, pudo verse que el 50% de los pacientes con anisakidosis tenían respuesta IgG, IgM e IgA específica a partir de la primera semana tras la infestación; entre la cuarta y la octava semana, la eficiencia diagnóstica del test era del 100% y a partir de la semana doce el test se hacía negativo. Por otro lado, se evidenció que la respuesta IgE-específica era muy precoz e intensa, evidenciándose a partir del primer día de la infestación en casi el 95% de los pacientes testados9. Así pues, este método serológico es útil en el diagnóstico clínico de la anisakidosis, sobre todo la respuesta IgE-específica, dado que es positiva desde el primer día. Por otro lado, el test es muy específico, no teniendo reactividad cruzada con otros parásitos taxonómicamente cercanos a Anisakis simplex ni fue positivo en ninguno de los controles sanos. Recientemente, autores españoles de la Universidad de Santiago de Compostela, han desarrollado cinco anticuerpos monoclonales específicos de Anisakis simplex (UA1…. UA5) que comparados con An2 parece que son igualmente específicos y podrían usarse con fines diagnósticos88. Últimamente, se ha enfatizado el papel de los antígenos de excreciónsecreción en la respuesta inmune de la anisakidosis. Se ha demostrado con técnicas de inmunoblotting que la respuesta IgE e IgA específica para estos antígenos es más específica que la respuesta IgG y está presente en fases muy precoces de la enfermedad. Estos antígenos tendrían un peso molecular variable entre 50 y 120 kDa89. No obstante, estos estudios se han realizado con un pequeño número de pacientes y su aplicación al diagnóstico clínico es todavía incierta. 29 MENU SALIR 6.1.3. –DIAGNÓSTICO HISTOPATOLÓGICO9, 72 ,90, 91, 92, 93. La anisakidosis, desde el punto de vista histopatológico, se divide en: - Anisakidosis gástrica - Anisakidosis intestinal - Anisakidosis extragastrointestinal - Estadio agudo o forma fulminante - Estadio crónico o forma leve, que a su vez se divide: - Primera etapa o inflamatoria - Segunda etapa o abscesiforme - Tercera etapa o abscesiforme-granulomatosa - Cuarta etapa o granulomatosa 6.1.3.1. Anisakidosis gástrica aguda. Casi todos los casos de este tipo de anisakidosis, curan mediante la extracción endoscópica del parásito, por lo que los estudios histológicos son raros. Puede encontrarse una severa infiltración eosinofílica y edema submucoso. A veces, puede encontrarse cortes del parásito en la capa submucosa, con una característica luz intestinal en “Y” y la pared intestinal conteniendo unas 60-80 células (células de Renette). En estos casos, el diagnóstico es definitivo. 6.1.3.2. –Anisakidosis gástrica crónica. a) Primera etapa o inflamatoria: Se ve con poca frecuencia y es secundaria a la respuesta inmunológica por reinfestación, probablemente por un mecanismo de hipersensibilidad tipo Arthus (tipo III). Histológicamente, es indistinguible del estadio agudo. b) Segunda etapa o abscesiforme: En esta etapa, se forma un absceso alrededor de la larva muerta o sus restos, con tejido necrótico infiltrado de eosinófilos. Puede verse una pequeña cantidad de tejido granulomatoso rodeando al absceso conteniendo eosinófilos, macrófagos y linfocitos, junto a edema y exudación de fibrina. c) Tercera etapa o abscesiforme-granulomatosa: A partir de los seis meses de la infestación, el absceso tiende a desaparecer. Aparece tejido granuloso alrededor del mismo, disminuyendo la infiltración eosinofílica y apareciendo un infiltrado 30 MENU SALIR linfocitario. También pueden verse células gigantes de cuerpo extraño invadiendo los restos de la larva. d) Cuarta etapa o granulomatosa: los restos de larva están rodeados de tejido granulomatoso con fibrosis, células gigantes de cuerpo extraño, linfocitos y escasos eosinófilos. Esta respuesta correspondería a un fenómeno de hipersensibilidad mediado por células. 6.1.3.3. –Anisakidosis intestinal aguda. En este tipo de anisakidosis, la pared intestinal es de tres a cinco veces más gruesa de lo normal, a expensas de un intenso edema de la submucosa y marcado infiltrado celular, sobre todo eosinofílico. También puede verse vasculitis severa con necrosis fibrinoide, sobre todo en la submucosa, hiperplasia de los folículos linfoides y del plexo de Auerbach y cambios inflamatorios leves de la muscularis submucosae. También pueden encontrarse cortes transversales o sagitales del parásito, como hemos comentado. Estos hallazgos histopatológicos, pueden verse a las 48 horas de la infestación y también puede analizarse el líquido ascítico, aunque es raro en fases agudas. De forma característica, los eosinófilos superan el 30% del total de células halladas en dicho líquido. 6.1.3.4. –Anisakidosis intestinal crónica. a) Primera etapa o inflamatoria: Es indistinguible de la fase aguda. b) Segunda etapa o abscesiforme: idéntica a la descrita en la forma gástrica (ver página anterior) c) Tercera etapa o abscesiforme-granulomatosa: La mayoría de los casos de este tipo, son hallazgos casuales en un acto quirúrgico por otros motivos (ileo, neoplasia, enteritis regional, etc.). Como hemos comentado, alrededor del absceso con los restos del parásito, se va organizando tejido granulomatoso y empieza a aparecer el infiltrado linfocitario y células gigantes de cuerpo extraño. d) Cuarta etapa o granulomatosa: Este tipo es encontrado rara vez a nivel intestinal, ya que la mayoría de los pacientes son intervenidos quirúrgicamente en estadios anteriores y no llegan a este nivel. En el caso de encontrarse, el diagnóstico de anisakidosis es casi imposible, ya que los restos de la larva no pueden identificarse como tal. En estos casos, podrían aplicarse técnicas inmunohistoquímicas usando 31 MENU SALIR anticuerpos monoclonales específicos para Anisakis simplex, para identificar el material hallado dentro del granuloma. 6.2. –DIAGNÓSTICO DE HIPERSENSIBILIDAD A PROTEÍNAS DE Anisakis simplex. El objetivo del diagnóstico de hipersensibilidad a Anisakis simplex es demostrar la presencia de anticuerpos IgE específicos para el antígeno del parásito. Esto puede hacerse con la realización de pruebas in vivo y pruebas in vitro. 6.2.1. PRUEBAS IN VIVO. 6.2.1.1. - Pruebas cutáneas. Con las pruebas cutáneas, intentamos reproducir en la piel el fenómeno de hipersensibilidad IgE-mediado. La reacción cutánea se expresa con una respuesta dérmica inmediata de habón y eritema que a veces, se sigue de una reacción tardía edematosa poco definida. La respuesta inmediata, depende de los mastocitos cutáneos sensibilizados que se degranulan rápidamente tras exposición al alergeno. Esta respuesta, se inicia a los cinco minutos y tiene un pico a los quince minutos. Los mediadores que se liberan fundamentalmente son agentes vasoactivos como la histamina, leucotrienos sulfidopéptidos y mediadores neurogénicos. La respuesta tardía, aparece entre las tres y cinco horas después, con un pico entre las seis y doce horas y consiste en una reacción edematosa poco definida debido al flujo de células inflamatorias, fundamentalmente eosinófilos y sus mediadores inflamatorios. En todos los tests cutáneos, se debe introducir un control negativo, que puede ser el diluyente del antígeno probado o suero fisiológico y un control positivo, que ha de ser un secretagogo; se emplea normalmente histamina a una concentración de 10 mg/ml para prick y 1 mg/ml para intradermoreacción. En todos los casos, han de seguirse las recomendaciones de la Academia Europea de Alergología e Inmunología Clínica (EAACI)94. 32 MENU SALIR 6.2.1.2. - Métodos de pruebas cutáneas. - Escarificación: Consiste en un raspado de la piel, sin producir sangre, y aplicación posterior del antígeno. Este método, fue empleado por Kasuya con extracto de Anisakis simplex a una concentración de 2.8 mgr/ml57, 58. No obstante, este método no se usa en la actualidad, siendo sustituido por la prueba de punción que es más sencilla, está mejor estandarizada y es menos molesta para el paciente. - Punción (Prick-test): Consiste en puncionar la piel a través de una gota de alergeno depositada en la piel, generalmente en la cara anterior del antebrazo, usando unas lancetas especiales con una punta de 1 mm. y unos topes a los lados para que sólo la punta penetre la piel (Prick lancet de DHS-Bayer de acero, tipo Morrow-Brown de Stallergenes de plástico, etc.). Para el diagnóstico de hipersensibilidad a proteínas de Anisakis simplex, es el método de elección, al igual que con la mayoría de alergenos inhalantes y alimentarios. En cuanto al extracto, se ha utilizado a diferentes concentraciones: 0.08 mgr/ml59, actualmente se dispone de extracto comercial a 60, 66 , 0.05 mgr/ml64 y 1 mg/ml (International Pharmaceutical Immunology, IPI, Madrid y ALK-Abelló, Madrid). 6.2.1.3. -Pruebas de exposición o tolerancia. En alergia alimentaria, las pruebas de tolerancia son la regla de oro o “gold standard” en el diagnóstico definitivo95. No obstante, en el caso que nos ocupa no es ético administrar extracto de un parásito vía oral a un paciente para asegurar el diagnóstico. 6.2.2. –PRUEBAS IN VITRO. 6.2.2.1. -Determinación de IgE específica. Para la determinación de IgE específica se usa como técnica standard el método de fluoroenzimoinmunoensayo (CAP-FEIA) desarrollado por Laboratorios Pharmacia & Upjohn (Uppsala, Suecia) en 199096. Las iniciales de CAP pueden traducirse como polímero transportador hidrofílico encapsulado y consiste en un cilindro de celulosa en el que están adheridos los alergenos. (Ver metodología en el apartado Material y Métodos, página 54). 33 MENU SALIR Como hemos dicho, todos los autores han usado este sistema para la determinación de IgE-específica a proteínas de Anisakis simplex mostrando sobre todo una alta sensibilidad, aunque la especificidad sería más variable, oscilando entre el 75% y 85%59, 60, 62, 64, 65, 97. 6.2.2.2. -Determinación de IgG específica. La determinación de IgG específica a Anisakis simplex no tiene utilidad en el diagnóstico, ya que su valor predictivo es muy bajo pues pueden encontrarse valores positivos en sujetos controles sanos, en pacientes con otras parasitosis (infestación por Ascaris) y en personas africanas con filariasis97. La técnica empleada, fue el ELISA. Así pues, pasaría algo parecido a la Anisakidosis, en la que con técnicas de Inmunoblotting Akao y colaboradores demuestran una falta de especificidad de los anticuerpos IgG específicos89. Resultados similares, fueron obtenidos por Desowitz y colaboradores usando técnica de RAST81. 6.2.2.3. -Liberación de histamina. Consiste en medir la histamina que se libera de los basófilos en una muestra de sangre total heparinizada, tras incubación con anti-IgE monoclonal o diluciones de un alergeno determinado. La histamina liberada se determina por fluorometría. Se ha realizado de forma anecdótica en el diagnóstico de hipersensibilidad a Anisakis simplex, en muestras aisladas 59, 60, 97 . Este método, no es aplicable en la práctica por varias razones: a) La existencia de individuos no liberadores. En un extenso trabajo de Moneo y colaboradores, en la que se midió la liberación de histamina en 357 controles sanos, vieron que el porcentaje de no liberadores era del 15.1% y del 22.7% en 361 atópicos, aunque también mostraron que en 67 pacientes parasitados el porcentaje de no liberadores era sólo del 4.4% 98 . b) La existencia de liberación espontánea de histamina. c) No refleja necesariamente la liberación de histamina de los mastocitos ni en el órgano de choque. d) Presenta una gran variabilidad interindividual e interensayo, que puede llegar al 40% e) Requiere células vivas para su realización. 34 MENU SALIR 6.2.2.4. -Detección de IgE específica por Inmunoblotting. La técnica de Inmunoblotting (sin traducción al castellano) se basa en la transferencia de proteínas separadas electroforéticamente desde un gel a otro soporte (nitrocelulosa, PVDF, etc.) y tratamiento posterior del mismo. Las proteínas del extracto se separan usando la técnica de electroforesis en gel de poliacrilamida en presencia de dodecil sulfato sódico (SDS-PAGE) (ver descripción de la técnica en el apartado material y métodos). En el caso de usarse como diagnóstico de hipersensibilidad IgE-mediado, el tratamiento posterior se realiza con el suero problema y añadido de anti-IgE marcada de forma diversa (I125, peroxidasa, biotina, etc.) y de esta forma podemos detectar aquellas proteínas alergénicas, es decir, las que tienen capacidad para fijar IgE. Autores españoles, han demostrado que el Inmunoblotting es la herramienta diagnóstica in vitro más específica para el diagnóstico de hipersensibilidad a proteínas de Anisakis simplex99. Estos autores, realizaron la técnica en un grupo de 25 pacientes con diagnóstico clínico de hipersensibilidad a Anisakis simplex (pruebas cutáneas y determinación de IgE específica positiva), y vieron que el 80% de este grupo presentaba un patrón característico de Inmunoblotting: un grupo de bandas de medio peso molecular (entre 30 y 50 kDa) y otro grupo de bandas de bajo peso molecular (entre 14 a 30 kDa). Este grupo, fue comparado con un grupo de pacientes no alérgicos; en éstos, sólo el 12.5% tenían ese tipo de inmunoblotting. Los autores concluyen que el diagnóstico de hipersensibilidad a Anisakis simplex no debe basarse sólo en la historia clínica y la demostración de IgE específica in vivo o in vitro, ya que pueden encontrarse falsos positivos en la población general, que varía desde el 10%100 al 27.4%99. 35 MENU SALIR 7. -PROFILAXIS. La mejor profilaxis de la anisakidosis, consiste en evitar la ingesta de pescado crudo o poco cocinado. No obstante, cuando se quiera consumir crudo, hay una normativa vigente en varios países, que consiste en congelar previamente el pescado al menos a -20º C durante 24 horas (legislación holandesa) o a -23º C durante tres días (legislación norteamericana)101. En cuanto al cocinado, se necesitan al menos 10 minutos durante 60º C para destruir a la larva ya que es capaz de sobrevivir a 50º C102. El parásito resiste el salazón, ahumado, marinado, seis días en formol a temperatura ambiente, 50 días a 2º C y hasta 51 días en vinagre45. Por otro lado, el cocinado en horno microondas, tampoco destruye la larva102. También se ha recomendado la evisceración precoz para evitar la migración de larvas desde el tubo digestivo al tejido muscular; no obstante, no hay acuerdo entre los diferentes autores y no parece suceder en todas las especies11,15. Asimismo, se han publicado observaciones diversas sobre la capacidad vermicida de algunos aditivos alimentarios usados por la cocina tradicional china y japonesa. Kasuya y colaboradores han publicado que el extracto de jengibre usado en la cocina china con los platos de pescado crudo, contiene como principios activos gingerol y soganol, con efecto vermicida a dosis de 250 y 62.5 microgramos/ml respectivamente103. Yamada, publicó que el polvo de rábano picante junto a la salsa de soja, empleado en la cocina japonesa, paralizaba la movilidad de las larvas de Anisakis en diez minutos104. Por último, Hayasaka y colaboradores, demostraron que la mitad de las larvas de anisakis morían en sake (alcohol destilado de arroz muy consumido en Japón) en 20 minutos y casi todas a los 50 minutos105. En cuanto a la profilaxis en las reacciones de hipersensibilidad, consiste en evitar el consumo de pescado susceptible de estar infestado por el parásito, bien sea crudo, semicrudo o cocinado, ya que como hemos mencionado, las proteínas alergénicas de Anisakis simplex son termoestables59. En cualquier caso, se instruirá al paciente en la identificación de especies de pescado más susceptibles de tener parásitos así como los lugares anatómicos de más probable infestación: hígado, ventresca y región paravisceral. Así, en caso de comer pescado de tamaño grande, se tomaría con preferencia la parte de la cola y se evitaría el pescado poco fresco. Se ha de advertir claramente al paciente, que al igual que ocurre con otros alimentos 36 MENU SALIR (leche, huevo) las proteínas de estos parásitos son termoestables y por lo tanto, el cocinado tradicional (fritura, horno, microondas, guisado) no previene las reacciones alérgicas. 8. -TRATAMIENTO. No existe tratamiento antihelmíntico específico para la anisakidosis. Se ha utilizado Tiabendazol106 y Albendazol107, en casos de anisakidosis intestinal con buenos resultados. Se ha demostrado que el pamoato de pirantel aún a concentraciones de 1 mg/ml, no tiene ningún efecto letal in vitro sobre las larvas108. En la forma clínica gástrica, el tratamiento de elección es la endoscopia precoz y la extracción de las larvas. En algún caso, se han extraído hasta 56 larvas del parásito en un paciente109. A veces, tras la extracción del parásito es necesario administrar antiácidos, pero la formación de úlceras es rara110. En el caso de la anisakidosis intestinal, la mayoría de las veces el tratamiento quirúrgico no es necesario, ya que el cuadro se resuelve con medidas conservadoras, pero si no es así, se requiere la resección del segmento intestinal afectado111, 112 . La muerte por Anisakidosis es improbable, aunque se han publicado dos fallecimientos en la literatura por peritonitis secundaria a perforación intestinal112. En cuanto al tratamiento de las reacciones de hipersensibilidad, es sintomático y no difiere en nada al tratamiento de otras reacciones IgE-mediadas. En caso de aparecer urticaria y/o angioedema, se administrarán antihistamínicos vía oral, preferentemente de segunda generación (Cetirizina, Loratadina, Ebastina, Fexofenadina, Mizolastina). A veces, es necesario usar dos preparados de grupo químico diferente (por ejemplo Fexofenadina y Cetirizina) o bien asociarlos con antihistamínicos de primera generación (Hidroxicina). En raras ocasiones, se necesitan usar esteroides orales (Prednisona, Deflazacort) y en caso de usarse se prescribirá una pauta corta descendente. En la anafilaxia se administrarán vía parenteral antihistamínicos (Dexclorfeniramina, una ampolla de 5 mg cada seis horas) junto a esteroides (Hidrocortisona, dosis inicial de 7-10 mg/Kg de peso y continuar conn dosis de 5 mg/Kg/6 horas). Posteriormente se instaurará tratamiento oral con antihistamínicos y esteroides orales. A los pacientes con anafilaxia, sobre 37 MENU SALIR todo si ha sido severa, se les debe instruir en el uso de adrenalina subcutánea al 1:1000, (0.3-0.5 ml, dosis que puede repetir en tres ocasiones cada quince-veinte minutos), ya que aún no están disponibles en nuestro país los autoinyectables tipo Epi-pen. 38 MENU SALIR MATERIAL Y MÉTODOS 39 MENU SALIR 1. -ESTUDIO DE LA PREVALENCIA DE INFESTACIÓN POR Anisakis simplex EN PESCADOS. 1.1 -MATERIAL USADO. - Lupa con punto de luz incorporada de 4 aumentos. - Bisturí, Pinzas y tijeras. - Guantes quirúrgicos - Suero fisiológico - Microscopio óptico 1.2. -RECOGIDA DE MUESTRAS. Durante un año (Mayo 1997 a Abril 1998) se recogieron muestras de pescado mensualmente de forma aleatoria en dos mercados de nuestra ciudad: Atarazanas y Nuestra Señora del Carmen. Se analizaron ocho especies de pescados: - Bacaladilla (Micromesistius poutassou) - Boquerón (Engraulis encrasicholus) - Jurel (Trachurus trachurus) - Sardina (Sardina pilchardus) - Pijota (Merlucius merlucius) - Rape (Lophius piscatorius) - Caballa (Scomber scombrus) - Calamar (Lóligo vulgaris) Se analizó el mismo número de especies en cada muestreo (con variaciones de uno o dos ejemplares) y en el caso de especies cuyo tamaño en el mercado es variable, se cuidó que todas las muestras tuviesen un peso similar: - Jurel (Trachurus trachurus): 200-250 gr. por ejemplar. - Pijota (Merlucius merlucius): 100-125 gr. por ejemplar. - Rape (Lophius piscatorius): 2.000-2.400 gr. por ejemplar. - Caballa (Scomber scombrus): 300-350 gr. por ejemplar. - Calamar (Lóligo vulgaris): 150-200 gr. por ejemplar. 40 MENU SALIR En el caso del boquerón, se analizaron sólo muestras procedentes del Mediterráneo (Bahía de Málaga, Fuengirola, Estepona, Algeciras y Caleta de Vélez); en el resto de los casos, no se analizó la procedencia. 1.3. -MÉTODO DE ESTUDIO. Una vez recogidas las muestras de pescado sin eviscerar, se les practicaba una incisión en la línea media ventral con bisturí desde el ano hasta el espacio interopercular con objeto de visualizar bien las vísceras (hepatopáncreas), cavidad peritoneal y paredes musculares adyacentes siguiendo metodología descrita por Olmedo y Berenguer113. Posteriormente con ayuda de la lupa se procedía a la búsqueda minuciosa de los parásitos y se introducían en suero salino. Se anotaba el número de parásitos visualizados en cada ejemplar y su localización anatómica (visceral o cavidad peritoneal). Posteriormente se procedía a la identificación morfológica de los parásitos con microscopía óptica de acuerdo a criterios parasitológicos publicados 15, 16, 113. 2. -PACIENTES. Durante un año (desde Julio de 1996 hasta Septiembre de 1997) se estudiaron todos los pacientes que acudieron a la consulta externa de Alergología del Centro Especialidades José Estrada y que cumplían los siguientes criterios: 1) Pacientes que acudían por síntomas clínicos de urticaria y/o angioedema recidivante no filiado. Se consideró recidivante a los pacientes que habían sufrido al menos tres episodios en un período máximo de doce meses. 2) Pacientes que referían consumir pescado de forma habitual. Se consideró habitual al menos una vez a la semana. Todos cumplimentaron un cuestionario de hábitos de consumo de pescado (Figura 13). Además, se les realizó un protocolo de estudio para descartar causas conocidas de urticaria-angioedema recidivante: Hematimetría, fórmula y recuento, Velocidad de sedimentación globular, Bioquímica (Glucosa, urea, creatinina, ácido úrico, Triglicéridos, Colesterol, proteínas totales), Complemento (C3, C4), Dosificación 41 MENU SALIR Inmunoglobulinas (IgG, IgA, IgM), Marcadores Hepáticos: Virus hepatitis B y C, Serología reumática, Anticuerpos antinucleares, Orina: standard y sedimento, Parásitos en heces (tres determinaciones seriadas) y Radiografía de tórax. A los pacientes con hipersensibilidad demostrada a Anisakis simplex, se les instauró una dieta exenta de todo tipo de pescado (fresco y congelado) y se les realizó un seguimiento clínico con revisiones a los seis y doce meses de la primera visita. Se obtuvo consentimiento oral de todos ellos antes de iniciar el estudio. 3. -CONTROLES. Cada paciente fue apareado con un control, recogido durante el mismo período de tiempo entre los pacientes que acudían a la citada consulta externa y que cumplían los siguientes criterios: 1) No haber padecido ningún episodio de urticaria y/o angioedema agudo. 2) Consumir pescado de forma habitual, como hemos descrito anteriormente. 3) Contestar el cuestionario de consumo de pescado (Figura 13). 4) Los controles, habían de ser del mismo sexo que los pacientes y con una edad +/- cinco años. A todos los controles se les realizó el mismo protocolo de estudio que a los pacientes descrito anteriormente. A todos se les requirió autorización verbal para incluirlos en el estudio. 42 MENU SALIR Figura 13. CUESTIONARIO Anisakis. HÁBITOS DE CONSUMO DE PESCADO. Paciente Control Nº Edad Varón ¿Come pescado habitualmente? 1 ¿Qué tipo de pescado? ¿Come pescado fresco? si Blanco si no Mujer no Azul Cefalópodos ¿Come pescado congelado? si no En caso de comer pescado fresco, ¿Qué tipo de pescado? : ¿Pescado pequeño? si no (Boquerones, sardinas, jureles, pijotas, etc.) ¿Pescado grande? si no (Merluza, Rape, Rosada, etc.) ¿Pescado crudo o semicrudo? si no (Boquerones en vinagre, ahumados, marinados, anchoas, etc.) ¿Dónde compra el pescado? 1 Lonja Mercado Supermercado Al menos una vez por semana. 43 MENU SALIR 4. -PRUEBAS CUTÁNEAS. Las pruebas cutáneas se realizaron con el método de punción (Prick-test) en la cara anterior del antebrazo y se usaron lancetas de acero tipo Morrow-Brown (DHS-Bayer). En todos los casos, fueron realizadas por la misma persona. Se usaron en todos los pacientes y controles los siguientes alergenos: - Batería de alergenos inhalantes: Phleum pratense, Lolium perenne, Cynodon dactylon, Platanus orientalis, Fraxinus excelsior, Cupressus arizónica, Quercus ilex, Olea europaea, Chenopodium album, Plantago lanceolata, Artemisia vulgaris, Parietaria judaica, Salsola kali, Dermatophagoides pteronyssinus, Dermatophagoides farinae, Alternaria alternata, Aspergillus fumigatus, Látex, epitelio de gato y epitelio de perro (Laboratorios ALK-Abelló, CBF Leti y Bial-Aristegui). - Batería de alergenos alimentarios: β-Lactoglobulina, α-Lactoalbúmina, Caseína, Clara de huevo, Bacalao, Merluza, Atún, Harina de trigo, Cacahuete, gamba y guisante (Laboratorios ALK-Abelló y CBF Leti). - Anisakis simplex: Se utilizó un extracto comercial (Laboratorios IPI – International Pharmaceutical Immunology) a concentración de 1 mg/ml. Se usó extracto del mismo lote para todo el estudio. Se usó histamina a concentración de 10 mg/ml como control positivo y suero salino como control negativo. Las lecturas, se efectuaron en todos los casos a los quince minutos y tras dibujar el borde de la pápula con rotulador negro fino, fueron trasladadas a papel con cinta adhesiva (Transpore). Se consideraron positivas pápulas con un diámetro al menos del 50% con respecto al control positivo. 5. -PRUEBAS IN VITRO. Se realizaron en todos los casos determinación de IgE específica a Anisakis simplex, Pescado blanco (Bacalao), Pescado azul (Atún), marisco (Camarón) y Dermatophagoides pteronyssinus. En los casos positivos (existencia de IgE específica a Anisakis simplex), se determinó IgE específica a Ascaris y Echinococcus y detección de anticuerpos IgE específicos a proteínas de Anisakis simplex con técnica de electroforesis con gel de poliacrilamida en presencia de dodecil sulfato sódico (SDS-PAGE) y posterior Inmunoblotting. Asimismo, se realizó determinación de IgE total en todos los casos. 44 MENU SALIR 5.1. -DETERMINACIÓN DE IgE ESPECÍFICA. La determinación de IgE específica, se realizó con método CAP-FEIA (Pharmacia & Upjohn Diagnostics, Uppsala, Suecia). Las iniciales pueden traducirse al castellano como método de Fluoroenzimoinmunoensayo usando cilindros de polímeros de celulosa hidrofílica. Se usó para ello un aparato UNICAP 100 RL. Brevemente, el fundamento de la técnica, es el siguiente: Los alergenos a estudiar, están unidos covalentemente a los cilindros de celulosa descritos (InmunoCAP) y reaccionan con la IgE específica presente en el suero problema. Después de un primer lavado para eliminar la IgE no específica, se añaden anticuerpos anti-IgE (anticuerpo monoclonal de ratón) marcados con una enzima (βD-galactosidasa), con lo que se formaría un complejo Ag-sIgE--antiIgE-enzima. Después de un periodo de incubación, se realiza otro lavado para eliminar la anti-IgE no unida y se incuba con la solución de desarrollo que contiene un preparado de fluoresceína (4-Metil-umbeliferil) que al reaccionar con la enzima, se forma 4-Metilumbeliferona. Tras parar la reacción con carbonato cálcico al 4% (solución de stop), se mide la fluorescencia emitida y se comparan los resultados de las muestras con los calibradores aportados por el fabricante. Todo este proceso, está automatizado. Se consideran positivos resultados mayores de 0,35 kU/l. 5.2. DETERMINACIÓN DE IgE TOTAL. La determinación de IgE total, se realizó igualmente con el método de fluoroenzimoinmunoensayo (CAP-FEIA) descrito anteriormente. Se consideran normales cifras inferiores a 150 UI/ml. 5.3. -DETECCIÓN DE IgE ESPECÍFICA MEDIANTE ELECTROFORESIS EN GEL DE POLIACRILAMIDA EN PRESENCIA DE DODECIL SULFATO SÓDICO (SDSPAGE) E INMUNOBLOTTING. 5.3.1. -SDS-PAGE. Realizada según método descrito por Laemmli (1970) (electroforesis de zona en un sistema disociante discontinuo)114. Se empleó gel de poliacrilamida (Acrilamida y N, N`metilénbisacrilamida, 50% P/V) al 12.5% con tampón Tris-Hcl 45 MENU SALIR 0.375 M, pH 8.8 como gel separador y poliacrilamida al 3,3% con tampón TrisHcl 0.125 M, pH 6.8 como gel concentrador. Como tampón de electrodos se usó Tris-glicina 0.025 M, pH 8.3 (60.6 gr. Tris 0.5 M, 144.2 gr. Glicina 0.192 M, 10 gr. dodecil sulfato sódico al 1% en 800 ml de agua destilada) y como tampón de muestra Tris-Hcl 0.0625 M, pH 6.8 (3 ml Tris-Hcl 0.03 M, 5 ml dodecil sulfato sódico al 2%, 5 ml glicerol al 10%, 0.5 ml azul de bromofenol 0.002% en 50 ml de agua destilada). Posteriormente añadieron 10 µl del extracto de Anisakis (preparado según método descrito59) en cada calle: en la calle 1 sin hervir y en condiciones no reductoras; en la calle 2, en condiciones reductoras (añadiendo 5% de β- mercaptoetanol al tampón de muestras) e hirviendo la muestra 5 minutos. Cada muestra contiene 20 µg de proteína según el método de Bradford115 utilizando la tinción de Coomassie. Se usó en paralelo un patrón de proteínas de peso molecular conocido (Pharmacia Biotech): Fosforilasa b (94.0 kDa, Albúmina sérica bovina (67.0 kDa), Ovoalbúmina (43.0 kDa), Anhidrasa carbónica (30.0 kDa), Inhibidor de tripsina (20.1 kDa) y α-lactoalbúmina (14.4 kda). Para el proceso de electroforesis se aplicó un voltaje de 220 V durante 40 minutos, usando el sistema de Miniprotean de BioRad. Se paró el proceso cuando el azul de bromofenol llegó al final del gel separador. Posteriormente, se realizó la tinción del gel con una solución al 0.1% de azul de Coomassie R-250 en metanol/ácido acético/agua destilada (4:1:5) durante dos horas. Después, se destiñó con varios cambios en solución de desteñir (la misma solución sin colorante) y acto seguido se secó el gel incubándolo 30 minutos en solución de desteñir a la que se añade un 2% de glicerol y aplicándole una corriente de aire durante varias horas. Una vez seca se exponen a una película radiográfica y se guardan a – 70º C durante 48 horas, procediendo después al revelado. Por último, la evaluación de las bandas obtenidas (cálculo de pesos moleculares) se realizó por análisis de imagen mediante el sistema Bio-Image (Millipore). 46 MENU SALIR 5.3.2. -INMUNOBLOTTING. Una vez realizada la electroforesis, el gel sin teñir se equilibró durante 30 minutos en tampón de transferencia (60.6 gr. de Tris 0.5 M, 144.2 gr. Glicina 1.92 M en 800 ml de agua destilada y se ajusta a pH 8.3). Cortamos tiras de membrana de polivinildifluoruro (PVDF, Immunobilon-P) y realizamos la transferencia según el método de Towbin y colaboradores116: sobre una rejilla de plástico se coloca una plancha de material poroso humedecida en tampón de transferencia y sobre ésta papel de filtro (Whatman 3 MM) humedecido también y a continuación el gel. Encima de éste se colocan las tiras de PVDF y se superponen capas de papel de filtro y material poroso humedecido y finalmente otra rejilla de plástico. Este conjunto se coloca en la cubeta de transferencia (se usó el sistema LKB 2117 Multiphor II Electrophoresis Unit) de forma que la membrana de PVDF quede orientada hacia el polo positivo y se aplica una corriente de 250 mA durante 2 horas. Después las tiras se saturan con albúmina sérica bovina al 1% en PBS y Tween 20 al 0.1% durante 1 hora a 38º C y se lavan tres veces con Tween 20 al 0.1% en PBS. Después, las tiras se incuban con 0.5 ml de los sueros durante 16 horas a 4º C. Posteriormente se lavaron tres veces las tiras con PBS-Tween 20 al 0.1% y se incubaron con un conjugado IgG de conejo anti-IgE humana marcada con peroxidasa (Laboratorios Dako, Glostrum, Denmark) durante tres horas. Tras nuevos lavados, las tiras se secaron y se revelaron por quimioluminiscencia con lumigen PS-3, siguiendo las instrucciones del fabricante (ECL Plus, Amersham Life Science). La evaluación de las bandas obtenidas (cálculo de pesos moleculares) se realizó por análisis de imagen mediante el sistema Bio-Image (Millipore). 47 MENU SALIR 6. -ANÁLISIS ESTADÍSTICOS. Se calcularon la media, desviación típica, asimetría, error típico de asimetría, curtosis y error típico de curtosis de los valores de IgE específica a Anisakis simplex en el grupo de pacientes y en el grupo control. Se calculó la media y desviación típica de los valores de IgE total en el grupo total de pacientes, en el grupo de pacientes sensibilizados a Anisakis simplex y en el grupo de pacientes no sensibilizados. Se aplicó la prueba de Kolmogorov-Smirnov para ver el tipo de distribución de las muestras. Como pruebas de muestras independientes, se usaron la prueba de Levene para igualdad de varianzas y la prueba t para igualdad de medias. Los resultados finales se expresaron en tablas de contingencia y para comparar las sensibilizaciones entre ambos grupos, se usaron la prueba Chi-cuadrado de Pearson y el Estadístico exacto de Fisher. Se realizó el estudio con dos puntos de corte: CAP > 0,35 y CAP > 0,70. Para ver el tipo de dependencia (fuerte o débil) entre las variables urticaria y CAP positivo, se calcularon las medidas simétricas coeficiente Phi y V de Cramer. 7. -SOPORTE INFORMÁTICO. Para la realización del presente trabajo se utilizó un ordenador personal Pentium S 133 Mhz con 48 Mb de memoria RAM, sistema operativo Windows-95, versión 4.00.950 B, procesador de textos Microsoft Word 97, base de datos Microsoft Access 97 y Microsoft Powerpoint 97 como editor de imágenes. Para el análisis estadístico de los datos se usó el programa SPSS versión 8.0. Para la obtención de imágenes de Anisakis simplex se usó un ordenador Macintosh Performa 675, con sistema 7.1, software de entorno Quick Time y microscopio Nikon YS2-HF con cámara de vídeo integrada. 48 MENU SALIR RESULTADOS 49 MENU SALIR 1. –SELECCIÓN DE PACIENTES Y CONTROLES. Durante el período de estudio, fueron vistos en consulta 2.256 pacientes, de los cuales 302 (13.38%) acudieron por síntomas cutáneos. Con los criterios de selección descritos, fueron incluidos en el estudio 76 pacientes (21 varones, 55 mujeres), con una edad media de 35.4 años (rango: 14-70 años, desviación típica 14.682) y un tiempo medio de evolución de su patología de 27 meses (Tabla II). De estos pacientes, 32 (42.1%) vivían en Málaga capital y 44 (57.9%) en diferentes puntos de la provincia (Gráfico 1). TABLA II. CARACTERÍSTICAS DE LA MUESTRA DE PACIENTES. Número Nombre Sexo Edad Domicilio paciente 1 A. M. M. H 65 MALAGA 2 A. M. A. M 37 MÁLAGA 3 B. L. F. H 33 MÁLAGA 4 C. C. S. M 27 ANTEQUERA 5 C. C. J. M 18 VALLE DE ABDALAJIS 6 G. V. M. A. M 28 MÁLAGA 7 G. S. M. P. M 44 MÁLAGA 8 G. G. R. H 17 MARBELLA 9 R. L. J. H 46 MARBELLA 10 J. G. R. M 27 ANTEQUERA 11 J. C. P. M 61 ALH. DE LA TORRE 12 L. C. C. M 45 ALAMEDA 13 M. R. C. M 62 MÁLAGA 50 MENU SALIR Número Nombre Sexo Edad Domicilio paciente 14 M. C. M. M 17 HUMILLADERO 15 M. S. S. M 21 MÁLAGA 16 M. R. J. A. H 19 MOLLINA 17 N. O. M. I. M 29 VVª DEL ROSARIO 18 P. C. A. H 39 FUENGIROLA 19 R. H. D. H 52 FUENGIROLA 20 R. L. V. M 25 FUENGIROLA 21 R. M. A. M 34 MALAGA 22 R. A. B. M 20 MOLLINA 23 R. M. V. M 23 NERJA 24 R. V. E. H 20 MALAGA 25 R. L. A. M 55 MARBELLA 26 R. A. E. M 45 MALAGA 27 K. K. E. M 49 BENALMADENA 28 M.V. M.C. M 41 ESTEPONA 29 A. D. N. M 23 MARBELLA 30 G. E. G. M 37 VVª DEL TRABUCO 31 M. C. J. M 60 MALAGA 32 A. A. A. M 37 TORROX 33 V. P. M.. H 29 MALAGA 34 M. G. M. H 58 CHURRIANA 35 F. M. I. M 21 MALAGA 36 A. C. A. M 39 MARBELLA 37 C. G. I. M 54 MIJAS 38 G. L. L. M 17 MALAGA 39 R. V. A. H 37 FUENGIROLA 40 P. A. A. M 27 HUMILLADERO 41 G. P. D. M 20 VALLE ABDALAJIS 42 F. G. J. A. H 25 VVª DEL ROSARIO 51 MENU SALIR Numero Nombre Sexo Edad Domicilio 43 G. P. A. M 34 CAMPILLOS 44 C. C. D. M 41 MALAGA 45 A. M. L. M 27 MALAGA 46 M. M. R. H 39 MARBELLA 47 D. O. C. H 36 CARTAMA 48 G. M. G. H 14 MÁLAGA 49 O. C. R. M 14 MÁLAGA 50 P. G. M. M 16 MÁLAGA 51 O. A. M. D. M 26 CARTAMA 52 M. M. A. M 24 ESTEPONA 53 N. LL. A. M 70 MÁLAGA 54 M. H. F. H 50 C. DE SAN MARCOS 55 P. L. Y. M 25 MÁLAGA 56 B. M. E. H 43 CASABERMEJA 57 V. R. E. M 14 VVª DEL ROSARIO 58 A. .G.A. H 65 MÁLAGA 59 R. M. M. M 42 MÁLAGA 60 C. M. D. M 28 CAMPANILLAS 61 A. S. M. H 51 TORREMOLINOS 62 G. G. M. M 36 MÁLAGA 63 A. R. A H 52 RONDA 64 G. C. G. M 21 MÁLAGA 65 P. G. M. M 16 MÁLAGA 66 A. M. R. M 34 MÁLAGA 67 C. C. A. M 64 VVª DEL ROSARIO 68 F. R. A. M 39 NERJA 69 P. CH. M. C. M 43 MARBELLA 70 S. G. F. M 48 MÁLAGA 71 G. R. A. M 17 CHURRIANA 72 P. B. A. M 47 MÁLAGA 73 C. A. J. H 21 ARDALES 52 MENU SALIR Número Nombre Edad Domicilio paciente 74 M. R. A. H 29 VVª LA CONCEPCIÓN 75 P. R. M. T. M 44 TORREMOLINOS 76 V.T. M. M 38 MÁLAGA 53 VV ªT S N O O I JI C IÓ R U LA B PC SA A A E O D R C B N ªR A O E VV ªC LL VV VA TO R R O X TO R R EM O LI N O S R O N D A N ER JA M O LL IN A S LA A IJ EL M B R A M U A AG AL M H M IL LA D ER O FU EN G IR O LA ES TE U S A A N EV PO C S. M A R S S A S A A O M EJ LA EN LO C L M L D I TA A N R PI ER A M B PA LM C A A M C SA A A EN C C B A S IN R LE ER U A U A D Q R LH TE A A N A A ED M LA A 40 30 20 10 0 SALIR MENU GRÁFICO 1. DOMICILIO GRUPO DE PACIENTES 54 MENU SALIR En el grupo control la media de edad fue de 35.9 años (rango 14-69 años, desviación típica 15.123) (Tabla III). 53 (69.7%) vivían en Málaga capital y 23 (30.3%) en la provincia (Gráfico 2). TABLA III. CARACTERÍSTICAS DE LA MUESTRA DE CONTROLES. Número Nombre Sexo Edad Domicilio 1 A. C. C. H 61 MÁLAGA 2 M. P. E. M 38 ARROYO DE LA MIEL 3 E. C. A. H 37 MÁLAGA 4 F. A. F. M 26 MÁLAGA 5 A. A. J. F. M 22 MÁLAGA 6 N. C. M. A. M 32 ANTEQUERA 7 O. P. Y. M 40 MÁLAGA 8 R. O. V. H 16 VELEZ-MÁLAGA 9 G. J. A. H 45 MÁLAGA 10 C. J. R. M 29 TORROX 11 M. R. C. M 59 MÁLAGA 12 C. C. A. C. M 41 ANTEQUERA 13 R. F. E. M 60 MÁLAGA 14 A. B. E. M 19 BENALMÁDENA 15 M. R. B. M 21 MÁLAGA 16 M.C. J. A. H 16 MARBELLA 17 M. A. A. M 25 MÁLAGA 18 L. O. M. A. H 34 MÁLAGA 19 R. L. A. H 57 MIJAS-COSTA 20 F. J. L. M 22 MÁLAGA 21 B. P. A. M 33 MÁLAGA 55 MENU SALIR Número Nombre Sexo Edad Domicilio 23 M. A. F. M 20 MÁLAGA 24 G. S. M. H 23 ARROYO DE LA MIEL 25 V. R. A. M 56 PIZARRA 26 B. C. A. M 49 MÁLAGA 27 C. L. A. M 52 ALHAURIN DE LA TORRE 28 R. P. S. M 45 MÁLAGA 29 P. R. J. M 27 MÁLAGA 30 M. L. M. D. M 37 COIN 31 J. L. A. M 59 MÁLAGA 32 R. M. N. M 33 MÁLAGA 33 F. C. F. H 27 VÉLEZ-MÁLAGA 34 A. J. P. H 54 MÁLAGA 35 F. C. R. M 17 MÁLAGA 36 A. J. L. M 35 MÁLAGA 37 G. G. M. M 56 MÁLAGA 38 P. F. A. M. M 17 TORREMOLINOS 39 D. B. S. H 36 MÁLAGA 40 T. M. E. M 44 MÁLAGA 41 F. G. M. H 19 PERIANA 42 F. R. A. H 26 MÁLAGA 43 M. D. A. M 38 ANTEQUERA 44 R. T. A. M 46 MÁLAGA 45 B. H. M. A. M 25 MÁLAGA 46 G. M. G. M 43 MÁLAGA 47 C. R. R. H 39 ALAHURIN DE LA TORRE 48 F. A. J. H 16 MÁLAGA 49 M. A. A. M. M 18 MÁLAGA 50 G. M. R. M 15 MÁLAGA 51 F. R. L. M 21 MÁLAGA 52 G. G. M. M 24 ANTEQUERA 53 G. J. L. M 69 MÁLAGA 56 MENU SALIR Número Nombre Sexo Edad Domicilio 55 C. L. E. M 30 MÁLAGA 56 G. G. J. A. H 47 MÁLAGA 57 G. V. M. M 14 MÁLAGA 58 R. M. A. H 64 ANTEQUERA 59 A. G. M. M 46 MÁLAGA 60 G. R. A. M 33 MÁLAGA 61 G. R. L. H 55 MARBELLA 62 L. M. A. M. M 31 MÁLAGA 63 T. M. J. H 55 MÁLAGA 64 M. G. A. M 16 MÁLAGA 65 P. G. A. M 26 ESTEPONA 66 G. D. A. M 16 MÁLAGA 67 T. G. M. M 39 MÁLAGA 68 F. G. E. M 61 MÁLAGA 69 R. T. L. M 43 MÁLAGA 70 G. G. F. H 47 MÁLAGA 71 P. E. F. M 50 MARBELLA 72 A. A. J. F. M 14 MÁLAGA 73 N. G. J. M H 52 MÁLAGA 74 R. G. L. H 19 MÁLAGA 75 T. E. F. M 33 MÁLAGA 76 V. F. D. M 48 MÁLAGA 57 MENU SALIR GRÁFICO 2. DOMICILIO GRUPO DE CONTROLES. VELEZ-MALAGA VALLE ABDALAJIS TORROX TORREMOLINOS PIZARRA PERIANA MIJAS COSTA MARBELLA MALAGA ESTEPONA COIN BENALMÁDENA ARROYO MIEL ANTEQUERA ALHAURIN 0 20 40 60 58 MENU SALIR 2. - PREVALENCIA DE INFESTACIÓN POR Anisakis simplex EN PESCADOS. 2.1. -PREVALENCIA DE INFESTACIÓN EN BACALADILLLA (Micromesistius poutassou). Se analizaron en total 56 ejemplares de bacaladilla, encontrándose 42 muestras parasitadas, lo que supone una prevalencia de parasitación del 75%. El número total de parásitos localizados fue de 194, lo que supone una media de 4.6 parásitos por ejemplar parasitado. En cuanto a la localización, de los 194 parásitos, 106 se encontraron en cavidad peritoneal (54.6%) y 88 en hígado (45.4%) ( ver Tabla IV en la página siguiente). 59 MENU SALIR Tabla IV. PREVALENCIA DE INFESTACIÓN EN BACALADILLA (Micromesistius poutassou). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 6 6 39 13 26 100 Junio-97 5 3 17 13 4 60 Julio-97 5 3 12 7 5 60 Agosto-97 5 4 22 14 8 80 Sept.-97 5 4 6 5 1 80 Octubre-97 6 5 29 8 21 83 Nov.-97 5 4 7 0 7 80 Dic.-97 5 2 10 7 3 40 Enero-98 5 2 9 1 8 40 Febrero-98 5 3 18 12 6 60 Marzo-98 5 3 12 2 10 60 Abril-98 5 3 13 6 7 60 TOTAL 56 42 194 88 106 75 1 1 P%: Prevalencia de infestación en porcentaje. 60 MENU SALIR 2.2. -PREVALENCIA DE INFESTACIÓN EN BOQUERÓN (Engraulis encrasicholus). Se analizaron 167 muestras durante el periodo de estudio, no encontrándose en ningún caso parásitos en ninguna localización anatómica (Tabla V). Tabla V. PREVALENCIA DE INFESTACIÓN EN BOQUERÓN (Engraulis encrasicholus). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 13 0 0 0 0 0 Junio-97 15 0 0 0 0 0 Julio-97 14 0 0 0 0 0 Agosto-97 13 0 0 0 0 0 Sept.-97 15 0 0 0 0 0 Octubre-97 14 0 0 0 0 0 Nov.-97 13 0 0 0 0 0 Dic.-97 14 0 0 0 0 0 Enero-98 14 0 0 0 0 0 Febrero-98 14 0 0 0 0 0 Marzo-98 14 0 0 0 0 0 Abril-98 14 0 0 0 0 0 TOTAL 167 0 0 0 0 0 1 1 P%: Prevalencia de infestación en porcentaje. 61 MENU SALIR 2.3. -PREVALENCIA DE INFESTACIÓN EN PIJOTA (Merlucius merlucius). Se analizaron en total 46 ejemplares de Pijotas, de los cuales 24 estaban parasitadas, lo que supone una prevalencia de parasitación del 52%. El número total de parásitos localizados fue de 59, lo que supone una media de 2.4 parásitos por ejemplar infestado. En cuanto a la localización, de los 59 parásitos, 9 se encontraron en cavidad peritoneal (15.3%) y 50 en hígado (84.7%) (ver Tabla VI). 2.3. -PREVALENCIA DE INFESTACIÓN EN JUREL (Trachurus trachurus). Se analizaron en total 62 ejemplares de Jurel, 25 de los cuales estaban parasitados (prevalencia de parasitación del 40%). El número total de parásitos localizados fue de 54, lo que supone una media de 2.1 parásitos por ejemplar infestado. En cuanto a la localización, de los 54 parásitos, 20 se encontraron en cavidad peritoneal (37.1%) y 34 en hígado (62.9 %) (ver Tabla VII). 62 MENU SALIR Tabla VI. PREVALENCIA DE INFESTACIÓN EN PIJOTA (Merlucius merlucius). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 4 1 5 3 2 25 Junio-97 4 3 13 12 1 75 Julio-97 4 1 2 2 0 25 Agosto-97 3 0 0 0 0 0 Sept.-97 4 3 5 5 0 75 Octubre-97 4 4 7 6 1 100 Nov.-97 4 3 4 3 1 75 Dic.-97 3 3 5 4 1 100 Enero-98 4 1 9 7 2 25 Febrero-98 4 1 1 1 0 25 Marzo-98 4 2 3 3 0 50 Abril-98 4 2 5 4 1 50 TOTAL 46 24 59 50 9 52 1 1 P%: Prevalencia de infestación en porcentaje. 63 MENU SALIR Tabla VII. PREVALENCIA DE INFESTACIÓN EN JUREL (Trachurus trachurus). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 5 0 0 0 0 0 Junio-97 5 1 3 3 0 20 Julio-97 5 3 5 2 3 60 Agosto-97 6 3 7 2 5 50 Sept.-97 5 0 0 0 0 0 Octubre-97 5 3 4 1 3 60 Nov.-97 5 2 7 5 2 40 Dic.-97 5 2 3 2 1 40 Enero-98 5 2 3 3 0 40 Febrero-98 6 2 9 6 3 33 Marzo-98 5 3 5 4 1 60 Abril-98 5 4 8 6 2 80 TOTAL 62 25 54 34 20 40 1 1 P%: Prevalencia de infestación en porcentaje. 64 MENU SALIR 2.4 -PREVALENCIA DE INFESTACIÓN EN CABALLA (Scomber scombrus). En cuanto a la caballa, se analizaron 49 ejemplares en el período de estudio. Resultaron parasitadas 19 ejemplares, con lo que la prevalencia de infestación se sitúa en el 38%. Fueron hallados un total de 215 parásitos, lo que supone una media de 11.3 por ejemplar infestado. De éstos, 145 (67.4%) fueron hallados en la cavidad peritoneal y 70 (32.6%) en vísceras (hepatopáncreas) (Tabla VIII). 2.4. -PREVALENCIA DE INFESTACIÓN EN SARDINA (Sardina pilchardus). Fueron analizados 49 ejemplares de sardina, encontrándose sólo dos muestras parasitadas, suponiendo una prevalencia de infestación del 4.08%. En dichas muestras, se encontraron 7 parásitos; 6 de ellos en cavidad peritoneal (85.7%) y 1 en hepatopáncreas (14.3%) (Tabla IX). 65 MENU SALIR Tabla VIII. PREVALENCIA DE INFESTACIÓN EN CABALLA (Scomber scombrus). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 4 0 0 0 0 0 Junio-97 4 2 34 5 29 50 Julio-97 4 3 42 12 30 75 Agosto-97 4 2 19 7 12 50 Sept.-97 4 3 22 17 5 75 Octubre-97 4 0 0 0 0 0 Nov.-97 4 2 11 7 4 50 Dic.-97 4 1 14 2 12 25 Enero-98 4 2 13 1 12 50 Febrero-98 5 2 35 12 23 40 Marzo-98 4 1 9 0 9 25 Abril-98 4 1 16 7 9 25 TOTAL 49 19 215 70 145 38 1 1 P%: Prevalencia de infestación en porcentaje. 66 MENU SALIR Tabla IX. PREVALENCIA DE INFESTACIÓN EN SARDINA (Sardina pilchardus). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 4 0 0 0 0 0 Junio-97 4 0 0 0 0 0 Julio-97 4 1 4 1 3 25 Agosto-97 5 1 3 0 3 20 Sept.-97 4 0 0 0 0 0 Octubre-97 4 0 0 0 0 0 Nov.-97 4 0 0 0 0 0 Dic.-97 4 0 0 0 0 0 Enero-98 4 0 0 0 0 0 Febrero-98 4 0 0 0 0 0 Marzo-98 4 0 0 0 0 0 Abril-98 4 0 0 0 0 0 TOTAL 49 2 7 1 6 4 1 1 P%: Prevalencia de infestación en porcentaje. 67 MENU SALIR 2.5. -PREVALENCIA DE INFESTACIÓN EN RAPE (Lophius piscatorius). En cuanto al rape, se analizaron 24 ejemplares, encontrándose 17 de ellos parasitados (71%). En esta especie, se encontraron un total de 101 parásitos lo que supone una media de 5.9 por ejemplar parasitado, de los cuales 86 (85.1%) tenían una localización hepática y 15 peritoneal (14.9%) (Tabla X). 2.6. -PREVALENCIA DE INFESTACIÓN EN CALAMAR (Lóligo vulgaris). Fueron analizados 22 ejemplares de calamar fresco durante el período de estudio, no encontrándose ningún parásito en su interior (Tabla XI). 68 MENU SALIR Tabla X. PREVALENCIA DE INFESTACIÓN EN RAPE (Lophius piscatorius). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 2 2 14 12 2 100 Junio-97 2 1 9 7 2 50 Julio-97 2 2 8 6 2 100 Agosto-97 2 1 4 4 0 50 Sept.-97 2 1 6 6 0 50 Octubre-97 2 1 10 8 2 50 Nov.-97 2 2 19 17 2 100 Dic.-97 2 2 14 10 4 100 Enero-98 2 2 6 6 0 100 Febrero-98 2 1 2 2 0 50 Marzo-98 2 1 2 2 0 50 Abril-98 2 1 7 6 1 50 TOTAL 24 17 101 86 15 71 1 1 P%: Prevalencia de infestación en porcentaje. 69 MENU SALIR Tabla XI. PREVALENCIA DE INFESTACIÓN EN CALAMAR (Lóligo vulgaris). MES Número Parasitadas de Parásitos Localización Localización (total) Hepática en cav. muestras P (%) peritoneal Mayo-97 2 0 0 0 0 0 Junio-97 2 0 0 0 0 0 Julio-97 2 0 0 0 0 0 Agosto-97 2 0 0 0 0 0 Sept.-97 2 0 0 0 0 0 Octubre-97 2 0 0 0 0 0 Nov.-97 2 0 0 0 0 0 Dic.-97 2 0 0 0 0 0 Enero-98 1 0 0 0 0 0 Febrero-98 1 0 0 0 0 0 Marzo-98 2 0 0 0 0 0 Abril-98 2 0 0 0 0 0 TOTAL 22 0 0 0 0 0 1 1 P%: Prevalencia de infestación en porcentaje. 70 MENU SALIR 2.7.- PREVALENCIA DE PARASITACIÓN EN CONJUNTO. En total fueron analizadas 475 muestras de ocho especies distintas, de las cuales 129 muestras estaban parasitadas: 42 muestras de bacaladilla (75%), 0 muestras de boquerón (0%), 24 muestras de pijotas (52%), 25 muestras de jurel (40%), 19 muestras de caballa (38%), 2 muestras de sardina (4%), 17 muestras de rape (71%) y 0 muestras de calamar (0%) ( ver Gráfico 3 en la página siguiente). Esto supone que el 27.2% del total de muestras, estaban parasitadas por Anisakis simplex. 71 MENU SALIR GRÁFICO 3. PREVALENCIA DE PARASITACIÓN POR Anisakis simplex EN LAS DIFERENTES ESPECIES DE PESCADO ESTUDIADAS. Calamar 100 0 29 Rape 71 Sardina 4 96 62 Caballa 38 60 Jurel 40 48 Pijota 52 100 Boquerón 0 25 Bacaladilla 75 0 50 No parasitadas 100 Parasitadas 72 MENU SALIR 2.7. -INTENSIDAD DE PARASITACIÓN. En cuanto a la intensidad de parasitación, hemos encontrado que de las 129 muestras parasitadas, en 60 (46.5%) se encontraron entre 1 y 5 parásitos; en 42 (32.5%), entre 5 y 10 parásitos y en 27 muestras (21%) más de diez parásitos (Gráfico 4). GRÁFICO 4. INTENSIDAD DE PARASITACIÓN EN EL CONJUNTO DE MUESTRAS PARASITADAS. 27 60 42 1-5 parásitos 5-10 parásitos > 10 parásitos 73 MENU SALIR Estudiando la intensidad de parasitación por especie, obtenemos los siguientes resultados (media de parásitos por ejemplar parasitado) (Gráfico 5): - Bacaladilla: 4.6. - Pijota: 2.4. - Jurel: 2.1. - Caballa: 11.3. - Sardina: 3.5. - Rape: 5.9. GRÁFICO 5. INTENSIDAD MEDIA DE PARASITACIÓN POR Anisakis simplex EN LAS DIFERENTES ESPECIES DE PESCADO ESTUDIADAS. 11,3 10 8 4,6 3,5 2,4 2,1 Jurel 4 Pijota 6 5,9 Rape Sardina 0 Caballa 2 Bacaladilla Media de parásitos por ejemplar parasitado 12 74 MENU SALIR 2.8. -LOCALIZACIÓN ANATÓMICA DE LOS PARÁSITOS. Analizando en conjunto las 129 muestras parasitadas, encontramos un total de 630 larvas de Anisakis simplex. De éstas, 329 (52.2%) fueron encontradas en vísceras (hepatopáncreas) y 301 (47.8%) en cavidad peritoneal (Gráfico 6). GRÁFICO 6. LOCALIZACIÓN ANATÓMICA DE LOS PARÁSITOS 350 329 Nº de parásitos 300 301 250 200 150 100 50 0 Visceral Peritoneal 75 MENU SALIR Analizando los datos por especies, en la bacaladilla, 88 parásitos (45.4%) tenían localización visceral y 106 (54.6%) localización peritoneal; en la pijota, 50 (84.7%) localización visceral y 9 (15.3%) localización peritoneal; en el jurel, 34 (62.9%) localización visceral y 20 (37.1%) localización peritoneal; en la caballa, 70 (32.6%) localización visceral y 145 (67.4%) localización peritoneal; en la sardina, 1 (14.3%) localización visceral y 6 (85.7%) localización peritoneal y en el rape, 86 (85.1%) localización visceral y 15 (14.9%) localización peritoneal (Gráfico 7). GRÁFICO 7. LOCALIZACIÓN ANATÓMICA DE LOS PARÁSITOS EN Visceral Rape Sardina Caballa Jurel Pijota 90 80 70 60 % 50 40 30 20 10 0 Bacaladilla LAS DIFERENTES ESPECIES DE PESCADO ESTUDIADAS. Peritoneal 76 MENU SALIR 2.9.- VARIACIONES ESTACIONALES EN LA INTENSIDAD DE PARASITACIÓN POR Anisakis simplex. Las variaciones estacionales en la intensidad media de parasitación de Anisakis simplex en las especies más infestadas (Bacaladilla, Rape, Pijota, Jurel y Caballa) se muestran en el gráfico 8 de líneas apiladas (ver en página siguiente). La intensidad media de parasitación se obtiene del cociente entre el número total de parásitos y el número de muestras parasitadas en cada mes de muestreo. 77 MENU SALIR GRÁFICO 8. VARIACIONES ESTACIONALES EN LA INTENSIDAD MEDIA DE PARASITACIÓN POR Anisakis simplex.1 45 40 35 30 25 20 15 10 5 0 e br m ie re ic D mb ie ov N re ub re ct b O m ie pt Se o st go A lio Ju o ni Ju o ay M il br A zo ar M ro e br Fe o er En Bacaladilla 1 Rape Pijota Jurel Caballa Intensidad media parasitación = Número total parásitos / Número de muestras parasitadas. 78 MENU SALIR 3. -HÁBITOS DE CONSUMO DE PESCADO. Los resultados de la encuesta sobre hábitos de consumo de pescado se muestran en el gráfico 9 de la página siguiente. Es de destacar que el 100% de los pacientes y controles, consumen pescado fresco y que el 100% de los pacientes y el 98% de los controles consumen pescado pequeño. El consumo de pescado semicrudo (fundamentalmente en vinagre) es también muy elevado: el 68% en el grupo de pacientes y el 62%en el grupo control. La mayoría compran el pescado en supermercado y pescaderías pequeñas (60%) y el resto (40%) en el Mercado. Sólo un paciente del grupo control, restaurador de profesión, lo compraba en la Lonja. 79 MENU SALIR Gráfico 9. HÁBITOS DE CONSUMO DE PESCADO (Resultados expresados en tantos por ciento) 100 90 80 70 60 % 50 40 30 20 10 0 PESCADO BLANCO PESCADO AZUL CEFALÓP. PESCADO FRESCO PESCADO CONGELADO PESCADO PEQUEÑO PESCADO GRANDE PESCADO SEMICRUDO PACIENTES 90 95 73 100 59 100 91 68 CONTROLES 97 79 75 100 54 98 93 62 PACIENTES CONTROLES 80 MENU SALIR 4. -PRUEBAS CUTÁNEAS. 4.1. -GRUPO DE PACIENTES. De los 76 pacientes, 26 (34.2%) tuvieron pruebas cutáneas positivas a alergenos inhalantes, 9 (11.8%) a alergenos alimentarios, 14 (18.4%) a proteínas de Anisakis simplex y en 37 pacientes (48.6%) fueron negativas a todos los alergenos probados (Tabla XII). En el grupo de 14 pacientes con pruebas cutáneas positivas a Anisakis simplex, 4 (28.6%) presentaban pruebas cutáneas positivas a algún alergeno inhalante, 2 (14.3%) con alergenos inhalantes y alimentarios, 1 (7.1%) con alergenos alimentarios y en 9 (64.2%) sólo eran positivas a Anisakis simplex (Tabla XIII). TABLA XII. RESULTADO DE LAS PRUEBAS CUTÁNEAS EN EL GRUPO DE PACIENTES Número Nombre Prick test alergenos inhalantes paciente Prick test Prick test alergenos Anisakis alimentarios simplex 1 A. M. M. NEGATIVO NEGATIVO NEGATIVO 2 A. M. A. NEGATIVO NEGATIVO NEGATIVO 3 B. L. F. NEGATIVO NEGATIVO NEGATIVO 4 C. C. S. Parietaria NEGATIVO NEGATIVO 5 C. C. J. NEGATIVO NEGATIVO NEGATIVO 6 G. V. M. A. Gramíneas NEGATIVO NEGATIVO 7 G. S. M. P. NEGATIVO NEGATIVO NEGATIVO 8 G. G. R. D.pteronyssinus, D. Farinae NEGATIVO NEGATIVO 9 R. L. J. D. pteronyssinus, D. Farinae Trigo, Almendra POSITIVO 10 J. G. R. NEGATIVO NEGATIVO NEGATIVO 11 J. C. P. NEGATIVO NEGATIVO NEGATIVO 12 L. C. C. NEGATIVO NEGATIVO NEGATIVO 13 M. R. C. NEGATIVO NEGATIVO NEGATIVO 14 M. C. M. NEGATIVO NEGATIVO NEGATIVO 15 M. S. S. NEGATIVO NEGATIVO NEGATIVO 16 M. R. J. A. NEGATIVO NEGATIVO NEGATIVO 81 MENU Número SALIR Nombre Prick test alergenos inhalantes paciente Prick test Prick test alergenos Anisakis alimentarios simplex 17 N. O. M. I. Cassuarina NEGATIVO NEGATIVO 18 P. C. A. D.pteronyssinus, Artemisia, NEGATIVO NEGATIVO Alternaria 19 R. H. D. NEGATIVO NEGATIVO NEGATIVO 20 R. L. V. NEGATIVO NEGATIVO NEGATIVO 21 R. M. A. Fraxinus, Aspergillus NEGATIVO NEGATIVO 22 R. A. B. NEGATIVO NEGATIVO NEGATIVO 23 R. M. V. NEGATIVO NEGATIVO POSITIVO 24 R.V. E. NEGATIVO NEGATIVO NEGATIVO 25 R. L. A. NEGATIVO NEGATIVO NEGATIVO 26 R. A. E. NEGATIVO NEGATIVO NEGATIVO 27 K. K. E. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 28 M. V. M. C. D. pteronyssinus NEGATIVO NEGATIVO 29 A. D. N. NEGATIVO Pescado azul NEGATIVO (atún) 30 G. E. G. NEGATIVO NEGATIVO POSITIVO 31 M. C. J. NEGATIVO NEGATIVO POSITIVO 32 A. A. A. NEGATIVO NEGATIVO NEGATIVO 33 V. P. M. A. Gramíneas, Olea, D. Pteronyssinus, NEGATIVO NEGATIVO NEGATIVO NEGATIVO D. farinae 34 M. G. M. Fraxinus, Olea, Artemisia, D. Pteronyssinus, D. farinae, Aspergillus. 35 F. M. I. NEGATIVO NEGATIVO NEGATIVO 36 A. C. A. NEGATIVO NEGATIVO NEGATIVO 37 C. G. I. NEGATIVO NEGATIVO NEGATIVO 38 G. L. L. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 39 R. V. A. Chrysanthemum, Mercurialis, gato NEGATIVO NEGATIVO 40 P. A. A. NEGATIVO NEGATIVO POSITIVO 41 G. P. D. NEGATIVO NEGATIVO NEGATIVO 42 F. G. J. A. NEGATIVO Ovoalbúmina NEGATIVO 43 G. P. A. NEGATIVO NEGATIVO POSITIVO 82 MENU Número SALIR Nombre Prick test alergenos inhalantes paciente Prick test Prick test alergenos Anisakis alimentarios simplex 44 C. C. D. NEGATIVO NEGATIVO NEGATIVO 45 A. M .L. NEGATIVO NEGATIVO NEGATIVO 46 M. M. R. NEGATIVO Almendra POSITIVO 47 D. O. C. NEGATIVO NEGATIVO POSITIVO 48 G. M. G. Gramíneas Melocotón NEGATIVO 49 O. C. R. Aspergillus NEGATIVO NEGATIVO 50 P. G. M. D. pteronyssinus, D. farinae, perro, Almendra, NEGATIVO gato, Olea, Artemisia. Cacahuete Gramíneas, Olea, Plantago, D. pt., NEGATIVO NEGATIVO NEGATIVO NEGATIVO 51 O. A. M. D. D. f., Aspergillus, Alter 52 M. M. A. Gramíneas, Olea, Chenopodium, Plantago, Artemisia, Parietaria, D.pteronyssinus, D.farinae 53 N. LL. A. NEGATIVO NEGATIVO NEGATIVO 54 M. H. F NEGATIVO NEGATIVO POSITIVO 55 P. L. Y. D. pteronyssinus., D.farinae, perro, NEGATIVO NEGATIVO gato, hamster 56 B. M. E. Gramíneas NEGATIVO NEGATIVO 57 V. R. E. NEGATIVO NEGATIVO NEGATIVO 58 A. G. A. NEGATIVO Melocotón, NEGATIVO Pescado azul 59 R. M. M. NEGATIVO NEGATIVO NEGATIVO 60 C. M. D. NEGATIVO NEGATIVO NEGATIVO 61 A. S. M. NEGATIVO NEGATIVO POSITIVO 62 G. G. M. NEGATIVO NEGATIVO NEGATIVO 63 A. R. A. NEGATIVO NEGATIVO NEGATIVO 64 G. C. G. D. pteronyssinus, D. Farinae NEGATIVO POSITIVO 65 P. G. M. D. pteronyssinus, D. farinae, ep. Cacahuete, NEGATIVO Perro y gato, Olea, Artemisia. almendra 66 A. M. R. Olea NEGATIVO NEGATIVO 67 C. C. A. NEGATIVO NEGATIVO NEGATIVO 68 F. R. A NEGATIVO NEGATIVO NEGATIVO 69 P. CH. M.C. NEGATIVO NEGATIVO NEGATIVO 70 S. G. F. NEGATIVO POSITIVO NEGATIVO 83 MENU SALIR Número Nombre Prick test alergenos inhalantes paciente 71 G. R. A. D. pteronyssinus, Prick test Prick test alergenos Anisakis alimentarios simplex NEGATIVO POSITIVO D.farinae,Gramíneas, Olea 72 P. B. A. Gramíneas, Olea, Cassuarina NEGATIVO NEGATIVO 73 C. A. J. D. pteronyssinus, D. Farinae Gamba POSITIVO 74 M. R. A. NEGATIVO NEGATIVO NEGATIVO 75 P. R. M. T. NEGATIVO NEGATIVO NEGATIVO 76 V. T. M. NEGATIVO NEGATIVO NEGATIVO TABLA XIII. PRUEBAS CUTÁNEAS EN EL GRUPO DE PACIENTES POSITIVOS A Anisakis simplex. Número 9 Nombre R. L. J. Prick test alergenos inhalantes D. pteronyssinus, D. Farinae Prick test Prick test alergenos Anisakis alimentarios simplex Trigo, POSITIVO Almendra 23 R. M. V. NEGATIVO NEGATIVO POSITIVO 30 G. E. G. NEGATIVO NEGATIVO POSITIVO 31 M. C. J. NEGATIVO NEGATIVO POSITIVO 40 P. A. A. NEGATIVO NEGATIVO POSITIVO 43 G. P. A. NEGATIVO NEGATIVO POSITIVO 46 M. M. R. NEGATIVO Almendra POSITIVO 47 D. O. C. NEGATIVO NEGATIVO POSITIVO 54 M. H. F NEGATIVO NEGATIVO POSITIVO 61 A. S. M. NEGATIVO NEGATIVO POSITIVO 64 G. C. G. D. pteronyssinus, D. Farinae NEGATIVO POSITIVO 70 S. G. F. NEGATIVO NEGATIVO POSITIVO 71 G. R. A. D. pteronyssinus, NEGATIVO POSITIVO Gamba POSITIVO D.farinae,Gramíneas, Olea 73 C. A. J. D. pteronyssinus, D. Farinae 84 MENU SALIR 4.2. -GRUPO DE CONTROLES. En el grupo control, 32 pacientes (42.1%) eran atópicos mientras que en 44 (57.9%) no se demostró ninguna positividad cutánea a alergenos inhalantes y/o alimentarios. Tres pacientes (3.9%) (Nº 17, 22 y 49) presentaron pruebas cutáneas positivas a Anisakis simplex (Tabla XIV). TABLA XIV. RESULTADO DE LAS PRUEBAS CUTÁNEAS EN EL GRUPO DE CONTROLES. Número Nombre Prick test alergenos inhalantes Prick test Prick test alergenos Anisakis alimentarios simplex 1 A. C. C. NEGATIVO NEGATIVO NEGATIVO 2 M. P. E. NEGATIVO NEGATIVO NEGATIVO 3 E. C. A. NEGATIVO NEGATIVO NEGATIVO 4 F. A. F. NEGATIVO NEGATIVO NEGATIVO 5 A. A. J. NEGATIVO NEGATIVO NEGATIVO N. C. M. NEGATIVO NEGATIVO NEGATIVO F. 6 A. 7 O. P. Y. NEGATIVO NEGATIVO NEGATIVO 8 R. O. V. Gramíneas, Olivo, Chenopodium NEGATIVO NEGATIVO 9 G. J. A. NEGATIVO NEGATIVO NEGATIVO 10 C. J. R. Plantago, Artemisia, Chenopodium NEGATIVO NEGATIVO 11 M. R. C. NEGATIVO NEGATIVO NEGATIVO 12 C. C. A. NEGATIVO NEGATIVO NEGATIVO C. 13 R. F. E. NEGATIVO NEGATIVO NEGATIVO 14 A. B. E. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 15 M. R. B. D. pteronyssinus, D. farinae, NEGATIVO NEGATIVO NEGATIVO NEGATIVO Alternaria, Olea 16 M.C. J. D. pteronyssinus, D. Farinae A. 17 M. A. A. Artemisia, Chenopodium, Plantago, NEGATIVO POSITIVO 85 MENU SALIR Número 18 Nombre Prick test alergenos inhalantes L. O. M. NEGATIVO Prick test Prick test alergenos Anisakis alimentarios simplex NEGATIVO NEGATIVO A. 19 R. L. A. NEGATIVO NEGATIVO NEGATIVO 20 F. J. L. NEGATIVO NEGATIVO 21 B. P. A. Artemisia, Chenopodium, Salsola NEGATIVO NEGATIVO 22 G. G. J. Chenopodium, Parietaria, NEGATIVO POSITIVO Olea, Gramíneas Gramíneas 23 M. A. F. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 24 G. S. M. Gramíneas, Olea, Plantago, NEGATIVO NEGATIVO Aspergillus, Ept. Gato 25 V. R. A. NEGATIVO NEGATIVO NEGATIVO 26 B. C. A. NEGATIVO NEGATIVO NEGATIVO 27 C. L. A. NEGATIVO NEGATIVO NEGATIVO 28 R. P. S. NEGATIVO NEGATIVO NEGATIVO 29 P. R. J. Gramíneas, Olea, Ricinus NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO communis 30 M. L. M. D. pteronyssinus, D. Farinae D. 31 J. L. A. NEGATIVO 32 R. M. N. Gramíneas, Olea NEGATIVO NEGATIVO 33 F. C. F. D. pteronyssinus, D. farinae, NEGATIVO NEGATIVO NEGATIVO NEGATIVO Alternaria, ept. Gato 34 A. J. P. NEGATIVO 35 F. C. R. Gramíneas, Olea, Chenopodium NEGATIVO NEGATIVO 36 A. J. L. NEGATIVO NEGATIVO Gramíneas, Olea, D. pteronyssinus, D. farinae 37 G. G. M. NEGATIVO NEGATIVO NEGATIVO 38 P. F. A. D. pteronyssinus, D. farinae, Ept. NEGATIVO NEGATIVO NEGATIVO NEGATIVO M. 39 Perro, ept. Gato D. B. S. Gramíneas, Olea, Chenopodium, Parietaria 40 T. M. E. NEGATIVO NEGATIVO NEGATIVO 41 F. G. M. Gramíneas, Olea NEGATIVO NEGATIVO 86 MENU SALIR Número Nombre Prick test alergenos inhalantes Prick test Prick test alergenos Anisakis alimentarios simplex 42 F. R. A. Gramíneas, olea, Parietaria NEGATIVO NEGATIVO 43 M. D. A. NEGATIVO NEGATIVO NEGATIVO 44 R. T. A. NEGATIVO NEGATIVO NEGATIVO 45 B. H. M. NEGATIVO NEGATIVO NEGATIVO A. 46 G. M. G. NEGATIVO NEGATIVO NEGATIVO 47 C. R. R. NEGATIVO NEGATIVO NEGATIVO 48 F. A. J. NEGATIVO NEGATIVO D. pteronyssinus, D. farinae, ept. Perro, ept. Gato 49 M. A. A. D. pteronyssinus, D. Farinae NEGATIVO POSITIVO 50 G. M. R. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 51 F. R. L. D. pteronyssinus, D. farinae, Olea NEGATIVO NEGATIVO 52 G. G. M. D. pteronyssinus, D. farinae, NEGATIVO NEGATIVO Alternaria, ept. Gato 53 G. J. L. NEGATIVO NEGATIVO NEGATIVO 54 F. M. A. NEGATIVO NEGATIVO NEGATIVO 55 C. L. E. NEGATIVO NEGATIVO NEGATIVO 56 G. G. J. NEGATIVO NEGATIVO NEGATIVO A. 57 G. V. M. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 58 R. M. A. NEGATIVO NEGATIVO NEGATIVO 59 A. G. M. NEGATIVO NEGATIVO NEGATIVO 60 G. R. A. NEGATIVO NEGATIVO NEGATIVO 61 G. R. L. NEGATIVO NEGATIVO NEGATIVO 62 L. M. A. NEGATIVO NEGATIVO NEGATIVO M. 63 T. M. J. NEGATIVO NEGATIVO NEGATIVO 64 M. G. A. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 65 P. G. A. Parietaria, Artemisia, NEGATIVO NEGATIVO Chenopodium, Plantago 66 G. D. A. D. pteronyssinus, D. Farinae NEGATIVO NEGATIVO 67 T. G. M. NEGATIVO NEGATIVO NEGATIVO 87 MENU SALIR Número Nombre Prick test alergenos inhalantes Prick test Prick test alergenos Anisakis alimentarios simplex 68 F. G. E. NEGATIVO NEGATIVO NEGATIVO 69 R. T. L. NEGATIVO NEGATIVO NEGATIVO 70 G. G. F. NEGATIVO NEGATIVO NEGATIVO 71 P. E. F. NEGATIVO NEGATIVO NEGATIVO 72 A. A. J. D. pteronyssinus, D: farinae, Olea, Almendra, F. ept. Gato 73 NEGATIVO cacahuete N. G. J. NEGATIVO NEGATIVO NEGATIVO M 74 R. G. L. D. pteronyssinus, D. farinae, Olea NEGATIVO NEGATIVO 75 T. E. F. Parietaria, Gramíneas, NEGATIVO NEGATIVO NEGATIVO NEGATIVO Chenopodium 76 V. F. D. NEGATIVO 5. -DETERMINACIÓN DE IgE ESPECÍFICA. 5.1. -GRUPO DE PACIENTES. Los resultados de la determinación de IgE específica se muestran en la Tabla XV. Los datos de estadística descriptiva del CAP a Anisakis simplex se presentan en la tabla XVI. 16 pacientes (21.05%) presentaron valores superiores a 0.35 kU/l a proteínas de Anisakis simplex, con una media de 6.71 kU/l, y desviación típica de 10.42. De estos 16 pacientes, 13 (81.25%) tenían CAP positivo sólo a Anisakis simplex y los tres restantes (pacientes 9, 71 y 73) tuvieron valores positivos con D. Pteronyssinus, pescado blanco (paciente 9), pescado azul (paciente 9), y marisco (pacientes 9 y 73). 88 MENU SALIR TABLA XV. RESULTADOS DE LA DETERMINACIÓN DE IgE ESPECÍFICA EN EL GRUPO DE PACIENTES. Número 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 CAP CAP pescado CAP pescado CAP CAP D. blanco (bacalao) azul (atún) Anisakis marisco pteronyssin < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 1,06 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 5,70 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,58 < 0,35 < 0,35 < 0,35 < 0,35 3,71 < 0,35 < 0,35 < 0,35 < 0,35 1,57 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,59 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,47 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 1,73 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,70 < 0,35 < 0,35 < 0,35 0,58 < 0,35 < 0,35 9,76 35,40 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 4,34 < 0,35 < 0,35 5,21 < 0,35 < 0,35 0,49 1,42 (gamba) < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 5,72 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 89 MENU SALIR Número CAP CAP pescado CAP pescado CAP CAP D. blanco (bacalao) azul (atún) Anisakis marisco pteronyssin 48 < 0,35 < 0,35 < 0,35 < 0,35 (gamba) < 0,35 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 < 0,35 100,00 62,70 4,96 < 0,35 < 0,35 72,20 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 100,00 < 0,35 99,20 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0<,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,52 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 27,50 < 0,35 < 0,35 0,47 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 2,94 1,64 < 0,35 13,50 < 0,35 1,31 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,63 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 92,70 < 0,35 < 0,35 < 0,35 90 MENU SALIR TABLA XVI. ESTADÍSTICA DESCRIPTIVA DE LA DETERMINACIÓN DE IgE ESPECÍFICA A Anisakis simplex EN EL GRUPO DE PACIENTES. N 76 Media 1,6909 Mediana 0,3500 Moda 0,35 Desviación típica 5,3449 Asimetría 5,164 Error típico de asimetría 0,276 Curtosis 28,008 Error típico de curtosis 0,545 Valor mínimo 0,35 Valor máximo 35,40 91 MENU SALIR En el grupo de pacientes con IgE específica positiva a Anisakis simplex, se determinó además la IgE específica a Ascaris y Echinococcus. 6 pacientes (37.5%) mostraron resultados positivos a Ascaris, con una media de 6.755 kU/l; dos de éstos fueron positivos además a Echinococcus. En la tabla XVII se expresan estos resultados. TABLA XVII. RESULTADOS DE LA DETERMINACIÓN DE IgE ESPECÍFICA EN EL GRUPO DE PACIENTES CON CAP POSITIVO A Anisakis simplex. Número CAP CAP CAP CAP Anisakis CAP CAP CAP D. Pescado Pescado azul simplex Ascaris Echinococc marisco blanco (atún) us (gamba) < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,51 < 0,35 < 0,35 5,65 < 0,35 5,72 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 92,70 < 0,35 pteronyssinus (bacalao) 9 23 27 30 31 40 43 46 47 54 61 64 70 71 73 75 1,06 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 100,00 99,20 < 0,35 0,59 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,47 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 1,73 0,70 0,58 9,76 35,40 4,34 5,21 0,49 1,42 0,52 27,50 0,47 2,94 1,64 13,50 1,31 0,52 0,68 < 0,35 < 0,35 < 0,35 1,79 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 2,25 < 0,35 4,09 31,20 < 0,35 92 MENU SALIR En cuanto a la comparación de resultados de IgE específica y pruebas cutáneas a proteínas de Anisakis simplex, se muestran en la tabla XVIII. De los 16 pacientes con CAP-FEIA > 0.35 kU/l, 2 de ellos (pacientes 27 y 75) habían presentado pruebas cutáneas negativas. Esto supone un 12.5% de falsos negativos de pruebas cutáneas en esta serie. TABLA XVIII. COMPARACIÓN DE RESULTADOS DE IgE ESPECÍFICA Y PRUEBAS CUTÁNEAS POSITIVAS A Anisakis simplex EN EL GRUPO DE PACIENTES Número 9 23 27 30 31 40 43 46 47 54 61 64 70 71 73 75 Prick test alergenos Prick test alergenos Prick test CAP inhalantes alimentarios Anisakis Anisakis D. pteronyssinus, D. NEGATIVO D. pteronyssinus, D. NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO D. pteronyssinus, D. NEGATIVO D. pteronyssinus, D. pteronyssinus, D. NEGATIVO Trigo, Almendra NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO Almendra NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO NEGATIVO Gamba NEGATIVO POSITIVO POSITIVO NEGATIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO POSITIVO NEGATIVO 1,73 0,70 0,58 9,76 35,40 4,34 5,21 0,49 1,42 0,52 27,50 0,47 2,94 1,64 13,50 1,31 93 MENU SALIR 5.2- GRUPO DE CONTROLES. En el grupo de controles, tres pacientes (números 22, 17 y 49) tuvieron valores positivos de IgE específica a Anisakis simplex. Esto supone una prevalencia del 3.94% en esta serie. Los tres pacientes, eran atópicos, con pruebas cutáneas positivas a otros alergenos inhalantes (Tablas XIX y XX). TABLA XIX. IgE ESPECÍFICA POSITIVA A Anisakis simplex EN EL GRUPO DE CONTROLES. Número Prick test Prick test Prick test alergenos alergenos Anisakis inhalantes alimentarios simplex CAP CAP CAP CAP Anisakis marisco pescado pescado azul simplex (gamba) blanco (atún) (bacalao) 22 Chenopodiu NEGATIVO POSITIVO 0,89 0,35 0,35 0,35 NEGATIVO POSITIVO 1,23 0,35 0,35 0,35 NEGATIVO POSITIVO 0,79 0,35 0,35 0,35 m Parietaria, Gramíneas 17 Artemisia, Chenopodiu mPlantago, Parietaria 49 D. pteronyssinu s D. farinae 94 MENU SALIR TABLA XX. ESTADÍSTICA DESCRIPTIVA DE LA DETERMINACIÓN DE IgE ESPECÍFICA A Anisakis simplex EN EL GRUPO DE CONTROLES. N 76 Media 0,3745 Mediana 0,3500 Moda 0,35 Desviación típica 0,1272 Asimetría 5,544 Error típico de asimetría 0,276 Curtosis 31,943 Error típico de curtosis 0,545 Valor mínimo 0,35 Valor máximo 1,23 6. -DETERMINACIÓN IgE TOTAL. Los resultados de la determinación de IgE total en el grupo de pacientes, se muestran en la Tabla XXI. La media fue de 167.3 UI/ml, desviación típica 330.39, con un valor mínimo de 27 UI/ml y máximo de 2.500 UI/ml. En el grupo de pacientes sensibilizados a Anisakis simplex, la media fue de 441.5 UI/ml, con una desviación típica de 639.53. En este grupo de pacientes, 5 de ellos (31.25%), tuvieron valores normales de IgE total. En el grupo de pacientes no sensibilizados, la media fue de 94.2 UI/ml, con una desviación típica de 94.64. 95 MENU SALIR TABLA XXI. DETERMINACIÓN IgE TOTAL EN EL GRUPO DE PACIENTES. Número IgE CAP Número total Anisakis 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 34 55 103 45 33 33 89 227 778 34 34 33 73 247 33 33 146 34 33 94 38 34 403 33 48 33 158 91 33 82 129 33 37 82 100 57 111 53 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 1,73 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,70 < 0,35 < 0,35 < 0,35 0,58 < 0,35 < 0,35 9,76 35,40 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 IgE CAP total Anisakis 101 172 96 27 38 50 74 27 52 27 311 457 199 179 67 63 229 51 112 266 56 62 133 54 91 846 457 133 37 30 117 386 2500 30 1110 113 187 30 < 0,35 4,34 < 0,35 < 0,35 5,21 < 0,35 < 0,35 0,49 1,42 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 0,52 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 27,50 < 0,35 < 0,35 0,47 < 0,35 < 0,35 < 0,35 < 0,35 < 0,35 2,94 1,64 < 0,35 13,50 < 0,35 1,31 < 0,35 96 MENU SALIR 7. -ELECTROFORESIS EN GEL DE POLIACRILAMIDA EN PRESENCIA DE DODECIL SULFATO SÓDICO (SDS-PAGE) E INMUNOBLOTTING. 7.1 - SDS-PAGE. En la Figura 14, se muestra el perfil electroforético de las proteínas presentes en el extracto de Anisakis simplex tras tinción con azul de Coomassie. Figura 14. SDS-PAGE del extracto de Anisakis simplex. Calle 1: Extracto de Anisakis simplex en condiciones no reductoras (sin βmercaptoetanol) y sin hervir. Calle 2: Extracto de Anisakis simplex en condiciones reductoras (en presencia de β-mercaptoetanol). M: Patrón de masas moleculares. 97 MENU SALIR El cálculo de los pesos moleculares de las bandas obtenidas, se realizó por análisis de imagen mediante el sistema Bio-Image (Millipore) y los resultados se muestran en la tabla XXII. TABLA XXII. RESULTADOS DEL SDS-PAGE. CALLE BANDA TAMAÑO(Da) 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 77.645 68.480 59.509 55.961 52.625 47.570 42.788 41.133 38.012 31.284 27.221 24.986 23.911 21.496 17.246 16.253 14.907 2 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 112.471 104.238 94.861 79.795 67.367 59.771 55.472 51.936 46.130 42.369 40.629 37.639 35.476 34.527 33.110 30.977 29.586 27.923 26.598 24.986 23.966 22.724 20.571 18.119 98 MENU SALIR CALLE M 25 26 BANDA 27 28 1 2 3 4 5 6 16.742 15.586 TAMAÑO(Da) 14.797 13.145 94.000 67.000 43.000 30.000 20.100 14.400 7.2. SDS-PAGE INMUNOBLOTTING. MUESTRA EN CONDICIONES REDUCTORAS. En la figura 15 (página siguiente) se muestra el resultado del SDS-PAGE Inmunoblotting del extracto de Anisakis simplex tras ser incubado con el suero de los pacientes. Se realizó en condiciones reductoras (el tampón de la muestra llevaba βmercaptoetanol) y la muestra se hirvió 5 minutos antes de someterla al proceso de electroforesis. 99 MENU SALIR Figura 15. SDS-PAGE INMUNOBLOTTING. MUESTRA EN CONDICIONES REDUCTORAS. Calle 1: Paciente Nº 47; Calle 2: Paciente Nº 75; Calle 3: Paciente Nº 31; Calle 4: Paciente Nº 64; Calle 5: Paciente Nº 9; Calle 6: Paciente Nº 61; Calle 7: Paciente Nº 43; Calle 8: Paciente Nº 46; Calle 9: Paciente Nº71; Calle 10: Paciente Nº54; Calle 11: Paciente Nº30; Calle 12: Paciente Nº 23; Calle 13: Paciente Nº 73; Calle 14: Paciente Nº 70; Calle 15: Paciente Nº 40. C: Pool sueros personas no alérgicas; M: patrón de pesos M. 100 MENU SALIR El cálculo de los pesos moleculares de las bandas obtenidas, se realizó por análisis de imagen mediante el sistema Bio-Image (Millipore) y los resultados se muestran en la tabla XXIII. TABLA XXIII. RESULTADOS DEL SDS-PAGE-INMUNOBLOTTING. MUESTRA EN CONDICIONES REDUCTORAS. CALLE BANDA TAMAÑO (Da) 3 1 2 3 4 5 6 7 8 9 62.059 39.113 35.005 31.669 25.128 24.053 22.656 21.988 18.409 6 1 2 3 4 5 6 7 8 9 10 11 12 13 14 66.462 62.562 56.109 49.517 40.078 34.628 31.927 28.323 26.739 25.419 24.108 21.988 18.781 16.827 7 1 2 3 4 5 6 7 34.910 28.388 25.244 23.777 22.038 19.861 18.336 8 1 23.723 9 1 2 4 5 29.794 25.360 21.242 18.781 11 1 37.253 101 MENU SALIR CALLE BANDA 2 3 4 5 6 TAMAÑO (Da) 34.910 32.187 25.831 23.777 22.448 12 1 25.360 13 1 2 3 4 37.153 35.868 29.657 28.783 14 1 2 3 4 5 6 61.810 57.252 35.482 32.892 25.951 24.275 C 1 2 3 38.797 37.354 22.656 M 1 2 3 4 5 6 94.000 67.000 43.000 30.000 20.100 14.400 7.3. SDS-PAGE INMUNOBLOTTING. MUESTRA EN CONDICIONES NO REDUCTORAS. En la figura 16 se muestra el resultado del SDS-PAGE Inmunoblotting del extracto de Anisakis simplex tras ser incubado con el suero de los pacientes en condiciones no reductoras (el tampón de la muestra no llevaba β-mercaptoetanol) y sin hervir antes de someterla al proceso de electroforesis. 102 MENU SALIR Figura 16. SDS-PAGE INMUNOBLOTTING. MUESTRA EN CONDICIONES NO REDUCTORAS. Calle 1: Paciente Nº 47; Calle 2: Paciente Nº 75; Calle 3: Paciente Nº 31; Calle 4: Paciente Nº 64; Calle 5: Paciente Nº 9; Calle 6: Paciente Nº 61; Calle 7: Paciente Nº 43; Calle 8: Paciente Nº 46; Calle 9: Paciente Nº71; Calle 10: Paciente Nº54; Calle 11: Paciente Nº30; Calle 12: Paciente Nº 23; Calle 13: Paciente Nº 73; Calle 14: Paciente Nº 70; Calle 15: Paciente Nº 40. C: Pool sueros personas no alérgicas; M: patrón de pesos M. 103 MENU SALIR El cálculo de los pesos moleculares de las bandas obtenidas, se realizó por análisis de imagen mediante el sistema Bio-Image (Millipore) y los resultados se muestran en la tabla XXIV. TABLA XXIV. RESULTADOS DEL SDS-PAGE-INMUNOBLOTTING. MUESTRA EN CONDICIONES NO REDUCTORAS. CALLE 1 BANDA 1 2 3 4 5 6 TAMAÑO (Da) 57.226 53.675 46.757 38.586 35.745 27.489 2 1 88.772 3 1 2 3 4 53.940 49.362 44.950 38.709 4 1 2 3 4 5 6 7 8 9 74.767 55.833 42.863 39.582 36.319 33.969 28.195 26.875 18.831 5 1 2 3 4 47.688 38.709 28.195 15.409 6 1 2 3 4 5 6 7 69.938 60.712 51.855 49.606 31.070 27.411 18.273 7 1 2 3 4 5 6 7 8 84.637 78.419 73.355 64.410 53.411 50.097 44.509 26.649 104 MENU SALIR CALLE BANDA TAMAÑO (Da) 9 24.556 10 23.079 11 19.455 8 1 2 3 38.832 26.202 24.695 9 1 2 3 4 5 6 7 8 9 10 53.675 46.299 39.456 35.974 33.114 30.482 27.722 23.014 21.629 17.034 10 1 2 3 4 5 6 7 85.042 70.609 51.855 41.124 38.463 35.293 26.875 11 1 2 3 4 5 6 7 8 71.968 66.017 46.757 40.863 37.257 34.957 27.180 25.690 12 1 2 3 4 5 6 7 8 9 77.675 61.616 51.600 42.456 40.346 36.902 35.745 31.974 27.411 13 1 2 3 4 51.600 38.463 32.799 31.368 14 1 2 3 4 105.943 90.051 80.312 73.355 105 MENU SALIR CALLE BANDA 5 6 7 8 9 10 11 12 13 14 15 TAMAÑO (Da) 67.320 57.509 51.600 46.988 41.255 30.677 27.958 26.128 23.605 19.602 16.696 15 1 2 55.286 35.745 C 1 2 3 4 5 6 7 8 48.878 46.299 43.000 39.582 36.319 33.861 32.178 26.276 M 1 2 3 4 5 6 94.000 67.000 43.000 30.000 20.100 14.400 14 106 MENU SALIR 8. -EVOLUCIÓN CLÍNICA DE LOS PACIENTES SENSIBILIZADOS A Anisakis simplex. Las características clínicas de los 16 pacientes sensibilizados a Anisakis simplex, se muestran en la tabla XXV. 13 pacientes (10 mujeres, 3 hombres) referían clínica de urticaria recidivante y 3 (2 hombres, 1 mujer) de urticaria y angioedema recidivante. La edad media de estos pacientes era de 37.6 años; 4 vivían en Málaga capital y 12 en la provincia. Los resultados de hematimetría, fórmula y recuento, velocidad de sedimentación globular, bioquímica, complemento, dosificación inmunoglobulinas (IgG, IgA, IgM), marcadores hepáticos (VHB, VHC), serología reumática, anticuerpos antinucleares, Orina (standard y sedimento), parásitos en heces y Radiografía de tórax, fueron normales en todos ellos. 6 pacientes relacionaban todos sus episodios con la ingesta previa de pescado; 7 de ellos los relacionaban a veces y 3 no lo relacionaban o no estaban seguros. Tras instauración de dieta exenta de todo tipo de pescado y revisión posterior a los seis meses, sólo en cuatro pacientes (Nº 30, Nº 31, Nº 40 y Nº 61) habían desaparecido los síntomas. Las pruebas cutáneas, se negativizaron en cuatro pacientes (Nº 23, Nº 46, Nº 47, Nº 64) permaneciendo positivas en el resto. La paciente Nº 27, no pudo revisarse por motivos laborales. 107 MENU SALIR TABLA XXV. CARACTERÍSTICAS CLÍNICAS DE LOS PACIENTES SENSIBILIZADOS A Anisakis simplex. Paciente 9 Sexo H Edad Domicilio 46 Marbella Clínica Urt.Ang. 2 1 Ingesta Sí (Lenguado, Merluza 3 Evolución 4 Negativa (Pijota), marisco) 23 27 30 31 M M M M 23 49 37 60 Nerja Benalmád VVª Málaga Urticaria Urticaria Urticaria Urticaria Sí (Calamares, Jurel y otros) Sí (Merluza, Rape) Sí (Calamares, Rosada, Sí (Pijotas, Merluza, Negativa * ---5 Positiva Positiva 40 M 27 Humillade Urticaria Rosada, Rape) 6 A veces (Sardina, Positiva Lenguado, Pintarroja) ro 7 43 46 47 54 61 64 70 M M H H H M M 34 39 36 50 51 21 48 Campillos Marbella Cártama C. S. Torremoli Málaga Málaga Urt.-Ang. Urticaria Urt.-Ang. Urticaria Urticaria Urticaria Urticaria No A veces (Jureles, Rodaballo) A veces (Jureles, No Sí (Pijotas, Merluza, Jurel) A veces (no especifica A veces (Pijota, Bacaladilla, Negativa Negativa Negativa Negativa Positiva Negativa Negativa 71 M 17 Málaga Urticaria Gallo) A veces (Sardina, Negativa 73 H 21 Ardales Urticaria Boquerones, Merluza) A veces (Calamares, Rape, Negativa Gambas) 75 M 44 Torremoli Urticaria No Negativa * La paciente 27 no acudió a revisión y no pudo seguirse evolución clínica. 1 Relación de los episodios con ingesta previa de pescado. 2 Urticaria-Angioedema. 3 Todos los episodios tienen relación con la ingesta previa de pescado. 4 Los síntomas no desaparecieron con la dieta exenta de pescado. 5 Los síntomas desaparecieron con la dieta exenta de pescado. 6 Algunos episodios tienen relación con la ingesta previa de pescado. 7 No relaciona los episodios con la ingesta previa de pescado. 108 MENU SALIR 9.- ANÁLISIS ESTADÍSTICO DE LOS RESULTADOS. Prueba de Kolmogorov-Smirnov en la muestra de pacientes N Parámetros normales a,b EDAD 76 35,4079 14,6826 ,116 ,116 -,072 1,012 ,257 Media Desviación típica Absoluta Positiva Negativa Diferencias más extremas Z de Kolmogorov-Smirnov Sig. asintót. (bilateral) a. La distribución de contraste es la Normal. b. Se han calculado a partir de los datos. Dado el valor de la prueba (0,257), podemos suponer que los datos siguen una distribución normal (Ver gráfico). p 12 10 8 6 4 Desv. típ. = 14,68 2 Media = 35,4 N = 76,00 0 15,0 25,0 20,0 35,0 30,0 45,0 40,0 55,0 50,0 65,0 60,0 70,0 EDAD 109 MENU SALIR Prueba de Kolmogorov-Smirnov en la muestra de controles N Parámetros normales a,b EDAD 76 35,9474 15,1234 ,105 ,105 -,073 ,911 ,377 Media Desviación típica Absoluta Positiva Negativa Diferencias más extremas Z de Kolmogorov-Smirnov Sig. asintót. (bilateral) a. La distribución de contraste es la Normal. b. Se han calculado a partir de los datos. Dado el valor de la prueba (0,377), podemos suponer que los datos siguen una distribución normal (Ver gráfico). g 12 10 8 6 4 Desv. típ. = 15,12 2 Media = 35,9 N = 76,00 0 15,0 25,0 20,0 35,0 30,0 45,0 40,0 55,0 50,0 65,0 60,0 70,0 EDAD 110 MENU SALIR Pruebas T Prueba de Levene para la igualdad de varianzas CAP Anisakis Se han F de Snedecor Significación 16,354 ,000 asumido varianzas iguales No se han asumido varianzas iguales Prueba T para la igualdad de medias t gl Significaci Diferencia ón de medias (bilateral) CAP Anisakis Se han 2,14 150 asumido ,033 1,3165 ,035 1,3165 7 varianzas iguales No se asumido han 2,14 75,0 7 85 varianzas iguales 111 MENU SALIR Prueba T para la igualdad de medias Error típico Intervalo de confianza de la CAP Anisakis Se para la diferencia diferencia Inferior Superior han ,6133 ,1047 2,5282 han ,6133 9,480E-02 2,5381 asumido varianzas iguales No se asumido varianzas iguales Se acepta la hipótesis alternativa de diferencias de varianzas y puesto que el valor del test es 0,035, a un nivel de significación de 0,05, se acepta la hipótesis de diferencia de medias. Tabla de contingencia. Punto de corte CAP positivo > 0,35. Anisakis + Anisakis Urticaria + Recuento 16 60 76 9,5 66,5 76,0 % del total 10,5% 39,5% 50,0% Recuento 3 73 76 9,5 66,5 76,0 % del total 2,0% 48,0% 50,0% Recuento 19 133 152 19,0 133,0 152,0 12,5% 87,5% 100,0% Frecuencia esperada Urticaria - Frecuencia esperada Total Total Frecuencia esperada % del total 112 MENU SALIR Pruebas de chi-cuadrado. Valor Chi-cuadrado 10,16 gl Significaci Significación Significación ón exacta exacta (unilateral) (bilateral) (bilateral) 1 ,001 a de Pearson 5 Corrección 8,662 1 ,003 de 11,03 1 ,001 de continuidadb Razón verosimilitud 8 Estadístico exacto ,002 ,001 de Fisher a 0 casillas (,0%) tienen una frecuencia esperada inferior a 5. La frecuencia mínima esperada es 9,50. b Calculado para una tabla de 2x2. Mediante la prueba Chi-cuadrado de Pearson, se concluye que las variables son dependientes. Medidas simétricas Nominal por nominal Phi V de Cramer N de casos válidos a N i d l hi ót i Valor ,259 ,259 152 Sig. aproximada ,001 ,001 l Con el coeficiente Phi, cuyo valor es 0.259, se observa que la asociación entre ambas variables (urticaria y CAP Anisakis positivo), es débil. 113 MENU SALIR Gráfico 10. RESULTADO DEL PROCESAMIENTO DE CASOS. PUNTO DE CORTE CAP POSITIVO > 0,35. 80 70 60 P<0,01 50 40 30 20 10 0 Urticaria + Urticaria - Anisakis + Anisakis - Tabla de contingencia. Punto de corte CAP positivo > 0,70. Anisakis + Anisakis Urticaria + Recuento 12 64 76 7,5 68,5 76,0 % del total 7,9% 42,1% 50,0% Recuento 3 73 76 7,5 68,5 76,0 % del total 2,0% 48,0% 50,0% Recuento 15 137 152 Frecuencia esperada 15,0 137,0 152,0 % del total 9,9% 90,1% 100,0% Frecuencia esperada Urticaria - Frecuencia esperada Total Total 114 MENU SALIR Pruebas de chi-cuadrado. Valor gl Significaci Significación Significación ón exacta exacta (unilateral) (bilateral) (bilateral) Chi-cuadrado 5,991a 1 ,014 de Pearson Corrección 4,734 1 ,030 de 6,374 1 ,012 de continuidadb Razón verosimilitud Estadístico exacto ,027 ,013 de Fisher a 0 casillas (,0%) tienen una frecuencia esperada inferior a 5. La frecuencia mínima esperada es 7,50. b Calculado para una tabla de 2x2. Mediante la prueba Chi-cuadrado de Pearson, se concluye que las variables son dependientes. Medidas simétricas Nominal por nominal N de casos válidos Phi V de Cramer Valor ,199 ,199 152 Sig. aproximada ,014 ,014 Con el coeficiente Phi, cuyo valor es 0.199, se observa que la asociación entre ambas variables (urticaria y CAP Anisakis positivo), es débil. 115 MENU SALIR Gráfico 11. RESULTADO DEL PROCESAMIENTO DE CASOS. PUNTO DE CORTE CAP POSITIVO > 0,70. 80 70 60 P < 0,05 50 40 30 20 10 0 Urticaria + Anisakis + Urticaria Anisakis - 116 MENU SALIR DISCUSIÓN 117 MENU SALIR 1. -ESTUDIO DE PARASITACIÓN DE LOS PESCADOS POR Anisakis simplex. Como hemos revisado en este estudio, Anisakis simplex está presente en multitud de peces teleósteos y cefalópodos (calamares) en mares de todo el mundo, especialmente en aquéllos de aguas más frías. El ser humano es un hospedador accidental al consumir dichos hospedadores paraténicos; si los consume crudos o poco cocinados (sin alcanzar 60º C de cocción durante 10 minutos) puede infestarse y padecer la Anisakidosis; si los consume cocinados puede evitar la parasitosis, pero puede padecer síndromes de hipersensibilidad. España, es el tercer consumidor mundial de pescado, estimándose un consumo medio de 85 gramos de pescado por persona y día117, después de Portugal (92 gramos por persona y día) y a mucha distancia de Japón (239 gramos por persona y día) que son los primeros consumidores del mundo. En este país, la anisakidosis constituye un problema de salud pública, dada la ancestral costumbre de consumir pescado crudo en la dieta diaria. En nuestro país, a pesar consumirse pescado crudo o semicrudo con relativa frecuencia (boquerones en vinagre, anchoas), sólo se han publicado 22 casos de anisakidosis hasta la fecha8, 118, 119, 120, 121, 122, 123, 124, 125, 126 . Es posible que más casos de anisakidosis pasen desapercibidos, sobre todo porque el diagnóstico precoz requiere la realización de endoscopia urgente, práctica poco habitual en nuestros hospitales ante un abdomen agudo. Tampoco es frecuente incluir en la historia clínica de urgencias preguntas sobre el hábito de consumo de pescado del paciente, que sería orientativo para el clínico. En resumen, no se piensa en la anisakidosis a la hora de hacer un diagnóstico diferencial en el abdomen agudo o epigastralagia. Por otra parte, parece que está aumentando el número de casos de anisakidosis en nuestro país últimamente; Olveira y colaboradores126, del Servicio de Digestivo del Hospital La Paz, Madrid, han publicado siete casos de anisakidosis (5 gástricas, 2 intestinales) diagnosticadas en un período de tiempo muy corto (durante el otoño de 1996). 4 de los cinco casos de anisakidosis gástrica, fueron diagnosticados por endoscopia de urgencia, por lo que cabe pensar que están aumentando los casos de anisakidosis porque se están diagnosticando más. 118 MENU SALIR En cuanto a la prevalencia de parasitación por Anisakis simplex en los pescados y cefalópodos de consumo humano, se han hecho multitud de estudios en diferentes países. .Son los autores japoneses los que más experiencia tienen desde hace treinta años en el manejo de la anisakidosis, habiendo realizado multitud de estudios de parasitación de pescados. Inicialmente, Kagei en 1970 y 1974 listó más de 120 especies de pescados como hospedadores paraténicos de Anisakis simplex, capturados en aguas japonesas127, 128 . Huang en 1988, analizó 1169 ejemplares de 10 especies diferentes procedentes de mercados de París129, encontrando una prevalencia de infestación del 82% en arenques, 71% en bacaladillas, 88% en merluza, 30% en caballas, 4% en sardinas y 3% en boquerones. En 1989, Deardoff en Washington, examinó 50 ejemplares de salmón encontrando una prevalencia de infestación del 100Posteriormente, en 1990, Nagasawa concluye que la mayor prevalencia de parasitación se presenta en la caballa del pacífico (Scomber japonicus), y jurel del pacífico (Trachurus japonicus), pero que la prevalencia variaba según la procedencia; así, en la provincia de Kanazawa, la prevalencia de infestación de la caballa era del 100%, pero disminuía al 28% en las muestras recogidas en la provincia de Seto130. También han observado que la parasitación de las especies es variable año tras año; así por ejemplo, hay grandes variaciones en la infestación del calamar común japonés (Todarodes pacificus) que se encuentra parasitado con relativa frecuencia (un 30% de las muestras), de forma que en 1987 no se encontró ningún ejemplar parasitado en los muestreos que realiza el Instituto Nacional de Investigación de Pesca Japonés130. Estas variaciones son debidas a las complejas interacciones entre los hospedadores paraténicos y los intermediarios, que como se ha descrito en este trabajo son fundamentalmente los crustáceos eufausiidos que forman el krill oceánico y son muy sensibles a los cambios de temperatura del océano. En Europa, Smith es uno de los investigadores que más ha estudiado al parásito Anisakis simplex y sus hospedadores22, 31, 32, siendo el único autor que ha estudiado el papel de los cefalópodos, sobre todo calamares, en el ciclo vital del parásito, encontrando Anisakis simplex en 4 especies (Todarodes saggittatus, 119 MENU SALIR Todaropsis eblane, Lóligo forbesi y Allotheuthis media) en aguas del mar del Norte y Escocia131. También se han recogido muestras de peces infestadas por Anisakis simplex en el Océano Antártico132, Mar de Bohai (China)133, Canadá134, Korea135, Kuwait136, Italia137, Chile138, Península de Yucatán (México)139, Argentina140, Golfo de Tongking (Este de China)141, Mar de Okhotsk y Bering (Rusia)142, Namibia143, Islandia144 y Noruega145. En nuestro país, hay muy pocos estudios de infestación de pescados por Anisakis simplex. El estudio más amplio corresponde a Sanmartín y colaboradores (1989) del Departamento de Parasitología de la Universidad de Santiago de Compostela, que analizaron 1435 muestras de peces procedentes de las Rías de Muros y Arosa, investigando la presencia de todo tipo de nematodos parásitos146. Desgraciadamente, entre las especies estudiadas no figuraban la merluza, el boquerón o el calamar, importantes especies de consumo en nuestro país y susceptibles de estar infestadas por Anisakis simplex. Posteriormente, estos estudios fueron recogidos en un libro publicado en 199415. En este mismo año, aparece publicado un trabajo en una revista no indexada (Alimentaria) firmado por López Giménez y Castell Monsalve, del Servicio de Salud de Castilla La Mancha, en la que investigan específicamente la presencia de Anisakis simplex en 410 muestras de 20 especies diferentes recogidas en las cinco capitales de provincia de la Comunidad de Castilla La Mancha durante el período de un año147. Posteriormente, en 1996, Adroher y colaboradores, del Departamento de Parasitología de la Universidad de Granada, publican un interesante trabajo de parasitación por larvas de Anisákidos (Anisakis simplex e Hysterothylacium sp.) en 360 muestras de jureles (Trachurus trachurus)148 . En nuestro estudio, se han analizado 475 muestras de ocho especies de gran consumo en nuestra área, y hemos encontrado una prevalencia de parasitación en 120 MENU SALIR conjunto por Anisakis simplex del 27.2%, porcentaje muy similar al encontrado por López Giménez en su estudio (22.9%). Sanmartín, sin embargo, no ofrece este dato de conjunto en su estudio, ya que lo analiza por especie. En la tabla XXIV, resumimos estos datos, comparando nuestros resultados con los obtenidos por Huang, Sanmartín, López Giménez y Adroher. TABLA XXVI COMPARACIÓN DE RESULTADOS DE ESTUDIOS DE PARASITACIÓN DE PESCADOS POR Anisakis simplex.a Autor Ref. N Merluza Bacaladilla Caballa Huang 125 1169 88 Boquerón Jurel 3 NEb 71 30 Sardina Rape 4 NE Calamar NE Sanmartín # 15 497 NE NE 44 63 NE NE NE NE Sanmartín ## 15 938 NE NE 67 70 48 10 78 NE López 145 410 23 0 42 29 32 0 NE NE Adroher 146 360 NE NE 26 NE NE NE NE NE Nuestro -- 475 52 0 40 75 38 4 70 0 Giménez estudio N: Número de muestras estudiadas. a Resultados expresados en prevalencia de parasitación (Nº muestras parasitadas / Nº muestras totales x 100). b No estudiado # Muestras procedentes de la Ría de Muros. ## Muestras procedentes de la Ría de Arosa. Analizando estos resultados, habría que hacer algunas consideraciones. En cuanto a la merluza, nosotros hemos analizado ejemplares pequeños (pijotas) que son los que se consumen en nuestra zona, mientras que Huang y López Giménez analizan ejemplares adultos. Las tasas de parasitación del jurel, son muy parecidas en las diferentes series; Adroher obtiene sólo un 26% de parasitación en esta especie, pero si analizamos la procedencia, encuentra un 49.5% de parasitación en las muestras provenientes del mar Cantábrico. 121 MENU SALIR En cuanto a la bacaladilla, nosotros hemos obtenido la prevalencia de parasitación más alta: un 75%; resultados similares a los obtenidos por Huang (71%) y SanMartín (63% y 70%). Igual sucede con la caballa, en la que obtenemos un 38% de parasitación, similar al 30% de Huang, 48% de Sanmartín ó 32% de López Giménez. Además, en esta especie es donde hemos observado una mayor intensidad de parasitación, con una media de 11.3 parásitos por ejemplar parasitado, resultado muy similar al obtenido por Sanmartín, con 10 parásitos de media por ejemplar parasitado. (El resto de los autores, no ofrece este dato). Como anécdota, en un ejemplar de esta especie encontramos 28 parásitos, el mayor número de todos los observados. En rape, encontramos una alta parasitación (70%) similar al 75% encontrado por Sanmartín. Para este autor, es el hospedador paraténico con mayor índice de infestación de los analizados por él, y lo explica porque el rape es un pez muy voraz que se alimenta de eufausiidos y sobre todo de otros hospedadores paraténicos más pequeños, como el abadejo pequeño (que él estudia y encuentra una prevalencia de parasitación del 75%) y la bacaladilla, igualmente infestada por Anisakis simplex. La sardina, parece tener una baja prevalencia de infestación (4% Huang, 10% Sanmartín, 0% López Giménez, 4% nuestra serie), pero que ha sido implicada en tres casos de anisakidosis en nuestro país118. El calamar, hospedador paraténico de Anisakis simplex como hemos comentado, no ha sido analizado por ningún autor español, y nosotros no hemos encontrado ningún parásito en los 22 ejemplares analizados. Mención aparte merece el boquerón (Engraulis encrachisolus). Es el pez que con mayor frecuencia se consume crudo o semicrudo en nuestro país y concretamente en nuestra zona, los boquerones en vinagre son un plato rutinario en hogares y restaurantes Malagueños. Asimismo, se ha implicado en la etiología de varios casos de anisakidosis124, 125 como de hipersensibilidad59, 65 en nuestro país. En nuestra serie, 2 de los 16 pacientes sensibilizados a Anisakis simplex relacionan la ingesta de boquerones con episodios de urticaria y/o angioedema. Sin embargo y de forma sorprendente, no hemos encontrado ningún parásito de Anisakis simplex en las 167 muestras de boquerones analizadas. Tampoco encontró ningún ejemplar parasitado López Giménez en su estudio y Huang encontraba sólo un 3% de infestados. 122 MENU SALIR Revisando la literatura, sólo encontramos un estudio de prevalencia de infestación por Anisakis simplex en boquerones, realizado por Song y colaboradores del departamento de Parasitología de la Universidad de Pusan, Corea, en 1995. Estos autores estudiaron 2.180 ejemplares de boquerón del pacífico (Engraulis japonica) encontrando una prevalencia de parasitación del 6.9%, no encontrando relación con el tamaño de las muestras149. Nuestros resultados al igual que los obtenidos por López Giménez, pueden estar subestimados, dado que no se hicieron estudios de digestión muscular para investigar la presencia del parásito en este tejido. Este método, fue realizado por Sanmartín en algunas muestras de su estudio usando la técnica de McGladdery150 y aunque pueden obtenerse hasta un 10% más de parásitos, todas las muestras musculares parasitadas provenían de peces en los que se encontraron parásitos a nivel visceral o peritoneal. Es decir, el análisis del tejido muscular incide en la intensidad de parasitación pero no en la prevalencia de parasitación. Este hecho, unido a la laboriosidad de la técnica, hace que el método de elección en los estudios parasitológicos, sea la disección. Por otro lado, nuestras muestras de boquerones se seleccionaron, estudiándose sólo las que procedían del Mar Mediterráneo. En este sentido, Adroher en su estudio con jureles, mostró que la prevalencia de parasitación de jureles procedentes del Mediterráneo, era sólo del 6.3%, frente al 49.5% de los procedentes del Mar Cantábrico148. También, inicialmente Kagei en 1974, mostró como el grado de parasitación de los hospedadores intermediarios (eufausiidos) descendía a medida que descendía la latitud y aumentaba la temperatura del agua27. En cuanto a las variaciones estacionales en la intensidad de parasitación por Anisakis simplex, aún cuando no se ha podido hacer estudio estadístico (test ANOVA) porque se necesitaría un mayor número de muestras, no se han observado variaciones importantes. No obstante, como se puede observar en el gráfico 8 de la página 90, hay niveles máximos en cuatro de las cinco especies más parasitadas en el mes de junio. También es curioso observar como el rape, pijota y jurel, siguen líneas paralelas de parasitación, dándose la circunstancia que dichas especie son piscívoras, mientras que la caballa y la bacaladilla que se alimentan fundamentalmente de eufausiidos, siguen líneas divergentes. 123 MENU SALIR 2. -ESTUDIO DE SENSIBILIZACIÓN AL PARÁSITO Anisakis simplex EN EL GRUPO DE PACIENTES. En este trabajo, hemos estudiado la prevalencia de sensibilización en un grupo de pacientes con clínica de urticaria y/o angioedema recidivante idiopático. Durante el período de estudio, se atendieron en la consulta externa de Alergología del Centro de Especialidades un total de 2.256 pacientes de primera visita. De éstos, 302 consultaron por síntomas cutáneos (urticaria, angioedema, eczema) lo que supone un 13.38% del total. Los episodios de urticaria y/o angioedema, son un motivo de consulta frecuente en clínica alergológica, siendo raro que el paciente lo asocie con algún desencadenante específico. El protocolo de estudio (alergológico, búsqueda de enfermedades autoinmunes, infecciosas, endocrinológicas, etc.) suele ser negativo, por lo que el paciente recibe el diagnóstico de urticaria-angioedema recidivante idiopático. Durante 1995-96, con la publicación de autores españoles del Hospital Santiago Apóstol de Vitoria de diversos trabajos de sensibilización al parásito Anisakis simplex59, 60, 151 , se observó que casi todos los pacientes presentaban clínica de urticaria-angioedema, casi siempre recidivante, por lo que se abrió una vía de investigación en esta patología. Por este motivo, diseñamos la metodología de este trabajo con estos pacientes que consumiesen pescado de forma habitual, establecido de al menos una vez a la semana. Los hábitos de consumo de pescado en este grupo, resultaron muy similares a los que previamente se habían descrito en nuestra zona mediante encuestas realizadas en pacientes atópicos que acudían a nuestra Sección por diferentes motivos152. Asimismo, son similares a los descritos en otras zonas geográficas de nuestro país153, y se puede afirmar que entre el 95% y el 98% de nuestra población consume pescado de forma habitual. En cuanto a la ingesta de pescado semicrudo (fundamentalmente boquerones en vinagre) en nuestro estudio es del 68% (62% en el grupo control), similar al 63% descrito por Barceló152 ó al 68% descrito por López Sáez en Madrid153. 124 MENU SALIR En el grupo de 76 pacientes incluidos en nuestro estudio, 14 (18.4%) tuvieron pruebas cutáneas positivas con Anisakis simplex y la determinación de IgE específica (CAP-FEIA), fue positiva en 16 (21.05%). Esta prevalencia de sensibilización en pacientes con clínica de urticaria-angioedema recidivante, es inferior a otras series publicadas: 43.8%154, 76%63, ó 45%153. En el grupo control (sujetos sin clínica de urticaria y consumo habitual de pescado), se encuentran 3 pacientes (3.94%) con sensibilización a Anisakis simplex en pruebas cutáneas y CAP. Los tres pacientes eran atópicos con sensibilización a pólenes en dos de ellos y a ácaros del polvo doméstico en el tercero. Esta prevalencia de sensibilización es llamativamente baja, teniendo en cuenta que el 42% del grupo eran atópicos. No obstante, en un estudio previo de prevalencia de sensibilización a Anisakis simplex en un grupo de 103 pacientes atópicos realizado por nuestro grupo152, mostró un resultado sorprendente: ningún paciente (0%) mostró sensibilización al parásito. Estos resultados de nuestra zona geográfica, contrastan enormemente con otros estudios de prevalencia en población atópica, en el que se encontraban positividades en el 56%155. En población general, hay un estudio realizado in vitro con técnica de ELISA sobre 1.008 sueros156, ofreciendo una prevalencia de sensibilización a Anisakis simplex del 6%, aunque otros autores, en la zona geográfica del País Vasco y con método de CAP, encuentran una prevalencia del 27.4% en un grupo de 51 sueros obtenidos del banco de sangre de su Hospital99. Aunque es difícil comparar estos resultados porque la metodología diagnóstica es diferente, sí llama la atención la baja prevalencia de sensibilización en nuestra zona geográfica con respecto a otras, sobre todo del norte del país. En Japón, por otro lado, la prevalencia de sensibilización en población sana ha mostrado ser del 63%157. La diferencia de sensibilización encontradas entre ambos grupos en nuestro estudio (urticaria positivo-urticaria negativo), es estadísticamente significativa, o dicho de otro modo, la probabilidad de que dichas diferencias sean debidas al azar es p< 0.01. Si establecemos el punto de corte del CAP en 0,70 KU/l, diferencias de sensibilización también son significativas (p< 0.05). 125 las MENU SALIR La edad media de los pacientes sensibilizados a Anisakis simplex, ha sido de 37.6 años. Este hecho, ha sido constatado previamente en varias publicaciones, en la que la edad media de pacientes sensibilizados a Anisakis simplex estaría alrededor de los 40 años59, 60, 65 ; en otra serie es aún mayor: 53 años64. Este hecho, es muy llamativo si consideramos Anisakis simplex un alimento (o alimento oculto dentro del pescado), ya que la alergia a proteínas del pescado es más frecuente en edades tempranas de la vida158. Las pruebas cutáneas se realizaron con el único extracto comercial disponible en la fecha de realización del trabajo ( Laboratorios International Pharmaceutial Immunology). Comparando los resultados obtenidos con la determinación de IgE específica por CAP, vemos que 2 de los 16 pacientes con CAP positivo, tienen pruebas cutáneas negativas (12.5%). Nuestros resultados coinciden con los obtenidos por otros autores que, usando el mismo extracto comercial, tienen también diferentes porcentajes de falsos negativos: 23% (Montoro63), 13% (Moreno Ancillo65) o el 26% (López Sáez153). Otros autores usando un extracto de fabricación propia, obtuvieron una concordancia diagnóstica del 100% con respecto a los resultados del CAP59, 60 . Así, a la vista de estos resultados, podemos afirmar que las pruebas cutáneas (usando el extracto comercial descrito), son menos sensibles que el CAP; probablemente la identificación de las proteínas alergénicas de Anisakis simplex, mejoraría la calidad del mismo. El valor medio del CAP en nuestro grupo de pacientes sensibilizados, fue de 6.71 kU/l, con un valor máximo de 35.40 kU/l (Clase 4), valor también inferior a los publicados en otras series (17.022 kU/l65, 57 kU/l59, 15 kU/l64 o 11.5 kU/l153). Se ha descrito la existencia de reactividad cruzada entre Anisakis simplex, Ascaris, y Echinococcus159. Esta reactividad cruzada de la familia Ascaridoidea, parece deberse a una proteína de 14 kDa, perteneciente a un grupo de antígenos muy importante en los nematodos, llamados poliproteínas alergénicas de nematodos (NPA)160. En nuestro estudio, 6 pacientes (37.5%) presentaron CAP positivo a Ascaris, y dos de ellos además a Echinococcus, con un valor medio de 6.75 kU/l. El valor 126 MENU SALIR más alto, correspondió al paciente 73, con 31.20 kU/l, que curiosamente, es un paciente que no presentó un patrón típico de Inmunoblotting, como describiremos más adelante. La reactividad cruzada con Ascaris ha sido descrita en otras series publicadas de pacientes sensibilizados a Anisakis simplex con diferentes resultados: 36.3% (Ardusso Lovera161), 43.4% (Moreno Ancillo65), 8% (Montoro63), 26.3% (López Sáez153) e incluso el 100% (Audícana59). Ardusso Lovera, estudió específicamente la reactividad cruzada de Anisakis simplex, Ascaris y Echinococcus, mediante inhibición del CAP, en sueros de 11 pacientes con diagnóstico de alergia a Anisakis simplex. Encontró un porcentaje de inhibición del CAP a Echinococcus con extracto de a Anisakis simplex, que oscilaba entre el 30-60%; sin embargo, observó una inhibición máxima del 20% del CAP a Ascaris con extracto de a Anisakis simplex161. Estos resultados son algo sorprendentes, ya que Echinococcus está más alejado taxonómicamente que Ascaris. También se ha demostrado reactividad cruzada in vitro de Anisakis simplex con Hysterothylacium aduncum162, parásito frecuente del pescado, sobre todo del jurel148, pero que no produce patología en humanos, ya que es incapaz de penetrar la pared intestinal y no resiste la temperatura corporal15. La fuerte respuesta IgE a los helmintos en humanos y otros mamíferos, está bien establecida163; sin embargo, de forma sorprendente, no se producen síntomas clínicos de hipersensibilidad. Esto parece que puede deberse a las altísimas concentraciones de IgG4 específica presente en el suero de estas personas infestadas164. Así pues, por un lado la producción de estos anticuerpos IgG4 bloqueantes benefician al huésped porque evitan respuestas de hipersensibilidad que podrían ser nocivas para el mismo, pero por otro lado benefician al parásito porque evita su eliminación mediante anticuerpos IgE específicos. Tal vez por esto, los parásitos (sobre todo los helmintos) han coexistido con los mamíferos (o mejor dicho, con el sistema inmunitario de los mamíferos) en todas las etapas evolutivas de éstos165. 127 MENU SALIR Tres pacientes de nuestro grupo (18.75%) tuvieron CAP positivo a Dermatophagoides pteronyssinus (paciente 9, 1.06 kU/L; paciente 71 > 100 kU/l y paciente 73, 99.2 kU/l) y dos a proteínas de gamba (paciente 9, 5.72 kU/l y paciente 73, 92.70 kU/l). Se ha descrito reactividad cruzada entre Anisakis simplex y gamba, insectos (Blattella Dermatophagoides pteronyssinus166, germanica, Chironomus spp.) y 167 . Al parecer, este nuevo panalergeno es una tropomiosina de peso molecular de 36 kDa168. Esta reactividad cruzada, se ha demostrado in vitro mediante inhibición del CAP, viéndose una inhibición en las bandas de alrededor de 40 kDa usando sueros de 21 pacientes con CAP de Anisakis simplex mayor de 3.5 kU/l; sin embargo, en ningún caso se inhibieron bandas en la zona de 14 kDa, específica de la familia Ascaridoidea166. Asimismo, el paciente numero 73, mostró niveles elevados de IgE específica a gamba y Dermatophagoides pteronyssinus, no presentando clínica de rinitis y/o asma bronquial. Curiosamente, este paciente también presentó los niveles más altos a Ascaris y Echinococcus, lo que nos sugiere en conjunto la existencia de reactividad cruzada, aún cuando hubiese hecho falta realizar estudios de inhibición para confirmarlo. También puede ser una co-sensibilización, ya que algunos episodios de urticaria los relacionaba con la ingesta de marisco (en unión a otros pescados). Tampoco hemos de olvidar el elevado porcentaje de sujetos en nuestra zona geográfica sensibilizados a Dermatophagoides pteronyssinus sin clínica asociada; en un trabajo previo de nuestro grupo realizado en población adolescente sana, este porcentaje ascendía al 51%169. En el paciente numero 9, sucede algo parecido, aunque con valores de IgE específica inferiores; este paciente consumía marisco sin problemas y sin embargo presenta valores de 5.73 kU/l a gamba. El paciente numero 71, presenta un CAP clase 6 a Dermatophagoides pteronyssinus (>100 kU/L), pero negativo a gamba. No obstante, este paciente refería síntomas de rinitis perenne. Así pues, hay que tener en cuenta la existencia de estas reactividades cruzadas a la hora de valorar los resultados de sensibilización a Anisakis simplex. Hacen falta más estudios para identificar exactamente al alergeno responsable de esta reactividad cruzada entre estas especies no relacionadas taxonómicamente (nematodos, crustáceos, insectos). 128 MENU SALIR Respecto a la dosificación de IgE total, hemos encontrado valores medios superiores en los pacientes con CAP positivo a Anisakis simplex frente a los no sensibilizados, aunque con una enorme desviación típica. Este hallazgo, ha sido descrito por varios autores65, 153 aunque nosotros hemos encontrado niveles normales en 5 de los 16 pacientes (31%), lo que contrasta con otras descripciones clínicas en la que todos los pacientes tenían niveles de IgE total elevados59. No obstante, en adultos la dosificación de IgE total, es una herramienta diagnóstica de poca utilidad. Numerosos estudios muestran que casi el 50% de los adultos con asma bronquial y/o rinitis atópica, tienen cifras de IgE total normales170, mientras que al contrario, valores elevados sí tienen un alto valor predictivo positivo, que oscilaría entre el 80% y el 95% dependiendo del punto de corte171. Dicho de otro modo; la dosificación de IgE total presenta una baja sensibilidad (se encuentran muchos falsos negativos), pero sin embargo presenta un alta especificidad (pocos falsos positivos). Por otro lado, ninguno de nuestros pacientes presentó eosinofilia, hecho bastante característico en la infestación de este parásito, como hemos descrito en este trabajo. En 15 de los 16 pacientes, se les realizó detección de IgE específica mediante SDS-PAGE e Inmunoblotting; excepto en tres pacientes (numero 40, 73 y 75) el resto (80%) presentaron un patrón característico de hipersensibilidad a Anisakis simplex, como se ha descrito97, 99 . En nuestro estudio, las bandas proteicas fijadoras de IgE más significativas, presentaron un peso molecular de ≅ 40-33 kDa, ≅ 29-26 kDa, ≅19 kDa y ≅16 kDa, es decir, grupos de bandas de peso molecular medio y grupos de bajo peso molecular. El seguimiento clínico del grupo de pacientes sensibilizados, reveló que sólo en 4 (26.6%) de los 15 pacientes (la paciente 27 no pudo acudir a las revisiones), desaparecieron los síntomas cutáneos tras seis meses de dieta de exclusión de pescados y cefalópodos. Las pruebas cutáneas, se negativizaron en cuatro pacientes, que por otro lado, habían presentado valores bajos de IgE específica (media de 0.770 kU/l). 129 MENU SALIR Hemos estado hablando en este trabajo de sensibilización a proteínas de Anisakis simplex, es decir, a la presencia de anticuerpos IgE específicos demostrada tanto in vivo como in vitro. Pero para un clínico que valora pacientes con síntomas alergológicos, las preguntas que se hacen son: ¿Tiene este paciente alergia o hipersensibilidad a Anisakis simplex? ¿Cuál es la sensibilidad, especificidad, valor predictivo positivo o valor predictivo negativo de las pruebas que aplico?. Hasta el momento, no hay respuestas a estas preguntas. No sabemos cuál es la eficacia diagnóstica de las pruebas cutáneas a Anisakis simplex o del CAP, es decir, no sabemos la probabilidad que tiene un paciente de ser alérgico a Anisakis simplex en caso de tener pruebas cutáneas y/o CAP positivo o viceversa ( y no menos importante); no sabemos la probabilidad que no sea alérgico a Anisakis simplex en el caso que ambas pruebas sean negativas. Esto es así porque no existe un patrón de referencia diagnóstica, que en el caso que nos ocupa, si vemos al parásito Anisakis simplex como un alergeno alimentario, sería la provocación oral controlada a doble ciego con placebo. Por otro lado, como hemos comentado, la respuesta inmune a los parásitos es muy compleja, existiendo siempre una fuerte respuesta IgE. No sabemos bien las características de esta respuesta IgE; ¿Cuál es la diferencia entre la respuesta IgE de un enfermo parasitado que padece anisakidosis y la respuesta IgE de un enfermo alérgico con síntomas de urticaria o anafilaxia?. Con estas premisas, se ha publicado que para diagnosticar a un paciente de alergia o hipersensibidad a Anisakis simplex, se requerirían los siguientes criterios: a) Síntomas sugestivos IgE-mediados (urticaria y/angioedema, anafilaxia) hasta seis horas después de la ingestión de pescado. b) Pruebas cutáneas positivas a Anisakis simplex. c) IgE específica positiva a Anisakis simplex. d) Exclusión de otras causas ó alergia a proteínas del pescado. Además de esto, se ha observado que un 80% de los pacientes que cumplían los criterios anteriores, mostraban un patrón característico de Inmunoblotting, como hemos comentado, por lo que se sugirió que era una herramienta 130 MENU SALIR diagnóstica útil en el diagnóstico de hipersensibilidad a Anisakis simplex (no obstante, esta técnica es inviable en la práctica clínica diaria). Con estos criterios diagnósticos, en nuestro grupo de 16 pacientes sensibilizados, se hubieran diagnosticado de alérgicos a Anisakis simplex 12 de ellos, pero sin embargo, siguiendo su evolución clínica, sólo 4 respondieron a la dieta de exclusión. Además, uno de estos cuatro pacientes (numero 40), no tenía un patrón de inmunoblotting característico de hipersensibilidad a Anisakis simplex. Por lo tanto, según nuestro parecer, a los criterios diagnósticos descritos, habría que añadir uno más: resolución de los síntomas con la dieta de eliminación. Consideramos que con Anisakis simplex ocurriría lo mismo que con otros alergenos alimentarios, es decir, la existencia de pacientes adultos sensibilizados a determinados alimentos, pero que lo toleran sin problemas. La dificultad con Anisakis simplex estriba en que el paciente no puede discriminar si lo está ingiriendo o no, por lo que la historia clínica no es útil en este caso. Por lo tanto, el único camino posible es una dieta de exclusión rigurosa, exenta de todo tipo de pescado y cefalópodos y observar la evolución clínica del paciente. Anisakis simplex debe considerarse un nuevo alergeno alimentario, con una prevalencia de sensibilización mayor que otros alimentos en la población adulta, por lo que debería probarse de forma rutinaria en todos los pacientes con clínica de urticaria/angioedema o anafilaxia y que consuman pescado de forma habitual. Hay que insistir en la relación de los episodios con la ingesta previa de pescado o cefalópodos ya que los síntomas clínicos pueden aparecer hasta seis horas después. En resumen, hemos descrito una aproximación parasitológica y clínica al problema de Anisakis simplex en nuestra zona geográfica. Nuestro estudio de prevalencia de infestación por Anisakis simplex en las especies de pescado de consumo más frecuente es el primero efectuado en el sur de Europa. Estas observaciones preliminares indican que Anisakis simplex existe en los pescados de consumo más frecuente de nuestro medio y que existen pacientes sensibilizados al parásito, aunque parece que esta prevalencia de sensibilización 131 MENU SALIR es menor que en otras zonas geográficas de nuestro país. Hacen falta estudios más amplios que den información sobre la verdadera prevalencia de sensibilización a Anisakis simplex y sobre las características del alergeno responsable, como el estudio multicéntrico que actualmente está en marcha bajo la dirección de la SEAIC. 132 MENU SALIR CONCLUSIONES 133 MENU SALIR 1.- Se han encontrado parásitos de Anisakis simplex en el 27.2 % de las especies de pescado estudiadas. 2.- Las tres especies de pescado más parasitadas han sido la bacaladilla, rape y pijota. 3.- La mayor intensidad de parasitación, se ha observado en la caballa. 4.- En cuatro especies, la intensidad media de parasitación más elevada se ha observado en el mes de junio. 5.- No se han encontrado parásitos en boquerón y calamar. 6.- La prevalencia de sensibilización a Anisakis simplex en el grupo de pacientes estudiados ha sido del 21%, frente al 3.9% en el grupo control. 7.- La diferencia de sensibilización entre ambos grupos ha sido estadísticamente significativa. 8.- La edad media del grupo sensibilizado, ha sido de 37.6 años. 9.- La sensibilidad del CAP se ha mostrado superior a las pruebas cutáneas, usando el extracto descrito en el trabajo. 10.- Debe tenerse en cuenta la existencia de reactividad cruzada de Anisakis simplex con nematodos, insectos y crustáceos. 11.- La dosificación IgE total, fue elevada en el 69% de los pacientes sensibilizados. 12.- No se ha encontrado eosinofilia en ningún paciente sensibilizado. 13.- El 80% de los pacientes presentó un patrón característico de inmunoblotting. 134 MENU SALIR 14. - El 73.4% de los pacientes, no respondió a la dieta de exclusión de pescado. 15.- Debe añadirse a los criterios diagnósticos vigentes de hipersensibilidad a Anisakis simplex, la resolución de los síntomas con la dieta de eliminación. 16.- Anisakis simplex debe considerarse un nuevo alergeno alimentario y debe probarse de forma rutinaria en todos los pacientes con clínica urticaria/angioedema o anafilaxia que consuman pescado de forma habitual. 135 de MENU SALIR BIBLIOGRAFÍA 136 MENU SALIR 1. –Ishikura H and Asanuma T.: On the strange terminal ileitis accompanied with acute ileocecal syndromes (first report). J Hokkaido Branch Jpn Surg Soc 1958; 3:63-64. 2. –Ishikura H, Tanaka M.: On the strange terminal ileitis accompanied with acute ileocecal syndromes (second report). J Hokkaido Branch Jpn Surg Soc 1959; 5:3738. 3. –Van Thiel PH, Kuiper FC, Roskam RT.: A nematode parasitic to herring causing acute abdominal syndromes in man. Trop Geogr Med 1960; 12:97-113. 4. –Van Thiel PH.: Anisakiasis. Parasitology 1962; 52(suppl):16-17 5. –Namiki M, Morooka T, Kawauchi H et al.: Diagnosis of acute gastric anisakiasis. Stomach and Intestine 1970; 5:1437-1440. 6. –Calvet JP, Zuckmann P and Texier J.: Granulome éosinophile allergique parasitaire de l´iléon. Mém Acad Chir 1969; 95:648-651. 7. –Pinkus GS, Coolidge C and Little MD.: Intestinal Anisakiasis. First case report from North America. Am J Med 1975; 59:114-120. 8. –Arenal Vera JJ, Marcos Rodriguez JL, Borrego Pintado MH, Bowakin Dib W, Castro Lorenzo J y Blanco Álvarez JI.: Anisakiasis como causa de apendicitis aguda y cuadro reumatológico: primer caso en la literatura médica. Rev Esp Enf Digest 1991; 79:355-358. 137 MENU SALIR 9. –Ishikura H, Kokichi K, Kazuya N, Toshio O, Hiroshi T, Noriyuki S et al.: Anisakidae and Anisakidosis. Progress in Clinical Parasitology 1994; 3:43-102. 10. –Mckerrow JH, Sakanari JA, Deardorff TL.: Anisakiasis: revenge of the sushi parasite. N Engl J Med 1988; 319:1228-1229. 11. –Smith JW.: Anisakis simplex (Rudolphi, 1809, det. Krabbe, 1878) (Nematoda: Ascaridoidea): Morphology and morphometry of larvae from euphausiids and fish, and a review of the life-history and ecology. J Helminthol 1983; 57:205-224. 12. –Cheng TC.: Superfamilia Heterocheiloidea. En: AC Editores. Parasitología general; 1978. P.649-651. 13. –Myers BJ.: The nematodes that cause anisakiasis. J Milk and Food Techno 1975; 38:774-782. 14. –Gibson DI.: The systematics of ascaridoid nematodes – a current assessment. In: AR Stone, HM Platt and LF Khalil editors.Concepts in Nematode Systematics. 1983. Special Vol. Nº 22, 400 pp. Academic Press Inc: New York & London. 15. –SanMartín ML, Quintero P, Iglesias R y cols.: Nematodos parásitos en peces de las costas gallegas. Ed. Díaz de Santos, S.A. Madrid. 1994, pp 31-37. 16. –Ishii Y, Fujino T, Weerasooriya MV.: Morphology of Anisakinae larvae. In: Gastric anisakiasis in Japan. Epidemiology, diagnosis, treatment. Ishikura H and Namiki M eds. Springer-Verlag, Tokyo, 1989; pp. 19-30. 138 MENU SALIR 17. –Smith JW, Wootten R. Anisakis and anisakiasis. Adv Parasitol 1978; 16:93-163. 18. –Oshima T, Oya S, Wakai R. In vitro cultivation of Anisakis type I and type II larvae collected from fishes caught in japanese coastal waters and their identification. Jap J Parasitol 1982; 31:131-134. 19. –Nagasawa K. The life cycle of Anisakis simplex: A review. In: Intestinal anisakiasis in Japan. Infected fish, sero-immunological diagnosis and prevention. Ishikura H and Kikuchi K eds. Springer-Verlag, Tokyo, 1990; pp. 31-40. 20. –Grabda J.: Studies on the cycle and morphoghenesis of anisakis simplex (Rudolphi, 1809) (Nematoda:Anisakidae) culture in vitro. Acta Ichtyol Piscat 1976; 6:119-141. 21. –Dayley MD, Brownell RL Jr.: A checklist of marine mammal parasites. In: Ridgway SH eds.: Mammals of the sea. Biology and Medicine. Charles C Thomas, Springfield, IL, 1972, pp. 528-589. 22. –Smith JW. Larval Anisakis simplex (Rudolphi, 1809, det. Krabbe, 1878) and larval Hysterothylacium sp. (Nematoda: Ascaridoidea) in euphausiids (Crustacea:Malacostraca) in the North-East Atlantic and northern North Sea. J Helminthol 1983; 57:167-177. 23. –Davey JT. A revision of the genus Anisakis Dujardin, 1845 (Nematoda: Ascaridata). J Helminthol, 1971; 45:51-72. 139 MENU SALIR 24. –Banning PV.: Some notes on a successful rearing of the herring-worm Anisakis marina (Nematoda:Heterocheilidae) J Cons Int Explor Mer 1971; 34:84-88. 25. –Smith JW.: Thysanoessa inermis and T. longicaudata (euphausiidae) as first intermediate hosts of Anisakis sp. (Nematoda:Ascaridata) in the northern North Sea, to the north of Scotland and Faroe. Nature 1971; 234:478. 26. –Williams H and Jones A.: Parasitic worms of fish. Taylor & Francis eds. London, 1994 27. –Kagei N.: Studies on Anisakid Nematoda (Anisakinae). IV. Survey of Anisakis larvae in the marine Crustacea. Bull Inst Publ Health 1974; 23: 65-71. 28. –Oshima T, Shimazu T, Koyama H, Akahane H.: On the larvae of the genus Anisakis (Nematoda: Anisakidae) from the euphausiids. Jpn J Parasitol 1969; 18: 241-248. 29. -Smith JW: Experimental transfer of Anisakis sp. larvae (Nematoda: Ascaridida) from one fish host to another. J Helminthol 1974; 48: 229-234. 30. –Kagei N, Kureha K.: Studies on Anisakid Nematoda (Anisakinae). I. Survey of Anisakis sp. on marine mammals collected in the Antartic Ocean. Bull Inst Publ Health 1970; 19: 193-196. 31. –Smith JW.: The abundance of Anisakis simplex L3 in the body-cavity and flesh of marine teleosts. Int J parasitol 1984; 14:491-495. 140 MENU SALIR 32. –Smith JW, Wooten R.: Experimental studies on the migration of Anisakis sp. Larvae (Nematoda:Ascaridida) into the flesh of herring Clupea harengus. Int J Parasitol 1975; 5:133-136. 33. –Gambell R.: The blue whale. Biologist, 1979; 26: 209-215. 34. –Petter AJ.: Enqûete sur les nématodes des poissons de la région nantaise. Identification des larves d`ascarides parasitant les sardines. Annales de Parasitologie Humaine et Comparée 1969; 44: 559-580. 35. –Shiraki T.: Larval nematode of family anisakidae in the northern sea in Japan, as a causative agent of eosinophilic phlegmon or granuloma in the human gastrointestinal tract. Acta med biol 1974; 22: 57-98. 36. –Bouree P, Paugam and Petithory JC.: Anisakidosis: report of 25 cases and review of the literature. Comp Immun Microbiol Infect Dis 1995; 18: 75-84. 37. –Mauchline J.: The biology of mysids and euphausiids. Advances in Marine Biology, 1980; 18: 680. 38. –Hoberg EP, Henny CJ, Hedstrom OR, Grove RA.: Intestinal helminths of river otters (Lutra canadiensis) from the Pacific northwest. J Parasitol 1997; 83(1): 105110. 141 MENU SALIR 39. –Huh S, Sohn WM, Chai JY.: Intestinal parasites of cats purchased in Seoul. Korean J Parasitol 1993; 31: 371-373. 40. –Ishikura H.: Current topics on anisakidosis –popularization, decide diagnostic and specific antigen. Jpn J Gastroenterol 1990; 87:1740-1743. 41. –Ishikura H.: Epidemiological aspects of intestinal anisakiasis and its pathogenesis. In: Intestinal anisakiasis in Japan. Infected fish, sero-immunological diagnosis and prevention. Ishikura H and Kikuchi K eds. Springer-Verlag, Tokyo, 1990; pp.3-21. 42. –Young PC.: Larval nematodes from fish of the subfamily Anisakinae and gastrointestinal lesions in mammals. J Comp Path 1969; 79: 301-313. 43. –Myers BJ. The migration of Anisakis-type larvae in experimental animals. Canad J Zool 1963; 45: 147-148. 44. -Kikuchi Y, Ueda T, Yoshiki T. et al.: Experimental immunopathological studies on intestinal anisakiasis. Igakuno Ayumi 1967; 62(11): 731-736. 45. –Sakanari JA and Mckerrow JH.: Anisakiasis. Clin Microbiol Rev 1989; 2: 278284. 142 MENU SALIR 46. –Kennedy MW, Tierney J, Puzeng Y et al.: The secreted and somatic antigens of the third stage larva of Anisakis simplex and antigenic relationship with Ascaris suum, Ascaris lumbricoides and Toxocara canis. Mol Biochem Parasitol 1988; 31: 35-46. 47. –Sakanari JA and McKerrow JH.: Identification of the secreted neutral proteases from Anisakis simplex. J Parasitol 1990; 76: 625-630. 48. –Perteguer MJ, Raposo R, Cuellar C.: In vitro study on the effect of larval excretory/secretory products and crude extracts from Anisakis simplex on blood coagulation. Int J Parasitol 1996; 26(1): 105-108. 49. –Asaishi K, Nishino C, Totsuka M et al.: Studies on the etiologic mechanism of anisakiasis. 1) Immunological reactions of digestive tract induced by Anisakis larvae. Gastroenterol Jpn 1980; 15(2): 128-134. 50. –Ishikura H. Clinical features of intestinal anisakiasis. In: Intestinal anisakiasis in Japan. Infected fish, sero-immunological diagnosis and prevention. Ishikura H and Kikuchi K eds. Springer-Verlag, Tokyo, 1990a; pp.89-100. 51. –Ohtaki H, Ohtaki R. Clinical manifestation of gastric anisakiasis. In: Gastric anisakiasis in Japan. Epidemiology, diagnosis, treatment. Ishikura H and Namiki M eds. Springer-Verlag, Tokyo, 1989; pp.37-46. 143 MENU SALIR 52. –Ohtaki H, Ohtaki R, Ohtaki T and Nakaya H.: Clinical study of gastric anisakiasis diagnosed and treated by endoscopy. Scan J Gastroenterol 1982; 17 (78): 66. 53. –Shinno T, Watanabe K, Yoshimura H, Akao N.: A case of gastric anisakiasis with hematoemesis. Jpn J Gastroenterol 1982; 79: 1544. 54. – Machi T, Okino S, Saito Y, Horita Y et al.: Severe chest pain due to gastric anisakiasis. Intern Med 1997; 36(1): 28-30. 55. –Del Olmo Escribano, M, Cózar Ibáñez A, Martínez de la Victoria y cols.: Anisakiasis a nivel ileal. Rev Esp Enferm Dig 1998; 90(2): 120-123. 56. –Urita Y, Nishino M, Koyama H, Kondo E et al.: Esophageal anisakiasis accompanied by reflux esophagitis. Intern Med 1997; 36(12): 890-893. 57. –Kasuya S, Hamano H & Izumi S.: Gastric anisakiasis with anaphylactoid reactions. ACI News, 1989; 1: 13-14. 58. –Kasuya S, Hamano H and Izumi S.: Mackerel-induced urticaria and Anisakis. Lancet, 1990: 335: 665. 59. –Audícana M, Fernández de Corres L, Muñoz D, del Pozo MD, Fernández E, García M, Díez J.: Anisakis simplex: una nueva fuente de antígenos alimentarios. Estudio de sensibilización a otros parásitos del orden Ascaridoidae. Rev Esp Alergol Inmunol Clin 1995; 10(6): 325-331. 144 MENU SALIR 60. –Fernández de Corres L, Audícana M, Del Pozo MD, Muñoz D, Fernández E et al.: Anisakis simplex induces not only anisakiasis: Report on 28 cases of allergy caused by this nematode. J Invest Allergol Clin Immunol 1996; 6(5): 315-319. 61. –Fernández Meléndez S, Muñoz C, Barcelo M y cols.: Monosensibilización a proteínas de Anisakis simplex en pacientes con urticaria-angioedema recidivante idiopático. Rev Esp Alergol Inmunol Clin, 1996; 11:199. 62. –Fernández S, Muñoz C, De La Fuente Jl et al.: Sensitization to Anisakis simplex in idiopathic recidivant urticaria. Allergy, 1997, 37: 174. 63. –Montoro A, Perteguer MJ, Chivato T, Laguna R, Cuéllar C.: Recidivous acute urticaria caused by Anisakis simplex Allergy 1997; 52: 985-991. 64. –Del Pozo MD, Audícana M, Díez JM, Muñoz D et al.: Anisakis simplex, a relevant etiologic factor in acute urticaria. Allergy 1997; 52: 576-579. 65. –Moreno-Ancillo A, Caballero MT, Cabañas R, Contreras J et al.: Allergic reactions to Anisakis simplex parasitizing seafood. Ann Allergy Asthma Immunol 1997; 79: 246-250. 66. –Audícana M, Fernández de Corres L, Muñoz D, Fernández E et al.: Recurrent anaphylaxis due to Anisakis simplex parasitizing sea fish. J Allergy Clin Immunol 1995; 96: 558-560. 145 MENU SALIR 67. –Añíbarro B and Seoane FJ.: Occupational conjunctivitis caused by sensitization to Anisakis simplex. J Allergy Clin Immunol 1998; 102: 331-332. 68. –Armentia A, Lombardero M, Callejo A, Martín Santos JM, et al.: Occupational asthma by Anisakis simplex. J Allergy Clin Immunol 1998; 102: 831-834. 69. –Carretero Añibarro P, Blanco carmona J, García González F, et al.: Protein contact dermatitis caused by Anisakis simplex. Contact Dermatitis 1997; 37(5): 247. 70. –Asaishi K, Nishino C, Totsuka M et al.: Studies on the etiologic mechanism of anisakiasis (I). Immunological reactions of digestive tract induced by anisakis larvae. Gastroenterol Jpn 1980; 15(2): 128-134. 71. –Shibata O, Uchida Y, Furusawa T.: Acute gastric anisakiasis with special analysis of the location of the worms penetrating the gastric mucosa. In: Ishikura H, Namiki M eds. Gastric Anisakiasis in Japan. Epidemiology, Diagnosis, Treatment. Springer-Verlag, Tokyo, 1989, pp. 53-57. 72. –Yazaki Y, Namiki M.: Biopsy of gastric anisakiasis with acute symptons. In Ishikura H, Namiki M eds: Gastric anisakiasis in Japan. Epidemiology, Diagnosis, Treatment. Springer-Verlag, Tokyo, 1989, pp. 113-116. 73. – Ishikura H.: Clinical and immunological studies on anisakiasis. Hokkaido J med Sci 1968; 43: 83-99. 146 MENU SALIR 74. – Kusuhara T, Watanabe K, Fukuda M.: Radiographic study of acute gastric anisakiasis. Gastrointest Radiol 1984; 9: 305-309. 75. –Matsui T, Iida M, Murakami M et al.: Intestinal anisakiasis: clinical and radiologic features. Radiology 1985; 157: 299-302. 76. –Higashi M, Tanaka K, Kitada T, Nakatake K, Tsuji M.: Anisakiasis confirmed by radiography of the large intestine. Gastrointest Radiol 1988; 13: 85-86. 77. –Shirahama M, Koga T, Ishibashi H, Uchida S, Ohta Y and Shimoda Y.: Intestinal anisakiasis: high-resolution ultrasound in diagnosis. Radiology, 1992; 185: 789-793. 78. –Ouchterlony O.: In vitro method for testing the toxin-producing capacity of diphteria bacteria. Acta Pathol Microbiol Scand 1948; 25: 186. 79. –Mancini G, Carbonara AO and Heremans JF.: Immunochemical quantitation of antigens by single radial immunodiffusion. Immunochemistry 1965; 2: 235. 80. –Petithory JC, Lapierre J, Rousseau M, Clique MT.: Diagnostic sérologique de l`anisakiase (granulome eosinophile digestif) par précipitation en milieu gélifié (Ouchterlony, électrosynérèse, immunoélectrophorése). Med Mal Inf 1986; 3: 157162. 147 MENU SALIR 81. –Desowitz RS, Raybourne RB, Ishikura H and Kliks MM.: The radioallergosorbent test (RAST) for the serological diagnosis of human anisakiasis. Trans Roy Soc Trop Med Hyg 1985; 79: 256-259. 82. –Wide L, Bennich H and Johansson SGO.: Diagnosis of allergy by an in vitro test for allergen antibodies. Lancet 1967; 2: 1105. 83. –Ceska M, Eriksson R, Varga JM.: Radioimmunosorbent assay of allergens. J Allergy Clin Immunol 1972; 49: 1, 84. –Takahashi A, Sato N and Ishikura H.: Establishment of monoclonal antibodies that discriminate the antigen distribution specifically found in Anisakis larvae (type 1). J parasitol 1986; 72: 960-962. 85. –Yagihashi A, Sato N, Takahashi S, Ishikura H. et al.: Establishment of a serodiagnostic assay system for anisakiasis using a monoclonal antibody specific for Anisakis larvae antigen. J Clin & Exp Med 1989; 148: 213-214. 86. –Yagihashi A, Sato N, Takahashi S, Ishikura H. et al.: A sero-diagnostic assay by microenzyme-linked immunosorbent assay for human anisakiasis using a monoclonal antibody specific for Anisakis larvae antigen. J Infect Dis 1990; 161:995-998. 148 MENU SALIR 87. –Homburger HA and Katzmann JA.: Métodos de laboratorio en Inmunología. En: Middleton E, Reed CE, Ellis EF, Adkinson NF and Yunginger eds: Alergia, Principios y práctica .3ª edición (versión española). Barcelona: Salvat Editores; 1992; pp. 380395. 88. –Iglesias R, Leiro J, Santamarina MT, Ubeira FM.: Monoclonal antibodies against diagnostic Anisakis simplex antigens. Parasitol Res 1997; 83(8): 755-761. 89. –Akao N, Ohyama TA and Kondo K.: Immunoblot analysis of serum IgG, IgA and IgE responses against larval exretory-secretory antigens of Anisakis simnplex in patients with gastric anisakiasis. J Helminthol 1990; 64: 310-318. 90. –Kojima K, Koyanagi T, Shiraki K.: Pathological studies of anisakiasis. Jpn J Clin Med 1966; 24:134-143. 91. –Shiraki T.: On the pathological diagnosis of gastrointestinal larva migrans of anisakiasis. Saishin Igaku 1969; 24:378-389. 92. –Kikuchi Y, Ishikura H, Kikuchi K, Hayasaka H. Pathology of gastric anisakiasis. En: Gastric anisakiasis in Japan. Epidemiology, diagnosis, treatment. Ishikura H and Namiki M eds. Springer-Verlag, Tokyo, 1989; pp.117-127. 93. –Kikuchi Y, Ishikura H, Kikuchi K. Pathology of intestinal anisakiasis. En: Intestinal anisakiasis in Japan. Infected fish, sero-immunological diagnosis and prevention. Ishikura H and Kikuchi K eds. Springer-Verlag, Tokyo, 1990; pp.129-143. 149 MENU SALIR 94. –Dreborg S and Frew A.: Allergen standarization and skin tests. Position paper EAACI. Allergy 1993: 48: 7-20. 95. –Bock SA.: In vivo diagnosis: skin testing and oral challenge procedures. In: Metcalfe DD, Sampson HA and Simon RA eds. Food allergy: adverse reactions to foods and food additives. Second edition. Cambridge,Massachusetts: Blackwell Science, 1997.pp.151-166. 96. –Ewan PW, Coote D.: Evaluation of a capsulated hydrophilic carrier polimer (the immunoCAP) for measurement of specific IgE antibodies. Allergy 1990; 45: 22-29. 97. –Del Pozo MD, Moneo I, Fernández de Corres L, et al.: Laboratory determinations in Anisakis simplex allergy. J Allergy Clin Immunol 1996; 97: 977-984. 98. –Moneo I, Puente S, Sánchez Agudo L, y cols.: Estudio de liberación de histamina en sujetos normales, atópicos y parasitados. Inmunología 1993; 12: 54-58. 99. –García M, Moneo I, Audicana MT, Del Pozo MD, et al.: The use of IgE immunoblotting as a diagnostic tool in Anisakis simplex allergy. J Allergy Clin Immunol 1997; 99: 497-501. 100. –Kasuya S, Koga K.: Significance of detection of specific IgE in Anisakis-related diseases. Arerugi 1992; 41:106-110. 150 MENU SALIR 101. –Deardorff TL, Rayburne RB and Desowitz RS.: Behavior and viability of thirdstage larvae of terranova sp. and Anisakis simplex larvae encapsulated in salmon and rockfish. J Food Protect 1984; 47: 49-52. 102. –Bouree P, Paugam A and Petithory JC.: Anisakidosis: report of 25 casos and review of the literature. Comp Immun Microbiol Infect Dis 1995; 18(2): 75-84. 103. –Kasuya S, Goto C, Koga k et al.: lethal efficacy of components of ginger or gingerol and shogaol on Anisakis larvae. Jpn J parasitol 1990; 39: 220-225. 104. –Yamada G.: Studies on the prevention of Anisakis larava infection. J Osaka City Med 1971; 20: 131-150. 105. –Hayasaka H, Iwano H Tagaki R et al.: Studies on anisakiasis -on the influence of alcohol and isothiocyanate on the anisakis larvae. Hokkaido J Surg 1969; 14: 167171. 106. –Fraj LJ, Remacha B, Colas C et al.: Anisakis, Anisakiasis and IgE-mediated immunity to Anisakis simplex. J Investig Allergol Clin Immunol 1998; 8(1): 61-63. 107. –Ioli A, Leonaldi R Gaugemi C et al.: A propos of 1 case of anisakiasis contracted in Sicily. Bull Soc Pathol Exot 1998; 91(3): 232-234. 151 MENU SALIR 108. –Goto C, Kasuya S, Koga K, Ohtomo H and Kagei N.: Lethal efficacy of extract from Zinziber officinale (traditional Chinese medicine) or [6]-shogaol and [6]-gingerol in Anisakis larvae in vitro. Parasitol Res 1990; 76(8): 653-656. 109. –Kagei N and Isogaki H.: A case of abdominal syndrome caused by the presence of a large number of Anisakis larvae. Int J Parasitol 1992; 22(2): 251-253. 110. –Sugimachi K, Inokuchi K, Ooiwa T et al.: Acute gastric anisakiasis. Analysis of 178 cases. JAMA 1985; 253(7): 1012-1013. 111. –Matsui K, Iida M, Murakami M, Kimura Y et al.: Intestinal Anisakiasis: clinical and radiologic features. Radiol 1985; 157: 299-302. 112. –Deardorff TL, Kayes SG and Fukumura T.: Human anisakiasis transmitted by marine food products. Hawaii Med J 1991; 50(1): 9-16. 113. -Olmedo Medicouague JB y Berenguer Soler J.: Control de la incidencia de parasitación por nematodos del género Anisakis sobre peces destinados al consumo humano. Inf Vet 1991:31-35. 114. -Laemmli UK. Cleavage of structural proteins during the assembly of the bacteriophage T4. Nature 1970; 227: 680-685. 152 MENU SALIR 115. –Bradford MM.: A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principles of protein-dye-binding. Anal Biochem 1976; 72: 248-254. 116. –Towbin H, Staehelin I, Gordon J.: Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: Procedures and some applications. Proc Natl Acad Sci USA 1979; 76: 4350-4354. 117. –Ministerio de Agricultura, Pesca y Alimentación. Secretaría General de Alimentación. La alimentación en España. Madrid, 1992. 118. – López-Vélez R, García A, Barros C y cols.: Anisakiasis en España. Descripción de tres casos. Enf Inf Microbiol Clin 1992; 10:158-161. 119. –Valero A, Mira Gutiérrez J, Pérez Cano R y cols: Descripción de un caso de anisakiasis humana. Abstracts de la IX Reunión Científica de la Asociación de Parasitólogos Españoles, León, 1992; 69. 120. –Martín Cavanna J, Monturiol JM, Louredo A et al.: Abdomen agudo y anisakiasis. A propósito de dos casos. Cir Esp 1994; 56 (I): 265. 121. –Martín del Olmo JC, De la Cuesta de la Llave C, Vaquero Puerta C et al.: Obstrucción intestinal por anisakidosis. Aportación de dos nuevos casos Cir Esp 1995; 59: 174-176. 153 MENU SALIR 122. –Acebes Rey JM, Fernández Orcajo P, Díaz González G, et al.: Dos casos de anisakiasis en el Hospital del Río Ortega. Rev Esp Enf Digest 1996; 88: 59-60. 123. –Romeo Ramírez JA, Martínez-Conde López U, Olivares Galdeano A et al.: Anisakiasis gástrica diagnosticada por endoscopia. Gastroenterol Hepatol 1997; 20: 306-308. 124. –Louredo Méndez A, Acedo De la Rosa F, Arribas de Paz V, et al.: Anisakidosis del colon como causa de abdomen agudo. Rev Esp Enf Digest 1997; 89: 403-406. 125. –Del Olmo Escribano M, Cózar Ibáñez A, Martínez de la Victoria et al.: Anisakiasis a nivel ileal. Rev Esp Enf Digest 1998; 90: 120-123. 126. –Olveira A, Sánchez Rancano S, Conde Gacho P et al.: Rev Esp Enf Digest 1999; 91(1): 70-72. 127. –Kagei N.: List of the larvae of Anisakis spp. Recorded from marine fishes and squids caught off the Japan and its adjacent islands. Bull Inst Publ Health 1970; 19: 76-85. 128. –Kagei N.: A list of fish infected with larval nematodes of the subfamily Anisakinae. Jpn Soc Sci Fish 1974; 7: 98-107. 154 MENU SALIR 129. –Huang W.: Anisakides et anisakidoses. Enquête sur les anisakidés de poissons commerciaux du marché parisien. Annls Parasit Hum Comp 1988; 63: 197208. 130. –Nagasawa K.: Anisakis larvae in intermediate and paratenic hosts in Japan. In: Ishikura H and Kikuchi K eds. Intestinal anisakiasis in Japan. Springer-Verlag, Tokyo 1990; pp. 23-29. 131. –Smith JW.: Larval ascaridoid nematodes in myopsid and oegopsid cephalopods from around Scotland and in the northern North Sea. J Mar Biol Assoc UK 1984; 64: 563-572. 132. –Chai JY, Guck SM, Sung JJ, Kim HC et al.: Recovery of Anisakidae larvae from codfish of the Antarctic Ocean. Korean J Parasitol 1995; 33: 231-234. 133. –Ma HW, Jiang TJ, Quan FS, Chen XG et al.: The infection status of anisakid larvae in marine fish and cephalopods from the Bohai Sea, China, and their taxonomical consideration. Korean J Parasitol 1997; 35(1): 19-24. 134. –Chandra CV, Khan RA.: Nematode infestation of fillets from Atlantic cod, Gadus morhua, off eastern Canada. J Parasitol 1988; 74: 1038-1040. 155 MENU SALIR 135. –Chai JY, Cho SR, Kook J, Lee SH.: Infection status of the sea eel (Astroconger myriaster) purchased from the Noryanjin fish market wirh anisakid larvae. Korean J Parasitol 1992; 30: 157-162. 136. –Sey O, Petter AJ.: Incidence of ascaridoid larvae in Kuwaiti food fishes. Southeast Asian J Trop Med Public Health 1997; 28(1): 168-172. 137. –Orecchia P, Paggi L, Mattiucci S et al.: Infestation by larvae of Anisakis simplex A and Anisakis physeteris in fish species of the Italian seas. Parassitologia 1989; 31: 37-43. 138. –Cattan PE, Carvajal J.: A study of the migration of larval Anisakis simplex (Nematoda:Ascaridida) in the Chilean hake Merluccius gayi . J Fish Biol 1984; 24: 649-654. 139. –Moravec F, Vidal-Martínez VM, Vargas Vázquez J et al.: Helminth parasites of Epinephelus morio (Pisces: Serranidae) of the Yucatan Peninsula, southeastern Mexico. Folia Parasitol (Praha) 1997; 44(4): 255-266. 140. –Ramallo G, Torres P.: Contracaecum sp. larvae (Nematoda, Anisakidae) infection in Salminus maxillosus (Pisces: Characidae) in the dam of Termas de Rio Hondo, Argentina. Bol Chil Parasitol 1995; 50 (1-2): 21-23. 156 MENU SALIR 141. –Sun SZ, Koyama T, Kagei N.: Anisakidae larvae found in marine fishes and squids from the gulf of Tongking, the East China Sea and teh Yellow Sea. Jpn J Med Sci Biol 1991; 44(3): 99-108. 142. –Serdiukov AM.: The problem of anisakiasis. Med Parazitol Mosk 1993; MarApr(2): 50-54. 143. –Reimer LW.: Parasites of Merluccius capensis and M. Paradoxus from the coast of Namibia. Appl Parasitol 1993; 34(2): 143-150. 144. –Hauktson E.: Prevalence and abundance of larvae of Phocanema decipiens and Anisakis sp. (Nematoda:Ascaridida) in cod (Gadus morhua) from Icelandic waters. Hafrannsoknir 1984; 30: 5-26. 145. –Distribution of whaleworm (Anisakis simplex, Nematoda, Ascaridoidea) L3 larvae in three species of marine fish; saithe (Pollachius virens), cod (Gadus morhua) and redfish (Sebastes marinus) from Norwegian waters. Parasitol Res 1998; 84(4): 281-285. 146. –Sanmartín ML, Quintero P, Ubeira FM.: Nematode parasites of commercially important fish in NW Spain. Dis Aquat Org 1989; 7: 75-77. 157 MENU SALIR 147. –López Giménez R, Castell Monsalve J.: Estudio de la tasa de parasitación por Nematodos del género Anisakis en el pescado fresco de venta más frecuente en Castilla La Mancha. Alimentaria 1994: 37-42. 148. –Adroher FJ, Valero A, Ruiz Valero J, Iglesias L.: Larval anisakids (Nematoda: Ascaridoidea in horse mackerel (Trachurus trachurus) from the fish market in Granada (Spain). Parasitol Res 1996; 82: 253-256. 149. –Song SB, Lee SR, Chung HH et al.: Infection status of anisakid larvae in anchovies purchased from local fishery market near southern and eastern seas in Korea. Korean J Parasitol 1995; 33: 231-234. 150. –McGladdery SE.: Anisakis simplex (Nematoda: Anisakidae) infection of the musculature and body cavity of Atlantic herring (Clupea harengus harengus). Can J Zool 1986; 7: 1312-1317. 151. –Audícana M, Fdez. de Corres L, Muñoz D et al.: Anisakis simplex, a new seafood allergen. Allergy 1995; 50(26): 127. 152. –Barceló JM, De la Fuente JL, Torrecillas M et al.: Sensibilización a Anisakis simplex en pruebas cutáneas en población alérgica. Resultados preliminares. Rev Esp Alergol Inmunol Clín 1996; 11(2): 197. 158 MENU SALIR 153. –López Sáez MP, Zubeldia JM, Matheu V et al.: Sensibilización a Anisakis simplex: prevalencia en una consulta de alergia hospitalaria de Madrid. Rev Esp Alergol Inmunol Clin 1999; 14: 23-29. 154. –López Sáez MP, Baeza ML, Zubeldia JM et al.: Prevalencia de sensibilización a Anisakis simplex en una consulta de alergia. Rev Esp Alergol Inmunol Clin 1996; 11(2): 195. 155. –Muñoz Pereira M, San Martín M, Ornia N et al.: Incidencia de IgE específica frente a Anisakis simplex y Ascaris lumbricoides en población normal y atópica. Rev Esp Alergol Inmunol Clin 1996; 11(2): 197. 156. –García Palacios L, González ML, Esteban MI Mirabent E et al.: Enzyme-linked immunosorbent assay, immunoblot analysis and RAST fluoroimmunoassay analysis of serum responses against crude larval antigens of Anisakis simplex in a Spanish random population. J Helminthol 1996; 70(4): 281-289. 157. – Asaishi K, Nishino C, Totsuka M, Hayasaka H et al.: Studies on the etiological mechanisms of anisakiasis. II. Epidemiologic study of inhabitants and questionnaire survey in Japan. Gastroenterol Jpn 1980; 15(2): 128-134. 158. –O´Neil C, Helbling AA, Lehrer SB.: Allergic reactions to fish. Clin Rev Allergy 1993; 11: 183-200. 159 MENU SALIR 159. –Kennedy MW, Tierney J, Puzeng Ye, Fiona A et al.: The secreted and somatic antigens of the third stage larva of Anisakis simplex and antigenic relationship with Ascaris suum, Asacaris lumbricoides and Toxocara canis. Mol Biochem Parasitol 1988; 31: 35-46. 160. –McReynolds LA, Kennedy MW, Selkirk ME.: The polyprotein allergens of nematodes. Parasitol Today 1993; 9: 403-406. 161. –Ardusso Lovera DD, Quirce Gancedo S, Díez Gómez ML, Cuevas Agustín M et al.: Hipersensibilidad inmediata al parásito del pescado Anisakis simplex. Estudio de reactividad cruzada. Rev Esp Alergol Inmunol Clin 1996; 11(6): 280-286. 162. –Fernández-Caldas E, Quirce S, Marañon F, Diez Gómez ML, et al.: Allergenic cross-reactivity between third stage larvae of Hysterothylacium aduncum and Anisakis simplex. J Allergy Clin Immunol 1998; 101: 554-555. 163. –Hagan P.: IgE and protective immunity to helminth infections. Parasite Immunol 1993; 73: 110-116. 164. –Ottesen EA, Skvaril F, Tripathy SR, Poindexter RW et al.: Prominence of IgG4 in the IgG antibody response to human filariasis. J Immunol 1985; 134: 2707-2712. 165. –Allen JE, Maizels RM. Immunology of human helminth infection. Int Arch Allergy Immunol 1996; 109: 3-10. 160 MENU 166. SALIR –Pascual CY, Crespo JF, San Martín S, Ornia N, Ortega N et al.: Cross- reactivity between IgE-binding proteins from Anisakis, German cockroach and chironomids. Allergy 1997; 52: 514-520. 167. –Pascual C, Crespo JF, Ortega N, Ornia N et al.: High prevalence of sensitization to Anisakis simplex in patients with increased levels of total IgE. J Allergy Clin Immunol 1996; 97: 233. 168. –Witterman AM, Akkerdaas JH, Leeuwen J, Zee JS et al.: Identification of a cross reactive allergen (presumably tropomyosin) in shrimp, mite and insects. Int Arch Allergy Immunol 1994; 105: 56-61. 169. –Carmona MJ, García JJ, Vega JM et al.: Asthma and rhinoconjunctivitis associated to Dermatophagoides pteronyssinus positive skin tests. Allergy, 1995; 50 (26): 159. 170. –Homburger HA and Katzmann JA.: Methods in Laboratory Immunology. Principles and interpretation of laboratory tests for allergy. In: Middleton E, Reed Ch E, Ellis EF, Adkinson NF and Yunginger JW eds: Allergy, Principles and Practice, fourth edition. St Louis (MS), Mosby; 1993; pp 554-572. 171. –Wittig HJ, Belloit J, De Fillipi I and Royal G.: Age-related serum immunoglobulin E levels in healthy subjects and in patients with allergic disease. J Allergy Clin Immunol 1980; 66:305-313. 161