Vidrio.Leccion12.FormacionVIDRIO.Presentacion.2011.2012
Anuncio
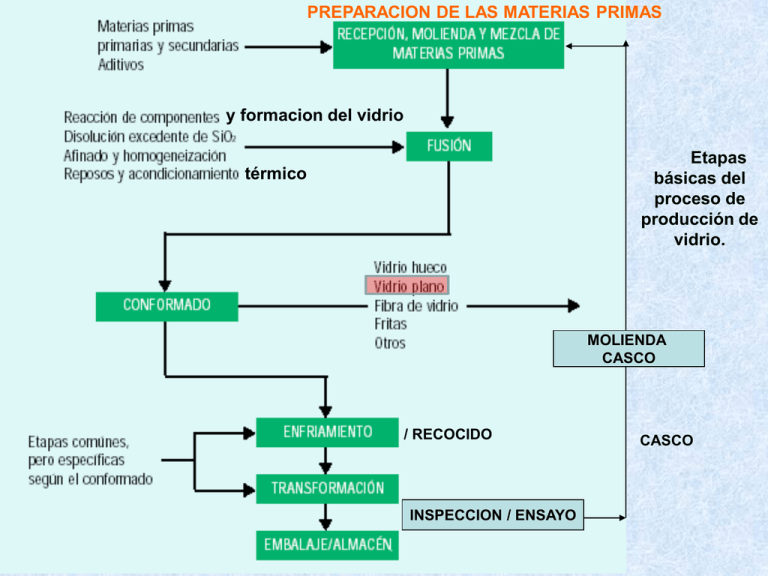
PREPARACION DE LAS MATERIAS PRIMAS y formacion del vidrio Etapas básicas del proceso de producción de vidrio. térmico MOLIENDA CASCO / RECOCIDO INSPECCION / ENSAYO CASCO VIDRIO PLANO VIDRIOS CON CAPAS VIDRIOS CON CAMARA TEMPLADOS LAMINADOS FABRICACION VIDRIO Consumos de materias primas y energía en la etapa de fusión del vidrio plano FABRICACION VIDRIO (1).- Conjunto de enfornadora (2).- Back – wall (3).- Vidrio fundido (4).- Quemador. FABRICACION VIDRIO FABRICACION VIDRIO LA FORMACIÓN DEL VIDRIO COMPRENDE UNA SERIE DE TRANSFORMACIONES FÍSICAS Y REACCIONES QUÍMICAS, A ALTA TEMPERATURA, EN VIRTUD DE LAS CUALES: MEZCLA VITRIFICABLE → MASA VITREA FABRICACION VIDRIO ENTRE LOS FENÓMENOS FÍSICOS SE PUEDEN CITAR LOS SIGUIENTES: 1.- LA FUSIÓN DE CADA CONSTITUYENTE Y LA DE LOS PRODUCTOS DE REACCIÓN 2.- LA MODIFICACIÓN DE SU ESTADO CRISTALINO (TRANSFORMACIONES CRISTALINAS) 3.- DESPRENDIMIENTO DE GASES 4.- UNA VOLATILIZACIÓN PARCIAL Transformaciones polimórficas de la sílice Clasificación gráfica de las fases de la sílice, con indicación de las temperaturas de inversión térmica Las líneas de trazo continuo indican estados estables y las de trazo discontinuo estados metaestables e inestables. Curvas de dilatación térmica de las fases cuarzo, cristobalita y tridimita. LA FORMACIÓN DE CRISTOBALITA TAMBIÉN PUEDE CONSTITUIR UN SERIO INCONVENIENTE DURANTE EL PROCESO DE FUSIÓN DE LOS VIDRIOS. LOS GRANOS DE CUARZO REACCIONAN FÁCILMENTE CON LOS COMPONENTES DE LA MEZCLA VITRIFICABLE, PERO, SI EVENTUALMENTE LLEGAN A TRANSFORMARSE EN CRISTOBALITA, SU INCORPORACIÓN A LA MASA FUNDIDA RESULTA MUCHO MÁS DIFÍCIL, YA QUE AL TENER MENOR DENSIDAD QUE ÉSTA, TIENDEN A ACUMULARSE EN SU SUPERFICIE VASO MOSTRANDO UN INFUNDIDO DE SILICE DE GRAN TAMAÑO Y UNA ZONA DE CUERDAS A SU ALREDEDOR FABRICACION VIDRIO ENTRE LOS FENÓMENOS QUÍMICOS SE TIENEN: 1.- EVAPORACIÓN DEL AGUA DE HUMEDAD 2.- UNA DESHIDRATACIÓN DE CIERTOS CONSTITUYENTES (SALES HIDRATADAS) 3.- UNA DISOCIACIÓN DE CARBONATOS, SULFATOS Y EN FABRICACIONES DE COLOR DE NITRATOS 4.- UNA ASOCIACIÓN DE LOS ÓXIDOS LIBERADOS (REACCIONES ENTRE LAS DISTINTAS ESPECIES QUÍMICAS). FABRICACION VIDRIO SE PUEDEN ESTABLECER TRES TIPOS DE REACCIONES: - - REACCIONES ENTRE 20 Y 740 ºC - REACCIONES ENTRE 740 Y 900 ºC REACCIONES ENTRE 900 Y 1450 ºC. A 1450 ºC SE PUEDE CONSIDERAR QUE TODAS LAS MATERIAS PRIMAS ESTÁN VITRIFICADAS Y SE PASA A LA FASE DE AFINADO. FABRICACION VIDRIO Reacciones entre 20 y 740 ºC La reacción eutéctica que tiene lugar es: CRISTAL MIXTO+(CO3)2CaNa2 ⇒LE 813 2CO3Ca.3Na2CO3 38.6 % CO3Ca 48.5 % 106 100 La reacción eutéctica que tiene lugar es: CRISTAL MIXTO+(CO3)2CaNa2 ⇒LE Al pasar de los 785 ºC se tendrá: (CO3)2CaNa2 + LE y a 800 ºC todo es fase fundida 785 ºC 38.6 % 2CO3Ca.3Na2CO3 38.6 % CO3Ca 600 ºC → Reducción de sulfato por el carbón EL SULFATO SÓDICO SE PUEDE EMPLEAR LIMITADAMENTE COMO MATERIA PRIMA ALCALINA PARA LA FUSIÓN DEL VIDRIO. SI BIEN DESDE EL PUNTO DE VISTA ECONÓMICO SERÍA DESEABLE QUE PUDIERA INTRODUCIRSE EN PROPORCIÓN ELEVADA, SUSTITUYENDO AL CARBONATO SÓDICO MÁS COSTOSO, SU DIFÍCIL ASIMILACIÓN POR EL VIDRIO REDUCE SU USO CASI EXCLUSIVAMENTE AL PAPEL DE AFINANTE. CON EL FIN DE OBTENER UN AFINADO MEJOR DEL VIDRIO SE INTRODUCE EN LA COMPOSICIÓN UNA PEQUEÑA PARTE DEL ÓXIDO DE SODIO BAJO LA FORMA DE SULFATO. INCONVENIENTES: - FUERTE ACCIÓN AGRESIVA SOBRE EL MATERIAL REFRACTARIO - DIFÍCIL MANTENIMIENTO DEL EQUILIBRIO CARBÓN-SULFATO - PERTURBACIONES QUE PUEDE INDUCIR EN EL VIDRIO (BURBUJAS DE SULFATO, COLORACIÓN AMARILLENTA) - ELEVADA CONTAMINACIÓN ATMOSFÉRICA POR EFECTO DEL SO2 RESULTANTE 600 ºC → Reducción de sulfato por el carbón LA REACCIÓN DEL SULFATO SÓDICO CON LA SÍLICE NO SE PRODUCE MÁS QUE A MUY ALTA TEMPERATURA, PRÁCTICAMENTE EN LAS PROXIMIDADES DE 1400 ºC E INCLUSO POR ENCIMA. SIN EMBARGO, EN PRESENCIA DE UN REDUCTOR COMO EL CARBONO, EL SULFATO PUEDE REDUCIRSE A SULFURO A PARTIR DE LOS 700 ºC Y EN FORMA DE SULFURO SI PUEDE INCORPORARSE AL VIDRIO EL SULFURO SODICO RESULTANTE REACCIONA CON LA SILICE FORMANDO UN SULFOSILICATO, DE ESTEQUIOMETRIA VARIABLE, DE NATURALEZA VITREA Y DE COLOR PARDO OSCURO: Na2 S xSiO2 Na2 S.xSiO2 SULFOSILICATO EL SULFOSILICATO A CONTINUACION REACCIONA CON MAS SULFATO Y CARBON DE ACUERDO CON LA REACCION: Na2 S.xSiO2 Na2 SO4 2C 2 Na2 S.xSiO2 2CO2 SO2 S EL AZUFRE LIBRE SE FIJA SOBRE PARTE DEL SULFURO DANDO LUGAR A LA FORMACION DE POLISULFUROS La descomposición del sulfato aumenta con la proporción de carbón COLORACION AMARILLA (VIDRIO DE COLOR AMBAR) 600 ºC → Reducción de sulfato por el carbón DIFÍCIL MANTENIMIENTO DEL EQUILIBRIO CARBÓN-SULFATO EXCESO DE CARBONO SOBRE EL CONTENIDO DE SULFATO (CONDICIONES REDUCTORAS) EL CARBONO REDUCE A LOS SULFATOS CONTENIDOS EN EL VIDRIO DANDO: - POLISULFUROS→ COLORACION AMARILLA - VIDRIO BIEN AFINADO EXCESO DE SULFATO SOBRE EL CONTENIDO DE CARBONO - VIDRIO MAL AFINADO→ PRESENCIA DE BULLONES BULLON: INCLUSION GASEIFORME DENTRO DEL VIDRIO FUNDIDO - NO HABRA COLORACION AMARILLA FABRICACION VIDRIO EL SULFATO SÓDICO QUE NO HA REACCIONADO PUEDE INCORPORARSE AL VIDRIO POR REACCIÓN CON EL SiO2 A ALTAS TEMPERATURAS. ESTA REACCIÓN, SI ES INCOMPLETA PUEDE SER EL ORIGEN DE LOS BULLONES DE SAL O DE LA "GALLE" (SEGREGACIÓN DE SULFATO EN LA SUPERFICIE DEL VIDRIO EN ZONAS FAVORABLES DEL HORNO). POR EL CONTRARIO LA FALTA DE SO4Na2 (O EL C EN EXCESO) PUEDEN SER EL ORIGEN DE ONDAS EN EL VIDRIO. Las segregaciones se producen por inmiscibilidad líquida. Si el vidrio fundido contiene mayor cantidad de sulfato de la que puede incorporar, el exceso se separa formando gotas o una capa líquida sobrenadante que puede dar lugar a una espuma abundante en la superficie. La fase de sulfato fundido tiene una densidad muy próxima a la del vidrio, de tal manera que si algunas de estas gotas son arrastradas hacia el interior de la masa vítrea, bien por corrientes de convección, o por movimientos turbulentos, difícilmente vuelven a aflorar a la superficie, pues su empuje ascensional es muy pequeño. El sulfato sódico contenido en estas gotas, que se mantienen en estado líquido mientras el vidrio se halla fundido, solidifica al enfriar éste Jarra de vidrio plagada de burbujas de sulfato. Reacciones entre 740 ºC y 900 ºC 785 ºC Por encima de 795° funde, en la zona de contacto disilicato cuarzo, el correspondiente eutéctico cuya composición corresponde aproximadamente al trisilicato (Na2O.3SiO2). 74.4 % SiO2 (2) → 795 ºC Na2O.2SiO2 Na2O.3SiO2 Debido a la migración de CaO y SiO2 se forma en la zona de reacción una combinación próxima a Na2O.3CaO.6SiO2 Na2O.3SiO2 3 CaO.SiO2 (DEVITRITA) SiO2 CaO SiO2 La reacción global sería: 3[Na2Ca(CO3)2] + 10[SiO2] ⇔ 2[Na2O.2SiO2] + [Na2O.3CaO.6SiO2] + 6(CO2) 1 : 3 : 6 (DEVITRITA, PF = 1045 ºC) La devitrita reacciona con el disilicato presente según la reacción (Fusión peritéctica): Na2O.3CaO.6SiO2 + Na2O.2SiO2 ⇔ Na2O.2CaO.3SiO2 + FUNDIDO 1:3:6 1 : 2 : 3 PF = 1284 ºC DEVITRITA DISILICATO PF =874 ºC EL Na2O.2CaO.3SiO2 REACCIONA CON EL SiO2 SEGUN LA REACCION: 5 Na2O.2CaO.3SiO2 6SiO2 2 Na2O.CaO.3SiO2 3 Na2O.3CaO.6SiO2 2:1:3 DEVITRITA EL 2Na2O.CaO.3SiO2 (2:1:3) JUNTO CON EL DISILICATO (Na2O.2SiO2) FORMA A MAYORES TEMPERATURAS, ENTRE 827 Y 834 º C, EL COMPUESTO Na2O.2CaO.3SiO2 Y UN FUNDIDO, MEDIANTE LA REACCIÓN PERITECTICA 2 Na2O.CaO.3SiO2 Na2O.2SiO2 Na2O.2CaO.3SiO2 FUNDIDO 2:1:3 1:2:3 FABRICACION VIDRIO FABRICACION VIDRIO K2O.Al2O3.6SiO2 FABRICACION VIDRIO Reacciones y transformaciones térmicas que tienen lugar en el sistema Na2O – CaO - SiO2 – CO2. FABRICACION VIDRIO 1450 ºC → Descomposición del sulfato por la sílice: El SO4Na2 se descompone solo a 1400 ºc, pero los granos de sílice que han quedado sin disolver, favorecen dicha descomposición, según la reacción: SO4Na2 + SiO2 → SiO3Na2 + SO3 FABRICACION VIDRIO DESPUÉS DE HABER REACCIONADO ENTRE SÍ LOS COMPONENTES DE LA MEZCLA VITRIFICABLE Y DE HABER DADO LUGAR A LA FORMACIÓN DE UNA FASE FUNDIDA, QUEDA TODAVÍA UN EXCESO DE SÍLICE SIN DIGERIR POR EL VIDRIO SU INCORPORACIÓN SE LLEVA A CABO MEDIANTE UN LENTO PROCESO DE DISOLUCIÓN REGIDO POR UN MECANISMO DE DIFUSIÓN. ASÍ, PUES, EL TIEMPO QUE TARDAN LOS GRANOS DE ARENA EN DISOLVERSE ES DIRECTAMENTE PROPORCIONAL AL CUADRADO DE SU RADIO E INVERSAMENTE A SU COEFICIENTE DE DIFUSIÓN. DE ACUERDO CON ELLO, PARECERÍA CONVENIENTE DISMINUIR LO MÁS POSIBLE SU TAMAÑO. PERO, SI BIEN ES CIERTO QUE ASÍ SE ACELERARÍA SU DISOLUCIÓN, TAMBIÉN TENDRÍA EL INCONVENIENTE, DE QUE SE PRODUCIRÍA UN NOTABLE Y PREMATURO AUMENTO DE LA VISCOSIDAD DEL FUNDIDO, SIN DAR TIEMPO A QUE SE ELIMINARAN PARTE DE LOS GASES DISUELTOS Y OCLUIDOS EN ÉL, LO QUE DIFICULTARÍA POSTERIORMENTE SU AFINADO. DISOLUCION DE LA SILICE SiO 2 dR h Ce Cs s dt R R CeCe GRANO DE SILICE FASE FUNDIDA Cs R = Radio del grano de silice (m) T = Tiempo (s) Ce= Concentración de equilibrio del SiO2 en el fundido en la intercara del grano de sílice, con la asunción de que la densidad del fundido en la intercara no es diferente de la del fundido global Cs = Concentración del SiO2 en el fundido S, SiO2 = Densidad de la fase fundida y del cuarzo, respectivamente (kg/m3) h = Coeficiente de transferencia de masa (m.s -1) Sh 1 1 hD 2 R Sh Dt 2 (m / s ) The required time for complete sand grain dissolution can be estimated for a melt with strong convection flows: FABRICACION VIDRIO LOS GRANOS DE CUARZO DURANTE SU CALENTAMIENTO SUFREN LA INVERSIÓN Cuarzo Cuarzo A LA TEMPERATURA DE 573 ºC. COMO LA MODIFICACIÓN CRISTALINA DE ALTA TEMPERATURA POSEE UNA ORDENACIÓN ESTRUCTURAL DE MENOR DENSIDAD, LOS GRANOS EXPERIMENTAN UNA BRUSCA EXPANSIÓN QUE DETERMINA SU RESQUEBRAJAMIENTO. ESTOS GRANOS, A TEMPERATURAS MÁS ALTAS, SON ATACADOS EN SUS BORDES POR EL VIDRIO FUNDIDO QUE PENETRA A TRAVÉS DE SUS GRIETAS, TANTO MÁS PROFUNDAMENTE CUANTO MENOR SEA SU TENSIÓN SUPERFICIAL. SI SE SOBREPASA LA TEMPERATURA DE TRANSFORMACIÓN DEL CUARZO EN CRISTOBALITA, DE MENOR DENSIDAD QUE ÉSTE, SIN QUE SE HAYAN DISUELTO LOS GRANOS, SU INCORPORACIÓN AL VIDRIO RESULTARÍA MUCHO MÁS DIFÍCIL. ρ = 2.65 g/cm3 ρ = 2.30 g/cm3 FABRICACION VIDRIO UN FENÓMENO CARACTERÍSTICO QUE SE PRODUCE DURANTE LA DISOLUCIÓN DE LA SÍLICE EN EL VIDRIO ES LA FORMACIÓN DE NUMEROSAS BURBUJAS PRODUCIDAS POR EL AUMENTO DE ACIDEZ QUE EXPERIMENTA EL FUNDIDO. EN LA PRIMERA ETAPA DE REACCIÓN Y FUSIÓN, EL FUNDIDO ERA MUY ALCALINO Y ELLO FAVORECÍA LA DISOLUCIÓN QUÍMICA DE CANTIDADES IMPORTANTES DE CO2, SO3 Y VAPOR DE AGUA. PERO AL IRSE INCORPORANDO LA SÍLICE POR DIGESTIÓN, EL VIDRIO SE VA HACIENDO CADA VEZ MÁS ÁCIDO Y LA SOLUBILIDAD DE DICHOS GASES DISMINUYE PRODUCIÉNDOSE SU SEGREGACIÓN EN FORMA DE BURBUJAS. ESTA ES LA RAZÓN DE QUE SIEMPRE SE OBSERVE UNA AUREOLA DE PEQUEÑAS BURBUJAS RODEANDO A LOS GRANOS DE SÍLICE EN DISOLUCIÓN. EL NACIMIENTO DE DICHAS BURBUJAS EN ESE MEDIO SATURADO DE GASES RESULTA ADEMÁS FAVORECIDO POR UN PROCESO DE NUCLEACIÓN HETEROGÉNEA EN LAS INMEDIACIONES DE TALES GRANOS. FABRICACION VIDRIO ALREDEDOR DE CADA GRANO SE FORMA INICIALMENTE Na2O.2SiO2 QUE SE DISUELVE EN EL VIDRIO. ESTE ATAQUE PUEDE IR ACOMPAÑADO TAMBIÉN DE LA TRANSFORMACIÓN PARCIAL DEL CUARZO EN CRISTOBALITA EN LA ZONA PERIFÉRICA DE LOS GRANOS, TRANSFORMACIÓN QUE RESULTA FAVORECIDA POR EL EFECTO MINERALIZADOR QUE EJERCE EL FUNDIDO. A UNA TEMPERATURA DE UNOS 1250 ºC TODA LA ARENA SE DISUELVE EN LA MASA VÍTREA FORMÁNDOSE ALREDEDOR DE LOS GRANOS PEQUEÑAS ZONAS MUY ENRIQUECIDAS EN SÍLICE QUE CONSTITUYEN HETEROGENEIDADES LOCALES DE COMPOSICIÓN QUE POSTERIORMENTE HAN DE DIFUNDIRSE PARA CONSTITUIR UN VIDRIO LO MÁS HOMOGÉNEO POSIBLE. FABRICACION VIDRIO ES IMPORTANTE QUE TODO EL CUARZO SE DISUELVA CON RELATIVA RAPIDEZ EN EL VIDRIO, DE LO CONTRARIO, LOS GRANOS TENDERÍAN A ACUMULARSE FORMANDO UNA CAPA SOBRE LA SUPERFICIE DEL FUNDIDO A LA QUE LLEGAN ASCENDIENDO LENTAMENTE, EN OCASIONES ARRASTRADOS EN SU MOVIMIENTO POR LAS PROPIAS BURBUJAS QUE SE PRODUCEN EN SU REACCIÓN Y QUE QUEDAN ADHERIDAS A SUS BORDES









