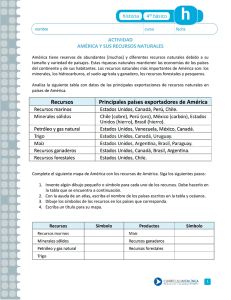
Ejercicios de Química General basados en Programas de Cómputo
Anuncio

Ejercicios de Química General basados en Programas de Cómputo Thomas J. Manning, Aurora Pérez Gramatges With Special Contributions from Peter Vu, Sofia Bullah, CJ Mock, Landon Lassiter, Vineet Kumar, Jeff Felton, Caley Alley, Travis Ireland, Geyser Fernández Catá 1 Objetivo, Beneficiarios y Propósito de este libro: • Este manual es una colección de ejercicios en hojas de cálculo (Excel) y de cómputo (Spartan). • Está diseñado para los estudiantes de pregrado con énfasis en los contenidos de Química General. • Este libro ofrece una alternativa viable con ejercicios que pueden por sí solos satisfacer los requerimientos de un curso práctico de Química General de dos semestres. • Muchos de estos ejercicios pueden introducirse en cursos de Química de la enseñanza media. • Los ejercicios están diseñados para tener una duración entre tres y doce horas. • Los estudiantes pueden completar los ejercicios con mínima supervisión por parte de un instructor de laboratorio. • Muchas de las instituciones académicas tiene el problema logístico de que una matrícula creciente de estudiantes deben ser atendidos por la misma cantidad de profesores, de locales de laboratorios, de financiamiento, etc. La posibilidad de dividir una sesión de laboratorio entre prácticas con reactivos y laboratorios computacionales representa una disminución en los recursos que se consumen. • Este manual reconoce el uso creciente de las técnicas computacionales en el mundo actual de la Química, lo cual no se ve reflejado en muchos de los currículos de las carreras de ciencias. Por otra parte, el uso de hojas de cálculo representa una herramienta valiosa para la simulación de sistemas y la manipulación de datos experimentales por parte de los estudiantes. • Este manual puede ser una excelente alternativa para la realización de laboratorios en cursos de enseñanza a distancia. • La existencia de versiones en inglés y en español extiende el mercado del libro. • El último ejercicio (La Química y la Geografía) es de tipo interdisciplinario, que no requiere de Excel o Spartan, pero sí el acceso a los recursos en Internet. 2 Antecedentes: En octubre del 2006, Thomas Manning realizó una visita junto a un grupo de delegados de la Sociedad Americana de Química al XXVII Congreso Latinoamericano de Química, que tuvo lugar del 16 al 20 de octubre en el Palacio de las Convenciones de La Habana Cuba (CEN, 20 de noviembre, 2006, vol. 84, número 47, p. 93, ¡Viva la Química!). Durante esta visita, tuvo la oportunidad de conocer a varios químicos que trabajan en Universidades e Institutos establecidos en Cuba. A partir de este evento científico surge una colaboración que nos permitió inicialmente participar en un proyecto de clase conjunto, el cual incluyó un nuevo ejercicio llamado Esquemas de Análisis Cualitativo Electrónico (EQAS, The Chemical Educator, 2007). Esta colaboración se extendió a la realización del presente libro. Agradecimientos: Los autores quieren agradecer a los organizadores del XXVII Congreso Latinoamericano de Química, en especial al Dr. Alberto Núñez, Dr Romerto Cao y Dra. Irma Castro. Gracias también a la Sociedad Americana de Química por la organización del viaje de los delegados norteamericanos (Dr. Brad Miller, Dr. Beth Rudd, Dr. Jerry Bell y Tamara Nameroff). De igual forma, nuestro agradecimiento a la Universidad Estadual de Valdosta (VSU), incluyendo los Departamentos de Química (Dr. Jim Baxter), Programas Internacionales (Dr. Ivan Nikolov, Dave Starling), Artes y Ciencias (Dr. Linda Calendrillo, Dr. Jim La Plant), Relaciones Académicas (Dr. Louis Levy) y Tecnología de la Información (Joe Newton, Ike Barton), los cuales ayudaron al éxito de varios aspectos de este proyecto. 3 Consideraciones: Las instrucciones del programa de Excel son para versiones de MS posteriores al MS’07. Cuando MS’07 o Google App’s se hayan establecido sólidamente como las hojas de cálculo del futuro, se publicará una versión actualizada de este folleto. Para la realización de los ejercicios del 3 al 21 se asume que los estudiantes han completado los ejercicios 1 y 2 y que ya están por tanto familiarizados con los comandos básicos del Excel y el Spartan, así como con el formato para confeccionar los informes de laboratorio. 4 Índice Ejercicio 1. Ecuaciones en Excel p. 6 Ejercicio 2. Enlaces y Pares de Electrones Libres en Moléculas Pequeñas: Introducción al Spartan p. 23 Ejercicio 3. Simulación de una Curva de Valoración de una Base Fuerte con un Ácido Fuerte p. 35 Ejercicio 4. Esquemas de Análisis Cualitativo Electrónico p. 44 Ejercicio 5. Geometrías moleculares, hibridación y polaridades p. 55 Ejercicio 6. Veinticinco Tendencias Periódicas. Graficando la Tabla Periódica para darle Vida p. 66 Ejercicio 7. Valoración que involucra una Base Fuerte y un Ácido Débil p. 73 Ejercicio 8. Modelación de Bases y Ácidos Débiles p. 80 Ejercicio 9. Demostrando los Conceptos de Enlaces y Fuerzas: del Nitrógeno a los Nanotubos p. 90 Ejercicio 10. El Cinturón de Estabilidad Nuclear p. 104 Ejercicio 11. Gráficos de Especiación y pH p. 113 Ejercicio 12. Los imanes moleculares simples Mn12 y Fe8 p. 122 Ejercicio 13. Cinética de Descomposición del Ozono p. 136 Ejercicio 14. Treinta Ecuaciones para la Química General p. 148 Ejercicio 15. Cinética Química de Reacciones de Primer Orden y la Radioactividad Natural p. 173 Ejercicio 16. Química en una Nanogota p. 182 Ejercicio 17. Átomos en el Espacio: Isómeros, Compuestos de Coordinación y otras Estructuras p. 203 Ejercicio 18. Construyendo y Visualizando algunos Materiales de Uso Común p. 207 Ejercicio 19. Fluido Supercrítico de Dióxido de Carbono y Nanotubos de Carbono Ejercicio 20. Equilibrio radiactivo Ejercicio 21. Un Acertijo Periódico Ejercicio 22. La Geografía y el Mercado Químico Global 5 Ejercicio Uno. Ecuaciones en Excel Objetivos de este ejercicio: 1. Enseñar a los estudiantes los aspectos básicos para realizar cálculos en una hoja de trabajo de Excel. Para ello, se utilizarán algunos conceptos químicos básicos como la conversión de unidades de temperatura y de energía, el pH y la cinética química. 2. Enseñar a los estudiantes los aspectos básicos para generar gráficos en Excel. 3. Enseñar a los estudiantes la estructura correcta del informe de laboratorio, el cual será generado separadamente en un programa procesador de textos. En este ejercicio de laboratorio Ud. debe generar un informe en un programa procesador de texto. Para ello escribirá preguntas y repuestas, importará gráficos de la hoja de cálculo, etc. En la parte superior de la primera página de su informe debe aparecer su nombre completo, la fecha y el título del ejercicio. En la elaboración del informe deberá utilizar un tamaño de letra 12, con las páginas numeradas en la esquina inferior derecha y márgenes alrededor de 1 pulgada de ancho (Izquierda, Derecha, Arriba y Abajo). Al escribir los números, recuerde incluir las unidades correspondientes (ej. 4 o F no 4). Las ecuaciones deben estar centradas en una línea y las variables deben aparecer claramente definidas con el siguiente formato: PV = nRT (1.1) P = Presión (atm) V = Volumen (litros) n = moles (mol) R = Constante Universal de los Gases (0.0821 l.atm / mol.K) T = Temperatura (Kelvin) Ud. deberá realizar sus propios cálculos y escribir el informe. Si existe alguna evidencia de fraude, la misma será analizada por el instructor de laboratorio, 6 I. Preguntas Previas: Copie la Pregunta 1, Pregunta 2 y Pregunta 3 en un documento Word, muestre la ecuación que utilizó para responder la pregunta y escriba en este documento su respuesta. 1. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados Fahrenheit (oF) a grados Celsius (ºC)? Convierta 72 oF en ºC, y 4 oC en oF. 2. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados Fahrenheit (oF) a grados absolutos (Kelvin)? Convierta 298 K en oF, y 212 oF en K. 3. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados absolutos (Kelvin) a grados Celsius (ºC)? Convierta 25 ºC en K, y 0 K en oC y oF. II. Ejercicio Excel #1. Conversión de Temperatura y Gráfico 2-D Guarde su trabajo regularmente en una memoria personal (ej. HDD personal o memoria extraíble). Muchas de las computadoras en las universidades y bibliotecas tienen programas instalados que pueden borrar su archivo por razones de seguridad, si se guarda automáticamente en el disco duro. 1. Abra un nuevo Libro de trabajo en Excel (las instrucciones a continuación asumen que Ud. está trabajando en Excel). 2. En la celda A1 escriba “TEMP, oC” 3. En la celda A2 escriba el número “0,0” 4. En la celda A3 escriba la ecuación “=suma(a2+1)” 5. Oprima el botón izquierdo del ratón en A3, de manera que los bordes de la celda se oscurecen. 6. Oprima ahora el botón derecho, y seleccione “copiar”. La celda debe mostrar una línea punteada en movimiento. 7 7. Coloque el cursor en A4, y oprima el botón izquierdo y seleccione continúe oprimiéndolo, a la vez que lo arrastra hacia la celda A1000 (las celdas deben quedar “marcadas”). Mientras más cerca coloque el cursor de la parte inferior de la página, más rápido se moverá. Una vez en la celda A1000, libere el cursor, presione el botón derecho y seleccione “pegar”. Los números deben ir desde 0-998 en incrementos de 1. ¡Mucho más fácil que entrar cada número por separado! 8. La columna A es la temperatura en grados Celsius. 9. En la columna B vamos a convertir Celsius a Kelvin. En B1 escriba “TEMP, K” 10. En B2 escriba “=suma(a2+273,15)” Esta ecuación toma el valor en la celda A2 y le adiciona 273,15. 11. Presione el botón izquierdo en B2 de manera que los bordes de la celda se oscurezcan, ahora presione el botón derecho y seleccione el comando “copiar”. La línea punteada en movimiento debe aparecer alrededor de la celda. 12. Coloque el cursor en B3, presiónelo y arrástrelo hasta B1000, y entonces presione el botón derecho y seleccione “pegar”. En la celda B1000 debe estar el número 1271,15. 13. Ahora, vamos a generar un gráfico sencillo utilizando los datos en A2..A1000 y B2..B1000. 14. En el menú superior, debe haber un comando que diga “Insertar”. Selecciónelo, y entonces seleccione “Gráfico”. 15. Seleccione “Tipos estándar”, “XY (Dispersión)” y en “Subtipo de gráfico”, aquel que sólo muestra puntos. Entonces seleccione “Siguiente” (parte inferior del cuadro) 16. Seleccione “Serie” y en caso de que exista alguna serie, seleccione “Quitar”. 17. Una vez que el cuadro de la serie está vacío seleccione “Agregar” y coloque el cursor en el cuadro de “Valores de X”. El cursor debe estar intermitente dentro de este recuadro. 8 18. Ahora seleccione la celda A2, presione el botón izquierdo, arrástrelo hasta A1000 y libérelo. De esta manera, Ud. acaba de definir los valores para el eje x. La línea de puntos intermitente debe aparecer alrededor de estos valores. 19. A continuación, seleccione el cuadro de “Valores de Y”. Si aparece cualquier símbolo o texto, bórrelo. Ahora seleccione esta vez B2 a B1000 con el cursor, para definir los valores del eje y. 20. Seleccione “Siguiente”. En este momento, Ud. debe poder observar una versión preliminar del gráfico. 21. En “Título del Gráfico” escriba “Conversión de Temperatura. Su nombre” 22. Para el eje x, escriba “Temperatura (oC)”. Siempre es aconsejable escribir tanto el nombre del parámetro como la unidad que se está utilizando. 23. Para el eje y, escriba “Temperatura (K)” 24. Seleccione ahora “Líneas de División” en el menú superior, y quite todas las marcas que puedan existir en los cuadros. En algunos casos, esto es una cuestión de preferencia, a no ser que Ud. esté tratando de correlacionar valores del eje con la línea de tendencia. 25. Seleccione “Leyenda” del menú, y quite también la marca en el cuadro “Mostrar leyenda”. La leyenda de un gráfico es esencial si Ud. está graficando dos o más series de datos en el mismo gráfico, pero cuando se trata de una sola serie, no es necesario utilizarla. 26. Seleccione “Siguiente”. Ahora Ud. tiene la opción de colocar su gráfico dentro de la misma Hoja de trabajo (Hoja) o en una hoja aparte (Gráfico). Seleccione “Gráfico”, y a continuación “Finalizar”. 27. Una vez que el gráfico aparece, pueden realizarse algunas modificaciones adicionales. Primero, oprima el botón derecho dentro del gráfico pero fuera de la línea de tendencia. En “Formato del área de trazado”, seleccione “Área”, “Ninguna”. Esto hará que desaparezca el fondo gris, lo cual, además de ahorrar tóner de impresión, le brinda una visión más “limpia” del gráfico. 9 28. Coloque la punta de la flecha del cursor directamente sobre el eje x y oprima el botón izquierdo, de manera que aparezcan dos puntos en los extremos del eje. Inmediatamente presione el botón derecho y seleccione “Formato de ejes” y “Escala”. Cambie la “Unidad mayor” a “100” y seleccione “Aceptar” 29. Ahora vamos a añadir una línea de tendencia que ajuste los datos a una línea recta y=mx+b. 30. Seleccione los datos en el gráfico de manera que la mayoría de los puntos se hagan más intensos. Si la flecha del cursor se traba en algún momento, simplemente coloque el cursor fuera del gráfico, en la Hoja de trabajo, y presione el botón del ratón una o dos veces, y después retorne a la línea de tendencia en el gráfico. 31. Una vez que los datos estén marcados, oprima el botón derecho y seleccione “Agregar línea de tendencia”. 32. En el menú superior, seleccione “Tipo” y “Lineal”. Después pase a “Opciones” y seleccione “Presentar ecuación en el gráfico” y “Presentar el valor R cuadrado en el gráfico”, y después “Aceptar”. 33. Si lo desea, puede seleccionar con el botón izquierdo la ecuación y el coeficiente de correlación, y colocarlos en un área donde no interfiera con los datos y la recta. Un valor de R2 de 1 significa un ajuste perfecto. En este caso, Ud. debe obtener una pendiente igual a 1 y un intercepto en 273,15. 34. Seleccione el cuadro externo que rodea el gráfico. Debe definirse con puntos negros en los extremos. Copie y pegue su gráfico en un documento WORD. Reduzca el tamaño a 4 pulgadas de ancho y 3 pulgadas de altura. 35. Escriba un pie de figura que explique claramente el gráfico. Este debe ser un procedimiento estándar en todos los gráficos que Ud. construya. 36. Asegúrese de hacerse el hábito de guardar su fichero Excel frecuentemente mientras está trabajando en él. También guarde de la misma manera cu documento WORD. 10 37. En la esquina superior derecha de Excel y WORD hay un recuadro con texto que dice “Escriba una pregunta”. Ud. no debe pasarse todo su tiempo aprendiendo cada función que estos programas ofrecen, pero en ocasiones necesitará aprender nuevas funciones y posibilidades. Este es el Laboratorio 1, por lo que las tablas deben numerarse como Tabla 1.1, Tabla 1.2, etc. De la misma manera, los gráficos deberán numerarse como Gráfico 1.1, Gráfico 1.2, etc. Cada gráfico, figura o tabla que Ud. inserte debe tener un título que describa su contenido. Este es el formato general de su informe de laboratorio. No olvide incluir las Preguntas 1, 2, 3. José Pérez, 15 de enero del 2008, Laboratorio 1 1. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados Fahrenheit (oF) a grados Celsius (ºC) (Su respuesta) 2. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados Fahrenheit (ºF) a grados absolutos (Kelvin)? (Su respuesta) 3. ¿Cuál es la ecuación que se utiliza para convertir la temperatura de grados absolutos (Kelvin) a grados Celsius (ºC)? (Su respuesta) 11 CONVERSION DE TEMP, José Pérez Temperatura (K) 1400 1200 1000 800 600 y = x + 273,15 R2 = 1 400 200 0 0 100 200 300 400 500 600 700 800 900 100 110 0 0 Temperatura (oC) Figura 1.1 Correlación entre las escalas de temperatura Celsius y Kelvin. En la esquina inferior derecha está la ecuación de ajuste (y=mx+b) y el coeficiente de correlación para la recta. III. Conversión de Unidades y un Gráfico Tridimensional. Construya la tabla 1.1 en su informe y complétela utilizando las conversiones de unidades de energía necesarias. Esta tabla debe aparecer en el informe, con el título “Tabla 1.1 Conversiones de Unidades de Energía.” 1,00 Caloría (cal) Kilocalorías (kcal) Horas Watt Segundos Watt Kilowatt Horas (kW/hr) Kilowatt segundos (kW/s) Joules (J) Kilojoules (kJ) Ergs Unidades Térmicas Británicas (UTBs) Tabla 1.1. Construya y complete esta tabla de conversión de energía en su informe. 12 Primero, vamos a realizar las operaciones para construir un gráfico 3-D (ejes x,y,z) en Excel utilizando los datos de la tabla que aparece a continuación de este ejercicio. a. Copie los valores X,Y,Z de la tabla en Excel. Los títulos de las accisas (X,Y,Z) deben colocarse en A1, B1, C1 y los valores numéricos en un bloque definido por A2….C16. b. En Excel, marque con el cursor las tres columnas (A2…C16). c. Seleccione “Insertar” en el menú superior, y después “Gráfico”. d. En el tipo de gráfico, selecciones “Superficie”. e. Seleccione el esquema gráfico que muestra un gráfico 3D. f. Seleccione “Siguiente”; ahora pruebe seleccionando “Filas” y “Columnas” alternativamente, para ver como quedará cada gráfico. X Y Z 1 0 0 2 2 5 3 4 10 4 6 15 5 8 20 6 10 25 7 12 30 8 14 35 9 16 40 10 18 45 11 20 50 12 22 55 13 24 60 14 26 65 15 28 70 Tabla 1.2. Datos a utilizar en la construcción de un gráfico 3D. g. En el menú superior, seleccione “Series” y note que tiene graficado 15 series, o que sus datos se han distribuido en 15 series de valores (x, y, z). 13 h. Seleccione “Siguiente”. En el cuadro de “Títulos”, escriba “Tiempo (s)” para el eje x, “Distancia (m)” para el eje, y “Reglas Químicas (diversión)” en el eje z, y “Su nombre” como el título del gráfico. Note que –TODOS LOS GRÁFICOS deben tener su nombre en la parte superior. Si no hay un nombre, no será evaluado! i. En el menú superior, seleccione “Líneas de división” y quite todas las marcas que aparezcan, al igual que en el menú “Leyendas”. j. Seleccione “Siguiente” y “Finalizar”. Su gráfico debe ser similar al siguiente: José Neutrón 80 60 Reglas Químicas 40 (diversión) 20 0 Tiem 1 2 3 po (s) C15 C8 Distancia (m) C1 Figura 1.3. Ejemplo de un gráfico 3D. Copie este gráfico en su informe. El título del gráfico debe ser “Tabla 1.2. Gráfico prueba en 3D”. Ahora Ud. va a crear un gráfico 3D basado en las unidades de energía de la Tabla 1 (arriba), el cual se titulará “Gráfico 1.3. Relaciones de energía”. Este gráfico va a ser generado en su hoja de cálculo y copiado después dentro de su informe. Asegúrese de incluir el título del gráfico y su nombre en la parte superior. 14 El eje de las x (columna A) será Joules (0,10,20,30,40,50,60,70,80,90,100). La celda A1 será para el título de la serie, y los valores deben colocarse en A2……A12. El eje de las y (columna B) serán las calorías. La celda B1 para el título, y en B2…B12 se utilizará primero la ecuación “=suma(A2/4,184)”, y después copiarla en la columna hacia abajo. El eje de las z (columna C) será para los kiloJoules. En la celda C1 el título, y en C2…C12 Ud. convertirá la columna A en kJ utilizando la ecuación “suma(A2/1000)”, después copiar y pegarla en el resto de las celdas de la columna. Una vez que haya introducido los valores en la Hoja de cálculo, asegúrese de escribir el título de las accisas, escriba SU nombre en la parte superior y siga el resto de las instrucciones para terminar el gráfico (quitar la Leyenda, etc.). Copie y pegue este gráfico en su documento WORD. Y tenga cuidado de que el mismo no ocupe más de 1/3 de la página. También asegúrese de escribir un pie de figura breve (1 oración) en la parte inferior. III. El pH y [H+]; Exponentes y logaritmos en Excel. En el curso de Química General, Ud. va a necesitar el uso de las funciones matemáticas log, ln y exponenciales. El objetivo de este ejercicio es la familiarización con operaciones básicas asociadas con este tipo de cálculos. Más adelante en el curso Ud. estudiará los conceptos de acidez y basicidad. La ecuación que se utiliza con más frecuencia es la que se define para el cálculo del pH a partir de la concentración de ión hidronio (H3O+): pH = -log10[H3O+] (1.2) De igual forma, la [H3O+] puede calcularse a partir del pH utilizando la ecuación: 15 [H3O+] = 10-pH (1.3) El pH es un número adimensional, mientras que [H3O+] tiene unidades de Molaridad (M, moles/litro). Utilizando su calculadora, complete la siguiente tabla (esta tabla debe aparecer en su informe como “Tabla 1.2. La escala de pH y de concentración del ión hidronio”). pH 1.0 (muy ácido) [H3O+] 7.0 (neutral) 14.0 (muy básico) -1 (ácido fuerte concentrado) 7.34 (la sangre) 8.3 (el océano) 4.0 (un poco ácido, un refresco) 10-7 M 10-4 M 10-10 M 2,3 x10-5 M 6,78x10-10 M 0,00712 M Tabla 1.3. Construya y complete esta tabla en su informe, en el cual debe aparecer como Tabla 1.2. En Excel, vamos a introducir aproximadamente 150 valores de pH, en incrementos de 0,1, y convertirlos a valores de [H3O+]. En la parte inferior de su Hoja de cálculo Excel, observe que aparecen los letreros Hoja1, Hoja2 y Hoja3. Ud. puede utilizar más de una hoja de cálculo dentro del mismo documento. 16 a. Abra una nueva Hoja de cálculo. b. En la celda A1 escriba el título “pH” c. En la celda A2 escriba el número “-1” d. En la celda A3 escriba la ecuación “=suma(A2+0,1)” e. Copie esta ecuación hacia abajo hasta la celda A152. El número que debe aparecer en esta celda es 14,0. Fíjese que el valor en A12 debe ser cero (0) pero en realidad no lo es (el valor que aparece es -1,4x10-16). Esto es un error de redondeo en la computadora, pero es lo suficientemente pequeño como para no tener importancia en estos cálculos. f. En B2 escriba la ecuación “=suma(10^-A2)”. No olvide el signo negativo de la ecuación. La función “ ^ ” se usa para elevar un valor a una potencia, en este caso, diez elevado a la potencia de 2. g. Copie y pegue la ecuación hacia abajo en la columna hasta la celda B152. h. Marque con el cursor A2..B152. i. Comience a construir el gráfico (seleccione “Insertar”, “Gráfico” de la misma manera que en los ejercicios anteriores). j. Una vez que el Asistente para Gráficos aparezca (Paso 1), seleccione el “Tipo de Gráfico” de “XY (Dispersión)”, y seleccione la imagen con líneas curvas, y después “Siguiente”. k. Asegúrese de que en “Series en” está marcado “Columnas”. l. Seleccione “Siguiente” (Paso 3). Escriba “pH” en el título del eje x, “Conc de Hidronio, M” en el eje y, y su nombre en el Título del gráfico. m. Elimine las “Líneas de división” y la “Leyenda”, y presione “Siguiente”. n. Su gráfico debe aparecer ahora en la Hoja de cálculo. Elimine el fondo gris de la misma manera que anteriormente. 17 o. Coloque la punta del cursor directamente en el eje x y presiones el botón izquierdo del ratón. Si lo hace correctamente, deben aparecer dos puntos negros en los extremos del eje. En este caso, presione el botón derecho hasta que aparezca “Formato de ejes”. p. Cambie la escala a -1 (mínimo) y 14 (máximo) y la unidad mayor a “1”. q. Si observa los valores de la columna B columna, notará que la mayoría de ellos son extremadamente pequeños (<0.001) y prácticamente no se pueden apreciar en el gráfico. Por ejemplo, Ud. no puede diferenciar entre los valores de Molaridad de 10-8, 10-10 y 10-13. r. Seleccione el eje y de la misma manera, y seleccione “Formato de ejes” nuevamente. s. Seleccione “Escala”, y ahora la “Escala logarítmica”. Presione “Aceptar”. t. Una vez más, selecciones el eje y de manera que aparezca “Formato de ejes”. u. Seleccione la ventana de “Número” en el menú superior, y la categoría “Científica”, con “2” posiciones decimales. Presione “Aceptar”. v. Fíjese en el gráfico ahora, y note la parte negativa (por debajo de cero). Este gráfico puede lucir diferente porque los estudiantes están acostumbrados a gráficos con valores de X y Y siempre positivos. w. Copie y pegue este gráfico en su documento WORD. Asegúrese de que las dimensiones son 2,5 pulgadas de altura y 3 pulgadas de ancho. Escriba el pie de figura correspondiente. Fíjese que el eje y representa la [H3O+]. x. En la esquina superior derecha de la Hoja de Excel está el área de “Escriba una pregunta”. Escriba la palabra “Exponente” y oprima la tecla “Aceptar” en la computadora. y. Busque el comando “Potencia”. Debajo del gráfico describa brevemente el uso de este comando. 18 V. Cinética de Primer Orden y un Gráfico Exponencial. Como parte del curso de Química General, Ud. estudiará los diferentes modelos que describen la velocidad de una reacción química. Esta área de la Química se denomina Cinética. Una de las ecuaciones más importantes es la ecuación que describe una reacción de primer orden y que permite estimar la concentración de un reaccionante en función del tiempo. Por ejemplo, la molécula de ozono (O3) se descompone lentamente para formar oxígeno (O2) 2O3(g) → 3O2(g) (1.4) La ecuación que permite el cálculo de la cantidad de ozono que queda después de un período de tiempo (t) es: ln(A) = -kt + ln(A0) (1.5) donde: Ao = concentración inicial de ozono k = constante de velocidad (h-1) A = concentración de ozono después de un tiempo (t) ln = logaritmo natural (basado en el número 2.7182818) Esta ecuación puede ser re-escrita a: A/Ao = e-kt (1.6) Y finalmente queda de la forma en que la utilizaremos: A = Aoe-kt (1.7) Para este ejercicio vamos a asumir una concentración inicial de 10-5 M y una constante e velocidad de 0,23 h-1 ó 0,00385 min-1. 1. Abra una nueva hoja de cálculo. En “A1” escriba el título “Tiempo (min)” 2. En la celda A2 coloque el número “0” 3. En A3 escriba la ecuación “=suma(A2+1)” y cópiela hacia abajo hasta la celda A622. 4. En B1 escriba “Conc A’ 19 5. En B2 escriba la ecuación “=EXP(-A2*0,00385)*10^-5” . Esta es la ecuación X arriba. A2 representa el tiempo, 0,00385 es la constante de velocidad y 10^-5 es la concentración inicial (definida arriba). 6. Copie y pegue esta ecuación hacia abajo en la columna hasta la celda B602. 7. Utilice el comando de gráficos y siga los procedimientos comunes (Gráfico, XY (Dispersión), eliminar las Líneas de División, eliminar la Leyenda, etc., para un gráfico 2D). Nombre el eje de las x como “Tiempo (min)” y el eje de las y como “[A]” y escriba su nombre en la parte superior del gráfico. 8. El gráfico que Ud. Ha obtenido se define como un decaimiento exponencial. En este caso en particular el reactivo (A u O3) disminuye con el tiempo. 9. Vaya al menú superior “Ver” y seleccione “Barras de Herramientas” y después “Dibujo”. 10. Una vez que esta barra de herramientas aparezca, seleccione el comando de líneas, el cual aparece como una línea inclinada. Selecciónelo con el ratón. Seleccione el punto 4*10-6 en el eje y y trace una línea recta desde el eje hasta la línea de decaimiento exponencial (vea la Figura x). 11. A partir del punto sobre la línea, trace una línea hacia abajo hasta el eje x. 12. Si Ud. presiona el botón izquierdo del ratón en ese punto, Excel le mostrará el valor (x,y). 13. Ahora seleccione un punto sobre la línea graficada y presione el botón derecho del ratón. Un número de puntos sobre la línea deben iluminarse. 14. Seleccione el commando “Añadir línea de tendencia”. Obviamente, el ajuste aquí no puede ser lineal (ej. y = mx + b). Esto es una curva. 15. Seleccione “Exponencial”, y después vaya al menú de “Opciones” y “Presentar ecuación en el gráfico” y “Presenta el valor R cuadrado en el gráfico”, y “Aceptar” a continuación. 16. Mueva el texto hacia unas de las esquinas del gráfico, separándolo de la línea de ajuste. 20 José Neutrón 0,000012 0,00001 -0,0038x y = 1E-05e 2 R =1 [A] 0,000008 0,000006 0,000004 0,000002 0 0 100 200 300 400 500 600 700 Tiempo (min) Figura 1.3. Curva de decaimiento exponencial y línea de ajuste de los puntos, con el coeficiente de correlación. Estos ejercicios le servirán para familiarizarse con los aspectos diferentes que se utilizan para realizar cálculos y elaborar gráficos en Excel. Copie el gráfico en su informe e incluya un título apropiado y numerado para el gráfico. En la preparación de su informe, deberá tomar en cuenta los siguientes aspectos: 1. ¿Aparece su nombre en la parte superior de cada gráfico? (ej. ver fig. 1.3, “José Neutrón”) 2. ¿Están correctamente identificados los ejes de su gráfico con las unidades correspondientes (ej. Tiempo(min)) 3. ¿Las dimensiones de todos sus gráficos no exceden las 3 pulgadas de ancho por tres pulgadas de altura? 4. ¿Tienen todos los gráficos un pie de figura apropiado con la numeración correspondiente? ¿Están ordenados secuencialmente estos pies de figura? 5. ¿Respondió Ud. todas las preguntas con oraciones completas? ¿Utilizó correctamente los subíndices y supraíndices en estas oraciones (en caso de ser necesario)? 21 6. ¿Aparece su nombre completo y su identificación en la parte superior de la primera página del informe? 7. ¿Están insertados los números de página en el informe (esquina inferior, a la derecha)? 8. ¿Está escrito su informe en formato de doble espacio, con letra 12 y una pulgada para los márgenes? 9. ¿Sabe Ud. si su instructor requiere que le entregue una copia dura del informe o sólo el archivo digital? En caso de que sea una copia en papel, ¿está adecuadamente presillada? 10. ¿Necesita su informe algún tipo de referencias? (en este ejercicio en específico no se requiere, pero en el futuro puede ser necesario incluir alguna referencia bibliográfica). A partir de aquí y en el resto de los ejercicios de este manual se asumirá que Ud. ha completado este laboratorio y por lo tanto, se encuentra familiarizado con el formato y los procedimientos para elaborar un informe de laboratorio. 22 Ejercicio 2. Enlaces y Pares de Electrones Libres en Moléculas Pequeñas: Introducción al Spartan Objetivos de este ejercicio: 1. Introducir a los estudiantes al programa de modelación molecular (Spartan). 2. Que los estudiantes construyan y visualicen algunas moléculas pequeñas en dos y tres dimensiones. 3. Que los estudiantes calculen y determinen algunos parámetros geométricos básicos como las distancias y ángulos de enlace utilizando estructuras tridimensionales. Los estudiantes realizarán el nivel más sencillo de un análisis teórico (Mecánica Molecular) y la determinación de distancias de enlace y ángulos de enlace de veinticinco moléculas de uso general. El modelo de la repulsión de pares de electrones de la capa de valencia (VSEPR) es un modelo que se usa para predecir enlaces, pares de electrones libres y las geometrías que se derivan de estos para muchas de las moléculas pequeñas. La Teoría de Orbitales Moleculares (TOM o MOT, en inglés) permite la predicción del orden de enlace y las características paramagnéticas o diamagnéticas de una molécula. Para la construcción de estas especies, resulta muy útil seguir las reglas que aparecen en la tabla 2.1. Elemento Carbono Nitrógeno Oxígeno Flúor Neón Hidrógeno # de enlaces 4 3 2 1 0 1 # de pares de 0 1 2 3 4 0 electrones libres Total 4 4 4 4 4 1 Tabla 2. 1 Para la construcción de moléculas no metálicas pequeñas, el número de enlaces y pares de electrones libres sigue las tendencias indicadas (al menos la mayoría de las veces!). De acuerdo con las propiedades periódicas, las moléculas de cloro, bromo y yodo a menudo se comportan como flúor, y el azufre se comporta como oxígeno. 23 Cada enlace consiste de dos electrones y cada par libre también consiste de dos electrones. Tanto los enlaces como los pares de electrones libres ocupan un espacio alrededor del átomo central. Como los electrones están cargados negativamente, los enlaces y pares libres se repelen entre sí. Los enlaces pueden ser simple, doble o triple, e involucrar dos, cuatro o seis electrones, respectivamente. Por ejemplo, el carbono en la molécula de CH4 tiene cuatro enlaces simples, en el CH2O tiene dos simples y uno doble, en el CO2 tiene dos dobles enlaces, mientras que en el HCN, el átomo de carbono tiene un enlace simple y uno triple. En cada uno de estos casos, la suma de los enlaces es igual a cuatro. De manera similar, los átomos de oxígeno en la molécula de CH2O y CO2 tienen dobles enlaces, mientras que el hidrógeno de cada especie tiene un enlace simple y el nitrógeno en el HCN tiene un triple enlace con el carbono. Ahora Ud. debe reproducir la tabla 2.2 en su informe, creando una tabla de dimensiones similares, con el mismo formato y conteniendo las moléculas en el mismo orden. Siguiendo las reglas que aparecen en la tabla 2.1, dibuje las estructuras de las moléculas con el número correcto de enlaces y pares de electrones libres. Para lograr la geometría correcta en dos dimensiones, tome en cuenta que: si se trata de cuatro enlaces simples, el ángulo de enlace debe ser 90º; si se trata de un enlace doble y dos simples, estarán separados en un ángulo de aproximadamente 120o, si son tres enlaces simples y un solo par de electrones libres, el ángulo será 90o (recuerde, los pares libres ocupan espacio también!), y si se trata de dos dobles enlaces, entonces la separación es de 180o. En resumen, al dibujar una estructura, lo más importante para obtener la geometría correcta es colocar los enlaces y los pares de electrones libres simétricamente alrededor del átomo central (ver la figura 2.1). Estas imágenes pueden crearse en programas como “Paint”, “ISIS” o “WORDART”. 24 A X Y C B Y Y Y Y Y X Y F E D Y X Y Z Y X Y Z Z Y H G I Z Z Y X Y Y Y Y Y X Y Z Y Figura 2.1. Ejemplo de como dibujar estructuras en dos dimensiones para diferentes moléculas. Estas estructuras pueden relacionarse con algunas de las moléculas den la tabla 2. Las letras X, Y, y Z se utilizan para representar los átomos y las líneas son los enlaces simples, dobles o triples. (A) El átomo central (X) tiene cuatro enlaces simples y no tiene pares de electrones libres, mientras que los átomos enlazados (Y) tienen un solo enlace simple y ningún par libre. (B) El átomo central (X) tiene dos dobles enlaces y ningún par de electrones libres, mientras que los dos átomos (Y) enlazados tienen dos enlaces y dos pares de electrones libres. (C) Los dos átomos tienen un enlace simple cada uno, y ningún par de electrones libres. Las moléculas diatómicas no tienen ángulo de enlace. (D) El ángulo central (X) tiene un enlace triple y uno simple, mientras que uno de los otros átomos, (Y), tiene un enlace triple y un par de electrones libres y el otro átomo, (Z), tiene un enlace simple y ningún par de electrones libres. (E) El átomo central (X) tiene tres enlaces simples y un par de electrones libres, mientras que los tres átomos enlazados (Y) tienen un enlace simple y ningún par de electrones libres. (F) Los dos átomos idénticos (Z) tienen dos enlaces (un doble enlace) y dos pares de electrones libres. (G) El átomo central (Z) tiene dos enlaces simples y dos pares de electrones libres, mientras que los dos átomos enlazados (Y) tienen un enlace simple y ningún par de electrones libres. (H) El átomo central (X) tiene un doble enlace y dos enlaces simples, y ningún par de electrones libres, mientras que uno de los átomos enlazados, (Z), tiene un enlace doble y dos pares de electrones libres, y los otros átomos enlazados (Y) tienen cada uno un enlace simple y ningún par de electrones libres. (I) El átomo central (X) tiene cuatro enlaces simples y el otro átomo con enlaces múltiples, (Z), tiene dos enlaces y dos pares de electrones libres. Los otros átomos (Y) todos tienen enlaces simples y ningún par de electrones libres. Construya la tabla que aparece a continuación en un documento separado y escriba (solamente) las fórmulas empíricas. El título debe ser “Tabla 1. Geometrías de Moléculas Pequeñas en Dos Dimensiones.” Las otras columnas (nombre, estructura, # enlaces) serán completadas con lápiz. Asegúrese de utilizar subíndices en las fórmulas (es decir, CH4, no CH4). 25 Tabla 2.2 Construya esta tabla en otro documento y dibuje dentro las estructuras con uno de los programas 2D (ISIS, WordArt, Saint, etc.). SU nombre debe aparecer en la parte superior de la primera página. Fórmula Empírica Nombre Estructura # enlaces # de pares de electrones libres 1. CH4 2. H2CO 3. (CH3)2CO 4. HCN 5. N2 6. O2 7. H2 26 8. NH3 9. F2 10. Cl2 11. Br2 12. I2 13. H2O 14. H2S 15. HF 27 16. HCl 17. (NH2)2CS 18. CH3OH 19. C2H6 20. C2H4 21. C2H2 22. CCl4 23. N2H4 28 24. H2O2 25. C6H6 (ayuda: es un anillo) Hay dos puntos importantes que debemos recordar cuando se usan las reglas de la tabla 2.1 como guía para representar moléculas pequeñas, 1. Existen reglas sencillas que funcionan con muchas de las moléculas pequeñas no metálicas, pero también hay algunas excepciones notables, como el monóxido de carbono (CO) y el ozono (O3). Cuando realicemos laboratorios más avanzados sobre geometría e hibridación moleculares, observe que estas reglas no siempre funcionan para átomos y moléculas de mayor tamaño. 2. La representación de estas moléculas en dos dimensiones no siempre brinda una imagen exacta de la cómo existe esta molécula en tres dimensiones. Ud. utilizará el programa Spartan para construir las moléculas en tres dimensiones y realizar algunos cálculos sencillos. Asegúrese de que su primera tabla haya sido terminada antes de pasar a la sección siguiente y que tenga un encabezamiento apropiado en la primera página (su nombre, fecha, título del ejercicio, etc.) Ud. debe tener un icono de Spartan en el escritorio de la computadora. Abra el programa, y si ya está abierto, asegúrese de cerrar todas las estructuras que estén presentes (Seleccione “File” y después “Close”). Guarde su trabajo regularmente en una memoria personal (ej. HDD personal o memoria extraíble). Muchas de las computadoras en las universidades y bibliotecas tienen programas 29 instalados que pueden borrar su archivo por razones de seguridad, si se guarda automáticamente en el disco duro. Para el trabajo futuro, es sumamente importante que recuerde guardar y cerrar las estructuras anteriores que haya realizado. 1. En la esquina superior derecha, seleccione “Options”. 2. Seleccione “Colors”. Debe aparecer “Background”. Puede ajustar el color de fondo. Para copiar y pegar estas imágenes, el color de fondo ideal es el blanco. Ajuste el fondo a blanco ahora. A medida que Ud. construya las diferentes moléculas, puede utilizar este comando para ajustar el color de los diferentes átomos seleccionándolos con el botón izquierdo del ratón (por ejemplo, para dibujar de verde todos los átomos de carbono, seleccione un carbono y utilice este comando). Cierre esta ventana. 3. Ahora, seleccione “File” y “New”. En el lado derecho debe aparecer un cuadro con tipos de átomos a seleccionar. 4. Seleccione el átomo de carbono con cuatro enlaces y coloque y presione el cursor en el centro de su área de trabajo. Debe aparecer un átomo de carbono mostrando cuatro enlaces. 5. Ahora, seleccione el átomo de hidrógeno con un enlace simple. Coloque y presione el cursor en los extremos de los cuatro enlaces de carbono, uno a la vez, y verá como aparece el átomo de hidrógeno. 6. Coloque el cursor en cualquier lugar del área de trabajo que no sea la molécula y rótelo. Esta molécula (Metano) tiene cuatro enlaces simétricos cuando se observa en tres dimensiones. Cuando se analizan los ángulos de enlace, su estructura es diferente a la estructura que Ud. representó anteriormente (Tabla 2). 7. Presione la tecla “Shift” y oprima y mueva el botón derecho del ratón hacia abajo. El tamaño de la molécula puede hacerse mayor o menor utilizando este comando. 30 8. Utilizando el comando “Model” en el menú superior, Ud. puede cambiar la apariencia de la estructura, una vez que haya realizado su optimización (lo cual haremos más adelante en el paso 11). En este manual utilizaremos el modelo de bolas y varillas (“ball and spoke”). 9. En el menú de “Model”, seleccione “Labels”. Este comando enumera los átomos. Dependiendo del esquema y selección de colores, Ud. puede o no ser capaz de ver estos números. Si no puede ver estos números con el fondo blanco, pruebe a cambiar el color. 10. También en el menú “Model”, seleccione “Configure” y después “Mass Number.” Este comando asigna las masas (ej. C=12 g/mol). Esto puede ser útil en moléculas grandes conteniendo varios elementos (C, N, S, O, etc), los cuales son difícil de distinguir entre sí. Una vez que Ud. vea esto, cancele la selección y retorne a los números asignados a los diferentes átomos. 11. En el paso próximo, Ud. minimizará la energía molecular. Seleccione “Build” y “Minimize.” Note que dice ENERGY en la esquina inferior derecha. Para construir moIéculas más grandes, el comando para minimizar puede ser de gran utilidad para lograr la estructura aproximada a medida que la va construyendo. 12. Seleccione “Setup” y “Calculations.” 13. Comenzando por la parte superior, seleccione: “Single Point energy” “Molecular mechanics” y “MMFF” “Initial” Check “Symmetry” Total Charge “Neutral” Compute (no seleccione ninguno) Multiplicity “Singlet” Print (no seleccione ninguno) Seleccione “Check on Converge”, and “OK”. Vaya al menú superior “Setup” y seleccione “Submit”. Escriba un nombre, por ej. “Metano”, y “Save”. Seleccione “OK” si aparece que su molécula está comenzada y terminada. 14. En su informe, elabore una tabla que tenga cuatro columnas y veintiuna filas. La tabla 3 muestra en forma abreviada como debe verse su tabla (en este caso sólo hay tres filas). 31 15. Haga su molécula de Metano lo suficientemente grande como para que ocupe todo el área. 16. Puede numerar los átomos en la pantalla, si está con la apariencia de “ball and wire” o “wire”. Esto será importante para la asignación de distancias y ángulos de enlaces. 17. En Spartan, seleccione “Edit” y después “Copy” 18. En el documento de su informe, que también debe estar abierto, coloque el cursor en la estructura del Metano e insértela (Edición, Pegar). Generalmente, la estructura aparece muy grande para el cuadro de imagen, y Ud. tendrá que reducir su tamaño hasta que ajuste adecuadamente. 19. El programa Spartan y el documento con su informe deben estar abiertos al mismo tiempo. 20. Vaya al Spartan y seleccione “Geometry” y “Measure distance”, y determine las distancias de enlace de los cuatro enlaces C-H, uno a la vez. Realice esta operación posicionando y oprimiendo el cursor en el enlace, y copiando los valores de las cuatro distancias que se muestran en la esquina inferior derecha (están en Angstroms). Note que en la esquina inferior derecha los números de los átomos están incluidos en el reporte de las mediciones. 21. Asegúrese de incluir las unidades. Si Ud. está re-utilizando WORD, puede ir a “Insertar” y “Símbolo” y encontrar el símbolo de Angstrom. 22. Vaya al Spartan y seleccione “Geometry” y “Measure angle.” Es importante que estas operaciones se realicen en la secuencia adecuada: seleccione el átomo de Hidrógeno con el cursor (debe colorearse), entonces seleccione el átomo de Carbono y el otro átomo de Hidrógeno. Repita esto para los cuatro ángulos de enlace. Si Ud. se equivoca al realizar esta operación (ej. C, H, H), no va a obtener el ángulo de enlace del átomo central. 23. Cuando termine de trabajar con la molécula de metano, guarde su trabajo, preferiblemente en una memoria o disco externo, y cierre su hoja de trabajo (Seleccione “File” y “Close”). Seleccione “New” en el menú principal, para poder trabajar en la representación de una nueva estructura. 32 24. Ahora haremos el mismo procedimiento para la molécula de (CH3)2CO o acetona, pero con una pequeña diferencia. Si observa el menú de elementos a la derecha de su área de trabajo, notará en el menú “Entry” un átomo de carbono con un doble enlace y dos enlaces simples. Selecciónelo, y coloque y oprima el cursor en el centro de su área de trabajo. Debe aparecer un átomo de carbono con los tres enlaces. 25. Seleccione ahora el átomo de oxígeno con un doble enlace (=O). Agregue el oxígeno a la estructura (en el doble enlace del carbono), y después seleccione el carbono tetraédrico (con cuatro enlaces simples) y colóquelo en los dos enlaces simples del carbono. Complete los enlaces restantes con átomos de hidrógeno, minimice y rote la molécula. Tabla 2.3. La segunda tabla en su informe debe tener de 3 a 4 páginas de longitud (en dependencia del tamaño de sus estructuras) e incluya las 25 moléculas en el mismo orden que están en la tabla 2 (arriba). En su informe, esta tabla debe estar titulada “Tabla 2. Moléculas Pequeñas en Tres Dimensiones; Resultados Computacionales.” En aquellas moléculas donde el mismo enlace produce el mismo ángulo o distancia de enlace varias veces (ej. Vea el CH4 debajo), sólo escriba la distancia o el ángulo respectivo una vez. Fórmula Empírica Estructura Ángulos, distancias y Nombre CH4 metano CO2 Dióxido de C-H(todos) 1.096 Å (4 enlaces C-H iguales) H-C-H 109.47o (todos los ángulos H-C-H son iguales) C=O(1) 1.096 Å C=O(2) 1.096 Å O=C=O 180o carbono 33 Realice todos los pasos mencionados arriba (construir, número de átomos, minimizar, calcular, medir, guardar, cerrar) para las 25 especies moleculares que aparecen en la tabla 2. Cuando Ud. complete esta tabla, debe haber desarrollado imágenes mentales de algunas de las estructuras más comunes que se encontrará en el curso de Química. También debe notar que la Mecánica Molecular está basada en la Física Newtoniana, y no se considera el método computacional más exacto. Por otra parte, este método es mucho más rápido que otros niveles de teoría. Esto es un compromiso común en Química Computacional: para realizar cálculos más exactos se requiere de computadoras más poderosas y tiempos de cálculo más largos. Niveles más bajos de teoría pueden realizarse en una computadora personal en cuestión de segundos. Para nuestro trabajo de laboratorio, los resultados aproximados alcanzados con la mecánica molecular son aceptables. En su informe, comente sobre las siguientes tendencias que se observan en sus datos. Incluya aquellos números/datos que fundamenten sus argumentos. Nombre esta sección en su informe como “Tres estructuras dimensionales y tendencias observadas en las distancias de enlaces.” 3a. Compare las distancias de enlaces de los enlaces carbono-carbono simple, doble y triple en las estructuras 19, 20 y 21 utilizando sus resultados computacionales. ¿Qué impacto tiene en incrementar el número de enlaces en la distancia de enlace promedio? 3b. Compare y comente sobre las distancias de enlace C-H en las estructuras 1, 3, 4, 18, 19, 20, y 21. ¿Son iguales o diferentes? ¿Por qué? 3c. Compare las distancias de enlaces simple y triple en el enlace nitrógeno-nitrógeno de las estructuras 5 y 23. ¿Cuál es la más larga y cuál es la más corta? ¿Cuál es más fuerte y cuál más débil? 3d. Compare las distancias de enlace simple y doble del oxígeno en las estructuras 6 y 24. ¿Cuál es la más larga y cuál es la más corta? ¿Cuál es más fuerte y cuál más débil? 3e. Compare las distancias de enlace carbono-carbono en los enlaces simple y doble de las estructura 25. ¿Cuál es la más larga y cuál es la más corta? ¿Cuál es más fuerte y cuál más débil? 34 Ejercicio 3. Simulación de una Curva de Valoración de una Base Fuerte con un Ácido Fuerte Objetivos de este ejercicio: 1. Reforzar en los estudiantes los conceptos de las reacciones ácido-base, específicamente entre un ácido fuerte con una base fuerte. 2. Los estudiantes simularán una curva de valoración para la adición de un ácido fuerte (bureta) sobre una base fuerte (beaker). Introducción. En este ejercicio se utiliza una hoja de cálculo para simular la curva de valoración que se obtiene con la adición de un ácido fuerte a una base fuerte. Los estudiantes reciben instrucciones para realizar los cálculos paso a paso, simulando la reacción de neutralización en la valoración de una solución de hidróxido de sodio (NaOH) con ácido clorhídrico (HCl), ambos en fase acuosa. Al final del ejercicio, el estudiante debe tener calculada y graficada una curva de valoración que cubra el rango desde la zona muy ácida (pH=1) hasta la zona muy básica (pH=13). Las dos reacciones fundamentales son: HCl(aq) + NaOH(aq) 2H2O(l) → → H2O(l) + NaCl(aq) H3O+(aq) + OH-(aq) (1) (2) Se generará un informe de laboratorio, el cual incluirá preguntas previas, la curva de valoración obtenida, y las preguntas finales del laboratorio, todo dentro de un mismo documento. Su instructor 35 puede asignarle una curva de valoración adicional para calcular, graficar e incluirla en este informe (ver ejercicios adicionales). Utilice el mismo encabezamiento de los laboratorios 1 y 2 para esta práctica (título, su nombre, nombre del instructor, fecha). Asegúrese de numerar las preguntas previas al laboratorio, y mostrar todos los cálculos y razonamientos realizados. Su instructor le indicará si debe escribir todo el trabajo, o solo las preguntas, y responder en una hoja aparte. Las preguntas previas son las siguientes: 1. Calcule el pH, pOH, [OH-], [H+] del agua pura. 2. Calcule el pH, pOH, [OH-], [H+] de HCl 0.1 M. 3. Calcule el pH, pOH, [OH-], [H+] de NaOH 0.1 M. 4. Calcule el pH, pOH, [OH-], [H+] si se mezclan 50 mL de HCl 0.1 M y 100 mL de NaOH 0.1 M. 5. Calcule el pH, pOH, [OH-], [H+] si se mezclan 100 mL de HCl 0.1 M y 100 mL de NaOH 0.1 M. 6. Calcule el pH, pOH, [OH-], [H+] si se mezclan 150 mL de HCl 0.1 M y 100 mL de NaOH 0.1 M. El nombre/título y preguntas previas debe extenderse hasta un máximo de dos páginas, y su gráfico debe pegarse en una hoja separada con un pie de figura (ej. Figura 1. Una hoja de cálculo se utilizó para generar…). La primera curva se construirá siguiendo las instrucciones que aparecen debajo. Una vez terminada, su instructor puede asignarle otra valoración en condiciones diferentes para que construya su propia curva. Un ejemplo típico puede encontrarlo a continuación de las preguntas finales del laboratorio. En general, la forma continúa siendo la misma, pero puede haber algunas diferencias en dependencia del experimento que está simulando. Ahora comenzaremos con la simulación paso a paso de una curva de valoración. La curva de valoración que Ud. construya es una réplica de la valoración de una base fuerte (100 mL de NaOH 0.1 M, en un beaker) con un ácido fuerte (HCl 0.1 M), utilizando incrementos de un mililitro. Se añade un total de 198 mililitros de HCl, de manera que en la curva simulada se representen apropiadamente las regiones en las cuales hay un exceso de ácido y base (x-s). Este laboratorio asume que Ud. ha 36 completado el Laboratorio 1, en el cual se explican muchas de las operaciones básicas de Excel. También existen ciertas formas de condensar y reagrupar estas operaciones en la hoja de cálculo, pero en este ejercicio se presenta en formato de paso a paso, de manera que el estudiante pueda seguir fácilmente cada paso. Guarde su trabajo regularmente en una memoria personal (ej. HDD personal o memoria extraíble). Muchas de las computadoras en las universidades y bibliotecas tienen programas instalados que pueden borrar su archivo por razones de seguridad, si se guarda automáticamente en el disco duro. a. En la celda A1, escriba el título “Conc. NaOH.” En la celda A2, escriba el valor 0,1 y cópielo hasta la celda A200. Esta es la concentración inicial de la base fuerte, la cual está en el beaker. b. En la celda B1, escriba el título “Conc. HCl.” En la celda B2, escriba el valor 0,1 y cópielo hasta la celda B200. Esta es la concentración inicial del ácido fuerte, que se encuentra en la bureta. c. En la celda C1, escriba el título “mL NaOH.” En la celda C2, escriba el valor 100 y cópielo hasta la celda C200. Este es el volumen de NaOH que están en el beaker. d. En la celda D1, escriba el título “mL añadidos de HCl.” En la celda D2, escriba el valor 0,0. Entonces, utilizando el comando “=SUMA(D2+1)”, el cual debe escribirse en D3, copie el comando hacia abajo hasta la celda D200. Debe haber un incremento en una unidad en cada celda, siendo el valor en D200 igual a 198. Esta columna representa la adición de 1 mL de HCl durante la valoración. e. En la celda E1, escriba el título “mL de NaOH después de la reacción de neutralización”. En la celda E2 escriba el comando lógico “ =SI(C2>D2,SUMA(C2-D2),"") ”. Copie y pegue este 37 comando en la columna hasta la celda E200. El valor debe disminuir en una unidad en cada celda, y el valor de la celda E101 debe ser 1. Esta columna representa la cantidad de NaOH que no ha sido neutralizado. Después de este punto en la valoración (E101), Ud. ha neutralizado todo el NaOH y tendrá una solución neutra o un exceso de ácido. Ud. le está pidiendo a la hoja de cálculo que compare los valores en C2 y D2 y que determine cuál es mayor. Si C2 es mayor que D2, realizará la sustracción “C2-D2”. Esto se define como un comando lógico. Si C2 es menor que D2, entonces la respuesta es ningún valor. En la esquina superior derecha de Excel hay un comando de Ayuda que puede utilizarse para esclarecer esta operación u otro comando que Ud. desee utilizar. f. En la celda F1, escriba el título “mL de HCl sin reaccionar después de la reacción”. En la celda F2, escriba el comando lógico “=SI(D2>C2,SUMA(D2-C2),"") ”. Copie y pegue este comando en la columna hasta la celda E200. De F2 a F102 deben ser celdas en blanco. En F103 debe aparecer el número 1 y este debe incrementarse en una unidad hasta la celda F200, en la cual debe leerse “98”. Los valores numéricos en esta columna (1,2,3,4,5…) representan los mililitros de HCl 0.1 M que quedan después de la reacción de neutralización (Ecuaciones 1,2). g. En al celda G1, escriba “Volumen Total en litros”. En la celda G2 escriba la fórmula “=SUMA(C2+D2)/1000 ”. Esta ecuación suma el número total de mililitros en el beaker (C2 + D2), y lo divide por 1000 para convertir de mL a litros. Esta operación es necesaria porque las concentraciones son en Molaridad (moles/litro). h. En la celda H1, escriba el título “Concentración de base x-s”. En la celda I2, escriba la formula lógica “=SI(E2>0,SUMA(A2*(E2/1000)/G2),"") “. Copie esta ecuación en la columna hasta H200. Este comando determina si hay un exceso de base después de cada adición, analizando la 38 columna E. Si hay un exceso de base, la cantidad de base se determina multiplicando los mililitros en exceso de NaOH (E2) por su concentración (A2), el cual da los moles de base en exceso (es decir, moles = m V). El término de los mililitros debe dividirse por 1000, para poder convertir de mililitros a litros. Para convertir los moles totales de base en exceso a molaridad, es necesario dividir por el volumen total en litros (G2). i. En la celda I1, escriba el título “Concentración de ácido x-s”. En la celda I2 escriba la formula lógica “ =SI(F2>0,SUMA(B2*(F2/1000)/G2),"") “. Copie esta ecuación en la columna hasta I200. Ud. debe comenzar a ver valores reales a partir de I103. Esta ecuación determina si queda ácido en exceso (columna F) después de la adición del ácido a la base. Si existe el exceso (x-s), se calcula la molaridad del ácido presente multiplicando la molaridad (B2) por el volumen en exceso (F2), para dar los moles de ácido en exceso. Los moles de ácido en exceso se dividen a continuación por el volumen total (recuerde que Ud. está mezclando dos soluciones) de la solución, en litros (G2). j. En la celda J1, escriba el título “pOH, x-s base”. En J2, escriba la formula lógica “=SI(H2>0,1*LOG(H2),"") “ y cópiela en la columna hasta J200. Si la cantidad de hidróxido es mayor que la cantidad de ión hidronio (H3O+) presente, entonces se calcula el pOH de la solución. k. En la celda K1, escriba el título “pH, x-s base”. En K2 escriba el comando lógico “ =SI(J2>0,SUMA(14-J2)) “. Este comando convierte el pOH a pH para los puntos de la valoración en los cuales hay un exceso de base, y utiliza la fórmula pH=14-pOH. l. En la celda L1, escriba el título “pH, x-s ácido”. En la celda L2, escriba el comando lógico “=SI(I2>0,-1*LOG(I2),"") “. Cópielo en la columna hasta L200. Este comando determina si la 39 concentración de H3O+ (exceso de HCl) es mayor que la de OH-. Si lo es, utilize la ecuación pH = -log(H3O+). m. En la celda M1, escriba el título “Neutral”. Hasta este punto, todos nuestros cálculos se relacionan con el exceso de ácido o de base. Todavía no hemos realizado un cálculo en el cual los moles de ácido y los moles de base son iguales. Debe haber una adición particular o punto de valoración que defina este valor. En la celda M2, escriba el comando lógico “ =SI(A2*C2=B2*D2,SUMA(7*1),"") “. Cópielo en la columna hasta M200. Este comando calcula los moles de ácido (B2, D2) y los moles de base (A2,C2) a partir de los moles equivalentes = MV. Si los moles son iguales, entonces aparece un valor o un pH de 7,0, el cual es el punto de equivalencia. En este momento Ud. Debe haber sido capaz de completar todos los cálculos necesarios para generar una curva de valoración. Ahora vamos a graficar esta curva en tres segmentos del mismo gráfico. La figura 3.1 muestra cómo debe aparecer su gráfico terminado (con su nombre en el encabezamiento, por supuesto!). a. Seleccione “Insertar” en el menú superior, y después “Gráfico”. b. En el menú de “Tipos estándar”, seleccione “XY (Dispersión)”, y después seleccione el subtipo que sólo muestra los puntos. c. Seleccione “Siguiente” y a continuación “Serie”. Seleccione “Agregar” y coloque el cursor dentro del cuadro “Valores de X”. El eje x siempre será el volumen añadido en la curva de valoración. Marque las celdas D2…D101 en la hoja de cálculo. El siguiente comando debe aparecer en el cuadro “ =Hoja1!$D$2:$D$101 ”. Generalmente resulta más fácil marcar las celdas que se desea graficar que escribir este comando en el cuadro. 40 d. Ahora posicione el cursor en el cuadro del “Valores de Y”, y marque en la hoja de cálculo las celdas K2…K101. En el cuadro de “Nombre” escriba “Exceso de base”. Su fichero Excel debe mostrar la parte básica de la curva de valoración. e. A continuación vamos a graficar el punto singular que representa el punto donde los moles de ácido se igualan a los moles de base. Seleccione en Serie el comando “Agregar” nuevamente. Coloque el cursor en el cuadro de “Valores de Y”, y después seleccione la celda M102 (la cual debe contener el número 7). f. Seleccione el cuadro “Valores de Y” y después la celda D102. Esta celda contiene el valor de la cantidad de ácido añadida. En el cuadro “Nombre”, escriba “Ácido=Base”. Este es el punto de equivalencia. g. Seleccione “Agregar” para incluir una serie más, esta vez con los valores que representan la región donde existe un exceso de ácido. Coloque el cursor en el cuadro “Valores de Y” y marque a continuación las celdas L103…L200. h. Coloque el cursor en “Valores de X” y marque las celdas D103….D200. En el “Nombre” escriba “Exceso de Ácido” y después “Siguiente”. i. En “Título del gráfico” escriba “Valorar BF con AF, SU NOMBRE” j. En “Eje de valores (X)” escriba “Volumen añadido de HCl 0.1 M (mL)” k. En “Eje de valores (Y)” escriba “pH” l. En el menú superior “Ejes”, asegúrese de marcar los cuadros “Eje de valores (X)” y “Eje de valores (Y)”. m. En el menu “Leyenda”, marcar “Mostrar leyenda” n. Seleccione “Siguiente”. Puede seleccionar si desea mostrar su gráfico en la misma hoja de cálculo, o en una hoja separada. En este caso, simplemente seleccione “Hoja1”. o. Ahora puede copiar y pegar el gráfico terminado en su informe de laboratorio en el documento Word. 41 Valorar BF con AF, Jose Neutron 14 12 10 Exceso de acido pH 8 acido-base 6 exceso de base 4 2 0 0 50 100 150 200 250 Vol HCl (mL) Figura 3.1. La curva de valoración completa para la valoración de una base fuerte con ácido fuerte, en incrementos de 1 mililitro. Está graficada en tres segmentos. Preguntas Finales. Incluya las respuestas a estas preguntas en su informe. 1. ¿Los ácidos y bases fuertes tienen constantes de equilibrio? (Ka, Kb). ¿Qué porciento de un ácido fuerte se disocia (ej. HCl)? 2. ¿Cuáles son los iones inertes en la valoración simulada en este ejercicio? ¿Tienen estos iones un impacto significativo en el pH después de cada adición? 3. Si Ud. valora 100 mL de una solución de KOH 0.1 M con 200 mL de HNO3 0.1 M, en incrementos de 1 mL, ¿cómo sería la curva de valoración en comparación con la curva que se muestra en la Fig. 3.1? 42 4. Utilizar una computadora para similar una valoración es una situación ideal y excluye todo tipo de errores experimentales. Diga dos errores experimentales posibles, uno de manipulación y otro instrumental, que puedan dar lugar a una curva de valoración que tenga una forma ligeramente diferente a la que se genera por computadora. 5. Utilizando un programa de dibujo 2-D, haga el esquema de la forma de una curva de valoración en la cual una base fuerte se valora con un ácido fuerte (ayuda: es el opuesto de la valoración que Ud. acaba de simular). Rotule el eje x como “Volumen” y el eje y como “pH”. Ejercicios adicionales. 1. Genere una hoja de cálculo para una curva de valoración en la cual se valoran 200 mL of NaOH 0.1 M con 100 mL de HCl 0.1 M, en incrementos de 1 mililitro. 2. Genere una hoja de cálculo para una curva de valoración en la cual se valoran 200 mL de LiOH 0.023 M con 98.2 mL de HClO4 0.12 M en incrementos de 0.5 a 1.0 mililitros (Ud. puede seleccionar el valor del incremento, pero utilice el mismo valor para cada adición). Ud. debe tener un número igual de puntos calculados a ambos lados del punto de equivalencia. 43 Ejercicio 4. Esquemas de Análisis Cualitativo Electrónico Objetivos de este ejercicio: 1. Enseñar las diferentes propiedades químicas y físicas para aproximadamente 98 elementos. 2. Enseñar un rango amplio de propiedades periódicas. 3. Instruir a los estudiantes en el uso más avanzado del Excel y sus comandos lógicos. Los esquemas tradicionales de análisis cualitativo involucran la separación e identificación de varios iones solubles en agua por precipitación, cambios de olor o color de la solución, pruebas en estado sólido o en la llama. Usando un ejemplo simple, la separación e identificación de Ag+, NH4+ y Na+ en fase acuosa puede lograrse en un esquema de tres pasos. En el primer paso, el ion Ag+ se separa y se detecta por la adición de cloruro (ej. KCl) obteniéndose un precipitado blanco. En el segundo paso, se varía el pH de la solución por la adición de una base fuerte (ej. KOH) obteniéndose que NH4+ + OH- => NH3 + H2O. El NH3 es más volátil que el NH4+ y puede detectarse por el olfato. Finalmente la presencia de Na+ puede detectarse por un ensayo en la llama. El doblete del sodio es un emisor fuerte en la luz amarilla (589 nm) que puede observarse fácilmente. Debido a que el equipamiento moderno permite el análisis elemental en niveles de partes por billón (o más bajo) (ej. ICP-MS) y debido a que estos esquemas sólo tienen que ver con un pequeño número de elementos y enfatizan propiedades muy específicas, en este ejercicio trataremos de desarrollar un análisis cualitativo más general mediante el cual se puedan identificar grupos de elementos según sus propiedades físicas y químicas más relevantes. En este ejercicio, un grupo de estudiantes desarrollará un esquema de análisis cualitativo electrónico (EACE) para aproximadamente 98 elementos y un número de iones moleculares simples, basado en sus propiedades físicas y químicas. A cada estudiante en el laboratorio se le asignará un 44 grupo entre 4-8 especies con características similares. Por ejemplo un estudiante puede tener Li, Na, K, Rb, Cs, y Fr, mientras que otro estudiante puede tener los primeros siete lantánidos (La, Ce, Pr, Nd, Pm, Sm, Eu). Considerando que hay aproximadamente 100 elementos y mas de 20 iones moleculares (ej. OH-1, SO4-2, etc.), un grupo de 20-22 estudiantes puede cubrir la tabla periódica entera. Si son menos los estudiantes involucrados, pueden eliminarse algunos grupos o el número de especies por estudiante se puede aumentar (ej. todos los lantánidos se combinan en un grupo). Primeramente los estudiantes tienen la guía para el análisis cualitativo electrónico de los metales alcalinos para programarlo en Excel. Este esquema enseña el concepto de esquema de análisis cualitativo electrónico y las especificidades de programarlo paso a paso. Una vez que se esto se ha completado, los estudiantes reciben su propio grupo de elementos y se les pide que hagan un esquema cualitativo electrónico. Hay algunas reglas básicas que deben seguirse y muchas de ellas se hacen más obvias después que los estudiantes completan el esquema de los metales alcalinos. Las reglas para desarrollar el esquema son las siguientes: 1. El número de preguntas realizadas en todo el esquema de análisis cualitativo debe ser tres veces el número de elementos. Por lo que 6 elementos deben tener un total de 18 preguntas. Estas preguntas deben permitir a los participantes identificar el grupo y el elemento con el que se trabaja. 2. Debe haber un acuerdo de las referencias a las que todos los participantes tienen fácil acceso (ej. Libro de texto, Wikipedia, Tabla Periódica, etc.). 3. Los participantes no pueden incorporar preguntas obvias (ej. Su elemento tiene el símbolo H, ¿Cuál es?) o preguntas muy ambiguas (ej. Su elemento tiene menos de 150 protones) 4. Debe haber un mínimo de tres preguntas que permita al estudiante identificar el grupo. 45 5. Debe haber al menos una pregunta característica que permita identificar al elemento. 6. Debe haber un mínimo de una pregunta relacionada con la configuración electrónica. 7. Debe haber un mínimo de una pregunta relacionada con la densidad. 8. Debe haber un mínimo de una pregunta relacionada con espectroscopía (Luz emitida o absorbida). 9. Debe haber un mínimo de una pregunta relacionada con propiedades físicas (Conductividad, dureza, etc.) 10. Debe haber un mínimo de una pregunta relacionada con procesos de obtención o fuentes minerales de origen. 11. Debe haber un mínimo de una pregunta relacionada con electronegatividad, potencial de ionización o radio atómico. 12. Debe haber un mínimo de una pregunta relacionada con propiedades electroquímicas (potenciales de reducción, etc.) 13. Debe haber un mínimo de una pregunta relacionada con isótopos y radioactividad. 14. Debe haber un mínimo de una pregunta relacionada con la solubilidad en un solvente. 15. Debe haber un mínimo de una pregunta relacionada con estados de oxidación en sales o en disolución acuosa. 16. Debe haber un mínimo de una pregunta relacionada con aplicaciones industriales o historia. 17. En las reglas de la 6-16, puede haber casos donde las condiciones estén combinadas en una sola pregunta. Por ejemplo la pregunta: “Su elemento forma un ión divalente cuando se disuelve en agua, su núcleo absorbe los rayos X fuertemente y precipita cuando se mezcla con iones sulfato” pero recuerde que todo lo que escriba debe caber en una celda de Excel, así que las preguntas muy largas no son convenientes. 18. Los participantes que hagan el esquema cualitativo también deben hacer los códigos numéricos y las teclas de respuesta en WORD. 46 19. Cada elemento debe tener su propio código representado por una serie de 1’s y 0’s. Los estudiantes que hagan un esquema en particular deben hacer los códigos para cada elemento en su grupo particular. 20. Cada grupo tiene su propio conjunto de códigos Each group has its own set of codes based that appear “1011011000111110” these are entered, 1 digit at a time, in the A column (going down). 21. Asegúrese de ajustar el ancho de sus columnas de Excel para que todas las palabras sean visibles. 47 A continuación aparece el diagrama de flujo para la construcción de su esquema cualitativo electrónico. Utilizando las instrucciones que se brindan en este texto, introduzca el esquema cualitativo electrónico para los metales alcalinos. Revise las reglas definidas para la construcción de un esquema cualitativo electrónico. Su instructor le asignará a Ud. o a su grupo un juego de elementos para que construya su propio esquema electrónico cualitativo. Investigue las diferentes propiedades químicas y/o físicas del grupo y elementos asignados. Utilice las fuentes de referencias que se definieron de manera conjunta para este ejercicio. Escriba sus preguntas en la columna B de su hoja de cálculo. Desarrolle el código de respuestas a medida que elabora su esquema cualitativo electrónico. Pruebe/compruebe cada elemento en su esquema cualitativo y su código de respuestas correspondiente. Envíe su esquema cualitativo electrónico (Excel) y su código de respuestas (WORD) a su instructor como ficheros adjuntos. Asigne a cada fichero un nombre que permita su identificación (ej. grupo 3.doc; grupo 3.xls) Su instructor le dará un esquema cualitativo y una hoja par alas respuestas. Ud. escribirá el código binario correspondiente y resolverá el esquema. Pata ello puede utilizar las mismas fuentes que empleó para la elaboración de su propio esquema. 48 Este enfoque tiene la ventaja educacional de que abarca un mayor número de elementos y tendencias que un esquema analítico cualitativo experimental tradicional. A continuación están las instrucciones paso a paso para construir el esquema cualitativo para los metales alcalinos 1. Abra una nueva hoja de Excel. Deje las celdas A1…A18 vacías. Más adelante Ud. probará sus códigos en estas posiciones. En la celda B1 entre el comando lógico “ =SI(A1=1;"Su grupo tiene carga 1+ en sales";"") “ Asegúrese de expandir la columna B para que el texto se vea completo. Una vez que se escribe el comando, Ud. puede entrar el número “1” en la celda A1 para ver que se escribe en B1. Este comando ayuda a los estudiantes a identificar en cuál grupo de la Tabla Periódica está el elemento. Todos los elementos en este grupo deben tener un “1” como primer dígito. 2. En la celda B2, entre el comando: “ =SI(A2=1;"Su grupo reacciona fuertemente con el agua en su forma neutra";"") “ Esto también se aplica a todos los metales alcalinos por lo que debe haber un “1” para todos los códigos. 3. En la celda B3 escriba el comando: “ =SI(A3=1;"Su grupo tiene carga 1+ cuando se disuelve en agua";"") “ Como todos los metales alcalinos son M+1(ac), debe haber un “1” en el tercer lugar el código. 4. En la celda B4 entre el comando lógico: “ =SI(A4=1;"Son electrolitos fuertes cuando se enlazan con los haluros";"") “ Como todos los metales alcalinos se disocian 100% cuando están enlazados a F-, Cl-, Br- o I-, debe haber un “1” en la cuarta posición del código. 5. En la celda B5 escriba el comando lógico: “ =SI(A5=1;"Su elemento tiene punto de fusión de 28 oC","") “ Esta propiedad física sólo se aplica a un elemento, el Cs . Entonces si el elemento es Cs, se entra un “1” en este lugar pero si es otro elemento entre un “0” o un “2” u otro número. Si este elemento es el Cs, el código debe aparecer como 11111.., pero si es Na debe aparecer como 11110… o 11112… 49 6. En la celda B6 escriba el comando: “ =SI(A6=1;"Este elemento es soluble en muchas formas, excepto como feldespato";"") “ Como el grupo ya se ha identificado, elementos que también se encuentran en los feldespatos (ej. Al, Ca) no deben considerarse, pero el K y el Na son posibilidades en este punto; otras preguntas nos ayudarán a escoger uno de los dos. En este punto el código del Na o el K debe aparecer como 111101… , Cs debe aparecer como 111110…, y Li, Rb, y Fr debe ser 111100…… 7. En la celda B7 entre el comando lógico: “ =SI(A7=1;"Su elemento emite luz amarilla a 589 nm";"") “ Esta propiedad física pertenece al sodio y junto con la pregunta 6 ayuda a identificar el elemento especifico. En este punto, el código del Na debe ser 1111011, pero K debe ser 1111010…. 8. En la celda B8 entre el comando lógico: “ =SI(A8=1;"Su elemento es el metal menos denso después del litio";"") “ El valor específico de la propiedad física no se da, forzando al estudiante a revisar todas las densidades de los metales alcalinos. 9. En la celda B9 escriba: “ =SI(A9=1;"Su elemento se produce en Chile y Argentina, y se puede encontrar in pozos de salmuera. X-6 es uno de sus isótopos";"") “ De estos pozos pueden aislarse más de un elemento (aunque la abundancia en estos países sudamericanos permite estrechar un poco el rango), pero el isótopo apunta directamente al Li. En este momento, el código del litio debe ser 111100001…. 10. En la celda B10 entre el comando lógico: “ =SI(A10=1;"XAg4I5 es el cristal iónico que se conoce con la mayor conductividad a temperatura ambiente";"") “ Los subíndices (Ag4I5) no se pueden entrar en la hoja de cálculo, y X es el Rb. 11. En la celda B11 entre el comando: “ =SI(A11=1;"El electrón externo de su elemento tiene espín positivo en el estado neutro";"") “ 50 Este planteamiento se aplica a todos los elementos en el grupo de los metales alcalinos pues su último electrón es s1 (Li, 2s1; Na 3s1; K, 4s1; Rb, 5s1; Cs, 6s1; Fr, 7s1). 12. En la celda B12 escriba el comando lógico: “ =SI(A12=1;"Sólo hay entre 340 y 550 gramos de su elemento en la corteza terrestre";"") “ La razón por la que el francio se menciona muy poco en la mayoría de los cursos de pregrado debe ser obvia. 13. En la celda B13 escriba: “=SI(A13=1;"El elemento menos electronegativo que se conoce";"") “ Mientras que todos los argumentos académicos de electronegatividad terminan con Cs, este planteamiento fuerza a los estudiantes a identificar el elemento en la parte más baja de la esquina izquierda de la tabla periódica. 14. En la celda B14, escriba el comando lógico: “ =SI(A14=1;"Este elemento forma un compuesto llamado halita o sal gema";"") “ El compuesto se conoce comúnmente como sal de roca, y en lenguaje más técnico, cloruros de sodio. 15. En la celda B15, entre el comando: “ =SI(A15=1;"Su forma pura es un metal de color gris-blanco, y se sustituye rápidamente por potasio en los minerales";"") “ Esta descripción física puede aplicarse a más de un metal pero el Rb es sustituido por el K en varios minerales. 16. En la celda B16, entre el comando lógico: “ =SI(A16=1;"Su cloruro puede utilizarse para parar el corazón";"") “ EL KCl se utiliza en cirugías del corazón y en inyecciones letales para parar el corazón. 17. En la celda B17 escriba: “ =SI(A17=1;"Su potencial de reducción de M+ => M(s) es -2.925 V";"") “ 51 Este planteamiento fuerza a los estudiantes a revisar todos los potenciales de reducción de los elementos del grupo. 18. En la celda B18 escriba el comando lógico: “ =SI(A18=1;"Su calor de fusión es 63,9 kJ/mol, más de diez veces mayor que el del agua!";"") “ Puede seleccionarse un grupo de parámetros termodinámicos (fusión, vaporización, sublimación, etc.). La Tabla 4.1 ejemplifica la salida para el sodio. El código para este elemento debe ser: “111101100010010000” . Un estudiante puede usar esta pista para deducir que no sólo tiene un metal alcalino, sino que este metal es el sodio. Aunque esta guía en particular está enfocada en las propiedades del grupo primero y las propiedades de los elementos después, estas preguntas pueden presentarse en cualquier orden. Para esta guía en particular, cada elemento debe tener los códigos que se presentan en la Tabla 4.2. Tabla 4.1. Ejemplo del resultado de una hoja de cálculo para el elemento sodio. El número 1 (en la columna A) hace que aparezca la propiedad característica, mientras que el “0” la mantiene oculta. Estas pistas sobre las propiedades que aparecen visibles en la tabla para un código específico permiten al usuario identificar el grupo y el elemento. 1 1 1 1 0 1 1 0 0 0 1 0 0 1 0 0 0 0 Su grupo tiene carga +1 en las sales Su grupo reacciona violentamente con el agua cuando está en forma neutra Su grupo tiene una carga +1 cuando se disuelve en agua Su grupo forma electrolitos fuertes con los haluros Este elemento es soluble en la mayoría de las formas, excepto como feldespato Su elemento emite luz amarilla a 589 nm El electro más externo de su elemento tiene espín positive en el estado neutro Forma un compuesto llamado halite 52 Tabla 4.2. Los códigos para los diferentes elementos alcalinos. Cada serie de códigos muestra las diferentes pistas que permiten al participante deducir el elemento (utilizando los recursos apropiados). Elemento Li Na K Rb Cs Fr Código 111100001010000000 111101100010010000 111101010010000110 111100000110001000 111100000010000001 111100000011100000 Una vez que esta parte se haya completado, su instructor le asignará un número o le asignará un grupo específico de elementos. Ud. debe desarrollar su propio esquema de análisis cualitativo electrónico, como se ha realizado anteriormente. Asegúrese que la referencia que utilice esté disponible para todas las partes participantes. En nuestro trabajo se utilizaron libros de texto de Química General y las descripciones de los elementos en www.wikipedia.com. Revise las 19 reglas y la guía dadas en la introducción antes de comenzar su propia hoja de cálculo. Una vez que termine, pruebe su algoritmo, y desarrolle un código de respuestas como el que se muestra en la Tabla 4.2. Una vez que Ud. haya completado su esquema electrónico, va a ser recogido por su instructor (el esquema en Excel y las respuestas en Word). El instructor entonces redistribuirá los esquemas electrónicos cualitativos (EEC) y los códigos numéricos. Una vez solucionado el problema, lo debe entregar al instructor con el elemento que Ud. dedujo al lado del código. 53 Tabla 4.3. La tabla periódica y varios iones moleculares combinados en 22 grupos. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16. 17. 18. 19. 20. 21. 22. Nombre Metales alcalinos (1A) Gases nobles(8A) Alcalinotérreos (2A) Metales de transición (3B, 4B) Lantánidos I Metaloides Actínidos I Metales de transición (5B, 6B) Lantánidos II Halógenos Metales suaves No metales Metales de transición 7B,1B Metales de transición 8B Actínidos II Metales de transición 8B, 2B Metales suaves II Aniones de oxígeno y azufre Aniones de nitrógeno, carbono y fósforo Oxianiones de halógenos Aniones de metales y metaloides Haluros (pregunte Química específica de los haluros, diferentes de la de los elementos específicos del grupo 10) y amonio Li, Na, K, Rb, Cs, Fr H, He, Ne, Ar, Kr, Xe, Rn Be, Mg, Ca, Sr, Ba, Ra Sc, Y, Ti, Zr, Hf, La Ce, Pr, Nd, Pm, Sm, Eu, Gd B, Si, As, Te, Ge, Sb Ac, Th, Pa, U, Np, Pu V,Nb,Ta,Cr,Mo,W Tb,Dy,Ho,Er,Tm,Yb,Lu F, Cl, Br, I, At Al, Ga, In, Sn C, P, Se, N,O,S Mn,Tc,Re,Cu,Ag,Au Fe, Ru,Os,Ir,Rh,Co Am,Cm,Bk,Cf,Es,Fm,Md,No Ni, Pd, Pt,Zn,Cd,Hg Pb, Bi, Po, In, Tl S-2. SO3-2, SO4-2, O-2, O2-, O2-2, OHNO3-, NO2-, N-3, CO3-2, C-4, C22- , PO4-3 ClO4-,ClO3-,ClO2-,ClO-, BrO3-, IO3MnO4-, CrO4-2,Cr2O7-2, AsO4-3 F-, Cl-, Br-, I-, NH4+ NOTA: Este ejercicio se utiliza en el primer semestre de Química General. Los esquemas cualitativos electrónicos se escriben en la primera semana de asignado el laboratorio. Los estudiantes reciben todos los esquemas cualitativos electrónicos para resolverlos en la segunda semana del ejercicio de laboratorio. 54 Ejercicio 5. Geometrías moleculares, hibridación y polaridades Objetivos de este ejercicio: 1. Reforzar los conceptos básicos de la Teoría de Repulsión de Pares Electrónicos de la Capa de Valencia (VSEPR) y la construcción y visualización de estructuras en tres dimensiones utilizando este enfoque. 2. Los estudiantes construirán moléculas con geometrías lineal, trigonal plana, tetraédrica, trigonal bipiramidal, cuadrada plana y octaédrica. 3. Los estudiantes identificarán las hibridaciones de varias moléculas construidas en el programa de modelación. 4. Los estudiantes utilizarán métodos semiempíricos para calcular los momentos dipolo de las especies construidas. Introducción. En este ejercicio el estudiante construirá una serie de moléculas con hibridaciones sp, sp2, sp3, sp3d y sp3d2. A continuación realizará un cálculo semiempírico (PM3) para cada estructura y usará los resultados para obtener datos estructurales de su geometría así como su momento dipolo. Como en todos estos ejercicios se asume que el estudiante tiene acceso a un libro de química general y está familiarizado con los temas específicos relacionados con la geometría molecular. Este ejercicio asume que los estudiantes tienen alguna base en la construcción de estructuras utilizando la teoría de repulsión de pares de electrones (VSEPR) y conocen los conceptos de hibridación y polaridad. La notación ABxLy representa al átomo central (A) el cual es el átomo que se examinará cuando se determine la hibridación, B es el número de enlaces que tiene el átomo central. Todos los enlaces, 55 simple, doble o triple cuentan como uno en este número. L es el número de pares solitarios en el átomo central. Por ejemplo, metano (CH4) debe ser AB4L0 o AB4 porque el carbono solo tiene cuatro enlaces simples (C-H) y no tiene pares solitarios. Típicamente se omite la letra si su subíndice es cero. De la misma forma CCl4 debe ser AB4 porque el carbono tiene cuatro simples enlaces y no tiene pares solitarios. Los pares solitarios de los iones cloruro no cuentan. La molécula de agua (H2O) debe ser AB2L2 porque el átomo de oxigeno, que es el átomo central, tiene dos enlaces y dos pares solitarios. Se asume que los estudiantes están familiarizados con el uso básico del programa Spartan, después de la realización de un laboratorio previo. En este ejercicio deben construir, calcular y evaluar seis estructuras: BeCl2, SnCl2, C2H2, XeF4, I3-, SF6 y esto le permitirá trabajar con 22 estructuras adicionales. Las imágenes en tres dimensiones unidas a los resultados de los cálculos proporcionarán una imagen clara de varias geometrías y de sus polaridades encontradas rutinariamente por los químicos Ejercicio previo: En el siguiente ejercicio hay 28 moléculas. Construya las estructuras de Lewis con enlaces y pares solitarios. Puede usarse una referencia (libro de texto, sitio web) para asignar las geometrías moleculares y electrónicas para las hibridaciones (sp, sp2, sp3, dsp3, d2sp3). Tabla 5.1. Número de electrones de valencia de los elementos que pueden encontrarse en este ejercicio. Elemento H Be B C, Si, N,P O,S F,Cl,Br,I Ne, Ar, Sn Kr, Xe # electrones 1 2 3 4 5 6 7 8 de valencia Primeramente prepare una tabla en Word de siete columnas y 29 filas y nómbrelas como se muestra en la tabla 5.2. Esta tabla debe aparecer en su informe en formato Horizontal. Se recomienda trabajar las estructuras de Lewis (enlaces, pares de electrones) en un papel aparte primeramente, y después construirlas en la computadora. Utilice un programa de dibujo en 2D para construir las 56 estructuras planas de las 29 estructuras. Asegúrese de escribir su nombre, la fecha, el nombre del instructor y el título del laboratorio en la parte superior de la primera página del informe. 1. BeCl2: La primera molécula a construir en Spartan es BeCl2. Be es el átomo central y como tal es átomo clave para determinar hibridación y geometrías. Los iones cloruro están unidos al átomo central y sus enlaces y pares solitarios siguen las reglas de la tabla 2.1. En todas las estructuras que se construyan en este ejercicio, los átomos que están unidos al átomo central seguirán las reglas que se resumen en la tabla 2.1, pero los enlaces y pares solitarios del átomo central serán determinados por la estructura. El Be dona dos electrones de valencia y cada cloro dona siete electrones de valencia para un total de 16 electrones de valencia. Dos electrones, sean un enlace o un par solitario se representan por una línea. Siguiendo la tabla 5.1, ponemos un simple enlace y tres pares solitarios alrededor de cada átomo de cloro y ponemos el Be en el medio. La suma de todos los electrones debe ser 16. Usando una referencia (ej. libro de texto) esta estructura clasifica como geometría lineal (AB2) con hibridación sp. Vamos ahora a construir esta estructura en Spartan. Asegúrese de que todas las estructuras están cerradas y abra una nueva página. En el menú “exp” seleccione “Be” y escoja _ la estructura lineal “-*-“ y el enlace simple “ “ e inserte el átomo de Be en el área de trabajo. Ahora seleccione el átomo de cloro del menú “Ent” (o “Exp”). Asegúrese de seleccionar un simple enlace “*- “ si esta trabajando en “Ent”. Vaya al menú “build” y “minimize” para minimizar la energía de su estructura. Asegúrese de guardarla con un nombre reconocible. Vaya al menú “Set Up” y “Calculations” y seleccione lo siguiente: A. B. C. D. E. F. Single Point energy “Semi empirical” y “PM3” Start from “Initial” geometry (Comenzar desde la geometría inicial) Check “Symmetry” Total Charge “Neutral” Compute “El. Charges” 57 G. H. I. J. K. Multiplicity “Singlet” En Print selecione “Atomic Charges” Seleccione “Converge” Seleccione “Global Calculations” Seleccione “Submit” y después “Ok” cuando comienza la corrida del cálculo y “Ok”cuando se termina. L. Asegúrese de hacer el fondo blanco y agrande la estructura para ocupar todo el espacio del área de trabajo. M. Mida el ángulo de enlace con el átomo central como el segundo elemento. Mida el ángulo de todos los enlaces en que participa el átomo central. N. Seleccione “Display” en el menú principal y “Properties” y obtenga el momento dipolo de la estructura. 2. SnCl2. La segunda molécula a construir es el cloruro de estaño (II). En la tabla periódica el estaño esta debajo del C por lo que tiene 4 electrones de valencia a donar. Cada átomo de cloro tiene siete electrones de valencia para un total de 18 electrones de valencia entre tres átomos. Usando la tabla 5.1, a cada átomo de cloro se le asigna un enlace y tres pares solitarios par un total de 16 electrones. Esto deja un par de electrones que no se usa y se asigna al átomo central Sn como un par solitario de electrones. Esto resulta en un átomo central con hibridación sp2 (AB2L1 o AB2L). Asegúrese de guardar y cerrar el fichero de Spartan anterior y abrir uno nuevo. Seleccione “Sn” del menú “Exp” y seleccione la estructura angular (-* \ ). Seleccione “Cl” y use la opción de simple enlace “*-“. Minimice la energía de la estructura y guárdela. Seguiremos el mismo procedimiento computacional descrito en la construcción del BeCl2. Copie la estructura y los valores específicos de las magnitudes calculadas en su reporte. 3. C2H2. El etileno o acetileno tiene 10 electrones de valencia, cuatro por cada carbono y uno por cada átomo de hidrogeno. Cada átomo de carbono funciona como un átomo central y los hidrógenos solo tienen un simple enlace sin pares de electrones solitarios. La estructura resultante tiene un triple enlace y dos enlaces simples, la cual corresponde con la hibridación sp. Comparando esta estructura con el BeCl2 vemos que las dos estructuras se corresponden con la hibridación sp pero el BeCl2 tiene solo simples enlaces mientras que el C2H2 tiene triple y 58 simple enlace. La hibridación del átomo central y la geometría no están dadas por el tipo de enlace (simple, doble o triple) del átomo central, lo que es importante es el número de enlaces y el número de pares solitarios. Vamos a construir la estructura en Spartan. En Spartan el etileno requiere la selección de un átomo de C que tenga un simple enlace y un triple enlace que puede encontrarse en el menú “Ent”. Enlace los dos átomos de C por el triple enlace y adicione los átomos de hidrogeno a los enlaces simples. Una vez construida la estructura, siga el enfoque computacional que se describe arriba, y guarde, copie y pegue la estructura y los datos en su informe. 4. XeF4. La cuarta molécula a construir es el tetrafluoruro de xenón. Xe es un gas inerte y contribuye con 8 electrones de valencia a la estructura de Lewis. El fluor contribuye con siete electrones por cada átomo para un total de 36 electrones. Cada átomo de fluor tiene un enlace simple y tres pares solitarios hasta llegar a 32 electrones (8 x 4 = 32). Esto deja un total de 4 electrones (36-32 = 4) que se asignan al átomo central como dos pares solitarios. Esto significa que el Xe, el átomo que determina la geometría tiene cuatro enlaces simples y dos pares de electrones solitarios. El tetrafloruro de xenón tiene geometría cuadrado plana, que puede encontrarse en el menú “Exp”. Además de seleccionar la geometría cuadrado plana seleccione simple enlace. El fluor puede seleccionarse del mismo menú y enlazarse a los cuatro enlaces simples que aparecen en el Xe. Minimice la estructura y haga los cálculos como se describió anteriormente. Con esta estructura simétrica, se pueden medir dos ángulos, 90º y 180º. Algunas versiones de Spartan pueden no estar capacitadas para calcular esta estructura utilizando “Semi empirical.” Si este es el caso, use “Molecular mechanics” y “MMFF”. (Si usted encuentra otras estructuras con átomos pesados que no pueda calcularse en “semi empirical”, use MM). Después de completar los cálculos, escriba los parámetros en su informe y copie la estructura. 59 5. I3- . La quinta molécula a construir e insertar en su reporte es I3- . Cada átomo de yodo dona siete electrones de valencia para un total de 21 electrones. En la mayoría de los casos, Ud. encontrará un número par de electrones para distribuir, por lo que siempre trate de comprobar sus cálculos si lo que obtiene es un número impar. En este caso la molécula triatómica es además un ión por lo hay que adicionar un electrón para un total de 22 electrones. Uno de los átomos de yodo es el átomo central y los otros dos están enlazados a él (ej. I-I-I). Los dos átomos enlazados tienen un simple enlace al átomo central y tres pares de electrones libres. Entre estos dos átomos de yodo se colocan 16 electrones, quedando 6 electrones o tres pares sin asignar (22 de valencia – 16 sobre el I = 6 restantes). Estos tres pares de electrones se asignan al átomo central de yodo, quedando con una geometría AB2L3 con hibridación sp3d (o dsp3). En la construcción del I3-, hay dos nuevos aspectos en la construcción y el cálculo de la estructura. Primeramente, cuando usted seleccione el primer átomo de iodo (átomo central) use el menú “Exp” seleccione iodo con “-*-“ o dos enlaces y seleccione simple enlace. Seguidamente, vaya al menú “ent’ y seleccione iodo nuevamente y conéctelo a los dos enlaces del átomo central y minimice la estructura. En las condiciones del cálculo, cambie “Total Charge” a “anion”, porque su estructura tiene carga -1. En estructuras cargadas asegúrese de chequear la carga antes de iniciar el cálculo. Seleccione en el menú principal “Model” y “label” y vea como están enumerados los átomos de iodo 1,2 y 3. Ahora seleccione “Display” y “Output”. Revise el resumen del cálculo donde dice “Atomic charges” y compruebe que cada átomo de iodo tiene una carga parcial negativa. Esta es la distribución promedio de la carga -1 en toda la molécula. También note que la molécula no tiene momento dipolo pues tiene cargas en cada átomo. Nuevamente, realice las mediciones pertinentes y copie todos estos datos a su informe. 6. SF6. La sexta y última estructura que vamos a construir es el hexafluoruro de azufre. El azufre contribuye con 6 electrones de valencia y cada fluor con 7 electrones para un total de 48 60 electrones (1xS(6 e-) + 6 x F(7e-) = 48e-). Siguiendo la tabla 5.1, cada átomo de flúor tiene un enlace y tres pares de electrones solitarios para un total de ocho electrones por cada átomo de flúor. Considerando los seis átomos de flúor, se consideran 48 electrones en total en seis enlaces simples y 18 pares solitarios (6F x 3), resultando una geometría octaédrica. Guarde y cierre (Save y close) las estructuras abiertas y abra un espacio de trabajo nuevo. Ahora construiremos el hexafloruro de azufre. Seleccione S del menú “Exp” y seleccione la estructura octaédrica (seis enlaces). En el menú “Ent” seleccione el fluor y enlácelo en los seis enlaces y minimice la estructura. Si no se puede calcular por “semiempirical” calcúlela por “Molecular mechanics”. Adicionalmente, en el comando “Display” y “Output” puede encontrar el momento dipolo para la molécula. Si Ud. realiza diferentes cálculos (ej. Cambiar de Single Point Energy a Equilibrium Geometry, o calcula con Molecular Mechanics y Semiempirical) puede observar un pequeño corrimiento en las distancias de enlaces. 61 Tabla 5.2. Configure su tabla en posición horizontal, con el siguiente formato. Las instrucciones para las primeras seis moléculas se dieron anteriormente. Su tabla debe tener siete columnas y 39 filas. Use los mismos encabezamientos. Especie ABxLy Hibridación., Geometría electrónica Geom Molec. BeCl2 AB2 sp lineal lineal sp2 trigonal plana angular SnCl2 AB2L Estructura de Lewis Be Cl Sn Cl C2H2 AB2 sp lineal lineal XeF4 AB4L2 sp3d2 octaédrica cuadrado plana Cl Cl H C C H F F Xe F Estructura de Spartan Propriedades Calculadas ángulo=180o Be-Cl (2), 1.36 Å 0.0 Debye (apolar) ángulo = 109o Cl-Sn=2.32 Å 4.11 Debye (polar) ángulo =180o C-H 1.066 Å CC, 1.20 Å 0.0 Debye (apolar) ángulos=90o,180o Xe-F, 1.924 Å 0.0 Debye (apolar) F 62 I3 - AB2L3 sp3d bipiramide trigonal Lineal SF6 AB6 sp3d2 octaédrica octaédrica I I I ángulo = 180 I-I=1.926 Å 0.0 Debye (apolar) F F F S F F ángulos = 180, 90 S-F = 1.660 Å 0.0 Debye (apolar) F 63 En su informe usted debe incluir las seis moléculas que se han completado. Ahora usted construirá y calculará otras 22 estructuras, algunas comunes y otras no tanto, para el mejor entendimiento y visualización de las diferentes hibridaciones y geometrías y su impacto en los ángulos y distancias de enlaces, así como en el momento dipolo. A continuación se relacionan las estructuras y algunos datos para su construcción. Estas estructuras son: • • • • • • • • • • • • • • • • • • • • • • SF5I (el azufre es el átomo central, ¿Como es el momento dipolo comparado con SF6?) H2O, (con dos enlaces simples el oxígeno siempre es angular) NH3, (con el nitrógeno en el centro su estructura parece un trípode) CH4, (una molécula tetraédrica clásica, diga como cambia el momento dipolo si se sustituye H por Cl) CH3Cl, (clorometano) CH2Cl2, (diclorometano) CHCl3, (tricloro metano) CCl4, (tetraclorometano) C2H4, (molécula insaturada) C2H6, (molécula saturada, compare las geometrías en 3 D de C2H2, C2H4 y C2H6) H2S, (S esta debajo del O en la tabla periódica, por lo que esta molécula es similar a la de agua) H2SO4, (S es el átomo central, O puede tener dos simples enlaces (S-O-H, seleccione O angular) o un enlace doble (S=O) H3PO4 , (P es el átomo central, O puede tener dos simples enlaces (P-O-H, seleccione O angular) o un enlace doble (P=O) SF4 BrF3 IF5 ICl3 H3O+ (En el cálculo seleccione “cation”, O tiene tres enlaces, como un trípode) NH4+ (En el calculo seleccione “cation”, tiene forma tetraédrica) TeCl4 (si “semi empirical” no funciona, use “molecular mechanics”) H2O2 (cada O tiene dos enlaces, ambos angulares) XeCl2F2 (construya dos estructuras, una con los Cl uno al lado del otro y la otra en posiciones opuestas, vea la figura 5.1). F Cl Xe Xe Cl Cl F F Cl F Figura 5.1. La estructura de la derecha se conoce como “cis’ y la de la izquierda es la “trans”. 64 Preguntas finales: 1. ¿Por qué sólo se considera al átomo central cuando se asignan hibridaciones y geometrías? 2. Para la serie CH4, CH3Cl,… to CCl4 discuta cúal es el impacto de reemplazar un hidrógeno por cloro en el momento dipolo total de la molécula. 3. Las moléculas como I3- y NH4+ son simétricas y no tienen momento dipolar por lo que son apolares. ¿Por qué son solubles en agua? 4. Para el ácido acético (CH3COOH), ¿tiene los dos átomos de carbono la misma simetría e hibridación? (vea figura 5.2) O H3C C OH Figura 5.2. Acido acético (HAc, CH3COOH, C2H3O2) es un ácido débil común. 65 Ejercicio 6. Veinticinco Tendencias Periódicas. Graficando la Tabla Periódica para darle Vida Objetivos de este ejercicio: 1. Los estudiantes aprenderán propiedades químicas y físicas asociadas con elementos específicos. 2. Los estudiantes construirán los gráficos de un número de tendencias en función de grupos diferentes de elementos y determinarán si se observa una periodicidad. Introducción: La Tabla Periódica representa gran parte de las tendencias químicas y físicas. En este ejercicio el estudiante utilizará una hoja de cálculo para graficar un total de 30 tendencias posibles y brindar una explicación breve (2-3 oraciones) para cada tendencia propuesta. Las Tablas 6.1, 6.2, 6.3 y 6.4 contienen parámetros químicos y físicos para cuatro grupos diferentes de elementos. Los estudiantes utilizarán los datos de estas tablas para comenzar a explorar tendencias que pueden o no existir. La Tabla 6.5 representa las veinticinco correlaciones que los estudiantes deben graficar en Excel. Los datos se introducen en la hoja de cálculo y se grafican en dos dimensiones, nombrando los dos ejes, así como un título y su nombre en el encabezamiento, y se debe incluir la ecuación de regresión y el coeficiente de correlación del mejor ajuste de los datos. La Figura 6.1 muestra un ejemplo del gráfico y el pie de figura. Cada página (8.5 x 11) debe contener tres gráficos y sus respectivos pie de figuras. 66 Punto de Fusión (K) Joe Neutrón, Halógenos, Gráfico #X PF vs M 400 300 200 y = 2,849x + 33,58 R2 = 0,9552 100 0 0 20 40 60 80 100 120 140 Masa Atómica Figura 6.1. La masa atómica de los átomos de halógeno (F, Cl, Br, I) se grafica en función del Punto de Fusión de las sustancias, las cuales son moléculas diátomicas en fase sólida y líquida. (ej. I2, Br2, etc.). A medida que la masa atómica aumenta, el punto de fusión aumenta también. Si Ud. no está familiarizado con la función de mejor ajuste (lineal o exponencial) o el coeficiente de correlación (R2) en Excel, utilice la opción de Ayuda en la esquina superior derecha. En algunos casos, puede que NO haya una buena correlación, en cuyo caso debe anotarlo en sus descripciones. Una vez que los veinticinco gráficos se hayan completado, el estudiante seleccionará cinco tendencias adicionales que no hayan sido graficadas y las incluirá (Figuras 26-30). Para las figuras 26-30, debe haber al menos un gráfico a partir de cada tabla (ej. tablas 6.1, 6.2, 6.3, 6.4). Con tres gráficos por página y 30 gráficos en total, su informe debe tener una extensión (exacta) de 10 páginas. No habrá preguntas previas o posteriores a este laboratorio. Este ejercicio asume que los estudiantes han completado laboratorios previos y que tienen conocimientos sobre cómo graficar datos en una hoja de cálculo. También se asume que los estudiantes conocen los conceptos que se dan en cada tabla (electronegatividad, calor de fusión, etc.). 67 Tabla 6.1. Algunos parámetros químicos y físicos asociados con los halógenos. PF3 M4 RA5 ZN6 PR7 Elemento Estado1 PE2 Flúor (F2) G 85.1K 53.63K 18.9984 0.57Å 9 2.87 Cloro (Cl2) G 239.25K 172.31K 35.4527 0.97Å 17 1.36 Bromo (Br2) L 332.4K 266.05K 79.904 1.12Å 35 1.08 Iodo (I2) S 458.55K 386.65K 126.9045 1.32Å 53 .535 S8 202 223 152 116 CT9 0.000279 0.000089 0.0012 0.00449 CE10 _ _ _ - D11 1.696 g/L 3.214 g/L 3.119 g/cc 4.93 g/cc PI12 17.422 12.967 11.814 10.451 EN13 3.98 3.16 2.96 2.66 CF14 - 1 Estado, s=sólido, l=líquido, g=gas. PE = Punto de Ebullición en Kelvin. 3 PF = Punto de Fusión en Kelvin, 4 M = Masa Atómica (g/mol) 5 RA = Radio Atómico (Å) 6 ZN = # Z (# de protones) 7 PR = Potencial de Reducción Estándar (Volts) 8 S = Entropía en Joules/Kelvin.mol 9 CT = Conductividad Térmica, W/cmK 10 CE = Conductividad Eléctrica 106/cm 11 D = Densidad (note las unidades y la fase! Convertir cc o cm3 a litros) 12 PI = Potencial de Ionización (eV, primero) 13 EN = Electronegatividad 14 CF = Calor de Fusión (kJ/mol) 2 68 Tabla 6.2. Algunos parámetros químicos y físicos asociados con los metales alcalinos. Elemento Litio Sodio Potasio Rubidio Cesio Estado1 Sólido Sólido Sólido Sólido Sólido PE2 1615 1156 1032 961 944 PF3 453.85 96.96 336.5 312.7 301.7 M4 6.941 22.98 39.09 85.46 132.9 RA5 2.05 2.23 2.77 2.98 3.34 ZN6 3 11 19 37 55 PR7 -3.05 -2.71 -2.93 -2.98 -2.92 S8 29.1 51.2 64.6 85.2 CT9 .847 1.41 1.024 .582 .359 CE10 .108 .21 .139 .0779 .0489 D11 .534 .971 .862 1.63 1.87 PI12 5.392 5.139 4.341 4.177 3.894 EN13 .98 .93 .82 .82 .79 CF14 2.09 2.59 2.33 2.19 2.092 1 Estado, s=sólido, l=líquido, g=gas. PE = Punto de Ebullición en Kelvin. 3 PF = Punto de Fusión en Kelvin, 4 M = Masa Atómica (g/mol) 5 RA = Radio Atómico (Å) 6 ZN = # Z (# de protones) 7 PR = Potencial de Reducción Estándar (Volts) 8 S = Entropía en Joules/Kelvin.mol 9 CT = Conductividad Térmica, W/cmK 10 CE = Conductividad Eléctrica 106/cm 11 D = Densidad (g/cm3) 12 PI = Potencial de Ionización (eV, primero) 13 EN = Electronegatividad 14 CF = Calor de Fusión (kJ/mol) 2 69 Tabla 6.3. Algunos parámetros químicos y físicos asociados con los elementos de los bloques s,d,p. PF3 M4 RA5 ZN6 PR7 S8 CT9 CE10 D11 PI12 EN13 CF14 Elemento Estado1 PE2 Potasio S 1032 3365 39.0983 2.77 19 1.024 .139 .862 4.341 .82 2.334 Calcio S 1757 1112 40.078 2.23 20 2.01 .298 1.55 6.113 1 8.54 Escandio S 3104 1812 44.95591 2.09 21 .158 .0177 2.99 6.54 1.36 14.1 Titanio S 3560 1933 47.88 2 22 .219 .0234 4.54 6.82 1.54 15.45 Vanadio S 3682 2175 80.9415 1.92 23 .307 .0489 6.11 6.74 1.63 20.9 Cromio S 2945 2130 51.9961 1.85 24 .937 .0774 7.19 6.766 1.66 16.9 Manganeso S 2235 1517 54.93805 1.79 25 .0782 .00695 7.43 7.435 1.55 12.05 Hierro S 3023 1808 55.847 1.72 26 .802 .0993 7.874 7.87 1.83 13.8 Cobalto S 3143 1768 58.9332 1.67 27 1 .0172 8.9 7.86 1.88 16.19 Nickel S 3005 1726 58.6934 1.62 28 29.87 .907 .143 8.9 7.635 1.91 17.47 Cobre S 2840 1357.75 63.546 1.57 29 4.01 0.596 8.96 7.726 1.9 13.05 Zinc S 1180 692.88 65.39 1.53 30 1.16 0.166 7.13 9.394 1.65 7.322 Galio S 2676 303.05 69.723 1.81 31 0.406 0.0678 5.907 5.99 1.81 5.59 Germanio S 3103 1210.55 72.61 1.52 32 0.599 1.45E-8 5.323 7.899 2.01 36.94 Arsénico S 876 1081 74.922 1.33 33 0.502 0.0345 5.72 9.81 2.18 369.9 Selenio S 958 494 78.96 1.22 34 .0204 1.0E-12 4.79 9.752 2.55 6.694 Bromo L 332.4 266.05 79.904 1.12 35 .00122 0 3.119 11.814 2.96 5.286 Kriptón G 119.95 115.93 83.8 1.03 36 .0000949 0 3.75 13.99 2.94 1.638 1 Estado, s=sólido, l=líquido, g=gas a 25 oC y 1 atm 2 PE = Punto de Ebullición en Kelvin. 3 PF = Punto de Fusión en Kelvin, 4 M = Masa Atómica (g/mol) 5 RA = Radio Atómico (Å) 6 ZN = # Z (# de protones) 7 PR = Potencial de Reducción Estándar (Volts). Como los elementos tienen diferentes estados de oxidación (K+, Ca+2, etc.), no se considera aquí. 8 S = Entropía en Joules/Kelvin.mol 9 CT = Conductividad Térmica, W/cmK 10 CE = Conductividad Eléctrica 106/cm 11 D = Densidad (g/cm3) 12 PI = Potencial de Ionización (eV, primero) 13 EN = Electronegatividad 14 CF = Calor de Fusión (kJ/mol) 70 Tabla 6.4. Algunos parámetros químicos y físicos asociados con algunos elementos del bloque p. PF3 M4 RA5 ZN6 CV7 S8 CT9 Elemento Estado1 PE2 355.8 5.6 1.29 Carbonp S 5100 3773 12.011 .91 6 (grafito) Nitrógeno G 77.5 63.29 14.00674 .75 7 2.79 191 .0002 598 439 18.8 1.48 Silicio S 2628 1683 28.0855 1.46 14 Fósforo (blanco) Germanio S 553 317.45 30.97376 1.23 S 3103 1210.55 72.61 Arsénico S 876 1081 74.92159 Estaño S 2543 505.21 118.71 Antimonio S 1860 904.05 121.757 Plomo S 2013 600.75 207.2 Bismuto S 1837 544.67 208.9804 1 Estado, s=sólido, l=líquido, g=gas a 25 oC y 1 atm 2 PE = Punto de Ebullición en Kelvin. 3 PF = Punto de Fusión en Kelvin, 4 M = Masa Atómica (g/mol) 5 RA = Radio Atómico (Å) 6 ZN = # Z (# de protones) 7 CV = Calor de vaporización (kJ/mol) 8 S = Entropía en Joules/Kelvin.mol 9 CT = Conductividad Térmica, W/cmK 10 CE = Conductividad Eléctrica 106/cm 11 D = Densidad (g/cm3) 12 PI = Potencial de Ionización (eV, primero) 13 EN = Electronegatividad 14 CF = Calor de Fusión (kJ/mol) 15 12.43 1.52 32 330.9 41.1 .0002 35 .599 1.33 1.72 1.53 1.81 1.03 33 50 51 82 83 34.76 290.4 77.14 179.4 104.8 .502 51.1 .666 .243 64.8 .353 .0787 CE10 .00061 D11 2.26 PI12 11.26 EN13 2.55 0 1.2506 14.534 3.04 .3604 2.52 x 10-12 10-17 2.33 8.151 50.55 1.82 10.486 2.19 .657 1.45 x 10-8 .0345 .0917 .0288 .0481 .00867 5.323 7.899 2.01 36.94 5.72 7.31 6.684 11.35 9.75 9.81 7.344 8.641 7.416 7.289 2.18 1.96 2.05 2.33 2.02 369.9 7.029 19.87 4.799 11.3 1.9 CF14 104.6 71 Tabla 6.5. Los estudiantes deben construir los siguientes gráficos y brindar una breve explicación para cada observación. Tabla # (arriba) y el Grupo Periódico 1 (Halógenos) 1 (Halógenos) 1 (Halógenos) 1 (Halógenos) 1 (Halógenos) 1 (Halógenos) 1 (Halógenos) 2 (Metales Alcalinos) 2 (Metales Alcalinos) 2 (Metales Alcalinos) 2 (Metales Alcalinos) 2 (Metales Alcalinos) 2 (Metales Alcalinos) 3 (K-Kr) 3 (K-Kr) 3 (K-Kr) 3 (K-Kr) 3 (K-Kr) 3 (K-Kr) 4 (Bloque-P) 4 (Bloque-P) 4 (Bloque-P) 4 (Bloque-P) 4 (Bloque-P) 4 (Bloque-P) Tendencia a graficar. Eje-X (primero) y Eje-Y (segundo) Números Radio Atómico verses Punto de Fusión Potencial de Reducción verses Electronegatividad Radio Atómico verses Potencial de Ionización Punto de Ebullición verses Punto de Fusión Masa Molar verses Punto de Ebullición Radio Atómico verses Potencial de Reducción Radio Atómico verses Electronegatividad Electronegatividad vs. Potencial de Ionización Conductividad Eléctrica verses Conductividad Térmica Conductividad Eléctrica vs. Punto de Fusión # de Protones verses Radio Atómico Punto de Fusión verses Calor de Fusión Potencial de Ionización verses Radio Atómico Conductividad Térmica verses Conductividad Eléctrica Radio Atómico verses Potencial de Ionización # de Protones verses Radio Atómico Calor de Fusión verses Punto de Fusión Punto de Ebullición verses Conductividad Eléctrica # de Protones verses Densidad Conductividad Eléctrica verses Conductividad Térmica Potencial de Ionización verses Electronegatividad Punto de Ebullición verses # de Protones Punto de Fusión verses Radio Atómico Densidad verses Punto de Ebullición Densidad verses Entropía 5 vs. 13 7 vs. 13 5 vs. 12 2 vs. 3 2 vs. 4 5 vs. 7 5 vs. 13 12 vs. 13 9 vs 10 3 vs. 10 5 vs. 6 3 vs. 14 5 vs. 12 9 vs. 10 5 vs. 12 5 vs. 6 3 vs. 14 2 vs. 10 6 vs. 11 9 vs. 10 12 vs. 13 2 vs. 6 3 vs. 5 2 vs. 11 8 vs. 11 72 Ejercicio 7. Valoración que involucra una Base Fuerte y un Ácido Débil Objetivos de este ejercicio: 1. Los estudiantes aprenderán acerca de las reacciones entre una base fuerte y un ácido débil, así como entre una base débil y un ácido fuerte. 2. Los estudiantes simularán la curva de valoración que se obtendría si reaccionaran un ácido fuerte y una base débil. 3. Los estudiantes profundizarán en sus conocimientos y habilidades en el uso de hojas de cálculo en ejercicios relacionados con la Química. Introducción: En el laboratorio anterior (ver Ejercicio #3) se simuló la valoración de un ácido fuerte y una base fuerte con una hoja de cálculo de Excel. Las valoraciones AF/BF involucran la formación de agua y de iones inertes (Ej. Na+, Cl-), especies que tienen un impacto despreciable en el pH. Cuando reemplazamos el ácido fuerte con un ácido débil o reemplazamos la base fuerte con una base débil, la simulación en una hoja de cálculo se hace más compleja debido a las constantes de equilibrio de los electrolitos débiles (Ka, Kb). En esta valoración el hidróxido de sodio está en el vaso de precipitados (50 mL 0.05 M) y el ácido acético (HAc) está en la bureta (0.075 M), y se valora en incrementos de 0.5 mL hasta que se han añadido 100 mL de ácido débil. El ácido acético (HC2H3O2, CH3COOH) y el hidróxido de sodio participan en una reacción de neutralización, HAc(ac) + NaOH(ac) = H2O(l) + Ac-(ac) + Na+(ac) (7.1) 73 Mientras que el agua es neutra y el Na+(ac) es un ion inerte en reacciones ácido/base, el ion acetato Ac(ac), es una base débil y reacciona con el agua para producir una disolución básica. Ac-(ac) + H2O(l) === HAc(ac) + OH-(ac) Kb = 5.5 x 10-10 (7.2) y la concentración de hidróxido puede estimarse de la siguiente ecuación: [OH-] = (Kb*[Ac-])1/2 = (5.5x10-10*[Ac-])1/2 (7.3) Esta expresión puede utilizarse cuando la concentración del ion acetato es mucho mayor que la Kb (al menos 1000 veces). Cuando se calcula [Ac-] después de cada adición también puede estimarse la [OH] que se produce por la reacción de la ecuación 3 y se confirma que esta concentración es mucho menor que la producida por la disociación de un electrolito fuerte como el NaOH. El ácido acético considerado disuelto en agua es un ácido débil HAc(ac) + H2O(l) == H3O+(ac) + Ac-(ac) Ka = 1.8 x 10-5 (7.4) y la concentración de hidronio ([H3O+]) puede estimarse de la siguiente ecuación [H3O+] = (Ka*[HAc])1/2 = (1.8x10-5*[HAc])1/2 (7.5) Como en el cálculo de [OH-] (ec. 7.3), esta ecuación puede usarse para estimar la concentración del ion hidronio cuando la concentración del ácido débil (HAc) es mucho mayor que la Ka. (al menos 1000 veces). En esta simulación se encuentran dos regiones durante la valoración de hidróxido de sodio con ácido acético. La primera región es cuando hay exceso de hidróxido o, 74 Moles OH- presentes > Moles HAc añadidos (7.6) Mientras la reacción produce Ac-, una base débil (ver ec. 7.2), el pH estará controlado por el electrolito fuerte NaOH. La cantidad de OH- producida por los aniones Ac- se considera despreciable en comparación con la cantidad de NaOH presente en ese cálculo y debe confirmarse usando la ecuación 7.3. La segunda región aparece después del punto de equivalencia o cuando se han añadido más moles de HAc que los que había de NaOH originalmente en el vaso de precipitado. En esta región el pH está controlado por el exceso de ácido acético (ec. 7.4). El punto de equivalencia de una valoración de una BF con un AF simulado anteriormente en el ejercicio 3, ocurre a pH siete (7). Cuando la valoración involucra una base débil o un ácido débil, el punto de equivalencia se corre a la región de pH básica o ácida. Preguntas previas: Asegúrese de revisar la introducción escrita anteriormente donde se explica el origen de las ecuaciones usadas en la hoja de cálculo. Escriba la reacción ajustada y dibuje la curva de valoración de las cuatro valoraciones dadas abajo (2 curvas por página). Estas curvas deben realizarse en un programa de dibujo 2D con los ejes debidamente identificados, su nombre y un título en la parte superior, así como el pie de figura correspondiente. Lo más importante es la forma de cada curva y la localización del punto de equivalencia (si el pH es <, > o = a 7.0), y no la posición exacta de los puntos iniciales y finales, ya que estos valores varían con las condiciones y las cantidades de los ácidos y bases. Escriba la reacción correspondiente con la curva. Asegúrese de nombrar los ejes e identifique donde esta el punto de equivalencia en términos de región de pH ácida o básica. Como usted no conoce la concentración (asuma que están en el rango de 0.01 a 0.1 M ) o los volúmenes exactos, usted no puede identificar el punto de equivalencia exacto, el pH inicial, etc. pero su gráfico debe representar aproximadamente la 75 forma observada. En cada caso la primera especie está en el vaso de precipitado y la segunda en la bureta. a. Valoración de ácido acético (HAc) con hidróxido de sodio (NaOH ) b. Valoración de hidróxido de sodio (NaOH ) con ácido acético (HAc) c. Valoración de ácido clorhídrico (HCl) con acetato de sodio (NaAc) d. Valoración de acetato de sodio (NaAc) con ácido clorhídrico (HAc). Una vez terminado este ejercicio usted puede comenzar a simular la valoración de hidróxido de sodio (vaso de precipitados) con ácido acético (bureta) en su hoja de cálculo de Excel. Los gráficos obtenidos, apropiadamente titulados y con un pie de figura, deben transferirse a su informe. Ejercicios del laboratorio: A. Abra una hoja de cálculo nueva. En la celda A1 escriba el encabezamiento “Conc. de ácido acético”. En la celda A2 escriba el número “.075” y copie/pegue hacia abajo hasta la celda A202. Esta (0.075 M) es la concentración del ácido acético en la bureta. B. En la celda B1 escriba el encabezamiento “Conc. de NaOH” y en la celda B2 entre el número “.05” y cópielo hacia abajo hasta la celda B202. Este valor, 0.05M, es la concentración inicial de NaOH en el vaso de precipitados o en el frasco. C. En la celda C1 escriba el encabezamiento “Constante de equilibrio de HAc” y en la celda C2 entre el valor “0.000018” (o 1.8 x 10-5) y copie/pegue hacia abajo hasta la celda C202. Esta es la Ka del ácido acético. D. En la celda D1 escriba el encabezamiento “mLs de NaOH” y en la celda D2 entre el valor “50” y cópielo hacia abajo hasta D202. E. En la celda E1 escriba el encabezamiento “mLs de HAc” y en la celda E2 entre el valor “0”. En la celda E3 entre el comando “=SUMA(E2+0.5)” y copie/pegue hacia abajo hasta la celda E202. 76 F. En la celda F1 entre el encabezamiento “moles iniciales de HAc añadidos” y en la celda F2 entre la fórmula “=SUMA(A2*E2/1000)” y copie/pegue hacia abajo hasta la celda F202. Aquí se calcula usando la fórmula moles = conc. V. Se divide por 1000 para convertir de mililitros a litros. G. En la celda G1 escriba el encabezamiento “moles iniciales de NaOH en el beaker” y en la celda G2 entre la ecuación “=SUMA(D2*B2/1000)” y copie/pegue hacia abajo hasta la celda G202. Esta ecuación también está basada en moles=conc. V y el número (.0025) debe ser constante hasta el final de la valoración. H. En la celda H1 escriba el encabezamiento “moles de OH- después de la reacción” y en la celda H2 escriba el comando “ =SI(G2>F2,SUMA(G2-F2),"") “ y copie/pegue hacia abajo hasta la celda H202. Esta ecuación pregunta si hay más moles de NaOH que de HAc, y si la respuesta es si, calcula los moles de OH- considerando la reacción de neutralización en la ecuación 1. I. Escriba “moles HAc después de neutralización” en la celda I1 y en la celda I2 escriba el comando lógico “ =SI(F2>G2,SUMA(F2-G2),"") “. Copie y pegue esta ecuación hacia abajo hasta la celda I202. Este comando determinara si los moles de HAc son mayores que los moles de NaOH, si esto es cierto, usa la reacción de neutralización en la ecuación 1 para saber cuánto ácido acético queda después de la reacción con el hidróxido. J. Escriba el encabezamiento “moles de Ac- producidos” en la celda J1 y entre la ecuación “ =SI(G2>H2,SUMA(G2-H2),"") “ en la celda J2. Copie y pegue esta ecuación hacia abajo hasta la celda J202. Este comando determina cuántos moles de OH- del NaOH quedan después de la reacción de neutralización con ácido acético. K. En la celda K1 escriba el título “Vol Total (Litros)” y en la celda K2 entre la ecuación “ =SUMA((D2+E2)/1000) “ Copie y pegue hacia abajo hasta la celda K202. Esta ecuación combina los 50 mls de NaOH con el HAc que ha sido añadido. Se divide por 1000 para convertir de mLs a litros. Recuerde que para calcular pH y pOH se deben usar las concentraciones molares de [H3O+] y [OH-], respectivamente. 77 L. En la celda L1 escriba el título “pH cuando OH- esta en exceso” y en la celda K2 entre la ecuación “ =SI(H2>0,SUMA(14-LOG(H2/K2)*-1),"") “ Copie y pegue esta ecuación hacia abajo hasta la celda L202. Esta ecuación determina si hay exceso de OH- del NaOH después de la neutralización del HAc. Si esto es cierto, se calcula el pOH con la ecuación pOH = -log[OH-] (LOG(H2/K2)*-1) y entonces se usa la igualdad pH = 14 - pOH para determinar el pH. H2 está en moles y K2 en litros por lo que la concentración de OH- está en moles por litros. M. En la celda M1 escriba el encabezamiento “ [H+] si HAc está en exceso “ y en la celda M2 entre la ecuación “ =SUMA((I2/K2)*C2)^(0.5) “Copie y pegue esta ecuación hacia abajo hasta la celda M202. Esta ecuación calcula la cantidad de ion hidronio [H3O+] que se produce de la disociación del exceso de ácido acético (ec. 5). N. En la celda N1 entre el título “pH cuando HAc está en exceso” y en la celda N2 calcule el pH utilizando la ecuación “ =LOG(M2)*-1 “. Copie y pegue esta ecuación hacia abajo hasta la celda N202. En este punto usted ha completado los cálculos de pH para las regiones donde la base o el ácido están en exceso, respectivamente. Vamos a calcular ahora el punto de equivalencia. O. El punto de equivalencia es el punto de la valoración donde los moles de ácido (HAc) son iguales a los moles de base (NaOH). Primeramente utilizaremos la hoja de cálculo y vamos a identificar si ya se ha calculado el punto de equivalencia. En la celda O1 escriba el encabezamiento “Punto de equivalencia” y en la celda O2 escriba la ecuación “ =SI(F2=G2,"punto de Eq.") “Copie y pegue esta ecuación hacia abajo hasta la celda O202. Este comando lógico compara los moles de OH- y de HAc y escribe “punto de Eq.” cuando son iguales. Después que usted copie esta ecuación hacia abajo, trate de localizar este punto. Si esto no aparece, compare visualmente las columnas F2 y G2 y vea si hay un punto en el cual los moles de acido y de base son iguales. Usted no debe obtener el mismo número para las dos especies, el problema es que en una curva de valoración real o simulada puede que no se obtenga en una adición exactamente el punto de equivalencia, que puede ser estimado o calculado a partir de la forma de la curva de valoración. 78 P. Ahora vamos a plotear los datos de la curva de valoración. Se asume que usted ha completado la curva de valoración de BF con AF (ver ejercicio 3) y que está familiarizado con plotear datos en Excel. Valoración de NaOH con HAc, José Neutrón 14 12 pH 10 8 Exceso NaOH 6 Exceso HAc 4 2 0 0 20 40 60 80 100 Vol (mL), HAc 0.075 M Figura 7.1. Simulación de la valoración de una base fuerte (NaOH) con un ácido débil (HAc). Ejercicio Adicional: Construya la curva de valoración del hidróxido de potasio con ácido fluorhídrico (HF), utilizando su hoja de cálculo como plantilla. Copie y pegue el gráfico en su informe y escriba la reacción de neutralización que ocurre. 79 Ejercicio 8. Modelación de Bases y Ácidos Débiles Objetivos de este ejercicio: 1. Los estudiantes modelarán las estructuras de ácidos monopróticos, dipróticos y tripróticos, así como sus bases conjugadas. 2. Los estudiantes calcularán el momento dipolo, el volumen molecular y el área superficial de cada molécula y calcularán las cargas atómicas sobre cada átomo en las moléculas. 3. Los estudiantes identificarán correlaciones entre el pKa de los ácidos, su momento dipolo y las cargas atómicas sobre los átomos más cercanos al sitio de protonación/desprotonación. Ejercicio Previo: Las siguientes preguntas se responderán al inicio de su informe. 1. Identifique los ácidos fuertes (escriba los nombres y la fórmula empírica). 2. Escriba el nombre/fórmula para un mínimo de quince ácidos débiles. 3. Para cada ácido débil, escriba un nombre y la fórmula empírica de su base conjugada. Figura 8.1 El ácido clorhídrico tiene un momento dipolo (1.38 D) y el átomo de hidrógeno (0.238) y el de cloruro (-0.238) tienen ambos una carga parcial o cargas atómicas debido al corrimiento de electrones sobre la molécula polar. Los cálculos están realizados para la molécula en fase gaseosa. La tabla 8.1 y las figuras 8.1 y 8.2 brindan detalles sobre el tipo de cálculo que Ud. realizará y las correlaciones que investigará, asumiendo que exista alguna. En estos datos, y para cada molécula que 80 aparece en la Tabla 8.1, note que las cargas parciales negativas y positivas son iguales y opuestas. Como cada especie (ej. HF, HCl, etc.) es neutral, la suma de las cargas parciales sobre los átomos individuales debe ser igual a cero. Si la molécula tiene una carga negativa (ej. ClO4-), la suma de las cargas atómicas individuales será igual a -1. Mientras que el HF es un ácido débil y tiene una Ka, HCl, HBr y HI son ácidos fuertes y no tienen constantes de equilibrio para su disociación. En este caso, no se puede encontrar una correlación entre las Ka (o pKa) y los momentos dipolos o las cargas atómicas. En algunos de los siguientes ejercicios, se utilizarán los gráficos de momento dipolo vs. carga atómica, momento dipolo vs. pKa, y pKa vs. carga atómica, para identificar algún tipo de correlación entre los parámetros. Tabla 8.1 Ejemplo de correlaciones entre el momento dipolo y las cargas parciales sobre los átomos individuales. Especie Momento Dipolo Positiva Parcial Negativa Parcial (H) (X) HF 1.41 D 0.327 -0.327 HCl 1.38 D 0.238 -0.238 HBr 1.26 D 0.203 -0.203 HI 0.92 D 0.149 -0.149 Los procedimientos computacionales utilizados para generar la tabla anterior fueron: 1. Single Point Energy, Semiempirical (PM3), Initial 2. Check: Symmetry, Compute (Elect. Charges), Print (Atomic Charges), Converge 3. Select: Charge (Neutral), Multiplicity (Singlet). Los estudiantes construirán una serie de ácidos y sus bases conjugadas o aniones en Spartan (típicamente, los aniones de los ácidos fuertes no son especies básicas, sino iones inertes en reacciones ácido/base). La tabla 8.2 ilustra el formato para la tabla que debe aparecer en su informe. 81 Identificador Nombre, Fórmula, pK D, V, A Ácido acético HC2H3O2 pKa = 4.74 Carga atómica sobre los tres átomos -O : -0.291 =O : -0.333 -C= : 0.385 Monoprótico, Ácido # 1 Base conjugada #1 Acetato C2H3O2pKb = 9.26 -O : -0.648 =O : -0.643 -C= : 0.434 D = 7.02 D V = 59.12 Å3 A = 81.06 Å2 Estructura D = 4.05 D V = 61.7 Å3 A = 83.5 Å2 Tabla 8.2. Los resultados de los cálculos en el formato correcto para el ácido acético y su base conjugada, el acetato. (D = momento dipolo, V = volumen molecular, A = área superficial). Los estudiantes pueden encontrar pequeñas variaciones en los valores calculados (cargas atómicas, D,V, A) dependiendo de la versión del software y/o parámetros computacionales utilizados. Proporcione en su informe una tabla para las especies monopróticas, otra para las especies dipróticas y una tercera para las especies tripróticas En el programa de modelación molecular (Spartan) los estudiantes deben familiarizarse con la determinación de dipolos, volúmenes y áreas superficiales (vea el capítulo 5). Después de construir cada molécula: 1. Seleccione en Setup en la parte superior de la página, y después seleccione Calculations. Aquí debe aparecer un cuadro de diálogo. Asegúrese de seleccionar los siguientes parámetros: Single Point Energy Semi-Empirical, PM3 Initial, Symmetry (check) Charges (neutral; anion, dianion, cation or dication – check charge on species) Compute: Elect. Charges Multiplicity, Singlet (doublet may arise in some structures). Print, Atomic Charges 82 2. Una vez completado y guardado, seleccione Display y después Output. Al final de la página, Ud. debe encontrar el título: Natural Atomic Populations and Charges. Aquí encontrará las cargas atómicas para cada átomo. 3. Seleccione Display y después Properties. Aquí encontrará los valores para el momento dipolo (Dipole Moment), el volumen molecular (Molecular Volume), y el área superficial (Surface Area). Ejercicio: Utilizando el Spartan, construya las siguientes estructuras, realice el procedimiento computacional descrito anteriormente y guarde los valores necesarios en su tabla. Una vez que sus tablas estén completas, se le asignarán los gráficos a realizar en su hoja de cálculo, para investigar las posibles correlaciones entre los parámetros. Por favor, note que las Ka y las Kb (pKa, pKb) no se calculan, sino que se toman a partir de otras fuentes. 83 Tabla 8.3 A continuación aparece una lista de ácidos monopróticos para que el estudiante construya y evalúe. Las estructuras se dibujan sin los pares de electrones libres. Estos pares de electrones son cruciales en el modelo VSEPR, cuando se determina la geometría de la especie molecular. 1. Fluoruro (F-) (Pista: seleccione F con un enlace simple y elimine cualquier enlace que sobresalga). 1. Ácido fluorhídrico (HF) 2. Hidronio (H3O+) 2. Agua (H2O) H + H O H O H H especie con hibridación sp3 tetraédrica (3 enlaces, 1 par de electrones libres) • cargada, catión 3. Amonio (NH4+) • • • • • especie con hibridación sp3 2 enlaces, 2 pares de electrones libres neutral 3. Amoníaco (NH3) H + H H N H N H H H • • • 3 especie con hibridación sp tetraédrica, 4 enlaces simples catión 4. Ácido cloroacético (CClH2COOH) Cl O • especie con hibridación sp3 • tetraédrica (3 enlaces simples, un par de electrones libres) • neutral 4. Cloroacetato (C2H2ClO2-) Cl H O H H • carbonos con hibridación sp3 y sp2 • Molécula neutral O H H • O Anión (-1) 84 5. Ácido nítrico (HNO3, ácido fuerte, no Ka) O -1 O N O • H O -1 O N -1 O 6. Ácido nitroso (HNO2, pKa = 3.25) -1 O N + -1 • Anión (-1) para un ácido fuerte tiene propiedades básicas mínimas. 6. Nitrito (NO2−, pKb = 10.75) H -1 O -1 +1 O N 7. Ácido cianhídrico (HCN, pKa = 9.2) +1 +2 -3 H C N 8. Ácido fórmico (CHO2H, pKa = 3.75) +1 7. Cianuro (CN-, pKb = 4.8) +2 -3 C N - 8. Formato (CHO2 , pKb = 10.25) O O H -1 +2 El ácido nítrico y el nitrato son estructuras deslocalizadas. O 5. Nitrato (NO3-) C O H H El ácido fórmico es el ácido carboxílico más simple. El enlace C-O-H es angular (el O no tiene ninguna estructura lineal con 2 enlaces simples) C O -1 El formato es el carboxilato más simple. 85 Tabla 8.4. La siguiente tabla contiene ácidos dipróticos y sus aniones asociados. Los estudiantes deben construir y calcular cada estructura y colocar sus resultados en el informe. 9. Ácido oxálico (H2C2O4, pKa1 = 1.23) O OH C O C 10. Ácido carbónico (H2CO3 , pKa1 = 6.35) O H O El ácido carbónico es instable y se descompone para formar CO2 y H2O. 11. Ácido sulfúrico (H2SO4, ácido fuerte) O H O S O 12. Ácido sulfuroso (H2SO3, pKa1 = 1.85) O O H S O O O -1 11. Sulfato (SO4-2) O S O O O -1 O Seleccione una geometría tetraédrica con todos los enlaces simples (realice los cálculos), después seleccione una geometría tetraédrica con todos los enlaces dobles y realice los cálculos. Compare sus resultados. 12. Sulfito (SO3-2) -1 S O C O -1 El Segundo protón que se disocia tiene una constante de equilibrio. Seleccione todos los enlaces simples para el sulfuro tetraédrico y seleccione todos los enlaces simples para el oxígeno. (no es completamente exacto, pero los electrones están deslocalizados). 12. Sulfito de hidrógeno (HSO3-, pKa2 = 7.20) O H O O -1 -1 O -1 O O O -1 11. Monohidrógeno sulfato (HSO4-, pKa2 = 1.98) S C 10. Carbonato (CO3-2) C O -1 En Spartan, seleccione “dianion” para la carga. O O O C -1 En Spartan, seleccione “anion” para la carga. 10. Bicarbonato (HCO3-, pKa2 = 10.33) H O H El primer protón se disocia en un 100%. Seleccione una estructura tetraédrica para el sulfuro desde la página exp. -1 O OH H O C H C O O C O OH En Spartan, seleccione “neutral” para la carga. 9. Oxalato (C2O4-2) 9. Oxalato monohídrico (HC2O4-, pKa2 = 4.19) O H O S -1 O 86 (cont.) Use el modelo VSEPR para confirmar que el átomo de azufre tiene tres áreas enlazantes y un solo par de electrones libres en una geometría tetraédrica (seleccione todos como simples enlaces) (cont.) Use la misma geometría que para el H2SO3, pero con un par de electrones libres sobre el átomo de oxígeno con una carga -1. Mientras dibujamos enlaces simples y dobles con estructuras de Lewis, esta especie tiene estructuras resonantes (cont.) Use la misma geometría que para el H2SO3, pero con un enlace simple sobre los dos átomos de oxígeno con una carga -1. Esta es una estructura deslocalizada y tiene efectos resonantes. Tabla 8.5. A continuación se presenta una lista de ácidos tripróticos para construir y evaluar. Las estructuras 2D están dibujadas sin los pares de electrones libres. Estos pares de electrones son cruciales en el modelo VSEPR, cuando se determina la geometría de la especie molecular. 13. Monohidrógeno 13. Fosfato (PO4-3) 13. Ácido fosfórico 13. Dihidrógeno fosfato (HPO4-2, (H3PO4, pKa1=2.16) fosfato (H2PO4− , pKa2 = 7.21) pKa3 = 12.32) O O H O H O P O H O O P O O H H Seleccione una geometría tetraédrica para el fósforo con todos los enlaces simples. 14. Ácido bórico (H3BO3, pKa1 = 9.27) H H O O B O Seleccione “anion” para la carga sobre esta especie y “dianion” para la próxima especie (HPO4-2). 14. Dihidrógeno borato (H2BO3-, pKa2 = 12.7) H O H Boro, el átomo central, no tiene pares de electrones libres, por lo que resulta una geometría trigonal plana. O H -1 -1 O O P O -1 Para las tres estructuras con cargas negativas, cada una tiene electrones deslocalizados y estructuras resonantes. 14. Monohidrógeno borato (HBO3-2, pKa3 = 13.28) H H O B O H Seleccione “anion” para esta especie y “dianion” para la próxima. -1 -1 O O B O -1 O O P -1 O -1 El Spartan no tiene una opción para una especie tri-aniónica. 14. Borato (BO3-3) -1 O -1 O B O -1 El Spartan no tiene una opción para una carga -3. 87 1. Para sus ácidos monopróticos débiles, genere en una hoja de cálculo los tres gráficos que se definen a continuación. Asegúrese de identificar los ejes, escribir su nombre en la parte superior de cada gráfico y SOLO utilice el mejor ajuste posible (no conecte simplemente los puntos). Una vez que estos gráficos estén terminados, discuta sus resultados (ej. ¿existe alguna correlación entre los diferentes parámetros, por qué o por qué no?). a. Grafique la carga atómica sobre el átomo negativo en la especie neutral vs. el momento dipolo. b. Grafique la carga atómica sobre el átomo negativo en la especie neutral vs. el pKa. c. Grafique el momento dipolo vs. el pKa. 2. Para sus ácidos débiles monopróticos, genere en una hoja de cálculo los tres gráficos que se definen a continuación. Asegúrese de identificar los ejes, escribir su nombre en la parte superior de cada gráfico y SOLO utilice el mejor ajuste posible (no conecte simplemente los puntos). Una vez que estos gráficos estén terminados, discuta sus resultados (ej. ¿existe alguna correlación entre los diferentes parámetros, por qué o por qué no?). a. Grafique la carga atómica sobre el átomo negativo enlazado al primer protón que se pierde vs. el momento dipolo de la especie neutral. (ej. en H2CO3, el átomo de O enlazado al primer H que se desprotona para quedar HCO3-) b. Grafique la carga atómica sobre el átomo negativo enlazado al primer protón que se pierde vs. el pKa1. c. Grafique el momento dipolo vs. el primer pKa (pKa1) para cada especie diprótica. 88 Glicina (C2H5NO2) O H2N C OH Tabla 8.6. Aquí aparece una imagen 2D de la glicina, un amino ácido. Construya y calcule los parámetros para la glicina, su base conjugada y su zwiterión. Ud. debe tener tres estructuras en su informe (las especies anteriores, los zwiteriones, las especies básicas o desprotonadas). 89 Ejercicio 9. Demostrando los Conceptos de Enlaces y Fuerzas: del Nitrógeno a los Nanotubos Objetivos de este ejercicio: 1. Los estudiantes estudiarán las fuerzas químicas como los enlaces covalentes, los enlaces iónicos, las interacciones ió-dipolo y los enlaces por puente de hidrógeno. Introducción: Los estudiantes construirán un nanotubo (10,0). Esta estructura, relativamente inerte, se utilizará como un molde o plantilla para construir una estructura de péptido en forma de hoja. Este péptido contiene los residuos ácido aspártico y glutamina, conectados por un enlace peptídico. Esta construcción se utilizará para demostrar que: a) Enlaces covalentes- son enlaces químicos en los cuales los átomos comparten electrones. Por ejemplo, todos los enlaces en el metanol (fig. 9.1) son de naturaleza covalente. Figura 9.1. El metanol (CH3OH) es una molécula pequeña que tiene los enlaces covalentes C-H, C-O y O-H. b) Enlaces iónicos- son el resultado de los enlaces entre iones de cargas opuestas. Típicamente, se forman entre los cationes (+1, +2, etc.) y los aniones (-1, -2, etc.) que tiene cargas mayores o iguales que 1 (ver fig. 9.2). 90 Figura 9.2. El ión acetato, con su grupo carboxilato cargado negativamente, tiene un enlace iónico con un dicatión calcio. El enlace iónico se representa con una línea punteada. c) Fuerza ión-dipolo- es una fuerza atractiva que resulta de la atracción electrostática entre un ión y una molécula neutra que tiene un momento dipolo (fig. 9.3). Figura 9.3. La atracción entre el cobre(II) y el par de electrones libres sobre el nitrógeno o la amina se denomina una interacción ión-dipolo. d) Atracción dipolo-dipolo- es la atracción que existe entre los momentos dipolos de dos o más moléculas. Una carga parcial positiva o una carga menor que +1 (δ+) es atraída hacia una carga parcial negativa (δ-) o una carga menor que -1, dando lugar a una interacción dipolo-dipolo (fig. 9.4). 91 Figura 9.4. La carga parcial negativa sobre el átomo de iodo en el ácido yodídrico es atraída hacia la carga parcial positiva sobre el átomo de hidrógeno en otra molécula de HI, formando de esta manera una interacción dipolo-dipolo. e) Enlace por puente de hidrógeno- es una interacción de tipo dipolo-dipolo que incluye un átomo de hidrógeno enlazado a oxígeno, nitrógeno, flúor, cloro o azufre y atraído hacia un dipolo sobre el oxígeno, nitrógeno, flúor, cloro o azufre. Debido a su fortaleza relativa a otras interacciones dipolodipolo y su importancia en sistemas bioquímicos y ambientales, se le confiere su propia clasificación (ver fig. 9.5). Figura 9.5. Las cargas parciales negativas sobre el oxígeno (δ-) y las cargas parciales positivas sobre el hidrógeno (δ+) en diferentes moléculas de agua son los enlaces por puente de hidrógeno. f) Fuerzas de London- son fuerzas extremadamente débiles que ocurren entre dos moléculas o átomos cualesquiera y son el resultado de momentos dipolos temporales. Por ejemplo, dos moléculas de nitrógeno (N2, 78% del aire) pueden estar brevemente atraídas entre sí mediante una distorsión de la nube electrónica dando como resultado una atracción electrostática muy débil (fig. 9.6). 92 Figura 9.6. Durante un instante (ej. <10-10 segundos), un dipolo temporal en una molécula de nitrógeno es atraído hacia un momento dipolo temporal en otra molécula N2. Esta atracción se conoce como Fuerza de London. Preguntas previas: Todas las estructuras construidas en este ejercicio se deben transferir a su informe. Utilice flechas para identificar los enlaces o posiciones principales. En este ejercicio utilizaremos un tipo especial de enlace covalente: el enlace peptídico, mediante el cual se enlazan entre sí dos grupos aminoácidos. n. Construya los aminoácidos Asp y Gln separadamente en el programa Spartan. o. Utilizando los cálculos Sempiempíricos (PM3), estime el momento dipolo de cada aminoácido (Asp y Gln). p. Ahora construya un péptido simple compuesto por un Asp y un Gln, e indique en su informe dónde se localiza el enlace peptídico. q. Existen dos tipos de enlaces por puente de hidrógeno en las hojas de péptidos (alfa, beta). Incluya una descripción breve sobre la naturaleza de cada tipo. r. El carbono tiene tres alótropos (grafito, diamante, fulereno). Los nanotubos consisten en hojas de carbono enrolladas para formar tubos con diámetros pequeños (ej. < 10 nm). Diga el tipo de hibridación presente y haga una descripción breve (2-3 oraciones) de las estructuras del diamante, del grafito y de un fulereno esférico (ej. C60). 93 Ejercicio uno Este ejercicio asume que Ud. ha completado los ejercicios previos en Spartan y que está familiarizado con el programa computacional. También se asume que Ud. tiene algún conocimiento o está familiarizado con el programa Excel. 1. En ficheros separados, construya F2, Cl2, Br2 e I2. Cuando vaya a calcular las estructuras, utilice el comando “Single Point energy”, “Semiempirical (PM3)”. En el recuadro de explicación, responda: a) ¿Qué tipo de enlace conecta los átomos en cada molécula de halógeno? b) Brinde una explicación sobre el cambio en la distancia de enlace. 2. En ficheros separados, construya N2, N2H2, N2H4 y recuerde que al nitrógeno le gusta tener 3 enlaces (triple, sencillo y doble o tres sencillos) y que al hidrógeno le gusta un solo enlace. a) ¿Qué tipo de enlace conecta los átomos de nitrógeno? b) Brinde una explicación sobre el corrimiento en la distancia de enlace N,N en cada estructura. 3. En ficheros separados, construya las estructuras LiF, NaF y KF y recuerde que a los haluros les gusta formar un enlace sencillo. a) ¿Qué tipo de enlace forma la sal entre un álcali y un haluro? b) Brinde una explicación para las diferencias en las distancias de enlace. 4. Construya una molécula de acetato (CH3COO-, carga = anión). En la misma pantalla, seleccione un átomo (del comando ETN) con dos enlaces sencillos y conecte uno a cada átomo de oxígeno del carboxilato (vea la fig. 9.2 arriba). Cuando entre los datos para el cálculo (Semiempirical, PM3) asegúrese de seleccionar la carga como +1 para el complejo (-1 del carboxilato y +2 del calcio). Una vez que el cálculo estructural se complete, copie la imagen dentro de su hoja de trabajo y determine y anote las distancias de los enlaces Ca-O. Ahora realice el mismo cálculo para el Mg2+94 acetato, Sr2+- acetato y Ba2+- acetato; copie las estructuras obtenidas en su hoja de cálculo y determine las distancias de enlace catión-oxígeno. a) ¿Qué tipo de enlace existe entre el ión alcalino y el acetato? b) Explique las tendencias calculadas (si existe alguna) que involucren el enlace entre el catión y el oxígeno. 5. Construya una molécula H-Br y minimícela. Copie y pegue la estructura (presione los botones izquierdo y derecho del ratón) hasta tener 10 moléculas de H-Br en la misma ventana (note que cuando Ud. pega una estructura en Spartan, la misma se copia sobre sí misma, de manera que varias estructuras pueden estar presentes pero aparecer como una sola). Mueva la estructura para que estén más cerca unas de otras y entonces minimice la congregación de moléculas. a) ¿Qué tipo de fuerza causa que las moléculas se atraigan entre sí? b) Determine y anote al menos seis distancias de enlace que involucren interacciones dipolodipolo que comprendan un –H sobre un átomo y un –Br sobre otro. ¿Cómo se comparan estas distancias con aquellas correspondientes a los enlaces covalentes (ej. N=N, etc.)? 6. Construya una molécula de agua y minimícela. Copie y pegue esta estructura (presionando los botones izquierdo y derecho del ratón) hasta que Ud. tenga diez moléculas de agua en la misma ventana (note que cuando Ud. pega una estructura en Spartan, la misma se copia sobre sí misma, de manera que varias estructuras pueden estar presentes pero aparecer como una sola). Mueva la estructura para que estén más cerca unas de otras y entonces minimice la congregación de moléculas. a) ¿Qué tipo de fuerza causa que las moléculas se atraigan entre sí? b) Determine y anote al menos seis distancias de enlace que involucren interacciones dipolodipolo que comprendan un –H sobre un átomo y un –O sobre otro. ¿Cómo se comparan estas distancias con aquellas correspondientes a los enlaces covalentes? 95 7. Construya una molécula de N2 y minimícela. Copie y pegue esta estructura (presionando los botones izquierdo y derecho del ratón) hasta que Ud. tenga diez moléculas de nitrógeno en la misma ventana (note que cuando Ud. pega una estructura en Spartan, la misma se copia sobre sí misma, de manera que varias estructuras pueden estar presentes pero aparecer como una sola). Mueva la estructura para que estén más cerca unas de otras y entonces minimice la congregación de moléculas. a) ¿Existe alguna evidencia de que las moléculas se atraigan entre sí? b) Si este es el caso, ¿qué tipo de fuerza causa que las moléculas se atraigan entre sí? c) Determine y anote al menos seis distancias de enlace que involucren interacciones dipolodipolo que comprendan un N sobre un átomo y un N sobre otro. 96 Tabla 9.1 Después de contestar las preguntas previas, construya una tabla en Word similar a la que aparece a continuación (ajuste el tamaño de las celdas según sea necesario). Copie sus imágenes de Spartan en la columna de las estructuras (utilice un fondo blanco) y determine la distancia de enlace de cada una (en Angstrom). Especies Estructura Distancia (A) Explicación 1. F2, Cl2, Br2, I2 2. N2, N2H2, N2H4 3. LiF, NaF, KF 4. Mg-Ac, Ca-Ac, Sr-Ac, Ba-Ac 5. HBr 6. H2O 7. N2 97 Ejercicio Avanzado: Extendiendo un péptido utilizando un nanotubo Primeramente aprenderemos a construir un nanotubo (10,1). Ud. se dará cuenta de que este conjunto de tubos (10,0; 12,0; 14,0; etc.) son muy fáciles de construir utilizando este programa de modelación molecular. Las instrucciones son las siguientes: 1. Marque en el comando ENT y seleccione el carbono que tiene hibridación sp2. 2. Utilizando solamente átomos de carbono con hibridación sp2 construya una cadena de 10 átomos de carbono. Asegúrese de que todos los dobles enlaces están contenidos en la cadena y que no existen dobles enlaces laterales en la misma (fig. 9.7A). Figura 9.7. (A) Una cadena de diez carbonos (B) la cadena se cierra para formar un anillo que constituye la unidad básica repetitiva para un nanotubo (10,0). 3. Ahora conecte los dos extremos de la cadena para formar un anillo (fig. 9.7B). 4. Copie y pegue un anillo en el mismo espacio de trabajo y conecte cada una de los otros enlaces formando una porción del anillo (10,0). Deben haberse formado una serie de anillos de 6 miembros (fig. 9.8). Figura 9.8. La geometría del nanotubo comienza a tomar forma. 98 5. Copie y pegue la subunidad (los 2 anillos enlazados) y conecte cada enlace para formar un minitubo con cuatro anillos. Copie y pegue la unidad de cuatro anillos, conecte los enlaces y forme una unidad de ocho anillos. Repita esta unidad y Ud. tendrá un nanotubo de aproximadamente 6-7 nm de largo (Fig. 9.9). Figura 9.9. La estructura final de carbonos, vista a través de su interior, ilustra su geometría tubular. Parte B. El nanotubo construido se utilizará como un fondo o molde inerte para construir el péptido. Los estudiantes pueden variar la geometría del péptido de una forma predecible tan sólo variando el diámetro (ej. 10,0; 16,0; 22,0) del nanotubo. Este péptido se utilizará para explicar una variedad de enlaces, asociándolos con los diferentes tipos básicos de enlace descritos con anterioridad. 1. Construya un Asp-Gln en una secuencia total de 16 aminoácidos (Asp1, Gln2, Asp3...Asp8, Gln8) en un espacio de trabajo separado del utilizado para el nanotubo. Deje abierto este último correspondiente al nanotubo. 2. Copie y pegue esta estructura de péptido dos veces en el espacio de trabajo que contiene el nanotubo. Conecte el enlace protuberante al final del péptido con el enlace protuberante al final del tubo. Conecte el otro extremo del péptido al otro extremo del nanotubo en línea recta. (ver fig. 9.10). 99 3. Copie y pegue un segundo péptido al espacio de trabajo del nanotubo y conecte los extremos del péptido a los extremos opuestos del nanotubo en línea recta, de manera que ahora Ud. tiene dos cadenas peptídicas pegadas al nanotubo (ver fig. 9.11). 6. Ahora copie y pegue y conecte un tercer (primero) y un cuarto (último) péptido al esqueleto del nanotubo. Ninguno de los cuatro péptidos están conectados entre sí –aún (fig. 9.12). Guarde este fichero como “peptido_nanotubo”. Figura 9.10. Un segmento del péptido está siendo enlazado al esqueleto del nanotubo. Figura 9.11. Dos péptido están enlazados al molde de nanotubo, pero no están conectados entre sí – aún! 100 Figura 9.12. Todos los cuatro péptidos están enlazados al nanotubo mediante cuatro enlaces en cada extremo (8 enlaces en total). Minimice la energía de esta estructura nanotubo-péptido. 8. Desconecte (comando de romper enlaces) los ocho enlaces que sujetan los cuatro péptidos al nanotubo. Conecte los cuatro péptidos con tres enlaces (ver fig. 9.13). Remueva el nanotubo de esta nueva estructura peptídica y recórtelo del espacio de trabajo de manera que sólo quede el nuevo péptido. Guarde este fichero como “peptido”. Figura 9.13. Después de desconectar el péptido del nanotubo, hay tres enlaces que conectan los cuatro péptidos, formando a su vez una sola estructura de mayor longitud. 101 9. Construya un ion Ca(II) (Semiempirical, PM3, carga=dication). Una vez que termine el cálculo computacional sobre un ión sencillo, cópielo y péguelo diez veces dentro de la estructura del péptido. Guarde esta estructura como “peptido_calcio” y minimícela. Identifique cuáles grupo(s) funcional(es) ejercen atracción sobre los iones Ca(II) y determine las distancias entre el ión (los diez) y el grupo correspondiente. Tomando en consideración la Ley de Coulomb, discuta/explique este resultado en su informe de laboratorio. 10. Abra el fichero “peptido” en un nuevo espacio de tabajo y guárdelo como “peptido-fluor”. En un espacio separado, construya un ión fluoruro (F-) y realice los cálculos típicos (“recall”, carga=anion). Una vez que este cálculo se complete, copie y pegue diez de los aniones dentro de una estructura de péptido y minimice la energía del sistema y guarde este sistema como “peptido_fluor”. Determine y anote las diez distancias (entre F- y el grupo funcional)) y tomando en consideración la Ley de Coulomb explique los resultados obtenidos. 11. Abra el fichero “peptido” en un nuevo espacio de trabajo y guárdelo como “peptido-agua”. En un espacio separado, construya una molécula de agua y realice los cálculos típicos (“recall”, carga=anion). Una vez que este cálculo se complete, copie y pegue diez de las moléculas dentro de una estructura de péptido y minimice la energía del sistema y guarde este sistema como “peptido_agua”. Determine y anote las diez distancias (entre el agua y el grupo funcional)) y tomando en consideración la Ley de Coulomb explique este resultado. Adicionalmente, observe y trate de determinar las diferencias entre esta estructura y los dos sistemas previos (flúor y calcio). Discuta el impacto que tiene el agua sobre la estructura. 12. Abra en un nuevo espacio de trabajo otra estructura de péptido. En otro espacio separado, construya y calcule la molécula de etanol. Copie y pegue diez estructuras de etanol dentro del espacio del péptido y guarde este sistema como “peptido_etanol”. Minimice la energía del sistema y estudie la interacción entre el alcohol y el péptido. Compare y resuma las posibles diferencias que Ud. 102 observe entre estas estructuras de péptido y aquellas obtenidas al minimizarlas en presencia de las moléculas de agua. 13. Asegúrese de copiar y pegar los cuatro sistemas (calcio, flúor, agua, etanol) en su informe y utilice flechas cuando sea posible para ayudar a identificar los cambios estructurales principales entre los cuatro sistemas. Algunos parámetros, como los volúmenes moleculares, ancho o longitud, ángulos de enlace críticos y corrimientos generales en la estructura del péptido, pueden ser utilizados como ejemplos de cambios ente los diferentes sistemas. 103 Ejercicio 10. El Cinturón de Estabilidad Nuclear Objetivos de este ejercicio: 1. Los estudiantes aprenderán a balancear reacciones nucleares. 2. Los estudiantes evaluarán la estabilidad nuclear basada en la relación protón/neutrón. 3. Los estudiantes construirán los cinturones de estabilidad utilizando un programa de cálculo. La incorporación de ejercicios de Química Nuclear en el currículo del estudiante de pregrado es una tarea difícil, debido a muchas razones que incluyen medidas de seguridad, el costo de los equipos y reactivos, y las largas horas necesarias para estudiar la mayoría de estas reacciones. Este ejercicio propone que los estudiantes evalúen diferentes juegos de datos de desintegración nuclear y estudien los aspectos diversos relacionados con los cinturones de estabilidad. La Tabla 10.1 ofrece una lista de elementos y de sus isótopos estables. Las tablas de estabilidad incluyen sólo los isótopos estables (no radiactivos). Comience su informe respondiendo a las siguientes preguntas. Preguntas Previas: 1. Escriba una reacción nuclear química que representa una desintegración beta. Considerando la relación protón/neutrón, ¿qué tipos de núcleos experimentan desintegración beta hacia núcleos más estables? 2. Muestre el proceso de captura electrónica (EC) en una reacción nuclear química balanceada. ¿Cómo afecta la EC el número másico o el número atómico del elemento que se está desintegrando? 3. ¿Qué es un positrón? Escriba una ecuación nuclear balanceada que demuestre la emisión 104 positrónica. Si el carbono (12C) experimenta emisión positrónica, escriba la ecuación balanceada. 4. ¿Qué es una partícula alfa? ¿Cómo experimentará desintegración alfa un átomo de U-235 (escriba la reacción nuclear balanceada)? Parte I. 1. Para elementos con Z# =1-30 (hidrógeno al zinc), grafique el número del protones (eje-x) vs el número de neutrones (eje-y) para CADA isótopo. Algunos elementos pueden tener más de un isótopo (grafique los valores p, n para todos los isótopos). La Tabla 10.X muestra los datos iniciales que se requieren. Utilice un gráfico de dispersión x,y y ajuste sus datos con un ajuste lineal; obtenga y muestre la ecuación y el coeficiente de correlación en el gráfico. Recuerde identificar apropiadamente los ejes y escribir su nombre en la parte superior del gráfico antes de copiarlo en su informe. Incluya un pie de figura y un comentario sobre la relación que existe entre los protones y los neutrones para núcleos estables con menos de 31 protones. Este gráfico debe tener dimensiones de al menos 12x12 cm. 2. Dentro de su gráfico, utilice una flecha para mostrar dónde se encuentra el 14C y, debajo del pie de figura, escriba también la reacción. 3. El hierro tiene algunos isótopos estables (Fe-54, Fe-56, Fe-57, Fe-58) y algunos inestables (Fe52, Fe-55, Fe-59, Fe-60). Identifique dónde se puede encontrar cada isótopo inestable dentro del cinturón de estabilidad (use una flecha, Î Fe-60). Debajo del pie de figura, escriba la reacción de desintegración y su tiempo de vida media. 4. El sodio tiene un isótopo estable (Na-23) y dos isótopos inestables (Na-22 y Na-24). Utilizando una flecha, muestre dónde se encontraría cada isótopo inestable dentro del gráfico. Debajo del pie de figura, escriba el esquema de desintegración nuclear para cada isótopo que se convierte nuevamente en un núcleo estable. 105 5. Uno de los elementos de su gráfico tiene dos isótopos que vienen dados por los símbolos “D” y “T”. Considerando la relación entre neutrones y protones, T es único comparado con los otros elementos de la tabla periódica. ¿A qué se debe esta singularidad? ¿Cuál es su reacción de desintegración nuclear? Parte II. Los estudiantes ahora generarán un nuevo gráfico, utilizando el mismo formato de los realizados en la Parte I. Use los isótopos de la tabla que están contienen entre 31 y 82 protones – incluya todos los isótopos. El gráfico que se muestra debajo es un ejemplo de protones vs neutrones de elementos de Z# 31-82. Incluya en su gráfico la ecuación y = mx+b (ajuste lineal) y su coeficiente de correlación (y su nombre). Adicionalmente, su gráfico debe contener un pie de figura. La figura 10.1 muestra la forma general que deben tener sus gráficos de estabilidad. Neutrones elementos 1-82 Protones Figura 10.1. La relación entre protones y neutrones para núcleos/elementos estables de Z# 31-82. Considere la pendiente del segundo gráfico (Z# 31-82) y el primer juego de datos (Z# 1-30), y responda las siguientes preguntas. 106 1. ¿Por qué las pendientes de los dos gráficos son diferentes? 2. ¿Por que la pendiente NO es igual a uno (m=1) en el segundo juego de datos? 3. ¿Cuántos núcleos en este segundo gráfico tienen una relación protón a neutrón de 1.00? Si existe algún núcleo de este tipo, diga cuáles son. 4. Tanto el Sr-90 como el Cs-137 son isótopos radiactivos que se obtienen en reacciones nucleares industriales. Debajo de su gráfico, escriba las reacciones que los originan y el uso de estas reacciones. Utilizando una flecha, indique dónde se encontrarían estos isótopos en el cinturón de estabilidad. 5. El I-131 se utiliza en medicina nuclear. Describa dos aplicaciones y escriba la reacción de desintegración y el tiempo de vida media de este isótopo. Indique la localización de este isótopo (I-131Î ) en su gráfico. 6. El Tc y el Pm no tienen isótopos estables y no se encuentran en la corteza terrestre. El Tc99m se utilice en medicina nuclear. Describa su uso, y brinde un mecanismo para su reacción de desintegración, indicando el significado de “m” en la simbología “99m”. Muestre la localización de este isótopo en su cinturón de estabilidad. 7. En la región a la izquierda del cinturón de estabilidad (alta relación n/p) ¿cuál es el mecanismo de desintegración para retornar al cinturón de estabilidad (escriba una reacción de ejemplo)? 107 Tabla 10.1. Lista alfabética de elementos y sus isótopos estables. Los cinturones de estabilidad están compuestos por núcleos estables. Utilice una tabla periódica para obtener el Z# (protones) para cada elemento. Nombre I.E. masa Aluminio 27 27 Antimonio 121 121 Argón Arsénico Azufre 36 75 32 36 74.9 32 Bario Berillio Bismuto Boro Bromo 130 9 209 10 79 130 9.01 209 10 78.9 Cadmio 106 106 Calcio Carbono 40 12 40 12 Cerio Cesio Cloro 136 133 35 136 133 35 Cromo Cobalto 50 59 49.9 58.9 Cobre 63 62.9 Disprosio 156 156 Erbio 162 162 Estaño 112 112 I.E. masa Sb123 123 Ar-38 38 S-33 Ba132 33 132 B-11 Br-81 Cd110 Ca42 C-13 Ce138 11 80.9 Cl-37 37 Cr-52 51.9 Cu65 Dy158 Er164 Sn114 110 42 13 138 I.E. Masa Ar40 40 S-34 Ba134 Cd111 Ca43 34 134 I.E. masa S-36 Ba135 35.97 134.9 43 Cd112 Ca44 Ce140 140 Ce142 141.9 Cr53 52.9 Cr54 53.94 111 111.9 43.96 I.E. masa I.E. masa I.E. masa Ba136 136 Ba137 137 Ba138 138 114 Cd116 116 Dy164 164 Sn119 119 Cd113 Ca46 113 46 Cd114 Ca48 48 64.9 158 164 114 Dy160 Er166 Sn115 160 166 115 Dy161 Er167 Sn116 160.9 166.9 115.9 Dy162 Er168 Sn117 162 168 117 Dy163 Er170 Sn118 163 170 118 108 Europio Flúor Fósforo 151 19 31 151 19 31 Galio 69 68.9 Gadolinio 152 152 Germanio 70 69.9 Hafnio Helio Holmio Hidrógeno Indio Iodo 174 3 165 1 113 127 174 3.02 165 1.01 113 127 Iridio 191 191 Hierro 54 53.9 Iterbio Itrio 168 89 168 88.9 Kriptón 78 77.9 Lantano 138 138 Plomo Litio 204 6 204 6.02 Lutecio 175 175 Magnesio Manganeso 24 55 24 54.9 Mercurio 196 196 Eu153 Ga71 Gd154 Ge72 Hf176 He-4 H-2 In115 Ir193 Fe56 Yb170 Kr-80 La139 Pb206 Li-7 Lu176 Mg25 Hg198 153 70.9 154 71.9 176 4 Gd155 Ge73 Hf177 155 72.9 177 Gd156 Ge74 Hf178 155.9 73.92 177.9 Gd157 Ge76 Hf179 Gd158 158 179 Hf180 180 157 Gd160 160 Yb176 176 Hg204 204 75.9 2.01 115 193 170 Fe57 Yb171 171 Fe58 Yb172 79.9 Kr82 81.9 Pb207 207 25 Mg26 26 198 Hg199 199 55.9 56.9 57.93 171.9 Yb173 173 Yb174 174 Kr83 82.91 Kr84 83.9 Kr86 85.9 Pb208 208 Hg200 200 Hg201 201 Hg202 202 139 206 0.02 176 109 Molibdeno 92 91.9 Neodimio 142 142 Neón 20 20 Níquel Niobio Nitrógeno Oro 58 93 14 197 57.9 92.9 14 197 Osmio Oxígeno 184 16 184 16 Paladio 102 102 Plata 107 107 Platino Potasio Praseodimio 190 39 141 190 39 141 Renio Rodio 185 103 185 103 Rubidio 85 84.9 Rutenio 96 95.9 Samario Scandio 144 45 144 45 Selenio 74 73.9 Silicio Sodio Stroncio 28 23 84 28 23 83.9 Mo94 Nd143 Ne21 93.9 143 21 Ni-60 59.9 N-15 15 Os186 O-17 Pd104 Ag109 Pt192 K-40 192 40 Re187 187 Rb87 Ru98 Sm147 186 17 104 Mo95 Nd144 Ne22 Ni61 Os187 O-18 Pd105 94.9 144 Mo96 Nd145 144.9 Mo97 Nd146 Ni62 61.93 Ni64 63.9 Os188 188 Os189 189 Pd106 105.9 Pd108 Pt195 195 Pt196 95.9 148 Mo100 Nd150 Os190 190 Os192 108 Pd110 110 196 Pt198 198 96.9 146 Mo98 Nd148 97.9 99.9 150 22 60.9 187 18 105 192 109 Pt194 K-41 194 41 86.9 97.9 147 Ru99 Sm148 Se76 75.9 Si-29 29 Se77 Si30 Sr-86 85.9 Sr- 148 Ru100 Sm149 148.9 Ru101 Sm150 76.9 Se78 77.92 Se80 Sr- 87.91 98.9 99.9 150 Ru102 Sm152 79.9 Se82 101 102 152 Ru104 Sm154 104 154 81.9 30 86.9 110 87 Tántalo 180 180 Teluro Terbio 122 159 122 159 Talio Torio Tulio 203 232 169 203 232 169 Titanio 46 46 Tungsteno 180 180 Uranio Vanadio 234 50 234 49.9 Xenón 124 124 Zinc 64 Zirconio 90 Ta181 Te123 Tl205 88 181 123 Te124 124 Te125 124.9 Te126 126 Te128 128 Te130 130 Xe131 131 Xe132 132 205 235 50.9 63.9 Ti-47 W182 U235 V-51 Xe126 Zn66 47 89.9 Zr-91 90.9 182 126 65.9 Ti48 W183 U238 Xe128 Zn67 Zr92 47.9 183 Ti49 W184 48.95 184 Ti50 W186 49.9 186 238 128 66.9 91.9 Xe129 Zn68 Zr94 128.9 67.92 93.91 Xe130 Zn70 Zr96 130 69.9 95.9 *I.E. significa Isótopo del Elemento * Esta no es una tabla completa de isótopos 111 Parte III. Si Ud. hace una búsqueda en google.com y escribe un isótopo específico (ej. uranio-235), puede encontrar fácilmente los datos que necesita. a. La tabla 10.2 muestra algunos elementos y sus isótopos que tienen más de 83 protones. Note que los de Z>83 no están en la lista de los cinturones de estabilidad. ¿Por qué? (Ayuda: para Z>83 ¿qué tipo de desintegración ocurre?). Para el radio, el radón, el torio, el uranio y el plutonio, encuentre los isótopos para cada isótopo de esta lista (todos serán inestables) y desarrolle una tabla con el mismo formato de la Tabla 10.2. b. El I-131, Am-245, Co-60, Cs-137, Sr-90 son isótopos radiactivos que se utilizan en aplicaciones industriales o médicas, o que tienen un importante impacto en la contaminación ambiental. Describa brevemente el papel de cada isótopo en el campo de aplicación por el que mejor se le conoce. Tabla 10.2. Elabore una tabla en su reporte, siguiendo el mismo formato. Es importante conocer el mecanismo por el cuál los isótopos de Z# > 83 retornan al cinturón de estabilidad. Elemento # # Relación Reacción de Tiempo de vida /isótopo Protones Neutrones n/p desintegración media (incluya unidades de tiempo) U-235 92 146 U-238 Î Th-234 + He-4 U-238 U-242 Np-225 Np-229 Pu-232 Pu- 228 Am- 235 Am-238 Pa-215 112 Ejercicio 11. Gráficos de Especiación y pH Objetivos de este ejercicio: 1. Los estudiantes revisarán los aspectos fundamentales de la química ácido/base en fase acuosa. 2. Los estudiantes simularán el impacto que tienen los cambios de pH en el equilibrio de especies monopróticas, dipróticas o polipróticas. Introducción. La acidez o basicidad de un sistema puede impactar o alterar significativamente la química que tiene lugar en un beaker, un organismo vivo o un ecosistema. Por ejemplo, el hierro metálico se disuelve en un medio muy ácido para formar hierro(II) o hierro(III), los cuales existen en fase acuosa. Si el pH del medio cambia hacia valores más básicos, entonces el hierro precipitará en forma de óxido (ej. FeO), hidróxido (Fe(OH)2) o un oxihidróxido (FeOOH). En este ejercicio el estudiante trabajará con cuatro ácidos y graficará las especies presentes desde pH=0 hasta pH=14. Primeramente, el estudiante seguirá las instrucciones paso a paso en una hoja de cálculo para similar la desprotonación del ácido acético (HAc) para formar acetato (Ac-) en función del pH. Los comandos que se orientan son para su uso en Excel. HAc(ac) + H2O(l) Î H3O+(ac) + Ac-(ac) (11.1) Y la expresión de la constante de equilibrio es la siguiente: Ka = [H3O+][ Ac-] [HAc] = 1.8 x 10-5 (11.2) La cual puede ser expandida a la ecuación de Henderson-Hasselbalch (H-H), que se utiliza generalmente par alas soluciones tampón o buffer. pH = pKa + log10[Ac-]/[HAc] (11.3) 113 En esta simulación, el pH y el pKa se definen en cada punto. El valor del pH aumentará desde 0 hasta 14 en incrementos de 0.1 (0, 0.1, 0.2, etc.) mientras que el pKa (4.74) es el mismo para todos los puntos. Esto nos permite un reordenamiento de la ecuación de H-H: 10(pH-pKa) = [Ac-]/[HAc] (11.4) Esta ecuación se redefine entonces como: 10(pH-pKa) = [X]/[C-X] (11.5) Donde C es la concentración inicial de HAc y X es la cantidad de HAc que se desprotona y forma acetato. Esta ecuación puede reordenarse de la siguiente manera: C*10(pH-pKa) = X 1+ 10(pH-pKa) (11.6) Ahora utilizaremos esta ecuación para simular un gráfico de especiación para el ácido acético y el acetato. Preguntas previas. Primero responda las preguntas previas en su informe, seguidas de las copias de sus gráficos (con los pies de figuras correspondientes). Cuando termine de realizar todo el ejercicio, Ud. debe tener cuatro gráficos (dos de ácidos monopróticos y dos de ácidos dipróticos). 1. Escriba el nombre y la formula empírica para los seis ácidos fuertes más comunes. 2. Escriba el nombre y la formula empírica para las seis bases fuertes más comunes. 3. ¿Los ácidos y bases fuertes tienen constantes de equilibrio? Explique. 4. Escriba la reacción y la ecuación del equilibrio para los siguientes ácidos débiles monopróticos. Incluya sus valores de Ka. (ver arriba las ecuaciones 11.1, 11.2 para la forma). a. Ácido fluorhídrico b. Ácido nitroso 114 c. Ácido cianhídrico d. Amonio e. Ácido fórmico 5. Escriba la reacción para cada desprotonación y la ecuación de equilibrio correspondiente para los siguientes ácidos débiles dipróticos o tripróticos. Incluya el valor de Ka para cada protón (ver arriba las ecuaciones 11.1, 11.2 para la forma). a. Ácido carbónico b. Ácido sulfuroso c. Ácido oxálico d. Ácido fosfórico Las partes 1 y 2 son ácidos monopróticos y las partes 3 y 4 son ácidos dipróticos. Su instructor le indicará cuáles especies graficar. Las instrucciones se brindan para el primer ácido monoprótico y para el primer ácido diprótico. Utilice las instrucciones y el formato que se dan para el HAc y el H2SO3 para la segunda serie de ácidos. Parte 1. 1. Abra una nueva hoja de cálculo de Excel 2. En la celda A1 escriba “pH” 3. En la celda A2 escriba el valor 0. 4. En la celda A3 escriba la ecuación “=SUMA(A2+0,1)” 5. Copie y pegue esta ecuación hacia bajo hasta A142. Su último valor (A142) debe ser 14. 6. En la celda B1 escriba “pKa” 115 7. En la celda B2 escriba el valor 4,74 y copie este valor hacia bajo hasta B142. El mismo valor debe aparecer en todas las celdas. 8. En la celda C1 escriba “pH - pKa” 9. En la celda C2 escriba la ecuación “=SUMA(A2-B2)” y cópiela hacia abajo hasta C142. En la celda C2 Ud. debe tener el valor -4,74 y en la última celda (C142) debe estar el valor 9,26 (utilizando pKa + pKb = 14, ¿cuál es el pKb del par ácido acético/acetato?). 10. En la celda D1 escriba “pH/pKa; exp”. La ecuación que se escriba en esta columna será parte de esta ecuación. 11. En la celda D2 escriba la ecuación “=EXP(C2)” y cópiela hacia abajo hasta D142. 12. En la celda E1 escriba “Conc. Inic. Acético”, que representa la concentración inicial de ácido acético. Asegúrese de hacer las columnas lo suficientemente anchas como para poder leer el encabezamiento. 13. En la celda E2 escriba el número “1” y cópielo hacia abajo hasta E142. Ud. está comenzando con ácido acético 1 M. Una pequeña fracción de este se disociará en pH ácido, pero a medida que la acidez de las soluciones disminuye y la basicidad aumenta, la fracción de ácido acético disminuirá y la cantidad de acetato se incrementará. 14. En la celda F1 escriba “Conc Acetato” 15. En la celda F2 escriba la ecuación “=SUMA(E2*D2/(1+D2))” y copie/pegue hacia abajo hasta F142. Esta es la ecuación 11.6 de arriba. 16. En la celda G1 escriba “Conc. Equil. Ácido Acético”. Esta columna calculará la concentración en el equilibrio de ácido acético (HAc) a cada pH o [H3O+]. 17. En la celda G2 escriba la ecuación “=SUMA(E2-F2)” y cópiela hacia abajo hasta G142. Su primer valor (G2) debe ser aproximadamente 0,991 y su valor último (G142) debe ser aproximadamente 0,00009. 116 18. Ahora Ud. creará un gráfico con dos series utilizando un ayudante para gráficos. En la primera serie, el eje x corresponde a los valores de pH (A2…A142) y el eje y a los valores de concentración de acetato (F2…F142). En la segunda serie, utilice los mismos valores de pH (A2…A142) para el eje x, y los valores de concentración de ácido acético (G2…G142) para el eje y. 19. Nombre el eje x (pH) y el eje y (Concentración) y utilice su nombre para el título en la parte superior del gráfico. Asegúrese de que el eje del pH esté numerada desde 0-14. Su gráfico debe lucir como el que se muestra en la figura 11.1. Conc Acetato HAC Concentración 1.2 1 0.8 0.6 0.4 0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 pH Figura 11.1. Gráfico de especiación generado en una hoja de cálculo para el par ácido acético y acetato. Parte II. Construya un gráfico de especiación para el ácido fluorhídrico (HF) utilizando las mismas direcciones descritas en la Parte 1. Utilice una concentración de 0.5 M y calcule el pKa a partir del Ka de arriba. 117 Parte III. Este ejercicio se centrará en la generación de un gráfico de especiación para el ácido diprótico H2SO3. 1. Abra una nueva hoja de cálculo en Excel. 2. En la celda A1 escriba “pH” 3. En la celda A2 escriba el valor 0. 4. En la celda A3 escriba la ecuación “=SUMA(A2+0,1)” 5. Copie y pegue esta ecuación hacia abajo hasta A142. El último valor (A142) debe ser 14. 6. En al celda B1 escriba “pKa” 7. En la celda B2 escriba el valor 1,85 y copie este valor hacia abajo hasta B142. El mismo valor debe aparece en todas las celdas. 8. En la celda C1 escriba “pH - pKa” 9. En la celda C2 escriba la ecuación “=SUMA(A2-B2)” y cópiela hacia abajo hasta C142. En la celda C2 debe aparecer el valor -1,85 y en la última celda (C142) debe estar el valor 12,15. 10. En la celda D1 escriba “pH/pKa; exp”. La ecuación que se escriba en esta columna será parte de la ecuación. 11. En la celda D2 escriba la ecuación “=EXP(C2)” y cópiela hacia abajo hasta D142. 12. En la celda E1 escriba “Conc. Inic. Sulfuroso” que representa la concentración inicial de ácido sulfuroso. Asegúrese de que las columnas estén lo suficientemente anchas como para poder leer claramente el título. 13. En la celda E2 escriba el número “0,5” y cópielo hacia abajo hasta E142. Ud. comienza con 0.5 M . Una pequeña fracción de esto se disociará en un pH ácido, pero a medida que la acidez de las soluciones disminuye y la basicidad aumenta, la fracción de ácido acético disminuirá y la cantidad de acetato aumentará. 14. En la celda F1 escriba “Conc.-HSO3”. 118 15. En la celda F2 escriba la ecuación “=SUMA(E2*D2/(1+D2))” y copie/pegue hacia abajo hasta F142. 16. En la celda G1 escriba “Conc. Eq. Ácid. Sulf.” Esta columna calculará la concentración en el equilibrio del ácido sulfuroso (H2SO3) a cada pH o [H3O+]. 17. En la celda G2 escriba la ecuación “=SUMA(E2-F2)” y cópiela hacia abajo hasta G142. Su primer valor (G2) debe ser aproximadamente 0,43 y el último valor (G142) debe ser aproximadamente 0,0000026. 18. Para mayor claridad, deje en blanco la columna H. Como el ácido sulfuroso tiene dos pKa hay que representar las tres especies presentes (H2SO3, HSO3-, SO3-2). 19. En la celda I1 escriba “pKa2”. 20. En la celda I2 escriba el valor 7,20 y cópielo hasta I142. 21. En la celda J1 escriba “pH-pKa2”. 22. En la celda J2 escriba la ecuación “=SUMA(A2-I2)” y cópiela hacia abajo hasta J142. 23. En la celda K1 escriba “pH/pK2, exp”. 24. En la celda K2 escriba la fórmula “=EXP(J2)” y cópiela hacia abajo hasta K142. 25. En la celda L1 escriba “SO3-2 Inicial”, lo cual representa la concentración inicial de sulfito. 26. En la celda L2 escriba la ecuación “=SUMA(K2*F2/(K2+1))”. ¿Cuál ecuación de la introducción del laboratorio está representada en esta celda? ¿Cuáles son las variables que K2 y F2 representan? Copie esta ecuación hacia abajo hasta L142. El último valor (L142) debe ser aproximadamente 0,499. 27. En la celda M1 escriba “HSO3- Final”, que representa la concentración final de HSO3- a cada valor de pH. 28. En la celda M2 escriba la ecuación “=SUMA(E2-G2-L2)” y cópiela hacia abajo hasta M142. ¿Qué representan las variables E2, G2 y L2? 119 29. Ahora crearemos un gráfico con el asistente para gráficos que contendrá tres series (SO3-2, HSO3-, H2SO3). Estas tres series utilizarán los valores de pH (A2…A142) para el eje x. El H2SO3 se graficará utilizando G2...G142 para el eje y, el HSO3- se graficará usando los datos de M2..M142, y el SO3-2 se graficará usando los datos de L2…L142. 30. Identifique el eje x (pH) y el eje y (Concentración), y utilice su nombre para el título del gráfico en la parte superior. Asegúrese de que el eje del pH está numerado con unidades desde 0-14 (ej. 0, 1 ,2, 3..). Su gráfico debe lucir como el que se representa como ejemplo en la figura 11.2 (excepto con SU nombre arriba!). 31. Asegúrese de copiar y pegar este gráfico en su informe. HSO3- SO3-2 H2SO3 0.6 0.5 Conc 0.4 0.3 0.2 0.1 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 pH Figura 11.2. La especiación de sulfito en el rango de pH de 0-14. La concentración inicial para H2SO3 es 0.15 M. Parte IV. Construya un gráfico de especiación para el ácido oxálico utilizando el mismo formato y las instrucciones descritas en la Parte III. Utilice una concentración de 0.75 M y calcule el pKa a partir del Ka en las preguntas previas. Asegúrese de copiar y pegar este gráfico en su informe. 120 Preguntas finales. Escriba las respuestas a estas preguntas en su informe. a. ¿Por qué Ud. siempre utilizó las concentraciones molares cuando adicionó o sustrajo cantidades, en lugar de utilizar moles? Específicamente, a Ud. nunca se le suministró el volumen para ninguno de los gráficos de especiación. Explique por qué el volumen y por lo tanto los moles (moles = MV) no son necesarios. b. El EDTA puede ser un ácido hexaprótico. Dibuje la estructura para el ácido hexaprótico (asumiendo que los dos nitrógenos están protonados). ¿Qué quiere decir EDTA? Escriba los pKa que Ud. pueda encontrar para las disociaciones del EDTA (puede que no encuentre los 6 valores!). c. El EDTA es conocido como un aminocarboxilato. El DTPA es otro aminocarboxilato bien conocido. Dibuje su estructura y señale los ocho sitios por donde puede protonarse. El compuesto Gd(III)-DTPA (Gd es el lantánido Gadolinio) se utiliza en Imageneología por Resonancia Magnética (IRM o MRI), una técnica médica. ¿Para qué se utiliza el Gd(III)-DTPA en esta técnica médica? d. En las ecuaciones 11.2 y 11.3 de la introducción, se mostró brevemente la relación de la expresión del equilibrio con la ecuación de Henderson-Hasselbalch. Desarrolle paso a paso el procedimiento por el cual se convierte la ecuación 11.2 en la ecuación 11.3. 121 Ejercicio 12. Los imanes moleculares simples Mn12 y Fe8 Objetivos de este ejercicio: 1. Los estudiantes revisarán algunos conceptos fundamentales incluyendo la geometría molecular, la configuración electrónica, el magnetismo, las interacciones metal-ligando, y ciencias de los materiales. 2. Los estudiantes utilizarán programas de modelación molecular para construir, visualizar y estudiar materiales de avanzada (imanes moleculares simples). Introducción En este ejercicio se utiliza un programa de modelación molecular para construir dos estructuras complejas, Mn12 y Fe8, que se conocen como imanes moleculares simples. Para ser un imán molecular simple, la sustancia debe tener un espín magnético neto y tener una interacción magnética despreciable entre sus moléculas. Estos imanes moleculares simples han sido ampliamente estudiados en las investigaciones sobre nanomateriales. Los científicos creen que los imanes moleculares simples muestran aplicaciones en la realización de pequeñas unidades prácticas capaces de mantener una memoria magnética. Esto se debe al valor típicamente grande de su anisotropía de espín biestable. Adicionalmente, estos imanes moleculares se han utilizado para estudiar varios aspectos de la mecánica cuántica. Este ejercicio interdisciplinario incorpora un número de tópicos analizados en Química General incluyendo magnetismo, geometrías moleculares, hibridación, ciencia de materiales, nanotecnología y estados de oxidación. En su reporte, responda las preguntas previas y utilice un programa de arte 2D para los dibujos. Después de la construcción de las estructuras de Fe8 and Mn12 en el Spartan, incluya al 122 menos tres imágenes diferentes de cada estructura (desde diferentes ángulos) y mida los ángulos y distancias de enlace requeridos (ver las Tablas 12.1, 12.2). Preguntas previas: En la primera página de su reporte, responda las siguientes preguntas: 1. Escriba la configuración electrónica de Mn, Mn+3, Mn+4 2.¿Cuántos electrones desapareados hay en cada ion Mn+3 y Mn+4? 3.¿Con cuatro iones Mn+4 y ocho iones Mn+3, cuántos electrones desapareados puede tener potencialmente el Mn12 a la misma vez? 4. Defina diamagnético, paramagnético y ferromagnético. 5. ¿Es Mn12 diamagnético, paramagnético o ferromagnético? ¿Por qué? 6. Defina qué constituye un imán molecular simple, una computadora cuántica. 7. Fe8 es la abreviatura para hierro(8+), dodeca-hidroxihexakis(octahidro-1H-1,4,7-triazoninaN1,N4,N7)di-3-oxoocta-, octabromuro, nonahidrato. Identifique tres especies pequeñas encontradas en la estructura. 8. Mn12 es la abreviatura de Mn12O12(CH3COO)16(H2O)4]2CH3COOH.4H2O. Identifique cuatro especies pequeñas iónicas o moleculares presentes en la estructura. 9. ¿Qué es el número de coordinación? ¿Qué es un ligando? ¿Qué es un ligando monodentado? ¿Cómo es la geometría octaédrica? Dibújela en 2D. 123 Me Me Me O O O Me O Mn Mn O O O O H H HH O O O Me O O O O Mn Mn H H H O O H Me Mn O O O O O O O O Mn O Me Mn O O Me O O Mn O Me O O O O O Me O Mn Me O Mn Me O O O O O Mn O Me O O O Me Mn Me O Me Figura 12.1. Imagen 2D del imán molecular simple Mn12. Mn12-acetato está compuesto por cuatro moléculas de agua, 16 moléculas de acetato, 12 átomos de Mn (III y IV) con geometría octaédrica y 12 iones óxidos. Mn12 tiene la formula empírica Mn12O12(CH3COO)16(H2O)4. Esta molécula contiene cuatro iones Mn+4(S=3/2) en un tetraedro central rodeados por ocho iones Mn+3(S=2) donde S es el numero de espín}. Mn12 contiene puentes de oxígeno que permiten el intercambio entre los iones Mn. 124 H H 12 C H O 12 C O Figura 12.2a. (arriba) El ión acetato (CH3COO-) es un ligando clave. El carboxilato se enlaza a la carga positiva de los cationes Mn. “Me” es un grupo metilo (-CH3). (b) (abajo) El cluster de Mn12 esta compuesto por agua, acetato, iones Mn y óxidos. El óxido que se usa en la construcción de Mn12 tiene tres enlaces, el tercero es una atracción electrostática (típicamente el oxígeno tiene dos enlaces). Fe8 Para preparar a los estudiantes para construir Mn12, primeramente vamos a construir el imán molecular simple Fe8 que es más pequeño en un esquema paso a paso. Esta molécula va a ser construida en Spartan y copiada en su reporte después de las preguntas previas. Los estudiantes van a construir esta molécula por partes y finalmente van a unir los fragmentos para obtener la estructura completa. Los estudiantes de química general pueden no entender la representación por líneas que se usa en la química orgánica, en la figura 12.3 se ilustra una abreviación común de la estructura que se encuentra en la figura 12.4. 125 N N CH2 CH2 N N Figura 12.3. En química orgánica, las líneas angulares representan átomos de carbono con hidrógenos enlazados. Esta estructura de etileno se encuentra en Fe8. (1) HN (2) NH NH Fe 3+ OH- (3) HN OH- OH- OH- Fe 3+ N Fe O 2- O 2- NH 3+ (5) 3+ N N OHFe NH OH- Fe N HN 3+ N 3+ OH- Fe OH- N (4) HN Fe 3+ OH- OH(7) NH (6) OH- HN OHFe 3+ NH HN (8) Figura 12.4. El imán molecular simple Fe8 tiene la formula empírica C36H102Fe8N18O14 8Br9H2O. Los átomos de hierro han sido marcados previamente 1-8 para ayudar en la construcción. Cuando se construya el Mn12, también deben marcarse los átomos secuencialmente. 126 Ejercicio I. Construcción de Fe8. En estas instrucciones se asume que los estudiantes han realizado otros ejercicios de Spartan y están familiarizados con varias estructuras moleculares (octaédrica, trigonal plana, etc.). Los átomos de hierro dentro de la estructura han sido marcados por los estudiantes en la figura 12.4. Aunque es posible asignar un estado de oxidación a un átomo antes de realizar cualquier cálculo en Spartan, este ejercicio está centrado en factores básicos de geometría y por lo tanto los estados de oxidación no son necesarios en este punto. Las instrucciones para construir Fe8 se relacionan a continuación: 1.) Abra Spartan y seleccione en “File”, “New” para comenzar una nueva molécula. 2.) Fe8 va a ser construido en secciones. La construcción comenzará con el cuadrante superior izquierdo de la molécula (Fig. 12.4) centrado en el átomo de Fe designado #1. Seleccione Fe del menú “Exp.”. Déle al átomo de Fe una configuración con 6 enlaces, seleccionando la geometría octaédrica con todos los enlaces simples. Una vez insertado en el espacio de trabajo debe aparecer como la figura 12.5. Figura 12.5. Fe con geometría octaédrica. 3.) Seguidamente se enlazan átomos de oxígeno y nitrógeno al átomo de Fe. Seleccione N sp3 (geometría tetraédrica) del menú “Exp.”. Coloque tres átomos de N en el átomo de Fe #1 (ver Fig. 12.6). Ud. puede cambiar el color de un elemento específico seleccionando el elemento, “options” y “color.” Figura 12.6. Fe (verde) esta enlazado a tres átomos de N (azules) 127 4.) Adicione tres átomos de oxígeno a los enlaces restantes del Fe. Cuando seleccione la geometría del oxígeno, escoja trigonal plana con simples enlaces. (Fig. 12.7). Figura 12.7. Átomos de oxígeno (rojos) están enlazados al átomo central Fe 5.) Dos átomos de carbono con hibridación sp3 se enlazan a los átomos de N. Conecte dos átomos de C (dos grupos metilo separados, -CH3) a cada átomo de N en la estructura Fe #1, dejando un enlace libre en cada átomo de N. (ver Fig. 12.8) Figura 12.8. Dos grupos metilo (6 en total) están enlazados a cada átomo de N. 6.) Utilizando la imagen anterior como guía, enumere los átomos de carbono de 1-6 comenzando por abajo de la esquina izquierda y vaya a favor de las manecillas del reloj por la imagen. Enlace el C1 al C6, C2 al C3, y C4 al C5, obteniéndose la figura 12.9. Guarde su estructura después de la adición de dos o tres átomos. 128 Figura 12.9. Los átomos de carbono de diferentes N están enlazados. 7.) Seleccione “File” y “Save as” para guardar la molécula. Guarde su molécula con el nombre “Fragmento”. 8.) Preste atención a la estructura de Fe8 (Fig. 12.4), Note que el fragmento de la figura 12.9 se repite cuatro veces. La figura 12.9 representa los clusters centrados en Fe #1, Fe #3, Fe #6, y Fe #8. Copie y pegue su estructura y rótela hasta la esquina superior derecha. Debe verse como la figura 12.10. Figura 12.10. La estructura creada en la figura 12.9 se copia, se pega y se rota hasta esta posición. 9.) Refiriéndose a la figura 12.2, añada el átomo de Fe #2 (octaédrico) de manera que se enlace a dos átomos de oxígeno de cada cluster (ver figura 12.11), sirviendo de puente en este punto. Un átomo de oxigeno de cada cluster debe quedar en la misma dirección que los enlaces libres del átomo central Fe #2. 129 Figura 12.11. El átomo de Fe central tiene dos enlaces Fe-O con cada cluster. Los dos enlaces restantes están en la misma dirección de los átomos de oxígeno sin enlazar de los clusters. 10.) Copie y pegue su complejo (figura 12.11) en el espacio de trabajo y rote la estructura 180º utilizando el mismo método que el paso 13. Figura 12.12. Copie, pegue y rote su estructura hasta que tenga la apariencia de la especie que se muestra arriba. 11.) Una los dos complejos usando los átomos de oxígeno que tienen geometría trigonal plana (3 enlaces). Los dos átomos de Fe involucrados en este nuevo puente son Fe #2 y Fe #7. NO 130 MINIMICE en este paso pero guarde esta estructura con el nombre “Medio enlazados”. Su estructura debe parecerse a la mostrada en la figura 12.13. Figura 12.13. Los dos complejos están unidos por puentes de oxígeno. 12.) Refiriéndose a la figura 12.13, de la derecha a la izquierda del centro, hay tres átomos de oxígeno que forman un triángulo. El triángulo en cada lado esta hecho por el átomo de O central que está enlazado a Fe #2 y Fe #7 y los dos oxígenos con enlaces libres de los clusters. A la izquierda los átomos de oxígeno están enlazados a Fe #1 y Fe #6 y en la derecha los átomos de oxígeno están enlazados a Fe #3 y Fe #8. 13.) Adicione un átomo de Fe con geometría octaédrica en la parte izquierda (fig. 12.13) que se enlace a Fe #2 y Fe #7. Entonces conecte dos enlaces del átomo de hierro a los átomos de O enlazados a Fe #1 y Fe #6. 14.) Repita el paso 13 en la parte derecha de la molécula. Use el otro átomo de oxígeno central que está enlazado a Fe #2 y Fe #7, y los átomos de oxígeno que están enlazados a Fe #3 y Fe #8. Minimice y guarde la estructura, la cual debe lucir como la mostrada en la figura 12.14. 131 Figura 12.14. Se adicionan dos átomos de Fe octaédricos. 15. ) Los nuevos átomos insertados son el Fe #4 (izquierda), y Fe #5 (derecha). Los anillos de carbono y nitrógeno alrededor de Fe #4 y Fe #5 son los mismos alrededor de Fe #1, 3, 6, y 8. Empiece a construir un anillo alrededor de Fe #4 y Fe #5 adicionando un átomo de N con cuatro enlaces a cada uno de los sitios sin enlazar en Fe #4 y Fe #5. 16. ) Cada átomo de nitrógeno que se adicionó tiene tres enlaces libres. En cada átomo de N, adicione dos átomos de C con hibridación sp3 a dos de los tres enlaces libres. Seleccione los sitios más cercanos a los otros átomos de N. En cada N debe quedar un enlace libre, apuntando contrario a los otros átomos de N. 17. ) Construya un enlace entre un átomo de carbono de un nitrógeno y un átomo de carbono del otro nitrógeno. Repita este paso para formar un anillo por cada lado de la molécula. Si se hace correctamente debe ser N-C-C-N-C-C-N-C-C. Spartan adiciona automáticamente los átomos de hidrógeno cuando se minimiza la estructura. 18. ) Su molécula está terminada, presione el botón “V” para ver la forma total con los átomos de hidrogeno adicionados (ver figura 12.15). Calcule la estructura con “molecular mechanics” y 132 en “Display” y “data” compruebe que su fórmula empírica es correcta. Asegúrese de guardar esta estructura en, al menos, dos lugares, incluyendo en una memoria externa. Figura 12.15. La molécula completa del imán molecular simple Fe8 19. ) En el menú “Model”, Ud. puede cambiar la apariencia de su estructura (por ejemplo, ver figura 12.16). 20. ) Construya una tabla para almacenar los datos medidos en su estructura de Fe8 (ver tabla 12.1). Esta es sólo para los datos asociados a los átomos de Fe. Asegúrese de copiar y pegar la estructura de Fe8 en su reporte. Cópiela y péguela desde tres perspectivas diferentes (tres imágenes por página). Enumere los átomos en su imagen y relaciónelo con los números de los átomos de Fe en su tabla 12.1. Utilice flechas si es necesario y escriba un pie de figura para cada imagen. 133 Figura 12.16. Fe8 con otra apariencia diferente. Tabla 12.1. Tabla resumen que los estudiantes llenarán con los parámetros de la estructura Fe8. Debe contener ocho filas, una para cada átomo de Fe y sus parámetros. Átomo Fe # Número de Coordinación 1 6 2 6 Ligando a. X b. Y c. . . a. X . Distancia de enlace 2.66 Å 2.51 Å 2.45 Å 2.45 Angulo de enlace desde el primer ligando 0 65.4 77.3 0 134 Ejercicio II. Construcción de Mn12. En este ejercicio el estudiante va a idear un método similar al de la construcción del Fe8 para construir el imán molecular simple Mn12 (ver fig. 12.1). Primeramente, enumere los átomos de Mn de 1-12 en su imagen 2-D (fig. 12.1), el orden en el que ud. construirá la estructura. Después de marcar los átomos de Mn comience a construir la estructura en Spartan sólo usando átomos de Mn y los iones óxido que los conectan. Su primer fragmento estructural debe ser un complejo Mn12-óxido. Una vez que esto esté terminado, adicione los acetatos y las aguas. Es más fácil adicionar componentes moleculares (acetatos, agua) que construirlas átomo a átomo. De manera similar al ejercicio de Fe8, copie y pegue su estructura de Spartan desde tres ángulos diferentes en su reporte y escriba un pie de figura para cada una. Además enumere los átomos y correlacione los números (Mn #1, Mn #2, etc.) con los números de Mn en la tabla que Ud. construirá en su informe (vea la lista en la tabla 12.2). Una vez terminada, calcule su estructura en “molecular mechanics” y compruebe la fórmula empírica. Tabla 12.2. Tabla resumen que los estudiantes van a llenar con los parámetros del complejo Mn12-Ac. La tabla debe tener 12 filas, una para cada átomo de Mn y sus parámetros.. Atomo Mn # Número de Ligando Distancia de Angulo de Coordinación enlace enlace desde el primer ligamdo 1 6 d. H20 (Mn-O) 2.56 Å 0 e. Acetato 2.71 Å 89.4 f. Oxido 2.89 Å 66.3 . . 2 6 Preguntas finales: 1. Después de calcular cada estructura con “Molecular Mechanics” en Spartan, ¿Cuál es el volumen del cluster de Mn12 en Å3? Si su versión de Spartan no hace este cálculo, estime la longitud, el ancho y la altura y calcule el volumen. 2. ¿Es el acetato un ligando o un agente quelatante? ¿Qué son el agua y el óxido? Explique su respuesta. 135 Ejercicio 13. Cinética de Descomposición del Ozono Objetivos de este ejercicio: 1. Los estudiantes analizarán algunas de las aplicaciones de un producto químico de importancia industrial. A partir de este estudio, comprenderán la importancia de conocer a profundidad los parámetros químicos y físicos de las diferentes especies químicas. 2. Los estudiantes utilizarán los datos experimentales de reacciones que incluyen la descomposición del ozono para formar oxígeno, para poder determinar el orden de reacción y la constante de velocidad. 3. Los estudiantes realizarán cálculos y construirán gráficos a partir de los componentes de este ejercicio utilizando un programa de cálculo, profundizando de esta manera sus habilidades en el uso de la computación. Preguntas previas (incluir en su informe). 1. Escriba las ecuaciones de concentración en función del tiempo para reacciones de orden cero, primero y segundo orden. Defina cada una de las variables de la ecuación e incluya las unidades. 2. Describa cómo se utilizan los gráficos lineales para el ajuste de datos de reacciones de orden cero y primero y segundo orden con el objetivo de obtener las constantes de velocidad (genere los gráficos para cada uno en un programa 2D de dibujo, nombre los ejes y describa la forma del gráfico, así como la relación entre la pendiente y la constante de velocidad). 3. Escriba las ecuaciones necesarias para convertir una constante de velocidad en el tiempo de vida media para reacciones de orden cero y primer y segundo orden. Incluya las unidades para todas las variables utilizadas. 136 Introducción. El ozono (O3) tiene muchas y variadas aplicaciones en nuestra sociedad, incluyendo en la acuicultura y el tratamiento de aguas de acuarios, en el tratamiento de aguas residuales y potable, como agente blanqueador en la industria del papel, como desinfectante, como agente oxidante en la industria química, en el tratamiento del agua de las piscinas, como material abrasivo, y en la remoción de olores. En la mayoría de los casos, las aplicaciones se basan en la combinación de su fuerte potencial de reducción, sus características favorables al medio ambiente y la relativa velocidad de sus reacciones con especies químicas y biológicas. El estudio de la formación del ozono en varios tipos de descargas y plasmas constituye un tema de investigación latente para científicos e ingenieros tanto para aplicaciones ambientales como industriales. El ozono puede obtenerse mediante una amplia variedad de métodos que incluyen la descarga de corona (DC), las celdas electroquímicas y utilizando la luz UV. La DC es el método más común para la producción comercial a gran escala de ozono a partir de oxígeno puro o aire. En la DC, se aplican varios miles de voltios entre dos electrodos separados sólo varios milímetros, con un flujo de corriente regulado por un material dieléctrico. Este plasma o medio de descarga que se crea está caracterizado por altas temperaturas y altas densidades electrónicas. El ozono tiene algunas ventajas conocidas sobre otros agentes oxidantes fuertes. El producto de su reducción (O2) no es tóxico comparado con los productos de otros agentes oxidantes. Por ejemplo, el HClO2 produce un residuo clorinado, mientras que el flúor gaseoso (F2) es altamente corrosivo. Los resultados experimentales obtenidos para la cinética de descomposición de numerosos compuestos orgánicos mediante reacción con ozono muestran que el proceso es muy ventajoso comparado con otros agentes oxidantes. El ozono también tiene resultados impresionantes como desinfectante de microorganismos como enterobacterias, virus, esporas bacterianas y amebas en diferentes suministros de agua. Generalmente, los resultados son superiores a los obtenidos con otros agentes oxidantes 137 comunes como HOCl, OCl- y NH2Cl en la inactivación de microorganismos, y tiene la ventaja ambiental de que no quedan residuos tóxicos. La capacidad del ozono para absorber la luz ultravioleta en el rango de 200 a 300 nm y su disminución consecuente debido a los clorofluorocarbonos ha atraído mucha atención sobre este alótropo del oxígeno. El Premio Nóbel de Química de 1995 se le otorgó a Mario Molina y F. Sherwood Rowland por el modelo de predicción del efecto de los clorofluorcabonos (CFC) sintetizados por el hombre sobre los niveles de ozono en la estratosfera. La primera reacción de transformación del oxígeno en ozono involucra la disociación del oxígeno molecular (O2) por la luz ultravioleta (hν) con una longitud de onda menor de 240 nm, para formar oxígeno atómico (O), O2 + hν ⇒ O + O (13.1) En la descarga eléctrica, los electrones producen esta disociación del oxígeno molecular. O2 + e- ⇒ O + O (13.2) Si analizamos la producción de ozono desde un punto de vista termodinámico, la conversión del oxígeno a ozono es un proceso endotérmico, donde la energía (∆H) viene suministrada por la descarga, 3O2(g) ⇒ 2O3(g) ∆H = +286 kJ (13.3) El oxígeno atómico se combina con el oxígeno molecular para producir ozono O(g) + O2(g) ⇒ O3(g) (13.4) El cambio de la energía libre de Gibbs (∆G) necesario para la transformación de vuelta del ozono a oxígeno tiene un valor negativo, indicando que la reacción está favorecida termodinámicamente, 2O3(g) ⇒ 3O2(g) ∆G = - 326 kJ (13.5) 138 En esta parte del laboratorio, la cinética de esta conversión de un alótropo de oxígeno a otro ya se ha determinado y los datos de este experimento se le proporcionan al estudiante. Los datos experimentales que se utilizarán involucran el uso de una descarga de corona para la disociación de O2 y la formación de O3 (Ecuaciones 13.3, 13.4). Típicamente, menos de un 1% del O2 que entra en la descarga se convierte en O3. El ozono es una molécula instable que se desintegra para formar oxígeno en cuestión de minutes u horas, dependiendo de las condiciones (ej. presión, temperatura, presencia de catalizador, etc.). Una vez que se forma el O3, el gas se transfiere a una cubeta de cuarzo. La cubeta, de 10 cm de longitud, se inserta en un espectrofotómetro que permite determinar la concentración de O3. Los datos suministrados son para la descomposición del ozono en O2 puro o del ozono en mezclas de O2 y Argón. El Ar constituye el 0.9% de la atmósfera de la Tierra. Una parte del ejercicio consiste en investigar (1.) el efecto que el Argón tiene sobre la producción de ozono en la descarga, y (2.) el impacto que tienen altos niveles de Argón (y consecuentemente bajos niveles de O2) sobre la descomposición de ozono en la cubeta de cuarzo bajo condiciones ambientales. 139 Tabla 13.1 (Ejercicio #1). Transfiera los siguientes datos a una tabla en su hoja de cálculo. Estos datos describen la descomposición del ozono en una atmósfera de O2 puro (a temperatura y presión ambiente), y la medición se realiza durante 75 minutos. Se realizaron tres experimentos separados con ozono y oxígeno atrapado en una celda de cuarzo de 10 cm. Los valores de absorbancia (Abs) que se brindan se determinaron a 254 nm. Las cuatro columnas (tiempo, abs, abs, abs) son las columnas A,B,C, and D de su hoja de cálculo. Tiempo/mins 0 3 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 Abs 0,291 0,271 0,257 0,226 0,201 0,181 0,159 0,145 0,13 0,117 0,104 0,093 0,086 0,077 0,069 0,061 0,055 Abs 0,297 0,242 0,225 0,197 0,179 0,162 0,147 0,132 0,119 0,108 0,097 0,087 0,078 0,073 0,066 0,057 0,053 Abs 0,297 0,252 0,237 0,209 0,189 0,172 0,157 0,143 0,131 0,118 0,108 0,098 0,092 0,083 0,073 0,07 0,064 Este ejercicio permitirá: a. Calcular los valores de absorbancia promedio (Abs) de los tres experimentos. b. Graficar los valores de absorbancia promedio vs. tiempo, y copiar este gráfico en su informe. c. Convertir los valores de absorbancia promedio, utilizando la ley de Beer, en las concentraciones de ozono promedio en fase gaseosa (en Molar). d. Generar un gráfico de primer orden (ln(conc)) vs.. tiempo), y utilizar la pendiente obtenida para calcular la constante de velocidad de la reacción. Esto se realizará para los cinco juegos de datos. e. Copiar los gráficos obtenidos en su informe. 140 f. Construir gráficos adicionales para examinar el papel potencial que pueden jugar el argón y/o el oxígeno en la producción de ozono en la descarga y en la descomposición de ozono en la celda de cuarzo. Las instrucciones que se dan a continuación par alas hojas de cálculo (en Excel) le permitirán un análisis paso a paso para el primer juego de datos. Ud. debe repetir este análisis para los cinco juegos de datos. 1. Abra una nueva hoja de cálculo en Excel. 2. Escriba el encabezamiento “tiempo/mins” en la celda A1. 3. En la celda A2, escriba el número “0”. 4. En la celda A3, escriba el número “3”. 5. Escriba el número “5” en la celda A4. 6. En la celda A5 escriba la ecuación “=SUMA(A4+5)”. 7. Copie y pegue la ecuación hacia abajo hasta la celda A18 (el valor en A18 debe ser 75). Este juego de datos (A2..A18) son los valores de tiempo (en minutos) que aparecen en la tabla 13.1. 8. Escriba el encabezamiento “Abs” en la celda B1. Copie los valores (2a columna) de la tabla 13.1 en las celdas B2 a la B18. Este es su primer juego de valores de absorbancia en el monitoreo de la descomposición de ozono durante 75 minutes. 9. Escriba el encabezamiento “Abs” en las celdas C1 y D1. 10. Escriba los valores de la 3ª y 4ª columnas en las celdas C2-C18 y D2-D18. Guarde esta tabla (la cual debe tener el mismo formato que la tabla 13.1). Promedio y Desviación Estándar 11. Escriba el encabezamiento “Abs Prom” en la celda E1. 141 12. Escriba la ecuación “=PROMEDIO(B2:D2)” en la celda E2. 13. Copie la ecuación en las celdas E3..E18. 14. Escriba el encabezamiento “Desviación Estándar” en la celda F1. 15. Escriba la ecuación “=DESVEST(B2:D2)” en la celda F2 y copie/péguela hacia abajo hasta F18. 16. Seleccione el asistente para gráficos en el menú de su hoja de cálculo. Seleccione “XY(Dispersión)” y marque “Siguiente”. 17. Seleccione la pestaña “Serie” y “Agregar”. 18. Utilizando el cuadro con flecha roja, selecciones las celdas A2 hasta A18 para los “Valores de X” y las celdas E2 a la E18 para los “Valores de Y”, y marque “Siguiente”. 19. Escriba “Cambio en Absorbancia vs. Tiempo/min” en el cuadro del Título del gráfico. Escriba también su nombre en este título. 20. Escriba “Tiempo(min)” en los valores del eje x, y “Absorbancia” en los valores del eje y. 21. Quite la marca en el cuadro “Mostrar Leyenda” en el menú de Leyenda y marque “Siguiente”. Como estamos trabajando con un solo juego de datos, no hay necesidad de indicar de cuál serie se trata. 22. Coloque el gráfico “En una hoja nueva” y marque “Finalizar”. Este gráfico debe copiarse en su informe y, con el pie de figura correspondiente, no debe extenderse a más de ½ página. La Ley de Beer se utiliza para convertir la absorbancia (A), un número adimensional, en la concentración (c). Α =ε ι c (13.6) Calcule la concentración de ozono en la fase gaseosa donde l = 10 cm (longitud del paso óptico), 3000 M-1cm-1 ( ε ε= se refiere a la conductividad molar del coeficiente de extinción). 142 23. En la celda G1 escriba el encabezamiento “Concentración Promedio”. 24. En la celda G2 escriba la ecuación “=SUMA(E2/(3000*10))”. Esta es la ecuación 13.6, pero reordenada en la forma A/(ε ι). 25. Copie/pegue la ecuación de la celda G2 a las celdas G3..G18. 0 0 10 20 30 40 50 60 70 80 -2 ln(conc) -4 -6 -8 -10 tiempo Figura 13.1. Gráfico de primer orden para la descomposición de una especie química. Note que el eje y disminuye hacia valores más negativos. Su gráfico debe incluir un título, su nombre y unidades en el eje x. Deben aparecer también en el gráfico los resultados de un ajuste lineal óptimo (la ecuación y = mx+b, y el coeficiente de correlación). 26. Escriba el encabezamiento “ln(conc)” en la celda H1. 27. En la celda H2 escriba la ecuación “=ln(G2)”. Copie/pegue esta ecuación en H3… H18. 28. Construya un gráfico con los valores calculados del logaritmo natural (G2..G18), ln(conc.) en el eje y, vs. el tiempo en el eje x. Recuerde incluir las unidades, un título en el gráfico y su nombre. 29. Utilizando un ajuste lineal, obtenga la ecuación del mejor ajuste lineal y muéstrela en el gráfico, así como el coeficiente de correlación lineal. Copie el gráfico en su informe y convierta la 143 pendiente de la línea a una constante de velocidad (1er orden). Incluya la constante de velocidad (con unidades!) en el pie de su figura. 30. Repita los pasos 1-29 para los juegos de datos de las Tablas 13.2, 13.3, 13.4, y 13.5. Ud. debe tener cinco series de datos en sus hojas de cálculo respectivas. 31. En este momento Ud. debe haber graficado los datos de la reacción de primer orden para los cinco juegos de datos, y debe haber obtenido las constantes de velocidad (las constantes de velocidad son siempre positivas!). Ahora generaremos un sexto gráfico utilizando estos datos para investigar su el argón tiene alguna influencia en la descomposición del ozono en oxígeno. Grafique las constantes de velocidad (eje y) en función de las concentración de oxígeno (1.0, 0.8, 0.6, 0.4, 0.2). Copie el gráfico en su informe y discuta el impacto que el argón tiene en la cinética de descomposición del ozono en un ambiente de argón/oxígeno. 32. Convierta las constantes de velocidad de primer orden a tiempos de vida media y grafique el tiempo de vida media (eje y) vs. la concentración de oxígeno (eje x), y explique la tendencia obtenida, si existe alguna. Preguntas Finales. Incluya las respuestas a estas preguntas en su informe después de los gráficos. 1. Grafique la concentración inicial de ozono (t = 0) vs. la constante de velocidad de cada experimento. ¿Considera Ud. que el ozono juega un papel importante en su propia descomposición? Por ejemplo, ¿considera Ud. que las reacciones “O3 + O3 == producto” o “O3 +O2 == producto” constituyen el mecanismo principal? 2. Grafique la concentración inicial de ozono vs. la fracción de argón. La concentración inicial de ozono representa la concentración de ozono que se produce durante la descarga que convierte el oxígeno en ozono. Discuta, tanto desde un punto de vista cualitativo como cuantitativo, el papel que juega el argón en la producción de ozono en una descarga eléctrica. 144 3. Explique la absorción de luz UV por el ozono, el oxígeno, el argón, el cuarzo y los otros plásticos, y cómo la selección de los gases y materiales a utilizar son importantes en este diseño experimental. 145 Tabla 13.2. Datos experimentales de la descomposición de ozono en una atmósfera de 20% Argón y 80% O2 a temperatura y presión ambiente. La concentración de ozono está por debajo del 1% de la presión total del gas (O2, Ar, O3), por lo que no se toma en cuenta en la relación 20/80. Tiempo (min) Abs (1) 0 0,681 3 0,568 5 0,537 10 0,481 15 0,445 20 0,413 25 0,383 30 0,364 35 0,334 40 0,305 45 0,285 50 0,264 55 0,251 60 0,239 65 0,222 70 0,206 75 0,19 Abs (2) 0,677 0,573 0,558 0,518 0,487 0,457 0,429 0,402 0,371 0,343 0,321 0,297 0,29 0,271 0,254 0,234 0,219 Abs (3) 0,685 0,581 0,562 0,524 0,494 0,466 0,44 0,415 0,39 0,369 0,347 0,326 0,307 0,289 0,272 0,254 0,235 Tabla 13.3. Datos experimentales de la descomposición de ozono en una atmósfera que consiste en 40% Argón y 60% O2. El primer valor (Tiempo = 0) es el valor que indica la la concentración de ozono que se está generando por la descarga de la corona. Tiempo (min) 0 3 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 Abs 1,321 1,098 1,023 0,935 0,879 0,833 0,789 0,747 0,708 0,67 0,637 0,603 0,571 0,541 0,513 0,485 0,464 Abs 1,246 1,043 0,988 0,908 0,865 0,826 0,788 0,746 0,712 0,679 0,647 0,617 0,59 0,559 0,525 0,503 0,476 Abs 1,309 1,117 1,041 0,943 0,904 0,863 0,825 0,773 0,733 0,699 0,655 0,635 0,606 0,578 0,549 0,524 0,497 146 Tabla 13.4. Datos experimentales de la descomposición de ozono en una atmósfera que consiste en 60% Argón y 40% O2. Se utilizó una cubeta de cuarzo porque el cuarzo transmite la luz ultravioleta, mientras que el plástico y otros cristales (ej. pyrex) absorben la luz UV. Los otros gases involucrados en estos experimentos, el argón y el oxígeno, absorben cantidades despreciables de luz UV. En este experimento, solamente el ozono absorbe con facilidad la radiación UV a 254 nm. Tiempo (min) 0 3 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 Abs 2,082 1,793 1,674 1,501 1,411 1,339 1,275 1,203 1,169 1,112 1,059 1,013 0,963 0,902 0,864 0,841 0,8 Abs 2,175 1,894 1,78 1,559 1,482 1,426 1,357 1,297 1,233 1,187 1,141 1,078 1,034 0,973 0,947 0,907 0,865 Abs 1,89 1,67 1,556 1,388 1,314 1,256 1,205 1,151 1,1 1,05 0,991 0,973 0,936 0,888 0,856 0,826 0,789 Tabla 13.5. Datos experimentales de la descomposición de ozono en una atmósfera que consiste en 80% Argón y 20% O2. El Tiempo = 0 minutes representa la primera medición después que se recoge el gas a partir de la descarga de la corona. El gas dentro de la descarga puede llegar a tener varios miles de grados de temperatura, pero se enfría rápidamente a temperatura ambiente cuando se transfiere a la cubeta de cuarzo. Tiempo (min) 0 3 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 Abs 3,37 3,073 2,92 2,612 2,49 2,39 2,297 2,202 2,107 2,042 1,947 1,852 1,771 1,727 1,644 1,582 1,522 Abs 3,569 3,221 3,031 2,754 2,63 2,521 2,391 2,35 2,264 2,144 2,093 2,016 1,938 1,862 1,779 1,713 1,644 Abs 3,306 2,93 2,797 2,702 2,536 2,436 2,337 2,251 2,163 2,077 1,997 1,92 1,843 1,771 1,709 1,658 1,594 147 Ejercicio 14. Treinta Ecuaciones para la Química General Objetivos de este ejercicio: 1. Los estudiantes revisarán los conceptos y las ecuaciones asociadas con treinta relaciones importantes que se estudian en Química General. 2. Los estudiantes utilizarán una hoja de cálculo para graficar las correlaciones asociadas con cada ecuación. 3. Este ejercicio se puede realizar en cualquier parte del curso práctico de Química General. Si se imparte al principio del curso, cumple un objetivo introductorio para los contenidos del mismo. Si el ejercicio se imparte al final del curso, entonces funciona como una revisión excelente de muchos de los conceptos aprendidos a través del semestre. Escriba su nombre, la fecha y el título del proyecto en la la parte superior de su informe de laboratorio. Cada ejercicio tiene un gráfico que debe aparece en su informe, junto con las preguntas y respuestas correspondientes. Cada uno de estos gráficos tendrá un título y su nombre (insertado cuando trabaje en el programa de cálculo), los ejes debidamente identificados y con las unidades correspondientes, y se debe colocar un pie de figura que describa brevemente los datos representados (ej. Figura 1. Este es un gráfico de …). Si se requieren dibujos para el informe, los mismos deberán realizarse en un programa de dibujo 2D. Cada página del informe contendrá como máximo un gráfico (o un ejercicio) por página, y cada nuevo ejercicio comenzará en el principio de una nueva página. Las páginas deben estar numeradas en la esquina inferior derecha y el informe final complete deberá estar presillado. 148 A continuación aparecen las treinta relaciones (ecuaciones) que se utilizan rutinariamente en varias áreas de la Química y de otras ciencias en general. En este ejercicio, Ud. aplicará estas relaciones a diferentes sistemas con algunas aplicaciones biomédicas y ambientales. En cada sección de las ecuaciones aparece el nombre de la relación (A), la ecuación (B), la definición de variables y unidades (C), y una descripción breve del concepto (D). Para la confección de su reporte, Ud. creará el gráfico y escribirá un pie de figura descriptivo utilizando oraciones completas (parte E). De igual forma, deberá responder, con 1-3 oraciones, una pregunta relacionada con la relación química de que se trate. 1. (A) Condición de frecuencia de Bohr (B) E = hv (C) ∆E es la diferencia en energía (Joules) h es la constante de Planck (6.626 x 10-34 J*s) v es la frecuencia (Hz) de la radiación (D) La energía luminosa tiene una dualidad de onda y partícula. Cuando la longitud de onda es corta, la frecuencia es alta y el fotón tiene la misma energía. (E) 700 nm aparece como luz roja, 600 nm como luz amarilla, 500 nm como luz verde y 400 nm como luz azul. Convierta cada longitud de onda en frecuencia y calcule su energía. Grafique la longitud de onda (nm) vs. la energía (J, eje x) y añada una línea con el mejor ajuste. ¿Qué representa la pendiente en este ajuste? (F) Coloque las siguientes regiones de la radiación electromagnética en orden de (1) energía más alta a menor energía, (2) longitud de onda más corta a la más larga, (3) frecuencia más alta a la más corta. Infrarrojo, ultravioleta, gamma, microondas, visible, rayos x, ondas de radio, ultravioleta de vació. 2. (A) Frecuencia y Longitud de Onda (B) λ v = c 149 (C) λ es la longitud de onda de la radiación electromagnética (metros) v es la frecuencia (Hz) c es la velocidad de la luz (3x108 m/s en el vacío) (D) La luz o radiación electromagnética está caracterizada por una frecuencia y una longitud de onda, las cuales están relacionadas con su energía. La frecuencia es el número de ciclos que pasan a través de un punto estacionario durante un periodo de tiempo dado. (E) 700 nm aparece como luz roja, 600 nm como luz amarilla, 500 nm como luz verde y 400 nm como luz azul. Convierta cada longitud de onda en una frecuencia y grafique la longitud de onda vs. la frecuencia (s-1, eje x) y añada una línea con el mejor ajuste. ¿Qué representa la pendiente en este ajuste? (F) La velocidad de la luz (c) se determina típicamente como la velocidad de la luz en el vacío. ¿Cuál es la velocidad de la luz en agua pura? ¿Y cuál es en un cristal como en el diamante? 3. (A) Ecuación de Molaridad (B) mol = MV (C) mol = moles M = Molaridad (moles/litros) V = Volumen (litros) (D) La molaridad es la concentración de una solución expresada como el número de moles de soluto por litro de solución. Un mole de cualquier sustancia se define como la cantidad de material que contiene 6.0221421 x 1023 partículas. (E) Si considera que Ud. tiene un mol de cada una de las siguientes sales: cloruro de sodio, cloruro de calcio, cloruro de magnesio, cloruro de hierro (III), cloruro de cobre (II), cloruro de estaño (IV), pentacloruro de fósforo, cloruro de uranio (VI), cloruro de tungsteno (VI), cloruro de manganeso (VII). Grafique la carga sobre el catión (eje x) vs. los moles de cloruro presentes. (F) Encuentre la molaridad de los ocho iones (cationes/aniones) que más comúnmente se encuentran en la sangre, así como sus concentraciones respectivas. 150 4. (A) Molaridad (B) M = mol/l (C ) molaridad (moles/litro) moles de soluto (moles) volumen (litros) (D) La molaridad es una unidad de concentración ampliamente utilizada. Se identifica abreviadamente con una “M”. Por ejemplo, el HCl 6 M se entiende como una solución de ácido clorhídrico de concentración seis molar. Esta ecuación (#5) es un reordenamiento algebraico de la ecuación 4. (E) Los ríos fluyen hacia el océano, lo cual produce el cambio de agua dulce en agua salobre. Una gran porción de la desembocadura del río se ve impactada por las mareas, de manera, en los momentos de marea alta, se puede encontrar agua salada del océano varios kilómetros dentro del río. Las unidades de concentración son partes por mil (ppt- por sus siglas en inglés) y representan una medida de porciento másico. 1 ppt es 1 gramo de NaCl por 1000 mililitros (1000 gramos) de agua (DH2O = 1 g/mL) o 1 mg de NaCl por 1 mL de agua. Supongamos que un científico mide el cambio en la concentración de NaCl a lo largo de un río a medida que este desemboca en el océano: Table 14.1. Datos de salinidad (concentración salina) tomados de un río que desemboca en el océano.(Nota: 1 milla es equivalente a 1.61 Km) Posición (millas río arriba) 5 millas 3 millas 2 millas 1 millas 0.75 millas 0.5 millas 0.25 millas 0.0 millas ppt (NaCl) Temperatura 1.1 3.05 11.5 18.9 25.9 31.8 33.2 35.0 25 oC 25 oC 25 oC 25 oC 25 oC 25 oC 25 oC 25 oC Primeramente, convierta las concentraciones (Tabla 14.1, ppt) a molaridad. Asuma que su solución de 1.1 ppt está constituida por 1.1 gramos de NaCl por 1 litro de agua. 1.1 gramos/ (58.45 g/mol) son los 151 moles de NaCl en 1 litro de agua. Grafique la concentración de NaCl (en Molar) vs. la distancia (eje x) dentro del río, y utilice un ajuste lineal (y = mx + b) para obtener la ecuación de la línea. Coloque la ecuación y el coeficiente de correlación en su gráfico. (F) Escriba los diez iones (cationes/aniones) que más comúnmente pueden encontrarse en el agua de mar y sus concentraciones en ppt y en concentración molar. 5. (A) Ecuación de Dilución (B) M1 V1 = M2 V2 (C) M1V1 es la molaridad inicial (moles/litros) y el volumen (litros) de la solución concentrada. M2V2 es la molaridad final y el volumen de la solución diluida. (D) Esta ecuación se usa a menudo para resolver los problemas relacionados con la dilución en una fase acuosa. (E) Consideremos una solución inicial de 100 mililitros de 35 ppt de agua de mar filtrada. Esta puede ser su solución patrón para construir una curva de conductividad, pero primeramente Ud. tiene que realizar una serie de diluciones (use agua destilada y desionizada en la dilución). El volumen final de cada dilución será de 10 mL (en total), y las concentraciones finales serán 5, 10, 15, 20, 25, 30 y 35 ppt. Grafique el volumen de su solución patrón necesario para preparar cada solución de 10 mL. (F) ¿Cuál solución tiene una concentración mayor de solución salina: (1) una piscina de agua dulce a la que se ha añadido un cubo de agua de mar o (2) una cucharada de agua de mar? ¿Cuál tiene la mayor cantidad de sal (en términos de gramos)? Explique su respuesta. 6. (A) Presión osmótica (B) π = iMRT (C) i = M= R = T = factor de van’t Hoff Molaridad (moles/litros) Constante de los gases, donde R = 0.08206 L atm · mol-1 · K-1 Temperatura (anteriormente conocida como temperatura absoluta) (Kelvins) 152 (D) El proceso de ósmosis se define como el flujo de un solvente desde una solución que tiene baja concentración de soluto hacia una con alta concentración de soluto. La ósmosis es una propiedad coligativa. (E) Dadas cinco soluciones separadas de NaCl (1.0 g/l, 3.0 g/l, 5.0 g/l, 10.0 g/l, 20.0 g/l): calcule y grafique la concentración de la sal (M, eje y) vs. la presión generada por estas soluciones a través de una membrana semipermeable a 25 oC. (F) Dibuje e identifique una celda osmótica simple (agua pura en un lado de la membrana, 1.0 M de sacarosa en la otra) y explique de qué manera las soluciones fluyen a través de la membrana en los procesos que ocurren en los filtros de ósmosis y ósmosis reversa (OR o RO). 7. (A) Ley de Boyle (B) P1V1 = P2V2 (C) P es la presión de un gas en un sistema sellado (P1 es la presión inicial, P2 es la presión final), V es el volumen (en L) del gas. (D) Las unidades (ej. atm, Pa, mm Hg, Torr, psi, etc.) para P1 y P2 no son importantes PERO sí es importante que se usen las mismas unidades en la relación. La consistencia en el uso de las unidades es también un factor crítico para los valores de la presión. Cuando la temperatura se mantiene constante, el sistema se denomina isotérmico. (E) En la superficie del océano, el cuerpo humano recibe una presión de 1 atmósfera. Una vez que Ud. se sumerge, cada vez que desciende 33 pies, la presión sobre su cuerpo se incrementa en otra (1) atmósfera. A 99 pies de profundidad existe 1 atm de presión (de la atmósfera) y 3 atmósferas de presión (de los 99 pies de la columna de agua), para un total de 4 atm de presión total que se ejerce sobre su cuerpo. A 198 pies existirán aproximadamente siete atmósferas de presión total. Grafique la presión total (eje y) que se ejerce sobre su cuerpo cuando se encuentra a 0, 33, 66, 99, 132, 165, 198 pies de profundidad. 153 (F) ¿Qué es la apoplejía por cambios bruscos de presión (enfermedad) y cómo la Ley de Boyle nos ayuda a entender mejor esta enfermedad? 8. (A) Ley de Charles (B) V1/T1 = V2/T2 (C) V1 = Volumen Inicial, V2 = Volumen Final T1 = Temperatura Inicial (K), T2 = Temperatura Final (K) (D) La Ley de Charles ilustra la relación entre el volumen (V) y la temperatura (T) de un gas en condiciones isobáricas (presión constante) en un recipiente sellado. Las unidades de volumen pueden variar (ej. Litros, mL, etc.), pero debe haber consistencia entre V1 y V2. Los valores de temperatura tienen que estar expresados en Kelvin (K). (E) Considerando una burbuja de aire con la forma de una esfera (r inicial = 0.1 mm) a 25 oC, grafique su volumen (eje x) a 25, 30, 35, 40 y 45 oC (pista: utilice el radio para calcular el volumen de cada esfera, y use siempre la temperatura en K). (F) ¿Por qué no debemos usar Celsios como unidad de temperatura? (pista: ¿qué ocurriría en el punto de congelación del agua desde el punto de vista algebraico?). 9. (A) Ley Combinada de los Gases (B) P1V1/T1 = P2V2/T2 (C) P = Presión V = Volumen T = Temperatura (K) (D) Esta ecuación asume que el gas se encuentra en un sistema cerrado y se varían dos o tres de las variables. La Ley de Boyle y la Ley de Charles, así como P1/T1 = P2/V2, pueden derivarse de esta igualdad. (E) Una burbuja de aire comienza a 198 pies de altura, donde su diámetro es 0.5 mm. Grafique la presión (eje y) que se ejerce sobre la burbuja cuando esta en la superficie (28 oC), a 33 pies debajo de la 154 superficie (23.5 oC), a 66 pies por debajo (21.2 oC), a 99 pies por debajo (19.2 oC), a 132 pies por debajo (17.9 oC), a 165 pies por debajo (16.3 oC), y a 198 pies por debajo de la superficie (15 oC). Recuerde que la presión en la superficie es de 1 atm, y se incrementa 1 atm por cada 33 pies de profundidad. La temperatura (K) debe estar en el eje z del gráfico tridimensional que Ud. construirá. (F) Si el número de moles en un sistema cerrado cambia durante una expansión o una contracción, ¿pueden aún aplicarse las leyes de Charles, de Boyle, o Combinada de los Gases? 10. (A) Ley de los Gases Ideales (B) PV = nRT (C) P = presión (atmósferas, atm) V = volumen (litros) n = moles of gas (mol) R = Constante Universal de los Gases (0.0821 litro.atm/mol Kelvin) T = temperatura (Kelvin) (D) La ley de los gases ideales describe la relación entre el número de moles de un gas, su temperatura y su presión, y el volumen en que está contenido el gas. Se trata de un sistema estático o uno en el cual no ocurren cambios de P, V o T en el tiempo. A diferencia de los sistemas dinámicos vistos anteriormente (Boyle, Charles, etc). Las unidades que se definen arriba son de uso obligatorio con esta ecuación. (E) Un tanque de acero de 20 litros de capacidad se llena hasta 2500 psi (14.7 psi = 1 atm) a 25 oC, con hidrógeno gaseoso. El hidrógeno gaseoso (H2) se utiliza como material prima en una celda de combustible. Considerando que la cantidad de hidrógeno del tanque se consume a razón de 1 gramo/hora durante veinte horas, bajo condiciones isotérmicas, grafique los moles de H2 (eje x) vs. la presión de cada hora, por veinte horas. (F) ¿Cuál es la corrección que se introduce con la ecuación de van der Waals comparada con la Ley de los Gases Ideales? 155 11. (A) Ley de las Presiones Parciales (B) Pt = P1 + P2 + P3….. (C) Pt = presión toral de la mezcla de gases P1 = presión parcial del gas 1 (atm) P2 = presión parcial del gas 2 (atm) P3 = presión parcial del gas 3(atm) (D) La ley de las presiones parciales establece que la presión total de una mezcla de gases es la suma de las presiones parciales de sus componentes individuales. (E) Asuma que el porciento del gas en la atmósfera es el mismo que su presión parcial (N2 = 78%, O2 = 21%, Ar = 0.9%, CO2 = 0.036%). Grafique la masa molar de cada especie (eje x) vs. su presión parcial en la atmósfera. ¿Existe alguna correlación entre la masa molar y la composición atmosférica? (F) ¿Se alterará significativamente la presión parcial de los tres gases componentes mayoritarios si variamos la temperatura? Explique. 12. (A). Ecuación de Henderson-Hasselbalch (B) pH = pKa + log10 (base/ácido) (C) pH = -log [H+] pH varía entre -1 y 14 y constituye un indicador útil de la acidez pKa = -logKa Ka es la constante de equilibrio para un ácido débil (D) La ecuación de Henderson-Hasselbalch se utiliza para estimar el pH de una solución buffer a partir de las concentraciones iniciales del par ácido/base conjugado que se emplea en la solución. (E) Para una solución buffer de ácido acético (Ka=1.8x10-5) y acetato, grafique el pH (eje y) a medida que la concentración de ácido aumenta (0.05, 0.1, 0.2, 0.3, 0.4, 0.5) y la de la base se mantiene constante (0.1 M). (F) Describa cómo el bicarbonato (HCO3-) funciona como un sistema buffer simple en el océano (pH=8.3) y en la sangre humana (pH = 7.34). Incluya las ecuaciones ácido/base que sean de relevancia. 13. (A). Ley de Henry (B) Pg = kC 156 (C) Pg = presión parcial (atm) del soluto encima de la solución C = concentración del soluto (gas) en la solución k = Constante de la Ley de Henry, las unidades pueden ser L·atm/mol, atm/(fracción molar) o Pa·m3/mol (D) La Ley de Henry establece que la solubilidad de un gas en un líquido es proporcional a la presión parcial del gas encima de la superficie, porque un incremento en la presión se corresponde con un incremento en la velocidad a la cual las moléculas de gas colisionan con la superficie del solvente. (E) La Constante de la Ley de Henry para el oxígeno en agua es 769.2 L·atm/mol. Una regla general para los gases disueltos en agua (en lagos, océanos, etc.) es que por cada 33 pies debajo de la superficie, la presión se incrementa en 1 atm. Calcule y grafique la cantidad de oxígeno en el agua (eje x) vs. la presión al nivel del mar o de la superficie (1 atm), a 33 pies (2 atm), a 66 pies (3 atm), a 99 pies (4 atm), a 132 pies (5 atm), a 165 pies (6 atm), y a 197 pies (7 atm). Recuerde que el O2 constituye aproximadamente el 20% del aire. (F) ¿Cuál es la concentración de O2 disuelto en el fluído sanguíneo (busque arriba)? ¿Cómo se compara este valor con el del O2 disuelto en agua? 14. (A) La Ley de Raoult (B) P = xsolvente Ppuro (C ) xsolvent = fracción molar del componente en la solución Ppure = presión de vapor (torr) del componente puro P = presión de vapor del solvente en la mezcla (D) La Ley de Raoult establece que la presión de vapor de un solvente en presencia de un soluto no volátil es proporcional a la fracción molar del solvente en la mezcla. (E) La presión de vapor del agua a 25 oC es 23.76 mmHg. Si la fracción molar del agua en una mezcla disminuye desde 1.0 hasta 0.0 en incrementos de 0.1, grafique la presión de vapor (eje y) vs. la fracción molar. 157 (F) ¿Cuál de los siguientes solventes tiene la presión de vapor más alta y cuál la más baja (agua, metanol, etanol, dióxido de carbono)? Explique el por qué en términos de las fuerzas intermoleculares y la habilidad para evaporarse de los solventes respectivos. 15. (A) Cinética, Primer Orden, Concentración vs. Tiempo (B) ln[A]t = -kt + ln[A]0 (C) [A]t = concentración de la especie A en un tiempo t k = constante de velocidad (unidades de 1/t) [A]0 = concentración inicial o de partida (D) Una reacción en la cual sólo una molécula sufre un cambio químico es una reacción de primer orden. Las unidades de concentración o cantidad para A pueden ser molar, moles, gramos, ppm, etc., siempre que sean las mismas unidades tanto para A como para Ao. (E) Asumamos que se tiene un sistema cerrado que contiene 10-4 M de ozono (O3) al principio de la reacción. La reacción de descomposición tiene un tiempo de vida media de 90 minutos a una cierta temperatura y presión. Grafique como varía la concentración de ozono cada cinco minutos, durante un período de cinco horas. (F) Si el ozono es una molécula instable y se descompone en oxígeno en cuestión de minutos u horas, ¿cómo es posible que esta molécula sea capaz de bloquear continuamente la luz ultravioleta que proviene del sol cuando se encuentra en la estrósfera? (Pista: ¿cómo se produce el ozono en la atmósfera superior?) 16. (A) Cinética, Segundo Orden, Concentración vs. Tiempo (B) l/[A]t = kt + l/[A]o (C) [A]t = concentración de la especie A en un tiempo t k = constante de velocidad de segundo orden (unidades = 1/(tiempo*conc)) [A]0 = concentración inicial o de partida (D) Una reacción en la cual dos moléculas reaccionan o colisionan para inducir un cambio químico es una reacción de segundo orden. Las unidades de la constante de velocidad para una reacción de este 158 tipo son diferentes que las unidades de la constante para una reacción de primer. Las unidades de concentración o cantidad para A pueden ser molar, moles, gramos, ppm, etc., siempre que sean las mismas unidades tanto para A como para Ao y que se correspondan con las unidades de la constante de velocidad (k). (E) Para una reacción hipotética 2AÎ B , los siguientes datos (tiempo, conc) fueron obtenidos para la descomposición de A en función del tiempo (0 s, 0.0105 M), (61 s, 0.00679 M), (119 s, 0.0051 M), (182 s, 0.004101), (245 s, 0.00348M), (310 s, 0.00291), (360, 0.00262). Grafique 1/(conc A) (eje y) vs. el tiempo (eje x) y utilice este gráfico para determinar la constante de velocidad de segundo orden. (F). For the reaction A+B Î C, it has the second order rate constant k= 3.24 s-1M-1. If the reaction is second order with respect to A and zero order with respect to B, what is the rate law? Plot the rate of reaction (y-axis) verses the starting concentration of A (axis), if six experiments had [A]o of 0.1, 0.075, 0.055, 0.040, 0.025, 0.0152 M and [B]o was held constant at 0.05 M. Explain what impact A has on the rate of reaction. On the same graph (2 series) plot the rate of reaction (y-axis) verses the starting concentration of B (axis), if six experiments had [B]o of 0.1, 0.075, 0.055, 0.040, 0.025, 0.0152 M. Explain what impact A has on the rate of reaction [A]o was held constant at 0.05 M. Fit both data sets with its own best fit line and include the slope and correlation coefficient on the graph. 17. (A) Cinética, Primer Orden, Tiempo de Vida Media (B) t1/2 = 0.693/k (C) t1/2 = tiempo d vida media k = constante de velocidad (D) Para una reacción de primer orden, el t1/2 es independiente de la concentración inicial. Las unidades del tiempo para t1/2 y k tienen que estar relacionadas. Por ejemplo, si el tiempo está expresado 159 en segundos, entonces la constante d velocidad debe expresarse en 1/s o s-1, o si el tiempo está en años, entonces la constante de velocidad estará en años-1. (E) Las constantes de velocidad para seis reacciones hipotéticas son 0.1 s-1, 0.1 min-1, 0.03 hr-1, 1234.8 días-1, 8.23 s-1 y 0.000482 ms-1. Convierta estos valores en los tiempos de vida media correspondientes, y cambie las unidades a minutos. Recalcule después las constantes de velocidad en min-1. Grafique las constantes de velocidad (en min-1) en función del tiempo de vida media (eje x, en min) e incluya este gráfico en su informe. Diga si la pendiente del gráfico da evidencia de algún número significativo. (F) Las reacciones nucleares que ocurren en la Naturaleza siguen una cinética de primer orden. Utilizando los conceptos que aparecen en las definiciones de reacciones unimoleculares, bimoleculares y termoleculares, explique por qué la desintegración de un núcleo es una reacción de primer orden. 18. (A) Cinética, Segundo Orden, Tiempo de Vida Media (B) t1/2 = 1/k[A]o (C) t1/2 = tiempo de vida media k = constante de velocidad de segundo orden [A]0 = concentración inicial (D) En una reacción de segundo orden, el tiempo de vida media depende de la concentración inicial. Debido a que se necesita de la colisión de dos especies, el tiempo de vida media de la reacción de segundo orden aumenta a medida que disminuye la concentración. Esta constante de velocidad tiene unidades de 1/(tiempo*concentración), como M-1s-1. (E)Una reacción de segundo orden tiene una constante de velocidad de 9.1 M-1hr-1 para una concentración inicial [A]o de 0.1 M. Calcule el tiempo de vida media de la reacción para las concentraciones iniciales siguientes: 1.0 M, 0.75 M, 0.5 M, 0.25 M, 0.1 M. 0.075 M, 0.05 M, 0.025 M y 0.01 M. Grafique la constante de velocidad vs. el tiempo de vida media (eje x) e incluya la ecuación del mejor ajuste lineal y el coeficiente de correlación en el gráfico. (F) Para la reacción: 2 NO + O2 -> 2 NO2, se obtuvieron los siguientes resultados: 160 Experimento # 1 2 3 [NO] 0.1 0.1 0.2 [O2] 0.05 0.10 0.05 Velocidad 0.1 0.2 0.4 ¿Cuál es el orden de la reacción con respecto a la [NO]? ¿Y cuál es la ley de velocidad general? ¿Y el valor de la constante de velocidad? ¿Se podría utilizar la ecuación de velocidad de la reacción de segundo orden para calcular el tiempo de vida media? Explique. 19. (A) Ecuación de Arrehenius (B) k = A–Ea/RT (C) k R A Ea T = = = = = constante de velocidad la Constante Universal de los Gases (8.314 J/mol*K) una constante llamada el factor de frecuencia o factor pre-exponencial energía activación (J) temperatura (K) (D) La ecuación de Arrehenius se utiliza para ajustar la constante de velocidad de una reacción química en función de la temperatura. Para realizar este cálculo, se necesita del valor de la energía de activación. (E) Un estudiante investiga una reacción a diferentes temperaturas (20 oC, 25 oC, 30 oC, 35 oC, 40 oC, 45 oC) y determina la constante de velocidad de primer orden para cada temperatura. El estudiante utiliza los datos de las constantes de velocidad para calcular el tiempo de vida media a cada temperatura (2.3 s, 3.42 s, 4.6 s, 5.79 s, 6.88s, 7.99 s). Expanda la ecuación de Arrehenius de arriba utilizando logaritmos naturales (ej. ln) y grafique 1/T (en K-1) vs. el lnk, y derive y reporte la constante de velocidad. (F) Existe una forma de la ecuación de Arrehenius que no incluye el factor pre-exponencial “A”, pero tiene dos constantes de velocidad (k1 y k2) y dos valores de temperatura (T1 y T2). Escriba esta ecuación y explique su uso en la modelación de la cinética química. ¿Cuáles son los signos que siempre tienen 161 las energías de activación, las constantes de velocidad y las temperaturas que se utilizan en la ecuación de Arrehenius? (G) Construya un diagrama de energía en un programa de dibujo 2D para la reacción AÎB. Esta reacción tiene una Ea de 40 kJ/mol sin usar un catalizador y una Ea de 25 kJ/mol con el catalizador (incluya las dos opciones en su diagrama). Señale el estado de transición (complejo activado), su entalpía (-12.3 kJ/mol), nombre cada eje adecuadamente, e identifique el tiempo y las energías para los productos y los reaccionantes. 20. (A) Ecuación de Nernst (B) Ecelda = E°celda – 0.0592/ n log Q (C) Ecelda = potencial de la celda (V) E°celda = potencial de la celda estándar (V) n = moles de electrones transferidos (n = 1,2,3, etc) Q = cociente de reacción (similar a K, constante de equilibrio) (D) El potencial electroquímico de una reacción (Eocelda) asume que esta ocurre a una temperatura de 25 o C, una presión de 1 atm y en concentraciones de 1 M para todas las especies disueltas en el solvente. La ecuación de Nernst proporciona una corrección a Eocelda cuando las concentraciones no son 1M. (E) Una celda galvánica común es la celda de Daniell, la cual puede representarse con la notación Zn(s) | ZnSO4(ac) || CuSO4(ac) | Cu(s) Las dos ecuaciones de reducción para las semi-reacciones que ocurren en la celda son Cu2+ + 2e− → Cu (Eo = +0.34 V) y Zn2+ + 2e− → Zn (Eo = −0.76 V) y la reacción espontánea total es Cu2+ + Zn → Cu + Zn2+ , las cuales resultan en un potencial eléctrico Eocelda = +0.34 V −(−0.76 V) = 1.10 V (note que se necesita una reacción de oxidación y una de reacción de reducción, por lo que hay que invertir la reacción del Zn y cambiar el signo). Utilizando la ecuación de Nernst, calcule el potencial de la celda si la concentración de Cu+2 disminuye desde 1.0 M hasta 0.1 M en incrementos de 0.1 M (ej. 1.0, 0.9, 0.8, …0.1). Grafique el potencial correcto de la celda (E) vs. la concentración de Cu+2 (asuma que la concentración de Zn+2 se mantiene en 1.0 M en todos los experimentos). 162 (F) Explique las semejanzas y las diferencias entre Q y K en función de la constante de equilibrio (P/R) y el tiempo de reacción. 21. (A) Midiendo la Entalpía (B) ∆H = mc∆T (C) ∆H m c ∆T = cambio de entalpía en un sistema químico (J) = masa de un sistema (g) = calor específico (J/g*C°) = cambio de temperatura (K) (D) Esta ecuación se utiliza de conjunto con los datos experimentales. En un arreglo experimental típico, se mezclan un ácido fuerte y una base fuerte (reaccionantes típicos) en un contenedor aislado, y se utiliza una sonda para determinar el cambio de la temperatura en función del tiempo (termostato, termómetro, etc.). Este valor es ∆T y entonces, conociendo el calor específico del solvente (ej. H2O = 4.184 J/goC) y la masa total del solvente y los reaccionantes, la entalpía puede determinarse con relativa facilidad. (E) En la tabla 14.2 aparecen los datos calorimétricos asociados con una reacción química. Grafique los datos (tiempo, eje x) y determine el ∆T. El solvente son 100 mL de agua (ej. c = 4.184 J/g oC; DH2O = 1 g/mL). Si 0.01 moles de A reaccionaran con 0.01 moles de B, ¿cuál sería el ∆H (en kJ/mol) de esta reacción? 163 Tabla 14.2. Datos calorimétricos para una reacción exotérmica (libera calor). Nota: los datos continúan en la página siguiente. Tiempo (s) 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 380 390 400 410 420 430 440 450 Temp (oF) 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 71.6 72 73.5 75.2 76.4 77.5 78.3 78.7 79.1 79.5 79.8 79.9 80.1 80.2 80.3 80.4 80.45 80.5 80.5 80.55 80.6 80.6 80.6 80.6 80.65 80.65 80.65 80.65 80.65 80.65 80.65 80.65 80.65 164 460 470 480 80.65 80.65 80.65 (F) Compare las semejanzas y las diferencias entre un calorímetro de solución y un calorímetro de bomba. Escriba dos semejanzas y dos diferencias en su construcción y operación. 22. (A) Energía Libre de Gibbs, Entalpía y Entropía (B) ∆G = ∆H – T∆S (C) ∆G ∆H T ∆S = cambio en la Energía Libre de Gibbs (J) = cambio de entalpía (J) = temperatura (K) = cambio de entropía (J/K) (D) Una energía libre de Gibbs negativa es una representa una reacción espontánea (ej. una pila o batería), una energía positiva significa que no el proceso no es espontáneo (ej. N2 + O2 Î 2NO bajo condiciones normales); una entalpía negativa indica que se trata de una reacción exotérmica (ej. Una reacción de combustión), mientras que un valor positivo indica una reacción endotérmica (ej. las bolsas de enfriamiento rápido); un valor de entropía positivo indica que con la reacción aumenta el desorden (ej. el hielo se derrite para formar agua) y una entropía negativa significa que el desorden aumenta (ej. el agua se congela para formar hielo). (E) En un rango pequeño de temperaturas, y asumiendo que no ocurren cambios de fase, uno puede asumir que los cambios en ∆H y ∆S debido a la temperatura son despreciables, pero el ∆G puede variar a medida que cambia la temperatura. Para una reacción exotérmica (∆H = -41.6 kJ/mol) en la cual el desorden se incrementa (∆S = 95.2 J/molK), calcule la energía libre (en J) a diferentes temperaturas (25 a 37 oC en incrementos 1 oC). Grafique los resultados (Temp (K) en el eje x). (F) Para una transición de fases (ej. hielo a agua; agua a vapor), ¿cuál es el valor de ∆G y cómo queda la ecuación de esta sección cuando se introduce ese valor? 165 23. (A) Energía Libre de Gibbs y el Potencial Redox (B) ∆G = -nFEcelda (C) ∆G = Energía Libre de Gibbs (J) n = moles de electrones en una ecuación balanceada (ej. 1,2,3..) F = constante de Faraday (9.6485 x 104 C/mol) Ecelda = potencial de la celda (voltios) (D) Cualquier reacción de oxidación y/o reducción con un potencial de celda puede también describirse utilizando parámetros termodinámicos. Recuerde también que ∆G = ∆H – T∆S , por lo que una simple sustitución nos lleva a -nFEcelda = ∆H – T∆S, y como ∆G = -RTlnK (K = constante de equilibrio), con otra sustitución la ecuación queda como -nFEcelda = -RTlnK, la cual muestra que las constantes de equilibrio están relacionadas con los potenciales redox. (E) En la tabla 14.3, se presenta una lista de ácidos débiles, con sus reacciones de equilibrio y sus constantes de equilibrio respectivas (Ka). En su hoja de cálculo, grafique la Ka (eje x) para cada ácido vs. su energía libre de Gibbs (en kJ/mol). Grafique la energía de Gibbs en el primer eje y (a la izquierda). Después, grafique la Ka vs. el potencial de la celda (potencial de la celda en el segundo eje, a la derecha). Utilice la opción de mejor ajuste para cada juego de datos. ¿Qué indican las pendientes de cada gráfico? 166 Tabla 14.3. Algunos ácidos débiles comunes, sus reacciones de eauilibrio y sus constantes de equilibrioe en la fase acuosa. Ácido acético (HAc, en el vinagre) Ácido bezoico (preservante de alimentos) H+ + C2H3O2− HC2H3O2 C6H5CO2H H+ + C6H5CO2− 1.8 × 10−5 6.4 × 10−5 Ácido hipocloroso (en forma pura es inestable) HClO2 Ácido fórmico (¡veneno de hormigas!) HCHO2 Ácido cianhídrico (CN- es el cianuro) HCN Ácido fluorhídrico (note que HCl, HBr, HI son ácidos fuertes) HF Ácido hipobromoso HOBr H+ + OBr− 2 × 10−9 Ácido hipocloroso (¡la lejía!) HOCl H+ + OCl− 3.5 × 10−8 Ácido hipoyodoso HOI Ácido láctico (se produce haciendo ejercicios) CH3CH(OH)CO2H H+ + CH3CH(OH)CO2− Ácido nitroso (un intermediario importante en la átmosfera) HNO2 Ácido fenólico HOC6H5 H+ + ClO2− H+ + CHO2− H+ + CN− H+ + F− H+ + OI− H+ + NO2− H+ + OC6H5− Ácido propiónico (un CH3CH2CO2H ácido carboxílico) H+ + CH3CH2CO2− 1.2 × 10−2 1.8 × 10−4 6.2 × 10−10 7.2 × 10−4 2 × 10−11 1.38 × 10−4 4.0 × 10−4 1.6 × 10−10 1.3 × 10−5 (F) A continuación tenemos siete ácido fuertes comunes: HCl, ácido clorhídrico; HBr, ácido bromhídrico; HI, ácido yodhídrico; H2SO4, ácido sulfúrico (sólo el primer protón es fuerte); HNO3, ácido nítrico; HClO4, ácido perclórico; HClO3, ácido clórico; y dos bases fuertes comunes: NaOH, hidróxido de sodio; KOH, hidróxido de potasio. Cuando estas especies se disocian en solución para 167 formar cationes y aniones, ¿se puede decir que existe un equilibrio químico (con constante de equilibrio) o que la reacción genera un potencial? Explique. 24. (A) Elevación del Punto de Ebullición (B) ∆TB = Kbm (C) ∆TB = aumento de la temperatura de ebullición (oC) Kb = constante de elevación del punto de ebullición (C°/m) m = molalidad (moles de soluto por kilogramo de solvente) (D) Al añadir una sustancia como una sal (ej. NaCl) aumenta el punto d ebullición de un solvente (ej. H2O). La unidad de concentración que se utiliza es la molalidad, la cual se calcula dividiendo los moles de soluto por los kilogramos de solvente (ej. moles/kg). (E) Se añade NaCl a 100 mL de agua en diez incrementos de 0.5 gramos (0, 0.5, 1.0, 1.5, …5.0 g). Calcule el nuevo valor del punto de ebullición (pista: comience a 100 oC) después de cada adición y grafique los valores del punto de ebullición (eje y) vs. la masa total de NaCl añadido (0, 0.5, 1.0, 1.5,…). (F) Explique brevemente cómo la molaridad, la normalidad y la molalidad son formas (unidades) diferentes de expresar la concentración. 25. (A) Disminución del Punto de Congelación (B) ∆TF = Kfm (C) ∆TF = disminución en la temperatura de congelación (oC) Kf = disminución del punto de congelación del solvente (C°/m) m = molalidad de la sal en el solvente (mol/ kg) (D) La adición de una sal a una solución disminuye su punto de congelación. Por ejemplo, si se vierte sal sobre las carreteras para derretir el hielo, lo que ocurre es que el punto de congelación del agua disminuye por debajo de 0 oC. (E) Se añade NaCl a 100 mL de agua en diez incrementos de 0.5 gramos (0, 0.5, 1.0, 1.5, …5.0 g). Calcule el nuevo valor del punto de congelación (pista: comience a 0 oC) después de cada adición y 168 grafique los valores del punto de congelación (eje y) vs. la masa total de NaCl añadido (0, 0.5, 1.0, 1.5,…). (F) Defina el término “propiedad coligativa” y mencione los cuatro ejemplos. 26. (A) Ecuación de Rydberg (para el átomo de hidrógeno) (B) 1/λvac = RH Z2 ( 1/η12 - 1/η22 ) (C) λvac = longitud de onda (metros) del fotón emitido en el vacío RH = Constante de Rydberg para el hidrógeno (1.097 x 107 m-1) η1 = nivel inferior de energía η2 = nivel superior de energía (η1 < η2 ; los dos valores son números enteros y positivos: 1,2,3,4, etc.) Z = número atómico (1 para el hidrógeno) (D) Como el átomo de hidrógeno tiene un solo electrón, puede modelarse fácilmente con la fórmula de Rydberg. Cuando los átomos tienen más de un electrón, la complejidad de la modelación aumenta dramáticamente. (E) Para las siguientes seis transiciones en un átomo de hidrógeno (η1 => η2, η1 => η3 , η1 => η4 , η1 => η5 , η1 => η6, η1 => η7), calcule la λvac y grafique la longitud de onda (eje y) vs. la diferencia (η4 - η1 = 3) en niveles energéticos. (F) ¿Qué son las series de Lyman, Balmer, Paschen, Brackett, Pfund y Humphreys, y cómo se relacionan con la fórmula de Rydberg? 27. (A) Ecuación de De Broglie (B) λ = h/mv (C) λ = longitud de onda (metros) h = constante de Planck (6.626 x 10-34 J*s) m = masa (kg) v = velocidad (m/s) (D) La longitud de onda de un electrón (λ) de masa (m) que se mueve a una velocidad (v) se representa por la relación de De Broglie. Esto significa que cualquier objeto con una masa y una velocidad determinada tienen la misma longitud de onda! 169 (E) Un electrón tiene una masa de 9.11 × 10−31 kg. Grafique si longitud de onda (eje y) vs. su velocidad si la misma es 0.001 %, 0.005%, 0.0076 %, 0.01 %, 0.026%, 0.052%, 0.091%, 0.1%, 0.23%, 0.65 % y 1 % de la velocidad de la luz. (F) Describa brevemente (en 6-7 oraciones) el experimento de Davisson-Germer (1927, Bell Labs, NJ), y cómo el mismo complementó el experimento de Bragg con rayos X y ayudó a probar la hipótesis de De Broglie. 28. (A) Ecuación de Clausius-Clapeyron (B) ln(P2/P1)= -∆Hvap/R*(1/T2- 1/T1) (C) P = presión de vapor (torr) ∆Hvap = calor de vaporización (J/mol) T = temperatura (K) R = constante de los gases (8.314 J/mol*K) P1 es la presión de vapor a T1, y P2 es la presión de vapor a T2. (D) La relación que existe entre la presión de vapor y la temperatura es de tipo exponencial, y puede predecirse o modelarse si se conoce el calor de vaporización. (E) La presión de vapor para el agua a 15 oC es 12.79 mmHg y 23.76 mmHg a 25 oC. Calcule primero el calor de vaporización del agua. Una vez que Ud. tenga este valor, genere un gráfico (utilizando una hoja de cálculo) para la presión de vapor del agua (eje y) en función de la temperatura. Utilice los valores de temperatura desde 1 oC hasta 99 oC en incrementos de 1 grado. (F) Para el agua, compare la magnitud del calor de vaporización con el calor de fusión. ¿Cuál es mayor? Explique por qué uno es mayor que el otro. 29. (A) Densidad (B) D = M/V (C) D = densidad (kg/L o g/mL) M = masa (kg o g) V = volumen (L o mL) (D) La densidad puede utilizarse para describir un sólido, líquido, gas, un fluido supercrítico o un plasma. 170 (E) Utilizando los datos de la siguiente tabla, grafique la densidad (eje x) del metal vs. su número atómico Z# (# protones) y la densidad (eje x) vs. la masa molar de los metales. Obtenga la línea de mejor ajuste e incluya la ecuación y el coeficiente de correlación en el gráfico. ¿Existe alguna correlación entre la densidad y alguno de estos parámetros? Explique. Tabla 14.2. Densidades de varios metales. Metal Densidad (g/cm3) aluminio 2.70 zinc 7.13 hierro 7.87 cobre 8.96 plata 10.49 plomo 11.36 mercurio 13.55 oro 19.32 (F) En la mayoría de los casos, la densidad se usa para describir una muestra sólida, líquida o gaseosa, pero también se utiliza para otras fases, el plasma y los fluidos supercríticos. Describa química/físicamente cada uno de estos estados y mencione un ejemplo de cada fase. 30. (A) Ecuación Electrostática (B) F = q1q2/(4πεor2) (C) F = Fuerza de atracción o repulsión (Newtons) εo = Permitividad en el vacío q1, q2 = magnitudes de carga r = distancia entre las especies cargadas (m) (D) Para dos partículas de igual carga (ej. para 2 electrones, -1 y -1) se utiliza esta ecuación para calcular la fuerza de repulsión. Para dos partículas de cargas opuestas (ej. Na+, Cl-), calcula la fuerza de atracción. La ecuación asume que las dos especies están en el vacío. 171 (E) Supongamos el caso de dos iones (ej. Na+, Cl-) que están separados en el vacío a 100 nm. Ignore todos los términos en la ecuación excepto F y r2. (F = k/r2, asuma k =1). A medida que los dos iones se acercan (100, 99.9 nm, 99.8 nm, 99.7 nm,….0.2, 0.1 nm) calcule la F en cada incremento de 0.1 hasta llegar a cero nm. Grafique la fuerza de atracción relativa (eje y) vs. la distancia (eje x). (F) Considerando los cálculos realizados y el gráfico (Parte E), ¿cómo sería el cambio si los iones estuvieran disueltos en agua? 172 Ejercicio 15. Cinética Química de Reacciones de Primer Orden y la Radioactividad Natural La radioactividad es un proceso natural que puede medirse en suelos y aguas. Muchos de los elementos pesados que se encuentran en la Naturaleza provienen de las series radioactivas naturales. Existen cuatro series radioactivas que han sido identificadas: la serie del Neptunio (Tabla 15.1), la serie del Torio (Tabla 15.2), la serie del Radio (Tabla 15.3) y la serie del Actinio (Tabla 15.4). Como se puede observar en estas tablas, los periodos de semi-desintegración varían ampliamente. Algunos isótopos existen solamente durante fracciones de segundo, mientras que otros duran millones de años. La cinética de la desintegración nuclear natural se rige por una cinética de primer orden. En este ejercicio el estudiante debe simular la cantidad de cada isótopo presente en una muestra en función del tiempo. Como el ejercicio se realizará en Excel, se deben tomar en cuenta algunas limitaciones para el trabajo con las hojas de cálculo. Primeramente, una hoja de cálculo típica solamente admite 32 000 valores, aproximadamente. Aunque este número parece suficientemente grande, veamos que sucede al realizar los cálculos para tres especies: A (t1/2 = 5 millones de años), B (t1/2 = 1 milisegundo) y C (t1/2 = 5 millones de años). Estas especies se desintegran según el esquema A => B => C. Para graficar la especie que tiene t1/2 en el orden de los milisegundos en función del tiempo, Ud. necesitará un valor de actividad o concentración cada 0.2 milisegundos. Para realizar los gráficos de las otras dos especies, Ud. necesitará un valor cada 1 millón de años. Estime cuantas veces 0.2 milisegundos está contenido en 1 millón de años. Resulta obvio que Ud. no puede calcular las dos especies en la misma hoja, y a la vez tener suficiente resolución para identificar las especies A, B y C. Debido a esta variación en los tiempos de vida media, será difícil graficar a la vez todas las especies que se encuentran en el mismo esquema radioactivo. 173 Tabla 15.1. Serie de desintegración del Neptunio. Núcleo padre y producto de la desintegración (hijo) 241 Tipo de desintegración Periodo de semidesintegración Pu-241Am Beta Alfa 14.4 años 432.7 años Np-233Pa 233 Pa-233U Alfa Beta 2.14·106 años 27.0 años 233 U-229Th Alfa 1.592·105 años Th-225Ra 225 Ra-225Ac 225 Ac-221Fr 221 Fr-217At 217 At-213Bi 213 Bi-209Tl 209 Tl-209Pb 209 Pb-209Bi 209 Bi-205Tl 205 Tl Alfa Beta Alfa Alfa Alfa Alfa Beta Beta Alfa 7.54·104 años 14.9 d 10.0 d 4.8 min 32 ms 46.5 min 2.2 min 3.25 hrs 1.9·1019 años Estable 241 Am- 237 Np 237 229 . 174 Tabla 15.2. Serie de desintegración del Torio Núcleo padre y Tipo de Periodo de semiproducto de la desintegración desintegración desintegración (hijo) 232 Th-228Ra Alfa 1.405·1010 años 228 Ra-228Ac Beta 5.75 años 228 228 Th Beta 6.25 hrs Ra Alfa 1.9116 años Ra-220Rn Ac- 228 224 220 Th-- 224 Alfa 3.6319 d 216 Alfa 55.6 s 212 Alfa 0.145 s Beta 10.64 hrs Rn- Po 216 Po- 212 Pb 212 Pb- Bi Beta 212 Bi-212Po,208Tl 64.06% Beta 60.55 min 35.94% 212 208 Po- 208 Pb Alfa 299 ns Tl-208Pb Beta 3.053 min . Estable 208 Pb 175 Tabla 15.3. Serie de desintegración del Radio. Núcleo padre y producto de la desintegración (hijo) Tipo de desintegración Periodo de semidesintegración Alfa 4.468·109 años 234Th 234 - Pa Beta 24.10 d 234 Pa-234U Beta 6.70 hrs 234 230 238 X-234Th Alfa 245500 años 230 U- Th 226 Th- Ra Alfa 75380 años 226 Ra-222 Rn Alfa 1602 años 222 Rn-218Po 218 Po-214Pb,218At Alfa 99.98 % Beta 0.02 % 3.10 min 218 At-214Bi,218Rn Alfa 99.90 % Beta 0.10 % 1.5 s 218 Rn-214Po Alfa 35 ms 214 Pb-214Bi Beta 26.8 min 214 Bi-214Po,210Tl Beta 99.98 % Alfa 0.02 % 19.9 min 214 Po-210Pb Alfa 0.1643 ms 210 Tl-210Pb Beta 1.30 min 210 Pb-210Bi Beta 22.3 años 210 Bi-210Po,206Tl Beta 99.99987% Alfa 0.00013% 5.013 d 210 Po-206Pb Alfa 138.376 d 206 206 Tl- Pb Beta 4.199 min 206 Pb . Estable Alfa 3.8235 d 176 Tabla 15.4. Serie de desintegración del Actinio. Núcleo padre y producto de la desintegración (hijo) Tipo de desintegración Periodo de semidesintegración 239 Pu-235U Alfa 2.41·104 años 235 U-231Th Alfa 7.04·108 años 231 Th-231Pa Beta 25.52 hrs 231 Pa-227Ac Alfa 32760 años 227 Ac-227Th,223Fr Beta 98.62% Alfa 1.38% 21.772 años 227 Th-223Ra Alfa 18.68 d 223 223 Fr- Ra Beta 22.00 min 223 Ra-219Rn Alfa 11.43 d 219 Rn-215Po Alfa 3.96 s 215 Po-211Pb,215At Alfa 99.99977% Beta 0.00023% 1.781 ms 215 At-211Bi Alfa 0.1 ms Beta 36.1 min Alfa 99.724% Beta 0.276% 2.14 min 211 211 Pb- Bi 211 Bi-207Tl,211Po 211 Po-207Pb Alfa 516 ms 207 207 Tl- Pb Beta 4.77 min 207 Pb . Estable 177 En la primera parte del ejercicio trabajaremos con la secuencia de desintegración: 213 Bi => 209Tl => 209Pb => 209Bi (1) la cual es parte de la serie del Neptunio (tabla 15.1). Note que los periodos de semi-desintegración se encuentran en escalas similares de tiempo (46,5 min, 2,2 min, 3,25 hrs). 1. Abra una hoja nueva de cálculo en Excel y escriba en el título de la columna 1 (celda A1) “Tiempo, minutos” 2. En la celda A2 escriba el valor “0” y en la A3 escriba la ecuación “=SUMA(A2+0,1)” 3. Copie y pegue esta ecuación hacia abajo hasta la posición A10000. 4. En B1 escriba el título “masa inicial” y en B2 escriba el número “100” y cópielo hacia abajo hasta B10000. La masa inicial de Bi-213 es 100 gramos. 5. El título de la columna C es “k, Bi-213”. En C2 calcule la constante de velocidad k (en min-1) utilizando la ecuación “ =SUMA(0,693/45,6) “, que proviene del cálculo del tiempo de vida media en una cinética de primer orden: k = 0,693 / t1/2. Copie esta ecuación hacia bajo hasta C10000. El valor de 0,015197 debe aparecer en cada celda. 6. En la celda D1 escriba el título “Masa A en el tiempo”. Esta columna utilizará un reordenamiento de la relación entre la concentración y el tiempo correspondiente a una cinética de primer orden: ln(A/Ao) = - kt (2) En la celda D2 escriba la ecuación “=EXP(-1*C2*A2+LN(100))” y cópiela hacia abajo hasta D10000. Debe comenzar con el valor calculado de 100 e ir disminuyendo regularmente, pero siempre dando como resultado un número positivo. 178 7. En la celda E1 escriba el título “Masa de Tl-209” y en E2 escriba la ecuación “=SUMA(100D2)” y cópiela hacia abajo hasta E10000. Los valores deben comenzar en cero gramos, pero puede que lo que aparezca sea un número excesivamente pequeño debido al redondeo (alrededor de -10-15). 8. En la celda F1 escriba el título “k, Tl-209” y en F2 calcule la constante de velocidad para la desintegración de Tl utilizando la ecuación “=SUMA(0,693/2,2)”. Debe obtenerse el valor 0,315. Copie la ecuación hacia abajo hasta la celda F10000. 9. En la celda G1 escriba el encabezamiento “Masa, Tl, en el tiempo” y en G2 escriba la ecuación “=EXP(-1*F2*A2+LN(E2)) “. Esto es un reordenamiento de la ecuación de la concentración en función del tiempo de una reacción de primer orden (ecuación 2). Copie esta ecuación hacia abajo hasta G10000. En la primera celda (G2) el mensaje de error (#NUM) debe aparecer. Esto se debe a que se calculó el log natural de un valor negativo (el error redondeado) en E2. A partir de la celda G3 los valores deben incrementarse hasta G33, y entonces comenzar un descenso gradual. 10. En la celda H1 escriba el título “Masa Pb-209, Comienzo” y en la celda H2 escriba la ecuación: “ =SUMA(100-G2-D2) “. Copie esta ecuación hacia abajo hasta la posición H10000. 11. En la celda I1 escriba el título “Constante de Velocidad, Desintegración, Pb-209”. En la celda I2 escriba la ecuación “=SUMA(0,693/205)”, mediante la cual se realiza la conversión del periodo de semi-desintegración a la constante de velocidad de una reacción de primer orden. Copie esta ecuación hacia abajo hasta la celda I10000. 12. En la celda J1 escriba el título “Masa en función del tiempo. Pb-209”. En J2 escriba la ecuación “=EXP(-1*I2*A2+LN(H2)) “ Este es un reordenamiento de la ecuación 2, que define la concentración en una reacción de primer orden en función del tiempo. Copie esta ecuación hacia abajo hasta la celda J10000. 179 13. En la celda K1 escriba el título “Suma de 3 masas; Bi-213, Tl-209, Pb-209” y en la K2 escriba la ecuación “=SUMA(D2+G2+J2)” y cópiela hacia abajo hasta K10000. 14. En la celda L1 escriba el título “Masa de Bi-209, isótopo estable”. 209 Bi tiene un periodo de semi-desintegración del orden de 1019 años, por lo que en comparación con los otros tres isótopo modelados en este gráfico, se puede considerar como un isótopo estable. En la celda L2 escriba la ecuación “=SUMA(100-K2)” y cópiela hacia abajo hasta L10000. En este momento, Ud. acaba de completar todos los cálculos necesarios para construir el gráfico, y ahora vamos entonces a graficar. En este gráfico, el título del eje de las x será “Tiempo (min)” y el eje de las y se titulará “Masa (g)”. El rango de valores en x es de 0-1000 minutos y el de las y es de 0-100 gramos. Vamos a trabajar con cuatro series: 1. A2….…A10000 (eje x) vs D2……D10000 (eje y). En la leyenda, nombre esta serie como “Bi-213”. 2. A2….…A10000 (eje x) vs G2……G10000 (eje y). En la leyenda, nombre esta serie como “Tl-209”. 3. A2….…A10000 (eje x) vs J2..…J10000 (eje y). En la leyenda, nombre esta serie como “Pb209” 4. A2….…A10000 (eje x) vs L2..…L10000 (eje y). En la leyenda, nombre esta serie como “Bi-209”. Construya el gráfico y cópielo/péguelo en su informe del laboratorio. El gráfico debe lucir similar al que se muestra en la figura 1. Note que la especie Tl-209 no se observa en su gráfico. Esto NO es un error. Cambie la escala del eje x a un rango de valores de 0-35 minutos y la escala de las y de 0-4 gramos. Ahora Ud. debe ser capaz de ver el Tl-209. Como tiene un periodo de semidesintegración menor que las otras especies, no se aprecia la curva en la misma escala de las especies de mayor periodo de semi-desintegración. 180 Joe Neutron, Esquema de desintegración Tiempo (min) 100 90 80 70 60 50 40 30 Bi-213 Tl-209 Pb-209 Bi-209, estable 20 10 0 0 200 400 600 800 1000 masa (g) Figura 1. Gráfico de especiación de núcleos con cuatro especies de la serie del Neptunio. Ejercicio adicional: Seleccione tres productos de desintegración consecutivos de las otras tres series radioactivas, de forma tal que los periodos de semi-desintegración se diferencien en menos de dos órdenes de magnitud entre ellos, y genere un gráfico de especiación similar al realizado en el ejercicio de laboratorio. La tercera especie puede ser muy estable o tener un periodo de semi-desintegración corto, pero Ud. debe graficar solamente el incremento de la masa en función del tiempo (ignore el impacto de su desintegración y la formación de una cuarta especie). Asuma que la masa inicial de la muestra es de 100 gramos. 181 Ejercicio 16. Química en una Nanogota Objetivos de este ejercicio: 1. Los estudiantes replicarán las interacciones en gotas de solvente simuladas (agua, etanol, etc.) cuyas dimensiones son del orden de unos pocos nanómetros. 2. Los estudiantes construirán sistemas que les permitirán revisar algunas de las interacciones fundamentales como son el enlace por puente de hidrógeno, las interacciones dipolo-dipolo y las ión-dipolo. 3. Los estudiantes determinarán las correlaciones o tendencias que involucran interacciones o parámetros físicos. 4. Los estudiantes aprenderán acerca de las interacciones iónicas, atómicas y entre moléculas pequeñas en una nanogota de un solvente común como el agua, etanol y metanol. El diámetro de estas nanogotas varía típicamente entre dos y seis nanómetros. 5. Los estudiantes examinarán la interacción de una nanogota de solvente con dos péptidos de encefalina para una mejor comprensión del concepto de plegamiento molecular (folding). (Nota: La construcción y minimización de la energía de una gota de solvente puede consumir bastante tiempo. En algunos casos, los instructores pueden tener estos agregados ya construidos y distribuir los ficheros de Spartan a los estudiantes, en caso de que haya límite de tiempo). En los ejercicios experimentales los estudiantes inducen, miden y observan las reacciones químicas en la macroescala. Cuando se adiciona una sal al agua y se agita la solución, se determina si la sal es soluble o insoluble mediante una observación visual. Estas observaciones se realizan mediante el total de experimentos con un gran número de iones, átomos y moléculas que se comportan de una 182 manera similar. En este ejercicio, los estudiantes replicarán algunas de estas interacciones a escala nanométrica para entender mejor las observaciones a macroescala. Los cálculos siguientes (incluya una explicación de cada cálculo y utilice las unidades apropiadas) serán las preguntas previas al laboratorio en su informe. 1. Calcule el volumen de una esfera de diámetro 4.05 nm. Calcule el volumen en nm3 y cm3. 2. ¿Cuál es la masa, en gramos, de 1000 moléculas de agua? 3. Si tenemos 1000 moléculas de agua contenidas en una esfera de diámetro de 4.05 nm, ¿cuál es la densidad en gramos/cm3? 4. La densidad del agua es aproximadamente 1.0 gramos/ cm3. (Responda cada pregunta en el mismo formato de viñetas). • ¿Tendrá una nanogota de agua la misma densidad que una taza de agua? Explique. • ¿Serán iguales los valores de presión de vapor y tensión superficial para los volúmenes macro y nano del agua o cualquier otro solvente? Explique. • ¿Cree Ud. que la relación de área superficial a volumen total (AS/V) de una nanogota será la misma que esta relación en el agua contenida en un beaker o en un tubo de ensayos? Explique. EJERCICIO (Instrucciones) A. Para el primer conjunto de estructuras use las siguientes instrucciones para el trabajo computacional, realice un cálculo “Single Point Energy”, “Semiempirical”, PM3, “Initial”, “symmetry” (comprobar, debe estar desmarcado cuandoe l número de átomos es grande), comprobar “Elect. Charge”, “Total charge” (“neutral, anion, cation” ver instrucciones individuales), “Multiplicity” (“singlet”), “Print” (“atomic charges), marque “Converge” y “Global”. B. Guarde y cierre cada estructura cuando termine 183 C. En su informe debe haber un pie de figura debajo de cada figura (ej. Figura 16.1, Esto es ….). Si hay alguna pregunta relacionada con esa estructura, la respuesta debe darse en el pie de figura. D. Todas las estructuras que se generan en Spartan deben ser copiadas y pegadas en su informe con pie de figura en orden numérico. Debe haber un máximo de dos figuras por página. E. El título del laboratorio, su nombre y fecha deben estar al principio de la primera página del informe. A continuación debe haber un índice de figuras (1. Moléculas de Agua, página 2). Las figuras no deben aparecer hasta que no se hayan respondido las preguntas previas. 1. Construya la molécula de agua en Spartan y calcule la estructura usando los parámetros definidos anteriormente. Una vez que el cálculo este terminado, guarde el fichero con el nombre “agua”, copie y pegue la molécula de agua de manera que haya dos moléculas de agua en su espacio de trabajo y minimice las dos estructuras (ver figura 16.1). El cálculo realizado asume que estas especies están en fase gaseosa. Mida la distancia entre un átomo de oxígeno de una de las especies con el H más cercano de la otra molécula. ¿Qué tipo de interacción es esta? Adicionalmente copie estas dos moléculas de agua en su informe y responda las preguntas en el pie de figura. Asegúrese de cerrar el fichero cuando termine. 184 Figura 16.1 Se construye y duplica una molécula de agua neutra. Después del cálculo se mide la distancia entre un átomo de oxígeno de una molécula y el hidrógeno más cercano de la otra. (Los colores de los átomos pueden cambiarse) 2. Construya un ion Na+ (“charge = cation”) y minimícelo. Guarde este fichero con el nombre “sodio”. Copie y pegue su estructura de manera que aparezcan dos iones en la pantalla (ver figura 16.2). Copie y pegue esta figura en su informe. Con los dos iones presentes (no haga ningún cálculo todavía), mida la distancia entre los iones, después minimice su estructura. ¿Qué ha pasado? (Normalmente se separan tanto que es muy difícil traerlos de vuelta a la misma pantalla). Explique su observación basándose en la Ley de Coulomb. Al igual que en el caso anterior, responda estas preguntas en el pie de figura. Figura 16.2 Dos iones Na+ están colocados muy cerca antes de que se haya minimizado la estructura. En este caso la distancia es 1.257 Å. 185 3. Realice el mismo procedimiento para el Ca2+ (“charge = dication”) que el que realizó para el sodio. Guarde el fichero con el nombre “calcio”. 4. Construya un anión F- y minimícelo (“charge = anion”) y guarde esta estructura con el nombre “fluoruro”. Una vez que el cálculo haya terminado, copie y pegue la estructura de manera que haya dos iones en la pantalla cercanos entre sí y mida la distancia entre ellos (ver figura 9.3). Minimice la energía y diga qué pasa con el valor de la energía que aparece en la parte inferior derecha de la pantalla. Explique esta reacción usando la Ley de Coulomb. Figura 16.3 Dos iones fluoruro antes de la minimización. 5. Usando estructuras de Lewis, identifique la geometría y la hibridación del ion sulfato. Ahora construya el ion sulfato en Spartan y calcule sus parámetros (“charge = dication”). Guarde el fichero con el nombre “sulfato”. ¿Esta estructura tiene momento dipolar?¿Cuáles son los ángulos de enlace?¿Cuáles son las distancias de enlace?¿Cuál es la carga atómica sobre el S y sobre cada O? (Recuerde copiar la estructura en su informe) 6. Abra sus ficheros “sodio” y “fluoruro” en diferentes pantallas de Spartan. Copie y pegue en otra pantalla (ver figura 16.4). Minimice la energía y mida las distancias de enlace entre las dos 186 estructuras. En términos de la Ley de Coulomb, explique sus observaciones y compare con las interacciones Na+ - Na+ y F- - F-. Figura 9.4 Un ion F- y un ion Na+ se colocan uno cerca del otro y la energía del sistema se minimiza. A diferencia de los dos cationes (Na+ - Na+) o los aniones (F- - F-), estos dos iones (Na+ F-) se atraen mutuamente. 7. Realice el mismo procedimiento para “sodio” y “sulfato” (1Na+ y 1SO4-2). Mida la distancia entre el sodio y el oxígeno más cercano, seguidamente mida la distancia entre el sodio y el átomo de azufre ¿Cuál es la distancia de enlace correcta? ¿Por qué? ¿Es la distancia Na+ - SO42igual o diferente a la distancia Na+- F-? Explique. 8. Realice el mismo procedimiento para el sodio y el sulfato, pero use dos iones sodio (2Na+ y 1SO4-2). ¿La distancia Na+ - SO42- es la misma que para el caso anterior 1:1? Explique. (asegúrese de copiar cada sistema en su informe y explicar los resultados en el pie de figura) 9. Realice el mismo procedimiento para el calcio y el sulfato (1Ca2+ y 1SO42-). ¿La distancia Na+ SO42- es la misma o diferente de Ca2+- SO42-? Explique. 10. Realice el mismo procedimiento para calcio y fluoruro (1Ca2+y 1F-). ¿La distancia de enlace Ca2+- SO42- es la misma o diferente de la distancia Ca2+- F-? Explique (asegúrese de cerrar los ficheros cuando termine) 187 11. Abra el fichero “fluoruro” y el fichero “agua” en pantallas separadas. Copie y pegue la molécula de agua en la pantalla del fluoruro dos veces (ver figura 16.5). Minimice el sistema ion-molécula. Mida las distancias entre los átomos de oxígeno y de hidrógeno de la molécula de agua y el ion fluoruro. ¿Cuál es el más cercano al fluoruro? ¿Por qué? ¿Cómo se clasifica este tipo de interacción atractiva (puente de hidrógeno, dipolo-dipolo, ion-dipolo, fuerzas de London, etc.)? Figura 16.5 Un ion fluoruro (verde) es atraído por la carga parcial positiva que existe sobre un átomo de hidrógeno (blanco) de la molécula de agua 12. Realice el mismo procedimiento para el sulfato y dos moléculas de agua (haga las mismas mediciones y responda las mismas preguntas) y compare sus resultados con el sistema agua – fluoruro. 13. Abra los ficheros “sodio” y “agua” en pantallas separadas de Spartan. Copie y pegue la molécula de agua en la pantalla del sodio dos veces (ver figura 16.6) Minimice el sistema de un ion y dos moléculas. Mida la distancia entre los átomos de O e H de la molécula de agua y el ion sodio. ¿Cuál es el más cercano al ion? ¿Por qué? ¿Qué tipo de atracción describe esta interacción? 14. Realice el mismo procedimiento para el calcio (Ca2+) y el agua. Aplicando la Ley de Coulomb, ¿cuál sistema (Na+ - agua, Ca+2 – agua) produce una interacción más fuerte? Explique. 188 Figura 16.6 Un ion sodio está situado entre dos moléculas de agua, lo cual es un ejemplo de la interacción ion–dipolo. ¿Por qué los átomos de H de las dos moléculas de agua están en planos diferentes? 15. Construya la molécula de 1-propanol, minimícela (“neutral, singlet”) y guarde el fichero con el nombre “propanol”. Una vez que el cálculo esté terminado, copie, pegue y minimice de manera que aparezcan dos moléculas en la pantalla (ver figura 16.7). Note cómo las dos moléculas que contienen un grupo polar (-OH) y un componente no polar (la cadena C3) se alinean por sí solas. ¿Cuál es la distancia entre el O y el H más cercanos que forman un puente de hidrógeno entre las dos moléculas? Figura 16.7 Dos moléculas de 1-propanol se atraen entre sí mediante un enlace por puente de hidrógeno. 189 16. Construya una molécula de octano (C8H18) en su espacio de trabajo. Calcule la estructura y guarde el fichero con el nombre “octano”. Copie la estructura y minimice la energía (ver figura 16.8). Mida y anote las distancias de enlace entre los cinco átomos de hidrógeno más cercanos entre las dos moléculas. Compare las distancias entre las dos moléculas hidrocarbonadas no polares con la distancia entre dos moléculas de agua (ver arriba). ¿Explica este hecho la diferencia entre las densidades del agua líquida (1.0 g/cm3) y del octano líquido (0.917 g/cm3)? ¿Esta correlación de distancias explica la diferencia entre la tensión superficial del octano (21.62 mN/m) y del agua (72.80 mN/m)? Explique. Figura 16.8 Las dos moléculas de octano permanecen cercanas después de la minimización de la estructura. 17. Ud. va a construir un total de tres ficheros/ventanas de trabajo diferentes en este ejercicio. Asegúrese de guardar y cerrar los ficheros antes de pasar a la estructura siguiente. Haga una tabla en su informe como la Tabla 16.1. Primeramente construya una molécula de metanol, minimícela y guarde el fichero con el nombre “metanol”. Copie y pegue la estructura de manera que haya dos moléculas en la pantalla y minimice este sistema. Mida las distancias del puente 190 de hidrógeno entre las dos moléculas (H de una molécula y O de la otra) y anótela en la tabla. Cierre el fichero del metanol y construya y calcule la molécula de etanol. Copie y minimice la energía y mida la distancia del puente de hidrógeno entre las dos estructuras. Con etanol (y seguidamente propanol) mida la distancia entre los dos carbonos que están más alejados del átomo de oxígeno: los carbonos de los grupos metilo (ver figura 16.9). Realice las mismas operaciones para el propanol y guarde el fichero. Tabla 16.1 Después de realizar los cálculos de los sistemas del metanol, etanol y propanol, anote sus datos en una tabla con el siguiente formato en su informe. Encuentre los datos de presión de vapor y tensión superficial en el Handbook CRC (solicite la ayuda del Instructor en caso de ser necesario). Temperatura de ebullición Densidad (g/mL) Metanol 66 0.791 Etanol 78 0.789 Propanol 97 0.804 Molécula Distancia entre H y O más cercanos Presión de vapor Tensión superficial Figura 16.9 Entre las moléculas de etanol se establece un puente de hidrógeno. 191 18. Abra la molécula de agua en un nuevo espacio de trabajo (para todos los agregados que se construyan a continuación minimice, haga un “Single Point Energy”, “symmetry”, “Molecular Mechanics (MMFF)”, “neutral, single, Converge”. La mecánica molecular (MMFF) es un nivel de teoría más bajo que los métodos semiempíricos pero pueden realizarse cálculos de agregados grandes utilizando una computadora personale. Note que a medida que el número de moléculas de agua aumenta, el tiempo de cálculo también aumenta. Construya una tabla de 7 columnas con los siguientes encabezados (Tabla 1 en su informe): (A) Número de moléculas de agua (B) volumen molecular (valor de Spartan) (C) área superficial (D) Momento dipolo (E) Imagen (inserte una figura de su agregado en esta columna) (F) Comentarios (G) Volumen (calculado por la fórmula V=4/3πr3) Los valores en las columnas B, C y D se encuentran en los iconos “Display”, “Properties”. Para obtener el valor de la columna G, escoja dos átomos en lados opuestos del agregado que represente el diámetro y mida la distancia a través de la nanogota y use este valor para obtener el radio y el volumen del agregado. Por ejemplo, ver la figura 16.10H. Copie y pegue la molécula de agua de manera que haya dos moléculas en el área de trabajo. Minimice y haga los cálculos, obtenga los datos necesarios para rellenar la tabla y guarde el fichero con el nombre “agua_2”. ¿Qué tipo de enlace mantiene estas moléculas unidas? (responda esta pregunta en el cuadro de comentarios) Copie y pegue las dos moléculas que forman este agregado para obtener un agregado de cuatro moléculas de agua, minimice y calcule, anote los datos y guarde el fichero con el nombre “agua_4”. ¿Qué forma tiene el agregado de cuatro moléculas de agua? Copie y pegue el agregado de cuatro moléculas de agua para obtener un agregado de ocho moléculas, minimícelo y calcule. Nuevamente note que la forma del agregado está 192 definida por los ocho átomos de oxígeno. Mida de 3 a 4 ángulos y distancias de enlace que definan la forma del agregado para confirmar la forma final obtenida. Copie y pegue el sistema de ocho moléculas para obtener un agregado de 16 moléculas de agua y lleve a cabo el cálculo respectivo. Guarde las estructuras en un dispositivo de memoria. En cualquiera de los cálculos que realicen en este ejercicio (agua, metanol, etanol), detenga la minimización si ésta toma más de ocho minutos (8 min máximo). Repita este ciclo (1, 2, 4, 8, 16, 32, 64, 128, 256) hasta tener un agregado de 256 moléculas de agua. Ud. debe tener un mínimo de cinco estructuras por página en su tabla. Guarde todas las estructuras con el nombre “agua_#” y anote los datos en la tabla (agua_32, agua_64, agua_128, agua_256). Realice el mismo procedimiento para el metanol y el etanol (1, 2, 4, 8, 16, 32, 64, 128, 256), colocando los parámetros calculados y las imágenes en la tabla. En la columna de comentarios, se deben discutir brevemente algunos conceptos: a) explique la tendencia o la diferencia observada en el momento dipolo de una molécula de agua, metanol o etanol comparado con el de un agregado de moléculas, b) ¿son los volúmenes medidos iguales o diferentes? ¿Por qué?, c) ¿En cuántos enlaces por puentes de H están involucradas las moléculas de la superficie de la nanogota en comparación con las del interior del agregado? (B) Cuando su tabla esté terminada, genere cinco gráficos en Excel (use los valores de los parámetros de agua, metanol y etanol en cada gráfico). Cada gráfico debe estar en una página independiente y debe tener su pie de figura en orden numérico. a) # de moléculas (2, 4, 8, 16, 32, 64, 128, 256) en el eje x, versus volumen molecular (el valor de Spartan) en el eje y. Asegúrese de poner cada sistema en una serie diferente y graficar el mejor ajuste de los puntos. Incluya un pie de figura (ej. Gráfico 1. Este gráfico es …) 193 b) # de moléculas (2, 4, 8, 16, 32, 64, 128, 256) en el eje x, versus área superficial (valor de Spartan) en el eje y. Asegúrese de designar el agua, etanol y metanol como series independientes y graficar el mejor ajuste de los puntos. c) # de moléculas en el eje x, versus el volumen calculado (utilizando V = (4/3)πr3) en el eje y. d) Volumen calculado (eje x) versus volumen molecular (Spartan) en el eje y. e) Volumen molecular (Spartan) versus área superficial en el eje y. Explique las tendencias observadas en cada gráfico debajo de cada gráfico que corresponda (ejemplo, la pendiente es ∆y/∆x - ¿qué nos dice este valor acerca de cada agregado de solvente?). ¿El volumen del agregado calculado por Spartan incluye sólo el volumen ocupado por las moléculas de agua o también el espacio entre ellas? Ud. puede deducir esta conclusión comparando los dos volúmenes calculados para cada agregado – volumen calculado por Spartan vs. el valor por V = (4/3)πr3. ¿Cuál es la densidad normal del agua a temperatura y presión ambiental? ¿Por qué este valor es diferente considerando la relación entre el área superficial de la gota y la masa de la esfera? ¿Por qué se obtiene una esfera cuando se minimizan las estructuras y no otra forma (triángulo, cilindro, etc.)? Responda esto en el pie de la figura. 194 Figura 16.10 Las moléculas de agua se agregan para formar una nanogota. (A) dos (21) moléculas de agua enlazadas por un puente de hidrógeno, (B) cuatro (22) moléculas de agua, (C) ocho (23) moléculas de agua, (D) dieciséis (24) moléculas de agua, (E) treinta y dos (25) moléculas de agua, (F) sesenta y cuatro (26) moléculas de agua, (G) ciento veitiocho (27) moléculas de agua, (H) doscientos cincuenta y seis (28) moléculas de agua, (I) quinientos doce (29) moléculas de agua, (J) mil veinticuatro (210) moléculas de agua. (todos los diagramas no están en la misma escala). (note que la minimización de las estructuras más grandes puede tomar horas, por lo que su Instructor le dará estas estructuras ya hechas). 195 19. Abra el fichero del sodio (Na+) y copie y pegue el ion cuatro veces de manera que haya cinco iones en la pantalla. No lo minimice todavía. Copie y pegue en su informe. a) Abra el fichero agua_256, metanol_256 y etanol_256 en sus pantallas (debe tener cuatro pantallas a la vez: agua, metanol, etanol, ion sodio). b) Copie los iones sodio en cada uno de estos solventes c) Minimice la energía en la pantalla del sodio y note que le pasa a los cationes (no trate de encontrar los iones una vez que la minimización haya terminado). Explique esta observación en el pie de figura del sodio basándose en la Ley de Coulomb. d) Seguidamente minimice el sodio en cada solvente (uno a la vez). Cuando un solvente esté terminado, aumente la región donde están situados los iones y estudie las interacciones entre los iones y el agua. Mida tres o cuatro de las interacciones ion-dipolo más cortas. Copie y pegue la imagen en su informe y usando flechas señale las interacciones ion solvente. Trate de no tener más de 10-12 átomos en su imagen. e) Haga lo mismo para los otros dos solventes, nuevamente anote las distancias y copie la imagen. Guarde los ficheros con el nombre “agua_256_Na”, “metanol_256_Na”, “etanol_256_Na”, en cada pie de figura comente cómo se interpretan sus resultados computacionales en términos de la solubilidad (es decir: ¿es el Na+ soluble en agua? ¿por qué? ¿Por qué el Na+ tendría una mayor solubilidad en agua comparado con en etanol?) f) Realice el mismo conjunto de cálculos para el ion sulfato en los tres solventes de la misma manera que se hizo para el sodio (es decir, inserte SO4-2 en lugar de sodio). ¿Los iones sulfato se comportan de la misma manera cuando están aislados o en los solventes? ¿Por qué no? 196 20. Temas importantes para revisar: a) b) c) d) Enlace peptídico y estructura de proteínas Ángulos diedros positivos (a favor de las manecillas del reloj) y negativos (en contra) Gráfico de Ramachandran Identificación de ángulos phi y psi en la estructura de una proteína. En esta sección se medirá el impacto de los diferentes solventes en la estructuras de los péptidos y proteínas. Utilizando un buscador de Internet, realice una búsqueda con los términos “plegamiento de proteínas, enfermedad” o “plegamiento de proteínas, Alzheimer”, y lea sobre el impacto que tiene la forma de una proteína en un número de enfermedades (el Instructor puede pedirle al estudiante que escriba uno o dos párrafos sobre esta área medicinal). Tabla 16.2 Genere una tabla con el siguiente formato. Incluya una vista lateral y una frontal y con flechas señale los ángulos. Ángulos Ψ Φ Estructura Φ Estructura Ψ (0,0) (inserte la estructura de Spartan e incluya flechas para identificar los ángulos) (0,45) (0,90) En Spartan, use el menú “pep” (péptido) y construya la polyglicina (3 residuos). Ud puede ajustar dos de los ángulos diedros en el programa (seleccione “other” y entre los valores de los ángulos). Escriba los siguientes ángulos phi y psi y genere el tri-péptido, pero no minimice la energía: (0,0), (0,45), (0,90), (0,135), (0,180), (0,-45), (0,-90), (0,-135), (0,-180) Después genere la estructura con los siguientes ángulos: 197 (45,0), (90,0), (135,0), (180,0), (-45,0), (-90,0), (-135,0), (-180,0) Una vez que Ud. entre los ángulos y genere las estructuras, NO minimice la energía. Manipule la estructura de manera que pueda observar en los ejes e identificar los ángulos (seleccione un ángulo phi y uno psi por estructura y escríbalos en su tabla). Puede utilizar el icono de “Constrain” en Spartan para seleccionar cuatro átomos y obtener un ángulo phi o psi. Utilice este enfoque para identificar y conformar los ángulos que ha seleccionado y para ayudarlo a identificar rápidamente estos dos ángulos importantes que involucran a cuatro átomos. Copie y pegue cada vista en su tabla y use una flecha para identificar el ángulo. Este ejercicio le ayudará a identificar rápidamente cada ángulo y también a visualizar como influyen los ángulos diedros en la estructura de las proteínas. Cuando construya la tabla debe tener como máximo 5 ángulos por página (por ej. (0,0), (0,45), (0,90), (0,135), (0,180)). 21. Encuentre las estructuras (secuencia) de los péptidos metionina-encefalina y leucina-encefalina. Escriba un párrafo corto acerca del papel de cada péptido en su informe e incluya sus secuencias 22. Desarrolle una nueva tabla con el siguiente formato (puede usar el formato apaisado): Tabla 16.3. Datos para ángulos de enlace Ángulos phi, psi originales Solvente, péptido +115,-120 Agua (256) leucina Ángulos phi y psi medidos después de la minimización en la nanogota Imagen de la estructura (el péptido de separa de la estructura, no requiere de las flechas) etc. 23. Construya la metionina encefalina y seleccione angulos phi entre -110 y -140 y angulos psi entre +110 y +135. Use estos valores para todas las estructuras de la encefalina. No minimice la energía de las estructuras. En otra pantalla abra la nanogota “agua_256”. Copie y pegue el 198 péptido dentro de la gota y minimice la estructura. La minimización del agregado puede tomar un máximo de tres minutos (o hasta que se complete). Usando el icono “aling” puede mover el péptido fuera del agregado y copiarlo y pegarlo en otra pantalla. Mida los ángulos phi y psi en cada estructura. Guarde el agregado (asegúrese de tener el fichero agua_256 separadamente). 24. Construya la metionina encefalina y use los mismos ángulos descritos anteriormente. No minimice aún las estructuras. En una pantalla separada abra la nanogota “metanol_256”. Copie y pegue el péptido en la gota y minimice el agregado. La minimización del agregado puede tomar un máximo de tres minutos (o hasta que se complete). Remueva el péptido del agregado y cópielo en otra pantalla. Mida y anote los valores de los ángulos diedros de la estructura. Copie la estructura en la tabla. 25. Construya la metionina encefalina y use los mismos ángulos descritos anteriormente. No minimice aún las estructuras. En una pantalla separada abra la nanogota “etanol_256”. Copie y pegue el péptido en la gota y minimice el agregado. La minimización del agregadopéptidoetanol puede tomar un máximo de tres minutos (o hasta que se complete). Remueva el péptido del agregado y cópielo en otra pantalla. Mida y anote los valores de los tres ángulos diedros de la estructura. 26. Construya la leucina encefalina y seleccione ángulos phi entre -110 y -140 y angulos psi entre +110 y +135. Use estos valores para todas las estructuras de la encefalina. No minimice aún las energías de la estructuras. En otra pantalla abra la nanogota “agua_256”. Copie y pegue el péptido dentro de la gota y minimice la estructura. La minimización del agregado péptido-agua puede tomar un máximo de tres minutos (o hasta que se complete). Remueva el péptido del agregado y cópielo en otra pantalla. Mida y anote los valores de los ángulos diedros de la estructura. Copie la estructura en la tabla. 27. Construya la leucina encefalina y seleccione ángulos phi entre -110 y -140 y angulos psi entre +110 y +135. No minimice aún las energías de las estructuras. En otra pantalla abra la nanogota 199 “metanol_256”. Copie y pegue el péptido dentro de la gota y minimice la estructura. La minimización del agregado péptido-agua puede tomar un máximo de tres minutos (o hasta que se complete). Remueva el péptido del agregado y cópielo en otra pantalla. Mida y anote los valores de los ángulos diedros de la estructura. Copie la estructura en la tabla. 28. Construya la leucina encefalina y seleccione ángulos phi entre -110 y -140 y angulos psi entre +110 y +135. No minimice aún las energías de la estructuras. En otra pantalla abra la nanogota “etanol_256”. Copie y pegue el péptido dentro de la gota y minimice la estructura. La minimización del agregado péptido-agua puede tomar un máximo de tres minutos (o hasta que se complete). Remueva el péptido del agregado y cópielo en otra pantalla. Mida y anote los valores de los ángulos diedros de la estructura. Copie la estructura en la tabla. 29. Construya la metionina encefalina en una pantalla sin solvente, use los ángulos de partida definidos anteriormente y minimice la estructura sin solvente. Mida los ángulos diedros optimizados. 30. Construya la leucina encefalina en una pantalla sin solvente, use los ángulos de partida definidos anteriormente y minimice la estructura sin solvente. Mida los ángulos diedros optimizados. 31. Genere dos gráficos de Ramachandran usando sus datos. Uno para la metionina encefalina y uno para los cuatro conjuntos de datos de la leucina. Asegúrese de que cada eje va desde -180 hasta 180 y que hay cuatro cuadrantes en su gráfico. Cada gráfico debe tener cuatro series de datos (sin solvente, agua, metanol y etanol). Cada serie de datos debe tener un símbolo único (agua = cuadrado, etanol = cruz, etc.) que se indica en la leyenda. 32. Una vez que sus gráficos estén completos, deben responderse algunas preguntas separadamente debajo de los gráficos: a) ¿Los valores finales de los ángulos phi y psi indican una estructura alfa o beta? ¿Si es alfa, es a la izquierda o a la derecha? 200 b) ¿Existen diferencias estructurales entre MenK y LenK en dependencia del solvente? c) Usando el procedimiento semiempírico descrito anteriormente calcule el momento dipolo (D) y el volumen molecular (V) para el agua, metanol y etanol. Calcule la relación D/V (momento dipolo/volumen molecular) para cada molécula. d) Grafique la relación D/V para cada solvente (eje y) versus (eje x) y el volumen molecular calculado de los péptidos (tanto para leucina como metionina). Este gráfico debe tener al menos seis puntos. Basándose en la estructura y sus subcomponentes (grupos polares y no polares), desarrolle y discuta acerca de cómo los diferentes solventes pueden influir en la energía involucrada en el plegamiento de un péptido o de una proteína. Algunos detalles importantes a recordar para la preparación del informe: 1. Título (Química en una Nanogota, Formato de Fuente 18), nombre, fecha: centrado en la parte superior de la primera página. 2. Índice de todas las figuras, los gráficos y las tablas, comenzando en la primera página, debajo del título. Esto debe aparecer a espacio sencillo, con las figuras primero (ej. Figura 1. Moléculas de Agua, p. 3), después los gráficos y por último la sección de las tablas. 3. Cada figura, gráfico o tabla debe tener su título independiente, escrito en forma de oración, y que explique la imagen (ej. Figura 1. Dos moléculas de agua se atraen mutuamente mediante un enlace por puente de hidrógeno y están separadas a 1.77 Angstroms). 4. Las Figuras 1,2,3,4…; los gráficos 1,2,3…; las tablas 1,2,3… tienen cada uno sus números individuales. 5. Las figuras deben estar centradas en las páginas. Generalmente se recomiendan dos figuras por página. 6. Las figuras del Spartan deben tener un fondo blanco. 7. Corte y expanda las figuras si es necesario. Utilice flechas para indicar las interacciones o estructuras discutidas en la descripción. 8. Comience las tablas y los gráficos en una nueva página. Un gráfico por página. 201 9. Las ecuaciones deben estar en una sola línea con un número. Ej. PV = nRT (1) 10. Identifique las variables y las unidades utilizadas en las ecuaciones. Ej. P es la presión y se expresa en atmósferas (atm) 11. Escriba los títulos de los ejes de gráficos y sus unidades correspondientes. Ej. Tiempo (seg). 12. Cuando utilice la función de ajuste (y = mx + b), incluya la ecuación y el coeficiente de correlación en el gráfico. 13. Su nombre y el título deben aparecer en la parte superior de cada gráfico (ej. Datos de Velocidad del Carro, José Smith). 14. Los márgenes de cada página deben ser de 1x1x1x1 pulgadas. 15. Se debe utilizar formato de fuente 11 o 12, New Times Roman o Arial. Los números de las páginas deben estar en la esquina inferior derecha. 16. Las descripciones de las figuras, gráficos o tablas deben estar escritas a espacio sencillo. Las otras partes del laboratorio deben escribirse a dos espacios. ¡Presille su reporte! No se necesita de portada o cubierta. 202 Ejercicio 17. Átomos en el Espacio: Isómeros, Compuestos de Coordinación y otras Estructuras Objetivos de este ejercicio: 1. Los estudiantes utilizarán un programa de modelación molecular para construir y estudiar los diferentes tipos de isómeros. 2. Los estudiantes utilizarán un programa de modelación molecular para construir y estudiar los diferentes compuestos de coordinación. 3. El trabajo con estructuras dinámicas en 3D le permite a los estudiantes la visualización y comprensión de factores geométricos que son difíciles de entender utilizando una imagen plana (2D). Introducción Los isómeros son moléculas que poseen la misma fórmula empírica pero cuyos átomos están ordenados de manera diferente en el espacio. Los isómeros de un mismo compuesto pueden tener diferentes propiedades químicas y físicas. Los tipos básicos de isómero se muestran en la tabla 19.1. En este ejercicio Ud. tendrá que construir diferentes estructuras en dos y tres dimensiones. Para las estructuras 2D, utilice un programa como el ISIS o WordArt para construir las estructuras. Cuando utilice el programa de modelación, realizará también los cálculos semiempíricos (Semiempirical, PM3) para las estructuras que construya en 3D (Spartan). 203 Tabla 17.1. Construya una tabla similar a esta para incluirla en su informe de laboratorio. Se sugiere el uso del formato apaisado (horizontal) para configurar esta página debido a que sus estructuras pueden utilizar un espacio relativamente grande. En la tabla se incluyen compuestos de coordinación e isómeros. Solamente asigne el átomo central, el número de coordinación y la carga sobre el átomo central para los compuestos de coordinación. Importe sus estructuras 2D y 3D (Spartan) en la tabla, y en la columna “Aspecto singular” brevemente defina la geometría o describa aquello que la hace diferente y singular comparado con las otras geometrías. Pareja de coordinación Nombre Átomo central Estructura 2D Estructura 3D Aspecto singular Número de coordinación Carga del átomo central K3[Fe(CN6)] (coordinación; estructura sencilla) [N(H2O)6]Cl3 (coordinación; estructura sencilla) Na2[Cu(H2O)2Cl2Br2] (coordinación; 2 isómeros) [Zn(en)(CO3)O] (coordinación; 2 isómeros) Na[Cr(SO4)(OH)2(H2O)2] (coordinación; 2 isómeros) Na3[Fe(ox)3] (coordinación; 2 isómeros) mer-[CoCl3(NH3)3] (coordinación; estructura sencilla) fac-[CoCl3(NH3)3] (coordinación; estructura 204 sencilla) cis-[CoCl2(NH3)4]+ (coordinación; estructura sencilla) trans-[CoCl2(NH3)4]+ (coordinación; estructura sencilla) [Co(EDTA)](coordinación; estructura sencilla) Cis-Plat (coordinación; estructura sencilla) Famosa droga contra el cáncer Trans-Plat (coordinación; estructura sencilla) Poca actividad contra el cáncer formas D y L de la leucina (¿cuál es – y cuál +?) Use dos estructuras dek Bromoclorofluorometano para explicar los enantiómeros. Use tres estructuras de C5H12 para explicar los isómeros estructurales. Use dos ejemplos de rotámeros utilizando el C2H4Cl2. 205 Use dos estructuras del butano para explicar las conformaciones gauche y anti. Un ejemplo de un isómeros de enlace usando SCN(construya dos estructuras de SCN con enlazamientos diferentes) Use dos anillos de poliglicina (12 residuos cada una) para ilustrar un Catenano Use una cadena de ADN para construir un nudo molecular (Topoisómero) Las formas R y S de la serina Explique una estructura de rotaxano utilizando la αciclodextrina como la macromolécula y el 1,1,10,10tetrafenildecano como la molécula que actúa como pesa. 206 Ejercicio 18. Construyendo y Visualizando algunos Materiales de Uso Común Objetivos de este ejercicio: 1. Los estudiantes utilizarán un programa de modelación molecular para construir una estructura de enrejado. 2. Los estudiantes aprenderán a construir un material estructurado en hojas como el grafito. 3. Los estudiantes aprenderán a construir un material intercalado. 4. Los estudiantes aprenderán a construir un fulereno (“buckyball”, C60) y un aza-fulereno (C48N12). 5. Los estudiantes aprenderán a construir un nanotubo de carbono a partir de cadenas de moléculas de carbono. 6. Los estudiantes profundizarán en sus habilidades para visualizar estructuras 3D. Preguntas previas: 1. Dibuje y describa brevemente una estructura cúbica simple (SC), cúbica centrada en el cuerpo (BCC), cúbica centrada en las caras (FCC), FCC primitiva, hexagonal primitiva y cúbica cerrada con máximo empaquetamiento. 2. ¿Cuál es el concepto de celda unitaria? ¿Por qué una celda unitaria incluye fracciones (⅛, ¼, ½) de átomos en sus esquinas y caras laterales? Describa las celdas unitarias S1, S2 y S3 utilizando dibujos 2D. 3. ¿En qué consiste la Ley de Coulomb (ecuación, variables, unidades, qué modela)? 207 4. Existen tres alótropos del carbono: fulerenos, grafito y diamante. Describa brevemente las estructuras (hibridaciones, ángulos de enlace, longitud de enlace, etc.) para cada uno de ellos. Adicionalmente, describa la geometría de un nanotubo de carbono de pared sencilla (SWNT). 5. ¿En qué consiste un compuesto intercalado en grafito (GIC)? Mencione dos aplicaciones de los GIC en el área comercial o de investigaciones. Defina brevemente la fuerza de van der Waals y cómo se aplica este concepto en las estructuras de las hojas del grafito. El programa de modelación molecular constituye una herramienta excelente para la visualización de estructuras en tres dimensiones. Este ejercicio de laboratorio tiene por objetivo lograr que los estudiantes sean capaces de construir una serie de materiales incluyendo estructuras como el grafito, un compuesto intercalado en grafito, el diamante, una estructura de diamante dopada, nanotubos de carbono, C60 y C48N12, una hoja de nitruro de boro y nanotubo de nitruro de boro. Ejercicio 1. Cloruro de sodio. Los estudiantes aprenden que las sales simples se mantienen enlazadas mediante fuerzas electrostáticas, cuyas interacciones se describen mediante la Ley de Coulomb. Los parámetros de estas estructuras están determinados por el radio iónico y las cargas. Este ejercicio asume que el estudiante posee alguna experiencia previa en el trabajo con Spartan. Los parámetros computacionales que se utilizarán son Single Point Energy, Semiempirical (PM3), Start (Initial), Check Symmetry, Check electrical charges, total charge (cation or anion), Multiplicity (singlet). 1. Primeramente, vamos a construir el catión sodio. Seleccione Na en el comando “Exp” y elimine todos los enlaces que aparezcan, de manera que se observe como una esfera simple (figura 18.1A). Realice los cálculos que se describieron en el párrafo anterior, pero seleccione “cation” para la carga y “singlet” para la multiplicidad. En un espacio de trabajo diferente construya un ión cloruro 208 (Cl-) y asegúrese de seleccionar “anion” para la carga. Copie y pegue un ión en el espacio del otro y minimice el sistema de manera que se forme una molécula de NaCl (figura 18.1B). Figura 18.1. Un ión sodio (Na+) aparece como una esfera en el Spartan. Comience a copiar y pegar la estructura de NaCl una y otra vez en el mismo espacio de trabajo. Es posible que tenga que mover de lugar algunos de los iones de manera que las fuerzas de repulsión no empujen a los iones hacia fuera del espacio de trabajo. Después de cada duplicación, minimice el enrejado. Construya una tabla de dos columnas. Nombre la primera columna como “Descripción” y la segunda columna como “Estructura”. En su informe deben aparecer agregados para 2, 4, 8, 16, 32, 64, 128 y 256 pares de NaCl. En la primera columna escriba el número de pares de NaCl presentes (ej. 2, 4, 8, 16, 32,...256), y escriba hasta cinco valores para las distancias Na-Cl de los iones que están en contacto entre sí y estime el volumen y el área superficial. Realice los cálculos semiempíricos (PM3, 209 neutral) o de mecánica molecular para obtener estos valores. A medida que la estructura de enrejado crece (ver figura 18.2A, B), debe comenzar a aparecer una estructura. Una vez que Ud. construya y determine las dimensiones de la sal o del agregado de mayor tamaño (256 pares de NaCl), identifique la celda unitaria y sus dimensiones. La estructura cristalina del cloruro de sodio (halita) tiene seis iones vecinos que están situados en la esfera interna y posee una geometría octaédrica (se conoce como cúbica de empaquetamiento cerrado (ccp)). La estructura de la halita NaCl puede visualizarse como un enrejado FCC de iones cloruros donde los cationes ocupan los huecos o vacancias. ¿Es ésta la geometría de su enrejado? La eficiencia tridimensional de empaquetamiento (PE) de un enrejado puede calcularse como: P.E. = (volumen de las esferas) / (volumen de la celda) (18.1) donde V = 4/3π r3. Estime el PE de su celda unitaria y escriba este valor en la columna/recuadro correspondiente a la estructura mayor (256). Una vez que haya completado este paso, construya una segunda tabla con el mismo formato de la primera. Esta tabla se utilizará para los datos del CsCl. En espacios de trabajo diferentes, construya las especies Cs+ y Cl-, y después de realizar los cálculos, mueva los iones hacia un mismo espacio. Construya, calcule y determine los mismos parámetros del ejemplo anterior para las estructuras sucesivas (2, 4, 8, 16, 32, 64, 128, 256) de CsCl. Analice su estructura y celdas unitarias y determine si esta es una estructura cúbica simple. Ejercicio II: Estructuras de Carbono. Los dos alótropos de carbono más conocidos son el diamante y el grafito. Estas especies difieren en sus propiedades físicas y químicas debido a sus diferencias en la organización y enlazamiento entre los átomos. En la estructura del grafito, cada carbono tiene una hibridación sp2 mientras que en la del diamante los átomos tienen una hibridación sp3. En el grafito, las hojas de átomos de carbono están formadas por anillos de seis miembros. Si se coloca un átomo o molécula entre estas hojas de carbono, se denomina como compuesto intercalado en grafito (GIC). El 210 descubrimiento de los fulerenos fue reportado por primera vez en 1985 por Harold W. Kroto, Robert F. Curl y Richard E. Smalley. El fulereno más común obtenido se compone de 60 átomos de carbono aromáticos, C60. El C60 es una estructura de caja cerrada que puede construirse conectando apropiadamente doce estructuras de ciclopentadieno. El sistema de nomenclatura para los fulerenos de carbono puros se basa en un código numérico. C60 (565 (56)5 (65)5655). Este primer anillo es un anillo de cinco (5) miembros (ver figura 18.2A), el segundo nivel son cinco anillos y cada uno formado por anillos de seis miembros (hexágonos) (figura 18.2B), seguidos a su vez por anillos de 5 y 6 miembros, cinco de cada uno (figura 18.2C). La arquitectura del C70 se describe como 565 (56)5 65 (65)5655. Utilizando la figura 18.2 como referencia, construya una estructura de C30. Esta estructura se describe como un “bucky-bowl” (pozuelo) y es ½ de un “buckyball”.Una vez que su buckybowl esté terminado, debe copiarlo, pegarlo y conectar las dos estructuras entre sí para formar un C60 simétrico. Copie este alótropo esférico del carbono en su informe y utilizando los parámetros computacionales normales (Single Point Energy, Semiempirical, PM3, neutral, etc.) calcule el área superficial, el volumen y el momento dipolar. También determine y anote las distancias de diez enlaces carbono-carbono en la estructura (¿Son las mismas o diferentes? Explique que significa esto en términos de deslocalización.) 211 Figura 18.2 (A). Construya un anillo de carbono de cinco miembros con carbonos de hibridación sp2. La estructura debe contener dos dobles enlaces y un tercer enlace sobresaliendo de la estructura. (B). Se copia el anillo y se pega cinco veces en el mismo espacio de trabajo resultando en seis anillos de cinco miembros en el espacio de trabajo. La secuencia de conexión de los cinco anillos al anillo central es crítica (muy importante). Cuando se conectan los anillos, el doble enlace sobresaliente debe aparecer en la posición orto. (C). Cuando conecte los anillos al anillo central, conecte primeramente los dobles enlaces. A medida que vaya conectando estos enlaces, se formarán los anillos de seis miembros. Ene ste momento, deben haber diez enlaces sencillos sobresaliendo del bucky-bowl (C30). (D). Copie y pegue la estructura de su bucky-bowl C30 en la misma ventana y conecte los enlaces de manera que sólo se formen enlaces de seis miembros. (A) (C) (B) (D) 212 La figura 18.3 brinda los detalles visuales para la construcción de un nanotubo de carbono (10,0). Construya un tubo (10,0) que tenga al menos 5 nm de longitud. Una vez que lo termine, copie la estructura a su informe de laboratorio y responda las siguientes preguntas asociadas con la estructura (A) ¿Cuál es su volumen? (B) ¿Podría Ud. cerrar (tapar) el final del tubo con una estructura de C6 (tipo benceno)? Brinde alguna evidencia visual (estructural) que demuestre el por qué o por qué no funcionará esta estructura como una tapa. A. B. C. D. E. Figura 18.3 (A) Construya una cadena de diez átomos de carbonos utilizando átomos con hibridación sp2. Todos los dobles enlaces deben estar en la cadena y solamente los enlaces simples pueden sobresalir de la cadena. (B) Conecte los dos extremos de la cadena para formar un anillo (de aquí el nombre (10,0) SWNT). (C) Copie y pegue el anillo en el mismo espacio de trabajo y conecte de manera alterna los enlaces para formar anillos de seis miembros. Los átomos deben tener un enlace protuberante de forma alterna. (D) Copie y pegue esta unidad, conectando cada enlace para formar un mini-tubo con 4 anillos, después copie y pegue para formar un mini-tubo con 8 anillos, etc. (E) Cuando Ud. mueva la estructura hasta tener el tubo de frente, debe mostrar una apariencia altamente simétrica. 213 Su instructor puede asignarle ahora estructuras de nanotubos o fulerenos adicionales para construir, como son: (A) C60 asimétrico (5557551075555) (B) C70 (565(56)565(65)5655) (C) dos isómeros del C96: C96 (65676(56)6(65)675566) y C96 (666(56)6(66)6(65)6666) (D) nanotubo (16,0). (E) C60 esférico con dos átomos de helio atrapados dentro. Calcule el momento dipolo de la estructura octaédrica. (F) C60 esférico con 38 átomos de hidrógeno covalentemente enlazados por fuera de la estructura. Calcule el momento dipolo de la estructura exoédrica. Ahora Ud. construirá una hoja de grafito. El grafito puede enrollarse de una manera asimétrica para formar nanotubos con (6,6) y (9,10). El sistema de nanotubo descrito anteriormente para nanotubos como (10,0), (12,0), (14,0) o (20,0) se construye con facilidad en un programa de modelación molecular. Analice detalladamente la figura 18.4 y determine una estrategia para construir esta estructura de hojas que está compuesta totalmente por carbonos con hibridación sp2. Construya una hoja que sea aproximadamente cuadrada (largo ≈ altura) y de un área de al menos 9 nm2. Localice una unidad que se repita y que le permita a Ud. copiar y pegar una sección del grafito para construir una hoja más grande, en lugar de tener que estar añadiendo átomos de carbono de uno en uno. Una vez que haya realizado este paso, copie la estructura en su informe, y calcule el número de átomos de carbono como átomos/ nm2. A continuación, copie y pegue su estructura en el mismo espacio de trabajo de manera que tenga dos hojas de grafito. Después de minimizar, determine al menos diez valores de distancia entre las dos hojas. En un espacio separado, construya una molécula de Br2 y copie dos Br2 entre el área de hojas dobles de grafito y minimice la estructura. Esta es una representación simple de un compuesto intercalado en grafito. Utilizando al menos diez puntos, determine la distancia promedio entre las dos hojas. Nuevamente, cópielo en su informe y escriba una descripción breve. 214 Figura 18.4. (A) Una hoja de grafito está compuesta por carbonos con hibridación sp2 y seis anillos laterales. (B) Un compuesto intercalado en grafito con dos moléculas de bromo situadas en sándwich entre las dos hojas. A. B. La próxima estructura a construir es un cristal de carbono o el diamante. El mismo está compuesto por átomos de carbono con hibridación sp3. Como se muestra en la figura 18.5, construya un nano-cristal de diamante que consiste en al menos 200 átomos con la longitud, ancho y altura de esta estructura, todos con dimensiones similares. Copie la estructura en su informe y calcule su volumen. Considerando los enlaces remanentes en la superficie del cristal, ¿qué le sucedería a esta estructura si se encontrase bajo condiciones normales, como las atmosféricas? 215 Figura 18.5. Una estructura de diamante donde todos los carbonos que la componen tienen hibridación sp3. La estructura final a construir es el aza-fulereno, C48N12. Esta estructura estará compuesta por doce unidades C4N1 y es capaz de producir un número extraordinariamente grande de isómeros. La figura 18.6 perfila la construcción de un isómero simple del aza-fulereno C48N12. El primer anillo de cinco miembros consiste en cuatro carbonos de hibridación sp2 y un átomo de átomo de nitrógeno de hibridación sp3. Todos los dobles enlaces deben estar contenidos dentro del anillo y solamente cinco enlaces simples pueden sobresalir de la estructura. Existe una unidad central de C4N1 rodeada por 5 unidades idénticas (figura 18.6B). A diferencia de la construcción del C30 que requirió de dobles enlaces, la construcción del aza-buckyball C24N6 tiene solamente enlaces simples que permiten una mayor flexibilidad en su construcción. Una vez que termine la construcción de un aza-buckyball, cópielo y péguelo en el mismo espacio de trabajo y conéctelos para formar la estructura esférica. 216 Mientras que esta construcción se centra en la utilización del pirrol como bloque básico de construcción, en teoría un aza-fulereno se puede formar a partir de moléculas desde C59N1 hasta C1N59. Dentro de la mayoría de estas fórmulas empíricas existen muchos isómeros potenciales (al menos podemos modelarlos – la síntesis completa de un aza-fulereno nunca ha sido reportado en la literatura, aunque trabajos en el laboratorio sugieren la formación de un aza-fulereno hidrogenado en una descarga de alto voltaje). Tampoco existe un método simple disponible en la actualidad para nombrar o identificar azafulerenos, por lo que hemos desarrollado uno para este ejercicio. El C60 sólo tiene átomos de carbono, por lo que las estructuras pueden identificarse por el orden y las dimensiones de los anillos. Aquí nosotros describimos un método numérico que permite distinguir los isómeros del C48N12 construidos con un C4N1. Comienza con un anillo central (figura 18.6A) construido con átomos de carbono con hibridación sp2 y un nitrógeno con hibridación sp3. Esta estructura se copia cinco veces y cada una se conecta al pirrol central. Estas estructuras pueden organizarse de diferentes maneras gracias a que los enlaces que sobresalen son todos simples, por lo que incluso en el caso de que el tamaño de los anillos sea el mismo (ej. anillos de 5 miembros), las propiedades físicas como el volumen, el área superficial y el momento dipolo son diferentes (ver tabla 19.1, figura 19.8) debido a la posición del nitrógeno. Esto fue lo que nos llevó a desarrollar un sistema numérico para describir cada estructura. Comenzamos por la unidad central de C4N1, la cual se numera de 1-5 (figura 18.7A). El primer anillo de unidades de C4N1 también se numera de 1-5, PERO el átomo #1 es el átomo enlazado al anillo central de pirrol. Entonces, moviéndonos en el sentido de las manecillas del reloj, el superíndice indica la posición en que está este nitrógeno (1-5). Este sistema nos permite nombrar con facilidad los aza-buckybowls. Dos de estos compuestos pueden unirse para formar un aza-fulereno (C48N12). La nomenclatura de los buckyballs se realiza partiendo del sistema numérico anterior (de los “bowls”), por lo que quedaría como 1322314251 – 72º 1322314251. La primera secuencia nos da el orden del “bowl” en la parte posterior y la segunda 217 secuencia es el orden en el frente. Los 72º (o 1/5 de 360º) representan los grados de rotación en el sentido de las manecillas del reloj que existen entre el átomo de nitrógeno en el anillo central y el nitrógeno en el anillo posterior (ver figura 18.8). Figura 18.6. (A) Una subunidad de C4N1 es el bloque básico de construcción del C48N12. Todos los dobles enlaces se encuentran dentro del anillo de cinco miembros. (B) Cinco de los anillos están enlazados a la unidad central C4N1, pero en dependencia de la organización de los enlaces, se producen diferentes isómeros. (C) El “buckybowl” en (B) se copia, pega y se conecta para formar un alótropo esférico del carbono. A. B. C. 218 Figura 18.7. (A) La unidad central de pirrol se numera del 1-5, comenzando con el átomo de nitrógeno. (B) Los cinco pirroles que están enlazados al pirrol central se numeran del 1-5, siendo el #1 el átomo enlazado al pirrol central y el superíndice representa la posición del nitrógeno. Usando el sistema de nomenclatura que aquí se presenta, el nombre para esta estructura sería “1322314251”. (C) Usando el sistema de nomenclatura que aquí se presenta, el nombre para esta estructura sería “1421344452”. 1 N 2 5 3 4 A. N N N N N N B. N N N N N N C. 219 Figura 18.8. (A) El “buckybowl” 1322314254. Esta estructura se copia y pega y los dos “bowls” se unen para formar un “bowl”. Cuando las dos mitades idénticas se enlazan se pueden obtener nuevamente un gran número de isómeros. La representación numérica para esta geometría es 1322314254 – 256º 1322314254. El ángulo 256º indica cuántos grados ha rotado el nitrógeno en el anillo posterior con respecto al nitrógeno en el anillo frontal. Utilizando el comando “Label” en Spartan Ud. puede llevar la cuenta de los números de los átomos (hay 12 anillos de cinco miembros) (A) (B) 220 En un programa de 2D (ej. ISIS) construya los siguientes “bucky-bowls”: (a) 1225314352 (b) 1323324254 . Una vez que complete estas estructuras, construya cada una en el programa de modelación molecular (Spartan). Cuando tenga las cuatro estructuras (dos en 2D y dos en 3D), cópielas en su informe. Conecte los dos “bowls” en el mismo espacio de trabajo y haga cinco estructuras diferentes variando el orden de enlace de los “bowls”. Además de nombrarlas usando el método numérico descrito en este ejercicio con anterioridad, calcule su momento dipolo, el volumen molecular y el área superficial y escriba estos valores, junto a su nombre y una copia de la estructura, en una tabla de cinco columnas (nombre, estructura, momento dipolo, volumen molecular y área superficial son los encabezamientos). Asegúrese de tener en cada estructura el “bowl” 1225314352 en el frente, con el nitrógeno sobre la unidad central C4N1 en posición de las 12 horas. 221 Ejercicio 19. Fluido Supercrítico de Dióxido de Carbono y Nanotubos de Carbono Objetivos de este ejercicio: 1. Utilizar un nanotubo de carbono como tubo de ensayos en fase gaseosa. 2. Estudiar la transición de un gas a un fluido supercrítico para CO2. 3. Comparara la Ley del Gas Ideal con la ecuación de van der Waals. El dióxido de carbono es una molécula crítica para un gran número de procesos naturales y antropogénicos, desde jugar un papel importante como fuente básica de alimento en las plantas hasta su controversial papel como gas de invernadero. De igual forma, constituye uno de los productos fundamentales de los procesos de combustión: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) (19.1) El dióxido de carbono se puede fácilmente transformar en un fluido supercrítico porque su Tc y Pc se alcanzan fácilmente utilizando equipamiento de uso común. El dióxido de carbono es también la especie primaria que se usa para extraer la cafeína en los procesos de descafeinación. Preguntas previas: 1. Escriba una ecuación balanceada para la combustión del octano, el carbón y el carbón vegetal. 2. ¿Qué se conoce como un fluido supercrítico? Utilizando un programa de 2D, dibuje el diagrama de fase del CO2 y el H2O. Incluya y nombre la Tc y la Pc (temperatura y presión críticas) y el punto triple para ambas especies en sus gráficos. 222 3. ¿En qué consiste la Ley del Gas Ideal? ¿Y las ecuaciones de van der Waals? Identifique los parámetros y sus unidades en cada ecuación, así como bajo qué condiciones se pueden utilizar dichas ecuaciones. 4. ¿Cuáles son los parámetros específicos “a” y “b” y sus unidades para el CO2 que se utilizan en la ecuación de van der Waals? Ejercicio: Para este ejercicio Ud. utilizará un nanotubo cerrado. Puede construir esta nanoestructura o su instructor le dará un nanotubo en un fichero de Spartan. Si Ud. construye el nanotubo, puede utilizar las estructuras realizadas en el ejercicio 18. Específicamente, las “tapas” del nanotubo se construyen a partir de “buckybowls”. Observe el bowl obtenido y estime el tipo o diámetro del nanotubo (ej. (10,0), (20,0), etc.) que puede cerrarse con una mitad de buckyball. Su tubo (10,0) sería demasiado pequeño y un tubo tipo (50,0) sería demasiado grande. Su tubo debe tener aproximadamente el mismo diámetro y longitud que el ejemplo mostrado en la figura 19.1. En un espacio de trabajo separado construya una molécula de CO2 (use el menú EXP para obtener =C=), realice los cálculos (Single Point Energy, Semiempirical, PM3, neutral, singlet) para la estructura y guarde este fichero. Copie y pegue una molécula de CO2 dentro de du nanotubo y minimice la energía. Guarde el fichero con el nombre “nanotube_CO2_1”. Copie y pegue esta estructura en su informe y responda las preguntas en el pie de figura (muestre los cálculos realizados, con unidades). Para todos los cálculos en este trabajo asuma la temperatura supercrítica (lo que se calcula es la presión). Calcule el volumen en nm3 dentro del nanotubo (ayuda: mida su altura y diámetro interno). Utilizando PV=nRT, calcule la presión dentro del tubo con una sola molécula de CO2 (ayuda: 1 molécula/6.02x1023 moléculas CO2/mol) = moles de CO2). Adicionalmente, use la ecuación de van der Waals y calcule la presión para cada volumen. 223 Pegue una segunda molécula de CO2 dentro del nanotubo y minimice la energía. Mida la distancia entre las dos moléculas. Utilizando PV=nRT y la ecuación de VDW calcule la presión dentro del tubo con dos moléculas de CO2. Para todas las estructuras, copie y pegue la molécula en su informe y responda las preguntas debajo en el pie de figura. Pegue una tercera molécula de CO2 dentro del nanotubo y minimice la energía. Mida la distancia entre las tres moléculas (ej. 1→2, 2→3) y promedie este valor. Utilizando PV=nRT y la ecuación de VDW, calcule la presión dentro del tubo con tres moléculas de CO2. Siga añadiendo una molécula de CO2 a la vez hasta que la presión dentro del tubo sea al menos tres veces el valor de la presión crítica. Después de cada adición, calcule la presión y escriba las distancias entre cada molécula adyacente y promedie este valor. Una vez que Ud. haya alcanzado el triple de la presión crítica, grafique la distancia promedio entre moléculas adyacentes de CO2 en función de la presión calculada (Fif. 19.3). Ud. debe tener dos gráficos: uno para la presión calculada a partir de la ley del gas ideal y una segunda utilizando la presión de la ecuación de VDW. Explique sus datos considerando la transición de un gas a un fluido supercrítico. ¿Pueden considerarse como válidas las ecuaciones del gas ideal y de VDW una vez por encima de la Tc y la Pc? ¿Por qué o por qué no? También observe y explique cómo las moléculas de CO2 llenan el interior del tubo (es decir, se alinean ella mismas) a altas presiones. Incluya en el informe varias imágenes del nanotubo con diferentes números de moléculas de CO2 atrapadas en su interior. Finalmente, después de añadir cada CO2 y que se calculen todos los parámetros, mida varias de las distancias de enlace C=O y los ángulos de enlaces O=C=O. Grafique la presión vs. la distancia promedio de enlace C=O. ¿Se observa algún cambio en estos parámetros? Explique. 224 Figura 19.1. Siete moléculas de CO2 atrapadas en un nanotubo de carbono. Mida la distancia entre cada molécula adyacente (1,2; 2,3; 3,4; 4,5; 5,6; 6,7) y promedie los valores. Calcule también la presión usando la temperatura supercrítica. Figura 19.2. Una molécula sencilla de CO2. Mida las distancia de enlace C=O y los ángulos de enlace O=C=O después de cada cálculo. 225 Distancia Promedio A Distancia Promedio vs. Presión Calculada Presión Calculada Atm Figura 19.3. La distancia promedio entre moléculas de CO2 atrapadas dentro de un nanotubo y la presión calculada con la Ley del Gas Ideal. Se observa un punto de ruptuta aproximadamente en el valor de la Pc. 226 Ejercicio 20. Equilibrio radiactivo Objetivos de este ejercicio: 4. Familiarizar a los estudiantes con los tipos de equilibrio radiactivo. 5. Enseñar a los estudiantes a construir los gráficos de desintegración radiactiva utilizando las funciones en Excel para gráficos con más de una serie.. 6. Los estudiantes realizarán una comparación entre las curvas obtenidas en dependencia del tipo de equilibrio. La reacción de desintegración radiactiva es un ejemplo típico de reacción que sigue una cinética de primer orden. En este ejercicio los estudiantes se enfrentarán a las transformaciones que ocurren cuando tenemos una mezcla de radioisótopos que se encuentran relacionados entre sí por una reacción de desintegración, y que se comportan de manera análoga a las reacciones consecutivas clásicas. Para ello, los estudiantes se familiarizarán con algunos términos básicos de la química nuclear y graficarán en Excel los resultados que se obtienen al alcanzarse la condición de equilibrio radiactivo. En este ejercicio los estudiantes también podrán aprender a utilizar la opción de escala logarítmica en un gráfico con múltiples series. Los procesos de desintegración radiactiva constituyen las reacciones nucleares más conocidas, mediante las cuales un núcleo inestable se transforma en un núcleo diferente por emisión de una o más partículas. En estos procesos el núcleo reactivo se suele llamar padre y el núcleo producto se suele llamar hijo. Por ejemplo, en la ecuación nuclear de desintegración radiactiva del núcleo de uranio-235, el uranio-235 padre se descompone para formar el núcleo hijo torio-231 por emisión de una partícula alfa: 227 4 2+ U → 231 90Th + 2 He 235 92 La velocidad de la reacción de desintegración de un radioisótopo es proporcional al número de átomos de este isótopo que están presentes en ese momento. Por lo tanto, la desintegración radiactiva cumple con una cinética de primer orden, y su ley de velocidad se puede expresar como − dN = Nλ , dt donde N es el número de átomos presentes a un tiempo t y λ es la constante de velocidad de primer orden, también llamada constante de la desintegración radiactiva, la cual se relaciona con el tiempo de vida media según la ecuación: λ = ln 2 . (Note que aquí se utiliza λ en lugar de k para la constante de T1 2 velocidad, y tiene por tanto dimensiones de tiempo-1, ej. s-1). El signo negativo implica que hay una desintegración de los átomos. El producto Nλ se conoce como radiactividad o simplemente actividad (A) y su valor decrece exponencialmente en función del tiempo: A = A0 e − λt . La actividad tiene unidades de desintegraciones por unidad de tiempo, generalmente se define en desintegraciones por segundo (dps). Las unidades de la radioactividad son: 1 Becquerel (Bq) = 1 dps, 1 Curie (Ci) = 3.7 x 1010 dps. De manera análoga a lo que se obtiene para reacciones que siguen una cinética de primer orden, el tiempo requerido para la desintegración de la mitad de los átomos padres a los átomos hijos se define como el tiempo de vida media (T1/2) del núcleo padre. En los procesos de desintegración radioactiva existen dos posibilidades: que el producto sea estable o que el producto sea radioactivo. En los casos donde el producto hijo es también radioactivo y su T1/2 es menor que el T1/2 de su padre, entonces la actividad del hijo crece con el tiempo y es representada por la ecuación: −λ t λ 2 −λ1t A2 = A10 −e 2 e λ 2 − λ1 donde A10 es la actividad inicial del padre, λ1 λ2 son las constantes de desintegración radiactiva del padre y del hijo, respectivamente. 228 La actividad total teniendo en cuenta la desintegración del padre y el crecimiento del hijo se puede expresar como la suma de las actividades de los núcleos padre e hijo: −λ t −λ t λ 2 −λ1t A = A10 e 1 + A10 −e 2 e λ 2 − λ1 En dependencia de las constantes de desintegración del padre y el producto hijo tenemos tres casos de desintegraciones correlacionadas. El equilibrio secular ocurre en aquellos casos donde el T1/2 del padre es mucho mayor que el del hijo, por lo que la constante de desintegración λ1 (padre) << λ2 (hijo). El equilibrio transitorio ocurre en los casos donde las constantes de desintegración λ1 (padre) y λ2 (hijo) están en una relación 0.1. Estos dos casos se conocen como equilibrios radiactivos. En los casos donde el T1/2 del hijo es mayor que el del padre, no se llega a la condición de equilibrio, aunque la actividad del producto hijo aumenta hasta alcanzar un máximo y decae con su T1/2 característico. Preguntas previas: 1. ¿Cuál es la definición de tiempo de vida media (T1/2) de un proceso de desintegración radiactiva? ¿Cuál es su relación con la constante de velocidad de este proceso? 2. El Cs-137 se desintegra a Ba-137m mediante la emisión de una partícula beta. Considerando que el T1/2 de la reacción es 30 años, calcule la constante de desintegración radiactiva (λ1). 3. El Ce-144 se desintegra a Pr-144, con un T1/2 = 284.89 días, y este a su vez a Nd-144, con un T1/2 = 17.28 min. Ambas reacciones ocurren con la emisión de una partícula beta. Diga si se cumple la condición de equilibrio radiactivo en estas reacciones consecutivas, y de ser el caso, qué tipo de equilibrio se pone de manifiesto. Ejercicios del laboratorio: Su nombre y el título del laboratorio, así como las preguntas previas, deben aparecer en dos páginas como máximo en el informe del laboratorio. Su gráfico debe copiarse y pegarse en una página 229 independiente con el pie de figura correspondiente (ej. Figura 1. Gráfico de Actividad vs. Tiempo para la desintegración….). Después de completar la primera parte del laboratorio, Ud. debe realizar el ejercicio correspondiente a la Parte II; en este caso se trata de otro tipo de equilibrio radioactivo. Note que aunque se utiliza un procedimiento similar, los gráficos obtenidos no son iguales. Para ello, Ud. debe obtener primero una ecuación general para el cálculo de la actividad total en función del tiempo en este nuevo tipo de equilibrio. Recuerde guardar todo su trabajo (ficheros de Excel, informe, etc.) regularmente en al menos dos dispositivos de memoria (ej. memoria extraíble, disco duro, etc.). Muchas de las computadoras en universidades y bibliotecas están programadas para borrar automáticamente los ficheros de usuarios por razones de seguridad. Parte I. Un ejemplo típico de equilibrio secular es la reacción de desintegración: 137Cs Î 137mBa. (T1/2(137Cs) = 30.04 años y T1/2(137mBa) = 2.55 min. Considere la actividad inicial del 137Cs como A10(137Cs) = 1 mCi. 1. Abra una hoja de cálculo nueva. En la celda A1 escriba el encabezamiento “Tiempo”. En la celda A2 escriba el número “0”. En la celda A3 escriba el comando “= SUMA (A2+0.1)” y copie/pegue hacia abajo hasta la celda A302. Verifique que en la celda A302 se encuentre el número “200”. Estos valores representan los intervalos de tiempo a los cuales se determina la velocidad de la reacción. 2. En la celda B1 escriba “Constante Desint. Padre”. En la celda B2 escriba el comando ““=LN(2)/(30.04*365*24*60)”. Este es el valor de la constante de velocidad de la reacción 137Cs Î 137mBa, después de convertir 30.04 años en minutos. Copie este valor y péguelo hacia abajo en la columna hasta la celda B302. 230 3. En la celda C1 escriba “Constante Desint. Hijo”. En la celda C2 escriba “=LN(2)/2.55”. Este es el valor para la constante de velocidad de la reacción 137Cs Î 137mBa. Copie este valor y péguelo hacia abajo hasta la celda C302. 4. En la celda D1 escriba el encabezamiento “Act. Padre” y en la celda D2 escriba el valor “2.22E+09” (A0, la actividad inicial del padre-137Cs). En la celda D3 escriba el comando “=$D$2*EXP (-B3*A3)” y copie/pegue hacia abajo hasta la celda C302. Note que los valores numéricos para la actividad del padre son prácticamente los mismos, ya que el tiempo de vida media del padre es lo suficientemente grande como para que la actividad se mantenga prácticamente constante durante el intervalo de tiempo que estamos analizando (30 min). Pregunta: ¿Cuál será la actividad del padre después de transcurridos 20 años? 5. En la celda E1 escriba el encabezamiento “Act. Hijo” y en la celda E2 escriba el valor “0” que es la actividad inicial del 137mBa (Hijo). En la celda E3 escriba el comando “=$D$2*(C3/(C3B3))*(EXP(-B3*A3)-EXP(-C3*A3))” y copie/pegue hacia abajo hasta la celda E302. 6. En la celda F1 escriba el encabezamiento “Act. Padre + Hijo” y en la celda F2 escriba el valor “2.22E+09”. A tiempo cero, la actividad total en una muestra pura que sólo contiene al núcleo padre es igual a la actividad inicial (A0) del 137Cs (padre), en Bequerel. 7. Ahora vamos a calcular la actividad total (Padre + Hijo) a diferentes tiempos, utilizando la Ec. 5.2. En la celda F3 escriba el comando “=$F$2*EXP(-B3*A3)+$F$2*(C3/(C3-B3))*(EXP(-B3 *A3)EXP(-C3*A3))” y copie/pegue hacia abajo hasta la celda F302. 8. Ahora vamos a graficar los datos de las tres curvas que representan el equilibrio radiactivo. Se asume que usted está familiarizado con graficar datos en Excel. Nombre la primera serie “Act. Padre + Hijo”, la segunda serie “Act. Padre” y la tercera serie “Act. Hijo”. Use los valores de las celdas D2…D302, E3…E302 y F2…F302 para los ejes y de cada una de las series respectivamente y los valores de las celdas A2…A302 para el eje x en las tres series por igual. Una vez que el gráfico esté hecho, ajuste la escala del eje y de 1E+09 a 1E+10 y seleccione la opción de escala 231 logarítmica para este eje. Ajuste la escala del eje x de 0 a 30. (Note que en el caso de los valores de la Actividad del Hijo, el valor inicial no se utiliza en el gráfico, ya que el logaritmo de cero no está definido.) Escriba un título para el gráfico (“Equilibrio Secular”), y nombre el eje x “Tiempo (h)” y el eje y “Actividad (en escala Log)”. Elimine el color de fondo del gráfico y active las líneas de división secundarias en el menú del gráfico. Copie y pegue el gráfico en su informe y escriba un pie de figura apropiado. Después de realizar todas estas actividades deberá observar el siguiente gráfico (Figura 1). Equilibrio Secular Actividad (en escala log) 1.00E+10 Act. Padre+Hijo Act. Padre Act. Hijo 1.00E+09 0 5 10 15 20 25 30 Tiempo (min) Figura 1. Gráfico de la Actividad vs. Tiempo en la desintegración 137Cs Î 137mBa. Parte II. Construya las curvas de desintegración radiactiva del equilibrio 99Mo Î 99mTc. (T1/2(99Mo) = 66.7 h y T1/2(99mTc) = 6.01 h). Tómese además la actividad inicial del 99Mo como A10(99Mo) = 1 mCi. (Recuerde que 1 Ci = 1.37x1010 Bq = 1.37x1010 desintegraciones/segundo) 232 Nota: En el caso del equilibrio transitorio la actividad total (suma de la actividad del padre y del hijo en una muestra inicialmente pura del padre) alcanza un máximo antes de que se llegue al equilibrio. Preguntas finales: 1. ¿Por qué es necesario expresar la actividad en Becquerel en la ecuación de la desintegración radiactiva? 2. ¿Cree Ud. que las constantes de velocidad de las desintegraciones radiactivas se modifiquen con los cambios en las condiciones ambientales, como la temperatura y la presión, como sucede en las reacciones químicas ordinarias? Explique su respuesta. 2. Considere la reacción de desintegración radiactiva 122Xe Î 122I Î 122Te (estable). Calcule la actividad presente en una muestra inicialmente pura de 1 Ci de 122Xe después de pasados 2 minutos. T1/2 (122Xe) = 20.1 h, T1/2 (122I) = 3.6 min. 233 Ejercicio 21. Un Acertijo Periódico Objetivos de este ejercicio: 1. Este es un ejercicio tipo el Sudoku con énfasis en las tendencias periódicas y los símbolos de los elementos. 2. El ejercicio requiere que los estudiantes tengan acceso a una Tabla Periódica interactiva. 3. ¡Es difícil! La lógica detrás de los cuadrados Latinos (figura 21.1) se ha popularizado con la serie de acertijos tipo Sudoku. El Sudoku aparece en muchos de los periódicos, foros en línea y libros de juegos que pueden comprarse para resolver este popular juego de números. Este ejercicio comparte algunas similitudes generales pero es diferente en otros aspectos, incluyendo el hecho de que sólo tiene solución con 81 símbolos químicos de elementos diferentes, además de que la distribución de los espacios se organiza por grupos periódicos y algunas consideraciones alfabéticas. La habilidad para reconocer tendencias y patrones es de gran importancia en muchas de las ramas de la química y las estructuras moleculares. Polímeros naturales, como el ADN, ARN, las proteínas, la celulosa y la lignina tienen todos patrones reconocibles. Las sales y los materiales como NaCl, CsCl y el grafito tienen unidades repetitivas que definen sus estructuras. El mejor enfoque para solucionar este acertijo consiste en desarrollar y aplicar una serie de nueve patrones (nueve filas). Durante el proceso de solución, los estudiantes se verán obligados a examinar la tabla periódica con detenimiento y deberán ser capaces de reconocer los diferentes grupos. 234 La figura 21.1 brinda un ejemplo sencillo de un cuadrado Latino simple de 3x3 con 3 símbolos (1,2,3). 1 2 3 3 1 2 2 3 1 Los estudiantes serán orientados a consultar un sitio web o se les brindará una clase breve sobre las reglas del Sudoku. Una vez que se explique la lógica de este popular juego numérico, se definirán los grupos (ver tabla 21.1) y las reglas utilizadas en este ejercicio. Tabla 22.1 Los nueve grupos utilizados en los acertijos periódicos. A. El elemento es un gas a 1 atm y 0ºC. B. Los elementos tienen un estado de oxidación estable de +1 en un complejo, sal o cuando se disuelven en agua. C. El elemento es uno de los lantánidos (La-Lu). D. El elemento es uno de los actínidos (Ac-Lr). E. El elemento tiene un estado de oxidación de +2 (complejo, sal, o disuelto en agua). F. El elemento es un no metal o un metaloide (todos están a la derecha de la frontera con los metaloides) G. El elemento es un metal blando o un metaloide (a la izquierda de la frontera) o un metal de transición con un orbital externo 4d (Y-Cd). H. El elemento es un metal de transición con un orbital externo 5d (Hf-Hg). I. El elemento es un elemento artificial con 104 a 118 protones (Rf-Uuo). 235 A. Acertijo Periódico Completo. Las reglas para el formato del Acertijo Periódico son: 1. Cada bloque 3x3 contiene un elemento de cada uno de los nueve grupos que se listan arriba. Cada tabla cuadriculada resuelta correctamente tendrá 81 símbolos elementales diferentes (3 x 3 x 9). 2. No pueden existir dos elementos provenientes del mismo grupo (A-I arriba) en la misma fila o columna (vertical, horizontal). Un elemento puede clasificar en dos grupos (Cl como un no metal o como un gas) pero una vez que se usa en un grupo específico, no se puede usar para un segundo grupo. 3. Escriba solamente el símbolo químico del elemento (sin la carga, el estado físico, subíndices, etc.). 4. http://www.dayah.com/periodic/ Esta tabla periódica contiene todos los elementos que pueden utilizarse en esta cuadrícula. Si se selecciona el símbolo del elemento, aparece un enlace a los estados de oxidación más estables. 5. Se pueden utilizar los símbolos para las especies que tiene hasta 118 protones. 6. Los símbolos múltiples pueden usarse para cuadros específicos (¡pero seleccione sabiamente!). 7. Cada elemento puede usarse una sola vez en todo el acertijo de 9x9. El acertijo final debe tener 81 símbolos diferentes. 8. Algunos elementos tienen la posibilidad de estar en dos grupos diferentes (ej. el Cl puede ser un no metal o un gas). Una vez que Ud. use un elemento en un grupo, el mismo no podrá ser usado en otro grupo. 9. El Hidrógeno (H), el Deuterio (D) y el Tritio (T) son isótopos pero se consideran especies por separado debido a sus usos potenciales como un gas (T2, D2, H2), como un ión cargado simple (T+, D+, H+) o como un no metal (T, D, H). 10. Para un grupo que se caracteriza por un número de oxidación, se utiliza la especie estable que existe cuando se disuelve en agua, cuando forma parte de una sal o parte de un complejo. No tiene que necesariamente ser una especie con un solo estado de oxidación estable (ej. Fe2+, Fe3+). 11. Cada fila y columna sólo pueden tener un elemento con la misma primera letra en el símbolo (ej. el azufre (S) y el samario (Sm) no pueden estar en la misma fila o columna). Los símbolos en cualquiera de las listas verticales u horizontales deben comenzar con nueve letras diferentes. 12. No existe ninguna restricción de letras o grupos para las diagonales. 236 Figura 21.1. Esta tabla cuadriculada vacía de 9x9 contiene nueve sub-cuadrículas de 3x3. Esta tabla se le suministrará a los participantes en el ejercicio, además de las reglas para completar la tabla de 9x9, acceso a una tabla periódica en línea y los nueve grupos elementales (tabla 21.1). Típicamente, el mejor enfoque para solucionar este acertijo consiste en desarrollar un patrón lógico basado en los grupos. Por ejemplo, la primera fila transversal sería un elemento de los grupos A, B, C, D, E, F, G, H, I en los cuadros consecutivos, y la segunda fila transversal serían elementos de los grupos G, H, I, A, B, C, D, E, F en cuadros consecutivos, etc. Una vez que esto se realice, los elementos pueden reorganizarse de manera que no coincidan símbolos de igual letra inicial. De ser necesario, se puede obtener una copia del acertijo resuelto a través del correo electrónico: [email protected]. 237 Ejercicio 22. La Geografía y el Mercado Químico Global Objetivos de este ejercicio: 1. Este es un ejercicio interdisciplinario que abarca la geografía, la química y la medicina y que relaciona otro número de tópicos (la geología, la agricultura, etc.). 2. Los estudiantes examinarán la ubicación de un país y sus recursos naturales que pueden ser relacionados con algunas facetas de la industria química. 3. Los estudiantes correlacionarán el desarrollo de la industria química con el indicador de esperanza de vida. En la mayoría de los cursos de química existen temas como el enlace químico, la espectroscopía, la cinética, la síntesis, la estequiometría y la termodinámica que son los que predominan en las conferencias, los laboratorios y las tareas extraclases. Este ejercicio interdisciplinario introduce el impacto que tiene la industria química en la economía global. Los estudiantes recibirán una lista de países, los cuales deberán ubicar su posición en un mapa e identificarán 1-3 productos o recursos naturales producidos por este país. La industria química guarda estrecha relación con la mayoría de las grandes industrias, incluyendo la petroquímica, la agrícola, la minera, el transporte, la farmacéutica y de productos especializados. Mientras que un país puede no parecer tecnológicamente avanzado, el mismo puede poseer un recurso natural (yacimientos, madera, ganado, etc.) que son parte de la industria química global. Un área como la agricultura ilustra cómo numerosas áreas de la química están involucradas en un mercado más amplio que incluye la genética, la producción de herbicidas y pesticidas, la producción de fertilizantes y las pruebas de control de la calidad de los alimentos. 238 En este ejercicio los estudiantes deberán completar la tabla 22.1. Algunos sitios web de interés incluyen: 1. “The CIA Fact book”: https://www.cia.gov/library/publications/the-world-factbook/ 2. Lista de países en la Wikipedia: http://en.wikipedia.org/wiki/List_of_Countries Existen otros muchos recursos en Internet relacionados con este ejercicio pero los dos sitios que se mencionan arriba son fáciles para navegar en búsqueda de información. Cuando se llene la tabla 22.1, se deben también identificar los tres países vecinos. En el caso de una isla, simplemente selecciones los tres países más cercanos (3ª columna). Cuando se escriban los recursos naturales (4ª columna), selecciones tres productos que se exportan y que pudieran estar involucrados con la industria química. Los países pequeños puede que sólo puedan exportar algún tipo de alimento, pero este puede haber sido obtenido eficientemente mediante el uso de pesticidas y herbicidas o preservado utilizando productos químicos. Los países más grandes pueden tener empresas comerciales muy desarrolladas en diferentes áreas, pero seleccione sólo tres de las más grandes. En la quinta columna (final), escriba la esperanza de vida promedio de ese país. Este número nos brinda una percepción sobre cuán avanzados son los recursos básicos de este país, incluyendo la calidad del agua potable, los niveles nutricionales disponibles y la salud de los recién nacidos y niños pequeños. Cuando Ud. considera que una mujer en Japón hoy en día vivirá hasta alcanzar una edad promedio de 82 años, mientras que una mujer nacida en Swazilandia (situado en el sur de África) vivirá hasta una edad menor que la mitad de este valor (39 años), entonces Ud. comenzará a comprender el impacto positivo que la industria química puede tener en la calidad de vida. Su instructor de laboratorio puede decidir reducir el número total de países a examinar (ej. sólo los países numerados impares o uno cada tres países de la lista, etc.) pero cuando el ejercicio se termine Ud. debe haber adquirido una percepción mejor sobre el mundo en el que vivimos y sobre el impacto que la química tiene sobre nuestra sociedad global. 239 Pregunta Extra: Nombre tres minas en Canadá que producen uranio para los reactores nucleares. ¿Cuál es el impacto económico de esta operación? Asegúrese de presillar todas las hojas e imprimir su nombre en la primera página de este ejercicio. 240 Tabla 22.1. Esta tabla debe imprimirse y completarse a mano utilizando los datos y mapas de las páginas de consulta de Internet. # País 1 Afghanistán 2 Angola 3 Arabia Saudita 4 Argelia 5 Argentina 6 Armenia 7 Australia 8 Austria 9 Bahamas Tres Países Vecinos Productos Químicamente Relacionados Esperanza de Vida 241 10 Bahrein 11 Bangladesh 12 Barbados 13 Bélgica 14 Belice 15 Bermuda 16 Botswana 17 Brasil 18 Brunei 19 Burkina Faso 20 Burundi 242 21 Bután 22 Camboya 23 Camerún 24 Canadá 25 Chile 26 China (República Popular) 27 Chipre 28 Colombia 29 Congo 30 Corea del Norte 31 Corea del Sur 243 32 Costa Rica 33 Croacia 34 Cuba 35 Dinamarca 36 Djiboutí 37 Ecuador 38 Egipto 39 Emiratos Árabes Unidos 40 Eslovenia 41 España 42 Estados Unidos de América 244 43 Estonia 44 Fiji 45 Filipinas 46 Finlandia 47 Francia 48 Gabón 49 Gran Bretaña 50 Grecia 51 Guatemala 52 Guinea 53 Guinea Ecuatorial 245 54 Guinea-Bissau 55 Guyana 56 Haití 57 Honduras 58 Hong Kong 59 Hungría 60 India 61 Indonesia 62 Irán 63 Iraq 64 Irlanda 246 65 Islandia 66 Islas Salomón 67 Islas Vírgenes Británicas 68 Israel 69 Italia 70 Jamaica 71 Japón 72 Kazajastán 73 Kenia 74 Kirguizstán 75 Kuwait 247 76 Líbano 77 Libia 78 Macedonia 79 Madagascar 80 Malasia 81 Malí 82 México 83 Micronesia 84 Mongolia 85 Nicaragua 86 Níger 248 87 Nigeria 88 Noruega 89 Nueva Zelanda 90 Panamá 91 Papua Nueva Guinea 92 Paquistán 93 Perú 94 Qatar 95 República Central Africana 96 República Checa 249 97 República Dominicana 98 Rumania 99 Rusia 100 Rwanda 101 Samoa 102 Senegal 103 Serbia y Montenegro 104 Sierra Leona 105 Singapur 106 Siria 107 Somalia 250 108 Sri Lanka 109 Sudáfrica 110 Sudán 111 Suecia 112 Swazilandia 113 Taiwán 114 Timor-Este 115 Togo 116 Tonga 117 Turcas y Caicos 118 Turkmenistán 251 119 Turquía 120 Ucrania 121 Uganda 122 Uruguay 123 Uzbekistán 124 Venezuela 125 Viet Nam 126 Yemen 127 Zimbawe 252