PM-TEB Agosto 2015
Anuncio

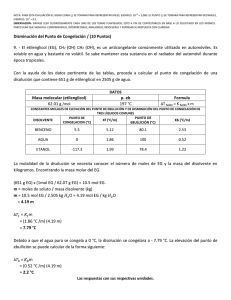
DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN OBJETIVO El alumno determinará la masa molecular de un compuesto puro, por elevación del punto de ebullición de una disolución con etanol. CONSIDERACIONES TEÓRICAS Las soluciones diluidas presentan algunas propiedades que no dependen de la naturaleza de los solutos, sino del número total de partículas (iones o moléculas) disueltas. Estas propiedades se denominan coligativas y son: a) el descenso en la presión de vapor, b) el descenso en el punto de congelación, c) el aumento en el punto de ebullición y d) la presión osmótica. El descenso en la presión de vapor (respecto del disolvente puro), debido a la presencia de un soluto no volátil en el disolvente, se comprende fácilmente si se considera que el disolvente sigue la Ley de Raoult (lo cual es normal en disoluciones diluidas). (1) Donde P es la presión de vapor del disolvente en la disolución, es la presión de vapor del disolvente puro y x la fracción molar del disolvente en la disolución. Si el soluto es no volátil, la presión de vapor de la disolución será la misma que la del disolvente, y como x 1, se tendrá por la ecuación (1) que , lo que explica la disminución de la presión de vapor del disolvente por el soluto disuelto. Los cambios en los puntos de congelación y ebullición de un solvente puro debido a que tiene disuelto un soluto no volátil, pueden comprenderse mejor a partir del diagrama de fases de un disolvente puro (H2O) y de su disolución, como se observa en la Figura 1. En estos diagramas se muestran todos los posibles equilibrios entre las fases que se pueden presentar a diferentes presiones. Las tres líneas representan los puntos de estado de los equilibrios de fases; líquidovapor, líquido-sólido y sólido-vapor. La línea curva que se forma entre la región del líquido y el gas representa el equilibrio de fases líquido-vapor. Como se muestra en el gráfico, el punto formado por la presión de 1 atm y la temperatura de 100 °C corresponde al punto de ebullición normal del agua pura (línea continua). Si existe un soluto no volátil disuelto en el agua, entonces la presión de vapor de la disolución será ahora menor que la del disolvente puro a cualquier temperatura, como se muestra en la línea punteada. A 100 °C la presión de vapor de la disolución es menor a 1 atm y por lo tanto no hervirá a 100 °C, es necesario aumentar la temperatura hasta Te para que la disolución hierva a 1 atm. Esto explica el aumento en el punto de ebullición del disolvente puro debido al soluto disuelto. 1 Figura 1. Diagrama de fases del agua (línea continua) y de una disolución acuosa (línea discontinua). Para una disolución líquida en equilibrio con su vapor (disolvente puro), se sabe que los potenciales químicos del disolvente en ambas fases, son iguales: µ(T,p,x ) = µvap (T,p) (2) donde µ es el potencial químico del disolvente en la disolución líquida y µvap es el potencial químico del disolvente en el vapor. La forma explícita del potencial químico con la concentración de la disolución, se expresa como: µº(T,p) + RT ln x = µvap (T,p) (3) En donde x es la fracción molar del disolvente en la disolución. Despejando el ln x de la ecuación (3), se tiene o vap o Gvap ( T , p ) ln x RT (4) RT Para observar los cambios de la temperatura de ebullición con cualquier valor de la concentración se deriva la ecuación (4) con respecto de xa presión constante y posteriormente se integra, de tal procedimiento se puede obtener: ln x H vap 1 R 1 To T (5) donde Hvap es la entalpía molar de vaporización del disolvente, To la temperatura de ebullición del disolvente puro en grados Kelvin, T la temperatura de ebullición de la disolución en grados Kelvin y R la constante universal de los gases. 2 Ahora bien, para evaluar los cambios en la temperatura de ebullición con los cambios de concentración (molalidad) para disoluciones diluidas, se deriva la ecuación (4) con respecto de la fracción molar (x) a presión constante, se cambia la concentración de fracción molar a molal y se considera que la concentración de la disolución tiende a cero. La siguiente expresión se obtuvo de ese procedimiento matemático: MRT o2 T K b m p , m 0 H vap donde Kb es la constante ebulloscópica o constante de aumento de la temperatura de ebullición, M es la masa molecular del disolvente puro y m es la molalidad de la disolución. Si el aumento en la temperatura de ebullición es θb = T - To, el dθb = dT, el cual es reemplazado en la ecuación anterior, lo que genera: (6) Kb m p , m 0 integrando la ecuación (6) para disoluciones diluidas, se obtiene: θb = Kb m (7) En la determinación de masas moleculares por aumento en la temperatura de ebullición, se mide experimentalmente el aumento en el punto de ebullición θb y por la ecuación (7) se calcula la molalidad de la disolución, la cual sirve para calcular la masa molecular del soluto si se conocen las masas de soluto y disolvente empleadas al formar la disolución. En esta práctica, para la determinación de la masa molecular de un compuesto se requiere obtener el punto de ebullición del etanol puro y el de una disolución del compuesto en etanol. El soluto puede ser urea, ácido benzoico, ácido salicílico, etc. GUÍA DE ESTUDIOS 1. ¿Qué son las propiedades coligativas? 2. ¿Cuáles son las propiedades coligativas? 3. ¿Por qué aumenta el punto de ebullición de un solvente cuando contiene disuelto un soluto no volátil? 4. ¿Cómo determinaría experimentalmente la constante ebulloscópica del etanol? 5. ¿Cuál es la relación funcional existente entre la constante ebulloscópica y la entalpía de vaporización de un solvente?, ¿Cómo depende ésta constante con la entalpía antes mencionada? 3 6. Calcule los gramos de ácido salicílico necesarios para obtener una disolución 2 molal a 25 ºC, utilizando como solvente 10 mL de etanol absoluto. Repita el cálculo para el ácido benzóico. 7. Investigue en la referencia bibliográfica la constante ebulloscópica del etanol y calcule el aumento en el punto de ebullición esperado para una disolución 2 molal. Reporte este resultado con dos cifras significativas, ¿Qué resolución debe tener el termómetro que recomendaría utilizar para medir el aumento del punto de ebullición? 8. Mencione tres aplicaciones en donde se presentan las propiedades coligativas MATERIAL Barra de agitación (1), cerillos o encendedor (1), espátula (1), mechero (1), placa de calentamiento con agitación (1), pipeta volumétrica de 10 mL (2), pipeteador (1), tapón de hule del No. 4 bihoradado (1), termómetro de 0 °C a 110 °C (2), termómetro de 60 °C a 90 °C con divisiones de 0.1 °C (1), tubo capilar (1), tubo de ensaye de 150 mm x 23 mm (3), tubo de vidrio de 50 cm de largo y 3 mm de diámetro (1), vaso de precipitado de 600 mL (1), vaso de precipitado de 50 mL (1). REACTIVOS Etanol absoluto, sustancia en estudio. PROCEDIMIENTO 1. En el vaso de 600 mL, prepare un baño maría a 80 °C y mantenga constante esa temperatura durante todo el experimento. 2. Con la flama de un mechero, selle un tubo capilar por uno de sus extremos. 3. En el tubo de ensaye vierta 10 mL de etanol absoluto medidos con pipeta volumétrica. 4. Introduzca el tubo capilar previamente sellado con la parte abierta hacia abajo. El capilar sirve de manómetro indicador del instante en que se igualan la presión de vapor del líquido y la presión atmosférica. 5. Tape el tubo de ensaye con el tapón bihoradado que tiene el termómetro de 60 °C a 90 °C con divisiones de 0.1 °C y el tubo de vidrio. Debe introducir el bulbo del termómetro dentro del etanol y el tubo de vidrio debe quedar como 14 cm arriba del nivel del etanol. 6. Fije con unas pinzas el tubo de ensaye dentro del baño maría de tal manera que el nivel del etanol coincida con el nivel del agua. 4 7. Anote la temperatura de ebullición del etanol cuando esta permanezca constante y se forme una columna de burbujas desde el capilar (la presión atmosférica y la presión de vapor del líquido se igualan a la temperatura que indica el termómetro sumergido en el etanol, y que corresponde a su punto de ebullición). 8. Saque el tubo de ensaye del baño maría y deje enfriar por unos minutos. 9. Pese en la balanza analítica la cantidad de sustancia problema necesario para obtener una disolución 2 molal, anotando el peso exacto. 10. Remueva cuidadosamente el tapón del tubo de ensaye y añada la sustancia problema, tape y agite ligeramente para que se disuelva totalmente el soluto. (Si se considera necesario, se puede introducir otro tubo capilar como se indica en el punto 4) 11. Regrese el tubo de ensaye al baño maría de acuerdo a lo descrito en el punto 6. 12. Repita el paso 7 para la disolución formada. 13. Lea y anote la presión atmosférica y la temperatura ambiente. 14. Recolecte el residuo obtenido del experimento en un contenedor debidamente rotulado. NOTA: Maneje con cuidado el etanol, ya que es flamable. 5