Postulados de la Mecánica Cuántica
Anuncio
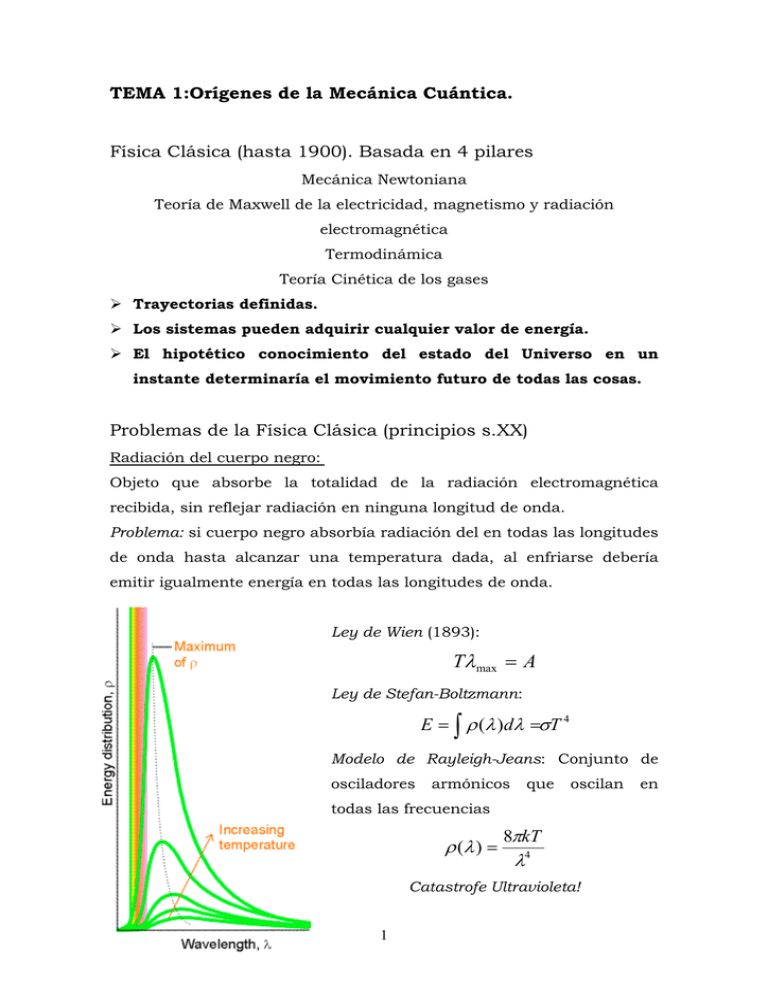
TEMA 1:Orígenes de la Mecánica Cuántica. Física Clásica (hasta 1900). Basada en 4 pilares Mecánica Newtoniana Teoría de Maxwell de la electricidad, magnetismo y radiación electromagnética Termodinámica Teoría Cinética de los gases ¾ Trayectorias definidas. ¾ Los sistemas pueden adquirir cualquier valor de energía. ¾ El hipotético conocimiento del estado del Universo en un instante determinaría el movimiento futuro de todas las cosas. Problemas de la Física Clásica (principios s.XX) Radiación del cuerpo negro: Objeto que absorbe la totalidad de la radiación electromagnética recibida, sin reflejar radiación en ninguna longitud de onda. Problema: si cuerpo negro absorbía radiación del en todas las longitudes de onda hasta alcanzar una temperatura dada, al enfriarse debería emitir igualmente energía en todas las longitudes de onda. Ley de Wien (1893): Tλ max = A Ley de Stefan-Boltzmann: E = ∫ ρ (λ )dλ =σT 4 Modelo de Rayleigh-Jeans: Conjunto de osciladores armónicos que oscilan todas las frecuencias ρ (λ ) = 8πkT λ4 Catastrofe Ultravioleta! 1 en Efecto fotoeléctrico (Lenard, 1902) Al exponer ciertos metales a la radiación electromagnética se producía la emisión de electrones desde la superficie metálica. • Al disminuir la longitud de onda de la radiación se incrementaba la energía cinética de los electrones. • Un aumento en la intensidad de la radiación provocaba la expulsión de más electrones. Teoría atómica. Espectros atómicos y moleculares El espectro del átomo de hidrógeno contiene únicamente determinadas frecuencias. Ley empírica de Rydberg (1890): ν = 1 1 = RH 2 − 2 λ n1 n2 c Constante de Rydberg para el átomo de H RH = 109677 cm-1 n1 = 1 ⇒ Serie de Lyman. n1 = 2 ⇒ Serie de Balmer. n1 = 3 ⇒ Serie de Paschen En general Cuando un átomo o molécula cambia su estado absorbiendo/emitiendo radiación de frecuencias definidas. 2 lo hace Primeros éxitos de la Teoría cuántica Hipótesis de Planck (1901) Las partículas de materia no emiten y absorben radiación electromagnética (luz) de manera continua sino solo en cantidades discretas hν proporcionales a la frecuencia de la luz emitida/absorbida. Constante de Planck: h = 6.626·10-34 J·s Correcta descripción de la radiación del cuerpo negro. Explica leyes de Wien y Stephan-Boltzmann. Efecto Fotoeléctrico. Einstein (1905) Aplicación de las ideas de Planck a la radiación electromagnética. 1 hν = Φ + mv 2 2 Parte de la energía que es absorbida por el electrón se utiliza para superar las fuerzas que lo mantiene unido al metal (función trabajo, Φ) y el resto se transforma en energía cinética del electrón emitido. Capacidad calorífica de sólidos a bajas temperaturas: Einstein (1905) Termodinámicamente para sólidos se tiene monoatómicos que que oscilan en tres direcciones del espacio Cv = 3R Pero a temperaturas bajas Cv tiende a cero! Einstein restringe la oscilación de los átomos a ciertas frecuencias que cumplen la hipótesis de Planck. 3 Átomo de Bohr (1913). Postulados: • Existen estados estacionarios con energías definidas. Las transiciones entre dos estados (E1 y E2) están acompañadas por la emisión o absorción de energía radiante equivalente a la diferencia de energía entre ambos estados ∆E = E2 - E1. • La frecuencia de la radiación emitida/absorbida es ν = ∆E . Las h partículas emitidas/absorbidas reciben el nombre de fotones. • Los estados posibles para el átomo de hidrogeno son aquellos en que el momento angular asociado a las órbitas circulares de los electrones sean múltiplos enteros de h =h 2π Explica las formulas empíricas de Balmer, Lyman, Paschen, etc... que reproducían el espectro del átomo hidrogeno. La teoría constante predice de que Rydberg la para átomos hidrogenoides tiene la forma: Z 2e4 µ z RZ = 2 3 8ε 0 h c 1 µz 4 = , donde 1 1 + me mz Hipótesis de de Broglie (1924): Dualidad Onda-corpusculo E = mc 2 h h ⇒ λ particula = ⇒ λ foton = mc mv E = hν Comportamiento corpuscular: • Descubrimiento de los rayos catódicos por J. J. Thompson (1897). Premio Nobel. • Efecto Compton (1923): (Colisión entre fotón y electrón) Comportamiento ondulatorio: • Comprobado experimentalmente por G. P. Thompson (su hijo!) con su experimento de difracción de electrones (1925). Premio Nobel tambien! Principio de Incertidumbre (W. Heisenberg 1927) Es imposible determinar simultáneamente y con precisión arbitraria la posición y el momento de una partícula. Cuantitativamente ∆p x ∆x ≥ h 2 La naturaleza dual de las partículas limita las posibilidades de medir su posición y momento. Para concluir... La magnitud de la constante de Planck implica que los efectos cuánticos sólo son significativos a nivel microscópico. Sin embargo, éstos efectos son esenciales para describir, entre otros aspectos, la estructura atómica y el enlace químico, que a su vez determinan las propiedades macroscópicas de la materia. 5 Mecánica cuántica moderna Dos formulaciones contemporáneas equivalentes. Heisenberg, Born (1925): Mecánica matricial: Schrödinger (1926): Mecánica Ondulatoria. En lugar de buscar ecuaciones que describieran exactamente la posición y velocidad de las partículas de un sistema, Schrödinger, inspirado por los pensamientos de De Broglie, introducía una función de las coordenadas de las partículas del sistema y el tiempo (función de onda) que representan el estado del sistema y a partir de la cual se podía obtener las probabilidades de los distintos resultados posibles. Por tanto, ello suponía renunciar a describir exactamente el comportamiento de un sistema. Schrödinger planteaba una ecuación de onda, apoyada en una serie de postulados, cuyas únicas soluciones posibles eran precisamente las funciones de onda del sistema y en las que los numeras cuánticos aparecían como parámetros. El planteamiento matemático riguroso de Schrödinger conduce de forma directa a la cuantización, una condición que Planck había impuesto inicialmente de forma resultado experimental. 6 arbitraria para explicar un