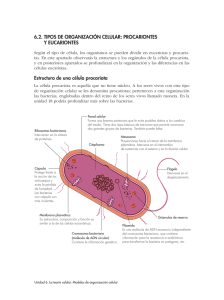
Estrucutura y función de la célula procariota
Anuncio

Microbiología quinta edición LANSING M. PRESCOTT Augustana College JOHN P. HARLEY Eastern Kentucky University DONALD A. KLEIN Colorado State University Traducción Carlos Gamazo de la Rasilla Universidad de Navarra Íñigo Lasa Uzcudum Universidad Pública de Navarra MADRID • BUENOS AIRES • CARACAS • GUATEMALA • LISBOA • MÉXICO NUEVA YORK • PANAMÁ • SAN JUAN • SANTAFE DE BOGOTÁ • SANTIAGO • SÃO PAULO AUCKLAND • HAMBURGO • LONDRES • MILÁN • MONTREAL • NUEVA DELHI • PARÍS SAN FRANCISCO • SYDNEY • SINGAPUR • ST. LOUIS • TOKIO • TORONTO CONTENIDO PARTE I Introducción a la microbiología 1 Historia y ámbito de la microbiología 1 2 Estudio de la estructura microbiana: microscopía y preparación de muestras 18 3 Estructura y función de la célula procariota 43 4 Estructura y función de la célula eucariota 78 PARTE II Nutrición, crecimiento y control microbiano 5 Nutrición microbiana 99 6 Crecimiento microbiano 118 7 Control de microorganismos por agentes físicos y químicos 145 PARTE III Metabolismo microbiano 8 Metabolismo: energía, enzimas y regulación 163 9 Metabolismo: liberación y conservación de la energía 184 10 Metabolismo: uso de la energía en la biosíntesis 219 PARTE IV Biología molecular y genética microbiana 11 Genes: estructura, replicación y mutación 243 12 Genes: expresión y regulación 279 13 Recombinación microbiana y plásmidos 313 PARTE V Tecnología del DNA y genómica 14 Tecnología del DNA recombinante 343 15 Genómica microbiana 371 PARTE VI 26 Algas 614 27 Protozoos 628 PARTE VIII Ecología y simbiosis 28 Interacciones microbianas y ecología microbiana 641 29 Microorganismos en ambientes acuáticos 682 30 Microorganismos en ambientes terrestres 719 PARTE IX Respuesta inmunitaria y resistencia inespecífica del huésped 31 Microbiota normal y resistencia inespecífica del huésped 751 32 Inmunidad específica 785 33 Inmunología médica 822 PARTE X Enfermedades microbianas y su control 34 35 36 37 38 39 40 Patogenicidad de los microorganismos 849 Quimioterapia antimicrobiana 869 Microbiología clínica 892 Epidemiología de las enfermedades infecciosas 915 Enfermedades humanas causadas por virus 941 Enfermedades humanas causadas por bacterias 973 Enfermedades humanas causadas por hongos y protozoos 1021 PARTE XI Microbiología de los alimentos e industrial 41 Microbiología de los alimentos 1043 42 Microbiología industrial y biotecnología 1075 Los virus 16 Los virus: introducción y características generales 389 17 Los virus: bacteriófagos 411 18 Los virus: virus de eucariotas 429 PARTE VII ABREVIADO La diversidad del mundo microbiano 19 Taxonomía microbiana 455 20 Archaea 487 21 Bacterias: deinococos y Gram negativas no proteobacterias 504 22 Bacterias: las proteobacterias 525 23 Bacterias: Gram positivas con bajo contenido en G + C 558 24 Bacterias: Gram positivas con alto contenido en G + C 578 25 Hongos (Eumycota), mohos mucosos y mohos acuáticos 595 APÉNDICES Apéndice I Revisión de la química de las moléculas biológicas 1113 Apéndice II Rutas metabólicas comunes 1125 Apéndice III Clasificación de procariotas de acuerdo con la primera edición del Bergey’s Manual of Systematic Bacteriology 1135 Apéndice IV Clasificación de procariotas de acuerdo con la segunda edición del Bergey’s Manual of Systematic Bacteriology 1140 Apéndice V Clasificación de los virus 1149 Glosario 1155 Créditos 1189 Índice 1195 vii PREFACIO Los libros son los portadores de la civilización. Sin libros, la historia calla, la literatura, enmudece, la ciencia se paraliza, y el pensamiento y la especulación se detienen. Ellos son motores del cambio, ventanas al mundo, faros que se alzan en el mar del tiempo. Barbara Tuchman a microbiología es una disciplina extraordinariamente amplia, que abarca especialidades tan diversas como la bioquímica, la biología celular, la genética, la taxonomía, la bacteriología de patógenos, la microbiología industrial y de los alimentos, y la ecología. Un microbiólogo debe estar familiarizado con muchas disciplinas biológicas y con los principales grupos de microorganismos: virus, bacterias, hongos, algas y protozoos. El equilibrio es la clave. Los estudiantes ajenos al tema necesitan una introducción al conjunto antes de concentrarse en aquellas partes que más les interesen. Este libro aporta una introducción a las áreas más importantes de la microbiología, adecuada para estudiantes de diversa procedencia. Gracias a esta adecuación, el texto se adapta a asignaturas con una orientación que puede variar desde la microbiología básica hasta la microbiología médica y aplicada. No sólo será útil para estudiantes de medicina, odontología, enfermería y otras ciencias de la salud, sino también para aquellos que se dedican a la investigación, la docencia y la industria. Se dan por superados dos cuatrimestres/semestres para biología y otros dos para química, y el Apéndice I aporta además unas nociones esenciales de química. L Organización y enfoque El libro está organizado de manera flexible, para que los capítulos y temas puedan colocarse casi en cualquier orden. Se ha hecho lo más autosuficiente posible cada capítulo para facilitar esta flexibilidad. Algunos temas esenciales en microbiología han recibido un tratamiento más extenso. El libro está dividido en 11 partes. Las seis primeras introducen los fundamentos de la microbiología, la estructura de los microorganismos, el crecimiento microbiano y su control, el metabolismo, la biología y la genética moleculares, la tecnología del DNA y la genómica, y la naturaleza de los virus. La Parte VII constituye un estudio del mundo microbiano. En la quinta edición, el estudio de las bacterias sigue de cerca la organización general de la segunda edición del Manual Bergey de sistemática bacteriana (Bergey’s Manual of Systematic Bacteriology). Aunque se dedica mayor atención a las bacterias, los eucariotas reciben también considerable cobertura. Hongos, algas y protozoos son importantes por derecho propio. La introducción a su biología en los Capítulos 25-27 es esencial para comprender temas tan diversos como la microbiología clínica y la ecología microbiana. La Parte VIII se centra en las relaciones de los microorganismos con otros seres vivos y con su entorno (ecología microbiana). Introduce además la microbiología acuática y terrestre. El Capítulo 28 presenta los principios generales subyacentes a la ecología microbiana y la microbiología ambiental y con ello evita redundancias en los capítulos siguientes sobre el hábitat acuático y el terrestre. El capítulo describe además diversos tipos de interacciones microbianas que se producen en el medio ambiente, como el mutualismo, la protocooperación, el comensalismo y la predación. Las Partes IX y X están relacionadas con el potencial patógeno, la resistencia y la enfermedad. Los tres capítulos de la Parte IX describen la microbiota normal, la resistencia inespecífica del huésped, los principales aspectos de la respuesta inmunitaria y la inmunología médica. La Parte X empieza abordando temas esenciales como el potencial patógeno, la quimioterapia antimicrobiana y la epidemiología. Los Capítulos 38-40 estudian después las enfermedades microbianas más importantes en el ser humano. La separación de enfermedades por capítulos sigue un esquema básicamente taxonómico; mientras que dentro de cada capítulo, se han agrupado por modo de transmisión. Este enfoque aporta flexibilidad y permite al estudiante un fácil acceso a la información relativa a cualquier enfermedad que busque. No se trata de un simple catálogo de enfermedades, sino que éstas se incluyen en función de su importancia médica y su capacidad para ilustrar los principios básicos de la enfermedad y la resistencia. La Parte XI concluye este tratado con una introducción a la microbiología industrial y de los alimentos. Cinco apéndices ayudan al estudiante a repasar algunos conceptos químicos básicos y aportan información extra sobre algunos temas importantes que el libro no llega a completar. El libro está pensado como una eficaz herramienta didáctica. En la medida de su facilidad de lectura, así se presta cualquier texto a que el estudiante lo utilice. Con este objetivo en mente, se ha recurrido a un estilo de redacción directo y relativamente sencillo, con muchos epígrafes de secciones y un guión que dirige cada capítulo. El nivel de dificultad se ha establecido con cautela, pensando en los lectores a los que va dirigido. Durante la preparación de la quinta edición, se ha comprobado cuidadosamente la claridad de cada frase, y se ha revisado en caso necesario. Se han seguido en la medida de lo posible los acuerdos de nomenxix xx Prefacio clatura y abreviaturas del ASM Style Manual de la American Society for Microbiology. Los numerosos términos nuevos que se encuentran en el estudio de la microbiología representan un escollo enorme para los estudiantes. Este texto reduce el problema reforzando el aprendizaje de vocabulario de tres modos: 1) no emplea ningún término nuevo sin haberlo definido claramente (a veces se aportan también palabras derivadas), es decir, el estudiante no necesita un conocimiento previo de términos microbiológicos para poder utilizar el libro; 2) los términos más importantes están impresos en negrita cuando aparecen por vez primera; y 3) al final se incluye un glosario extenso y actualizado, con referencias de paginación. Como las ilustraciones son fundamentales para aprender y disfrutar de la microbiología, todas ellas son a color, y se han utilizado numerosas fotografías excelentes también a todo color. Con ello no sólo se realza el atractivo del texto, también la eficacia didáctica de cada figura, y por tanto se ha invertido considerable esfuerzo en los dibujos. Gran parte de los dibujos utilizados en la cuarta edición ha sido retocada y mejorada para su empleo en esta quinta edición. Los dibujos nuevos se han realizado bajo la supervisión directa de un editor artístico y de los autores, en la idea de ilustrar y reforzar determinados puntos del texto. En consecuencia, cada ilustración guarda relación directa con los párrafos a los que acompaña, y se cita específicamente allí donde procede. Se ha tenido un exquisito cuidado en situar las ilustraciones lo más cerca posible del lugar donde se citan, y se ha revisado la exactitud y la claridad de cada figura y de su pie correspondiente. Temas en el libro Al menos siete temas dirigen el curso de la obra, aunque alguno de ellos pueda ser más evidente que los otros en ciertos puntos. Estos temas son los siguientes: 1. El desarrollo de la microbiología como ciencia. 2. La naturaleza e importancia de las técnicas empleadas para aislar, cultivar, observar e identificar los microorganismos. 3. El control de los microorganismos y la reducción de sus efectos perjudiciales. 4. La importancia de la biología molecular para la microbiología. 5. La importancia médica de la microbiología. 6. Las distintas maneras en que los microorganismos interactúan con su entorno y las consecuencias prácticas de estas interacciones. 7. Las influencias de los microorganismos y las aplicaciones de la microbiología en la vida cotidiana. Estos temas contribuyen a la unificación y refuerzan la continuidad del texto. El estudiante llegará a encariñarse con la actividad de los microbiólogos y su repercusión en la sociedad. Novedades que aporta la quinta edición En la quinta edición se han efectuado muchos cambios y mejoras sustanciales, entre ellos: 1. Se ha modificado la organización general del texto para ofrecer un flujo más lógico de los temas y poner un mayor énfasis en la ecología microbiana. La síntesis de ácidos nucleicos y de proteínas se ha trasladado a los capítulos de genética para integrar la discusión de la estructura de los genes, su replicación, expresión y regulación. La tecnología del DNA recombinante constituye ahora una sección aparte que contiene además un capítulo sobre genómica microbiana. Los tres capítulos de introducción a la ecología microbiana se colocan ahora después del estudio de la diversidad microbiana, acercándose así ésta a la parte en que se presentan los principios básicos de la microbiología. La Parte IX contiene ahora una descripción de la resistencia inespecífica del huésped, así como una introducción a los fundamentos de la inmunología. Se discuten las asociaciones simbióticas en el contexto de la ecología microbiana. Se dedica un capítulo completo a la patogenia microbiana, agrupado con otros aspectos de índole médica en la Parte X. 2. Asimismo se han ampliado las herramientas pedagógicas. Una nueva sección con dos o más Cuestiones para reflexionar sigue a la sección de Preguntas para razonar y repasar. Se han numerado las principales secciones de cada capítulo para incrementar la precisión de las referencias cruzadas. El resumen contiene referencias en negrita a tablas y figuras que servirán para el repaso del capítulo. 3. Se han añadido ilustraciones nuevas a prácticamente todos los capítulos. Además, nuestro editor artístico ha revisado minuciosamente cada figura, y retocado muchas para mejorar su aspecto y su utilidad. 4. Se han revisado y actualizado todas las secciones de referencias bibliográficas. Además de estos cambios generales en el texto, se han actualizado todos los capítulos, algunos de ellos con modificaciones sustanciales. Algunas de las principales mejoras son las siguientes: Capítulo 1. Se han añadido un recuadro con los postulados de Koch y una nueva sección sobre el futuro de la microbiología. Capítulo 2. Se describen las técnicas de microscopía de contraste de interferencia diferencial y microscopía confocal. Capítulo 3. Se aportan más detalles sobre el mecanismo de movilidad flagelar. Capítulo 5. Se describen la captación de fosfatos y los transportadores ABC. Prefacio Capítulo 6. Contiene información nueva sobre las proteínas de la inanición, la limitación del crecimiento por factores ambientales, los procariotas viables pero no cultivables y la autoinducción (quorum sensing). Capítulo 8. Se han combinado las descripciones de regulación metabólica y control de la actividad enzimática con la introducción a la energía y a las enzimas. Capítulo 9. Se ha reescrito la descripción general del metabolismo para facilitar su comprensión, y se han actualizado y ampliado las secciones sobre transporte de electrones, fosforilación oxidativa y respiración anaerobia. Capítulo 11. Este capítulo se centra en la estructura de los ácidos nucleicos y de los genes, las mutaciones y la reparación del DNA. Se ha añadido información nueva sobre metilación del DNA. Capítulo 12. Se ha trasladado aquí la información sobre expresión génica (transcripción y síntesis proteica), combinada con una extensa discusión sobre la regulación de la misma. Se han añadido secciones nuevas, sobre sistemas de regulación global y sistemas de fosfotransferencia de dos componentes. Capítulo 15. Capítulo nuevo que aporta una breve introducción a la genómica microbiana, incluyendo comentarios sobre secuenciación del genoma, bioinformática, características generales de los genomas microbianos y genómica funcional. Capítulo 18. Se ha actualizado la taxonomía de los virus y se han añadido esquemas de ciclos vitales. Capítulo 19. Se ha añadido material sobre taxonomía polifásica y los efectos de la transferencia génica horizontal sobre los árboles filogenéticos. Se ha revisado y actualizado la introducción a la segunda edición del Manual Bergey. Capítulos 20-24. Se han revisado a fondo los capítulos de estudio de procariotas para adaptarlos a la segunda edición del Manual Bergey. Capítulo 28. Este capítulo, antaño el 40, ha sido reescrito en gran parte para abordar el tema de la simbiosis y las interacciones microbianas (mutualismo, protocooperación, comensalismo, predación, competición, etc.). Se ha añadido un apartado sobre desplazamiento microbiano entre ecosistemas, y se ha ampliado la discusión sobre biofilms y tapetes microbianos. Capítulo 29. El capítulo sobre microorganismos en el medio acuático incluye información nueva sobre temas como los flujos de oxígeno en el agua, el bucle microbiano, Thiomargarita namibiensis, microorganismos en agua dulce y estándares para el agua corriente potable. Capítulo 30. Trata de los microorganismos sobre suelos de zonas frías y húmedas, suelos de desiertos y suelos geotérmicos hipertermales. Se describen con mayor extensión los efectos del nitrógeno, el fósforo y los xxi gases atmosféricos sobre las plantas y el suelo. Existe una sección nueva sobre la biosfera del subsuelo. Capítulo 31. El capítulo se ha reorganizado y describe la microbiota normal y la resistencia inespecífica. Se han incluido descripciones de la resistencia del huésped, y de las células, tejidos y órganos que componen el sistema inmunitario, así como una introducción a las vías del complemento alternativa y de la lectina. Se presenta también un resumen de las propiedades y funciones de las citoquinas. Capítulo 32. Se han traído a este capítulo todos los aspectos de la inmunidad específica en aras de la claridad y la coherencia. El capítulo contiene una visión general de la inmunidad específica, una discusión sobre antígenos y anticuerpos y la acción de estos últimos, la biología de las células T y de las células B, la vía clásica del complemento y una sección sobre tolerancia inmunitaria adquirida. Finaliza con un resumen del papel de los anticuerpos y los linfocitos en la resistencia. Capítulo 33. Capítulo nuevo sobre inmunología médica que contiene aspectos prácticos directamente relacionados con la salud y la microbiología clínica: vacunas e inmunizaciones, trastornos inmunitarios e interacciones antígeno-anticuerpo in vitro, que previamente aparecían dispersos en tres capítulos. La sección sobre vacunas se ha ampliado notablemente. Capítulo 34. Se ha extendido la descripción de la patogenicidad microbiana hasta constituir un capítulo aparte. Se han ampliado o añadido varios temas: regulación de los factores de virulencia bacterianos e islas de patogenicidad, mecanismos de acción de exotoxinas y mecanismos microbianos para escapar de las defensas del huésped. Capítulo 37. En el capítulo de epidemiología se ha ampliado la discusión sobre las enfermedades emergentes y se han añadido secciones nuevas sobre bioterrorismo y los efectos sobre la salud de los viajes por el mundo. Capítulos 38-40. Se han actualizado los capítulos dedicados al estudio de las enfermedades, y las enfermedades bacterianas se agrupan ahora en un solo capítulo. Se ha añadido información nueva sobre herpes genital, listeriosis, empleo terapéutico de las toxinas de clostridios y otros temas. Se aporta una tabla nueva que describe las enfermedades de transmisión sexual más habituales y su tratamiento. Capítulo 41. La novedades relativas a microbiología de los alimentos incluyen el empaquetado en atmósfera modificada, las toxinas de las algas, las bacteriocinas como conservantes, la nueva variante de la enfermedad de Creutzfeldt-Jakob, la intoxicación alimentaria por alimentos crudos, las nuevas técnicas para el estudio de brotes de enfermedades relacionadas con los alimentos y el empleo de probióticos en la dieta. xxii Prefacio Capítulo 42. Se ha revisado el capítulo sobre microbiología industrial y biotecnología para incluir los últimos avances debidos a las nuevas técnicas moleculares. Se ha añadido una sección sobre desarrollo y selección de microorganismos para uso industrial. Se han añadido o revisado de forma importante temas como la síntesis de productos de aplicación médica, la biodegradación de pesticidas y otros contaminantes, la adición de microorganismos al medio ambiente y el empleo de la tecnología de micromatrices (microarrays). Las ayudas pedagógicas para el estudiante son inestimables. La más importante es la precisión, pero si el texto no es claro, fácil de leer y atractivo, su actualización y su precisión son gasto inútil porque el estudiante no lo leerá. Los estudiantes deben ser capaces de comprender el material que se les presenta, de utilizar eficazmente el texto como instrumento de aprendizaje, y de disfrutar con su lectura. Con fines de eficacia didáctica, un texto debe presentar la ciencia microbiológica con claridad. Para ello se ha recurrido a ciertas ayudas que facilitan las tareas de enseñanza y aprendizaje. A continuación del Prefacio, la sección especial dirigida al estudiante revisa los principios de un aprendizaje eficaz, entre ellos la técnica de estudio SQ4R: estudio (survey), preguntas (question) y las 4 R de lectura (read), repaso (revise), registro (record) y revisión (review). Las ayudas recogidas en cada capítulo se describen en la sección de Visita guiada. Además, el texto contiene un glosario, un índice y cinco apéndices. El extenso glosario define los términos más importantes de cada capítulo e incluye referencias de paginación. La mayor parte de las definiciones no se ha tomado directamente del texto, sino que se ha escrito de nuevo para facilitar la comprensión del estudiante. Para facilitar la consulta y el acceso al contenido del texto, la quinta edición está dotada de un índice detallado y amplio. Los apéndices aportan información extra sobre principios químicos y rutas Los autores desean dar las gracias a los revisores que aportaron sus críticas y análisis detallados. Sus sugerencias han servido para mejorar enormemente el producto final. Revisores para la primera y la segunda ediciones Richard J. Alperin, Community College of Philadelphia Material complementario El siguiente material didáctico tan sólo está disponible en su versión inglesa. Ayudas para el estudiante Agradecimientos metabólicas, junto a un mayor detalle de la taxonomía de bacterias y virus. Para ayudar al estudiante en el terreno siempre cambiante de la taxonomía de procariotas, el apéndice III ofrece la clasificación de estos seres vivos siguiendo la primera edición del Bergey’s Manual of Systematic Bacteriology, mientras que el apéndice IV aporta la clasificación de la segunda edición del mismo manual. Para el estudiante 1. 2. 3. 4. 5. 6. Student Study Guide Interactive E-TEXT Microbes in Motion Hyperclinic Laboratory Exercises in Microbiology Microbiology Study Cards Para el profesor 1. 2. 3. 4. 5. 6. Testing CD Transparencies Visual Resource Library Projection Slides Customized Laboratory Manual PageOut, PageOut Lite y McGraw-Hill Course Solutions Recursos en la red Prescott 2002 Online Learning Center. Puede visitarse la dirección www.mhhe.com/prescott5 Susan T. Bagley, Michigan Technological University Dwight Baker, Yale University R. A. Bender, University of Michigan Hans P. Blaschek, University of Illinois Dennis Bryant, University of Illinois Douglas E. Caldwell, University of Saskatchewan Arnold L. Demain, Massachusetts Institute of Technology A. S. Dhaliwal, Loyola University of Chicago Donald P. Durand, Iowa State University John Hare, Linfield College Robert B. Helling, University of Michigan-Ann Arbor Barbara Bruff Hemmingsen, San Diego State University R. D. Hinsdill, University of WisconsinMadison John G. Holt, Michigan State University Robert L. Jones, Colorado State University Prefacio Martha M. Kory, University of Akron Robert I. Krasner, Providence College Ron W. Leavitt, Brigham Young University David Mardon, Eastern Kentucky University Glendon R. Miller, Wichita State University Richard L. Myers, Southwest Missouri State University G. A. O’Donovan, North Texas State University Pattle P. T. Pun, Wheaton College Ralph J. Rascati, Kennesaw State College Albert D. Robinson, SUNY-Potsdam Ronald Wayne Roncadori, University of Georgia-Athens Ivan Roth, University of GeorgiaAthens Thomas Santoro, SUNY-New Paltz Ann C. Smith, University of Maryland, College Park David W. Smith, University of Delaware Paul Smith, University of South Dakota James F. Steenbergen, San Diego State University Henry O. Stone, Jr., East Carolina University James E. Struble, North Dakota State University Kathleen Talaro, Pasadena City College Thomas M. Terry, The University of Connecticut Michael J. Timmons, Moraine Valley Community College John Tudor, St. Joseph’s University Robert Twarog, University of North Carolina Blake Whitaker, Bates College Oscar Will, Augustana College Calvin Young, California State University-Fullerton Revisores para la tercera y la cuarta ediciones Laurie A. Achenbach, Southern Illinois University Gary Armour, MacMurray College Russell C. Baskett, Germanna Community College George N. Bennett, Rice University Prakash H. Bhuta, Eastern Washington University James L. Botsford, New Mexico State University Alfred E. Brown, Auburn University Mary Burke, Oregon State University David P. Clark, Southern Illinois University William H. Coleman, University of Hartford Donald C. Cox, Miami University Phillip Cunningham, Wayne State University Richard P. Cunningham, SUNY at Albany James Daly, Purchase College, SUNY Frank B. Dazzo, Michigan State University Valdis A. Dzelzkalns, Case Western Reserve University Richard J. Ellis, Bucknell University Merrill Emmett, University of Colorado at Denver Linda E. Fisher, University of Michigan-Dearborn John Fitzgerald, University of Georgia Harold F. Foerster, Sam Houston State University B. G. Foster, Texas A&M University Bernard Frye, University of Texas at Arlington Katharine B. Gregg, West Virginia Wesleyan College Eileen Gregory, Rollins College Van H. Grosse, Columbus CollegeGeorgia Maria A. Guerrero, Florida International University Robert Gunsalus, UCLA Barbara B. Hemmingsen, San Diego State University Joan Henson, Montana State University William G. Hixon, St. Ambrose University John G. Holt, Michigan State University Ronald E. Hurlbert, Washington State University Robert J. Kearns, University of Dayton Henry Keil, Brunel University Tim Knight, Oachita Baptist University Robert Krasner, Providence College xxiii Michael J. Lemke, Kent State University Lynn O. Lewis, Mary Washington College B. T. Lingappa, College of the Holy Cross Vicky McKinley, Roosevelt University Billie Jo Mello, Mount Marty College James E. Miller, Delaware Valley College David A. Mullin, Tulane University Penelope J. Padgett, Shippensburg University Richard A. Patrick, Summit Editorial Group Bobbie Pettriess, Wichita State University Thomas Punnett, Temple University Jo Anne Quinlivan, Holy Names College K. J. Reddy, SUNY-Binghamton David C. Reff, Middle Georgia College Jackie S. Reynolds, Richland College Deborah Rochefort, Shepherd College Allen C. Rogerson, St. Lawrence University Michael J. San Francisco, Texas Tech University Phillip Scheverman, East Tennessee University Michael Shiaris, University of Massachusetts at Boston Carl Sillman, Penn State University Ann C. Smith, University of Maryland David W. Smith, University of Delaware Garriet W. Smith, University of South Carolina at Aiken John Stolz, Duquesne University Mary L. Taylor, Portland State University Thomas M. Terry, University of Connecticut Thomas M. Walker, University of Central Arkansas Patrick M. Weir, Felician College Jill M. Williams, University of Glamorgan Heman Witmer, University of Illinois at Chicago Elizabeth D. Wolfinger, Meredith College Robert Zdor, Andrews University xxiv Prefacio Revisores de la quinta edición Stephen Aley, University of Texas at El Paso Susan Bagley, Michigan Technological University Robert Benoit, Virginia Polytechnic Institute and State University Dennis Bazylinski, Iowa State University Richard Bernstein, San Francisco State University Paul Blum, University of Nebraska Matthew Buechner, University of Kansas Mary Burke, Oregon State University James Champine, Southeast Missouri State University John Clausz, Carroll College James Cooper, University of California at Santa Barbara Daniel DiMaio, Yale University Leanne Field, University of Texas Philip Johnson, Grande Prairie Regional College Duncan Krause, University of Georgia Diane Lavett, Georgia Institute of Technology Ed Leadbetter, University of Connecticut Donald Lehman, University of Delaware Mark Maloney, Spelman College Maura Meade-Callahan, Allegheny College Ruslan Medzhitov, Yale University School of Medicine Al Mikell, University of Mississippi Craig Moyer, Western Washington University Rita Moyes, Texas A&M University David Mullin, Tulane University Richard Myers, Southwest Missouri State University Anthony Newsome, Middle Tennessee State University Wade Nichols, Illinois State University La publicación de un libro de texto requiere el esfuerzo de muchas personas además de los autores. Queremos expresar un agradecimiento especial a la plantilla de editorial y producción de McGraw-Hill, por su excelente trabajo. En particular, queremos dar las gracias a Deborah Allen, la editora del proyecto, por su orientación, su paciencia, su estímulo y su apoyo. La coordinadora de nuestro proyecto, Vicki Krug, supervisó la producción de esta compleja tarea con atención y detalle encomiables. Liz Rudder, nuestra editora artística, trabajó arduamente en la revisión y la mejora de todas las ilustraciones de esta edición, tanto de las nuevas como de las procedentes de la edición anterior. Beatrice Sussman, revisora de pruebas desde la segunda hasta la cuarta edición, ha corregido otra vez aquí nuestros errores y contribuido inmensamente a la claridad, la coherencia y la facilidad de lectura del texto. Cada uno de nosotros desea extender su agradecimiento a aquellas personas que nos ayudaron a nivel individual en la marcha del trabajo. Lansing Prescott quiere dar las gracias a George M. Garrity, editor en jefe de la segunda edición del Ronald Porter, Pennsylvania State University Sabine Rech, San Jose State University Anna-Louise Reysenbach, Portland State University Thomas Schmidt, Michigan State University Linda Sherwood, Montana State University Michele Shuster, University of Pittsburgh Joan Slonczewski, Kenyon College Daniel Smith, Seattle University Kathleen C. Smith, Emory University James Snyder, University of Louisville School of Medicine William Staddon, Eastern Kentucky University John Stolz, DuQuesne University Thomas Terry, University of Connecticut James VandenBosch, Eastern Michigan University Bergey’s Manual, por su ayuda en la preparación de esta quinta edición. La revisión de la clasificación de procariotas no habría sido posible sin su ayuda. También queremos agradecer a Amy Cheng Vollmer su aportación de cuestiones para reflexionar a cada capítulo. Seguramente enriquecerán mucho la experiencia de aprendizaje del estudiante. John Harley recibió una gran ayuda de James Snyder en la sección de bioterrorismo. Donald Klein desea agradecer la ayuda de Jeffrey O. Dawson, Frank B. Dazzo, Arnold L. Demain, Frank G. Ethridge, Zoila R. Flores Bustamante, Michael P. Shiaris, Donald B. Tait y Jean K. Whelan. Por último, pero en primer lugar por su importancia, queremos dar las gracias a nuestras familias por su paciencia y su ánimo, especialmente a nuestras mujeres, Linda Prescott, Jane Harley y Sandra Klein. A ellas dedicamos este libro. Lansing M. Prescott John P. Harley Donald A. Klein CAPÍTULO 3 Estructura y función de la célula procariota Las especies bacterianas pueden diferir en los patrones de distribución de sus flagelos. Estas células de Pseudomonas tienen un único flagelo polar que utilizan para su locomoción. Índice Conceptos 3.1 1. Las bacterias son pequeñas y de estructura sencilla cuando se comparan con las células eucariotas, incluso, a menudo, tienen formas y tamaños característicos. Resumen de la estructura de la célula procariota 44 Tamaño, forma y agrupamiento 44 Organización de la célula procariota 47 3.2 Membranas de la célula procariota 48 Membrana plasmática 48 Sistemas internos de membrana 51 3.3 La matriz citoplasmática 52 Cuerpos de inclusión 52 Ribosomas 55 3.4 Nucleoide 55 3.5 La pared de las células procariotas 57 Estructura del peptidoglicano 59 Pared celular de las bacterias Gram positivas 59 Pared celular de las bacterias Gram negativas 61 Mecanismo de la tinción de Gram 64 La pared celular y protección osmótica 64 3.6 Componentes externos a la pared celular 65 Cápsulas, «slime» y capas S 65 Pili y fimbriae 66 Flagelos y movilidad 66 3.7 3.8 Quimiotaxis 70 Endospora bacteriana 72 2. Aunque poseen una membrana plasmática, necesaria para todas las células vivas, las bacterias carecen normalmente de sistemas extensos y complejos de membrana. 3. La matriz citoplasmática normalmente contiene varios constituyentes que no están rodeados por una membrana: cuerpos de inclusión, ribosomas y el nucleoide con el material genético. 4. La pared celular procariótica es química y morfológicamente compleja, y casi siempre contiene peptidoglicano. La mayoría de las bacterias se pueden clasificar en Gram positivas o Gram negativas en función de la estructura de la pared celular y de la respuesta a la tinción de Gram. 5. Los componentes como cápsulas y fimbriae se localizan fuera de la célula. Uno de éstos es el flagelo, que muchas bacterias utilizan como propulsor para desplazarse hacia las sustancias atrayentes o alejarse de las repelentes. 6. Algunas bacterias forman endosporas, formas latentes de resistencia, para sobrevivir condiciones ambientales extremas. 44 Capítulo 3 Estructura y función de la célula procariota La época en que los científicos solían considerar a las bacterias como pequeñas bolsas de enzimas finalizó hace mucho tiempo. Howard J. Rogers. ncluso un examen superficial del mundo microbiano revelaría que las bacterias son uno de los grupos más importantes de seres vivos, desde cualquier criterio: número de organismos, importancia ecológica general, o importancia práctica para los seres humanos. De hecho, la mayor parte de nuestro conocimiento sobre los fenómenos bioquímicos y de biología molecular proceden de la investigación con bacterias. Aunque gran parte de la investigación se ocupa de microorganismos eucariotas, el núcleo principal radica en los procariotas. En consecuencia, la sección sobre morfología microbiana comienza con la estructura de los procariotas. Como se mencionó en el Capítulo 1 (véase la p. 12), hay dos grandes grupos de procariotas bien diferenciados: Bacteria y Archaea. Este capítulo se va a centrar principalmente en la morfología de Bacteria; en el Capítulo 20 se discutirá la composición y estructura celular de Archaea. Para evitar confusiones, debe recordarse que, en sentido general, debe emplearse el término procariota, que incluye a Bacteria y Archaea; el término bacteria se refiere específicamente a las células del dominio Bacteria. Eucariotas, procariotas y I (a) (b) composición del mundo microbiano (pp. 12; 95-96). El dominio Archaea (pp. 487-503). 3.1 Resumen de la estructura de la célula procariota (c) Como gran parte de este capítulo se va a ocupar de la descripción de componentes celulares individuales, a continuación se expone un resumen general sobre la célula procariota en su conjunto. Tamaño, forma y agrupamiento Se podría esperar que organismos pequeños, relativamente simples como las bacterias, fuesen uniformes en cuanto a forma y tamaño. Aunque es cierto que muchas bacterias tienen una morfología similar, existen importantes variaciones (Figuras 3.1 y 3.2; véanse también las Figuras 2.8 y 2.15). Figura 3.1 Bacterias representativas. Observación con el microscopio óptico de bacterias teñidas. (a) Staphylococcus aureus; obsérvense las células esféricas Gram positivas en racimos irregulares; tinción de Gram (× 1000). (b) Enterococcus faecalis; obsérvense las cadenas de cocos; contraste de fases (× 200). (c) Bacillus megaterium, bacteria en forma de bacilo formando cadenas; tinción de Gram (× 600). (d) Rhodospirillum rubrum; contraste de fases (× 500). (e) Vibrio cholerae; bacilos curvados con flagelos polares (× 1000). (d) (e) 3.1 Resumen de la estructura de la célula procariota (a) (b) 45 (c) 2 µm Yema Hifa (f) Hifa (d) (e) En esta sección se describen los principales modelos morfológicos y se mencionan interesantes variantes en procariotas (Capítulos 20-24). La mayoría de las bacterias conocidas presentan forma de coco o de bacilo. Los cocos son células casi esféricas. Pueden existir como células individuales, pero se asocian también en agrupaciones características que son útiles frecuentemente para identificar a las bacterias. Los diplococos se forman cuando los cocos se dividen y permanecen juntos para constituir pares (Neisseria; Figura 2.15d). Cuando las células después de dividirse repetidamente en un mismo plano no se separan, se forman cadenas largas de cocos; este modelo se observa en los géneros Streptococcus, Enterococcus y Lactococcus (Figura 3.1b). Las bacterias del género Staphylococcus se dividen en planos aleatorios para generar racimos irregulares similares a los de las uvas (Figura 3.1a). Las divisiones en dos o tres planos consecutivos perpendiculares entre sí pueden producir racimos simétricos de cocos: Figura 3.2 Bacterias con formas atípicas. Ejemplos de bacterias con formas diferentes a los tipos de bacilo y coco. (a) Actinomyces, MEB (× 21 000). (b) Mycoplasma pneumoniae, MEB (× 62 000). (c) Spiroplasma, MEB (× 13 000). (d) Hyphomicrobium con hifas y yema; microfotografía electrónica con tinción negativa. (e) Bacteria cuadrada de Walsby. (f) Gallionella ferruginea con un pedúnculo. los miembros del género Micrococcus se dividen a menudo en dos planos para formar paquetes cuadrados de cuatro células denominados tétradas; en el género Sarcina los cocos se dividen en tres planos, formando paquetes cúbicos de ocho células. La otra forma común bacteriana es el bastoncillo, denominado bacilo. Bacillus megaterium es el ejemplo clásico de una bacteria con forma de bastoncillo (Figura 3.1c; véase también la Figura 2.15a, c). Los bacilos varían considerablemente en la proporción entre longitud y diámetro, siendo los cocobacilos tan cortos y anchos que parecen cocos. La forma del extremo del bacilo varía a menudo entre especies; puede ser plana, redondeada, en forma de puro o bifurcada. Aunque muchos bacilos aparecen aislados, pueden permanecer juntos después de dividirse, formando parejas o cadenas (p. ej., Bacillus megaterium forma largas cadenas). Unas pocas bacterias con forma de bastoncillo, los vibrios, son curvados, con forma de coma o de espiral incompleta (Figura 3.1e). 46 Capítulo 3 Estructura y función de la célula procariota A parte de estas dos formas más frecuentes, las bacterias pueden adquirir una gran variedad de formas. Los actinomicetos forman largos filamentos multinucleados característicos, o hifas, que pueden ramificarse para constituir una red denominada micelio (Figura 3.2a). Muchas bacterias poseen una forma semejante a bacilos largos retorcidos como espirales o hélices; se denominan espirilos si son rígidos, y espiroquetas cuando son flexibles (Figuras 3.1d, 3.2c; véase también la Figura 2.8a,c). El microorganismo Hyphomicrobium, de forma ovalada a pera (Figura 3.2d), produce una yema al final de la larga hifa. Otras bacterias como Gallionella forman pedúnculos (Figura 3.2f). Pocas bacterias son realmente planas. Por ejemplo, Anthony E. Walsby ha descubierto bacterias cuadradas en charcas salinas (Figura 3.2e). Estas bacterias tienen una forma parecida a cajas planas, cuadradas a rectangulares, de aproximadamente 2 × 2-4 µm y sólo 0.25 µm de grosor. Finalmente, algunas bacterias pueden presentar formas variables (Figura 3.2b); se denominan pleomórficas, aunque, generalmente, pueden tener forma bacilar, como Corynebacterium. En conjunto, el grupo bacteriano también varía en tamaño tanto como en forma (Figura 3.3). Las más pequeñas Espécimen Oscillatoria Eritrocito E. coli 7000 1300 × 4000 475 Poxvirus 230 × 320 85 Bacteriófago T2 de E. coli 65 × 95 Virus del mosaico del tabaco 15 × 300 Virus de la poliomielitis Figura 3.3 Diámetro × longitud, en nm Rickettsia Virus de la gripe (p. ej., miembros del género Mycoplasma) tienen aproximadamente 0.3 µm de diámetro, casi el tamaño de los virus más grandes (poxvirus). Recientemente, se han publicado investigaciones sobre células incluso menores. Las nanobacterias o ultramicrobacterias tienen un diámetro aproximado de entre 0.2 µm y menos de 0.05 µm. Se han cultivado en el laboratorio algunas cepas, pero la mayoría son sencillamente objetos muy pequeños similares a bacterias, que sólo se pueden observar microscópicamente. Algunos microbiólogos piensan que las nanobacterias son artefactos; es preciso realizar más investigaciones para aclarar la importancia de estas formas bacterianas. Escherichia coli, bacilo de tamaño medio, mide 1.1-1.5 µm de ancho y 2.0-6.0 µm de largo. Algunas bacterias son bastante grandes; la cianobacteria Oscillatoria tiene un diámetro de casi 7 µm (el mismo que un eritrocito), y algunas espiroquetas pueden alcanzar ocasionalmente una longitud de 500 µm. Se ha descubierto una bacteria enorme en el intestino del pez cirujano Acanthurus nigrofuscus. La bacteria Epulopiscium fishelsoni presenta un tamaño de 600 por 80 µm, algo menor que un guión impreso. Más recientemente, ha sido descubierta una bacteria aún 27 Tamaño de bacterias y virus. Se relacionan los tamaños aproximados de algunas bacterias con el de los eritrocitos y virus. 3.1 Resumen de la estructura de la célula procariota más grande en sedimentos oceánicos, Thiomargarita namibiensis (Recuadro 3.1). En definitiva, algunas bacterias tienen un tamaño incluso mayor que la media de las células eucariotas (las típicas células de plantas y animales presentan un diámetro de 10-50 µm). 47 Organización de la célula procariota Las células procariotas contienen numerosas estructuras. Sus funciones principales se resumen en la Tabla 3.1, y la Figura 3.4 ilustra muchas de ellas. No están todas las Recuadro 3.1 Microbios monstruosos L os biólogos han diferenciado a menudo las células procariotas de las eucariotas por su tamaño. Generalmente, las procariotas son más pequeñas que las eucariotas. Las células procariotas crecen muy rápido en comparación con la mayoría de las eucariotas, y carecen de los complejos sistemas de transporte vesicular que poseen las células eucariotas (véase el Capítulo 4). Se ha asumido que deben ser pequeñas por la necesidad de una proporción mayor entre superficie y volumen, y así, por ejemplo, favorecer la difusión intracelular de nutrientes. Por ello, cuando Fishelson, Montgomery y Myrberg descubrieron un microorganismo grande, con forma de puro, en el intestino del pez cirujano, Acanthurus nigrofuscus, propusieron en su artículo publicado en 1985, que era un protista. Este microorganismo era demasiado grande para ser otra cosa. En 1993, Esther Angert, Kendall Clemens y Norman Pace emplearon técnicas para comparar secuencias de rRNA (p. 468) que les permitieron identificar a este microorganismo, denominado actualmente Epulopiscium fishelsoni, como un procariota próximo al género Gram positivo Clostridium. E. fishelsoni [latín epulum, banquete, y piscium, pez] cuya longitud es normalmente de 200 a 500 µm, puede alcanzar un tamaño de 80 µm por 600 µm (véase la figura del recuadro). Tiene, aproximadamente, un volumen mil veces superior al de Escherichia coli. A pesar de su gran tamaño, este organismo posee una estructura celular procariota. Es móvil y nada a una velocidad de unas dos veces su longitud por segundo (aproximadamente, 2.4 cm/min) usando los flagelos de tipo bacteriano que cubren su superficie. El citoplasma contiene nucleoides grandes y muchos ribosomas, como sería necesario para una célula tan grande. Epulopiscium puede superar los límites de tamaño establecidos para la difusión gracias a una membrana plasmática muy plegada. Esto aumenta el área de la superficie celular y facilita el transporte de nutrientes. Parece que Epulopiscium se transmite de huésped a huésped por contaminación fecal. La bacteria se puede eliminar dejando en ayunas al pez cirujano durante unos días, aunque parece ser que los adultos son resistentes, ya que si se colocan alevines sanos junto a adultos infectados, los alevines se contagiarán, pero no contagiarán a otros adultos sanos. En 1997, Heidi Schulz descubrió en los sedimentos oceánicos de la costa de Namibia un procariota aún más grande. Thiomargarita namibiensis es una bacteria esférica, entre 100 y 750 µm de diámetro, que a menudo forma cadenas. Es unas 100 veces más grande en volumen que E. fishelsoni. Una vacuola ocupa cerca del 98 % de la célula, y contiene un fluido rico en nitratos; ésta está rodeada de una capa de citoplasma de unos 0.5-2.0 µm llena de gránulos de azufre. Esta capa citoplasmática es tan fina como la que presentan la mayoría de las bacterias, para permitir tasas adecuadas de difusión. La oxidación del azufre la utilizan como fuente de energía, siendo el nitrato el aceptor de electrones. (a) (b) Bacterias gigantes. (a) Esta fotografía, realizada con pseudoiluminación de campo oscuro, muestra a Epulopiscium fishelsoni en la parte superior de la Figura, empequeñeciendo a los paramecios que aparecen en la parte inferior (× 200). (b) Una cadena de células de Thiomargarita namibiensis visualizadas mediante microscopía óptica. Obsérvese la cubierta mucosa externa, así como los glóbulos internos de azufre. El descubrimiento de estos procariotas limita en gran medida la diferenciación entre procariotas y eucariotas en función de su tamaño celular, ya que estos dos procariotas tienen un tamaño mayor que una célula eucariota normal. Además, se ha descubierto que algunas células eucariotas son más pequeñas de lo que se pensaba. El mejor ejemplo es Nanochlorum eukaryotum. Nanochlorum tiene sólo de 1 a 2 µm de diámetro, aunque es verdaderamente eucariota y tiene un núcleo, un cloroplasto y una mitocondria. Es preciso evaluar de nuevo nuestros conocimientos sobre los factores que limitan el tamaño de las células procariotas. Ya no es seguro asumir que las células grandes son eucariotas y las pequeñas procariotas. 48 Capítulo 3 Estructura y función de la célula procariota Tabla 3.1 Funciones de las estructuras de células procariotas Membrana plasmática Vacuola de gas Ribosomas Cuerpos de inclusión Nucleoide Espacio periplásmico Pared celular Cápsulas y «slime» Fimbriae y pili Flagelos Endospora Barrera permeable selectiva, frontera mecánica de la célula, transporte de nutrientes y residuos, localización de muchos procesos metabólicos (respiración, fotosíntesis), detección de señales ambientales quimiotácticas Hincha la célula para flotar en un medio acuático Síntesis de proteínas Almacenamiento de carbono, fosfato y otras sustancias Localización del material genético (DNA) Contiene enzimas hidrolíticas y proteínas de unión para la captura y transporte de nutrientes Confiere a las bacterias una forma rígida y las protege frente a la lisis en soluciones diluidas Resistencia frente a la fagocitosis, adherencia a superficies Adherencia a superficies, conjugación bacteriana Movimiento Supervivencia en condiciones ambientales adversas estructuras de cada género. Además, existen diferencias significativas en la pared celular de las células Gram negativas y Gram positivas. Sin embargo, a pesar de estas variaciones, se puede considerar que las células procariotas son constantes en su estructura fundamental y en la presencia de ciertos componentes fundamentales. Las células procariotas casi siempre están limitadas por una pared celular químicamente compleja. Separada de ésta Nucleoide Ribosoma Cuerpos de inclusión Cápsula por un espacio periplásmico, se sitúa la membrana plasmática. Esta membrana puede estar invaginada para formar estructuras membranosas internas. Como la célula procariota no contiene orgánulos internos rodeados por membrana, su interior parece morfológicamente muy simple. El material genético se localiza en una región discreta, el nucleoide, que no está separado del resto del citoplasma por membranas. Los ribosomas y otros cuerpos de mayor tamaño, denominados cuerpos de inclusión, están dispersos por la matriz del citoplasma. Tanto las células Gram positivas como las Gram negativas pueden utilizar flagelos para desplazarse. Además, muchas células están rodeadas por una cápsula o capa mucosa, externa a la pared celular. Las células procariotas son morfológicamente mucho más sencillas que las eucariotas. Estos dos tipos celulares se compararán cuando se repase la estructura de la célula eucariota (véanse las pp. 95-96). 1. ¿Qué formas características pueden adquirir las bacterias? Describa las formas en que las células bacterianas pueden agruparse. 2. Dibuje una célula bacteriana y señale todas sus estructuras importantes. 3.2 Membranas de la célula procariota Las membranas son un componente imprescindible para todos los organismos vivos. Las células deben interactuar recíprocamente con su ambiente de forma selectiva, tanto si se trata del medio interno de un organismo multicelular como de un medio externo, menos protegido y más variable. Las células no deben ser sólo capaces de tomar nutrientes y eliminar residuos, sino también de mantener su interior en un estado constante, muy organizado frente a cambios externos. La membrana plasmática rodea el citoplasma de las células procariotas y eucariotas. Esta membrana es el punto clave de contacto con el entorno celular y, por ello, es responsable de gran parte de su relación con el mundo exterior. Para comprender la función de la membrana es preciso familiarizarse con su estructura y, particularmente, con la de la propia membrana plasmática. Membrana plasmática Capa S Flagelo Membrana plasmática Pared celular Figura 3.4 Morfología de una bacteria Gram positiva. La mayoría de las estructuras que se muestran en esta figura se encuentran en todas las células Gram positivas. Únicamente se ha incluido una pequeña parte de las proteínas de la capa S para simplificar el dibujo; cuando existen, estas proteínas cubren toda la superficie. Las membranas contienen tanto proteínas como lípidos, aunque las proporciones exactas de unas y otros varían ampliamente. Las membranas plasmáticas bacterianas presentan una proporción más alta de proteínas que las de eucariotas, probablemente debido a las numerosas funciones que realizan; en el caso de eucariotas, dichas funciones se llevan a cabo en membranas de orgánulos internos. La mayoría de 3.2 Membranas de la célula procariota 49 Etanolamina Extremo polar e hidrofílico HO (a) Colesterol (esteroide) Glicerol OH OH Ácidos grasos OH Cadenas largas de ácidos grasos, no polares, hidrofóbicos (b) OH Bacteriohopanetetrol (hopanoide) Figura 3.5 Estructura de un lípido polar de membrana. Fosfatidiletanolamina, fosfolípido anfipático, presente a menudo en las membranas bacterianas. Los grupos R son cadenas largas de ácidos grasos no polares. Figura 3.6 comunes. los lípidos asociados a membranas son estructuralmente asimétricos, con extremos polares hidrofílicos y no polares hidrofóbicos (Figura 3.5), por tanto son anfipáticos. Los extremos no polares son insolubles en agua y tienden a asociarse entre sí. Esta propiedad de los lípidos les confiere la capacidad de formar membranas en bicapa. Las superficies externas son hidrofílicas, mientras que los extremos hidrofóbicos quedan inmersos en el interior, lejos del agua circundante. Muchos de estos lípidos anfipáticos son fosfolípidos (Figura 3.5). Las membranas bacterianas se diferencian normalmente de las de eucariotas en que carecen de esteroles, como colesterol (Figura 3.6a). Sin embargo, muchas mem- branas bacterianas contienen moléculas pentacíclicas, tipo esteroles, denominadas hopanoides (Figura 3.6b), presentes en gran cantidad en nuestro ecosistema (Recuadro 3.2). Los hopanoides se sintetizan a partir de los mismos precursores que los esteroides. Estas sustancias, cumplirían en procariotas la misma función que los esteroides en eucariotas, estabilizar la membrana. Los componentes lipídicos de la membrana de procariotas se distribuye en dos capas de moléculas ordenadas de extremo a extremo (Figura 3.7). Por el contrario, muchas membranas de Archaea están conformadas por una monocapa de moléculas lipídicas. Archaea (Capítulo 20). Esteroides y hopanoides de membrana. Ejemplos Recuadro 3.2 Bacterias y combustibles fósiles D urante muchos años ha existido un enorme interés por el origen de los combustibles fósiles, como carbón y petróleo. En los océanos hay una constante sedimentación de membranas y otros compuestos orgánicos de procariotas que se depositan en el fondo de los océanos. La formación de los combustibles fósiles comienza cuando la materia orgánica queda enterrada antes de que los microorganismos puedan oxidarla a dióxido de carbono. Cuando la materia orgánica está enterrada profundamente y sometida a temperaturas crecientes, en condiciones anaerobias, se forman con frecuencia carbón y petróleo. La cantidad de materia que participa en este proceso es enorme. Se ha estimado que la Tierra contiene aproximadamente 1016 toneladas de carbono en los sedimentos. Existen cada vez más pruebas de que gran parte de la materia orgánica presente en los sedimentos tiene origen bacte- riano. Cerca del 90 % de estos materiales se encuentra en forma de querogeno, precursor orgánico del petróleo. Recientemente, se ha aislado del querogeno el hopanoide bacteriohopanetetrol (Figura 3.6b), y aumentan las pruebas que demuestran que el querogeno se produce como consecuencia de la actividad bacteriana. Quizás, las reservas de combustibles fósiles las debamos principalmente a las bacterias que sirven como descomponedoras finales de la materia orgánica de los organismos muertos. Se ha estimado que la cantidad total de hopanoides en los sedimentos es de aproximadamente 1011-12 toneladas, tanto como la masa total de carbono orgánico de todos los organismos vivos (1012 toneladas). Es posible que los hopanoides sean las moléculas biológicas más abundantes de nuestro planeta. 50 Capítulo 3 Estructura y función de la célula procariota Glucolípido Oligosacárido Proteína integral Proteína integral Hélice α hidrofóbica Hopanoide Fosfolípido Proteína periférica Figura 3.7 Estructura de la membrana plasmática. Este diagrama del modelo de mosaico fluido de la estructura de la membrana plasmática bacteriana muestra a las proteínas integrales (azul) flotando en una doble capa lipídica. Las proteínas periféricas (morado) están asociadas íntimamente con la superficie de la membrana. Las esferas pequeñas representan los extremos hidrofílicos de los fosfolípidos de membrana, y las colas onduladas, las cadenas de ácidos grasos hidrofóbicos. Puede haber también otros lípidos de membrana, como hopanoides (rosa). Para que quede más claro, los fosfolípidos se muestran con un tamaño proporcionalmente muy superior al que poseen en las membranas verdaderas. Las membranas celulares son estructuras muy delgadas, aproximadamente de 5 a 10 nm de grosor, y sólo pueden verse con el microscopio electrónico. La técnica de criofractura se ha empleado para romper membranas por entre la doble capa lipídica, dividiéndola en dos partes y exponiendo las partes ocultas. De esta forma, se ha descubierto que muchas membranas, incluida la plasmática, tienen una estructura interna compleja. Así, aparecen pequeñas partículas globulares, que son proteínas que se sitúan dentro de la doble capa lipídica (Figura 2.26). Técnica de criofractura (p. 35). El modelo de estructura de membrana más aceptado actualmente es el modelo de mosaico fluido de S. Jonathan Singer y Garth Nicholson (Figura 3.7). Estos investigadores diferenciaron entre dos tipos de proteínas de membrana. Las proteínas periféricas están débilmente conectadas a la membrana y pueden eliminarse fácilmente. Son solubles en soluciones acuosas, y constituyen aproximadamente el 20-30 % del total de las proteínas de membrana. El resto, 70-80 % de las proteínas de membrana, son proteínas integrales, que no se extraen fácilmente y son insolubles en soluciones acuosas cuando se eliminan los lípidos. Química de proteínas y lípidos (Apéndice I). Las proteínas integrales, al igual que los lípidos de membrana, son anfipáticas; sus regiones hidrofóbicas están inmersas en la fracción lipídica, mientras que las porciones hidrofílicas sobresalen de la superficie de la membrana (Figura 3.7). Algunas de estas proteínas atraviesan completamente la capa lipídica. Estas proteínas pueden difundir lateralmente en la superficie hasta una nueva posición, pero no giran. A menudo, la membrana presenta hidratos de carbono unidos a su superficie externa, que parecen poseer funciones importantes. La nueva imagen de la membrana celular está formada por un sistema muy organizado y asimétrico, flexible y dinámico a la vez. Aunque, aparentemente las membranas tienen un diseño básico común, existen grandes variaciones en su capacidad, tanto estructural como funcional. Las diferencias son tan grandes y características que la composición química de las membranas se puede utilizar en la identificación. Las membranas plasmáticas de las células bacterianas tienen que desempeñar satisfactoriamente un número increíble de funciones. A continuación, se expondrán muchas de las funciones principales de la membrana plasmática, aunque se describirán más delante de forma individual. La membrana plasmática retiene el citoplasma, particularmente crítico en las células sin pared, y lo separa del medio exterior. Esta membrana actúa también como barrera selectivamente permeable: permite el paso de iones y moléculas particulares, tanto hacia dentro como hacia fuera de la célula, mientras que evita el tráfico de otras. Por ello, esta membrana evita la pérdida de componentes esenciales, mientras que permite la difusión o transporte de otras moléculas. Como muchas sustancias no pueden atravesar la membrana plasmática sin ayuda, hay que facilitar este movimiento cuando sea necesario. Se pueden emplear sistemas de transporte para esas actividades, como la absorción de nutrientes, la excreción de residuos y la secreción de proteínas. La membrana plasmática de procariotas es también el lugar donde se desarrollan numerosos procesos metabólicos: respiración, fotosíntesis, síntesis de lípidos y de constituyentes de la pared celular y, probablemente, la segregación cromosómica. Finalmente, la membrana contiene moléculas receptoras especiales que ayudan a las bacterias a detectar y responder a sustancias químicas del 3.2 Membranas de la célula procariota 51 medio exterior. Resulta evidente que la membrana plasmática es esencial para la supervivencia de los microorganismos. Ósmosis (p. 64); Transporte de sustancias a través de membranas (pp. 104-109). Sistemas internos de membrana Aunque el citoplasma bacteriano no contiene orgánulos membranosos complejos como mitocondrias o cloroplastos, se pueden observar varias clases de estructuras membranosas. Una común es el mesosoma. Los mesosomas son invaginaciones de la membrana plasmática, conformando vesículas, túbulos o lamelas (Figura 3.8 y Figura 3.11). Se observan tanto en las bacterias Gram positivas como en las Gram negativas, aunque son más prominentes, en general, en las primeras. Los mesosomas a menudo se encuentran próximos a los septos o tabiques que dividen las bacterias, y a veces parecen unidas al cromosoma bacteriano. Por ello, se piensa que deben participar en la formación de la pared celular durante la división o desempeñar un papel en la replicación del cromosoma y su distribución a las células hijas. Sin embargo, actualmente, muchos bacteriólogos consideran que los mesosomas son artefactos generados durante la fijación química de las bacterias para su observación con el microscopio electrónico. Posiblemente, representan aque- n n (a) «Mesosoma» (b) Figura 3.9 Membranas internas bacterianas. Membranas de bacterias nitrificantes y fotosintéticas. (a) Nytrocystis oceanus con membranas paralelas atravesando toda la célula. Obsérvese el nucleoplasma (n) con estructura fibrilar. (b) Ectothiorhodospira mobilis con un sistema extenso de membrana intracitoplasmática (× 60 000). Nucleoide Figura 3.8 Estructura del mesosoma. Bacillus fastidiosus (× 91 000). Se observa un gran mesosoma junto al nucleoide. llas partes de la membrana plasmática con una composición química diferente y que se alteran más con los fijadores. Muchas bacterias poseen otros sistemas internos de membrana más evidentes diferentes de los mesosomas (Figura 3.9). Los plegamientos de la membrana plasmática pueden ser extensos y complejos en bacterias fotosintéticas, como las cianobacterias y las bacterias púrpuras, o en bacterias con una intensa actividad respiratoria, como las nitrificantes (Capítulo 22). Pueden constituir agregados de vesículas esféricas, vesículas aplanadas, o membranas tubulares. Su función sería la de ofrecer una superficie amplia de membrana para realizar una mayor y más rápida actividad metabólica. 52 Capítulo 3 Estructura y función de la célula procariota 1. Describa con un diagrama y con palabras el modelo de mosaico fluido de las membranas celulares. 2. Enumere las funciones de la membrana plasmática. 3. Discuta la naturaleza, estructura y posibles funciones del mesosoma. 3.3 La matriz citoplasmática La matriz citoplasmática es la sustancia situada entre la membrana plasmática y el nucleoide (p. 55). La matriz está compuesta fundamentalmente por agua (casi el 70 % de la masa bacteriana es agua). La de las células procariotas, a diferencia de la de eucariotas, carece de orgánulos limitados por una membrana unitaria. No posee rasgos distintivos en microfotografías electrónicas, pero a menudo está compactada con ribosomas y se encuentra muy organizada (Figura 3.10). Proteínas específicas se sitúan en lugares particulares, como el polo celular y el punto donde la célula bacteriana se divide; así, aunque la bacteria carezca de un verdadero citoesqueleto, su matriz citoplasmática presenta un sistema proteico con esa función. La membrana plasmática y todo el contenido interior se denomina protoplasto; por tanto, la matriz citoplasmática es una parte principal del protoplasto. Cuerpos de inclusión Numerosos cuerpos de inclusión, gránulos de material orgánico o inorgánico, visibles a menudo con el microscopio de luz, se encuentran en la matriz citoplasmática. Estos cuerpos normalmente se utilizan como reserva (p. ej., de compuestos de carbono, sustancias inorgánicas, y de energía), y también pueden reducir la presión osmótica mediante la agregación de moléculas en forma particulada. Algunos no están rodeados por una membrana y permanecen libres en el citoplasma —p. ej., gránulos de polifosfato, cianoficina y de glucógeno—. Otros cuerpos de inclusión están rodeados por una membrana no unitaria de una sola capa de aproximadamente 2.0 a 4.0 nm de grosor. Ejemplos de cuerpos de inclusión rodeados por una membrana no unitaria son los gránulos de poli-β-hidroxibutirato, algunos de glucógeno y de azufre, carboxisomas y vacuolas de gas. La composición de los cuerpos de inclusión es variable. Algunos son de naturaleza proteica, mientras que otros contienen lípidos. Debido a que algunos cuerpos de inclusión se utilizan como cuerpos de almacenamiento, su cantidad variará dependiendo del estado nutricional de la célula. Por ejemplo, los gránulos de polifosfato desaparecerán en hábitats acuáticos en donde el fosfato sea limitante. A continuación, se expone una breve descripción de varios cuerpos de inclusión. Los cuerpos de inclusión orgánicos suelen contener glucógeno o poli-β-hidroxibutirato. El glucógeno es un polímero de unidades de glucosa, compuesto por cadenas largas formadas por enlaces glucosídicos α (1 → 4) unidos a cadenas ramificadas por enlaces glucosídicos α (1 → 6) (véase β-hidroxibutirato (PHB) contiene el Apéndice I). El poli-β moléculas de β-hidroxibutirato unidas por enlaces éster entre grupos carboxilos e hidroxilos de moléculas adyacentes. Normalmente, sólo hay presente uno de estos polímeros orgánicos en una especie, pero las bacterias fotosintéticas tienen ambos. El poli-β-hidroxibutirato se acumula en distintos cuerpos de inclusión, de aproximadamente 0.2 a 0.7 µm de diámetro, que se tiñen fácilmente con negro Sudán para observarlos con microscopio óptico, y son claramente visibles con el microscopio electrónico (Figura 3.11). El glucógeno se dispersa más uniformemente por la matriz en forma de gránulos pequeños (aproximadamente de 20 a 100 nm de diámetro) y a menudo sólo pueden verse con el microscopio electrónico. Si las células contienen una gran cantidad de glucógeno, al teñirlas con una solución yodada adquieren un color marrón rojizo. Los cuerpos de inclusión de glucógeno y de PHB son reservas de carbono, que aportan material para obtener energía y realizar la biosíntesis. Muchas bacterias acumulan también carbono en forma de gotitas lipídicas. Las cianobacterias tienen dos tipos característicos de cuerpos de inclusión orgánicos, gránulos de cianoficina y carboxisomas. Los gránulos de cianoficina (Figura 3.13a) están compuestos por polipéptidos grandes que contienen aproximadamente la misma cantidad de los aminoácidos arginina y ácido aspártico. Los gránulos son a menudo lo suficientemente grandes para ser visibles con el microscopio óptico y acumulan el exceso de nitrógeno como reserva bacteriana. Los carboxisomas están presentes en muchas cianobacterias, bacterias nitrificantes y tiobacilos. Son poliédricos, de aproximadamente 100 nm de diámetro, y contienen la enzima ribulosa-1,5-bisfosfato carboxilasa (p. 223) en una disposición paracristalina. Sirven como reserva de esta enzima, y pueden ser el lugar de fijación de CO2. Un cuerpo de inclusión orgánico realmente extraordinario, la vacuola de gas, está presente en muchas cianobacterias (véase sección 21.3), así como en bacterias fotosintéticas púrpuras y verdes, y en algunas bacterias acuáticas, como Halobacterium y Thiothrix. Estas bacterias flotan en o cerca de la superficie, gracias a las vacuolas de gas que les confieren flotabilidad. Esto se demuestra claramente con un experimento sencillo, pero eficaz. Las cianobacterias mantenidas en un frasco lleno y cerrado herméticamente flotarán, pero si se golpea el tapón con un martillo, las bacterias se hundirán hacia el fondo. El examen de las bacterias al inicio y al final del experimento revela que la repentina presión provocada por el martillazo hizo colapsar las vacuolas de gas, eliminando la flotabilidad de los microorganismos. Las vacuolas de gas son agregados de un gran número de estructuras pequeñas, huecas, cilíndricas, denominadas vesículas de gas (Figura 3.12). La pared de las vesículas de 3.3 La matriz citoplasmática Flagelo Motor flagelar 53 Espacio periplásmico Ribosoma Proteosoma Membranas celulares Figura 3.10 Dibujo ampliado un millón de veces de un corte transversal de la bacteria Escherichia coli. En la parte superior se observan el glicocálix, el flagelo, la pared celular Gram negativa y la membrana plasmática. Los ribosomas sintetizando proteínas se encuentran en toda la matriz citoplasmática subyacente. En la parte inferior se observa el nucleoide con su densa maraña de DNA y proteínas asociadas. Chaperonina DNA Piruvato deshidrogenasa DNA polimerasa 54 Capítulo 3 Estructura y función de la célula procariota MP PHB R ejemplo es el de los magnetosomas, utilizado por algunas bacterias para orientarse según el campo magnético terrestre. Estos cuerpos de inclusión contienen hierro en forma de magnetita (Recuadro 3.3). N M PC Figura 3.11 Estructura de una célula Gram positiva típica. Microfotografía electrónica de Bacillus megaterium (× 30 500). Obsérvense la gruesa pared celular, PC; «el mesosoma», M; el nucleoide, N; el cuerpo de inclusión de poli-β-hidroxibutirato, PHB; la membrana plasmática, MP; y los ribosomas, R. gas no contiene lípidos y está compuesta únicamente por pequeñas proteínas. Concretamente, se trata de la repetición de un único tipo proteico conformando un cilindro rígido que es hueco e impermeable al agua, pero totalmente permeable a los gases atmosféricos. Las bacterias con vacuolas de gas pueden regular su flotabilidad para permanecer en la profundidad necesaria para obtener una intensidad de luz, concentración de oxígeno y niveles de nutrientes adecuados. La bacteria desciende tras el colapso de las vesículas, y flotan hacia arriba cuando se forman otras nuevas. Se han observado dos clases importantes de cuerpos de inclusión inorgánicos. Muchas bacterias acumulan fosfato como gránulos de polifosfato o gránulos de volutina (Figura 3.13a). El polifosfato es un polímero lineal de ortofosfatos unidos por enlaces éster. Así, los granos de volutina actúan como reservas de fosfato, un componente importante de los constituyentes celulares, como los ácidos nucleicos. En algunas células, actúan como reserva y fuente de energía directa para reacciones químicas. Estos gránulos se denominan a veces gránulos metacromáticos porque muestran un efecto metacromático; esto es, aparecen de un color rojo o de una gama diferente de azul, cuando se tiñen con los colorantes azul de metileno o azul de toluidina. Algunas bacterias acumulan también temporalmente azufre en gránulos de azufre, un segundo tipo de cuerpo de inclusión inorgánico (Figura 3.13b). Por ejemplo, las bacterias púrpuras fotosintéticas pueden utilizar sulfuro de hidrógeno como dador de electrones en la fotosísntesis (véase la sección 9.11) y acumulan el azufre restante en el espacio periplásmico o en estos gránulos citoplasmáticos especiales. Los cuerpos de inclusión inorgánicos pueden utilizarse para otros propósitos diferentes al de reserva. Un excelente (a) (b) Figura 3.12 Vesículas de gas y vacuolas. (a) Filamentos de la cianobacteria Anabaena flos-aquae al microscopio óptico. (b) Preparación por criofractura de Anabaena flos-aquae (× 89 000). Racimos de vesículas en forma de puro forman las vacuolas de gas. Pueden observarse cortes, tanto longitudinales como transversales, de vesículas de gas. 3.4 El nucleoide c LI MP L II L III PF CP c PF Tilacoides L IV (a) (b) Figura 3.13 Cuerpos de inclusión en bacterias. (a) Ultraestructura de la cianobacteria Anacystis nidulans. La bacteria se está dividiendo y se ha formado parcialmente un septo, LI y LII. Pueden observarse varias estructuras características, incluyendo capas de la pared celular, LIII y LIV; la membrana plasmática, mp; gránulos de polifosfato, pf; un cuerpo poliédrico, cp; y material de cianoficina, c. Los tilacoides se distribuyen a lo largo de la célula. Barra = 0.1 µm. (b) Chromatium vinosum, bacteria púrpura del azufre, con gránulos intracelulares de azufre; campo claro (× 2000). Ribosomas Como se ha mencionado anteriormente, la matriz citoplasmática contiene numerosos ribosomas; éstos también pueden encontrarse adheridos débilmente a la membrana plasmática. En microfotografías electrónicas de pocos aumentos, los ribosomas aparecen como partículas pequeñas, sin características distintivas (Figura 3.11), pero son realmente objetos muy complejos, compuestos de proteínas y de ácido ribonucleico (RNA). Son el lugar de la síntesis de proteínas; los ribosomas de la matriz citoplasmática sintetizan proteínas destinadas a permanecer dentro de la célula, mientras que los ribosomas de la membrana plasmática elaboran proteínas que son transportadas al exterior. Los recién formados polipéptidos se pliegan en su forma final tan pronto como 55 son sintetizados, o bien, inmediatamenmte después de su síntesis. La forma final de cada proteína viene determinada por su secuencia de aminoácidos. Proteínas especializadas denominadas chaperonas moleculares, o chaperonas, ayudan a conseguir el plegamiento apropiado. La síntesis de proteínas, incluida una descripción detallada de los ribosomas, se expondrá ampliamente en el Capítulo 12. Recuerde que los ribosomas de procariotas son más pequeños que los de eucariotas. Se denominan comúnmente ribosomas 70S, tienen un tamaño de aproximadamente 1415 nm por 20 nm, un peso molecular de aproximadamente 2.7 millones y están constituidos por subunidades de 50S y de 30S (unidades Svedberg). La unidad Svedberg es la unidad del coeficiente de sedimentación, medida de la velocidad de sedimentación en una centrífuga; cuanto mayor sea la velocidad de desplazamiento de una partícula al ser centrifugada, mayor será su valor Svedberg, o coeficiente de sedimentación. Este coeficiente depende del peso molecular, volumen y forma de la partícula (véase la Figura 16.7). Las partículas más pesadas y compactas suelen tener normalmente valores de coeficiente de sedimentación o unidades Svedberg superiores. Los ribosomas de la matriz citoplasmática de las células eucariotas son de 80S y con un diámetro de aproximadamente 22 nm. A pesar de las diferencias generales en tamaño, ambos ribosomas están compuestos de forma similar, por una subunidad grande y otra pequeña. 1. Describa brevemente la naturaleza y función de la matriz citoplasmática y de los ribosomas. ¿Qué es un protoplasto? 2. ¿Qué clases de cuerpos de inclusión poseen los procariotas? ¿Cuáles son sus funciones? 3. ¿Qué es una vacuola de gas? Explique su estructura y función. 3.4 El nucleoide Probablemente, la diferencia más característica entre organismos procariotas y eucariotas es la forma de organización del material genético. Las células eucariotas tienen dos o más cromosomas dentro de un orgánulo delimitado por una membrana, el núcleo. Por el contario, las procariotas carecen de un núcleo limitado por membrana. El cromosoma procariótico, casi siempre constituido por un único círculo de doble cadena de ácido desoxirribonucleico (DNA), está irregularmente distribuido en una zona amplia denominada nucleoide (se emplean también otros términos: cuerpo nuclear, cuerpo de cromatina, región nuclear). Normalmente, los procariotas contienen un único anillo de doble hebra de ácido desoxirribonucleico (DNA), aunque algunos tienen un cromosoma linear (p. ej., Borrelia burgdorferi), y otros, más de un cromosoma (p. ej., Vibrio cholerae, Brucella y Agrobacterium, entre otros). Aunque el aspecto del nucleoide varía según el método de fijación y tinción, a 56 Capítulo 3 Estructura y función de la célula procariota Recuadro 3.3 Imanes vivos L as bacterias pueden responder a otros factores ambientales, además de a sustancias químicas. Un ejemplo fascinante es cómo las bacterias magnetotácticas acuáticas se orientan por sí mismas en el campo magnético terrestre. La mayoría de estas bacterias tiene cadenas intracelulares de partículas magnéticas (Fe3O4), o magnetosomas, con un diámetro de aproximadamente 40 a 100 nm y rodeadas por una membrana (véase la figura del recuadro). Algunas especies que viven en hábitat sulfurosos poseen magnetosomas con greigita (Fe3S4) y pirita (FeS2). Como cada partícula de hierro es un pequeño imán, las bacterias utilizan su cadena de magnetosomas para orientar las direcciones norte y sur, y así nadar hacia los sedimentos ricos en nutrientes o a la profundidad óptima en hábitat de agua dulce o marinos. También se encuentran magnetosomas en la cabeza de aves, atunes, delfines, tortugas verdes y otros animales, posiblemente como ayuda para la navegación. Los animales y las bacterias comparten más características de comportamiento de lo que anteriormente se pensaba. EP ME PM MC (b) (a) Bacterias magnetotácticas. (a) Microfotografía electrónica de transmisión de la bacteria Aquaspirillum magnetotacticum (× 123 000). Obsérvese la larga cadena electrodensa de partículas de magnetita, PM. Otras estructuras: ME, membrana externa; EP, espacio periplásmico; MC, membrana citoplasmática. (b) Magnetosomas aislados (× 140 000). (c) Bacterias migrando en oleadas al ser sometidas a un campo magnético. (c) 3.5 La pared de las células procariotas menudo se observan fibras en microfotografías electrónicas (Figura 3.11 y Figura 3.14) que probablemente se traten de DNA. El nucleoide es visible también con el microscopio óptico, después de teñir la preparación con la técnica de Feulgen, que reacciona específicamente con DNA. Una célula puede tener más de un nucleoide cuando se produce la división celular, después de duplicarse el material genético (Figura 3.14a). En bacterias que están creciendo activamente, el nucleoide presenta proyecciones que se extienden dentro de la matriz citoplasmática (Figura 3.14b,c). Posiblemente, estas proyecciones contienen DNA que está siendo transcrito activamente a mRNA. Estudios rigurosos realizados con microscopía electrónica a menudo revelan al nucleoide en contacto con el mesosoma o la membrana plasmática. También se pueden obser- 57 var membranas unidas a nucleoides aislados. Son pruebas de la unión del DNA bacteriano a las membranas celulares, que podrían participar en la separación del DNA para su transmisión a las células hijas durante la división celular. Se han aislado nucleoides intactos y libres de membranas. Análisis químicos revelan que están compuestos por casi el 60 % de DNA, algo de RNA y una pequeña cantidad de proteínas. En Escherichia coli, célula en forma de bacilo de 2 a 6 µm de longitud, el DNA circular mide aproximadamente 1400 µm. Obviamente, éste debe estar muy enrrollado y plegado para que se adapte en el interior del nucleoide (véase la Figura 11.8), probablemente lo consigue gracias a la ayuda del RNA y las proteínas del nucleoide (proteínas diferentes de las histonas del núcleo eucariota). Existen pocas excepciones respecto de la descripción anterior. Dos géneros de planctomicetos poseen regiones con DNA limitadas por membrana. Pirellula presenta una membrana sencilla que rodea una región, pirelusoma, que contiene un nucleoide fibrilar y partículas semejantes a ribosomas. El cuerpo nuclear de Gemmata obscuriglobus está rodeado por dos membranas (véase la Figura 21.12). Es preciso seguir investigando para determinar las funciones de estas membranas y hasta qué punto está extendido este fenómeno. El ciclo y la división de la célula (pp. 307-308). DNA procariótico y su función (Capítulos 11 y 12). (a) (b) Numerosas bacterias poseen plásmidos, además de su cromosoma. Se trata de moléculas circulares, de doble cadena de DNA, que pueden existir y replicarse independientemente del cromosoma o pueden integrarse en éste; en cualquier caso, son heredados por las células hijas. Sin embargo, los plásmidos no están normalmente unidos a la membrana plasmática, por lo que, a menudo, durante la división celular una de las células hijas no lo adquiere. Los plásmidos no son necesarios para el crecimiento y la multiplicación del huésped, aunque pueden llevar genes que aportan a la bacteria huésped una ventaja selectiva. Los genes plasmídicos pueden conferir a las bacterias resistencia a fármacos, nuevas capacidades metabólicas, transformarlas en patógenas o dotarlas de otras numerosas propiedades. Frecuentemente, se produce lo que se denomina «transferencia horizontal» de plásmidos entre bacterias, facilitándose que algunas características se extiendan fácilmente entre la población bacteriana, como por ejemplo la resistencia a fármacos. Plásmidos (pp. 316-319). (c) 1. Caracterice el nucleoide respecto a su estructura y función. 2. ¿Qué es un plásmido? Figura 3.14 El nucleoide bacteriano. (a) Nucleoides en células de Bacillus teñidas con HCl-Giemsa y observadas con microscopio óptico (barra = 5 µm). (b) Sección de E. coli en crecimiento activo, inmunodetección para observar específicamente DNA, examinado con microscopio electrónico de transmisión. La transcripción y la traducción se producen en partes del nucleoide que se extienden hacia el citoplasma. (c) Modelo de dos nucleoides en una célula de E. coli en crecimiento activo. Obsérvese que el nucleoide metabólicamente activo no es compacto ni esférico, sino que posee proyecciones que se extienden en la matriz citoplasmática. 3.5 La pared de las células procariotas La pared celular es la capa, normalmente muy rígida, que se encuentra justo por encima de la membrana plasmática. Es una de las partes más importantes de una célula procariota 58 Capítulo 3 Estructura y función de la célula procariota por varias razones. Salvo algunos micoplasmas (véase la sección 23.1) y algunas Archaea (véase el Capítulo 20), la mayoría de las bacterias tienen una fuerte pared que les da forma y protege de la lisis osmótica (p. 64); tanto la forma como la integridad de la pared celular se deben fundamentalmente al peptidoglicano, como se mostrará más adelante. La pared celular de muchos microorganismos patógenos tienen componentes que contribuyen a su patogenicidad. La pared puede proteger a una célula frente a sustancias tóxicas y es el lugar de acción de varios antibióticos. Después de que Christian Gram desarrollase la tinción que lleva su nombre, en 1884, se comprobó que las bacterias podían clasificarse en dos grupos principales, según su respuesta a este método de tinción (véase la Tabla 19.9). Las bacterias Gram positivas se tiñen de color morado, mientras que las Gram negativas adquieren un color rosa a rojo. La diferencia estructural verdadera entre estos dos grupos se puso de manifiesto con el desarrollo del microscopio electrónico de transmisión. La pared de una célula Gram positiva está formada por una única capa homogénea, de 20 a 80 nm de grosor, de peptidoglicano o mureína, situada por encima de la membrana plasmática (Figura 3.15). Por el contrario, la pared de la célula Gram negativa es bastante compleja. Posee una capa de peptidoglicano (2-7 nm de grosor), rodeada por una membrana externa (7-8 nm). Precisamente debido a su gruesa capa de peptidoglicano, la pared celular de las bacterias Gram positivas es más fuerte que la de las Gram negativas. En ocasiones, los microbiólogos denominan envoltura o envoltura celular a todas las estructuras exteriores; éstas incluyen la pared y estructuras como cápsulas (p. 65), cuando existen. Método de tinción de Gram (p. 29). Con frecuencia, en microfotografías electrónicas, se observa un espacio entre la membrana plasmática y la externa de bacterias Gram negativas, y a menudo se puede observar un espacio similar, pero más pequeño, entre la membrana plasmática y la pared celular en bacterias Gram positivas. Este espacio se denomina espacio periplásmico. Estudios recientes han demostrado que este espacio está ocupado por el entramado de peptidoglicano. Posiblemente, se trate de un espacio ocupado por un gel, más que por un líquido. La sustancia que ocupa el espacio periplásmico se denomina periplasma. Las celulas Gram positivas pueden presentar un periplasma aun cuando carezcan de un espacio como tal. El tamaño estimado del espacio periplásmico en bacterias Gram negativas varía de 1 nm hasta 71 nm. Algunos estudios recientes han revelado que puede constituir entre el 20 y el 40 %, aproximadamente, del volumen total de la envoltura celular (30-70 nm de diámetro), pero es preciso seguir investigando para determinarlo con más precisión. Cuando las paredes celulares se rompen con cuidado o se extraen sin alterar la membrana plasmática subyacente, se liberan enzimas periplásmicas y otras proteínas. El espacio periplásmico de las bacterias Gram negativas contiene muchas proteínas que participan en la captación de nutrientes —p. ej., enzimas hidrolíticas frente a ácidos nucleicos y moléculas fosforiladas, y proteínas ligadoras que participan en el transporte de sustancias hacia el interior de la célula—. Las bacterias desnitrificadoras y quimiolitoautotrofas (véanse las secciones 9.6 y 9.10) poseen a menudo proteínas transportadoras de electrones en su periplasma. El espacio periplásmico contiene también enzimas que participan en la síntesis del peptidoglicano y en la modificación de compuestos tóxicos que podrían lesionar a la célula. Es posible que las bacterias EP Pared celular Gram negativa Pared celular Gram positiva Peptidoglicano Membrana plasmática Pared celular MP Membrana externa Peptidoglicano Membrana plasmática ME PG MP PG EP Pared celular Espacio periplásmico Figura 3.15 Paredes celulares de células Gram positivas y Gram negativas. La microfotografía de la envoltura Gram positiva corresponde a Bacillus licheniformis (izquierda), y la de la célula Gram negativa es de Aquaspirillum serpens (derecha). PG, capa de peptidoglicano o mureína; ME, membrana externa; MP, membrana plasmática; EP, espacio periplásmico. 3.5 La pared de las células procariotas Gram positivas no tengan un espacio periplásmico tan visible, ni tengan tantas proteínas periplásmicas; más bien, secretan varias enzimas, que serían normalmente periplásmicas en bacterias Gram negativas. Estas enzimas secretadas se denominan a menudo exoenzimas. Algunas enzimas permanecen en el periplasma asociadas a la membrana plasmática. El dominio Archaea se diferencia de otros procariotas por muchos motivos (véase el Capítulo 20). Aunque tintorialmente pueden ser tanto Gram positivas como Gram negativas, sus paredes celulares son distintivas en cuanto a estructura y composición química; carecen de peptidoglicano y están constituidas por proteínas, glicoproteínas o polisacáridos. Después de este resumen sobre la envoltura celular, se describen a continuación la estructura del peptidoglicano y la organización de la pared celular en las bacterias Gram positivas y Gram negativas. D-Ácido láctico L-Alanina Ácido D-glutámico Estructura del peptidoglicano El peptidoglicano o mureína es un gran polímero compuesto por muchas subunidades idénticas. El polímero contiene dos derivados de azúcar, N-acetilglucosamina y ácido N-acetilmurámico (éter lactilo de N-acetilglucosamina) y varios aminoácidos, tres de los cuales —ácido D-glutámico, D-alanina y ácido meso-diaminopimélico— no están presentes en las proteínas. La presencia de D-aminoácidos protege frente a la mayoría de peptidasas. La subunidad de peptidoglicano que normalmente se encuentra en las bacterias Gram negativas y muchas de las Gram positivas se muestra en la Figura 3.16. El esqueleto de este polímero está constituido por residuos alternantes de N-acetilglucosamina y ácido N-acetilmurámico. Una cadena peptídica de cuatro aminoácidos D- y L- alternantes está conectada a un grupo carbóxilo del ácido N-acetilmurámico. Muchas bacterias sustituyen la Llisina de la tercera posición por otro diaminoácido, el ácido meso-diaminopimélico (Figura 3.17). Resumen de la química de las moléculas biológicas (Apéndice I); Variaciones en la estructura del peptidoglicano (pp. 562-564). Las cadenas de subunidades de peptidoglicano están entrecruzadas por sus péptidos. A menudo, el grupo carboxilo de la D-alanina terminal de una mureína está conectado directamente al grupo amino del ácido diaminopimélico de una mureína de otra cadena paralela, pero en otras ocasiones se puede emplear en su lugar un interpuente peptídico (Figura 3.18). La mayoría de los peptidoglicanos de las bacterias Gram negativas carece de este tipo de puente. Este entrecruzamiento produce un saco de peptidoglicano de gran tamaño, que realmente es una malla densa, interconectada (Figura 3.19). Se han aislado estas mallas en bacterias Gram positivas y son lo suficientemente fuertes como para mantener su forma e integridad (Figura 3.20), aunque son elásticos y pueden estirarse en cierto grado, al contrario que la celulosa. También, deben ser porosos, para que puedan atravesarlos las moléculas. 59 Ácido mesodiaminopimélico D-Alanina Puede unirse a otra cadena tetrapeptídica por un puente peptídico, o directamente al ácido diaminopimélico Figura 3.16 Composición de la subunidad del peptidoglicano. Subunidad del peptidoglicano de Escherichia coli, y de la mayoría del resto de bacterias Gram negativas y de muchas Gram positivas. NAG es N-acetilglucosamina; NAM es N-acetilmurámico (NAG con ácido láctico unido por un enlace éter). La cadena lateral tetrapeptídica está compuesta por aminoácidos D- y L- alternantes; el ácido mesodiaminopimélico está unido a través de su carbono L. NAM y la cadena tetrapeptídica a la que está unido se representan con diferentes gamas de color para mayor claridad. Pared celular de las bacterias Gram positivas Normalmente, la gruesa pared celular de las bacterias Gram positivas está constituida principalmente por peptidoglicano, cuyas mureínas a menudo están entrelazadas por puentes peptídicos (Figura 3.20 y Figura 3.21). Sin embargo, estas células contienen también una gran cantidad de ácidos teicoicos, polímeros de glicerol y ribitol unidos por grupos fosfato (Figuras 3.21 y 3.22). Aminoácidos como D-alanina o azúcares como glucosa están unidos a los grupos glicerol y ribitol. Los ácidos teicoicos pueden estar unidos al peptidoglicano mediante un enlace covalente con el hidroxilo seis del ácido N-acetilmurámico, o bien, a los lípidos de la membrana plasmática; en este último caso, se 60 Capítulo 3 Estructura y función de la célula procariota COOH H 2N C COOH H H 2N C CH2 CH2 CH2 CH2 CH2 CH2 CH2 H 2N C Ácido N-acetilmurámico H N-Acetilglucosamina H NH2 COOH (a) (b) Figura 3.17 Diaminoácidos presentes en un peptidoglicano. (a) L-Lisina. (b) Ácido meso-Diaminopimélico. Cadena peptídica (a) Puente de pentaglicina denominan ácidos lipoteicoicos. Los ácidos teicoicos parece que se extienden hasta la superficie del peptidoglicano y, como están cargados negativamente, contribuyen a dotar a la pared celular de su carga negativa. Las funciones de estas moléculas están todavía por aclarar, pero pueden ser fundamentales para mantener la estructura de la pared. Los ácidos teicoicos no están presentes en las bacterias Gram negativas. NAM (b) NAG Figura 3.19 Estructura del peptidoglicano. Segmento de peptidoglicano que muestra las cadenas de polisacáridos, cadenas laterales tetrapeptídicas y puentes peptídicos. (a) Diagrama esquemático. (b) Modelo tridimensional compacto de la mureína en una célula Gram negativa con cuatro subunidades repetidas de peptidoglicano en el plano del papel. Dos cadenas están ordenadas verticalmente a este plano. L-Ala D-Glu D-Ala DAP DAP D-Ala D-Glu L-Ala (a) NAM NAM NAG NAG L-Ala D-GluNH L-Lis D-Ala D-Ala 2 Gli Gli Gli Gli ídico pt pe e Interpuent Gli L-Lis D-GluNH 2 L-Ala (b) NAM NAG Figura 3.18 Entrecruzamientos en el peptidoglicano. (a) Peptidoglicano de E. coli con enlace directo, típico de muchas bacterias Gram negativas. (b) Peptidoglicano de Staphylococcus aureus (bacteria Gram positiva) mostrando un entrecruzamiento con puente peptídico. NAM es ácido N-acetilmurámico; NAG, Nacetilglucosamina; Gly, glicina. Aunque se representan las cadenas de polisacáridos una enfrente de otra, también puede producirse estos entrecruzamientos entre cadenas paralelas (véase la Figura 3.19). Figura 3.20 Pared celular aislada de una bacteria Gram positiva. Pared de peptidoglicano de Bacillus megaterium, bacteria Gram positiva. Las esferas de látex tienen un diámetro de 0.25 µm. 3.5 La pared de las células procariotas Ácido teicoico Peptidoglicano Ácido lipoteicoico 61 Membrana plasmática Espacio periplásmico Figura 3.21 Envoltura de una bacteria Gram positiva. Pared celular de las bacterias Gram negativas Incluso una observación rápida de la Figura 3.15 revela que la pared celular de las bacterias Gram negativas es mucho más compleja que la de las Gram positivas. La capa delgada de peptidoglicano, próxima a la membrana plasmática no O O P O– O CH2 H C O R CH2 O O P O– O CH2 H C O R CH2 O O P O– O Figura 3.22 Estructura del ácido teicoico. Fracción de ácido teicoico constituido por fosfato, glicerol y una cadena lateral, R. R puede representar D-alanina, glucosa u otras moléculas. constituye más del 5 al 10 % de todo el peso de la pared. En E. coli, es de unos 2 nm de grosor, y está formada sólo por una o dos capas de peptidoglicano. La membrana externa está situada por fuera de la capa fina de peptidoglicano (Figuras 3.23 y 3.24). La proteína de membrana más abundante es la lipoproteína de Braun, una pequeña lipoproteína unida covalentemente al peptidoglicano subyacente, e incluida en la membrana externa por su extremo graso hidrofóbico. La membrana externa y el peptidoglicano están tan firmemente unidos por esta lipoproteína que pueden aislarse como una unidad. Otra estructura que puede dar resistencia a la pared Gram negativa y mantener la membrana externa en su posición es el lugar de adhesión. Las membranas externa y plasmática parece que están en contacto directo en muchos lugares en la pared Gram negativa. En células plasmolizadas de E. coli, se han observado áreas de contacto de 20 a 100 nm entre las dos membranas. Los lugares de adhesión pueden ser regiones de contacto directo o posiblemente, de verdaderas fusiones de membrana. Se ha propuesto que las sustancias pueden desplazarse al interior de la célula a través de estos lugares de adhesión, en lugar de viajar a través del periplasma. Posiblemente, los constituyentes más inusuales y característicos de la membrana externa sean sus lipopolisacáridos (LPS). Estas moléculas grandes y complejas contienen tanto lípidos como hidratos de carbono, y están formadas por tres partes: 1) lípido A, 2) polisacárido central o core, y 3) cadena lateral O. No existe una estructura de LPS universal, el LPS que más se ha estudiado es el de Salmonella typhimurium, cuya estructura se describe en este texto (Figura 3.25). La región del lípido A contiene dos deriva- 62 Capítulo 3 Estructura y función de la célula procariota Porina Lipoproteína de Braun Cadenas laterales específicas O Lipopolisacáridos Membrana externa Espacio periplásmico y peptidoglicano Fosfolípidos Membrana plasmática Peptidoglicano Proteína integral Figura 3.23 Envoltura de una bacteria Gram negativa. Lipopolisacáridos Porina Fosfolípidos Lipoproteína de Braun Peptidoglicano Figura 3.24 Modelo químico de la membrana externa y estructuras asociadas de E. coli. Corte transversal a escala. La porina OmpF tiene dos canales en el frente (flechas negras), y uno por detrás (flecha blanca) del complejo proteico trímerico. Las moléculas de LPS pueden ser más largas que las representadas en la figura. 3.5 La pared de las células procariotas 63 Cadena O Core etanolamina etanolamina Lípido A Ácido graso (a) (b) Figura 3.25 Estructura de un lipopolisacárido. (a) Lipopolisacárido de Salmonella. Este diagrama, ligeramente simplificado, ilustra una forma de LPS. Abreviaturas: Abe, abecuosa; Gal, galactosa; Glu, glucosa; GlcN, glucosamina; Hep, heptulosa; KDO, 2-ceto-3-desoxioctulosónico; Man, manosa; NAG, N-acetilglucosamina; P, fosfato; Rha, L-ramnosa. (b) Modelo molecular del lipopolisacárido de E. coli. En este modelo, el lípido A y el core se han representado rectos; la cadena lateral O está en ángulo. dos del azúcar glucosamina, cada uno de ellos está unido a tres ácidos grasos y grupos fosfato o pirofosfato. El lípido A se encuentra inserto en la membrana externa, mientras que el resto de la molécula de LPS sobresale de la superficie. Un polisacárido central denominado core está unido al lípido A. En Salmonella, está formado por 10 azúcares, muchos de ellos con una estructura poco corriente. La cadena lateral O o antígeno O es una cadena polisacarídica más o menos larga que se extiende hacia fuera del núcleo. Puede poseer azúcares peculiares, variando la composición según la cepa bacteriana. Aunque las cadenas laterales O son fácilmente reconocibles por los anticuerpos del huésped, las bacterias Gram negativas pueden incapacitar las defensas del huésped cambiando rápidamente la naturaleza de sus cadenas laterales O para evitar su detección. La interacción de los anticuerpos con el LPS, antes de alcanzar la membrana externa propiamente dicha, puede también proteger a la pared celular frente a un ataque directo. Anticuerpos y antígenos (Capítulos 32 y 33). El LPS es importante por varias razones, además de las ya mencionadas de defensa frente al huésped. Contribuye a la carga negativa de la superficie bacteriana, ya que el poli- sacárido central contiene normalmente azúcares cargados y fosfato (Figura 3.25). El LPS facilita la estabilización de la estructura de la membrana. Además, el lípido A es a menudo tóxico, como consecuencia, el LPS puede actuar como una endotoxina (véase la sección 34.3) y causar algunos de los síntomas que se desarrollan en las infecciones por bacterias Gram negativas. Una de las funciones más importantes de la membrana externa es servir como barrera protectora. Evita o disminuye la entrada de sales biliares, antibióticos y otras sustancias tóxicas que podrían destruir o lesionar a la bacteria. También, la membrana externa es incluso más permeable que la plasmática y permite el paso de moléculas pequeñas, como glucosa y otros monosacáridos. Esto se debe a la presencia de proteínas porinas (Figuras 3.23 y 3.24). Se agrupan tres moléculas de porina y se extienden a través de la membrana externa para formar un canal estrecho a través del cual pueden pasar moléculas menores de 600 a 700 dalton. Moléculas mayores, como la vitamina B12, pueden transportarse a través de la membrana externa mediante transportadores específicos. La membrana externa evita también la pérdida de constituyentes como las enzimas periplásmicas. 64 Capítulo 3 Estructura y función de la célula procariota Mecanismo de la tinción de Gram Aunque se han propuesto varias explicaciones sobre el fundamento de la tinción de Gram, parece probable que la diferencia entre las bacterias Gram negativas y Gram positivas se deba a la naturaleza física de sus paredes celulares. Si la pared celular se elimina en las bacterias Gram positivas, éstas se convierten en Gram negativas. El peptidoglicano no se tiñe propiamente, más bien, parece que actúa como barrera de permeabilidad para evitar la pérdida de cristal violeta. Durante el proceso, las bacterias se tiñen primero con cristal violeta, y luego se tratan con yoduro para favorecer la retención del colorante. Cuando a continuación se decoloran las bacterias Gram positivas con etanol-acetona, se cree que el alcohol contrae los poros de la gruesa capa de peptidoglicano. En consecuencia, el complejo colorante-yodo no es eliminado durante la fase de decoloración y las bacterias continuarán de color morado. Por el contrario, la capa de peptidoglicano de las bacterias Gram negativas es muy fina, sin tantos enlaces y con poros de mayor tamaño, además, también es posible que el tratamiento con alcohol extraiga suficientes lípidos de la envoltura de las células Gram negativas, como para aumentar su porosidad. Por estos motivos, el alcohol elimina más fácilmente el complejo cristal violeta-yodo en las bacterias Gram negativas. La pared celular y protección osmótica La pared celular es necesaria normalmente para proteger a las bacterias frente a la destrucción por presión osmótica. Los solutos están mucho más concentrados en el citoplasma bacteriano que en la mayoría de hábitat microbianos, que son hipotónicos. Durante la ósmosis, el agua se desplaza a través de membranas selectivamente permeables, como la membrana plasmática, desde soluciones diluidas (concentración mayor de agua) a soluciones más concentradas (concentración menor de agua). Por ello, el agua entra normalmente en las células bacterianas, y la presión osmótica puede alcanzar 20 atmósferas (20 kg/cm2). La membrana plasmática no podría soportar estas presiones y la célula se hincharía, alterándose físicamente y destruyéndose, proceso denominado lisis, sin la presencia de la pared, que resiste la hinchazón celular y la protege. Por el contrario, en hábitat hipertónicos Inhibición de la síntesis de la pared celular por penicilina. Incubación en un medio con sacarosa los solutos están más concentrados que en la célula, por ello, el agua fluye hacia fuera y el citoplasma se contrae. Este fenómeno se denomina plasmólisis y es útil en la conservación de alimentos, pues muchos microorganismos no pueden crecer en alimentos secos y jaleas, al no poder evitar la deshidratación (véanse las pp. 128-131, Capítulo 41). La importancia de la pared celular en la protección bacteriana frente a la lisis osmótica se ha demostrado al tratarlas con lisozima o penicilina. La enzima lisozima ataca al peptidoglicano, al hidrolizar el enlace que une el ácido N-acetilmurámico con el carbono cuatro de la N-acetilglucosamina. La penicilina inhibe la síntesis del peptidoglicano (véase la sección 35.6). Si se incuban bacterias con penicilina en una solución isotónica, las bacterias Gram positivas se convierten en protoplastos, sin pared celular, pero en medios isotónicos pueden continuar creciendo. Las células Gram negativas conservan la membrana externa después del tratamiento con penicilina y se denominan esferoplastos porque conservan parte de su pared celular. Los protoplastos y esferoplastos son osmóticamente sensibles. Si se transfieren a una solución diluida se lisarán debido a la entrada descontrolada de agua (Figura 3.26). Aunque la mayoría de las bacterias precisan de una pared celular intacta para sobrevivir, algunas carecen de ella por completo. Por ejemplo, los micoplasmas no la tienen, aunque pueden crecer en medios diluidos o ambientes terrestres porque su membrana plasmática es más resistente de lo normal. Se desconoce la razón exacta de ello, aunque la presencia de esteroles en las membranas de muchas especies puede ofrecer una resistencia añadida. Sin una pared celular rígida, los micoplasmas tienden a ser pleomórficos, variables en cuanto a forma. 1. Describa con detalle la composición y la estructura del peptidoglicano, y de la pared celular de las bacterias Gram positivas y Gram negativas. Incluya diagramas con leyendas en la respuesta. 2. Defina o describa los siguientes términos: membrana externa, espacio periplásmico, envoltura, ácido teicoico, lipopolisacárido y porina. 3. Explique el papel de la pared celular como protectora frente a la lisis, y cómo puede demostrarse experimentalmente. ¿Qué son los protoplastos y esferoplastos? Transferencia a un medio diluido Hinchazón debida a la entrada de H2O Lisis Protoplasto H2O Figura 3.26 Formación de un protoplasto. Formación de un protoplasto inducida por incubación con penicilina en un medio isotónico. La transferencia a un medio diluido producirá su lisis. 3.6 Componentes externos a la pared celular 65 3.6 Componentes externos a la pared celular Las bacterias tienen una variedad de estructuras fuera de la pared celular que sirven para proteger a la célula, fijarla a objetos o permitir su desplazamiento. A continuación, se describen algunas de estas estructuras. Cápsulas, «slime» y capas S Algunas bacterias poseen una capa de material fuera de la pared celular. Cuando una capa está bien organizada y no se elimina fácilmente, se denomina cápsula. «Slime» es una capa de material difuso, no organizado, que se puede eliminar fácilmente. El glicocálix (Figura 3.27) es una red de polisacáridos que se extiende desde la superficie de las bacterias y otras células (en este sentido, englobaría los términos cápsula y «slime»). Las cápsulas y el «slime» están compuestos normalmente por polisacáridos, pero pueden estar constituidas por otros materiales. Por ejemplo, Bacillus anthracis posee una cápsula de ácido poli-D-glutámico. Las cápsulas son claramente visibles con el microscopio óptico cuando se emplean tinciones negativas o especiales para cápsulas (Figura 3.27a), pero se pueden estudiar también con el microscopio electrónico (Figura 3.27b). glicocálix Figura 3.28 Glicocálix bacteriano. Las bacterias se conectan entre sí y con la pared intestinal por sus glicocálices, redes de fibras que se extienden desde las células (× 17 500). Aunque las cápsulas no son necesarias para el crecimiento y multiplicación bacterianas en cultivos de laboratorio, confieren varias ventajas a las bacterias cuando éstas crecen en su hábitat normal. Les ayudan a resistir la fagocitosis por células fagocíticas. Streptococcus pneumoniae es un ejemplo clásico. Cuando carece de cápsula se destruye fácilmente y no causa enfermedad, mientras que la variante capsulada mata rápidamente a ratones infectados. La cápsula contiene una gran cantidad de agua y puede proteger a las bacterias frente a la desecación. Evitan los virus bacterianos y la mayoría de los materiales tóxicos hidrofóbicos, como detergentes. El glicocálix ayuda también a las bacterias a fijarse a objetos sólidos en medios acuáticos, o a superficies tisulares en huéspedes vegetales y animales (Figura 3.28). Las bacterias deslizantes a menudo producen un «slime» que le ayuda en su movilidad (véase el Recuadro 21.1). Relación entre polisacáridos de superficie, fagocitosis y colonización del huésped (Capítulos 31 y 34). (a) gli (b) Figura 3.27 Cápsulas bacterianas. (a) Klebsiella pneumoniae con su cápsula teñida para poder observarla con el microscopio óptico (× 1500). (b) Glicocálix (gli) de Bacteroides, MET (× 71 250). Muchas bacterias Gram positivas y Gram negativas tienen una capa regularmente estructurada, denominada capa S, sobre su superficie. Las capas S son también comunes en Archaea, en las que pueden constituir la única estructura de pared, fuera de la membrana plasmática. La capa S tiene un modelo estructural similar a la distribución de baldosas en un suelo y está compuesta por proteínas y glicoproteínas (Figura 3.29). En las bacterias Gram negativas, la capa S se adhiere directamente a la membrana externa; en las Gram positivas, está asociada con la superficie del peptidoglicano. Puede proteger a la célula frente a fluctuaciones iónicas y de pH, estrés osmótico, enzimas, o frente a la bacteria depredadora Bdellovibrio (véase la sección 22.4). La capa S ayuda también a mantener la forma y rigidez de la envoltura en, al menos, algunas células bacterianas. Puede facilitar la adhesión a superficies. Finalmente, esta capa parece que protege 66 Capítulo 3 Estructura y función de la célula procariota gados, compuestos por subunidades de proteínas organizadas helicoidalmente, de 3 a 10 nm de diámetro, aproximadamente, pudiendo alcanzar varios µm de longitud. Algunos tipos de fimbriae fijan las bacterias a superficies sólidas, como rocas en riachuelos, y a los tejidos del huésped. Los pili sexuales (s., pilus) son apéndices similares, aproximadamente 1 a 10 por célula, que se diferencian de las fimbriae por lo siguiente. Los pili sexuales son más anchos que las fimbriae (aproximadamente, de 9 a 10 nm de diámetro), están determinados genéticamente por factores sexuales o plásmidos conjugativos, y son necesarios para la conjugación bacteriana (véase el Capítulo 13). Algunos virus bacterianos se fijan específicamente a receptores en los pili sexuales al comienzo de su ciclo de multiplicación. Flagelos y movilidad Figura 3.29 Capa S. Microfotografía electrónica de la capa S de Deinococcus radiodurans después de sombrearla. a algunos agentes patógenos frente al ataque del complemento y de la fagocitosis, contribuyendo con ello a su virulencia. Pili y fimbriae Muchas bacterias Gram negativas poseen apéndices cortos, finos, similares a pelos, más delgados que los flagelos y que, normalmente, no participan en la movilidad celular. Se denominan fimbriae (s., fimbria). Aunque una célula puede estar cubierta por un número de hasta 1000 fimbriae, sólo son visibles con el microscopio electrónico debido a su pequeño tamaño (Figura 3.30). Aparecen como tubos del- La mayoría de las bacterias móviles se desplazan mediante flagelos, apéndices locomotores en forma de hilos que se extienden hacia fuera de la membrana plasmática y de la pared celular. Son estructuras delgadas, rígidas, de casi 20 nm de ancho y hasta 15-20 µm de largo. Los flagelos son tan delgados que no pueden observarse directamente con un microscopio de campo claro, sino que deben teñirse con técnicas especiales para aumentar su grosor (véase el Capítulo 2). La estructura detallada de un flagelo puede verse solamente con el microscopio electrónico (Figura 3.30). Las especies bacterianas difieren a menudo claramente por sus modelos de distribución de flagelos. Las bacterias monotricas (trichous significa pelo) tienen sólo un flagelo; si se sitúa al final, se denomina flagelo polar (Figura 3.31a). Las bacterias anfitricas (amphi significa «en ambos lados») tienen un único flagelo en cada polo. Por el contrario, las bacterias lofotricas (lopho significa mechón) poseen un grupo de flagelos en uno o ambos extremos (Figura 3.31b). Los flagelos se distribuyen bastante uniformemente sobre toda la superficie en las bacterias peritricas (peri significa «alrededor») (Figura 3.31c). Los modelos de distribución de los flagelos son muy útiles para identificar las bacterias. Ultraestructura flagelar Figura 3.30 Flagelos y fimbriae. Los flagelos largos y las numerosas fimbriae cortas son evidentes en esta microfotografía electrónica de Proteus vulgaris (× 39 000). Estudios con el microscopio electrónico de transmisión han demostrado que el flagelo bacteriano está compuesto por tres partes. 1) La parte más larga y expuesta es el filamento, que se extiende desde la superficie celular hasta la punta. 2) El cuerpo basal, inserto en la célula; y 3) el gancho, un segmento curvado y corto, que une el filamento al cuerpo basal y actúa como acoplamiento flexible. El filamento es un cilindro rígido y hueco constituido por una proteína sencilla, denominada flagelina, cuyo peso molecular varía de 30 000 a 60 000. El filamento acaba en una proteína «capuchón». Algunas bacterias tienen vainas rodeando a los flagelos, como en Bdellovibrio, Helicobacter pylori y Vibrio cho- 3.6 Componentes externos a la pared celular 67 lerae, cuyo flagelo polar está cubierto por una extensión de la membrana externa. El gancho y el cuerpo basal son diferentes estructuralmente al filamento (Figura 3.32). El gancho, ligeramente más ancho que el filamento, está formado por diferentes subunidades de proteínas. El cuerpo basal es la parte más compleja de un flagelo (Figura 3.32 y Figura 3.33). En E. coli y la mayoría de las bacterias Gram negativas, el cuerpo tiene cuatro anillos unidos por una vástago central. Los anillos externos L y P se asocian con las capas de lipopolisacárido y peptidoglicano, respectivamente. El anillo interno M contacta con la membrana plasmática. Las bacterias Gram positivas tienen sólo dos anillos en el cuerpo basal, uno interno en comunicación con la membrana plasmática y otro externo, unido probablemente a la capa de peptidoglicano. (a) Síntesis de los flagelos (b) La síntesis de los flagelos es un proceso complejo en el que participan al menos de 20 a 30 genes. Además del gen de la flagelina, 10 o más genes codifican la síntesis de las proteínas del gancho y del cuerpo basal; otros genes controlan la construcción o función de los flagelos. Se desconoce el mecanismo por el cual la célula regula o determina la localización exacta de los flagelos. Se pueden eliminar los flagelos bacterianos para poder estudiar la regeneración de los filamentos flagelares. Se piensa que las subunidades de flagelina son transportadas a través del núcleo interno del hueco del filamento. Cuando alcanzan la punta, las subunidades se agregan espontáneamente, de manera que el filamento crece por su extremo, en lugar de por su base (Figura 3.34). La síntesis del filamento es un ejemplo excelente de autoensamblaje. Muchas otras estructuras se forman espontáneamente mediante la asociación de sus partes estructurales, sin la ayuda de enzimas especiales u otros factores. La información necesaria para construir un filamento está presente en la propia estructura de la subunidad de flagelina. Mecanismo del movimiento flagelar (c) Figura 3.31 Distribución de flagelos. Ejemplos de varios modelos de distribución de flagelos, tal como se observan con el microscopio óptico. (a) Monotrica polar (Pseudomonas). (b) Lofotrica (Spirillum). (c) Peritrica (Proteus vulgaris, × 600). Barras = 5 µm. Los flagelos de procariotas funcionan de distinta forma que los de eucariotas. El filamento tiene forma de hélice rígida y la bacteria se mueve cuando esta hélice gira. Numerosas pruebas han demostrado que los flagelos actúan justo como las hélices de un barco. Mutantes de bacterias con flagelos rectos o con ganchos anormalmente largos (mutantes poliganchos) no pueden nadar. Cuando se fijan bacterias a un portaobjetos de vidrio usando anticuerpos frente a las proteínas del filamento o del gancho, la célula gira rápidamente sobre el flagelo inmóvil. Si se fijan esferas de poliestireno-látex a los flagelos, éstas giran sobre el eje flagelar debido a la rotación del flagelo. El motor del flagelo puede girar muy rápidamente. El de E. coli gira a 270 revolucio- 68 Capítulo 3 Estructura y función de la célula procariota Figura 3.32 Ultraestructura de flagelos en bacterias Gram negativas. (a) Flagelos de Escherichia coli teñidos negativamente (× 66 000). Las flechas indican el lugar de los ganchos y de los cuerpos basales. (b) Vista aumentada del cuerpo basal de un flagelo de E. coli (× 485 000). Pueden observarse los cuatro anillos (L, P, S y M) con claridad. La flecha más superior se encuentra en la unión del gancho con el filamento. Barra = 30 nm. (a) (b) nes por segundo; el de Vibrio alginolyticus tiene una media de 1100 rps. Flagelos de eucariotas y movilidad (pp. 93-95). La dirección de la rotación flagelar determina la naturaleza del movimiento bacteriano. En las bacterias monotricas, el flagelo polar gira en dirección contraria a las agujas de un reloj (vistas desde fuera de la célula) durante el movimiento normal de avance, mientras que la célula rota lentamente cuando el flagelo gira en la dirección de las agujas del reloj. El giro del filamento helicoidal del flagelo empuja la célula hacia adelante (Figura 3.35). Las bacterias monotricas se paran y giran al azar, cambiando la dirección de la rotación flagelar. Las bacterias flageladas peritricas actúan de forma similar; para avanzar, los flagelos giran en dirección contraria a las agujas de un reloj. Al hacer este movimiento, se doblan Filamento Gancho Anillo L Membrana externa Capa de peptidoglicano Anillo P Vástago Anillo S Espacio periplásmico Membrana plasmática Anillo M 22 nm (a) (b) Figura 3.33 Ultraestructura de los flagelos bacterianos. Cuerpo basal y gancho de un flagelo en bacterias Gram negativas (a) y Gram positivas (b). 3.6 Componentes externos a la pared celular 69 Flagelina Membrana externa Peptidoglicano Membrana plasmática mRNA Ribosoma Figura 3.34 Crecimiento de los filamentos flagelares. Las subunidades de flagelina viajan a través del núcleo hueco del flagelo y se fijan al extremo en crecimiento. por sus ganchos para formar un haz giratorio que impulsa a las células hacia delante. La rotación de los flagelos en sentido de las agujas de un reloj altera el haz y la célula da un giro. Hacia delante (a) Giro (b) Hacia delante (c) Giro (d) Figura 3.35 Movilidad flagelar. Relación entre la rotación flagelar y el movimiento bacteriano. Las partes (a) y (b) describen el movimiento de bacterias monotricas polares. Las partes (c) y (d) ilustran el movimiento de organismos peritricos. Como las bacterias nadan por rotación de sus flagelos rígidos, debe existir una especie de motor en su base. Un vástago se extiende desde el gancho hasta el anillo M, que puede girar libremente en la membrana plasmática (Figura 3.36). Se piensa que el anillo S está unido a la pared celular en bacterias Gram positivas y no gira. Los anillos P y L de las bacterias Gram negativas actuarían como cojinetes del vástago de rotación. Algunas evidencias apoyan la hipótesis de que el cuerpo basal es una estructura pasiva y gira dentro de un complejo proteico incluido en la membrana, más bien como el giro del rotor de un motor eléctrico en el centro de un anillo de electroimanes (el estátor). El mecanismo exacto que dirige la rotación del cuerpo basal está aún por aclarar. La Figura 3.36 nos ofrece una imagen más detallada del cuerpo basal en bacterias Gram negativas. La parte correspondiente al rotor estaría formada primordialmente por el vástago, el anillo M y un anillo C unido a él sobre la cara citoplasmática del cuerpo basal. Estos dos anillos están compuestos de proteínas; Fli G es particularmente importante para generar la rotación flagelar. Las dos proteínas más importantes del estátor del motor son Mot A y Mot B. Ambas forman un canal de protones a través de la membrana citoplasmática, y Mot B fijaría el complejo Mot al peptidoglicano. Algunos experimentos sugieren que Mot A y Fli G interactúan directamente durante la rotación flagelar. La rotación flagelar en procariotas sería dependiente del gradiente de protones o sodio, y no del ATP como en eucariotas. El flagelo es un aparato natatorio muy eficaz. Desde el punto de vista bacteriano, la natación es casi una necesidad 70 Capítulo 3 Estructura y función de la célula procariota Filamento 1. Describa brevemente: cápsula, capa mucosa, glicocálix y capa S. ¿Cuáles son sus funciones? 2. Distinga entre fimbriae y pili sexuales y explique la función de cada uno. 3. Discuta los temas siguientes: modelos de distribución flagelar; estructura y síntesis de flagelos; mecanismo por el que los flagelos hacen mover a las bacterias. Gancho Anillo L Anillo P Membrana externa H+ go sta S Vá illo An Peptidoglicano Espacio periplásmico Anillo M Membrana plasmática Mot B Mot A Fli G i y Anillo C Fli M, N t Figura 3.36 Mecanismo del movimiento flagelar. En este diagrama del flagelo de una bacteria Gram negativa se muestran algunos de los componentes más importantes del mismo, así como el flujo de protones que dirige la rotación. Se señalan cinco de las numerosas proteínas implicadas (Mot A, Mot B, Fli G, Fli M, Fli N). porque el agua circundante les parece tan espesa y viscosa como la melaza. Si la actividad flagelar cesa, la célula se detiene casi instantáneamente. A pesar de esta resistencia ambiental al movimiento, las bacterias pueden nadar de 20 a casi 90 µm/segundo. Esto equivale a viajar a una velocidad de 2 a más de 100 veces la longitud celular por segundo. Como ejemplo, una persona de 1.80 m, excepcionalmente rápida, podría correr unas 5 veces su altura por segundo. Las bacterias se pueden mover por otros mecanismos diferentes a la rotación flagelar. Las espiroquetas y las bacterias helicoidales se desplazan en medios viscosos, como el fango, mediante movimientos de flexión y giro producidos por un filamento axial especial (véase la sección 21.6). Muchas bacterias emplean tipos de movilidad muy diferentes, como por ejemplo la movilidad por deslizamiento: cianobacterias (véase la sección 21.3), mixobacterias (véase la sección 22.4), citofagas (véase la sección 21.7), algunos micoplasmas (véase la sección 23.1). Algunos fimbriae contráctiles y otras estructuras no bien determinadas podrían estar involucrados en estos tipos alternativos de movilidad, que permiten velocidades de deslizamiento por superficies sólidas de hasta 3 µm/segundo. Mecanismo de la movilidad por deslizamiento (Recuadro 21.1). 3.7 Quimiotaxis Las bacterias no siempre nadan sin sentido, sino que son atraídas por nutrientes como azúcares y aminoácidos, y repelidas por muchas sustancias peligrosas y productos residuales bacterianos. (Las bacterias pueden también responder a otras señales ambientales, como temperatura, luz y gravedad; Recuadro 3.3). El movimiento hacia o en contra de sustancias se conoce como quimiotaxis. Este comportamiento ofrece obviamente ventajas a las bacterias. La quimiotaxia se puede demostrar observando las bacterias en un gradiente químico producido cuando se llena un tubo fino capilar con un atrayente y se introduce en una suspensión bacteriana. A medida que el atrayente difunde desde el extremo del capilar, las bacterias se agrupan y nadan hasta el tubo. El número de bacterias dentro del capilar, después de un tiempo corto refleja la fuerza de atracción y el grado de quimiotaxis. También se puede estudiar la quimiotaxis positiva y negativa con cultivos en placas de petri (Figura 3.37). Si se colocan las bacterias en el centro de una placa de agar nutritivo que contiene un atrayente, aquéllas acabarán el nutriente local y luego, nadarán hacia delante en favor del gradiente formado por la sustancia atrayente. El resultado es un anillo de bacterias en expansión. Cuando se coloca un disco con un repelente en una placa de petri que contiene agar semisólido y bacterias, éstas nadarán en dirección contraria al repelente, creando una zona clara alrededor del disco (Figura 3.38). Las bacterias pueden responder a niveles muy bajos de sustancias atrayentes (casi 10–8 M para algunos azúcares), aumentando la magnitud de su respuesta con la concentración del atrayente. Normalmente, sólo detectan la presencia de repelentes a concentraciones elevadas. Si hay un atrayente y un repelente, la bacteria comparará ambas señales y responderá a la sustancia química cuya concentración sea más eficaz. Los atrayentes y los repelentes se detectan por quimiorreceptores, proteínas especiales que se unen a sustancias químicas y transmiten señales a otros componentes del sistema quimiosensor. De momento, se han descubierto unos 20 quimioatrayentes y 10 quimiorrepelentes. Estas proteínas quimiorreceptoras pueden estar situadas en el espacio periplásmico o en la membrana plasmática. Algunos receptores participan en las fases iniciales del transporte de azúcares al interior de la célula. 3.7 Quimiotaxis Figura 3.37 Quimiotaxis bacteriana positiva. Se puede demostrar la quimiotaxis sobre un medio de cultivo sólido conteniendo varios nutrientes. A la izquierda, quimiotaxia positiva de Escherichia coli. El anillo exterior está constituido por bacterias que consumen serina. El segundo anillo se ha formado por E. coli consumidoras de aspartato, una sustancia con menor poder quimiotáctico. La colonia situada en la parte superior derecha está constituida por mutantes móviles, pero no quimiotácticos. La colonia de la parte inferior derecha está formada por bacterias no móviles. El comportamiento quimiotáctico de las bacterias se ha investigado con el microscopio de seguimiento (trazado), microscopio con una pantalla móvil que permite automáticamente mantener en observación una bacteria individual. En ausencia de un gradiente químico, E. coli y otras bacterias se mueven al azar. Una bacteria se desplaza en línea recta o ligeramente curva, carrera, durante unos segundos; luego, para y gira. Este último movimiento continúa con una carrera en otra dirección (Figura 3.39). Cuando se expone una bacteria a un gradiente atrayente, gira con menos frecuencia (o realiza carreras más largas) cuando se desplaza a favor del gradiente, pero lo hace con una frecuencia normal si se mueve en contra del gradiente. En consecuencia, la bacteria se mueve a favor del gradiente. El comportamiento bacteriano depende de cambios temporales en la concentración química: la bacteria compara su medio actual con el experimentado momentos antes; si la concentración del atrayente es superior, se suprimen los giros y la carrera es más larga. La respuesta opuesta se produce con un gradiente repelente. El movimiento de giro disminuye (la carrera se alarga), por consiguiente, la bacteria se desplaza en dirección contraria al gradiente del repelente. Aunque la quimiotaxis bacteriana, movimiento dirigido, parece una acción deliberada, debemos tener presente que no lo es. Cuando el entorno ambiental es constante, las bac- 71 terias tienden a moverse aleatoriamente. Es decir, se produce una secuencia aleatoria de carreras seguidas de giros. Si una carrera se produce en un sentido que mejora las condiciones, se suprimen los giros por lo que la bacteria correrá hacia esa favorable condición ambiental. Se dice que es una trayectoria basada en el azar pero que en suma va hacia agentes atrayentes y escapa de repelentes. En definitiva, las células individuales no escogen una particular dirección, sino que deciden si continuar o no en la misma dirección. Se han realizado numerosos trabajos sobre el mecanismo de la quimiotaxis en Escherichia coli. Recuérdese que el movimiento hacia delante se debe a la rotación del flagelo en dirección contraria a las agujas de un reloj, mientras que los giros se producen por la rotación en dirección de las agujas del reloj. Las bacterias deben ser capaces de responder a gradientes, de tal forma que se agrupen en regiones con nutrientes y de un nivel adecuado de oxígeno, mientras que deben evitar materiales tóxicos. E. coli posee cuatro quimiorreceptores diferentes que reconocen serina; aspartato y maltosa; ribosa y galactosa; y dipéptidos, repectivamente. Estos quimiorreceptores se denominan a menudo proteínas de quimiotaxis metilaceptoras (PQM). Parece ser que en bacterias bacilares como E. coli se localizan en los extremos. Las PQM no influyen directamente sobre la rotación flagelar, sino que actúan a través de una serie de proteínas. Figura 3.38 Quimiotaxis bacteriana negativa. Quimiotaxis negativa de E. coli como respuesta al repelente acetato. Los discos claros son de agar conteniendo acetato, colocados en la placa de petri con agar diluido inoculado con E. coli. La concentración de acetato aumenta desde cero, en la parte superior derecha, hasta 3 M, en la parte superior izquierda. Obsérvese la correlación entre el aumento de acetato con el incremento del diámetro de las zonas libres de bacterias. Las bacterias han migrado durante 30 minutos. 72 Capítulo 3 Estructura y función de la célula procariota Giro Carrera 1. Defina quimiotaxis, carrera y giros. 2. Explique de forma general la manera en que las bacterias son atraídas por sustancias como nutrientes, y repelidas por materiales tóxicos. (a) (b) Figura 3.39 Movimiento dirigido en bacterias. (a) Movimiento al azar de una bacteria en ausencia de un gradiente de concentración. La frecuencia de giros es bastante constante. (b) Movimiento en un gradiente atrayente. La frecuencia de giros se reduce cuando la bacteria se mueve a favor del gradiente. Por ello, las carreras en favor de un atrayente en aumento son más largas. Todo el proceso es tan eficiente que un estímulo puede disparar una respuesta motora en menos de 200 milésimas de segundos. Los fundamentos moleculares de la quimiotaxia son bastante complejos. Implica cambios conformacionales de proteínas, metilación y foforilación de proteínas. Cuando un atrayente, como por ejemplo un nutriente, no se une a una PQM, la proteína Che A es forforilada vía ATP. Esta proteína fosforilada puede entonces ceder su fosfato a la proteína Che Y, que interaccionará entonces con Fli M en la base del flagelo para inducir una rotación a favor de las agujas del reloj provocando un giro. Un incremento en la concentración de nutrientes facilitará una mayor interacción de PQM con los mismos, por lo que Che A quedará defosforilada, provocando una rotación en contra de las agujas del reloj, es decir, una carrera. Cuando no se encuentren en el medio ni atrayentes ni repelentes, el sistema mantiene unos niveles intermedios de Che A fosforilada y Che Y fosforilada, que producirá una trayectoria normal aleatoria. En términos muy generales, el sistema dispone de una proteína sensora que puede ser fosforilada y entonces ésta fosforile a otra proteína para inducir una respuesta. Como veremos más adelante, a este sistema se le denomina «sistema fosforilable de dos componentes». Los detalles moleculares del sistema de quimiotaxia se describirán en el Capítulo 12, una vez sea discutido el sistema general de dos componentes. Por otra parte, debe destacarse que un sistema similar se utiliza para responder a otros factores ambientales como el oxígeno (aerotaxia), luz (fototaxia), temperatura (termotaxia) y presión osmótica (osmotaxia). Sistemas fosforilables de dos componentes (pp. 305-307). 3.8 Endospora bacteriana Diversas bacterias Gram positivas pueden formar una estructura latente, de especial resistencia, denominada endospora. Las endosporas se desarrollan dentro de células bacterianas vegetativas de tan sólo algunos géneros como: Bacillus y Clostridium (bacilos), y Sporosarcina (cocos). Estas estructuras son extraordinariamente resistentes a situaciones estresante ambientales, como calor, radiación ultravioleta, desinfectantes químicos y desecación. De hecho, algunas endosporas han permanecido viables durante unos 100 000 años, habiéndose recuperado vivas endosporas de actinomicetos (que no son auténticas endosporas), después de haber estado enterradas en el barro durante 7500 años. Debido a su resistencia y al hecho de que varias especies de bacterias formadoras de endosporas son agentes patógenos peligrosos, las endosporas tienen una gran importancia en microbiología alimentaria, industrial y médica. Las endosporas sobreviven a menudo la cocción durante una o más horas; por ello, hay que emplear autoclaves (véase el Capítulo 7) para esterilizar muchos materiales. Las endosporas tienen también un interés teorético considerable. Como las bacterias producen estas entidades intrincadas de una manera muy organizada, en pocas horas, la formación de endosporas es un tema muy conveniente para investigar la construcción de estructuras biológicas complejas. En el ambiente, las endosporas permiten la supervivencia de las bacterias cuando la humedad o los nutrientes son escasos. Resistencia de endosporas a temperaturas elevadas (Capítulo 7). Las endosporas se pueden examinar con los microscopios óptico y electrónico. Como las endosporas son impermeables a la mayoría de los colorantes, a menudo se observan como áreas incoloras en bacterias tratadas con azul de metileno y otros colorantes; se han utilizado tinciones especiales para endosporas con el fin de poder verlas mejor (véase el Capítulo 2). La situación de la endospora en la célula madre, o esporangio, difiere frecuentemente según la especie, teniendo por ello un valor considerable en la identificación. Las endosporas pueden estar situadas centralmente, cerca de un extremo (subterminal), o claramente terminales (Figura 3.40). A menudo, una endospora es tan grande que hincha el esporangio. Microfotografías electrónicas muestran que la estructura de la endospora es compleja (Figura 3.41). La endospora está a menudo rodeada por una capa delicada y delgada, denominada exosporio. La cubierta de la endospora se encuentra debajo del exosporio, es responsable de la birre- 3.8 Endospora bacteriana 73 (a) Figura 3.42 Ácido dipicolínico. (b) (d) (c) Figura 3.40 Ejemplos de localización y tamaño de endosporas. (a) Endospora central. (b) Endospora subterminal. (c) Endospora terminal. (d) Endospora terminal con esporangio hinchado. fringencia característica en observaciones microscópicas, ya que está compuesta por varias capas de proteínas hidrófobas, pudiendo ser bastante gruesa. El córtex, que puede ocupar tanto como la mitad del volumen celular, descansa debajo de la cubierta de la endospora. Está constituida por un peptidoglicano modificado, con menos enlaces que en las células vegetativas. La pared celular de la endospora se encuentra dentro del córtex y rodea al protoplasto. El protoplasto contiene las estructuras celulares normales como ribosomas y un nucleoide, pero es metabólicamente inerte. Aún no se ha determinado con precisión por qué la endospora es tan resistente al calor y a otros agentes letales, R N PP CX CE EX Figura 3.41 Estructura de una endospora. Endospora de Bacillus anthracis (× 151 000). Obsérvense las siguientes estructuras: exosporio, EX; cubierta de la endospora, CE; córtex, CX; pared del protoplasto, PP; y el protoplasto con su nucleoide, N y los ribosomas, R. aunque se dispone de algunos datos muy sugerentes. Por ejemplo, tanto como el 15 % del peso seco de la endospora consiste en ácido dipicolínico formando complejos con iones de calcio en el protoplasto (Figura 3.42). Desde hace mucho tiempo se ha creído que el ácido dipicolínico era responsable directo de la resistencia al calor de las endosporas, aunque recientemente se han aislado mutantes termorresistentes que carecen de ácido dipicolínico. Es conocido que el calcio sí que protege frente al calor húmedo, agentes oxidantes e incluso, a veces, frente al calor seco. Quizás, el complejo dipicolinato cálcico estabilice los ácidos nucleicos de la endospora. Recientemente, se han descubierto en endosporas pequeñas proteínas, acidosolubles, ligadas al DNA, que saturan el DNA de la endospora y la protegen frente al calor, la radiación, la desecación y las sustancias químicas. La deshidratación del protoplasto parece que es muy importante en la resistencia al calor. El córtex puede eliminar osmóticamente agua del protoplasto, y con ello proteger a la célula frente, tanto al calor como a una lesión por radiación. La cubierta de la endospora también parece protegerla frente a enzimas y otros compuestos químicos como el peróxido de hidrógeno. Por último, las endosporas contienen diversas enzimas de reparación del DNA. De esta forma el DNA puede ser reparado durante la germinación una vez que el protoplasto es de nuevo activo. En resumen, en la termorresistencia de las endosporas estén probablemente involucrados varios mecanismos: estabilización del DNA por dipicolinato cálcico y proteínas acidosolubles, deshidratación del protoplasto, y una mayor estabilidad de las proteínas en bacterias adaptadas a crecer a temperaturas elevadas, entre otras. La formación de endosporas, esporogénesis o esporulación, comienza normalmente cuando cesa el crecimiento debido a una falta de nutrientes. Se trata de un proceso complejo y puede dividirse en varias fases (Figura 3.43). Primero se forma un filamento axial de material nuclear (fase I), seguido de un plegamiento interno de la membrana celular para englobar una de las hebras de DNA, formándose el septo de la prespora (fase II). La membrana continúa creciendo y engloba a la endospora inmadura con una segunda membrana (fase III). A continuación, se elabora el córtex en el espacio situado entre las dos membranas, donde se acumulan tanto calcio como ácido dipicolínico (fase IV). Después, se forman las cubiertas de proteínas (fase V), y madura la endospora (fase VI). Finalmente, las enzimas líticas destruyen el esporangio liberando la endospora (fase VII). La esporulación precisa solamente de 10 horas en Bacillus megaterium. Regulación de la esporulación en Bacillus (pp. 303, 305-306). 74 Capítulo 3 Estructura y función de la célula procariota 0.25 h N N División celular Pared Espora libre 10.5 I Formación Cubierta del filamento VII Córtex axial Lisis del Protoplasto esporangio, modificado liberación de Membrana la espora plasmática Cubierta de la endospora N Exosporio CX CE MEP VI Terminación de la síntesis de la cubierta, incremento en la refractilidad y la termorresistencia S M 4 DNA II Formación del septo Exosporio V Síntesis de la cubierta Córtex 8 IV Formación del córtex III Englobamiento de la preespora CX MEP N CE MIP MIP MEP N 5.5 N 6.5 Figura 3.43 Formación de una endospora: ciclo vital de Bacillus megaterium. Las fases se señalan con números romanos. Los números de los círculos indican el número de horas desde el final de la fase logarítmica. 0.25 h: célula vegetativa típica; 4 h: célula en fase II, septación; 5.5 h: célula en fase III, englobamiento; 6.5 h: célula en fase IV, formación del córtex; 8 h: célula en fase V, formación de la cubierta; 10.5 h: célula en fase VI, endospora madura en el esporangio. Abreviaturas utilizadas: CX, córtex; MIP y MEP, membranas interna y externa de la prespora, respectivamente; M, mesosoma; N, nucleoide; S, septo; CE, cubierta de la endospora. Barras = 0.5 µm. Resumen 75 germinará satisfactoriamente, incluso en un medio rico en nutrientes, salvo que haya sido activada. La activación es un proceso reversible que prepara a las endosporas para su germinación, y se produce normalmente como resultado de tratamientos, como el calentamiento. Está seguida de la germinación, esto es, la finalización del estado de reposo de la endospora. Este proceso se caracteriza por hinchazón de la endospora, rotura o absorción de la cubierta de la endospora, pérdida de resistencia al calor y a otros factores estresantes, pérdida de la refractilidad o birrefringencia, liberación de los componentes de la endospora, y aumento de la actividad metabólica. Muchos metabolitos o nutrientes normales (p. ej., aminoácidos y azúcares) pueden desencadenar la germinación después de la activación. La germinación continúa con la tercera fase, el crecimiento. El protoplasto de la endospora produce nuevos componentes, emerge a partir de los restos de la cubierta de la endospora y se transforma de nuevo en una bacteria activa (Figura 3.44). Figura 3.44 Germinación de la endospora. Clostridium pectinovorum emergiendo de la endospora durante la germinación. Barra = 0.5 µm. 1. Describa la estructura de la endospora bacteriana mediante un diagrama con leyendas. Parece que la transformación de endosporas latentes en células vegetativas activas es casi tan compleja como la esporogénesis. Se producen tres fases: 1) activación, 2) germinación, y 3) crecimiento. A menudo, una endospora no 2. Describa brevemente la formación y la germinación de la endospora. ¿Cuál es la importancia de la endospora? ¿A qué puede deberse su termorresistencia? Resumen 1. Las bacterias pueden ser esféricas (cocos), en forma de bastoncillos (bacilos), espirales o filamentosas; forman yemas y mechones; o incluso no tienen una forma característica (pleomórficas). 6. La matriz citoplasmática contiene los cuerpos de inclusión y los ribosomas. 12. Algunas bacterias, como los micoplasmas, carecen de pared celular. 7. El material genético procariótico se localiza en un área denominada nucleoide, que no está cubierta por una membrana. 13. Estructuras como cápsulas, fimbriae y pili sexuales se localizan fuera de la pared celular. 2. Las células bacterianas pueden permanecer juntas después de dividirse para formar pares, cadenas y racimos de varios tamaños y formas. 8. La mayoría de las bacterias tiene una pared celular por fuera de la membrana plasmática para darles forma y protegerlas frente a la lisis osmótica. 14. Muchas bacterias son móviles, normalmente gracias a orgánulos locomotores similares a hilos, denominados flagelos (Figura 3.32). 3. Todas las bacterias son procariotas y mucho más sencillas estructuralmente que las eucariotas. La Tabla 3.1 resume las funciones principales de las estructuras de la célula bacteriana. 9. Las paredes bacterianas son complejas químicamente y contienen normalmente peptidoglicano o mureína (Figuras 3.16-3.19). 15. Las especies bacterianas difieren en el número y la distribución de sus flagelos. 4. La membrana plasmática y otras membranas están compuestas por una capa doble lipídica, en la que están incluidas las proteínas integrales (Figura 3.7). Las proteínas periféricas están más débilmente unidas a las membranas. 5. La membrana plasmática puede invaginarse para formar algunas estructuras simples, como los sistemas de membrana que contienen los sistemas respiratorios y fotosintéticos y, posiblemente, mesosomas. 10. Las bacterias suelen clasificarse como Gram positivas o Gram negativas, según las diferencias en la estructura de la pared celular y su respuesta a la tinción de Gram. 11. Las paredes de las bacterias Gram positivas tienen capas gruesas y homogéneas de peptidoglicano y ácidos teicoicos (Figura 3.21). Las bacterias Gram negativas tienen una capa fina de peptidoglicano rodeada por una membrana externa compleja que contiene lipopolisacáridos (LPS) y otros componentes (Figura 3.23). 16. El filamento flagelar es una hélice rígida que gira como las hélices de un barco para impulsar a la bacteria en el agua (Figuras 3.35 y 3.36). 17. Las bacterias móviles pueden responder a gradientes de sustancias atrayentes y repelentes, fenómeno denominado quimiotaxis. 18. Algunas bacterias sobreviven a condiciones ambientales adversas formando endosporas, estructuras latentes que son resistentes al calor, la desecación y a muchas sustancias químicas (Figura 3.41). 76 Capítulo 3 Estructura y función de la célula procariota Palabras clave ácido desoxirribonucleico (DNA) ácido dipicolínico 73 ácido teicoico 59 anfitrico 66 antígeno O 63 autoensamblaje 67 bacilo o bastoncillo 45 cadena lateral O 63 capa S 65 cápsula 65 carboxisomas 52 carrera 71 coco 45 core del LPS 61 córtex 73 cubierta de la endospora 72 cuerpo basal 66 cuerpo de inclusión 52 diplococo 45 endospora 72 envoltura 58 esferoplasto 64 espacio periplásmico 58 espirilos 46 espiroqueta 46 esporangio 72 esporogénesis 73 esporulación 73 exoenzima 59 55 exosporio 72 filamento axial 70 filamento 66 fimbria 66 flagelina 66 flagelo 66 flagelo polar 66 gancho 66 germinación 75 giros 71 glicocálix 65 glucógeno 52 gránulo metacromático 54 gránulo de volutina 54 gránulos de cianoficina 52 gránulos de polifosfato 54 hidrofílico 49 hidrofóbico 49 interpuente peptídico 59 lípido A 61 lipopolisacárido (LPS) 61 lisis 64 lisozima 64 lofotrica 66 magnetosomas 54 matriz citoplasmática 52 membrana externa 58 membrana plasmática 48 micelio 46 Preguntas para razonar y repasar 1. Enumere las estructuras principales de células procariotas descritas en este capítulo, y exponga una breve descripción de las funciones de cada una de ellas. 2. Algunos microbiólogos consideran que la membrana plasmática participa en la síntesis de DNA durante la multiplicación bacteriana. ¿Cómo podría demostrarse que esto es así? propiedades químicas entre las paredes de las bacterias Gram positivas y Gram negativas. 4. ¿Qué es el autoensamblaje y por qué es tan importante para las células? 5. ¿Cómo podría demostrarse que las bacterias forman verdaderas endosporas? 3. Razone un mecanismo probable que fundamente la tinción diferencial de Gram, en términos de diferencias en estructura y modelo de mosaico fluido 50 monotrica 66 movilidad por deslizamiento 70 mureína 58 nucleoide 55 ósmosis 64 pared celular de la endospora 73 penicilina 64 peptidoglicano 58 periplasma 58 peritrica 66 pili sexuales 66 plásmido 57 plasmólisis 64 pleomórfico 46 poli-β-hidroxibutirato (PHB) 52 porina 63 proteínas integrales 50 proteínas periféricas 50 protoplasto 52 quimiorreceptores 70 quimiotaxis 70 ribosoma 55 «slime» 65 unidad Svedberg 55 vacuola de gas 52 vesículas de gas 52 vibrio 45 Cuestiones para reflexionar 1. Proponga un modelo para el ensamblaje de un flagelo en una bacteria Gram positiva. ¿De qué manera habría que modificar dicho modelo para explicar el ensamblaje en una Gram negativa? 2. ¿Cómo se podría determinar si una célula es procariota o eucariota sin el empleo de un microscopio? Asuma que el organismo puede multiplicarse fácilmente en el laboratorio. 3. El peptidoglicano ha sido comparado con la malla que protegía a los caballeros medievales bajo su armadura, ya que proporciona protección así como flexibilidad. ¿Podría describir otras estructuras biológicas que realicen funciones análogas? ¿De qué manera son reemplazadas o modificadas para acomodar el crecimiento del organismo? Lecturas suplementarias General Balows, A.; Truper, H. G.; Dworkin, M.; Harder, W.; and Schleifer, K.-H. 1992. The prokaryotes, 2d ed. New York: Springer-Verlag. Beveridge, T. J. 1989. The structure of bacteria. In Bacteria in Nature, vol. 3, J. S. Poindexter and E. R. Leadbetter, editors, 1-65 New York: Plenum. Chung, K.-T.; Stevens, Jr., S. E.; and Ferris, D. H. 1995. A chronology of events and pioneers of microbiology. SIM News 45(1):3-13. Lecturas suplementarias Gest, H., and Mandelstam, J. 1987. Longevity of microorganisms in natural environments. Microbiol. Sci. 4(3):69-71. Goodsell, D. S. 1991. Inside a living cell. In Trends Biochem. Sci., 16:203-6. Henning, U. 1975. Determination of cell shape in bacteria. Annu. Rev. Microbiol. 29:45-60. Hoppert, M., and Mayer, F. 1999. Prokaryotes. American Scientist 87:518-25. Koch, A. L. 1995. Bacterial growth and form. New York: Chapman & Hall. Koch, A. L. 1996. What size should a bacterium be? A question of scale. Annu. Rev. Microbiol. 50:317-48. Lederberg, J. 2000. Encyclopedia of microbiology, 2d ed. San Diego: Academic Press. Mayer, F. 1986. Cytology and morphogenesis of bacteria. Berlin: Gebrüder Borntraeger. Neidhardt, F. C., editor-in-chief. 1996. Escherichia coli and Salmonella: Cellular and molecular biology, 2d ed. Washington, D.C.: ASM Press. Neidhardt, F. C.; Ingraham, J. L.; and Schaechter, M. 1990. Physiology of the bacterial cell: A molecular approach. Sunderland, Mass.: Sinauer Associates. Rogers, H. J. 1983. Bacterial cell structure. Washington: American Society for Microbiology. Shapiro, L., and Losick, R. 1997. Protein localization and cell fate in bacteria. Science 276:712-18. 3.2 Membranas de la célula procariota Drews, G. 1992. Intracytoplasmic membranes in bacterial cells: Organization, function and biosynthesis. In Prokaryotic structure and function, S. Mohan, C. Dow, and J. A. Coles, editors, 249-74. New York: Cambridge University Press. Ourisson, G.; Albrecht, R; and Rohmer, M. 1984. The microbial origin of fossil fuels. Sci. Am. 251(2):44-51. Salton, M. R. J., and Owen, P. 1976. Bacterial membrane structure. Annu. Rev. Microbiol. 30:451-82. 3.3 La matriz citoplasmática Bazylinski, D. A. 1995. Structure and function of the bacterial magnetosome. ASM News 61(7):337-43. Blakemore, R. P. 1982. Magnetotactic bacteria. Annu. Rev. Microbiol. 36:217-38. Dawes, E. A. 1992. Storage polymers in prokaryotes. In Prokaryotic structure and function, S. Mohan, C. Dow, and J. A. Coles, editors, 81-122. New York: Cambridge University Press. Margolin, W. 1998. A green light for the bacterial cytoskeleton. Trends Microbiol. 6(6):233-38. Stolz, J. F. 1993. Magnetosomes. J. Gen. Microbiol. 139:1663-70. Walsby, A. E. 1977. The gas vacuoles of blue-green algae. Sci. Am. 237(2):90-97. Wittmann, H. G. 1983. Architecture of prokaryotic ribosomes. Annu. Rev. Biochem. 52:35-65. 3.4 El nucleoide Brock, T. D. 1988. The bacterial nucleus: A history. Microbiol. Rev. 52:397-411. Robinow, C., and Kellenberger, E. 1994. The bacterial nucleoid revisited. Microbiol. Rev. 58(2): 211-32. Schmidt, M. B. 1988. Structure and function of the bacterial chromosome. Trends Biochem. Sci. 13(4):131-35. Trun, N. J., and Marko, J. F. 1998. Architecture of a bacterial chromosome. ASM News 64(5):276-83. 3.5 La pared celular procariota Beveridge, T. J. 1995. The periplasmic space and the periplasm in gram-positive and gram-negative bacteria. ASM News 61(3):125-30. Ferguson, S. J. 1992. The periplasm. In Prokaryotic structure and function, S. Mohan, C. Dow, and J. A. Coles, editors, 311-40. New York: Cambridge University Press. Ghuysen, J.-M., and Hakenbeck, R., editors. 1994. Bacterial cell wall. New York: Elsevier. Hancock, R. E. W. 1991. Bacterial outer membranes: Evolving concepts. ASM News 57(4):175-82. Kotra, L. P.; Amro, N. A.; Liu, G.-Y.; and Mobashery, S. 2000. Visualizing bacteria at high resolution. ASM News 66(11):675-81. Navarre, W. W., and Schneewind, O. 1999. Surface proteins of gram-positive bacteria and mechanisms of their targeting to the cell wall envelope. Microbiol. Mol. Biol. Rev. 63(1):174-229. Osborne, M. J., and Wu, H. C. P. 1980. Proteins of the outer membrane of gram-negative bacteria. Annu. Rev. Microbiol. 34:369-422. Rietschel, E. T., et al. 1994. Bacterial endotoxin: Molecular relationships of structure to activity and function. FASEB J. 8:217-25. Scherrer, R. 1984. Gram’s staining reaction, Gram types and cell walls of bacteria. Trends Biochem. Sci. 9:242-45. Sharon, N. 1969. The bacterial cell wall. Sci. Am. 221(5):92-98. 3.6 Componentes externos a la pared celular Bayer, M. E., and Bayer, M. H. 1994. Biophysical and structural aspects of the bacterial capsule. ASM News 60(4):192-98. Costerton, J. W.; Geesey, G. G.; and Cheng, K.-J. 1978. How bacteria stick. Sci. Am. 238(1):86-95. DeRosier, D. J. 1998. The turn of the screw: The bacterial flagellar motor. Cell 93:17-20. 77 Doetsch, R. N., and Sjoblad, R. D. 1980. Flagellar structure and function in eubacteria. Annu. Rev. Microbiol. 34:69-108. Ferris, F. G., and Beveridge, T. J. 1985. Functions of bacterial cell surface structures. BioScience 35(3):172-77. Harshey, R. M., and Toguchi, A. 1996. Spinning tails: homologies among bacterial flagellar systems. Trends Microbiol. 4(6):226-31. Hultgren, S. J.; Abraham, S.; Caparon, M.; Falk, P.; St. Geme, III, J. W.; and Normark, S. 1993. Pilus and nonpilus bacterial adhesins: Assembly and function in cell recognition. Cell 73:887-901. Messner, P., and Sleytr, U. B. 1992. Crystalline bacterial cell-surface layers. In Advances in microbial physiology, vol. 33, A. H. Rose, editor, 213-75. New York: Academic Press. Sleytr, U. B., and Beveridge, T. J. 1999. Bacterial S-layers. Trends Microbiol. 7(6):253-60. Troy, F. A. 1979. The chemistry and biosynthesis of selected bacterial capsular polymers. Annu. Rev. Microbiol. 33:519-60. Yonekura, K., et al. 2000. The bacterial flagella cap as the rotary promoter of flagellin self-assembly. Science 290:2148-52. 3.7 Quimiotaxis Adler, J. 1976. The sensing of chemicals by bacteria. Sci. Am. 234(4):40-47. Berg, H. C. 1975. How bacteria swim. Sci. Am. 233(2):36-44. Blair, D. F. 1995. How bacteria sense and swim. Annu. Rev. Microbiol. 49:489-522. Manson, M. D.; Armitage, J. P.; Hoch, J. A.; and Macnab, R. M. 1998. Bacterial locomotion and signal transduction. J. Bacteriol. 180(5):1009-22. Parkinson, J. S. 1993. Signal transduction schemes of bacteria. Cell 73:857-71. 3.8 La endospora bacteriana Aronson, A. I., and Fitz-James, P. 1976. Structure and morphogenesis of the bacterial spore coat. Bacteriol. Rev. 40(2):360-402. Driks, A. 1999. Bacillus subtilis spore coat. Microbiol. Mol. Biol. Rev. 63(1):1-20. Errington, J. 1993. Bacillus subtilis sporulation: Regulation of gene expression and control of morphogenesis. Microbiol. Rev. 57(1):1-33. Nicholson, W. L.; Munakata, N.; Horneck, G.; Melosh, H. J.; and Setlow, P. 2000. Resistance of Bacillus endospores to extreme terrestrial and extraterrestrial environments. Microbiol. Mol. Biol. Rev. 64(3):548-72. Setlow, P. 1995. Mechanisms for the prevention of damage to DNA in spores of Bacillus species. Annu. Rev. Microbiol. 49:29-54. Slepecky, R. A. 1978. Resistant forms. In Essays in microbiology, J. R. Norris and M. H. Richmond, editors, 14/1-14/31. New York: John Wiley and Sons.