(1) - manuelaFQ2
Anuncio

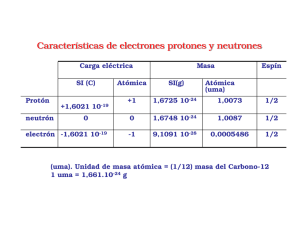
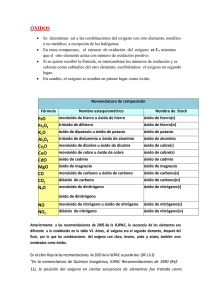
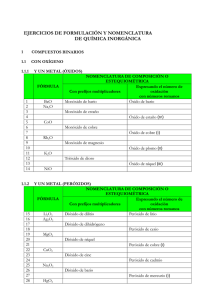
Son uniones entre el oxígeno y un átomo metálico o no metálico, en ambos casos se nombran y formulan de la misma manera: Formulación: El oxígeno actúa con estado de oxidación (-2), y se sitúa a la derecha del compuesta. El otro elemento con el que se combine, ha de actuar con un estado de oxidación positivo, y se sitúa a la izquierda del compuesto. En el compuesto, los estados de oxidación se escriben intercambiados y como subíndices. Observa: +3 -2 Al O → Al2O3 El aluminio actúa con su único estado de oxidación posible, el +3, y el oxígeno con -2. Al intercambian los números, éstos se escriben sin los signos. *SIMPLIFICACIÓN: Puede ocurrir que los números sean pares los dos, por lo que en este caso, al igual que en matemáticas, hay que simplificar, dividiendo los dos números por 2. Observa: +4 -2 Pt O → Pt2O4 → Pt O2 Nomenclatura: Al nombrar un compuesto, es decir, para leerlo, hay que nombrar primero el elemento escrito después, es decir, leerlo al revés. Así, como el oxígeno es el que está detrás, es el primero en decirse, y en lugar de oxígeno, se dice: ÓXIDO. El nombre del segundo elemento no cambia. Existen tres formas de nombrar los óxidos, aunque una de ellas (nomenclatura tradicional) está desaconsejada por la IUPAC por ser un sistema muy antiguo. 1.Nomenclatura Stock: Se nombran por orden (inverso) los dos elementos, y se escribe entre paréntesis el estado de oxidación con el que está actuando el primer elemento. El estado de oxidación del segundo es único, por lo que no hay que nombrarlo en ningún caso, ya que se entiende que es conocido por todos. IMPORTANTE!! Ten en cuenta que si el compuesto está simplificado, los números que estás viendo no son los reales, puesto que éstos han sido divididos por la mitad: Fe2O3 As2O5 Au2O3 Al2O3 Óxido Óxido Óxido Óxido de de de de hierro (III) arsénico (V) oro (III) aluminio PdO CO2 SO3 CaO Óxido Óxido Óxido Óxido de de de de paladio (II) carbono (IV) azufre (VI) calcio IMPORTANTE: En algunos de ellos no se ha puesto el paréntesis; esto es debido a que el elemento de la izquierda sólo tiene un estado de oxidación, por lo que se supone que es conocido y no hay que escribirlo!! 2.Nomenclatura Sistemática: Al igual que en el caso anterior, en lugar de oxígeno decimos óxido y el compuesto se lee en el sentido contrario al que está escrito. Ahora no se indica el estado de oxidación entre paréntesis, sino que se nombran los números como prefijos, antes del nombre de los elementos. Así cuando haya un 2, diremos di-, si hay un 3, tri-, si hay un 4, tetra-, un 5 se dice penta-, un 6 se dice hexa- y el 7 hepta-, y el 1 se dice mono-. Fe2O3 As2O5 Au2O3 Al2O3 Trióxido de dihierro PdO Pentaóxido de CO2 diarsénico Trióxido de dioro SO3 Trióxido de CaO dialuminio Monóxido de paladio Dióxido de carbono Trióxido de azufre Monóxido de calcio 3.Nomenclatura Tradicional: Esta nomenclatura a pesar de no estar aconsejada por la IUPAC, aún la podemos encontrar en libros o enunciados de ejercicios. Los óxidos son compuestos ácidos sin “agua”, de ahí que también se puedan llamar “anhídridos”, palabra que se utiliza en esta nomenclatura en lugar de “óxido”. El otro elemento también cambia, se nombra terminado en –oso, si actúa con la valencia más pequeña, y terminado en –ico, si actúa con la valencia más grande de las que posee, o si sólo tiene una. CO2 → anhídrido carbónico (porque el carbono tiene e.o.= +2 y +4, y está actuando con el mayor) N2O3 → anhídrido nitroso (el nitrógeno tiene e.o.= +3 y +5, y está actuando con el estado de oxidación menor)