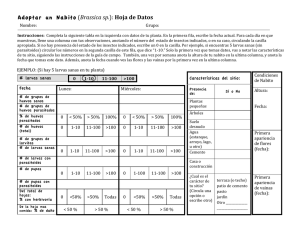
Estado actual del conocimiento de Lepidoptera en el Sector
Anuncio

UNIVERSIDAD ESTATAL A DISTANCIA VICERRECTORÍA ACADÉMICA ESCUELA DE CIENCIAS EXACTAS Y NATURALES PROGRAMA MANEJO Y PROTECCIÓN DE RECURSOS NATURALES Estado actual del conocimiento de Lepidoptera en el Sector Altamira, Parque Internacional La Amistad Tesis de grado sometida a la consideración del Tribunal Examinador del Programa de Licenciatura en Manejo y Protección de Recursos Naturales, como requisito parcial para optar por el grado de Licenciatura en Manejo y Protección de Recursos Naturales Róger González Tenorio y Manuel Solís Vargas Noviembre, 2008 1 TRIBUNAL EXAMINADOR Este proyecto de Graduación ha sido aceptado y aprobado en su forma presente por el Tribunal Examinador del Programa de Licenciatura en Manejo y Protección de Recursos Naturales de la Escuela de Ciencias Exactas y Naturales de la Universidad Estatal a Distancia, como requisito parcial para optar por el grado de Licenciatura en Manejo y Protección de Recursos Naturales. _______________________ Olman Díaz Sánchez, M.Sc. Director de la Escuela de Ciencias Exactas y Naturales. _______________________ Johnny Villarreal Orias, M.Sc. Encargado del Programa de Manejo de los Recursos Naturales. _______________________ Gilbert Fuentes González, M.Sc. Director de Tesis. _______________________ Isidro Chacón Gamboa, Lic. Lector del Trabajo Final de Graduación. _______________________ Germán Vega Araya, Lic. Lector del Trabajo Final de Graduación. 2 Contenido Página Dedicatoria..................................................................................................................................I Agradecimientos........................................................................................................................II Resumen..................................................................................................................................III Índice de siglas y abreviaturas.............................................................................................IV-V 1. INTRODUCCIÓN................................................................................................................1-4 Antecedentes de la investigación científica en la entomofauna costarricense....................2-4 2. OBJETIVOS 2.1 Objetivo general............................................................................................................5 2.2 Objetivos específicos....................................................................................................5 3. MARCO TEÓRICO 3.1 Importancia de este estudio........................................................................................6-7 3.2 Aportes de otras investigaciones...................................................................................7 3.3 Conceptos teóricos de la historia natural de Lepidoptera.........................................7-10 3.4 Antes que existiera el PILA..........................................................................................10 3.5 Antecedentes del PILA...........................................................................................10-11 3.6 Ubicación geográfica del PILA................................................................................11-12 3.7 Características Biofísicas del PILA a. Geomorfología.................................................................................................12 b. Suelos..............................................................................................................13 c. Clima................................................................................................................13 d. Precipitación.....................................................................................................13 e. Temperatura.....................................................................................................14 f. Zonas de Vida..................................................................................................14 g. Caracterización de flora y fauna.................................................................14-15 h. Estado de conservación..............................................................................15-16 4. METODOLOGÍA 4.1 Análisis de la información generada por el INBio y selección de especies............19-20 4.2 Generación de información y metodología de crianza…………………...………….20-21 3 a. Recolecta in situ de estados inmaduros...........................................................21-22 b. Rotulación de las bolsas de crianza.......................................................................22 c. Libreta de campo o de eventos..............................................................................22 d. Toma de fotografías digitales.................................................................................22 e. Alimentación de las larvas.....................................................................................23 f. Revisión diaria de los eventos...............................................................................23 g. Libreta de testigos…………………………………………………………...................23 h. Montaje de los especimenes............................................................................23-24 i. Ingreso de la información a la base de datos……………………...………………...24 j. Identificación taxonómica de los lepidópteros........................................................24 k. Identificación taxonómica de los parasitoides........................................................25 l. Identificación taxonómica de las plantas hospederas............................................25 m. Proceso de curación del material colectado..........................................................26 n. Etiquetado del material…………………………………………………......................26 o. Ingreso y mantenimiento en la colección de Artrópodos del INBio........................26 5. RESULTADOS 5.1 Riqueza específica de Lepidoptera en el sector Altamira, Parque Internacional La Amistad.........................................................................................................................27-69 5.2 Historia natural de 30 especies de Lepidoptera presentes en el sector Altamira Parque Internacional La Amistad…………………………………………………………..…..69 5.2.1 Familia Arctiidae................................................................................69-70 5.2.1.1 Subfamilia Arctiinae. ...........................................................................70 5.2.1.1.1 Tribu Arctiini......................................................................................70 Especie 1: Amastus rumina.............................................................71-72 Especie 2: Bertholdia crocea...........................................................72-73 Especie 3: Bertholdia philoptera...........................................................73 Especie 4: Elysius melanoplaga...........................................................74 Especie 5: Opharus belus....................................................................75 Especie 6: Opharus procroides............................................................76 5.2.1.1.2 Tribu Ctenuchini. .............................................................................77 Especie 7: Amycles adusta.............................................................77-78 Especie 8: Holophaea lycone...............................................................78 5.2.1.1.3 Tribu Pericopini................................................................................79 4 Especie 9: Dysschema cerialis........................................................79-80 Especie 10: Pelochyta affinis..........................................................80-81 5.2.2 Familia Bombycidae.....................................................................................81-82 5.2.2.1 Subfamilia Apatelodinae.....................................................................82 Especie 11: Tarchon felderi.............................................................83-85 5.2.3 Familia Crambidae.............................................................................................85 5.2.3.1 Subfamilia Pyraustinae.......................................................................85 Especie 12: Herpetogramma agavealis..........................................86-87 5.2.4 Familia Hesperiidae......................................................................................87-90 5.2.4.1 Subfamilia Hesperiinae.......................................................................90 Especie 13: Talides sinois cantra....................................................90-91 5.2.4.2 Subfamilia Pyrginae............................................................................91 Especie 14: Astraptes fulgerator.....................................................91-92 Especie 15: Celaenorrhinus stallingsi...................................................93 Especie 16: Telemiades gallius............................................................94 5.2.5 Familia Lycaenidae................................ ......................................................95-96 5.2.5.1 Subfamilia Riodininae....................................................................96-97 Género Nymphidium.............................................................................98 Especie 17: Nymphidium ascolia ascolia......................................99-100 5.2.6 Familia Notodontidae................................................................................100-102 5.2.6.1 Subfamilia Dioptinae.........................................................................102 Especie 18: Lirimiris fascis..........................................................102-103 Especie 19: Polypoetes villia..............................................................104 5.2.7 Familia Nymphalidae................................................................................105-106 5.2.7.1 Subfamilia Charaxinae...............................................................106-107 Especie 20: Memphis beatrix......................................................107-108 5.2.7.2 Subfamilia Ithomiinae.................................................................109-111 Especie 21: Pteronymia picta notilla...........................................112-113 5.2.7.3 Subfamilia Morphinae (Tribu Morphini y Tribu Brassolini)……..114-115 Especie 22: Caligo brasiliensis sulanus......................................116-117 Especie 23: Opsiphanes bogotanus alajuela..............................117-119 Especie 24: Opsiphanes cassina……......………………………...119-121 Especie 25: Opsiphanes quiteria talamancensis........................121-122 5.2.7.4 Subfamilia Nymphalinae...................................................................123 5 Especie 26: Hypanartia dione arcaei..........................................124-125 5.2.8 Familia Saturniidae...................................................................................125-126 5.2.8.1 Subfamilia Hemileucinae...........................................................126-127 Especie 27: Automeris banus......................................................127-129 Especie 28: Gamelia musta........................................................130-131 5.2.8.2 Subfamilia Saturniinae......................................................................132 Especie 29: Copaxa rufinans......................................................132-134 5.2.9 Familia Sphingidae...................................................................................134-135 5.2.9.1 Subfamilia Macroglossinae...............................................................136 Especie 30: Perigonia stulta........................................................136-137 6. DISCUSIÓN DE RESULTADOS.......................................................................................138 6.1 Riqueza específica de Lepidoptera del sector Altamira………………………....138-143 6.2 Historia natural de 30 especies de Lepidoptera del sector Altamira…………...143-144 Especie 1: Amastus rumina.........................................................144-146 Especie 2: Bertholdia crocea..............................................................146 Especie 3: Bertholdia philoptera.........................................................147 Especie 4: Elysius melanoplaga..................................................147-148 Especie 5: Opharus belus..................................................................148 Especie 6: Opharus procroides..........................................................149 Especie 7: Amycles adusta.........................................................149-150 Especie 8: Holophaea lycone.............................................................151 Especie 9: Dysschema cerialis...........................................................151 Especie 10: Pelochyta affinis..............................................................152 Especie 11: Tarchon felderi.........................................................152-153 Especie 12: Herpetogramma agavealis......................................153-154 Especie 13: Talides sinois cantra................................................154-156 Especie 14: Astraptes fulgerator.................................................156-157 Especie 15: Celaenorrhinus stallingsi.........................................157-158 Especie 16: Telemiades gallius..........................................................158 Especie 17: Nymphidium ascolia ascolia....................................159-160 Especie 18: Lirimiris fascis..........................................................160-161 Especie 19: Polypoetes villia.......................................................161-162 Especie 20: Memphis beatrix......................................................162-163 6 Especie 21: Pteronymia picta notilla...........................................163-165 Especie 22: Caligo brasiliensis sulanus......................................165-167 Especie 23: Opsiphanes bogotanus alajuela..............................167-169 Especie 24: Opsiphanes cassina………………………................169-171 Especie 25: Opsiphanes quiteria talamancensis........................171-173 Especie 26: Hypanartia dione arcaei..........................................173-175 Especie 27: Automeris banus......................................................175-176 Especie 28: Gamelia musta........................................................176-177 Especie 29: Copaxa rufinans......................................................177-178 Especie 30: Perigonia stulta........................................................178-179 7. CONCLUSIONES Y RECOMENDACIONES Conclusiones......................................................................................................180-181 Recomendaciones..............................................................................................182-183 8. LITERATURA CITADA.............................................................................................191-192 Comunicaciones personales............................................................................................192 Sección de anexos……………………………………………………………......................193-215 Apéndice 1. Ciclo biológico, tasas de supervivencia, reproducción y longevidad de los adultos en cautiverio de Opsiphanes cassina C. & R. Felder, 1862 (Morphinae; Nymphalidae; Lepidoptera)…………………………………………………………………………………………216 Cuadros Cuadro 1. Especies de Lepidoptera del sector Altamira Parque Internacional La Amistad, recolectadas de 1993 al 2006…………………………........................................................29-69 Cuadro 2. Plantas hospederas para T. felderi en ACG según Janzen y Hallwachs………83-84 Cuadro 3. Plantas hospederas para A. banus en ACG según Janzen y Hallwachs......128-129 Cuadro 4. Plantas hospederas para G. musta en ACG según Janzen y Hallwachs…..130-131 Cuadro 5. Lepidoptera, plantas hospederas y su respectivo número de testigo de las especies criadas en la EBA-PILA, durante los años 2004 -2007………………………..193-198 Cuadro 6. Dípteros parasitoides de las especies de Lepidoptera criadas por los Parataxónomos en la EBA-PILA, durante los años 2004-2006…………………............199-200 7 Cuadro 7. Himenópteros parasitoides de las especies de Lepidoptera criadas por los Parataxónomos en la EBA-PILA, durante los años los años 2004-2006…….………….200-203 Cuadro 8. Lista de autores de las especies de insectos citadas en el texto……….......204-205 Cuadro 9. Lista de autores de especies de plantas citadas en el texto…………..……..206-211 Cuadro 10. Duración del ciclo biológico de O. cassina en base a las observaciones realizadas en el Insectario de Investigación del INBio………………………………………….220 Cuadro 11. Medidas de huevos de Opsiphanes cassina puestos en condiciones de cautiverio en el insectario de investigación del INBio……………………………………………………….222 Cuadro 12. Medidas de larvas en cautiverio de Opsiphanes cassina en primer estadio en el insectario de investigación del INBio……………………………………………………………..224 Cuadro 13. Medidas de larvas en cautiverio de Opsiphanes cassina en segundo estadio en el insectario de investigación del INBio…………………………………………….................225-226 Cuadro 14. Medidas de larvas en cautiverio de Opsiphanes cassina en tercer estadio en el insectario de investigación del INBio……………………………………………………………..227 Cuadro 15. Medidas de larvas en cautiverio de Opsiphanes cassina en cuarto estadio en el insectario de investigación del INBio……………………………………………………………..229 Cuadro 16. Medidas de larvas en cautiverio de Opsiphanes cassina en quinto estadio en el insectario de investigación del INBio…………………………………………......………………230 Cuadro 17. Supervivencia de huevos, larvas, pupas y adultos de Opsiphanes cassina bajo condiciones controladas en el Insectario de Investigación del INBio……………..................233 Cuadro 18. Tasa de reproducción (oviposición) de Opsiphanes cassina bajo condiciones de laboratorio en el Insectario de Investigación del INBio…………………………………………234 Cuadro 19. Longevidad de adultos de la segunda generación (F2) obtenidos en crianza y liberados en el Insectario de Investigación del INBio…………………………….....................236 Figuras Figura 1. Distribución de los senderos y tipos de vegetación en la EBA, PILA.......................16 Figura 2. Zonas de Vida del PILA…………………………………………………………………..17 Figura 3. a) Cuarto de crianza en Estación Biológica Altamira, PILA. b) Bolsa de crianza con adultos recién emergidos de Pteronymia picta notilla (Nymphalidae).......…………………….23 Figura 4. Curva de acumulación de especies de Lepidoptera en la EBA (PILA) con base a la información generada por el Instituto Nacional de Biodiversidad (INBio, 2007)………………28 Figura 5. Fases del ciclo biológico de Amastus rumina…………................…………………..71 Figura 6. Fases del ciclo biológico de Bertholdia crocea………………………………………...72 8 Figura 7. Fases del ciclo biológico de Bertholdia philoptera…………………………………….73 Figura 8. Fases del ciclo biológico de Elysius melanoplaga…………………………………….74 Figura 9. Fases del ciclo biológico de Opharus belus…………………………………..............75 Figura 10. Fases del ciclo biológico de Opharus procroides…………………………...............76 Figura 11. Fases del ciclo biológico de Amycles adusta………………………............………..77 Figura 12. Fases del ciclo biológico de Holophaea lycone……………………………..............78 Figura 13. Fases del ciclo biológico de Dysschema cerialis…………………………………….79 Figura 14. Fases del ciclo biológico de Pelochyta affinis…………………………….................80 Figura 15. Fases del ciclo biológico de Tarchon felderi………………………………...............83 Figura 16. Fases del ciclo biológico de Herpetogramma agavealis…………………………….86 Figura 17. Fases del ciclo biológico de Talides sinois cantra.…………………………………..90 Figura 18. Fases del ciclo biológico de Astraptes fulgerator…………………………………….92 Figura 19. Fases del ciclo biológico de Celaenorrhinus stallingsi………………………………93 Figura 20. Fases del ciclo biológico de Telemiades gallius…………………………………….94 Figura 21. Fases del ciclo biológico de Nymphidium ascolia escolia………………………......99 Figura 22. Fases del ciclo biológico de Lirimiris fascis…………………………………………103 Figura 23. Fases del ciclo biológico de Polypoetes villia……………………………………….104 Figura 24. Fases del ciclo biológico de Memphis beatrix……………………………..............108 Figura 25. Fases del ciclo biológico de Pteronymia picta notilla………………………………112 Figura 26. Diptera (Tachinidae) parasitoide de P. picta notilla……………………..………….113 Figura 27. Fases del ciclo biológico de Caligo brasiliensis sulanus………………….............116 Figura 28. Fases del ciclo biológico de Opsiphanes bogotanus alajuela…………………….118 Figura 29. Fases del ciclo biológico de Opsiphanes cassina…………………………............119 Figura 30. Opsiphanes cassina posada sobre heces de Puma concolor……………..……...120 Figura 31. Fases del ciclo biológico de Opsiphanes quiteria talamancensis………………...121 Figura 32. Avispas parasitoides Microgastrinae (Braconidae) en larva de O. quiteria talamancensis…………………………………………………………………………...................122 Figura 33. Fases del ciclo biológico de Hypanartia dione arcaei……………………..............124 Figura 34. Fases del ciclo biológico de Automeris banus……………………………..............127 Figura 35. Fases del ciclo biológico de Gamelia musta………………………………………..130 Figura 36. Fases del ciclo biológico de Copaxa rufinans………………………………………133 Figura 37. Fases del ciclo biológico de Perigonia stulta………………………….....…………136 Figura 38. Proporción de la distribución geográfica y grupos ecológicos de adultos de la superfamilia Papilionoidea……………………………………………………………..................141 9 Figura 39. Etiqueta de información general (a) y código de barras (b).……………………....213 Figura 40. Campos a llenar en una base de testigos de crianza …………………................214 Figura 41. Campos de la pantalla principal del sistema ATTA………………………..............215 Figura 42. Duración promedio de las fases del ciclo biológico de O. cassina en cautiverio en el insectario de investigación del INBio…………………………………………………………..219 Figura 43. Duración en promedio de los estadios larvales de O. cassina en cautiverio en el insectario de investigación del INBio……………………………………………………………..221 Figura 44. Huevos de O. cassina recién puestos (izq.) y de dos a tres días posterior a la puesta (der.).…………………………………………………….................................................221 Figura 45. Diámetro y alto de los huevos de O. cassina puestos en condiciones de cautiverio en el insectario de investigación del INBio……………....………………………………………222 Figura 46. Tamaño promedio de cada estadio larval de O. cassina criados en cautiverio en el insectario de investigación del INBio. Long 1; medida de la cabeza al margen posterior del segmento anal y Long 2; medida de la cabeza al ápice de las caudas anales…………......................................................................................................................223 Figura 47. Larva de O. cassina en primer estadio. Larva recién eclosionada (izq.), larva días después de la eclosión (centro) y detalle frontal de la cápsula cefálica (der.)……………….223 Figura 48. Larva de O. cassina en segundo estadio. Vista dorsal (izq.) y detalle de formas de coloración de la cápsula cefálica (cent. y der.). ………………………………………………...225 Figura 49. Larva de O. cassina en tercer estadio. Vista dorsal (izq.) y detalle frontal de la cápsula cefálica (cent. y der.)………………………………………………..……………………226 Figura 50. Larvas de O. cassina en cuarto estadio. Vista dorsal (izq.) y detalle frontal de la cápsula cefálica (cent. y der.)………………………………………………………....................228 Figura 51. Larva de O. cassina en quinto estadio. Vista dorsal (izq.), detalle frontal (cent.) y lateral (der.) de la cápsula cefálica.………………………………………….............................229 Figura 52. Prepupa de O. cassina. Vista dorsal (izq.), lateral (cent.) y detalle dorsal de la cabeza (der.)………………………………………………………………………….....................231 Figura 53. Pupa de O. cassina. Vista lateral (izq.), dorsal (centro) y detalle dorsal del ápice (der.)………………………………………………………………………………………………….232 Figura 54. Tasas de supervivencia de huevos, larvas, pupas y adultos emergidos de O. cassina expresada en porcentajes……………………………………………………................233 Figura 55. Cantidad de hembras fértiles y huevos recolectados por día durante la investigación…………………………………………………………………………………………235 Figura 56. Longevidad de hembras y machos de O. cassina durante el estudio……………235 10 Dedicatoria Esta investigación está dedicada a nuestros compañeros de labores, pues este trabajo refleja el esfuerzo de todos ellos. A los investigadores científicos, quienes al igual que nosotros dedican sus vidas al estudio de la biodiversidad y conservación de los recursos naturales. Por quienes ya se fueron, por los que aún existen y por los que han de venir. 11 Agradecimientos Gracias al Instituto Nacional de Biodiversidad, al Área de Conservación la Amistad Pacífico, al Parque Internacional la Amistad y a la Universidad Estatal a Distancia por permitirnos y darnos el apoyo en nuestra formación profesional. Nuestro más sincero agradecimiento a las siguientes personas que de alguna manera contribuyeron al desarrollo del presente trabajo de investigación: Gilbert Fuentes, Paul Hanson, Isidro Chacón, José Montero, Manuel Zumbado, Montgomery Wood, Ronald Zúñiga, Roberto Delgado, Didier Rubí, Walter Araya, Marcos Moraga, José Antonio Azofeifa, Róger Aguilar, Grettel Vargas, Ana Lépiz, Armando Soto, Francisco Morales, Alexander Rodríguez, Barry Hammel, Nelson Zamora, Daniel Santamaría y Daniel Solano. Muchas gracias al personal del PILA, especialmente a Nelson Elizondo, Gravin Villegas, Olman Alemán, Mainor Castillo, Errol Morales, Fredy Guzmán y Peregrina Gómez. Gracias a todo el personal del Área de Conservación la Amistad, especialmente a Luis Sánchez, Ronald Chang y Adrián Arias. Gracias a nuestras madres Zelmira González y María Gabriela Vargas por darnos el regalo de la vida. A nuestras familias y parejas por el apoyo, constancia y tolerancia 12 Resumen El objetivo general de esta investigación es describir el estado actual del conocimiento de Lepidoptera al 2008 en el Sector Altamira, Parque Internacional La Amistad, Costa Rica. Los objetivos específicos son determinar la riqueza específica y describir la historia natural, plantas hospederas, ciclo biológico y parasitoides asociados a 85 de las especies de lepidópteros (mariposas diurnas y nocturnas) presentes en el área de estudio. La investigación se desarrolló en la Estación Biológica Altamira, en los senderos: Gigantes del Bosque, Límite-Río Platanillal, Toma del Agua, Casa Coca y Cerro Biolley-Cerro Tonduz, los cuales se encuentran entre 1 400 y 1 900 m de elevación. El área de estudio se ubica en el distrito de Biolley, cantón de Buenos Aires, Puntarenas, en el sureste de Costa Rica. Además de una ser una estación biológica y la principal ruta de acceso al Parque Internacional La Amistad, Altamira es un centro operativo de guardaparques y desde donde se toman las principales decisiones de manejo y administración del Área Protegida. El Parque Internacional La Amistad es de carácter binacional (Costa Rica-Panamá), por lo cual es el Área Protegida más densa y extensa de Centro América. Posee las dos categorías de conservación internacional otorgadas por la UNESCO: Reserva de la Biósfera y Sitio de Patrimonio Mundial de la Humanidad. La metodología empleada durante este estudio se basó en la experiencia de investigación de Daniel Janzen en el Área de Conservación Guanacaste y el Instituto Nacional de Biodiversidad Tal metodología consiste en la crianza de los estados inmaduros del orden Lepidoptera, proceso que permite identificar la o las especies de plantas hospederas, así como determinar el ciclo biológico y los parasitoides asociados. Esto permitió recopilar los datos de historia natural de 85 especies de Lepidoptera, 30 de las cuales se desarrollan en un acápite que recopila y analiza su biología y ecología, complementados con información bibliográfica. Nuestra experiencia laboral como entomólogos nos permitió hacer observaciones para algunas de las especies. Complementariamente se hizo una búsqueda sistematizada de las especies de Lepidoptera recolectadas en la zona de estudio por investigadores del Instituto Nacional de Biodiversidad, en el período 1993-2006. Con estos datos se generó una lista de especies de Lepidoptera reportadas en la colección entomológica del Instituto Nacional de Biodiversidad, lo cual se interpretó gráficamente mediante una curva de acumulación de especies. Se recomienda realizar estudios más sistemáticos y de grupos específicos de Lepidoptera, aplicar diseños experimentales bien definidos y por periodos de dos a tres años como mínimo, dar un mayor énfasis en la recolecta de mariposas diurnas, realizar una curación completa de lepidópteros y dar un mayor esfuerzo de estudio taxonómico y sistemático a los parasitoides dípteros e himenópteros provenientes de la Estación Biológica Altamira. 13 Índice de siglas y abreviaturas. AACUE: Acuerdo de Asociación entre Centroamérica y la Unión Europea. ACLAC: Área de Conservación la Amistad Caribe. ACLAP: Área de Conservación la Amistad Pacífico. ACG: Área de Conservación Guanacaste. ASOPROLA: Asociación de Productores Orgánicos la Amistad. ASP: Área Silvestre Protegida. BINABITROP: Bibliografía Nacional en Biología Tropical CB: Corredor Biológico. CIBIO: Centro Iberoamericano de la Biodiversidad (Universidad de Alicante, España). cf.: Diminutivo del latín “confer”. Indica que un determinado taxón (familia, género o especie) es muy cercano (emparentado) o muy semejante a otro. EBA: Estación Biológica Altamira. FAO: Organización de las Naciones Unidas para la Agricultura y la Alimentación. INBio: Instituto Nacional de Biodiversidad. MCE: Ministerio de Comercio Exterior. MINAE: Ministerio del Ambiente y Energía. MIRENEM: Ministerio de Recursos Naturales, Energía y Minas. MN: Monumento Nacional. OET: Organización para Estudios Tropicales. PILA: Parque Internacional la Amistad. PN: Parque Nacional. PROCOMER: Promotora de Comercio Exterior. RNA: Reserva Natural Absoluta. PNUMA: Programa de las Naciones Unidas para el Medio Ambiente. RBA: Reserva de la Biosfera la Amistad. RB: Reserva Biológica. RF: Reserva Forestal. RI: Reserva Indígena. RVS: Refugio de Vida Silvestre. SINAC: Sistema Nacional de Áreas de Conservación. SPN: Sistema de Parques Nacionales. TNC: The Nature Conservation. UICN: Unión Internacional para la Conservación de la Naturaleza y sus Recursos Naturales. 14 UNED: Universidad Estatal a Distancia. UNESCO: Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura. WRI: World Resources Institute. ZP: Zona Protectora. 15 1. INTRODUCCIÓN El orden Lepidoptera es uno de los grupos de insectos mejor conocidos en Costa Rica. Según Chacón y Montero (2007) se estima que existen entre 12 000 a 14 000 especies. Sin embargo, en otros grupos como los insectos parasitoides sólo se han descrito cerca del 10% de las especies de Centro América (Hanson, 1990). El conocimiento de la biología y ecología de las especies de insectos es un campo en el que se han realizado muchas investigaciones, pero en el que también falta mucho por hacer. Dicho conocimiento es fundamental para el manejo de la vida silvestre (Martín, 1997). En el Plan de Manejo de un ASP se incluyen y justifican los recursos que ésta pretende conservar. Pero ¿incluyen a los insectos? ¿Por qué hay que conservarlos? Según Martín (1997) para responder a esta pregunta primero hay que saber que existen varias áreas de interrelación hombre-insecto y que la importancia de esta interrelación aún no se ha establecido por completo. A pesar de que no todos los beneficios provenientes de los insectos son valorados económicamente, en Costa Rica se obtienen importantes divisas por concepto de la producción de miel de abeja, así como de pupas de mariposas diurnas y su exportación a Norte América y Europa. Según datos del AACUE, las exportaciones del sector miel en el 2005 alcanzaron un monto total de €1,13 millones, lo que equivale a unos 819 616 063 colones en el presente, beneficiando a unos 10 630 trabajadores (MCE, 2007). Uno de los mayores beneficios de las abejas es su labor como agente polinizador en varias especies silvestres, plantaciones forestales y cultivos agrícolas. Este último concepto surgió recientemente a razón del aumento en la calidad y cantidad del cultivo de melón en América Central. En 1998 ingresaron a Costa Rica $415 038 878 por concepto de exportación de cultivos polinizados por abejas (MAG-BCCR, 1998). Esto permite considerar a la apicultura como una actividad económica prometedora, de gran perspectiva, rentable y de gran valor social, que puede ir más allá de la producción de miel de abeja (Aguilar, 1999). Según PROCOMER, durante el periodo 1998-2005, la exportación anual de pupas de mariposas diurnas alcanzó la suma de US$ 5 743 358 ($719 866 en el 2005, equivalente a 359 213 134 colones en el presente). Esto es poco si se toma en cuenta que sólo se han 16 investigado y explotado el 10% de las especies de mariposas diurnas conocidas en Costa Rica (Montero, 2005 y 2007). El PILA es un ASP que alberga una enorme riqueza biológica debido a sus características físico-geográficas y climáticas, además de que presenta la mayor cobertura de bosque natural continuo de Centro América (Borges, 2005). Este trabajo de investigación, resume los datos de plantas hospederas y parasitoides asociados a 85 especies de Lepidoptera presentes en el Sector Altamira del PILA, en un ámbito altitudinal de 1 400 a 1 900 m. Treinta de estas 85 especies, se desarrollan más a fondo, pues tienen un gran potencial económico ya sea por la producción de pupas y adultos para la exportación y exhibición, o bien como posibles plagas de cultivos agrícolas. Este trabajo de investigación se desarrolló durante dos etapas paralelas y complementarias entre sí. La fase “a” consistió en la observación y experimentación en el área de estudio durante un periodo de dos años (2004-2005), y fue en la que partiparon directamente los escritores de este estudio, en conjunto con dos parataxónomos del INBio (Roberto Delgado y Didier Rubí). La otra fase es un complemento que recopila los datos generados en la EBAPILA, durante 13 años (1993-2006) por otros investigadores (en su mayoría parataxónomos) del INBio. La primer etapa es la que permitió generar los datos de historia natural (plantas hospederas, ciclos de vida, parasitoides asociados) para 85 de las especies de Lepidoptera presentes en la EBA. Paralelamente al trabajo de campo realizado en el sitio de estudio (EBA-PILA), en el Insectario de Investigación del INBio se llevó a cabo un estudio ex situ en ciclo cerrado con una de las especies recolectadas y criadas en la EBA. Estos datos se complementaron con información bibliográfica pertinente, para ampliar conceptos como la distribución geográfica y los grupos ecológicos (alimentación de larvas y adultos) de cada una de las 30 especies que se desarrollan en el resultado dos de este documento. La fase “b” consistió en la consulta realizada (por los escritores de esta investigación), al Sistema ATTA del INBio. Esto permitió tener un listado de las especies que se han recolectado desde 1993 hasta el 2006 en la EBA-PILA, en base a lo cual se construyó la curva de acumulación de especies de Lepidoptera. 17 Antecedentes de la investigación científica en la entomofauna costarricense. El estudio de los insectos en Costa Rica empezó con la llegada de los primeros naturalistas europeos. Por ejemplo Paul Biolley tuvo una gran influencia sobre naturalistas costarricenses como Anastasio Alfaro y la consecuente fundación del Museo Nacional de Costa Rica, donde se albergan las primeras colecciones entomológicas del país (Méndez y Monge, 2003). Biología Centrali-Americana (disponible en: http://www. sil.si.edu/digitalcollection/bca) es uno de los trabajos más importantes que aún hoy día, en su versión electrónica, es un documento de consulta para los taxónomos y naturalistas. Esta publicación presenta 58 volúmenes con más de 50 000 descripciones de animales y plantas de Mesoamérica recopiladas entre 1879 y 1901. DeVries (1987) y DeVries (1997) describe el trabajo realizado por los principales investigadores de lepidópteros en Costa Rica. Además, recopila información de la biología de 783 especies de mariposas diurnas de Costa Rica (faltan 734 pertenecientes a las familias Lycaenidae y Hesperiidae), sus plantas hospederas, ciclos de vida, dando ejemplos de patógenos, parásitos y parasitoides relacionados a mariposas diurnas. Desde 1989, el INBio ha generado información sobre la biogeografía, biología e historia natural de los insectos de Costa Rica, dando énfasis a la investigación dentro de las ASP. Uno de los lugares en donde se ha generado más información sobre historia natural de insectos es el Sector Altamira, del PILA. Janzen (1991) elaboró una lista anotada de especies de insectos de Costa Rica con datos de su historia natural e hizo énfasis en las necesidades de estudios sobre la entomofauna costarricense. Él expuso que, “en un futuro cercano aparecerán artículos de revisión en dos áreas de la biología de insectos de Costa Rica en las cuales se está acumulando información con bastante rapidez: biología de parasitoides e interacciones insectos-planta hospedera.” Desde 1978, D.H. Janzen y W. Hallwachs establecieron uno de los proyectos más extensos y complejos de investigación en el inventario e historia natural de lepidópteros del Neotrópico. Este proyecto ha generado datos sobre ciclos de vida, plantas hospederas y parasitoides asociados a 3 200 especies de Lepidoptera (de las aproximadamente 9 500) presentes en el ACG. Este proyecto ha hecho posible la conservación de uno de los 18 ecosistemas más importantes de Mesoamérica: el bosque tropical seco (Janzen et al. 2005; Janzen y Hallwachs 2005; Miller et al. 2006). Chacón y Montero (2007) trataron la taxonomía y sistemática del orden Lepidoptera en Costa Rica. Describen la anatomía y fisiología de cada una de las etapas del ciclo biológico de las mariposas, así como 32 familias de las 73 que habitan en el país. Montero (2007), presenta información sobre el ciclo biológico y enemigos naturales de algunas especies de mariposas diurnas que se reproducen ex situ en los zoocriaderos de mariposas de Costa Rica. Rodríguez (2005), ha recopilado una lista de plantas hospederas para larvas y adultos utilizadas en los zoocriaderos de mariposas. Hanson y Gauld (1995) realizaron un inventario de los himenópteros de Costa Rica. Incluyen revisiones de la biología de todas las familias, subfamilias, géneros y algunas especies presentes en dicho estudio. Recientemente Hanson y Gauld (2006) recopilaron información taxonómica y biológica sobre este orden de insectos conocidos en el Neotrópico. Brown, Wood y Zumbado (en prep.) están elaborando un manual que comprende dos volúmenes sobre la taxonomía y biología de los dípteros centroamericanos. El INBio ha publicado una serie de guías de campo de diferentes grupos de insectos en donde destacan Zumbado (1999 y 2006) con las Familias de Diptera de Costa Rica y el Neotrópico, Ugalde (2002) con las familias de Hymenoptera conocidas para Costa Rica y Solís (2002) con las familias de Coleoptera más comunes de Costa Rica. En la base de datos BINABITROP de la Organización para Estudios Tropicales (http://www.ots.ac.cr/index.php?option=com_content&task=view&id=139&Itemid=299), se pueden encontrar más de 100 publicaciones que se refieren sobre todo a las relaciones entre los lepidópteros, sus plantas hospederas y parasitoides en Costa Rica. La gran mayoría, acerca de especies plagas de cultivos y el uso del control biológico para su manejo. Sin embargo, son muy pocas las que se encuentran sobre los ciclos biológicos y parasitoides de especies de mariposas diurnas y nocturnas (Fuentes, 2006). 19 2. OBJETIVOS 2.1. Objetivo general. Describir el estado actual del conocimiento de Lepidoptera al 2008 en el Sector Altamira, Parque Internacional La Amistad, Costa Rica. 2.3. Objetivos específicos. Determinar la riqueza específica del orden Lepidoptera en el sector Altamira, Parque Internacional La Amistad, Costa Rica. Describir la historia natural, plantas hospederas, ciclo biológico y parasitoides asociados a los lepidópteros conocidos en el sector Altamira, Parque Internacional La Amistad, Costa Rica. 20 3. MARCO TEÓRICO 3.1. Importancia de este estudio. Esta investigación permite conocer parte de la diversidad de especies de Lepidoptera presentes en el PILA. Además, registra las especies de plantas hospederas silvestres (in situ), los parasitoides (in situ/ex situ) y datos de su ciclo biológico (ex situ) asociados a unas 85 de las especies de mariposas diurnas y nocturnas presentes en Altamira y en áreas no agrícolas. Tal información es de gran importancia para el manejo de esta ASP, así como para sus comunidades aledañas. Según Borges (2004), estas comunidades son de escasos recursos económicos y actualmente no ven mucha ganancia en mantener protegido el bosque. Por el contrario, a veces sienten que la fauna silvestre les causa daño a sus cultivos agrícolas. En los cultivos orgánicos sembrados en ASOPROLA que forman parte del área de amortiguamiento del PILA; se logró determinar algunas especies de insectos asociados a estos cultivos. Se encontró larvas de Plutella xylostella (Yponomeutidae: Lepidoptera) y de algunas especies (aún no identificadas) de Pyralidae y Geometridae (Lepidoptera) alimentándose de las hojas de repollo y pepino (INBio-CIBIO, inédito). En este documento se citan algunas especies de enemigos naturales (parasitoides), que en un futuro, quizás se puedan utilizar como parte de un control biológico para disminuir de manera significativa las poblaciones de larvas de Lepidoptera, las cuales podrían causar un considerable impacto económico en las cosechas. Aunque las comunidades aledañas al PILA tienen pocos recursos económicos, poseen un alto potencial turístico, parte del cual pueden desarrollar fundamentando sus bases en investigaciones como ésta. Este trabajo de investigación refuerza el proceso de educación y concientización ambiental en las comunidades aledañas al PILA. La información presente en este documento contiene el conocimiento básico de la biología de algunos lepidópteros, sus plantas hospederas y parasitoides asociados en el sector Altamira. Esta información puede servir de base a investigaciones más específicas como por ejemplo el ciclo biológico, supervivencia, mortalidad y reproducción de estos insectos, tanto in situ es decir en el medio natural como ex situ, en cautiverio en un laboratorio, insectario o zoocriadero. 21 En el apéndice 1, se presenta un ensayo de cría de Opsiphanes cassina (Nymphalidae) ex situ, en ciclo cerrado dentro del insectario de investigación del INBio. La metodología empleada en este ensayo (ver Montero, 2007), puede ser repetida y adaptada por otros investigadores interesados en realizar este tipo de estudios en cualquier parte del país, con fines científicos, académicos y económicos. 3.2. Aportes de otras investigaciones. El único trabajo de investigación similar a este estudio desarrollado en Costa Rica y quizás en el Neotrópico, es el de Janzen y Hallwachs (2005). El mismo inició en 1978 con la capacitación de un equipo de parataxónomos, a los cuales se les entrenó en la recolección de larvas de Lepidoptera y sus plantas hospederas en varios sitios del ACG, abarcando los ecosistemas ahí presentes. La publicación electrónica de esta investigación se llama “Dynamic database for an inventory of the macrocaterpillar fauna, and its food plants and parasitoids, of Area de Conservación Guanacaste (ACG), northwestern Costa Rica” y se encuentra disponible en http://janzen.sas.upenn.edu/caterpillars/database.lasso. Esta publicación comprende 312 968 registros de unas 3 200 especies de Lepidoptera, sus ciclos de vida, plantas hospederas y parasitoides asociados. Tal trabajo de investigación científica involucra la participación de una gran cantidad de taxónomos alrededor del mundo (Janzen et al., 2005; Janzen y Hallwachs, 2005). Sin embargo aún se desconoce la historia natural de unas 6 500 especies de lepidópteros reportados en el ACG. Los estudios de Janzen son muy importantes para el presente trabajo de investigación, ya que el 60% de las especies (mamíferos, aves, plantas, insectos) que hay en el ACG también se encuentran en el resto del país (Chacón com. pers.) Por esta razón, muchas de las especies que están en Altamira y tratadas en este estudio se encuentran también en el ACG y por ende existe información disponible del trabajo realizado por Janzen y sus colaboradores. 3.3. Conceptos teóricos de la historia natural de Lepidoptera. La importancia ecológica y ambiental de los lepidópteros radica en el hecho de que los adultos de casi todas las especies son polinizadoras, las larvas se alimentan de varias partes de las plantas y son consumidas por depredadores insectívoros o parasitoides. También las 22 larvas y adultos ayudan a descomponer materia orgánica, ya sea al provocar la caída de tejido vegetal (u ocasionalmente animal), o por continuar el proceso de putrefacción mediante la alimentación de detrito (Sáenz y De La Llana, 1990; Scoble, 1992a). Los lepidópteros se clasifican dentro de la clase Insecta, en la división Endopterygota como un orden de insectos holometábolos. Es decir, que tienen metamorfosis completa y su ciclo biológico se compone de cuatro fases bien definidas, a saber: huevo, larva, pupa y adulto. El huevo es la fase embrionaria. La larva es la fase de alimentación y crecimiento. La pupa o crisálida, como se conoce exclusivamente para las mariposas diurnas, es la fase en la cual el tejido larval sufre transformaciones morfológicas y fisiológicas para formar un adulto. Las larvas se alimentan y almacenan energía que utilizan para la formación del adulto dentro de la pupa. La mayoría de especies de lepidópteros nocturnos pupan dentro de un capullo, el cual construye la larva utilizando seda y sus pelos urticantes. Tal estructura les protege de parasitoides, depredadores y la desecación. El adulto es la fase sexualmente madura cuyo principal fin es la reproducción y dispersión (DeVries, 1987; Scoble, 1992a; DeVries, 1997; Chacón y Montero 2007). Los lepidópteros son uno de los principales grupos de insectos en donde tanto los estados inmaduros como los adultos son fitófagos. Las larvas se alimentan de casi todas las estructuras vegetativas (hojas, flores, frutos, tallos y semillas) tanto de angiospermas como de gimnospermas, así como de helechos, hepáticas y musgos (Powell et al. 1999). Los adultos se alimentan de polen, néctar y jugos de los frutos en proceso de fermentación (descomposición) (Scoble, 1992a). Un aspecto crítico en el ciclo biológico de un lepidóptero es la habilidad de la hembra de encontrar la especie de planta específica donde ovipositar y de la cual se alimentarán la o las larvas. Una especie de Lepidoptera puede ser monófaga, oligófaga o polífaga dependiendo de la variedad de plantas hospederas en que desarrolle su ciclo de vida. Cuando las larvas de una determinada especie de Lepidoptera se alimentan de una sola especie de planta hospedera, se dice que es una especie monófaga. Cuando las larvas de una especie de Lepidoptera se alimentan de varias especies de plantas emparentadas entre sí (un mismo género o familia), es una especie oligófaga. Las especies de Lepidoptera polífagas son las que se alimentan de una gran variedad de especies y familias de plantas (DeVries, 1987; 23 DeVries, 1997) y también se les conoce como especies generalistas, mientras que a las monófagas se les denomina específicas. La relación entre plantas hospederas y lepidópteros es tan fuerte en la escala de la evolución, que es posible encontrar un linaje particular de lepidópteros asociado con tipos de plantas o compuestos químicos de especies muy particulares. Los extensos patrones de relación entre plantas hospederas e insectos (particularmente lepidópteros), ha hecho nacer la idea de la coevolución entre insectos y linajes de plantas (Brues, Ehrlich y Raven, citados en DeVries, 1997). Los lepidópteros son fuente de alimento para un gran número de especies animales, lo cual les atribuye una gran importancia ecológica y ambiental. Las especies de insectos parasitoides de los ordenes Diptera e Hymenoptera son de los principales consumidores que controlan las poblaciones de Lepidoptera en la naturaleza (DeVries, 1987 y 1997; Scoble, 1992a). Según Eggleton y Gaston, citados por Hanson y Gauld (1995), un parasitoide es “un organismo que se desarrolla dentro o sobre otro único organismo, extrayendo alimento de éste y matándolo como resultado directo o indirecto de su desarrollo.” En Costa Rica se han relacionado tres familias de Diptera (Bombyliidae, Sarcophagidae y Tachinidae) como parasitoides de Lepidoptera. En lo que respecta a Hymenoptera, las familias más comunes son Ichneumonidae, Braconidae, Chalcididae, Encyrtidae, Eulophidae, Eupelmidae, Trichogrammatidae, Pteromalidae y Scelionidae (Hanson y Gauld, 1995; Solís, 2007; Zumbado, 2006). De las características biológicas de los parasitoides es importante comprender que existen los koinobiontes, quienes atacan un hospedero que se encuentra expuesto, al cual paralizan momentáneamente para poder ovipositar uno o varios huevos dentro de él. Luego el hospedero continúa su ciclo biológico normal, alimentándose, creciendo e incluso pasando a otras fases, hasta el momento en que la larva parasitoide comienza a alimentarse de los tejidos y órganos internos del hospedero, provocándole la muerte. Los parasitoides idiobiontes atacan hospederos que se encuentran ocultos, a los cuales paralizan por completo, impidiéndoles continuar con su desarrollo. El o los huevos del parasitoide eclosionan muy rápido y las larvas empiezan a alimentarse del hospedero hasta matarlo (Godfray, 1994; Hanson y Gauld, 1995; Gauld y Bolton, 1998; Ugalde, 2002; Solís, 2007). 24 Los ectoparasitoides se alimentan externamente del cuerpo del hospedero, mientras que los endoparasitoides se alimentan internamente. En los parasitoides solitarios una larva única se alimenta del hospedero. En los gregarios varias larvas se alimentan de un mismo hospedero. Otras características en los parasitoides son el superparasitismo, donde el hospedero recibe huevos de más de una hembra de la misma especie; el multiparasitismo, cuando un hospedero recibe huevos de varias especies; y el hiperparasitismo, cuando una especie parasitoide se alimenta de otra especie parasitoide (Gauld y Bolton, 1998; Godfray, 1994; Hanson y Gauld, 1995; Ugalde, 2002; Solís, 2007). 3.4. Antes que existiera el PILA. Los bosques que cubrían la totalidad del territorio de lo que hoy día son los pueblos del distrito de Biolley, Puntarenas (comunidades aledañas al PILA), fueron “colonizados” por Gromaco. Esta compañía estadounidense se dedicaba a la explotación de madera y al cultivo del café: el primer indicio de un sistema agroforestal en esta zona. Tal sistema estaba compuesto básicamente por el cultivo de café y árboles de amarillón los cuales se sembraban con dos propósitos: sombra para el café y para su posterior aprovechamiento forestal (Guerrero y Días, 2000). Esta actividad se desarrolló entre 1960 y 1970. Al final de este período, la compañía Gromaco abandonó la zona, lo cual motivó a los campesinos que trabajaban en ese sitio, a iniciar sus propias actividades productivas, expandiendo con esto la frontera agrícola hacia la Cordillera de Talamanca (actualmente PILA). Años más tarde, tanto los bosques vírgenes como las plantaciones forestales y los mismos cafetales fueron reemplazados por repastos (potreros) y pastos de corta para consolidar lo que sería la principal actividad agropecuaria por varias décadas y que aún persiste hoy día: la ganadería extensiva con doble propósito (leche y carne). Por este motivo, la mayor parte de los terrenos que rodean al PILA son potreros y repastos (Guerrero y Días, 2000). 3.5. Antecedentes del PILA. En agosto de 1982, la UNESCO declaró al PILA como parte de la RBA, pues protege la mayor parte de la Cordillera de Talamanca, constituyéndose de esta manera en el área núcleo de dicha Reserva. El PILA forma parte de la RBA, conjuntamente con los Parques Nacionales Chirripó, Tapantí-Macizo de la Muerte, Barbilla, Reserva Biológica Hitoy Cerere, 25 Reserva Forestal Río Macho, Zona Protectora las Tablas, Jardín Botánico Robert y Catherine Wilson y las Reservas Indígenas Talamanca, Tayni, Telire, Chirripó, Ujarrás, Salitre y Cabagra. En 1983, la UNESCO le otorgó una nueva nominación al PILA, declarándolo Sitio de Patrimonio Mundial de la Humanidad debido a la gran diversidad de ecosistemas que se protegen dentro de su territorio, lo cual es de gran importancia para la investigación científica, la conservación y la belleza escénica (Borges, 2005). El documento “Bosques Tropicales: un llamado a la acción” (preparado por el Banco Mundial, el WRI y el PNUMA) señalan que los bosques que se protegen dentro el PILA son un ecosistema forestal crítico. Este documento considera que el PILA es una de las prioridades de acción en conservación e investigación para Costa Rica (Borges, 2005). La FAO, en su documento “Programa de Acción Forestal en los Trópicos” recomienda la protección del PILA como parte de una acción global de conservación de ecosistemas tropicales. La UICN en su Programa de Bosques Tropicales, asigna al PILA una gran prioridad en materia de conservación e investigación en América Central (Borges, 2005). 3.6. Ubicación geográfica del PILA. El PILA se localiza en la Cordillera de Talamanca, en el sureste de Costa Rica y continúa en el noreste panameño por 207 000 ha más. Fue establecido mediante Decreto Ejecutivo 13324-A el 4 de febrero de 1982 con una extensión territorial (en Costa Rica) de 194 129 ha, que en ese momento correspondía a un 50% de la superficie total que protegía el MIRENEM dentro del SPN (Borges, 2005). Según este mismo autor, el PILA es una de las ASP con mayor diversidad biológica de Costa Rica debido a la presencia de muchos tipos de micro hábitat con ecosistemas muy variados, además de un alto endemismo. Esto se atribuye a las siguientes razones: Su amplio rango latitudinal, pues se encuentra entre los 9º y 10º Latitud Norte y 82º 45’ y 83º 30’ Longitud Oeste. Los fuertes cambios climáticos. La gran variedad de suelos. Es el ASP donde se mantiene el bosque lluvioso natural, virgen y continuo más grande de Costa Rica (3,68% del territorio nacional). Es una de las ASP más grandes de Centroamérica. 26 La administración del PILA, se lleva a cabo en la EBA, con lo cual se ha convertido en la principal puerta de ingreso y toma de decisiones para su manejo. El ecosistema de los alrededores de la EBA, es uno de los pocos remanentes de bosque de premontano presentes en toda la Cordillera de Talamanca y que se conservan dentro de un ASP (González, 2004). El área de trabajo seleccionada se encuentra en la zona media altitudinal. DeVries (1991) menciona que en las zonas de altitud media (500 a 1 600 m) de ambas vertientes, existe una gran diversidad de especies, posiblemente por que se da una confluencia de las especies de altitudes bajas y altas. Altamira se ubica geográficamente en el distrito de Biolley, cantón de Buenos Aires de Puntarenas. La investigación se llevó a cabo en los diferentes senderos que hay en el PILA, en el sector Altamira, a saber: Sendero los Gigantes del Bosque, Sendero al Cerro BiolleyTonduz, Sendero Límite-Río Platanillal, Sendero a Casa Coca y Sendero a la Toma del Agua. Estos cinco senderos incluyen una muestra representativa de diferentes tipos de hábitat de la zona, tales como charral o tacotal, bosque en regeneración, bosque secundario y bosque primario, con lo cual es bastante amplia la gama de especies de plantas. Los cinco senderos se encuentran en un ámbito altitudinal entre los 1 400-1 900 m (Figura 1). 3.7. Características biofísicas del PILA. a. Geomorfología: La Cordillera de Talamanca es el accidente fisiográfico más notable de Costa Rica y se originó hace 40 a 60 millones de años, durante el Eoceno (Dengo, 1962 citado por Brenes et al. 2004). El levantamiento de toda el área se debe a un plegamiento de origen tectónico. La consolidación de la actual Cordillera sucedió entre cinco y tres millones de años atrás, época en que ocurrió afallamiento y vulcanismo extenso (Boza et al. 1988 citados por Brenes et al. 2004). Lo que predomina sobre la Cordillera de Talamanca en el sector del PILA son materiales de origen volcánico, principalmente de la edad terciaria. El sector Altamira del PILA se encuentra en una zona dominada por rocas intrusitas (lavas, tobas y tobáceas andesitas), que también se pueden encontrar en las partes más altas de la Cordillera de Talamanca. En 27 los alrededores de la zona de estudio existe la presencia de rocas volcánicas (Brenes et al. 2004). b. Suelos: Las características geológicas, climáticas y topográficas tan variables que presenta el PILA, han permitido la formación de una amplia gama de tipos de suelos. En los alrededores de la EBA (senderos Gigantes del Bosque, Límite-Río Platanillal y Toma del Agua) el suelo es fuertemente ondulado y tiene pendientes con una inclinación del 30-60%. Los senderos a Cerro Biolley y Casa Coca tienen un suelo escarpado con una pendiente mayor al 60%. En el sector Altamira predominan los suelos inceptisoles, los cuales se derivan de las cenizas volcánicas y tienen un bajo contenido de bases. Es posible que en el pie de monte del Cerro Biolley se encuentren suelos ultisoles (catosol rojo amarillento), los cuales son profundos y arcillosos. Los tipos de uso del suelo varían mucho: desde bosques (primarios y secundarios), pastizales y otras áreas abiertas (en las zonas bajas) hasta robledales y páramos (en las zonas altas). Los bosques comprenden cerca el 81% de la cobertura del PILA, muestra del grado de conservación del sitio (TNC, 2001). c. Clima: las condiciones climáticas del PILA son muy variables. Esto se debe a la ubicación geográfica en que se encuentra (ambas vertientes) así como un amplio ámbito altitudinal que va desde los 400 hasta los 3 000 m. Además, la relativa cercanía de ambos océanos favorece las precipitaciones orográficas locales, provocadas por los vientos alisios del noreste en el Caribe y alisios del suroeste en el Pacífico. Los cambios bruscos de temperatura que sufre la atmósfera en las partes altas de Talamanca, provocan cambios de precipitación y viento, así como la presencia de neblina (niebla) en la EBA, sus alrededores y otras partes bajas del PILA (Brenes et al. 2004). d. Precipitación: el promedio de precipitación anual del PILA es de 3 000 mm/año, sin embargo, esto varía según la elevación y ubicación, entre el sureste y el noroeste y dependiendo de la vertiente (Torres y Mendoza, 1987). La precipitación de la zona de estudio (Altamira) es de 3 400-3 600 mm/año, lo cual equivale a unos 247,7 mm/mes, o a 8,26 mm/día. Setiembre y octubre son los meses de mayor precipitación, con 646,4 y 490,4 mm respectivamente. Los meses más secos son febrero con apenas 19,9 mm y enero con 27,7 mm. 28 e. Temperatura: la temperatura es muy variable, pues en las partes más altas de la Cordillera de Talamanca dentro del PILA, se han registrado temperaturas inferiores a los 0°C, mientras que en las partes más bajas la temperatura puede alcanzar los 23°C (Brenes et al. 2004). La EBA y sus alrededores (senderos donde se desarrolló esta investigación) reporta una temperatura promedio de 19-20°C. Los meses más calientes son febrero y mayo, con 19,8 y 20,4°C respectivamente. Los meses más fríos corresponden a noviembre y diciembre, con 10°C para cada uno y la temperatura promedio mensual es de 18,1°C. Los meses más húmedos son agosto y octubre, con un 80% de humedad relativa cada uno. Los meses más secos son febrero (64%) y marzo-abril (66% de humedad relativa). Los meses con mayor radiación son febrero y marzo, con 10,8 y 9,8 megajulios respectivamente. La época en donde hay menos radiación son los meses de agosto (5 megajulios) y julio y noviembre (5,4 megajulios cada uno). f. Zonas de Vida: en el PILA están presentes ocho de las 12 zonas de vida descritas por Holdridge (1979; citado por Arias, 2001) para Costa Rica (Figura 2). Estas zonas de vida se agrupan en cinco pisos altitudinales, uno de los cuales es el piso premontano, cuyo bosque se ubica entre 800 y 1 400 m y que es donde está la EBA y sus alrededores inmediatos. Según la figura 2, la EBA y sus alrededores se encuentran en la zona de vida Bosque Húmedo Premontano o según TNC (2001) en la zona de vida Bosque Pluvial Montano Bajo (bp-MB). Este tipo de bosque se encuentra en ambos lados de la Cordillera de Talamanca y sus estribaciones, entre los 1 400 y 2 500 m. La precipitación es superior a los 3 600 mm anuales en promedio y la biotemperatura media anual oscila entre 12 y 17°C. g. Caracterización de flora y fauna: el PILA está considerado como el ASP con la mayor diversidad de especies de Costa Rica (Silberman, 1982 citado por Brenes et al. 2004). Esta ASP cuenta con una riqueza biológica única, donde se alberga aproximadamente el 4% de la diversidad de especies terrestres de Costa Rica (Araya y de Marco, 2001). En 1990, el INBio inició el estudio de los insectos del PILA. Este esfuerzo se concentró en la recolección de especímenes para documentar la presencia de las diferentes especies y para describir las nuevas (inventario de la biodiversidad). Gracias a esto se pueden generar 29 mapas de recolección y listas taxonómicas. En el 2004 el INBio inició con la crianza de insectos con la finalidad de conocer las relaciones insecto-planta e insecto-insecto. A partir de ese año este proceso permitió la generación de información de la historia natural de los insectos del PILA, principalmente en el Sector Altamira. Uno de los grupos de seres vivos más diversos en el PILA, es el de los insectos. De las 3 752 especies de insectos que se conocen en el PILA, 2 888 (77%) se han recolectado en los senderos de la EBA y 1 572 son lepidópteros (INBio, 2007). Se considera que en el PILA se protege un gran número de especies de insectos que aún no han sido registradas debido a que la mayoría de sitios para la investigación científica son de difícil acceso. Aunado a esto, los datos de historia natural de los insectos del sector Altamira, se han enfocado principalmente en especies de lepidópteros y parasitoides asociados a éstos. Sin embargo esta información aún no está sistematizada al 100%, ni disponible a todo el público (González, 2004). h. Estado de conservación: el PILA en territorio costarricense tiene una extensión de casi 200 000 ha, y en ellas posee una serie de características abióticas (geológicas, geomorfológicas, climáticas) que le confieren muestras representativas de ecosistemas, unidades bióticas, hábitats y especies endémicas, raras, amenazadas y en peligro de extinción. Su forma alargada es una limitación para el manejo integral del ASP. Sin embargo, tal limitante se ve mitigada por la presencia de una serie de ASP con diferentes categorías de manejo así como territorios indígenas con diferentes niveles de desarrollo y cambio cultural que ejercen el papel de zonas de amortiguamiento alrededor del PILA (Chuprine, 2005). De acuerdo con el sistema de clasificación de categorías de manejo de la UICN, al PILA le corresponde la categoría II: Parque Nacional, que es un ASP manejada principalmente para la conservación de ecosistemas y con fines de recreación (Chuprine, 2005). Según este autor, uno de los objetivos principales en el manejo de un Parque Nacional es proteger áreas naturales y escénicas de importancia nacional e internacional, con fines espirituales, científicos, educativos, recreativos o turísticos. 30 La administración del PILA ha tomado muy en cuenta este objetivo y ha hecho de la investigación científica una de sus actividades primordiales. Quizás esto se deba a que se ha seguido el principio de que no podemos conservar lo que aún no conocemos, basado en la frase célebre del ecologista Africano Baba Dioum “Conservaremos sólo aquello que amemos, amaremos sólo aquello que entendamos y entenderemos sólo lo que se nos enseñe”. La remota ubicación geográfica del PILA, el mal estado de las vías de acceso y las características ecológicas de esta ASP la hace un tanto difícil para el turismo. Sin embargo, ha sido un punto atractivo para investigadores científicos tanto nacionales como extranjeros de varias disciplinas, los cuales han encontrado las puertas abiertas y bastantes facilidades en comparación con otros sitios. 31 Figura 1. Distribución de los senderos y tipos de vegetación en la EBA-PILA, según el sistema de clasificación del proyecto ECOMAPAS. 32 Figura 2. Zonas de Vida del Parque Interacional La Amistad. 33 4. METODOLOGÍA 4.1 Análisis de la información generada por el INBio y selección de especies. La información de Lepidoptera generada por el INBio en el sector Altamira, se analizó mediante la consulta a la base de datos ATTA, la cual es un sistema desarrollado por el INBio para el manejo de la información taxonómica, biogeográfica y biológica almacenada en las colecciones biológicas de plantas, hongos, líquenes, artrópodos (ubicadas en el INBio), moluscos (ubicada en la UCR) y nemátodos (ubicada en la UNA). Las consultas se realizaron por medio del sistema de información de especímenes ATTAweb, que se encuentra en línea y de forma gratuita (Figura 41) en: http://ATTA.inbio.ac.cr/scripts/pbcgi60.exe/TUTORIAL/uo_pbdemo/f_getinfo (INBio, 2007). Esta información se complementó revisando la colección de insectos, bases de datos y bitácoras de los parataxónomos del INBio, quienes generaron información de historia natural, plantas hospederas, parasitoides y ciclo biológico en la zona de estudio del 2001 al 2006. Como resultado de esta consulta, se elaboró una lista de las especies de Lepidoptera que se han recolectado mediante una serie de técnicas (trampas de frutas, recolecta con red entomológica, trampas de luz y crianza) en el sector Altamira. Esta lista representa el primero de los resultados obtenidos y pretende ayudar a documentar y comprender el estado del conocimiento de este grupo de insectos. La lista de especies está ordenada filogenéticamente a nivel de suborden, superfamilia y familia, siguiendo la taxonomía que utilizan Chacón y Montero (2007). Los géneros, especies y subespecies están ordenados alfabéticamente, el taxón de género se presenta escrito en mayúscula y las especies y subespecies escritas en minúscula con letra itálica. Se incluyen las morfoespecies no catalogadas (por ejemplo Conchylodes sp.3), las cuales son especies reconocidas por los distintos expertos en el respectivo grupo taxonómico y que están sin describir o publicar. Para tener una mayor comprensión del estado del conocimiento de los lepidópteros en la zona de estudio (EBA), se presenta una curva de acumulación de especies, basada en los datos del sistema ATTA, así como en las bases de datos y bitácoras de los parataxónomos. Se siguió como modelo de curva de acumulación de especies un análisis realizado por 34 Roubik y Baus (sin publicar; citados en Roubik y Hanson, 2004) quienes realizaron una estimación de la riqueza de abejas euglosinas en Ecuador. Para la generación de la curva se extrajo del sistema ATTA todos los reportes existentes de lepidópteros en el sector Altamira. Estos datos se tabularon en columnas de una hoja de cálculo Excel en especies por año (el año de recolecta se tomó como la unidad muestreal). Cada columna se ordenó alfabéticamente y se filtró para obtener registros únicos. Luego se comparó cada periodo con el acumulado de especies, de tal forma que se obtuvieron la cantidad de especies nuevas y el acumulado de especies en cada periodo. La selección de las 30 especies cuya historia natural se describe en el apartado dos de la sección de resultados, se hizo de acuerdo con la cantidad de datos generados por los parataxónomos. Se escogieron las especies con mayor cantidad de registros de crianza, con la finalidad de obtener datos confiables. Aparte de estas 30 especies se criaron otras 55, las cuales se incluyen en la lista de especies y anexos, puesto que no todas cuentan con datos suficientes. 4.2. Generación de información y metodología de crianza (in situ/ex situ). Janzen y Hallwachs (2005) exponen la metodología utilizada para la recolecta y crianza de lepidópteros, plantas hospederas y parasitoides asociados, la cual fue utilizada desde el II Curso de Parataxónomos que impartió el INBio. Esta misma metodología ha sido aplicada por el INBio durante más de una década y es la misma que se siguió en este trabajo de investigación, complementada con lo que recomiendan DeVries (1987 y 1997), Hanson y Gauld (1995) y Zumbado (1999 y 2006), para el estudio de estados inmaduros de estos grupos de insectos. El número de evento es un registro con el cual se identifica la información asociada a cada larva (o grupo de larvas en caso de que fueran gregarias) recolectada en un momento y lugar determinado. Dicho registro está conformado por el año de recolección, las iniciales del recolector y un número consecutivo. Por ejemplo 2006-RGT#247 es un registro provisional de un evento, el cual se asignó temporalmente a la larva 247, la cual se colectó y mantuvo en crianza durante el 2006 hasta que pupó y emergió el adulto. El número de evento se escribe en la libreta de eventos (libreta borrador de testigos) así como en la bolsa de crianza. 35 El número de testigo (por ejemplo RGT-00456) es un registro consecutivo con el cual se identifica la información asociada para cada especie, una vez que el espécimen adulto ha emergido; o bien, cuando se hayan obtenido parasitoides. Cuando estos especímenes llegan a la colección de insectos del INBio, se ingresan con el número de testigo correspondiente, el cual les identificará por el resto del tiempo. El número de testigo se le asigna a los especímenes adultos emergidos, a las mudas de sus estadios larvales y a la exhuvia de la pupa. El número de testigo se escribe con tinta indeleble (tinta china) en una etiqueta de papel, la cual se pincha en el mismo alfiler del espécimen montado, sus mudas, exhuvias, capullos y parasitoides. También se escribe en la libreta de testigos y en la base de datos de crianza. El proceso de crianza en el sector Altamira se desarrolló siguiendo los siguientes pasos: a. Recolecta in situ de estados inmaduros. Se buscaron y recolectaron in situ, tanto huevos como larvas en sus diferentes estadios. Tal recolecta se hizo recorriendo cada uno de los senderos que se escogieron para trabajar y que se representan en la Figura 1. Para esto se dedicó una cantidad de tiempo y trabajo similar en cada sendero. El esfuerzo de trabajo en la recolecta de inmaduros equivale al desempeño de dos personas a tiempo completo durante dos años y dedicando cinco horas diarias. Los recorridos en búsqueda de larvas y huevos se hicieron durante la mañana, tarde y noche. La recolecta de los huevos y las larvas fue manual, buscando entre el follaje, tanto en la haz como en el envés de las hojas. También se buscó en la corteza de árboles, flores, frutos y en cualquier lugar donde se observara indicios de acción (daños) de larvas, como por ejemplo: heces, el raspado, enrollado y comido de hojas. Si se encontraba una especie que ya había sido recolectada y criada, de igual manera se recolectó para tener más registros y obtener más información del ciclo biológico y de las plantas hospederas asociadas a cada especie. Los huevos recolectados se depositaron dentro de un plato Petri con una pequeña muestra de la planta hospedera hasta que eclosionaran las larvas (ex situ). La mayoría de los huevos recolectados murieron durante el primer estadio larval o simplemente no eclosionaron. Este principio evolutivo de la supervivencia, basa su éxito en la cantidad de huevos que pone cada hembra. La mayoría de individuos muere, algunos pasan con éxito los primeros estadios, y sólo unos pocos individuos llegan a la fase adulta. Además, en la mayoría de las especies, las hembras adultas ovipositan sobre el follaje de la planta hospedera. Sin 36 embargo existen casos en los que las hembras ovipositan al azar o simplemente dejar caer sus huevos mientras vuelan. El primer alimento de la larva es la cáscara del huevo, luego ésta tiene que buscar su propia comida. Por esta razón la mayor parte de las especies criadas se obtuvieron de individuos recolectados durante su fase larval. Las larvas se depositaron dentro de bolsas plásticas transparentes de 14 por 20 pulgadas junto con una muestra de la planta hospedera. b. Rotulación de las bolsas de crianza. En cada una de las bolsas se anotó el número de evento con un marcador de tinta permanente. Las bolsas plásticas se colgaron en un lugar abierto y bajo techo, para impedir que la temperatura y humedad dentro de la bolsa se viera afectada por la incidencia directa de los rayos del sol. Sin embargo, cabe destacar que el cambio del medio natural a la bolsa, distorsiona el ambiente natural en donde se está criando la larva. En ocasiones, la pared interna de la bolsa se llena de gotitas de agua, producto de la humedad de la planta hospedera, con lo cual la temperatura puede variar con respecto al entorno natural (ambiente exterior de la bolsa plástica). Las bolsas se mantuvieron llenas de aire, se inflan abriéndolas por la boca y agitándolas hacia arriba, nunca soplando con la boca como si fuera un globo, pues se estaría introduciendo dióxido de carbono, intoxicando las larvas. Se mantienen cerradas con un nudo y sujetas a un mecate con prensas para tender ropa (Figura 3). c. Libreta de campo o de eventos. Es un cuaderno en el cual se anotan todos los datos relacionados a los estados inmaduros (huevos, larvas, pupas) recolectados. Se anota el número de evento, la fecha de recolección, sitio exacto donde se recolectó, breve descripción de los huevos, larvas o pupas, número de individuos, identificación de la planta hospedera, fechas de eclosión de huevos, cambios de estadios larvales, prepupa, formación de la pupa, emersión de adultos o muerte en cualquiera de las fases inmaduras; así como cualquier otro dato observado. d. Toma de fotografías digitales. Se utilizó una cámara digital Nikon Coolpix para tomar fotografías de cada una de las fases del ciclo biológico. Se tomaron fotografías de las larvas, pupas y adultos. Cuando fue posible se tomaron fotografías de la vista anterior, posterior, dorsal y lateral en cada uno de los estadios larvales. En algunos casos, a los adultos se les tomó fotografías ventral y dorsalmente, para ilustrar caracteres diagnósticos. Todas las 37 fotografías tomadas se almacenaron en discos compactos en carpetas correspondientes al número de testigo. Figura 3. a) Cuarto de crianza ex situ en la EBA, PILA. b) Bolsa de crianza con adultos recién emergidos de Pteronymia picta notilla (Nymphalidae). Fotografia: Róger González. e. Alimentación de las larvas. El alimento de las larvas (planta hospedera) ex situ, se sustituyó por follaje fresco cada tres días. La cantidad de follaje varió dependiendo de la cantidad de larvas recolectadas, de la voracidad de las mismas y del estadio larval en que se encontraban. En el caso de las plantas hospederas con follaje muy suculento y que se descomponen en poco tiempo, se cambió cada dos días. Esto porque al descomponerse sus tejidos liberan gases como el amoníaco, que puede causar la muerte de las larvas. f. Revisión de los eventos. Aunque la comida se cambió cada tres días, los eventos se revisaron diariamente con varios fines: anotar el tiempo de eclosión de los huevos, mudas de larvas, formación de pupas y emersión de adultos; ventilar las bolsas y eliminar gases y humedad acumulada en el interior de estas, producida por la descomposición de los tallos y hojas y desechar las heces de las larvas para evitar la contaminación de las mismas. g. Libreta de testigos. Es un cuaderno en donde se registran los datos de los eventos en los que se obtuvieron los adultos de Lepidoptera o bien, sus parasitoides. Bajo un mismo número de testigo se puede registrar la información de uno o más eventos, siempre y cuando éstos sean de la misma especie. h. Montaje de los especímenes. Los lepidópteros adultos recién emergidos, necesitan de un lapso de tiempo para hacer circular la hemolinfa a través de las venas de sus alas y 38 extenderlas por completo. Luego de esto, se liquidaron introduciéndolos dentro de cámaras de éter (para los especímenes con coloraciones verdes y amarillentas) ó amoníaco (para el resto de coloraciones). Esto porque dependiendo del químico utilizado, puede decolorar o modificar los colores de las escamas de los lepidópteros y con ello dificultar su identificación taxonómica. El montaje de los insectos se hizo siguiendo los protocolos de curación establecidos por el INBio. Dependiendo del tamaño y robustés del cuerpo (tórax) de cada individuo, se utilizaron alfileres entomológicos número uno (más delgado), dos (intermedio) ó tres (más grueso) para pinchar el espécimen en el centro de su tórax. Las alas se extendieron utilizando tablas para montaje de mariposas y se colocaron dentro de un cajón cerrado, con una bombilla de 75 voltios, durante 48 horas. La metodología de montaje para los lepidópteros se describe ampliamente en Chacón y Montero (2007) y Montero (2007). Esto se hizo para eliminar las sustancias corporales del insecto y dejarlo seco. Algunos especímenes muy grandes o robustos necesitaron de un mayor tiempo de secado. Luego se sacaron del horno y se dejaron entre 15-20 minutos a temperatura ambiente antes de quitar las tiras de papel con las cuales se prensaron las alas, para evitar que al quitarlas se quebraran las antenas, patas o incluso las alas. Los especímenes se transportaron en cajas Schmidt, cuyo fondo es de polietileno expandido. i. Ingreso de la información a la base de datos. La información descrita en la libreta de testigos se ingresó en una base de datos File Maker, la cual contiene una serie de campos a llenar para cada uno de los aspectos mencionados en dicha libreta (Figura 40). Estas bases de datos son únicas de cada parataxónomo y actualmente no están disponibles al público. j. Identificación taxonómica de los lepidópteros. La identificación previa de los especímenes adultos y algunas de larvas se hizo utilizando los volúmenes 1 y 2 del libro “The Butterflies of Costa Rica” de Philip J. DeVries y mediante comparación directa con especímenes previamente identificados. Una vez en INBio, la identificación definitiva de las especies la realizaron los curadores a cargo de la colección de Lepidoptera: José Montero, Isidro Chacón y Bernardo Espinoza. 39 k. Identificación taxonómica de parasitoides. Los parasitoides que se obtuvieron (in situ/ex situ) son especies de los órdenes Diptera e Hymenoptera. En la mayoría de los casos, los himenópteros adultos emergieron directamente de las larvas de Lepidoptera, mientras que los parasitoides dípteros, puparon y emergieron fuera de su hospedero. Los parasitoides con un tamaño mayor a los 5 mm se conservan montados en seco, mientras que los más pequeños se conservan en etanol al 75% (excepto los dípteros) en la colección húmeda del INBio. Todos los parasitoides se liquidaron en un período de 24-48 horas luego de su emersión. En algunos casos, los restos de larvas y pupas hospederas estaban en buen estado, por lo que se conservan en seco, montadas en cartulina o bien, en etanol al 75%. La identificación previa de los parasitoides se hizo en el laboratorio de la EBA. Aquí se determinó el orden y la familia de cada espécimen. Una vez en el INBio, la identificación de los especímenes la realizó Manuel Solís con el apoyo de Montgomery Wood (especialista en moscas parasitoides de la familia Tachinidae), Manuel Zumbado (curador de Diptera del INBio) y Ronald Zúñiga (experto en avispas parasitoides de la familia Ichneumonidae). l. Identificación taxonómica de las plantas hospederas. Algunas de las especies de plantas se identificaron directamente en el campo, mediante el uso de guías (Alfaro, 2001 y González, 2005). Para corroborar dichas identificaciones e identificar los especímenes desconocidos, se recolectaron muestras de cada una de ellas. Cada muestra botánica se recolectó con follaje, flores y frutos para su identificación. Una vez obtenida la muestra, se prensó entre dos láminas de papel periódico, se le escribió el número de evento asignado a la larva que comía dicha planta, se colocó dentro de una bolsa plástica y se humedeció la muestra con etanol al 75%, para preservarla hasta que llegara al herbario del INBio. Cuando las muestras llegaron al INBio, se sacaron de las bolsas plásticas y se prensaron debidamente para secarlas y poderlas identificar dentro de la colección. La identificación de las plantas hospederas fue realizada por los curadores de Botánica del INBio: Armando Soto, Francisco Morales, Alexander Rodríguez, Daniel Santamaría, Daniel Solano, Ricardo Kriebel, Barry Hammel y Nelson Zamora. Una vez identificadas, las plantas 40 se llevaron de nuevo al laboratorio de la EBA, en donde se conservan en seco como una colección de referencia para la posterior identificación de otras muestras. m. Proceso de curación del material recolectado. Una vez que los especímenes criados estaban debidamente secos y montados, se trasladaron al laboratorio del INBio para su posterior ingreso a la colección de insectos, en donde se conservarán por el resto del tiempo. Antes de ingresar a la colección, el material pasa por un período de cuarentena dentro de un congelador para eliminar ácaros, hongos u otros agentes externos que puedan contaminar el resto de la colección. Luego de la cuarentena a temperatura bajo cero, el material fue revisado por los curadores de Lepidoptera ya mencionados, con la finalidad de observar e identificar las especies criadas, hacer sus respectivas observaciones y dar el visto bueno para el ingreso del material a la colección. n. Etiquetado de los especímenes. Antes de ingresar a la colección, a cada espécimen se le asigna una etiqueta. Existen tres tipos básicos de etiquetas: los insectos provenientes de la crianza se etiquetan con el número de testigo correspondiente (RGT-00456). Si son insectos recolectados por medio de alguna trampa (Malaise, luz, intersección, foso, frutas, etc.), cada espécimen recibe dos etiquetas superpuestas. La superior (Figura 39a) tiene la información general de recolecta, como la ubicación (país, provincia, cantón, distrito, área protegida, otras señas, coordenadas geográficas y elevación), también describe la metodología y fecha de recolecta así como el nombre del recolector. La etiqueta inferior (Figura 39b) es un código de barras y permite asociar a cada espécimen la información taxonómica y de recolecta en el Sistema Atta. o. Ingreso y mantenimiento en la colección de Artrópodos del INBio. Los especímenes criados se depositaron en las colección seca de testigos de Lepidoptera. Los parasitoides microhimenópteros testigos se conservan en etanol al 75% en la colección húmeda. Los testigos parasitoides más grandes se conservan montados en la colección seca de testigos de Diptera e Hymenoptera respectivamente. El ambiente dentro de la colección se mantiene con aire acondicionado, controlando la temperatura y la humedad para mantener en buen estado los especímenes. 41 5. RESULTADOS 5.1. Riqueza específica de Lepidoptera en el Sector Altamira, Parque Internacional La Amistad. Se han recolectado 10 367 especímenes correspondientes a 1 572 especies de Lepidoptera, lo cual representa el 11,2% del total de especies estimadas para Costa Rica. Entre las 1 572 especies se encuentran 38, cuyos especímenes sólo se han obtenido mediante la metodología de crianza (Cuadro 1 y Figura 4). El Cuadro 1 comprende una lista con 1 444 especies de Lepidoptera. De estas, se conocen datos de historia natural, ciclo biológico, plantas hospederas y parasitoides asociados de sólo un 6% (85 especies) y 30 de éstas se tratan con detenimiento en este documento. La curva de acumulación de especies (Figura 4) indica que hacia el 2006 la cantidad de especies de lepidópteros conocidas en el área de estudio empieza a estabilizarse y la probabilidad de reportar nuevas especies disminuye considerablemente. Aún así, hay que tomar en cuenta que el esfuerzo de recolecta y el de identificación de especies no ha sido el mismo para todos los años. El periodo con mayor número de especies es 1994 con 888 recolectadas y 449 reportes nuevos. A partir de este periodo, la curva tiene un crecimiento exponencial y proporcional en cada periodo. Las cantidades de especies nuevas disminuye rápidamente en cada periodo, sin embargo hay un repunte significativo en el periodo 2004-2005 (Figura 4). Este mismo periodo es en el que se empieza con la metodología de muestreo en el sector Altamira, enfocado a la crianza de larvas de Lepidoptera, Coleoptera, Hymenoptera y Diptera. 42 N° de especies en el muestreo anual Especies nuevas Total acumulado de especies 1700 850 1600 800 1500 750 1400 700 1300 650 1200 600 1100 550 1000 500 900 450 800 400 700 350 600 300 250 500 200 400 150 300 100 200 50 100 0 N° acumulado de especies Total de especies 900 0 1993 1994 1995 1996 1997 1998 2001 2004 2005 2006 Año de muestreo Figura 4. Curva de acumulación de especies de Lepidoptera en el Sector Altamira (PILA) con base a la información generada por el Instituto Nacional de Biodiversidad (INBio, 2007). Autor: González y Solís, 2007. Fuente: INBio, 2007. 43 Cuadro 1. Especies de Lepidoptera del sector Altamira, Parque Internacional La Amistad, recolectadas de 1993 al 2006. Suborden Superfamilia Familia Género Glossata Gelichioidea Elachistidae Antaeotricha Especie o Subespecie Cerconota Chlamydastis Ethmia Chlamydastis orion Ethmia baliostola Ethmia terpnota Stenoma exarata Stenoma Stenoma impressella Glossata Zygaenoidea Coleophoridae Blastobasis Megalopygidae Aithorape Aithorape roseicornis Macara Macara argentea Megalopyge albicollis Megalopyge basalis Megalopyge Megalopyge opercularis Megalopyge salebrosa Megalopyge tharops Mesoscia Mesoscia terminata Norape Norape sp.12 Podalia contigua Podalia Podalia orsilocha Thoscora Thoscora acca Trosia incostata Trosia Trosia nigropunctigera Trosia sp.10 Glossata Zygaenoidea Acharia apicalis Limacodidae Acharia Acharia hyperoche Acharia ophelians Epiperola Euclea Epiperola vafera Euclea norba Euclea zygia Euphobetron Euphobetron aquapennis Miresa argentea Miresa Miresa clarissa Natada caria Natada Natada lalogamezi 44 Suborden Superfamilia Familia Glossata Zygaenoidea Limacodidae Género Especie o Subespecie Natada truncata Paleophobetron Parasa Paleophobetron arcuata Parasa cebrenis Parasa imitata Perola nitidissima Perola Perola producta Perola sericea Phobetron* Prolimacodes Prolimacodes triangulifera Talima aurora Talima Talima emilia Glossata Zygaenoidea Acraga hamata (End.) Dalceridae Acraga Acraga isothea Acraga melinda (End.) Glossata Zygaenoidea Zygaenidae Neoalbertia Neoalbertia anacreon Glossata Sesioidea Castniidae Amauta Amauta cacica Divana Divana diva Glossata Choreutoidea Choreutidae Brenthia * Tortyra Tortyra sp.8 Zodia * Glossata Tortricoidea Tortricidae Amorbia Amorbia rectilineana Amorbia shombobasis * Anacrusis Anacrusis nephrodes Argyrotaenia Bonagota Bonagota costaricana Clepsis Cuproxena Cuproxena cornuta Cuproxena neonereidana Hilarographa Icteralaria Icteralaria idiochroma Netechma Netechma n.sp Omiostola Orthocomotis chaldera Orthocomotis herbacea Orthocomotis Orthocomotis longicilia Orthocomotis magicana 45 Suborden Superfamilia Familia Género Glossata Tortricoidea Tortricidae Platynota Especie o Subespecie Polyortha Pseudatteria Pseudatteria leopardina Pseudomeritastis Tina Tinacrucis Glossata Pyraloidea Pyralidae Accinctapubes apicalis Accinctapubes Accinctapubes chionopheralis Achoria * Azamora Azamora sororia Bibasilaris Bibasilaris trisulcata Bonchis Carcha Casuaria Carcha hersilialis Casuaria catocalis Casuaria crumena Chloropaschia pegalis Chloropaschia Chloropaschia rufibasis Dasycnemia Deuterollyta basilata Deuterollyta Deuterollyta chlorisalis Deuterollyta majuscula Deuterollyta umbrosalis Macalla finstanalis Macalla Macalla niveorufa Macalla noctuipalpis Mapeta Mapeta xanthomelas Milgithea melanoleuca Milgithea Milgithea suramisa Parachma Parachma tarachodes Phidotricha Phidotricha erigens Psectrodes Psectrodes abrasalis Salobrena Salobrena sp. 7 Salobrena vacuana Sthenobaea Sthenobaea nitidalis Tamyra Tamyra inclyta Tancoa Tancoa metaxanthalis 46 Suborden Superfamilia Familia Glossata Pyraloidea Crambidae Género Especie o Subespecie Agathodes Agathodes designalis Anania Anania inclusalis Anarmodia inflexalis Anarmodia Anarmodia nebulosalis Anarmodia cf. inflexalis Apogeshna Apogeshna acestealis Aponia Aponia minnithalis Argyractoides leucogonialis Argyractoides lucianalis Argyractoides Argyractoides nitens Argyractoides sp.2 Asturodes Asturodes fimbriauralis Ategumia Aulacodes Aulacodes sp.3 Azochis Blepharomastix colubralis Blepharomastix Blepharomastix cf. schistisemalis Blepharomastix rufilinealis Bocchoris Cliniodes Cliniodes opalalis Coenostolopsis Coenostolopsis apicalis Compacta Conchylodes bryophilalis Conchylodes platinalis Conchylodes Conchylodes salamisalis Conchylodes sp.3 Condylorrhiza Condylorrhiza vestigialis Cryptobotys Cryptobotys zoilusalis Desmia Desmia bajulalis Diacme Diacme mopsalis Diaphania costaricalis Diaphania Diaphania exclusalis Dichogama Dichogama prognealis Dismidila Dismidila drepanoides Erupa 47 Suborden Superfamilia Familia Género Glossata Pyraloidea Crambidae Eulepte Especie o Subespecie Eurrhyparodes Glyphodes Hahncappsia mellinalis Hahncappsia Hahncappsia nigripes Herpetogramma agavealis * ∆ Herpetogramma Herpetogramma phaeopteralis Herpetogramma semilaniata Hileithia Hymenia Hymenia perspectalis Lamprosema cf. esperanzalis Lamprosema Lamprosema excurvalis Linosta Linosta sinceralis Lipocosma Lipocosma nigripictalis Lypotigris Lypotigris reginalis Maruca Maruca vitrata Massepha Massepha lupa Megastes Megastes pusialis Mesocondyla Microcrambus Microcrambus pusionellus Microphysetica Microphysetica hermeasalis Midila Midila daphne Neargyractis Neoleucinodes Neoleucinodes cf. prophetica Neurophyseta albinalis Neurophyseta arcuatalis Neurophyseta clymenalis Neurophyseta Neurophyseta cyclicalis Neurophyseta dasymalis Neurophyseta mollitalis Neurophyseta turrialbalis Oligostigmoides Oligostigmoides cryptalis Omiodes albicilialis Omiodes gazalis Omiodes Omiodes insolutalis Omiodes ochrosoma 48 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Pyraloidea Crambidae Oxyelophila Oxyelophila puralis Palpita Pantographa acoetesalis Pantographa Pantographa expansalis Pantographa limata Petrophila amethystina Petrophila Petrophila triumphalis Phaedropsis Phostria Phostria euagra Pilocrocis Pilocrocis ramentalis Plectrona Plectrona dohrnii Pleuroptya Pleuroptya silicalis Polygrammodes elevata Polygrammodes hartigi Polygrammodes Polygrammodes hercules Polygrammodes sanguinalis Portentomorpha Portentomorpha xanthialis Prenesta fenestrinalis Prenesta Prenesta latifascialis Pseudopyrausta Pseudopyrausta cf. acutangulalis Pyrausta insignitalis Pyrausta Pyrausta panopealis Pyrausta xanthomela Rhectosemia Rhectosemia viriditincta Salbia lotanalis Salbia Salbia zena Samea Samea ecclesialis Schoenobius Siga Siga pyronia Sparagmia Sparagmia gonoptera Spilomela Spoladea Spoladea recurvalis Syllepis Syllepis hortalis Syllepte cf. nitidalis Syllepte Syllepte pactolalis Synclera Synclera jarbusalis 49 Suborden Superfamilia Familia Glossata Pyraloidea Crambidae Género Especie o Subespecie Syngamia dilutalis Syngamia Syngamia florella Syntrita Syntrita cf. nimalis Terastia Terastia meticulosalis Tortriculladia Trichaea Trichaea pilicornis Undulambia Undulambia polystichalis Usingeriessa onyxalis Usingeriessa Usingeriessa symphonalis Glossata Thyridoidea Thyrididae Dysodia cf. flagrata Dysodia Dysodia speculifera Microsca Microsca polychloralis Rhodoneura intermedia Rhodoneura Rhodoneura thiastoralis Glossata Glossata Mimallonoidea Lasiocampoidea Mimallonidae Cicinnus Cicinnus pudens Druentica Druentica inscita Mimallo Mimallo amilia Euglyphis albigrisea Lasiocampidae Euglyphis amathuria Euglyphis braganza Euglyphis capillata Euglyphis charax Euglyphis definita Euglyphis directa Euglyphis egra Euglyphis guttularis Euglyphis Euglyphis indentata Euglyphis inflata Euglyphis lanea Euglyphis lankesteri Euglyphis larunda Euglyphis libnites Euglyphis melancholica Euglyphis nebula Euglyphis obtusa Euglyphis palma 50 Suborden Superfamilia Familia Glossata Lasiocampoidea Lasiocampidae Género Especie o Subespecie Euglyphis phedonioides Euglyphis phyllis Euglyphis submarginalis Nesara caramina Nesara Nesara casada Nesara francesca Prorifrons Tolype Glossata Bombycoidea Eupterotidae * Glossata Bombycoidea Bombycidae Anticla Anticla antica Apatelodes erotina Apatelodes merlona Apatelodes pandara Apatelodes Apatelodes pandarioides Apatelodes satellitia Apatelodes turrialba Colla rhodophe Colla Colla sp.16 Epia Epia muscosa Olceclostera indentata Olceclostera Olceclostera magniplaga Olceclostera sp. 45 Quentalia ephonia Quentalia Quentalia subumbrata Quentalia surynorta Glossata Bombycoidea Saturniidae Tarchon Tarchon felderi * ∆ Zanola Zanola verago Adeloneivaia Adeloneivaia jason Arsenura Arsenura armida Automeris banus ** ∆ Automeris belti Automeris celata Automeris Automeris postalbida ** Automeris tridens Automeris zugana Cerodirphia Cerodirphia avenata (End.) 51 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Bombycoidea Saturniidae Citheronia Citheronia bellavista Citheronioides Citheronioides collaris Copaxa Copaxa rufinans * ∆ Dirphia Dirphia horcana Dirphiopsis Dirphiopsis flora Eacles imperialis Eacles Eacles ormondei Gamelia Gamelia musta * ∆ Hylesia continua Hylesia Hylesia frigida Hylesia lineata Hyperchiria Hyperchiria nausica Molippa Molippa nibasa Oxytenis beprea Oxytenis Oxytenis naemia Glossata Bombycoidea Paradirphia Paradirphia winnifredae Pseudodirphia Pseudodirphia menander Rhescyntis Rhescyntis hippodamia Rothschildia Rothschildia orizaba Schausiella Schausiella moinieri (End.) Syssphinx Syssphinx molina Adhemarius dariensis Sphingidae Adhemarius fulvescens Adhemarius Adhemarius gannascus Adhemarius ypsilon Callionima denticulata Callionima Callionima falcifera Callionima parce Enyo Enyo lugubris Cocytius Cocytius lucifer Erinnyis obscura Erinnyis Erinnyis oenotrus Eumorpha Eumorpha obliquus Madoryx Madoryx plutonius Manduca Manduca occulta Manduca pellenia 52 Suborden Superfamilia Familia Glossata Bombycoidea Sphingidae Género Especie o Subespecie Manduca rustica Manduca schausi Perigonia Perigonia lusca ** Perigonia stulta ** ∆ Protambulyx Protambulyx strigilis Stolidoptera Stolidoptera tachasara Xylophanes acrus Xylophanes ceratomioides Xylophanes chiron Xylophanes crotonis Xylophanes germen Xylophanes Xylophanes hannemanni Xylophanes jordani Xylophanes neoptolemus Xylophanes pluto Xylophanes thyelia Xylophanes titana Glossata Hedyloidea Macrosoma amaculata (End.) Hedylidae Macrosoma Macrosoma conifera Macrosoma rubedinaria Glossata Glossata Hesperoidea Papilionoidea Hesperiidae Pieridae Astraptes Astraptes alardus * Astraptes fulgerator * ∆ Celaenorhinus Celaenorrhinus stallingsi * ∆ Myscelus Myscelus belti * Talides Talides sinois cantra * ∆ Telemiades Telemiades gallius * ∆ Thracides Thracides phidon * Urbanus Urbanus pronus Catasticta ctemene actinotis (End.) Catasticta Catasticta flisa melanisa Dismorphia crisia lubina (End.) Dismorphia Dismorphia zathoe pallidula (End.) Eurema Eurema xanthochlora xanthochlora Leodonta Leodonta dysoni dysoni Leptophobia aripa aripa Leptophobia Leptophobia caesia tenuicornis (End.) 53 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Papilionoidea Pieridae Lieinix Lieinix nemesis nemesis Glossata Papilionoidea Lycaenidae Arawacus Arawacus leucogyna Emesis Emesis cypria paphia * Euselasia Euselasia argentea * Mesosemia asa Mesosemia Mesosemia grandis (End.) Glossata Papilionoidea Nymphalidae Methone Methone cecilia chrysomela** Nymphidium Nymphidium ascolia ascolia * ∆ Altinote Altinote ozomene nox Actinote Actinote anteas anteas* Anthanassa crithona (End.) Anthanassa Anthanassa fulviplaga (End.) Caligo atreus dionysos* ∆ (End.) Caligo Caligo brasiliensis sulanus * ∆ Catonephele Catonephele chromis godmani (End.) Cithaerias Cithaerias pireta pireta Cyllopsis Cyllopsis rogersi (End.) Diaethria astala astala Diaethria clymena marchalii Diaethria Diaethria gabaza eupepla Diaethria pandama Dircenna jemina chiriquensis Dircenna Dircenna klugii Dircenna olyras relata (End.) Doxocopa cyane cyane Doxocopa Doxocopa laurentia cherubina Dryadula Dryadula phaetusa Godyris zavaleta caesiopicta (End.) Godyris Godyris zavaleta zygia (End.) Greta Greta annette championi Heliconius clysonymus montanus (End.) Heliconius cydno pachinus (End.) Heliconius Heliconius erato petiverana Heliconius sara theudela (End.) Hypanartia Hypanartia dione arcaei * ∆ (End.) Ithomia Ithomia heraldica heraldica (End.) 54 Suborden Superfamilia Familia Glossata Papilionoidea Nymphalidae Género Especie o Subespecie Ithomia patilla Ithomia xenos xenos (End.) Laparus Laparus doris viridis Marpesia Marpesia merops ** Mechanitis Mechanitis menapis saturata ** Megeuptychia Megeuptychia antonoe * Memphis beatrix * ∆ (End.) Memphis Memphis ambrosia ambrosia (End.) Memphis proserpina elara (End.) Morpho Morpho helenor marinita Oleria rubescens Oleria Oleria vicina (End.) Opsiphanes bogotanus alajuela * ∆ Opsiphanes Opsiphanes cassina * ∆ Opsiphanes quiteria talamancensis** ∆ Oxeoschistus Oxeoschistus cothon (End.) Pteronymia artena [n.ssp.] (End.) Pteronymia fulvimargo (End.) Pteronymia Pteronymia picta notilla * ∆ Pteronymia latilla fulvescens (End.) Satyrotaygetis Satyrotaygetis satyrina Siproeta Siproeta epaphus epaphus Tegosa Tegosa anieta anieta Tithorea Tithorea tarricina pinthias ** (End.) Yphthimoides Yphthimoides renata Glossata Depranoidea Thyatiridae Thyatira Thyatira mexicana Glossata Geometroidea Sematuridae Coronida Coronida leachii * Sematura Glossata Geometroidea Uraniidae Urania Urania fulgens Glossata Geometroidea Geometridae Acronyctodes Acronyctodes cautama Acrosemia undilinea Acrosemia Acrosemia vulpecularia Anacamptodes Anacamptodes lurida Anisodes Anisodes tychius? Anisoperas Anisoperas atropunctaria Apiciopsis Apiciopsis sp.1 55 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Geometroidea Geometridae Argyrotome Argyrotome melae Asestra Asestra cabiria Astyochia crane Astyochia Astyochia faula Astyochia sp. 1 Bagodares Bagodares prosa Bassania amethystata Bassania Bassania crocallinaria Brachurapteryx Brachurapteryx tesserata Bryoptera Bryoptera friaria Cartellodes Cartellodes levis Cathydata Cathydata batina Certima Certima turmalis Chavarriella porcius Chavarriella Chavarriella semiornata Chloropteryx diluta Chloropteryx Chloropteryx opalaria Chloropteryx sp.3 Chrysomima Chrysomima semilutearia Cimicodes albicosta Cimicodes Cimicodes subapicata Cirsodes acuminata ** Cirsodes Cirsodes sp.1 Cratoptera primularia Cratoptera Cratoptera zarumata Cyclophora Cyclophora prunelliaria Cyphoedma Cyphoedma transvolutata Dichorda Dichorda obliquata Eois dibapha Eois dryantis Eois Eois insignata Eois mexicaria Eois nundina Epimecis anonaria Epimecis Epimecis diffundaria Epimecis fraternaria 56 Suborden Superfamilia Familia Glossata Geometroidea Geometridae Género Especie o Subespecie Epimecis nasica Epimecis plumbilinea Epimecis sp.1 Erateina Erateina leptocircata Erosina Erosina hyberniata Eubaphe conformis Eubaphe Eubaphe lobula Euclysia Euclysia columbipennis Euphyia Euphyia subguttaria Eusarca crameraria Eusarca flexilis Eusarca Eusarca minucia Eusarca nemora Eusarca oberthuri Eutomopepla Eutomopepla vorda Glena Graphidipus Graphidipus fulvicostaria Hagnagora clustimena Hagnagora Hagnagora ephestris Hammaptera Hammaptera improbaria Herbita amicaria ? Herbita artayctes Herbita Herbita extranea Herbita tenebrica Heterusia Heterusia dividata Hyalochlora Hyalochlora splendens Hydata Hydata sp. 1 Hydatoscia Hydatoscia ategua Hydriomena Hydriomena polyphonta Hygrochroma nondina Hygrochroma olivinaria Hygrochroma Hygrochroma sp.1 Hygrochroma sp.3 Hylaea Hylaea pardiria ? Hymenomima memor ? Hymenomima Hymenomima umbelularia 57 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Geometroidea Geometridae Hypomecis Hypomecis laeca Idaea Ira Ira somnolenta Iridopsis anaisaria Iridopsis chalcea Iridopsis lurida Iridopsis Iridopsis oberthuri Iridopsis sp.2 Iridopsis sp.3 Iridopsis validaria Ischnopteris chavesi Ischnopteris Ischnopteris fassli Isochromodes granula Isochromodes nebulosa Isochromodes Isochromodes sheila Isochromodes sp. 6 Leuciris Leuciris fimbriaria Leucula lucidaria Leucula Leucula meganira Leuculopsis Leuculopsis unifasciata Lissochlora albociliaria Lissochlora Lissochlora manostigma Lissochlora ronaldi Lomographa argentata Lomographa Lomographa candida Lomographa molesta Macaria approximaria Macaria ostia Macaria Macaria regulata Macaria subfulva Macaria tenuiscripta Macrotes Melanolophia Macrotes commatica Melanolophia attenuata Melanolophia flexilinea Melanoscia Melanoscia oreades Melinodes Melinodes detersaria 58 Suborden Superfamilia Familia Género Glossata Geometroidea Geometridae Metanema Microgonia Microxydia Especie o Subespecie Microgonia perfulvata Microxydia orsitaria Microxydia ruficomma Mimosema Mimosema sobrina Nematocampa completa Nematocampa Nematocampa sp.1 Nematocampa sp.2 Nemoria astraea Nemoria carolinae Nemoria epaphras Nemoria erina Nemoria karlae Nemoria Nemoria nympharia Nemoria punctilinea Nemoria rectilinea Nemoria remota Nemoria vermiculata Neotherina callas Neotherina Neotherina imperilla Nepheloleuca Nepheloleuca politia Nephodia admirationis ? Nephodia azenia Nephodia betala Nephodia coalitaria Nephodia Nephodia orcipennata Nephodia ordaea Nephodia organa Nephodia viatrix Nepitia Nepitia detractaria Oenoptila alexonaria Oenoptila Oenoptila recessa Oenoptila separata Oligopleura Oligopleura aulaeata Oospila asmura Oospila Oospila athena 59 Suborden Superfamilia Familia Glossata Geometroidea Geometridae Género Especie o Subespecie Oospila atopochlora Oospila concinna Oospila depressa Oospila dicraspeda Oospila venezuelata Opisthoxia asopis Opisthoxia bella Opisthoxia miletia Opisthoxia Opisthoxia molpadia Opisthoxia phrynearia Opisthoxia saturniaria Oxydia apidania Oxydia augusta Oxydia bilinea Oxydia masthala Oxydia Oxydia mexicata Oxydia nimbata Oxydia platypterata Oxydia translinquens Oxydia trychiata Pantherodes Pantherodes unciaria Paragonia arbocala Paragonia Paragonia cruraria Parallage Parallage diaphanata Parourapteryx Parourapteryx sulphuraria Patalene aenetusaria Patalene Patalene asychisaria Patalene falcularia Patalene trogonaria Periclina apricaria Periclina Periclina merana Periclina syctaria Perigramma Perigramma albivena Perissopteryx commendata Perissopteryx Perissopteryx delusa Perissopteryx gamezi 60 Suborden Superfamilia Familia Glossata Geometroidea Geometridae Género Especie o Subespecie Perissopteryx griseobarbipes Perissopteryx nigricomata Perissopteryx raveni Perissopteryx ugaldei Pero afuera Pero bulba Pero circumflexata Pero costa Pero delauta Pero derecha Pero fusaria Pero iraza Pero melissa Pero mnasilaria Pero Pero pallidior Pero parambensis Pero plagodiata Pero polygonaria Pero rosota Pero rotundata Pero saturata Pero simila Pero spongiata Pero vecina Pero xylinaria Petelia Petelia purpurea Pherotesia Phrudocentra pupillata Phrudocentra Phrudocentra trimaculata Phrygionis platinata Phrygionis Phrygionis polita ** Phyle Phyle arcuosaria Phyllodonta flabellaria Phyllodonta Phyllodonta indeterminata Phyllodonta latrata Physocleora 61 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Geometroidea Geometridae Pityeja Pityeja histrionaria Polla Polla hemeraria Priapodes Priapodes longipalpata Prochoerodes onustaria Prochoerodes Prochoerodes striata Prochoerodes tetragonata Pseudoasellodes Pseudasellodes fenestraria Pseudomennis Psilosetia Psilosetia sp.1 Pyrinia divalis Pyrinia Pyrinia selecta Racasta Racasta caberaria Rhodochlora Rhodochlora exquisita Rhomboptila Rhomboptila brantisiata Sabulodes arge Sabulodes colombiata Sabulodes nubifera Sabulodes Sabulodes ornatissima Sabulodes plauta Sabulodes sp.1 Sabulodes sp.3 Scopula Scopula privata Sericoptera Sericoptera mahometaria Sicya directaria Sicya Sicya inquinata Simena Simena luctifera Simopteryx Simopteryx torquataria Smicropus Smicropus laeta Sphacelodes Sphacelodes vulneraria Synchlora astraeoides Synchlora dependes Synchlora Synchlora expulsata Synchlora gerularia Synnomos firmamentaria Synnomos Synnomos sp.1 Tarma Tarma theodora 62 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Geometroidea Geometridae Telotheta Telotheta muscipunctata Thysanopyga abdominaria Thysanopyga Thysanopyga carfinia Thysanopyga casperia Thysanopyga cermala Tmetomorpha Tmetomorpha bitias Trygodes amphion Trygodes Trygodes niobe Glossata Noctuoidea Notodontidae Antaea Antaea licormas Apela Apela neobule Bardaxima Bardaxima lucilinea ** Cerura Cerura rarata Crinodes besckei Crinodes Crinodes striolata Dasylophia maxtla Dasylophia Dasylophia cf. russula Dasylophia xylinata Dicentria disparilis Dicentria Dicentria drucei Dicentria hidalgonis Didugua Didugua sp 1. Disphragis baracoana Disphragis biundata Disphragis dolorosa Disphragis edwardsi Disphragis gelduba Disphragis lama Disphragis livida Disphragis Disphragis lucoides Disphragis manethusa Disphragis mephitis Disphragis meretricia Disphragis notabilis Disphragis cf. lloreda Disphragis cf. bochica Disphragis proba 63 Suborden Superfamilia Familia Glossata Noctuoidea Notodontidae Género Especie o Subespecie Disphragis remuria Disphragis splendens Disphragis sp. 2 Disphragis tharis Disphragis tricolor Dognina Dognina veltini Elymiotis Elymiotis corana Eragisa barnesi Eragisa Eragisa sabulosa Eragisa sp. 1 Farigia albicans Farigia gamarra Farigia Farigia montana Farigia vecina Hapigia Hapigia repandens Hapigia simplex Hemiceras bilinia Hemiceras cadmia Hemiceras clarki Hemiceras coatina Hemiceras conspirata Hemiceras dentata Hemiceras flava Hemiceras modesta Hemiceras muscosa Hemiceras nigrescens Hemiceras Hemiceras nigricosta Hemiceras oleaginea Hemiceras pallidula Hemiceras punctata Hemiceras sabis Hemiceras sp.1 Hemiceras sp.2 Hemiceras sp.3 Hemiceras sp.5 Hemiceras sp.7 64 Suborden Superfamilia Familia Glossata Noctuoidea Notodontidae Género Especie o Subespecie Hemiceras sp.10 Hemiceras sp.15 Hemiceras sp.25 Hemiceras vecina Elasmia Elasmia astuta Kalkoma Kalkoma pylaon Lepasta bractea Lepasta Lepasta concordens Lirimiris fascis ** ∆ Lirimiris Lirimiris lignitecta Lirimiris truncata Lobeza Lobeza medina Malocampa albolineata Malocampa argentata Malocampa Malocampa piratica Malocampa punctata Malocampa satis Meragisa albescens Meragisa politioides Meragisa Meragisa sp.5 Meragisa sp.8 Meragisa valdeviesoi Naprepa Naprepa pulcheria Navarcostes Navarcostes limnatis Nystalea aequipars Nystalea ebalea Nystalea marmorea Nystalea Nystalea nigritorquata Nystalea ocellata Nystalea parsoni Nystalea striata Pauluma Pentobesa Pauluma corina Pentobesa pinna Pentobesa xylinioides Phastia Phastia alcimede Polypoetes Polypoetes villia ** ∆ 65 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Notodontidae Procolax Procolax apulana Psilacron luteovirens Psilacron Psilacron macarisma Psilacron plagimargo Rifargia dissepta Rifargia distinguenda Rifargia Rifargia felderi Rifargia lineata Rifargia myconos Rosema deolis Rosema epigena Rosema Rosema myops Rosema thestia Rosema tinae Sericochroa Sericochroa corda Sericochroa tenuis Skaphita Skaphita salona Symmerista Symmerista cf. sauvis Tachuda Tachuda albosigma Tithraustes albinigra * Tithraustes Tithraustes maximus Tithraustes mirma Tithraustes cf. moerens * Xenorma Glossata Noctuoidea Noctuidae Xenorma exturbata Acanthodica penicillum Acanthodica Acanthodica sinuilinea Acronicta Acronicta beameri Acronicta velia Acroria Acroria terens Aglaonice Aglaonice hirtipalpis Agrapha ahenea Agrapha Agrapha meretricia Agrapha oxygramma Agrotis ipsilon Agrotis Agrotis repleta Alabama Alabama argillacea 66 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Noctuidae Amolita Amolita sentalis Ampelasia Ampelasia azelinoides Amyna Amyna octo Amyna tristis Anicla ignicans Anicla Anicla infecta Anomis editrix Anomis eucystica Anomis gymnopus Anomis Anomis luridula Anomis patagiata Anomis rubida Anomis rufescensoides Antiblemma agrestis Antiblemma anguinea Antiblemma borrega Antiblemma chephira Antiblemma chiva Antiblemma laranda Antiblemma Antiblemma memoranda Antiblemma penelope Antiblemma rubrilinea Antiblemma sp.626 Antiblemma sp.970 Antiblemma sp.1321 Antiblemma stelligera Anticarsia Anticarsia anisospila Anticarsia gemmatalis Araeopteron Araeopteron elam Argania Argania pilosa Argyrogramma Argyrogramma verruca Argyrosticta Argyrosticta aurifundens Aristaria Aristaria nigrifons Aristaria theroalis Athyrma Athyrma adjutryx Autoplusia Autoplusia egenoides 67 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Noctuidae Azeta Azeta quassa Bagisara patula Bagisara Bagisara repanda Baniana Baniana strigata Bleptina Bleptina confusalis Bryolymnia bicon Bryolymnia Bryolymnia roma Callopistria Callopistria floridensis Calymniodes Calymniodes conchylis Calyptis Calyptis idonea Calyptis iter Celiptera grisescens Celiptera Celiptera levina Celiptera remigioides Ceroctena Ceroctena amynta Chamyna Chamyna homichlodes Charadra nigracreta Charadra Charadra nitens Chytonidia Chytonidia albimixta Chytonix elegans Chytonix Chytonix splendens Coenipeta bibitrix Coenipeta catoxantha Coenipeta dimidiata Coenipeta Coenipeta medina Coenipeta parilis Coenipeta tanais Coenobela Coenobela joha Collomena Collomena filifera Concana mundissima Concana Concana permixta Condica abida Condica circuita Condica Condica concisa Condica cupienta 68 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Condica imitata Condica mimica Condica mobilis Condica pagetolophus Condica roxana Condica samula Condica selenosa Condica sutor Condica vacillans Craterestra Craterestra lucina Cropia connecta Cropia Cropia minthe Cucullia Cucullia costaricensis Dargida Dargida albomarginata Diastema Diastema tigris Dogninades Dogninades jactatalis Drobeta ithaca Drobeta melagonia Drobeta Drobeta tiresias Drobeta tristigma Dyomyx Dyomyx inferior Dyomyx placida Dyops Dyops chromatophila Dypterygia assuetus Dypterygia Dypterygia ordinarius Dysgonia Elaeognatha Dysgonia purpurata Elaeognatha argentea Elaeognatha argyritis Elaphria acaste Elaphria agrotina Elaphria deltoides Elaphria jalapensis Elaphria Elaphria marmorata Elaphria medioclara Elaphria melanodonta Elaphria niveopis 69 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Elaphria pallescens Elaphria perigeana Elaphria pulchra Elaphria renipes Elaphria rubripicta Elaphria subobliqua Elaphria tenebrosa Emarginea Emarginea niphoplaga Encruphion Encruphion leena Ephyrodes Ephyrodes repandens Epidromia Epidromia pannosa Epistrema Epistrema ora Epitausa coppryi Epitausa Epitausa flagrans Epitausa prona Erastroides Erastroides emarginata Eriopyga ditissima Eriopyga fea Eriopyga mesostrigata Eriopyga Eriopyga monilis Eriopyga perfusca Eriopyga rubripuncta Eriopyga volcania Eublemma Eublemma cinnamomea Euclystis guerini Euclystis Euclystis laluma Euclystis maxima Eudocima Eudocima serpentifera Eudyops Eudyops telmela Eulepidotis alabastraria Eulepidotis argyritis Eulepidotis dominicata Eulepidotis Eulepidotis electa Eulepidotis ezra Eulepidotis folium Eulepidotis fortissima 70 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Eulepidotis hermura Eulepidotis juncida Eulepidotis ornata Eulepidotis perducens Euplexia Euplexia triplaga Eutelia abscondens Eutelia Eutelia auratrix Eutelia chrysotermina Faronta Faronta albilinea Gerra Gerra aelia Gizama Gizama undilinealis Goniocarsia Goniocarsia electrica Gonodes Gonodes aroensis Gonodonta biarmata Gonodonta bidens Gonodonta correcta Gonodonta holosericea Gonodonta incurva Gonodonta maria Gonodonta Gonodonta mexicana Gonodonta cf. sinaldus Gonodonta primulina Gonodonta pyrgo Gonodonta sicheas Gonodonta sinaldus Gonodonta uxor Graphigona Graphigona regina Hampsonodes maneti Hampsonodes melagona Hampsonodes Hampsonodes naevia Hampsonodes orbica Helia Helia homopteridia Heliothis Heliothis subflexa Hemeroblemma mexicana Hemeroblemma Hemeroblemma opigena 71 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Hemicephalis alesa Hemicephalis Hemicephalis paulina Herminocala Herminocala sabata Herminodes Herminodes subclara Heterochroma bellona Heterochroma beryllus Heterochroma celestina Heterochroma Heterochroma exundata Heterochroma lineata Heterochroma sarepta Heterodelta Heterodelta nea Heterogramma Heterogramma circumflexalis Hypena abscondalis Hypena acclinalis Hypena andraca Hypena andrapana Hypena angitia Hypena calistalis Hypena coatalis Hypena demonalis Hypena drucealis Hypena gaudialis Hypena glumalis Hypena Hypena gueneealis Hypena hemonalis * Hypena lactiferalis Hypena levana Hypena livia Hypena lollia Hypena mactatalis Hypena purpuralis Hypena tossalis Hypena turalis Hypena variabilis Hypocala Hypocala andremona Ipnista Ipnista marina 72 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Iscadia aperta Iscadia Iscadia mariva Iscadia producta Isogona Isogona continua Itomia Itomia intrahens Lacinipolia Lacinipolia laudabilis Lascoria alucitalis Lascoria barbaralis Lascoria laurentia Lascoria Lascoria leucorabdota Lascoria majoralis Lascoria manes Lascoria orneodalis Lephana Lepidodes Lephana tetraphorella Lepidodes gallopavo Lepidodes limbulata Lepteria Lepteria viridicosta Lesmone duplicans Lesmone Lesmone formularis Lesmone umbrifera Letis buteo Letis caligula Letis Letis herilia Letis magna Letis scops Leucania humidicola Leucania Leucania inconspicua Leucania latiuscula Leucania microgonia Leucosigma Leucosigma uncifera Lichnoptera Lichnoptera illudens ** Lithacodia costaricana Lithacodia Lithacodia jora Lithacodia merta Lophomyra Lophomyra tacita 73 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Macrodes columbalis Macrodes Macrodes cynara Magusa Magusa orbifera Mamerthes Mamerthes nigrilinea Massala abdara Massala Massala obvertens Mazacyla Mazacyla relata Meganola bifiliferata Meganola micans Meganola Meganola pernitens Meganola placens Meganola polydonta Melipotis fasciolaris Melipotis januaris Melipotis Melipotis ochrodes Melipotis perpendicularis Melipotis punctifinis Melipotis sp. 347 Metalectra ardesiaca Metalectra carneomacula Metalectra Metalectra lineata Metalectra praecisalis Metria amata Metria aperta Metria celia Metria Metria minta Metria obscura Metria obsolefacta Micranthops Micranthops alceste Micrathetis Micrathetis dasarada Mocis diffluens Mocis Mocis latipes Mursa Mursa sotiusalis Nagara fenestra Nagara Nagara heterogramma Neocodia Neocodia asna 74 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Neophaenis frauenfeldi Neophaenis Neophaenis psittacea Neophaenis respondens Neopalthis Neopalthis madates Neostictoptera chlorotica Neostictoptera Neostictoptera nigripuncta Nephelistis clauda Nephelistis differens Nephelistis Nephelistis noctivaga Nephelistis vellerea Nola intermedia Nola mesographa Nola Nola semirufa Nola triplaga Obroatis Obroatis vinea Ogdoconta Ogdoconta pulverulenta Ommatochila Ommatochila mundula Ophisma basigutta Ophisma Ophisma pyrosticha Ophisma tropicalis Oraesia Oraesia aeneofusa Oraesia striolata Orthodes curvirena Orthodes Orthodes lanaris Orthodes orbica Ostha Ostha concinna Oxidercia Oxidercia toxea Ozarba Ozarba bascura Paectes chrysoplaga Paectes Paectes devincta Paectes fovifera Palthis angustipennis Palthis Palthis bizialis Palthis calcalis Palyna Palyna metagona 75 Suborden Superfamilia Familia Glossata Noctuoidea Noctuidae Género Especie o Subespecie Parangitia corma Parangitia Parangitia mosaica Parangitia temperata Perasia garnoti Perasia Perasia helvina Perigea agnonia Perigea berinda Perigea glaucoptera Perigea Perigea hippia Perigea ignitincta Perigea illicita Perigea lineata Phobolosia Revizar en coleccion Phosphila Phosphila xylophila Physula Physula rona Plusia caudata Plusia Plusia illustrata Plusia masoni Plusiodonta aborta Plusiodonta Plusiodonta incitans Plusiodonta miranda Plynteria florens Plynteria Plynteria stellata Polia marea Polia Polia psittacus Polypogon Polypogon pulchellescens Praina Praina temperata Proroblemma Proroblemma rosea Prosoparia Revisar en coleccion Pseudaletia sequax Pseudaletia Pseudaletia unipuncta Pseudogerespa Pseudogerespa usipetes Pseudophisma Pseudophisma pritanis Pseudoplusia Pseudoplusia includens Ptichodes Ptichodes immunis Pyrgion Pyrgion repanda 76 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Noctuidae Radara Radara nealcesalis Rejectaria amicalis Rejectaria atrax Rejectaria funebris Rejectaria Rejectaria lineata Rejectaria lysandria Rejectaria lyse Renia acclamalis Renia Renia vinasalis Rhosologia Rhosologia porrecta Safidia Safidia druceria Scopifera antelia Scopifera falsirenalis Scopifera Scopifera lycagusalis Scopifera menippusalis Scopifera phrygialis Selenisa Selenisa sueroides Sidemia Sidemia hipparion Sigela Sigela sodis Simplicia Revisar en coleccion Sosxetra Sosxetra grata Spodoptera dolichos Spodoptera Spodoptera latifascia Spragueia apicalis Spragueia Spragueia perstructana Strathocles Strathocles pulla Syllectra Syllectra erycata Tarista Tarista lydia Tautobriga Tautobriga euspila Thioptera Thioptera aurifera Thyriodes Thyriodes terrabensis Trachea Trachea uscana Trichestra Trichestra goniophora Trichorthosia Buscar coleccion Trogoblemma Trogoblemma modesta Tympanobasis Tympanobasis pterogoneis 77 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Noctuidae Tyrissa Tyrissa perstrigata Vespola Vespola caeruleifera Ypsora Ypsora homochroa Zale fictilis Zale peruncta Zale Zale setipes Zale sexplagiata Glossata Noctuoidea Lymantriidae Orgyia Orgyia costarricensis Thagona Thagona tibialis Afrida polyglotta Glossata Noctuoidea Nolidae Afrida Afrida sp.3 Afrida zoephila Glossata Noctuoidea Aclytia heber Arctiidae Aclytia punctata Aclytia Aclytia sp.1 Aclytia ventralis Agaraea longicornis Agaraea Agaraea schausi Amastus albicinctus Amastus fuscescens Amastus Amastus polystrigata Amastus rumina **∆ Amastus suffusa orosiana Amaxia Amaxia pardalis osmophora Amycles adusta *∆ Amycles Amycles anthracina * Anaulosia Anaulosia sp.3 Areva Areva trigemmis Bernathonomus Bernathonomus piperita Bertholdia albipuncta Bertholdia crocea **∆ Bertholdia Bertholdia myosticta Bertholdia philoptera ** ∆ Bertholdia yashoquintela Biturix Biturix venosata Calonotos Calonotos tiburtus 78 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Arctiidae Carales Carales astur Carathis Carathis byblis Castrica Castrica phalaenoides Clemensia sp.1 Clemensia Clemensia sp.4 Clemensia sp.5 Correbia fulvescens Correbia Correbia sp.1 (cf. undulata) Correbidia germana Correbidia cf. germana Correbidia Correbidia cf. striata Correbidia striata Cosmosoma advenum Cosmosoma albifrons Cosmosoma cingulatum Cosmosoma festivum Cosmosoma impar Cosmosoma impudica Cosmosoma joavana Cosmosoma Cosmosoma pudicum Cosmosoma semifulva Cosmosoma sp.1 Cosmosoma stibostictum Cosmosoma teuthras Cosmosoma thiacia Cosmosoma vatsoni Cosmosoma xanthostictum Cratoplastis Cratoplastis diluta Cyanopepla arrogans * Cyanopepla Cyanopepla scintillans Dycladia Dycladia emerita Dysschema cerialis ** ∆ Dysschema Dysschema leda Dysschema ultima Elysius melanoplaga ** ∆ Elysius Elysius superba 79 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Arctiidae Epeiromulona Epeiromulona lephina Episcepsis hypoleuca Episcepsis lenaeus Episcepsis sp.3 Episcepsis Episcepsis sp.4 Episcepsis thetis Episcepsis vinasia Eucereon aeolum Eucereon aroa Eucereon centrale Eucereon chloraenoma Eucereon confine Eucereon consorta Eucereon costulatum Eucereon darantasia Eucereon decora Eucereon discolor Eucereon fanum Eucereon flavicaput Eucereon Eucereon leria Eucereon myrtusa Eucereon cf. obscurum Eucereon cf. tarona Eucereon patrona Eucereon phaeoproctum Eucereon rogersi Eucereon n. sp. Eucereon striata Eucereon tarona Eucereon tigrata Eucereon tripunctatum Gardinia Gardinia magnifica Graphea Graphea marmorea Gymnelia Gymnelia nobilis Halysidota atra Halysidota Halysidota fuliginosa 80 Suborden Superfamilia Familia Glossata Noctuoidea Arctiidae Género Especie o Subespecie Halysidota fumosa Halysidota intensa Halysidota interlineata Halysidota pectenella Halysidota schausi Halysidota underwoodi Heliactinidia Holophaea Holophaea lycone **∆ Homoeocera Homoeocera crassa Hyaleucerea gigantea Hyaleucerea Hyaleucerea sororia Hyalurga Hyalurga fenestra Hypercompe cotyora Hypercompe Hypercompe nemophila Hypercompe ockendeni ** Hyperthaema Hyperthaema sp.3 Hypocrita Hypocrita drucei Hyponerita Hyponerita tipolis Idalus perlineosa Idalus Idalus vitrea Isanthrene Isanthrene felderi Isanthrene monticola Ischnocampa Ischnocampa tristis Ixylasia schausi Ixylasia Ixylasia n. sp. Josiomorpha Josiomorpha penetrata ** Lampruna Lampruna rosea Leucanopsis Leucanopsis sp.1 Leucotmemis Leucotmemis nexa Lophocampa cf. atriceps Lophocampa citrina Lophocampa modesta Lophocampa Lophocampa pectina ** Lophocampa propinqua Lophocampa sp.8 Lycomorphodes Lycomorphodes reducta 81 Suborden Superfamilia Familia Glossata Noctuoidea Arctiidae Género Especie o Subespecie Macrocneme iole Macrocneme Macrocneme lades Melese chiriquensis Melese sp.1 Melese sp.2 Melese Melese sp.3 Melese sp.7 Melese sp.8 Melese sp.11 Mesenochroa Mesenochroa rogersi Mesothen Mesothen temperata Myrmecopsis Myrmecopsis ichneumonea Napata lelex Napata Napata walkeri Neonerita Neonerita intorta Neonerita cf. arcifera Nodozana Nodozana fifina Notarctia Notarctia proxima Nyridela Nyridela xanthocera ** Ochrodota Ochrodota pronapides Onthyes Onthyes pallidicosta Opharus albiceps Opharus belus * ∆ Opharus Opharus consimilis Opharus procroides ** ∆ Opharus roseistriga Ordishia Ordishia godmani Ordishia rutilus Ormetica ataenia Ormetica pauperis Ormetica Ormetica sicilia Ormetica temperata Pachydota drucei Pachydota Pachydota cf. peruviana Pachydota rosenbergi Pareuchaetes Pareuchaetes insulata 82 Suborden Superfamilia Familia Género Especie o Subespecie Glossata Noctuoidea Arctiidae Pelochyta Pelochyta affinis ** ∆ Phaenarete Phaenarete diana Phaio Pheia albisigna Pheia Pheia elegans Poliopastea Poliopastea sp.6 Pompiliodes Pompiliodes albomarginata Pseudalus Pseudalus leos Pseudohemihyalea daraba Pseudohemihyalea Pseudohemihyalea mansueta Pseudohemihyalea schausi Pseudophaloe cotta Pseudophaloe Pseudophaloe ninonia Rhabdatomis Rhabdatomis laudamia Robinsonia Robinsonia polyplagia Sarosa Sarosa lutibasis Saurita Saurita tipulina Scaptius Scaptius vinasia Scena Scena potentia Selenarctia Selenarctia schausi Sutonocrea Sutonocrea reducta Symphlebia aryllis Symphlebia costarricensis Symphlebia herbosa Symphlebia hyalina Symphlebia Symphlebia pyrgion Symphlebia sp.1 Symphlebia suanoides Symphlebia suanus Symphlebia tessellata ** Syntomeida Syntomeida melanthus Thyone Thyone sp.1 Thysanoprymna Thysanoprymna morio Thysanoprymna superba Trichodesma Trichodesma ursula Utetheisa Utetheisa ornatrix 83 Suborden Superfamilia Familia Género Glossata Noctuoidea Arctiidae Virbia Especie o Subespecie Viviennea ardesiaca Viviennea Viviennea tegyra Xenosoma geometrina Xenosoma Xenosoma nigromarginatum Autor: González y Solís, 2007. Fuente: INBio, 2007. Simbología: * especies cuyos especímenes se obtuvieron como resultado del trabajo de crianza (anexos, cuadro 5); ** Géneros, especies o subespecies reportados previamente (fuente ATTA) de los que se conocen datos de su hstoria natural (anexos, cuadros 5, 6 y 7); (End.) son especies endémicas para Nicaragua, Costa Rica y Panamá; ∆ son las 30 especies seleccionadas cuya historia natural se presenta en el acápite 2 de esta sección. 5.2. Historia natural de 30 especies de Lepidoptera presentes en el sector Altamira, Parque Internacional La Amistad. 5.2.1. Familia Arctiidae La mayoría de larvas están cubiertas por muchos pelos, que pueden ser urticantes. Su alimentación incluye líquenes y muchas especies de plantas herbáceas y leñosas. Pupan dentro de capullos que hacen con pelo larval enmarañado, a veces con un poco de seda. Algunas especies se pueden convertir en serias plagas (Covell, 1984). Chacón y Montero (2007) indican que las larvas obtienen pirrolizidinas y cardenólidos de sus plantas hospederas, los cuales se almacenan durante la pupa y en los adultos. Estos compuestos secundarios representan un método de defensa ante sus depredadores, ya que les brinda un sabor desagradable. Los adultos de estos lepidópteros tienen una coloración atractiva, aunque algunas especies son de coloración opaca. La coloración de sus alas varía entre blanco, amarillo, naranja y rojo, con manchas negras en las alas anteriores (Covell, 1984); las cuales pueden ser translúcidas o semitranslúcidas con tonos negros, azul y verde metálico o azul iridiscente (Espinoza, com. pers.). Algunas especies vuelan durante el día, mientras que otras lo hacen por la noche (Covell, 1984). Los árctidos pueden ser de tamaños medianos a grandes. La longitud de las alas anteriores varía entre 6 y 45 mm. Algunas especies tienen ocelos y otras carecen de ellos. Algunas especies tienen las antenas simples (sin sensilios), mientras que 84 en otras sí los poseen (antenas bipectinadas). En dado caso, los machos tienen las antenas ciliadas (con sensilios), mientras que en las hembras son simples (Chacón y Montero, 2007). Las subfamilias Arctiinae, Syntominae y Lithosiinae (sólo el primer grupo tratamos en este trabajo), forman un complejo mulleriano. Esto se debe a que cuando se sienten amenazados, pliegan sus alas, mostrando una coloración aposemática en el abdomen. Cuando son molestados secretan sustancias con olor desagradable, el cual producen mediante las glándulas torácicas. Dichos líquidos tienen propiedades tóxicas y están compuestos de acetilcolina, histaminas y quizás pirazinas, los cuales brindan protección contra los depredadores (Chacón y Montero, 2007). Según Scoble, 1992a (los árctidos emiten sonidos ultrasónicos similares a los de los murciélagos. Estos chillidos los producen mediante el órgano timpánico y sirven para confundir o desorientar a los murciélagos. Además, es posible que se utilicen durante el cortejo. Kitching y Rawlins (1999; citados por Chacón y Montero, 2007) mencionan que en el mundo se conocen alrededor de 11 000 especies, de las cuales 1 000 están presentes en Costa Rica (Espinoza com. pers.). 5.2.1.1. Subfamilia Arctiinae Kitching y Rawlins (1999; citados por Chacón y Montero, 2007) mencionan que esta subfamilia reúne alrededor de 4 400 especies. 5.2.1.1.1. Tribu Arctiini La mayoría de especies de este grupo se conocen comúnmente como “mariposas tigre”, quizás debido a que en el abdomen tienen manchas en patrones de filas. Estos lepidópteros tienen el cuerpo robusto, son de tamaño grande y sus alas son anchas (Covell, 1984). 85 Especie 1: Amastus rumina Ciclo biológico: Larva: 39 días (n = 5) Prepupa: dos días (n = 5) Pupa: 47 días (n = 5) Figura 5. Fases del ciclo biológico de A. rumina: a) Larva tercer estadio vista dorsal. b) Larva tercer estadio vista frontal-lateral. c) Pupa. d) Adulto. Fotografías: Róger González. Planta hospedera: Tres larvas se alimentaron de Inga longispica, una larva se crió alimentándose de Gonzalagunia rosea y una larva en Melanthera aspera (EBA). Distribución: Los individuos criados en la EBA se recolectaron en los senderos Límite-Río Platanillal, Casa Coca y Gigantes del Bosque, en un ámbito altitudinal de 1 200-1 600 m. Según la base de datos ATTA (INBio, 2007) también se conoce en de la Vertiente Caribe entre 500-3 000 m en las Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde), Cuenca del San Carlos (PN Arenal, RB Alberto Manuel Brenes y ZP Arenal-Monteverde), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte y RF Río Macho), Cuenca del Sarapiquí (PN Braulio Carrillo, RVS Jaguarandi), Cuenca del Matina (PN Barbilla y RF Río Pacuare). 86 En la Vertiente Pacífica entre 100-3 000 m en la Cuenca del Pirris-Damas y Cuenca del Savegre (ZP Caraigres, ZP Río Navarro y Río Sombrero y RF Los Santos), Cuenca TérrabaSierpe (PILA y ZP Las Tablas), Cuenca del Tárcoles (PN Volcán Poás), Península de Osa (RF Golfo Dulce). Especie 2: Bertholdia crocea Ciclo biológico: Larva: 12 días (n = 3) Prepupa: cuatro días (n = 3) Pupa: 28 días (n = 3) Figura. 6. Fases del ciclo biológico de B. crocea. a) Larva tercer estadio. b) Pupa. c) Adulto (dorsal) e) Adulto (ventral). Fotografías: Róger González. Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Vernonia patens. Distribución: En Altamira, las larvas de B. crocea se recolectaron únicamente en el Sendero a la Toma del Agua, a una altitud de 1 350-1 450 m. Esta especie también se ha recolectado en la Vertiente Caribe entre 1 100 a 1 400 m Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte, MN Guayabo), y Cuenca del Matina. En la Vertiente Pacífica entre 1 200-2 000 m en la Cuenca Térraba-Sierpe (PILA, ZP Las Tablas y RI Boruca Térraba) y Cuenca del PirrísDamas (ZP Río Navarro y Río Sombrero) (INBio, 2007). 87 Especie 3: Bertholdia philoptera Ciclo biológico: Larva: 12 días (n = 4) Prepupa: dos días (n = 4) Pupa: 30 días (n = 4) Figura 7. Fases del ciclo biológico de B. philoptera. a) Larva tercer estadio vista lateral. b) Larva tercer estadio vista dorsal. c) Pupa. d) Adulto (macho). Fotografías: Róger González. Planta hospedera: Las cuatro larvas criadas en la EBA se alimentaron de Elaegia auriculata. Distribución: En Altamira se recolectó en el Sendero a Cerro Biolley, a una altitud de 1 7001 760 m. También se ha recolectado en la Vertiente Caribe entre 1 300-2 500 m en la Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte), Cuenca del San Carlos, Cuenca del Sarapiquí (PN Braulio Carrillo y RVS Jaguarandi) y en Tararia (PILA). También en la Vertiente Pacífica entre 200-2 800 m, en Cuencas del Río Lagarto y Guacimal (ZP ArenalMonteverde), Cuenca Térraba-Sierpe (PILA), Península de Osa (RF Golfo Dulce), Cuenca del Savegre (RF Los Santos) y Cuenca del Tárcoles (INBio, 2007). 88 Especie 4: Elysius melanoplaga Ciclo biológico: Larva: 12 días (n = 67) Prepupa: tres días (n = 67) Pupa: 32 días (n = 67) Figura 8. Fases del ciclo biológico de E. melanoplaga: a) Larvas segundo estadio. b) Larva cuarto estadio. c) Pupa. d) Adulto. Fotografías: Róger González y Roberto Delgado. Planta hospedera: Las 67 larvas criadas en la EBA se alimentaron de Mikania banisteriae. Distribución: E. melanoplaga se recolectó en los senderos Toma del Agua, Cerro Biolley y Casa Coca, en un ámbito altitudinal de 1 350-1 760 m. También se conoce de la Vertiente Caribe entre 700-1 700 m, en la Cuenca del Matina (RI Chirripó), Cuenca del Sarapiquí (PN Braulio Carrillo) y Cuenca del Reventazón (PN Tapantí-Macizo de La Muerte). En la Vertiente Pacífica entre 1 200-2 000 m, en la Cuenca Térraba-Sierpe (PILA y ZP Las Tablas), Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde) y Cuenca del Pirrís-Damas (ZP Río Navarro y Río Sombrero) (INBio, 2007). 89 Especie 5: Opharus belus Ciclo biológico: Larva: nueve días (n = 4) Prepupa: tres días (n = 4) Pupa: 29 días (n = 4) Figura 9. Ciclo biológico de O. belus: a) Larva cuarto estadio vista lateral. b) Larva cuarto estadio vista dorsal. c) Pupa. d) Adulto ♂. Fotografías: Róger González. Planta hospedera: Las cuatro larvas criadas en la EBA se alimentaron de Celtis iguanaea. Distribución: En Altamira, O. belus se recolectó en los senderos Cerro Biolley-Cerro Tonduz y Gigantes del Bosque, en un ámbito altitudinal de 1 300-1 600 m. También se encuentra en la Vertiente Caribe entre 800-1 400 m, en la Cuenca del Matina, Cuenca del Reventazón y Cuenca del Sarapiquí. En la Vertiente Pacífico entre 1 200-1 700 m, en la Cuenca del Térraba-Sierpe, Cuencas del Lagarto y Guacimal (INBio, 2007). 90 Especie 6: Opharus procroides Ciclo biológico: Larva: 30 días (n = 3) Prepupa: tres días (n = 3) Pupa: 33 días (n = 3) Figura 10. Fases del ciclo biológico de O. procroides: a) Larva tercer estadio vista dorsal. b) Larva tercer estadio vista frontal-lateral. c) Pupas. d) Adulto. Fotografías: Róger González. Planta hospedera: De las tres larvas criadas en la EBA, una se alimentó en Urera caracasana y dos se alimentaron en Cecropia polyphlebia. Distribución: En Altamira esta especie se recolectó en los senderos Límite-Río Platanillal, Casa Coca y Gigantes del Bosque en un ámbito altitudinal de 1 200-1 500 m. También se le encuentra en la Vertiente Caribe entre 800-1 700 m, en la Cuenca del Sarapiquí (PN Braulio Carrillo), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte) y Cuenca del San Carlos. En la Vertiente Pacífico entre 1 000-2 100 m, en la Cuenca del Lagarto y Guacimal (ZP Arenal-Monteverde), Cuenca del Tempisque (PN Guanacaste), Cuenca del TérrabaSierpe (PILA) y Cuenca del Tárcoles (RVS Jaguarandi) (INBio, 2007). 5.2.1.1.2 Tribu Ctenuchini La mayoría de especies de este grupo tienen las alas anteriores angostas, venación reducida, alas transparentes (hialinas) y el segmento basal del abdomen en forma de una 91 cintura similar al abdomen de las avispas, a las cuales mimetizan. Estos lepidópteros imitan la forma, el color y el comportamiento (son activos durante el día) de avispas de la familia Vespidae (Chacón y Montero, 2007). Especie 7: Amycles adusta Ciclo biológico: Larva: 35 días (n = 9) Prepupa: dos días (n = 9) Pupa: 17 días (n = 9) Figura 11. Fases del ciclo biológico de A. adusta: a) larva cuarto estadio vista lateral. b) Larva cuarto estadio parasitada por Microgastrinae (Braconidae: Hymenoptera). c) Prepupa. d) Adulto. Fotografías: Róger González. Planta hospedera: De las nueve larvas criadas en la EBA, cinco se alimentaron en Heliconia tortuosa y cuatro en Canna tuerkheimii. En el ACG, Janzen y Hallwachs (2005) reportan las especies Canna indica, Musa acuminata (especies introducidas) y H. latispatha. Distribución: En el PILA, se ha recolectado en Cerro Pittier y Altamira, específicamente en los senderos Gigantes del Bosque y Límite-Río Platanillal, en un ámbito altitudinal de 1 300 1 500 m. También se le encuentra en la Vertiente Caribe entre 400-700 m, en el Volcán Orosí y Cuenca del Sapoá (PN Guanacaste). En la Vertiente Pacífico entre 200-1 800 m, en 92 la Cuenca del Tárcoles, Cuenca del Tempisque (PN Guanacaste) y Cuenca del TérrabaSierpe (ZP Las Tablas) (INBio, 2007). Parasitoides: Las larvas de A. adusta son parasitadas por avispas de la subfamilia Microgastrinae (Braconidae: Hymenoptera). Especie 8: Holophaea lycone Ciclo biológico: Larva: 36 días (n = 3) Prepupa: tres días (n = 3) Pupa: 17 días (n = 3) Figura 12. Fases del ciclo biológico de H. lycone: a) Larva cuarto estadio vista dorsal. b) Larva cuarto estadio vista lateral. c) Pupa. d) Adulto ♀. Fotografías: Róger González. Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Symphonia globulifera. Distribución: En Altamira, H. lycone se recolectó en el Sendero Cerro Biolley, a una altitud de 1 660-1 760 m. También se le encuentra en la Vertiente Caribe entre 900-1 400 m, en la Cuenca del San Carlos (RB Alberto Manuel Brenes), y en la Cuenca del Matina (PN Barbilla). En la Vertiente Pacífico entre 1 100-1 800 m, en la Cuenca del Térraba-Sierpe (PILA y ZP 93 Las Tablas), Cuenca del Tempisque (ZP Miravalles) y Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde) (INBio, 2007). 5.2.1.1.3 Tribu Pericopini Algunas especies vuelan durante el día y presentan coloraciones con manchas brillantes. Presentan un abultamiento largo y redondeado en ambos costados del primer segmento abdominal (Covell, 1984), estructura que se conoce con el nombre de capucha timpánica (Espinoza com. pers.). Estos árctidos son de contextura frágil y delicada. Tienen dimorfismo sexual y algunas especies son grandes, aposemáticas o mimetizadoras de otras especies de lepidópteros (Chacón y Montero, 2007). Especie 9: Dysschema cerialis Ciclo biológico: Larva: 17 días (n = 3) Prepupa: dos días (n = 3) Pupa: 23 días (n = 3) Figura 13. Fases del ciclo biológico de D. cerialis: a) Larva tercer estadio vista dorsal. b) Larva tercer estadio vista lateral. c) Pupa. d) Adulto. Fotografías: Róger González. 94 Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Baccharis trinervis. Distribución: En el PILA, D. cerialis se ha recolectado en el Valle del Silencio y en Altamira, en el Sendero Gigantes del Bosque, a una altitud de 1 300-1 400 m. Según la base de datos ATTA (INBio, 2007) también se conoce de la Vertiente Caribe entre 700-2 500 m en la Cuenca del Reventazón (PN Tapantí-Macizo de La Muerte), Cuenca del Matina (PN Barbilla y RI Chirripó), Cuenca del Sarapiquí (PN Braulio Carrillo RF Cordillera Volcánica Central y RVS Jaguarandi), Cuenca del San Carlos (PN Arenal y RB Alberto Manuel Brenes), Cuenca de la Estrella (RB Hitoy Cerere) y en Tararia (PILA). En la Vertiente Pacífico entre 900-2 000 m en las Cuencas de Lagarto y Guacimal (ZP Arenal-Monteverde), Cuenca del Tempsique (ZP Miravalles), Cuenca Térraba-Sierpe (PILA, RI Boruca-Térraba y ZP Las Tablas) y Cuenca del Pirrís-Damas (ZP Río Navarro y Río Sombrero). Especie 10: Pelochyta affinis Ciclo biológico: Larva: 18 días (n = 4) Prepupa: tres días (n = 3) Pupa: 22 días (n = 2) Figura 14. Fases del ciclo biológico de P. affinis: a) Larva tercer estadio vista dorsal. b) Larva tercer estadio vista lateral. c) Pupa. d) Adulto. Fotografías: Róger González. 95 Planta hospedera: Las cuatro larvas criadas en la EBA se alimentaron de Vernonia patens. Distribución: P. affinis se ha recolectado en el PILA en el Valle del Silencio (2 450 m) y Estación Altamira, en el Sendero Toma del Agua (1 400 m). Según la base de datos ATTA (INBio, 2007), también se le encuentra en la Vertiente Caribe entre 0-2 500 m en la Cuenca del Sarapiquí (PN Braulio Carrillo, RF Cordillera Volcánica Central y ZP La Selva), Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte), Cuenca del Matina (PN Barbilla, RF Río Pacuare y RI Chirripó), Cuenca del San Carlos (PN Arenal, ZP Arenal-Monteverde, ZP Tenorio y RB Alberto Manuel Brenes), Cerros Tararia (PILA), Cuenca del Pizote (PN Guanacaste-Rincón de la Vieja y PN Guanacaste), Volcán Orosí (PN Guanacaste), Cuenca del Zapote y Cuenca del Río Frío (PN Volcán Tenorio). En la Vertiente Pacífico se le encuentra entre 700-2 300 m. en la Cuenca del Tárcoles, Cuenca del Tempisque (PN Guanacaste, PN Rincón de la Vieja y ZP Miravalles), Cuenca del Térraba Sierpe (PILA, ZP Tenorio y ZP Las Tablas), Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde) y Cuenca del Savegre (RF Los Santos). 5.2.2 Familia Bombycidae Los bombícidos son mariposas nocturnas de cuerpo pesado (Covell, 1984). Según este mismo autor, en Europa del Sur, Asia del Sur y Asia del Oeste existen alrededor de 100 especies. Chacón y Montero (2007) afirman que esta familia se distribuye en todo el mundo excepto en el continente Europeo, presentando una mayor diversidad en las regiones oriental y neotropical. Lemaire y Minet (1999; citados por Chacón y Montero, 2007) mencionan que en el mundo se conocen cerca de 350 especies agrupadas en 40 géneros. En Costa Rica se han reportado 78 especies de Bombycidae (Chacón y Montero, 2007). El tamaño de estos lepidópteros varía de pequeño a grande: 10-37 mm. Las alas son anchas y en posición de descanso, tanto las alas anteriores como posteriores tienden a colgar alejadas del tórax. El abdomen generalmente aparece doblado hacia arriba o hacia algún costado. Las antenas son muy similares en ambos sexos: bipectinadas o tripectinadas. Los palpos labiales son medianos o vestigiales y la probóscide es muy pequeña o está ausente (Chacón y Montero, 2007). 96 Aunque el gusano de seda (Bombix mori) no es una especie de Lepidoptera nativa de nuestra región, se usa para la enseñanza y la investigación y está presente en algunas colecciones privadas. La sericultura o cultura de seda comercial surgió en China cerca del año 2 697 a.C. (Chacón y Montero, 2007 aumentan esta fecha hasta el año 3 400 a.C.). Los chinos exportaban seda, pero guardaron el secreto de su producción hasta el año 555 d.C., cuando dos monjes pasaron a Constantinopla algunos huevos, con lo cual inició la industria de seda europea. Los esfuerzos en Norteamérica (EE.UU.) por la producción de seda no han dado buenos resultados y han fracasado (Covell, 1984). Actualmente el gusano de seda no está presente en estado silvestre ni siquiera en su lugar natal (China). La reproducción de esta especie en granjas de sericultura durante más de 5000 años de cría selectiva, ha logrado aumentar la producción continua de seda de un solo capullo hasta en más de 600 m (Chacón y Montero, 2007). Cabe destacar que esta especie (Bombix mori) perdió su capacidad de vuelo durante el proceso de domesticación (Chinery, 1988; citado por Chacón y Montero, 2007). 5.2.2.1 Subfamilia Apatelodinae En años anteriores, algunos investigadores se han referido a este mismo taxón con los nombres de Eupterotidae y Zanolidae pues anteriormente, los apatelódinos se clasificaban como una familia aparte. Ahora se han reagrupado dentro de la familia Bombycidae como una pequeña subfamilia (Covell, 1984) que según Becker (1996c; citado por Chacón y Montero, 2007) reúne cerca de 145 especies repartidas en 10 géneros. En Costa Rica existen 37 especies de apatelódinos (Chacón y Montero, 2007). La forma de las larvas es aplanada y son muy peludas. Las plantas hospederas pueden ser árboles y arbustos de varias especies y familias (Covell, 1984). Las larvas de la mayoría de especies pupan en el suelo. Sin embargo, las especies de los géneros Zanola y Tarchon construyen capullos de seda dentro de los cuales ocurre la pupación (Chacón y Montero, 2007). Los adultos son de tamaño mediano, con pequeñas ventanas transparentes en las alas anteriores y con una envergadura alar que oscila entre 32 y 42 mm. La probóscide está reducida en algunas especies y ausente en otras. Machos y hembras tienen el ápice de las antenas bipectinadas (Covell, 1984). 97 Especie 11: Tarchon felderi Ciclo biológico: Larva: 85 días (n = 7). Una de las larvas tardó 195 días (6,5 meses) en pupar. Prepupa: tres días (n = 7) Pupa: 34 días (n = 7) Figura 15. Fases del ciclo biológico de T. felderi: a) Larva cuarto estadio vista latero-dorsal. b) Pupa c) Adulto vista dorsal. d) Adulto vista ventral. Fotografías: Róger González. Planta hospedera: De las siete larvas criadas en la EBA, dos se alimentaron en Elaeagia auriculata, cuatro en Quercus rapurahuensis y una en Philodendron brenesii. Janzen y Hallwachs (2005) reportan una amplia lista de plantas hospederas para T. felderi en el ACG, las cuales se presentan en el cuadro 2. Cuadro 2. Plantas hospederas para T. felderi en ACG, según Janzen y Hallwachs (2005). Familia Araceae Especie Anthurium consobrinum, Philodendron rhodoaxis, Rhodospatha pellucid, Syngonium angustatum Arecaceae Chamaedorea costaricana, Chamaedorea tepejilote Asteraceae Mikania guaco, Salmea scandens, Zexmenia virgulta Bignoniaceae Amphitecna latifolia, Anemopaegma puberulum, Arrabidaea chica, Tabebuia rosea Bombacaceae Pachira aquatica Bromeliaceae Aechmea pubescens 98 Familia Especie Cecropiaceae Cecropia obtusifolia Dilleniaceae Davilla nitida Euphorbiaceae Acalypha diversifolia, Acidoton nicaraguensis, Conceveiba pleiostemon., Croton billbergianus, C. schiedeanus Centrosema plumieri, Dioclea wilsonii, Inga oerstediana, I. punctat., I. Sapindoides, Fabaceae Lonchocarpus oliganthus, Pithecellobium furcatum, Pterocarpus officinalis, Senna papillosa Heliconiaceae Heliconia latispatha, Heliconia pogonantha Icacinaceae Calatola costaricensis Lauraceae Cinnamomum brenesii Malvaceae Malvaviscus arboreus, M. palmanus, Pavonia schiedeana Marantaceae Pleiostachya leiostachya Meliaceae Guarea bullata, G. glabra Musaceae Musa acuminata (especie introducida) Myrtaceae Myrcia splendens, Psidium guajava (especie introducida) Piperaceae Piper aduncum, P. auritum, P. chrysostachyum, P. peltatum Poaceae Lasiacis procerrima, L. rhizophora, Setaria paniculifera Rosaceae Prunus annularis Amaioua Rubiaceae pedicellata, Chiococca alba, Coussarea austin-smithii, Hoffmannia longipetiolata, Posoqueria latifolia, Psychotria berteriana, P. correae, P. cyanococca, P. pubescens Rutaceae Zanthoxylum melanostictum, Citrus sinensis (especie introducida) Salicaceae Casearia nitida, Hasseltia floribunda, Xylosma intermedia Sapindaceae Serjania atrolineata Schizaeaceae Lygodium venustum Smilacaceae Smilax spinosa Solanaceae Cestrum fragile, C. megalophyllum, C. Solanum hayesii, S. schlechtendalianum Sterculiaceae Guazuma ulmifolia Tiliaceae Apeiba membranacea, Heliocarpus americanus Urticaceae Myriocarpa longipes, Urera eggersii Verbenaceae racemosum, Citharexylum costaricensis, Gmelina arborea (especie introducida), Petrea volubilis, Citharexylum sp. Violaceae Rinorea deflexiflora Vitaceae Vitis tiliifolia Zingiberaceae Renealmia cernua 99 Distribución: En Altamira, T. felderi se ha recolectado en el Sendero Cerro Biolley y Sendero a Casa Coca, en un ámbito altitudinal de 1 600-1 800 m. También está presente en la Vertiente Caribe entre 0 y 50 m, en la Cuenca Tortuguero-Sierpe (PN Tortuguero) y en la Vertiente Pacífica entre los 0-1 400 m, en la Cuenca del Tempisque (PN Guanacaste), Cuenca del Tárcoles (PN Carara) y Península de Osa (PN Corcovado) (INBio, 2007). Parasitoides: No se han obtenido parasitoides asociados a T. felderi en Altamira, pero Janzen y Hallwachs (2005) reportan los himenópteros de los géneros Glyptapanteles, Meteorus (Braconidae) y Dusona (Ichneumonidae) así como los dípteros de las especies Chrysoexorista sp., Hyphantrophaga virilis, Pantelloa xanthura y Triodontopyga flavolimbata (Tachinidae) como parasitoides asociados a este lepidóptero. 5.2.3 Familia Crambidae (anteriormente esta subfamilia pertenecía a la familia Pyralidae). Las larvas son barrenadoras, es decir, se introducen, alimentan y desarrollan dentro del tejido de los tallos de las plantas. Algunas especies representan serias plagas en plantas de importancia económica principalmente de la familia Poaceae (arroz y caña de azúcar) (Covell, 1984). Los adultos de la mayoría de especies tienen una coloración café, gris o blanca, algunas veces con líneas plateadas. El ala anterior es larga, estrecha y enrollada, en algunos casos esto les da una apariencia de ramita seca cuando el lepidóptero está en reposo. Los palpos labiales tienen forma de pico, como un estilete (Covell, 1984). 5.2.3.1 Subfamilia Pyraustinae Anteriormente se clasificaba como una subfamilia de Pyralidae. Actualmente es la subfamilia más grande de Crambidae. Las larvas de algunas especies enrollan las hojas en donde comen y defecan, otras especies perforan tallos y frutos de algunas plantas. El cuerpo de los adultos es delgado, las alas son anchas como en los Geometridae, pero con el abdomen mucho más largo. Algunas especies tienen patrones de coloración brillante (Covell, 1984). 100 Especie 12: Herpetogramma agavealis Ciclo biológico: Larva: 20 días (n = 28) Prepupa: tres días (n = 11) Pupa: 23 días (n = 11) Figura 16. Fases del ciclo biológico de H. agavealis: a) Larva tercer estadio vista latero-dorsal. b) Larva cuarto estadio vista dorsal c) Hojas enrolladas con seda. d) Larva en Prepupa. e) Pupa. f) Adulto. Fotografías: Róger González. Planta hospedera: De las 28 larvas criadas en la EBA, 16 se alimentaron en Celastrus vulcanicola, 11 en Heliocarpus americanus y una en Iresine diffusa. Distribución: En Altamira, se recolectaron y criaron larvas de H. agavealis provenientes de los Senderos Cerro Biolley, Gigantes del Bosque y Toma del Agua en un ámbito altitudinal de 1 400-1 700 m. También se conoce de la Vertiente Caribe de los 0-800 m, en la Cuenca del Sixaola (RI Talamanca), Cuenca del Sarapiquí (RF Cordillera Volcánica Central), Cuenca Tortuguero-Sierpe (RVS Barra del Colorado), Cuenca del Pizote (PN Guanacaste-Rincón de la Vieja) y Volcán Orosí (PN Guanacaste). En la Vertiente Pacífico se ha recolectado entre los 100-1 300 m, en la Cuenca del Tárcoles (PN Carara), Cuenca Térraba-Sierpe, Cuencas 101 del Lagarto y Guacimal, Cuenca del Tempisque (PN Santa Rosa) y Península de Osa (RF Golfo Dulce) (INBio, 2007). Parasitoides: En la EBA se reporta el díptero Lixophaga sp. (Tachinidae) como parasitoide de H. agavealis. 5.2.4 Familia Hesperiidae Este grupo fue descrito por Latreille, en el año 1809 y representa una de las familias más primitivas y numerosas de mariposas diurnas (De Olano et al. 1990 y De la Maza, 1987; citados por Barrios et al., 2006). A veces son tratadas dentro de la Superfamilia Papilionoidea (Heppner, 2008), pero aquí seguimos el criterio de considerarlas como una familia de la superfamilia Hesperioidea. La familia Hesperiidae incluye siete subfamilias: Trapezitinae de Australia, Heteropterinae de distribución mundial excepto en Australia, Coeliadinae en África tropical, Asia y Australia; Pyrginae y Hesperiinae de distribución amplia, casi cosmopolita; Pyrrhopyginae restringida al Neotrópico y Megathyminae restringida a EE.UU. México y América Central (Heppner, 1991; Scoble, 1995). Las mariposas de la familia Hesperiidae están presentes en todo el mundo excepto en Nueva Zelanda. De las cinco familias de mariposas diurnas, Hesperiidae es la tercera más grande en cantidad de especies conocidas y esperadas (Barrios et al., 2006). Algunos autores clasifican los Rhopalocera (lepidópteros diurnos) en dos superfamilias: Papilionoidea y Hesperioidea. Otros reconocen sólo la superfamilia Papilionoidea, donde incluyen la familia Hesperiidae. En todo caso, el número de especies de Rhopalocera en todo el mundo es de 19 238 y de 5 419 a 7 927 en el Neotrópico, en donde está presente la mayor diversidad. Lamas (2004) estima que existen unas 7 784 especies de Rhopalocera neotropicales, y que la riqueza mundial de Hesperiidae es de 3 658 especies, de las cuales 2 365 son neotropicales (Heppner, 1991; Mielke, 2004; citado por Barrios et al., 2006). Aún se conoce muy poco de los Hesperiidae del Neotrópico en relación a la riqueza de especies, biogeografía y su historia natural. En Mesoamérica los países con más información sobre hespéridos son México, El Salvador y Cuba (De la Maza 1987, Llorente et al. 1990 y 1993, Luis et al. 2003, Steinhauser 1975, Warren 2000; citados por Barrios et al., 2006). Sin embargo, Chacón (com. pers.) predice que Costa Rica es el país donde se conocen mejor 102 los Hesperiidae. Austin (inédito) predice que en Costa Rica existen 500 especies de hespéridos. Al igual que en otras familias de Lepidoptera, la rareza de las especies puede estar influenciada por factores demográficos, por la abundancia de sus poblaciones o por la especificidad de su hábitat (hábitos alimenticios que van desde monófagas a oligófagas). Algunas especies heliófilas y comunes que están asociadas con hábitats abiertos y perturbados podrían ser menos vulnerables. La mayoría de las especies de Hesperiidae se distribuyen en hábitats de borde, por lo que dependen en gran manera de los bosques y, aunque no se ha documentado el impacto de la deforestación sobre su diversidad, no podemos ignorar esta relación. Son pocas las especies asociadas a bosque primario, tales como Astraptes, Pythonides y los Pyrrhopyginae. La mayor diversidad de Hesperiidae está asociada a los bosques cálidos y húmedos, por lo que la acelerada tasa de pérdida de estos ecosistemas se puede ver afectada directamente sus poblaciones. El escaso conocimiento sobre la biología de este grupo hace más difícil establecer la dimensión de esta amenaza (Burns y Janzen, 2001). Para determinar algunos géneros y especies de Hesperiidae se pueden usar las características morfológicas y la coloración. Cuando hay especies difíciles de identificar o que incluso son crípticas, se debe recurrir al estudio de los genitales de ambos sexos, debido a que su complejidad y diversidad de formas hacen difícil la existencia de dos especies con idéntica estructura. Los genitales están situados en el extremo del abdomen tanto en los machos como en las hembras. El aparato copulador del macho incluye un órgano para el transporte de espermatozoos hacia la hembra así como un grupo de estructuras asociadas adaptadas para sujetar la hembra (Barrios et al., 2006). Existe poca información de la ecología de los hespéridos. Algunos estudios muy puntuales sugieren una relación de la distribución de algunas especies con el tipo de vegetación. Burns y Janzen (2001) realizaron una investigación en Costa Rica, donde estudiaron tres ecosistemas: el bosque seco, el bosque nuboso y el lluvioso, registrándose un total de 15 especies de Pyrrhopyginae. Para el bosque seco encontraron tres especies, cuatro especies en bosque nuboso de montaña y diez especies en el bosque lluvioso (elevaciones medias). Los resultados sugieren que es un grupo especialista ya que no se encontraron especies compartidas entre los tres ecosistemas (Burns y Janzen, 2001). 103 Los huevos son hemisféricos, manchados o ribeteados y son ovopositados en forma individual. Las larvas poseen muchas setas secundarias sobre la cabeza y cuerpo. La cápsula cefálica es muy grande y de color verde o café. En la mayoría de las especies, las larvas se alimentan y habitan dentro de nidos que construyen con hojas enrrolladas con seda. Las larvas se alimentan en hojas y tallos de leguminosas, mirtáceas, ramnáceas, euforbiáceas, rutáceas, bambusáceas y solanáceas (De la Maza, 1987; citado por Barrios et al., 2006). Las larvas de Megathyminae taladran las hojas, tallos y raíces de Agavaceae; la especie más conocida de los Megathyminae es Aegiale hesperiaris, llamada gusanillo blanco del maguey; es comestible (Ramos-Elorduy J., 2004 citado por Barrios et al., 2006). Las larvas construyen sus refugios empolvando el sustrato con una secreción cerosa de las glándulas abdominales (Scoble, 1995). En la Cordillera Volcánica Central, las larvas de Achyloides busirus son defoliadoras de árboles tropicales de importancia económica como Hyeronima alchorneoides, Laetia procera, Pithecellobium elegans, P. macradenium, Stryphnodendron microstachyum, Virola koschnyi, Terminalia amazonia, Vochysia ferruginea, V. guatemalensis y Zanthoxylum mayanum (Moulaert y Arguedas, 1993). Algunas especies son plagas en plantaciones de palmas, frijoles, arroz y otras gramíneas. La pupa o crisálida es alargada y de color café. Se les encuentra dentro de un “guacal” formado con seda y la hoja de la planta enrollada o directamente sobre el sustrato (semienterrada) (De la Maza, 1987; citado por Barrios et al., 2006). La pupa tiene una probóscide que en la mayoría de las especies está bien desarrollada (larga) y que se extiende hasta el cremáster. En algunas especies, las pupas pueden tener un anillo de seda que rodea al tórax y con el cual se adhieren al sustrato (Scoble, 1995). Los adultos de algunas especies habitan en áreas húmedas y terrenos abiertos donde abundan flores. Otras especies prefieren lugares con vegetación densa y sombría, en donde se posan en el envés de las hojas. Son de tamaño mediano (5-55 mm de envergadura alar). La mayoría de especies son de colores opacos, sin embargo, algunas tienen coloraciones atractivas, como por ejemplo Astraptes fulgerator. Por su aspecto parecieran que son mariposas nocturnas (Barrios et al., 2006). En algunas especies, el dimorfismo sexual no es 104 muy marcado y en otras no existe. Los machos de la mayoría de especies poseen un pliegue en el costado de las alas anteriores, en el cual tienen androconias o un estigma, que son escamas especializadas en la producción de feromonas (Alayo y Hernández, 1987; citados por Barrios et al., 2006). La mayoría de especies tienen la cabeza tan ancha como su tórax, las antenas son muy separadas en la base y curvadas y delgadas en la punta. El cuerpo es fuerte, robusto y está cubierto por escamas con forma de pelo, lo cual les permite volar con agilidad. El vuelo de los hespéridos es rápido, irregular y cerca del suelo, por lo que en inglés se les conoce como “skippers” (saltarines). Vuelan trazando círculos amplios desde el lugar donde se posan y a veces regresan al mismo sitio (Barrios et al., 2006). 5.2.4.1 Subfamilia Hesperiinae Especie 13: Talides sinois cantra Ciclo biológico: Larva: 15 días (n = 6) Prepupa: tres días (n = 6) Pupa: 50 días (n = 5) Figura 17. Fases del ciclo biológico de T. sinois cantra: a) Larva cuarto estadio vista latero-dorsal. b) Larva tercer estadio vista frontal. c) Prepupa. d) Pupa e) Adulto. Fotografías: Róger González. 105 Planta hospedera: Las cuatro larvas criadas en la EBA se alimentaron de Heliconia tortuosa. En el ACG, Janzen y Hallwachs (2005), reportan las siguientes especies: Canna indica (especie introducida), Heliconia irrasa, H. latispatha, H. longa, H. longiflora, H. mathiasiae, H. pogonantha, H. tortuosa, H. vaginalis, Maranta arundinacea, Musa acuminata, M. cavendishii (ambas especies introducidas) y Lasiacis procerrima. Distribución: Las larvas se recolectaron en los senderos Límite-Río Platanillal y Gigantes del Bosque, a una altitud de 1 300-1 400 m. Esta especie también se encuentra reportada en la Vertiente Caribe entre 0-800 m. en la región Caribe Norte, Cuenca del Tortuguero-Sierpe (RVS Barra del Colorado), Cuenca del Río Frío, Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Sarapiquí (PN Braulio Carrillo) y Cuenca del Reventazón. En la Vertiente Pacífico entre 0-100 m. en las Serranías de Golfito (PN Piedras Blancas) (INBio, 2007). Parasitoides: No se lograron registrar parasitoides asociados a T. sinois cantra en Altamira. Sin embargo, en el ACG, Janzen y Hallwachs (2005) reportan cinco especies de de Diptera parasitoides, a saber: Blepharipa ciliata, B. fimbriata, B. sp., Patelloa xanthura y Spathidexia sp. (Tachinidae: Diptera). También reportan varias especies de Hymenoptera: Alphomelon talidicida (Braconidae), Creagrura nigripes, Hyposoter sp. (Ichneumonidae), Baryscapus sp., Miotropis sp. (Eulophidae), y al menos una especie de la familia Chalcididae. 5.2.4.2 Subfamilia Pyrginae Especie 14: Astraptes fulgerator Ciclo biológico: Larva: 52 días (n = 12) Prepupa: dos días (n = 12) Pupa: 45 días (n = 9) Planta hospedera: De las 12 larvas criadas en la EBA, ocho se alimentaron en Hampea appendiculata, dos en Vigna candida, una en Heliconia tortuosa y una en Senna papillosa. Se han observado algunos adultos de A. fulgerator alimentándose del néctar de las flores de Melanthera aspera y Stachytarpheta frantzii. En el ACG, Janzen y Hallwachs (2005) reportan las especies Dioclea reflexa, Entada gigas, Inga sapindoides, S. hayesiana y S. papillosa como hospederos de las larvas de A. fulgerator. 106 Figura 18. Fases del ciclo biológico de A. fulgerator: a) Larva cuarto estadio vista dorsal. b) Larva tercer estadio vista lateral. c) Pupa. d) Adulto. Fotografías: Róger González. Distribución: En Altamira se han recolectado y criado larvas provenientes de los senderos Cerro Biolley, Límite-Río Platanillal y Gigantes del Bosque, en un ámbito altitudinal de 1 5001 750 m. Además según la base de datos ATTA (INBio, 2007) se le encuentra en la Vertiente Caribe entre los 0-1 300 m, en la Cuenca del Tortuguero-Sierpe (RVS Barra del Colorado), Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Sixaola, Cuenca del Sarapiquí (PN Braulio Carrillo y ZP La Selva), Cuenca del San Carlos (ZP Arenal-Monteverde, PN Tenorio y PN Arenal), Cuenca del Reventazón (MN Guayabo), Volcán Orosí (PN Guanacaste), Cuenca del Sapoá (PN Guanacaste), Cuenca del Pizote (Volcán Rincón de la Vieja y PN Guanacaste). En la Vertiente Pacífica se le encuentra entre los 0-2 000 m. en la Península de Osa (PN Corcovado, PN Piedras Blancas y RF Golfo Dulce), Cuenca del Paquita y Naranjo (PN Manuel Antonio), Cuenca del Tempisque (PN Palo Verde, PN Rincón de la Vieja y PN Guanacaste), Cuenca de Santa Elena (PN Santa Rosa), Cuenca del Tárcoles (PN Carara), Península de Nicoya (RNA Cabo Blanco), Cuencas del Lagarto y Guacimal (ZP MonteverdeArenal), Cuenca del Jesús María, Cuenca del Térraba-Sierpe (PILA y ZP Las Tablas). Parasitoides: Se obtuvieron 25 especímenes Microgastrinae (Braconidae:Hymenoptera) los cuales emergieron de una sola larva de A. fulgerator. 107 Especie 15: Celaenorrhinus stallingsi Ciclo biológico: Larva: 46 días (n = 2) Prepupa: dos días (n = 2) Pupa: 21 días (n = 2) Figura 19. Fases del ciclo biológico de C. stallingsi a) Larva tercer estadio vista frontal. b) Larva tercer estadio vista dorsal. c) Pupa. d) Adulto. Fotografías: Róger González y Roberto Delgado. Planta hospedera: En la EBA se registró la especie Dicliptera iopus. En el ACG, Janzen y Hallwachs (2005) reportan las especies Aphelandra scabra y Justicia macrantha. Distribución: En la EBA, C. stallingsi se recolectó únicamente en bosque primario, en el Sendero Cerro Biolley, a una altitud de 1 700-1 780 m. De acuerdo con la Base de datos Atta (INBio, 2007), existe sólo un registro de una hembra recolectada en el lado oeste del Volcán Orosí a 600 m (PN Guanacaste). Janzen y Hallwachs (2005), reporta esta especie en varios sitios del PN Guanacaste entre 300 y 1 100 m. Parasitoides: Janzen y Hallwachs (2005) reportan la especie Hyphantrophaga virilis (Tachinidae) y una especie no identificada de avispa parasitoide de la familia Braconidae como parasitoides de C. stallingsi. 108 Especie 16: Telemiades gallius Ciclo biológico: Larva: 27 días (n = 1) Prepupa: dos días (n = 1) Pupa: 30 días (n = 1) Figura 20. Fases del ciclo biológico de T. gallius: a) Larva cuarto estadio vista latero-dorsal. b) Prepupa. c) Pupa. d) Adulto. Fotografías: Róger González y Roberto Delgado. Planta hospedera: En la EBA se registró la especie Inga oerstediana. En el ACG, Janzen y Hallwachs (2005) reportan la especie I. sapindoides. Distribución: En Altamira se recolectó en el Sendero Gigantes del Bosque, a una altitud de 1 400-1 500 m. Janzen y Hallwachs (2005) reporta esta especie en Estación Pitilla en el Volcán Orosí (PN Guanacaste) y San Cristóbal en la Cuenca del Pizote (CB GuanacasteRincón de la Vieja) entre los 500 a 900 m. 109 5.2.5 Familia Lycaenidae Este grupo de mariposas está presente en casi todo el mundo (cosmopolita), pero su mayor diversidad se da en los trópicos (Ackery et al. 1999; citado por Chacón y Montero, 2007). Hasta el momento se conocen cerca de 6 000 especies en todo el mundo, de las cuales 511 existen en Costa Rica (Chacón y Montero, 2007) y se les puede encontrar desde el nivel del mar hasta los 2 000 m de altitud en ambas vertientes. La mayoría de especies necesitan hábitats con alguna alteración, pero algunas pocas vuelan bajo los árboles del bosque primario o secundario viejo (Robbins, 1994). La mayor abundancia de adultos se da durante la estación seca, de manera que hay una variación en el tamaño de las poblaciones con respecto a la época seca o lluviosa (Robbins, 1994). Los adultos son de tamaño pequeño a mediano. Las alas anteriores tienen una longitud que varía entre 8-35 mm. Cuando están posadas, la mayoría de especies mueven sus alas posteriores en forma alterna hacia atrás y hacia adelante (Robbins, 1994). La gran mayoría de especies (90%) presentes en Costa Rica son de color azul iridiscente en el dorso y tienen colas filamentosas en las alas posteriores (Robbins, 1994). Los palpos labiales están bien desarrollados (Chacón y Montero, 2007) y la probóscide es relativamente corta y les permite libar el néctar de algunas flores con corolas cortas (Mangifera indica y Cordia alliodora) (Robbins, 1994). Generalmente los huevos tienen forma de domo y su superficie es bastante esculpida o densamente reticulada. El cuerpo de las larvas tiene forma de huso (onisciformes) (Chacón y Montero, 2007) y se asemejan a la forma de una babosa. Las larvas y pupas de muchas especies de licaénidos tienen asociaciones especiales con formícidos (hormigas) y homópteros (chicharritas) (Robbins, 1994). Estas relaciones simbióticas mutualistas son factibles gracias a que los licaénidos han desarrollado estructuras corporales especializadas. Ejemplo de ellas son la glándula dorsal y órgano eversible, las cuales tienen poros por donde secretan gotas de sustancias azucaradas de las que se alimentan las hormigas (Chacón y Montero, 2007). A cambio, es posible que reciban protección contra sus enemigos naturales (depredadores y parasitoides) (Robbins, 1994). Según Chacón y Montero (2007), durante las interacciones químicas que ocurren entre las larvas de los licaénidos y las hormigas, las larvas liberan aminoácidos como una forma de 110 pago a las hormigas. La producción de estos aminoácidos quizás se debe a que muchas de las larvas de este grupo se alimentan de plantas cuyas hojas tienen un alto contenido de nitrógeno como algunas especies de la familia Fabaceae (guabas y guajiniquiles). Las larvas de algunas especies son detritívoras, es decir, se alimentan de materia orgánica en descomposición, especialmente de flores caídas. Otras especies están estrechamente relacionadas con los matapalos (Loranthaceae y Viscaceae) y cicadáceas. Sin embargo, la mayoría de especies se alimentan de botones florales, flores, frutos y hojas tiernas de una gran cantidad de especies de plantas. Unas cuantas especies son plagas de cultivos con importancia económica como la piña, el frijol, la anona y la guanábana (Robbins, 1994). Algunas especies son carnívoras mientras que otras se alimentan de hongos y líquenes (Chacón y Montero, 2007). 5.2.5.1 Subfamilia Riodininae El grupo de los riodíninos es muy diverso y algunas especies pueden confundirse con otras especies de las familias Notodontidae (Dioptinae), Arctiidae, Nymphalidae, Papilionidae, Pieridae y Lycaeninae. Con frecuencia, los Riodininae se posan con sus alas abiertas en el envés de las hojas, mientras que los Lycaeninae lo hacen con las alas hacia atrás (dejando ver la superficie ventral) y generalmente en la haz de las hojas (DeVries, 1994). En Costa Rica existen 263 especies de las 1 250 que hay en todo el mundo (Chacón y Montero, 2007). Los Riodininae tienen un amplio rango de distribución, pero su mayor diversidad (90%) se da exclusivamente en el neotrópico (Ackery et al. 1999 citado por Chacón y Montero, 2007). Aunque están presentes en la mayoría de hábitats, los riodíninos prefieren bosques de alturas intermedias (DeVries, 1994). Muchas de las especies presentes en Costa Rica se distribuyen en todo Centro América y hasta Colombia. Otras especies se han reportado exclusivamente en Costa Rica y Panamá, mientras que unas pocas son endémicas de Costa Rica. Los huevos pueden ser débilmente esculturados hasta muy ornamentados (Chacón y Montero, 2007). En algunas especies de Riodininae, las hembras ponen sus huevos cerca de los nidos de algunas especies de hormigas que habitan en galerías dentro de tallos de las plantas. Cuando emergen las larvas de las mariposas, las hormigas se las llevan para el interior de sus hormigueros, en donde también habitan unos homópteros que producen sustancias azucaras, de lo cual se alimentan las hormigas. Una vez dentro de los 111 hormigueros, las larvas de Riodininae se alimentan de los homópteros, y al igual que éstos (pero en mayor cantidad) producen sustancias ricas en aminoácidos y azúcares (Chacón y Montero, 2007). Las larvas de estas mariposas producen sonidos de muy bajo volumen o frecuencia, por medio de los cuales avisan a las hormigas que poseen sustancias azucaradas o que se encuentran en peligro. Las larvas de la mayoría de especies son muy peludas y tienen forma de huso. Sin embargo, hay especies que carecen de pelo y tienen estructuras en la cabeza como adaptaciones de las asociaciones con hormigas. Las especies en las que las larvas están asociadas a hormigas se alimentan generalmente de plantas con nectarios extraflorales como las del género Inga (Fabaceae) obteniendo líquidos de los nectarios a la vez que consumen tejido de las hojas (DeVries, 1994). Las larvas de la mayoría de especies se alimentan de las hojas de muchas especies de varias familias de plantas (polífagas). Algunas especies se alimentan de botones florales o de hojas muertas en el suelo, sin embargo, se desconocen las plantas hospederas para la mayoría de las especies de riodíninos. Las larvas pueden alimentarse en grupos o solitarias. Para ello enrollan las hojas o las esqueletizan. Pueden descansar en la misma o en otra planta hospedera (DeVries, 1994). Según Chacón y Montero (2007), los adultos de la mayoría de especies son de tamaño pequeño (9-35 mm) y tienen manchas y colores iridiscentes en sus alas. Las patas anteriores de los machos están reducidas a menos de la mitad del tamaño normal de las demás patas (Chacón y Montero, 2007) y tienen forma de cepillo como en la familia Nymphalidae. De manera que estas mariposas poseen sólo cuatro patas útiles para caminar (lo cual les diferencia de Lycaeninae) (DeVries, 1994). Los adultos pueden estar activos desde que amanece hasta que anochece. Los períodos de vuelo pueden ser muy restringidos dependiendo de la especie, de manera que algunos vuelan sólo durante una hora temprano en la mañana, otras lo hacen al medio día, mientras que algunas especies vuelan sólo cuando está oscureciendo. Se alimentan exclusivamente del néctar de flores. Algunas especies son miméticas con otros lepidópteros que tienen sabor desagradable, mientras que otras especies se camuflan muy bien en su medio. Es posible que las especies de este grupo son comestibles por algunos depredadores (DeVries, 1994). 112 Género Nymphidium Este género fue descrito en 1807 por Fabricius y está presente desde México hasta América del Sur, sin embargo la mayor cantidad y diversidad de las especies se encuentra en la cuenca del Amazonas. En el mundo se conocen alrededor de 30 especies de Nymphidium, de las cuales siete están presentes en Costa Rica, y tres de ellas son bastante raras. Callaghan (1985, 1986c, 1988, 1989; citado en DeVries, 1997) suministra información extra relacionada con este género. Las larvas de Nymphidium se alimentan exclusivamente de plantas de la familia Fabaceae, sobre todo del género Inga (“guabas”). DeVries (1994) presenta algunos registros de larvas alimentándose en plantas de las familias Convolvulaceae, Malpighiaceae, Sapindaceae, Passifloraceae, Lecythidaceae y Loranthaceae (DeVries, 1997). Las larvas de todas las especies tienen papillas vibratorias; sin embargo, algunas no producen sonidos porque tienen unas setas en el epicráneo que impiden el contacto de las papillas con la cabeza (DeVries, 1991). Aunque las larvas no poseen setas urticantes, tienen setas en el primer segmento del tórax. Las especies de Nymphidium son las únicas que presentan papillas vibratorias y que además tienen la habilidad de producir sonidos con los cuales llaman a las hormigas. Las larvas embeben néctar extra floral de los nectarios presentes en los retoños nuevos de Inga. Las pupas tienen forma cilíndrica, son de colores poco llamativos y se les puede encontrar en los bordes enrollados de las hojas (DeVries, 1997). Las especies de Nymphidium presentes en Costa Rica se pueden encontrar en diversos hábitats boscosos desde el nivel del mar hasta los 1 500 m. A veces ocurre una explosión masiva en el número de individuos de una población, lo cual sucede periódicamente y en sitios o localidades muy específicas. El vuelo es débil y oscilante, las alas anteriores son ligeramente alargadas y tienen una banda blanca o amarilla en ellas. No existe dimorfismo sexual y las antenas son largas, lo cual permite distinguir las especies de Nymphidium de otras especies similares de los géneros Synargis, Juditha, Pixus y Pseudonymphidia (DeVries, 1997). 113 Especie 17: Nymphidium ascolia ascolia En parte de la literatura, N. ascolia aparece como Cachrus ascolides, una combinación de una especie diferente (Cachrus) y un sinónimo (ascolides) (DeVries, 1997). Ciclo biológico: Larva: 17 días (n = 6) Prepupa: dos días (n = 4) Pupa: 16 días (n = 4) Figura 21. Fases del ciclo biológico de N. ascolia: a) Larva en cuarto estadio vista dorsal en una relación de mutualismo con hormigas de la especie Pheidole biolleyi. b) Larva cuarto estadio vista dorsal. c) Pupa. d) Adulto. Fotografías: Róger González y Roberto Delgado. Planta hospedera: De las cuatro larvas criadas en la EBA, dos se alimentaron en Inga oerstediana, una en I. longispica y una en Senna papillosa. DeVries (1997), menciona que con frecuencia las larvas embeben de los nectarios extra florales y que cuando no se alimentan, enrollan las hojas hacia los bordes y se esconden dentro. Por su parte, los adultos de ambos sexos visitan las flores de Lantana camara, Cordia sp., Psychotria sp., Croton sp. y varias especies herbáceas de la familia Asteraceae (DeVries, 1997). Distribución: Las seis larvas criadas en Altamira se recolectaron en los Senderos Cerro Biolley, Límite-Río Platanillal y Casa Coca, en un ámbito altitudinal de 1 400 a 1 600 m. También se ha recolectado en la Vertiente Caribe entre los 0-200 m en el Caribe Norte y Cuenca Tortuguero-Sierpe (RVS Barra del Colorado). En la Vertiente del Pacífico de los 0 1 600 m en la Cuenca del Tárcoles (PN Carara), Cuenca del Tempisque (PN Santa Rosa) 114 Península de Osa (PN Corcovado, PN Piedras Blancas, RVS Golfito) y Cuenca del TérrabaSierpe (INBio, 2007). Según DeVries (1997) esta especie se encuentra en la mayoría de hábitats del bosque húmedo en ambas vertientes, desde del nivel del mar a los 1 400 m. DeVries encontró que esta especie era muy común en los alrededores de la Península de Osa. Godman y Salvin (1886; citados por DeVries 1997) mencionan haber recolectado una gran cantidad de individuos en Nicaragua y Panamá, pero no reportaron ningún espécimen proveniente de Costa Rica. Podría ser que ellos no visitaron nuestro país o que la abundancia y/o rango de distribución de N. ascolia ha aumentado debido a la extensa deforestación en los últimos años (DeVries, 1997). DeVries (1997) afirma que esta especie se distribuye desde Guatemala a Brasil y Bolivia. Sin embargo, la subespecie (N. ascolia ascolia) no está presente en Bolivia. Este mismo autor menciona que recolectó esta especie en las siguientes localidades y fechas: “Alajuela: San Mateo (octubre), Atenas (febrero-abril, agosto, setiembre); San José: El Rodeo (julio, agosto), Desamparados (setiembre), Desamparaditos (setiembre). Heredia: Chilamate (setiembre), La Selva (abril). Puntarenas: Carara (mayo), Piedras Blancas (junio), Sirena (febrero, abril, julio), Quepos (enero, febrero, julio), Monte Verde (setiembre), San Vito (abriljunio, setiembre-noviembre), Las Alturas (setiembre, diciembre), Parrita (diciembre), Rincón de Osa (febrero), Río Catarata (setiembre), Cacao de Río (setiembre), Chacarita (setiembre), Abangares. Limón: Bananito (abril, setiembre) y Tortuguero (julio)”. 5.2.6 Familia Notodontidae Se conocen más de 2 800 especies de notodóntidos, las cuales están presentes en todo el mundo (Kitching y Rawlins, 1999; citados por Chacón y Montero 2007). En Costa Rica se han reportado alrededor de 500 especies (Miller et al.1997 citados por Chacón y Montero, 2007). La mayoría de especies de Notodontidae tienen ámbitos de distribución bastante amplios. En Costa Rica, Hemiceras es el género que agrupa el mayor número de especies. Están presentes en todas las elevaciones y hábitats del país. Sin embargo, la mayor cantidad de especies se encuentra en las áreas con elevaciones baja y media, tanto en bosque lluvioso como en bosque seco (Janzen, 1994). 115 Las larvas tienen diversas formas. Algunas son verdes y semejan hojas u otras estructuras de las plantas hospederas. Algunas especies tienen bandas de colores y se alimentan en grupos. La pupación ocurre generalmente en una cámara o celda en el suelo, pero algunas especies construyen capullos sueltos en la tierra (Covell, 1984). En la mayoría de especies, las larvas son de color verde, poseen una cola o proyección caudal, son peludas y se alimentan sólo durante la noche. Este último aspecto quizás favorezca el hecho de que sean poco atacadas por parasitoides. Las larvas de algunas especies tienen ojos falsos u otras características que causan confusión en sus posibles enemigos. Sin embargo, larvas y adultos tienen sabor agradable para la mayoría de sus depredadores, pues en la mayoría de especies, las larvas se alimentan de sólo una o de muy pocas especies de plantas (monófagas u oligófagas) cuyas hojas poseen altos contenidos de taninos y otros inhibidores de digestión y que son poco tóxicos (Janzen, 1994). Las larvas de algunas especies tienen la capacidad de rociar ácido fórmico y cetonas contra sus enemigos, por medio de la glándula cervical o adenosma (Scoble, 1992a). Otro método de defensa que tienen algunas especies es que son crípticas, es decir, se parecen mucho al sustrato en donde se encuentran, camuflándose perfectamente con la corteza de los árboles, hojas, musgo o líquenes. Algunas especies muestran colores bastante atractivos. Las larvas de los notodóntidos son fitófagas, es decir, que se alimentan exclusivamente de las hojas de hierbas, arbustos y árboles (Chacón y Montero, 2007). Durante los primeros estadios larvales, se alimentan de toda la hoja excepto de las venas, por lo cual se dice que son larvas esqueletizadoras. En los estadios larvales más maduros, las larvas consumen casi toda la hoja, dejando sólo las venas más grandes (Godfrey y Appleby, 1987; citados por Chacón y Montero, 2007). Los adultos de unas pocas especies son de tamaño pequeño, pero la mayoría son medianas ó grandes (longitud del ala anterior de 13-48 mm). En algunas especies la probóscide está bien desarrollada, mientras que en otras puede estar reducida o ausente. Los machos de la mayoría de especies tienen las antenas bipectinadas, mientras que en las hembras son simples o débilmente bipectinadas (Chacón y Montero, 2007). La mayoría de los notodóntidos son de colores y patrones oscuros y crípticos (café, gris, negro, beige, verde y veteado) (Janzen, 1994). Sus cuerpos son muy peludos y pesados. Los machos son más pequeños que las hembras, pero en ambos sexos el cuerpo es robusto. 116 Las alas anteriores son un poco elongadas. En la mayoría de especies, las alas están sostenidas en forma de techo o enrolladas, de manera que aparentan ser ramitas (Covell, 1984). Con frecuencia los Notodontidae llegan a las luces de casas, edificios y trampas para insectos, pues vuelan específicamente durante la noche. Los adultos de todas las especies son muy estacionales y aparentemente no migran (Janzen, 1994). Algunas especies visitan flores para absorber néctar, otras especies buscan otras fuentes de alimento tales como jugos, saliva y sangre. Los adultos de algunas especies no se alimentan, su único fin es reproducirse, por lo que su periodo de vida es de unos pocos días (Janzen, 1994). La única diferencia entre los machos y las hembras es que éstas son más pesadas y tienen las alas un poco mas anchas. Los huevos son de color verde y son ovipositados en la superficie de las hojas en grupos o solitarios (Janzen, 1994). 5.2.6.1 Subfamilia Dioptinae Aunque son mariposas nocturnas, sus hábitos son diurnos. Tienen el cuerpo muy delicado y colores vistosos. Las larvas de muchas especies tienen colores muy contrastantes y llamativos como el amarillo, negro, rojo y naranja (Chacón y Montero, 2007). Especie 18: Lirimiris fascis Ciclo biológico: Larva: 15 días (n = 4) Prepupa: tres días (n = 4) Pupa: 46 días (n = 4) Planta hospedera: De las cuatro larvas criadas en la EBA, dos se alimentaron en Mortoniodendron abelianum y dos en Malvaviscus arboreus. En el ACG, Janzen y Hallwachs (2005) reportan las especies Malvaviscus arboreus, M. palmanus y Mortoniodendron guatemalense. 117 Figura 22. Fases del ciclo biológico de L. fascis: a) Larva en cuarto estadio vista dorsal. b) Larva quinto estadio larval c) Adulto. d) Prepupa e) Pupa. Fotografías: Róger González y Didier Rubí. Distribución: En Altamira, esta especie se recolectó en los senderos Cerro Biolley-Cerro Tonduz y Sendero Gigantes del Bosque, en un ámbito altitudinal de 1 400-1 800 m. También según la base de datos ATTA (INBio, 2007) se le encuentra en la Vertiente Caribe entre 0100 m en Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Sarapiquí (PN Braulio Carrillo y ZP La Selva), Cuenca del San Carlos (RB Alberto Manuel Brenes y ZP Arenal-Monteverde), Cuenca del Reventazón (PN Tapantí-Macizo de La Muerte y MN Guayabo), Cuenca del Matina, Cuenca del Pizote (CB Guanacaste-Rincón de la Vieja), Cuenca del Sapoá (PN Guanacaste), Volcán Orosí (PN Guanacaste), Cuenca del Río Frío (PN Volcán Tenorio). En la Vertiente del Pacífico entre 900-1 900 m, en la Cuenca del Tempisque (PN Guanacaste, PN Rincón de la Vieja y ZP Miravalles), Cuenca Térraba-Sierpe (PILA y ZP Las Tablas) y Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde). Parasitoides: En el ACG, Janzen y Hallwachs (2005) reportan la especie Enicospilus simoni (Ichneumonidae: Hymenoptera). 118 Especie 19: Polypoetes villia Ciclo biológico: Larva: ocho días (n = 3) Prepupa: Un día (n = 3) Pupa: 13 días (n = 1) Figura 23. Fases del ciclo biológico de P. villia: a) Larva en cuarto estadio vista dorsal. b) Larva en quinto estadio vista lateral. c) Pupa d) Adulto. Fotografías: Róger González. Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Malvaviscus arboreus. Distribución: Esta especie se recolectó en Altamira únicamente en el Sendero Gigantes del Bosque, a una altitud de 1 400-1 500 m. Según la base de datos ATTA (INBio, 2007), esta especie también se encuentra en la Vertiente Caribe entre 1 000-2 100 m, en la Cuenca del Matina (PN Barbilla, RF Río Pacuare), Cuenca del San Carlos (RB Alberto Manuel Brenes, PN Arenal y ZP Tenorio), Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte y MN Guayabo), Cuenca del Pizote y Volcán Orosí (PN Guanacaste), Cuenca del Sarapiquí (PN Braulio Carrillo y RVS Jaguarandi), Cuenca del Zapote y Cuenca del Río Frío (PN Volcán Tenorio). En la Vertiente del Pacífico se encuentra entre 1 000 y 2 800 m, en Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde), Cuenca del Térraba-Sierpe (PILA y ZP Las Tablas), Cuenca del Tárcoles (RVS Jaguarandi) y Cuenca del Tempisque (PN Guanacaste). 119 5.2.7 Familia Nymphalidae Aparte de los licaénidos, este grupo de mariposas reúne la mayor cantidad de especies, la mayor diversidad de plantas hospederas y una enorme variedad de formas larvales (DeVries, 1987). Esta familia incluye la tercera parte todas las especies de mariposas diurnas y se les encuentran en todo el mundo, excepto en la Antártica y el Ártico. En Costa Rica se han reportado 460 especies de las aproximadamente 6 000 que existen en el mundo (Ackery et al. citado por Chacón y Montero, 2007). La mayor diversidad de estos lepidópteros está en el Neotrópico (Chacón y Montero, 2007). La filogenia de los ninfálidos se desconoce casi por completo, por lo que el número de subfamilias puede variar dependiendo de la autoridad o publicación que se consulte. Ehrlich (1958b; citado por DeVries, 1987) reconoce ocho subfamilias, Clark (1949; citado por DeVries, 1987) reconoce 25 y DeVries (1987) reconoce 20. Estos números pueden cambiar cuando la familia Nymphalidae sea estudiada con mayor detalle (DeVries, 1987). Los huevos son de forma esférica, cónicos o de barril y son ovipositados en grupos o solitarios. Las larvas de algunas especies pueden ser jorobadas, otras pueden tener espinas o filamentos carnosos y muchas setas secundarias. Se les puede encontrar solas o en grupos, dentro de refugios que construyen uniendo con seda las hojas de las plantas hospederas, las cuales pueden ser especies de una gran variedad de familias (Chacón y Montero, 2007). Los adultos de estas mariposas diurnas son de tamaño variable (la longitud del ala anterior va desde 12-91 mm) e incluye especies que van desde tamaños pequeños hasta grandes. Igualmente, la coloración y los patrones de las alas son muy variables. Aunque existe una gran diversidad y variedad en formas y tamaños, los adultos de Nymphalidae se caracterizan porque poseen sólo cuatro patas hábiles para caminar. Según Chacón y Montero (2007) sólo las hembras de la subfamilia Libytheinae las utilizan para caminar. Las otras dos patas (anteriores) están muy reducidas (tanto que en algunas especies parecen plumas), de lo cual se deriva su nombre común “mariposas que se cepillan con las patas” (DeVries, 1987) o “mariposas patas de brocha” (Chacón y Montero, 2007). Estos mismos autores exponen que los machos tienen escamas en forma de pelo con las que las patas se unen al tórax. Las patas anteriores de los machos no son sensoriales, sin 120 embargo, las hembras adultas las utilizan para dar golpes y rasgar (mediante una percusión) las hojas o sitios potenciales en donde depositarán sus huevos. Luego las frotan contra sus antenas, transmitiendo olores y sabores de sustancias químicas presentes en la posible planta hospedera, las cuales andan buscando o que más bien pretenden evitar para que se alimenten sus crías. 5.2.7.1 Subfamilia Charaxinae Incluye una gran cantidad de especies presentes en todos los trópicos (donde se da el mayor número de especies, especialmente en la cuenca del Amazonas) y unas pocas en las regiones templadas (DeVries, 1987) como Norte América, Europa, China y el sur de Australia. De las 400 especies conocidas en todo el mundo, 53 se han reportado en Costa Rica (Chacón y Montero, 2007). Aunque se conoce muy bien la taxonomía de este grupo, la filogenia y biología especialmente de las especies Neotropicales son pobremente conocidas. Según DeVries (1987) la mayor referencia sistemática para el Neotrópico la presentan Fruhstorfer (1916); Stichel (1961); Comstock (1961) y Rydon (1971). Las especies de Charaxinae reportadas en Costa Rica están presentes en hábitats con un ámbito altitudinal que va desde 0 hasta 2 000 m, pero el mayor número de especies se da en bosques con elevaciones intermedias entre 500-800 m. La mayoría de especies se distribuyen ampliamente en todo el territorio costarricense y hasta América del Sur, sin embargo, existen especies raras y poco comunes en las colecciones, ya que pocas veces se observan en el campo. Es probable que algunas especies se encuentren únicamente en la Cordillera de Talamanca (DeVries, 1987). Los huevos tienen pequeñas espinas en los extremos, los cuales son chatos pero en general, son lisos y de forma globular. Las larvas se alimentan de varias especies de plantas pertenecientes a una gran diversidad de familias. Durante los primeros estadios larvales, las larvas consumen casi toda la superficie de la hoja, excepto la nervadura principal, en donde descansan y forman cadenas. Los demás estadios se desarrollan libremente, excepto algunas especies no Neotropicales, las cuales son gregarias (DeVries, 1987). Durante los dos últimos estadios larvales, se esconden dentro de hojas (de la planta hospedera) que enrollan uniendo sus bordes con seda (Chacón y Montero, 2007). 121 Las larvas carecen de espinas en el cuerpo, tienen cola bífida y presentan cuernos cefálicos, lo cual también ocurre en las larvas de las subfamilias Apaturinae y especialmente en Satyrinae, con los cuales están estrechamente relacionados (DeVries et al. 1985; citado por DeVries, 1987). En la mayor parte de los géneros, las pupas son de forma globosa y semejan cápsulas; sin embargo, las pupas de algunas especies son ovoides. Se supone que los depredadores de los charáxinos encuentran un sabor agradable en todas las especies (DeVries, 1987). Los adultos tienen el cuerpo robusto, palpos largos o cortos y probóscide robusta. Se alimentan de frutos en descomposición, hongos, carroña y estiércol, pero nunca del néctar de las flores. Las coloraciones pueden variar entre opaco a brillante en el dorso. En la parte ventral, tienen coloraciones crípticas que asemejan hojas muertas o madera. Algunas especies del viejo mundo (géneros Charaxes y Euxanthe) poseen un borde dentado bien desarrollado en las alas anteriores. Tales estructuras constituyen un mecanismo de defensa ante sus depredadores, a la vez que se usan en las interacciones entre los machos (DeVries, 1987). Los adultos de la mayoría de especies habitan en el dosel del bosque, por lo cual es difícil observarles. Además, los charáxinos tienen un vuelo muy ágil y rápido, por lo que es difícil recolectarlos mientras vuelan. Sin embargo, luego que un individuo se alimenta de frutas fermentadas, parece dócil y es más fácil recolectarlo. Esto sucede porque al alimentarse el abdomen se estira mucho, y la mariposa puede tener dificultades para volar. De esta manera se puede recolectar incluso manualmente (DeVries, 1987). Especie 20: Memphis beatrix Ciclo biológico: Larva: 17 días a partir del segundo estadio (n = 2) Prepupa: dos días (n = 2) Pupa: 25 días (n = 2) Planta hospedera: Las dos larvas recolectadas en la EBA se alimentaron de Piper arboreum. En el ACG, Janzen y Hallwachs (2005) reportan las especies Piper aduncum, P. arboreum, P. cenocladum, P. fimbriulatum, P. flavidum, P. guanacostense, P. jacquemontianum y P. psilorhachis. DeVries (1987) reporta una especie no identificada de 122 Piper. No se han reportado los hábitos alimenticios de los adultos de esta especie en Altamira, sin embargo, Chacón (2002a) menciona que visitan cebos de frutas colocadas en el dosel, mientras que DeVries (1987) expone que estos lepidópteros se pueden atraer fácilmente con bananos o plátanos en estado de descomposición (fermentación). Figura 24. Fases del ciclo biológico de M. beatrix: a) Larva en tercer estadio vista lateral (arriba), larva en tercer estadio vista dorsal (abajo). b) Pupa vista frontal. c) Pupa vista dorsal. d) Larva en cuarto estadio e) Adulto ♀. Fotografías: Róger González y Roberto Delgado. Distribución: De Costa Rica a Panamá. Chacón (2002a) menciona que en Costa Rica se encuentra de los 700 a 1 500 m en ambas faldas de la Cordillera de Talamanca, falda este de la Cordillera Volcánica Central y la Fila Costeña en bordes de bosques, claros, dosel y subdosel. En la colección del INBio (INBio, 2007) se encuentran registrados sólo seis especímenes provenientes del PILA a 1 600 m. En el PILA sector Altamira, M. beatrix se recolectó en los senderos Casa Coca a 1 700 m y en el sendero Cerro Biolley-Cerro Tonduz a 1 800 m en bosque secundario y bosque primario respectivamente. DeVries (1987) menciona que M. beatrix es una especie característica del bosque montano y que se distribuye a lo largo de Costa Rica en un ámbito altitudinal de 700-1 600 m. 123 5.2.7.2 Subfamilia Ithomiinae Esta subfamilia es tan diversa que algunos investigadores (Fox, 1956; citado por DeVries, 1987) la consideran un grupo separado de Nymphalidae. Los Ithomiinae tienen una estrecha relación con las mariposas de la subfamilia Danainae, pues tanto la morfología de las larvas como de los adultos son similares (Arkery y Vane-Wright, 1984; citados por DeVries, 1987). En Costa Rica se han reportado 64 especies de las 300 que habitan en todo el mundo, agrupadas en 50 géneros (Ackery et al. 1999 citados por Chacón y Montero, 2007). Los huevos son ribeteados y en forma de barril (Chacón y Montero, 2007). Las hembras de algunas especies ponen sus huevos alrededor de los huecos de las hojas hechos por otras larvas (DeVries, 1987). Éstas no poseen setas, algunas tienen proyecciones laterales que nacen cerca del vientre y otras poseen filamentos carnosos y móviles que nacen en el tórax cerca de la cabeza (similar a los Danainae). Generalmente son verdes y opacas, sin embargo, en algunas especies son de colores atractivos. Aunque existen muchas formas de pupas, la mayoría semejan gotas de agua, pues tienen coloraciones reflectivas entre plateado y dorado, lo cual también se da en los Danainae (DeVries, 1987). La longitud del ala anterior en los adultos es de 19-49 mm. Éstos tienen escamas en las antenas (Chacón y Montero, 2007) con una ligera masa en el ápice, los ojos son pequeños y el abdomen es largo y delgado. La mayoría de especies presentes en Centroamérica tienen las alas transparentes, con una coloración ámbar translúcido. Las especies presentes en Costa Rica tienen se caracterizan por tener un vuelo oscilante (DeVries, 1987). Algunas especies de Ithomiinae se pueden confundir con miembros de los géneros Heliconius, Lycorea o Dismorphia. La venación de las alas posteriores ayuda a distinguir a nivel de géneros, los especímenes se pueden identificar mediante las características e ilustraciones descritas por DeVries en su primer volumen del libro Mariposas de Costa Rica (DeVries, 1987). Los machos de la subfamilia Ithomiinae poseen escamas androconiales que utilizan para atraer a las hembras y copularlas. Tales estructuras son alargadas, parecen pelos y en están en el costado de sus alas posteriores. Generalmente, estos cortejos ocurren en áreas boscosas, cerca de las quebradas (DeVries, 1987). 124 Una asamblea de Ithomiinae se puede constituir de varias especies y géneros. Harber (1978; citado por DeVries 1987) demostró que varios machos posados en el follaje exponen sus pelos androconiales y segregan una feromona, con lo cual inicia la asamblea. Un macho puede atraer varios machos y hembras tanto de su especie como de otras incluso de otros géneros. Los individuos de diferentes especies segregan sus feromonas que atraen aún más individuos, y en unos pocos días, la asamblea puede estar conformada por individuos de diferentes especies. La cantidad de especies que se pueden hallar en una asamblea es proporcional al tiempo que éste tiene de darse en un área determinada. De manera que existe un mayor número de especies en los sitios donde ha habido una asamblea durante más cantidad de tiempo (Haber, 1978 y Gilbert, 1969a; citados por DeVries, 1987). Según Bates (1862) y Müller (1879); citados por DeVries (1987), los Ithomiinae representan los modelos más importantes de imitación o mimetismo que pueden darse en todas las especies de mariposas del Neotrópico. Es posible que los naturalistas del siglo pasado conocieran muy poco de la química ecológica, pero sabían que los Ithomiinae tenían un método de defensa bastante efectivo: un sabor desagradable al paladar de sus depredadores. Tal conocimiento llevó al desarrollo de la teoría del mimetismo (Bates 1862 y Müller 1879; citados por DeVries, 1987). Tales propiedades defensivas se atribuían a que las larvas de todas las especies se alimentan de Solanaceae, una familia de plantas que posee una gran variedad de químicos venenosos. Sin embargo, Brown (1984) citado por DeVries (1987), demostró que el alcaloide Pirrolizidina es el que les confiere el sabor desagradable y no está presente en las solanáceas. Tal sustancia la adquiere el macho adulto tras alimentarse de néctar en las flores de plantas de Heliotropium, Tournefourtia y Myosotis (Boraginaceae) y Eupatorium, Neomirandia y Senecio (Asteraceae). Estas plantas se pueden dejar en descomposición durante algunos días, al final de lo cual se puede encontrar una cantidad representativa de las especies de Ithomiinae que hay en la zona (DeVries, 1987). La razón por la que los machos buscan la pirrolizidina es porque a partir de dicho alcaloide se derivan las feromonas usadas durante el apareamiento. Además, es posible que esta sustancia les brinde un sabor desagradable ante el paladar de sus predadores. Durante el cortejo, las hembras escogen el macho que tenga la mayor cantidad de pirrolizidina, puesto que dicho alcaloide les será trasmitido por el macho mediante el espermatóforo (DeVries, 125 1987). Boppré (1984) y Edgar (1984); citados por DeVries, (1987) ofrecen un resumen con los usos del alcaloide pirrolizidina para la defensa y la cópula. Las larvas de algunas especies se alimentan de plantas de las familias Gesneriaceae y Rutaceae (Chacón y Montero, 2007). Sin embargo, la mayoría de especies se alimentan de plantas de la familia Solanaceae y unas pocas de Apocinaceae. Aunque Haber (1978) y DeVries (1985a); citados por DeVries, (1987) tienen una gran cantidad de registros de plantas hospederas, no existe una descripción detallada de los estadios inmaduros de la gran mayoría de especies que hay en Costa Rica. Las larvas se alimentan en forma individual o gregaria, dependiendo de la especie. Algunas especies consumen la totalidad de la planta, mientras que otras sólo hacen hoyos en el tejido de las hojas (DeVries, 1987). Los adultos se alimentan del néctar de las flores de algunas plantas. Además, las hembras de algunas especies se alimentan de deyecciones frescas de aves insectívoras, como un complemento rico en aminoácidos. Por ejemplo, algunas especies de Melinaea, visitan deyecciones de los pájaros formicáridos, que están asociados a las hormigas arrieras. Posiblemente, esto permite a las hembras obtener una rica fuente de nitrógeno para sus huevos (Ray y Andrews, 1980; citados por DeVries, 1987). Los Ithomiinae están distribuidos en el Neotrópico, desde México hasta Sur América, sin embargo, la mayor diversidad de especies se encuentra en la vertiente oriental de los Andes. Aunque las especies registradas en Costa Rica se pueden encontrar en todos los hábitats, la mayor diversidad se encuentra en los bosques con elevaciones medias (600 y 1 500 m). Muy pocas especies habitan áreas abiertas, es más común encontrarlas en bosques densos, en donde (debido a sus alas transparentes) se observan con un vuelo fantasmal (DeVries, 1987). La mayoría de especies que hay en Costa Rica tienen migraciones altitudinales, las cuales se activan con los cambios estacionales ocasionados por las lluvias locales. Es por esto que casi el 80% de las especies de Ithomiinae de Costa Rica se puede encontrar en las áreas rurales cercanas a San José. Es muy difícil delimitar el hábitat que tiene cada especie en particular, pues ellas están en constante movimiento (DeVries, 1987). 126 Especie 21: Pteronymia picta notilla Ciclo biológico: Huevo: seis días (n = 97) Larva: 16 días: cinco días en primer estadio, cinco días en segundo estadio y seis días en tercer estadio (n = 67) Prepupa: dos días (n = 42) Pupa: nueve días (n = 35) Figura 25. Fases del ciclo biológico de P. picta notilla: a) Huevos b) Larvas segundo estadio. c) Larvas tercer estadio. d) Pupas e) Adulto. Fotografías: Róger González. Descripción general: Estadios inmaduros: los huevos son ovipositados individualmente y son de color blanco. La cápsula cefálica de las larvas maduras es de color negro brillante, el dorso es negro y con una raya blanca central a lo largo de todo el cuerpo. Las pupas tienen el abdomen comprimido y son de color metálico brillante. Los adultos tienen un marcado dimorfismo sexual. La longitud del ala anterior es de 23-27 mm (DeVries, 1987). Planta hospedera: Todas las larvas criadas en la EBA se alimentaron de Cestrum megalophyllum. En el ACG, Janzen y Hallwachs (2005) reportan las especies Solanum arboreum y S. rovirosanum. Otros autores reportan las especies S. brenesii (Chacón, 2002b y DeVries, 1987) y S. arboreum (DeVries, 1987). 127 Se han observado adultos de P. picta notilla obteniendo sales minerales en deyecciones de aves y excrementos de algunos mamíferos. También se observó adultos de esta especie visitando flores de Melanthera aspera de donde obtienen néctar. Chacón (2002b) reporta el adulto visitando plantas de los géneros Eupatorium e Inga. Según DeVries (1987), los adultos de ambos sexos visitan flores de varias especies de Asteraceae y de Inga (Fabaceae). Distribución: En Altamira, P. picta notilla se recolectó en áreas abiertas sobre los bordes del bosque primario y secundario, en los senderos Gigantes del Bosque, Cerro Biolley, Toma del Agua y Sendero a Casa Coca, a una altitud de 1 500 -1 700 m. También se le conoce en la Vertiente Caribe entre 500-1 200 m en Volcán Orosí (PN Guanacaste), Cuenca del Pizote (CB Guanacaste-Rincón de la Vieja) y Cuenca del Río Frío (PN Volcán Tenorio). En la Vertiente Pacífica se encuentra entre 800-1 600 m en la Cuenca Térraba-Sierpe (ZP Las Tablas), Cuenca del Tempisque (PN Rincón de la Vieja y ZP Miravalles) (INBio, 2007). Según DeVries (1987), esta especie se distribuye desde Colombia hasta Costa Rica, en donde se le puede encontrar en un ámbito altitudinal de 800 a 2 000 m en ambas vertientes y en asociación con todos los hábitats del bosque. Parasitoides: El único parasitoide obtenido es un Tachinidae de un género nuevo cercano a Myiopharus (Wood, com. pers.). Este díptero ataca los últimos estadios larvales de P. picta notilla en donde deposita sus huevos. La larva del Tachinidae emerge de la crisálida para pupar fuera de ésta y tarda cerca de 20 días para emerger el adulto. Figura 26. Díptero parasitoide cf. Myiopharus (Tachinidae) de P. picta notilla. a) Pupario de Myiopharus sp. formado fuera de la pupa del lepidóptero. b) Adulto de Myiopharus sp. Fotografías: Róger González. 128 5.2.7.3 Subfamilia Morphinae (Tribu Morphini y Tribu Brassolini) Esta subfamilia se compone de 40 géneros representados por 230 especies de las cuales 34 se encuentran en Costa Rica. El ala anterior de los adultos tiene una longitud que oscila entre 29-91 mm (Chacón y Montero, 2007). Las hembras de algunas especies presentes en Sur América depositan sus huevos en grupos, pero generalmente son depositados en forma individual. Los huevos son de forma hemisférica, lisos o esculpidos. Las larvas son muy coloridas e hirsutas y poseen una cola bífida en el último segmento abdominal (DeVries, 1987). Las larvas de la tribu Brassolini se defienden de sus depredadores con ácido fórmico el cual tiene un olor muy desagradable y que secretan por medio de una glándula eversible en el primer segmento torácico (Hallberg y Poppy, 2003; citados por Chacón y Montero, 2007). Existe una gran diversidad en las formas de las pupas: ovoides, elongadas y angulares, pero siempre son colgantes (DeVries, 1987). Los adultos de algunas especies están entre las mariposas más espectaculares de todos los lepidópteros. Los machos poseen mechones androconiales bien desarrollados en las alas y en los costados del abdomen. Algunas de las especies de Caligo se entrecruzan libremente, creando llamativos híbridos en los insectarios (DeVries, 1987). Este mismo autor, menciona haber mantenido en cautiverio (insectario) Caligo memmon y C. brasiliensis durante un período de cinco a 12 semanas, sin embargo, no existen datos de longevidad de los adultos en su hábitat natural. Algunas especies emiten un olor a vainilla u otras fragancias dulces mientras están con vida (DeVries, 1987). Se desconoce si los brasólinos tienen sabor desagradable ante sus depredadores. Sus mecanismos de defensa consisten en un vuelo rápido durante el alba o el crepúsculo, así como una coloración mimética en la parte ventral de sus alas, en donde poseen una mancha en forma de roseta y similar al ojo de un búho. Además, algunas especies vuelan en la parte baja de los bosques primarios (sotobosque), en donde hay poca luz, lo cual sugiere que algunas especies pueden estar activas incluso durante la noche (DeVries, 1987). El único caso de foresia que se conoce en mariposas, corresponde a un estudio (Malo, 1961 citado por DeVries, 1987) el cual demostró que los parasitoides (Hymenoptera: Trichogrammatidae) parasitan los huevos de Caligo cuando éstos son ovipositados. Los parasitoides adultos se cuelgan en los márgenes de las alas de las mariposas de ambos 129 sexos y se transfieren a las hembras durante la cópula. Malo y Willis (1961); citados por DeVries (1987), mencionan que en Ecuador existen ocho especies de parasitoides cuyos hospederos son estadios inmaduros de especies de Caligo que son plagas en plantaciones de banano. Las larvas se alimentan de varias especies de plantas de las familias Arecaceae, Poaceae, Fabaceae, Menispermaceae, Mimosaceae y Sapindaceae (DeVries, 1987). Chacón y Montero (2007) mencionan otras familias de plantas hospederas como Capparidaceae, Dichapetalaceae, Malpighiaceae, Bromeliaceae, Heliconiaceae, Musaceae, Smilacaceae, Cannaceae, Zingiberaceae y Ochnaceae. Las especies de Opsiphanes y Caligo son plagas en plantaciones de palma africana y banano (Chacón y Montero, 2007). Harrison (1962); citado por DeVries (1987) menciona que según estudios económicos de cultivos agrícolas, si las bananeras se fumigan poco o nada, la población de larvas de Caligo disminuye por acción de sus enemigos naturales, los parasitoides. En cambio, si las cosechas se fumigan en forma constante, los parasitoides naturales mueren y las larvas de Caligo que sobreviven causan considerables daños en la plantación de banano. Chacón y Montero (2007) señalan que los adultos se alimentan de jugos de frutos en descomposición y de secreciones fermentadas de cortezas y bejucos, hongos y carroña pero (según DeVries, 1987) nunca del néctar de las flores. Aunque los adultos se alimentan de frutos en descomposición, existen especies raras que nunca han llegado a las trampas de frutas. DeVries (1987) menciona que en algunas épocas del año y en la mayoría de especies de Caligo y de Morpho se han encontrado ácaros en la base de la probóscide de las mariposas. Sin embargo, se desconoce si tales ácaros tienen algún efecto en las mariposas. Los Morphinae son mariposas Neotropicales presentes en los trópicos de IndoAustralia (Amathusiini) y América (Brassolini y Morphini en México, Centro y Sur América), pero ausentes en el África Tropical (Chacón y Montero, 2007). La mayor diversidad de especies se encuentra en la cuenca del Amazonas (DeVries, 1987). Aunque algunas especies de mórfinos se pueden hallar en las altas montañas de los Andes o en áreas extremadamente secas de México, la mayoría de especies se encuentran en bosques de tierras bajas. La biología de los Morphinae es poco conocida, aunque están entre las mariposas más 130 buscadas debido a su belleza, su uso en el comercio y el espectacular vuelo lento de los machos de algunas especies (DeVries, 1987). Especie 22: Caligo brasiliensis sulanus Ciclo biológico: Larva: 34 días (n = 3) Prepupa: 3 días (n = 3) Pupa: 38 días (n = 2) Figura 27. Fases del ciclo biológico de C. brasiliensis sulanus: a) Larva cuarto estadio: detalle de cabeza. b) Larva quinto estadio (arriba). c) Prepupa (abajo). d) Pupa. e) Adulto vista ventral. f) Adulto vista dorsal. Fotografías: Róger González. Planta hospedera: Las tres larvas criadas en la EBA se alimentaron en Heliconia tortuosa. DeVries (1987) menciona que las larvas se alimentan de algunas especies de Heliconia (Heliconiaceae), Calathea (Marantaceae) y Musa (Musaceae), por lo que pueden ser una plaga en plantaciones de banano. Chacón (2001a) menciona que las hembras ovipositan en la haz, envés y tallos de varias especies de Heliconia y Musa. No se han observado adultos alimentándose en su estado natural, sin embargo, en Altamira se capturaron algunos adultos en trampas de frutas, alimentándose de los jugos de frutos en descomposición (banano y papaya). 131 Distribución: En Altamira se le ha encontrado en bosque secundario a orillas del Sendero Gigantes del Bosque, a 1 400 m. La especie C. brasiliensis se encuentra distribuida desde Guatemala hasta el Amazonas. Según DeVries (1987), la subespecie C. brasiliensis sulanus se distribuye desde Guatemala hasta Panamá. Chacón (2001a), menciona que esta subespecie está presente desde los 0 a 1 500 m en ambas vertientes de las Cordillera de Talamanca, falda este de las cordilleras Volcánica Central, Tilarán y Guanacaste, llanuras de Sarapiquí, tierras bajas del Caribe, Pacífico Central, Fila Costeña y Península de Osa. Se le ha observado en bordes de bosque, senderos dentro del bosque, trochas madereras y bosques secundarios viejos (Chacón, 2001a); siempre asociada con hábitats del bosque húmedo (DeVries, 1987). Parasitoides: Hasta el momento, en Altamira no se han asociado parasitoides a esta especie de mariposa. En el ACG, Janzen y Hallwachs (2005) reportan las especies de Diptera Leptostylum auratum (Tachinidae) y Peckia volucris (Sarcophagidae) así como los Hymenoptera Hyposoter sp. (Ichneumonidae) y Cotesia sp. (Braconidae). Solís (2007) menciona las especies de Hymenoptera Platyplectrus sp. (Eulophidae) y Anastatus sp. (Eupelmidae) como endoparasitoides idiobiontes en huevos de esta mariposa. Especie 23: Opsiphanes bogotanus alajuela La especie O. bogotanus fue descrita por Distant, 1875 (DeVries, 1987). Ciclo biológico: Larva: 24 días (n = 6). Las larvas fueron recolectadas por lo general entre el primer y tercer estadio larval. Las larvas de varias especies de la subfamilia Morphinae acostumbran alimentarse de sus propias exhuvias larvales incluyendo Caligo y Opsiphanes (Montero com. pers.) por lo que no se logró determinar el momento en que ocurrieron los estadios larvales intermedios. Prepupa: dos días (n = 6) Pupa: 29 días (n = 6) Planta hospedera: Las seis larvas criadas en la EBA se alimentaron en Heliconia tortuosa. DeVries (1987) menciona que las larvas de esta especie se alimentan de palmas, sin embargo puede que esto sea un error, puesto que la especie asociada con Arecaceae (palmas) es O. cassina, mientras que O. bogotanus se alimenta de Heliconiáceas y Musáceas. Janzen y Hallwachs (2005) reportan las especies Heliconia irrasa, H. latispatha, 132 Figura 28. Fases del ciclo biológico de O. bogotanus alajuela: a) Larva cuarto estadio vista dorsal (arriba). b) Larva quinto estadio vista dorsal (abajo). c) Detalle de cabeza larva quinto estadio. d) Detalle de cola larva cuarto estadio. e) Prepupa. f) Pupa. g) Adulto vista dorsal. h) Adulto vista ventral. Fotografías: Róger González. H. longa, H. pogonantha, H. vaginalis, Calathea lutea, así como las especies introducidas Musa acuminata y M. cavendishii. En Altamira no se han observado los adultos alimentándose, pero se supone que al igual que otras especies de la subfamilia Morphinae, se alimentan de sustancias de frutos en descomposición. DeVries (1987) menciona que los adultos de ambos sexos liban los jugos de bananos en descomposición. Distribución: La zona de Altamira es un nuevo registro de distribución para la subespecie O. bogotanus alajuela. En este sitio se puede encontrar principalmente en bordes de bosque y orillas de los Senderos Gigantes del Bosque, Cerro Biolley y Casa Coca, tanto en bosque primario como secundario, en un ámbito altitudinal de 1 300-1 800 m. También se encuentra de 0 a 1 500 m en la falda este de las cordilleras de Talamanca, Volcánica Central, Tilarán y las llanuras de Sarapiquí, sobre bordes de bosque, claros, márgenes de quebradas y trochas madereras abandonadas (Chacón, 2002c). O. bogotanus está presente desde Costa Rica 133 hasta Colombia. En Costa Rica, está asociada con hábitats del bosque nuboso en ambas vertientes, entre los 700 y 1 600 m (DeVries, 1987). Parasitoides: En la EBA se registró una especie de Diptera: Chrysotachina sp. (Tachinidae). En el ACG, Janzen y Hallwachs (2005) reportan tres especies que parasitan O. bogotanus alajuela. Dos de ellas son Diptera: Tachinidae (Anoxynops auratus y Winthemia sp.) y la otra es una especie de Hymenoptera: Braconidae (Cotesia sp.). Especie 24: Opsiphanes cassina Ciclo biológico: Larva: cinco días (n = 3). Siempre que se localizaron larvas de esta especie se encontraron en el último estadio larval. Prepupa: tres días (n = 3) Pupa: 25 días (n = 3) Figura 29. Fases del ciclo biológico de O. cassina. a) Larva en quinto estadio vista dorsal; b) Detalle de la cabeza de larva en quinto estadio; c) Pupa; d) Adulto vista dorsal. e) Adulto vista ventral. Fotografías: Róger González. Alimentación: De las cuatro larvas criadas en la EBA, tres se alimentaron de Chamaedorea crucensis y una de Geonoma interrupta. Janzen y Hallwachs (2005) reportan otras especies de la familia Arecaceae entre estas Acrocomia aculeata, Astrocaryum alatum, Bactris 134 gasipaes (especie introducida), B. guineensis, B. major, Chamaedorea costaricana, C. tepejilote, Chrysalidocarpus lutescens (especie introducida), Cocos nucifera (especie introducida) y Prestoea decurrens, como plantas hospederas de O. cassina, así como un inusual reporte de Heliconia latispatha. Durante el desarrollo de esta investigación se observaron tres adultos de O. cassina posados sobre las heces frescas de puma (Puma concolor) (Figura 30). Se presume que son excrementos de esta especie de felino puesto que en dos ocasiones se ha observado directamente en los alrededores de la EBA y sus huellas se han identificado en el Sendero Gigantes del Bosque. Es posible que estas mariposas estuvieran libando sales minerales presentes en los excrementos. Es muy probable que los adultos también se alimenten de los jugos de frutos en descomposición. Figura 30. O. cassina posada sobre heces de P. concolor. Fotografía: Róger González. Distribución: Durante el desarrollo de esta investigación, esta especie se reportó en los bordes del bosque primario y secundario en el Sendero Gigantes del Bosque entre los 1 500 a 1 600 m. La especie O. cassina se distribuye desde México hasta la base del Amazonas. En Costa Rica se encuentra de los 0 a 1 700 m en la vertiente Pacífica de las Cordilleras de Talamanca, Tilarán y Volcánica Central, Península de Nicoya, Península de Osa y Valle Central en la vertiente Caribe en las llanuras de Sarapiquí, del Norte y Caribe así como serranías y tierras bajas del Caribe (INBio, 2007). 135 Parasitoides: Hay una especie de Braconidae y una de Ichneumoninae (Ichneumonidae) indeterminada, que son endoparasitoides de las larvas de O. cassina. Montero (com. pers.) reporta Blepharipa fimbriata (Tachinidae) como parasitoide de O. cassina. Los adultos de estos dípteros emergen de las pupas de la mariposa. Janzen y Hallwachs (2005) reportan dípteros de las especies Anoxynops auratus, Chetogena scutellaris e Hyphantrophaga virilis (Tachinidae), además de especies no determinadas en los géneros Blepharipa, Lespesia y Winthemia (Tachinidae). También reportan avispas parasitoides de los géneros Cotesia (Braconidae) e Hyposoter (Ichneumonidae). El ciclo biológico, las tasas de supervivencia, reproducción y longevidad de los adultos de Opsiphanes cassina en cautiverio (ex situ en sistema cerrado) se describen con mayor detalle en el Apéndice 1. Especie 25: Opsiphanes quiteria talamancensis Ciclo biológico: Larva: 30 días desde el segundo hasta el quinto estadio (n = 7) Prepupa: tres días (n = 4) Pupa: 28 días (n = 4) Figura 31. Fases del ciclo biológico de O. quiteria talamancensis: a) Larva cuarto estadio vista dorsal. b) Larva quinto estadio vista dorsal. c) Pupa. d) Adulto vista ventral. e) Adulto vista dorsal. Fotografías: Róger González. 136 Planta hospedera: De las siete larvas criadas en la EBA, cinco se alimentaron en Chamaedorea crucensis y dos en Geonoma interrupta. Es probable que los adultos visiten y se alimenten de frutas en descomposición. En el ACG, Janzen y Hallwachs (2005) reportan otras especies de plantas hospederas, a saber: Acrocomia aculeata, Asterogyne martiana, Astrocaryum alatum, Bactris dianeura, B. gasipaes (especie introducida), B. gracilior, B. hondurensis, Calyptrogyne ghiesbreghtiana, C. trichostachys, Chamaedorea anemophila, C. costaricana, C. dammeriana, C. pinnatifrons, C. tepejilote, C. warscewiczii, Chrysalidocarpus lutescens (especie introducida), Euterpe precatoria, Geonoma congesta, G. cuneata, G. ferruginea, G. interrupta, Neonicholsonia watsonii, Prestoea decurrens y Synechanthus warscewiczianus. Distribución: En Altamira se ha recolectado en los bordes del bosque primario y secundario de los Senderos Gigantes del Bosque, Cerro Biolley y Casa Coca, en un ámbito altitudinal de 1 400-1 700 m. También se le encuentra en la vertiente caribe entre 0-1 300 m. en la Cuenca del Sixaola (R.I Talamanca), Cuenca del Sarapiquí, Cuenca del Reventazón (P.N. TapantíMacizo de la Muerte), Cuenca del Río Frío (P.N. Volcán Tenorio) y en la vertiente del Pacífico entre 1 200-1 400 m, en la Cuenca del Térraba Sierpe (PILA) (INBio, 2007). Parasitoides: En la EBA se registraron tres casos de larvas de O. quiteria talamancensis parasitadas por avispas de la subfamilia Microgastrinae (Braconidae: Hymenoptera). En el ACG, Janzen y Hallwachs (2005) reportan dos especies de Hymenoptera que son parasitoides de O. quiteria talamancensis: Cotesia sp. (Braconidae) e Hyposoter sp. (Ichneumonidae). Estos investigadores también reportan como parasitoides a tres especies de Diptera: Anoxynops auratus, Houghia sp. y Winthemia spp. (Tachinidae). Figura 32. a) Arriba: Larva de O. quiteria talamancensis quinto estadio parasitada. b) Abajo: Larva quinto estadio luego de emergidos los parasitoides. c) Adulto de Microgastrinae (Braconidae). Fotografías: Róger González. 137 5.2.7.4 Subfamilia Nymphalinae Dentro de los ninfálidos, esta es la subfamilia más heterogénea y menos conocida filogenéticamente, pues agrupa todos los géneros que no calzan bien con las características de las demás subfamilias. No existe una lista definitiva de características con las cuales se pueda identificar correctamente a estas mariposas (DeVries, 1987). Los primeros estadios larvales son muy diversos (DeVries, 1987). Los huevos son reticulados y en forma de barril. Las larvas poseen espinas, son gregarias y construyen telas comunales con el follaje de las plantas en donde se alimentan (Chacón y Montero, 2007). Los adultos de muchas de las especies realizan migraciones y mimetizan otras especies de ninfálidos (Heliconiini e Ithominae). Algunas especies tienen sabor desagradable para sus depredadores, mientras que otras tienen colores crípticos o aposemáticos, los cuales son sus principales mecanismos de defensa (DeVries, 1987). La longitud del ala anterior es de 12-55 mm. Tanto los machos como las hembras tienen las patas anteriores reducidas (Chacón y Montero, 2007). Las larvas de Nymphalinae se alimentan de una gran variedad de especies de plantas de las familias Acanthaceae, Burseraceae, Ericaceae, Euphorbiaceae, Melastomataceae, Moraceae, Rubiaceae, Sapindaceae, Tiliaceae, Ulmaceae, Urticaceae y Verbenaceae (DeVries, 1987). Otros autores (Janzen y Hallwachs, 2005 citados por Montero y Chacón, 2007) mencionan como plantas hospederas algunas especies de las familias Asteraceae, Cecropiaceae, Lamiaceae y Scrophulariaceae. Los adultos de la mayoría de especies se alimentan exclusivamente del néctar de las flores, mientras que algunas especies se alimentan de frutos en descomposición. En varias especies de los géneros Eunica y Marpesia, los machos visitan la arena mojada en la orilla de ríos o charcos (DeVries, 1987). Algunas especies visitan carroña en busca de alimento (Chacón y Montero, 2007). Las especies de Nymphalinae presentes en Costa Rica se pueden encontrar en todos los hábitats, algunas de las cuales son las especies de mariposas más comunes de observar. Esta subfamilia se distribuye en todo el mundo y en Costa Rica existen 59 especies (Chacón y Montero, 2007). 138 Especie 26: Hypanartia dione arcaei Ciclo biológico: Larva: 19 días(n = 3). Una de las larvas fue recolectadas en el último estadio. Prepupa: tres días (n = 2) Pupa: 19 días (n = 2) Figura 33. Fases del ciclo biológico de H. dione arcaei: a) Larva quinto estadio vista frontal. b) Larva quinto estadio vista lateral. c) Pupa vista lateral. d) Pupa vista dorsal. e) Adulto vista dorsal. f) Adulto vista ventral. g) Pupa vista frontal. Fotografías: Róger González. Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Cecropia polyphlebia. Chacón (2001b) reporta esta especie alimentándose de una planta del género Pilea (Urticaceae). En el ACG, Janzen y Hallwachs (2005) reportan las especies C. polyphlebia, Myriocarpa longipes y Urera eggersii como plantas hospederas de H. dione arcaei. Según DeVries (1987), los adultos de esta mariposa ocasionalmente visitan las flores de Senecio megaphyllus y otras de la familia Asteraceae. Distribución: H. dione arcaei se recolectó en el borde del bosque primario, únicamente en el sendero a Casa Coca, a una altitud de 1 800 m. Esta especie se ha recolectado en un ámbito altitudinal que va de 1 200 a 2 900 m en las cordilleras de Talamanca, Volcánica Central y 139 montañas que rodean el Valle Central en bordes de bosque, márgenes de quebrada, caminos bordeados de bosques primarios y secundarios (Chacón, 2001b). Según DeVries (1987), esta especie se encuentra presente únicamente en Costa Rica y Panamá. Su ámbito de distribución oscila entre los 1 200-2 000 m en ambas vertientes. Esta especie se encuentra asociada con hábitats del bosque nuboso en la Cordillera de Talamanca (DeVries, 1987). Parasitoides: Se obtuvo una especie no identificada de Hymenoptera: Braconidae. 5.2.8 Familia Saturniidae Las larvas de algunas especies tienen pelos urticantes y espinas con las cuales se defienden de sus posibles enemigos, liberando sustancias irritantes y tóxicas como la histamina y acetilcolina (Miller et al 2006 citados por Chacón y Montero, 2007). Algunas especies son gregarias y pupan en un capullo o directamente en el suelo, en donde construyen una cámara pupal, utilizando tierra, hojas y ramitas (Chacón y Montero, 2007). Las larvas de la mayoría de especies son carnosas, con grupos de setas levantados como tubérculos. En los géneros Hemileuca y Automeris, las larvas poseen pequeños pelos urticantes. Algunas especies pueden causar serios daños al alimentarse de las hojas de árboles y arbustos (Covell, 1984). En la mayoría de las especies, los machos adultos tienen las antenas cuadripectinadas (doblemente bipectinadas). En el caso de las hembras, dependiendo de la especie, las antenas varían desde simples, bipectinadas o cuadripectinadas. En algunas especies los adultos están activos durante el día, mientras que otras esto ocurre en el crepúsculo o en la noche (Covell, 1984). Las especies de Saturniidae tienen tamaños que varían desde medianos a muy grandes, e incluyen las mariposas nocturnas más grandes de Costa Rica y Norte América (Covell, 1984; Chacón y Montero, 2007). En las especies presentes en Costa Rica, el ala anterior tiene una longitud que varía entre 17-97 mm. En general, el cuerpo de las hembras es más voluminoso que el de los machos. La coloración de los satúrnidos es muy variable, pero predomina el color café. Algunas especies presentan colas en las alas posteriores, otras tienen ventanas y manchas oculares, que usan como una señal de advertencia al desplegar sus alas. Dichas manchas tienen anillos concéntricos, como ocurre en el planeta Saturno, por lo que el 140 nombre de esta familia (Saturniidae) hace referencia a dicho planeta (Chacón y Montero, 2007). Las larvas de la mayoría de especies se alimentan de una gran variedad de plantas, por lo cual se dice que son polífagas (generalistas). Generalmente, los adultos tienen cortos períodos de vida y no necesitan alimentarse, motivo por el cual la probóscide está reducida en algunas especies y ausente en otras (Chacón y Montero, 2007). Los satúrnidos están presentes en todo el mundo. Se estima que existen un total de 1 480 especies agrupadas en 165 géneros, pero su mayor diversidad está en el neotrópico (Lemaire y Minet, 1999 citados por Chacón y Montero, 2007). En Costa Rica se han registrado un total de 118 especies (Janzen, 1982; citado por Chacón y Montero, 2007). 5.2.8.1 Subfamilia Hemileucinae Las larvas habitan en grupos y durante los primeros estadios se desplazan juntas de un lugar a otro. Además, poseen tubérculos prominentes en forma de espinas los cuales usan como mecanismo de defensa (Scoble, 1992a). En los adultos el ala anterior tiene una longitud de 18-76 mm. Las hembras adultas del género Hylesia tienen pelos urticantes en el abdomen. En algunas especies, los machos están activos durante el día. Las antenas son aserradas o filiformes en las hembras y cuadripectinadas en los machos (Chacón y Montero, 2007). El abdomen es corto, no tan grande como las alas posteriores (Covell, 1984). Las larvas se alimentan de plantas de las familias Acanthaceae, Anacardiaceae, Annonaceae, Apocynaceae, Araceae, Araliaceae, Arecaceae, Asteraceae, Bignoniaceae, Bombacaceae, Boraginaceae, Burseraceae, Cannaceae, Cecropiaceae, Celastraceae, Chrysobalanaceae, Clethraceae, Clusiaceae, Combretaceae, Connaraceae, Cunoniaceae, Cyatheaceae, Dichapetalaceae, Dilleniaceae, Elaeocarpaceae, Euphorbiaceae, Ericaceae, Erythroxylaceae, Fabaceae, Flacourtiaceae, Hamamelidaceae, Heliconiaceae, Hippocastanaceae, Juglandaceae, Lauraceae, Malpigiaceae, Malvaceae, Marantaceae, Marcgraviaceae, Melastomataceae, Meliaceae, Menispermaceae, Moraceae, Musaceae, Myristicaceae, Myrtaceae, Ochnaceae, Olacaceae, Passifloraceae, Piperaceae, Poaceae, Polygalaceae, Polygonaceae, Polypodiaceae, Proteaceae, Rhamnaceae, Rosaceae, Rubiaceae, Rutaceae, Sabiaceae, Sapindaceae, Sapotaceae, Simaroubaceae, Solanaceae, Sterculiaceae, Styracaceae, Theaceae, Tiliaceae, Trigoniaceae, Ulmaceae, Urticaceae, 141 Verbenaceae, Vitaceae, Vochysiaceae y Zingiberaceae (Janzen y Hallwachs, 2005 citados por Chacón y Montero, 2007). Las larvas de H. lineata se alimentan de una gran variedad de plantas, de las cuales se han registrado un total de 46 especies hospederas pertenecientes a 18 familias diferentes (Janzen, 1984 citado por Chacón y Montero, 2007). Las larvas pupan en la hojarasca, pero algunas especies lo hacen en el suelo, en donde construyen capullos (Chacón y Montero, 2007). La subfamilia Hemileucinae se encuentra distribuida únicamente en el Nuevo Mundo, en donde se han registrado cerca de 670 especies agrupadas en 49 géneros (Lemaire, 2002 citado por Chacón y Montero, 2007). La mayor diversidad se da en el Neotrópico, representadas en Costa Rica por 61 especies (Lemaire y Janzen, 1996 citados por Chacón y Montero, 2007). Especie 27: Automeris banus Ciclo biológico: Larva: 39 días (n = 4) Prepupa: tres días (n = 4) Pupa: 36 días (n = 4) Figura 34. Fases del ciclo biológico de A. banus: a) Arriba: Larva quinto estadio vista dorsal. b) Abajo: Larva quinto estadio vista lateral. c) Larva quinto estadio vista frontal. d) Capullo. e) Pupa f) Adulto. Fotografías: Róger González. 142 Planta hospedera: De las cuatro larvas criadas en la EBA, dos se alimentaron de Melanthera aspera, una de Gonzalagunia rosea y una de Palicourea padifolia. En el ACG, Janzen y Hallwachs (2005) reportan varias especies de plantas hospederas las cuales se presentan en el Cuadro 3. Cuadro 3. Plantas hospederas de A. banus en ACG, según Janzen y Hallwachs (2005). Familia Especie Acanthaceae Mendoncia retusa Arecaceae Bactris guineensis, Geonoma ferruginea Asteraceae Salmea scandens, Vernonia patens, Zexmenia virgulta Bignoniaceae Tabebuia sp. Bombacaceae Ochroma pyramidale Boraginaceae Cordia alliodora, C. cymosa, C. eriostigma Cannaceae Canna indica (especie introducida) Cecropiaceae Cecropia obtusifolia, C. peltata, Coussapoa nymphaeifolia Clethraceae Clethra lanata, C. mexicana Combretaceae Combretum laxum Connaraceae Connarus vulcanicus Cunoniaceae Weinmannia wercklei Dichapetalaceae Dichapetalum morenoi Elaeocarpaceae Sloanea faginea Euphorbiaceae Acalypha diversifolia, Acidoton nicaraguensis, Sapium glandulosum Andira inermis, Dioclea malacocarpa, Erythrina lanceolata, Inga chocoensis, I. herrerae, Fabaceae I. oerstediana, I. punctata, I. semialata, Lonchocarpus oliganthus, Machaerium acuminatum, M. cobanense, Pterocarpus rohrii, Senna papillosa, Swartzia cubensis Lacistemataceae Lacistema aggregatum Malpighiaceae Hiraea reclinata Malvaceae Hampea appendiculata, Malvaviscus palmanus, Pavonia schiedeana Melastomataceae Tibouchina longifolia Meliaceae Guarea glabra Menispermaceae Abuta panamensis, Cissampelos pareira Moraceae Brosimum alicastrum, Sorocea trophoides Myrtaceae Myrcia splendens, Psidium guajava (especie introducida) Poaceae Pharus parvifolius, Cynodon nlemfuensis (especie introducida) Rhamnaceae Gouania colombiana 143 Familia Especie Rosaceae Prunus annularis, Rubus urticifolius Rubiaceae Augusta rivales, Guettarda foliacea, Pentagonia donnell-smithii, Rondeletia buddleioides Sabiaceae Meliosma glabrata Sapindaceae Allophylus psilospermus, Cupania glabra, Paullinia bracteosa Sapotaceae Pouteria exfoliata Solanaceae Solanum torvum Sterculiaceae Guazuma ulmifolia Styracaceae Styrax argenteus Tiliaceae Heliocarpus appendiculatus, Triumfetta lappula Urticaceae Myriocarpa longipes, Urera caracasana, U. elata Verbenaceae Citharexylum costaricensis Distribución: En Altamira A. banus se recolectó en los Senderos Casa Coca, Toma del Agua y Gigantes del Bosque, en un ámbito altitudinal de 1 450-1 800 m. También según la base de datos ATTA (INBio, 2007), se le encuentra en la Vertiente Caribe entre 0-1 400 m. en la región Tortuguero-Sierpe (RVS Barra del Colorado), en la Cuenca del Sarapiquí (PN Braulio Carrillo y ZP La Selva), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte y MN Guayabo), Cuenca del Matina, Volcán Orosí (PN Guanacaste), Cuenca del Pizote (PN Guanacaste y CB Guanacaste-Rincón de la Vieja), Cuenca del San Carlos (PN Arenal, RB Alberto Manuel Brenes y ZP Tenorio), Cuenca del Zapote y Cuenca de Río Frío (PN Volcán Tenorio). En la Vertiente Pacífico entre 0-1 700 m, en la Cuenca del Tárcoles (PN Carara), Cuenca del Lagarto y Guacimal, Cuenca del Tempisque (PN Guanacaste, PN Rincón de la Vieja y ZP Miravalles), Península de Osa (PN Corcovado, RF Golfo Dulce) y Cuenca del Térraba-Sierpe (PILA y ZP Las Tablas). Parasitoides: En la EBA no se reportan parasitoides para esta especie. En ACG, Janzen y Hallwachs (2005) reportan dos especies de Hymenoptera: Enicospilus cameronii y E. tenuigena (Ichneumonidae); así como tres especies de Diptera: Anoxynops auratus, Belvosia spp. y Patelloa xanthura (Tachinidae). 144 Especie 28: Gamelia musta Ciclo biológico: Larva: 76 días (n = 5) Prepupa: cinco días (n = 5) Pupa: 32 días (n = 5) Figura 35. Fases del ciclo biológico de G. musta: a) Larva cuarto estadio vista dorsal. b) Pupa. c) Adulto vista dorsal. Fotografías: Róger González y Didier Rubí. Planta hospedera: De las cinco larvas criadas en la EBA, tres se alimentaron de Quercus rapurahuensis, una de Myrcia splendens y una de Palicourea padifolia. En el ACG, Janzen y Hallwachs (2005) mencionan varias especies de plantas hospederas para las larvas de G. musta, las cuales se indican en el siguiente cuadro. Cuadro 4. Plantas hospederas para G. musta en ACG, según Janzen y Hallwachs (2005). Familia Especie Sabiaceae Meliosma glabrata Sapindaceae Serjania mexicana, Cupania glabra Asteraceae Vernonia patens Bignoniaceae Xylophragma seemannianum Boraginaceae Cordia panamensis Clethraceae Clethra mexicana Combretaceae Combretum laxum Connaraceae Cnestidium rufescens Elaeocarpaceae Sloanea faginea 145 Familia Euphorbiaceae Especie Acalypha diversifolia, Alchornea latifolia, Adelia triloba, Pausandra trianae Cojoba valerioi, Erythrina lanceolata, Inga herrerae, I. longispica, I. mortoniana, I. Fabaceae oerstediana, I. punctata, I. semialata, Lonchocarpus oliganthus, L. retiferus, Machaerium acuminatum, Ormosia cruenta, Pachyrhizus erosus, Pithecellobium furcatum, Pterocarpus officinalis, P. rohrii, Senna papillosa, Zygia longifolia Hippocastanaceae Billia hippocastanum Juglandaceae Alfaroa guanacastensis Lacistemataceae Lacistema aggregatum Malvaceae Hampea appendiculata, Malvaviscus arboreus Marantaceae Calathea crotalifera Meliaceae Guarea glabra Moraceae Pseudolmedia spuria, Sorocea trophoides, Trophis involucrata Myrtaceae Myrcia splendens Polygonaceae Coccoloba tuerckheimii Olacaceae Heisteria macrophylla Rubiaceae Posoqueria latifolia, Rondeletia buddleioides, Spermacoce ovalifolia Sapindaceae Serjania valerii Sapotaceae Pouteria exfoliata, P. reticulata Ulmaceae Trema micrantha Urticaceae Urera elata, Myriocarpa longipes Verbenaceae Citharexylum costaricensis Distribución: Los especímenes de G. musta recolectados y criados en Altamira se recolectaron en los Senderos Cerro Biolley y Gigantes del Bosque, en un ámbito altitudinal de 1 400-1 700 m. También se le encuentra en la Vertiente Caribe entre 100-1 200 m en la Cuenca del Sarapiquí (PN Braulio Carrillo), Cuenca del San Carlos (RB Alberto Manuel Brenes), Cuenca del Estrella (RB Hitoy Cerere), Cuenca del Matina, Cuenca del Sapoá (PN Guanacaste), Cuenca del Zapote (PN Volcán Tenorio), Cuenca del Pizote (PN Rincón de la Vieja. En la Vertiente Pacífico entre 0-1 600 m. en la Península de Nicoya (RNA Cabo Blanco), Cuenca del Tempisque (PN Guanacaste y PN Rincón de la Vieja) (INBio, 2007). Parasitoides: No se han reportado parasitoides para G. musta en la zona de Altamira. En el ACG, Janzen y Hallwachs (2005) reportan dos especies de Hymenoptera: Cotesia sp. y Parapanteles sp. (Braconidae). 146 5.2.8.2 Subfamilia Saturniinae Las larvas de algunas especies se han utilizado comercialmente en la producción de seda. Éstas construyen capullos de seda adheridos a la planta hospedera, dentro del cual ocurre la pupación. Los adultos son mariposas nocturnas de tamaño grande (envergadura alar de 4282 mm), en cuyas alas tienen ventanas traslúcidas (fenestras) de forma ovoide o triangular. En algunas especies los machos tienen comportamiento diurno (Chacón y Montero, 2007). Los adultos de ambos sexos tienen las antenas cuadripectinadas; con un par de ramificaciones externas en cada segmento antenal, que en los machos nunca tocan las ramificaciones internas. El abdomen es más corto que el ala posterior (Covell, 1984). Las larvas se alimentan de varias especies de las familias Anacardiaceae, Annonaceae, Apocynaceae, Araliaceae, Asteraceae, Bombacaceae, Caprifoliaceae, Combretaceae, Erythroxylaceae, Euphorbiaceae, Fagaceae, Flacourtiaceae, Lauraceae, Meliaceae, Rhizophoraceae, Rosaceae, Rubiaceae, Rutaceae, Simaroubaceae y Solanaceae (Janzen y Hallwachs, 2005 citados por Chacón y Montero, 2007). Los satúrninos se encuentran distribuidos en todo el mundo, con un total de 480 especies agrupadas en 59 géneros. Sin embargo, la mayor diversidad de especies se da en los trópicos del Viejo Mundo (Lemaire y Minet, 1999; citados por Chacón y Montero, 2007). En Costa Rica se han registrado 14 especies (Chacón y Montero, 2007). Especie 29: Copaxa rufinans Ciclo biológico: Larva: 64 días (n = 12) Prepupa: dos días (n = 5) Pupa: 34 días (n = 5) Planta hospedera: De las cinco larvas de C. rufinans recolectadas y criadas en la EBA, cuatro se alimentaron del follaje de Nectandra salicina y una de Ocotea stenoneura. En el ACG, Janzen y Hallwachs (2005) reportan las siguientes especies de plantas hospederas: Beilschmiedia brenesii, Cinnamomum brenesii, C. triplinerve, Nectandra salicifolia, N. hihua, N. martinicensis, N. membranacea, N. salicina, Ocotea aff. smithii, O. aff leucoxylon, O. insularis, O. mollifolia, O. veraguensis, O. whitei, Persea americana (especie introducida) y P. schiedeana. 147 Figura 36. Fases del ciclo biológico de C. rufinans: a) Larvas segundo estadio. b) Arriba: Larva segundo estadio vista lateral. c) Abajo: Larva tercer estadio vista dorsal. d) Vista frontal larva tercer estadio. e) Larva cuarto estadio vista lateral. f) Larva cuarto estadio vista dorsal. g) Larva quinto estadio vista lateral. h) Pupa. i) Adulto macho. j) Adulto hembra. Fotografías: Róger González. Distribución: En Altamira se recolectaron especímenes de C. rufinans en los Senderos Casa Coca y Gigantes del Bosque, en un ámbito altitudinal de 1 400-1 800 m. Según la base de datos ATTA (INBio, 2007) también se le encuentra en la Vertiente Caribe entre 100-1 700 m en la Cuenca del Sarapiquí (PN Braulio Carrillo), Cuenca del Reventazón (PN TapantíMacizo de la Muerte y MN Guayabo), Cuenca del Matina, Cuenca del Pizote (PN Guanacaste y CB Guanacaste-Rincón de la Vieja), Cuenca del Sapoá y Volcán Orosí (PN Guanacaste), Cuenca del San Carlos (RB Alberto Manuel Brenes y ZP Tenorio) y Cuenca del Zapote (PN Volcán Tenorio). 148 En la Vertiente Pacifico, entre 0-2 000 m. en la Península de Osa (P.N Corcovado y R.F. Golfo Dulce), Serranías de Golfito (P.N. Piedras Blancas y R.V.S. Golfito), Cuenca del Térraba-Sierpe (Z.P. Las Tablas, R.I Boruca-Térraba), Cuenca del Tempisque (P.N. Barra Honda, P.N. Guanacaste, P.N Rincón de la Vieja y Z.P. Miravalles), Cuenca del Tárcoles (P.N. Carara), Cuencas del Lagarto y Guacimal (Z.P. Arenal-Monteverde), Cuenca del PirrísDamas (Z.P. Río Navarro y Río Sombrero). Parasitoides: En el ACG, Janzen y Hallwachs (2005) reportan los dípteros Blepharipa sp. e Hystricia sp. (Tachinidae) como parasitoides de C. rufinans. 5.2.9 Familia Sphingidae Las hembras adultas depositan los huevos en forma individual (Chacón y Montero, 2007). Las larvas presentan unas pocas setas en su cuerpo y en muchas especies tienen un prominente cuerno caudal en los últimos segmentos del abdomen. En la mayoría de especies, la pupación ocurre en el suelo; sin embargo, algunas especies construyen capullos sueltos en la hojarasca del suelo (Covell, 1984). Las larvas de la mayoría de especies tienen coloraciones atractivas y crípticas. En algunas especies existen marcas aposemáticas, incluso en Centroamérica hay algunas larvas (Eumorpha labruscae y Hemerophanes triptolemus) cuya forma y coloración mimetiza muy bien a una serpiente (Chacón y Montero, 2007). Las larvas de Manduca sexta y M. quinquemaculata causan grandes pérdidas económicas en cultivos de tomate, papa y tabaco (Janzen, 1984 y Stehr, 1987c; citados por Chacón y Montero, 2007). Los adultos varían en tamaño desde medianos hasta muy grandes. Las especies presentes en Costa Rica tienen una envergadura alar que varía entre 16-85 mm. Las alas anteriores tienen forma semi triangular y en comparación con las alas anteriores, son largas (Chacón y Montero, 2007) y terminan abruptamente, mostrando un margen irregular en la mayoría de las especies. Esto ha favorecido que algunas especies de esfíngidos tengan uno de los vuelos más rápidos de todos los lepidópteros (Covell, 1984) que junto a su enérgico vuelo les hace capaces de recorrer largas distancias, por lo que algunas especies realizan grandes migraciones (Chacón y Montero, 2007). 149 Algunas especies vuelan únicamente en la noche, mientras que otras lo hacen durante el alba, en el crepúsculo (Covell, 1984) o durante el día (Chacón y Montero, 2007). Su cuerpo es muy robusto y el abdomen se adelgaza a medida que se aleja del tórax (fusiforme). No tienen ocelos ni órganos timpánicos abdominales o metatoráxicos. Las antenas son muy delgadas en las puntas (Covell, 1984) (ápice puntiagudo), generalmente son filiformes, casi siempre lameladas ventralmente, clavadas o pectinadas (Chacón y Montero, 2007). Las larvas de algunas especies tienen hábitos alimenticios diurnos, mientras que en otras se alimentan durante la noche. Las plantas hospederas incluyen varias especies leñosas y herbáceas, algunas de las cuales pueden llegar a convertirse en plagas (Covell, 1984). La probóscide está bien desarrollada, en algunas especies es extremadamente desarrollada y en otras es reducida y no funcional (Chacón y Montero, 2007). Los adultos de algunas especies del género Manduca se alimentan de flores cuyo cáliz es profundo (flores con forma de campana o trompeta de muchas enredaderas), razón por la cual tienen la probóscide extremadamente larga. Existen especies de Sphingidae que han coevolucionado con ciertas especies de plantas, de tal manera que sólo una determinada especie de mariposa nocturna puede polinizar las flores de una determinada especie de planta. Con el fin de embeber néctar (principalmente en horas crepusculares), algunos esfíngidos visitan flores de plantas, como por ejemplo de Stachytarpheta frantzii, por lo que se pueden confundir con abejorros o colibríes. La longevidad en ambos sexos es bastante prolongada, y por ende, los adultos necesitan alimentarse durante largos períodos. Los esfíngidos han desarrollado apropiadamente su capacidad neuronal. Esto les permite volar mientras buscan y reconocen periódicamente las flores, de cuyo néctar se alimentan a veces mientras descansan sobre la flor. En otras ocasiones se mantienen volando en un solo lugar, como suspendidos en el aire (vuelo cernido), muy similar a como ocurre en las aves de la familia Trochilidae (colibríes) (Chacón y Montero, 2007). La mayoría de especies de Sphingidae se encuentran distribuidas en el trópico (Covell, 1984) aunque están presentes en todo el mundo, con aproximadamente 1 200 especies clasificadas en 200 géneros (Lemaire y Minet, 1999 citados por Chacón y Montero, 2007). En Costa Rica se han registrado 145 especies (Chacón y Montero, 2007). 150 5.2.9.1 Subfamilia Macroglossinae Las larvas tienen un cuerno caudal reducido en un corto abultamiento y las manchas oculares se encuentran en el abdomen. Todas las especies tienen algunas setas o pelos en la superficie interior del primer segmento de los palpos labiales, los cuales funcionan como pequeños sensores. Los adultos son de tamaños medios, con una evergadura alar de 16-71 mm. Tienen la probóscide bien desarrollada y funcional (Covell, 1984). Las larvas se alimentan en las hojas de varias especies de plantas de las familias Actinidaceae, Apocynaceae, Asclepiadaceae, Bignoniaceae, Caricaceae, Cecropiaceae, Chrysobalanaceae, Dilleniaceae, Euphorbiaceae, Melastomataceae, Moraceae, Onagraceae, Rosaceae, Rubiaceae, Sapotaceae, Verbenaceae, Vitaceae y Vochysiaceae (Janzen y Hallwachs, 2005 citados por Chacón y Montero, 2007). Especie 30: Perigonia stulta Ciclo biológico: Larva: 10 días (n = 3) Prepupa: cuatro días (n = 3) Pupa: 28 días (n = 3) Figura 37. Fases del ciclo biológico de P. stulta: a) Larva quinto estadio vista dorsal. b) Larva quinto estadio vista lateral. c) Prepupa vista lateral. d) Prepupa vista dorsal. e) Pupa. f) Adulto. Fotografías: Róger González. 151 Planta hospedera: Las tres larvas criadas en la EBA se alimentaron de Cinchona pubescens. En ACG, Janzen y Hallwachs (2005) reportan las especies Cosmibuena macrocarpa y Elaeagia auriculata. Distribución: En Altamira se recolectaron larvas de P. stulta en el Sendero Gigantes del Bosque, a una altitud de 1 300-1 400 m. También se le encuentra en la Vertiente Caribe entre 400-1 700 m, en la Cuenca del Sarapiquí (PN Braulio Carrillo y ZP La Selva), Cuenca del Reventazón (PN Tapantí-Macizo de la Muerte y MN Guayabo), Volcán Orosí (PN Guanacaste) y en la Cuenca del San Carlos (RB Alberto Manuel Brenes y ZP Tenorio). En la Vertiente Pacífico entre 100-1 800 m, en las Serranías de Golfito (RVS Golfito), Península de Osa (RF Golfo Dulce), Cuenca del Térraba-Sierpe (PILA), Cuenca del Tempisque (PN Guanacaste, ZP Miravalles), Cuencas del Lagarto y Guacimal (ZP Arenal-Monteverde) (INBio, 2007). Parasitoides: Aunque no se lograron determinar especies de parasitoides para P. stulta en la EBA, en el ACG Janzen y Hallwachs (2005) reportan la familia Encyrtidae asociada a esta especie, probablemente como parasitoide de los huevos. 152 6. DISCUSIÓN DE RESULTADOS 6.1. Riqueza específica de Lepidoptera en el sector Altamira. En el PILA, sector Altamira habitan entre 1 400 y 1 600 (Figura 4) especies de lepidópteros (INBio, 2007), es decir cerca del 10% de las especies de Lepidoptera estimadas para Costa Rica. Este dato no es definitivo y la cantidad de especies puede variar (incrementar). Tal y como lo muestra el Cuadro 1, hay 54 géneros con especies no determinadas y muchas otras se omitieron de la lista debido a que son especies sin describir o en proceso de publicación. También existen complejos de especies bajo el mismo nombre científico, por ejemplo Lophocampa atriceps, Virbia spp. (Espinoza com. pers.) y Tarchon felderi (Montero com. pers.). Hasta el momento, estos grupos no se han trabajado ni determinado a un nivel taxonómico que permita la determinación y esclarecimiento de tales especies. Estudios de ADN en Astraptes fulgerator desarrollados en el ACG, demostraron que una especie polimórfica en estado larval es en realidad un complejo de diez especies (Hebert et al., 2004 y Broker, 2006). Lo anterior permite estimar una gran diversidad de lepidópteros para el sitio de estudio y concuerda con el criterio de DeVries (1987): las zonas de altitud media poseen una mayor riqueza de especies en comparación con las áreas de alta y baja altitud. Montero (com. pers.) estima que se puede esperar un mayor número de especies para esta zona principalmente en mariposas diurnas. La baja cantidad de especies de mariposas diurnas (77) en comparación con las nocturnas (1 495) se debe en parte a que el esfuerzo de recolecta en los años 90 se enfocó más en el segundo grupo, mediante la utilización de trampas de luz. Además, durante los años de muestreo (1993 a 2006), en el sitio de estudio no se utilizó la metodología de recolecta con trampas de frutas, y según DeVries (1987) el 40-55% del total de especies de Nymphalidae en bosques tropicales son frugívoros. De las 1 572 especies de Lepidoptera reportadas en el sitio de estudio, 77 corresponden a especies de mariposas diurnas de las familias Hesperiidae, Pieridae, Nymphalidae y Lycaenidae. No se registró ninguna especie de Papilionidae debido al factor altitud, ya que la mayoría de especies de esta familia se distribuyen en tierras bajas y medias (0-1 400 m) según DeVries (1987). Algunas especies de tierras altas (Papilio garamas syedra, P. polixenes stabilis y P. cleotas archytas) podrían estar presentes en el sector Altamira, pues según DeVries (1987), su ámbito de distribución es de 1 200-2 800 m, 500-1 800 m y en 153 tierras arriba de 1 300 m respectivamente. Chacón (1997) realizó un estudio en Fila Las Cruces (Coto Brus) y recolectó 390 especies de mariposas diurnas, incluyendo las tres especies mencionadas anteriormente, en sitios por arriba de los 1 200 metros. Por lo contrario, recolectó otras siete especies en sitios por debajo de los 1 200 m hasta los 700 m. De las 1572 especies de Lepidoptera registradas en la zona de estudio, 38 se obtuvieron mediante la metodología crianza de sus huevos, larvas y pupas. Es posible que los adultos de estas especies sean raros o que frecuentan hábitats poco explorados, lo cual dificulta su recolección en forma directa. Por otra parte, los adultos de varias de estas especies no son atraídos por las trampas de frutas ni por las trampas de luz. Para comprender mejor el conocimiento de los lepidópteros en el sitio de estudio, se analizó la biogeografía de algunos géneros que se han estudiado ampliamente en el Neotrópico. Esto permitió registrar 33 especies endémicas para la zona Nicaragua-Costa Rica-Panamá. Veintiocho de esas especies pertenecen a la superfamilia Papilionoidea (DeVries, 1987 y 1997), dos especies a la familia Dalceridae (Miller, 1994), una especie a la familia Hedylidae (Scoble, 1992b) y dos especies son de la familia Saturniidae (Lemaire, 2002). El 76% (52 especies) de las mariposas diurnas (Papilionoidea) registradas en Altamira son de hábitos nectarívoros y sólo el 23% (16 especies) son frugívoras (Figura 38). Esto se debe a que hay especies de mariposas frugívoras que habitan sólo en el dosel y difícilmente se pueden recolectar en el sotobosque. DeVries (1988) argumenta que especies que habitan en el dosel pueden ser recolectadas en bordes de bosque a nivel del suelo (con una red entomológica) debido a que las mariposas tratan el borde como un dosel en posición vertical donde los niveles de luz son los similares. Las mariposas diurnas Neotropicales se han clasificado en dos grandes grupos ecológicos dependiendo de la fuente alimenticia a la que se encuentra asociada el adulto, a saber: las especies frugívoras y las nectarívoras. Sin embargo, en la naturaleza no todo es específico y existen especies (por ejemplo Morpho helenor marinita) que se alimentan de los jugos de frutos en descomposición, por lo que es una especie frugívora. Sin embargo, los adultos de esta especie también visitan heces de mamíferos, excretas de aves y varias especies de hongos, de los cuales obtienen nutrientes. 154 Otras especies de mariposas diurnas (por ejemplo Heliconius spp.) visitan únicamente flores en busca de polen y nectar, por lo cual son especies nectarívoras. Estas especies además pueden visitar carroña animal, sin embargo no compite con especies frugívoras por su fuente de alimento principal, más bien comparten una fuente de alimento secundaria. Habría que hacer un estudio que determine los nutrientes que busca cada especie en particular en esas fuentes secundarias de alimento y determinar si están compitiendo o nó por ellas. Los datos anteriores reflejan que aún no se conoce bien la fauna de las mariposas diurnas (Hesperoidea y Papilionoidea) que habitan en el sector Altamira. Ya que se conocen unas 250 especies de mariposas frugívoras en el país y la relación de mariposas nectarívoras y frugívoras, es por lo general equivalente. Lo contrario sucede en algunas superfamilias de mariposas nocturnas tales como Noctuoidea, Geometroidea, Bombycoidea y Pyraloidea. En estos grupos se ha dado un mayor esfuerzo de trabajo (en Costa Rica) por parte de parataxónomos y taxónomos expertos. La biogeografía de las especies de la superfamilia Papilionoidea se analizó más detalladamente como un grupo referente dado el amplio conocimiento que existe de las mariposas diurnas (DeVries, 1987 y 1997; Lamas, 2004). De las 69 especies de Papilionoidea registradas en la EBA, 28 (40%) son especies endémicas para Nicaragua, Costa Rica y Panamá y la mayoría de éstas se registran sólo en Costa Rica y Panamá. El 29% (20 especies) tienen una distribución amplia en Centro y Suramérica (son especies principalmente de áreas abiertas). El 19% (13 especies) son de una distribución norte, restringida a Mesoamérica. El 12% (ocho especies) son de una distribución sur, es decir de Nicaragua hacia Suramérica hasta Perú o Ecuador (Figura 38). El análisis y aplicación de esta información puede adquirir un gran valor con respecto al estado de conservación de lepidópteros y su hábitat en el PILA, sector Altamira, así como en sus alrededores. Las 33 especies endémicas registradas en el sitio de estudio le dan a esta zona un gran valor en términos de conservación biológica. Esto adquiere aún más importancia al considerar que la distribución de estas especies está restringida a la región Talamanca-Chiriquí. Estos datos justifican la necesidad de conservar aún más el bosque prístino presente dentro del PILA, así como ampliar y proteger la cobertura boscosa en la zona de amortiguamiento de dicha Área Protegida, que actualmente se ve sometida y bajo presión de diferentes tipos de usos del suelo. Conformando el PILA, en conjunto con otras 155 Áreas Protegidas una Rerva de la Bioesfera (Borges, 2005), y estando el sector Altamira, entre las zonas de influencia y la zon núcleo de la reserva, hacen de este sitio un lugar ideal para realizar estudios de biodiversidad, tal como lo indican Halffter et al. (2001). Proporción de la distribución geográfica de los adultos de la superfam ilia Papilionoidea Proporción de los grupos ecológicos de los adultos de la superfam ilia Papilionoidea 1% 12% 23% 29% 19% 76% 40% Amplia Endémica Norte Sur Fruta Figura 38: Proporción de la distribución geográfica y grupos ecológicos Nectar Ambos de adultos de la superfamilia Papilionoidea. En una zona cercana al Sector Altamira (San Vito de Coto Brus) y de características similares, Horner-Devine et al. (2003) realizaron un estudio de las mariposas diurnas en la Reserva Forestal las Cruces (Estación Biológica de la OET) y las plantaciones de café de los lugares aledaños. Estos investigadores demostraron que las plantaciones de café con bosques remanentes poseen una mayor diversidad de especies de mariposas diurnas que las plantaciones de café sin bosque. Además quedó claro que dentro de la reserva se encontraron la mayoría de especies “raras” y todas las especies de distribución geográfica restringida (endémicas) a diferencia de las plantaciones cafetaleras donde no se encontraron ninguna de las especies endémicas. La función ecológica de los lepidópteros es otro aspecto importante en términos de conservación. La polinización, tanto de especies silvestres como agrícolas y ornamentales, es una de las principales actividades que cumplen muchas especies de Lepidoptera. Se evaluó la composición de la fauna de Papilionoidea en nectarívoros y frugívoros, así como el endemismo de este grupo en el sitio de estudio. De las 28 especies de Papilionoidea endémicas, 21 son nectarívoras y podrían tener asociaciones muy específicas con especies de plantas de distribución restringida o de 156 hábitats especializados. Uno de los grupos más importantes en la polinización de plantas son los lepidópteros de la familia Sphingidae. Varias especies de esfíngidos están asociadas a plantas, cuyas flores tienen estructuras especializadas, para que la polinización la realicen únicamente este grupo de insectos. Tal asociación se da a nivel de especies de Sphingidae que polinizan sólo algunas especies de orquídeas, creando un síndrome de polinización conocido como esfingofilia (Kitching y Cadion, 2000). El esfuerzo de trabajo de 1993 a 1998 es similar, el cual consistió en la recolecta de especímenes por medio de trampas de luz principalmente, así como el uso de red entomológica. En el periodo 1999-2000 no se realizaron recolectas en el sitio. En el 2001 se realizaron recolectas sólo en abril y setiembre. Durante el periodo 2002-2003 la recolecta se realizó en el sector Valle del Silencio. En el 2004 se inició con los estudios de ciclos de vida de lepidópteros, proceso que se prolongó hasta el año 2006. La curva de acumulación de especies de la Figura 4 tiende a estabilizarse, a pesar de lo poco uniforme del esfuerzo de muestreo y la variación de metodologías en los últimos años. También hay que tomar en consideración que en un inventario de diversidad biológica, a menudo resulta imposible registrar todas las especies de un área determinada (Gotelli y Colwell, 2001; citados por Jiménez-Valverde y Hortal, 2003). La curva de acumulación de especies puede indicar que ya se conoce una gran parte (si no la mayoría), de las especies de Lepidoptera esperadas para el PILA, sector Altamira, con lo que las probabilidades de que aparezcan nuevos reportes disminuye considerablemente. Sin embargo, si se lograra identificar a nivel de especie todos los especímenes de Lepidoptera, recolectados en el sitio de estudio, la posición de la curva podría cambiar de estable a mantenerse en crecimiento. Para lograr una cantidad significativa de nuevos reportes de estas especies, los futuros estudios deberán enfocarse en los hábitats menos accesibles e inexplorados. Ejemplo de esto es el dosel del bosque, en donde se podría emplear metodologías de recolecta como las trampas de frutas. Además se debe aplicar un mayor esfuerzo de trabajo en grupos taxonómicos específicos, como por ejemplo las superfamilias Hesperoidea y Papilionoidea o bien grupos en los que la taxonomía y sistemática aún es poco conocida. 157 Lo poco sistemática (en funciones estadísticas) de la metodología de inventario, hace imposible realizar ejercicios estadísticos paramétricos. Esto se debe a que la metodología de inventario aplicada por el INBio, ha sido con el único fin de registrar especies, descubrir y publicar las nuevas, dejando de lado el censo estadístico de la diversidad en las distintas áreas de estudio de Costa Rica. El INBio ha realizado inventarios de diversidad biológica (cantidad de especies y número de individuos por especie) de algunos grupos como plantas, hongos, moluscos marinos, mariposas diurnas y escarabajos coprófagos. Sin embargo, éstos estudios han sido puntuales (aislados) en tiempo y espacio geográfico, pues aunque el principal objetivo del INBio ha sido llevar a cabo el inventario nacional de la biodiversidad de Costa Rica, lo primero que se debía hacer (y aún se seguirá haciendo) es un inventario biológico, es decir, conocer la biota presente en el territorio costarricense sin tomar en cuenta su abundancia. Este primer paso es la base fundamental para que se continúe desarrollando estudios que permitan llevar a cabo el Inventario Nacional de la Biodiversidad, lo cual requiere de muchos años más, así como de recursos económicos y profesionales, que cada vez son más escasos. Para tener mayor claridad de la diversidad de especies de un grupo de insectos en un área específica, es necesario realizar inventarios más sistemáticos en periodos más cortos (dos a tres años). Por ejemplo Balcázar (2004) presenta un informe de la biodiversidad de Lepidoptera de las superfamilias Mimallonoidea, Lasiocampoidea, Bombycoidea y Pyraloidea con análisis estadísticos paramétricos, como curvas de acumulación de especies. Para realizar este estudio se basaron en la experiencia del INBio y la capacitación de parataxónomos en la recolecta e identificación de las especies de Lepidoptera de la Sierra Tarahumara en México. 6.2. Historia natural de 30 especies de Lepidoptera del sector Altamira. De las treinta especies tratadas en este apartado, se obtuvieron por primera vez, datos del ciclo biológico y de las plantas hospederas asociadas a diez especies de Lepidoptera, a saber: Amastus rumina, Bertholdia philoptera, Elysius melanoplaga, Opharus belus, O. procroides, Herpetogramma agavealis, Holophaea lycone, Dysschema cerialis, Pelochytta affinis, y Polypoetes villia. Además, se obtuvieron nuevos registros de plantas hospederas para otras diez de las especies de Lepidoptera presentes en el PILA (Amycles adusta, 158 Tarchon felderi, Astraptes fulgerator, Celaenorrhinus stallingsi, Telemiades gallius, Lirimiris fascis, Pteronymia picta notilla, Automeris banus, Gamelia musta, Perigonia stulta). De acuerdo con los datos de la colección de Lepidoptera del INBio, la zona de estudio (Altamira) se reporta como un nuevo punto de distribución para cinco de las especies tratadas (H. agavealis, Talides sinois cantra, C. stallingsi, T. gallius y Opsiphanes bogotanus alajuela). Por primera vez se asoció a los parasitoides de seis especies de Lepidoptera (A. adusta, H. agavealis, A. fulgerator, P. picta notilla, Opsiphanes quiteria talamancensis e Hypanartia dione arcaei). Se generó información de parasitoides asociados a varias de las especies de lepidópteros presentes en la zona de estudio. Ejemplo de ello es la recolecta de especies y géneros de Diptera nuevos para la ciencia (Cuadro 6; sección de anexos). Debido a la complejidad y dificultad de identificación taxonómica de los parasitoides himenópteros (especialmente la subfamilia Microgastrinae: Braconidae); no fue posible la determinación de los géneros, ni las especies, para muchos de los casos (Cuadro 7; sección de anexos). Especie 1: Amastus rumina Todos los individuos criados se recolectaron en segundo o tercer estadio larval. Las larvas mudaron en cuatro ocasiones antes de que puparan. Se determinó que la fase larval tarda en promedio 39 días. El día 40 la larva entra en su último estadio (prepupa), que tarda un día. El día 42 la pupa está bien formada dentro del capullo, el cual envuelven entre dos superficies de hojas. El adulto emerge al día 89, es decir que durante la fase de pupa tardó casi el mismo tiempo (47 días) que la fase de larva (39), ya que como se mencionó anteriormente, éste último dato es un promedio de la cantidad de días que tardaron las cuatro larvas criadas. Sin embargo, una de ellas tardó 45 días en la fase de larva. Tanto la larva como los capullos de la pupa presentan setas urticantes que producen comezón y dolor si se les manipula inadecuadamente y llegan a rozar la piel (excepto en las manos). Las larvas de A. rumina que se observaron, mostraron actividad nocturna, pues se alimentaban únicamente durante la noche. Durante el día prefieren estar bajo las hojas y otros sitios protegidos de la incidencia directa de los rayos del sol. Cuando se les manipula bajo alguna fuente de luz (como por ejemplo una bombilla eléctrica), buscan el sitio más oscuro posible. 159 Los lepidópteros son ectodermos y se ha demostrado que las larvas necesitan de la luz del sol para tomar energía y desarrollar el proceso alimenticio. Durante los primeros estadios, las larvas se exponen al sol antes de alimentarse. En los últimos estadios sucede lo contario: las larvas se alimentan y luego se exponen a los rayos del sol mientras digieren el alimento (Wasserthal, 2003; citado por Montero, 2007). Es probable que a las larvas de A. rumina no les moleste estar expuestas a la luz del sol en horas de la mañana o durante los días oscuros (nublados). Una de las larvas criadas se dispuso directamente bajo los rayos del sol con el fin de tomarle fotografías con luz natural. Tal larva mostró un comportamiento peculiar que hemos observado en otras especies de Arctiidae: mueven la cabeza y los últimos dos o tres segmentos abdominales levantándolos y en forma de zig-zag. Es decir, mientras la cabeza va a la derecha, el abdomen se dirige hacia la izquierda. Este movimiento lo realizan de manera continua y periódica durante aproximadamente un minuto. Luego de esto, la larva camina en busca de un sitio oscuro. Las larvas de esta especie tienen una coloración aposemática (ver Figura 5). Los colores negro, naranja y blanco son muy contrastantes tanto entre sí como con el verde de la vegetación. Mediante estos colores indican o advierten a sus posibles depredadores que tienen sabor desagradable. Esto les confiere cierta seguridad en comparación con las larvas de otras especies, las cuales tienen sabores no desagradables y por lo tanto deben esconderse. En cuanto a los hábitos alimenticios, las larvas de A. rumina son polífagas. Tres de las larvas criadas se recolectaron y criaron alimentándose del follaje de Gonzalagunia rosea. Las otras dos larvas se alimentaron en Melanthera aspera e Inga longispica. Estas plantas pertenecen a familias poco emparentadas entre sí y son especies comunes en bordes de bosque, orillas de senderos y bosque en regeneración. Las cinco larvas criadas se recolectaron en bosque secundario de los senderos Gigantes del Bosque, Casa Coca y el Límite-Río Platanillal. Se han recolectado 15 adultos de A. rumina en el Mirador del Sendero los Gigantes del Bosque, en el inicio del Sendero Límite-Río Platanillal y en el Sendero a Casa Coca, cerca de la Quebrada la Mina mediante las trampas de luz, a las cuales son atraídos. 160 Aunque los registros que se tienen en el PILA (EBA) son de sitios ubicados entre los 1 400 y 1 600 m, la información generada por medio de recolectas durante muchos años (INBio, 2007), demuestran que A. rumina es una especie que está presente en hábitats muy variados desde los 100 y hasta los 3 000 m en ambas vertientes. Es decir que su ámbito de distribución vertical es muy amplio, pues está presente en sitios casi desde el nivel del mar hasta algunos de los cerros más altos de Costa Rica en donde predomina el bosque nuboso y el páramo. Según Espinoza (com. pers.), aunque A. rumina es una especie común en Costa Rica y el resto de América Central, no existe información de historia natural asociada a esta especie. Por tal motivo, la información aquí expuesta y obtenida mediante este trabajo de investigación, viene a llenar parte de ese vacío de información. Especie 2: Bertholdia crocea La fase de larva tarda en promedio 12 días a partir del segundo estadio larval, tomando en cuenta que las tres larvas mudaron en dos ocasiones antes de llegar al último estadio larval (prepupa). Durante éste último período la larva tarda cuatro días (desde el día 13 hasta el día 16). La pupa se forma en el día 17 y el adulto emerge el día 45. Tanto las larvas como los capullos de las pupas poseen pelos urticantes que pueden irritar la piel. El adulto tiene una coloración atractiva: abdomen rojo, alas anteriores cafés con una muesca amarilla hacia el ápice y las alas posteriores amarillas. Las larvas no tienen colores tan atractivos como los adultos, sin embargo, en la parte dorsal poseen filas de tubérculos con una coloración azulada; y algunas de sus setas son blancas intrincadas en medio de las demás que son negras. Las tres larvas que se criaron se alimentaron de una sola especie de planta hospedera (Vernonia patens), por lo cual se puede sugerir que B. crosea es una especie monófaga. La planta hospedera es una especie propia de charrales y otros lugares abiertos tales como potreros, bordes de bosque y orillas de senderos. Las larvas se recolectaron en los Senderos Toma del Agua, Casa Coca y Límite-Río Platanillal. B. crocea se recolectó en la EBA-PILA a una altitud promedio de 1 450 m. Sin embargo, de acuerdo con la información extraída de INBio (2007), esta especie habita en tierras medias y altas de ambas vertientes (1 100- 2 000 m). 161 Especie 3: Bertholdia philoptera De acuerdo con los registros de testigos (Cuadro 5), esta especie es monófaga. Las cuatro larvas criadas en la EBA, se alimentaron del follaje de una sola especie de planta hospedera: Elaeagia auriculata. Esta planta está presente en bosque primario y bosque poco intervenido, como el presente al pie del Cerro Biolley. Tanto las larvas como los adultos tienen una coloración atractiva. El cuerpo de las larvas es de color negro, con los segmentos dos, cuatro, ocho y diez de color naranja. Los adultos tienen el abdomen de color blanco en la parte ventral y rojo en la parte dorsal (los últimos segmentos abdominales son negros en la parte dorsal). Ambos pares de alas son cafés con un área transparente hacia el subápice y margen costal de las alas anteriores. Las larvas tienen pelos urticantes que pueden causar irritación, dolor y comezón en la piel. La pupación ocurre dentro de un capullo construído con estos setas, los cuales siguen siendo urticantes aún después de que el adulto haya emergido. En la EBA-PILA, B. philoptera se recolectó a una altitud de 1 750 m. El ámbito de distribución altitudinal es amplio para Costa Rica. Según los registros de recolectas obtenidos de INBio (2007), éste lepidóptero se encuentra presente en ecosistemas de tierras bajas (200 m) hasta los de tierras altas (2 800 m.) en ambas vertientes. Especie 4: Elysius melanoplaga Los huevos son ovipositados en grupos. Las larvas son gregarias y se encontraron en grupos relativamente grandes. Esta es una estrategia de sobrevivencia: entre mayor sea la cantidad de individuos, se incrementa la posibilidad de cada uno para llegar a la fase de adulto. Por otra parte, el hecho de que permanezcan agrupadas puede favorecerles a razón de que un posible depredador o parasitoide se sienta confundido al ver un cuerpo voluminoso en vez de uno pequeño. En total se recolectaron 67 larvas en cuatro grupos: uno de 25, uno de 17, uno de 15 y otro de diez. Sin embargo, las larvas de esta especie tienen un alto índice de mortalidad, ya que de las 67 larvas, sólo ocho individuos llegaron a la fase de adulto. La coloración de los dos primeros estadios es muy diferente a los estadios cuatro y cinco. El tercer estadio es una 162 fase de transición entre ambas coloraciones. La larva en cuarto estadio (Figura 8) tiene una coloración atractiva, pues las setas son de colores naranja, negro y blanco. Estos pelos son urticantes tanto en la larva como en el capullo. E. melanoplaga es una especie monófaga pues todas las larvas criadas fueron recolectadas en una sola especie de planta hospedera: Mikania banisterae. Esta especie de planta crece frecuentemente en el bosque secundario de los senderos Toma del Agua, Casa Coca y Cerro Biolley. En la zona de estudio, E. melanoplaga se recolectó a una altitud de 1 350-1 760 m. Sin embargo, de acuerdo con la información obtenida de INBio (2007), la distribución de esta especie varía entre los 700 y 2 000 m en ambas vertientes. Especie 5: Opharus belus Las larvas de esta especie son atractivas. El color de las setas es negro en la mayor parte del cuerpo, sin embargo tienen penachos blancos insertados en los costados a lo largo de su cuerpo. Tanto en la parte anterior como posterior de su cuerpo las setas son mucho más largas que las del resto. Estas setas son urticantes y protegen tanto a las larvas como a las pupas. El adulto es de color café y en la parte dorsal de la cabeza y últimos segmentos del abdomen es amarillo con manchas negras. De acuerdo con los registros de las cuatro larvas que se criaron, esta especie es monófaga. Todas las larvas se recolectaron alimentándose del follaje Celtis iguanae. Esta especie de planta es común en el bosque secundario de los senderos Gigantes del Bosque y Sendero a Cerro Tonduz. Dos de los individuos criados se recolectaron en bosque secundario y dos en bosque primario, a una altura de 1,5-2,5 m sobre el suelo. Sólo dos de las cuatro larvas recolectadas llegaron a adultos. Para esta especie en particular se tuvo un 50% de mortalidad, obviamente en condiciones de crianza muy diferentes a su ambiente natural. Aunque todas las larvas puparon, dos de ellas se quedaron en la fase de pupa y el adulto no emergió aún después de seis meses de espera. Uno de los adultos es una hembra y el otro es un macho. Éste último proviene de una larva recolectada en el Sendero los Gigantes del Bosque. Esto es muy importante ya que se tienen datos del ciclo de vida de ambos sexos de O. belus. 163 En la EBA del PILA, las larvas de esta especie se recolectaron en un ámbito altitudinal de 1 450 a 1 600 m. Los adultos se han recolectado en esta misma altitud, mediante trampas de luz, a las cuales son atraídos. De acuerdo con los datos registrados en ATTA (INBio, 2007); la distribución geográfica de esta especie para Costa Rica no es tan amplia, pues se ha recolectado entre 800 y 1 700 m. de elevación en ambas vertientes. Especie 6: Opharus procroides Las tres larvas criadas se recolectaron durante el primer estadio, pues se contabilizaron cuatro cambios de muda. A partir del momento de la recolecta, el promedio de tiempo que duró la fase larval fue de un mes exacto (30 días). El último estadio larval (prepupa) tardó tres días (31 al 33). El día 34 la pupa estaba bien formada dentro del capullo. La fase de pupa tardó 33 días, pues el adulto emergió el día 67. En total se recolectaron y criaron tres larvas, las cuales alcanzaron la fase de adulto. Esta especie es polífaga. Una de las larvas se recolectó y crió alimentándose del follaje de Cecropia polyphlebia. La planta hospedera de las otras dos larvas fue Urera caracasana. Ambas especies son plantas colonizadoras de áreas abiertas. En el sitio de estudio, O. procroides se recolectó a una altitud promedio de 1 400 m, sin embargo, la especie se encuentra ampliamente distribuida en Costa Rica, en ambas vertientes, desde 800 hasta 2 100 m (INBio, 2007). Especie 7: Amycles adusta En el ACG, Janzen y Hallwachs (2005) ya habían reportado tres especies de plantas hospederas para A. adusta, a saber: Canna indica, Musa acuminata (especies introducidas) y Heliconia latispatha. Sin embargo, las plantas hospederas reportadas en la EBA-PILA son nuevos registros. Cinco de las larvas criadas se alimentaron de Heliconia tortuosa. La planta hospedera de las otras larvas fue Canna tuerkheimii. De acuerdo con los datos anteriores, las larvas de A. adusta son oligófagas. Sin embargo, todas las plantas están estrechamente relacionadas o emparentadas entre sí, pues son platanillas y pertenecen al orden Zingiberales. Estas plantas hospederas son comunes en áreas abiertas, principalmente en el bosque secundario, orillas de senderos, ríos, quebradas 164 y bordes de bosque, ambientes que son comunes en los Senderos Gigantes del Bosque y Límite-Río Platanillal. Las larvas de A. adusta presentan coloración de tonos naranjas. Durante el día están en el envés de las hojas, en follaje tierno (hojas aún no estiradas) o en follaje maduro que ellas mismas enrollan y del cual se alimentan libremente durante la noche. Los adultos de esta especie mimetizan en forma y color (Figura 11 d) a las avispas véspidas “Chías” o “Ala blanca” (Mischocyttarus atramentarius ó Parachartergus apicalis). Estos himenópteros se clasifican dentro de la familia Vespidae y tienen un aguijón con el cual pueden inocular sustancias irritantes (constituidas por ácidos y proteínas) con las cuales se defiende y atacan a sus enemigos. Este veneno puede causar gran dolor muscular e incluso a nivel de articulaciones. Por otra parte, los adultos de A. adusta se han observado volando durante el día. Este comportamiento, además del abdomen semi ensanchado (similar a la famosa “cinturita de avispa” presente únicamente en algunos Hymenoptera), les permite mimetizarse aún más a las avispas mencionadas; lo cual obviamente constituye un método de defensa ante sus posibles depredadores y demás enemigos. Sin embargo, las larvas de esta especie son las que con mayor frecuencia se observan parasitadas. Sólo la tercera parte (tres de nueve) de las larvas que se recolectaron llegaron a la fase de adulto. Las demás larvas (seis) murieron incluso antes de pupar, pues estaban parasitadas. Las larvas de la avispa parasitoide salen del cuerpo de su hospedero (larvas de A. adusta) en el cuarto estadio larval, antes de que el lepidóptero llegue a la fase de pupa. Una vez afuera, los Microgastrinae construyen capullos de seda (dentro de los cuales forman la pupa) sobre el dorso de la larva de Lepidoptera (Figura 11b). Después de que el parasitoide sale de su hospedero y pupa, las larvas de A. adusta pueden continuar viviendo hasta por siete días, tiempo durante el cual no se alimentan y van perdiendo su capacidad de locomoción hasta que la larva queda inmóvil y muere. Los adultos parasitoides tardaron 13 días para emerger desde el momento en que puparon. De las 20 pupas de Braconidae, 16 llegaron a la fase de adulto. En la zona de estudio, A. adusta se recolectó a una altitud promedio de 1 450 m. Sin embargo, con base en la información extraída de ATTA (INBio, 2007), la distribución de esta 165 especie se da desde los 200 hasta los 1 800 m en ambas vertientes. Aunque los adultos están activos durante la noche, es posible que también vuelen durante el día (Espinoza com. pers.). Especie 8: Holophaea lycone De las tres larvas que se recolectaron, emergieron dos adultos: un macho y una hembra. Una de las larvas murió atacada por un micro hongo. Las larvas de H. lycone son monófagas; se alimentaron de la planta: Symphonia globulifera la cual es una especie abundante en el bosque primario de Cerro Biolley. La coloración de las larvas es atractiva, ya que tanto la cabeza como los segmentos torácicos y los dos últimos segmentos abdominales son rojizos. El resto del cuerpo es de color negro. Las setas son negras con su ápice blanco. El capullo es de color amarillo y está construído con las setas urticantes de la larva. El adulto tiene las alas, cabeza y abdomen negruscas, con una mancha de color rojo en el primer segmento abdominal y los costados del tórax, cerca de la cabeza. En la zona de estudio, H. lycone se recolectó a una altitud promedio de 1 700 m. Con base en la información extraída de ATTA (INBio, 2007), esta especie está presente en ambas vertientes desde 800 a 1 800 m. Aunque algunos adultos de esta especie se han observado volando durante el día, la mayoría de registros provienen de recolectas en la trampa de luz. Especie 9: Dysschema cerialis Las tres larvas recolectadas puparon. Sin embargo, una de ellas murió (se secó), por lo cual emergieron sólo dos adultos. Las larvas de esta especie son monófagas y se alimentan de Baccharis trinervis. Esta planta es común en los charrales y bosque secundario. Tanto las larvas, como las pupas y adultos son atractivos (Figura 13). Las larvas poseen setas urticantes que mediante el capullo también protegen a la pupa. Las larvas son muy activas durante el día. Cuando se les manipula o sienten una fuente de luz natural o artificial, buscan refugio entre el follaje. Esta especie habita en tierras altas y medias de Costa Rica. Se ha reportado desde los 700 a 2 500 m en ambas vertientes. En la EBA-PILA, Las larvas de D. cerialis se recolectaron en los senderos Gigantes del bosque y Sendero a Casa Coca, a una elevación promedio de 166 1 500 m. Los adultos de esta especie se han observado y recolectado atraídos por las trampas de luz. Especie 10: Pelochyta affinis De las cuatro larvas recolectadas sólo emergió un adulto. Los otros tres individuos murieron por razones desconocidas uno en estado de larva y dos en estado de pupa. Las larvas de esta especie son monófagas, pues todas las larvas recolectadas se alimentaron de una sola especie de planta: Vernonia patens. La planta hospedera es común en charrales y otras áreas abiertas o en regeneración presentes en los Senderos Toma del Agua, Gigantes del Bosque y Sendero a Casa Coca. En la zona de estudio, P. affinis se recolectó en una elevación promedio de 1 500 m. Según la base de datos ATTA (INBio, 2007), P. affinis se ha recolectado en elevaciones desde el nivel del mar hasta 2 500 m en ambas vertientes. La Figura 14 permite ver que las larvas de esta especie tienen una coloración atractiva. En el dorso tienen penachos de setas urticantes de color rojizo, mientras que en los costados y en la parte frontal tienen setas negras. También tienen setas blancas del doble del tamaño que las demás, dirigidas hacia arriba y hacia adelante, tanto en la parte anterior como posterior y en los costados. Los pelos urticantes de la larva les protegen aún después que han pupado, pues el capullo está construido casi en su totalidad con éstos. El adulto tiene una coloración cafezusca en sus alas. La cabeza y parte ventral del abdomen y tórax es amarilla con manchas negras. La parte dorsal del tórax está cubierta por setas del mismo color que las alas, mientras que el abdomen es amarillo con manchas negras en cada uno de los segmentos abdominales. Estas manchas negras cubren casi todo el dorso del abdomen, de manera que sólo los costados son amarillos. Los adultos de esta especie son atraídos a las trampas de luz, en donde se han recolectado la gran mayoría de especímenes presentes en la colección. Especie 11: Tarchon felderi Durante el desarrollo de esta investigación se recolectaron siete larvas, de las cuales emergieron seis adultos. Una de las pupas murió por razones desconocidas. En la EBA esta especie se crió en tres especies de plantas hospederas. Dos larvas se alimentaron de 167 Elaeagia auriculata (bosque secundario en Senderos a Cerro Biolley y Casa Coca), cuatro larvas se alimentaron en Quercus rapurahuensis (sólo en bosque primario de Cerro Biolley) y sólo una larva se alimentó de Philodendron brenesii (bosque secundario de Cerro Biolley). El trabajo de investigación desarrollado por Janzen en el ACG ha permitido identificar 85 especies de plantas hospederas de T. felderi pertenecientes a 36 familias. Las tres especies de plantas reportadas en la EBA son nuevos reportes de hospederos para este lepidóptero. Una de las especies (Q. rapurahuensis) pertenece a la familia Fagaceae, la cual se reporta como un nuevo registro de familia hospedera para T. felderi. Con los datos mencionados anteriormente, se puede afirmar que las larvas de esta especie son polífagas. En la colección de insectos del INBio existen sólo cuatro especímenes (tres hembras y un macho) recolectados mediante trampas de luz en los parques nacionales Tortuguero, Carara, Corcovado y Guanacaste. Los seis especímenes criados en la EBA vienen a enriquecer esta colección. Es posible que T. felderi sea un complejo de varias especies muy semejantes y que se podrían diferenciar solamente por las larvas y/o estudios genéticos (Montero, com. pers.). Tanto por su forma como por su coloración, las larvas de T. felderi (Figura 15a) son unas de la más atractivas que se lograron recolectar en la EBA. La pupa y el adulto igualmente son atractivos. Las siete larvas que se recolectaron estaban en el segundo estadio larval. A partir de este momento, las larvas tardaron 85 días (casi tres meses) en pupar. Sin embargo, una de ellas estuvo 195 días (seis meses y medio) en fase larval. Es posible que esta larva no encontrara las condiciones óptimas requeridas para pupar. Se ha reportado que T. felderi tiene enemigos naturales en el ACG, en donde es atacada por tres especies de avispas parasitoides (Braconidae e Ichneumonidae). También se ha reportado especies de moscas parasitoides (Tachinidae) asociadas a las larvas de T. felderi (Janzen y Hallwachs, 2005). Especie 12: Herpetogramma agavealis Las larvas de H. agavealis son gregarias. Conviven juntas comiendo y defecando en grupo. Construyen algo similar a un nido, utilizando las hojas y ramitas de la planta hospedera, las cuales unen con seda. Dentro de ese nido el ambiente es muy húmedo y ahí habitan otras especies de insectos que desarrollan parte de su ciclo biológico, alimentándose de la materia 168 orgánica en descomposición (heces y hojas). Tal es el caso de adultos de la familia Staphylinidae (Coleoptera) y Phoridae (Diptera), así como las larvas de las familias Milichiidae y Drosophilidae (Diptera), los cuales se recolectaron y criaron conviviendo junto a las larvas de H. agavealis. Los primeros estadios larvales de esta especie son de color verde en la parte dorsal, con el vientre de color verde amarillento. La cabeza es de color negro brillante y presenta cuatro manchas negras dorsales en cada uno de los segmentos del cuerpo. Durante su último estadio larval (prepupa), el color de ésta se torna rojizo. La pupa se forma en medio de las hojas enrolladas de la planta hospedera, tiene una coloración caoba y no construye capullo. El adulto de esta especie es de color poco atractivo (Figura 16 f). Esta especie tarda en promedio 23 días en la fase de larva. Los últimos tres días corresponden al último estadio larval (prepupa). El adulto tarda 23 días en emerger. En total se recolectaron 28 larvas, siete de las cuales murieron en estado larval (individuos muertos por razones desconocidas). Las larvas de esta especie son polífagas, y se alimentaron del follaje de tres especies de plantas: Iresine diffusa (una larva), Heliocarpus americanus (11 larvas) y Celastrus vulcanicola (16 larvas). Estas plantas son típicas del bosque secundario en los senderos Gigantes del Bosque (1 450 m), Toma del Agua (1 400 m) y Cerro Biolley (1 700 m). De acuerdo con los datos obtenidos de ATTA (INBio, 2007) H. agavealis se había reportado desde el nivel del mar hasta 1 300 m en ambas vertientes. Esta investigación registra la especie a una elevación mayor y se reporta por primera vez para la Vertiente Pacífico de la Cordillera de Talamanca y el PILA. Lixophaga sp. (Tachinidae) es un díptero parasitoide que ataca las larvas de H. agavealis. Es posible que las larvas de Lixophaga salgan de las pupa del lepidóptero para formar el pupario. Los adultos del parasitoide emergen casi tres meses después de que pupa su hospedero (larva de H. agavealis). Especie 13: Talides sinois cantra La coloración de las larvas de esta especie es atractiva, son blancuzcas con cabeza de color naranja. Las larvas en último estadio (prepupa), producen una secreción serosa blancuzca 169 (como un talco) por medio de las glándulas abdominales. Es posible que esto les sirva como un repelente contra el agua y contra posibles parasitoides. La pupación ocurre en una hoja de la misma planta hospedera, la cual enrollan utilizando hilos de seda. La pupa es de color verde. El adulto tiene una coloración atractiva: tiene tonos cafés con un patrón de pintas amarillas tanto en sus alas anteriores como posteriores. El margen distal tanto de las alas anteriores como de las posteriores es de color naranja (Figura 17 e). De acuerdo con los datos obtenidos en esta investigación, las larvas de esta especie son monófagas. Las seis larvas recolectadas se alimentaron de la misma especie de planta: Heliconia tortuosa. Esta especie de planta es común en el bosque secundario de los Sendero a Cerro Biolley, Límite-Río Platanillal y Gigantes del Bosque. El adulto de esta mariposa está asociado con los bordes de bosque, orillas de senderos y bosques secundarios. Las larvas recolectadas se encontraron a una altura de 1,0-1,5 m sobre el suelo. En el ACG, Janzen y Hallwachs (2005) reportan 13 especies de plantas hospederas, de las cuales ocho son especies del género Heliconia. Las especies de plantas hospederas reportadas están muy emparentadas entre sí, por lo que T. sinois cantra se puede considerar como una especie oligófaga. Las especies reportadas son: Canna indica (introducida), H. irrasa, H. latispatha, H. longa, H. longiflora, H. mathiasiae, H. pogonantha, H. tortuosa, H. vaginalis, Maranta arundinacea, Musa acuminata, M. cavendishii (ambas especies introducidas) y Lasiacis procerrima. Esta especie de mariposa diurna se recolectó a una elevación promedio de 1 500 m, pero uno de los especímenes se recolectó a 1 700 m, en Cerro Biolley. De acuerdo con la información extraída de ATTA (INBio, 2007), T. sinois cantra se había reportado en elevaciones desde 0 a 800 m en ambas vertientes, por lo que esta investigación aporta un nuevo registro en el ámbito de distribución altitudinal de esta especie en la Cordillera de Talamanca y el PILA. De las seis larvas que se recolectaron, se obtuvieron cinco adultos, pues un individuo murió en la fase de pupa. En promedio, las larvas recolectadas tardaron 18 días en alcanzar la fase de pupa desde el momento en que fueron recolectadas. El último estadio larval (prepupa) tardó tres días y la pupa tardó 50 días. 170 Durante el desarrollo de esta investigación no se logró obtener datos de parasitoides asociados a esta especie de mariposa. Sin embargo en el ACG, Janzen y Hallwachs (2005) reportan 11 especies parasitoides, de las cuales seis son himenópteros (Alphomelon talidicida, Creagrura nigripes, Hyposoter sp., Baryscapus sp., Miotropis sp., y un Chalcididae) y cinco son dípteros (Blepharipa ciliata, B. fimbriata, B. sp., Patelloa xanthura y Spathidexia sp.). Especie 14: Astraptes fulgerator De las 12 larvas que se recolectaron, emergieron nueve adultos. Una de las larvas estaba parasitada por Braconidae (Hymenoptera), cuya especie no fue posible identificar. Las otras dos larvas murieron por razones desconocidas. A partir del momento de recolecta, las larvas tardaron 52 días en alcanzar su último estadio (prepupa), el cual tardó dos días más. La fase de pupa tardó 45 días. Las larvas de A. fulgerator son oligófagas, pues se alimentan del follaje de varias especies de plantas emparentadas entre sí. En la EBA se registraron cuatro especies: Hampea appendiculata (ocho larvas), Heliconia tortuosa (dos larvas) Senna papillosa (una larva), Vigna candida (dos larvas). Janzen y Hallwachs (2005) reportan otras cuatro especies como hospederas de A. fulgerator: Dioclea reflexa, Entada gigas, Inga sapindoides, S. hayesiana y S. papillosa. Las larvas de esta especie tienen una coloración atractiva (Figura 18 a y b). La parte ventral y la cabeza son de color rojo, mientras que la parte dorsal del resto del cuerpo es negra con dos manchas amarillas por cada segmento abdominal, una en cada costado. Las manchas del penúltimo segmento se unen y forman una sola mancha amarilla. El color grisáceo y la forma de la pupa también son atractivos (Figura 18 c). El adulto es bastante colorido: el área basal de las alas anteriores y posteriores es de color azul. La cabeza y parte del tórax es azul-verdoso. El resto del tórax y parte del abdomen (dorsalmente) es azul brillante. Las alas son de color café oscuro. Presentan cuatro celdas transparentes en el subápice y otras cuatro (más grandes) en el área postmedial de las alas anteriores. 171 Ventralmente presentan una mancha azulada en el margen costal del área basal. Las alas posteriores presentan una mancha blanca en el margen costal del área basal. El resto de la superficie ventral las alas es de color café claro. La cabeza, tórax y abdomen (ventralmente) es de color amarillento. Se han observado algunos adultos de A. fulgerator alimentándose del néctar de las flores de Melanthera aspera. De las 12 larvas recolectadas, nueve se recolectaron en bosque primario (Cerro Biolley) y tres en bosque secundario (Senderos Gigantes del Bosque y Límite-Río Platanillal). Todas las larvas se encontraron a una altura promedio de 1,5 m sobre el suelo. Los sitios en donde se observaron los adultos y se recolectaron las larvas de A. fulgerator tienen una elevación de 1 500 a 1 750 m. Según los registros de ATTA (INBio, 2007), esta especie se encuentra reportada en ambas vertientes, en elevaciones que van desde el nivel del mar hasta los 2 000 m. Es posible que nos estemos enfrentando a un gran complejo de especies, lo cual fue demostrado por Hebert et al. (2004). Este autor realizó estudios del ADN de especímenes de A. fulgerator en el ACG y concluye que se trata de diez posibles especies. Brower (2006) analizó los datos obtenidos del “Gen Bank” y criticó el trabajo de Hebert et al. (2004), y demuestra que no son más de siete especies. Sin embargo no se ha logrado determinar que exista polimorfía de larvas de A. fulgerator en el sector Altamira. Especie 15: Celaenorrhinus stallingsi Se recolectaron dos larvas y en ambos casos emergieron los adultos. Los dos individuos criados tardaron 48 días en la fase de larva. El último estadio larval (prepupa) tardó dos días. La fase de pupa tardó 21 días. La única especie de planta hospedera reportada para las larvas de esta especie en la EBA es Dicliptera iopus, la cual crece en bosque primario y secundario, principalmente en Cerro Biolley. En el ACG, las larvas de C. stallingsi se alimentan de Aphelandra scabra y Justicia macrantha (Janzen y Hallwachs, 2005). Las tres especies de plantas hospederas de las cuales se alimentan las larvas C. stallingsi, pertenecen a una sola familia: Acanthaceae. De manera que los hábitos alimenticios de estas larvas son monófagos. En el ACG, C. stallingsi es atacada por dos especies de parasitoides: Hyphantrophaga virilis (Tachinidae) y una especie no identificada de la familia Braconidae (Janzen y Hallwachs, 2005). 172 Las larvas son semi transparentes y es posible observar algunos de sus órganos internos. El primer segmento torácico es amarillo y la cabeza es rojiza (Figura 19 a y b). La pupa es de color crema y el adulto es de color café claro, con un patrón de celdas transparente en el área medial y en el subápice del ala anterior. Los especímenes se recolectaron en una elevación de 1 750 m. Según la consulta realizada a ATTA (INBio, 2007), C. stallingsi sólo se había recolectado en el lado oeste del Volcán Orosí a 600 m. Este trabajo de investigación viene a llenar parte del vacío de información que hay para esta especie en particular. En el ACG, esta especie se ha recolectado en varios sitios con elevaciones que van desde 300 a 1 100 m (Janzen y Hallwachs, 2005). Con la información disponible hasta el momento, el ámbito de distribución de C. stallingsi va desde los 300 a los 1 750 m de la Vertiente Pacífico. Especie 16: Telemiades gallius El único individuo criado tardó 31 días en la fase de larva (ultimos dos días en prepupa) y 30 días en la fase de pupa. La coloración de la larva es atractiva: su cabeza, primer segmento torácico y último segmento abdominal son de color naranja. El resto del cuerpo es verde con manchas amarillas en ambos costados, dos por cada segmento, a partir el segmento II. La pupa es de color crema. El adulto es de color café oscuro, con el torno del ala posterior de color amarillo. La larva recolectada en la EBA se alimentó de Inga oerstediana. En el ACG, lal larvas de esta especie se alimentan de I. sapindoides (Janzen y Hallwachs, 2005). Con la información disponible hasta el momento, se argumenta que las larvas de T. gallius son monófagas. Esta especie se reporta en la EBA, en bosque primario del sendero Gigantes del Bosque, a 1 450 m. En el ACG, T. gallius se ha recolectado en elevaciones intermedias de 500 a 900 m de la Vertiente Pacífico (Janzen y Hallwachs, 2005). Los individuos criados de esta especie son los primeros especímenes que se depositan en la colección del INBio y son el primer reporte de esta especie en la Cordillera de Talamanca y el PILA. Hasta el momento no se tiene información de parasitoides que ataquen esta especie de mariposa. 173 Especie 17: Nymphidium ascolia ascolia Se recolectaron seis larvas, de las cuales emergieron cuatro adultos. Las otras dos larvas murieron por razones desconocidas. En promedio, los individuos recolectados tardaron 19 días en la fase de larva (últimos dos días en prepupa) y 16 en pupa. Tres de las larvas se alimentaron en Inga longispica, dos se alimentaron en I. oerstediana y una en Senna papillosa. Las larvas de N. ascolia ascolia son monófagas, pues las tres especies de plantas hospederas pertenecen a la familia Fabaceae y son muy comunes sobre todo en el bosque secundario. DeVries (1997) reporta que los huevos son de color blanco y con forma de globo. La coloración de las larvas maduras es verde amarillento, con la cabeza café claro pálido y con bandas blancas en los costados y en el centro del dorso. La pupa es de color café claro. El adulto es atractivo: dorsalmente es de color amarillo con una banda café oscuro en el margen distal y costal y una banda rojiza en el área submarginal del ala posterior. Según DeVries (1997), esta banda es variable y puede estar ausente en algunos individuos. No existe dimorfismo sexual. Según DeVries (1997), las hembras depositan los huevos en grupos de ocho a 15, en un nervio prominente o en brotes tiernos. Los huevos son ovipositados generalmente entre las 11:00 a.m. y 12:30 p.m. en presencia o no de sus hormigas asociadas. Las larvas de N. ascolia ascolia están estrechamente asociadas con hormigas de los géneros Paratrechina (Formicinae), Crematogaster, Pheidole, Solenopsis y la especie Megalomyrmex foreli (Myrmicinae). Estas larvas no producen sonidos o llamados, pero sí poseen papillas vibratorias (DeVries, 1997). Junto a las larvas de N. ascolia ascolia recolectadas en la EBA, se encontraron hormigas de la especie Pheidole biolleyi (Formicidae). Las hormigas vigilan constantemente las larvas de la mariposa y las protegen ante cualquier posible depredador. A cambio, la larva les proporciona una sustancia azucarada que segrega mediante unas glándulas especializadas para este fin, las cuales posee cerca de la cabeza. La relación es tan estrecha que si las hormigas llegan a faltar, la larva muere (obs. pers.). Por este motivo, para criar esta mariposa fue necesario recolectar tanto las larvas de la mariposa como las hormigas. 174 Las larvas recolectadas se encontraron a una altura de 1,0-2,5 m sobre el suelo en bosque secundario de los senderos el Límite-Río Platanillal, Casa Coca y Cerro Biolley, en una elevación de 1 400 a 1 600 m. Según la consulta realizada a ATTA (INBio, 2007), N. ascolia ascolia se ha registrado en ambas vertientes en tierras bajas y medias, en elevaciones entre cero y 1 600 m. La pupa se forma dentro de una hoja semi-enrollada de la misma planta hospedera o incluso de otra. Es posible que los adultos vuelen solitarios durante las horas más soleadas del día (9:30 a.m. - 2:00 p.m.) en áreas abiertas tales como bordes de bosque, orillas de senderos, caminos y quebradas (DeVries, 1997). Especie 18: Lirimiris fascis La fase larval (cuyo último estadio tardó tres días) se extendió durante 18 días, en la cual tardaron tres días. La fase de pupa tardó 46 días y emergieron cuatro adultos. Las larvas se recolectaron en bosque poco alterado, en Cerro Tonduz (1 750 m) y bosque secundario en el sendero Gigantes del Bosque (1 450 m). De acuerdo con la consulta realizada a ATTA (INBio, 2007) esta especie se ha recolectado desde el nivel del mar hasta los 1 900 m, en ambas vertientes. Con estos datos, se prevé que la distribución de esta especie esté restringida a elevaciones bajas y medias. En la EBA, las larvas de L. fascis se alimentan del follaje de Mortoniodendron abelianum y de Malvaviscus arboreus. Aunque estas dos especies de plantas hospederas se clasifican en familias aparte, están muy emparentadas entre sí, por lo cual las larvas son olígófagas. Esto se fundamenta con la información tomada de Janzen y Hallwachs (2005), quienes en el ACG registran a Malvaviscus arboreus, M. palmanus y Mortoniodendron guatemalense como plantas hospederas de L. fascis. Las larvas de esta especie son atractivas (Figura 22 a). Su cuerpo es de color amarillo con una línea negra longitudinal en el centro del dorso. A partir de esta línea y en dirección opuesta y hacia la parte ventral, inician otras líneas negras. La cabeza, primer segmento torácico y último segmento abdominal son rojizos. En ambos extremos del cuerpo tienen un penacho de setas urticantes de color blanco, las cuales también están presentes en el resto del cuerpo, pero en menor cantidad. Durante el último estadio larval (prepupa), la larva pierde sus pelos urticantes y sus últimos dos segmentos abdominales se engrosan, de manera que pareciera tener dos cabezas 175 (Figura 22 b). El color amarillo de la larva se torna casi naranja y su cuerpo se observa más robusto y ensanchado. La larva construye un capullo similar a una cápsula dentro de la cual ocurre la pupación. Esta estructura es transparente (Figura 22 d) y está hecha de un material chicloso, similar a la goma blanca cuando se seca. La pupa (Figura 22 e) se protege dentro de un capullo cuya apariencia, forma y color es la de una semilla. Esto les puede servir como una estrategia de protección que les permite pasar desapercibidos de posibles depredadores, tomando en consideración que en su estado natural, la mayoría de los lepidópteros de esta familia pupan en el suelo (Covell, 1984). Los adultos tienen una coloración atractiva (Figura 22 c). Aunque los colores son beige y café suave, la composición en sí hace que el dorso de las alas parezca una superficie irregular, similar a la corteza de un tronco. Ventralmente, tanto las alas como el abdomen son de color amarillo-crema. Enicospilus simoni (Ichneumonidae) es una avispa parasitoide que en el ACG ataca las larvas de L. fascis (Janzen y Hallwachs, 2005). En la EBA no se reportó ningún parasitoide para esta especie. Especie 19: Polypoetes villia Las larvas de esta especie se encontraron alimentándose durante la noche. Durante el proceso de crianza, continuaron alimentándose sólo durante la noche. La planta hospedera fue identificada como Malvaviscus arboreus. Esta especie se encuentra en bosque primario, aunque ocasionalmente se puede observar en áreas abiertas (charrales y bordes de bosque) de los senderos a Casa Coca y Gigantes del Bosque. De las tres larvas recolectadas sólo emergió un adulto hembra. Las otras dos pupas murieron por razones desconocidas. Es la primera vez que se registra la planta hospedera de las larvas de P. villia. Las larvas recolectadas se encontraron a una altura 1,5 m sobre el suelo, en el sendero Gigantes del Bosque, en una elevación de 1 450 m. Sin embargo, de acuerdo con los datos obtenidos de ATTA (INBio, 2007), esta especie se distribuye en tierras medias y altas (1 000 a 2 800 m) de ambas vertientes. 176 Las larvas son de color gris, con una franja negra en ambos costados, a lo largo del cuerpo. Esta franja negra está en medio de dos líneas paralelas de color amarillo. De manera que tanto el dorso como el vientre de la larva son grises (Figuras 23 a y b). La pupa tiene una coloración atractiva (Figura 23 c): es amarilla con un patrón de manchas negras. En los adultos, el área discal de las alas posteriores es transparente y parecieran ser de color blanco. Cerca del subápice de las alas anteriores también presentan una pequeña celda transparente. La venación de las alas anteriores es de color naranja. En el tórax presentan un par de rayas de este mismo color. El resto de las alas y del cuerpo es de color gris oscuro (Figura 23 d). Especie 20: Memphis beatrix Se recolectaron dos larvas, las cuales tardaron 19 días desde el segundo hasta el último estadio larval (prepupa) el cual tardó dos días. La fase de pupa tardó 25 días. Las larvas de M. beatrix son monófagas, puesto que los registros de crianza tanto en las EBA como en el ACG han demostrado que este lepidóptero se alimenta de ocho especies de un solo género de Piper. De acuerdo con Chacón (2002a) y DeVries (1987), los adultos se alimentan de los nutrimentos que obtienen al embeber los jugos de frutos en fermentación. Las larvas de esta especie son de color negro con setas blancas, las cuales son engrosadas en la base. Las setas están presentes en todo el cuerpo, incluyendo la cabeza (Figura 24 a y d). Según DeVries (1987), las larvas maduras tienen el cuerpo de color castaño oscuro con pelos blanquecinos, la parte frontal es de color negro y la cápsula cefálica es redondeada y con una corona de tubérculos amarillentos, negros y rojizos. La pupa es de forma convexa y tiene un color verde amarillento con manchas cafés (Figura 24 b y c). La forma y coloración del adulto es atractiva (Figura 24 e). DeVries (1987), afirma que los adultos presentan un marcado dimorfismo sexual. La longitud del ala anterior en los machos es de 35-38 mm, mientras que en las hembras es de 37-40 mm. Las alas anteriores tienen una muesca en el torno. Las alas posteriores tienen una cola en el torno. Ambos pares de alas son de color azul desde la base en el tórax hasta más o menos el área media, a partir de aquí son negras. En el subápice de las alas anteriores presentan tres manchas azules unidas entre sí. El dorso del tórax y parte del abdomen presentan setas 177 azuladas que dan la impresión de un azul intenso dependiendo del ángulo en que se observe. Ventralmente tienen una coloración críptica, lo cual les sirve como defensa ante sus posibles depredadores. Las alas parecen hojas secas, de manera que si la mariposa se posa con las alas plegadas, se puede confundir fácilmente en la vegetación seca. M. beatrix es una especie endémica de Costa Rica y Panamá. En nuestro país se ha reportado en ambas vertientes, en elevaciones que van desde 700 a 1 600 m. Sin embargo, las dos larvas recolectadas se encontraron en una elevación de 1 700 y 1 800 m respectivamente, lo cual representa dos nuevos puntos de recolecta en su ámbito de distribución altitudinal. Especie 21: Pteronymia picta notilla Los huevos recolectados tardaron seis días en eclosionar. De los 97 huevos eclosionaron 67 larvas, las cuales tienen un proceso de crecimiento y desarrollo rápido: en 18 días ya han pasado por todos sus estadios larvales. La prepupa tarda dos días. Una vez que pupan, los adultos tardan nueve días en emerger. De las 67 larvas eclosionadas, murieron 25, la mayoría en primero y segundo estadio. De manera que 42 individuos puparon. De esas 42 pupas, siete murieron por razones desconocidas y emergieron sólo 35 adultos. Según DeVries (1987), los huevos de esta especie se encuentran solitarios, pues son ovipositados individualmente. Sin embargo, los que se recolectaron durante esta investigación estaban en grupos, uno de 57 y dos de 20 unidades respectivamente. Los 97 huevos recolectados se encontraron adheridos al envés de las hojas; incluso en la misma planta hospedera en donde ya había larvas de la misma especie. Tanto los huevos, como las larvas, pupas e incluso los adultos son gregarios y es posible encontrar varios estadios larvales e incluso las tres fases (huevos, larvas y pupa) al mismo tiempo y en una sola planta. Los huevos son de color blanco y los dos primeros estadios larvales son de color verde. A partir del tercer estadio, las larvas tienen la cápsula cefálica de color negro brillante, el dorso es negro y con una raya blanca central a lo largo de todo el cuerpo. Durante su primer estadio, las larvas permanecen juntas y esqueletizan el centro de la hoja. 178 En estadios larvales más avanzados (dos y tres), las larvas se dispersan por la planta y se alimentan en toda la superficie de la hoja, sin embargo parecen tener preferencia por los brotes tiernos. Las larvas de esta mariposa son monófagas, pues su alimentación está restringida a cuatro especies de plantas, todas de la familia Solanaceae. Mediante esta investigación se aportó un nuevo registro (género y especie) de planta hospedera, pues anteriormente sólo se habían reportado tres especies del género Solanum. En la EBA, la mayor cantidad de larvas se observa entre mayo y julio. A partir de agosto la presencia de larvas disminuye significativamente y se observan grupos de adultos posados en piedras y troncos de árboles caídos. En setiembre, no se encuentran huevos ni larvas en los senderos de la estación. Conforme se acerca la época lluviosa, los adultos migran hacia sitios de menor altitud en busca de plantas hospederas. Según DeVries (1987), durante los cambios de las épocas seca y lluviosa, P. picta notilla sufre fluctuaciones en su abundancia en las áreas del Valle Central. Las pupas son atractivas y crípticas, pues son de color gris metálico. Los adultos de P. picta notilla se observaron alimentándose del néctar en las flores de Melanthera aspera. Esto ocurrió en horas de la mañana, en áreas abiertas y en días soleados. En cuatro ocasiones se observaron adultos embebiendo sales minerales en deyecciones de aves que había en la vegetación a orillas del Sendero Gigantes del Bosque y Sendero a la Toma del Agua. Los adultos (al igual que las larvas) están activos durante el día, principalmente en la mañana, sin embargo disminuyen su actividad conforme llega la tarde o el sol es cubierto por las nubes. Según DeVries (1987), el vuelo de los adultos es lento y bajo, principalmente en los bordes de los parches boscosos. Además, este mismo autor afirma que los adultos tienen un marcado dimorfismo sexual. En algunos lugares, a estas mariposas se les conoce con el nombre vernáculo de “espejitos o alas de vidrio”, pues la mayor parte de la superficie de sus alas es transparente. Los márgenes (costal, anal y distal) de las alas, así como su venación, la cabeza, el tórax y el abdomen son de color negro. Esto les favorece para escapar de posibles depredadores ya que al ser transparentes se confunden con el entorno. 179 De acuerdo con la consulta realizada a ATTA (INBio, 2007), esta especie se ha recolectado en tierras con elevaciones de 500-1 200 m en la vertiente Caribe y de 800 a 1 600 m en el Pacífico. En el área de estudio, P. picta notilla se ha observado y recolectado en los Senderos Gigantes del Bosque, Cerro Biolley, Toma del Agua y Sendero a Casa Coca, sitios que se encuentran en elevaciones entre 1 500 a 1 700 m. Esta última cifra corresponde a Cerro Biolley y hasta el momento es la parte más alta en que se ha registrado la especie. Sin embargo, DeVries (1987), afirma que el ámbito de distribución de P. picta notilla es 800 a 2 000 m y que está presente desde Costa Rica hasta Colombia. En la EBA se reportó un parasitoide que ataca los últimos estadios larvales de P. picta notilla. Se trata de una mosca parasitoide de la familia Tachinidae de un género nuevo cercano a Myiopharus, lo cual significa un nuevo aporte para la ciencia (Wood, com. pers.). La larva de la mosca emerge de la crisálida, pupa fuera de ésta y luego de 20 días emerge el adulto parasitoide. Especie 22: Caligo brasiliensis sulanus Las tres larvas recolectadas en la EBA se alimentaron de Heliconia tortuosa. Aunque se han reportado otras especies de este mismo género de planta, además de especies de otros géneros y familias como Calathea y Musa (DeVries, 1987), todas son plantas emparentadas ya que pertenecen al orden Zingiberales. Por esta razón, es posible afirmar que las larvas de C. brasiliensis sulanus son oligófagas. Los adultos se alimentan de los nutrimentos que obtienen al embeber los jugos de frutos en descomposición. En promedio, las larvas tardan 35 días desde el segundo hasta el quinto estadio. Esto se determinó puesto que se contabilizaron tres mudas (cápsulas cefálicas) desde el momento en que se recolectaron las larvas hasta el último estadio larval (prepupa), que tardó tres días. Una de las larvas murió porque estaba parasitada. La fase de pupa tardó 38 días. Las larvas son muy similares en coloración y forma después del primer estadio. Las larvas maduras tienen seis penachos en el dorso con apariencia de espinas (Figura 27 b), las cuales son de color café un poco más oscuro que el resto de su cuerpo. Las patas torácicas son de color rojo y los propodios son cafés. La cápsula cefálica tiene una coloración café con ocho cuernos (Figura 27 a), los cuales son curvados hacia afuera (dorsales) y hacia adentro (laterales). 180 Durante el último estadio larval (prepupa) el cuerpo se ensancha, luce más corto y gordo que en cualquiera de los demás estadios (Figura 27 c). La larva teje una almohadilla de seda en la superficie de la hoja o donde vaya a pupar. Ahí enclava el cremáster y se cuelga cabeza abajo. La pupa es de aspecto robusto y de color café claro. En el dorso tiene una línea longitudinal y varias líneas transversales a ella, que le dan un aspecto similar a la venación de una hoja seca, con la cual se camufla en color y forma. Cerca de la base de las antenas, la pupa muestra una mancha blanca en cada costado, una grande de forma triangular y otra más pequeña de forma ovoide. Estas manchas se mantienen en la exubia aún después que el adulto ha emergido. La coloración críptica de esta mariposa es muy interesante. La superficie dorsal de ambos pares de alas desde la base hasta el área media es gris-azulado (Figura 27 f). El área postmedial y marginal de las alas posteriores es de color negro. Ésta misma área en las alas anteriores tiene una franja ancha negra seguida de matices naranjas y café claro. En el subápice de cada una de las alas anteriores, cerca del margen costal presentan tres manchas blancas. La superficie ventral de las alas (Figura 27 e) tiene una coloración grisácea. Presenta ocho ocelos, que en las alas posteriores son más grandes, negros y están rodeados de un anillo amarillo y otro anillo negro. Estos dos ocelos (15 mm de diámetro cada uno) semejan los ojos de una lechuza o búho, razón por la cual, en algunos lugares, esta especie se conoce con el nombre vernáculo de “mariposa búho”. Esta coloración le permite a la mariposa confundir o asustar a sus posibles depredadores (lagartijas y aves principalmente). En los adultos, la longitud del ala anterior es de 77-91 mm (DeVries, 1987). Esta es la mariposa diurna más grande que existe en Costa Rica. Las larvas se recolectaron a orillas del Sendero Gigantes del Bosque, en áreas abiertas cerca del Mirador. Se observaron y recolectaron cinco adultos en el Sendero Gigantes del Bosque y tres adultos en Sendero Cerro Biolley-Cerro Tonduz. Estas mariposas volaban en bosque primario, a orillas de los senderos durante las tardes o en las mañanas de días nublados. 181 El comportamiento del vuelo de esta especie es muy similar a otras especies de Caligo. La actividad de vuelo se da principalmente en horas crepusculares, se le observa durante la mañana y tarde, pero en lugares con bastante sombra (como el sotobosque) o en lugares abiertos pero cuando el día es nublado. El vuelo es muy bajo y algo rápido. C. brasiliensis sulanus es distintivamente atractiva cuando vuela por los destellos de luz azul iridiscente que produce. Según DeVries (1987), en condiciones de cautiverio C. memmon y C. brasiliensis se han entrecruzado, generando un híbrido similar a C. brasiliensis. Los puntos de recolecta, tanto de adultos como de larvas de C. brasiliensis sulanus en la EBA se sitúan entre 1 400 y 1 700 m. Esta última cifra representa un nuevo punto de elevación en que se encuentra la “mariposas búho”, pues según Chacón (2001b), esta mariposa está presente desde el nivel del mar hasta 1 500 m en ambas vertientes. DeVries (1987) menciona que la subespecie está presente desde Guatemala hasta Panamá y que la especie (C. brasiliensis) se distribuye desde Guatemala hasta la cuenca del Amazonas. Solís (2007) menciona dos especies de Hymenoptera que son endoparasitoides idiobiontes en los huevos de esta mariposa. En el ACG, las larvas de C. brasiliensis sulanus son atacadas por cuatro especies de parasitoides: dos especies de Diptera y dos de Hymenoptera (Janzen y Hallwachs, 2005). Sin embargo, en la EBA no se reportó ninguna de esas especies parasitoides. Especie 23: Opsiphanes bogotanus alajuela Durante el proceso de investigación se recolectaron seis larvas, que en promedio tardaron 26 días desde el segundo y hasta el último estadio larval (prepupa), el cual tardó dos días. La fase de pupa se prolongó durante 29 días hasta que emergió el adulto. Las larvas de O. bogotanus alajuela son oligófagas, pues se alimentan exclusivamente de plantas de dos familias muy emparentadas entre sí: las platanillas (Heliconia spp) y los bananos (Musa spp), las cuales son especies introducidas. En la EBA, las larvas se alimentaron exclusivamente de Heliconia tortuosa. En el ACG, Janzen y Hallwachs (2005) reportan ocho especies de plantas hospederas, todas ellas de las familias Heliconiaceae y Musaceae. 182 El cuerpo es de color verde amarillento, con rayas longitudinales de color verde oscuro. Tienen una franja de color naranja en el centro del dorso, la cual está en medio de dos franjas celestes (Figura 28 a y b). La cápsula cefálica posee ocho cuernos de color naranja: tres en cada costado (cortos y rectos) y dos que nacen en la parte superior de la cabeza. Éstos últimos son curvados hacia fuera y son mucho más largos (Figura 28 c). Algo muy característico de las larvas de este grupo es que tienen una cola caudal bífida la cual puede variar en coloración dependiendo del estadio larval en que se encuentre, sin embargo suelen ser anaranjadas (Figura 28 d). Cuando están en prepupa, las larvas construyen una almohadilla de seda adherida al sustrato donde van a pupar (en algunas ocasiones en el follaje de la planta hospedera, pero no siempre). Esta estructura la construyen con el hilador labial y les sirve para adherirse con el cremáster y colgarse cabeza abajo. Poco a poco el cuerpo de la larva se torna de un color verde-grisáceo y se va ensanchando, hasta que la larva luce más gorda y corta que en los estadios anteriores (Figura 28 e). El color de los cuernos cefálicos y de la cola caudal cambia de naranja a un tono grisáceo. La pupa es de color verde y dependiendo de la posición en que se observe pareciera una hoja (Figura 28 f). Según DeVries (1987), los estadios inmaduros de esta especie no se han descrito; Janzen y Hallwachs presentan datos del ciclo biológico de esta especie y esta investigación aporta información nueva. La superficie dorsal de las alas es café oscuro. La longitud del ala anterior es de 41-58 mm. En las hembras el ala anterior tiene una banda naranja y el borde es dentado. Las alas anteriores de los machos tienen el margen más excavado y el ápice más agudo. En el ala posterior, el margen es más ondulado. Los machos presentan una banda ancha de color naranja, en sentido transversal del área media en el margen costal hasta el torno de las alas anteriores. En el ápice de las alas anteriores tienen tres manchas blancas (Figura 28 g). La coloración ventral es compleja (Figura 28 h). Presentan seis ocelos: dos en las alas anteriores y cuatro en las posteriores. La banda de color naranja presente en el dorso también es visible en la superficie ventral, especialmente cerca del torno. Esta coloración críptica le permite al adulto confundir o asustar a sus posibles depredadores. Incluso la 183 mariposa puede pasar desapercibida cuando sus alas están plegadas y está posada sobre una superficie con hojas secas. Los adultos son activos durante el día. De las diez larvas criadas, ocho provienen de bosque secundario y sólo dos de bosque primario. En las plantas hospederas en donde se recolectaron las larvas, éstas estaban entre 0,5-1,5 m sobre el suelo. En la EBA, las larvas y adultos de O. bogotanus alajuela se recolectaron entre 1 300 y 1 800 m principalmente en bordes de bosque primario y orillas de los Senderos Gigantes del Bosque, Cerro Biolley y Casa Coca. La especie O. bogotanus está presente desde Costa Rica hasta Colombia (DeVries, 1987). Chacón (2002c), menciona que la subespecie se distribuye desde el nivel del mar hasta 1 500 m en la falda este de las cordilleras de Talamanca, Volcánica Central, Tilarán y las llanuras de Sarapiquí. En todo caso, las recolectas realizadas en la zona de estudio (EBA) representan un nuevo registro de distribución para la subespecie, especialmente las recolectas realizadas en los Senderos a Casa Coca y Cerro Biolley, en donde se registra una elevación superior a las reportadas anteriormente. Chrysotachina sp. es una especie de Tachinidae que parasita las larvas de O. bogotanus alajuela. Estas moscas son endoparasitoides koinobiontes gregarios que atacan los últimos estadios larvales de la mariposa. Es probable que la mosca adulta ponga sus huevos sobre la larva hospedera y cuando ésta pupa, los parasitoides empiezan a alimentarse de sus tejidos internos. De la pupa parasitada de O. bogotanus alajuela emergen hasta tres larvas parasitoides, las cuales pupan en el exterior de su hospedero y luego de 27 días emergen los adultos. En el ACG, Janzen y Hallwachs (2005) reportan tres especies parasitoides, dos de ellas son dípteros y la otra es himenóptero. Especie 24: Opsiphanes cassina Las tres larvas recolectadas en la EBA se alimentaron del follaje de dos especies de palmas. En el ACG Janzen y Hallwachs (2005) reportan diez especies de palmas diferentes a las que 184 se reportaron en la EBA. Con este nuevo aporte, la lista de plantas hospederas para las larvas de O. cassina aumentó a 12 especies. Es posible afirmar que las larvas de esta mariposa son oligófagas, puesto que su alimentación está restringida a la familia Arecaceae. Sin embargo, Janzen y Hallwachs (2005) registran el caso de una larva de O. cassina alimentándose en el follaje de Heliconia latispatha. Los tres individuos recolectadas estaban en penúltimo estadio larval. Esto se determinó puesto que tres días después de su recolecta estaban en prepupa y tres días mas tarde alcanzaron la fase de pupa, período que se extendió durante 25 días. Al final emergieron tres adultos. La forma y coloración de las larvas, pupas y adultos de O. cassina es muy semejante a los de O. bogotanus alajuela. Sin embargo, las larvas de O. cassina no presentan la franja de color naranja en medio de dos líneas celestes que presentan las larvas de O. bogotanus alajuela (Figura 29 a). Además, la cápsula cefálica de O. cassina presenta cuatro cuernos de color rojo con las puntas de color negro brillante (Figura 29 b) y la cola caudal es de color celeste-grisáceo. La pupa es convexa y de color verde, con una mancha blanca cerca de la punta de las antenas (Figura 29 c). El adulto es de color café oscuro. En el ala anterior presentan una banda de color naranja que va del área media en el margen costal hasta el torno. En el subápice tienen tres manchas pequeñas de color blanco. Las alas posteriores tienen una banda de color naranja que corre paralela a lo largo del margen costal y continúa un poco interno en el margen distal y llega hasta el torno (Figura 29 d). La parte ventral es muy similar a O. bogotanus alajuela (Figura 29 e). En el subápice de las alas anteriores hay un ocelo. La banda naranja presente sobre la superficie dorsal también es visible en la parte ventral. El ala anterior presenta dos ocelos grandes y dos pequeños sobre un fondo barreteado. Los adultos de O. cassina están activos durante el día. Los adultos que se encontraron alimentándose en heces de felinos fueron observados en horas crepusculares antes de las 185 seis de la mañana. Generalmente, las larvas se alimentan durante la noche. Las hembras buscan las plantas hospederas para ovipositar, principalmente en horas crepusculares de la tarde. Young y Muyshondt (1975) realizaron una comparación descriptiva en el ciclo de vida, hábitats y plantas hospederas de O. tamarindi y O. cassina en Costa Rica y El Salvador. Encontraron que ambas especies tienen un periodo de desarrollo muy similar desde el huevo hasta el adulto a pesar de que se alimentan de grupos de plantas muy distintos. Las larvas y adultos recolectados se encontraron en bordes de bosque primario y secundario en el Sendero Gigantes del Bosque entre 1 500 y 1 600 m. De acuerdo con ATTA (INBio, 2007), esta especie está presente en Costa Rica entre 0 y 1 700 m en ambas vertientes. Esta especie tiene un amplio ámbito de distribución, pues se ha reportado desde México hasta la cuenca del Amazonas. En el área de estudio se reportaron dos especies de parasitoides que debido a lo complejo del grupo, no se les pudo dar una identificación taxonómica más allá de familia (Braconidae e Ichneumonidae). Estas avispas son endoparasitoides de las larvas de O. cassina. Entre estas dos especies se da el multiparasitismo y es posible que también exista superparasitismo por parte de la especie de Ichneumonidae. De una sola larva de O. cassina emergieron 28 avispas bracónidas. Cuatro días después emergieron 69 avispas icneumónidas. Las moscas hembras de Blepharipa fimbriata (Tachinidae) parasitan las larvas de O. cassina. Los adultos de estos dípteros emergen de las pupas del hospedero (Montero, com. pers.). En el ACG, Janzen y Hallwachs (2005) reportan seis especies de moscas parasitoides y algunas especies no determinadas de dos géneros de avispas parasitoides. Especie 25: Opsiphanes quiteria talamancensis En la EBA se recolectaron siete larvas, tres de ellas murieron porque estaban parasitadas. Las otras cuatro llegaron a la fase de adulto. Las larvas de esta especie se alimentaron del follaje de dos especies de palma. En el ACG, Janzen y Hallwachs (2005) reportan 24 especies de plantas hospederas para las larvas de O. quiteria talamancensis. Es posible 186 entonces afirmar que las larvas de esta especie de mariposa son oligófagas (Arecaceae). Los adultos se alimentan de los jugos producidos por la fermentación de las frutas. Las larvas recolectadas tardaron 33 días desde el segundo hasta el último estadio larval (prepupa). La fase de pupa tardó 28 días. Las larvas y pupas de esta especie son muy similares a las de O. cassina (Figura 31 a, b y c). Los adultos también tienen un patrón de coloración similar. La superficie dorsal de ambos pares de alas es de color café. Las alas anteriores tienen una banda amarilla en el área media en dirección margen costal – torno. En el subápice tienen dos pequeñas manchas de color blanco. En el ápice de las alas posteriores presentan tres manchas consecutivas de color amarillo y el torno es de color rojizo. La cabeza y tórax son de color café oscuro, mientras que el abdomen es rojizo. Ventralmente tienen una coloración críptica, muy similar a las dos especies de Opsiphanes mencionadas anteriormente. Las alas anteriores presentan un ocelo cada una en el subápice. La banda amarilla presente en el dorso es visible ventralmente. Las alas posteriores son barreteadas con dos ocelos en cada una de ellas, ambos en el área medial. Las larvas y adultos recolectados en los senderos de la EBA se encontraron entre 1 400 1 700 m. De acuerdo con la consulta realizada a ATTA (INBio, 2007), esta especie se ha registrado en elevaciones desde el nivel del mar hasta 1 400 m en ambas vertientes. Los especímenes recolectados en la EBA a 1 700 m (Cerro Biolley), representan un nuevo registro de elevación. En el área de estudio, se registró que hay una especie (aún sin determinar) de Hymenoptera de la subfamilia Microgastrinae (Braconidae) que ataca las larvas de O. quiteria talamancensis. Estas avispas parasitoides son endoparasitoides koinobiontes y gregarios. Los adultos del parasitoide atacan su hospedero en estadios larvales tempranos. Las larvas de las avispas Microgastrinae se alimentan del cuarto o quinto estadio larval de O. quiteria talamancensis. Cuando las larvas parasitoides van a pupar, salen del cuerpo de su hospedero y se dirigen hacia su parte ventral (Figura 32 a). Ahí forman capullos de seda que sujetan al cuerpo de la larva y que utilizan como protección (Hanson y Gauld, 2006). La larva de la mariposa permanece viva por aproximadamente 25 días después que puparon los 187 parasitoides y que justamente es el período que tardan en emerger los adultos de Microgastrinae (Figura 32 c). La larva de O. quiteria talamancensis se mantiene viva (paralizada) aún después de que salen y pupan las larvas de Microgastrinae. Esto se debe a que las larvas de los parasitoides consumen los tejidos y órganos del hospedero en forma parcial, por lo que no destruyen por completo el cuerpo de la larva. Es posible que este comportamiento sea un mecanismo de defensa de los parasitoides, ya que si la larva hospedera muriera inmediatamente después que las avispas emergen, el proceso de descomposición de la larva atraiga a otros insectos carroñeros, depredadores e hiperparasitoides (Hanson y Gauld, 2006). En el ACG se han reportado cinco especies de parasitoides que atacan las larvas de O. quiteria talamancensis. Dos de ellas son especies de Hymenoptera y las otras tres son Diptera (Janzen y Hallwachs, 2005). Especie 26: Hypanartia dione arcaei En la zona de estudio se recolectaron tres larvas, las cuales estaban en bosque primario, entre 1,5-2,5 m de altura sobre el suelo. Los individuos recolectados tradaron 22 días desde el segundo y hasta el último estadio larval (prepupa). El estado de pupa se prolongó durante 19 días. En la EBA, se reportó una especie de avispa parasitoide que ataca las larvas de H. dione arcaei. Por esta razón, de las tres larvas recolectadas, emergieron dos adultos, pues una de ellas estaba parasitada. En la EBA se registró sólo una especie planta hospedera: Cecropia polyphlebia, que también se ha registrado en el ACG. Las larvas de esta especie también se alimentan de una especie del género Pilea (Chacón, 2001c), así como de dos especies más de la familia Urticaceae (Janzen y Hallwachs, 2005). Con base en esto, se puede afirmar que las larvas de H. dione arcaei son oligófagas, pues se alimentan de cuatro especies de plantas clasificadas en dos familias emparentadas entre sí. DeVries (1987) menciona que no se conocen las plantas hospederas para las larvas de esta especie, pero que los adultos vuelan solitarios en los bordes de ríos y lugares húmedos, incluso vuelan en días oscuros o nublados. Los machos frecuentan sitios en donde se filtra el 188 agua y se posan en la vegetación que hay alrededor de los ríos. Ocasionalmente visitan las flores de Senecio megaphyllus y otras de la familia Asteraceae (DeVries, 1987). En la EBA no se observaron adultos de H. dione arcaei alimentándose en su estado natural. Chacón (2001c) menciona que los machos de H. dione arcaei visitan suelos húmedos, probablemente para la obtención de sales minerales. Los machos son más probables de observar que las hembras, lo cual se ve reflejado en la colección del INBio, en donde hay muy pocas hembras. DeVries (1987) menciona que no se conocen los estadios inmaduros de esta especie. Por este motivo se describe con el mayor detalle posible cada uno de los estadios. Las larvas de H. dione arcaei tienen una coloración atractiva: todo el cuerpo, incluyendo la cabeza es de color negro (Figura 33 a y b). A lo largo del dorso tienen nueve pares de setas amarillas y desarrolladas en la base. En los costados tienen dos filas bien definidas de setas blancas. En la cabeza se aprecian una serie de pelos muy pequeños de color negro. La forma y color de la pupa es compleja (Figura 33 c y d). La superficie es verde y a partir del segundo segmento abdominal presentan un par de espinas por segmento. Estas estructuras están bien desarrolladas en los segmentos abdominales tres, cuatro, cinco y seis y son de color rojo con negro. En los segmentos dos, siete, ocho y nueve se aprecian sólo como pequeños puntos negros. Los cuernos cefálicos de la cabeza son de color rojo y negro (Figura 33 g). El adulto tiene la cabeza, el tórax, el abdomen y la mayor parte de la superficie dorsal de las alas de color café claro. En el área medial, entre las venas Cu1 y Cu2 de las alas anteriores hay una pequeña ventana de forma ovoide, que pareciera una mancha blanca. La mayor parte del área postmedial, incluyendo el ápice es de color naranja (Figura 33 e). Según DeVries (1987), la longitud del ala anterior es de 28-30 mm, en la cual poseen una banda amarillenta con manchas hialinas. En el área post medial de las alas posteriores se observan dos bandas de color café oscuro que corren paralelas al margen distal y hasta el torno. En medio de tales bandas y entre las venas 1A+2A, Cu1, Cu2, M3, M2 y M1 hay cinco manchas pequeñas de color café oscuro. La coloración ventral varía desde café claro hasta amarillo-beige. 189 Aunque esta especie de mariposa se recolectó únicamente en el sendero a Casa Coca, a una altitud de 1 800 m, de acuerdo con la consulta de especímenes realizada a ATTA (INBio, 2007), la especie se distribuye en ambas vertientes desde 1 200 a 2 900 m. Según DeVries (1987), esta especie es endémica para la región Costa Rica-Panamá. Especie 27: Automeris banus Los cuatro individuos recolectados en la EBA tardaron 42 días en estado larval (los últimos tres días corresponden a la prepupa) y 36 días en la fase de pupa. En el área de estudio se registraron tres especies de plantas hospederas, las cuales pertenecen a dos familias. Según Janzen y Hallwachs (2005), en el ACG se han registrado 75 especies de plantas hospederas clasificadas en 37 familias (Cuadro 3). De acuerdo con lo anterior, las larvas son polífagas. Cuando la larva muda se come sus propias exubias (Figura 34 c), las cuales posiblemente son una fuente extra de vitaminas. Las larvas tienen una coloración café verdoso con puntos amarillos. Tienen una banda de color amarillo en ambos costados a lo largo de todo el cuerpo (Figura 34 b). Las setas urticantes nacen en el dorso y parecen espinas, dispuestas en tres grupos por cada segmento del cuerpo (Figura 34 a). Cada seta se bifurca, de manera que parecen las ramas de un árbol de ciprés. De ahí que han recibido el nombre vernáculo de “gusanos ciprés”, tanto larvas de A. banus como las de otras especies del género Automeris. Las espinas correspondientes a los segmentos cinco, seis y siete son más pequeñas que el resto. Las más desarrolladas están en los primeros segmentos, cerca de la cabeza. La espina central es de color naranja, mientras que las que se originan a partir de ésta (secundarias) son de color negro. Los pelos urticantes y espinas liberan acetilcolina e histaminas, que pueden causar alergia en algunas personas. En algunos casos el dolor puede afectar tanto los músculos como los huesos (popularmente conocido como una “seca”) cercanos al área afectada. Las pupas son de color café y presentan unas pocas y pequeñas setas urticantes en el dorso (Figura 34 e). La pupación ocurre dentro de un capullo (Figura 34 d) que forman con seda y uniendo la superficie de algunas hojas. Los adultos son de color amarillento. En las alas posteriores se observan un par de ocelos grises, con el centro blanco y un anillo negro. Hay dos líneas de color café que van paralelas al margen distal. La mayor parte del tórax es de 190 color café, mientras que el abdomen es amarillo con anillos cafés entre cada segmento (Figura 34 f). Las cuatro larvas criadas se recolectaron en bosque secundario, entre 0,7-3,0 m sobre el suelo. Los adultos de varias especies del género Automeris tienen pelos urticantes en el abdomen, los cuales exponen al replegar sus alas hacia adelante cuando se sienten amenazados, al mismo tiempo que dejan ver las manchas oculares (Chacón y Montero, 2007). Las larvas y adultos recolectados en la zona de estudio estaban entre 1 450 y 1 800 m. Esto es un nuevo registro en la distribución de A. banus, ya que de acuerdo con la base de datos ATTA (INBio, 2007), esta especie se ha recolectado en ambas vertientes, desde el nivel del mar hasta los 1 700 m. En el ACG hay cinco especies de parasitoides que atacan las larvas de A. banus. Dos de esas especies son avispas parasitoides de la familia Ichneumonidae. Las otras tres son especies de moscas parasitoides de la familia Tachinidae (Janzen y Hallwachs, 2005). En la EBA no se han registrado parasitoides asociados con A. banus. Especie 28: Gamelia musta Los individuos recolectados tardaron 81 días en la fase de larva. Los últimos cinco días de este perioodo corresponden al último estadio larval (prepupa). La fase de pupa tardó 32 días. Las larvas son de color gris, con cuatro líneas de color blanco, que corren paralelas en el dorso del cuerpo (Figura 35 a). Presentan setas urticantes en forma de espinas bifurcadas. La pupa es de color café oscuro. En el dorso presenta setas urticantes de color amarillo (Figura 35 b). Los adultos tienen las alas de color gris en varios tonos. En las alas anteriores se observan dos líneas oscuras paralelas desde el subápice hasta el torno. El área marginal de las alas posteriores es de color gris oscuro, similar a la coloración de las alas anteriores. El resto de la superficie de las alas posteriores es de color gris claro. Presentan un ocelo grande de color rojo, con el centro blanco y un anillo de color negro (Figura 35 c). Ventralmente, la coloración de todo el cuerpo es muy uniforme (beige), excepto por un par de manchas negras (una en cada ala) presentes en el área media. 191 Las larvas son polífagas, ya que se alimentan de una gran variedad de especies de plantas hospederas. En la EBA se registraron tres especies de plantas hospederas correspondientes a tres familias lejanas morfológica y taxonómicamente. En el ACG se han reportado 56 especies de plantas hospederas de 27 familias (Cuadro 4) Janzen y Hallwachs (2005). Las larvas recolectadas se encontraron entre 1 400 y 1 700 m. Esta elevación es un nuevo registro para la distribución de G. musta, pues de acuerdo con ATTA (INBio, 2007), esta especie se ha reportado en ambas vertientes, desde el nivel del mar hasta 1 600 m. De las cinco larvas criadas, tres se recolectaron en bosque secundario y dos en bosque primario. En el ACG se han reportado dos especies de parasitoides que atacan las larvas de G. musta (Janzen y Hallwachs, 2005). En el área de estudio no se reportó ningún caso de parasitoide asociado con esta especie. Especie 29: Copaxa rufinans Los individuos recolectados tardaron 66 días en la fase de larva, cuyo último estadio (prepupa) tardó dos días. El estado de pupa tardó 34 días. En el área de estudio se recolectaron 12 larvas, las cuales estaban en tres grupos de cuatro larvas cada uno. Las larvas son gregarias: se alimentan juntas en la misma rama y a veces hasta en la misma hoja de la planta hospedera. Las larvas son de color verde. En los primeros dos estadios presentan cinco líneas negras en el dorso, las patas son verdes y tienen setas urticantes con las puntas de color negro (Figura 36a). A partir del tercer estadio larval, aparecen puntos de color azul celeste dispuestos en seis líneas longitudinales. En cada costado hay una línea subespiracular de diez puntos celestes y otra línea supraespiracular de 11 sobre éstos. En el dorso se observan dos líneas de 11 puntos celestes cada una (Figura 36c). A partir del tercer estadio, la cabeza, patas, propodios y espiráculos se tornan de color café (Figura 36d, e, f, g). La pupación ocurre dentro de un capullo hecho de seda y construido generalmente entre la superficie de varias hojas unidas entre sí (Figura 36h). Los adultos presentan un marcado dimorfismo sexual. Los machos tienen las antenas cuadripectinadas, lo cual les permite captar los olores de las feromonas emitidas por las hembras a veces en pleno vuelo. Esto con el fin de acoplarse y reproducirse. 192 Las alas de los machos son cafezuscas en la parte dorsal y rojizas ventralmente (Figura 36i). En las hembras, las alas son grises y las antenas son pectinadas (Figura 36j). En el área media de las alas anteriores y posteriores de las hembras, se observan unas ventanas (parecen manchas de color blanco), que en los machos son muy reducidas y tienen un anillo de color amarillo. Las larvas de C. rufinans son oligófagas, pues se alimentan de varias especies de plantas (17 reportadas hasta el momento), todas de una misma familia: Lauraceae. En la EBA se reportaron dos especies de plantas hospederas, una de las cuales (Ocotea stenoneura) no se había registrado como hospedero de las larvas de este lepidóptero. En el ACG, Janzen y Hallwachs (2005) reportan 16 especies de plantas hospederas para C. rufinans. La especie C. rufinans tiene un amplio ámbito de distribución altitudinal. Las larvas recolectadas en la zona de estudio se encontraron entre 1 400 y 1 800 m. Sin embargo, de acuerdo con la información tomada de ATTA (INBio, 2007), esta especie se ha registrado en elevaciones desde 100-1 700 m en la vertiente Caribe y entre 0-2 000 m en la Vertiente del Pacífico. En el ACG se han registrado dos especies de moscas parasitoides que atacan las larvas de C. rufinans (Janzen y Hallwachs, 2005). En la EBA, las larvas recolectadas se alimentaban sólo durante la noche. Durante el día estaban entre el follaje. La relación de machos y hembras de los adultos emergidos fue de 1:3 respectivamente. De las 12 larvas recolectadas, cuatro provienen de bosque poco alterado, las demás son de bosque secundario. Todas las larvas estaban a 1,5 m de altura sobre el suelo en la planta hospedera donde se encontraron. Especie 30: Perigonia stulta Las tres larvas que se recolectaron y criaron tardaron un promedio de diez días en estado larval. Las larvas se caracterizan porque tienen una prominente cuerno caudal. Durante los primeros estadios, las larvas son de color verde tierno. En los ultimos estadios, las larvas son robustas y de un color verde más oscuro. El dorso de los individuos en último estadio larval (prepupa) se torna rojizo y el resto de la larva tiene una coloración amarillo verdoso. Además, su cuerpo se ensancha, de modo que 193 parecieran más cortas y gruesas. Aunque estos cambios ocurren en dos días, el último estadio larval se prolonga por dos días más, de manera que la fase de larva en los individuos recolectados tardó 14 días. Ninguno de los individuos criados formó capullo cuando pupó. La pupa es bien robusta, de color café brillante. En promedio, P. stulta tarda 28 días durante la fase de pupa. Los adultos tienen una coloración atractiva, pues son de color café con matices y manchas oscuras. Además, en las alas posteriores tienen una mancha amarilla en el área discal y en el margen anal. Las larvas de P. stulta criadas en la EBA se alimentaron de Cinchona pubescens. En el ACG, se ha reportado que las larvas de esta especie se alimentan de Cosmibuena macrocarpa y Elaeagia auriculata (Janzen y Hallwachs, 2005). Las tres especies de plantas hospederas reportadas hasta el momento son de una misma familia: Rubiaceae. Por esta razón, se afirma que las larvas de P. stulta tienen un hábito alimenticio monófago. En la zona de estudio, esta especie se observó y recolectó en bosque secundario y bosque poco alterado, en puntos cercanos a los 1 400 m. De acuerdo con los datos tomados de ATTA (INBio, 2007), P. stulta tiene un ámbito de distribución altitudinal que va desde los 1001 800 m en ambas vertientes. En el ACG, los huevos de esta especie son parasitados por avispas de la familia Encyrtidae (Janzen y Hallwachs, 2005). Johnson (1990), reporta avispas parasitoides de la especie Telenomus dilophonotae, atacando huevos de P. stulta. 194 7. CONCLUSIONES Y RECOMENDACIONES 7.1. Conclusiones La riqueza específica de Lepidoptera en la EBA es de 1 572 especies, reflejadas en los 10 367 especímenes recolectados y depositados en la colección del INBio. En la zona de estudio habitan cerca del 10% de las especies de Lepidoptera estimadas para Costa Rica. Este dato no es definitivo y puede aumentar si se utilizan otras técnicas de recolecta (trampas de frutas) que permitan muestrear ambientes tan complejos y diversos como el dosel del bosque. Los estudios de ADN y la consecuente identificación a nivel de especie de algunos grupos de Lepidoptera que actualmente están tienen un nivel taxonómico de morfoespecie, permitirán esclarecer varios complejos de especies. Esto también puede influir en la variación (incremento) de la cantidad de especies de Lepidoptera en el sector Altamira. En la zona de estudio se determinaron 38 especies de Lepidoptera que sólo se han recolectado mediante la metodología crianza de los estados inmaduros. Esto quizás se debe a que los adultos de esas especies son poco comunes de observar (y por ende de recolectar en forma directa) y tampoco son atraídos a las trampas de frutas ni a las trampas de luz. La lista de especies y la curva de acumulación (Figura 4), sugieren que se ha recolectado la mayoría de especies de lepidópteros nocturnos, que podrían habitar en el sector Altamira. La colección refleja un mayor esfuerzo de recolecta de lepidópteros nocturnos y muy poco de lepidópteros diurnos y microlepidópteros, por lo que se estima que la cantidad de especies podría aumentar significativamente. El 76% (52 especies) de los Papilionoidea registrados en el sitio de estudio son de hábitos nectarívoros y sólo 16 especies (23%) son frugívoras. De acuerdo con estos datos y tomando en cuenta que en Costa Rica se conocen cerca 250 especies frugívoras y que la relación entre mariposas nectarívoras y frugívoras, por lo general es equivalente, permite considerar que aún no se conoce bien la fauna de mariposas diurnas que habitan en el sector Altamira. Las especies de mariposas nectarívoras nunca van a competir por una fuente de alimento con las especies frugívoras. En este último grupo se pueden hacer dos grupos locales 195 ecológicos: las mariposas frugívoras del dosel y las especies propias del sotobosque. Aunque en algunas ocasiones se puedan recolectar especies de sotobosque (por ejemplo M.helenor marinita) en el dosel (por lo que explica DeVries ,1988). Existe un mayor conocimiento de la diversidad de especies de Lepidoptera de las superfamilias Noctuoidea, Geometroidea, Bombycoidea y Pyraloidea que habitan en el sector Altamira. Esto se debe que parataxónomos y taxónomos expertos en dichos grupos han dedicado mayor esfuerzo a su estudio. En el sitio de estudio se registraron 33 especies endémicas de la zona Nicaragua-Costa Rica-Panamá. De estas especies, 28 pertenecen a la superfamilia Papilionoidea, así como una a la familia Dalceridae, una a Hedylidae y otra a Saturniidae. Esto le confiere un gran valor en términos de conservación al sector Altamira, más aún cuando la distribución de varias de estas especies se restringe a la región Talamanca-Chiriquí. Además, al formar parte de la zona de influencia y la zona núcleo de la RBA, lo hace ser un lugar ideal para realizar estudios de biodiversidad con fines de conservación. Se conocen algunos datos de historia natural de sólo 85 de las 1 572 especies de Lepidoptera registradas en el sector Altamira. Esto representa apenas un 6% de las especies conocidas en la zona de estudio e indica que es necesario continuar investigando la historia natural de este grupo de insectos por varios años más. La zona de estudio se reportó como un nuevo punto de distribución geográfica para cinco de las especies de Lepidoptera. Por primera vez se generó información del ciclo biológico ex situ asociadas a diez de las especies de Lepidoptera. Se registraron nuevas especies de plantas hospederas para otras diez de las especies de Lepidoptera. De las 30 especies tratadas en el documento, seis son como polífagas, diez oligófagas y 14 son monófagas. En el sector Altamira se registraron cerca de 30 especies de moscas parasitoides de la familia Tachinidae asociadas a diez familias de Lepidoptera. De estos taquínidos, se reportaron cinco géneros y ocho especies nuevas. Se obtuvieron 98 registros de himenópteros parasitoides de las familias Braconidae, Ichneumonidae, Chalcididae, Eulophidae y Encyrtidae asociados a diez de las familias de Lepidoptera, sin embargo no se logró identificar géneros ni especies en la mayoría de los casos. 196 7.2. Recomendaciones Realizar estudios más sistemáticos y en grupos específicos de Lepidoptera, donde la taxonomía sea clara, por ejemplo las familias Sphingidae y Saturniidae (mariposas nocturnas) y Nymphalidae, Pieridae y Papilionidae (mariposas diurnas). Aplicar diseños experimentales bien definidos y por periodos de dos a tres años como mínimo, con el fin de analizar los datos mediante modelos estadísticos paramétricos y no paramétricos; además de medir la diversidad alfa, beta y gamma, y aplicar los resultados en la toma de decisiones de conservación en la Reserva de la Biosfera La Amistad. Dar un mayor énfasis en la recolecta de mariposas diurnas mediante la metodología de trampas de frutas para acceder a los hábitat como el dosel del bosque y conocer mejor este grupo en la zona de estudio. Realizar una curación completa de la colección de lepidópteros de esta zona, identificar (taxón y sexo) todo el material recolectado y depositado en las colecciones de INBio. Continuar estudios de historia natural de los lepidópteros, plantas hospederas y parasitoides asociados en la zona de estudio, enfocar el esfuerzo por grupos específicos de lepidópteros o plantas hospederas. Para lograr una asociación más precisa, entre las especies parasitoides y sus hospederos, es necesario criar las formas adultas de los lepidópteros, ya que en muchos grupos no es posible identificar las larvas a género o especie. Si se desconoce la especie del lepidóptero hospedero y éste muere, se debe buscar la planta hospedera para recolectar más inmaduros y lograr obtener un adulto que relacione específicamente la especie parasitoide con el lepidóptero. Realizar un mayor esfuerzo en el estudio taxonómico y sistemático de los parasitoides asociados a lepidópteros en el sector Altamira, especialmente en los himenópteros, de los cuales no se lograron identificar ni asociar la especie hospedera, de la mayoría de los registros. 197 Involucrar a los caficultores de las comunidades aledañas (zona de amortiguamiento) al PILA, en sistemas agroforestales en donde se mantengan y recuperen los remanentes de bosque dentro de sus fincas. Esto ayudaria a aumentar la diversidad de mariposas diurnas de la zona así como de otros organismos. 198 8. LITERATURA CITADA Aguilar, I. 1999. Polinización de cultivos: una alternativa económica para la apicultura regional en el nuevo milenio. Resumen 110. XI Congreso Nacional Agronómico/ V Congreso Nacional de Entomología. CINAT-PRAM, Universidad Nacional, Heredia, Costa Rica. Alfaro, A. 1915. La mariposa de la pacaya. Revista Chilena de Historia Natural, Pura y Aplicada. 19(3/6): 89-93. Alfaro, E. y Navarro, E. 2001. Gigantes del Bosque: Plantas y Hongos. Editorial INBio. Santo Domingo de Heredia, Costa Rica. 105 p. Araya, J. y De Marco, G. 2001. Informe sobre el avance y desarrollo de la Reserva de la Biósfera La Amistad-Talamanca. Ministerio del Ambiente y Energía. Área de Conservación La Amistad Pacífico. San José, Costa Rica. 81 p. Arias, E. 2001. Caracterización Biofísica del Parque Internacional La Amistad. Documento elaborado como apoyo al proceso de planificación para la conservación de sitios desarrollado por The Nature Conservancy (TNC). Instituto Nacional de Biodiversidad. Heredia, Costa Rica. 96 p. Balcázar, M.A. 2004. Biodiversidad de la Sierra Tarahumara. Lepidoptera: Mimallonoidea, Lasiocampoidea, Bombycoidea y Pyraloidea. Universidad de Colima. Informe final SNIBCONABIO proyecto No. X008. México D. F. 22 p. Barrios, M; Méndez, C y Austin, G. 2006. Las Hesperiidae (Lepidoptera: Hesperioidea) de Guatemala. Biodiversidad de Guatemala. Cano, E.B. (ed.), Volumen 1. Hesperiidae (Lepidoptera). Editorial Universidad del Valle. Ciudad de Guatemala. pp 431-439. Borges, C. 2004. Diagnóstico socioeconómico de los distritos Volcán, Potrero Grande, Biolley y Pittier. SEDER. San José, Costa Rica. 19 p. ________. 2005. Plan de Manejo para el Parque Internacional La Amistad-Talamanca. SEDER. San José, Costa Rica. 200 p. 199 Brenes, O.; Castro, K.; Jiménez, V. Y Mora, A. 2004. Determinación de la Capacidad de Carga Turística del Parque Internacional La Amistad. San José, Costa Rica. Centro Científico Tropical-The Nature Conservancy. 254 p. Brower, A. 2006. Problems with DNA barcodes for species delimitation: ‘ten species’ of Astraptes fulgerator reassessed (Lepidoptera: Hesperiidae). Systematics and Biodiversity 4(2): 127–132 Chacón, I. 1997. Butterflies of Fila Cruces in Coto Brus, Costa Rica. P. 47. In: Tropical Diversity Origins, Maintenance, and Conservation. ATB & OTS Symposium and Annual Meeting Abstracts, San José, CR, 15-20 June, 1997. ________. 2001a. Caligo eurilochus sulanus Fruhstorfer, 1904. Especies de Costa Rica. Instituto Nacional de Biodiversidad. (en línea). Heredia, CR. Consultado 10 Noviembre del 2006. Disponible en http://darnis.inbio.ac.cr/FMPro?-DB=UBIpub.fp3&-lay=WebAll&- Format=/ubi/detail/.html&-Op=bw&id=3717&-Find _________. 2001b. Hypanartia arcaei Godman & Salvin, 1871. Especies de Costa Rica. Instituto Nacional de Biodiversidad. (en línea). Heredia, CR. Consultado 10 Noviembre del 2006. Disponible en http://darnis.inbio.ac.cr/FMPro?-DB=UBIpub.fp3&-lay=WebAll&- Format=/ubi/detail/.html&-Op=bw&id=3833&-Find _________. 2002a. Memphis beatrix Druce, 1874; Especies de Costa Rica. Instituto Nacional de Biodiversidad. (en línea). Heredia, CR. Consultado 10 Noviembre del 2006. Disponible en http://darnis.inbio.ac.cr/FMPro?-DB=UBIpub.fp3&-lay=WebAll&-Format=/ubi/detail/.html&Op=bw&id=3866&-Find _________. 2002b. Pteronymia notilla Butler y Druce, 1872. Especies de Costa Rica. Instituto Nacional de Biodiversidad. (en línea). Heredia, CR. Consultado 10 Noviembre del 2006. Disponible en http://darnis.inbio.ac.cr/FMPro?-DB=UBIpub.fp3&-lay=WebAll&- Format=/ubi/detail/.html&-Op=bw&id=3917&-Find _________. 2002c. Opsiphanes bogotanus Distant, 1875. Especies de Costa Rica. Instituto Nacional de Biodiversidad. (en línea). Heredia, CR. Consultado 10 Noviembre del 2006. 200 Disponible en http://darnis.inbio.ac.cr/FMPro?-DB=UBIpub.fp3&-lay=WebAll&- Format=/ubi/detail/.html&-Op=bw&id=3896&-Find __________ y Montero, J. 2007. Mariposas de Costa Rica / Butterflies and moths of Costa Rica. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 624 p. Chuprine, A. 2005. Características, categoría de manejo, viabilidad, fortalezas y objetivos de conservación del PILA. Documento de Trabajo. San José, Costa Rica. Inédito.13 p. Covell, Ch. 1984. Eastern Moths. Peterson Field Guides. Houghton Mifflin Company Boston. USA. 496 p. DeVries, P. J. 1987. The Butterflies of Costa Rica and their Natural History: Papilionidae, Pieridae, Nymphalidae. New Jersey. Princeton University Press. v. 1, 327 p. __________. 1988. Stratification of fruit-feeding nymphalid butterflies in a Costa Rican rainforest. Journal of Research on the Lepidoptera. 26(1-4):98-108 DeVries, P.J. 1997. __________. 1991. Lista de Mariposas. En: Historia Natural de Costa Rica, ed. Janzen, D. Editorial de la Universidad de Costa Rica. San José, C.R. pp. 666-672. __________. 1994. Familia Riodinidae. En: Las familias de insectos de Costa Rica, Ángel Solís (ed). (en línea). Consultado el 22 de abril, 2007. Disponible en: http://www.inbio.ac.cr/papers/insectoscr/Texto43.html __________. 1997. The Butterflies of Costa Rica and their Natural History: Riodinidae. New Jersey. Princeton University Press. v. 2, 288 p. Fuentes, G. comp. 2006. Bibliografía de Parasitoides de Lepidoptera. (Base de datos) BINABITROP-OET. Consultado 13 mar. 2006. Disponible en: http://www.ots.ac.cr/en/rdmcnfs/binabitrop.shtml 201 Gauld, I. y Bolton, B. 1988. The Hymenoptera. Oxford University Press. New York, U.S.A. 332 p. Godfray, H.C. 1994. Parasitoides: Behavioral and Evolutionary Ecology (Monographs in Behavior and Ecology). Princeton University Press. New Jersey, USA. 464 p. González, L. 2005. Árboles y arbustos comunes del Parque Internacional La Amistad. Editorial INBio. Santo Domingo de Heredia, Costa Rica. 286 p. González, R. 2004. Inventario preliminar de Chrysomelidae (Coleoptera) del Valle del Silencio, PILA. Tesina para optar por el grado académico de Bachiller en Manejo y Protección de Recursos Naturales. Universidad Estatal a Distancia. 190 p. Guerrero, Ch. y Días, L. 2000. Plan Inicial de Desarrollo del Distrito de Biolley-Parque Internacional La Amistad. Tesis Carrera de Empresas y Actividades Turísticas. Colegio Universitario de Cartago, Costa Rica. 91 p. Halffter, G. Moreno, C. E. y Pineda, E.O. 2001. Manual para evalación de la biodiversidad en Resevas de la Biosfera. M&T-Manuales y Tesis SEA, vol. 2. Zaragoza, España. 80 p. Hanson, P. 1990. La sistemática aplicada al estudio de la biología de los parasitoides. Manejo Integrado de Plagas. 15: 53-66 __________ y Gauld, I. 1995. The Hymenoptera of Costa Rica. Oxford University Press. The Natural History Museum. London, England. 893 p. ___________________. 2006. Hymenoptera de la Región Neotropical. Memoirs of the American Entomological Institute. Volume 77. Florida, USA. 994 p. Hebert, P.D., Penton, P.E., Burns, J.M., Janzen, D.H. y Hallwachs, W. 2004. Ten species in one: DNA barcoding reveals cryptic species in the neotropical skipper butterfly Astraptes fulgerator. PNAS. 101 (41): 14812-14817. 202 Heppner, J. 1991. Faunal regions and the diversity of Lepidoptera. Tropical Lepidoptera. 2(1): 1-84. _________. 2008. Family classification of Lepidoptera. Consultado el 30 de enero del 2008. Disponible en http://www.troplep.org/famlist.htm Horner-Devine, M.C.; Daily, G.C.; Ehrlich, P.R. y Boggs, C.L. 2003. Countryside biogeography of tropical butterflies. Conservation Biology 17 (1): 168-177. INBio-CIBIO. 2003. Informe Técnico: Proyecto Desarrollo Sostenible de las comunidades de Altamira y Biolley en la zona de amortiguamiento del Parque Internacional La Amistad. Inédito. 11 p. Instituto Nacional de Biodiversidad (INBio). 2007. ATTA: base de datos de especímenes (en línea). Heredia, C.R. Consultado 29 Febrero 2007. Disponible en: http://ATTA.inbio.ac.cr/scripts/pbcgi60.exe/TUTORIAL/uo_pbdemo/f_getinfo Janzen, D. H. 1991. Historia Natural de Costa Rica. Editorial Universidad de Costa Rica. San José, Costa Rica. 803 p. __________. 1994. Familia Notodontidae. En: Las familias de insectos de Costa Rica, Ángel Solís (ed). (en línea). Consultado el 22 de abril, 2007. Disponible en: http://www.inbio.ac.cr/papers/insectoscr/Texto43.html __________, Hajibabaei, M., Burns, J., Hallwachs, W., Remigo, E., Hebert, P. 2005. Wedding biodiversity inventory of a large and complex Lepidoptera fauna with DNA barcoding. Philosophical Transactions of the Royal Society. Series B, Biological Sciences 360:18351845. __________, and Hallwachs, W. 2005. Dynamic database for an inventory of the macrocaterpillar fauna, and its food plants and parasitoids, of Area de Conservación Guanacaste (ACG), northwestern Costa Rica (en linea). Guanacaste, C.R. Consultado 15 Enero del 2007. Disponible en http://janzen.sas.upenn.edu/caterpillars/database.lasso Jiménez-Valverde, A. y Hortal, J. 2003. Las curvas de acumulación de especies y la necesidad de evaluar los inventarios biológicos. Revista Ibérica de Aracnología 8:151-161. 203 Johnson, N.F. 1990. Telenomus Hymenoptera: Scelionidae egg parasites of Erinnyis ello (Lepidoptera: Sphingidae). Proceedings of the Entomological Society of Washington. 92(2): 306-309. Kitching, I. J. y Cadiou, J.M. 2000. Hawkmoths of the world: an annotated and illustrated revisionary checklist (Lepidoptera: Sphingidae). Cornell University Press. pp. 9-10. Lamas, G. 2004. Atlas of Neotropical Lepidoptera: Checklist: Part. 4A HesperioideaPapilionoidea. Scientific Pub. 439 p. Lemaire, C. 2002. The Saturniidae of America. Goeck & Evers, Keltern. Germany. 1388 p. Martín, F. 1997. Apuntes sobre biodiversidad y conservación de los insectos: dilemas, ficciones y ¿soluciones? Boletín de la Sociedad Entomológica Aragonesa 20: 25-55. Méndez, V.H. y Monge, J. 2005. Segunda Reimpresión. Costa Rica: Historia natural. EUNED. San José, Costa Rica. 260 p. Miller, S.E. 1994. Systematics of the Neotropical moth family Dalceridae (Lepidoptera). Bulletin of the Museum of Comparative Zoology. 153(4): 301-495. Miller, J.C., Janzen, D.H., Hallwachs W. 2006. One hundred caterpillars portraits from the tropical forest of Costa Rica. The Harvard University Press. Massachusetts, USA. London, England. 264 p. Ministerio de Comercio Exterior. Acuerdo de Asociación entre Centroamérica y la Unión Europea; Sector Miel (documento preliminar) actualizado al 10-09-07 (en línea). San José, Costa Rica. Consultado el 21 de Febrero del 2008. Disponible en: http://www.aacue.go.cr/comercio/sectoriales/documentos/06%20miel%20v.pdf Montero, J. 2005. Mariposarios. En: Undécimo Informe sobre el Estado de la Nación en Desarrollo Humano Sostenible: Informe Final Gestión de Patrimonio. García, R., Obando, V., Murillo, K. (en línea). San José, Costa Rica. Consultado 30 marzo 2006. Disponible en: http://www.estadonacion.or.cr/Info2005/Ponencias/Gesti%F3n%20del%20Patrimonio.pdf 204 Montero, J. 2007. Manual para el manejo de mariposarios. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 204 p. Moulaert, A. y Arguedas, M. 1993. Insectos herbívoros asociados con diez especies forestales en le Región Huetar Norte de Costa Rica. Revista Forestal Centroamericana 2: 2426. Powell, J.A., Mitter, C., Farrel, B. 1999. 20. Evolution of Larval Food Preferences in Lepidoptera. In: Kristensen, N.P. (ed.). Part 35, Lepidoptera, Moths and Butterflies. v. 1: Evolution, Systematics and Biogeography. In: Fischer, M. (ed.). Handbuch der Zoologie. Volume IV - Insecta. Berlín, Walter de Gruyter y Co., pp. 403-422. Rawlins, J.E. 1982. A revision of the moths in the genus Bertholdia (Lepidoptera: Arctiidae); Systematics, Phylogeny and Biogeography. Dissertation for Ph.D. Cornell University. Resumen de tesis. Robbins, R.K. 1994. Familia Lycaenidae. En: Las familias de insectos de Costa Rica. Solís, A. (en línea). Consultado el 22 de abril, 2007. Disponible en: http://www.inbio.ac.cr/papers/insectoscr/Texto43.html Rodríguez, A. 2005. Plantas hospederas, nectaríferas y/o productoras de néctar utilizadas en zoocriaderos de mariposas de Costa Rica. I Curso Introducción al orden Lepidoptera v. 2. (Disco compacto). INBio. Heredia, Costa Rica. 1 disco compacto 120 mm. Roubik, D.W. y Hanson, P.E. 2004. Abejas de orquídeas de la América tropical. Biología y guía de campo / Orchiid bees of tropical America. Biology and field guide. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 352 p. Sáenz, M.R., De la Llana A.A. 1990. Entomología Sistemática. Universidad Centroamericana (UCA). Managua, Nicaragua. 225 p. Scoble, M.J. 1992a. The Lepidoptera: Form, Function and Diversity. New York, Oxford University Press, 404 p. 205 __________. 1992b. Guía de las mariposas hedílidas de Costa Rica, Lepidoptera Hedylidae. Guía No 1 (traducido por J. Corrales). Instituto Nacional de Biodiversidad. Santo Domingo, Heredia. 30 p. __________. 1995. The Lepidoptera: form, function and diversity. The Natural History Museum, Oxford University Press. 404 p. Solís, A. 2002. Escarabajos de Costa Rica. Costa Rica Beetles. 2da. edición. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 132 p. Solís, M. A. 2007. Patógenos, parásitos, depredadores y parasitoides de mariposas diurnas en zoocriaderos. En: Montero. Manual para el manejo de mariposarios. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. pp 138-153. The Nature Conservancy. 2001. Caracterización Biofísica del Parque Internacional La Amistad. Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, C.R. 96 p. Torres, H. y Hurtado de Mendoza, L. 1987. Plan General de Manejo y Desarrollo Parque Internacional de La Amistad. CATIE-SPN-FPN. Turrialba, C.R. 280 p. Ugalde, J. A. 2002. Avispas, abejas y hormigas de Costa Rica / Wasps, bees and ants of Costa Rica. 1. ed. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 176 p. Young, A.M. y Muyshondt A. 1975. Studies on the natural history of Central American butterflies in the family cluster Satyridae-Brassolidae-Morphidae (Lepidoptera: Nymphaloidea). III. Opsiphanes tamarindi and Opsiphanes cassina in Costa Rica and El Salvador. Studies on the Neotropical Fauna. 10: 19-56. Zumbado, M. A. 1999. Dípteros de Costa Rica / Diptera of Costa Rica. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 143 p. 206 _____________. 2006. Dípteros de Costa Rica y la América tropical / Diptera of Costa Rica and the New World tropics. Editorial Instituto Nacional de Biodiversidad. Santo Domingo de Heredia, Costa Rica. 267 p. Comunicaciones Personales Espinoza, 2007, Identificación de Especímenes de la Familia Arctiidae (Lepidoptera). Santo Domingo de Heredia, Instituto Nacional de Biodiversidad, Comunicación personal. Montero, 2007. Comportamiento de las larvas de lepidópteros en crianza. Santo Domingo de Heredia, Instituto Nacional de Biodiversidad. Comunicación Personal. Wood, 2006. Identificación de Especímenes de la Familia Tachinidae (Diptera). Santo Domingo de Heredia, Instituto Nacional de Biodiversidad. Comunicación personal. 207 Sección de anexos. Cuadro 5. Plantas hospederas y su respectivo número de testigo de las especies de Lepidoptera criadas en la EBA-PILA, durante los años 2004 -2007. Lepidoptera Planta Hospedera Género, Especie o Subespecies Familia Especie Familia No. Testigo Achoria Pyralidae Juglans olanchana Juglandaceae DRC-00356 ¿¿?? Actinote anteas Nymphalidae ¿¿?? DRC-00313 RDR-00292 Heliconia tortuosa Heliconiaceae DRC-00310 Rubus pittieri Rosaceae DRC-00321 Gonzalagunia rosea Rubiaceae RDR-00164 Inga longispica Fabaceae RGT-00716.1 Amastus rumina Arctiidae RGT-00716.2 RGT-00716.3 Amorbia shombobasis Amycles adusta Tortricidae Arctiidae Melanthera aspera Asteraceae RGT-00735 Posoqueria latifolia Rubiaceae RGT-00812 Canna tuerkheimii Cannaceae Heliconia tortuosa Heliconiaceae DRC-00320 RDR-00354 RGT-00721.1 RGT-00721.2 Amycles anthracina Anacrusis Arctiidae Tortricidae RDR-00134 Heliconia tortuosa Heliconiaceae Bocconia frutescens Papaveraceae Inga longispica Fabaceae DRC-00325 RDR-00352 Apatelodes Bombycidae Bidens reptans Asteraceae Astraptes alardus Hesperiidae Erythrina berteroana Fabaceae RDR-00260 DRC-00323 DRC-00324 DRC-00361 RDR-00165 DRC-00259 DRC-00260 RDR-00128 Hampea appendiculata Astraptes fulgerator Malvaceae RDR-00131 RDR-00154 RDR-00157 Hesperiidae RGT-00777 RGT-00827 Astraptes Hesperiidae Heliconia tortuosa Heliconiaceae DRC-00362 Vigna candida Fabaceae RGT-00949 Senna papillosa Fabaceae DRC-00365 Canna tuerkheinii Cannaceae RDR 00130 208 Lepidoptera Género, Especie o Subespecies Planta Hospedera Familia Especie Familia No. Testigo RDR-00129 Automeris banus Saturniidae Heliconia tortuosa Heliconiaceae RDR-00155 Malvaviscus sp. Malvaceae RDR-00160 Gonzalagunia rosea Rubiaceae RDR-00319 Melanthera aspera Asteraceae Palicourea padifolia Rubiaceae DRC-00350 DRC-00339 RDR-00313 Automeris postalbida Saturniidae Paullinia talamancensis Sapindaceae DRC-00315 Bardaxima luscilinea Notodontidae Byrsonima crassifolia Malpighiaceae RGT-00791 RDR-00193.1 Bertholdia crocea Arctiidae Vernonia patens Asteraceae RDR-00193.2 RDR-00193.3 RGT-00871.1 Bertholdia philoptera Arctiidae Elaeagia auriculata Rubiaceae RGT-00871.2 RGT-00871.3 RGT-00871.4 Brenthia Choreutidae Alsophila erinacea Cyatheaceae RGT-00710 Clematis sp. Ranunculaceae RGT-00720 Coffea arabica Rubiaceae RGT-00723 Calidota sp.1 Arctiidae Celastrus vulcanicola Celastraceae RGT-00672 Caligo atreus dionysos Nymphalidae Heliconia tortuosa Heliconiaceae RGT-00891.1 RGT-00883.1 Caligo brasiliensis sulanus Nymphalidae Heliconia tortuosa Heliconiaceae RGT-00883.2 RGT-00883.3 Celaenorrhinus stallingsi Hesperiidae Cirsodes acuminata Geometridae Dicliptera iopus ¿¿?? Acanthaceae ¿¿?? RDR-00226 RDR-00223 RDR-00135 RDR-00168.1 Copaxa rufinans Saturniidae Nectandra salicina Lauraceae RDR-00168.2 RDR-00181.1 RDR-00181.2 Ocotea stenoneura Lauraceae RGT-00876 Coronidia leachii Sematuridae Inga longispica Fabaceae RGT-00887 Cyanopepla arrogans Arctiidae Iresine diffusa Amaranthaceae RDR-00138 Dysschema cerialis Arctiidae Baccharis trinervis Asteraceae RGT-00886.1 RGT-00886.2 RGT-00886.3 Elysius melanoplaga Arctiidae Mikania banisterae Asteraceae RDR-00206 209 Lepidoptera Género, Especie o Subespecies Planta Hospedera Familia Especie Familia No. Testigo RDR-00216.1 RDR-00216.2 RDR-00326 RDR-00342 Emesis cypria paphia Lycaenidae Clematis sp. Ranunculaceae RGT-00758 Episcepsis Arctiidae Baccharis trinervis Asteraceae RGT-00859 Allophylus psilospermus Sapindaceae RGT-00822 RDR-00136.1 Eucereon Arctiidae Erythrina berteroana Fabaceae RDR-00136.2 RGT-00603 Eucereon sp.1 Euclea Arctiidae Limacodidae Quercus bumelioides Fagaceae RGT-00636 Ficus velutina Moraceae RGT-00802 Costus wilsonii Costaceae DRC-00286 Geonoma edulis Arecaceae DRC-00347 Selustocarpha sp. Euselasia argentea argentea Gamelia musta Lycaenidae ¿¿?? RGT-00875 ¿¿?? RDR-00220 Urera caracasana Urticaceae DRC-00359 Myrcia splendens Myrtaceae DRC-00376 Palicourea padifolia Rubiaceae DRC-00241 Saturniidae DRC-00343 Quercus rapurahuensis Fagaceae RDR-00350 RDR-00351 Gamelia Saturniidae Paullinia talamancensis Sapindaceae RGT-00904 Gymnelia Arctiidae Paullinia talamancensis Sapindaceae RGT-00833 Cecropia polyphlebia Cecropiaceae RDR-00143 Inga longispica Fabaceae Inga punctata Fabaceae Heliocarpus americanus Tiliaceae Iresine diffusa Amaranthaceae RGT-00806 Celastrus vulcanicola Celastraceae RGT-00602.4 RDR-00140 Hemiceras Herpetogramma agavealis Notodontidae Crambidae RGT-00695 RGT-00889 RDR-00127 RDR-00132 RDR-00199 RDR-00201 Herpetogramma Crambidae Triumfetta lappula Malvaceae Holophaea lycone Arctiidae Symphonia globulifera Clusiaceae Hylesia Arctiidae Elaeagia auriculata Rubiaceae RGT-00759 Inga oerstediana Fabaceae RGT-00885 RGT-00892.1 RGT-00892.2 210 Lepidoptera Género, Especie o Subespecies Planta Hospedera Familia Especie Familia No. Testigo Pelargonium graveolens Geraniaceae RGT-00743 RGT-00670 Hymenomima Geometridae Phyllanthus mocinianus Euphorbiaceae Hypanartia dione arcaei Nymphalidae Cecropia polyphlebia Cecropiaceae Hypena hemonalis Noctuidae Urera caracasana Urticaceae Hypercompe ockendeni Arctiidae ¿¿?? Josiomorpha penetrata Arctiidae Urera caracasana Urticaceae DRC-00266 Lichnoptera illudens Noctuidae Ardisia quadrata Myrsinaceae RGT-00630 Juglans olanchana Juglandaceae DRC-00341 Malvaviscus arboreus Malvaceae Mortoniodendron abelianum Tiliaceae Erythrina berteroana Fabaceae DRC-00292 Conceveiba pleistomona Euphorbiaceae RDR-00202 Quercus bumelioides Fagaceae RGT-00884 Calathea crotalifera Marantaceae RGT-00690 Inga longispica Fabaceae RGT-00865.1 Cestrum megalophyllum Solanaceae RGT-00845 Lirimiris fascis ¿¿?? Notodontidae RDR-00149 RGT-00682 RDR-00171 RDR-00213.1 DRC-00240 DRC-00252 RDR-00158 RDR-00188 Lophocampa pectina Arctiidae Lophocampa Arctiidae Macaria Geometridae Manduca Sphingidae Marpesia merops Nymphalidae ¿¿?? ¿¿?? RDR-00239 Mechanitis menapis saturata Nymphalidae ¿¿?? ¿¿?? RDR-00172 Megeuptychia antonae Nymphalidae Calathea crotalifera Marantaceae Memphis beatrix Nymphalidae Piper arboreum Piperaceae Methone cecilia chrysomela Lycaenidae Heliconia tortuosa Heliconiaceae RDR-00311 Myscelus belti Hesperiidae Malvaviscus arboreus Malvaceae DRC-00374 Inga longispica Fabaceae RDR-00265 Inga oerstediana Fabaceae Senna papillosa Fabaceae RDR-00263 Paullinia talamancensis Sapindaceae RDR 00341 Nymphidium ascolia ascolia Nyridela xanthocera Lycaenidae Arctiidae RGT-00902 RDR-00258 RDR-00297 RDR 00358 RDR-00264 RDR-00345 Opharus belus Arctiidae Celtis iguanaea Ulmaceae RGT-00873.1 RGT-00873.2 RGT-00873.3 Cecropia polyphlebia Opharus procroides Cecropiaceae RDR-00360.1 RDR-00360.2 Arctiidae Urera caracasana Urticaceae DRC-00366 211 Lepidoptera Género, Especie o Subespecies Planta Hospedera Familia Especie Familia No. Testigo DRC-00199 DRC-00294 Opsiphanes bogotanus alajuela Nymphalidae Heliconia tortuosa Heliconiaceae RDR-00203 RDR-00307 RGT-00763 RGT-00826 RDR-00163 Opsiphanes cassina Nymphalidae Chamaedorea crucensis Arecaceae RGT-00798.1 RGT-00798.3 Geonoma interrupta Arecaceae RDR-00261 DRC-00358 Opsiphanes quiteria talamancensis Nymphalidae Chamaedorea crucensis Arecaceae RDR-00103 RDR-00119 Geonoma interrupta Arecaceae RDR-00211 RGT-00831.1 Pelochyta affinis Arctiidae Vernonia patens Asteraceae RGT-00831.2 RGT-00831.3 RGT-00831.4 Pelochyta Arctiidae Malvaviscus arboreus Malvaceae RDR-00359 Perigonia lusca Sphingidae Cinchona pubescens Rubiaceae DRC-00312 RDR-00189 Perigonia stulta Sphingidae Cinchona pubescens Rubiaceae RGT-00669.1 RGT-00669.2 Phrygionis polita Geometridae ¿¿?? ¿¿?? RDR-00194 RGT-00724.1 Polypoetes villia Notodontidae Malvaviscus arboreus Malvaceae RGT-00724.2 RGT-00724.3 RDR-00210 RGT-00727.1 RGT-00765.2 Pteronymia picta notilla Nymphalidae Cestrum megalophyllum Solanaceae RGT-00937.1 RGT-00942 RGT-00946 RGT-00771 Rhodochlora Geometridae Posoqueria latifolia Rosema Notodontidae Urera caracasana Urticaceae Symphlebia tessellata Arctiidae Meliosma depressiva Sabiaceae RGT-00834 RGT-00674 DRC-00284 RDR-00115 212 Lepidoptera Género, Especie o Subespecies Planta Hospedera Familia Especie Familia No. Testigo DRC-00254 DRC-00316 Talides sinois cantra Hesperiidae Heliconia tortuosa Heliconiaceae DRC-00328 DRC-00337 RGT-00828 RGT-00829 Tarchon felderi Elaeagia auriculata Rubiaceae Philodendron brenesii Araceae Bombycidae DRC-00250 RDR-00212 DRC-00364 RDR-00357 Quercus rapurahuensis Fagaceae RDR-00432 RDR-00332 RDR-00331 Telemiades gallius Thracides phidon Hesperiidae Inga oerstediana Fabaceae Costus wilsonii Costaceae RDR-00305 DRC-00248 DRC-00285 DRC-00265 Hesperiidae Heliconia tortuosa Heliconiaceae RDR-00120 RDR-00126 RDR-00190 Tithorea tarricina pintias Nymphalidae Malvaviscus arboreus Malvaceae DRC-00264 DRC-00269 Tithraustes albinigra Notodontidae Chamaedorea crucensis Arecaceae RDR-00159 RDR-00169 RDR-00170.1 Tithraustes haemon Notodontidae Chamaedorea crucensis Arecaceae Tithrautes cf. moerens Notodontidae Chamaedorea crucensis Arecaceae RDR-00170.2 Xylophanes Sphingidae Hoffmania sp. Rubiaceae DRC-00261 Zodia sp. Choreutidae Erythrina berteroana Fabaceae RGT-00846 RDR-00198 Autor: González y Solís, 2008 213 Cuadro 6. Dípteros parasitoides de las especies de Lepidoptera criadas por los Parataxónomos en la EBA-PILA, durante los años 2004-2006. Dípteros Parasitoides Lepidópteros hospederos Género, especie o subespecie No. Testigo Género o especie Familia Familia Anoxynops auratus Tachinidae Belvosia n. sp. probab. Altura Tachinidae Belvosia sp. Tachinidae Calolydella Tachinidae DRC-00318 Calolydella sp.1 Tachinidae RGT-00917 Calolydella sp.2 Tachinidae Campylocheta Tachinidae Carcelia Tachinidae Megalopyge albicollis Megalopygidae RGT-00900 Chrysotachina Tachinidae Opsiphanes bogotanus alajuela Nymphalidae DRC-00295 Drino Tachinidae Sphingidae RGT-00719.2 Eucelatoria Tachinidae Hesperiidae RGT-00897 Eucelatoria Tachinidae Pyralidae RGT-00736.2 Género nuevo Tachinidae RGT-00733.1 Género nuevo Tachinidae RGT-00937 Género nuevo (Blondeliini) Tachinidae DRC-00253 Género nuevo cf. Myiopharus Tachinidae Género nuevo cf. Phytomyptera Tachinidae Hystrichia laxa Tachinidae Saturniidae RGT-00890.2 Hystrichia laxa Tachinidae Saturniidae RGT-00893.2 Hystrichia n. sp. Tachinidae DRC-00239 Jurinella Tachinidae DRC-00148 Jurinia sp. Tachinidae RDR-00214 Leschenaultia n. sp. Tachinidae Leskia Tachinidae Lespesia Tachinidae Lespesia aletiae complex Tachinidae Actinote anteas Nymphalidae RGT-00894.2 Lespesia aletiae complex Tachinidae Actinote anteas Nymphalidae RGT-00894.3 Lespesia sp. Tachinidae Acrolophidae RDR-00235 Lixophaga Tachinidae Crambidae RGT-00602 Lixophaga Tachinidae Pyralidae RGT-00835.2 Pantelloa Tachinidae Hesperiidae RGT-00726.2 Panzeria ? ampelus Tachinidae Arctiidae RGT-00637 Sphaerina Tachinidae Thelairaporia Tachinidae Saturniidae DRC-00373 Uramya Tachinidae Arctiidae RGT-00836.2 Tachinidae Arctiidae RGT-00648.2 DRC-00251 Automeris belti Eupterotidae RGT-00869.2 Saturniidae RGT-00895.2 Opsiphanes cassina RGT-00934 RGT-00933 Pteronymia picta notilla Nymphalidae RGT-00727 DRC-00319 Caligo atreus dionysos Nymphalidae RGT-00891.2 Pyralidae RGT-00863.2 RGT-00879.2 Herpetogramma agavealis DRC-00327 214 Dípteros Parasitoides Género o especie Lepidópteros hospederos Familia Género, especie o subespecie No. Testigo Familia Tachinidae Noctuidae RGT-00697.2 Autor: González y Solís, 2008. Cuadro 7. Himenópteros parasitoides de las especies de Lepidoptera criadas por los Parataxónomos en la EBA-PILA, durante los años los años 2004-2006. Himenópteros Parasitoides Género o especie Familia Mesochorus sp. Lepidópteros hospederos Género, especie o subespecie Ichneumonidae No. Testigo Familia Arctiidae Braconidae RGT-00663 RGT-00712 (Microgastrinae) Braconidae Arctiidae RGT-00713 (Microgastrinae) Braconidae RGT-00717 (Microgastrinae) Braconidae Pyralidae RGT-00725.2 Crambidae RGT-00731.1 Hesperiidae RGT-00744.2 (Microgastrinae) Braconidae (Microgastrinae) Braconidae (Microgastrinae) Pristomerus sp. Ichneumonidae Pyralidae RGT-00746.2 Trieces wascia Ichneumonidae Pyralidae RGT-00736.3 Braconidae Pyralidae RGT-00767.2 Hesperiidae RGT-00777.2 (Microgastrinae) Braconidae Indeterminado Braconidae Opsiphanes cassina Nymphalidae RGT-00798.2 Ichneumonidae Opsiphanes cassina Nymphalidae RGT-00798.3 Pyralidae RGT-00808.2 Nymphalidae RGT-00861.2 Pyralidae RGT-00816.2 (Ichneumoninae) Braconidae Braconidae Indeterminado Dione juno juno Ichneumonidae (Ichneumoninae) Braconidae RGT-00817.2 (Microgastrinae) Braconidae Pyralidae RGT-00824.2 Nymphalidae RGT-00839.2 (Microgastrinae) Brachymeria sp. Chalcididae Actinote anteas anteas 215 Himenópteros Parasitoides Género o especie Familia Lepidópteros hospederos Género, especie o subespecie No. Testigo Familia Braconidae RGT-00844.2 (Microgastrinae) Mesochorus sp. Ichneumonidae Braconidae Opsiphanes quiteria Arctiidae RGT-00857.2 Nymphalidae RDR-00103.2 talamancensis Braconidae Opsiphanes quiteria Microgastrinae talamancensis Braconidae RDR-00103 Nymphalidae Arctiidae RDR-00121.2 Braconidae Hesperiidae RDR-00156.1 Braconidae Hesperiidae RDR-00174 Nymphalidae RDR-00175.1 (Microgastrinae) Braconidae Opsiphanes sp. (Microgastrinae) Apectis zapoteca Ichneumonidae RDR-00176.1 Braconidae Hesperiidae RDR-00185.2 (Microgastrinae) RDR-00204 Braconidae RDR-00218.1 (Microgastrinae) Braconidae RDR-00219.1 (Microgastrinae) Braconidae Hesperiidae Braconidae RDR-00224.1 RDR-00227.1 (Microgastrinae) Braconidae RDR-00229 (Microgastrinae) Apectis zapoteca Ichneumonidae RDR-00230.1 Braconidae RDR-00231 (Microgastrinae) Encyrtidae parasit. RDR-00234 Tachinidae Braconidae Braconidae Opsiphanes sp. Hesperiidae RDR-00236.1 Nymphalidae RDR-00267.1 Hesperiidae RDR-00268.1 Hesperiidae RDR-00269.1 (Microgastrinae) Braconidae (Microgastrinae) Braconidae (Microgastrinae) 216 Himenópteros Parasitoides Género o especie Familia Braconidae Lepidópteros hospederos Género, especie o subespecie Phobetron sp. No. Testigo Familia Limacodidae RDR-00270.1 (Microgastrinae) Braconidae ¿Caligo sp.? RDR-00272 (Microgastrinae) Nymphalidae Braconidae Hesperiidae Braconidae Agrypon sp. Ichneumonidae RDR-00281.1 RDR-00282 Tortricidae RDR-00298.1 Braconidae RDR-00299 Braconidae RDR-00301 (Microgastrinae) Mesochurus sp. Ichneumonidae Lycaenidae RDR-00303.1 RDR-00304 Braconidae Hesperiidae RDR-00320.1 Eulophidae RDR-00325 Braconidae RDR-00329.1 (Microgastrinae) Dusona sp. Ichneumonidae Dusona sp. Ichneumonidae RDR-00330.1 Arctiidae RDR-00336.1 RDR-00337 RDR-00339 Braconidae Nymphalidae RDR-00356 RDR-00374 RDR-00375 Braconidae RDR-00407 (Microgastrinae) Mesochurus sp. Ichneumonidae RDR-00407 Braconidae RDR-00408 (Microgastrinae) Braconidae RDR-00449 (Microgastrinae) Braconidae RDR-00450 (Microgastrinae) Braconidae DRC-00156 (Microgastrinae) DRC-00173 Cryptophion sp. Eiphosoma sp. Ichneumonidae DRC-00182 Braconidae DRC-00193 Ichneumonidae DRC-00203 217 Himenópteros Parasitoides Género o especie Familia Lepidópteros hospederos Género, especie o subespecie No. Testigo Familia Chalcididae DRC-00205 Braconidae DRC-00208 Braconidae DRC-00211 (Microgastrinae) Dusona sp. Ichneumonidae DRC-00216 Braconidae DRC-00220 (Microgastrinae) Mesochurus sp. Ichneumonidae DRC-00228 Indeterminado Ichneumonidae DRC-00231 (Banchinae) Mesochurus sp. Ichneumonidae DRC-00255 Ichneumonidae DRC-00270 Braconidae (Microgastrinae) Agrypon sp. Opsiphanes sp. Nymphalidae Ichneumonidae Braconidae DRC-00275 DRC-00282 Hesperiidae DRC-00283 Braconidae DRC-00299 Mesochurus sp. Ichneumonidae DRC-00322 Mesochurus sp. Ichneumonidae DRC-00329 Braconidae DRC-00345 (Microgastrinae) Mesochurus sp. Ichneumonidae DRC-00354 Ichneumonidae DRC-00367 Braconidae DRC-00377 Braconidae DRC-00391 Braconidae DRC-00400 (Microgastrinae) Ichneumonidae DRC-00405 Ichneumonidae DRC-00406 Braconidae DRC-00410 (Microgastrinae) Braconidae DRC-00412 (Microgastrinae) Mesochurus sp. Ichneumonidae DRC-00414 Autor: González y Solís, 2008. 218 Cuadro 8. Lista de autores de las especies de insectos citadas en el texto. Orden Familia Especie o subespecie Autor Diptera Sarcophagidae Peckia volucris (van der Wulp, 1895) Diptera Tachinidae Anoxynops auratus Townsend Diptera Tachinidae Blepharipa ciliata (Macquart, 1834) Diptera Tachinidae Blepharipa fimbriata (van der Wulp, 1890) Diptera Tachinidae Hyphantrophaga virilis (Aldrich and Webber, 1924) Diptera Tachinidae Leptostylum auratum Diptera Tachinidae Pantelloa xanthura Diptera Tachinidae Triodontopyga flavolimbata Diptera Tachinidae Winthemia pinguis Fabricius, 1805 Hymenoptera Braconidae Alphomelon talidicida (Wilkinson 1931) Hymenoptera Ichneumonidae Creagrura nigripes Townes, 1971 Hymenoptera Ichneumonidae Enicospilus cameronii (Dalla Torre, 1901) Hymenoptera Ichneumonidae Enicospilus simoni Gauld, 1988 Hymenoptera Ichneumonidae Eniscopilus tenuigena (Kriechbaumer, 1901) Hymenoptera Formicidae Pheidole biolleyi Forel, 1908 Hymenoptera Scelionidae Telenomus dilophonotae Cameron, 1913 Hymenoptera Vespidae Mischocyttarus atramentarius Zikán, 1949 Hymenoptera Vespidae Parachartergus apicalis (Fabricius, 1804) Lepidoptera Arctiidae Amastus rumina Druce, 1906 Lepidoptera Arctiidae Amycles adusta (Felder, 1874) Lepidoptera Arctiidae Bertholdia crocea Schaus, 1910 Lepidoptera Arctiidae Bertholdia philoptera Druce, 1897 Lepidoptera Arctiidae Dysschema cerialis Druce, 1884 Lepidoptera Arctiidae Elysius melanoplaga Hampson, 1901 Lepidoptera Arctiidae Holophaea lycone Druce, 1884 Lepidoptera Arctiidae Opharus belus Druce, 1897 Lepidoptera Arctiidae Opharus procroides Walter, 1855 Lepidoptera Arctiidae Pelochyta affinis Rothschild, 1909 Lepidoptera Bombycidae Tarchon felderi (Druce, 1887) Lepidoptera Crambidae Herpetogramma agavealis (Walker, 1859) Lepidoptera Hesperiidae Achyloides busirus (Cramer, 1779) Lepidoptera Hesperiidae Aegiale hesperiaris (Walker, 1856) Lepidoptera Hesperiidae Astraptes fulgerator (Walch, 1775) Lepidoptera Hesperiidae Celaenorrhinus stallingsi H.A. Freeman, 1946 Lepidoptera Hesperiidae Elbella scylla (Menetries, 1855) Lepidoptera Hesperiidae Jemadia hospita Butler 1877 Lepidoptera Hesperiidae Melanopyge erythrosticta (Godman & Salvin 1879) Lepidoptera Hesperiidae Myscelus amystis (Hewitson, 1867) 219 Orden Familia Especie o subespecie Autor Lepidoptera Hesperiidae Myscelus belti Godman & Salvin 1879 Lepidoptera Hesperiidae Mysoria ambigua Mabille & Boullet 1908 Lepidoptera Hesperiidae Saliana antoninus Latreille 1824 Lepidoptera Hesperiidae Talides sinois cantra Evans, 1955 Lepidoptera Hesperiidae Telemiades gallius Mabille, 1883 Lepidoptera Hesperiidae Yanguna cosyra (Druce 1875) Lepidoptera Lycaenidae Cachrus ascolides (Boisduval, 1870) Lepidoptera Lycaenidae Nymphidium ascolia ascolia Hewitson, 1853 Lepidoptera Megalopygidae Megalopyge albicollis (Walker 1855) Lepidoptera Notodontidae Lirimiris fascis Schaus, 1890 Lepidoptera Notodontidae Polypoetes villia Druce, 1897 Lepidoptera Nymphalidae Caligo atreus dionysos Fruhstorfer, 1912 Lepidoptera Nymphalidae Caligo brasiliensis (Felder, 1862) Lepidoptera Nymphalidae Caligo brasiliensis sulanus Fruhstorfer, 1904 Lepidoptera Nymphalidae Caligo eurilochus sulanus Fruhstorfer 1904 Lepidoptera Nymphalidae Caligo memnon (C. Felder y R. Felder, 1867) Lepidoptera Nymphalidae Hypanartia dione arcaei (Godman & Salvin, 1871) Lepidoptera Nymphalidae Memphis beatrix (Druce, 1874) Lepidoptera Nymphalidae Opsiphanes bogotanus Distant, 1875 Lepidoptera Nymphalidae Opsiphanes bogotanus alajuela Bristow, 1991 Lepidoptera Nymphalidae Opsiphanes cassina C. & R. Felder, 1862 Lepidoptera Nymphalidae Opsiphanes quiteria talamancensis Bristow, 1991 Lepidoptera Nymphalidae Opsiphanes tamarindi Felder, 1861 Lepidoptera Nymphalidae Pteronymia picta notilla Butler y H. Druce, 1872 Lepidoptera Saturniidae Automeris banus (Boisduval, 1875) Lepidoptera Saturniidae Copaxa rufinans Schaus, 1906 Lepidoptera Saturniidae Gamelia musta Schaus, 1912 Lepidoptera Saturniidae Hylesia lineata Druce 1886 Lepidoptera Sphingidae Eumorpha labruscae (Linnaeus 1758) Lepidoptera Sphingidae Hemerophanes triptolemus (Cramer, 1779) Lepidoptera Sphingidae Manduca quinquemaculata (Haworth 1803) Lepidoptera Sphingidae Manduca sexta (Linnaeus 1763) Lepidoptera Sphingidae Perigonia stulta Herrich-Schaffer & Schaffer, 1854 Autor: González y Solís, 2008. 220 Cuadro 9. Lista de autores de especies de plantas citadas en el texto. Familia Especie Autor Nombre común Acanthaceae Aphelandra scabra (Vahl) Sm. Acanthaceae Dicliptera iopus Lindau Acanthaceae Justicia macrantha Benth. Acanthaceae Mendoncia retusa Turrill Amaranthaceae Iresine diffusa Humb. & Bonpl. ex Willd. Anacardiaceae Mangifera indica L. Araceae Anthurium consobrinum Schott Araceae Philodendron brenesii Standl. Araceae Philodendron rhodoaxis G. S. Bunting Araceae Rhodospatha pellucida Croat & Grayum -ined Araceae Syngonium angustatum Schott Arecaceae Acrocomia aculeata (Jacq.) Lodd. ex Mart. Arecaceae Asterogyne martiana (H. Wendl.) H. Wendl. ex Hemsl. Arecaceae Astrocaryum alatum H. F. Loomis Arecaceae Bactris dianeura Burret Pacaya Arecaceae Bactris gasipaes Kunth Pejibaye Arecaceae Bactris gracilior Burret Pacaya Arecaceae Bactris guineensis (L.) H. E. Moore Pacaya Arecaceae Bactris hondurensis Standl. Pacaya Arecaceae Bactris major Jacq. Pacaya Arecaceae Calyptrogyne ghiesbreghtiana (Linden & H. Wendl.) H. Wendl. Arecaceae Calyptrogyne trichostachys Burret Arecaceae Chamaedorea anemophila Hodel -ined. Arecaceae Chamaedorea costaricana Oerst. Pacaya Arecaceae Chamaedorea crucensis Hotel Pacaya Arecaceae Chamaedorea dammeriana Burret Pacaya Arecaceae Chamaedorea pinnatifrons (Jacq.) Oerst. Pacaya Arecaceae Chamaedorea tepejilote Liebm. Pacaya Arecaceae Chamaedorea warscewiczii H. Wendl. Pacaya Arecaceae Chrysalidocarpus lutescens H. Wendl Arecaceae Cocos nucifera L. Arecaceae Euterpe precatoria Mart Arecaceae Geonoma congesta H. Wendl. ex Spruce Arecaceae Geonoma cuneata H. Wendl. ex Spruce Arecaceae Geonoma edulis H. Wendl. ex Spruce Arecaceae Geonoma ferruginea H. Wendl. ex Spruce Mango Coco 221 Familia Especie Autor Nombre común Arecaceae Geonoma interrupta (Ruiz & Pav.) Mart. Arecaceae Neonicholsonia watsonii Dammer Arecaceae Prestoea decurrens (H. Wendl. ex Burret) H. E. Moore Arecaceae Synechanthus warscewiczianus H. Wendl. Asteraceae Baccharis trinervis (Lam.) Pers. Asteraceae Melanthera aspera (Jacq.) Small Asteraceae Mikania banisteriae DC. Asteraceae Mikania guaco Humb. & Bonpl. Asteraceae Salmea scandens (L.) DC. Asteraceae Senecio megaphyllus Greenm. Asteraceae Vernonia patens Kunth Asteraceae Zexmenia virgulta Klatt Bignoniaceae Amphitecna latifolia (Mill.) A. H. Gentry Bignoniaceae Anemopaegma puberulum (Seibert) Miranda Bignoniaceae Arrabidaea chica (Humb. & Bonpl.) Verl. Bignoniaceae Tabebuia rosea (Bertol.) DC. Bignoniaceae Xylophragma seemannianum (Kuntze) Sandwith Bombacaceae Ochroma pyramidale (Cav. ex Lam.) Urb. Bombacaceae Pachira aquatica Aubl. Boraginaceae Cordia alliodora (Ruiz & Pav.) Oken Boraginaceae Cordia cymosa (Donn. Sm.) Standl. Boraginaceae Cordia eriostigma Pittier Boraginaceae Cordia panamensis Riley Bromeliaceae Aechmea pubescens Baker Cannaceae Canna indica L. Cannaceae Canna tuerkheimii Kraenz Cecropiaceae Cecropia obtusifolia Bertol. Guarumo Cecropiaceae Cecropia peltata L. Guarumo Cecropiaceae Cecropia polyphlebia Donn. Sm. Guarumo Cecropiaceae Coussapoa nymphaeifolia Standl. Celastraceae Celastrus vulcanicola Donn. Sm. Clethraceae Clethra lanata M. Martens & Galeotti Clethraceae Clethra mexicana A. DC. Clusiaceae Symphonia globulifera L.f. Combretaceae Combretum laxum Jacq. Combretaceae Terminalia amazonia (J. F. Gmel.) Exell Connaraceae Cnestidium rufescens Planch. Rasgatrapo Tuete Laurel Cerillo Amarillón 222 Familia Especie Autor Nombre común Connaraceae Connarus vulcanicus J.F. Morales Cucurvitaceae Cucumis melon Standl. Cunoniaceae Weinmannia wercklei Standl. Dichapetalaceae Dichapetalum morenoi Prance Dilleniaceae Davilla nitida (Vahl) Kubitzki Elaeocarpaceae Sloanea faginea Standl. Euphorbiaceae Acalypha diversifolia Jacq. Euphorbiaceae Acidoton nicaraguensis (Hemsl.) G. L. Webster Euphorbiaceae Adelia triloba (Müll. Arg.) Hemsl. Euphorbiaceae Alchornea latifolia Sw. Euphorbiaceae Conceveiba pleiostemona Donn. Sm. Euphorbiaceae Croton billbergianus Müll. Arg. Euphorbiaceae Croton schiedeanus Schltdl. Euphorbiaceae Hyeronima alchorneoides Allemao Euphorbiaceae Pausandra trianae (Müll. Arg.) Baill Euphorbiaceae Sapium glandulosum (L.) Morong Fabaceae Andira inermis (W. Wright) Kunth Fabaceae Centrosema plumieri (Turpin) Benth Fabaceae Cojoba valerioi Britton & Rose Fabaceae Dioclea malacocarpa Ducke Fabaceae Dioclea reflexa Hook. f. Fabaceae Dioclea wilsonii Standl. Fabaceae Entada gigas (L.) Fawc. & Rendle Fabaceae Erythrina lanceolata Standl. Poró Fabaceae Inga chocoensis T. Elias Guaba Fabaceae Inga herrerae N. Zamora sp. spuria (Willd.) León Guaba Fabaceae Inga longispica Standl. Guaba Fabaceae Inga mortoniana Jorge León Guaba Fabaceae Inga oerstediana Benth. ex Seem Guaba Fabaceae Inga punctata Willd. Guaba Fabaceae Inga sapindoides Willd. Guaba Fabaceae Inga semialata (Vell. Conc.) C.Martius Guaba Fabaceae Lonchocarpus oliganthus F. J. Herm. Fabaceae Lonchocarpus retiferus Standl. & L. O. Williams Fabaceae Machaerium acuminatum Kunth Fabaceae Machaerium cobanense Donn. Sm. Fabaceae Ormosia cruenta Rudd Fabaceae Pachyrhizus erosus (L.) Urb. Melón 223 Familia Especie Autor Nombre común Fabaceae Pithecellobium elegans Ducke Fabaceae Pithecellobium furcatum Benth. Fabaceae Pithecellobium macradenium Pittier Fabaceae Pterocarpus officinalis Jacq. Fabaceae Pterocarpus rohrii Vahl Fabaceae Senna hayesiana (Britton & Rose) Irwin & Barneby Fabaceae Senna papillosa (Britton & Rose) Irwin & Barneby Fabaceae Stryphnodendron microstachyum Poepp. & Endl. Fabaceae Swartzia cubensis (Britton & P. Wilson) Standl. Fabaceae Zygia longifolia (Humb. & Bonpl. ex Willd.) Britton & Rose Fagaceae Quercus rapurahuensis Pittier ex Trel. Flacourtiaceae Laetia procera (Poepp.) Eichler Heliconiaceae Heliconia longa (Griggs) H. J. P. Winkl. Platanilla Heliconiaceae Heliconia irrasa R.R.Sm Platanilla Heliconiaceae Heliconia latispatha Bent. Platanilla Heliconiaceae Heliconia longiflora R.R.Sm Platanilla Heliconiaceae Heliconia mathiasiae G. S. Daniels & F. G. Stiles Platanilla Heliconiaceae Heliconia pogonantha Cufod. Platanilla Heliconiaceae Heliconia tortuosa Grigs Platanilla Heliconiaceae Heliconia vaginalis Benth. Platanilla Hippocastanaceae Billia hippocastanum Peyr. Icacinaceae Calatola costaricensis Standl. Juglandaceae Alfaroa guanacastensis D. Stone Lacistemataceae Lacistema aggregatum (Bergius) Rusby Lauraceae Beilschmiedia brenesii C. K. Allen Lauraceae Cinnamomum brenesii (Standl.) Kosterm. Lauraceae Cinnamomum triplinerve (Ruiz & Pav.) Kosterm. Lauraceae Nectandra hihua (Ruiz & Pav.) Rohwer -ined. Lauraceae Nectandra martinicensis Mez Lauraceae Nectandra membranacea (Sw.) Griseb. Lauraceae Nectandra salicifolia (Kunth) Nees Lauraceae Nectandra salicina C. K. Allen Lauraceae Ocotea aff leucoxylon (Sw.) Laness. Lauraceae Ocotea aff. smithii C. K. Allen Lauraceae Ocotea insularis (Meisn.) Mez Lauraceae Ocotea mollifolia Mez & Pittier Lauraceae Ocotea stenoneura Mez & Pittier Lauraceae Ocotea veraguensis (Meisn.) Mez Roble Aguacatillo 224 Familia Especie Autor Nombre común Lauraceae Ocotea whitei Woodson Lauraceae Persea americana Mill. Lauraceae Persea schiedeana Nees Malpighiaceae Hiraea reclinata Jacq. Malvaceae Hampea appendiculata (Donn. Sm.) Standl. Malvaceae Malvaviscus arboreus Cav. Malvaceae Malvaviscus palmanus Pittier & Donn. Sm. Malvaceae Pavonia schiedeana Steud. Marantaceae Calathea crotalifera S. Watson Marantaceae Calathea lutea (Aubl.) Schult. Marantaceae Maranta arundinacea Plum. ex L. Marantaceae Pleiostachya leiostachya (Donn. Sm.) Hammel Melastomataceae Tibouchina longifolia (Vahl) Baill. ex Cogn. Meliaceae Guarea bullata Radlk. Meliaceae Guarea glabra Vahl Menispermaceae Abuta panamensis (Standl.) Krukoff & Barneby Menispermaceae Cissampelos pareira L. Moraceae Brosimum alicastrum Sw. Moraceae Pseudolmedia spuria (Sw.) Griseb. Moraceae Sorocea trophoides W. C. Burger Moraceae Trophis involucrata W. C. Burger Musaceae Musa acuminata Colla Banano Musaceae Musa cavendishii L. Plátano Myristicaceae Virola koschnyi Warb. Myrtaceae Myrcia splendens (Sw.) DC. Myrtaceae Psidium guajava L. Olacaceae Heisteria macrophylla Oerst. Piperaceae Piper aduncum L. Piperaceae Piper arboreum Aubl. Piperaceae Piper auritum Kunth Piperaceae Piper cenocladum C. DC. Piperaceae Piper chrysostachyum C. DC. Piperaceae Piper fimbriulatum C. DC. Piperaceae Piper flavidum C. DC. Piperaceae Piper guanacostense C. DC. Piperaceae Piper jacquemontianum Kunth Piperaceae Piper peltatum L. Aguacate Amapola Guayaba 225 Familia Especie Autor Nombre común Piperaceae Piper psilorhachis C. DC. Poaceae Cynodon nlemfuensis Vanderyst Poaceae Lasciacis rhizophora (Fourn.) Hitchc. Poaceae Lasiacis procerrima (Hack.) Hitchc. Poaceae Pharus parvifolius Nash Poaceae Setaria paniculifera (Steud.) E. Fourn. ex Hemsl. Polygonaceae Coccoloba tuerckheimii Donn. Sm. Rhamnaceae Gouania colombiana Suess. Rosaceae Prunus annularis Koehne Rosaceae Rubus urticifolius Poir. Rubiaceae Amaioua pedicellata Dwyer Rubiaceae Augusta rivales (Benth.) J.H. Kirkb Rubiaceae Chiococca alba (L.) Hitchc. Rubiaceae Cinchona pubescens Vahl Quina Rubiacaea Coffea arabica L. Café Rubiaceae Cosmibuena macrocarpa Benth. Rubiaceae Coussarea austin-smithii Standl. Rubiaceae Elaeagia auriculata Hemsl. Rubiaceae Elaegia auriculata Hemsl. Rubiaceae Gonzalagunia rosea Standl. Rubiaceae Guettarda foliacea Standl. Rubiaceae Hoffmannia longipetiolata Pol. Rubiaceae Palicourea padifolia (Roem. & Schult.) C. M. Taylor & Lorence Rubiaceae Pentagonia donnell-smithii (Standl.) Standl. Rubiaceae Posoqueria latifolia (Rudge) Roem. & Schult. Rubiaceae Psychotria berteriana DC. Cafecillo (Dwyer & M. V. Hayden) W. C. Burger & Rubiaceae Psychotria correae C. M. Taylor Rubiaceae Psychotria cyanococca Seem. ex Dombrain Rubiaceae Psychotria pubescens Sw. Rubiaceae Rondeletia buddleioides Benth. Rubiaceae Spermacoce cf. f ovalifolia (M. Martens & Galeotti) Hemsl. Rutaceae Citrus sinensis (L.) Osbeck Rutaceae Zanthoxylum mayanum Standl. Rutaceae Zanthoxylum melanostictum Schltdl. & Cham. Sabiaceae Meliosma glabrata (Liebm.) Urb. Salicaceae Casearia nitida (L.) Salicaceae Hasseltia floribunda Kunth Limón, mandarina 226 Familia Especie Autor Nombre común Salicaceae Xylosma intermedia (Seem.) Triana & Planch. Sapindaceae Allophylus psilospermus Radlk. Sapindaceae Cupania glabra Sw. Sapindaceae Serjania atrolineata Sauvalle & C. Wright Sapindaceae Serjania mexicana (L.) Willd. Sapindaceae Serjania valerii Standl. Sapotaceae Pouteria exfoliata T. D. Penn. Sapotaceae Pouteria reticulata (Engl.) Eyma Schizaeaceae Lygodium venustum Sw. Smilacaceae Smilax spinosa Mill. Solanaceae Cestrum fragile Francey Solanaceae Cestrum megalophyllum Dunal Solanaceae Cestrum racemosum Ruiz & Pav. Solanaceae Solanum arboreum Humb. & Bonpl. ex Dunal Solanaceae Solanum brensii C.V.Morton & Standl. Solanaceae Solanum hayesii Fernald Solanaceae Solanum rovirosanum Donn. Sm. Solanaceae Solanum schlechtendalianum Walp. Solanaceae Solanum torvum Sw. Sterculiaceae Guazuma ulmifolia Lam. Styraceae Styrax argenteus C. Presl Tiliaceae Heliocarpus americanus L. Tiliaceae Heliocarpus appendiculatus Turcz. Tiliaceae Mortoniodendron abelianum Standl. Tiliaceae Mortoniodendron guatemalense Standl. & Steyerm. Tiliaceae Triumfetta lappula L. Ulmaceae Celtis iguanaea (Jacq.) Sarg. Ulmaceae Trema micrantha (L.) Blume Urticaceae Myriocarpa longipes Liebm. Urticaceae Urera caracasana (Jacq.) Griseb. Urticaceae Urera eggersii Hieron. Urticaceae Urera elata (Sw.) Griseb. Verbenaceae Citharexylum costaricensis Moldenke Verbenaceae Gmelina arborea (L.) Roxb. Melina Verbenaceae Lantana camara L. Siete negritos Verbenaceae Petrea volubilis L. Verbenaceae Stachytarpheta frantzii Polak Zorrillo Burío Ortiga Rabo de león 227 Familia Especie Autor Violaceae Rinorea deflexiflora Bartlett Vitaceae Vitis tiliifolia Humb. & Bonpl. Vochysiaceae Vochysia ferruginea Mart. Vochysiaceae Vochysia guatemalensis Donn. Sm. Zingiberaceae Renealmia cernua (Sw.) J. F. Macbr. Nombre común Autor: González y Solís, 2008. Figura 39: a- Etiqueta de información general de cada espécimen. b- Código de barras. 228 Figura 40. Campos a llenar en una base de datos de testigos. Fotografía: Manuel Solís. 229 Figura 41. Campos de la página principal del sistema ATTA-Web. Fotografía: Róger González. 230 Apéndice 1. Ciclo biológico, tasas de supervivencia, reproducción y longevidad de los adultos en cautiverio de Opsiphanes cassina C. & R. Felder, 1862 (Morphinae; Nymphalidae; Lepidoptera). Introducción En este apéndice se describe el ciclo biológico, tasas de supervivencia de huevos, larvas, pupas y adultos de O. cassina en cautiverio (ex situ en sistema cerrado), así como las tasas de reproducción y longevidad de las mariposas adultas, en el insectario de investigación del INBio. Se adaptó la metodología propuesta por Montero (2007) para obtener los datos aquí expuestos con el fin de que otros investigadores la puedan aplicar en el estudio de la biología ex situ de las especies de lepidópteros presentes en la EBA y otros lugares del país. Se trabajó con O. cassina por ser una especie fácil de observar y encontrar en el sector Altamira. También es una especie de importancia agrícola y económica por ser una plaga potencial en cultivos de pacayas, pejibaye y otras especies de la familia Arecaceae, así como su uso en zoocriaderos de mariposas para la exportación de sus pupas y exhibición. O. cassina es una especie que tiene una amplia distribución en el país (Especie 24, pp. 146 y 202) y sus larvas son comunes en las pacayas de los jardines de las casas, motivo por el cual se le conoce como la mariposa de la pacaya (Alfaro, 1915). Metodología De octubre del 2006 a febrero del 2007 se estudiaron las fases inmaduras del ciclo biológico de O. cassina logrando criar hasta dos generaciones ex situ en un sistema cerrado. Se recopilaron los datos sistemáticamente y se describe la duración del ciclo biológico, el crecimiento longitudinal de las larvas en cada estadio, las tasas de supervivencia en huevos, larvas, pupas y adultos emergidos, reproducción y longevidad de adultos de esta especie. Se inició con un pie de cría de nueve machos y cinco hembras adultos de O. cassina que se recolectaron mediante trampas de frutas con un cebo de puré de banano principalmente y piña en algunas ocasiones, colocadas dentro del INBioparque y el vivero del INBio. A inicios de octubre del 2006 se recolectaron cinco machos y una hembra de O. cassina con los cuales se obtuvo el primer grupo de huevos, larvas y pupas para la toma de datos. Un segundo pie de cría de cuatro machos y cuatro hembras se capturó a inicios del mes de noviembre del 2006 para aumentar la cantidad de datos. 231 Dentro del insectario se colocaron tres pacayas pequeñas de la especie Chamaedorea costaricana (Arecaceae) como plantas hospederas para que las hembras de O. cassina ovipositaran. Para la alimentación de los adultos dentro del insectario se colocaron recipientes con puré de banano y piña. Las larvas se alimentaron con trozos de hojas de C. costaricana y Dypsis lutescens (Arecaceae, ornamental introducida) de los alrededores de los jardines de los edificios del INBio, ya que las plantas en el insectario eran muy pequeñas y con poco follaje para alimentar las larvas. Los huevos recolectados se mantuvieron en cajitas plásticas con un algodón ligeramente mojado para mantener la humedad. Las larvas fueron criadas en grupos de hasta seis larvas durante el primer y segundo estadio dentro de frascos de vidrio de 100 ml y de tres a una larva durante el tercer a quinto estadio en frascos de vidrio de 1 000 ml. La comida se les cambio cada dos a tres días dependiendo de la cantidad de tejido vegetal consumido y la suciedad del frasco. Las pupas se separaron en bolsas plásticas de 16x24 cm o dentro de un cajón de madera con puerta de cedazo llamado pupario. En todos los casos se utilizaron etiquetas con información básica como el número testigo, especie, cantidad de individuos, fecha y sexo. Se llevó un control diario de la oviposición, eclosión de huevos, crecimiento y mudas de las larvas, formación de pupas, emersión y longevidad de adultos. Inicialmente se registró en una libreta de testigos la cantidad de huevos puestos por día y a ese grupo de huevos se le asignó un número testigo consecutivo (por ejemplo MSV00184). Con la ayuda de una “hoja de registro de mudas” única para cada número testigo (grupo de huevos) se anotó la fecha cada vez que un huevo eclosionó, que una larva mudó, se formó una pupa o emergió un adulto. Se tomaron medidas del alto y diámetro de los huevos. Para las larvas se tomaron dos medidas: del borde anterior de la cabeza al borde posterior del segmento anal (long1) y del borde anterior de la cabeza al ápice de las caudas anales (long2). Las mudas se determinaron considerando el desprendimiento de la cápsula cefálica. Cada vez que ocurrió una muda y antes de que las larvas se alimentaran, estas se midieron para determinar el crecimiento en cada estadio larval. 232 Los huevos y las larvas en primer estadio se midieron con un Estereoscopio Olympus SZ 6045 y un micrómetro ocular 0-100 µ. La medida obtenida a 1X de magnificación se multiplica por 0,098 para transformarla en milímetros (por ejemplo; 50 µ a 1X * 0,098 = 4,9 mm.). Las medidas de las larvas desde el segundo hasta el quinto estadio se obtuvieron con un compás de precisión de punta fija marca Staedtler y un calibrador o “pie de rey” digital Avenger 0-150 mm. Se determinaron las tasas de supervivencia para los huevos, larvas, pupas y adultos anotando la cantidad de individuos muertos en cada etapa del ciclo. Las tasas de supervivencia se expresan en números porcentuales aplicando las siguientes fórmulas (ver Montero, 2007): % huevos eclosionados = Nº de huevos eclosionados / Nº total de huevos x 100 % supervivencia larvas = total de larvas vivas / Nº de larvas eclosionadas x 100 % supervivencia pupas = total de pupas vivas / total de larvas vivas x 100 % de adultos emergidos = adultos vivos / pupas vivas x 100 Las tasas de reproducción se determinaron mediante la cantidad de huevos puestos por día y la frecuencia (cada cuántos días) con que las hembras liberadas dentro del insectario ovipositaron. La recolección de los huevos se hizo entre las siete y nueve de la mañana, de tal forma que se contabilizaron los huevos puestos en el día anterior. En el caso en que la cantidad de hembras liberadas en el jardín del insectario fueron dos o más, se contó la cantidad total de huevos recolectados y se dividió entre la cantidad de hembras liberadas y la cantidad de días anteriores a la recolección. Por ejemplo: 40 huevos recolectados / 5 hembras = 8 huevos por hembra 8 huevos por hembras / 2 días = 4 huevos por hembra en un día Para determinar la longevidad de los adultos, estos se marcaron con un número consecutivo en la superficie ventral de las alas. En una “hoja de control de adultos” a este número se le asocio la fecha de pupación, emersión o captura, el sexo respectivo, día en que se liberó dentro del insectario y el día en que se encontró muerto. 233 Resultados a) Ciclo biológico El cuadro 10 y las figuras 42 y 43 se presentan los datos del ciclo biológico de 40 individuos criados de O. cassina con base al registro de las observaciones realizadas durante la investigación, sin embargo no todos los 40 individuos completaron con éxito el ciclo biológico, como se analiza más adelante (cuadro 17). En términos generales, el ciclo biológico completo de esta mariposa duró en promedio unos 80 días (n= 25), la fase de huevo duró unos 10 días (n= 36), la fase de larva duró unos 49 días (n= 32) y la fase de pupa unos 19 días (n= 25). De los 25 individuos que lograron completar el ciclo biológico, 10 fueron hembras y 15 fueron machos. 90 80,6 80 Cantidad de dìas 70 60 49,21 50 40 30 19,2 20 10,11 11,67 10 0 Huevo Larva Prepupa Pupa Promedio Total Fase del ciclo de vida Figura 42. Duración promedio de las fases del ciclo biológico de O. cassina en cautiverio en el insectario de investigación del INBio. Autor: Solís y González, 2008. 234 Cuadro 10. Duración del ciclo biológico de Opsiphanes cassina con base a las observaciones realizadas en el Insectario de Investigación del INBio. Fase Testigo Fase Huevo Primer estadio Segundo estadio Tercer estadio Cuarto estadio Quito estadio Larval Prepupa Fase Pupa Total MSV00179 MSV00181 MSV00182 MSV00183 MSV00184 Días Ciclo Sexo Emersión Oviposición Eclosión Inicio Muda Días Inicio Muda Días Inicio Muda Días Inicio Muda Días Inicio Prepupa Días días Inicio Muda Días Formación Adulto Días Días Adulto ……… 7.x.06 7.x.06 17.x.06 10 17.x.06 25.x.06 8 25.x.06 2.xi.06 8 2.xi.06 12.xi.06 10 12.xi.06 22.xi.06 10 46 22.xi.06 25.xi.06 3 25.xi.06 12.xii.06 17 66 H ……… 7.x.06 7.x.06 17.x.06 10 17.x.06 26.x.06 9 26.x.06 2.xi.06 7 2.xi.06 12.xi.06 10 12.xi.06 22.xi.06 10 46 22.xi.06 25.xi.06 3 25.xi.06 15.vii.06 20 69 M 4.x.06 14.x.06 10 14.x.06 28.x.06 14 28.x.06 3.xi.06 6 3.xi.06 10.xi.06 9 10.xi.06 20.xi.06 10 20.xi.06 2.xii.06 12 51 2.xii.06 ……… ………. ……….. 4.x.06 14.x.06 10 14.x.06 28.x.06 14 28.x.06 3.xi.06 6 3.xi.06 10.xi.06 9 10.xi.06 21.xi.06 11 21.xi.06 3.xii.06 12 52 3.xii.06 7.xii.06 4 7.xii.06 25.xii.06 18 84 H 5.x.06 15.x.06 10 15.x.06 28.x.06 13 28.x.06 3.xi.06 6 3.xi.06 10.xi.06 9 10.xi.06 20.xi.06 10 20.xi.06 2.xii.06 12 50 2.xii.06 5.xii.06 3 5.xii.06 24.xii.06 19 82 M 5.x.06 15.x.06 10 15.x.06 28.x.06 13 28.x.06 5.xi.06 8 5.xi.06 14.xi.06 9 14.xi.06 24.xi.06 10 24.xi.06 7.xii.06 14 54 7.xii.06 9.xii.06 2 9.xii.06 28.xii.06 19 85 H 6.x.06 16.x.06 10 16.x.06 28.x.06 12 28.x.06 4.xi.06 7 4.xi.06 12.xi.06 8 12.xi.06 23.xi.06 11 23.xi.06 4.xii.06 11 49 4.xii.06 8.xii.06 4 8.xii.06 28.xii.06 20 83 M 6.x.06 16.x.06 10 16.x.06 28.x.06 12 28.x.06 5.xi.06 8 5.xi.06 13.xi.06 8 13.xi.06 24.xi.06 11 24.xi.06 4.xii.06 10 49 4.xii.06 8.xii.06 4 8.xii.06 28.xii.06 20 83 M 6.x.06 16.x.06 10 16.x.06 28.x.06 12 28.x.06 5.xi.06 8 5.xi.06 ……… ……… ……… ……… ……… ……… ……… ……… ……… 6.x.06 16.x.06 10 16.x.06 ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… 6.x.06 ……….. ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… 7.x.06 17.x.06 10 17.x.06 29.x.06 13 29.x.06 5.xi.06 7 5.xi.06 14.xi.06 9 14.xi.06 23.xi.06 9 23.xi.06 3.xii.06 10 48 3.xii.06 8.xii.06 5 8.xii.06 25.xii.06 17 80 H 7.x.06 17.x.06 10 17.x.06 29.x.06 13 29.x.06 7.xi.06 9 7.xi.06 16.xi.06 9 16.xi.06 25.xi.06 9 25.xi.06 5.xii.06 10 50 5.xii.06 10.xii.06 5 10.xii.06 28.xii.06 18 83 M 7.x.06 18.x.06 11 18.x.06 29.x.06 12 29.x.06 7.xi.06 9 7.xi.06 16.xi.06 9 16.xi.06 26.xi.06 10 26.xi.06 5.xii.06 9 49 5.xii.06 12.xii.06 7 12.xii.06 1.i.07 20 87 M 9.x.06 18.x.06 9 18.x.06 28.x.06 10 28.x.06 3.xi.06 6 3.xi.06 9.xi.07 6 9.xi.07 19.xi.06 10 19.xi.06 30.xii.06 11 43 30.xii.06 3.xii.06 3 3.xii.06 21.xii.06 18 73 M 9.x.06 19.x.06 10 19.x.06 28.x.06 9 28.x.06 4.xi.06 7 4.xi.06 11.xi.06 7 11.xi.06 21.xi.06 10 21.xi.06 1.xii.06 10 44 1.xii.06 6.xii.06 5 6.xii.06 24.xii.06 17 76 M …….. 22.xi.06 MSV00185 MSV00186 MSV00187 MSV00188 9.x.06 19.x.06 10 19.x.07 28.x.06 9 28.x.06 5.xi.06 8 5.xi.06 11.xi.06 6 11.xi.06 22.xi.06 11 2.xii.06 15.xii.06 13 47 15.xii.06 17.xii.06 2 17.xii.06 7.i.07 21 80 H 9.x.06 20.x.06 11 20.x.06 29.x.06 9 29.x.06 5.xi.06 7 5.xi.06 12.xi.06 7 12.xi.06 22.xi.06 10 22.xi.06 2.xii.06 10 43 2.xii.06 6.xii.06 4 6.xii.06 25.xii.06 19 77 M 9.x.06 20.x.06 11 20.x.06 29.x.06 9 29.x.06 5.xi.06 7 5.xi.06 12.xi.06 7 12.xi.06 23.xi.06 11 23.xi.06 3.xii.06 10 44 3.xii.06 7.xii.06 4 7.xii.06 27.xi.06 20 79 M 9.x.06 20.x.06 11 20.x.06 29.x.06 9 29.x.06 7.xi.06 9 7.xi.06 15.xi.06 8 15.xi.06 23.xi.06 8 23.xi.06 3.xii.06 10 44 3.xii.06 ……… ……… ……… 9.x.06 20.x.06 11 20.x.07 30.x.06 10 30.x.06 7.xi.06 8 7.xi.06 15.xi.06 8 15.xi.06 27.xi.06 12 27.xi.06 10.xii.06 13 51 10.xii.06 13.xii.06 13.xii.06 1.i.07 19 84 H 9.x.06 20.x.06 11 20.x.08 30.x.06 10 30.x.06 7.xi.06 8 7.xi.06 ……… ……… ……… ……… ……… ……… ……… ……… ……… 9.x.06 20.x.06 11 20.x.09 31.x.06 11 31.x.06 8.xi.06 8 8.xi.06 16.xi.06 8 16.xi.06 27.xi.06 11 27.xi.06 11.xii.06 14 52 11.xii.06 15.xii.06 4 15.xii.06 ……… 10.x.06 18.x.06 8 18.x.06 28.x.06 10 28.x.06 4.xi.06 7 4.xi.06 15.xi.06 11 15.xi.06 27.xi.06 12 27.xi.06 9.xii.06 12 52 9.xii.06 13.xii.06 4 13.xii.06 1.i.07 19 83 H 10.x.06 19.x.06 9 19.x.06 28.x.06 9 28.x.06 5.xi.06 8 5.xi.06 15.xi.06 10 15.xi.06 28.xi.06 13 28.xi.06 9.xii.06 11 51 9.xii.06 13.xii.06 4 13.xii.06 1.i.07 19 84 H 10.x.06 22.x.06 12 22.x.06 3.xi.06 12 3.xi.06 9.xi.06 6 9.xi.06 18.xi.06 9 18.xi.06 28.xi.06 10 28.xi.06 9.xii.06 11 48 9.xii.06 13.xii.06 4 13.xii.06 1.i.07 19 83 M 10.x.06 22.x.06 12 22.x.07 3.xi.06 12 3.xi.06 10.xi.06 7 10.xi.06 18.xi.06 8 18.xi.06 ……… ……… ……… ……… ……… ……… ……… 10.x.06 22.x.06 12 22.x.08 3.xi.06 12 3.xi.06 11.xi.06 8 11.xi.06 20.xi.06 9 20.xi.06 30.xi.06 30.xi.06 9.xii.06 9.xii.06 13.xii.06 13.xii.06 1.i.07 19 83 M 10.x.06 22.x.06 12 22.x.09 ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… 10.x.06 22.x.06 12 22.x.10 ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… 10.x.06 ……….. ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… ……… 11.x.06 18.x.06 7 18.x.06 31.x.06 13 31.x.06 8.xi.06 8 8.xi.06 18.xi.06 10 18.xi.06 29.xi.06 11 29.xi.06 11.xii.06 12 54 11.xii.06 14.xii.06 3 14.xii.06 4.i.07 21 85 H 11.x.06 20.x.06 9 20.x.06 28.x.06 8 28.x.06 5.xi.06 9 5.xi.06 14.xi.06 9 14.xi.06 24.xi.06 10 24.xi.06 7.xii.06 13 49 7.xii.06 10.xii.06 3 10.xii.06 30.xii.06 20 81 M 11.x.06 22.x.06 11 22.x.06 1.xi.06 10 1.xi.06 9.xi.06 8 9.xi.06 18.xi.06 9 18.xi.06 28.xi.06 10 28.xi.06 11.xii.06 13 50 11.xii.06 14.xii.06 3 14.xii.06 ……… 11.x.06 22.x.06 11 22.x.06 2.xi.06 11 2.xi.06 10.xi.06 8 10.xi.06 19.xi.06 9 19.xi.06 29.xi.06 10 29.xi.06 12.xii.06 13 51 12.xii.06 ……… ……… ……… 11.x.06 22.x.06 11 22.x.06 3.xi.06 12 3.xi.06 11.xi.06 8 11.xi.06 20.xi.06 9 20.xi.06 30.xi.06 10 30.xi.06 15.xii.06 15 54 15.xii.06 17.xii.06 2 17.xii.06 7.i.07 21 88 H 12.x.06 20.x.06 8 20.x.06 28.x.06 8 28.x.06 4.xi.06 7 4.xi.06 12.xi.06 8 12.xi.06 22.xi.06 10 22.xi.06 3.xii.06 11 44 3.xii.06 6.xii.06 3 6.xii.06 25.xii.06 19 74 M 12.x.06 20.x.06 8 20.x.06 28.x.06 8 28.x.06 5.xi.06 8 5.xi.06 14.xi.06 9 14.xi.06 26.xi.06 12 26.xi.06 13.xii.06 17 54 13.xii.06 14.xii.06 1 14.xii.06 4.i.07 21 84 M 12.x.06 20.x.06 8 20.x.06 28.x.06 8 28.x.06 5.xi.06 8 5.xi.06 15.xi.06 10 15.xi.06 28.xi.06 13 28.xi.06 13.xii.06 15 54 13.xii.06 ……… ……… ……… 12.x.06 20.x.06 8 20.x.06 29.x.06 9 29.x.06 5.xi.06 7 5.xi.06 15.xi.06 10 15.xi.06 28.xi.06 13 28.xi.06 13.xii.06 13.xii.06 ……… ……… ……… 10 9 48 3 4 15 54 n 36 35 35 33 32 32 32 27 25 25 Mínima 7 8 6 6 8 9 43 1 17 66 Máxima 12 14 9 11 13 17 54 7 21 88 Media 10 10 8 9 10 11,5 49,5 4 19 83 Prmedio 10,11 11 7,6 8,5 11 11,8 49,22 3,55 19 80,6 235 12 11.8 11 11 10 Cantidad de dìas 8.5 7.6 8 6 4 2 0 Primero Segundo Tercero Cuarto Quinto Estadio larval Figura 43. Duración en promedio de los estadios larvales de O. cassina en cautiverio en el insectario de investigación del INBio. Autor: Solís y González, 2008. Huevo Figura 44. Huevos de O. cassina recién puestos (izq.) y de dos a tres días posterior a la puesta (der.). Fotografía: Manuel Solís. Los huevos son esféricos con un diámetro de 1, 568 mm y 1,47 mm de alto (n=45, cuadro 11, y Figura 45). Durante los primeros días los huevos son de color blanco y al tercer día se les forman tres líneas transversales de color café (Figura 44). Tres días antes de que eclosionen se tornan de color negro y es posible apreciar las larvas con las líneas rojizas. Los huevos eclosionaron entre los 7 a 12 días posteriores a la puesta (cuadro 10). Los huevos fueron puestos solitarios o en grupos de hasta 8 huevos. 236 Cuadro 11. Medidas de huevos de Opsiphanes cassina puestos en condiciones de cautiverio en el insectario de investigación del INBio. No. Testigo MSV00179 MSV00181 MSV00182 Diámetro Alto No. Testigo Diámetro Alto 1,568 1,372 MSV00185 1,568 1,568 1,372 1,568 Diámetro Alto 1,47 1,568 1,568 1,568 1,47 1,568 1,568 1,372 1,568 1,47 1,568 1,47 1,568 1,47 1,568 1,47 1,568 1,47 1,686 1,47 1,568 1,47 1,568 1,47 1,686 1,568 1,568 1,47 1,568 1,47 1,666 1,47 1,568 1,47 1,568 1,47 1,666 1,47 1,666 1,372 1,568 1,372 1,568 1,372 1,666 1,568 1,568 1,47 1,372 1,568 1,47 1,568 1,47 1,372 1,568 1,47 1,568 1,47 1,47 1,568 1,47 n 45 45 1,47 1,568 1,47 Mínima 1,568 1,372 1,47 1,568 1,47 Máxima 1,686 1,568 1,47 1,666 1,568 Media 1,568 1,47 1,47 1,666 1,568 Promedio 1,59 1,47 1,666 1,568 1,568 1,568 1,568 MSV00183 1,568 1,568 1,666 1,666 MSV00184 1,666 1,568 MSV00186 MSV00187 No. Testigo MSV00188 MSV00189 Autor: Solís y González, 2008 1,59 1,6 Tamaño en milìmetros 1,58 1,56 1,54 1,52 1,5 1,47 1,48 1,46 1,44 1,42 1,4 Diámetro Alto 237 Larva La fase larval de O. cassina, tiene cinco estadios larvales bien definidos en ambos sexos. El Cuadro 10 y las figuras 42 y 43 presentan los periodos de duración en días para cada una de los estadios larvales y la prepupa. A continuación se describe la fase larval con datos de longitud del cuerpo de la larva y la duración de cada estadio larval. Se consideran dos medidas; long1 de la cabeza al segmento anal y long2 de la cabeza a las proyecciones o caudas anales (Figura 46). 47.83 33.77 22 Long2 Longiudes 13.81 6.89 40.09 24.56 16.97 Long1 11.18 5.71 0 10 20 30 40 50 60 Tamaño en milìmetros 1er estadio 2o estadio 3er estadio 4to estadio 5to estadio Figura 46. Tamaño promedio de cada estadio larval de O. cassina criados en cautiverio en el insectario de investigación del INBio. Long 1; medida de la cabeza al margen posterior del segmento anal y Long 2; medida de la cabeza al ápice de las caudas anales. Autor: Solís y González, 2008. - Primer estadio Figura 47. Larva de O. cassina en primer estadio. Larva recién eclosionada (izq.), larva días después de la eclosión (centro) y detalle frontal de la cápsula cefálica (der.). Fotografía: Manuel Solís. 223 Las larvas en primer estadio tienen la cápsula cefálica completamente negra, algunas veces la cara es de color amarillo y sin cuernos prominentes. Posterior a la eclosión el cuerpo de la larva tiene líneas longitudinales rojizas y blancas, en el dorso tiene una línea blanca grande dividida al medio por una delgada línea rojiza y dos líneas dorso-laterales de color rojo. Una vez que la larva se alimenta cambia su coloración rojiza por pigmentos verdes. Las caudas son de color negro con setas blancas en la mitad basal y el ápice (Figura 47). Las larvas tienen una longitud promedio de 5,71 mm (long1) y 6,89 mm (long2), las caudas anales miden en promedio 1, 18 mm (Cuadro 12 y Figura 46). El primer estadio larval duró entre 7 a 12 días (cuadro 10 y Figura 43). Cuadro 12. Medidas de larvas en cautiverio de Opsiphanes cassina en primer estadio en el insectario de investigación del INBio. Longitudes No Testigo MSV00179 MSV00181 MSV00182 MSV00183 MSV00184 MSV00185 Long1 Long2 Caudas Longitudes No Testigo Long2 Caudas Long1 5,48 6,566 1,086 5,88 6,958 1,078 5,096 6,174 1,078 5,684 6,958 1,274 5,782 6,958 1,176 5,488 7,564 2,076 6,076 7,154 1,078 5,39 6,566 1,176 5,978 …… ….. 5,684 6,958 1,274 5,782 6,958 1,176 5,096 6,37 1,274 5,39 6,566 1,176 MSV00187 6,37 7,35 0,98 5,488 6,566 1,078 n 20 19 19 6,174 7,35 1,176 Mínima 5,096 6,174 0,98 5,782 6,958 1,176 Máxima 6,37 7,564 2,076 5,39 6,468 1,078 Media 5,733 6,958 1,176 6,272 7,448 1,176 Promedio 5,71 6,89 1,18 6,076 7,056 0,98 MSV00186 Autor: Solís y González, 2008. 224 - Segundo estadio Figura 48. Larva de O. cassina en segundo estadio. Vista dorsal (izq.) y detalle de formas de coloración de la cápsula cefálica (cent. y der.). Fotografía: Manuel Solís. Las larvas en segundo estadio tienen la cápsula cefálica negra dorsalmente y un color café transparente en la superficie ventral. La frente es negra, con dos franjas dorsales anchas de color amarillo o un par de pequeñas marcas rojizas y la cara es de color amarillo. En este estadio aparecen los cuernos posteriores; un par grandes en el centro que son negros o con la mitad apical de color café, también poseen dos pares de cuernos laterales, el inferior mucho más pequeño que el superior, ambos de color café (Figura 48). El cuerpo tiene líneas longitudinales de color verde y amarillo, en el dorso tiene una línea ancha de color amarillo y dos líneas dorso-laterales de color verde. Las caudas anales son de color negro con una serie de setas blancas a lo largo de estas (Figura 48). Las larvas en segundo estadio tienen una longitud promedio de 11,18 mm (long1) y 13,81 mm (long2), las caudas miden en promedio 2,62 mm (Cuadro 13 y Figura 46). El segundo estadio duró de 6 a 9 días (Cuadro 10 y Figura 43). Cuadro 13. Medidas de larvas en cautiverio de Opsiphanes cassina en segundo estadio en el insectario de investigación del INBio. Longitudes No Testigo MSV00179 MSV00182 MSV00183 MSV00184 Long1 Long2 Caudas 11,662 14,406 9,408 Longitudes No Testigo Long1 Long2 Caudas 2,744 12 14,5 2,5 12,152 2,744 11 13,5 2,5 12,2 14,5 2,3 11,2 13 1,8 11 14 3 10 12,5 2,5 12,2 14 1,8 11,5 14 2,5 11,5 14,5 3 12 14 2 MSV00185 225 Longitudes No Testigo MSV00186 MSV00187 Long1 Long2 Caudas 11 14 11 Longitudes No Testigo Long1 Long2 Caudas 3 10 13,5 3,5 14 3 11 12 1 10 13 3 12 15 3 12 15 3 12 14 2 10,36 14,31 3,95 11 14,5 3,5 10,4 13,39 2,99 n 27 27 27 11,51 13,59 2,08 Mínima 9,408 12 1 12 14 2 Máxima 12,2 15 3,95 10,1 13,12 3,02 Media 11,2 14 2,744 12 14,5 2,5 Promedio 11,18 13,81 2,62 MSV00188 Autor: Solís y González, 2008. - Tercer Estadio Figura 49. Larva de O. cassina en tercer estadio. Vista dorsal (izq.) y detalle frontal de la cápsula cefálica (cent. y der). Fotografía: Manuel Solís. Las larvas en tercer estadio tienen la cápsula cefálica con los costados de color negro o grisáceo y un color verde hacia la superficie ventral. Las partes bucales son de color blanco en los bordes y negro al centro, la cara tiene un rombo de color amarillo y la frente tiene dos franjas dorsales anchas de color amarillo algunas veces teñidas de color naranja. Los cuernos posteriores medios son completamente negros ó anaranjados con el ápice negro, también los cuernos laterales superiores son negros o una combinación de gris con verde, los cuernos inferiores mucho más pequeños son de color verde (Figura 49). 226 El cuerpo tiene líneas longitudinales de color verde y amarillo, en el dorso tiene una línea media ancha de color amarillo y dos líneas laterales verde de color más oscuro que en el segundo estadio. En algunos casos el cuerpo tiene puntos amarillos y blancos. Las caudas anales son de color grisáceo en la base, turquesa en el medio, negro en el ápice (a veces), y los márgenes internos son amarillos (Figura 49). Las larvas en tercer estadio tienen una longitud promedio de 16,97 mm (long1) y 22 mm (long2), las caudas anales miden en promedio 5,03 mm (cuadro 14 y Figura 46). El tercer estadio duró de 6 a 11 días (cuadro 10 y Figura 43). Cuadro 14. Medidas de larvas en cautiverio de Opsiphanes cassina en tercer estadio en el insectario de investigación del INBio. Longitudes No Testigo MSV00179 MSV00181 MSV00182 MSV00183 MSV00184 MSV00185 Long1 Long2 Caudas 17 20,5 3,5 17 21,5 4,5 17,23 22,04 16,76 Longitudes No Testigo Long1 Long2 Caudas 16,75 22,25 5,5 18,22 23,27 5,05 4,81 16,6 21,43 4,83 21,94 5,18 17,41 23,93 6,52 16,81 21,64 4,83 17,7 23,65 5,95 17,82 24,24 6,42 15,13 16,93 1,8 16,05 21,17 5,12 15,12 20,43 5,31 16,19 22,65 6,46 14,86 20,82 5,96 16,21 21,71 5,5 17,53 21,63 4,1 18,72 23,03 4,31 16,28 21,31 5,03 17,22 22,93 5,71 15,9 21,86 5,96 16,93 20,4 3,47 16,74 22,54 5,8 17,72 22,54 4,82 n 29 29 29 18,34 23,74 5,4 Mínima 14,86 16,93 1,8 18,25 23,79 5,54 Máxima 18,72 24,24 6,52 17,78 21,75 3,97 Media 17 21,94 5,12 17,9 22,57 4,67 Promedio 16,97 22 5,03 MSV00186 MSV00187 MSV00188 Autor: Solís y González, 2008. 227 - Cuarto Estadio Figura 50. Larvas de O. cassina en cuarto estadio. Vista dorsal (izq.) y detalle frontal de la cápsula cefálica (cent. y der.). Fotografía: Manuel Solís. Las larvas en cuarto estadio tienen la cápsula cefálica con los costados de color grisáceo o café con una línea sin pigmentación dividiéndolos, o bien pueden ser verdes con manchas grisáceas. Tiene color blanco hacia la superficie ventral, las partes bucales son de color blanco con una línea café delineando los bordes y negro al centro. La cara tiene un rombo de color amarillo y la frente tiene al medio, dos franjas anchas de color amarillo algunas veces teñidas de color anaranjado en el extremo posterior. Los cuernos posteriores medios son color naranja con el ápice negro a veces con un anillo de color blanco anterior al ápice. Los cuernos laterales superiores son blancos, grises ó verdes con el ápice negro, el inferior mucho más pequeño es transparente, sin pigmentación (Figura 50). El cuerpo tiene líneas longitudinales de color verde y amarillo, en el dorso tiene una línea ancha de color amarillo dividida por una línea delgada de color verde, dos líneas dorsolaterales de color verde con puntos amarillos, blancos y turquesa, en este estadio aparecen unas líneas latero-ventrales de color turquesa. Las caudas anales son de color verde en la mitad basal y turquesa en la mitad apical, o bien completamente turquesa y negro en el ápice, los márgenes internos y externos son amarillos (Figura 50). Las larvas en cuarto estadio tienen una longitud promedio de 24,56 mm (long1) y 31,77 mm (long2), las caudas anales miden en promedio 7,21 mm (cuadro 15 y Figura 46). El cuarto estadio duró de 8 a 13 días (cuadro 10 y Figura 43). 228 Cuadro 15. Medidas de larvas en cautiverio de Opsiphanes cassina en cuarto estadio en el insectario de investigación del INBio. Longitudes No Testigo MSV00179 MSV00181 MSV00182 MSV00183 MSV00184 MSV00185 MSV00186 Longitudes Long1 Long2 Caudas 24 33,5 25 No Testigo Long1 Long2 Caudas 9,5 25 32 7 33 8 25,33 33,36 8,03 24,68 31,63 6,95 25,75 28 2,25 23,73 30,28 6,55 23 29 6 23,1 31,59 8,49 24,5 34 9,5 25,52 34,06 8,54 25,64 33,42 7,78 23 30,55 7,55 24,96 31,31 6,35 25,82 34,1 8,28 n 20 20 20 24,46 32,34 7,88 Mínima 23 28 2,25 24,07 30,11 6,04 Máxima 25,82 34,1 9,5 24,13 30,99 6,86 Media 24,655 31,61 7,275 24,63 31,13 6,5 Promedio 24,56 31,77 7,21 24,89 31,16 6,27 MSV00187 MSV00188 Autor: Solís y González, 2008. - Quinto Estadio Figura 51. Larva de O. cassina en quinto estadio. Vista dorsal (izq.), detalle frontal (cent.) y lateral (der.) de la cápsula cefálica. Fotografía: Manuel Solís. Las larvas en quinto estadio tienen la cápsula cefálica con los costados de color grisáceo o café con una línea blanca. Tiene color blanco hacia la superficie ventral, y una línea ventral de color negro que empieza en la parte anterior de la cabeza hasta los cuernos laterales inferiores. Las partes bucales son de color blanco con una línea café delineando los bordes y negro al centro, la cara tiene un semi-triangulo de color blanco y la frente tiene dos franjas al medio anchas de color blanco divididas por una delgada línea gris. Los cuernos posteriores medios son de color anaranjado con el ápice negro a veces con un anillo blanco 229 antes del ápice. Los cuernos laterales superiores son blancos con el ápice negro, el inferior mucho más pequeño es de color negro (Figura 51). El cuerpo tiene líneas longitudinales de color verde y amarillo, en el dorso tiene una línea ancha de color verde, a veces con dos delgadas líneas de color amarillo en los bordes y dos líneas laterales de color verde más oscuro con puntos blancos en todo el cuerpo. Las caudas son de color turquesa con los bordes internos y externos de color amarillo, celeste en el ápice con las puntas de color negro (Figura 51). Las larvas en quinto estadio tienen una longitud promedio de 40,09 mm (long1) y 47,83 mm (long2), las caudas anales miden en promedio 7,74 mm (cuadro 16 y Figura 46). El quinto estadio duró de 9 a 17 días (cuadro 10 y Figura 43). Cuadro 16. Medidas de larvas en cautiverio de Opsiphanes cassina en quinto estadio en el insectario de investigación del INBio. Longitudes No Testigo MSV00179 MSV00181 Long1 Long2 Caudas 41 48,69 7,69 41,14 49,28 8,14 39 45,5 6,5 40,6 MSV00182 MSV00185 MSV00186 Longitudes 48,6 No Testigo MSV00187 MSV00188 8 Long1 Long2 Caudas 40,68 48,58 7,9 40,77 49,06 8,29 39,9 45,05 5,15 39,1 46,3 7,2 40 48 8 n 14 14 14 39 46 7 Mínima 39 45,05 5,15 40,52 47,9 7,38 Máxima 41,14 51,55 12,19 39,92 45,69 5,77 Media 40,32 48,29 7,795 40,32 49,5 9,18 Promedio 40,09 47,83 7,74 39,36 51,55 12,19 Autor: Solís y González, 2008. 230 - Prepupa Figura 52. Prepupa de O. cassina. Vista dorsal (izq.), lateral (cent.) y detalle dorsal de la cabeza (der.). Fotografía: Manuel Solís. A medida que la larva en quinto estadio empieza a cambiar hacia la fase de pupa la coloración cambia ligeramente. La cabeza toma un color uniforme más oscuro casi marrón, los cuernos toman un color más rojizo. El cuerpo se ensancha y toma un color verde más uniforme, las líneas dorsales medias y laterales desaparecen. Unas marcas lineales pequeñas color púrpura aparecen en el dorso y una línea longitudinal lateral sobre los espiráculos color púrpura. Las caudas anales toman un color amarillo en el dorso y un color turquesa más oscuro en los bordes interno y externo (Figura 52). La larva deja de alimentarse y busca un lugar apto para colgarse, ya sea una hoja o bien la superficie del frasco en que se le mantiene. Se cuelga del último segmento abdominal y en un periodo de uno a siete días (cuadro 10 y Figura 42) desde que deja de alimentarse se prepara para transformarse en pupa (Figura 52). 231 Pupa Figura 53. Pupa de O. cassina. Vista lateral (izq.), dorsal (centro) y detalle dorsal del ápice (der.). Fotografía: Manuel Solís. La pupa de O. cassina duró 19 días en promedio (17-21 n = 25, Cuadro 10 y Figura 42). Su coloración es verde claro brillante, la parte anterior tiene forma similar a la cabeza de un ave con una proyección media puntiaguda, posee un par de parches laterales de color blanco que refleja la luz, de estos nace una carena lateral que se proyectan hacia el ápice anterior y forman la proyección media. Por debajo de los parches dorados empiezan otras carenas longitudinales ligeramente sinuadas que se proyectan hacia el extremo posterior hasta el cremáster. En al superficie dorsal posee una carena longitudinal que empieza en la mitad apical y se extiende hacia el extremo posterior hasta el cremáster (Figura 53). b) Tasas de supervivencia y reproducción Supervivencia Se pudo llevar el seguimiento completo (de huevo a adulto) a la cría de 46 individuos iniciales y 25 finales en diez números testigo. En el proceso, perecieron 23 individuos en diferentes fases. En promedio las tasas de supervivencia dieron resultados de: 81,75% de supervivencia en los huevos; 87, 22% de supervivencia en las larvas; 85,08% de supervivencia en las pupas; y 97,22% de adultos emergidos. En el cuadro 17 y figura 54 se presentan los datos de supervivencia de Opsiphanes cassina obtenidos en el insectario de investigación del INBio, expresado en porcentajes de huevos eclosionados, larvas, pupas y adultos vivos obtenidos de diez testigos diferentes. Cada 232 testigo contiene un número determinado de individuos que son la primera generación (F1) obtenida del pie de cría. Cuadro 17. Supervivencia de huevos, larvas, pupas y adultos de Opsiphanes cassina bajo condiciones controladas en el Insectario de Investigación del INBio Huevos Larvas Pupas Adultos Total Huevos % Larvas Larvas % Larvas Pupas % Adultos Pupas % Testigo Huevos Eclosionados Supervivencia Vivas Eclosionadas Supervivencia Vivas Vivas Supervivencia Vivos Vivas Supervivencia MSV00179 4 2 50 2 2 100 2 2 100 2 2 100 MSV00181 2 2 100 2 2 100 2 1 50 1 1 100 MSV00182 2 2 100 2 2 100 2 2 100 2 2 100 MSV00183 5 4 80 2 4 50 2 2 100 2 2 100 MSV00184 3 3 100 3 3 100 3 3 100 3 3 100 MSV00185 9 9 100 7 9 77,77777778 7 6 85,71428571 6 6 100 MSV00186 8 7 87,5 4 7 57,14285714 4 4 100 4 4 100 MSV00187 5 5 100 5 5 100 5 4 80 3 4 75 MSV00188 4 4 100 4 4 100 4 2 50 2 2 100 MSV00189 4 0 0 N 46 38 31 38 31 26 25 26 Mínima 2 0 0 2 2 50 2 1 50 1 1 75 Máxima 9 9 100 7 9 100 7 6 100 6 6 100 Media 4 3,5 100 3 4 100 3 2 100 2 2 100 Promedio 81,75 87,21 85,07 97,22 Autor: Solís y González, 2008. 100 97,22 95 % Supervivencia 90 87,21 85,07 85 81,75 80 75 70 Huevos Larvas Pupas Adultos Fase Figura 54. Tasas de supervivencia de huevos, larvas, pupas y adultos emergidos de O. cassina expresada en porcentajes. Autor: Solís y González, 2008. 233 Reproducción En el cuadro 18 y figura 55 se presentan los datos de la capacidad de reproducción de O. cassina expresado en la cantidad de huevos que puede producir y fertilizar por día una hembra de esta mariposa. Se presentan los datos de oviposición de la primera generación de hembras (F 1) o pie de cría y los datos de oviposición de siete hembras de la segunda generación (F 2). Se determinó la cantidad de huevos por día que pusieron un total de 13 hembras de O. cassina, incluyendo las hembras de la primera (pie de cría) y segunda generación. Sin embargo del total de hembras adultas de la segunda generación, no fue posible monitorearlas en su periodo de vida adulto completo. Una hembra tiene la capacidad de poner al menos 4 huevos por día, entre un total de 443 huevos puestos en un acumulado de 24 días de registro de datos. Cuadro 18. Tasa de reproducción (oviposición) de Opsiphanes cassina bajo condiciones de laboratorio en el Insectario de Investigación del INBio. Fecha de Cantidad de Cantidad de Cantidad de Recolección Hembras Días Huevos Huevos/Hembra/Día 3 Oct. 06 1 1 4 4 4 Oct. 06 1 1 2 2 5 Oct. 06 1 1 2 2 6 Oct. 06 1 1 5 5 7 Oct. 06 1 1 3 3 9 Oct. 06 1 2 9 4.5 10 Oct.06 1 1 8 8 11 Oct. 06 1 1 5 5 12 Oct. 06 1 1 4 4 13 Oct. 06 1 1 3 3 9 Nov. 06 3 1 16 5.33 10 Nov. 06 3 1 36 12 13 Nov. 06 2 3 16 2.66 14 Nov. 06 2 1 4 2 15 Ene. 07 7 3 136 6.47 17 Ene. 07 7 2 100 7.14 19 Ene. 07 7 2 90 6.42 n 13 24 443 Mínima 2 2 Máxima 136 7,14 Media 5 4 Promedio 26,058 4,54 Autor: Solís y González, 2008. 234 Huevos recolectados 160 7 140 6 120 5 100 4 80 3 60 2 40 1 20 0 0 Cantidad de Huevos Hembras fertiles 3 O ct .0 6 4 O ct .0 6 5 O ct .0 6 6 O ct .0 6 7 O ct .0 6 9 O ct .0 10 6 O ct . 11 06 O ct 12 . 06 O ct 13 . 06 O ct .0 6 9 No v. 10 0 N 6 ov 13 . 06 N ov 14 . 06 N ov 15 . 0 En 6 e 17 . 07 En e 19 . 07 En e. 07 Cantidad de Hembras 8 Día de Recolecta Figura 55. Cantidad de hembras fértiles y huevos recolectados por día durante la investigación. Autor: Solís y González, 2008. Los registros de oviposición de la primera generación de hembras adultas y el corto periodo de monitoreo de las hembras de la segunda generación, determinan que la frecuencia con que las hembras de O. cassina ovipositan es diaria. Según los datos del cuadro 19 y la figura 56 el período de vida de las hembras adultas es de 16 días (13-20, n =10), es decir que pueden tener la capacidad de poner unos 64 huevos en su periodo de vida adulto. El cuadro 19 y la figura 56 muestran que el período de vida de los machos adultos de O. cassina es de 13 días (11-20, n = 8). Al parecer no existe mucha diferencia entre la cantidad de días que puede vivir cada sexo. 16,22 16,4 16,2 Cantiad de dìas 16 15,8 15,6 15,12 15,4 15,2 15 14,8 14,6 14,4 Hembras Machos Sexo Figura 56. Longevidad de hembras y machos de O. cassina durante el estudio. Autor: Solís y González, 2008. 235 Cuadro 19. Longevidad de adultos de la segunda generación (F2) obtenidos en crianza y liberados en el Insectario de Investigación del INBio. Machos No. Control No. Testigo Fecha de Emersión Fechas de Muerte Longevidad (días) 11 MSV00185 25 Dic. 06 10 Ene. 07 16 13 MSV00185 27 Dic. 06 6 Ene. 07 11 14 MSV00183 28 Dic. 06 10 Ene. 07 13 15 MSV00183 28 Dic. 06 10 Ene. 07 13 17 MSV00184 28 Dic. 06 10 Ene. 07 13 19 MSV00187 30 Dic. 06 10 Ene. 07 11 22 MSV00186 1 Ene. 07 23 Ene. 07 22 25 MSV00186 1 Ene. 07 23 Ene. 07 22 8 n Mínima 11 Máxima 22 Media 13 Promedio 15,12 Hembras No. Control No. Testigo Fecha de Emersión Fechas de Muerte Longevidad (días) 9 MSV00181 25 Dic. 06 10 Ene. 07 16 16 MSV00182 28 Dic. 06 10 Ene. 07 13 18 MSV00191 29 Dic. 06 10 Ene. 07 12 21 MSV00186 1 Ene. 07 20 Ene. 07 20 23 MSV00186 1 Ene. 07 20 Ene. 07 20 24 MSV00185 1 Ene. 07 20 Ene. 07 20 26 MSV00187 4 Ene. 07 20 Ene. 07 17 30 MSV00187 7 Ene. 07 20 Ene. 07 14 31 MSV00191 7 Ene. 07 20 Ene. 07 14 n 10 Mínima 13 Máxima 20 Media Promedio 16 16,2 Autor: Solís y González, 2008. 236