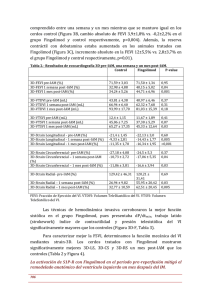
Informe técnico de evaluación de Fingolimod
Anuncio

AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios FINGOLIMOD (Gilenya®) Tratamiento de la Esclerosis Múltiple Remitente Recurrente Informe técnico de Evaluación de nuevos medicamentos Fecha: Octubre de 2012 1.- IDENTIFICACIÓN DEL MEDICAMENTO Y AUTORES DEL INFORME Medicamento: Fingolimod. Indicación clínica: en monoterapia como tratamiento modificador del curso de la enfermedad en la esclerosis múltiple remitente recurrente muy activa para los siguientes grupos de pacientes: - Pacientes con elevada actividad de la enfermedad a pesar del tratamiento con un interferón beta. Estos pacientes pueden definirse como los que no han respondido a un curso completo y adecuado (normalmente un año de tratamiento por lo menos) de un interferón beta. Los pacientes deben haber tenido al menos un brote durante el año anterior mientras recibían la terapia, y tener al menos 9 lesiones hiperintensas en T2 en la resonancia magnética craneal o al menos 1 lesión realzada con gadolinio. Los pacientes «no respondedores» pueden definirse también como los que presentan una tasa de recidivas igual o mayor, o recidivas activas graves, en comparación con el año anterior. - Pacientes con esclerosis múltiple remitente recurrente grave de evolución rápida definida por 2 o más brotes discapacitantes en un año, y con 1 o más lesiones realzadas con gadolinio en la RM craneal o un incremento significativo de la carga lesional en T2 en comparación con una RM anterior reciente. Autores / Revisores (orden alfabético): Marta Caja, Natalia García del Busto, Mª Jesús López y Agustín Sánchez. Declaración conflicto de intereses de los autores: No existe conflicto de intereses. Ver declaración en anexo al final del informe. 2.- ÁREA DESCRIPTIVA DEL MEDICAMENTO Nombre genérico: Fingolimod. ® Nombre comercial: Gilenya . Laboratorio: Novartis Pharmaceuticals Grupo terapéutico: Denominación: inmunomodulador Código ATC: L04AA27 Vía de administración: Oral. 13 Tipo de dispensación: Uso Hospitalario, previa autorización del Comité Asesor . Vía de registro: Centralizado. Tabla 1. Presentaciones y precio Forma farmacéutica y dosis Gilenya 0,5mg, cápsulas duras Unidades por envase 28 cápsulas Código Nacional 677661 Coste unidad PVP con IVA 61,50 € Coste unidad PVL con IVA 54,97 € 1 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 3.- ÁREA DE ACCIÓN FARMACOLÓGICA 3.1 Mecanismo de acción. Fingolimod es un modulador selectivo del receptor de esfingosina-1-fosfato. Es metabolizado por la enzima esfingosina quinasa dando lugar al metabolito activo fingolimod fosfato. Se une al receptor 1 de la esfingosina 1-fosfato (S1P) localizado en los linfocitos, y atraviesa la barrera hematoencefálica para unirse al receptor S1P1 de las células neurales del sistema nervioso central. Actúa como antagonista a nivel de los linfocitos, bloqueando la capacidad de los mismos de salir de los ganglios linfáticos, de manera que se redistribuyen y se reduce su migración hacia el sistema nervioso central, reduciendo la inflamación y el daño tisular provocado. Estudios en animales y experimentos in vitro indican que fingolimod también podría tener efecto gracias a su interacción con los receptores de la S1P de las células neurales. En la esclerosis múltiple (EM) los linfocitos T se activan y atacan a las células nerviosas. Esto va a provocar la desmielinización de las mismas, dificultando la transmisión de impulsos nerviosos. Tanto la destrucción de las vainas de mielina como la degeneración axonal tienen un importante componente inflamatorio, que se ve reducido mediante la acción del fingolimod. 3.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación. AEMyPS y EMA Fecha de aprobación: 17/03/2011 Tratamiento modificador de la enfermedad en monoterapia en pacientes con esclerosis múltiple remitente-recidivante con alta actividad de la enfermedad en los siguientes grupos de pacientes: • • Pacientes con elevada actividad de la enfermedad a pesar del tratamiento con betainterferón. Pacientes que no han respondido a un curso completo y adecuado de betainterferón (de forma habitual al menos un año de tratamiento). Los pacientes deberían haber tenido al menos una recaída en el año anterior mientras estaban con tratamiento, y tener al menos 9 lesiones hiperdensas en T2 en resonancia magnética cerebral o al menos una lesión realzada con gadolinio. También se podría definir un “no respondedor” como un paciente con una tasa de recaídas sin cambios o incrementada o con recaídas que se van agravando, comparado con el año anterior. Pacientes con esclerosis múltiple remitente-recidivante con evolución rápida de su gravedad definida por dos o más recaídas incapacitantes en un año, y con una o más lesiones cerebrales realzadas con gadolinio en resonancia magnética o un incremento significativo en el número y volumen de las lesiones en T2 de la resonancia magnética comparado con resonancias previas”. FDA Fecha de aprobación: 21/09/2010 Tratamiento de esclerosis múltiple remitente-recurrente (EMRR) en pacientes adultos, o secundaria progresiva con recaídas, para reducir la frecuencia de las exacerbaciones y retrasar la aparición de discapacidad física. En la Comunidad Valenciana la utilización de fingolimod ha de ajustarse a los criterios de utilización que se recogen en la Instrucción 3/2012, sobre el procedimiento para la tramitación de solicitudes de tratamiento con interferon beta, acetato de glatiramero, natalizumab y fingolimod de la Dirección General de Farmacia y Productos Sanitarios. Consellería de 13 Sanidad : 2 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios El Comité Asesor de la Conselleria de Sanidad para la utilización del interferón beta en el tratamiento de la esclerosis múltiple, ha publicado una instrucción que modifica la circular previa de 2/2011 incorporando los criterios y protocolos de tratamiento con fingolimod: 1.- Criterios de tratamiento con Fingolimod La utilización del Fingolimod en la Comunitat Valenciana, se considera como tratamiento de segunda línea, y se admitirá en las siguientes situaciones: A).-FRACASO DEL TRATAMIENTO INMUNOMODULADOR Se considera que nos encontramos en esta situación si se dan alguna de las siguientes situaciones: - Aparición de 2 brotes de la enfermedad en el último año de tratamiento. o - Aparición de un sólo brote mientras se está en tratamiento siempre que se cumplan las condiciones siguientes: -Recuperación con secuelas tras el mismo (EDSS mayor a 2) y RNM simultánea o en cualquier momento tras el brote en la que tiene que haber: Aumento del número de lesiones en T2 o -Lesión que capte Gadolinio o -Recuperación sin secuelas tras el mismo (EDSS menor o igual a 2) y RNM de control (pasados 3 meses del brote) en la que tiene que haber: Aumento del número de lesiones en T2 o Lesión que capte Gadolinio B).- ESCLEROSIS MÚLTIPLE AGRESIVA A efectos de iniciar tratamiento con fingolimod en pacientes que no llevan tratamiento inmunomodulador, se puede autorizar el mismo si se cumplen las dos siguientes condiciones: - Dos brotes en el último año que hayan dejado secuelas (EDSS mayor de 2). y -Aumento de la carga lesional en RNM o aparición de una lesión que capte gadolinio en comparación con una resonancia anterior reciente. Precauciones especiales -Debe constar de forma clara el supuesto clínico que motiva la petición de tratamiento con fingolimod. -En pacientes con antecedentes de uveítis o diabetes mellitus se deberá realizar una revisión oftalmológica antes de iniciar el tratamiento y durante el tratamiento de forma obligada a los tres meses. -Debe hacerse constar en la solicitud todos los tratamientos inmunomoduladores o inmunosupresores que el paciente haya llevado. En caso de tratamiento inmunosupresor previo debe haber transcurrido al menos tres meses y tener constancia de la normalidad de los parámetros inmunológicos (subpoblaciones linfocitarias). -En caso de tratamiento previo con natalizumab, debe haber un periodo de lavado de al menos DOS meses, y de seis meses tras mitoxantrona o ciclofosfamida. -Se tendrá especial precaución en el caso de riesgo de infecciones oportunistas -Se debe recabar el consentimiento informado del paciente. 2.- Criterios para no administrar el tratamiento con fingolimod No se utilizará la administración de tratamiento con fingolimod en los siguientes casos: 1. En niños y adolescentes (menores de 18 años), y en mayores de 65 años. 2. EDSS ≥ 6,0 3 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 3. Hipersensibilidad a fingolimod o algún excipiente. 4. En combinación con cualquier inmunosupresor o en combinación con Interferón, acetato de glatiramero o natalizumab. 5. Neoplasias activas, excepto carcinoma basocelular. 6. Embarazo y lactancia. 7. En tratamiento con antiarrítmicos Clase Ia o III. 3.3 Posología, forma de preparación y administración. La dosis recomendada de fingolimod es de 0,5 mg/día administrada por vía oral, con o sin alimentos. Los pacientes deberían ser observados durante 6 horas tras la primera dosis con el fin de monitorizar los signos y síntomas de bradicardia. Dosis mayores a 0,5 mg no han demostrado beneficio adicional pero sí mayores reacciones adversas. Si se olvida una dosis el tratamiento debe continuarse con la siguiente dosis según lo prescrito. Los pacientes pueden cambiar directamente de interferón beta o acetato de glatirámero a fingolimod, siempre que no haya signos de anomalías relevantes relacionadas con el tratamiento, por ej. neutropenia. Poblaciones especiales Pacientes con insuficiencia renal No se ha estudiado en pacientes con alteración renal en los ensayos principales de EM. En base a los estudios de farmacología clínica, no es necesario ajuste de dosis en pacientes con alteración renal leve o moderada. Pacientes con insuficiencia hepática No debe utilizarse en pacientes con insuficiencia hepática grave (Child-Pugh clase C). Aunque no es necesario ajuste de dosis en pacientes con alteración hepática leve o moderada, en estos pacientes debe tenerse precaución durante el inicio del tratamiento. Pacientes de edad avanzada No existen datos específicos en estos pacientes, por lo que se recomienda utilizar fingolimod con precaución en este grupo de edad. Población pediátrica No se ha establecido todavía la seguridad y eficacia de fingolimod en niños de 0 a 18 años, por lo que no se puede hacer una recomendación posológica. Pacientes diabéticos No se ha estudiado en este grupo de pacientes, pero debe utilizarse con precaución debido a que presentan un incremento del riesgo de edema macular. Se deben realizar exámenes oftalmológicos de manera regular. Forma de administración La dosis es de 1 cápsula al día tomada con un vaso de agua, con o sin alimentos. 3.4 Farmacocinética. Absorción: Fingolimod se absorbe de forma lenta y prolongada, alcanzando las concentraciones máximas en 12-16 horas (tmáx). Presenta una biodisponibilidad oral del 93%. Su absorción no se ve afectada por la presencia o no de alimentos en el estómago. Se alcanza el estado estacionario en 1-2 meses de tratamiento. 4 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios Distribución: Fingolimod se distribuye ampliamente a los glóbulos rojos (86%), así como al resto de los tejidos del organismo (Vd 1.200 ± 260 L). Tanto el fármaco como el metabolito activo se unen fuertemente a proteínas plasmáticas (>99%). Metabolismo: Fingolimod sufre biotransformación mediante tres vías diferentes: fosforilación reversible al enantiómero S de fingolimod-P, oxidación a través del citocromo P450 (CYP450) y formación de análogos de ceramida apolares e inactivos. La participación de múltiples isoenzimas de CYP450 en la oxidación del fármaco sugiere que la presencia de un inhibidor de una isoenzima concreta no tiene por qué alterar su metabolismo. Eliminación: El aclaramiento sanguíneo del fármaco es de 6,3±2,3 L/h y la semivida de eliminación (t1/2) en plasma es de 6-9 días. La hemodiálisis reduce en un 14% las concentraciones plasmáticas de fingolimod, en concordancia con su fuerte unión a proteínas plasmáticas y su elevado volumen de distribución. Se elimina principalmente en la orina en un 81% en forma de metabolitos inactivos. El 89% de la dosis administrada se recupera al cabo de 34 días. 3.5 Características comparadas con otros medicamentos con la misma indicación En la tabla 2 se resumen los aspectos más significativos de fingolimod comparados con los otros medicamentos comercializados actualmente con la misma indicación Tabla 2. Características comparadas con otros medicamentos similares Nombre Presentación Posología Vía administración FINGOLIMOD INTERFERON β1B INTERFERON β1A GILENYA® 0,5 mg 28 cápsulas BETAFERON®/ EXTAVIA® 8MUI 15 jeringas REBIF® 44 y 22 12 plumas 4 cartuchos AVONEX® 30mcg 4 jeringas 0,5 mg/día 8MUI/48 horas 30µg/semana 20 mg/día 300 mg/mes Oral s.c. 22-44 mg 3 veces a la semana s.c. i.m. rotando el lugar de inyección s.c. Inf IV ACETATO DE GLATIRAMERO COPAXONE® 28 jeringas NATALIZUMAB TYSABRI® 1 Vial 5 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios Características diferenciales Indicado para pacientes con EMRR que no responden a terapias de 1ºlínea y para aquellos con una evolución rápida de la enfermedad. Indicado para pacientes con EMRR y al menos 2 recaídas en últimos 3 años, o con un único episodio desmielinizante si fue lo bastante agudo como para requerir corticoides intravenosos, o con EMSP activa evidenciada con brotes. Requiere monitorización tras la administración de la primera dosis. Requiere escalado inicial de la dosis. Se recomienda seguimiento, especialmente tras la aparición de problemas de seguridad relacionados con la administración del fármaco (muerte súbita e infarto) Contraindicado en hepatopatía grave descompensada. Segunda línea Primera línea Indicado para EMRR o EMSP en brotes (al menos 2 brotes en los últimos 2 años). No en EMSP sin brotes activos Indicado en EMRR en pacientes con al menos 2 recaídas en últimos 3 años sin evidencia de progresión continua en ese periodo, o con un único episodio desmielinizante si fue lo bastante agudo como para requerir corticoides intravenosos. Suspender en pacientes que desarrollen EMSP. Primera línea Primera línea Indicado en EMRR (al menos 2 brotes en últimos 2 años) o paciente con primer episodio clínico bien definido con riesgo de EM clínicamente definida Mismas indicaciones que fingolimod No en EM progresiva No contraindicado en pacientes con depresión Asociado a un incremento del riesgo de LMP. Recomendado la determinación de anticuerpos antiVJC Primera línea. Segunda línea EMRR esclerosis múltiple recurrente-recidivante EMSP esclerosis múltiple secundaria progresiva LMP leucoencefalopatía multifocal progresiva VJC virus JC 4.- EVALUACIÓN DE LA EFICACIA 4.1 Ensayos clínicos disponibles para la indicación clínica evaluada (descripción de la búsqueda bibliográfica: criterios y resultados de la misma). Disponemos de los siguientes ensayos clínicos: - 2 estudios fase II (D2201 y D2201E1 extensión del anterior) - 2 estudios fase III principales (D2301: FREEDOMS y D2302: TRANSFORMS). El estudio en fase II (D2201) es de búsqueda de dosis, de 6 meses de duración donde se evalúan dos dosis: 5mg y 1,25mg. Además, existen otros estudios para evaluar el efecto a largo plazo en eficacia, seguridad y tolerancia frente a placebo: D2201E1, D2309, D1201 Y D2306. Los dos estudios principales (D2301 y D2302) en fase III, uno frente a placebo y el segundo frente a un comparador activo (interferón beta 1a im), estudian la eficacia de las dosis de fingolimod 0,5 mg y 1,25 mg en pacientes con EMRR. Se dispone así mismo del informe de revisión de la FDA para su autorización y el informe EPAR de la EMEA en el que se detalla el desarrollo clínico del fármaco. 6 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios Los resultados detallados de los dos estudios principales se presentan en el siguiente apartado. 4.2 Resultados de los ensayos clínicos Los resúmenes de los ensayos clínicos se pueden ver en las tablas 3-5. Tabla 3. Kappos L, Radue EW et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010;362:387401 Estudio FREEDOMS (D2301)4 -Nº de pacientes: 1.272 pacientes -Diseño: fase III, multicéntrico, randomizado (1:1:1), doble ciego, controlado frente a placebo -Tratamiento grupo activo: fingolimod 1,25 mg/día o fingolimod 0,5 mg/día -Tratamiento grupo control: placebo -Criterios de inclusión: pacientes 18 y 55 años; diagnóstico de EMRR; con al menos 1 recaída documentada en el año previo o al menos 2 recaídas documentadas en los 2 años previos; EDSS entre 0 y 5,5 (grado de discapacidad, Expanded Disability Status Scale). El tratamiento con interferón o acetato de glatiramero debía haberse suspendido al menos tres meses antes y con natalizumab seis meses antes. -Criterios de exclusión: EM diferente de EMRR, recaída o tratamiento con corticoides en los 30 días previos a la randomización; infección activa, edema macular, diabetes mellitus, inmunosupresión, alteración cardiaca o pulmonar; recuento de linfocitos < 800células/mm3; -Pérdidas: 96 de 429 (22,4%) en el brazo de fingolimod 1,25 mg, 56 de 425 (13,2%) en el de fingolimod 0,5 mg y 86 de 418 (20,6%) en el de placebo. -Tipo de análisis: por intención de tratar -Duración: 24 meses Resultados Variable Resultado principal -Tasa de recaídas/año (a 2 años) Resultados secundarios de interés -Pacientes sin progresión de la discapacidad (confirmada tras 3 meses) -Pacientes sin recaídas a los 24 meses Fingolimod 1,25 mg N (429) Fingolimod 0,5 mg N (425) Placebo N (418) 0,16 (0,13-0,19) 0,18 (0,15-0,22) 0,40 (0,34-0,47) Diferencia de medias (IC95%) Fingolimod Fingolimod 0,5 1,25 mg mg 0,24 (0,234 a 0,246) 0,22 (0,214 a 0,226) RAR (IC95%) 358 (83,4%) 350 (82,3%) 314 (75,9%) 322 (75%) 297 (70%) 192 (46%) Valor de p frente a placebo Fingolimod Fingolimod 1,25 mg 0,5 mg p <0,001 p <0,001 NNT (IC95%) 7,5% (2,9% - 13,8%) 6,4% (1,7% - 12,7%) NNT: 14 (8 a 35) NNT: 16 (8 a 59) 29,1% (22,8- 35,4%) 23,9% (17,5 - 30,4%) NNT: 4 (3 a 5) NNT: 5 (4 a 6) El análisis de subgrupos de los datos del estudio Freedom a 2 años, mostró que fingolimod, a ambas dosis, reduce la tasa de recidiva frente a placebo. Esta recaída es estadísticamente significativa tanto en los pacientes que habían recibido tratamiento modificador previamente (aproximadamente un 60% de la población) como en los que no. Hay que señalar que también es estadísticamente significativo el porcentaje de pacientes que progresan en el grupo placebo frente al grupo tratado. Tabla 4. Cohen JA, Barkhof F et al. Oral fingolimod or intramuscular interferón for relapsing multiple sclerosis. N Engl J Med 2010;362:402-15 Estudio TRANSFORMS (D2302)5 -Nº de pacientes: 1.292 pacientes -Diseño: fase III, multicéntrico, randomizado, doble ciego, controlado frente a interferón β-1 A, doble enmascaramiento -Tratamiento grupo activo: fingolimod 1,25 mg/día o fingolimod 0,5 mg/día -Tratamiento grupo control: interferón β-1A 30 µg/semana vía intramuscular -Criterios de inclusión: edad entre 18 y 55 años; diagnóstico de EMRR; con al menos 1 recaída documentada en el año previo o al menos 2 recaídas documentadas en los 2 años previos; EDSS entre 0 y 5,5 (grado de discapacidad, Expanded Disability Status Scale). -Criterios de exclusión: recaída o tratamiento con corticoides en los 30 días previos a la randomización; infección activa, edema macular, diabetes mellitus, inmunosupresión, alteración cardiaca o pulmonar; depresión o epilepsia en los 3 meses previos a la randomización; recuento 7 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios de linfocitos < 800células/mm3; El tratamiento reciente con interferón β o acetato de glatirámero de forma previa a la randomización no fue un criterio de exclusión. -Pérdidas: 62 de 420 (14,7%) en el brazo de fingolimod 1,25 mg, 44 de 429 (10,25%) en el de fingolimod 0,5 mg y 51 de 431 (11,8%) en el de placebo. 1096 pacientes completaron el estudio -Tipo de análisis: por intención de tratar (12 pacientes randomizados no fueron finalmente tratados, el análisis por intención de tratar se basa en 1280 pacientes). -Duración: 12 meses Resultados Variable evaluada en el Fingolimod Fingolimod Interferón β1a Diferencia de medias Valor de p estudio 1,25 mg 0,5 mg 30µg/semana Fingolimod Fingolimod Fingolimod Fingolimod N (420) N (429) IM 1,25mg 0,5mg 1,25mg 0,5mg N (431) Resultado principal -Tasa de recaídas/año 0,20 0,16 0,33 0,13 0,17 p <0,001 p <0,001 (0,16-0,26) (0,12-0,21) (0,26-0,42) (0,12-0,14) (0,16-0,18) - tasa de recaída en 0,17 0,15 0,31 0,14 0,16 pacientes sin terapia (0,11-0,25) (0,10-0,23) (0,22-0,41) p <0,001 modificadora previa 0,27 - tasa de recaída en 0,33 0,26 0,53 0,20 pacientes con terapia (0,26-0,42) (0,19-0,34) (0,43-0,65) modificadora previa RAR RAR (IC95%) Resultados secundarios NNT (IC95%) de interés 354 (82,5%) 302 (70,1%) 10,4% -Pacientes sin recaída 338 (80,5%) 12,4% NNT: 10 NNT: 9 (4,7% a 16,2%) (6,8% a 18,1%) en 12 meses (7 a 22) (6 a 15) -Nuevas lesiones 2,1 hiperdensas o aumento 1,4 1,5 --NS NS de tamaño de las existentes 392 (93,3%) 404 (94,1%) 397 (92,1%) 1,2% -Pacientes sin 2,1% NS NS progresión confirmada de ( -2,3% a 4,7%) (-1,3% a 5,4%) la discapacidad a los 3 meses Los datos del estudio TRANSFORMS a 1 año, mostraron una proporción de pacientes libres de recaída a los 12 meses mayor en el grupo de fingolimod (80,5 % para la dosis de 1,25mg y 82,5% para la dosis de 0,5mg) comparado con 70,1 % para el grupo tratado con interferón beta 1a IM, siendo la diferencia estadísticamente significativa p<0,001. No se observaron diferencias estadísticamente significativas entre los dos grupos tratados con diferentes dosis de fingolimod. En cambio, en el porcentaje de pacientes sin progresión en la escala EDSS, confirmada a los 3 meses, no hubo diferencias estadísticamente significativas entre las dos dosis de fingolimod y el IFN beta-1a. En el análisis de subgrupos post-hoc, en el subgrupo de pacientes tratados previamente y con actividad clínica grave, así como el subgrupo de no- respondedores y el subgrupo de actividad en la RM, la tasa anualizada de recidivas también fue significativamente menor a favor del fingolimod y tampoco se encontraron diferencias en la progresión de la discapacidad. La proporción de pacientes que discontinuaron el tratamiento debido a efectos adversos fue ligeramente superior en el grupo de fingolimod 1,25 mg que en los otros dos grupos. A continuación, se resume el estudio en fase II (D2201) de búsqueda de dosis, de 6 meses de duración y donde se evalúan dos dosis: 5mg y 1,25mg. Finalmente se descartó la dosis de 5mg por presentar un perfil de seguridad desfavorable, sin aumento de eficacia respecto a la dosis de 1,25mg. Por ello para los estudios en fase III se seleccionaron las dosis de 1,25mg y 0,5mg. Tabla 5. Kappos L, Antel J et al. Oral fingolimod for relapsing multiple sclerosis. N Engl J Med 2006;355:1124-40 D22016 8 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios -Nº de pacientes: 281 pacientes -Diseño: fase II, multicéntrico, randomizado, doble ciego, controlado frente a placebo - Duración del seguimiento 6 meses -Tratamiento grupo activo: fingolimod 1,25 mg/día o fingolimod 5 mg/día -Tratamiento grupo control: placebo -Criterios de inclusión: edad entre 18 y 60 años; diagnóstico de esclerosis múltiple; con al menos 1 recaída documentada en el año previo o al menos 2 recaídas documentadas en los 2 años previos; EDSS entre 0 y 6; al menos una lesión con captación de gadolinio detectada por resonancia magnética; sin recaída en los 30 días previos al screening. -Criterios de exclusión: uso de corticoides en los 30 días previos, terapia inmunomoduladora en los 3 meses previos, azatioprina o metotrexato en los 6 meses previos, ciclofosfamida en los 12 meses previos, mitoxantrona o cladribina en los 12 meses previos; patología cardiaca que pueda aumentar el riesgo de fallo cardiaco; recuento de células blancas < 3500/mm3, recuento de linfocitos < 800/mm3. -Pérdidas: 6 de 94 (6,4%) en el brazo de fingolimod 1,25 mg, 13 de 94 (14,3%) en el de fingolimod 5 mg y 7 de 93 (7,5%) en el de placebo. -Tipo de análisis: por protocolo (resultados en resonancia magnética) y por intención de tratar (resultados clínicos) Resultados Variable evaluada en Fingolimod Fingolimod Placebo RAR (IC95%) Valor de p el estudio 1,25 mg 5 mg N (92) Fingolimod Fingolimod 5mg Fingolimod Fingolimod N (93) N (92) 1,25mg 1,25mg 5mg Resultado principal -Número de lesiones 8,4 5,7 14,8 --p < 0,001 p = 0,006 hiperdensas en T1 Resultados secundarios de interés -p < 0,001 p < 0,001 3,0 1,9 6,4 --Número de nuevas lesiones hiperdensas T2 o aumento de tamaño de las existentes 86 86 66 20,7% 21,7% p = 0,003 p = 0,004 -Número de pacientes (10,1%-21,4%) (11,2%-32,2%) libres de recaída -Tasa de recaídas/año 0,35 0,36 0,77 RR=55% RR=53% p = 0,009 p = 0,01 (18% a 75%) (14% a 74%) 4.3 Evaluación de la validez y de la utilidad práctica de los resultados Ensayo FREEDOMS (fingolimod vs placebo). Validez interna: Se trata de un ensayo bien diseñado de elevada calidad metodológica. Destaca como limitación el elevado porcentaje de pérdidas, superior en dos de los grupos al 20%, lo que limita la fiabilidad de los resultados obtenidos. Validez externa: La principal limitación de este estudio es la comparación frente a placebo. El grupo de pacientes que han experimentado una recaída y que continúan con el tratamiento al que han fallado se encuentran infratratados y por tanto mayor riesgo de aparición de efectos adversos. Los fármacos que podrían haberse considerado de elección serían una dosis mayor de interferón, acetato de glatirámero si no lo hubiese recibido (escalada de tratamiento recomendada por la Sociedad Española de Neurología) o bien natalizumab. Ensayo TRANSFORMS (fingolimod vs. interferón β-1a). Existen varias limitaciones referentes a este estudio: 9 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 1. El comparador elegido, interferón β-1a administrado vía intramuscular, no es el más adecuado por diferentes causas: - La eficacia del interferón im es inferior a la del interferón sc. En el ensayo TRANSFORMS se ha utilizado como comparador interferón β1a intramuscular. A este respecto, en el estudio EVIDENCE se comparó interferón β1a por vía subcutánea frente a interferón β1a vía intramuscular con resultados favorables al interferón subcutáneo. El objetivo principal del estudio EVIDENCE consistió en comparar la proporción de pacientes que no experimentaron un brote en 24 y 48 semanas. A las 48 semanas, el 62% de los pacientes tratados con Rebiff® no sufrió ningún brote, frente al 52% de los pacientes a los que se administró Avonex®, siendo esta diferencia estadísticamente significativa (p = 0,009). A las 48 semanas, los pacientes tratados con interferón sc experimentaron una reducción del 30% en la frecuencia de aparición del primer brote respecto a los pacientes a los que se administró interferón im (p<0,003). El estudio INCOMIN comparó interferón β1b vía subcutánea frente a interferón β1a vía intramuscular, siendo favorable al primero en cuanto a tasa de recaídas. Si bien, ambos estudios son randomizados pero ninguno doble ciego. - Existe un subgrupo de pacientes que habiendo experimentado una recaída, continúan con el tratamiento al que han fallado. 2. No existe un análisis predeterminado de subgrupos, aunque las poblaciones incluidas en el ensayo son muy diferentes entre sí (por ejemplo pacientes refractarios vs. pacientes con evolución muy rápida de la enfermedad). Esto dificulta posicionar terapéuticamente al fármaco frente al resto de alternativas actualmente disponibles. Relevancia clínica de los resultados: Aunque fingolimod produce una reducción de la tasa de recaídas al año frente a interferón β1a, no se ha podido demostrar que esto mejore la progresión de la enfermedad ni que mejore la calidad de vida de los pacientes. Los autores del estudio argumentan que la escasa duración del seguimiento (2 años en el estudio de extensión del TRANSFORMS) ha impedido obtener diferencias entre los tratamientos. Los análisis de validez y de aplicabilidad de los ensayos clínicos se muestran en las tablas 6-9. Kappos L, Radue EW et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010;362:387-40. (Estudio FREEDOMS). Referencia del ensayo evaluado: 1) Análisis de validez interna del ensayo Tabla 6. ESCALA DE VALIDACIÓN DE ENSAYOS CLÍNICOS DE SUPERIORIDAD (A. JADAD) PUNTUACIÓN 10 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 1 ¿Se describe el estudio como aleatorizado? (*) ¿Se describe el estudio como doble ciego? (*) ¿Se describen los abandonos y exclusiones del estudio? (*) ¿Es adecuado el método de aleatorización? (**) ¿Es adecuado el método de doble ciego? (**) TOTAL (*) SÍ= 1 / NO= 0 (**) SÍ= 1 / NO= -1 / no consta= 0 Rango de puntuación: 0-5 Estudio de baja calidad: Puntuación < 3 1 1 1 1 5 2) Análisis de Aplicabilidad Tabla 7. CUESTIONARIO SOBRE LA APLICABILIDAD DE UN ENSAYO CLÍNICO ¿Considera adecuado el comparador? ¿Es el tratamiento control adecuado en nuestro medio? ¿Son importantes clínicamente los resultados? SI/NO NO JUSTIFICAR Se compara frente a placebo en lugar del tratamiento adecuado estándar. SI Disminuye la tasa de recaídas/año. ¿Considera adecuada la variable de medida utilizada? SI Es una variable de elección en todas las guías de práctica clínica. ¿Considera adecuados los criterios de inclusión y/o exclusión de los pacientes? ¿Cree que los resultados pueden ser aplicados directamente a la práctica clínica? SI Bien definidos y elegidos adecuadamente. NO Se debería conocer la eficacia comparada con el tratamiento habitual. SI El grupo de pacientes que han experimentado una recaída y que continúan con el mismo tratamiento tienen mayor riesgo de aparición de efectos adversos. Otros sesgos o limitaciones encontradas en el estudio Referencia del ensayo evaluado: Cohen JA, Barkhof F et al. Oral fingolimod or intramuscular interferón for relapsing multiple sclerosis. N Engl J Med 2010;362:402-15 (Estudio TRANSFORMS) 1) Análisis de validez interna del ensayo Tabla 8. ESCALA DE VALIDACIÓN DE ENSAYOS CLÍNICOS DE SUPERIORIDAD (A. JADAD) PUNTUACIÓN 1 ¿Se describe el estudio como aleatorizado? (*) ¿Se describe el estudio como doble ciego? (*) ¿Se describen los abandonos y exclusiones del estudio? (*) ¿Es adecuado el método de aleatorización? (**) ¿Es adecuado el método de doble ciego? (**) 1 1 1 1 11 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios TOTAL (*) SÍ= 1 / NO= 0 (**) SÍ= 1 / NO= -1 / no consta= 0 Rango de puntuación: 0-5 Estudio de baja calidad: Puntuación < 3 5 2) Análisis de Aplicabilidad Tabla 9. CUESTIONARIO SOBRE LA APLICABILIDAD DE UN ENSAYO CLÍNICO ¿Considera adecuado el comparador? ¿Es el tratamiento control adecuado en nuestro medio? SI/NO NO JUSTIFICAR El comparador elegido, interferón β-1a administrado vía intramuscular, no es el más adecuado porque la eficacia del interferón im es inferior a la del interferón sc. ¿Son importantes clínicamente los resultados? SI Disminuye la tasa de recaídas/año. ¿Considera adecuada la variable de medida utilizada? SI Es una variable de elección en todas las guías de práctica clínica. ¿Considera adecuados los criterios de inclusión y/o exclusión de los pacientes? ¿Cree que los resultados pueden ser aplicados directamente a la práctica clínica? SI Bien definidos y elegidos acertadamente. SI Otros sesgos o limitaciones encontradas en el estudio SI Fingolimod produce una reducción de la tasa de recaídas al año frente a interferón β1a, aunque no se ha podido demostrar que esto mejore la progresión de la enfermedad ni que mejore la calidad de vida de estos. Escasa duración del seguimiento (2 años). 4.4 Revisiones sistemáticas publicadas y sus conclusiones No se han localizado revisiones sistemáticas. 4.5 Evaluación de fuentes de información National Institute for Health and clinical excellence. Fingolimod for the treatment of relapsing-remitting multiple sclerosis. Comentarios realizados por Multiple Sclerosis Society: - El 1 de diciembre de 2011 se publicó la segunda revisión del informe en el que el NICE se ha posicionado desfavorablemente frente a este fármaco, concluyendo que el fármaco no es coste-efectivo frente a las alternativas disponibles. Este organismo propone negociar un nuevo coste para el tratamiento, aunque no asegura su inclusión a pesar de disminuir su coste. 5. EVALUACIÓN DE LA SEGURIDAD 5.1 Descripción de los efectos adversos más significativos Los efectos adversos más frecuentes descritos en los estudios realizados pre-comercialización fueron dolor de cabeza (25%), infección por el virus influenza (13%), dolor de espalda (12%), 12 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios elevación de las enzimas hepáticas (14%), tos (10%), disminución del ritmo cardiaco después de la primera dosis (4%), linfocitopenia (4%), riesgo de edema macular, posible riesgo aumentado para infecciones por el virus del herpes, disminución de la función pulmonar, aumento leve de la presión arterial. El único efecto adverso que ocasionó abandono del tratamiento con fingolimod 0,5mg fue la elevación de las transaminasas. A continuación se describen los efectos adversos más graves descritos para el fármaco: -Alteraciones cardiacas El inicio del tratamiento produce una disminución transitoria del ritmo cardiaco y también puede estar asociado con retraso de la conducción aurículoventricular. En los ensayos clínicos, la disminución máxima en el ritmo cardiaco apareció a las 4-5 horas del inicio del tratamiento, con una disminución media de 8 latidos por minuto con la dosis de 0,5 mg. El ritmo cardiaco volvió a los valores basales tras aproximadamente 1 mes de tratamiento. En algunos pacientes puede aparecer bloqueo aurículoventricular. En los ensayos, el 4,7% de los pacientes que recibieron fingolimod 0,5 mg, el 2,8% de los que recibieron interferón β1a intramuscular y el 1,5% de los que recibieron placebo sufrieron bloque aurículoventricular de primer grado. En menos del 0,5% de los pacientes en tratamiento con fingolimod 0,5 mg se detectó bloqueo de segundo grado. -Infecciones Un efecto farmacodinámico de fingolimod es la reducción dosis dependiente del recuento de linfocitos periféricos a un 20-30% de los valores basales. Esto se debe al secuestro reversible de linfocitos en los tejidos linfáticos. En los ensayos clínicos se han producido infecciones graves, debidas, principalmente, a herpes simple. Se produjeron dos muertes de infección por herpes (un caso de encefalitis por herpes simple y otro de infección primaria diseminada por varicela zoster), ambos con la dosis de fingolimod de 1,25 mg. -Neoplasias Las neoplasias se localizaron a nivel cutáneo; en el estudio FREEDOMS la incidencia fue mayor en el grupo que recibió placebo, pero en el TRANSFORMS hubo 12 pacientes con neoplasia, detectándose un solo caso en el grupo de Interferón β1a intramuscular y el resto en el fingolimod. La incidencia de linfomas fue de 3 por cada 10.000 pacientes/año en los pacientes tratados con fingolimod, no habiendo aparecido ningún caso en el grupo control (placebo o interferón β1a intramuscular). Son necesarios más datos de seguridad largo plazo para descartar que exista una relación causal entre estos casos y la administración de fingolimod. -Edema macular Los casos con edema macular se resolvieron mediante la discontinuación del tratamiento en un plazo de tiempo variable entre 1 y 8 meses. La incidencia fue del 1,1% y del 0,4% para la dosis de 1,25 mg y 0,5 mg de fingolimod respectivamente. En estudios clínicos de trasplante renal donde se incluyeron pacientes con diabetes mellitus, el tratamiento con fingolimod 2,5 mg y 5 mg incrementó 2 veces la incidencia de edema macular. 5.2. Seguridad. Ensayos Clínicos comparativos Notas AGEMED 13 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios En enero de 2012, la AGEMED publicó que el Comité de Medicamentos de Uso Humano (CHMP), comité científico de la Agencia Europea de Medicamentos (EMA) constituido por representantes de todas las agencias nacionales europeas, había iniciado la revisión del balance beneficio- riesgo de fingolimod. Esta revisión se inició tras conocer el caso de una paciente de 59 años que falleció en Estados Unidos durante las 24 horas posteriores a la administración de la primera dosis de fingolimod. La paciente se encontraba en tratamiento concomitante con metoprolol y amlodipino. Además, se han comunicado otros 15 casos en los que también se ha producido la muerte de pacientes. Para valorar adecuadamente este asunto, el CHMP ha revisado toda la información disponible procedente de ensayos clínicos y notificación espontánea, incluyendo los 15 casos de pacientes que fallecieron (de forma súbita o inexplicada) mientras se encontraban en tratamiento con fingolimod. La mayor parte de los fallecimientos y de los eventos cardiovasculares notificados han tenido lugar en pacientes que se encontraban en tratamiento concomitante con otros medicamentos o que ya presentaban una historia previa de patología cardiovascular. Asimismo se ha puesto de manifiesto que la disminución de la frecuencia cardiaca que produce fingolimod tiene su efecto máximo, en la mayor parte de los pacientes, durante las primeras 6 horas posteriores a la administración de la primera dosis y que este efecto puede ser revertido tras la administración de atropina o isoprenalina. La evaluación concluye que el balance beneficio-riesgo de fingolimod continúa siendo favorable para la indicación actualmente establecida, si bien recomienda que para prevenir el posible riesgo cardiovascular deben tenerse en cuenta nuevas advertencias y llevar a cabo una estrecha monitorización de los pacientes. La AEMPS informa a los profesionales sanitarios de lo siguiente: • • • No se recomienda la administración de fingolimod: o En pacientes que se encuentren en tratamiento con antiarrítmicos de clase Ia ó III. o En pacientes con antecedentes de patología cardiovascular o cerebrovascular en los que la aparición de bradicardia pueda empeorar su situación clínica (ej. bloqueos AV de 2º grado tipo Mobitz II, síndrome del seno enfermo, isquemia cardiaca, historia de bradicardia sintomática o síncopes recurrentes). Si se considerase necesario iniciar tratamiento con fingolimod se deberá consultar con un cardiólogo. o En pacientes que sigan tratamiento con ciertos medicamentos con capacidad para provocar descensos de la frecuencia cardiaca (ej. beta bloqueantes, verapamilo, diltiazem, ivabradina, digoxina, agentes anticolinesterásicos, pilocarpina). Si se considerase necesario iniciar tratamiento con fingolimod se deberá consultar con un cardiólogo. A todos los pacientes a los que se les vaya administrar fingolimod por primera vez se les deberá: o Realizar un electrocardiograma antes de administrar la primera dosis y a las 6 horas de administrada ésta. o Medir la tensión arterial y la frecuencia cardiaca cada hora durante las 6 primeras horas, siendo recomendable una monitorización electrocardiográfica continua durante este periodo. Se recomienda prolongar el tiempo de monitorización más allá de las 6 horas posteriores a la administración de la primera dosis de fingolimod si: 14 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios o Al final del periodo de las 6 horas el paciente presenta la frecuencia cardiaca más baja de las observadas desde que se le administró la dosis del medicamento. En este caso la monitorización deberá prolongarse hasta que la frecuencia se normalice y en cualquier caso al menos, durante un periodo de 2 horas. o Si durante las 6 horas posteriores a la administración de la primera dosis de fingolimod se presenta alguna de las siguientes condiciones clínicas, se recomienda prolongar la monitorización al menos durante toda la noche: Frecuencia cardiaca ≤ 45 lpm Intervalo QTc ≥ 500 msec En enero de 2013 la AGEMED publica una nota informativa donde se amplían las recomendaciones de monitorización. Y así, recomienda repetir el mismo esquema de monitorización establecido para los pacientes a los que se les administra la primera dosis de fingolimod cuando: o Aparezca bradiarritmia que precise tratamiento farmacológica tras la administración de la primera dosis de fingolimod. Se recuerda que estos pacientes deberán ser monitorizados en un centro médico al menos durante toda la noche. o Se interrumpa la administración del medicamento durante al menos un día durante las dos primeras semanas de tratamiento. o Se interrumpa la administración del medicamento durante más de 7 días durante las semanas 3º y 4º de tratamiento. o Se interrumpa la administración del medicamento durante más de 2 semanas después de transcurrido el primer mes de tratamiento. Si el tratamiento se interrumpe durante periodos de tiempo inferiores a los anteriormente mencionados, la administración de la siguiente dosis fingolimod podrá realizarse según el calendario inicialmente establecido. Ensayos clínicos Se incluyen los datos valorados de seguridad del ensayo TRANSFORMS comparativo entre fingolimod e interferón β 1a. Tabla 10. Referencia: Cohen JA, Barkhof F et al. Oral fingolimod or intramuscular interferón for relapsing multiple sclerosis. N Engl J Med 2010;362:402-15 (TRANSFORMS) -Nº de pacientes: 1.292 pacientes -Diseño: fase III, multicéntrico, randomizado, doble ciego, controlado frente a interferón β-1 A., doble enmascaramiento -Tratamiento grupo activo: fingolimod 1,25 mg/día o fingolimod 0,5 mg/día -Tratamiento grupo control: interferón β-1A 30 µg/semana vía intramuscular Resultados de seguridad Variable de seguridad Fingolimod Fingolimod Interferón RAR (IC 95%) p NNH o evaluada en el estudio 1.25 mg 0,5 mg beta 1 A (para fingolimod NND (n=420) (N=429)* ( N= 431) 0,5mg) (IC 95%) - cualquier efecto adverso - cualquier efecto adverso que lleva a la discontinuación del tratamiento 90,5% 86% 91.6% -5,6 NS 10% 5,6% 3,7% 1,9 NS - 15 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios - efectos adversos severos - muerte - bradicardia o bradicardia sinusal - bloqueo atrioventricular de primer grado - infección por herpes virus - carcinoma baso celular - Melanoma - cáncer de mama - disnea Efectos adversos reportados mas frecuentemente - nasofaringitis - infección del tracto respiratório superior - influenza - infección urinària - infección por herpesvirus - cefalea 10,7% 0,5% 7% 0% 5,8% 0% 1,2 - 2,4% 0,5% 0% 0,5% 0,5% 0,7% 0,5% 0% 0,5% 0,5% 0,2% 0,2% 0,7% 0,7% 0,5% 0% 0% 0,2% 0,2% 0% 0% 0% 0,7 0,5 22,1% 20,.5% 20,4% 0,1 8,6% 6,7% 7,2% 6,8% 6,3% 7,4% 0,9 0,6 5,7% 5,5% 22,9% 6,1% 2,1% 23,1% 5,1% 2,8% 20,4% 1 ns ns ns ns ns ns ns ns Los efectos adversos notificados fueron similares en los tres grupos de pacientes, oscilando entre el 86-92%, y entre 3,7-10% para aquellos que requirieron interrumpir el tratamiento. 5.3 Fuentes sobre seguridad En las fuentes secundarias descritas anteriormente se hace especial hincapié en la necesidad de verificar la seguridad a largo plazo de fingolimod, así como realizar una monitorización de los pacientes, especialmente en la primera administración, para detectar las complicaciones cardiacas y otros eventos adversos graves que puedan aparecer. Guías clínicas: No se han encontrado referencias del fármaco relativas a seguridad en guías de práctica clínica (NICE) ni evaluaciones del fármaco por otros organismos independientes. 5.4 Precauciones de empleo en casos especiales - Embarazo: Estudios en animales han demostrado que existe riesgo teratogénico a dosis altas; no existen estudios controlados en mujeres embarazadas, por lo que se recomienda evitar su uso durante el embarazo. Antes de iniciar el tratamiento en mujeres que puedan estar embarazadas, es necesario disponer de un resultado negativo del test de embarazo. Durante el tratamiento en mujeres en edad fértil, se recomienda una anticoncepción activa durante el tratamiento con fingolimod y hasta 2 meses después de haberlo finalizado. Si una mujer se queda embarazada durante el tratamiento, se recomienda la discontinuación del mismo. -Lactancia: Se desconoce si el bromuro de fingolimod se excreta en la leche humana. Los estudios en animales han mostrado que el fingolimod se elimina en la leche. - Insuficiencia renal: no se requieren ajustes de dosis. No obstante no hay estudios específicos en este tipo de población - Insuficiencia hepática: no requiere ajuste de dosis en insuficiencia hepática leve o moderada. Se debe evitar en pacientes con insuficiencia hepática grave. En los ensayos clínicos, un 8% de pacientes experimentaron elevación de niveles de transaminasas 3 veces por encima de los valores normales, a dosis de 0,5mg, frente a un 2% placebo. Un 2% tuvo una elevación de 5 16 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios veces los valores normales vs 1% del placebo. En todos los casos los valores de transaminasas volvieron a los niveles normales al suspender el tratamiento. - Población pediátrica: no se han realizado estudios en pacientes menores de 18 años. La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con fingolimod en uno o más grupos de la población pediátrica en esclerosis múltiple - Pacientes con edad avanzada: no existen datos específicos en pacientes de edad superior a 65 años, por lo que se recomienda utilizar fingolimod con precaución en este grupo de edad. Contraindicaciones: Su uso está contraindicado en pacientes con síndrome de inmunodeficiencia conocida, elevado riesgo de infecciones oportunistas, con infecciones activas graves y/o crónicas, procesos cancerígenos activos (excepto carcinoma cutáneo de células basales) o alteración hepática grave (Child-Pugh clase C). También está contraindicado en pacientes hipersensibilidad al principio activo o a alguno de los excipientes. con con con con No se recomienda la administración de fingolimod: - En pacientes que se encuentren en tratamiento con antiarrítmicos de clase Ia o III. - En pacientes con antecedentes de patología cardiovascular o cerebrovascular en los que la aparición de bradicardia pueda empeorar su situación clínica (ej. bloqueos AV de 2º grado tipo Mobitz II, síndrome del seno enfermo, isquemia cardiaca, historia de bradicardia sintomática o síncopes recurrentes). Si se considerase necesario iniciar tratamiento con fingolimod se deberá consultar con un cardiólogo. - En pacientes que sigan tratamiento con ciertos medicamentos con capacidad para provocar descensos de la frecuencia cardiaca (ej. beta bloqueantes, verapamilo, diltiazem, ivabradina, digoxina, agentes anticolinesterásicos, pilocarpina). Si se considerase necesario iniciar tratamiento con fingolimod se deberá consultar con un cardiólogo. Interacciones: El fingolimod no afecta a la farmacocinética de los fármacos metabolizados por las isoenzimas del citocromo P450 pero sí presenta interacciones con los siguientes medicamentos: - Los tratamientos antineoplásicos, inmunosupresores o inmunomoduladores no deben coadministrarse debido al riesgo de efectos aditivos sobre el sistema inmune. - Vacunas: evitar el uso de vacunas atenuadas durante el tratamiento con fingolimod y hasta 2 meses después de haberlo finalizado. - Antiarrítmicos de clase Ia y III: precaución debido al riesgo de alterar el ritmo cardiaco. Monitorizar a estos pacientes durante el inicio de tratamiento con fingolimod. - Betabloqueantes: El uso concomitante con atenolol produjo una reducción adicional del 15% del ritmo cardiaco. Al inicio del tratamiento, en pacientes que reciban fármacos que reduzcan el ritmo cardiaco (por ej., verapamil, digoxina, agentes anticolinesterásicos o pilocarpina), debe tenerse especial precaución, considerando la relación beneficio-riesgo. - La administración concomitante con ketoconazol sistémico causó un incremento de un 70% en la exposición a fingolimod. Monitorización y seguimiento: 1. A todos los pacientes a los que se les vaya administrar fingolimod por primera vez se les deberá: 17 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios - Realizar un electrocardiograma antes de administrar la primera dosis y a las 6 horas de administrada ésta. - Medir la tensión arterial y la frecuencia cardiaca cada hora durante las 6 primeras horas, siendo recomendable una monitorización electrocardiográfica continua durante este periodo. Se recomienda prolongar el tiempo de monitorización más allá de las 6 horas posteriores a la administración de la primera dosis de fingolimod si: - Al final del periodo de las 6 horas el paciente presenta la frecuencia cardiaca más baja de las observadas desde que se le administró la dosis del medicamento. En este caso la monitorización deberá prolongarse hasta que la frecuencia se normalice y en cualquier caso al menos, durante un periodo de 2 horas. - Si durante las 6 horas posteriores a la administración de la primera dosis de fingolimod se presenta alguna de las siguientes condiciones clínicas, se recomienda prolongar la monitorización al menos durante toda la noche: Frecuencia cardiaca ≤ 45 lpm Intervalo QTc ≥ 500 msec Si se interrumpe el tratamiento durante más de 2 semanas, con la reanudación posterior deberán aplicarse las mismas precauciones que con el inicio del tratamiento. 2. Se debe realizar un recuento sanguíneo completo antes del inicio (si no se dispone de uno realizado en los 6 meses previos) ante el riesgo aumentado de padecer infecciones. Durante el tratamiento también se recomienda realizar evaluaciones de forma periódica, y cuando exista signos de infección. Si se confirma un recuento absoluto de linfocitos <0,2x109/L debe interrumpirse el tratamiento hasta su resolución, ya que en los ensayos clínicos se interrumpió el tratamiento con fingolimod en los pacientes con un recuento absoluto de linfocitos <0,2x109/L. El inicio del tratamiento con el fármaco debe posponerse en pacientes con infección activa grave 3. Se debe evitar el uso de vacunas con virus vivos durante y 2 meses después del tratamiento con fingolimod. 4. Se recomienda realizar una revisión oftalmológica previa al tratamiento y a los 3-4 meses del inicio del tratamiento por el riesgo de edema macular. Especial atención a los pacientes diabéticos o con uveítis. 5. Se deben determinar los niveles de enzimas hepáticas y de bilirrubina antes de iniciar el tratamiento (si no se dispone de estos datos en los 6 meses previos). El laboratorio comercializador ha elaborado un formulario (tabla 11) para la monitorización del paciente antes, al inicio, durante y después del tratamiento con fingolimod (programa de gestión de riesgos). 18 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios Tabla 11. Formulario para la monitorización del paciente en tratamiento con Fingolimod 19 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 5.5. Seguridad: prevención de errores de medicación en la selección e introducción de un nuevo fármaco La dosis recomendada de fingolimod es de 0,5 mg/día administrada por vía oral. Consideramos que esta posología minimiza los errores de medicación al ser una toma única diaria, sin embargo podría dar lugar a errores por falta de adherencia del paciente. 6. ÁREA ECONÓMICA 6.1. Coste tratamiento / día y coste del tratamiento completo. Coste incremental. Comparación con la terapia de referencia o alternativa a dosis usuales Tabla 12. Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s MEDICAMENTO Precio unitario (PVL+IVA-7.5% RD) Posología GILENYA® 0,5 mg 28 cápsulas FINGOLIMOD BETAFERON®/ EXTAVIA® 8MUI 15 jeringas INTERFERON β1B REBIF® 44 4 cartuchos INTERFERON β1B REBIF® 22 4 cartuchos INTERFERON β1B 1.539,2 € 832,13 € 1.122,85 € 748,58 € 0,5 mg / día 8 MUI / 48 horas 44 mcg / 3 veces semana 43,35 € 15.824,05 € 22 mcg / 3 veces semana 26,73 € 10.549,54 € AVONEX® 30mcg 4 jeringas INTERFERON β1A 804 € COPAXONE® 28 jeringas ACETATO DE GLATIRAMERO TYSABRI® 300mg 1 vial NATALIZUMAB 751,56 € 1574,64 30 mcg / semana 20 mg / día 300 mg/mes 26,84 € 9.796,6 € 58,48 18.895,68€ -- -- -- -- -10.267,97€ -1.168,89€ Coste día 54,97€ 27,73 € 28,71 € Coste 20.064,57€* 10.125,45 € 10.479,15 € tratamiento/año Costes asociados -----a** Coste global -----tratamiento/año*** Coste incremental -9.939,12 € -4.240,52 € -9.515,03 € -9.585,42€ (diferencial) frente a fingolimod *** Suma del coste del tratamiento completo+costes asociados Sólo se han considerado los costes directos de los medicamentos. No se han tenido en cuenta costes asociados. Se ha encontrado un estudio de O’Day et al donde se desarrolló un modelo analítico de decisión para estimar el coste incremental por recaída evitada de natalizumab y fingolimod desde la perspectiva del pagador. Se consideró el coste de 2 años de tratamiento de pacientes con EM incluyendo costes de adquisición, costes de administración y monitorización y costes de recaídas. La efectividad fue medida en términos de recaídas evitada (se obtuvieron los datos del estudio AFFIRM y del FREEDOMS). Se realizó un análisis probabilístico de sensibilidad para valorar la incertidumbre. El coste medio estimado de tratamiento fue de 86.461$ con natalizumab y de 98.748$ con fingolimod. Los pacientes tratados con natalizumab tuvieron una media a los dos años de 0,74 recaídas evitadas vs 0,59 para fingolimod. Natalizumab fue el tratamiento dominante en el análisis coste-efectividad incremental, fue menos costoso y más efectivo en la reducción de recaídas. El análisis de sensibilidad mostró que los resultados del análisis fueron robustos. La ausencia de comparaciones directas es una de las limitaciones de este análisis, así como considerar la reducción en la tasa de recaídas antes que la progresión de la discapacidad sostenida, el considerar 100% de adherencia a los tratamientos y no considerar el coste de los acontecimientos adversos. 20 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios 6.2- Coste Eficacia Incremental (CEI). Tabla13. Coste Eficacia Incremental (CEI) Variables binarias Referencia TRANFORMS Fingolimod 0,5 mg Tipo de resultado Variable evaluada Medicamento con que se compara NNT Coste incremental anual (A-B)* Principal Tasa anual de recaídas Interferon β1A 5,9 (4,8-7,1) 9.585,42€ CEI (IC95%) 56.553,97€ (46.010,0068.056,47) *A:Fingolimod B:Interferon beta 1-A IM Interpretación: Se deberían tratar 6 pacientes con fingolimod 0.5mg para evitar una recaída adicional respecto al tratamiento con interferon β 1a lo que supondría un CEI de 56.553,97€. 6.3. Estimación del número de pacientes/año candidatos al tratamiento en el hospital, coste estimado anual y unidades de eficacia anuales Se desconoce el número de pacientes que pueden ser candidatos a recibir tratamiento con este fármaco. 6.4. Estimación del impacto económico global a nivel autonómico. No se dispone de datos. 7.- ÁREA DE CONCLUSIONES Ver tabla 14. Tabla de síntesis de la evidencia. 7.1 Resumen de los aspectos más significativos y propuesta -Fingolimod se ha autorizado como terapia de segunda línea en pacientes con esclerosis múltiple remitente recurrente en los que la enfermedad es grave y de rápida evolución, o bien no han respondido al tratamiento con interferon β. -Ha demostrado superioridad en la reducción del número de recaídas en la esclerosis multiple remitente-recurrente, tanto frente a placebo como frente a interferon β 1a vía intramuscular, aunque no ha demostrado esta superioridad en la reducción de la progresión de la discapacidad. -Se desconoce su eficacia frente a otras terapias utilizadas en el tratamiento de la esclerosis múltiple de mayor eficacia que interferón β1A vía intramuscular (acetato de glatirámero) y frente a natalizumab, fármaco aprobado con la misma indicación. -Fingolimod es un medicamento de reciente comercialización con un mecanismo de acción nuevo. Por tanto, la información sobre su seguridad es limitada. 21 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios -En enero de 2011 el Comité de Medicamentos de Uso Humano (CHMP) inició una revisión del balance beneficio-riesgo de fingolimod tras conocerse el caso del fallecimiento de un paciente en los Estados Unidos tras la administración de la primera dosis. En abril de 2012 este comité publica una nota informativa concluyendo que el balance beneficio-riesgo continúa siendo favorable para la indicación establecida, si bien recomienda que para prevenir el posible riesgo cardiovascular deben tenerse en cuenta nuevas advertencias y llevar a cabo una estrecha monitorización de los pacientes. -En los ensayos clínicos realizados, los efectos adversos más frecuentes han sido infecciones del tracto respiratorio, cefalea, fatiga, infección por el virus herpes y elevación de enzimas hepáticas, apareciendo en más del 10% de los pacientes tratados con fingolimod. -Los efectos adversos más graves que se han presentado son las alteraciones cardiacas, las infecciones graves, neoplasias y edema macular entre otros. -En general podemos decir que es un fármaco con un buen perfil de seguridad, a dos años pero que se desconoce su seguridad a largo plazo. -Su principal ventaja en comparación con los fármacos modificadores de la enfermedad actuales es su vía de administración oral, que puede suponer un importante beneficio para el paciente en cuanto a una mayor comodidad y posible mejora de la calidad de vida. -El coste de fingolimod es mayor que con interferón β-1A im, con un coste incremental de 9.585,42 euros/paciente/año. 7.2 Lugar en terapéutica. Condiciones de uso en el hospital. Aplicación de los datos y conclusiones al hospital. Fingolimod representa una nueva clase de tratamiento, no sólo porque permite una administración vía oral sino también por su mecanismo de acción que actúa no sólo en el sistema inmune, sino también en las células neuronales. En el ámbito de la Agencia Valenciana de Salud la utilización del Fingolimod ha de ajustarse a los criterios de utilización que se recogen en la Instrucción 3/2012, sobre el procedimiento para la tramitación de solicitudes de tratamiento con interferon beta, acetato de glatiramero, 13 natalizumab y fingolimod . Se deberá realizar una monitorización exhaustiva del paciente tanto al inicio como durante el tratamiento, para la detección y seguimiento de los efectos adversos y de los resultados terapéuticos obtenidos. 7.3 Indicaciones y servicios aprobados. EMRR que no responde a las terapias de primera línea, presentan intolerancia o está contraindicado su uso y como alternativa al uso de natalizumab (pacientes con serología JC positiva y/o tratamiento previo con inmunosupresores). La prescripción de fingolimod debe realizarse por Servicios de Neurología especializados que garanticen un correcto uso del mismo y una monitorización estrecha de los pacientes. Así mismo, su dispensación se realizará en las Unidades de Atención Farmacéutica a Pacientes Externos asegurando un correcto seguimiento farmacoterapéutico. Cada vez que se quiera iniciar un tratamiento con fingolimod el médico deberá solicitarlo mediante el protocolo de solicitud de inicio de tratamiento de esclerosis múltiple con fingolimod, 22 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios el cual se tramitará al Comité Asesor de la Conselleria de Sanidad para el tratamiento de la esclerosis múltiple y no se podrá iniciar hasta que no sea autorizado por dicho comité. 7.4 Especificar si la inclusión del fármaco va acompañada con la propuesta de retirada de algún otro fármaco. No procede. 7.5 Especificar si se produce algún cambio en el PIT (Programa de Intercambio Terapéutico). No procede. 8.- BIBLIOGRAFÍA. 1. Ficha técnica de Gilenya® (Fingolimod) disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Public_assessment_report/human/002202/WC500104530.pdf Consultado el 12 de Noviembre de 2012. 2. Informe CDER de la FDA disponible en: http://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022527Orig1s000medr.pdf 3. BOT: Base de datos del Medicamento. Consejo General de Colegios Oficiales de Farmacéuticos. Disponible en: http://www.portalfarma.com (2012). 4. Kappos L, Radue EW et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010;362:387-401 5. Cohen JA, Barkhof F et al. Oral fingolimod or intramuscular interferón for relapsing multiple sclerosis. N Engl J Med 2010;362:402-15 6. Kappos L, Antel J et al. Oral fingolimod for relapsing multiple sclerosis. N Engl J Med 2006;355:1124-40 7. Comi G, O`Connor P et al. Phase II study of oral fingolimod (FTY720) in multiple sclerosis: 3-year results. Mult Scler 2010;16:197-207. 8. Panitch H, Googin DS et al. Randomized, comparative study of interferón beta-1a treatment regimens in MS: The EVIDENCE Trial. Neurology 2002; 59:1496-506. 9. Barbero P, Bergui M et al. Every-other-day interferón beta-1b versus once-weekly interferón beta-1a for multiple sclerosis (INCOMIN Trial) II: analysis of MRI responses to treatment and correlation with Nab. Mult Scler. 2006;12:72-6 10. Fingolimod (Drugdex® Evaluations). Drugdex® System. Micromedex. Disponible en URL: http://www.thomsonhc.com [accedido 15-09-2012] 11. Nota informativa de seguridad. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).Fingolimod (Gilenya®):inicio de la revisión del balance beneficioriesgo. http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/segurid ad/2012/NI-MUH_01-2012.htm 12. Nota informativa de seguridad. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).Fingolimod (Gilenya®): conclusiones sobre la revisión del balance beneficio-riesgo. http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/segurid ad/2012/NI-MUH_06-2012.htm 13. Instrucción 3/2012. Procedimiento para la Tramitación de solicitudes de tratamiento con interferon beta, acetato de glatiramero, natalizumab y fingolimob. Dirección General de Farmacia y Productos Sanitarios. Conselleria de Sanidad. Disponible en: 23 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios URL: http://www.san.gva.es/cas/prof/dgf/pdf/Instrucción_3_2012.pdf 14. Informe de evaluación de fingolimod para el tratamiento de la EMRR del grupo GÉNESIS de la SEFH y GHEMA de la SAFH. Disponible en URL:http://gruposdetrabajo.sefh.es/genesis/genesis/Enlaces/InformesHosp_abc.htm. [accedido 10-09-2012]. 15. National Multiple Sclerosis Society. FDA panel recommends approval of oral fingolimod for relapsing MS—if agency follows advice, it would become first oral disease-modifying therapy for MS. Disponible en: http://www.nationalmssociety.org/news/newsdetail/index.aspx?nid=3338. 16. O'Day K, Meyer K, Miller RM, Agarwal S, Franklin M. Cost-effectiveness of natalizumab versus fingolimod for the treatment of relapsing multiple sclerosis. J Med Econ. 2011; 4(5):617-27. 24 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios ANEXO APARTADO 1 del informe DECLARACIÓN DE CONFLICTO DE INTERESES DE LOS AUTORES/REVISORES DE LA EVALUACIÓN Los autores/revisores de este informe, declaran: -No tener ningún contrato con las compañías farmacéuticas que tienen registrado el medicamento que se evalúa, ni tampoco con los laboratorios que compiten comercialmente con el mismo. -No beneficiarse de ninguna beca o ayuda por parte de dichas compañías. -No tener ninguna otra relación personal, comercial o profesional que pueda influir en la valoración objetiva y científica del medicamento Nombre, fecha y firma: 25 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios TABLA 14.Tabla de síntesis de la evidencia. Referencia (autor, publicación) FREEDOMS Autores: Kappos L. et al. (N Engl J Med 2010;362:387401) Financiado por Novartis Pharma. Tipo de estudio y objetivo Población estudiada (criterios de inclusión/exclusión) EC multicéntrico, fase III, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, multicéntrico, internacional, en 138 centros de 22 países. Aleatorización 1:1:1 en cada grupo para FNG 1,25 mg, FNG 0,5 mg o placebo durante 24 meses. Objetivo principal: Determinar la eficacia (tasa anualizada de recidivas) y seguridad de FNG a las dosis de 1,25 mg y 0,5 mg frente a placebo en la EMRR. Objetivo secundario: Evaluar el efecto del FNG en la progresión de la discapacidad por la EDSS 1.564 pacientes elegibles, se aleatorizaron 1.272 (ITT) Criterios de inclusión: -Edad entre 18-55 años -Diagnóstico de EMRR según los criterios McDonald. -Haber tenido ≥ 1 recidivas documentadas el año anterior o ≥ 2 recidivas en los 2 años anteriores al inicio del estudio. -Tener una puntuación de 0 a 5,5 en la EDSS Criterios de exclusión: -Tener una recidiva o tratamiento con corticoides los 30 días previos a la aleatorización. - Enf cardiovascular (IM, angina, ICC, etc); Enf pulmonar; Infección activa; Edema macular; Diabetes mellitus; Enfermedad sistémica; inmunosupresión (linfocitos < 800/mm3). Pauta de tratamiento Variables de medida (end-point) Resultados (tamaño del efecto/ valores p/intervalos de confianza) FNG 1,25 mg/día (n=429) FNG 0,5 mg/día (n=425) Placebo (n=418). Seguimiento: Un total de 1.033 de los 1.272 pacientes (81,2%) completaron el estudio de 24 meses. Evaluaciones clínicas: inicio, 2 semanas, 1, 2 y c/3 meses EDSS c/ 3 meses MSFC c/ 6meses RM inicio y c/6 meses Pérdidas FNG 1,25 mg vs FNG 0,5 mg vs PCB 96 (22,4%) vs 56 (13,2%) vs 86 (20,6%) Variable principal Tasa anualizada de recidivas a los 2t4 meses (IC95%); p-valor y NNT vs PCB. Diferencia entre FNG 0,5mg vs 1,25mg p-valor Variables secundarias % pac sin progresión en EDSS a 24 meses (IC95%); p-valor y NNT vs PCB (Kaplan Meier) Diferencia entre FNG 0,5mg vs 1,25mg p-valor HR de progresión en EDSS FNG vs PCB (IC95%) Cambio en Volumen cerebral a 24 meses respecto basal. Mediana (IQR); p-valor vs PCB. FNG 1,25: 0,16 (0,13- 0,19) ; p<0,001 vs PCB FNG 0,5: 0,18 (0,15- 0,22) ; p<0,001 vs PCB; NNT=4,5 (4 - 5,26) vs PCB PCB: 0,40 (0,34- 0,47) p=0,226 vs FNG FNG 1,25: 83,4% ± 1,9 (79,7- 87,1); p=0,01 vs PCB FNG 0,5: 82,3% ± 1,9 (78,686,1); p=0,03 vs PCB; NNT=15,6 (14,5 - 16,9) PCB: 75,9% ± 2,2 (71,780,2) p=0,743 vs FNG FNG 1,25: 0,68 (0,5- 0,93); p=0,02 FNG 0,5: 0,70 (0,52-0,96); p=0,02 FNG 1,25: -0,7(-6,33 a 3,04) FNG 0,5: -0,67 (-13,5 a 2,16); p<0,001 PCB: -0,98 (-7,58 a 2,38) FNG 1,25mg vs FNG 0,5mg vs INF 404 (94%) vs 401 (94,4%) vs 387 (92,6%) Calidad del estudio (escala Jadad) Aleatorización:1 Doble ciego: 1 Pérdidas: 1 Aleatorizac. apropiada: 1 Ciego apropiado: 1 TOTAL: 5 puntos 26 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios -Inmunosupresores (azatioprina, MTX), inmunoglobulinas y/o ac monoclonales (natalizumab) en 6 meses previos. - Interferón o glatirámero en 3 meses previos. Población representativa 70% mujeres, caucásicas. Duración media EM 8,2 años; Media de recidivas año previo 1,5; EDSS basal 2,4; 60% naive; de los 40% tratados previamente el 71% fueron con IFN- beta. TRANSFORM S Cohen J et al. N Engl J Med 2010;362:402-15 Periodo de realización: Mayo 2006Septiembre 2007 Financiado por: Novartis Pharma EC multicéntrico, fase III, aleatorizado, doble ciego, doble enmascaramiento, con control activo, de grupos paralelos, multicéntrico, internacional, en 172 centros de 18 países. Aleatorización 1:1:1 Objetivo principal: Determinar la eficacia y seguridad de FNG a las dosis de 1,25 mg y 0,5mg frente a Interferón beta -1a en EMRR. Objetivos secundarios: Nº de nuevos o aumento de las lesiones hiperintensas 1.573 pacientes elegibles; 1.292 pacientes aleatorizados 1.280 pacientes población MITT Un total de 89% completaron el estudio de 12 meses y el 87% pasan a la fase de extensión. Criterios de inclusión: -Edad entre 18-55 años. - Diagnóstico de EMRR según los criterios McDonald - Haber tenido ≥ 1recidivas documentadas el año anterior o≥ 2 recidivas en los 2 años anteriores al inicio del estudio. - Tener una puntuación de 0 a 5,5 en la escala EDSS. Criterios de exclusión: -Tener una recidiva o -FNG 1,25 mg/día (n=420) -FNG 0,5 mg/día (n=429) -Interferón beta -1a 30 mcg/ semanal im (n=431) Seguimiento: -Las evaluaciones clínicas se hicieron: inicio, semana 2 y los meses 1,2,3, y c/ 3 meses - EDSS c/ 3 meses y MSFC c/ 6 meses. -RMN aleatorización y 12 meses. Pérdidas: FNG 1,25 mg vs FNG 0,5 mg vs Interferón beta -1a: 51 (12%) vs 31 (7,2%) vs 45 (10,4%) Efectos adversos: - Incidencia global - Abandonos por RAM: -Muertes (con FNG 1,25mg): -EAG: Bradicardia: -EAF: Disnea: Bloqueo atrioventricular Primer grado: Segundo grado: Edema Macular: Hipertensión: Aumento ALAT> 3veces: Linfocitopenia: Infección herpes virus 61 (14,2%) vs 32 (7,5%) vs 32 (7,7%) 1 (0,2%) vs 0 vs 2 (0,5 %) 3 (0,72 %) vs 4 (0,9 %) vs 1 (0,2 %) 23 (5,43%) vs 30 (7,1%) vs 19 (4,5%) 5 (1,2%) vs 2 (0,51%) vs 2 (0,5%) 1 (0,2%) vs 0 vs 1 (0,2%) 7 (1,6%) vs 0 vs 0 27 (6,3%) vs 26 (6,1%) vs 16 (3,8%) (12,5%) vs (8,5%) vs (1,7%) 23 (5,4%) vs 15 (3,5%) vs 2 (0,5%) 25 (5,8%) vs 37(8,7%) vs 33 (7,9%) Variable principal Tasa anualizada de recidivas a los 12 meses (IC95%); p-valor y NNT vs IFN Variables secundarias % pac sin progresión en EDSS a 12 meses (IC95%); pvalor vs IFN (Kaplan Meier) % pac libres de recidiva a 12 meses (IC95%); p-valor vs IFN Cambio en Volumen cerebral a 12 meses respecto basal. Mediana (IQR); p-valor vs IFN. Efectos adversos FNG 1,25mg= 0,20 (0,160,26); p<0.001 FNG 0,5 mg= 0,16 (0,120,21); p<0,001; NNT= 5,9 (4,8 - 7,1) IFN beta 1-a= 0,33 (0,260,42) FNG 1,25: 93,3 ±1,24 (90,92- 95,77) ; p=0,498 NS FNG 0,5: 94,1 ± 1,15 (91,8296,33) ; p=0,247 NS IFN beta 1-a: 92,1±1,33 (89,45- 94,66) FNG 1,25: 79,8% (75,983,7); p<0,001 FNG 0,5: 82,6%(79- 86,3); p<0,001 IFN beta 1-a: 69,3% (64,873,8) FNG 1,25: -0,2 (-2,9 a 2,2); p<0,001 FNG 0,5: -0,2 (-3,7 a 2); p<0,001 Aleatorización: 1 Doble ciego: 1 Pérdidas: 1 Aleatorizac. apropiada: 1 Ciego apropiado: 1 TOTAL: 5 puntos 27 AGENCIA VALENCIANA DE LA SALUD DG de Farmacia y Productos Sanitarios Tiempo a progresión de la discapacidad confirmada a los 3 meses tratamiento con corticoides los 30 días previos a la aleatorización. - Enf cardiovascular (IM, angina, ICC, etc); Enf pulmonar; Infección activa; Edema macular; Diabetes mellitus; Inmunosupresión (linfocitos < 800/mm3); enfermedad sistémica. -Inmunosupresores (azatioprina, MTX), inmunoglobulinas y/o ac monoclonales (natalizumab) en 6 meses previos. - Se permitía terapia previa con IFN beta o acetato de glatirámero, sin lavado. Población representativa 67% mujeres, caucásicas. Duración media EM 7,4 años; Media de recidivas año previo 1,5; EDSS basal 2,2; 43% naive - Incidencia global - Abandonos por RAM: - Muertes (con FNG 1,25mg): -EAG: Bradicardia: Bloqueo atrioventricular Primer grado: Segundo grado: Disnea: Infección herpesvirus -EAF: Edema Macular: Hipertensión: Aumento ALAT> 3veces Linfocitopenia: IFN beta 1-a: -0,4 (-3,4 a 2,6) FNG 1,25mg vs FNG0,5mg vs INF 380 (90,5%); 369 (86%); 395 (91,6) 42 (10%) vs 24 (5,6%) vs 16 (3,7%) 2 (virus zoster diseminado y encefalitis por virus herpes simple) 45 (10,7 %) vs 30 (7,0%) vs 25 (5,8 %) 10 (2,4%) vs 2 (0,5%) vs 0 2(0,5%) vs 1(0,2%) vs 0 3(0,7%) vs 1(0,2%) vs 0 2(0,5%) vs 0 vs 0 3(0,7%) vs 1(0,2%) vs 1(0,2%) 1% vs 0,5% vs 0% 21 (5%) vs 16 (3,7%) vs 8 (1,9%) 24(5,7%) vs 28(6,5%) vs 8 (1,9%) 4(1%) vs 1(0,2%) vs 0 28