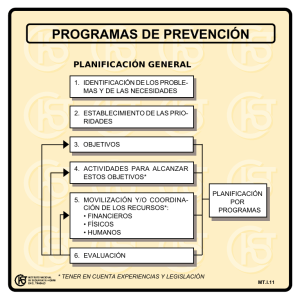
2. Plomo
Anuncio

2. Plomo Pb. El más abundante entre los metales pesados Forma compuestos estables y muy insolubles (óxidos, carbonatos, cloruros). Muchas menas en España: Jaén y Badajoz. Usos: Desde hace 4000 años. EN DESUSO: Transporte de agua, catalizador de gasolina, edulcorante, conservas, insecticidas, imprenta. ACTUALMENTE: Pinturas, protección de radioactividad, cristalería, proyectiles, soldaduras, baterías Plomo Debido a su persistencia y a la lenta sustitución, sigue siendo el 5º metal más usado y su toxicidad es muy relevante Movilización Los compuestos de Pb son muy insolubles, pero una bajada aparente del pH hace aumentar su solubilidad (envases, recipientes y juguetes) Extracción del mineral, reciclaje de viejas infraestructuras, gasolinas, lodos cloacales Plomo Transporte y acumulación Fundamentalmente se transporta por el aire Debido a su insolubilidad y a su falta de reactividad, se acumula en suelos y sedimentos marinos Persistencia en el entorno (puede usarse como indicador histórico) Presenta "biominificación“. En humanos se acumula en huesos y riñón. Toxicidad Humanos: Aunque no fácil, puede pasar a cerebro, provocando desórdenes neurológicos. Saturnismo: Envenenamiento debido a exposición aguda a niveles altos de Pb: estupor, convulsiones, parálisis, etc... Pb afecta al transporte de oxígeno por la hemoglobina: Palidez y Anemia. Afecta al metabolismo del calcio. Plomo Otros seres vivos: Síntomas análogos (cisnes y otras aves) Los organismos acuáticos acumulan Pb en órganos Las aves acumulan Pb huesos y tejidos blandos provocando crecimiento anómalo y efectos teratogénicos. Acumulación en cáscaras. Microorganismos: Retardan degradación heterótrofa de la materia orgánica 3. Cadmio Cd. Muy escaso pero muy tóxico Forma óxidos estables, se encuentra generalmente como impureza de minerales de Zn. Usos: Electrodeposición de acero, aleaciones, manofactura de PVC, pigmento, agente antifricción, semiconductor y pilas. Cadmio Tiolprivo, afinidad por los grupos tioles (SH) presentes en el aminoácido cisteina. Muy diferente la toxicidad del Cd2+ en disolución de la del Cd2+ particular. Movilización, transporte y acumulación Manufactura del Zn, humo del tabaco Cd forma vapores y partículas en el aire muy volátiles Se acumula en organismos acuáticos (moluscos) y plantas regadas con aguas residuales y fertilizantes. Cadmio Los humanos se intoxican principalmente por ingesta, acumulándose en riñones, hígado y órganos reproductores, al igual que otros animales. Toxicidad Mimetiza al Zn en su bioquímica y compite con Ca por proteínas trasnportadoras y canales. Inhibición de diversas enzimas. Humanos: Alteración renal, hepática y pulmonar (edemas, pneumonitis, cancer). En dosis pequeñas vómitos, diarreas, colitis. En dosis crónicas hipertensión, hipertrofia coronaria y muerte Cadmio La mayor epidemia se describió en el río Jintsu (Toyama, Japón 1955) por ingestión de arroz contaminado (disfunción renal, osteomalacia, osteroporosis, deformidades esqueleticas,...). Otros seres vivos: Los Crustáceos acumulan Cd en el hepatopáncreas, afectando a funciones digestivas, metabólicas y reproductoras. 4. Cobre Cu. Es un elemento micronutriente para muchos seres vivos. Metal central de muchas metaloenzimas. Usos: Desde hace 6000 años. Como aleaciones en herramientas, joyería, monedas... Actualmente destaca su uso en fontanería, cableado y fungicidas. Forma sales poco solubles que se movilizan a pH ácidos. Forma complejos solubles pero poco biodisponibles. Concentraciones altas de Cu se depositan en suelos y sedimentos (minas de Cu o dispersión de fungicidas). Cobre No presenta acumulación en humanos. Se ha encontrado acumulación en huevos de aves de presa. Afecta a seres vivos acuáticos y microorganismos. En general, la toxicidad se apreciaría a muy altas concentraciones y en condiciones particulares. 5. Níquel Ni. Elemento traza de plantas, bacterias e invertebrados (metal central de enzimas ureasas). Usos: En aleaciones como anticorrosivo, pilas, bisutería, decoración. Se moviliza por la quema de combustibles fósiles, fundiciones, humo de tabaco, etc... Penetra en mamíferos por inhalación. Níquel Ni se acumula en el citosol celular y se une a proteínas de bajo peso molecular. A pesar de ser micronutriente y su baja vida media biológica, se ha comprobado su toxicidad (dermatitis, desórdenes respiratórios y cáncer, daños cromosómicos). Depende de la especie química. Ni(CO)4 6. Aluminio Al. El metal más abundante de la corteza terrestre. Usos: Envases, recubrimientos, utensilios de cocina, etc. El metal más importante del s. XX. Tecnología aeroespacial Los compuestos de Al(III) son insolubles, pero se movilizan a pH bajos. Aluminio Penetra preferentemente por ingestión por el uso de medicamentos y utensilios de cocina. Se acumula en huesos, cerebro, hígado y bazo. Osteomalacia en pacientes renales. En otros seres vivos destaca por intervenir en el metabolismo del fósforo. Medios acuáticos ácidos afectan a invertebrados y peces donde el Al precipita en las branquias provocando asfixia 7. Cromo Cr. Los estados de oxidación más comunes son III y VI, con diferentes propiedades químicas y toxicológicas. Usos: Aceros y otras aleaciones, cromados, industria aeroespacial, como anticorrosivo y para curtir pieles. Aluminio El Cr(III) es un elemento micronutriente para mamiferos, pues participa en diversos metabolismos Movilización, propiedades y toxicidad Se moviliza a partir de torres de refrigeración, incineración de combustibles fósiles, desechos urbanos, aguas residuales e industria química y metalurgia, para pasar a la atmósfera, sedimentos y agua Fundiciones e industria del papel liberan Cr a medios acuáticos Penetra en humanos preferentemente inhalación atmosférica, aunque también por ingestión Cromo El polvo de Cr(VI) provoca ulceración de la mucosa nasal y perforación del septum nasal. Tasas de reproducción alterada en otros seres vivos. Crónicamente puede llevar a cáncer de pulmón y anormalidades cromosómicas. 8. Hierro Fe. Centro catalítico de reacciones redox. Hemoglobina. Clorofila. Usos: Conocido desde la antigüedad, ha sido el metal más importante en la historia de la humanidad. Fe (II) es más soluble y tóxico pero, en condiciones aeróbicas, se transforma en Fe (III), menos soluble y menos tóxico. Movilización. Siderurgia. Manipulación de residuos, donde las condiciones anaerobias favorecen la forma ferrosa. Drenaje en minas de Fe. Hierro Captación. Fundamentalmente por ingestión oral. Transfusiones. Los cultivos de arroz (suelos inundados) captan mucho hierro. Toxicidad: Polvo de hierro: pneumoconiosis Movilización de pirita. Seres vivos drenadores de suelos benigna. 9. Zinc Zn, N.ox.= 2 No es de los elementos más abundantes en la corteza terrestre, pero algunos suelos tienen altas concentraciones de forma natural. Varias menas: Picos de Europa; San Javier y Sierra de Cartagena (MU), Udias (S). Zinc Usos: Baterías, recubrimiento de tejados, anticorrosión, numismática, latón, bisutería Movilización, propiedades y toxicidad Movilización: Minas, fundición, combustibles fósiles, incineración de residuos; movilizan polvo de Zn a la atmósfera y aguas. Micronutriente: Núcleo prostético de muchas enzimas. Síntesis de RNA (dedos de Zn) Acumulación: Se deposita en suelos y aguas favorecida por la acidificación. Inhalación en industrias de polvo de Zinc. La principal vía de incorporación es por la ingesta de alimento. Toxicidad: Fiebre de Zn, exposición a polvo de Zn produce escalofríos, fiebres y nauseas. Humos de ZnCl2: casos de muerte por edema pulmonar. Zinc Otros seres vivos: Suelen tolerar bien Zn, los más sensibles son los organismos acuáticos. Se acumulan en varios tejidos. 10. Berilio Be, N.ox.= 2 Escasas menas: Pontevedra, Madrid. Usos: Piedras preciosas, reactores nucleares, industria aeroespacial Movilización: Combustión de carbón. Acumulación: Fundamentalmente en pulmón. Los tejidos de los mamíferos no lo excretan, por tanto se acumula. Berilio Toxicidad: En humanos daña la piel y las mucosas, en el pulmón produce BERILIOSIS. Cáncer de pulmón y médula ósea. Compite con el Mg por los centros enzimáticos: Inhibe la DNApolimerasa, timidina quinasa y fosfatasa alcalina 11. Vanadio V, N.ox.= 2,3,4,5. Muy distribuido por la corteza terrestre. Generalmente en rocas asociado a minerales de titanio o uranio. Usos: Industria nuclear, aditivo en la manufactura de hierros y aceros, colorantes, cerámica y catalizadores de la industria química Vanadio Movilización: Petróleo crudo y carbón contienen altos niveles de V. La combustión de fuel libera gran cantidad de partículas a la atmósfera Movilización, propiedades y toxicidad Elemento traza esencial para ratas, pollos y algunas bacterias Acumulación: Los humanos se exponen al V por inhalación, depositándose y acumulándose a pulmones. El V ingerido por alimento es pobremente absorbido. Se acumula en barros de estuarios. Vanadio Toxicidad: Inhibe la oxidación de tejidos, la síntesis de colesterol, fosfolípidos y aminoácidos. En pequeñas concentraciones incrementa la tasa de crecimiento de ciertas algas. A altas concentraciones es causante de reducir especies de fitoplacton.