GUÍA PRÁTICA LABORATORIO No. 2. Técnicas y métodos de
Anuncio

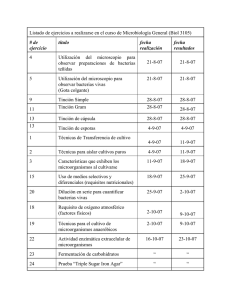
GUÍA PRÁTICA LABORATORIO No. 2. Técnicas y métodos de tinción bacteriana. Observación al microscopio. 1. Introducción. Encontramos microorganismos en todas partes, en el suelo, en el agua, en el aire y sobre y dentro de organismos multicelulares incluyendo los humanos. A este grupo de microorganismos se les llama la flora normal microbiana. Hay algunos microorganismos que permanecen por pocos días o hasta meses en nuestro cuerpo, a este tipo de flora se le llama transitoria. La asociación entre dos organismos se llama simbiosis y esto ocurre con nuestra flora bacteriana, al igual que con la asociación de otros organismos. La relación puede ser beneficiosa o perjudicial. Por ejemplo, algunas bacterias beneficiosas para nosotros pertenecen al género Lactobacillus y Escherichia coli, esta última nos provee de vitamina K y ciertas vitaminas del complejo B. Las siguientes partes del cuerpo contienen su propia flora microbiana: nariz, boca, conjuntiva, oído externo, estómago, piel, uretra, vagina, intestino delgado e intestino grueso. Si estas bacterias pasan de su lugar natural del cuerpo a otra parte del cuerpo pueden ocasionar enfermedades. Esto ya sería una relación perjudicial. Podemos adquirir las bacterias desde nuestro ambiente o desde diferentes partes de la piel, boca, nariz y garganta. La boca contiene millones de bacterias en cada mililitro de saliva y en distintos organismos pueden existir varios de acuerdo a su régimen alimentario. Algunas de ellas son bacterias transitorias que llegan aquí con los alimentos. Para poder visualizarlas y estudiarlas se hace necesario la aplicación de técnicas de tinción lo que facilitaría el estudio de su estructura y características primarias. 1.1. Tinción. Es el proceso por el cual las moléculas de un colorante se adsorben a una superficie. El uso de colorantes permite cambiar el color de las células de los microorganismos y poder realizar la observación en microscopio óptico. Dado que las bacterias son casi incoloras, no presentan contraste con el medio en el cual se encuentran suspendidas y no pueden observarse claramente sin algún tratamiento previo. De acuerdo a la reacción que ocurre, existen diferentes tipos de tinción: a) Frotis: Se denomina frotis a la extensión que se realiza sobre un portaobjetos de una muestra o cultivo con objeto de separar lo más posible los microorganismos, ya que si aparecen agrupados en la preparación es muy difícil obtener una imagen clara y nítida. Este frotis debe ser posteriormente fijado al vidrio del portaobjetos para poder aplicar los métodos habituales de tinción que permiten la observación al microscopio de las bacterias sin que la muestra sea arrastrada en los sucesivos lavados. La fijación de una extensión bacteriana hace que las bacterias queden inactivadas y adheridas al vidrio alterando lo menos posible la morfología y bacteriana y las posibles agrupaciones de células que pudiera haber. Una vez realizado el frotis y fijadas las bacterias, las preparaciones pueden ser observadas al microscopio, aunque carecen de contraste. Lo normal es continuar con el proceso de tinción. b) Tinción simple: El colorante utilizado sirve solo para denotar la morfología celular. En este caso, se observan dos formas principales: Bacilos y cocos c) Tinción diferencial: El colorante utilizado pone de manifiesto diferencias entre células bacterianas o entre partes de una misma célula. Estas técnicas utilizan más de un colorante o bien ciertos reactivos complementarios para la tinción. Ejemplos: Tinción de Gram, Tinción de Ziehl-Neelsen, etc. 1.1.1. Tinción diferencial de Gram: Esta tinción se denominada así por el bacteriólogo danés Christian Gram, quien la desarrolló en 1844. Sobre la base de su reacción a la tinción de Gram, las bacterias pueden dividirse en dos grupos, grampositivas y gram-negativas. Las bacterias gram-positivas y gram-negativas tiñen de forma distinta debido a las diferencias constitutivas en la estructura de sus paredes celulares. La pared de la célula bacteriana sirve para dar su tamaño y forma al organismo así como para prevenir la lisis osmótica. El material de la pared celular bacteriana que confiere rigidez es el peptidoglicano. La pared de la célula gram-positiva es gruesa y consiste en varias capas interconectadas de peptidoglicano así como algo de ácido teicoico. Generalmente, 80%90% de la pared de la célula gram-positiva es peptidoglicano. La pared de la célula gram-negativa, por otro lado, contiene una capa mucho más delgada, únicamente de peptidoglicano y está rodeada por una membrana exterior compuesta de fosfolípidos, lipopolisacáridos, y lipoproteínas. Sólo 10% - 20% de la pared de la célula gram-negativa es peptidoglicano. 1.1.2 Tinción diferencial ZIEHL-NEELSEN (Método ácido resistente): Las paredes celulares de ciertos parásitos y bacterias contienen ácidos grasos (ácidos micólicos) de cadena larga (50 a 90 átomos de carbono) que les confieren la propiedad de resistir la decoloracíón con alcohol-ácido, después de la tinción con colorantes básicos. Por esto se denominan ácido-alcohol resistentes. El frotis se tiñe durante unos 5 min con Fucsina fenicada aplicando calor suave. Lavar con agua. Decolorar con alcohol etílico 95% con un 3% de HCl concentrado. Lavar y teñir durante 30-60 seg con Azul de Metileno (color de contraste). Lavar y secar. 1.1.3. Tinción diferencial de Wirtz: Algunos géneros bacterianos, entre los que destacan Clostridium y Bacillus, producen en su interior formas de resistencia denominadas esporas. Se producen cuando las condiciones ambientales son desfavorables (agotamiento de los nutrientes, temperaturas extremas, radiaciones, compuestos tóxicos, etc.) formándose una espora por cada forma vegetativa. Al finalizar el proceso de esporogénesis, la célula vegetativa se lisa y libera la espora al exterior. Cuando el ambiente es favorable, la espora germina generando una nueva forma vegetativa. La capacidad de germinar perdura durante años. Esta tinción requiere de dos colorantes; el Verde malaquita, el cual es capaz de teñir las esporas en caliente y la Safranina; el cual es un colorante de contraste que tiñe las formas vegetativas. Las endosporas, tras la primera tinción, no perderán el colorante en el lavado con agua, y sí lo harán las formas vegetativas, que quedarán teñidas con el segundo colorante. I. II. OBJETIVOS. 1. Que el alumno sea capaz de realizar adecuadamente las preparaciones de frotis y tinciones bacterianos (tinción simple, tinción de Gram, tinción de cápsulas y esporas). 2. Caracterizar la morfología y formas de agrupación de las bacterias y algunas estructuras como cápsulas y endosporas. 3. Identificar las bacterias gram-negativo y gram-positivas. MATERIALES. Placas Petri con cepas bacterianas. Tubos de ensayos con cepas bacterianas. Asas de platino. Láminas. III. Mecheros de alcohol. Colorante de cristal violeta. Solución de lugol. Solución Alcohol-acetona. Colorante Safranina. Microscopio. PROCEDIMIENTOS EXPERIMENTALES. Preparación de frotis y fijación. 1. Proceda a realizar el marcado del portaobjeto o lámina en uno de sus extremos. 2. Flamee cuidadosamente en asa de platino, como se le enseño en la actividad anterior. 3. Tome el tubo de ensayo con la cepa bacteriana a observar y proceda a flamear la boca del tubo, para la extracción de la muestra proceda como se le indicó en la actividad anterior. 4. Coloqué la muestra en el centro de la lámina y extiéndala en el centro de ella, realizando un frotis. 5. Fije la muestra (frotis) por medio del flameado de la lámina por la llama del mechero. De 2 a 3 veces. Tinción simple. 1. Cubra con azul de metileno y deje reposar por un intervalo de tiempo de 3 a 4 minutos. 2. Lave con un chorro suave de agua. 3. Seque su preparación con papel absorbente. 4. Observe al microscopio con el lente de 40x y de 100x. Descripción de la tinción de GRAM: 1. Proceda a realizar el marcado del portaobjeto o lámina en uno de sus extremos. 2. Flamee cuidadosamente en asa de platino, como se te enseño en la actividad anterior. 3. Tome el tubo de ensayo con la cepa bacteriana a observar y proceda a flamear la boca del tubo, para la extracción de la muestra proceda como se te indicó en la actividad anterior. 4. Coloqué la muestra en el centro de la lámina y extiéndala en el centro de ella, realizando un frotis. 5. Fije la muestra (frotis) por medio del flameado de la lámina por la llama del mechero. De 2 a 3 veces. 6. Aplicar unas gotas de colorante Cristal Violeta sobre el área del frotis por 1 min. 7. A continuación se lava con agua. 8. De forma inmediata se cubre con solución Yodada durante 1 - 2 min. 9. Lavar de nuevo con agua. 10. Decolorar con mezcla alcohol etílico/acetona. 11. Escurrir y cubrir con Safranina (color de contraste) durante 1 – 2 min. 12. Lavar y secar. 13. Llevar al microscopio y observar. Una vez concluida la observación debes realizar las anotaciones de tú observación las cuales deben estar dirigida a: a) Por su forma (bacilos o cocos). b) Son gram-negativas o gram-positivas. c) Cualquier otra observación que consideres de interés. d) Debes realizar una búsqueda sobre las características que tienen ambos tipos de bacterias gramnegativas y gram-positivas. e) Además de buscar ejemplos de ambos tipos y cuáles son sus relaciones con el hombre, animales y planta, destacando su importancia. Bibliografía. Titulo: Microbiology: A Laboratory Manual (9th Edition). Autor: James Cappuccino (Author), Natalie Sherman (Author). ISBN: 978-0321840226. Editorial/año: Benjamin Cummings; January, 2013. Titulo: Microbiology: A Human Perspective. Autor: Eugene Nester (Author), Denise Anderson (Author), Jr., C. Evans Roberts (Author). ISBN: 978-0073375311. Editorial/año: McGraw-Hill Science/Engineering/Math; October, 2011.