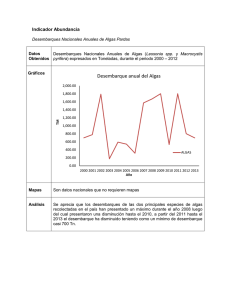
dirección general de políticas interiores
Anuncio

CATALOGUE BA-31-11-434-ES-C Dirección General de Políticas Interiores Departamento TemÁTICO Políticas Estructurales y de Cohesión Dirección General de Políticas Interiores Departamento TemÁTICO Políticas Estructurales y de Cohesión B B Agricultura y Desarrollo Rural Cultura y Educación Cometido Pesca Pesca Los departamentos temáticos constituyen unidades de análisis que prestan asesoramiento especializado a comités, delegaciones interparlamentarias y otros órganos parlamentarios. Desarrollo Regional Áreas políticas Transporte y Turismo Agricultura y Desarrollo Rural Cultura y Educación Pesca Desarrollo Regional Transporte y Turismo ¿FAVORECE LA SOBREEXPLOTACIÓN LA PROLIFERACIÓN DE ALGAS? Documentos: Visite la web del Parlamento Europeo: http://www.europarl.europa.eu/studies Créditos de las fotografías: iStock International Inc., Photodisk, Phovoir NOTA ISBN 978-92-823-3663-2 doi: 10.2861/57421 ES DE EN FR IT PT 2011 DIRECCIÓN GENERAL DE POLÍTICAS INTERIORES DE LA UNIÓN DEPARTAMENTO TEMÁTICO B: POLÍTICAS ESTRUCTURALES Y DE COHESIÓN PESCA ¿FAVORECE LA SOBREEXPLOTACIÓN LA PROLIFERACIÓN DE ALGAS? NOTA Este estudio fue solicitado por la Comisión de Pesca del Parlamento Europeo. AUTOR Britas Klemens ERIKSSON Departamento de Ecología y Evolución Bentónicas Marinas del Centro de Estudios Ecológicos y de Evolución de la Universidad de Groningen Países Bajos ADMINISTRADORA RESPONSABLE Irina POPESCU Departamento Temático de Políticas Estructurales y de Cohesión Parlamento Europeo Correo electrónico: [email protected] ASISTENCIA EDITORIAL Virginija KELMELYTE VERSIONES LINGÜÍSTICAS Original: EN Traducciones: DE, ES, FR, IT, PT ACERCA DEL EDITOR Para ponerse en contacto con el Departamento Temático o suscribirse a su boletín mensual, diríjase a: [email protected] Manuscrito terminado en noviembre de 2011 Bruselas, © Parlamento Europeo, 2011 Este documento ha sido publicado en Internet en: http://www.europarl.europa.eu/studies CLÁUSULA DE EXENCIÓN DE RESPONSABILIDAD Las opiniones que se expresan en este documento son exclusivamente responsabilidad de los autores y no reflejan necesariamente la posición oficial del Parlamento Europeo. La reproducción y la traducción de este documento con fines no comerciales están autorizadas a condición de que se cite explícitamente la fuente y se avise previamente al editor, adjuntándosele una copia. DIRECCIÓN GENERAL DE POLÍTICAS INTERIORES DE LA UNIÓN DEPARTAMENTO TEMÁTICO B: POLÍTICAS ESTRUCTURALES Y DE COHESIÓN PESCA ¿FAVORECE LA SOBREEXPLOTACIÓN PESQUERA LA PROLIFERACIÓN DE ALGAS? NOTA Resumen En la presente nota se presentan pruebas científicas que demuestran que existe una relación entre la sobreexplotación y la proliferación de algas, así como varios casos de estudio europeos que sustentan esta hipótesis. La sobreexplotación ha contribuido a aumentar el problema de la proliferación de algas en Europa. La sobreexplotación de las poblaciones de alta mar ha modificado la estructura de numerosos ecosistemas marinos, lo que ha promovido la acumulación de biomasa de algas. Actualmente, los efectos perjudiciales que tiene la sobreexplotación en las cadenas alimenticias en alta mar se extienden a los ecosistemas costeros y generan problemas como el deterioro de la calidad de las aguas cercanas a la costa y la pérdida de hábitats. IP/B/PECH/IC/2011-105 PE 474.461 Noviembre de 2011 ES ¿Favorece la sobreexplotación pesquera la proliferación de algas? ÍNDICE LISTA DE ABREVIATURAS 5 LISTA DE FIGURAS 7 LISTA DE CUADROS 9 RESUMEN 11 1. INTRODUCCIÓN 15 2. TIPOS Y EFECTOS DE LAS PROLIFERACIONES DE ALGAS 19 2.1. ¿Qué son las proliferaciones de algas? 19 2.2. Efectos ecológicos de las proliferaciones de algas 19 2.3. Grupos de algas nocivas 20 2.4. Problemas y costes para la sociedad en general 22 2.5. Efectos concretos en la pesca europea 23 3. ECOLOGÍA DE LAS PROLIFERACIONES DE ALGAS 27 3.1. Un proceso natural cuya frecuencia aumenta con la eutrofización 27 3.2. Los nutrientes y los herbívoros controlan conjuntamente el desarrollo de la proliferación de algas 30 3.3. La disminución de los peces depredadores de nivel superior coincide con el aumento de las algas 32 3.4. Las cascadas tróficas dependen de la diversidad de recursos y depredadores 33 4. ¿CONTRIBUYE LA SOBREEXPLOTACIÓN PESQUERA A LA PROLIFERACIÓN DE ALGAS EN EUROPA? 37 4.1. Modelos de los efectos de la sobreexplotación y la eutrofización 37 4.2. Estudio del caso del mar del Norte 40 4.3. Estudio del caso del mar Negro 43 4.4. Estudio del caso del Kattegat 46 4.5. El mar Báltico – estudio del caso de alta mar 49 4.6. El mar Báltico – estudio del caso de aguas costeras 53 5. CONCLUSIONES Y RECOMENDACIÓN 59 REFERENCIAS 63 3 Departamento Temático de Políticas Estructurales y de Cohesión 4 ¿Favorece la sobreexplotación pesquera la proliferación de algas? LISTA DE ABREVIATURAS ASP Toxina amnésica de molusco (Amnesic Shellfish Poisoning) CFP Toxinas de ciguatera (Ciguatera Fish Poisoning) CPUE Capturas por unidad de esfuerzo DSP Toxina diarreica de moluscos (Diarrhetic Shellfish Poisoning) EBM Gestión basada en el ecosistema (Ecosystem-Based Management) FK Proliferación de algas mortal para los peces (Fish Killing algal blooms) GLM Modelo lineal general (General Linear Model) HAB Proliferación de algas nocivas (Harmful Algal Bloom) HBNT Proliferación de algas no tóxicas de gran biomasa (High Biomass Non-Toxic algal blooms) HBT Proliferación de algas tóxicas de gran biomasa (High Biomass Toxic algal blooms) NAO Oscilación del Atlántico Norte (North Atlantic Oscillation) NSP Toxina neurotóxica de molusco (Neurotoxic Shellfish Poisoning) PSP Toxina paralizante de molusco (Paralytic Shellfish Poisoning) ST Proliferación de algas tóxicas para los alimentos marinos (Seafood Toxic algal blooms) 5 Departamento Temático de Políticas Estructurales y de Cohesión 6 ¿Favorece la sobreexplotación pesquera la proliferación de algas? LISTA DE FIGURAS Figura 1: Efectos potenciales de la sobreexplotación pesquera en la estructura de las cadenas alimenticias marinas, que muestran la relación entre la pesca y la proliferación de algas 16 Figura 2: Grupos de organismos que generan proliferaciones de algas nocivas y tipología de las mismas 19 Figura 3: Aumento del punto máximo estival de la biomasa de algas a lo largo del tiempo en el mar Negro. 27 Figura 4: Duración de la temporada de proliferación de algas en el mar de Frisia. 29 Figura 5: Extensión del punto máximo de proliferación de cianobacterias en el mar Báltico entre 1997 y 2009. 30 Figura 6: Efecto relativo de los herbívoros en la biomasa de algas en sistemas bentónicos y pelágicos. 31 Figura 7: El descenso de los depredadores de nivel superior provocado por la pesca coincide con un aumento abrupto de la población permanente de algas en el Atlántico del Norte, el mar Báltico y el mar Negro. 32 Figura 8: El aumento de la producción de biomasa procedente del enriquecimiento con nutrientes se acumula en diferentes niveles tróficos en función del número de niveles tróficos del ecosistema. 36 Figura 9: Cadena alimenticia genérica de un ecosistema pelágico templado situado cerca de la costa. 38 Figura 10: Cadena alimenticia genérica de un ecosistema pelágico templado situado cerca de la costa. 39 Figura 11: Tendencias de los desembarques de peces grandes y pequeños en el mar del Norte 41 Figura 12: Tendencias de los desembarques de grandes especies pelágicas en el mar del Norte 41 Figura 13: Tendencias de los desembarques de grandes especies demersales en el mar del Norte 42 Figura 15: Tendencias del nivel trófico medio de los desembarques en el mar del Norte 42 Figura 16: Tendencias de los desembarques de atún y marlín de las flotas pesqueras rusa, rumana y turca del mar Negro 45 Figura 17: Tendencias de los desembarques de especies pelágicas pequeñas y medianas en el mar Negro 45 7 Departamento Temático de Políticas Estructurales y de Cohesión Figura 18: Tendencias del nivel trófico medio de los desembarques en el mar Negro 45 Figura 19: Tendencias de la biomasa relativa de zooplancton y fitoplancton en el mar Negro 46 Figura 20: Tendencias de los desembarques de bacalao y otros grandes peces depredadores en el Kattegat 47 Figura 21: Tendencias de la biomasa total de bacalao en el Kattegat 48 Figura 22: Tendencias de la abundancia de cangrejos de playa y peces de tamaño mediano observadas en el seguimiento costero en Ringhals en el Kattegat. 48 Figura 23: Relación entre el bacalao de alta mar y las poblaciones costeras de depredadores medianos = abundancia total de cangrejo de playa, lábridos y gobio negro. 48 Figura 24: Relación entre las temperaturas en primavera y las poblaciones costeras de depredadores medianos = abundancia total de cangrejo de playa, lábridos y gobio negro. 49 Figura 25: Tendencias de las poblaciones de peces dominantes en el mar Báltico 50 Figura 26: Biomasa del zooplancton y del fitoplancton en el mar de Gotland, al sur del Báltico. 51 Figura 27: Intensidad de la proliferación de primavera en el mar de Gotland, al sur del Báltico. Biomasa media de fitoplancton entre 0 y 10 metros de profundidad. 51 Figura 28: Importancia relativa de los diferentes factores biológicos y medioambientales para determinar la densidad del espadín en el mar Báltico. 52 Figura 29: Importancia relativa de los diferentes factores biológicos y medioambientales para determinar la densidad de zooplancton y fitoplancton en el sur del mar Báltico. 53 Figura 30: Descenso de la población de perca en la costa sueca al sur del mar Báltico 55 Figura 31: Descenso de la población de lucio en la costa sueca al sur del mar Báltico 55 Figura 32: Tendencias de la abundancia de grandes peces depredadores costeros en Kalmar, al sur del mar Báltico. 56 Figura 33: Tendencias de la abundancia de bacalao, espadín y picón en alta mar. 56 Figura 34: Abundancia de picón por red de arrastre manual y porcentaje de la superficie cubierta de algas filamentosas en función de la densidad de depredadores de nivel superior. 57 Figura 35: La eliminación de la perca y el lucio, junto con la eutrofización, aumentan el desarrollo de las algas filamentosas proliferantes 57 8 ¿Favorece la sobreexplotación pesquera la proliferación de algas? LISTA DE CUADROS Cuadro 1: Incidentes de proliferación de algas registrados en el Mediterráneo y el mar Negro. 28 Cuadro 2: Relación entre los grandes predadores pelágicos (biomasa de atunes y marlines, por ejemplo) y los niveles tróficos inferiores en el mar Negro a lo largo del tiempo. 46 Cuadro 3: Relación entre los niveles tróficos adyacentes en el mar Báltico entre 1974 y 2006. 51 9 Departamento Temático de Políticas Estructurales y de Cohesión 10 ¿Favorece la sobreexplotación pesquera la proliferación de algas? RESUMEN Antecedentes La proliferación de algas es el nombre colectivo que se da a los episodios de crecimiento excesivamente rápido de algas y bacterias fotosintetizantes. Como tales, los organismos específicos que producen la proliferación de algas guardan muy poca relación entre ellos y pertenecen a un grupo sumamente variable de organismos acuáticos fotosintetizantes. La proliferación de algas puede provocar perjuicios importantes a los seres humanos, pues tiene un efecto negativo en partes valiosas de los ecosistemas, como la denominada proliferación de algas nocivas (HAB). Un resumen de los datos disponibles sobre aguas marinas europeas muestra que las consecuencias socioeconómicas negativas de la proliferación de algas nocivas se eleva al menos a 850 millones de euros anuales. Sin embargo, esta cifra no incluye todos los países europeos ni los episodios no contemplados. La frecuencia de la proliferación de algas ha aumentado con la eutrofización en todo el mundo, y los efectos negativos de la proliferación de algas nocivas en Europa se han incrementado de modo significativo desde los años sesenta. Estos efectos negativos pueden dividirse en dos amplias categorías: Proliferaciones de alta densidad: grandes acumulaciones visibles de algas o bacterias que tiñen el agua y provocan perjuicios por su simple abundancia. Las grandes biomasas de algas pueden ser perjudiciales para el ecosistema de varias formas, por ejemplo, al formar capas de algas a la deriva y cargas excesivas de mucosidad que obstruyen el flujo del agua y se acumulan junto con la espuma en las playas, o al provocar anoxia tras la proliferación debido a la descomposición de grandes cantidades de materia orgánica acumulada. Productores de toxinas: un grupo de algas unicelulares, en el que predomina el grupo de los dinoflagelados, produce toxinas de gran potencia. Estas toxinas son responsables de una gran mortalidad entre peces y moluscos, y pueden tener graves efectos en la salud humana si se acumulan en la cadena alimenticia, en particular a través de la intoxicación por moluscos. Las proliferaciones que causan intoxicación de moluscos a menudo no pueden observarse a simple vista. Otras especies tienen importantes efectos negativos directos tanto en el ganado como en los seres humanos al combinar proliferaciones de alta densidad con un bajo nivel de toxicidad. En los últimos diez años se han acumulado indicios que señalan que la sobreexplotación pesquera puede contribuir al problema de la proliferación de algas. En una serie de sistemas marinos, el aumento de la masa y el incremento de la frecuencia de las proliferaciones de algas han coincidido con una drástica reducción de las poblaciones comerciales de grandes peces depredadores. Un fenómeno común en estos sistemas afectados es que tras la reducción de los grandes peces depredadores se han producido: 1) aumentos significativos de sus presas, es decir, peces de menor tamaño, y 2) un descenso de los animales herbívoros, que son presa de los peces de menor tamaño y consumen algas. De este modo, podría existir una relación entre el descenso de las poblaciones comerciales de peces y el aumento de las proliferaciones de algas, provocados a su vez por las relaciones entre depredadores y presas, que finalmente disminuyen la presión que ejercen los animales herbívoros sobre las algas. 11 Departamento Temático de Políticas Estructurales y de Cohesión Objetivo El objetivo general de esta nota informativa es describir los antecedentes necesarios para comprender la relación entre la proliferación de algas y la pesca, y presentar pruebas científicas que demuestren que la sobreexplotación pesquera podría contribuir a los crecientes problemas que plantea dicha proliferación. En esta nota se presentan casos de estudio europeos que indican que la proliferación de algas está relacionada con la sobreexplotación pesquera y se expone hasta qué punto y en qué circunstancias el agotamiento de poblaciones puede provocar o favorecer esta proliferación. La nota aborda cuatro preguntas concretas: ¿Qué consecuencias tiene la proliferación de algas para la pesca? ¿Existen efectos sinérgicos de la sobreexplotación pesquera y la eutrofización? ¿Cuáles son los tipos de poblaciones de peces cuyo agotamiento suele facilitar la proliferación de algas? ¿Qué tipos de proliferación de algas están relacionados con la sobreexplotación pesquera? Principales conclusiones La proliferación de algas nocivas tiene efectos negativos en la pesca europea. El coste total estimado de la proliferación de algas nocivas para la pesca europea se cifra como mínimo en 177 millones de euros anuales. Esta cifra incluye los efectos negativos en la pesca comercial, las pérdidas para el sistema de protección social y el coste del análisis de las proliferaciones de algas para detectar intoxicación de alimentos marinos. La proliferación de algas tóxicas tiene un coste elevado para el sector de la acuicultura. Las pérdidas directas de productos comercializables del sector de los moluscos oscilan entre 15 y 62 millones de euros al año. Las proliferaciones de alta densidad causan problemas a todos los tipos de pesca costera. Las capas de algas a la deriva y las proliferaciones que forman mucílago interfieren con los aparejos de pesca y hacen que estos resulten menos eficaces. La anoxia posterior a la proliferación produce una gran mortalidad tanto en la acuicultura como en las poblaciones de peces silvestres. La anoxia interfiere igualmente en la reproducción a lo largo de la costa, que es una de las principales zonas de reproducción de numerosas poblaciones de peces de alta mar. La sobreexplotación de los peces depredadores de nivel superior contribuye a aumentar la frecuencia e intensidad de la proliferación de algas. La proliferación de algas es un fenómeno natural controlado por una serie de factores medioambientales. Sin embargo, la sobreexplotación pesquera contribuye a la proliferación de algas al debilitar un importante control biológico del crecimiento excesivo, ya que al eliminar a los principales depredadores, genera cambios en la configuración de la cadena alimenticia, que por lo general promueve la abundancia de peces de menor tamaño, y provoca una merma de la abundancia de los herbívoros que consumen algas, como el zooplancton o los herbívoros invertebrados. Junto con factores abióticos, los herbívoros controlan el desarrollo de la biomasa de las algas y cuando se reduce su número, la proliferación de algas se desarrolla con mayor facilidad. Actualmente, los efectos perjudiciales que tiene la sobreexplotación en las cadenas alimenticias en alta mar se extienden a los ecosistemas costeros y provocan problemas como el deterioro de la calidad de las aguas cercanas a la costa y la pérdida de hábitats. 12 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Es muy probable que la sobreexplotación pesquera haya contribuido a aumentar el problema de la proliferación de algas nocivas en el mar Báltico y el mar Negro. Aunque la ecología y la regulación de la proliferación de algas son complejas, los análisis de series temporales y la coincidencia de episodios indican claramente que la sobreexplotación pesquera ha contribuido a aumentar el problema y el coste económico de la proliferación de algas en el mar Báltico y el mar Negro, al provocar cambios a gran escala en la estructura de esos ecosistemas marinos. Es probable que la sobreexplotación pesquera haya contribuido a aumentar el problema de la proliferación de algas nocivas en el mar del Norte. Los modelos y análisis de los datos disponibles correspondientes al mar del Norte indican que el aumento de la masa de algas puede depender de cambios estructurales de la comunidad de peces provocados por la pesca. Carecemos de datos sobre la tendencia de la proliferación de algas en el Kattegat, pero hay experimentos que indican que el descenso documentado a largo plazo del bacalao ha tenido efectos perjudiciales sobre las comunidades de vegetación marina debido al aumento de la proliferación de algas filamentosas. El problema general de la falta de datos sobre los mares europeos limita la capacidad para estimar los efectos de la pesca. Existe en general una falta de análisis de tendencias que incluyan a más de un grupo de organismos de diferentes cuencas marinas europeas, pero se han señalado problemas tanto con la sobreexplotación pesquera como la proliferación de algas. Esto indica que falta información importante, al tiempo que numerosas organizaciones e instituciones europeas no hacen públicos datos que podrían servir para realizar referencias cruzadas. La sobreexplotación pesquera y la eutrofización generan efectos sinérgicos. Los cambios en las comunidades de depredadores de nivel superior y la proliferación de algas coinciden con la eutrofización. No cabe duda de que la eutrofización a escala europea ha promovido la proliferación de algas, pero los cambios de composición de la comunidad de peces han agravado el problema de la proliferación de algas nocivas. Por ejemplo, en el estado actual del mar Báltico, rico en nutrientes, las tendencias de las poblaciones de peces comerciales coinciden más con las tendencias de la biomasa de las algas que con las de los nutrientes, lo que indica que actualmente la sobreexplotación pesquera contribuye de forma significativa a la aparición de la proliferación de algas. El efecto sinérgico entre la sobreexplotación y el enriquecimiento en nutrientes ha sido confirmado por experimentos sobre el terreno que demuestran claramente que la proliferación de algas filamentosas se ve facilitada tanto por los nutrientes como por la eliminación de los principales peces depredadores, y que actúan de forma concertada, de modo que el efecto combinado de los nutrientes y la eliminación de los depredadores resulta a menudo varias veces superior al efecto que cada uno de ellos tendría por separado. La sobreexplotación pesquera seguramente favorece ante todo la proliferación de algas cuando afecta a una sola especie que predomina en la presencia y la función de la comunidad de peces. Los efectos que tiene la eliminación de depredadores en las especies presa son por lo general mucho mayores si la comunidad de depredadores está dominada por una sola especie, como las poblaciones demersales de bacalao del mar Báltico y del Kattegat, o las comunidades pelágicas de anchoa del mar Negro. La proliferación de algas de alta densidad son las que presentan una mayor relación con la sobreexplotación pesquera. Los datos disponibles indican que las proliferaciones no tóxicas de alta densidad son las más sensibles a la sobreexplotación. Así pues, la sobreexplotación favorece al parecer ante todo proliferaciones de algas de alta 13 Departamento Temático de Políticas Estructurales y de Cohesión densidad y genera problemas relacionados con: 1) capas de algas a la deriva, 2) la producción de mucílago y espuma y 3) anoxia tras la proliferación. Sin embargo, algunos análisis genéricos de la cadena alimenticia de mares templados muestran igualmente que la intensificación de la pesca, como la de peces pelágicos de pequeño tamaño, puede favorecer la proliferación de algas y medusas tóxicas. Este fenómeno puede observarse en la cadena alimenticia del mar Negro, donde las medusas se incrementaron drásticamente tras el colapso de una pesca intensiva de la anchoa en los años noventa. Recomendación La presente nota informativa demuestra que la gestión tradicional de los recursos marinos tiene graves limitaciones, ya que a menudo ignora las interacciones tanto dentro de las cadenas alimenticias como entre las cadenas alimenticias de alta mar y las costeras. Los efectos en cascada de la sobreexplotación alteran las relaciones entre depredadores y presas y de este modo aumentan la frecuencia e intensidad de la proliferación de algas nocivas, lo que a su vez afecta a la rentabilidad del sector pesquero y puede generar efectos negativos a largo plazo en las poblaciones que tienen una importancia comercial. Sin embargo, el coste de la pesca no se limita al sector pesquero, sino que también afecta a las comunidades costeras en las que el incremento de los problemas que causa la proliferación de algas provoca importantes pérdidas de ingresos obtenidos con el turismo y costes relacionados con los efectos negativos en la salud humana. Las pruebas demuestran que se requiere un método de gestión basado en el ecosistema (EBM) que reconozca tanto 1) los efectos que tiene la pesa en el resto del ecosistema, como 2) los flujos entre los hábitats de alta mar y los costeros. 14 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 1. INTRODUCCIÓN La proliferación de algas es el nombre colectivo que se da al crecimiento excesivamente rápido de algas y bacterias fotosintetizantes. Es un fenómeno que puede provocar perjuicios importantes a los seres humanos, pues tiene un efecto negativo en partes valiosas de los ecosistemas, como la denominada proliferación de algas nocivas (Hoagland y Scatasta, 2006). Entre estos efectos negativos se encuentran la obstrucción de playas y aparejos de pesca, la creación de condiciones carentes de oxigeno que matan a los invertebrados y peces que viven en el fondo del mar y la toxicidad del agua y alimentos procedentes del mar. No cabe duda de que la frecuencia de la proliferación de algas nocivas ha aumentado en todo el mundo, junto con la masa de nutrientes antropogénicos (Hallegraeff, 1993; Sellner y cols., 2003; Glibert y Burkholder, 2006; Heisler y cols., 2008; Smith y Schindler, 2009). Sin embargo, en los últimos diez años se ha tomado mayor conciencia de que el agotamiento de las poblaciones de peces de alto nivel trófico puede contribuir al problema de la proliferación de algas (Frank y cols., 2005; Scheffer y cols., 2005; Daskalov y cols., 2007; Casini y cols., 2008; Moksnes y cols., 2008; Eriksson y cols., 2009; Eriksson y cols., 2011). En una serie de sistemas marinos, el aumento de la masa y el incremento de la frecuencia de las proliferaciones de algas han coincidido con una drástica reducción de las poblaciones comerciales de grandes peces depredadores. Un efecto común en estos sistemas afectados es que tras la reducción de las poblaciones de grandes peces depredadores se han producido: 1) aumentos significativos de sus presas, es decir, peces de menor tamaño, y 2) un descenso de los animales herbívoros, que son presa de los peces de menor tamaño y consumen algas. De este modo, podría existir una relación entre el descenso de las poblaciones comerciales de peces y el aumento de las proliferaciones de algas, provocados a su vez por las relaciones entre depredadores y presas, que finalmente disminuyen la presión que ejercen los animales herbívoros sobre las algas (figura 1). En esta nota informativa se exponen los antecedentes científicos necesarios para comprender la relación entre la proliferación de algas y la pesca, y se presentan pruebas científicas que demuestran que la sobreexplotación favorece dicha proliferación. Las algas son productores primarios situados en la base de la mayoría de las cadenas alimenticias marinas y, como tales, interactúan con niveles tróficos superiores a través de la transferencia de energía. La energía solar que fijan las algas se canaliza a través de la cadena alimenticia y controla en última instancia la producción de valiosas poblaciones de peces. Esta descripción de una simple pirámide trófica puede parecer banal, pero las pirámides tróficas no son simples cadenas lineales de sucesos, en las que la cantidad de recursos abióticos disponibles se traduce en un producto orgánico predestinado en niveles tróficos superiores, sino complejas interacciones entre diferentes organismos biológicos que crean nuevas propiedades que pueden considerarse convenientes o no para los seres humanos. Desde una perspectiva de gestión, las cadenas alimenticias marinas presentan dos propiedades muy importantes que deben tenerse en cuenta para garantizar un ecosistema sostenible que produzca poblaciones valiosas de peces comerciales, a saber: 1) Todos los consumidores dependen tanto de la cantidad como de la calidad de los alimentos. De este modo, no solo la abundancia, sino también la composición de la comunidad de algas determina la estructura del sistema, es decir, la producción y composición de la comunidad de peces. 2) Los niveles tróficos superiores afectan a los niveles inferiores al consumirlos, es decir, los peces depredadores reducen el número de sus presas, que a su vez eliminan biomasa primaria al comer plantas y algas. Esta interacción bidireccional en el interior de las cadenas alimenticias ha dado lugar a un prolongado debate científico sobre si los efectos «ascendentes» (transferencia de energía desde los recursos elementales) o los «descendentes» (consumo de los niveles tróficos 15 Departamento Temático de Políticas Estructurales y de Cohesión superiores) controlan la abundancia de plantas y algas en los distintos ecosistemas. Hoy en día sabemos que los consumidores, las presas y los recursos dependen a menudo unos de otros, de tal modo que la acumulación de algas provocada por el aumento de recursos depende de la presión del consumo por parte de los herbívoros (Worm y cols., 2002). Figura 1: Efectos potenciales de la sobreexplotación pesquera en la estructura de las cadenas alimenticias marinas, que muestran la relación entre la pesca y la proliferación de algas sustainable fishing Increased fishing pressure overfishing piscivorous fish decreases in large predatory fish piscivorous fish planktivorous fish increases in smaller predatory fish planktivorous fish zooplankton decreases in organisms that eat algae ‐ grazers zooplankton phytoplankton increases in primary producing algae phytoplankton Fuente: Extraído de Scheffer y cols. (2005), basado en Frank y cols. (2005). La interacción documentada entre los recursos acuáticos y los consumidores ha llevado a suponer que los cambios que provoca la sobreexplotación en las cadenas alimenticias marinas pueden dar lugar a la proliferación de algas. Es importante señalar desde un principio que la eliminación de los consumidores no aumenta necesariamente la productividad de los productores primarios. La producción primaria está controlada por recursos primarios como la luz y los nutrientes y por limitaciones medioambientales como la temperatura. Así, la eliminación de peces en general no acelera el crecimiento de algas. Este no es el tema del debate. Lo que la ciencia ha demostrado es que los consumidores tienen la capacidad de dar forma a la estructura de las cadenas alimenticias, dentro de los límites definidos por determinadas condiciones básicas y restricciones medioambientales. La idea de que las interacciones de las cadenas alimenticias dan forma a los ecosistemas y tienen consecuencias para su funcionamiento y capacidad para ofrecer bienes y servicios, ha puesto de manifiesto la necesidad de una gestión de los recursos marinos basada en el ecosistema (EBM). La EBM es un método de gestión adaptable que se centra en la complejidad de las interacciones dentro de los sistemas ecológicos y sociales, y entre ellos, y reconoce que la diversidad de especies y sus características son importantes para el rendimiento y estabilidad de los ecosistemas (Christensen y cols., 1996). 16 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Hasta ahora existen muy pocas pruebas científicas sobre la influencia que ejerce la pesca en las algas. Ello se debe a la falta de interés por estudiar los vínculos y relaciones entre los niveles tróficos en el marco de los programas de seguimiento marino. El seguimiento de las proliferaciones de algas y de sus consumidores, el zooplancton o los herbívoros invertebrados, no ha sido especialmente frecuente en ningún país, lo que ha limitado de forma crítica la duración de las series temporales disponibles. Los peces de menor tamaño, que son un vínculo importante entre los peces comerciales de mayor tamaño y las algas, tampoco han sido objeto de gran atención. Por otra parte, se han publicado muy pocos resultados y muy pocas bases de datos públicas han hecho un seguimiento de la comunidad de peces conjuntamente con las algas y sus herbívoros, que permitan realizar comparaciones precisas de las tendencias entre estos grupos. Todo ello refleja los límites de la gestión sectorial y las divisiones entre las disciplinas académicas, como entre la pesca y la calidad del agua, y la zoología y la botánica, lo que indica que puede ser necesario un cambio dentro de la estructura organizativa de la gestión para poder evaluar correctamente los efectos que tiene la pesca a escala de los ecosistemas (Olsson y cols., 2008; Osterblom y cols., 2010). Y lo que resulta aún más crucial: las organizaciones que recogen esta información no facilitan gran parte de ella a investigadores externos. Así pues, las estructuras de las organizaciones e intereses privados hacen imposible sintetizar los efectos que los grupos de organismos y niveles tróficos tienen en los ecosistemas. No obstante, cada vez más pruebas científicas circunstanciales indican que la sobreexplotación de las poblaciones de peces comerciales puede permitir la proliferación de algas cuando las condiciones medioambientales son favorables, al eliminar una limitación de la cadena alimenticia a la acumulación de la biomasa de algas. En la presente nota informativa se presentan brevemente algunos antecedentes sobre la ecología de la proliferación de algas que son necesarios para comprender la amenaza que representan y la forma en que funcionan, y a continuación se exponen casos de estudio relevantes y los últimos estudios sobre la relación entre la proliferación de algas y la pesca. En el capítulo 2 se presentan los efectos negativos de las proliferaciones de algas para la sociedad, y en particular algunos pormenores sobre las consecuencias que tienen estas proliferaciones en la pesca. En el capítulo 3 se expone la ecología de las proliferaciones de algas, se describen sus tendencias, se explica la lógica de la conexión entre estas y la pesca, y se describen los factores ecológicos que pueden favorecer dicha relación. En el capítulo 4 se detallan los posibles efectos sinérgicos de la sobreexplotación pesquera, el vertido excesivo de nutrientes y las proliferaciones de algas en Europa, y se presentan pruebas de casos concretos que demuestran que la sobreexplotación pesquera puede provocar estas proliferaciones. 17 Departamento Temático de Políticas Estructurales y de Cohesión 18 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 2. TIPOS Y EFECTOS DE LAS PROLIFERACIONES DE ALGAS 2.1. ¿Qué son las proliferaciones de algas? Las proliferaciones de algas consisten en numerosos tipos de algas que solo están lejanamente emparentados entre ellos. Su forma de vida puede ser solitaria y unicelular, pueden construir colonias o ser filamentosas, y pueden ser planctónicas o bentónicas. Entre los grupos comunes de algas que forman proliferaciones se encuentran los dinoflagelados, otros flagelados, las diatomeas, las cianobacterias y las algas filamentosas verdes, marrones o rojas (Graneli y Turner, 2006). Debido a su amplia composición taxonómica resulta difícil definir exactamente qué es una proliferación de algas. Así pues, la definición debe depender del contexto. Por consiguiente, los niveles de alerta de las proliferaciones tóxicas de los programas se seguimiento pueden variar entre 100 y 300 células por litro de dinoflagelados, y de 150 000 a 200 000 células por litro de diatomeas y cianobacterias (Organización Mundial de la Salud, 2002; Hinder y cols., 2011). En la presente nota, las proliferaciones de algas se definen como grandes acumulaciones de algas (incluidas cianobacterias) que tienen efectos perjudiciales en el ecosistema circundante. 2.2. Efectos ecológicos de las proliferaciones de algas Debido a su amplia composición taxonómica, las proliferaciones de algas también tienen efectos nocivos sumamente diversos. Sin embargo, podemos clasificar sus efectos negativos en dos principales tipos: efectos relacionados con la alta densidad en sí y efectos químicos de producción de toxinas (figura 2) (Smayda, 1997; Nastasi, 2010). Figura 2: Grupos de organismos que generan proliferaciones de algas nocivas y tipología de las mismas Producing high biomass/ Producing toxins/ ”green tides” ”red tides” diatoms mechanical disturbance shading anoxia filamen‐ tous algae shellfish poisioning Harmful algal blooms dino‐ flagellates clogging the water & overgrowth mucus & foam formation cyano‐ bacteria flagellates Fuente: Granielli y cols. (1996) 19 direct lethal toxicity ambush predation Departamento Temático de Políticas Estructurales y de Cohesión Las proliferaciones de alta densidad que tiñen el agua y causan daños por su mera abundancia están formadas por numerosos tipos de algas proliferantes, pero son características de las cianobacterias, algunos flagelados (Phaeocystis, Crysocromulina), diatomeas y algas filamentosas (mareas verdes). Una elevada biomasa de algas puede ser perjudicial para el ecosistema de diversas maneras. Los daños mecánicos causados por la irritación de partículas pueden provocar efectos en las branquias de peces y crustáceos, y la perforación de las branquias que provocan las diatomeas pueden causar incluso insuficiencia respiratoria (Smayda, 1997). La producción de polímeros extracelulares puede dar lugar a daños físicos en otros organismos, por ejemplo, al atascar las branquias y producir una mucosidad excesiva que retiene el agua y se acumula junto con la espuma en las playas (Smayda, 2006). La descomposición de grandes cantidades de materia orgánica acumulada tras la proliferación puede consumir todo el oxígeno disponible, generando así anoxia local, que es letal para los organismos que viven en el fondo del mar y ahuyenta o mata la fauna móvil, como peces y crustáceos (Hallegraeff, 1993; Vahteri y cols., 2000; Cloern, 2001; Breitburg, 2002). Los productores de toxinas son un grupo de 60 a 80 especies de algas (unicelulares), de las cuales tres cuartas partes son dinoflagelados (Smayda, 1997; Van Dolah, 2000; Hinder y cols., 2011). Las toxinas de las algas son muy potentes y responsables de una gran mortalidad entre peces y moluscos. Estas toxinas pueden acumularse en la cadena alimenticia y, por consiguiente, tener graves repercusiones en la salud humana, en particular a través de la intoxicación con moluscos. En el caso de estos productores de toxinas bastan bajas densidades de células para alcanzar niveles de toxicidad peligrosos, por lo que las proliferaciones perjudiciales tóxicas a menudo no pueden observarse a simple vista. Por el contrario, las cianobacterias y otros flagelados (por ejemplo, Chrysocromulina, Prymnesium) suelen formar proliferaciones visibles y también producen toxinas que tienen importantes efectos negativos directos en el ganado y los seres humanos (Organización Mundial de la Salud, 2002; Edvardsen e Imai, 2006; Peaerl y Fulton III, 2006). 2.3. Grupos de algas nocivas Existen cinco categorías principales de algas proliferantes reconocidas en los programas de seguimiento o en la bibliografía científica sobre proliferaciones de algas. En el capítulo siguiente se presenta un breve resumen. Para obtener información más detallada y completa, véanse los estudios sobre algas de Smayda (2006) y Graneli y Turner (2006). 2.3.1. Dinoflagelados Los dinoflagelados son organismos unicelulares formados por una célula flagelada que tiene una movilidad limitada pero importante (Burkholder y cols., 2006). Son responsables de cuatro de los cinco grupos más comunes de toxinas de los alimentos marinos: toxina paralizante de molusco (PSP), toxina neurotóxica de molusco (NPS), toxinas de ciguatera (CFP) y toxinas diarreicas de molusco (DSP) (Smayda, 1997; Van Dolah, 2000). En Europa, las proliferaciones de dinoflagelados nocivos que provocan intoxicación de alimentos marinos se registran principalmente en las costas atlánticas. En ocasiones, los dinoflagelados están relacionados con daños provocados por proliferaciones de alta densidad, como la proliferación anóxica de Ceratium tripos, que tuvo lugar en Nueva York y mató peces en una superficie superior a un millón de hectáreas, y con episodios de formación de mucosidad, junto con otras algas, en el Mediterráneo y el mar de Mármara (en particular Gonyaulax fragilis) (Tufekci y cols., 2010). La especie Karenia mikimotoi es otro dinoflagelado muy común que se considera una importante amenaza para la acuicultura. Entre los daños registrados se encuentra una mortalidad a gran escala de 20 ¿Favorece la sobreexplotación pesquera la proliferación de algas? moluscos a lo largo de la costa francesa, y de crustáceos y salmón de acuicultura en Noruega (Smayda, 2006). En el Mediterráneo se registran periódicamente problemas con proliferaciones de alta densidad de especies de Ostreopsis. 2.3.2. Otros flagelados Los flagelados proliferantes, distintos de los dinoflagelados, que tienen importantes efectos negativos en los seres humanos incluyen las clases de Prymnesiophyceae y Raphidophyceae (Edvardsen e Imai, 2006). Prymnesiophytes es una clase de flagelados con una distribución cosmopolita que en ocasiones forma proliferaciones nocivas; en Europa, estas se registran principalmente en el mar del Norte. La especie Prymnesium parvus puede alcanzar densidades de hasta 800 millones de células por litro (Smayda, 2006). Provoca periódicamente mortalidad de peces a lo largo de la costa británica, pero también se presenta en altas densidades hasta la costa meridional del mar Báltico. La especie Chrysochromulina polylepis es una alga primnesiofita tóxica asociada con la mortalidad de peces. En 1988, una proliferación de C. polylepis en las costas atlánticas de Suecia y Noruega tuvo importantes efectos perjudiciales tanto en organismos silvestres como en la acuicultura en una superficie superior a 75 000 km2 (Maestrini y Graneli, 1991; Granéli y cols., 1996; Dahl y cols., 2005). Las especies Phaeocystis son algas primnesiofitas que forman repetidamente proliferaciones en el Atlántico del Norte y producen grandes cantidades de material mucilaginoso que adopta la forma de matorrales de espuma sobre la superficie del agua y las playas (Lancelot y cols., 1998; Smayda, 2006). En 2001, un episodio de anoxia mató diez millones de kilos de mejillones tras una proliferación de Phaeocystis en Oosterschelde, un estuario situado en la costa atlántica de los Países Bajos (Peperzak y Poelman, 2008). Las rafidofitas incluyen tres taxones que provocan gran mortandad entre los peces, a saber, las especies Chattonella, Heterosigma akashiwo y Fibrocapsa japonica. Se han registrado episodios de mortandad de peces relacionadas con proliferaciones de rafidofitas en el Adriático y a lo largo de las costas francesas, neerlandesas y británicas (de Boer, 2006). Varios episodios de mortandad de peces a gran escala se relacionaron en un principio con la especie Chattonella verruculosa, pero posteriormente se descubrió que se debían al silicoflagelado Pseudochattonella verruculosa. El primer episodio de mortandad de peces provocado por esta especie se observó en los meses de abril y mayo de 1998 en el Skagerrak, en el mar del Norte. Desde entonces se ha considerado que las especies Pseudochattonella han sido responsables de varios episodios de mortandad de peces en esta zona. 2.3.3. Diatomeas Las proliferaciones de diatomeas generalmente no son tóxicas, pero a menudo se señalan efectos perjudiciales en los peces de acuicultura en Europea provocados por proliferaciones de alta densidad de unas 14 especies de diatomeas (Smayda, 2006). Las diatomeas tienen frústulos de silicio —un esqueleto exterior de silicio duro— y a menudo presentan espinas que pueden provocar daños mecánicos en las branquias durante las proliferaciones (Smayda, 1997). Asimismo se registran a menudo efectos anóxicos y formación de mucosidad tras las proliferaciones (Smayda, 2006). Por otra parte, las diatomeas (multiserie Pseudo-nitzschia) producen la toxina amnésica de molusco (ASP). Se registran periódicamente proliferaciones de la multiserie Pseudo-nitzschia a lo largo de la costa del mar del Norte, que provocan el cierre temporal de la captura de vieira y mejillón (Smayda, 2006). 21 Departamento Temático de Políticas Estructurales y de Cohesión 2.3.4. Cianobacterias Las cianobacterias se denominan a menudo algas verdiazules, pero en realidad son bacterias fotosintetizantes que pueden formar colonias. Las proliferaciones de cianobacterias son muy comunes en los hábitats de aguas salobres y en los mares intracontinentales como el mar Báltico, el mar de Mármara y los estuarios (Peaerl y Fulton III, 2006). Generalmente forman proliferaciones de alta densidad de más de 200 000 individuos por litro, pero también producen toxinas. Existen tres grupos comunes de cianotoxinas: las hepatotoxinas, que producen lesiones en el hígado; las neurotoxinas, que actúan en el sistema nervioso; y las dermatoxinas, que provocan reacciones irritantes y alérgicas en contacto con la piel (Organización Mundial de la Salud, 2002). 2.3.5. Algas filamentosas Las algas filamentosas son responsables de las mareas verdes que se producen cerca de la costa y son una mezcla de algas filamentosas verdes, rojas y marrones, que incluyen especies como Cladophora, Ectocarpus, Pilayella, Ulothrix, Ulva y Urospora, pero también colonias de diatomeas, como la especie Melosira (Eriksson y cols., 2009; Eriksson y cols., 2011). No son tóxicas, pero provocan un crecimiento excesivo y crean grandes capas de algas que van a la deriva y que compiten con los macrofitos bentónicos, provocando anoxia localizada de las entradas de agua. Las proliferaciones de algas filamentosas también atascan los aparejos de pesca, embarcaciones e instalaciones de playa y representan una amenaza para el turismo local. En Europa, los episodios nocivos de capas de algas a la deriva y proliferaciones de algas filamentosas se registran especialmente en el mar Báltico, el Kattegat y el Skagerrak (Bonsdorff y cols., 1997; Pihl y cols., 1999; Vahteri y cols., 2000; Baden y cols., 2003; Eriksson y cols., 2009; Eriksson y cols., 2011), pero también en relación con el depósito de algas a lo largo de la costa atlántica (Organización Mundial de la Salud, 2002). 2.4. Problemas y costes para la sociedad en general Se ha demostrado que las proliferaciones de algas tienen una serie de efectos negativos en la sociedad e importantes repercusiones económicas en las comunidades costeras (Hoagland y cols., 2002; Organización Mundial de la Salud, 2002; ECOHARM, 2003; Hoagland y Scatasta, 2006). Las proliferaciones de algas tóxicas afectan a la salud humana a través del contacto, la ingestión y la dispersión atmosférica (Organización Mundial de la Salud, 2002), lo que tiene consecuencias económicas negativas para el turismo y la industria de los alimentos marinos (Hoagland y cols., 2002; ECOHARM, 2003; Hoagland y Scatasta, 2006). Las grandes biomasas de algas provocan anoxia al descomponerse, lo que tiene importantes efectos negativos en las poblaciones de peces y moluscos (Hallegraeff, 1993; Breitburg, 2002). En los peces, las fases juveniles, como las larvas y los huevos, se pueden ver gravemente afectados por la anoxia, debido a su limitada movilidad (Breitburg, 2002). Las proliferaciones con grandes biomasas de algas también afectan a los aparejos de pesca al hacer que aumente el peso de las redes y al dañarlas por atascamiento, lo que incluye crecimiento excesivo y la formación de mucosidad (Organización Mundial de la Salud, 2002). Las grandes biomasas de algas también hacen que las aguas costeras y playas pierdan atractivo para los seres humanos, tanto por el atasco visible del agua como por los malos olores que producen las grandes cantidades de materia orgánica al descomponerse (Organización Mundial de la Salud, 2002). El programa ECOHARM (2003), patrocinado por la Comisión Europea, analizó las pérdidas socioeconómicas derivadas de la proliferación de algas nocivas en Europa. El programa ECOHARM divide las proliferaciones de algas nocivas en proliferaciones tóxicas para los 22 ¿Favorece la sobreexplotación pesquera la proliferación de algas? alimentos marinos (ST), proliferaciones que provocan mortandad de peces (FIK), proliferaciones tóxicas de gran biomasa (HBT) y proliferaciones no tóxicas de gran biomasa (HBNT). Los resultados muestran que las toxinas de alimentos marinos son el efecto negativo más frecuente de las HAB en Europa, seguido de las proliferaciones no tóxicas de gran biomasa. El programa ECOHARM ha calculado que las pérdidas económicas medias anuales provocadas por las HAB en Europa se elevan a 813 millones de dólares estadounidenses (dólares de 2005), que se desglosan en efectos en la salud pública (11 millones de dólares), en la pesca comercial (147 millones), en la recreación y el turismo (637 millones) y el coste del seguimiento y evaluación de las proliferaciones tóxicas (18 millones) (véase igualmente Hoagland y Scatasta, 2006). Los efectos se distribuyen de forma desigual en Europa, por lo que el programa ECOHARM dividió los países europeos en países de HBNT y países de ST, en función del tipo de proliferación más frecuente. Los países de HBNT fueron: Estonia, Finlandia, Francia, Alemania, Letonia, los Países Bajos, Polonia y Suecia, lo que indica que los problemas derivados de las proliferaciones no tóxicas de gran biomasa se presentan principalmente en los países ribereños del mar Báltico, incluido el mar de Frisia y los estuarios de la costa neerlandesa. En Francia, el problema de las HBNT se asocia sobre todo a las acumulaciones de algas filamentosas en las playas, pero también se registra un gran número de incidentes con toxinas de alimentos marinos (el quinto porcentaje más alto de Europa). Los países de ST fueron: Dinamarca, Irlanda, Italia, Noruega, Portugal, España y el Reino Unido. Junto con Francia, esto indica que la intoxicación por alimentos marinos es un problema predominantemente en el Atlántico y el Mediterráneo. Cabe señalar que no se evaluaron el mar Negro ni el mar de Mármara. 2.5. Efectos concretos en la pesca europea El coste total de las proliferaciones de algas nocivas en la pesca europea incluye los efectos negativos directos en la pesca comercial, las pérdidas para el sistema de protección social y el coste del seguimiento de las proliferaciones de algas para evitar la intoxicación de alimentos marinos. Según el programa ECOHARM (2003), el coste anual total estimado para la pesca europea se cifra en 177 millones de euros. Resulta difícil destacar algunas especies nocivas proliferantes, cuyo coste sea mayor o menor para la pesca, ya que los costes se reparten entre los episodios nocivos que generan todos los grupos de algas mencionados anteriormente. Sin embargo, podemos dividir los ejemplos específicos en los que tenemos una buena documentación científica en tipos de efectos para describir una situación general, siempre que tengamos en cuenta que existen otras amenazas y numerosas excepciones de carácter local. 2.5.1. Proliferaciones tóxicas para los alimentos marinos Las proliferaciones de algas son una de las tres principales causas de pérdidas en la acuicultura, junto con los daños causados por las enfermedades y las condiciones meteorológicas (Rutter, 2010), y un 99 % de las proliferaciones tóxicas para las alimentos marinos registradas en Europa se refieren a moluscos (ECOHARM, 2003). Las pérdidas directas de ingresos para el sector de la acuicultura del mejillón oscilan entre 15 y 62 millones de euros anuales en Europa, sin contar el coste del seguimiento y la protección social. Las proliferaciones toxicas para los alimentos marinos son un problema sobre todo a lo largo de las costas atlánticas y mediterráneas de Europa, y como es lógico se concentran en los países que tienen un sector de acuicultura importante (ECOHARM, 2003). Los principales motivos de preocupación son las proliferaciones de dinoflagelados que pueden provocar intoxicación de alimentos marinos y mortandad de poblaciones silvestres y de acuicultura, como las especies Dinophysis, Alexandrium y Karenia mikimotoi (Smayda, 2006). Otro importante motivo de preocupación son las diatomeas de la multiserie Pseudo23 Departamento Temático de Políticas Estructurales y de Cohesión nitzschia que producen toxinas y proliferan regularmente a lo largo de la costa del mar del Norte de Europa (Smayda, 2006). Todas estas especies provocan periódicamente cierres temporales de la captura de moluscos a lo largo de las costas europeas. Asimismo, cada vez se tiene mayor conciencia de la amenaza que representan las rafidofitas Heterosigma akashiwo y Fibrocapsa japonica para las poblaciones de alimentos marinos (de Boer, 2006). 2.5.2. Proliferaciones de gran biomasa Los principales problemas provocados por las proliferaciones de gran biomasa parecen concentrarse en los mares intracontinentales y cerrados, y los estuarios (ECOHARM, 2003). Al parecer, una excepción significativa son las acumulaciones de Pheocystis y algas filamentosas en las playas de las costas del mar del Norte de Francia, Bélgica y los Países Bajos (Organización Mundial de la Salud, 2002). Las proliferaciones de gran biomasa pueden tener efectos diferentes en la pesca, como trastornos mecánicos, muerte por inanición y sofocación (véase más arriba, Smayda, 1997; Van Dolah, 2000). Sin embargo, los estudios de casos europeos muestran que el atasco provocado por capas de algas o mucosidad en el agua y la anoxia posterior a la proliferación son los efectos negativos registrados con mayor frecuencia que tiene importantes consecuencias económicas para el sector pesquero. Capas de algas a la deriva Los efectos negativos documentados de las capas de algas a la deriva en la pesca se registran sobre todo en la zona del mar Báltico. Por ejemplo, en 2005, un 65 % de los pescadores profesionales de Finlandia que utilizaban aparejos estacionarios (trampas y redes de enmalle) y un 35 % de los pescadores que utilizaban redes de arrastre señalaron que habían sufrido daños económicos causados por capas de cianobacterias (Viitasalo y cols., 2005). Durante las proliferaciones, estos pescadores dedicaron un tiempo considerable a limpiar su equipo y expusieron que sus capturas habían disminuido debido a que los peces evitan los aparejos atascados con algas. Las capas de algas filamentosas a la deriva también pueden reducir a gran escala la calidad de los hábitats de reproducción que utilizan las bahías poco profundas y la vegetación como zona de cría (Pihl y cols., 2006; Ljunggren y cols., 2010). La calidad de los hábitats ejerce una gran influencia en la reproducción de los peces (Alheit y Niquen, 2004; Leggett y Frank, 2008). En el Kattegat y el Skagerrak, la fuerte disminución de los lechos de hierba marina (Zostera marina) como consecuencia del aumento de la masa de algas filamentosas ha empobrecido importantes hábitats de reproducción para las poblaciones de bacalao de alta mar y de costa (Gadus morhua) (Pihl y cols., 1999; Baden y cols., 2003; Pihl y cols., 2006). En el mar Báltico, la invasión de las bahías poco profundas con grandes capas de algas filamentosas a la deriva interfiere a nivel local con la reproducción de la perca (Perca fluviatilis), que es el depredador predominante en la costa y pone sus huevos en la vegetación de aguas poco profundas (Ljunggren y cols., 2010). Proliferaciones que forman mucílago Los efectos negativos del mucílago en los aparejos de pesca se registran sobre todo en el mar Adriático y el mar de Mármara (Zengin y cols., 2009; Turk y cols., 2010; Zengın y cols., 2011). En el Mediterráneo y el mar de Mármara, las proliferaciones de algas que forman una masa gelatinosa y cremosa en el agua contienen una rica comunidad de especies diferentes, que incluye cianobacterias, diatomeas y dinoflagelados (Tufekci y cols., 2010; Turk y cols., 2010). En particular, las diatomeas Skeletonema costatum y Cylindrotheca closterium, y el dinoflagelado Gonyaulax fragilis son especies muy comunes 24 ¿Favorece la sobreexplotación pesquera la proliferación de algas? que producen mucosidad (Tufekci y cols., 2010). Durante años se han registrado episodios de mucosidad en el mar Adriático, pero estos se han incrementado en las últimas décadas (Turk y cols., 2010). En el mar de Mármara, los desembarques disminuyeron casi un 50 % respecto a 2006 durante las graves proliferaciones de mucílago de 2007 y 2008, pues pasaron de 75 000 toneladas a 44 450 y 38 400, respectivamente (Zengin y cols., 2009; Zengın y cols., 2011). Los aparejos de pesca aumentaron excesivamente de peso debido a la masa gelatinosa de algas mezclada con medusas, lo que hizo que las redes se rompieran e impidió subirlas a bordo. Este fenómeno afectó a todos los tipos de pesca del mar de Mármara y se estima que redujo un 91 % los beneficios anuales (Zengin y cols., 2009; Zengın y cols., 2011). Anoxia posterior a las proliferaciones La anoxia afecta principalmente los mares intracontinentales cerrados y los estuarios. La disminución de la cantidad de oxígeno que provoca la degradación de las grandes biomasas de algas puede desarrollarse con más facilidad cuando el agua presenta una estratificación de la densidad durante el verano, que limita la renovación del agua de fondo (Cloern, 2001; Breitburg, 2002). La anoxia constituye una importante amenaza para todos los tipos de acuicultura y para las comunidades bentónicas de invertebrados. Por ejemplo, un episodio de anoxia ocurrido en 2001 tras una proliferación de Pheocystis mató diez millones de kg de mejillones de acuicultura (Mytilus edulis) en Oosterscheelde, un estuario situado en la costa atlántica de los Países Bajos, provocando una perdida estimada entre 15y 20 millones de euros (Peperzak y Poelman, 2008). La anoxia también es una amenaza para las poblaciones de peces silvestres. Generalmente, las aguas superficiales sirven de refugio a los peces adultos durante los episodios de anoxia en las aguas de fondo (Breitburg, 2002). Sin embargo, el agotamiento del oxígeno se extiende en ocasiones a aguas poco profundas cercanas. En 1997, la anoxia relacionada con una proliferación de dinoflagelados (Prorocentrum minimum) se extendió rápidamente a toda la columna de agua en una superficie de 25 km en el fiordo Mariager en el norte de Dinamarca, lo que dio lugar a una gran mortandad de peces e invertebrados (Fallesen y cols., 2000). La anoxia puede ser una amenaza a gran escala para la reproducción de las poblaciones de peces silvestres. Las capas de algas a la deriva pueden provocar anoxia a nivel local en bahías poco profundas y matar los huevos y larvas de peces costeros (Pihl y cols., 1996; Ljunggren y cols., 2010). Asimismo, los huevos de especies pelágicas se hunden en las capas anóxicas del fondo (Breitburg, 2002). En particular, debido a la estratificación del mar Báltico, la supervivencia de los huevos de bacalao depende de la presencia de agua con una salinidad suficientemente alta para generar flotabilidad (de modo que los huevos no se vayan al fondo) y un contenido suficiente de oxígeno. Esta condición se denomina volumen reproductivo del agua disponible (Österblom y cols., 2007). Durante los pronunciados descensos de la población de bacalao que se registraron a finales de los años ochenta, la salinidad era muy baja en las aguas de fondo y se observó que un 95 % de los huevos de bacalao se encontraban a niveles de oxígeno inferiores a los necesarios para su supervivencia (Breitburg, 2002; Österblom y cols., 2007). La salinidad y el contenido de oxígeno del agua en el mar Báltico dependen de la entrada de agua rica en oxígeno con una elevada salinidad procedente del Atlántico, pero la descomposición de plancton a gran escala favoreció el aumento del volumen de las aguas anóxicas de fondo (HELCOM, 2009). De este modo, las proliferaciones de algas podrían contribuir directamente al descenso de la reproducción del bacalao, pero este aspecto no se ha investigado suficientemente. 25 Departamento Temático de Políticas Estructurales y de Cohesión 26 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 3. ECOLOGÍA DE LAS PROLIFERACIONES DE ALGAS 3.1. Un proceso eutrofización natural cuya frecuencia aumenta con la Las proliferaciones de algas son fenómenos naturales en la mayoría de los sistemas marinos que presentan ciclos anuales de acumulación de distintas especies en primavera y verano. Generalmente son controladas por los recursos abióticos de luz y nutrientes y las condiciones medioambientales de temperatura y turbulencia. Cuando existen recursos disponibles y las temperaturas son suficientemente altas para promover un crecimiento rápido, pueden producirse proliferaciones de algas. Las proliferaciones de alta densidad requieren normalmente unas condiciones meteorológicas tranquilas, pues las turbulencias que provoca el viento impiden la acumulación de algas en el agua. En los últimos treinta años, el aumento de los recursos disponibles debido a la eutrofización a escala mundial ha contribuido de forma considerable al incremento de la frecuencia de las proliferaciones de algas y sus efectos en todo el mundo (Hallegraeff, 1993; Van Dolah, 2000; Cloern, 2001; Sellner y cols., 2003; Heisler y cols., 2008). La documentación de las tendencias de las proliferaciones de algas presenta dos problemas de carácter general. En primer lugar, los datos que podemos utilizar para documentar estas tendencias presentan graves limitaciones. El seguimiento de las proliferaciones de algas resulta difícil y solamente se lleva a cabo desde las últimas décadas. En segundo lugar, las proliferaciones son episodios extremos y, por consiguiente, de una tremenda variabilidad. El escaso seguimiento y el hecho de que solo se realice desde hace poco implican que a menudo no podamos separar la variabilidad natural de las tendencias temporales. No obstante, las pruebas tanto directas como circunstanciales en Europa indican que han aumentado los problemas provocados por las proliferaciones de algas nocivas. Figura 3: Aumento del punto máximo estival de la biomasa de algas a lo largo del tiempo en el mar Negro. Las barras muestran el valor máximo en perfiles chl a, lo que indica la intensidad máxima de la proliferación de algas. Cabe señalar que, en 1995 y 1996, la frecuencia de muestreo fue muy baja, y no se realizaron muestreos en junio y julio., por lo que es probable que las proliferaciones se hayan subestimado en esos años. Cabe señalar igualmente que si faltan barras, ello se debe a que no existen datos de esos años. Chl a (mg per m3) 3 Chl A maximum 2 1 0 1960 1965 1970 1975 1980 1985 Fuente: Extraído de Yunev y cols. (2005) 27 1990 1995 Departamento Temático de Políticas Estructurales y de Cohesión En el mar Negro, la abundancia de algas proliferantes aumentó junto con el inicio de la eutrofización moderna (Zaitsev, 1992). La biomasa medida de fitoplancton se duplicó en los años ochenta, y la frecuencia e intensidad de las proliferaciones de fitoplancton han aumentado muy considerablemente desde los años setenta (Zaitsev, 1992; Kideys, 1994; Daskalov, 2002; Yunev y cols., 2002; Yunev y cols., 2005) (figura 3). La contribución relativa de los dinoflagelados ha aumentado del 10 % en los años sesenta y setenta al 30 % en los ochenta, lo que ha hecho que aumenten considerablemente las mareas rojas y la abundancia de algunas especies nocivas de dinoflagelados (en particular las especies Prorocentrum cordatum y Noctiluca miliaris) (Kideys, 1994). Cuadro 1: Incidentes de proliferación de algas registrados en el Mediterráneo y el mar Negro. Año Finales sesenta de Especies de algas responsables de la proliferación los Años setenta Norte del Adriático: Prorocentrum Norte del Adriático: Noctiluca, Gonyaulax, Prorocentrum, Gyrodinium, Glenodinium Norte del Adriático: Katodinium, Noctiluca, Glenodinium, Prorocentrum, Gyrodinium, Gonyaulax, Scrippsiella, Massarthia Años ochenta España, 1984: Gonyaulax Mar Negro, 1986: Prorocentrum Mediterráneo, 1989: Gymnodinium Mar Negro: Pseudo-nitzschia, Nitzschia, Cheatoceros, Ditylum, Cylindrotheca, Rhizosolenia, Heterocapsa, Protoperidinium, Scripsiella, Emiliania, Gonyaulax, Prorocentrum Años noventa Mar Negro, 1993: Dinoflagellates Túnez, 1994: Karenia España, 1994 y 1996-1999: Alexandrium Grecia, 1994 y 1997: Prorocentrum, Noctiluca, Erythropsidinium Francia, 1998: Alexandrium Grecia, 1998: Chattonella Francia, 1999: Prorocentrum Mar Tirreno, 1998, 2000-2001: Ostreopsis Mar Negro: Skeletonema, Cerataulina, Prorocentrum, Gymnodinium Década del 2000 España, 2003: Alexandrium, Gymnodinium Grecia, 2000-2004: Prorocentrum, Noctiluca, Alexandrium, Dinophysis, Pseudo-nitzschia Mar de Liguria, 2005-2006: Ostreopsis Túnez, 2006: Coolia Norte del Adriático, 2007: Ostreopsis Italia, 2010: Ostreopsis Apulia 2010 Sicilia 2010 Fuente: Nastasi (2010) 28 Gymnodinium, ¿Favorece la sobreexplotación pesquera la proliferación de algas? En el mar Mediterráneo, tanto en el noroeste (Cataluña) como en el noreste (mar Adriático) se ha detectado en las últimas décadas una alta frecuencia de proliferaciones de algas potencialmente nocivas (Degobbis 1989, Vila y cols. 2001a, Vila y cols. 2001b). En el mar Adriático, la producción primaria se duplicó entre los años sesenta y los ochenta, y una serie de episodios de mucosidad a gran escala, relacionados con proliferaciones de diatomeas (Skeletonema costatum), provocaron problemas económicos para las comunidades costeras (Solic y cols., 1997; Thornton y cols., 1999; Cloern, 2001). Desde los años ochenta se han registrado proliferaciones masivas de los dinoflagelados Ostreopsis, Prorocentrum, Noctiluca, Gymnodinium, Alexandrium, Dinophysis y Gonyaulax, así como de las diatomeas Pseudo-nitzschia y Skeletonema tanto en el Mediterráneo como en el mar Negro (cuadro 1; Nastasi, 2010). En el Atlántico, los episodios registrados de proliferaciones de algas potencialmente tóxicas y de intoxicación de moluscos aumentaron en los años ochenta y noventa a lo largo de toda la costa europea (por ejemplo, de rafidofitas, véase de Boer, 2006). Por otra parte, las proliferaciones de mucílago que se acumulan en forma de espuma en las playas representan un problema en las costas de Francia, Bélgica, los Países Bajos y Alemania (Riegman y cols., 1992; Organización Mundial de la Salud, 2002). Se señala que la frecuencia de estas proliferaciones de Phaeocystis, han aumentado en las costas meridionales del mar del Norte (Lancelot y cols., 1987; Passow y Wassmann, 1994; Riebesell y cols., 1995). En el mar de Frisia neerlandés existen indicios de que la producción primaria y la población permanente de algas bentónicas se duplicaron entre los años sesenta y los ochenta (Cloern, 2001; Eriksson y cols., 2011), y de que la duración de la proliferaciones de Phaeocystis ha aumentado de forma muy marcada (figura 4) (Cloern, 2001). En el Kattegat, en el linde entre el mar del Norte y el Báltico, la producción primaria se duplicó en los años ochenta respecto a los cincuenta (Richardson y Heilmann, 1995). Al mismo tiempo, la transparencia del agua y las concentraciones de oxígeno en el agua de fondo disminuyeron considerablemente, lo que indica la existencia de una mayor cantidad de plancton en el agua que absorbe la luz y consume el oxígeno al descomponerse (HELCOM, 2009). Se señala que, al norte del Kattegat, en el Skagerrak, las comunidades locales de hierbas marinas han disminuido un 60 % debido a la masiva proliferación de algas filamentosas (Pihl y cols., 1999; Baden y cols., 2003). Duración de la temporada de proliferación de algas en el mar de Frisia. 350 300 Duration of the bloom season in days 250 Days Figura 4: 200 150 100 50 0 1970 1975 1980 Fuente: Extraído de Cloern (2001) 29 1985 1990 Departamento Temático de Políticas Estructurales y de Cohesión Figura 5: Extensión del punto máximo de proliferación de cianobacterias en el mar Báltico entre 1997 y 2009. 14000 12000 Areal extent of algal blooms km2 10000 8000 6000 4000 2000 0 1997 1999 2002 2004 2006 2008 Fuente: Hansson y Öberg (2009) - SMHI En el mar Báltico, las concentraciones tanto de nitrógeno como de fósforo en el agua aumentaron considerablemente entre los años sesenta y los ochenta, y la transparencia del agua ha disminuido en toda las subregiones en los últimos cien años (HELCOM, 2009). Las proliferaciones de cianobacterias son parte natural del sistema del Báltico, pero antes de los años cuarenta se registraban muy pocos problemas relacionados con ellas (Finni y cols., 2001). Este hecho viene confirmado por los depósitos de sedimentos que muestran que las proliferaciones de cianobacterias aumentaron de forma considerable en la segunda mitad del siglo XX (Poutanen y Nikkila, 2001). El seguimiento por satélite muestra un gran desarrollo de las proliferaciones de cianobacterias durante los años noventa y la década posterior (figura 5) (Kahru y cols., 1994; Hansson, 2005), y los taxones Nodularia y Aphanizomenon, que producen toxinas, formaron las mayores aglomeraciones de la primera década de este siglo (HELCOM, 2009). Las concentraciones de oxígeno en el fondo del mar disminuyeron drásticamente en general entre los años sesenta y los ochenta en el mar Báltico, y se han mantenido bajas durante los años noventa y la primera década del siglo, de modo que la anoxia de larga duración afecta a zonas extensas (HELCOM, 2009). Por otra parte, en la mayoría de las zonas costeras del mar Báltico se registran problemas con capas de algas filamentosas provocadas por la eutrofización (Bonsdorff y cols., 1997; Bonsdorff y cols., 2002). 3.2. Los nutrientes y los herbívoros controlan conjuntamente el desarrollo de la proliferación de algas No cabe duda de que el enriquecimiento con nutrientes ha aumentado el problema de las proliferaciones de algas en Europa (véase el apartado 2.1). Sin embargo, en las últimas décadas se ha llegado a un consenso entre los científicos sobre la base de un gran número de experimentos que muestran que las consecuencias del enriquecimiento con nutrientes de los sistemas marinos depende igualmente de la presión que ejercen el zooplancton y los herbívoros invertebrados (Worm y cols., 2002). Este consenso ha propiciado la idea de que los herbívoros pueden actuar como factor de control, que limita o evita los efectos negativos de la eutrofización al consumir la producción excedentaria de biomasa de algas (Worm y Lote ,2006; Eriksson y cols., 2007). Los herbívoros tienen efectos importantes en la acumulación de biomasa de algas, pero estos efectos dependen del contexto y varían con el lugar y el tiempo. Algunas síntesis ecológicas, que calculan los efectos medios de numerosos experimentos diferentes en 30 ¿Favorece la sobreexplotación pesquera la proliferación de algas? distintas zonas, muestran que la eliminación de los herbívoros o la adición de nutrientes aumentan considerablemente la biomasa de algas en todos los tipos de sistemas marinos, muy a menudo a más del doble (Worm y cols., 2002; Gruñir y cols., 2008). En una síntesis de Gruñir y cols. (2008), la eliminación de herbívoros aumentó el efecto relativo de los nutrientes en costas rocosas (efecto de interacción significativo). Esto significa, por ejemplo, que los nutrientes pueden aumentar la biomasa de algas un 40 % en presencia de herbívoros, pero la aumentan un 80 % en ausencia de los mismos. En fondos blandos, los nutrientes duplicaron de media la biomasa con o sin herbívoros, pero aún así estos redujeron la biomasa total a la mitad. Worm y Lote (2006) realizaron un experimento coordinado con nutrientes y herbívoros en bahías eutrofizadas del mar Báltico y Nueva Escocia y descubrieron que los segundos redujeron la biomasa de algas filamentosas proliferantes en casi un 80 % en todas las zonas estudiadas, pero que los nutrientes tenían un efecto positivo en la acumulación de biomasa a pesar de la fuerte presión ejercida por los herbívoros. Así pues, los efectos negativos de la eutrofización pueden evitarse con la presencia de herbívoros, pero en ocasiones el enriquecimiento con nutrientes supera el control ejercido por los herbívoros y la masa de algas comienza a acumularse. Aún así, los niveles naturales de herbívoros en general limitan la abundancia de algas a niveles significativamente más bajos de los que existirían sin herbívoros. A partir del cuerpo acumulado de experimentos acuáticos con manipulación de herbívoros a escala mundial podemos hacer una evaluación general de la intensidad del control que realizan los herbívoros en los ecosistemas tanto bentónicos como pelágicos. Un resumen de 650 experimentos, 507 en ecosistemas bentónicos y 143 en pelágicos, muestra que la presencia de herbívoros limita la biomasa de algas bentónicas al 50 % y la biomasa de algas pelágicas al 70 % respecto a la biomasa permanente que se acumula al eliminar los herbívoros (figura 6). Así pues, existe un firme consenso científico en que los herbívoros aumentan la resistencia de las comunidades costeras a los efectos negativos de la eutrofización. Figura 6: Efecto relativo de los herbívoros en la biomasa de algas en sistemas bentónicos y pelágicos. The relative effect of grazers on algal biomass (logaritmic scale) El eje y muestra el ratio logarítmico de respuesta de la eliminación de los herbívoros; es decir, una respuesta positiva significa que la biomasa de algas aumentó al eliminar los herbívoros. Un ratio logarítmico de respuesta de 0,69 indica que la biomasa se duplicó. En la figura, la eliminación de los herbívoros aumentó la biomasa de las algas bentónicas en un 100 % y la de las algas pelágicas en un 40 %. El estudio se basa en una síntesis de 650 experimentos procedentes de todo el mundo. 1 0.5 0 benthic Fuente: El autor 31 pelagic Departamento Temático de Políticas Estructurales y de Cohesión 3.3. La disminución de los peces depredadores de nivel superior coincide con el aumento de las algas El aumento de la producción potencial de eutrofización antropogénica va acompañado de grandes cambios a gran escala en los niveles tróficos superiores provocados por la sobreexplotación pesquera. En diversos sistemas marinos, el marcado descenso de los depredadores de nivel superior y los posteriores cambios en cascada en los niveles tróficos inferiores coinciden con un aumento abrupto de la población permanente de algas, en particular en el mar Negro, el mar Báltico, la plataforma de Nueva Escocia en el Atlántico Occidental (figura 7) (Daskalov, 2002; Frank y cols., 2005; Daskalov y cols., 2007; Casini y cols., 2008; Eriksson y cols., 2011). En todos estos sistemas, el descenso del control ejercido por los herbívoros que provoca la sobreexplotación pesquera parece contribuir a un aumento a gran escala de la biomasa de algas. La mayor acumulación de biomasa de algas debería aumentar la probabilidad de que se produzcan proliferaciones. A continuación se describe la cadena de acontecimientos a partir del Atlántico occidental y se exponen los factores que podrían contribuir a un vínculo entre los niveles tróficos superiores y la proliferación de algas, mientras que en el capítulo 4 se detallan estudios de casos específicos europeos que incluyen un análisis de la cadena alimenticia correspondiente al mar del Norte. Figura 7: El descenso de los depredadores de nivel superior provocado por la pesca coincide con un aumento abrupto de la población permanente de algas en el Atlántico del Norte, el mar Báltico y el mar Negro. Scotian shelf Black Sea Baltic Sea Increased fishing pressure overfishing overfishing overfishing decreases in large predatory fish demersal top predators (mainly cod) pelagic top predators cod increases in smaller predatory fish planktivorous fish planktivorous fish (mainly anchovy) planktivorous fish (sprat) decreases in organisms that eat algae ‐ grazers larger zooplankton larger zooplankton larger zooplankton increases in primary producing algae phytoplankton phytoplankton/ dinoflagellates phytoplankton Fuente: Frank y cols. (2005), Daskalov (2007), Casini y cols. (2008) En la plataforma de Nueva Escocia, situada en el Atlántico Noroccidental (Nueva Escocia, Canadá), el colapso de la comunidad de peces bentónicos, que había sido objeto de una intensa pesca entre 1985 y 1995, coincidió con un cambio general en la abundancia de fitoplancton, que pasó de niveles bajos en los años sesenta y setenta a niveles altos en los años noventa y la primera década de este siglo (Frank y cols., 2005). La comunidad de peces bentónicos se encontraba dominada por el bacalao (Gadus morhua), pero también 32 ¿Favorece la sobreexplotación pesquera la proliferación de algas? disminuyeron otras especies de peces demersales de mayor tamaño, como el eglefino (Melanogrammus aeglefinus), la merluza (Urophycis tenuis, Merluccius bilinearis) y el carbonero (Pollachius virens). Tras el colapso de los principales depredadores de mayor tamaño, muchas de sus especies presa aumentaron significativamente, incluida la biomasa total de peces pelágicos pequeños, cangrejos y gambas (Frank y cols., 2005). Durante esta transición a peces planctívoros de menor tamaño, se redujo igualmente la abundancia de las especies de mayor tamaño de zooplancton (Mountain y Kane, 2010; Pierik y cols., 2011). El zooplancton de mayor tamaño es la fuente de alimento preferida de los peces pelágicos de menor tamaño, y a principios de los años ochenta, la abundancia de este zooplancton era un 45 % superior a la de los años noventa, mientras que la abundancia de zooplancton de menor tamaño se mantuvo constante. Los análisis de correlación muestran que los cambios anuales en los peces bentónicos desde los años setenta se reflejaron negativamente en los peces pelágicos pequeños y el fitoplancton, y positivamente en el zooplancton de mayor tamaño, pues se observó una correlación negativa significativa entre la biomasa de los peces bentónicas y los peces pelágicos pequeños (r = –0,61, n = 33), una correlación positiva significativa entre la biomasa de los peces bentónicos y el zooplancton de mayor tamaño (r = 0,45, n = 23), y una correlación negativa significativa entre la biomasa de peces bentónicos y el fitoplancton (r = –0,72, n = 24) (Frank y cols., 2005). Estos cambios recíprocos en la abundancia de los niveles tróficos indican que el descenso de los peces demersales de mayor tamaño pudo haber promovido un aumento de la abundancia de fitoplancton al aumentar indirectamente la abundancia de las especies de zooplancton de mayor tamaño y, por ende, al disminuir la presión general de los herbívoros. Los cambios en la estructura de la red alimentaria, en los que el descenso de los depredadores de nivel superior va seguido de cambios alternos en los niveles tróficos — como un aumento de los depredadores de menor tamaño, una disminución de los herbívoro y un aumento de la biomasa de plantas o algas— se definen como «cascadas tróficas» (Pace y cols., 1999). Se han realizado muy pocos experimentos en un ecosistema a una escala pertinente que vinculen causalmente a predadores con algas de sistemas marinos. No obstante, las pruebas circunstanciales de la existencia de cascadas tróficas marinas dentro de un sistema se acumulan (Estes y cols., 1998; Jackson y cols., 2001; Daskalov, 2002; Frank y cols., 2005; Casini y cols., 2008; Eriksson y cols., 2011), y se han efectuado varios experimentos a pequeña escala que confirman la importancia que tienen los depredadores de peces para la biomasa de algas (Shurin y cols., 2002; Borer y cols., 2005; Borer y cols., 2006; Eriksson y cols., 2009; Sieben y cols., 2011a, 2011b). Las cascadas tróficas son bien conocidas en la gestión de lagos, donde experimentos realizados en todo un lago muestran que la introducción de peces depredadores de nivel superior en lagos turbios dominados previamente por el fitoplancton puede reducir considerablemente la biomasa de algas y transformarlos en lagos de aguas claras (Carpenter y cols., 2001). Así pues, la biomanipulación de los niveles tróficos superiores se ha convertido en una herramienta útil para limitar la proliferación de algas en lagos eutrofizados (Sondergaard y cols., 2007). 3.4. Las cascadas tróficas dependen de la diversidad de recursos y depredadores Los efectos que tiene el descenso de los depredadores en los ecosistemas han sido explorados exhaustivamente en las últimas décadas, tanto mediante modelos como en estudios sobre el terreno. Actualmente sabemos que los cambios en cascada en la estructura de las cadenas alimenticias tras el descenso de los depredadores de nivel trófico superior son comunes en diversos ecosistemas, como los lagos (Carpenter y cols., 1985), las corrientes (Power, 1990), los bosques de cistos (Estes y cols., 1998), los estuarios 33 Departamento Temático de Políticas Estructurales y de Cohesión (Jackson y cols., 2001), los sistemas intermareales rocosos (Menge, 2000), las plataformas continentales (Frank y cols., 2007) y también en alta mar (Ward y Myers, 2005). Sin embargo, también comenzamos a darnos cuenta de que las cascadas tróficas dependen de interacciones complejas entre las condiciones medioambientales, el suministro de recursos, las características de las distintas especias y la complejidad de la cadena alimenticia (Strong, 1992; Polis y Strong, 1996; Menge, 2000; Oksanen y Oksanen, 2000; Shurin y cols., 2002; Borer y cols., 2005; Borer y cols., 2006; Hopcraft y cols., 2010). De este modo, el efecto que tienen los depredadores en la configuración de la cadena alimenticia depende en gran medida del contexto, y las propiedades del ecosistema determinarán las posibles reacciones a la sobreexplotación de los depredadores de nivel superior. Sin embargo, podemos formular una serie de generalidades que podrían indicar que dichos sistemas son vulnerables a las cascadas tróficas y, por consiguiente, en las que la sobreexplotación pesquera podría contribuir a la proliferación de algas. Las cascadas tróficas aumentan con la productividad (Pace y cols., 1999), lo que significa que el descenso de los peces depredadores de nivel superior interactúa con la eutrofización marina. En realidad, las cascadas tróficas implican que cada segundo nivel trófico es controlado por los recursos y cada segundo nivel es controlado por los consumidores (Oksanen y Oksanen, 2000), lo que da por resultado una relación positiva entre la producción primaria y cada segundo nivel trófico. De esta manera, en un sistema marino con cuatro niveles tróficos efectivos: (1) algas, 2) herbívoros, 3) depredadores pequeños que se alimentan de herbívoros y 4) depredadores de nivel superior que se alimentan de depredadores pequeños), los herbívoros y los depredadores de nivel superior deberían aumentar con el enriquecimiento con nutrientes. En cambio, si reducimos el sistema a tres niveles tróficos efectivos mediante la sobreexplotación de los depredadores de nivel superior, las algas y los pequeños depredadores deberían aumentar con el enriquecimiento con nutrientes (Oksanen y Oksanen, 2000; Eriksson, 2011) (figura 8). Este hecho se refleja en los ejemplos documentados de los efectos en cascada del descenso de los peces depredadores de nivel superior que coinciden con el aumento de la biomasa de algas en el mar Negro y el Báltico (véanse los casos de estudio que figuran más abajo; Daskalov, 2002; Casini y cols., 2008), donde la sobreexplotación pesquera y la eutrofización se han producido de forma simultánea. Algunos estudios sobre el terreno, tanto terrestres como marinos, apoyan la existencia de una relación positiva entre la productividad a gran escala y las cascadas tróficas (Sinclair y cols., 2000; Elmhagen y Rushton, 2007; Vasas y cols., 2007; Hopcraft y cols., 2010), y varios experimentos a pequeña escala de bentos marinos sostienen concretamente que el enriquecimiento con nutrientes promueve la propagación de las cascadas tróficas de los peces depredadores de nivel superior a las algas (Moksnes y cols., 2008; Eriksson y cols., 2009; Sieben y cols., 2011b). Por ejemplo, Vasas y cols. (2007) crearon un modelo de cadena alimenticia basada en estudios publicados sobre el mar del Norte y demostraron que la sobreexplotación pesquera y la eutrofización tenían efectos sinérgicos que promueven la proliferación de algas nocivas (véase el caso del mar del Norte en el apartado 4.2). Sieben y cols. (2011b) mostraron que eliminando los depredadores bentónicos de nivel superior mediante jaulas se indujo una cascada trófica que aumentó drásticamente la biomasa de las algas bentónicas, pero únicamente en combinación con el enriquecimiento con nutrientes (véase el caso del mar Báltico en el apartado 4.6). Por consiguiente, las consecuencias que tiene la eliminación de los depredadores de nivel superior para la proliferación de algas dependen de los recursos disponibles. Las cascadas tróficas son más pronunciadas en los bentos marinos que en el plancton marino (Strong, 1992; Shurin y cols., 2002; Borer y cols., 2005). Por lo general, los efectos positivos en la biomasa de plantas o algas que comporta la eliminación de los herbívoros mediante depredación son más pronunciados en el agua que en tierra (Strong, 1992). Sin 34 ¿Favorece la sobreexplotación pesquera la proliferación de algas? embargo, esta es la causa principal de los fortísimos efectos en cascada en las algas de bentos marinos (Shurin y cols., 2002). En una revisión de todos los estudios sobre cascadas tróficas marinas publicados hasta ese momento, Borer y cols. (2005) mostraron que los depredadores medianos que consumen herbívoros tenían efectos positivos significativos tanto en el fitoplancton marino como en las algas bentónicas, pero mientas que estos depredadores aumentaron la biomasa de plancton en casi un 30 %, la depredación aumentó varias veces la biomasa de algas bentónicas. De este modo, cabe esperar que la eliminación de los depredadores de nivel superior tenga un mayor efecto en las proliferaciones de algas filamentosas que en las de fitoplancton. Por otra parte, las cascadas tróficas con pronunciados efectos recíprocos entre depredadores y presas se producen sobre todo en sistemas en los que la fuerza de la interacción está determinada por unas cuantas especies funcionalmente dominantes (Strong, 1992; Pace y cols., 1999). Una recopilación de 108 experimentos de eliminación de depredadores muestra que estos últimos eliminan en promedio un 57 % de las presas o de la biomasa (datos personales), lo que se corresponde con la eliminación media de la biomasa de productores por parte de herbívoros analizada en una síntesis de 191 experimentos (Gruñir y cols., 2008). Sin embargo, el efecto de la depredación en la biomasa de sus presas de nivel trófico inferior solo fue constantemente negativo en los sistemas en que una sola especie de depredadores domina la comunidad de estos. En aquellas comunidades que tienen un solo depredador dominante, la depredación eliminó en promedio dos tercios de la biomasa de las presas, mientras que con una mayor diversidad de depredadores la depredación no tuvo efectos negativos significativos. Esto indica que si bien los depredadores eliminan biomasa, la presión de su depredación a menudo no es suficiente para controlar la biomasa de sus presas cuando la diversidad de depredadores es alta, probablemente debido a interacciones negativas entre los propios depredadores. De este modo, cabe esperar que la sobreexplotación de sistemas marinos tenga efectos pronunciados cuando la comunidad de peces está dominada por un pequeño número de especies muy abundantes y funcionalmente importantes. Esto es lo que ocurre en el sistema del mar del Norte, donde la anchoa domina la comunidad de peces pelágicos, y en el sistema del mar Báltico, donde el bacalao domina la comunidad de depredadores de nivel superior y los clupeidos (espadín y arenque) dominan la comunidad de peces planctívoros (véanse los casos de estudio de los apartados 4.3 y 4.5). 35 Departamento Temático de Políticas Estructurales y de Cohesión Figura 8: El aumento de la producción de biomasa procedente del enriquecimiento con nutrientes se acumula en diferentes niveles tróficos en función del número de niveles tróficos del ecosistema. 4 trophic levels 3 trophic levels Top‐ predators Smaller predators Smaller predators Herbivores Herbivores Algae Algae nutrients Fuente: Frank y cols. (2005), Daskalov (2007), Casini y cols. (2008) 36 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 4. ¿CONTRIBUYE LA SOBREEXPLOTACIÓN PESQUERA A LA PROLIFERACIÓN DE ALGAS EN EUROPA? Desde una perspectiva metodológica resulta casi imposible encontrar pruebas concluyentes de los efectos de procesos tan vastos como la sobreexplotación pesquera. Los efectos de la pesca se sobrepondrán a una serie de importantes variables medioambientales e interactuarán con ellas. Puesto que no podemos manipular sistemas de la magnitud de cuencas oceánicas, necesitamos utilizar análisis de tendencias y modelos basados en datos obtenidos sobre el terreno en combinación con experimentos a pequeña escala para explorar las hipótesis más probables y evaluar sus efectos. Las pruebas de los efectos que tiene la pesca en la proliferación de algas, aunque mayoritariamente circunstanciales, muestran que es muy probable que la sobreexplotación pesquera contribuya a la proliferación de algas en algunos sistemas marinos europeos. Por consiguiente debemos concluir que la sobreexplotación contribuye a la proliferación de algas, pero que la magnitud y gravedad de esta proliferación varía a lo largo de las estaciones y en el espacio, entre sistemas marinos y dentro de ellos. 4.1. Modelos de los efectos de la sobreexplotación y la eutrofización Para poner a prueba concretamente los efectos conjuntos de la pesca y la eutrofización marina, Vasas y cols. (2007) construyeron un modelo en red de un ecosistema genérico pelágico templado situado cerca de la costa. El modelo en red estaba formado por una red alimentaria topológica, que es una simple descripción de las relaciones entre los grupos importantes de especies e información sobre cuál se alimenta de cuál. Este modelo nos da la organización básica del ecosistema y puede utilizarse para estudiar el comportamiento general del sistema al quedar expuesto a perturbaciones claramente definidas, pero no para predecir abundancias específicas o comportamientos dinámicos. La identificación de las agrupaciones de nutrientes y grupos de especies funcionalmente más importante, así como las relaciones entre los grupos de especies, se obtuvieron mediante una reseña general de 25 estudios de transferencia trófica, es decir, el consumo de una agrupación de nutrientes o grupo de especies o la contribución a una agrupación de nutrientes mediante la introducción de nutrientes o sedimentación y el uso de datos obtenidos sobre el terreno en el mar del Norte (Rousseau y cols., 2000). De este modo, los resultados de este análisis son pertinentes para cualquier ecosistema europeo, pero en particular para el mar del Norte. En una revisión de la bibliografía, Vasas y cols. (2007) identificaron 19 especies de grupos y 7 agrupaciones de nutrientes que eran relevantes para la función de las comunidades pelágicas templadas costeras. Entre ellos había cuatro grupos de algas proliferantes: 1) grandes diatomeas, 2) grandes dinoflagelados no tóxicos, 3) algas no comestibles, incluidas las algas y bacterias nocivas que forman proliferaciones de algas tóxicas o no comestibles; el análisis incluyó, por ejemplo, especies nocivas de cianobacterias (Nodularia spumigena), dinoflagelados (Noctiluca, Alexandrium, Karenia brevis), primnesiofitas (Prymnesium parvus, Chrysochromulina polylepis, Phaeocystis), rafidofitas (Heterosigma akashiwo). Un aspecto importante para este análisis fue que la red incluía también zooplancton de gran tamaño que se alimenta de diatomeas y dinoflagelados comestibles (grupos 1 y 2), peces planctívoros (pequeños peces pelágicos que se alimentan de plancton), peces piscívoros (peces pelágicos de mayor tamaño que se alimentan de peces) y medusas, es decir, zooplancton de forma gelatinosa que son miembros de las especies Cnidaria (verdaderas medusas) y Ctenofora (ctenóforo americano) (figura 9). 37 Departamento Temático de Políticas Estructurales y de Cohesión Figura 9: Cadena alimenticia genérica de un ecosistema pelágico templado situado cerca de la costa. Los círculos corresponden a grupos tróficos de organismos o nutrientes, y las flechas muestras cuál se alimenta de cuál. La cadena alimenticia sostenible (a) se basa en relaciones tróficas descritas para los mares modernos europeos sin fuertes descensos de poblaciones de peces comerciales. La hipótesis (b) de sobreexplotación de grandes peces depredadores es el cambio previsto en las relaciones entre los grupos tróficos cuando la cadena alimenticia es objeto tanto de sobreexplotación de los peces de mayor tamaño que se alimentan de peces como de eutrofización. En la hipótesis de sobreexplotación de grandes peces depredadores podemos prever un fuerte aumento de los peces planctívoros y de las proliferaciones de algas no tóxicas. a) ”larger fish that eat fish” ”smaller fish that eat zoo‐ plankton” b) pisci‐ vorous fish plank‐ tivorous fish Sustainable modern food‐web piscivorous fish plank‐ tivorous fish jelly fish large Overfishing of larger predatory fish jelly fish large zoo‐ plankton zoo‐ plankton toxic algae toxic algae large nontoxic algae large nontoxic algae nutrients nutrients Fuente: Vasas y cols. (2007) Efectos de la sobreexplotación de depredadores de nivel superior: el análisis de la red genérica predijo que la sobreexplotación de los depredadores de mayor tamaño debía favorecer la proliferación de grandes diatomeas y dinoflagelados no tóxicos, pero solo con un enriquecimiento simultáneo con nutrientes (Vasas y cols., 2007). La disminución de los depredadores de mayor tamaño hizo aumentar la biomasa de los peces planctívoros y, por ende, redujo indirectamente la abundancia del plancton de mayor tamaño que se alimenta de las diatomeas y dinoflagelados no tóxicos (figura 9b). De esta manera, la sobreexplotación de los peces depredadores de mayor tamaño debería generar una cascada trófica lineal en las relaciones entre depredadores y presas que favorezca la proliferación de algas no tóxicas de alta densidad. 38 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Figura 10: Cadena alimenticia genérica de un ecosistema pelágico templado situado cerca de la costa. Los círculos corresponden a grupos tróficos de organismos o nutrientes, y las flechas muestras cuál se alimenta de cuál. La cadena alimenticia sostenible (a) se basa en relaciones tróficas descritas para los mares modernos europeos sin fuertes descensos de poblaciones de peces comerciales. En la «hipótesis de reducción de la cadena alimenticia mediante la pesca» (b), la cadena alimenticia queda expuesta a la sobreexplotación de poblaciones de pequeños peces pelágicos comerciales. Este fenómeno es habitual cuando colapsan las poblaciones de peces de mayor tamaño y la pesca se dirige a peces planctívoros de menor tamaño (por ejemplo, en el mar Negro). En la «hipótesis de reducción de la red alimentaria mediante la pesca» cabe esperar que aumente la abundancia de medusas y la proliferación de algas tóxicas. a) ”larger fish that eat fish” ”smaller fish that eat zoo‐ plankton” b) pisci‐ vorous fish plank‐ tivorous fish Sustainable modern food‐web piscivorous fish planktivorous fish jelly fish large large zoo‐ plankton zoo‐ plankton toxic algae large nontoxic algae ”Fishing down the food web” jelly fish toxic algae large non‐toxic algae nutrients nutrients Fuente: Vasas y cols. (2007) Efectos de la sobreexplotación de peces planctívoros: el análisis de la red genérica predijo que la sobreexplotación de peces planctívoros debería favorecer la proliferación de algas no comestibles y medusas, independientemente de la eutrofización (grupos 3, 4 y 5) (figura 10) (Vasas y cols., 2007). La razón de ello es que al eliminar los peces planctívoros aumentó considerablemente el zooplancton de mayor tamaño, lo que dio lugar a una reducción de sus principales presas, a saber, las diatomeas y dinoflagelados no tóxicos. Esto implica a su vez que las algas no comestibles quedaron liberadas de la competencia por nutrientes con las algas comestibles y su cantidad aumentó. Al mismo tiempo, las medusas quedaron liberadas de su competencia con los peces planctívoros y su cantidad también aumentó. De esta forma, la sobreexplotación de peces planctívoros debería favorecer la proliferación de algas tóxicas y medusas, al liberarlas de la competencia. 39 Departamento Temático de Políticas Estructurales y de Cohesión En conclusión, el modelo de cadena alimenticia genérica de un ecosistema pelágico templado cercano a la costa elaborado por Vasas y cols. (2007) prevé que: 1) la sobreexplotación de los peces depredadores de mayor tamaño, junto con la eutrofización, debería facilitar el desarrollo de proliferaciones de algas no tóxicas de alta biomasa, y 2) la sobreexplotación de pequeños peces planctívoros — «reducción de la cadena alimenticia mediante la pesca»— debería facilitar el desarrollo de proliferaciones de algas tóxicas y el aumento de la abundancia de zooplancton gelatinoso. Este simple análisis ofrece un modelo para comprender la forma en que la sobreexplotación pesquera puede contribuir a las tendencias temporales de los casos de estudio que se exponen a continuación. 4.2. Estudio del caso del mar del Norte En el mar del Norte, el descenso de los peces depredadores de mayor tamaño debido a la sobreexplotación se encuentra bien documentado desde los años setenta (Pauly y cols., 1998; Christensen y cols., 2003). Sin embargo, a partir de 1980 se produce igualmente un cambio de carácter general en el ecosistema del mar del Norte, que incluye cambios de composición de la comunidad de peces y una mayor abundancia de fitoplancton (Reid y cols., 2001; Weijerman y cols., 2005; McQuatters-Gollop y cols., 2007). Las capturas de peces depredadores de longitud superior a 90 cm han disminuido de forma constante desde 1970, pasando de un máximo de 1 000 000 toneladas a 200 000 toneladas en 2000 (figura 11). La pesca de atún y marlín, los mayores depredadores pelágicos, colapsó a principios de los años sesenta, mientras que la pesca de tiburones y rayas alcanzó su punto máximo en los años sesenta y registró un descenso continuo a partir de los años setenta (figura 12). Actualmente, los depredadores comerciales dominantes son especies demersales: el bacalao y el carbonero (Pollachius virens). Las capturas de bacalao y carbonero alcanzaron su punto máximo en los años setenta, cuando eran dos veces y media superiores a las actuales. Desde alrededor de 1980, las capturas de bacalao y carbonero han experimentado un fuerte descenso (figura 13). A mediados de los años setenta, la composición de las capturas cambió significativamente, ya que el descenso de las capturas de peces de gran tamaño vino acompañado de un fuerte aumento de las capturas de peces menores de 30 cm (figura 11). Junto con el descenso generalizado de las poblaciones de grandes predadores, la transición a los peces de menor tamaño se debe a un fuerte aumento de la pesca industrial de saltones (seaaroundus.org). En torno a 1980, la estructura del ecosistema del mar del Norte cambió, en particular debido a un rápido aumento de la biomasa de algas (figura 14) (McQuatters-Gollop y cols., 2007). Si se compara el período 1947-1979 con el período 1980-2003 se observa un aumento de la concentración de los pigmentos de fitoplancton del 13 % en las aguas abiertas y del 21 % en las regiones costeras del mar del Norte (McQuatters-Gollop y cols., 2007). Los análisis de las variables climáticas a gran escala indican la posible existencia de una serie de variables medioambientales que afectan a toda la región noroccidental de Europa, desencadenando este cambio de la estructura biológica, en particular la salinidad, las condiciones meteorológicas y variaciones extensas de la claridad del agua (Reid y cols., 2001; Weijerman y cols., 2005; McQuatters-Gollop y cols., 2007). Todo ello ha llevado a suponer que los cambios de las condiciones climáticas a gran escala han provocado un cambio de régimen a gran escala en el mar del Norte que afecta a todos los niveles tróficos, desde el plancton y los peces de alta mar hasta los invertebrados bentónicos y los peces costeros (Beaugrand, 2004). Sin embargo, este cambio coincide igualmente con un descenso del nivel trófico medio de las capturas, que depende de los efectos combinados del aumento de la pesca de peces de menor tamaño y el descenso de los grandes depredadores (figura 15). De este modo observamos cambios paralelos en la comunidad de peces y de fitoplancton, en los que la intensificación de la pesca y el descenso de los peces de gran tamaño, en particular el bacalao, guardan relación con el aumento de la biomasa 40 ¿Favorece la sobreexplotación pesquera la proliferación de algas? de fitoplancton. Esta correlación concuerda con los efectos conjuntos previstos de la sobreexplotación de grandes peces depredadores y la eutrofización en el mar del Norte (Vasas y cols., 2007). En conclusión, podemos decir, aunque con carácter muy especulativo, que las tendencias en el mar del Norte indican que debemos estudiar si los cambios producidos por la pesca y el clima han contribuido al aumento de la biomasa de fitoplancton, lo que implicaría un posible aumento del riesgo de proliferación de algas. Figura 11: Tendencias de los desembarques de peces grandes y pequeños en el mar del Norte 1600 small < 30 cm catch tonnes x 10 3 1400 1200 large > 90 cm 1000 800 600 400 200 0 1950 1960 1970 1980 1990 2000 Fuente: Seaaroundus.org Figura 12: Tendencias de los desembarques de grandes especies pelágicas en el mar del Norte 60 Sharks & rays catch tonnes x 10 3 50 Tuna & billfishes 40 30 20 10 0 1950 1960 1970 1980 Fuente: Seaaroundus.org 41 1990 2000 Departamento Temático de Políticas Estructurales y de Cohesión Figura 13: Tendencias de los desembarques de grandes especies demersales en el mar del Norte catch tonnes x 10 3 400 350 Atlantic cod 300 Saithe 250 200 150 100 50 0 1950 1960 1970 1980 1990 2000 Fuente: Seaaroundus.org Figura 14: Tendencias de la abundancia de algas en el mar del Norte 4.5 coastal North Sea open North Sea Chl a (mg m‐3) 4 3.5 3 2.5 2 1950 1960 1970 1980 1990 2000 Fuente: McQuatters-Gollop y cols. (2007) Figura 15: Tendencias del nivel trófico medio de los desembarques en el mar del Norte 3.6 mean trophic level Mean trophic level 3.5 3.4 3.3 3.2 3.1 1950 1960 1970 1980 Fuente: Seaaroundus.org 42 1990 2000 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 4.3. Estudio del caso del mar Negro En el mar Negro, tras un pronunciado descenso de los grandes depredadores que culminó a principios de los años setenta, se produjo un fuerte aumento de la biomasa de fitoplancton que alcanzó su punto máximo a principios de los años ochenta con un aumento relativo del 100 % (Daskalov, 2002; Daskalov y cols., 2007). Desde el cambio de composición de peces en los años setenta, la frecuencia e intensidad de las proliferaciones de fitoplancton han aumentado de forma muy considerable (Zaitsev, 1992; Kideys, 1994; Daskalov, 2002; Yunev y cols., 2002; Yunev y cols., 2005). Durante todos los años sesenta, los depredadores dominantes de nivel superior en el mar Negro fueron objeto de una intensa explotación, incluidos los delfines y las grandes especies migratorias, como el bonito (Sarda sarda), el atún y el pez espada (Daskalov, 2002). Sin embargo, a finales de esa década, la pesca de grandes especies colapsó y sus poblaciones se agotaron o desaparecieron. Actualmente presenciamos una lenta recuperación del atún y el marlín en las estadísticas de capturas, sobre todo debido al aumento de las capturas de atún rojo del Atlántico en los caladeros turcos y rusos (figura 16). Tras el descenso de las grandes especies pelágicas, su principales especies presa, los peces pelágicos pequeños y medianos, como la anchoa (Engraulis encrasiccolus), el espadín (Sprattus sprattus) y el jurel (Trachurus mediterraneus), aumentaron considerablemente a principios de los años setenta, lo que atrajo la pesca comercial (figura 17) (Kideys, 1994; Daskalov, 2002). En consecuencia, el nivel trófico medio de las capturas en el mar Negro disminuyó considerablemente a lo largo de la segunda mitad del siglo XX, produciéndose un cambio de composición de la comunidad de peces de las especies pelágicas grandes a las medianas y pequeñas (figura 18). Tras el cambio en la comunidad de peces en detrimento de los grandes peces depredadores y a favor de peces planctívoros más pequeños, la biomasa de zooplancton disminuyó fuertemente y la de fitoplancton aumento en consecuencia (figura 19) (Daskalov, 2002; Daskalov y cols., 2007). Los peces planctívoros se alimentan principalmente de zooplancton de mayor tamaño, y los cambios de composición de la comunidad de zooplancton indican que la disminución de la biomasa se debe en parte a que las especies de mayor tamaño fueron reemplazadas por especies más pequeños de plancton de crustáceos (Zaitsev, 1992; Kideys, 1994). La comunidad de fitoplancton también cambió de carácter, ya que la abundancia relativa de fitoplancton de mayor tamaño, dominado por los dinoflagelados, aumentó respecto al fitoplancton de menor tamaño, dominado por las diatomeas (Kideys, 1994; Daskalov, 2002). En particular, en el mar del Norte observamos un segundo efecto en cascada que establece abundancias aún mayores de biomasa de fitoplancton y una mayor frecuencia de las proliferaciones de algas en los años noventa. Tras el abandono de los grandes depredadores de nivel superior a favor de especies pelágicas de menor tamaño en la pesca comercial, las capturas de anchoa aumentaron fuertemente hasta convertirla en el pez planctívoro más importante para la pesca comercial turca. Entre 1988 y 1991, las capturas de anchoa disminuyeron un 25 % respecto a las de los años ochenta. La disminución de las capturas de anchoa se confirma con un pronunciado descenso de la biomasa total general de peces planctívoros de menor tamaño en el mar Negro (Daskalov y cols., 2007). Sin embargo, la comunidad de zooplancton no se recuperó. En lugar de ello se produjo un fuerte aumento de dos especies de zooplancton gelatinoso que compiten con los peces planctívoros por su principal presa, el zooplancton, lo que indica que la pesca pudo haber promovido las proliferaciones de algas en el mar del Norte en dos episodios independientes de sobreexplotación, que dieron lugar a la reducción de la presión del zooplancton herbívoro sobre el fitoplancton. Existen sólidas pruebas circunstanciales que señalan que la sobreexplotación y la eutrofización han contribuido conjuntamente a una cascada trófica que aumentó la biomasa 43 Departamento Temático de Políticas Estructurales y de Cohesión de fitoplancton en el mar del Norte (Daskalov, 2002; Daskalov y cols., 2007). En primer lugar, existe una correlación inversa entre los niveles tróficos adyacentes a lo largo del tiempo (de los años cincuenta y sesenta hasta 2003), mientras que existe una correlación positiva entre los niveles tróficos no adyacentes (Cuadro 2) (Daskalov, 2007): en particular, una relación negativa significativa entre la abundancia de grandes peces pelágicos depredadores y la biomasa de fitoplancton (n = 43, r = –0,39). En segundo lugar, Daskalov (2002) construyó un modelo de la cadena alimenticia (un modelo dinámico de equilibrio de masas) del sistema pelágico en los años sesenta al cartografiar la biomasa, producción, tasas de consumo y dietas medias de 15 importantes grupos de la cadena alimenticia, entre los que se encontraban delfines, grandes depredadores, peces planctívoros, larvas de peces, diversas especies de zooplancton gelatinoso y zooplancton y fitoplancton de gran y pequeño tamaño. A continuación, Daskalov (2002) realizó simulaciones de pesca y eutrofización con este modelo. Una hipótesis basada exclusivamente en la pesca, en la que se supuso que la presión pesquera había aumentado un 300 % en un período de treinta años, reprodujo correctamente los cambios alternados en los niveles tróficos observados en los años setenta y ochenta en la cadena alimenticia del mar Negro, que incluían 1) el aumento de los peces planctívoros, 2) la disminución de la biomasa de zooplancton provocada por el descenso de la abundancia relativa de las especies de zooplancton de mayor tamaño, y 3) el aumento de la biomasa de fitoplancton debido al incremento de la abundancia relativa de las especies de fitoplancton de mayor tamaño. Cabe señalar que la presión pesquera aplicada es una estimación mínima a fin de no exagerar sus efectos. Aún así, el modelo basado «exclusivamente en la pesca» tan solo produjo un aumento de la biomasa de fitoplancton de aproximadamente un 30 %, que es inferior al aumento observado del 100%. Sin embargo, suponiendo un aumento del 300 % de la pesca y un incremento de la producción primaria del sistema debido a la eutrofización, se predijo correctamente un aumento de la biomasa de fitoplancton entre el 95 % y el 100 %. En conclusión, si consideramos 1) la gran frecuencia de las proliferaciones de algas desde los años setenta (Zaitsev, 1992; Kideys, 1994; Daskalov, 2002; Yunev y cols., 2002; Yunev y cols., 2005), 2) los cambios simultáneos de composición de la comunidad de peces y de las relaciones entre depredadores y presas (figuras 16 a 19) (Daskalov, 2002; Daskalov y cols., 2007), y 3) los resultados del modelo de la cadena alimenticia de Daskalov (2002), que indican que el descenso del control de los grandes peces depredadores junto con la eutrofización dan lugar generalmente a un aumento de la biomasa de fitoplancton, es probable que la sobreexplotación pesquera y la eutrofización contribuyan conjuntamente a las proliferaciones de algas en el mar del Norte. En particular, las algas cuyo aumento se preveía debido a la sobreexplotación pesquera en el mar del Norte eran sobre todo fitoplancton grande, como los dinoflagelados de las especies Prorocentrum cordatum y Noctiluca miliaris, que forman grandes mareas rojas, especies que también aumentaron considerablemente en los años setenta durante el período en que colapsó la pesca de grandes peces pelágicos (Kideys, 1994; Daskalov, 2002). 44 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Figura 16: Tendencias de los desembarques de atún y marlín de las flotas pesqueras rusa, rumana y turca del mar Negro 30 Tuna & Billfishes Atlantic bonito catch tonnes x 10 3 25 Atlantic bluefin tuna 20 15 10 5 0 1950 1960 1970 1980 1990 2000 Fuente: Seaaroundus.org catch tonnes x 10 3 Figura 17: Tendencias de los desembarques de especies pelágicas pequeñas y medianas en el mar Negro 900 800 700 600 500 400 300 200 100 0 1950 Perch ‐likes Herring ‐likes Anchovies 1960 1970 1980 1990 2000 Fuente: Seaaroundus.org Figura 18: Tendencias del nivel trófico medio de los desembarques en el mar Negro 3.5 Mean trophic level trophic level 3.4 3.3 3.2 3.1 1950 1960 1970 1980 Fuente: Seaaroundus.org 45 1990 2000 Departamento Temático de Políticas Estructurales y de Cohesión Figura 19: Tendencias de la biomasa relativa de zooplancton y fitoplancton en el mar Negro 4.5 Zooplankton Phytoplankton relative biomass 3.5 2.5 1.5 0.5 ‐0.5 ‐1.5 1950 1960 1970 1980 1990 2000 Fuente: Daskalov (2002) Cuadro 2: Relación entre los grandes predadores pelágicos (biomasa de atunes y marlines, por ejemplo) y los niveles tróficos inferiores en el mar Negro a lo largo del tiempo. Número (n) Coeficiente de correlación (r) Significancia (p) Biomasa de peces planctívoros 38 -0,55 <0,01 Biomasa de zooplancton 43 0,44 <0,01 Biomasa de fitoplancton 43 -0,39 <0,01 Fuente: Daskalov y cols. (2007) 4.4. Estudio del caso del Kattegat En el Kattegat, en la costa sueca del mar del Norte, un tendencia descendente a largo plazo del depredador demersal dominante, el bacalao, coincide con un descenso del 60 % de los lechos de plantas marinas atribuido a la proliferación de algas filamentosas en forma de capas (Baden y cols., 2003; Moksnes y cols., 2008; Baden y cols., 2010; Eriksson y cols., 2011). El bacalao es el depredador demersal dominante en esta zona y fue objeto de una intensa pesca comercial que tuvo como resultado una reducción continua de las capturas desde los años setenta (figura 20). Las evaluaciones de la población indican una disminución total de la biomasa de bacalao de 25-35 a 5-10 106 kg en el Kattegat entre 1976 y 2008 (figura 21). Al mismo tiempo, las poblaciones costeras locales de bacalao estacionario han disminuido muy considerablemente. En el Kattegat, los alevines de la población de bacalao de alta mar se establecen en los hábitats cercanos a la costa y los de mayor tamaño llevan a cabo una importante depredación entre los peces depredadores más pequeños de las comunidades costeras, inclusive gobíidos, cangrejos comunes de playa (Carcinus maenus) y lábridos (Pihl, 1982; Pihl y Ulmestrand, 1993; Salvanes y Nordeide, 1993). Por consiguiente, junto con el descenso de las poblaciones de bacalao, la abundancia de gobio negro (Gobius niger), cangrejos de playa y los lábridos dominantes, la poderrana (Symphodus melops) y el tabernero (Ctenolabrus rupestris), ha aumentado constantemente a lo largo de la costa (figura 22) (Eriksson y cols., 2011). Tanto el gobio negro como los cangrejos de playa y los lábridos pueden regular la abundancia de los 46 ¿Favorece la sobreexplotación pesquera la proliferación de algas? herbívoros crustáceos y gastrópodos («mesoherbívoros»), que a su vez se alimentan de las algas que forman proliferaciones de algas filamentosas (Norderhaug y cols., 2005; Newcombe y Taylor, 2010). De forma similar, si se comparan las comunidades de animales que vivían en los lechos de hierba marina entre los años ochenta y la primera década de este siglo, se observa que una comunidad de mesoherbívoros crustáceos abundante en los años ochenta había desaparecido totalmente de dichos lechos en la década del 2000 (Baden y cols., 2011). Al mismo tiempo, las poblaciones de bacalao se redujeron al 25 % y las de depredadores de pequeño tamaño, como el gobio negro, aumentaron un 600 %. De este modo, la sobreexplotación del bacalao puede haber dado lugar a efectos en cascada que promueven las proliferaciones de algas filamentosas al reducir indirectamente la presión ejercida por los herbívoros invertebrados (Moksnes y cols., 2008; Baden y cols., 2010; Eriksson y cols., 2011). Existen pruebas tanto circunstanciales como experimentales que sostienen la hipótesis de que los cambios estructurales de la cadena alimenticia del Kattegat, provocados por el descenso del bacalao inducido por la pesca, han contribuido a aumentar la abundancia de proliferaciones de algas y a reducir a gran escala las hierbas marinas. En primer lugar, existe una correlación significativa entre el descenso del bacalao de alta mar y el aumento de los pequeños peces costeros (figura 23). Asimismo existe una correlación significativa entre las altas temperaturas de las aguas costeras en primavera y la gran abundancia de pequeños peces costeros (figura 24). Sin embargo, no se observó una tendencia ascendente de la temperatura en las aguas costeras en las que se hizo el seguimiento de los peces y la correlación con el descenso del bacalao es estadísticamente mayor, pues el bacalao explica un 47 % de la variación de la abundancia total de pequeños peces depredadores y la temperatura tan solo un 28 % (véanse los valores R de los figuras 23 y 24). Esto indica que aunque la temperatura es importante para la supervivencias de los peces costeros, es más probable que el descenso del bacalao haya provocado el aumento de los pequeños peces depredadores (Eriksson y cols., 2011). Por otra parte, existen sólidas pruebas experimentales que señalan que los pequeños peces depredadores promueven el aumento de la biomasa de algas filamentosas al alimentarse de los herbívoros crustáceos presentes en el sistema (Moksnes y cols., 2008; Baden y cols., 2010). Al retirar los herbívoros y depredadores presentes sobre el terreno mediante diferentes tipos de jaulas se observó que la abundancia natural de pequeños depredadores en los lechos de hierba marina disminuyó la presencia de mesoherbívoros crustáceos en un 98 %, y tuvo un efecto negativo en el crecimiento de la hierba marina al aumentar la masa de algas filamentosas que forman capas en las zonas costeras del Kattegat. Figura 20: Tendencias de los desembarques de bacalao y otros grandes peces depredadores en el Kattegat 400 Cod ‐ offshore bottom trawl survey Catch per unit effort 350 Other large predators (haddock, ling, pollack) 300 250 200 150 100 50 0 1975 1985 1995 Fuente: Seaaroundus.org 47 2005 Departamento Temático de Políticas Estructurales y de Cohesión Figura 21: Tendencias de la biomasa total de bacalao en el Kattegat 40 Estimated total biomass of cod in Kattegat biomass (kg 106) 35 30 25 20 15 10 5 0 1975 1985 1995 2005 Fuente: Eriksson y cols. (2011) Figura 22: Tendencias de la abundancia de cangrejos de playa y peces de tamaño mediano observadas en el seguimiento costero en Ringhals en el Kattegat. Catch per unit effort 35 30 25 20 Costal monitoring of: wrasses 0.8 shore crab 0.6 black goby 0.4 15 10 0.2 5 0 1975 0 1985 1995 2005 Fuente: Eriksson y cols. (2011) total CPUE coastal fish Figura 23: Relación entre el bacalao de alta mar y las poblaciones costeras de depredadores medianos = abundancia total de cangrejo de playa, lábridos y gobio negro. 40 R² = 0.4723 30 20 10 0 0 10 20 30 Total cod biomass kg 106 Fuente: Eriksson y cols. (2011) 48 40 ¿Favorece la sobreexplotación pesquera la proliferación de algas? total CPUE coastal fish Figura 24: Relación entre las temperaturas en primavera y las poblaciones costeras de depredadores medianos = abundancia total de cangrejo de playa, lábridos y gobio negro. R² = 0.2844 40 30 20 10 0 3 4 5 6 7 8 Water temperature Celsius 9 Fuente: Eriksson y cols. (2011) De este modo, resulta muy plausible que la disminución del bacalao provocada por la sobreexplotación pesquera y el gran aumento posterior de los pequeños peces depredadores a lo largo de la costa hayan contribuido a aumentar la masa de las proliferaciones de algas filamentosas. Cabe destacar que los efectos negativos del aumento de las proliferaciones de algas filamentosas han afectado gravemente a las comunidades de hierbas marinas. Anteriormente se encontraba una gran abundancia de alevines de bacalao en los lechos de hierbas marinas, lo que indica que eran importantes zonas de cría para la población de bacalao de alta mar. Esto plantea el problema de que la sobreexplotación del bacalao genera respuestas negativas para la reproducción de esta especie en el Kattegat al contribuir a la pérdida de zonas de reproducción costeras. 4.5. El mar Báltico – estudio del caso de alta mar En el mar Negro, la cadena alimenticia de alta mar ha cambiado drásticamente desde los años ochenta, pues se han producido marcados descensos de las poblaciones de bacalao, que es el pez demersal dominante, y aumentos de la biomasa de fitoplancton y de la frecuencia de las proliferaciones de algas (Kahru y cols., 1994; Poutanen y Nikkila, 2001; Alheit y cols., 2005; Hansson, 2005; Casini y cols., 2008; Möllmann y cols., 2008; HELCOM, 2009). En un principio, tras la expansión de la pesca del bacalao en los años setenta, las poblaciones de bacalao de alta mar del Báltico se redujeron un 75 % durante los años ochenta (figura 25) (ICES, 2010). Tras este descenso se produjo un aumento del 400 % del espadín (Sprattus sprattus), que es la principal presa del bacalao y que se convirtió en el planctívoro pelágico dominante (Österblom y cols., 2007; Casini y cols., 2008). Las muestras de zooplancton son muy deficientes, pero datos procedentes del mar de Gotland, en la parte meridional del Báltico, muestran que la biomasa de verano de las principales especies de zooplancton que son presa del espadín (una serie de grandes copépodos y cladoceranos (crustáceos)), disminuyó aproximadamente un 50 % en los años noventa respecto a los ochenta (Casini y cols., 2008). Al mismo tiempo se duplicó la biomasa de fitoplancton estimada mediante las concentraciones de clorofila en el agua (figura 26). Asimismo, la biomasa de fitoplancton en las aguas superficiales del mar de Gotland durante la proliferación de primavera de marzo a mayo aumentó considerablemente entre los años ochenta y los noventa (figura 27) (Wasmund y cols., 1998). 49 Departamento Temático de Políticas Estructurales y de Cohesión Existen firmes pruebas circunstanciales de que los cambios de composición de la comunidad de peces también han afectado a los niveles tróficos del mar Báltico (Österblom y cols., 2007, Casini y cols., 2008). Antes que nada, entre 1974 y 2006, la biomasa de bacalao y la de espadín, la biomasa de espadín y la de zooplancton y la biomasa de zooplancton y de fitoplancton presentaban relaciones inversas significativas entre sí (datos de Casini y cols. (2008), utilizando la biomasa de zooplancton y fitoplancton del mar de Gotland, situado al sur del Báltico, cuadro 3). Aparte de ello, como se predice para una cascada trófica, los niveles tróficos no adyacentes presentaban relaciones positivas, pues la reducida biomasa de bacalao coincidía con la reducida biomasa de zooplancton, mientras que la gran biomasa de espadín coincidía con la gran biomasa de fitoplancton. En segundo lugar, Casini y cols. (2008) compararon el efecto que tiene cada nivel trófico superior en el nivel trófico inferior con el efecto de diversas variables medioambientales, como la temperatura, la salinidad y las variaciones del clima en general (índice de invierno de la oscilación del Atlántico norte). Esta comparación mostró constantemente que la biomasa o abundancia del nivel trófico superior era el principal factor que explica la variación del nivel trófico inferior, ya que la abundancia de bacalao explicaba un 90 % de la variación anual del espadín; la abundancia del espadín explicaba un 83 % de la variación anual de la biomasa de zooplancton, y la biomasa de zooplancton explicaba un 91 % de la variación anual de fitoplancton (figuras 28 y 29). En conclusión, el descenso del bacalao ha provocado un aumento masivo del espadín en las aguas abiertas del Báltico debido a la reducción de la presión de los depredadores, y es probable que haya generado una cascada trófica con menores biomasas de zooplancton y mayores biomasas de fitoplancton en general a partir de los primeros años noventa. El aumento de la biomasa de fitoplancton coincide con un pronunciado aumento de la intensidad de las proliferaciones de primavera (figura 27), y en los años noventa y la primera década de este siglo se observó una mayor frecuencia e intensidad de las proliferaciones de cianobacterias en el mar Báltico (figura 5) (Kahru y cols., 1994; Poutanen y Nikkila, 2001; Hansson, 2005; HELCOM, 2009). De este modo, las pruebas colectivas apuntan firmemente a que la sobreexplotación del bacalao ha contribuido en general a un aumento de las proliferaciones de algas. Figura 25: Tendencias de las poblaciones de peces dominantes en el mar Báltico 2 6 Atlantic cod Sprat 5 4 1 3 2 0.5 1 0 1970 1980 1990 Fuente: Eriksson y cols. (2011) 50 2000 0 2010 #sprat 1010 # cod 109 1.5 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Figura 26: Biomasa del zooplancton y del fitoplancton en el mar de Gotland, al sur del Báltico. 4 700 zooplankton 600 phytoplankton 3 500 400 2 300 200 1 100 0 1970 1980 1990 Chlorophyll a (mg dm‐3) zooplankton biomass (mg m‐3) 800 0 2010 2000 Fuente: Casini y cols. (2008) Figura 27: Intensidad de la proliferación de primavera en el mar de Gotland, al sur del Báltico. Biomasa media de fitoplancton entre 0 y 10 metros de profundidad. mean biomass (wt mg m3) 2500 2000 spring bloom intensity 1500 1000 500 0 1970 1980 1990 2000 2010 Fuente: Wasmund y cols. (1998) Cuadro 3: Relación entre los niveles tróficos adyacentes en el mar Báltico entre 1974 y 2006. La biomasa de bacalao y espadín corresponden a estimaciones totales del mar Báltico, mientras que la biomasa de zooplancton y fitoplancton proceden de los datos de seguimiento del sur del mar Báltico (mar de Gotland). Número (n) Coeficiente de correlación (r) Relación entre la biomasa de bacalao y la de espadín 33 -0,60 Relación entre la biomasa de bacalao y la de zooplancton 33 0,46 Relación entre la biomasa de espadín y la de zooplancton 33 -0,53 Relación entre la biomasa de espadín y la de fitoplancton 28 0,62 Relación entre la biomasa de zooplancton y la de fitoplancton 28 -0,47 Fuente: Casini y cols. (2008) 51 Departamento Temático de Políticas Estructurales y de Cohesión Figura 28: Importancia relativa de los diferentes factores biológicos y medioambientales para determinar la densidad del espadín en el mar Báltico. Modelo GLM que utiliza selección inversa con la C de Mallows como criterio de selección; para más información, véase la publicación original. sprat abundance cod abundance temperature salinity NAO winter index food availability adults food availability juveniles sprat biomass cod biomass temperature salinity NAO winter index food availability adults food availability juveniles Fuente: Casini y cols. (2008) 52 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Figura 29: Importancia relativa de los diferentes factores biológicos y medioambientales para determinar la densidad de zooplancton y fitoplancton en el sur del mar Báltico. Modelo GLM que utiliza selección inversa con la C de Mallows como criterio de selección; para más información, véase la publicación original. zooplankton biomass sprat biomass temperature salinity NAO winter index phytoplankton prey availability zooplankton abundance sprat abundance temperature salinity NAO winter index phytoplankton prey availability phytoplankton biomass zooplankton biomass temperature salinity NAO winter index nutrient availability Fuente: Casini y cols. (2008) 4.6. El mar Báltico – estudio del caso de aguas costeras Al igual que en el Kattegat, existen sólidos indicios de que las proliferaciones de algas filamentosas han aumentado en la costa central del mar Báltico como consecuencia directa de la pesca de bacalao en alta mar, pero en este caso junto con descensos a escala 53 Departamento Temático de Políticas Estructurales y de Cohesión local de las poblaciones costeras de perca y lucio (Eriksson y cols., 2009; Ljunggren y cols., 2010; Eriksson y cols., 2011; Sieben y cols., 2011a, 2011b). Desde 1990 se ha producido un descenso continuo de la capturas de los grandes depredadores dominantes de la costa: la perca europea (Perca fluviatilis) y el lucio (Esox lucius) a lo largo de la costa sueca del Báltico estricto (figuras 30 y 31). El descenso de la perca y el lucio tiene carácter local, ya que las poblaciones en algunas zonas parecen estar en buen estado, mientras que han desaparecido totalmente en otras. Esto concuerda con los problemas de reproducción que se concentran en las zonas insulares abiertas, mientras que las zonas protegidas a lo largo de la costa parecen favorecer tanto la reproducción como la existencia de grandes poblaciones de estas especies. En consecuencia, el seguimiento a largo plazo del brazo de Kalmar, una zona insular abierta situada en la costa báltica de Suecia, muestra un descenso generalizado de los grandes depredadores, incluida una antigua gran población costera de bacalao (figura 32) (Eriksson y cols., 2011). Así pues, los cambios estructurales de la comunidad de peces en aguas abiertas del Báltico también han afectado a las zonas cercanas a la costa. En los años setenta y ochenta se registraba una alta abundancia de bacalao cerca de la costa, pero esta especie ha desaparecido desde principios de los años noventa. Actualmente, el picón de tres púas (Gasterosteus aculeatus), un pequeño pez depredador que se alimenta de mesoherbívoros crustáceos y gasterópodos, domina completamente numerosas comunidades costeras protegidas (Eriksson y cols., 2009; Ljunggren y cols., 2010). El picón se encuentra subrepresentado en los programas de seguimiento costero debido a que la mayoría de ellos migran a alta mar tras el período de reproducción en verano y están presentes sobre todo de mayo a junio (datos no publicados). Sin embargo, sondeos acústicos en alta mar muestran que la población de picón aumentó de forma exponencial entre 2006 y 2010 (figura 33) (Ljunggren y cols., 2010). Así pues, un fuerte aumento de la población de picón puede deberse tanto a la disminución de la presión de los depredadores a causa del debilitamiento de las poblaciones costeras de bacalao, perca y lucio, como al descenso de las poblaciones de bacalao en alta mar. Existen pruebas de que la gran abundancia de picón se debe a la disminución de las poblaciones de perca y lucio, y de que este cambio de composición de la comunidad de peces favorece indirectamente las proliferaciones de algas filamentosas. No se ha realizado un seguimiento de los herbívoros invertebrados ni existen series temporales de datos sobre algas filamentosas de duración suficiente para analizar tendencias temporales. Sin embargo, el desarrollo de algas filamentosas y la abundancia de picón a lo largo de la costa sueca del Báltico aumentan con la disminución de la abundancia de perca y lucio (Eriksson y cols., 2009). En zonas de escasa abundancia de perca y lucio, el picón domina las comunidades de peces y casi un 50 % de las bahías de aguas poco profundas están cubiertas de algas filamentosas (figura 34). En zonas con una gran abundancia de perca y lucio, los picones escasean y tan sólo un 10 % de las bahías están cubiertas de estas algas. Algunos experimentos realizados en el mar Báltico demuestran igualmente la existencia de un vínculo causal entre depredadores costeros y algas. En una bahía infestada de picones que a menudo está cubierta de algas filamentosas, una manipulación a gran escala para retirar miles de picones de cercados de 20 x 30 m hizo que la reproducción de algas filamentosas se redujera un 60 %. En una zona con una población de depredadores sana, una serie de experimentos a pequeña escala con jaulas demostraron igualmente que la exclusión de la perca y el lucio hizo que la abundancia de picón aumentara varias veces. Este aumento hizo que disminuyera la presión de los herbívoros sobre las algas y, en consecuencia, la biomasa de algas filamentosas aumentó entre un 100 % y un 300 %. Por otra parte, la influencia que tiene la eliminación de la perca y el lucio sobre la producción de algas filamentosas se ve reforzada considerablemente por el enriquecimiento con 54 ¿Favorece la sobreexplotación pesquera la proliferación de algas? nutrientes (figura 35) (Sieben y cols., 2011b), lo que indica que el descenso de los depredadores y el enriquecimiento con nutrientes contribuyen conjuntamente al problema de la capas de algas filamentosas. En conclusión, la sobreexplotación y la eutrofización promueven conjuntamente el desarrollo de las proliferaciones de algas filamentosas en las zonas costeras del mar Báltico. Durante los años noventa, los episodios de capas de algas a la deriva se convirtieron en un problema más común (Vahteri y cols., 2000). Ahora se registran periódicamente tanto un aumento del crecimiento de las algas filamentosas proliferantes como problemas con dichas capas en las zonas costeras del mar Báltico (Bonsdorff y cols., 1997; Bonsdorff y cols., 2002). Figura 30: Descenso de la población de perca en la costa sueca al sur del mar Báltico 120 perch 100 monitoring # cpue Landings Area 27 80 2 60 40 1 20 0 1994 1996 1998 2000 2002 2004 2006 commercial landings tons 3 Mönsterås gilnet monitoring 0 2008 Fuente: Ljunggren y cols. (2010) Figura 31: Descenso de la población de lucio en la costa sueca al sur del mar Báltico 0.2 pike Landings Area 27 monitoring # cpue 0.15 60 50 40 0.1 30 20 0.05 10 0 1994 1996 1998 2000 2002 2004 Fuente: Ljunggren y cols. (2010) 55 2006 0 2008 commercial landings tons 70 Mönsterås gilnet monitoring Departamento Temático de Políticas Estructurales y de Cohesión Figura 32: Tendencias de la abundancia de grandes peces depredadores costeros en Kalmar, al sur del mar Báltico. 2500 # larger predatory fish cpue Perch 2000 Pike Atlantic cod 1500 1000 500 0 1970 1980 1990 2000 Fuente: Eriksson y cols. (2011) Figura 33: Tendencias de la abundancia de bacalao, espadín y picón en alta mar. Atlantic cod Sprat Stickleback 6 5 # cod 109 1.5 4 3 1 2 0.5 1 0 1970 1980 1990 Fuente: Eriksson y cols. (2011) 56 2000 0 2010 #sprat 1010 #stickleback 104 2 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Figura 34: Abundancia de picón por red de arrastre manual y porcentaje de la superficie cubierta de algas filamentosas en función de la densidad de depredadores de nivel superior. A) Bahías en las que han desaparecido las poblaciones de perca y lucio = escasa abundancia de depredadores de nivel superior, y B) bahías con poblaciones sanas de perca y lucio = gran abundancia de depredadores de nivel superior. Number cpue 1000 Sticklebacks 500 0 A) Low B) High Overgrown plots (%) 60 50 Filamentous algae in August 40 30 20 10 0 A) Low B) High Fuente: Eriksson y cols. (2009) Figura 35: La eliminación de la perca y el lucio, junto con la eutrofización, aumentan el desarrollo de las algas filamentosas proliferantes 200 No nutrient addition Volume dm3 per m2 150 Nutrient enriched 100 50 0 Large fish excluded Large fish present Fuente: Sieben y cols. (2011), datos no publicados 57 Departamento Temático de Políticas Estructurales y de Cohesión 58 ¿Favorece la sobreexplotación pesquera la proliferación de algas? 5. CONCLUSIONES Y RECOMENDACIÓN En la presente revisión se presentan pruebas sólidas de que la sobreexplotación de los grandes peces depredadores de nivel superior contribuye a aumentar la frecuencia o intensidad de las proliferaciones de algas en Europa: La proliferación de algas es un fenómeno natural controlado por una serie de factores medioambientales. Sin embargo, la sobreexplotación pesquera contribuye a agravar el problema del desarrollo de la proliferación de algas al debilitar un importante control biológico del crecimiento excesivo. Ello se debe a que la pesca, al eliminar los depredadores de nivel superior, produce cambios en las configuraciones de las cadenas alimenticias, que por lo general favorecen a los peces pequeños y provocan un descenso de la abundancia de los herbívoros que consumen algas, como el zooplancton y los herbívoros invertebrados. Junto con factores abióticos, los herbívoros controlan el desarrollo de la biomasa de las algas y cuando se reducen estos, la proliferación de algas se desarrolla con mayor facilidad. De este modo, los efectos de la pesca en las proliferaciones de algas varían en función de los sistemas, la temporada y el año. Este aspecto es importante, porque dificulta la detección y gestión de los efectos de la pesca en las proliferaciones de algas. Las respuestas de las algas no presentan una relación lineal con los depredadores de nivel superior, pero también dependen de otras circunstancias que pueden incrementar o debilitar los efectos de la sobreexplotación pesquera. De esta manera, el acceso a datos comparativos de larga duración, que incluyan todos los niveles tróficos de la cadena alimenticia marina, es importante para averiguar hasta qué punto la pesca contribuye a las proliferaciones de algas. En el mar Báltico y el mar Negro, la sobreexplotación pesquera ha modificado las configuraciones de los ecosistemas y es muy probable que la sobreexplotación pesquera haya contribuido a aumentar el problema de la proliferación de algas nocivas: Aunque la ecología y la regulación de la proliferación de algas son complejas, existen pruebas circunstanciales sólidas que señalan que la sobreexplotación ha contribuido a aumentar el problema de las proliferaciones de algas y, al mismo tiempo, ha reducido las poblaciones de grandes peces depredadores comerciales y aumentado a gran escala la biomasa de algas y las proliferaciones de algas nocivas en diversos mares europeos. Los análisis de series temporales del mar Báltico y el mar Negro y los episodios coincidentes indican a todas luces que la sobreexplotación ha contribuido a aumentar el problema y los costes económicos de las proliferaciones de algas. En particular, las tendencias observadas en el mar Negro revelan que los efectos perjudiciales de la sobreexplotación pesquera en alta mar se extienden actualmente a los ecosistemas costeros y provocan problemas de calidad del agua y la pérdida de hábitats en las zonas cercanas a la costa. Carecemos de datos sobre la tendencia de la proliferación de algas en el Kattegat, pero algunos experimentos señalan que el descenso documentado a largo plazo de las poblaciones costeras y de alta mar de bacalao ha tenido efectos perjudiciales sobre las comunidades de vegetación marina debido al aumento de la proliferación de algas filamentosas. Los modelos y el análisis de los datos disponibles correspondientes al mar del Norte predicen el aumento de la masa de algas debido a cambios documentados en la estructura de la comunidad de peces provocados por la pesca. Existe en general una falta de análisis tendenciales que incluyan a más de un grupo de organismos de diferentes cuencas marinas europeas, pero se han señalado problemas tanto con la sobreexplotación pesquera como la proliferación de algas. Ello indica que falta información importante, ya que no hay datos disponibles para realizar referencias cruzadas. 59 Departamento Temático de Políticas Estructurales y de Cohesión Los análisis de los ecosistemas del mar Báltico y el mar del Norte ilustran que para conocer los efectos de la pesca es preciso estudiar las relaciones entre los niveles tróficos. La sobreexplotación pesquera y la eutrofización generan efectos sinérgicos: un doble problema Los cambios en las comunidades de los depredadores de nivel superior y la proliferación de algas coinciden con la eutrofización. No cabe duda de que la eutrofización a escala europea ha promovido la proliferación de algas, pero posteriormente los efectos de los cambios en la composición de la comunidad de peces han venido a agravar el problema de la proliferación de algas nocivas. Por ejemplo, los problemas que representan los fondos anóxicos que genera el aumento de la producción de algas en el mar Báltico se multiplicaron al inicio de la eutrofización en los años sesenta y setenta. Sin embargo, en las últimas décadas, el consumo de los herbívoros describe la variación anual de la biomasa de fitoplancton mucho mejor que los nutrientes (una biomasa de zooplancton reducida = una gran biomasa de fitoplancton; figura 29). Así pues, en el actual estado rico en nutrientes del mar Báltico, la sobreexplotación pesquera ha contribuido al aumento de la biomasa de algas. Por otra parte, experimentos realizados sobre el terreno demuestran claramente que la proliferación de algas filamentosas se ve facilitada tanto por los nutrientes como por la eliminación de los peces depredadores de nivel superior, y que actúan de forma concertada, de modo que el efecto combinado de los nutrientes y la eliminación de los depredadores resulta a menudo varias veces superior al efecto que cada uno de ellos tendría por separado. La proliferación de algas de alta densidad en la costa es la que presenta una mayor relación con la sobreexplotación pesquera No existen pruebas concluyentes de que algunas especies o tipos de proliferaciones de algas sean más o menos sensibles a los cambios de composición de las comunidades de peces. Sin embargo, los datos disponibles indican algunas tendencias de carácter general. Entre las proliferaciones de algas nocivas, las proliferaciones no tóxicas de alta densidad son las más sensibles a la sobreexplotación pesquera, ya que las proliferaciones tóxicas o no comestibles deberían ser menos sensibles a la presión de los herbívoros. Por consiguiente, las pruebas concluyentes más sólidas de los efectos de la sobreexplotación pesquera proceden de las bahías costeras, en las que el descenso de los grandes peces depredadores promueve las proliferaciones no tóxicas de algas filamentosas. Los resultados de modelos basados en los conocimientos disponibles sobre mares costeros templados y los datos correspondientes al mar del Norte muestran igualmente que las grandes diatomeas y dinoflagelados no tóxicos son los principales grupos que aumentan con la sobreexplotación de los grandes peces depredadores. Así pues, la sobreexplotación debería promover ante todo las proliferaciones de algas de alta densidad y provocar problemas como consecuencia de 1) las capas de algas a la deriva, 2) la producción de mucílago y espuma, y 3) la anoxia posterior a las proliferaciones. No obstante, el análisis de la cadena alimenticia del mar del Norte realizado por Vasas y cols. (2007) muestra igualmente que la pesca intensiva puede generar efectos inesperados al modificar las jerarquías competitivas entre algas y planctívoros. Los resultados indican que, si se permite que la pesca comercial sustituya las capturas de grandes peces depredadores por la pesca intensiva de pequeños peces planctívoros —reducción de la cadena alimenticia mediante la pesca—, se promueven las proliferaciones de algas tóxicas y medusas. Este fenómeno puede observarse igualmente en la cadena alimenticia del mar Negro, donde las medusas se incrementaron drásticamente tras el colapso de una pesca intensiva de la anchoa en los años noventa. 60 ¿Favorece la sobreexplotación pesquera la proliferación de algas? La sobreexplotación pesquera favorece ante todo la proliferación de algas cuando se centra en una sola especie que domina la abundancia y la función de la comunidad de peces Los efectos que tiene la eliminación de los depredadores en las especies presa generalmente son mucho más pronunciados si la comunidad de depredadores está dominada por una sola especie. Este es un resultado típico de los casos de estudio europeos mejor descritos. En el mar Báltico y el Kattegat, estos efectos están relacionados con el descenso de un depredador único, el bacalao, que dominaba las comunidades de depredadores demersales de nivel superior. En el mar Negro, un mayor número de depredadores de nivel superior participaron en los cambios iniciales de los ecosistemas en los años sesenta y setenta. Sin embargo, los efectos más pronunciados en los ecosistemas, incluido el aumento de las algas, se generaron cuando la comunidad de pequeños peces pelágicos colapsó en torno a 1990. Esta comunidad estaba dominada por una sola especie de anchoa, que fue objeto de una intensa explotación. Todo ello indica que es necesario incluir la biodiversidad como estrategia de gestión, ya que el mantenimiento de una pesca diversificada y de una comunidad rica en especies de peces protegerá los sistemas marinos contra los efectos en cascada perjudiciales que favorecen las proliferaciones de algas. La proliferación de algas nocivas tiene efectos negativos en la pesca europea. El coste total estimado de la proliferación de algas nocivas para la pesca europea se cifra como mínimo en 177 millones de euros anuales. Esta cifra incluye los efectos negativos en la pesca comercial, las pérdidas para el sistema de protección social y el coste del análisis de las proliferaciones de algas para detectar intoxicación de alimentos marinos. La proliferación de algas tóxicas tiene altos costes para el sector de la acuicultura. Las pérdidas directas de productos comercializables del sector de los moluscos oscilan entre 15 y 62 millones de euros al año. Las proliferaciones de alta densidad causan problemas a todos los tipos de pesca costera. Las capas de algas a la deriva y las proliferaciones que forman mucílago interfieren con los aparejos de pesca y hacen que estos resulten menos eficaces. La anoxia posterior a la proliferación produce una gran mortalidad tanto en la acuicultura como en las poblaciones de peces silvestres. La anoxia interfiere igualmente en la reproducción a lo largo de la costa, que es una de las principales zonas de reproducción de numerosas poblaciones de peces de alta mar. En el mar Báltico, el aumento de la anoxia en los fondos marinos puede incluso interferir en la reproducción del bacalao en alta mar. Recomendación: una gestión basada en el ecosistema La presente revisión demuestra que la gestión tradicional de los recursos marinos tiene graves limitaciones, ya que a menudo ignora las interacciones tanto dentro de las cadenas alimenticias, como entre las cadenas alimenticias de alta mar y las costeras. Los efectos en cascada de la sobreexplotación alteran las relaciones entre depredadores y presas y de este modo aumentan la frecuencia e intensidad de la proliferación de algas nocivas, lo que a su vez afecta a la rentabilidad del sector pesquero y puede generar efectos negativos a largo plazo en las poblaciones que tienen una importancia comercial. De este modo, las respuestas negativas pueden ser perjudiciales para la sostenibilidad a largo plazo de los recursos marinos. Sin embargo, el coste de la pesca no se limita al sector pesquero, sino que también afecta a las comunidades costeras en las que el incremento de los problemas que causa la proliferación de algas provoca importantes pérdidas en los ingresos obtenidos con el turismo y costes relacionados con los efectos negativos en la salud humana. Las pruebas indican que una gestión basada en el ecosistema (EBM) es necesaria para ofrecer una mejor plataforma para la gestión integrada de la pesca y las costas. Los dos principales objetivos de la futura EBM deberían ser: 1) la incorporación de los efectos que tiene en los ecosistemas la explotación de los niveles tróficos superiores, y 2) consideraciones 61 Departamento Temático de Políticas Estructurales y de Cohesión territoriales que incluyan los flujos entre los hábitats de alta mar y costeros, lo cual tiene dos consecuencias inmediatas: En primer lugar, al reconocer los efectos que tiene la pesca en los ecosistemas, una primera medida necesaria será modificar los objetivos de gestión. Es preciso recuperar las poblaciones de depredadores, no solo para maximizar la producción de las especies de captura, sino también para que alcancen niveles que permitan restaurar su función ecológica en las cadenas alimenticias tanto costeras como de alta mar. Ello implica aumentar la abundancia de los peces depredadores de nivel superior hasta restaurar su control de los niveles tróficos inferiores, lo que incluye reforzar el control que ejercen los herbívoros sobre las algas proliferantes. En segundo lugar, al reconocer la existencia de importantes flujos entre los hábitats costeros y los de alta mar se pondrá de manifiesto la interdependencia entre los diferentes objetivos de los distintos sectores de gestión, que han estado tradicionalmente separados, como la importancia de restaurar la función de las poblaciones de peces de alta mar para mejorar la calidad del agua al limitar las proliferaciones de algas nocivas, y la importancia de mejorar la protección de los valiosos hábitats costeros para la reproducción de numerosas poblaciones de peces comerciales de alta mar. 62 ¿Favorece la sobreexplotación pesquera la proliferación de algas? REFERENCIAS Alheit J., Möllmann C., Dutz J., Kornilovs G., Loewe P., Mohrholz V., Wasmund N., 2005. Synchronous ecological regime shifts in the central Baltic and the North Sea in the late 1980s. ICES Journal of Marine Science 62, 1205-1215. Alheit J., Niquen, M., 2004. Regime shifts in the Humboldt Current ecosystem. Progress in Oceanography 60, 201-222. Baden S., Bostrom C., Tobiasson S., Arponen H., Moksnes P.O., 2010. Relative importance of trophic interactions and nutrient enrichment in seagrass ecosystems: A broad-scale field experiment in the Baltic-Skagerrak area. Limnology and Oceanography 55, 1435-1448. Baden S., Emanuelsson A., Pihl L., Svensson C.J., Åberg P., 2011. Shift in seagrass food web structure over decades linked to overfishing. Reunión de Ciencias Acuáticas de la ASLO, 13 a 18 de febrero de 2011, San Juan, Puerto Rico, Estados Unidos. Baden S., Gullstrom M., Lunden B., Pihl L., Rosenberg R., 2003. Vanishing seagrass (Zostera marina, L.) in Swedish coastal waters. Ambio 32, 374-377. Beaugrand G., 2004. The North Sea regime shift: evidence, causes, mechanisms and consequences. Progress in Oceanography 60, 245-262. Bonsdorff E., Blomqvist E. M., Mattila J., Norkko A., 1997. Coastal eutrophication: causes, consequences and perspectives in the archipelago areas of the northern Baltic Sea. Estuarine, Coastal and Shelf Science 44, 63-72. Bonsdorff E., Ronnberg C., Aarnio, K., 2002. Some ecological properties in relation to eutrophication in the Baltic Sea. Hydrobiologia 475, 371-377. Borer E.T., Halpern B.S., Seabloom E.W., 2006. Asymmetry in community regulation: Effects of predators and productivity. Ecology 87, 2813-2820. Borer E.T., Seabloom E.W., Shurin J.B., Anderson K.E., Blanchette C.A., Broitman B., Cooper S.D., Halpern B.S., 2005. What determines the strength of a trophic cascade? Ecology 86, 528-537. Breitburg D., 2002. Effects of hypoxia, and the balance between hypoxia and enrichment, on coastal fishes and fisheries. Estuaries 25, 767-781. Burkholder J.M., Azanza R.V., Sako Y., 2006. The ecology of harmful dinoflagellates. In: Graneli E., Turner J.T. (editors). Ecology of harmful algal blooms. Springer. Carpenter S.R., Cole J.J., Hodgson J.R., Kitchell J.F., Pace M.L., Bade D., Cottingham K.L., Essington T.E., Houser J.N., Schindler D.E., 2001. Trophic cascades, nutrients, and lake productivity: whole-lake experiments. Ecological Monographs 71, 163-186. Carpenter S.R., Kitchell J.F., Hodgson J.R., 1985. Cascading Trophic Interactions and Lake Productivity. Bioscience 35, 634-639. Casini M., Lovgren J., Hjelm J., Cardinale M., Molinero J.C., Kornilovs G., 2008. Multilevel trophic cascades in a heavily exploited open marine ecosystem. Proceedings of the Royal Society B-Biological Sciences 275, 1793-1801. Christensen N.L., Bartuska A.M., Brown J.H., Carpenter S., Dantonio C., Francis R., Franklin J.F., MacMahon J.A., Noss R.F., Parsons D.J., Peterson C.H., Turner M.G., Woodmansee R.G., 1996. The report of the ecological society of America committee on the scientific basis for ecosystem management. Ecological Applications 6, 665-691. Christensen V., Guenette S., Heymans J.J., Walters C.J., Watson R., Zeller D., Pauly D., 2003. Hundred-year decline of North Atlantic predatory fishes. Fish and Fisheries 4, 124. 63 Departamento Temático de Políticas Estructurales y de Cohesión CIEM, 2010. Report of the Baltic Fisheries Assessment Working Group (WGBFAS). ICES CM 2010/ACOM, 10. Cloern J.E., 2001. Our evolving conceptual model of the coastal eutrophication problem. Marine Ecology Progress Series 210, 223-253. Dahl E., Bagoien E., Edvardsen B., Stenseth N.C., 2005. The dynamics Chrysochromulina species in the Skagerrak in relation to environmental conditions. Daskalov G.M., 2002. Overfishing drives atrophic cascade in the Black Sea. Daskalov G.M., Grishin A.N., Rodionov S., Mihneva V., 2007. Trophic cascades triggered by overfishing reveal possible mechanisms of ecosystem regime shifts. Proceedings of the National Academy of Sciences of the United States of America 104, 10518-10523. de Boer M.K., 2006. Fibrocapsa japonica (Raphidophyceae) in Dutch coastal waters. Universidad de Groninga, Groninga. Degobbis D., 1989. Increased eutrophication of the northern Adriatic Sea - 2nd act. Marine Pollution Bulletin 20, 452-457. ECOHARM, 2003. The socio-economic impact of harmful algal blooms in European marine waters. http://www.bom.hik.se/ecoharm/index.html. Edvardsen B., Imai I., 2006. The ecology of harmful flagellates. En: Graneli E., Turner J.T. (encargados de la edición). Ecology of harmful algal blooms. Springer. Elmhagen B., Rushton S.P., 2007. Trophic control of mesopredators in terrestrial ecosystems: top-down or bottom-up? Ecology Letters 10, 197-206. Eriksson B.K., Ljunggren L., Sandstrom A., Johansson G., Mattila J., Rubach A., Raberg S., Snickars M., 2009. Declines in predatory fish promote bloom-forming macroalgae. Ecological Applications 19, 1975-1988. Eriksson B.K., Rubach A., Hillebrand H., 2007. Dominance by a canopy forming seaweed modifies resource and consumer control of bloom-forming macroalgae. Oikos 116, 1211-1219. Eriksson B.K., Sieben K., Eklöf J., Ljunggren L., Olsson J., Casini M., Bergström U., 2011. Effects of altered offshore food webs on coastal ecosystems emphasizes the need for cross-ecosystem management. Ambio 40, 786-797. Estes J.A., Tinker M.T., Williams T.M., Doak D.F., 1998. Killer whale predation on sea otters linking oceanic and nearshore ecosystems. Science 282, 473-476. Fallesen G., Andersen F., Larsen B., 2000. Life, death and revival of the hypertrophic Mariager Fjord, Denmark. Journal of Marine Systems 25, 313-321. Finni T., Kononen K., Olsonen R., Wallstrom K., 2001. The history of cyanobacterial blooms in the Baltic Sea. Ambio 30, 172-178. Frank K.T., Petrie B., Choi J.S., Leggett W.C., 2005. Trophic cascades in a formerly coddominated ecosystem. Science 308, 1621-1623. Frank K.T., Petrie B., Shackell N.L., 2007. The ups and downs of trophic control in continental shelf ecosystems. Trends in Ecology and Evolution 22, 236-242. Glibert P.M., Burkholder J.M., 2006. The complex relation between increases in fertilization of the earth, coastal eutrophication and profiliation of harmful algal blooms. En: Graneli E., Turner J.T. (editors). Ecology of harmful algal blooms. Springer. Granéli E., Paasche E., Maestrini S.Y., 1996. Three years after the Chrysochromulina polylepis bloom in Scandinavian waters in 1988: Some conclusions of recent research and monitoring. En: Smayda T.J., Shimizu Y. (encargados de la edición). Toxic Phytoplankton Blooms in the Sea. Elsevier. 64 of ¿Favorece la sobreexplotación pesquera la proliferación de algas? Graneli E., Turner J.T., 2006. Ecology of harmful algal blooms. Springer. Gruner D. S., Smith J.E., Seabloom E.W., Sandin S.A., Ngai J.T., Hillebrand H., Harpole W.S., Elser J.J., Cleland E.E., Bracken M.E.S., Borer E.T., Bolker B.M., 2008. A crosssystem synthesis of consumer and nutrient resource control on producer biomass. Ecology Letters 11, 740-755. Hallegraeff G.M. 1993. A review of harmful algal blooms and their apparent global increase. Phycologia 32, 79-99. Hansson M., 2005. Cyanobakterieblomningar i Östersjön, resultat från satellitövervakning 1997-2005. 0283-7714 ICES, Sveriges Meteorologiska och Hydrologiska Institut, Oceanografiska enheten, Gotemburgo. Hansson M., Öberg J., 2009. Cyanobacterial blooms in the Baltic Sea. Instituto Sueco de Meteorología e Hidrología. Heisler J., Glibert P.M., Burkholder J.M., Anderson D.M., Cochlan W., Dennison W.C., Dortch Q., Gobler C.J., Heil C.A., Humphries E., Lewitus A., Magnien R., Marshall H.G., Sellner K., Stockwell D.A., Stoecker D.K., Suddleson M., 2008. Eutrophication and harmful algal blooms: A scientific consensus. Harmful Algae 8, 3-13. HELCOM, 2009. Eutrophication in the Baltic Sea - An integrated thematic assessment of the effects of nutrient enrichment ansd eutrophication in the Baltic Sea region. Baltic Sea Environmental Proceedings 115B. Hinder S.L., Hays G.C., Brooks C.J., Davies C.J., Edwards M., Walne A.W., Gravenor M. B., 2011. Toxic marine microalgae and shellfish poisoning in the British Isles: history, review of epidemiology, and future implications. Environmental Health 10. Hoagland P., Anderson D.M., Kaoru Y., White A.W., 2002. The economic effects of harmful algal blooms in the United States: Estimates, assessment issues, and information needs. Estuaries 25, 819-837. Hoagland P., Scatasta S., 2006. The economic effects of harmful algal blooms. En: Graneli E., Turner J.T. (encargados de la edición). Ecology of harmful algal blooms. Springer. Hopcraft J.G. C., Olff H., Sinclair A.R.E., 2010. Herbivores, resources and risks: alternating regulation along primary environmental gradients in savannas. Trends in Ecology and Evolution 25, 119-128. Jackson J.B.C., Kirby M.X., Berger W.H., Bjorndal K.A., Botsford L.W., Bourque B.J., Bradbury R.H., Cooke R., Erlandson J., Estes J.A., Hughes T.P., Kidwell S., Lange C.B., Lenihan H.S., Pandolfi J.M., Peterson C.H., Steneck R.S., Tegner M.J., Warner R.R., 2001. Historical overfishing and the recent collapse of coastal ecosystems. Science 293, 629-638. Kahru M., Horstmann U., Rud O., 1994. Satellite detection of increased cyanobacteria blooms in the Baltic Sea - natural fluctuation or ecosystem change? Ambio 23, 469-472. Kideys A.E., 1994. Recent dramatic changes in the Black Sea ecosystem - the reason for the sharp decline in Turkis anchovy fisheries. Journal of Marine Systems 5, 171-181. Lancelot C., Billen G., Sournia A., Weisse T., Colijn F., Veldhuis M.J.W., Davies A., Wassman P., 1987. Phaeocystis blooms and nutrient enrichment in the continental coastal zones of the North Sea. Ambio 16, 38-46. Lancelot C., Keller M.D., Rousseau V., Smith Jr. W.O., Mathot S., 1998. Autecology of the marine Haptophyte Phaeocystis sp. En: D.M. Anderson, A.D. Cembella, G.M. Hallegraeff (encargados de la edición). Physiological Ecology of Harmful Algal Blooms. NATO ASI Series, Springer-Verlag, Berlín, 209-224. 65 Departamento Temático de Políticas Estructurales y de Cohesión Leggett W.C., Frank K.T., 2008. Paradigms in fisheries oceanography. Oceanography and Marine Biology: an Annual Review, 46. Ljunggren L., Sandstrom A., Bergstrom U., Mattila J., Lappalainen A., Johansson G., Sundblad G., Casini M., Kaljuste O., Eriksson B.K., 2010. Recruitment failure of coastal predatory fish in the Baltic Sea coincident with an offshore ecosystem regime shift. ICES Journal of Marine Science 67, 1587-1595. Maestrini S.Y., Graneli E., 1991. Environmental conditions and ecophysiological mechanisms which led to the 1988 chrysochromulina-polylepis bloom - an hypothesis. Oceanologica Acta 14, 397-413. McQuatters-Gollop A., Raitsos D.E., Edwards M., Pradhan Y., Mee L.D., Lavender S.J., Attrill M.J., 2007. A long-term chlorophyll data set reveals regime shift in North Sea phytoplankton biomass unconnected to nutrient trends. Limnology and Oceanography 52, 635-648. Menge B.A., 2000. Top-down and bottom-up community regulation in marine rocky intertidal habitats. Journal of Experimental Marine Biology and Ecology 250, 257-289. Moksnes P.-O., Gullstrom M., Tryman K., Baden S., 2008. Trophic cascades in a temperate seagrass community. Oikos 117, 763-777. Möllmann C., Muller-Karulis B., Kornilovs G., St John M.A., 2008. Effects of climate and overfishing on zooplankton dynamics and ecosystem structure: regime shifts, trophic cascade, and feedback coops in a simple ecosystem. ICES Journal of Marine Science 65, 302-310. Mountain D.G., Kane J., 2010. Major changes in the Georges Bank ecosystem, 1980s to the 1990s. Marine Ecology Progress Series 398, 81-91. Nastasi A., 2010. Algal and Jellyfish Blooms in the Mediterranean and Black Sea: a brief review. In: GFCM Workshop on Algal and Jellyfish Blooms in the Mediterranean and Black Sea: a brief review, Estambul, Turquía. Newcombe E.M., Taylor R.B., 2010. Trophic cascade in a seaweed-epifauna-fish food chain. Marine Ecology Progress Series 408, 161-167. Norderhaug K.N., Christie H., Fossa J.H., Fredriksen S., 2005. Fish-macrofauna interactions in a kelp (Laminaria hyperborea) forest. Journal of the Marine Biological Association of the United Kingdom 85, 1279-1286. Oksanen L., Oksanen, T., 2000. The logic and realism of the hypothesis of exploitation ecosystems. American Naturalist 155, 703-723. Olsson P., Folke C., Hughes T.P., 2008. Navigating the transition to ecosystem-based management of the Great Barrier Reef, Australia. Proceedings of the National Academy of Sciences of the United States of America 105, 9489-9494. Organización Mundial de la Salud, 2002. Eutrophication and Health. Informe de las Comunidades Europeas http://europa.eu.int. Osterblom H., Gardmark A., Bergstrom L., Muller-Karulis B., Folke C., Lindegren M., Casini M., Olsson P., Diekmann R., Blenckner T., Humborg C., Mollmann C., 2010. Making the ecosystem approach operational-Can regime shifts in ecological- and governance systems facilitate the transition? Marine Policy 34, 1290-1299. Österblom H., Hansson S., Hjerne O., Larsson U., Wulff F., Elmgren R., Folke C., 2007. Human-induced trophic cascades and ecological regime shifts in the Baltic Sea. Ecosystems 10, 887-889. Pace M.L., Cole J.J., Carpenter S.R., Kitchell J.F., 1999. Trophic cascades revealed in diverse ecosystems. Trends in Ecology and Evolution 14, 483-488. 66 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Passow U., Wassmann P., 1994. On the trophic fate of Phaeocystis pouchetii (Hariot): IV. The formation of marine snow by pouchetii. Marine Ecology Progress Series 104, 153-161. Pauly D., Christensen V., Dalsgaard J., Froese R., Torres F., 1998. Fishing down marine food webs. Science 279, 860-863. Peaerl H.W., Fulton III R. S., 2006. Ecology of harmful cyanobacteria. En: Graneli E., Turner J.T. (encargados de la edición). Ecology of harmful algal blooms. Springer. Peperzak L., Poelman M., 2008. Mass mussel mortality in The Netherlands after a bloom of Phaeocystis globosa (prymnesiophyceae). Journal of Sea Research 60, 220-222. Pierik M., van Ruijven J., Bezemer T.M., Geerts R., Berendse F., 2011. Recovery of plant species richness during long-term fertilization of a species-rich grassland. Ecology 92, 1393-1398. Pihl L., 1982. Food-intake of young cod and flounder in a shallow bay on the Swedish west-coast. Netherlands Journal of Sea Research 15, 419-432. Pihl L., Baden S., Kautsky N., Ronnback P., Soderqvist T., Troell M., Wennhage H., 2006. Shift in fish assemblage structure due to loss of seagrass Zostera marina habitats in Sweden. Estuarine Coastal and Shelf Science 67, 123-132. Pihl L., Magnusson G., Isaksson I., Wallentinus I., 1996. Distribution and growth dynamics of ephemeral macroalgae in shallow bays on the Swedish west coast. Journal of Sea Research 35, 169-180. Pihl L., Svenson A.M., Moksnes P-O., Wennhage H., 1999. Distribution of green algal mats throughout shallow soft bottoms of the Swedish Skagerrak archipelago in relation to nutrient sources and wave exposure. Journal of Sea Research 41, 281-294. Pihl L., Ulmestrand M., 1993. Migration pattern of juvenile cod (Gadus morhua) on the Swedish west coast. Polis G.A., Strong D.R., 1996. Food web complexity and community dynamics. American Naturalist 147, 813-846. Poutanen E.L., Nikkila K., 2001. Carotenoid pigments as tracers of cyanobacterial blooms in recent and post-glacial sediments of the Baltic Sea. Ambio 30, 179-183. Power M.E., 1990. Effects of Fish in River Food Webs. Science 250, 811-814. Reid, P.C., Borges M.D., Svendsen E., 2001. A regime shift in the North Sea circa 1988 linked to changes in the North Sea horse mackerel fishery. Fisheries Research 50, 163171. Richardson K., Heilmann J.P., 1995. Primary production in the Kattegat: Past and present. Ophelia 41, 317-328. Riebesell U., Reigstad M., Wassmann P., Noji T., Passow U., 1995. On the trophic fate of Phaeocystis pouchetii (hariot): VI. Significance of Phaeocystis-derived mucus for vertical flux. Netherlands Journal of Sea Research 33, 193-203. Riegman R., Noordeloos A.A.M., Cadee G.C., 1992. Phaeocystis blooms and eutrophication of the continental coastal zones of the North Sea. Marine Biology 112, 479-484. Rousseau V., Becquevort S., Parent J.Y., Gasparini S., Daro M.H., Tackx M., Lancelot C., 2000. Trophic efficiency of the planktonic food web in a coastal ecosystem dominated by Phaeocystis colonies. Journal of Sea Research 43, 357-372. Rutter T., 2010. Managing Risk and Uncertainty. En: Advancing the Aquaculture Agenda, París. 67 Departamento Temático de Políticas Estructurales y de Cohesión Salvanes A.G.V., Nordeide, J.T., 1993. Dominating sublittoral fish species in a west Norwegian fjord and their trophic links to cod (Gadus morhua L.). Sarsia 78, 221-234. Scheffer M., Carpenter S., de Young B., 2005. Cascading effects of overfishing marine systems. Trends in Ecology and Evolution 20, 579-581. Sellner K.G., Doucette G.J., Kirkpatrick G.J., 2003. Harmful algal blooms: causes, impacts and detection. Journal of Industrial Microbiology and Biotechnology 30, 383406. Shurin J.B., Borer E.T., Seabloom E.W., Anderson K., Blanchette C.A., Broitman B., Cooper S.D., Halpern, B.S., 2002. A cross-ecosystem comparison of the strength of trophic cascades. Ecology Letters 5, 785-791. Sieben K., Ljunggren L., Bergstrom U., Eriksson B.K., 2011a. A meso-predator release of stickleback promotes recruitment of macroalgae in the Baltic Sea. Journal of Experimental Marine Biology and Ecology 397, 79-84. Sieben K., Rippen A.D., Eriksson B.K., 2011b. Cascading effects from predator removal depend on resource availability in a benthic food web. Marine Biology 158, 391-400. Sinclair A.R.E., Krebs C.J., Fryxell J.M., Turkington R., Boutin S., Boonstra R., Seccombe-Hett P., Lundberg P., Oksanen, L., 2000. Testing hypotheses of trophic level interactions: a boreal forest ecosystem. Oikos 89, 313-328. Smayda T.J., 1997. Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea. Limnology and Oceanography 42, 1137-1153. Smayda T.J., 2006. Harmful Algal Bloom Communities in Scottish Coastal Waters: Relationship to Fish Farming and Regional Comparisons – A Review. Scottish Executive Environment Group Paper 2006/3 2005. Smith V. H., Schindler D.W., 2009. Eutrophication science: where do we go from here? Trends in Ecology and Evolution 24, 201-207. Solic M., Krstulovic N., Marasovic I., Baranovic A., Pucher Petkovic T., Vucetic T., 1997. Analysis of time series of planktonic communities in the Adriatic Sea: Distinguishing between natural and man-induced changes. Oceanologica Acta 20, 131-143. Sondergaard M., Jeppesen E., Lauridsen T.L., Skov C., Van Nes E.H., Roijackers R., Lammens E., Portielje R., 2007. Lake restoration: successes, failures and long-term effects. Journal of Applied Ecology 44, 1095-1105. Strong D.R., 1992. Are trophic cascades all wet? Differentiation and donor-control in speciose ecosystems. Ecology 73, 747-754. Thornton D.C.O., Santillo D., Thake B., 1999. Prediction of Sporadic Mucilaginous Algal Blooms in the Northern Adriatic Sea. Marine Pollution Bulletin 38, 891-898. Tufekci V., Balkis N., Beken C.P., Ediger D., Mantikci M., 2010. Phytoplankton composition and environmental conditions of a mucilage event in the Sea of Marmara. Turkish Journal of Biology 34, 199-210. Turk V., Hagstrom A., Kovac N., Faganeli J., 2010. Composition and function of mucilage macroaggregates in the northern Adriatic. Aquatic Microbial Ecology 61, 279289. Vahteri P., Makinen A., Salovius S., Vuorinen I., 2000. Are drifting algal mats conquering the bottom of the Archipelago Sea, SW Finland? Ambio 29, 338-343. Van Dolah F.M., 2000. Marine algal toxins: Origins, health effects, and their increased occurrence. Environmental Health Perspectives 108, 133-141. 68 ¿Favorece la sobreexplotación pesquera la proliferación de algas? Vasas V., Lancelot C., Rousseau V., Jordán F., 2007. Eutrophication and overfishing in temperate nearshore pelagic food webs: a network perspective. Marine Ecology Progress Series 336, 1–14. Viitasalo M., Peltonen H., Pääkkönen J.-P., 2005. Blue-green algal blooms interfere with the growth of young fish and cause fishermen financial losses. The Baltic Sea Portal http://www.itameriportaali.fi/en/ajankohtaista/mtl_uutisarkisto/2005/en_GB/210. Vila M., Camp J., Garces E., Maso M., Delgado M., 2001a. High resolution spatiotemporal detection of potentially harmful dinoflagellates in confined waters of the NW Mediterranean. Journal of Plankton Research 23, 497-514. Vila M., Garces E., Maso M., Camp J., 2001b. Is the distribution of the toxic dinoflagellate Alexandrium catenella expanding along the NW Mediterranean coast? Marine Ecology Progress Series 222, 73-83. Ward P., Myers R.A., 2005. Shifts in open-ocean fish communities coinciding with the commencement of commercial fishing. Ecology 86, 835-847. Wasmund N., Nausch G., Matthaus W., 1998. Phytoplankton spring blooms in the southern Baltic Sea - spatio-temporal development and long-term trends. Journal of Plankton Research 20, 1099-1117. Weijerman M., Lindeboom H., Zuur A.F., 2005. Regime shifts in marine ecosystems of the North Sea and Wadden Sea. Marine Ecology Progress Series 298, 21-39. Worm B., Lotze H.K., 2006. Effects of eutrophication, grazing, and algal blooms on rocky shores. Limnology and Oceanography 51, 569-579. Worm B., Lotze H.K., Hillebrand H., Sommer U., 2002. Consumer versus resource control of species diversity and ecosystem functioning. Nature 417, 848-851. Yunev O.A., Moncheva S., Carstensen J., 2005. Long-term variability of vertical chlorophyll a and nitrate profiles in the open Black Sea: eutrophication and climate change. Marine Ecology Progress Series 294, 95-107. Yunev O.A., Vedernikov V.I., Basturk O., Yilmaz A., Kideys A.E., Moncheva S., Konovalov S.K., 2002. Long-term variations of surface chlorophyll a and primary production in the open Black Sea. Marine Ecology Progress Series 230, 11-28. Zaitsev Y.P., 1992. Recent changes in the trophic structure of the Black Sea. Fisheries Oceanography 1:180-189. Zengin M., Gungör H., Demirkol C., Yuksek A., 2009. Effects of Algal Bloom on the Fisheries of the Sea of Marmara through the 2007/2008 Fishing Period. En: FAO-GFCM SAC/SCMEE Working Group on Workshop on algal and jelly fish blooms, Estambul. Zengın M., Güngör H., Demırkol C., Yüksek A., 2011. Effects of mucilage bloom on the fisheries of the Sea of Marmara through the 2007/2008 fishing period. En: Report of the workshop on algal and jellyfish blooms in the Mediterranean and the Black Sea, Istanbul. Marsella, Francia. 69 CATALOGUE BA-31-11-434-ES-C Dirección General de Políticas Interiores Departamento TemÁTICO Políticas Estructurales y de Cohesión Dirección General de Políticas Interiores Departamento TemÁTICO Políticas Estructurales y de Cohesión B B Agricultura y Desarrollo Rural Cultura y Educación Cometido Pesca Pesca Los departamentos temáticos constituyen unidades de análisis que prestan asesoramiento especializado a comités, delegaciones interparlamentarias y otros órganos parlamentarios. Desarrollo Regional Áreas políticas Transporte y Turismo Agricultura y Desarrollo Rural Cultura y Educación Pesca Desarrollo Regional Transporte y Turismo ¿FAVORECE LA SOBREEXPLOTACIÓN LA PROLIFERACIÓN DE ALGAS? Documentos: Visite la web del Parlamento Europeo: http://www.europarl.europa.eu/studies Créditos de las fotografías: iStock International Inc., Photodisk, Phovoir NOTA ISBN 978-92-823-3663-2 doi: 10.2861/57421 ES DE EN FR IT PT 2011