CODIGO: GA-T-02 INSTITUCIÓN EDUCATIVA PEDAGÓGICO INTEGRAL
Anuncio

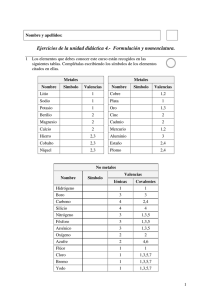
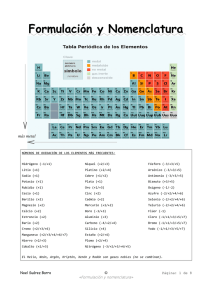
INSTITUCIÓN EDUCATIVA PEDAGÓGICO INTEGRAL CODIGO: GA-T-02 FECHA: Junio/2012 VERSIÓN: 01 TALLER Página 1 de 4 AREA:QUIMICA GRADO:NOVENO PERÍODO: PROFESOR:BEATRIZ MILENA OTALVARO VILLADA COMPETENCIA: INTERPRETATIVA, ARGUMENTATIVA Y PROPOSITIVA. ESTUDIANTE: Este taller es para resolverlo y estudiarlo. 1. ¿Cuáles son las funciones químicas y que grupo funcional representa o determina a cada una? 2. ¿Qué es un Hidruro? ¿Cómo se forma un hidruro? ¿Cuál es su grupo funcional? Escriba 6 ejemplos de Hidruros. 3. ¿Cómo se forma un oxido? ¿Cuál es su grupo funcional? ¿Cómo se forman los óxidos básicos y los óxidos ácidos? ¿Qué otros nombres tienen? Escriba 6 ejemplos de cada oxido. 4. ¿Cómo se forma un ácido? ¿Cuál es su grupo funcional? ¿Cuántos tipos de ácidos hay? ¿Qué otros nombres tienen? Escriba 6 ejemplos. 5. ¿Cómo se forma un Hidróxido? ¿Cuál es su grupo funcional? Escriba 6 ejemplos de Hidróxido. 6. ¿Qué es la nomenclatura en química?, ¿Qué significan los grupos funcionales H, O, OH? 7. Recuerda y escribe cuales son los principios de la nomenclatura clásica, sistemática y stock, para nombrar los óxidos. 8. ¿Cómo se forma una sal? ¿Cuál es su grupo funcional? 9. Relaciona estos compuestos: CaH2 NaOH H2S CaO H2SO4 Con su tipo de compuesto: Óxido Oxácido Hidróxido Hidruro Hidrácido 10. Relaciona la fórmula con el tipo de sal que representa. o o o o o NaNO3 Al2(SiO3)3 Ca3(PO4)2 CaCO3 CuSO4 Sulfato Carbonato Nitrato Fosfato Silicato 11. ¿Qué compuesto es el H2SO4? a. Ninguno de los mencionados b. Ácido nítrico c. Ácido sulfúrico d. Hidróxido sódico 12. ¿Cuál de estas fórmulas se corresponde con el ácido fosfórico? a. b. c. d. H3PO4 H2CO3 HNO3 H2SO4 13. Formula o nombra los siguientes compuestos ternarios NaOH : o o o : Es hidróxido potásico : Es hidróxido de calcio : Es hidróxido de magnesio Al(OH)3: 14. Nombra los siguientes óxidos metálicos: Nomenclatura tradicional MgO PbO2 SnO2 SnO NiO Ni2O3 PtO2 PtO Cu2O PbO HgO CrO Nomenclatura Stock Nomenclatura sistemática Hg2O 15. Nombra por las tres nomenclaturas: - SrO K2O BaO Au2O3 Li2O FeO Ag2O ZnO 16. Nombra los siguientes óxidos no metálicos: Nomenclatura Stock N2O NO N2O3 N2O4 NO2 N2O5 Br2O Br2O3 ClO2 SO2 CO2 Nomenclatura sistemática 17. Nombra los siguientes hidruros metálicos: Nomenclatura tradicional NaH LiH KH CaH2 AuH NiH2 CuH Nomenclatura Stock Nomenclatura sistemática 18. Nombra las siguientes sales binarias: Nomenclatura tradicional CaF2 FeCl2 FeCl3 PbI2 KBr Nomenclatura Stock 19. Nombra los siguientes compuestos: Nomenclatura sistemática - BrCl ICl ClF IBr3 NCl3 Si3N4 BP Nomenclatura sistemática 20. Formula los siguientes óxidos: Óxido de titanio (IV): _____________ Óxido de cobre (II): _____________ Óxido de calcio: _____________ Óxido de sodio: _____________ Trióxido de Molibdeno: _____________ Óxido férrico: _____________ Óxido auroso: _____________ Heptaóxido de dimanganeso: _____________ 21. Formula los siguientes óxidos: Óxido de fósforo (III): _____________ Pentaóxido de difósforo: _____________ Óxido de boro: _____________ Trióxido de diyodo: _____________ Trióxido de difósforo: _____________ Óxido de yodo (V): _____________ 22. Formula los siguientes hidruros: Hidruro de cesio: _____________ Hidruro de cinc: _____________ Hidruro de magnesio: _____________ 23. Escriba las fórmulas de las siguientes sustancias: ácido sulfúrico, hidróxido de aluminio, fosfato de sodio, hidróxido de zinc, ácido nítrico, carbonato de potasio, nitrato de calcio. 24. Para cada una de las sustancias anteriores, calcule la masa molar. 25. Para cada sustancia mencionada en el ejercicio 1, calcule la cantidad de moles que hay en 100 gramos de la misma. 26. Calcule el peso equivalente de cada una de las sustancias mencionadas en la actividad anterior. 27. ¿Cuál será la molaridad de una solución que contiene 4.46 moles de KOH en 3 litros de solución? 28. Se disuelven 15 gramos de H3PO4 en agua hasta obtener 70 ml de solución. Calcular: MOLARIDAD. 29. ¿Qué cantidad de disolvente se requiere para una solución .5 m, a partir de 75g de NH4 Cl como soluto? 30. Encuentra la molalidad de una solución formada por 20 g de CH3OH y 150 g de agua. 31.Encuentra la molalidad de una solución que está formada por 10 g de CH3CH2OH y120 g de agua. 32. ¿Qué es una fórmula química? De ejemplos. 33. ¿Qué es un enlace químico? 34. Define las clases de enlaces químicos y de ejemplos en cada caso 35. Define reacciones químicas 36. Da ejemplos de las diferentes reacciones químicas 37. ¿Qué es el balanceo de ecuaciones? 38. ¿Cuáles son los tipos de balanceo de ecuaciones? Da ejemplos de cada uno y explícalos. 39. Relaciona las siguientes conclusiones experimentales con el modelo atómico a que dieron lugar: El átomo no es indivisible ya que al aplicar un fuerte voltaje a los átomos de un elemento en estado gaseoso, éstos emiten partículas con carga negativa: Al reaccionar 2 elementos químicos para formar un compuesto lo hacen siempre en la misma proporción de masas: Los átomos de los elementos en estado gaseoso producen, al ser excitados, espectros discontinuos característicos que deben reflejar su estructura electrónica: Al bombardear los átomos de una lámina delgada con partículas cargadas positivamente, algunas rebotan en un pequeño núcleo situado en el centro del átomo: 40. Crea uno de los modelos de átomo, el que más te llame la atención. Utiliza material reciclable o de desecho. Documéntate más sobre el tema. NOTA: TODO DEBE SER REALIZADO A MANO, TIPO TRABAJO ESCRITO LEGAJADO Y ENTREGADO EN UNA CARPETA, ANEXANDO LA BIBLIOGRAFIA CONSULTADA