- Universidad Autónoma de Nuevo León
Anuncio

COORDINACIÓN EDITORIAL
CUERPO ACADÉMICO DE NUTRICIÓN CLÍNICA
MSP. Hilda Irene Novelo Huerta
ENC. María del Carmen Mata Obregón
MSP. Alpha Berenice Medellín Guerrero
Dr. en Med. Gerardo Garza Sepúlveda
Dra. en C. María de Jesús Ibarra Salas
Dr. Erik Ramírez López
Dra. Aurora de Jesús Garza Juárez
ESPECIALIDAD EN NUTRIOLOGÍA CLÍNICA
ENC. María del Carmen Mata Obregón, ED
ÁREA DE FORMACIÓN EN NUTRICIÓN CLÍNICA SALUD – ENFERMEDAD
ENC. Leticia Márquez Zamora
ENC. Maria Alejandra Sánchez Peña, NC
COLEGIO MEXICANO DE NUTRIÓLOGOS A.C. CAPÍTULO NUEVO LEÓN
ENC. José Angel Torres Treviño, NC
CONTENIDO
FUNDAMENTOS DEL GASTO ENERGÉTICO ....................................................... 1
Introducción ......................................................................................................... 1
Gasto energético basal ........................................................................................ 2
Gasto energético en reposo ................................................................................. 2
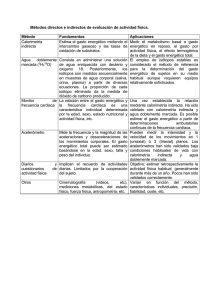
Métodos para determinar el Gasto Energético ..................................................... 2
Principios de la Calorimetría Indirecta (CI) ........................................................... 2
Termogénesis ...................................................................................................... 4
Factores que influencian el GE ............................................................................ 4
Conclusión ........................................................................................................... 5
Referencias bibliográficas .................................................................................... 5
COMPARACIÓN DE 3 ECUACIONES PARA ESTIMAR EL GASTO ENERGÉTICO
EN REPOSO VS CALORIMETRÍA INDIRECTA EN ESCOLARES CON OBESIDAD
................................................................................................................................ 7
Introducción ......................................................................................................... 7
Metodología ......................................................................................................... 7
Resultados ........................................................................................................... 8
Conclusión ........................................................................................................... 9
Referencias bibliográficas .................................................................................... 9
REQUERIMINETO ENERGÉTICO EN PACIENTES CON TRASPLANTE DE
ÓRGANOS ............................................................................................................ 10
Valoración y tratamiento nutricionales ............................................................... 10
Pre trasplante ..................................................................................................... 10
Periodo pos trasplante inmediato ....................................................................... 11
Periodo pos trasplante tardío ............................................................................. 11
Dieta de baja carga bacteriana .......................................................................... 12
Requerimiento energético en el trasplante renal ................................................ 13
Periodo pos trasplante inmediato y tardío .......................................................... 14
Requerimiento energético en el trasplante hepático .......................................... 15
Requerimiento energético en el trasplante de médula ósea .............................. 16
Conclusión ......................................................................................................... 18
Referencias bibliográficas .................................................................................. 19
ESTIMACIÓN DEL GASTO ENERGÉTICO PARA EL ADULTO MAYOR ............ 20
Introducción ....................................................................................................... 20
Fórmulas para la estimación del gasto energético ............................................. 21
Harris-Benedict. (Tabla 2) ............................................................................... 21
FAO/WHO/UNU (Tabla 3)............................................................................... 22
Fredrix (Tabla 4) ............................................................................................. 23
Mifflin-St Jeor (Tabla 5)................................................................................... 23
Lührmann (Tabla 6). ....................................................................................... 24
Müller (Tabla 7). .............................................................................................. 24
Henry (Tabla 8) ............................................................................................... 25
Frankenfield (Tabla 9) ..................................................................................... 25
Conclusiones ..................................................................................................... 26
Referencias bibliográficas .................................................................................. 26
REQUERIMIENTO ENERGÉTICO EN PACIENTES EN ESTADO CRÍTICO ....... 27
Introducción ....................................................................................................... 27
Validación de ecuación predictiva. ..................................................................... 36
Conclusiones ..................................................................................................... 38
Referencias bibliográficas .................................................................................. 42
FUNDAMENTOS DEL GASTO ENERGÉTICO
ME. Gabriela Quiroz Olguín N.C.
Adscrita al Servicio de Nutriología Clínica del Instituto Nacional de Ciencias Médicas
y Nutrición Salvador Zubirán.
Introducción
La energía que el cuerpo humano requiere para mantener sus funciones vitales es
obtenida por la oxidación de los macro nutrimentos provenientes de los alimentos.
(1)
El gasto energético es considerado como un proceso de producción de energía
proveniente de la combustión de sustratos (hidratos de carbono, lípidos, proteínas),
en donde hay oxígeno consumido (O2) y producción de dióxido de carbono (CO2).
Parte de esta energía química es perdida en forma de calor y orina, y la energía
restante es almacenada en moléculas de alta energía conocida como adenosín
trifosfato (ATP). (2)
En las últimas décadas ha habido un creciente interés por estudiar el gasto
energético (GE) en diferentes situaciones, como lo es el ejercicio, o en el ámbito
hospitalario, para determinar el requerimiento energético de los pacientes
críticamente enfermos que requieren nutrición parenteral o enteral, o en aquellos
que se someten a procesos reductivos de peso. Así mismo han aparecido diversas
herramientas que nos ayudan a obtener estos datos. Entre los más usados se
encuentran la calorimetría indirecta (CI) y las fórmulas de predicción; siendo estas
últimas las más utilizadas debido a la disponibilidad y facilidad de uso. Sin embargo,
para que una fórmula pueda ser precisa, es necesario considerar ciertos aspectos
como los componentes del GE y las cosas que pueden modificar su precisión.
El Gasto Energético Total (GET) representa la energía que el organismo consume;
está constituido por la suma del gasto energético basal (GEB), también denominado
la tasa metabólica basal (TMB), la termogénesis endógena (TE) y la actividad física
(AF). (3) La Organización Mundial de la Salud (OMS) define el GET como: “el nivel
de energía necesario para mantener el equilibrio entre el consumo y el gasto
energético, cuando el individuo presenta peso, composición corporal y actividad
física compatibles con un buen estado de salud, debiéndose hacer ajustes para
individuos con diferentes estados fisiológicos como crecimiento, gestación,
lactancia y envejecimiento”. (4)
1
Gasto energético basal
El Gasto Energético Basal (GEB) es la pérdida de calor o la fracción del gasto de
energía total que se requiere para mantener los procesos vitales del cuerpo, como
el metabolismo celular, la síntesis de proteínas, el equilibrio de iones, además de
las actividades nerviosa, cardiovascular, respiratoria, digestiva, endócrina y la
necesaria para el mantenimiento de la temperatura corporal. (5)
El GEB contribuye del 60 al 70% del requerimiento de energía diaria para la mayoría
de los individuos sedentarios y cerca del 50% para aquellos que son físicamente
activos. (6)
El GEB debe ser medido en condiciones ambientales estandarizadas como
temperatura y humedad. El individuo debe de estar en completo reposo después de
al menos 8 horas de sueño y después de 12 a 14 horas de ayuno nocturno. (7)
Gasto energético en reposo
El GEB es diferente al gasto energético en reposo (GER); este último se obtiene
cuando la determinación se hace en reposo y en las condiciones descritas para el
GEB pero no en ayuno, incluyendo por lo tanto la energía utilizada para el
aprovechamiento biológico de los alimentos, además que el sujeto la mayoría de las
veces se encuentra en estrés emocional. Estas mediciones, difieren en menos del
10% y ambos términos se tienden a utilizar indistintamente. En la actualidad se
utiliza más la denominación del GER y habitualmente se determina por medio de
ecuaciones predictivas. (8)
Métodos para determinar el Gasto Energético
Existen muchos métodos para medir el Gasto Energético (GE), muchos de ellos
utilizados con fines de investigación por ser más caros y otros son más accesibles
aunque poco precisos. Entre ellos se encuentran la calorimetría indirecta, el agua
doblemente marcada y las fórmulas de predicción.
Principios de la Calorimetría Indirecta (CI)
Por CI se entiende el proceso de medición del gasto energético a partir de la
cuantificación de los elementos del metabolismo de la combustión. La CI tuvo sus
principios con las primeras discusiones sobre el intercambio de gases que inició
Lavoisier y sus contemporáneos, quienes establecieron que el O2 y el CO2 eran
gases importantes en el proceso de combustión y en el metabolismo de los animales
y humanos. (9)
Boyle inventó un aparato que producía vacío y con esto inició los primeros
experimentos sobre la combustión y el metabolismo. Lavoisier en París estudiaba
2
la combustión y oxidación de metales. (8) El dio el nombre de oxígeno al material
absorbido por el metal cuando se calentaba en aire. El término de caloría, se
introdujo para describir el calor generado tras la combustión. Más tarde Lavoisier
realizó más experimentos para describir como los animales tomaban O2 y
generaban CO2 junto con la producción de calor. El calor producido fue medido por
calorímetro de hielo y ayudó a establecer las bases de la calorimetría. (10)
Todas las funciones biológicas requieren energía. Los hidratos de carbono, las
grasas y las proteínas contienen la energía que se utilizará para el trabajo biológico.
Por ello se puede hablar, tanto de energía de los alimentos, como de energía
utilizada en la realización de trabajo biológico. (11)
La caloría se define como la cantidad de calor necesaria para aumentar en 1ºC la
temperatura de 1 kg de agua desde 14.5 a 15.5 ºC. Para medir el valor energético
de un nutrimento se puede usar un calorímetro. Para ello se quema el alimento en
un recinto cerrado y se mide el calor liberado en dicha combustión. El calor liberado
en la oxidación de un alimento se conoce como su calor de combustión, y representa
el valor energético total de dicho alimento.
El valor energético de las grasas varía algo en relación con su composición en
ácidos grasos. El calor de combustión medio de un gramo de grasa al oxidarse, se
considera como de 9.4 kcal. El calor de combustión de un hidrato de carbono
también es variable, dependiendo de la distribuación de los átomos de la molécua.
La glucosa tiene un calor de combustión de 3.74 y el almidón de 4.20
respectivamente. En general se usa el valor de 4.2 como el calor de combustión de
un gramo de cualquier hidrato de carbono.
La energía liberada durante la combustión de una proteína depende, sobre todo, de
la proporción de nitrógeno contenida en dicha proteína. Muchas proteínas contienen
aproximadamente un 16% de nitrógeno y un calor de combustión medio de 5.65
kcal/gr (proteína de huevo, carne, soja). El calor de combustión medio de un gramo
de proteína se considera de 5.65 kcal/gr.
El valor energético de un alimento en el organismo no es exactamente el mismo que
su calor de combustión determinado por calorimetría. En el caso de las proteínas,
el nitrógeno se combina con el hidrógeno para formar urea, que se elimina por la
orina. Esta eliminación de hidrógeno representa una pérdida potencial de energía
que disminuye el calor de combustión de la proteína en el cuerpo hasta 4.6 kcal/gr,
en lugar de los 5.65 obtenidos en el calorímetro. En el caso de las grasas y los
hidratos de carbono, el calor de combustión es muy similar al observado en el
calorímetro.
Otro aspecto a considerar en la determinación de la energía total obtenida de un
aliemento, es la eficacia del proceso digestivo. El coeficiente de digestibilidad es la
proporción de alimento ingerido que se utiliza para ser metabolizado por el
3
organismo. Los coeficientes de digestibilidad de los hidratos de carbono son de
aproximadamente del 97%, los de las grasas del 95% y los de las proteínas del
92%. (12)
Termogénesis
La termogénesis obligatoria supone entre un 10 y 12% de la energía ingerida. Esta
energía se utiliza para la absorción intestinal, las transformaciones bioquímicas y el
acúmulo de nutrimentos. La termogénesis inducida por los alimentos, o terigénesis
posprandial, se puede medir también mediante calorimetría indirecta.
El primero en hablar de termogénesis inducida por la dieta fue Rubner, cuando
decidió hacer calorimetrías a perros en ayuno, donde observó que el gasto
energético medido de un perro era de 742 kcal. Al siguiente día le dio de comer y
nuevamente tomó la calorimetría indirecta y observó que ahora el GE había
cambiado y era de 1046 kcal, es decir una diferencia del 16% por lo que nuevamente
lo puso en ayuno y observó un gasto similar al primero de 746 kcal. (13) Este
experimento dio la pauta para introducir el concepto de termogénesis inducida por
alimentos.
Factores que influencian el GE
El GER está determinado sobre todo por el peso corporal y es proporcional al
tamaño corporal del individuo (talla), los individuos de mayor tamaño requieren
mayor energía que los pequeños. (14) Con relación a la edad, el GER es mayor en
niños que en adultos debido a sus requerimientos para el crecimiento. De forma
evolutiva y expresada en función del peso corporal el GER es más alto en la vida
prenatal, luego en los dos primeros años de vida y a partir de esa edad tiende a
disminuir dado que la velocidad de crecimiento durante la edad escolar se lentifica.
Posteriormente, se incrementa de nuevo durante a pubertad y a partir de los 30
años el GER disminuye un 0,4% anualmente, lo que está asociado con la reducción
en la actividad metabólica de síntesis. También se han encontrado diferencias en el
GER de acuerdo con el sexo, aún existen dudas sobre hasta qué punto éstas son
debidas a la composición corporal o a influencias hormonales con independencia
de la causa, pues está claro que el GER es mayor en hombres que en mujeres.
Además, en mujeres fértiles se ha observado una variación de entre un 6 y 10%
ocurrido a lo largo del ciclo menstrual. (15)
La temperatura corporal es otro factor que se debe tener en cuenta, los humanos
pasan significativamente más tiempo en la zona neutral térmica, por lo cual cuando
se encuentran en temperaturas superiores o inferiores requieren de energía para
mantener la temperatura corporal. En seres humanos se incrementa el GER de 7 a
17% en periodos de fiebre o a una temperatura corporal elevada. Por cada grado
centígrado que aumente la temperatura central, la exposición al calor también
disminuye la ingesta de alimentos, sin embargo no se ha demostrado que la
4
exposición crónica al calor cambie el balance de energía suficiente para influir en el
peso corporal en los seres humanos. Así mismo cuando se encuentran expuestos
al frío también aumenta el gasto energético. La exposición a 16º C es suficiente para
aumentar el gasto de energía por aproximadamente 160 kilocalorías por día y la
exposición también aumenta la ingesta de alimentos. (16)
Conclusión
El GE está influenciado por diversos factores como el peso, la edad, la talla y la
temperatura corporal entre otras cosas. Existen muchos métodos que pueden
ayudarnos a determinarlo, sin embargo dependerá de la disponibilidad de cada uno
así como del costo o el grado de complejidad en el uso de cada uno de ellos.
En la actualidad la calorimetría es el estándar de oro para la predicción del GE, sin
embargo resulta un instrumento caro y poco disponible en el sector salud. Así
mismo, se requiere de personal capacitado y calificado para realizar la prueba
además de poder interpretarla correctamente.
Debemos tomar en cuenta cada una de las variaciones que el GE tiene para poder
tomar una cifra de manera correcta. El individualizar a nuestros pacientes hará que
la decisión sobre que herramienta usar sea la más adecuada.
El conocer el GE de un paciente nos servirá ante todo, para poder dar una correcta
prescripción del tratamiento nutricional y así poder minimizar tanto la
sobrealimentación como la subalimentación.
Referencias bibliográficas
(1) Diener JRC. Calorimetría Indireta. Rev Assoc Med Bras 1997; 43 (3): 245-53.
(2) Labayen I, Lopes-Marqués J, Martinez JA. Métodos de medida del gasto energético. Nutr Clin
1997; 6 (16): 203.
(3) Vargas M, Lancheros L, Barrera M. Gasto energético en reposo y composición corporal en
adultos. 2011;59(1):43–58.
(4) (WHO). WHO. Obesity: preventing and managing the global epidemic. 2000.
(5) Guyton A, Hall J. Energética e metabolismo. In: Guyton A, Hall J, Eds. Tratado de fisiología
médica. 10 ed: Editora ABPDEA 2002: 762- 8.
(6) Oliveira FCE, Cruz ACM, Oliveira CG, Cruz ACRF, Nakajima VM, Bressan J. Gasto energético
de adultos brasileños saludables: una comparación de métodos. Nutr Hosp 2008; 23 (6): 554-61.
(7) Rodrigues AE, Marostegan PF, Mancini MC et al. Analise dataxa metabólica de repouso avaliada
por calorimetria indireta em mulheres obesas com baixa e alta ingestão calórica. Arq Bras Endocrinol
Metabol 2008; 52 (1): 76-84.
(8) Vargas M., Op cit.
(9) Simon Bursztein. Energy Metabolism. Indirect Calorimetry, and Nutrition. 1989. Williams & Wilkins
USA
(10) Holmes FL. Lavoisier and the chemistry of Life. Madison, The University of Wisconsin Press.
1985.
(11) McArdle WD, Katch VL. Exercise physiology. Energy, nutrition and human performance.
Philadelphia Lea and Febiger, 1991.
5
(12) Maffeis C, Schutz Y, Zoccante L, Miccolo R, Pinelli R. Meal-induced thermogenesis in lean and
obese prepubertal children. Am J Clin Nutr. 1993;57:481-5
(13) Simon Bursztein, Op cit.
(14) Heymsfield SB, Pietrobelli A. Body size and human energy requirements: Reduced mass-specific
total energy expenditure in tall adults. Am J Hum Biol. 2010;22(3):301–9.
(15) Chiquete E, Tolosa P. Conceptos tradicionales y emergentes sobre el balance energético. Rev
Endocrinol y Nutr. 2013;21(2):59–68.
(16) Dhurandhar EJ, Keith SW. The aetiology of obesity beyond eating more and exercising less.
Best Pract Res Clin Gastroenterol. Elsevier Ltd; 2014 Aug;28(4):533–44.
6
COMPARACIÓN DE 3 ECUACIONES PARA ESTIMAR EL GASTO
ENERGÉTICO EN REPOSO VS CALORIMETRÍA INDIRECTA EN
ESCOLARES CON OBESIDAD
LN Beatriz Ramírez Reséndez
Estudiante de la Especialidad en Nutriología Clínica, Facultad de Salud Pública y
Nutrición, Universidad Autónoma de Nuevo León.
Introducción
La obesidad infantil es un problema de salud pública en México que ha aumentado
7.4% durante los últimos siete años. (1)
El gasto energético en reposo (GER) es la energía necesaria para mantener las
funciones fisiológicas esenciales, es constante y característico para cada individuo,
no modificándose salvo por alteración patológica. (2) Dentro de los métodos para
evaluar el GER se encuentra la calorimetría indirecta (CI), método utilizado en el
área clínica y considerada un estándar de oro.
Diversas ecuaciones han sido propuestas a nivel internacional para la estimación
del GER en niños, las cuales han sido validadas contra el GER medido por CI. Sin
embargo, varían de acuerdo a edad, sexo, raza y composición corporal del grupo
estudiado. (3)
En este estudio se busca comparar ecuaciones de predicción para el GER con el
obtenido por CI en escolares obesos.
Metodología
Estudio comparativo y descriptivo a conveniencia; bajo previo consentimiento donde
se evaluaron escolares participantes en un campamento de verano para niños con
sobrepeso y obesidad organizado por el gobierno estatal (SENL, SSNL) y la
FASPYN de la UANL en Julio de 2014.
Se realizó evaluación antropométrica de peso, masa grasa y masa libre de grasa
por medio de bioimpedancia eléctrica y medición de estatura para obtener el IMC
(kg/m2). El diagnóstico nutricional se obtuvo con base a tablas de la OMS 2007
(obesidad = +3 DE ó ≥ 97 percentil).
La determinación del GER por CI se realizó en las instalaciones del campamento
del Bioparque Estrella utilizando un calorímetro modelo Quark RMR® previamente
calibrado. La medición se realizó por personal entrenado, en una habitación con
condiciones adecuadas, el niño recostado en posición supina y posterior ayuno y
7
reposo de 14 horas. Se les colocó una mascarilla “Kanopi” para recolección de
gases por un periodo entre 25 y 30 minutos.
La creación de la base de datos y comparación de las fórmulas se realizó con el
programa Windows-Excel® 2013 para su posterior análisis estadístico. El análisis
estadístico se llevó a cabo con el software MedCalc®, versión 13.3 comparando las
ecuaciones predictivas (Tverskaya, Schofield y Lazzer) contra el GER medido por
CI. La equivalencia grupal entre el GER calculado por las ecuaciones y la CI se
evaluó con el sesgo o media de las diferencias y un análisis de regresión simple
donde la pendiente no fuera significativa (P> 0.05). Y la equivalencia individual se
evaluó con un método no paramétrico sugerido por Bland y Altman 1999.
Resultados
Del total de los escolares analizados, 59% fueron niñas y 41% fueron niños, con un
promedio de 9 ± 2 años de edad. De acuerdo con la clasificación del IMC, el 100%
presentó obesidad.
De las ecuaciones estudiadas, Schofield tuvo un promedio de las diferencias de 232
kcal (p<0.0001), Tverskaya 89 kcal (p<0.0028) y Lazzer 251 kcal (p<0.0001). Todas
las ecuaciones sobreestiman significativamente el GER comparado con CI y en
ninguna se encontró error proporcional. Los límites de concordancia para el rango
de diferencias en kcal fueron: Schofield (660,-195), Tverskaya (443,-264) y Lazzer
(624,-121).
El promedio de kcal por calorimetría indirecta y estimada por cada una de las
ecuaciones es la siguiente: calorimetría indirecta (1321±172), Schofield (1553±242),
Tverskaya (1411±203) y Lazzer (1572±217). Todas las ecuaciones sobreestiman
sistemáticamente.
Para confirmar el uso individual entre el GER calculado con las ecuaciones
predictivas y la CI se utilizaron valores en calorías que representan los cambios
mínimos del GER por cada grupo de edad entre los 6 y 12 años de acuerdo a la
OMS del 2001. En 1 de cada 3 pacientes las ecuaciones estiman el GER comparado
con la calorimetría por debajo de las 100 kcal de diferencia, en los valores por debajo
de 125, 150 y 175 kcal la ecuación que más porcentaje tiene es la de Tverskaya.
El 90% de los casos que se comparó con la ecuación de Tverskaya cae por debajo
de las 300 kcal, comparado con las ecuaciones de Schofield y Lazzer el 50% de los
niños presenta diferencia en cuanto a kcal por debajo de 300.
8
Conclusión
Con base en los resultados obtenidos, en cuanto a la evaluación grupal se concluye
que las tres ecuaciones de predicción sobreestiman significativamente el GER
comparado con CI y ninguna presentó error proporcional.
A nivel individual, los límites de concordancia resultantes mostraron variaciones
entre 660 y -264 kcal, sólo la ecuación de Tverskaya presentó al 90% de los casos
con una diferencia por debajo de 300 kcal respecto a CI.
La ecuación de Tverskaya fue la que presentó menor error sistemático comparado
con CI, sin embargo ésta se recomienda únicamente a nivel poblacional ya que su
exactitud es buena a nivel grupal pero no a nivel individual. Ninguna de las
ecuaciones se recomienda en pacientes institucionalizados ya que su uso resultaría
cuestionable dado los límites de concordancia.
Es importante realizar estudios con un tamaño de muestra suficiente para confirmar
el uso de estas ecuaciones de predicción en esta población.
Referencias bibliográficas
(1) Olaiz G, Rivera J, Shamah T, Rojas R, Villalpando S, Hernández M, Sepúlveda J. 2006. Encuesta
Nacional de Salud y Nutrición. Instituto Nacional de Salud Pública. Cuernavaca, México.
(2) M. Alonso Franch, Mª.P. Redondo del Río, J. Torrecilla Cañas, Mª.J. Castro Alija, F. Conde
Redondo, D. Redondo Merinero, Mª.J. Martínez Sopena. 2006. Dificultades de la estimación del
gasto energético en la población infantil. BOL PEDIATR, VOL. 46 Nº 195. 74-108.
(3) Margie Balas-Nakash, Angélica Villanueva-Quintana, Felipe Vadillo-Ortega, Otilia PerichartPerera. 2008. Validación del uso de fórmulas para estimar el gasto energético en reposo en niños
mexicanos de 9 a 12 años de edad con y sin obesidad. Revista de Investigación Clínica/Vol. 60,
Núm.5/Septiembre-Octubre, 2008 / pp 395- 402
9
REQUERIMINETO ENERGÉTICO EN PACIENTES CON
TRASPLANTE DE ÓRGANOS
E.N. LN. Enedelia Montes de Oca Leal
Tutor de la Especialidad en Nutriología Clínica, Facultad de Salud Pública y
Nutrición, UANL.
Instituto Mexicano del Seguro Social # 25, Monterrey, N.L.
Introducción
El trasplante de órganos y tejidos sanos para sustituir a sus equivalentes enfermos
se ha convertido en un tratamiento cada vez más eficaz y frecuente. El avance en
nuestro conocimiento sobre inmunosupresión ha reducido considerablemente el
rechazo de los trasplantes.
Trasplante Alogénico (de una persona a otra), autólogo (dentro de la misma
persona) o incluso Xenogénico (de un animal a una persona), los receptores de
trasplantes compartan problemas nutricionales comunes. La administración de un
tratamiento nutricional óptimo antes de la realización del trasplante e
inmediatamente después del mismo, seguido de un buen control nutricional a largo
plazo, conseguir que se reduzcan las complicaciones y que mejore la morbilidad de
los pacientes.
Valoración y tratamiento nutricionales
En el paciente trasplantado se consideran tres fases:
1) Pretrasplante
2) Período pos trasplante inmediato (aproximadamente dos meses), y
3) Periodo post trasplante tardío.
Pre trasplante
Estado nutricional del paciente que puede afectar considerablemente el resultado
quirúrgico, el tiempo de estancia hospitalaria, la morbilidad y la mortalidad. El
Especialista en nutrición deberá llevar a cabo una valoración nutricional previa al
trasplante. El objetivo del tratamiento nutricional durante esta fase consiste en hacer
óptimo el aporte de nutrientes respetando cualquier modificación dietética
necesaria.
En aquellos pacientes que se someten al trasplante hepático, se han empleado
dietas de baja carga bacteriana acompañadas de antibióticos profilácticos por vía
oral, con el fin de reducir la incidencia de infecciones.
El control, la revaluación y el apoyo nutricional por vía enteral aseguran una ingesta
adecuada en el tratamiento de estos pacientes.
10
Periodo pos trasplante inmediato
Las necesidades nutricionales dependen del estado nutricio previo al trasplante del
grado de hipermetabolismo y/o hipercatabolismo y de la función del aloinjerto. En
pacientes sépticos o sometidos a algún estrés puede ser difícil determinar sus
necesidades energéticas.
En pacientes con dependencia de ventilador, infecciones, trastornos de la fusión
gastrointestinal, ingesta oral insuficiente o interrupciones frecuentes de la ingesta,
pueden requerir alimentación por vía enteral o parenteral.
El tratamiento inmunosupresor impide el rechazado del órgano o tejido trasplantado.
Dado que el sistema inmune es responsable de combatir las infecciones, es preciso
establecer un equilibrio entre la evitación del rechazo y la lucha contra la infección.
Aunque pueden emplearse diversos fármacos para suprimir la respuesta inmune, la
combinación de ciclosporina, azatioprina y prednizona constituyen un régimen de
uso frecuente. El paciente debe consumir dichos medicamentos de forma indefinida.
Estos fármacos se asocian a un conjunto de efectos colaterales relacionados con la
nutrición, con frecuencia se indica una dieta baja en carga bacteriana, con la
finalidad de reducir al mínimo el riesgo de intoxicación alimentaria. Debe llevarse a
acabo de forma rutinaria el control de las interacciones entre el fármaco y nutrientes.
La dieta puede ajustarse a demanda para prevenir problemas nutricionales y
satisfacer las necesidades inmediatas a largo plazo.
Periodo pos trasplante tardío
El incremento excesivo de peso durante el primer año de un trasplante constituye
un problema nutricional frecuente. Este incremento de peso contribuye a un
aumento del apetito debido al tratamiento con corticoides. Entre los factores
coadyuvantes se incluye la falta de ejercicio, aumento de la absorción de nutrientes,
ingesta de dieta variada, tras un régimen pretrasplante altamente restringido.
Aquellos pacientes cuyo peso es inferior al ideal en el momento del trasplante
precisa normalizarlo, deben evitar el incremento excesivo de peso para reducir al
mínimo la hiperlipidemia, la hipertensión, y la diabetes como consecuencia de los
corticoides.
Dado el efecto catabólico del estrés y de la medicación postrasplante se recomienda
una ingesta adecuada de proteínas para evitar la reducción de sus reservas
proteicas.
Se recomienda la ingesta de grasa menor al 30% del total de kilocalorías, las grasas
saturadas menos del 10% de dicho total, y 300 mg de colesterol al día con el fin de
controlar los efectos lipemientas de los corticoides.
Se aconseja una dieta sin sal añadida, si persiste o aparece hipertensión o retención
de líquidos, se indicará una mayor reducción en la ingesta de sodio.
11
En el resto de los nutrientes se limitan los carbohidratos simples para facilitar el
control de peso y la hiperlipidemia. Se recomienda una dieta con elevado contenido
en fibra soluble. Las necesidades de electrolitos, como potasio, fósforo y calcio,
varían con la función del órgano y los efectos colaterales de la medicación, se
recomienda el control rutinario de los niveles séricos postrasplante.
El especialista deberá proporcionar una educación nutricional adecuada a los
pacientes y sus familiares.
Dieta de baja carga bacteriana
Son diversos los tipos de dieta de baja carga bacteriana empleados, como medida
de prevención de la infección en el paciente trasplantado dichas dietas varían según
el tipo de trasplante, y se ajustan a tres principios generales:
Evitar alimentos que puedan contener bacterias gramnegativas y algunas
levaduras.
Practicar técnicas seguras de manipulación y preparación de alimentos para evitar
la contaminación.
Evitar alimentos contaminados con microorganismos, como los huevos crudos, la
carne poco cocida, el pescado, el marisco y la leche no pasteurizada.
Las dietas son similares a las hospitalarias en general, no carecen de nutrientes,
con aportes dietéticos recomendados por la ADR.
Las infecciones son una causa fundamental de mortalidad y morbilidad en los
receptores de trasplante. El tratamiento dietético se emplea con frecuencia en la
descontaminación intestinal, la antibioterapia y/o el control ambiental para prevenir
las infecciones. El objetivo de estas dietas consiste en reducir al mínimo la
incidencia de infecciones evitando alimentos asociados con elevado contenido de
bacterias gramnegativas y enfermedades de origen alimentario.
La prescripción dietética debe iniciar con alimentos sin frutas ni verduras frescas,
sin pimienta o bolsitas de hierbas, restricción de sodio, el especialista determina el
nivel calórico adecuado y las características de la dieta a partir de la valoración
nutricional, la tolerancia del paciente y la consulta con el médico.
12
Grupo de
Alimentos
Dietas de Baja Carga Bacteriana. Alimentos que deben evitarse.
Tipo de Trasplante
Órganos
Torácicos
Cualquier tipo
poco cocido
Medula Ósea☼
Hígado ┼
Cualquier tipo
poco cocido
Grasas
Leche
Almidón
Verduras
-
Fruta
-
Todas las
verduras crudas
(incluyendo
ensaladas y
aderezos)
Todas las frutas
frescas
Cualquier tipo
poco cocido;
todos los
derivados del
queso y el
requesón
Todas las
verduras crudas
(incluyendo
ensaladas y
aderezos)
Fruta fresca con
piel comestible
(p. ej., uvas,
cerezas, bayas)
-
Carnes y Huevos
Bebidas
Condimentos
especias
/
Pimienta,
bolsitas de
hierbas secas
-
Páncreas Riñón ≡
Cualquier tipo
poco cocido;
todos los
derivados del
queso y el
requesón.
Todas las
verduras crudas
(incluyendo
ensaladas y
aderezos)
Fruta fresca con
piel comestible
(p. ej., uvas,
cerezas, bayas)
-
☼ Debe seguirse siempre que el recuento de neutrofilos sea <0.5 x 109 x 1
┼ Debe seguirse durante un mínimo de 21 días siguientes a la realización de un trasplante hepático ortopico y
siempre que se ingiera alguna solución descontaminante intestinal selectiva por vía oral.
≡ Debe seguir solo tas trasplante pancreatorrenal y siempre que se tome una solución descontaminante intestinal
selectiva por vía oral.
£ Se admite la ingesta de las frutas frescas que puedan pelarse y lavarse de forma razonable (p.ej. manzanas,
naranjas, plátanos, pomelos, peras, melón, piña, melocotón, nectarinas, kiwi).
Requerimiento energético en el trasplante renal
El trasplante de este órgano solido se lleva a cabo con mayor frecuencia,
tratamiento aceptado por muchos pacientes con enfermedad renal terminal, entre
las enfermedades de mayor frecuencia que producen una insuficiencia renal crónica
irreversible, como la glumeronefritis, la pielonefritis crónica, oliquistosis renal, la
nefropatía diabética y la nefroesclerosis hipertensiva. El trasplante renal se
considera un procedimiento de alto riesgo en individuos diabéticos u obesos.
La realización de la valoración nutricional adecuada, el peso corporal y las
mediciones antropométricas se ven afectadas por el edema y el tratamiento
diurético. Las técnicas empleadas para valorar el estado proteico (balance de
nitrógeno, albúmina, transferrina) se ven disminuidas en pacientes con enfermedad
renal y pueden afectar los niveles de hidratación, las reservas de hierro o posibles
infecciones.
13
La historia exhaustiva sobre nutrición (incluyendo ingesta y restricción de nutrientes,
suplementos de vitaminas y minerales, cambios de peso relativos en relación con el
adelgazamiento, el apetito y la intolerancia alimentaria), se lleva acabo de forma
rutinaria la intervención dietética adecuada, contribuye a desacelerar el deterioro de
la función renal y reduce al mínimo los riesgos nutricionales del trasplante.
Se aconseja al paciente disminuir en su dieta proteínas y sodio, también limitar la
ingesta de potasio y/o la de fósforo, a medida que el paciente presenta nefropatía
terminal (insuficiencia renal crónica, síndrome nefrótico, diálisis peritoneal y
hemodiálisis).
Periodo pos trasplante inmediato y tardío
Kilocalorías ☼
Proteínas
Sodio
Potasio
Calcio
Colesterol
Grasa
Hidratos de carbono
simples
Fibra
Alcohol
Cuidados Nutricionales en Trasplante Renal
Periodo de postrasplante
Periodo de postrasplante
inmediato *
tardío
Harris-Benedict basal + 30%
Harris-Benedict basal + 1020% (para evitar incremento
excesivo de peso)
1.3-1.5 g/kg/día
1 g/kg/día
90-135 g/kg/día
Sin sal añadida 90 mEq si
existe hipertensión
Sin Restricción
Igual
70 mEq/día en caso de
hipercaliemia
1.200 mg/día
Igual
Igual
≤300 mg/dia
30% de Kilocalorías;
Igual
importancia de grasa no
saturada
Limitar
Igual
Subrayar importancia
Evitar
Igual
Igual
☼ Aproximadamente los primeros dos meses tras el trasplante
£ La ecuación de Harris - Benedict y las necesidades proteicas se basan en el peso real (seco).
14
Requerimiento energético en el trasplante hepático
Se considera una modalidad terapéutica adecuada. Existen cuatro criterios
fundamentales que deben cumplir los candidatos al trasplante hepático:
Hepatopatía progresiva irreversible
Inexistencia o Ineficacia de tratamientos alternativos útiles
Ausencia de contra indicaciones absolutas
Aceptación del trasplante por parte del paciente y su familia
Hepatopatías Candidatas a Trasplante
Genéticas
Enfermedad de Wilson
Síndrome de Crigler-Najiar, Tipo1
Protoporfiria
Alfa- antitripsina
Hepatopatías metabólicas
Atresia biliar extra hepática
Cáncer Hepatobiliar
Hepatopatía parenquimatosa crónica
Síndrome de Budd-Chiari
Hepatitis crónica activa y cirrosis
Cirrosis biliar primaria
Colangitis esclerosarte
Hepatopatía Alcohólica
Proceso hepático fulminante (agudo)
Viral
Farmacológico
Enfermedad de Wilson
La mayoría de los pacientes con hepatopatías crónicas terminales, que requieren
trasplante muestran algún signo de mal nutrición. La valoración nutricional de estos
pacientes resulta difícil debido a los efectos de la hepatopatía crónica que no se
separan de la malnutrición, su valoración nutricia previa al trasplante debe consistir
en una combinación de pruebas habituales de laboratorio y determinaciones
antropométricas junto con parámetros subjetivos como el aspecto, historia
nutricional y peso, el grado de ascitis o edema.
15
Cuidado Nutricional en el Trasplante Hepático
Pretrasplante
Periodo de
Periodo de
postrasplante
Postrasplante
inmediato *
Tardío
Kilocalorías
Basal + 20%
Basal +15-20%
Basal 10-20% para
mantener el peso
deseable
Proteínas
1 g/kg/día (reducir la 1,2-1,75 g/kg/día
1 g/kg/día
necesidad
de
restricción)
Grasa
A demanda
30% de kilocalorías
30% de Kilocalorías
bajo
en
grasas
saturadas
Hidratos de carbono
A demanda
50-60%
de Reducir la ingesta de
kilocalorías
azucares simples
Sodio
90 mEq o menos
90-180 mEq
90-135 mEq
Líquidos
1.000-1.500 ml
A demanda
A demanda
Calcio
800-1.200 mg
800-1.200 mg
1.200-1.500 mg
Vitaminas/otros
Hasta satisfacer ADR Hasta satisfacer ADR Hasta satisfacer ADR
minerales
Forma hidrosoluble de
vitaminas A, D, y E
Dieta de baja carga Durante la activación
Durante un mínimo de Según indicación
bacteriana
21 días
* Aproximadamente los primeros dos mese después del trasplante
La ecuación de Harris-Benedict y las necesidades proteicas se basan en el peso corporal ideal del periodo previo
al trasplante y del periodo inmediatamente siguiente al mismo, así como en el peso real (seco) durante el periodo
postrasplante tardío.
Requerimiento energético en el trasplante de médula ósea
Constituye el tratamiento de algunas enfermedades hematológicas como la anemia
aplasia, la leucemia aguda, algunas formas de linfomas y algunos tumores sólidos
como el cáncer de mama. Resulta crítico para el éxito del trasplante la existencia de
un donante histocompatible. El mayor grado de semejanza de antígenos de
histocompatibilidad se produce entre gemelos genéticamente idénticos (Alogénico).
En algunos casos se aspira la propia médula ósea del paciente para inyectarla
posteriormente (autólogo).
Antes del trasplante los pacientes se encuentran generalmente en un estado de
nutrición adecuado. En el momento del ingreso hospitalario los pacientes son
sometidos a valoración dietética, que incluye preferencias y gustos alimentarios que
nos sirven de referencia durante la fase postrasplante correspondiente al reinicio de
la alimentación oral.
La fase de asesoramiento pretrasplante incluye información sobre alimentos y
servicios nutricionales, evitar frutas y verduras frescas debido a su contenido
bacteriano, comentar posibles efectos colaterales de la medicación entre la
preparación “quimioterapia y radiación”.
16
Antes del trasplante, se administra al paciente quimioterapia a altas dosis durante
varios días, con el fin de erradicar hasta donde sea posible la leucemia o linfoma y
prevenir posibles rechazos del injerto y/o caídas.
Entre las consecuencias nutricionales en la fase de acondicionamiento se pueden
incluir náuseas, vómito, mucositis, esofagitis, xerostomía, saliva espesa y viscosa,
disguesia, anorexia, sensación de saciedad precoz, diarrea y esteatorrea. La
duración e intensidad de estos síntomas y el estrés por el tratamiento provoca en
los casos cierto grado de malnutrición proteico calórica. Las diversas estrategias
terapéuticas planeadas para tratar estos problemas constituyen un objetivo
fundamental en los cuidados nutricionales durante la fase postrasplante.
Otras consecuencias de la fase de preparación es la alteración de la función inmune
y la reducción de la capacidad del organismo del paciente de luchar contra
patógenos bacterianos y micóticos por lo tanto se indica una dieta de baja carga
bacteriana.
Estos pacientes de TMO con frecuencia son incapaces de mantener una ingesta
oral adecuada debido a ulceraciones de la mucosa y anorexia inducidos por el
programa de preparación de trasplante, infecciones o enfermedades de injerto
contra el huésped.
Cuidados Nutricionales en Caso de Trasplante de Médula Ósea
Periodo pretrasplante Periodo postrasplante Periodo postrasplante
(incluye
fase
de inmediato*
tardío
preparación)
Kilocalorías
Basal +10-20%
Basal + 20%
Basal + 10-15%
Proteínas
1 g/kg/día
1,2-1,5 g/kg/día
1 g/kg/día
Grasa
A demanda
A demanda
A demanda
Hidratos de carbono / A demanda
A demanda
A demanda
fibra
Sodio
A demanda
A demanda
A demanda
Líquidos
A demanda
A demanda
A demanda
Calcio
800-1.200 mg/día
800-1.200 mg/día
800-1.200 mg/día
Vitaminas/otros
Hasta satisfacer ADR Hasta satisfacer ADR Hasta satisfacer ADR
minerales
Dieta de baja carga Durante
fase
de En
caso
de En
caso
de
bacteriana
preparación
neutropenia
neutropenia
*Aproximadamente los dos primeros meses tras el trasplante
£ La ecuación de Harris-Benedict y las necesidades proteicas se basan en el peso real (seco)
17
Tratamiento dietético de la enfermedad de injerto contra huésped
Etapa 1
Reposo intestinal y dieta absoluta hasta que el volumen de heces sea inferior a 500 ml/día
durante dos o más días.
Se administra NPC
Etapa 2
Introducción de bebidas de bajo contenido en residuo y lactosa (preferiblemente
isosmóticas) en comidas frecuentes y poco copiosas. Cuando mejoran los síntomas, pasa
a Etapa # 3. Se administra NPC para cumplir los objetivos de nutrientes y kilocalorías.
Etapa 3
Introducción de alimentos sólidos con bajo contenido en residuo, lactosa y grasa
(aproximadamente 30 g de grasa al día) y que carecen de irritantes gástricos. Estos
alimentos deben consumirse según tolerancia. Es necesario introducirlos con lentitud, de
uno en uno y en comidas frecuentes y poco copiosas.
Etapa 4
Liberalizar gradualmente las restricciones dietéticas anteriores hasta que se tolere de forma
asintomática la dieta normal.
Conclusión
La evolución y la educación nutricional son importantes en todas las fases, aun
previamente al trasplante de órganos. La evaluación nutricional debe ser frecuente
y el asesoramiento agresivo a fin de prevenir o tratar el aumento de peso,
principalmente durante el primer año pos trasplante. La educación del paciente
acerca de los potenciales efectos colaterales de los agentes inmunosupresores y
de las posibles restricciones de la dieta debe iniciarse antes de la cirugía, siempre
que resulte posible, o en el periodo pos trasplante inmediato, y conseguirse a largo
plazo.
Se requieren intervenciones nutricionales repetidas para facilitar la correlación de
los hábitos alimentarios y el desarrollo de la disciplina de un estilo de vida productivo
y saludable, para mejorar los trastornos metabólicos inducidos o influidos por la
dieta.
18
Referencias bibliográficas
(1) Ohara MM. Inmunosuppression in solid organ transplantation: a nutrition perpective.
Top Clin Nutr 1992;7 (3): 6 - 1.
(2) Wiesner RH, Hermans P, Rakela J, Washington J, Perkins J, DiCecco S, Krom RAF.
Selective bow decontamination to prevent gram-negative aerobic bacterial and candida colonization
and prevent infection following orthotropic liver transplantation.
Transplantation 1988;45:570-574.
(3) Pagenkemper JJ, Foulks CJ, Nutritional management of the adult renal transplant patient J Renal
Nutr 1991; 1:119-124
(4) Pruchno CJ, Hunsicker LG, Nutritional requirements of renal transplant patients, In: Mitch WE,
Klahr S, ads. Nutrition and the kidney. Boston: Little, Brown, 1993:346-364.
(5) Moore RA, Callahan RF, Cody M, Adams PL, Litchford M, Buckner K, Galloway J, The effect of
the American Heart Association Step One Diet on hyperlipidemia following renal transplantation.
Transplantation 1990; 49:60-62
(6) Schenker S. Medical treatment vs. Transplantation in liver disorders. Hepatology 1984;4:10251065.
(7) Hasse JM. Nutritional implications of liver transplantation. Henry Ford Hosp Med J 1990;38:235240
(8) Hasse JM. Nutritional implications of liver transplantation. Top Clin Nutr 1992;7(3):24-33
(9) Aker SN. Bone marrow transplantation: nutrition support and monitoring. In: Bloch SA, ed.
Nutrition management of the cancer patient. Rockville MD: Aspen Pubs 1990:199-225
(10) Gauvreau Jm, Lenssen P, Cheney Cl, Aker SN, Hutchinson ML, Barale KV, Nutritional
management of patients with intestinal graft-versus-host disease. J Am Diet Assoc 1981;79:673-677
19
ESTIMACIÓN DEL GASTO ENERGÉTICO PARA EL ADULTO
MAYOR
ENC. José Angel Torres Treviño, NC
Profesor de la Especialidad en Nutriología Clínica, Facultad de Salud Pública y
Nutrición, Universidad Autónoma de Nuevo León.
Introducción
En la historia del metabolismo energético, debemos reconocer al padre de la
nutrición: el francés Antonio Laurent de Lavosier, quien en 1783, junto al marqués
Pierre-Simon Laplace, llevaron a cabo los experimentos necesarios para sentar las
bases de la calorimetría directa e indirecta, vigentes hasta la actualidad.
En 1899 Adolph Magnus-Levy fue el primero en acuñar el término Grundumsatz,
que en alemán significa: metabolismo basal, el término enfatizaba en la necesidad
de cumplir con los siguientes requisitos: ausencia de actividad muscular, estado
post-absortivo, mínima distracción emocional, desvelo, condición nutricional normal,
ausencia de enfermedad o infección y ambiente térmico neutral, sin embargo tales
requerimientos difícilmente se cumplían en la práctica, debido a que el término:
‘metabolismo basal’ se confundía con el nivel más bajo de gasto energético, lo cual,
es incorrecto, pues durante el sueño y en estados de desnutrición, se observa un
metabolismo menor que el basal, por ello, Krogh, en 1923, lo definió como:
‘metabolismo estándar’ detallando los criterios necesarios para la evaluación: 1)
Con el sujeto descansado, acostado y despierto, 2) Con ayuno de 10-12 horas, 3)
Temperatura ambiental de 22-26º C; y 4) Sin estrés emocional o familiar.
Aunque se cuenta con registros históricos sobre los requerimientos de energía
propuestos desde 1890 por Carl Voit, Atwater en 1895 y Graham Lusk en 1918,
estos fueron realizados según la ingesta dietética de energía. Fue hasta 1957 en
que la FAO publicó el documento: ‘Calorie requirements’, el cual utilizó por primera
vez el término: ‘gasto energético’ para calcular el requerimiento de energía. El
resultado del documento fue la formulación empírica de una ecuación simplificada
en años posteriores, para la estimación de energía en ambos géneros. A
continuación se muestra la fórmula (Tabla 1):
Tabla 1: Fórmula FAO, 1957
Hombres = 815 + 36.6*PC
Mujeres = 580 + 31.1*PC
PC: Peso Corporal
Desde 1981, en que el comité de expertos en requerimientos energéticos y proteicos
de la FAO, OMS y la Universidad de las Naciones Unidas lanzaron la primer
20
publicación sobre este tema a nivel mundial, se han realizado diversas estimaciones
en torno al requerimiento basal de energía en los diferentes grupos de edad (1).
También existe el método del agua doblemente marcada, considerado el gold
standard para la determinación del gasto energético y el cual es utilizado en
humanos desde hace 30 años. Para determinar la producción de CO2 y el cociente
respiratorio, el sujeto de estudio recibe una carga de dos isótopos estables: 2H y
18O, los cuales se combinan con los átomos de Hidrógeno y Oxígeno del cuerpo, al
producirse energía, se libera CO2 y agua, excretados por exhalación, así como por
fluidos corporales, como: saliva, orina y sudor, la pérdida de 2H y 18O, refleja el índice
por medio del cual el CO2 es producido, lo que puede ser utilizado para estimar el
gasto energético, utilizando la tasa de producción de CO2 y el cociente respiratorio
(2).
Fórmulas para la estimación del gasto energético
A continuación se describe la metodología utilizada por los autores originales en la
elaboración de las ecuaciones para estimar el gasto de energía en reposo o el
requerimiento basal de energía. Los resultados están expresados en *Mega Joules,
para realizar la conversión a calorías, se requiere multiplicarlo por un factor de 238.8
respectivamente.
Harris-Benedict.
James Arthur Harris y Francis Gano Benedict, en 1919 publicaron la gran obra: “A
biometric study of basal metabolism in man” en el Laboratorio de Nutrición de la
Carnegie Institution of Washington en Boston, EU, quienes junto a un equipo de
colaboradores, elaboraron una ecuación para estimar el requerimiento energético,
utilizando por primera vez los principios de la entonces novedosa Biometría,
implementando la rigurosa metodología propuesta por Magnus-Levy y haciendo
coeficientes de correlación parcial, se crearon estudios de calorimetría indirecta en
239 sujetos (136 hombres y 103 mujeres) de 21 a 70 años, en población normal,
atletas y vegetarianos, concluyendo que el peso y la talla tienen una relación
independiente en la estimación del Requerimiento Metabólico Basal (RMB) (3), más
de 60 años después, Daly (1985) concluiría en su estudio lo que el propio Benedict
habría aceptado años después de la publicación en 1919, la ecuación sobreestima
de un 10 a un 15% el RMB, especialmente en mujeres jóvenes, aun así, se
considera la fórmula más conocida y ampliamente utilizada a nivel mundial (4).
Tabla 2. Fórmula Harris y Benedict, 1919
H= [66.473 + (13.752 x PC) + (5.003 x T) – (6.755 x E)] x 4.186
M= [655.096 + (9.563 x PC) + (1.850 x T) – (4.676 x E)] x 4.186
PC: Peso Corporal en kg, T: talla/estatura en cm, E: edad en años
21
FAO/WHO/UNU
Los expertos de la Organización para la Agricultura y la Alimentación, la
Organización Mundial de la Salud y la Universidad de las Naciones Unidas, en el
tema de requerimientos energético – proteicos, realizaron en 1981 una cumbre en
Roma, Italia, en donde Durnin y su equipo plantearon los resultados de una revisión
científica sobre la tasa metabólica en reposo (TMR) y datos antropométricos de
2,238 individuos, presentando tablas para estimar la TMR a partir del peso, edad y
género, fue entonces cuando se delegó la tarea de ampliar la muestra para la
obtención de ecuaciones predictivas, a Schofield y su equipo, concluyendo con una
serie de ecuaciones predictivas para ambos sexos, por grupos de edad en años: 03, 3-10, 10-18, 18-30, 30-60; y >60, las cuales conformaron las ecuaciones oficiales
del documento de la FAO/WHO/UNU de 1985: ‘Energy and Protein Requirements’,
utilizando una muestra de 114 estudios publicados sobre la TMR con un total de
7,173 individuos (5), sin embargo, fue el propio reporte de la FAO/WHO/UNU el que
reconoció una sobreestimación del 10-11% en la población asiática y de los trópicos,
lo que posteriormente fue corroborado por distintos autores en Caucásica y Asiática,
así como una sobreestimación del 7% en población de individuos afro-americanos
de 8 a 17 años.
Lo anterior está relacionado a la inclusión del 47% de la muestra de 3,388 individuos
de nacionalidad italiana, quienes aparentemente tienen una mayor TMR por
kilogramo de peso que los otros dos grupos étnicos mencionados, también fue
debido a una inclusión de pocos pacientes asiáticos (322) y de los trópicos (615),
esto fue reconocido por el propio Schofiled y se replantearon las ecuaciones,
excluyendo a la población italiana, para la obtención de la TMR, aunque solo para
la población de 18 a 30 años.
Para población mayor de 60 años, se utilizó una muestra de 38 mujeres y 50
hombres, por lo que algunos autores han propuesto fórmulas alternas para la
comparación y estimación de la TMR, debido al reporte de subestimación en éste
grupo de edad, aun así, las ecuaciones de Schofield son ampliamente conocidas y
utilizadas gracias a la aproximación para la estimación de la TMR (6).
Tabla 3. Fórmula FAO/WHO/UNU, 1985
H= [(8.8 x PC) + (1128 x T) – 1071] x 4.186
M= [(9.2 x PC) + (637 x T) – 302] x 4.186
PC: Peso Corporal en kg, T: talla/estatura en cm.
22
Fredrix
E. W. Fredrix, en 1990 publicó la primera ecuación específica para estimación del
gasto energético en reposo (GER) en adultos mayores, en el Departamento de
Biología Humana de la Universidad de Limburgo, en Maastricht, Holanda, junto a su
equipo de colaboradores, identificaron que la población de adultos mayores en
hospitales holandeses aumentaba, por lo que midieron el gasto energético en
reposo de 40 adultos mayores sanos de 51 a 82 años, utilizando calorimetría
indirecta con sistema de ventilación en campana, concluyendo que algunas
ecuaciones comúnmente utilizadas, subestiman en 6% del GER en esta población,
correlacionando significativamente el GER con la masa libre de grasa y el peso
corporal. El análisis de regresión múltiple por pasos, mostró la mejor predicción del
GER cuando se utilizaba la combinación de: peso corporal, sexo y edad, aun así, el
resultado podría subestimarse o sobreestimarse en 225 calorías debido a la
variación de parámetros entre pacientes, también midieron el gasto energético del
sueño, concluyendo que era 7% más bajo que el GER (7).
Tabla 4. Fórmula Fredrix, 1990
H= [1,641 + (10.7 x PC) – (9.0 x E) – 203] x 4.186
M= [1,641 + (10.7 x PC) – (9.0 x E) – 406] x 4.186
PC: Peso Corporal en kg, E: edad en años
Mifflin-St Jeor
Mark D. Mifflin, Sachiko St Jeor y colaboradores, publicaron en 1990 una ecuación
para predecir el gasto energético en reposo (GER) en individuos sanos, utilizando
la base de datos del estudio RENO Diet-Study, que involucró un seguimiento de 5
años en 498 pacientes de un estudio aprobado por el comité de ética de la
Universidad de Nevada, Reno, EU. Los participantes fueron estratificados en 5
grupos de edad: 20-29, 30-39, 40-49, 50-59 y >60, excluyendo a los de bajo peso y
obesidad mórbida seleccionando la muestra con 264 individuos de IMC normal y
234 con obesidad, en quienes se evaluó el GER por medio de calorimetría indirecta.
La ecuación se obtuvo por medio de un análisis de regresión múltiple, utilizando el
GER como variable fija y relacionándola con el peso, altura y edad en ambos sexos,
se logró la mayor relación entre el GER y la masa libre de grasa, también se
encontró una relación significativa con la fórmula de Harris-Benedict, concluyendo
que dicha fórmula sobreestima en un 5% el GER en comparación con la presentada
por los autores (8).
Tabla 5. Fórmula Mifflin – St. Jeor, 1990
H= [(10 x PC) + (6.25 x T) – (5 x E) + 5] x 4.186
M= [(10 x PC) + (6.25 x T) – (5 x E) + 161] x 4.186
PC: Peso Corporal en kg, T: talla/estatura en cm, E: edad en años
23
Lührmann
P.M. Lührmann y su equipo de colaboradores publicaron en 2002 una ecuación
específica para la estimación de la Tasa Metabólica en Reposo (TMR) en la
población de Adultos Mayores, trabajo realizado en el Instituto de Ciencias
Nutricionales de la Universidad de Giessen en Alemania.
Se evaluó la TMR por medio de calorimetría indirecta, en una muestra de 179
pacientes femeninos y 107 masculinos de la población de Giessen, quienes
contaban con al menos 60 años y no padecían disfunción tiroidea. Se realizó un
análisis de regresión lineal múltiple, paso a paso para estimar los mejores
indicadores de la TMR, considerando el peso corporal, talla, edad y sexo.
Los resultados fueron comparados con los de las ecuaciones de la WHO de 1985 y
se concluyó que no había diferencia significativa entre ambas ecuaciones para la
población femenina, mientras que en la masculina, se encontró un volumen mayor
de la TMR, que lo calculado por la fórmula de la WHO (9).
Tabla 6. Fórmula Lührmann, 2002
H= 3,169 + [(50 x PC) – (15.3 x E)] + 746
M= 3,169 + [(50 x PC) – (15.3 x E)]
PC: Peso Corporal en kg, E: edad en años.
Müller
Manfred J. Müller y sus colaboradores, publicaron en 2004, ecuaciones de
referencia para la estimación del Gasto Energético en Reposo (GER) en el Instituto
de Nutrición Humana y Ciencias de la Alimentación de la Universidad zu Kiel en
Kiel, Alemania. Fue un estudio retrospectivo sobre el GER y la composición corporal
de 2,528 individuos de 5 a 91 años, de 7 diferentes centros entre 1985 y 2002.
Se hizo una regresión de multi-variables para la estimación del GER, las pruebas
de asociación entre los resultados de las ecuaciones generadas, fueron
comparadas con las ecuaciones de la WHO de 1985, concluyendo que éstas
últimas, sobreestimaron el GER en la población estudiada (10).
Tabla 7. Fórmula Müller, 2004
H= {[(0.047 x PC) – (0.01452 x E) + 3.21] + 1.009} * 238.8
M= {[(0.047 x PC) – (0.01452 x E)] + 3.21} * 238.8
PC: Peso Corporal en kg, E: edad en años.
24
Henry
Henry publicó en 2005 nuevas ecuaciones para la estimación de la Tasa Metabólica
Basal (TMB) en la Escuela de Ciencias Biológicas y Moleculares de la Universidad
de Oxford Brookes, Reino Unido. Fue un estudio de revisión que incluyó una
muestra final de 166 investigaciones publicadas sobre la TMB, con un total de
10,552 individuos, de la que se había excluido la población italiana y se incluía a
4,018 individuos de los trópicos. Los resultados en general mostraban valores más
bajos que aquéllos mostrados por las ecuaciones de la FAO/WHO/UNU de 1985
(11).
Tabla 8. Fórmula Henry, 2005
H= [(11.4 x PC) + (541 x T) – 256] x 4.186
M= [(8.52 x PC) + (421 x T) + 10.7] x 4.186
PC: Peso Corporal en kg, T: Talla en cm.
Frankenfield
David Frankenfield publicó en 2010 una validación de 2 ecuaciones para estimar la
Tasa Metabólica en Reposo (TMR) para adultos mayores con obesidad y
críticamente enfermos, en el Departamento de Nutrición Clínica del Centro Médico
Milton S. Hershey, de la Universidad de Penn State, en Hershey, Pensilvania, EU
de América.
Estudio prospectivo de 50 pacientes con edad ≥ 60 años e Índice de Masa Corporal
(IMC) ≥ 30 kg/m2, las mediciones se realizaron por medio de calorimetría indirecta
y calculadas con un 95% de intervalo de confianza, utilizando la fórmula modificada
de la Universidad de Penn State (PSU), a partir de la ecuación de Mifflin y
comparándola con el método propuesto. En la muestra se reportaron pacientes con
traumatismo, quirúrgicos y bajo cuidados médicos, en el 36% del total se
encontraron febriles durante las 24 horas previas al estudio y se usaron inotrópicos
en el 44% de los casos.
No se encontró diferencia significativa entre los resultados de ambas fórmulas, sin
embargo hubo un menor número de errores máximos en la ecuación propuesta, por
lo que se reconoce una mayor exactitud en la misma y se sugiere su implementación
en poblaciones con características similares a las presentadas en el estudio (12).
Tabla 9. Fórmula Frankenfield, 2010
H= (PA x 0.96) + Tmax (167) + VE(31) – 6,212
PA: peso actual en kg, Tmax: Temperatura máxima en las últimas 24 horas (ºC). V E: minutos de
ventilación (L/min).
25
Conclusiones
Se sugiere el uso de las ecuaciones presentadas en población con características
similares a las presentadas por cada autor. La fórmula de la FAO/OMS/UNU de
1985 subestima la TMR en población de adultos mayores, Harris y Benedict
sobreestima de un 5 a un 15% el RMB, Mifflin continúa siendo la ecuación más
precisa en adultos mayores con obesidad y Frankenfield está indicada en mayores
de 60 años en unidades de terapia intensiva. Henry y Müller son las ecuaciones más
cercanas a la TMR por la selección de la muestra y metodología utilizada.
Referencias bibliográficas
(1) Henry, C.J. (2005). Basal Metabolic Rate studies in humans: measurement and development of
new equations. Public Health Nutr, 8(7A), 1133-52.
(2) Weir, J.B. (1990). New methods for calculating metabolic rate with special reference to protein
metabolism. Nutrition, 6(3), 213-21.
(3) Harris J., & Benedict, F. (1919). Biometric study of basal metabolism in man. Washington DC:
Carnegie Inst of Wash.
(4) Henry, C.J. Op Cit.
(5) FAO/WHO/UNU. (2005). Human energy requirements. Scientific background papers of the joint
FAO/WHO/UNU expert consultation, Rome 17-24 October 2001. Public Health Nutr, 8, 929-1228.
(6) Henry, C.J. Op Cit.
(7) Fredrix, E.W., Soeters, P.B., Deerenberg, I.M., Kester, A.D., von Meyenfeldt, M.F. & Saris, W.H.
(1990). Resting and sleeping energy expenditure in the elderly. Eur J Clin Nutr, 44(10), 741-7.
(8) Mifflin, M.D., St Jeor, S.T., Hill, L.A., Scott, B.J., Daugherty, S.A. & Koh, Y.O. (1990). A new
predictive equation for resting energy expediture in healthy individuals. Am J Clin Nutr, 51(2), 241-7.
(9) Lührmann, P.M., Herbert, B.M., Krems, C., Neuhäuser-Berthold, M. (2002). A new equation
especially developed for predicting resting metabolic rate in the elderly for easy use in practice. Eur
J Nutr, 41(3), 108-13.
(10) Müller, M.J., Bosy-Westphal, A., Klaus, S., Kreymann, G., Lührmann, P.M., Neuhäuser-Berhold,
M., Noack, R., Pirke, K.M., Platte, P., Selberg, O. & Steiniger, J. (2004). World Health Organization
equations have shortcomings for predicting resting energy expenditure in persons from a modern,
affluent population: generation of a new reference standard from a retrospective analysis of a German
database of resting energy expenditure. Am J Clin Nutr, 80(5), 1379-90.
(11) Henry, C.J. Op Cit.
(12) Frankenfield, D., Roth-Yousey, L. & Compher, C. (2005). Comparison of predictive equations for
resting metabolic rate in healthy nonobese and obese adults: a systematic review. J Am Diet Assoc,
105(5), 775-89.
26
REQUERIMIENTO ENERGÉTICO EN PACIENTES EN ESTADO
CRÍTICO
Dra. María Dolores Flores Solís
Tutora de la Especialidad en Nutriología Clínica, Facultad de Salud Pública y
Nutrición, UANL.
Jefe del Servicio de Nutrición Enteral y Parenteral
Hospital General Dr. Miguel Silva, SS Michoacán
Docente e Investigador de Tiempo Completo
Facultad de Enfermería, U.M.S.N.H.
Introducción
La malnutrición en el paciente crítico es un problema común y su consecuencia más
importante es el aumento en la morbilidad y mortalidad, la cual se ha asociado con
una mayor incidencia de infecciones, retraso en los procesos de cicatrización de los
tejidos, disminución en la funcionalidad muscular, aumento de la estancia
hospitalaria y mayores costos en la atención. (1) Con el propósito de disminuir el
riesgo de malnutrición en estos pacientes, el soporte nutricional (SN) es
fundamental y debe ser parte de su manejo integral. En la unidad de cuidados
intensivos (UCI), el Soporte Nutricional especializado debe estar a cargo del equipo
multidisciplinario que implemente los protocolos desde la selección del paciente
hasta el control ambulatorio. (2)
La calorimetría Indirecta (CI), es el método considerado, en la clínica, como el
“estándar de oro”, (3) para obtener los requerimientos energéticos de estos
pacientes en estado crítico. Presenta varios problemas cuando se quiere una CI
(equipamiento costoso, tiempo para realizar las mediciones, experiencia y falta de
disponibilidad en la mayoría de las unidades) y no está disponible en todas las
Unidades. Además, intenta predecir el gasto energético total a partir de mediciones
entre 5 y 30 minutos, habiéndose demostrado variaciones del mismo de hasta el
20% a lo largo del día. De esta forma deberemos añadir un 15-20% al gasto
energético en reposo para calcular el gasto energético total. Más exacto es
mantener las mediciones durante 24 horas para conocer el gasto energético total
por medio de CI. (4)
La Calorimetría Indirecta (CI) es un método que permite estimar el gasto metabólico
de forma indirecta mediante el estudio del intercambio gaseoso, midiendo el
consumo de oxígeno (VO2) y la producción de CO2 (VCO2). Esta metodología puede
ser de dos tipos: calorimetría indirecta circulatoria y calorimetría indirecta
ventilatoria. La primera requiere de la determinación del oxígeno en la sangre
arterial y venosa mixta, mediante la inserción de un catéter Swan-Ganz, mientras
que en la segunda, el paciente requiere respirar aire a una concentración
determinada, a través de una boquilla cerrando la nariz con una pinza, a través de
una mascarilla, tubo orotraqueal/ traqueostomía o una caperuza, también llamado
27
canopy. Debido a que es menos invasiva, es más utilizada la ventilatoria, que a su
vez se divide en circuitos abiertos (Deltatrac, MCOVX, bolsa Douglas) o cerrados
(Body-Gem, MedGem), según la metodología del instrumento de medición. (5)
El paciente en estado crítico presenta una enfermedad aguda o crónica reagudizada
que provoca un daño que va desde la limitación funcional de uno o más órganos
hasta la muerte. Los pacientes con lesiones graves como quemaduras,
traumatismo, y los que tienen infección documentada (sepsis), presentan una
sucesión de trastornos progresivos que se reflejan en anomalías clínicas,
hemodinámicas, metabólicas y funcionales que se conoce como la respuesta
inflamatoria. (6) Cuando la inflamación aparece en áreas diferentes al sitio de la
lesión afectando también tejidos sanos se le llama síndrome de respuesta
inflamatoria generalizada (SRIG), que se caracteriza por liberación de citoquinas,
enzimas, radicales libres tóxicos y activación de la cascada de complemento.
Además, se producen otros cambios como disfunción endotelial progresiva con
aumento de la permeabilidad capilar, llevando a alteración de los mecanismos de
vasodilatación y vasoconstricción, responsables de la muerte por choque en
muchos de los pacientes.
El síndrome de respuesta inflamatoria sistémica (SIRS) se caracteriza por
hipermetabolismo, gasto cardíaco alto, consumo bajo de oxígeno, saturación alta
de oxígeno en sangre venosa, acidosis láctica y balance de líquidos positivo que se
acompaña de edema y disminución aguda de las proteínas circulantes. Una de las
hipótesis del origen de este proceso es la falla de la barrera intestinal que permite
el paso de las bacterias a los ganglios linfáticos mesentéricos para luego entrar al
torrente sanguíneo y colonizar a distancia; a pesar de que esto no se ha demostrado
en humanos, es claro, que existe una alteración en la relación simbiótica entre las
bacterias intestinales y el huésped, ocasionada por la falta de nutrientes en la luz
intestinal, la isquemia mesentérica provocada por la enfermedad o el tratamiento
con fármacos vasoactivos que causan cambios en la flora intestinal. (7)
En pacientes en los que se determina el gasto energético mediante calorimetría
indirecta CI, se recomienda comenzar con un aporte energético alrededor del 80%
durante los primeros 7-10 días tras la fase de estabilización, dado lo próximo que
están al gasto energético en reposo y el gasto energético total durante esta primera
fase. Posteriormente se debería aumentar el aporte energético pero sin sobrepasar
en las primeras semanas el 120-130% del gasto energético medido, dado el
aumento del mismo durante la segunda semana y la fase de convalecencia. En
pacientes con desnutrición previa importante y sin altos niveles de agresión, se
pueden utilizar aportes en el rango más alto. En pacientes donde no se pueda medir
el gasto energético son aplicables las recomendaciones de las guías que nos
proporcionan: ACCP- ASPEN, SEMICYUC-SENPE, ESPEN, CRITICAL CARE.
Estas Recomendaciones abarcan todo tipo de paciente crítico, estando
contempladas diferentes situaciones clínicas y metabólicas, por lo que no son muy
ajustadas. (8)
28
La literatura incluye más de 200 fórmulas para estimar el gasto energético (GE),
ninguno de los cuales han demostrado una buena correlación con las mediciones
realizadas por CI. Sin embargo, se recomienda su uso cuando no se puede realizar
calorimetría. Para seleccionar la fórmula más adecuada, debe considerarse el tipo
de pacientes de la evaluación (IIb). Un estudio ha sido publicado recientemente, que
incluye a 202 pacientes críticos que reciben ventilación mecánica en comparación
con CI utilizando diferentes fórmulas para el cálculo de base del GE. Los autores
concluyeron que la fórmula de Penn State, proporciona una evaluación más precisa
de la tasa metabólica en los pacientes críticamente enfermos con ventilación
mecánica (Ib).
Ecuación de Penn State, Harris-Benedict (0,85) + VE (33)+ Tmax (175) - 6433.
(Peso actual. VE = volumen L/min, según el registro del ventilador. Tmax =
temperatura máxima, en grados centígrados, en las 24 horas previas según la
gráfica del paciente). Por lo cual se requiere contar que el paciente este dependiente
del ventilador.
Otro es el método de Fick un método alternativo para el cálculo del gasto-energético
a partir de la medición del gasto cardiaco, la concentración de hemoglobina y la
concentración de O2 en sangre arterial y venosa mezclada, por lo que se necesita
tener insertado un catéter de termo-dilución. En la literatura médica, mientras unos
trabajos evidencian una alta correlación con la calorimetría indirecta otros no la
encuentran, este método no ha mostrado una buena correlación con la calorimetría
y raramente se utiliza en la práctica diaria (III). (9)
Método de Fick para el cálculo del Gasto energético (GE)
GE = GC x Hb (Sa O2 – Sv O2) 95,18
Donde:
– GC: gasto cardiaco
– Hb: concentración de hemoglobina sanguínea
– Sa O2: saturación arterial de oxígeno
– Sv O2: saturación venosa de oxígeno
Todos los métodos han demostrado una correlación pobre con el GE medido, con
sobreestimación en el 80% de los casos, por lo que se considera que los pacientes
críticamente enfermos son a menudo una población diferente que la utilizada como
base para esta fórmula.
La correlación no es buena debido a las múltiples variables del paciente crítico (III).
Varios estudios muestran que no hay buena correlación entre la ingesta de una
cantidad fija de calorías (25 kcal/kg/día) y calorimetría indirecta CI (IIa), para obtener
mejores resultados con este último.
29
En el 2009 se publicaron los resultados de un estudio en el cuál se realizó CI en una
población de 202 adultos críticos, bajo ventilación mecánica. Posteriormente se
calculó el gasto energético con las siguientes ecuaciones: Penn State, Swinamer,
Ireton-Jones, Mifflin, Mifflin x 1.25, HB x 1.25, HB con peso ajustado y HB con peso
ajustado x 1.25. (10)
Penn State University (PSU). Fue formulada en una población de 169 adultos que
se encontraban en terapia intensiva. Los datos de CI fueron recolectados entre 1992
y 1997. Toma en cuenta variables de tamaño corporal para el cálculo del gasto
energético basal, ya sea con la ecuación de HB o Mifflin, y variables de la respuesta
inflamatoria como la ventilación por minuto y la temperatura corporal19. Su utilización
no requiere ajustar el peso corporal, multiplicadores de estrés ni agregar el efecto
térmico de los alimentos (ETA).
Swinamer. La ecuación data de 1990, fecha en la que se realizó un estudio en 112
adultos críticos de una región de Canadá.
Ireton- Jones. La ecuación de Ireton Jones, una de las más populares en pacientes
críticos, data de 1992, como resultado de una investigación en 65 adultos
estadounidenses en estado crítico. Esta fórmula tiende a sobreestimar el
requerimiento energético en la población sin obesidad, y a subestimar en la
población con obesidad.
En el estudio mencionado, se encontró que la ecuación de Penn State University,
modificada por Mifflin St-Jeor era la que tenía mejor exactitud de la predicción (67%)
sin embargo su utilización no es exacta en la población de adultos mayores con
obesidad, población para la cual proponen otra fórmula. Esta propuesta fue validada
en el 2010 en 55 adultos mayores, la cual es únicamente para individuos de más de
60 años con un IMC mayor a 30.
La primera versión ha sido validada para pacientes en coma barbitúrico 10. Así
mismo, ambas fórmulas son propuestas por las guías ASPEN para el manejo
nutricional de los pacientes en estado crítico con obesidad. (12)
Una de las propuestas del artículo, y de interés para realizar el cálculo del gasto
energético en individuos que no están bajo ventilación mecánica es utilizar la
ecuación de Mifflin x 1.25, la cual tiene una menor exactitud de la predicción
comparada con la fórmula de HB utilizando peso ajustado x 1.25, sin embargo, ésta
tiende a sobreestimar los requerimientos de los pacientes. Cuándo se utilizan estos
tipos de factores de estrés, no es necesario incorporar el ETA. Otra propuesta
realizada por Frankenfield y su equipo de trabajo, para estimar el gasto energético
en individuos no críticos ha sido publicada, sin embargo aún no ha sido validada.
(12)
30
Una de las desventajas de la fórmula de PSU es que en población con IMC <20.5
kg/m2, la exactitud de la predicción es menor a 60%, razón por la cual se han
propuesto dos ecuaciones modificadas a utilizar en esta población, sin embargo
faltan estudios que validen su exactitud de la predicción. (11)
Existen algunas otras recomendaciones para estimar el peso corporal que se basan
únicamente en el peso corporal; ASPEN recomienda de 20 a 35 kcal/kg en adultos,
y de 11 a 14 kcal/kg de peso actual para el caso de los adultos críticos con obesidad,
o bien realizar el cálculo con 22-25 kcal/kg de peso ideal. Mientras tanto, la ACCP
recomienda 25 kcal/kg, sin embargo la utilización de las estrategias que se basan
únicamente en la variable de peso no es recomendable en los pacientes en estado
crítico. (12)
Las necesidades cambiarán según la fase metabólica donde el paciente este: fase
catabólica o fase anabólica de recuperación. Si el GE no puede medirse, una fuente
tan cerca como sea posible a los requisitos medidos por calorimetría indirecta en la
fase inicial, se recomienda aumentar en las fases de convalecencia más avanzadas,
basadas en estudios que muestran una mayor incidencia de infecciones en
comparación con balance negativo de Calorías (III) y mejores resultados con un
balance de calorías positivas (Ib). Algunos autores recomiendan suplementar con
nutrición parenteral (PN) cuando los requisitos no cumplen (60-70% de alimentación
enteral). (13) Un meta-análisis de estudios que compararon la nutrición enteral (EN)
con nutrición mixta, aplicada desde la admisión del paciente, no muestra menor
incidencia de complicaciones infecciosas, días de estancia en UCI y días de
ventilación mecánica (Ia).
El peso a utilizar en la fórmula dependerá del índice de masa corporal (IMC). En
pacientes con IMC < 18 kg/m2 se recomienda usar el peso actual, para prevenir el
síndrome de realimentación, y para el resto de los pacientes el peso antes de la
agresión, como el peso actual muestra cambios importantes como resultado de la
reanimación inicial. En los últimos años hipoalimentación permisiva durante las
primeras fases del paciente crítico (18 kcal/kg peso corporal/día) se está
convirtiendo en cada vez más aceptado (III), espera alcanzar el objetivo completo
de los requisitos (25 kcal/kg/día) después de la primera semana. Los estudios
recientes apoyan este enfoque de búsqueda de mejores resultados clínicos cuando
la ingesta de calorías, durante los primeros días de la fase de catabolismo, es entre
33 y 66% de los requerimientos estimados (IIb). Suministros de baja energía
estimada estarían asociadas con un mayor número de bacteremias (III) y más alto
con complicaciones (IV). Sin embargo, esta recomendación no puede ser fundada
sin un estudio prospectivo, que aún no está disponible. (14)
La glucosa sigue siendo el sustrato principal de calorías en pacientes críticamente
enfermos. Una infusión de glucosa a 4 mg/kg/min sólo suprime la gluconeogénesis
(50%) en el catabolismo de proteína en 10-15%, por lo que se recomienda no
31
administrar una fuente de glucosa superior a 4 g/kg/día. En general, los hidratos de
carbono representan el 50% de las necesidades de energía globales, aunque este
porcentaje puede variar dependiendo de factores individuales y la severidad de la
agresión. Debido a la alimentación y el estrés metabólico, la hiperglucemia se
produce y se ha asociado con pobre mejoría clínica (III). Múltiples estudios y metaanálisis (Ia) recomiendan mantener la glucemia en valores entre 140 y 180 mg/dL,
con insulina si se supera este límite, aunque no existe consenso sobre el valor límite
más adecuado. Los valores más altos estarían relacionados con peores resultados
clínicos, particularmente en las complicaciones infecciosas. (15)
El soporte nutricional especializado (SNS) en pacientes críticamente enfermos ha
sido una de las intervenciones terapéuticas más polémicas, y se ha dado
preferencia a otros tratamientos que se consideraban más importantes para mejorar
el curso clínico de estos pacientes. Sin embargo, en los últimos años numerosos
ensayos clínicos han causado que esta situación cambie. Hay pruebas suficientes
de que la desnutrición es un factor de riesgo independiente para morbilidad, con
una tasa mayor de infecciones, estancia en UCI y hospitalaria, días de ventilación
mecánica, dificultad para la cicatrización y mayor mortalidad. Al mismo tiempo, la
evidencia sobre la eficacia y el impacto del apoyo nutricional para mejorar resultados
en el curso clínico de estos pacientes ha aumentado en la última década. Además,
es un tipo de pacientes que pueden experimentar cambios o complicaciones durante
su curso que podrá modificar perceptiblemente su gravedad y por lo tanto su
pronóstico y tratamiento.
Sin embargo, el término "paciente crítico" se refiere a un grupo de pacientes con
diversas enfermedades, con respuestas metabólicas a veces muy diferentes o
incluso opuestas, por lo que no se puede establecer recomendaciones generales
para todos los pacientes admitidos a un departamento de medicina de cuidados
intensivos o a otras unidades de cuidados críticos, cualquiera que sea la causa de
la admisión. (15)
Debido a la alta prevalencia de obesidad en adultos, los médicos de asistencia de
nutrición están encontrando un mayor número de pacientes obesos que requieren
apoyo nutricional durante la hospitalización. El propósito de esta guía clínica es
servir como un marco para el apoyo de nutrición y cuidado de pacientes adultos con
obesidad.
Una revisión sistemática de la mejor evidencia disponible para responder a una serie
de preguntas relativas al manejo del soporte nutricional en pacientes con obesidad,
se llevó a cabo y evaluó usando conceptos adoptados en el grupo de trabajo de
clasificación de recomendaciones, evaluación, desarrollo y evaluación. Un proceso
de consenso, que incluye la consideración de la fuerza de la evidencia junto con los
riesgos y beneficios para el paciente, se utilizó para desarrollar las
recomendaciones de la pauta clínica antes de múltiples niveles de revisión interno
y externo y la aprobación por la Junta Directiva de A.S.P.E.N. Preguntas: los
32
resultados clínicos (1) varían según los niveles de obesidad en pacientes críticos.
(16)
¿Los resultados clínicos varían según los niveles de obesidad en pacientes de UCI
no críticamente enfermos u hospitalizados?
Pacientes críticamente enfermos con obesidad experimentan más complicaciones
que los pacientes con niveles óptimos de IMC. Evaluación de nutrición y desarrollo
de un plan de ayuda de nutrición se recomienda dentro de 48 horas de la admisión
de UCI.
Todos los pacientes hospitalizados, independientemente del IMC, deben ser
defendidos para riesgo de nutrición dentro de las 48 horas de admisión, evaluación
de nutrición para los pacientes que se consideran en riesgo.
¿Cómo deben determinarse los requerimientos de energía en los pacientes obesos
críticamente enfermos u hospitalizados no UCI?
En el paciente obeso crítico, si la calorimetría indirecta no está disponible, los
requisitos de energía deben basarse en la ecuación predictiva de 2010 de la Penn
State University, o la ecuación de Penn State modificada si el paciente tiene 60 años
o más.
En el paciente obeso hospitalizado, si la calorimetría indirecta está disponible y las
ecuaciones de la Penn State University no puede utilizarse, las necesidades de
energía pueden estar basadas en la ecuación de Mifflin-St Jeor utilizando el peso
corporal real.
¿Son los resultados clínicos mejores con dieta hipocalórica alta en proteínas en los
pacientes hospitalizados con obesidad?
Los resultados clínicos son al menos equivalentes en pacientes con dieta de alto
valor proteico e hipocalórica a aquellos con alto valor proteico. Un ensayo de dieta
hipocalórica, alta en proteínas se sugiere en pacientes que tienen disfunción renal
o hepática severa. Alimentación hipocalórica puede comenzar con 50-70% de las
necesidades energéticas estimadas o <14 kcal/kg de peso real. Alimentación alta
en proteínas puede comenzar con 1,2 g/kg peso real o 2-2.5 g/kg de peso corporal
ideal, con el ajuste de la ingesta de proteína meta por los resultados de los estudios
de balance de nitrógeno.
hipocalórica, alimentación baja en proteínas se asocia con resultados
desfavorables. Se sugiere vigilancia clínica para suministro de proteínas adecuadas
en pacientes que tienen disfunción renal o hepática severa.
¿En los pacientes obesos que han tenido un procedimiento quirúrgico restrictivo o
malabsorción, se deben evaluar qué micronutrientes?
Pacientes sometidos a manga gástrica, bypass gástrico o Derivación
Biliopancreática switch duodenal con aumento del riesgo de deficiencia de
nutrientes. En pacientes agudo hospitalizados con la historia de estos
procedimientos, se sugiere evaluación de evidencia de la depleción de hierro, cobre,
zinc, selenio, tiamina, ácido fólico y vitaminas B12, D y repleción de estados
carenciales. (16)
33
Son datos que apoyan esta recomendación, donde la ingesta de proteínas de 1.2
g/kg de peso real, (2 g/kg de peso corporal ideal) todos los días se administró a
pacientes con dieta hipocalórica, o aporte eucalórico. Un estudio adicional en
comparación con los requisitos de proteína basados en estudios de balance de
nitrógeno por separado, para pacientes de UCI y pacientes fuera de la UCI. Los
pacientes de la UCI requirieron de 2-2.5 g/kg/día y los pacientes fuera de la UCI 1.81.9 g/kg/d para el equilibrio de nitrógeno de enfoque con los requisitos más altos
para aquellos con IMC> 40 kg/m2. Estos estudios incluyeron pacientes de hasta 302
kg y con IMC de hasta 50,6 kg/m2, sin embargo la mayoría de los sujetos estuvieron
considerablemente por debajo de estos niveles. Los datos no se han encontrado
para establecer metas de ingesta de nitrógeno razonable para los pacientes, más
allá de estos límites. El balance de nitrógeno fue similar a este nivel de ingesta de
proteínas si el consumo de energía es hipocalórica o eucalorica. Estas
recomendaciones iniciales deben ajustarse mediante estudios de balance
nitrogenado, con el objetivo de equilibrar el nitrógeno entre la ingesta y la excersión.
(16)
La terapia nutricional en pacientes críticamente enfermos es de suma importancia
para la recuperación y rehabilitación de estos. La nutrición juega un papel crucial en
la disminución de la fase catabólica, que es sinónimo de enfermedad aguda. Como
una de las mejores prácticas en pacientes que requieren de ventilación mecánica
se recomienda iniciar nutrición enteral (NE) en las primeras 24-48 horas de su
admisión. Sin embargo, el aporte óptimo de NE para obtener resultados clínicos
positivos es aún controversial. Diversos estudios sugieren que un aporte por debajo
de los requerimientos energéticos totales en cortos periodos (“subalimentación
permisiva”) puede mejorar la condición del paciente, o al menos no causar daño.
Otros estudios han demostrado mejoras en la evolución clínica del paciente con un
déficit reducido de energía. En un estudio observacional dirigido por un balance
negativo de energía se correlacionó con resultados indeseables, como: falla renal,
sepsis y una tasa mayor de complicaciones (Heidegger et al), recientemente
reportaron una disminución del riesgo de infecciones nosocomiales en pacientes
que recibieron adecuadas cantidades de nutrición versus aquellos que recibieron
solo el 77% de sus requerimientos energéticos.
La sobrealimentación también ha sido relacionada con complicaciones como
azoemia, aumento en el tiempo de ventilación mecánica y alteraciones de la función
hepática. Se han relacionado dichas complicaciones cuando se aporta más del
110% de los requerimientos energéticos como resultado de un incremento de la
demanda metabólica asociada a un exceso de sustrato y un aumento de la
producción de dióxido de carbono. Cada vez un mayor número de artículos apoyan
la necesidad de valorar, monitorear y ajustar cuidadosamente las metas
nutricionales de los pacientes para evitar complicaciones. El método para
determinar los requerimientos energéticos en pacientes críticamente enfermos hoy
en día es un tema en debate.
34
Muchos apoyan el uso de la calorimetría indirecta (CI) para calcular GEER, a través
de la medición del volumen de oxígeno inspirado y dióxido de carbono expirado. Sin
embargo, la validación de las mediciones de la CI en la práctica clínica siguen
siendo cuestionadas, y algunos autores han disputado su efectividad. La
incapacidad de distinguir puntualmente entre el uso de sustrato de forma endógena
y exógena y lograr la estabilidad del paciente en la unidad de cuidados intensivos,
son factores que cuestionan la precisión del uso de la CI. Sin embargo, la CI sigue
siendo considerada como el “Gold Standard” para determinar el GEER en pacientes
críticamente enfermos. En ausencia de CI, dietistas estiman el GEER de los
pacientes con ecuaciones predictivas, que en general, fueron validadas en
poblaciones de pacientes sanos y que se cuestionan para su uso en poblaciones de
paciente en la unidad de cuidados intensivos (UCI). (17)
Se ha desarrollado una ecuación predictiva del nuevo (Gasto Energético Total) GET
en la cohorte predictiva de pacientes con t medido (en kcal/Kg/d) como variable
dependiente y como variables independientes diferentes factores conocidos que
influyen el GET: edad, género, peso, altura y tipo de lesión. Las variables
independientes continuas fueron categorizadas para simplificar la ecuación
predictiva. El género femenino y la edad de más de 50 años, tienen el valor 1 en la
ecuación de regresión múltiple. Altura y peso actual (en el día cuando se realizó la
CI) fueron reemplazados por el IMC. (18)
Los pacientes fueron estratificados en categorías de IMC según los criterios de la
OMS, de manera similar para el estudio de Zauner et al., las categorías de IMC
tienen los siguientes valores en regresión lineal: peso normal (IMC 18.5-24.9) valor
de 0, los obesos (BMI 25-29.9) de 1, obeso clase I valor (IMC 30-34.9) de clase 2 y
obesa valor II (IMC 35-39.9) de 3. El tipo de lesión tenía un valor de 0 para los
pacientes de trauma, un valor de 1 para pacientes médicos y un valor de 2 para los
pacientes quirúrgicos en el análisis de regresión lineal. La ecuación predictiva fue:
GETEP = 33 - (3 x E) - (3 x IMC) - (1 x G).
Dónde: E (edad en años): ≤ 50 = 0; > 50 = 1.
IMC (kg /m2): 18.5- 24.9 = 0; 25-29.9 = 1; 30-34.9 = 2; 35-39.9 = 3.
G (género): hombre = 0; mujer = 1.
El sesgo (IC del 95%) entre el GET medido y el predicho fue de -0.1 (-1.0 a 0.7)
kcal/ kg/día y los límites (2 DE) fueron -8.0 a 7.8 kcal/kg/d. El GET de la ecuación
predictiva fue preciso (entre el 85% y el 115%) en el 73,6% de los pacientes.
En el análisis de regresión lineal, las variables independientes que entraron en la
nueva ecuación predictiva TEE (en kcal/Kg/d) fueron edad, IMC y género (r2 = 0,37,
p < 0.001), cayó el tipo de lesión de la ecuación (Fig. 2 y tabla II). La nueva ecuación
predictiva de la TEE en la cohorte de validación fue simplificada sin decimales como
se muestra a continuación: T = 33 - (3 x A) - (3 x IMC)-(1 x G) donde: (años): ≤ 50 =
35
0; > 50 = 1; IMC (Kg/m2): 18.5 – 24.9 = 0, 25 – 29.9 = 1, 30 – 34.9 = 2, 35 – 39.9 =
3; Género: masculino = 0, mujer = 1.
Tabla 2
Regresión lineal de la ecuación predictiva del Gasto Energético Total (GET)
Variable
B
95% IC for B
Constante
33.01
-32.1 – 34.2
Edad, (≤50 años= 0; > 50 años = 1) - 2.97
- 4.4 – - 1.6
Género, (Hombre=0; Mujer =1)
- 1.3
- 2.6 – - 0.1
Índice de Masa Corporal *
- 3.1
- 3.9 – - 2.2
p
< 0.001
<0.001
0.03
<0.001
Figura 2: Gasto Energético Total medido por CI (GETCI) estratificado por IMC, edad
≤ 50 años o > 50 años de edad y género en 179 pacientes de la cohorte de
predicción. Las líneas horizontales dentro de las cajas indican medianas, la parte
inferior y superior, extremos de las cajas de los percentiles 25 y 75. Requisitos de
energía óptima en pacientes críticamente enfermos están pendientes de un
polémico tema. Diferentes estudios recientes demostraron una asociación entre el
equilibrio de la energía negativa acumulada e infección nosocomial mayor y la
mortalidad de UCI en pacientes críticamente enfermos con ventilación mecánica
prolongada destacando la necesidad de una vigilancia estrecha de la ingesta de
calorías y proteína. En este entorno, el concepto de "control de calorías" se
presentó para evitar sobre y sub alimentación en estos pacientes.
Validación de ecuación predictiva.
Las diferencias entre medición y predicción de la t por la ecuación de HarrisBenedict y la ecuación de Ireton-Jones 1997, fueron imparciales (IC del 95%), o por
Ireton-Jones 1992, ecuación parcial (IC del 95%) (Tabla III). Los límites de acuerdo
(diferencia de medias, 2 DE) entre medida y predicción del GET fueron ancho para
todas las ecuaciones, sobre todo por las 2 ecuaciones de Ireton-Jones (tabla III).
Predicción del GET por la ecuación de nuevo y por la ecuación de Harris - Benedict
(REE predijo un 30%) en 90% - 110% de la medida t en casi 55% de los pacientes
y en 85% - 115% en casi 75% de los pacientes (Figura 3). Las ecuaciones de IretonJones 1992 y 1997, tuvieron menor exactitud para predecir GET, dentro de 90-110%
36
de la medida t en solamente 29% y 36% de los pacientes y en 85-115% en 44% y
55% de los pacientes respectivamente (Figura 3)
Figura 3. — Porcentaje de predicción precisa de la t (cada barra representa un 5% de diferencia de
medida t) con la nueva ecuación de predicción, la ecuación de Harris-Benedict y las 2 ecuaciones
de Ireton-Jones.
En esta cohorte de pacientes la nueva ecuación predictiva de t tenía una exactitud
aceptable en casi 74% de los pacientes. Sin embargo, debido a los grandes límites
de acuerdo entre GET medido por CI y el GET predicho por la nueva ecuación, debe
utilizarse con precaución en la práctica clínica. Lo mismo se aplica a la ecuación de
Harris-Benedict aumentada en un 30%, mientras que la t predicha por las
ecuaciones de Ireton-Jones, tuvo exactitud pobre y tenía límites muy grandes, por
lo tanto, no debe utilizarse en pacientes críticamente enfermos con ventilación
mecánica.
Una exactitud del 10% de ecuaciones predictivas del GET (dentro de 90-110%) en
comparación con t medido por CI sería lo ideal. Sin embargo, teniendo en cuenta
que la ecuación de Harris-Benedict es ampliamente aceptada, se estima el GER de
37
un sujeto normal con una precisión del 14%, los autores la consideraron aceptable
en la práctica clínica habitual con una precisión del 15% (dentro de 85-115%).
Muchos factores influyen en el GET en pacientes críticamente enfermos, y todos
ellos no se han tenido en cuenta en nuestra ecuación, porque el objetivo del estudio
fue describir una ecuación simplificada para pacientes críticamente enfermos con
ventilación mecánica. Los principales factores que modifican el GET en pacientes
críticamente enfermos son:
– El envejecimiento. Hemos simplificado el efecto del envejecimiento en nuestra
nueva ecuación predictiva de t con un límite de 50 años de edad, ya que la
disminución progresiva de GER tiene un punto de interrupción para una más rápida
declinación alrededor de 39 a 54 años de edad según género e IMC.
– Género. Encontramos que las mujeres tenían 1,3 kcal/Kg/día menos que los
hombres, mucho más bajos que las 3,7 kcal/Kg/d en el estudio de (Drolz et al). Las
causas pueden incluir el número uno de mujer y la potencial interacción entre la
edad, el IMC y el sexo con el GER.
– Índice de masa corporal, altura y peso. Utilizamos el peso actual para calcular el
IMC, ya que anteriormente se encontró que el GER en kcal/Kg/d es el mismo (27 ±
3 kcal/Kg/d) con alto y bajo peso. Las variaciones rápidas de peso fueron atribuibles
a cambios agudos en el volumen de agua extracelular.
– Tipo de lesión. Como era de esperar, el tipo de lesión se cayó de la regresión
lineal. Anteriormente encontramos que los pacientes críticamente enfermos con
diferentes tipos de lesiones que reciben ventilación mecánica, tenían mediciones de
GER similares cuando fueron emparejados según edad, género, peso, composición
corporal y temperatura, como en la ecuación de Frankenfield. (18)
Conclusiones
Definir el requerimiento de Energía de un paciente crítico depende de la fase
metabólica por la que este cursando, el tipo de patología o trauma, o lesión, como
quemaduras, neurocrítico, con problema ventilatorio, pancreatitis, sepsis o
quirúrgico, por lo que es muy variada su estabilidad, y por otro lado son muy
dinámicos los cambios, su proceso y evolución, lo que se debe de cuidar es no
sobreestimar las calorías ni subestimar el aporte de energía como marcan las guías
de la práctica clínica que debemos de aplicar en nuestro quehacer profesional, esto
según las condiciones de estabilidad hemodinámica de nuestro enfermo.
ASPEN
Los requerimientos energéticos se pueden calcular por ecuaciones o por CI (E).
Se debe proveer >50-65% del requerimiento calórico durante la primera semana de
hospitalización para obtener los beneficios clínicos de la Nutrición Enteral (NE) (E).
38
Importante: previo a iniciar la NE se deben evaluar la pérdida de peso e ingesta
alimentaria antes del ingreso, severidad de la enfermedad y su correlación con el
estado nutricional, comorbilidades y función del tracto gastrointestinal (GI) (E).
la NE se debe iniciar en los pacientes críticos incapaces de alcanzar sus
requerimientos calóricos por vía oral (C).
La nutrición se debe aumentar hasta alcanzar sus requerimientos en las siguientes
48-72 hrs (E).
Si el paciente está comprometido hemodinámicamente (requiere soporte
hemodinámico que incluye dosis de agentes vasopresores, ya sea solos o
combinados, con grandes volúmenes de líquidos o resucitación sanguínea para
mantener la perfusión celular, entonces la NE se debe detener hasta que el paciente
este completamente resucitado/estable y con datos de adecuada perfusión tisular
(E). (19)
ESPEN
El uso de la CI en el paciente crítico es recomendado. (A)
Durante la enfermedad aguda, el objetivo debe ser proporcionar energía lo más
cerca posible al gasto de la energía medido, con el fin de disminuir el balance
energético negativo (B)
No se puede hacer una recomendación general, debe de adecuarse a la evolución
de la enfermedad y la tolerancia digestiva.
En ausencia de calorimetría indirecta, los pacientes de UCI deben recibir 25
kcal/kg/día e ir progresando a la meta en los próximos 2-3 días. (C)
Durante la fase anabólica de recuperación el objetivo es de 25-30 kcal/kg. (C)
Durante la fase aguda de la enfermedad un aporte mayor a 20-25 kcal/kg se puede
asociar a peores resultados.
En pacientes con desnutrición severa se debe proveer más de 25-30 kcal/kg/día por
vía enteral. si los requerimientos no son alcanzados durante los primeros 2 días
considere suplementar con NP (C). (20)
CANADIENSE
Calorimetría indirecta vs formulas predictivas:
Sin cambios en las guías del 2013 al 2015.
No existe suficiente información para hacer una reconvención sobre el uso de CI vs
formulas predictivas para determinar los requerimientos energéticos o como guía
para la indicación de soporte nutricional en el paciente crítico.
El uso de calorimetría indirecta comparada con fórmulas predictivas para cubrir los
requerimientos nutricionales no tiene efecto sobre la mortalidad.
El uso de CI comparada con fórmulas predictivas para complementar la NET con
NPT se asocia con una disminución significativa de la mortalidad hospitalaria.
El uso de CI comparada con fórmulas predictivas para complementar la NET con
NPT pudiera asociarse con una mayor incidencia de infecciones.
El uso de CI comparada con fórmulas predictivas para complementar la NET con
NPT pudiera asociarse con una estancia prolongada en UCI y duración de
ventilación mecánica
39
El uso de CI comparada con fórmulas predictivas pudiera mejorar la ingestión
nutricional. (12)
SENPE
Se recomienda el inicio de la NE en los pacientes dentro de las 24-48 hrs de ingreso
a UCI.
La precocidad en el aporte se ha relacionado, en algunos grupos de pacientes
críticos, con mejoría de la tolerancia a la dieta, menor disfunción de la barrera
intestinal, disminución de infecciones y días de estancia hospitalaria, así como
disminución de días de ventilación mecánica.
No hay estudios planteados en cuanto al plazo de consecución de los objetivos
energéticos establecidos. El plazo en el que deben alcanzarse estos objetivos,
según la recomendación de algunos autores, estaría en torno a 48-72 hrs de inicio
del soporte nutricional.
Los propios autores de los estudios relacionados recomiendan aplicación juiciosa
de estos hallazgos en la práctica clínica.
Aporte calórico: las necesidades variaran dependiendo de la fase metabólica en la
que se encuentre el paciente: fase catabólica inicial o fase anabólica de
recuperación.
Donde no se pueda medir el GE se recomienda un aporte lo mas próximo posible a
los requerimientos medidos mediante CI (a) en la fase inicial, para aumentar en
fases más avanzadas de la convalecencia, basándose en estudios que demuestren
una mayor incidencia de infecciones en relación con el balance calórico negativo y
mejores resultados con un balance calórico positivo.
Algunos autores recomiendan suplementar con nutrición parenteral (NP) cuando no
se llegan a cubrir los requerimientos (60-70% del aporte enteral)
En pacientes con IMC <18kg/m2 se recomienda usar el peso actual para evitar el
síndrome de sobrealimentación, y para el resto de los pacientes se ha recomendado
que sea el peso previo a la agresión, ya que el peso actual presenta amplias
variaciones como consecuencia de la reanimación inicial.
En ausencia de CI, se recomienda aportar de 25 kcal/kg peso actual/día en
pacientes con IMC <30 (C).
En enfermos con ventilación mecánica se recomienda un cálculo estimado en los
requerimientos calóricos mediante la ecuación de Penn State (B) (22)
CRITICO OBESO
ASPEN
La evaluación inicial de los pacientes críticamente enfermos deben incluir medidas
antropométricas (peso corporal actual, peso ideal y circunferencia de cintura), así
como biomarcadores de síndrome metabólico (niveles séricos de triglicéridos,
colesterol y glucosa). Específicamente peso, IMC, debe considerarse, “signos
vitales para los pacientes obesos y registrarse en el expediente clínico.
El grado de la reacción inflamatoria sistémica debe ser evaluado para determinar si
el paciente está en una condición de estrés oxidativo o metabólico.
40
Patrones de ingesta y cambio de peso antes de una nueva admisión, debe ser
evaluado.
El uso de peso actual no es recomendado debido a la falta de estudios de validación
y variabilidad de la definición en la literatura.
Los requerimientos de proteína y calorías deben ser determinados y utilizados para
establecer los objetivos de la terapia nutricional, los requerimientos calóricos se
deben medir cuando sea posible por CI.
La provisión calórica debe ser aproximadamente de 60-70% de kcal, requerimientos
calóricos determinados por calorimetría indirecta o por ecuaciones predictivas
cuando la CI no esté disponible.
Una simple fórmula basada en el peso puede aproximar este objetivo (11-14
kcal/peso actual o 22-25 kcal/peso ideal).
En pacientes con IMC mayor de 30 los requerimientos proteicos van de 1.2 a 2 gr/kg
de peso actual/día y puede ser más alto en pacientes con quemaduras o trauma
múltiple. (E) (23)
SENPE
El uso de recomendaciones calóricas basadas en el peso real puede inducir la
aparición de complicaciones como hiperglucemia e infecciones secundarias, por lo
que hay controversia acerca de la utilización del peso actual, peso ideal o peso
ajustado para el cálculo calórico.
Hay recomendaciones basadas, bien en un porcentaje fijo del gasto energético (6070%) o bien en el peso actual (11-14 kcal/kg/día) o en el peso ideal (22-25
kcal/kg/día).
En tipos de obesidad se puede usar la nutrición hipocalórica, al igual en la obesidad
mórbida, o estimar 20-25 kcal/peso ajustado. (C)
Se considera la CI como gold stadard. (A)
Estudio demostró que solo las ecuaciones de Ireton Jones 1992 y Penn-State fueron
precisas, por lo que Penn-State 1998 se considera como la ecuación recomendable
para su uso en paciente crítico, obeso o no obeso.
Se constató que ni la severidad de la enfermedad medida por el SOFA, ni la fiebre,
ni la patología traumática, quirúrgica o médica cambiaban la precisión de las
ecuaciones.
Existe consenso en considerar que en el paciente obeso crítico, la aplicación de
cualquier fórmula utilizando el peso real sobrestima las necesidades calóricas, pero
la utilidad de las diferentes alternativas existentes sigue siendo objeto de
controversia.
No hay suficiente evidencia para recomendar el uso del peso ideal o del peso
ajustado.
La relación de hidratos de carbono/lípidos como fuente energética no se ha
estudiado en el paciente obeso crítico, por lo que deben seguirse las
recomendaciones habituales, con una relación 60/40 o 70/30 del total energético
proteico, buscando siempre la mejor relación que permita controlar la glucemia en
valores adecuados, así como los triglicéridos (deben mantenerse por debajo de 400
mg/dl). (22)
41
Referencias bibliográficas
(1) Ulibarri Pérez JI, Picón César MJ, García Benavent E. Detección precoz y control de la
desnutrición hospitalaria. Nutr Hosp. 2002; 17:139–46.
(2) Villazon A, Torres R. Importancia de la nutrición en el apoyo metabólico del paciente grave. En:
Morales JL, ed. Nutrición, cirugía y terapia intensiva. Bogotá: Manual Moderno; 2004. p. 521–7.
(3) García de Lorenzo A, Montejo JC, Planas M: Requerimientos energéticos en los pacientes
críticos. Calorimetría indirecta. Med Intensiva 1995, 2:86-94
(4) Ortiz Leyba C.; Gómez-Tello V y Serón Arbeloa C.; Requerimientos de Macronutrientes y
MicronutrientesNutr. Hosp. (2005) XX (Supl. 2) 13-17 ISSN 0212-1611
(5) Marsé P. Calorimetría: aplicaciones y manejo. Nutrición Clínica en Medicina. 2008; 2(3): 155-166
(6) Nin L, Pemann M, Kiegler G. Apoyo nutricional en el paciente grave En: Arenas H, Anaya R eds.
Nutrición enteral y parenteral. México: McGraw–Hill; 2007. p. 321–38.
(7) Agudelo Ochoa G.M, Giraldo Giraldo N.A. Soporte Nutricional en el Paciente crítico: una puesta
al día. Revisión Bibliográfica, PERSPECTIVAS EN NUTRICIÓN HUMANA. ISSN 0124-4108 Vol. 10
No. 2 Julio-Diciembre de 2008. Universidad de Antioquia. Medellín. Colombia págs. 191-211
(8) Bonet Sarisa, A; Márquez Vácarob JA; Serón Arbelo C. Guidelines for specialized nutritional and
metabolic support in the critically-ill patient. Update. Consensus SEMICYUC-SENPE: Macronutrient
and micronutrient requirements. Nutr Hosp 2011;26 (Supl. 2):16-20 ISSN (Versión papel): 0212-1611
ISSN (Versión electrónica): 1699-5198
(9) Raurich JM, Ibañez J: Gasto energético en reposo: calorimetría indirecta frente a Fick. Nutr Hosp
1998, 13:303-309.
(10) Frankenfield D. Analysis of estimation methods for resting metabolic rate in Critically Ill Adults.
Journal of Parenteral and Enteral Nutrition. 2009; 33:27
(11) Ashcraft C, Frankenfield C. Energy expenditure During Barbiturate Coma. Nutrition in Clinical
Practice. 2013; 28:603
(12) Choban P. ASPEN Clinical Guidelines: nutrition Support of Hospitalized Adult Patients with
Obesity. Journal of Parenteral and Enteral nutrition. 2013.
(13) Frankenfield D. Prediction of Resting Metabolic Rate in Critically Ill Patients at the extremes of
Body Mass Index. Journal of Parenteral and Enteral Nutrition. 2013: 37: 361
(14) A. Bonet Sarisa, J. A. Márquez Vácarob and C. Serón Arbeloaca. Guidelines for specialized
nutritional and metabolic support in thecritically-ill patient. Update. Consensus SEMICYUC-SENPE:
Macronutrient and micronutrient requirements. Nutr Hosp 2011; 26(Supl. 2):16-20 SSN (Versión
papel): 0212-1611. ISSN (Versión electrónica): 1699-5198
(15) A. Mesejoa, C. Vaquerizo Alonsob, J. Acosta Escribanoc, C. Ortiz Leibad and J. C. Montejo
Gonzáleze, Guidelines for specialized nutritional and metabolic support in the critically-ill patient.
Update. Consensus SEMICYUC-SENPE: Introduction and methodology. Nutr Hosp 2011;
26(Supl.2):1-6. ISSN (Versión papel): 0212-1611. ISSN (Versión electrónica): 1699-5198.
(16) Patricia Choban, MD1; Roland Dickerson, PharmD, BCNSP2;Ainsley Malone, MS, RD, CNSC3;
Patricia Worthington, A.S.P.E.N. Clinical Guidelines: Nutrition Support of Hospitalized Adult Patients
With Obesity. ASPEN. Journal of Parenteral and Enteral Nutrition. Volume 37 Number 6, November
2013 714–
744c
2013.
American
Society
for
Parenteral
and
Enteral
Nutrition.
DOI:
10.1177/0148607113499374. www.jpen.sagepub.com. hosted at online.sagepub.com
(17) Oana A. Tatucu-Babet, APD, B; Emma J. Ridley, APD and Audrey C. “The Prevalence of
Underprescription or Overprescription of Energy Needs in Critically Ill Mechanically Ventilated Adults
as Determined by Indirect Calorimetry: A Systematic Literature Review. Journal of Parenteral and
Enteral Nutrition. Volume XX Number X Month 201X 1–14. © 2015 American Society for Parenteral
and Enteral Nutrition. DOI: 10.1177/0148607114567898Downloaded from pen.sagepub.com at
American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) on September 18, 2015
(18) Raurich,JM; Llompart-Pou, JA; Ferreruela,M; Riera,M; Homar,J; Pere. Marse, Asuncion
Colomar and Ignacio Ayestaran. “A simplified equation for total energy expenditure in mechanically
42
ventilated critically ill patients. Nutr Hosp. 2015; 32(3):1273-1280. ISSN 0212-1611 • CODEN
NUHOEQ.S.V.R. 318
(19) American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. Clinical
“Guidelines for the Use of Parenteral and Enteral Nutrition in Adult and Pediatric Patients,
2009Journal of Parenteral and Enteral Nutrition” Volume 33 Number 3, May/June 2009 255-259. ©
2009 American Society for Parenteral and Enteral Nutrition, 10.1177/0148607109333115,
http://jpen.sagepub.com, hosted at, http://online.sagepub.com
(20) ESPEN Guidelines on Parenteral Nutrition: Intensive care. Pierre Singer a, Mette M. Berger b,
Greet Van den Berghe c, Gianni Biolo d, Philip Calder e, Alastair Forbes f, Richard Griffiths g, Georg
Kreyman h, Xavier Leverve i, Claude Pichard j. Clinical Nutrition 28 (2009) 387-400.
(21) Critical Care nutrition, Guías Canadienses de práctica Clínica 2013.
(22) A. Bonet Saris,, J.A. Márquez Vácaro y C. Serón Arbeloa. “Recomendaciones para el soporte
nutricional y metabólico especializado del paciente crítico”. Actualización. Consenso SEMICYUCSENPE: Requerimientos de macronutrientes y micronutrientes. Med Intensiva. 2011;35 (Supl 1):1721
(23) Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically
Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral.
Nutrition (A.S.P.E.N.) JPEN J Parenter Enteral Nutr 2009 33: 277. Stephen A. McClave, Robert G.
Martindale, Vincent W. Vanek, Mary McCarthy, Pamela Roberts, Beth Taylor, Juan B. Ochoa, Lena
Napolitano, Gail Cresci, the A.S.P.E.N. Board of Directors and the American College of Critical Care
Medicine.
43