Diagnostico de Parásitos Sanguineos. Protozoarios y Filarias
Anuncio

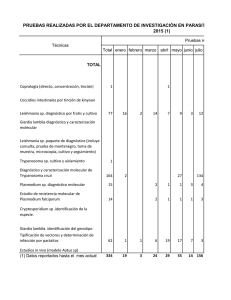
PRACTICA #16 DIAGNOSTICO DE PARASITOS SANGUINEOS Protozoarios y filarias OBJETIVO DE LA PRACTICA Conocer los protozoarios y helmintos que pueden detectarse en especimenes de sangre, aprender a preparar frotes sanguíneos delgados y gruesos para estudios parasitológicos, INTRODUCCCION La prueba confirmativa para diagnóstico de parásitos sanguíneos es efectuada mediante el examen de preparaciones de frotis sanguíneos. para buscar su presencia. Sin embargo, debe considerarse que la observación de los frotis consume mucho tiempo, ya que los parásitos pueden estar presentes en la sangre periférica en número muy pequeño. La presencia de un solo parásito en un frotis es significativo y debe identificarse la especie, enseguida. Se requiere un examen muy cuidadoso de los frotis sanguíneos antes de reportar el estudio como negativo para parásitos. Por tal motivo es necesario adquirir experiencia para un examen acertado de frotis sanguíneos, en el diagnóstico de parásitos. Con frecuencia las plaquetas sobre los eritrocitos pueden ser confundidas erróneamente como parásitos, por lo que cualquier cosa sospechosa debe confirmarse. Los protozoarios parásitos sanguíneos posibles de observar en frotis sanguineos son Plasmodium y Trypanosoma. Las especies de aschelmintos sanguíneas son las Filarias, como Onchocerca volvulus. Trypanosoma se puede diagnosticar por cultivo en sangre y pruebas serológicas. MATERIALES Y METODOS. Diagnóstico de Trypanosoma cruzi, Plasmodium y Onchocercavolvulus. I. Diferentes tipos de frotes sanguineos. 1. Observación de sangre en fresco. Aunque el examen microscópico de sangre fresca no es una técnica rutinaria, es muy útil en la detección de Plasmodium, Trypanosoma y microfilarias, los cuales pueden ser reconocidos por sus características de movilidad en sangre fresca. Se coloca una pequeña gota de sangre en un portaobjetos cubierto con un cubreobjetos. Enseguida se observa al microscopio a baja amplificación, pudiendo observarse un movimiento como circular de las microfilarias, y uno ondulatorio de los trypanosomas. 2. Frote Sanguíneo Delgado. Los frotes delgados de sangre se desarrollan en la misma forma que los frotes hechos para estudios de hematología. Este tipo de preparaciones son utilizadas para la identificación de Plasmodium, Trypanosoma y microfilarias. Es esencial que la película de sangre que quede en el portaobjetos, sea verdaderamente delgada. La ventaja del frote delgado es que preserva la estructura del parasito con un mínimo de distorsión. 3. Frote sanguíneo grueso El frote grueso es preferido con respecto al delgado, para el diagnóstico de Plasmodium, ya que revela al parásito mas rápidamente, debido a que permite examinar de 10 a 50 veces mayor cantidad de sangre, que en un frotis delgado. Este tipo de frotis es más efectivo en los casos de infecciones nuevas o crónicas por Plasmodium, cuando los parásitos no son abundantes. 3.1. Coloque una gota grande de sangre conteniendo Plasmodium, a un cm de la orilla del portaobjetos limpio y desengrasado. Use la esquina de otro portaobjetos y con un movimiento circular extienda la sangre en una gran gota durante cerca de 20 min, con el fin de desfibrinarla. 3.2. Pueden quedar una o mas gotas en el mismo portaobjetos. Se deja secar a temperatura ambiente y posteriormente se colorea. Las muestras de sangre deben tomarse a intervalos de 6 a 18 horas durante tres dias sucesivos. 4. Tinción de los frotes: Generalmente se usan dos tipos de tinción: a. Tinción de Wright : contiene una combinación de fijador y colorante. b. Tinción de Giemsa: contiene por separado el fijador y el colorante. Interpretación de los frotes de Plasmodium: El frote grueso es usado para detectar la presencia del genero Plasmodium. El frote delgado es usado para identificar la especie del Plasmodium. Se debe examinar un mínimo de 100 campos microscópicos antes de que un frote sea reportado como negativo. II. Identificación de de T. cruzi a partir de sangre de animales reservorios, en frote sanguíneo: 1. Se capturan animales silvestres (ej: mapaches, opossums, woodrats, armadillos, y pequeños roedores) y se anestesian por inyección intramuscular de xylazina (0.25 mg/kg de peso corporal) mezclado con cloruro de cetamina (25 mg/kg). 2. Se obtiene sangre del animal por punción cardiaca, o a partir de la vena femoral, colocando la sangre en un tubo Vacutainer® heparinizado. 3. Para el cultivo, se inocula 1 ml de sangre en 9 ml de medio InfusiónTryptosa-Higado (LIT medio) para permitir el crecimiento de cualquier trypanosoma presente. 4. Se tiñe un frote delgado de cada animal con Giemsa y se examina al microscopio para buscar Trypanosoma. 5. El plasma separado de la sangre se guarda a -80° C para pruebas serológicas. III. Identificación de de T. cruzi por Inmunodiagnostico: 1. Se prepara antígeno de cultivo de epimastigotes de 11-días de una cepa Brazil cultivada en medio Infusión- Tryptosa-Higado (LIT). Los Epimastigotes se lavan tres veces con buffer de fosfatos salino (PBS) y se resuspenden en formol al 1% en PBS. El antígeno se coloca en los círculos de portaobjetos de prueba comercial y se secan a 50° C por 30 minutos. Los portaobjetos se almacenan en un desecador con CaCl2 a -4° C no mas de 1 mes, para pruebas serológicas. 2. Prueba indirecta de anticuerpos inmunofluorescentes (IFAT): El metodo IFAT y la prueba de ELISA son conocidos como muy sensibles y especificos para diagnostico de infecciones con T. cruzi 3. Para la prueba de IFAT se utiliza un reactivo comercial a base de un conjugado de IgG -fluoresceína anti-mapache. Se toman alicuotas de 150 ml y se congelan a -80° C, diluyendo en solucion de Azul Evans 0.1% antes de usarse. El azul de Evans tine los epimastigotes de color rojo, que observados al microscopio de fluorescencia, se ven fluorescentes, usando un iluminador 50W Hg (488 nm excitacion y un filtro 520 nm band-pass filter). Las concentraciones optimas de suero (1:40) y de conjugado (1:10) se obtienen por titulación, usando un suero control positivo de mapache y un control negativo. 4. Otras pruebas inmunodiagnósticas son: Prueba de fijación del complemento, haemaglutinación indirecta y ELISA inmunoensayo unido a una enzima IV. Diagnóstico de Plasmodium por frote sanguineo: 1.Se puede utilizar la sangre de ratones silvestres. Para obtener sangre de la cola, se limpia con solución yodada el extremo de la cola y se hace un corte en la punta, recogiendo la sangre con un portaobjetos y haga un frote, practicando el metodo de la gota gruesa. 2. Tiña la preparación con Giemsa y observe al microscopio a 10 X para buscar eritrocitos parasitados. RESULTADOS, DISCUSION Y CONCLUSIONES. BIBLIOGRAFIA DPDx Diagnostic procedures for blood specimens. 2001. Malaria Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale, Plasmodium vivax. Michael J. Yabsley, Gayle Pittman Noblet, and Oscar J. Pung. 1999. Use of the Indirect Immunofluorescent Antibody Test (IFAT) and Blood Culture to Detect Trypanosoma cruzi Infections in Raccoons from Georgia. Department of Biological Sciences, Clemson University, Clemson, South Carolina 29634-0326 USA (Yabsley and Noblet) and Department of Biology and Institute for Arthropodology and Parasitology, Georgia Southern University, Statesboro, Georgia 30460-8042 USA (Pung). http://www.vet.uga.edu/ivcvm/1999/yabsley/yabsley.htm