Guía Estequiometría I
Anuncio
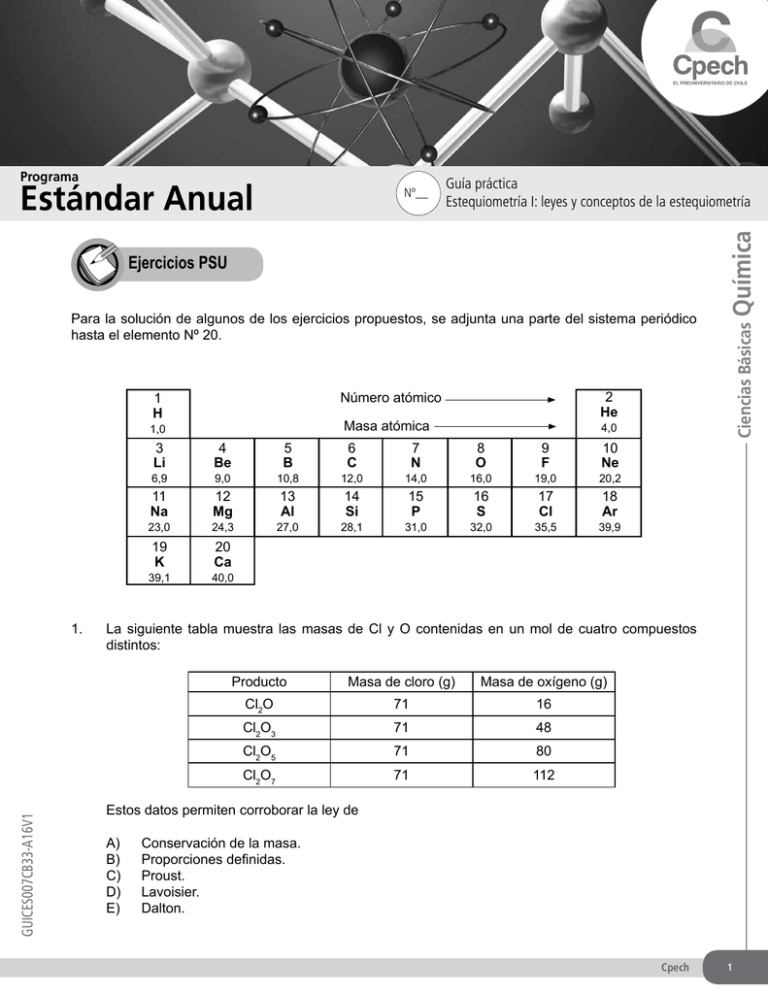
Guía práctica Estequiometría I: leyes y conceptos de la estequiometría Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema periódico hasta el elemento Nº 20. Masa atómica 1,0 4 Be 9,0 10,8 12,0 14,0 16,0 19,0 20,2 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 23,0 24,3 19 K 20 Ca 39,1 GUICES007CB33-A16V1 5 B 27,0 6 C 28,1 7 N 4,0 3 Li 6,9 1. 2 He Número atómico 1 H 31,0 Química Estándar Anual Nº__ Ciencias Básicas Programa 8 O 32,0 9 F 35,5 10 Ne 39,9 40,0 La siguiente tabla muestra las masas de Cl y O contenidas en un mol de cuatro compuestos distintos: Producto Masa de cloro (g) Masa de oxígeno (g) Cl2O 71 16 Cl2O3 71 48 Cl2O5 71 80 Cl2O7 71 112 Estos datos permiten corroborar la ley de A) Conservación de la masa. B) Proporciones definidas. C)Proust. D)Lavoisier. E)Dalton. Cpech 1 Ciencias Básicas Química 2. Si la masa molar del ácido sulfúrico (H2SO4) es de 98 g/mol, ¿cuántos mol hay en 294 gramos de ácido sulfúrico? A) 3,0 mol B) 2,5 mol C) 2,0 mol 3. D) 0,8 mol E) 0,4 mol La masa molar del ácido acético (CH3COOH) es 60 g/mol. ¿Qué masa del ácido se encuentra contenida en 3 mol de esta sustancia? A) 0,15 g B) 20,00 g C) 40,00 g D) 60,00 g E) 180,00 g 4. La masa molar del fosfato de amonio ((NH4)3PO4) es 5. La masa de un mol de sulfato de aluminio (Al2(SO4)3) es 6. La masa de 2 mol de gas nitrógeno (N2) es A) 113 g/mol B) 121 g/mol C) 140 g/mol A) 123 g B) 150 g C) 219 g A) 56 g B) 32 g C) 28 g D) 149 g/mol E) 303 g/mol D) 342 g E) 603 g D) 14 g E) 7 g 7. ¿Qué porcentaje de oxígeno existe en el ácido tiosulfúrico (H2S2O3)? A)42,1% B)48,0% C)50,0% 2 Cpech D)56,1% E)65,1% GUÍA PRÁCTICA 8. La masa molar de un elemento químico es X g/mol. Esto significa que I) un átomo del elemento masa X gramos. II) un mol de átomos del elemento masa X gramos. III) 6,02 x 1023 átomos del elemento masan X gramos. Es (son) correcta(s) A) solo I. B) solo II. C) solo III. D) solo II y III. E) I, II y III. 9. La masa molar del clorato de potasio (KClO3) es A) B) C) 106,6 g/mol 110,5 g/mol 115,6 g/mol D) E) 120,5 g/mol 122,6 g/mol 10. ¿Cuál es el porcentaje de nitrógeno en el ácido nítrico (HNO3)? A) 14,0% B)22,2% C)50,0% D) 72,2% E)100,0% 11. El número de Avogadro (6,023 x 1023) es el número de partículas que hay en un mol de cualquier sustancia. Para verificarlo, un estudiante deposita 250 gotas de ácido oleico en un vaso de precipitado usando una bureta, y determina su masa y volumen. Luego calcula el volumen de una gota y agrega una en un matraz aforado de 500 mL, completando el volumen con etanol. A continuación, calcula la concentración de ácido oleico disuelto y el volumen del aceite que está contenido en una gota de disolución. En un instrumento llamado cristalizador, deposita una gota de la disolución de ácido oleico, la que forma una película monomolecular sobre el agua. Esto le permite estimar el volumen de una molécula de ácido oleico y, sabiendo el volumen del compuesto contenido en una gota de disolución, calcula el número de moléculas presentes en la gota. A partir de la densidad, calcula la masa de ácido oleico contenida en la gota y, ya conocida la masa molar del compuesto, calcula el número de moléculas contenidas en un mol. Este resulta ser 6,6 x 1019. Con respecto a este experimento, es correcto que A) B) C) D) E) permitió validar empíricamente el valor del número de Avogadro. permitió establecer un valor más preciso para el número de Avogadro. origina discrepancias con el valor teórico debido a que requiere numerosas estimaciones. genera diferencias con el valor real debido a que requiere la aplicación de técnicas muy complejas. el compuesto utilizado no es adecuado para determinar el valor del número de Avogadro debido a su elevada masa molar. Cpech 3 Ciencias Básicas Química 12. Considerando que la masa atómica del cobre (Cu) es 63,5 uma, los átomos de cobre contenidos en 127 gramos de dicho metal son A) 6,02 x 1023 átomos. B) 2 x 6,02 x 1023 átomos. C) 6,02 x 1023 / 63,5 átomos. D) 6,02 x 1023 / 127 átomos. E) 63,5 x 6,02 x 1023 átomos. 13. La masa atómica del hierro (Fe) es 56 uma. ¿Cuántos gramos de sulfato ferroso (FeSO4) equivalen a 5 mol del compuesto? A) 104 g B) 152 g C) 280 g D) 520 g E) 760 g 14. La masa de un átomo de calcio es D) 6,02 x 1023 g A) 40 x 6,02 x 1023 g 23 E) 6,02 x 10−23 g B) 40 / (6,02 x 10 ) g 23 C) (6,02 x 10 ) / 40 g 15. El porcentaje de carbono en el ácido acético (CH3COOH) es A) 25% B) 40% C) 50% D) 55% E) 65% 16. La ley de proporciones definidas establece que en un compuesto dado, los elementos constituyentes se combinan siempre en la misma proporción. A partir de esta ley, es posible predecir que A) B) C) D) E) 4 Cpech las fórmulas químicas de dos compuestos distintos pueden ser iguales entre sí. las masas de O contenidas en un mol de distintos compuestos oxigenados deben ser distintas. si se descomponen 10 g de distintos compuestos formados por H y C, se obtendrá la misma masa de uno de los elementos. si se descomponen tres compuestos formados por N y O hasta obtener 0,5 g de O, las masas de N obtenidas deben ser iguales. si se analizan tres muestras de 5 g del mismo compuesto, deben contener la misma masa de cada elemento constituyente. GUÍA PRÁCTICA 17. A continuación se representa una molécula del aminoácido arginina: H O C HO H C N H CH2 CH2 CH2 NH C H2N NH A partir de la imagen, se puede establecer que sus fórmulas empírica y molecular son Fórmula empírica C3H7N2O Fórmula molecular C6H14N4O2 C6H14N4O2 C6H14N4O2 C) C3H5N2O C6H10N4O2 D) C 3H 5N 2O C3H5N2O E) C12H28N8O4 C 3H 7N 2O A) B) 18. En la siguiente tabla se presenta la composición porcentual de una sustancia: Elemento Hidrógeno Oxígeno Azufre Composición 2% 65% 33% Teniendo en cuenta que la masa molar de la sustancia es 98 g/mol, la fórmula molecular es A)H18SO3 B)H2S2O2 C)H4S2O D)H2SO4 E)H2SO3 Cpech 5 Ciencias Básicas Química 19. La masa molar del gas freón-12 (CCl2F2) es 121 g/mol. Entonces, es posible afirmar que A) B) C) D) E) 6,02 x 1023 átomos de freón-12 tienen una masa de 121 g. la masa de un mol de C, un mol de F y un mol de Cl es de 121 g. si se masa un volumen de 22,4 L de freón-12 en CNPT, se obtienen 121 g. 121 g de freón-12 contienen 3 x 6,02 x 1023 átomos de distintos elementos. 242 g de freón-12 contienen mayor número de moléculas que 2 mol de agua. 20. ¿A cuántos mol de carbonato cálcico (CaCO3) corresponden 100 gramos de la sustancia? A) B) C) D) E) 0,1 mol 1,0 mol 10,0 mol 100,0 mol 1000,0 mol 21. El gas oxígeno (O2) tiene una masa molar de 32 g/mol. A partir de esta información, es correcto afirmar que I) II) III) la masa de una molécula de O2 es 32 gramos. la masa de un mol de átomos de O es 16 gramos. la masa de un mol de O2 es 32 gramos. A) B) C) D) E) Solo I Solo II Solo III Solo I y II Solo II y III 22. ¿Cuántos mol de ozono (O3) se necesitan para obtener la misma masa que hay en 6 mol de oxígeno (O2)? A) 2 B) 4 C) 6 D)12 E)16 23. El yeso es sulfato de calcio dihidratado (CaSO4· 2H2O). ¿Cuántos átomos hay en 2 mol de yeso? A) B) C) D) E) 6 Cpech 2 átomos 24 átomos 2 x 6,02 x 1023 átomos 12 x 6,02 x 1023 átomos 24 x 6,02 x 1023 átomos GUÍA PRÁCTICA 24. La siguiente fórmula estructural corresponde al adenosín trifosfato (ATP), molécula fundamental para los procesos energéticos celulares. NH2 C N C HC C N OH OH HO P O O P O ¿Cuál es su masa molar? A) B) C) D) E) CH N OH O P O O CH2 C H N O H H C C OH OH C H 47 g/mol 74 g/mol 299 g/mol 507 g/mol 597 g/mol 25. Una muestra de 29 g de un hidrocarburo, de masa molar 58 g/mol, contiene 24 g de carbono (C) y 5 g de hidrógeno (H). ¿Cuál es su fórmula molecular? A)CH3 B)C2H5 C)C4H8 D)C4H10 E)C4H12 Cpech 7 Ciencias Básicas Química Tabla de corrección Ítem 8 Cpech Alternativa Habilidad 1 Comprensión 2 Aplicación 3 Aplicación 4 Aplicación 5 Aplicación 6 Aplicación 7 Aplicación 8 Comprensión 9 Aplicación 10 Aplicación 11 ASE 12 Aplicación 13 Aplicación 14 Aplicación 15 Aplicación 16 ASE 17 Comprensión 18 Aplicación 19 Comprensión 20 Aplicación 21 Comprensión 22 Aplicación 23 Aplicación 24 Aplicación 25 Aplicación GUÍA PRÁCTICA Resumen de contenidos La estequiometría (del griego stoicheîon, “elemento” y metrie, “medida”) es el cálculo de las proporciones cuantitativas o relaciones de masa entre los reactantes y productos en el transcurso de una reacción química. Leyes de la estequiometría • Ley de conservación de la masa (ley de Lavoisier): En una reacción química la masa permanece constante, es decir, la masa de los reactantes será igual a la de los productos. Por ejemplo, en la reacción de formación del agua (2H2 + O2 → 2H2O), cuando 4 gramos de hidrógeno reaccionan con 32 gramos de oxígeno, se forman 36 gramos de agua. • Ley de las proporciones definidas (ley de Proust): En un compuesto dado, los elementos participantes se combinan siempre en la misma proporción, sin importar su origen y modo de obtención. Por ejemplo, en el óxido de cinc (ZnO) siempre hay un átomo de cinc por cada átomo de oxígeno y la proporción de masas es 80,3% de cinc y 19,7% de oxígeno. • Ley de las proporciones múltiples (ley de Dalton): Cuando dos o más elementos se combinan para dar más de un compuesto, las masas de uno de ellos, que se unen a una masa fija del otro, tienen como relación números enteros y sencillos. Por ejemplo, en los anhídridos de nitrógeno (N2O, NO, N2O3, NO2 y N2O5), si se fija la masa de nitrógeno en 7 gramos, las masas de oxígeno en cada compuesto son, respectivamente, 8 g, 16 g, 24 g, 32 g y 40 g. La razón entre estas masas es: 8 : 16 : 24 : 32 : 40 = 1: 2 : 3 : 4 : 5 Conceptos estequiométricos • Mol: es la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas) como átomos hay exactamente en 12 gramos del isótopo de carbono-12. • Número de Avogadro (NA): número de entidades elementales que hay en un mol. Este número se determina experimentalmente y su valor es de 6,02 x 1023. Al igual que una docena de naranjas contiene 12 naranjas, un mol de átomos de H contiene 6,02 x 1023 átomos y un mol de moléculas de CO2, 6,02 x 1023 moléculas. • Unidad de masa atómica (uma o u): unidad utilizada para expresar la masa de un átomo. Equivale a la duodécima parte (1/12) de la masa de un átomo de carbono-12. 1 uma = 1,66 x 10─24 g Cpech 9 Ciencias Básicas Química • Masa atómica (o peso atómico): masa de un átomo en unidades de masa atómica (uma). Por ejemplo, la masa atómica del oxígeno (O) es 16,0 uma. • Masa molecular (o peso molecular): masa de una molécula (suma de las masas atómicas, en uma). Por ejemplo, la masa molecular del SO2 es 64 uma (32 uma + 2 x 16 uma). • Masa molar: masa (en gramos) de 1 mol de unidades (átomos o moléculas) de una sustancia. Por ejemplo, la masa molar del SO2 es 64 g/mol (32 g/mol + 2 x 16 g/mol). Para cualquier átomo o molécula: masa atómica o molecular (uma) = masa molar (gramos) A nivel molecular + Un átomo de C (12 uma) Una molécula de O2 (32 uma) Una molécula de CO2 (44 uma) A nivel macroscópico 32 g de oxígeno en un globo 12 g de carbono en un vidrio de reloj 44 g de dióxido de carbono en un globo + Es útil recordar la relación que existe entre número de mol (n), masa en gramos (m) y masa molar (MM): n= m MM Que también se puede expresar como: m = n ∙ MM 10 Cpech GUÍA PRÁCTICA Masa molar (g/mol) 1 mol 6,02x1023 partículas • Volumen gases (en C.N.P.T.) = 22,4 L Composición porcentual: informa sobre el porcentaje de cada elemento presente en un compuesto. Para calcularla, se debe considerar la masa molar del compuesto como el 100%. Por ejemplo, para determinar el porcentaje de hidrógeno presente en el agua (H2O), cuya masa molar es 18 g/mol, hay que realizar el siguiente cálculo utilizando la masa molar del hidrógeno (1 g/mol): 18 g/mol → 100% 2 g/mol → X X = 11,11% de hidrógeno Cpech 11 Registro de propiedad intelectual de Cpech. Prohibida su reproducción total o parcial.








