Biología Celular
Anuncio

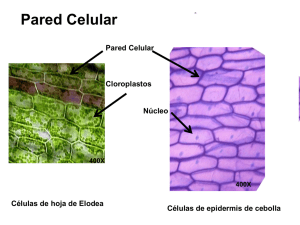
Célula Vegetal Parte 3. Pared celular y Citoesqueleto AV 2016 Sin pared, un protoplasto adopta una forma esférica Temario • 1.- Cómo está constituida la pared celular • Estructura • Composición química • 2.- Función de la pared celular • 3.- Origen de la pared celular • 4.- Crecimiento de la pared celular: • Crecimiento en longitud • Crecimiento en grosor de la pared celular • 5.- Plasmodesmos • 6.- Otros tipos de conexiones intercelulares diferentes de los plasmodesmos: puntuaciones (en general, encélulas con paredes secundarias), áreas y placas cribosas (elementos conductores del floema), placas perforadas (elementos de vaso del xilema). Mención de células sin conexiones intercelulares (células oclusivas de los estomas) Tema 1 • 1.- Cómo está constituida la pared celular • Estructura • Composición química La celulosa es la biomolécula orgánica más abundante ya que forma la mayor parte de la biomasa terrestre. Celulosa Hidratos de Carbono: Mono-, Di- y Poli-sacáridos. Almidón y Celulosa Celulosa Modelo 3-D de los Tipos I y II de pared celular • A pesar de que está formada por glucosas, los animales no pueden utilizar la celulosa como fuente de energía, ya que no cuentan con la enzima necesaria para romper los enlaces β-1,4-glucosídicos, es decir, no es digerible por los animales. • En el aparato digestivo de los rumiantes, de otros herbívoros y de las termitas existen microorganismos que poseen la enzima celulasa que rompe el enlace β1,4-glucosídico y al hidrolizarse la molécula de celulosa quedan disponibles las glucosas como fuente de energía. • También algunas bacterias y hongos de vida libre son capaces de hidrolizar la celulosa. Tienen una gran importancia ecológica, pues reciclan materiales celulósicos como papel, cartón y madera. La estructura química de los glicanos ligantes de las paredes celulares de las Angiospermas. El principal es el xiloglucano Y el glucurono-arabino-xilano Dos componentes principales: Ácido poligalacturónico Glucuronoarabinoxilanos Los órdenes de las Angiospermas diferenciados por los glicanos ligantes de sus paredes celulares Hemicelulosas en paredes reservantes Polímeros de la matriz péctica Homogalacturonanos Rhamnogalacturanos I Proteínas estructurales de la pared celular Proteínas estructurales de la pared Crecimiento de la pared primaria Crecimiento pared Primaria: Aflojamiento Crecimiento pared Primaria: Las expansinas Origen de las diferentes moléculas que integran la pared celular Un ejemplo de proteína integral Síntesis de celulosa Los complejos celulosa-sintasa aprecen como anillos o rosetas Roseta: 6 partículas en un hexágono; se distribuyen en la Membrana plamática Epidermis. Cutícula Sección coloreada con safranina. La cutícula no aparece coloreada. Cutina: Las secciones B, están coloreadas con Sudan (red y black) Lípidos estructurales: Cutina: polímeros de ácidos grasos C16 y C18 oxigenados, ligados por uniones ester Suberina • Un poliester compuesto de ácidos grasos y compuestos aromáticos. Presentes en las paredes celulares del súber o corcho Variaciones en la peridermis en diferentes especies Sección no coloreada, observada con contraste de fases Suberina Corcho o suber de Quercus suber Lignina polímeros fenólicos . Conexiones intercelulares • • • • Plasmodesmos Puntuaciones * Placas perforadas* Placas y áreas cribosas* *Se estudiarán en detalle con los tejidos que correspondan •Plasmodesmos: •Desmotúbulos •Laminilla media •Pared primaria •Pared secundaria Conexiones intercelulares: plasmodesmos y puntuaciones Plasmodesmos • • • • • • Desmotúbulo: RE Anillo citoplásmico Membrana plasmática SEL: Size Exclusion Limit MEL: Mass Exclusion Limit (800 Da) Transporte simplásmico Plasmodesmo Campo de Puntuaciones primarias Campo de puntuaciones primarias Modelos de movimiento del ARN viral MP, proteína de movimiento BP., protína de unión R, receptor citocitosólico Valor basal de MEL: 1kDa. Pero puede alcanzar 20-40 kDa Dextrano: PM variable; común 40 kDa TMV:-MP: 10 kDa Modelo de movimiento de proteínas especificas de un tamaño mayor que el SEL pasivo 10 kDa Elementos de vaso y fibra Ligninas A. Hola de Arabidopsis con ácido fuchsínico y fluorescencia B . Floroglucinol en leño del tallo de Robinia pseudoacacia La tinción de la lignina • • • • Ácido fucsínico Safranina Floroglucinol Reactivo de Mäule (tiñe de rojo a la lignina que está formada por el alcohol syringyl pero no a la lignina que esta formada predominantemente por coniferoles (ver WT y una mutante de Arabidopsis, que no puede sintetizar lignina syringyl) Pared secundaria en elementos de vasos Engrosamiento de la pared (pared secundaria) Engrosamiento de la pared (pared secundaria) Pared celular primaria y secundaria (3 capas de pared secundaria Citoesqueleto • Microfilamentos de actina • Microtúbulos Citocinesis Origen de la pared celular La placa celular y el fragmoplasto Ensamble del huso mitótico Microscopía confocal en el estudio del ensamble del huso mitótico Formación del fragmosoma Microtúbulos del fragmoplasto. Placa celular Red túbulovesicular Moléculas de actina: “G-Actin” (proteína globular, 375 aa, “F-actin” (polimérica o filamentosa) “Pointed end” o “minus end”: extremo asociado a miosina “Barbed end” o “plus end”: extremo opuesto • Hay toxinas que interfieren en la dynámica de la actina, ya sea previniendo su polimerización (latrunculina y citochalasina D) o por estabilizarla (faloidina) • Latrunculina es una toxina producida por esponjas, se une a la G-actina previniendo que se formen microfilamentos. • Cytocalasina D, es un alcaloide producido por un hongo que se une al extremo (+) de la F-actin previniendo la adición de nuevos monómeros. • Faloidina, es una toxina que ha sido aislada del hongo Amanita phalloides. Se une a la interfase entre monómeros de actina en el polímero de la F-actin previniendo su despolimerización. Comportamiento dinámico de la actina Miosina interactúa con filamentos de actina Estructura de microtúbulos Nucleótido de guanina pero sólo el de la unidad B se hidroliza y cambia GDP-GTP. 13 protofilamentos Modelos para inestabilidad dinámica de los microtúbulos • Los microtúbulos son polímeros constituidos por dimeros. • Cada dímero está formado por α- y β-tubulina. • Los dímeros polimerizan en 13 protofilamentos, que se agregan lateralmente para formar estructuras cilíndricas huecas. • Para polimerizar se requiere la presencia de dímeros a una concentración mínima determinada denominada concentración crítica. • Una importante característica de los microtúbulos es su polaridad. La tubulina polimeriza por adición de dímeros en uno o ambos extremos del microtúbulo. La adición es por unión cabeza con cola, en la formación de los protofilamentos. • Debido a que todos los protofilamentos de un microtúbulo tienen la misma orientación, un extremo está compuesto por un anillo de α-tubulina (denominado extremo -) y, el opuesto, por un anillo de β-tubulina (denominado extremo +). Tubulina • Inhibidores de su polimerización: colchicina. • Inmunodetección: Anti-tubulina Rabbit Polyclonal Tuba1b Antibody IF Rat monoclonal Tubulin antibody [YL1/2] Movimiento de cloroplastos en hoja de Arabidopsis Alga del género Mougeotia Bibliografía – Beck CB. 2005. An Introduction to Plant Structure and Development. Cambridge University Press, Cambridge. – Buchanan BB, Gruissem W, Jones RL. 2000. Biochemistry and Molecular Biology of Plants. American Society of Plant Physiology, Rockville, Maryland. – Dickison WC. 2000. Integrative Plant Anatomy. Academic Press, New York. – Evert RF. 2007. Essau´s Plant Anatomy. 3rd. Ed. Wiley Lis. Hoboken, NJ – MacAdam JW. 2009. Structure & function of Plants. Wiley-Blackwell, Iowa. Fin Luz polarizada