Determinación del Ácido Acético en el Vinagre Objetivos Introducción
Anuncio

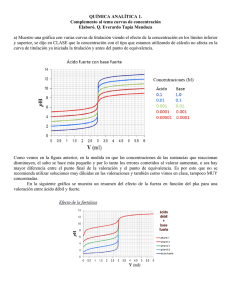
CUAUHTÉMOC HERNÁNDEZ ORTIZ FACULTAD DE INGENIERÍA Determinación del Ácido Acético en el Vinagre Objetivos 1. Conocerá y utilizará el método volumétrico para realizar una titulación ácido-base. 2. Determinará el punto de equivalencia de una reacción química empleando una disolución indicadora y un medidor de pH. 3. Titulará una muestra que contiene ácido acético y trazará la curva de titulación para determinar el punto deequivalencia. 4. Determinará el contenido de ácido acético en un producto comercial (vinagre). Introducción Para poder interpretar adecuadamente lo que sucede durante una titulación ácido base en medio acuoso (el caso más frecuente), es conveniente comenzar por los reactivos y su interacción con el solvente: Cuando tenemos un ácido fuerte, HCl por ejemplo, al tener una solución acuosa significa que este se encuentra totalmente disociado, lo que habitualmente escribimos como Al escribir H+(ac) estamos significando la interacción del protón con el solvente, en este caso sería mas correcto escribir: Es decir que el reactivo que participará en la titulación es el producto del protón con el agua (el solvente), y por lo tanto la reacción neta que ocurrirá es: Esta reacción será la misma independientemente de la identidad de los ácidos y bases, ni tampoco si son fuertes o débiles. Cuando los ácidos o bases son muy débiles resulta difícil titularlos puesto que no se produce un cambio notable del pH en las cercanías del punto equivalente. De esta manera aquellas especies que tengan Ka o Kb menor que 10-7 no son posibles de titular en medio acuoso. Hipótesis Conociendo la cantidad del ácido acético podremos determinar experimentalmente el punto de equivalencia de la reacción con una base de molaridad conocida. Se espera que el punto de equivalencia quede entre un pH de 8 y 10. CUAUHTÉMOC HERNÁNDEZ ORTIZ FACULTAD DE INGENIERÍA Resultados Medición ∆ V [ml] V [ml] pH Medición ∆ V [ml] V [ml] pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 0 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 8.5 9.0 9.5 10.0 10.5 11.0 11.5 12.0 12.5 13.0 13.5 14.0 14.5 15.0 15.5 16.0 16.5 17.0 17.5 18.0 18.5 19.0 19.5 20.0 20.5 21.0 21.5 22.0 22.5 23.0 23.5 24.0 24.5 25.0 25.5 26.0 26.5 3.11 3.12 3.15 3.17 3.20 3.23 3.26 3.28 3.30 3.33 3.35 3.36 3.38 3.40 3.42 3.44 3.46 3.48 3.49 3.51 3.52 3.54 3.55 3.56 3.58 3.59 3.60 3.63 3.65 3.68 3.70 3.72 3.74 3.76 3.78 3.80 3.82 3.83 3.85 3.87 3.89 3.90 3.92 3.93 3.95 3.96 3.98 3.99 4.00 4.02 4.03 4.05 4.06 4.07 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 0.5 0.5 0.5 0.5 0.5 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 27.0 27.5 28.0 28.5 29.0 29.5 30.0 30.5 31.0 31.5 32.5 33.5 34.5 35.5 36.5 37.5 38.5 39.5 40.5 41.5 42.5 43.5 44.5 45.5 46.5 47.5 48.5 49.5 50.5 51.5 52.5 53.5 54.5 55.0 55.5 56.0 56.5 57.0 58.0 59.0 60.0 61.0 62.0 63.0 64.0 65.0 66.0 67.0 68.0 69.0 70.0 71.0 72.0 73.0 4.08 4.09 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.19 4.25 4.32 4.38 4.45 4.50 4.56 4.62 4.68 4.73 4.78 4.85 4.91 4.97 5.04 5.12 5.19 5.29 5.39 5.50 5.65 5.89 6.27 7.88 9.50 9.95 10.30 10.65 10.80 11.00 11.16 11.25 11.35 11.43 11.50 11.53 11.58 11.63 11.67 11.70 11.73 11.76 11.79 11.82 11.84 CUAUHTÉMOC HERNÁNDEZ ORTIZ FACULTAD DE INGENIERÍA Al momento de la titulación el volumen de la disolución de NaOH fue de 54.8 [ml] .01[mol ] NaOH = 0.0058[mol ] NaOH 58[ml ] dis 100 [ ml ] dis Ecuación balanceada: CH3COOH + NaOH CH3COONa + H2O 1 mol 1 mol 1 mol 1 mol Relación 1:1 Por lo tanto había 0.0058 [mol] de CH3COOH disueltos en 28 [ml] , entonces tenemos: 60[ g ]CH 3COOH = 0.348[ g ] CH 3COOH 0.0058[mol ]CH 3COOH 1 [ mol ] CH COOH 3 0.348[ g ] CH 3COOH • 100 =1.2429 % %m / v = ml dis 28 [ ] Análisis de Resultados Del detalle de la gráfica de la curva de titulación del ácido acético podemos observar que el punto de equivalencia se dio en un pH de 8.15. Se esperaba un valor entre 8 y 10, así que el valor quedó dentro de la hipótesis. La concentración de ácido empleada en el experimento resultó del 1.2428 % [m/v]; que fue menor a la dada para el vinagre comercial, pero tomemos en cuenta que diluimos aún más la solución de ácido acético (vinagre) con agua destilada. Conclusiones Se pudo apreciar que la curva de titulación al acercarse a la titulación se convierte casi en una recta vertical y cerca de este punto una pequeña adición de solución titulante provoca grandes cambios en el pH de la disolución. Comprobamos que se puede obtener la cantidad de ácido conociendo la concentración de la sustancia titulante y del punto de equivalencia. BIBLIOGRAFÍA CUAUHTÉMOC HERNÁNDEZ ORTIZ FACULTAD DE INGENIERÍA Mortimer Charles E. QUIMICA Grupo Editorial Iberoamericana, 1983 Brown Theodore L, LeMay H. Eugene, Bursten Bruce E. QUIMICA, La ciencia central. PrinteHall, 1993 Web: http://dcb.fi-c.unam.mx/deptos/fisquim/quimica/articulos/a_udeconcentracion2.pdf http://wwwprof.uniandes.edu.co/~infquimi/ANALISIS/titulaciones/titulaciones.html#C %E1lculos http://www1.uprh.edu/quimgen/4-Exp-8.htm