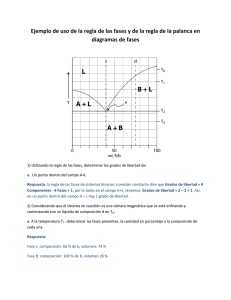
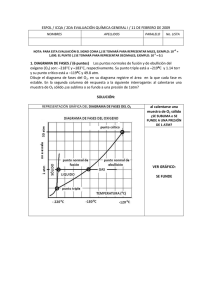
diagrama de fases - colegio agustiniano ciudad salitre
Anuncio
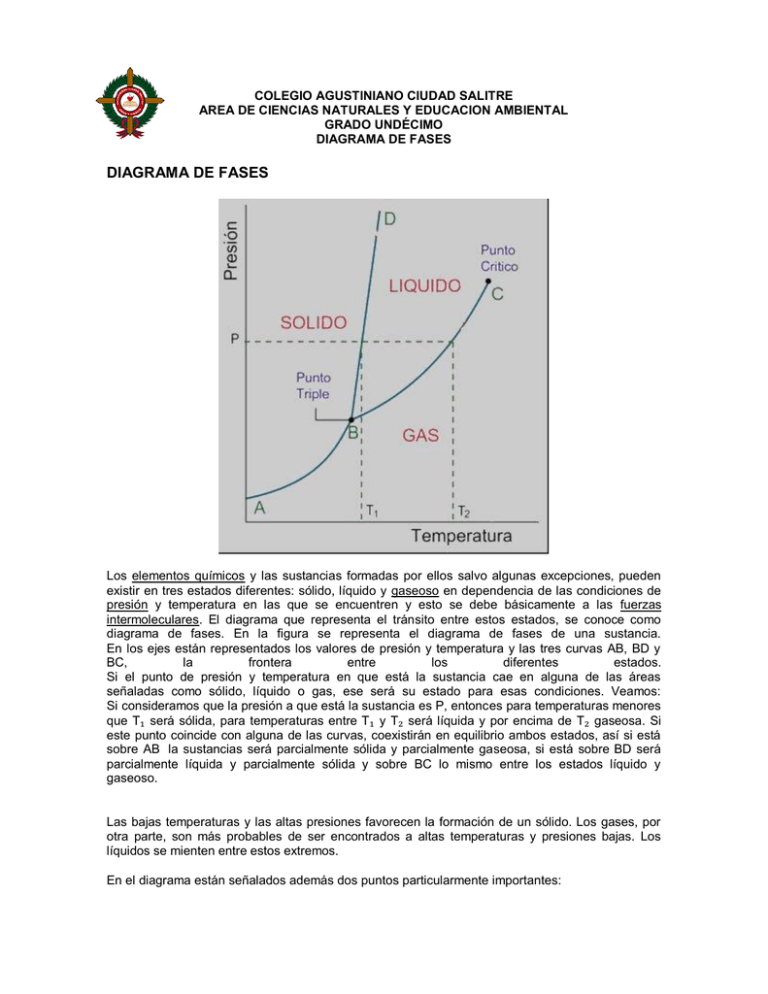
COLEGIO AGUSTINIANO CIUDAD SALITRE AREA DE CIENCIAS NATURALES Y EDUCACION AMBIENTAL GRADO UNDÉCIMO DIAGRAMA DE FASES DIAGRAMA DE FASES Los elementos químicos y las sustancias formadas por ellos salvo algunas excepciones, pueden existir en tres estados diferentes: sólido, líquido y gaseoso en dependencia de las condiciones de presión y temperatura en las que se encuentren y esto se debe básicamente a las fuerzas intermoleculares. El diagrama que representa el tránsito entre estos estados, se conoce como diagrama de fases. En la figura se representa el diagrama de fases de una sustancia. En los ejes están representados los valores de presión y temperatura y las tres curvas AB, BD y BC, la frontera entre los diferentes estados. Si el punto de presión y temperatura en que está la sustancia cae en alguna de las áreas señaladas como sólido, líquido o gas, ese será su estado para esas condiciones. Veamos: Si consideramos que la presión a que está la sustancia es P, entonces para temperaturas menores que T₁ será sólida, para temperaturas entre T₁ y T₂ será líquida y por encima de T₂ gaseosa. Si este punto coincide con alguna de las curvas, coexistirán en equilibrio ambos estados, así si está sobre AB la sustancias será parcialmente sólida y parcialmente gaseosa, si está sobre BD será parcialmente líquida y parcialmente sólida y sobre BC lo mismo entre los estados líquido y gaseoso. Las bajas temperaturas y las altas presiones favorecen la formación de un sólido. Los gases, por otra parte, son más probables de ser encontrados a altas temperaturas y presiones bajas. Los líquidos se mienten entre estos extremos. En el diagrama están señalados además dos puntos particularmente importantes: Punto triple En este punto en la sustancia coexisten en equilibrio los tres estados, está parcialmente solida, parcialmente líquida y parcialmente gaseosa. Obsérvese que para valores de presión o temperatura más bajas que el punto triple la sustancia en cuestión no puede existir en estado líquido y solo puede pasar desde sólido a gaseoso en un proceso conocido como sublimación. Punto crítico El punto C indica el valor máximo de temperatura en el que pueden coexistir en equilibrio dos fases, y se denomina punto crítico. Representa la temperatura máxima a la cual se puede licuar el gas simplemente aumentando la presión. Gases a temperaturas por encima de la temperatura del punto crítico no pueden ser licuados por mucho que se aumente la presión. En otras palabras, por encima del punto crítico, la sustancia solo puede existir como gas. Punto de ebullición El punto de ebullición de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y gaseoso a determinada presión. Los diferentes puntos de ebullición para las diferentes presiones corresponderían a la curva BC. Punto de fusión El punto de fusión de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y sólido a determinada presión. Los diferentes puntos de fusión para las diferentes presiones corresponderían a la curva BD. Podemos por lo tanto probar si se ha etiquetado correctamente un diagrama de fase dibujando una línea de izquierda a derecha a través de la parte más alta del diagrama, que corresponde a un aumento en la temperatura del sistema a presión constante. Cuando un sólido se calienta a presión constante, se derrite para formar un líquido, que hierve eventualmente para formar un gas. Los diagramas de fase se pueden utilizar en varias maneras. Podemos centrarnos en las regiones separadas por las líneas en estos diagramas, y conseguimos una cierta idea de las condiciones de temperatura y de presión que son más probables para producir un gas, un líquido, o un sólido. Podemos también centrarnos en las líneas que dividen el diagrama en los estados, que representan las combinaciones de la temperatura y de la presión en las cuales se tienen estados en equilibrio. Los puntos a lo largo de la línea que conecta A y B en el diagrama de fase representan todas las combinaciones de temperatura y de presión a las cuales el sólido está en equilibrio con el gas. A estas temperaturas y presiones, la tasa a la cual el sólido sublima para formar un gas es igual a la tasa a la cual el gas condensa para formar un sólido. A lo largo de línea AB: Razón a la que el sólido sublima para formar un gas que un gas se condensa para formar un sólido. razón a la La línea entre los puntos B y C es idéntica con el diagrama de la dependencia de la temperatura a la presión del vapor del líquido. Contiene todas las combinaciones de temperatura y de presión a las cuales el líquido hierve. En cada punto a lo largo de esta línea, el líquido hierve para formar un gas y el gas condensa para formar un líquido. A lo largo de la línea BC: Razón a la cual un líquido hierve para formar un gas la cual un gas condensa para formar un líquido razón a La línea entre los puntos B y D contiene las combinaciones de temperatura y de presión a las culaes el sólido y el líquido están en equilibrio. En cada punto a lo largo de esta línea, el sólido se derrite en la misma razón con la cual el líquido se congela. A lo largo de línea de BD: Razón en la cual un sólido se funde para formar un líquido razón a la cual un líquido se congela para formar un sólido. La línea de BD es casi vertical porque el punto de fusión de un sólido no es muy sensible a los cambios en la presión. Para la mayoría de los compuestos, esta línea presenta una pendiente positiva pequeña, debe tenerse en mente que la pendiente de esta línea es levemente negativa para el caso particular del agua. Consecuentemente, el agua se puede derretir a temperaturas cercanas a su punto de congelación cuando está sujetada a presión. La facilidad con la cual los patinadores del hielo se deslizan a través de un lago congelado se puede explicar por el hecho de que la presión ejercida por sus patines derrite una porción pequeña del hielo y se forma una superficie líquida entre el hielo y sus patines. La siguiente figura muestra que sucede cuando dibujamos una línea horizontal a través de un diagrama de fase a una presión de exactamente de 1 atmósfera. Esta línea cruza la línea entre los puntos B y D en el punto de fusión de la sustancia porque los sólidos derriten normalmente a la temperatura a la cual el sólido y el líquido están en equilibrio a la presión de una atmósfera. La línea cruza la línea entre los puntos B y C en el punto de ebullición de la sustancia porque en este punto el líquido y el gas están en equilibrio. DIAGRAMA DE FASE DEL AGUA En termodinámica se denomina diagrama de fase a la representación de las fronteras entre diferentes estados de la materia, en función de ciertas variables. Por ejemplo, el diagrama de fase del agua muestra las fronteras de transición entre los estados sólido (hielo), líquido (agua líquida) y gaseoso (vapor de agua), en función de la temperatura y la presión. En la Tierra a nivel del mar estamos habituados a ver que el agua se congela a 0ºC y que se evapora a 100ºC. Esto se puede apreciar en la línea roja de la gráfica, que indica la presión de una atmósfera. Sin embargo, si la presión se reduce lo suficiente, se podría observar como el hielo pasa a estado gaseoso directamente. O incluso encontrar un punto en el que se puede conseguir cualquiera de los tres estados con una pequeña variación de los parámetros (punto triple). Este punto presenta un gran interés para la calibración de termómetros de precisión. Por otra parte, si aumentamos la temperatura y la presión se puede ver que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico. Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene al mismo tiempo propiedades de un líquido y de un gas. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado DIAGRAMA DE FASE DEL AGUA CON CAMBIOS DE ESTADO DIAGRAMA DE FASE DEL DIÓXIDO DE CARBONO