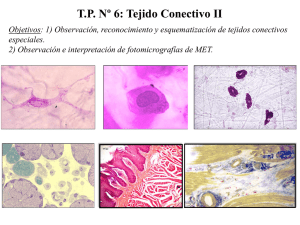
Obtención ambulatoria ASC`s
Anuncio

Master de Medicina Cosmética y del Envejecimiento Trabajo de Investigación TÉCNICA DE OBTENCIÓN AMBULATORIA DE CÉLULAS MADRE A PARTIR DEL TEJIDO ADIPOSO Dr. Fernando López Dra. Bettina Tiravanti 2011 INDICE RESUMEN I. INTRODUCCIÓN II. MARCO TEÓRICO 2.1 TEJIDO ADIPOSO. 2.1.1 IMPORTANCIA DEL TEJIDO ADIPOSO 2.1.2 MORFOLOGÍA DEL TEJIDO ADIPOSO 2.1.3 DESARROLLO DEL TEJIDO ADIPOSO BLANCO 2.1.4 MODELOS IN VITRO DE DIFERENCIACIÓN DEL TEJIDO ADIPOSO 2.1.5 PROCESOS DE LA DIFERENCIACIÓN DEL TEJIDO ADIPOSO 2.1.5.1 INHIBICIÓN DEL CRECIMIENTO. 2.1.5.2 EXPANSIÓN CLONAL. 2.1.5.3 CAMBIOS TEMPRANOS EN LA EXPANSIÓN DE SUERO. 2.1.5.4 EVENTOS TARDÍOS Y DIFERENCIACIÓN TERMINAL. 2.1.5.5 FACTORES QUE MODULAN LA DIFERENCIACIÓN DE LOS ADIPOCITOS 2.2 CÉLULAS MADRE 2.2.1 CONCEPTOS Y DEFINICIÓNES 2.2.2 CELULAS MADRE DE ORIGEN EMBRIONARIO 2.2.3 CÉLULAS MADRE NO EMBRIONARIAS 2.2.3.1 DERIVADAS DE LA MÉDULA ÓSEA 2.2.3.2 DERIVADAS DEL TEJIDO ADIPOSO 2 2.2.3.3 CÉLULAS MADRE DERIVADAS DE LOS PRECURSORES DE LA PIEL 2.2.3.4 CÉLULAS MADRE DERIVADAS DEL LÍQUIDO AMNIÓTICO 2.2.3.5 CÉLULAS MADRE DERIVADAS DEL CÓRDON UMBILICAL 2.2.4 APLICACIONES CLÍNICAS Y EXPERIMENTALES 2.3 LIPOSUCCIÓN III. JUSTIFICACIÓN, OBJETIVOS E HIPOTESIS IV. MATERIAL Y MÉTODOS 4.1 DESCRIPCIÓN DE LA TÉCNICA 4.1.1 INSTRUMENTAL 4.1.2 ELECCION DE LA ZONA DONANTE 4.1.3 DESINFECCIÓN Y ANESTESIA 4.1.4 OBTENCIÓN DE LA GRASA 4.1.5 TRANSPORTE 4.1.6 PROCESAMIENTO 4.1.7 CRIOCONSERVACIÓN V. RESULTADOS VI. CONCLUSIONES VII. BIBLIOGRAFÍA 3 RESUMEN Objetivos: El trabajo pretende estudiar y a la vez certificar la validez de una técnica que permita obtener un número viable y suficiente de células madre mesenquimales a partir del tejido adiposo. Se describe una técnica ambulatoria sencilla y práctica que pueda ser utilizada en el ámbito de la medicina regenerativa y otras especialidades como la medicina estética y del envejecimiento. Metodología: Se estudiaron a 5 pacientes (3 mujeres, 2 hombres) entre los 35 a 63 años, se les extrajo 60 cc de grasa a nivel de abdomen y flanco izquierdo. Las muestras fueron enviadas a un laboratorio en Bélgica (Crio Save), Banco de Células Madre; donde fueron procesadas y crio preservadas a una temperatura promedio de ‐196 ºC. Resultados: Se obtuvieron 5 muestras para su validación con un volumen total promedio de 31 ml y un volumen promedio de grasa de 48% o volumen de grasa procesada, útil (PLA). Se efectuó una comparación de los diversos parámetros del SVF (Stromal Vascular Fraction) de las 5 muestras antes y después de su criopreservación. . Los parámetros que se determinaron fueron: Número de MSC/g (células madre de origen mesenquimal) a p0, todas las muestras descongeladas presentaron un número de MSC superiores a los 12500/g; Marcadores de los antígenos específicos de las células madre (CD 73+, CD 105+, CD 45/34‐), en las muestras frescas y en las descongeladas fue superior al 94% ; Marcador de vitalidad 7AAD, los resultados en las muestras antes y después de la criopreservación fueron de 97‐99% y 98% respectivamente. Conclusiones: Las células madre mesenquimales se encuentran de forma viable en el tejido adiposo obtenido de manera ambulatoria, tanto antes como después de su procesamiento y crioconservación. Es una técnica válida y accesible para los profesionales que trabajan con frecuencia con el tejido adiposo. Palabras claves: Células madre, Tejido adiposo, Liposucción. 4 I. INTRODUCCION 5 Las células madre (stem cell) o células troncales son un tipo especial de células indiferenciadas, que tienen la capacidad de dividirse indefinidamente sin perder sus propiedades y llegar a producir células especializadas. Los trabajos con células madre mesenquimales se iniciaron en 1963, cuando se describieron unas células autoregenerantes en la médula ósea del ratón. 1 Fue Ernest McCulloch y su colega James Hill quienes crearon el primer método para identificar a estas células. Se postularon como células madre regenerativas, para luego ser denominadas Células Madre Hematopoyéticas. La importancia de estas células radica en su gran capacidad de diferenciación en distintos tipos celulares en el cuerpo humano, sobre todo durante la primera etapa de vida y crecimiento y como un sistema de reparación de tejidos dañados y/o envejecidos. A su vez, el empleo del tejido adiposo como material de relleno, fue descrito por primera vez por el médico alemán Gustav Alber Neuber en 1893, cuya experiencia consistió en inyectar una pequeña cantidad de grasa extraída del brazo, en un defecto óseo en la cara. 2 En 1911, Burming describió por primera vez el uso de una jeringuilla como instrumento para la implantación de grasa autóloga a nivel subcutáneo. Los primeros ensayos para rellenar defectos corporales con grasa extraída, datan desde 1950. Peer en 1956, ratificó mediante estudios histológicos la posibilidad de obtener adipocitos vivos mediante liposucción, y es quien propone la teoría de la “supervivencia”, frente a la del “reemplazo o fibrosis”. 3 Posteriormente a estos autores, otros siguieron realizando trasplante de grasa en diferentes partes del cuerpo, pero sin mucho éxito, motivo por el que se abandonó ésta técnica. 6 Al comienzo de la década de los 80, con la aparición y popularización de la liposucción, empiezan otra vez los intentos de reinyectar la grasa autóloga obtenida mediante esa técnica quirúrgica. El comienzo del trasplante autòlogo de grasa se inicia con Illouz, 4 con la reinyección de grasa obtenida mediante liposucción. En 1987, los doctores Vila‐Rovira y Serra‐Renon, publican un libro sobre liposucción en cirugía plástica y estética, incluyendo dos capítulos de la inyección de grasa como injerto, siendo la primera publicación con evidencias iconográficas sobre la aspiración de la grasa con jeringa. 5 En 1988 Illouz publica una supervivencia de solo el 20% de grasa y aconseja la sobrecorrección. 6 En los 90, aparece una nueva generación en técnicas para obtener la grasa y trasplantarla con mayor éxito. Los estudios realizados demuestran que los injertos de grasa autóloga son posibles y se establecen las condiciones óptimas para el éxito del tratamiento. A partir de ésta época, la supervivencia del tejido graso autólogo trasplantado da un gran giro, pasando de ser un procedimiento poco fiable y transitorio a un procedimiento permanente y fácilmente reproducible. 7 Coleman 8, Carpaneda 9, Niechajev 10 y múltiples autores han dejado mucha evidencia de los ensayos que han realizado, de la importancia que tiene el modo de obtención de la grasa en el mantenimiento de viabilidad tisular. También de la importancia que tiene una correcta implantación de la grasa, para asegurar la máxima supervivencia del tejido. El siguiente trabajo pretende estudiar y a la vez certificar la validez de una técnica que permita obtener un número viable y suficiente de células madre mesenquimales a partir del tejido adiposo. Se describe una técnica ambulatoria, que por su carácter 7 sencillo y práctico, pueda ser utilizada en el ámbito de la medicina regenerativa y otras especialidades como la medicina estética y del envejecimiento. 8 II. MARCO TEORICO 9 2.1 TEJIDO ADIPOSO 2.1.1 IMPORTANCIA DEL TEJIDO ADIPOSO El tejido adiposo juega un papel fundamental en el mantenimiento del balance energético en mamíferos. Durante los períodos de alta ingesta energética, los adipocitos almacenan energía en forma de grasa (triglicéridos). Esta grasa puede ser posteriormente liberada en forma de ácidos grasos libres, en periodos de restricción calórica. Sin embargo el tejido adiposo, no puede ser considerado solo como un tejido pasivo que solo almacena energía. Algunos estudios recientes han puesto de manifiesto que tiene funciones endocrinas importantes, secreta importantes moléculas que intervienen en procesos tales como: respuesta inmune (TNF alfa), regulación de la ingesta y gasto energético (Leptina, Acrp30/AdipoQ), y la función vascular (angiotensina y el inhibidor del plasminógeno tisular tipo I). Determinadas alteraciones en el crecimiento, desarrollo y función del tejido adiposo, pueden estar implicadas por lo tanto, en el desarrollo de diferentes patologías como la obesidad, resistencia a la insulina y diabetes tipo II, aterosclerosis, hipertensión11. 2.1.2 MORFOLOGÍA DEL TEJIDO ADIPOSO El tejido adiposo se encuentra distribuido en diferentes regiones en el organismo. Estos depósitos se encuentran principalmente a nivel dérmica, subcutánea, mediastínica, mesentérica, perigonadal, perirrenal y retroperitoneal. Además se distinguen dos tipos de tejido adiposo: el tejido adiposo blanco y el tejido adiposo pardo o marrón, los dos presentan diferencias no solo por la coloración, sino por la morfología, distribución, genes y función. El tejido adiposo pardo, presenta adipositos multiloculados con abundantes mitocondrias que expresan altas cantidades de proteína desacoplante I (UCP I), la cual es responsable de la actividad termogénica de éste tejido12. Por el contrario, el tejido adiposo blanco, está formado por adipositos uniloculados, que contienen mitocondrias diferentes a las encontradas en el tejido adiposo pardo. 10 Estas células producen Leptina, una hormona que informa al cerebro del estado nutricional del individuo, para regular la ingesta y el gasto energético. Por lo tanto, la función de éste tejido es la de controlar la ingesta energética y la distribución de la misma a otros tejidos en los períodos interdigestivos13. El balance entre tejido adiposo blanco y pardo puede verse influido por factores como el frío, el calor, la obesidad, etc. Así, en animales aclimatados al frío, el balance es a favor del tejido adiposo pardo, debido principalmente al desarrollo y proliferación de sus precursores. También la morfología de los adipocitos pardos maduros se modifica, aumentando el número, el tamaño, la densidad y la concentración de UPC I de las mitocondrias. Además también se observa proliferación del tejido adiposo pardo en los depósitos blancos 14. Por el contrario, en animales aclimatados al calor, las áreas pardas están menos coloreadas y su histología está intensamente modificada. Los adipocitos marrones son uniloculados y presentan una concentración menor de mitocondrias, aunque siguen mostrando inmunorreactividad por UPC I 15. En los animales obesos, se produce un enorme aumento del tejido adiposo blanco por hiperplasia e hipertrofia de sus adipocitos. 2.1.3 DESARROLLO DEL TEJIDO ADIPOSO BLANCO El desarrollo del tejido adiposo blanco comienza antes del nacimiento, aunque la cronología varía de unas especies a otras. La capa de grasa subcutánea de la hipodermis se puede identificar a partir del cuarto mes del feto. 16 El mayor crecimiento del mismo tiene lugar unas semanas tras el nacimiento, pero el desarrollo es un proceso continuo a lo largo de toda la vida. Es conocido la capacidad del adulto de generar nuevas células grasas a expensas de una dieta alta en glúcidos y grasas. 17. Una vez que el tejido adiposo está formado, los adipocitos representan entre el uno y los dos tercios del mismo. El resto del tejido está formado por células sanguíneas, endoteliales, pericitos y precursores de los adipocitos con diferente grado de diferenciación, especialmente fibroblastos, aunque también aparecen preadipocitos 11 (células interticiales o vacías de lípidos), células mesenquimales y células grasas muy pequeñas. 18 Aunque el origen embrionario de las células grasas no es del todo conocido, varios estudios han sugerido que la línea adipocitaria deriva de un precursor embrionario multipotente y que posee capacidad para diferenciarse en células unipotentes y comprometidas hacia el desarrollo de varios tipos celulares determinados, tales como adipocitos, condrocitos, osteoblastos y miocitos. Los procesos celulares que llevan a la conversión de las células pluripotentes en adipoblastos unipotentes son todavía altamente desconocidos19. 2.1.4 MODELOS IN VITRO DE DIFERENCIACIÓN DE ADIPOCITOS Los procesos implicados en la diferenciación de los precursores adipocitarios hasta adipocitos maduros han sido ampliamente estudiados utilizando modelos celulares in vitro. Éstos han permitido la caracterización de los eventos moleculares y celulares que tienen lugar durante la transición de preadipocitos indiferenciados tipo fibroblastos hasta células grasas redondeadas maduras. Las líneas celulares utilizadas se pueden dividir en 3 categorías: 1) células embrionarias totipotentes capaces de generar todas las líneas celulares; 2) células multipotentes que pueden dar lugar a miocitos, adipocitos y condrocitos; 3) células ya comprometidas hacia la línea adiposa, que son las denominadas líneas celulares de preadipocitos (Tabla 1). 12 Tabla 1 Fueron aisladas por clonaje desde células derivadas de embriones de ratones Swiss 3T38. La línea TA1 se estableció por el tratamiento de células fibroblásticas embrionarias de ratón CH310T1/2 con el agente demetilante 5‐azacitidina9. La línea Ob1710 y sus derivadas se generaron desde precursores adipocitarios presentes en la grasa epididimal de ratones adultos genéticamente obesos (ob/ob). Se ha logrado también el cultivo de preadipocitos primarios así como la inducción de su transformación en adipocitos maduros en diversas especies animales incluido el hombre. Las células primarias son diploides y reflejan mejor, por tanto, la situación in vitro que las líneas celulares aneuploides. Además, presentan la ventaja de que pueden ser obtenidas desde varias especies a diferentes etapas del desarrollo postnatal y de diferentes depósitos grasos. Esto último es muy importante, ya que se han observado importantes diferencias moleculares y bioquímicas entre los distintos grasos20. depósitos 13 Durante la fase de crecimiento tanto las líneas celulares de preadipocitos como los preadipocitos primarios son morfológicamente similares a los fibroblastos. Una vez que las células han alcanzado la confluencia, el tratamiento con los inductores adecuados de la diferenciación conduce a un cambio drástico en la forma de las células. Los preadipocitos se convierten en células de forma esférica que empiezan a acumular lípidos, y que van adquiriendo progresivamente las características morfológicas y bioquímicas propias de los adipocitos maduros21. El tratamiento capaz de inducir la diferenciación varía en los distintos modelos celulares descritos (Tabla 1). Aunque los preadipocitos de diferentes fuentes son similares en múltiples aspectos, su respuesta a los agentes inductores de la diferenciación varía considerablemente. Estas diferencias pueden venir determinadas por el diferente estadio de maduración en el que se obtuvieron los preadipocitos22. En la mayor parte de los casos se requiere la presencia de insulina. En algunos casos, como por ejemplo en los preadipocitos 3T3‐L1, la diferenciación se ve acelerada tras el tratamiento durante 48 horas con dexametasona, un corticoide; isobutilmetilxantina (IBMX), un estimulante del AMPcíclico; y altas concentraciones de insulina, en presencia de suero bovino fetal. Tras este periodo inductor de la diferenciación, no se requiere la presencia de algunos de estos inductores de la diferenciación para el mantenimiento del fenotipo del adipocito maduro23. 2.1.5 PROCESOS DE LA DIFERENCIACIÓN DE ADIPOCITOS La diferenciación de los adipocitos es un proceso complejo en el que los preadipocitos deben interrumpir su crecimiento y salir del ciclo celular previamente a su conversión terminal en adipocitos. Este proceso de diferenciación supone cambios cronológicos en la expresión de numerosos genes. Así, se van adquiriendo aquellos genes característicos de los adipocitos, al mismo tiempo que se van reprimiendo genes que son inhibitorios para la adipogénesis o que no son innecesarios para la función del adipocito maduro. Todos estos cambios en la expresión y función de estos genes conducen finalmente a la adquisición del fenotipo característico del adipocito24. Aunque los fenómenos moleculares implicados en la diferenciación de los adipocitos 14 no son totalmente conocidos, se ha sugerido un modelo que incluye varias etapas (se describe como ejemplo el modelo de diferenciación propuesto para la línea celular 3T3‐L1). 2.1.5.1 INHIBICIÓN DEL CRECIMIENTO Una vez alcanzada la confluencia, los predipocitos 3T3‐L1 sufren inhibición por contacto y cesan su crecimiento, y comienzan a exhibir algunos de los marcadores tempranos de la diferenciación25. 2.1.5.2 EXPANSIÓN CLONAL El tratamiento de estas células en las que ha cesado el crecimiento con medio de diferenciación las induce a reentrar en el ciclo celular, y se producen varias rondas de replicación de DNA y duplicación celular. Esta expansión mitótica clonal de células comprometidas es esencial para completar la diferenciación terminal en adipocitos maduros. Las proteínas del retinoblastoma (Rb) modulan la actividad de E2F, un factor de transcripción que juega un papel fundamental en la regulación de la progresión del ciclo celular. Varios estudios recientes han sugerido que las proteínas Rb juegan un papel fundamental en la regulación de la expansión mitótica clonal necesaria para la diferenciación de los adipocitos 3T3‐L126‐27. 2.1.5.3 CAMBIOS TEMPRANOS EN LA EXPRESIÓN DE GENES Conforme la expansión clonal cesa, se inicia la activación transcripcional coordinada de genes específicos del adipocito. La expresión de estos genes se acompaña de cambios bioquímicos y morfológicos dramáticos que conducen a la adquisición del fenotipo del adipocito. La expresión de lipoprotein lipasa (LPL) ha sido considerada a menudo como un signo temprano de la diferenciación adipocitaria. La expresión de LPL ocurre, sin embargo, de manera espontánea al alcanzar la confluencia y es independiente de los inductores de la diferenciación. Esta circunstancia sugiere que LPL puede reflejar la etapa de cese del crecimiento más que ser un marcador temprano del proceso de diferenciación28. Hasta ahora, se han descrito dos familias de factores de transcripción, las C/EBPs 15 (CCAAT/Enhancer Binding Proteins) y PPARg (Peroxisome Proliferator‐Activated Receptor g), que han sido identificadas como “directores” reguladores de la transcripción de genes adipogénicos29. La familia C/EBP está constituida por varias isoformas30: C/EBPa, C/EBPb y C/EBPd. C/EBPa parece ser un factor nuclear indispensable y crítico en el proceso de diferenciación de los adipocitos31.32. Varios estudios han puesto de manifiesto que este factor de transcripción es no sólo requerido, sino también suficiente para poner en marcha el proceso de diferenciación de los adipocitos incluso en ausencia de agentes inductores de la diferenciación33.34. En apoyo de esta hipótesis, se ha observado que la supresión de la expresión de C/EBPa por un tratamiento con antisentidos provoca una inhibición en la diferenciación terminal de los adipocitos, lo cual parece indicar que este proceso requiere el mantenimiento de la expresión sostenida de C/EBPa 35. Esta expresión de C/EBPa durante la etapa de diferenciación terminal se ha atribuido a un fenómeno de autoactivación de su propio gen, el cual contiene un lugar de unión para C/EBP en la región proximal de su promotor. Además, la importancia de C/EBPa para la activación de otros genes específicos del adipocito maduro se pone también de manifiesto por la identificación de lugares de unión para C/EBPa en los promotores de varios de estos genes, tales como aP236. Sin embargo, el hecho de que C/EBPa se active relativamente tarde en la secuencia de eventos del proceso de diferenciación (días 3‐4) ha hecho surgir algunas cuestiones referentes a su papel de maestro director en este proceso. En este sentido, se ha observado que la activación de las isoformas b y d de la familia de las C/EBPs es cronológicamente anterior a la de C/EBPa, lo que sugiere que ambas (b y d) juegan un papel preparatorio muy temprano en la cascada de fenómenos que conducen a la diferenciación37. Los niveles de C/EBPb y C/EBPd se ven incrementados en respuesta a la isobutilmetilxantina (IBMX) y la dexametasona respectivamente20, y su principal función es iniciar la activación de C/EBPa, el cual es finalmente responsable de la activación de la serie de genes específicos de los adipocitos. El PPARg es el único miembro de una familia de receptores nucleares/factores de transcripción (PPAR), que se encuentra expresado en altos niveles específicamente en 16 tejido adiposo y que se ha demostrado es un importante mediador del proceso adipogénico. La expresión de PPARg antecede la inducción de C/EBPa en la cascada de eventos que conducen a la diferenciación de los adipocitos38. Al igual que lo observado con C/EBPa, la expresión retroviral de PPARg es suficiente para inducir la conversión de varias líneas celulares de fibroblastos en adipocitos39. En este sentido, se ha observado que la coexpresión de PPARg y C/EBPa en fibroblastos tiene un efecto sinérgico sobre la inducción del proceso de conversión en adipocitos. Las tiazolidinedionas, fármacos con acción antidiabética, actúan como ligandos directos de PPARg, y se ha observado que son, por tanto, potentes y efectivos estimulantes de la adipogénesis40. Los factores de transcripción C/EBPb y C/EBPd parecen jugar también un importante papel en la inducción de PPARg. De hecho, su expresión ectópica provoca un incremento en los niveles de PPARg equivalente al de las células adiposas normales41. Otro factor que también parece estar implicado en el proceso de diferenciación es ADD1/SREBP1 (Adipocyte Determination Differentiation Dependent Factor 1/ Sterol Regulatory Element Binding Protein 1). La coexpresión de este factor de transcripción incrementa la actividad transcripcional de PPARg incluso en ausencia de sus ligandos activadores. Entre los genes que disminuyen su expresión a lo largo de la diferenciación es de destacar Pref‐1 (Preadipocyte Factor‐1). Pref‐1 presenta altos niveles de expresión en preadipocitos y su expresión disminuye durante la diferenciación, siendo completamente indetectable en adipocitos maduros42. 2.1.5.4 EVENTOS TARDÍOS Y DIFERENCIACIÓN TERMINAL Durante la fase final de la diferenciación, los adipocitos en cultivo incrementan marcadamente la lipogénesis de novo, observándose, por tanto, un incremento en la expresión y actividad de enzimas implicados en esta ruta tales como la sintasa de ácidos grasos, enzima málica, glicerol 3‐fosfato deshidrogenasa… Durante esta etapa aumenta también considerablemente la sensibilidad a la insulina, debido a un gran 17 aumento en el número de receptores de insulina y transportadores de glucosa dependientes de insulina (GLUT4). La diferenciación de los adipocitos conlleva una pérdida de receptores adrenérgicos b1, mientras que se produce un incremento de los b2 y b3, resultando un incremento total en el número de receptores adrenérgicos43. Además, se expresan y sintetizan también otros genes y productos específicos de los adipocitos como aP2, una proteína fijadora de ácidos grasos específica de adipocitos y perilipina, una proteína asociada a las gotas de lípidos. Además, los adipocitos en esta etapa comienzan a secretar algunas sustancias endocrinas y paracrinas tales como leptina, adipsina, PAI‐1 y la angiotensina44. 2.1.5.5 FACTORES QUE MODULAN LA DIFERENCIACIÓN DE LOS ADIPOCITOS Según lo expuesto hasta ahora puede deducirse que la diferenciación de los adipocitos es un proceso altamente complejo, que se encuentra sometido a regulación por diferentes hormonas y factores de crecimiento. La identificación de estos factores que regulan tanto positiva como negativamente el proceso de diferenciación adipocitario, y el conocimiento de las rutas implicadas, provee importante información para una mejor comprensión de los mecanismos moleculares implicados en el proceso diferenciador (Tabla 2). 18 Tabla 2 2.2 CELULAS MADRE Las células madre fueron estudiadas por primera vez por Becker et al. (1963), quienes inyectaron células de médula ósea en ratones irradiados y notaron que en el bazo de los ratones se desarrollaron nódulos en proporción al número de células de médula ósea inyectadas. Llegaron a la conclusión de que cada nódulo surgió de una sola célula de la médula. Más tarde, encontraron la evidencia de que estas células eran capaces de auto‐renovación infinita, una característica esencial de las células madre. Así, las células madre, por definición, tienen dos propiedades esenciales, es decir, la capacidad de auto‐renovación, dando lugar a más células madre, y la capacidad de diferenciarse en linajes de células diferentes bajo condiciones adecuadas. En términos generales, hay dos tipos principales de células madre, embrionarias y no embrionarias. Las células madre embrionarias (CES) son totipotentes y, por consiguiente, pueden diferenciarse en las tres capas germinales embrionarias. Por otro lado, las células madre no embrionarias (no‐CES), también conocidas como células madre adultas, son sólo multipotentes, su potencial de diferenciarse en diferentes 19 tipos de células parece ser más limitado 45. La potencialidad de estas células y la facilidad relativa de aislarlas y amplificarlas son propiedades de valor incalculable para la medicina regenerativa. 2.2.1.‐ CONCEPTOS Y DEFINICIÓNES Nicho de células madre Varias ideas se han propuesto para explicar la determinación del linaje de las células madre. Una línea actual de investigación se centra en el microambiente de células madre o "nicho". Un nicho se consiste de moléculas de señalización, comunicación intercelular y la interacción entre las células madre y su matriz extracelular. Se cree que este microambiente tridimensional influencia/ controla las propiedades y los genes que definen la "troncalidad" de las células madre, es decir, auto‐renovación o desarrollo de células comprometidas 46. Una interesante teoría propuesta es que las células madre podrían ser células diferenciadas terminales con el potencial para mostrarse como un tipo de célula u otro, dependiendo del lugar de acogida. Las células madre adultas que se implantan en un lugar totalmente diferente (diferente capa germinal) potencialmente pueden diferenciarse en tipos celulares similares a los que se encuentran en el nuevo entorno. Por ejemplo, se ha visto que células madre neuronales humanas producen músculo cuando se implantan en el músculo esquelético 47. Células de la médula ósea se diferenciaron en células neuronales cuando fueron trasplantadas en un tejido neural 48 . Además, se logró "transdiferenciación" de células hepáticas en celulas los islotes 49 . Estos resultados evidencian la posibilidad de la influencia "fuerte" del nicho que conduce a la plasticidad de células madre adultas (la capacidad de desdiferenciación en las células de otros linajes. El entusiasmo generado por estos hallazgos en la plasticidad de células madre ha sido contrarrestado por un grado de controversia y escepticismo en muchos centros de investigación que sugieren la fusión célula‐célula, en lugar de la plasticidad 50. Sin embargo, se necesitan más estudios para comprender plenamente el mecanismo de potencial de diferenciación de células madre. 20 2.2.2.‐ CELULAS MADRE DE ORIGEN EMBRIONARIO Las células embrionarias (ESCs) pluripotenciales se derivan de la masa celular interna (ICM) de blastocistos de 5‐6 días de vida. Cuando un blastocisto se implanta en el útero, la masa celular interna (ICM) con el tiempo se convierte en un feto humano (dentro de 2 meses) y el trofoblasto circundante se desarrolla en la placenta. En la embriogénesis, ICM da lugar a dos capas de células distintas, la epiblasto y el hipoblasto. El hipoblasto forma el saco vitelino, mientras que el epiblasto se diferencia en las tres capas clásicas del embrión, es decir, ectodermo, mesodermo y endodermo, con la posibilidad de formar diferentes tejidos del cuerpo. Las ESCs se describieron por primera vez por Martin (1981) de la Universidad de California en San Francisco. A partir de entonces, tomó 17 años antes de que la primera línea de ESCs humanas sea establecida en 51 1998 . en la Universidad de Wisconsin‐Madison, EE.UU. Hasta la fecha, por lo menos 225 líneas de ESCs humanos han sido creadas. Una línea de ESCs se define por la "inmortalidad" de las células en cultivo. El Blastocisto y la clonación terapéutica El pluralismo ético y legal en Europa implica que depende de cada uno de los Estados miembros legislar sobre la situación de el embrión humano y sobre el uso de células madre. Así, la legislación en materia de ESCs es diversa en toda la Unión Europea (UE). Por ejemplo, no existe una legislación sobre la investigación de embriones en Italia, Luxemburgo y Portugal. Por otro lado, en Finlandia, Bélgica, Países Bajos, Suecia y el Reino Unido la ley lo permite bajo ciertas condiciones, la formación de líneas de ESCs a partir de embriones supernumerarios. Alemania prohíbe la producción de ESCs y la investigación con ESCs sólo se permite si se usan líneas creadas antes de 1 de enero 2002 en el país de origen, de conformidad con las la legislación nacional. Por otro lado, Austria, Dinamarca, Polonia, Eslovaquia, Lituania, Malta, Francia, Irlanda y España prohiben por ley la formación y el uso de líneas de ESCs 52. El punto de continuo debate ético sobre los ESCs es la fuente de donde proviene el blastocisto. Estos son en la actualidad derivados del exceso de óvulos fertilizados obtenidos in vitro en clínicas de fertilización. Sin 21 embargo, esta fuente es limitada y otras opciones son posibles, por ejemplo, la clonación nuclear. La clonación nuclear (también conocida como transferencia nuclear) implica la introducción de un núcleo de una célula donante en un ovocito enucleado para generar un embrión con un “maquillaje genético” que es del 99,5% idéntico al del donante. Hay dos tipos de clonación nuclear: (a) la clonación reproductiva, que conduce a la generación de un embrión para la continuación de vida, y (b) la clonación terapéutica, generando embriones en etapas tempranas para la adquisición de los ESCs, que se utiliza en la investigación y terapias celulares. El primero es científicamente y éticamente condenado. Sin embargo, este último tiene importantes implicaciones para el futuro de las terapias con ESCs. Esto permite la producción de líneas EScs específicos para cada paciente, lo que evita reacciones alogénicas. Además, estos podrían constituirse en bancos y con el tiempo ser utilizados para el tratamiento de futuras condiciones médicas. 2.2.3. CÉLULAS MADRE NO EMBRIONARIAS Células madre (Non‐ESCs) no embrionarias son de jerarquía más baja dentro de las variedades de celulas madre. Se cree que han perdido la capacidad pluripotente que las ESCs tienen. Sin embargo, durante toda la vida de un organismo, Non‐ESCs mantienen el potencial de diferenciación multipotente. Non‐ESCs se pueden derivar de varias fuentes incluyendo líquido amniótico 53 , el cordón umbilical (gelatina de Wharton), el tejido adiposo, sistema nervioso central, médula ósea, la retina y la piel. 2.2.3.1. CÉLULAS MADRE DERIVADAS DE MÉDULA ÓSEA En biología la palabra "Estroma" se refiere a los tejidos, o "parénquima", que da soporte a las células activas con funciones específicas. Los hematólogos fueron los primeros en describir el estroma de la médula como una población heterogénea de células del tejido conectivo. Estas células son el soporte estructural de la hematopoyesis de la médula 54. Así, esta compleja estructura de células heterogéneas constituye el “nicho” de las células madre hematopoyéticas, 22 estas últimas, posiblemente, también apoyan a células de la médula ósea, formando un doble “nicho” en ambos sentidos. A partir de entonces, el término “células estromales de la medula osea” (BMSCs) se aplicó a células aisladas de la médula ósea con potencial para formar los tejidos conectivos. Entre estas BMSCs existe una subpoblación de células indiferenciadas pluripotentes capaces de generar mesénquima, la masa de tejido que se desarrolla a partir del mesodermo del embrión. Esta población celular que se conoce que esta presente en todos los tejidos después del parto y se define como células madre mesenquimales 55. Las células madre derivadas de la médula ósea, se aislaron y describieron por primera vez por Friedenstein y Owen en la Universidad de Oxford, Reino Unido, en la década de 1960 56. Tomaron la médula ósea y la incubaron en plastos plásticos de cultivo, después de 4 h retiraron las células no adherentes. Una población de células heterogeneas fue recuperada, con algunas células adherentes que muestran una forma de huso; también, se multiplicaron rápidamente in vitro, formando distintas colonias llamadas unidad formadora de colonias de fibroblastos (CFU‐Fs) 57. Con el tiempo, estas células se aislaron con éxito en varios mamíferos, incluyendo seres humanos. Además, se encontró que las CFU‐Fs tienen potencial multipotente, lo que implica que tienen propiedades de células madre 58. Estas células se diferenciaron in vitro en múltiples linajes de células mesenquimales, incluyendo el hueso 59, ligamento 60, adiposo 61, el cartílago 62 y el músculo 63. Asimismo, tras el trasplante de CFU‐Fs en vivo, se formaron pequeños depósitos de hueso, cartílago o grasa. Esto sustentó más el potencial multipotente de las CFU‐Fs. Células similares se han aislado de diferentes tejidos mesenquimales, incluyendo sinovia, los tendones, los músculos esqueléticos y tejido adiposo incluyendo la almohadilla de grasa de la articulación de la rodilla 64. BMSCs o MSCs son por lo general aisladas de la capa mononuclear de la médula ósea después de la separación por el gradiente de densidad en centrifugación. Estas células mononucleares se cultivan en medios de cultivo que contienen un 10‐15% de suero fetal bovino o suero autólogo. Las BMSCs se adhieren al plástico de cultivo de tejidos, dejando pequeñas células adheridas similares a fibroblastos. A partir de entonces, las células se dividen y proliferan rápidamente. In vitro, se ha observado que las BMSCs necesitan de ácido ascórbico, β‐glicerofosfato y glucocorticoides, como la dexametasona durante 2‐3 semanas para inducir la diferenciación osteogénica 65. 23 Varios otros métodos se utilizan para ayudar a diferenciar BMSCs en condrocitos, adipocitos, miocitos o tenocitos in vitro. 2.2.3.2. CÉLULAS MADRE DERIVADAS DE TEJIDO ADIPOSO En el 2002, Zuk y et al, demostraron que el tejido adiposo humano "grasa " puede ser una buena fuente alternativa de células madre multipotentes.65, 66. Estas células madre (ADSCs) derivadas de tejido adiposo, tienen una capacidad osteogénica in vitro 67 e in vivo. Del mismo modo, ADSCs pueden ser inducidas para diferenciarse in vitro en diferentes líneas celulares, incluyendo condrogénicas 68 , adipogénicas, hepáticas 69 y linajes neurogénicos 70. Mizuno et al. (2002) demostraron que las ADSCs cultivadas en condiciones miogénicas llevó a la expresión de genes relacionados con los músculos 71 . Rangappa et al. (2003) obtuvo diferenciación cardiomicitica, jugando con las células de manera espontánea y manteniendo su fenotipo por un máximo de 2 meses. Por otra parte, usando la fracción vascular derivado del estroma de tejido adiposo de ratones, se obtuvo células hematopoyéticas. Los estudios se llevaron a cabo para caracterizar ADSCs; estos informes mostraron que el fenotipo y el genotipo a nivel transcripcional son muy similares a los de BMSCs. Sin embargo, el potencial de diferenciación puede ser diferente. Afizah et al. (2007)72 encontraron que, en condiciones similares la diferenciación in vitro condrogénica es mejor en BMSCs que en ADSCs. En particular, se han empleado clínicamente para controlar las reacciones de injerto‐huésped en trasplante hematopoyético (Le Blanc et al., 2002). Del mismo modo, se ha encontrado que las ADSCs tienen funciones inmunorreguladoras. Clínicamente, García‐Olmo et al. (2005) informó sobre el uso de ADSCs en el tratamiento de las fístulas relacionadas con la enfermedad de Crohn en cuatro pacientes. Los autores demostraron que la mayoría de las fístulas curaron con éxito. Además, Lendeckel et al. (2004)73 trató a un joven paciente con ADSCs autólogas, el paciente tenia varios defectos de calota craneana ocasionados por multiples lesiones en la cabeza. El paciente mostró aumento de la formación de hueso y la curación casi completa. La evidencia experimental y clínica muestra que ADSCs son una fuente alternativa adecuada para la regeneración en medicina. En particular, se sabe que las ADSCs pueden ser mantenidas in vitro por 24 largos períodos de tiempo con duplicaciones de población estable y bajos niveles de senescencia66. A pesar de que la médula ósea es una confiable fuente de células madre, su cosecha es un procedimiento invasivo y el número de células aisladas puede ser bajo y dependiente de la edad. Pittenger et al. (1999) mostró que sólo 0.01‐0.001% de las células mononucleares aisladas de médula ósea conducen a unidades formadoras de colonias. Por otra parte, el tejido adiposo puede producir grandes cantidades de células madre y se puede obtener en abundancia 74. Las ADSCs han abierto numerosas perspectivas y se ve muy prometedor para terapias regenerativas. 2.2.3.3. CÉLULAS MADRE DERIVADAS DE PRECURSORES DE LA PIEL (SKP) La piel es considerada como el órgano más grande del cuerpo. Al igual que el tejido nervioso, se desarrolla a partir de la capa germinal ectodermica del embrión. Toma et al. (2001) describió el aislamiento de células multipotentes de la dermis de roedores jovenes y adultos. Los autores afirman que estas células in vitro proliferaron y diferenciaron en diferentes tipos de celulas tanto neurales como del mesodermo, incluidas las neuronas, glía, músculo liso y adipocitos. A pesar de las CMM también se pueden aislar de la piel, se sugirio que, al ser nestina positivo, precursor derivado de la piel, son un tipo diferente de células madre 75. La mayoría de las células de los nervios generados por SKPS son similares a las neuronas periféricas y de Schwann células. Estas células estarían presentes en la piel durante la embriogénesis, que persisten en los números más bajos en la edad adulta 76. SKPS pueden ser aislados de tejidos humanos, incluyendo tan sólo 2.1 cm3 de prepucio y pequeños biopsias por punción del cuero cabelludo 77. El descubrimiento de SKPS tiene gran importancia terapéutica. Dado que en la piel, los SKPS son fuente disponible y accesible de los precursores neurales que se puede utilizar para las terapias regenerativas de la sistema nervioso. Hasta la fecha, se han realizado estudios sobre el uso de las células de Schwann para lesiones de la médula espinal. Sin embargo, las biopsias de nervio son necesarias, ya que es una fuente frente a posibles complicaciones. Además, las células de Schwann tienen un potencial de expansión limitada. Debido a la capacidad de SKPS de diferenciarse en células de Schwann, estas 25 células ofrecen una alternativa de fuente autóloga. Esto da a la piel no sólo un uso interesante para la regeneración del nervio periférico sino también una fuente de células para la osteogénesis. Sin embargo, se requieren más estudios adicionales para establecer claramente su potencial. 2.2.3.4. CÉLULAS MADRE DERIVADAS DE LÍQUIDO AMNIÓTICO En el Instituto Wake Forest fueron capaces de aislar células madre multipotenciales en el líquido amniótico 78 . Estas células de alguna manera representan una etapa intermedia entre los dos tipos de células madre, CES y no los CES. Líquido amniótico derivado de células madre se encontraron para expandir ampliamente. Estas células tienen la capacidad de diferenciarse en células funcionales correspondientes a cada una de los tres capas principales germinales embrionarias (ectodermo, endodermo y el mesodermo); así ser capaces de dar lugar a células adipogénicas, osteogénica, miogénica, endoteliales, neuronales y hepáticas. 2.2.3.5. CÉLULAS MADRE DERIVADAS DEL CORDÓN UMBILICAL El cordón umbilical y tejido de la placenta puede proporcionar células madre a través de dos compartimentos, de la sangre del cordón umbilical y de la matriz del cordón umbilical, también conocido como gelatina de Wharton. La sangre del cordón umbilical es una fuente de células madre pluripotenciales79 y de células madre hematopoyéticas. Cuando se trasplantan a un alo‐receptor, estas células muestran baja inmunogenicidad y pueden tener incluso funciones inmunosupresoras localizadas. Esta fuente de células madre tiene la ventaja de estar disponible (normalmente se desecha) y su uso no origina ningún problema de morbilidad a la madre o al recién nacido. Esto proporciona un potencial suministro ilimitado de células madre, con la posibilidad de aislar un gran número de células madre con pocas o ninguna consideración ética. Estas propiedades hacen que las células del cordón umbilical sean ideales para la práctica actual de almacenamiento de células madre. 26 2.2.4. APLICACIONES CLINICAS Y EXPERIMENTALES 2.2.4.1. EL TEJIDO ÓSEO, CARTÍLAGO, TENDONES Y LIGAMENTOS, MEDULA ESPINAL, MUSCULO CARDIACO, VEJIGA 2.2.4.1.1. El tejido óseo Los defectos óseos se producen debido a causas congénitas o adquiridas, tales como trauma, cirugía y tumores, que pueden dar lugar a una pérdida ósea extensa y a defectos que requieren trasplante de tejido óseo o sustitutos para restaurar la integridad estructural y la funcionalidad. El tratamiento postraumático de complicaciones esqueléticas, como el retraso en las uniones, la falta de unión y uniones defectuosas, son desafiantes. El “Estándar de oro” actual es el uso de injertos autólogos de hueso esponjoso. Sin embargo, la disponibilidad ósea adecuada es limitada, especialmente en pacientes con osteoporosis, pacientes pediátricos y oncológicos y su obtención incrementa la morbilidad de la zona donante, lo que da lugar al dolor, al hematoma o infección. El injerto de hueso no es eficaz en todos los casos. Actualmente ya se practican terapias alternativas, incluyendo el uso de factores de crecimiento como BMPs 80. Un nuevo enfoque es el uso de terapias con células, incluyendo BMSCs. La mayoría de los estudios clínicos y experimentales proporcionan pruebas que apoyan la eficacia de BMSCs en la mejora de la formación ósea y la cicatrización de defectos del hueso. Los grandes modelos animales mostraron que el tratamiento de grandes defectos óseos con la aplicación de BMSCs con un portador osteoconductivo puede tener éxito 81. Los resultados experimentales en el campo son lo suficientemente sugerentes para la aplicación clínica. 2.2.4.1.2. Cartílago El cartílago articular tiene un escaso potencial de regeneración después de ser lesionado, como consecuencia de ello cambios degenerativos y artritis pueden surgir después de la lesión. Procedimientos que emplean las células madre como un modo de tratamiento han evolucionado con el tiempo. Wakitani et al. (1994) informó sobre el uso exitoso de MSCs en un Gel de colágeno tipo I para reparar defectos condrales carpianos. Esto se tradujo con éxito a la práctica clínica. El 27 trasplante autólogo de BMSCs se utilizó para tratar defectos del espesor total del cartílago articular en las rótulas de dos pacientes 82. También informaron sobre 12 pacientes que sufrieron de osteoartritis de la rodilla (OA), que recibieron inyecciones con BMSCs en los defectos del cartílago del cóndilo medial femoral en el momento de realizar osteotomía tibial alta. Experimentos anteriores y actuales indican que las BMSCs representan una opción alternativa para ayudar a regenerar los meniscos y prevenir la artrosis. 2.2.4.1.3. Los tendones y ligamentos Estos tejidos se curan con tejido cicatrizal de inferior calidad, con el riesgo de ruptura posterior en el sitio de la reparación o formación de adherencias fibrosas. Varios estudios se han llevado a cabo para estudiar la posibilidad de utilizar terapias de regeneración basadas en el uso de células. Cao et al. (2002) obtuvieron buenos resultados con tenocitos implantados subcutaneamente en entramados de ácido poliglicólico en ratones experimentales. Sin embargo, los tenocitos tienen una zona limitada de obtención y requieren largo tiempo de cultivo in vitro. Por lo tanto, una posible alternativa es el uso de BMSCs para tales terapias regenerativas. 83. BMSCs se sembraron en lesiones experimentales de 1 cm en el tendón de Aquiles de conejos, y se demostró buena formación de fibras transversales de colágeno. BMSCs también pueden ser utilizadas clínicamente para incrementar la curación en la interface hueso‐tendón después de procedimientos como la reconstrucción del ligamento cruzado anterior 84. 2.2.4.1.4. La médula espinal El traumatismo de la médula espinal puede llevar a graves daños neurológicos. A pesar de que las células madre endógenas presentes en la médula espinal tienen capacidad de regeneración, la recuperación de la lesión de la médula espinal es difícil. A partir de que es posible la diferenciación in vitro de BMSCs en células neuronales 85, una estrategia para mejorar la regeneración anxonal podría implicar el trasplante de BMSCs en la médula espinal lesionada. El traslado de modelos animales a ensayos en 28 humanos es difícil; sin embargo, ensayos clínicos controlados aleatorios son necesarios para comprender el uso potencial de células madre para el tratamiento de lesiones de la médula espinal. 2.2.4.1.5. Músculo cardíaco El descubrimiento de un sistema de reparación endógeno cuestiona el viejo paradigma que describe al corazón como un órgano post mitotico. Nos lleva a la hipótesis de que la regeneración cardiaca puede ser regulada por las células madre. De hecho, células en división con grandes figuras de mitosis se encontraron en el músculo cardíaco. Estas pueden ser de origen endógeno, derivadas del epicardio, o incluso ser extracardíacas. Esto último es sugerido por estudios de pacientes sometidos a trasplante de corazón, los pacientes eran de sexo masculino y recibieron corazones femeninos, mostrando en las biopsias cardiomiocitos que llevan cromosoma Y 86. Además, una población endógena de células madre cardíacas capaces de diferenciarse en cardiomiocitos y linajes vasculares se ha aislado y expandido con éxito a través de biopsias de miocardio humano. Esto sugiere que estas células podrían utilizarse para reparar el tejido cardiaco. La inyección intramiocárdica de estas células después de un infarto en ratones, produjo la formación de cardiomiocitos y células vasculares, mejorando la función sistólica 87. Una fuente alternativa de células es el uso de BMSCs. La regeneración de la enfermedad isquémica del corazón se puede lograr mediante la distribución en las arterias coronarias de médula ósea integra o de BMSCs cultivadas y expandidas, o directamente en el miocardio, para aumentar la regeneración endógena del conjunto de células 88. Janssens et al. (2006) informó sobre la implantación de BMSCs para el tratamiento del infarto de miocardio. La terapia con células madre dio como resultado una reducción significativa en el tamaño del infarto de miocardio y mejores tasas de recuperación de la función sistólica regional después de 4 meses de seguimiento. Sin embargo, no se observó ningún beneficio significativo en términos de la fracción de eyección del ventrículo izquierdo, perfusión del miocardio o el metabolismo cardíaco. El mecanismo de reparación tras el implante de células madre aún no está claro. No hay evidencia que confirma la presencia de estructuras contráctiles derivadas de BMSC 29 después de la implantación en el músculo cardíaco. 2.2.4.1.1.6. Tejidos Urinarios‐La vejiga Los urólogos siempre han tenido que hacer frente al problema de la sustitución vesical. Tradicionalmente, esto ha sido llevado a cabo mediante la construcción de neovejiga con segmentos de intestino. Sin embargo, esto implica la complicada resección intestinal y las posibles complicaciones, tales como adherencias, la secreción de moco, alteraciones metabólicas e incluso transformación maligna. Por lo tanto, es necesario encontrar alternativas adecuadas. La regeneración célular de la vejiga hecha mediante bioingeniería se ha reportado en varios modelos animales 89. Atala et al. (2006) informó sobre el primer ensayo clínico de las vejigas de ingeniería que se llevó a cabo en siete pacientes con mielomeningocele que sufrían de alta presión o vejigas con mal funcionamiento. La aplicación clínica de la ingeniería de tejidos ha permitido dar pasos importantes, sin embargo, queda mucho por hacer en el futuro para lograr el objetivo de regenerar y trasplantar un órgano completo en urología. 2.3 LIPOSUCCION El exceso de grasa, antes de que apareciera el concepto de liposucción, se trataba extirpándola junto con la piel, por medio de pequeñas incisiones, dejando en consecuencia muchas cicatrices. En la década de los 70, Schrudde fue el pionero en este tipo de técnica cerrada, llamándola lipoexéresis. Realizaba la extracción de grasa haciendo uso de una legra uterina. Aunque fue utilizada por diversos cirujanos, dejó de emplearse porque producía linforreas e irregularidades cutáneas. Giorgio Fischer fue el primero en crear un instrumento especialmente destinado para la extracción de tejido adiposo, que denominó planótomos y un aspirador de gran potencia para transportar este tejido adiposo hacia el exterior. De esta manera, lograba la exéresis de la grasa a 13 mm por debajo de la piel, mediante un movimiento electromecánico que seccionaba y fragmentaba el tejido adiposo, para poder extraerlo 30 a través de la aspiración. El planótomo consistía en una cánula roma con un orificio cercano a su extremidad. A pesar de ser romo, el orificio presentaba una lámina cortante, que destruía todos los vasos sanguíneos, provocando grandes complicaciones, como hemorragias y linforreas de larga duración. En el año 1977, Illouz empezó a utilizar la técnica de lipolisis con una cánula roma, al igual que Fisher, para ir creando túneles. Infiltraba de manera previa a la cirugía, una solución hipotónica para romper las células y facilitar su aspiración. Esta técnica fue llamada Blunt Disection (disección con cánula roma). Esta técnica fue seguida también por Pierre Fournier, pero a diferencia de Illouz, era un procedimiento seco, llamándola Lipoplastia, ya que realizaba la liposucción de la grasa y un remodelamiento periférico. Illouz presentó su técnica a la Sociedad de Cirujanos Plásticos Franceses en 1979, empezando de esta manera la verdadera difusión de esta nueva técnica para el tratamiento de las lipodistrofias localizadas. A partir de entonces, se han producido modificaciones y adelantos en la técnica. El uso de jeringas, ultrasonido y laser son alguno de ellos. Actualmente la liposucción se ha convertido en uno de los procedimientos más realizados dentro de la especialidad de Cirugía Plástica y en la primera indicación para mejorar el contorno corporal. 31 III. JUSTIFICACIÓN, OBJETIVOS E HIPOTESIS 32 JUSTIFICACION La importancia de este estudio sobre la obtención de células madre mesenquimales procedentes de tejido adiposo, radica precisamente en la técnica utilizada. El poder demostrar la validez de un procedimiento ambulatorio, permitiría una mayor accesibilidad a los médicos que trabajan de forma frecuente con la grasa. Esto contribuiría a seguir abriendo posibilidades y oportunidades para el campo de la investigación científica y facilitaría la utilización de las células madre mesenquimales en medicina regenerativa y otras especialidades como la estética. OBJETIVOS . Demostrar la presencia de células madre mesenquimales viables en el tejido adiposo obtenido de una técnica ambulatoria, tanto antes como después de su procesamiento y crioconservación. . Validar la técnica de obtención ambulatoria de células madre mesenquimales viables a partir del tejido adiposo. HIPOTESIS . En el tejido adiposo obtenido a partir de una técnica ambulatoria se obtiene e identifica un número suficiente y viable de células madre mesenquimales, tanto antes como después de su procesamiento y crioconservación. . La técnica de obtención ambulatoria de células madre mesenquimales a partir del tejido adiposo es un procedimiento válido. 33 IV. MATERIAL Y MÉTODOS 34 El diseño del estudio es de tipo descriptivo, abierto (ya que los investigadores conocen las variables que se estudian), experimental y transversal. La población de estudio fue de 5 pacientes, 3 de sexo femenino y 2 de sexo masculino. La edad estaba comprendida entre los 35 a 63 años. (Tabla 3) La selección fue de tipo no aleatoria, con el siguiente criterio de exclusión, no presentar seropositividad frente al VIH ni al VHB. A todos se les practicó la extracción de 60 gr grasa, a nivel de abdomen (2) y de flanco izquierdo (3). Todas las muestras fueron enviadas a un laboratorio en Bélgica (Niel), conocido como Crio Save, Banco de Células Madre; donde fueron procesadas y crio preservadas a una temperatura promedio de ‐196 ºC. Tabla 3 Paciente Codificación Sexo Edad Zona de extracción 1 L00028 M 63 Abdomen 2 L00029 F 41 Abdomen 3 L00030 M 35 Flanco izquierdo 4 L00031 F 47 Flanco izquierdo 5 L00032 F 35 Flanco izquierdo 4.1 DESCRIPCIÓN DE LA TÉCNICA 4.1.1. INSTRUMENTAL El material que se necesita para la obtención ambulatoria de la grasa es el siguiente (Foto 1): .‐ Jeringuilla de 5 cc (con anticoagulante para la toma de muestra de sangre). .‐ Jeringuilla de 5cc luer lock. .‐ Jeringuilla de 20cc luer lock (para infiltrar la anestesia local) 35 .‐ Jeringuilla VacLock de 50 cc (con seguro para mantener el vacío al tirar del émbolo hacia atrás.) .‐ Aguja de 30 G (para hacer el habón anestésico). .‐ Aguja Spinocan (Yale) de 19 G. (para la infiltración de la anestesia local). .‐ Aguja de 18 G ( para hacer la incisión en la piel por donde va a entrar la cánula LuerLock). .‐ Aguja de 21 G (para toma de muestra de sangre). .‐Solución Salina al 0.9%. .‐ Lidocaína al 2%. .‐ Adrenalina. .‐ Cánula LuerLock (con 4 agujeros, 3 mm x 15 ctm). .‐ Bolsa recolectora para la grasa ( freeze‐Pak 60 ml Bio‐Container). .‐ Bolsa de plástico con cierre hermético (safety bag with hermetic quick lock). .‐ Recipiente para almacenar la solución anestésica. .‐ Tallas estériles (campos). .‐ Clorhexidina acuosa al 2%. .‐ Gasas. .‐ Guantes estériles sin polvo. .‐ Méfix. .‐ 2 Packs de gel. .‐ Caja de polietileno (inner small cardboard box inside a neopor box for transport). .‐ Caja de cartón con código de barras y con el código del paciente (para transportar la grasa). .‐ Etiquetas con código de barras con el número de cada paciente, para poder indentificar las muestras. 36 Foto 1. Parte del material, que incluye agujas (30 G, 18 G, 19 G), cánula LuerLock, jeringuillas de 5 cc, 20 cc, jeringuilla VacLock de 50 cc, bolsa recolectora para la grasa (freeze‐Pak 60 ml Bio‐Container), recipiente para la solución anestésica, gasas. 4.1.2.‐ ELECCIÓN DE LA ZONA DONANTE Las zonas donantes para la extracción ambulatoria de grasa, son las zonas descritas por Mendieta, que pueden ser abdomen, flancos, trocánteres y caras internas de muslos y rodillas 90. Por comodidad para el paciente y para el cirujano y por que es la zona que con más frecuencia hay acumulo de grasa, preferimos la zona del abdomen y de ésta la región infraumbilical, pero esto va a depender de cada paciente. En pacientes con poca grasa, se pueden utilizar varias zonas para poder obtener la cantidad necesaria de tejido adiposo. Se realiza el marcaje del área donante con rotulador no permanente. 4.1.3 DESINFECCIÓN Y ANESTÉSIA. Una vez definida la zona donante (abdomen, flancos, trocánteres, caras internas de muslos y rodillas), se procede a la desinfección del área con clorhexidina acuosa al 2%( para no manchar al paciente con soluciones yodadas). Se pone el campo estéril. En un recipiente preparamos la anestesia que se va a utilizar, la misma que consiste en: Solución Salina al 0.9% 60 cc + lidocaína al 2% 10 cc. 37 Se realiza un habón anestésico (con la jeringuilla 5 cc y con aguja de 30 G más lidocaína al 2%) en el punto por donde va a entrar la aguja Yale y de la cánula. Se procede a infiltrar la solución anestésica con la jeringuilla luer lock de 30 cc con aguja Yale de 19 G. Primero en un plano subcutáneo profundo, de manera muy lenta (para que moleste menos), y luego de manera más superficial. Se espera 10 minutos para que actúe la anestesia. 4.1.4 OBTENCIÓN DE LA GRASA Una vez que ha transcurrido el tiempo de espera para que actúe la anestesia (10 minutos), se procede a obtener la grasa. Se realiza una pequeña incisión con la aguja de 18 G, (en el punto en donde se ha hecho el habón anestésico), se introduce la cánula (LuerLock con 4 agujeros de 3mm x 15 ctm), se conecta a la jeringuilla (VackLock syringe de 50 cc), se desplaza el émbolo hacia atrás para crea el vacío y se gira el mismo para bloquearlo, de ésta manera se mantiene el vacío. Con movimientos hacia delante y hacia atrás se realiza la pequeña liposucción, con la precaución de realizar los movimientos en forma de abanico, para no provocar depresiones en la zona donante, y sin salirnos de la zona de la infiltración anestésica, para no provocar dolor al paciente. Una vez que se a llenado la jeringuilla VackLock, se pasa el tejido adiposo a la bolsa recolectora, para esto se retira la cánula y se enrosca la jeringuilla al seguro de la misma. Se apertura el seguro de la bolsa y se procede a transferir la grasa, lentamente; una vez terminado, se cierra el seguro de la bolsa recolectora y se desenrosca la jeringa, así mantenemos la esterilidad en todo momento del tejido graso. Este proceso se repite hasta alcanzar los 60 cc de grasa. Finalmente, se procede a la extracción de 5 cc de sangre, con la jeringuilla de 5 cc (con anticoagulante) y aguja de 21 G. 38 La bolsa recolectora con la grasa y la jeringa con la muestra de sangre se introducen en la bolsa de plástico con cierre hermético (safety bag with hermetic quick lock) (Foto 2). Foto 2. Se muestra la bolsa recolectora de grasa, la jeringuilla con la muestra de sangre y la bolsa de plástico con cierre hermético Se ponen las etiquetas con el código del paciente en la bolsa recolectora de la grasa, en la jeringa con la muestra de sangre, en la bolsa de plástico con cierre hermético (safety bag with hermetic quick lock), en la caja de polietileno (inner small cardboard box inside a neopor box for transport) y en la caja de cartón. En la caja de polietileno se ponen 2 packs de gel (ambos a temperatura ambiente), uno en el fondo y el otro por encima de la bolsa de plástico con cierre hermético. Se cierra la caja de polietileno y se introduce en la caja de cartón (Foto 3 a y b). Foto 3 (a y b). Almacenaje de las muestras recogidas (grasa y sangre) en la caja de polietileno entre dos pack de gel. 39 4.1.5 TRANSPORTE El transporte se debe realizar en el menor tiempo posible (máximo 48 hrs.). Este debe de ser a temperatura estable, 22 ºC +/‐ 4 ºC (según Estándares Internacionales para el transporte del Cordón umbilical). La experiencia de Crio‐Save, en más de 140 000 muestras en los últimos 10 años, demuestra que el transporte a temperatura ambiente mantiene el tejido adiposo viable, manteniéndose la capacidad de proliferación, capacidad de diferenciación (osteoblastos, adipositos y condroblastos) y capacidad de adherencia al plástico (Foto 4). Dentro de las primeras 48 hrs. luego de la obtención de la muestra, la temperatura no debe exceder los 25 ºC, para evitar la contaminación. Foto 4. Caja de Cartón con el código de barras y el número de referencia de cada paciente. 4.1.6 PROCESAMIENTO Inmediatamente luego de la recolección de la grasa, ésta debe ser sellada y transportada para su procesamiento, dentro de las siguientes 48 hrs como máximo. En caso de que se exceda en el tiempo, las posibilidades de viabilidad de las células madre se reducirían. Una vez llegado al laboratorio, la muestra recolectada es equilibrada durante 30 minutos, hasta formar 3 fases: una capa de aceite, una fracción de tejido adiposo y una fracción de fluido. La fracción de tejido adiposo es extraída; por lo menos 1ml es extraído, pudiendo extraer preferentemente 5 ml, 7.5 ml o 10 ml. Esto dependerá del volumen del lipoaspirado. Se realiza un control de calidad del tejido 40 adiposo, para controlar su esterilidad. Esto se realiza filtrando el tejido adiposo usando un filtro de Milipore (poros de tamaño de 0.45 micrometro) y luego haciendo un cultivo del filtro, durante 2 semanas; si luego de este tiempo no hay contaminación, se considera la muestra estéril. 4.1.7 CRIOCONSERVACIÓN Para esta etapa es necesario de un medio crioprotector, una solución fisiológica conteniendo glycerol, sucrosa y/o albúmina sérica. El glicerol puede estar presente en una concentración entre 15 wt% a 25 wt%, siendo el ideal a 20 wt%; la sucrosa entre 4 wt% a 10 wt%, (lo ideal a 0.2 M); la albúmina sérica 0.1 wt% a 5 wt%, (lo ideal a 2 wt%). Lo ideal es contar con iguales concentraciones de tejido adiposo y medio crioprotector, el volumen ratio aconsejado de tejido adiposo y medio crioprotector va en proporción de 2:1 y 1:2, lo preferible es 1:1. El medio crioprotector es preincubado a 4ºC durante 15 min, siendo el ideal a 60 min, antes de agregar el tejido adiposo. Existen dos métodos de crioconservación, el lento y el rápido. El método lento, se requiere iguales cantidades de tejido adiposo y de medio crioprotector; se recolectan en una bolsa de 100 ml (pudiendo ser también de 50 ml o de 25 ml). La bolsa es llevada a una temperatura de 4 ºC. Antes de sellar la bolsa se retira el aire de la misma. Luego es enfriada gradualmente hasta aproximadamente ‐45 ºC. Se enfría a una velocidad que va de ‐0.1 ºC a ‐5 ºC por minuto (se prefiere entre ‐0.5 ºC y ‐2 ºC). Luego de alcanzar esta temperatura, la bolsa es llevada gradualmente a una temperatura de ‐80 ºC, ‐100 ºC y ‐150 ºC para después hacer uso del nitrógeno líquido y llevarla a ‐196 ºC. El método de crioconservación rápido o vitrificación se realiza en cualquier tipo de contenedor. Se debe de tener presente que el congelamiento debe ser por igual en toda el área del contenedor elegido. En esta fase la bolsa es llevada a una temperatura de ‐80 ºc, ‐100 ºC, ‐150 ºC y a ‐196 ºC con el nitrógeno líquido. La velocidad de enfriamiento va de ‐20 ºC a ‐80 ºC por minuto (lo ideal ‐40 ºC a ‐60 ºC). El tejido adiposo en estado criogénico puede permanecer en esa condición por largos períodos de tiempo (meses o años). 41 Cuando se necesite descongelar, se realiza en baño de María, a máximo 40 ºC (entre 10 y 40 ºC) la velocidad de descongelamiento va entre 10 a 40 ºC por minuto. Luego del descongelado, el tejido adiposo es obtenido removiendo el medio crioprotector a través de varias centrifugaciones y lavados secuenciales. El control de calidad durante este proceso debe de realizarse varias veces; tanto para controlar la esterilidad, caracterización inmuno fenotípica, test de diferenciación y control de la morfología de las células madre. El control de esterilidad se realiza filtrando el cultivo a través de un filtro (poros de 0.22 micrómetros) y posteriormente se cultiva el filtro en placas de petri con medio agar. Si no se observa contaminación luego de 2 semanas, el cultivo se considera estéril. La caracterización inmuno fenotípica de las células madre, se realiza a través de un análisis de citometría de flujo. Durante este análisis los marcadores de superficie específicos de las células madre son detectados y analizados. El test de diferenciación evalúa la capacidad de las células madre de poder diferenciarse en osteoblastos, adipositos y condrocitos, usando un test de cultivo de tejido in Vitro. La morfología de las células madre se realiza por una técnica de inspección visual. El porcentaje de viabilidad de esta técnica para obtener células madre viables luego del descongelado va de mínimo 70% a 100% (50 a 100 millones de células madre) 91. 42 V. RESULTADOS 43 Tabla 4 Visual aspect Total volume Fat volume Fat volume % L00028 bloody 41 12 29% L00029 bloody 24 14 58% L00030 bloody 25 11 44% L00031 bloody 18 10 56% L00032 yellow 45 24 53% mean 31 14 48% SD 12 6 12% min 18 10 29% max 45 24 58% VALIDATION SAMPLES Fat number Para las 5 muestras estudiadas: Aspecto visual de la grasa fresca que llega al banco, 4 con color rojizo (debido a la sangre) y 1 con color amarillo (grasa sin sangre). Volumen total de grasa fresca nativa de cada muestra que llega al banco y el volumen promedio, la desviación estándar, el valor mínimo y máximo. Fat volume o volumen de grasa procesada (útil) o PLA obtenido a partir de la grasa nativa que llega al banco y el volumen promedio, la desviación estándar, el valor mínimo y máximo. Porcentaje de volumen de la grasa nativa que se convierte en PLA y porcentajes promedio, desviación estándar, valor mínimo y máximo. Grafico 1 Para las 5 muestras estudiadas: comparación entre el número de células madre mesenquimales (MSC) por gramo de tejido contabilizadas a P0; tanto antes (grasa fresca), como después de congelar las muestras (grasa descongelada). P0 es el momento en que tras ser cultivadas aproximadamente de 7 a 11 días, las MSC ocupan el 70% de la placa dónde son cultivadas y se procede a su contaje. 44 Tabla 5 MSCs in P0 (1g) Fresh Thawed cell number # culture days CD73+ CD105+ CD45/34- vitality (7AAD) cell number # culture days CD73+ CD105+ CD45/34- vitality (7AAD) L00028 563000 9 99 100 99 99 19097 7 - - - - L00029 638000 9 98 98 99 97 648000 7 99 100 99 98 L00030 808600 9 99 100 99 99 733000 7 100 100 99 98 L00031 852000 9 99 99 94 98 884000 7 99 100 96 98 L00032 536000 11 98 98 97 97 941000 7 97 98 98 98 mean 679520 9 99 99 98 98 645019 7 99 100 98 98 SD 143448 1 1 1 2 1 368865 0 1 1 1 0 min 536000 9 98 98 94 97 19097 7 97 98 96 98 max 852000 11 99 100 99 99 941000 7 100 100 99 98 VALIDATION SAMPLES Fat number Para cada una de las 5 muestras estudiadas, tanto frescas (6 primeras columnas) como descongeladas (6 últimas columnas): • Número de MSC a P0. • Días de cultivo necesarios para alcanzar PO y contabilizar. • Porcentaje de las células que reaccionan positivamente ante los marcadores CD73+, CD 105+, CD 45/34‐, la especificidad de dichos marcadores por las MSC, nos permiten afirmar que se trata de MSC. • Vitalidad (7AAD): porcentaje de MSC que están viables (vivas) ya que su membrana ha reaccionado positivamente con la sustancia 7AAD. Cuando la MSC está muerta (no viable), no es capaz de reaccionar con esta sustancia. Para todos se muestran porcentaje promedio, desviación estándar, valor mínimo y máximo. 45 Grafico 2 Para cada una de las 5 muestras estudiadas en estado fresco (antes de ser congeladas): Porcentaje de las células que reaccionan positivamente ante los marcadores CD73+, CD 105+, CD 45/34‐, la especificidad de dichos marcadores por las MSC, nos permiten afirmar que se trata de MSC. Vitalidad (7AAD) porcentaje de MSC que están viables (vivas) ya que su membrana ha reaccionado positivamente con la sustancia 7AAD. Grafico 3 Para cada una de las 5 muestras estudiadas una vez descongeladas: Porcentaje de las células que reaccionan positivamente ante los marcadores CD73+, CD 105+, CD 45/34‐. Vitalidad (7AAD) porcentaje de MSC que están viables (vivas) ya que su membrana ha reaccionado positivamente con la sustancia 7AAD. 46 Se obtuvieron 5 muestras para su validación, todas de aspecto rojizo, sanguinolento, excepto una, de color amarillo; con un volumen total promedio de 31 ml y un volumen promedio de grasa de 48% o volumen de grasa procesada, útil (PLA) (Tabla 4). Para determinar la viabilidad de las células madre obtenidas ambulatoriamente a partir de tejido adiposo se efectuó una comparación de los diversos parámetros del SVF (Stromal Vascular Fraction) de las 5 muestras antes y después de su criopreservación. Es decir se compararon diversos parámetros de las muestras frescas con las muestras descongeladas para comprobar si, tras la criopreservación de las células medre, los valores son comparables a los previamente existentes en las muestras frescas (Tabla 5). Los parámetros que se determinaron fueron: • • Número de MSC/g (células madre de origen mesenquimal) a p0. • Los marcadores de los antígenos específicos de las células madre: CD 73+ CD 105+ CD 45/34‐ El marcador de vitalidad 7AAD Número de MSC/g (células madre de origen mesenquimal) en p0 (pasaje 0) El número que se considera viable en el contaje de MSC /g a p0 es de 12.500 células, lo que equivaldría a 500 células por cm2 en un cultivo efectuado sobre una base de 25 cm2. Por debajo de esa cantidad se considera que no tienen capacidad para seguir proliferando hacia el siguiente pasaje, probablemente porque el número de contactos intercelulares que se establecerían no serían suficientes. Todas las muestras descongeladas presentaron un número de MSC superiores a los 12500/g y en algunos casos incluso superiores al número contabilizado en la muestra fresca. (Gráfico 1) De las 5 muestras, 4 mostraron números dentro del intervalo esperado. 47 La muestra descongelada L00028 presentó un número inferior al esperado, si bien superior al mínimo. Por carecer de muestra sobrante no se pudo repetir el cultivo para descartar un artefacto de laboratorio. Ratio de viabilidad celular Expresado en función del valor de los marcadores de antígenos específicos localizados en la membrana de las células madre: CD 73+ CD 105+ CD 45/34‐ Dichos marcadores establecen los criterios mínimos para definir la presencia de MSC multipotenciales. Tanto en las muestras frescas como en las descongeladas la presencia de dichos marcadores fue superior al 94% y se situó muy cerca del 100% en 4 de las 5 muestras en ambos casos, lo que indica que la población celular estudiada pertenece específicamente a la estirpe de MSC (Gráfico 2 y 3). Las determinaciones se obtuvieron utilizando la citometría de flujo mediante FACSCAN (BD Biosciences) El marcador de vitalidad 7AAD Expresado como [número de células madre vivas/ número total de células madre] * 100. De nuevo los resultados entre las muestras respecto a la vitalidad antes y después de la criopreservación fueron completamente comparables, siendo el valor para las muestras frescas de 97‐99%; y para las muestras tras su descongelación de 98% (Gráfico 2 y 3). 48 VI. 49 CONCLUSIONES • Las células madre mesenquimales se encuentran de forma viable en el tejido adiposo obtenido de manera ambulatoria, tanto antes como después de su procesamiento y crioconservación. • La técnica de obtención ambulatoria de tejido graso, es una técnica válida, ya que se obtienen células madre mesenquimales viables antes y después de su crioconservación. • Al ser una técnica ambulatoria, resulta más accesible para los profesionales que trabajan con frecuencia con el tejido adiposo. • Con un único procedimiento de obtención ambulatoria de tejido adiposo, se puede guardar/crioconservar el mismo para futuras aplicaciones tanto de células madre y/o tejido adiposo. • Este trabajo constituye un primer paso para futuros estudios relacionados con la aplicación de células madre mesenquimales en el campo de la medicina regenerativa y en la cirugía y medicina estética. 50 VII. BIBLIOGRAFIA 51 1. Becker AJ, McCulloch EA, Till JE. 1963; Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells. Nature 197: 452‐454. 2. Neuber F. Fettransplantation. Bericht uber die Verhandlun gen der Deutschen Gesellschaft fur Chirurgie. Zbl Chir, 1893; 22:66. 3. Niechajev I, Sevcuk O. Long‐term results of fat transplantation: clinical and histologic studies. Plast Reconstr Surg. 1994 Sep; 94(3):496‐506. 4. Illouz YG. The fat cell graft. New thechnique to fill depresión. Plast Reconstr Surg. 1986; 78:122‐3. 5. Vila‐Rovira R., Serra‐Renom J.M. Liposucción en Cirugía Plástica y Estética. Edición 1987 Salvat. España. 6. Illouz YG. Present Result of Fat Injection. Aesth Plast Surg. 1988; 12:175. 7. Carpaneda CA., Ribiero MT. Study of Histologic Alteration and viability of the adipose graft in humans. Aesth Plast Surg. 1993 Winter; 17 (1):43‐7. 8. Coleman SR. Facial recontouring with lipoestructure. Facial Cosmetic surgery. 1997; 24, 2:347. 9. Carpaneda CA. Percentage of graft viability versus injected volumen in adipose autotransplants. Aesth Plast Surg, 1994; 18:17. 10. Niechajev I., Sevcuk O. Long‐term result of fat transplantation clinical and histologic Studies. Plast Reconstr Surg. 1994 Sep; 94 (3):496‐506. 11. Moreno MJ, Martinez J.A. “Adipose tissue: A storage and secretory organ. ANALES Sis San Navarra 2002; 25 (supl. 1): 29‐39. 12. Cinti S. “Adipose tissue morphology: basic concepts and insights. En: Guy‐Grand B, Allaud G, editors. Progress in Obesity Research 8.London: Jhon Libbey and company Ltda.1999; 3‐12. 13. Ailhaud G, Hauner H. “Developmed of white adipose tissue. En: GA, Bray, Claude Bouchard, W.P.T. James, Handbook of obesity. New York. Marcel Dekker Inc, 1998: 359‐378. 14. Morroni M, Barbatelli G, Zingaretti MC, Cinti S. Inmunohistochimical, ultrastructural and morphometric evidence for brown adiposite tissue recuriment due to cold acclimation in old rats. Int. J Obesity.1995; 19:126‐131. 52 15. Cinti S. “Adipose tissue morphology: basic concepts and insights. En: Guy‐Grand B, Allaud G, editors. Progress in Obesity Research 8.London: Jhon Libbey and company Ltda.1999; 3‐12. 16. Smahel J.” Adipose tissue in plastic surgery”. Ann Plast Surg. 1986 May; 16(5):444‐53. 17. Margareto J, Gomez‐Ambrosi J, Martí A, Martinez JA. “Time‐depended effects of a hight‐energy‐yielding diet on the regulation of specific white adipose tissue genes. Biochem Biophys Res Commun 2001; 283: 6‐11. 18. Ailhaud G, Hauner H. “Developmed of white adipose tissue. En: GA, Bray, Claude Bouchard, W.P.T. James, Handbook of obesity. New York. Marcel Dekker Inc, 1998: 359‐378. 19. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809. 20. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809 21. Ailhaud G, Hauner H. Development of white adipose tissue. En: GA. Bray, Claude Bouchard, W.P.T. James, editores. Handbook of Obesity. New York: Marcel Dekker Inc, 1998: 359‐378. 22. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809. 23. Moreno‐Aliaga MJ, Matsumura F. Endrin inhibits adipocyte differentiation by selectively altering expression pattern of CCAAT/enhancer binding protein‐a in 3T3‐L1 cells. Mol Pharmacol 1999; 56: 91‐101. 24. MacDougald OA, Lane MD. Transcriptional regulation of gene expression during adipocyte differentiation. Annu Rev Biochem 1995; 64: 345‐358. 25. Richon VM, Lyle RE, McGehee RE Regulation and expression of retinoblastoma proteins p107 and p130 during 3T3‐L1 adipocyte differentiation. J Biol Chem 1997; 272: 10117‐10124. 53 26. Richon VM, Lyle RE, McGehee RE Regulation and expression of retinoblastoma proteins p107 and p130 during 3T3‐L1 adipocyte differentiation. J Biol Chem 1997; 272: 10117‐10124. 27. Shao D, Lazar MA. Peroxisome proliferator activated receptor γ CCAAT/enhancer‐binding protein α, and cell cycle status regulate the commitment to adipocyte differentiation. J Biol Chem 1997; 272: 21473‐21478. 28. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809. 29. MacDougald OA, Lane MD. Transcriptional regulation of gene expression during adipocyte differentiation. Annu Rev Biochem 1995; 64: 345‐358. 30. Cao Z, Umek RM, McKnight SL. Regulated expression of three C/EBP isoforms during adipose conversion of 3T3‐L1 cells. Genes Dev 1991; 5: 1538‐1552. 31. Lin FT, Lane MD. CCAAT/enhacer binding protein alpha is sufficient to initiate the 3T3‐L1 adipocyte differentiation program. Proc Natl Acad Sci USA 1994; 91: 8757‐8761. 32. Yeh W‐C, Cao Z, Classon M, McKnight SL. Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper proteins. Genes Dev 1995; 9: 168‐181. 33. Lin FT, Lane MD. CCAAT/enhacer binding protein alpha is sufficient to initiate the 3T3‐L1 adipocyte differentiation program. Proc Natl Acad Sci USA 1994; 91: 8757‐8761. 34. Freytag S O, Paielli DL, Gilbert JD. Ectopic expression of the CCAAT/enhancer‐ binding protein α promotes the adipogenic program in a variety of mouse fibroblastic cells. Genes Dev 1994; 8: 1654‐1663. 35. Lin FT, Lane MD. Antisense CCAAT/enhacer‐binding protein RNA suppresses coordinate gene expression and trigliceride accumulation during differentiation of 3T3‐L1 preadipocytes. Genes Dev 1992; 6: 533‐544. 36. MacDougald OA, Lane MD. Transcriptional regulation of gene expression during adipocyte differentiation. Annu Rev Biochem 1995; 64: 345‐358. 54 37. Yeh W‐C, Cao Z, Classon M, McKnight SL. Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper proteins. Genes Dev 1995; 9: 168‐181. 38. Tontonoz P, Hu E, Spiegelman BM. Regulation of adipocyte gene expression and differentiation by peroxisome proliferator activated receptor γ. Curr Opin Genet Dev 1995; 5: 571‐576. 39. Tontonoz P, Hu E, Spiegelman BM. Stimulation of adipogenesis in fibroblast by PPARγ2, a lipid‐activated transcription factor. Cell 1994; 79: 1147‐1156 40. Tontonoz P, Hu E, Spiegelman BM. Regulation of adipocyte gene expression and differentiation by peroxisome proliferator activated receptor γ. Curr Opin Genet Dev 1995; 5: 571‐576. 41. Wu Z, Bucher NLR, Farmer SR. Conditional ectopic expression of C/EBPβ in NIH‐ 3T3 cells induces PPARγ and stimulates adipogenesis. Genes Dev 1995; 9: 2350‐ 2363. 42. Smas CM, Sul HS. Characterization of pref‐1 and its inhibitory role in adipocyte differentiation. Int J Obesity Related Metab Disorders 1996; 20 (3 Suppl): 65‐72. 43. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809. 44. Gregoire F, Smas C, Sul HS. Understanding adipocyte differentiation. Physiol Rev 1998; 78: 783‐809. 45. Lee EH, Hui JHP. 2006; The potencial of stem cells in orthopaedic surgery. J Bone Jt Surg 88(7): 841‐853. 46. Watt FM, Hogan BL. 2000; Out of Eden: Stem cells and their niches. Sciences 287:1427‐1430. 47. Galli R, Borello U, Gritti A, et al. 2000; Skeletal myogenic potencial of human and mouse neural stem cells. Nat Neurol 3:986‐991. 48. Zhao LR, Duran WM, Reyes M, et al. 2002; Human bone marrow stem cells exhibit neural phenotypes and ameliorate neurological deficits alter grafting into the ischaemic brain of rats. Exp Neurol 174:11‐20. 55 49. Alam T, Sollinger HW. 2002; Glucose‐regulated insuline production in hepatocytes. Transplantation 74 (12):1781‐1787. 50. Wurmser AE, Gage SH. 2002; Stem cells: Cell fusion causes confusion. Nature 416(6880):485‐487. 51. Thompson JA, Itskovitz‐Eldor J, Shapiro SS, et al. 1998; Embryonic stem cell lines derived from human blastocysts. Science 282:1145‐1147. 52. European Commission. 2003; http://ec.europa.eu/reserch/press/2003/pdf/sec2003‐441report_en.pdf (last accessed 2 february 2007). 53. De Coppi P, Bartsch G Jr, Siddiqui MM, et al. 2007; Isolation of amniotic stem cells lines with potential for therapy. Nat Biotechnol 25 (1):100‐106. 54. Tavassoli M, Friedenstein A. 1983; Hemopoietic stromal microenvironment. Am J Hematol 15(2):195‐203. 55. Caplan AI. 2005; Review: mesenchymal stem cells: cell‐based reconstructive therapy in orthopedics. Tissue Eng 11(7–8): 1198–1211. 56. Friedenstein AJ, Piatetzky‐Shapiro II, Petrakova KV. 1966; Osteogenesis in transplants of bone marrow cells. J Embryol Exp Morphol 16(3): 381–390. 57. Friedenstein AJ. 1995; Marrow stromal fibroblasts. Calcif Tissue Int 56(1): S17. 58. Owen M. 1988; Marrow stromal stem cells. J Cell Sci Suppl 10: 63–76. 59. Beresford JN, Graves SE, Smoothy CA. 1993; Formation of mineralized nodules by bone derived cells in vitro: a model of bone formation? Am J Med Genet 45(2): 163–178. 60. Altman GH, Horan RL, Martin I, et al. 2002; Cell differentiation by mechanical stress. FASEB J 16(2): 270–272. 61. Beresford JN, Bennett JH, Devlin C, et al. 1992; Evidence for an inverse relationship between the differentiation of adipocytic and osteogenic cells in rat marrow stromal cell cultures. J Cell Sci 102(2): 341–351. 62. Johnstone B, Hering TM, Caplan AI, et al. 1998; In vitro chondrogenesis of bone marrow‐derived mesenchymal progenitor cells. Exp Cell Res 238(1): 265–272. 56 63. Wakitani S, Saito T, Caplan AI. 1995; Myogenic cells derived from rat bone marrow mesenchymal stem cells exposed to 5‐azacytidine. Muscle Nerve 18(12): 1417–1426. 64. Dragoo JL, Samimi B, Zhu M, et al. 2003; Tissue‐engineered cartilage and bone using stem cells from human infrapatellar fat pads. J Bone Joint Surg Br 85(5): 740–747. 65. Zuk PA, Zhu M, Mizuno H, et al. 2001; Multilineage cells from human adipose tissue: implications for cell‐based therapies. Tissue Eng 7: 211–228. 66. Zuk PA, Zhu M, Ashjian P, et al. 2002; Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 13(12): 4279–4295. 67. Halvorsen YD, Franklin D, Bond AL, et al. 2001; Extracellular matrix mineralization and osteoblast gene expression by human adipose tissue‐ derived stromal cells. Tissue Eng 7(6): 729–741. 68. Erickson GR, Gimble JM, Franklin DM, et al. 2002; Chondrogenic potential of adipose tissue‐derived stromal cells in vitro and in vivo. Biochem Biophys Res Commun 290(2): 763–769. 69. Seo MJ, Suh SY, Bae YC, et al. 2005; Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo. Biochem Biophys Res Commun 328(1): 258–264. 70. Safford KM, Hicok KC, Safford SD, et al. 2002; Neurogenic differentiation of murine and human adipose‐derived stromal cells. Biochem Biophys Res Commun 294(2): 371–379. 71. Mizuno H, Zuk PA, Zhu M, et al. 2002; Myogenic differentiation by human processed lipoaspirate cells. Plast Reconstr Surg 109(1):199–209. 72. Afizah H, Yang Z, Hui JH, et al. 2007; A comparison between the chondrogenic potential of human bone marrow stem cells (BMSCs) and adipose‐derived stem cells (ADSCs) taken from the same donors. Tissue Eng 13(4): 659–666. 73. Lendeckel S, Jodicke A, Christophis P, ¨ et al. 2004; Autologous stem cells (adipose) and fibrin glue used to treat widespread traumatic calvarial defects: case report. J Craniomaxillofac Surg 32(6):370–373. 74. Strem BM, Hicok KC, Zhu M, et al. 2005; Multipotential differentiation of adipose tissue‐derived stem cells. Keio J Med 54(3): 132–141. 57 75. Toma JG, Akhavan M, Fernandes KJ, et al. 2001; Isolation of multipotent adult stem cells from the dermis of mammalian skin. Nat Cell Biol 3(9): 778–784. 76. Fernandes KJ, McKenzie IA, Mill P, et al. 2004; A dermal niche for multipotent adult skin‐derived precursor cells. Nat Cell Biol 6(11):1082–1093. 77. Toma JG, McKenzie IA, Bagli D, et al. 2005; Isolation and characterization of multipotent skin‐derived precursors from human skin. Stem Cells 23(6): 727– 737. 78. De Coppi P, Bartsch G Jr, Siddiqui MM, et al. 2007; Isolation of amniotic stem cell lines with potential for therapy. Nat Biotechnol 25(1): 100–106. 79. Kogler G, Sensken S, Airey JA, et al. 2004; A new human somatic stem cell from placental cord blood with intrinsic pluripotent differentiation potential. J Exp Med 200(2): 123–135. 80. Geesink RG, Hoefnagels NH, Bulstra SK. 1999; Osteogenic activity of OP‐1 bone morphogenetic protein (BMP‐7) in a human fibular defect. J Bone Joint Surg Br 81(4): 710–718. 81. Bruder SP, Kraus KH, Goldberg VM, et al. 1998; The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects. J Bone Joint Surg Am 80(7): 985–996. 82. Wakitani S, Mitsuoka T, Nakamura N, et al. 2004; Autologous bone marrow stromal cell transplantation for repair of full‐thickness articular cartilage defects in human patellae: two case reports.Cell Transpl 13: 595–600. 83. Young RG, Butler DL, Weber W, et al. 1998; Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair. J Orthop Res 16: 406–413. 84. Lim JK, Hui J, Li L, et al. 2004; Enhancement of tendon graft osteointegration using mesenchymal stem cells in a rabbit model of anterior cruciate ligament reconstruction. Arthroscopy 20(9):899–910. 85. Sanchez‐Ramos J, Song S, Cardozo‐Pelaez F, et al. 2000; Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp Neurol 164(2): 247–256. 86. Muller P, Pfeiffer P, Koglin J, et al. 2002; Caridiomyocytes of noncardiac origin in myocardial biopsies of human transplanted hearts. Circulation 106: 31–35. 87. Messina E, De Angelis L, Frati G, et al. 2004; Isolation and expansion of adult cardiac stem cells from human and murine heart. Circ Res 95(9): 911–921. 58 88. Boyle AJ, Schulman SP, Hare JM, et al. 2006; Is stem cell therapy ready for patients? Stem cell therapy for cardiac repair. Ready for the next step. Circulation 114(4): 339–352. 89. Nuininga JE, van Moerkerk H, Hanssen A, et al. 2004; A rabbit model to tissue engineer the bladder. Biomaterials 25(9): 1657–1661. 90. Medienta CG. Intramuscular gluteal augmentation technique. Clin Plast Surg. 2006; 33; 423‐434. 91. Improved Cryopreservation of adipose tissue for the isolation of mesenquymal stem cells. WIPO Patent Application WO/2009/115581. Abstract. Public Patent file. 59