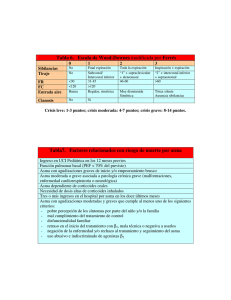
II Curso Nacional de Actualización en Neumología Pediátrica
Anuncio

Libro II curso 31/1/05 17:26 P gina 01 I I Curso Nacional de Actualización en Neumología Pediátrica ERRNVPHGLFRVRUJ Libro II curso 31/1/05 17:26 P gina 02 Reservados todos los derechos. Ni la totalidad ni parte de este libro pueden reproducirse o transmitirse por ningún procedimiento electrónico o mecánico, incluyendo fotocopias, grabación magnética o cualquier almacenamiento de información y sistema de recuperación, sin el previo permiso escrito del editor. © 2005 Ergon C/ Arboleda, 1. 28220 Majadahonda (Madrid) ISBN: 84-8473Depósito Legal: M- -2005 Libro II curso 31/1/05 17:26 P gina 03 Autores Cobos Barroso, Nicolás Unidad de Neumología Pediátrica y Fibrosis Quística. Hospital Universitario Vall d’Hebron. Barcelona Escribano Montaner, Amparo Unidad de Neumología Infantil Hospital Clínico Universitario de Valencia. Valencia García Hernández, Gloria Sección de Neumología y Alergia Pediátricas. Hospital Universitario Doce de Octubre. Madrid González Pérez-Yarza, Eduardo Unidad de Neumología Infantil. Servicio de Pediatría Hospital Donostia. San Sebastián Liñán Cortés, Santos Unidad de Neumología Pediátrica y Fibrosis Quística. Hospital Universitario Materno Infantil.Vall d’Hebron. Barcelona Navarro Merino, Martín Sección de Neumología Infantil. Unidad de Fibrosis Quística. Hospital Universitario Virgen Macarena. Sevilla Oliva Hernández, Concepción Unidad de Neumología Infantil. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife Pérez Frías, Javier Hospital Regional Carlos Haya. Hospital Materno Infantil Cátedra y Departamento de Pediatría. Sección de Neumología Infantil. Málaga Sirvent Gómez, Josep Unidad de Neumología y Alergia Pediátricas. Hospital Materno-Infantil. Conplexo Universitario “Juan Canalejo”. A Coruña Villa Asensi, José Ramón Sección de Neumología. Hospital Infantil Universitario Niño Jesús. Madrid Libro II curso 31/1/05 17:26 P gina 04 Libro II curso 31/1/05 17:26 P gina 05 Índice Neumonía adquirida en la comunidad. Complicaciones y problemas en la práctica diaria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . J. Pérez Frías, Mª Á. Tejero, A. Madrid, Mª M. Serrano 1 Neumonías recurrentes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . G. García Hernández, A. Martínez Gimeno 15 Novedades en tuberculosis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . C. Oliva Hernández, A. Callejón Callejón, C. L. Marrero Pérez 23 Infección viral y sibilancias recurrentes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . M. Navarro Merino, M. Haro Gómez, G. Pérez Pérez, M. Romero Pérez 45 Cómo se diagnostica el asma . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . J. R. Villa Asensi, M. I. González Álvarez 67 Tratamiento del asma . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . S. Liñán Cortés, A. Moreno Galdó, S. Gartner 83 Control del asma . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 101 N. Cobos Barroso, A. Moreno Galdó, S. Gartner Perspectivas futuras en el tratamiento del asma . . . . . . . . . . . . . . . . . . . . . . . 111 E. G. Pérez-Yarza, A. Bordoy, U. Astigarraga, N. Crespo Malformaciones broncopulmonares congénitas . . . . . . . . . . . . . . . . . . . . . . . 141 S. Liñán, A. Moreno, G.Vizmanos Displasia broncopulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 159 G.García Hernández, C. Luna Paredes Libro II curso 31/1/05 17:26 P gina 06 Trastornos respiratorios relacionados con el sueño en el lactante . . . . . . . . . 169 E. G. Pérez-Yarza, O. Sardón, I. Olaciregui, M. Estévez Hipertensión Pulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 193 J. Sirvent Gómez Fibrobroncoscopia en pediatría . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 211 A. Escribano Montaner Fibrosis Quística . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 223 N. Cobos Barroso, S. Gartner, A. Moreno Galdó Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 239 J. Pérez-Frías Libro II curso 31/1/05 17:26 P gina 1 Neumonía adquirida en la comunidad. Complicaciones y problemas en la práctica diaria J. Pérez Frías, Mª A. Tejero, A. Madrid, Mª M. Serrano Hospital Regional Carlos Haya. Hospital Materno Infantil. Cátedra y Departamento de Pediatría. Sección de Neumología Infantil, Málaga. RESUMEN La neumonía adquirida en la comunidad (NAC) es una infección común y potencialmente grave que afecta a los pacientes infantiles de todo el globo; sus aspectos clínicos y sus repercusiones son totalmente diferentes a los del adulto. La incidencia anual para menores de 5 años es de 34 a 40 casos por 1.000 en Europa y Estados Unidos más alta que en cualquier otra etapa de la vida y sigue aumentando. Si se consideran países en vías de desarrollo, este proceso no sólo es más frecuente y más grave, sino el proceso tradicionalmente responsable de la mayoría de muertes en la infancia. A efectos didácticos definiremos neumonía como aquel episodio caracterizado por fiebre, síntomas respiratorios agudos o ambos, más la evidencia de infiltrados parenquimatosos en la radiografía de tórax. Numerosos microorganismos son capaces de causar neumonía en niños y hacen difícil su diagnóstico etiológico. A pesar de definirse el proceso por parámetros clínicos, está aceptada la conveniencia y utilidad de la confirmación radiológica. Se revisan en este trabajo distintos protocolos y guías sobre el proceso neumónico en la infancia y valorando que el manejo correcto de la NAC en la edad pediátrica requiere el análisis de varios puntos que se discuten en nuestro trabajo: a) cuándo tratar con antibióticos, con cuál y por qué vía; b) duración del tratamiento; c) qué hacer ante los fallos terapéuticos; y d) criterios de ingreso hospitalario y en UCIP. Libro II curso 31/1/05 17:26 P gina 2 2 INTRODUCCIÓN La neumonía adquirida en la comunidad (NAC) es una infección común y potencialmente grave que afecta a los pacientes infantiles de todo el globo; sus aspectos clínicos y sus repercusiones son totalmente diferentes con respecto al adulto, y esto tiene que comprenderse bien por parte del médico a cargo de su diagnostico y tratamiento(1). La incidencia anual para menores de 5 años es de 34 a 40 casos por 1.000 en Europa y Estados Unidos más alta que en cualquier otra etapa de la vida, excepto en mayores de 75 u 80 años(2). Y sigue aumentando, incluso en países desarrollados, como Suecia según atestiguan estudios retrospectivos con estadísticas fiables, especialmente en niños menores de un año(3). Si se consideran países en vías de desarrollo este proceso no sólo es más frecuente y más grave, sino el proceso tradicionalmente responsable de la mayoría de muertes en la infancia. El concepto de neumonía es variable; para algunos autores se requiere únicamente la presencia de infiltrados radiológicos demostrables en la radiografía torácica, mientras que para otros basta con la presencia de ciertos síntomas o signos respiratorios. La Organización Mundial de la Salud (OMS) definió, hace veinticinco años(4), el concepto de neumonía basándose únicamente en signos clínicos obtenidos por inspección visual más la frecuencia respiratoria. Este tipo de definición supone un problema, especialmente en el caso de lactantes, debido a que la bronquiolitis y la neumonía son comunes en J. Pérez Frías, et al. este grupo de edad y las características de ambas enfermedades se superponen con frecuencia. Muchos de los estudios, especialmente aquellos llevados a cabo en países en vías de desarrollo, aplican el término infección aguda de vías respiratorias inferiores sin poder hacer ninguna diferenciación entre neumonía o bronquiolitis. En nuestro caso nos parece más adecuado definir neumonía como aquel episodio caracterizado por fiebre, síntomas respiratorios agudos o ambos, más la evidencia de infiltrados parenquimatosos en la radiografía de tórax. Incluso aplicando estos criterios, es probable el sobrediagnóstico de neumonía en los niños, especialmente en los menores, como lo demuestran estudios en países de nuestro entorno(5). CAUSAS Un numeroso grupo de microorganismos son capaces de causar neumonía en niños según recogemos en las tablas I y II y hacen difícil su diagnóstico etiológico. Rara vez acudimos a la muestra directa del tejido pulmonar, y la obtención de muestras de esputo que represente las secreciones de la vía aérea inferior es difícil de obtener en niños. Además, al igual que en los adultos, el cultivo de secreciones de la vía aérea superior no es útil dado que la flora normal en esta zona incluye las bacterias comúnmente responsables del proceso neumónico. Numerosas publicaciones durante las décadas de los 60 y 70 en Estados Unidos y Europa enfatizan la importancia de los Libro II curso 31/1/05 17:26 P gina 3 3 Neumonía adquirida en la comunidad TABLA 1. Etiología de NAC en edad pediátrica; estudio de Juvén et al(15) (año 2000). Edad < 2 años 2-5 años > 5 años Total 108% 84% 62% 254% Virales 80% 58% 37% 62% Bacterianas 47% 56% 58% 53% Mixtas 34% 33% 19% 30% TABLA 2. Etiología de la NAC en edad pediátrica según edad y gérmenes más frecuentes; trabajos de Heiskanen-Kosma et al(39) (Helsinki) y Wubbel et al(40) (Dallas). Helsinki Dallas Edad 0-4 años 0-4 años Streptoc Pneumoniae 24% 33% Mycoplasma Pneumoniae 4% 6% Chlamidia. Pneumoniae 1% 3% Viral 37% 28% Helsinki Dallas 5-9 años 5-9 años 36% 14% 30% 7% 13% 9% 21% 10% Helsinki Dallas 10-16 años 10-16 años 31% 29% 51% 14% 35% 14% 4% 0% agentes virales como causantes de neumonía en los preescolares, y de Mycoplasma pneumoniae en la edad escolar, así como de Chlamydia trachomatis entre las dos semanas y los cuatro meses de vida. De manera similar, el papel de Cytomegalovirus, Ureaplasma urealyticum, Pneumocystis carinii y, más recientemente, de los rinovirus, en lactantes y niños, permanece controvertido en vista de la falta de confirmación bacteriológica en algunos casos y la alta frecuencia de portadores sintomáticos o asintomáticos. El papel de los agentes bacterianos en las neumonías graves y especialmente en las asociadas a derrame pleural, ha estado mejor documentado por métodos de búsqueda bacteriológica directa - punción pulmonar - y se ha confirmado la importancia de Streptococcus pneumoniae, Staphylo- coccus aureus y - antes de la vacunación Haemophilus influenzae como los principales agentes causales, apareciendo también con frecuencia S. pyogenes y gramnegativos. El papel de las bacterias en neumonías menos graves es más controvertido, ya que no existen estudios de confirmación bacteriológica directos y se recurre a estudios antigénicos, PCR (polymerase chain reaction, reacción en cadena de la polimerasa), anticuerpos o antigenuria siendo cuestionado el rendimiento de todos estos tests aun aceptando que a mayor número de tests mayor rendimiento diagnóstico. DIAGNÓSTICO En 1994 se publicó la primera guía de NAC validada en niños, propuesta por la Libro II curso 31/1/05 17:26 P gina 4 4 OMS, la cual basó su diagnóstico en cinco parámetros clínicos: frecuencia respiratoria (más de 50 respiraciones por minuto en niños menores un año de edad y más de 40 en niños mayores), retracción del tórax, cianosis, dificultad para alimentarse y ausencia de sibilancias, destinada a países con alta tasa de mortalidad por neumonía especialmente de etiología bacteriana, nivel socioeconómico bajo, difícil acceso a centros hospitalarios y a medicamentos. No obstante, en los países desarrollados está aceptada la conveniencia y utilidad de la confirmación diagnóstica radiológica, con la cual se estimará su extensión, se describirá su patrón radiológico (alveolar o intersticial) y podrán detectarse posibles complicaciones. Además, el estudio radiográfico se recomienda por la mayoría de las guías(6) como importante ayuda a la hora de planificar o no un tratamiento antibiótico empírico. También el estudio radiológico es importante a la hora de excluir o sospechar procesos con características bien definidas desde ese punto de vista, como son la tuberculosis y la infección por Pneumocystis carinii(7). La aproximación diagnóstica al proceso neumónico(8) consta de dos fases, una primera de evaluación clínica, radiológica y analítica para establecer el diagnóstico de enfermedad y una segunda de evaluación microbiológica para determinar el diagnóstico etiológico. Clásicamente se han descrito dos formas clínicas de neumonía: la típica (fiebre, escalofríos, dolor costal y tos productiva) referida principalmente a la etiología neumocócica y la atípica (comienzo gra- J. Pérez Frías, et al. dual, tos no productiva, cefalea, malestar general, etc.) causada preferentemente por virus o agentes intracelulares. Esta distinción es aplicable a niños mayores y adolescentes, pero en neonatos y lactantes se hace más difícil la diferenciación, y en la práctica estos patrones pueden ser originados por distintos microorganismos. Las neumonías bacterianas típicas suelen presentar leucocitosis con desviación izquierda y proteína C reactiva superior a 50 mg/L. Las neumonías atípicas suelen cursar con linfocitosis y con menor elevación de proteína C reactiva. La presencia de anemia hemolítica puede ser sugestiva de infección por Mycoplasma pneumoniae, y el hallazgo de alteraciones bioquímicas es también más frecuente en las neumonías atípicas. El patrón radiológico alveolar, atribuible generalmente a neumonía bacteriana, se caracteriza por consolidación lobar, broncograma aéreo y, a veces, efusión pleural. El patrón viral presenta hiperinsuflación, infiltrados peribronquiales, atelectasias y adenopatías hiliares. Diversos estudios(9) han intentado correlacionar estos patrones radiológicos y otros exámenes de laboratorios complementarios, como la VSG, PCR y el recuento de leucocitos, con etiologías determinadas, concluyendo que la etiología bacteriana es más frecuente en pacientes con infiltrados alveolares específicamente lobares en la radiografía de tórax, que los infiltrados intersticiales se ven en neumonías virales y bacterianas y que los exámenes complementarios no aportan mucho al diagnóstico etiológico, a excepción de la PCR(10). Libro II curso 31/1/05 17:26 P gina 5 5 Neumonía adquirida en la comunidad La detección de un agente etiológico causal de la infección, de modo que nos permita un tratamiento específico, es el objetivo del laboratorio microbiológico. El diagnóstico etiológico de seguridad sólo se puede establecer mediante el aislamiento de un microorganismo patógeno en un líquido estéril (sangre y líquido pleural). Desgraciadamente el test ideal para la mayoría de los patógenos no existe todavía. Las actuales investigaciones que incluyen tinción de Gram y cultivos en esputo, sangre y líquido pleural, serología, detección antigénica y métodos de amplificación del ADN, sólo permiten obtener un diagnóstico etiológico de probabilidad. Tinciones y cultivos de muestras biológicas Con un apropiado manejo y cuidadosa obtención de la muestra, el aislamiento, cuando se da, de un germen predominante en esputo sigue teniendo valor como guía de un tratamiento antibiótico, y nos permite en muchos casos pasar a monoterapia orientada tras cualquiera que sea el tratamiento empírico inicial(11). El hemocultivo, si bien es raramente positivo (5-16%)(12), se considera obligatorio en pacientes hospitalizados antes de establecer una terapia antibiótica, ya que su positividad se considera clásicamente el patrón de oro para establecer un definitivo diagnóstico bacteriológico y de gran ayuda como factor pronóstico(13). Antígeno urinario Especialmente críticos se muestran los estudios recientes sobre la utilidad de la detección del antígeno neumocócico en orina, al cual no se le da ya casi ningún valor, máxime si el niño es pequeño, ya que el antígeno urinario también se detecta en portadores; si bien su sensibilidad se acerca al 100% -orina concentrada - su especificidad no supera el 12%, lo cual hace el test inaceptable para el diagnóstico de la neumonía neumocócica en niños(14). TRATAMIENTO Debido a la dificultad para diferenciar la etiología de las neumonías, muchas guías recomiendan el uso empírico de antimicrobianos en aquellos pacientes que no es posible vigilar cercanamente, siendo la excepción la neumonía del lactante ingresado con un cuadro clínico claramente vírico. Se recomienda que la decisión del tratamiento se base en algoritmos que comienzan con la edad del niño, la clínica, factores epidemiológicos y finalmente la imagen radiológica. Teniendo presente que el agente etiológico bacteriano más frecuente desde los tres meses de edad es S. pneumoniae, y que su resistencia a la penicilina así como también a macrólidos en el concierto mundial y específicamente en nuestro país es alto, el tratamiento empírico debe tener en cuenta esta consideración. La cuestión práctica a la que habitualmente nos enfrentamos es la de diferenciar la etiología vírica o bacteriana de la NAC. La edad, las vacunas recibidas (gripe, Hib, neumocócica no conjugada y/o conjugada), las manifestaciones clínicas, Libro II curso 31/1/05 17:26 P gina 6 6 radiológicas y algunos datos de laboratorio, orientan la respuesta a esa cuestión, interesante para iniciar un tratamiento empírico adecuado. El estudio de Juvén et al (año 2000)(15), demostró coexistencia de patógenos en un 40% de casos; en un 30% se trataba de una coinfección vírica y bacteriana (normalmente la primera predispone a la segunda), siendo la combinación S. pneumoniae y VRS la más frecuente. Siguiendo el protocolo elaborado en nuestro centro(16), el manejo terapéutico de la NAC en la edad pediátrica requiere el análisis de varios puntos: a) cuándo tratar con antibióticos, con cuál y por qué vía; b) duración del tratamiento; c) qué hacer ante los fallos terapéuticos; y d) criterios de ingreso hospitalario y en UCIP. ¿Cuándo tratar con antibióticos? En el momento actual continúa siendo difícil diferenciar las neumonías virales de las bacterianas(17). El recuento de leucocitos y la velocidad de sedimentación no las distingue entre sí. El valor de la proteína C reactiva posee una sensibilidad muy baja para tener utilidad clínica. La mayoría de niños con condensación alveolar en la radiografía de tórax presenta una infección bacteriana, pero los infiltrados intersticiales se observan, tanto en las neumonías virales, como en las bacterianas. Ya que es imposible excluir la presencia de infección bacteriana con criterios clínicos, radiológicos y analíticos, algunos expertos opinan que todos los niños diagnosticados de neumonía deben recibir antibióticos, pero no así otros, como la guía de la Sociedad Torácica Británica(18) que indica J. Pérez Frías, et al. que los niños pequeños con síntomas leves de infección del tracto respiratorio inferior no necesitan ser tratados con antibióticos. El tratamiento antimicrobiano suele ser un tratamiento empírico, ya que no es habitual contar, con la antelación suficiente, con un diagnóstico etiológico que nos permita establecer un tratamiento basado en él. Debemos valorar para su instauración la edad del paciente, el entorno epidemiológico, la apariencia radiográfica, las vacunas recibidas, ya que la vacunación frente a Haemophilus influenzae elimina virtualmente esta posibilidad causal, y la gravedad del paciente(19). La situación de la sensibilidad de los patógenos respiratorios en España se conoce gracias a los estudios SAUCE (Sensibilidad de los Antimicrobianos Utilizados en la Comunidad en España) realizados en dos períodos: SAUCE I (1996-1997, en 14 áreas geográficas) y SAUCE II (1998-1999, en 17 áreas geográficas)(20,21), y en él nos basamos para hacer las siguientes propuestas. La amoxicilina oral a dosis de 80-100 mg/kg/día es la opción preferida actualmente para el tratamiento ambulatorio de la NAC típica en cualquier edad con efectividad igual a la de la penicilina parenteral, incluso en niños pequeños por encima del tercer mes de vida(22). La administración en dos o tres dosis fractas parece tener la misma efectividad, por lo que quizá es hora de modificar nuestras ideas al respecto(23). Aquellos niños con neumonía neumocócica sospechada o confirmada que Libro II curso 31/1/05 17:26 P gina 7 Neumonía adquirida en la comunidad precisen ingreso hospitalario, serán subsidiarios de antibioterapia parenteral. Siguiendo el mismo razonamiento previo para la elección del antibiótico oral, dado que no está comercializada la amoxicilina para administración por vía parenteral, el antibiótico de primera línea en estas situaciones debería ser la ampicilina por vía intravenosa, a dosis altas (200 mg/kg/día). Otra opción a considerar sería amoxicilina-clavulánico i.v., aunque como hemos dicho las resistencias no son por inhibición de las betalactamasas y, además, tiene un mayor coste. Las cefalosporinas de tercera generación (como cefotaxima y ceftriaxona) se reservarán para los fallos terapéuticos con ampicilina o ante la presencia de neumonías complicadas con derrame(24). En cualquier caso y para simplificar el tema vamos a considerar el tratamiento antibiótico de elección según grupos de edad, excluyendo a neonatos. Pacientes entre 4 semanas y 3 meses de edad Dada su corta edad, debe realizarse ingreso hospitalario en todas las ocasiones. El tratamiento propuesto en nuestro protocolo es ampicilina más cefotaxima i.v. a 150 mg/kg/día para ambas, y en los casos de sospecha de Staphylococcus aureus se utilizará cloxacilina como primera elección o vancomicina. No existen datos contrarios en otras publicaciones consultadas. Los lactantes de uno a 3 meses de edad pueden presentar un cuadro clínico característico con ausencia de fiebre y presencia de tos, taquipnea, dificultad respi- 7 ratoria progresiva e infiltrados pulmonares bilaterales difusos. Este cuadro se ha denominado “síndrome de neumonitis afebril”. Los patógenos más habituales son Chlamydia trachomatis y los virus respiratorios, y debe incluirse en el diagnóstico diferencial también Ureaplasma urealyticum y Bordetella pertussis(25). Por este motivo, en los lactantes afebriles con neumonitis se recomienda la administración de eritromicina o claritromicina. Pacientes entre 3 meses y 4 años de edad Streptococcus pneumoniae es la causa más frecuente de neumonía bacteriana en este grupo de edad. En los pacientes ambulatorios, el tratamiento de elección es amoxicilina oral a dosis elevadas (80-100 mg/kg/día). Las posibles alternativas son amoxicilina-ácido clavulánico o una cefalosporina oral de segunda o tercera generación. Si las características clínicas sugieren una neumonía atípica, a partir de los 3 años de edad cabe utilizar también un macrólido. En niños hospitalizados podemos utilizar los mismos fármacos, pero por vía intravenosa (ampicilina, 200 mg/kg/día; amoxicilina-ácido clavulánico, 100-150 mg/kg/día); o una cefalosporina de tercera generación si existe mala evolución clínica (ceftriaxona 100 mg/kg/día; cefotaxima, 200 mg/kg/día). Se debe asociar eritromicina o claritromicina intravenosa a partir de los 3 años de edad en caso de sospechar neumonía atípica. Existe tambien acuerdo general en este apartado. Libro II curso 31/1/05 17:26 P gina 8 8 Mayores de 4 años de edad La mayoría de las guías que hemos mencionado incluyen como tratamiento de elección, en los niños mayores de 4 años que no precisan hospitalización, los macrólidos (eritromicina, claritromicina y azitromicina), dada la elevada frecuencia de Mycoplasma pneumoniae y Chlamydia pneumoniae en este grupo de edad, y la teórica efectividad de estos antibióticos para el tratamiento del S. pneumoniae. Sin embargo, el aumento de la prevalencia de resistencia a los macrólidos del S. pneumoniae en nuestro país obliga a replantear el papel de este grupo de antimicrobianos en el tratamiento de la infección respiratoria debida a este microorganismo, de forma que, al existir una alta prevalencia de resistencia, los macrólidos no deben utilizarse en el tratamiento empírico de las infecciones respiratorias de supuesta etiología neumocócica en nuestro medio. Así, podríamos establecer la siguiente recomendación en este grupo de edad: - Pacientes con criterios de neumonía típica (fiebre elevada, escalofríos, dolor pleurítico, tos productiva, condensación lobar): amoxicilina oral (80-100 mg/ kg/día, hasta un máximo de 1 g/8 h). Como segunda elección, en lugar de amoxicilina podemos utilizar amoxicilina-ácido clavulánico a las mismas dosis o una cefalosporina de segunda o tercera generación (cefpodoxima a 10 mg/kg/día). - Criterios de neumonía atípica (inicio gradual, síntomas de cefalea y malestar general, tos no productiva, febrícu- J. Pérez Frías, et al. la, ausencia de consolidación lobar, ausencia de leucocitosis y neutrofilia): eritromicina, claritromicina o azitromicina por vía oral. - Neumonía no bien clasificada: en muchas ocasiones en la clínica existe una superposición entre la presentación clínica producida por los diferentes microorganismos y no es posible diferenciar la neumonía producida por M. pneumoniae de la causada por otros microorganismos. En esta situación puede ser adecuada la asociación de amoxicilina y azitromicina o claritromicina por vía oral, como indican algunos autores. Cuando la gravedad indique la necesidad de hospitalización, podemos utilizar betalactámicos o una combinación de un betalactámico y un macrólido por vía i.v.. En pacientes con mala evolución o críticamente enfermos esta combinación es obligatoria, y se emplearán cefotaxima o ceftriaxona asociados a eritromicina o claritromicina intravenosas. En niños hospitalizados y con buena evolución puede ser aceptada la combinación de cefotaxima, ceftriaxona o amoxicilina-clavulánico intravenosas asociadas a azitromicina o claritromicina oral si el paciente presenta una buena tolerancia. Es en este punto donde surgen las mayores discrepancias y donde la asociación de betalactámicos y macrólidos no está recogida por nuestro protocolo como de primera elección en pacientes hospitalizados, como sí lo está en otros. (Moreno A., Liñán S. Neumonías. Orientación terapéutica. An Pediatr Cont 2003). Libro II curso 31/1/05 17:26 P gina 9 Neumonía adquirida en la comunidad ¿Duración? La respuesta suele ser rápida si el agente bacteriano es sensible al antibiótico empleado. Ante una NAC típica suelen ser suficientes 7-10 días de antibiótico oral, mientras que en la NAC por Mycoplasma o Chlamydia prolongaremos el tratamiento hasta los 10-14 días, y 21 días en las infecciones por Staphylococcus aureus. En los niños ingresados se debe mantener el tratamiento intravenoso durante, al menos 24-48 horas después de remitir la fiebre. Después se mantendrá por vía oral hasta completar unos 7-10 días(26). Probablemente la duración del tratamiento antibiótico está sobrevalorada como lo ponen de manifiesto estudios realizados en áreas del tercer mundo y en neumonías no graves, en los que se concluye que, el tratamiento con amoxicilina durante tres días fue tan efectivo como el mantenido durante cinco, con tasas de curación del 89,5% y del 89,9% respectivamente(27). ¿Fallo terapéutico? ¿Complicaciones? En aquellos pacientes en los que se sospeche una neumonía bacteriana y se instaure un tratamiento antibiótico, consideraremos fallo terapéutico, siguiendo a la BTS, la persistencia de fiebre o mal estado general a las 48 horas de iniciado aquél(28). Podemos estar ante una antibioterapia no adecuada (tipo de antibiótico, dosis, patología previa no valorada adecuadamente, etc…), o ante una complicación, como derrame pleural paraneumónico (con características o no de empiema) o, de forma más rara, un absceso pulmonar. Por 9 tanto, ante estos casos estaría justificada la revaluación radiológica y terapéutica. En los casos de sospecha de cuadro aspirativo, puede asociarse clindamicina a la cefalosporina o emplear amoxicilina-ácido clavulánico. Si la imagen radiológica corresponde a un absceso pulmonar, el tratamiento puede limitarse a monoterapia con amoxicilina-ácido clavulánico. En los pacientes con fibrosis quística se deben incluir Staphylococcus aureus y Pseudomonas aeruginosa como causa de la neumonía, y en los pacientes inmunodeprimidos se deben considerar también los microorganismos gramnegativos y los gérmenes oportunistas. Derrame pleural paraneumónico Aproximadamente un 40% de las neumonías en niños presentan derrame pleural. Un 1-2% de ellas se complica con acumulo de material purulento en la cavidad pleural o empiema(29). La presencia de un derrame pleural asociado a la neumonía es siempre una indicación de ingreso hospitalario. Muchos niños tienen derrames paraneumónicos no complicados, y responden bien al tratamiento antibiótico contra los microorganismos más usuales según la edad del paciente, sin requerir drenaje torácico. Si el derrame es pequeño (menos de 10 mm en la radiografía en decúbito lateral), no es necesario realizar una toracocentesis, y observaremos la evolución con el tratamiento antibiótico. Si el derrame es mayor, está indicado realizar una ecografía torácica y una toracocentesis diagnóstica ini- Libro II curso 31/1/05 17:26 P gina 10 10 cial, en cuyos resultados se basará la actitud a seguir. La muestra de líquido pleural se tiene que obtener en condiciones de anaerobiosis y el análisis bioquímico tiene que ser rápido, la medición del pH inmediata y en jeringa heparinizada. En lo relativo a los diferentes parámetros bioquímicos en líquido pleural, la LDH y la glucosa son los parámetros con mayor valor predictivo negativo y el pH es el parámetro con mayor valor predictivo positivo(30). Los criterios para decidir cuando un derrame debe ser drenado por simple toracocentesis y cuando debe hacerse a través de un drenaje pleural, pueden resumirse en lo siguiente: toracocentesis diagnóstica: realizarla siempre que exista derrame suficiente para ello. Toracocentesis evacuadora: como criterio general debe ser evacuado todo exudado con gran cantidad de líquido y que provoque síntomas; la excepción puede ser el empiema TBC en el que es preferible evitar su evacuación, ya que aumenta el riesgo de sobreinfección bacteriana, lo que complica su tratamiento. Así, será necesario colocar un drenaje torácico de forma temprana en las siguientes situaciones indicativas de derrame complicado: - Presencia de pus en el espacio pleural. - Tinción de Gram del líquido pleural positiva. - Glucosa del líquido pleural < 50 mg/dL. - pH del líquido pleural < 7 o < de 7,20 según los autores. - Presencia de bandas o tabiques en el líquido pleural en la ecografía. El drenaje se debe mantener hasta que J. Pérez Frías, et al. el débito de líquido sea menor de 25-50 mL/día o de 1-1,5 mL/kg/día. Para algunos autores (no así en nuestro protocolo), el tratamiento antibiótico empírico inicial de las neumonías con derrame pleural complicado incluye la combinación de cefotaxima (200 mg/kg/día) o ceftriaxona (100 mg/kg/día) con cloxacilina o clindamicina, o como alternativa la utilización de amoxicilina y ácido clavulánico (100 mg/kg/día de amoxicilina)(31). Se aconseja continuar el tratamiento antibiótico por vía intravenosa 7-10 días después de haber cedido la fiebre y el drenaje del líquido, completándolo a continuación con una o dos semanas más por vía oral(32,33). Si en la ecografía se observan tabicaciones múltiples complejas, además del drenaje torácico, es conveniente la instilación de fibrinolíticos. Algunos autores recomiendan, en este caso, realizar de entrada una toracoscopia y el desbridamiento de los tabiques, medida que resultará en una mejoría más rápida y una menor duración del ingreso hospitalario(34), aunque no se han comparado directamente la eficacia de estos 2 tratamientos en los niños. En cualquier caso, se debe valorar la utilidad del drenaje torácico a las 24 h, período en el que debe ocurrir una mejoría radiológica y clínica. Si ésta no se produce en 24-48 h y no existe un problema mecánico de obstrucción del drenaje, se debe considerar el tratamiento quirúrgico temprano Secreción inadecuada de hormona antidiurética Es casi universal la recomendación de aumentar la ingesta de líquidos en el cur- Libro II curso 31/1/05 17:26 P gina 11 Neumonía adquirida en la comunidad so de las infecciones respiratorias, basada en la necesidad de compensar las pérdidas insensibles a causa de la fiebre y la evaporación por el tracto respiratorio, prevenir la deshidratación por la disminución de la ingesta y para reducir la viscosidad de las secreciones. No obstante hay teóricas razones para pensar que el aumento de la ingesta hídrica no está exenta de peligros, ya que es conocida la elevación de la hormona antidiurética en niños y adultos durante el curso de infecciones respiratorias de vías bajas, virales o bacterianas; quizás producida por estímulo pulmonar directo, debido a la hiperinsuflación y/o ocupación alveolar percibida, falsamente como hipovolemia, por los receptores intratorácicos(35); esto explicaría la relación directa entre la extensión de la lesión parenquimatosa pulmonar y la producción de hormona antidiurética, ya conocida desde hace más de veinte años(36). El incremento de fluidos coincidiendo con el de hormona antidiurética puede, al menos en teoría, dar lugar a hiponatremia y sobrecarga hídrica, con la consecuencia de la posible aparición de clínica acompañante de irritabilidad, confusión, letargia, convulsiones o, en última instancia, coma hiponatrémico. Quizás la indicación de restricción hídrica podría ser una forma de prevención más apropiada(37). CRITERIOS DE INGRESO Y UCIP De una forma somera y atendiendo a diversos criterios clínicos, radiograficos u 11 otros, podemos proponer los siguientes criterios de ingreso, siempre teniendo en cuenta las particularidades de cada comunidad y cada centro. De manera general, y atendiendo a la clínica que presentan, podría estar indicado el ingreso en aquellos pacientes con afectación del estado general, sépticos o con otros signos de gravedad evidentes (inestabilidad hemodinámica, hipoxia, convulsiones asociadas…), taquipnea (aprox. > 50 rpm en menores de un año o > 40 rpm en mayores), tiraje y uso de la musculatura accesoria, deshidratación, rechazo del alimento o vómitos frecuentes, riesgo de incumplimiento terapéutico, problemática socioeconómica familiar y/o falta de respuesta al tratamiento oral tras 48-72 h desde su inicio. Desde el punto de vista radiológico se pueden considerar como criterios de ingreso: la afectación multifocal, absceso pulmonar, neumatocele, derrame pleural, patrón intersticial marcado e imágenes compatibles con sospecha de germen no habitual. Otro factor a tener en cuenta será la edad. En pacientes menores de seis o doce meses suele indicarse el ingreso. También en aquéllos que presenten una patología de base, como malnutrición, inmunodeficiencias, cardiopatías, fibrosis quística, etc. que constituyan un mayor riesgo de complicaciones y/o mala evolución. Si se considera la posibilidad de ingreso en UCIP, han de considerarse la presencia de dificultad respiratoria grave o agotamiento a pesar del oxígeno suplementario, hipoxemia (Sat O2 < 90%) a pe- Libro II curso 31/1/05 17:26 P gina 12 12 J. Pérez Frías, et al. sar de oxigenoterapia, afectación radiología rápidamente progresiva, derrame pleural paraneumonico que precise drenaje y provoque distrés, neumotórax, descompensación de enfermedades crónicas (cardiopatías, diabetes, etc.), alteraciones metabólicas acompañantes y/o disminución del nivel de conciencia. Seguimiento En aquellos pacientes que hayan presentado una evolución favorable con el tratamiento recibido (desaparición de la fiebre y los síntomas respiratorios, normalización de los parámetros analíticos previamente alterados, mejoría en el estado general,…) no siempre va a ser necesario repetir la radiografía de tórax. Si no surgen complicaciones no es de utilidad repetirla tras el cuadro y de hacerlo deberá hacerse en un plazo no inferior al mes, ya que controles antes de esta fecha pueden mostrarnos una imagen residual del proceso que podría llevarnos a conclusiones erróneas (disociación clinicorradiológica). Prevención El proceso neumónico continúa siendo una de las principales causas de mortalidad en la infancia, especialmente en países en vías de desarrollo, pero también en los del primer mundo. Es evidente que el progreso en las condiciones de salud y la mejora en el acceso a sus servicios han contribuido, de manera considerable, a disminuir su mortalidad; sin embargo, la aparición de nuevos patógenos o la modificación de la respuesta de los gérmenes a los tratamientos habituales, son escollos que siguen apareciendo periódicamente en la lucha contra esta enfermedad. Entre los progresos que podíamos considerar como probados por los EC aleatorizados destaca la eficacia de la vacunación universal contra el Haemophilus influenzae tipo b (Hib) y las vacunas multivalentes conjugadas antineumocócicas, efectivas contra la neumonía, meningitis y sepsis causadas por estos gérmenes. Los problemas derivados de su costo y la consecución de programas efectivos son tareas todavía no completadas(38). BIBLIOGRAFÍA 1. Kenneth McIntosh, Community-Acquired Pneumonia in Children. N Engl J Med 2002; 346:429-37. missions for lower respiratory illness among Swedish children from 1987 to 2000. BMC Public Health 2003; 3:22. 2. Ostapchuk M, Roberts DM, Haddy R. Community-acquired pneumonia in infants and children. Am Fam Physician 2004; 70:899908. 4. Clinical management of acute respiratory infections in children: a WHO memorandum. Bull World Health Organ 1981; 59: 707-16. 3. Björ O, Bråbäck L. A retrospective population based trend analysis on hospital ad- 5. Clark CE, Coote JM, Silver DA, Halpin DM. Asthma after childhood pneumonia: six year follow up study. BMJ 2000; 320:1514-6. Libro II curso 31/1/05 17:26 P gina 13 Neumonía adquirida en la comunidad 6. Bartlett JG, Dowell SF, Mandell LA, File TM, Musher DM, Fine MJ. Practice guidelines for the management of community-acquired pneumonia in adults. Clin Infect Dis 2000; 31:347-82. 7. Smith PR. What diagnostic tests are needed for community acquired pneumonia? Med Clin N Am 2001; 85:1381-96. 8. Irastorza I, Landa J, González E. Neumonías. Etiología y diagnóstico. An Pediatr Cont 2003; 1:1-8. 9. Virkki R, Juven T, Rikalainen H, Svedstrom E, Mertsola J, Ruuskanen O. Differentiation of bacterial and viral pneumonia in children. Thorax 2002; 57:438-41. 10. Álvarez AM. Neumonía adquirida en la comunidad en niños: Aplicabilidad de las guías clínicas. Rev Chil Infect 2003; 20:S59 - S62. 11. Rozón B, Carratalá J, Verdaguer R, Dorca J, Manresa F, Gudiol F. Prospective study of the usefulness of sputum Gram stain in the initial approach to community-acquired pneumonia requiring hospitalization. Clin Infect Dis 2000; 31:869-74. 12. Skerrett, SJ. Diagnostic testing to establish a microbial cause is helpful in the management of community-acquired pneumonia. Semin Respir Infect 1997; 12:308-21. 13. The ATS Board of Directors. Guidelines for the initial management of adults with community-acquired pneumonia: diagnosis, assessment of severity and initial antimicrobial therapy. Am Rev Respir Dis 1993; 148: 1418-26. 14. Domínguez J, Blanco S, Rodrigo C, Azuara M, Galí N, Mainou A, et al. Usefulness of Urinary Antigen Detection by an Immunochromatographic Test for Diagnosis of Pneumococcal Pneumonia in Children. J Clin Microbiol 2003; 41: 2161-3. 15. Juvén T, Mertsola J, Waris M, Leinonen M, Meurman O, Roivainen M, et al. Etiology of community-acquired pneumonia in 254 hospitalized children. Pediatr Infect Dis J 2000; 19:293-8. 13 16. Moreno Pérez D, García Martín FJ, Camacho Alonso JM, Rodríguez Amuedo F, Pérez Ruiz E, Blasco Alonso J, et al. Neumonía adquirida en la comunidad en edad pediátrica. Guía de actuación hospitalaria. [Enero]. Hospital Materno-Infantil “Carlos Haya”, Málaga. 2003. 17. Moreno A, Liñán S. Neumonías. Orientación terapéutica. An Pediatr Cont 2003; 1:9-15. 18. British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Childhood. Thorax 2002; 57:11-24. 19. Nelson JD. Community-acquired pneumonia in children: guidelines for treatment. Pediatr Infect Dis J 2000; 19:251-3. 20. Baquero F, García-Rodríguez JA, García de Lomas J, Aguilar L. Antimicrobial resistance of 1.113 Streptococcus pneumoniae isolates from patients with respiratory tract infections in Spain: results of a 1-year (19961997) multicenter surveillance study. The Spanish Surveillance Group for Respiratory Pathogens. Antimicrob Agents Chemother 1999; 43:357-9. 21. Pérez Trallero E, Fernández-Mazarrasa C, García-Rey C, Bouza E, Aguilar L, García de Lomas J, et al. Antimicrobial susceptibilities of 1684 Streptococcus pneumoniae and 2039 Streptococcus pyogenes isolates and their ecological relationship: results of a 1 year (1998-1999) multicenter surveillance study in Spain. Antimicrob Agents Chemother 2001; 45:3334-40. 22. Addo-Yobo E, Chisaka N, Hassan M, Hibberd P, Lozano JM, Jeena P, et al. Oral amoxicillin versus injectable penicillin for severe pneumonia in children aged 3 to 59 months: a randomised multicentre equivalency study. Lancet 2004; 364:1141-8. 23. Fonseca W, Hoppu K, Rey LC, Amaral J, Qazi S. Comparing Pharmacokinetics of Amoxicillin Given Twice or Three Times per Day to Children Older than 3 Months with Pneumonia. Antimicrob Agents Chemother 2003; 47:997-1001. Libro II curso 31/1/05 17:26 P gina 14 14 24. Lamb HM, Ormrod D, Scott LJ, Figgitt DP. Ceftriaxone: an update of its use in the management of community-acquired and nosocomial infections. Drugs 2002; 62:1041-89. 25. Davies HD, Matlow A, Petric M, Glazier R, Wang EEL. Prospective comparative study of viral, bacterial, and atypical organisms identified in pneumonia and bronchilitis in hospitalized Canadian infants. Pediatr Infect Dis J 1996; 15:371-5. 26. Jadavji T, Law B, Lebel MH, Kennedy WA, Gold R, Wang EE. A practical guide for the diagnosis and treatment of pediatric pneumonia. CMAJ 1997; 156:S703-11. 27. ISCAP Study Group. Three day versus five day treatment with amoxicillin for non-severe pneumonia in young children: a multicentre randomised controlled trial. BMJ 2004; 328:791. 28. British Thoracic Society Standards of Care Committee. British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Childhood. Thorax 2002; 57:11-24. 29. Hardie W, Bokulic R, García VF, Reising SF, Christie CD. Pneumococcal pleural empyemas in children. Clin Infect Dis 1996; 22:1057-106. 30. Pérez Frías J, Pérez Ruiz E, Valdés P, Martínez T. Aire y líquido en patología pleural. An Esp Pediatr 2001; 54:23-9. 31. Del Castillo F, García Miguel MJ, García S. Manejo racional de la neumonía adquirida en la comunidad. An Esp Pediatr 1999; 51:609-16 32. Asensio de la Cruz O, Blanco González J, Moreno Galdó A, Pérez Frías J, Salcedo Po- J. Pérez Frías, et al. sadas A, Sanz Borrell L. Tratamiento de los derrames pleurales paraneumónicos. An Esp Pediatr 2001; 54:272-82. 33. Efrati O, Barak A. Pleural effusions in the pediatric population. Pediatr Rev 2002; 23: 417-26. 34. Grewal H, Jackson RJ, Wagner CW, Smith SD. Early video-assisted thoracic surgery in the management of empyema. Pediatrics 1999; 103:e63. 35. Gozal D, Colin AA, Jaffe M, Hochberg Z. Water, electrolyte, and endocrine homeostasis in infants with bronchiolitis. Pediatr Res 1990; 27:204-9. 36. Rivers RP, Forsling ML, Olver RP. Inappropriate secretion of antidiuretic hormone in infants with respiratory infections. Arch Dis Child 1981; 56:358-63. 37. Guppy MP, Mickan SM, Del Mar CB. “Drink plenty of fluids”: a systematic review of evidence for this recommendation in acute respiratory infections. BMJ 2004; 328:499-500. 38. Schuchat A, Dowell SF. Pneumonia in children in the developing world: New challenges, new solutions. Semin Pediatr Infect Dis 2004; 15:181-9. 39. Heiskanen-Kosma T, Korppi M, Jokinen C, Kurki S, Heiskanen L, Juvonen H, et al. Etiology of childhood pneumonia: serologic results of a prospective, populationbased study. Pediatr Infect Dis J 1998; 17:986-91. 40. Wubbel L, Muniz L, Ahmed A, Trujillo M, Carubelli C, McCoig C, et al. Etiology and treatment of community-acquired pneumonia in ambulatory children. Pediatr Infect Dis J 1999; 18:98-104. Libro II curso 31/1/05 17:26 P gina 15 Neumonías recurrentes G. García Hernández, A. Martínez Gimeno Sección de Neumología y Alergia Pediátricas. Hospital Universitario Doce de Octubre. Madrid RESUMEN El niño con neumonías de repetición constituye un motivo de consulta no infrecuente para el especialista. Se define como neumonía recurrente la presencia de dos episodios de neumonía en un año o tres en cualquier momento de la vida, habiéndose producido la resolución radiológica en los intervalos; en caso contrario, se habla de neumonía persistente. La historia clínica y radiología previa ayudarán a confirmar estos extremos y orientarán las pruebas complementarias a realizar. El asma y la aspiración recurrente, bien por trastornos de la deglución o por reflujo gastroesofágico, son las causas más frecuentes de estos procesos, pero habrá que descartar otros, como la aspiración de un cuerpo extraño, inmunodeficiencias, fibrosis quística, síndrome del cilio inmóvil, malformaciones del aparato respiratorio, presencia de vasos aberrantes o tumores endobronquiales. Libro II curso 31/1/05 17:26 P gina 16 16 G. García Hernández, A. Martínez Gimeno INTRODUCCIÓN La neumonía es un cuadro frecuente en la infancia. En los países desarrollados su incidencia anual se cifra en 30-45 casos por 1.000 niños menores de 5 años y 16-22 casos en mayores de esa edad(1). Algunos de estos pacientes van a presentar episodios repetidos de neumonía, que precisarán estudios posteriores para determinar su causa. Se define como neumonía recurrente la presencia de dos episodios de neumonía en un año o tres en cualquier momento de la vida, habiéndose objetivado la resolución radiográfica en los intervalos, mientras que se reserva el término de neumonía persistente o no resuelta a aquélla en la que no se normaliza la imagen radiológica en ningún momento(2). En este artículo hablaremos de ambas, pues en bastantes ocasiones se desconoce o se plantean dudas sobre si se produjo o no la resolución del episodio neumónico. Existen pocos trabajos que indiquen la frecuencia real de estos procesos. Además, muchos de ellos están sesgados por referirse a pacientes ingresados(3), con algún tipo de inmunodeficia(4) o pertenecientes a países de ámbito distinto al nuestro(5,6), por lo que es difícil determinar su incidencia real en la población general. En estudios realizados con niños ingresados por neumonía se ha visto que entre el 8 y el 9% de ellos cumplía criterios de neumonía recurrente(3,7). ENFOQUE DIAGNÓSTICO El estudio de un paciente de este tipo se inicia realizando una buena historia clí- nica y verificando que cumple los criterios antes señalados. Además, es muy aconsejable disponer de todas las imágenes radiológicas de los procesos. Con todo ello podremos orientar el caso y determinar que pruebas complementarias vamos ha realizar. Este esquema permite llegar a determinar la causa en el 80-95% de los casos(7,8). En la anamnesis preguntaremos por los síntomas que condujeron a la realización de la radiografía de tórax, tratamientos recibidos y evolución posterior. No es infrecuente que las imágenes radiológicas de un episodio neumónico tarden en normalizarse más de 2 meses(9). Si durante este tiempo el paciente sufre un nuevo episodio febril y se repite la radiografía es posible diagnosticar de nuevo neumonía, cuando en realidad se trata de la primera imagen no resuelta aún. Basados en las radiografías que aporte el paciente y en la historia clínica recogida, podremos hacer una primera aproximación diagnóstica y decidir qué pruebas complementarias se realizarán y en qué orden(10) (Tabla 1). A continuación exponemos alguno de los cuadros que tendremos en cuenta a la hora de hacer el diagnóstico diferencial. ASMA El asma es la enfermedad pulmonar crónica más frecuente en la infancia y la neumonía recurrente puede ser una manifestación más de la misma(11,12). Durante la exacerbación asmática aumenta la producción de moco, que además se es- Libro II curso 31/1/05 17:26 P gina 17 17 Neumonías recurrentes TABLA 1. Sospecha diagnóstica según los hallazgos radiológicos. Afectación de un lóbulo • Obstrucción bronquial intraluminal - Cuerpo extraño - Tapón de moco - Tumores endobronquiales • Compresión bronquial extraluminal - Ganglio linfático - Vaso aberrante - Cicatriz en la pared • Anomalías estructurales - Bronquiectasias - Estenosis bronquial - Secuestro - Síndrome del lóbulo medio pesa y se vuelve más viscoso, formando tapones que pueden obstruir la luz bronquial e incluso ocupar algunos alvéolos. Se calcula que esto puede suceder en alguna ocasión en el 4-20% de los asmáticos, siendo más susceptibles los niños pequeños. Puede haber fiebre como manifestación de sobreinfección del moco o, más habitualmente, de la infección vírica que ocasionó la exacerbación. La presencia de roncus y sibilancias generalizadas durante el episodio agudo y la historia previa de crisis similares, ayudan a orientar el diagnóstico. En la radiografía de tórax se observan infiltrados difusos, que pueden acompañarse de atelectasias subsegmentarias, segmentarias, lobares y más raramente de todo un pulmón. A veces alternan zonas de atrapamiento aéreo con otras de atelectasia. Las imágenes radiológicas suelen evolucionar de forma favorable y rápida en cuanto se instaura un tratamiento adecuado con broncodilatadores, Afectación de varios lóbulos • Síndromes aspirativos - Trastornos de la deglución - Reflujo gastroesofágico - Fístula traqueoesofágica • Asma • Fibrosis quística • Inmunodeficiencias • Síndrome del cilio inmóvil • Cardiopatías congénitas • Otros: - Alveolitis alérgica extrínseca - Hemosiderosis pulmonar corticoides y fisioterapia. En raras ocasiones hay que recurrir al empleo de fluidificantes del moco, como la DNasa(13). Sólo en algunos niños asmáticos persisten las imágenes de atelectasia y precisan otras pruebas diagnósticas y terapéuticas. ASPIRACIÓN RECURRENTE La aspiración de pequeños volúmenes de contenido gástrico puede dar lugar a episodios de estridor, apnea, tos crónica, asma o neumonías recurrentes. Tanto los trastornos de la deglución(14) como el reflujo gastroesofágico(15) favorecen su aparición, y hay que estar especialmente alerta cuando el paciente presente alguna de las patologías que figuran en la tabla 2. Los pacientes con enfermedad neuromuscular están más predispuestos a sufrir neumonías de repetición, tanto por la debilidad de los músculos respiratorios y de Libro II curso 31/1/05 17:26 P gina 18 18 G. García Hernández, A. Martínez Gimeno TABLA 2. Patologías que favorecen la aspiración. Alteraciones anatómicas - Macroglosia (síndrome de BeckwithBiedeman) - Micrognatia (síndromes de PierreRobin, Treacher-Collins, Goldenhar) - Fisura palatina - Hendidura laríngea - Tumores y masas faríngeas - Divertículo faríngeo - Fístula traqueoesofágica - Anillos vasculares Enfermedades neuromusculares - Parálisis cerebral Parálisis del IX par Parálisis de cuerdas vocales Lesión medular cervical o torácica alta Atrofias musculares espinales Distrofias musculares Síndromes miasténicos Miopatías congénitas, mitocondriales, metabólicas la pared abdominal, que hace que la tos sea débil e ineficaz, como por los trastornos de la deglución y el reflujo gastroesofágico que presentan con frecuencia(16). No hay que olvidar que la disminución de su capacidad inspiratoria facilita la aparición de atelectasias, y que la presencia de sondas nasogástricas o cánulas de traqueostomía pueden favorecer la aspiración. Por último, hay que tener en cuenta que aquellos que reciben tratamiento con corticoides o ACTH, por su enfermedad de base, pueden estar predispuestos a sufrir infecciones por gérmenes no habituales, igual que cualquier paciente inmunodeprimido. ASPIRACIÓN DE CUERPO EXTRAÑO No es infrecuente asistir a pacientes con sospecha de aspiración de un cuerpo extraño, especialmente si se trata de menores de 4 años. En algunos casos el episodio agudo no se recoge en la historia clínica, bien por no haber estado presente un adulto en ese momento o por haberlo olvidado a la hora de consultar con el médico(17). Aunque se puede desarrollar una atelectasia, incluso de todo un pulmón, en menos de 1 hora, la reabsorción del aire distal a la obstrucción y el posterior desarrollo de atelectasia suele ser gradual y tardar unas 24 horas. Si la extracción del cuerpo extraño se demora 2-3 días es posible que se produzca infección y el cuadro se manifieste como una neumonía, habitualmente situada en lóbulos inferiores y con cierto componente atelectásico, de resolución tórpida o incompleta pese al tratamiento médico aparentemente correcto(18). En este caso es obligado realizar una broncoscopia, que será a la vez diagnóstica y terapéutica. PACIENTES CON INMUNODEFICIENCIAS Los pacientes con neoplasias, trasplantados o sometidos por alguna otra razón a tratamientos inmunosupresores, tienen mayor riesgo de padecer infecciones pulmonares de repetición. Los antecedentes recogidos en la historia clínica hacen innecesarias ulteriores investigaciones sobre la causa subyacente, debiendo centrarse Libro II curso 31/1/05 17:26 P gina 19 19 Neumonías recurrentes nuestra atención sobre el diagnóstico etiológico de la neumonía que permita un tratamiento más adecuado de la misma. En el caso del paciente con SIDA, tanto la neumonía intersticial linfoide, como la hiperplasia intersticial linfoide constituyen manifestaciones patognomónicas de la enfermedad. Estos pacientes también son propensos a padecer infecciones bacterianas, víricas y por gérmenes oportunistas, como Pneumocystis carinii, Citomegalovirus, hongos o Mycobacterias(19). Las inmunodeficiencias primarias son poco frecuentes, aunque no es raro que debuten con infecciones pulmonares(20). Habrá que descartar su presencia cuando exista una historia familiar de inmunodeficiencia y siempre que un niño presente más de dos neumonías en un año, o un episodio neumónico por un germen no habitual, o haya tenido más de ocho episodios de otitis en el año o dos sinusitis de importancia en el año(21). Así mismo, constituyen signos de alerta los antecedentes de infecciones cutáneas profundas recurrentes o abscesos en órganos, úlceras bucales, candidiasis bucal después del año de año de vida, lesiones en la piel (eccemas importantes, petequias, telangiectasias), ausencia de amígdalas o ganglios linfáticos o retraso del crecimiento. Cuando la patología se inicia antes de los seis meses de edad hay que pensar en trastornos de la inmunidad humoral y celular, mientras que si lo hace después de esa edad se deben descartar, en primer lugar, alteraciones de la inmunidad humoral. Como primer paso se realizará un hemograma completo, así como determinación de inmunoglobuli- nas, incluidas subclases de IgG, recuento de linfocitos y subpoblaciones linfocitarias. Si estas pruebas resultan normales se continúa con el estudio de la hipersensibilidad tardía, respuesta de anticuerpos tras la vacunación frente a Streptococcus pneumoniae y Haemophilus influenzae, estudio de la fagocitosis y del complemento y consulta con el inmunólogo(22). FIBROSIS QUÍSTICA Aunque el inicio de las manifestaciones respiratorias de esta enfermedad es variable, no es raro que esto suceda en los primeros años de vida. Los síntomas más precoces suelen consistir en tos iterativa asociada a infecciones víricas, que evoluciona de forma tórpida con el tratamiento habitual. La auscultación pulmonar no suele ser llamativa, pero no es raro que la radiografía de tórax muestre la presencia de áreas de consolidación o de atelectasia, alternando o no con áreas de hiperinsuflación. En ocasiones debuta como una bronquitis vírica de evolución tórpida pese al tratamiento, siendo rara la presentación inicial en forma de neumonía aguda. En bastantes ocasiones, ya en esta fase inicial, se producen otras manifestaciones de la enfermedad, como la existencia de heces esteatorreicas, escasa ganancia ponderal o episodios de deshidratación con alcalosis hipoclorémica, que orientan el diagnóstico. La presencia de gérmenes no habituales, como Pseudomonas aeruginosa, también obliga a descartar la enfermedad(23). El curso posterior no es Libro II curso 31/1/05 17:26 P gina 20 20 uniforme en todos los pacientes. Durante la infancia, algunos pueden tener reagudizaciones respiratorias, quedando libres de síntomas en los intervalos o manteniendo únicamente tos matutina o con la fisioterapia, aunque con el tiempo, especialmente si no se instaura un tratamiento correcto, la mayoría sufrirá un aumento de los síntomas respiratorios, con tos y expectoración habitual, taquipnea, presencia de acropaquias y auscultación patológica, siendo más raros los episodios aislados de neumonía aguda(24). La radiografía de tórax mostrará imágenes patológicas, como zonas de condensación o atelectasia, áreas de hiperinsuflación, imágenes quísticas y de bronquiectasias. La obtención de un test del sudor patológico nos dará el diagnóstico de la enfermedad, que se completará con el estudio genético, así como del resto de pruebas que nos confirmen el grado de afectación respiratoria, digestiva y nutricional. DISCINESIA CILIAR PRIMARIA Bajo este término se engloban todos aquellos procesos ocasionados por defectos congénitos del cilio, como el síndrome del cilio inmóvil, el síndrome de Kartagener y los defectos primarios de movilidad y orientación del cilio. La mitad de los individuos afectos pueden presentar síntomas en el período neonatal (taquipnea sin causa aparente o neumonía), asociados o no a dextrocardias o rotación de órganos en imagen especular u otras malformaciones (cardiopatía, atresia de esó- G. García Hernández, A. Martínez Gimeno fago, atresia biliar, hidrocefalia). Durante la infancia suele haber otitis media secretora crónica con exacerbaciones recurrentes, sinusitis y afectación de vías bajas en forma de infecciones de repetición con tos crónica, generalmente acompañada de expectoración, y, finalmente, desarrollo de bronquiectasias(25). Para el diagnóstico, y como pruebas de despistaje, se puede valorar el aclaramiento mucociliar (con sacarina o carbón vegetal, albúmina o teflón marcados con Tc99) y constatar la disminución de óxido nítrico exhalado, pero el diagnóstico definitivo se realizará mediante biopsia del epitelio ciliar y estudio de su movilidad y ultraestructura(26). OTRAS CAUSAS Algunas alteraciones anatómicas pueden dar lugar a neumonías de repetición o a imágenes radiológicas que planteen este diagnóstico. Entre ellas hay que señalar a la malformación adenomatoidea quística, los quistes broncogénicos y el secuestro pulmonar(27), siendo más raras la estenosis bronquial congénita, el bronquio traqueal y la presencia de anillos vasculares que compriman algún bronquio(28). Por último, señalar que en ocasiones los tumores endobronquiales, raros en la infancia, pueden debutar con un cuadro de neumonía persistente(29). En resumen, no es infrecuente que un niño sea derivado a la consulta del especialista por el antecedente de neumonías de repetición. El primer paso será comprobar que verdaderamente los cumple cri- Libro II curso 31/1/05 17:26 P gina 21 21 Neumonías recurrentes terios antes señalados para aplicar este diagnóstico. Posteriormente se tratará de averiguar si existe alguna causa subyacente, siendo las historias clínica y radiológica las herramientas principales que orientarán el caso. BIBLIOGRAFÍA 1. Wright AL, Taussing LM, Ray CG, Harrison HR, Holberg CJ. The Tucson Children´s Respirtory Study II: Lower respiratory trac illness in the first year of life. Am J Epidemiol 1989; 129:1232-46. 2. Wald E R. Recurrent and non-resolving pneumonia in children. Semin Respir Infect 1993; 8:46-58. 3. Ciftci E, Gunes M, Koksal Y, Ince E, Dogru U. Underlying causes of recurrent pneumonia in Turkish children in a university hospital. J Trop Pediatr 2003; 49: 212-5. 4. Pérez Ruiz E, Pérez Frías J, García Martín FJ, Vázquez López R, González Martínez B, Martínez Valverde A. Manifestaciones pulmonares de las inmunodeficiencias primarias. An Esp Pediatr 1998; 48:238-44. 5. Rahim KA. Persistent or recurrent penumonia in Saudi children seen at King Khalid University Hospital, Riyadh: clinical profile and some predisposing factors. Ann Trop Paediatr 1991; 11:129-35. 6. Mello MD, David JS, Cunha AJ, March MD, Ferreira S, Sant ante; Anne CC. Recurrent pneumonia in a pediatric pulmonology outpatient with: concept and prevalence. J Pediatric (Rio J) 2000;76:44-8. 7. Owayed AF, Campbell DM, Wang EEL. Underlying causes of recurrent pneumonia in children. Arch Pediatr Adolesc Med 2000; 154:190-4. 8. Lodha R, Puranik M, Natchu UC, Kabra SK. Recurrent pneumonia in children: clinical profile and underlying causes. Acta Paediatr 2002; 91:1170-3. 9. Grossman LK, Wald ER, Nair P, Papiez J. Roentgenographic follow-up of acute pneumonia in children. Pediatrics 1979: 63:30-1. 10. Vaughan D, Katkin JP. Chronic recurrent pneumonias in children. Semin Respir Infect 2002; 17:72-84. 11. Sirvent Gómez J, Pérez-Yarza EG. Fisiopatología, diagnóstico y evaluación del paciente asmático. En: Cobos N, Pérez-Yarza EG (eds.). Tratado de Neumología infantil. Madrid: Ergon, 2003; p. 577-98. 12. Heffelfinger JD, Davis TE, Gebrian B, Bodeau R, Schwartz B, Dowell SF. Evaluation of children with recurrent penumonia diagnosed by World Health Organization criteria. Pediatr Infect Dis J 2002; 21: 108-12. 13. Durward A, Forte V, Shemie SD. Resolution of mucus plugging and atelectasis after intratracheal rhDNase therapy in a mechanically ventilated child with refractory status asthmaticus. Crit Care Med 2000; 28:560-2. 14. Sheikh S, Allen E, Shell R, Hruschak J, Iram D, Castile R, et al. Chronic aspiration without gastroesophageal reflux as a cause of chronic respiratory symptoms in neurologically normal infants. Chest 2001; 120: 1190-5. 15. El-Serag HB, Gilger M, Kuebler M, Rabeneck L. Extraesophageal associations of gastroesophageal reflux disease in children without neurologic defects. Gastroenterology 2001; 121: 1294-9. 16. Morton RE, Wheatley R, Minford J. Respiratory tract infections due to direct and reflux aspirations in children with severe neurodisability. Dev Med Child Neurol 1999; 41: 329-34. Libro II curso 31/1/05 17:26 P gina 22 22 17. Fernández Jiménez I, Gutiérrez Segura C, Álvarez Muñoz V, Peláez Mata D. Broncoaspiración de cuerpos extraños en la infancia: revisión de 210 casos. An Esp Pediatr 2000; 53:335-8. 18. Karakoc F, Karadag B, Akbenlioglu C, Ersu R, Yildizeli B, Yuksel M, et al. Foreign body aspiration: what is the outcome? Pediatr Pulmonol 2002: 34:30-6. 19. Pérez Mato S, Van Syke RB. Pulmonary infections in children with HIV infection. Semin Respir Infect 2002; 17:33-46. 20. Quezada A, Norambuena X, Bravo A, Castro-Rodríguez JA. Recurrent pneumonia as warning manifestation for suspecting primary immunodeficiencies in children. J Investig Allergol Clin Immunol 2001; 11:295-9. 21. Report of an IUIS Scientific Commitee. Primary immunodeficiency Diseases. Clin Exp Immunol 1999; 118:1-28. 22. Finocchi A, Angelini F, Chini L, Di Cesare S, Cancrini C, Rossi P. et al. Evaluation of the relevance of humoral immunodeficiencies in a pediatric population affected by recurrent infections. Pediatr Allergy Immunol 2002; 13: 443-7. G. García Hernández, A. Martínez Gimeno 23. Saiman L. Microbiology of early CF lung disease. Paediatr Respir Rev 2004; 5:S367-9. 24. Rabin HR, Butler SM, Wohl ME, Geller DE, Colin AA, Schidlow DV et al. Pulmonary exacerbations in cystic fibrosis. Pediatr Pulmonol 2004; 37:400-6. 25. Noone PG, Leigh MW, Sannuti A, Minnix SL, Carson JL, Hazucha M et al. Primary ciliary dyskinesia: diagnostic and phenotypic features. Am J Respir Crit Care Med 2004; 169: 459-67. 26. Pizzi S, Cazzato S, Bernardi F, Mantovani W, Cenacchi G. Clinico-pathological evaluation of ciliary dyskinesia: diagnostic role of electron microscopy. Ultrastruct Pathol 2003; 27:243-52. 27. Couriel J. Assessment of the child with chest infections. Br Med Bull 2002; 61:115-32. 28. Van Aalderen WM, Hoekstra MO, Hess J, Gerritsen J, Knol K. Respiratory infections and vascular rings. Acta Paediatr Scand 1990; 79:477-80. 29. Al-Qahtani AR, Di Lorenzo M, Yazbeck S. Endobronchial tumors in children: Institutional experience and literature review. J Pediatr Surg 2003; 38:733-6. Libro II curso 31/1/05 17:26 P gina 23 Novedades en tuberculosis C. Oliva Hernández, A. Callejón Callejón, C. L. Marrero Pérez Unidad de Neumología Infantil. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife RESUMEN La tuberculosis (TBC) es aún en el siglo XXI una de las infecciones crónicas más importantes del mundo. El abordaje diagnóstico en el niño debe apoyarse en la evaluación conjunta de criterios epidemiológicos, clínicos, tuberculínicos, radiológicos, microbiológicos e histopatológicos, siendo fundamental llevar a cabo este abordaje de forma individualizada. En España, la creciente inmigración procedente de países con alta prevalencia de TBC y VIH, hace necesario que se establezca un nuevo consenso que modifique y actualice los criterios de positividad de la prueba tuberculínica (PT) en el niño, ya que ésta es un pilar diagnóstico fundamental en el paciente pediátrico. Actualmente se están llevando a cabo estudios para encontrar pruebas más específicas, como “ELISPOT” (detección de interferón gamma [IFN-γ] en sangre periférica), que parece ser la expectativa más prometedora, constituyendo una posible alternativa a la PT, aunque se precisan más estudios antes de poder utilizarla de forma rutinaria. La TBC resistente a fármacos constituye un nuevo desafío. Actualmente el tratamiento se basa en una serie de recomendaciones, mezcla de conocimientos generales, extrapolaciones y opiniones de expertos, pero sin conformar un protocolo estándar. Libro II curso 31/1/05 17:26 P gina 24 24 INTRODUCCIÓN La tuberculosis (TBC) es aún en el siglo XXI una de las infecciones crónicas más importantes del mundo. Actualmente la TBC va en aumento en nuestro país, debido entre otros factores, a fenómenos como la inmigración de países con alta prevalencia en TBC y a la infección por el VIH, constituyendo un importante problema de salud pública en el mundo. Establecer el diagnóstico de TBC en el niño supone un gran reto para el pediatra, y este abordaje diagnóstico debe apoyarse en la evaluación conjunta de criterios epidemiológicos, clínicos, tuberculínicos, radiológicos, microbiológicos e histopatológicos, siendo fundamental llevar a cabo este abordaje de forma individualizada en cada paciente. El aislamiento de la Mycobacterium tuberculosis (MT) en muestras biológicas debe investigarse en todos los casos, dado que es el único método que nos aporta el diagnóstico de certeza de la enfermedad tuberculosa, pero dadas las características paucibacilares de los niños esto no siempre es posible, por lo que es importante adoptar un alto índice de sospecha para establecer un correcto diagnóstico y tratamiento de la TBC en la infancia(1). PRUEBA DE LA TUBERCULINA La prueba de tuberculina (PT) es uno de los pilares fundamentales para el diagnóstico de la TBC en el niño. Es actualmente el único método utilizado para iden- C. Oliva Hernández, et al. tificar la infección por MT en el paciente pediátrico que no padece la enfermedad tuberculosa. Para la utilización correcta de la PT se requiere el conocimiento de los siguientes hechos: • El antígeno empleado: la tuberculina, y las bases epidemiológicas de las reacciones del huésped frente a dicho antígeno. • La técnica de administración. • Lectura correcta de los resultados, y • Evaluación de los mismos, conjuntamente con las experiencias epidemiológica y clínica con la PT. La PT carece de la sensibilidad y especificidad suficientes, debido a que demora 2-3 días en aportar resultados y es útil básicamente para detectar los infectados por MT. La excepción a esta regla la constituyen los niños, en los que una PT positiva puede ser útil para el diagnóstico de la enfermedad tuberculosa(1,2). Bases inmunológicas Todo paciente infectado por micobacterias, desarrolla una respuesta inmune humoral y celular frente a sus antígenos(3-5). Por tanto, con la PT se pone de manifiesto una respuesta inmunológica mediada por células de tipo retardado. La reacción a la tuberculina comienza a las 5-6 horas tras la inyección, produce su máxima induración a las 48-72 horas y persiste tras varios días, siendo válida su lectura hasta el 5º día(2). Se debe tener en cuenta que hay pacientes en los que la reacción puede no alcanzar “su pico máximo” hasta las 72 horas. Estas reacciones “retardadas” no alte- Libro II curso 31/1/05 17:26 P gina 25 25 Novedades en tuberculosis ran la interpretación de la prueba. Por otra parte, también pueden aparecer “reacciones de hipersensibilidad inmediata” a la tuberculina o a los constituyentes del diluyente; estas reacciones desaparecen en 24 horas, y no deben confundirse con reacciones retardadas de hipersensibilidad. Sin embargo, si la reacción inmediata es grave, no es conveniente repetir la prueba. Tipo de tuberculina, técnica de administración y lectura Para la realización de la PT se deben utilizar 2 unidades de tuberculina (UT) PPD RT-23, equivalente a 5 UT de PPD-S, definida por la OMS como la tuberculina estándar internacional. La dosis recomendada en España es la de 2 UT de PPD RT23 con tween 80, en 0,1 mL. Se administra mediante la intradermorreacción de Mantoux, inyectando 0,1 mL. de la dilución por vía intradérmica, en la cara anterior del antebrazo a 10 cm de la flexura del codo, en piel libre de lesiones y lejos de las venas(2,6). Para la inyección se debe utilizar una jeringuilla preferentemente de plástico desechable, con aguja de acero del calibre 26 ó 27 con bisel corto, dirigido hacia arriba, comprobando que la técnica se efectúa correctamente si se produce un “habón” de 6 a 10 mm de diámetro, que desaparece a los pocos minutos. No debe sangrar. La lectura se efectúa a las 48-72 horas después de la inyección, las realizadas después de las 72 horas tienden a desestimar los resultados. La lectura se lleva a cabo con el brazo ligeramente flexionado sobre el codo, siendo la base de esta lectura la presencia o ausencia de induración, que debe determinarse, tanto mediante inspección, como palpación. Se mide el diámetro de la máxima induración transversalmente al eje longitudinal del antebrazo en su cara ventral, expresándose el resultado en mm. La ausencia de induración ha de informarse como 0 mm, nunca como “negativa”. La interpretación correcta de la PT es fundamental, y, por tanto, al informarla debe precisarse: 1. Tipo de tuberculina utilizada. 2. Dosis de la misma. 3. Técnica de administración. 4. Tamaño de la induración expresado en mm. Cuando la reacción es muy intensa, puede acompañarse de vesiculación o necrosis, y en ocasiones de linfangitis y adenopatía satélite. Estas circunstancias deben registrarse, pues son altamente específicas de infección por MT(2,6). Criterios de positividad de la PT El Consenso Nacional para el control de la TBC en España en 1992 aportó las directrices para nuestro país(1) (Tabla 1). No TABLA 1. Prueba de la tuberculina: criterios de positividad. Vacunación con BCG Induración (mm) No vacunados Vacunados ≥5 ≥ 14 Consenso Nacional para el control de la Tuberculosis en España(1). Libro II curso 31/1/05 17:26 P gina 26 26 obstante, en los últimos años han sido comunicadas distintas guías para la interpretación de la PT en diferentes países. Sus recomendaciones quedan reflejadas en las tablas 2, 3 y 4(2,4,7). Recientemente se ha comunicado que hasta que se establezca el nuevo dintel de positividad de la PT en nuestro medio, se pueden admitir como criterios de positividad los referidos en las tablas 3 y 4(4,7). Criterios de positividad de la PT en vacunados con BCG La eficacia de la vacunación BCG es incierta. Existen numerosos trabajos que demuestran que la BCG protege contra la TBC diseminada y la meningitis TBC; sin embargo, la protección frente a la enfermedad pulmonar es inconstante y limitada en el tiempo. Paradójicamente la reactividad a la PT que resulta de la vacunación no se correlaciona con la protección contra la TBC. Por otro lado, uno de los problemas importantes que plantea la vacunación BCG es que da lugar a interferencia en la interpretación de la PT, que pierde especificidad. No todos los autores están de acuerdo en los criterios de positividad de la PT en vacunados con BCG; algunos pacientes no son reactores a la tuberculina, y las induraciones que se obtienen en otros suelen presentar un diámetro inferior que en los infectados por MT. Por otro lado, existen trabajos que avalan positividades de la PT achacables a la vacunación con BCG hasta 25 años después de puesta la misma(4,8-13). En la tabla V se especifican los diferentes criterios de positividad de la PT en C. Oliva Hernández, et al. pacientes vacunados con BCG referidos en la literatura más relevante hasta el momento actual(1,2,4,6,7,8,10,11). Según se deduce de todo ello, se puede aceptar que una PT ≥ 15mm en pacientes vacunados con BCG siempre es indicativa de infección TBC, independientemente del tiempo transcurrido desde la vacunación. En todos los casos se debe tener en cuenta la posibilidad de falsos positivos (Tabla 6)(6) y falsos negativos (Tabla 7)(6,1416). La negatividad de la PT nunca excluye el diagnóstico de infección o enfermedad tuberculosa. Aproximadamente un 10% de niños sanos con patología documentada mediante cultivo no reaccionan inicialmente a la PT(6,16). En el recién nacido no se puede detectar la positividad de la PT hasta las 8-12 semanas de vida en algunos casos, y hasta los 6 meses en la totalidad de los mismos. En ocasiones, para minimizar el dolor de los niños por la inyección se emplean pomadas con anestésicos locales (lidocaína y prilocaína), esto puede modificar el resultado de la PT, dando lugar a una medida sobreestimada; por tanto, no se recomienda su utilización(11). Por todo lo expuesto hasta aquí podemos concluir que se precisa un nuevo consenso para la erradicación de la tuberculosis en España que modifique y actualice sus recomendaciones, teniendo en cuenta las circunstancias actuales de nuestra sociedad. Infección tuberculosa: nuevo test diagnóstico La PT es una técnica muy antigua que aún no ha sido superada por ninguna Libro II curso 31/1/05 17:26 P gina 27 27 Novedades en tuberculosis TABLA 2. Interpretación de la positividad de la prueba tuberculínica. Induración ≥ 5 mm Induración ≥ 10 mm - Personas con infección por VIH - Contactos recientes con enfermos con TBC - Lesiones radiológicas (cambios fibróticos) compatibles con TBC antigua no tratada - Pacientes trasplantados o inmunodeprimidos (tratados con ≥ 15 mg/día de prednisona durante ≥ 1 mes) - Emigrantes que han llegado hace menos de 5 años de países de alta prevalencia - Adictos a drogas por vía parenteral - Empleados y residentes en áreas de hacinamiento: prisiones, guarderías, residencias, albergues... - Personal de laboratorio de microbiología - Enfermedades con riesgo añadido: diabetes, insuficiencia renal crónica, trastornos hematológicos (leucemia, linfoma), enfermedades malignas (carcinoma cabeza, cuello o pulmón), pérdida de peso ≥ 10% del peso ideal, gastrectomizados con “by-pass” yeyunoileal - Niños < 4 años o niños y adolescentes en contacto con adultos de alto riesgo Induración ≥ 15 mm - Personas sin factores de riesgo de TBC - Niños con BCG ATS/CDC and Prevention(2). otra para el diagnóstico de la infección tuberculosa. Recientemente se están llevando a cabo diversos estudios para intentar encontrar otras pruebas que sean capaces de evaluar la infección tuberculosa con mayor especificidad que la PT, ya que puede presentar falsos positivos en pacientes vacuna- dos de BCG o en infectados por micobacterias atípicas(17-20). Por tanto, no existen métodos totalmente fiables para detectar la infección latente por MT. Parece ser que la expectativa más prometedora en este sentido es la técnica “ELISPOT”, que determina en sangre periférica el interferón gamma (IFN-γ)(21,22), secretado por las cé- Libro II curso 31/1/05 17:26 P gina 28 28 C. Oliva Hernández, et al. TABLA 3. Prueba de la tuberculina. Criterios de positividad. Induración ≥ 5 mm Situaciones de riesgo de infección o enfermedad • Contactos con enfermos • Infecciones recientes • Enfermos con síntomas o radiología sugerentes • Inmunodeprimidos... • Resto de casos Induración ≥ 10 mm • Resto de casos Alcaide Megías J, Altet Gómez MN. Tratado de Neumología Infantil 2003; 427-55(4) TABLA 4. Interpretación de la prueba tuberculínica en niños. Induración ≥ 5 mm - - Niños en contacto íntimo con casos índice o sospechosos de TBC Niños sospechosos de enfermedad TBC clínica o radiológica Niños en situaciones de inmunodepresión o infección por VIH Niños con conversión de Mantoux previamente negativa Induración ≥ 10 mm - Cualquier otro caso, incluídos los niños inmigrantes y el cribado de niños sanos AEP(7). lulas T, que responden a los epítopos de ESAT-6 (Early Secretory Antigen Target 6)(23,24), siendo éste un antígeno altamente específico del MT complex, y que además está ausente en la Mycobacterium bovis, Mycobacterium bovis de la BCG y en otras micobacterias atípicas(25,26). Un trabajo reciente de Lalvani et al (27)demuestra que las células T representan un marcador exacto de infección por MT, y esta determinación permite la detección rápida (menos de 24 horas) de TBC activa y la presencia de infección en individuos asintomáticos expuestos, con alto riesgo de desarrollar infección latente por dicho germen. Otro dato muy importante es que diferencia claramente entre pacientes infectados por MT de las positividades de la PT debidas a vacunación con BCG, infectados por Mycobacterium bovis o incluso por otras micobacterias atípicas (23,24), permitiendo, por tanto, un inicio rápido de la terapéutica adecuada. Libro II curso 31/1/05 17:26 P gina 29 29 Novedades en tuberculosis TABLA 5. Prueba de la tuberculina. Criterios de positividad con vacunación BCG. Induración en mm Referencias bibliográficas Consenso Nacional para el control de la TBC en España(1). ≥ 14 mm Protocolo del Tratamiento de la Tuberculosis Infantil. Sociedad Española de Neumología Pediátrica(8). ≥ 15 mm o vesiculación o necrosis. Difícil establecer un límite exacto. A mayor induración y más tiempo transcurrido desde la vacunación: mayor probabilidad de que la PT positiva sea por infección TBC. ATS/ CDC and Prevention(2). • 10 mm: reacción postvacunal. Valoración individualizada • ≥ 15 mm: PT positiva Chee CBE, et al.(10). Infección TBC • ≥ 5 mm: pacientes VIH y contactos íntimos • ≥ 10 mm: no BCG y BCG al nacer • ≥ 15 mm: revacunados BCG • ≥ 18 mm: BCG con PT anterior Caminero Luna JA(6). Sensibilidad tuberculínica por BCG: no tiene límite preciso en el tiempo 15 mm: límite de positividad. AEP. Sociedad Española de Infectología Pediátrica(7). BCG puesta en los 3 últimos años • ≤ 10mm: reacción postvacunal • 11-14 mm: valoración individualizada • ≥ 15 mm: PT positiva Alcaide Megías J, Altet Gómez MN(4). • Vacunados BCG en contacto íntimo y frecuente con enfermo bacilífero: ≥ 5 mm • Vacunados BCG sin contacto con enfermo o contactos esporádicos con enfermo, contactos íntimos y frecuentes con enfermos no bacilíferos: ≥ 15 mm • Entre 5-15 mm: a mayor induración mayor probabilidad de infección TBC Chadelat K(11). • ≥ 5 mm PT < 10 mm: reacción postvacunal BCG •≥ 10 mm PT < 15 mm: estudio individualizado •≥ 15 mm: estudio de TBC Libro II curso 31/1/05 17:26 P gina 30 30 C. Oliva Hernández, et al. TABLA 6. Prueba de la tuberculina: falsos positivos. • Infecciones por micobacterias atípicas • Vacunación con BCG previa • Transfusión de sangre (concentrado de linfocitos o factor de transferencia) de donantes reactores positivos • Hematoma local • Infección del punto de inyección • Sensibilidad a los componentes de la tuberculina • Mala preparación de la tuberculina (reacción precoz de menor duración) Caminero Luna JA(6). TABLA 7. Prueba de la tuberculina: falsos negativos. Relacionados con el paciente • Período “ventana” (2-12 semanas tras la infección) • Fiebre elevada • Infecciones víricas (VIH, varicela, parotiditis, sarampión) • Infecciones bacterianas (fiebre tifoidea, brucelosis, tos ferina, lepra, TBC reciente, masiva o diseminada, pleuritis TBC) • Infecciones fúngicas (blastomicosis) • Vacunación con virus vivos en los dos meses previos: sarampión, parotiditis, polio, varicela, fiebre amarilla • Vacunación oral antitifoidea • Deterioros metabólicos: fallo renal crónico • Hipoproteinemia (depleción proteica severa, afibrinogenemia). Desnutrición • Enfermedades que afectan a los órganos linfoides: enfermedad de Hodgkin, linfoma, leucemia crónica, sarcoidosis • Fármacos (corticosteroides e inmunosupresores) • Edad (recién nacidos, ancianos) • Estrés (cirugía, quemaduras, enfermedad mental, reacción injerto contra el huésped) Relacionados con la tuberculina • Almacenamiento inadecuado (exposición a luz y calor) • Dilución inapropiada • Desnaturalización química • Contaminación • Absorción (parcialmente controlado con la adición de Tween 80) Relacionados con el método de administración y lectura • Menor dosis administrada • Inyección subcutánea o en área inflamada o próxima a otros tests cutáneos ... / ... Libro II curso 31/1/05 17:26 P gina 31 31 Novedades en tuberculosis TABLA 7. Prueba de latuberculina: falsos negativos. (Continuación) Relacionados con el método de administración y lectura • Retraso en la administración tras su extracción en jeringa • Inexperiencia, error en lectura, error en registro Caminero Luna JA(6) Oliva C, et al(4) Oliva C (15) Por otra parte, la identificación de genes, como ESAT-6 y la CF P10 (Culture filtrate protein 10) en el genoma del MT(28,29), que están ausentes en la Mycobacterium bovis, Mycobacterium bovis de la BCG y en otras micobacterias atípicas ha ofrecido la oportunidad de desarrollar tests específicos para el diagnóstico de la infección por MT. INFECCIÓN TUBERCULOSA: FARMACORRESISTENCIAS La aparición de nuevas enfermedades, así como el resurgir de otras que se consideraban erradicadas, o al menos controladas, son el motivo por el cual la TBC vuelve a ser tema de actualidad en nuestro país. Si lo aplicamos a la población infantil la preocupación aumenta, puesto que el contacto TBC puede ser resistente a los fármacos habituales. El bacilo tuberculoso está experimentando continuamente mutaciones espontáneas, que crean resistencias a los fármacos antituberculosos de forma individual. Sin embargo, la frecuencia de estas mutaciones es lo suficientemente baja, como para que con una combinación adecuada de quimioterápicos no se desarrollen resistencias clínicamente significativas (resistencia natural)(30). Lo más frecuente es que se adquieran resistencias en los casos en que exista una gran población bacilífera, como, por ejemplo, en presencia de cavitaciones pulmonares, cuando el régimen de tratamiento es inadecuado (tanto en la elección de fármacos como por dosis insuficiente), o cuando haya un fallo combinado, tanto por parte del paciente, como del sistema sanitario para asegurar una correcta administración del tratamiento(31). Raramente se producen resistencias por malabsorción de alguno de los fármacos. Es más probable que éstas ocurran en casos de TBC pulmonar cavitada, debido al gran número de bacilos que se multiplican rápidamente en las cavidades(32). Durante un tratamiento prolongado o repetido, pueden desarrollarse resistencias a múltiples fármacos (resistencia secundaria) y estos sujetos pueden transmitir estas cepas a otros, que en caso de desarrollar TBC sufrirían farmacorresistencia primaria. Este es el caso más común en la población pediátrica. La presencia de resistencias en un paciente diagnosticado recientemente de Libro II curso 31/1/05 17:26 P gina 32 32 TBC, debe hacernos sospechar el antecedente de tratamiento previo(33,34), o circunstancias epidemiológicas determinadas como contacto con un caso conocido de resistencias o estancia en regiones donde la farmacorresistencia es frecuente. En tales situaciones es prudente emplear un tratamiento empírico prolongado, especialmente si el paciente presenta afectación clínica severa. Las resistencias deben demostrarse con tests de sensibilidad llevados a cabo por un laboratorio competente (Tabla 8)(35,36). Los pasos a seguir cuando descubrimos un caso de farmacorresistencia son de vital importancia. Los pacientes que albergan cepas de MT resistente a isoniazida (INH) y rifampicina (RIF), tuberculosis multirresistente, (TBC-MDR), tienen un elevado riesgo de fracaso terapéutico, así como de desarrollar una resistencia adquirida posteriormente (farmacorresistencia secundaria); en estos casos hay que enviar inmediatamente al paciente a un centro especializado. Los enfermos con resistencia únicamente a RIF tienen mejor pronóstico que los casos de MDR, pero también existe mayor riesgo de fracaso terapéutico o del desarrollo de resistencias, por lo que deben ser manejados con precaución. La resistencia a RIF se asocia en casi la totalidad de los casos a resistencia cruzada con rifabutina y rifapentina(37). Aunque existen cepas poco comunes que a pesar de ser resistentes a la RIF conservan sensibilidad a la rifabutina (por mutaciones poco frecuentesen el locus de la RNA polimerasa)(38), no deberíamos utilizar este fármaco en los casos de resistencia a RIF. El C. Oliva Hernández, et al. caso de resistencia cruzada entre RIF y rifapentina ocurre de manera consideracion universal(37). Consideraciones sobre el test de sensibilidad farmacológica El test de sensibilidad farmacológica del MT es de importancia vital para el manejo correcto del paciente, y deberá llevarse a cabo siempre en una muestra inicial de todos los enfermos en los que se identifique la micobacteria(39). Debe repetirse el antibiograma en caso de obtener cultivos positivos después de tres meses de tratamiento, o si aparece de nuevo un cultivo positivo después de un período de cultivos negativos(40). Estos tests deberían realizarse siguiendo una metodología estándar, tal como recomienda el Comité Nacional para Estándares de Laboratorios Clínicos (última revisión del estándar publicada en el año 2000)(41). La sensibilidad del MT se determina evaluando la posibilidad de una muestra para crecer en agar u otro medio que contenga una concentración crítica de un fármaco40, entendiéndose ésta como aquélla en la que se inhibe el crecimiento de la mayoría de células de una población salvaje (cepas que nunca han estado en contacto con medicamentos antituberculosos)(42). El método de las proporciones agar ha sido propuesto como el de referencia para testar todos los fármacos antituberculosos, excepto para la pirazinamida (PZA), en la que se usa el método BACTEC(40). Se define resistencia en el método de proporciones agar, al crecimiento en la placa que contiene el fármaco a una concentración Libro II curso 31/1/05 17:26 P gina 33 33 Novedades en tuberculosis TABLA 8. concentraciones (µg/mL) farmacológicas recomendadas para los tests de sensibilidad Método y proporciones Fármaco Fármacos de primera línea Isoniazida Isoniazida (altas dosis) Rifampicina Etambutol Pirazinamida* Fármacos de segunda línea Estreptomicina Estreptomicina (altas dosis) Etambutol (altas dosis)** Capreomicina Etionamida Kanamicina Ofloxacino Ácido paraaminosalicílico Rifabutina ** Medios líquidos 7H10 Agar 7H11 Agar Radiométrico (BACTEC) ESP Myco MGIT BacT/ ALERT MB# 0,2‡ 1,0 1,0‡ 5,0‡ NR 0,2‡ 1,0 1,0 7,5 NR 0,1‡ 0,4 2,0‡ 2,5‡ 100,0‡ 0,1‡ 0,4 1,0‡ 5,0‡ — 0,1 0,4 1,0 5,0 100,0 0,09 0,4 0,9 2,3 200,0 2,0‡ 10,0 10,0 10,0 5,0 5,0 2,0 2,0 0,5 2,0 10,0 10,0 10,0 10,0 6,0 2,0 8,0 0,5 2,0‡ 6,0 7,5 — — — 1,0 4,0 7,5 0,9 — — ESP Myco = ESP (Extra Sensing Power) Sistema de cultivo II; BacT/ALERT MB = BacT/ALERT MB kit de sensibilidad; MGIT = mycobacterial growth indicator tube; NR = no recomendado. # BacT/ALERT MB no aprobado actualmente por la FDA para los tests de sensibilidad. ‡ Concentración crítica del fármaco en este medio. *Hacer test de sensibilidad a fármacos de segunda línea en aquellas muestras resistentes a rifampicina o a dos o más fármacos de primera línea. Además la NCCLS recomienda una concentración más elevada de etambutol para el test de sensibilidad (p.e., 10 mg/mL, tanto para 7H10, como para 7H11). ** Algunos laboratorios la testan a concentraciones más elevadas normalmente a 1,0 o 2,0 mg/mL. ATS/CDC and Prevention. Am J Resp Crit Care Med 2000; 161: 1376-95 2 Treatment of Tuberculosis. MMWR 2003; 52: RR-1135 Woods GL. Clin Infect Dis 2000;31:1209-1215 36 mayor del 1%, comparado con el crecimiento en la placa sin fármaco(43). Como este método tarda unas 6 semanas en aportar resultados, se recomienda el uso de métodos más rápidos (BACTEC) para la realización del test de sensibilidad inicial para fármacos de primera línea. El objetivo, como ha declarado el CDC, es tener los resultados del test de sensibilidad a fárma- cos de primera línea a partir de los 28 días de ser recibida la muestra(44). El Comité Nacional para Estándares de Laboratorio recomienda que el test sea realizado para INH a dos concentraciones, RIF y etambutol (EMB) a una concentración cada uno, utilizando un método en medio líquido en todas las muestras iniciales de MT (Tabla 8). Libro II curso 31/1/05 17:26 P gina 34 34 Se deberá hacer el test para la PZA si existe una elevada prevalencia de resistencia a este fármaco en la zona geográfica que nos ocupe. Se recomienda también realizar antibiograma para todo el abanico de fármacos, incluyendo los de segunda línea, en los casos en que exista resistencia individual a la RIF o a dos o más fármacos. La determinación de la resistencia a PZA es técnicamente problemática, por lo que no se realiza en muchos laboratorios(45). Cuando se testa este fármaco en medio de BACTEC se necesita modificar el pH del medio de crecimiento, puesto que la actividad de este fármaco es óptima con pH de 5,5 y no con pH de 6,8 que es el habitual en estos medios. El problema es que la mayoría de los MT crecen pobremente y algunos parcialmente a ese pH, por este motivo sopesando el crecimiento bacteriano y la actividad farmacológica, se ha establecido el dintel del pH en 6. Además, para aumentar la precisión y fiabilidad del testado de PZA, se realizan también distintos ajustes de métodos radiométricos(46). Sin embargo, no es frecuente que exista resistencia a la PZA en ausencia de resistencias a otros fármacos de primera línea. Si se constata tal resistencia y, sobre todo, si es una resistencia aislada, hay que investigar qué tipo de micobacteria es la implicada, descartando Mycobacterium bovis y Mycobacterium bovis BCG que suelen ser resistentes, a diferencia del MT. Esto es un hecho importante a tener en cuenta, sobre todo, en aquellos laboratorios donde únicamente identifican el MT complex mediante sondas de hibridación. C. Oliva Hernández, et al. El test para fármacos de segunda línea suele ser llevado a cabo por laboratorios de la Sanidad pública, utilizando el método de las proporciones agar. Los fármacos de segunda línea sobre los que se hace antibiograma son principalmente la capreomicina, etionamida, kanamicina (que también sirve para predecir la sensibilidad a la amicacina), ofloxacino (utilizado para valorar la actividad de las fluorquinolonas), ácido paraaminosalicílico (PAS), rifabutina y estreptomicina (SM)(41), y se recomienda una segunda concentración de EMB en los tests para fármacos de segunda línea. Por último, el test de sensibilidad a la cicloserina no se recomienda por los problemas técnicos asociados que plantea (Tabla 8)(2,35,36). Los resultados del antibiograma deben ser comunicados con rapidez. El informe debe incluir: el nombre del fármaco investigado, el método realizado, la concentración testada y los resultados (sensibilidad o resistencia mediante el método BACTEC y sensibilidad o porcentaje de resistencia mediante el método de proporciones agar). La farmacorresistencia debe ser informada vía telefónica o por escrito, y confirmado su conocimiento con el médico responsable del paciente, personal sanitario relacionado con él, así como con las autoridades sanitarias locales para seguimiento estricto del caso. Es importante una relación estrecha entre los técnicos de laboratorio y los médicos que tratan al paciente, para de este modo poder aclarar de forma individualizada las discrepancias que surjan entre la sensibilidad farmacológica y la respuesta Libro II curso 31/1/05 17:26 P gina 35 35 Novedades en tuberculosis clínica del enfermo(47). Así, por ejemplo, si se detecta fármacorresistencia a alguno o a todos los fármacos de primera línea, algunos laboratorios tras determinar la concentración crítica farmacológica, realizan un segundo test haciendo uso de dosis farmacológicas más altas, determinándose así la concentración crítica y confirmando, por tanto, tal resistencia. Esto aporta información sobre el nivel de resistencia y puede ser utilizado por el médico para decidir si continúa con la dosis inicial recomendada o aumenta ésta, en función de la evolución clinicoradiológica del paciente. Gracias al estudio en otras especies tales como E. Coli, se ha avanzado en las investigaciones acerca del mecanismo de acción de los fármacos antituberculosos y de las resistencias farmacológicas del MT(48). Los hallazgos principales se han registrado al analizar la resistencia a RIF. En más del 96% de las resistencias a este fármaco, se detecta una mutación en el segmento 81 bp del gen rpoB, motivo por el cual se ha utilizado este fármaco como marcador de multirresistencia. Los métodos empleados para detectar la mutación en esta región génica, son fundamentalmente por amplificación mediante la reacción en cadena de la polimerasa (PCR) de la secuencia identificada, así como la determinación de dicha secuencia de DNA y sondas de hibridación para determinar el polimorfismo entre otros. Antes de que su uso sea ampliamente extendido se necesitarán análisis costo-beneficio, comparándolo con los resultados obtenidos mediante los métodos convencionales. TIPAJE GENÓMICO DE LA MICOBACTERIA TBC Se realiza mediante el método Southern blot, en el que los microorganismos cultivados son desnaturalizados mediante calor, separados en un gel agarosa mediante electroforesis, transferidos a una membrana y posteriormente enfrentados a sondas con secuencias genéticas específicas. Actualmente existe un protocolo estandarizado para permitir comparar los genotipos tipados en los distintos laboratorios del mundo(49). El tipaje genómico es útil para confirmar contaminaciones cruzadas en el laboratorio(50), investigar epidemias de TBC(51), evaluar el seguimiento de contactos(52), así como determinar si los nuevos episodios de TBC son debidos a reinfección o reactivación(53); además, el tipaje genómico es útil para dilucidar el lugar y el patrón de transmisión de la TBC dentro de las distintas comunidades(54,55). Como consecuencia de varias epidemias nosocomiales y del incremento de TBC en los pacientes VIH positivos a principios de los años 90, el CDC ha establecido una red nacional de vigilancia y tipaje de los MT. El consenso entre los protocolos moleculares modernos que identifican cepas mediante niveles de DNA y los métodos epidemiológicos convencionales, ha proporcionado una estrategia conjunta en el control de la TBC(46). TRATAMIENTO La posibilidad de resistencia farmacológica en niños debe ser considerada en las siguientes circunstancias(35,56): Libro II curso 31/1/05 17:26 P gina 36 36 1. Si existe contacto con adulto fármacorresistente. 2. Si no se identifica el contacto, pero la comunidad o el país donde el niño reside o ha residido tienen una alta prevalencia de farmacorresistencia. 3. Si el contacto TBC realizó un tratamiento incompleto o presentó fracaso terapéutico (completó el tratamiento pero persistió positivo el cultivo al final del mismo) o llevó a cabo un retratamiento (segundo episodio de TBC) o se considera caso crónico (TBC a pesar de dos ciclos de tratamiento previos con sensibilidad farmacológica desconocida). 4. Niños con respuesta no satisfactoria tras haber efectuado el tratamiento correcto y completo. 5. Niños con recaída de TBC pulmonar tras haber realizado un tratamiento incorrecto o incompleto. Debido a que no se han realizado estudios aleatorizados o controlados concluyentes en pacientes con distintos patrones de farmacorresistencia, el tratamiento de estos pacientes se apoya en un conjunto de principios generales, extrapolaciones y la opinión de expertos(57,58). Tanto la Organización Mundial de la Salud (OMS) como la International Union Against Tuberculosis and Lung Diseases (IUATLD) han formulado un protocolo estándar para el manejo de casos crónicos y de fracaso terapeútico. Esta metodología es más adecuada para regiones que carezcan de recursos suficientes, tanto para realizar tests de sensibilidad, como para acceder a la amplia batería de medicamen- C. Oliva Hernández, et al. tos disponibles; sin embargo, no debe emplearse en países industrializados con amplios recursos(59,60). Consideraciones generales 1. Nunca debe añadirse un fármaco nuevo de forma individual a una terapia que haya fracasado. 2. Cuando se inicie o se modifique un tratamiento, siempre se debe intentar utilizar, al menos, tres fármacos no empleados previamente a los que haya sensibilidad in vitro, y uno de ellos deberá ser un fármaco inyectable. 3. No hay que limitar el tratamiento a tres fármacos, si tenemos disponibles otros no utilizados previamente que presumiblemente sean activos. En pacientes con gérmenes multirresistentes en tratamiento con fármacos, de primera línea, se deben asociar de cuatro a seis fármacos porque parece que proporciona mejores resultados(61-64). 4. Los pacientes deberán recibir tratamiento hospitalario o domiciliario de forma individualizada. 5. No deberá emplearse una terapia intermitente para tratar la TBC causada por organismos resistentes, excepto quizás en el caso de utilizar medicación inyectable después de una etapa inicial de tratamiento de, al menos, dos o tres meses. 6. No deben utilizarse fármacos que tengan resistencias demostradas por tests de sensibilidad, debido primero, a su falta de eficacia y segundo, porque normalmente se dispone de otras alternativas. Sin embargo, la trascendencia clí- Libro II curso 31/1/05 17:26 P gina 37 Novedades en tuberculosis nica y la efectividad de la INH en el marco de un bajo nivel de resistencia no están del todo claras. Debe reseñarse que se obtuvieron mejores tasas de supervivencia en pacientes con la cepa W del MT multirresistente, que fue susceptible de tratamiento a concentraciones elevadas de INH(60). 7. No existe resistencia cruzada entre la SM y otros medicamentos inyectables: amicacina, kanamicina y capreomicina, aunque pueden surgir resistencias como hallazgos independientes; sin embargo, la resistencia cruzada entre amicacina y kanamicina es universal(31). No se recomienda el uso simultáneo de ambos agentes inyectables, ya que no hay constancia de que mejore la eficacia terapéutica y existe, sin embargo, el riesgo de potenciar la toxicidad farmacológica. Las directrices para el manejo de pacientes con TBC por gérmenes resistentes quedan reflejadas en las tablas IX y X(62). La incidencia y el espectro de resistencias del MT son reflejo directo de las que circulan en la comunidad. Aunque el manejo de adultos TBC-MDR ha sido ampliamente documentado, se conoce relativamente poco sobre el diagnóstico y tratamiento de la TBC-MDR en la infancia(32. Dado que en niños la TBC es paucibacilar, el desarrollo de resistencias a fármacos y en especial la TBC-MDR tras tratamiento previo es menos frecuente(36). En distintos trabajos realizados(65-72) se han investigado niños en contacto con adultos TBC-MDR, llegando a la conclusión de que la resistencia farmacológica en 34) 37 el paciente pediátrico suele ser primaria, ya que pocos tienen el antecedente de tratamiento antituberculoso previo(37-39). Se confirma mediante análisis genético en cada uno de los estudios que, la cepa del Mycobacterium TBC-MDR se transmite genéticamente(53,59,70). En los casos en que el antibiograma no fue concordante con el estudio genético, se constató que el niño había sido infectado por una cepa distinta de la que circulaba en su ámbito familiar(64). Respecto al tratamiento se han postulado diferentes pautas. En un estudio de seguimiento realizado en Sudáfrica por Schaaf et al(68) todos los niños de cualquier edad infectados, y a los menores de 2 años que nunca habían recibido tratamiento, se les administró la siguiente asociación medicamentosa: • INH a altas dosis, 15-20 mg/kg/día. • PZA, 25-35 mg/kg/día. • Etionamida, 10-15 mg/kg/día y/o. • EMB, 15-20 mg/Kg/día y/u. • Ofloxacino, 15 mg/kg/día, introduciendo los dos últimos fármacos en función de la sensibilidad de la cepa del adulto considerado como caso índice. La duración de una quimioprofilaxis óptima en los contactos con TBC-MDR se desconoce. En este estudio la duración fue de seis meses; sin embargo, algunos autores recomiendan ampliarlo hasta un año. Quizás una alternativa intermedia sea lo más correcto(65,70,71). Los niños afectos de TBC activa recibieron tratamiento individualizado que incluía un régimen de cuatro o cinco fárma- Libro II curso 31/1/05 17:26 P gina 38 38 C. Oliva Hernández, et al. TABLA 9. Pauta de tratamiento en las resistencias a un solo fármaco. Resistencia Tratamiento de ataque 2 meses Tratamiento de consolidación Conocida a INH RIF+EMB SM+RIF+PZA+EMB RIF+EMB 12 meses RIF+EMB 7 meses Después inicio tratamiento Mantener o suprimir INH* RIF SM+RIF+PZA+EMB INH+SM+PZA+EMB RIF+EMB (12-18 meses) INH+EMB (18 meses)** Altet MN, Alcaide J, Pascual MªT. Tuberculosis Infantil Resistente a Fármacos 2000; 124: 195-212(62) *La administración de INH en caso de resistencia es controvertida **Malos resultados con pautas breves TABLA 10. Fármacos para el tratamiento de la TBC-MDR en niños. Fármaco Dosis diaria (mg/kg/día) Dosis máxima Actividad antimicrobiana Pirazinamida 20-30 2g Bactericida (pH ácido) Etambutol 25-15 2,5 g Bacteriostático Aminoglucósidos Estreptomicina Kanamicina Amicacina Capreomicina 15-30 1g Bactericida (organismos en multiplicación activa) Adultos 400 mg/12 horas 500-1500 mg/12 horas 800 mg 1,5 g Bactericida débil 15-20 (en 2-3 dosis) 1g Bactericida 200-300 (en tres dosis) 10g Bacteriostático Fluoroquinolonas Ofloxacino Ciprofloxacino Tioamidas Etionamida Protionamida PAS Altet MN, et al(62). cos, en los que se incluían dos o tres a los que la cepa del adulto índice fuera sensible. En el caso de la INH se determinó que en la mitad de los pacientes pediátricos Libro II curso 31/1/05 17:26 P gina 39 39 Novedades en tuberculosis con resistencia primaria esta era de bajo nivel (concentración inhibitoria mínima menor de 2 µg/mL), siendo superada con tratamiento a dosis de 15-20 mg/kg/día(32,34,69). El EMB se ha aceptado como fármaco de primera línea en el tratamiento de la TBC, estando recomendado en niños por encima de los 5 años. Revisiones de ensayos clínicos llevados a cabo en niños menores de 5 años no han revelado complicaciones oculares importantes durante el tratamiento con este fármaco, siendo la dosis utilizada de 15 mg/kg/día, considerándose un fármaco esencial en el tratamiento de la TBC-MDR, incluso en niños por debajo de los 5 años. En definitiva, es importante asociar EMB como cuarto fármaco cuando se sospeche resistencia a la INH, o en aquellos pacientes con riesgo más elevado de resistencias(73,74). Las fluoroquinolonas no están recomendadas en niños por el daño en el cartílago de crecimiento que pueden producir. Las revisiones efectuadas refieren como posibles efectos secundarios las artralgias en niños que recibieron ofloxacino durante un período de seis a doce meses de duración(75-77). Otro fármaco utilizado es la etionamida que produce importantes efectos secundarios gastrointestinales, motivo por el que causa problemas de adherencia al tratamiento. En cada uno de los artículos revisados, la duración del tratamiento estuvo en función de la extensión de la enfermedad, oscilando entre nueve meses en las formas de TBC primaria leve, y un año tras el úl- timo cultivo negativo en las formas severas de TBC- MDR(65,70,71,78). CONCLUSIONES En el momento actual se precisa un nuevo consenso para tratar de erradicar la TBC en España. Este consenso debe actualizar los criterios de positividad de la PT en nuestro país, teniendo en cuenta las circunstancias epidemiológicas nuevas a las que estamos asistiendo, como son la inmigración de países con alta prevalencia en TBC y la infección por el VIH. Por otra parte, debido a la poca especificidad de la PT, con posibilidad de presentar falsos positivos en pacientes vacunados con BCG o en infectados por Micobacterias atípicas, sería importante encontrar otras pruebas o determinaciones que sean capaces de evaluar la infección TBC con mayor especificidad que la PT. En este sentido, la técnica “ELISPOT” diferencia claramente entre pacientes infectados por MT de las positividades de la PT debidas a vacunación BCG, o infectados por Mycobacterium bovis u otras Micobacterias atípicas. Detecta infecciones precoces y latentes por MT, aportando resultados en menos de 24 horas y permitiendo, por tanto, el inicio rápido de la terapéutica correcta. Por todo ello “ELISPOT” constituye una posible alternativa a la PT, aunque aún se precisan más estudios antes de recomendar su empleo de forma rutinaria. Por último, el especialista en pediatría debe actualizar los estándares para el tra- Libro II curso 31/1/05 17:26 P gina 40 40 C. Oliva Hernández, et al. tamiento de la TBC, ya que las resistencias a los fármacos de primera línea han pasado de ser casos individualizados debidos a mutaciones espontáneas del bacilo tuberculoso o a fracaso del tratamiento del caso índice, a casos de multirresistencia difíciles de diagnosticar y tratar, sobre todo, porque la base epidemiológica no está del todo clara, ya que debido al auge del turismo, la inmigración, etc., se está conformando una población microbiológica muy cosmopolita, que no tiene en cuenta límites geográficos. Ya que no disponemos de estudios actuales que nos puedan guiar en la con- formación de una terapia estandarizada para casos multirresistentes, y debido a la gran amenaza que esto supone para la población pediátrica, se hace necesario establecer cuanto antes un consenso que nos permita seguir una pauta determinada en el manejo de estos pacientes y su contexto familiar/epidemiológico. Actualmente se sigue una serie de recomendaciones, mezcla de conocimientos generales, extrapolaciones y opiniones de expertos, pero sin conformar un protocolo estándar. BIBLIOGRAFÍA 1. Consenso Nacional para el control de la Tuberculosis en España. Med Clin (Barc) 1992; 98: 24-31. 2. American Thoracic Society, Centers for Disease Control and Prevention. Diagnosis Standards and Classification of Tuberculosis in adults and children. Am J Resp Crit Care Med 2000; 161:1376-95. 3. Caminero Luna JA. Diagnóstico serológico de la Tuberculosis. En: Guía de la Tuberculosis para médicos especialistas. Unión Internacional contra la Tuberculosis y Enfermedades Respiratorias (UICTER).París: UICTER, 2003; p. 148-50. 4. Alcaide Megías J, Altet Gómez MN. Infecciones por Micobacterias. En: Cobos N, PérezYarza EG (eds.). Tratado de Neumología Infantil. Madrid: Ergon, 2003; p. 427-55. 5. Caminero Luna JA. Tuberculosis Infantil. En: Guía de la Tuberculosis para médicos especialistas. Unión Internacional contra la Tuberculosis y Enfermedades Respiratorias (UICTER). París: UICTER, 2003; p. 291-302. 6. Caminero Luna JA. Diagnóstico de la Infección Tuberculosa. Prueba de la Tuberculina. En: Guía de la Tuberculosis para médicos especialistas. Unión Internacional contra la Tuberculosis y Enfermedades Respiratorias (UICTER). París: UICTER, 2003; p. 6076. 7. Asociación Española de Pediatría. Grupo de trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica. Interpretación de la prueba de tuberculina en niños. An Pediatr (Barc) 2003; 59: 582-5. 8. Protocolo del tratamiento de la Tuberculosis Infantil. Sociedad Española de Neumología Pediátrica. An Esp Pediatr 1998; 48: 89-97. 9. Caminero Luna JA. Vacunación BCG. En: Guía de la Tuberculosis para médicos especialistas. Unión Internacional contra la Tuberculosis y Enfermedades Respiratorias (UICTER). París: UICTER, 2003; p. 273-90. 10. Chee CBE, Soh CH, Boudville IC, Chor SS, and Wang YT. Interpretation of tuberculin Libro II curso 31/1/05 17:26 P gina 41 Novedades en tuberculosis skin test in Mycobacterium Bovis BCG-vaccinated Singaporean schoolchildren. Am J Respir Crit Care Med 2001; 164: 958-61. 11. Chadelat K. Conduite à tenir devant une intradermoreaction à tuberculine-positive; Guidelines for positive tuberculin test. Archives de Pediatrie 2003; 10: 1109-12. 12. Masvidal Aliberch RM, Miguel Gil B, Vall Mayans M, Zabaleta del Olmo E, Carnero Olmedo E, Rodríguez de la Rubia Rodríguez Manzaneque C. Estudio de la infección tuberculosa en una zona de gran incidencia de Tuberculosis y con un elevado porcentaje de inmigrantes. An Pediatr (Barc) 2004; 60: 22-7. 13. American Thoracic Society, Centers for Disease Control and Prevention. Targeted tuberculin testing and treatment of latent Tuberculosis Infection. Am J Resp Crit Care Med 2000; 161:S 221-47.En http://www. ajrccm.ats_journals. org. 14. Oliva Hernández C, Velasco González V, Callejón Callejón A. Tuberculosis infantil: formas de presentación inusual. An Esp Pediatr 2000; 52: 53-60. 15. Oliva Hernández C. Diagnóstico y tratamiento de la Tuberculosis pulmonar. En: I Curso Nacional de actualización en Neumología Pediátrica. Madrid: (eds.) Ergon, 2004; p. 35-52. 16. Steiner P, Rao M, Victoria MS. Persistently negative tuberculin reactions: their presence among children culture positive for Mycobacterium Tuberculosis. Am J Dis Child 1980; 134:747-50. 17. Huebner RE, Schein MF, Bass JB Jr. The tuberculin skin test. Clin Infect Dis 1993; 17: 968-75. 18. Zuber PL, Mckenna MT, Binkin NJ, Onorato IM, Castro KG. Long-term risk of tuberculosis among foreign-born persons in the United States. JAMA 1997; 278:304-7. 19. Rose AM, Watson JM, Graham C, Nunn AJ, Drobniewski F, Ormerod LP, et al. Public Health Laboratory Service/British Thoracic So- 41 ciety/Department of Health Collaborative Group. Tuberculosis at the end of the 20th century in England and Wales: Results of a national survey in 1998. Thorax 2001; 56: 173-9. 20. Jasmer RM, Nahid P, Hopewell PC. Clinical Practice: Latent Tuberculosis Infection. N Engl J Med 2002; 347:1860-6. 21. Ewer K, Deeks J, Alvarez L, Bryant G, Waller S, Andersen P, et al. Comparison of T-Cellbased assay with Tuberculin skin test for diagnosis of Mycobacterium Tuberculosis Infection in a school Tuberculosis outbreak. Lancet 2003; 361:1168-73. 22. Andersen P, Munk ME, Pollock JM, Doherty TM. Specific Immune-based diagnosis of Tuberculosis. Lancet 2000; 356:1099-104. 23. Lein AD, Von Reyn CF, Raun P, Horsburgh CR Jr, Alexander LN, Andersen P. Cellular immune responses to ESAT-6 discriminate between patients with pulmonary disease due to Mycobacterium avium complex and those with pulmonary disease due to Mycobacterium tuberculosis. Clin Diagn Lab Immunol 1999; 6:606-9. 24. Harboe M, Oettinger T, Wiker HG, Rosenkrands I, Andersen P. Evidence for occurrence of the ESAT-6 protein in Mycobacterium Tuberculosis and virulent Mycobacterium Bovis and for its absence in Mycobacterium bovis BCG. Infect Immun 1996; 64: 16-22. 25. Barnes PF. Diagnosis latent Tuberculosis Infection: The 100-year upgrade. Am J Respir Crit Care Med 2001; 163:807-8. 26. Lalvani A, Brookes R, Hambleton S, Britton WJ, Hill AV, Mc Michael AJ. Rapid effector function in CD8+ memory T cells. J Exp Med 1997; 186:859-65. 27. Lalvani A, Pathan AA, Mc Shane H, Wilkinson RJ, Latif M, Conlon CP, et al. Rapid dectection of Mycobacterium Tuberculosis Infection by enumeration of antigen-specific T cells. Am J Respir Crit Care Med 2001; 163:824-8. Libro II curso 31/1/05 17:26 P gina 42 42 28. Mahairas GG, Sabo PJ, Hickey MJ, Singh DC, Stover CK. Molecular analysis of genetic differences between Mycobacterium Bovis BCG and virulent M. Bovis. J Bacteriol 1996; 178: 1274-82. 29. Arend SM, Andersen P, van Meijgaarden KE, Skjot RL, Subronto YW, van Dissel JT, et al. Detection of active Tuberculosis infection by T cell responses to early-secreted antigenic target 6-kDa protein and culture filtrate protein 10. J Infect Dis 2000; 181:185054. 30. David HL, Newman CM. Some observations on the genetics of isoniazid resistance in the tubercle bacilli. Am Rev Respir Dis 1971; 104:508-15. 31. Mahmoudi A, Iseman MD. Pitfalls in the care of patients with tuberculosis: common errors and their association with the acquisition of drug resistance. JAMA 1993; 270: 65-8. 32. Canetti G. The J. Burns Amberson Lecture: present aspects of bacterial resistance in tuberculosis. Am Rev Respir Dis 1965; 92:682703. 33. Espinal MA, Laszlo A, Simonsen L, Boulahbal F, Kim SJ, Reniero A, et al. Global trends in resistance to antibuberculosis drugs. World Health Organization-International Union against Tuberculosis and Lung Disease Working Group on Anti-Tuberculosis Drug Resistance Surveillance. N Engl J Med 2001; 344:1294-303. 34. Dye C, Espinal MA, Watt CJ, Mbiaga C, Williams BG. Worldwide incidence of multidrug-resistant tuberculosis. J Infect Dis 2002; 185:1197-202. 35. American Thoracic Society, Centers for Disease Control and Infectious Diseases Society of America. Treatment of Tuberculosis. MMWR 2003; 52:RR-11. En http://www. cdc.gov/mmwr/preview/mmwrhtml/rr5211a 1.htm 36. Woods GL. Susceptibility testing for mycobacteria. Clin Infect Dis 2000; 31: 1209- C. Oliva Hernández, et al. 15. En: http://www.nccls.org/microbiology.htm 37. Moghazeh SL, Pan X, Arain T, Stover CK, Musser JM, Kreiswirth BN. Comparative antimicrobial activities of rifampin, rifapentine, and KRM-1648 against a collection of rifampin-resistant Mycobacterium tuberculosis isolates with known rpoB mutations. Antimicrob Agents Chemother 1996; 40: 265557. 38. Bodmer T, Zürcher G, Imboden I, Telenti A. Molecular basis of rifabutin susceptibility in rifampicin-resistant M. tuberculosis. J Antimicrob Chemother 1995; 35:345-8. 39. National Committee for Clinical Laboratory Standards (NCCLS). Susceptibility testing of mycobacteria, Nocardia, and other aerobic actinomycetes. 2nd ed. Tentative standard M24-T2. Wayne, PA: National Committee for Clinical Laboratory Standards; 2000. En: http:// www.nccls.org/microbiology.htm 40. Heifets, L. Drug susceptibility testing. Clin Lab Med 1996; 16:641-56. 41. Kent PT, Kubica GP. Antituberculosis chemotherapy and drug susceptibility testing. En: Kent PT, Kubica GP. Public health mycobacteriology: a guide for the level III laboratory. Atlanta: Centers for Disease Control, 1985; p. 159-84. 42. Tenover FC, Crawford JT, Huebner RE, Geiter LJ, Horsburgh CR Jr, Good RC. The resurgence of tuberculosis: is your laboratory ready? J Clin Microbiol 1993; 31:767-70. 43. Moore M, Onorato IM, McCray E, Castro KG. Trends in drug-resistant tuberculosis in the United States 1993-1996. JAMA 1997; 278:833-7. 44. Inderlied CT, Salfinger M. Antimicrobial agents and susceptibility tests: mycobacteria. En Murray PR, Baron EJ, Pfaller MS, Tenover FC and Yolken RH,(eds.). Manual of Clinical Microbiology. 7th ed. . Washington DC: American Society for Microbiology, 1999; p. 1601-23. Libro II curso 31/1/05 17:26 P gina 43 Novedades en tuberculosis 45. Parsons LM, Driscoll JR, Taber HW, and Salfinger M. Drug resistance in mycobacteria. Infect Dis Clin North Am 1997; 11:905-28. 46. Van Embden J, Cave MD, Crawford JT, Dale JW, Eisenach KD, Gicquel B, et al. Strain identification of Mycobacterium tuberculosis by DNA fingerprinting: recommendations for a standardized methodology. J Clin Microbiol 1993; 31:406-9. 47. Dunlap NE, Harris R, Benjamín WH Jr, Harden J,Hafner D. Laboratory contamination of M tuberculosis (MTB) cultures. Am J Respir Crit Care Med 1995; 152:1702-4. 48. Valway S, Sánchez M, Shinnick T, Orme I, Agerton T, Hoy D, et al. An outbreak involving extensive transmission of a virulent strain of Mycobacterium tuberculosis. N Engl J Med 1998; 338:633-9. 49. Behr M, Small P. Molecular fingerprinting of Mycobacterium tuberculosis how can it help the clinician? Clin Infect Dis 1997; 15:806-10. 50. Kimerling ME, Benjamin WH Jr, Lok K, Curtis G, Dunlap NE. Restriction fragment length polymorphism (RFLP) screening of MTB isolates: population surveillance for targeting disease transmission in a community. Int J Tuberc Lung Dis 1998; 2:65562. 51. Braden C, Templeton G, Cave M, Valway S, Onorato I, Castro K, et al. Interpretation of restriction fragment length polymorphism analysis of Mycobacterium tuberculosis isolates from a state with a large rural population. J Infect Dis 1997; 175:1446-52. 52. Schaaf HS, Shean K, Donald PR. Culture confirmed multidrug resistant tuberculosis: diagnostic delay, clinical features and outcome. Arch Dis Child 2003; 88:1106-11. 53. World Health Organization. Treatment of tuberculosis: guidelines for national programmes. Geneva: World Health Organization; 1996. WHO/TB/96.199. En: http:// www.who.int/grb/publications. 43 54. Enarson DA, Rieder HL, Arnadottir T, Trébucq A. Management of tuberculosis: a guide for low income countries. International Union against Tuberculosis and Lung Disease. 5th edition. 2000. En: http://www. iuatld.org/assets/images/Management-ofTB. 55. Espinal MA, Kim SJ, Suárez PG, Kam KM, Khomenko AG, Migliori GB, et al. Standard short-course chemotherapy for drug-resistant tuberculosis: treatment outcome in six countries. JAMA 2000; 283:2537-45. 56. García García M, Ponce de León A, Jiménez Corona ME, Jiménez Corona A, Palacios-Martínez M, Balandrano Campos S, et al. Clinical consequences and transmissibility of drug-resistant tuberculosis in southern Mexico. Arch Intern Med 2000; 160:630-6. 57. Goble M, Iseman MD, Madsen LD, Waite D, Ackerson L, Horsburgh CR Jr. Treatment of 171 patients with pulmonary tuberculosis resistant to isoniazid and rifampin. N Engl J Med 1993; 328:527-32. 58. Park SK, Kim CT, Song SD. Outcome of chemotherapy in 107 patients with pulmonary tuberculosis resistant to isoniazid and rifampin. Int J Tuberc Lung Dis 1998; 2:877-84. 59. Geerligs WA, Van Altena R, de Lange WCM, Van Soolingen D, Van der Werf TS. Multidrug-resistant tuberculosis: long-term treatment outcome in the Netherlands. Int J Tuberc Lung Dis 2000; 4:758-64. 60. Frieden TR, Sherman LF, Maw KI, Fujiwara PI, Crawford JT, Nivin B, et al. A multi-institutional outbreak of highly drug-resistant tuberculosis: epidemiology and clinical outcomes. JAMA 1996; 276:1229-35. 61. Mitchison DA, Nunn AJ. Influence of initial drug resistance on the response to shortcourse chemotherapy of pulmonary tuberculosis. Am Rev Respir Dis 1986; 133:42330. 62. Altet Gómez MN, Alcaide Megías J, Pascual Sánchez MT. Tuberculosis Infantil Resisten- Libro II curso 31/1/05 17:26 P gina 44 44 C. Oliva Hernández, et al. te a Fármacos. Monografías de Pediatría. Tuberculosis en la Infancia (II) 2000; 124:195212. 63. Van Rie A, Warren R, Richardson M, Gie RP, Enarson DA, Beyers N, et al. Classification of drug-resistant tuberculosis in an epidemic area. Lancet 2000; 356:22-5. 64. Schaaf HS, Van Rie A, Gie RP, Beyers N, Victor TC, Van Helden PD, et al. Transmission of multidrug resistant tuberculosis. Pediatr Infect Dis J 2000; 19:695-9. 65. Schaaf HS, Gie RP, Kennedy M, Beyers N, Hesseling PB, Donald PR. Evaluation of young children in contact with adult multidrug-resistant pulmonary tuberculosis: a 30–month follow-up. Pediatrics 2002; 109: 765-71. 66. Schaaf HS, Vermeulen HAS, Gie RP, Beyers N, Donald PR. Evaluation of young children in household contact with adult multidrugresistant pulmonary tuberculosis cases. Pediatr Infect Dis J 1999; 18:494-500. 67. Beyers N, Gie RP, Schaaf HS, van Zyl S, Nel ED, Talent JM, et al. Delay in the diagnosis, notification and initiation of treatment and compliance in children with tuberculosis. Tuberc Lung Dis 1994; 75:260-5. 68. Schaaf HS, Botha P, Beyers N, Gie RP, Vermeulen HA, Groenewald P, et al. The 5- year outcome of multidrug resistant tuberculosis patients in the Cape Province of South Africa. Trop Med Int Health 1996; 1:71822. 69. Schaaf HS, Gie RP, Beyers N, Sirgel FA, de Klerk PJ, Donald PR. Primary drug- resistant tuberculosis in children. Int J Tuberc Lung Dis 2000; 12:1149-55. 70. Centers for Disease Control and Prevention. Management of persons exposed to multidrug-resistant tuberculosis. MMWR Morb Mortal Wkly Rep 1992; 41(RR-11):61-71. 71. Joint Tuberculosis Committee of the British Thoracic Society. Chemotherapy and management of tuberculosis in the United Kingdom: recommendations. Thorax 1998; 53:536-48. 72. Swanson DS, Starke JR. Drug-resistant tuberculosis in pediatrics. Pediatr Clin North Am 1995; 42:553-81. 73. Trèbucq A. Should ethambutol be recommended for routine treatment of tuberculosis in children? A review of the literature. Int J Tuberc Lung Dis 1997; 1:12-5. 74. Graham SM, Daley HM, Banerjee A, Salaniponi FM, Harries AD. Ethambutol in tuberculosis: time to reconsider? Arch Dis Child 1998; 79:274-8. 75. Redmond AO. Risk-benefit experience of ciprofloxacin use in pediatric patients in the United Kingdom. Pediatr Infect Dis J 1997; 16:147-9. 76. Schaad UB. Pediatric use of quinolones. Pediatr Infect Dis J 1999; 18:469-70. 77. Maranetra KN. Quinolones and multidrugresistant tuberculosis. Chemotherapy 1999; 45:12-8. 78. Iseman MD. Treatment and implications of multidrug-resistant tuberculosis for the 21th century. Chemotherapy 1999; 45: 34-40. Libro II curso 31/1/05 17:26 P gina 45 Infección viral y sibilancias recurrentes M. Navarro Merino, M. Haro Gómez, G. Pérez Pérez, M. Romero Pérez Sección de Neumología Infantil. Unidad de Fibrosis Quística. Hospital Universitario Virgen Macarena. Sevilla RESUMEN Las sibilancias recurrentes en los primeros años de la vida constituyen una de las patologías más prevalentes de la edad pediátrica. En este capítulo abordaremos en primer lugar el estudio de la bronquiolitis aguda, analizando aspectos clínicos y epidemiológicos. Posteriormente estudiaremos la patogenia de la inflamación pulmonar inducida por el virus respiratorio sincitial (VRS) y su relación con el desarrollo posterior de sibilancias recurrentes e hiperreactividad bronquial (HRB). En cuanto al tratamiento de la bronquiolitis aguda abordaremos la problemática actual, debido a que con la mayoría de las intervenciones terapéuticas las evidencias de su eficacia son muy pobres. Por último, analizaremos las dificultades del manejo del lactante con sibilancias recurrentes, ya que al no disponer de un test predictivo seguro y no saber inicialmente que niños van a evolucionar hacia sibilancias transitorias precoces o persistentes, el tratamiento estará basado en la intensidad y frecuencia de los síntomas. Libro II curso 31/1/05 17:26 P gina 46 46 INTRODUCCIÓN Las sibilancias recurrentes en los primeros años de vida constituyen una de las patologías más prevalentes de la edad pediátrica, tienen como expresión común la obstrucción recurrente de la vía aérea; pero sus mecanismos fisiopatológicos son complejos y hetereogéneos, y esto va a condicionar que sea difícil predecir en un paciente concreto cual va a ser su evolución a largo plazo y la respuesta al tratamiento. Numerosos estudios han mostrado desde hace décadas que la mayoría de los episodios de sibilancias en el niño están favorecidos por infecciones virales(1). En la actualidad el virus respiratorio sincitial (VRS) constituye la primera causa de bronquiolitis y hospitalización secundaria a infección respiratoria de la pequeña vía aérea (IRPVA) en niños menores de 2 años(2). Además de la morbilidad aguda causada por el VRS, numerosos estudios han descrito la asociación entre la infección por el VRS en la infancia y el desarrollo posterior de sibilancias recurrentes e hiperreactividad bronquial (HRB)(3,4,5,6). El objetivo del presente artículo es el análisis de los distintos factores, tanto epidemiológicos, del huésped o de la respuesta inflamatoria tras la infección viral que pueden contribuir a la obstrucción de la vía aérea y al aumento de la HRB que se observa durante la infección viral y a los episodios de sibilancias recurrentes posteriores, que pueden ser variables entre pacientes en cuanto al porcentaje de incidencias, como a su prolongación en el tiempo. M. Navarro Merino, et al. Dado que el VRS es el agente etiológico más frecuente y la bronquiolitis el cuadro más lesivo, haremos referencia fundamentalmente a la tríada VRS-bronquiolitis-sibilancias recurrentes. EPIDEMIOLOGÍA La bronquiolitis es una enfermedad inflamatoria aguda de las vías aéreas inferiores (bronquiolos) que produce una obstrucción de la pequeña vía aérea. Esta enfermedad se presenta de forma epidémica desde octubre hasta abril, y se manifiesta inicialmente como una infección respiratoria de las vías altas con rinorrea, estornudos y tos, en ocasiones con fiebre, y posteriormente se añaden los signos de dificultad respiratoria aguda: taquipnea, cianosis, aleteo nasal y tiraje intercostal. La bronquiolitis se produce típicamente en niños menores de seis meses, aunque puede aparecer hasta los dos años de edad. Los niños mayores de esta edad y los adultos toleran mejor el edema bronquiolar, y cuando sufren una infección por el VRS (u otro virus) no presentan el cuadro clínico de la bronquiolitis del lactante. Se sugiere que los niños con una función pulmonar alterada al nacimiento tienen más probabilidad de padecer una bronquiolitis cuando se infectan por VRS(7,8). También los hijos de madres fumadoras (fundamentalmente durante el embarazo), lactantes que no tienen lactancia materna, condiciones de hacinamiento, título bajo de anticuerpos contra el VRS, asistencia a guardería y naci- Libro II curso 31/1/05 17:26 P gina 47 Infección viral y sibilancias recurrentes miento entre abril y septiembre, tienen mayor probabilidad de padecer bronquiolitis Numerosos estudios han mostrado desde hace décadas que la mayoría de los episodios de sibilancias en el niño están favorecidos por infecciones virales(1). Clásicamente, los virus identificados con más frecuencia en los aspirados son VRS, parainfluenza y adenovirus(9). Sin embargo, en los últimos años ha aumentado la importancia de los rinovirus, que se han identificado hasta en el 25% de los niños menores de un año ingresados por infección de las vías aéreas inferiores(10). Además, recientemente se ha descrito en Holanda(11) un nuevo agente viral, desconocido hasta ahora, el metapneumovirus, que aunque infecta a personas de todas las edades, produce mayor afectación clínica en lactantes y niños pequeños. En España se ha descrito recientemente una serie de lactantes menores de dos años ingresados por infección respiratoria, en los que el metapneumovirus fue el tercer agente causal en frecuencia, tras el VRS y el adenovirus. Las manifestaciones clínicas más frecuentes en estos niños fueron las sibilancias recurrentes y la bronquiolitis(12). En la actualidad, el virus respiratorio sincitial constituye la primera causa de bronquiolitis en niños menores de 2 años(2). En un estudio multicéntrico realizado en Argentina con 1.178 niños menores de 5 años, hospitalizados por infección aguda de las vías respiratorias bajas, se aisló el VRS en el 78,2% de todos los casos positivos (que representaron el 32% del total). La incidencia del VRS fue estadísticamente ma- 47 yor que la de los otros virus (p<0,001)(13). El virus respiratorio sincitial es un virus ARN, perteneciente al género Pneumovirus y la familia Paramixoviridae. Fue identificado inicialmente en 1956 como el agente causal de un brote de infección respiratoria en una colonia de chimpancés(14), y aislado por primera vez en lactantes con bronquiolitis en 1957, y en 1975 se le asignó el nombre de “virus respiratorio sincitial”, por su capacidad de formar sincitios en cultivos celulares in vitro. Es un virus no segmentado, estable, formado por una única cadena de ARN en sentido negativo, constituido por 11 proteínas de diferentes pesos moleculares(15). Sólo dos de ellas son proteínas no estructurales (NS1, NS2) y se encuentran, por tanto, presentes únicamente en las células infectadas, no en los viriones. Entre las proteínas estructurales, las glucoproteínas G y F, asociadas a la envoltura, son las más importantes desde el punto de vista inmunológico. Desempeñan funciones de adhesión y fusión, respectivamente, y son responsables del mantenimiento de la replicación viral de una célula a otra. Variaciones antigénicas en la proteína G y también en las proteínas F, N, P, son responsables de que existan dos tipos distintos de VRS: A y B(16). La prevalencia de la infección por VRS es tan universal en la infancia que, prácticamente todos los niños sufren una infección en los primeros años de vida. En un estudio en el que se observó a 125 niños desde que nacieron hasta los 12 meses, y se siguió a 92 entre los 24 y los 60 meses de edad, todos menos uno habían sufrido, al menos, una infección por el VRS Libro II curso 31/1/05 17:26 P gina 48 48 antes de los 2 años. Del 68% (85/125) de los niños infectados en el primer año de vida, el 21,6% (27/125) mostraba indicios de enfermedad respiratoria baja. Asimismo, dos lactantes (1,6%) fueron hospitalizados por bronquiolitis; ambos tenían menos de 3 meses cuando padecieron la infección(17). (Fig. 1) PATOGENIA La patogenia de la inflamación pulmonar inducida por el VRS es multifactorial. La replicación viral en las células epiteliales es un acontecimiento esencial en el comienzo de la respuesta inmunitaria y la inflamación de las vías respiratorias. La respuesta inflamatoria a la infección viral se manifiesta por aumento de la secreción nasal, edema de las mucosas e infiltración de células inflamatorias. Se produce, por una parte, un efecto citopático directo del virus sobre el epitelio respiratorio y, por otra, una inflamación mediada por mecanismos neuronales (sustancia P y neurocinina) y por la inmunidad innata y adaptativa. Casi todos los componentes del sistema inmunitario han sido implicados en la patogenia de la infección por el VRS, incluida una selección de células inflamatorias y sus productos. Se han propuesto distintos mecanismos para explicar la asociación entre la infección por VRS en etapas tempranas de la vida y el desarrollo posterior de HRB; sin embargo, los mecanismos implicados en la evolución hacia este estado o secuelas no están aún completamente definidos. Entre los me- M. Navarro Merino, et al. canismos que entran en juego en el proceso patogénico de la bronquiolitis destacan los siguientes: a. Neuropéptidos y sensibilización aumentada de ciertos receptores (sustancia P y neurocinina 1 [NK1]) que además de ocasionar HRB actúan como moléculas proinflamatorias, atrayendo y activando leucocitos(18,19). b. Prostaglandinas, leucotrienos y otros metabolitos celulares. Los cisteinil leucotrienos (CysLT) tienen un interés especial en la infección por el VRS, debido a su capacidad para inducir la obstrucción de las vías respiratorias. La liberación de CysLT en las vías respiratorias durante la infección por el VRS posiblemente juegue un papel relevante en las sibilancias observadas en la bronquiolitis (20). Sus efectos comprenden broncoconstricción potente, reclutamiento de eosinófilos, estimulación de la producción de moco y aumento de la permeabilidad vascular(21). La inflamación y la exposición crónica de la pared de las vías respiratorias a los CysLT también pueden favorecer la hipertrofia del músculo liso (Fig. 2). c. Activación de mastocitos, eosinófilos e IgE, debido a una desviación persistente hacia una respuesta Th2 (mediada por las citocinas IL-4,5,9,13) (Fig. 3). Parece que la mayoría de niños durante el primer episodio de bronquiolitis producen inmunoglobulina E (IgE) antiVRS. Pero es sobre todo la cantidad, persistencia y duración de esta respuesta la que parece estar directamente relacio- Libro II curso 31/1/05 17:26 P gina 49 49 Niños con infección por VRS (%) Infección viral y sibilancias recurrentes 100 80 97,1 % 100,0 % 13-24 25-36 68,0 % 60 40 20 0 0-12 Edad (meses) Figura 1. Prevalencia de la infección por el VRS. Glezen WP, et al. Am J Dis Child 1986;140:543-546. Aumento de la secreción de moco Descenso del transporte de moco Proteínas catiónicas (lesión de las células epiteliales) Epitelio de las vías respiratorias Mayor liberación de taquicininas Vaso sanguíneo Fibras C sensitivas CysLT Musculo liso Edema Contracción y proliferación Células inflamatorias (p.ej., mastocitos, eosinófilos) Figura 2. Respuesta inflamatoria a la infección por el VRS. Adaptado de Hay DW, et al. Trends Pharmacol Sci 1995;16:304-309 Libro II curso 31/1/05 17:26 P gina 50 50 M. Navarro Merino, et al. VRS Th1 Activación de los Th2 linfocitos T Macrófagos Linfocitos NK Neutrófilos TNF α, β RANTES IL-1 IL-6 IFNγ IL-4, IL-5 Basófilos Mastocitos Eosinófilos Cisteinil leucotrienos (CysLT) Mediadores inflamatorios Sibiliancias Figura 3. Cascada inflamatoria con desviación de respuesta hacia linfocitos Th2. Adaptado de van Schaik SM, et al. Pediatr Pulmonol 2000;30:131-138. nada con el desarrollo posterior de sibilancias recurrentes y/o asma(22). d. Liberación de citocinas inmunorreguladoras proinflamatorias, como interleucina 4, IL-6, RANTES, MIP-1, eotaxina, IL-8, y factor de necrosis tumoral alfa (TNF-α) que movilizan otras células al lugar de la infección(23). EVOLUCIÓN Además de la morbilidad aguda causada por el VRS, numerosos estudios han demostrado la asociación entre infección por VRS en la infancia y el desarrollo posterior de sibilancias recurrentes e hiperreactividad bronquial (HRB)(3-6). Es evidente que los ni- ños que han padecido una bronquiolitis aguda tienen con más frecuencia episodios de sibilancias recurrentes durante el primer o segundo año tras el episodio agudo, pero ¿qué ocurre en edades posteriores? Nosotros en un estudio prospectivo sobre una cohorte de 98 niños que fueron ingresados por bronquiolitis y seguidos durante el primer año tras el episodio agudo, comprobamos que el 66% de los pacientes tuvo sibilancias recurrentes, siendo factores de riesgo el sexo masculino, los antecedentes familiares de asma y la exposición al humo del tabaco en la vivienda del niño(24). Un resumen de los estudios retrospectivos y prospectivos disponibles de niños con infección respiratoria baja por el VRS Libro II curso 31/1/05 17:26 P gina 51 Infección viral y sibilancias recurrentes leve-moderada o grave, muestra que la infección en la lactancia puede asociarse a un mayor riesgo de síntomas bronquiales obstructivos varios años después de la infección, y que la función pulmonar puede quedar afectada durante varios años(25). Rooney y Williams(6) siguieron hasta los 7 años de vida a un grupo de 62 pacientes diagnosticados de bronquiolitis por el VRS en la época de lactante. Observaron que el 57% de los pacientes desarrolló posteriormente episodios de sibilancias recurrentes y de ellos, el 71% tenía antecedentes familiares de asma. Por otro lado, el 38% de los pacientes no desarrolló episodios posteriores de hiperreactividad bronquial, y sólo existía historia familiar de asma en un 18%. Estos hallazgos iniciales se han ido consolidando a lo largo de los años; así, Sigurs(26), en un estudio de 140 niños, 47 de los cuales fueron hospitalizados por bronquiolitis por el VRS durante la época de lactante, el 30% del grupo VRS había desarrollado asma a los 7,5 años, en comparación con el 3% en el grupo control (p=0,001). La prevalencia acumulada de “todas las sibilancias” fue del 68 y del 34%, respectivamente (p 0,001). Stein(27) realizó un estudio de 888 niños seguidos de forma ambulatoria y prospectiva hasta los 13 años de edad que fueron evaluados por su pediatra cada vez que mostraban signos o síntomas de enfermedad de las vías respiratoria bajas y se sometieron a pruebas de detección de virus y otros agentes. De ellos, el 43,9% (207/427) habían padecido una infección respiratoria baja por el VRS antes de los 3 51 años y ninguno había precisado hospitalización. Aquéllos que habían presentado infecciones por el VRS antes de los 3 años tuvieron 3,2 más probabilidades de sufrir sibilancias infrecuentes y 4,3 más probabilidades de mostrar sibilancias frecuentes a los 6 años, en comparación con los otros niños. El riesgo de sufrir sibilancias frecuentes e infrecuentes disminuyó con la edad y dejó de ser significativo a los 13 años. Estos dos últimos trabajos, ponen de manifiesto que la infección por el VRS se asocia de forma significativa con un riesgo aumentado de padecer sibilancias recurrentes no sólo en los lactantes que desarrollaron bronquiolitis grave y necesitaron hospitalización(26), sino también en niños con bronquiolitis que no requirieron hospitalización y fueron seguidos de forma ambulatoria(27). Pero independientemente del tipo de estudio realizado, en pacientes hospitalizados frente a ambulatorios; prospectivo frente a retrospectivo, la mayoría llegan a la conclusión de que la infección de vías aéreas bajas (IRPVA) por el VRS en la época de lactante se asocia con episodios de sibilancias recurrentes posteriores hasta en el 71% de los pacientes y se acompañan de alteración en las pruebas de función pulmonar a largo plazo. Tanto el FEV1 (volumen espiratorio máximo en el primer segundo) como el FEF 25-75 (flujo espiratorio entre el 25-75% de la capacidad vital forzada FVC) son menores en niños de edad escolar que padecieron una IRPVA por el VRS en edades tempranas de la vida, en comparación con el grupo control(3,26-30). Libro II curso 31/1/05 17:26 P gina 52 52 Infeccion viral por el VRS huésped Actualmente no esta claro si el VRS es el agente causal principal o si, por el contrario, es la existencia previa de predisposición genética en estos pacientes en los que el VRS desencadena el desarrollo de HRB posterior(31,32). Y así podríamos preguntarnos ¿es la infección por el VRS en etapas tempranas de la vida la responsable por sí sola de las alteraciones en la función pulmonar que se observan posteriormente? O, por el contrario, ¿es la combinación de la infección por el VRS en ciertas etapas de la vida con factores propios del huésped responsables de la HRB y las alteraciones de la función pulmonar? Como factores propios del huésped, parece que ciertos polimorfismos en los genes que codifican o regulan la expresión de la IL-8 y la proteína A del surfactante(32,34), parecen aumentar la predisposición a padecer asma. También hay datos que indican que el riesgo de HRB es mayor en lactantes que tienen la vía respiratoria más pequeña, han estado expuestos al tabaco o tienen historia familiar de asma o atopia(35,36). Sin embargo, la mayoría de lactantes infectados por VRS que desarrollan posteriormente HRB no tiene asociados factores de riesgo evidentes. TRATAMIENTO ACTUAL DE LA BRONQUIOLITIS El tratamiento de los niños con bronquiolitis no ha cambiado de manera sustancial en los últimos 25-30 años. Aunque habitualmente se utilizan tratamientos far- M. Navarro Merino, et al. macológicos, como broncodilatadores o corticoides en muchos centros, las evidencias de su eficacia en el momento actual son muy pobres. La oxigenoterapia es el único tratamiento demostrado eficaz en la actualidad para el episodio agudo de la bronquiolitis. Se debe utilizar para mantener una saturación de oxígeno por encima del 94%, evitando así las situaciones de hipoxia. Una adecuada hidratación debe tenerse en cuenta, procurando la vía oral siempre que sea posible y optando por la vía intravenosa si existe intolerancia alimentaria o dificultad respiratoria severa. Esta última situación suele observarse en los niños más pequeños. Los lactantes con bronquiolitis grave deben ser ingresados y vigilar mediante monitorización respiratoria las posibles crisis de desaturación y las pausas de apnea. En cuanto al tratamiento farmacológico, la terapia broncodilatadora (agonistas β2-adrenérgicos) está muy debatida. En una revisión sistemática de ocho ensayos con 394 niños se constató que, el tratamiento con broncodilatadores se asocia a un efecto beneficioso moderado a corto plazo de la bronquiolitis. Se observó un aumento estadísticamente significativo en el porcentaje de niños tratados con broncodilatadores en cuanto a una mejora de las puntuaciones clínicas, en comparación con los controles. No obstante, la magnitud de mejoría de la puntuación necesaria para considerarse clínicamente importante sólo se definió en un subgrupo del estudio, y sólo pudo utilizarse en ese subgrupo. En este subgrupo se incluyeron los Libro II curso 31/1/05 17:26 P gina 53 Infección viral y sibilancias recurrentes dos estudios que mostraron un efecto beneficioso sustancial, pero su metodología era más defectuosa, pues admitieron a pacientes con sibilancias recidivantes. No se apreció ningún efecto beneficioso en cuento a la oxigenación ni a la duración de la hospitalización con el uso de broncodilatadores(37). Un metaanálisis de tres estudios con pacientes hospitalizados y cinco con pacientes ambulatorios aportaron resultados inconcluyentes sobre la eficacia de los agonistas β2-adrenérgicos para el tratamiento de la bronquiolitis(38). Dado que no siempre es posible distinguir a un paciente asmático de uno con bronquiolitis y es por lo tanto imposible predecir la respuesta a los broncodilatadores, se aconseja que cuando exista duda se realice una prueba terapéutica con β2-adrenérgicos inhalados, y si no se encuentra respuesta clara, suspenderlos. Parece que podrían ser más útiles en el subgrupo de niños más mayores (edad superior a seis meses). Otro fármaco utilizado es la adrenalina nebulizada. En un estudio comparativo se ha sugerido la posibilidad de que era más efectiva que los β2-adrenérgicos en la bronquiolitis(39), pero esto no se ha seguido corroborando en otros estudios más recientes(40). En un metaanálisis Cochrane en el que incluyen 14 estudios, se determina que la adrenalina pudiera ser mejor que el efecto del placebo conseguido en los pacientes en un plazo corto tras la bronquiolitis. Pero este efecto beneficioso sólo se observó en los pacientes no hospitalizados, no ocurriendo igual en los pacientes hospitalizados, quienes no comprobó esta mejoría(41). 53 Aunque durante años se han utilizado los corticoides sistémicos para el tratamiento de la bronquiolitis aguda, la mayoría de los datos clínicos disponibles en la actualidad no respaldan su uso(42,43,44). En un ensayo controlado y aleatorizado de 118 lactantes (1-12 meses) hospitalizados por bronquiolitis, la dexametasona (3 dosis de 1 mg/kg al día) no mejoró la duración de la oxigenoterapia ni el tiempo transcurrido hasta la resolución de los síntomas(45). Un metaanálisis examinó varios ensayos prospectivos y controlados con placebo de corticoides sistémicos en la bronquiolitis de la lactancia. Los cinco estudios seleccionados evaluaron la duración de la hospitalización y de los síntomas con resultados poco concluyentes(46). La administración de corticoides sistémicos no modificó el curso agudo de la enfermedad, ni tuvo ningún impacto en los parámetros inflamatorios (recuento de leucocitos en aspirados nasales y traqueales, y concentraciones de citocinas y quemocinas) o de gravedad clínica (días de hospitalización, estancia en la unidad de cuidados intensivos y necesidad de ventilación mecánica). Además, los pacientes que recibieron placebo en las primeras 48 h eliminaron el virus en el tracto respiratorio inferior más rápidamente (p < 0,05) que el grupo que recibió dexametasona(47). Una revisión sistemática de varios ensayos controlados y aleatorizados de ribavirina para las infecciones respiratorias bajas por el VRS en lactantes y niños pequeños, puso de manifiesto que la ribavirina acorta la duración de la ventilación mecánica, lo que puede determinar una Libro II curso 31/1/05 17:26 P gina 54 54 reducción subsiguiente de los días totales de hospitalización. No se pudo demostrar que la ribavirina disminuyera de forma significativa la mortalidad o el deterioro respiratorio(48). En algunos estudios, el uso precoz de ribavirina redujo el número de episodios de HRB posteriores tras la infección por el VRS(49,50). De todas formas, en el momento actual, su uso es muy restrictivo y su papel dudoso(51). Se han realizado diferentes estudios con antagonistas de leucotrienos, tanto en seres humanos, como en modelos animales con diferentes resultados(52,53). El único estudio realizado en seres humanos se llevó a cabo en lactantes ingresados con bronquiolitis por el VRS con una media de edad al diagnóstico de 9 meses. Sesenta y un pacientes frente a 55 controles recibieron, comenzando el día 3-7 de hospitalización y durante 28 días, 5 mg diarios de montelukast, un antagonista del receptor de los cis-leucotrienos. Los efectos de montelukast empezaron a ser evidentes a las 2 semanas del inicio del tratamiento. Así, los lactantes que recibieron el antileucotrieno tuvieron más días libres de síntomas una vez pasada la fase de bronquiolitis, en comparación con el grupo placebo (6/28 frente a 1/28; p < 0,015), menos tos y tardaron más tiempo en desarrollar exacerbaciones de la enfermedad. Los pacientes que recibieron montelukast tardaron 23 días en tener una exacerbación frente a 8 días en el grupo placebo. No se observaron diferencias a largo plazo entre placebo y montelukast, a partir de las 4 semanas de finalizado el tratamiento(52). M. Navarro Merino, et al. Recientemente se han orientado los estudios sobre la quimioprofilaxis de la infección por el VRS. La gammaglobulina específica frente al VRS (IGIV-VRS) disminuye la incidencia de hospitalización y la gravedad de la bronquiolitis por el VRS en prematuros con o sin DBP. Tiene un gran inconveniente, que es la necesidad de su administración en perfusión intravenosa lenta mensualmente (750 mg/kg) durante toda la estación epidémica del VRS (octubre-marzo) así como su alto coste, por lo que su uso está muy limitado. En los últimos años se dispone de un anticuerpo monoclonal humanizado frente al VRS que inhibe específicamente un epitopo de la proteína F de los subtipos A y B del VRS. La dosis utilizada es de 15 mg/kg por vía intramuscular profunda cada 30 días durante la estación epidémica del VRS (generalmente suelen ser 5-6 dosis en los meses de octubre a marzo). Es un fármaco bien tolerado con escasas reacciones adversas (febrícula, irritabilidad, enrojecimiento en el lugar de la inyección). El estudio Impact-RSV(54), realizado en Norteamérica fue un estudio multicéntrico, controlado con placebo que incluyó 1.502 prematuros o lactantes con DBP y demostró que la hospitalización por bronquiolitis por el VRS se reducía en un 55% (4,8% vs 10,6% en el grupo placebo, p < 0,0001). Tras este estudio, la Academia Americana de Pediatría(55) recomendó el uso de palivizumab sólo en niños de alto riesgo, concretamente en prematuros y niños con displasia broncopulmonar (DBP), debido a su alto coste. En nuestra experienia(56), tras un seguimiento de 4 años en niños pre- Libro II curso 31/1/05 17:26 P gina 55 Infección viral y sibilancias recurrentes maturos menores de 32 semanas afectos de DBP, hemos comprobado la eficacia del palivizumab al descender las tasas de hospitalización de forma significativa, ya que antes de su uso ingresaron un 27% de los niños por infección respiratoria por el VRS y desde que se comenzó a utilizar no hubo ningún ingreso hospitalario por infección por el VRS en esos años. En nuestro país, basándose en este trabajo y en otros estudios, tanto nacionales(57,58), como internacionales, la Sociedad Española de Neonatología ha publicado una serie de recomendaciones(59) para el uso de palivizumab: - Lactantes y niños menores de 2 años con DBP que han precisado tratamiento médico para la misma en los 6 meses previos al inicio de la estación epidémica del VRS. - Niños nacidos con 32 semanas o menos de gestación y que tengan 6 meses o menos al inicio de la estación epidémica. - Niños nacidos con 28 semanas o menos de gestación y que tengan un año o menos al inicio de la estación epidémica. - Niños nacidos entre 32 y 35 semanas de gestación, que tengan 6 meses o menos al inicio de la estación epidémica y además tengan algún factor de riesgo añadido, como hermanos en edad escolar, asistencia a guardería, antecedentes de atopia, etc. Este grupo se debe individualizar en cada caso. - Últimamente se recomienda su uso en todos los niños con cardiopatía congénita menores de 2 años al inicio de la estación epidémica. 55 Nuevas perspectivas de intervención terapéutica Diferentes estudios sugieren que existe una correlación directa entre la concentración de VRS en el tracto respiratorio y la gravedad de la infección(60,61). Sin embargo, cuando la enfermedad progresa, parece que es, sobre todo, la respuesta inmunitaria, más que la replicación viral, la responsable de las manifestaciones clínicas y la gravedad de la infección. Muchos estudios han intentado investigar si el tratamiento inicial de la bronquiolitis por el VRS podrá tener algún impacto o modificar las consecuencias a largo plazo que este virus ocasiona en el aparato respiratorio. Recientemente ha sido publicado un estudio con el objetivo de determinar el impacto de la disminución de la replicación de VRS en los parámetros de gravedad de la infección, para ello, distintos grupos de ratones previamente infectados por el VRS, fueron tratados con anticuerpo monoclonal neutralizante frente a la glucoproteína F del VRS o placebo. Demostrando que existe una correlación significativa entre las reducciones de la replicación viral, lesiones inflamatorias pulmonares, concentraciones de citocinas inflamatorias y obstrucción de la vía aérea documentadas durante la fase aguda de la enfermedad y una mejoría de las alteraciones de las pruebas de función pulmonar a largo plazo inducidas por el VRS(62). Estos resultados experimentales llevan a los autores a proponer la realización de estudios clínicos para evaluar el papel de palivizumab en la prevención de las secuelas pulmonares a largo plazo causadas por el VRS en la población pediátrica. Libro II curso 31/1/05 17:26 P gina 56 56 MANEJO DEL LACTANTE CON SIBILANCIAS RECURRENTES Antes de iniciar un tratamiento en un lactante con sibilancias recurrentes, lo primero que deberíamos hacer es un diagnóstico diferencial, para descartar patología de base asociada, y en segundo lugar, sería útil hacer un análisis de las posibilidades evolutivas del paciente y de las posibles respuestas al tratamiento; basado en los resultados de diferentes estudios longitudinales a largo plazo que actualmente disponemos y en los cuales se han puesto en evidencias diferentes fenotipos. Diagnóstico diferencial del lactante con sibilancias Las sibilancias son muy frecuentes durante la primera infancia. En la gran mayoría de los casos son secundarias a una infección viral, siendo el VRS el agente etiológico más frecuente y un pequeño subgrupo de estos niños tienen una patología alérgica de base. Tanto el asma como las sibilancias recurrentes durante las infecciones son tan frecuentes que en muchas ocasiones no pensamos en otras patologías que pueden presentarse del mismo modo, y muchas veces estas enfermedades tienen un diagnostico tardío, lo que ha condicionado la elección de una medicación inapropiada y, lo que es aun más grave, el no haberse beneficiado de un tratamiento más específico y precoz(63). Por lo tanto, ante un lactante con sibilancias y, sobre todo, si no tiene una respuesta favorable al tratamiento hemos de descartar otras patologías(64) (Tabla 1). M. Navarro Merino, et al. TABLA 1. Diagnóstico diferencial de las sibilancias recurrentes en la primera infancia(64). Vías aéreas superiores • Anomalías congénitas de la región laríngea (laringomalacia, parálisis de cuerdas vocales) Obstrucción de las grandes vías aéreas • Anomalías congénitas de la tráquea y bronquios principales (traqueomalacia, broncomalacia, estenosis traqueal o bronquial) • Anillos vasculares o membranas laríngeas • Cuerpo extraño en tráquea o bronquios • Adenopatías o tumores Obstrucción de las pequeñas vías aéreas • Bronquiolitis viral • Bronquiolitis obliterante • Fibrosis quística • Displasia broncopulmonar • Discinesia ciliar primaria • Cardiopatías congénitas Otras • Reflujo gastroesofágico y síndromes aspirativos Posibilidades evolutivas de las sibilancias recurrentes en el niño Diferenciación Fenotípica De los estudios de la evolución a largo plazo de las sibilancias recurrentes del niño, los realizados por el grupo de Martínez en Arizona son una referencia obligada. El primer estudio, ya clásico, clasificaba las sibilancias, según la edad de inicio, en sibilancias precoces transitorias, sibilancias de comienzo tardío y sibilancias persistentes(65). Recientemente este mismo Libro II curso 31/1/05 17:26 P gina 57 57 Infección viral y sibilancias recurrentes grupo ha propuesto una modificación que mantiene las sibilancias precoces transitorias, pero clasifica los otros dos grupos, fundamentalmente, en función de la presencia o ausencia de atopia(66). Esta clasificación no separa a los niños en grupos estancos y con frecuencia será difícil encuadrar a un niño concreto en uno u otro grupo. Sin embargo, si puede ayudar a identificar a los niños con mayor riesgo de sibilancias recurrentes a largo plazo. • Sibilancias precoces transitorias. Un 60% de los niños menores de 3 años tiene sibilancias transitorias precoces, suele comenzar con episodios recurrentes de sibilancias en el primer año de vida y sus síntomas suelen remitir antes de los seis años. Presenta síntomas casi exclusivamente durante las infecciones víricas y la gravedad de los episodios es variable. Uno de los factores de riesgo más importante para el desarrollo de sibilancias transitorias durante el primer año es la exposición durante el embarazo al humo del tabaco(67). Otros factores de riesgo en este grupo de niños, son la asistencia a guarderías o la convivencia con hermanos mayores, el sexo masculino y la disminución de la función pulmonar observada poco después de nacer, antes de haber presentado ningún episodio de sibilancias(68-72). Generalmente, los niños con sibilancias precoces transitorias no presentan antecedentes familiares de asma y tienen una pobre respuesta al tratamiento con broncodilatadores y corticoides. • Sibilancias persistentes no atópicas Aproximadamente el 40% de los niños que presentan sibilancias durante los primeros tres años continúa con síntomas a la edad de seis años. Sin embargo, la mitad de ellos es decir el 20%, a pesar de la persistencia de sibilancias, no muestra evidencia alguna de sensibilización atópica. En la mayoría de estos niños las sibilancias comienzan en el primer año de la vida, mientras que los niños con sibilancias persistentes y atopia comienzan algo más tarde, en le segundo o tercer año. Los síntomas de la mayoría de estos sibilantes persistentes no atópicos remiten antes de los once años(72) y suelen mostrar una reducción de la función pulmonar, con valores postbroncodilatadores normales(73). Un subgrupo especial de estos pacientes está compuesto por los niños prematurs, que presentan sibilancias con mucha mayor frecuencia que los niños nacidos a término(74). • Sibilancias persistentes atópicas El otro 20% de niños que presentan sibilancias durante los primeros tres años y continúan con síntomas a la edad de seis años, lo constituyen los niños con sibilancias persistentes atópicas. Aunque los síntomas de este grupo de lactantes, que serán los verdaderos asmáticos persistentes del futuro, suelen ser más graves, pueden aparecer con o sin infección respiratoria y suelen comenzar algo más tarde, en el segundo o tercer año de vida, en la practica clínica Libro II curso 31/1/05 17:26 P gina 58 58 M. Navarro Merino, et al. diaria son difícilmente distinguibles de los niños con sibilancias transitorias o persistentes no atópicas. Una buena anamnesis es de gran utilidad, ya que los niños con asma atópico persistente tienen una posibilidad cuatro veces mayor de tener antecedentes familiares de asma y tres veces mayor de tener dermatitis atópica que el resto de los grupos. La detección de IgE específica frente a algún aeroalérgeno, aunque es muy poco frecuente en lactantes, cuando está presente se asocia de forma casi invariable con asma en el futuro(75). A pesar de todo lo expuesto con anterioridad, es difícil para un pediatra predecir con exactitud ante un niño menor de dos o tres años con sibilancias recurrentes cual va a ser su futuro, al igual que le será problemático elegir el tratamiento adecuado y el tiempo de su aplicación. En este sentido, el grupo de Martínez ha desarrollado un índice clínico, para intentar predecir con mayor precisión el riesgo de asma en los lactantes con sibilancias recurrentes, con objeto de identificar a los niños que podrían beneficiarse de una intervención terapéutica precoz(76) (Tabla 2). Un niño que presenta sibilancias precoces infrecuentes y que posee un factor de riesgo mayor y dos menores de los indicados, tendrá una probabilidad alta de padecer asma a los 13 años (odds ratio:3.0). El valor predictivo negativo de este índice es del 86,5%, es decir, la mayoría de los niños que no desarrollarán asma en la edad escolar tienen un índice negativo en los primeros años de vida. Sin embargo, el valor predictivo positivo es de sólo del 31%, por lo cual su utilidad clínica es limitada. TRATAMIENTO DEL LACTANTE CON SIBILANCIAS RECURRENTES El tratamiento adecuado del lactante con sibilancias recurrentes es en la actualidad uno de los aspectos más controvertidos de la neumología pediátrica. A pesar del análisis de las posibilidades evolutivas, basado en estudios longitudinales a largo plazo que hemos expuesto con anterioridad, en muchas ocasiones es imposible predecir correctamente el pronóstico individual de un niño concreto, ya que no se dispone actualmente de un marcador que identifiqué a los niños con riesgo de desarrollar a largo plazo asma persistente y disminución de la función pulmonar. Por lo tanto, al no disponer de un test predictivo seguro, el tratamiento de las sibilancias recurrentes/asma del lactante está basado, al igual que en el niño mayor y en el adulto, en la intensidad y frecuencia de los síntomas. Sin embargo, tampoco es fácil la clasificación de la gravedad del asma en el niño pequeño, ya que en la mayoría de los casos no es posible realizar pruebas de función pulmonar y sólo se tienen en cuenta los síntomas referidos, no por el propio paciente, sino por sus padres. Algunas de las clasificaciones más habituales GINA(77) se han concebido pensando en el adulto y son poco prácticas cuando se aplican a lactantes. Por ello, tomando Libro II curso 31/1/05 17:26 P gina 59 59 Infección viral y sibilancias recurrentes TABLA 2. Factores de riesgo de padecer asma en lactantes on sibilancias recurrentes. Criterios mayores Criterios menores • • • • Diagnóstico médico de asma en los padres Diagnóstico médico de dermatitis atópica. • Diagnóstico médico de rinitis Sibilancias no relacionadas con catarros Eosinofilia ≥ 4% TABLA 3. Clasificación del asma infantil según gravedad(80). Asma episódica ocasional Asma persistente moderada • Episodios de pocas horas o días de duración menos de una vez cada 10-12 semanas. Máximo 4-5 crisis al año • Asintomático en la intercrisis y con buena tolerancia al ejercicio • Exploración funcional respiratoria: normal en las intercrisis • Episodios más de una vez cada 4-5 semanas • Síntomas leves en las intercrisis Sibilancias con esfuerzos moderados • Síntomas nocturnos más de 2 veces por semana • Necesidad de β2-adrenérgicos más de 3 veces por semana • Exploración funcional respiratoria: - FEM o FEV1 > 70% del valor predicho - Variabilidad del FEM entre el 20-30% Asma episódica frecuente • Episodios menos de una vez cada 5-6 semanas (máximo 6-8 crisis/año) • Intercrisis asintomáticas, aunque puede tener sibilancias con esfuerzos intensos • Exploración funcional respiratoria: normal en las intercrisis Asma persistente grave • Episodios frecuentes • Síntomas en las intercrisis. Sibilancias con esfuerzos pequeños • Síntomas nocturnos más de 2 veces por semana • Requerimientos de β2-adrenérgicos más de 3 veces por semana • Exploración funcional en la intercrisis: - FEM o FEV1 < 70% de su valor predicho - Variabilidad del FEM > 30% como referencia la clasificación publicada por la Sociedad Española de Neumología Pediátrica, a través del Grupo de Trabajo de Asma Infantil(78), la clasificación del último Consenso Pediátrico (79), y el protocolo de tratamiento del asma de la Asociación Española de Pediatría (AEP)(80), se clasifica el asma en cuatro apartados, resultando mucho más adaptada a la edad pediátrica (Tabla 3). Libro II curso 31/1/05 17:26 P gina 60 60 M. Navarro Merino, et al. TABLA 4. Dosis equivalentes de corticoides inhalados en miligramos. Budesonida Fluticasona Ciclesonide Dosis bajas Dosis medias Dosis altas 200-400 100-250 100-200 400-800 250-500 200-400 > 800 > 500 > 400 TRATAMIENTO FARMACOLÓGICO En todos los estadios de gravedad está indicado el uso de agonistas β-adrenérgicos de acción rápida (AA-β2-AR) para el alivio de los síntomas. Las pautas de tratamiento de mantenimiento son: • Asma episódica ocasional: se recomienda la administración de un agonista β-adrenérgico de acción rápida a demanda en caso de tener síntomas. El uso frecuente de AA-β2-AR obliga a revisar el nivel de gravedad y el tratamiento. • Asma episódica frecuente: el fármaco de elección es el glucocorticoide inhalado (GCI) en dosis inferiores a 200 mg/día de budesonida o equivalente (Tabla 4). Puede considerarse el uso de antileucotrienos (ARLT) cuando no puedan emplearse glucocorticoides inhalados (incumplimiento, mala técnica, efectos secundarios), aunque no se han publicado hasta la fecha ensayos clínicos con ARLT en niños menores de dos años. • Asma persistente moderada: la primera elección es el GCI en dosis medias: 200-400 mg/día de budesonida o equivalente. No hay estudios que evalúen el papel ahorrador de corticoides de los antileucotrienos o los agonistas β2-adre- • nérgicos de acción prolongada en menores de dos años. No obstante, dado que montelukast está aprobado en niños mayores de seis meses, podría considerarse su utilización junto a GCI. Asma persistente grave: se utilizarán dosis elevadas de GCI, entre 400-800 mg/día de budesonida o equivalente. Se podría considerar la utilización de antileucotrienos. Añadir glucocorticoides orales si el control clínico es insuficiente, valorando relación riesgo-beneficio. Consideraciones especiales del tratamiento del asma en el lactante • La administración de la medicación inhalada antiasmática se realizará mediante cámara espaciadora y mascarilla facial, tras un adecuado entrenamiento de los padres. Como alternativa puede emplearse un nebulizador con mascarilla facial. • Ante una evolución no favorable tras el tratamiento inicial, antes de etiquetar al paciente como no respondedor al tratamiento antiasmático, es necesario comprobar el cumplimiento de la medicación y que la técnica inhalatoria sea correcta. • Se debe utilizar siempre la menor dosis posible de GCI con la que el paciente esté controlado. Libro II curso 31/1/05 17:26 P gina 61 61 Infección viral y sibilancias recurrentes • Antes de incrementar la dosis de GCI por falta de respuesta, con buena adherencia al tratamiento y técnica de in- halación correcta, es necesario descartar otras causas de sibilancias distintas al asma. BIBLIOGRAFÍA 1. Mclntosh K, Ellis EF, Hoffman LS, Lybass TG, Eller JJ, Fulginiti VA. The association of viral and bacterial respiratory infections with exacerbations of wheezing in young asthmatic children. J Pediatr 1973; 82:578-90. 2. Psarras S, Papadopoulos NG, Johnston SL. Pathogenesis of respiratory syncytial virus bronchiolitis-related wheezing. Paediatr Respir Rev 2004; 5:179-84. 3. Pullan CR, Hey EN. Wheezing, asthma, and pulmonary dysfunction 10 years after infection with respiratory syncytial virus in infancy. Br Med J (Clin Res Ed) 1982; 284:1665-9. 4. Sigurs N, Bjarnason R, Sigurbergsson F, Kjellman B. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7. Am J Respir Crit Care Med 2000; 161:1501-7. 5. Martínez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med 1995; 332:133-8. 6. Rooney JC, Williams HE. The relationship between proved viral bronchiolitis and subsequent wheezing. J Pediatr 1971; 79:744-7. 7. Tumer SW, Young S, Landau LI, Le Souef PN. Reduced lung function both before bronchiolitis and at 11 years. Arch Dis Child 2002;87: 417-20. 8. Young S, O´Keeffe PTm Arnott J, Landau LI. Lung fuction, airway responsiveness, and respiratory symptoms before and after bronchiolitis. Arch Dis Child 1995; 72:16-24. 9. García García ML, Ordobás M, Calvo C, González MI, Aguilar J, Arregui A et al. Infección viral de vías respiratorias bajas en niños hospitalizados: etiología, manifestaciones clínicas y factores de riesgo. An Esp Pediatr 2001; 55:101-7. 10. Papadopolous NG, Moustaki M, Tsolia M, Bossios A, Astra E, Prezerakou A, et al. Association of rhinovirus infection with increased disease severity in acute bronchiolitis. Am J Respir Crit Care Med 2002; 165: 1285-9. 11. Van den Hoogen Bg, de Jong JC, Groen J, Kuiken T, de Groot R, Fouchier RA, et al. Anewly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med 2001; 7:719-24. 12. García ML, Calvo Rey C, Martín del Valle F, López Huertas MR, Casa Flecha I, Díaz-Delgado R ,et al. Infecciones respiratorias por metapneumovirus en lactantes hospitalizados. An Pediatr (Barc) 2004;61:213-8. 13. Carballal G, Videla CM, Espinosa MA, Savy V, Uez O, Sequeira MD, et al. Multicentered study of viral acute lower respiratory infections in children from four cities of Argentina, 1993-1994. J Med Virol 2001; 64:16774. 14. Blount RE Jr., Morris JA, Savage RE. Recovery of cytopathogenic agent from chimpanzees with coryza. Proc Soc Exp Biol Med 1956; 92:544-9. 15. Dickens LE, Collins PL, Wertz GW. Transcriptional mapping of human respiratory syncytial virus. J Virol 1984; 52:364-9. Libro II curso 31/1/05 17:26 P gina 62 62 M. Navarro Merino, et al. 16. Ogra PL. Respiratory syncytial virus: the virus, the disease and the immune response. Paediatr Respir Rev 2004; 5:119-26. chiolitis in infancy is an important risk factor for asthma and allergy at age 7. Am J Respir Crit Care Med 2000; 161:1501-7. 17. Glezen WP, Taber LH, Frank AL, Kasel JA. Rsik of primary infection and reinfection with respiratory syncytial virus. Am J Dis Child 1986; 140:543-6. 27. Stein RT, Sherrill D, Morgan WJ, Holberg CJ, Halonen M, Taussig LM, et al. Respiratory syncytial virus in early life and risk of wheeze and allergy by age 13 years. Lancet 1999; 354:541-5. 18. Piedimonte G. Neural mechanisms of respiratory syncytial virus-induced inflammation and prevention of respiratory syncytial virus sequelae. Am J Respir Crit Care Med 2001;163:S18-21. 19. Silvestri M, Sabatini F, Defilippi AC, Rossi GA. The wheezy infant-immunological and molecular considerations. Paediatr Respir Rev 2004; 5:81-7. 20. Van Schaik SM, Welliver RC, Kimpen JL. Novel pathways in the pathogenesis of respiratory syncytial virus disease. Pediatr Pulmonol 2000; 30:131-8. 21. Bisgaard H. Leukotriene modifiers in pediatric asthma management. Pediatrics 2001; 107:381-90. 22. Welliver RC, Duffy L. The relationship of RSV-specific immunoglobulin E antibody responses in infancy, recurrent wheezing, and pulmonary function at age 7-8 years. Pediatr Pulmonol 1993; 15:19-27. 23. Sheeran P, Jafri H, Carubelli C, Saavedra J, Johnson C, Krisher K, et al. Elevated cytokine concentrations in the nasopharyngeal and tracheal secretions of children with respiratory syncytial virus disease. Pediatr Infect Dis J 1999; 18:115-22. 24. Garrocho García A, Pérez Pérez G, Gentles Newman M, García Botia J, Navarro Merino M. Sibilancias recurrentes. Estudio longitudinal tras un año de seguimiento. An Esp Pediatr 1998; 48(Supl 110):47-48. 25. Sigurs N. Clinical perspectives on the association between respiratory syncitial virus ad reactive airway disease. Respir Res 2002; 3:S8-S14. 26. Sigurs N, Bjarnason R, Sigurbergsson F, Kjellman B. Respiratory syncytial virus bron- 28. Hall CB, Hall WJ, Gala CL, MaGill FB, Leddy JP. Long-term prospective study in children after respiratory syncytial virus infection. J Pediatr 1984; 105:358-64. 29. Mok JY, Simpson H. Outcome for acute bronchitis, bronchiolitis, and pneumonia in infancy. Arch Dis Child 1984; 59:306-9. 30. Bont L, Aalderen WM, Kimpen JL. Longterm consequences of respiratory syncytial virus (RSV) bronchiolitis. Paediatr Respir Rev 2000; 1:221-7. 31. Castro J, Tellería JJ, Blanco-Quirós A. Susceptibility genes for asthma and allergy: hits and questions. J Investig Allergol Clin Immunol 2001; 11:73-8. 32. Goetghebuer T, Isles K, Moore C, Thomson A, Kwiatkowski D, Hull J. Genetic predisposition to wheeze following respiratory syncytial virus bronchiolitis. Clin Exp Allergy 2004; 34:801-3. 33. Hull J, Thomson A, Kwiatkowski D. Association of respiratory syncytial virus bronchiolitis with the interleukin 8 gene region in UK families. Thorax 2000; 55:1023-7. 34. Lofgren J, Ramet M, Renko M, Marttila R, Hallman M. Association between surfactant protein A gene locus and severe respiratory syncytial virus infection in infants. J Infect Dis 2002; 185:283-9. 35. McBride JT. Pulmonary function changes in children after respiratory syncytial virus infection in infancy. J Pediatr 1999; 135:2832. 36. Pardos Martínez C, Pérez-Yarza EG, Isanta Pomar C, Fuertes Fernández-Espinar J, Meriz Rubio J. Factores de riesgo de asma, aler- Libro II curso 31/1/05 17:26 P gina 63 Infección viral y sibilancias recurrentes 63 gia e hiperreactividad en niños de 6 a 8 años. An Esp Pediatr 2001; 55:205-12. meta análisis. Pediatrics, 2000; 105:E441E6. 37. Kellner JD, Ohlsson A, Gadomski AM, Wang EE. Bronchodilators for bronchiolitis (Cochrane Review). En: The Cochrane Library, Issue 1. Oxford: Update Sofware, 2003. 47. Buckingham SC, Jafri HS, Bush AJ, Carebelli CM, Sheeran P, Hardy RD, et al. A randomized, double-blind, placebo-controlled trial of dexamethasone in severe respiratory syncytial virus (RSV) infection: effects on RSV quantity and clinical outcome. J Infect Dis 2002; 185:1222-8. 38. Flores G, Horwitz RI. Efficacy of b2-agonists in bronchiolitis: areappraisal and metaanalysis. Pediatrics 1997; 100:233-9. 39. Sánchez I, De Koster J, Powell LE, Powell RE, Wolstein R, Chernick V. Effect of racemic epinephrine and salbutamol on clinical score and pulmonary mechanics in infants with bronchiolitis. J Pediatr 1993; 122:145-51. 40. Wainwright C, Altamirano L, Cheney M, Cheney J, Barber S, Prece D, et al. Amulticenter, randomized, double-blind, controlled trial of nebulized epinephrine in infants with acute bronchiolitis. N Engl J Med 2003; 349:27-35. 41. Hartling L, Wiebe N, Russell K, Patel H, Klassen TP. A meta-analysis of randomized controlled trials evaluating the efficacy of epinephrine for the treatment of acute viral bronchiolitis. Arch Pediatr Adolesc Med 2003; 257:957-64. 42. Lugo RA, Nahata MC. Patogénesis and treatment of bronchiolitis. Clin Pharm 1993; 12:95-116. 43. Kimpen JL. Prevention and treatment of respiratory syncytial virus bronchiolitis and postbronchiolitic wheezing. Respir Res 2002; 3:S40-S5. 44. Martinón-Torres F, Rodríguez NA, Martinón Sanchez JM. Acute bronchiolitis: evaluation of evidence-based trerapy. An Esp Pediatr 2001; 55:345-54. 45. Roosevelt G, Sheehan K, Grupp-Phelan J, Tanz RR, Listernick R. Dexamethasone in bronchiolitis: a randomised controlled trial. Lancet 1996; 348:292-5. 46. Garrison MM, Christakis DA, Harvey E, Cummings P, Davis RL. Corticoides sistémicos en la bronquiolitis del lactante: un 48. Randolh AG, Wang EE. Ribavirin for respiratory syncytial virus infection of the lower respiratory tract (Cochrane Review). The Cochrane Library, Issue 1. Oxford: Update Software, 2003. 49. Edell D, Khoshoo V, Ross G, Salter K. Early ribavarin treatment of bronchiolitis: Effect on long-term respiratory morbidity. Chest 2002; 122:935-9. 50. Edell D, Bruce E, Hale K, Khoshoo V. Reduced long-term respiratory morbidity after treatment of respiratory syncytial virus bronchiolitis with ribavirin in previously healthy infants: A preliminary report. Pediatr Pulmonol 1998; 25:154-8. 51. King VJ, Viswanathan M, Bordley WC, Jackman AM, Sutton SF, Lohr KN, et al. Pharmacologic treatment of bronchiolitis in infants and children: a systematic review. Arch Pediatr Adolesc Med 2004; 158:127-37. 52. Bisgaard H. A randomized trial of montelukast in respiratory syncytial virus postbronchiolitis. Am J Respir Crit Care Med 2003; 167:379-83. 53. Welliver RC II, Hintz KH, Glori M, Welliver RC. Zileuton reduces respiratory illness and lung inflammation, during respiratory syncytial virus infection, in mice. J Infect Dis 2003; 187:1773-9. 54. The Impact-RSV Study Group. Palivizumab, a humanized respiratory syncytial virus monoclonal antibody, reduces hospitalisation from respiratory syncytial virus infection in highrisk infants. Pediatrics 1998; 102:531-7. 55. American Academy of Pediatrics. Committee on Infections Diseases and Committee Libro II curso 31/1/05 17:26 P gina 64 64 M. Navarro Merino, et al. on Fetus and Newborn Prevention of respiratory syncytial virus infections: indications for the use of palivizumab an update on the use of RSV-IVIG. Pediatrics 1998; 102:12116. 56. Pérez Pérez G, Navarro Merino M, Romero Pérez MM, Sáenz Reguera C. Morbilidad respiratoria tras el alta hospitalaria en niños prematuros (≤ 32 semanas) con displasia broncopulmonar. An Pediatr (Barc) 2004; 60:117-24. 57. Carbonell-Estrany X, Quero J. The IRIS Study Group. Hospitalisation rates for respiratory syncytial virus infection in premature infants younger born during two consecutive seasons. Pediatr Infect Dis 2001; 20:874-79. 58. Grupo Benazuza. Quimioprofilaxis con palivizumab en Andalucía. Resultados de la epidemia 2000-2001. An Esp Pediatr 2002; 56:293-7. 59. Carbonell-Estrany X, Quero J. Comité de Estándares de la Sociedad Española de Neonatología y Junta Directiva de la Sociedad Española de Neonatología. Recomendaciones para la prevención de la infección por virus respiratorio sincitial. An Esp Pediatr 2000; 52:372-4. 60. Malley R, DeVincenzo J, Ramilo O, Dennehy PH, Meissner HC, Gruber WC, et al. Reduction of respiratory syncytial virus (RSV) in tracheal aspirates in intubated infants by use of humanized monoclonal antibody to RSV F protein. J Infect Dis 1998; 178:155561. 61. Malley R, Vernacchio L, Devincenzo J, Ramilo O, Dennehy PH, Meissner HC, et al. Enzyme-linked immunosorbent assay to assess respiratory syncytial virus concentration and correlate results with inflammatory mediators in tracheal secretions. Pediatr Infect Dis J 2000; 19:1-7. 62. Mejías A, Chaves-Bueno S, Ríos AM, Fonseca-Aten M, Gómez AM, Jafri HS, Ramilo O. Asma y virus respiratorio sincitial. Nuevas oportunidades de intervención terapéutica. An Pediatr (Barc) 2004; 61:252-60. 63. Navarro Merino M. Asma del lactante, diagnóstico diferencial con otras broncopatías. Rev Esp Alergol Inmunol Clin 1998; 13:1518. 64. Villa Asensi JR, García García ML. Síntomas respiratorios inducidos por virus en el niño pequeño. Programa de formación en asma infantil. Prasmi (CD 2). Grupo MSD, 2004; 61-8. 65. Martínez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med 1995; 332:133-8. 66. Martínez FD. Development of wheezing disorders and asthma in preschool children. Pediatrics 2002; 109:362-7. 67. Stein RT, Holberg CJ, Sherrill D, Wright AL, Morgan WJ, Taussig L, et al. Influence of parental smoking on respiratory symptoms during the first decade of life: the Tucson Children’s Respiratory Study. Am J Epidemiol 1999; 149:1030-7. 68. Ball TM, Castro-Rodríguez JA, Griffith KA, Holberg CJ, Martínez FD, Wright AL. Siblings, daycare attendance, and the risk of asthma and wheezing during childhood. N Engl J Med 2000; 343:538-43. 69. Park JH, Gold DR, Spiegelman DL, Burge HA, Milton DK. House dust endotoxin and wheeze in the first year of life. Am J Respir Crit Care Med 2001; 163:322-8. 70. Rusconi F, Galassi C, Corbo GM, Forastiere F, Biggeri A, Ciccone G, et al. Risk factors for early, persistent, and late onset wheezing in young children. SIDRIA Collaborative Group. Am J Respir Crit Care Med 1999; 160:1617-22. 71. Hoo AF, Dezateux C, Hanrahan JP, Cole TJ, Tepper RS, Stocks J. Sex-specific prediction equations for Vmax(FRC) in infancy: a multicenter collaborative study. Am J Respir Crit Care Med 2002; 165:1084-92. 72. Stein RT, Holberg CJ, Morgan WJ, Wright AL, Lombardi E, Taussig L, et al. Peak flow Libro II curso 31/1/05 17:26 P gina 65 Infección viral y sibilancias recurrentes variability, met- hacholine responsiveness and atopy as markers for detecting different wheezing phenotypes in childhood. Thorax 1997; 52:946-52. 73. Stein RT, Sherrill D, Morgan WJ, Holberg CJ, Halonen M, Taussig LM, et al. Respiratory syncytial virus in early life and risk of wheeze and allergy by age13 years. Lancet 1999; 354:541-5. 74. Rona RJ, Gulliford MC, Chinn S. Effects of prematurity and intrauterine growth on respiratory health and lung function in childhood. BMJ 1993; 306:817-20. 75. Kotaniemi-Syrjanen A, Reijonen TM, Romppanen J, Korhonen K, Savolainen K, Korppi M. Allergen specific immunoglobulin E antibodies in wheezing infants: the risk for asthma in later childhood. Pediatrics 2003; 11:255-61. 76. Castro-Rodríguez JA, Holberg CJ, Wright AL, Martínez FD. A clinical index to define risk of asthma inyoung children with recurrent 65 wheezing. Am J Respir Crit Care Med 2000; 162:1403-6. 77. Global strategy for asthma management and prevention. WHO/NHLI workshop report. National Institutes for Health, National Heart, Lung and Blood Institute. Publication Nº 02-3659/2002. 78. Protocolo del tratamiento del asma infantil. Grupo de Trabajo en asma infantil. Sociedad Española de Neumología Pediátrica. An Esp Pediatr 1995; 43:439-46. 79. Warner JO, Naspitz CK. Third International Pediatric Consensus Statement on the Management oj Chilhood Asthma. Pediatr Pulmonol 1998; 25:1-17. 80. Escribano A, Ibero M,Garde J, Gartner S,Villa Asensi JR, Pérez FríasJ(SENP, SEICAP). Protocolos terapéuticos en el asma infantil. En: Protocolos comunes Neumología-Alergia. Protocolos AEP Tomo7:171-186. Disponible en: http://www.aeped.es/protocolos/alergia/tratamiento-asma-aep.pdf. Libro II curso 31/1/05 17:26 P gina 66 Libro II curso 31/1/05 17:26 P gina 67 Cómo se diagnostica el asma J. R. Villa Asensi, M. I. González Álvarez Sección de Neumología. Hospital Infantil Universitario Niño Jesús. Madrid RESUMEN En el asma existen tres aspectos fundamentales: una clínica característica, una alteración funcional de la vía aérea con hiperrespuesta bronquial y obstrucción variable al flujo aéreo y una inflamación crónica de la vía aérea. El diagnóstico del asma debe, pues, basarse en estos tres aspectos. Los síntomas del asma, aunque característicos, son inespecíficos y comunes a otras enfermedades respiratorias. Existen enfermedades muy diversas que se manifiestan con sibilancias durante los primeros años de vida y cuya presentación clínica puede ser muy similar en unas y en otras, siendo un gran reto distinguirlas. Siempre que sea posible se debe confirmar el diagnóstico del asma mediante pruebas de función pulmonar. Inicialmente se intentará comprobar si existe una obstrucción reversible mediante broncodilatador al flujo aéreo (prueba de broncodilatación), que, junto con una clínica compatible, nos dará el diagnóstico de asma. En ocasiones es necesario realizar pruebas de broncoprovocación (ejercicio o metacolina) para apoyar el diagnóstico. En los niños no colaboradores el estudio funcional es más complejo. Se están realizando grandes avances en el estudio de marcadores de la inflamación bronquial, pero todavía no disponemos de un método sencillo que sea suficientemente sensible y específico para el diagnóstico del asma. Libro II curso 31/1/05 17:26 P gina 68 68 INTRODUCCIÓN Para los clínicos, el asma es una enfermedad crónica en la que se producen episodios de tos, sibilancias y dificultad respiratoria reversibles de forma espontánea o con medicación, para los fisiólogos es una obstrucción variable al flujo aéreo secundaria a la existencia de unas vías aéreas hiperreactivas, y para los patólogos es una enfermedad inflamatoria crónica de las vías aéreas. La definición del asma actualmente más aceptada es la que propone la GINA, según la cual “el asma es una enfermedad inflamatoria de la vía aérea en la que muchas células y elementos celulares juegan un papel. La inflamación crónica produce un aumento de la hiperrespuesta bronquial que provoca episodios recurrentes de sibilancias, dificultad respiratoria, opresión torácica y tos, particularmente por la noche o al amanecer. Estos episodios se asocian, generalmente, a una obstrucción generalizada, pero variable al flujo aéreo que es reversible espontáneamente o con tratamiento”(1). De acuerdo con esta definición, en el asma existen tres aspectos fundamentales: una clínica característica, una alteración funcional de la vía aérea con hiperrespuesta bronquial y obstrucción variable al flujo aéreo y una inflamación crónica de la vía aérea. Por lo tanto, el diagnóstico debe basarse en estos tres aspectos. Los síntomas del asma, aunque característicos, son inespecíficos y comunes a otras enfermedades respiratorias. Esta inespecificidad ocasiona que muchos pacientes estén infradiagnosticados y también, J. R. Villa Asensi, et al. que por el contrario, pueda haber una sobreestimación del diagnóstico en edades en que las sibilancias son muy frecuentes como en los lactantes. Aunque debemos asumir el principio de que “no todo lo que pita es asma”, esta enfermedad es sin duda la causa más frecuente de sibilancias y su prevalencia es tan alta que podríamos aceptar que “lo que pita es asma mientras no se demuestre lo contrario”. En los últimos años hemos podido ir comprobando que el asma no es una única enfermedad con límites bien definidos y un comportamiento uniforme, si no que, sobre todo en los niños, existen distintos fenotipos que van a conllevar pronósticos diferentes y probablemente diversas respuestas al tratamiento. El problema es que no tenemos forma de definir fácilmente dichos fenotipos, de modo que, aunque sabemos que el diagnóstico de asma engloba patologías diferentes, no existe hoy día ningún término mejor para definirlas. Sí sería recomendable que cuando utilicemos el diagnóstico de asma intentemos precisar aspectos como la gravedad, el patrón de comportamiento (episódico o persistente), los factores precipitantes (inducido por virus, ejercicio, alérgico a…) o aspectos fisiológicos (respuesta a broncodilatadores o a agentes broncoconstrictores, como metacolina o histamina)(2). Aunque el diagnóstico de asma es eminentemente clínico, siempre que sea posible debemos intentar llegar a un diagnóstico objetivo de la enfermedad, mediante pruebas complementarias que valoren la existencia de una obstrucción reversible al flujo aéreo. Libro II curso 31/1/05 17:26 P gina 69 69 Cómo se diagnostica el asma Ante un niño con clínica sugestiva de asma deberemos, en primer lugar, realizar una historia clínica y exploración física detalladas, y posteriormente una serie de pruebas complementarias que nos ayuden a confirmar el diagnóstico y a descartar otras patologías, y en tercer lugar deberemos buscar cuales son los factores que en este paciente en concreto favorecen la aparición de los síntomas de asma o de las crisis (factores ambientales, alergia, infecciones, rinitis-sinusitis, reflujo gastroesofágico etc…). Posteriormente, habrá que clasificar la gravedad del asma del paciente para así poder decidir cual es el tratamiento más adecuado. En la figura 1 se muestra el esquema diagnóstico del asma en el niño mayor. HISTORIA CLÍNICA Y EXPLORACIÓN FÍSICA Los síntomas característicos del asma son la tos, sibilancias, dificultad respiratoria y la opresión torácica. Dependiendo de la intensidad del asma, el niño puede sufrir estos síntomas sólo durante períodos más o menos cortos (exacerbaciones o crisis) o puede mantener síntomas persistentes, que muchas veces empeoran con el esfuerzo o durante las noches. La forma de presentación del asma es muy variable, fundamentalmente en los niños. Es variable, no sólo entre los diversos niños, si no en las distintas épocas de la vida de un niño. En los niños más pequeños es característico que tengan episodios, incluso severos, de disnea, generalmente, con las infecciones virales, y que entre estos episodios estén completamente asintomáticos. Sin embargo, en los niños mayores el asma se parece más al de los adultos, en general, tienen menos crisis pero más síntomas entre las crisis (Fig. 2). En la tabla 1 se muestran las preguntas que nos deben hacer sospechar que un niño tenga asma(1). El síntoma predominante del asma es la tos y en algunos casos es casi la única manifestación de modo que se ha utilizado el término de “tos como variante de asma” para describir esa tos sin sibilancias como síntoma aislado, que empeora por la noche, se asocia a hiperreactividad bronquial y mejora tras el tratamiento con broncodilatadores. Durante mucho tiempo se ha considerado el asma como la causa más común de aparición de tos persistente en el niño(3). Más recientemente se ha puesto en duda la relación entre la tos crónica en el niño y el asma, y se ha comprobado que ambas entidades presentan diferencias epidemiológicas y fisiológicas fundamentales(4). DIAGNÓSTICO FUNCIONAL El objetivo del estudio funcional en el asma es demostrar la presencia de obstrucción bronquial al flujo aéreo reversible con broncodilatadores o de hiperrespuesta bronquial frente a diversos estímulos específicos o inespecíficos (Fig. 2). La prueba más útil para valorar la obstrucción bronquial es la espirometría forzada. El problema es que para realizar una espirometría necesitamos una buena co- Libro II curso 31/1/05 17:26 P gina 70 70 J. R. Villa Asensi, et al. I. Sospecha clínica Síntomas de asma Espirometría con prueba broncodilatadora (BD) II. Confirmación diagnóstica Normal Medir 2 semanas FEM en domicilio Variabilidad FEM < 20% Patrón obstructivo BD positiva BD negativa Prueba terapéutica y repetir espirometría Variabilidad FEM = 20% Normalización Persiste obstrucción Prueba de provocación Negativa Positiva ASMA Plantear otros diagnósticos Plantear otros diagnósticos III. Estudio de factores precipitantes Prick test a neumoalérgenos Figura 1. Algoritmo diagnóstico del asma. laboración por parte del paciente, esto es difícil de lograr en niños menores de 5-6 años de edad. Por debajo de esta edad tenemos que utilizar pruebas más complejas y muchas veces sólo accesibles en laboratorios especializados, lo que hace que la mayoría de las veces, en niños menores de 5 años, tengamos que basarnos exclusivamente en un diagnóstico clínico. Otro método para valorar la función pulmonar es la medición del flujo espiratorio forzado (PEF), que tiene la ventaja de ser un método más simple y barato, siendo accesible en cualquier consulta, en urgencias o en el domicilio del paciente, pero la desventaja de ser menos preciso que la espirometría. Los estudios de función pulmonar son de gran utilidad no sólo para el diagnóstico, sino para valorar la respuesta al tratamiento y la evolución de la enfermedad. Espirometría forzada Mide volúmenes y flujos pulmonares generados en una maniobra de espiración voluntaria máxima. La espirometría forzada comienza desde la capacidad pulmonar total y termina al alcanzar el volumen residual. Los dos parámetros más impor- Libro II curso 31/1/05 17:26 P gina 71 71 Cómo se diagnostica el asma Síntomas persistentes (± episódico) Asma persistente Gravedad Asma episódico Figura 2. Diferentes patrones del asma en el niño. En el primer caso el paciente tiene crisis importantes de broncoespasmo estando asintomático entre las crisis el segundo paciente tiene un patrón más persistente de síntomas con algunos episodios de broncoespasmo y el tercero tiene síntomas crónicos sin volver nunca a la normalidad. tantes obtenidos mediante la espirometría son: - FEV1 (volumen espiratorio forzado en el primer segundo). - FVC (capacidad vital forzada). Ambos parámetros son volúmenes y se miden en litros. Otros parámetros también útiles son: - Cociente FEV1/FVC: es el porcentaje de - la capacidad vital forzada que se espira en el primer segundo. Su valor normal es alrededor del 80% y está disminuido en el asma y en los procesos obstructivos. Flujo espiratorio máximo (FEM): es el flujo máximo que se mide durante la maniobra de espiración forzada. Es un parámetro muy dependiente del esfuerzo y también disminuye en procesos obstructivos TABLA 1. Preguntas que nos deben hacer considerar el diagnóstico de asma(1). • ¿Ha presentado episodios recurrentes de sibilancias? • ¿Tiene tos persistente por las noches? • ¿Tiene tos o sibilancias tras el ejercicio físico? • ¿Tiene tos, sibilancias u opresión torácica tras la exposición a alérgenos ambientales o contaminantes? • ¿Tiene catarros “que bajan al pecho” o que duran más de 10 días? • ¿Mejoran sus síntomas con tratamiento antiasmático? - Flujo espiratorio forzado entre el 25 y el 75% de la FVC (FEF 25-75): este parámetro es muy sensible a la obstrucción de las vías aéreas más pequeñas y en Libro II curso 31/1/05 17:26 P gina 72 72 J. R. Villa Asensi, et al. ocasiones es el único que se afecta en el asma leve. La variable que define la existencia de obstrucción bronquial es la relación FEV1/FVC, la magnitud de la obstrucción se mide a partir del valor del FEV1. Una vez demostrada la obstrucción debemos valorar la reversibilidad con broncodilatador. Para ellos se administra un β2-agonista por vía inhalada y se repite la espirometría pasados 20 minutos. Consideraremos que una prueba broncodilatadora es positiva cuando se produce un incremento del FEV1 mayor del 12% respecto al valor basal o del 9% respecto al valor teórico (Tabla 2). Una espirometría con obstrucción bronquial y una prueba broncodilatadora negativa no excluye el diagnóstico de asma pues puede que la obstrucción sea consecuencia más de la inflamación bronquial que del broncoespasmo por lo que deberíamos reevaluar al paciente tras la administración de un ciclo de corticoides orales. Los niños con asma leve tendrán una prueba de función pulmonar normal fuera de las exacerbaciones por lo que será más difícil el diagnóstico funcional. En estos casos deberemos comprobar si existe variabilidad en el FEM o hiperrespuesta bronquial. Medición del FEM Consiste en la medición del flujo espiratorio máximo mediante un aparato portátil. Al igual que la espirometría, requiere una maniobra dependiente del esfuerzo, por lo que su uso también se limita a los niños mayores de 4-6 años. La medición del FEM puede ser útil en las siguientes situaciones: TABLA 2. Diagnóstico funcional del asma en niños mayores de 5 años. • Prueba broncodilatadora positiva: ↑ del FEV1 ≥ 9% del valor teórico o ≥ 12% del valor basal. • Variabilidad del FEM ≥ 20%. • Provocación con metacolina, histamina o adenosina: ↓ FEV1 ≥ 20%. • Prueba de esfuerzo ↓ FEV1 ≥ 15%. • Provocación con suero salino hipertónico: ↓ FEV1 ≥ 15%. - Diagnóstico y valoración de asma en atención primaria cuando no se dispone de espirometría. El incremento de un 15% del PEF en repuesta a un broncodilatador o ciclo de corticoides, sugiere el diagnóstico de asma. - Monitorización diaria del PEF en domicilio: se considera diagnóstico de asma una variación entre el valor matutino y vespertino del PEF mayor de 20% en más de tres días por semana a lo largo de 2 semanas. La magnitud de esta variabilidad es proporcional a la severidad de la enfermedad. En la práctica muy pocos niños con asma muestra esta variabilidad en el FEM. - La monitorización diaria del FEM en el asma moderado puede ser útil en la detección precoz de signos de deterioro del asma. Sin embargo, es importante tener en cuenta que las medidas de FEM no siempre se correlacionan con otras medidas de función pulmonar. Por ejemplo, en niños asmáticos, el FEM puede ser normal en presencia de obstrucción del flujo aéreo, pu- Libro II curso 31/1/05 17:26 P gina 73 Cómo se diagnostica el asma diendo infravalorar el grado de obstrucción bronquial. Siempre que sea posible es preferible comparar las mediciones de PEF con el mejor valor personal del paciente, en lugar de con el valor que teóricamente le corresponde por las medidas antropométricas. Aunque algunos consensos han preconizado la medición diaria en el domicilio del paciente del FEM en todos los asmáticos, desde el punto de vista práctico hoy sólo se recomienda a pacientes con asma moderada o grave, pobre percepción de la gravedad de los síntomas y hospitalizaciones frecuentes. Estudio de la hiperrespuesta bronquial Otro de los aspectos que definen funcionalmente al asma es la existencia de hiperrespuesta de los bronquios ante diversos estímulos. Para su estudio se somete al paciente a una provocación reglada con dosis progresivas de una sustancia broncoconstrictora (metacolina, histamina, adenosina o suero salino hipertónico) por vía inhalada y se mide la función pulmonar mediante espirometría antes y tras cada dosis del agente broncoconstrictor. Consideraremos que una prueba es positiva cuando se produce una caída del FEV1 igual o superior al 20% respecto al valor basal; en la provocación con suero salino hipertónico se considera positiva una caída igual o superior al 15%. Una prueba positiva es muy sugestiva de asma, aunque no patognomónica, pues otras enfermedades bronquiales pueden acompañarse de hiperrespuesta bronquial, una prueba negativa prácticamente descarta el diagnóstico de asma. 73 Otra prueba útil, sobre todo en niños, para valorar la existencia de hiperrespuesta bronquial es la prueba de esfuerzo. Ésta consiste en inducir un broncoespasmo mediante la realización de un ejercicio intenso durante 6 a 8 minutos, generalmente con un tapiz rodante. Se considera la prueba positiva cuando se produce una caída ≥ 15% del FEV1 tras la realización del esfuerzo. Estudio funcional en el lactante y en el niño preescolar En los niños que no colaboran para la realización de una espirometría, el diagnóstico funcional del asma es complejo. Hasta hace muy pocos años no podíamos medir la función pulmonar en estos niños, pero más recientemente han ido apareciendo una serie de técnicas que pueden ayudarnos a valorarla. Las técnicas que nos ayudan a medir el grado de obstrucción bronquial y su respuesta a broncodilatadores de forma pasiva valoran la resistencia de las vías respiratorias. Las más utilizadas son la pletismografía corporal, la oscilometría de impulsos (IOS) y las resistencias por oclusión (Rint). Estas técnicas, en general, presentan una alta sensibilidad para detectar una respuesta broncodilatadora, pero una especificidad baja. Se considera que una prueba broncodilatadora es positiva cuando se produce un incremento de la conductancia específica (sGaw) ≥ 25% en la pletismografía o una caída del la Rsr5 (resistencia a 5 Hz) ≥ 30% o el aumento de la Xrs5 (reactancia 5 Hz) ≥ 40% en la oscilometría o una caída de la Rint ≥ 30% con la técnica de la oclusión(5). Libro II curso 31/1/05 17:26 P gina 74 74 Las técnicas de función pulmonar más utilizadas en lactantes son la pletismografía corporal y la técnica de la compresión rápida toracoabdominal con o sin insuflación previa. Ambas técnicas requieren un aparataje caro, requieren la sedación del paciente y son muy laboriosas, por lo que no se utilizan en la clínica habitual, quedando restringidas a la investigación o a casos seleccionados. DIAGNÓSTICO DE LA INFLAMACIÓN BRONQUIAL Dado que una de las características fundamentales del asma es la existencia de inflamación bronquial, desde hace años se han introducido diferentes métodos para monitorizar esa inflamación. El método de referencia sería la biopsia bronquial, pero es un método agresivo, por lo que no se puede realizar en la práctica clínica habitual. La determinación del tipo, cantidad y proporción de células en el lavado broncoalveolar se correlaciona bien con el resultado de las biopsias, pero también exige hacer una broncoscopia, por lo que se ha introducido su determinación en esputo inducido. El esputo inducido está bien estandarizado en adultos, pero su uso en niños es más complejo. Un método sencillo y que nos permite conocer su resultado en el momento es la medición de la concentración de óxido nítrico (NO) en aire exhalado. Este método está bien estandarizado(6), incluso para niños pequeños(7), pero su utilidad para el diagnóstico del asma está muy limitada J. R. Villa Asensi, et al. pues los valores de los niños asmáticos se solapan con los de los niños sanos. La concentración de proteína catiónica del eosinófilo (ECP) en suero se correlaciona también con algunas variables del asma, como la función pulmonar o la clínicaé pero también sus valores se solapan. El valor de la ECP en suero en niños con sibilancias recurrentes en los primeros años de la vida podría correlacionarse con la evolución posterior del asma(8). Así pues, aunque se están realizando avances importantes en este campo, todavía no estamos en disposición de determinar de una forma sencilla y fiable el grado de inflamación bronquial en la clínica diaria. VALORACIÓN DE LA ALERGIA Los alérgenos inhalados son agentes desencadenantes del asma en un porcentaje elevado de los niños mayores, y con mucha menos frecuencia en lactantes y preescolares. En los niños con asma se recomienda identificar los alérgenos que puedan estar implicados en su enfermedad para intentar evitarlos. Para ello debemos hacer una historia clínica detallada de la exposición a alérgenos y de la relación entre la clínica del paciente y la exposición y posteriormente un estudio de alergia para demostrar la existencia de una sensibilización. La técnica más útil en el diagnóstico alergológico son las pruebas cutáneas mediante prick test, que son sencillas, rápidas y seguras en ocasiones puede utilizarse también la determinación de IgE es- Libro II curso 31/1/05 17:26 P gina 75 75 Cómo se diagnostica el asma pecífica en suero (RAST o CAP system), aunque su coste es más elevado. La prevalencia de pruebas cutáneas positivas en los niños con asma es elevada, pero su trascendencia clínica no está bien establecida. Es frecuente encontrar niños alérgicos que no tienen asma y, por otro lado, niños asmáticos que no tienen alergia y no es raro encontrar niños con asma durante todo el año que sólo muestran sensibilización a pólenes estacionales. Los neumoalérgenos más frecuentes que causan asma se detallan en la tabla 3. No existe correlación entre el tamaño de las pruebas cutáneas o el valor de la IgE específica y la intensidad del asma. CLASIFICACIÓN DE LA GRAVEDAD DEL ASMA Todos los protocolos actuales de manejo del asma proponen un tratamiento farmacológico escalonado dependiendo de su gravedad. Es, por lo tanto, fundamental clasificarlo correctamente, pues de ello depende que elijamos un tratamiento u otro. Las clasificaciones habituales, como la de la GINA(1), se han concebido pensando en el adulto y no se adaptan bien a las características del niño, lo cual las hace complejas y poco útiles en el ámbito pediátrico. Una clasificación más adaptada a la realidad de los niños es la propuesta por el protocolo conjunto de la Sociedad Española de Neumología Pediátrica y de la Sociedad Española de Alergia Infantil(9) (Tabla 4). Se consideran 4 estadios: asma episódica ocasional, asma episódica frecuente, asma persistente moderada y asma per- TABLA 3. Neumoalergenos más frecuentes que causan asma. • Pólenes: - Gramíneas: Phleum, Cynodon… - Malezas: parietaria, artemisa, Plantago, Chenopodium… - Árboles: olivo, plátano, ciprés, abedul… • Ácaros: - Dermatophagoides pteronyssinus, Lepydoglyphus, Tyrophagus… • Epitelios de animales: - Gato, perro, caballo, cobaya… • Hongos: - Alternaria, Cladosporium, Aspergillus… sistente grave. Para clasificar el asma utilizaremos parámetros clínicos, como frecuencia de las crisis y síntomas entre las crisis y funcionales. En los niños menores de 5-6 años se utiliza exclusivamente la clínica para la clasificación. Hay que tener en cuenta que la gravedad del asma en un niño puede variar con el tiempo y, por lo tanto, debemos reclasificar al paciente. Una vez que está en tratamiento podemos clasificarlo dependiendo del tratamiento que precise para mantenerse controlado. DIAGNÓSTICO DIFERENCIAL DEL ASMA EN EL NIÑO PEQUEÑO Las sibilancias son muy frecuentes durante la primera infancia. En la gran mayoría de los niños son secundarias a una infección viral, ya sea por virus respiratorio sincitial (VRS), sobre todo, en los pri- Libro II curso 31/1/05 17:26 P gina 76 76 J. R. Villa Asensi, et al. TABLA 4. Clasificación del asma en el niño. Episódica ocasional - Episodios de pocas horas o días de duración menos de una vez cada 1012/semanas - Máximo 4-5 crisis al año - Asintomática en la intercrisis con buena tolerancia al ejercicio Exploración funcional respiratoria: - Normal en las intercrisis Episódica frecuente - Episodios menos de una vez cada 56 semanas (máximo 6-8 crisis/año) - Sibilancias a esfuerzos intensos - Intercrisis asintomáticas Exploración funcional respiratoria: - Normal en las intercrisis. Persistente moderada - Episodios más de una vez cada 4-5 semanas - Síntomas leves en las intercrisis - Sibilancias a esfuerzos moderados - Síntomas nocturnos menos de 2 veces por semana - Necesidad de β-adrenérgicos menos de 3 veces por semana Exploración funcional respiratoria: - FEM o FEV1 > 70% del valor predicho - Variabilidad del PEF entre el 20-30% Persistente grave - Episodios frecuentes - Síntomas en las intercrisis - Requerimientos de β2-agonistas más de 3 veces por semana - Síntomas nocturnos más de 2 veces por semana - Sibilancias a esfuerzos mínimos Exploración funcional en la intecrisis: - FEM o FEV1 < 70% de su valor predicho - Variabilidad del PEF > 30% * En menores de 6 años no es preciso valorar la función pulmonar a efectos de clasificación. En el lactante, las intercrisis se valorarán por su repercusión en su actividad normal diaria (llanto, risa, juego y alimentación). meros meses de vida o por otros virus posteriormente. Un pequeño subgrupo de estos niños tienen una base atópica, con antecedentes familiares de asma o con dermatitis atópica, y estas sibilancias son más similares a las que tienen los niños mayores con asma. Afortunadamente la mayoría de los niños con sibilancias tienen un pronóstico excelente e irán mejorando a los largo de los primeros años de vida y muchos se curarán definitivamente. El principal problema lo plantea el que las sibilancias son síntomas muy inespecíficos que aparecen, tanto en un niño con una infección viral banal, como en un niño con una enfermedad respiratoria grave como una fibrosis quística o una malformación congénita broncopulmonar o un anillo vascular. Existen enfermedades muy diversas que se manifiestan con sibilancias durante los primeros años de vida, y cuya presentación clínica puede ser muy similar en unas y en otras, siendo un gran reto distinguirlas. Tanto el asma como las sibilancias recurrentes durante las infecciones virales son tan frecuentes que muchas veces los pediatras olvidamos que hay otras patologías que pueden presentarse del mismo modo (Tabla 5) ,y en muchas ocasiones los niños con estos problemas son diagnosticados muy tarde, lo que les ha hecho recibir medicaciones inapropiadas y no beneficiarse de un tratamiento más específico. ¿Cuándo sospechar la existencia de patologías infrecuentes en el niño con sibilancias? Existen algunos síntomas o signos que deben hacernos sospechar que estamos ante un paciente de este tipo(10). Libro II curso 31/1/05 17:26 P gina 77 77 Cómo se diagnostica el asma Historia clínica • Edad de inicio de los síntomas: las sibilancias son muy infrecuentes durante los primeros 2 meses de vida(11). Incluso en los niños con bronquiolitis aguda por debajo de esta edad, las sibilancias y la dificultad respiratoria no suelen ser los síntomas de presentación más frecuentes, sino que suelen manifestarse con apnea o con dificultad para la alimentación. Después de los 2 meses de edad, la aparición de sibilancias van haciéndose cada vez más frecuente, alcanzado un pico entre los 5 y los 6 meses de vida(12). Después de los 6 • meses, la incidencia (número de casos nuevos) va disminuyendo y se mantiene relativamente estable durante los primeros 2-3 años de edad(13). En un niño con antecedentes de prematuridad y fundamentalmente si ha requerido tratamiento intensivo y que tiene síntomas respiratorios desde el primer momento deberemos sospechar una displasia broncopulmonar. La presencia de síntomas respiratorios desde los primeros días de vida en un niño sin antecedentes de prematuridad debe hacernos sospechar un diagnóstico alternativo pues como hemos comentado, las sibilancias secundarias a asma o a infecciones virales son excepcionales antes de los 2 meses de edad. Patrón de los episodios: los síntomas persistentes sin remisión entre los episodios debe hacernos descartar un diagnóstico alternativo al de asma. Un comienzo brusco de los síntomas en un niño que ha comenzado a caminar, debe hacer- TABLA 5. Patologías que pueden cursar con sibilancias en la primera infancia. • Vías aéreas superiores - Anomalías congénitas de la región laríngea: laringomalacia, parálisis de cuerdas vocales, angiomatosis laríngea • Obstrucción de las grandes vías aéreas - Anomalías congénitas de la tráquea y bronquios principales: traqueomalacia, broncomalacia, estenosis traqueal o bronquial - Anillos vasculares o membranas laríngeas - Cuerpo extraño en tráquea o bronquios - Adenopatías o tumores • Obstrucción de las pequeñas vías aéreas - Bronquiolitis viral o bronquiolitis obliterante - Fibrosis quística - Displasia broncopulmonar - Discinesia ciliar primaria - Cardiopatías • Otras: - Reflujo gastroesofágico y síndromes espirativos • nos siempre sospechar la posibilidad de una aspiración de cuerpo extraño. Patologías asociadas: la existencia de malnutrición o diarrea crónica junto con síntomas respiratorios debe hacernos sospechar una fibrosis quística, aunque no debemos olvidar que alrededor de un 20% de los niños con fibrosis no tienen insuficiencia pancreática y por lo tanto no tienen síntomas gastrointestinales. Un niño con sinusitis u otitis de repetición podría tener una discinesia ciliar primaria. La asociación de patología respiratoria con dermatitis atópica hace más probable que el niño tenga asma. La aso- Libro II curso 31/1/05 17:26 P gina 78 78 • • J. R. Villa Asensi, et al. ciación con enfermedades infecciosas supuradas o diarrea crónica debe hacer pensar en una inmunodeficiencia. Un niño con retraso psicomotor podría tener aspiraciones y un niño que vomita, un reflujo gastroesofágico. Relación con la alimentación: debemos considerar la posibilidad de que un niño con episodios recurrentes de broncoespasmo, tenga reflujo gastroesofágico o aspiraciones, sobre todo si presenta vómitos o si tiene síntomas durante las comidas o tras las comidas aunque algunos niños pueden tener aspiraciones también durante el sueño tras la comida. El problema es que a veces existe reflujo en un niño sin síntomas digestivos claros y por otro lado, el reflujo es bastante frecuente en niños sanos. Debemos considerar este diagnóstico en cualquier niño pequeño con síntomas respiratorios que no evolucionan de la forma esperada. La relación entre las sibilancias en el niño pequeño y la alergia a proteínas de leche de vaca es excepcional y ésta última generalmente se manifiesta con síntomas cutáneos o gastrointestinales. Crecimiento y desarrollo: la mayoría de niños con asma o con sibilancias en relación con infecciones virales, suelen tener un desarrollo póndero estatural normal. Por lo tanto en cualquier niño con síntomas respiratorios y retraso del desarrollo deberá sospecharse fibrosis quística. Se debe tener en cuenta que cualquier patología respiratoria grave, como una displasia broncopulmonar o una malformación puede asociarse • • • con retraso ponderal por el alto consumo calórico que implica para estos pacientes respirar. Historia familiar: algunas enfermedades respiratorias, como la fibrosis quística tienen un claro patrón hereditario. El asma es más frecuente en hijos de padres con atopia o asma. Las malformaciones pulmonares no presentan un patrón hereditario. Ambiente: la exposición al humo de tabaco, fundamentalmente durante el embarazo y en los primeros años de la vida, se asocia de forma intensa con patología respiratoria en el lactante. En un niño con asma los síntomas pueden aumentar si está en contacto con tabaco. Aunque es poco frecuente por debajo de los 3-5 años de edad, siempre se debe investigar el contacto del niño con alérgenos que pueden estar influyendo en la evolución de su asma, sobre todo epitelios de animales o ácaros. La aparición de los síntomas en ciertas épocas del año, como la primavera nos hará sospechar la existencia de una sensibilización a pólenes. Respuesta al tratamiento: debemos valorar todos los tratamientos que ha recibido previamente el paciente y su respuesta a los mismos. Hay que tener en cuenta si la dosis y la vía de administración han sido adecuadas. La mayoría de los niños con asma responden bien al tratamiento broncodilatador y al tratamiento con corticoides inhalados. Sin embargo, no es raro encontrar niños que tiene episodios de broncoespasmo exclusivamente con las in- Libro II curso 31/1/05 17:26 P gina 79 Cómo se diagnostica el asma fecciones virales y que tienen una mala respuesta a un tratamiento antiasmático adecuado(14). Examen físico El examen físico puede ayudarnos a identificar a los pacientes con más probabilidades de sufrir causas atípicas de episodios de sibilancias. Como hemos referido, un niño malnutrido probablemente tendrá alguna causa más grave de patología pulmonar, como fibrosis quística, inmunodeficiencia etc.…; un niño con retraso psicomotor puede tener fácilmente aspiraciones. La configuración del tórax de un niño pequeño con asma o con sibilancias recurrentes por infecciones virales, es en general, normal. Un tórax hiperinsuflado a esta edad debe hacernos pensar en una patología respiratoria más importante. A veces un pectum excavatum(15) u otras alteraciones torácicas podrían acompañarse de malformaciones de las vías aéreas. La auscultación pulmonar puede ser completamente normal en el momento de la exploración del paciente. La auscultación en el asma puede ser muy variable de un momento a otro, en general, las sibilancias suelen ser bilaterales. La existencia de una reducción clara de los ruidos respiratorios en un hemitórax o en un lóbulo pulmonar, debe hacernos sospechar lesión localizada, como aspiración de cuerpo extraño o malformación broncopulmonar. Sin embargo, no es raro que un niño con asma tenga un tapón mucoso en un momento determinado que haga que exista hipoventilación marcada en una 79 zona pulmonar, que podría desaparecer en poco tiempo incluso tras un golpe de tos. En general, los sonidos que escuchamos durante la auscultación de un paciente asmático son polifónicos, y pueden aparecer, tanto en inspiración, como espiración. La auscultación de un sonido monofónico, especialmente durante la inspiración, debe hacernos sospechar la existencia de patología en la vía aérea superior (laringe o zona extratorácica de la tráquea). Un sonido monofónico que aparece, tanto en inspiración, como espiración debe hacernos sospechar patología de la tráquea intratorácica, como traqueomalacia o compresión traqueal por un anillo vascular u otra patología malformativa. No debemos olvidar que los ruidos que se producen en la nariz o en la faringe, también se transmiten al tórax y podemos interpretarlos como secundarios a patología bronquial. Pruebas complementarias básicas En un niño con patología respiratoria recurrente se deben realizar, al menos, unos exámenes complementarios básicos que deberían incluir: una Rx de tórax simple, un hemograma con contaje de eosinófilos y una IgE total (estos últimos podrían ayudarnos a valorar los factores de riesgo de continuar con asma(16). En niños un poco más mayores puede ser útil realizar unas pruebas cutáneas para neumoalérgenos, que nos ayudarán a comprobar si el niño tiene o no sensibilización a determinados alérgenos ambientales. Unas pruebas positivas apoyarían el diagnóstico de asma y nos ayudarían a establecer unas normas de evitación alergénica, pero unas pruebas alér- Libro II curso 31/1/05 17:26 P gina 80 80 gicas negativas no invalidan en absoluto el diagnóstico de asma. La radiografía de tórax puede mostrar zonas de atelectasia o de atrapamiento aéreo, que nos obligarían descartar patología bronquial localizada, como la existencia de un cuerpo extraño o de alguna compresión bronquial. Los niños con asma suelen tener una radiografía de tórax normal, aunque no es raro encontrar hiperinsuflación pulmonar durante las crisis o en cualquier momento, atelectasias o infiltrados secundarios a tapones de moco. La zona que con más frecuencia se encuentra afectada es el lóbulo medio derecho. En los niños con aspiración de cuerpo extraño solemos encontrar signos indirectos, como atrapamiento localizado, en la mayoría de las ocasiones el cuerpo extraño es radiotransparente. Se debe valorar cuidadosamente el contorno cardiovascular, por ejemplo un arco aórtico derecho debe hacer sospechar un anillo vascular u otra compresión vascular. Hoy día es muy sencillo obtener una medición de saturación de oxígeno mediante pulsioximetría. Los niños con asma o sibilancias recurrentes deben tener una saturación de oxígeno normal, excepto en las crisis importantes. Si encontramos una disminución persistentemente disminuida debemos descartar cardiopatía o afectación pulmonar parenquimatosa. Estudios que podemos realizar para el diagnóstico diferencial en el niño con sospecha de sibilancias de causa atípica Una vez que sospechamos que estamos ante un niño con una causa atípica de sibi- J. R. Villa Asensi, et al. lancias, debemos realizar más pruebas complementarias que nos ayuden a llegar al diagnóstico. Estas pruebas deben estar dirigidas a las patologías concretas que sospechemos de acuerdo a la clínica y exploración física del paciente. Cuando hablamos de niños, debemos ser especialmente precavidos y valorar siempre la relación riesgo/beneficio de cualquier prueba antes de realizarla. Las pruebas más útiles son el ionotest, para descartar fibrosis quística; estudio inmunológico, para descartar inmunodeficiencias, el esofagograma en niños con sospecha de anillo vascular; la TC de alta resolución para la valoración del parénquima pulmonar; la resonancia magnética, para el estudio de las masas mediastínicas, de las malformaciones pulmonares congénitas, como el secuestro pulmonar y de las malformaciones vasculares mediastínicas. La fibrobroncoscopia (FBC) nos permite explorar la vía aérea de forma sencilla y segura. En vez de tener que estar especulando sobre la posibilidad de que un paciente tenga una alteración funcional de la vía aérea (laringo o traqueomalacia) o una compresión traqueobronquial, podemos visualizar el problema directamente. La FBC está indicada en la mayoría de los lactantes o niños preescolares con respiración ruidosa o sibilancias de causa inexplicada. La broncoscopia puede servir en el diagnóstico de cuerpos extraños no sospechados previamente (aunque su extracción deba realizarse con broncoscopia rígida(17), colapso dinámico de la vía aérea, compresión traqueal, bronquial extrínse- Libro II curso 31/1/05 17:26 P gina 81 81 Cómo se diagnostica el asma ca y lesiones intrínsecas, tales como estenosis bronquial que pueden producir sibilancias(18,19). Es importante realizar una FBC en todo paciente con sibilancias en el que se haya descartado asma o fibrosis quística y no responda bien al tratamiento. En una serie reciente de 30 niños de menos de 18 meses con sibilancias recurrentes de causa no clara, la broncoscopia demostró anomalías de la vía aérea en el 57% de los niños, siendo éstas más frecuentes en los menores de 6 meses(20). El lavado broncoalveolar puede ser útil en la investigación de los síntomas respiratorios recurrentes asociados a reflujo gastroesofágico, con el estudio del índice de macrófagos cargados de lípidos, que, aunque no es una prueba patognomónica, si es muy sugestiva de esta patología(21). La combinación de edema postglótico, de aritenoides y de cuerdas vocales tiene una sensibilidad del 75% y una especificidad del 67%, y el edema postglótico asociado a cualquier otra anomalía de cuerdas o ventrículo laríngeo un valor predictivo positivo del 100%(22). Las pruebas de función pulmonar son difíciles de realizar en lactantes y niños preescolares no colaboradores. Por este motivo se utilizan, fundamentalmente, para estudios de investigación. Se están desarrollando métodos que pueden ayudarnos de forma más sencilla a diagnosticar la obstrucción y su respuesta al tratamiento broncodilatador o para valorar la existencia de hiperreactividad bronquial en niños no colaboradores. BIBLIOGRAFÍA 1. Global strategy for asthma management and prevention. WHO/NHLBI workshop report. National Institutes for Health, National Heart, Lung and Blood Institute. Publication Number 02-3659 2002. 2. Silverman M, Wilson N. Asthma-time for a change of name? Arch Dis Child 1997; 77:62-4. 3. Cloutier MM, Loughlin GM. Chronic cough in children: a manifestation of airway hyperreactivity. Pediatrics 1981; 67:6-12. 4. Faniran AO, Peat JK, Woolcock AJ. Persistent cough: is it asthma? Arch Dis Child 1998; 79:411-4. 5. Nielsen KG, Bisgaard H. Discriminative capacity of bronchodilator response measured with three different lung function techniques in asthmatic and healthy children aged 2 to 5 years. Am J Respir Crit Care Med 2001; 164:554-9. 6. Recommendations for standardized procedures for the on-line and off-line measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide in adults and children-1999. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, July 1999. Am J Respir Crit Care Med 1999; 160:2104-17. 7. Buchvald F, Bisgaard H. FeNO measured at fixed exhalation flow rate during controlled tidal breathing in children from the age of 2 yr. Am J Respir Crit Care Med 2001; 163(3 Pt 1):699-704. 8. Villa JR, García G, Rueda S, Nogales A. Serum eosinophilic cationic protein may predict clinical course of wheezing in young children. Arch Dis Child 1998; 78:448-52. Libro II curso 31/1/05 17:26 P gina 82 82 9. Escribano A, Ibero M, Garde J, Gartner S, Villa Asensi J, Pérez Frías J. Protocolos terapéuticos en asma infantil. Protocolos Diagnóstico-terapéuticos AEP. Neumología y Alergia. Madrid: Asociación Española de Pediatría, 2003; p. 187-210. 10. Martínez FD, Godfrey S. The wheezy infant and preschool child: differential diagnosis. En: Martinez FD, Godfrey S, editors. Wheezing disorders in the preschool child. Pathophysiology and management. New York: Martin Dunitz, Taylor & Francis Group plc, 2003; p. 97-122. 11. Parrott RH, Kim HW, Arrobio JO, Hodes DS, Murphy BR, Brandt CD, et al. Epidemiology of respiratory syncytial virus infection in Washington, D.C. II. Infection and disease with respect to age, immunologic status, race and sex. Am J Epidemiol 1973; 98:289-300. 12. Holberg CJ, Wright AL, Martinez FD, Ray CG, Taussig LM, Lebowitz MD. Risk factors for respiratory syncytial virus-associated lower respiratory illnesses in the first year of life. Am J Epidemiol 1991; 133:1135-51. 13. Rakes GP, Arruda E, Ingram JM, Hoover GE, Zambrano JC, Hayden FG et al. Rhinovirus and respiratory syncytial virus in wheezing children requiring emergency care. IgE and eosinophil analyses. Am J Respir Crit Care Med 1999; 159:785-90. 14. McKean M, Ducharme F. Inhaled steroids for episodic viral wheeze of childhood. Cochrane Database Syst Rev 2000;(2): CD001107. 15. Godfrey S. Association between pectus excavatum and segmental bronchomalacia. J Pediatr 1980; 96:649-52. J. R. Villa Asensi, et al. 16. Castro-Rodríguez JA, Holberg CJ, Wright AL, Martínez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med 2000; 162(4 Pt 1):1403-6. 17. Martinot A, Closset M, Marquette CH, Hue V, Deschildre A, Ramon P, et al. Indications for flexible versus rigid bronchoscopy in children with suspected foreign-body aspiration. Am J Respir Crit Care Med 1997; 155:1676-9. 18. Wood RE. The emerging role of flexible bronchoscopy in pediatrics. Clin Chest Med 2001; 22:311-7. 19. Moreno Galdó A, de Gracia Roldán J, Liñán Cortés S. Exploraciones directas. Broncoscopia. Lavado broncoalveolar. Biopsia pulmonar. Esputo inducido. En: Cobos N, Pérez-Yarza EG, (eds.). Tratado de Neumología Infantil. Madrid: Ergon, 2003; p. 193212. 20. Schellhase DE, Fawcett DD, Schutze GE, Lensing SY, Tryka AF. Clinical utility of flexible bronchoscopy and bronchoalveolar lavage in young children with recurrent wheezing. J Pediatr 1998; 132:312-8. 21. Colombo JL, Hallberg TK. Pulmonary aspiration and lipid-laden macrophages: in search of gold (standards). Pediatr Pulmonol 1999; 28:79-82. 22. Carr MM, Nguyen A, Poje C, Pizzuto M, Nagy M, Brodsky L. Correlation of findings on direct laryngoscopy and bronchoscopy with presence of extraesophageal reflux disease. Laryngoscope 2000; 110:1560-2. Libro II curso 31/1/05 17:26 P gina 83 Tratamiento del asma S. Liñán Cortés, A. Moreno Galdó, S. Gartner Unidad de Neumología Pediátrica y Fibrosis Quística. Hospital Universitario Materno Infantil. Vall d’Hebron. Barcelona RESUMEN La definición de asma ha ido incrementando su complejidad con el transcurso de los años, al constatarse una serie de complejos mecanismos inmunológicos y celulares. Las actuales directrices para el tratamiento del asma, se encuentran definidas en las principales guías para el control y manejo de esta enfermedad. Dichas guías ofrecen una serie de recomendaciones orientativas, remarcando un enfoque escalonado basado en un método sencillo como es la valoración clínica de la intensidad del asma. En este trabajo se exponen los fármacos disponibles en este momento, las vías y dispositivos de administración de los mismos y sus recomendaciones, así como una serie de nuevas estrategias. Se insiste en las medidas higiénico ambientales y en los problemas que genera el mal cumplimiento del tratamiento. Libro II curso 31/1/05 17:26 P gina 84 84 INTRODUCCIÓN La definición de asma ha ido incrementando su complejidad con el transcurso de los años, al constatarse la participación de una serie de mecanismos celulares e inmunológicos. Se acepta como asma, “la inflamación crónica de las vías aéreas en la que desempeñan un papel destacado determinadas células y mediadores. Este proceso se asocia a la presencia de hiperrespuesta bronquial que produce episodios recurrentes de sibilancias, disnea, opresión torácica y tos, particularmente durante la noche. Estos episodios se asocian generalmente con un mayor o menor grado de obstrucción al flujo aéreo a menudo reversible de forma espontánea o con tratamiento”. La base del proceso asmático se apoya sobre todo en la persistencia crónica de un tipo de inflamación caracterizada por la presencia de linfocitos Th0 y Th2, eosinófilos y mastocitos. Exiten dos tipos de fenómenos fundamentales que caracterizan el asma: • Hiperrespuesta bronquial. Cuando un agente desencadenante (estímulo físico, químico o biológico) actúa sobre las terminaciones nerviosas de las vías aéreas y pone en marcha los mecanismos celulares de la respuesta asmática, se produce una contracción del músculo liso bronquial que provoca la obstrucción de la vía aérea. • Inflamación. Se trata de un proceso complejo y multifactorial, de instauración más lenta pero que se asocia al anterior. Las células inflamatorias li- S. Liñán Cortés, et al. beran unas sustancias conocidas como mediadores de inflamación lo que se traducirá en un aumento de la secreción de moco, edema o hinchazón de la mucosa. La persistencia de la inflamación será lo que a la larga perpetúe la sintomatología del paciente, y la utilización de la palabra crónica. Aunque el control de estos fenómenos conlleva su reversibilidad si bien no total, sí que consigue una evidente mejoría clínica. En el asmático la presencia de síntomas es el reflejo directo de la inflamación bronquial. Las actuales directrices para el tratamiento del asma se encuentran definidas en las principales guías para el control y manejo de esta enfermedad(1-3). Sus objetivos (Tabla 1), tienen como meta principal permitirles una satisfactoria calidad de vida. Todas las guías de que disponemos, ofrecen una serie de recomendaciones orientativas sobre el tratamiento del asma, con un enfoque escalonado basado en un método sencillo como es, la valoración clínica de la intensidad del asma. Según publicaciones recientes(4), el utilizar los fármacos de acuerdo con la sintomatología asmática en cada paciente, parece un principio intuitivamente razonable, ya que equilibra los riesgos de los efectos secundarios frente a sus beneficios potenciales. El sistema de clasificación según la intensidad, establece fundamentalmente dos categorías de asma: el asma episódica y el asma persistente (Tabla 2). Ambas se subdividen a a su vez en otras dos categorías; por un lado el asma episódica ocasional y el asma episódica frecuente y por otro Libro II curso 31/1/05 17:26 P gina 85 85 Tratamiento del asma TABLA 1 . Objetivos del tratamiento del niño asmático. 1. Controlar los síntomas de asma 2. Prevenir la aparición de exacerbaciones 3. Mantener la función pulmonar lo más cercana posible a la normalidad. 4. Conseguir que el sujeto afecto, pueda efectuar una actividad física normal, incluyendo el ejercicio 5. Evitar al máximo los efectos secundarios de la medicación 6. Prevenir el desarrollo de una obstrucción al flujo aéreo irreversible 7. Prevenir la mortalidad. el asma persistente valorada en moderada o grave. Se basa principalmente en las manifestaciones clínicas y las diferentes categorías se utilizan como umbral para la introducción de los llamados fármacos controladores. Los síntomas diurnos, despertares nocturnos, necesidad de B2-adrenérgicos y la valoración de la función pulmonar, constituyen las variables ponderadas, si bien algunos autores han señalado el hecho de que los síntomas que el paciente explica, en nuestro caso las familias y las pruebas objetivas de obstruc- TABLA 2. Clasificación del asma en función de la gravedad del proceso. ASMA EPISODICA OCASIONAL - Episodios de pocas horas o días de duración, menos de una vez cada 10-12 semanas - Máximo 4-5 crisis por año - Asintomático en la intercrisis, con buena tolerancia al ejercicio Características funcionales: - Exploración funcional respiratoria normal en la intercrisis - FEM o FEV1 superior al 80% del predicho - Variabilidad en los valores del FEM menor del 20% ASMA EPISODICA FRECUENTE - Episodios menos de una vez cada 5-6 semanas (máximo 6-8 crisis/año) - Sibilancias a esfuerzos intensos - Intercrisis asintomáticas Características funcionales: - Normal en la intercrisis - FEM o FEV1 superior al 80% del predicho - Variabilidad del FEM menor del 20% ASMA PERSISTENTE MODERADA - Síntomas leves en la intercrisis. - Reagudizaciones más de una vez cada 4-6 semanas - Sibilancias a esfuerzos moderados - Necesidades de β2-agonistas Características funcionales: - FEM o FEV1 superior al 70% del predicho - Variabilidad del FEM entre el 20-30% ASMA PERSISTENTE GRAVE - Síntomas continuos - Reagudizaciones frecuentes - Uso frecuente de β-2 adrenérgicos (más de 3 veces por semana) - Síntomas nocturnos frecuentes - Actividades físicas limitadas por los síntomas. Sibilantes a esfuerzos mínimos Características funcionales: - FEM o FEV1 inferior al 70% del predicho - Variabilidad del FEM superior al 30% Libro II curso 31/1/05 17:26 P gina 86 86 ción de la vía aérea se disocian con facilidad(5). Algunos autores establecen una crítica a estas guías al revelar un desacuerdo entre los propios especialistas, señalando una escasa concordancia a la hora de clasificar la intensidad del proceso(6), recomendando estudios de fiabilidad sobre la forma en que estas directrices deben aplicarse de forma homogénea por todos. En el terreno del asma infantil, estos parámetros están condicionados por la edad de nuestros pacientes(7). En los niños de menos de 6 años, la clasificación lógicamente se basa de forma casi exclusiva en la sintomatología, ya que por debajo de esta edad es prácticamente imposible llevar a cabo controles de la función pulmonar con garantías. Con ello se intenta conseguir un control más rápido de la enfermedad al iniciar el tratamiento en el escalón más adecuado a cada uno de ellos. No obstante el especialista tiene en todo momento la capacidad para poder variar una determinada actitud terapéutica, según sea la situación del paciente. Es por ello que el tratamiento del niño asmático es dinámico, disponiendo de un amplio arsenal de fármacos. Para poder alcanzar los objetivos marcados en el tratamiento del niño asmático, debemos apoyarnos en: 1. Diagnóstico correcto 2. Evaluación de la gravedad en cada paciente 3. El tratamiento farmacológico 4. Las medidas de control ambiental, dirigidas a evitar los posibles agentes desecadenantes S. Liñán Cortés, et al. 5. La educación tanto del niño y de sus padres como la de sus educadores TRATAMIENTO FARMACOLOGICO DEL ASMA Aunque el asma no se cura con medicamentos, tal y como entendemos por ejemplo, la acción de un antibiótico sobre una infección, lo que conseguimos es la estabilización y control de la enfermedad, proporcionando al paciente una mejor calidad de vida, exenta de los vaivenes que producen los episodios de agudización. En el tratamiento tanto del adulto como en el niño con asma, se combinan dos tipos de fármacos: 1. Fármacos dirigidos al tratamiento de la manifestación aguda del proceso, es decir del broncoespasmo. Se conocen como medicación sintomática o aliviadora, y están representados fundamentalmente por los broncodilatadores. 2. Fármacos dirigidos a conseguir el control de la enfermedad (medicación controladora), es decir a intentar mantener al paciente libre de síntomas. En este grupo situamos la medicación antinflamatoria (corticoides, cromonas y antileucotrienos). Fármacos disponibles Para una mejor comprensión tanto de su empleo como de sus características, puede ser interesante dividirlas en varios grupos: Libro II curso 31/1/05 17:26 P gina 87 87 Tratamiento del asma Broncodilatadores Fármacos dirigidos a conseguir mantener abierta la vía aérea, proporcionando un alivio rápido y eficaz de los síntomas (tos, disnea, sibilantes, etc). Su administración provoca la relajación de la musculatura lisa bronquial y mejora la función mucociliar, controlando la obstrucción al flujo aéreo existente en los asmáticos. Por su estructura farmacológica y por el lugar de su acción, podemos separarlos en: B2-adrenérgicos o simpaticomiméticos y anticolinérgicos. Existe un tercer grupo, las metilxantinas, con una acción broncodilatadora más limitada. • β2-adrenérgicos de acción corta (B2AC) (salbutamol, terbutalina, fenoterol) Son los broncodilatadores de mayor utilización (sobre todo los dos primeros) sea cual sea la edad del paciente y constituyen el tratamiento de elección, en los episodios de crisis asmática. Aunque pueden utilizarse por vía oral, la vía inhalatoria es sin dudas la de mayor eficacia y con menores efectos secundarios. Su acción se inicia a los pocos minutos de su administración, con un efecto máximo entre los 10-15 minutos y con una duración que no sobrepasa las 4-6 horas. Sus efectos secundarios son la aparición de temblores y cierta taquicardia. Se aconseja su administración “a demanda”, es decir según las necesidades del paciente en los momentos en que se presentan los síntomas. • β2-adrenérgicos de acción prolongada (B2AP) (formoterol, salmeterol). Existen actualmente dos fármacos B2-adrenérgicos de acción prolongada con un ini- • • cio de acción no tan rápido como los anteriores pero con una duración mucho más larga (10-12 horas). Las diferencias entre ambos fármacos son escasas. El formoterol, tiene un inicio de acción más rápido (3 minutos) con un efecto máximo a los 30-60 minutos similar al salbutamol. El salmeterol de inicio algo más lento (10-20 minutos) tiene también una acción similar al salbutamol a los 30 minutos. Debido a este lento inicio no se aconseja utilizar este último fármaco para el tratamiento de la sintomatología aguda. Los efectos secundarios de los B2AP son similares a los de acción corta. Anticolinérgicos (bromuro de ipratropio) Tienen un efecto broncodilatador de menor potencia, precisando entre 30 a 60 minutos para alcanzar su efecto máximo, por lo que su empleo en las crisis agudas no es tan eficaz utilizando de forma aislada. Tiene un efecto aditivo al utilizarlo junto a los B2, sobre todo en las crisis de mayor gravedad(8). Una revisión reciente(9) llevada a cabo por la Librería Cochrane, pone en duda su efecto sobre los sibilantes en los menores de dos años. Metilxantinas (teofilina, aminofilina), Tienen un efecto broncodilatador limitado, por lo que son fármacos relegados a un segundo plano. Su exponente más conocido es la teofilina, fármaco con limitado efecto broncodilatador y en el que se ha descrito una cierta acción antiinflamatoria, aunque por mecanismos no bien conocidos. Aunque se pueden utilizar como tratamiento Libro II curso 31/1/05 17:26 P gina 88 88 S. Liñán Cortés, et al. combinado acompañando a los corticoides inhalados (CI), nunca alcanzan la efectividad de los B2AP. Además producen efectos secundarios con frecuencia (vómitos y naúseas). Antiinflamatorios Se incluyen en este grupo, una serie de medicamentos dirigidos a combatir el componente inflamatorio del asma. • Glucocorticoides, Son los fármacos antiinflamatorios de mayor eficacia y seguridad en el tratamiento del asma. Se ha comprobado que, utilizados por espacio de un mes, disminuyen la inflamación bronquial y reducen de forma paulatina la hiperrespuesta bronquial. La vía de administración puede ser oral, parenteral o inhalada, siendo esta última la más recomendada cuando se trata de establecer un tratamiento estabilizador. El empleo por vía oral, se reserva para los momentos de exacerbación, en forma de pautas de pocos días de duración y utilizando siempre la menor dosis posible. La vía parenteral, queda reservada para su utilización en momentos críticos, con el paciente ingresado. Se ha atribuido a los glucocorticoides inhalados (GCI) utilizados a largo plazo un efecto hormonal sobre el eje hipotalámico-hipofisosuprarrenal, que puede condicionar entre otras consecuencias, la presencia de un cierto retraso del crecimiento. No obstante, cuando se utilizan a dosis bajas estos efectos se minimizan. Se trata de un efecto dosis dependiente que debemos tener en cuenta, utilizando las dosis más bajas posibles pero que al mis- mo tiempo tengan una buena respuesta terapéutica. Hemos de tener en cuenta además que la curva dosis respuesta con estos fármacos se aplana con el incremento de la dosis, por lo cual a partir de unas ciertas dosis, que podríamos cifrar en 400 mg/día de budesonida o 200 mg/día de fluticasona, conseguimos aumentar los efectos secundarios pero no su efectividad. No obstante para tranquilidad de todos, la revisión GINA 2002, concreta los siguientes puntos: 1) En estudios incluyendo más 3.500 niños tratados durante 1-13 años, han alcanzado de forma constante la talla adulta normal. 2) Los niños entre los 4 y los 10 años son más susceptibles que los adolescentes. 3) No se ha demostrado un efecto adverso sobre el crecimiento a la dosis de 100-200 mg inhalados. 4) El retraso en el crecimiento es dosis dependiente. 5) Existen diferencias entre los diferentes CI. 6) El asma no controlado puede afectar de forma adversa al crecimiento. 7) Los cambios producidos por los CI en la velocidad de crecimiento durante el primer año son transitorios y no reflejan la talla final. Los efectos locales cuando se utilizan por la vía inhalada y a corto plazo, son casi nulos: presencia muy ocasional de candidiasis orofaríngea, afonía y cierta tos irritativa en el momento de la administración. Estos efectos se evitan con el empleo de las cámaras de inhalación y enjuagándose la boca después de su administración. Se proponen para el empleo de los GCI dos alternativas: o bien los iniciamos con dosis elevadas (Tabla 3), para reducir estas dosis en el momento en que consideremos al paciente controlado o bien administra- Libro II curso 31/1/05 17:26 P gina 89 89 Tratamiento del asma TABLA 3. Etiología de NAC en edad pediátrica; estudio de Juvén et al(15) (año 2000). Glucocorticoides inhalados Dosis bajas Budesonida Hasta 200µg/día Fluticasona Hata 100 µg/día Ciclosenide* hasta 100 µg/día Dosis medias Entre 200-400 µg/día Entre 100-250 µg/día Entre 100-200 µg/día Dosis altas Más de 400 µg/día Más de 250 µg/día Más de 200 µg/día * Próxima comercialización en nuestro país mos dosis bajas y la regulamos hasta su control. Esta última propuesta parece que sería la más sensata atendiendo a las recomendaciones en cuanto a sus efectos secundarios, no obstante los grupos de expertos recomiendan el control rápido del paciente para minimizar el riesgo de posibles exacerbaciones o el abuso de medicación de rescate. • Cromoglicato sódico / Nedocromil sódico, Son fármacos antiinflamatorios no esteroideos. Su mecanismo de acción no es bien conocido, aduciendose un efecto sobre macrófagos, mastocitos y eosinófilos. Su vía de administración es la inhalada y sus efectos secundarios mínimos. No todos los pacientes responden de igual forma a su administración, pudiéndose efectuar un ensayo terapéutico de 4-6 semanas para evaluarlo. Su eficacia es bastante menor que la de los CI. Un reciente estudio(10) efectuado en niños de 5 a 12 años se decanta sin dudas hacia la utilización de los CI. Por otro lado una de las revisiones Cochrane pone de manifiesto que el nedocromil utilizado antes del ejercicio, disminuye la gravedad y duración del broncoespasmo inducido por el ejercicio. • Antileucotrienos. Son fármacos (montelukast), aprobados hace ya unos años para su utilización en niños y cuyo mecanismo de acción se basa en el bloqueo de los leucotrienos (antagonistas de los cisteinil-leucotrienos), sustancias que se consideran mediadores de los fenómenos inflamatorios. Además de su acción antiilflamatoria (menor que la de los CI), tienen una cierta acción broncodilatadora , aunque también menor que la de los B2-agonistas, que contribuye a los efectos positivos de estos fármacos. Su efecto antiinflamatorio se complementa con el de los CI ya que estos a la dosis utilizada habitualmente, no previenen la liberación de leucotrienos. El uso de los antileucotrienos permite en muchos casos una reducción de la dosis de los CI e incluso su supresión si la evolución es favorable. Su única vía de administración es oral en forma de comprimidos que el paciente debe de masticar o deglutir en las preparaciones de dosificación más elevada, lo que contribuye a mejorar el factor de cumplimiento. Actualmente disponemos de una preparación en forma de granulado para su utilización en niños más peque- Libro II curso 31/1/05 17:26 P gina 90 90 ños. En general son bien tolerados, con pocos efectos secundarios: cefaleas e insomnio, descritos aisladamente. Su papel en el tratamiento del asma, se concreta en al tratamiento del asma leve como alternativa a los GCI, como tratamiento combinado(11) con los GCI y en el broncoespasmo inducido por el ejercicio(12). Hay que hacer constar que existe aproximadamente un 40% de los pacientes que no son respondedores al fármaco, sin poder predecir quienes serán. Vías y dispositivos de administración del tratamiento inhalado Como ya hemos comentado, la vía inhalada es la que goza de un mayor predicamento, ya que permite la liberación del producto directamente en el interior de la vía aérea, consiguiendo unas concentraciones locales más elevadas, con un mayor efecto, acción más rápida y menores efectos secundarios. Los sistemas que utilizamos para la vía inhalada, podemos agruparlos en tres grandes grupos: los inhaladores de dosis medida única, los preparados en forma de polvo seco y las soluciones para su administración mediante nebulizadores. En general podemos considerar que la edad del paciente será el principal factor que condicionará la utilización de uno u otro sistema. Mostramos en la tabla 4, un cuadro orientativo del empleo de los dispositivos. Inhaladores. Cámaras de inhalación El fármaco se utiliza bajo la forma de un inhalador presurizado de dosis me- S. Liñán Cortés, et al. dida (MDI), dotado de un mecanismo valvular que se abre mediante presión o en algunos modelos de reciente aparición, por la propia fuerza de la inspiración. Aporta una dosis conocida y siempre igual del producto, aunque se mantenga la presión sobre el mecanismo liberador. Estos dispositivos precisan, sobre todo en niños, de una perfecta coordinación entre el momento en que se produce la liberación del fármaco al efectuar la presión y el inicio de la inspiración profunda que es necesaria para conseguir un buen deposito intrapulmonar del producto. Con el fin de evitar los problemas derivados de una deficiente coordinación, se diseñaron las cámaras de inhalación o cámaras espaciadoras, de las que en la actualidad existen diferentes modelos, variando logicamente su precio y efectividad. Las modernas están dotadas de mecanismos valvulares bidireccionales, que permiten en la inspiración la toma del producto y en la fase espiratoria, expulsar el aire al exterior (Aerochamber“, Babyhaler“, Nebuchamber“ y Optichamber“. Se utilizan en niños muy pequeños. Las cámaras dotadas de boquilla y válvula unidireccional (Nebuhaler“, Volumatic“, Fisonair“), son utilizadas para niños más mayorcitos. Existe alguna pequeña cámara sin válvula útil por su facilidad de transporte (Ribujet“). Se recomienda iniciar la inhalación tras la pulsación del dispositivo, ya que el retarso en el incio disminuye la cantidad de fármaco disponible en la cámara. Libro II curso 31/1/05 17:26 P gina 91 91 Tratamiento del asma TABLA 4. Utilización de los dispositivos en función de la edad del paciente. Edad Niños menores de 4 años Niños entre 4 y 6 años Mayores de 6 años Mecanismo de elección Cámara espaciadora con mascarilla y doble válvula Cámara espaciadora de válvula única y con pieza bucal Inhaladores de polvo seco MDI actuados por la inspiración Cámara espaciadora de válvula única y con pieza bucal Dispositivos en polvo seco Recientemente, han aparecido en el mercado sistemas de inhalación en forma de polvo seco. Tienen como principal ventaja la ausencia de propelentes, permitiendo una inhalación y un depósito pulmonar más eficaz del producto. Incluyen una resistencia moderada al flujo aéreo que requiere por parte del usuario generar un flujo inspiratorio de al menos 30-50 L/m, lo que permite liberar la dosis del fármaco. Este umbral tiene como finalidad que se alcance un flujo útil para generar una fracción de finas partículas (< 5 micras) clínicamente eficaces. No se aconseja la utilización de estos dispositivos en niños menores de 5-6 años, debido a la necesidad de generar el flujo inspiratorio mencionado, aunque. no requieren coordinación entre la inspiración y la administración del fármaco. En el mercado se encuentran fundamentalmente bajo tres formas: el sistema accuhaler“ y el sistema turbuhaler“ (multidosis) y el diskhaler“ (monodosis), todos ellos de efectividad similar. Actualmente disponemos en el mercado de un nuevo sistema de inhalador en polvo seco (Novolizer“) Alternativa Nebulizador con mascarilla Nebulizador con mascarilla Nebulizador con mascarilla El depósito pulmonar de fármaco que se consigue con estos sistemas, casi llega a duplicar el conseguido con el sistema MDI. Nebulizadores Son aparatos caros, desprecian una gran cantidad de medicación y además son incómodos de utilizar. No obstante, son el sistema más utilizado para la administración de medicación broncodilatadora en las unidades de urgencias, sobre todo cuando se trata de niños de corta edad, en los que la colaboración en los momentos críticos se encuentra comprometida. Tratamiento combinado En el control de cualquier enfermedad crónica, suele ser necesario en ocasiones recurrir a asociaciones de fármacos con propiedades diferentes, pero que al administrarse de forma conjunta pueden potenciar los efectos aislados de cada uno. Queremos insistir en esta apartado como paso previo al comentario de las pautas actuales, ya que como comprobaremos más adelante, gozan en la actualidad de un lugar preminente en las pautas de tratamiento Libro II curso 31/1/05 17:26 P gina 92 92 Recordemos que los glucocorticoides (GC) penetran en la célula por difusión pasiva, sin necesidad de acoplamiento a un receptor de membrana, como ocurre con los B2-adrenérgicos. Su receptor se encuentra ubicado en el citoplasma y es un factor de transcripción nuclear, es decir una proteína que al unirse al GC es capaz de traslocarse al núcleo, interaccionar con el ADN e iniciar la transcripción genética. A partir de los años 90, se inicia la generalización del uso de los B2AP, aunque en aquellos momentos su empleo no esta exento de los temores a sus posibles efectos negativos(13). Hoy en día conocemos que los B2AP pueden potenciar los efectos de los GCI a través de dos vías diferentes: por un lado los B2AP contribuyen a la activación de los receptores de GC por lo cual este se trasloca al nucleo con mayor facilidad y a dosis menores y por otro lado, multiplican lo efectos que los GC ejercen de forma individual sobre las células inflamatorias(14). Cuando el control del asma no alcanza el nivel óptimo y el paciente precisa dosis frecuentes de medicación de rescate, podemos plantearnos dos posibilidades: 1) El aumento de la dosis de CI que el paciente estaba tomando. Ya hemos comentado anteriormente que la curva dosis respuesta en el caso de los CI no es lineal, sino que en un momento determinado por mucho que aumentemos la dosis sólo conseguimos aumentar los efectos secundarios pero no la eficacia. 2) En la actualidad se ha demostrado que el añadir a los CI, dosis de B2AP, en terapia combinada aditiva, es más eficaz que el aumento aislado S. Liñán Cortés, et al. de la dosis de CI. No se contempla el empleo de los β2 como monoterapia, ya que no constituye una indicación valida(15). Estudios efectuados en niños, apoyan la idea de que el añadir salmeterol a los GCI no sólo mejoran los parámetros de función pulmonar (FEV1) sino también los parámetros clínicos sobre todo cuanto más grave es el asma(16). Idénticos resultados se obtienen con la asociación de formoterol a la budesonida(17). Otros autores(18) demostraron la eficacia de la asociación de ambos fármacos frente al aumento aislado de los CI, con los riesgos que ello comporta. Se han emitido algunas opiniones contrarias al empleo de este tipo de asociación, pero todas ellas han sido rebatidas por los estudios llevados a cabo. De entre ellas destacamos: 1) El empleo de β2-agonistas comporta el fenómeno de la tolerancia, que disminuye la respuesta broncodilatadora. Se ha demostrado que este hecho no tiene un efecto clínico relevante en las crisis. 2) El empleo de la combinación atribuye a los GC la capacidad de poder revertir la perdida de sensibilidad de los b2agonistas, al aumentar la síntesis de receptor b2 cuya presencia en la superficie de las células disminuye de forma paralela al desarrollo de tolerancia. Es importante concretar que la administración de estos fármacos se forma asociada empleando un solo mecanismo de administración, ya sea en forma de MDI o bien en forma de polvo seco, contribuyen de forma extraordinaria a mejorar el cumplimiento del tratamiento por parte de los pacientes, ya que simplifica la forma de efectuar el mismo. Libro II curso 31/1/05 17:26 P gina 93 Tratamiento del asma En resumen, las guías internacionales basadas en la evidencia sobre el tratamiento del asma en los niños y en el adulto, recomiendan el empleo regular de B2AP (salmeterol, formoterol), como parte del tratamiento complementario al de los CI cuando estos no llegan a controlar el asma1, al demostrase más eficaz que el aumentar la dosis CI de forma aislada Otra forma de asociación es la combinación de los GCI con los anaagonistas de los leucotrienos (ALT). Ya que lo primeros no parecen afectar a la síntesis y liberación de los últimos, en principio podría parecer que la combinación de ambos fármacos puede constituir una opción valorable en el tratamiento del asma con respeusta incompleta al tratamiento exclusivo con GCI11. La adición de 5 mg de montelukast al tratamiento de base con GCI en niños entre los 5 y los 12 años, frente a placebo ha demostrado su eficacia. Recientemente han surgido estudios que sugieren una posible acción en niños menores de dos años(19). Manejo del paciente asmatico La clasificación propuesta ha sido difundida en multiples ocasiones, centrandola en cuatro apartados. Cada uno de ellos lleva implicito un determinado tratamiento que variará en fucnión del grado de control conseguido (Tabla 5). El tratamiento que proponemos se concreta en: Asma Episódica Ocasional Todos los autores están de acuerdo en que el único tratamiento que se recomienda en estos casos es el empleo de los 93 b2-agonistas de AC administrados a demanda. El nivel de evidencia se establece en el nivel A para pacientes > 12 años, nivel B para los de 5-12 años y nivel D para los menores de 5 años. No existe una clara evidencia de un beneficio ni de perjuicio entre utilizarlos a demanda o de forma pautada (Por ejemplo cada 6 horas). Es fundamental valorar su grado de utilización, ya que su empleo frecuente es índice de un pobre control del asma. Asma Episódica Frecuente En este escalón se ha demostrado en múltiples publicaciones, que los GCI constituyen el tratamiento preventivo de elección. El momento de su introducción ha sido bien establecido, existiendo una clara evidencia de que los pacientes que requieren el empleo de B2AC entre dos o tres veces por día, deberían ser tratados con CI, aunque hemos de hacer notar que pacientes con menores requerimientos de B2AC también se pueden beneficiar de ellos. La dosis inicial debe de ser la apropiada para sla sintomatología. En niños se establece en este escalón la utilización de dosis bajas: 200 mcg/día de BUD o su equivalente en fluticasona 100 mcg/12h. Inicialmente debemos utilizarlos cada 12 horas, y posteriormente podemos considerar la dosis única diaria según el grado de control alcanzado. Como alternativas a utilizar en este escalón disponemos de: - Antileucotrienos. Debemos considerar su empleo en lugar de los CI, en los casos en que estos no puedan emplearse: Libro II curso 31/1/05 17:26 P gina 94 94 S. Liñán Cortés, et al. TABLA 5. Tratamiento escalonado del asma infantil. ASMA EPISODICA OCASIONAL β2-agonistas de AC, utilizados a demanda. ASMA EPISODICA FRECUENTE β2-agonistas de AC, utilizados a demanda. Glucocorticoides inhalados a dosis bajas Considerar como alternativas: - Antileucotrienos - Cromonas (No se aconseja la utilización aislada de B2AP) ASMA MODERADA PERSISTENTE β2-agonistas de AC, utilizados a demanda Glucocorticoides inhalados a dosis medias Considerar la introducción de la terapia combinada con: - B2AP - Antileucotrienos ASMA GRAVE PERSISTENTE B2-agonistas de AC, utilizados a demanda Glucoorticoides inhalados a dosis elevadas Glucoorticoides inhalados más B2AP Glucoorticodes inhalados más antileucotrienos Teofilina de liberación lenta Tandas de corticoides orales si el control es insuficiente mal cumplimiento, técnica inhalatoria defectuosa, efectos secundarios en vías altas y cuando exista un componente de broncoespasmo inducido por el ejercicio. - Cromonas. Aparte del inconveniente de su frecuente dosificación, el cromoglicato ha demostrado una eficacia similar al placebo en niños y el nedocromil se ha mostrado eficaz sólo por encima de los 5-12 años. - No se aconseja el empleo aislado de los B2AP como primera línea de tratamiento. - Los antihistamínicos y el ketotifeno se han demostrado ineficaces. Como medicación de rescate debemos utilizar los B2AC (nivel de evidencia A para los mayores de 12 años y B entre los 5-12 años). Asma Moderada Persistente En los niños menores de 4 años, podemos utilizar los CI aislados (evidencia A) a dosis medias: budesonida (400 mcg/día) y fluticasona (200-250 mcg/día). Si no se consigue el control del paciente, podemos intentar el tratamiento combinado con montelukast a la dosis de 4 mg/día (evidencia B). En los niños de más de 4 años existen varias alternativas: - GCI a dosis medias: budesonida (400 mcg/día) o fluticasona (200-250 mcg/día) (evidencia A) - Tratamiento combinado con CI (bud,200 mcg/día o fluticasona 100 mcg/día) más B2 AP (evidencia B para los < 12 años y evidencia A para los >12 años) - Tratamiento combinado con CI a las mismas dosis más antileucotrienos (evidencia B) Como medicación de rescate debemos utilizar los B2AC (nivel de evidencia A para los mayores de 12 años y B entre los 5-12 años). Libro II curso 31/1/05 17:26 P gina 95 Tratamiento del asma Asma Grave Persistente En los niños menores de 4 años, tilizar los CI a dosis elevadas (budesonida 400-800 mcg/día o fluticasona 250-500 mcg/día) (evidencia A) En los niños mayores de 4 años, utilizar los GCI (budesonida 800 mcg/día o fluticasona 500 mcg/día más B2) (evidencia B). En todos los casos debemos considerar la introducción del montelukast a partir de los dos años (evidencia B) o teofilinas de acción retardada (evidencia C) Ante la persistencia de la falta de control, puede ser necesaria la utilización de tandas de corticoides orales, en ciclos cortos hasta conseguir la estabilización del paciente, sobre todo en las fases iniciales del tratamiento. Como medicación de rescate debemos utilizar los B2AC (nivel de evidencia A para los mayores de 12 años y B entre los 5-12 años). Recomendaciones Los pacientes pueden presentarse con parámetros o síntomas que pertenezcan a dos categorias. Hemos de elegir siempre la que consideremos de mayor gravedad. Ello nos dará en función de la medicación que establezcamos una idea global del nivel de importancia de la enfermedad. Ya que el asma es una entidad que evoluciona en el tiempo, la catalogación debemos plantearnosla como un hecho no inmóvil, sino que en función del nivel de control que manifieste el paciente, el tratamiento variará. Con este fin, efectuaremos revisiones periódicas del tratamiento una vez se haya con- 95 seguido la estabilización del proceso, disminuyendo de forma progresiva la medicación utilizada cada 3 meses, hasta conseguir la utilización de las mínimas dosis posibles. Algunos autores aconsejan suspender el tratamiento de base tras un período libre de síntomas no inferior a los 6 meses. Nuevas estrategias Tradicionalmente los pacientes reciben una dosis fija de tratamiento de base, dosis que revisamos de forma periódica. Se han propuesto una serie de pautas de autoregulación, dirigidas a los pacientes asmáticos (niños mayorcitos y adultos). El tratamiento que se ha establecido de base, fundamentalmente en pacientes sometidos a terapia combinada debe incrementarse en los momentos de agravamiento y posteriormente reducirse hasta un nivel compatible con el mantenimiento de un control eficaz del paciente. La mayor comodidad en la administración de los preparados actuales, el rápido inicio de su efecto y la mejoría que establecen en la cumplimentación, facilitan esta opción terapéutica. No obstante los parámetros que se consideran útiles en la toma de decisión del cambio de dosis, (necesidades de B2 agonistas superiores 3 veces al día en dos días consecutivos y los despertares nocturnos), tienen para nosotros una cierta dificultad de apreciación, ya que en el caso de los niños son las familias las que deben reconocer los síntomas y no el propio paciente, como ocurre con los adultos. Este sistema de dosis ajustable, tiene como finalidad el no infratratar a los pacientes en fases de inestabilidad y evitar un sobre- Libro II curso 31/1/05 17:26 P gina 96 96 tratamiento en los momentos en quer por el contrario el paciente se encuentra estable. El programa SAMS, llevado a cabo con budesonida/formoterol, demuestra la eficacia de esta estrategia frente a la dosificación fija(20). INMUNOTERAPIA El abuso de forma injustificada que en ciertos medios se ha hecho de este tipo de medicación, ha contribuido en gran manera a mantener un cierto escepticismo sobre su eficacia. Al mismo tiempo hemos de tener en cuenta que se trata de un tipo de tratamiento de un valor económico elevado, molesto en algunas de sus formas de administración y en ocasiones peligroso por sus posibles reacciones adversas. Las indicaciones generales, las podemos concretar en los siguientes puntos: - Pacientes mayores de 4 años - Pacientes monosensibilizados (fundamentalmente a polenes) - Asma episódica frecuente o asma persistente moderada - Pacientes en los que las medidas de control ambiental y un tratamiento farmacológico correcto no permitan controlar la enfermedad. Pensamos que este tipo de tratamiento no debe ser utilizado de forma aislada sino acompañando a un tratamiento antiinflamatorio que se ha demostrado de una elevada eficacia. De aparición más reciente, existen unas formas orales de aplicación sublingual, que reducen las molestias que dicho trata- S. Liñán Cortés, et al. miento puede ocasionar, pero que requieren su administración diaria y cuidadosa. MEDIDAS HIGIÉNICO AMBIENTALES Dentro de los diversos aspectos del tratamiento del niño asmático, un papel tan o más importante que la utilización de los fármacos lo constituyen las medidas higiénico ambientales dirigidas a evitar la participación de una serie de factores considerados como desencadenantes o favorecedores de la aparición de las exacerbaciones asmáticas. Dichos factores estimulan la reacción inflamatoria bronquial. En los consensos más recientes se pormenorizan la utilidad de las medidas ambientales dirigidas contra los ácaros(1,21). Se calcula que en nuestro país, más de un millón de personas padece una alergia desencadenada por los ácaros del polvo doméstico, principales desencadenantes del asma alérgica (53%). En las zonas costeras, Cantábrico, Mediaterráneo y Canarias el género Dermatophagoides (pteronissimus y farinae) son los de mayor prevalencia. En climas más secos y con oscilaciones térmicas más acusadas su supervivencia es más problemática. La mayoría de los alérgenos son enzimas proteolíticas relacionadas con el proceso digestivo de los ácaros. Es por ello que las partículas fecales son el transporte de la mayoría de los alérgenos(22). Se ha publicado que concentraciones superiores a 100-200 ng/g de polvo se pueden considerar como de riesgo para desarrollar una sensibilización alérgica y por encima de los 10 mg constitu- Libro II curso 31/1/05 17:26 P gina 97 97 Tratamiento del asma yen un factor de riego para el desencadenamiento de una crisis asmática aguda. La exposición a esta concentración en los primeros años de la vida, multiplica por cuatro el riesgo de desarrollar asma. Pocos estudios se han dirigido a evaluar la eficacia de las medidas ambientales tanto en la prevención primaria (antes de la sensibilización), como en la secundaria (antes de la aparición de los síntomas) o terciaria (una vez la enfermedad se ha establecido). Algunos autores defienden su efectividad frente a otros que no encuentran diferencias en el desarrollo de la sensibilización(23). No obstante, aunque no se ha podido concretar la utilidad real de las medidas ambientales, pensamos que dichas medidas pueden y deben ser recomendadas. Dichas medidas pueden incluir una serie de medidas físicas: modificadores de la humedad y temperatura ambiental, fundas impermeables y una serie de medidas químicas utilizando desnaturalizadores del alérgeno y los acaricidas. Para algunos autores el empleo de estas medidas químicas puede ser perjudicial para el propio paciente(24) (Tabla 6). Por lo que respecta a la sensibilización a Alternaria, existen pocas evidencias de que las medidas preventivas como dicho hongo pueda mejorar el control del paciente asmático. Los pájaros y los animales domésticos de pelo, utilizados en muchas ocasiones como mascotas, desprenden productos que son potencialmente alergénicos. La medida más eficaz es separarlos del entorno del paciente, no obstante hemos de recordar TABLA 6. Principales medidas de control frente a los ácaros de polvo doméstico - Evitar las alfombras - Evitar el empleo de mantas de lana, edredones y almohadas de plumas, difíciles de - Lavar - Utilizar fundas especiales para el colchón y la almohada, que actuaran como sistemas de barrera frente a ellos. - Lavar la ropa de cama en agua a temperaruras superiores a los 50º, por lo menos cada 15 días. - Retirar del entorno del niño, los peluches, alfombras. moquetas y cortinas. En general todo cuanto pueda acumular o retener el polvo. - Lavar con frecuencia la ropa de la cama a temperaturas de unos 65 grados. - Utilizar el aspirador o paños humedos para efectuar la limpieza de la casa. - Secar la ropa al sol si es posible. - Reducir al máximo la humedad. Evitar los humidificadores - Mantener en el dormitorio un ambiente seco y ventilado que transcurre un período de tiempo prolongado antes que el paciente experimente una franca mejoría, sobre todo con los gatos. Al igual que las anteriores medidas, existen pocas evidencias de su resultado. En los casos de sensibilización a pólenes, el paciente debe ser informado sobre las épocas en que tiene lugar la polinización, con el fin de limitar en lo que se pueda las actividades al aire libre en los lugares en que crezcan dichas plantas. Libro II curso 31/1/05 17:26 P gina 98 98 La práctica del deporte es fundamental en la educación del niño. Debemos de ser conscientes de que una buena forma física, tendrá una clara repercusión sobre los factores psicológicos anteriormente citados. Existen muchos deportistas de élite que son asmáticos y el niño o niña debe conocer este hecho. En la actualidad el COI (Comité Olímpico Internacional) admite la mediación para el asma, siempre que este avalada por un especialista. En un primer momento el deporte, puede ocasionar la aparición de ciertos síntomas asmáticos (tos y sibilancias). Un buen calentamiento, el evitar efectuar el ejercicio a temperaturas muy bajas y la administración previa de medicación, permiten la práctica de la mayoría de los deportes. Apoyo psicológico El asma es una enfermedad que a la larga comporta en las familias y en los pacientes una actitud de rechazo frente a ella, que puede llegar a provocar en los pacientes especialmente predispuestos una sensación de ansiedad o depresión que conlleva problemas de relación con su entorno, con interferencias tanto en su evolución como en su control. En los niños, la risa, el llanto y el grito por ejemplo, pueden precipitar o agravar el asma, limitando su actividad. La sensación de ahogo puede producir un cierto grado de ansiedad que agrava una crisis asmática. En otras ocasiones esta actitud de rechazo, comporta un cierto “pasotismo” que apoya el descontrol anárquico, refle- S. Liñán Cortés, et al. jado en el comportamiento no sólo a nivel familiar sino y de manera importante en el ambiente escolar. EDUCACION DEL PACIENTE CON ASMA Es especialmente importante que el paciente pueda conocer todo lo relacionado con la enfermedad: en qué consiste, cómo se presenta, agentes desencadenantes y sobre todo reconocer el inicio de una crisis y saber como actuar. Conocer los medicamentos que anteriormente hemos comentado, medicación de “alivio o rescate” y el momento idóneo de su utilización, siguiendo los planes de autocontrol especificados por el especialista, aseguran el control de la enfermedad. No obstante hemos de tener en cuenta que cuando el uso de este tipo de medicación es muy frecuente puede indicarnos que el asma esta siendo mal controlada y deberá modificarse por parte de médico el tratamiento de base que efectúa el paciente. La monitorización del FEM (pico de flujo máximo espiratorio), traduce de forma aproximada el grado de obstrucción bronquial. Conocer el máximo valor del paciente en circunstancias normales y el valor que presenta en un momento de exacerbación, permite que el paciente actúe siguiendo los planes establecidos. Si tomamos el valor máximo como el 100%, cuando el paciente presenta unos valores entre el 80 y el 100% no existen problemas, si los valores se encuentran entre el Libro II curso 31/1/05 17:26 P gina 99 99 Tratamiento del asma 60 y el 80% debe tomar medicación y si están por debajo del 60% debe consultar con su médico.Un estudio reciente llevado a cabo por la Librería Cochrane, comparando el control del paciente mediante la observación del FEM o de los síntomas, concluye en que ambos sitemas tienen una eficacia similar, si bien se constató un menor número de visitas a urgencias al monitorizar el FEM. El sistema ideal es consensuar los planes de autocontrol con la familia y el paciente, haciéndolos fáciles y comprensibles. Deben incluir el tratamiento de base que establezcamos, el empleo de la medicación de alivio y sobre todo cuando debe solicitar ayuda médica. La tarjeta con diferentes zonas de color (sistema del semáforo) es el más utilizado PROBLEMAS QUE GENERA UN MAL CUMPLIMIENTO DEL TRATAMIENTO Los medicamentos expuestos, de efectividad confirmada por amplios estudios y administrados en sus diferentes formas, fallan estrepitosamente si el paciente no muestra una buena adherencia al tratamiento. En el asma, este apartado alcanza una gran importancia. El factor de mayor importancia en este punto, está sin lugar a dudas ocasionado por el hecho de que los pacientes pasan períodos más o menos prolongados en que se encuentran libres de síntomas. La simplificación tanto en número como en horario de los medicamentos a utilizar, puede mejorar la adherencia de forma evidente. BIBLIOGRAFÍA 1. Global Initiative for Asthma. Global strategy for asthma management and prevention. US.Departament of Health and Human Services. National Institute of Health. Publication No 02-3659.Betthesda, MD. Revised 2002. 2. V.Plaza. FJ. Alvarez, P.Casan, N.Cobos, A.Lopez, MA.Llanguer, y col. Guia Española para el Manejo del Asma.(GEMA). Arch Bronconeumol 2003; 39(Supl 5):9-42. 3. Britihs Thoracic Society, Scottish Intercollegiate Gidelines Network. Britihs Guideline on the management of asthma. Thorax 2003;(Supl 1):1-94. 4. Colice GI, La seducción de clasificar la intensidad del asma. Chest, (Ed. española-Pediatría) 2004;2:59-61. 5. Teeter JG, Bleecker ER, Relationship between airway obstruction and respiratory symptoms in adult asthmatics. Chest 1998; 113:272-7. 6. Baker K, Brand DA, Hen J. Clasificación del asma. Desacuerdo entre los especialistas. Chest (Edición española). 2004; 2:63-71. 7. Grupo de trabajo para el estudio de la enfermedad asmática. Síndrome de obstrucción bronquial en la infancia. An Esp Pediatr 2002; 56(Supl 7):37-43. 8. Zorc JJ, Pusic MV,Ogborn CJ,Lebet R, Duggan AK,.ipratropium bromide added to asthma treatment in the pediatric emergency department. Pediatrics 1999; 103:748-52. Libro II curso 31/1/05 17:26 P gina 100 100 9. Everard MI, Bara A, Kurian M. Anti-cholinergic drugs for wheezein children under the age or two years. (Cochrane Review) En:The Cochrane Library, Issue 2.Oxford.Update Software, 2001. S. Liñán Cortés, et al. budesonide alone in children with persistent asthma. Pediatric Pulmonol 2002; 34:342-350. 10. The Chilhood asthma management Program Research Group. Long-term effects of budesonide or nedocromil in children with asthma. N Engl J Med 2000; 343:1054-63. 18. Verbene AAPH, Frost C, Duiverman EJ, Grol MH, Dutch Paediatric Asthama Study Group. Addition of salmetrol versus doubling the dose of beclomethasone in children with asthma. Am J Respir crit Care Med 1998; 158:213-9. 11. Simons FER, Villa JR, Lee BW, Teper AM, Lytle B, Aristrizabal G et al. Montelukast added to budesonide in children with persistent asthma: A randomized double blind, crossover study. J Pediatr 2001; 694-8. 19. Bisgaard H. for the study Group on Montelukast and respiratory Syncytial virus. A Randomized trial of Montelukast in Respiratory Syncytial virus postbronchiolitis. Am Respir Crit Care Med.2003; 167:370-383. 12. Kemp JP, Dockhorn RJ, Shapiro GG, Nguyen H, Reis TF et al. Montelukast once daily inhibits exercice-induced bronchoconstriction in 6-14 years-old children with asthma.. J Pediatr 1998; 133:424-8. 20. Aalbers R, Backer V, Kava TT, Omenaas ER, Sandtrom T, Jorup T. Adjustable maintenance dosing with budesonide/formoterol compared with fixed-dose salmeterol/fluticasone in moderate/severe asthma. Curr Med Res Opin 2004; 20:225-240. 13. Van Schayck CP, ¿Merecen los agonistas de los beta adrenérgicos de acción prolongada un lugar diferente en las recomendaciones para el tratamiento del asma y la EPOC. Eur Respir J (ed española). 2000; 1:317-20. 14. Agusti Garcia-Navarro A, Sigritz N. Terapia combinada en el asma. Arch Bronconeumol 2002; 38 (supl 4):27-30. 15. Bisgaard H. Long actin beta 2 agonists in management of chilhood asthma. A critical review of the literature. Pediatrc Pulmonol 2000; 29:221-34. 16. Byrnes C, Shrewsbury S, Barnes PJ. A salmeterol in paediatric asthma. Thorax 2000; 55:780-784. 17. Tal A, Simon G, Vermeulen JH, Petru V, Cobos N, Everad ML et al. Symbicort (budesonide/formoterol in a single inhaler) improves lung function compared with 21. Bousquet J, Van Cauwenberge P, Khaltaev N, ARIA workshop group; World Health Organization. Allergyc rhinitis and its impact on asthma. Allergy Clin Inmunol. 2001; 108:S147-S334. 22. Arlian LG, MorganMS. Biology, ecology and prevalenceof dust mites. Inmunol Allergy Clin N Am 2003; 23:443-68. 23. Koopman Lp, Van Strien RT,Kerkhof M, Wigja A, Smit HA. De Jongste JL et al. Placebo-controlled trial of house dust mite-impermeable mattress covers: effect of symptoms in early chilhood. Am J Respir Crit Care Med 2002; 166:307-13. 24. Gotzsche PC, Johansen HK, Burr Ml, Hammarquist C, House dust mite control measures for asthma. (Cochrane review). En: The Cochrane Library (1) Oxford:Update Software, 2003. Libro II curso 31/1/05 17:26 P gina 101 Control del asma N. Cobos Barroso, A. Moreno Galdó, S. Gartner Unidad de Neumología Pediátrica y Fibrosis Quística. Hospital Universitario Vall d’Hebron. Barcelona RESUMEN El asma es una enfermedad inflamatoria crónica de las vías aéreas que se caracteriza por una gran prevalencia en la infancia, que ha experimentado a lo largo de los últimos 50 años una serie de avances terapéuticos que han permitido mejorar, de manera evidente, la calidad de vida de nuestros pacientes. Con la aparición de diversas guías nacionales e internacionales (GINA) para el manejo del asma, se indican una serie de parámetros que definen el concepto de “control de la enfermedad” y afirman que éste debe ser nuestro objetivo. Disponemos de instrumentos de control funcionales, marcadores de la inflamación y controles de calidad de vida que nos permiten averiguar el grado de control de la enfermedad alcanzado. Los resultados obtenidos demuestran que la mayoría de nuestros enfermos se hallan mal controlados. Cuando se investigan las causas que contribuyen al mal control del asma, se deduce que el uso insuficiente de corticosteroides inhalados, la mala aplicación de las guías de consenso y la mala percepción y bajas expectativas por parte del paciente son factores fundamentales. Trabajos recientes demuestran que con los fármacos de que disponemos se puede conseguir el control total del asma. De nosotros depende la mejor utilización de los mismos, y la buena educación del paciente y/o de su familia, lo cual se traducirá en conseguir la máxima eficacia terapéutica y un mejor cumplimiento por parte del paciente. Dicho de otra forma, en un mejor control de su enfermedad. Libro II curso 31/1/05 17:26 P gina 102 102 INTRODUCCIÓN El asma es la enfermedad inflamatoria de las vías aéreas de mayor prevalencia en la infancia, especialmente en los países desarrollados. En Europa occidental, se calcula que la prevalencia media del asma en los adultos es del 8,4%, y del 13% en los niños. A lo largo de los últimos 50 años, se han sucedido de manera inintrerrumpida una serie de avances en el tratamiento del asma, que han permitido mejorar de manera evidente la calidad de vida de nuestros pacientes. A pesar de todo la prevalencia del asma sigue aumentando, y no parece reducirse la mortalidad por su causa. Durante la década de los 50 el tratamiento sintomático del asma se basaba fundamentalmente, en la administración de broncodilatadores no selectivos derivados de la adrenalina, administrados por vía oral o mediante atomizadores primitivos de bomba de goma de escasa precisión dosificadora muy difíciles de utilizar. Pero fue a finales de esta década, en el año 1956 cuando apareció el primer inhalador dosificador denominado Medihaler. Hemos de agradecer este gran avance en el tratamiento del asma a la hija de 13 años del presidente de los laboratorios Riker, actualmente 3M Pharmaceuticals, afecta de asma, que le pidió a su padre que los medicamentos que tomaba para el asma deberían ir en un pulverizador como la laca para el pelo y así fue. En la década de los 60 se producen dos nuevos avances terapéuticos fundamentales. La aparición en el mercado del cromoglicato disódico descubierto por Roger N. Cobos Barroso, et al. Altounyan para el tratamiento de los asmáticos alérgicos(1) y la introducción del salbutamol inhalado, primer fármaco dirigido específicamente al receptor β2 que se acababa de descubrir. En la década de los 70 se produce un nuevo descubrimiento que revoluciona el tratamiento del asma. Aparece el primer corticosteroide inhalado, el dipropionato de beclometasona(2). A lo largo de la década de los 80 se consolida la eficacia de los corticosteroides inhalados, y en la década de los 90 se introducen los β2 de acción prolongada y en 1995 se publica la primera Iniciativa Global para el Asma(3) (GINA). Ya habían aparecido otras guías nacionales, pero GINA adquirió un carácter internacional como ninguna otra. Mediante GINA se proporcionó a todos los médicos del mundo unas indicaciones consensuadas sobre el manejo integral del asma, en sus aspectos epidemiológicos, fisiopatológicos, terapéuticos y educacionales. Se establecen los escalones terapéuticos en función de la gravedad, asume los estudios más importantes que señalan las ventajas del tratamiento combinado, corticoides inhalados y β2 de larga acción(4,5), y concluye diciendo que “ aunque no se ha encontrado todavía un tratamiento curativo para el asma, es razonable considerar que en la mayoría de nuestros pacientes podemos alcanzar y mantener el control de la enfermedad”. GINA define el control de la enfermedad de acuerdo con los siguientes parámetros: • Mínimos síntomas crónicos, incluidos los nocturnos (a ser posible ninguno). • Mínimas exacerbaciones. Libro II curso 31/1/05 17:26 P gina 103 Control del asma • • • • • • Ninguna visita a urgencias. Mínima utilización de β2 a demanda (a ser posible ninguna). Ninguna limitación física o de cualquier otro tipo de actividad. Variación circadiana del flujo espiratorio máximo (FEM) menor del 20%. FEM normal o casi normal. Mínimos efectos adversos por la mediación (a ser posible ninguno). INSTRUMENTOS DE CONTROL Una vez efectuado el diagnóstico de asma, nuestra línea de actuación encaminada a conseguir el control de la enfermedad, y de acuerdo con la mayoría de los consensos, se dirigirá, en primer lugar, a determinar en qué escalón de gravedad situamos al paciente, recordando que en nuestro caso por tratarse de niños la clasificación clínica que utilizamos es la siguiente: • Asma episódica ocasional • Asma episódica frecuente • Asma persistente moderada • Asma persistente grave A partir de esta clasificación, se instaurará el tratamiento adecuado, que podemos sintetizar en β-agonistas de acción corta en todos los escalones, corticoides inhalados a dosis bajas en el segundo escalón y tratamiento combinado (corticoides inhalados y β-agonistas de larga acción) en el tercer y cuarto escalones, pero con dosis distintas. En algunas ocasiones puede ser conveniente añadir antileucotrienos a los corticoides inhalados. 103 Evitar los factores precipitantes, y educar al niño y a su familia sobre los aspectos generales de la enfermedad, fármacos que utilizamos, indicaciones y efectos secundarios de los mismos, medidas de autocontrol de la enfermedad etc., forman parte fundamental e inseparable de estas líneas de actuación. Pero es evidente que una vez instaurados los mecanismos terapéuticos encaminados a controlar el asma, necesitamos instrumentos adecuados que nos indiquen si en relación con los parámetros señalados en la guía GINA, estamos consiguiendo o hemos conseguido el control de la enfermedad. Los instrumentos de control que se pueden utilizan son, fundamentalmente: • Funcionales. • Marcadores de la inflamación. • Valorar el impacto de la enfermedad sobre la calidad de vida. Instrumentos funcionales de control El estudio de la función pulmonar es uno de los instrumentos más utilizados en este sentido. La espirometría, la monitorización del FEM y el estudio de su variabilidad, se señalan con frecuencia como instrumentos de control. Sin embargo, hemos de matizar este concepto. Por un lado, es evidente que el estudio de la función pulmonar en el ámbito indicado resulta imprescindible para valorar la gravedad de la enfermedad, la respuesta terapéutica e incluso como pieza diagnóstica fundamental, pero es indudable que son muchos los pacientes que demuestran una función pulmonar normal, y su asma no se halla controlada en el sentido que nos ocupa. Libro II curso 31/1/05 17:26 P gina 104 104 Marcadores de la inflamación Como todos sabemos, el asma es una inflamación eosinofílica de la vía aérea, y son muchos los trabajos que demuestran que el número de eosinófilos en el esputo inducido es un buen marcador del control el asma y que se correlaciona muy bien con la concentración de óxido nítrico en el aire exhalado (ONE) y con la función pulmonar6. Sin embargo, la determinación de eosinófilos en el esputo inducido no se puede practicar en niños menores de 7 a 8 años, es una técnica algo engorrosa y complicada a la hora de procesar la muestra. No es un instrumento que se pueda aplicar de manera rutinaria en el control de nuestros enfermos. Tampoco existen estudios que comparen este parámetro con las características clínicas que definen el control del asma. La determinación del ONE como marcador no invasivo de la inflamación de la vía aérea ha sido motivo de más de 700 publicaciones, la mayoría de las cuales muestran claras evidencias sobre su aplicabilidad en el diagnóstico de la enfermedad, la monitorización de la respuesta terapéutica, la predicción de las exacerbaciones y la evaluación del control de los síntomas. Se correlaciona bien con el grado de HRB, la prueba broncodilatadora, los prick tests cutáneos, la IgE sérica total, la eosinofilia periférica, los síntomas diurnos y nocturnos de asma y las necesidades de β2-agonistas(7-10). Una vez el paciente está en tratamiento con corticoides inhalados el ONE tiende a normalizarse, lo que lógicamente indica una disminución de la inflamación N. Cobos Barroso, et al. bronquial, aunque en estas circunstancias no siempre se haya conseguido un control total del asma. Valoración del impacto de la enfermedad sobre la calidad de vida A lo largo de los últimos años se han desarrollado diversos cuestionarios encaminados a valorar el control del asma, en función de la calidad de vida del paciente. En general, son cuestionarios que el paciente cumplimenta en el momento de la visita al médico. Las preguntas que se realizan inciden, fundamentalmente, sobre los items que definen el control del asma, es decir, tos, sibilancias, disnea en reposo o de esfuerzo, tos nocturna, opresión torácica etc.. se insiste también sobre número de exacerbaciones, visitas a urgencias, necesidades de β-agonistas de rescate, actividad física, laboral, escolar etc(11). Habitualmente se constata también la función pulmonar focalizada en el FEV1 y en el FEM. fundamentalmente. Existen también cuestionarios de calidad de vida para los niños asmáticos(12). ¿SE ALCANZAN LOS OBJETIVOS DE CONTROL QUE PROPONE GINA? Desde hace ya algunos años disponemos de diversas guías sobre el manejo del asma para conseguir el control óptimo de la misma. Sin embargo, la percepción por parte del médico y del propio paciente parecen indicar que se está muy lejos de conseguir dicho objetivo. Libro II curso 31/1/05 17:26 P gina 105 Control del asma En este sentido, se han publicado recientemente algunos trabajos que demuestran que dicha percepción es correcta. En Europa, Rabe et al publican en 1999 el estudio AIRE(13) que se basa en la identificación de 3.488 domicilios en los que residía algún asmático, tras contactar telefónicamente con 73.880 domicilios. Completaron el estudio 2.803 pacientes, es decir. el 80,4% de los asmáticos identificados. El 46% de los pacientes presentaban síntomas diurnos y el 30% de los mismos señalaban despertares nocturnos, por lo menos, una vez en la última semana. En los últimos 12 meses el 25% de los pacientes habían precisado acudir a su médico sin cita previa, el 10% habían precisado acudir a un servicio de urgencias y el 7% había pasado una noche en el hospital a causa de una exacerbación. Aproximadamente el 50% de los pacientes que presentaban síntomas de asma persitente moderada-grave, consideraba que su asma estaba bien controlada. Participaron en este estudio siete países Europeos entre los cuales estaba España. La muestra se componía de 753 niños y 2.050 adultos. De acuerdo con los resultados obtenidos mediante el estudio AIRE, sólo el 5,8% de los niños alcanzan el control de su asma. Adams et al publican(14) en el año 2002 un trabajo realizado en América cuyo objetivo fue describir la medicación que se utiliza para el asma en EE.UU, y qué influencia ejerce sobre los síntomas. Se detectaron asmáticos en 3.273 casas, el 7,8% de las que se contactó telefónicamente. 105 Completaron la entrevista telefónica 2.509 personas afectas de “asma actual”, de las cuales 721 eran niños menores de 16 años. Sólo el 20% de los enfermos usaban mediación antiinflamatoria de base. De éstos, el 72,5% lo hacían con corticosteroides inhalados, el 11,4% con antileucotrienos y el 18,6% con nedocromil. De las personas con síntomas de asma persistente durante el último mes sólo el 26,2% seguía tratamiento de mantenimiento con corticosteroides inhalados. Cuando se investigó sobre la calidad de vida de estos pacientes se comprobó que, el 64% tenía sus actividades limitadas a causa de la enfermedad, se habían producido 470.000 ingresos por asma en el último año y se constató una alta frecuencia de visitas a los servios de urgencias de los hospitales y de visitas urgentes no programadas a sus médicos. Lai et al(15) publican en 2003 el estudio (AIRIAP), realizado en Asia-Pacífico con el objetivo de evaluar los síntomas, los tratamientos y el manejo en general del asma en la región Asia-Pacífico. Se basa en la administración de un cuestionario “cara a cara” a 3.207 asmáticos contactados telefónicamente de entre 108.360 domicilios. El 51,4% presentaba síntomas diurnos de asma, el 44,3% señalaba trastornos del sueño en la últimas 4 semanas. El 43,6% había sido hospitalizado, acudido a un servicio de urgencias o a su médico en visita urgente sin cita previa en el curso de los 12 meses últimos. El 34,3% de los enfermos que presentaban síntomas de asma persistente moderada-grave consideraba que Libro II curso 31/1/05 17:26 P gina 106 106 su asma estaba bien controlada. Sólo el 13,6% de los entrevistados era tratado con corticosteroides inhalados. El 36,5% de los niños había presentado ausencias escolares en el último año y el 26,5% de los adultos ausencias laborales. Es evidente que, en general, el asma no se trata de acuerdo con las guías publicadas, y que un tanto por ciento muy elevado de los pacientes no se acercan ni remotamente a los objetivos de “control del asma” que hemos indicado al principio de este documento. ¿QUÉ FACTORES CONTRIBUYEN AL MAL CONTROL DEL ASMA? Desde un punto de vista global, los factores que pueden influir en el mal control del asma son múltiples. Podríamos incluir los diagnósticos erróneos, tratamientos inadecuados, asma refractario o corticorresistente, enfermedades concomitantes, incumplimiento terapéutico etc. Pero si nos atenemos a los resultados de los estudios que acabamos de comentar, en relación con los cuestionarios utilizados, podemos concretar los siguientes puntos: • Uso insuficiente de corticosteroides inhalados. • Mala aplicación de las guías de consenso. • Mala percepción y bajas expectativas por parte del paciente. No parece existir duda alguna en la actualidad sobre la eficacia de los CI en el tratamiento del asma. Todas las guías, los consensos y las publicaciones sitúan a es- N. Cobos Barroso, et al. tos fármacos en la primera línea de elección desde el punto de vista antiinflamatorio. Sin embargo, resulta sorprendente que el estudio AIRE, que es la encuesta más amplia realizada en Europa para valorar el control del asma en niños y adultos, refleja, por un lado, un control insuficiente del asma en ambos grupos, y, por otro, se observa una infrautilización de los CI. La proporción de niños de Suecia que utilizaban CI hallándose afectos de asma persistente moderada era del 71,4%, y para el asma persistente grave del 83,33. En segundo lugar se situaba España con un 33,3% en el asma moderada persistente, y un 42,9% en el grave. En Francia, Alemania, Italia, Holanda y Reino Unido, las cifras eran mucho más bajas. Para los adultos, el uso de dicha medicación era más baja en Italia, Francia y España que en Holanda Suecia y el Reino Unido. En general, y atendiéndonos a este hecho, podríamos decir que en Europa, los niños asmáticos están mejor tratados que los adultos. Otro hecho a destacar es la alta utilización de los broncodilatadores de acción corta en relación con el uso de los CI, lo que indica de manera evidente la infrautilización de estos. De la encuesta AIRE se deduce también que la mayoría de los asmáticos son atendidos en Atención Primaria y, en general, pocos los que son visitados por un especialista. Tal vez deberían identificarse mejor los asmáticos que podrían beneficiarse de la atención de un especialista16. Muchos niños y adultos no habían sido visitados nunca por un especialista o tan sólo cuando habían presentado complicacio- Libro II curso 31/1/05 17:26 P gina 107 Control del asma nes. Es más, en Francia, Reino Unido y Holanda a la mayoría de los niños los controlaban los médicos generales y no los médicos pediatras. Diversos trabajos han demostrado que la falta de cumplimiento de la medicación es un hecho desgraciadamente frecuente en los siete países incluidos en la encuesta y, sobre todo, en Holanda. Es posible que uno de los factores que contribuyen a esta falta de cumplimiento es la poca información que reciben los enfermos en cuanto a las características generales de la enfermedad, y al papel que juegan los fármacos en particular. A pesar de la gran difusión que GINA y otras guías y consensos han experimentado en estos últimos años, AIRE demuestra que existen grandes diferencias en el conocimiento que tienen los médicos del asma y su tratamiento. La aplicación de las directrices de las guías es muy baja. Así, por ejemplo, sólo el 36% de los pacientes disponía de una agenda de visitas programadas, a sólo el 21% se le había suministrado un plan de actuación escrito, y sólo el 33% de los encuestados había realizado una espirometría en el último año. En los niños, la cifra más baja correspondía al Reino Unido con un 13,5%, el más alto a Alemania con un 60% y en España fue del 26,7%. Italia también estaba por debajo de España con un 21,7%. Finalmente, se observó que un gran número de pacientes no valoraban bien la gravedad de su asma, y, por otro lado, sobrevaloraban su control de la enfermedad. La percepción de los pacientes respecto al 107 control no se correspondía con la gravedad de los síntomas que padecían. Más del 50% de los niños afectos de asma persistente grave, consideraban que su asma estaba bien controlada. En España concretamente, el 85,6% de los niños con asma persistente grave y el 50,7% de los adultos referían un buen control de la enfermedad. Vemos pues que las expectativas de control por parte de los pacientes es muy baja. De estos resultados se desprende que uno de los objetivos básicos para el futuro inmediato es conseguir la aplicación efectiva de las directrices de las guías, consiguiendo para nuestros pacientes asmáticos un tratamiento adecuado, un control programado de su función pulmonar y una educación del paciente o de sus padres en el caso de los niños, en los aspectos básicos de la enfermedad, puesto que probablemente así mejoraremos uno de los factores fundamentales para el control. Nos referimos al cumplimiento con la medicación. Pero de estos estudios tan interesantes que acabamos de comentar, no sólo se desprende que el asma está, en general, muy mal controlada, y que nuestros enfermos se hallan muy lejos de cumplir con los parámetros que GINA señala para el “control del asma”, sino que, incluso gran parte de los pacientes asmáticos que siguen tratamiento con CI tampoco se hallan bien controlados. Así pues, partiendo de la base de que disponemos de fármacos que han demostrado ampliamente su capacidad anti-inflamatoria en el asma, y de que debemos Libro II curso 31/1/05 17:26 P gina 108 108 conseguir que el cumplimiento terapéutico de nuestros pacientes sea bueno; desde un punto de vista teórico deberíamos ser capaces de conseguir el control total del asma en un gran número de nuestros asmáticos. CONTROL DEL ASMA. ¿ES POSIBLE? A lo largo de estos últimos años, diversas publicaciones demuestran que el control del asma, según la definición de las guías de manejo el asma, se puede conseguir. Las estrategias terapéuticas que utilizan tratamiento combinado, CI más β2agonistas de larga acción son las que logran mejores resultados. Sin embargo, como acabamos de comentar, el número de pacientes que lo consiguen es muy bajo, y la mayoría de los que lo consiguen es a expensas de una sobrevaloración de su situación de control. En estos estudios publicados en los últimos años, que por tratarse de ensayos clínicos controlados podemos suponer que los resultados alcanzados dependen exclusivamente de la estrategia terapéutica utilizada, no se ha contemplado la modificación del tratamiento a lo largo del estudio, en función de la respuesta terapéutica, o dicho de otro modo, del grado de control alcanzado. De ahí que recientemente se hayan publicado dos trabajos en cuya metodología sí se contempla esta modificación del tratamiento a lo largo del estudio, en función del grado de control que se va alcanzando. En uno de ellos17 se compara el tratamiento N. Cobos Barroso, et al. combinado salmeterol-fluticasona, frente a monoterapia con fluticasona, a partir de una dosis inicial establecida, en función del escalón de gravedad en el que se ha situado al enfermo. La dosis se va incrementando, si es necesario, hasta conseguir el control total del enfermo o alcanzar una dosis máxima. Los resultados obtenidos al finalizar el estudio confirman que se puede alcanzar el control en un gran número de enfermos, proporcionalmente mayor en el grupo de la terapia combinada. El segundo trabajo (18) publicado por Aalbers et al. se basa en el hecho de que el asma es una enfermedad variable y de manera más evidente en los niños, la mayoría de los cuales se pasa largos períodos de tiempo con escasa o nula sintomatología interrumpidos por episodios agudos de agravamiento, de tal manera que niños afectos de asma calificada de leve, puede presentar súbitamente agudizaciones graves. La segunda idea de la que parte el estudio, se basa en las propias recomendaciones de las guías actuales de tratamiento del asma, que recomiendan tratar a nuestros pacientes de acuerdo con el escalón de gravedad en el que se les sitúa. Sin embargo, tradicionalmente se les prescribe una dosis fija a lo largo de unos meses, para ajustarla luego en función de la evolución y así sucesivamente. La tercera idea asume que, uno de los problemas de utilizar pautas fijas es que de acuerdo con la variabilidad propia del asma, en los períodos en los que el paciente no se halla bien controlado, es evi- Libro II curso 31/1/05 17:26 P gina 109 Control del asma dente que se halla infratratado y viceversa, probablemente en los períodos asintomáticos recibe más medicación de la necesaria. A partir de estas premisas, el objetivo del estudio de Aalbers es comprobar si el asma se controla mejor cuando los pacientes ajustan su dosis de budesonina /formoterol (Symbicort Turbuhaler® 160/4,5 mg) entre un mínimo y un máximo, según su situación clínica, en comparación con un régimen tradicional de dosis fija, en este caso se comparó con salmeterol/fluticasona a dosis fija (Seretide Diskus® 50/250 mg), y con la misma combinación de budesonida/formoterol también a dosis fija. El ensayo fue aleatorizado, doble ciego seguido de extensión abierta de grupos paralelos efectuado en consultas ambulatorias de 93 centros de seis países Europeos. En total se incluyeron 1.044 pacientes en el estudio de los que se aleatorizaron 658. Al grupo budesonida/formoterol dosis ajustable se asignaron 219 pacientes. Al grupo budesonida/formoterol dosis fija 215 y al grupo salmeterol/fluticasona dosis fija 224. Durante un período doble ciego de 4 semanas los grupos de budesonida/formoterol dosis ajustable y dosis fija, recibieron dos inhalaciones dos veces al día, y el grupo salmeterol/fluticasona una inhalación dos veces al día. Durante la extensión abierta que siguió de 6 meses, los dos grupos de dosis fija siguieron con la misma medicación, mientras que los pacientes de dosis ajustable, podían variar su dosis entre un inhalación dos veces al día y cuatro inhalaciones dos veces al día durante 7-14 días si los s empeoraban. To- 109 dos los pacientes podían tomar terbutalina o salmeterol de rescate cuando lo precisaran. La variable principal consistió en las posibilidades de conseguir una semana con asma bien controlada. Al final del estudió se comprobó que la dosis fija con budesonida/formoterol y salmeterol/fluticasona proporciona grados parecidos de control del asma. Sin embargo, ambos tratamientos se asociaron a una mayor variabilidad de la enfermedad, un uso más frecuente de medicación de rescate y un mayor número de exacerbaciones, que la pauta de dosis ajustable de mantenimiento con budesonida/formoterol, a pesar de que con esta se redujo en un 15% del uso medio de fármacos. Hemos comprobado, según resultados obtenidos por trabajos realizados en casi todo el mundo, que, en general, el asma está muy mal controlada en la mayoría de los pacientes. No se consiguen los objetivos de control que se indican en las guías. Disponemos de herramientas que nos permiten valorar adecuadamente el grado de control que alcanzan nuestros pacientes. Disponemos de fármacos capaces de conseguir dicho control. De nosotros depende, en gran parte, la correcta utilización de los mismos, y conseguir una buena educación del paciente, que se traducirá en un mejor cumplimiento y en una mejor percepción con respecto al control de su enfermedad, porque, como acabamos de comentar, es posible conseguir el control total del asma. Libro II curso 31/1/05 17:26 P gina 110 110 N. Cobos Barroso, et al. BIBLIOGRAFÍA 1. Howell JBL, Altounyan REC. A double-blind trial of disodium cromoglycate in the treatment af allergic bronchial asthma. Lancet 1967; 2:539-42. 2. Morrow Brown H, Storey G, George WHS. Beclomethasone dipropionate: a new steroid aerosol for the treatment of allergic asthma. BMJ 1972; 1:585-90. 3. Global Initiative for Asthma. Asthma Management and Prevention. NIH Publication 1995; 96-3659A . 4. Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher-dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. UK Study Group. Lancet 1994; 344:219-24. 5. Global Initiative for Asthma. Astma Management and Prevention. Revised 2002. www.ginasthma.com. 6. Jatakanon A, Lim S, Barnes P. Changes in sputum eosinophils predict loss of asthma control. Am J Respir Crit Care Med 2000; 161:64-72. 7. Stirling RG, Kharitonov SA, Campbell D, Robinson DS, Durham SR, Chung KF, et al. Increase in exhaled nitric oxide in patients with difficult asthma and correlation with symptoms and disease severity despite treatment with oral and inhaled corticostroids. Asthma and Allergy Group. Thorax 1998; 53:1030-4. 8. Covar RA, Szefler SJ, Martin RJ, Sundstrom DA, Silkoff PE, Murphy J, et al. Relations between exhaled nitric oxide and measures of disease activity among children with mild-to-moderate asthma. J Pediatr 2003; 142: 469-75. 9. Bates CA, Silkoff PE. Exhaled nitric oxide in asthma: from bench to bedside. J Allergy Clin Immunol 2003; 111:256-62. 10. Covar RA, Spahn JD, Martin RJ, Silkoff PE, Sundstrom DA, Murphy J, et al. Safety and application of induced sputum analysis in childhood asthma. J Allergy Clin Immunol 2004; 114:575-82. 11. Juniper EF, O’Byrne PM, Guyatt GH, Ferrie PJ, King DR. Development and validation of a questionnaire to measure asthma control. Eur Respir J 1999; 14:902-7. 12. Badía X, García-Hernández G, Cobos N, López-David C, Nocea G, Roset M. Validación de la versión española de un cuestionario pediátrico sobre calidad de vida para evaluar la calidad de vida de los niños amáticos. Med Clin 2001; 116:565-72. 13. Rabe KF, Vermeire PA, Soriano JB, Maier WC. Clinical management of asthma in 1999: the Asthma Insights and Reality in Europe (AIRE) study. Eur Respir J 2000; 16:802-7. 14. Adams RJ, Fuhlbrigge A, Guilbert T, Lozano P, Martínez F. Inadequate use of asthma medication in the United States: results of the asthma in America national population survey. J Allergy Clin Immunol 2002; 119:58-64. 15. Lai CK, De Guia TS, Kim yy, Kuo SH, Mukhopadhyay A, Soriano JB, et al. Asthma control in the Asia-Pacific region: the Asthma Insights and Reality in Asia-Pacific Study (AIRIAP). J Allergy Clin Immunol 2003; 111:263-8. 16. Legorreta AP, Christian-Jerman J, O’Connor RD, Hasan MM, Evans R, Leung KM, Compliance with national asthma management guidelines and speciality care. A health maintenance organization experience. Arch Intern Med 1998; 158:457-64. 17. Bateman ED, Boushey HA, Bousquet J, Busse WW, Clark TJ, Pauwels RA, et al. Can guideline-defined asthma controlbe achieved ? The Gaining Optimal Asthma ControL. Am J Respir Crit Care Med 2004; 170:836-44. 18. Aalbers R, Backer V, Kava ttk, Omenaas ER, Sandstrom T, Jorup C,et al. Adjustable maintenance dosing with budesonide/formoterol compared with fixed-dose salmeterol/fluticasone in moderate to severe asthma. Curr Med Res Opin 2004; 20:225-40. Libro II curso 31/1/05 17:26 P gina 111 Perspectivas futuras en el tratamiento del asma E. G. Pérez-Yarza, A. Bordoy, U. Astigarraga, N. Crespo Unidad de Neumología Infantil, Servicio de Pediatría. Hospital Donostia. Osakidetza-Servicio Vasco de Salud. San Sebastián RESUMEN El asma es el resultado de la interacción entre factores medioambientales y factores genéticos, cuya expresión es una enfermedad del aparato respiratorio que se caracteriza por inflamación (mediada por numerosas células, destacando la participación de eosinófilos, linfocitos T, células epiteliales y miocitos), limitación del flujo aéreo intrapulmonar (variable, reversible espontáneamente o mediante medicación, parcial o total) e hiperrespuesta bronquial (frente a estímulos inespecíficos o específicos, directos o indirectos). El tratamiento farmacológico actual se basa en terapia inhalada con fármacos antiinflamatorios, bien en monoterapia o en terapia combinada (asociados a β2-agonistas adrenérgicos de larga acción) en régimen pautado o variable, junto a β2-agonistas adrenérgicos de corta acción a demanda, como medicación de alivio. Sin embargo, los avances en la patogenia y en la fisiopatología del asma han permitido reconocer nuevas dianas terapéuticas en la cascada inflamatoria, que han dado lugar a nuevos inhibidores frente a mecanismos inmunológicos mediados por linfocitos Th2, como son la interleucina 12 recombinante, los anticuerpos antiinterleucina 4 y 5, entre otros. Las expectativas de control del asma con estos nuevos fármacos son limitadas, su aplicación clínica no sería universal y no parece que vayan a sustituir a la terapia actual de manejo farmacológico del asma. Libro II curso 31/1/05 17:26 P gina 112 112 INTRODUCCIÓN El tratamiento del asma se basa en medidas no farmacológicas, que consisten en controlar los factores desencadenantes y en la educación del niño y de su entorno respecto a la enfermedad, y en medidas farmacológicas, dirigidas a lograr un control completo de todas las manifestaciones del asma. La patogenia central del asma es la inflamación. En ella participan numerosas células, mediadores, citocinas, factores de trascripción, moléculas de adhesión, etc., unos con importancia clave en el proceso y otros más secundarios dentro de la cascada inflamatoria (Fig. 1). Uno de los intereses primordiales en la investigación del asma es el establecer qué factores intervienen de manera crítica en la expresión de la enfermedad y cuáles son los factores principales de esa amplia relación de participantes. Si lo son, se consideran target o diana en la patogenia de la inflamación, y tendrán aplicación universal o casi universal en el manejo terapéutico de la enfermedad asmática(1) (Fig. 2). De los resultados de las investigaciones en asma, cabe destacar que las dianas terapéuticas en el asma son, hoy por hoy, la célula presentadora del antígeno (CPA), el linfocito Th0, el linfocito Th2, la interleucina 5 (IL-5), la molécula de adhesión ICAM-1, la interleucina 4 (IL-4), el factor de necrosis tumoral alfa (TNF-α) y el factor de crecimiento de colonias de macrófagos y granulocitos (GM-CSF)(2). La IL-5 permite el paso de los eosinófilos de la medula ósea al sistema circulatorio. La molécula de ad- E. G. Pérez-Yarza, et al. hesión (ICAM-1) facilita la salida del eosinófilo del lecho vascular, es decir, participa en el transporte transendotelial. La IL-4 y el TNF-α son necesarios para que se localicen los eosinófilos en el tejido respiratorio. El GM-CSF condiciona la respuesta inflamatoria Th2 que regulan las células dendríticas. Además, la IL-3 (que controla el desarrollo de los mastocitos y los basófilos), la IL-9 (que regula el crecimiento de los mastocitos y la producción de IgE) y la IL-13 (relacionada con la expresión de la hiperrespuesta bronquial), son citocinas que desempeñan un papel relevante en la patogenia del asma. La movilización y activación de la cascada de células y mediadores están controladas por los linfocitos Th0 y Th2, y en este control también desempeñan un papel relevante las células del propio epitelio bronquial y el músculo liso(3). En teoría, la intervención farmacológica sobre estas células y sobre estos mediadores lograría, en la amplia cascada de células y mediadores que supone la reacción asmática, un “efecto dominó, mancha de aceite o castillo de naipes”: actuando sobre una o varias dianas, se modificaría de forma contundente el resto del proceso inflamatorio(4). De las perspectivas actuales y futuras trata la revisión que se expone a continuación. TRATAMIENTO ACTUAL Los glucocorticoides (GC) actúan regulando los genes que controlan la síntesis de sustancias que intervienen en las re- Libro II curso 31/1/05 17:26 P gina 113 113 Perspectivas futuras en el tratamiento del asma Figura 1. Patogenia central del asma. CPA Th0 Th2 acciones alérgicas e inflamatorias(5). Los mecanismos moleculares de acción(6) de los GC se basan en que, al ser lipofílicos, atraviesan la membrana celular muy rapidamente y se unen en el citoplasma con el receptor específico de los glucocorticoides (RG). El receptor está inactivo debido a su unión a proteínas activadas por estrés calórico de 90 kD (hsp 90). Las moléculas proteínicas que mantiene el RG en estado inactivo (hsp 90) se disocian al entrar en contacto con el GC, y el complejo RG-GC entra en el núcleo de la célula, actuando como factor de transcripción, fijándose al ADN en la región promotora de los genes respondedores a GC, elementos de respuesta glucocorticoidea intranuclear. Esta interacción con el ADN lleva a la activación o supresión del gen diana, que conduce a un aumento o a un descenso en la producción del ARNm (Fig. 3). El resultado final es de dos tipos: uno, se incrementan la producción de lipocortina- IL-4 TNF-α Médula ósea Células dendríticas ICAM-1 IL-3 IL-5 GM-CSF IL-5 Sistema circulatorio Figura 2. Factores críticos en la patogenia del asma. Libro II curso 31/1/05 17:26 P gina 114 114 E. G. Pérez-Yarza, et al. Figura 3. Genes diana respondedores a esteroides. 1, endonucleasas, endopeptidasa neutra y β-receptores adrenérgicos; y dos, se reduce la producción de las citocinas, la sintetasa inducible de NO (SONY), la ciclooxigenesa inducible (COX-2), la fosfolipasa A2, los receptores NK2, y la endotelina1, entre otras. Esta reducción en la producción de citocinas, debida a una disminución en la transcripción, es probablemente la acción fundamental de los GC inhalados (GCI) en el tratamiento del asma, sin desdeñar otras importantes acciones e interacciones. Por otra parte, se sabe que las citoquinas también actúan sobre las células, modificando la transcripción genética (Fig. 4). Las citocinas interaccionan con los receptores de la superficie celular, activando los factores transcripcionales, como son el factor nuclear κ B (NF-κB) y la proteína activadora 1 [(AP)-1]. Estos factores de trascripción llegan al núcleo de la célula y se fijan al ADN, influenciando la producción del ARNm y la producción de las proteínas proinflamatorias (mediadores de la inflamación en el asma) por parte de la célula. Hoy se sabe que el complejo RG-GC interactúa directamente en el núcleo con la NF-κB y la (AP)-1, evitando su acción y bloqueando eficazmente Libro II curso 31/1/05 17:26 P gina 115 Perspectivas futuras en el tratamiento del asma 115 Figura 4. Secuencia codificadora. los efectos de las citoquinas sobre las células. Esta interacción proteína-proteína se considera que es un mecanismo tan importante o más que el anterior reseñado en la acción antiinflamatoria de los GC en el asma. Otro mecanismo de acción de los GC es la estimulación en la producción de la proteína I κ B α (IκBα). Esta proteína se asocia en el citoplasma con el factor de transcripción nuclear NF-κB, impidiendo su traslocación al núcleo. Esto da lugar a una reducción en la liberación de citocinas y a una disminución de la respuesta inflamatoria. Así, los GC controlan la inflamación asmática inhibiendo diversos procesos inflamatorios a través del incremento de la trascripción de genes antiinflamatorios y reduciendo la trascripción de genes inflamatorios: aumentan la síntesis de proteínas antiinflamatorias [inhibidor de la proteasa del leucocito secretor (SLPI), IkBα, interleucina-10 (IL-10), antagonista del receptor de la interleucina-1 (IL-1ra), receptor tipo II de la IL-1 (IL-1rII), enzima endopeptidasa neutra (NEP)]; incrementan la expresión de los receptores agonistas adrenérgicos tipo 2 (AA2); inhiben la síntesis de citocinas de fenotipo Th-2 Libro II curso 31/1/05 17:26 P gina 116 116 [IL-1β, TNF-α, factor estimulante de colonias de granulocitos y macrófagos (GMCSF), IL-2, IL-3, IL-4, IL-5, IL6, IL-11, IL-8, RANTES, MCP-1,MCP-3, MIP-1 y eotaxina); inhiben determinadas enzimas inflamatorias, como la sintetasa inducible del óxido nítrico (iNOS) al inhibir la trascripción del gen de la iNOS, la ciclooxigenasa inducible (COX-2) y la endotelina-1 (ET1); reducen la trascripción de los genes codificadores de ciertos receptores inflamatorios, como el NK-1; disminuyen la supervivencia de los eosinófilos, al bloquear los efectos de la IL-5 y del GMCSF, aumentando la apoptosis de las mismas; e inhiben la expresión de las moléculas de adhesión, como la ICAM-1 y la selectina E. Estos efectos sobre la inflamación asmática se han objetivado en biopsias y lavados broncoalveolares, donde se confirma que los GCI (budesonida, fluticasona) reducen el número y la activación de células inflamatorias en las vías aéreas(7,8); en el esputo inducido, donde los GCI disminuyen el número de eosinófilos y la tasa de proteína catiónica del eosinófilo (PCE)(9,10); midiendo el óxido nítrico exhalado (ONe), donde los GCI disminuyen la tasa de ONe y se asocia a la mejoría clínica y de la función pulmonar (11,12); estudiando la hiperrespuesta bronquial (HRB), donde el tratamiento crónico con GCI disminuye la HRB y se limita el estrechamiento máximo de la vía aérea en respuesta a estímulos espasmógenos(13). Los β2-agonistas adrenérgicos de acción prolongada (BAAP), formoterol y salmeterol, administrados por vía inhalato- E. G. Pérez-Yarza, et al. ria, actúan como broncodilatadores de acción sostenida (12 horas), inhiben la liberación de histamina y de cisteinil-leucotrienos por parte de los mastocitos, actúan sobre los capilares vasculares inhibiendo la exudación de plasma e inhiben la respuesta no adrenérgica no colinérgica de los nervios sensoriales(14). Hoy en día, la terapia combinada de GCI (budesonida, fluticasona) asociados a BAAP (formoterol, salbutamol) representa la mejor oferta terapéutica para el control óptimo del asma(15,16,17). Ambos fármacos actúan en sinergia: los GCI aumentan la trascripción de los receptores β2 y regulan al alza el número de los mismos; los BAAP potencian los receptores corticoideos y actúan sobre el músculo liso produciendo broncodilatación y limitando la actividad proinflamatoria del músculo liso en la patogenia del asma(18). FÁRMACOS EN INVESTIGACIÓN Durante los 20 últimos años son numerosos y millonarios los esfuerzos investigadores en el manejo farmacológico del asma, con el fin de actuar sobre dianas inflamatorias en el asma(19,20). Nuevos glucocorticoides Los GCI pasan desde los pulmones a la circulación sistémica. En dosis altas pueden tener efectos secundarios sistémicos(6). En este sentido, el objetivo investigador es lograr mayor eficacia y menos o ningún efecto secundario sistémico con nuevos corticoides. Libro II curso 31/1/05 17:26 P gina 117 Perspectivas futuras en el tratamiento del asma Esteroides suaves y ciclesonida Una de las nuevas vías de investigación es encontrar corticoides que actúen en el pulmón evitando la absorción sistémica. Se han buscado nuevos corticoides que sean inactivados por las esterasas de las vías aéreas, de forma que las moléculas que no penetran en las células de la vía aérea sean inactivadas antes de ser absorbidas vía sistémica. Se han estudiado el butixocort y el tipredano(21) que han resultado inefectivos ya que se inactivan posiblemente antes de actuar en la célula diana. La ciclesonida es un profármaco inactivo tipo éster, sin apenas afinidad por el receptor y que necesita ser hidrolizado para ser activo a través de las esterasas de la vía aérea, liberando un metabolito activo la disisobutyryl-ciclesonida. Ciclesonida es más lipofílico que otros GCI, es menos soluble en medios fisiológicos acuosos, con lo que tendría una mayor duración de la acción, por lo que se administra una sola vez al día en forma inhalada(22). En ensayos clínicos en fase III muestra una actividad antiasmática similar a budesonida, con menos efectos sistémicos(23,24). Corticoides disociados Los mecanismos de actuación de los corticoides en el asma son la inhibición de la inflamación mediada por citoquinas, mediante la inhibición (transrepresión)(25) de la acetilación de las histonas y la estimulación de la desacetilación de las histonas. Por el contrario, los efectos secundarios sistémicos de los corticoides parecen ser mediados por la vía del DNA (transactivación)(26). La fluticasona y la bude- 117 sonida tienen mayor efecto transrepresor que transactivador. Las vías de investigación van dirigidas a encontrar glucocorticoides disociados que actúen selectivamente sobre la transrepresión minimizando efectos sistémicos, algunos de los cuales parecen presentar buenos resultados in vivo. Nuevos broncodilatadores Los β2-agonistas presentan una eficacia y seguridad difícil de mejorar en la actualidad (Fig. 5). Se están investigando nuevos β2-gonistas más selectivos y con mayor duración de la acción (carmoterol). También, se investiga en otras moléculas broncodilatadoras que actúan con mecanismos similares, como son los análogos del VIP (Ro-25-1553), los agonistas PGE selectivos, los agonistas del receptor del péptido natriurético atrial (PNA) y las moléculas que inducen la apertura de canales del potasio. Antihistamínicos El receptor H4 se expresa en mastocitos, célula T y eosinófilos. El antagonista selectivo de receptor H4 (JNJ 7777120) inhibe de forma potente la activación de mastocitos y la quimiotaxis, pudiendo disminuir los síntomas y exacerbaciones en el asma(27). Modificadores de leucotrienos Los actuales antileucotrienos (montelukast, pranlukast y zafirlukast) son antagonistas selectivos del receptor Cys LT1, mediador de la broncoconstricción y secreción de moco. Un segundo receptor, LT2, Libro II curso 31/1/05 17:26 P gina 118 118 E. G. Pérez-Yarza, et al. Figura 5. Mecanismos de acción de las fármacos β2-agonistas adrenérgicos (modificado de Barnes PJ(19)) puede ser una importante diana para el tratamiento del asma ya que actúa favoreciendo la proliferación del músculo liso de la vía aérea(28). El inhibidor de 5-LO (Zileuton) bloquea la producción de cisteinil-leucotrienos y también se une al receptor LTB4. El desarrollo de los inhibidores 5-LO está limitado por la toxicidad hepática(29). Antagonistas de las prostaglandinas Se ha estudiado el bloqueo de la producción de la PGD2 con los inhibidores de la ciclooxigenasa no presentando beneficios clínicos en el asma. Antagonistas de la endotelina La endotelina 1 (ET1) induce la proliferación del músculo liso y favorece la fibrosis. Hay en investigación antagonistas no selectivos(30). Inhibidores del óxido nítrico Un inhibidor de larga duración de la sintetasa inducible del óxido nítrico podría ser útil para restablecer la respuesta a los GC en pacientes con asma grave(31). La prodroga L-N6-(l-iminoetil)lisina-5-tetrazol amida (SC-51) se convierte en L-N6(l-iminoetil)lisina (L-NIL) metabolito acti- Libro II curso 31/1/05 17:26 P gina 119 Perspectivas futuras en el tratamiento del asma vo que reduce los niveles de óxido nítrico exhalado en pacientes asmáticos(32). Antagonistas de la adenosina La adenosina activa los mastocitos. Se están estudiando antagonistas de la adenosina que podrían ser beneficiosos en el tratamiento del asma(33). Inhibidores de la triptasa La triptasa de los mastocitos aumenta la contracción del músculo liso, el reclutamiento de eosinófilos, estimula los fibroblastos y promueve la proliferación del músculo liso(34). El BMS-363131 es un inhibidor de la triptasa que esta en investigación(35). Antagonistas de las interleucinas 4 y 13 La IL-4, producida por las células Th2, media importantes funciones proinflamatorias en el asma que incluyen la síntesis de IgE por los linfocitos B, la expresión de la VCAM-1 en el endotelio de la vía respiratoria, la migración transendotelial del eosinófilo, la producción de mucina, la actividad de la 15-lipooxigenasa y es una de las principales inductoras de la estimulación de los linfocitos Th2, que conducirá a la síntesis secundaria de IL-4, IL-5 e IL-13. Existen diversas formas de inhibir las citocinas proinflamatorias en el asma, como se expone en la figura 6. En este sentido, los anticuerpos que bloquean la IL-4 inhiben la hiperreactividad inducida por los alérgenos, la metaplasia y la eosinofilia pulmonar(36). El inhibidor de la IL-4 más desarrollado es el receptor soluble de la IL- 119 4 (IL-4-Rs), que fija la IL-4 antes de que alcance el receptor celular, antagonizando así los efectos proinflamatorios. El receptor soluble recombinado humano (IL-4R, altrakincept) actúa en la mediación celular. Por vía inhalada tiene una vida media sérica de 7 días. Un ensayo clínico (fase I-II) aleatorizado, dobleciego, controlado con placebo, en 25 sujetos con asma moderada bajo tratamiento con glucocorticoides, muestra que una dosis única de IL4R es segura y eficaz, en términos de mejorar la función pulmonar, disminuir los valores de óxido nítrico exhalado (eNO), de VCAM-1 sérica y de la proteína catiónica del eosinófilo (ECP)(37). Otro ensayo clínico aleatorizado, dobleciego, controlado con placebo, llevado a cabo en 62 sujetos con asma moderada durante 12 semanas, muestra que el tratamiento semanal con IL-4R es seguro y eficaz frente a placebo respecto del FEV1 (grupo placebo -0,4L, -13% sobre valor predicho; grupo intervención -0,1L, -2%) y escala de síntomas(38). Estudios posteriores en pacientes con asma leve muestran resultados decepcionantes. Recientemente un receptor heterodímero soluble con todos los componentes del receptor de la IL-4 (citocina trap) ha demostrado tener mayor afinidad por IL4, pudiendo ser útil(39). El BAY 36-1677 es una mutación de la IL- 4 que se une y bloquea el receptor de IL-4 y al receptor IL-13, inhibiendo las dos acciones(40), pero su efecto es de corta duración. La IL-4 y IL-13 a través de un receptor compartido, el IL-4Rα, activa la trascrip- Libro II curso 31/1/05 17:26 P gina 120 120 E. G. Pérez-Yarza, et al. Figura 6.Diferentes modalidades de inhibición de las citocinas proinflamatorias (modificado de Barnes PJ(19)) ción del factor STAT6(41) (Fig. 7). La deleción del gen que codifica el STAT6 tiene acción similar a la ausencia de IL-4(42). Esto conduce a la búsqueda de inhibidores del STAT6, aunque se han descubierto péptidos inhibidores que interfieren la interacción entre STAT6 y el JAK (Janus activated kinases) asociados al receptor de IL-4 α, será difícil de liberar intracelularmente. Se están investigando. Existe mayor evidencia de que IL-13 causa lesiones similares al asma en modelos animales, incluyendo HRB, hipersecreción de moco, fibrosis de la vía aérea, independientemente de la respuesta in- flamatoria de los eosinófilos(43). Induce potencialmente la secreción de eotaxina por parte de las células epiteliales de la vía aérea y transforma el epitelio en secretor. Con el bloqueo el gen codificador de IL-13 en ratas (Fig. 8), se previene el desarrollo de la hiperreactividad bronquial después de exposición a alérgeno, a pesar de una respuesta importante de eosinófilos(44), el aumento de hiperreactividad bronquial inducido por la IL-13 aparece cuando se pierde la expresión del STAT6 en la vía aérea(45). La señal de la IL-13 a través del IL-4Rα, puede activar diferentes vías intracelulares, mediante la activación Libro II curso 31/1/05 17:26 P gina 121 121 Perspectivas futuras en el tratamiento del asma Linf TH2 Mastocito Basófilo Eosinófilo IL-4/ IL-13 IL-4 IL-13 Rα2 JAK 1 IL-13 STAG6 IL-4 Rα I1-13Rα2 Tipo I IL-4-R IL-13 Receptor Tipo I IL-4-R JAK 3 JAK 1 STAT6 γC IL-13 Rα1 IL-4 Rα STAT6 STAT6 P Núcleo STAT6 RNA STAT6 POL Gen eotaxina-1 P Figura 7. Mecanismos de acción de los antagonistas de las interleucinas 4 y 13. del IL 13Rα1, y su amplio espectro hace que sea una diana potencialmente importante para el desarrollo de nuevas terapias. Existe un segundo receptor soluble de alta afinidad para IL-13, IL-13Rα2, que se une a la IL-13 secretada, evitando la activación del IL-13 R α1. El Rc soluble IL13Rα2 es efectivo en el bloqueo de la acción de IL-13, incluyendo la formación de IgE, eosinofilia pulmonar e hiperreactividad bronquial en ratones(46). En el modelo del asma murino, el IL13R_2 es más efectivo que los anticuerpos que bloquean la IL-4, lo cual destaca la importancia potencial de la IL-13 como mediador de la respuesta inflamatoria. El bloqueo de la IL13 debe ser más importante en el asma es- tablecido, debido a que la concentración de IL-13 es mucho mayor que la de IL-4. El IL-13Rα2 y los anticuerpos anti IL13 se están estudiando como posibles terapias para el asma. Antagonistas de la interleucina 9 Es una citocina de la vía Th2 que conduce los linfocitos Th2 hacia la inflamación, amplifica la liberación de mediadores de la inflamación por parte de los mastocitos y la producción de IgE(47), y favorece la hipersecreción mucosa(48). La expresión de la IL-9 y sus receptores está aumentada en la vía aérea del asmático(49), el bloqueo con anticuerpos anti IL9 inhibe la inflamación de la vía aérea y la Libro II curso 31/1/05 17:26 P gina 122 122 E. G. Pérez-Yarza, et al. Figura 8. Interleucina 13: efectos que se producen por el bloqueo del gen codificador de la IL-13 (modificado de Barnes PJ(19)). hiperreactividad bronquial en el modelo de asma murino(50). Se están desarrollando nuevas estrategias para el bloqueo de la IL-9, incluyendo los anticuerpos humanizados(51). Antagonistas de la interleucina La expresión de IL-1 está aumentada en la vía aérea de los asmáticos(52) y activa muchos genes de la inflamación que intervienen en el asma. La citocina endógena antagonista del receptor IL-1 (IL-1ra)(53) ha demostrado que reduce la hiperreactividad bronquial en modelos animales tras estimulación por alérgeno. Aunque la IL- 1ra recombinante (anakinra (Kineret; Amgen) no parece ser efectiva(54). Estrategias antiinterleucina 5 La IL-5 es una citocina segregada, fundamentalmente, por los linfocitos T y también por los mastocitos y los eosinófilos. Induce la diferenciación de los precursores de los eosinófilos en la médula ósea y regula muchas de las funciones terminales de los eosinófilos, como son la adhesión, degranulación y quimiotaxis y la liberación de los mismos al sistema circulatorio(55). Si se entiende el asma como un fenómeno inmunológico mediado por IL-5 Libro II curso 31/1/05 17:26 P gina 123 Perspectivas futuras en el tratamiento del asma que da lugar a una bronquitis eosinofílica, la estrategia terapéutica pasa por ensayar, en primer lugar, inhibidores de la producción de IL-5 y, en segundo lugar, antagonistas de la actividad IL-5(56) (Fig. 9). Un ensayo clínico aleatorizado, dobleciego, controlado con placebo, mediante la administración única intravenosa de anticuerpos monoclonales humanizados antiIL-5, muestra que actúan disminuyendo la producción de eosinófilos y la eosinofilia sanguínea. Sin embargo, los resultados han sido decepcionantes, ya que no modifica la respuesta antigénica en la prueba de provocación bronquial específica y tampoco modifica la hiperrespuesta bronquial (HRB) inespecífica(57), lo que sugiere que la disminución de los eosinófilos en el tejido pulmonar no es suficiente como diana de tratamiento del asma. Un mutante de la IL-5 [IL-5 (E12K)] se ha comprobado que está desprovisto de actividad agonista para los receptores IL-5 en cuanto a las funciones de proliferación y adhesión de los eosinófilos. Sin embargo, se 123 comporta como un agonista completo en cuanto a la supervivencia de los mismos(58). El desarrollo de los conocimientos sobre los factores de trascripción (Raf-1) y la identificación de señales, el bloqueo de la cadena α del receptor (IL-5Rα), puede aportar estrategias de interés en el futuro(59). Antagonismo del TNF-α El TNF-α desempeña un importante papel en la inflamación asmática, mediante la activación de los factores de trascripción que facilitan la regulación al alza de los genes y la producción de mediadores de la inflamación, mediante la activación del factor nuclear κB (NF-κB), del activador de proteína-1 (AP-1) y de otros factores de la trascripción(60). Se han ensayado moléculas, tales como el receptor truncado del TNF, anticuerpos monoclonales antiTNF-α e inhibidores de la convertasa del TNF-α, así como anticuerpos bloqueantes del TNF-α(61). El TNF-α se expresa en la vía aérea de los asmáticos y debe ser un factor clave en Figura 9. Diferentes estrategias para actuar frene a la interleucina 5 (modificado de Barnes PJ(19)). Libro II curso 31/1/05 17:26 P gina 124 124 la amplificación de la inflamación en el asma. Los anticuerpos monoclonales frente a TNF-α (infliximab) y los receptores solubles de TNF-α (etanercept), han tenido una respuesta clínica favorable en enfermedades, como la artritis reumatoide y la enfermedad de Crohn, incluso en pacientes que no respondían a esteroides(62). Los inhibidores del TNF-α son una buena estrategia terapéutica frente al asma y se están realizando ensayos clínicos. Sin embargo, preocupan sus posibles efectos secundarios a largo plazo, como el aumento de la susceptibilidad a infecciones. Citocinas antiinflamatorias Interleucina 10 Diversos estudios realizados parecen indicar que los macrófagos de los pacientes asmáticos presentan un déficit de producción de IL-10(63,64). Cuando las células T reguladoras secretan IL 10 tras ser estimuladas por presentación antigénica, se inhibe el desarrollo de la respuesta celular (vía Th1), manteniéndose niveles muy bajos de anticuerpos. Se cree que este mecanismo está implicado en los efectos beneficiosos de la inmunoterapia con alérgenos específicos(65). La IL-10 inhibe la producción de quimiocinas (eotaxina, RANTES) y citocinas inflamatorias (IL-1β, TNF-α, GM-CSF). También disminuye la acción de enzimas inflamatorias (iNOS, COX-2) y citocinas Th2. La IL-10 recombinante se ha demostrado efectiva en la enfermedad de Crohn y en la psoriasis, mediante inyecciones semanales(66). Los corticoides, la teofilina y los E. G. Pérez-Yarza, et al. inhibidores de la fosfodiesterasa-4 también parecen aumentar los niveles de IL-10. Interferón γ El IFNγ promueve la diferenciación de los linfocitos Th0 a linfocitos Th1, inhibiendo la activación de células Th2 e induciendo la diferenciación de anticuerpos al subtipo IgG2. En la inmunoterapia con alérgenos específicos se observa un aumento de la producción de IFNγ por las células T circulantes(67). En los estudios realizados en pacientes asmáticos el IFNγ nebulizado no ha resultado efectivo(68), pero podría ser útil mediante otras vías de administración en asma grave resistente a corticoides(69). Interleucina 12 e interleucina 18 La IL-12 y la IL-18 tienen un efecto sinérgico en la estimulación de la liberación de IFNγ(70). La IL-12 local unida a alérgenos parece inducir respuestas específicas de tipo Th1 en los estudios realizados(71), por lo que podría resultar curativa en caso de ser aplicada en estadios tempranos de la enfermedad atópica. Un estudio ha evaluado la eficacia de administrar IL-12 a un grupo de asmáticos, mostrando que disminuye la eosinofilia en esputo y en sangre periférica, sin modificar la respuesta bronquial a la histamina ni la respuesta alérgica tardía. Además, mostró efectos no deseables de importancia (fiebre, mialgias, arritmias)(72). Lactoferrina La lactoferrina es una proteína recombinante humana que aumenta los niveles Libro II curso 31/1/05 17:26 P gina 125 Perspectivas futuras en el tratamiento del asma de IL-18, induciendo la diferenciación de las células Th0 a Th1. En modelos animales de asma se reduce la respuesta temprana y tardía a alérgenos y la acumulación de eosinófilos y neutrófilos en los pulmones. Inhibidores de receptores de quimiocinas Las quimiocinas son pequeñas proteínas que actúan reclutando células inflamatorias. Sus receptores pueden ser inactivados mediante moléculas de pequeño tamaño o anticuerpos, siendo estos últimos capaces de bloquearlas de manera prolongada, con menos efectos secundarios (Fig. 10). El receptor 3 de quimiocinas (CCR3) se encuentra en eosinófilos, linfocitos Th2 y mastocitos y es activado por las quimiocinas eotaxina, eotaxina-2, eotaxina-3, RANTES (o CCR1), MCP3, MCP-4 y MCP-5(73). En pacientes asmáticos la expresión de CCR3 está aumentada y se correlaciona con la hiperrespuesta bronquial(74). Se están realizando ensayos clínicos con pequeñas moléculas inhibitorias de CCR3, como UCB35625, SB-297006 y SB-328437, que ya han demostrado reducir el reclutamiento de eosinófilos en modelos animales(75). 125 Los anticuerpos antieotaxina disminuyen el reclutamiento de eosinófilos y la hiperrespuesta bronquial(76). La quimiocina MCP-1 activa monocitos, linfocitos y mastocitos mediante el receptor 2 de quimiocinas (CCR-2). En modelos animales los anticuerpos antiMCP-1 han demostrado disminuir la inflamación de las vías aéreas y la hiperrespuesta bronquial. Se están estudiando pequeñas moléculas inhibidoras de CCR-2. El receptor 4 de quimiocinas (CCR-4) se expresa selectivamente en células Th2, siendo activado por las quimiocinas MDC (derivado de monocitos) y TARC(77). La pequeña molécula inhibitoria AMD3100 disminuye la inflamación inducida por fenómenos alérgicos en modelos animales de asma(78). Inhibidores de la fosfodiesterasa-4 Los inhibidores selectivos de la fosfodiesterasa (PDE) son una familia de enzimas que inhiben la hidrólisis intracelular de AMPc y, en consecuencia, la activación celular. Podrían actuar disminuyendo la contractilidad del músculo liso y la inflamación(79) (Fig. 11). Figura 10. Quimiocinas: factores activadores y factores inhibidores (modificado de Barnes PJ(19)). Libro II curso 31/1/05 17:26 P gina 126 126 La PDE-4 es el tipo de PDE que tiene mayor importancia en las células inflamatorias(80). En algunos estudios se ha observado sobreexpresión de la PDE-4 en células de pacientes atópicos. En modelos animales de asma se ha observado que los inhibidores de la PDE-4 (roflumilast, cilomilast) reducen la infiltración de eosinófilos en la vía aérea y la hiperrespuesta bronquial tras estímulo alergénico(81). El empleo clínico de la mayoría de los inhibidores de la PDE4 está limitado por la aparición de náuseas y vómitos, cuya aparición parece estar especialmente asociada a la inhibición del subtipo PDE-4D(82). En cambio, en los estudios realizados, se observa que el subtipo PDE-4B tiene mayor relevancia en las células inflamatorias(83). Tanto inhibidores selectivos de la PDE-4B como inhibidores de la PDE-4 que pudieran administrarse por vía inhalada y que tuvieran poca biodisponibilidad oral podrían ser útiles en el futuro como terapia para el asma. Inhibidores de los factores de trascripción El NF-κB regula muchas moléculas inflamatorias, como citocinas (IL-1B, IL-4, IL-5, IL-9, IL-15, TNF α), quimiocinas (RANTES, MAP 3, eotaxina) y moléculas de adhesión (ICAM 1, Vcam 1)(84). El NFκB se encuentra en el citoplasma de forma inactiva al estar unido a las inhibidoras del κB (IκB). La fosforilación del IκB mediante la IKK produce la activación del NF-kB. Con la inhibición de este IKK (sobre todo del IKK2), se inhibe el NF-κB(85). E. G. Pérez-Yarza, et al. Inhibidores del NF-AT La ciclosporina, el tacrolimus y el primecrolinus inhiben la función del linfocito T inhibiendo el NF-AT. Inhiben también la IL-2, IL-4, IL-5, IL-13 y el GM-CSF, disminuyendo el número de eosinófilos. El problema de estos fármacos es su toxicidad, motivo que limita extraordinariamnte su uso(86). Bloqueadores del GATA 3 El GATA 3 actúa en la diferenciación del linfocito hacia el Th2(87). Bloqueando éste, se evita la inflamación a través del bloqueo en los eosinófilos. Inhibidores de las cinasas El MAP actúa en la inflamación grave(88). Sus inhibidores inhiben la síntesis de citocinas, quimiocinas y enzimas inflamatorias. Inhiben también la diferenciación de las Th2 y aumentan la apoptosis de los eosinófilos. Entre los fármacos de este grupo, se encuentran el SB 203580, SB 239063, KW 567657(89). El inhibidor específico del MAPK/ERB (U0126), reduce los eosinófilos, IL-4, IL-5, IL-13 y la eotaxina(90). El JNK activa el factor AP-1, que recluta la inflamación de la vía aérea. La JNK también se asocia a la resistencia a los glucocorticoides, por lo que los inhibidores mejorarían la inflamación y la acción de los glucocorticoides(91). La SYK-cinasa aumenta la afinidad del receptor IgE en el mastocito produciendo la degranulación del mastocito. Los inhibidores de la SYK cinasa evitarán la degranulación del mastocito inhibiendo la inflamación(92). Libro II curso 31/1/05 17:26 P gina 127 127 Perspectivas futuras en el tratamiento del asma Figura 11. Inhibidores de la fosfodiesterasa 4: bloquean la inflamación y disminuyen la contratibilidad de la musculatura lisa (modificado de Barnes PJ(19)). El LYN actúa en la activación de los eosinófilos y en la IL-5. El inhibidor del LYN (PP1), inhibe la inflamación y la activación del mastocito(93). Antagonismo de las moléculas de adhesión La adhesión de los leucocitos al endotelio es clave para el reclutamiento de estas células en el área inflamatoria. Esta adhesión depende de la regulación al alza de determinadas moléculas de adhesión sobre la superficie celular y sobre el endotelio capilar, como respuesta a ciertos estímulos inflamatorios (citocinas). Por ello, si se bloquean las moléculas de adhesión, se actuaría preventivamente sobre la in- filtración leucocitaria. En este sentido, hay diversas moléculas en estudio que se exponen a continuación: - Antagonistas glucomiméticos de la selectina. Inhiben las selectinas E, P y L, e inhiben también la fase 2 de la HRB en la provocación bronquial específica en experimentación animal(94). - Oligonucleótidos que previenen la traslación génica de la ICAM-1(95). - Anticuerpos monoclonales antiICAM1(96). - Anticuerpos monoclonales humanizados antiantígeno 4 (VLA-4α4b1), que actúa de transportador de la molécula de adhesión VCAM-1 al endotelio vascular(97). Libro II curso 31/1/05 17:26 P gina 128 128 - - Peptidomiméticos, antagonistas del segmento de conexión (CS-1) de la fibronectina endotelial, transportadora de la VLA-4(98). Inhibidores de la VLA-4 que impiden el acoplamiento de la VLA-4 a los ligandos del endotelio vascular(99). Inmunomodulación Las estrategias para inhibir las respuestas alérgicas en el asma, se exponen en la figura 11. La molécula CTLA4 inhibe los receptores CD80 y CD86 de las células presentadoras del antígeno, bloqueando la señal entre estos receptores y el receptor de la célula T CD28. El efecto terapéutico derivado de la prevención del efecto coestimulador está en estudio(100). Se han desarrollado también formas sintéticas de oligodesoxinucleótidos, que en animales de experimentación se caracterizan por inhibir la respuesta inflamatoria tipo Th2 después de la provocación con metacolina y con alérgenos(101). Este efecto parece persistente y ofrece perspectivas de interés para el futuro de las enfermedades alérgicas(102). Inhibidores de las moléculas co-estimuladoras Las moléculas co-estimuladoras tienen un importante papel en la relación entre la célula presentadora de antígeno y el CD4. La interacción entre B7 y el CD28 determina hacia que tipo de célula T se diferenciará la vía. La B7.2 (CD86) promueve la respuesta a Th2. Siendo así, los anticuerpos contra el B7.2, inhiben la libe- E. G. Pérez-Yarza, et al. ración de la IgE, la eosinofilia pulmonar y la hiperreactividad bronquial. En cambio, los anticuerpos contra el B7.1 (CD80) son inefectivos. Otra molécula co-estimuladora de los linfocitos T es el CTLA4. La proteína de fusión soluble CTLA4-Ig, inhibe la función del CTLA4 disminuyendo la hiperreactividad bronquial, pero no es muy efectiva en la inflamación alérgica severa. La CTLA4 inhibe los receptores CD80 y CD86 de la células presentadoras de antígeno, bloqueando la señal entre estos receptores y el receptor de la célula T CD28. Los anti-CD28, anti-B7.2 y CTLA4-Ig, bloquean la respuesta proliferativa a los alérgenos de las células T. Estas moléculas son las dianas futuras para el tratamiento antialérgico, sobre todo de la dermatitis atópica. La molécula coestimuladora inducible (ICOS), se relaciona con la CD28 y se une a la B7RP-1. Los anticuerpos antiICOS, bloquean la diferenciación del linfocito Th2 inhibiendo la cascada inflamación subsiguiente. Anticuerpos antiIgE La IgE desempeña un papel importante en la patogénesis de las reacciones alérgicas(103). La IgE se produce por los linfocitos B mediada por la IL-4 y la IL-13, interleucinas producidas por los linfocitos Th2. La IgE se crea tras la interacción entre el ligando CD 40 del Th2 y el CD 40 del linfocito B (104), y se une a los receptores de alta afinidad Fc-ε- RI que se encuentran en la superficie de los mastocitos y de los basófilos. La activación del mastocito da lugar a la liberación de Libro II curso 31/1/05 17:26 P gina 129 Perspectivas futuras en el tratamiento del asma 129 Figura 12. (Diferentes estrategias para inhibir la respuesta alérgica en el asma (modificado de Barnes PJ(19)). mediadores que producen broncoconstricción. Por lo tanto, las IgE actúan en la fase inmediata de la reacción asmática o fase I. El omalizumab, anticuerpo monoclonal recombinante humanizado, bloquea el dominio C-ε-3 de la IgE libre en el suero con alta afinidad, impidiendo que la IgE se una al FC-ε-RI, inhibiendo la unión al mastocito y su degranulación(105). El omalizumab es efectivo administrándose vía subcutánea cada 2-4 semanas con dosis dependientes de los niveles séricos de IgE, y consigue una rápida disminución de la IgE circulante. Administrado en aerosol no es eficaz(106). El omalizumab administrado vía intravenosa 2 veces por semana durante 10 semanas, disminuye la respuesta a la alergia, la respuesta a la metacolina y la respuesta tardía a los alérgenos. A su vez, disminuyen los eosinófilos y la reactividad de la vía aérea (efecto antiinflamatorio), inhibiendo la activación de los mastocitos y actuando sobre otros mediadores inflamatorios vía CD27. Se puede considerar como una terapia coadyuvante en el asma grave. Existen ensayos clínicos de fase III donde se estudia el efecto del omalizumab en pacientes con asma moderado-grave, prick test positivo y en tratamiento con corticoides inhalados. Los resultados muestran que la terapia con omalizumab consigue disminuir la dosis de corticoides necesaria, presentan menos agudizaciones y aumenta el por- Libro II curso 31/1/05 17:26 P gina 130 130 centaje de pacientes que utilizan el tratamiento discontinuo con corticoides. A su vez, otros estudios han demostrado que disminuyen el uso de medicación de rescate, disminuye la gravedad del asma y mejoran la calidad de vida, presentando menos consultas a urgencias(107,108). Dentro de los efectos adversos, están el exantema urticarial y la anafilaxia y no hay evidencia de si el tratamiento continuado con el omalizumab disminuye en efectividad o si se crean anticuerpos. Moduladores de citocinas La síntesis de IgE se suprime inhibiendo la IL-4 o IL-13, INF_ e IL12 que son los mediadores que inducen a la diferenciación del linfocito Th2. En este campo, las investigaciones se han desarrollado en los aspectos siguientes: - El receptor recombinado soluble del receptor IL-4 (altrakincept: IL-4R) vía inhalatoria, disminuye la necesidad de corticoides(19). - El receptor soluble contra la IL-13, no es eficaz en clínica. - La anti IL-12, disminuye la circulación de los eosinófilos, probablemente por efecto de la IL-5, pero no es bien tolerado. - El INF γ no es efectivo. - Anticuerpos antiCD23. CD23 presenta alta afinidad por el receptor FC-ε-RII que media en el efecto inflamatorio de las IgE en las células presentadoras de antígenos. Los anticuerpos antiCD23, por ejemplo el IDEC-152, disminuye los niveles de IgE en pacientes asmáticos y reduce la clínica. E. G. Pérez-Yarza, et al. Vacunas, inmunoterapia e inmunoestimulación Vacunas Una falta relativa de infecciones puede ser el factor que influencia en el desarrollo de atopia en individuos genéticamente predispuestos. Esta hipótesis ha conducido a la idea de usar la vacunación para inducir las respuestas protectoras Th1 que previenen la sensibilización y, por lo tanto, el desarrollo de la enfermedad atópica. La inoculación de la vacuna BCG a ratas 14 días antes de la sensibilización reduce la formación de IgE específica frente a alérgeno, así como la respuesta a eosinófilos y la hiperreactividad bronquial, con un aumento de producción de IFN-γ(110). Esto ha incitado a realizar varios ensayos clínicos con BCG para prevenir el desarrollo de la atopia. La vacunación con BCG demostró mejorar el control del asma y para reducir marcadores de activación Th2(111). Inmunoterapia específica La inmunoterapia consiste en la inyección subcutánea de pequeñas cantidades de alérgeno purificado. El mecanismo celular de desensibilización es desconocido, pero podría estar relacionado con la estimulación de IL-10 y con la liberación del factor de crecimiento β que actúa sobre las células T, regulando a la baja la actividad Th2 y aumentando la actividad de las células Th1 y de sus citocinas, IFN-γ e IL-12(112). La clonación de genes de alérgenos comunes ha permitido preparar inyecciones con alérgenos recombinantes, aunque su Libro II curso 31/1/05 17:26 P gina 131 Perspectivas futuras en el tratamiento del asma pureza puede perjudicar su poder alergénico, ya que la mayoría de alérgenos naturales contienen varias proteínas. En ratas, una inyección intramuscular del ADN del plásmido de los ácaros del polvo, previene el desarrollo de la respuesta IgE frente al alérgeno inhalado(113). Esto indica que la vacuna con ADN podría ser una nueva estrategia terapéutica frente al asma. Péptidos de células T Los péptidos de células T derivados del alérgeno principal del gato (Fel d1) parecen eficaces en el bloqueo de la respuesta inflamatoria frente a dicho alérgeno, pero puede producir una respuesta tardía aislada frente al alérgeno por activación directa de las células T, seguido de una disminución de la respuesta prolongada(114). Los péptidos Fel d1 inhiben la respuesta cutánea frente al alérgeno de gato, pero no se conoce si será eficaz en el asma. Uno de los problemas de esta estrategia son las diferencias en la respuesta inmunitaria de cada individuo en reconocer a los péptidos epítopos de célula T, además, muchos paciente están sensibilizados a más de un alérgeno. Los resultados clínicos son contradictorios. Desoxioligonucleótidos Los desoxioligonucleótidos (CpG) son secuencias inmunoestimuladoras de DNA, como la CpG ODNs. Se comportan como potentes inductores de las citocinas de los Th1, estimulando la liberación de la IL-12(15). La administración de CpG ODN a ratones aumenta la ratio de Th1/Th2, disminuye la formación de Ig E específica y reduce la respuesta eosinófila 131 frente a alérgeno, un efecto que tarda más de 6 semanas(116). El tratamiento con CpG ODN también puede revertir la inflamación mediada por eosinófilos en ratas(117) y revertir la HRB en ratas sensibilizadas frente a alérgenos del polen(118). La idea de que Cp ODN y las vacunas con ADN pueden prevenir o curar las enfermedades atópicas en el futuro, viene reforzada por estudios animales, y en la actualidad hay ensayos clínicos en curso(119). Aunque son prometedores las estrategias dirigidas a inclinar el equilibrio hacia los Th1, en términos de modificación de la respuesta de la enfermedad, hay verdadera preocupación de que pueda aumentar el desarrollo de enfermedades mediadas por los Th1, como las enfermedades autoinmunes: esclerosis múltiple, enfermedad intestinal inflamatoria crónica, artritis reumatoide y diabetes mellitus, sobre todo en niños. Oligonucleótidos antisentido y terapia génica El asma presenta una herencia poligénica que interactúa de forma compleja con el medio ambiente, lo cual dificulta la aplicación efectiva de estas nuevas terapias. Por otro lado, el conocimiento de los genes implicados en el asma, posibilita la predicción de la respuesta a diferentes terapias(120) y ayuda a encontrar nuevas dianas más específicas(121). Oligonucleótidos antisentido Los oligonucleótidos antisentido son secuencias de ácidos nucleicos que se unen con alto grado de afinidad al ARN o ADN, Libro II curso 31/1/05 17:26 P gina 132 132 E. G. Pérez-Yarza, et al. pudiendo bloquear la expresión de una proteína específica. Podrían ser útiles las terapias con oligonucleótidos que fueran capaces de bloquear factores de trascripción específicos como el NF-κB y los STAT(122). Interferencia del ARN Se emplea para determinar la función de cada gen en la célula humana y, como terapia, parece más efectiva que los oligonucleótidos antisentido para inactivar los genes. Los estudios realizados con secuencias de ARN de pequeña interferencia aplicados por vía nasal parecen mostrar inhibición de la expresión de genes específicos en los pulmones(123). En resumen, si se analizan globalmente las aportaciones farmacológicas comentadas en esta revisión, se observa que en la selección de las dianas farmacológicos se ha confiado demasiado en modelos experimentales centrados en los mecanis- mos inflamatorios ligados a las manifestaciones del asma en adultos. Estos desarrollos no tienen en cuenta la creciente evidencia de que el sistema respiratorio es particularmente susceptible al daño inflamatorio en edades tempranas de la vida, y que las drogas de nueva generación pueden ser útiles para tratar los síntomas del asma, pero no proporcionan una solución a largo plazo al problema del aumento progresivo de las tasas de enfermedad. El funcionamiento ambiguo de las nuevas drogas antiinflamatorias específicas en ensayos clínicos en adultos asmáticos, hace necesario un cambio en la perspectiva de estudio de los investigadores y de la industria farmacéutica frente al asma, para desarrollar fármacos capaces de frenar la progresión del asma desde su inicio, desde el lactante, al niño y al adulto, y desde las formas agudas a las formas crónicas, considerando que éste es el reto futuro en la farmacología del asma. BIBLIOGRAFÍA 1. Pérez-Yarza EG, Moreno Galdó A. Nuevas perspectivas en el tratamiento del asma. An Esp Pediatr 2000; 53 (Supl 3): 78-82. 2. Gajewska BU, Wiley RE, Jordana M. GM-CSF and dendritic cells in allergic airway inflammation: basic mechanisms and prospects for therapeutic intervention. Curr Drug Targets Inflamm Allergy 2003; 2:279-92. 3. Cisneros C, Ruiz A, Ancochea J. Avances en el tratamiento del asma. Rev Patol Respir 2004; 7:131-7. 4. Álvarez D, Wiley RE, Jordana M. Cytokine therapeutics for asthma: an appraisal of current evidence and future prospects. Curr Pharm Des 2001; 7:1059-81. 5. Torrego A, Pujols L, Picado C. Respuesta al tratamiento glucocorticoideo en el asma. Papel de las isoformas a y b del receptor glucocorticoideo. Arch Bronconeumol 2002; 38: 436-40. 6. Barnes PJ, Pedersen S, Busse W. Efficacy and safety of inhaled corticosteroids. New developments. Am J Respir Crit Care Med 1998; 157: S1-S53. 7. Laitinen LA, Laitinen A, Haahtela T. A comparative study of the effects of an inhaled Libro II curso 31/1/05 17:26 P gina 133 Perspectivas futuras en el tratamiento del asma corticosteroid, budesonide, and a b2-agonist, terbutaline, on airway inflammation in newly diagnosed asthma: a randomized, double-blind, parallel-group controlled trial. J Allergy Clin Immunol 1992; 90:32-42. 8. 9. Djukanovic R, Wilson JW, Britten YM, Wilson SJ, Walls AF, Poche WF, et al. Effects of an inhaled corticosteroid on airway inflammation and symptoms of asthma. Am Rev Respir Dis 1992; 145:674-99. Woolley KL, Gigson PG, Carty K, Wilson AJ, Twaddell SH, Woolley MJ. Eosinophil apoptosis and the resolution of airway inflammation in asthma. Am J Respir Crit Care Med 1996; 154:237-43. 10. Keatings VM, Jatakanon A, Worsdell YM, Barnes PJ. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am J Respir Crit Care Med 1997; 155:542-8. 11. Kharitonov SA, Yates DH, Chung KF, Barnes PJ. Changes in the dose of inhaled steroid affect exhaled nitric oxide levels in asthmatic patients. Eur J Respir Dis 1996; 9:196-201. 12. Beck-Ripp J, Griese M, Arenz S, Koring C, Pasqualoni B, Bufler P. Changes of exhaled nitric oxide during steroid treatment of childhood asthma. Eur Respir J 2002; 19: 1015-9. 13. Bel EH, Timmers MC, Zwinderman AH, Dijkman JH, Sterk PJ. The effect of inhaled corticosteroids on the maximal degree of airway narrowing to methacholine in asthmatic subjects. Am Rev Respir Dis 1991; 143:109-13. 14. Villa Asensi JR, Reverté Bover C, Cobos Barroso N. Tratamiento del asma. En: Tratado de Neumología Infantil, Cobos N, Pérez-Yarza EG Madrid:(eds.). Ergon, 2003; p. 599-619. 15. Barnes PJ. Scientific rationale for inhaled combination therapy with long-acting beta2-agonists and corticosteroids. Eur Respir J 2002; 19:182-91. 133 16. Bateman ED, Boushey HA, Bousquet J, Busse WW, Clark TJ, Pauwels RA, et al. Can Guideline-defined Asthma Control Be Achieved? The Gaining Optimal Asthma. Control Study. Am J Respir Crit Care Med 2004; 170:836-44. 17. O’Byrne PM, Bisgaard H, Godard PP, Pistolesi M, Palmqvist M, Zhu Y, et al. Budesonide/Formoterol combination therapy as both maintenance and reliever medication in asthma. Am J Respir Crit Care Med 2004 Oct 22. 18. Adcock IM, Maneechotesuwan K, Usmani O. Molecular interactions between glucocorticoides and long-acting beta-2-agonists. J Allergy Clin Immunol 2002; 110: S261-8. 19. Barnes PJ. New drugs for asthma. Nature Rev 2004; 3:831-44. 20. Holt PG, Sly PD, Martínez FD, Weiss ST, Björksten B, von Mutius, et al. Drug development strategies for asthma: in search of a new paradigm. Nature Immunol 2004; 5: 695-8. 21. Brattsand R, Axelsson B. New Drugs for Asthma, Barnes PJ (ed.). London: IBC Technical Services Ltd, 1992; p. 192-207. 22. Taylor DA, Jensen MW, Kanabar V, Engelstatter R, Steinijans VW, Barnes PJ, et al. A dose-dependent effect of the novel inhaled corticosteroid ciclesonide on airway responsiveness to adenosine-5’-monophosphate in asthmatic patients. Am J Respir Crit Care Med 1999; 160:237-43. 23. Reynolds N A, Scott L J. Ciclesonide. Drugs 2004; 64:511–9. 24. Bernstein JA, Noonan MJ, et al. Ciclesonide has minimal oropharingeal side effects in the treatment of patients with moderate to severe asthna. J Allergy Clin Immunol 2004; 113:s113. 25. Barnes PJ, Adcock IM. How do corticosteroids working asthma? Ann Intern Med 2003; 139:359–70. 26. Schacke H, Schottelius A, Docke WD, Strehlke P, Jaroch S, Schemees N, et al. Dis- Libro II curso 31/1/05 17:26 P gina 134 134 E. G. Pérez-Yarza, et al. sociation of transactivation from transrepression by a selective glucocorticoid receptor agonist leads to separation of therapeutic effects from side effects. Proc Natl Acad Sci USA 2004; 101:227–32. 36. Gavett SH, O´Heam DJ, Karp CL, Patel EA, Schofield BH, Finkelman FD, et al. Interleukin-4 receptor blockade prevents airway responses induced by antigen challenge in mice. Am J Physiol 1997; 272:L253-6. 27. Hofstra CL, Desai PJ, Thurmond RL, FungLeung WP. Hi stamine H 4 receptor mediates chemotaxis and calcium mobilization of mast cells. J Pharmacol Exp Ther 2003; 305:1212–21. 37. Borish LC, Nelson HS, Lanz MJ, Claussen L, Whitmore JB, Agosti JM, et al. Interleukin-4 receptor in moderate atopic asthma. A phase I/II randomized, placebo-controlled trial. Am J Respir Crit Care Med 1999; 160:1816-23. 28. Back M. Functional characteristics of cysteinyl-leukotriene receptor subtypes. Life Sci 2002; 71:611–22. 29. Nasser SMS, Bell GS, Hawksworth RJ, Spruce KE, MacMillan R, Williams AJ, et al. Effect of the 5-lipoxygenase inhibitor ZD2138 on allergen-induced early and late responses. Thorax 1994; 49:743–8. 30. Benigni A, Remuzzi G. Endothelin antagonists. Lancet 1999; 353:133–8. 31. Saleh D, Ernst P, Lim S, Barnes, PJ, Giaid A. Increased formation of the potent oxidant peroxynitrite in the airways of asthmatic patients is associated with induction of nitric oxide synthase: effect of inhaled glucocorticoid. FASEB J 1998; 12:929–37. 32. Hansel TT, Kharitonov SA, Donnelly LE, Erin EM, Currie MG, Moore WM, et al. A selective inhibitor of inducible nitric oxide synthase inhibits exhaled breath nitric oxide in healthy volunteers and asthmatics. FASEB J 2003; 17:1298–1300. 33. Fozard JR, McCarthy C. Adenosine receptor ligands as potential therapeutics in asthma. Curr Opin Investig Drugs 2002; 3: 69–77. 34. He S, Walls AF. Human mast cell tryptase: a stimulus of microvascular leakage and mast cell activation. Eur J Pharmacol 1997; 328:89–97. 35. Slusarchyk WA, Bolton SA, Hartl KS, Huang MH, Jacobs G, Meng W, et al. Synthesis of potent and highly selective inhibitors of human tryptase. Bioorg Med Chem Lett 2002; 12:3235–8. 38. Borish LC, Nelson HS, Corren J, Bensch G, Busse WW, Whitmore JB, et al. Efficacy of soluble IL-4 receptor for the treatment of adults with asthma. J Allergy Clin Immunol 2001; 107:963-70. 39. Economides AN, Carpenter LR, Rudge JS, Wong V, Koehler-Stec EM, Hartnett C, et al. Cytokine traps: multi-component, highaffinity blockers of cytokine action. Nature Med 2003; 9: 47-52. 40. Shanafelt AB, Forte CP, Kasper JJ, SánchezPescador L, Wetzel M, Gundel R, et al. An immune cell-selective interleukin 4 agonist. Proc Natl Acad Sci USA 1998; 95: 9454-8. 41. Jiang H, Harris MB, Rothman P. IL-4/IL-13 signaling beyond JAK/STAT. J. Allergy Clin Immunol 2000; 105:1063–70. 42. Foster PS. STAT6: an intracellular target for the inhibition of allergic disease. Clin Exp Allergy 1999; 29:12-6. 43. Wills-Karp M, Chiaramonte M. Interleukin-13 in asthma. Curr Opin Pulm Med 2003; 9:21-7. 44. Walter DM, McIntire JJ, Berry G, McKenzie AN, Donaldson DD, DeKruyff RH, et al. Critical role for IL-13 in the development of allergen-induced airway hyperreactivity. J Immunol 2001; 167:4668-75. 45. Kuperman DA, Huang X, Koth LL, Chang GH, Dolganov GM, Zhu Z, et al. Direct effects of interleukin-13 on epithelial cells cause airway hyperreactivity and mucus overproduction in asthma. Nature Med 2002; 8:885-9. Libro II curso 31/1/05 17:26 P gina 135 Perspectivas futuras en el tratamiento del asma 135 46. Wills-Karp M, Luyimbazi J, Xu X, Schofield B, Neben TY, Karp CL, et al. Interleukin-13: central mediator of allergic asthma. Science 1998; 282:2258-61. from the bone marrow stimulated by interleukin 5: the role of specific adhesion molecules and phosphatidyllinositol 3-kinase. J Exp Med 1998; 188:1621-32. 47. Levitt RC, McLane MP, MacDonald D, Ferrante V, Weiss C, Zhou T, et al. IL-9 pathway in asthma: new therapeutic targets for allergic inflammatory disorders. J Allergy Clin Immunol 1999; 103:S485-91. 56. Singh AD, Sanderson CJ. Anti-interleukin 5 strategies as a potential treatment for asthma. Thorax 1997; 52:483-5. 48. Longphre M, Li D, Gallup M, Drori E, Ordonez CL, Redman T, et al. Allergen-induced IL-9 directly stimulates mucin transcription in respiratory epithelial cells. J Clin Invest 1999; 104:1375-82. 49. Shimbara A, Christodoulopoulos P, SoussiGounni A, Olivenstein R, Nakamura Y, Levitt RC, et al. IL-9 and its receptor in allergic and nonallergic lung disease: increased expression in asthma. J Allergy Clin Immunol 2000; 105:108-15. 50. Cheng G, Arima M, Honda K, Hirata H, Eda F, Yoshida N, et al. Anti-interleukin-9 antibody treatment inhibits airway inflammation and hyperreactivity in mouse asthma model. Am J Respir Crit Care Med 2002; 166: 409-16. 51. Zhou Y, McLane M, Levitt RC. Interleukin9 as a therapeutic target for asthma. Respir Res 2001; 2:80-4. 52. Sousa AR, Lane SJ, Nakhosteen JA, Lee TH, Poston RN. Expression of interleukin-i(ILi) and interleukin-1 receptor antagonist (IL1ra) on asthmatic bronchial epithelium. Am J Respir Crit Care Med 1996; 154:1061–6. 53. Arend WP, Malyak M, Guthridge C J, Gabay C. Interleukin-1 receptor antagonist: role in biology. Annu Rev Immunol 1998; 16:27-55. 54. Rosenwasser LJ. Biologic activities of IL-1 and its role in human disease. J Allergy Clin Immunol 1998; 102:344-50. 55. Palframan RT, Collins PD, Severs NJ, Rothery S, Williams TJ, Rankin SM. Mechanisms of acute eosinophil mobilization 57. Leckie MJ, ten Brinke A, Khan J, Diamant Z, O’Connor BJ, Walls CM, et al. Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsiveness, and the late asthmatic response. Lancet 2000; 356:2114-6. 58. McKinnonM, Page K, Uings IJ, Banks M, Fattah AEI, Proudfoot AEI, et al. An interleukin 5 mutant distinguishes between two functional responses in human eosinophils. J Exp Med 1997; 186:121-9. 59. Adachi T, Alam R. The mechanism of IL-5 signal transduction. Am J Physiol 1998; 275:C623-33. 60. Kips JC, Tavernier JH, Joos GF, Peleman RA, Pauwels RA. The potential role of tumor necrosis factor in asthma. Clin Exp Allergy 1993; 23: 247-50. 61. Feldman M, Taylor P, Paleolog E, Brennan FM, Maini RN. Anti-TNF alpha therapy is useful in rheumatoid arthritis and Crohn’s disease: analysis of the mechanism of action predicts utility in other diseases. Transplant Proc 1998; 30:4126-7. 62. Palladino MA, Bahjat FR, Theodorakis EA, Moldawer LL. Anti-TNF-atherapies: the next generation. Nature Rev Drug Discov 2003; 2:736-46. 63. Borish L, Aaons A, Rumbyrt J, Cvietusa P, Negi J, Wenzel S. Interleukin-10 regulation in normal subjects and patients with asthma. J Allergy Clin Immunol 1996; 97:128896. 64. John M, Lim S, Seybold J, Jose P, Robichaud A, O´Connor B, et al. Inhaled corticosteroids increase interleukin-10 but reduce macrophage inflammatory protein-1alpha_, granulocyte-macrophage colony-sti- Libro II curso 31/1/05 17:26 P gina 136 136 E. G. Pérez-Yarza, et al. mulating factor, and intrferon-gamma release from alveolar macrophages in asthma. Am J Respir Crit Care Med 1998; 157: 256-62. 65. Jutel M, Askis M, Budak F, Aebischer-Casaulta C, Wrzyszcz M, Blaser K, et al. IL10 and TGF-beta _cooperate in the regulatory T cell response to mucosal allergens in normal immunity and specific immunotherapy. Eur J Immunol 2003; 33:120514. 66. Fedorak RN, Gangl A, Elson CO, Rutgeerts P, Schreiber S, Wild G, et al. Recombinant human interleukin 10 in the treatment of patients with mild to moderately active Crohn’s disease. The interleukin 10 inflammatory bowel disease cooperative study group. Gastroenterology 2000; 119: 1473-82. 67. Benjaponpitak S, Oro A, Maguire P, Marinkovich V, deKruyff RH, Umetsu DT, et al. The kinetics of change in cytokine production by CD4 T cells during conventional allergen immunotherapy. J Allergy Clin Immunol 1999; 103:468–75. 68. Boguniewicz M, Martin RJ, Martin D, Gibson U, Celniker A. The effects of nebulized recombinant interferon_ in asthmatic airways. J Allergy Clin Immunol 1995; 95:1335. 69. Simon HU, Seelbach H, Ehmann R, Schmitz M. Clinical and immunological effects of low-dose IFN-_ treatment in patients with corticosteroid-resistant asthma. Allergy 2003; 58:1250-5. 70. Dinarello CA. Interleukin-18, a proinflammatory cytokine. Eur Cytokine Netw 2000; 11: 483-6. 71. Kim TS, DeKruyff RH, Rupper R, Marcker HT, Levy S, Umetsu DTl. An ovalbumin-IL12 fusion protein is more effective than ovalbumin plus free recombinant IL-12 in inducing a T helper cell type 1-dominated immune response and inhibiting antigenspecific IgE production. J Immunol 1997; 158:4137-44. 72. Bryan SA, Biuchard P, Sigounas A, Holbert D, Metzger WJ. Immunomodulatory effects of IL-12 on allergic lung inflammation depend on timing dosis. J Immunol 1996; 125:4173-80. 73. Gutiérrez-Ramos JC, Lloyd C, Gonzalo JA. Eotaxin: from an eosinophilic chemokine to a major regulator of allergic reactions. Immunol Today 1999; 20:500-4. 74. Ying S, Meng O, Zeibecoglou K, Robinson DS, Macfarlane A, Humbert M, et al. Eosinophil chemotactic chemokines (eotaxin, eotaxin-2, RANTES, monocyte chemoattractant protein-3 (MCP-3), and MCP-4), and C-C chemokine receptor 3 expression in bronchial biopsies from atopic and nonatopic (Intrinsic) asthmatics. J Immunol 1999; 163:6321-9. 75. Erin EM, Williams TJ, Barnes PJ, Hansel TT. Eotaxin receptor (CCR3) antagonism in asthma and allergic disease. Curr Drug Targets Inflamm Allergy 2002; 1:201-14. 76. Gonzalo JA, Lloyd CM, Kremer L, Finger E, Martinez-A C, Siegelman MH,et al. Eosinophil recruitment to the lung in a murine model of allergic inflammation. The role of T cells, chemokines, and adhesion receptors. J Clin Invest 1996; 98:2332-45. 77. Lloyd CM, Delaney T, Nguyen T, Tian J, Martínez-A C, Coyle AJ, et al. CC chemokine receptor (CCR)3/eotaxin is followed by CCR4/monocyte-derived chemokine in mediating pulmonary T helper lymphocyte type 2 recruitment after serial antigen challenge in vivo. J Exp Med 2000; 191: 265-74. 78. Lukacs NW, Berlin A, Schols D, Skerlj RT, Bridger GJ. AMD3100, a CxCR4 antagonist, attenuates allergic lung inflammation and airway hyperreactivity. Am J Pathol 2002; 160:1353-60. 79. Essayan DM. Cyclic nucleotide phosphodiesterases. J Allergy Clin Immunol 2001; 108:671-80. 80. Torphy TJ. Phosphodiesterase isoenzymes. Am J Respir Crit Care Med 1998; 157:351-70. Libro II curso 31/1/05 17:26 P gina 137 Perspectivas futuras en el tratamiento del asma 81. Hatzelmann A, Schudt C. Anti-inflamatory and immunomodulatory potential of the novel PFE4 inhibitor roflumilast in vitro. J Pharmacol Exp Ther 2001; 297:267-79. 82. Lamontagne S, Meadows E, Luk P, Normandin D, Muise E, Boulet L, et al. Localization of phosphodiesterase-4 isoforms in the medulla and nodose ganglion of the squirrel monkey. Brain Res 2001; 920:84-96. 83. Jin SL, Conti M. Induction of the cyclic nucleotide phosphodiesterase PDE4B is essential for LPS-activated TNF-a responses. Proc Natl Acad Sci USA 2002; 99:7628-33. 84. Henderson WR Jr, Chi EY, Teo JL, Nguyen C, Kahn M. A small molecule inhibitor of redox-regulated NF-kappa B and activator protein-1 transcription blocks allergic airway inflammation in a mouse asthma model. J Inmunol 2002; 169:5294-9. 85. Delhase M, Li N, Karin M. Kinase regulation in inflamatory response. Nature 2000; 406:367-8. 86. Evans DJ, CuIlinan P, Geddes DM. Cyclosporin as an oral corticosteroid Sparinng agent in stable asthma. (Cochrane-Review) Cochrane Database Syst Rev 2001; 2:CDO O2993. 87. Z’hou M, Ouyang W. The function role of GATA-3 in Th1 and Th2 differentiation. Immunol Res 2003; 28:25-37. 88. Kumar S, Boehm J, Lee JC. p38 MAP kinases: key signalling molecules as therapeutic targets for inflamatory diseases. Nature Rev Drug Discov 2003; 2:717-26. 89. Kankaanranta H, Giembycz MA, Barnes PJ, Lindsay DA. SB203580, and an inhibitor of p38 mitogen-activated protein kinase, enhances constitutive apoptosis of cytokinedeprived human eosinofils. J Pharmacol Exp Ther 1999; 290:621-8. 90. Duan W, Chan JH, Wong CH, Leung BP, Wong WS. Antiinflamatory effects of mitogen activated protein kinase inhibitor U0126 in an asthma mouse model. J Immunol 2004; 172:7053-9. 137 91. Sousa AR, Lane SJ, Soh C, Lee TH. In vivo resistance to corticosteroids in bronchial asthma is associated with enhanced phosphorylation of JUN N- terminal kinase and failure of prednisolone to inhibit JUN Nterminal kinase phosphorilation. J Allergy Clin Immunol 1999; 104:565-74. 92. Costello PS, Turner M, Walters AE, Cunningham CN, Bauer PH, Downward J, et al. Critical role for the tyrosine kinase Syk in signaling through the high affinity IgE receptor of mast cells. Oncogen 1996; 13: 2595-605. 93. Amoui M, Draber P, Draberova L. Src family-selective tyrosine kinase Inhibitor, PP1, inhibits both Fc epsilon RI-and Thy1-medialted activation of rat basophilic leukemia cells. Eur J lmmunol 1997; 27:1881-6. 94. Kim MK, Brandley BK, Anderson MB, Bochner BS. Antagonism of selectin-dependent adhesion of human eosinophils and neutrophils by glycomimetics and oligosaccharide compounds. Am J Respir Cell Mol Biol 1998; 19:836-41. 95. Bennett CF, Kornbrust D, Henry S, Stecker K, Howard R, Cooper S et al. An ICAM1 antisense oligonucleotide prevents and reverses dextran sulfate sodium-induced colitis in mice. J Pharmacol Exp Ther 1997; 280:988-1000. 96. Davis LS, Kavanaugh AF, Nichols LA, Lipsky PE. Induction of persistent T cell hyporesponsiveness in vivo by monoclonal antibody to ICAM-1 in patients with rheumatoid arthritis. J Immunol 1995; 154:352537. 97. Lin KC, Castro AC. Very late antigen 4 (VLA4) antagonists as anti-inflammatory agents. Curr Opin Chem Biol 1998; 2:4537. 98. Jackson DY, Quan C, Artis DR, Rawson T, Blackburn B, Struble M, et al. Potent alpha 4 beta 1 peptide antagonists as potential anti-inflammatory agents. J Med Chem 1997; 40:3359-68. Libro II curso 31/1/05 17:26 P gina 138 138 99. Abraham WM, Gill A, Ahmed A, Sielczak MW, Lauredo IT, Botinnikova Y, et al. A small-molecule, tight-binding inhibitor of the integrin alpha(4)beta(1) blocks antigen-induced airway responses and inflammation in experimental asthma in sheep. Am J Respir Crit Care Med 2000; 162:60311. 100. Robinson DS. T cell costimulation: a potential therapeutic target in asthma? Clin Exp Allergy 1998; 28:788-90. 101. Kline JN, Waldschmidt TJ, Businga TR, Lemish JE, Weinstock JV, Thorne PS et al. Modulation of airway inflammation by CpG oligodeoxynucleotides in a murine model of asthma. J Immunol 1998; 160:2555-9. 102. Sur S, Wild JS, Choudhury BK, Sur N, Alam R, Klinman DM. Long term prevention of allergic lung inflammation in a mouse model of asthma by CpG oligodeoxynucleotides. Immunol 1999; 162:6284-93. 103. Corry DB, Kheradmand F. Induction and regulation of the IgE response. Nature 1999; 402:13-8. 104. De Vries JE, Carballido JM, Aversa G. Receptors and cytokines involved in allergic TH2 cell responses. J Allergy Clin Immunol 1999; 103:84-92. 105. Easthope S, Jarvis B. Omalizumab. Drugs 2001; 61:253-60. 106. Fahy JV, Cockcroft DW, Boulet LP. Effect of aerosolized anti-IgE (E25) on airway responses to inhaled allergen in asthmatic subjects. Am J Respir Crit Care Med 1999; 160:1023-7. 107. Soler M, Matz J, Townley R, Buhl R. The anti-IgE antibody omalizumab reduces exacerbations and steroid reqierement in allergy asthmatics. Eur Respir J 2001; 18: 254-61. 108. Busse W, Corren J, Lanier BQ, McAlary M. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol 2001; 108:184-90. E. G. Pérez-Yarza, et al. 109. Borish LC, Nelson HS, Lanz MJ. Interleukin-4 receptor in moderate atopic asthma. A phase I/II randomized, placebo-controlled trial. Am J Respir Crit Care Med 1999; 160:1816-23. 110. Herz U, Gerhold K, Gruber C, Braun A, Wahn U, Renz H, et al. BCG infection suppresses allergic sensitization and development of increased airway reactivity in an animal model. J Allergy Clin Immunol 1996; 102:867-74. 111. Choi IS, Koh YI. Therapeutic effects of BCG vaccination in adult asthmatic patients: a randomized, controlled trial. Ann Allergy Asthma Immunol 2002; 88:584-91. 112. Durham SR, Ying S, Varney VA. Grass pollen immunotherapy inhibits allergen-induced infiltration of CD4+ T lymphocytes and eosinophils in the nasal mucosa and increases the number of cells expressing messenger RNA for interferon-gamma. J Allergy Clin Immunol 1996; 97:1356-65. 113. Hsu CH, Chua KY, Tao MH, Lai YL, Wu HD, Huang SK, et al. Immunoprophylaxis of allergen-induced immunoglobulin E synthesis and airway hyperresponsiveness in vivo by genetic immunization. Nat Med 1996; 2:540-4. 114. Oldfield WL, Larche M, Kay AB. Effect of T-cell peptides derived from Fel d 1 on allergic reactions and cytokine production in patients sensitive to cats: a randomised controlled trial. Lancet 2002; 360:47–53. 115. Horner AA, Van Uden JH, Zubeldia JM, Broide D, Raz E. DNA-based immunotherapeutics for the treatment of allergic disease. Immunol Rev 2001;179:102-18. 116. Sur S, Wild JS, Choudhury BK, Sur N, Alam R, Klinman DM. Long term prevention of allergic lung inflammation in a mouse model of asthma by CpG oligodeoxynucleotides. J Immunol 1999; 162:6284-93. 117. Kline JN, Kitagaki K, Businga TR, Jain VV. Treatment of established asthma in a murine model using CpG oligodeoxynucleo- Libro II curso 31/1/05 17:26 P gina 139 Perspectivas futuras en el tratamiento del asma 139 tides. Am J Physiol Lung Cell Mol Physiol 2002; 283:L170-9. 121. Cookson WO. Asthma genetics. Chest 2002; 121:7S-13S. 118. Santeliz JV, Van Nest G, Traquina P, Larsen E, Wills-Karp M. Amb a 1-linked CpG oligodeoxynucleotides reverse established airway hyperresponsiveness in a murine model of asthma. J Allergy Clin Immunol 2002; 109:455-62. 122. Morishita R, Tomita N, Kaneda Y, Ogihara T. Molecular therapy to inhibit NF-B activation by transcription factor decoy oligonucleotides. Curr Opin Pharmacol 2004; 4:139-46. 119. Agrawal S, Kandimalla ER. Medicinal chemistry and therapeutic potential of CpG DNA. Trends Mol Med 2002; 8:114-21. 120. Hall IP. Pharmacogenetics of asthma. Eur Respir J 2000; 15:449–51. 123. Zhang X, Shan P, Jiang D, Noble PW, Abraham NG, Kappas A, et al. Small interfering RNA targeting heme oxygenase-1 enhances ischemia-reperfusion-induced lung apoptosis. J Biol Chem 2004; 279:1067784. Libro II curso 31/1/05 17:26 P gina 140 Libro II curso 31/1/05 17:26 P gina 141 Malformaciones broncopulmonares congénitas S. Liñán, A. Moreno, G.Vizmanos Unidad de Neumología Pediátrica y Fibrosis Quística Hospital Materno Infantil. Vall d’Hebrón. Barcelona RESUMEN Las malformaciones broncopulmonares congénitas se presentan con una frecuencia que oscila entre el 7,5% y el 18,7% de todas las malformaciones. Un agente nocivo que actúe en una etapa del desarrollo ocasionará una serie de alteraciones morfológicas, cuya repercusión dependerá del tipo de agresión y del momento evolutivo en que tengan lugar. Se expone la teoría de Clements, que apoya el hecho de que las diferentes opciones que pueden aparecer son el reflejo del momento en que tuvo lugar la agresión. Para su mejor concreción se ha optado por agruparlas en tres grupos: 1) alteraciones dismórficas pulmonares, 2) malformaciones de tipo focal y 3) malformaciones vasculares. Hemos de señalar, no obstante, que con frecuencia se asocian a otras malformaciones, fundamentalmente, las que afectan al sistema cardiovascular. En este capítulo se lleva a cabo una revisión de estas malformaciones señalando los datos, tanto clínicos como radiológicos característicos de cada una de ellas, aportando una serie de consideraciones que nos pueden ser de ayuda para su diagnóstico y tratamiento. Libro II curso 31/1/05 17:26 P gina 142 142 INTRODUCCIÓN Las malformaciones pulmonares congénitas se presentan entre el 7,5% y el 18,7% de todas las malformaciones. No obstante, pese a esta elevada frecuencia, muchas de ellas se mantienen asintomáticas, lo que favorece que permanezcan tiempo sin llegar a ser diagnosticadas. Habitualmente este grupo de malformaciones se dividen en cinco grupos anatómicos: 1) pulmón contemplado como un todo; 2) laringe, tráquea y grandes vías aéreas; 3) pequeñas vías y parénquima pulmonar; 4) sistemas linfático y vascular; y 5) caja torácica. En este capítulo nos centraremos, fundamentalmente, en las anomalías broncopulmonares y vasculares. El desarrollo adecuado del aparato respiratorio, es, al igual que el de otros órganos o sistemas, fundamental para el cumplimiento de las funciones que le son inherentes. Un agente nocivo que actúe en una etapa del desarrollo causará alteraciones morfológicas, cuya mayor o menor repercusión dependerá del momento evolutivo en que se produzcan. El epitelio y las glándulas que revisten la laringe, tráquea y bronquios, se desarrollará a partir del endodermo. El cartílago y los músculos que componen la tráquea, bronquios y pulmones se originan en el mesodermo esplácnico que circunda el intestino anterior. En la organogénesis podemos establecer las siguientes etapas (Tabla 1). Hacia la 4ª semana de gestación el aparato respiratorio sólo es una pequeña yema endodérmica formada por la evaginación del tubo S. Liñán, et al. TABLA 1. Embriología. Fases del desarrollo embrionario del pulmón. Estadio embrionario (Primeras 6 semanas) Formación del surco laringotraqueal Aparición de los esbozos broncopulmonares. División lobar Estadio pseudoglandular (5ª-17ª semanas) División de las ramas bronquiales secundarias y terciarias Desarrollo vascular similar Estadio canalicular (17ª-26ª semanas) Formación de la membrana alveolocapilar y los acinos Inicio de la síntesis del surfactante Estadio sacular (24ª semana al nacimiento) Crecimiento del árbol vascular y linfático Estadio alveolar (Hasta 12-18 meses de vida) Aumento del número de alvéolos digestivo primitivo procedente del endodermo. A la 5ª semana, el brote inicial ha crecido constituyendo la tráquea, que experimenta en este momento dos divisiones, que constituirán los dos bronquios principales. A la 6ª semana, se establece la conexión de los vasos arteriales y venosos con las cavidades cardíacas derecha e izquierda. En las 7-8ª semanas se diferencia el músculo liso, apareciendo también: el epitelio, las glándulas mucosas y las células caliciformes que recubren las vías aéreas; se completan las ramificaciones del árbol bronquial. Sobre las 10-12ª semanas Libro II curso 31/1/05 17:26 P gina 143 Malformaciones broncopulmonares congénitas estos elementos aparecen en la tráquea y bronquios. Al final de la 14ª semana se detecta, según algunos autores, la presencia de moco y aparece cartílago primero en tráquea y después en los bronquios. Entre la 16 y la 24ª semana, el pulmón consigue su aspecto lobular, estando desarrollada la vía aérea de forma prácticamente total. Se han formado hasta 17 órdenes de ramificación y los bronquiolos respiratorios terminales. La luz de bronquios y bronquiolos aumenta de tamaño iniciándose la formación de bronquiolos respiratorios, conductos alveolares, alvéolos y tejido pulmonar subyacente. En esta etapa se puede efectuar el intercambio de gases dada la completa vascularización. Entre la semana 22 y la 24 el epitelio cuboide se aplana y aparece la diferenciación entre neumocitos tipo I (futura membrana alveolocapilar) y tipo II (formación de células secretoras productoras de factor tensoactivo). Entre las semanas 26 y 32, tiene lugar la formación de las últimas generaciones de las vías aéreas (conductos y sacos alveolares), sobreviniendo el crecimiento de los capilares alveolares y la barrera entre la zona aérea (epitelio alveolar) y la zona sanguínea (endotelio capilar) se adelgaza. El aparato respiratorio se encuentra a partir de este momento en situación de poder realizar su función a pleno rendimiento. Clements(1) expone su teoría sobre la aparición de las malformaciones, basándose en que el desarrollo pulmonar se rige por unos principios básicos: 1) el árbol bronquial completa su desarrollo hacia la 16ª semana de gestación; 2) los vasos 143 preacinares siguen el desarrollo de las vías aéreas y los intraacinares el de los alvéolos; 3) la práctica totalidad de los alvéolos (95%) se desarrollan posteriormente al nacimiento, aumentando su número hasta los 8 años de edad; 4) en cualquier estadio del desarrollo, el crecimiento de las diferentes estructuras (vías aéreas, alvéolos, arterias, etc.) no siempre es uniforme; 5) en los estadios tempranos, los extremos de los brotes bronquiales son irrigados por un plexo capilar sistémico, derivado de la aorta primitiva. Este plexo regresa mientras el pulmón avanza con el desarrollo de la arteria pulmonar. Basándose en estos principios se puede ofrecer una explicación si no de todas las malformaciones pulmonares, si de las que vemos con mayor frecuencia. Esta teoría presenta las diferentes opciones que pueden resultar de una agresión, durante el desarrollo bronquial, remarcando que no se trata tanto del tipo de agresión sino del momento evolutivo en que tiene lugar (Fig. 1). MALFORMACIONES BRONCOPULMONARES CONGÉNITAS Para su mejor concreción hemos optado por dividirlas en tres grandes grupos: 1. Alteraciones dismórficas pulmonares, caracterizadas por el paro en el desarrollo de la totalidad de un pulmón o de un lóbulo: agenesia, aplasia e hipoplasia. 2. Malformaciones focales, que normalmente sólo afectan a una parte del pul- Libro II curso 31/1/05 17:26 P gina 144 144 S. Liñán, et al. Lesión focal Normal Vascularización sistémica a pulmón normal Arteria pulmonar Plexo sistémico (aorta primitiva) Agnesia Pulmón anómalo con vascularización normal Vascularización sistémica a pulmón anómalo Figura 1. Malformaciones congénitas broncoplumonares. Desarrollo anormal del pulmón (Adaptado de Clements(1)). món, difíciles de clasificar en ocasiones cuando se han presentado fenómenos infecciosos. Entre ellas se encuentran: la atresia bronquial, el enfisema lobar, los quistes torácicos únicos (quiste broncogénico), la malformación adenomatoidea quística y el secuestro pulmonar. 3. Malformaciones vasculares, entre las que señalamos las anomalías arteriales, venosas, arteriovenosas. Con frecuencia se asocian a otras anomalías congénitas, sobre todo, las que afectan al sistema cardiovascular (secuestro pulmonar y el pulmón hipogenético). 1. Alteraciones dismórficas pulmonares Boyden describió tres términos para describir estas anomalías: agenesia pulmonar, aplasia pulmonar e hipoplasia pulmonar. En una visión más moderna se engloban las tres posibilidades bajo la denominación de “complejo agenesia-hipoplasia”, ya que la radiología es similar en todos ellos(2). Agenesia pulmonar Corresponde a la falta de árbol bronquial y tejido pulmonar. Suele ser de tipo Libro II curso 31/1/05 17:26 P gina 145 Malformaciones broncopulmonares congénitas familiar y se acompaña de otras malformaciones, sobre todo, de tipo cardiovascular. Habitualmente es unilateral. Son raros los casos de agenesia lobar afectando, sobre todo, a los lóbulos superiores y medio. La presencia de agenesia bilateral es rarísima y se asocia a anencefalia. La radiografía de tórax anteroposterior muestra un tórax opaco con evidente desplazamiento del mediastino hacia el lado afecto, estrechamiento de los espacios intercostales y herniación del pulmón contralateral que ocupa el hemitórax afectado, recordando una extensa atelectasia del pulmón (Fig. 2). Puede manifestarse en el neonato como un distrés respiratorio, asimetría torácica con desplazamientos de los tonos cardíacos hacia el lado afecto y ocasionalmente como infecciones recurrentes en la primera infancia. No obstante, se trata de una malformación bien tolerada y que no impide un desarrollo normal. El pronóstico para la agenesia en el lado derecho es peor que las lesiones en la izquierda, dado el mayor desplazamiento del corazón y mediastino, lo que comporta una mayor distorsión de la vía aérea. Es recomendable el control de la asimetría torácica y de la posible escoliosis. Aplasia pulmonar Existe un bronquio rudimentario, pero sin tejido pulmonar. Hipoplasia pulmonar El pulmón contiene todos los elementos que le corresponden, pero de un tamaño más reducido. Cuando se presenta 145 Figura 2. Agenesia pulmonar. Opacidad del hemitórax derecho condesplazamiento mediastínico hacia la derecha. como una malformación aislada la tolerancia es perfecta y puede ser un hallazgo casual. Con frecuencia forma parte del llamado síndrome de la cimitarra, caracterizado por hipoplasia pulmonar derecha, dextrocardia y drenaje venoso anómalo. La hipoplasia pulmonar se asocia, habitualmente, con la hernia diafragmática congénita, ya que ésta ocasiona una falta de desarrollo pulmonar ipsilateral, por reducción del espacio intratorácico disponible para su crecimiento. En los casos de hipoplasia (Fig. 3) se visualiza un pulmón de tamaño reducido, con desplazamiento mediastínico. Su sintomatología está condicionada por la presencia de otras alteraciones asociadas (síndrome de la cimitarra). La gammagrafía pulmonar pone de manifiesto una hipoperfusión uniforme del pulmón afecto. La TC visualiza la rotación mediastínica con el desplazamiento de las estructuras mediastínicas(3,4). Libro II curso 31/1/05 17:26 P gina 146 146 S. Liñán, et al. Figura 3. Hipoplasia pulmonar (hernia diafragmática intervenida). Pequeño desplazamiento mediastínico derecho. Gammagrafía pulmonar: ausencia prácticamente total de perfusión en pulmón derecho. 2. Malformaciones focales Atresia bronquial La obliteración de la luz proximal de un bronquio segmentario manteniendo al mismo tiempo una estructura distal normal, se conoce como atresia bronquial. Su origen parece estar relacionado con una agresión vascular, probablemente entre las 4ª-15ª semanas de gestación, que interrumpe el desarrollo evolutivo, formándose el segmento atrésico. El aire penetra en el segmento afectado a través de vías colaterales (poros de Cohn y canales de Lambert), produciendo hiperinsuflación y atrapamiento aéreo. Las secreciones generadas en los bronquios distales se acumulan en el bronquio proximal obstruido provocando la impactación del moco (mucocele/broncocele). La imagen del mucocele, constituye una característica de esta alteración, pudiendo presentarse bajo diferentes formas(5) (Fig. 4). Figura 4. Atresia bronquial segmentaria. Hiperclaridad derecha. Imagen densa hiliar que corresponde al mucocele. Esta malformación normalmente afecta a un segmento y muy raramente a un bronquio lobar. En la mayoría de los casos (64%) se sitúa a nivel del lóbulo superior izquierdo (segmento apical-posterior), en un 14% en lóbulo inferior izquierdo y un Libro II curso 31/1/05 17:26 P gina 147 147 Malformaciones broncopulmonares congénitas Figura 5. Atresia bronquial segmentaria. Imágenes de TC torácica, mostrando la hiperclaridad y el mucocele. 8% en lóbulo medio(6), pudiendo asociarse a otras anomalías. En muchas ocasiones es asintomática (50% de los casos), pudiendo llegar a ser un hallazgo radiológico ocasional. El mucocele se traduce en la radiografía por una opacidad de forma ovoidea, que se encuentra rodeada por un área de hiperlucencia, fácilmente demostrable realizando una placa en fase espiratoria, que pone de manifiesto durante la fase espiratoria el atrapamiento aéreo localizado, con una imagen redondeada central que corresponde al mucocele. La TC torácica, muestra una zona de hiperinsuflación con la imagen típica del mucocele en su interior (Fig. 5) que muestra en su interior la presencia de gas y líquido, pudiendo tener aspecto quístico. Otros casos son sintomáticos, con infecciones recurrentes o en los que la distensión de la zona afecta puede comprometer la función de la parte de pulmón normal. En esta situación la exéresis quirúrgica es el tratamiento recomendado. En los pacientes asintomáticos, se puede mantener una actitud expectante. Enfisema lobar congénito Se trata de una malformación relacionada con una anomalía cartilaginosa (50%) o del tejido de sostén bronquial. Esta alteración provoca un mecanismo valvular, que permite la entrada de aire en un lóbulo al mismo tiempo que dificulta su salida. Algunos autores sugieren la posibilidad de que exista un número excesivo de ramificaciones broncoalveolares que originan un lóbulo polialveolar. Suele presentarse con mayor frecuencia en los lóbulos superiores de uno u otro pulmón y ocasionalmente en el lóbulo medio del pulmón derecho, pudiéndose observar desde los primeros momentos de la vida(7). Actualmente los estudios ecográficos permiten su diagnóstico en el período antenatal, mostrándose como un pulmón ecogénico brillante(8). Dados los mecanismos valvulares que concurren en esta malformación, lo más Libro II curso 31/1/05 17:26 P gina 148 148 llamativo es la presencia de una hiperinsuflación progresiva del lóbulo enfisematoso, que tiende a ocupar la mayor parte del hemitórax desplazando el mediastino y provocando un grado variable de dificultad respiratoria. En función de ello, esta anomalía puede manifestarse ya en los primeros momentos de la vida, con dificultad respiratoria manifiesta y datos auscultatorios que permiten su sospecha: desplazamiento de los tonos cardíacos y asimetría ventilatoria. Habitualmente estas manifestaciones son progresivas, comprometiendo la función respiratoria y obligando a actuar de forma drástica. En ocasiones la sintomatología es más leve y de aparición algo más tardía, manifestándose como cuadros de bronquitis obstructiva en el curso de una virosis respiratoria. Existen también pacientes totalmente asintomáticos en los que el diagnóstico se efectúa de forma casual al practicar una radiografía de tórax. En algunos casos aislados la tendencia natural es hacia la regresión de los síntomas, como hemos tenido ocasión de comprobar. Radiológicamente se muestra como un parénquima pulmonar hiperinsuflado, con desplazamiento mediastínico hacia el lado contralateral y herniación del lóbulo afecto (Fig. 6). La TC de alta resolución demuestra la zona enfisematosa y la compresión del parénquima no afectado. La gammagrafía pulmonar de perfusión confirma la sospecha diagnóstica al mostrar una zona de hipoperfusión localizada. El tratamiento a recomendar en los casos que presentan síntomas evidentes, no permite dudas. La exéresis del lóbulo afec- S. Liñán, et al. Figura 6. Enfisema lobar congénito. Hiperinsuflación del lóbulo superior izquierdo. Desplazamiento mediastínico. to es el tratamiento de elección. En los casos poco o nada sintomáticos puede permitirse una actitud expectante de la indicación quirúrgica. Quiste broncogénico Esta entidad se denomina también con el término de quiste congénito único del tórax(4). Representa casi el 5% de las masas mediastínicas(9). Se origina por una alteración de la ramificación del árbol traqueobronquial. Se trata de cavidades cerradas recubiertas de epitelio ciliado pseudoestratificado al igual que el de tráquea y bronquios, rodeado de tejido muscular y conjuntivo con o sin cartílago. Dado que la mucosa es secretora, los quistes pueden contener una sustancia de aspecto opalino, y crecer en función del acúmulo de esta secreción. La catalogación definitiva del quiste vendrá definida por el estudio de su pared, aunque hay que señalar que en los casos en que se asocia Libro II curso 31/1/05 17:26 P gina 149 149 Malformaciones broncopulmonares congénitas Figura 7. Quiste broncogénico. Imagen de masa en mediastino posterior .TC Torácica: imagen paravertebral de localización en mediastino posterior. a infección el diagnóstico se hace francamente difícil. Anatomopatológicamente, en ocasiones, se hace difícil el poder distinguir si se trata o no de un quiste congénito, ya que algunos quistes adquiridos pueden presentar, así mismo, epitelio pseudoestratificado ciliado. Su localización va a depender del momento evolutivo en el que tiene lugar la agresión, puede ser, tanto en mediastino (75%), como en parenquima (25%). Son excepcionales otras localizaciones, cutánea, pericardica, diafragmática e incluso abdominal. Un reciente estudio sobre 68 casos de quiste broncogénico, demostró cifras similares con un claro predominio de la localización mediastínica (85%) frente a un 10% intrapulmonar(10). La región subcarinal es la más frecuente para los mediastínicos y los lóbulos inferiores para los intrapulmonares. Este hecho condiciona que, en ocasiones, pueda comprometer tráquea, esófago o bronquios, provocando manifes- taciones clínicas por los fenómenos compresivos que origina (hiperinsuflación del pulmón ipsilateral). Su presentación clínica es muy variable. Puede manifestarse como un distrés respiratorio al nacer o bien en fases más tardías(11,12). Aunque existen formas de presentación asintomáticas constituyendo un hallazgo casual, no es infrecuente que en los niños se pueda presentar bajo una forma de compromiso respiratorio, con una historia más o menos prolongada de procesos bronquiales intercurrentes. La radiografía de tórax puede ser suficiente para detectar esta malformación, ya sea por la lesión por sí misma o por las complicaciones que puede ocasionar (Fig. 7). La TC permite evaluar su relación anatómica con las estructuras adyacentes, poniendo de manifiesto la existencia de una masa redondeada de mayor densidad, probablemente debida a hemorragias intraquísticas, elevado contenido proteico o presencia de calcio. La resonancia magnética (RM) contribuye a confirmar la informa- Libro II curso 31/1/05 17:26 P gina 150 150 ción. Los estudios de RM efectuados en el período de gestación posibilitan en ocasiones el diagnóstico prenatal(13,14). La ecografía mediastínica puede permitirnos la confirmación de que se trate de una masa quística. Los estudios gammagráficos de perfusión informan sobre la presencia de una zona ausente de perfusión de aspecto redondeado. Aunque algunos autores han recomendado una actitud expectante ante esta malformación manteniendo un control evolutivo periódico, en la actualidad se recomienda que los quistes de localización intrapulmonar, se consideren como quistes broncogénicos y se sometan a cirugía, dado que por su constitución secretora y al ser una cavidad cerrada, su tendencia natural será a crecer con el riesgo que este hecho comporta, al potenciar los fenómenos compresivos(15). Malformacion adenomatoidea quística congénita La característica principal de esta malformación es la proliferación adenomatoidea en los bronquiolos terminales, que produce quistes de tamaño variable y recubiertos por epitelio bronquial. Constituyen aproximadamente el 25% de las malformaciones pulmonares congénitas. En 1977, Stoker dividió morfológicamente esta entidad en tres tipos: Tipo I, quistes mayores de 2 mm (50%), Tipo II menores de 2 mm (40%) y Tipo III, malformación de aspecto sólido de apariencia seudoglandular con quistes menores de 0,5 mm y abundante tejido muscular liso (10%). S. Liñán, et al. Raramente afecta a más de un lóbulo, y en ocasiones puede tener vascularización sistémica asociada a secuestro pulmonar. A veces se asocia también a polihidramnios e hidrops fetal, siendo rara la asociación a malformaciones extrapulmonares. Histológicamente está formada por espacios quísticos recubiertos de epitelio respiratorio cuboidal ciliado, glándulas mucosas, paredes bronquiales y sacos alveolares. Puede manifestarse en los primeros momentos de la vida bajo la forma de un distrés respiratorio grave, sobre todo en las llamadas formas sólidas (Tipo III) en las que además coexiste una hipoplasia del pulmón por la compresión que supone la masa(2). La zona pulmonar afectada puede estar conectada a estructuras bronquiales teniendo a nivel perférico comunicación con el parénquima aireado. Puede ser aparente ya en la vida fetal, sobre todo cuando su tamaño es grande y sólido (Tipo III). En el recién nacido se puede manifestar como un distrés respiratorio, con ausencia del murmullo vesicular, desplazamiento de los tonos cardíacos e hiperexpansión del hemitórax afecto. Si los quistes se infectan la evolución del problema se complica. No es infrecuente que se descubra tras una infección respiratoria diagnosticada de neumonía de lenta resolución. Ocasionalmente ha sido confundida con un derrame tabicado. La ecografía que se lleva a cabo en los derrames pleurales ha permitido evitar estos errores (Fig. 8). Al igual que otras malformaciones su diagnóstico puede ser como un hallazgo Libro II curso 31/1/05 17:26 P gina 151 Malformaciones broncopulmonares congénitas 151 Figura 8. Malformación adenomatoidea quísitica congénita. Rx tórax; infiltrado en base izquierda. TC: imagen de múltiples quistes en la zona afecta; vascularización aumentada. accidental, en los casos en que no ha existido infección. Su pronóstico viene condicionado por: el carácter secretor de sus estructuras, hecho que favorece el crecimiento de los quistes, por su comunicación con la vía aérea, lo que no hace infrecuente su infección y por la dimensión del tejido afectado que determina la viabilidad del feto. Los controles ecográficos prenatales pueden poner en evidencia la presencia de polihidramnios, por alteración de la dinámica del líquido amniótico, y de ocupación torácica por malformación de quistes pequeños, lo que se relaciona con un peor pronóstico, mientras que los quistes de mayor tamaño y con ausencia de polihidramnios lo tienen mejor. La TC o la RM, permiten definir mejor el aspecto de la lesión, mostrando usualmente unos quistes más pequeños que, habitualmente, rodean al de mayor tamaño (Figs. 9 y 10). En el período fetal, el diagnóstico de esta malformación constituye una de las indicaciones de la cirugía fetal, dada la elevada mortalidad que presentan las formas con polihidramnios. En el recién nacido o en niños más mayorcitos, la cirugía(16) con la extirpación del lóbulo afecto es sin duda el tratamiento de elección. Hay que tener en cuenta en los casos de grandes quistes el grado de hipoplasia existente, ya que ésta puede comprometer la evolución posterior. Secuestro pulmonar Definimos el secuestro pulmonar como una porción de parénquima pulmonar sin conexión con el árbol traqueobronquial, y que recibe suministro arterial sistémico que, habitualmente, proviene de la aorta torácica o abdominal. El secuestro pulmonar representa una malformación de los sistemas respiratorio y vascular primitivos, en la cual el tejido pulmonar fetal es separado de la estructura traqueobronquial principal dotado de irrigación sistémica (2,17). Su origen embrionario es muy precoz y probablemen- Libro II curso 31/1/05 17:26 P gina 152 152 Figura 9. Malformación adenomatoidea quística congénita. TC: múltiples quistes de localización basal izquierda. te puede corresponderse con una alteración de la vasculogénesis del territorio afecto o bien con una oclusión de los vasos que, normalmente, deben irrigarlo. La zona afecta queda aislada y conectada con el territorio sistémico. Los secuestros pertenecen al grupo de las alteraciones o defectos del intestino anterior. Se han descrito dos tipos: 1) extralobar, que tiene su propia pleura que lo separa del resto del pulmón y con retorno venoso sistémico; 2) intralobar, que comparte pleura con el pulmón normal y cuyo drenaje venoso es a través de las venas pulmonares. Este último se considera más que una malformación congénita, una malformación adquirida, probablemente secundaria a procesos infecciosos repetidos. El trabajo de Stoker en más de 42.000 estudios necrópsicos en lactantes, no encontró ningún caso de secuestro intralobar. Todo parece indicar que la mayoría de los casos de secuestro intralobar se trata de secuestros adquiridos(13). En los dos casos, S. Liñán, et al. Figura 10. Malformación adenomatoidea quística congénita. TC: quiste único. la zona secuestrada no tiene una estructura normal, ya que al no estar conectado a la vía aérea, ni se airea normalmente, ni es posible que drene sus secreciones. En los intralobares parece existir cierta conexión que permite una discreta aireación pero que no permite el drenaje de las secreciones. Se ha descrito también el pseudosecuestro pulmonar que se correspondería con una herniación del tejido hepático en el territorio pulmonar. Recientemente hemos tenido ocasión de ver un caso de fusión hepatopulmonar, en que el que se demostró la existencia de una irrigación sistémica de la porción “pulmonar”, además de un drenaje venoso anómalo e hipoplasia pulmonar. Estos hallazgos hacen difícil su clasificación. Desde el punto de vista clínico, el secuestro extralobar habitualmente no da sintomatología, dada su falta de comunicación con la vía aérea, excepto los secundarios al efecto masa. El intralobar por el contrario, puede manifestarse como neu- Libro II curso 31/1/05 17:26 P gina 153 153 Malformaciones broncopulmonares congénitas Figura 11. Secuestro pulmonar. Rx de tórax: condensación basal de localización en LII. Angiografía digital: vascularización anómala que parte de la aorta abdominal. monías de repetición de idéntica localización, como absceso pulmonar o por la presencia de hemoptisis amenazantes. Radiológicamente el secuestro aparece como una imagen densa triangular en el segmento medial basal del lóbulo inferior, con desplazamiento de la trama broncovascular (Fig. 11). En ocasiones se aprecia una proyección lineal hacia la aorta. La TC torácica helicoidal (18), proporciona infor- mala. Hay que tener en cuenta que la existencia de una arteria sistémica puede complicar el curso operatorio. Hay que señalar que algunos autores(19) han descrito que los secuestros pueden disminuir e incluso llegar a desaparecer espontáneamente, por lo cual proponen no actuar quirúrgicamente en los casos asintomáticos. mación sobre la localización del secuestro, pero es la RN, la que aporta los detalles, llegando a desplazar a la arteriografía que constituía una exploración habitual en estos casos. El tratamiento es quirúrgico en los dos tipos de secuestro. En los intralobares se debe efectuar una lobectomía y en el extralobar, al ser una masa aislada, se puede intentar la resección de la zona anó- 3. Malformaciones vasculares Incluimos en este grupo diversas anomalías anatómicas aparecidas como consecuencia de alteraciones en el desarrollo embrionario de los vasos pulmonares, fundamentalmente arco aórtico y arteria pulmonar, que pueden ocasionar con frecuencia, la compresión de las vías respiratorias con la sintomatología que ello comporta. Libro II curso 31/1/05 17:26 P gina 154 154 S. Liñán, et al. Figura 12. Anillos vasculares. A) Doble arco aórtico. B) Arco aórtico derecho. C) Arteria pulmonar izquierda anómala Anillos vasculares Gross, en 1945, describe por primera vez la anatomía de los anillos vasculares, y posteriormente Stewart los clasifica en función de los hallazgos embriológicos, radiológicos y anatomopatológicos. El consenso actual señala cuatro grandes grupos: 1. Doble arco aórtico. Es la forma más frecuente de anillos que causa sintomatología(20). Tiene lugar cuando el cuarto arco branquial y las raíces aórticas dorsales persisten a ambos lados. Se forma entonces un anillo cuya parte anterior es el arco izquierdo y la posterior el arco derecho, que suele ser de mayor tamaño. El anillo comprime la tráquea por delante y el esófago por detrás. Con ello el calibre de la tráquea se encuentra disminuido llegando a presentar una estenosis tipo III, con o sin traqueomalacia asociada (Fig. 12). 2. Arco aórtico derecho. Esta variante cursa habitualmente sin síntomas, ya que no comprime ninguna estructura aé- rea. El cuarto arco branquial izquierdo dorsal sufre una regresión parcial o total, el derecho pasa por detrás del esófago y desciende por la izquierda. El ligamento arterioso, que partiendo de la aorta descendente se extiende hasta la arteria pulmonar izquierda, completa el anillo. La presencia de arteria subclavia izquierda aberrante es una variante de esta anomalía. En este caso hay una persistencia de la aorta dorsal izquierda que se fusiona con la séptima intercostal, provocando una compresión esofágica. El ligamento arterioso que se extiende de la aorta descendente a la pulmonar izquierda completa el anillo. El anillo desaparece al liberar el ligamento. 3. Arteria innominada. La compresión que origina este vaso se debe a un origen anómalo de esta arteria que compromete la cara anterior de la tráquea. La alta inciencia de traqueomalacia y el hallazgo de identaciones traqueales Libro II curso 31/1/05 17:26 P gina 155 Malformaciones broncopulmonares congénitas anteriores (broncoscopia) pone en duda el verdadero papel de la compresión vascular como origen de los síntomas. Ocasionalmente provocan una clínica de obstrucción leve que se soluciona con el paso del tiempo. El estridor y los episodios de apnea y cianosis aparecen en el lactante, relacionándose, fundamentalmente, con la traqueomalacia. Hay que señalar que cursa con un esofagograma normal. 4. Sling de la pulmonar. Esta anomalía no es muy frecuente. Se produce cuando la arteria pulmonar izquierda tiene su origen en la pulmonar derecha. Al intentar nutrir el pulmón izquierdo, el vaso anómalo es arrastrado al hilio pulmonar izquierdo entre la tráquea y el esófago. Este nacimiento tan anómalo provoca una compresión de la tráquea distal y del bronquio principal derecho al pasar la arteria entre la tráquea y el esófago en su trayecto hacia el pulmón izquierdo. Se clasifica en dos tipos: tipo I, la carina en estos casos se encuentra a nivel de las vértebras torácicas; tipo II, la morfología traqueobronquial no está conservada, no existe una auténtica carina. Este tipo se asocia a diferentes grados de estenosis bronquial, en ocasiones comprometiendo importantes segmentos bronquiales. Puede presentarse asociada a otras malformaciones, siendo éste un dato importante en la precocidad de su diagnóstico. En estos tipos de alteraciones vasculares, el grado de compresión de la tráquea y del esófago van a marcar la sintomatología. La intensidad de los mismos abar- 155 ca desde un cuadro de dificultad respiratoria en el período neonatal inmediato, al diagnóstico casual en el adulto. En los casos en que las manifestaciones clínicas son muy precoces (en el primer año de la vida), se precisa la corrección quirúrgica del anillo. La compresión de la tráquea es la manifestación de frecuencia más elevada (7597% según las series)(21). El estridor incrementado por el ejercicio, la ingesta y las sobreinfecciones respiratorias es el principal síntoma. En algunos casos los niños pueden presentar taquipnea y tendencia a la hiperextensión del cuello, como mecanismo para aliviar la compresión. Las técnicas de imagen contribuyen al diagnóstico en mayor o menor grado. La radiografía simple de tórax tiene un valor relativo. En algunas series la rentabilidad alcanza el 100% de los casos(22), aunque este resultado nos parece algo exagerado. El esofagograma mostrando las identaciones esofágicas en todos los anillos, menos, tal y como hemos nombrado anteriormente, en la compresión de la arteria innominada, mantiene una elevada rentabilidad, entre el 95 y el 100%. La TC helicoidal y la RM son técnicas que muestran con nitidad los anillos(23), sobre todo en los casos en que el esofagograma es normal. Con la técnica de TC helicoidal es posible el estudio vascular con imágenes angiográficas de enorme calidad. Con la angiografía-TC se visualizan imágenes en el momento en que las arterias estan llenas de contraste endovenoso y, posteriormente se pueden procesar para conseguir imágenes angiográficas (Fig. 13). La RM constituye la técnica de elección en la evalua- Libro II curso 31/1/05 17:26 P gina 156 156 S. Liñán, et al. Figura 13. TC: doble arco aórtico. Improntas esofágicas ción de anomalías de la arteria pulmonar y de la aorta y sus ramas, ya que permite alcanzar una elevada definición anatómica. Por lo que respecta al tratamiento de estas anomalías, podemos concretar los siguientes puntos: 1) cualquier paciente que presente sintomatología importante con crisis de apnea, disfagia muy evidente, signos de dificultad respiratoria e infecciones respiratorias recurrentes es susceptible de la intervención quirúrgica; 2) sólamente los sintomas ocasionados por la presencia de la arteria innominada son tributarios de un tratamiento conservador, ya que el crecimiento favorece su mejoría; 3) es importante en todos los casos valorar la presencia de anomalías asociadas, ya que pueden comprometer la resolución del problema después de la corrección quirúrgica. Algunos autores aconsejan la práctica de una broncoscopia intraoperatoria para confirmar la resolución de la compresión de la vía aérea. Síndrome de la cimitarra Se le conoce también con el nombre de síndrome venolobar congénito, y se ca- racteriza por un retorno venoso anómalo total o parcial del pulmón derecho a la vena cava inferior o a la aurícula derecha asociado a hipoplasia del pulmón afecto y aporte sistémico arterial parcial. Las manifestaciones clínicas de esta alteración son dependientes de la asociación que presente con otras malformaciones (cardiopatías en el 35%). En el período neonatal con frecuencia se une a anomalías cardíacas con un gran aporte arterial sistémico, lo que comporta la presencia de hipertensión pulmonar. La taquipnea, insuficiencia cardíaca y la hipertensión pulmonar son la regla. En edades más tardías puede pasar desapercibido al no asociarse a anomalías La RM permite valorar la intensidad del shunt izquierda-derecha demostrando el suministro arterial infradiafragmático (Fig. 14). Su tratamiento(24) va a depender la la gravedad de la hipertensión pulmonar y del grado de insufiencia cardíaca que presentan los pacientes. En muchos casos hay que efectuar una neumectomía e incluso el trasplante pulmonar por la hipertensión pulmonar Libro II curso 31/1/05 17:26 P gina 157 157 Malformaciones broncopulmonares congénitas agenesia de ramas puede incluso ser normal. Debe mantenerse un tratamiento conservador si no existe hipertensión pulmonar y el paciente no presenta sintomatología. Figura 14. Síndrome de la cimitarra o síndrome venolobar congénito. Signo de la cimitarra. Hipoplasia derecha, drenaje venoso pulmonar anómalo. Agenesia de la arteria pulmonar o de sus ramas Constituye una anomalía infrecuente, normalmente asociada otras malformaciones cardíacas. El pulmón de la agenesia tiene un suministro arterial sistémico y el contralateral un hiperaflujo sanguíneo a través de la arteria pulmonar de su lado. Las manifestaciones clínicas son las infecciones respiratorias repetidas y la presencia de hemoptisis por la vascularización sistémica. La radiografía de tórax puede mostrar un pulmón hiperlucente. En la Fístulas arteriovenosas En esta malformación vascular, la comunicación directa entre el territorio arterial y venoso da lugar a un shunt derecha izquierda. En función de la importancia del shunt se presenta desaturación de oxígeno, que puede alcanzar el 55%. Aunque se trata de una malformación congénita su diagnóstico suele ser tardío. Ocasionalmente se asocia al síndrome de Rendu-Osler-Weber (telangiectasia hereditaria). En el lactante y niño pequeño se presenta con una clínica de cianosis, policitemia y acropaquia. La radiografía de tórax puede mostrar una imagen de condensación con cierto aspecto quístico o bien un aumento vascular difuso, según se trate de una forma localizada o difusa. En el adolescente no es infrecuente la presencia de hemoptisis o accidentes cerebrovasculares. Puede intentarse la embolectomía, aunque no es infrecuente que se demuestre insuficiente y debamos recurrir a la lobectomía. BIBLIOGRAFÍA 1. Clements Barry S. Congenital malformations of the lungs and airways. Tausig LM, -Landau LI. (Ed.).Pediatric Respiratory Medicine. St Louis (Missouri): Mosby Inc, 1998; p. 1106-36. 2. Mata JM, Castellote A. Pulmonary malformations beyond the neonatal period. Lucaya J, Strife JL (Ed.), Pediatric Chest Imaging. Heidelberg, Edit Springer 2002; p. 93-111. Libro II curso 31/1/05 17:26 P gina 158 158 S. Liñán, et al. 3. Mata JM, Cáceres J. The dysmorphic lung: imaging findings. Eur Radiol 1996; 6:403-14. cyst diagnosed using prenatal MR imaging. Am J Roentgenol 2001; 176:49-52. 4. Mata JM, Cáceres J, Castañer E,Gallardo X, Andreu J. The dysmorphic lung: imaging findings. Postgrad Radiol 2000; 20:3-15. 15. Takeda S, Miyosi S, Minami M, Ohta M, Masaoka A, Matsuda H. Clinical spectrum of mediastinal cysts. Chest 2003; 124:125-32. 5. Ward S, Morcos SK. Congenital bronchial atresia. Presentation of three cases and pictorial review. Clin Radiol 1999; 54:144-8. 16. Adel K Ayed, Abdulla Owayed. Pulmonary resection in infants for congenital pulmonary malformations. Chest 2003; 124:98101. 6. Kinsella D, Sissons G, Williams MP. The radiological imaging of bronchial atresia. Br J Radiol 1992; 65:681-5. 7. Roberts PA, Holland AJ, Halliday RJ, Arbuckle SM, Cass DT. Congenital lobar emphysema:Like father like son. J Pediatr Surg 2002; 37:799-801. 8. Lacy DE, ShawNJ, Pilling DW, Walkinshaw S. Outcome of congenital lung anormalities detected antenatally. Acta Pediatr 1999; 88:454-8. 9. Pérez Ruiz E, Martinón León MI, Maese Heredia R. Anomalías congénitas de las vías aéreas. En: Cobos N, Pérez-Yarza EG, eds. Tratado de Neumología Infantil. Majadahonda: Ergon, 2003; p. 577-98. 10. McAdams HP, Kirejczyk WM, Rosado-de-Christenson ML, Matsumoto S. Bronchogenic cyst: imaging features with clinical and histopathologic correlation. Radiology 2000; 217:441-6. 11. Sarper A. Ayten A, Golbasi L, Demircan A, Isin E. Bronchogenic Cyst. Tex Heart Inst J 2003; 30:105-8. 12. Aktogu S, Yuncu G, Halilcoar H, Ermete S, Budeneli T. Bronchogenic cyst: clinicopathological presentation and treatment. Eur Respir J 1996; 9:2017-21. 13. Winters W, Eggmann E. Congenital Masses of the lung, Prenatal and postnatal imaging evaluation. J Thorac Imaging 2001; 16:196206. 14. Levine D, Jennings R, Barnewolt C, Mehta T, Wilson J, Wong G. Progressive fetal bronchial obstrucction caused by bronchogenic 17. Tovar Larrucea JA, Martínez Martínez L. Malformaciones broncopulmonares. En: Cobos N. Pérez-Yarza EG, eds. Tratado de Neumología Infantil. Majadahonda: Ergon, 2003; p. 231-42. 18. Lucaya X, Garcia Peña P,Herrera L. Expiratory chest CT in children. Am J Roentgenol 2000;174:235-41. 19. García Peña P, Lucaya J, Hendry GM. Spontaneus involution of pulmonary sequestration in children: a report of two cases and review of the literature. Pediatr Radiol 1998; 28:266-70. 20. Woods RK, Sharp RJ, Holcomb GW, Snyder CL, Lofland GK, Ashcraft KW, et al. Vascular anomalies and tracheoesophageal compression: a single institution’s 25 yeras experience. Ann Thorac Surg 2001; 72:434-8. 21. Bakker DA, Berger RM, Witsenburg M, Bogers AJ. Vascular rings; a rare cause of common respiratory symptoms. Acta Pediatr1999; 88:947-52. 22. Pickhardt PJ, Siegel MJ, Gutiérrez FR. Vascular rings in symptomatic children:frecuency of chest radiographic findings. Radiology 1997; 203:423-6. 23. Shell R, Allen E, Mutabagani K, Long F, Davis JT, McCoy K, et al. Compresion of the traquea by the innominate artery in a 2month-old child. Pediatr Pulmonol 2001; 31:80-5. 24. Huddleston CB, Exil V,Canter CE, Mendeloff E. Scimitar syndrome presenting in infancy. Ann Thorac Surg 1999; 67:154-9. Libro II curso 31/1/05 17:26 P gina 159 Displasia broncopulmonar G. García Hernández, C. Luna Paredes Sección de Neumología y Alergia Pediátricas. Hospital Universitario Doce de Octubre. Madrid RESUMEN La displasia broncopulmonar continúa siendo una enfermedad respiratoria importante en la edad pediátrica, pese a los avances obtenidos en la prevención y tratamiento del síndrome del distrés respiratorio neonatal. Dichos avances han posibilitado la supervivencia de niños muy inmaduros, lo que ha dado lugar a modificaciones en el perfil de la enfermedad. La inmadurez pulmonar, la falta de surfactante y la infección prenatal, junto con la oxigenoterapia y la ventilación mecánica, contribuyen al desarrollo del cuadro. La presencia de radicales de oxígeno, citocinas proinflamatorias y enzimas proteolíticas liberadas por neutrófilos migrados al pulmón, reforzarían el proceso inflamatorio. La oxigenación adecuada y la nutrición del paciente son pilares básicos del tratamiento. El empleo de diuréticos, corticoides y broncodilatadores resulta más controvertido. Durante los primeros años de vida son frecuentes las agudizaciones respiratorias, por lo que se aconseja el seguimiento de estos niños por un neumólogo pediátrico. El pronóstico a largo plazo suele ser favorable. Libro II curso 31/1/05 17:26 P gina 160 160 G. García Hernández, et al. INTRODUCCIÓN DEFINICIONES En 1967, Northway describió un cuadro pulmonar que se presentaba en prematuros con enfermedad de la membrana hialina (EMH), tratados con ventilación mecánica y altas concentraciones de oxígeno, y lo denominó displasia broncopulmonar (DBP) (1). La media de edad gestacional de esos niños era de 32 semanas y anatomopatológicamente el cuadro se caracterizaba por bronquiolitis necrotizante, cambios compatibles con hipertensión pulmonar, infiltrados celulares inflamatorios y zonas de hiperinsuflación, alternando con otras de atelectasia, así como presencia de fibrosis en las fases avanzadas(2). Desde entonces ha mejorado la asistencia perinatal, y esto se ha traducido por una mayor supervivencia de prematuros, cada vez más inmaduros. Actualmente es poco habitual que la DBP aparezca en recién nacidos de 32 semanas, siendo más frecuente entre los de 23-28 semanas, cuando todavía no se ha completado la fase de alveologénesis en el pulmón. Las características clínicas y anatomopatológicas de esta “nueva DBP” han hecho que algunos autores prefieran denominarla enfermedad pulmonar crónica neonatal o de la prematuridad (EPCP) (3) . Sin em- Los criterios diagnósticos clásicos de la DBP incluyen: 1. Antecedentes de daño pulmonar agudo (primario o inducido por ventilación mecánica) durante las dos primeras semanas de vida. 2. Clínica respiratoria: taquipnea, retracción costal, auscultación patológica. 3. Necesidad de oxígeno: presión arterial de oxígeno (PaO2) < 60 mm Hg y/o saturación de oxígeno (Sat O2) < 90%, con una fracción inspirada de oxígeno (FiO2) de 0,21. 4. Las alteraciones clínicas y la necesidad de oxígeno suplementario persisten a los 28 días de vida. 5. Existen alteraciones radiológicas (ver más adelante), pero éstas pueden aparecer pasados dichos 28 días. La mayor supervivencia de los niños más inmaduros hace que bastantes de aquéllos que pesaron menos de 1.000 g al nacer sigan necesitando oxígeno a los 28 días de vida, resultando más útil el criterio de precisar oxígeno a las 36 semanas de edad gestacional corregida, para identificar a aquellos niños que después van a presentar patología pulmonar (6). Más recientemente se ha propuesto una nueva clasificación que evalúa a los pacientes en momentos distintos, dependiendo de su edad gestacional5 (Tabla 1). bargo, parece más adecuado continuar aplicando el término DBP y reservar el de EPCP para describir el conjunto de enfermedades pulmonares crónicas, entre las que se incluye la DBP, que aparecen en el prematuro(4,5). EPIDEMIOLOGÍA A pesar de los avances efectuados en la prevención y tratamiento del síndro- Libro II curso 31/1/05 17:26 P gina 161 161 Displasia broncopulmonar TABLA 1. Criterios diagnósticos de la DBP(5). Momento de la evaluación 36 semanas de EPC o al alta (en < 36 semanas de EG) DBP leve No precisa oxígeno suplementarío DBP moderada DBP grave > 28 días y < 56 días de EPC o al alta (en ≥ 32 semanas de EG) Precisa oxígeno suplementario (< 30%) Precisa oxígeno suplementario ≥ 30% y/o presión positiva (VPP o CPAP nasal) EG: edad gestacional. EPC: edad postconcepcional me de distrés respiratorio (SDR) neonatal y al empleo de surfactante, la DBP continúa siendo la enfermedad respiratoria más importante que aparece en prematuros sometidos a ventilación mecánica. Su incidencia varía, dependiendo de los criterios utilizados para definirla, así como del tipo de centro y población atendida (7,8), pero en todas las estadísticas se constata su aumento a medida que disminuye la edad gestacional(9). Así, en recién nacidos de 1.250-1.500 g de peso se sitúa alrededor del 13-14%, mientras que en menores de 800 g oscila entre el 15 y el 50%. FACTORES DE RIESGO Y TRATAMIENTOS PREVENTIVOS Ya en la DBP clásica se consideraban como causas desencadenantes principales la toxicidad del oxígeno(1,10), así como el barotrauma y volutrauma causados por la ventilación mecánica(11). Además, son factores de riesgo la infección, especialmente en menores de 1.200 g(12) y la per- sistencia del ductus arterioso(13). En los niños muy prematuros se sumaría una detención del proceso de alveolización pulmonar y desarrollo de los vasos pulmonares(14). Entre las medidas preventivas que han demostrado su eficacia para disminuir el SDR en prematuros está la administración prenatal de corticoides a la madre(15) y el uso de surfactante exógeno (16). Sin embargo, su contribución a la disminución de la incidencia de DBP es más modesta, quizás por haberse conseguido una supervivencia mayor de niños más inmaduros. Otra medida eficaz consiste en proporcionar una ventilación mecánica adecuada, procurando que exista una presión media en la vía aérea lo más baja posible, pero que consiga una buena oxigenación, sin hiperventilación, ni sobredistensión pulmonar, ni repercusión en el gasto cardíaco(11). También se debe evitar la sobrecarga de líquidos, siendo conveniente restringir sus aportes(17). Finalmente, la suplementación con vitamina A(18) e inositol(19)parece disminuir la incidencia de DBP. Libro II curso 31/1/05 17:26 P gina 162 162 HALLAZGOS ANATOMOPATOLÓGICOS Y FISIOPATOGENIA En la DBP clásica se distinguían cuatro estadios que se solapaban entre si(20): 1. Inflamación (1ª semana de vida): además de los restos de membrana hialina hay necrosis bronquiolar y bronquiolitis obliterativa. 2. Resolución de la inflamación (hasta el final del 1er mes): existe fibrosis perialveolar, engrosamiento de las paredes septales, proliferación de miofibroblastos e hiperplasia de neumocitos tipo II. 3. Cicatrización y remodelación (1er año de vida): se observa fibrosis intersticial, más o menos intensa, áreas con alvéolos colapsados que alternan con otras zonas enfisematosas, disminución del número de alvéolos e hipertrofia del músculo liso bronquial. 4. Crecimiento y desarrollo pulmonar (primeros años de vida): determinan el resultado a largo plazo de la enfermedad. En la actualidad, la DBP que se ve en los prematuros más inmaduros se caracteriza por disminución del número de alvéolos y presencia de menos fibrosis intersticial que la observada en las formas antiguas graves(21). No se conoce bien la fisiopatología de la enfermedad, pero se postula que la inmadurez fisiológica del pulmón del prematuro, unido a la falta de surfactante y quizás a la presencia de infección e inflamación antenatales, determinaría la aparición de insuficiencia respiratoria, que G. García Hernández, et al. obligaría al tratamiento con oxígeno y ventilación mecánica. Ambos elementos contribuirían a dañar el pulmón (liberación de radicales libres de oxígeno y citocinas proinflamatorias)(22,23). Por otra parte, la generación local de interleucina (IL-8) atraería neutrófilos al tejido pulmonar. Ellos liberarían enzimas proteolíticas, como la elastasa, que también dañarían al pulmón. La falta de antiproteinasas, debido a la inmadurez pulmonar, aumentaría la acción destructora de las enzimas proteolíticas(24). El proceso reparador comenzaría con el reclutamiento de macrófagos y el aumento local de TGF-β (transforming growth factor-β) que aumenta la síntesis de enzimas antiproteoliticos, pero también la transcripción de fibronectina y procolágeno, habiéndose asociado los niveles más altos de TGF-β con la presencia de fibrosis pulmonar más intensa(25). CLÍNICA En la forma clásica de la DBP, descrita por Northway(1), se distinguían cuatro estadios: 1. Estadio I (2º-3er día de vida): clínica y radiología propias de la EMH. 2. Estadio II (4º-10º día de vida): mejoría de los síntomas respiratorios o empeoramiento, que obliga a aumentar la asistencia respiratoria. En la radiografía de tórax se constatan áreas de opacificación con broncograma y enfisema intersticial. 3. Estadio III (2ª-3ª semanas de vida): mejoría de la clínica o empeoramiento, es- Libro II curso 31/1/05 17:26 P gina 163 Displasia broncopulmonar pecialmente si hay enfisema intersticial, infección o ductus arteriososus persistente. En la radiografía de tórax se observan áreas de enfisema y atelectasia, así como áreas quísticas. 4. Estadio IV (a partir de la 4ª semana de vida): mejoría progresiva, permitiendo disminuir la asistencia respiratoria, aunque probablemente se requieran suplementos de oxígeno durante las siguiente semanas o meses. También puede suceder que el paciente presente insuficiencia respiratoria progresiva, que obligue a aumentar la asistencia ventilatoria y los aportes de oxígeno. Esta situación se puede complicar si se desarrolla hipertensión pulmonar e insuficiencia cardíaca derecha. Radiológicamente existiría hiperinsuflación pulmonar, áreas quísticas, especialmente en lóbulos inferiores, así como áreas de atelectasia y cicatrización. Los prematuros de muy bajo peso al nacer pueden presentar un cuadro distinto, que se inicia con una leve insuficiencia respiratoria, que responde al tratamiento con surfactante y oxígeno a bajas concentraciones, para en los días siguientes mejorar hasta llegar a prescindir de este último. Posteriormente, presentan un deterioro progresivo, a veces desencadenado por infección o por la persistencia del ductus, que obliga de nuevo a suplementar con oxígeno y a veces requiere ventilación mecánica(26). Radiológicamente puede manifestarse como una opacificación leve difusa que se mantiene durante un tiempo, aunque en otros casos los cambios son similares a los del estadio IV de la DBP clásica. 163 Clínicamente los lactantes con DBP presentan síntomas respiratorios más o menos acusados, según la gravedad del proceso. Los más afectados tienen mayor frecuencia respiratoria, tiraje intercostal y subcostal e hipoxemia respirando aire ambiental. Las exacerbaciones respiratorias son frecuentes(27), y aunque el virus respiratorio sincitial (VRS) y otros virus son los principales responsables, también hay que descartar la presencia de aspiración o de insuficiencia cardíaca. Así mismo, puede haber episodios de apnea, además de los siguientes problemas: a. Patología adquirida de las vías aéreas superiores: estenosis subglótica, granulomas laríngeos, parálisis de cuerdas vocales, laringomalacia y traqueomalacia. b. Escasa ganancia de peso y talla: se suele recuperar coincidiendo con la mejoría respiratoria y la disminución de las necesidades de oxígeno. Esta falta de medro se atribuye al mayor trabajo respiratorio que tienen estos pacientes, a la hipoxemia y a la presencia de reflujo gastroesofágico asociado y/o de insuficiencia cardíaca. c. Reflujo gastroesofágico: no es infrecuente y se puede manifestar con vómitos, rechazo del alimento e irritabilidad, así como con la escasa ganancia ponderal ya señalada, o bien cursar sin síntomas digestivos. Desde el punto de vista respiratorio puede dar lugar a episodios de empeoramiento respiratorio clínico y radiológico, así como estridor y episodios de apnea. Libro II curso 31/1/05 17:26 P gina 164 164 d. Problemas cardíacos: hipertensión pulmonar, hipertrofia ventricular derecha e izquierda, shunt derecha-izquierda a través del foramen oval permeable e incluso hipertensión arterial sistémica. e. Otros: alteraciones del desarrollo neurológico, retinopatía de la prematuridad, pérdidas de la audición, problemas de aprendizaje. PRUEBAS DE FUNCIÓN RESPIRATORIA Es difícil realizar pruebas de función respiratoria en los niños más pequeños, pues su falta de colaboración obliga a emplear la sedación. Además, se precisa disponer de equipos costosos, personal entrenado y tiempo. Por otra parte, la situación clínica de estos niños, a veces comprometida, no anima a su realización(28). La distensibilidad pulmonar está disminuida desde el principio y se suele normalizar entre el primer y segundo años de vida. Se ha observado que aquellos niños que después van a desarrollar una forma grave de DBP, presentan valores muy bajos durante la segunda semana de vida(29). La resistencia en la vía aérea es alta y disminuye algo a partir del tercer año. Mediante técnicas de dilución con helio o nitrógeno se observa que la capacidad residual funcional esta disminuida durante los primeros 6 meses, para luego normalizarse e incluso superar los valores normales. Con la pletismografía corporal total se encuentra aumento de los volúmenes pulmonares, que comienzan a normalizarse a partir de los 12 meses, y con la G. García Hernández, et al. técnica de compresión toracoabdominal rápida se pueden obtener curvas de flujo-volumen, que muestran limitación importante del flujo aéreo, incluso más allá del primer año de vida(30). TÉCNICAS DE IMAGEN Además de la radiografía de tórax, cuyos hallazgos ya hemos comentado, es posible realizar una tomografía axial computarizada de alta resolución (TCAR). Con esta técnica, en las fases tempranas, se observan engrosamientos intersticiales peribronquiales e interlobulares, áreas de apariencia quística y otras de atelectasia, así como bandas parenquimatosas subpleurales. Después de los 2 años predominan los patrones en mosaico, alternando áreas de atrapamiento aéreo con otras de atelectasia, engrosamientos de los septos interlobulares, opacidades subpleurales y distorsión de la arquitectura pulmonar(31). TRATAMIENTO Antes de los 28 días de vida, si se sospecha que el cuadro respiratorio puede evolucionar hacia una DBP, se pueden restringir los aportes líquidos e iniciar tratamiento con diuréticos, para evitar que el edema pulmonar pueda complicar más el cuadro respiratorio. La furosemida ha demostrado ser eficaz, pues mejora la distensibilidad pulmonar y disminuye la resistencia en las vías aéreas. La dosis es de 1-2 mg/kg/día y hay que suplementar con Libro II curso 31/1/05 17:26 P gina 165 165 Displasia broncopulmonar cloruro potásico (2-3 mEq/kg). Puede producir desequilibrio electrolítico por pérdidas de sodio, potasio, cloro y calcio, alcalosis metabólica, nefrocalcinosis y litiasis renal. En tratamientos prolongados se puede utilizar la combinación de hidroclorotiazida (1-3 mg/kg/día) y espironolactona (1-3 mg/kg/día), que produce menos pérdidas electrolíticas. Últimamente estos fármacos también han sido cuestionados, pues se ha visto que pueden dar lugar a situaciones de hipovolemia y de inestabilidad hemodinámica, por lo que habrá que ser cautos a la hora de emplearlos(32). En esta fase también resultan útiles los corticoides sistémicos, pues mejoran la función pulmonar y facilitan el destete del respirador. El que más se ha empleado ha sido la dexametasona (0,2-0,5 mg/kg/día como dosis inicial). Desgraciadamente, además de los efectos secundarios conocidos de los corticoides, se ha observado que incrementan el riesgo de parálisis cerebral, por lo que actualmente su uso está reservado a los casos más graves dependientes del respirador(33). Así mismo, se pueden administrar fármacos por vía inhalada, recomendándose el uso de cámaras espaciadoras para ello. Podemos utilizar β2-adrenérgicos (salbutamol o terbutalina) y bromuro de ipratropio, especialmente útiles si se produce broncoespasmo. También se pueden utilizar corticoides inhalados para intentar disminuir la necesidad de tratamiento con corticoides sistémicos(34). La oxigenoterapia es esencial para estos pacientes. Manteniendo saturaciones de oxígeno ≥ 94% se acelera la ganancia ponderal y la mejoría del cuadro pulmonar, ade- más de evitar la aparición de hipertensión pulmonar(35). La nutrición también constituye un aspecto importante, pues la mejoría de la función respiratoria está en relación directa con una buena ganancia ponderal. Se recomienda una ingesta de 120150 cal/kg/día, el 60% de ellas en forma de grasas, con 3,5 g/kg/día de proteínas y menos de 120 mL/kg/día de aportes líquidos. Durante el seguimiento de estos pacientes se irá retirando la medicación, siempre de forma paulatina y según la respuesta clínica. Hay que ser especialmente cautos con la retirada del oxígeno en los niños dados de alta y que lo reciben en su casa, siendo aconsejable la realización periódica de pulsioximetrías con registro para mayor seguridad. La retirada se iniciará en períodos de vigilia, luego durante las tomas y finalmente durante sueño. No olvidar que en las reagudizaciones respiratorias pueden necesitar de nuevo, de forma transitoria, suplementos de oxígeno. Estos niños deben recibir las vacunas habituales. Además, se recomienda la vacunación antigripal a toda la familia y cuidadores, y a partir de los 6 meses a los propios pacientes. En los menores de 2 años, que continúen con tratamiento de su patología de base en los 6 meses anteriores al comienzo de la epidemia por VRS, se recomienda profilaxis con IgG monoclonal específica (palivizumab). PRONÓSTICO Desde el punto de vista clínico la mayoría evoluciona favorablemente y al lle- Libro II curso 31/1/05 17:26 P gina 166 166 G. García Hernández, et al. gar a los 14 años, o incluso antes, no tienen síntomas respiratorios(36). Sin embargo, si se practican pruebas de función respiratoria no es raro encontrar algunas anomalías. En general, se observa que los flujos espiratorios, habitualmente disminuidos, tienden a normalizarse con la edad. En los pacientes más graves esto sucede con mayor lentitud, si es que alguna vez llega a alcanzarse. En algunos se observa disminución de la capacidad vital, del volumen residual y aumento de la resistencia en la vía aérea(37). Algunos autores han observado que, entre los niños con antecedentes de prematuridad existía mayor prevalencia de sibilancias en los primeros años de vida, pero sólo en aquéllos que han heredado una predisposición atópica se desarrolla verdadera asma(38). Finalmente, en ciertos casos se ha encontrado hiperrespuesta a la metacolina, aire frío y/o ejercicio, aunque no se haya podido demostrar un claro correlato con la clínica que mostraban los pacientes en el momento de la realización de estas pruebas(39). BIBLIOGRAFÍA 1. Northway WH, Rosan RC, Porter DY. Pulmonary disease following respirator therapy of hyaline-membrane disease: Bronchopulmonary dysplasia. N Engl J Med 1967; 276: 357-68. 2. Bonikos DS, Bensch KG, Northway WH, Edwards DK. Bronchopulmonary dysplasia: the pulmonary pathologic sequel of necrotizing bronchiolitis and pulmonary fibrosis. Hum Pathol 1976; 7:643-66. 3. Hyde I, English RE, Williams JD. The changing pattern of chronic lung disease of prematurity. Arch Dis Child 1989; 64:448-51. 4. Kotecha S, Silverman M. Chronic respiratory complications of prematurity. En: Taussing LM, Landau LI, Le Souëf PN, Martínez FD, Morgan WJ, Sly PD (eds.). Pediatric Respiratory Medicine. St Luis, Missouri: Mosby, 1999; p. 488-521. 5. Jobe AH, Bancalari E. Bronchopulmonary dysplasia. NICHD-NHLBI-ORD Workshop. Am J Respir Crit Care Med 2001; 163:1723-9. 6. Shennan AT, Dunn MS, Ohlsson A, Lennox K, Hoskins EM. Abnormal pulmonary outcomes in premature infants: prediction from oxygen requirement in the neonatal period. Pediatrics 1988; 82:527-32. 7. Lemons JA, Bauer CR, Oh W, Korones SB, Papile LA, Stoll BJ, et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 through December 1996. Pediatrics 2001; 107:E1. 8. Warner B, Musial MJ, Chenier T, Donovan E. The effect of birth hospital type on the outcome of very low birth wight infants. Pediatrics 2004; 113:35-41. 9. Berger TM, Bachmann II, Adams M, Schubiger G. Impact of improved survival of very low-birth-weight infants on incidence and severity of bronchopulmonary dysplasia. Biol Neonate 2004; 86:124-30. 10. Saugstad OD. Bronchopulmonary dysplasia-oxidative stress and antioxidants. Semin Neonatol 2003; 8:39-49. 11. Clark RH, Gerstmann DR, Jobe AH, Moffitt ST, Slutsky AS, Yoder BA. Lung injury in neonates: causes, strategies for prevention, and long-term consequences. J Pediatr 2001; 139: 478-86. Libro II curso 31/1/05 17:26 P gina 167 Displasia broncopulmonar 12. Schmidt B, Cao L, Mackensen-Haen S, Kendziorra H, Klingel K, Speer CP. Chorioamnionitis and inflammation of the fetal lung. Am J Obstet Gynecol 2001; 185:173-7. 13. González A, Sosenko IR, Chandar J, Hummler H, Claure N, Bancalari E, Influence of infection on patent ductus arteriosus and chronic lung disease in premature infants weighing 1000 grams or less. J Pediatr 1996; 128:470-8. 14. Jobe AJ. The new BDP: an arrest of lung development. Pediatr Res 1999; 46:641-3. 15. Crowley P. Prophylactic corticosteroids for preterm birth. Cochrane Database Syst Rev 2000; 2:CD000065. 16. Soll RF, Morley CJ. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2001; 2:CD00 0510. 17. Tammela OK. Appropriate fluid regimens to prevent bronchopulmonary dysplasia. Eur J Pediatr 1995; 154:S15-8. 18. Darlow BA, Graham PJ. Vitamin A supplementation for preventing morbidity and mortality in very low birthweight infants. Cochrane Database Syst Rev 2002; 4:CD00 0501. 167 for development of bronchopulmonary dysplasia. Am J Obstet Gynecol 1997; 177:82530. 23. Dreyfuss D, Saumon G. Ventilator-induced lung injury. Am J Respir Crit Care Med 1998; 157:294-323. 24. Speer CP. New insights into the pathogenesis of pulmonary inflammation in preterm infants. Biol Neonate 2001; 79:2059. 25. Grande JP. Role of transforming growth factor-b in tissue injury and repair. Proc Soc Exp Biol Med 1997; 214:27-40. 26. Charafeddine L, D´Angio CT, Phelps DL. Atypical chronic lung disease patterns in neonates. Pediatrics 1999; 103:759-65. 27. Smith VC, Zupancic JAF, McCormick MC, Croen LA,Green J, Escobar GJ, et al. Rehospitalization in the first year of life among infants with bronchopulmonary dysplasia. J Pediatr 2004; 144:799-803. 28. American Thoracic Society/European Respirtory Society. Respiratory mechanics in infants: physiologic evaluation in health and disease. Am Rev Respir Dis 1993; 147: 474-96. 19. Howlett A, Ohlsson A. Inositol for respiratory distress syndrome in preterm infants. Cochrane Database Syst Rev 2003; 4:CD00 0366. 29. Tortorolo L, Vento G, Matassa PG, Zecca E, Romagnoli C. Early changes of pulmonary mechanics to predict the severity of bronchopulmonary dysplasia in ventilated preterm infants. J Matern Fetal Neonatal Med 2002; 12:332-7. 20. Anderson WR, Engel RR. Cardiopulmonary sequelae of reparative stages of bronchopulmonary dysplasia. Arch Pathol Lab Med 1983; 107:603-8. 30. Robin B, Kim YJ, Huth J, Klocksieben J, Torres M, Tepper RS, et al. Pulmonary function in bronchopulmonary dysplasia. Pediatric Pulmonol 2004; 37:236-42. 21. Husain AN, Siddiqui NH, Stoker JT. Pathology of arrested acinar development in postsurfactant bronchopulmonary dysplasia. Hum Pathol 1998; 29:710-7. 31. Aquino SL, Schechter MS, Chiles C, Ablin DS, Chipps B, Webb WR. Hight-resolution inspiratory and expiratory CT in older children and adults with bronchopulmonary dysplasia. AJR 1999; 173:963-7. 22. Yoon BH, Romero R, Jun JK, Park KH, Park JD, Ghezzi F, et al. Amniotic fluid cytokines (interleukin-6, tumor necrosis fator-a, interleukin-1b, and interleukin-8) and the risk 32. Brion LP, Soll RF. Diuretics for respiratorory distress syndrome in preterm infants. Cochrane Database Syst Rev 2001; 2:CD001454. Libro II curso 31/1/05 17:26 P gina 168 168 33. American Academy of Pediatrics. Postnatal corticosteroids to treat or prevent chronic lung disease in preterm infants. Pediatrics 2002; 109;330-8. 34. Cole CH, Colton T, Shah BL, Abbasi S, MacKinnon BL, Demissie S, et al. Early inhaled glucocorticoid therapy to prevent bronchopulmonary dysplasia. N Engl J Med 1999; 340; 1005-10. 35. Poets CF. When do infants need additional inspired oxygen? A review of the currente literature. Pediatr Pulmonol 1998; 26:424-8. 36. Doyle LW, Cheung MM, Ford GW, Olinsky A, Davis NM, Callanan C. Birth weight < G. García Hernández, et al. 1501 g and respiratory health at age 14. Arch Dis Child 2001; 84:40-4. 37. Korhonen P, Laitinen J, Hyödymaa E, Tammela O. Respiratory outcome in school-aged, very-low-birth-weight children in the surfactant era. Acta Paediatr 2004; 93:316-21. 38. Siltanen M, Savilahti E, Pohjavuori M, Kajosaari M. Respiratory symptoms and lung function in relation to atopy in children born preterm. Pediatr Pulmonol 2004; 37:44-9. 39. Eber E, Zach MS. Long term sequelae of bronchopulmonary dysplasia (chronic lung disease of infancy). Thorax 2001; 56:317-23. Libro II curso 31/1/05 17:26 P gina 169 Trastornos respiratorios relacionados con el sueño en el lactante E. G. Pérez-Yarza, O. Sardón, I. Olaciregui, M. Estévez Unidad de Neumología Infantil, Servicio de Pediatría. Hospital Donostia. Osakidetza-Servicio Vasco de Salud. San Sebastián ...un solo momento de descuido y me olvido de respirar. Dirán que morí por no molestarme en respirar... Jean Giraudoux, 1939 (Ondine, Acto Tercero) RESUMEN En condiciones normales, ante la hipoxemia, la hipercapnia y el aumento de las resistencias de vías aéreas superiores producidas durante el sueño, se activan el sistema nervioso autónomo y diversas estructuras corticales que producen microdespertares eléctricos. La alteración de dicho mecanismo de defensa favorece los episodios apneicos. La apnea es el trastorno del control de la respiración más frecuente del recién nacido y del lactante; las apneas del prematuro, los episodios de aparente riesgo vital y el síndrome de muerte súbita del lactante, son los más habituales durante el primer año de vida. Las apneas primarias del prematuro se producen por inmadurez del sistema nervioso central y se manifiestan por una respuesta ventilatoria poco eficaz ante la hipoxemia. El 25% de los prematuros presenta apneas (en su mayoría centrales o mixtas), disminuyendo su frecuencia proporcionalmente al aumento de la maduración fetal. El tratamiento se basa en medidas generales y/o específicas (cafeína, presión continua de distensión alveolar). Si la edad gestacional es inferior a 37 semanas la monitorización es obligada. Los episodios de aparente riesgo vital son, en su mayoría, apneas obstructivas que suelen requerir maniobras de resucitación o estimulación enérgica por parte de los cuidadores. La etiología es múltiple, siendo el 38% idio- Libro II curso 31/1/05 17:26 P gina 170 170 RESUMEN E. G. Pérez-Yarza, et al. pática. No se han descrito marcadores individuales premortem frente al síndrome de muerte súbita del lactante ni relación causal entre ambas entidades, aunque parece existir una asociación genética entre dichas enfermedades. El requerimiento de monitorización domiciliaria se basa en la gravedad y en la posibilidad de recurrencia de los episodios. La evolución, generalmente, es excelente. El síndrome de muerte súbita del lactante es el resultado de la interacción de factores medioambientales diversos sobre una base genética compleja (polimorfismos genéticos en Phox2a, Ret, etc.). Los factores de riesgo más destacados son la posición en la cuna en decúbito prono, la exposición al humo del tabaco y la edad inferior a 20 años. Las apneas del prematuro persistentes, los episodios de aparente riesgo vital que hayan precisado reanimación, y los hermanos de los los casos de síndrome de muerte súbita del lactante, precisan todos estudio polisomnográfico y algunos estudio genético, junto con monitorización domiciliaria adecuada. En el caso de indicar dicha monitorización, será necesaria la instrucción de los padres en las maniobras básicas de reanimación cardiopulmonar. Libro II curso 31/1/05 17:26 P gina 171 Trastornos respiratorios relacionados con el sueño en el lactante ABREVIATURAS CPAP presión continua de distensión alveolar. DTP difteria, tétanos y tos ferina. ECG electrocardiograma. EEG electroencefalograma. EMG electromiograma. EOG electrooculograma. FC frecuencia cardiaca. FR frecuencia respiratoria. FRC capacidad funcional residual. LCR líquido cefalorraquídeo. RCP reanimación cardiopulmonar. RN recién nacido. SAS síndrome de apneas obstructivas del sueño. SHCC síndrome de hipoventilación cerebral congénito. SG semanas de gestación. SMSL síndrome de muerte súbita del lactante. SNA sistema nervioso autónomo. SNC sistema nervioso central. StcO2 saturación transcutánea de oxígeno. REM fase del sueño con movimientos oculares rápidos. TA tensión arterial. TRS trastornos respiratorios relacionados con el sueño. VAS vía aérea superior. VC volumen corriente. INTRODUCCIÓN Los cambios fisiológicos que se producen en la respiración durante el sueño, no han sido motivo de atención hasta las últimas décadas. Es obvio que el sueño tiene efectos sobre la respiración, y que los cambios que se producen no tienen 171 efectos adversos en el individuo sano. Los cambios que se producen son, fundamentalmente, un cierto grado de hipoventilación con la hipercapnia subsiguiente y una disminución de la respuesta a los estímulos respiratorios. Sin embargo, en pacientes con enfermedades pulmonares crónicas, estos cambios fisiológicos durante el sueño pueden tener un efecto importante sobre el intercambio de gases en la unidad funcional pulmonar, y pueden desarrollar episodios de hipoxemia marcada, sobre todo, en la fase de sueño con rápidos movimientos oculares (sueño REM). Además, hay alteraciones respiratorias específicas que sólo están presentes durante el sueño, como es el síndrome de apneas obstructivas del sueño (SAOS). El manual para la clasificación internacional de las alteraciones del sueño desarrolla códigos para un grupo de trastornos respiratorios relacionados con el sueño (TRS)(1) (Tabla 1), algunos de elevada prevalencia, como son el ronquido primario y el SAOS, y otros menos frecuentes, pero de impacto sociofamiliar y morbimortalidad elevados, como son los episodios de aparente riesgo vital (ALTE) y el síndrome de muerte súbita del lactante (SMSL). Desde años atrás, la disfunción o disregulación del sistema nervioso autónomo (SNA) se ha relacionado con el síndrome de hipoventilación central congénito o síndrome de Ondine (SHCC) con el gen Phox2b (paired-like homeobox gene), locus 4p12, gen de extrema importancia en las etapas precoces de desarrollo neuronal, Libro II curso 31/1/05 17:26 P gina 172 172 E. G. Pérez-Yarza, et al. TABLA 1. Trastornos respiratorios relacionados con el sueño (modificado de Kiely et al)(1). Descripción Sinónimos Código ICD-9-CM Síndrome de apnea obstructiva del sueño Síndrome de obesidad-hipoventilación Síndrome de Pickwick 780.53-0 Síndrome de apnea central del sueño Síndrome de apnea no obstructiva del sueño Respiración de Cheyne-Stokes 780.51-0 Síndrome de hipoventilación alveolar central Hipoventilación alveolar primaria Hipoventilación alveolar no apneica 780.51-1 Ronquido primario Ronquido simple 780.53-1 Apnea del sueño del lactante Apnea del prematuro Apnea del lactante ALTE Síndrome de apnea obstructiva del sueño 770.8 Síndrome de hipoventilación central congénita Síndrome de hipoventilación alveolar primaria Maldición de Ondine Códigos ICD-9 e ICD-9-CM para diversos trastornos respiratorios relacionados con el sueño. ICD-9: clasificación internacional de enfermedades, WHO, 9ª edición. ICD-9-CM: modificación clínica norteamericana a la ICD-9. TABLA 2. Genes que participan en el control de la respiración. Genes Locus Función KROX-20 10q21.1-q22.1 Automatismo RET 10q11.2 Respuesta ventilatoria a la hipercapnia MASH-1 12q22-q23 Respuesta ventilatoria a la hipercapnia BMP2 2p13.3 Sistema nervioso autónomo PHOX2a 4p12 Sistema nervioso autónomo PHOX2b 4p12 Sistema nervioso autónomo ECE1 1p36.1 Sistema nervioso autónomo TLX3 5q35.1 Sistema nervioso autónomo EN1 2q13-q21 Sistema nervioso autónomo EDN1 6p24.1 Sistema nervioso autónomo 5-HTTP 17q11.1-q12 Serotonina Libro II curso 31/1/05 17:26 P gina 173 Trastornos respiratorios relacionados con el sueño en el lactante ya que actúa como represor de las señales inducidas por Notch (un antagonista de la restricción de la diferenciación neuronal producida por BMP, bone morphogenetic proteins), y porque se apoya en Mash1 (mammalian achaete-scute homolog 1), con el que coordina la expresión de factores, tales como la homeoproteína Phox2a, necesaria para la regulación de los genes cRet, TH (tiroxina hidroxilasa) y DbH (dopamina-β-hidroxilasa), genes que participan en la expresión del fenotipo catecolaminérgico. Hoy se sabe que hay una asociación estadísticamente significativa entre la mutación heterocigota en el gen Phox2b (expansión de polialanina en el exón 3) y el SHCC, y que actualmente puede usarse como test predictivo positivo al diagnóstico (sensibilidad 97,06% y especificidad 100%)(2). El avance científico es tan apasionante (Tabla 2), que en los últimos meses se ha establecido que la mutación en el gen Phox2b, gen causal mayor del SHCC, no se asocia al síndrome de muerte súbita del lactante, uno de cuyos genes relacionados es el gen Phox2a (locus 4p12)(3,4). De los aspectos históricos y de los avances recientes de los TRS en recién nacidos y en lactantes, se va a tratar a continuación. ALTE episodio de aparente riesgo vital. EL SUEÑO Y LA RESPIRACIÓN La respiración se inicia espontáneamente y se mantiene automáticamente por el sistema nervioso central (SNC). Es un proceso de retroalimentación negativa 173 constituido por una vía aferente (mecano y quimiorreceptores del sistema respiratorio, cardiovascular y SNC), un mecanismo regulador central y una vía eferente (sistema nervioso somático, vegetativo y muscular), cuyo objetivo es mantener los gases sanguíneos dentro de la normalidad (Fig. 1). El sistema regulador central está formado por centros protuberanciales (centro neumotáxico, con acción inspiratoria y espiratoria; centro apneústico, que regula la finalización de la respiración), centros bulbares, hipotalámicos (grupo dorsomedial, que regula el ritmo respiratorio; grupo ventrolateral, amplitud respiratoria; y grupo infundibular, núcleo arcuato), que integran las señales enviadas por los receptores, y generan el inicio y final de la respiración(5). El gen Phox2a, las neuronas A6 pontinas y la noradrenalina, son esenciales para el desarrollo del ritmo respiratorio normal, al menos en el ratón, como han descubierto Viemari et al(6) muy recientemente. El sueño es el único estado fisiológico caracterizado por episodios de relativa inactividad motora, que pueden ser revertidos de forma muy rápida por las respuestas arousal. Convencionalmente podría definirse en términos del cambio hacia una actividad electroencefalográfica progresivamente más baja, mientras se mantiene una situación de marcada hipotonía (sueño REM). En general, la frecuencia respiratoria (FR) es mayor en el sueño REM que en el sueño no REM en recién nacidos y en lactantes. En los niños mayores la frecuencia respiratoria alcanza su nivel más bajo en la fase II del sueño no REM y du- Libro II curso 31/1/05 17:26 P gina 174 174 E. G. Pérez-Yarza, et al. CENTRO RESPIRATORIO RECEPTORES - Centrales - Periféricos VENTILACIÓN CORTEZA CEREBRAL SISTEMA NERVIOSO AUTÓNOMO (Reflejos) MÚSCULOS - Diafragma - Músculos de la vía aérea - Músculos de la caja torácica y abdomen Figura 1. Control de la respiración (López-Herce et al(5)) (autorizada la reproducción) rante la segunda parte de la noche. En los adolescentes, por el contrario, la FR es mayor y variable durante el sueño REM y menor durante las fases III y IV del sueño no REM. Estas diferencias son más evidentes en lactantes y mucho menos importantes en escolares y en adolescentes. Además, la ventilación disminuye durante el sueño en comparación con la vigilia. Durante el sueño no REM la ventilación se controla por factores metabólicos (quimiorreceptores); la respiración es regular, el volumen corriente (VC) y la FR son menores que en vigilia, lo que produce una disminución del volumen minuto. Esta reducción, junto con la posición en la cuna en supino y el descenso del tono de los músculos intercostales, da lugar a una disminución de la capacidad residual funcional (FRC). También se produce un marcado aumento de la resistencia de la vía aérea superior (VAS), secundaria a la disminución del volumen pulmonar y al descenso del tono de los músculos de la VAS(7). Durante el sueño REM predomina el control cortical y disminuye la reactividad de los mecano y quimiorreceptores. La respiración es irregular: la FR y el VC varían, y son habituales las apneas centrales. Además, la inhibición de la actividad tónica de los músculos intercostales durante el sueño REM, da lugar a una mayor reducción de la FRC que la que se observa en el sueño no REM. De forma complementaria, se produce una hipotonía de los músculos de la VAS sin cambios en la contractibilidad del diafragma, lo que favorece la aparición de apneas obstructivas. Por último, la respuesta ventilatoria a la hi- Libro II curso 31/1/05 17:26 P gina 175 Trastornos respiratorios relacionados con el sueño en el lactante poxia y a la hipercapnia disminuye durante el sueño, dando lugar a una hipercapnia y desaturación de oxígeno relativas(8,9). Estos hallazgos adquieren especial relevancia en neonatos y lactantes, ya que la duración del sueño y de la fase REM (superior a 2/3 del total en neonatos) son mayores que en escolares y en adolescentes. La hipercapnia, el aumento de la resistencia de VAS y la hipoxemia durante el sueño, SNA y diversas estructuras corticales que producen microdespertares eléctricos, despertares transitorios o arousals (más frecuentes en fase REM). La alteración de dicho mecanismo de defensa principalmente durante la segunda mitad de la noche, favorece los episodios apneicos(10). TRASTORNOS RESPIRATORIOS RELACIONADOS CON EL SUEÑO La apnea, definida como ausencia de flujo aéreo, es el trastorno del control de la respiración más frecuente en el recién nacido (RN) y en el lactante. Hay 3 grupos de apneas durante el primer año de edad: las apneas del prematuro, los episodios de aparente riesgo vital (ALTE, apparent lifethreatening events) y el SMSL, tal como se describen en la clasificación internacional de las alteraciones del sueño (Tabla 1). Apneas del prematuro Las apneas del prematuro son la alteración más importante del control de la respiración dentro del período neonatal. Son la consecuencia del desarrollo in- 175 completo del control de la respiración, que se manifiesta por una respuesta ventilatoria a la hipoxemia poco eficaz, por la inhibición de la respiración por estimulación de los receptores vagales de la vía aérea de conducción. Cuando se provoca la estimulación de los receptores laríngeos con soluciones noisotónicas, la respuesta es la inhibición de la respiración, respuesta que expresa la inmadurez del sistema nervioso central, consistente en un menor desarrollo neural y mielínico. Presenta apneas el 25% de los prematuros en total y la frecuencia disminuye proporcionalmente al aumento de la maduración del feto. El 7% de los RN entre 34-35 semanas de gestación (SG) tiene apneas, el 14% de los RN de 32-33 SG, 5% de 30-31 SG y aproximadamente todos los RN de menos de 28 SG. Las apneas persistentes contribuyen a prolongar la hospitalización de muchos prematuros. Las apneas son excepcionales en el RN a término y siempre son de causa patológica. En prematuros (que se definen como RN de edad gestacional inferior a 37 semanas) es frecuente observar apneas breves (de 5 a 10 segundos) en sueño REM y se consideran fisiológicas. La apnea se considera patológica si la duración es igual o superior a 20 segundos, o si es menor de 20 segundos y se asocia a cianosis, palidez o bradicardia(11). La mayoría de las apneas del prematuro son centrales o mixtas. Estas últimas tienen un componente obstructivo y un componente central (la obstrucción de la vía aérea con esfuerzo inspiratorio, precede a Libro II curso 31/1/05 17:26 P gina 176 176 la apnea central.). En un estudio realizado sobre 2.082 episodios de apneas en 47 neonatos, el 40% de los episodios se clasificó como apneas centrales, el 50% fué mixto y el 11% se catalogó de apneas obstructivas(12). Las apneas del prematuro se presentan en los dos primeros días de vida en los prematuros en ventilación espontánea, sin apoyo respiratorio. En los neonatos asistidos con CPAP o con ventilación mecánica, las apneas pueden no constatarse hasta retirar el apoyo ventilatorio. La pausa respiratoria se acompaña, fundamentalmente, de bradicardia y de cianosis(13). Las apneas después de la primera semana de vida en RN que no han estado con apoyo respiratorio, o que recurren después de 1-2 semanas sin apneas, se asocian a enfermedades graves del neonato, como son sepsis y enterocolitis necrotizante. Cuando esto ocurre, hay que evaluar los factores precipitantes de estos procesos. Las apneas no se presentan después de 37 semanas de EG corregida para los RN de EG superior a 28 semanas. En cambio, en el caso de los RN de EG inferior a 28 semanas, las apneas pueden persistir después de 40 semanas de EG corregida(14). Las apneas del prematuro, consecuencia de la inmadurez del SNC, deben diferenciarse de las apneas asociadas a diversos procesos patológicos, es decir, secundarias a la hipoxemia, infecciones, metabolopatías, inestabilidad térmica, hemorragia intracraneal, etc. La evaluación diferencial de las apneas primarias y secundarias del prematuro incluyen la determinación de la tempe- E. G. Pérez-Yarza, et al. ratura y oxigenación, hemograma, hemocultivo y líquido cefalorraquídeo (LCR) (si la sospecha es infección), glucemia, calcemia y nivel de metilxantinas, si está bajo este tratamiento. La frecuente asociación de apneas y hemorragia intracraneal, obliga a realizar estudios de imagen en esta patología. El tratamiento de las apneas del prematuro debe instaurarse cuando las apneas son frecuentes, prolongadas y/o se asocian a bradicardia o hipoxemia. Deben instaurarse las medidas generales dirigidas a evitar los factores desencadenantes de las mismas (servocontrol térmico óptimo, posición adecuada, fosas nasales permeables, oxigenoterapia, si precisa). Si las medidas generales no son suficientes, hay que instaurar medidas específicas, como son la CPAP nasal y los derivados metilxantínicos (cafeína, teofilina). La CPAP nasal disminuye la incidencia de apneas obstructivas y de apneas mixtas en RN pretérminos(15), al mantener distendida la vía aérea superior (faringe) evitando el colapso de la misma, con independencia de mejorar la oxigenación al estabilizar la ratio ventilación/perfusión(16) y evitar los efectos negativos del reflejo de Hering-Brauer(17). Se recomienda establecer niveles iniciales de CPAP nasal de 4-6 cm de H2O con flujos de 4-5 L/min. Los niveles de CPAP nasal se van aumentando progresivamente hasta lograr mantener controladas las apneas, sin sobrepasar niveles de 10-12 cm de H2O, todo ello dependiendo del tipo de cánulas nasales y del sistema de administración de CPAP nasal disponible. Libro II curso 31/1/05 17:26 P gina 177 Trastornos respiratorios relacionados con el sueño en el lactante La CPAP nasal es muy útil en prematuros extremos, donde el colapso faríngeo es más habitual, sobre todo, antes de las 32-34 semanas de edad gestacional corregida. Deben evitarse los cambios frecuentes de cánulas y las aspiraciones nasales a través de las mismas, para evitar la irritación local. Algunos casos desarrollan intolerancia alimentaria secundaria a acúmulo de gas en el aparato digestivo. El tratamiento farmacológico de las apneas del prematuro con metilxantinas (cafeína, teofilina) es muy habitual y de uso universal. Una revisión sistemática de intervención de metilxantinas frente a placebo, muestra que la intervención activa reduce la frecuencia de la apnea (riesgo relativo de fracaso de tratamiento 0,43) y la necesidad de ventilación asistida (riesgo relativo 0,34)(18). Otra revisión sistemática que compara la eficacia entre cafeína y teofilina, concluye que la reducción de la apnea y de la bradicardia en la primera semana, fue similar para ambas intervenciones terapéuticas(19). El mecanismo de acción de los derivados metilxantínicos es poco conocido. Pueden actuar aumentando la respuesta ventilatoria al CO 2, facilitando la contracción del diafragma, mejorando el tono de la musculatura faríngea y disminuyendo la duración de la fase de sueño REM. Los efectos secundarios incluyen intolerancia alimentaria y taquicardia, más intensos con teofilina que con cafeína, además de poliuria y aumento de la eliminación renal de calcio, que se presenta igual con ambos fármacos. La 177 teofilina facilita el reflujo gastroesofágico. La cafeína aumenta el metabolismo basal y el consumo de oxígeno, lo que puede representar una menor ganancia de peso. La cafeína tiene ventaja sobre la teofilina. Su vida media larga (65-100 horas) permite una única administración por día y el índice terapéutico amplio minimiza los efectos secundarios. Se recomienda la administración en forma de citrato de cafeína, con una dosis de choque endovenosa de 20 mg/kg (equivalente a 10 mg/kg de cafeína base) seguida de una dosis de mantenimiento a las 24 horas de 5-8 mg/kg al día, en dosis única (equivalente a 2,5-4 mg/kg de cafeína base) por vía endovenosa u oral. Si persisten las apneas, puede administrarse una dosis adicional de choque (10 mg/kg) y aumentar la dosis de mantenimiento al 20%. Los niveles terapéuticos de eficacia son muy amplios, 5-25 µg/ml, motivo por lo que no se precisa su monitorización rutinaria, excepto si existe disfunción hepática, apneas persistentes o signos de toxicidad. Es necesario continuar el tratamiento hasta alcanzar las 34-36 semanas de edad postmenstrual con 5 días como mínimo sin apneas. Se precisa continuar la monitorización hasta dos semanas después de suspender el tratamiento (ya que la cafeína puede actuar hasta 7 días después de haber suspendido) siempre que hallan trascurrido 5-7 días sin apneas. La teofilina se utiliza cuando se requiere un efecto sostenido menor para el tratamiento de las apneas del prematuro. La dosis de choque de 4-6 mg/kg endovenosa Libro II curso 31/1/05 17:26 P gina 178 178 en 30 minutos o por vía oral, seguida de dosis de mantenimiento de 1,5-3 mg/kg por dosis, oral o endovenosa lenta, cada 8-12 horas. La vida media de la teofilina es de 13-58 horas. Su metabolismo y el aclaramiento cambian según la edad postmenstrual, motivo que explica la necesidad de monitorización en suero (rango terapéutico 8-12 µg/L), si persisten las apneas, si se detectan efectos secundarios y/o una vez por semana cuando se ha alcanzado el rango terapéutico. El doxapram es un fármaco que no se recomienda en la terapia de las apneas del prematuro, ya que asocia numerosos efectos secundarios, tales como irritabilidad, convulsiones e hipertensión sistémica, además de requerir administración exclusivamente por vía endovenosa(20). La frecuencia y la severidad de la apnea se asocian en ocasiones a anemia, aunque los resultados de los estudios son a veces contradictorios(21). En este sentido, se recomienda trasfundir concentrado de hematíes cuando el hematocrito es inferior al 25% y las apneas son frecuentes e intensas, a pesar del tratamiento con metilxantinas en rangos séricos correctos. En resumen, las apneas primarias del prematuro están ligadas a la inmadurez de los sistemas que regulan la respiración. Precisan monitorización todos los RN de EG inferior a 37 semanas. La monitorización convencional ha sido la FC y saturación transcutánea de oxígeno hasta las 36 semanas de edad postmenstrual, siempre que no hayan tenido apneas en los 7 días anteriores. La monitorización más adecuada se expone al final de este capítulo. E. G. Pérez-Yarza, et al. Episodios de aparente riesgo vital Episodio de aparente riesgo vital (ALTE) es un término que se aplica para describir un cambio agudo e inesperado en la respiración de un lactante, que asusta sobre manera al adulto que lo observa (padres, cuidadores, etc.), y que incluye alguna combinación de los siguientes hallazgos(22). - Apnea, la mayoría de las veces sin esfuerzo respiratorio (apnea central) y en ocasiones con dificultad (apnea obstructiva). - Cambio de color, la mayoría de las veces cianosis o palidez; en ocasiones eritematoso. - Marcado cambio en el tono muscular (hipotonía aunque en ocasiones hipertonía). - Atragantamiento o sofocación. En algunos casos el observador cree que el niño ha fallecido. La recuperación del patrón respiratorio normal sólo se produce tras estimulación enérgica o tras maniobras de resucitación. Cualquier suceso similar a ALTE que normalice la respiración con maniobras menores, no debe incluirse en este grupo. El término ALTE se remonta a 198612 y vino a reemplazar otros términos, tales como muerte súbita frustrada del lactante, lo que implicaba una asociación directa entre ALTE y síndrome de muerte súbita del lactante. El diagnóstico de ALTE puede ser equívoco, ya que la definición de caso depende del observador y éste fundamentalmente es una persona sin experiencia(23). La incidencia de ALTE varía entre el 0,05 y el 1%(24,25). Libro II curso 31/1/05 17:26 P gina 179 Trastornos respiratorios relacionados con el sueño en el lactante La etiología de los ALTE es múltiple(26). En más de la mitad de los casos (62%) puede identificarse la causa, destacando los problemas neurológicos, el reflujo gastroesofágico y las infecciones; la patología cardíaca, la obstrucción de la vía aérea superior y las metabolopatías, tienen una incidencia muy baja. Cuando se constata una historia de ALTE recurrentes en el mismo lactante, deben ponerse en marcha los mecanismos diagnósticos diferenciales con las apneas intencionales y de los traumatismos craneales no intencionales (maltrato)(27). En el caso de los ALTE idiopáticos (38%), es más frecuente que hayan precisado estimulación o resucitación más vigorosas (39%) que en los ALTE secundarios(28). Los ALTE idiopáticos tienen un notable incremento de apneas en comparación con los controles de su misma edad, con buena respuesta ventilatoria y arousal a la hipoxia, correcta respuesta a la hipercapnia, respuestas evocadas auditivas con picos y latencias normales y ausencia de alteraciones en el ritmo cardíaco. A pesar de los numerosos esfuerzos investigadores llevados a cabo y de haberse establecido diferencias cardiorrespiratorias, autonómicas y neurofisiológicas en el ALTE como grupo, no existen marcadores individuales frente a controles o marcadores premortem frente a SMSL(29). Los lactantes con ALTE representan un grupo extremadamente heterogéneo de edad variable y de fisiopatologías diversas, lo que traduce un manejo extremadamente individualizado de cada caso. Cuando se estudia la relación entre ALTE y SMSL, la con- 179 clusión es que no hay relación causal entre ambas entidades: - En la mayoría de casos de SMSL no hay antecedente de ALTE. - El ALTE es un grupo heterogéneo con una escala de gravedad muy amplia (desde leve a casi fatal), mientras el SMSL conlleva siempre éxitus. - En el ALTE, la definición de caso depende de la observación de los padres o de los cuidadores, lo que conlleva a error en numerosas ocasiones(30). - El 80% de los casos de SMSL ocurren entre las 0 y las 6 horas, mientras que el 82% de los ALTE entre las 8 y las 20 horas(31). Sin embargo, es posible que exista una relación entre ALTE, SMSL y el SAOS, como se observa la presencia de estos cuadros en individuos diferentes de la misma familia, bien porque el fenotipo que exprese una vía respiratoria superior más estrecha(32), bien porque genotipos diversos expresen anomalías en el control de la respiración (Krox-20, un factor de transcripción que participa en la maduración del tronco del encéfalo, locus 10q21.1-q22.1)(33,34) y anomalías en la respuesta ventilatoria a la hipercapnia a través de la vía colinérgica muscarínica del tronco del encéfalo, reguladas por el protooncogén Ret (rearranged during transfection factor, locus 10q11.2)(35,36) y el Mash-1 (mammalian achaetescute homolog-1)(37). El Mash-1 se expresa en las neuronas del locus coeruleus del tronco del encéfalo, área que regula la respuesta arousal. Además, Mash-1 asienta en el cromosoma X, lo que explicaría el mayor riesgo de ALTE y SMSL en varones. Libro II curso 31/1/05 17:26 P gina 180 180 Todos estos fenómenos requieren investigaciones en grupos familiares multigeneracionales, para establecer exactamente la relación entre los diversos trastornos respiratorios relacionados con el sueño, sobre la base de que existen alteraciones en el control de la ventilación en estudios de agregación familiar de TRS, ALTE y SMSL, junto con modificaciones maxilomandibulares craneofaciales que dan lugar a una vía aérea superior de menor diámetro, donde los sujetos asintomáticos lo serían por su capacidad de mantener permeable la VAS durante el sueño(38). La mayoría de los episodios de ALTE requieren ingreso hospitalario, para observación y monitorización de las constantes vitales (FC, FR, TA), incluyendo saturación transcutánea de oxígeno (StcO2). La exploración debe incluir el peso, talla y perímetro craneal, las constantes vitales, la valoración del desarrollo, la evaluación de la posible obstrucción de la vía aérea superior, incluyendo la dismorfia facial(39) y un exhaustivo examen del fondo de ojo(40). Hay que realizar las pruebas diagnósticas básicas (bioquímica general, magnesio, equilibrio ácido-base, radiografía de tórax, ECG, EEG), además de pH-metría de 24 horas. En los casos de ALTE idiopático debe realizarse una polisomnografía(41), que incluya estadiaje del sueño, esfuerzo torácico y abdominal, ECG, StcO2, análisis del flujo aéreo por termistancia y capnografía y monitorización del pH esofágico. Las recomendaciones generales para el manejo de un lactante que ha tenido un ALTE, incluye la enseñanza de una RCP básica y las recomendaciones de la posi- E. G. Pérez-Yarza, et al. ción en la cuna en decúbito supino, evitar el exceso de ropa y las temperaturas, extremas, así como la exposición prenatal y postnatal al humo del tabaco. La decisión de monitorización domiciliaria(42) debe basarse en la posibilidad de recurrir los ALTE y en la gravedad del episodio. Se necesita monitorizar FC, TR y StcO2, y almacenar en memoria dichas variables para realizar el análisis subsiguiente de las mismas. El riesgo de que un episodio de ALTE desarrolle después un SMSL es inferior al 1%(43), pero la heterogeneidad del proceso causal del ALTE hace que esta estimación no sea de utilidad clínica. Algunos subgrupos de ALTE, como los ALTE recurrentes que requieren RCP, tienen un riesgo de SMSL de 10-30%(44). En este subgrupo debe insistirse en el diagnóstico de enfermedades poco frecuentes (metabólicas, neurodegenerativas) o en la intencionalidad del cuadro clínico (maltrato). La evolución de los ALTE es excelente y no existe ninguna diferencia en la maduración y en el desarrollo a los 10 años, cuando se compara con la población general(45). En resumen, los ALTE no son una entidad diagnóstica específica, sino una grupo amplio se síntomas que describen un episodio muy alarmante para el observador en relación a la respiración, al color y al estado de salud del lactante. Deben realizarse todos los esfuerzos necesarios para identificar la causa y establecer el tratamiento adecuado. Cuando el episodio es grave o recurrente, deben indicarse todas las exploraciones necesarias para estable- Libro II curso 31/1/05 17:26 P gina 181 181 Trastornos respiratorios relacionados con el sueño en el lactante cer un diagnóstico correcto, incluida la polisomnografía, como se describe al final del capítulo. Síndrome de muerte súbita del lactante El SMSL se define como la muerte súbita de un lactante menor de un año de edad, no explicable tras la investigación exhaustiva del caso, incluyendo necropsia completa, examen del lugar del suceso y revisión de la historia clínica(46). Esta definición no incluye el concepto histórico de “éxitus no explicable por la historia clínica”, lo cual significa que los casos de SMSL pueden no tener un perfecto estado de salud previo. En este sentido, cumpliendo con la definición de caso, los hallazgos postmortem llegan a identificar la causa del éxitus en un 15% de SMSL(47), procesos patológicos muy diversos que se exponen en la tabla 3, destacando las cardiopatías congénitas estructurales o no, que constituyen el 10% de la revisión retrospectiva de Montreal sobre muerte súbita en niños entre siete días y dos años(48). Por definición de SMSL, no tiene que haber hallazgos necrópsicos que expliquen el éxitus, aunque sí hay otros hallazgos que con frecuencia se observan en los estudios anatomopatológicos cuando se efectúan estudios cualitativos: retraso madurativo del SNC, leucomalacia subcortical y periventricular, gliosis del tronco del encéfalo, peso cerebral aumentado, modificaciones en la densidad de las espinas dendríticas y anomalías en el núcleo arcuato. Este núcleo, situado en la región ventral del tronco del encéfalo, participa en TABLA 3. Patología que puede expresarse como SMSL. Generales Sepsis Asfixia (accidental o provocada) Descompensación metabólica Hipertermia Procesos hematológicos Anemia de células falciformes Procesos cardiológicos Fibroelastosis subendocárdica Cardiopatías congénitas (especialmente estenosis aórtica) Aparato respiratorio Neumonía Bronquiolitis Hipertensión pulmonar idiopática Traqueobronquitis grave Procesos renales Intoxicaciones Pielonefritis Aparato digestivo Eneterocolitis (Salmonella, Shigella o E. coli enteropatógeno) Hígado Hepatitis Intoxicaciones Cambios grasos por errores innatos del metabolismo Páncreas Pancreatitis Intoxicación por ácido bórico Fibrosis quística Suprarrenales Hiperplasia adrenogenital congénita SNC Encefalitis Traumatismos (fractura, edema cerebral, hemorragia subdural) Esqueleto Fracturas Libro II curso 31/1/05 17:26 P gina 182 182 las respuestas presoras vasculares y ventilatorias a la hipoxia y a la hipercapnia. La densidad de los receptores cainados y muscarínicos está disminuida en los casos de SMSL, y su capacidad de respuesta también está disminuida en más del 50% de los casos de SMSL, cuando se comparan con controles(49). Estudios más recientes han mostrado que hay anomalías en las neuronas serotoninérgicas(50) que, localizadas junto a las grandes arteriales cerebrales, son las responsable de la respuesta de hiperventilación frente a la hipercapnia. Estos hallazgos sugieren que el SMSL se debe a un retraso madurativo o una anomalía del tronco del encéfalo, que afecta a la neurorregulación del sistema cardiorrespiratorio, que se expresa como alteraciones cardíacas, respiratorias y/o del sueño. Esta hipótesis se apoya en hallazgos observacionales que muestran que hay factores de riesgo ambientales prenatales y maternos(51), así como anomalías cardíacas, respiratorias, del patrón arousal(52), junto con apneas obstructivas con diferente respuesta del SNA(53) en los lactantes que después presentan SMSL, en comparación con los controles sanos. Así mismo, la mayor incidencia de SMSL está en el grupo de edad 2-4 meses, período de cambios importantes en el desarrollo de los patrones cardíacos, respiratorios y sueño-vigilia en el lactante; la coincidencia de este período del desarrollo con el pico mayor de SMSL sugiere la vulnerabilidad para la muerte súbita en el período crítico de maduración del sistema nervioso autónomo(54). La incidencia es variable dependiendo de los países y según los años (0,4-6,3/1.000 E. G. Pérez-Yarza, et al. recién nacidos). La distribución del SMSL tiene unas características peculiares: excepcional en el período neonatal, se incrementa a partir del 2º mes, alcanza el pico máximo a los 3-4 meses y desciende gradualmente. El 75% tiene lugar entre 2 y 4 meses, y el 90% son menores de 6 meses. Hay un predominio estacional: el 95% suceden entre los meses de octubre y abril. Los casos se acumulan en los fines de semana y durante los períodos vacacionales. La relación con las horas es variable, predominando durante la noche (dos de cada 3 casos)(55). Uno de los factores de riesgo mayores para desarrollar SMS es la posición en la cuna en decúbito prono(56). Esta posición en la cuna se relaciona con el desarrollo de hipercapnia, como resultado de rebreathing CO2 espirado, y con la hipoxemia por mecanismos de obstrucción vascular a nivel cervical, aunque los mecanismos patogénicos no están claros. Las campañas institucionales nacionales e internacionales llevadas a cabo para que los lactantes no duerman en decúbito prono, han logrado disminuir la incidencia de SMSL en un 50-70%, sin aumentar las tasas de mortalidad postnatal(57). Además, la posición en supino en la cuna se ha mostrado más saludable la posición en prono, en estudios longitudinales de medidas repetidas a 1, 3 y 6 meses de edad(58). Corregida la posición al dormir, cuestión todavía pendiente en numerosas áreas poblacionales(59) y en RN pretérminos donde en algunas maternidades persisten en recomendar al alta la posición en la cuna en prono(60), los dos factores maternos que se consideran de riesgo mayor, con Libro II curso 31/1/05 17:26 P gina 183 Trastornos respiratorios relacionados con el sueño en el lactante independencia del peso del neonato, y que incrementan el riesgo entre 2 y 4 veces(61,62), son el tabaquismo materno y la edad de la madre inferior a 20 años. El tabaquismo materno durante la gestación incrementa la incidencia en SMSL (OR 4,11; IC95% 2,72-6,21) y, sobre todo, se considera en la actualidad el factor más importante susceptible de intervención(63). El incremento en la incidencia del SMSL es dosisdependiente, fundamentalmente en los casos de presentación precoz (menos de 67 días de vida). El riesgo se dobla si el padre también fuma. El tabaquismo se asocia a SMSL por mecanismos diversos, tales como hipoxia fetal, inhibición del crecimiento y desarrollo de la vía aérea e incremento de la susceptibilidad a las infecciones virales. Se conoce que la nicotina activa los receptores nicotínicos colinérgicos (nAChRs), interfiriendo el control colinérgico de la respiración y los arousal(64). Otros factores de riesgo ligados a la madre incluyen el consumo de drogas, por el efecto biológico de la droga sobre el feto, por el incremento de la prematuridad, bajo peso neonatal, o por la asociación a otros factores (socioeconómicos, ambientales o sociales), destacando, entre ellos, el consumo de alcohol periconcepcional [OR(a) 6,2; CI 95% 1,6-23,3] y durante el primer trimestre de la gestación [OR(a) 8,2; IC95% 1,9-35,3](65). Entre los factores de riesgo dependientes del neonato se han descrito, entre otros, la prematuridad, que incrementa el riesgo de SMSL 3-4 veces por encima de los RN a término(66), las apneas previas y la administración de la vacuna antidifteria-tétanos-tosferina (DTP). Se han descrito ap- 183 neas previas en el 5% de los casos de SMSL y en el 3% de la población control, lo que invalida la apnea previa como factor de riesgo(67). Así mismo, la vacuna DTP no tiene ninguna asociación con el SMSL(68). Recientemente, también se ha sugerido que los RN con niveles bajos de hemoglobina tipo adulto en las primeras horas de vida, tiene un riesgo elevado de SMSL, señalando que el retraso en la maduración para la producción de hemoglobina tipo adulto desempeñaría un papel patogénico en el SMSL(69). La lactancia materna disminuye la susceptibilidad frente a las infecciones en el lactante, motivo por el que la lactancia artificial se asocia con SMSL. El sobrecalentamiento por arropar en exceso [OR(a) 6,2; IC95% 1,4-26,5] se ha considerado también como un factor de riesgo para SMSL(64), sobre todo, si se asocia con el decúbito prono y con infecciones de la vía aérea. Otros autores tampoco han encontrado asociación entre SMSL y temperaturas extremadamente elevadas máximas y medias, en un período de estudio donde la mayoría de los lactantes dormían en prono(70). Otros factores también se relacionan con riesgo de SMSL: la polución atmosférica respecto a tasas elevadas de SO2 y NO2, que muestran una asociación muy estrecha con el SMSL, según el estudio de Dales et al(71) de muy reciente publicación. El llamado efecto “fin de semana”, que persiste en los estudios realizados antes y después de la intervención sobre la postura en prono, como ha comunicado Mooney et al(72), insistiendo en la necesidad de incidir en el apoyo a las familias de riesgo. Libro II curso 31/1/05 17:26 P gina 184 184 También determinadas infecciones respiratorias pueden actuar como factores asociados primarios o asociados a otros factores, destacando entre ellos la infección por Bordetella pertussis, detectando su presencia entre 5-18% de los casos donde se ha investigado(73). La distribución estacional de las enfermedades de la vía aérea superior (virus y Bordetella pertussis) coincide con la distribución estacional del SMSL. Los agrupamientos temporales del SMSL y los períodos largos silentes, apoyarían esta hipótesis. La deprivación de sueño, que puede suceder por factores externos ajenos al lactante o fragmentación del sueño por causas digestivas, fiebre o por obstrucción de la vía aérea superior, da lugar a apneas obstructivas del sueño y a un significativo aumento del umbral para los arousals. Dicha deprivación del sueño también afecta a los mecanismos de control de la respiración, modificando la respuesta ventilatoria y arousal a los estímulos químicos y disminuyendo la actividad electromiográfica del músculo geniogloso durante el sueño en fase REM. Todos estos cambios en los mecanismos de control respiratorios contribuyen al desarrollo de apneas obstructivas durante el sueño(74). El riesgo de SMSL en un hermano de una víctima se multiplica por 5: si asumimos una incidencia de 1,5/1.000 RN vivos (0,15%), el riesgo para hermanos sucesivos es inferior a 1%(75). En gemelos, el riesgo de SMSL en el superviviente, también es inferior al 1%(76). Esta falta de concordancia parece indicar que no se trata de una enfermedad genética primaria(77). E. G. Pérez-Yarza, et al. Sin embargo, los factores medioambientales, biológicos y/o epidemiológicos, explican sólo en parte la epidemiología del SMSL. En los casos de SMSL se han descrito alteraciones en los sistemas noradrenérgicos, dopaminérgicos, serotoninérgicos, colinérgicos e histaminérgicos relacionados con la respuesta al estrés durante el sueño. La serotonina (5HT) ejerce una acción excitatoria en los núcleos ventrolaterales, que regulan la respiración, sistema cardiovascular, la temperatura y el ciclo vigilia-sueño. El transportador de serotonina (5-HTT, locus 17q11.1-q12) controla la recaptación de 5HT en el espacio extracelular, la duración y grado de interacción con su receptor y contribuye al desarrollo postnatal de la plasticidad neuronal del sistema dependiente de la 5HT. En la actualidad, hay evidencia en el SMSL de polimorfismos genéticos que dan lugar a disfunciones del SNA, en los genes Phox2a (paired-like homeobox gene), Ret (rearranged during transfection factor locus 10q11.2), Ece1 (endothelin converting enzyme-1 gene, locus 1p36.1), Tlx3 (T-cell leukemia homeobox gene, locus 5q35.1) y En1 (engrailed-1 gene, locus 2q13-q21), genes que actúan sobre el desarrollo embriológico del sistema nervioso autónomo(78-81). La sobreexpresión del gen que regula los canales SK, en la subunidad SK3, disminuye la respuesta neuronal a la hipoxia, fenómeno que no sucede cuando los canales SK3 son bajos(82). Además, de forma progresiva se van incrementando los genes relacionados con el SMSL. Algunos de los polimorfismos se Libro II curso 31/1/05 17:26 P gina 185 Trastornos respiratorios relacionados con el sueño en el lactante identifican en la región promotora de la proteína transportadora de la serotonina (5-HTT) (locus 17q11.2), que afectan a la captación y regulación transmembrana de la serotonina. Existe un polimorfismo de la secuencia de alelos VTNR en el intrón 2 (haplotipo 12/12) y otro en la región promotora del gen 5-HTT (short, long y XL alleles clasificados en función del número de repeticiones). El genotipo L/L y XL parece aumentar la expresión de 5-HTT, que aumenta la recaptación de 5HT en el espacio extracelular con disminución de los niveles de 5HT en sangre y de la unión con su receptor en los núcleos del rafe, núcleo arcuato y otras regiones medulares dependientes de 5HT. También se ha observado una asociación positiva entre el genotipo L/L, el haplotipo 12/12 y el desarrollo de SMSL, mientras que el genotipo S/S se relaciona con patología psiquiátrica diversa. Estos hallazgos parecen explicar la variabilidad étnica que existe en el SMSL, mayor incidencia en afroamericanos (mayor expresión de L-12) respecto a caucasianos(83-85). Además, la subunidad β2 del gen que regula el receptor nicotínico de acetilcolina (nAChRs), contribuye a la organización del sueño regulando el inicio, la duración de la fase REM y la respuesta ante el estrés (arousals). La exposición prenatal a la nicotina parece reducir la respuesta ante la hipoxia por sobreestimulación de receptores β2 nAChRs, favoreciendo de esta manera la disminución del ritmo respiratorio(86). En los últimos años se describen nuevos genes asociados a la muerte súbita(87), como son un defecto en el gen KChIP2 (lo- 185 cus 10q24)(88), que da lugar a una disminución de la actividad del canal de potasio I (to) que conduce a la disminución del gradiente transmural, lo que produce una marcada susceptibilidad para las arritmias (taquicardia ventricular), y 5 polimorfismos del gen del canal del sodio (SCN5A, locus 3p21)(89). Además, otros polimorfismos genéticos asociados a la oxidación de los ácidos grasos se han relacionado también con el SMSL(90). Otra asociación comunicada es un polimorfismo del gen IL-10 (interleucina antiinflamatoria, locus 1q31-q32): el alelo IL10-592*A está presente en el 70% de los casos estudiados por Summers et al(91), lo que condicionaría una respuesta antiinflamatoria menor, hipoinmune, que explicaría la hipótesis tóxica o infecciosa del SMSL. Por último, hace unos meses se ha localizado e identificado la alteración genética del síndrome de muerte súbita con disgenesia testicular (SIDDT) en el locus 6q22.1-q22.31(92), que da lugar a un trastorno en la diferenciación sexual y en el desarrollo del tronco cerebral, que conlleva muerte súbita precoz. Todo ello converge en considerar al SMSL como la expresión de diversos factores medioambientales sobre una base genética compleja, y que los factores de riesgo independientes son la posición en la cuna en prono, el tabaquismo materno durante la gestación y una respuesta anormal en arousals y en hiperventilación a la hipoxemia y a la hipercapnia. Expresión todo ello de una disfunción del SNA, confirmado en los hallazgos anatomopatológi- Libro II curso 31/1/05 17:26 P gina 186 186 E. G. Pérez-Yarza, et al. cos postmortem y en los estudios epidemiológicos de los lactantes con SMSL, en los estudios fisiológicos parentales, en lactantes asintomáticos y en lactantes afectos de ALTE(93). Por el contrario, no parece existir asociación familiar entre SAOS y SMSL, como ha comunicado Vennelle et al(94), aunque sí se observan desaturaciones durante el sueño en los padres de SMSL que requieren posteriores estudios. El manejo del SMSL por parte de los profesionales incluye, como en cualquier otro caso de muerte de un lactante, una respuesta compasiva, empática, de apoyo y no acusatoria. Al mismo tiempo, es esencial descubrir la causa de la muerte, si es posible. El personal que actúa en primer lugar debe estar entrenado para reconocer determinados elementos en la escena muy importantes, como son la posición del lactante, marcas o señales en el cuerpo, temperatura corporal y rigor mortis, tipo de cuna/cama, tipo y características de la ropa de cama, temperatura de la habitación, tipo de ventilación y de calor, así como las reacciones físicas y emocionales de los padres, cuidadores, etc. Es necesario hacer comprender a los padres que, en ausencia de datos que hagan sospechar de maltrato, es preciso proseguir el estudio (necropsia) para avanzar en el diagnóstico y confirmar o excluir el SMSL. Por último, para indicar la monitorización a los hermanos o familiares de un caso de SMSL, no hay datos suficientes para elaborar una rutina adecuada(95). Sin embargo, ante apneas del prematuro persistentes, casos de ALTE idiopáticos que hayan precisado reanimación y hermanos de éxitus por SMSL, hay indicación absoluta de realizar (antes del alta hospitalaria, en los dos primeros) un estudio polisomnográfico, que incluya los siguientes registros(96): EEG (C4-A1; C3-A2; O2-A1; O1-A2), termistancia oral-nasal, EMG (mentón), actividad, EOG (electroóculogramas derecho e izquierdo), PETCO2 (presión parcial de anhídrido carbónico espiratoria final) incluyendo capnograma, movimientos torácicos y abdominales por pletismografía de inductacia, saturación trascutánea de oxígeno, onda de pulso, frecuencia cardíaca y ECG. Si del resultado del estudio polisomnográfico se deriva indicación de monitorización domiciliaria para detectar apneas del sueño, el monitor debe ser un equipo multicanal con memoria de registro y alarmas en audio que incluya, como mínimo, flujo nasal, PETCO2, FC y FR, además del conocimiento estructurado y supervisado por parte de los padres / cuidadores de las maniobras básicas de reanimación cardiopulmonar. BIBLIOGRAFÍA 1. Kiely JL, McNcholas WT. Overview and historical aspects of breathing disorders during sleep. Eur Respir Monogr 1998; 10:1-8. 2. Weese-Mayer DE, Berry-Kravis EM, Zhou L, Maher BS, Silvestri JM, Curran ME, et al. Idiopatic congenital central hypoventila- Libro II curso 31/1/05 17:26 P gina 187 Trastornos respiratorios relacionados con el sueño en el lactante tion syndrome: analysis of genes pertinent to early autonomic nervous system embryologic development and identification of mutations in PHOX2b. Am J Med Genet 2003; 123A:267-78. 3. Adachi M, Browne D, Lewis EJ. Paired-like homeodomain proteins Phox2a/Arix and Phox2b/NBPhox have similar genetic organization and independently regulate dopamine beta-hydroxylase gene transcription. DNA Cell Biol 2000; 19:539-54. 4. Kijima K, Sasaki A, Niki T, Umetsu K, Osawa M, Matoba R, et al. Sudden infant death syndrome is not associated with the mutation of PHOX2B gene, a major causative gene of congenital central hypoventilation syndrome. Tohoku J Exp Med 2004; 203: 65-8. 5. López-Herce J, Rupérez Lucas M, García Sanz C, García Sánchez E. Fisiología de la respiración. En: Tratado de Neumología Infantil, Cobos N, Pérez-Yarza EG. Madrid: (eds.). Ergon, 2003; p. 73-86. 6. Viemari JC, Bévengut M, Burnet H, Coulon P, Pequignot JM, Tiveron MC, et al. Phox2a gene, A6 neurons, and noradrenaline are essential for development of normal respiratory rhythm in mice. J Neurosci 2004; 24: 928-37. 7. Durán Cantolla J, Rubio Aramendi R. El sueño y la respiración en las edades extremas: lo normal y lo anormal. En: Trastornos respiratorios del sueño. Monografía NeumoMadrid. Madrid: (eds.) Ergon, 2004; p. 189211. 8. Marcus CL. Sleep-disordered breathing in children. Am J Respir Crit Care Med 2001; 164:16-30. 9. Feroah TR, Forster HV, Pan L, Wenninger J, Martino P, Rice T. Effect of slow wave and REM sleep on thyropharyngeus and stylopharyngeus activity during induced central apneas. Respir Physiol 2001; 124:129-40. 10. Kato I, Franco P, Groswasser J, Scaillet S, Kelmanson I, Togari H, et al. Incomplete arou- 187 sal processes in infants who were victims of sudden death. Am J Respir Crit Care Med 2003; 168:1298-303. 11. National Institutes of Health Consensus Development Conference on Infantile Apneas and Home Monitoring, Sept 29 to Oct 1, 1986. Pediatrics 1987; 79:292-9. 12. Finer NN, Barrington KJ, Hayes BJ, Hugh A. Obstructive, mixed, and central apnea in the neonate: physiologic correlates. J Pediatr 1992; 121:943-50. 13. Adams JM Jr. Clinical features and management of apnea of prematurity. En: UpToDate (database).Version 12.2. Wellesley (MA): UptoDate, 2004 (cited 2004 sept 24). 14. Eichenwald EC, Aina A, Stark AR. Apnea frequently persists beyond term gestation in infants delivered at 24 to 28 weeks. Pediatrics 1997; 100:354-9. 15. Miller MJ, Carlo WA, Martín RJ. Continuous positive airway pressure selectively reduces obstructive apnea in preterm infants. J Pediatr 1985; 106:91-4. 16.Durand M, McCann E, Brady JP. Effect of continuous positive airway pressure on the ventilatory response to CO2 in preterm infants. Pediatrics 1983; 71:634-8. 17. Martín RJ, Nearman HS, Katona PG, Klaus MH. The effect of a low continuous positive airway pressure on the reflex control of respiration in the preterm infant. J Pediatr 1977; 90:976-81. 18. Henderson-Smart DJ, Steer P. Methylxanthine treatment for apnea in preterm infants. Cochrane Database Syst Rev 2001:CD00 0140. 19. Steer PA, Henderson-Smart DJ. Caffeine versus theophylline for apnea in preterm infants. Cochrane Database Syst Rev 2000: CD000273. 20. Henderson-Smart DJ, Steer P. Doxapram versus methylxanthine for apnea in preterm infants. Cochrane Database Syst Rev 2000: CD000075. Libro II curso 31/1/05 17:26 P gina 188 188 21. Stute H, Greiner B, Linderkamp O. Effect of blood transfusion on apnea frequency in growing premature infants. Arch Dis Child Fetal Neonatal Ed 1995; 72:F194-6. 22. Rosen CL. Apparent life-threatening event in infants. En: UpToDate (database).Version 12.2. Wellesley (MA): UptoDate, 2004 (cited 2004 sept 24). 23. Krongrad E. Infants at high risk for suden infant death síndrome? Have they been identified? A commentary. Pediatrics 1991; 88:1274-8. 24. Wennergren G, Milerad J, Lagercrantz H, Karlberg P, Svenningsen NW, Sedin G, et al. The epidemiology of suden infant death síndrome and attachs of lifelessness in Sweden. Acta Paediatr Scand 1987; 76:898-906. 25. Sunkaran K, McKenna A, O´Donnell M, Ninan A, Kasian G, Skwarchuk J, et al. Apparent life-threatening prolonged infant apnea in Saskatchewan. West J Med 1989; 150: 293-5. 26. Gray C, Davies F, Molyneux E. Apparent lifethreating events presenting to a pediatric emergency department. Pediatr Emerg Care 1999; 15:195-9. 27. Altman RL, Brand DA, Forman S, Kutscher ML, Lowenthal DB, Franke KA, et al. Abusive head injury as a cause of apparent lifethreating events in infancy. Arch Pediatr Adolesc Med 2003; 157:1011-5. 28. Khan A, Rebuffat E, Franco P, N’Duwimana M, Blum D. Apparent life-threatening events and apnea of infancy. En: Respiratory control disorders in infants and children, Beckerman RC, Brouilltte RT, Hunt CE (eds). Baltimore: Williams&Wilkins, 1992; p. 178-89. 29. Brooks JG. Apparent life-threatening events and apnea of infancy. Clin Perinatol 1992; 19:809-38. 30. Cote A, Hum C, Brouillette RT, Themens M. Frequency and timing of recurrent events in infants using home cardiorespiratory monitors. J Pediatr 1998; 132:783-9. E. G. Pérez-Yarza, et al. 31. Kahn A, Groswasser J, Rebuffat E, Sottiaux M, Blum D, Foerster M, et al. Sleep and cardiorespiratory characteristics of infant victims of sudden death: a prospective case control study. Sleep 1992; 15:287- 92. 32. Guilleminault Ch, Pelayo R, Leger D, Philip P, Ohayon M. Sleep-disorders breathing and upper-airweay anomalies in firts-degree relatives of ALTE children. Pediatr Res 2001; 50:14-22. 33. Chavier P, Janssen-Timmen U, Mattei MG, Zerail M, Bravo R, Charney P. Structure, chromosome location, and expression of the mouse zinc finger gene Krox-2: multiple products and coregulation with the proto-oncogene c-fos. Mol Cell Biol 1989; 9:787-97. 34. Jacquin TD, Borday V, Schneider-Maunoury S, Topliko P, Ghilini G, et al. Reorganization of pontine rhythmogenic neuronal networks in Krox-20 knockout mice. Neuron 1996; 17:747-58. 35. Burton MD, Kawashima A, Brayer JA, Kazemi H, Shannon DC, Schuchardt A, et al. RET proto-oncogene is important for the development of respiratory CO2 sensitivity. J Auto Nerv System 1997; 63:137-43. 36. Cinti R, Schena F, Passalacqua M, Ceccherini I, Ravazzolo R. Replication pattern of the pericentromeric region of chromosoma 10q and expression of the RET protooncogene. Exp Cell Res 2004; 298:602-10. 37. Dauger S, Renolleau S, Vardon G, Nepote V, Mas C, Simonneau M, et al. Ventilatory responses to hypercapnea and hypoxia in Mash-1 heterozigous newborn and adult mice. Pediatr Res 1999; 46:535-42. 38. Hunt CE. Familial small upper airways and sleep-disordered breathing: relationship to idiopathic apparent-life-threatening events. Pediatr Res 2001;50: 3-5. 39. Guilleminault C, Pelayo R, Leger D, Philip P. Apparent life-threating events, facial dysmorphia and sleep-disorders breathing. Eur J Pediatr 2000; 159:444-9. 40. Pitetti RD, Maffei F, Chang K, Hickey R, Berger R, Pierce MC. Prevalence of retinal he- Libro II curso 31/1/05 17:26 P gina 189 Trastornos respiratorios relacionados con el sueño en el lactante morrhages and child abuse in children who present with apparent life-threating event. Pediatrics 2002; 110:557-62. 41. Kahn A.European Society for the Study and Prevention of Infant Death. Recommended clinical evaluation of infants with an apparent life-threating event. Consensus document of the European Society for the Study and Prevention of Infant Death 2003. Eur J Pediatr 2004; 163:108-15. 42. Committee on Fetus and Newborn. American Academy of Pediatrics. Apnea, sudden infant death síndrome, and home monitoring. Pediatrics 2003; 111:914-7. 43. Brooks JG. Apparent life-threatening events and apnea of infancy. Clin Perinatol 1992; 19:809-38. 44. Oren J, Kelly D, Shannon D. Identification of a high-risk group for sudden infant death syndrome among infants who were resuscitated for sleep apnea. Pediatrics 1986; 77:495-9. 45. Kahn A, Sottiaux M, Appelboom-Fondu J, Blum D, Rebuffat E, Levitt J. Long-term development of children monitored as infants for an apparent life-threating event during sleep: a 10-year follow-up study. Pediatrics 1989; 83:668-73. 46. American Academy of Pediatrics. AAP Task force on infant positioning and SIDS: positioning and SIDS. Pediatrics 1992; 89: 1120-6. 47. Valdés-Dapena M. The sudden infant death syndrome: patologic findings. Clin Perinatol 1992; 19:701-16. 48. Dancea A, Cote A, Rohlicek C, Bernard C, Oligny LL. Cardiac pathology in sudden unexpected infant death. J Pediatr 2002; 141:336-42. 49. Panigrahy A, Filiano JJ, Sleeper LA, Mandell F, Valdes-Dapena M, Krous HF, et al. Decreased kainate receptor binding in the arcuate nucleus of the sudden indant death syndrome. J Neuropathol Exp Neurol 1997; 56: 1253-61. 189 50. Bradley ER, Pieribone VA, Wang W, Severson ChA, Jacobs RA, Richerson GB. Chemosensitive serotoninergic neurons are closely associated with large medullary arteries. Nature Neuroscience 2002; 5:401-2. 51. Li DK, Wi S. Maternal placental abnormality and the risk of sudden infant death syndrome. Am J Epidemiol 1999; 149:608-11. 52. Schechtman VL, Lee MY, Wilson AJ, Harper RM. Dynamics of respiratory patterning in normal infants and infants who subsequently died of the sudden infant death syndrome. Pediatr Res 1996; 40:571-7. 53. Franco P, Szliwowski H, Dramaix M, Kahn A. Decreased autonomic responses to obstructive sep events in future victims of suden infant death síndrome. Pediatr Res 1999; 46:33-9. 54. Hunt CE. Sudden infant death syndrome. En: Respiratory control disorders in infants and children, Beckerman RC, Brouillette RT, Hunt CE (eds.). Baltimore: Williams&Wilkins, 1992. 55. Williams SM, Mitchell EA, Taylor BJ. Are risk factors for sudden infant death syndrome different at night? Arch Dis Child 2002; 87: 274-8. 56. Taylor JA, Krieger JW, Reay DT, Davis RL, Harruff R, Cheney LK. Prone sleep position and the sudden infant death syndrome in King County, Washington: a case-control study. J Pediatr 1996; 128:626-30. 57. Willinger M, Hoffman HJ, Wu KT, Hou JR, Kessler RC, Ward SL, et al. Factors associated with the transition to nonprone sleep position of infants in the United States. The National Infant Sleep Position Study. JAMA 1998; 280:329-35. 58. Hunt CE, Lesko SM, Vezina RM, McCoy R, Corwin MJ, Mandell F, et al. Infant sleep position and associated health outcomes. Arch Pediatr Adolesc Med 2003; 157:469-74 59. Hauck FR, Moore CM, Herman SM, Donovan M, Kalelkar M, Christoffel KK, et al. The contribution of prone sleeping position to Libro II curso 31/1/05 17:26 P gina 190 190 E. G. Pérez-Yarza, et al. the racial disparity in sudden infant death syndrome: the Chicago Infant Mortality Study. Pediatrics 2002; 110:772-80. me after immunization with the diphtheria-tetanus-pertussis vaccine. N Engl J Med 1988; 319:618-23. 60. Bhat RY, Greenough AA. Prematurity, sleeping position and sudden infant death syndrome. Curr Paediatr 2002;12: 431-4. 69. Richardson DB, Wing S, Lorey F, Hertz-Piccioto I. Adult hemoglobin levels at birth and risk of sudden infant death syndrome. Arch Pediatr Adolesc Med 2004; 158:366-71. 61. MacDorman MF, Cnattinjius S, Hoffman HJ, Kramer MS, Haglund B. Sudden infant death syndrome and smoking in the United States and Sweden. Am J Epidemiol 1997; 146:249-57. 62. Alm B, Milerad J, Wennergren G, Skjaerven R, Oyen N, Norvenius G, et al. A case-control stydy of smoking and sudden infant death syndrome in the Scandinavian countries, 1992 to 1995. The Nordic epidemiological SIDS study. Arch Dis Child 1998; 78: 329-34. 63. Chong DS, Yip PS, Karlberg J. Maternal smoking: an increasing unique risk factor for sudden infant death syndrome in Sweden. Acta Paediatr 2004; 93: 471-8. 64. Cohen G, Han Z-Y, Grailhe R, Gallego J, Gaultier C, Changeux J-P. b2 nicotinic acetylcholine receptor subunit modulates protective responses to stress: a receptor basis for sleep-disorders breathing after nicotinic exposure. Proc Nat Acad Sci 2002; 90:13272-7. 65. Iyasu S, Randall LL, Welty TK, Hsia J, Kinney HC, Mandell F, et al. Risk factors for sudden infant death syndrome among northern plains Indians. JAMA 2002; 288:271723. 66. Malloy MH, Hoffman HJ. Prematurity, sudden infant death syndrome, and age of death. Pediatrics 1995; 96:464-71. 67. Hoffman HJ, Damus K, Hillman L, Krongrad E. Risk factors for SIDS. Results of the National Institute of Child Health and Human Development SIDS Cooperative Epidemiological Study. Ann N Y Acad Sci 1988; 533:13-30. 68. Griffin MR, Ray WA, Livengood JR, Schaffner W. Risk of sudden infant death syndro- 70. Scheers-Masters JR, Schootman M, Thach BT. Heat stress and sudden death syndrome incidence: a United States population epidemiologic study. Pediatrics 2004; 113:e586-92. 71. Dales R, Burnett RT, Smith-Doiron M, Stieb DM, Broock JR. Air pollution and sudden infant syndrome. Pediatrics 2004; 113:e62831. 72. Mooney JA, Helms PJ, Jolliffe IT. Higher incidence of SIDS at weekends, especially in younger infants. Arch Dis Child 2004;89: 670-2. 73. Heininger U, Kleemann WJ, Cherry JD, Sudden Infant Death Syndrome Study Group. A controlled study of the relationship between Bordetalle pertussis infections and sudden deaths among Geman infants. Pediatrics 2004;e9-15. 74. Franco P, Seret N, Van Hees JN, Scaillet S, Vermeulen F, Groswasser J, et al. Decreased arousals among healthy infants after shortterm sleep deprivation. Pediatrics 2004; 114:e192-7. 75. Beal SM. Siblings of sudden infant death syndrome victims. Clin Perinatol 1992; 19: 839-48. 76. Beal SM. Sudden infant death syndrome in twins. Pediatrics 1989; 84:1038-44. 77. Hunt CE. Sudden infant death syndrome and other causes of infant mortality. Diagnosis, mechanisms, and risk for recurrence in siblings. Am J Respir Crit Care Med 2001; 164:346-57. 78. Kohler A, Logan C, Joyner AL, Muenke M. Regional assignment of the human homeobox-containing gene EN1 to chromosome 2q13-q21. Genomics 1993; 15:233-5. Libro II curso 31/1/05 17:26 P gina 191 Trastornos respiratorios relacionados con el sueño en el lactante 79. Matsuoka R, Sawamura T, Yamada K, Yoshida M, Furutani Y, Ikura T, et al. Human endothelin converting enzyme gene (ECE1) mapped to chromosomal region 1p36.1. Cytogenet Cell Genet 1996; 72: 322-4. 80. Nagel S, Kaufmann M, Drexler HG, MacLeod RA. The cardiac homeobox gene NKX25 is deregulated by juxtaposition with BCL11B in pediatric T-ALL cell lines via a novel t(5;14)(q35.1;q32.2). Cancer Res 2003; 63:5329-34. 81. Weese-Mayer DE, Berry-Kravis LZ, Zhou L, Maher BS, Curran ME, Silvestri JM, et al. Sudden infant death syndrome: case-control frequency differences at genes pertinent to early autonomic nervous system embryologic development. Pediatr Res 2004; 56: 391-5. 82. Bond CT, Sprengel R, Bissonnette JM, Kaufmann WA, Pribnow D, Neelands T, et al. Respiration and parturition affected by conditional overexpression of the Ca2+-activated K+ channel subunit, SK3. Science 2000;289:1942-6. 83. Narita N, Narita M, Takashima S, Nakayama M, Nagai T, Okado N. Serotonin transporter gene variation is a risk factor for sudden infant death syndrome in the Japanese population. Pediatrics 2001; 107: 690-2. 84. Weese-Mayer DE, Berry-Kravis EM, Maher BS, Silvestri JM, Curran ME, Marazita ML. Sudden infant death syndrome: association with a promoter polymorphism of the serotonin transporter gene. Am J Med Genet 2003; 117A:268-74. 85. Weese-Mayer DE, Zhou L, Berry-Kravis EM, Maher BS, Silvestri JM, Marazita ML. Association of the serotonin transporter gene with sudden infant death syndrome: a haplotipe analysis. Am J Med Genet 2003; 122A:238-45. 86. Lena C, Popa D, Grailhe R, Escourrou P, Changeux JP, Adrien J. Beta 2 containing nicotinic receptors contribute to the organiz of sleep and regulate putative micro-arousals in mice. J Neurosci 2004; 24:5711-8. 191 87. Kuo HC, Cheng CF, Clark RB, Lin JJ, Lin JL, Hoshijima M, et al. A defect in the Kv channel-interacting protein 2 (KchIP2) gene leads to a complete loss of I(to) and confers susceptibility to ventricular tachycardia. Cell 2001; 107:801-13. 88. Decher N, et al. HKChlP2 is a funtional modifier of hKv4.3 potassium channels: cloning and expression of a short hKChIP2 splice variant. Cardiovasc Res 2001; 52:255-64. 89. Ackerman MJ, Siu BL, Sturner WQ, Tester DJ, Valdivia CR, Makielski JC, et al. Postmortem molecular analysis of SCN5A defects in sudden infant death syndrome. JAMA 2001; 2264-9. 90. Wood JC, Maguera MJ, Rinaldo P, Seashore MR, Strauss AW, Friedman A. Diagnosis of very long chain acyl-dehydrogenase deficiency from an infant’s newborn screening card. Pediatrics 2001; 108:e19. 91. Summers AM, Summers CW, Drucker DB, Barson A, Hajeer AH, Hutchinson IV. Association of IL-10 genotype with sudden infant death syndrome. Human Immunol 2000; 61:1270-3. 92. Puffenberger EG, Hu-Lince D, Parod JM, Craig DW, Dobrin SE, Conway AR, et al. Mapping of sudden infant death with dysgenesis of the testes syndrome (SIDDT) by a SNP genome scan and identification of TSPYL loss of function. PNAS 2004; 101: 11689-94. 93. Hunt CE. Genes and sudden infant death syndrome. Pediatr Res 2004; 56:321-2. 94. Vennelle M, Brander PE, Kingshott RN, Rees K, Warren PM, Keeling JW, et al. Is there a familial association between obstructive sleep apnoea/hypopnoea and the sudden infant death syndrome? Thorax 2004; 59: 337-41. 95. Brooks J. Risk related intervention for SIDS prevention: timely or premature. Paediatr Perinat Epidemiol 1994; 8: 10-21. 96. Silvestri JM, Weese-Mayer DE, Hunt CE. Home monitoring during infancy: what is normal? Paediatr Respir Rev 2002; 3: 10-7. Libro II curso 31/1/05 17:26 P gina 192 Libro II curso 31/1/05 17:26 P gina 193 Hipertensión pulmonar J. Sirvent Gómez Unidad de Neumología y Alergia Pediátricas. Hospital Materno-Infantil. Complexo Universitario Hospitalario “Juan Canalejo”. A coruña RESUMEN La hipertensión arterial pulmonar es una rara y grave “situación”, que bien idiopática o relacionada con otras enfermedades, como defectos cardíacos congénitos, neumopatías, enfermedades del colágeno, etc., tiene un mal pronóstico, si no es diagnosticada y tratada precozmente. Es desesperante que ya en el siglo XXI persistan entidades como ésta, cuya etiopatogenia permanece aun sin aclarar del todo. Pero recientes avances producidos, tanto en el conocimiento de su biopatología, diagnóstico y, sobre todo, tratamiento han mejorado el pronóstico de los pacientes, que se refleja en una mejoría de la calidad de vida, una mayor tolerancia al ejercicio y una mejora de los parámetros hemodinámicos. Siguen abiertas líneas de investigación (por ejemplo, la genética) sobre el conocimiento íntimo del proceso, y sobre nuevos tratamientos. Ello nos hace albergar una esperanza: que no esté lejana la solución definitiva de los pacientes con hipertensión arterial pulmonar. Este capítulo pretende ser una revisión actualizada de la situación en la que se encuentra el tema, con énfasis en las opciones terapéuticas disponibles. Libro II curso 31/1/05 17:26 P gina 194 194 INTRODUCCIÓN La hipertensión arterial pulmonar (HAP) es una enfermedad grave y progresiva, bien idiopática (antigua hipertensión arterial pulmonar primaria) bien relacionada con otras muchas enfermedades. Aunque poco frecuente en la infancia, presenta peor pronóstico que en los adultos(1), si no es identificada y tratada precozmente. Por fortuna, recientemente se han producido significativos progresos, tanto en el diagnóstico (los avances tecnológicos permiten una valoración más temprana y precisa de la gravedad del proceso), como en el tratamiento. Ello da lugar a una mejor calidad de vida, capacidad de ejercicio y supervivencia de los niños afectos de HAP(2). DEFINICIÓN La HAP se define como aquella situación caracterizada por el aumento progresivo de la presión arterial pulmonar y de la resistencia vascular pulmonar, que da lugar a insuficiencia ventricular derecha y muerte prematura. Se considera que existe HAP si la presión media pulmonar arterial es ≥ 25 mmHg en reposo o ≥ 30 mmHg durante el ejercicio, medida por cateterización cardíaca(3). La inclusión de las anormalidades hemodinámicas ante el ejercicio es importante, ya que los niños tienen una mayor reactividad del lecho vascular pulmonar al ejercicio o la hipoventilación. No es infrecuente la historia de niños con síncopes repetidos por el ejercicio o durante el sueño, que tienen una presión ar- J. Sirvent Gómez terial media pulmonar sólo de 25 mmHg, pero que aumenta considerablemente con el ejercicio o las desaturaciones de oxígeno durante el sueño. Esta definición es la misma para los adultos que para los niños, habiendo sido adaptada por algunos autores de aquéllos para lactantes y niños(4). CLASIFICACIÓN La HAP se ha clasificado en dos categorías: • Hipertensión arterial pulmonar idiopática, cuando no se puede determinar la causa del aumento de la presión arterial pulmonar, a pesar de minuciosos exámenes médicos. • Hipertensión arterial pulmonar secundaria, cuando se identifica una enfermedad coexistente o un desencadenante que pueda explicar el aumento de la presión arterial pulmonar. En 1998, la reunión de expertos que tuvo lugar en Evian (Francia), propuso un nuevo esquema de clasificación diagnóstica(5), en la que se agrupan las diferentes causas de enfermedad vascular pulmonar por sus rasgos clínicos comunes. Esta clasificación recoge los recientes avances en los conocimientos fisiopatológicos que conducen a la HAP, y reconoce la similitud entre la hipertensión arterial pulmonar idiopática y la hipertensión arterial pulmonar de ciertas otras causas. Posteriormente, en el III Simposio Mundial de Hipertensión pulmonar arterial (Venecia, Italia, 2003), se decidió mantener la arquitectura y filosofía Libro II curso 31/1/05 17:26 P gina 195 195 Hipertensión pulmonar de la clasificación de Evian, pero con algunas modificaciones (Tabla 1)(6): principalmente, el cambio del término “hipertensión arterial pulmonar primaria” por el de “hipertensión arterial pulmonar idiopática”, reflejando el hecho de que éste es un diagnóstico de exclusión, con causas exactas aún no conocidas; reclasificar la enfermedad venooclusiva pulmonar y la hemangiomatosis capilar pulmonar; actualizar los factores de riesgo y condiciones asociadas a la HAP; y proponer algunas recomendaciones para mejorar la clasificación de las derivaciones sistémico-pulmonares congénitas, que fueron agrupadas según el tipo, el tamaño, las malformaciones extracardíacas asociadas y la presencia o no de intervenciones correctoras. EPIDEMIOLOGÍA La frecuencia real de la HAP, tanto en niños, como en adultos, no se conoce. La incidencia de la HAP idiopática se estima en 1-2 nuevos casos por millón de habitantes y año(7). Si bien la enfermedad es rara, cada vez son más frecuentes las comunicaciones de casos confirmados, en niños y adultos, de HAP anteriormente no reconocidos. En ocasiones, en niños fallecidos presumiblemente con el diagnóstico de síndrome de muerte súbita, el examen postmorten demuestra que tenían HAP idiopática. La incidencia por sexos es algo mayor en el femenino, con una relación de aproximadamente 1,7:1(3), sin diferencias significativas entre adultos o niños, ni si éstos son pequeños o mayores(2). ANATOMÍA PATOLÓGICA Y BIOPATOLOGÍA Aunque la patogenia de la HAP es desconocida, sus alteraciones anatopatológicas están bien definidas(8). Tanto en la HAP idiopática como en la HAP asociada a diversos trastornos, se produce una serie de alteraciones anatomopatológicas obstructivas virtualmente idénticas en la vasculatura pulmonar. Se han distinguido tres cuadros histológicos: a) la arteriopatía pulmonar; b) la venopatía oclusiva pulmonar; y c) la microvasculopatía pulmonar. La arteriopatía pulmonar se caracteriza por la hipertrofia de la capa media, el engrosamiento de la íntima y las lesiones complejas, como las plexiformes, las lesiones en colador y la arteritis con infiltración por células inflamatorias. En los niños, cuanto menores, más predomina la hipertrofia de la media, y con el aumento de la edad, aparecen la fibrosis de la íntima y las lesiones plexiformes. Ello podría indicar que la primera lesión precede a las otras en el desarrollo de los cambios en la vasculatura pulmonar (2). La venopatía oclusiva pulmonar representa una proporción pequeña de los casos de HAP, caracterizada por una oclusión intensa y difusa de las vénulas y venas pulmonares, debida a la proliferación de su íntima. Aunque rara, es muy importante diferenciar la venopatía oclusiva de los otros cuadros, pues el tratamiento de estos casos con vasodilatadores intravenosos, como la prostaciclina puede ser fatal para el paciente. La microvasculopatía pulmonar es un trastorno infrecuente caracterizado por Libro II curso 31/1/05 17:26 P gina 196 196 TABLA 1. Clasificación clínica de la hipertensión pulmonar (Venecia 2003)(6). 1. Hipertensión pulmonar arterial 1.1. Idiopática 1.2. Familiar 1.3. Asociada con: 1.3.1. Enfermedad vascular del colágeno 1.3.2. Derivaciones sistémico – pulmonares congénitas 1.3.3. Hipertensión portal 1.3.4. Infección VIH 1.3.5. Fármacos y toxinas 1.3.6. Otros (alteraciones tiroideas, glucogenosis, enfermedad de Gaucher, telangectasia hemorrágica hereditaria, hemoglobinopatías, trastornos mieloproliferativos, esplenectomía) 1.4. Asociada con compromiso venoso o capilar 1.4.1. Enfermedad venooclusiva pulmonar 1.4.2. Hemangiomatosis capilar pulmonar 1.5. Hipertensión pulmonar persistente del recién nacido 2. Hipertensión pulmonar con cardiopatía izquierda 2.1. Cardiopatía auricular o ventricular izquierda 2.2. Cardiopatía valvular izquierda 3. Hipertensión pulmonar asociada con enfermedad pulmonar y/o hipoxemia 3.1. Enfermedad pulmonar obstructiva crónica 3.2. Enfermedad pulmonar intersticial ... / ... J. Sirvent Gómez (Continuación) TABLA 1. Clasificación clínica de la hipertensión pulmonar (Venecia 2003)(6). 3.3. Alteraciones respiratorias del sueño 3.4. Alteraciones alveolares con hipoventilación 3.5. Exposición crónica a altitud elevada 3.6. Alteraciones del desarrollo pulmonar 4. Hipertensión pulmonar debida a enfermedad crónica trombótica y/o embólica 4.1. Obstrucción tromboembólica de las arterias pulmonares principales 4.2. Obstrucción tromboembólica de las arterias pulmonares distales 4.3. Embolismo pulmonar no trombótico (tumores, parásitos, material extraño) 5. Miscelánea Sarcoidosis, Histiocitosis X, Linfangiomatosis, compresión de los vasos pulmonares (mediastinitis fibrosante aguda) una proliferación capilar localizada en el pulmón. En 1977, Wagenwoort y Wagenwoort lanzaban la hipótesis de que “la hipertensión arterial pulmonar idiopática es una enfermedad de individuos con vasos pulmonares hieperreactivos, en los que diferentes estímulos provocan vasoconstricción, con el desarrollo consecuente de las características lesiones vasculares”(9). Libro II curso 31/1/05 17:26 P gina 197 197 Hipertensión pulmonar Los niños más pequeños parecen tener un lecho vascular pulmonar más reactivo, tanto a la vasodilatación, como a la vasoconstricción. Así, crisis agudas más graves de HAP suceden más a menudo en los menores que en los niños mayores o adultos. No es extraño, que basándose en estas observaciones, hasta principios de los 90, el mecanismo propuesto para explicar la HAP idiopática fuera la vasoconstricción pulmonar. Más recientemente se han descrito diversas alteraciones celulares, estructurales y funcionales, que pueden desempeñar un papel importante en el desarrollo y progresión de la enfermedad(10). Entre estas alteraciones se encuentran la disfunción endotelial, caracterizada por el desequilibrio entre la síntesis de sustancias vasodilatadoras (prostaciclina y óxido nítrico) y vasoconstrictoras (tromboxano A2 y endotelina 1)(11), defectos en los canales del potasio de las células del músculo liso de las arterias pulmonares y un aumento de la síntesis de mediadores inflamatorios(10). Estas alteraciones elevan el tono vascular y estimulan el remodelado obstructivo de los vasos. El proceso de remodelado vascular pulmonar afecta a todas las capas del vaso y se caracteriza por las alteraciones proliferativas y obstructivas histológicas antes mencionadas, que implican a diferentes tipos celulares, como el endotelio, el músculo liso y los fibroblastos(8). A pesar los descubrimientos de estos mecanismos, siguen sin esclarecerse las interacciones precisas que hay entre ellos mismos y, si son causa o una consecuencia del proceso de la enfermedad. GENÉTICA La identificación de varias mutaciones en el receptor de la proteína morfogenética ósea 2 (BMPR2) en un elevado número de casos (60%) de la HAP familiar(12) y también, aunque en menor proporción (25%), en los casos esporádicos de HAP(13), ha constituido un importante avance en esta línea de investigación. Sin embargo, la elevada frecuencia de los casos esporádicos de HAP y la reducida penetración del gen BMPR2 (sólo manifiestan la enfermedad el 20% de los portadores de las mutaciones de este gen, y a veces no antes de los 30-40 años de edad), sugieren que son necesarios factores adicionales para el desarrollo de esta enfermedad. La evaluación genética de los pacientes con HAP hoy día es sólo una herramienta de investigación al alcance de muy pocos(14). PRESENTACIÓN CLÍNICA Los síntomas de la HAP son inespecíficos y variables. Los niños presentan signos de bajo gasto cardíaco, como anorexia, fallo de crecimiento, cansancio, sudoración, taquipnea, taquicardia e irritabilidad. En los lactantes, el llanto o gritos son probablemente el reflejo del dolor torácico. La cianosis con el ejercicio se debe al cortocircuito derecha izquierda a través de un foramen oval patente. Los niños sin un adecuado cortocircuito a través del foramen oval pueden presentar síncopes por la imposibilidad de aumentar su gasto cardíaco con el ejercicio. Al crecer los niños Libro II curso 31/1/05 17:26 P gina 198 198 tienen los mismos síntomas que los adultos. Los síntomas más comunes son la disnea con el ejercicio, ocasionada por la alteración en el aporte de oxígeno, y ocasionalmente el dolor torácico, debido a la isquemia del ventrículo derecho. Los síncopes indican una mayor restricción del gasto cardíaco que conduce a una disminución del flujo sanguíneo cerebral. El fallo cardíaco derecho es poco frecuente entre los menores de 10 años. Los edemas periféricos son reflejo del fallo ventricular derecho asociado a una enfermedad vascular pulmonar avanzada. El intervalo entre el inicio de los síntomas y el diagnóstico suele ser más corto en los niños que en los adultos, especialmente si aquellos presentan síncopes con el ejercicio. Además, los niños pueden presentar convulsiones hipoxémicas consecuencia de los síncopes o de una exagerada vasoconstricción pulmonar debida a las desaturaciones de oxigeno durante el sueño (sobre todo en las primeras horas de la mañana)(2,15). APROXIMACIÓN DIAGNÓSTICA El abordaje diagnóstico ha sido definido con mayor claridad según la nueva clasificación clínica y el consenso alcanzado respecto a los algoritmos de los procedimientos diagnósticos que excluyan las diferentes causas y garanticen un diagnóstico preciso de la HAP(16). En la historia clínica de un niño con sospecha de HAP es obligado recoger los datos de su historia perinatal (hipoxia, aspiración meconial, etc.), descartar una his- J. Sirvent Gómez toria de enfermedad pulmonar crónica (p. ej., displasia broncopulmonar o fibrosis quística), e investigar la presencia de síncopes o convulsiones sin causa. Deben investigarse los antecedentes familiares sobre hemoptisis, disnea de esfuerzo o dolor torácico que pudieran revelar que otros miembros de la familia también padecieran HAP. La evaluación de la sintomatología de los pacientes según la clasificación funcional de la New York Heart Association (NYHA) modificada por la OMS(17) (Tabla 2) es muy útil en el proceso de determinar la gravedad del proceso. La exploración física debe ser especialmente cuidadosa en el examen cardiológico y otros signos de congestión sistémica venosa relacionados con el fallo ventricular derecho. En la auscultación cardíaca se puede apreciar un refuerzo del segundo ruido, un soplo de insuficiencia pulmonar o un soplo pansistólico de regurgitación tricuspídea. La ingurgitación venosa yugular es rara en los niños. La hepatomegalia es un buen indicador del grado del fallo cardíaco derecho. La ascitis y los edemas periféricos pueden observarse en los casos más graves. Las acropaquias y la cianosis aparecen en casos con enfermedad pulmonar de base o en el síndrome de Eisenmenger. Otros hallazgos pueden deberse a una causa sistémica de la HAP, como por ejemplo, un rash característico de lupus eritematoso. Las pruebas complementarias a realizar en la aproximación diagnóstica de la HAP son muchas (en la figura 1 se recoge el algoritmo de la aplicación de las mis- Libro II curso 31/1/05 17:26 P gina 199 199 Hipertensión pulmonar TABLA 2. Clasificación funcional de la hipertensión pulmonar. Clase I Sin limitación de la actividad física. La actividad física ordinaria no causa disnea o cansancio, dolor torácico o síncope Clase II Ligera limitación de la actividad física. Cómodos en reposo. La actividad física ordinaria causa disnea o cansancio, dolor torácico o casi síncope Clase III Limitación marcada de la actividad física. Cómodos en reposo. Una actividad física inferior a la normal ocasiona disnea o cansancio, dolor torácico o casi síncope Clase IV Incapaces de realizar cualquier actividad física sin presentar síntomas. Manifiestan signos de fallo cardíaco derecho. Pueden tener disnea o cansancio incluso en reposo. Cualquier actividad física aumenta su malestar mas(18)): radiografía de tórax, electrocardiograma (ECG), ecocardiografía Doppler transtorácica, pruebas de función pulmonar, gasometría arterial, estudio de la patología respiratoria del sueño, gammagrafía pulmonar de ventilación y perfusión, tomografía computarizada (TC) pulmonar de alta resolución, TC helicoidal potenciada con contraste de pulmón y resonancia magnética nuclear, angiografía, pruebas sanguíneas e inmunológicas, test del sudor, etc., y evaluación de la capacidad de esfuerzo y cateterismo cardíaco derecho con valoración de la capacidad vasodilatadora. La radiografía de tórax puede ser normal o mostrar una cardiomegalia más o menos considerable. Otros signos radiológicos son el aumento del tronco de la arteria pulmonar y la disminución de la vasculatura pulmonar periférica. En caso de enfermedad parenquimatosa pulmonar como causa de HAP (por ejemplo, fibrosis quística) los signos radiológicos serán los propios de cada enfermedad. En el ECG aparecen signos de la hipertrofia ventricular y auricular derechas y la desviación del eje a la derecha. La ecocardiografía Doppler transtorácica, generalmente, puede descartar la cardiopatía congénita como causa de HAP. Pero, además, puede demostrar la existencia de: 1. la sobrecarga del ventrículo derecho por su hipertrofia y/o dilatación, el aplanamiento y movimiento paradójico del tabique interventricular, la insuficiencia tricuspídea y la dilatación de la arteria pulmonar; 2. la HAP, estimando la presión sistólica pulmonar a través de la velocidad del chorro de la insuficiencia tricuspídea y la presión final de la diástole en la arteria pulmonar por la velocidad del chorro de la insuficiencia pulmonar; 3. otros fenómenos subyacentes, como coágulos, cortocircuitos, enfermedad ventricular izquierda, etc. Libro II curso 31/1/05 17:26 P gina 200 200 J. Sirvent Gómez Ecocardiografía Electrocardiograma Cardiopatía Radiografía de tórax Pruebas de función Pulmonar. Estudio del sueño Neumopatia SAOS Autoinmunidad Enfermedades del colágeno Anticuerpos VIH Infección por VIH Función hepática Hipertensión portal Cateterismo cardíaco Cardiopatía Hipertensión arterial pulmonar secundaria Hipertensión arterial pulmonar idiopática Cardiopatía Figura 1. Algoritmo diagnóstico de la hipertensión arterial pulmonar(18). En las pruebas de función pulmonar, la espirometría y los volúmenes pulmonares son normales. Si hubiera un claro patrón obstructivo debería descartarse una enfermedad parenquimatosa pulmonar. La difusión de monóxido de carbono está disminuida debida a la reducción del volumen sanguíneo capilar pulmonar. La prueba de caminar 6 minutos, en la que se valora la distancia recorrida y la saturación de oxigeno, permite comprobar desaturaciones con un esfuerzo no muy intenso y es muy útil en el seguimiento de los pacientes en su respuesta al tratamiento. Los resultados de esta prueba se correlacionan con la hemodinámica pulmonar y la supervivencia a largo plazo(19). La gasometría arterial en la mayoría de los casos muestra una hipoxemia con hipocapnia, consecuencia del desequilibrio perfusión-ventilación. Libro II curso 31/1/05 17:26 P gina 201 201 Hipertensión pulmonar La polisomnografía sirve para descartar un síndrome de apnea obstructiva del sueño que, en ocasiones, puede tener una presentación tan dramática que simule una HAP. La gammagrafía pulmonar de ventilación es normal. En cambio, en la de perfusión se observan defectos parcheados, debidos a la oclusión vascular en las formas de HAP venooclusiva y por trombos. Los cortes de alta resolución de la TC pulmonar ayudan a descartar enfermedad pulmonar parenquimatosa subyacente, y mediante la TC helicoidal y/o la resonancia magnética nuclear se observa la morfología de los grandes vasos y cavidades cardíacas y si presentan coágulos intravasculares. La angiografía pulmonar es útil si la gammagrafía de perfusión no es concluyente y es de obligada realización, aunque no exenta de riesgos, si existe la sospecha de enfermedad tromboembólica de los grandes vasos. Son muy amplias las determinaciones analíticas a efectuar: deberán descartarse los síndromes de hipercoagulabilidad (antígeno de von Willebrand, antitrombina III, proteína C, proteína S, etc.), e incluirse pruebas de función hepática, serologías de enfermedades infecciosas (VIH), test del cloro en sudor y pruebas inmunológicas (ANA, etc.), para descartar las enfermedades del colágeno. El cateterismo cardíaco derecho, es la prueba gold standard para el diagnóstico definitivo de la enfermedad, determinar su gravedad, establecer el pronóstico y seleccionar el tratamiento más adecuado. Es preceptiva la medición de las presiones en la aurícula y ventrículo derechos, en la arteria pulmonar y gasto cardíaco, la exclusión de cortocircuitos, y la valoración de la respuesta vasodilatadora. En la realización de la prueba vasodilatadora se usan, fundamentalmente, dos fármacos, el NO inhalado y la prostaciclina intravenosa, que tienen la ventaja de su corta duración de acción, de forma que sus efectos revierten rápidamente si se deteriora el paciente. Se considera que la prueba vasodilatadora es positiva al conseguir un descenso ≥ 20% de la presión media de la arteria pulmonar. En Venecia (año 2003) se propuso una nueva definición de la vasorreactividad aguda evaluada mediante la administración de NO: disminución de la presión pulmonar media de al menos 10 mm Hg hasta alcanzar un valor absoluto inferior a 40 mm Hg, y además sin cambios o aumento del gasto cardíaco(16). Los pacientes respondedores son una minoría, pero son más frecuentes entre los niños que entre los adultos4. TRATAMIENTO El tratamiento de la HAP depende de la causa que la origina, si ésta se identifica y si se puede actuar sobre ella. Si es así, los esfuerzos terapéuticos irán encaminados a tratar la enfermedad de base, por ejemplo, la corrección precoz de las cardiopatías con hiperaflujo previene el desarrollo de la enfermedad vascular irreversible. Sin embargo, en un diagnóstico tardío, o cuando la causa etiológica no tie- Libro II curso 31/1/05 17:26 P gina 202 202 ne un tratamiento específico, o en los casos de HAP idiopática, requieren establecer un tratamiento de la misma HAP. Medidas generales de soporte Los pacientes con hipoxia (PaO2 < 60 mm Hg) en reposo, nocturna o con el esfuerzo deben recibir oxigenoterapia suplementaria, pues mejora la vasoconstricción pulmonar hipóxica y reduce la postcarga del ventrículo derecho. Los diuréticos pueden ayudar a reducir la sobrecarga de volumen (hepatomegalia, edemas periféricos) en los pacientes con fallo cardíaco derecho. Debe vigilarse su uso excesivo que disminuye el gasto cardíaco y compromete la eficacia de los vasodilatadores. La digoxina se usa en casos de fallo cardíaco derecho, sin embargo su beneficio a largo plazo sigue discutiéndose. Un estudio con un pequeño número de pacientes con HAP idiopática, demuestra que a corto plazo mejoraba el gasto cardíaco(20), y su uso concomitante con bloqueantes de los canales del calcio parece contrarrestar el efecto inotrópico de estos(21). Anticoagulación Los pacientes con HAP tienen un riesgo aumentado de trombosis y tromboembolismo debido al lento flujo pulmonar, la dilatación de las cavidades cardíacas, la estasis venosa y la vida sedentaria. La anticoagulación crónica incrementa las tasas de supervivencia de los pacientes adultos con HAP idiopática, especialmente en los no “respondedores” a los vasodilatadores pulmonares(22); sin em- J. Sirvent Gómez bargo, y aunque usada, no se ha demostrado su eficacia en los niños(4). Se recomienda la anticoagulación oral con warfarina, con el objetivo de conseguir un cociente normalizado internacional (IRN) de 1,5-2. La aspirina y dipiridamol no parecen ser útiles en prevenir la trombosis in situ que puede ocurrir. La heparina intravenosa o la heparina de bajo peso molecular de administración subcutánea podrían ser una alternativa a la warfarina, pero sus efectos secundarios (osteopenia y trombocitopenia) son de preocupar. Bloqueadores de los canales del calcio Los bloqueadores orales de los canales del calcio son un grupo heterogéneo de fármacos que inhiben el paso de calcio a través de sus canales en las células del músculo liso vascular. Su utilidad en pacientes con HAP está basada en la capacidad de producir vasodilatación pulmonar. Pero sólo se usarán en aquellos pacientes que se demuestre una respuesta vasodilatadora aguda positiva en el cateterismo cardíaco. Incluso, no todos los “respondedores” agudos tienen una respuesta sostenida a largo plazo(4). Serán necesarias revaluaciones periódicas, incluyendo la prueba vasodilatadora, para que la terapia con bloqueadores orales de los canales del calcio sigua siendo adecuada(2). Menos de un 20% de los pacientes adultos y hasta un 40% de los niños con HAP idiopática responden al uso de bloqueadores orales de los canales del calcio. El más usado es el nifedipino, a dosis elevadas de 120-240 mg/día. Son alternativas el diltiacem (120-720 mg/día) y el am- Libro II curso 31/1/05 17:26 P gina 203 Hipertensión pulmonar lodipino (5-10 mg/día) que parece tener propiedades vasodilatadoras más selectivas. La dosis optima (tanto en niños como en adultos) de todos ellos es incierta. La aparición de efectos secundarios (hipoxemia por aumento del desequilibrio ventilación-perfusión, hipotensión sistémica, arritmias, fallo cardíaco derecho y muerte) obligan a monitorizar estrechamente a los pacientes sometidos a esta terapia y contraindica totalmente su uso en los que no son “respondedores” agudos. Otros efectos secundarios menos graves, pero mal tolerados, y que pueden ocasionar la retirada de estos fármacos son náuseas, vómitos, mareos y cefaleas intensas(21). Prostaglandinas El epoprostenol o prostaciclina es un vasodilatador natural producido por las células endoteliales. Además, tiene efecto antiagregante plaquetario e inhibidor de los fenómenos que provocan el remodelado vascular. Ha demostrado su eficacia en el tratamiento de los pacientes con HAP idiopática no “respondedores” agudos, y también en la HAP asociada a cardiopatías, enfermedades del colágeno, infección VIH o hipertensión portal, por lo que se ha convertido en la droga de primera elección en los pacientes en clase funcional III-IV de la NYHA(23). Debe ser administrado en infusión intravenosa continua, debido a su corta vida media (1-2 minutos) y a que es inactivado por el pH bajo del estómago. Requiere, por lo tanto, un sistema de bomba de perfusión continua conectada a un catéter ve- 203 noso central permanente. Los mayores efectos secundarios se derivan de este modo de administración: riesgos de infección, trombosis o malfuncionamiento de la bomba. La interrupción brusca de la perfusión puede ocasionar una crisis hipertensiva pulmonar, incluso mortal. Otros posibles efectos secundarios son: vómitos, hipotensión sistémica, mareos, síncopes, enrojecimiento cutáneo, cefaleas, dolor abdominal, diarreas y dolor mandibular. El tratamiento con epoprostenol está contraindicado en la enfermedad venooclusiva pulmonar al aumentar el flujo sanguíneo anterógrado(24). La dosis inicial es de 2 ng/kg/min que se va incrementando hasta conseguir la dosis terapéutica eficaz. Ésta suele oscilar entre 20 y 40 ng/kg/min, aunque en los niños, particularmente los más pequeños, puede estar más cercana a los 50-80 ng/kg/min. Existe una gran variabilidad en la dosis óptima, además de un fenómeno de tolerancia progresiva que puede requerir ir aumentando las dosis a lo largo del primer año de tratamiento. Otro problema de la terapia con prostaciclina es su elevado coste (entre 60.000 y 80.000 € por paciente y año). Por todos estos motivos se han investigado otras drogas, análogos de la prostaciclina, con vías de administración oral, inhalada o subcutánea. Ninguna, sin embargo, tiene probada una eficacia superior al epoprostenol intravenoso(24). Análogos de la prostaciclina Iloprost es un análogo de la prostaciclina con efectos similares a la misma, Libro II curso 31/1/05 17:26 P gina 204 204 pero con una vida media algo más larga (20-30 minutos), lo que permite su administración por vía inhalada, aunque en un número de 6-9 veces al día. Recientes estudios demuestra sus beneficios a corto y largo plazo (más de un año de administración)(25,26) y su eficacia similar al NO inhalado(27). Treprostinil o uniprost es otro análogo de la prostaciclina, con una vida media de 3 horas cuando es administrado subcutáneamente con una pequeña bomba. Su principal inconveniente es el frecuente desarrollo de dolor intenso en el lugar de administración. En un ensayo clínico doble ciego aleatorizado y comparado con placebo, los pacientes, incluyendo a niños, mejoraban en la tolerancia al ejercicio y la hemodinámica(28). Beraprost sódico es otro análogo de la prostaciclina activo oralmente, aunque con una potencia aproximada del 50% de ésta(29). Su uso, en ensayos autorizados en Japón(30) y Europa(31) en los que había incluidos niños mayores de 8 años, demuestra una mejoría de la tolerancia al ejercicio y de los índices de supervivencia de los pacientes. Sus efectos secundarios, principalmente náuseas, cefaleas y vértigo, limitan el aumento de dosis(29). Antagonistas de los receptores de la endotelina La endotelina 1 es uno de los más potentes vasoconstrictores identificados hasta la fecha. Los niveles séricos de endotelina 1 están aumentados en los pacientes con HAP idiopática y correlacionados inversamente a su pronóstico(32). J. Sirvent Gómez Bosentán es un antagonista dual de los receptores (existen, al menos, dos subtipos de receptores, los ETA y los ETB) de la endotelina. Administrado oralmente, a dosis de 62,5 mg dos veces al día el primer mes y después, 125 mg dos veces al día, ha demostrado su eficacia en el tratamiento de pacientes pediátricos con HAP idiopática o asociada con defectos cardíacos con clase funcional II y III(33). Puede producir hepatopatía (elevación de transaminasas), por lo que es necesario monitorizar la función hepática antes y durante el tratamiento, y está desaconsejado su uso si existe enfermedad hepática coexistente con la HAP. También está contraindicado durante el embarazo, por ser potencialmente teratógeno. Otros efectos secundarios son: cefalea, nasofaringitis, enrojecimiento, edemas de extremidades inferiores, hipotensión, palpitaciones, dispepsia, cansancio y prurito(32). El sitaxsentán es un antagonista selectivo del receptor ETA de la endotelina, que al igual que el bosentán también ha demostrado efectos beneficiosos en el tratamiento de pacientes con HAP(34). Oxido nítrico y otras terapias El óxido nítrico (NO) es un potente y selectivo vasodilatador pulmonar administrado por vía inhalatoria. El NO también tiene efectos antiproliferativos en el músculo liso e inhibe la adhesión plaquetaria(35). Está demostrada la seguridad y eficacia del NO inhalado en el tratamiento de la HAP persistente del recién nacido(36). También ha sido útil en el tratamiento de las Libro II curso 31/1/05 17:26 P gina 205 Hipertensión pulmonar exacerbaciones de la HAP idiopática, la HAP inmediata que sigue a la cirugía cardíaca, y otras formas de HAP. Aunque es amplia la experiencia en el uso de NO inhalado en situaciones a corto plazo, no está claro su papel de forma sostenida(35). La fosfodiesterasa tipo 5 actúa sobre el monofosfato de guanosina cíclico (GMPc), nucleótido que favorece las acciones vasculares del NO. Así pues, los inhibidores de la fosfodiesterasa, como el sildenifilo, pueden favorecer la acción de otras sustancias vasoactivas, como el NO y jugar un papel en el tratamiento de los pacientes con HAP(35). Tratamientos quirúrgicos En los pacientes con HAP grave pueden plantearse dos procedimientos quirúrgicos: la septostomía auricular y el trasplante pulmonar o cardiopulmonar. Basada en observaciones experimentales y clínicas (los pacientes con HAP y persistencia del foramen oval tienen una mayor supervivencia), la septostomía auricular con balón o cuchilla es un procedimiento que persigue la creación de un cortocircuito derecha-izquierda de manera controlada, con la consecuente descarga del corazón derecho. Aunque lógicamente disminuye la saturación de la hemoglobina, aumenta el gasto cardíaco y, por lo tanto, el aporte de oxígeno al territorio sistémico. Sólo estaría indicada en pacientes muy graves (clase funcional III y IV) que presenten sincopes repetidos y/o fallo cardíaco derecho a pesar de un tratamiento médico máximo, incluyendo las prosta- 205 ciclinas, como una medida puente paliativa al trasplante pulmonar o cardiopulmonar(37). El trasplante cardiopulmonar o pulmonar (único o bilateral) era la última posibilidad de tratamiento para los pacientes con HAP antes de la llegada de los avances producidos en el tratamiento médico. Y sigue siéndolo para aquellos pacientes muy graves, y que no responden satisfactoriamente a un tratamiento médico adecuado(37). En un principio, los diferentes grupos creían que el trasplante cardiopulmonar era el único posible, debido a la afectación del corazón derecho que presentan estos pacientes. Posteriormente, se han realizado con éxito, tanto trasplantes uni como bipulmonares, con la reparación de defectos cardíacos si era necesario como, por ejemplo, en el síndrome de Eisenmerger, pues el descenso inmediato de la presión en la arteria pulmonar y de la resistencia vascular pulmonar comporta una mejora de la función ventricular derecha. La supervivencia a los 3 y 5 años tras el trasplante es cercana al 55 y 45%, respectivamente(38), resultados algo inferiores a los del tratamiento médico en los pacientes que responden a él. Los pacientes en clase funcional III y IV y que tienen parámetros hemodinámicos que predicen una supervivencia corta, deben evaluarse para trasplante, independientemente de que se inicie tratamiento médico. Estos parámetros hemodinámicos son: un índice cardíaco < 2 L/min/m2, una presión en aurícula derecha > 15-20 mm Hg Libro II curso 31/1/05 17:26 P gina 206 206 y una presión media en arteria pulmonar > 55 mm Hg. La estrategia que se sigue para incluir a los pacientes en lista de espera de trasplante pulmonar es(39): 1. Todos los pacientes en clase funcional IV se incluyen en lista al mismo tiempo que se inicia tratamiento con prostaciclina. Si mejoraran hasta una clase funcional II se retiran de la lista. 2. Los pacientes en clase funcional III también inician tratamiento con prostaciclina. Si no muestran ninguna o muy pobre respuesta al tratamiento son listados. 3. Los pacientes en clase funcional II sólo se incluyen en lista de trasplante si empeoran a una clase funcional más avanzada o empeoran en sus datos hemodinámicos. PERSPECTIVAS FUTURAS Hoy, la investigación de la biopatología de la HAP está centrada en definir la importancia de los diferentes procesos moleculares y celulares, algunos ya apuntados, y las interacciones existentes entre los mismos. Además, será importante evaluar mejor la expresión de las mutaciones del gen BMPR2, lo que puede abrir incluso la posibilidad de una terapia génica. Se investiga sobre el papel que desempeñan los marcadores biológicos, como el péptido natriurético B y otros, para establecer el pronóstico y evaluación de los tratamientos. Muy probablemente en el futuro una combinación de diferentes medicamentos J. Sirvent Gómez disponibles, preferentemente administrados por vía oral, sea la base del tratamiento de la HAP, con el fin de conseguir la suma de sus efectos favorables. Y se investiga sobre la acción de nuevos tratamientos como las estatinas(40). PRONÓSTICO Y CONCLUSIONES La supervivencia de los pacientes pediátricos con HAP depende de diversos factores: a. Si la HAP tiene una causa etiológica conocida con un tratamiento específico o no; y b. Si se trata de una HAP idiopática, y en este caso de su diagnóstico precoz, de si los pacientes son “respondedores” a la prueba vasodilatadora o no, y de la disponibilidad de los nuevos fármacos para su tratamiento. Los recientes avances terapéuticos han significado una notable mejoría en el pronóstico de estos pacientes que poco más de hace una década era infausto. La terapia con los bloqueadores de los canales del calcio en los respondedores agudos de la prueba vasodilatadora, y el tratamiento continuo con epoprostenol intravenoso, parecen tan eficaces en los niños como en los adultos, y constituyen ya la base del tratamiento de pacientes con HAP idiopática. Pero muy probablemente en un futuro no muy lejano, los nuevos tratamientos, como el bosentán, o combinaciones de los mismos, supondrán aún un mejor pronóstico para los pacientes y la esperanza de alcanzar algún día de la curación total de la enfermedad. Libro II curso 31/1/05 17:26 P gina 207 207 Hipertensión pulmonar BIBLIOGRAFÍA 1. D´Alonzo GE, Barst RJ, Ayres SM, Bergofsky EH, Detre KM, Fishman AP, et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115: 343-9. 2. Rosenzweig EB, Widlitz AC, Barst RJ. Pulmonary arterial hypertension in children. Pediatr Pulmonol 2004; 38:2-22. 3. Rich S, Dantzker DR, Ayres SM, Bergofksy EH, Brundage BH, Detre KM, et al. Primary pulmonary hypertension. A national prospective study. Ann Intern Med 1987; 107: 216-23. 4. Barst RJ, Maislin G, Fishman AP. Vasodilator therapy for primary pulmonary hypertension in children. Circulation 1999; 99: 1197-208. 5. Nomenclature and classification of pulmonary hypertension. En: Rich S, (ed.). Primary pulmonary hypertension: executive summary from the World Symposium-Primary Pulmonary Hypertension 1998, 25-7. World Health Organization. Disponible en: http://www.who.int/ncd/cvd/pph.html 6. Simonneau G, Galie N, Rubin LJ, Langleben D, Seeger W, Domenighetti G, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004; 43 (12 Suppl 1): S5-S12. 7. Rubin LJ. Primary pulmonary hypertension. N Engl J Med 1997; 336:111-7. 8. Pietra GG, Capron F, Stewart S, Leone O, Humber M, Robbins IM, et al. Pathologic assessment of vasculopathies in pulmonary hypertension. J Am Coll Cardiol 2004; 43:S25-S32. 9. Wagenwoort CA, Wagenwoort N. Primary pulmonary hypertension. New York: Wiley & Sons, 1977. 10. Humber M, Morrel NW, Archer SL, Stenmark KR, MacLean MR, Lang IM, et al. Cellular and molecular pathobiology of arterial hypertension. J Am Coll Cardiol 2004; 43:S13S24. 11. Budhiraja R, Tuder RM, Hassoun PM. Endothelial dysfunction in pulmonary hypertension. Circulation 2004; 109:159-65. 12. Deng Z, Morse JH, Slager SL, Cuervo N, Moore KJ, Venetos G, et al. Familial primary pulmonary hypertension (gene PPH1) is caused by mutations in the bone morphogenetic protein receptor-II gene. Am J Hum Genet 2000; 67:737-44. 13. Thomson JR, Machado RD, Pauciulo MW, Morgan NV, Humbert M, Elliott GC, et al. Sporadic primary pulmonary hypertension is associated with germ-line mutations of the gene encoding BMPR-II, a receptor of the TFG-b family. J Med Genet 2000; 37:741-5. 14. Newman JH, Trembath RC, Morse JA, Grunig E, Loyd JE, Adnot S, et al. Genetic basis of pulmonary arterial hypertension: Current understanding and future directions. J Am Coll Cardiol 2004; 43:S33-S39. 15. Widlitz A, Barst RJ. Pulmonary arterial hypertension in children. Eur Respir J 2003; 21:155-76. 16. Barst RJ, McGoon M, Torbicki A, Sitbon O, Krowka MJ, Olschewski H, et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43:S40-S47. 17. Rich S, ed. Primary pulmonary hypertension: executive summary from the World Symposium-Primary Pulmonary Hypertension 1998. World Health Organization. Disponible en: http://www.who.int/ncd/cvd/ pph.html 18. Gaine SP, Rubin LJ. Primary pulmonary hypertension. Lancet 1998; 352:719-25. 19. Miyamoto S, Nagaya S, Satoh T, Kyotani S, Sakamaki F, Fujita M. Clinical correlates and Libro II curso 31/1/05 17:26 P gina 208 208 prognostic significance of six-minute walk test in patients with primary pulmonary hypertension. Comparison with cardiopulmonary exercise testing. Am J Respir Crit Care Med 2000; 161:487-92. J. Sirvent Gómez genital heart disease. Vasodilator capacity and cellular mechanisms. Circulation 2001; 103:544-8. 20. Rich S, Seidlitz M, Dodin E, Osimani D, Judd D, Genthner D, et al.The short-term effects of digoxin in patients with right ventricular dysfunction from pulmonary hypertension. Chest 1998;114:787-92. 28. Simonneau G, Barst RJ, Galie N, Naeije R, Rich S, Bourge RC, et al. Continuous subcutaneous infusion of treprostinil, a prostacyclin analogue, in patients with pulmonary hypertension: a double-blind, randomized, placebo-controlled trial. Am J Respir Crit Care Med 2002; 165:800-4. 21. Rich S, Kaufmann E, Levy PS. The effect of high doses of calcium-channel blockers on survival in primary pulmonary hypertension. N Eng J Med 1992; 327:76-81. 29. Barst RJ, McGoon MD, McLaughlin V, Tapson V, Rich S, Rubin L, et al. Beraprost therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2003; 41:2119-25. 22. Fuster V, Steele PM, Edwards WD, Gersh BJ, McGoon MD, Frye RL. Primary pulmonary hypertension: natural history and the importance of thrombosis. Circulation 1984; 70:580-7. 30. Nagaya N, Uematsu M, Okano Y, Satoh T, Kyotani S, Sakamaki F, et al. Effect of orally active prostacyclin analogue on survival of outpatients with primary pulmonary hypertension. J Am Coll Cardiol 1999; 34: 1188-92. 23. Barst RJ, Rubin LJ, Long WA, McGoon MD, Rich S, Badesch DB, et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. The Primary Pulmonary Hypertension Study Group. N Eng J Med 1996; 334:296-302. 24. Badesch DB, McLaughlin VV, Delcroix M, Vizza CD, Olschewski H, Sitbon O, et al. Prostanoid therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43:S56-S61. 25. Olschewski H, Simonneau G, Galie N, Higenbottam T, Naeije R, Rubin LJ, et al. Aerosolized Iloprost Randomized Study Group. Inhaled iloprost for severe pulmonary hypertension. N Eng J Med 2002; 347:322-9. 26. Wensel R, Opitz CF, Ewer R, Bruch L, Kleber FX. Effects of iloprost inhalation on exercise capacity and ventilatory efficiency in patients with primary pulmonary hypertension. Circulation 2000; 101:2388-92. 27. Rimensberger PC, Spahr-Schopfer I, Berner M, Jaeggi E, Kalangos A, Friedli B, et alt. Inhaled NO versus aerosolized iloprost in secondary hypertension in children with con- 31. Galie N, Humbert M, Vachiery JL, Vizza CD, Kneussl M, Manes A, et al. Effects of beraprost sodium, an oral prostacyclin analogue, in patients with pulmonary arterial hypertension: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol 2002, 39:1496-502. 32. Channick RN, Sitbon O, Barst RJ Manes A, Rubin LJ. Endothelin receptor antagonists in pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43:S62-S67. 33. Barst RJ, Ivy D, Dingemanse J, Widlitz A, Schmitt K, Doran A, et al. Pharmacokinetics, safety, and efficacy of bosentan in pediatric patients with pulmonary arterial hypertension. Clin Pharmacol Ther 2003; 73: 372-82. 34. Barst RJ, Langleben D, Frost A, Horn EM, Oudiz R, Shapiro S, et al. Sitaxsentan therapy for pulmonary arterial hypertension. Am J Respir Crit Care Med 2004; 169: 4417. 35. Ghofrani HA, Pepke-Zaba J, Barbera JA, Channick R, Keogh AM, Gómez-Sánchez MA, et al. Nitric oxide pathway and phosp- Libro II curso 31/1/05 17:26 P gina 209 Hipertensión pulmonar hodiesterase inhibitors in pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43:S68-S72. 36. Clark RH, Kueser TJ, Walker MW, Southgate WM, Huckaby JL, Perez JA, et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. Clinical Inhaled Nitric Oxide Research Group. N Engl J Med 2000; 342: 469-74. 37. Klepetko W, Mayer E, Sandoval J, Trulock EP, Vachiery JL, Dartevelle P, et al. Interventional and surgical modalities of treatment for pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43 (12 Suppl 1): S73-S80. 209 38. Boucek MM, Edwards LB, Keck BM, Trulock EP, Taylor DO, Hertz MI. Registry for the International Society for Heart and Lung Transplantation: seventh official pediatric report-2004. J Heart Lung Transplant 2004; 23:933-47. 39. Conte JV, Gaine SP, Orens JB, Harris T, Rubin LJ. The influence of continuous intravenous prostacyclin therapy for primary pulmonary hypertension on the timing and outcome of transplantation. J Heart Lung Transplant 1998; 17:679-85. 40. Girgis RE, Li D, Zhan X, Garcia JG, Tuder RM, Hassoun PM, et al. Attenuation of chronic hypoxic pulmonary hypertension by simvastain. Am J Heart Cir Physiol 2003;285:938-45. Libro II curso 31/1/05 17:26 P gina 210 Libro II curso 31/1/05 17:26 P gina 211 Fibrobroncoscopia en pediatría A. Escribano Montaner Unidad de Neumología Infantil. Hospital Clínico Universitario. Valencia RESUMEN La broncoscopia es una técnica que permite el diagnóstico e incluso el tratamiento de niños con patología respiratoria aguda o crónica de naturaleza no aclarada que, desde que fue introducida en pediatría a principio de la década de los 80, se ha trasformado en un procedimiento habitual en las Unidades de Neumología Infantil. A pesar de ello, no todos los pediatras conocen sus aplicaciones y las posibilidades que ofrece. En este capítulo se pretende recoger las principales aportaciones llevadas a cabo en este campo, los avances conseguidos y los retos futuros, haciendo hincapié en sus indicaciones, contraindicaciones, complicaciones y rendimiento. Libro II curso 31/1/05 17:26 P gina 212 212 INTRODUCCIÓN En la actualidad, la fibrobroncoscopia es un técnica totalmente asentada en la práctica neumológica asistencial del adulto, de la que cualquier médico conoce sus aplicaciones y rendimiento. En la infancia, se ha ido consolidando a lo largo de los últimos años como un procedimiento habitual en la mayor parte de las unidades respiratorias pediátricas, a pesar de lo cual, sigue siendo todavía en muchos aspectos, una gran desconocida para el pediatra que, o bien la identifica exclusivamente con la extracción de cuerpos extraños, o ignora, en muchos casos, sus enormes posibilidades. Es por eso muy importante que el residente de pediatría acabe su formación habiéndose familiarizado con ella, para que, posteriormente, pueda utilizarla adecuadamente en su vida profesional. HISTORIA Aunque el intento de acceder directamente a las vías aéreas se remonta al año 1828, cuando Buj Babington visualiza por primera vez la laringe con un laringoscopio, el origen de la broncoscopia se sitúa en 1897, cuando Gustav Killian, otorrinolaringólogo alemán, realiza el primer estudio endoscópico del árbol bronquial, utilizando un espejo de cabeza como fuente de luz, un esofagoscopio y un fórceps para extraer un hueso de cerdo enclavado en el bronquio principal derecho en un paciente de edad(1). A raíz de este suceso, A. Escribano Montaner Killian se hizo famoso como experto en la extracción de cuerpos extraños y su clínica atrajo a pacientes y a médicos de todo el mundo que comenzaron a generalizar su técnica. El siguiente gran avance fue logrado en 1904 por Chevalier Jackson, en Filadelfia, al presentar un endoscopio con iluminación distal, al que adaptó un canal de aspiración, logrando, así, reducir significativamente la mortalidad que se cifraba entonces en un 25%. Su principal aplicación siguió siendo la extracción de cuerpos extraños, pero, posteriormente, tras incorporar un sistema de lentes telescópicos en diferentes ángulos, se consiguió mejorar la imagen, permitiendo ampliar sus aplicaciones a la localización de hemoptisis y de otras lesiones endobronquiales(1). En 1966, el profesor H. H. Hopkins, inventó un sistema de lentes de vidrio engarzados entre sí para trasmitir la luz. Este sistema de fibra óptica un a vez perfeccionado revolucionó el examen endoscópico, consiguiendo trasmitir imágenes desde un extremo a otro del haz de luz, proveyendo una visión panorámica con imágenes contrastadas, brillantes y con color, que fue presentado por el Profesor Dr. Shigeto Ikeda en el “9th International Congress of Diseases of the Chest” en Copenague 1966(1), convirtiéndose desde entonces en uno de los procedimientos más útiles y populares en el estudio de las enfermedades pulmonares del adulto. En Pediatría, debido a las dificultades para desarrollar instrumentos suficientemente pequeños para acceder a las vías aéreas del niño, no se dispuso de un bron- Libro II curso 31/1/05 17:26 P gina 213 Fibrobroncoscopia en pediatría coscopio flexible hasta finales de 1978, cuando se diseñó el que sería el prototipo de fibrobroncoscopio pediátrico, con un diámetro de 3,5 mm y un canal de succión de 1,2 mm. Este instrumento fue comercializado en 1980. DESARROLLO DE LA FIBROBRONCOSCOPIA En España, el desarrollo de la fibrobroncoscopia infantil ha ido parejo al desarrollo de la neumología pediátrica, ya que fue también a finales de la década de los 70, cuando algunos pioneros de nuestra especialidad (E. Tardío, N. Cobos, S. Liñán, N. Lambruschini.), por aquel entonces sólo existente en algunos grandes hospitales, celebraron en Tarragona la 1ª Reunión de pediatras interesados en la creación de la Sección de Neumología Pediátrica, consiguiendo que fuera aceptada como tal por la Asamblea de la AEP. Hasta aquel momento la técnica broncoscópica se limitaba al manejo del broncoscopio rígido, para la extracción de cuerpos extraños enclavados en la vía aérea por parte, fundamentalmente, de otorrinolaringólogos o cirujanos y sólo de algunos pediatras que habíamos tenido la oportunidad de aprender a utilizarlo. Por eso se recibieron con tanto interés las aportaciones de algunos de estos especialistas sobre la utilización del broncoscopio flexible en niños, tanto para explorar los bronquios(3), como para valorar la obstrucción de la vía aérea superior y media(4). A ellas se sumó enseguida la primera pu- 213 blicación de Wood(5) sobre la aplicación de esta técnica en pediatría, lo que abría para nosotros un amplio campo de posibilidades, que no comenzaron a ser reales, como práctica habitual, hasta varios años después, a lo largo de la siguiente década, primero fuera de España y después en nuestro país. Fuera de España, algunos artículos de aquel entonces ilustran los pasos que fuimos dando como pediatras en el dominio de una técnica que, en los adultos, estaba ya totalmente consolidada. Inicialmente la mayor parte se centraron en demostrar la seguridad y rentabilidad del procedimiento en cualquier grupo de edad (6,7,8), incluso en los más pequeños(9,10). Posteriormente, esta exploración se extendió a los neonatos con la utilización de un nuevo fibrobroncoscopio ultrafino de 2,7 mm(11) y a los niños críticamente enfermos ingresados en la UCI (12). Por último, se publican las primeras series sin el uso de anestesia general(13,14). En España la primeras publicaciones aparecen en la década de los 90 y es Pérez Frías el que inicia esta información(15,16). Posteriormente, otros grupos, tanto de cirujanos pediátricos(17), como de neumólogos infantiles (18), aportan también su experiencia; en 1997 se elige como tema de una de las mesas en la XIX Reunión Nacional de la SENP(19) y en 1998, llega a ser motivo de un editorial en Anales Españoles de Pediatría(20). Por último, recientemente, es de nuevo Pérez Frías el que recopila los resultados de toda la década(21). Libro II curso 31/1/05 17:26 P gina 214 214 NORMATIVAS El primer protocolo pediátrico dedicado a este tema fue publicado en 1992, por la American Thoracic Society(22). En él se regularizan todos los aspectos de la técnica: equipo y preparación, monitorización, indicaciones y contraindicaciones, sedación y anestesia tópica, y complicaciones. En Europa, los primeros pasos se dieron en 1995, cuando el grupo de Broncología de la Asamblea Pediátrica de la Sociedad Respiratoria Europea (ERS) realizó una encuesta entre sus miembros, para obtener información sobre quién, cuándo y cómo se practicaba esta técnica(23). Los resultados, aunque dispares, sirvieron para conocer el estado de la cuestión. Sin embargo, hasta el año 2000 no se contaba con ninguna documentación oficial, siendo entonces cuando se publica la primera normativa europea, dedicada al lavado broncoalveolar (LBA) y que, probablemente, tardó tanto tiempo en ser presentada por la dificultad de contar con estudios realizados en la población infantil sana. Esta guía, elaborada por el Grupo de Trabajo en LBA en niños de la ERS(24), recoge exhaustivamente la metodología de la técnica y los valores de referencia para la población infantil, aspectos que posteriormente fueron incluidos en la ya definitiva normativa europea sobre fibrobroncoscopia pediátrica publicada el año 2003, en el European Respiratory Journal por este mismo grupo(25). En España tampoco nos hemos quedado atrás. En este momento se ofertan A. Escribano Montaner cada dos años, bajo el patrocinio de la SENP, dos cursos teórico-prácticos de broncoscopia infantil, uno desde el año 2002, dirigido por el equipo de Pérez Frías en el Hospital Carlos Haya de Málaga y el otro, desde el año 2000, por los equipos de Cirugía Pediátrica y Neumología Infantil del Hospital Doce de Octubre de Madrid. El primero de ellos ha dado lugar a la edición de dos monografías que recopilan sus contenidos y que, a su vez, han servido de base para que el Grupo de Trabajo de Técnicas de la SENP elaborase el primer protocolo español sobre fibrobroncoscopia infantil(26). A través de este análisis podemos darnos cuenta del camino recorrido, de los avances logrados, y de que, en este momento, la fibrobroncoscopia ya no se ve como en un principio, como algo lejano y desconocido de la que se ignora casi todo lo que puede aportar y que se proponía sólo en casos muy seleccionados. La experiencia diaria nos ha hecho ver que es una técnica rentable, relativamente fácil de aplicar, sin apenas complicaciones y que siempre ofrece información diagnóstica o terapéutica. Los que la practicamos solemos comentar que, cuando la efectuamos en alguno de nuestros pacientes, de lo único que podemos arrepentirnos es de no haberla indicado antes. APLICABILIDAD Y RENTABILIDAD Tipos de fibrobroncoscopios Actualmente existen broncoscopios rígidos con diámetros internos de 2,5 a 7 mm y de 20 a 50 cm de longitud, lo que per- Libro II curso 31/1/05 17:26 P gina 215 Fibrobroncoscopia en pediatría mite su utilización en todas las edades pediátricas. Se cuenta, además, con cuatro tamaños de broncoscopios flexibles para ser aplicados en niños. El prototipo pediátrico tiene un diámetro externo de 3,5-3,6 mm y un canal de trabajo de 1,2 mm por lo que puede ser usado desde el período neonatal, en recién nacidos (RN) a término, hasta en niños mayores. Los broncoscopios ultrafinos amplían su aplicación a RN pretérminos y de bajo peso, aunque el menor de ellos, de 2,2 mm de diámetro, no cuenta con canal de succión, por lo que sólo puede ser empleado en maniobras de exploración. En la tabla 1 se resumen las características de cada uno de ellos. Broncoscopio rígido versus broncoscopio flexible En general, se prefiere la broncoscopia flexible a la rígida por su mayor sencillez y maniobrabilidad. La broncoscopia rígida es sólo superior a la flexible en las extracciones de cuerpos extraños, hemoptisis masivas, sospecha de fístula traqueoesofágica en H, casos de hendidura laringoesofágica, parálisis abductora bilateral de cuerdas vocales(27) y manejo de lesiones estenóticas u obstructivas de la vía aérea(28), pero, en general, la elección de una u otra en casos concretos, va a depender de la disponibilidad del equipo y del entrenamiento del endoscopista(28). Idealmente, los broncoscopistas deberían saber manejar con igual destreza ambas, pero en cualquier caso, tal como propone Norris(3), el trabajo en equipo de pediatras experimentados en ambas técnicas podría sumar las ventajas de los dos. En oca- 215 siones el empleo conjunto de los dos es necesario para lograr objetivos diagnósticos o terapéuticos, sobre todo, en los niños de menor edad(6) y en los casos en que se sospecha una aspiración de cuerpo extraño(29). Las ventajas y desventajas de uno frente al otro quedan indicadas en la tabla 2. Principales indicaciones en niños En general, la mayor parte de broncoscopistas pediátricos(17,18,21,27,30) coincidimos en el tipo de patología que suele decidir su utilización, siendo el estridor, junto a las atelectasias o/y neumonías persistentes o recidivantes, las que con más frecuencia inducen su realización. La prevalencia de uno u otras en las distintas series, depende de que la técnica haya sido efectuada o no, por los otorrinolaringólogos. Las sibilancias persistentes, la tos crónica o inusual, la sospecha de aspiración bronquial de cuerpo extraño o la valoración de problemas asociados a intubación son otras de las indicaciones más comunes(22,25,26,30). En cualquier caso, sea cual sea la indicación, hay que tener presente que el niño puede tener más de una lesión significativa, por lo que siempre se ha de examinar por completo la vía aérea(27). En muchas otras ocasiones la fibrobroncoscopia se plantea para obtener muestras de secreciones de vías bajas, para cultivo o recuento celular, ya sea mediante broncoaspirado, lavado broncoalveolar(24) o cepillado bronquial. Por último, la realización de biopsias, bronquiales o transbronquiales, es un método utilizado cada vez más en pediatría(31), relativamente no invasivo y seguro(32), que permite moni- Libro II curso 31/1/05 17:26 P gina 216 216 A. Escribano Montaner TABLA 1. Fibrobroncoscopios aplicables en la edad pediátrica. Diámetro externo Canal de trabajo Edad Utillaje 4,8-4,9 mm 2-2,2 mm > 4 años (> 20-25 kg) TET* ≥ 6,5 mm Pinzas biopsia Catéteres y cepillos protegidos 3,5-3,6 mm* 1,2 mm* RN término (≥ 3,5 kg) TET* ≥ 5mm Pinzas biopsia No catéteres protegidos 2,8-3,1 mm 1,2 mm RN términopretérmino TET* ≥ 2,5 mm Pinzas biopsia No catéteres protegidos 2,2 mm No contiene Pretérminos TET* ≥ 2,5 mm *: tubo endotraqueal TET: tubo endotraqueal TABLA 2. Ventajas y aplicaciones del broncoscopio rígido y del fibrobroncoscopio. BRONCOSCOPIO RÍGIDO FIBROBRONCOSCOPIO Ventajas Ventajas Gran canal de trabajo, que permite ventilar al paciente y utilizar instrumentos terapéuticos Mayor maniobrabilidad y alcance de bronquios distales Mayor resolución de la imagen Ventilación espontánea/sedación Mejor visión de la faringe posterior y de la tráquea Posibilidad de introducción a través vía aérea artificial Indicaciones Indicaciones Extracción de cuerpos extraños Hemoptisis masivas Realización de biopsias, dilataciones Empleo de láser Signos/síntomas respiratorios/alteraciones radiográficas persistentes/preocupantes de etiología no clara Patología respiratoria neonatal Seguimiento de trasplantados de pulmón torizar los episodios de rechazo agudo en los pacientes trasplantados de pulmón(33), ayudar al diagnóstico de otras patologías pulmonares pediátricas(34), y evitar así, en muchos casos, la necesidad de realizar una toracotomía(35,36). Libro II curso 31/1/05 17:26 P gina 217 Fibrobroncoscopia en pediatría Contraindicaciones y complicaciones Se puede considerar que no existen contraindicaciones absolutas, aunque se podrían plantear en los casos de grave coagulopatía o diátesis hemorrágica, broncoobstrucción severa, hipoxemia refractaria o inestabilidad hemodinámica(28). Por otro lado, si la información que se va a obtener puede conseguirse por métodos menos invasivos, la endoscopia estaría contraindicada. No son frecuentes tampoco las complicaciones, que, además, se pueden minimizar cuando el procedimiento se efectúa por un equipo experimentado. Cuando se producen suelen estar ligadas a la sedación o al uso de anestésicos tópicos (desaturaciones más o menos pasajeras(37), -más frecuentes en los niños menores de 2 años de edad y en las anomalías laringotraqueales (38) -, arritmias, laringoespasmo o broncoespasmo(39)) y, con menor frecuencia, por pequeñas lesiones ligadas al paso del fibrobroncoscopio o a la realización de biopsias (epistaxis, hemorragias en la mucosa bronquial...). Raramente se describen neumotórax. Quizás una de las complicaciones más frecuentes sea la aparición de fiebre transitoria tras la realización de un lavado broncoalveolar (en el 18,8% de los casos, según De Blic(38) fundamentalmente, en los niños inmunodeprimidos, que tienen cultivos positivos en el LBA(40) o en los menores de dos años. Sin embargo las infecciones ligadas o provocadas por la propia técnica son muy raras si se utilizan los protocolos de limpieza instrumental adecuados. 217 Rendimiento La mayoría de las series aportan un significativo beneficio diagnóstico o terapéutico (entre 70(17) y 94%(12)) o comprueban que motivaron cambios en el tratamiento del paciente (entre el 26(13) y el 68%(14)). El rendimiento es especialmente alto en los niños con estridor en donde se llega al diagnóstico en, al menos, 15% de los casos(30,39), aunque en los neonatos puede alcanzar el 96%(41). Otro importante campo de aplicación lo constituye la tos crónica o las sibilancias persistentes(42) en donde es común el hallazgo de cuerpos extraños no sospechados, de colapso dinámico de la vía aérea (traqueo o/y broncomalacia), de compresiones traqueales o bronquiales extrínsecas (vasculares o adenopáticas) o de lesiones intrínsecas (estenosis bronquial). En los niños con neumonías o/y atelectasias recurrentes o persistentes puede tener no sólo un papel diagnóstico, sino terapéutico(43). La utilización del lavado broncoalveolar aumenta el rendimiento de la técnica(39,44), sobre todo, en los pacientes inmunocomprometidos, y es también especialmente útil en lactantes y niños pequeños con fibrosis quística(45), incapaces de producir esputo(46). El fibrobroncoscopio es particularmente útil en el manejo de pacientes con vía aérea artificial, intubaciones difíciles o fallos en la extubación. En estos casos el broncoscopio ultrafino 2,2 mm pueden ser utilizado con tubos endotraqueales de 2,5 mm consiguiendo no sólo el objetivo trazado, sino la evaluación anatómica de la vía aérea. Lo mismo ocurre cuando se tra- Libro II curso 31/1/05 17:26 P gina 218 218 ta de extubar a niños con problemas, asegurando, así, la reintubación si fuera necesaria. Entre las aplicaciones terapéuticas de broncoscopio flexible se ha visto que puede tener éxito la utilización de sustancias adhesivas para cerrar fístulas broncopleurales, introduciéndolas a través de un catéter de teflón, por el canal de succión(47). Del mismo modo, aunque la aplicación del broncoscopio rígido para la extracción de cuerpos extraños ha demostrado su alta rentabilidad y es el método elegido en los casos de diagnóstico claro(48), artículos recientes propugnan la utilización del broncoscopio flexible como un método seguro con mínimos riesgos y complicaciones(49). En estos casos, tal y como hemos comentado anteriormente, lo más aconsejable sería tener preparados los dos y utilizar uno u otro en función de las necesidades. Aspectos a desarrollar Un apartado que merece la pena comentar es el papel de la broncología intervencionista en pediatría. Durante la pasada década un buen número de las técnicas intervencionistas utilizadas en el adulto comenzaron a ser aplicadas en pacientes pediátricos. Tal es el caso de la broncoscopia láser(50), la dilatación con balón, la colocación de stents(51) y los lavados broncoalveolares de gran volumen para el tratamiento de trastornos de ocupación alveolar masiva(27). En ellas pueden utilizarse, tanto el fibrobroncoscopio, como el broncoscopio rígido. La broncoscopia láser se ha efectuado en niños de forma segura y eficaz. El láser A. Escribano Montaner de CO2 se ha empleado para tratar distintos tipos de patología traqueobronquial: estenosis secundaria a traumas o/y ventilación mecánica neonatal, granulomas postraumáticos (cuerpos extraños, traqueotomías) o de origen infeccioso (tuberculosis), o en raros casos de tumores traqueobronquiales(52). Las dilataciones con balón, se pueden llevar efectuar, tanto con broncoscopio rígido, como con fibrobroncoscopio, incluso el primero se ha utilizado a veces, por sí mismo, como instrumento dilatador de estenosis de la vía aérea. La utilización del balón es más apropiada en las estenosis de escasa longitud, aunque cualquier procedimento dilatador puede ser efectivo si la causa de la estenosis es membranosa o pseudomembranosa y de pequeña longitud. Las constricciones transmurales o más largas, requieren tratamiento quirúrgico o la colocación de un stent(53). Los stents de la vía aérea, hechos de metal, silicona u otros materiales, están disponibles en varias formas y tamaños. Pueden colocarse en la vía aérea obstruida, para aliviar los síntomas provocados por alteraciones benignas o malignas. Son más efectivos en los problemas traqueales y de los bronquios principales, que en aquéllos que afectan a los bronquios lobares o distales. Se han empleado stents metálicos expandibles para aliviar traqueomalacias o broncomalacias en pacientes seleccionados, pero su uso en niños es poco común y se debe plantear sólo cuando otras alternativas han fracasado(54), ya que no están exentos de riesgo(55). Libro II curso 31/1/05 17:26 P gina 219 219 Fibrobroncoscopia en pediatría BIBLIOGRAFÍA 1. Saeed AH. The History of broncoscopy- an Overview. In: Bronchology. Past, Present and Future Diagnostic Procedures. Saeed AH. , Tuttlingen Germany: Ed. Endo-Press 2000; p. 4-7. 2 Wood RE, Sherman JM. Pediatric flexible bronchoscopy. Ann Otol Rhinol Laryngol 1980; 89:414-6. 3. Norris CM. Current developments in bronchoscopy. The role of the flexible fiberscope. J Otolaryngol 1976; 5:193-202. 4. Vauthy PA, Reddy R. Acute upper airway obstruction in infants and children. Evaluation by the fiberoptic bronchoscope. Ann Otol Rhinol Laryngol 1980; 89:417-8. 5. Wood RE, Fink RJ. Applications of flexible fiberoptic bronchoscopes in infants and children. Chest 1978; 73:737-40. 6. Labbe A, Dalens B. Bronchial fiberscopy in infants and children. Technics. Applications. Poumon Coeur 1982; 38:217-20. 7. Hopkins RL. Pediatric flexible fiberoptic bronchoscopy. J La State Med Soc 1984; 136:23-4. 8. Wood RE, Postma D. Endoscopy of the airway in infants and children. J Pediatr 1988; 112:1-6. 9. Nussbaum E. Flexible fiberoptic bronchoscopy and laryngoscopy in children under 2 years of age: diagnostic and therapeutic applications of a new pediatric flexible fiberoptic bronchoscope. Crit Care Med 1982; 10:770-2. 10. Nussbaum E. Flexible fiberoptic bronchoscopy and laryngoscopy in infants and children. Laryngoscope 1983; 93:1073-5. 11. Fan LL, Sparks LM, Dulinski JP. Applications of an ultrathin flexible bronchoscope for neonatal and pediatric airway problems. Chest 1986; 89:673-6. 12. Fan LL, Sparks LM, Fix FJ. Flexible fiberoptic endoscopy for airway problems in a pe- diatric intensive care unit. Chest 1988; 93: 556-60. 13. Raine J, Warner JO. Fibreoptic bronchoscopy without general anaesthetic. Arch Dis Child. 1991; 66:481-4. 14. Dubus JC, Garnier JM, Unal D, Giraud F. Endoscopic bronchial exploration under local anesthesia in children. Pediatrie 1992; 47:839-44. 15. Pérez-Frías J, Pérez-Ruiz E, Durán Hidalgo I, Milano Manso G, Martínez Valverde A. Fibro-broncoscopia sin anestesia general en pacientes pediátricos. An Esp Pediatr 1992; 37:42-6. 16. Pérez-Frías J, Pérez-Ruiz E, González B, Picazo B, Martínez Valverde A. Fibro-broncoscopia infantil. Adaptación a los consensos de la American Thoracic Society. Arch Bronconeumol 1993; 29:73-76. 17. Bautista Casasnovas A, Estévez Martínez E, Buznego Sánchez R, Rodríguez Pérez E, Cabanas Gancedo R, Varela Cives R. Fibrobroncoscopia pediátrica. A propósito de 55 niños examinados. An Esp Pediatr 1993; 39:313-6. 18. Andrés Martín A, Pineda Mantecón M, Fernández Recuero J. Fibrobroncoscopia pediátrica. Nuestra experiencia. Arch Bronconeumol 1995; 31:519-25. 19. Mesa Redonda: “Fibrobroncoscopia en Pediatría”. An Esp Pediatr 1997; Supl 90: 334. 20. Liñán Cortés. Broncofibroscopia en neumología pediátrica. An Esp Pediatr 1998; 49:113-115. 21. Pérez-Ruiz E, Pérez-Frías J, Martínez-González B, Martínez-Arán T, Milano-Manso G, Martínez-Valverde A. Fibrobroncoscopia pediátrica Análisis de una década. An Esp Pediatr 2001; 55:421-8. 22. ATS. Flexible endoscopy of the pediatric airway. Am Rev Resp Dis 1992; 145:233-235. Libro II curso 31/1/05 17:26 P gina 220 220 23. Barbato A, Magarotto M, Crivellaro M, Novello A Jr, Cracco A, de Blic J, et al. Use of the paediatric bronchoscope, flexible and rigid, in 51 European centres. Eur Respir J 1997; 10:1761-6. 24. de Blic J, Midulla F, Barbato A, Clement A, Dab I, Eber E, et al. Bronchoalveolar lavage in children. ERS Task Force on bronchoalveolar lavage in children. European Respiratory Society. Eur Respir J 2000; 15:217-31. 25. Midulla F, de Blic J, Barbato A, Bush A, Eber E, Kotecha S, et al. ERS Task Force. Flexible endoscopy of paediatric airways. Eur Respir J 2003; 22:698-708. 26. Pérez Ruiz E, Barrio Gómez De Aguero MI. Broncoscpoia flexible en niños: Indicaciones y consideraciones generales. An Pediatr (Barc) 2004; 60:354-66. 27. Wood RE. The emergency role of flexible bronchoscopy in pediatrics Clin Chest Med 2001; 22:311-17. 28. Wood R E. Bronchoscopy. En: Kending’s Disorders of the Respiratory Tract in Children. Sixth Edition. Chernick V, Boat TF Eds and Kending EL Consulting Ed. Co, Philadelphia: WB Saunders 1998; p. 129- 142. 29. Wood RE, Gauderer MW. Flexible fiberoptic bronchoscopy in the management of tracheobronchial foreign bodies in children: the value of a combined approach with open tube bronchoscopy. J Pediatr Surg 1984; 19:693-8. 30. Sánchez I, Pesce C, Navarro H, Holmgren L, Bertrand P, Álvarez C. Experiencia en 10 años de aplicacion de fibrobroncoscopia en pacientes pediátricos. Rev Med Chil 2003; 131:1266-72 31. Jeffery P, Holgate S, Wenzel S. Methods for the assessment of endobronchial biopsies in clinical research: application to studies of pathogenesis and the effects of treatment. Am J Respir Crit Care Med 2003; 168:S1-17. 32. Salva PS, Theroux C, Schwartz D. Safety of endobronchial biopsy in 170 children with chronic respiratory symptoms. Thorax 2003; A. Escribano Montaner 58:1058-60. 33. Whitehead BF. Endoscopic monitoring of lung transplantation. Pediatr Pulmonol 1997; Suppl 16:103-4. 34. Whitehead BF. Bronchoscopic lung biopsy in pediatric patients. J Bronchol 1999; 6:4854. 35. McDougall JC, Cortese DA. Bronchoscopic lung biopsy. En: Prakash UBS, editor. Bronchoscopy. New York: Raven Press, Ltd., 1994; p. 141-6. 36. Villeneuve MR, Kvale P. Transbronchial lung biopsy. En: Feinsilver SH, Fein AM, (eds.). Textbook of bronchoscopy. Baltimore: Williams & Wilkins, 1995; p. 58-84. 37. Schnapf BM. Oxygen desaturation during fiberoptic bronchoscopy in pediatric patients. Chest 1991; 99:591-4. 38. de Blic J, Marchac V, Scheinmann P. Complications of flexible bronchoscopy in children: prospective study of 1,328 procedures. Eur Respir J 2002; 20:1271-6. 39. Wood RE. Spelunking in the pediatric airways: Explorations with the flexible fiberoptic bronchoscope. Pediatr Clin North Am 1985; 31:785. 40. Picard E, Schwarts S, Goldberg S, Glick T, Villa Y, Kerem E. A Prospective Study of Fever and Bacteremia After Flexible Fiberoptic Bronchoscopy in Children. Chest 2000; 117:573- 9. 41. Pérez CR, Wood RE. Update on pediatric bronchoscopy. Pediatr Clin N Amer 1994; 41:385-400. 42. Schellhase DE, Fawcett DD, Schutze GE, Lensing SY, Tryka AF. Clinical utility of flexible bronchoscopy and bronchoalveolar lavage in young children with recurrent wheezing. J Pediatr 1998; 132:3128. 43. Nussbaum E. Pediatric flexible bronchoscopy and its application in infantile atelectasis. Clin Pediatr 1985; 24:379-82 Libro II curso 31/1/05 17:26 P gina 221 Fibrobroncoscopia en pediatría 44. Godfrey S, Avital A, Maayan C, Rotschild M, Springer C. Yield from flexible bronchoscopy in children. Pediatr Pulmonol 1997; 23:261-9. 45. Muhlebach Ms, Stewart PW, Leigh MW, Noah TL. Quantitation of Inflammatory Responses to Bacteria in Young Cystic Fibrosis and Control Patients. Am J Respir Crit Care Med 1999; 160:186-91. 46. Rosenfeld M, Emerson J, Accurso F, Armstrong D, Castile R, Grimwood K, et al. Diagnostic accuracy of oropharyngeal cultures in infants and young children with cystic fibrosis. Pediatr Pulmonol 1999; 28:321-8 47. López MF, Pires J, Nogueria Brandao A, Reis A, Morais Leitao L. Endoscopic obliteration of a recurrent tracheoesophageal fistula with enbucrilate and polidocanol in a child. Surg Endosc 2003; 17:657. 221 50. Rimell FL. Pediatric laser bronchoscopy. Int Anesthesiol Clin 1997; 35:107-13. 51. Prasad M, Bent JP, Ward RF, April MM. Endoscopically placed nitinol stents for pediatric tracheal obstruction. Int J Pediatr Otorhinolaryngol 2002; 66:155-60. 52. Ayache D, Wagner I, Denoyelle F, Garabedian EN. Use of the carbon dioxide laser for tracheobronchial pathology in children. Eur Arch Otorhinolaryngol 2000; 257:287-9. 53. Pérez Frías J, Pérez Ruiz E, Cordón Martínez A, Serrano C. Broncoscopia, del clasicismo al siglo XXI. Una historia de la fibrobroncoscopia pediátrica. En: Fibrobroncoscopia pediátrica. Pérez Frías J, Pérez Ruiz E, Cordón Martínez A. Madrid: (eds.). Ergon, 2004; p. 1-6. 48. Baharloo F, Veyckemans F, Francis C, Biettlot MP, Rodenstein DO. Tracheobronchial foreign bodies: presentation and management in children and adults. Chest 1999; 115:1357-62. 54. Furman RH, Backer CL, Dunham ME, Donaldson J, Mavroudis C, Holinger LD. The use of balloon-expandable metallic stents in the treatment of pediatric tracheomalacia and bronchomalacia. Arch Otolaryngol Head Neck Surg. 1999; 125:203-7. 49. Swanson KL, Prakash UB, Midthun DE, Edell ES, Utz JP, McDougall JC, Brutinel WM. Flexible bronchoscopic management of airway foreign bodies in children. Chest 2002; 121: 1695-700. 55. Stotz WH, Berkowitz ID, Hoehner JC, Tunkel DE. Fatal complication from a balloon-expandable tracheal stent in a child: a case report. Pediatr Crit Care Med 2003; 4:115-7. Libro II curso 31/1/05 17:26 P gina 222 Libro II curso 31/1/05 17:26 P gina 223 Fibrosis Quística N. Cobos Barroso, S. Gartner, A. Moreno Galdó Unidad de Neumología Pediátrica y Fibrosis Quística. Hospital Vall d’Hebron. Barcelona RESUMEN La fibrosis quística (FQ) es la enfermedad hereditaria autosómica recesiva grave más frecuente de la raza Caucásica. Según estudios efectuados en Cataluña, la prevalencia en nuestro país es de 1/5.240 recién nacidos. A lo largo de los últimos años las perspectivas de vida de los pacientes han aumentado extraordinariamente, situandose en estos momentos en una media de más de 40 años. Las bases fisiopatológicas de la enfermedad se basan en un trastorno del transporte iónico en las células epiteliales y una sepsis bronquial crónica por la Pseudomonas aeruginosa. El pronóstico de la enfermedad depende del grado de afectación respiratoria. El diagnóstico de la FQ se basa en criterios clínicos, en el test del sudor y en el estudio genético El tratamiento de la enfermedad se fundamenta en la fisioterapia respiratoria y en el tratamiento de la infección broncopulmonar. Tratamientos de apoyo se efectúan con broncodilatadores y antiinflamatorios. La insuficiencia pancreática que acompaña a la inmensa mayoría de los enfermos, se controla con la administración de enzimas pancreáticas. En el momento actual, las directrices terapéuticas se dirigen al tratamiento precoz y agresivo de la primocolonicazión por Pseudomonas aeruginosa en un intento de lograr su erradicación, evitándose, así, la colonización crónica por dicho germen. Libro II curso 31/1/05 17:26 P gina 224 224 INTRODUCCIÓN La fibrosis quística (FQ) es la enfermedad hereditaria autosómica recesiva grave más frecuente de la raza Caucásica. Es una enfermedad compleja que afecta a las glándulas exocrinas dando lugar a una amplia variedad de manifestaciones clínicas y de complicaciones. Los resultados obtenidos de los estudios epidemiológicos y de detección precoz neonatal, demuestran gran variabilidad en la incidencia de la FQ entre diferentes países y razas. Algunas publicaciones señalan una incidencia de 1 por 2.000 a 1 por 5.200 en EE.UU., de 1 por 3.500 en algunas regiones de Italia, de 1 por 4.700 en Dinamarca(1). En Cataluña, el cribaje neonatal efectuado sobre más de 200.000 recién nacidos ha demostrado una incidencia de 1 por 5.2402. La importante morbimortalidad de esta enfermedad está relacionada con la afectación pulmonar y sus complicaciones que son responsables del 95% de los fallecimientos de los sujetos que la padecen. En la década de los 50 los niños afectos fallecían antes de los 2 años de edad, en la década de los 70 la media de supervivencia se incrementó a los 15 años. En la actualidad la media es de algo superior a los 30 años en la mayoría de los centros de los diferentes países. En Gran Bretaña y Dinamarca para los nacidos en la década de los 90 existe actualmente una expectativa de vida de más de 40 años. Entre los múltiples factores que se consideran responsables de esta evolución tan positiva, destacan el diagnóstico precoz, N. Cobos Barroso, et al. la utilización de los modernos antibióticos antipseudomonas, el control adecuado de los trastornos nutritivos, los modernos métodos de rehabilitación respiratoria, y particularmente el hecho de que los enfermos se traten en unidades especiales dedicadas a esta patología. Todo esto hace que la FQ haya pasado de ser una enfermedad que afectaba sólo a los niños a formar parte de las enfermedades que también afectan a los adultos. IDENTIFICACIÓN DEL GEN DE LA FQ Y SUS MUTACIONES Uno de los avances más importantes en esta enfermedad se relaciona con la identificacion y clonaje del gen responsable de la FQ en 1989, cuya secuencia, localizada en el brazo largo del cromosoma 7, codifica para una proteína de membrana denominada cystic fibrosis transmembrane regulator (CFTR). Aunque más de 800 mutaciones en este gen han sido ya identificadas, una mutación específica, la F508del, se encontró en el 70% de las muestras estudiadas en Estados Unidos. La mutación F508del es una deleción de tres pares de bases en el exón 10. Esto origina la deleción (delta) de un único aminoácido (fenilalanina, F) en la posición 508 de la CFTR. En España, la mutación F508del fue hallada sólo en el 50% de las muestras analizadas. La segunda mutación en frecuencia es la G542X. Las restantes mutaciones presentan frecuencias muy bajas, menos del 3%, siendo muchas de ellas únicas. En Libro II curso 31/1/05 17:26 P gina 225 225 Fibrosis quística la actualidad se han identificado alrededor de 70 mutaciones en la población española, que cubren el 90% de los cromosomas, con excepción del país vasco donde casi el 70% presenta la mutación F508del(3). La presentación clínica de la enfermedad, la gravedad y su ritmo de progresión varían considerablemente, lo cual podría estar relacionado con las diferentes mutaciones del gen. BASES FISIOPATOLÓGICAS DE LA ENFERMEDAD En la FQ, el defecto génico condiciona la síntesis de una proteína CFTR anómala, que es incapaz de regular correctamente el transporte iónico transcelular. A nivel de las células epiteliales normales se produce un transporte activo del cloro desde el intersticio hacia la luz, y de reabsorción de sodio en dirección opuesta. En la FQ se produce una relativa impermeabilidad de la membrana apical con respecto al cloro y un aumento en la reabsorción de sodio y agua, dando lugar a una hiperviscosidad del moco asociada a obstrucción bronquial y a una respuesta inflamatoria anormal con suceptibilidad a la infección endobronquial por bacterias específicas. Los macrófagos de las vías aéreas expresan una elevada cantidad de iL8 en respuesta a sustancias endógenas anormales (moco viscoso). La IL-8 es el quimiotáctico más potente de los neutrófilos, células claves en el desarrollo de la inflamación de las vías aéreas. Los neutrófilos liberan elastasa y radicales libres de oxígeno con un aumento del estrés oxidativo. Producen daño tisular. Además, la oxidación de las antiproteasas por los radicales libres disminuye su acción inhibitoria sobre la elastasa, produciendo mayor destrucción del tejido pulmonar. Se genera, así, un círculo vicioso que conduce a la formación de bronquiectasias, a la destrucción del parénquima pulmonar y a la insuficiencia respiratoria crónica e irreversible. Por consiguiente, el hecho fundamental que se produce en la FQ es la infección respiratoria crónica, que se puede iniciar ya en las épocas más tempranas de la vida y que, como se ha podido demostrar, juega un papel fundamental en la morbilidad y en la mortalidad de estos pacientes. Se considera que es la responsable del 90% de los fallecimientos(4). MECANISMOS DE LA INFECCIÓN PULMONAR CRÓNICA EN LA FQ Los pulmones del recién nacido son histológicamente normales. Sin embargo ,ya en los primeros meses de la vida algunos pacientes desarrollan una colonización bacteriana crónica endobronquial. En la fase inicial es característica la presencia de Haemophilus influenzae y /o Staphylococcus aureus. Posteriormente, la casi totalidad de los pacientes presenta colonización por Pseudomonas aeruginosa, que se asocia a un deterioro progresivo de la función pulmonar. Los mecanismos que dan como resultado la enfermedad de las vías aéreas en la FQ no están completamente dilucidados Libro II curso 31/1/05 17:26 P gina 226 226 y la relación entre la inflamación, la infección y la CFTR anormal no está clara todavía, pero si parece evidente que la FQ es una enfermedad en la que sus mecanismos de defensa innatos, son defectuosos. Durante los últimos años varios trabajos introdujeron el concepto de que la inflamación precede a la infección y por lo tanto ya está presente en pacientes con FQ en los primeros meses de la vida, y que jugaría un papel clave en el proceso de autodestrucción pulmonar. Este hecho no parece haberse confirmado y otros autores preconizan que la inflamación es una consecuencia de la infección(5,6). La hipótesis de los receptores celulares sugiere que los organelos celulares en la FQ son más ácidos o alcalinos que los organelos de las células normales y que este pH alterado reduce la sialisación de las glicoproteínas en las membranas de la células epiteliales(7). El aumento del número de moléculas asialoGM1, un receptor para muchas bacterias respiratorias patógenas, condiciona un aumento de los puntos de adherencia para la P. aeruginosa y el S. aureus. La hipótesis sal-defensinas se basa en que las células epiteliales de la FQ al igual que las de las glándulas sudoríparas aumentan la concentración luminal de sal y puesto que las defensinas (antimicrobianos segregados por las células epiteliales) se inactivan en los medios con concentraciones de sal mayores de 50 mmol/L las bacterias pueden multiplicarse en las superficies celulares(8). Finalmente, otra teoría que intenta relacionar el transporte iónico celular anómalo con la infección bacteriana es la que N. Cobos Barroso, et al. sugiere que el clearance mucociliar se halla alterado dado que el liquido periciliar que condiciona el normal tamaño y funcionamiento de los cilios ha perdido volumen y ha aumentado su viscosidad debido a la anormal absorción de sodio y al poco paso de cloro hacia la luz bronquial, a causa de la mala función de la CFTR alterada(9). Estos y otros hechos posiblemente desconocidos hacen que la prevalencia de la colonización por PA sea muy alta, tanto, que se considera que a partir de los 25-30 años, el 80% de los pacientes se hallan ya colonizados(10). Esto se explica por qué a partir de la colonización inicial en tan sólo 12 meses se considera que la colonización es ya crónica e irreversible. Existe pues un punto de “no retorno” a partir del cual el germen no puede ya ser erradicado del árbol respiratorio. Este punto parece estar muy relacionado con la activación de los genes de la PA que codifican para la producción de un exopolisacárido mucoide denominado alginato, formándose, así, microcolonias rodeadas en este biofilm de alginato que las hace menos susceptibles frente a los mecanismos de defensa del huésped y de los antibióticos. MANIFESTACIONES CLÍNICAS DE LA ENFERMEDAD La FQ es una enfermedad multisistémica que da lugar a una gran variabilidad clínica según la edad de presentación (Tabla 1). La mayor parte de los casos se diag- Libro II curso 31/1/05 17:26 P gina 227 Fibrosis quística TABLA 1. Manifestaciones clínicas de la enfermedad. Recién nacido Ileo meconial/ictericia prolongada Lactante hasta 2 años Anemia/hipoproteinemia Deshidratación hiponatrémica con alcalosis Esteatorrea Malabsorción Retraso de la curva pondoestatural Prolapso rectal Bronquitis obstructiva de repetición Infecciones respiratorias recurrentes Niño de 2 a 12 años Bronquitis obstructivas de repetición Neumonías de repetición Bronquiectasias Pólipos nasales Niño mayor de 13 años Enfermedad obstructiva crónica Sinusitis Pancreatitis recidivante. Diabetes Hipertensión portal Cirrosis biliar focal Obstrucción intestinal distal Esterilidad nostica en los primeros años de la vida: un 10% se presenta como íleo meconial en el período neonatal, y alrededor del 50% como bronquitis obstructivas a repetición. En edades posteriores se puede presentar en forma de neumonías recurrentes o de bronquitis crónica progresiva con el desarrollo de bronquiectasias que van evolucionando a una insuficiencia respiratoria. Las hemoptisis leves son relativamente fre- 227 cuentes a partir de la adolescencia. En cuanto a las manifestaciones digestivas el 85% de los pacientes presenta insuficiencia pancreática que ocasiona una malabsorción de nutrientes, y condiciona malnutrición y retraso del crecimiento. Algunos pacientes pueden permanecer prácticamente asintomáticos hasta la edad adulta, ya que las únicas manifestaciones de la enfermedad pueden ser infertilidad, pólipos nasales o pancreatitis. CARACTERÍSTICAS FUNCIONALES Y RADIOLÓGICAS DE LA AFECTACIÓN PULMONAR Una forma objetiva de evaluar la progresión de la enfermedad pulmonar es el estudio de la función pulmonar. La espirometría forma parte del control habitual de estos pacientes. El parámetro que se altera más precozmente es el que corresponde al flujo de las pequeñas vías aéreas. El FEV1 es el siguiente parámetro en alterarse a medida que el componente obstructivo progresa y es el principal parámetro evolutivo. Con la progresión de la enfermedad se va produciendo un incremento de las resistencias pulmonares, un atrapamiento aéreo y un componente restrictivo. La secuencias de las alteraciones en la radiología o en la tomografía computarizada están relacionadas con la fisiopatología y las alteraciones funcionales antes mencionadas, por lo que la primera evidencia de enfermedad respiratoria, suele ser una hiperinsuflación pulmonar y peribronquitis. Es frecuente la afectación del Libro II curso 31/1/05 17:26 P gina 228 228 lóbulo medio. A lo largo de la evolución el 100% de los pacientes presentan bronquiectasias, ya sea de tipo cilíndricas, saculares o quísticas. En las etapas avanzadas es característico la aparición de zonas de colapso y consolidaciones. COMPLICACIONES DE LA ENFERMEDAD PULMONAR La atelectasia lobar o segmentaria se presenta entre un 5-10% de los pacientes, especialmente adultos. Se producen por tapones de secreciones espesas o como complicación de una aspergilosis broncopulmonar alérgica (ABPA). Se debe instaurar un tratamiento agresivo de fisioterapia, broncodilatadores y antibióticos. Se ha empleado la DNAsa con éxito. EL 60% de los pacientes adultos presenta hemoptisis “minor” de manera recurrente. La hemoptisis masiva pone en peligro la vida del enfermo y requiere una embolización arterial de urgencia. El neumotórax predomina en la edad adulta. El tratamiento depende de su tamaño. La ABPA la presenta entre un 10-20% de los enfermos, y su diagnóstico se basa en criterios de laboratorio, clínicos, radiológicos y funcionales. El tratamiento de elección son los corticoides orales(11). El cor pulmonale y el fallo respiratorio son el estadio final de la enfermedad. DIAGNÓSTICO DE LA FQ El diagnóstico de la FQ se establece mediante criterios clínicos y de laboratorio N. Cobos Barroso, et al. (Fig. 1). Un test del sudor positivo y /o la presencia de dos mutaciones en el estudio genético, unido a íleo meconial o a enfermedad respiratoria crónica, o a una insuficiencia exocrina pancreática o a un cribaje neonatal positivo, o a una ausencia bilateral de conductos deferentes, o a una historia familiar positiva, confirman el diagnóstico(12). El test del sudor, descrito por Gibson y Cooke, se basa en la medición de la concentración de cloro en el sudor, mediante iontoforesis con pilocarpina. Se considera positiva cuando los niveles de cloro se hallan en una concentración superior a 60 mEg/L. En un pequeño grupo de pacientes la prueba del sudor puede tener valores dudosos (40-60 mEq/L) o incluso normales. La medición de la diferencia de potenciales de membrana es de gran ayuda para realizar el diagnóstico en este tipo de pacientes. TRATAMIENTO DEL PACIENTE CON FQ La detección precoz de la enfermedad permitirá la instauración de una terapéutica temprana a fin de enlentecer el progreso de la enfermedad, evitar las complicaciones y aumentar la supervivencia de estos pacientes. Dado que se trata de una enfermedad multisistémica, el tratamiento de estos pacientes se debe realizar en centros especializados multidisciplinarios organizados en Unidades de FQ. Estas unidades están formadas por diferentes especialistas que incluyen a neumólogos, gastroenterólogos, Libro II curso 31/1/05 17:26 P gina 229 229 Fibrosis quística Alto índice de sospecha (Clínica compatible con FQ Bajo índice de sospecha (test rutinario) Determinación de la conductividad Muestra suficiente para medición como mínimo por triplicado (Cystic fibrosis anlayzer o Sweat check) > 60 mmol/L < 60 mmol/L Test negativo. Se descarta en, principio FQ Realización de un QPIT con recogida de muestras mediante Macroduct CI < 40 mmol/L CI 40-60 mmol/L Test negativo Se descarta en principio, FQ Test sospechoso en niños Todavía más cuanto menor es la edad del paciente. En adultos, en principio, test negativo (tener en cuenta su posibilidad en casos excepcionales) Si clínica sugestiva CI 60-70 mmol/L Adultos Est. genético FQ probable Clínica sugestiva Clínica no sugestiva FQ confirmada FQ prácticamente segura Estudio genético Estudio genético Negativo (10% de la población española no se encuentra mutación) Niños FQ confirmada Clínica no sugestiva En niños con clínica sugestiva FQ muy probable. Incluso sin ella, diagnóstico posible CI > 70 mmol/L Adultos y niños* Positivo negativo FQ confirmada Potenciales transepiteliales nasal Exámenes complementarios exhaustivos Negativo Se descarta, en principio, FQ Considerar seguir al paciente Estudios complementarios y seguir al paciente si los resultados son negativos Positivo FQ confirmada * Si se excluyen las entidades que se han asociado a tests del sudor positivos Figura 1. Algoritmo de diagnóstico de la fibrosis quística. Libro II curso 31/1/05 17:26 P gina 230 230 dietistas, enfermeras, fisioterapeútas, asistentes sociales, etc. Los controles se deben realizar, como mínimo, cada 2-3 meses. Las posibilidades terapéuticas actuales y de futuro inmediato estan en relación con los diferentes niveles del proceso fisiopatológico(13). El tratamiento tradicional de la patología pulmonar incluye una fisioterapia respiratoria, un tratamiento antibiótico y un soporte nutricional adecuado. A estos enfoques habituales se pueden añadir nuevos enfoques ennumerados en la (Tabla 2). Tratamiento de la anomalía genética La terapia génica se basa en la transferencia del gen normal a las células epiteliales de las vías aéreas. Para ello se utilizan vectores, como los adenovirus o agentes químicos, como los liposomas. La esperanza tan alentadora en el inicio se ha visto ensombrecida por resultados poco convincentes. Una de las líneas terapéuticas más prometedoras en la actualidad, es la de restablecer la proteína funcionante de acuerdo a la clase de mutación que presente. Ya se ha publicado un ensayo clínico con resultados prometedores, utilizando el 4 fenilbutirato, el cual permite a la proteína llegar a la membrana en cantidad suficiente como para restablecer el transporte del cloro. Tratamiento del transporte iónico Actualmente se están investigando las intervenciones farmacológicas dirigidas a contrarrestar la secreción deficiente de cloro y la absorción aumentada de sodio N. Cobos Barroso, et al. TABLA 2. Posibilidades terapéuticas actuales y de futuro en la FQ. 1. Sobre la anomalía genética: la terapia génica y la terapia reparadora de la proteína 2. Sobre el trasporte de iones: los agentes secretagogos del cloro (ATP, UTP) y los bloqueantes del canal del cloro (amiloride) 3. Sobre el drenaje de las secreciones: las nuevas técnicas de fisioterapia respiratoria y la DNAsa para fluidificar el moco espeso 4. Sobre la obstrucción del flujo aéreo: los broncodilatadores 5. Sobre la inflamación: los corticoides orales e inhalados, el ibuprofeno o las antiproteasas 6. Sobre la infección: los antibióticos orales, endovenosos o inhalados 7. Sobre la lesión pulmonar irreversible: trasplante pulmonar en el epitelio respiratorio. Los agentes secretagogos de cloro como los nucleótidos trifosfatos (ATP y UTP) estimulan los canales exteriores rectificadores de cloro (ORCC) y los calcio dependientes. Otra estrategia de tratamiento sería la correción de la hipersecreción de sodio mediante el bloqueo de los canales de sodio. En este sentido se ha demostrado que el amiloride inhalado 4 veces al día disminuye la viscoelasticidad del moco y mejora el aclaramiento de las secreciones. Sin embargo, el uso de estos agentes está aún en el terreno experimental. Libro II curso 31/1/05 17:26 P gina 231 Fibrosis quística Tratamiento del drenaje mucociliar La fisioterapia respiratoria es uno de los pilares básicos en el tratamiento de la enfermedad pulmonar. Sus objetivos son movilizar y drenar las secreciones, desobstruir las vías aéreas, disminuir el riesgo de infecciones y mejorar la función pulmonar. Son múltiples las técnicas que se recomiendan pudiendose asociar algunas de ellas. Otro aspecto del tratamiento incide en la viscosidad de las secreciones purulentas. La alta concentración de ADN proveniente de los neutrófilos degradados es la principal causa del aumento de la viscoelasticidad. En los últimos años se ha podido sintetizar una enzima DNAsa recombinante, que reduce de forma significativa la viscosidad de las secreciones al degradar el ADN. Numerosos ensayos clínicos comprobaron que la administración de DNAsa inhalada una vez al día por pacientes con FQ, incrementaba la función pulmonar, disminuía la gravedad y frecuencia de la tos y favorecía la expectoración(14). En la actualidad se utiliza con frecuencia en pacientes con enfermedad pulmonar con un FEV1 entre el 40-70% de su valores de predicción. Su utilización en casos leves o graves es más limitada. Tratamiento broncodilatador Aunque el uso de broncodilatadores es controvertido en la literatura, la mayoría de los autores lo utilizan. En general, se recomienda su uso en pacientes con hiperrreactividad bronquial. También se utilizan previamente a la fisioterapia, ya que se ha comprobado que se mejora el aclaramiento mucociliar. 231 Sin embargo, su prescripción deberá ser individualizada, comprobando previamente siempre que se pueda que el paciente tiene el test broncodilatador positivo. Se utilizan los β2-adrenérgicos de acción corta o de acción prolongada, o el bromuro de ipratropio. Tratamiento de la inflamación Si recordamos el círculo vicioso de inflamación-infección vemos que es necesario considerar el tratamiento antinflamatorio. En un estudio con prednisolona oral administrada de forma prolongada, se demostró un incremento en los parámetros de la función pulmonar; sin embargo, se constataron efectos secundarios del tipo retraso en el crecimiento, diabetes y cataratas. El tratamiento con corticoides inhalados a corto plazo, en pacientes con FQ, mejora la función pulmonar, sin presentar efectos secundarios. El ibuprofeno es un antiinflamatorio no esteroideo que se ha utilizado con buenos resultados. Tiene una actividad contra el neutrófilo y mediadores de la inflamación. Un ensayo clínico multicéntrico bien diseñado demostró que, en los pacientes con FQ leve que recibieron ibuprofeno oral dos veces al día durante cuatro años, su función pulmonar no declinó con la misma rapidez que el grupo control. No se produjeron efectos adversos graves, pero se recomienda controlar los niveles en sangre. Tratamiento de la infección broncopulmonar La colonización crónica por P. aeruginosa (PA) se asocia a un deterioro progre- Libro II curso 31/1/05 17:26 P gina 232 232 sivo de la función pulmonar, de la morbilidad y de la mortalidad de estos pacientes, por lo que el objetivo prioritario es retrasar la colonización por PA y enlentecer la progresión de la enfermedad pulmonar(15). Ya en 1990 Kerem et al(16) publican un trabajo en el que evalúan la relación entre la colonización con PA y la evolución de la enfermedad en 895 pacientes del “Hospital for Sick Children” en Toronto. La prevalencia de pacientes colonizados fue del 82%. Los autores demuestran que la colonización crónica por PA durante 7 años se asocia a una pérdida de la función pulmonar de un 10%. Esta perdida no se produce de una manera rápida e inmediata, sino de una manera gradual pero progresiva. Más recientemente Gillian Nixon et al(17) efectúan un estudio prospectivo, observacional a una cohorte de 56 niños afectos de FQ diagnosticados mediante cribaje neonatal durante los años 1990-92. A los 7 años de edad el 43% de los niños presentaban infección por PA. Cuatro de estos niños habían fallecido infectados por una cepa mucoide de PA multiresistente. Los niños con infección por PA, presentaron mayor morbilidad, mayor variabilidad en su función pulmonar mayor número de ingresos hospitalarios y mayores necesidades terapéuticas. El grupo de “Cribaje Neonatal para la Fibrosis Quistica” de Wisconsin(18) publican en el año 2001 un trabajo en el que relacionan también la colonización por PA y la evolución de la enfermedad pulmonar. Estudian 56 niños diagnosticados por cribaje neonatal y utilizan como variables de N. Cobos Barroso, et al. control un “score” radiológico propio del grupo y la relación entre el volumen expiratorio forzado en un segundo y la capacidad vital forzada (FEV1/FVC) y, para determinar la fecha de adquisición de la PA utilizan la fecha del primer cultivo positivo y la magnitud del título de anticuerpos detectados utilizando como antígenos un lisado celular, exotoxina A purificada y un toxoide elastasa. Los resultados demuestran que antes de la adquisición de la PA la relación FEV1/FVC disminuía un 1,29% al año y el “score” radiológico empeoraba 0,45 puntos por año. Después de la infección por PA esta disminución se acelera significativamente para ambas variables, pasando la relación FEV1/FVC a un 1,81% al año (p = 0,001) y el score radiológico a 1,40 puntos año (p < 0,001). Esta disminución es gradual pero progresiva. Son muchos los datos que nos proporciona la literatura que indican que la inflamación y la infección progresan en ausencia de exacerbaciones agudas en niños clínicamente estables, y que la colonización crónica por PA se asocia a un deterioro progresivo de la función pulmonar. En consecuencia, el tratamiento con fármacos anti-inflamatorios y el tratamiento antibiótico agresivo a partir del momento en que se demuestra la primocolonización con PA del paciente, se comprende que constituyan los elementos básicos actuales con los que los clínicos manejamos a estos enfermos(19). A pesar de todo, seguimos siendo incapaces de evitar que la PA colonice y posteriormente cronifique la infección en el aparato respiratorio de nuestros pacientes. Libro II curso 31/1/05 17:26 P gina 233 Fibrosis quística Entre las diversas estrategias inmunológicas encaminadas a evitar esta colonización, la inmunización activa con vacunas anti-PA creemos que va a jugar un papel muy importante en el tratamiento de estos enfermos. Tratamiento de la primocolonización por PA Su finalidad es evitar o retrasar la colonización o infección crónica por PA. La estrategia, generalmente, más utilizada a partir del primer cultivo positivo consiste en la administración por vía oral de ciprofloxacino a la dosis de 30-40 mg/kg/ día repartido en dos tomas durante 21 días, más un antibiótico por vía inhalatoria ya sea con tobramicina solución para inhalación, a la dosis de 300 mgs cada 12 horas en ciclos de 28 días seguidos de 28 días sin tratamiento, o con colimicina a la dosis de 1-2 millones de unidades cada 12 horas en régimen continuo. Al cabo de 1 ó 2 meses como máximo, se repite el cultivo. Si el cultivo resulta positivo, se administra un nuevo ciclo de ciprofloxacino oral de 21 días, manteniendo la antibioterapia inhalatoria y si pasados 1 ó 2 meses más el cultivo todavía persiste positivo, se pautará un ciclo de antibióticos endovenosos de 14 días de duración. Si se sigue cultivando el germen consideraremos situación de colonización crónica y actuaremos en consecuencia. Si por el contrario, el cultivo se ha negativizado, se va confirmando esta erradicación con cultivos bimensuales y cuando transcurran 6-9 meses se suspende el antibiótico inhalado. 233 La combinación de antibióticos endovenosos más utilizada es la de un betalactámico, ceftazidima, generalmente a 150-200 mg/kg/día repartido en tres dosis y un aminoglucósido, ya sea la tobramicina a 8-10 mg/kg/día en una sola dosis o la amicacina a 30 mg/kg/día también en una sola dosis. Tratamiento de la infección respiratoria en fase de exacerbación Se recomienda tratar las exacerbaciones por vía endovenosa. Se administrará un ciclo de antibióticos endovenosos durante 2 a 4 semanas, en función de la gravedad del cuadro y de la respuesta terapéutica. Se asociará un antibiótico por vía inhalatoria, ya sea desde el inicio, o al terminar el tratamiento endovenoso. A partir de aquí, si se trataba de una primoinfección, se seguirá el protocolo de la primocolonización y si se trataba de una colonización crónica, se seguirá, a su vez, el protocolo pertinente. Tratamiento de la colonización crónica El tratamiento de mantenimiento en esta fase tiene como objetivo disminuir la carga bacteriana, evitar las exacerbaciones y retrasar, en lo posible, la pérdida de función pulmonar. Se trata, por consiguiente, de efectuar un tratamiento antibiótico programado y sistemático de la colonización o infección crónica. Existen, fundamentalmente, dos estrategias terapéuticas en esta situación. Algunas Unidades de Fibrosis Quistica (UFQ), fundamentalmente nórdicas, efectúan ciclos sistemáticos de antibióticos endove- Libro II curso 31/1/05 17:26 P gina 234 234 nosos cada 3-4 meses, independientemente del estado clínico del paciente, con o sin tratamiento antibiótico inhalado en los períodos intermedios. Otros grupos efectúan tratamiento de mantenimiento con antibióticos inhalados, añadiendo un ciclo de ciprofloxacino oral o de antibióticos endovenosos en cuanto aparecen mínimos signos de agravación clínica o caída de la función pulmonar. No existe ningún trabajo comparativo en este sentido, pero sí existe un trabajo multicéntrico con un nivel A de evidencia que demuestra, que la administración de altas dosis de tobramicina solución para inhalación en ciclos de 28 días seguidos de 28 días sin tratamiento, mejora la función pulmonar y evita, en parte, la aparición de exacerbaciones(20). Se favorecerán cuando sea posible los tratamientos endovenosos a domicilio, sobre todo, en los niños de más de 4-5 años, ya que se reduce, así, el número de ingresos hospitalarios, disminuye el coste sanitario, el paciente tiene mejor calidad de vida y la aceptación del tratamiento por parte del paciente es mucho mayor. Podemos recomendar un tratamiento antibiótico endovenoso a domicilio cuando los cuidadores estén bien entrenados y predispuestos, cuando se trate de un ciclo programado de mantenimiento o cuando la exacerbación sea leve o moderada, y cuando el paciente no requiera de ningún otro tipo de soporte terapéutico y tenga una vía de acceso segura. Por el contrario, si la exacerbación es moderadamente grave o grave, si el paciente presenta una hemoptisis, si necesita fisioterapia especial u otras medidas de soporte, y sobre todo, cuando la N. Cobos Barroso, et al. predisposición del paciente o de sus cuidadores no sea la adecuada, el tratamiento se realizará en régimen de ingreso hospitalario (Tablas 3-5). Tratamiento de la afectación digestiva El tratamiento de la insuficiencia pancreática se realiza con el aporte sustitutivo de enzimas pancreáticas. La dosis debe ser individualizada y ajustada con la ingesta, y controlarse con la eliminación de grasas de 24 horas. Se recomienda la dosis media de 2.500 U de lipasa/kg/día. El soporte nutricional es un pilar fundamental en el tratamiento de los pacientes con FQ, ya que está claramente demostrado en numerosos trabajos la relación existente entre el estado nutricional y la evolución de la enfermedad pulmonar. Las necesidades calóricas en estos pacientes son más elevadas, ya que tienen unos requerimientos energéticos basales de más de un 30% por encima de lo normal, que aumentan con la progresión de la enfermedad pulmonar y con el consumo total de oxígeno. En la actualidad para conseguir un aporte de calorías adecuadas es habitual el uso de suplementos dietéticos, ya sea por via oral, o por gastrostomía en aquellos pacientes muy desnutridos. Debido a la malabsorción, los niveles de vitaminas liposolubles están alterados, por lo que se deben suplementar de manera rutinaria. TRASPLANTE PULMONAR Si a pesar de todos los tratamientos la enfermedad progresa a una insuficiencia Libro II curso 31/1/05 17:26 P gina 235 235 Fibrosis quística TABLA 3. Tratamiento antibiótico en pacientes colonizados por S. aureus. Colonización ocasional Paciente estable Colonización crónica. brote de agudización Tratamiento antibiótico oral (1 m) Cambio de antibiótico si ya tomaba Cultivo - Suspender tratamiento Cultivo + Mejoría clínica No mejoría clínica Suspender Tratamiento Tratamiento AB e.v. 14-21 días Antibióticos (2 m) Cultivo + Colonización crónica. Tratar sólo exacerbaciones TABLA 4. Tratamiento antibiótico en pacientes colonizados por Pseudomonas aeruginosa Colonización inicial Antibióticos en aerosol (1 m) Fluoroquinilonas v.o. (21 días) Colonización crónica Estable Exacerbación AB en aerosol Cultivo - Cultivo + Fluoroquinolonas v.o. 21 días AB aerosol (6 m) AB e.v. 14-21 días Cultivo - Cultivo + Colonización crónica Mejoría No mejoría AB en aerosol AB e.v. 14-21 días Libro II curso 31/1/05 17:26 P gina 236 236 N. Cobos Barroso, et al. TABLA 5. Antibióticos en aerosol. Antibióticos Dosis Intervalo Tobramicina Colimicina Aztreonam Ceftazidima 100-300 mg/dosis 1-2 millones unidades 500-1.000 mg/dosis 500 -1.000 mg/dosis 12 horas 12 horas 12 horas 12 horas respiratoria irreversible el trasplante bipulmonar es la única alternativa. La mayoría de los grupos de trasplante de diferentes partes del mundo tienen resultados similares de supervivencia. Los últimos datos publicados por el Children´s Hospital de St Louis indican una supervivencia del 83% al año y del 70% a los dos años del trasplante(21). Las complicaciones del trasplante per se se relacionan con las infecciones, el rechazo agudo y la bronquiolitis obliterante. La mala absorción de inmunosupresores, los problemas relacionados con la malnutrición, las infecciones de las vías aéreas superiores, la diabetes mellitus, las obstrucciones intestinales y los problemas hepáticos son complicaciones que se agregan a las anteriores y que son propias de la FQ. PECULIARIDADES DE LA FQ EN RELACIÓN CON LA EDAD Existe actualmente una expectativa de vida de 40 años para los nacidos en la década de los 90 y ya en estos momentos, el 40% de los pacientes son adultos. Se comprende entonces que la FQ haya pasado de ser una enfermedad infantil a formar parte de las enfermedades que también afecta a los adultos. Se debe tener presente que el adulto plantea problemas especiales en cuanto al diagnóstico y en cuanto a las complicaciones pulmonares y extrapulmonares. Existe un grupo de pacientes que son diagnosticados en la edad adulta con formas monosintomáticas: pólipos nasales, enfermedad pulmonar crónica leve o mederada, sinusitis, pancreatitis crónica o esterilidad por ausencia de conductos deferentes. A veces la confirmación del diagnóstico es difícil, ya que pueden presentar la prueba del sudor con valores dudosos o incluso normales. En estos casos la medición de la diferencia de potenciales bioeléctricos es de gran ayuda. Siempre se debe realizar el estudio genético, aunque en un 7% de los casos resulte negativo. El aumento en la supervivencia de estos pacientes aumenta también la patología pulmonar y extrapulmonar: hemoptisis, neumotórax, aspergilosis broncopulmonar alérgica, insuficiencia respiratoria, diabetes mellitus, vasculitis, pancreatitis, cirrosis hepática, úlcera péptica, problemas de embarazo o de esterilidad, etc., que el médico especialista de adultos debe estar preparado para afrontar. Libro II curso 31/1/05 17:26 P gina 237 237 Fibrosis quística BIBLIOGRAFÍA 1. Cobos N, Gartner S, Liñán S. Epidemiología de la Fibrosis Quística. En: Dapena Fernández FJ. (Eds.) Fibrosis Quística. Editorial Alhulia SL. 1998; 31-40. 2. Gartner S, Cobos N, Maya A, Casals T, Séculi J, Asensio O. Neonatal screening for cystic fibrosis in Catalunya, España. Pediatr Pulmonol 2003; 25:221 3. Casals T, Ramos MD, Giménez J, Larriba S, Nunes V, Estivill X. High heterogeneity for cystic fibrosis in Spanish families: 75 mutations account for 90% of chromosomes. Hum Genet 1997; 101:365-70. 4. Anonymous. Cystic fibrosis foundation patient registry 1997 annual data report. Bethesda, MD, USA. Cystic Fibrosis Foundation 1998. 5. Khan TZ, Wagener JS, Bost T, Martínez J, Accurso FJ, Riches W. Early pulmonary inflammation in infants with cystic fibrosis. Am J Respir Crit Care Med 1995; 151:1075-82. 6. Armstrong DS, Grimwood K, Carlin, JB,Carzino R, Gutiérrez JP, Hull H, et al. Lower airway inflammation in infants and young children with cystic fibrosis. Am J Respir Crit Care Med1997; 156:1197-204. 7. Poschet JF, Boucher JC, Tatterson L, Sikmore J, Van Dyke RW, Deretic V. Molecular basis for defective glycosylacion and Pseudomonas pathogenesis in cystic fibrosis lung. Proc Natl Acad Sci USA 2001; 98:13972-7. 8. Widdicombe JH. Altered NaCl concentration of airway surface liquid in cystic fibrosis. Pfluggers Arch Eur J Physiol 2001;443 (suppl 1):S 8-10. 9. Jayaraman S, Song Y, Vetrivel L. Shankar L, Verkman AS. Noninvasive in vivo fluorescence measurement of airway surfaceliquid depth, sal concentracion, and pH. J Clin Invest 2001; 107:317-24. 10. FitzSimmons SC. The changing epidemiology of cystic fibrosis.J Pediatr 1993; 122:1-9. 11. Cobos N, Gartner S, Liñán S. Fibrosis Quística. Ed. Ja Caminero y L Fernández Fau. Manual de Neumología y Cirugía Torácica. Editores Médicos S.A. SEPAR 1998; p. 121736. 12. Rosenstein BJ, Cutting GR. The diagnosis of cystic fibrosis: A consensus statement. J Pediatr 1998; 132:589-95. 13. Zeitlin P. Novel pharmacologic therapies for cystic fibrosis. J Clin Invest 1999; 103:44752. 14. Cobos N, Danés I, Gartner S, González M, Liñán S, Arnau JM, et al. Dnase use in the daily care ef cystic fibrosis: who benefits from it, and to what extent ? Results of a cohort study of 199 patients in 13 centres Eur J Pediatr 2000; 159:176-81. 15. Gartner S, Moreno A, Cobos N. Tratamiento de la enfermedad respiratoria en la fibrosis quística. En: Cobos N, Pérez-Yarza EG eds., Tratado de Neumología Infantil. Madrid: Ergon, 2003; p. 717-30. 16. Kerem E, Corey M, Gold R, Levison H. Pulmonary function and clinical course in patients with cystic fibrosis after pulmonary colonization with Psedomonas aeruginos. J Pediatr 1990; 116:714-9. 17. Nixon GM, Armstrong DS, Carzino R, Carlin JB, Olinsky A, Robertson CF, et al. Clinical outcome after early Psedomonas aeruginosa infection in cystic fibrosis. J Pediatr 2001; 138:699-704. 18. Kosorok MR, Zeng L, West SE, Rock MJ, Splaingard ML, Laxova A, et al Acceleration of lun disease in children with cystic fibrosis after pseudomonas aeruginosa acquisition. Pediatr Pulmonol 2001; 32:277-87. 19. Frederiksen B, Lanng S, Koch C, Hoyby N. Improved survival in the Danish center-treated cystic fibrosis patients: results of aggressive treatment. Pediatr Pulmonol 1996; 21:153-8. Libro II curso 31/1/05 17:26 P gina 238 238 20. Ramsey BW, Pepe MS, Quan JM, Otto KL, Montgomery AB, Williams-Warren J. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. N. Cobos Barroso, et al. Cystic Fibrosis Inhaled Tobramycin Study Group. N Engl J Med 1999; 340:23-30 21. Mallory GB, Spray TL. Paediatric lung transplantation. Eur Respir J 2004; 24:839-45. Libro II curso 31/1/05 17:26 P gina 239 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): el César Carlos Javier Pérez-Frías Hospital Regional Universitario Carlos Haya. Hospital Materno-Infantil. Facultad de Medicina de la Universidad de Málaga Decía D. José de Letamendi(1) (médico, 1828-1897): El que medicina sólo sabe, ni medicina sabe. Sería imperdonable estar aquí sólo para aprender medicina; y también lo sería, siendo médicos, limitarse a ver lo que un turista al uso. Les propongo realizar una visita al R.M. del Escorial de otra manera, viendo con otros ojos las obras de arte que aquí se encuentran, mirando a través de ellas otra posible realidad. Como algunos de ustedes sabrán, pero la mayoría lo ignora, ni San Lorenzo murió en la parrilla, ni la batalla de San Quintín fue la causa de la fundación del monasterio..., pero esa es otra historia y para otro momento(2). De la misma manera, las pinturas o esculturas que vamos a ver, no sólo son lo que el título de las mismas dice que son, hay otras historias dentro de ellas, a veces explícitas y otras no tanto, que intentaremos desvelar. En la celda del Prior(3) nos encontramos con un lienzo de considerables dimensiones que representa el Juicio de Salomón. Todos conocen la historia... Así pensaba enfocar el tema, pero al documentarme sobre él descubrí otra visión, otra manera de mirar, si cabe todavía más fantástica, y es la historia y la vida de los personajes que levantaron esta fábrica o, como en el caso que nos ocupa, a causa de quienes se levantó. Y no podemos empezar por otro que por el Emperador - en singular el magnífico César Carlos, para quien su hijo - Felipe II - y en aras de cumplir su voluntad, reflejada documentalmente de forma autógrafa(4), de ser enterrado junto a sus parientes más cercanos, en especial de la Emperatriz Isabel, hizo construir este panteón. El Escorial fue concebido, por tanto, principalmente para dotar de una fuerte significación simbólica a los enterramientos de la dinastía austríaca, y no para celebrar San Quintín ni para loar a San Lorenzo y a su celebrado episodio de la parrilla. Con ojos de médico vamos a revisar la historia de estos personajes, más admirables cuanto más cercanos, vamos a realizar su historia clínica. Libro II curso 31/1/05 17:26 P gina 240 240 Antecedentes Personales Año de 1500; palacio de Ten Walle en Gante (Bélgica). Durante la celebración de un gran baile en el palacio, la archiduquesa Juana - Juana de Castilla, hija de los Reyes Católicos - sintió los primeros dolores de parto. Juana estaba casada con el archiduque Felipe de Austria, Gobernador de los Países Bajos por ser el primogénito del emperador Maximiliano I y de María de Borgoña. A las pocas horas, las tres y media de la madrugada(5) del lunes al martes del día 25 de febrero del año 1500, San Matías, la hija de los Reyes Católicos dio a luz al segundo de sus hijos que recibiría el nombre de Carlos - su hermana Leonor le había precedido algunos años antes -, el que habría de ser heredero de las coronas de Castilla y Aragón, de las Casas de Austria y Borgoña y titular del Sacro Imperio Romano Germánico(6). Isabel la Católica(7), al conocer la buena nueva, dijo: “Este será el que se lleve las suertes”. Fue bautizado con el nombre de “Carlos” en memoria de su bisabuelo Carlos el Temerario (1433-1477), último Duque de Borgoña, casado con Margarita de York, hermana de Eduardo IV y de Ricardo III de Inglaterra. Carlos el Temerario había intentado hacerse con los Países Bajos. Para ello ocupó el Ducado de Lorena, pero no pudo obtener del emperador Federico III el beneplácito para constituir el reino de Borgoña, que habría colmado sus ambiciones territoriales. Se distinguió como uno de los príncipes más notables de su época; muy instruido, inteligente y valeroso, sostuvo numerosas guerras con el Emperador Federico III de Alemania y con Luis XI de Fran- J. Pérez-Frías cia que le arrebató el Ducado de Borgoña. Este fracaso no impidió la ventajosa boda de su única hija, María de Borgoña, con Maximiliano (1459-1519), hijo y sucesor de Federico III al frente del Imperio. Carlos el Temerario murió en el sitio de Nancy el 5 de enero de 1477. Carlos recibió de los Habsburgo el prominente labio inferior(8) y de la Casa de Borgoña(9) el prognatismo del maxilar que le impedía cerrar adecuadamente la boca, rasgo que se cuidaron muy bien de no exagerar sus numerosos retratistas de la época, ni los pintores de tiempos posteriores(10). Antes de cumplir un año, su padre le armó caballero de la Orden del Toisón de Oro y le cedió el Ducado de Luxemburgo. Tras la muerte de Felipe el Hermoso (Burgos-1506), Margarita de Austria - doblemente viuda, en 1497 del primogénito de los Reyes Católicos, el príncipe Juan, y en 1504, de Filiberto de Saboya - fue nombrada por su padre el Emperador Maximiliano I Gobernadora de los Países Bajos. Fue ella la que escogió al deán de Lovaina, Adriano de Utrecht, futuro Papa Adriano VI, como tutor de Carlos. Luis de Vaca fue encargado, con escaso éxito, de enseñarle castellano. Años después, sólo hablaba francés, desconocía el flamenco, chapurreaba el castellano e ignoraba el latín, aunque fue aprendiéndolos más adelante. Como primer camarero y fiel guardián tuvo al Señor de Chièvres, Guillermo de Croy, que le influyó de forma decisiva. Mercurino Arbóreo, futuro Cardenal Grattinara, le familiarizó con su idea de lo que debía ser el comportamiento de un emperador y con el concepto “IMPERIO”. Libro II curso 31/1/05 17:26 P gina 241 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos Erasmo de Roterdan también influyó en Carlos desde pequeño y luego sería su consejero, aunque sus consejos sobre “huir de las guerras como del fuego” nunca fueron tomados en cuenta, con excesivo celo, por el futuro “Emperador Guerrero”. A pesar de sus eminentes tutores, Carlos, en su infancia, no dio muestras de poseer una inteligencia precoz. Prefería la caza, los deportes y los torneos, actividades en las que llegó a destacar. También estudió música y fue aficionado a tocar la espinela y el órgano. En Carlos quedaron probados profundamente los conceptos de honor y defensa de la fe católica, tal como estipulaban los estatutos de la Orden del Toisón de Oro(11). Medio social Constantinopla cayó en 1453, y con ella todos los restos del Imperio Bizantino, ante el empuje otomano cuyos ejércitos hacían estragos entre los reinos cristianos de los Balcanes. España y Portugal van consolidando sus imperios de ultramar. Francia e Inglaterra superan la Guerra de los Cien Años entre las Casas de York y Lancaster. Francia finalizaba victoriosa sus luchas con los borgoñones. Las nacionalidades inglesa, francesa, española y portuguesa se aglutinan, respectivamente, en las dinastías Tudor, Valois, Trastamara y Avís. En Italia, importante encrucijada comercial y cultural, florecen las cortes renacentistas de Florencia, Milán, Mantua, y Ferrara, así como la Roma de los papas y la Venecia de los mercaderes. Las figuras de Botticelli(12), Leonardo da Vinci(13) (14521516), Durero (1471-1528), Erasmo(14), Ra- 241 fael(15), Miguel Ángel(16) (1475-1564) y Tiziano(17) (1490-1576), encabezaron las expresiones de un arte sin par y difícilmente superable en los siglos venideros. Italia no tenía consistencia política territorial y Carlos VIII de Francia se adentraba en el Milanesado. Los Reyes Católicos habían pasado de Sicilia a Nápoles(18) y turcos y alemanes tanteaban su incorporación a semejante banquete. También es necesario recordar algunos de los grandes problemas, tanto de la sociedad del siglo XV, como de la del XVI(19). En primer lugar, la lucha contra las grandes distancias, ya que, como máximo, un correo real recorría unos cien kilómetros al día. También la casi nula defensa frente a las numerosas enfermedades y la mortalidad infantil y, en particular, contra la peste que hacía estragos en las ciudades, eran batallas no ganadas a la naturaleza. Cuando la noche se cernía sobre las ciudades, el bandolerismo suponía una peligrosa amenaza para los retrasados en refugiarse a cal y canto en sus hogares. Las gentes, como en los remotos tiempos de la antigua Grecia, seguía gustando de los temas misteriosos y de los libros de caballería(20), así como de la astrología y de las ciencias de adivinación y curación. Antecedentes familiares En febrero de 1496 se realizó la boda por poderes entre la infanta Juana y el archiduque Felipe. En agosto, una armada de 120 navíos con 15.000 hombres a bordo acompaña a la infanta hasta Flandes. La misma armada se encargaría de traer a España a la archiduquesa Margarita, her- Libro II curso 31/1/05 17:26 P gina 242 242 mana de Felipe, para sus nupcias con el heredero del trono español, el príncipe Juan, constituyendo un doble enlace sucesorio entre las coronas peninsulares y la dinastía austríaca. Cuando los esposos se encontraron, surgió entre ellos una fuerte atracción que alcanzó tal grado que, sin esperar a los esponsales oficiales, esa misma noche, se retiraron a sus aposentos para consumar el vínculo matrimonial. El 16 de noviembre de 1498 nació en Bruselas la infanta Leonor(21), hermana mayor del futuro emperador Carlos. Para entonces ya habían llegado a Castilla rumores sobre las graves desavenencias del joven matrimonio. Juana no podía soportar los devaneos extraconyugales de su marido, conocidos de toda la corte, y poco a poco se fue amargando y enrareciendo su carácter. Juan, el heredero de los Reyes Católicos, había fallecido en 1497. Isabel, siguiente en los derechos de sucesión, fallece de parto en el año 1500, y también su hijo poco después, cuando ya había sido reconocido como príncipe heredero por las Cortes de Castilla. Los Reyes Católicos, ante esa situación, reclaman la presencia en España de Juana y Felipe. Juana se ha convertido en la heredera de los reinos españoles y debe estar en ellos. Los archiduques cruzaron Francia con numeroso séquito y ajuar y el 29 de enero de 1502 entraban en España por Fuenterrabía. El 22 de mayo fueron reconocidos como príncipes de Castilla y de Aragón. Juana habría de ser la primera mujer que, por derecho propio, reinara sobre los aragoneses. J. Pérez-Frías Felipe se hartó pronto de la severa corte castellana y regresó a Flandes, dejando en España a su esposa que estaba embarazada del que sería el infante Fernando. Fernando nace en 1502 y su madre decide dejar España y seguir a su esposo a los Países Bajos, cosa que no consigue hasta 1504, por la fuerte oposición de sus padres a que deje el reino. Reunida con su esposo, la vida en común se hace cada vez más difícil y Juana -”La Terrible”, como era apodada en Flandes- celosa patológica, y además con razón, empezó a perder definitivamente la misma. Las tristes noticias sobre su hija aceleraron la muerte de Isabel la Católica, que en su testamento nombraba gobernador de Castilla a su esposo Fernando en ausencia de su hija, “...que en viniendo esta y no queriendo o no pudiendo gobernar, gobernará el rey Don Fernando”. Añadía que en caso de incapacidad de su hija, la regencia debería ser desempeñada por éste hasta la mayoría de edad de su nieto Carlos. La Reina falleció el 26 de noviembre de 1504 en Medina del Campo. Lo único que deseaba Felipe es que su suegro se desplazara cuanto antes a su reino de Nápoles y le dejara gobernar en solitario en Castilla, como después de varios encuentros, entre ambos, sucedió. Felipe comenzó a gobernar, pero no pudo conseguir mantener encerrada a su esposa, como deseaba, pues los procuradores del reino, tras entrevistarla, no hallaron razones para ello. El 12 de julio fueron jurados por las Cortes de Castilla, reunidas en Valladolid, como reina y rey consorte. Juana se hallaba embarazada de cinco meses de Libro II curso 31/1/05 17:26 P gina 243 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos la infanta Catalina, que sería el sexto de sus hijos en nueve años de matrimonio. Antes de ella habían nacido María, futura reina de Hungría, e Isabel(22), reina de Dinamarca. Aquel año, las malas cosechas y la propagación de la peste sumieron a la población castellana en una grave situación de hambre y mortandad. La corte se trasladó a Burgos y, allí, tras una rápida y violenta enfermedad, muere Felipe el Hermoso a los 28 años, el 25 de septiembre, sin haber cumplido los tres meses del tan ansiado reinado. Se pensó que había sido envenenado por orden de su suegro, pero la opinión más extendida fue que se vio contagiado por la epidemia de peste que venía extendiéndose por España desde 1502. Su virulenta y fulminante enfermedad, que le llevó a la muerte en tan sólo cuatro días, se produjo después una partida de caza que fue seguida de un partido de pelota, durante el que bebió agua helada. Su cuerpo fue embalsamado y su corazón enviado a Flandes en una caja de oro. Doña Juana enloquecida de dolor, inició un largo y fúnebre peregrinaje por tierras de Castilla, sin separarse en ningún instante del féretro que contenía los restos mortales de su esposo(23). Infancia y adolescencia Carlos, desde su nacimiento y hasta su tercer año permanece en Gante y pasa a residir desde su tercer hasta su sexto año en el Keizersberg en Leuven (Lovaina), donde fue criado por Adriano de Utrecht, el posterior papa Adriano VI, y Guillermo van Croy, señor de Chièvres. Al cumplir 243 los seis años se trasladara, junto con algunas de sus hermanas(24) a la corte de su tía Margarita en Malinas, donde ésta era regente de los Países Bajos. Carlos fue nombrado Gobernador de los Países Bajos en 1514. El señor de Chièvres, seguro de su ascendencia sobre Carlos se había deshecho, con el consentimiento de Maximiliano I, del gobierno de Margarita de Austria. Se reconoció su mayoría de edad, y el 5 de enero de 1515, en la gran sala del Palacio de Bruselas, en el mismo lugar donde 40 años más tarde abdicaría, fue nombrado, por los Estados Generales, Señor de los Países Bajos. No obstante esto, constituía un conglomerado político y no un estado como lo entendemos hoy día, como ejemplo de esta división Carlos tomó posesión del gobierno de los Países Bajos sin un único título que expresase la idea de unidad política, y así fue simplemente duque de Brabante, Limburgo y Luxemburgo; conde de Flandes, Artois, Hainaut, Holanda, Zelanda, Namur y Zutphen y señor de Frisia. En este contexto tuvo lugar el conocimiento de la muerte de Fernando el Católico en enero de 1516, siendo Carlos inmediatamente proclamado en Bruselas rey de Castilla y Aragón y corregente con su madre (aun incapacitada mantuvo la titulación de Reina) e iniciándose el traslado de Carlos hacia Castilla, donde el regente fue el Cardenal Francisco Jiménez de Cisneros hasta su llegada. El 12 de enero de 1519, murió el Emperador Maximiliano I. La Casa de Habsburgo llevaba casi un siglo al frente del Sacro Imperio Romano Germánico, desde la Libro II curso 31/1/05 17:26 P gina 244 244 elección de Federico III en 1440, pero su hijo Maximiliano I nunca fue coronado por el Papa como emperador y, por tanto, la sucesión de Carlos podía ser abiertamente cuestionada. Para Carlos I y su equipo flamenco se convirtió en objetivo prioritario hacerse con la sucesión del Imperio. Francisco I de Francia, alarmado por el peligro que esto podría suponer para una Francia rodeada por naciones en poder de Carlos, también optó a la sucesión. Por su parte, el Papa León X, que temía la concentración de poder en el flamenco-español, heredero de los reinos italianos de su abuelo materno, decidió oponerse a las pretensiones del aspirante. Pero el joven Carlos desplegó una intensa batalla diplomática, dirigida por su tía Margarita de Saboya (o de Austria), de nuevo Gobernadora de los Países Bajos, y compró las voluntades de los siete “Príncipes Electores”, comité de notables que, desde 1354, tenía encomendada la misión de la elección del emperador, de acuerdo con la “Bula de Oro” del emperador Carlos IV. Fue necesario emplear 850.000 florines de oro, “Guldens”, en pagos que allanasen el camino. A más de hacer varias promesas en diferentes cortes europeas; una de ellas fue la de la posible cesión a Francia del, recientemente incorporado a la Corona de Castilla, Reino de Navarra. El Papa cedió al fin y el futuro Emperador iniciaba su carrera hacia la gloria cuando aún no tenía 20 años. El 22 de junio de 1519, en Frankfurt, en la Iglesia de San Bartolomé, Carlos había sido designado Emperador por el arzobispo de Maguncia. Pero faltaba la tan ansiada coronación J. Pérez-Frías oficial en Aquisgrán por el papa León X, lugar donde también fue coronado Carlomagno, en el año 800, por León III. En cuanto a su devenir personal, Carlos se vio en la necesidad de buscar esposa. Portuguesa fue su bisabuela Isabel, la madre de Carlos el Temerario, duque de Borgoña; portuguesa también fue Leonor, la madre de Maximiliano (el abuelo de Carlos), que se casó con la hija del Temerario. Los Trastamaras castellanos también habían emparentado reiteradamente con las princesas de la Casa de Avís. Isabel la Católica era hija de una princesa portuguesa, otra Isabel, a la que las crónicas la describen como una ardiente belleza, que después de enviudar cayó en una suerte de divagaciones y manías, lo que obligó a encerrarla en el castillo de Arévalo. De Portugal, pues, le vino a Carlos la genialidad como a su madre le había venido la locura. Y a Portugal fue a buscar la madre de su heredero, tras renunciar al matrimonio con su prima María Tudor, hija de su tía Catalina y de Enrique VIII, que después se casaría con Felipe II. La boda se realiza en Sevilla el 10 de marzo de 1526 y los esposos pasan su luna de miel en la primavera granadina. Del carácter de esta reina española da cuenta una anécdota recogida por el Dr. J. Botella(25): la estricta educación que recibió Isabel de Portugal provocó que la reina se negase a gritar durante un duro parto: “La emperatriz hizo que la taparan la cara para que nadie viese su sufrimiento y cuando las matronas la pidieron que gritase para descargar su dolor ella contestó en portugués: Eu morrerei más naö gritarei”(moriré pero no gritaré). Libro II curso 31/1/05 17:26 P gina 245 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos Carlos, Emperador La Liga de Cognac o Clementina, contra España, se constituyó el 2 de mayo de 1526(26). Estaba integrada por Francia, Florencia, Venecia, Francisco Esforza y el Papa Clemente VII, además contaba con el apoyo de Enrique VIII, cuyas relaciones con Carlos se habían enfriado. Por toda Italia sonaban los gritos de “mueran los españoles”. Hungría había caído en poder del turco y Luis II de Hungría, cuñado de Carlos tras su matrimonio con su hermana María, había perdido la vida en la batalla de Mohacs. Fernando, hermano de Carlos y rey de Austria, se veía amenazado y urgía ayuda del Emperador. Las tropas imperiales, formadas por 45.000 hombres furiosos que culpaban a Clemente VII de sus sufrimientos y miserias, fueron inducidas por Carlos de Borbón a saquear Roma, como recompensa de las pagas siempre pendientes. Carlos de Borbón murió en el asalto, como “castigo” por la ofensa inferida al representante de Dios en la tierra, y el 6 de mayo de 1527 se iniciaba el famoso Saco de Roma. Las tropas se dedicaron a un brutal saqueo y al pillaje de todo lo que encontraron en su camino, especialmente las tropas protestantes enviadas desde Alemania. Un mes después, el Papa, que se había refugiado en el Castillo de Sant Angelo, se convertía en prisionero del Emperador. Siete meses después se le concedió la libertad ,tras ceder algunas plazas italianas y realizar el pago de 300.000 ducados para soldada del ejército. El 5 de junio de ese año murió Mercurino Grattinara. Carlos no nombró sustituto para su canciller y asumió de forma absoluta todo el poder ejecutivo. 245 Anecdótica, pero que revela el enfoque caballeresco de su vida es la siguiente situación surgida en estas fechas. Carlos estaba harto de la actuación de Francisco I y le desafió a un duelo personal para cortar las permanentes y constantes luchas con Francia, pero Francisco supo evitar el cuerpo a cuerpo e incluso encarceló, por su insistencia, al embajador español en París e intermediario en el desafío, Nicolás Perrenot Granvela El poder imperial se consolidaba en Italia, y el 5 de noviembre de 1529, firmada la paz con el Papa, Carlos hace su entrada triunfal en Bolonia, cortejado por tres mil soldados de los tercios españoles. Clemente VII, con su colegio cardenalicio, le recibe en la plaza de San Petronio. El Emperador le saluda en español y la coronación queda fijada para el 24 de febrero siguiente, aniversario de su nacimiento, siguiendo la tradición vigente, desde tiempos de Carlomagno, de proceder a una segunda coronación en Roma tras la celebrada en Aquisgrán. Durante los cuatro meses que restaban, Carlos recorrió algunos de los estados italianos reforzando su posición y relaciones con sus gobernantes. En 1531, ante las presiones de su hermano Fernando, decide que éste sea coronado Rey de Romanos en Aquisgrán. A la muerte de su tía Margarita, Gobernadora de los Países Bajos, nombró para este cargo a su hermana María, viuda de Luis II de Hungría; cargo que aceptó María con la condición de no volver a casarse. María gobernó con eficacia 23 años. Estas dos mujeres fueron de la mayor talla política y calidad humana del siglo XVI. Libro II curso 31/1/05 17:26 P gina 246 246 En 1539 - annus horribilis para Carlos - en el que había muerto Isabel de Portugal, Carlos tuvo que enfrentarse a la rebelión de Gante, su ciudad natal. Los de Gante, que cometieron todo tipo de tropelías en calles e iglesias, se habían rebelado por los excesivos impuestos que tenían que pagar para mantener las guerras con Francia y pidieron ayuda a Francisco I. Ayuda que éste les negó, debido a la reciente paz con España. Además, permitió el paso de las tropas españolas por Francia e incluso recibió en París al Emperador y le agasajó con grandes festejos. Carlos, antes de abandonar España, había nombrado regente nominal a su hijo Felipe, bajo la supervisión del cardenal Tavera y de Francisco de los Cobos, pues el príncipe sólo contaba con 13 años de edad. Tras unos años más tranquilos, las principales campañas se produjeron contra los protestantes en el Danubio, durante la segunda mitad del 1546 y en el Elba, en la primavera de 1547, esta batalla inspiró el famoso retrato ecuestre del Emperador, pintado por Tiziano. La habilidad de las tropas imperiales se puso de manifiesto una vez más y en Mühlberg se alcanzó la victoria final. Con esta victoria, Carlos V, llegó al momento cumbre de su poderío sobre Europa. Así, quedaba concluida la tercera etapa de su obra imperial. La primera había consistido en la pacificación de sus reinos españoles y en vincularse a la tierra que era el nervio y apoyo de su política. De flamenco pasó a ser español. En la segunda, consolidó su poder en Italia y contuvo la expansión del poder turco. Y en la tercera, se volcó en los siempre pro- J. Pérez-Frías blemáticos estados del norte de Europa y consiguió la reducción de la “herejía”. Las tres etapas se vieron aderezadas con los permanentes enfrentamientos con el rey francés, su cuñado. Carlos había cumplido 47 años y su salud se deterioraba día a día de forma irremisible. Su delicado estado físico y anímico padecía fuertes depresiones que hacían sospechar a algunos que existían vestigios de la enfermedad de su madre, todavía viva en Tordesillas - le forzaron a comenzar a plantearse la transmisión de poderes a su hijo Felipe. Si él se había hecho cargo de un Imperio a los 18 años ¿qué podía impedir que el príncipe lo hiciera al cumplir los 20?(27). Carlos concierta, en 1553, la boda de Felipe con María Tudor, la reina católica y sangrienta de Inglaterra (Bloody Mary), con lo que establece una fuerte alianza que compensó en occidente lo que no se consiguió en Alemania. Esto, unido a la muerte de Mauricio de Sajonia, da nuevos bríos a Carlos que ve reforzado a su hijo frente a los Países Bajos y frente a Francia. En esta favorable situación es cuando decide su retirada del mundo(28), no sin antes plantar, por última vez, cara a Francia y recuperar los territorios tomados por Enrique II. A principios de 1555, fallece Juana “la Loca”, a la edad de 75 años, en su casona de Tordesillas sobre el río Duero. De aquella mujer, que había tenido seis hijos, descendieron doce reyes de la cristiandad. En el Imperio, en España, en Italia, en Portugal, en Francia, en Hungría, en Inglaterra, en Polonia y en Dinamarca, las dinastías reinantes procedían de Doña Juana, Libro II curso 31/1/05 17:26 P gina 247 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos directamente o por matrimonios con descendientes de la infortunada reina. Abdicación y retiro La escenificación del acto oficial de la abdicación del Emperador Carlos fue grandiosa. Tuvo lugar el 25 de octubre de 1555, en el mismo marco en el que cuarenta años atrás se había producido su nombramiento como soberano de los Países Bajos. Carlos, de negro, lucía sobre su pecho, como único brillo, el Toisón de Oro. Un año después abandona los Países Bajos, partiendo de Gante a bordo de la nao capitana de una flota de 56 navíos, “La Bertendona”. Le acompañan sus hermanas, María y Leonor y una comitiva de 150 personalidades. Una vez en ruta, salió a su encuentro una escuadra inglesa enviada por María Tudor, esposa de Felipe II y prima de Carlos, para rendir honores. El 28 de septiembre la flota llegó a Laredo. La comitiva recorre Castilla y, tras franquear la Sierra de Gredos por Garganta de la Olla, entre Tornavacas y Jarandilla, llega a Jarandilla, donde recibió, entre otras muchas personas, a su amigo Francisco de Borja. Para acortar el trayecto, el maltrecho, agotado y gotoso Carlos, fue transportado en una improvisada silla fabricada con un arcón que llevaron a hombros un grupo de fornidos lugareños, a lo largo de tres leguas de intrincados senderos de montaña que quedan a la derecha del pico Almanzor. El imperial arcón está, en la actualidad, en sus habitaciones del Monasterio de Yuste. En Jarandilla estuvo alojado en el Castillo de los Condes de Oropesa. El 22 de fe- 247 brero se efectuó su traslado a Yuste, último viaje del inquieto Carlos I de España y V del Sacro Imperio Romano Germánico. Recluido en Yuste, en las modestas dependencias que se habían habilitado para el ilustre huésped, se dedicó a oír misas, a la lectura, a su afición por los relojes y a sus copiosas comidas. Durante muchos meses, a Yuste acudieron muchos personajes de la corte en busca de consejos e influencias. Desde aquel remoto lugar el aura del Emperador seguía planeando por las cortes de toda Europa. A su muerte - madrugada del 21 de septiembre de 1558, San Mateo(29) - el Emperador, según su expreso deseo fue enterrado bajo el altar mayor de la iglesia del Monasterio, con medio cuerpo bajo las losas donde oficiaban misa los monjes, para “... que el sacerdote que dijera misa ponga los pies encima de sus pechos y cabeza”. Los restos de Carlos V y de Isabel de Portugal fueron trasladados, años más tarde por Felipe II al Monasterio del Escorial; cumpliendo, así, el deseo de ambos de reposar juntos en la eternidad ¿Cuáles fueron sus males? El prognatismo -fruto de una marcada herencia-acompañó al emperador Carlos V durante toda su vida. Crisis epilépticas infantiles - tal vez convulsiones febriles -, hipertrofia adenoidea en la infancia, ataques esporádicos de asma y de migraña, además, de numerosas crisis de gota, fueron sus principales dolencias(30). En cualquier caso, su patología comienza ya en el momento de su nacimiento, es conocido que su madre, en Libro II curso 31/1/05 17:26 P gina 248 248 J. Pérez-Frías avanzado estado de gestación, estaba en una fiesta en palacio (Gante) cuando comenzó a sentir molestias, que atribuyó a patología abdominal dando, por tanto, a luz en un excusado. Sin duda se trató de un parto muy precipitado, fruto de una dilatación intempestiva, y, por supuesto escasamente higiénico, incluso para la época. Vivió casi siempre siendo un niño solitario, pues recibió escasa atención de sus padres, que en 1503 viajaron a España donde nació su hermano Fernando, y aunque tuvo más hermanos (Felipe y Juan, muertos prematuramente) y varias hermanas (Leonor, Isabel, María y Catalina) no tuvo lo que puede describirse como un ambiente familiar, lo que influyó, y tal vez condicionó, su posterior comportamiento. Nació con un mentón prominente debido al marcado prognatismo que le impedía cerrar la boca completamente y condiciono ulteriormente maloclusión dental con mordida anterior, que dificulto una correcta masticación toda su vida; además de dificultades para el habla (pronunciaba mal la c y la z). En su infancia fue el típico adenoideo, tal y como se aprecia en uno de los cuadros de Strigel, en el Museo de Viena(31) y en un busto con clara facies adenoidea realizado a sus, aproximadamente, quince años y que se conserva en Gante. Hasta los 28 años disfrutó de buena salud, tan sólo había padecido crisis epilépticas infantiles, adenoides y ataques esporádicos de asma. A partir de esa edad su salud comienza a deteriorarse y padece numerosos ataques migrañosos. Padeció frecuentes ataques de gota. Uno de los mejor documentados ocurrió en la batalla de Notdlingen (1546). A pesar de los fuertes dolores en un pie cabalgó durante horas. Para amortiguar el dolor se ató una banda de tela al estribo. En 1548 sufre una nueva crisis gotosa aguda. “Los galenos reales le aconsejan una estricta dieta, lo que provoca las iras del rey”. En diciembre de ese año sufre otro ataque. Según las crónicas, los dolores eran tan marcados que sus gritos se oían en todo palacio. Durante algunos meses precisa de un bastón para andar. Viajó en litera a Mühlberg, ya que no podía soportar cabalgar, debido a las hemorroides. Siempre fue glotón. A pesar de los consejos de sus médicos disfrutó de comidas pantagruélicas, lo que unido a la dificultad para una correcta masticación, le generó problemas de dispepsia(32). La gota y la diabetes que eran sus históricos males se agudizaron en Yuste, pero su muerte fue causada, al parecer, por la fiebre palúdica contraída por picaduras de los mosquitos que abundaban por aquel entonces en la Vera. BIBLIOGRAFÍA 1. Letamendi J. Discurso sobre la naturaleza y el origen del hombre. Madrid. 1867 2. Yanko A. El Escorial Esotérico y Hermético. San Fernando de Henares. Bitácora. 1990. Libro II curso 31/1/05 17:26 P gina 249 Lo que no es medicina ... ¿o sí? Otra visión de El Escorial (I): El Cesar Carlos 3. El juicio de Salomón. c 1581. Francesco da Urbino. 1545-1582. El Escorial. Madrid. 4. Carlos V. Codicilo de Yuste. 9. Sep. 1558. Biblioteca Nacional. Madrid. 5. López de Gomara F. Anales del Emperador Carlos V. (Ms. 1751. Papeles tocantes al emperador Carlos 5º, fol. 1-42). Biblioteca Nacional. Madrid. 6. Blockmans W. Carlos V. La utopía del imperio. Madrid. Alianza Editorial. 2000. 7. Isabel La Católica. Juan de Flandes. 1519. Museo del Prado. Madrid. 8. Maximiliano I. 1519. Alberto Durero. 14711528. Kunsthistorisches Museum. Viena. 9. María de Borgoña. 1490. Michael Pacher. 1435-1498. Collezione Kisters, Kreuzlingen. 10. Carlos V. Pantoja de la Cruz. El Escorial. Madrid. 11. Kohler A. Carlos V:1500-1558. Una biografía. Barcelona. Marcial Pons. 2000. 12. Portrait of a Young Man. c. 1480-85. Sandro Botticelli. (Alessandro di Mariano Filipepi). c. 1445-1510. National Gallery. London. 249 19. Fernández Álvarez M. La sociedad española del Renacimiento. Madrid: Espasa C, 1974. 20. El Caballero, la Muerte y el Diablo. 1513. Alberto Durero. 1471-1528. Albertina. Viena. 21. Leonor de Austria Reina de Francia. Joos van Cleve. c. 1530. Kunsthistorisches Museum. Viena. 22. Isabel de Dinamarca. Jacob van Oostsanem. c 1524. Thyssen. Madrid. 23. La reina Juana ante el féretro de su esposo, Felipe “el Hermoso”. 1878. Francisco Pradilla Ortiz (1848-1921). Cason del Buen Retiro. Madrid. 24. De Arteaga A. La vida privada del emperador. Barcelona. Círculo. 1999. 25. Botella J. Partos y Enfermedades de las Reinas de España. Conferencia 21 de marzo 2004. Colegio Libre de Eméritos. Madrid. 26. Fernández Álvarez, M. Carlos V, el César y el Hombre. Madrid: Espasa F, 1999. 27. Felipe II Joven. 1551. Tiziano. (Tiziano Vicellio). 1485-1576. El Prado. Madrid. 13. Autorretrato. 1516. Leonardo Da Vinci. (Leonardo di ser Piero da Vinci). 1452-1519. Palazzo Reale. Turín. 28. Braudel F. Carlos V y Felipe II. Madrid: Alianza Eds 1999. 14. Erasmo de Rotterdam. 1526. Alberto Durero. 1471-1528. National Gallery of Art. Washington. 29. Tellechea JI. Así murió el emperador: La última jornada de Carlos V (Yuste, 21 septiembre 1558). Salamanca. Universidad Pontifícia 1995. 15. Doble retrato, 1518-1519. Rafael. (Raffaello Sanzio). 1483-1520. Louvre. Paris. 16. Autorretrato. Miguel Ángel. (Michelangelo di Lodovico di Buonarroti). 1475-1564. 30. Gargantilla P. Carlos V. Un emperador enfermo. I Congreso Iberoamericano Transfronterizo de Medicina de Urgencias y Emergencias. Cáceres. 2000. 17. Autorretrato. c 1562. Tiziano. (Tiziano Vicellio). 1485-1576. Staatliche Museen. Berlín. 31. Emperor Maximilian I with his Family. 1516. Bernhard Strigel. (c. 1460-1528). Viena. 18. Terrero J. Historia de España. Barcelona: Sopena, 1972. 32. García-Simón A. El ocaso del Emperador: Carlos V en Yuste. Madrid: Nerea, 1995. Libro II curso 31/1/05 17:26 P gina 250