conservación en papel filtro
Anuncio
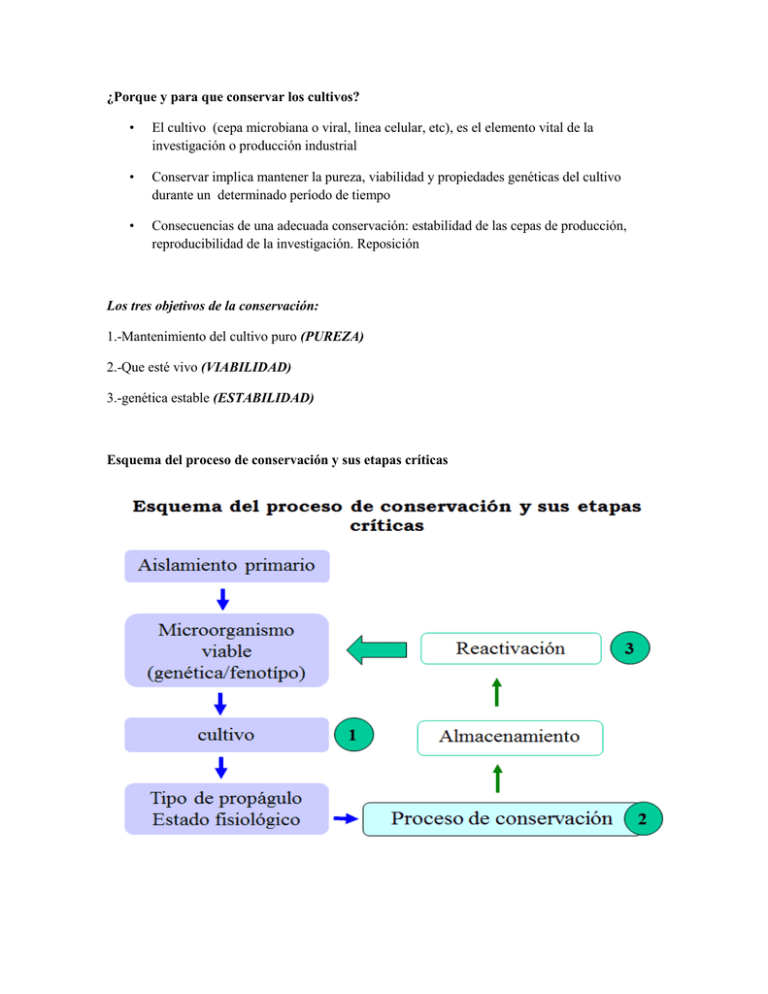
¿Porque y para que conservar los cultivos? • El cultivo (cepa microbiana o viral, linea celular, etc), es el elemento vital de la investigación o producción industrial • Conservar implica mantener la pureza, viabilidad y propiedades genéticas del cultivo durante un determinado período de tiempo • Consecuencias de una adecuada conservación: estabilidad de las cepas de producción, reproducibilidad de la investigación. Reposición Los tres objetivos de la conservación: 1.-Mantenimiento del cultivo puro (PUREZA) 2.-Que esté vivo (VIABILIDAD) 3.-genética estable (ESTABILIDAD) Esquema del proceso de conservación y sus etapas críticas CONSERVACIÓN EN PAPEL FILTRO La conservación en discos de papel de filtro se basada en la paralización del crecimiento celular por la eliminación del agua disponible para las células El empleo de un soporte de papel para el mantenimiento de células en condiciones de ausencia de agua es un procedimiento adecuado y sencillo, para conservar cepas. La técnica consiste en embeber tiras de papel de filtro con una suspensión densa de organismos en suero, glutamato de sodio u otro agente, las mismas son posteriormente colocadas en tubos para su posterior secado bajo vacío. De esta forma se han logrado conservar por períodos de hasta 2 años a temperatura ambiente. Para ello se utilizó un papel de filtro absorbente y estéril que se impregnó en una suspensión bacteriana de células (108 esp/mL), se dejó secar al aire en condiciones estériles y una vez secos los discos se colocaron en tubos Eppendorf estériles a 4°C La conservación en discos de papel de filtro se basada en la paralización del crecimiento celular por la eliminación del agua disponible para las células. Para ello se utilizó un papel de filtro absorbente y estéril que se impregnó en una suspensión bacteriana de células (108 esp/mL), se dejó secar al aire en condiciones estériles y una vez secos los discos se colocaron en tubos Eppendorf estériles a 4°C. PROCEDIMIENTO 1. Se toma el papel filtro Watman No ° 4 y se recortan en círculo con ayuda de una perforadora 2. Se toman los círculos de papel y se esterilizan en el autoclave por 15 min con la ayuda de un pedazo de papel aluminio que las envuelve 3. Se prepara la suspensión del microorganismo ( hongo o bacteria) con agua destilada estéril 4. Unas ves estériles los círculos de papel se colocan dentro de tobos eppendorf aproximadamente de 5 a 7 círculos 5. Existen dos formas de agregar la suspensión: a. Agregar directamente la suspensión al tubo eppendorf el cual mojara los círculos de papel pero se correr el riesgo de agregar un exceso de suspensión, el cual retardara el secado de los círculos en el desecador b. Agregar la suspensión a los círculos, uno por uno tratando de no crear un exceso de suspensión el cual nos retarde el secado (cuando se le agrega la suspensión uno por uno el secado en el desecador en más rápido ya que la cantidad de agua a eliminar será menor y el secado será más rápido) 6. Una vez húmedos los círculos se llevan al desecador con la tapa abierta para que pierdan humedad todo esto en esterilidad por 2 a 3 semanas a 4 °C. 7. Transcurrido el tiempo necesario para el secado de los círculos solo se aplican pruebas de viabilidad. La viabilidad se determinó a partir de su reactivación en medio caldo nutriente (CN). Forma en la que se colocan el papel filtro con el microorganismo El próximo paso fue la siembra por agotamiento en placas con AN, con el objetivo de obtener colonias aisladas, comprobar la pureza macroscópica de los cultivos por observación al microscopio estereoscopio y describir las características morfoculturales de las colonias de acuerdo con forma, tamaño de las colonias, bordes, elevación, color y textura comparada con la cepa de referencia. Se seleccionó una colonia de una cepa, se pasaron a tubos con cuñas de AN y se incubaron durante 72 h a 30°C; se realizó la tinción de Gram al cabo de 18 h para observar parámetros como la pureza microscópica de los cultivos y forma de las células La concentración (esporas por mililitro) de cada una de las suspensiones bacterianas se determinó por el conteo de las esporas presentes en cada uno de los cuadrantes a evaluar de la cámara de Neubauer (5 x 5) mediante la observación en el microscopio óptico con contraste de fase 400x. A partir de los cultivos sembrados en AN plano inclinado, se realizaron diluciones decimales hasta llegar a 108 UFC. La viabilidad se cuantificó por la producción de colonias. Para ello se tomó 1 mL se añadieron en placas de Petri estériles, luego se realizó la siembra por adición de 15 mL de medio de cultivo AN. Cada placa se agitó suavemente con el fin de lograr una mezcla homogénea de la suspensión bacteriana con el medio de cultivo y obtener colonias aisladas. Las placas se incubaron a 30°C y posteriormente se cuentan las unidades formadoras de colonias a las 24, 48 y 72 h. La concentración se determinó por la siguiente ecuación: C = XD 100 (UFC/mL) DÓNDE: X: Media del conteo de las colonias en las placas D: Factor de dilución = 1/dilución 100: Para convertir de µL a mL Referencias http://setas.org/cultivo-de-setas/cepas-hongos-en-papel-filtro/ http://www.science.oas.org/Simbio/mbio_ind/cap3_mi.pdf http://redalyc.uaemex.mx/redalyc/pdf/2091/209122285007.pdf