6. ESPONTANEIDAD DE LAS REACCIONES QUÍMICAS
Anuncio

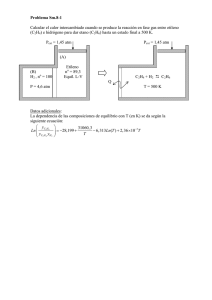
6. ESPONTANEIDAD DE LAS REACCIONES QUÍMICAS 4.- Calcular el cambio de energía libre para el proceso H2O(s) → H2O(l): (a) A 1 atm y 0 ºC; (b) A 1 atm y 20 ºC. Comentar los resultados. Considerar que ∆Hfus(H2O) = 6.01 kJ/mo y ∆Sfus(H2O) = 22,0 J/K mol son independientes de la temperatura. 5.- Utilizando las tablas termodinámicas, estudiar la posibilidad de obtener etileno por alguna de las reacciones siguientes: (a) Reacción de carbono e hidrógeno: C(graf) + H2(g) → C2H4(g) (b) Deshidrogenación del etano: C2H6(g) → C2H4(g) + H2(g) (c) Hidrogenación del acetileno: C2H2(g) + H2(g) → C2H4(g) (d) Deshidratación del etanol: C2H5OH(g) → C2H4(g) + H2O(g) 6.- El hierro puede obtenerse mediante la reacción 2 Fe2O3(s) + 3 C → 4 Fe(s) + 3 CO2(g) a temperatura elevada. Utilizando las tablas termodinámicas, estimar la temperatura a la cual esta reacción es termodinámicamente posible en condiciones estándar. Considerar que y ∆Sº son independientes de la temperatura. 838 K 7.- Las bolsas de aire (airbags) instaladas en la mayoría de los automóviles modernos para proteger a los pasajeros de posibles impactos, se basan en una reacción química que genera gas muy rápidamente (de un modo explosivo). Una reacción común para este fin es la descomposición de la azida de sodio, NaN3(s), en gas nitrógeno y sodio metálico. (a) Escribir la ecuación química de la reacción. (b) Predecir el signo del cambio de entropía de esta reacción sin realizar cálculos. (c) Calcular ∆Gº de la reacción a 25 ºC. Comentar el resultado. (d) ¿Cómo influye la temperatua en la espontaneidad o no de la reacción? Datos.- Sº(NaN3, s) = 96.9 J K-1 mol-1. ∆Hfº (NaN3, s) = +21,7 kJ/mol Tablas termodinámicas. 8.- ¿Puede haber un catalizador que descomponga el agua en hidrógeno y oxígeno a temperatura ambiente?