COLEGIO ROSARIO DE SANTODOMINGO BANCO DE PREGUNTAS BIOLOGÍA GRADO 7 - 2012
Anuncio
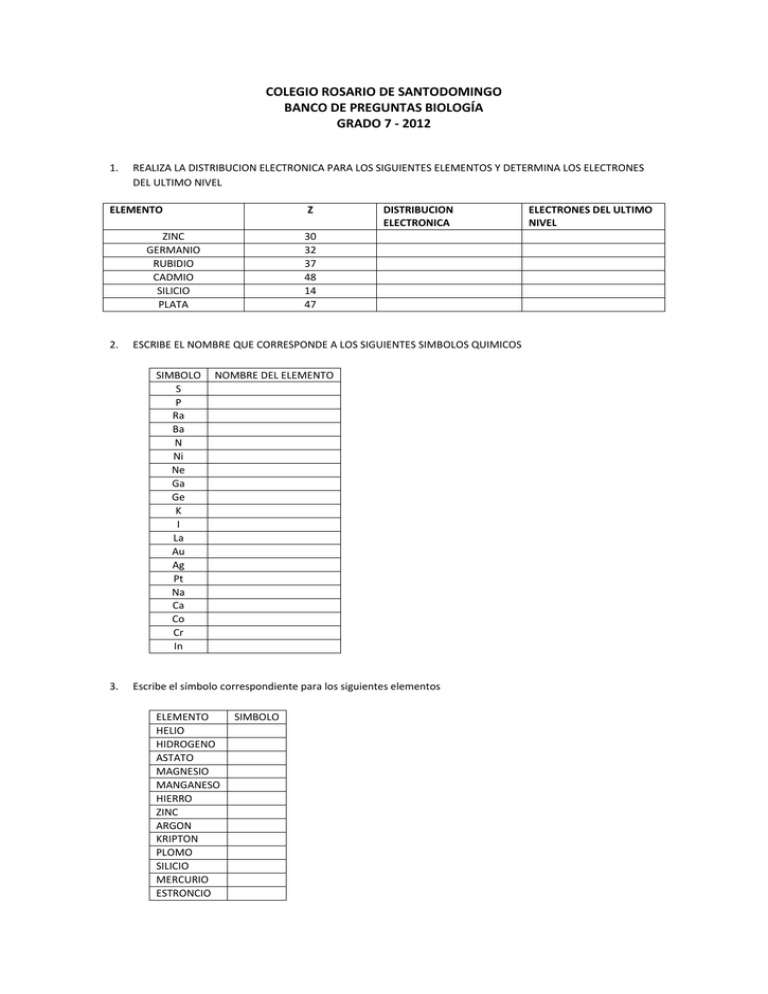
COLEGIO ROSARIO DE SANTODOMINGO BANCO DE PREGUNTAS BIOLOGÍA GRADO 7 - 2012 1. REALIZA LA DISTRIBUCION ELECTRONICA PARA LOS SIGUIENTES ELEMENTOS Y DETERMINA LOS ELECTRONES DEL ULTIMO NIVEL ELEMENTO Z ZINC GERMANIO RUBIDIO CADMIO SILICIO PLATA 2. 30 32 37 48 14 47 ESCRIBE EL NOMBRE QUE CORRESPONDE A LOS SIGUIENTES SIMBOLOS QUIMICOS SIMBOLO S P Ra Ba N Ni Ne Ga Ge K I La Au Ag Pt Na Ca Co Cr In 3. DISTRIBUCION ELECTRONICA NOMBRE DEL ELEMENTO Escribe el símbolo correspondiente para los siguientes elementos ELEMENTO HELIO HIDROGENO ASTATO MAGNESIO MANGANESO HIERRO ZINC ARGON KRIPTON PLOMO SILICIO MERCURIO ESTRONCIO SIMBOLO ELECTRONES DEL ULTIMO NIVEL BISMUTO TELURIO FLUOR FRANCIO HAFNIO ALUMINIO RUBIDIO A. 53 B. 7 5. PREGUNTAS DE SELECCIÓN MULTIPLE CON UNICA RESPUESTA 4. Los electrones para el último nivel de energía de un elemento que tiene número atómico 35 es de: Justifica tu respuesta. C. 5 D. 4 El rubidio es un elemento metálico que tiene número atómico de 37, al realizar la distribución electrónica presenta________niveles de energía. Justifica tu respuesta realizando la distribución A. 37 B. 5 C. 1 D. 6 6. Basadas en la información del punto anterior, los electrones que presenta en su último nivel de energía es de: Justifica tu respuesta. A. 2 B. 1 C. 5 D. 37 7. Completa correctamente cada uno de los siguientes enunciados: a. Cantidad de protones y neutrones que hay en el núcleo del átomo_______________________ b. Cantidad de protones que se encuentran en el núcleo del átomo________________________ c. Capacidad que posee un átomo para formar enlaces_______________________________ d. Electrodo o lámina cargada negativamente_________________________ e. Electrodo o lámina cargada positivamente ________________________ f. Átomos de la misma especie química con el mismo número atómico pero diferente número másico________________________ g. Átomos con el miso numero de protones en su núcleo pero diferente número de neutrones___________________________________. h. Átomos que poseen igual número másico pero difieren en su número atómico y pueden ser de especies químicas diferentes____________________________ i. ___________________ es la región del espacio donde existe la máxima probabilidad de encontrar un electrón. j. El modelo atómico que planteo por primera vez la existencia de los niveles de energía fue el de ___________________________________________________________ k. El modelo atómico de Thompson es similar a un pastel de pasas porque el planteamiento que el hizo fue: __________________________________________________________________________________ ________________________________________ l. El primer científico quien sugirió que en el átomo habían cargas positivas y negativas fue __________________________________________________________________________ m. El descubrimiento de la radioactividad se debe al Científico de nombre ___________________________________ n. En el modelo atómico actual en que parte del átomo encontramos los protones __________________________________________________________________________ o. Demócrito y Leucipo son importantes para la química porque: ___________________________________________________________________ p. Los elementos del grupo III A reciben también el nombre de: ___________________________________________________________________ q. 8. Los metales alcalinos corresponde a los elementos del grupo __________________________________________________________________ Basadas en la información del punto anterior, los electrones que presenta en su último nivel de energía es de: Justifica tu respuesta. A. 2 B. 1 C. 5 D. 37 9. Cuando existen átomos de elementos diferentes, es decir su número atómico varia, pero su masa atómica es la misma, estamos haciendo referencia a: A. Isótopos C. Isomorfismo B. Isóbaros D. Moléculas 17. El modelo atómico conocido como pastel de pasas , en el que se planteaba que los protones y electrones se encontraba distribuidos en todo el átomo fue propuesto por A. Niels Bohr B. Jhon Dalton C. Jhon Thomson D. Ernest Rutherford 10. En un mapa conceptual explica el desarrollo de los modelos atómicos. 11. En un cuadro sinóptico explica el desarrollo de la historia de la química. Para esto ten en cuenta las copias que tienes acerca de la historia de la química. 12. Escribe las diferencias que encuentras entre: a. Protón y electrón b. Átomo e ión c. A y Z d. Cátodo y ánodo e. Thomson y Rutherford f. Rutherford y Bohr g. Átomo y molécula h. Thomson y Bohr 13. Completa el siguiente cuadro con ayuda de la tabla periódica: SUSTANCIA AZUFRE CARBONO SILICIO CALCIO HIERRO ALUMINIO SODIO NUMERO MASICO NUMERO ATOMICO No DE PROTONES No DE NEUTRONES No DE ELECTRONES 14. En la siguiente tabla se presentan cinco átomos (hipotéticos) con el número de protones y de neutrones: a. b. ATOMO PROTONES A 15 B 20 C 23 D 18 E 15 ¿Cuáles de ellos son isótopos? Justifica tu respuesta ¿Cuáles de ellos son isóbaros? Justifica tu respuesta NEUTRONES 28 30 21 26 27 15. Los electrones para el último nivel de energía de un elemento que tiene número atómico 53 es de: Justifica tu respuesta. A. 53 B. 7 C. 5 D. 4 16. El rubidio es un elemento metálico que tiene número atómico de 37, al realizar la distribución electrónica presenta________niveles de energía. Justifica tu respuesta. A. 37 B. 5 C. 1 D. 6 B. PREGUNTAS DE SELECCIÓN MULTIPLE CON MULTIPLE Marque A si 1 y 2 son correctas Marque B si 2 y 3 son correctas Marque C si 3 y 4 son correctas Marque D si 2 y 4 son correctas RESPUESTA.(18-20) 18. El elemento químico Telurio posee número atómico de 52, al realizar la distribución electrónica tiene ____________ niveles de energía y__________ electrones en su último nivel. Justifica tu respuesta. 1. 5 niveles 2. 6 electrones 3. 6 niveles 4. 5 electrones 19. Dos de los científicos que plantearon que el átomo era una partícula indivisible fueron: 1. 2. 3. 4. Thompson Rutherford Demócrito y Leucipo Dalton. 20. El elemento plomo tiene una masa atómica de 207 y un número atómico de 82. El número de protones es de _____________ y neutrones_______. Justifique su respuesta. 1. 2. 3. 4. 207 120 82 125. 21. El número máximo de electrones que puede tener un elemento en el primer nivel es de ________________________ y en el tercer nivel___________ Justifique su respuesta. 1. 2. 3. 4. 2 18 8 14 22. Para el elemento indio de número atómico 49 y masa atómica 115, el número de electrones es de ________________ y en el último tiene posee electrones. Justifique su respuesta. 1. 2. 3. 4. 115 66 49 3 COMPLETA LOS SIGUIENTES ENUNCIADOS 18. Los elementos del grupo VI A reciben también el nombre de: _______________________________________________________________________ 19. Los metales metales alcalinotérreos son los siguientes: ( escribe símbolo y nombre de los elementos) ______________________________________________________________________________________ ________________________________________________________ Escribe en la siguiente tabla los elementos que pertenecen al periodo 3 y 5 18. 19. En el grafico anterior colorea la ubicación de los elementos de transición. 20. 21. 22. 23. Ubica con el símbolo químico y el grupo a que pertenecen los gases nobles. Ubica los elementos halógenos. Ubica en el grafico los elementos térreos Escribe 2 autores que contribuyeron en la organización de la tabla periódica. Los elementos del subnivel p pertenecen a los grupos __________________________ 18. Li B Mg Si V Rb Fe Zr Ba Co P Cl As Ag Kr In Re I Po Rn Para los anteriores símbolos ubicados en la tabla periódica escribe el nombre, el número atómico, grupo, periodo y el nombre de la familia a que pertenece. 18. SIMBOLO NOMBRE NUMERO ATOMICO GRUPO PERIODO NOMBRE DE LA FAMILIA DE ELEMENTOS 19. Observa cuidadosamente y determina las siguientes propiedades para los elementos anteriormente descritos. F H E G L B C I J K 19. Es un elemento halógeno del periodo 2 A. L B. J C. C D. D 20. Es un metal alcalinotérreo con número atómico 4 A. K B. J C. D D. C 21. Del elemento H podemos decir A. Es un elemento Halógeno B. Gas noble C. Pertenece a la familia de los térreos D. Posee 1 electrón de valencia 22. No podemos considerar como elemento de transición A. E B. G C. B D. C 23. El elemento D posee una de las siguientes características A. Es metal alcalinotérreo con dos electrones de valencia B. Es un elemento Halógeno C. Tiene numero atómico 5 D A D. Es un elemento anfígeno con dos electrones de valencia 24. Del elemento G podemos decir que: EXCEPTO: A. Tiene Z= 27 B. Es un elemento de transición C. Pertenece al grupo VIIIB D. Es del periodo 7 25. Los elementos de transición comprenden los periodos A. 1, 2,3 B. 4,5,6 C. 3,4,5 D. 1,2,5 26. Observando la tabla inicialmente planteada podemos decir que el elemento mas electronegativo Es: A. B. C. D. K C E L 37. la familia del nitrógeno pertenecen los elementos con los siguientes números atómicos. Con Excepción de: A. 15 B. 33 C. 7 D. 32 38. Teniendo en cuenta los números atómicos son elementos de transición los siguientes MENOS: A. B. C. D. 24 21 20 30 C G D E J F L I A H K B PREGUNTAS DE SELECCIÓN MULTIPLE CON UNICA RESPUESTA. OBSERVA DETENIDAMENTE EL ESQUEMA DE LA TABLA PERIODICA Y RESPONDE LOS SIGUIENTE CUESTIONAMIENTOS 39. ELEMENTO CON EL MAYOR CARÁCTER METALICO ES: A. A B. C C. D D. K 40. EL ELEMENTO MENOS ELECTRONEGATIVO ES: A. F C. J B. H D. B 41. EL ELEMENTO QUE NO POSEE VALENCIA POR CUMPLIR CON LA LEY DEL OCTETO ES: A. K C. L B. A D. J 42. EL ELEMENTO CON EL MENOR CARÁCTER METALICO ES: A. G B. J 43. EL ELEMENTO MÁS ELECTRONEGATIVO: C. L D. H A. J C. I B. L D. H 44. ESTE ELEMENTO POSEE DOS ELECTRONES DE VALENCIA A. C C. J B. G D. L 45. ESTA FAMILIA DE ELEMENTOS POSEE 7 ELECTRONES DE VALENCIA A. B. C. D. ANFIGENOS HALOGENOS TERREOS ALCALINOS 46. FAMILIA DE ELEMENTOS CON 2 ELECTRONES DE VALENCIA A. B. C. D. ANFIGENOS ALCALINOTERREOS TERREOS HALÓGENOS


