PTK: QUERATECTOMÍA FOTOTERAPÉUTICA
Anuncio
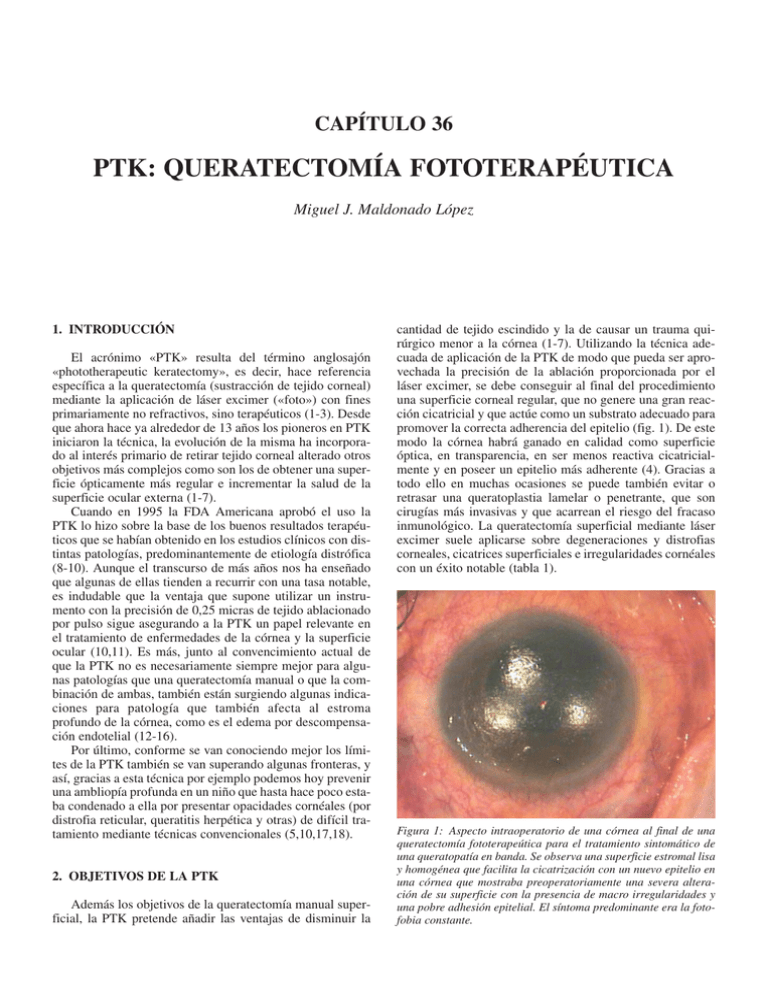
CAPÍTULO 36 PTK: QUERATECTOMÍA FOTOTERAPÉUTICA Miguel J. Maldonado López 1. INTRODUCCIÓN El acrónimo «PTK» resulta del término anglosajón «phototherapeutic keratectomy», es decir, hace referencia específica a la queratectomía (sustracción de tejido corneal) mediante la aplicación de láser excimer («foto») con fines primariamente no refractivos, sino terapéuticos (1-3). Desde que ahora hace ya alrededor de 13 años los pioneros en PTK iniciaron la técnica, la evolución de la misma ha incorporado al interés primario de retirar tejido corneal alterado otros objetivos más complejos como son los de obtener una superficie ópticamente más regular e incrementar la salud de la superficie ocular externa (1-7). Cuando en 1995 la FDA Americana aprobó el uso la PTK lo hizo sobre la base de los buenos resultados terapéuticos que se habían obtenido en los estudios clínicos con distintas patologías, predominantemente de etiología distrófica (8-10). Aunque el transcurso de más años nos ha enseñado que algunas de ellas tienden a recurrir con una tasa notable, es indudable que la ventaja que supone utilizar un instrumento con la precisión de 0,25 micras de tejido ablacionado por pulso sigue asegurando a la PTK un papel relevante en el tratamiento de enfermedades de la córnea y la superficie ocular (10,11). Es más, junto al convencimiento actual de que la PTK no es necesariamente siempre mejor para algunas patologías que una queratectomía manual o que la combinación de ambas, también están surgiendo algunas indicaciones para patología que también afecta al estroma profundo de la córnea, como es el edema por descompensación endotelial (12-16). Por último, conforme se van conociendo mejor los límites de la PTK también se van superando algunas fronteras, y así, gracias a esta técnica por ejemplo podemos hoy prevenir una ambliopía profunda en un niño que hasta hace poco estaba condenado a ella por presentar opacidades cornéales (por distrofia reticular, queratitis herpética y otras) de difícil tratamiento mediante técnicas convencionales (5,10,17,18). 2. OBJETIVOS DE LA PTK Además los objetivos de la queratectomía manual superficial, la PTK pretende añadir las ventajas de disminuir la cantidad de tejido escindido y la de causar un trauma quirúrgico menor a la córnea (1-7). Utilizando la técnica adecuada de aplicación de la PTK de modo que pueda ser aprovechada la precisión de la ablación proporcionada por el láser excimer, se debe conseguir al final del procedimiento una superficie corneal regular, que no genere una gran reacción cicatricial y que actúe como un substrato adecuado para promover la correcta adherencia del epitelio (fig. 1). De este modo la córnea habrá ganado en calidad como superficie óptica, en transparencia, en ser menos reactiva cicatricialmente y en poseer un epitelio más adherente (4). Gracias a todo ello en muchas ocasiones se puede también evitar o retrasar una queratoplastia lamelar o penetrante, que son cirugías más invasivas y que acarrean el riesgo del fracaso inmunológico. La queratectomía superficial mediante láser excimer suele aplicarse sobre degeneraciones y distrofias corneales, cicatrices superficiales e irregularidades cornéales con un éxito notable (tabla 1). Figura 1: Aspecto intraoperatorio de una córnea al final de una queratectomía fototerapeútica para el tratamiento sintomático de una queratopatía en banda. Se observa una superficie estromal lisa y homogénea que facilita la cicatrización con un nuevo epitelio en una córnea que mostraba preoperatoriamente una severa alteración de su superficie con la presencia de macro irregularidades y una pobre adhesión epitelial. El síntoma predominante era la fotofobia constante. 330 Superficie ocular Tabla 1. PTK en enfermedades de la córnea Láser Excimer utilizado Patología Éxito al Seguimiento final del (meses) seguimiento (%) Visx Summit Meditec Tauton Ojos Erosiones epiteliales recurrentes + + + + 203 16,5 77% Distrofias corneales Reis Buckler’s Lattice Granular Nodular de Salzmann Mapa -punto –huella Schnyder’s Avellino Climática Meesmann Endotelial de Fuch’s + + + + + + + - + + + + + + + + + + - + + + - 32 25 20 12 10 6 1 1 2 1 6,2 11 7,2 8,6 5,2 6 12 4 9 9 100% 92% 70% 67% 100% 67% 100% 100% 100% 100% Cicatrices corneales Postinfección Postraumático Herpética Tracoma Pterigión Síndrome de Steven-Johnson Tras lentes de contacto Etiología desconocida + + + + + + + + + + + + + + - + + + + - 12 23 24 3 10 3 2 12 8,5 11,1 15 6 11,2 11,7 3 14,6 50% 61% 71% 67% 80% 67% 50% 50% Irregularidades corneales Queratopatía en banda Cicatrices en queratocono + + + + - + - 136 21 12,3 9,7 91% 81% Displasia corneal intraepitelial - - + - 1 26 100% 3. EVALUACIÓN PREOPERATORIA EN LA PTK 3.1.1. Localización superficial de la patología En primer lugar debemos tener en cuenta que la PTK no sólo no es la única opción terapéutica —la queratectomía manual continúa teniendo un cierto papel— sino que además la PTK no es el tratamiento de primera elección para toda la patología de la córnea anterior (4). Desde esta perspectiva, según la cual la queratectomía fotorrefractiva no debe ser utilizada de modo indiscriminado deberemos atender a cuatro aspectos generales: 1.- la localización y la naturaleza de la patología corneal, 2.- la sintomatología subjetiva que genera, 3.- el error refractivo de partida, y 4.- la finalidad y expectativas que se fijen previamente. Desde este punto de vista la situación puede ser central, paracentral o periférica. La localización central, es decir dentro de los 3-4 mm centrales, implica que la lesión se encuentra en la zona óptica de modo que la visión va a estar afectada bien directamente por la falta de transparencia, bien por la inducción de astigmatismo irregular. El área paracentral comprende la córnea medio periférica situada entre el diámetro de los 4 y 7-8 mm. La patología situada en esta localización normalmente afectará a la visión de un modo indirecto, causando astigmatismo irregular o deslumbramiento en situaciones de baja luminosidad. En la zona periférica la patología existente causará sintomatología pero raramente afectará a la visión. 3.1. La localización y la naturaleza de la patología corneal 3.1.2. Patrón de distribución Inicialmente es necesario estudiar la extensión superficial, el patrón de distribución de la lesión y la profundidad a donde debe llegar la queratectomía. En general, cuanto más extensa y central, más homogéneamente esté distribuida y, en ocasiones, más profunda sea la lesión, más ventajas presentará la queratectomía con láser excimer sobre la manual (4). Según la regularidad y la extensión de las lesiones con respecto a la zona óptica podemos clasificar su distribución en nodular, segmentaria, difusa o completa. Las lesiones nodulares son alteraciones bien circunscritas, rodeadas de córnea sana y que se presentan de modo aislado o en bajo número. Capítulo 36. PTK: queratectomía fototerapéutica 331 Las lesiones segmentarias son similares a las nodulares pero ocupan una mayor extensión de córnea. La patología difusa hace referencia a la presencia de varias lesiones regularmente distribuidas por la córnea pero sin llegarla a ocupar en la mayoría de su extensión. La distribución completa comprende lesiones que ocupan la totalidad de la córnea central. 3.1.3. Profundidad La medida de la profundidad la da no la localización de la lesión sino hasta dónde ha de llegar la queratectomía para conseguir los efectos terapéuticos deseados. Por ejemplo, ante una distrofia reticular que llegue al estroma posterior el objetivo puede ser ablacionar las 100 micras más superficiales porque sean las más densas ópticamente. Aun así, para poder determinar el lugar más profundo de la queratectomía y clasificar la accesibilidad de la lesión es importante poder determinar mediante métodos objetivos el alcance antero posterior de la lesión. Para ello podemos contar con la inestimable ayuda de técnicas de imagen como la biomicroscopía ultrasónica convencional, el ultrasonido de muy alta frecuencia o el OCT (fig. 2) (19,20). La microscopía confocal puede además mostrar por sí misma características de la lesión que permitan por ejemplo filiar la distrofia en cuestión (21,22). Para aquellos centros en los que la dotación de los sistemas de imagen no incluya los antes mencionados, también se puede calcular la profundidad de una lesión utilizando el paquímetro óptico (1). Cuando consideremos la paquimetría central de la córnea a tratar es importante recordar que el valor que pueda ofrecer el sistema de exploración Orbscan estará falsamente disminuido por la presencia opacidad corneal (23,24). Los niveles que contemplamos según la profundidad son, pre-Bowman, Bowman, estromal anterior y estromal profundo. Las lesiones de localización pre-Bowman incluyen las que asientan en el epitelio y la membrana basal. La patología de localización en la membrana de Bowman abarca también la que se acompaña de alteraciones concomitantes en el epitelio y en la membrana basal. Las lesiones del estroma anterior comprenden las patologías que asientan fundamentalmente en las 100 a 150 micras superficiales de la córnea. La patología del estroma profundo se localiza más profunda que las 150 micras anteriores (fig. 2). 3.2. La sintomatología Además de las necesidades en relación con la agudeza visual sin y con corrección es frecuente que el paciente presente fotofobia, dolor o molestia importante, sensación de ver halos, deslumbramiento, diplopia monocular o nube a momentos del día o de modo constante. Figura 2: Imagen proporcionada por el tomógrafo de coherencia óptico (OCT) en la que se puede realizar una valoración del número y de la localización de las lesiones en una distrofia reticular. La distribución predominantemente posterior de las opacidades contraindica la aplicación de la PTK como tratamiento rehabilitador visual en este caso. acabar con una hipermetropía inducida significativa mientras que el que reciba una queratectomía manual no (2527). Teniendo esto en consideración, por ejemplo, un paciente con una distrofia de Reis-Bücklers, si es miope va a tolerar mucho mejor una PTK que si es emétrope o hipermétrope, y su grado de satisfacción va a ser mayor con una queratectomía manual. Cuando la patología es muy anterior también se puede plantear combinar la queratectomía láser con fines refractivos para la corrección de su ametropía con una desepitelización manual o una PTK transepitelial suave (4,28). 3.4. La finalidad y expectativas de la intervención En este apartado hay que incluir la expectativa del paciente de tener una buena agudeza visual sin corrección o con corrección (en cuyo caso se puede considerar la posibilidad de quedar hipermétrope). Por ejemplo, si un paciente se pretende corregir de una cicatriz corneal para axial que le permite una agudeza visual bastante buena, posiblemente va a tolerar muy mal una PTK que le deje con una agudeza visual corregida mejor pero con una mala agudeza visual sin corrección por una hipermetropía inducida (4). Por otra parte si el paciente se corrige de una patología del estroma anterior con la idea de intervenirse posteriormente de catarata y así evitar un procedimiento combinado (queratoplastia + extracción de catarata + implante LIO), poco importará si inicialmente la PTK le deja algo hipermétrope, ya que el cálculo apropiado del poder de la LIO acabará compensando este defecto refractivo inicial (29,30). 4. LA DECISIÓN TERAPÉUTICA 3.3. El error refractivo Ante una misma patología en un ojo emétrope se debe tener en cuenta que el paciente intervenido de PTK va a Cuando se decide acerca de la técnica de queratectomía más adecuada el primer factor a tener en cuenta es la localización de la lesión. A partir de entonces se procederá a con- 332 Superficie ocular siderar la distribución, la profundidad, la sintomatología que provoca la patología y los aspectos refractivos y las exigencias del paciente (4,27). cicatriz densa focalmente es difícil debido a la diferente tasa de ablación del tejido cicatricial y el sano. Además, al ablacionar áreas contiguas de córnea normal es fácil inducir por el mismo motivo astigmatismo irregular, visualmente significativo al ser de localización central. 4.1. En lesiones de localización central 4.1.1. De distribución nodular o segmentaria 4.1.2. De distribución difusa o completa Dentro de las lesiones situadas en la zona óptica, si la alteración es nodular o segmentaria habrá que proceder con la intención de escindir la lesión sin alterar la córnea sana circundante, objetivo que muchas veces se consigue adecuadamente con una queratectomía manual. La PTK en esta situación ofrece escasas ventajas; quizás la excisión sea algo más completa, lo cual sólo resultaría superior si patología justo se situara en la intersección del eje visual (en este caso la inducción de astigmatismo e hipermetropía podría ser menor utilizando la técnica de PTK con «pulido» —ver más adelante el epígrafe «estrategias de tratamiento»—). Por otro lado, se debe tener en cuenta que el fotoablacionar una Cuando la patología se presenta con una distribución difusa o completa la excisión selectiva de los componentes es habitualmente inviable, por lo que se suele plantear la queratectomía de toda la capa afectada de la córnea. A partir de este momento debemos considerar otros factores como la profundidad de la queratectomía para tomar la decisión más oportuna. — Las lesiones que afectan sólo al nivel pre-Bowman pueden ser eliminadas manualmente sin mayor dificultad y sin presentar riesgo elevado de inducir reacción cicatricial intensa. La aplicación del láser excimer puede estar justificada cuando además de eliminar el epitelio se desee tratar mínimamente la membrana de Bowman, como ocurre en el síndrome de la erosión corneal recurrente. En los casos en los que exista además un defecto de refracción se puede proceder con un tratamiento fotorrefractivo. — La patología que afecta al nivel de la membrana de Bowman es más susceptible de beneficiarse específicamente de la PTK, aunque en muchos casos la queratectomía manual va a jugar un papel relevante. Entonces serán otros aspectos como los refractivos o el grosor de córnea los que decidirán sobre la conveniencia de una técnica u otra. El ejemplo clásico lo constituye la distrofia de Reis-Bücklers, que en principio podría ser tratada manualmente (especialmente anticipando una probable recurrencia en el tiempo y un grosor de córnea algo escaso para realizar sucesivas fotoablaciones), pero que en un paciente que sea miope la aplicación de láser excimer (en forma de PTK sólo si es muy levemente miope o de PRK si la miopía es media o alta) va a constituir una decisión terapéutica más acertada (31-34). Cuando la patología no es fácilmente escindible mediante queratectomía manual, como resulta en los casos de cicatrices postinfecciosas o en la queratopatía climática, el papel de la PTK es indiscutible. Aun así es importante atender a los aspectos funcionales del paciente; no va aceptar igualmente una hipermetropía residual inducida por la PTK un paciente emétrope que preoperatoriamente muestre una agudeza visual aceptable (viendo por ejemplo 0,7 sin corrección preoperatoriamente y en el postoperatorio 0,5 sin corrección y 0,9 con corrección, pero insatisfecho con su nueva situación sin corrección) que aquél cuya agudeza visual preoperatoria sea lo suficientemente baja como para interferir en las tareas diarias como la conducción y la lectura. — Cuando la patología afecte al nivel estromal anterior la complejidad de realizar una buena queratectomía manual se incrementa notablemente, al igual que el riesgo de inducir una cicatriz postoperatoria importante (4,27). En estos casos la PTK debe ser aplicada con la estrategia quirúrgica más apropiada al caso, como se explica en los sucesivos epígrafes. De este modo se puede diferir o evitar la realización de una queratoplastia (fig. 3). Figura 3: A) Distrofia granular en la que las lesiones asientan predominantemente en el estroma anterior. B) En este caso la PTK muestra su utilidad para incrementar temporalmente la transparencia corneal y así poder diferir o incluso eludir una queratoplastia. (Foto cortesía del Dr. Rafael Martínez Costa, Hospital La Fe, Valencia). Capítulo 36. PTK: queratectomía fototerapéutica 333 — La patología que afecta al nivel estromal profundo sólo puede ser parcialmente tratada mediante PTK. En casos como la queratopatía bullosa o la distrofia macular, el láser excimer puede aliviar la espera del paciente hasta el momento de la queratoplastia penetrante (12-16). 4.2. En lesiones de localización paracentral Aquella patología que no afecta al área pupilar debe ser tratada primariamente mediante queratectomía manual. Estamos ante casos (como ocurre en un nódulo de Salzmann paracentral) en los que el objetivo fundamental es disminuir la sintomatología irritativa, la recurrencia de las erosiones o la probabilidad de que la patología se extienda centralmente, no de mejorar primariamente la agudeza visual. Por ello mismo no es necesario habitualmente escindir la totalidad de la lesión para obtener el beneficio terapéutico buscado. Por otro lado, la PTK no ofrece ninguna ventaja clara en estos casos y, es más, puede inducir más astigmatismo irregular al ablacionar la córnea adyacente sana (4,27). Figura 4: Imagen intraoperatoria en la que el láser excimer está realizando PTK transepitelial. Las flechas señalan una leve fluorescencia azulada que corresponde a la interacción entre el láser y el epitelio corneal y que sólo es perceptible bajo la oscuridad total. La luz verde central corresponde a los sistemas de fijación y alineación del láser. 4.3. En lesiones de localización periférica Cuando la alteración reside en la córnea periférica la indicación suele ser más bien sintomática y la probabilidad de inducir astigmatismo irregular visualmente significativo muy baja por la distancia existente con el eje visual. Entonces se puede realizar una queratectomía tanto manual, láser, como combinada. 5. TÉCNICAS DE QUERATECTOMÍA TERAPÉUTICA 5.1. Lo que hay que conocer acerca del láser excimer 5.1.1. Naturaleza del láser excimer y su interacción con el estroma y epitelio corneales El láser excimer constituye radiación del espectro ultravioleta C, más en concreto de longitud de onda de 193 nm (35,36). Cuando se aplica sobre la córnea, su elevada energía es absorbida por los glucosaminoglicanos, proteínas y ácidos nucleicos presentes en la córnea de modo que los enlaces moleculares son destruidos y los fragmentos moleculares son despedidos a una velocidad supersónica. A este proceso se le denomina foto descomposición ablativa y la eyección de material constituye la denominada «pluma efluente». La razón por la que esta longitud de onda es utilizada reside en su facultad de poder ser absorbida mayoritariamente por la superficie del tejido corneal expuesto causando un mínimo daño al tejido adyacente (ni térmico, ni acústico por las ondas de choque). A diferencia del bisturí que corta y escinde tejido, el láser excimer elimina tejido de la superficie de la córnea en una extensión idéntica al diámetro de su haz proyectado. Para que el láser excimer sea eficiente en su actividad de retirar tejido corneal es necesario que el «flujo», es decir, la densidad de energía por pulso sea mayor a 50 mJ/cm2. La mayoría de los láseres actuales rinden entre 120 y 250 mJ/cm2 por pulso, la duración del mismo oscila entre 10 y 20 ns, y trabajan con una frecuencia de pulso de entre 5 y 20 Hercios. De este modo, cuando el flujo se sitúa alrededor de los 180 mJ/cm2, cada pulso ablaciona 0,25 micras de tejido estromal por pulso (35,36). La tasa de ablación del epitelio corneal por pulso para un determinado flujo es mayor que para el tejido estromal, y para éste último mayor que para la membrana de Bowman (35). Además, cuando se ablaciona el epitelio éste emite una fluorescencia característica de color azulado que es perceptible cuando las luces de la sala del láser excimer están apagadas (fig. 4) (37). Cuando la ablación llega al tejido estromal entonces la auto fluorescencia desaparece, fenómeno que se debe a su menor contenido en agua, y aparecen inicialmente áreas oscuras pertenecientes a la interacción con el colágeno de la membrana de Bowman. Al haber eliminado todos los restos epiteliales, el área que se expone al haz del láser presenta un aspecto oscuro y ausencia total de auto fluorescencia. 5.1.2. Tipos de láser excimer según el sistema de liberación Existen tres tipos fundamentales de sistema de liberación (36). Según el sistema de liberación los láseres pueden ser: 1) De haz de campo amplio, en ellos el láser se proyecta sobre la córnea con un haz circular de diámetro controlable. Su acción ablativa suele ser rápida, sin embargo, son láseres en los que resulta difícil mantener una homogenei- 334 Superficie ocular 5.1.3. El perfil de la ablación en la PTK Figura 5: A) Perfil de ablación miópico caracterizado por una mayor eliminación de tejido corneal en el centro que en la periferia en la queratectomía fotorrefractiva. B) Perfil de ablación en una PTK; la eliminación de tejido pretende ser primariamente uniforme, remedando la curvatura original de la córnea, para no inducir ningún cambio refractivo. Sin embargo, la cicatrización epitelial y los fenómenos de retracción tisular del borde del área tratada condicionan habitualmente un cambio refractivo hacia la hipermetropía en el postoperatorio. dad perfecta en el perfil de energía de todo el haz. Por ello, en la práctica este diámetro es difícil que exceda los 6,5 mm. Aún así es posible encontrar la presencia de islas centrales o paracetrales que son la consecuencia de la presencia de heterogeneidades en el frente del haz ancho, la ineficacia en la limpieza de la pluma de eyección entre pulso y pulso, la falta de homogeneidad en la hidratación del tejido ablacionado o una combinación de ellas. 2) De hendidura de barrido, en éstos un haz en forma de hendidura actúa continuamente barriendo de derecha a izquierda y de izquierda a derecha de modo que un diafragma de apertura controlable determina el área de córnea expuesta al láser. El sistema es algo más lento pero, por el contrario, no es típica la presencia de islas centrales o paracentrales. 3) De punto flotante, en ellos el haz del láser presenta un diámetro constante de aproximadamente entre 1 y 2 mm de diámetro y es liberado sobre el área de la córnea a tratar de modo que acumulando los puntos de actuación contiguos se cubre el área deseada. El grado de solapamiento entre los puntos y la velocidad de actuación del láser dependen en gran medida del tipo de distribución de perfil del haz que, a su vez, puede ser, «gaussiano» (si el flujo es mayor en el centro y menor conforme se acerca a la periferia), en «sombrero plano» (si el flujo es constante en todo el diámetro del haz), o un híbrido entre ambos (plano en el centro y en disminución cerca del borde periférico). Estos láseres tienen en general una velocidad de actuación baja, requieren del concurso de un buen seguidor de los movimientos oculares para ser precisos, pero a cambio proporcionan un perfil de ablación para una extensión considerable de córnea mejor que cualquiera de los otros. A diferencia de la aplicación del láser excimer con fines refractivos, en los que por ejemplo se ablaciona más tejido en el centro de la córnea que en la periferia para corregir miopía, en la PTK el tejido estromal es ablacionado con un perfil plano, es decir, se retira igual cantidad de tejido en el centro de la córnea que en la periferia de la zona óptica seleccionada, constituyendo una figura similar a un cilindro cúbico de ablación (fig. 5). En la práctica, aunque la aplicación del láser excimer con un perfil plano no pretenda cambio refractivo alguno, lo cierto es que el epitelio corneal crea durante su cierre un menisco periférico que acaba induciendo una tendencia clara hacia el cambio hipermetrópico en estos ojos (6,7). Por ello, muchos láseres ofrecen en su modo de actuación PTK una transición de ablación por fuera de la zona óptica elegida para crear una progresión en el tejido estromal ablacionado que minimice la tendencia del epitelio corneal a crear menisco periférico. También la retracción de las lamelas corneales de la córnea adyacente al cráter de ablación parecen jugar un papel importante en el viraje hipermetrópico de la refracción tras la PTK (38). En general, la inducción de hipermetropía como consecuencia del tratamiento en modo PTK será menor cuanto: menor sea la profundidad de ablación elegida, mayor sea la zona óptica tratada y más progresiva sea la transición periférica. Algunos cirujanos que trabajan con láseres de haz de campo amplio sin la posibilidad de realizar transiciones periféricas programadas suelen aplicar a la cabeza del paciente un suave movimiento giratorio durante la ablación para lograr un efecto similar y así disminuir la tendencia hacia la hipermetropía (es la denominada «maniobra de pulido», ver epígrafe «estrategias de tratamiento) (39). Por último, existen láseres de haz de punto flotante que permiten elegir el modo de ablación PTK controlado por «joystick». Es decir, el haz de aproximadamente 2 mm de diámetro se puede dirigir mediante una barra que controla el cirujano con movimiento en el eje x e y, al área de la córnea que se desea tratar. Este modo de actuación es útil cuando se pretende ablacionar focalmente un área opacificada y/o elevada de la córnea que está rodeada de tejido sano. 5.1.4. Preparativos fundamentales para la aplicación del láser excimer (puesta a punto) Independientemente del tipo de láser del que se trate deberemos siempre realizar una serie de tareas que, aunque rutinarias, son indispensables antes de tratar cualquier caso (36). En primer lugar debe llevarse a cabo un calibrado de la energía para determinar que el flujo que presenta es el adecuado (se suele realizar sobre materiales ablacionables de un grosor y color predeterminado o, alternativamente, ablacionando una placa de PMMA que luego será llevada a un frontofocómetro para medir el cambio refractivo inducido cuando el láser se ha utilizado en modo de queratectomía fotorefractiva —PRK—). Durante el calibrado también se debe consignar la homogeneidad del haz. Si durante la ablación es muy clara Capítulo 36. la asimetría del haz de modo que se detecta un área en el que el láser ablaciona a una tasa menor que el resto, significa bien que la cavidad del láser necesita un recambio de gas, bien que la energía está al límite, bien que la óptica del láser se ha deteriorado por el uso y no es capaz de mantener la homogeneidad completa o una combinación de ellas. En la práctica, si no se consigue una ablación más regular sobre el material de prueba tras realizar un recambio de gas y/o elevar la energía de salida del láser es mejor posponer la cirugía y esperar a la actuación del servicio técnico. También habrá que consignar el centrado del haz con respecto al rayo guía, que según en los modelos de láser de haz de campo amplio y de punto flotante suelen ser de color rojo o verde. Si la alineación no es la adecuada y no se puede modificar hasta llegar a su punto idóneo es mejor no proceder con la intervención hasta que el servicio técnico lo centre perfectamente. En los aparatos con sistema de seguimiento ocular («eye tracker»), será imprescindible constatar que su funcionamiento es impecable. Aún así, la utilización coadyuvante de un anillo de fijación manual o unas pinzas de conjuntiva tipo Arrowsmith o Bores (siempre de material no reflectante para que no interfiera con el funcionamiento del sistema de seguimiento ocular) asegurará una mejor calidad de tratamiento en los pacientes menos colaboradores. PTK: queratectomía fototerapéutica 335 5.3. Estrategias de tratamiento En realidad la queratectomía fototerapéutica comprende un espectro de técnicas que comprenden desde aquéllas en las que sólo se aplica el láser excimer, hasta aquéllas en las que el láser excimer completa o sirve de coadyuvante a una queratectomía manual (27,45). Precisamente empezaremos por su antecesora, la queratectomía manual para mostrar las posibilidades de tratamiento existentes. 5.3.1. La queratectomía manual En la técnica manual el epitelio alterado o suprayacente a la lesión se suele raspar suavemente utilizando una lanceta (esponja) quirúrgica seca o una espátula con su borde no cortante. Se debe extremar el cuidado para no lesionar del tejido sano subyacente, ni el epitelio limbar para asegurar un buen cierre epitelial. Si la lesión se sitúa debajo del epitelio se debe identificar a continuación el plano de clivaje secando con la punta de lanceta (fig. 6) (45). Una vez identificado se procederá a la elevación de su borde utilizando la misma punta de la esponja, una espátula roma o el lado no cortante de un bisturí. A partir de este momento suele ser útil utilizar 5.2. Preparación del paciente Antes de realizar cualquier tipo de queratectomía se debe asegurar que la superficie ocular no esté con actividad inflamatoria. Por otro lado si existe infección ésta será tratada y controlada previamente. Se deberá buscar la existencia de blefaritis para que el tratamiento previo sitúe al ojo en mejor disposición de recibir la cirugía. Se debe tratar también la presencia de inflamación intraocular, que de lo contrario podría activarse más por la liberación tisular de mediadores de la inflamación (40). Cuando se vaya a ablacionar una cicatriz herpética se administrará con 3 días de antelación aciclovir o valaciclovir orales y/o aciclovir tópico para evitar la reactivación viral y sus complicaciones (41-43). Es conveniente aplicar povidona yodada diluida al 5% en los fondos de saco o un antibiótico tópico preoperatorio para disminuir la carga microbiana de la flora justo antes del procedimiento (44). La anestesia suele ser tópica exclusivamente, como se utiliza en otros procedimientos de aplicación de láser excimer. También puede ser prudente administrar un relajante benzodiacepínico, especialmente si el paciente es algo nervioso. En este sentido también puede ayudar el realizar un pequeño entrenamiento para que el paciente libere ansiedad, se acostumbre al ruido y a la emisión del olor característico del láser cuando interacciona con la córnea. Estos ensayos se pueden realizar disparando unos pocos pulsos (25 aproximadamente) sobre el epitelio, para luego proceder con la desepitelización completa bien manualmente o mediante láser, o sobre una fina capa de metilcelulosa al 1%. Figura 6: Técnica de queratectomía manual en la que con la ayuda de una lanceta quirúrgica se identifica el plano de clivaje y con la suave tracción de unas pinzas se va escisionando la lesión. 336 Superficie ocular 5.3.2. La PTK en superficie extensa Figura 7: Aplicación de la PTK para el tratamiento de una lesión de superficie extensa. unas pinzas para tirar perpendicularmente del tejido patológico mientras con la otra mano se prosigue a la disección de la lesión manteniendo el plano de clivaje. Cuando la adhesión es muy grande se puede utilizar con cuidado la cuchilla de un bisturí. Al final, si quedan residuos de la lesión o la superficie no ha quedado muy homogénea se puede raspar suavemente con la lanceta o el borde no cortante del bisturí. En el caso de la queratopatía en banda se aplicaría EDTA al 0.35% (46). Figura 8: Cuando la superficie del tejido a ablacionar es irregular la mera aplicación de una PTK deja al final del tratamiento un perfil análogamente irregular (arriba). La aplicación de metilcelulosa al 1% rellena las depresiones protegiéndolas de la ablación mientras que el láser va eliminando los picos de las irregularidades (intermedio). De este modo al final la PTK no sólo ha eliminado la lesión sino que también ha procurado una superficie más homogénea (abajo). Esta técnica, que es la más directa de PTK, se aplica sobre lesiones de distribución difusa o completa como ocurre en las distrofias de Reis-Bücklers, reticular y muchas otras queratopatías anteriores (fig. 7) (45). Si el epitelio muestra una superficie irregular éste deberá ser raspado utilizando una lanceta quirúrgica seca de modo análogo a como se acaba de explicar en la queratectomía manual. Así evitaremos que el láser traslade dicha irregularidad a las capas de la córnea que contienen colágeno. Por el contrario, si el epitelio parece cubrir de modo homogéneo irregularidades más internas, se aplicará el láser directamente sobre él, y nos beneficiaremos de la actuación del epitelio como «agente enmascarante» (27). Cuando se trate el síndrome de erosión corneal recidivante debido a la distrofia de membrana basal, el epitelio suprayacente es eliminado con una lanceta quirúrgica para luego aplicar el láser de un modo superficial (PTK de aproximadamente 4 micras de profundidad). En este tipo de aplicación el diámetro de la zona óptica del láser oscilará entre los 5 y los 7 mm, con sus respectivas zonas de transición, si las tuviera. En general el número de pulsos se calcula teniendo en cuenta que de media el láser viene a ablacionar una micra de tejido cada cuatro pulsos. Cuando se traten cicatrices cornéales hay que considerar sólo aquéllas que realmente sean superficiales (<100 micras) y evitar córneas demasiado delgadas para no inducir una ectasia iatrogénica. En ocasiones es necesario homogeneizar la superficie de la córnea que se está ablacionando. Para ello es necesario utilizar agentes enmascarantes (fig. 8) (47-51). El más utilizado es la metilcelulosa al 1%. Concentraciones superiores al 1% no sólo rellenan los «valles» del perfil sino también los picos haciendo la homogeneización poco efectiva. Por otro lado, concentraciones inferiores no se fijan bien sobre los «valles» del área deseada. La cantidad de metilcelulosa empleada ha de ser la apropiada. Cuando es excesiva, el sonido típico de chasquido del láser interactuando con la córnea se vuelve marcadamente amortiguado o apagado. Al ablacionar una capa de metilcelulosa es típico observar un cierto blanqueamiento de la superficie y la aparición de finas burbujas. En los últimos años han aparecido sistemas más complejos que pretenden homogeneizar completamente la superficie ablacionada mediante PTK, como son la «BioMask» y la «PALM». El sistema BioMask está compuesto de colágeno porcino tipo I que según se calienta (47°) se vuelve lo suficientemente líquido como para conformar la curvatura de una lente de contacto rígida con una curva base conocida y se ablaciona con una tasa de 0,28 micras/pulso (49,50). El sistema PALM está constituido por un gel que también se puede conformar a la curvatura que le proporcione a modo de molde una lente de contacto rígida (51). La metilcelulosa también puede ser utilizada para enmascarar áreas de córnea sana adyacentes a la lesión que se pretende tratar (fig. 9) (45). En esta situación, concentraciones superiores, en torno al 2,5%, suelen ser muy útiles porque la metilcelulosa tiende a permanecer muy compacta en el área instilada. De modo análogo, la metilcelulosa puede ser utilizada para proteger las áreas que la topografía Capítulo 36. PTK: queratectomía fototerapéutica 337 Figura 10: Técnica de «pulido» en la que el haz del láser recae siguiendo un movimiento circular para homogeneizar el tratamiento y lograr que la ablación sea máxima donde la lesión es más gruesa y disminuya progresivamente hacia la periferia. Figura 9: Cuando la lesión muestra un grosor asimétrico (arriba), la PTK llega a encontrarse con tejido corneal sano en un área y patológico en otra (intermedio). Para evitar que el láser elimine córnea sana y además deje una superficie irregular la metilcelulosa al 2,5% puede enmascarar el tejido sano mientras la PTK sigue eliminando la lesión. (especialmente con topografía de proyección-elevación) muestre que están más deprimidas y así homogeneizar las áreas más elevadas de la superficie óptica. Alternativamente el láser puede ser empleado focalmente con el perfil de ablación miópico ajustando el número de pulsos y el diámetro de la ablación para disminuir protusiones que puedan estar creando astigmatismo irregular (52). Cuando el área a tratar es muy extensa o cuando el láser de haz de campo amplio no ofrece zonas de transición preestablecidas se puede utilizar la técnica del «pulido» —para evitar un cráter profundo de paredes perpendiculares con una mayor inducción de hipermetropía— (fig. 10) (38,45). En estos casos la transición se consigue moviendo la cabeza del paciente de modo circular para crear un cierto escalonamiento periférico en el perfil de la ablación. Otra técnica alternativa sugerida por algunos autores consiste en ablacionar un anillo periférico correspondiente al borde de la PTK con un diámetro de haz pequeño (unos 2 mm) para disminuir el efecto «escalón». En su defecto, algunos autores han utilizado en el pasado la técnica de situar en el centro del área tratada, que debe coincidir con el centro pupilar, una lente de contacto recortada a un diámetro de 5 mm, un papel de filtro estéril recortado circularmente o una gota de metilcelulosa al 2,5% de similares dimensiones (fig. 11) (45). Entonces se aplicaba más PTK (entre 50 y 100 pulsos) con el mismo diámetro que de este modo creaba un surco periférico que tendía a corregir la hipermetropía inducida por la ablación terapéutica. Hoy en día esto se realizaría mejor aplicando una cierta corrección hipermetrópica al final de la PTK (5). Para realizar una excisión adecuada, ni excesivamente profunda ni demasiado superficial, es conveniente sentar al paciente con cierta periodicidad en una lámpara de hendidura y comprobar así el estado de ablación de la lesión. Cuando la rugosidad del estroma impide identificar bien el tejido corneal en el corte de la hendidura de luz, suele resultar muy práctico instilar una gota de metilcelulosa para que homogeneice la superficie óptica de la córnea. Alternativamente el uso de una endoluz de un vitreotomo a nivel limbar produce una dispersión luminosa de la esclerótica y córnea que permite observar opacidades incluso residuales bajo el microscopio quirúrgico, sin necesidad de utilizar una lámpara de hendidura (53). Hay que recordar que para muchas patologías el objetivo de la PTK no es la eliminación exhaustivamente completa de toda la opacidad sino su disminución significativa, ya que la primera suele darse a cambio de crear un gran cráter en la córnea con las repercusiones cicatriciales y refractivas que ello conlleva (27). Al final del procedimiento el estroma corneal muestra un aspecto típico de «cristal sin pulir» (fig. 1) que desaparecerá cuando el epitelio lo cubra totalmente en el postoperatorio. 338 Superficie ocular Figura 12: A) Técnica combinada en la que la queratectomía se inicia manualmente para eliminar el tejido más accesible y posteriormente la PTK ablaciona las localizaciones más profundas de la lesión. B) La PTK también se puede aplicar con metilcelulosa al 1% para poder conseguir además una superficie final más homogénea. Figura 11: Cuando la PTK se utiliza para tratar lesiones centrales (A), es habitual dejar al final un cráter de ablación (B) que induciría una hipermetropía notable. A continuación se puede colocar en el centro del área tratada un agente enmascarante (C) que facilite que una pequeña PTK adicional ablacione sólo tejido del área periférica (D), dejando así un perfil de curvatura que evite dicha tendencia hacia la hipermetropía (E). 5.3.3. PTK y queratectomía manual combinadas El realizar primero una desepitelización manual cuidadosa y excisión manual de las lesiones para aplicar posteriormente PTK con enmascaramiento de metilcelulosa resulta superior a la utilización únicamente de PTK para todo el procedimiento en patologías en las que existe una diferencia muy grande entre la consistencia de la lesión y la córnea normal (fig. 12) (45). Constituyen buenos ejemplos indicaciones como la queratopatía en banda, en la que el calcio se halla más concentrado en unas zonas que en otras, o lesiones cornéales con vascularización que al sangrar, bloquean parcialmente el efecto del láser (fig. 13). En estos casos, la diferente tasa de ablación para cada área actuando desde un principio dejaría finalmente una superficie muy irregular (45). 5.3.4. Aplicación (alisamiento) focal El láser excimer se puede aplicar focalmente sobre por ejemplo nódulos de Salzmann, o los apicales del queratocono para permitir un porte de la lente de contacto más confortable. Este efecto de «alisamiento» también se puede conseguir mediante queratectomía manual o combinada manual más láser. Es importante en estos casos evaluar preoperatoriamente la elevación de la lesión, de modo que por cada micra habrá que aplicar aproximadamente al menos 4 pulsos. La intervención se inicia retirando manualmente, mediante disección roma, el epitelio suprayacente, mientras que el epitelio que cubre córnea normal se deja intacto (fig. 14) (45). De este modo el epitelio enmascara las áreas de córnea sana. Capítulo 36. PTK: queratectomía fototerapéutica 339 Figura 13: PTK + membrana amniótica en córnea con queratopatía en banda y moderada descompensación endotelial. A) Irregularidad provocada por la queratopatía en banda antes de iniciar el alisamiento de la superficie mediante PTK. B) Instilación de agente enmascarante teñido con fluoresceína para permitir una mejor visualización del mismo. C y D) Ablación con láser de punto flotante en la que el área protegida por la metilcelulosa teñida emite mayor fluorescencia que el tejido corneal durante la PTK. Periódicamente se hace un pequeño paréntesis en la ablación para extender el agente enmascarante de un modo uniforme utilizando una espátula o una hemosteta. E) Ahora la córnea muestra una superficie ópticamente más regular que en «A». F) Se inicia el proceso de aplicación de la membrana amniótica para promover una mejor cicatrización postoperatoria y una menor inflamación asociada. 340 Superficie ocular Figura 14: Ante lesiones de distribución focal se puede desepitelizar localmente el epitelio suprayacente de modo mecánico, preservando el epitelio que protege la córnea sana adyacente como agente enmascarante, y proceder a una PTK del diámetro adecuado. Adicionalmente también se puede utilizar metilcelulosa al 2,5% para las áreas sanas adyacentes. El diámetro de la PTK se ajusta a la medida del área frontal de la lesión. La aplicación de láser se interrumpe para controlar biomicroscópicamente que la lesión se ha igualado con el tejido normal sin llegar a crear un cráter por sobre tratamiento. 5.4. Régimen postoperatorio Al finalizar la intervención bien se adapta una lente de contacto terapéutica o se ocluye el ojo hasta la epitelización completa (fig. 15). Siempre se debe administrar un antibiótico tópico (cada 3 ó 4 horas). La instilación de un antiinflamatorio no esteroideo suele convenir para controlar el dolor postoperatorio, para lo cual en ocasiones el paciente requiere recurrir a la analgesia oral (54). La pauta de un colirio ciclopléjico cada 8 horas también ayuda a controlar la molestia mientras ocurre el cierre epitelial. Una vez que la epitelización se ha completado se suele retirar la lente de contacto, el antibiótico y el ciclopléjico y se inicia una pauta frecuente de lágrimas artificiales y de fluorometolona al 0,1% 4 veces al día que se irá reduciendo a razón de 1 vez al día por cada mes transcurrido. Sólo cuando se presume una respuesta cicatricial mayor se utiliza el acetato de prednisolona al 1%. Cuando el tratamiento ha sido mínimo, por ejemplo 4 micras de ablación en una distrofia de membrana basal, los corticoides Figura 15: Proceso de epitelización tras una PTK: A) aspecto a las 24 horas, B) defecto epitelial pequeño próximo a su cierre completo a las 72 horas. no son necesarios. Cuando se trata una opacidad por herpes simple se administran peroperatoriamente (aproximadamente durante una semana empezando 3 días antes de la intervención) aciclovir oral (400 mg dos veces al día) o valaciclovir (500 mg al día en una o dos tomas). 5.5. Respuesta tisular a la PTK En la respuesta de la córnea a la queratectomía fototerapéutica se pueden distinguir tres fases. Una primera en la que se produce la re-epitelización y que dura entre 3 días y dos semanas, cuando se retrasa. A continuación, en las siguientes semanas y meses, se produce un remodelado del estroma corneal que tiende a reponer con tejido supuestamente sano una pequeña parte de lo ablacionado. Cuando la deposición de sustancia fundamental ocurre desordenadamente o con componentes no habituales de la córnea sana, puede entonces aparecer opacidad en la córnea («haze»). Finalmente, cuando transcurren los primeros meses se llega a una estabilización topográfica y refractiva que proviene fundamentalmente de la Capítulo 36. PTK: queratectomía fototerapéutica 341 contribución hiperplásica del epitelio, que tiende a crear un cierto menisco en la periferia de la PTK, y de la remodelación estromal. Por ello, los objetivos en el postoperatorio comprenden procurar una epitelización lo más rápida posible, minimizar la reacción cicatrizal estromal, y optimizar los resultados refractivos y topográficos. Aunque todavía no se ha estudiado suficientemente en humanos, es posible que la acción coadyuvante de la mitomicina C intra operatoria, la tiotepa, o la aplicación de membrana amniótica logre atenuar la respuesta cicatricial tras la PTK (fig. 16) (55-59). 6. INDICACIONES ESPECÍFICAS Y RESULTADOS 6.1. Síndrome de erosión corneal recidivante Constituye la indicación actual más frecuente de PTK (5). En realidad este síndrome abarca tanto presentaciones de etiología no filiada, como los casos post-traumáticos, además de aquellos asociados a la distrofia de membrana basal y a otras distrofias cornéales que lo presentan como síntoma destacado —aunque las de origen distrófico serán consideraras con detalle más adelante—. El primer paso ante un paciente con el síndrome de erosión corneal recidivante consiste en descartar que tenga sequedad ocular y/o blefaritis. Si se confirma que no es consecuencia de ambas, el tratamiento estándar mediante PTK comprende la desepitelización mecánica cuidadosa sobre el área patológica y, a continuación, la aplicación de una ablación con el láser excimer de entre 3 y 6 micras de profundidad en la membrana de Bowman (5). El epitelio se debe retirar en todo el área central pupilar para no inducir asimetrías o irregularidades con la ablación de la membrana de Bowman. Un detalle muy importante consiste en aplicar el láser en un área igual o superior a la desepitelizada. De otro modo si no podríamos estar induciendo nosotros mismos un daño a la membrana basal que no iba a ser reparado por el efecto del láser excimer, pudiendo encontrar áreas en la córnea paracentral o periférica proclives a la erosión recidivante. El éxito primario de esta técnica ronda el 68% (60-62). Parece que los resultados son ligeramente mejores en los casos postraumáticos que en los distróficos. Además, se ha podido comprobar la superioridad del tratamiento manual y láser combinado sobre el manual convencional en un estudio prospectivo randomizado elaborado en los inicios de la era PTK (61). También se ha constatado que la mayoría de las recurrencias aparecen dentro de los 4 primeros meses postoperatorios. Si no recurre inicialmente, la técnica parece mantener su efecto con el transcurso de los años. Además, la PTK se muestra también superior a otras alternativas terapéuticas que tienen publicada una tasa de éxito del 40-50% para la desepitelización seguida de micro puntura con láser YAG, o del 60% para la micro puntura mecánica, aunque no existe ningún estudio que las haya comparado todas de modo prospectivo (5,63). Si el síndrome recidiva tras una primera PTK, el retratamiento mediante una segunda PTK parece disminuir significativamente la recurrencia (64). Los resultados encontrados también avalan la idoneidad de com- Figura 16: Resultado de la aplicación intra operatoria de mitomicina C: A) cicatriz subepitelial residual tras PRK, B) una semana tras debridación manual y aplicación intra operatoria de mitomicina C al 0,02% durante 2 minutos se puede observar un estroma bastante claro y un epitelio recién cerrado, C) transparencia corneal y ausencia de recidiva 6 meses tras el tratamiento coadyuvante con mitomicina C. 342 Superficie ocular binar la PTK transepitelial con la PRK (queratectomía fotorrefractiva), cuando se desee una desepitelización láser hasta la membrana de Bowman (este método es explicado en el epígrafe «técnicas de queratectomía terapéutica») (65). 6.2. Distrofias corneales Dado que la queratoplastia en muchas distrofias no es sino una solución temporal, ya que muchas recurren en el injerto, y además el retrasplante aumenta el riesgo de rechazo inmunológico con respecto al primero, parece razonable pensar que cualquier terapia que post ponga la necesidad del trasplante de córnea es adecuada y conveniente (10). En este sentido la PTK parte con un éxito parcial asegurado, y es que en la peor de las situaciones siempre se puede recurrir a la cirugía convencional de trasplante de córnea. Además, la PTK ha logrado tiempos de supervivencia sin recidiva muy largos en muchos casos como tratamiento primario, e incluso, ha restaurado la suficiente transparencia corneal en injertos en los que llegó a recidivar la distrofia (5,10,66,67). A la hora de indicar la PTK un factor esencial a tener en cuenta es la probabilidad de recurrencia de la que se parte, que de entrada depende del tipo de distrofia en cuestión. Además, en general, cuantos más retratamientos de PTK se realicen más probable es la futura recidiva. Algunos autores distinguen recurrencias únicamente biomicroscópicas a diferencia de las clínicamente significativas (10). 6.2.1. Distrofia de Meesman En esta distrofia, de debut biomicroscópico en la década de los 20 y desarrollo sintomático entre los 30 y 40 años, la experiencia utilizando PTK para eliminar el epitelio central es limitada. Los resultados varían entre buenos (buena visión y sin signos de irritación ocular) hasta bastante negativos (con permanencia de síntomas y existencia de una opacidad corneal persistente). Tanto es así, que ni siquiera el resultado en el primer ojo parece ser predictivo del adelfo (5,10,68). Teóricamente el eliminar parte del epitelio enfermo cuando va a ser repuesto a partir de tejido adyacente igualmente distrófico parece poco práctico. Sin embargo, se ha especulado que la cirugía mediante PTK podría suprimir en parte la expresión completa del gen responsable de la distrofia (5,67). Debido a la información muy parcial que se tiene hasta ahora, sin referencias claras del tiempo sin recurrencia, hay autores que prefieren utilizar la PTK exclusivamente en casos en los que la sintomatología es notable, y siempre esperando a la recuperación anatómica de la transparencia corneal y funcional del primer ojo intervenido. 6.2.2. Distrofia en mapa-punto-huella Figura 17: A) Distrofia mapa (lesiones centrales-superiores), punto (lesiones centrales inferiores), huella (lesiones visibles en el área izquierda de la pupila). B) Seis meses tras el tratamiento con PTK trasepitelial + PRK + homogeneización de la superficie con el uso coadyuvante de hialuronidato sódico al 0,25%, la misma córnea presenta ausencia de alteraciones de la membrana basal junto a una mejoría ostensible de la fotofobia y la agudeza visual corregida (aumento de 0.5 a 0.8). Constituye la segunda indicación más frecuente de la PTK (5). Clínicamente se detectan por orden decreciente de prevalencia los cambios en mapa, puntos y, los menos comunes, en huella dactilar. Causada por una producción desordenada de membrana basal suele condicionar en el paciente la existencia de frecuentes cambios de refracción, leve a moderada sensación de borrosidad y erosiones recurrentes. El tratamiento fototerapéutico puede realizarse transepitelial (ablación plana de 7 mm de diámetro y aproximadamente de 55 micras de profundidad) si la apariencia biomicroscópica del epitelio es regular. Cuando la superficie epitelial es claramente irregular entonces puede ser mejor opción desbridar mecánicamente el epitelio utilizando un escaficador o una espátula. Una vez en la membrana de Bowman el objetivo es retirar unas 10 micras de tejido mediante una ablación plana. La recuperación en el postopetario es relativamente rápida, verificándose hacia los 2 meses la estabilidad refractiva y la disminución de la sintomatología. Además, también admite la combinación PTK/PRK (PRK transepitelial) para la corrección de defectos refractivos en pacientes con signos de distrofia de membrana basal (fig. 17). Capítulo 36. PTK: queratectomía fototerapéutica 343 En general los resultados son muy satisfactorios; la refracción típicamente se estabiliza pronto, la agudeza visual corregida mejora (76%) y las erosiones cesan (95%). No obstante, un cierto cambio en la refracción puede ocurrir pese a lo superficial de la ablación de la membrana de Bowman, por lo que la información preoperatoria al paciente debiera incluir este aspecto (5,10,68). Cuando recidivan, lo hacen en los primeros 6 a 9 meses (67). 6.2.3. Distrofia de Reis-Bücklers En esta distrofia el epitelio suele presentar suficiente homogeneidad como para que se pueda realizar un tratamiento con PTK de perfil plano desde la superficie. De este modo, el epitelio actúa como agente enmascarante que facilita la ablación regular de los «picos» de las proyecciones del estroma hacia la superficie, salvaguardando los «valles». En esta situación por lo tanto la desepitelización manual sería un error. Sólo cuando el epitelio insinúa una superficie ya irregular puede merecer la pena utilizar algún fluido enmascarante (p.e. hialuronidato), o técnicas como la PALM (5,10). Los resultados son generalmente buenos y las recurrencias significativas se dan habitualmente en pocos casos, de modo lento y diferido (31-34). En un estudio de Dinh y colaboradores, sin embargo, se llegan a detectar hasta en un 59 % recurrencias biomicroscópicas en un tiempo medio de 12,3 meses, y significativas tras 21,6 meses (11). 6.2.4. Distrofia de Thiel-Behnke En un estudio se describe la aplicación de PTK sobre 4 ojos con distrofia primaria de Thiel-Behnke, y sobre dos ojos con recurrencia en el injerto (70). Globalmente, el tratamiento fototerapéutico resultó efectivo, con una mejora en la agudeza visual, que además perduró en los años de seguimiento. 6.2.5. Distrofia granular La distrofia granular típicamente causa alteración visual a partir de los 50 años. Aunque en algunos casos se observan erosiones epiteliales, éstas no son frecuentes. El paciente habitualmente solicita ser tratado por la fotofobia y la disminución de la agudeza visual. A los resultados de la PTK en la distrofia granular se les considera buenos (fig. 18) (5,10,71). Aunque la mayoría de las opacidades se localizan en el estroma anterior, algunas pueden localizarse más profundas. Como en esta situación el ablacionar hasta las más profundas induciría una hipermetropía considerable, es mejor dejar las más profundas sin ablacionar totalmente ya que éstas tienen un impacto limitado sobre la visión. Durante el postoperatorio algunas pueden aumentar de tamaño de modo similar a como los cristales de sal lo hacen en agua saturada (5). El tiempo medio hasta la recurrencia son 32 meses, y hasta una recidiva clínicamente significativa 40 Figura 18: A) Distrofia granular en paciente de 36 años. B) La córnea ha ganado en trasparencia al eliminarse el cúmulo de opacidades más superficiales y la agudeza visual corregida ha mejorado en 5 líneas 6 meses tras PTK. Con el transcurso de los años se ha observado una moderada recidiva de las opacidades anteriores. (Foto cortesía del Dr. Rafael Martínez Costa, Hospital La Fe, Valencia). meses (11). Es excepcional que la recurrencia aparezca antes de los dos años. Cuando la mutación BIG-H3 es homocigótica el patrón de recurrencia tras la PTK es más severo, precoz y algo más periférico que el heterocigótico (67). El resultado de la PTK sobre recurrencias en ojos con queratoplastia penetrante parece ser bueno (una recurrencia cada 7 casos) (72). Después de la PTK para la distrofia granular se ha intentado con éxito la adaptación de lentes de contacto gas permeables que corrigieran la hipermetropía inducida (73). La adaptación llega a ser factible a la semana de la intervención, aunque los ajustes son necesarios pasados unos 4 meses. 6.2.6. Distrofia de Avellino En la variante de distrofia estromal anterior Avellino el tratamiento mediante PTK ha resultado útil en la disminución de la enfermedad y en la mejora de las condiciones de la superficie ocular (en parámetros como sensibilidad corneal, 344 Superficie ocular tiempo de ruptura de la película lagrimal en relación con la capa lipídica, y metaplasia escamosa conjuntival) (6,7). No obstante, cuando la enfermedad recurre existe un empeoramiento de los parámetros de salud de la superficie ocular (74). En las distrofias como ésta en las que la producción de TGF-β está involucrada, la cirugía LASIK está contraindicada al exacerbar la patología debido a la existencia de incitación por trauma quirúrgico y la creación de un nuevo espacio, la interfase, donde los depósitos se pueden acumular (67). 6.2.7. Distrofia reticular Esta distrofia se caracteriza por la presencia de filamentos o bandas de opacidad entrelazadas, de localización estromal, fundamentalmente anterior, pero también algunas llegan a capas más profundas. Con el tiempo aparece también una opacidad difusa en la parte anterior del estroma que, al ser central, reduce la visión significativamente. Como además, las erosiones espontáneas son relativamente frecuentes, la aplicación de la PTK transepitelial puede estar justificada en estos casos. La ablación del estroma anterior retira la opacidad difusa y parte de los filamentos ramificados. Aunque los estudios clínicos de PTK que la incluyen no son muy numerosos, se conoce que la mejoría visual es perceptible pero habitualmente no muy marcada (5,10). Esto es en parte debido a que resulta difícil eliminar las opacidades más profundas. La tasa de recurrencia es moderada y de aparición lenta. En un injerto corneal, la recurrencia de la distrofia reticular se presenta con opacidad difusa superficial que acaba interfiriendo con la visión (11). Sin embargo, la PTK puede eliminar dicha opacidad procurando una mejor visión durante al menos unos años. La distrofia reticular puede en ocasiones aparecer en la edad infantil, causando una ambliopía marcada (5). La rehabilitación visual lenta que asocia una queratoplastia en estas edades condiciona que sea una alternativa escasamente efectiva. La PTK, sin embargo, puede eliminar gran parte de la opacidad con una recuperación visual comparativamente más rápida y llevadera para el niño. De este modo se intentaría evitar la ambliopía en una edad crítica. 6.2.8. Distrofia reticular tipo 2 (síndrome de Meretoja) Se caracteriza por presentar finos filamentos de localización más anterior que en la reticular tipo 1. Los resultados iniciales tras la PTK son satisfactorios, sin embargo, la recurrencia puede presentarse transcurridos 2 años (5). En estos casos las complicaciones provienen de la reducción de la sensibilidad corneal, que asocia el correspondiente ojo seco, llegando a observarse queratopatía por exposición, según se ha descrito en el contexto sistémico de una amiloidosis generalizada (5). 6.2.9. Distrofia macular La distrofia macular es poco frecuente y afecta al paciente tanto por la erosión recurrente como por la reducción en la agudeza visual. Como la localización de las opacidades en el estroma suele ser bastante anterior, especialmente al inicio de la presentación, el tratamiento con PTK parece ser efectivo y el tiempo de recurrencia largo (75). Sin embargo, la experiencia publicada es muy limitada como para extraer más conclusiones (5). 6.2.10. Distrofia de Schnyder En esta distrofia aparecen tanto una opacidad difusa del estroma como unos cristales de localización subepitelial, los cuales causan un fenómeno de dispersión de la luz que degrada mucho la visión (22). El tratamiento de PTK en los pocos casos en los que se ha aplicado ha resultado efectivo en la eliminación de los cristales centrales superficiales. La opacidad difusa tiende a persistir limitando la visión en el orden de 5/10. La velocidad de recidiva en estos casos parece bastante lenta (5,76). 6.2.11. Distrofia de Fuchs En la distrofia endotelial de Fuchs la visión está limitada por la presencia de edema estromal y epitelial, y fibrosis subepitelial. Además, muchos pacientes presentan un ojo doloroso por la ruptura de las bullas epiteliales en la superficie corneal. El tratamiento mediante PTK en esta distrofia favorece varios mecanismos: el edema estromal tiende a disminuir cuando la cantidad de estroma retirado es notable (25% de la paquimetría central), ya que el endotelio comprometido es más eficiente en su acción deturgescente sobre un volumen de estroma y edema menores, las terminaciones y los plexos nerviosos son parcialmente eliminadas y la cicatriz subepitelial es ablacionada por el láser (12-15). Todo esto determina una córnea postoperatoria más delgada, más transparente y con una superficie ocular más sana al haber disminuido las bullas epiteliales. Aún con todo puede existir la posibilidad de una respuesta cicatricial anormal, por lo que la PTK se debe aplicar juiciosamente (77). Algunos autores han apuntado el beneficio del porte de una lente de contacto terapéutica en el postoperatorio (14). En la práctica esta modalidad terapéutica ha evitado la queratoplastia penetrante en pacientes con ojos que por otras causas presentaban un bajo potencial visual y en aquellos que no deseaban pasar por la rehabilitación visual lenta que asocia un trasplante de córnea. Incluso para aquellos pacientes en lista de espera para trasplante de córnea supone un alivio de su sintomatología dolorosa (12-15). 6.3. Queratopatía bullosa pseudofáquica En córneas no distróficas en las que debido al trauma quirúrgico, etc se ha desarrollado edema corneal con sintomatología relacionada con la ruptura de las bullas epiteliales tras la intervención de catarata e implante de lente intraocular, la aplicación de una PTK profunda (120 micras) no sólo alivia la sintomatología dolorosa sino que asocia una discreta mejoría en la visión (16). Esto favorece el confort del paciente que Capítulo 36. PTK: queratectomía fototerapéutica 345 Figura 19: A) Opacidad postraumática subepitelial paraaxial que se elimina excepcionalmente bien gracias a la desepitelización en modo PTK + PRK en un paciente con miopía, que además consiguió ver la unidad sin corrección en el postoperatorio. B) Opacidad postraumática central más extensa y más gruesa en otro paciente. C) El OCT muestra los aspectos más profundos de esta cicatriz a los que no llegará la PTK. D) Aspecto biomicroscópico de la opacidad residual tras la PTK que muestra una lesión menos densa ópticamente y algo más pequeña. En este caso el éxito de la PTK puede ser sólo parcial ya que una ablación que hubiera intentado eliminar toda la cicatriz hubiera podido inducir una gran hipermetropía inicial y queratectasia con el tiempo. está en lista de espera para la queratoplastia penetrante sin interferir con la técnica quirúrgica y, en pacientes con contraindicación por otra causa para el trasplante de córnea, puede suponer una alternativa a éste (10,16). 6.4. Cicatrices post traumáticas y post quirúrgicas El tejido cicatricial absorbe y dispersa la luz incidente en la córnea, por lo que es responsable de síntomas como el deslumbramiento y la visión de halos. Las cicatrices también suelen asociar alterar la superficie corneal que creando un astigmatismo irregular. En cuanto a la composición del tejido cicatricial, éste incluye el colágeno (de disposición desorganizada), los glucosaminoglicanos y los queratocitos activables hacia formas celulares que contienen actina de músculo liso y que presentan respuesta cicatricial agresiva tras la PTK (5). La PTK puede acceder a ablacionar cicatrices superficiales o aspectos superficiales de las mismas (fig. 19). Además, parece que la reacción cicatricial reactiva a la PTK es menor que a las queratectomías manuales (78). La PTK también se ha utilizado con éxito para eliminar cicatrices y opacidades corneales centrales asociadas a complicaciones lenticulares del LASIK y a los lentículos de epiqueratofaquia (5,79). En todas estas indicaciones suele ser necesario esperar en el postoperatorio más allá de los 6 meses para obtener no sólo una córnea más transparente, sino lo que es más importante, más regular. 6.5. Pterigión En los casos de extensión central del pterigión, tras la excisión manual aparece habitualmente un lecho de tejido cicatricial en el estroma superficial. La aplicación de la PTK 346 Superficie ocular sobre ese lecho puede reducir el defecto refractivo residual tras la cirugía del pterigión, sin embargo, la disminución de la irregularidad superficial en ese lecho no reduce su tasa de recurrencia (5). La técnica utilizada hasta ahora por algunos autores ha consistido en la aplicación local de la PTK para regularizar el lecho cicatricial tras haber realizado una ablación en el centro de la córnea de la membrana de Bowman de 15 micras de profundidad y de 6 mm de diámetro (5). La refracción tras la aplicación de PTK no es muy predecible en la práctica, y además, el área central ablacionada puede verse afectada por la invasión de queratocitos activados desde las inmediaciones donde está localizado el tejido cicatricial, lo que daría lugar a la aparición de un haze corneal importante y persistente. Por todo ello no es de extrañar que sean necesarios los retratamientos en estos casos (80). ablación, que puede tener un perfil miópico en vez de plano, se centra sobre el nódulo hasta disminuirlo significativamente. El tratamiento mediante PTK suele proporcionar al paciente una situación en la que bien con la gafa, bien con una lente de contacto que ahora ya se puede adaptar, la visión puede ser mejorada con respecto a la situación preoperatoria. En la mayor experiencia que se tiene sobre la aplicación de la PTK en la degeneración nodular de Salzmann la tasa de recurrencia se aproxima al 4 % a los dos años (10,11). No obstante, y pese a que la enfermedad tienda a ser un proceso continuo, esta cirugía con láser excimer permite retrasar la necesidad de una queratoplastia durante cerca de una década. En algún caso de recurrencia la aplicación intra operatoria de mitomicina C ha resultado efectiva para prevenir futuras recidivas (57). 6.8. Queratocono 6.6. PTK como coadyuvante de la cirugía convencional de la superficie corneal La PTK puede ser también utilizada en asociación a procedimientos mecánicos o químicos de tratamiento de la superficie ocular. En algunos casos de enclavamiento de múltiples cuerpos extraños en la córnea, la PTK ha servido para disminuir el grosor del estroma anterior y así poder acceder a algunos más profundos que eran difíciles de extraer mediante una aproximación sólo perpendicular (5). En la eliminación de calcificaciones cornéales importantes el láser excimer ha resultado un buen complemento a la aplicación de EDTA tópico y a la queratectomía mecánica para conseguir una superficie más uniforme y transparente. Cuando este tratamiento combinado se aplica sobre ojos con irritación y dolor esta sintomatología se alivia de modo notable (5). Varias formaciones voluminosas de la superficie corneal como son los queloides (en el síndrome de Lowe) o algunas cicatriciales pueden resultar demasiado lentas de ablacionar enteramente por el láser excimer. En estos casos la resección manual se puede continuar con un alisamiento de la superficie mediante PTK. Una superficie más uniforme suele condicionar una disminución de la sintomatología irritativa y produce un resultado cosméticamente más favorable, o cuanto menos, una cara anterior más uniforme como para admitir la adaptación de una lente de contacto o una prótesis (5). 6.7. Degeneración nodular de Salzmann Auque algunos nódulos cornéales se han asociado a uveítis crónicas, muchos de ellos aparecen primariamente. Estos nódulos, que suelen localizarse en la córnea medio periférica, inducen cambios refractivos y astigmatismo irregular con el agravante de impedir la adecuada adaptación de una lente de contacto. Parece que la ablación de los nódulos hasta el nivel del resto de la córnea resulta más simple que la excisión manual de los mismos (2). La técnica más adecuada consiste en la eliminación manual del epitelio exclusivamente suprayacente a las protusiones, de modo que el epitelio restante actúa como protector del estroma sano que las circunda. A continuación la Aunque algunos estudios han mostrado una aceptable efectividad del tratamiento con láser excimer en la mejora de la agudeza visual sin corrección y ausencia de progresión detectable del queratocono, los resultados obtenidos con seguimientos de aproximadamente dos años son algo peores que los de tratamientos en ojos normales (5). Si bien la cirugía con láser excimer evoluciona hacia tratamientos personalizados que intentan corregir irregularidades en la curvatura corneal, no se conoce todavía la respuesta de estos casos a largo plazo. Además la efectividad de la intervención en pacientes jóvenes con enfermedad incipiente años después es dudosa. Dado el carácter progresivo de la enfermedad lo lógico sería pensar que el beneficio en estos casos sólo es transitorio, y es posible incluso que la sustracción de tejido llevada a cabo por el láser pueda influir en una mayor debilidad estructural en comparación con un caso que no se haya intervenido. La ausencia de estudios controlados determina que en este campo las deducciones sean especulativas. Otra situación bien diferente es aquella que se genera cuando aparece una opacidad apical en el queratocono, típicamente después de un episodio de hidrops corneal. Aquí existe no sólo una pérdida de transparencia corneal sino también una protusión que impide la adaptación sin irritación de una lente de contacto. En este contexto, en el que el paciente está ya en muchas ocasiones en lista de espera para queratoplastia, la aplicación de la PTK produce una cierta disminución de la borrosidad existente y facilita el porte de una lente de contacto sintomatológicamente aceptable. No obstante, en un paciente con queratocono se ha descrito queratolisis y la formación de descematocele como complicación de la PTK asociada a una falta de cierre epitelial (5). 6.9. Cicatrices tras queratitis infecciosas 6.9.1. Queratitis bacterianas Las opacidades tras queratitis bacterianas suelen ser densas (fig. 20) y, en ocasiones, asocian adelgazamiento focal significativo. Esta última eventualidad puede impedir que el caso sea apropiado para una PTK ya que resultaría en exceso Capítulo 36. PTK: queratectomía fototerapéutica 347 Figura 20: A) Cicatriz central tras queratitis infecciosa. B) El examen biomicroscópico revela una considerable profundidad de la misma pero el ojo presenta miopía elevada (equivalente esférico –7 D). C) La reducción de los aspectos más superficiales (130 µm) de la cicatriz permite disminuir su densidad óptica y el viraje hipermetrópico inducido permite la reducción muy significativa de la miopía preoperatoria (a –0,5 D) y un aumento en la agudeza visual sin corrección (de 0,05 a 0,3). D) No obstante se puede observar un haze periférico debido al escalón que produce el borde de la ablación profunda con la córnea adyacente no tratada. debilitante para la integridad estructural corneal. Es posible que estos ojos se puedan beneficiar de ablaciones guiadas según topografía o de la utilización de sistemas de homogeneización de la superficie corneal (técnica PALM o BioMask), pero hasta la fecha no se dispone de una experiencia contrastada al respecto (5). En el caso de opacidades causadas por tracoma se ha llegado a comprobar la utilidad de la PTK en los casos en los que el estado del resto de la superficie ocular se mostraba suficientemente favorable (81). 6.9.2. Queratitis virales Las opacidades cornéales que admiten tratamiento mediante PTK en este grupo de enfermedades son el herpes simple, el herpes zoster y la queratoconjutivitis epidémica. Antes del tratamiento es necesario un completo examen biomicroscópico para asegurar la profundidad de la opacidad y la extensión del adelgazamiento si lo hubiere (especialmente en el herpes simple). Si el examen biomicroscópico no fuera concluyente habría que llevar a cabo exploración mediante la biomicroscopía ultrasónica, OCT u otro sistema diagnóstico que pudiera asegurar bien la distribución paquimétrica y de profundidad de la opacidad (el sistema Orbscan infraestima la paquimetría con opacidad corneal) (23,24). En general la presencia de un adelgazamiento significativo impide llegar a un buen resultado clínico con PTK. Dado que el láser excimer emite radiación ultravioleta C ha existido preocupación con relación a que la exposición de una lesión herpética a esta radiación pudiera reactivarla (41,42). Sin embargo, la experiencia demuestra que si se administra una profilaxis tópica o sistémica con antivirales (aciclovir o valaciclovir, respectivamente) en el período preoperatorio, pese a la administración de corticoides tópicos, no existen reactivaciones postoperatorias de la enfermedad herpética (5,43). Ya que tanto el herpes simple como el zoster reducen la sensibilidad 348 Superficie ocular corneal hay que seguir de cerca el cierre epitelial y el proceso de cicatrización. Aquellos casos de queratitis por herpes simple o zoster en niños con edad inferior a los 7 años pueden beneficiarse del tratamiento mediante PTK para evitar la ambliopía que de otro modo podría llegar a ser muy severa (5). Las opacidades subepiteliales tras las queratoconjuntivitis adenovirales pueden ser tratadas mediante PTK, sin embargo y pese a que los estudios son muy escasos como para estimar las tasas de recurrencia, dicha complicación ha sido descrita en la forma de opacidades de localización más profunda a la habitual, probablemente asociada al uso de corticoides tópicos en el postoperatorio (82). 6.10. Queratitis puntiforme superficial de Thygeson En un paciente miope ha podido ser constatada la utilidad de la PTK asociada a una PRK para el tratamiento de una queratitis de Thygeson con múltiples recidivas asociadas al cese de la corticoterapia tópica (83). ros años. Por ello muchos autores prefieren desepitelizar manualmente y aplicar directamente EDTA, con la ventaja de cara al futuro de no ablacionar un exceso de tejido (5). No obstante muchos de estos ojos presentan una baja visión y el objetivo es el de regularizar la superficie corneal para conseguir un alivio en la sintomatología irritativa. En estos casos se ha utilizado con éxito el tratamiento combinado queratectomía manual para las macro irregularidades, EDTA, y PTK para la homogeneización de la superficie. De este modo el 85% de los pacientes con queratopatía en banda y superficie irregular mejoran su sintomatología en el postoperatorio (10). En mi experiencia personal la rehabilitación funcional y anatómica de la superficie es óptima utilizando PTK y membrana amniótica para recubrir el defecto inmediatamente (figs. 13, 21 y 22). Sin embargo, mis casos no exceden los dos años de seguimiento y por lo tanto no puedo definir completamente el posible papel de la membrana amniótica en la inhibición de la inflamación posquirúrgica y la recurrencia de la calcificación. 6.14. Queratopatía climática 6.11. Defectos epiteliales La PTK ha sido utilizada con éxito para favorecer la cicatrización de defectos epiteliales crónicos que no cerraban tras aplicar otras modalidades de tratamiento médico o quirúrgico. La aplicación del láser excimer se realizó en la serie de Kim y colaboradores utilizando el modo PTK con un diámetro de 1mm y un rango de pulsos entre 150 y 200, y fue dirigido a los bordes epiteliales elevados que rodeaban al defecto (84). La epitelización completa ocurrió en la mayoría de los ojos en 7 días y en sólo dos hubo que esperar a los 12 días. Aunque sólo se tiene evidencia experimental, parece que la aplicación de PTK sobre una úlcera corneal cáustica favorece una epitelización más rápida (5). 6.12. Las úlceras alérgicas En el contexto de una queratoconjuntivitis vernal pueden aparecer úlceras cubiertas por precipitados de proteínas; proteína eosinofílica y proteína básica mayor. Como éstas proteínas resultan tóxicas para el epitelio la úlcera tiende a permanecer abierta. Además, como el sistema inmune de estos pacientes predispone a un mayor riesgo de infección las úlceras infectadas son complicaciones relativamente frecuentes en los pacientes con dermatitis atópica. La ablación de las proteínas superficiales mediante PTK y la subsiguiente inducción del cierre epitelial ha sido sugerido como una terapia adyuvante más a las ya existentes para las úlceras alérgicas (85). El conocimiento que se tiene de la aplicación de la PTK en esta infrecuente queratopatía es escasa. Pero pese a que se ha postulado que la exposición a la radiación ultravioleta es un posible factor etiológico, la respuesta a la PTK parece favorable en estos casos (29). Serán estudios a más largo plazo los que determinen si la aplicación de la PTK restaurando la regularidad en la superficie corneal inhibirá la progresión de la enfermedad. 6.15. Displasia ectodérmica En un caso aislado ha sido comunicada la aplicación de sucesivas PTKs hasta disminuir significativamente la limitación visual que provocaba una displasia ectodérmica en un niño que, de otro modo, probablemente hubiera acabado con una profunda ambliopía (17). 6.16. Displasia y carcinoma intraepitelial corneal La PTK ha sido utilizada con éxito en el tratamiento de tanto la displasia intraepitelial como del carcinoma intraepitelial corneal recurrente, según los casos anecdóticos recogidos en la literatura (87). Sin embargo, cuando se ablaciona totalmente una lesión sospechosa no se puede obtener una confirmación de la filiación histológica de la misma ni de su extensión, por lo que la realización de una biopsia del borde de la lesión antes de aplicar PTK podría ser muy adecuada. 6.13. Queratopatía en banda 6.17. Irregularidades topográficas Esta patología constituyó una de las primeras indicaciones de la PTK (86). Sin embargo, la experiencia ha demostrado que muchos casos recurrieron dentro de los dos prime- Cuando se elige la estrategia terapéutica adecuada, la PTK puede ayudar a regularizar la superficie corneal. Un Capítulo 36. PTK: queratectomía fototerapéutica 349 Figura 21: A) Queratopatía en banda y edema corneal en ojo vitrectomizado y afáquico. B) Tras el tratamiento mediante PTK con homogeneización de superficie y trasplante de membrana amniótica ya mostrado en la figura 13, éste es el aspecto biomicroscópico a las 24 horas. C) A la semana del procedimiento se observa cómo se continúa verificando el proceso de cierre epitelial debajo de la membrana amniótica. D) Aumento de la calidad óptica de la superficie corneal y de la transparencia estromal 6 meses tras la cirugía. ejemplo típico lo constituye la estadística de los estudios de Hersh et al y de Maloney et al (4,8). De modo similar en ambas series la mejora en la regularidad de la topografía se verificó entre el 60 y el 70% de los casos, permaneció esencialmente inalterada en entre el 25 y el 35%, y se deterioró entre el 2 y el 4%. Además los sistemas de enmascaramiento PALM y BioMask pueden resultar probablemente muy útiles en estos casos, aunque de momento no se disponen de resultados publicados con ambas técnicas (49-51). 6.18. Complicaciones de cirugía refractiva previa Las indicaciones principales de la PTK en estos casos abarcan bien las alteraciones topográficas bien la presencia de opacidad corneal (haze). Las irregularidades, que en muchas ocasiones son responsables de la percepción de diplopia monocular, halos y gran deslumbramiento, han sido ya parcialmente tratadas en otros epígrafes. La PTK de superficie extensa puede ser utilizada como técnica de superficie con los sistemas BioMask y PALM, o en el retratamiento del LASIK con la técnica descrita por Alió y colaboradores denominada ELASHY, en la que el hialuronidato sódico al 0,25% es teñido con fluoresceína para obtener una fluorescencia de control más exacta durante la aplicación de la PTK, que va eliminando sucesivamente las áreas más elevadas, logrando así una regularización de la superficie refractiva (48). De un modo parcialmente análogo a la técnica ELASHY, la metilcelulosa al 1% teñida con fluoresceína puede ser distribuida sobre las áreas más deprimidas del estroma para enmascararlas y que la PTK de superficie extensa rebaje sólo el área más elevada expuesta tras ablacionar el epitelio con una técnica de superficie —obstante el hialuronidato puede ser superior a la metilcelulosa en la medida que parece hacer disminuir la presencia de radicales libres en el tejido ablacionado—. Esta técnica, que utiliza la metilcelulo- 350 Superficie ocular Figura 22: Examen mediante OCT de la córnea en el caso mostrado en las figuras 13 y 21. A) Preoperatoriamente se muestra una córnea engrosada por el edema estromal y una hiperreflectividad anterior correspondiente a la deposición cálcica. B) Un día tras la cirugía se puede observar la ausencia de la hiperreflectancia atribuible al calcio y un cierto descenso del grosor estromal visible por debajo de la lente terapéutica y la membrana amniótica. C) Corte tomográfico que muestra 6 meses tras la cirugía una córnea transparente en su centro y un volumen estromal más reducido que en el preoperatorio. sa como agente enmascarante, y otras que utilizan el epitelio sin ser eliminado selectivamente también como agente enmascarante, han permitido mejorar grandes descentramientos de cirugías queratorefractivas previas (45,88). El láser en modo PTK también puede ser utilizado para desepitelizar la córnea en los retratamientos de PRK. En estos casos, parece que la combinación de una pequeña PRK miópica (ya que en el postoperatorio de la corrección miópi- Figura 23: A) Pliegue del disco corneal tras LASIK que afecta al área pupilar y que persiste después del tratamiento convencional mediante lavado de la entrecara y estiramiento mecánico. B) Seis meses después de una aplicación superficial de PTK transepitelial y suave homogeneización de la superficie con hialuronidato sódico al 0,25% el pliegue y su tinción negativa de fluoresceína han desaparecido. ca el epitelio suele presentar hiperplasia central) y PTK antes del tratamiento fotorrefractivo sobre el estroma mejora los resultados en comparación a la utilización del láser únicamente en modo PTK para la desepitelización corneal (89). Algunos autores también han utilizado una suave PTK con un agente enmascarante (hialuronidato sódico) al final de la PRK con el objetivo de obtener al final de la cirugía una superficie corneal más regular y homogénea (45). Cuando persisten estrías o pliegues visualmente significativos tras LASIK, una PTK suave que elimine el epitelio y unas micras de Membrana de Bowman con la ayuda de un agente enmascarante resulta un tratamiento altamente efectivo (fig. 23). En el postoperatorio inmediato la administración de corticoides tópicos es crucial para evitar una respuesta inflamatoria en la forma de una queratitis lamelar difusa. El láser también puede ser aplicado como tratamiento focal de la irregularidad, pero entonces suelen realizarse Capítulo 36. ablaciones selectivas de pequeño diámetro y con un perfil no plano, como el de la PTK, sino miópico. Estos tratamientos parecen tener más éxito cuando se puede identificar topográficamente un patrón claro de distribución de la irregularidad (52). Lo más importante en el tratamiento focal de las irregularidades es determinar las áreas de auténtica elevación de la córnea —el láser se dirigirá hacia ellas— ya que en un mapa de curvatura ocurre en ocasiones que un aumento de queratometría traduce un cambio en la pendiente del perfil de la córnea (lo que a veces se relaciona espacialmente no sólo con elevaciones sino también con depresiones focales contiguas) y porque en ocasiones el punto de mayor curvatura no coincide con el ápex de la elevación. En este sentido se hace casi imprescindible la utilización de los mapas de elevación (topografía de proyección) en vez de los de curvatura para identificar las áreas de tratamiento. También es útil el análisis semicuantitativo que aporta el fluorograma en la adaptación de una lente de contacto rígida, ya que las áreas más elevadas presentarán mayor toque con la lente y menos acumulo de fluoresceína. Todo esto es esencial porque lo peor que se puede realizar es aplicar el láser excimer sobre un área que en vez de estar sobreelevada se halle ya deprimida, puesto que entonces el perfil corneal resultante será más irregular todavía. Aún así siempre existirá un cierto grado de limitación con esta técnica porque la córnea no ofrece marcas de referencia tangibles sobre las cuales situar un tratamiento (habitualmente en PRK y LASIK se hace sobre el centro de la pupila). En el caso de una isla central tras PRK se suele aplicar focalmente el láser en modo PTK con un diámetro similar a la elevación y, cuando por control de la auto fluorescencia del epitelio se percibe que el láser ha dejado de ablacionar ya el epitelio, entonces se realiza una pequeña ablación estromal miópica del mismo diámetro, y profundidad que varía en función de la elevación topográfica de la irregularidad (37). La PTK ha sido utilizada también con éxito para eliminar opacidades cornéales presentes tras diferentes tipos de cirugía queratorrefractiva previa. Tras queratotomía radial ha sido útil en algunos casos y en otros se ha incitado una reacción cicatricial igual o mayor a la presente con anterioridad debido a la reactividad tisular de la córnea tras cirugía incisional (90). El raspado manual más la aplicación intra operatoria de mitomicina C al 0,02% durante dos minutos ha resuelto estos casos recalcitrantes con éxito (56). Igualmente la PTK con una buena transición periférica ha sido útil en la eliminación de muchas opacidades tras la PRK miópica y astigmática. Sin embargo, cuando tras un primer tratamiento el haze recidiva, la opción del raspado manual más mitomicina intra operatoria acaba siendo globalmente más eficaz que la repetición de sucesivas PTK, que típicamente inducen una hipermetropía sucesivamente mayor y la opacidad va recidivando con un patrón similar (fig. 24) (55). Tras LASIK, la PTK superficial también ha sido aplicada con éxito en los pacientes que presentaban en el postoperatorio distrofia de membrana basal sintomática (91). En los casos en los que tras la aparición de una complicación lenticular (típicamente un agujero ojal) ha existido opacidad corneal la PTK transepitelial ha jugado un papel terapéutico notable PTK: queratectomía fototerapéutica 351 (fig. 25). En este último caso, hay autores que preconizan la aplicación de la PTK de modo precoz, antes de que la opacidad desarrollada induzca astigmatismo irregular, para aplicar la PTK transepitelial y obtener así una superficie corneal más regular finalmente (79). Por último, tras LASIK, la PTK aplicada sobre el lecho estromal y la cara interna del disco corneal se ha mostrado efectiva para reducir la opacidad ocasionada por una queratitis lamelar difusa recalcitrante al tratamiento convencional (fig. 26) (92). 7. COMPLICACIONES DE LA PTK A diferencia de otras cirugías con láser excimer, en la PTK la cirugía se aplica sobre córneas con patología, por lo que a las complicaciones típicas de la cirugía corneal en general se añaden otras derivadas de esa condición (5). Además, la PTK puede inducir cambios topográficos que pueden condicionar efectos secundarios de carácter refractivo. 7.1. Retraso de epitelización Dado que muchos pacientes presentan un deficiente estado de la superficie ocular con una pérdida de vitalidad epitelial y alteraciones de las células madres del limbo corneal, no es infrecuente encontrar un alargamiento en el tiempo del cierre epitelial (generalmente se consideran tales cuando tarda 2 semanas, llegando hasta 4 semanas como máximo, a diferencia del cierre normal que se verifica dentro de la primera semana). En las series publicadas esta complicación apareció con una incidencia en torno a un 12% (10,27). En este contexto además, también pueden aparecer complicaciones secundarias como son la aparición de infiltrados estériles, queratitis infecciosa o cicatrización estromal con opacidad. Por ello, pacientes con causticaciones, penfigoides cicatriciales, queratoconjuntivitis atópica y queratitis seca severa deben ser seleccionados con precaución y tratados específicamente para mejorar el estado de la superficie externa antes de realizar la PTK. Igualmente, los pacientes que presenten alteración de la posición palpebral o blefaritis deben tener controlada la situación mediante tratamiento médico (limpieza palpebral, tetraciclinas orales, etc) o quirúrgico (tarsorrafia temporal parcial, etc) según se requiera. En el postoperatorio se debe prescribir una lubricación sin conservantes frecuente y apoyarse, especialmente en los primeros momentos, en el uso de lentes de contacto terapéuticas para promover el cierre epitelial lo más precoz posible. 7.2. Queratitis bacteriana Constituye una de las complicaciones graves más frecuentes, aunque el riesgo de aparición es menor que en la queratoplastia penetrante o lamelar. Dentro de las series más largas de PTK publicadas la incidencia resultó ser un 1,2% (93). Salvo excepciones, debuta en el postoperatorio inmediato (1 semana, hasta 2 meses), siempre mientras que el epi- 352 Superficie ocular Figura 24: A) Opacidad corneal grado III después de una PRK miópica. B) Tres meses tras la PTK existe un aumento reactivo del haze pasando a catalogarse de grado IV. C) Sin embargo, seis meses tras la debridación manual de la cicatriz subepitelial bajo control biomicroscópico y la aplicación intra operatoria de un disco de mitomicina C al 0,02% durante dos minutos la ausencia de recidiva es evidente y se mantiene 3 años después del procedimiento. D) Topografía tangencial del caso antes del raspado + mitomicina C. E) A las dos semanas del procedimiento se observa aplanamiento generalizado con la existencia de una isla central asociada a un cierre epitelial reciente con engrosamiento transitorio del mismo. F) Seis meses tras el procedimiento la isla central se va resolviendo y el patrón topográfico muestra una amplia zona óptica efectiva. Capítulo 36. PTK: queratectomía fototerapéutica 353 Figura 26: Opacidad ocasionada por una queratitis lamelar difusa. Algunos autores han preconizado la utilización de una PTK suave sobre el lecho estromal y el estroma del disco para eliminar las opacidades residuales al tratamiento convencional con corticoides tópicos (92). Figura 25: A) Nido epitelial y fibrosis subepitelial en agujero ojal lenticular tres meses después de un LASIK frustrado. B) Ausencia de opacidad corneal 6 meses tras PTK transepitelial + PRK. ablación es grande (5). Por ello lo que hay que adoptar todas las medidas para promover una epitelización precoz y completa y controlar la respuesta en el postoperatorio con el uso juicioso de los corticoides tópicos. En algunos casos la opacidad ha resultado tan densa y rebelde al retratamiento (figs. 20D y 24B), que ha habido que recurrir a la queratectomía lamelar superficial. Parece que el uso concomitante de mitomicina C intra operatoria o de tiotepa tópica ayuda a evitar la aparición de haze tras PTK (55-58). La aparición de opacidades de características análogas a un anillo inmune de Wessley ha sido descrita en los primeros 9 meses tras PTK (94). Así mismo, el entorno desfavorable que representa la existencia de blefaritis mal controladas puede facilitar la presencia de opacidades subepiteliales en el postoperatorio inmediato (fig. 27). telio presente una solución de continuidad. Las infecciones han sido causadas principalmente por bacterias gram-positivas. En general, los pacientes deben seguir siempre una profilaxis con un antibiótico no excesivamente tóxico (p.e. fluoroquinolonas), que especialmente se prolongará mientras el cierre epitelial no sea completo y/o esté presente la lente de contacto terapéutica. Por otro lado, hay que contemplar que la PTK disminuye en varias de sus indicaciones el riesgo de erosión recidivante, que a su vez puede constituir terreno abonado para el desarrollo de una queratitis infecciosa. 7.3. Opacidades subepiteliales Aunque la mayoría de las veces el haze es transitorio y de escasa densidad, en ocasiones puede aparecer una placa de fibrosis significativa que afecte a la visión del paciente. Este tipo de respuesta cicatricial agresiva se puede constatar más en los casos de pterigión central, cuando se trata una queratoplastia y, en general cuando la profundidad de la Figura 27: Opacidades subepiteliales en paciente intervenido de PTK con blefaritis posterior deficientemente controlada. En el borde libre palpebral superior se observa la presencia varios quistes de retención en los orificios de las glándulas de Meibomio. 354 Superficie ocular 7.4. Recurrencia de la enfermedad Hoy conocemos que tras la PTK, algunas patologías como la distrofia reticular, de membrana basal, o la degeneración de Salzmann tienden a recurrir lentamente en el tiempo (11). Hay que tener en cuenta que la queratectomía elimina parte del tejido enfermo e intenta regularizar la superifice corneal, pero no elimina todas las células epiteliales o queratocitos patológicos (11). Por ello es importante explicar al paciente esta posibilidad, en algunos casos tendencia, para que comprenda el beneficio temporal entre sucesivos retratamientos (10,11). 7.5. Rechazo del injerto En casos aislados se ha podido constatar la coincidencia en el tiempo de un tratamiento PTK y el desencadenamiento de una respuesta inmune contra el botón de la queratoplastia (95). De aparecer debe ser tratado de modo convencional utilizando corticoides tópicos, subconjuntivales, orales, etc. Por otro lado, no se tiene ninguna evidencia de que la queratoplastia penetrante sea técnicamente más compleja en un ojo con una PTK previa. 7.6. Insuficiencia límbica El desarrollo de insuficiencia límbica ha sido descrita en un caso de PTK con debridación epitelial extensa en el que confluían factores de riesgo generales como son la diabetes mellitus y el acné rosácea (96). 7.7. Recurrencia de la queratitis herpética Tanto la radiación del láser, que es ultravioleta C, como el trauma quirúrgico y el uso de corticoides pueden facilitar la reactivación de un virus herpes simple (41,42). Por ello, una PTK nunca se aplicará en el contexto de una queratitis herpética activa y se recomienda un período quiescente de al menos 6 meses. Además, será importante aplicar la profilaxis antiviral mencionada en epígrafes anteriores. De este modo la probabilidad de reactivación herpética en relación con la PTK es muy baja (5). pueden encontrar erosiones recurrentes del epitelio, pese a que la PTK en sí misma constituya uno de los tratamientos del síndrome de erosión recidivante. Aunque su incidencia es muy baja pueden verse durante el primer año del postoperatorio (5). 7.10. Alteraciones endoteliales Según los estudios clínicos llevados a acabo y con la experiencia de muchos pacientes se conoce que la aplicación de láser éxcimer, incluida la PTK, no produce una pérdida ni alteración endotelial significativa. La radiación ultravioleta o las ondas de choque que se propagan hacia el interior del ojo ayudados incluso por la propia desepitelización manual pueden condicionar que, en la eventualidad de acercarse la ablación a 90 micras o menos de la córnea posterior, pudieran llegar a existir cambios endoteliales (98). 7.11. Sensibilidad corneal disminuida y sequedad ocular Después de la ablación tisular en la cirugía con láser excimer se produce una disminución de la sensibilidad corneal (5,99). Mediante la regeneración nerviosa en el área tratada, tiende a restaurarse no obstante la sensibilidad. En este período es normal encontrar un cierto grado de sequedad ocular que debe ser tratado adecuada y precozmente. Además, en algunas de las patologías en las que la PTK está indicada existen ya problemas de reducción de la sensibilidad corneal y sequedad ocular (6,7). Sin embargo, en estos casos la PTK habitualmente acaba proporcionando una mejoría que se manifiesta en una superficie ocular más saludable. En el estudio de Dogru et al se pudo constatar que tras utilizar la PTK para tratar las distrofias de Avellino, granular y reticular, queratopatía en banda y cicatrices cornéales la sensibilidad corneal, el tiempo de ruptura lagrimal, la capa lipídica de la película lagrimal y el grado de metaplasia escamosa conjuntival acabaron mejorando (6,7). Los autores concluyeron que además de mejorar la regularidad y la claridad de la superficie corneal, con la PTK se terminaba obteniendo una película lagrimal con mayor estabilidad y una mejor producción de mucina en un epitelio más sano. 7.8. Queratectasia 7.12. Cambios refractivos inducidos Aunque de aparición muy rara, la ectasia iatrogénica tras PTK ha sido descrita de modo similar a como se conoce tras LASIK. Por ello habrá que extremar el cuidado con los tratamientos primarios, y sobre todo los retratamientos, en córneas finas (97). 7.9. Erosiones recurrentes Cuando la desepitelización manual abarca áreas que a continuación no son cubiertas por la ablación en la PTK se En general, lo que más claramente se percibe como una complicación refractiva es el hecho de dejar al paciente con hipermetropía, marcadamente anisométrope, o con un gran defecto refractivo bilateral (27). Como se explicó anteriormente en el epígrafe de «técnicas de queratectomía terapéutica», aunque el perfil de ablación estromal utilizado en la PTK es plano, y por lo tanto no está concebido para inducir cambio refractivo alguno, con la cicatrización del epitelio se suele generar una clara tendencia hacia un cambio hipermetrópico que será mayor cuanto más profunda sea la PTK cen- Capítulo 36. PTK: queratectomía fototerapéutica 355 Tabla 2. Cambios refractivos asociados a la PTK N.º de ojos Técnica PTK en superficie extensa PTK con queratectomía manual superficial Alisamiento focal Tratamiento de cicatrices DMB/SER* TOTAL N.º de ojos Cambio de refracción significativo Media de Cambio ±1,0 dioptrías pulsos de paquimétrico de refracción láser medio (micras) preoperatoria 7 + 2,9 D 643 46 2 6 5 5 + 4,1 D – 0,5 D + 2,7 D + 0,7 D 498 296 524 36 25 + 1,4 D 418 Hipermet. (> 1.00 D) Miopía (> 1.00 D) 2 4 1 110 36 69 13 1 4 1 4 1 1 4 0 0 1 0 1 31 12 (48%) 10 (40%) 3 (12%) * Distrofia de membrana basal epitelial/síndrome de erosión recurrente. tral, más pequeño sea su diámetro, y cuanto menor sea la transición que permita el equipo de láser utilizado. Otros factores que también pueden influir son la falta de homogeneidad de la distribución de la energía del láser, que en muchos sistemas de haz de campo amplio es mayor en el centro que en la periferia, la menor efectividad de la interacción del láser con la córnea más paracentral por el hecho de que el ángulo de incidencia se vuelve menos perpendicular que en la muy central, o la posibilidad de que las lamelas superficiales que se sitúan por fuera del área ablacionada se contraigan centrífugamente induciendo de este modo un perfil de lente negativa finalmente (38). Por otro lado, lesiones que por su situación sean ablacionadas de la córnea paracentral o medio periférica podrán asociar cambios miópicos en vez de hipermetrópicos. Aunque la inducción del cambio refractivo varía según las series, en el estudio de Hersh la media del cambio refractivo se situó en +1,4 D, con un rango que comprendió entre –5,25 y +7,25 D (27). Más en concreto, un viraje hipermetrópico mayor a 1 dioptría se verificó en un 40% de los casos (siendo la media en éstos de +4,8 D) y un cambio mayor a una dioptría de miopía se verificó en un 12% de los ojos tratados (situándose la media de éstos en –4,76 D). Como se puede comprobar en la tabla 2 el cambio hipermetrópico resultó mayor con estrategias de PTK de área extensa aplicada en el centro que cuando se aplicó para provocar alisamientos focales, muchos de éstos paracentrales. El pico del cambio hipermetrópico se suele observar transcurrido el primer mes tras a PTK y la estabilización de los cambios refractivos postoperatorios se suele completar hacia el tercer mes en aproximadamente el 75% de los casos, pero en el 25% de los tratamientos se constatan cambios mayores a la dioptría entre el examen del sexto mes y el del año (25,26). Cuando un paciente muestra una refracción residual desfavorable tras PTK se puede desde intentar una adaptación de una lente de contacto, en general las rígidas permeables al gas son más adecuadas para topografías irregulares, hasta volver a aplicar el láser excimer, bien en forma de PRK o LASIK para tratar de modo convencional el defecto refractivo, en forma de máscara ablacionable (PALM o BioMask), o focalmente la irregularidad presente. Para evitar las complicaciones refractivas arriba mencionadas y la inducción de astigmatismo irregular la selección del paciente adecuado también juega un papel importante; siendo aquéllos con miopía y lesiones excrecentes, en los que la PTK no sólo elimina la patología sino que también mejora el contorno de la superficie corneal, los mejores candidatos (4). 8. EVOLUCIONES FUTURAS DE LA PTK Con el tiempo quizás la respuesta de muchas de las alteraciones distróficas a la PTK estará caracterizada por el tipo de mutación cromosómica que las genere y será el análisis genotípico el que indicará a priori la idoneidad de este tratamiento (67). El láser excimer es muy efectivo para la eliminación de tejido corneal, pero con el refinamiento de sistemas como el BioMask o el PALM, la PTK probablemente mejore en el aspecto que en este momento todavía es algo deficiente, es decir, el de conseguir una superficie corneal totalmente regular (10). La generalización de la monitorización intra operatoria de la paquimetría en tiempo real y sin contacto favorecerá la precisión en los tratamientos y prevendrá el excesivo adelgazamiento corneal (100). Avances en la fármaco modulación de la respuesta cicatricial nos acercarán más al resultado deseado. No sólo la mitomicina C, que parece especialmente útil en las distrofias corneales relacionadas con el TGF-β, sino también la tiotepa, los anticuerpos anti-TGF-β y la electrolisis podrán quizás evitar las recidivas en las opacidades corneales tras PTK (67,101,102). En este campo quizás también se podrá constatar el beneficio de combinar técnicas de reconstrucción de la superficie ocular como es el trasplante de membrana amniótica (59). Por otro lado, con el refinamiento de las técnicas de láser de punto flotante guiadas por sistemas de topografía de proyección, no de reflexión, será posible tratar la patología de la superficie corneal de modo más específico, proporcionándole al paciente una visión sin corrección mejor al poder al mismo tiempo acercarle a la emetropia, además de conseguir una superficie corneal ópticamente más perfecta y clínicamente más saludable. 356 Superficie ocular BIBLIOGRAFÍA 1. Stark WJ, Gilbert ML, Gottsch JD, Munnerlyn C. Optical pachometry in the measurement of anterior corneal disease: an evaluative tool for phototherapeutic keratectomy. Arch Ophthalmol 1990; 108: 12-3. 2. Steinert RF, Puliafito CA. Excimer laser phototherapeutic keratectomy for a corneal nodule. Refract Corneal Surg 1990; 6: 352. 3. Sher NA, Bowers Ra, Zabel RW, et al. Clinical use of the 193nm excimer laser in the treatment of corneal scars. Arch Ophthalmol 1991; 109: 491-8. 4. Hersh PS, Wagoner MD. Excimer laser surgery for corneal disorders. 1ª ed. New York, USA: Thieme, 1998: 11-35. 5. Fagerholm P. Phototherapeutic keratectomy: 12 years of experience. Acta Ophthalmol Scand 2003; 81: 19-32. 6. Dogru M, Katakami C, Miyashita M, et al. Visual and tear function improvement after superficial phototherapeutic keratectomy (PTK) for mid-stromal corneal scarring. Eye 2000; 14: 779-84. 7. Drogu M, Katakami C, Miyashita M. Ocular surface changes after excimer laser phototherapeutic keratectomy. Ophthalmology 2000; 107: 1142-52. 8. Maloney RK, Thompson V, Ghiselli G, et al. A prospective multicenter trial of excimer laser phototherapeutic keratectomy for corneal vision loss. The Summit Phototherapeutic Keratectomy Study Group. Am J Ophthalmol 1996; 122: 149-60. 9. Fagerholm P, Fitzsimmons TD, Orndahl M, et al. Phototherapeutic keratectomy: long-term results in 166 eyes. Refract Corneal Surg 1993; 9: S76-81. 10. Rapuano CJ. Excimer laser phototherapeutic keratectomy. Curr Opin Ophthalmol 2001; 12: 288-93. 11. Dinh R, Rapuano CJ, Cohen EJ, Laibson PR. Recurrence of corneal dystrophy after excimer laser phototherapeutic keratectomy. Ophthalmology 1999; 106: 1490-7. 12. Thomann U, Meier-Gibbons F, Schipper I. Phototherapeutic keratectomy for bullous keratopathy. Br J Ophthalmol 1995; 79: 335-8. 13. Thomann U, Niesen U, Schipper I. Successful phototherapeutic keratectomy for recurrent erosions in bullous keratopathy. J Refract Surg 1996; 12: S290-2. 14. Lin PY, Wu CC, Lee SM. Combined phototherapeutic keratectomy and therapeutic contact lens for recurrent erosions in bullous keratopathy. Br J Ophthalmol 2001; 85: 908-11. 15. Maini R, Sullivan L, Snibson GT, et al. A comparison of different depth ablations in the treatment of painful bullous keratopathy with phototherapeutic keratectomy. Br J Ophthalmol 2001; 85: 912-5. 16. Rosa N, Cennamo G. Phototherapeutic keratectomy for relief of pain in patients with pseudophakic corneal edema. J Refract Surg 2002; 18: 276-9. 17. Stahl J, Fulcher S, Berkeley R. Corneal subepithelial nodular scarring treated with phototherapeutic keratectomy in a child with Rothmund-Thomson syndrome. Cornea 2000; 19: 110-5. 18. Autrata R, Rehurek J, Holousova M. Phototherapeutic keratetomy in the treatment of corneal surface disorders in children. Cesk Slov Oftalmol 2002: 58: 105-11. 19. Reinstein DZ, Aslanides IM, Silverman RH, et al. High-frequency ultrasound corneal pachymetry in the assessment of corneal scars for therapeutic planning. CLAO J 1994; 20: 198-203. 20. Izatt JA, Hee MR, Swanson EA, et al. Micrometer-scale resolution imaging of the anterior eye in vivo with optical coherence tomography. Arch Ophthalmol 1994; 112: 1584-9. 21. Grupcheva CN, Malik TY, Craig JP, et al. Microstructural assessment of rare corneal dystrophies using real-time in vivo confocal microscopy. Clin Exp Ophthalmol 2001; 29: 281-5. 22. Vesalouma MH, Linna TU, Sankila EM, et al. In vivo confocal microscopy of a family with Schnyder crystalline corneal dystrophy. Ophthalmology 1999; 106: 944-51. 23. Boscia F, La Tegola MG, Alessio G, Sborgia C. Accuracy of Orbscan optical pachymetry in corneas with haze. J Cataract Refract Surg 2002; 28: 253-8. 24. Fakhry MA, Artola A, Belda JI, et al. Comparison of corneal pachymetry using ultrasound and Orbscan II. J Cataract Refract Surg 2002; 28: 248-52. 25. Amm M, Duncker GI. Refractive changes after phototherapeutic keratectomy. J Cataract Refract Surg 1997; 23: 839-44. 26. Dogru M, Katakami C, Yamanaka A. Refractive changes after excimer laser phototherapeutic keratectomy. J Cataract Refract Surg 2001; 27: 686-92. 27. Hersh PS, Burnstein Y, Carr J, Etwaru G, Mayers M. Phototherapeutic keratectomy: surgical strategies and clinical outcomes. Ophthalmology 1996; 103: 1210-22. 28. Zhang M, Mai C, Nie S. Phototherapeutic keratectomy combined with photorefractive keratectomy for treatment of myopia with corneal scars. J Tongji Med Univ 2000; 20: 347-8. 29. Badr IA, al-Raijhi A, Wagoner MD, et al. Phototherapeutic keratectomy for climatic droplet keratopathy. J Refract Surg 1996; 12: 114-22. 30. Salah T, el Maghraby A, Waring GO. Excimer laser phototherapeutic keratectomy before cataract extraction and intraocular lens implantation. Am J Ophthalmol 1996; 122: 340-8. 31. McDonnell PJ, Seiler T. Phototherapeutic keratectomy with excimer laser for Reis-Buckler´s corneal dystrophy. Refract Corneal Surg 1992; 8: 306-10. 32. Hahn TW, Sah WJ, Kim JH. Phototherapeutic keratectomy in nine eyes with superficial corneal diseases. Refract Corneal Surg 1993; 9: S115-8. 33. Lawless MA, Cohen P, Rogers C. Phototherapeutic keratectomy for Reis-Buckler´s dystrophy. Refract Corneal Surg 1993; 9: S96-8. 34. El Aouni A, Briat B, Mayer F, et al. Reis-Buckler dystrophy: therapeutic photo-ablation with the excimer laser. J Fr Ophtalmol 1998; 21: 23-7. 35. Seiler T, Kriegerowski M, Schnoy N, Bende T. Ablation rate of human corneal epithelium and Bowman’s layer with the excimer laser (193 nm). Refract Corneal Surg 1990; 6: 99-102. 36. Maldonado MJ, Lohmann C. Cirugía de la miopía mediante el uso del láser. En Menezo JL, Güell JL, eds. Corrección quirúrgica de la alta miopía. 1.ª ed. Barcelona, España: Espaxs, 2001; 177-194. 37. Phillips AF, McDonnell PJ. Laser-induced fluorescence during photorefractive keratectomy; a method for controlling epithelial removal. Am J Ophthalmol 1997; 123: 42-7. 38. Dupps WJ, Roberts C. Effect of acute biomechanical changes on corneal curvature after photokeratectomy. J Refract Surg 2001; 17: 658-69. 39. Horgan SE, McLaughlin-Borlace L, Stevens JD, Munro PM. Phototherapeutic smoothing as an adjunct to photorefractive keratectomy in porcine corneas. J Refract Surg 1999; 15: 331-3. 40. Pisella PJ, Albou-Ganem C, Bourges JL, et al. Evaluation of anterior chamber inflammation after corneal refractive surgery. Cornea 1999; 18: 302-5. 41. Pepose JS, Laycock KA, Miller JK, et al. Reactivation of latent herpes simplex virus by excimer laser photokeratectomy. Am J Ophthalmol 1992; 114: 45-50. Capítulo 36. 42. Bialasiewicz AA, Schaudig U, Draeger J, et al. Descematocele after Excimer laser phototherapeutic keratectomy in herpes simplex virus-induced keratitis: a clinico-pathologic correlation. Klin Monatsbl Augenheilkd 1996; 208: 120-3. 43. Asbell PA. Valacyclovir for the prevention of recurrent herpes simplex virus eye disease after excimer laser photokeratectomy. Trans Am Ophthalmol Soc 2000; 98: 285-303. 44. Fergurson AW, Scott JA, McGavigan J, et al. Comparison of 5% povidone-iodine solution against 1% povidone-iodine solution in preoperative cataract surgery antisepsis: a prospective randomised double blind study. Br J Ophthalmol 2003; 87: 163-7. 45. Hersh PS, Wagoner MD. Excimer laser surgery for corneal disorders. 1.ª ed. New York, USA: Thieme, 1998: 36-74. 46. Breinin GM, DeVoe AG. Chelation of calcium with edathamil calcium-disodium in band keratopathy and corneal calcium affections. Arch Ophthalmol 1954; 52: 846-51. 47. Kornmehl EW, Steinert RF, Puliafito CA. A comparative study of masking fluids for excimer laser phototherapeutic keratectomy. Arch Ophthalmol 1991; 109: 860-3. Erratum in: Arch Ophthalmol. 1991; 109: 1114. 48. Alio JL, Belda JI, Shalaby AM. Correction of irregular astigmatism with excimer laser assisted by sodium hyaluronate. Ophthalmology 2001; 108: 1246-60. 49. Stevens SX, Bowyer BL, Sanchez-Thorin JC, et al. The BioMask for treatment of corneal surface irregularities with excimer laser phototherapeutic keratectomy. Cornea 1999; 18: 155-63. 50. Kremer F, Aronsky M, Bowyer B, Stevens SX. Treatment of corneal surface irregularities using biomask as an adjunt to excimer laser phototherapeutic keratectomy. Cornea 2002; 21: 28-32. 51. Katsanevaki VJ, Ginis HS, Naoumidi II, Pallikaris IG. The PALM technique: histological findings of masked phototherapeutic keratectomy on rabbit corneas. BMC Ophthalmol 2003; 19: 4. 52. Alio JL, Artola A, Rodriguez-Mier FA. Selective zonal ablations with excimer laser for correction of irregular astigmatis induced by refractive surgery. Ophthalmology 2000; 107: 662-73. 53. Hayashi H, Maeda N, Ikeda Y, et al. Sclerotic scattering illumination during phototherapeutic keratectomy for better visualization of corneal opacities. Am J Ophthalmol 2003; 135: 559-61. 54. Forster W, Ratkay I, Krueger R, Busse H. Topical diclofenac sodium after excimer laser phototherapeutic keratectomy. J Refract Surg 1997; 13: 311-3. 55. Maldonado MJ. Intraoperative MMC after excimer laser surgery for myopia. Ophthalmology 2002; 109: 826. 56. Majmudar PA, Forstor L, Dennis RF, et al. Topical mitomycin-C for subephitelial fibrosis after refractive corneal surgery. Ophthalmology 2000; 107: 89-94. 57. Marcon AS, Rapuano CJ. Excimer laser phototherapeutic keratectomy retreatment of anterior basement membrane dystrophy and Salzmann’s nodular degeneration with topical mitomycin C. Cornea 2002; 21: 828-30. 58. Anderson Penno E, Braun DA, et al. Topical thiotepa treatment for recurrent corneal haze after photorefractive keratectomy. J Cataract Refract Surg 2003; 29: 1537-42. 59. Lee HK, Kim JK, Kim EK, et al. Phototherapeutic keratectomy with amniotic membrane for severe subepithelial fibrosis following excimer laser refractive surgery. J Cataract Refract Surg 2003; 29: 1430-5. 60. Dausch D, Landesz M, Klein R, Schroder E. Phototherapeutic keratectomy in recurrent corneal epithelial erosion. Refract Corneal Surg 1993; 9: 419-24. PTK: queratectomía fototerapéutica 357 61. Öhman L, Fagerholm P. The influence of excimer laser ablation on recurrent corneal erosions: a prospective randomized study. Cornea 1998; 17: 349-52. 62. Rapuano CJ. Excimer laser phototherapeutic keratectomy: long-term results and practical considerations. Cornea 1997; 16: 151-7. 63. Reidy JJ, Paulus MP, Gona S. Recurrent erosions of the cornea: epidemiology and treatment. Cornea 2000; 19: 767-71. 64. Maini R, Loughnan MS. Phototherapeutic keratectomy re-treatment for recurrent corneal erosion syndrome. Br J Ophthalmol 2002; 86: 270-2. 65. Kremer I, Blumenthal M. Combined PRK and PTK in myopic patients with recurrent corneal erosion. Br J Ophthalmol 1997; 81: 551-4. 66. Örndahl MJ, Fagerholm PP. Treatment of corneal dystrophies with phototherapeutic keratectomy. J Refract Surg 1998; 14: 129-35. 67. Lee ES, Kim EK. Surgical do’s and don’ts of corneal dystrophies. Curr Opin Ophthalmol 2003; 14: 186-91. 68. Örndahl M, Fagerholm P, Fitzsimmons T, Tengroth B. Treatment of corneal dystrophies with excimer laser. Acta Ophthalmol (Copenh) 1994; 72: 235-40. 69. Starr M, Donnenfeld E, Newton M, et al. Excimer laser phototherapeutic keratectomy. Cornea 1996; 15: 557-65. 70. Amm M. Photo-therapeutic keratectomy (PTK): a successful treatment for Thiel-Behnke dystrophy and its recurrence. Ophthalmologe 1999; 6: 489-93. 71. Nassaralla BA, Garbus J, McDonnell PJ. Phototherapeutic keratectomy for granular and lattice corneal dystrophies at 1.5 to 4 years. J Refract Surg 1996; 12: 795-800. 72. Maclean H, Robinson LP, Wechsler AW, Goh A. Excimer phototherapeutic keratectomy for recurrent granular dystrophy. Aust N Z J Ophthalmol 1996; 24: 127-30. 73. Eggink FA, Beekhuis WH. Granular dystrophy of the cornea. Contact lens fitting after phototherapeutic keratectomy. Cornea 1995; 14: 217-22 74. Dogru M, Katakami C, Nishida T, Yamanaka A. Alteration of the ocular surface with recurrence of granular/avellino corneal dystrophy after phototherapeutic keratectomy: report of five cases and literature review. Ophthalmology 2001; 108: 810-7. 75. Wagoner MD, Badr IA. Phototherapeutic keratectomy for macular corneal dystrophy. J Refract Surg 1999; 15: 481-4. 76. Paparo LG, Rapuano CJ, Raber IM, et al. Phototherapeutic keratectomy for Schnyder crystaline corneal dystrophy. Cornea 2000; 19: 343-347. 77. Alaa M, Waring GO 3rd, Malaty A, Grossniklaus H. Increased corneal scarring after phototherapeutic keratectomy in Fuch´s corneal dystrophy. J Refract Surg 1997; 13: 308-10. 78. Migden M, Elkins BS, Clinch TE. Phototherapeutic keratectomy for corneal scars. Ophthalmic Surg Lasers 1996; 27: S503-7. 79. Kapadia MS, Wilson SE. Transepithelial photorefractive keratectomy for treatment of thin flaps or caps after complicated laser in situ keratomileusis. Am J Ophthalmol 1998; 126: 827-9. 80. Talu H, Tasindi E, Ciftci F, Yildiz TF. Excimer laser phototherapeutic keratectomy for recurrent pterygium. J Cataract Refract Surg 1998; 24: 1326-32. 81. Goldstein M, Loewenstein A, Rosner M, et al. Phototherapeutic keratectomy in the treatment of corneal scarring from trachoma. J Refract Corneal Surg 1994; 10: S290-2. 82. Starr MB. Recurrent subepithelial corneal opacities after excimer laser phototherapeutic keratectomy. Cornea 1999; 18: 117-20. 358 Superficie ocular 83. Goldstein MH, Feistmann JA, Bhatti MT. PRK-PTK as a treatment for a patient with Thygeson’s superficial punctate keratopathy. CLAO J 2002; 28: 172-3. 84. Kim MS, Song SW, Kim JH, Woo HM. Multifocal phototherapeutic keratectomy for the treatment of persistent epithelial defect. J Cataract Refract Surg 2000; 26: 1753-7. 85. Cameron JA, Antonios SR, Badr IA. Excimer laser phototherapeutic keratectomy for shield ulcers and corneal plaques in vernal keratoconjunctivitis. J Refract Surg 1995; 11: 31-5. 86. O’Brart DP, Gartry DS, Lohmann CP, et al. Treatment of band keratopathy by excimer laser phototherapeutic keratectomy: surgical techniques and long term follow up. Br J Ophthalmol 1993; 77: 702-8. 87. Dausch D, Landesz M, Schroder E. Phototherapeutic keratectomy in recurrent corneal intraepithelial dysplasia. Arch Ophthalmol 1994; 112: 22-3. 88. Talamo JH, Wagoner MD, Lee SY. Management of ablation decentration following excimer photorefractive keratectomy. Arch Ophthalmol 1995; 113: 706-7. 89. George SP, Johnson DG. Photorefractive keratectomy retreatments: comparison of two methods of excimer laser epithelium removal. Ophthalmology 1999; 106: 1469-79. 90. Fong Y-C, Chuck RS, Stark WJ, et al. Phototherapeutic keratectomy for supeficial corneal fibrosis after radial keratectomy. J Cataract Refract Surg 2000; 26: 616-619. 91. Rojas MC, Manche EE. Phototherapeutic keratectomy for anterior basement membrane dystrophy after laser in situ keratomileusis. Arch Ophthalmol 2002; 120: 722-7. 92. Leu G, Hersh PS. Phototherapeutic keratectomy for the treatment of diffuse lamellar keratitis. J Cataract Refract Surg 2002; 28: 1471-4. 93. Al-Raijhi AA, Wagoner MD, Badr IA, et al. Bacterial keratitis following phototherapeutic keratectomy. J Refract Surg 1996; 12: 123-7. 94. Teichmann KD, Cameron J, Huaman A, et al. Wessely-type immune ring following phototherapeutic keratectomy. J Cataract Refract Surg 1996; 22: 142-6. 95. Epstein RJ, Robin JB. Corneal graft rejection episode after excimer laser phototherapeutic keratectomy. Arch Ophthalmol 1994; 112: 157. 96. Nghiem-Buffet MH, Gatinel D, Jacquot F, et al. Limbal stem cell deficiency following phototherapeutic keratectomy. Cornea 2003; 22: 482-4. 97. Miyata K, Takahashi T, Tomidokoro A, et al. Iatrogenic keratectasia after phototherapeutic keratectomy. Br J Ophthalmol 2001; 85: 247-8. 98. Frueh BE, Böhnke M. Endothelial cell morphology after phototherapeutic keratectomy. Ger J Ophthalmol 1995; 4: 86-90. 99. Benitez del Castillo JM, del Río T, Iradier T, et al. Decrease in tear secretion and corneal sensitivity after laser in situ keratomileusis. Cornea 2001; 20: 30-2. 100. Bohnke M, Chavanne P, Gianotti R, Salathe RP. Continuous non-contact corneal pachymetry with a high speed reflectometer. J Refract Surg 1998; 14: 140-6. 101. Moller-Pedersen T, Cavanagh D, Petroll M, Jester JV. Neutralizing antibody to TGF-beta modulates stromal fibrosis but not regression of photoablative effect following PRK. Curr Eye Res 1998; 17: 736-47. 102. Mashima Y, Kawai M, Yamada M. Corneal electrolysis for recurrence of corneal stromal dystrophy after keratoplasty. Br J Ophthalmol 2002; 86: 273-5. Este capitulo está dedicado a la memoria de mi Padre que vivió sus últimos momentos y falleció durante la elaboración del mismo. Este trabajo intenta ser reflejo de la profesionalidad que siempre admiré en él y lo hice de la única manera que él me enseñó a trabajar: dándolo todo.