PREINFORME 1 ALCOHOLES Y FENOLES 1. OBJETIVO
Anuncio

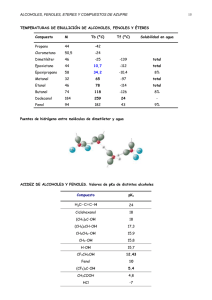
PREINFORME 1 ALCOHOLES Y FENOLES 1. OBJETIVO GENERAL Determinar la reactividad de algunos alcoholes y fenoles, comprobando así algunas características químicas particulares 2. OBJETIVOS ESPECÍFICOS Reconocer la presencia del grupo funcional hidroxilo en los alcoholes así como su ubicación dentro del mismo. 3. MARCO TEÓRICO 3.1 ALCOHOLES Los alcoholes son compuestos de fórmula general ROH, donde R es cualquier grupo alquilo, incluso sustituido. El grupo puede ser de cadena abierta o cíclico; puede contener un doble enlace, un átomo de halógeno, un anillo aromático, o grupos hidroxilo adicionales. Se puede pensar en los alcoholes como derivados del agua donde uno de sus hidrógenos ha sido reemplazado por grupos hidrocarbonados. Los alcoholes se clasifican como primarios, secundarios y terciarios, de acuerdo con el tipo de carbono que tiene el grupo funcional hidroxilo (-OH). Las variadas posiciones que puede adoptar el grupo funcional –OH pueden afectar la velocidad de ciertas reacciones y el tipo de reacción. 3.1.1 Propiedades físicas. Los alcoholes a temperatura ambiente son líquidos incoloros e inodoros de bajo peso molecular y de olor característico, su densidad es menor a la del agua. Las propiedades físicas de un alcohol se comprenden mejor, si reconocemos este hecho simple: estructuralmente, el alcohol es un derivado de un alcano y agua. Contiene un grupo lipófilo, del tipo de un alcano, y un grupo hidróxilo que es hidrófilo, similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características y el alquilo es el que las modifica, lo que depende de su tamaño y forma. El grupo –OH es muy polar y, lo importante, es capaz de establecer puentes de hidrógeno con sus moléculas compañeras, con otras moléculas neutras y con aniones. Entre los hidrocarburos, los factores que determinan puntos de ebullición suelen ser principalmente el peso molecular y la forma, lo que es de esperar de moléculas que se mantienen unidas esencialmente por fuerzas de van der Waals. Comparando los hidrocarburos y los alcoholes de peso molecular semejante, se observa una gran diferencia en el valor de sus puntos de ebullción. Lo anterior se explica teniendo en cuenta que para convertir un líquido en gas, es necesario vencer las fuerzas de atracción entre las moléculas del líquido. Estas atracciones intermoleculares son débiles en los alcanos ya que sus moléculas son no polares. En cambio, el enlace oxígenohidrógeno de los alcoholes es bastante polar y, en consecuencia, existen atracciones dipolares entre moléculas, específicamente entre el hidrógeno de una molécula y el oxígeno (y sus electrones no enlazantes) de otra. Además, a causa del diminuto tamaño del hidrógeno, es posible una estrecha asociación intermolecular llamada puentes de hidrógeno, lo que proporciona atracciones máximas, dando como resultado mayores puntos de ebullición. El comportamiento de los alcoholes en cuanto a su solubilidad también refleja la tendencia a formar puentes de hidrógeno. En marcado contraste con los hidrocarburos, los alcoholes inferiores son miscibles con agua. Puesto que las moléculas de los alcoholes se mantienen unidas por el mismo tipo de fuerzas intermoleculares que las de agua, puede haber mezcla de las dos clases de moléculas: la energía necesaria para romper un puente de hidrógeno entre dos moléculas de agua o dos de alcohol, es proporcionada por la formación de un puente entre una molécula de agua y otra de alcohol. Sin embargo, esto es cierto sólo para los alcoholes inferiores, en los que el grupo –OH constituye una parte considerable de la molécula. A medida que el grupo lipófilo aumenta de tamaño, disminuye la solubilidad en agua. 3.1.2 pH de los alcoholes. los alcoholes son bases, y de una fuerza similar a la del agua. Como el agua, también contiene oxígeno, y este oxígeno, con sus pares no compartidos, los hace básicos. Hemos visto muchas veces que su basicidad tiene un papel central en la determinación de su comportamiento químico, como sustratos y como reactivos. Aceptan protones de ácidos para generar alcoholes protonados, protonación que les permite actuar como sustratos en la sustitución nucleofílica y en la eliminación algo que no pueden hacer en la forma no protonada-. Aceptan protones de carbocationes, con lo que actúan como reactivos básicos para provocar una eliminación. Su basicidad también los hace nucleofílicos y capaces de causar sustitución en reacciones SN2 netas, prestando ayuda nucleofílica a la formación de carbocationes o combinándose con carbocationes, una vez que éstos se han formado. También hemos dicho que los alcoholes son ácidos, y de fuerza similar al agua. El hidrógeno está ligado al muy electronegativo elemento oxígeno. La polaridad del enlace O-H facilita la separación de un protón relativamente positivo; desde otro punto de vista, el oxígeno electronegativo acomoda muy bien la carga negativa de los electrones abandonados. La acidez de los alcoholes se demuestra por su reacción con metales activos para liberar hidrógeno gaseoso y formar alcóxidos. 3.1.3 Propiedades químicas de los alcoholes. 3.2 FENOLES Los fenoles son compuestos de fórmula general ArOH, donde Ar es fenilo, fenilo sustituido, o alguno de los demás grupos arilo. Los fenoles difieren de los alcoholes por tener el grupo –OH directamente unido al anillo aromático. Los fenoles y los alcoholes contienen el grupo –OH, por lo que ambas familias hasta cierto punto se asemejan. Por ejemplo, tanto fenoles como alcoholes pueden convertirse en éteres y ésteres. Sin embargo, en la mayoría de sus propiedades, como en su preparación, ambos compuestos difieren ampliamente, por lo que merecen ser clasificados como familias diferentes. 3.2.1 Propiedades físicas Los fenoles más sencillos son líquidos o sólidos de bajo punto de fusión; tienen puntos de ebullición bastante elevados, debido al hecho de que forman puentes de hidrógeno. El fenol mismo tiene cierta solubilidad en agua (9g por 100g de agua), probablemente por la formación de puentes de hidrógeno con ella. La mayoría de los otros fenoles es, esencialmente, insoluble. El fenol es poco soluble en agua ya que aunque presenta un puente de hidrógeno, la proporción de –OH respecto a la cantidad de carbonos es muy baja. Para que los compuestos que contienen grupos – OH sean solubles en agua, la razón entre carbonos y grupos –OH no debe ser mayor de 3:1. El fenol, el miembro más pequeño de este grupo contiene 6 átomos de carbono y un solo grupo –OH. Los demás monofenoles poseen mayor número de carbonos y un solo grupo –OH, por ello son insolubles en agua. Los difenoles y polifenoles con más de un grupo –OH presentan mayor solubilidad en el agua. Son en sí incoloros, salvo que presenten algún grupo capaz de imponerles coloración. Sin embargo, y al igual que las aminas aromáticas, se oxidan con facilidad, por lo que a menudo se les encuentra coloreados, a menos que estén cuidadosamente purificados, por la presencia de productos de oxidación. 3.2.2 pH La propiedad característica que distingue a los fenoles de los alcoholes es la acidez. Los fenoles son débilmente ácidos y se pueden neutralizar con hidróxido de sodio. Los alcoholes son de un millón a mil millones de veces menos ácidos que el fenol y no se neutralizan con hidróxido de sodio. 3.2.3 Propiedades químicas Aparte de su acidez, la propiedad química más notable de un fenol es la reactividad extremadamente elevada de su anillo en la sustitución electrofílica. La acidez desempeña un papel importante incluso en la sustitución anular, ya que la ionización de un fenol genera el grupo –O-, aún más liberador de electrones que el –OH, debido a su carga negativa. Los fenoles no sólo dan las reacciones de sustitución electrofílica típicas en la mayoría de los compuestos aromáticos, sino también muchas otras, que son posibles gracias a la reactividad excepcional del anillo. 3.3 PRUEBAS A REALIZAR EN LA PRÁCTICA DE LABORATORIO. -Pérdida del grupo OH: ensayo con el reactivo de Lucas. La prueba de Lucas indica si se trata de un alcohol primario, secundario o terciario; se basa en la diferencia de reactividad de los tres tipos con los halogenuros de hidrógeno. Los alcoholes (de no más de seis carbonos) son solubles en el reactivo de Lucas, que es una mezcla de ácido clorhídrico concentrado y cloruro de zinc. Los cloruros de alquilo correspondientes son insolubles. La formación de un cloruro, a partir de alcohol, se manifiesta por la turbiedad que aparece cuando se separa el cloruro de la solución; en consecuencia, el tiempo que transcurra hasta la aparición de la turbiedad es una medida de la reactividad del alcohol. Un alcohol terciario reacciona de inmediato con el reactivo de Lucas, mientras que uno secundario reacciona en cinco minutos; a temperatura ambiente, un alcohol primario no reacciona en forma apreciable. Las reacciones se muestran a continuación: -Oxidación de alcoholes: ensayo con permanganato de potasio y bicromato de potasio: la oxidación de un alcohol implica una pérdida de uno o más hidrógenos (hidrógenos α: primer átomo de hidrógeno unido al grupo funcional) del carbono que tiene el grupo –OH. El tipo de producto que se genera depende del número de estos hidrógenosα que contiene el alcohol: o sea, puede tratarse de uno primario, secundario o terciario. Un alcohol primario contiene dos hidrógeno α, de modo que puede perder uno de ellos para dar un aldehído: O ambos, para formar un ácido carboxílico: Un alcohol secundario puede perder su único hidrógeno α para transformarse en una cetona: Un alcohol terciario no tiene hidrógenos α, de modo que no es oxidado. No obstante, un agente oxidante ácido puede deshidratarlo a un alqueno, y oxidar luego a éste. La oxidación de alcoholes primario a ácidos carboxílicos por lo general se efectúa empleando permanganato de potasio. Se obtienen mejores rendimientos si se junta el permanganato y el alcohol en un disolvente no polar utilizando la catálisis de transferencia de fase. Cuando se completa la reacción, se filtra una solución acuosa de la sal potásica, soluble, del ácido carboxílico para separarla del MnO2, y el ácido se libera por adición de un ácido mineral más fuerte: La oxidación de alcoholes a la etapa de aldehído o cetona se logra por uso de Cr(VI), en este caso bicromato de potasio: Dado que los aldehídos son susceptibles de mayor oxidación, puede dificultar la conversión de un alcohol primario en aldehído. Uno de los mejores reactivos, y más convenientes para éste propósito, es el clorocromato de piridinio que se obtiene por reacción entre ácido crómico y cloruro de piridinio. Cuando la prueba del ácido crómico, o en este caso del bicromato de potasio, se efectúa con un alcohol primario o secundario, el color anaranjado cambia a verde o azul. -Ensayo del xantato. Los alcoholes pueden determinarse cualitativa y cuantitativamente, haciendo reaccionar los alcóxidos de sodio o potasio, con bisulfuro de carbono (CS2), para así formar productos insolubles, conocidos como xantatos. Las reacciones que tienen lugar son: El método consiste en mezclar aproximadamente 0,5 mililitros de alcohol con una lenteja de hidróxido de potasio y, posteriormente, mezclar el alcóxido con sulfuro de carbono. La formación casi instantánea de un sólido amarillo es prueba positiva para cualquier alcohol. -Reacción con cloruro férrico. La mayor parte de los fenoles dan disoluciones coloreadas (azul, verde, violeta, etc). Si el color es amarillo débil, el mismo que el del cloruro férrico, la reacción se considera negativa. El color depende de la naturaleza del fenol y de la concentración de la solución. A continuación se muestra un esquema de reacción: C6H5-OH + FeCl3 = ( C6H4-OCL)3(-) + Fe(+). El resultado obtenido es una variación de color de azul a negro debido a la alta concentración de los reactivos. Esta respuesta se debe al ataque producido por el Ion cloruro al hidrogeno del grupo hidroxilo provocando una ruptura de enlace y la unión del grupo fenoxido al hierro (formación de complejo), considerando que las disoluciones de fenoles presentan coloración, también se estima una reacción de oxidación del fenol llamada Quinona las cuales son coloreadas. La ecuación representativa es la siguiente: -Formación de ácido pícrico. HNO3 + H2SO4 --> H2O + NO2+ + HSO4El ácido nítrico junto con el ácido sulfúrico forman el grupo que nitrará al fenol C6H5OH + NO2+ ---> C6H4OHNO2 (p-nitrofenol) C6H4OHNO2 + NO2+ ---> C6H3OH(NO2)2 (2,4-dinitrofenol) C6H3OH(NO2)2 + NO2+ ---> C6H2OH(NO2)3 (ácido pícrico = trinitrofenol) Si bien no es un ácido orgánico sino un fenol, los grupos nitro son atractores de electrones haciendo que la molécula se desprotone dando un carácter ácido muy elevado (es más ácido que el ácido benzoico) -Ensayo con agua de bromo. El tratamiento de fenoles con soluciones acuosas de bromo produce el reemplazo de todo los hidrógenos ubicados en posiciones orto y para con respecto al grupo –OH y aún puede provocar el desplazamiento de ciertos grupos. Si se procede a la halogenación en un disolvente de polaridad baja, como el cloroformo, tetracloruro de carbono o sulfuro de carbono, puede limitarse la reacción a la monohalogenación. Esta reacción, el ensayo con agua de bromo, corresponde a una sustitución aromática electrofilica que posee un fuerte activante (OH-) orto-para , es una halogenación, en donde el fenol reacciona con bromo en solución acuosa para producir el compuesto 2,4,6 tribromofenol, el cual posee un precipitado blanco lechoso. A continuación se presenta el mecanismo de reacción de la halogenación del fenol correspondiente al ensayo con agua de bromo: