HOSPITAL TRAUMATOLÒGICO Y QUIRÙRGICO PROFESOR
Anuncio

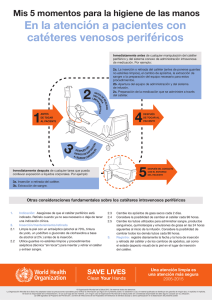
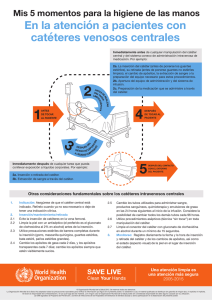
HOSPITAL TRAUMATOLÒGICO Y QUIRÙRGICO PROFESOR “JUAN BOSCH” DEPARTAMENTO DE EPIDEMIOLOGÌA COMITÉ DE CONTROL DE INFECCIONES ASOCIADAS A LA ATENCIÒN SANITARIA -CCIAS- GUÌA PARA LA PREVENCIÓN DE LA INFECCIÓN NOSOCOMIAL ASOCIADA A CATÉTER INTRAVASCULAR. La Vega, Junio de 2011.- 1 GUÌA PARA LA PREVENCIÓN DE LA INFECCIÓN NOSOCOMIAL ASOCIADA A CATÉTER INTRAVASCULAR. 2 CONTENIDO I. LOS NIVELES DE EVIDENCIA…4 II. ANTECEDENTES GENERALES…5 III. RECOMENDACIONES PARA LA PREVENCIÒN DE LA INFECCIÒN ASOCIADA A CATETERISMO INTRAVASCULAR…6 BIBLIOGRAFÌA…11 3 I. LOS NIVELES DE EVIDENCIA Se detallan las principales medidas de control de la infección nosocomial, clasificada por su ámbito de aplicación y el tipo de pruebas que las avalan. La nomenclatura que se utiliza para clasificar la evidencia-prueba es la siguiente:1,2,3 EvidencIa I : Efectividad fuertemente avalada por estudios experimentales. EvidencIa II: Efectividad suficientemente avalada por estudios observacionales. Evidencia III: Cualquier otro tipo de evidencia. No evidencia: Recomendación no avalada por pruebas. Asunto no resuelto. 4 II. ANTECEDENTES GENERALES La Bacteremia Asociada a Catéter Venoso Central (BAC/CVC), se observa en el 3% a 4% de los pacientes con catéteres de corta duración; en el 20% de los catéteres de duración prolongada, y en el 5% en catéteres totalmente implantados.4 La BAC/CVC incrementa en promedio la hospitalización en Unidades de Cuidados Intensivos en 2,4 días y en total la estancia hospitalaria en 7.5 días. La BAC/CVC está relacionada con alta morbilidad y mortalidad en un 16% a 25%.5,6 Las complicaciones asociadas a catéteres vasculares incluyen: flebitis, infección del sitio de salida cutáneo, infección del trayecto, infección del reservorio subcutáneo, bacteriemia o fungemia relacionada con el líquido de infusión, y la bacteriemia relacionada con el catéter.7 La patogénesis de la BAC/CVC, se produce por la migración de microorganismos de la piel o manos del personal y colonización del catéter; que puede ser intraluminal (contaminación de las conexiones, mayor de 30 días), y extraluminal (contaminación del sitio de inserción en menor de 10 días).5 Los microorganismos pueden ingresar a la sangre por: i) contaminación de los fluidos, ii) contaminación del sitio de inserción (entrada a la vena, sitio de salida en la piel, apéndice del catéter, capuchón), y iii) contaminación de las conexiones. En todas estas modalidades puede producirse siembra hematógena. En la contaminación por la vía endoluminal, las bacterias acceden por el interior del catéter desde las conexiones del mismo, y está involucran el 10% a 50% de los casos de BAC/CVC. La vía hematógena se involucra en el 3% a 10% de los casos y el uso de fluidos contaminados en menos de un 3% de los casos de BAC/CVC. 5 III. Recomendaciones para la prevención de la infección asociada a cateterismo intravascular 8,9,10,11 1. Recomendaciones generales. Evidencia I. ■ Inserción del catéter sólo cuando esté indicado y retirada cuando acabe la indicación clínica. ■ Formación continuada del personal sanitario sobre uso de los catéteres IV, adiestramiento en su inserción, en los cuidados en la manipulación y mantenimiento de los mismos. Evidencia II. ■ Garantizar una dotación adecuada de personal de enfermería para pacientes críticos: 1,2 enfermos por enfermera. 2. Técnica de cateterización. 2.1 Preparación del campo. Evidencia I. ■ Catéter periférico: en adultos, preferiblemente en miembro superior no dominante. ■ Catéter venoso central: preferiblemente vena subclavia antes que yugular o femoral. ■ Higiene de manos. ■ Antisepsia del sitio de inserción con clorhexidina al 2%. ■ No palpar la zona de inserción una vez desinfectada. ■ En catéter venoso central, preparación de campo estéril amplio. Evidencia III. ■ En pacientes pediátricos, mano, dorso del pie o cuero cabelludo. 6 3. Inserción del catéter. Evidencia I. ■ Higiene de manos. ■ Técnica aséptica. Guantes limpios en catéter periférico. ■ Máximas medidas de barrera en la inserción del CVC: gorro, mascarilla, bata y guantes estériles. ■ No usar pomadas o cremas antibióticas tópicas en las zonas de inserción. Evidencia II. ■ Material del catéter: catéteres periféricos: teflón o poliuretano. Catéteres centrales: poliuretano, silicona, o teflón. ■ Utilizar CVC con el menor número de lúmenes. 4. Fijación del catéter. Evidencia I. ■ Apósito estéril de gasa o transparente semipermeable. Evidencia II. ■ Fijación con sutura o con dispositivos sin sutura. 5. Mantenimiento del catéter, sistema de perfusión, conexiones y soluciones. 5.1 Manipulación. 5.1.1 Catéter, sistema y conexiones. Evidencia I. ■ Higiene de manos antes de realizar cualquier manipulación. ■ Manipular asépticamente, aplicando una solución de clorhexidina alcohólica al 0,5% sobre los dispositivos de conexión o acceso, antes y después de la manipulación. 7 Evidencia II. ■ Las salidas de las llaves de tres pasos y cualquier dispositivo de conexión que no estén siendo utilizados deben mantenerse protegidos con tapón. 5.1.2 Líquidos. Evidencia I. ■ No infundir soluciones parenterales que presenten turbidez, partículas, fugas o roturas en el envase o estén caducadas. ■ Si se utilizan viales multidosis: limpiar el tapón de acceso con clorhexidina alcohólica al 0,5%. Desechar cualquier vial multidosis cuya esterilidad estuviera comprometida. ■ Utilizar un dispositivo estéril para acceder a los viales. Evidencia II. ■ Utilizar viales unidosis siempre que sea posible. 5.1.3 Atención de la zona de inserción Evidencia II. ■ Visualizar diariamente si se utiliza un apósito transparente, o controlar por palpación a través del apósito intacto si es de gasa. ■ No realizar cultivos rutinarios del punto de inserción del catéter, como medida para prevenir la infección. 6. Cambios de catéteres. 6.1. Periféricos. Evidencia II. ■ Si presenta signos de flebitis (calor, dolor, eritema, cordón venoso palpable) o mal funcionamiento del catéter. 6.2. Centrales. Evidencia II ■ Si se observa supuración en la zona de inserción 8 Evidencia III. ■ Cuando no pueda asegurarse que se aplicó técnica aséptica. Se hará antes de 48 horas. ■ Si el paciente está hemodinámicamente inestable y se sospecha la existencia de BAC. ■ Usar guantes estériles antes de manipular el nuevo catéter si el cambio es a través de guía. 6.3. Apósitos. Evidencia II. ■ Debe cambiarse siempre que esté mojado, sucio o despegado. 6.4. Sistemas de perfusión y conexiones. Evidencia I. ■ No es necesario cambiarlos antes de las 72 horas de uso, salvo complicaciones. ■ Los sistemas de perfusión de propofol se cambiarán cada 6-12 horas. Evidencia II. • Los sistemas de perfusión de sangre y hemoderivados se cambiarán al finalizar la perfusión, o cada 24 horas. • Los sistemas de perfusión de soluciones lipídicas cambiar cada 24 horas. 6.5. Soluciones parenterales. Evidencia II. ■ Las perfusiones de sangre y hemoderivados se cambiarán a las 4 horas de ser iniciadas. ■ Las soluciones de nutrición parenteral se cambiarán cada 24 horas. 9 7. Otras Recomendaciones. Evidencia I. ■ No administrar profilaxis antimicrobiana, antes de la inserción o durante la utilización de un catéter intravascular. ■ No utilizar filtros antibacterianos en los sistemas de perfusión intravenosa. ■ No es necesario cultivar rutinariamente la punta del catéter tras su retirada. 7.1 Actitud ante sospecha de bacteriemia asociada a catéter 5 intravascular. Evidencia II. ■ Todo catéter retirado por sospecha de infección debe ser analizado. Enviar a Microbiología la punta distal del catéter (1cm), siendo retirado en condiciones asépticas para su cultivo. ■ Si se sospecha contaminación del material de perfusión, el catéter deberá ser retirado, mandando una muestra al laboratorio de microbiología. 7.2. Catéter periférico. ■ Si infección local tratamiento sintomático con antiinflamatorios y la retirada del catéter. ■ Si persiste la fiebre y signos inflamatorios locales (flebitis supurada) deben extraerse hemocultivos y administrar tratamiento antimicrobiano empírico: Vancomicina iv (1g/12 horas) o Teicoplanina iv (400mg/12 h) las tres primeras dosis después cada 24 horas. 7.3 Recomendaciones claves ■ Higiene de manos antes de realizar cualquier manipulación. ■ Antisepsia del sitio de inserción con clorhexidina alcohólica al 0,5% ■ Máximas medidas de barrera en la inserción del CVC: gorro, mascarilla, bata y guantes estériles. ■ Sistemas de perfusión y conexiones no es necesario cambiarlos antes de las 72 horas de uso. ■ No utilizar filtros antibacterianos en los sistemas de perfusión intravenosa. 10 BIBLIOGRAFÌA 1.IDSA Guideline for Intravascular Ctheter-Related Infection. CID 2009:49:1-45. 2 . Goede M, Coopersmith C. Catéter-Related Bloodstream Infection. Surg Clin Am 2009; 89:463-74. 3. Cicalini S, Palmieri F, Petrosillo N. New technologies for prevention of intravascular catheter related infections. Critical Care 2004;8(3):157-162. 4. Road, Et al. J. Inf. Dis. 1993:168:400-7. 1. Centers for Disease Control and Prevention. Guidelines for the Prevention of Intravascular catheter Related Infections. MMWR 2002; 51(Nº RR-10):1-30. 2. Informe epidemiológico de infección nosocomial, utilización de instrumentaciones y antimicrobianos. Informe global 2003; Servicio de Medicina Preventiva, Hospital La Paz. 3. León C, Ariza J. Guías para el tratamiento de las infecciones relacionadas con catéteres intravasculares de corta permanencia en adultos: conferencia de consenso SEIMCSEMICYUC. Enferm Infecc Microbiol Clin 2004; 22: 92-101. 4. IDSA Guideline for Intravascular Ctheter-Related Infection. CID 2009:49:145. 5 . Goede M, Coopersmith C. Catéter-Related Bloodstream Infection. Surg Clin Am 2009; 89:463-74. 6. Cicalini S, Palmieri F, Petrosillo N. New technologies for prevention of intravascular catheter related infections. Critical Care 2004;8(3):157-162. 7. Road, Et al. J. Inf. Dis. 1993:168:400-7. 8.Medidas para evitar o disminuir la infección nosocomial asociada a instrumentaciones: sondaje urinario, cateterismo intravenoso, respiración asistida. Guía para la Prevención y Control de la Infección Hospitalaria. Hospital La Paz, Madrid 2003; 99-104. 9. Berenholtz S, Pronovost MD. Eliminating catéter-related bloodstream infections in the intensive care unit. Crit Care Med 2004; 32:2014-20. 10. Safdar N., Fine J.P., and Maki D.G.: Meta-Analysis: Methods for Diagnosing Intravascular Device–Related.Bloodstream Infection. Ann Intern Med. 2005;142:451-466. 11. Guìa Prevenciòn y Control de Infecciones. “Hospital La Paz”. Madrid, 2010. 11